Группа изобретений относится к плазмидной ДНК pQE-70_LysAP46, рекомбинантному штамму бактерий Escherichia coli и термостабильному белку эндолизину LysAP46, синтезируемому указанным штаммом и обладающему гидролитической активностью относительно пептидогликанов клеточных стенок и разрушающему биопленки, сформированных Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus, и может быть использована в биотехнологии, генной и белковой инженерии.
Представители рода Staphylococcus являются комменсалами кожных и слизистых поверхностей человека и животных, однако способны вызывать инфекционные процессы у людей, особенно с ослабленным иммунным статусом. Основными патогенами человека являются золотистый стафилококк (Staphylococcus aureus), эпидермальный стафилококк (Staphylococcus epidermidis) и гемолитический стафилококк (Staphylococcus haemolyticus). Они способны вызывать различные заболевания, от незначительных кожных инфекций до опасных для жизни заболеваний. Самым патогенным представителем рода является коагулазоположительный Staphylococcus aureus [1], чья высокая патогенность основана на продукции широкого спектра факторов вирулентности, таких как белок А, коагулаза, коллагеназа, гиалуронидаза, гемолизины, липазы, различные токсины, адгезивные белки, а также белков, способствующих образованию биопленок. Staphylococcus epidermidis является наиболее патогенным представителем коагулазоотрипательных стафилококков, к которым относится и Staphylococcus haemolyticus. Для инфекций, вызванных Staphylococcus epidermidis, характерно хроническое протекание с образованием биопленок, увеличивающих устойчивость к антибиотикам. Было показано, что Staphylococcus epidermidis производит фенолорастворимые модулины, негативно влияющие на эритроциты и лейкоциты человека [2, 3, 4]
Многие годы антибиотики считались высокоэффективным средством против стафилококковых инфекций, но с началом их применения у бактерий стали регистрировать и резистентность к ним. Уже в 1960 году были обнаружены резистентные к метициллину больничные штаммы Staphylococcus aureus (MRSA), позднее MRSA штаммы быстро распространились по всему миру, и на сегодняшний день они представляют серьезную проблему. Еще большие опасения вызывает появление штаммов с множественной антибиотикорезистентностью [5]. В 2017 году Всемирная организация здравоохранения внесла Staphylococcus aureus в список наиболее опасных устойчивых к антибиотикам патогенов. В последние годы показано, что среди Staphylococcus epidermidis доля штаммов с множественной антибиотикорезистентностью может быть выше, чем среди Staphylococcus aureus [6], из-за чего Staphylococcus epidermidis также переходит в разряд опасных патогенов.
Эндолизины бактериофагов грамположительных бактерий являются одной из рассматриваемых альтернатив антибиотикам [7]. Эти фаговые белки обладают каталитической активностью, разрушающей связи в структуре пептидогликанов клеточной стенки бактерий. В жизненном цикле бактериофагов эндолизины необходимы на поздних стадиях для высвобождения наработавшихся вирусных частиц [8]. Эндолизины являются преимущественно гидролазами [7, 8], Эндолизин LysAP46 - это белок, имеющий молекулярной массой около 32 кДа, для которого характерна структура типичная для фаговых эндолизинов.
Близкими аналогами являются эндолизины бактериофагов, специфичных к определенным штаммам стафилококков, применяемые для борьбы с биопленками Staphylococcus aureus [патент ЕР, 2200442, МПК С07К 14/005, опубл. 30.06.2010 г.], либо активные против мультирезистентных штаммов Staphylococcus aureus [патент RU, 2715694, МПК А61Р 31/04, опубл. 02.03.2020 г.], [патент KR, 20170087770, МПК С07К 14/005, опубл. 31.07.2017 г.], [патент CN, 106636050, МПК А61К 38/51, опубл. 10.05.2017 г.], [заявка US, 2016090584, МПК C12N 9/80, опубл. 31.03.2016 г.], [заявка US, 2015247138, МПК А61К 38/47, опубл. 03.09.2015 г.], [межд. заявка WO, 2014039436, МПК А61К 38/46, опубл. 13.03.2014 г.], [межд. заявка WO, 2010036408, МПК А61К 38/47, опубл. 1.04.2010 г.], [патент US 9382298, МПК С07К 14/31, опубл. 05.07.2016 г.].
Наиболее близким техническим решением (прототипом) является эндолизин бактериофага Aeribacillus АР45, обладающего литической активностью относительно штамма термофильной бактерии Aeribacillus pallidus 656. Термофильный бактериофаг Aeribacillus АР45 выделен из Долины Гейзеров на Камчатке. (Morozova V, Bokovaya О, Kozlova Y, Kurilshikov A, Babkin I, Tupikin A, Bondar A, Ryabchikova E, Brayanskaya A, Peltek S, Tikunova N. A novel thermophilic Aeribacillus bacteriophage AP45 isolated from the Valley of Geysers, Kamchatka: genome analysis suggests the existence of a new genus within the Siphoviridae family. Extremophiles. 2019 Sep; 23(5):599-612.) [9].
Однако для эндолизина бактериофага АР45 способность разрушать пепетидогликаны клеточных стенок и биопленки представителей рода Staphylococcus не показана.
Основным преимуществом предлагаемого в настоящей заявке на изобретение эндолизина LysAP46 является его термостабильность, а также сочетание активности против мультирезистентных штаммов Staphylococcus aureus (Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus) со способностью разрушать биопленки мультирезистентных коагулазонегативных представителей рода Staphylococcus (Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus), способных вызвать инфекции у человека. Для эндолизина бактериофага АР45, способность разрушать пепетидогликаны клеточных стенок и биопленки представителей рода Staphylococcus не показана.
Техническим результатом заявляемого изобретения является создание такой плазмидной ДНК pQE-70_LysAP46, и на основе нее такого штамма бактерий Escherichia coli, которые обеспечивают синтез термостабильного рекомбинантного эндолизина LysAP46, обладающего гидролитической активностью относительно пептидогликанов клеточных стенок и разрушающего биопленки, сформированных Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, который может быть использован как потенциальный антибактериальный агент.
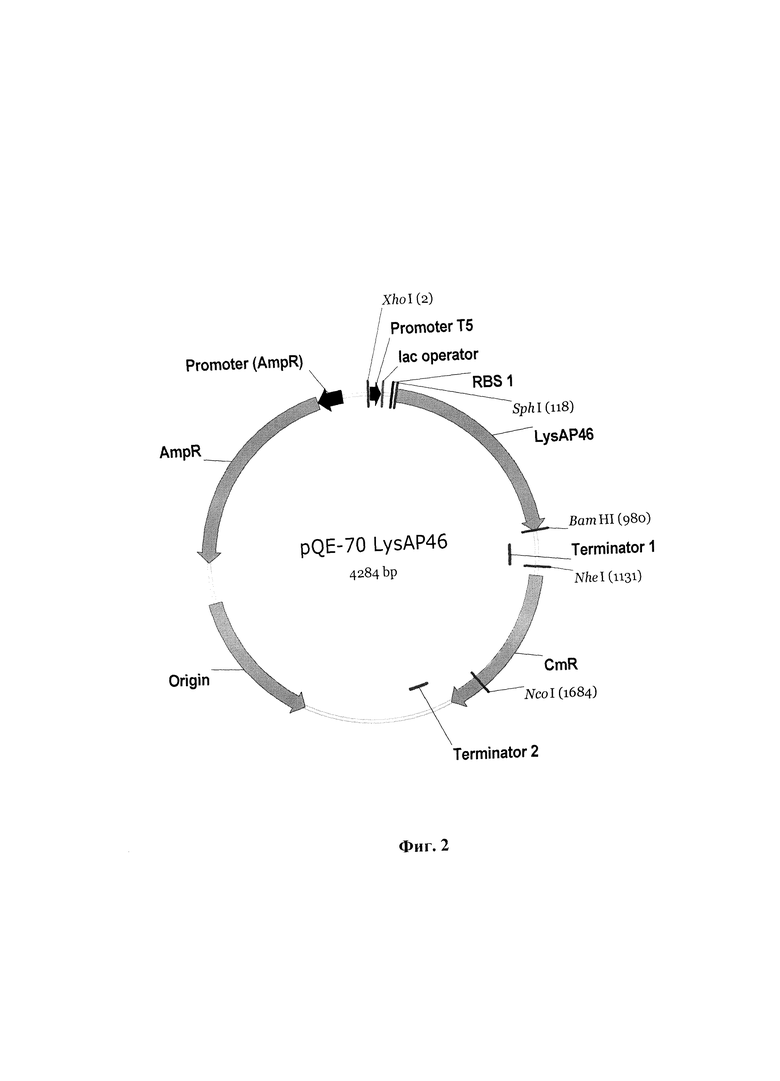
Указанный технический результат достигается тем, что создана рекомбинантная плазмидная ДНК pQE-70_LysAP46, обеспечивающая синтез в клетках Escherichia coli рекомбинантного термостабильного белка эндолизина LysAP46 бактериофага AeriP46, обладающего антибактериальным действием путем лизиса клеточных стенок и разрушения биопленок, сформированных Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, имеющая молекулярную массу 2,65 МДа, размер 4284 п. о., и содержащая в соответствии с физической и генетической картой плазмиды pQE-70_LysAP46, приведенной на фиг. 2, фрагмент плазмидной ДНК, включающий искусственный ген, кодирующий эндолизин LysAP46 бактериофага AeriP46 и С-концевой олигопептид GSRSHHHHHH, имеющие суммарный размер 897 п. о. и нуклеотидную последовательность SEQ ID NO:1, и плазмидный вектор pQE-70, обеспечивающий эффективную транскрипцию и экспрессию указанного искусственного гена, кодирующего рекомбинантный белок LysAP46 бактериофага AeriP46, который состоит из следующих элементов:
- сайта инициации репликации ColE1 из плазмиды pBR322;
- промотора бактериофага Т5/элемент lас-оператора;
- генетических маркеров: АМРr - ген β-лактамазы, определяющий устойчивость к ампициллину при трансформации клеток Escherichia coli;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющими следующие координаты: Sph I - 118, ВаmН I - 980, Nco I - 1684.
Указанный технический результат достигается также тем, что трансформацией штамма Escherichia coli M15 рекомбинантной плазмидной ДНК pQE-70_LysAP46 по п. 2 получен штамм бактерий Escherichia coli M15/pQE-70_LysAP46 - продуцент рекомбинантного термостабильного эндолизина LysAP46 бактериофага AeriP46, обладающего антибактериальным действием.
Указанный технический результат достигается также тем, что получен рекомбинантный термостабильный белок эндолизин LysAP46 бактериофага AeriP46 с молекулярной массой 33 кДа, обладающий антибактериальным действием путем лизиса клеточных стенок и разрушения биопленок, сформированных Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, состоящий из эндолизина LysAP46 бактериофага AeriP46 с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH, и имеющий аминокислотную последовательность SE:Q ID NO:2.
Сущность изобретения заключается в следующем.
Генно-инженерными методами получают плазмиду pQE-70_LysAP46, несущую ген, кодирующий рекомбинантный белок LysAP46, содержащий эндолизин бактериофага AeriP46 с 1 по 288 аминокислотный остаток и С-концевой олигопептид GSRSHHHHHH. Последовательность ДНК, кодирующую эндолизин бактериофага AeriP46 с 1 по 288 аминокислотный остаток, получают на основе ДНК бактериофага AeriP46, обладающего литической активностью относительно бактерий Aeribacillus pallidus 2205.
Клетки Escherihia coli M15 трансформируют сконструированной плазмидой pQE-70_LysAP46 и выращивают в течение ночи. Ночную культуру (1/100) засевают в свежую среду LB с ампициллином (100 мкг/мл). Синтез белка индуцируют добавлением изопропилтиогалактазида до концентрации 0,5 мМ в тот момент, когда культура достигает средне- логарифмической фазы роста. Индуцированные клетки растят 16 часов при 24°С, после чего собирают центрифугированием при 3000 g. Индуцированные клетки Escherihia coli M15/pQE-70_LysAP46 используют для очистки рекомбинантного белка LysAP46, являющего эндолизином бактериофага AeriP46 с помощью аффинной хроматографии. В результате получают рекомбинантный эндолизин LysAP46 бактериофага AeriP46, имеющий молекулярную массу около 33 кДа, состоящий из эндолизина с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH, обладающего гидролитической активностью относительно пептидогликанов клеточных стенок и разрушающего биопленки, сформированные Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, включающий аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 1 (фиг. 1, а).
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pQE-70_LysAP46 являются:
а) плазмидный вектор pQE-70 («QIAGEN», США), обеспечивающий встройку фрагмента ДНК, кодирующего белок LysAP46, являющийся эндолизином бактериофага AeriP46, и его экспрессию под контролем позднего промотора Т5.
б) фрагмент ДНК, кодирующий белок LysAP46, являющийся эндолизином бактериофага AeriP46, который получают в полимеразной цепной реакции с использованием в качестве матрицы ДНК бактериофага AeriP46 и олигонуклеотидных праймеров: endolysin_AeriP46_U25
5' GGCTTGCATGCTTCАААТСААААААС AACTGG3' и endolysin_AeriP46_L23
5' СССAAGGАТССAAAAGTTCCCTCАТТСAACCGTC3', соответствующих 5'- и 3'-концам ДНК, кодирующей белок LysAP46, и обеспечивающих наличие в амплификационном фрагменте сайтов рестрикции SphI и ВаmHI, соответственно. Полученная в результате плазмида pQE-70_LysAP46 (фиг. 2) характеризуется следующими признаками:
- имеет молекулярную массу 2,65 МДа и размер 4284 п. о.;
- кодирует рекомбинантный белок LysAP46, являющийся эндолизином бактериофага AeriP46 и состоящий из эндолизина с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH;
- состоит из следующих элементов: а) фрагмента ДНК, размером 897 п. о., содержащего ген, кодирующий эндолизин LysAP46 бактериофага AeriP46 и олигопептид GSRSHHHHHH.
б) плазмидного вектора pQE-70, обеспечивающего эффективную транскрипцию полученного гена, кодирующего рекомбинантный белок LysAP46 бактериофага AeriP46, и его экспрессию;
- содержит: а) сайт инициации репликации ColE1 из плазмиды pBR322;
б) промотор бактериофага Т5/элемент lас-оператора;
в) генетические маркеры: АМРr - ген β-лактамазы, определяющий устойчивость к ампициллину при трансформации клеток Escherichia coli;
г) искусственный ген, кодирующий белок LysAP46, являющийся эндолизином бактериофага AeriP46, с 1 по 288 аминокислотный остаток, и С-концевой олигопептид GSRSHHHHHH;
д) уникальные сайты узнавания эндонуклеазами рестрикции, имеющими следующие координаты: Sph I (118), BamHI (980), Nco I (1684).
Для получения штамма-продуцента рекомбинантного белка LysAP46 бактериофага AeriP46 компетентные клетки бактерий Escherichia coli M15 ((F, Ф80ΔlacM15, thi, lac-, mtl-, recA+, KmR) трансформируют сконструированной плазмидой pQE-70_LysAP46. Полученный таким образом штамм Escherichia coli M15/pQE-70_LysAP46 характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах.
При росте на агаре "Difko" - колонии круглые, гладкие, прижатые, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB бульоне) образуют интенсивную ровную муть. Клетки растут при температуре 37°С при оптимуме рН от 6.8 до 7.0.
Устойчивость к антибиотику. Клетки проявляют устойчивость к ампициллину (200 мкг/мл), обусловленную наличием плазмиды pQE-70_LysAP46 и к канамицину (до 100 мкг/мл), обусловленную наличием в штамме M15 плазмиды pREP4, несущей ген устойчивости к канамицину и кодирующей репрессор транскрипции.
Штамм Escherichia coli M15/pQE-70_LysAP46 обеспечивает индуцируемый изопропилтиогалактозидом синтез рекомбинантного белка LysAP46 с уровнем экспрессии более 20% суммарного клеточного белка. Индикацию экспрессии осуществляют с помощью гель-электрофореза в денатурирующих условиях (SDS-PAGE). Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси-R250 с использованием программного обеспечения Alfalmage, поставляемого с прибором Alphalmager (Alfalnnotech, США).
Штамм депонирован в Коллекции экстремофильных микроорганизмов и типовых культур ФГБУН Института химической биологии и фундаментальной медицины СО РАН под регистрационным номером №7448. Таким образом, впервые получена плазмидная ДНК и штамм- продуцент, обеспечивающие продукцию в бактериальных клетках Escherichia coli рекомбинантного эндолизина LysAP46, состоящего из эндолизина с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH, обладающего гидролитической активностью относительно пептидогликанов клеточных стенок и разрушающего биопленки, сформированные Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus.
Изобретение иллюстрируется следующими графическими материалами, представленными на фигурах с 1 по 7:
Фиг. 1а. Нуклеотидная последовательность фрагмента плазмиды pQE-70_LysAP46, кодирующего рекомбинантный эндолизин LysAP46 бактериофага AeriP46, состоящий из эндолизина с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH.
Фиг. 1б. Аминокислотная последовательность рекомбинантного эндолизина LysAP46 бактериофага AeriP46.
Фиг. 2. Общая схема структурной организации плазмиды pQE-70_LysAP46 (физическая карта). LysAP46 - ген, кодирующий рекомбинантный эндолизин LysAP46, Т5 - промотор фага Т5, AmpR- ген устойчивости к ампициллину; указаны некоторые сайты рестрикции.
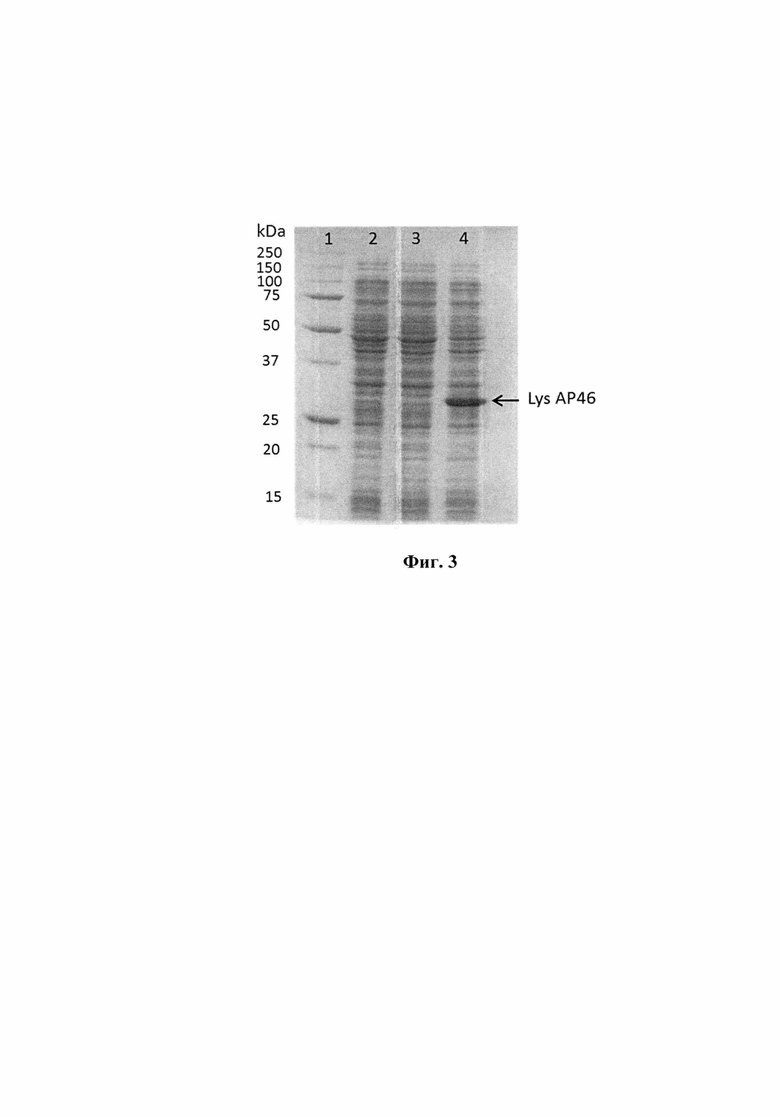
Фиг. 3. Электрофоретический анализ лизатов клеток Escherichia coli в 12,5% полиакриламидном геле с SDS. Дорожки: 1 - белковый маркер; 2 - культура клеток исходного штамма Escherichia coli M15, индуцированная ИПТГ (изопропилтиогалактозид); 3 - культура клеток Escherichia coli M15/pQE-70, индуцированная ИПТГ; 4 - культура клеток Escherichia coli M15/pQE-70_LysAP46, индуцированная ИПТГ. Слева приведены величины молекулярных весов в кДа.
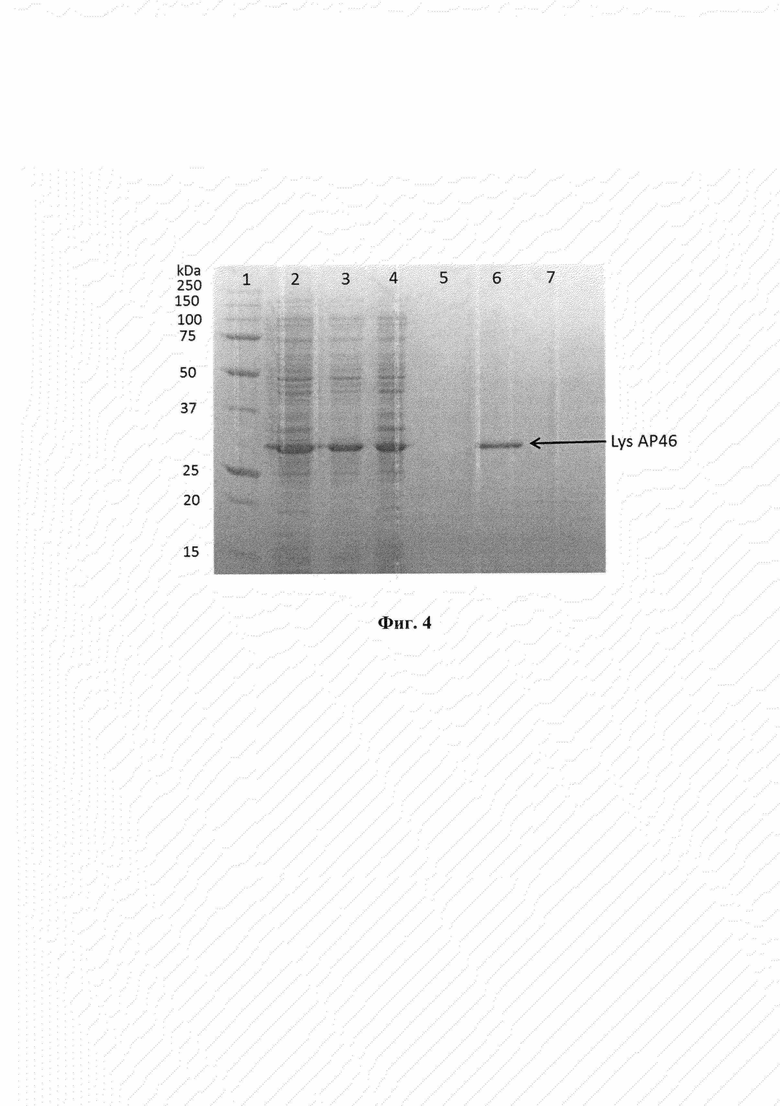
Фиг. 4. Электрофоретический анализ клеточных и белковых фракций Escherichia coli M15/pQE-70_LysAP46 в 12,5% полиакриламидном геле с SDS. Дорожки: 1 - белковый маркер; 2 - лизат клеток Escherichia coli M15/pQE-70, индуцированных ИПТГ; 3 - фракция растворимых белков цитоплазмы из клеток Escherichia coli M15/pQE-70_LysAP46, индуцированных ИПТГ; 4 - фракция телец включения из клеток Escherichia coli M15/pQE-70_LysAP46, индуцированных ИПТГ; 5 - элюат 25 мМ имидазолом с хроматографической колонки с Ni-NTA агарозой с нанесенной фракцией растворимых белков цитоплазмы из клеток Escherichia coli M15/pQE-70_LysAP46, индуцированных ИПТГ; 6 - элюат 100 мМ имидазолом с той же колонки. Слева приведены величины молекулярных весов в кДа.
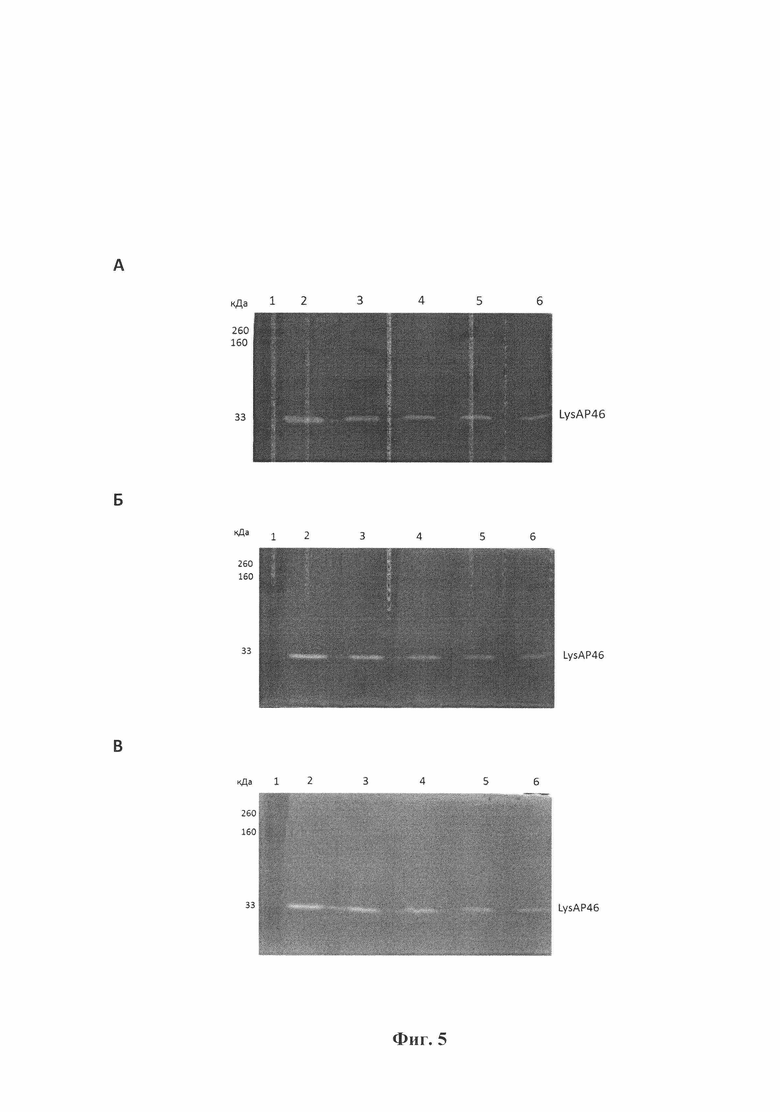
Фиг. 5. Зимографический анализ гидролитических свойств эндолизина LysAP46 относительно клеточной стенки Staphylococcus aureus КЭМТК 1685 (А); клеточной стенки Staphylococcus epidermidis КЭМТК 2043 (Б); клеточной стенки Staphylococcus haemolyticus КЭМТК 3413 (В). Дорожки: 1 - белковый маркер; 2, 3, 4, 5 и 6 - нанесено по 1,6 мкг, 0,8 мкг, 0,4 мкг, 0,2 мкг и 0,1 мкг эндолизина LysAP46 в каждый из гелей. Слева приведены величины молекулярных весов в кДа.
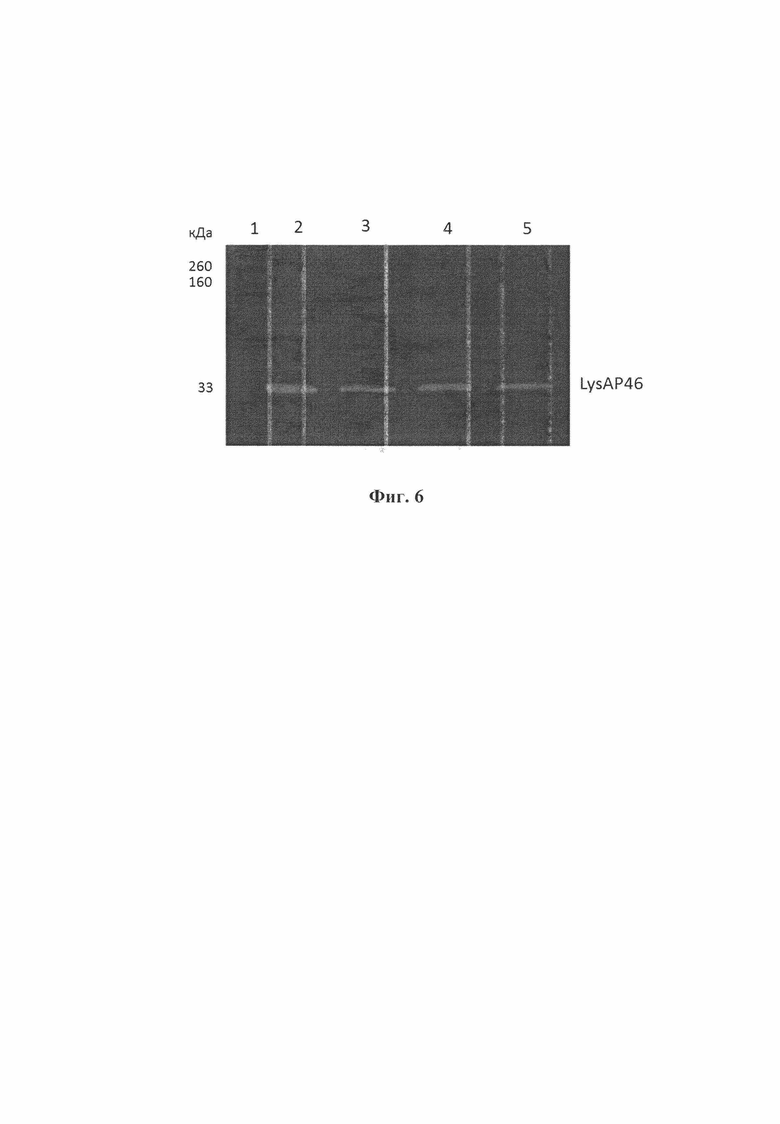
Фиг. 6. Зимографический анализ гидролитических свойств эндолизина LysAP46 после прогревания при 60°С, 70°С и 80°С в течение 30 минут относительно клеточной стенки штамма Staphylococcus aureus КЭМТК 1685. Дорожки: 1 - белковый маркер; 2 - эндолизин LysAP46 после прогревания при 60°С; 3 - эндолизин LysAP46 после прогревания при 70°С; 4 -эндолизин LysAP46 после прогревания при 80°С. Слева приведены величины молекулярных весов в кДа.
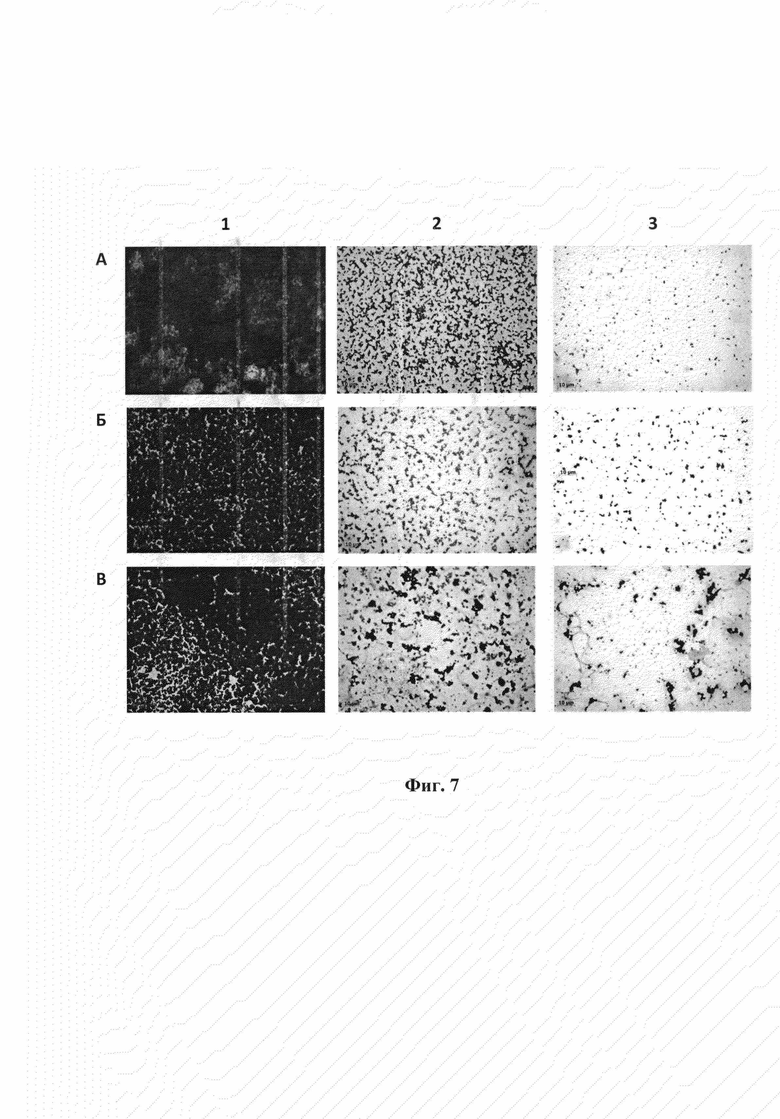
Фиг.7. Образцы биопленок Staphylococcus aureus КЭМТК 1685 (А), Staphylococcus epidermidis КЭМТК 2043 (Б) и Staphylococcus haemolyticus КЭМТК 3413 (В). 1 - образцы биопленок, на которые нанесен 0,9% NaCl; 2 и 3 - образцы биопленок соответственно через 3 и 6 часов после нанесения эндолизина LysAP46.
Для лучшего понимания сущности предлагаемого изобретения оно иллюстрируется следующими примерами его осуществления.
Пример 1. Способ конструирования плазмиды pQE-70_LysAP46. В качестве источника гена, кодирующего белок LysAP46 бактериофага AeriP46, была использована геномная ДНК бактериофага AeriP46. Амплификацию гена, кодирующего белок LysAP46 бактериофага AeriP46, проводят методом ПЦР с использованием Taq-ДНК-полимеразой («Fermentas»). Для синтеза фрагмента ДНК, кодирующего белок LysAP46, в реакционную смесь добавляют endolysin_AeriP46_U25
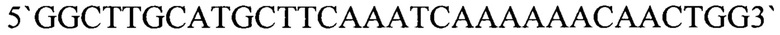 и
и
endolysin_AeriP46_L23
 , соответствующие 5'- и 3'- концам ДНК, кодирующей белок LysAP46 и обеспечивающие в амплификационном фрагменте наличие сайтов рестрикции SphI и BamHI соответственно. Реакцию проводят в амплификаторе «GeneAmp PCR System 9700» («Applied Biosystems», США). Условия проведения ПЦР: предварительная денатурация - 2 минуты при 94°С; 30 циклов - 30 секунд при 95°С, 30 секунд при 50°С, 1 минута 40 секунд при 72°С; заключительная стадия - 10 минут при 72°С.Продукт аплификации, кодирующий белок LysAP46, расщепляют ферментами рестрикции SphI и BamHI в реакционной смеси, содержащей 10 мМ Трис-HCl, рН 7.6, 10 мМ MgCl2, 50 мМ NaCl, 1 mM DTT и по 5 ед. активности соответствующих ферментов. Аналогично ведут обработку рестриктазами ДНК векторной плазмиды pQE-70. Реакцию ведут 2 часа при 37°С. После этого ПЦР-фрагмент и линеаризованный вектор очищают электрофоретически в 1% агарозном геле с последующим выделением ДНК с помощью набора GeneJET™ Gel Extraction Kit («Fermentas») в соответствии с рекомендациями производителя. В стандартном буфере проводят лигирование. Полученной лигазной смесью трансформируют клетки Escherichia coli M15. С помощью рестрикционного анализа и полимеразной цепной реакции отбирают клоны, содержащие вставку нужного размера. Полученную таким образом целевую плазмиду обозначают как pQE-70_LysAP46. Схема плазмидной ДНК pQE-70_LysAP46 (физическая карта) представлена на фиг. 2.
, соответствующие 5'- и 3'- концам ДНК, кодирующей белок LysAP46 и обеспечивающие в амплификационном фрагменте наличие сайтов рестрикции SphI и BamHI соответственно. Реакцию проводят в амплификаторе «GeneAmp PCR System 9700» («Applied Biosystems», США). Условия проведения ПЦР: предварительная денатурация - 2 минуты при 94°С; 30 циклов - 30 секунд при 95°С, 30 секунд при 50°С, 1 минута 40 секунд при 72°С; заключительная стадия - 10 минут при 72°С.Продукт аплификации, кодирующий белок LysAP46, расщепляют ферментами рестрикции SphI и BamHI в реакционной смеси, содержащей 10 мМ Трис-HCl, рН 7.6, 10 мМ MgCl2, 50 мМ NaCl, 1 mM DTT и по 5 ед. активности соответствующих ферментов. Аналогично ведут обработку рестриктазами ДНК векторной плазмиды pQE-70. Реакцию ведут 2 часа при 37°С. После этого ПЦР-фрагмент и линеаризованный вектор очищают электрофоретически в 1% агарозном геле с последующим выделением ДНК с помощью набора GeneJET™ Gel Extraction Kit («Fermentas») в соответствии с рекомендациями производителя. В стандартном буфере проводят лигирование. Полученной лигазной смесью трансформируют клетки Escherichia coli M15. С помощью рестрикционного анализа и полимеразной цепной реакции отбирают клоны, содержащие вставку нужного размера. Полученную таким образом целевую плазмиду обозначают как pQE-70_LysAP46. Схема плазмидной ДНК pQE-70_LysAP46 (физическая карта) представлена на фиг. 2.
Пример 2. Получение штамма-продуцента рекомбинантного белка LysAP46 стафилококкового бактериофага AeriP46 продукта плазмиды pQE-70_LysAP46.
Клетки Escherichia coli M15 трансформируют полученной плазмидой pQE-70_LysAP46. Клетки Escherichia coli M15, трансформированные плазмидой pQE-70_LysAP46, растят ночь при 37°С. Ночную культуру засевают в свежую среду LB с ампициллином (100 мкг/мл). Синтез РНК-полимеразы индуцируют добавлением изопропилтиогалактазида до концентрации 0,5 мМ в тот момент, когда культура достигает среднелогарифмической фазы роста. Индуцированные клетки растят ночь при 24°С, после чего собирают центрифугированием при 3000 g и анализируют методом электрофореза по Лэммли в 12,5% SDS-полиакриламидном геле (ПААГ) [10]. Результаты этого анализа, представленные на фиг. 3, показывают наличие в индуцированной культуре клеток Escherichia coli M15/pQE-70_LysAP46 дополнительного белка с молекулярной массой около 33 кДа, что соответствует расчетной молекулярной массе рекомбинантного белка LysAP46 (дорожка 4), который отсутствует в контрольном лизате индуцированных клеток Escherichia coli M15/pQE-70 (дорожка 3) и клеток исходного штамма Escherichia coli M15 (дорожка 2).
Пример 3. Очистка рекомбинантного белка LysAP46 из клеток Е. coli M15/pQE-70_LysAP46.
Эндолизин LysAP46 получают из цитоплазматической фракции индуцированных бактериальных клеток в результате аффинной хроматографии на Ni-NTA агарозе (Sigma, США) согласно инструкции производителя. Индуцированные клетки Escherichia coli M15/pQE-70_LysAP46 осаждают центрифугированием при 3000 g в течение 10 мин. Осадок растворяют в 1/10 объема буфера, содержащего 50 мМ Трис-НСl, рН 8.0, и разрушают с помощью ультразвукового дезинтегратора. Полученную суспензию центрифугируют при 16000 g в течение 10 минут, после чего переносят супернатант, представляющий собой раствор цитоплазматических белков, в чистую пробирку.
На хроматографическую колонку, содержащую 1 мл Ni-NTA агарозы (Sigma, США) и уравновешенную буфером А, содержащим 50 мМ Na-фосфатный буфер рН 8.0, 300 мМ NaCl, 5 мМ Трис-HCl, наносят 6 мл цитоплазматической фракции индуцированных клеток со скоростью потока 1 мл/мин. Колонку промывают 20 мл буфера А, после чего проводят предварительную элюцию неспецифически сорбирующихся белков E.coli 20 мл буфера А, содержащего дополнительно 25 мМ имидазола. Рекомбинантный пептид элюируют 10 мл буфера А, содержащего 100 мМ имидазола, а затем проводят дополнительную элюцию в денатурирующих условиях 10 мл буфера, содержащего 50 мМ Трис-HCl рН 8.0, 6 М гуанидин-HCl. Полученные белковые фракции диализуют против 150 мМ NaCl, Трис-HCl рН 7.5 (две смены по 18 ч при 5°С). Таким образом получают рекомбинантный эндолизин LysAP46 в растворимой форме, очищенный от других белков Е. coli, и анализируют электрофорезом в 12,5% ПААГ с SDS по Лэммли [10], приготавливая образцы для нанесения на гель в присутствии 2-меркаптоэтанола. Пример электрофоретического анализа приведен на фиг. 4.
Определение концентрации рекомбинантного эндолизина LysAP46 в препаратах проводят по методу Брэдфорда [11]. Для построения калибровочной кривой используют бычий сывороточный альбумин (Serva, США). Определение концентрации белка показывает, что общий выход составляет около 20 мг из 1 л культуры клеток Escherihia coli.
Пример 4. Оценка гидролитических свойств рекомбинантного белка LysAP46.
Проверку активности рекомбинантного эндолизина LysAP46 проводят методом зимографии. Выделяют ряд образцов клеточных стенок, содержащих пептидогликан из штамма Staphylococcus aureus КЭМТК 675, а также штаммов стафилококков, обладающих устойчивостью к двум и более антибиотикам из разных групп: Staphylococcus aureus КЭМТК 1685, Staphylococcus aureus КЭМТК 1733, Staphylococcus epidermidis КЭМТК 2043, Staphylococcus epidermidis КЭМТК 2079, Staphylococcus haemolyticus КЭМТК 3413 и Staphylococcus haemolyticus КЭМТК 3753.
Выделение клеточной стенки проводят согласно методике Fukushima Т., et al [12]. Бактериальную культуру растят до стационарной фазы (OD600=1-1.5) в 1 л питательной среды LB при температуре 37°С при постоянном перемешивании. Клетки осаждают центрифугированием в течение 10 минут при 10 000 g. Осадок ресуспендируют в 8 мл 4 М LiCl и кипятят на водяной бане 15 минут. Полученную суспензию центрифугируют при 11000 g в течение 10 минут. Осадок ресуспендируют в 5 мл деионизованной воды Milli-Q и разрушают на ультразвуковом дезинтеграторе в течение 30 минут, и снова центрифугируют при 11000 g в течение 10 минут. Супернатант удаляют, осадок ресуспендируют в 10 мл 4% SDS и кипятят на водяной бане 15 минут. Полученную суспензию центрифугируют 10 минут при 11000 g, при комнатной температуре. Полученный осадок ресуспендируют в 10 мл 1М NaCl и вновь центрифугируют (10 минут, 11000g). Последнюю процедуру повторяют еще 1-2 раза, до обесцвечивания осадка. Осадок ресуспендируют в 2-3 мл деионизованной воды Milli-Q, полученную суспензию центрифугируют 10 минут при 11000g. Промывку повторяют 2 раза. Осадок ресуспендируют в 1-2 мл воды Milli-Q, добавляют азид натрия до итоговой концентрации 0,02% и хранят при 4°С. Для оценки концентрации измеряют оптическую плотность раствора на спектрофотометре. OD540=1.0 соответствует концентрации клеточной стенки 1 мг/мл.
Электрофоретический анализ проводят в 12,5% ПААГ с 0,1% SDS по Лэммли, в разделяющий гель добавляют пептидогликан клеточной стенки бактерий до концентрации 0.1 мг/мл, лизирующий буфер для нанесения образцов готовят без добавления DTT. После проведения электрофореза гель осторожно отмывают в воде milli-Q, переносят в 30-40 мл ренатурирующего буфера (25 мМ трис-HCl, 1% Triton Х-100, рН 7.2) и инкубируют при 37°С в течение 1-2 часов. После чего гель окрашивают в растворе метиленового синего (0.01%) (w/v) метиленового синего и 0.01% КОН в деионизованной воде) и отмывают в деионизованной воде.
Результаты (фиг. 5 А, Б, В) подтвердили, что эндолизин LysAP46 проявляет гидролитическую активность в отношении клеточных стенок Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, в том числе и штаммы, обладающие устойчивостью к двум и более антибиотикам из разных классов.
Пример 5. Исследование термостабильности рекомбинантного белка LysAP46.
Наличие термостабильности у эндолизина LysAP46 проверяют методом зимографии после инкубации при 60°С, 70°С и 80°С в течение 30 минут. Выделяют ряд образец клеточных стенок, содержащих пептидогликан, из Staphylococcus aureus КЭМТК 1685.
Электрофоретический анализ проводят в 12,5% ПААГ с 0,1% SDS по Лэммли, в разделяющий гель добавляют пептидогликан клеточной стенки бактерий до концентрации 0.1 мг/мл, лизирующий буфер для нанесения образцов готовят без добавления DTT. После проведения электрофореза гель осторожно отмывают в воде milli-Q, переносят в 30-40 мл ренатурирующего буфера (25 мМ трис-HCl, 1% Triton Х-100, рН 7.2) и инкубируют при 37°С в течение 1-2 часов. После чего гель окрашивают в растворе метиленового синего (0.01% (w/v) метиленового синего и 0.01% КОН в деионизованной воде) и отмывают в деионизованной воде.
Результаты (фиг. 6) подтвердили, что эндолизин LysAP46 после его инкубации при 60°С, 70°С и 80°С в течение 30 минут проявляет гидролитическую активность в отношении клеточной стенки Staphylococcus aureus КЭМТК 1685.
Пример 6. Разрушение рекомбинантным эндолизином LysAP46 биопленок, сформированных Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus.
Наличие у эндолизина LysAP46 гидролитической активности в отношении биопленок, сформированных стафилококками, показывают на примере биопленок, образованных штаммами стафилококков, обладающих устойчивостью к двум и более антибиотикам из разных групп: Staphylococcus aureus КЭМТК 1733, Staphylococcus epidermidis КЭМТК 2043, Staphylococcus haemolyticus КЭМТК 3413.
Биопленки получают на поверхности покровных стекол, помещенных в чашки Петри. Клетки суспендируют в 200 мкл стерильного раствора 0,9М NaCl до концентрации 109 КОЕ/мл. Полученную суспензию добавляют в 10 мл питательной среды LB, тщательно перемешивают и вносят в чашку Петри, на дне которой находятся предварительно простерилизованные покровные стекла. Для формирования биопленки на покровных стеклах закрытую чашку инкубируют в течение 2-5 суток при 37°С. По истечении необходимого для роста биопленки времени покровные стекла с биопленкой изымают из среды LB. Качество биопленок контролируют микроскопией (Zeiss Axio Imager A2, Carl Zeiss, Германия). На полученные биопленки наносят по 50 мкл эндолизин LysAP46 с концентрацией 0,1 мг/мл, в контрольный образец - стерильный раствор 0,9М NaCl, и инкубируют 3 часа при температуре 37°С. Результаты эксперимента оценивают после окрашивания биопленок метиловым фиолетовым под микроскопом Zeiss Axio Imager А2 (Carl Zeiss, Германия). На контрольных образцах биопленок, сформированных Staphylococcus aureus КЭМТК 1733, Staphylococcus epidermidis КЭМТК 2043 и Staphylococcus haemolyticus КЭМТК 3413, на которые наносят физиологический раствор, обширный матрикс биопленки плотно заполнен бактериями, окрашенными метиловым фиолетовым (рис. 7). В образцах биопленок, сформированных Staphylococcus aureus КЭМТК 1733 (фиг. 7, A), Staphylococcus epidermidis КЭМТК 2043 (фиг. 7, Б) и Staphylococcus haemolyticus КЭМТК 3413 (фиг. 7, В), на которые наносят эндолизин LysAP46 наблюдаются остатки матрикса биопленок, в котором еще располагается некоторое количество стафилококков (фиг. 7). Однако по сравнению с контрольным образцом это количество незначительно.
Из изложенного выше видно, что получены плазмидная ДНК и бактериальный штамм-продуцент, обеспечивающие экспрессию рекомбинантного эндолизина LysAP46, имеющего молекулярную массу около 33 кДа, состоящего из эндолизина LysAP46 с 1 по 288 аминокислотный остаток и С-концевого олигопептида GSRSHHHHHH, включающий аминокислотную последовательность (SEQ ID NO:2), кодируемую нуклеотидной последовательностью SEQ ID NO: 1. (фиг. 1, а, б). Рекомбинантный эндолизин LysAP46 бактериофага AeriP46 обладает антибактериальной активностью за счет гидролитической активности относительно пептидогликанов клеточных стенок и разрушения биопленки коагулазоположительных и коагулазоотрицательных представителей рода Staphylococcus, а именно Staphylococcus aureus, Staphylococcus epidermidis и Staphylococcus haemolyticus, способных вызывать инфекцию у человека.
Источники научно-технической и патентной информации
1. Lee, A.S.; Lencastre, Н.; Garau, J.; Kluytmans, J.; Malhotra-Kumar, S.; Peschel, A.; Harbarth, S. Methicillin-resistant Staphylococcus aureus. // Nature Reviews Disease Primers, 2018, 4, 18033.
2. Becker, K.; Heilmann, C; Peters, G. Coagulase-Negative Staphylococci. // Clinical Microbiology Reviews. 2014, 27(4), 870-926.
3. Otto, M. Staphylococcus epidermidis Pathogenesis. // Methods Mol Biol, 2014, 1106, 17-31.
4. Paharik, A.E.; Horswill, A.R. The Staphylococcal Biofilm: Adhesins, Regulation, and Host Response. // Virulence Mechanisms of Bacterial Pathogens. 2016, 50, 529-566.
5. Szweda, P.; Schielmann, M.; Kotlowski, R.; Gorczyca, G.; Zalewska, M.; Milewski, S. Peptidoglycan hydrolases-potential weapons against Staphylococcus aureus. // Applied Microbiology and Biotechnology, 2012, 96(5), 1157-1174.
6. Bardasheva, A.; Tikunov, A.; Kozlova, Y.; Zhirakovskaia, E.; Fedorets, V.; Fomenko, N.; Kalymbetova, Т.; Chretien, S.; Pavlov, V.; Tikunova, N.; Morozova, V. Antibiotic Resistance and Pathogenomics of Staphylococci Circulating in Novosibirsk, Russia. // Microorganisms, 2021, 9(12), 2487.
7. Schmelcher, M.; Donovan, D.M.; Loessner, M.J. Bacteriophage endolysins as novel antimicrobials. // Future Microbiol. 2012, 7(10), 1147-1171.
8. Abdelrahman, F.; Easwaran, M.; Daramola, O.; Ragab, S.; Lynch, S.; Oduselu, T.J.; Khan, F.M.; Ayobami, A.; Adnan, F.; Torrents, E.; Sanmukh, S.; El-Shibinyl, A. Phage-Encoded Endolysins, // Antibiotics (Basel). 2021, 10(2), 124.
9. Morozova V, Bokovaya O, Kozlova Y, Kurilshikov A, Babkin I, Tupikin A, Bondar A, Ryabchikova E, Brayanskaya A, Peltek S, Tikunova N. A novel thermophilic Aeribacillus bacteriophage AP45 isolated from the Valley of Geysers, Kamchatka: genome analysis suggests the existence of a new genus within the Siphoviridae family. Extremophiles. 2019 Sep;23(5):599-612. (прототип).
10. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. // Nature. - 1970. - V. 227. - P. 680-685.
11. Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. // Anal. Biochem. - 1976. - V.72. - P. 248-254.
12. Fukushima, Т.; Sekiguchi, J. Zymographic Techniques for the Analysis of Bacterial Cell Wall in Bacillus. // Methods Mol Biol. 2016, 1440, 87-98.
13. Патент ЕР, 2200442, МПК C07K 14/005, опубл. 30.06.2010 г.
14. Патент RU, 2715694, МПК А61Р 31/04, опубл. 02.03.2020 г.
15. Патент KR, 20170087770, МПК С07К 14/005, опубл. 31.07.2017 г.
16. Патент CN, 106636050, МПК А61К 38/51, опубл. 10.05.2017 г.
17. Заявка US, 2016090584, МПК C12N 9/80, опубл. 31.03.2016 г.
18. Заявка US, 2015247138, МПК А61К 38/47, опубл. 03.09.2015 г.
19. Межд. заявка WO, 2014039436, МПК А61К 38/46, опубл. 13.03.2014 г.
20. Межд. заявка WO, 2010036408, МПК А61К 38/47, опубл. 1.04.2010 г.
21. Патент US 9382298, МПК С07К 14/31, опубл. 05.07.2016 г.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="Перечень последовательностей LysAP46.xml"
softwareName="WIPO Sequence" softwareVersion="2.2.0"
productionDate="2022-11-21">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1234567</ApplicationNumberText>
<FilingDate></FilingDate>
</ApplicationIdentification>
<ApplicantFileReference> 1</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное учреждение науки Институт химической биологии и
фундаментальной медицины Сибирского отделения Российской академии
наук </ApplicantName>
<ApplicantNameLatin>Institute of Chemical Biology and Fundamental
Medicine, Siberian Branch of the Russian Academy of Sciences
</ApplicantNameLatin>
<InventionTitle languageCode="ru">Рекомбинантная плазмидная ДНК
pQE-70_LysAP46, обеспечивающая синтез рекомбинантного белка LysAP46,
штамм бактерий Escherichia coli - продуцент рекомбинантного белка
LysAP46 и рекомбинантный белок LysAP46, обладающий антибактериальным
действием</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>897</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..897</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgttacaaattaaaaaacaactggtctcctccagaaagaatacctaca
cgggtataaatggacgtaaatatataaccattcatgaaactgacaatacgaataaaggcgcaaatgctca
agcacatgcaaacgtgcagtcgaggggaaattcaagatcagcttcatggcattggacagttgatgacaaa
gaagccatacaatcttttccgcatacgctccgctgttgggctgctggagacggcgacggaaacggaaact
ttaactctattcatattgaaatatgtgtcaacagtgagggtgattttaataaagctgttgaaaatgcggc
agcacttacaagaatgattatggaacaagaaaatattccactttcgaatgtagttcaacacaaccattgg
agtgggaaaaactgcccacgtaatctgagatcgggttctaaaggtatgacgtggaatgattttgtaaata
tggttgttgggaaaaaggttgatacaccaaaaaaagaactaaagcccgcacaaacaaaaaataaaacgaa
tatcatagttgacggaaaatgggggagtgaaacgacaaaagcgctacaaaaagcgttaggaacggtagta
gatggggtgattagcagtcaaccgcggaaccacgtaacggcagctatttacgacggaatcacttggggaa
caaaaggctccatgatggtacgtgcattacaaaagaaagtgggcgctaaggttaacgggaaattagactc
ggaaacaatccgcaagttacaaaaatatctcggtacgccgatagatgggaaaatcagcagaccagaatct
ttgatggtgaaagagttgcaaagacggttgaatgagggaacttttggatccagatctcatcaccatcacc
atcactaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>298</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..298</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MLQIKKQLVSSRKNTYTGINGRKYITIHETDNTNKGANAQAHANVQSRG
NSRSASWHWTVDDKEAIQSFPHTVRCWAAGDGDGNGNFNSIHIEICVNSEGDFNKAVENAAALTRMIMEQ
ENIPLSNVVQHNHWSGKNCPRNLRSGSKGMTWNDFVNMVVGKKVDTPKKELKPAQTKNKTNIIVDGKWGS
ETTKALQKALGTVVDGVISSQPRNHVTAAIYDGITWGTKGSMMVRALQKKVGAKVNGKLDSETIRKLQKY
LGTPIDGKISRPESLMVKELQRRLNEGTFGSRSHHHHHH</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---


Изобретение относится к биотехнологии. Предложен рекомбинантный термостабильный белок эндолизин LysAP46 с молекулярной массой 33 кДа, обладающий антибактериальным действием путем лизиса клеточных стенок и разрушения биопленок, сформированных Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus, состоящий из эндолизина LysAP46 и С-концевого олигопептида GSRSHHHHHH и имеющий размер 298 а.о. и аминокислотную последовательность SEQ ID NO: 2. Также предложена рекомбинантная плазмидная ДНК pQE-70_LysAP46, обеспечивающая синтез в клетках Escherichia coli указанного рекомбинантного термостабильного белка эндолизина LysAP46 и штамм бактерий Escherichia coli М15/pQE-70_LysAP46 - продуцент указанного рекомбинантного термостабильного белка эндолизина LysAP46, полученный трансформацией штамма Escherichia coli M15 указанной рекомбинантной плазмидной ДНК pQE-70_LysAP46. Изобретение обеспечивает эффективный синтез термостабильного рекомбинантного эндолизина LysAP46, обладающего гидролитической активностью относительно пептидогликанов клеточных стенок и разрушающего биопленки представителей рода Staphylococcus. 3 н.п. ф-лы, 7 ил., 6 пр.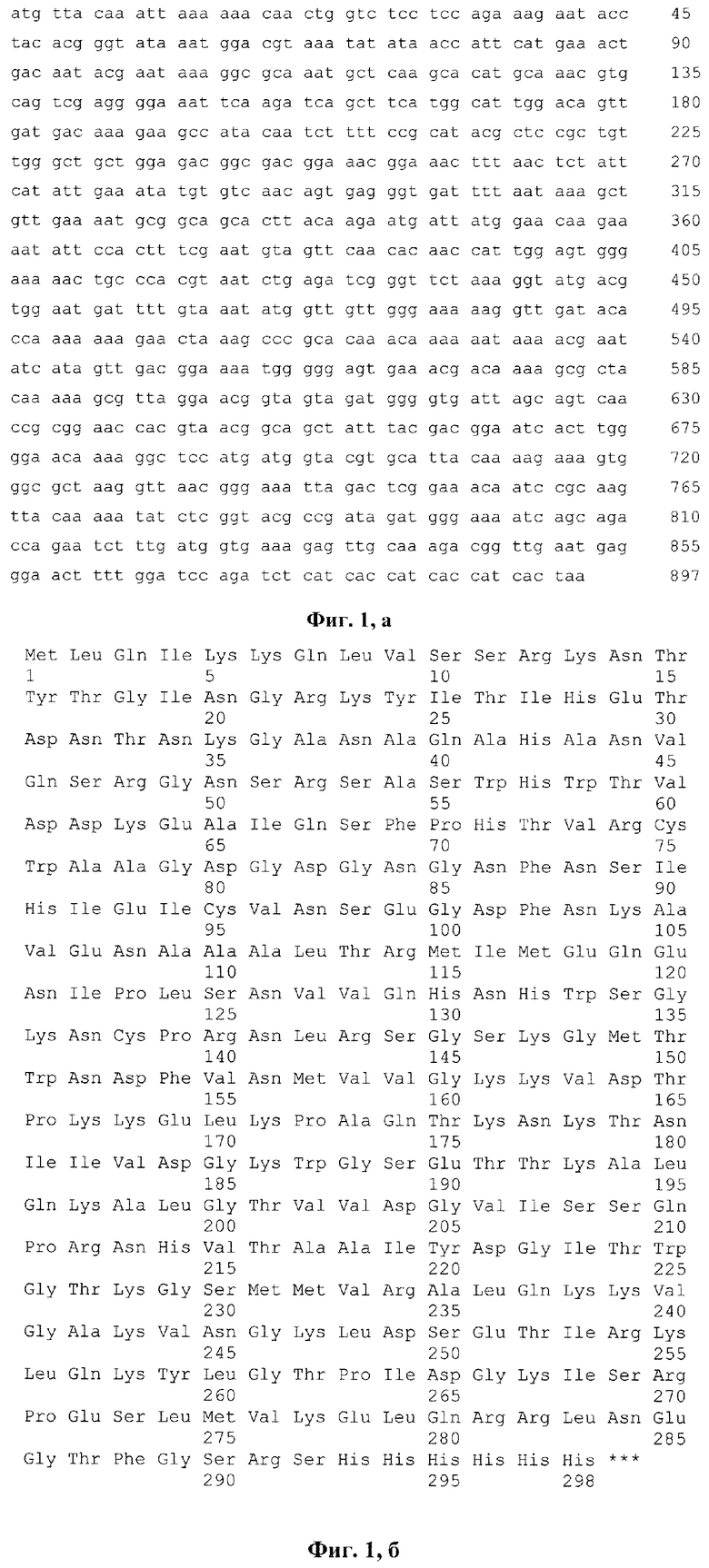
1. Рекомбинантный термостабильный белок эндолизин LysAP46 с молекулярной массой 33 кДа, обладающий антибактериальным действием путем лизиса клеточных стенок и разрушения биопленок, сформированных Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus, состоящий из эндолизина LysAP46 и С-концевого олигопептида GSRSHHHHHH и имеющий размер 298 а.о. и аминокислотную последовательность SEQ ID NO: 2.
2. Рекомбинантная плазмидная ДНК pQE-70_LysAP46, обеспечивающая синтез в клетках Escherichia coli рекомбинантного термостабильного белка эндолизина LysAP46 по п. 1, обладающего антибактериальным действием путем лизиса клеточных стенок и разрушения биопленок, сформированных Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus, имеющая молекулярную массу 2,65 МДа, размер 4284 п.о. и содержащая в соответствии с физической и генетической картой плазмиды pQE-70_LysAP46, приведенной на фиг.2, фрагмент плазмидной ДНК, включающий искусственный ген, кодирующий эндолизин LysAP46 и С-концевой олигопептид GSRSHHHHHH, имеющие суммарный размер 897 п.о. и нуклеотидную последовательность SEQ ID NO: 1, и плазмидный вектор pQE-70, обеспечивающий эффективную транскрипцию и экспрессию указанного искусственного гена, кодирующего рекомбинантный белок LysAP46, который состоит из следующих элементов:
- сайт инициации репликации ColE1 из плазмиды pBR322;
- промотор бактериофага Т5/элемент lac-оператора;
- генетические маркеры: AMPr - ген β-лактамазы, определяющий устойчивость к ампициллину при трансформации клеток Escherichia coli;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющими следующие координаты: Sph I - 118, ВатН I - 980, Nco I - 1684.
3. Штамм бактерий Escherichia coli М15/pQE-70_LysAP46 - продуцент рекомбинантного термостабильного белка эндолизина LysAP46 по п. 1, обладающего гидролитическим действием по отношению к клеточным стенкам Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus и в отношении биопленок, сформированных Staphylococcus aureus, Staphylococcus epidirmidis и Staphylococcus haemolyticus, полученный трансформацией штамма Escherichia coli M15 рекомбинантной плазмидной ДНК pQE-70_LysAP46 по п. 2.
| MOROZOVA V | |||
| et al | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| Extremophiles | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено онлайн: | |||
Авторы
Даты
2023-12-19—Публикация
2022-12-07—Подача