Изобретение относится к области микробиологии и биотехнологии, в частности к получению биологически активных веществ с помощью микроорганизмов.
На фоне недостатка высокоэффективных фармакологических средств для лечения социально-значимых заболеваний актуальной задачей является синтез новых химических соединений с выраженной биологической активностью, в том числе на основе растительных терпеноидов [Calixto J.В. The role of natural products in modern drug discovery. An. Acad. Bras. Cienc. 2019. V. 91. е20190105]. В этом плане одной из интенсивно разрабатываемых групп соединений являются растительные пентациклические тритерпеноиды, в частности олеаноловая кислота (3β-гидроксиолеан-12-ен-28-овая кислота, CAS 508-02-1). Олеаноловая кислота активно используется для получения новых полусинтетических производных с противовирусной, противомикробной, противовоспалительной, противоопухолевой и гепатопротекторной активностью [Huang L.R., Luo Н., Yang X.S., Chen L., Zhang J.X., Wang D.P., Нао X.J. Enhancement of anti-bacterial and anti-tumor activities of pentacyclic triterpenes by introducing exocyclic α,β-unsaturated ketone moiety in ring A. Med. Chem. Res. 2014. V. 23. P. 4631-4641; Wiemann J., Heller L., Csuk R. Targeting cancer cells with oleanolic and ursolic acid derived hydroxamates. Bioorg. Med. Chem. Lett. 2016. V. 26. P. 907-909; Zou L.W., Dou T.Y., Wang P., Lei W., Weng Z.M., Hou J., Wang D.D., Fan Y.M., Zhang W.D., Ge G.B. et al. Structure-activity relationships of pentacyclic triterpenoids as potent and selective inhibitors against human carboxylesterase 1. Front. Pharmacol. 2017. V. 8. 435; Patent US 11266632, 2022; Патент RU 2786134, 2022]. В настоящее время синтез новых тритерпеновых производных (олеаноловой кислоты, в частности) осуществляется в основном с использованием химических методов, которые реализуются в условиях экстремальных показателей кислотности, температуры, часто требуют применения дорогостоящих катализаторов и введения защитных групп реакционно-активных центров молекулы.
Наряду с химической модификацией, предпринимаются попытки биологической трансформации олеаноловой кислоты с использованием микроорганизмов. Это обусловлено их исключительной регио- и стереоселективностью, широким кругом метаболизируемых субстратов, отсутствием проблемы минимизации побочных реакций или необходимости введения и снятия защитных групп. Кроме того, микроорганизмы способны проводить селективную модификацию сайтов молекулы тритерпеноида, которые не доступны или модификация которых протекает с низкой эффективностью в условиях синтетических превращений [Shah S.А. А., Tan Н.L., Sultan S., Faridz M.А. В. М., Shah М.А. В. М., Nurfazilah S., Hussain М. Microbial-catalyzed biotransformation of multifunctional triterpenoids derived from phytonutrients. Int. J. Mol. Sci. 2014. V. 15. P. 12027-12060]. Такая функционализация молекул тритерпеноидов путем биокаталитического введения кислородсодержащих групп (например, гидроксильных и карбоксильных) позволяет расширить спектр новых биологически активных производных или практически значимых интермедиатов, которые могут быть использованы в качестве платформы для получения новых соединений с выраженными фармакологическими свойствами. Подавляющая часть описанных ранее процессов биологической трансформации олеаноловой кислоты осуществляется с использованием мицелиальных грибов и сопровождается образованием различных гидрокси-, оксо- и гликозидпроизводных [Capel С.S., de Souza А. С.D., de Carvalho Т.С., de Sousa J.Р. В., Ambrósio S.R., Martins С.H. G., Cunha W.R., Galan R.H., Furtado N.A. J. C. Biotransformation using Mucor rouxii for the production of oleanolic acid derivatives and their antimicrobial activity against oral pathogens. J. Ind. Microbiol. Biotechnol. 2011. V. 38. P. 1493-1498; Martinez A., Rivas F., Perojil A., Parra A., Garcia-Granados A., Fernandez-Vivas A. Biotransformation of oleanolic and maslinic acids by Rhizomucor miehei. Phytochemistry. 2013. V. 94. P. 229-237; Gong Т., Zheng L., Zhen X., He H.X., Zhu H.X., Zhu P. Microbial transformation of oleanolic acid by Trichothecium roseum. J. Asian Nat. Prod. Res. 2014. V. 16. P. 383-386]. Однако процессы, катализируемые грибными культурами, характеризуются сравнительно низким (до 50%) уровнем конверсии субстрата, технологически нецелесообразны и небезопасны вследствие мицелиального характера роста грибов и их способности к выработке микотоксинов с выраженным мутагенным и канцерогенным действием. Примеры бактериальной трансформации олеаноловой кислоты единичны и включают процессы, катализируемые представителями родов Nocardia и Streptomyces. Нокардии катализируют сайт-селективное метилирование олеаноловой кислоты по С28 атому, а также окисление по С3 атому [Zhang J., Cheng Z.H., Yu В.Y., Cordell G.A., Qiu S.X. Novel biotransformation of pentacyclic triterpenoid acids by Nocardia sp. NRRL 5646. Tetrahedron Lett. 2005. V. 46. P. 2337-2340; Ludwig В., Geib D., Haas C., Steingroewer J., Bley Т., Muffler K., Ulber R. Whole-cell biotransformation of oleanolic acid by free and immobilized cells of Nocardia iowensis: Characterization of new metabolites. Eng. Life Sci. 2015. V. 15. P. 108-115]. Тогда как стрептомицеты катализируют гидроксилирование олеаноловой кислоты по С24 и С21 атомам и дополнительное карбоксилирование по С29 атому [Zhu Y.Y., Qian L.W., Zhang J., Liu J.H., Yu B.Y. New approaches to the structural modification of olean-type pentacylic triterpenes via microbial oxidation and glycosylation. Tetrahedron. 2011. V. 67. P. 4206-4211; Xu S.H., Wang W.W., Zhang C., Liu X.F., Yu B.Y., Zhang J. Site-selective oxidation of unactivated C-H sp3 bonds of oleanane triterpenes by Streptomyces griseus ATCC 13273. Tetrahedron. 2017. V. 73. P. 3086-3092]. При этом выявленные бактериальные катализаторы проявляют каталитическую активность в отношении олеаноловой кислоты при концентрации тритерпеноида в среде не более 0,3 г/л.
Из уровня техники не выявлено наличие сведений о бактериальной трансформации олеаноловой кислоты.
Таким образом, актуален поиск новых непатогенных бактериальных катализаторов и инновационных технологий для получения новых производных олеаноловой кислоты с потенциальной биологической активностью.
Одной из активно разрабатываемых в биотехнологии групп микроорганизмов являются непатогенные актиномицеты рода Rhodococcus, характеризующиеся большим разнообразием трансформируемых гидрофобных органических соединений [Ivshina I.В., Kuyukina М.S., Krivoruchko А.V. Hydrocarbon-oxidizing bacteria and their potential in eco-biotechnology and bioremediation. In Microbial Resources; Kurtboke, I., Ed.; Elsevier. 2017. P. 121-148]. Типично бактериальный характер роста, лабильность метаболической системы, полифункциональность, синтез биосурфактантов, способность расти на минимальных средах и высокая катаболическая активность в экстремальных условиях среды обусловливают перспективность использования данной группы микроорганизмов для биотрансформации олеаноловой кислоты. Кроме того, ранее авторами изобретения была подтверждена биокаталитическая эффективность родококков в процессах образования новых биоактивных соединений из трициклических дитерпеноидов и пентациклических тритерпеноидов [Grishko V.V., Tarasova Е.V., Ivshina I.В. Biotransformation of betulin to betulone by growing and resting cells of the actinobacterium Rhodococcus rhodochrous IEGM 66. Process Biochem. 2013. V. 48. P. 1640-1644; Патент RU 2529365, 2014; Cheremnykh K.M., Luchnikova N.A., Grishko V.V., Ivshina I.B. Bioconversion of ecotoxic dehydroabietic acid using Rhodococcus actinobacteria. J. Haz. Mat. 2018. V. 346. P. 103-112; Иванова К.M., Гришко В.В., Ившина И.Б. Высокоэффективная биодеструкция экотоксичной дегидроабиетиновой кислоты нерастущими клетками Rhodococcus rhodochrous ИЭГМ 107. Микробиология. 2022. Т. 91. С. 419-432].
Задачей предлагаемого изобретения является разработка способа биотрансформации олеаноловой кислоты с использованием в качестве биотрансформаторов представителей рода Rhodococcus для получения соединений, обладающих биологической активностью.
Техническим результатом изобретения является обеспечение биотрансформации олеаноловой кислоты с использованием представителя рода Rhodococcus для получения 5α,22α-дигидрокси-гипсогеновой кислоты, обладающей антибактериальными свойствами и перспективной в качестве платформы для направленного синтеза новых фармакологически активных соединений.
Технический результат изобретения достигается посредством реализации способа биотрансформации олеаноловой кислоты, который предусматривает ее взаимодействие с клетками штамма R. rhodochrous ИЭГМ 757, выделенного из нефтезагрязненной почвы (Пермский край, Россия) и поддерживаемого в Региональной профилированной коллекции алканотрофных микроорганизмов (акроним коллекции ИЭГМ, номер 285 во Всемирной федерации коллекции культур, реестровый номер УНУ/ЦКП 73559/48086, www.iegmcol.ru). Штамм депонирован в Национальный биоресурсный центр Всероссийская коллекция промышленных микроорганизмов НИЦ "Курчатовский институт" - ГосНИИгенетика под регистрационным номером ВКПМ Ас-2189.
Согласно изобретению, предлагается способ микробной биотрансформации пентациклического тритерпеноида олеаноловой кислоты, предусматривающий взаимодействие олеаноловой кислоты с бактериальной суспензией штамма Rhodococcus rhodochrous ВКПМ Ас-2189 в минерально-солевой среде в условиях периодического культивирования в течение 5 суток с последующим экстрагированием этилацетатом полученного производного - 5α,22α-дигидрокси-гипсогеновой кислоты, проявляющей антибактериальные свойства и перспективной в качестве платформы для направленного синтеза новых фармакологически активных соединений.
Изобретение осуществляется следующим образом.
Бактериальные клетки штамма ВКПМ Ас-2189 выращивают в колбах Эрленмейера объемом 250 мл, содержащих 100 мл минерально-солевой среды K (г/л: K2HPO4 - 1,0; KH2PO4 - 1,0; KNO3 - 1,0; NaCl - 1,0; MgSO4 - 0,2; СаС12 - 0,02) и микроэлементы по Постгейту (0,1 об. %), в условиях периодического культивирования (5 суток) на орбитальном шейкере при 160 об/мин и температуре 28°С. Олеаноловую кислоту (Acros Organics, США) растворяют в диметилсульфоксиде (1 мг : 10 мкл) и вносят в концентрации 1,0 г/л.
В качестве контролей используют (1) стерильный раствор олеаноловой кислоты в минеральной среде (абиотический контроль); (2) бактериальную суспензию в минерально-солевой среде с добавлением 0,1 г/л дрожжевого экстракта (биотический контроль).
Для экстракции остаточной олеаноловой кислоты и продуктов ее биотрансформации постферментационную среду подкисляют 10% водным раствором HCl и трижды экстрагируют эквивалентным объемом этилацетата. Объединенные экстракты последовательно промывают 1% водным раствором NaHCO3 и дистиллированной водой (до рН 7,0). Полученный этилацетатный экстракт обезвоживают над Na2SO4. Растворитель удаляют с помощью роторного испарителя Laborota 4000 (Heidolph, Германия). Качественную оценку этилацетатных экстрактов проводят методом тонкослойной хроматографии (ТСХ) в системе н-гексан : этилацетат (1:1) на пластинках Alugram® Xtra SIL G/UV254 (Macherey-Nagel, Германия). Детекцию соединений проводят путем обработки пластинки 15% H2SO4 и последующим нагреванием при 100-120°С в течение 2-3 мин.
Остаток, полученный после удаления этилацетата (65,0 мг), разделяют методом колоночной хроматографии на силикагеле марки «Macherey-Nagel» (60-200 мкм, Германия). При использовании в качестве элюента смеси н-гексан : этилацетат с градиентом концентраций от 9:1 до 4:1 последовательно выделяют остаточную олеаноловую кислоту (0,5 мг) и 3β,5α,22α-тригидроксиолеан-12-ене-23,28-диовую кислоту (5α,22α-дигидрокси-гипсогеновую кислоту, 58,0 мг).
Оптическое вращение измеряют на поляриметре Perkin Elmer 341 (Perkin Elmer, США) при длине волны 589 нм для раствора производного олеаноловой кислоты в CHCl3. Точку плавления регистрируют с помощью автоматического прибора измерения температуры OptiMelt МРА100 (Stanford Research Systems, США) со скоростью нагрева 1°С/мин. 1Н, 13С и DEPT ЯМР спектры записывают на спектрометре Bruker AVANCE II 400 с использованием ДМСО-d6 в качестве растворителя и гексаметилдисилоксана в качестве внешнего стандарта при 400 и 100 МГц соответственно. Спектральные характеристики 5α,22α-дигидрокси-гипсогеновой кислоты представлены в Табл. 1.
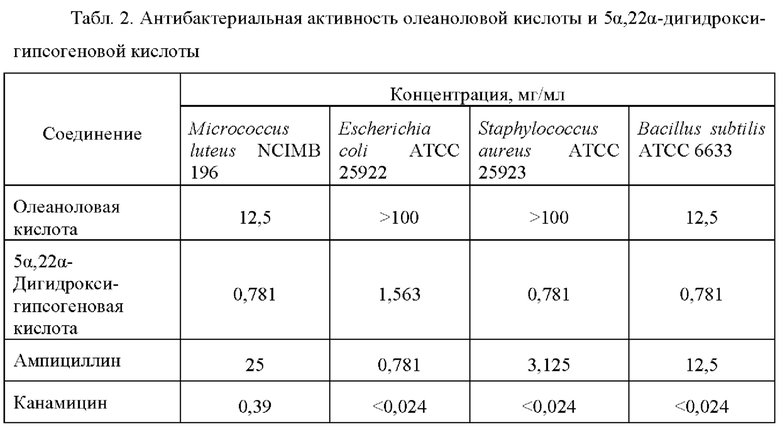
Антибактериальную активность олеаноловой и 5α,22α-дигидрокси-гипсогеновой кислот оценивают путем определения их минимальных подавляющих концентраций (МПК) методом двукратных серийных разведений с использованием 96-луночных полистироловых планшетов. Растворенные в ДМСО (1 мг : 10 мкл) вещества вносят в лунки, содержащие МПБ, в начальной концентрации 50 мг/мл с последующим серийным двукратным разведением. В лунки добавляют по 10 мкл бактериальной суспензии (2×106 кл/мл) тест-культур Bacillus subtilis АТСС 6633, Escherichia coli АТСС 25922, Micrococcus luteus NCIMB 196, Staphylococcus aureus ATCC 25923. Планшеты выдерживают при оптимальной для тест-культур температуре 28°С или 37°С в течение 24 ч. Жизнеспособность бактериальных клеток оценивают путем окрашивания йодонитротетразолия хлоридом (AppliChem, Германия). Образование нерастворимого формазана и соответствующего пурпурного окрашивания свидетельствует о наличии в лунках активно респирирующих клеток. В качестве контроля влияния растворителя используют ДМСО в аналогичной концентрации, в качестве положительного контроля служат антибактериальные препараты: ампициллин (AppliChem, Германия) и канамицин (AppliChem, Германия).
Изобретение поясняется следующим примером.
Пример
Способ получения 5α,22α-дигидрокси-гипсогеновой кислоты с использованием клеток Rhodococcus rhodochrous ВКПМ Ас-2189.
Биотрансформация 1,0 г/л олеаноловой кислоты штаммом R. rhodochrous ВКПМ Ас-2189 проходит в 100 мл среды K с добавлением микроэлементов по Постгейту (0,1 об. %) при температуре 28°С и постоянном перемешивании (160 об/мин) в течение 5 суток и сопровождается образованием 5α,22α-тригидроксиолеан-12-ене-23,28-дновой кислоты (5α,22α-дигидрокси-гипсогеновой кислоты) с выходом 58% (Фиг. 1): Rƒ 0,01 (н-гексан : этилацетат, 1:1), Тплав 201°С (этилацетат : хлороформ, 1:0.1),  (с 0,5, CHCl3).
(с 0,5, CHCl3).
Полиоксигенирование олеаноловой кислоты обеспечивает повышение антибактериальной активности. При этом значения МПЕ 5α,22α-дигидрокси-гипсогеновой кислоты составляют от 0,8 до 1,6 мг/мл, что значительно ниже таковых исходного соединения, а в отдельных случаях - широко распространенного антибиотика ампициллина (Табл. 2).


Изобретение также поясняется нижеследующими иллюстрирующими материалами. На Фиг. 1. приведена структурная формула 5α,22α-дигидрокси-гипсогеновой кислоты (3β,5α,22α-тригидроксиолеан-12-ене-23,28-диовой кислоты).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БИОТРАНСФОРМАЦИИ РАСТИТЕЛЬНОГО МОНОТЕРПЕНОИДА (-)-ИЗОПУЛЕГОЛА ДЛЯ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2022 |
|
RU2796679C1 |
| СПОСОБ БИОДЕСТРУКЦИИ ДЕГИДРОАБИЕТИНОВОЙ КИСЛОТЫ | 2022 |
|
RU2784816C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТУЛОНА | 2013 |
|
RU2529365C1 |
| ШТАММ RHODOCOCCUS RUBER ИЭГМ 346 - БИОДЕСТРУКТОР ДИКЛОФЕНАКА НАТРИЯ | 2018 |
|
RU2707536C1 |
| Биодеструктор ибупрофена | 2021 |
|
RU2762007C1 |
| Биотрансформация фенилметилового сульфида в (R)-сульфоксид с помощью иммобилизованных клеток Gordonia terrae ИЭГМ 136 | 2015 |
|
RU2607027C1 |
| СРЕДСТВО ДЛЯ БИОДЕСТРУКЦИИ КЕТОПРОФЕНА | 2023 |
|
RU2803338C1 |
| СПОСОБ БИОДЕСТРУКЦИИ ДЕГИДРОАБИЕТИНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ШТАММА Rhodococcus rhodochrous ИЭГМ 107 | 2017 |
|
RU2656145C1 |
| СПОСОБ ПОЛУЧЕНИЯ СТИГМАСТ-4-ЕН-3-ОНА ИЗ БЕТА-СИТОСТЕРОЛА | 2011 |
|
RU2472857C1 |
| Полифункциональный биопрепарат с широким спектром антагонистической активности и его применение | 2019 |
|
RU2733140C1 |

Изобретение относится к области биотехнологии, в частности к получению биологически активных веществ с помощью микроорганизмов. Способ предусматривает биотрансформацию пентациклического тритерпеноида олеаноловой кислоты (1,0 г/л) с использованием штамма Rhodococcus rhodochrous ВКПМ Ас-2189 в течение 5 суток с образованием ранее не описанной 5α,22α-дигидрокси-гипсогеновой кислоты, проявляющей антибактериальные свойства и перспективной в качестве платформы для направленного синтеза новых фармакологически активных соединений. Изобретение позволяет рассматривать штамм R. rhodochrous ВКПМ Ас-2189 в качестве активного биотрансформатора олеаноловой кислоты, способного катализировать регио- и стереоселективное окисление олеаноловой кислоты по малодоступным для химического синтеза положениям, и создает предпосылки для получения биологически активных производных на основе пентациклических тритерпеноидов с использованием родококков. Штамм хранится в Региональной профилированной коллекции алканотрофных микроорганизмов (акроним коллекции ИЭГМ) под номером ИЭГМ 757. 1 ил., 2 табл., 3 пр.
Способ получения 5α,22α-дигидрокси-гипсогеновой кислоты, проявляющей антибактериальные свойства, предусматривающий взаимодействие олеаноловой кислоты с бактериальной суспензией штамма Rhodococcus rhodochrous ВКПМ Ас-2189 в минерально-солевой среде в условиях периодического культивирования в течение 5 суток с последующим экстрагированием этилацетатом 5α,22α-дигидрокси-гипсогеновой кислоты.
| NATALIA A | |||
| LUCHNIKOVA et al | |||
| Biotransformation of Oleanane and Ursane Triterpenic Acids, Molecules 2020, 25, 5526; doi:10.3390/molecules25235526 | |||
| ШТАММ RHODOCOCCUS RHODOCHROUS NCIMB 41164 И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОДУЦЕНТА НИТРИЛГИДРАТАЗЫ | 2004 |
|
RU2403280C2 |
| ZHOU et al | |||
| Triterpenoids from the leaves of Ilex hainanensis., Institute of Medicinal Plant Development, Peking Union Medical College and Chinese Academy of Medical Sciences, | |||
Авторы
Даты
2023-12-27—Публикация
2023-04-28—Подача