ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к соединению, представленному общей формулой (I):
[0002]
[Формула 1]
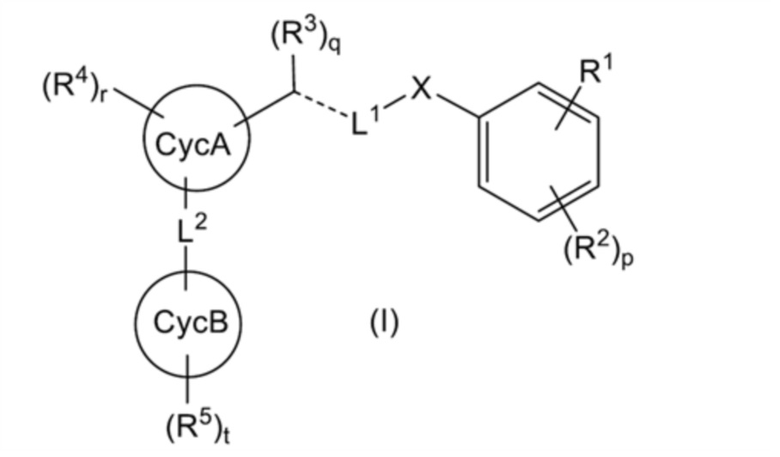
[0003]
(где все символы имеют такое же значение, как описано ниже) или его соли (где соединение или его соль в дальнейшем в этом документе иногда называются «соединением настоящего изобретения»).
УРОВЕНЬ ТЕХНИКИ
[0004]
Нервные системы грубо подразделяются на центральные нервные системы и периферические нервные системы. В частности, периферические нервные системы обеспечивают связь головного и спинного мозга с периферическими областями тела и, следовательно, участвуют в нейротрансмиссии. Периферические нервные системы подразделяются на соматические нервные системы (цереброспинальные нервные системы) и автономные нервные системы. Соматические нервные системы подразделяются на черепные нервы и спинномозговые нервы. С точки зрения функций соматические нервные системы классифицируются следующим образом: волокна, которые передают нервный сигнал (возбуждение), генерируемый сенсорным рецептором, к центральным нервам, подразделяются на афферентные или сенсорные нервные волокна, тогда как волокна, передающие нервный сигнал, направленный от головного и спинного мозга к эффекторным органам, таким как мышцы и железы, подразделяются на эфферентные или двигательные нервные волокна. Черепные нервы представляют собой периферические нервы, которые отходят от головного мозга, и их известно 12 пар. Среди черепных нервов некоторые состоят из сенсорных нервных волокон; некоторые состоят из двигательных нервных волокон; и некоторые состоят из смешанных нервных волокон. Нервные пары с первой по двенадцатую называются обонятельный нерв, зрительный нерв, глазодвигательный нерв, трохлеарный нерв, тройничный нерв, отводящий нерв, лицевой нерв, слуховой нерв, языкоглоточный нерв, блуждающий нерв, добавочный нерв и подъязычный нерв, соответственно. Среди этих нервов, обонятельный нерв, зрительный нерв, тройничный нерв, лицевой нерв, слуховой нерв, языкоглоточный нерв и блуждающий нерв известны как нервы, состоящие из сенсорных или смешанных нервных волокон. Спинномозговые нервы представляют собой периферические нервы, которые отходят от спинного мозга, и из них известна 31 соответствующая пара, в том числе 8 пар шейных нервов, 12 пар грудных нервов, 5 пар поясничных нервов, 5 пар крестцовых нервов и одна пара копчиковых нервов. Все спинномозговые нервы состоят из смешанных нервных волокон, каждое из которых содержит сенсорное волокно (дорсальный корешок), которое проходит в направлении кожи или тому подобное, и моторное волокно (вентральный корешок), которое проходит в направлении скелетной мышцы.
[0005]
Сенсорные нервные волокна, т.е. сенсорные нервы, берут на себя функцию точной передачи стимулов, таких как свет, звук, температура и прикосновение, воспринимаемых сенсорным рецептором, таким как оптический орган, орган слуха, орган обоняния, орган вкуса и кожа, к центральной нервной системе. Нервный сигнал, передаваемый в центральную нервную систему, в конечном счете передается в каждую сенсорную область коры головного мозга, такую как зрительная область, слуховая область и тому подобное, и, в результате, ощущение обычно распознается. Однако в этих сенсорных нервах аксоны, миелиновые оболочки, шванновские клетки или тому подобное могут быть повреждены вирусной инфекцией, опухолью, раком, диабетом, ишемией, травмой, сжатием, лекарством, лучевой терапией или тому подобным, иногда вызывая различные нейропатии, включая гибель клеток и демиелинизацию. В результате не происходит правильной нейротрансмиссии в сенсорном нерве, который подвергается нарушению, что приводит к развитию заболевания, как например, потеря слуха и нейропатическая боль. В дополнение к этим нарушениям также известна периферическая нейропатия, при которой различные периферические нервы, включая сенсорные нервы, повреждаются одновременно с конкретным сенсорным нервом в результате проявления заболевания, такого как метаболическое заболевание и аутоиммунное заболевание, травма, отравление лекарственными средствами или тому подобное. При этом заболевании может быть поврежден отдельный нерв, или два или более нерва, расположенных в различных областях, или большое число нервов может быть повреждено одновременно. Симптомы этого заболевания включают боль в периферической области, онемение, ощущение жжения, снижение проприоцепции суставов, снижение чувствительности к вибрации, боль (включая нейропатическую боль), аномальные ощущения, холод, прилив жара и тому подобное, и, таким образом, являются очень сложными и разнообразными.
[0006]
Однако, поскольку упомянутые выше заболевания, связанные с периферическими нервами, не изучены с точки зрения механизмов их развития или же являются физическими повреждениями нервов, симптоматическая терапия с целью облегчения симптомов или тому подобное в основном проводится для медицинского лечения этих заболеваний. Известно очень мало химических веществ, которые с клинической точки зрения полезны в качестве способов воздействия непосредственно на поврежденные нервные системы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКИЕ ЗАДАЧИ
[0007]
Настоящее изобретение решает задачу получения соединения, обладающего нейропротекторной и/или нейровосстанавливающей активностью.
РЕШЕНИЯ ЗАДАЧ
[0008]
Авторы настоящего изобретения провели обширные и интенсивные исследования для решения задачи. В результате, было обнаружено, что соединение, представленное общей формулой (I), обладает сильной нейропротекторной и/или нейровосстанавливающей активностью. Это обнаружение привело к осуществлению настоящего изобретения.
Настоящее изобретение соответствует следующим пунктам:
[1] соединение, представленное общей формулой (I):
[0009]
[Формула 2]
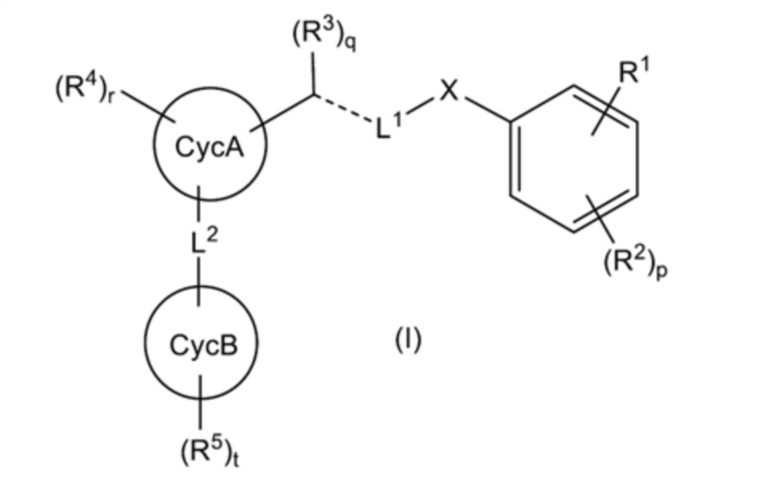
[0010]
[где:
R1 представляет собой (1) -R11-COOR12, (2) -R13-CONR14R15, (3) -R17-CN, (4) -R18-CONHS(O)2-R19, (5) -R20-CycD, или
[0011]
[Формула 3]

[0012]
(где: кольцо 1 представляет собой 3-6-членное азотсодержащее моноциклическое насыщенное гетероциклическое кольцо; R101 представляет собой (1) атом галогена, (2) C1-4 алкильную группу или (3) C1-4 галогеналкильную группу, и n представляет собой целое число от 0 до 3, при этом, когда n равно 2 или более, множество R101 могут быть одинаковыми или отличными друг от друга);
каждый из R11, R13, R16, R17, R18 и R20 независимо представляет собой (1) C1-6 алкиленовую группу, которая может быть замещена 1-3 атомами галогена, (2) C2-6 алкениленовую группу, которая может быть замещена 1-3 атомами галогена, или (3) С2-6 алкиниленовую группу, которая может быть замещена 1-3 атомами галогена, при этом, когда алкиленовая группа, алкениленовая группа или алкиниленовая группа представляет собой разветвленную цепь, две C1-2 алкильные группы, разветвленные от одного атома углерода, могут вместе образовывать C3-5 насыщенное карбоциклическое кольцо;
каждый из R12, R14, R15 и R19 независимо представляет собой (1) атом водорода, (2) C1-4 алкильную группу или (3) C1-4 галогеналкильную группу;
CycD представляет собой триазол или тетразол;
R2 представляет собой (1) атом галогена, (2) C1-4 алкильную группу или (3) C1-4 галогеналкильную группу, и p представляет целое число от 0 до 3, при этом, когда p равно 2 или более, множество R2 могут быть одинаковыми или отличными друг от друга;
X представляет собой (1) CH2 или (2) атом кислорода;
L1 представляет собой (1) линейную C3-7 алкиленовую группу, которая может быть замещена 1-4 RL1a, (2) линейную C3-7 алкениленовую группу, которая может быть замещена 1-4 RL1a, (3) линейную C3-7 алкиниленовую группу, которая может быть замещена 1-4 RL1a, или (4) (линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a);
RL1a представляет собой (1) атом галогена, (2) гидроксильную группу, (3) оксогруппу, или (4) C1-2 алкильную группу, при этом: когда присутствуют по меньшей мере два RL1a, множество RL1a могут быть одинаковыми или отличными друг от друга; и когда каждый из двух RL1a, связанных с одним атомом углерода, представляет собой C1-2 алкильную группу, C1-2 алкильная группа может образовывать C3-5 насыщенное карбоциклическое кольцо вместе с атомом углерода, к которому присоединена C1-2 алкильная группа;
[0013]
[Формула 4]

[0014]
представляет собой одинарную связь, двойную связь или тройную связь;
R3 представляет собой (1) атом водорода, (2) атом галогена, (3) гидроксильную группу, (4) C1-2 алкильную группу или (5) метилиденовую группу, и q представляет целое число от 0 до 2, при этом: когда
[0015]
[Формула 5]

[0016]
представляет собой одинарную связь, и q равно 2, множество R3 могут быть одинаковыми или отличными друг от друга; и когда по меньшей мере один из R3 представляет собой метильную группу, метильная группа может образовывать циклопропан в сочетании с атомом углерода в соседнем L1;
CycA представляет собой (1) C5-10 моноциклическое или бициклическое карбоциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо;
R4 представляет собой (1) атом галогена, (2) гидроксильную группу, (3) C1-4 алкильную группу, (4) C1-4 галогеналкильную группу; (5) C1-4 алкоксигруппу; (6) C1-4 галогеналкоксигруппу, (7) цианогруппу или (8)-SO2-(C1-2 алкильную группу) и r представляет целое число от 0 до 6, при этом, когда r равно 2 или более, множество R4 могут быть одинаковыми или отличными друг от друга;
L2 представляет собой -R31-L3-R32-;
L3 представляет собой (1) -NR201-S(O)-, (2) -NR202-S(O)2-, (3) -NR203-C(O)-, (4) -CR204(OH)-, (5) -NR205-, (6) -S(O)- или (7) -S(O)2-;
каждый из R201, R202, R203, R204 и R205 независимо представляет собой (1) атом водорода, (2) C1-4 алкильную группу или (3) C1-4 галогеналкильную группу, при этом алкильная группа или галогеналкильная группа может быть замещена (1) гидроксильной группой, (2) оксогруппой, (3) C3-6 моноциклическим карбоциклическим кольцом или (4) 3-6-членным моноциклическим гетероциклическим кольцом;
каждый из R31 и R32 независимо представляет собой (1) связь или (2) C1-3-алкиленовую группу, которая может быть замещена 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и оксогруппы;
CycB представляет собой (1) C5-10 моноциклическое или бициклическое карбоциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо; и
R5 представляет собой (1) атом галогена, (2) C1-6 алкильную группу, (3) C2-6 алкенильную группу, (4) C2-6 алкинильную группу, (5) C1-6 галогеналкильную группу, (6) C2-6 галогеналкенильную группу, (7) C2-6 галогеналкинильную группу, (8) C1-6 алкоксигруппу или (9) C1-6 галогеналкоксигруппу, и t представляет целое число от 0 до 6, при этом, когда t равно 2 или более, множество R5 могут быть одинаковыми или отличными друг от друга], или его соль;
[2] соединение или его соль по п.[1], где в общей формуле (I), группа:
[0017]
[Формула 6]

[0018]
представляет собой (1) =CH-(линейную C2-6 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, (2) -(линейную C3-7 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, или (3) -(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, (в (1)-(3) RL1a имеет то же значение, что и в п.[1]);
[3] соединение или его соль по п.[1] или п.[2], где R1 представляет собой -R11-COOR12;
[4] соединение или его соль по любому из п.п.[1]-[3], где L2 представляет собой (1) -NR202-S(O)2- или (2) -CR204(OH)-CH2-;
[5] соединение или его соль по любому из п.п.[1]-[4], где CycA представляет собой C5-6 моноциклическое карбоциклическое кольцо;
[6] соединение или его соль по любому из п.п.[1]-[5], где CycВ представляет собой C5-6 моноциклическое карбоциклическое кольцо;
[7] соединение или его соль по любому из п.п.[1]-[6], где общая формула (I) представляет собой общую формулу (I-1):
[0019]
[Формула 7]
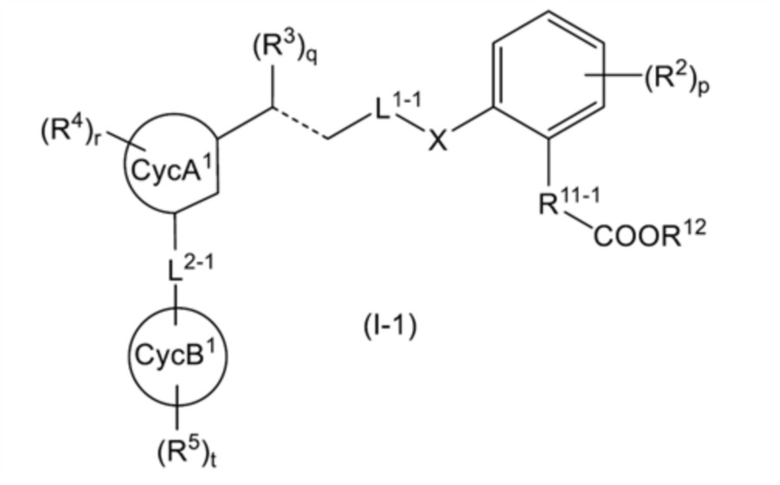
[0020]
[где: R11-1 представляет собой C2-4 алкиленовую группу; L1-1 представляет собой линейную C3-4 алкиленовую группу, которая может быть замещена 1-2 RL1a; каждый из CycA1 и CycB1 независимо представляет собой C5-6 моноциклическое карбоциклическое кольцо; L2-1 представляет собой (1) -NH-S(O)2- или (2) -CH(OH)-CH2-; и другие символы имеют такое же значение, как указано в п.[1]];
[8] соединение или его соль по любому из п.п.[1]-[7], где Х представляет собой атом кислорода;
[9] соединение или его соль по п.[1], где соединение или его соль представляет собой
(1) 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(2) 3-[2-[(3S)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановую кислоту,
(3) 3-[2-[(3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановую кислоту,
(4) 3-[2-[(E,3R)-5-[4-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(5) 3-[2-[(E,3R)-5-[3-(циклопентилсульфониламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(6) 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-2-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(7) 4-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]бутановую кислоту,
(8) 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]-2-гидроксибут-3-енокси]фенил]пропановую кислоту,
(9) (R)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановую кислоту,
(10) (S)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановую кислоту,
(11) 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропановую кислоту,
(12) 3-[2-[5-[3-(бензолсульфонамидо)фенил]пентокси]фенил]пропановую кислоту,
(13) 3-[2-[(3S)-3-гидрокси-5-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановую кислоту,
(14) 3-[2-[(3S)-3-гидрокси-5-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановую кислоту,
(15) 3-[2-[2-[2-[3-(бензолсульфонамидо)фенил]этокси]этокси]фенил]пропановую кислоту,
(16) 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-оксогексил]фенил]пропановую кислоту, или
(17) 3-[2-[5-[3-(бензолсульфонамидо)фенил]-3,3-дифторпентокси]фенил]пропановую кислоту, или
их соль;
[10] фармацевтическая композиция, содержащая соединение, представленное общей формулой (I), или его соль по п.1;
[11] средство для стимулирования дифференцировки шванновских клеток, содержащее соединение, представленное общей формулой (I), или его соль по п.[1];
[12] профилактическое и/или терапевтическое средство от нейропатии, содержащее соединение, представленное общей формулой (I), или его соль по п.[1];
[13] средство по п.[12], где нейропатия представляет собой периферическую нейропатию;
[14] средство по п.[13], где периферическая нейропатия представляет собой хроническую воспалительную демиелинизирующую полинейропатию, синдром Гийена-Барре, узелковый периартериит, аллергический васкулит, диабетическую периферическую нейропатию, компрессионную нейропатию, периферическую нейропатию, связанную с введением химиотерапевтического препарата, или периферическую нейропатию, связанную с болезнью Шарко-Мари-Тута;
[15] способ профилактики и/или лечения нейропатии, включающий введение эффективного количества соединения, представленного общей формулой (I), или его соли по п.[1] млекопитающему;
[16] соединение, представленное общей формулой (I), или его соль по п.[1], которое используется для предотвращения и/или лечения нейропатии;
[17] применение соединения, представленного общей формулой (I), или его соли по п.[1] для получения профилактического и/или терапевтического средства от нейропатии;
[18] фармацевтическая композиция для защиты и/или восстановления нерва, которая содержит соединение, представленное общей формулой (I), или его соль по п.[1];
[19] фармацевтическая композиция по п.[18], где защита и/или восстановление нерва представляет собой защиту и/или восстановление нерва через глиальную клетку (например, микроглию, астроцит, олигодендроцит, эпендимоцит, шванновскую клетку, сателлитную клетку);
[20] фармацевтическая композиция по п.[19], где защита и/или восстановление нерва через глиальную клетку представляет собой защиту и/или восстановление нерва за счет стимулирования миелинизации шванновской клетки; или тому подобное.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0021]
Соединение настоящего изобретения обладает сильной нейропротекторной и/или нейровосстанавливающей активностью и поэтому может использоваться для лечения нейропатии, такой как периферическая нейропатия.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0022]
На фиг.1 показаны ноцицептивные пороги в стрептозотоциновых моделях, которые были получены, когда каждое из соединений примеров 11, 36, 37 и 84 вводили в дозе 0,3 мг/кг (по вертикальной оси представлен ноцицептивный порог, а по горизонтальной оси представлено количество дней, прошедшее после введения стрептозотоцина).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0023]
Далее настоящее изобретение будет описано подробно.
[0024]
Термин «3-6-членное азотсодержащее моноциклическое насыщенное гетероциклическое кольцо», используемый в данном описании, относится к моноциклическому насыщенному гетероциклическому кольцу, содержащему по меньшей мере один атом азота, и его примеры включают азиридин, азетидин, пирролидин, имидазолидин, триазолидин, тетразолидин, пиразолидин, пиперидин, пиперазин, пергидропиримидин, пергидропиридазин, тетрагидрооксазол (оксазолидин), тетрагидроизоксазол (изооксазолидин), тетрагидротиазол (тиазолидин), тетрагидроизотиазол (изотиазолидин), тетрагидрофуразан, тетрагидрооксадиазол (оксадиазолидин), тетрагидрооксазин, тетрагидрооксадиазин, тетрагидротиадиазол (тиадиазолидин), тетрагидротиазин, тетрагидротиадиазин, морфолин и тиоморфолин.
[0025]
Термин «атом галогена», используемый в данном описании, относится к фтору, хлору, брому, йоду или тому подобное.
[0026]
Термин «C1-4 алкильная группа», используемый в данном описании, включает линейную или разветвленную C1-4 алкильную группу, и ее примеры включают метил, этил, пропил, бутил, изопропил, изобутил, втор-бутил и трет-бутил.
[0027]
Термин «C1-4 галогеналкильная группа», используемый в данном описании, относится к группе, имеющей такую структуру, что линейная или разветвленная C1-4 алкильная группа замещена по меньшей мере одним атомом галогена, и ее примеры включают фторметил, хлорметил, бромметил, йодметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2-хлорэтил, пентaфторэтил, 1-фторпропил, 2-хлорпропил, 3-фторпропил, 3-хлорпропил, 4,4,4-трифторбутил и 4-бромбутил.
[0028]
Термин «C1-6 алкиленовая группа», используемый в данном описании, включает линейную или разветвленную C1-6 алкиленовую группу, и ее примеры включают метилен, этилен, пропилен, бутилен, пентилен, гексанилен и их изомеры.
[0029]
Термин «C2-6 алкениленовая группа», используемый в данном описании, включает линейную или разветвленную C2-6 алкениленовую группу, и ее примеры включают этенилен, пропенилен, бутенилен, пентенилен, гексенилен и их изомеры.
[0030]
Термин «C2-6 алкиниленовая группа», используемый в данном описании, включает линейный или разветвленный C2-6 алкинилен, и ее примеры включают этинилен, пропинилен, бутинилен, пентинилен, гексинилен и их изомеры.
[0031]
Термин «линейная C3-7 алкиленовая группа», используемый в данном описании, включает, например, пропилен, бутилен, пентилен, гексанилен и гептанилен.
[0032]
Термин «линейная C3-7 алкениленовая группа», используемый в данном описании, включает, например, пропенилен, бутенилен, пентенилен, гексенилен, гептенилен и их изомеры.
[0033]
Термин «линейная C3-7 алкиниленовая группа», используемый в данном описании, включает, например, пропинилен, бутинилен, пентинилен, гексинилен и их изомеры.
[0034]
Термин «C1-2 алкильная группа», используемый в данном описании, относится к метилу или этилу.
[0035]
Термин «C3-5 насыщенное карбоциклическое кольцо», используемый в данном описании, включает, например, циклопропан, циклобутан и циклопентaн.
[0036]
Термин «C5-10 моноциклическое или бициклическое карбоциклическое кольцо», используемый в данном описании, включает, например, циклопентан, циклогексан, циклогептан, циклооктaн, циклононан, циклодекан, циклопентен, циклогексен, циклогептен, циклооктен, циклопентадиен, циклогексадиен, циклогептадиен, циклооктадиен, бензол, пентален, пергидропентален, азулен, пергидроазулен, инден, пергидроинден, индан, нафталин, дигидронафталин, тетрагидронафталин и пергидронафталин.
[0037]
Термин «5-10-членное моноциклическое или бициклическое гетероциклическое кольцо», используемый в данном описании, относится к 5-10-членному моноциклическому или бициклическому гетероциклическому кольцу, содержащему гетероатом, выбранный из атома кислорода, атома азота и атома серы, и ее примеры включают пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, фуран, пиран, оксепин, тиофен, тиопиран, тиепин, оксазол, изооксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, оксазепин, оксадиазепин, тиадиазол, тиазин, тиадиазин, тиазепин, тиадиазепин, индол, изоиндол, индолизин, бензофуран, изобензофуран, бензотиофен, изобензотиофен, дитианафталин, индазол, хинолин, изохинолин, хинолизин, пурин, фталазин, птеридин, нафтиридин, хиноксалин, хиназолин, циннолин, бензооксазол, бензотиазол, бензоимидазол, хромен, бензофуразан, бензотиадиазол, бензотриазол, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, дигидротиофен, тетрагидротиофен, дигидротиопиран, тетрагидротиопиран, дигидротиепин, тетрагидротиепин, пергидротиепин, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизооксазол, тетрагидроизооксазол (изооксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидрооксазепин, тетрагидрооксазепин, пергидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, пергидрооксадиазепин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, дигидротиазепин, тетрагидротиазепин, пергидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, пергидротиадиазепин, морфолин, тиоморфолин, оксатиан, индолин, изоиндолин, дигидробензофуран, пергидробензофуран, дигидроизобензофуран, пергидроизобензофуран, дигидробензотиофен, пергидробензотиофен, дигидроизобензотиофен, пергидроизобензотиофен, дигидроиндазол, пергидроиндазол, дигидрохинолин, тетрагидрохинолин, пергидрохинолин, дигидроизохинолин, тетрагидроизохинолин, пергидроизохинолин, дигидрофталазин, тетрагидрофталазин, пергидрофталазин, дигидронафтиридин, тетрагидронафтиридин, пергидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, пергидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, пергидрохиназолин, дигидроциннолин, тетрагидроциннолин, пергидроциннолин, бензооксатиан, дигидробензооксазин, дигидробензoтиазин, пиразинoморфолин, дигидробензооксазол, пергидробензооксазол, дигидробензотиазол, пергидробензотиазол, дигидробензоимидазол, пергидробензоимидазол, диоксолан, диоксан, дитиолан, дитиан, диоксаиндан, бензoдиоксан, хроман, бензoдитиолан и бензoдитиан.
[0038]
Термин «C1-4 алкоксигруппа», используемый в данном описании, включает линейную или разветвленную C1-4 алкоксигруппу, и ее примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси.
[0039]
Термин «C1-4 галогеналкоксигруппа», используемый в данном описании, включает группу, имеющую такую структуру, что линейная или разветвленная C1-4 алкоксигруппа замещена по меньшей мере одним атомом галогена, и ее примеры включают трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлорэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-бромпропокси, 3-хлорпропокси, 2,3-дихлорпропокси, 1-фторбутокси, 4-фторбутокси и 1-хлорбутокси.
[0040]
Термин «C3-6 моноциклическое карбоциклическое кольцо», используемый в данном описании, включает, например, циклопропан, циклобутан, циклопентaн, циклогексан, циклопентен, циклогексен, циклопентадиен, циклогексадиен и бензол.
[0041]
Термин «3-6-членное моноциклическое гетероциклическое кольцо», используемый в данном описании, относится к 3-6-членному моноциклическому гетероциклическому кольцу, содержащему гетероатом, выбранный из атома кислорода, атома азота и атома серы, и ее примеры включают пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, фуран, пиран, тиофен, тиопиран, оксазол, изооксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, тиадиазол, тиазин, тиадиазин, азиридин, азетидин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, оксиран, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, тииран, тиетан, дигидротиофен, тетрагидротиофен, дигидротиопиран, тетрагидротиопиран, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизооксазол, тетрагидроизоксазол (изооксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, морфолин, тиоморфолин, оксатиан, диоксолан, диоксан, дитиолан и дитиан.
[0042]
Термин «5-6-членное моноциклическое гетероциклическое кольцо», используемый в данном описании, относится к 5-6-членному моноциклическому гетероциклическому кольцу, содержащему гетероатом, выбранный из атома кислорода, атома азота и атома серы, и ее примеры включают пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, фуран, пиран, тиофен, тиопиран, оксазол, изооксазол, тиазол, изотиазол, фуразан, оксадиазол, оксазин, оксадиазин, тиадиазол, тиазин, тиадиазин, пирролин, пирролидин, имидазолин, имидазолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиразолин, пиразолидин, дигидропиридин, тетрагидропиридин, пиперидин, дигидропиразин, тетрагидропиразин, пиперазин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидротиофен, тетрагидротиофен, дигидротиопиран, тетрагидротиопиран, дигидрооксазол, тетрагидрооксазол (оксазолидин), дигидроизооксазол, тетрагидроизоксазол (изооксазолидин), дигидротиазол, тетрагидротиазол (тиазолидин), дигидроизотиазол, тетрагидроизотиазол (изотиазолидин), дигидрофуразан, тетрагидрофуразан, дигидрооксадиазол, тетрагидрооксадиазол (оксадиазолидин), дигидрооксазин, тетрагидрооксазин, дигидрооксадиазин, тетрагидрооксадиазин, дигидротиадиазол, тетрагидротиадиазол (тиадиазолидин), дигидротиазин, тетрагидротиазин, дигидротиадиазин, тетрагидротиадиазин, морфолин, тиоморфолин, оксатиан, диоксолан, диоксан, дитиолан и дитиан.
[0043]
Термин «5-6-членное моноциклическое ароматическое гетероциклическое кольцо», используемый в данном описании, относится к 5-6-членному моноциклическому ароматическому гетероциклическому кольцу, содержащему гетероатом, выбранный из атома кислорода, атома азота и атома серы, и ее примеры включают пиррол, имидазол, триазол, тетразол, пиразол, пиридин, пиразин, пиримидин, пиридазин, фуран, тиофен, оксазол, изооксазол, тиазол, изотиазол, фуразан, оксадиазол и тиадиазол.
[0044]
Термин «C1-3 алкиленовая группа», используемый в данном описании, включает линейную или разветвленную C1-3 алкиленовую группу, и ее примеры включают метилен, этилен, пропилен и их изомеры.
[0045]
Термин «C1-6 алкильная группа», используемый в данном документе, включает линейную или разветвленную C1-6 алкильную группу, и ее примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и их изомеры.
[0046]
Термин «C2-6 алкенильная группа», используемый в данном описании, включает линейную или разветвленную C2-6 алкенильную группу, и ее примеры включают этенил, пропенил, бутенил, пентенил, гексенил и их изомеры.
[0047]
Термин «C2-6 алкинильная группа», используемый в данном описании, относится к линейной или разветвленной C2-6 алкинильной группе, и ее примеры включают этинил, пропинил, бутинил, пентинил, гексинил и их изомеры.
[0048]
Термин «C1-6 галогеналкильная группа», используемый в данном описании, относится к группе, имеющей такую структуру, что линейная или разветвленная C1-6 алкильная группа замещена по меньшей мере одним атомом галогена, и ее примеры включают фторметил, хлорметил, бромметил, йодметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2-хлорэтил, пентaфторэтил, 1-фторпропил, 2-хлорпропил, 3-фторпропил, 3-хлорпропил, 4,4,4-трифторбутил, 4-бромбутил, 1-фторпентaн и 2-хлоргексан.
[0049]
Термин «C2-6 галогеналкенильная группа», используемый в данном описании, относится к группе, имеющей такую структуру, что линейная или разветвленная C2-6 алкенильная группа замещена по меньшей мере одним атомом галогена, и ее примеры включают 1-фторэтенил, 2-фторэтенил, 2-хлорэтенил, пентaфторэтенил, 1-фторпропенил, 2-хлорпропенил, 3-фторпропенил, 3-хлорпропенил, 4,4,4-трифторбутенил, 4-бромбутенил, 1-фторпентенил и 2-хлоргексенил.
[0050]
Термин «C2-6 галогеналкинильная группа», используемый в данном описании, относится к группе, имеющей такую структуру, что линейная или разветвленная C2-6 алкинильная группа замещена по меньшей мере одним атомом галогена, и ее примеры включают 1-фторэтинил, 2-фторэтинил, 2-хлорэтинил, пентaфторэтинил, 1-фторпропинил, 2-хлорпропинил, 3-фторпропинил, 3-хлорпропинил, 4,4,4-трифторбутинил, 4-бромбутинил, 1-фторпентинил и 2-хлоргексинил.
[0051]
Термин «C1-6 алкоксигруппа», используемый в данном описании, включает линейную или разветвленную C1-6 алкоксигруппу, и ее примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, н-пентокси, изопентокси, нeoпентокси, н-гексилокси и изогексилокси.
[0052]
Термин «C1-6 галогеналкоксигруппа», используемый в данном описании, относится к группе, имеющей такую структуру, что линейная или разветвленная C1-6 алкоксигруппа замещена по меньшей мере одним атомом галогена, и ее примеры включают трифторметокси, трихлорметокси, хлорметокси, бромметокси, фторметокси, йодметокси, дифторметокси, дибромметокси, 2-хлорэтокси, 2,2,2-трифторэтокси, 2,2,2-трихлорэтокси, 3-бромпропокси, 3-хлорпропокси, 2,3-дихлорпропокси, 1-фторбутокси, 4-фторбутокси, 1-хлорбутокси, 2-фторпентокси и 3-хлоргексилокси.
[0053]
Термин «линейная C2-6 алкиленовая группа», используемый в данном описании, включает, например, этилен, пропилен, бутилен, пентилен и гексанилен.
[0054]
Термин «линейная C3-7 алкиленовая группа», используемый в данном описании, включает, например, пропилен, бутилен, пентилен, гексанилен и гептанилен.
[0055]
Термин «линейная C1-3 алкиленовая группа», используемый в данном описании, включает, например, метилен, этилен и пропилен.
[0056]
Термин «C5-6 моноциклическое карбоциклическое кольцо», используемый в данном описании, включает, например, циклопентaн, циклогексан, циклопентен, циклогексен, циклопентадиен, циклогексадиен и бензол.
[0057]
Термин «C2-4 алкиленовая группа», используемый в данном описании, включает линейную или разветвленную C2-4 алкиленовую группу, и ее примеры включают этилен, пропилен, бутилен и их изомеры.
[0058]
Термин «C3-4 алкиленовая группа», используемый в данном описании, включает линейную или разветвленную C3-4 алкиленовую группу, и ее примеры включают пропилен, бутилен и их изомеры.
[0059]
В настоящем изобретении,
[0060]
[Формула 8]

[0061]
относится к одинарной, двойной или тройной связи. В случае, когда символ представляет двойную связь, двойная связь включает ее цис-форму и транс-форму.
[0062]
В настоящем изобретении направление связи L3 не имеет ограничений. Например, в случае, когда L3 представляет собой -NR202-S(O)2-, L2 может быть -R31-NR202-S(O)2-R32 или -R31-S(O)2-NR202-R32.
[0063]
В настоящем изобретении каждая из алкильных, алкенильных, алкинильных, алкиленовых, алкениленовых, алкиниленовых и алкоксигрупп включает как их линейную, так и разветвленную форму, если не указано иное.
[0064]
В настоящем изобретении в случае, когда R3 представляет собой метилиденовую группу, это означает, что формула:
[0065]
[Формула 9]
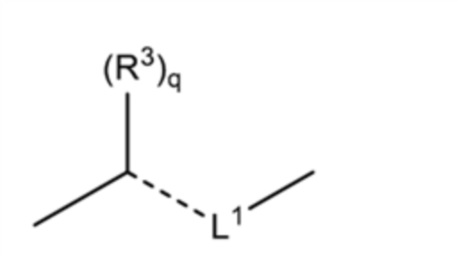
[0066]
[где все символы имеют такое же значение, как указано выше], которая является фрагментом структуры общей формулы (I), имеет структуру, показанную ниже:
[0067]
[Формула 10]

[0068]
[0069]
Соединение настоящего изобретения представляет собой соединение, представленное общей формулой (I), в которой число атомов, расположенных между CycA и бензольным кольцом, равно 5 или более, или его соль.
[0070]
[Формула 11]
[0071]
В настоящем изобретении R1 представляет собой предпочтительно -R11-COOR12, более предпочтительно -R11-COOH. R11 предпочтительно представляет собой C1-6 алкиленовую группу, которая может быть замещена 1-3 атомами галогена, более предпочтительно C2-4 алкиленовую группу, которая может быть замещена 1-3 атомами галогена.
[0072]
В настоящем изобретении, в случае, когда R1 представляет группу:
[0073]
[Формула 12]
 ,
,
[0074]
кольцо 1 представляет собой более предпочтительно 6-членное азотсодержащее моноциклическое насыщенное гетероциклическое кольцо, еще более предпочтительно - морфолин.
[0075]
В настоящем изобретении R101 предпочтительно представляет собой атом водорода.
[0076]
В настоящем изобретении каждый из R11, R13, R16, R17, R18 и R20 предпочтительно представляет собой C1-6 алкиленовую группу, которая может быть замещена 1-3 атомами галогена, более предпочтительно C2-4 алкиленовую группу, которая может быть замещена. 1-3 атомами галогена.
[0077]
В настоящем изобретении каждый из R12, R14, R15 и R19 предпочтительно представляет собой атом водорода.
[0078]
В настоящем изобретении R2 предпочтительно представляет собой атом галогена или C1-4 алкильную группу.
[0079]
В настоящем изобретении X предпочтительно представляет собой атом кислорода.
[0080]
В настоящем изобретении L1 предпочтительно представляет собой (1) линейную C3-7 алкиленовую группу, которая может быть замещена 1-4 RL1a, или (2) (линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a), более предпочтительно линейную C3-7 алкиленовую группу, которая может быть замещена 1-4 RL1a.
[0081]
В настоящем изобретении,
[0082]
[Формула 13]

[0083]
предпочтительно представляет собой одинарную или двойную связь.
[0084]
В настоящем изобретении,
[0085]
[Формула 14]
[0086]
представляет собой
предпочтительно (1) =CH-(линейную C2-6 алкиленовую группу, которая может быть замещена 1-3 RL1a)-, (2) -(линейную C3-7 алкиленовую группу, которая может быть замещена 1-3 RL1a)-, или (3) -(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, (в (1)-(3) RL1a имеет такое же значение, как указано выше),
более предпочтительно (1) =CH-(линейную C2-6 алкиленовую группу, которая может быть замещена 1-3 RL1a)- или (2) -(линейную C3-7 алкиленовую группу, которая может быть замещена 1-3 RL1a)- (в (1)-(2) RL1a имеет такое же значение, как указано выше),
еще более предпочтительно (1) =CH-(линейную C3 алкиленовую группу, которая может быть замещена 1-3 RL1a)- или (2) -(линейную C4 алкиленовую группу, которая может быть замещена 1-3 RL1a)- (в (1)-(2) RL1a имеет такое же значение, как указано выше).
[0087]
В настоящем изобретении RL1a предпочтительно представляет собой гидроксильную группу, атом галогена или оксогруппу, более предпочтительно гидроксильную группу.
[0088]
В настоящем изобретении R3 предпочтительно представляет собой атом водорода.
[0089]
В настоящем изобретении CycA предпочтительно представляет собой (1) C5-6-моноциклическое карбоциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, еще более предпочтительно бензол или 5-6-членное моноциклическое ароматическое гетероциклическое кольцо.
[0090]
В настоящем изобретении CycA предпочтительно представляет собой бензол, циклогексан, пиридин, тиазол, изоиндолин или тетрагидрохинолин, более предпочтительно бензол, изоиндолин или тетрагидрохинолин, еще более предпочтительно бензол.
[0091]
В настоящем изобретении R4 предпочтительно представляет собой атом галогена, C1-4 алкильную группу или C1-4 галогеналкильную группу, более предпочтительно атом галогена, метильную группу или тригалогенметильную группу.
[0092]
В настоящем изобретении L3 предпочтительно представляет собой -NR201-S(O)2- или -CR204(OH).
[0093]
В настоящем изобретении L2 предпочтительно представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-.
[0094]
В настоящем изобретении каждый из R201, R202, R203, R204 и R205 предпочтительно представляет собой атом водорода, C1-4 алкильную группу, C1-4 алкильную группу, которая замещена гидроксильной группой, C1-4 алкильную группу, которая замещена C3-6 моноциклическим карбоциклическим кольцом или C1-4 алкильную группу, которая замещена 3-6-членным моноциклическим гетероциклическим кольцом, более предпочтительно - атом водорода. С1-4 алкильная группа, которая замещена С3-6 моноциклическим карбоциклическим кольцом, предпочтительно представляет собой С1-4 алкильную группу, которая замещена циклопропаном или бензолом, и С1-4 алкильная группа, которая замещена 3-6-членным моноциклическим гетероциклическим кольцом, предпочтительно представляет собой C1-4-алкильную группу, которая замещена оксетаном, тетрагидрофураном или тетрагидропираном.
[0095]
В настоящем изобретении R31 предпочтительно представляет собой связь или C1-3 алкиленовую группу, более предпочтительно связь.
[0096]
В настоящем изобретении R32 предпочтительно представляет собой связь или C1-3 алкиленовую группу, более предпочтительно C1-3 алкиленовую группу.
[0097]
В настоящем изобретении CycB предпочтительно представляет собой (1) C5-6 моноциклическое карбоциклическое кольцо или (2) 5-6-членное моноциклическое гетероциклическое кольцо, более предпочтительно бензол или 5-6-членное моноциклическое ароматическое гетероциклическое кольцо.
[0098]
В настоящем изобретении CycB предпочтительно представляет собой циклопентан, бензол, циклогексан, тиофен, пиридин или бензофуран, более предпочтительно бензол.
[0099]
В настоящем изобретении R5 предпочтительно представляет собой атом галогена, C1-4 алкильную группу, C1-4 галогеналкильную группу или C1-4 алкоксигруппу, более предпочтительно атом галогена, C 1-4 алкоксигруппу, тригалогенметильную группу или C1-4 алкоксигруппу.
[0100]
В настоящем изобретении каждое из r и t предпочтительно является целым числом от 0 до 3, более предпочтительно целым числом от 0 до 2.
[0101]
В настоящем изобретении структура группы:
[0102]
[Формула 15]
[0103]
[где все символы имеют такое же значение, как указано выше] которая является фрагментом структуры общей формулы (I), представляет собой предпочтительно
[0104]
[Формула 16]
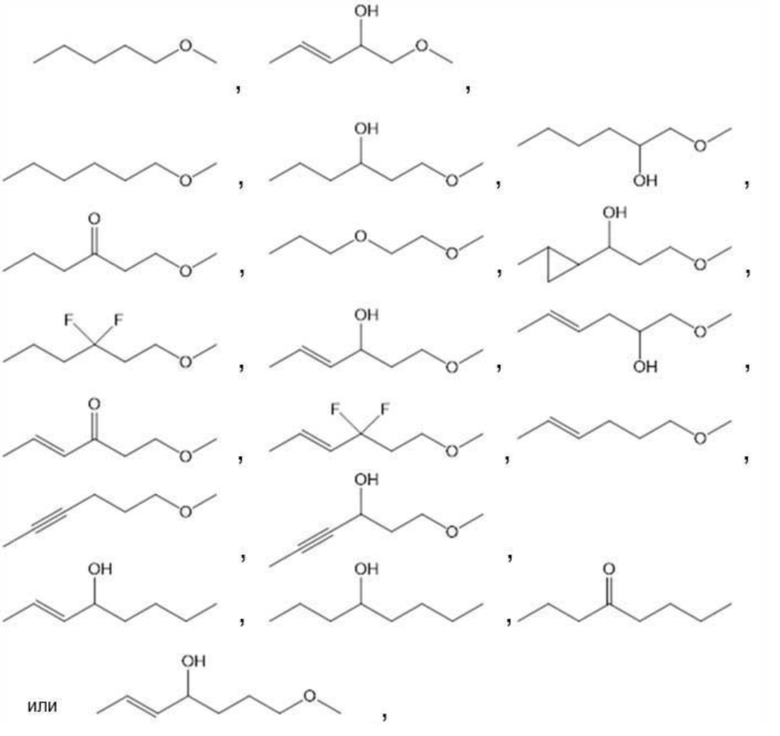
[0105]
более предпочтительно
[0106]
[Формула 17]
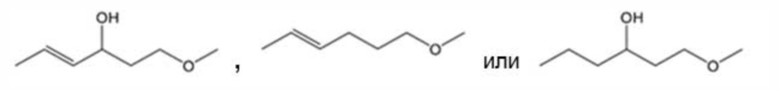
[0107]
[0108]
В настоящем изобретении структура формулы:
[0109]
[Формула 18]
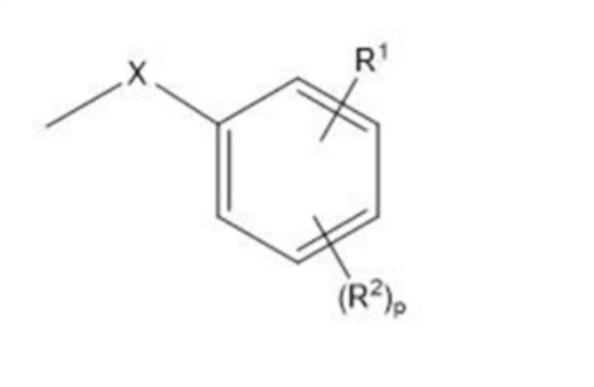
[0110]
[где все символы имеют такое же значение, как указано выше] которая является фрагментом структуры общей формулы (I), представляет собой предпочтительно
[0111]
[Формула 19]
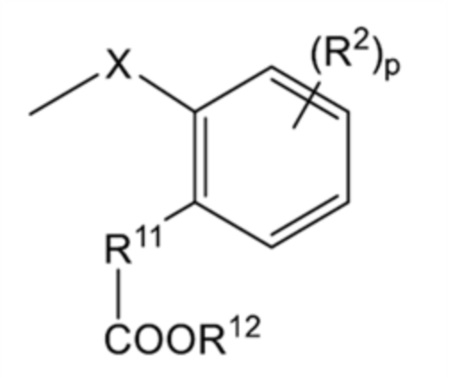
[0112]
[где все символы имеют такое же значение, как указано выше].
[0113]
В настоящем изобретении структура формулы:
[0114]
[Формула 20]
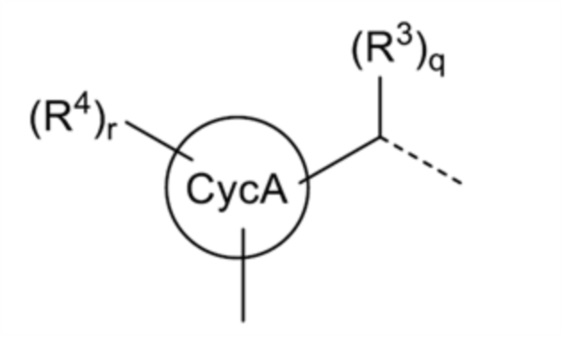
[0115]
[где все символы имеют такое же значение, как указано выше] которая является фрагментом структуры общей формулы (I), представляет собой предпочтительно
[0116]
[Формула 21]
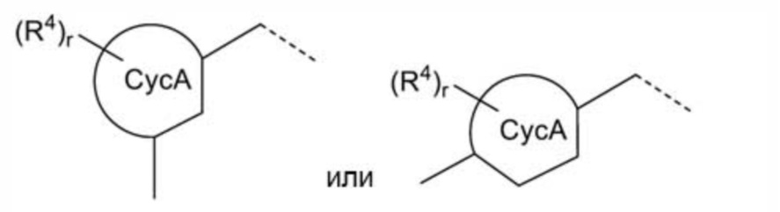
[0117]
[где все символы имеют такое же значение, как указано выше].
[0118]
В настоящем изобретении одним вариантом осуществления общей формулы (I) является общая формула (I-i):
[0119]
[Формула 22]
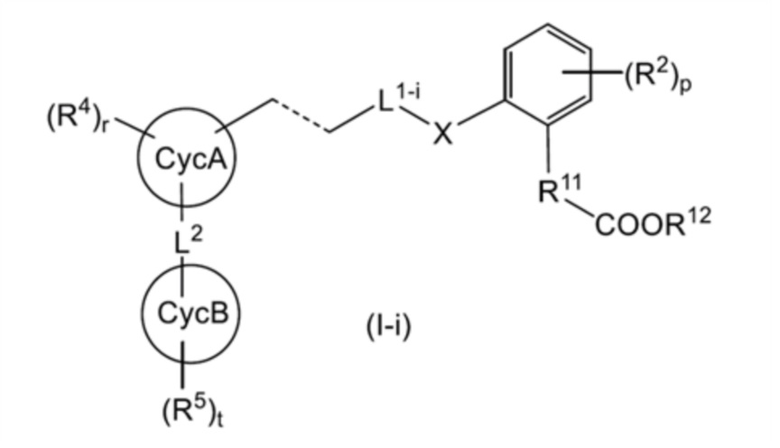
[0120]
[где L1-i представляет собой (1) линейную C2-4 алкиленовую группу, которая может быть замещена 1-3 RL1a, или (2) -O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-; и другие символы имеют такое же значение, как указано выше].
[0121]
В настоящем изобретении одним вариантом осуществления общей формулы (I-i) является общая формула (I-ii):
[0122]
[Формула 23]
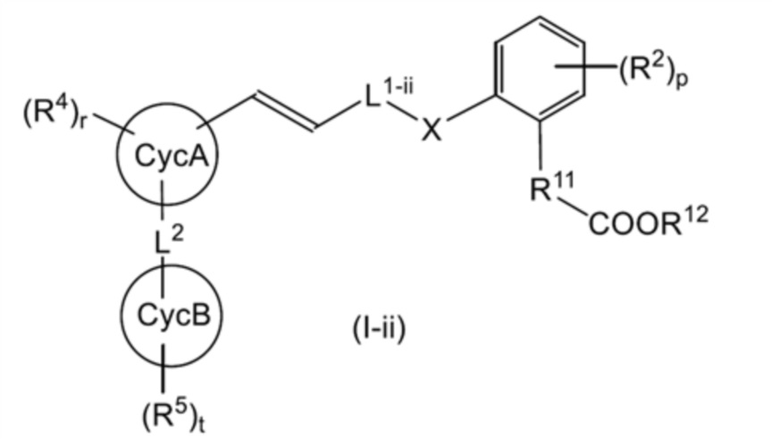
[0123]
[где L1-ii представляет собой линейную C2-4 алкиленовую группу, которая может быть замещена 1-3 RL1a; и другие символы имеют такое же значение, как указано выше];
общая формула (I-iii):
[0124]
[Формула 24]
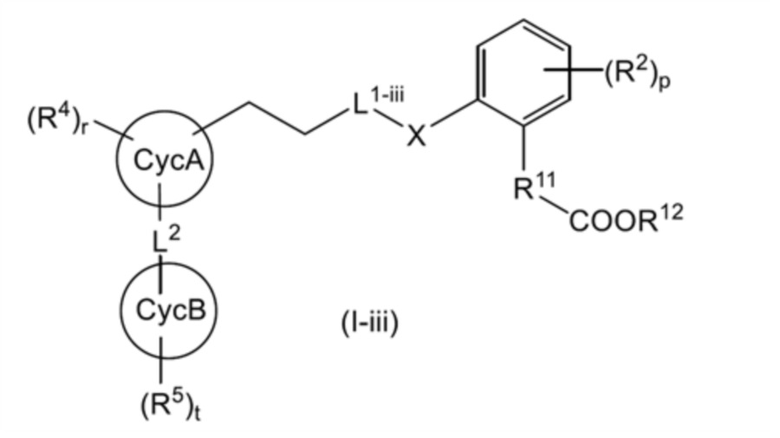
[0125]
[где L1-iii представляет собой (1) линейную C2-4 алкиленовую группу, которая может быть замещена 1-3 RL1a, или (2) -O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-; и другие символы имеют такое же значение, как указано выше]; или
общая формула (I-iv):
[0126]
[Формула 25]
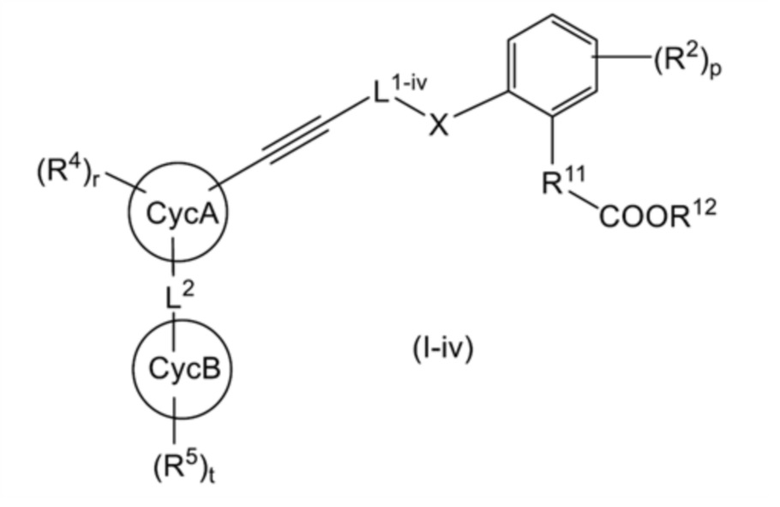
[0127]
[где L1-iv представляет собой линейную C2-4 алкиленовую группу, которая может быть замещена 1-3 RL1a; и другие символы имеют такое же значение, как указано выше].
[0128]
Одним из вариантов осуществления соединения, представленного общей формулой (I-i), (I-ii), (I-iii) или (I-iv), или его соли, является соединение, в котором:
(1) R11 представляет собой C2-4 алкиленовую группу;
(2) X представляет собой атом кислорода;
(3) RL1a представляет собой гидроксильную группу;
(4) CycA представляет собой (i) C5-6 моноциклическое карбоциклическое кольцо или 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, (ii) бензол или 5-6-членное моноциклическое ароматическое гетероциклическое кольцо, (iii) C5-6 моноциклическое карбоциклическое кольцо, или (iv) бензол, циклогексан, пиридин, тиазол, изоиндолин или тетрагидрохинолин;
(5) CycB представляет собой (i) C5-6-моноциклическое карбоциклическое кольцо или 5-6-членное моноциклическое гетероциклическое кольцо, (ii) бензол или 5-6-членное моноциклическое ароматическое гетероциклическое кольцо, (iii) C5-6 моноциклическое карбоциклическое кольцо, или (iv) циклопентaн, бензол, циклогексан, тиофен, пиридин или бензофуран;
(6) L2 представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-; или
(7) символы, кроме R11, X, RL1a, CycA, CycB и L2, представляют указанные выше группы (например, группы, которые указаны выше как «предпочтительные», «более предпочтительные» или «еще более предпочтительные» группы); или
(8) удовлетворяется комбинация двух или более пунктов (1)-(7),
или соль соединения.
В настоящем изобретении соединение, представленное общей формулой (I-i), (I-ii), (I-iii) или (I-iv), или его соль, предпочтительно представляет собой:
(1) соединение, в котором X представляет собой атом кислорода, и L2 представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-, или его соль;
(2) соединение, в котором X представляет собой атом кислорода, L2 представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-, и каждый из CycA и CycB представляет собой C5-6 моноциклическое карбоциклическое кольцо, или его соль;
(3) соединение, в котором R11 представляет собой C2-4 алкиленовую группу, X представляет собой атом кислорода, L2 представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-, и каждый из CycA и CycB представляет собой C5-6 моноциклическое карбоциклическое кольцо, или его соль; или
(4) соединение, в котором X представляет собой атом кислорода, RL1a представляет собой гидроксильную группу, L2 представляет собой -NR201-S(O)2- или -CR204(OH)-CH2-, и каждый из CycA и CycB представляет собой C5-6 моноциклическое карбоциклическое кольцо, или соль соединения.
[0129]
В настоящем изобретении другим вариантом осуществления общей формулы (I) является общая формула (I-1):
[0130]
[Формула 26]

[0131]
[где все символы имеют такое же значение, как указано выше].
В настоящем изобретении общая формула (I-1) предпочтительно представляет собой общую формулу (I-1-A):
[0132]
[Формула 27]
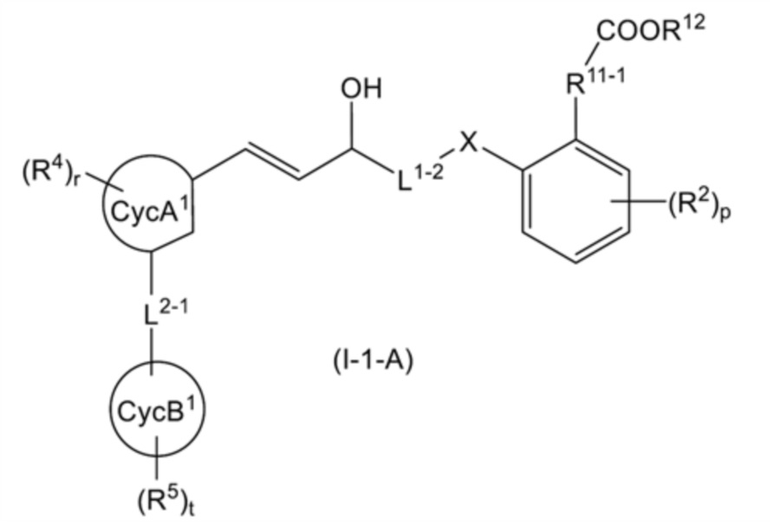
[0133]
[где L1-2 представляет собой линейную C2-3 алкиленовую группу; и другие символы имеют такое же значение, как указано выше];
общую формулу (I-1-B):
[0134]
[Формула 28]
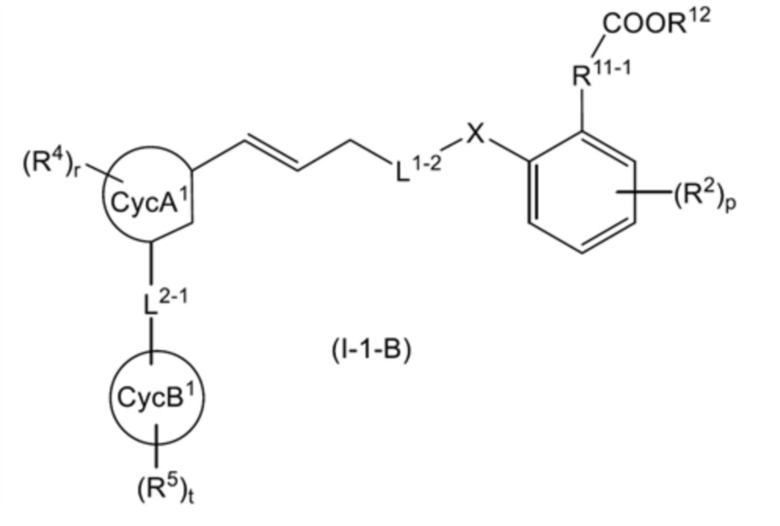
[0135]
[где все символы имеют такое же значение, как указано выше];
общую формулу (I-1-C):
[0136]
[Формула 29]
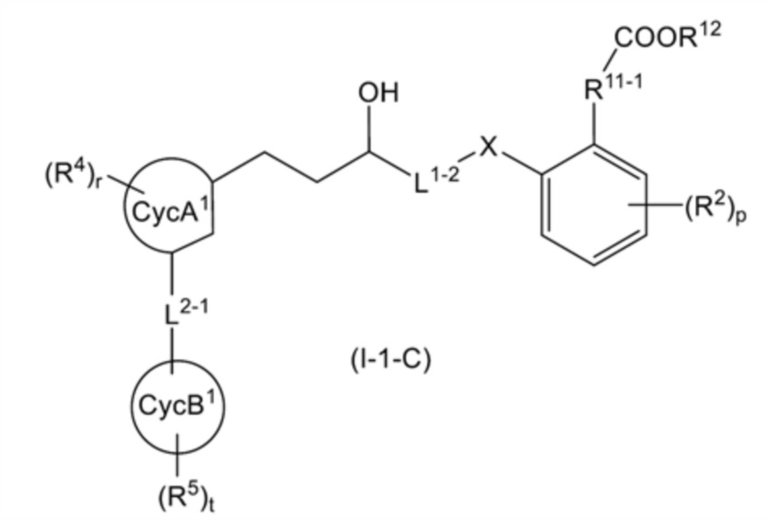
[0137]
[где все символы имеют такое же значение, как указано выше];
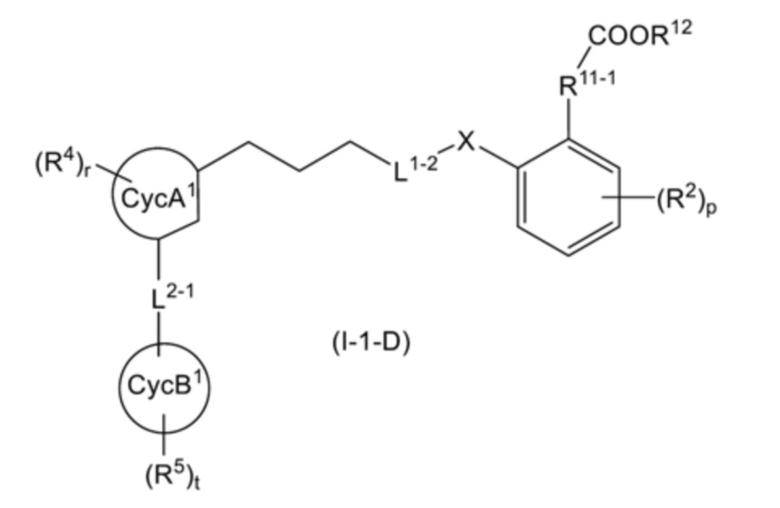
общую формулу (I-1-D):
[0138]
[Формула 30]
[0139]
[где все символы имеют такое же значение, как указано выше].
[0140]
Варианты осуществления соединения, представленного общей формулой (I-1-A), (I-1-B), (I-1-C) или (I-1-D), или его соли, включают:
(1) соединение, в котором X представляет собой атом кислорода, или его соль;
(2) соединение, в котором CycA1 представляет собой бензол, циклогексан, пиридин, тиазол, изоиндолин или тетрагидрохинолин, или их соль;
(3) соединение, в котором CycB1 представляет собой циклопентан, бензол, циклогексан, тиофен, пиридин или бензофуран, или его соль;
(4) соединение, в котором группы, отличные от X, CycA1 и CycB1, представляют собой указанные выше группы (например, группы, которые указаны выше как «предпочтительные», «более предпочтительные» или «еще более предпочтительные» группы), или его соль; и
(5) соединение, в котором удовлетворяется комбинация двух или более пунктов (1)-(4), или его соль.
[0141]
[Изомеры]
В настоящем изобретении, как очевидно для специалистов в данной области техники, символ:
[0142]
[Формула 31]

[0143]
означает, что связь проецируется ниже плоскости листа (т.е. α-конфигурация), символ:
[0144]
[Формула 32]

[0145]
означает, что связь проецируется выше плоскости листа (т.е. β-конфигурация), и символ:
[0146]
[Формула 33]

[0147]
означает, что связь представляет собой сочетание α-конфигурации и β-конфигурации при произвольном соотношении составляющих, если не указано иное.
[0148]
В настоящем изобретении изомер включает все эти изомеры, если не указано иное. Например, каждый из алкила, алкенила, алкинила, алкокси, алкилтио, алкилена, алкенилена, алкинилена, алкилидена и алкенилидена включает как их линейную, так и разветвленную форму. Кроме того, изомер в двойной связи, кольце или конденсированном кольце (E-, Z-, цис- или транс-форма), изомер из-за присутствия асимметричного углерода или тому подобное (R- или S-форма, α- или β-конфигурация, энантиомер, диастереомер), оптически активная форма, обладающая оптической активностью (D-, L-, d- или l-форма), полярное тело (высокополярное тело, слабо полярное тело), полученное хроматографическим разделением, равновесное соединение и вращающий изомер, а также их смесь и рацемическая смесь при произвольном соотношении компонентов в смеси также включены в объем настоящего изобретения.
[0149]
Оптически активное соединение настоящего изобретения может включать его 100% чистую форму, а также другие оптические изомеры, каждый из которых имеет чистоту менее 50%.
[0150]
В настоящем изобретении все утверждения о соединении настоящего изобретения охватывают утверждения, которые касаются соединения, представленного общей формулой (I), или его соли, N-оксида, сольвата или сокристалла, или N-оксида, сольвата или сокристалла соли соединения, представленного общей формулой (I).
[0151]
Соединение, представленное общей формулой (I), можно превратить в соответствующую соль известным способом. Соль предпочтительно является водорастворимой. Соль также предпочтительно представляет собой фармацевтически приемлемую соль. Примеры соли включают соль щелочного металла (например, лития, калия, натрия), соль щелочноземельного металла (например, кальция, магния), соль другого металла (например, серебра, цинка), соль аммония, соль фармацевтически приемлемого органического амина (например, тетраметиламмоний, холин, триэтиламин, метиламин, диметиламин, этиламин, диэтиламин, циклопентиламин, бензиламин, фенэтиламин, трет-бутиламин, этилендиамин, пиперидин, пиперазин, моноэтаноламин, диэтаноламин, трис(гидроксиметил)аминометан, N-бензил-2-фенэтиламин, динол, 2-(диэтиламино)этанол, 1-(2-гидроксиэтил)пирролидин, лизин, аргинин, N-метил-D-глюкамин), кислотно-аддитивную соль (например, соль неорганической кислоты (соль соляной кислоты, соль бромистоводородной кислоты, соль йодистоводородной кислоты, соль серной кислоты, соль фосфорной кислоты, соль азотной кислоты и т.п.), соль органической кислоты (соль уксусной кислоты, соль трифторуксусной кислоты, соль молочной кислоты, соль винной кислоты, соль щавелевой кислоты, соль фумаровой кислоты, соль малеиновой кислоты, соль бензойной кислоты, соль лимонной кислоты, соль метансульфоновой кислоты, соль этансульфоновой кислоты, соль бензолсульфоновой кислоты, соль толуолсульфоновой кислоты, соль изетионовой кислоты, соль нападисиловой кислоты, соль глюкуроновой кислоты, соль глюконовой кислоты, и т.д.) и тому подобное.
[0152]
Соединение, представленное общей формулой (I), или его фармацевтически приемлемая соль могут присутствовать в несольватированной форме или в форме, сольватированной фармацевтически приемлемым растворителем, таким как вода и этанол. Сольват предпочтительно является малотоксичным и водорастворимым, и более предпочтительно является гидратом. Соединение, представленное общей формулой (I), или его соль можно превратить в сольват известным способом.
[0153]
N-оксидная форма соединения, представленного общей формулой (I), является соединением, полученным окислением атома азота в соединении, представленном общей формулой (I). N-оксидная форма соединения, представленного общей формулой (I), может быть в форме указанной выше соли щелочного (щелочноземельного) металла, соли аммония, соли органического амина или кислотно-аддитивной соли.
[0154]
Соединение, представленное общей формулой (I), или его фармацевтически приемлемая соль может присутствовать в форме сокристалла с подходящим агентом, образующим сокристаллы. Сокристалл предпочтительно представляет собой фармацевтически приемлемый сокристалл, который образован с фармацевтически приемлемым агентом, образующим сокристаллы. Сокристалл обычно определяется как кристалл, образованный по меньшей мере двумя типами различных межмолекулярных взаимодействий. Сокристалл может быть комплексом нейтральной молекулы и соли. Сокристалл может быть получен известным способом, таким как кристаллизация из расплава, перекристаллизация из растворителя и физическое измельчение всех компонентов вместе. Примеры подходящего агента, образующего сокристаллы, включают: органическую кислоту (например, яблочную кислоту, янтарную кислоту, адипиновую кислоту, глюконовую кислоту, винную кислоту, бензойную кислоту, 4-гидроксибензойную кислоту, 3-гидроксибензойную кислоту, никотиновую кислоту, изоникотиновую кислоту); органический амин (например, имидазол, диэтаноламин, триэтаноламин, трис(гидроксиметил)аминометан, N-бензилфенэтиламин, динол, 2-(диэтиламино)этанол, 1-(2-гидроксиэтил)пирролидин, 4-(2-гидроксиэтил)морфолин, N-метил-D-глюкамин, глицин, гистидин, пролин); и другие органические соединения (например, кофеин, сахарин).
[0155]
Термин «пролекарство соединения, представленного общей формулой (I)» относится к соединению, которое может быть превращено в соединение, представленное общей формулой (I), посредством реакции с ферментом, кислотой желудочного сока или тому подобным in vivo. Примеры пролекарства соединения, представленного общей формулой (I), включают: в случае, когда соединение, представленное общей формулой (I), имеет аминогруппу, соединение, имеющее такую структуру, что аминогруппа в соответствующем соединении ацилирована, алкилирована или фосфорилирована (например, соединение, имеющее такую структуру, что аминогруппа i соединения, представленного общей формулой (I), является эйкозаноилированной, аланилированной, пентиламинокарбонилированной, (5-метил-2-оксо-1,3-доксолен-4-ил)метоксикарбонилированной, тетрагидрофуранилированной, пирролидилметилированной, пивалоилоксиметилированной, ацетоксиметилированной или трет-бутилированной); в случае, когда соединение, представленное общей формулой (I), имеет гидроксильную группу, соединение, имеющее такую структуру, что гидроксильная группа в соответствующем соединении является ацилированной, алкилированной, фосфорилированной или борированной (например, соединение, имеющее такую структуру, что гидроксильная группа в соответствующем соединении, представленном общей формулой (I), является ацетилированной, пальмитоилированной, пропаноилированной, пивалоилированной, сукцинилированной, фумарилированной, аланилированной или диметиламинометилкарбонилированной); и в случае, когда соединение, представленное общей формулой (I), имеет карбоксильную группу, соединение, имеющее такую структуру, что карбоксильная группа в соответствующем соединении является этерифицированной или амидированной (например, соединение, имеющее такую структуру, что карбонильная группа в соответствующем соединении, представленном общей формулой (I), является этилэтерифицированной, фенилэтерифицированной, карбоксиметилэтерифицированной, диметиламинометилэтерифицированной, пивалоилоксиметилэтерифицированной, этоксикарбонилоксиэтилэтерифицированной, фталидилэтерифицированной, (5-метил-2-оксо-1,3-диоксолен-4-ил) метилэтерифицированной, циклогексилоксикарбонилэтилэтерифицированной или метиламидированной). Эти соединения могут быть получены известными способами. Пролекарство соединения, представленного общей формулой (I), может быть сольватом. В качестве альтернативы, пролекарство соединения, представленного общей формулой (I), может быть соединением, которое может превращаться в соединение, представленное общей формулой (I), в физиологических условиях, как указано в «Development of Pharmaceuticals», vol. 7, «Design of Molecules», pages: 163-198, 1990, Hirokawa-Shoten Ltd. Кроме того, соединение, представленное общей формулой (I), может быть помечено изотопом (например, 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 35S, 18F, 36Cl, 123I, 125I) или тому подобное.
[0156]
[Способ получения соединения настоящего изобретения]
Соединение настоящего изобретения может быть получено соответствующим образом модифицированным методом известного способа, такого как способ, упомянутый в Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition (Richard C. Larock, John Wiley & Sons Inc, 1999) и способами, указанными в разделе «ПРИМЕРЫ», или путем комбинации этих способов.
[0157]
Среди соединений, представленных общей формулой (I), соединение, представленное общей формулой (I-A):
[0158]
[Формула 34]
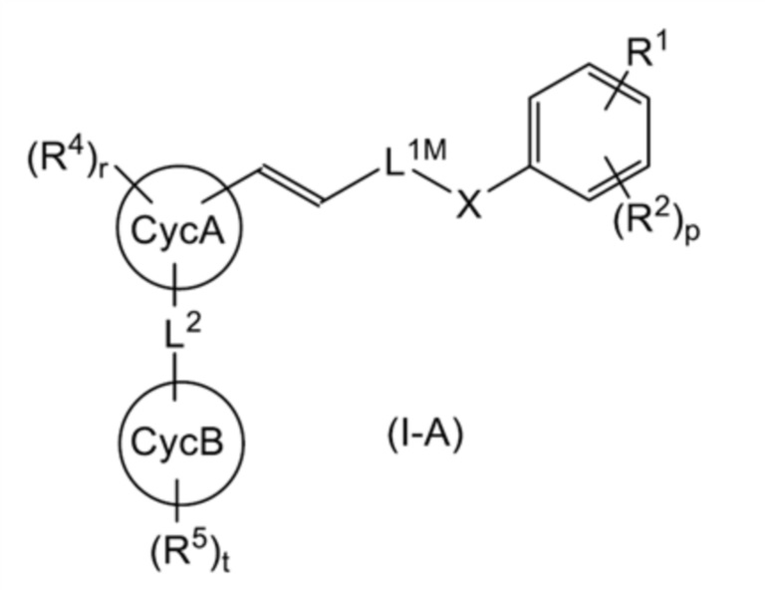
[0159]
(где L1M представляет собой (1) линейную C2-6 алкиленовую группу, которая может быть замещена 1-4 RL1a, (2) линейную C2-6 алкениленовую группу, которая может быть замещена 1-4 RL1a, (3) линейную C2-6 алкиниленовую группу, которая может быть замещена 1-4 RL1a, или (4) (линейную C1-3 алкиниленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a); и другие символы имеют такое же значение, как указано выше) может быть получено способом, показанным на следующей схеме реакции 1.
[0160]
[Формула 35]

[0161]
(где Hal представляет собой атом галогена; и другие символы имеют такое же значение, как указано выше).
[0162]
В схеме реакции 1 реакция 1-1 может быть достигнута путем осуществления реакции нуклеофильного присоединения с использованием соединения, представленного общей формулой (A-1), и 4,4,5,5-тетраметил-1,3,2-диоксаборолана. Реакция нуклеофильного присоединения известна, и может быть проведена, например, в органическом растворителе (например, гексане, гептане, октане, бензоле, толуоле, тетрагидрофуране (далее сокращенно обозначается «THF»), диоксане, диметоксиэтане, простом диэтиловом эфире, или смешанном растворителе, состоящем из двух или более из этих растворителей), или в условиях отсутствия растворителей при температуре 0-120 °C. Реакцию также можно проводить в присутствии катализатора с целью ускорения реакции. Примеры катализатора включают муравьиную кислоту, уксусную кислоту, бензойную кислоту, 4-диметиламинобензойную кислоту и реагент Шварца (регистрационный номер CAS: 37342-97-5).
[0163]
В схеме реакции 1 реакция 1-2 может быть достигнута путем осуществления реакции сочетания Сузуки с использованием соединения, представленного общей формулой (A-2), и соединения, представленного общей формулой (A-3). Реакция Сузуки известна, и может быть проведена, например, в органическом растворителе (например, толуоле, бензоле, N, N-диметилформамиде (далее сокращенно обозначается «DMF»), THF, метаноле, этаноле, ацетонитриле, диметоксиэтане, ацетоне, диоксане, диметилацетамиде), воде, смешанном растворителе, состоящем из двух или более из этих растворителей, или тому подобное, в присутствии палладиевого катализатора (например, тетракис(трифенилфосфин)палладия (Pd(PPh3)4), дихлорбис(трифенилфосфин)палладия (Cl2Pd(PPh3)2), ацетата палладия (Pd(OAc)2), бис(три-трет-бутилфосфин)пaллaдия(0) (Pd(tBu3P)2)) и в присутствии основания (например, гидроксида натрия, гидроксида калия, триэтиламина, карбоната натрия, бикарбоната натрия, карбоната калия, карбоната цезия, карбоната таллия, трикалийфосфата, фторида цезия, гидроксида бария, фторида тетрабутиламмония) при комнатной температуре до 120°C.
[0164]
Кроме того, соединение, представленное общей формулой (I-B):
[0165]
[Формула 36]
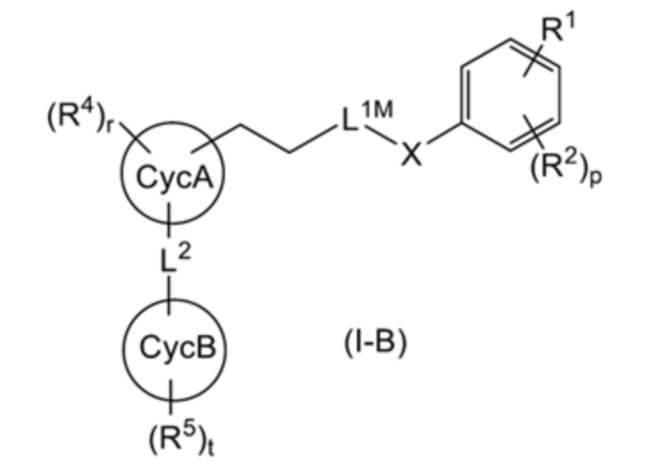
[0166]
(где все символы имеют такое же значение, как указано выше) может быть получено путем проведения реакции восстановления с использованием соединения, представленного общей формулой (I-A). Реакция восстановления известна и может быть проведена следующими способами. Например, упоминаются (1) реакция восстановления с использованием металла и (2) реакция диимидного восстановления. Реакция (1) восстановления с использованием металла может быть проведена, например, в органическом растворителе (например, THF, диоксане, диметоксиэтане, простом диэтиловом эфире, метаноле, этаноле, бензоле, толуоле, ацетоне, метилэтилкетоне, ацетонитриле, DMF, этилацетате, уксусной кислоте, воде, или смешанном растворителе, состоящем из двух или более из этих растворителей), в присутствии или при отсутствии катализатора гидрирования (например, палладия на угле, палладиевой черни, палладия, гидроксида палладия, диоксида платины, платины на угле, никеля, никеля Ренея, хлорида рутения), в присутствии или в отсутствие кислоты (например, соляной кислоты, серной кислоты, хлорноватистой кислоты, борной кислоты, тетрафторборной кислоты, уксусной кислоты, п-толуолсульфоновой кислоты, щавелевой кислоты, трифторуксусной кислоты (далее сокращенно обозначается «TFA»), муравьиной кислоты), в атмосфере водорода при атмосферном давлении или под давлением при 0-200 °С. Реакция (2) диимидного восстановления может быть проведена, например, в органическом растворителе (например, толуоле, бензоле, DMF, THF, ацетонитриле, диметоксиэтане, ацетоне, диоксане, диметилацетамиде, метаноле, этаноле, смешанном растворителе, состоящем из двух или более из этих растворителей), в присутствии или в отсутствие гидразинового соединения (например, гидразина, гидразинмоногидрата, тозилгидразина) и основания (например, гидроксида натрия, гидроксида калия, карбоната натрия, бикарбоната натрия, карбоната калия, карбоната цезия) при температуре от 0°C до 120°C.
[0167]
Среди соединений, представленных общей формулой (I), соединение, представленное общей формулой (I-С):
[0168]
[Формула 37]
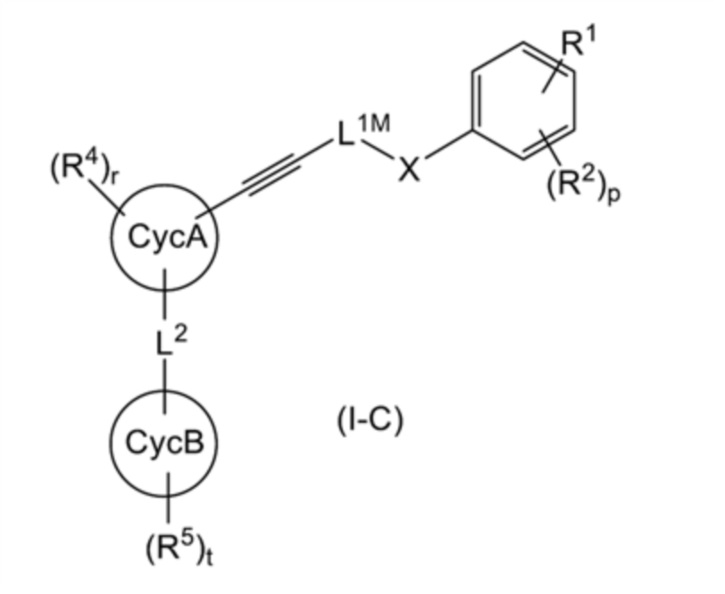
[0169]
(где все символы имеют такое же значение, как указано выше) может быть получено способом, показанным на схеме реакции 2 ниже.
[0170]
[Формула 38]
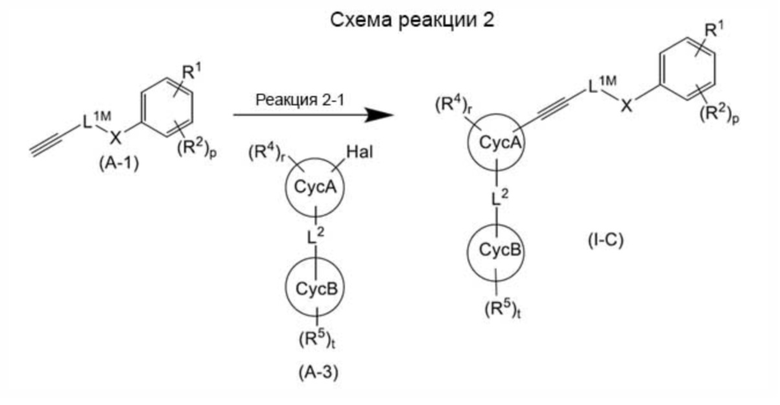
[0171]
(где все символы имеют такое же значение, как указано выше).
[0172]
В схеме реакции 2 реакция 2-1 может быть достигнута путем подвергания соединения, представленного общей формулой (A-1), и соединения, представленного общей формулой (A-3), реакции Соногаширы. Реакция Соногаширы известна и может быть достигнута, например, путем осуществления реакции в органическом растворителе (например, этилацетате, изопропилацетате, бензоле, толуоле, ксилоле, гептане, циклогексане, THF, диоксане, диметоксиэтане, этаноле, 2-пропаноле, полиэтиленгликоле, диметилсульфоксиде, DMF, N, N-диметилацетамиде, N-метил-2-пирролидиноне, метиленхлориде, хлороформе, ацетоне, ацетонитриле), воде, смешанном растворителе, состоящем из двух или более из этих растворителей, или тому подобное, или в условиях отсутствия растворителей, в присутствии основания (например, диэтиламина, триэтиламина, пропиламина, диизопропиламина, диизопропилэтиламина, дибутиламина, трибутиламина, пирролидина, пиперидина, N-метилпиперидина, 1,4-диазабицикло[2.2.2]октaна, пиридина, гидроксида натрия, бикарбоната натрия, карбоната натрия, карбоната калия, карбоната цезия, фосфата натрия, фосфата калия, фторида калия), в присутствии катализатора (например, палладиевого катализатора (например, тетракис(трифенилфосфин)палладия (Pd(PPh3)4), дихлорбис(трифенилфосфин)палладия (Cl2Pd(PPh3)2), ацетата палладия (Pd(OAc)2), бис(три-трет-бутилфосфин)пaллaдия(0) (Pd(tBu3P)2)), смеси палладиевого катализатора и медного катализатора (например, йодида меди (I)), при наличии или в отсутствие катализатора межфазного переноса (например, хлорида тетрабутиламмония, бромида тетрабутиламмония, йодида тетрабутиламмония, ацетата тетрабутиламмония) при комнатной температуре до 120°C.
[0173]
Среди соединений, представленных общей формулой (A-3) на схемах реакций 1 и 2, соединение, представленное общей формулой (A-3-1):
[0174]
[Формула 39]

[0175]
(где все символы имеют такое же значение, как указано выше) может быть получено способом, показанным на схеме реакции 3 ниже.
[0176]
[Формула 40]
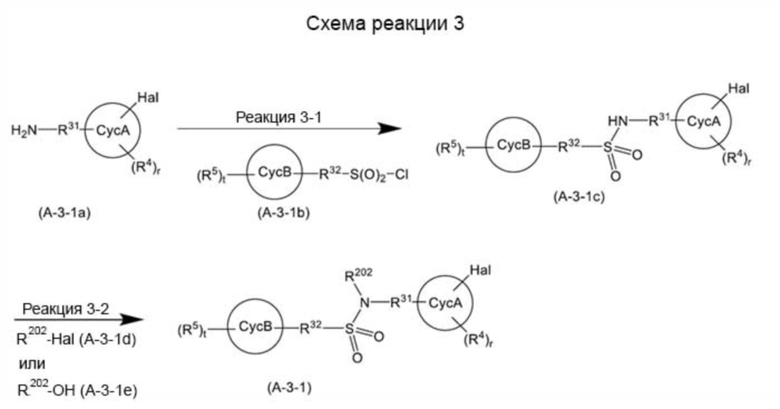
[0177]
(где все символы имеют такое же значение, как указано выше).
[0178]
В схеме реакции 3 реакция 3-1 может быть достигнута путем подвергания соединения, представленного общей формулой (A-3-1a), и соединения, представленного общей формулой (A-3-1b), реакции сульфонамидирования. Реакция сульфонамидирования известна и может быть достигнута, например, путем осуществления реакции в органическом растворителе (например, этилацетате, изопропилацетате, бензоле, толуоле, ксилоле, гептане, циклогексане, THF, диоксане, диметоксиэтане, этаноле, 2-пропаноле, диметилсульфоксиде, DMF, N, N-диметилацетамиде, N-метил-2-пирролидиноне, метиленхлориде, хлороформе, ацетоне, ацетонитриле, смешанном растворителе, состоящем из двух или более из этих растворителей) или в условиях отсутствия растворителей, при наличии или в отсутствие основания (например, диизопропилэтиламина, пиридина, триэтиламина, диметиланилина, гидроксида натрия, карбоната натрия, карбоната калия, карбоната цезия, фосфата натрия, фосфата калия), в присутствии или в отсутствие катализатора (например, 4-диметиламинопиридина) при температуре 0-120 °C.
[0179]
В схеме реакции 3 реакцию 3-2 можно проводить, подвергая соединение, представленное общей формулой (A-3-1c), и соединение, представленное общей формулой (A-3-1d), реакции алкилирования, или подвергая соединение, представленное общей формулой (A-3-1c), и соединение, представленное общей формулой (A-3-1e), реакции Мицунобу. Реакция алкилирования известна и может быть достигнута, например, путем осуществления реакции в органическом растворителе (например, DMF, диметилсульфоксиде, хлороформе, дихлорметане, простом диэтиловом эфире, THF, простом метил-трет-бутиловом эфире, ацетонитриле, воде, смешанном растворителе, состоящем из двух или более из этих растворителей), в присутствии основания (например, гидроксида натрия, гидроксида калия, гидроксида лития, гидроксида бария, гидроксида кальция, карбоната натрия, карбоната калия, гидрида натрия, бис(триметилсилил)амида лития, бис(триметилсилил)амида калия, бис(триметилсилил)амида натрия ) при температуре от 0°C до 100°C. Реакция Мицунобу известна и может быть достигнута, например, путем осуществления реакции в органическом растворителе (например, дихлорметане, простом диэтиловом эфире, THF, ацетонитриле, бензоле, толуоле), в присутствии азосоединения (например, диэтилазодикарбоксилата, диизопропилазодикарбоксилата, 1,1’-(азодикарбонил)дипиперидина, 1,1’-азобис(N, N-диметилформамида)) и фосфинового соединения (например, трифенилфосфина, трибутилфосфина, триметилфосфина, трифенилфосфина на полимерном носителе) при температуре 0-80 °C.
[0180]
Среди соединений, представленных общей формулой (A-3) на схемах реакций 1 и 2, соединение, представленное общей формулой (A-3-2):
[0181]
[Формула 41]
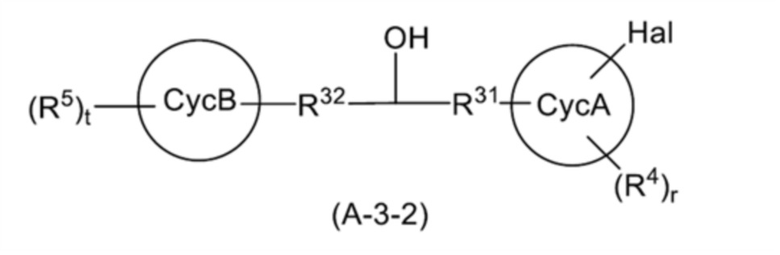
[0182]
(где все символы имеют такое же значение, как указано выше) может быть получено способом, показанным на схеме реакции 4 ниже.
[0183]
[Формула 42]
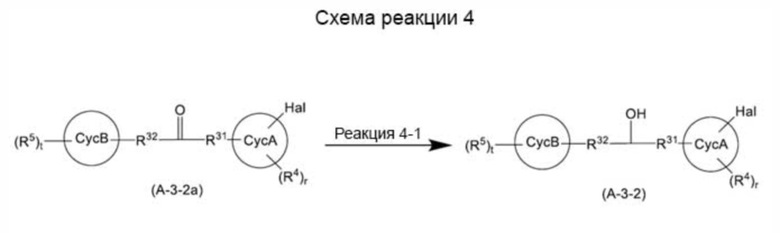
[0184]
(где все символы имеют такое же значение, как указано выше).
[0185]
В схеме реакции 4 реакция 4-1 может быть достигнута, например, путем реакции соединения, представленного общей формулой (A-3-2a), в органическом растворителе (например, THF, диметоксиэтане, толуоле, дихлорметане, простом диэтиловом эфире, диоксане, метаноле) в присутствии или в отсутствие хлорида церия с использованием восстановителя (например, борогидрида натрия, борогидрида цинка) при температуре от -20°С до 50°C. В случае, когда предполагается получение только одного из стереоизомеров селективно, реакцию проводят с использованием асимметричного восстановителя (например, хлордиизопинокамфилборана) или комбинации хирального вспомогательного агента и восстановителя (например, (R)-2-метил-CBS-оксазаборолидина и комплекса борогидрид-THF или комплекса боран-диметилсульфид, (S)-(-)-бинафтола и алюмогидрида лития) при температуре от -100°C до 50°C.
[0186]
В схеме реакции 1, 2, 3 или 4, в случае, когда защитная группа присутствует в соединении, представленном каждой из общих формул, при необходимости может быть проведена реакция снятия защиты. Реакция снятия защиты для защитной группы известна и может быть проведена следующими способами. Например, можно упомянуть (1) реакцию снятия защиты щелочным гидролизом, (2) реакцию снятия защиты в кислых условиях, (3) реакцию снятия защиты гидрогенолизом, (4) реакцию снятия защиты силильной группы, (5) реакцию снятия защиты с использованием металла и (6) реакцию снятия защиты с использованием комплекса металла.
[0187]
Эти способы будут описаны детально ниже.
(1) Реакцию снятия защиты щелочным гидролизом можно осуществлять, например, в органическом растворителе (например, метаноле, THF, диоксане), с использованием гидроксида щелочного металла (например, гидроксида натрия, гидроксида калия, гидроксида лития), гидроксида щелочноземельного металла (например, гидроксида бария, гидроксида кальция), карбоната (например, карбоната натрия, карбоната калия) или их водного раствора или их смеси при температуре 0-40 °C.
(2) Реакцию снятия защиты в кислых условиях можно проводить, например, в органическом растворителе (например, дихлорметане, хлороформе, диоксане, этилацетате, метаноле, изопропиловом спирте, THF, анизоле), в органической кислоте (например, уксусной кислоте, трифторуксусной кислоте, метансульфоновой кислоте, п-толуолсульфоновой кислоте) или неорганической кислоте (например, соляной кислоте, серной кислоте) или их смеси (например, бромид водорода/уксусная кислота) в присутствии или в отсутствие 2,2,2-трифторэтанола при температуре 0-100 °C.
(3) Реакцию снятия защиты гидрогенолизом можно осуществлять, например, в растворителе (например, растворителе эфирного типа (например, THF, диоксане, диметоксиэтане, простом диэтиловом эфире), в растворителе спиртового типа (например, метаноле, этаноле), в растворителе бензольного типа (например, бензоле, толуоле), в растворителе кетонового типа (например, ацетоне, метилэтилкетоне), в растворителе нитрильного типа (например, ацетонитриле), в растворителе амидного типа (например, DMF), воде, этилацетате, уксусной кислоте или смешанном растворителе, состоящем из двух или более из этих растворителей), в присутствии катализатора (например, палладия на угле, палладиевой черни, гидроксида палладия на угле, оксида платины, никеля Ренея), в атмосфере водорода при атмосферном давлении или под давлением, или в присутствии формиата аммония при температуре 0-200 °C.
(4) Реакция снятия защиты силильной группы может быть проведена, например, в органическом растворителе, смешивающемся с водой (например, THF, ацетонитриле), с использованием фторида тетрабутиламмония при температуре 0-40 °C. В качестве альтернативы, реакцию снятия защиты также можно осуществлять, например, в органической кислоте (например, уксусной кислоте, трифторуксусной кислоте, метансульфоновой кислоте, п-толуолсульфоновой кислоте) или неорганической кислоте (например, соляной кислоте, серной кислоте) или их смеси (например, бромид водорода/уксусная кислота) при температуре от -10°С до 100°C.
(5) Реакцию снятия защиты с использованием металла можно проводить, например, в кислотном растворителе (например, смешанном растворе уксусной кислоты, буферном растворе, имеющем значение pH 4,2-7,2, или его растворе с органическим растворителем, таким как THF), в присутствии цинкового порошка при температуре 0-40 °C, необязательно при применении ультразвуковых волн.
(6) Реакцию снятия защиты с использованием комплекса металла можно проводить, например, в органическом растворителе (например, дихлорметане, DMF, THF, этилацетате, ацетонитриле, диоксане, этаноле), воде или их смешанном растворителе в присутствии улавливающего реагента (например, гидрида трибутилолова, триэтилсилана, димедона, морфолина, диэтиламина, пирролидина), органической кислоте (например, уксусной кислоте, муравьиной кислоте, 2-этилгексановой кислоте) и/или соли органической кислоты (например, 2-этилгексаноате натрия, 2-этилгексаноате калия), в присутствии или в отсутствие реагента фосфинового типа (например, трифенилфосфина), используя комплекс металла (например, тетракис(трифенилфосфин)палладий (0), дихлорбис(трифенилфосфин)пaллaдий (II), ацетат палладия (II), хлортрис(трифенилфосфин)родий (I)) при температуре 0-40 °C.
[0188]
В дополнение к указанным выше способам реакцию снятия защиты также можно проводить, например, способом, описанным в T. W. Greene, Protective Groups in Organic Synthesis, Wiley, New York, 1999.
[0189]
Примеры защитной группы для гидроксильной группы включают метильную группу, тритильную группу, метоксиметильную (MOM) группу, 1-этоксиэтильную (ЕЕ) группу, метоксиэтоксиметильную (MEM) группу, 2-тетрагидропиранильную (THP) группу, триметилсилильную (TMS) группу, триэтилсилильную (TES) группу, трет-бутилдиметилсилильную (TBDMS) группу, трет-бутилдифенилсилильную (TBDPS) группу, ацетильную (Ac) группу, пивалоильную группу, бензоильную группу, бензильную (Bn) группу, п-метоксибензильную группу, аллилоксикарбонильную (Alloc) группу и 2,2,2-трихлорэтоксикарбонильную (Troc) группу.
[0190]
Примеры защитной группы для аминогруппы включают бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, аллилоксикарбонильную (Alloc) группу, 1-метил-1-(4-бифенил)этоксикарбонильную (Bpoc) группу, трифторацетильную группу, 9-флуоренилметилоксикарбонильную группу, бензильную (Bn) группу, п-метоксибензильную группу, бензилоксиметильную (BOM) группу и 2-(триметилсилил)этоксиметильную (SEM) группу.
[0191]
В дополнение к указанным выше защитным группам, защитная группа для гидроксильной группы или аминогруппы не имеет особых ограничений при условии, что защитная группа может быть легко и селективно отделена. Например, можно использовать защитные группы, упомянутые в T. W. Greene, Protective Groups in Organic Synthesis, Wiley, New York, 1999.
[0192]
В каждой из реакций, упоминаемых в описании, соединение, которое будет использоваться в качестве исходного сырьевого материала, например, соединение, представленное общими формулами (A-1), (A-3), (A-3-1a) и (A-3-1b), известно или же может быть легко получено известным способом.
[0193]
В каждой из реакций, упоминаемых в описании, реакция, включающая нагревание, может быть проведена с помощью водяной бани, масляной бани, песчаной бани или микроволнового излучения, что очевидно для специалистов в данной области.
[0194]
В каждой из реакций, упоминаемых в описании, можно также надлежащим образом использовать реагент на твердофазной подложке, нанесенный на высокомолекулярный полимер (например, полистирол, полиакриламид, полипропилен, полиэтиленгликоль).
[0195]
В каждой из реакций, упоминаемых в описании, продукт реакции может быть очищен традиционными способами очистки, такими как перегонка при атмосферном давлении или при пониженном давлении, высокоэффективная жидкостная хроматография с использованием силикагеля или силиката магния, тонкослойная хроматография, ионообменная смола, смола-поглотитель, колоночная хроматография, промывка и перекристаллизация. Очистку можно проводить для каждой реакции или же можно проводить после завершения нескольких реакций.
[0196]
[Токсичность]
Токсичность соединения настоящего изобретения достаточно низкая, и поэтому его можно безопасно использовать в качестве лекарственного средства.
[0197]
[Фармацевтическое применение]
Соединение настоящего изобретения обладает нейропротекторной и/или нейровосстанавливающей активностью.
В одном варианте осуществления соединение настоящего изобретения обладает нейропротекторной и/или нейровосстанавливающей активностью, имеющей превосходную устойчивость.
В связи с этим, соединение настоящего изобретения может использоваться, например, для лечения заболевания, связанного с нейропатией.
[0198]
В настоящем изобретении одним из примеров нейропротекторной и/или нейровосстанавливающей активности является нейропротекторная и/или нейровосстанавливающая активность посредством глиальных клеток (как, например, микроглия, астроцит, олигодендроцит, эпендимоцит, шванновская клетка, сателлитная клетка). Одним из примеров нейропротекторной и/или нейровосстанавливающей активности через глиальные клетки является активность, способствующая миелинизации шванновских клеток.
[0199]
В настоящем изобретении нейропатия включает в себя периферическую нейропатию и центральную нейропатию. Примеры заболевания, связанного с периферической нейропатией, включают диабетическую нейропатию, метаболическую периферическую нейропатию, связанную с уремией, периферическую нейропатию, связанную с дефицитом витамина B, периферическую нейропатию, связанную с инфекционным заболеванием, например, дифтерией, пищевой ботулизм, вирус герпеса (герпес зостер), медикаментозную периферическую нейропатию, связанную с введением фенитоина, который является противосудорожным средством, противомикробного средства (например, хлорамфеникола, нитрофурантоина, сульфаниламидного препарата), химиотерапевтического препарата (на основе таксана: паклитаксел, доцетаксел и т.д., препараты платины: оксалиплатин, цисплатин, карбоплатин, недаплатин и т.д., на основе алкалоидов винка: винбластин, винкристин, виндезин и т.д.) или седативного средства (например, барбитала, гексобарбитала), хроническую воспалительную демиелинизирующую полинейропатию, синдром Гийена-Барре, компрессионную нейропатию (например, карпальный туннельный синдром, синдром верхней грудной апертуры, кубитальный туннельный синдром, синдром грушевидной мышцы, тарзальный туннельный синдром, компрессионную нейропатию перонеального нерва), иммунологическую периферическую нейропатию, такую как мультифокальная моторная нейропатия, периферическую нейропатию, связанную с аллергическим заболеванием, таким как узелковый периартериит, аллергический васкулит и системная красная волчанка, токсическую периферическую нейропатию, связанную с попаданием внутрь тяжелых металлов, таких как свинец, ртуть, мышьяк и таллий, органического растворителя, такого как разбавитель, инсектицида на основе органического фосфора, токсичного вещества, такого как триортокрезилфосфат (TOCP) или спирта, периферическую нейропатию, вызванную сжатием нерва при раке, и периферическую нейропатию, связанную с генетическим заболеванием (например, гипотиреоз, почечная недостаточность, болезнь Шарко-Мари-Тута, болезнь Рефсума, порфирия, болезнь Фабри, наследственная нейропатия с предрасположенностью к компрессионным параличам).
[0200]
Примеры заболеваний, связанных с центральной нейропатией, включают болезнь Альцгеймера, болезнь Паркинсона, деменцию с тельцами Леви, лобно-височную лобарную дегенерацию, прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, болезнь Гентингтона, дистонию, прионную болезнь, множественную системную атрофию, спинально-церебеллярную атаксию, амиотрофический боковой склероз, первичный латеральный склероз, спинальную и бульбарную мышечную атрофию, спинальную мышечную атрофию, спастическую параплегию, сирингомиелию, рассеянный склероз, оптический нейромиелит, концентрический склероз, острый рассеянный энцефаломиелит, воспалительный диффузный склероз, подострый склерозирующий панэнцефалит, инфекционную нейропатию, такую как прогрессирующая многоочаговая лейкоэнцефалопатия, токсическую/метаболическую нейропатию, такую как гипоксически-ишемическая энцефалопатия и центральный понтинный миелинолиз, и васкулитную нейропатию, такую как болезнь Бинсвангера.
[0201]
В настоящем изобретении одним из примеров профилактики и/или лечения периферической нейропатии является профилактика и/или лечение периферической нейропатической боли.
[0202]
Что касается комбинированного лекарственного средства, содержащего соединение настоящего изобретения и другое лекарственное средство, комбинированное лекарственное средство может быть введено в форме смешанного препарата, в котором оба компонента смешаны в одном препарате, или эти лекарственные средства могут быть получены отдельно и введены. В случае, когда лекарственные средства готовятся отдельно и вводятся, введение включает одновременное введение и введение с разницей во времени. В случае введения с разницей во времени можно сначала ввести соединение настоящего изобретения, а затем ввести другое лекарственное средство, или сначала ввести другое лекарственное средство и затем ввести соединение настоящего изобретения. Способ введения соединения настоящего изобретения и способ введения другого лекарственного средства могут быть одинаковыми или же могут отличаться друг от друга.
[0203]
Заболевание, при котором комбинированное лекарственное средство может оказывать профилактический и/или терапевтический эффект, не имеет особых ограничений, и любое заболевание может использоваться при условии, что профилактический и/или терапевтический эффект соединения настоящего изобретения может быть дополнен или усилен в отношении заболевания.
[0204]
Примеры других лекарственных средств для дополнения и/или усиления профилактического и/или терапевтического эффекта соединения настоящего изобретения в отношении заболевания, связанного с нейропатией, включают ингибирующее альдозоредуктазу лекарственное средство, витаминное средство и защищающее мозг лекарственное средство. Примером лекарственного средства, ингибирующего альдозоредуктазу, является эпалрестат. Примером витаминного средства является мекобаламин. Примером лекарственного средства, защищающего мозг, является эдаравон.
[0205]
Сопутствующее лекарственное средство, используемое в комбинации с соединением настоящего изобретения, включает лекарственные средства, которые были открыты по настоящий момент, а также лекарственные средства, которые будут открыты в будущем.
[0206]
Как правило, соединение настоящего изобретения вводится системно или местно в виде пероральной или парентеральной лекарственной формы. Примеры перорального препарата включают жидкий препарат для внутреннего применения (например, эликсир, сироп, фармацевтически приемлемый препарат на водной основе, суспензию, эмульсию) и твердый препарат для внутреннего применения (например, таблетки (включая сублингвальные таблетки и таблетки, растворяющиеся во рту), пилюли, капсулы (включая твердые капсулы, мягкие капсулы, желатиновые капсулы и микрокапсулы), порошок, гранулу, пастилку). Примеры парентерального препарата включают жидкий препарат (например, инъекционный раствор (включая интравитреальную инъекцию, подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию, интраперитонеальную инъекцию, капельную инфузию), глазные капли (в том числе глазные капли на водной основе (например, раствор глазных капель на водной основе, суспензия глазных капель на водной основе, вязкий раствор глазных капель, солюбилизированный раствор глазных капель), глазные капли на безводной основе (например, раствор глазных капель на безводной основе, суспензия глазных капель на безводной основе)), препарат для наружного применения (включая мазь (например, глазную мазь)) и ушные капли. Эти препараты могут быть препаратами с контролируемым высвобождением, такими как препараты с быстрым высвобождением и препараты с замедленным высвобождением. Эти препараты могут быть получены известными способами, такими как способы, описанные в Японской фармакопее.
[0207]
Жидкий препарат для внутреннего применения, который используется в качестве перорального препарата, может быть получен, например, путем растворения, суспендирования или эмульгирования активного ингредиента в обычно используемом разбавителе (например, очищенной воде, этаноле, их смешанном растворе). Жидкий препарат может дополнительно содержать увлажняющее средство, суспендирующее средство, эмульгирующее вещество, подсластитель, ароматизатор, придающее аромат средство, консервант, буферное вещество и тому подобное.
[0208]
Твердый препарат для внутреннего применения, который используется в качестве перорального препарата, может быть приготовлен в соответствии с общепринятым способом, например, смешиванием активного ингредиента с эксципиентом (например, лактозой, маннитом, глюкозой, микрокристаллической целлюлозой, крахмалом), связующим (например, гидроксипропилцеллюлозой, поливинилпирролидоном, алюмометасиликатом магния), разрыхлителем (например, кальцийкарбоксиметилцеллюлозой), смазывающим веществом (например, стеаратом магния), стабилизирующим агентом, способствующим растворению средством (глутаминовой кислотой, аспарагиновой кислотой) и тому подобным. При необходимости твердый препарат может быть покрыт покрывающим агентом (например, белым сахаром, желатином, гидроксипропилцеллюлозой, фталатом гидроксипропилметилцеллюлозы) или может быть покрыт двумя или более слоями.
[0209]
Препарат для наружного применения, который используется в качестве препарата для парентерального введения, может быть получен известным способом или с использованием обычно используемой композиции. Например, мазь может быть получена путем растирания или расплавления активного ингредиента в веществе основы. Основа для мази может быть выбрана из известных или традиционно используемых веществ. Например, один или два или более компонентов, выбранных из высшей жирной кислоты или сложного эфира высшей жирной кислоты (как, например, адипиновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота, сложный эфир адипиновой кислоты, сложный эфир миристиновой кислоты, сложный эфир пальмитиновой кислоты, сложный эфир стеариновой кислоты, сложный эфир олеиновой кислоты), воск (например, пчелиный воск, спермацетовый воск, церезиновый воск), поверхностно-активное вещество (например, сложный эфир полиоксиэтиленалкилэфирфосфорной кислоты), высший спирт (например, цетанол, стеариловый спирт, цетостеариловый спирт), силиконовое масло (например, диметилполисилоксан), углеводород (например, гидрофильный вазелин, белый вазелин, очищенный ланолин, жидкий парафин), гликоль (например, этиленгликоль, диэтиленгликоль, пропиленгликоль, полиэтиленгликоль, макрогол), растительное масло (например, касторовое масло, оливковое масло, кунжутное масло, скипидарное масло), животное масло (например, норковый жир, желточное масло, сквалан, сквален), вода, ускоритель абсорбции и средство против высыпания, используемые отдельно или в смешанной форме. Мазь может дополнительно содержать увлажняющее средство, консервант, стабилизирующий агент, антиоксидант, придающее аромат средство, и тому подобное.
[0210]
Инъецируемый препарат, используемый в качестве парентерального препарата, включает твердый инъецируемый препарат, который растворяется или суспендируется в растворе, суспензии, эмульсии или растворителе для немедленного применения при использовании. Инъецируемый препарат используют в форме, полученной, например, путем растворения, суспендирования или эмульгирования активного ингредиента в растворителе. Примеры используемого растворителя включают дистиллированную воду для инъекций, физиологический раствор, растительное масло, спирт, такой как пропиленгликоль, полиэтиленгликоль и этанол, и их сочетание. Инъекционный препарат может дополнительно содержать стабилизирующий агент, способствующее растворению средство (например, глутаминовую кислоту, аспарагиновую кислоту, полисорбат 80 (зарегистрированный товарный знак)), суспендирующее средство, эмульгирующее вещество, анальгетик, буферное вещество, консервант и тому подобное. Инъекционный препарат стерилизуют на конечной стадии или получают стерильным способом. В качестве альтернативы, также можно получить стерильный твердый препарат, например, лиофилизированный продукт для инъекции и растворить твердый препарат в стерилизованной или не содержащей микроорганизмов дистиллированной воде для инъекций или другом растворителе перед использованием.
[0211]
Для применения соединения настоящего изобретения или комбинированного лекарственного средства соединения настоящего изобретения и другого лекарственного средства для указанных выше целей, соединение настоящего изобретения или комбинированное лекарственное средство обычно вводят системно или местно в виде пероральной или парентеральной лекарственной формы. Величина дозы может варьировать в зависимости от возраста, массы тела, клинических состояний, терапевтических эффектов, способов введения, периодов времени лечения и тому подобного, и обычно вводится перорально в однократной дозе или в нескольких разделенных дозах в день при разовой дозе от 1 нг до 1000 мг на дозу на взрослого человека, или вводится парентерально в виде однократной дозы или в нескольких разделенных дозах в день в количестве от 0,1 нг до 10 мг на дозу для взрослого человека, или вводится внутривенно продолжительным образом в течение 1-24 ч в день на одного взрослого человека. Как указано выше, величина дозы меняется в зависимости от разных факторов. Соответственно, введение в меньшем количестве, чем указанная выше величина дозы, может быть достаточным, или же может потребоваться введение в большем количестве, чем указанная выше величина дозы.
ПРИМЕРЫ
[0212]
Далее настоящее изобретение будет описано подробно со ссылкой на примеры. Однако настоящее изобретение не ограничивается данными примерами.
[0213]
Растворитель, упомянутый в разделе, касающемся разделения с помощью хроматографии или показанный в скобках в данных ТСХ, представляет собой используемый элюирующий растворитель или проявляющий растворитель, где соотношение выражено как объемное.
Условия, используемые в ЖХ/МС анализах в следующих примерах, показаны ниже. Колонка: YMC Triart C18, 2,0 мм × 30 мм, 1,9 мкм; скорость потока: 1,0 мл/мин; температура: 30°C; подвижная фаза A: 0,1% водный раствор TFA; подвижная фаза B: 0,1% раствор TFA в ацетонитриле; градиент (соотношение (подвижная фаза A):(подвижная фаза B)): 0-0,10 мин (95:5), 0,10-1,20 мин (от 95:5 до 5:95), 1,20-1,50 мин (5:95).
Вещество, указанное в скобках в данных ЯМР, представляет собой растворитель, используемый для измерения.
Каждое из соединений, использованных в описании, было названо с использованием компьютерной программы «ACD/Name» (зарегистрированный товарный знак) производства Advanced Chemistry Development (которая обычно дает наименования в соответствии с правилом номенклатуры IUPAC) или было названо в соответствии со способом номенклатуры IUPAC.
[0214]
Пример 1: изопропил-3-(2-гидроксифенил)пропанoат
Серную кислоту (0,26 мл) добавляли к раствору 3,4-дигидрокумарина (50,0 г) в изопропиловом спирте (500 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и полученный остаток разбавляли этилацетатом. Раствор промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (73,2 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,20, 2,66-2,70, 2,87-2,91, 4,95-5,08, 6,86-6,91, 7,06-7,15, 7,35.
[0215]
Пример 2: изопропил-3-(2-(2-(1,3-диоксан-2-ил)этокси)фенил)пропанoат
Фосфат калия (2,85 г) добавляли к раствору соединения, полученного в примере 1 (2,00 г), и 2-(2-бромэтил)-1,3-диоксану (2,43 г) в DMF (4 мл), и реакционную смесь перемешивали при 70°С в течение 2 ч. Реакционную смесь выливали в 1 М соляную кислоту и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5 → 4:1). Тем самым получали указанное в заголовке соединение (2,73 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,57 (гексан:этилацетат=2:1).
[0216]
Пример 3: изопропил-3-(2-(3-оксопропокси)фенил)пропанoат
Раствор соединения, полученного в примере 2 (500 мг) и лутидина (0,40 мл) в дихлорметане (1,5 мл), охлаждали до -15°C и к раствору добавляли триметилсилилтрифторметансульфонат (0,42 мл). Полученную реакционную смесь перемешивали при 0°C в течение 2 ч. К реакционному раствору добавляли лед (10 г) и полученный раствор перемешивали при 0°C в течение 15 мин. К раствору добавляли воду и этилацетат, полученный раствор перемешивали при 0°C в течение 20 ч, полученную реакционную смесь выливали в 1 М соляную кислоту и этилацетат, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (443 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,20, 2,50-2,55, 2,93-2,96, 4,33, 4,98, 6,85-6,92, 7,14-7,19, 9,90.
[0217]
Пример 4: изопропил-3-(2-((3-гидрокси-5-(триметилсилил)пент-4-ин-1-ил)окси)фенил)пропанoат
Раствор триметилсилилацетилена (5,0 мл) в THF (70 мл) охлаждали до -70°C, затем к раствору добавляли н-бутиллитий (1,6 М раствор в гексане, 20 мл), и реакционную смесь перемешивали при -70°C в течение 30 мин. Раствор соединения, полученного в примере 3 (7,15 г) в THF (10 мл), добавляли по каплям к раствору, и полученную реакционную смесь перемешивали при 0°С в течение 2 ч. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и полученный раствор затем экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5 → 7:3). Тем самым получали указанное в заголовке соединение (1,8 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,17, 1,19, 2,22-2,33, 2,56, 2,87-2,98, 4,09-4,23, 4,70, 3,60-4,93-5,03, 6,86-6,91, 7,14-7,18.
[0218]
Пример 5: изопропил-3-(2-((3-гидроксипент-4-ин-1-ил)окси)фенил)пропанoат
Раствор соединения, полученного в примере 4 (6,89 г) в THF (38 мл), охлаждали до 0°C, и фторид тетрабутиламмония (далее сокращенно обозначаемый «TBAF») (1,0 M раствор в THF, 7,3 мл) добавляли далее к раствору. Реакционную смесь перемешивали при 0°C в течение 10 мин. Реакционную смесь выливали в 1 М соляную кислоту и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5 → 1:1). Тем самым получали указанное в заголовке соединение (5,06 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,19, 2,20-2,26, 2,43, 2,50-2,59, 2,87-2,96, 4,08-4,26, 4,74, 4,99, 6,86-6,91, 7,14-7,21.
[0219]
Пример 6: изопропил-(R)-3-(2-((3-гидроксипент-4-ин-1-ил)окси)фенил)пропанoат
Винилацетат (4 мл) добавляли к раствору соединения, полученного в примере 5 (1,2 г), в гептане (24 мл). К раствору добавляли CHIRAZYME L-5 CA (торговое наименование) (0,4 г), и полученную реакционную смесь перемешивали при 45°C в течение 9 ч. Реакционную смесь фильтровали через целит (торговое наименование) и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=95:5 → 1:1) с получением указанного в заголовке соединения (0,54 г, > 99% э.и.), имеющего значения физических свойств, показанные ниже. Полученное таким образом соединение анализировали с помощью высокоэффективной жидкостной хроматографии (использованная колонка: Daicel Corporation, CHIRALPAK-IB (4,6 мм × 250 мм), подвижная фаза: гексан:2-пропанол=95:5, скорость потока: 1 мл/мин, длина волны: 254 нм, температура колонки: 40°C). В результате, время удерживания составляло 10,6 мин.
1H-ЯМР (CDCl3): δ 1,19, 2,20-2,26, 2,41, 2,50-2,59, 2,90-2,96, 4,08-4,26, 4,74, 4,99, 6,86-6,91, 7,14-7,21.
[0220]
Пример 7: изопропил-(R)-3-(2-((3-((триметилсилил)окси)пент-4-ин-1-ил)окси)фенил)пропанoат
Раствор соединения, полученного в примере 6 (500 мг) в DMF (3,4 мл), охлаждали до 0°C, и затем к раствору добавляли хлортриметилсилан (0,24 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=100:0 → 9:1). Тем самым получали указанное в заголовке соединение (600 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,17, 1,21, 2,18, 2,43, 2,54-2,59, 2,90-2,95, 4,06-4,15, 4,67, 4,99, 6,83-6,89, 7,14-7,20.
[0221]
Пример 8: изопропил-(R, E)-3-(2-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-3-((триметилсилил)окси)пент-4-ен-1-ил)окси)фенил)пропанoат
4,4,5,5-Тетраметил-1,3,2-диоксаборолан (2,09 г) и 4-диметиламинобензойную кислоту (53,9 мг) добавляли к раствору соединения, полученного в примере 7 (2,45 г), в гептане (6 мл), и полученный раствор перемешивали при 100°С в течение 13 ч. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=20:1 → 3:1). Тем самым получали указанное в заголовке соединение (1,45 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,14.
[0222]
Пример 9: N-(3-бромфенил)бензолсульфонамид
Пиридин (0,95 мл), N, N-диметиламинопиридин (далее сокращенно обозначаемый «DMAP») (72,4 мг) и бензолсульфонилхлорид (1,10 г) добавляли к раствору 3-броманилина (1,02 г) в дихлорметане (20 мл) при 0°C, и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор концентрировали и полученный остаток затем очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 2:1). Тем самым получали указанное в заголовке соединение (1,96 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,98.
[0223]
Пример 10: пропан-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoат
Соединение, полученное в примере 9 (1,18 г), хлор(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]пaллaдий (II) (регистрационный номер CAS: 1310584-14-5) (0,30 г) и 2 М водный раствор трикалийфосфата (5,7 мл) добавляли к раствору соединения, полученного в примере 8 (2,00 г), в THF (18 мл), и полученный раствор перемешивали при 60°C в течение 2 ч. Реакционный раствор охлаждали до комнатной температуры, затем к раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. TBAF (1,0 M раствор в THF, 6,3 мл) добавляли к раствору полученного остатка в THF (6 мл) и раствор перемешивали при комнатной температуре в течение 1 ч. В реакционный раствор добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 2:1). Тем самым получали указанное в заголовке соединение (1,41 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,21, 2,05-2,17, 2,21, 2,57-2,61, 2,91-2,95, 4,11-4,19, 4,62, 5,02, 6,25, 6,55, 6,72, 6,85-6,91, 6,99, 7,09-7,22, 7,41-7,45, 7,53, 7,75-7,78.
[0224]
Пример 11: 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
[0225]
[Формула 43]
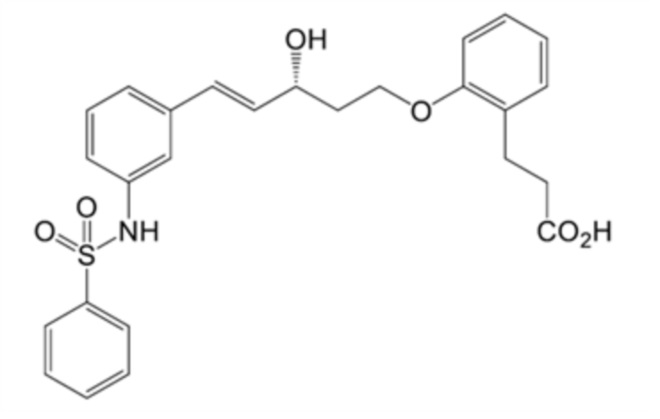
[0226]
1 М водный раствор гидроксида лития (5 мл) добавляли к раствору соединения, полученного в примере 10 (680 мг), в THF (5 мл) и метаноле (1 мл), и полученный раствор перемешивали при 30°C в течение 18 ч. К раствору добавляли 1 М соляную кислоту, чтобы сделать раствор кислым, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (600 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 2,05-2,10, 2,57-2,61, 2,91-2,95, 4,10, 4,17, 4,51-4,56, 6,24, 6,53, 6,86, 6,93, 6,98, 7,12-7,20, 7,45-7,50, 7,56, 7,75-7,78.
[0227]
Примеры 12 (1) - (13)
Проводили те же самые предусмотренные процедуры, что и в примере 10 → примере 11, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соответствующие галогенидные соединения. Тем самым были получены следующие соединения примеров.
[0228]
Пример 12(1): 3-[2-[(E,3R)-5-(3-бензамидофенил)-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 2,10-2,15, 2,59-2,63, 2,93-2,97, 4,13, 4,21, 4,60, 6,39, 6,67, 6,86, 6,95, 7,16, 7,24, 7,33, 7,52-7,63, 7,81, 7,95-7,97.
[0229]
Пример 12(2): 3-[2-[(E,3R)-5-[4-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
[0230]
[Формула 44]
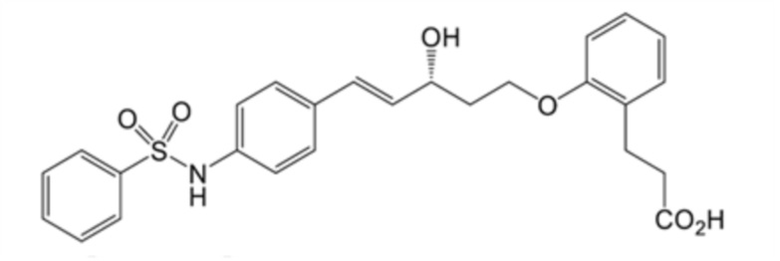
[0231]
Время удерживания ВЭЖХ (мин): 0,92;
МС (ESI, положит.): 464 (M+H-H2O)+.
[0232]
Пример 12(3): 3-[2-[(E,3R)-5-(4-бензамидофенил)-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 2,10-2,14, 2,58-2,63, 2,93-2,97, 4,13, 4,20, 4,58, 6,32, 6,64, 6,86, 6,95, 7,15-7,20, 7,44-7,55, 7,60, 7,67-7,71, 7,93-7,97.
[0233]
Пример 12(4): 3-[2-[(E,3R)-5-[2-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
МС (ESI, положит.): 464 (M+H-H2O)+.
[0234]
Пример 12(5): 3-[2-[(E,3R)-5-(2-бензамидофенил)-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,89;
МС (ESI, положит.): 428 (M+H-H2O)+.
[0235]
Пример 12(6): 3-[2-[(E,3R)-5-[3-(бензиламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,85;
1H-ЯМР (CD3OD): δ 2,05-2,10, 2,57-2,61, 2,92-2,95, 4,10, 4,17, 4,33, 4,52, 6,19, 6,49-6,56, 6,69-6,71, 6,85, 6,93, 7,04, 7,15-7,24, 7,29-7,33, 7,37-7,39.
[0236]
Пример 12(7): 3-[2-[(E,3R)-3-гидрокси-5-[3-(фенилсульфамоил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
МС (ESI, положит.): 464 (M+H-H2O)+.
[0237]
Пример 12(8): 3-[2-[(E,3R)-3-гидрокси-5-[3-(фенилкарбамоил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
МС (ESI, положит.): 428 (M+H-H2O)+.
[0238]
Пример 12(9): 3-[2-[(E,3R)-3-гидрокси-5-[3-(1-гидрокси-2-фенилэтил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CD3OD): δ 2,08-2,13, 2,58-2,62, 2,93-2,98, 3,06, 4,11, 4,19, 4,56, 4,84, 6,27, 6,62, 6,86, 6,94, 7,10-7,31.
[0239]
Пример 12(10): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидометил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,93;
МС (ESI, положит.): 478 (M+H-H2O)+.
[0240]
Пример 12(11): 3-[2-[(E,3R)-5-[2-(бензолсульфонамидометил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CDCl3): δ 1,99-2,07, 2,11-2,19, 2,68-2,72, 2,95-3,08, 4,12-4,26, 4,73-4,78, 6,12, 6,59, 6,86-6,92, 7,04-7,11, 7,16-7,23, 7,33-7,38, 7,44-7,48, 7,64-7,67.
[0241]
Пример 12(12): 3-[2-[(E,3R)-5-[1-(бензолсульфонил)-2-метилиндол-4-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
МС (ESI, положит.): 502 (M+H-H2O)+.
[0242]
Пример 12(13): 3-[2-[(E,3R)-3-гидрокси-5-[3-(2-гидрокси-1-фенилпропaн-2-ил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 2,10-2,15, 2,65-2,68, 2,94-3,14, 4,12-4,22, 4,62, 6,28, 6,64, 6,86-6,91, 7,00-7,02, 7,15-7,28, 7,44.
[0243]
Примеры 13(1) - (19)
Проводили те же самые предусмотренные процедуры, что и в примере 9 → примере 10 → примере 11, используя вместо 3-броманилина, применявшегося в примере 9, соответствующие аминные соединения. Тем самым были получены следующие соединения примеров.
[0244]
Пример 13(1): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-2-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
[0245]
[Формула 45]
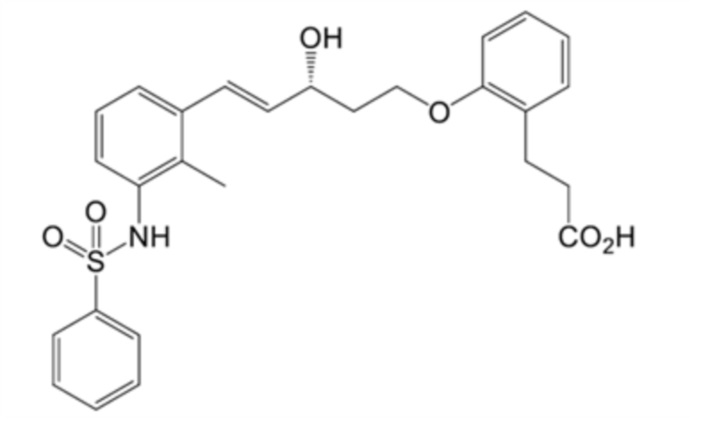
[0246]
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CD3OD): δ 1,96, 2,07-2,12, 2,56-2,60, 2,90-2,94, 4,10, 4,18, 4,57, 6,12, 6,78, 6,84-6,93, 7,04, 7,15-7,20, 7,36, 7,47-7,51, 7,60, 7,65-7,67.
[0247]
Пример 13(2): 3-[2-[(E,3R)-5-[5-(бензолсульфонамидо)-2-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 2,05-2,11, 2,19, 2,56-2,60, 2,91-2,95, 4,09, 4,19, 4,56, 6,01, 6,76, 6,84-6,94, 6,99, 7,12-7,20, 7,44-7,48, 7,56, 7,73-7,75.
[0248]
Пример 13(3): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-5-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CD3OD): δ 1,93-1,98, 2,12, 2,45-2,49, 2,79-2,83, 3,98, 4,05, 4,41, 6,09, 6,37, 6,69, 6,74, 6,80-6,83, 7,03-7,08, 7,34-7,38, 7,44, 7,63-7,66.
[0249]
Пример 13(4): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-4-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CD3OD): δ 1,89-1,97, 1,91, 2,46-2,50, 2,81-2,84, 3,98, 4,06, 4,40, 5,98, 6,37, 6,75, 6,83, 6,90, 6,97, 7,04-7,09, 7,34-7,38, 7,46, 7,56-7,58.
[0250]
Пример 13(5): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-2-фторфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CD3OD): δ 2,03-2,09, 2,55-2,59, 2,89-2,93, 4,09, 4,16, 4,53, 6,36, 6,63, 6,86, 6,92, 7,06, 7,15-7,19, 7,30-7,37, 7,45-7,49, 7,57, 7,75-7,77.
[0251]
Пример 13(6): 3-[2-[(E,3R)-5-[5-(бензолсульфонамидо)-2-фторфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CD3OD): δ 1,90-2,01, 2,45-2,49, 2,79-2,83, 3,99, 4,07, 4,43, 6,17, 6,56, 6,75, 6,81-6,88, 7,03-7,09, 7,34-7,38, 7,45, 7,60-7,63.
[0252]
Пример 13(7): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-5-фторфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CD3OD): δ 1,92-1,98, 2,44-2,48, 2,78-2,82, 3,98, 4,06, 4,42, 6,17, 6,39, 6,68, 6,70-6,82, 7,03-7,08, 7,37-7,41, 7,47, 7,68-7,71.
[0253]
Пример 13(8): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-4-фторфенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,92;
1H-ЯМР (CD3OD): δ 1,95-2,00, 2,45-2,49, 2,81-2,84, 4,00, 4,07, 4,44, 6,10, 6,45, 6,75, 6,81-6,86, 7,04-7,10, 7,34-7,39, 7,47, 7,64-7,66.
[0254]
Пример 13(9): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-2-(трифторметил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 1,94-2,00, 2,43-2,47, 2,78-2,82, 3,99, 4,06, 4,45, 6,08, 6,74, 6,79-6,85, 7,03-7,10, 7,32-7,43, 7,50, 7,58-7,60.
[0255]
Пример 13(10) 3-[2-[(E,3R)-5-[5-(бензолсульфонамидо)-2-(трифторметил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CD3OD): δ 1,94-2,00, 2,43-2,47, 2,79-2,83, 3,99, 4,07, 4,47, 6,09, 6,73-6,82, 7,04-7,08, 7,27, 7,38-7,42, 7,48, 7,73-7,76.
[0256]
Пример 13(11): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-5-(трифторметил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CD3OD): δ 1,91-2,03, 2,42-2,46, 2,79-2,83, 3,99, 4,07, 4,46, 6,25,6,49, 6,74, 6,81, 7,03-7,07, 7,16, 7,22-7,26, 7,37-7,41, 7,47, 7,67-7,70.
[0257]
Пример 13(12): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-4-(трифторметил)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 1,94-2,00, 2,46-2,50, 2,80-2,84, 4,00, 4,08, 4,46, 6,19, 6,49, 6,76, 6,84, 7,05-7,10, 7,24, 7,28, 7,39-7,52, 7,67-7,70.
[0258]
Пример 13(13): 3-[2-[(E,3R)-5-[6-(бензолсульфонамидо)пиридин-2-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,85;
1H-ЯМР (CD3OD): δ 1,92-2,00, 2,45-2,49, 2,79-2,83, 3,96-4,10, 4,47, 6,42, 6,64, 6,75, 6,79-6,83, 6,88, 7,03-7,08, 7,36-7,49, 7,85-7,88.
[0259]
Пример 13(14): 3-[2-[(E,3R)-5-[1-(бензолсульфонил)-2,3-дигидроиндол-6-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,11-2,16, 2,59-2,63, 2,82-2,86, 2,94-2,98, 3,94-3,98, 4,14, 4,22, 4,60, 6,34, 6,66, 6,87, 6,96, 7,05-7,09, 7,16-7,21, 7,48-7,52, 7,63, 7,66, 7,78-7,81.
[0260]
Пример 13(15): 3-[2-[(E,3R)-5-[1-(бензолсульфонил)-2,3-дигидроиндол-4-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,04-2,09, 2,51-2,55, 2,70-2,89, 3,89-3,96, 4,08, 4,14, 4,53, 6,23, 6,50, 6,83, 6,90, 7,08-7,19, 7,48-7,53, 7,63, 7,78-7,81.
[0261]
Пример 13(16): 3-[2-[(E,3R)-5-[2-(бензолсульфонил)-1,3-дигидроизоиндол-5-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,06-2,10, 2,55-2,59, 2,89-2,93, 4,10, 4,17, 4,54, 4,60, 6,31, 6,60, 6,85, 6,92, 7,13-7,18, 7,28-7,30, 7,58-7,68, 7,90-7,93.
[0262]
Пример 13(17): 3-[2-[(E,3R)-5-[1-(бензолсульфонил)-3,4-дигидро-2H-хинолин-7-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,59-1,66, 2,10-2,15, 2,40-2,43, 2,59-2,63, 2,93-2,97, 3,82-3,85, 4,14, 4,21, 4,59, 6,31, 6,62, 6,86, 6,94-7,01, 7,16-7,21, 7,45-7,49, 7,59-7,63, 7,79.
[0263]
Пример 13(18): 3-[2-[(E,3R)-5-[1-(бензолсульфонил)-3,4-дигидро-2H-хинолин-5-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,50-1,57, 2,01-2,15, 2,19-2,37, 2,53-2,57, 2,88-2,92, 3,75-3,78, 4,07, 4,16, 4,56, 6,12, 6,67, 6,84, 6,90, 7,13-7,21, 7,32, 7,45-7,49, 7,56-7,65.
[0264]
Пример 13(19): 3-[2-[(E,3R)-5-[2-(бензолсульфонил)-3,4-дигидро-1H-изохинолин-7-ил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,07-2,12, 2,57-2,61, 2,87-2,95, 3,36-3,39, 4,11, 4,18, 4,25, 4,55, 6,29, 6,57, 6,85, 6,93, 7,05, 7,14-7,19, 7,23, 7,59-7,70, 7,87-7,89.
[0265]
Пример 14: N-(3-бромфенил)-N-(оксетан-2-илметил)бензолсульфонамид
Оксетан-2-илметанол (132 мг), трифенилфосфин (394 мг) и диэтилазодикарбоксилат (40% раствор толуола, 0,68 мл) добавляли к раствору соединения, полученного в примере 9 (313 мг), в THF (2 мл), и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1 → 1:1). Тем самым получали указанное в заголовке соединение (381 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,34 (гексан:этилацетат=2:1).
[0266]
Пример 15: 3-[2-[(E,3R)-5-[3-[бензолсульфонил(оксетан-2-илметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 10 → примере 11, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соединение, полученное в примере 14. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 2,06-2,10, 2,48-2,69, 2,91-2,95, 3,80, 4,00, 4,10, 4,18, 4,47-4,64, 4,83, 6,21, 6,55, 6,87, 6,94-6,96, 7,03, 7,17-7,21, 7,27, 7,38, 7,50-7,54, 7,60-7,65.
[0267]
Примеры 16 (1) - (8):
Проводили те же самые предусмотренные процедуры, что и в примере 14 → примере 10 → примере 11, используя соответствующие спиртовые соединения вместо оксетан-2-илметанола, применявшегося в примере 14, и используя соответствующие галогенидные соединения вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым были получены следующие соединения примеров.
[0268]
Пример 16(1): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(оксетан-3-илметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CD3OD): δ 2,06-2,11, 2,57-2,61, 2,91-2,95, 3,04, 3,95, 4,10, 4,18, 4,36-4,40, 4,55, 4,63-4,67, 6,22, 6,55, 6,85-6,97, 7,16-7,21, 7,29, 7,40, 7,52-7,56, 7,62-7,67.
[0269]
Пример 16(2): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(оксолaн-2-илметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,72, 1,84-1,99, 2,06-2,11, 2,57-2,61, 2,92-2,95, 3,57, 3,66-3,80, 3,89, 4,10, 4,18, 4,55, 6,22, 6,56, 6,87, 6,94-6,97, 7,05, 7,16-7,21, 7,28, 7,38, 7,49-7,53, 7,58-7,64.
[0270]
Пример 16(3): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(оксолaн-3-илметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 1,74, 1,95, 2,06-2,11, 2,25, 2,57-2,61, 2,91-2,95, 3,57-3,61, 3,67-3,73, 3,87, 4,10, 4,19, 4,55, 6,23, 6,56, 6,87, 6,94-6,96, 7,02, 7,16-7,21, 7,30, 7,41, 7,50-7,54, 7,57-7,65.
[0271]
Пример 16(4):
3-[2-[(E,3R)-5-[3-[бензолсульфонил(оксан-2-илметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CD3OD): δ 1,26, 1,39-1,55, 1,68, 1,82, 2,06-2,11, 2,57-2,61, 2,92-2,95, 3,23-3,30, 3,51, 3,70, 3,87, 4,10, 4,18, 4,55, 6,20, 6,56, 6,87, 6,93-6,96, 7,02, 7,16-7,21, 7,28, 7,38, 7,49-7,53, 7,58-7,63.
[0272]
Пример 16(5): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(пропан-2-ил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,31 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 1,04, 1,98-2,21, 2,67, 2,89-3,01, 4,10-4,24, 4,55-4,66, 6,22, 6,59, 6,85-6,92, 7,07, 7,16-7,28, 7,38-7,57, 7,76.
[0273]
Пример 16(6): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(2-метилпропил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,34 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 0,91, 1,57, 2,08-2,15, 2,67, 2,97, 3,30, 4,10-4,24, 4,62, 6,20, 6,57, 6,83-6,92, 7,08, 7,16-7,25, 7,31, 7,40-7,47, 7,51-7,60.
[0274]
Пример 16(7): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(циклопропилметил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,79 (этилацетат);
1H-ЯМР (CDCl3): δ 0,09-0,13, 0,38-0,43, 0,80-0,90, 2,09-2,18, 2,67, 2,97, 3,42, 4,11-4,23, 4,63, 6,22, 6,58, 6,86-6,93, 7,14-7,26, 7,33, 7,44, 7,55, 7,63.
[0275]
Пример 16(8): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(2-фенилэтил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,74 (этилацетат);
1H-ЯМР (CDCl3): δ 2,07-2,21, 2,64-2,71, 2,74-2,81, 2,94-3,01, 3,72-3,80, 4,11-4,24, 4,63, 6,22, 6,59, 6,81-6,93, 7,09-7,26, 7,31-7,45, 7,51-7,60.
[0276]
Пример 17: N-(3-бромфенил)-N-(2-оксопропил)бензолсульфонамид
Гидрид натрия (60% в минеральном масле, 141 мг) добавляли к раствору соединения, полученного в примере 9 (1,00 г) в DMF (6 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре. Через 30 мин к раствору добавляли хлорацетон (0,52 мл) и затем перемешивали при комнатной температуре в течение 4 ч. К реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом магния и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=80:20 → 50:50). Тем самым получали указанное в заголовке соединение (1,10 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,42 (гексан:этилацетат=2:1).
[0277]
Пример 18: N-(3-бромфенил)-N-(2-гидрокси-2-метилпропил)бензолсульфонамид
Метилмагнийбромид (0,95 M раствор в THF, 1,0 мл) добавляли к раствору соединения, полученного в примере 17 (313 мг), в THF (3 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом магния и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=80:20 → 50:50). Тем самым получали указанное в заголовке соединение (50 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,58 (гексан:этилацетат=1:1).
[0278]
Пример 19: 3-[2-[(E,3R)-5-[3-[бензолсульфонил-(2-гидрокси-2-метилпропил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 10 → примере 11, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соединение, полученное в примере 18. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 1,18, 2,06-2,10, 2,58-2,62, 2,92-2,96, 3,66, 4,10, 4,18, 4,54, 6,20, 6,55, 6,87, 6,95, 6,99, 7,05, 7,17-7,21, 7,25, 7,35, 7,46-7,54, 7,60.
[0279]
Примеры 20 (1) - (4)
Проводили те же самые предусмотренные процедуры, что и в примере 17 → примере 10 → примере 11, используя соответствующие галогенидные соединения вместо хлорацетона, применявшегося в примере 17, и используя соответствующие галогенидные соединения вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым были получены следующие соединения примеров.
[0280]
Пример 20(1): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(метил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 2,06-2,11, 2,57-2,61, 2,91-2,95, 3,20, 4,10, 4,19, 4,55, 6,24, 6,57, 6,87, 6,93-7,00, 7,08, 7,17-7,20, 7,27, 7,36, 7,50-7,56, 7,63.
[0281]
Пример 20(2): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(этил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,01;
1H-ЯМР (CDCl3): δ 1,07, 2,06-2,11, 2,57-2,61, 2,92-2,96, 3,66, 4,11, 4,19, 4,55, 6,22, 6,57, 6,87, 6,92-6,96, 7,01, 7,16-7,21, 7,29, 7,39, 7,50-7,54, 7,59-7,65.
[0282]
Пример 20(3): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(бензил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,07;
1H-ЯМР (CDCl3): δ 2,04-2,09, 2,57-2,61, 2,91-2,95, 4,08, 4,16, 4,52, 4,80, 6,14, 6,48, 6,85-6,89, 6,93-6,96, 7,14-7,28, 7,54-7,58, 7,63-7,69.
[0283]
Пример 20(4): 3-[2-[(E,3R)-5-[3-[бензолсульфонил(2,2,2-трифторэтил)амино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,49 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,08-2,17, 2,62-2,70, 2,94-3,00, 4,11-4,26, 4,62, 6,21, 6,57, 6,83-6,93, 7,10, 7,17-7,25, 7,36, 7,47, 7,57-7,63.
[0284]
Пример 21: (R)-1-(3-бромфенил)-2-фенилэтан-1-ол
(R)-Метилоксазаборолидин (1,0 М раствор в толуоле, 3,6 мл) и боран-диметилсульфид (2,0 М раствор в THF, 3,6 мл) добавляли к раствору 1-(3-бромфенил)-2-фенилэтанона (регистрационный номер CAS: 40396-53-0) (2,00 г) в THF (70 мл) при -20°C, и полученный раствор перемешивали при той же температуре в течение 1 ч. К реакционному раствору добавляли метанол (1 мл) при -20°C, и полученный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 2:1). Тем самым получали указанное в заголовке соединение (1,91 г, 96% э.и.), имеющее значения физических свойств, показанные ниже. Полученное таким образом соединение анализировали СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IA (10 мм × 250 мм), подвижная фаза: CO2:ацетонитрил:метанол=90:9:1, скорость потока: 30 мл/мин; давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°С). В результате, время удерживания составляло 5,6 мин.
Время удерживания ВЭЖХ (мин): 1,08.
[0285]
Пример 22: изопропил-3-(2-(((R, E)-3-гидрокси-5-(3-((R)-1-гидрокси-2-фенилэтил)фенил)пент-4-ен-1-ил)окси)фенил)пропанoат
Проводили ту же самую предусмотренную процедуру, что и в примере 10, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соединение, полученное в примере 21. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,21.
[0286]
Пример 23: 3-[2-[(E,3R)-3-гидрокси-5-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 22. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 2,08-2,13, 2,58-2,62, 2,93-2,98, 3,06, 4,11, 4,19, 4,56, 4,84, 6,28, 6,62, 6,86, 6,94, 7,10-7,31.
[0287]
Пример 24: 3-[2-[(E,3R)-3-гидрокси-5-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 21 → примере 10 → примере 11, используя (S)-метилoксазаборолидин вместо (R)-метилoксазаборолидина, применявшегося в примере 21, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 2,08-2,13, 2,58-2,62, 2,93-2,98, 3,06, 4,11, 4,19, 4,56, 4,84, 6,27, 6,61, 6,86, 6,94, 7,10-7,31.
[0288]
Пример 25: 3-[2-[(E,3R)-3-гидрокси-5-[3-[(2R)-2-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 21 → примере 10 → примере 11, используя 2-(3-бромфенил)-1-фенилэтанон (регистрационный номер CAS: 27798-44-3) вместо 1-(3-бромфенил)-2-фенилэтанона, применявшегося в примере 21, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 2,10-2,15, 2,64-2,68, 2,94-3,05, 4,10-4,21, 4,59-4,64, 4,92, 6,27, 6,61, 6,86-6,91, 7,05-7,24, 7,27-7,37.
[0289]
Пример 26: 3-[2-[(E,3R)-3-гидрокси-5-[3-[(2S)-2-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 25, используя (S)-метилoксазаборолидин вместо (R)-метилoксазаборолидина, применявшегося в примере 25, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (CDCl3): δ 2,10-2,15, 2,63-2,67, 2,94-3,05, 4,10-4,22, 4,59-4,64, 4,91, 6,27, 6,61, 6,86-6,91, 7,06-7,08, 7,14-7,24, 7,28-7,38.
[0290]
Пример 27: 1-(3-бромфенил)-3-фенилпропaн-1-ол
Раствор 3-бромбензальдегида (500 мг) в THF (13,5 мл) охлаждали до 0°C, к раствору добавляли фенилмагнийхлорид (1,0 M раствор в THF, 3,5 мл) и полученную реакционную смесь перемешивали при 0°C в течение 30 мин. Реакционную смесь выливали в насыщенный раствор хлорида аммония, и полученный раствор экстрагировали метил-трет-бутиловым эфиром. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 2:1). Тем самым получали указанное в заголовке соединение (610 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,85, 1,98-2,15, 2,65-2,80, 4,65-4,69, 7,18-7,31, 7,39-7,42, 7,51.
[0291]
Пример 28: 3-[2-[(E,3R)-3-гидрокси-5-[3-(1-гидрокси-3-фенилпропил)фенил]пент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 10 → примере 11, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соединение, полученное в примере 27. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,82-2,03, 2,36-2,40, 2,47-2,63, 2,81-2,85, 3,96-4,09, 4,46-4,51, 6,22, 6,54, 6,69-6,79, 6,98-7,29.
[0292]
Пример 29: 1-(3-бромфенил)-2-метил-2-фенилпропaн-1-ол
Гидроксид калия (179 мг), 18-краун-6-эфир (4 мг) и метилйодид (0,29 мл) добавляли к раствору 1-(3-бромфенил)-2-фенил-этанона (регистрационный номер CAS: 40396-53-0) (220 мг) в толуоле (0,4 мл), и полученную реакционную смесь перемешивали при 70°C в течение 4 ч. К реакционной смеси добавляли воду, и полученный раствор экстрагировали 2-метокси-2-метилпропаном. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Боргидрид натрия (61 мг) добавляли к раствору полученного остатка в метаноле (1,5 мл), и полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1). Тем самым получали указанное в заголовке соединение (129 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,15 (исправленное).
[0293]
Пример 30: 3-[2-[(E,3R)-3-гидрокси-5-[3-(1-гидрокси-2-метил-2-фенилпропил)фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 10 → примере 11, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, соединение, полученное в примере 29. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 2,08-2,13, 2,64-2,68, 2,94-2,97, 4,08-4,21, 4,59, 4,75, 6,15, 6,56, 6,86-6,91, 6,97-7,00, 7,09, 7,15-7,25, 7,30-7,38.
[0294]
Пример 31: 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропaнамид
Триэтиламин (0,021 мл) и изобутилхлорформиат (0,016 мл) добавляли к раствору соединения, полученного в примере 11 (50 мг), в THF (1 мл) при охлаждении льдом, и реакционную смесь перемешивали при 0°C в течение 10 мин. Аммиак (0,5 M раствор в 1,4-диоксане, 0,4 мл) добавляли к раствору при 0°C и полученный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1 → 0:1). Тем самым получали указанное в заголовке соединение (38 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,88;
1H-ЯМР (CDCl3): δ 2,09-2,21, 2,54-2,63, 3,01, 4,13-4,23, 4,59, 5,70, 6,36, 6,54, 6,87-6,94, 7,00-7,22, 7,40-7,53, 7,79-7,82, 7,93.
[0295]
Примеры 32 (1) - (3)
Проводили ту же самую предусмотренную процедуру, что и в примере 31, используя вместо аммиака, применявшегося в примере 31, соответствующие аминные соединения. Тем самым были получены следующие соединения примеров.
[0296]
Пример 32(1): N-[3-[(E,3R)-3-гидрокси-5-[2-(3-морфолин-4-ил-3-оксопропил)фенокси]пент-1-енил]фенил]бензолсульфонамид
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CDCl3): δ 2,09-2,19, 2,60-2,65, 2,92-2,99, 3,41, 3,50-3,70, 4,09-4,23, 4,57, 6,30, 6,52, 6,85-6,91, 7,02-7,20, 7,40-7,56, 7,78-7,81.
[0297]
Пример 32(2): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-N, N-диметилпропанамид
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 2,09-2,19, 2,60-2,65, 2,86-3,03, 4,09-4,22, 4,55, 6,33, 6,51, 6,84-6,91, 6,98-7,00, 7,12-7,20, 7,23-7,26, 7,40-7,52, 7,78-7,83, 7,98.
[0298]
Пример 32(3): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-N-метилпропанамид
Время удерживания ВЭЖХ (мин): 0,90;
1H-ЯМР (CDCl3): δ 2,07-2,19, 2,41-2,53, 2,82, 2,93-2,97, 4,10-4,22, 4,60, 5,58, 6,31, 6,54, 6,86-6,90, 7,02-7,20, 7,40-7,54, 7,78.
[0299]
Пример 33: 3-[2-[(3S)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановая кислота
[0300]
[Формула 46]
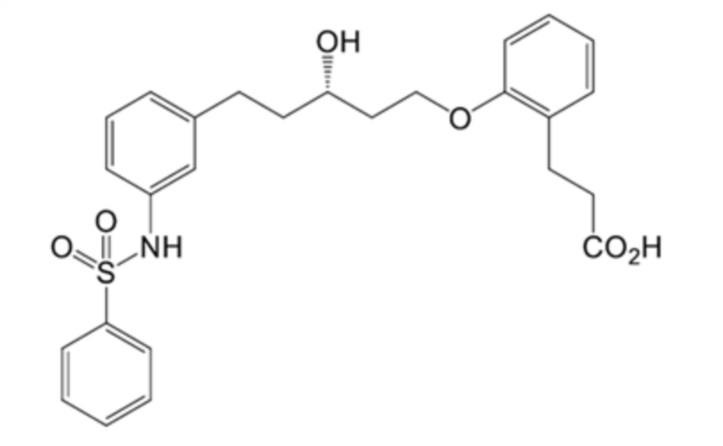
[0301]
5% палладий на угле (200 мг) добавляли к раствору соединения, полученного в примере 11 (1,1 г), в метаноле (10 мл), и полученный раствор перемешивали при комнатной температуре в течение 1 ч в атмосфере водорода. Реакционный раствор фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=70:30 → этилацетат:метанол=95:5). Тем самым получали указанное в заголовке соединение (1,05 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,30 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 1,69-2,02, 2,59-2,75, 2,90-2,96, 3,89, 4,05-4,18, 6,85-7,00, 7,11-7,22, 7,36-7,43, 7,44-7,53, 7,76.
[0302]
Пример 34: 3-[2-[(3S)-5-[3-(бензиламино)фенил]-3-гидроксипентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя соединение, полученное в примере 12(6), вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамид)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33. Тем самым были получены следующие соединения примера.
Время удерживания ВЭЖХ (мин): 0,81;
1H-ЯМР (CD3OD): δ 1,74-1,90, 2,00, 2,51-2,55, 2,59, 2,70, 2,85-2,89, 3,85, 4,07-4,16, 4,31, 6,47-6,56, 6,85, 6,92, 7,00, 7,13-7,23, 7,28-7,32, 7,36-7,38.
[0303]
Пример 35: изопропил-3-(2-(((S)-3-гидрокси-5-(3-((R)-1-гидрокси-2-фенилэтил)фенил)пентил)окси)фенил)пропанoат
п-Толуолсульфонилгидразид (2,66 г) и ацетат натрия (1,17 г) добавляли к раствору соединения, полученного в примере 22 (782 мг), в THF (10 мл) при комнатной температуре, и полученный раствор перемешивали при 80°C в течение 19 ч. Реакционный раствор охлаждали до комнатной температуры, затем к раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3 → 1:1). Тем самым получали указанное в заголовке соединение (515 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,22.
[0304]
Пример 36: 3-[2-[(3S)-3-гидрокси-5-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановая кислота
[0305]
[Формула 47]
[0306]
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя соединение, полученное в примере 35, вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CD3OD): δ 1,74-1,81, 1,89, 2,02, 2,52-2,56, 2,66, 2,79, 2,86-2,90, 2,94, 3,05, 3,86, 4,08-4,19, 4,82, 6,85, 6,94, 7,08-7,23.
[0307]
Пример 37: 3-[2-[(3S)-3-гидрокси-5-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановая кислота
[0308]
[Формула 48]
[0309]
Проводили те же самые предусмотренные процедуры, что и в примере 21 → примере 10 → примере 35 → примере 11, используя (S)-метилoксазаборолидин вместо (R)-метилoксазаборолидина, применявшегося в примере 21, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CD3OD): δ 1,74-1,81, 1,89, 2,02, 2,52-2,56, 2,66, 2,79, 2,86-2,90, 2,94, 3,05, 3,86, 4,08-4,19, 4,81, 6,85, 6,94, 7,08-7,23.
[0310]
Пример 38: изопропил-3-(2-((3R)-3-гидрокси-3-(2-(3-(фенилсульфонамид)фенил)циклопропил)пропокси)фенил)пропанoат
Раствор соединения, полученного в примере 10 (50 мг) в дихлорметане (2 мл), охлаждали до 0°C, затем к раствору добавляли диэтилцинк (1 M раствор в гексане, 0,5 мл), затем добавляли дийодметан (128 мг), реакционную смесь перемешивали при 0°C в течение 1,5 ч. К раствору добавляли насыщенный водный раствор хлорида аммония при 0°C, и полученный раствор перемешивали при комнатной температуре в течение 5 мин. Реакционную смесь выливали в воду, полученный раствор экстрагировали этилацетатом, и органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 2:1). Тем самым получали указанное в заголовке соединение (15 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10.
[0311]
Пример 39: 3-[2-[(3R)-3-[2-[3-(бензолсульфонамидо)фенил]циклопропил]-3-гидроксипропокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя соединение, полученное в примере 38, вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,92;
1H-ЯМР (CD3OD): δ 0,85-0,92, 1,03-1,08, 1,72-1,75, 2,03-2,09, 2,57, 2,91, 4,06-4,15, 6,68-6,69, 6,73-6,75, 6,84-6,89, 7,06, 7,14-7,20, 7,44-7,57, 7,72-7,74.
[0312]
Пример 40: 5-((3-нитробензил)сульфонил)-1-фенил-1H-тетразол
Раствор 5-[(3-нитробензил)тио]-1-фенил-1H-тетразола [J. Org. Chem. (2001), 80, pp.11611-11617] (8,50 г) в ацетонитриле (150 мл) и этаноле (150 мл) охлаждали до 0°C, и раствор тетрагидрата молибдата аммония (3,35 г) в водном растворе пероксида водорода (35%, 26 мл) добавляли по каплям к полученному раствору в течение 10 мин. Полученную реакционную смесь перемешивали при 0°C в течение 2 ч и затем при комнатной температуре в течение 2,5 ч. Реакционный раствор снова охлаждали до 0°C, и затем к реакционному раствору медленно в течение 20 мин добавляли водный раствор тиосульфата натрия (1 M, 150 мл). Полученный раствор концентрировали при пониженном давлении, остаток экстрагировали этилацетатом и органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный таким образом маслянистый продукт суспендировали в смешанном растворителе, состоящем из гексана и этилацетата, и отфильтровывали синий твердый материал. Твердый материал растворяли в дихлорметане с получением твердого материала, и твердый материал отфильтровывали, а фильтрат концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (7,71 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 5,12, 7,46-7,64, 7,82, 8,27, 8,35.
[0313]
Пример 41: (R)-1-((трет-бутилдиметилсилил)окси)-4-((4-метоксибензил)окси)бутан-2-ол
DMAP (0,73 г) и имидазол (6,08 г) добавляли к раствору (R)-4-[(4-метоксибензил)окси]бутан-1,2-диола (регистрационный номер CAS: 213978-61-1) (13,5 г) в DMF (300 мл), и полученную реакционную смесь перемешивали при 0°C в течение 5 мин. К раствору добавляли хлор-трет-бутилдиметилсилан (8,93 г) и полученный раствор перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли этилацетат для разбавления реакционного раствора, и органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (18,1 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,02, 0,83, 1,65-1,71, 2,73, 3,62-3,41, 3,74, 3,74-3,76, 4,39, 6,82, 7,18-7,21.
[0314]
Пример 42: (R)-1-((трет-бутилдиметилсилил)окси)-4-((4-метоксибензил)окси)бутан-2-илбензоат
Раствор соединения, полученного в примере 41 (5,60 г), и пиридина (27 мл) в дихлорметане (55 мл) охлаждали до 0°C, и N, N-диизопропилэтиламин (27 мл) и DMAP (0,2 г) затем добавляли в раствор. К полученному реакционному раствору добавляли бензилхлорид (2,5 мл), раствор перемешивали при комнатной температуре в течение ночи и затем концентрировали при пониженном давлении. Полученный остаток выливали в этилацетат, органический слой затем промывали 1 М соляной кислотой и насыщенным водным гидрокарбонатом натрия, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 7:3). Тем самым получали указанное в заголовке соединение (6,31 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,00, 0,01, 0,85, 2,02-2,08, 3,53-3,57, 3,76, 3,79, 4,40, 5,27-5,30, 6,81, 7,21, 7,42, 7,53-7,56, 8,01.
[0315]
Пример 43: (R)-1-гидрокси-4-((4-метоксибензил)окси)бутан-2-илбензоат
Раствор соединения, полученного в примере 42 (6,31 г) в THF (170 мл), охлаждали до 0°C, к раствору добавляли уксусную кислоту (3,6 мл) и фторид тетрабутиламмония (1,0 M раствор в THF, 21,2 мл), и полученный раствор перемешивали при комнатной температуре в течение ночи. Полученный остаток выливали в этилацетат, органический слой промывали насыщенным водным раствором аммиака и насыщенным водным раствором гидрокарбоната натрия, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (4,10 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,06-2,09, 2,57, 3,54-3,65, 3,78, 3,80-3,86, 4,41-4,46, 5,27-5,30, 6,84, 7,23, 7,43, 7,56, 8,02.
[0316]
Пример 44: (R)-4-((4-метоксибензил)окси)-1-оксобутан-2-илбензоат
Дихромат пиридиния (10,6 г) и молекулярное сито (торговое наименование) (21,7 г) суспендировали в дихлорметане (30 мл), и раствор соединения, полученного в примере 43 (3,1 г), в дихлорметане (100 мл) добавляли по каплям к полученному раствору. Полученный раствор перемешивали при комнатной температуре в течение 2,5 ч и затем разбавляли простым диэтиловым эфиром, и полученный раствор фильтровали. Фильтрат концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,27-2,40, 3,57-3,70, 3,76, 4,43, 5,40, 6,82, 7,15-7,24, 7,45, 7,60, 8,03, 9,64.
[0317]
Пример 45: (R, E)-5-((4-метоксибензил)окси)-1-(3-нитрофенил)пент-1-ен-3-илбензоат
Раствор соединения, полученного в примере 40 (3,56 г), в THF (70 мл) охлаждали до -70°C, и к раствору добавляли гексаметилдисилазид калия (0,5 М раствор в толуоле, 22,5 мл). Полученный реакционный раствор перемешивали при -70°C в течение 30 мин, затем раствор соединения, полученного в примере 44 (3,09 г), в THF (20 мл) добавляли по каплям к реакционному раствору в течение 5 мин, и реакционный раствор затем перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли этилацетат для разбавления реакционного раствора, органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (2,23 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,11-2,24, 3,60, 3,75, 6,81, 7,22, 7,43-7,47, 7,56-7,63, 8,04-8,09, 8,21.
[0318]
Пример 46: (R, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоат или (с,E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоат
2,3-Дихлор-5,6-дициано-1,4-бензохинон (2,26 г) добавляли к раствору соединения, полученного в примере 45 (2,23 г), в дихлорметане (100 мл) и фосфатном буфере (pH 7, 100 мл) при комнатной температуре, и полученный раствор интенсивно перемешивали при комнатной температуре в течение 3,5 ч. Реакционную смесь выливали в этилацетат и органический слой затем промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:4) с получением смеси указанных в заголовке соединений (1,25 г). Полученную смесь подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IA (20 мм × 250 мм), подвижная фаза: CO2:метанол=90:10, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 254 нм, температура колонки: 35°С). Оптически активные вещества, полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IA (10 мм × 250 мм), подвижная фаза:CO2:метанол=75:22,5:2,5, скорость потока: 30 мл/мин, давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°C). В результате, времена удерживания для (R, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-ил бензоата и (с,E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-ил бензоата составляли 5,4 мин и 8,5 мин, соответственно.
1H-ЯМР (CDCl3): δ 2,04, 2,10-2,14, 3,77-3,82, 5,92-5,95, 6,47, 6,79, 7,46-7,51, 7,60, 7,68, 8,08-8,12, 8,26.
[0319]
Пример 47: метил-2-(2-гидроксифенил)-2-метилпропанoат
Диизопропиламид лития (2,0 M раствор в THF, 18 мл) добавляли к раствору метил-2-(2-гидроксифенил)ацетата (регистрационный номер CAS: 22446-37-3) (1,5 г) в THF (120 мл) при -78°C, полученный раствор перемешивали при той же температуре в течение 1,5 ч. К реакционному раствору добавляли метилйодид (5,2 г) при -78°C, полученный раствор перемешивали при комнатной температуре в течение 30 мин. К реакционному раствору добавляли воду (40 мл) и уксусную кислоту (1 мл), и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток (1,8 г) растворяли в THF (150 мл), затем к раствору добавляли диизопропиламид лития (2,0 М раствор в THF, 10 мл) при -78°C, и полученный раствор перемешивали при той же температуре в течение 1,5 ч. К реакционному раствору добавляли метилйодид (2,85 г) при -78°C, и полученный раствор перемешивали при комнатной температуре в течение 30 мин. К реакционному раствору добавляли воду (40 мл) и уксусную кислоту (1 мл), и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (простой петролейный эфир:этилацетат=7:1). Тем самым получали указанное в заголовке соединение (538 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (ДМСО-d6): δ 1,42, 3,51, 6,70-6,83, 7,05, 7,19, 9,49.
[0320]
Пример 48: метил-1-(2-гидроксибензил)циклопропан-1-карбоксилат
Бис(триметилсилил)амид натрия (1,0 М раствор в THF, 75 мл) добавляли к раствору циклопропилкарбонитрила (регистрационный номер CAS: 5500-21-0) (3,35 г) в THF (50 мл) при комнатной температуре, и полученный раствор перемешивали в течение 20 мин. 1-(Хлорметил)-2-метоксибензол (регистрационный номер CAS: 7035-02-1) (7,83 г) добавляли к реакционному раствору при комнатной температуре, и полученный раствор перемешивали в течение 3 ч при нагревании с обратным холодильником. Раствор охлаждали до комнатной температуры, к реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (простой петролейный эфир:этилацетат=10:1) с получением неочищенного продукта (6,00 г) нитрильного соединения. Конц. серную кислоту (20 мл) добавляли к раствору неочищенного продукта (4,50 г) нитрильного соединения в метаноле (50 мл) при комнатной температуре, и полученный раствор перемешивали в течение 5 ч при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному остатку добавляли охлажденную льдом воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении с получением неочищенного продукта (3,20 г) сложноэфирного соединения. Трибромид бора (1,0 М раствор в дихлорметане, 18,2 мл) добавляли по каплям к раствору неочищенного продукта (2,00 г) сложноэфирного соединения в дихлорметане (30 мл) при -10°C, и полученный раствор перемешивали при комнатной температуре в течение 1 ч. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток очищали с помощью препаративной высокоэффективной жидкостной хроматографии (подвижная фаза A (0,1% водный раствор трифторуксусной кислоты (далее сокращенно обозначаемый «TFA»)):подвижная фаза B (0,1% TFA/ацетонитрил)=95:5 → 5:95). Тем самым получали указанное в заголовке соединение (550 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,11, 1,39, 2,90, 3,67, 6,87, 6,99, 7,18, 8,45.
[0321]
Пример 49: метил-4-(2-гидроксифенил)-2,2-диметилбутaнoат
Раствор диизопропиламида лития (2,0 M раствор в THF, 22,5 мл) добавляли к раствору метил-4-(2-гидроксифенил)бутаноата (регистрационный номер CAS: 93108-07-7) (3,00 г) в THF (150 мл) -78°C, и полученный раствор перемешивали при той же температуре в течение 30 мин. К реакционному раствору добавляли метилйодид (6,3 г) при -78°C, полученный раствор перемешивали при комнатной температуре в течение 2 ч. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью препаративной высокоэффективной жидкостной хроматографии (подвижная фаза A (0,1% водный раствор TFA):подвижная фаза B (0,1% TFA/ацетонитрил)=95:5 → 5:95). Тем самым получали указанное в заголовке соединение (538 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (ДМСО-d6): δ 1,17, 1,67-1,73, 2,38-2,43, 3,59, 6,66-6,76, 6,95-7,00, 9,19.
[0322]
Пример 50: метил-1-(2-метоксифенэтил)циклопропан-1-карбоксилат
Цинк (18,2 г) добавляли к раствору дихлорида бис(циклопентадиенил)титана (IV) (регистрационный номер CAS: 1271-19-8) (34,6 г) в THF (200 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 1 ч. Раствор метил-2-(1-ацетоксиметил)-2-пропеноата (регистрационный номер CAS: 30982-08-2) (11,0 г) и 1-(хлорметил)-2-метоксибензола (регистрационный номер CAS: 7035-02-1 ) (10,9 г) в THF (200 мл) добавляли к реакционному раствору при комнатной температуре, полученный раствор перемешивали при той же температуре в течение ночи. К реакционному раствору добавляли воду и полученный раствор экстрагировали простым диэтиловым эфиром. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (простой петролейный эфир:этилацетат=5:1 → 2:1) с получением неочищенного продукта (13,0 г) сложноэфирного соединения. Ацетат палладия (II) и диазометан (0,5 М раствор в простом диэтиловом эфире, 32,6 мл) добавляли к раствору неочищенного продукта сложноэфирного соединения (3,00 г) в простом диэтиловом эфире (100 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 4 ч. К реакционному раствору добавляли уксусную кислоту (4 мл) и воду, и полученный раствор экстрагировали простым диэтиловым эфиром. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (3,00 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (ДМСО-d6): δ 0,70, 1,21, 1,76-1,88, 2,76-2,87, 3,70, 3,83, 6,80-6,96, 7,11-7,32.
[0323]
Пример 51: метил-1-(2-гидроксифенэтил)циклопропан-1-карбоксилат
Трибромид бора (1,0 М раствор в дихлорметане, 38,4 мл) добавляли по каплям к раствору соединения, полученного в примере 50 (3,00 г), в дихлорметане (100 мл) при -78°C, и полученный раствор перемешивали при той же температуре в течение 5 ч. К реакционному раствору добавляли метанол (30 мл) и воду, и полученный раствор экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью препаративной высокоэффективной жидкостной хроматографии (подвижная фаза A (0,5% водный раствор гидрокарбоната аммония):подвижная фаза B (ацетонитрил)=80:20 → 25:75). Тем самым получали указанное в заголовке соединение (515 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (ДМСО-d6): δ 0,73, 1,06, 1,67-1,79, 2,58-2,70, 3,58, 6,63-6,80, 6,95-7,01, 9,17.
[0324]
Пример 52: этил-(E)-3-(2-(бензилокси)-5-фторфенил)акрилат
Раствор, полученный суспендированием гидрида натрия (60% в минеральном масле, 1,80 г) в DMF (30 мл), охлаждали до 0°C. К раствору добавляли триэтилфосфоноацетат (10,0 г), и полученный раствор перемешивали при 0°C в течение 30 мин, и к раствору по каплям добавляли раствор 2-бензилокси-5-фтор-бензальдегида (регистрационный номер CAS: 312314-37-7) (8,70 г) в DMF (10 мл), и полученный раствор перемешивали при 0°C в течение 1 ч. Смешанный реакционный раствор выливали в ледяную воду и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (13,2 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,33, 4,24, 5,13, 6,47, 6,85-7,00, 7,21-7,41, 7,99-8,05.
[0325]
Пример 53: этил-3-(5-фтор-2-гидроксифенил)пропанoат
Палладий на угле (1,95 г) добавляли к раствору соединения, полученного в примере 52 (11,0 г), в этаноле (18 мл), и полученный раствор перемешивали при комнатной температуре в течение 3 ч в атмосфере водорода. Реакционный раствор фильтровали через целит (торговое наименование), и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1 → 2:1). Тем самым получали указанное в заголовке соединение (5,8 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,24, 2,71, 2,86, 4,15, 6,77-6,83, 7,23.
[0326]
Пример 54: (R, E)-5-(2-((E)-3-метокси-3-оксопроп-1-ен-1-ил)фенокси)-1-(3-нитрофенил)пент-1-ен-3-илбензоат
Диизопропилазодикарбоксилат (далее сокращенно обозначаемый «DIAD») (0,1 мл) добавляли к раствору (R, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоата (110 мг), полученного в примере 46, метил-(E)-3-(2-гидроксифенил)проп-2-еноата (регистрационный номер CAS: 6236-69-7) (90 мг) и трифенилфосфина (130 мг) в THF (1 мл), и полученный раствор перемешивали при комнатной температуре в течение ночи. Раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:2). Тем самым получали указанное в заголовке соединение (200 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,43-2,55, 3,78, 4,24, 5,94-5,98, 6,46-6,53, 6,82, 6,90, 6,96, 7,29-7,33, 7,44-7,51, 7,57-7,60, 7,68, 8,00, 8,07-8,10, 8,23-8,24.
[0327]
Пример 55: (R, E)-1-(3-аминофенил)-5-(2-((E)-3-метокси-3-оксопроп-1-ен-1-ил)фенокси)пент-1-ен-3-илбензоат
Хлорид олова (IV) (310 мг) добавляли к раствору соединения, полученного в примере 54 (160 мг), в этаноле (7 мл), и полученный раствор перемешивали при 70°C в течение 3,5 ч. Реакционный раствор охлаждали до комнатной температуры, затем выливали в этилацетат и органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия, и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:2). Тем самым получали указанное в заголовке соединение (120 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,39-2,52, 3,66, 3,79, 4,20, 5,90, 6,28, 6,53, 6,57-6,59, 6,68, 6,73, 6,79, 6,89, 6,94, 7,09, 7,28-7,32, 7,42-7,47, 7,49-7,50, 7,54-7,58, 8,01, 8,05-8,07.
[0328]
Пример 56: (R, E)-5-(2-((E)-3-метокси-3-оксопроп-1-ен-1-ил)фенокси)-1-(3-(фенилсульфонамид)фенил)пент-1-ен-3-илбензоат
Раствор соединения, полученного в примере 55 (60 мг), и пиридина (0,016 мл) в дихлорметане (1 мл) охлаждали до 0°C, затем к полученному раствору добавляли фенилсульфонилхлорид (0,018 мл) и полученный раствор перемешивали в течение ночи, нагревая раствор до комнатной температуры. К реакционному раствору добавляли 1 М соляную кислоту и насыщенный солевой раствор, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (62 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 2,41-2,45, 3,87, 4,18-4,22, 5,84-5,88, 6,30-6,34, 6,51, 6,64, 6,89, 6,99, 7,05-7,19, 7,30-7,34, 7,38-7,50, 7,50-7,52, 7,56-7,59, 7,74-7,77, 8,04-8,07.
[0329]
Пример 57: (E)-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]проп-2-еновая кислота
1 М водный раствор гидроксида лития (0,5 мл) добавляли к раствору соединения, полученного в примере 56 (62 мг), в THF (1,5 мл) и метаноле (0,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 7 ч. К реакционному раствору добавляли 1 М соляную кислоту и насыщенный солевой раствор, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=10:0 → 9:1). Тем самым получали указанное в заголовке соединение (29 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,89;
1H-ЯМР (ДМСО-d6): δ 1,91-2,04, 4,10-4,22, 4,36, 5,12, 6,21-6,25, 6,44, 6,55, 6,93-6,99, 7,08-7,11, 7,16, 7,36-7,40, 7,52-7,55, 7,58-7,61, 7,66-7,68, 7,75-7,77, 7,85, 10,27, 12,31.
[0330]
Пример 58: N-[3-[(E,3R)-5-[2-(2-цианоэтил)фенокси]-3-гидроксипент-1-енил]фенил]бензолсульфонамид
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, соответствующее фенольное соединение. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 2,07-2,19, 2,60-2,65, 2,89-3,00, 4,10-4,23, 4,58, 6,24, 6,44, 6,56, 6,89-6,95, 7,10-7,27, 7,42-7,46, 7,52-7,56, 7,75-7,78.
[0331]
Пример 59: метил-1-[2-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]этил]циклопропан-1-карбоксилат
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, фенольное соединение, полученное в примере 51. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 0,71, 1,22, 1,79-1,83, 2,07-2,15, 2,44, 2,77-2,81, 3,65, 4,10-4,23, 6,24, 6,44, 6,55, 6,83-6,94, 7,08-7,20, 7,41-7,45, 7,51-7,55, 7,75-7,77.
[0332]
Пример 60: метил-4-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2,2-диметилбутаноат
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, фенольное соединение, полученное в примере 49. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,53, 1,56, 2,33-2,45, 3,63, 4,10-4,19, 5,95, 6,46, 6,71-6,91, 7,17-7,24, 7,45-7,52, 7,57-7,68.
[0333]
Примеры 61 (1) - (8)
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, соответствующие фенольные соединения. Тем самым были получены следующие соединения примеров.
[0334]
Пример 61(1): (E)-3-[4-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]проп-2-еновая кислота
Время удерживания ВЭЖХ (мин): 0,85;
1H-ЯМР (ДМСО-d6): δ 1,84-1,92, 4,06-4,17, 4,32-4,33, 5,07, 5,60-6,00, 6,10, 6,21, 6,37, 6,44, 6,94-6,97, 7,09-7,11, 7,16, 7,48-7,63, 7,75, 10,27, 12,15.
[0335]
Пример 61(2): 3-[4-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,86;
1H-ЯМР (ДМСО-d6): δ 1,80-1,84, 1,87-1,96, 2,48, 2,74, 3,95-4,01, 4,01-4,08, 4,28-4,34, 5,04, 6,21, 6,43, 6,82-6,94, 6,93-6,96, 7,08-7,13, 7,17, 7,51-7,56, 7,57-7,59, 7,75-7,78, 10,27, 12,04.
[0336]
Пример 61(3): (E)-3-[3-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]проп-2-еновая кислота
Время удерживания ВЭЖХ (мин): 0,89;
1H-ЯМР (ДМСО-d6): δ 1,83-1,98, 4,06-4,17, 4,31-4,35, 5,06, 6,20-6,25, 6,44, 6,54, 6,94-6,99, 7,09-7,11, 7,17, 7,23-7,26, 7,31, 7,52-7,61, 7,75-7,77, 10,27, 12,35.
[0337]
Пример 61(4): 3-[3-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,89;
1H-ЯМР (ДМСО-d6): δ 1,81-1,95, 2,51, 2,78, 4,31, 5,05, 6,21, 6,43, 6,73-6,79, 6,93-6,96, 7,09-7,10, 7,14-7,18, 7,52-7,55, 7,58-7,61, 7,75-7,78, 10,25, 12,10.
[0338]
Пример 61(5) 2-[3-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2-метилпропановая кислота
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (ДМСО-d6): δ 1,44, 1,81-1,97, 3,99-4,10, 4,30-4,35, 5,05, 6,21, 6,44, 6,79-6,82, 6,84-6,85, 6,88-6,90, 6,93-6,96, 7,08-7,10, 7,16, 7,23, 7,51-7,55, 7,57-7,61, 7,75-7,78, 10,25, 12,30.
[0339]
Пример 61(6):
2-[4-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2-метилпропановая кислота
Время удерживания ВЭЖХ (мин): 0,92;
1H-ЯМР (ДМСО-d6): δ 1,44, 1,83-1,93, 3,99-4,08, 4,29-4,33, 5,04, 6,21, 6,42, 6,86-6,88, 6,93-6,95, 7,07-7,09, 7,16, 7,23-7,25, 7,51-7,55, 7,57-7,60, 7,75-7,77, 10,25, 12,30.
[0340]
Пример 61(7): 4-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]бутановая кислота
[0341]
[Формула 49]

[0342]
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 1,92-2,00, 2,12, 2,28-2,42, 2,68-2,71, 4,07-4,20, 4,63, 6,85-6,96, 7,08-7,19, 7,40-7,59, 7,59-7,63, 7,75-7,77.
[0343]
Пример 61(8): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2,2-диметилпропановая кислота
Время удерживания ВЭЖХ (мин): 0,95
1H-ЯМР (CDCl3): δ 1,21, 2,05-2,15, 2,96, 4,07-4,15, 4,60, 6,23, 6,53, 6,85-7,00, 7,07-7,20, 7,40-7,63, 7,76-7,78.
[0344]
Пример 62: 2-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2-метилпропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, фенольное соединение, полученное в примере 47. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 1,63-1,65, 2,09-2,14, 4,13-4,21, 4,58, 6,28, 6,52, 6,82-6,84, 7,00-7,06, 7,15-7,19, 7,40-7,62, 7,76-7,78.
[0345]
Пример 63: 1-[[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]метил]циклопропан-1-карбоновая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, соединение, полученное в примере 48. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,38-1,40, 2,11-2,16, 4,13-4,18, 4,58, 6,28, 6,54, 6,85-7,20, 7,38-7,52, 7,74-7,76.
[0346]
Пример 64: 4-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]-2,2-диметилбутановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, соединение, полученное в примере 49. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 1,28, 1,74-1,91, 2,08-2,17, 2,61, 4,01-4,16, 4,62, 6,22, 6,51, 6,81-7,17, 7,39-7,43, 7,48-7,53, 7,75-7,78.
[0347]
Пример 65: 1-[2-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]этил]циклопропан-1-карбоновая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, фенольное соединение, полученное в примере 51. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 0,66-0,76, 1,19-1,30, 1,64-1,72, 1,79-1,88, 2,08-2,14, 2,75-2,89, 4,10-4,21, 4,65, 6,28, 6,55, 6,83-6,90, 6,96-7,00, 7,07-7,18, 7,35-7,39, 7,46-7,52, 7,73-7,76.
[0348]
Примеры 66 (1) - (3)
Проводили те же самые предусмотренные процедуры, что и в примере 1 → примере 54 → примере 55 → примере 56 → примере 57, используя вместо 3,4-дигидрокумарина, применявшегося в примере 1, соответствующие лактонные соединения. Тем самым были получены следующие соединения примеров.
[0349]
Пример 66(1): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-5-бромфенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CD3OD): δ 2,06-2,10, 2,56-2,60, 2,88-2,92, 4,07-4,19, 4,51, 6,23, 6,53, 6,86-6,88, 6,97-7,00, 7,11-7,19, 7,29-7,32, 7,46-7,50, 7,54-7,58, 7,76-7,78.
[0350]
Пример 66(2): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-5-метилфенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (CD3OD): δ 1,92-1,96, 2,13, 2,42-2,46, 2,75-2,79, 3,63-4,03, 4,41, 6,11, 6,42, 6,69, 6,84-6,89, 6,99-7,06, 7,34-7,46, 7,64-7,66.
[0351]
Пример 66(3): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-4-метилфенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 1,92-1,97, 2,18, 2,41-2,45, 2,74-2,78, 3,93-4,06, 4,42, 6,11, 6,41, 6,56, 6,64, 6,86-6,92, 7,00-7,07, 7,33-7,46, 7,64-7,66.
[0352]
Пример 67: 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-5-фторфенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, фенольное соединение, полученное в примере 53. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CDCl3): δ 2,09-2,15, 2,67-2,71, 2,93-2,97, 4,10-4,15, 4,59, 6,27, 6,54, 6,77-6,80, 6,84-6,90, 6,95-7,00, 7,08-7,10, 7,16, 7,40-7,44, 7,50-7,55, 7,76-7,78.
[0353]
Примеры 68 (1) - (2)
Проводили те же самые предусмотренные процедуры, что и в примере 52 → примере 53 → примере 54 → примере 55 → примере 56 → примере 57, используя соответствующие альдегидные соединения вместо 2-бензилокси-5-фтор-бензальдегида, применявшегося в примере 52, и используя соответствующие фенольные соединения вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54. Тем самым были получены следующие соединения примеров.
[0354]
Пример 68(1): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-6-фторфенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 2,09-2,15, 2,61-2,65, 2,97-3,01, 4,10-4,17, 4,60, 6,26, 6,54, 6,65-6,70, 6,97-7,00, 7,05-7,18, 7,41-7,44, 7,50-7,54, 7,76-7,79.
[0355]
Пример 68(2): 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]-3-фторфенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CDCl3): δ 2,09-2,15, 2,69-2,73, 3,01-3,05, 4,22-4,24, 4,67, 6,30, 6,58, 6,95-7,01, 7,10-7,20, 7,42-7,45, 7,51-7,54, 7,77-7,79.
[0356]
Пример 69: 3-[2-[(E,3S)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 57, используя соединение, полученное в примере 1, вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54, и используя (S, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоат, полученный в примере 54, вместо (R, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоата, применявшегося в примере 54. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 2,05-2,10, 2,57-2,61, 2,91-2,95, 4,10, 4,17, 4,51-4,56, 6,24, 6,53, 6,86, 6,93, 6,98, 7,12-7,20, 7,45-7,50, 7,56, 7,75-7,78.
[0357]
Пример 70: 3-[2-[(3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановая кислота
[0358]
[Формула 50]
[0359]
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя соединение, полученное в примере 69. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 1,69-2,02, 2,59-2,75, 2,90-2,96, 3,89, 4,05-4,18, 6,85-7,00, 7,11-7,22, 7,36-7,43, 7,44-7,53, 7,76.
[0360]
Пример 71: изопропил-(R, E)-3-(2-((5-(3-аминофенил)-3-((триметилсилил)окси)пент-4-ен-1-ил)окси)фенил)пропанoат
3-Броманилин (421 мг), хлор-(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]пaллaдий (II) (0,30 г) и 2 М водный раствор трикалийфосфата (5,7 мл) добавляли к раствору соединения, полученного в примере 8 (1,00 г), в THF (10 мл), и полученный раствор перемешивали при 70°C в течение 19 ч. Реакционный раствор охлаждали до комнатной температуры, затем к раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 2:1). Тем самым получали указанное в заголовке соединение (515 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,82.
[0361]
Пример 72: изопропил-(R, E)-3-(2-((5-(3-((4-фторфенил)сульфонамид)фенил)-3-гидроксипент-4-ен-1-ил)окси)фенил)пропанoат
Пиридин (0,018 мл), DMAP (2,7 мг) и 4-фторбензолсульфонилхлорид (регистрационный номер CAS: 349-88-2) (25,6 мг) добавляли к раствору соединения, полученного в примере 71 (50 мг), в THF (1 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 16 ч. TBAF (1,0 M раствор в THF, 0,27 мл) добавляли к реакционному раствору при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 1 ч. К реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью препаративной высокоэффективной жидкостной хроматографии (подвижная фаза A (0,1% водный раствор TFA) : подвижная фаза B (0,1% TFA/ацетонитрил) = 90:0 → 10:90). Тем самым получали указанное в заголовке соединение (515 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,11.
[0362]
Пример 73: 3-[2-[(E,3R)-5-[3-[(4-фторфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 72. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,94
1H-ЯМР (CD3OD): δ 2,06-2,11, 2,57-2,61, 2,91-2,95, 4,10, 4,18, 4,55, 6,26, 6,55, 6,86, 6,93, 6,99, 7,13-7,25, 7,79-7,82.
[0363]
Примеры 74 (1) - (21)
Проводили те же самые предусмотренные процедуры, что и в примере 72 → примере 11, используя вместо 4-фторбензолсульфонилхлорида, применявшегося в примере 72, соответствующие сульфонильные соединения. Тем самым были получены следующие соединения примеров.
[0364]
Пример 74(1):3-[2-[(E,3R)-5-[3-[(4-хлорфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (CD3OD): δ 2,06-2,11, 2,57-2,61, 2,91-2,95, 4,10, 4,18, 4,55, 6,26, 6,55, 6,86, 6,93, 6,99, 7,13-7,21, 7,48-7,51, 7,71-7,75.
[0365]
Пример 74(2):
3-[2-[(E,3R)-3-гидрокси-5-[3-[(4-метилфенил)сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CD3OD): δ 2,06-2,11, 2,37, 2,57-2,61, 2,91-2,95, 4,10, 4,18, 4,54, 6,24, 6,54, 6,86, 6,93, 6,98, 7,11-7,20, 7,27-7,30, 7,63-7,66.
[0366]
Пример 74(3): 3-[2-[(E,3R)-3-гидрокси-5-[3-[[4-(трифторметил)фенил]сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,01;
1H-ЯМР (CD3OD): δ 2,06-2,10, 2,57-2,61, 2,91-2,95, 4,10, 4,18, 4,54, 6,27, 6,55, 6,86, 6,93, 6,99, 7,15-7,22, 7,80-7,83, 7,93-7,95.
[0367]
Пример 74(4): 3-[2-[(E,3R)-5-[3-[(4-бутилфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,08;
1H-ЯМР (CD3OD): δ 0,93, 1,31-1,36, 1,55-1,63, 2,06-2,10, 2,57-2,67, 2,91-2,95, 4,11, 4,18, 4,54, 6,24, 6,54, 6,86, 6,93, 6,98, 7,11-7,20, 7,28-7,30, 7,65-7,68.
[0368]
Пример 74(5): 3-[2-[(E,3R)-5-[3-[(3-фторфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
МС (ESI, положит.): 482 (M+H-H2O)+.
[0369]
Пример 74(6): 3-[2-[(E,3R)-5-[3-[(3-хлорфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
МС (ESI, положит.): 498 (M+H-H2O)+.
[0370]
Пример 74(7): 3-[2-[(E,3R)-3-гидрокси-5-[3-[(3-метилфенил)сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
МС (ESI, положит.): 478 (M+H-H2O)+.
[0371]
Пример 74(8): 3-[2-[(E,3R)-3-гидрокси-5-[3-[[3-(трифторметил)фенил]сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
МС (ESI, положит.): 532 (M+H-H2O)+.
[0372]
Пример 74(9): 3-[2-[(E,3R)-5-[3-[(2-фторфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,94;
МС (ESI, положит.): 482 (M+H-H2O)+.
[0373]
Пример 74(10): 3-[2-[(E,3R)-5-[3-[(2-хлорфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
МС (ESI, положит.): 498 (M+H-H2O)+.
[0374]
Пример 74(11): 3-[2-[(E,3R)-3-гидрокси-5-[3-[(2-метилфенил)сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,97;
МС (ESI, положит.): 478 (M+H-H2O)+.
[0375]
Пример 74(12): 3-[2-[(E,3R)-3-гидрокси-5-[3-[[2-(трифторметил)фенил]сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
МС (ESI, положит.): 532 (M+H-H2O)+.
[0376]
Пример 74(13): 3-[2-[(E,3R)-5-[3-(циклопентилсульфониламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
[0377]
[Формула 51]
[0378]
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 1,60-1,67, 1,74-1,81, 1,90-2,05, 2,08-2,13, 2,58-2,62, 2,92-2,96, 3,56, 4,13, 4,20, 4,58, 6,35, 6,62, 6,86, 6,94, 7,14-7,20, 7,26-7,32.
[0379]
Пример 74(14): 3-[2-[(E,3R)-3-гидрокси-5-[3-(оксан-4-илсульфониламино)фенил]пент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,48 (этилацетат);
1H-ЯМР (CDCl3): δ 1,88-2,00, 2,15-2,20, 2,63-2,74, 2,90-3,02, 3,22-3,35, 4,04, 4,17, 6,38, 6,60, 6,88, 7,13-7,28.
[0380]
Пример 74(15): 3-[2-[(E,3R)-5-[3-(бензилсульфониламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,55 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,13-2,18, 2,67, 2,96, 4,13-4,22, 4,34, 4,64, 6,35, 6,61, 6,89, 6,96, 7,06, 7,13-7,36.
[0381]
Пример 74(16): 3-[2-[(E,3R)-3-гидрокси-5-[3-(пиридин-2-илсульфониламино)фенил]пент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,36 (этилацетат);
1H-ЯМР (CDCl3): δ 2,06-2,23, 2,72, 3,02, 4,16, 4,60, 6,31, 6,52, 6,86-6,93, 7,01, 7,10-7,22, 7,46, 7,85, 7,97, 8,41, 8,65.
[0382]
Пример 74(17): 3-[2-[(E,3R)-5-[3-(1-бензофуран-3-илсульфониламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (CDCl3): δ 2,08-2,13, 2,69, 2,96, 4,11, 4,55-4,62, 6,21, 6,52, 684-6,92, 6,99-7,03, 7,09-7,19, 7,30-7,40, 7,50, 7,70, 8,05.
[0383]
Пример 74(18): 3-[2-[(E,3R)-5-[3-[(4-бутоксифенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,40 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 0,95, 1,40-1,50, 1,68-1,79, 2,10-2,14, 2,68, 2,96, 3,93, 4,10-4,19, 4,60, 6,26, 6,52, 6,81-6,91, 6,97-7,09, 7,12-7,24, 7,68.
[0384]
Пример 74(19): 3-[2-[(E,3R)-3-гидрокси-5-[3-(тиофен-3-илсульфониламино)фенил]пент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,35 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,10-2,15, 2,68, 2,96, 4,09-4,20, 4,62, 6,27, 6,54, 6,84-6,92, 7,00-7,23, 7,27-7,32, 7,86.
[0385]
Пример 74(20): 3-[2-[(E,3R)-3-гидрокси-5-[3-[(2-пропилфенил)сульфониламино]фенил]пент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,38 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 1,00, 1,64-1,74, 2,10-2,15, 2,70, 2,93-3,01, 4,10-4,19, 4,60, 6,26, 6,53, 6,85-6,92, 7,02-7,06, 7,10-7,24, 7,33, 7,45, 7,95.
[0386]
Пример 74(21): 3-[2-[(E,3R)-5-[3-[(3-бутилфенил)сульфониламино]фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
ТСХ: Rf 0,38 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 0,86, 1,18-1,28, 1,42-1,53, 2,08-2,14, 2,57, 2,69, 2,97, 4,10-4,21, 4,61, 6,25, 6,53, 6,84-6,92, 6,98, 7,04-7,21, 7,29-7,32, 7,55-7,60.
[0387]
Пример 75: 3-[2-[(3S)-5-[3-(циклопентилсульфониламино)фенил]-3-гидроксипентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 74(13). Тем самым было получено следующее соединение примера.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 1,55-1,63, 1,74-2,07, 2,52-2,56, 2,73, 2,84, 2,85-2,89, 3,53, 3,89, 4,09-4,19, 6,85, 6,93, 7,02, 7,08-7,19, 7,23.
[0388]
Пример 76: метил-(R, E)-3-(2-((3-гидрокси-5-(3-(фенилсульфонамидо)фенил)пент-4-ен-1-ил)окси)фенил)пропанoат
Триметилсилилдиазометан (2,0 М раствор в гексане, 2,6 мл) добавляли к раствору соединения, полученного в примере 11 (500 мг), в метаноле (10 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 30 мин. К реакционному раствору добавляли уксусную кислоту при охлаждении льдом, и полученный раствор концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3 → 1:1). Тем самым получали указанное в заголовке соединение (495 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,03.
[0389]
Пример 77: метил-3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]-3-оксопент-4-енокси]фенил]пропанoат
Диоксид марганца (868 мг) добавляли к раствору соединения, полученного в примере 76 (495 мг), в дихлорметане (10 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 20 ч. Реакционный раствор фильтровали через целит (торговое наименование), и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3 → 1:1). Тем самым получали указанное в заголовке соединение (439 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10.
1H-ЯМР (CDCl3): δ 2,59-2,63, 2,88-2,92, 3,08-3,11, 3,68, 4,31-4,34, 6,80, 6,85-6,92, 7,12, 7,18-7,34, 7,42-7,56, 7,77-7,80.
[0390]
Пример 78: 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]-3-оксопент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 77, используя вместо метил-(R, E)-3-(2-((3-гидрокси-5-(3-(фенилсульфонамид)фенил)пент-4-ен-1-ил)окси)фенил)пропанoата, применявшегося в примере 77, соединение, полученное в примере 11. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 2,44-2,48, 2,81-2,85, 3,22, 3,25,4,33-4,37, 6,82, 6,86, 6,97, 7,14-7,21, 7,29, 7,33-7,39, 7,48-7,52, 7,56-7,63, 7,79-7,81.
[0391]
Пример 79: 3-[2-[5-[3-(бензолсульфонамидо)фенил]-3-оксопентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 78. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CD3OD): δ 2,47-2,51, 2,80-2,85, 2,88-2,91, 4,21-4,24, 6,85-6,95, 7,09-7,21, 7,44-7,48, 7,54, 7,74-7,76.
[0392]
Пример 80: 3-[2-[5-[3-(1-гидрокси-2-фенилэтил)фенил]-3-оксопентокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 78 → примере 79, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 78, соединение, полученное в примере 12(9). Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,48-2,52, 2,80-2,96, 3,03-3,08, 4,25, 4,82, 6,85-6,94, 7,08-7,22.
[0393]
Пример 81: изопропил-3-(2-(пент-4-ин-1-ил окси)фенил)пропанoат
Карбонат цезия (9,39 г) добавляли к раствору соединения, полученного в примере 1 (3,00 г), в N, N-диметилацетамиде (25 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 15 мин. 5-Хлор-1-пентин (регистрационный номер CAS: 14267-92-6) (1,63 г) добавляли к реакционному раствору при комнатной температуре, и полученный раствор перемешивали при 60°C в течение 3 ч. К реакционному раствору добавляли воду и полученный раствор экстрагировали простым диэтиловым эфиром. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:0 → 5:1). Тем самым получали указанное в заголовке соединение (2,40 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,13.
[0394]
Пример 82: изопропил-(E)-3-(2-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)пент-4-ен-1-ил)окси)фенил)пропанoат
4,4,5,5-Тетраметил-1,3,2-диоксаборолан (1,17 г) и 4-диметиламинобензойную кислоту (60,2 мг) добавляли к раствору соединения, полученного в примере 81 (1,00 г), в гептане ( 2 мл) при комнатной температуре, и полученный раствор перемешивали при 100°C в течение 4 ч. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=20:1 → 4:1). Тем самым получали указанное в заголовке соединение (503 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,38.
[0395]
Пример 83: изопропил-(E)-3-(2-((5-(3-(фенилсульфонамид)фенил)пент-4-ен-1-ил)окси)фенил)пропанoат
Соединение, полученное в примере 9 (168 мг), хлор-(2-дициклогексилфосфино-2’,4’,6’-триизопропил-1,1’-бифенил)[2-(2’-амино-1,1’-бифенил)]пaллaдий (II) (0,035 г) и 2 M водный раствор трикалийфосфата (0,67 мл) добавляли к раствору соединения, полученного в примере 82 (180 мг), в THF (3 мл), и полученный раствор перемешивали при 60°C в течение 1 ч. Реакционный раствор охлаждали до комнатной температуры, затем к раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:1 → 2:1). Тем самым получали указанное в заголовке соединение (113 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,24.
[0396]
Пример 84: 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропановая кислота
[0397]
[Формула 52]
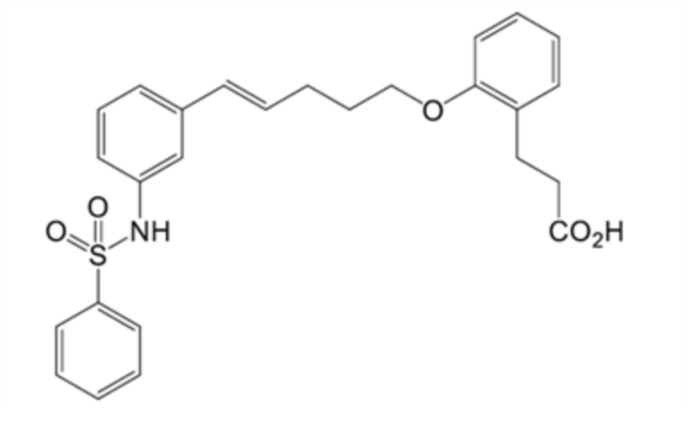
[0398]
1 М водный раствор гидроксида лития (0,5 мл) добавляли к раствору соединения, полученного в примере 83 (146 мг), в THF (0,5 мл) и метаноле (0,1 мл), и полученный раствор перемешивали при 50°C в течение 8 ч. К раствору добавляли 1 М соляную кислоту, чтобы сделать раствор кислым, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (105 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10
1H-ЯМР (CD3OD): δ 1,95-2,03, 2,41-2,46, 2,57-2,61, 2,92-2,95, 4,03-4,06, 6,24, 6,36, 6,86, 6,90-6,95, 7,06-7,08, 7,11-7,19, 7,45-7,49, 7,55, 7,75-7,78.
[0399]
Пример 85: 3-[2-[(E)-5-[4-(1-гидрокси-2-фенилэтил)фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 83 → примере 84, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83, 1-(4-бромфенил)-2-фенилэтан-1-ол (регистрационный номер CAS: 20498-64-0). Тем самым было получено следующее соединение примера.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,97-2,03, 2,41-2,45, 2,67-2,71, 2,96-3,03, 4,04, 4,86-4,90, 6,23-6,30, 6,44, 6,83-6,89, 7,16-7,34.
[0400]
Пример 86: 3-[2-[(E)-5-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 83 → примере 84, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83, соединение, полученное в примере 21. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,20;
1H-ЯМР (CDCl3): δ 2,00, 2,43, 2,64-2,70, 2,95-3,07, 4,04, 4,89, 6,28, 6,44, 6,83-6,89, 7,15-7,39.
[0401]
Пример 87: 3-[2-[(E)-5-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 21 → примере 83 → примере 84, используя (S)-метилoксазаборолидин вместо (R)-метилoксазаборолидина, применявшегося в примере 21, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,20;
1H-ЯМР (CDCl3): δ 2,00, 2,44, 2,66-2,70, 2,95-3,07, 4,04, 4,89, 6,28, 6,45, 6,83-8,89, 7,15-7,40.
[0402]
Примеры 87 (1) - (10)
Проводили те же самые предусмотренные процедуры, что и в примере 9 → примере 83 → примере 84, используя вместо 3-броманилина, применявшегося в примере 9, соответствующие аминные соединения. Тем самым получали указанные в заголовке соединения, имеющие значения физических свойств, показанные ниже.
[0403]
Пример 87(1): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-2-(трифторметил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,08;
1H-ЯМР (CDCl3): δ 1,92-1,99, 2,36-2,42, 2,64-2,68, 2,93-2,97, 3,99, 5,98, 6,02, 6,58-6,65, 6,81, 6,88, 7,00, 7,15-7,20, 7,39-7,45, 7,51-7,56, 7,65, 7,70-7,73.
[0404]
Пример 87(2): 3-[2-[(E)-5-[5-(бензолсульфонамидо)-2-(трифторметил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,97-2,04, 2,43-2,49, 2,74-2,78, 3,00-3,04, 4,04, 6,25-6,32, 6,66, 6,85, 6,91, 7,10-7,25, 7,44-7,48, 7,53-7,58, 7,84-7,87.
[0405]
Пример 87(3): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-5-(трифторметил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,11;
1H-ЯМР (CDCl3): δ 1,96-2,02, 2,41-2,46, 2,72-2,76, 2,97-3,01, 4,03, 6,31-6,40, 6,84, 6,90, 7,15-7,25, 7,43-7,48, 7,52-7,57, 7,79-7,82.
[0406]
Пример 87(4): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-4-(трифторметил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,98-2,05, 2,45-2,50, 2,68-2,72, 2,97-3,01, 4,04, 6,36-6,47, 6,80-6,91, 7,15-7,22, 7,37-7,44, 7,51-7,55, 7,74-7,79.
[0407]
Пример 87(5): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-2-цианoфенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,01;
1H-ЯМР (CDCl3): δ 1,95-2,02, 2,44-2,49, 2,64-2,68, 2,93-2,97, 4,01, 6,44, 6,60, 6,82, 6,88, 7,15-7,20, 7,31-7,32, 7,42-7,50, 7,52-7,60, 7,82-7,85.
[0408]
Пример 87(6): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-4-цианoфенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,98-2,04, 2,46-2,51, 2,57-2,61, 2,92-2,96, 4,04-4,07, 6,38-6,46, 6,87, 6,92, 7,16-7,20, 7,24, 7,34, 7,49-7,55, 7,60, 7,75-7,78.
[0409]
Пример 87(7): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-2,4-дихлорфенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,07;
1H-ЯМР (CD3OD): δ 1,87-1,94, 2,36-2,41, 2,44-2,48, 2,81, 3,95, 6,25, 6,59, 6,74, 6,79, 7,03-7,08, 7,22, 7,39-7,43, 7,49-7,53, 7,67-7,70.
[0410]
Пример 87(8): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-4-метилсульфонилфенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,98-2,05, 2,46-2,50, 2,67-2,50, 2,77, 2,96-3,00, 4,03, 6,40-6,42, 6,84, 6,90, 7,16-7,22, 7,47-7,52, 7,58, 7,64, 7,71, 7,91-7,94.
[0411]
Пример 87(9): 3-[2-[(E)-5-[3-(бензолсульфонамидо)-5-метилсульфонилфенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 1,97-2,03, 2,44-2,49, 2,72-2,76, 2,97-3,03, 4,04, 6,36, 6,41-6,48, 6,84, 6,90, 7,15-7,22, 7,40, 7,45-7,49, 7,54-7,58, 7,77, 7,82-7,84.
[0412]
Пример 87(10): 3-[2-[(E)-5-[3-(бензолсульфонамидометил)фенил]пент-4-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,96-2,02, 2,39-2,44, 2,66-2,70, 2,93-2,97, 4,03, 4,12, 5,33, 6,24, 6,36, 6,83-6,90, 6,96-6,99, 7,14-7,21, 7,47-7,52, 7,54-7,59, 7,84-7,88.
[0413]
Примеры 88 (1) - (2)
Проводили те же самые предусмотренные процедуры, что и в примере 83 → примере 35 → примере 84, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83, соответствующие галогенидные соединения. Тем самым получали указанные в заголовке соединения, имеющие значения физических свойств, показанные ниже.
[0414]
Пример 88(1): 3-[2-[5-[3-(1-гидрокси-2-фенилэтил)фенил]пентокси]фенил]пропановая кислота
ТСХ: Rf 0,61 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 1,47-1,55, 1,67-1,74, 1,79-1,85, 2,58, 2,65, 2,88, 2,97-3,07, 3,96, 4,89, 6,79-6,88, 7,09-7,33.
[0415]
Пример 88(2): 3-[2-[5-[4-(1-гидрокси-2-фенилэтил)фенил]пентокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,1;
1H-ЯМР (CDCl3): δ 1,47-1,80, 2,48-2,56, 2,64-2,69, 2,82-2,88, 3,02-3,06, 3,95, 4,89-4,93, 6,79-6,87, 7,11-7,34.
[0416]
Пример 89: (R)-3-[2-[5-[3-(1-гидрокси-2-фенилэтил)фенил]пентокси]фенил]пропановая кислота или (S)-3-[2-[5-[3-(1-гидрокси-2-фенилэтил)фенил]пентокси]фенил]пропановая кислота
Соединение, полученное в примере 88 (1), подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IF (10 мм × 250 мм), подвижная фаза: CO2:ацетонитрил:метанол=75:22,5:2,5, скорость потока: 30 мл/мин, давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°C). Оптически активные вещества примера 88(1), полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IF (10 мм × 250 мм), подвижная фаза: CO2:ацетонитрил:метанол=75:22,5:2,5, скорость потока: 30 мл/мин, давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°C). В результате, время удерживания для первого пика и второго пика составило 14,9 мин и 19,1 мин, соответственно.
[0417]
Пример 90: 4-бром-N-метокси-N-метилтиазол-2-карбоксамид
N, O-диметилгидроксиламина гидрохлорид (609 мг), диизопропилэтиламин (2,5 мл) и 1-(хлор-1-пирролидинилметилен)пирролидиния гексафторфосфат (2,4 г) добавляли к раствору 4-бромтиазол-2-карбоновой кислоты (1,0 г ) в дихлорметане (9,6 мл), и полученный раствор перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1). Тем самым получали указанное в заголовке соединение (1,0 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,3 (гексан:этилацетат=2:1).
[0418]
Пример 91: 1-(4-бромтиазол-2-ил)-2-фенилэтан-1-он
Бензилмагнийбромид (0,1 М раствор в простом диэтиловом эфире, 40 мл) добавляли к раствору соединения, полученного в примере 90 (300 мг), в простом диэтиловом эфире (1 мл) при 0°C, и полученный раствор перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси добавляли насыщенный раствор хлорида аммония, и полученный раствор экстрагировали простым диэтиловым эфиром. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=8:1). Тем самым получали указанное в заголовке соединение (181 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,7 (гексан:этилацетат=4:1).
[0419]
Пример 92: 3-[2-[(E)-5-[2-(1-гидрокси-2-фенилэтил)-1,3-тиазол-4-ил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 21 → примере 83 → примере 84, используя соединение, полученное в примере 91, вместо 1-(3-бромфенил)-2-фенилэтанона, применявшегося в примере 21, используя (RS)-метилоксазаборолидин вместо (R)-метилоксазаборолидина, применявшегося в примере 21, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (ДМСО-d6): δ 1,92-2,00, 2,41-2,48, 2,80-2,84, 2,85-2,90, 3,10-3,15, 4,01-4,06, 4,80-4,85, 5,83, 6,60-6,72, 6,85, 6,95, 7,14-7,18, 7,21-7,25.
[0420]
Пример 93: 3-[2-[(E)-5-[4-(1-гидрокси-2-фенилэтил)-1,3-тиазол-2-ил]пент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 90 → примере 91 → примере 21 (в котором (RS)-метилoксазаборолидин использовали вместо (R)-метилoксазаборолидина) → примере 83 → примере 84, используя 2-бромтиазол-4-карбоновую кислоту вместо 4-бромтиазол-2-карбоновой кислоты, применявшейся в примере 90, и используя соответствующее галогенидное соединение вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 83. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 1,98-2,05, 2,41-2,47, 2,66-2,70, 2,96-3,00, 3,08, 3,34, 4,03, 5,18, 6,42-6,46, 6,58, 6,62, 6,83-6,89, 6,93, 7,16-7,25, 7,27-7,34.
[0421]
Пример 94: 3-[2-[5-[5-(1-гидрокси-2-фенилэтил)-1,3-тиазол-2-ил]пентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 35, используя вместо изопропил-3-(2-(((R, E)-3-гидрокси-5-(3-((R)-1-гидрокси-2-фенилэтил)фенил)пент-4-ен-1-ил)окси)фенил)пропанoата, применявшегося в примере 35, соединение, полученное в примере 93. Тем самым было получено следующее соединение примера.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,56-1,64, 1,80-1,90, 2,57-2,61, 2,94, 3,05, 3,09-3,11, 3,96, 5,14, 6,80, 6,86, 7,14-7,25, 7,29-7,33, 7,46.
[0422]
Пример 95: 3-[2-[5-[2-(1-гидрокси-2-фенилэтил)-1,3-тиазол-5-ил]пентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 35, используя вместо изопропил-3-(2-(((R, E)-3-гидрокси-5-(3-((R)-1-гидрокси-2-фенилэтил)фенил)пент-4-ен-1-ил)окси)фенил)пропанoата, применявшегося в примере 35, соединение, полученное в примере 92. Тем самым было получено следующее соединение примера.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 1,51-1,59, 1,68-1,85, 2,57-2,61, 2,84, 2,90, 3,09, 3,27, 3,97, 5,14, 6,81, 6,86, 7,13-7,25, 7,28-7,32, 7,39.
[0423]
Пример 95(1): 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]-N-метилсульфонилпропaнамид
Метансульфонамид (102 мг), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (124 мг) и DMAP (78,7 мг) добавляли к раствору соединения, полученного в примере 84 (100 мг), в DMF (1 мл), и полученный раствор перемешивали при комнатной температуре в течение 23 ч. К реакционной смеси добавляли 1 М соляную кислоту и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 0:1). Тем самым получали указанное в заголовке соединение (80,7 мг), имеющее значения физических свойств, показанные ниже. Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 1,97-2,04, 2,37-2,42, 2,64-2,67, 2,96-2,99, 3,19, 4,05, 6,22, 6,33, 6,73, 6,85-6,92, 7,06-7,08, 7,13-7,17, 7,21, 7,41-7,45, 7,50-7,54, 7,76-7,78.
[0424]
Пример 95(2): 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропaнамид
Проводили ту же самую предусмотренную процедуру, что и в примере 31, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 31, соединение, полученное в примере 84. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,98;
1H-ЯМР (CDCl3): δ 1,95-2,02, 2,40-2,45, 2,60-2,64, 3,03-3,07, 4,04, 5,55, 5,82, 6,29, 6,34-6,41, 6,86, 6,89-6,95, 7,03-7,06, 7,11-7,22, 7,41-7,44, 7,49-7,53, 7,82-7,85, 8,25.
[0425]
Пример 95(3): N-[3-[(E)-5-[2-(2-цианоэтил)фенокси]пент-1-енил]фенил]бензолсульфонамид
Пиридин (0,052 мл) и ангидрид трифторуксусной кислоты (67,8 мг) добавляли к раствору соединения, полученного в примере 95(2) (100 мг), в THF (1 мл) при охлаждении льдом, и полученный раствор перемешивали при той же температуре в течение 1 ч. К реакционному раствору добавляли метанол и 1 М водный раствор гидроксида натрия, и полученный раствор перемешивали при комнатной температуре в течение 1 ч. Реакционный раствор выливали в воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1 → 1:1). Тем самым получали указанное в заголовке соединение (91,0 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 1,95-2,02, 2,37-2,42, 2,61-2,65, 2,95-2,99, 4,03, 6,20, 6,34, 6,49, 6,84-6,94, 7,05-7,25, 7,41-7,46, 7,51-7,55, 7,75-7,78.
[0426]
Пример 95(4): N-[3-[(E)-5-[2-[2-(1H-тетразол-5-ил)этил]фенокси]пент-1-енил]фенил]бензолсульфонамид
Триметилсилилазид (44,0 мг) и оксид дибутилолова (24,0 мг) добавляли к раствору соединения, полученного в примере 95(3) (43,0 мг) в толуоле (0,5 мл), и полученный раствор перемешивали при 100°C в течение ночи. Реакционный раствор очищали колоночной хроматографией на силикагеле (гексан:этилацетат:метанол=50:50:3 → 0:100:3). Тем самым получали указанное в заголовке соединение (15,0 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 1,92-1,99, 2,34-2,39, 3,11-3,15, 3,30-3,34, 4,02, 6,20, 6,30, 6,83-6,90, 7,30-7,22, 7,39-7,43, 7,49-7,53, 7,76-7,78.
[0427]
Пример 95(5): изобутил-(E)-(3-(5-(2-(3-амино-3-оксопропил)фенокси)пент-1-ен-1-ил)фенил)(фенилсульфонил)карбамат
Триэтиламин (0,20 мл) и изобутилхлорформиат (110 мг) добавляли к раствору соединения, полученного в примере 84 (100 мг), в THF (1 мл) при охлаждении льдом, и реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Аммиак (28% водный раствор, 0,5 мл) добавляли к реакционному раствору при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор выливали в воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1 → 0:1). Тем самым получали указанное в заголовке соединение (120 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,11.
[0428]
Пример 95(6): N-[3-[(E)-5-[2-[2-(1H-1,2,4-триазол-5-ил)этил]фенокси]пент-1-енил]фенил]бензолсульфонамид
N, N-диметилформамиддиметилацеталь (0,5 мл) добавляли к раствору соединения, полученного в примере 95(5) (120 мг) в DMF (0,2 мл), и полученный раствор перемешивали при 100°C в течение 4 ч. Реакционный раствор концентрировали при пониженном давлении, затем к раствору добавляли уксусную кислоту (1 мл) и гидразинмоногидрат (0,1 мл), и полученный раствор перемешивали при 100°C в течение 3 ч. Раствор охлаждали до комнатной температуры, затем к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1 → 0:1). 2 М водный раствор гидроксида натрия (0,2 мл) добавляли к раствору полученного остатка (48 мг) в метаноле (1 мл), и полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь нейтрализовали 1 М водным раствором дигидрофосфата натрия и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат:метанол=50:50:3 → 0:100:3). Тем самым получали указанное в заголовке соединение (24,0 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,90;
1H-ЯМР (CDCl3): δ 1,95-2,02, 2,38-2,43, 3,08-3,18, 4,04, 6,22, 6,32, 6,84-6,89, 6,94-6,97, 7,02, 7,07-7,21, 7,39-7,43, 7,49-7,53, 7,67, 7,75-7,77, 8,04.
[0429]
Пример 96: изопропил-(E)-3-(2-((4-гидрокси-6-(3-(фенилсульфонамид)фенил)гекс-5-ен-1-ил)окси)фенил)пропанoат
Проводили те же самые предусмотренные процедуры, что и в примере 2 → примере 3 → примере 4 → примере 5 → примере 7 → примере 8 → примере 10, используя вместо 2-(2-бромэтил)-1,3-диоксана, применявшегося в примере 2, 2-(3-бромпропил)-1,3-диоксан. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,43 (гексан:этилацетат=1:1).
[0430]
Пример 97: 3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 96. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,82-1,95, 2,67-2,71, 2,98-3,02, 3,97-4,04, 4,36-4,40, 6,20, 6,52, 6,83, 6,87-6,91, 7,00-7,04, 7,10-7,21, 7,40-7,45, 7,49-7,54, 7,66, 7,78-7,81.
[0431]
Пример 98: изопропил-(R, E)-3-(2-((4-гидрокси-6-(3-(фенилсульфонамидо)фенил)гекс-5-ен-1-ил)окси)фенил)пропанoат или изопропил-(S, E)-3-(2-((4-гидрокси-6-(3-(фенилсульфонамидо)фенил)гекс-5-ен-1-ил)окси)фенил)пропанoат
Соединение, полученное в примере 96, подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IC (20 мм × 250 мм), подвижная фаза: CO2:метанол=85:15, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). Оптически активные вещества примера 96, полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IC (10 мм × 250 мм), подвижная фаза: CO2:метанол=85:15, скорость потока: 30 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). В результате, время удерживания для первого пика и второго пика составило 13,6 мин и 15,8 мин, соответственно.
[0432]
Пример 99: (R)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енокси]фенил]пропановая кислота или (S)-3-[2-[(E)-6-[3-(бензолсульфонамид)фенил]-4-гидроксигекс-5-енокси]фенил]пропановая кислоота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, оптически активное вещество, соответствующее первому пику, которое было получено в примере 98. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,82-1,95, 2,67-2,71, 2,98-3,02, 3,97-4,04, 4,36-4,40, 6,20, 6,52, 6,83, 6,87-6,91, 7,00-7,04, 7,10-7,21, 7,40-7,45, 7,49-7,54, 7,66, 7,78-7,81.
[0433]
Пример 100: (R)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енокси]фенил]пропановая кислота или (S)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, оптически активное вещество, соответствующее второму пику, которое было получено в примере 98. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,82-1,95, 2,67-2,71, 2,98-3,02, 3,97-4,04, 4,36-4,40, 6,20, 6,52, 6,83, 6,87-6,91, 7,00-7,04, 7,10-7,21, 7,40-7,45, 7,49-7,54, 7,66, 7,78-7,81.
[0434]
Пример 101: 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-гидроксигексокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 97. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CDCl3): δ 1,58-1,67, 1,72-2,00, 2,65-2,09, 2,93-3,07, 3,59-3,65, 3,95-4,05, 6,82-6,93, 6,98-7,01, 7,12-7,22, 7,40-7,45, 7,50-7,54, 7,77-7,80.
[0435]
Пример 102: (R)-3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-гидроксигексокси]фенил]пропановая кислота или (S)-3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-гидроксигексокси]фенил]пропановая кислота
Соединение, полученное в примере 101, подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IB (20 мм × 250 мм), подвижная фаза: CO2:ацетонитрил:метанол=80:18:2, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). Оптически активные вещества примера 101, полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IB (20 мм × 250 мм), подвижная фаза: CO2:ацетонитрил:метанол=80:18:2, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). В результате, время удерживания для первого пика и второго пика составило 9,6 мин и 12,3 мин, соответственно.
[0436]
Пример 103: 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-оксогексокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 78 → примере 79, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 78, соединение, полученное в примере 97. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,45 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,01-2,10, 2,61-2,75, 2,83, 2,96, 3,96, 6,78-6,82, 6,86-6,91, 6,96, 7,10, 7,14-7,21, 7,42, 7,51, 7,68-7,84.
[0437]
Примеры 104 (1) - (2)
Проводили те же самые предусмотренные процедуры, что и в примере 81 → примере 82 → примере 83 → примере 84, используя вместо изопропил-3-(2-гидроксифенил)пропанoата, применявшегося в примере 81, соответствующие фенольные соединения. Тем самым были получены следующие соединения примеров.
[0438]
Пример 104 (1): 2-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]уксусная кислота
Время удерживания ВЭЖХ (мин): 1,01;
1H-ЯМР (CDCl3): δ 1,89-1,96, 2,33-2,38, 3,67, 4,01, 6,14, 6,29, 6,68, 6,85-6,94, 7,00-7,28, 7,39-7,43, 7,48-7,52, 7,74-7,77.
[0439]
Пример 104(2): 4-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]бутановая кислота
Время удерживания ВЭЖХ (мин): 1,07;
1H-ЯМР (CDCl3): δ 1,93-2,00, 2,37-2,43, 2,70, 4,00, 6,21, 6,33, 6,82-6,92, 7,04-7,19, 7,40-7,44, 7,49-7,53, 7,75-7,78.
[0440]
Примеры 105 (1) - (3)
Проводили те же самые предусмотренные процедуры, что и в примере 81 → примере 82 → примере 83 → примере 84, используя вместо 5-хлор-1-пентина, применявшегося в примере 81, соответствующие галогенидные соединения. Тем самым были получены следующие соединения примеров.
[0441]
Пример 105(1): 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]бут-3-енокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 1,01;
1H-ЯМР (CD3OD): δ 2,52-2,56, 2,67-2,71, 2,88-2,92, 4,10-4,13, 6,31, 6,46, 6,86, 6,93-6,98, 7,09-7,20, 7,44-7,49, 7,52-7,57, 7,75-7,78.
[0442]
Пример 105(2): 3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]гекс-5-енокси]фенил]пропановая кислота
ТСХ: Rf 0,44 (гексан:этилацетат=1:1);
1H-ЯМР (CDCl3): δ 1,65-1,76, 1,77-1,88, 2,25-2,31, 2,69-2,75, 2,99-3,05, 3,99, 6,18, 6,33, 6,83, 6,89, 6,95-7,00, 7,10-7,21, 7,44, 7,53, 7,67, 7,81.
[0443]
Пример 105(3): 3-[2-[(E)-7-[3-(бензолсульфонамидо)фенил]гепт-6-енокси]фенил]пропановая кислота
ТСХ: Rf 0,44 (гексан:этилацетат=1:1);
1H-ЯМР (CDCl3): δ 1,61-1,73, 1,77-1,88, 2,27, 2,76-2,82, 3,02-3,07, 4,01, 6,29-6,33, 6,83-6,93, 7,08-7,23, 7,45, 7,53, 7,84, 8,75.
[0444]
Пример 106: метил-3-(2-((4-гидрокси-5-(3-(фенилсульфонамидо)фенил)пентил)окси)фенил)пропанoат
Соединение, полученное в примере 84 (200 мг), растворяли в этилацетате (1 мл). К реакционному раствору добавляли метанол (1 мл) и триметилсилилдиазометан (2 М раствор в гексане, 0,3 мл) и полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении, и полученный остаток растворяли в дихлорметане (2 мл). К раствору добавляли насыщенный водный раствор бикарбоната натрия (2 мл) и м-хлорпероксибензойную кислоту (171 мг), и полученный раствор перемешивали при комнатной температуре в течение 5 ч. К реакционному раствору добавляли насыщенный водный раствор тиосульфата натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Остаток растворяли в метаноле (2 мл), затем к раствору добавляли 5% палладий на угле (20 мг), и полученный раствор перемешивали при комнатной температуре в течение 3 ч в атмосфере водорода. Реакционный раствор фильтровали, фильтрат концентрировали при пониженном давлении, и полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=70:30 → этилацетат). Тем самым получали указанное в заголовке соединение (53 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,31 (гексан:этилацетат=1:1).
[0445]
Пример 107: 3-[2-[5-[3-(бензолсульфонамидо)фенил]-4-гидроксипентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 106. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,60 (этилацетат);
1H-ЯМР (CDCl3): δ 1,50-1,68, 1,68-1,74, 1,77-2,00, 2,61-2,70, 2,72-2,79, 2,92-2,99, 3,87, 3,95-4,05, 6,82-7,03, 7,15-7,21, 7,38-7,45, 7,48-7,53, 7,77.
[0446]
Пример 108: этил-3-(2-(4-оксобутил)фенил)пропанoат
Гидрокарбонат натрия (0,56 г) и 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он (регистрационный номер CAS: 87413-09-0) (1,13 г) добавляли к раствору этил-3-[2-(4-гидроксибутил)фенил]пропанoата (регистрационный номер CAS: 864677-94-1) (0,56 г) в дихлорметане (9 мл) при 0°C, и полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор затем экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором тиосульфата натрия, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (0,34 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,30 (гексан:этилацетат=4:1).
[0447]
Пример 109: 3-[2-[(E)-6-[3-(бензолсульфонамид)фенил]-4-гидроксигекс-5-енил]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 4 → примере 5 → примере 7 → примере 8 → примере 10 → примере 11, используя вместо изопропил-3-(2-(3-оксопропокси)фенил)пропанoата, применявшегося в примере 4, соединение, полученное в примере 108. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 1,60-1,79, 2,66-2,72, 2,97-3,01, 4,30-4,35, 6,16, 6,49, 6,98-7,07, 7,13-7,17, 7,40-7,53, 7,77-7,79.
[0448]
Пример 110: (R)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановая кислота или (S)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановая кислота
[0449]
[Формула 53]
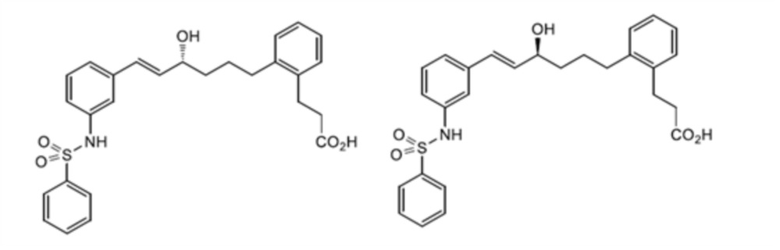
[0450]
Соединение, полученное в примере 109, подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IC (20 мм × 250 мм), подвижная фаза: CO2:метанол=85:15, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). Оптически активные вещества примера 109, полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IC (10 мм × 250 мм), подвижная фаза: CO2:метанол=85:15, скорость потока: 30 мл/мин; давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°С). В результате, время удерживания для первого пика и второго пика составило 12,4 мин и 14,4 мин, соответственно.
[0451]
Пример 111: 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-гидроксигексил]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 109. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CD3OD): δ 1,37-1,61, 2,39-2,58, 2,84, 6,79-6,81, 6,98-7,08, 7,30-7,42, 7,61-7,63.
[0452]
Пример 112: 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-оксогексил]фенил]пропановая кислота
[0453]
[Формула 54]
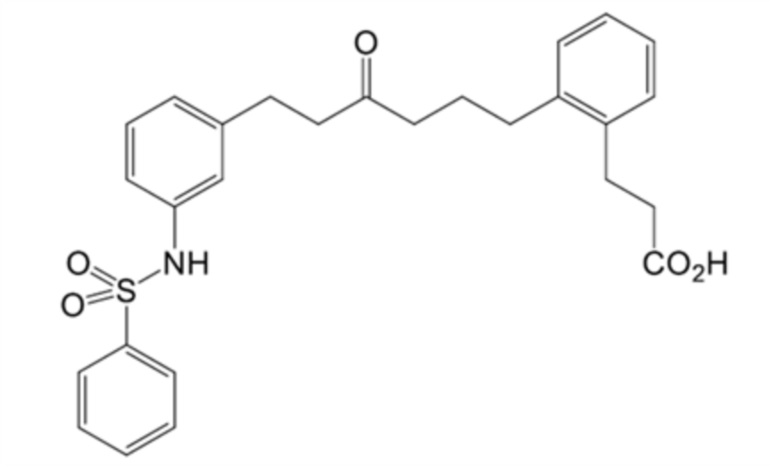
[0454]
Проводили те же самые предусмотренные процедуры, что и в примере 78 → примере 79, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 78, соединение, полученное в примере 109. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 1,75-1,83, 2,44-2,47, 2,54-2,61, 2,65-2,69, 2,75-2,79, 2,92-2,96, 6,90-6,94, 7,09-7,14, 7,18, 7,43-7,48, 7,54, 7,74-7,76.
[0455]
Пример 113: Изопропил-3-(2-((5-(3-(фенилсульфонамидо)фенил)пент-4-ин-1-ил)окси)фенил)пропанoат
Триэтиламин (6 мл), бис(трифенилфосфин)палладий (II) дихлорид (100 мг) и йодид меди (I) (50 мг) добавляли к раствору соединения, полученного в примере 81 (1,5 г), и полученного соединения в примере 9 (1,7 г) в DMF (6 мл), и полученный раствор перемешивали при 60°C в течение ночи. К реакционному раствору добавляли воду, затем полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом магния и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1 → 0:1). Тем самым получали указанное в заголовке соединение (1,57 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,39 (гексан:этилацетат=2:1).
[0456]
Пример 114: 3-[2-[5-[3-(бензолсульфонамидо)фенил]пент-4-инокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 113. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CD3OD): δ 2,06-2,12, 2,55-2,59, 2,64-2,67, 2,92-2,96, 4,13-4,16, 6,87, 6,95, 7,03-7,07, 7,12-7,20, 7,45-7,50, 7,56, 7,74-7,77.
[0457]
Пример 115: изопропил-(R)-3-(2-((5-(3-(фенилсульфонамидо)фенил)-3-((триметилсилил)окси)пент-4-ин-1-ил)окси)фенил)пропанoат
Проводили ту же самую предусмотренную процедуру, что и в примере 113, используя вместо изопропил-3-(2-(пент-4-ин-1-ил окси)фенил)пропанoата, применявшегося в примере 113, соединение, полученное в примере 7. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,12.
[0458]
Пример 116: изопропил-(R)-3-(2-((3-гидрокси-5-(3-(фенилсульфонамид)фенил)пент-4-ин-1-ил)окси)фенил)пропанoат
TBAF (1,0 M раствор в THF, 0,48 мл) добавляли к раствору соединения, полученного в примере 115 (170 мг) в THF (1 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 20 мин. Реакционный раствор очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3 → гексан:этилацетат=1:1). Тем самым получали указанное в заголовке соединение (82,8 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,12.
[0459]
Пример 117: 3-[2-[(3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-инокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 116. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,93;
1H-ЯМР (CD3OD): δ 2,19-2,30, 2,57-2,60, 2,91-2,95, 4,16-4,26, 4,85, 6,88, 6,96, 7,07-7,22, 7,46-7,51, 7,57, 7,75-7,77.
[0460]
Пример 118: 3-[2-[5-[3-(бензолсульфонамидо)фенил]пентокси]фенил]пропановая кислота
[0461]
[Формула 55]
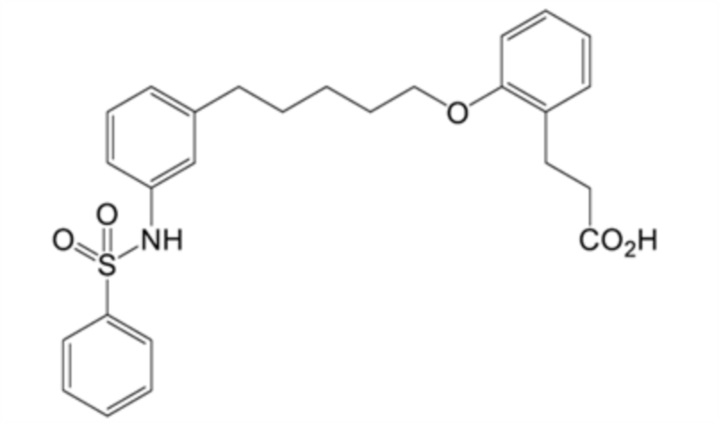
[0462]
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 114. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,42 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 1,42-1,49, 1,58-1,65, 1,75-1,82, 2,55, 2,67, 2,95, 3,95, 6,80-6,97, 7,10-7,21, 7,27, 7,40, 7,49, 7,76.
[0463]
Пример 119: изопропил-(Z)-3-(2-((5-(3-(фенилсульфонамидо)фенил)пент-4-ен-1-ил)окси)фенил)пропанoат
Катализатор Линдлара (содержащий палладий в количестве 5% масс.) (10,0 мг) и хинолин (12,8 мг) добавляли к раствору соединения, полученного в примере 113 (100 мг), в этилацетате (10 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 5 ч в атмосфере водорода. Реакционный раствор очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:3 → 1:1). Тем самым получали указанное в заголовке соединение (92,3 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,23.
[0464]
Пример 120: 3-[2-[(Z)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 119. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CD3OD): δ 1,89-1,95, 2,37-2,43, 2,49-2,53, 2,83-2,87, 3,97-4,00, 5,74, 6,38, 6,83-6,89, 6,96-7,02, 7,13-7,19, 7,41-7,45, 7,51, 7,72-7,76.
[0465]
Пример 121: 3-[2-[(Z,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 119 → примере 11, используя вместо изопропил-3-(2-((5-(3-(фенилсульфонамид)фенил)пент-4-ин-1-ил)окси)фенил)пропанoата, применявшегося в примере 119, соединение, полученное в примере 116. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,92;
1H-ЯМР (CD3OD): δ 2,00-2,07, 2,44-2,48, 2,77-2,80, 4,02, 4,11, 4,75, 5,72, 6,46,6,83-6,88, 6,92-7,04, 7,12-7,18, 7,42-7,47, 7,52, 7,74-7,77.
[0466]
Пример 122: этил-(E)-3-(2-(3-(бензилокси)-2-гидроксипропокси)фенил)акрилат
Простой бензилглицидиловый эфир (6,57 г) добавляли к раствору этил-(E)-3-(2-гидроксифенил)проп-2-еноата (регистрационный номер CAS: 6236-62-0) (1,92 г) и диизопропилэтиламина (0,69 мл) в гексаметилфорфорамиде (20 мл), и реакционную смесь перемешивали при 80°С в течение 19 ч. Реакционный раствор охлаждали до комнатной температуры, затем выливали в воду и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1). Тем самым получали указанное в заголовке соединение (2,66 г), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,33 (гексан:этилацетат=2:1).
[0467]
Пример 123: этил-(E)-3-(2-(3-(бензилокси)-2-((трет-бутилдиметилсилил)окси)пропокси)фенил)акрилат
Трет-бутилдиметилсилилхлорид (330 мг) добавляли к раствору соединения, полученного в примере 122 (300 мг), и имидазола (200 мг) в DMF (3 мл) при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=9:1). Тем самым получали указанное в заголовке соединение (380 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,41 (гексан:этилацетат=9:1).
[0468]
Пример 124: этил-3-(2-(2-((трет-бутилдиметилсилил)окси)-3-гидроксипропокси)фенил)пропанoат
Раствор соединения, полученного в примере 123 (380 мг), и 5% палладия на угле (50% увлажнение, 180 мг) в этаноле (8 мл) перемешивали при комнатной температуре в течение 1,5 ч в атмосфере водорода. Реакционную смесь фильтровали через целит (торговое наименование), и фильтрат концентрировали. Тем самым получали указанное в заголовке соединение (290 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,34 (гексан:этилацетат=4:1).
[0469]
Пример 125: этил-3-(2-(2-((трет-бутилдиметилсилил)окси)-3-оксопропокси)фенил)пропанoат
1,1,1-Триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он (390 мг) добавляли к раствору соединения, полученного в примере 124 (290 мг), и гидрокарбоната натрия (190 мг) в метиленхлориде (3 мл) при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали метиленхлоридом. Органический слой промывали насыщенным водным раствором тиосульфата натрия, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (250 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,40 (гексан:этилацетат=4:1).
[0470]
Пример 126: этил-(E)-3-(2-((2-гидрокси-4-(3-(фенилсульфонамидо)фенил)бут-3-ен-1-ил)окси)фенил)пропанoат
Проводили те же самые предусмотренные процедуры, что и в примере 45 → примере 55 → примере 56 → примере 116, используя вместо (R)-4-((4-метоксибензил)окси)-1-оксобутан-2-илбензоата, применявшегося в примере 45, соединение, полученное в примере 125. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,43 (гексан:этилацетат=1:1).
[0471]
Пример 127: 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]-2-гидроксибут-3-енокси]фенил]пропановая кислота
[0472]
[Формула 56]

[0473]
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 126. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 2,59-2,72, 2,93-3,08, 4,00, 4,17, 4,68-4,72, 6,40, 6,64, 6,84, 6,90-6,94, 7,03-7,07, 7,13-7,22, 7,38-7,52, 7,76-7,79.
[0474]
Пример 128: этил-(S, E)-3-(2-((2-гидрокси-4-(3-(фенилсульфонамидо)фенил)бут-3-ен-1-ил)окси)фенил)пропанoат или этил-(R, E)-3-(2-((2-гидрокси-4-(3-(фенилсульфонамид)фенил)бут-3-ен-1-ил)окси)фенил)пропанoат
Соединение, полученное в примере 126, подвергали оптическому разделению с использованием СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IB (20 мм × 250 мм), подвижная фаза: CO2:2-пропанол=83:17, скорость потока: 100 мл/мин; давление: 120 бар (12 МПа), длина волны: 220 нм, температура колонки: 35°С). Оптически активные вещества примера 126, полученные в условиях оптического разделения, анализировали с помощью СФХ (используемая колонка: Daicel Corporation, CHIRALPAK-IB (10 мм × 250 мм), подвижная фаза: CO2:2-пропанол=83:17, скорость потока: 30 мл/мин; давление: 100 бар (10 МПа), длина волны: 220 нм, температура колонки: 35°С). В результате, время удерживания для первого пика и второго пика составило 12,6 мин и 14,6 мин, соответственно.
[0475]
Пример 129: 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]-2-гидроксибут-3-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, оптически активное вещество, соответствующее первому пику, которое было получено в примере 128. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 2,59-2,72, 2,93-3,08, 4,00, 4,17, 4,68-4,72, 6,40, 6,64, 6,84, 6,90-6,94, 7,03-7,07, 7,13-7,22, 7,38-7,52, 7,76-7,79.
[0476]
Пример 130: 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]-2-гидроксибут-3-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, оптически активное вещество, соответствующее второму пику, которое было получено в примере 128. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 2,59-2,72, 2,93-3,08, 4,00, 4,17, 4,68-4,72, 6,40, 6,64, 6,84, 6,90-6,94, 7,03-7,07, 7,13-7,22, 7,38-7,52, 7,76-7,79.
[0477]
Пример 131: N-(3-бромфенил)-N-(фенилсульфонил)бензолсульфонамид
Триэтиламин (1,6 мл), DMAP (177 мг) и ангидрид бензолсульфоновой кислоты (1,9 г) добавляли к раствору 3-броманилина (500 мг) в дихлорметане (10 мл), и полученный раствор перемешивали при комнатной температуре в течение 18 ч. К реакционной смеси добавляли воду, и полученный раствор экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (950 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,30 (гексан:этилацетат=4:1).
[0478]
Пример 132: N-(3-(4-гидроксибут-1-ин-1-ил)фенил)-N-(фенилсульфонил)бензолсульфонамид
Триэтиламин (1,5 мл), 3-бутин-1-ол (220 мг), йодид меди (40 мг) и бис(трифенилфосфинпалладий) дихлорид (147 мг) добавляли к раствору соединения, полученного в примере 131 (949 мг) в DMF (4 мл), и полученный раствор перемешивали при 80°C в течение 2 ч. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=2:1). Тем самым получали указанное в заголовке соединение (771 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,30 (гексан:этилацетат=2:1).
[0479]
Пример 133: N-(3-(4-гидроксибутил)фенил)-N-(фенилсульфонил)бензолсульфонамид
Раствор соединения, полученного в примере 132 (600 мг), и 20% гидроксида палладия на угле (50% увлажнение, 150 мг) в метаноле (5 мл) перемешивали при комнатной температуре в течение 9 ч в атмосфере водорода. Реакционную смесь фильтровали через целит (торговое наименование), и фильтрат концентрировали. Тем самым получали указанное в заголовке соединение (575 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00.
[0480]
Пример 134: 3-[3-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]пропановая кислота
Метил-3-(3-гидроксифенил)пропаноат (22 мг), DIAD (82 мг) и трифенилфосфин (40 мг) добавляли к раствору соединения, полученного в примере 133 (45 мг) в THF (0,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. 5 н. водный раствор гидроксида натрия (0,4 мл) добавляли к раствору полученного остатка в метаноле (0,5 мл) и 1,2-диметоксиэтане (0,5 мл), и полученный раствор перемешивали при 45°C в течение 19 ч. К реакционной смеси добавляли 2 М соляную кислоту и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1). Тем самым получали указанное в заголовке соединение (14 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97;
1H-ЯМР (CDCl3): δ 1,66-1,75, 2,61, 2,74, 2,94, 3,94, 6,71-6,73, 6,79-6,86, 6,91-7,00, 7,14, 7,21, 7,37-7,41, 7,47-7,52, 7,72-7,74.
[0481]
Примеры 135 (1) - (6)
Проводили ту же самую предусмотренную процедуру, что и в примере 134, используя вместо метил-3-(3-гидроксифенил)пропанoата, применявшегося в примере 134, соответствующие фенольные соединения. Тем самым были получены следующие соединения примеров.
[0482]
Пример 135(1): 3-[4-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,96;
1H-ЯМР (CD3OD): δ 1,64-1,74, 2,55-2,61, 2,86, 3,91, 6,80-6,84, 6,92-6,94, 7,11-7,15, 7,42-7,46, 7,50-7,54, 7,73-7,76.
[0483]
Пример 135(2): 4-[2-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]бутановая кислота
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 1,77-1,83, 1,96-2,03, 2,48, 2,60, 2,71-2,75, 3,97, 6,82, 6,87-6,90, 7,05-7,07, 7,11-7,20, 7,39-7,43, 7,47-7,52, 7,78-7,81.
[0484]
Пример 135(3): 4-[3-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]бутановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 1,70-1,74, 1,95-2,02, 2,40, 2,59, 2,65, 3,93, 6,71-6,78, 6,86, 6,93-6,95, 7,12-7,21, 7,39-7,43, 7,48-7,52, 7,74-7,77.
[0485]
Пример 135(4): 2-[2-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]уксусная кислота
Время удерживания ВЭЖХ (мин): 0,94;
1H-ЯМР (CDCl3): δ 1,68-1,72, 2,57, 3,65, 3,96, 6,80-6,94, 7,13, 7,21-7,24, 7,37-7,42, 7,47-7,52, 7,74-7,77.
[0486]
Пример 135(5): 2-[3-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]уксусная кислота
Время удерживания ВЭЖХ (мин): 0,95;
1H-ЯМР (CDCl3): δ 1,74-1,77, 2,57-2,60, 3,66, 3,98, 6,83-6,86, 6,91-6,96, 7,11, 7,19-7,26, 7,36-7,43, 7,48-7,52, 7,75-7,78.
[0487]
Пример 135(6): 3-[2-[4-[3-(бензолсульфонамидо)фенил]бутокси]фенил]пропановая кислота
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (CDCl3): δ 1,70-1,86, 2,61, 2,66-2,70, 2,97-3,01, 3,97, 6,82, 6,87-6,91, 7,03-7,06, 7,12-7,21, 7,40-7,44, 7,48-7,53, 7,60, 7,78-7,81.
[0488]
Пример 136: изопропил-(E)-3-(2-((5-(3-нитрофенил)-3-оксопент-4-ен-1-ил)окси)фенил)пропанoат
Проводили те же самые предусмотренные процедуры, что и в примере 10 → примере 77, используя вместо N-(3-бромфенил)бензолсульфонамида, применявшегося в примере 10, 3-бромнитробензол. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,43 (гексан:этилацетат=2:1).
[0489]
Пример 137: изопропил-(E)-3-(2-((3,3-дифтор-5-(3-нитрофенил)пент-4-ен-1-ил)окси)фенил)пропанoат
Соединение, полученное в примере 136 (205 мг), растворяли в дихлорметане (0,4 мл), затем к раствору добавляли трифторид бис-(2-метоксиэтил)аминосеры (1,5 мл), и полученный раствор перемешивали при комнатной температуре в течение 3 дней. Реакционный раствор выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом магния и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=90:10 → этилацетат). Тем самым получали указанное в заголовке соединение (29 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,66 (гексан:этилацетат=2:1).
[0490]
Пример 138: 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]-3,3-дифторпент-4-енокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 55 → примере 56 → примере 11, используя вместо (R, E)-5-(2-((E)-3-метокси-3-оксопроп-1-ен-1-ил)фенокси)-1-(3-нитрофенил)пент-1-ен-3-илбензоата, применявшегося в примере 55, соединение, полученное в примере 137. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,22 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,50-2,62, 2,72, 2,93, 4,20, 6,30, 6,80-6,95, 7,05, 7,12-7,25, 7,43, 7,53, 7,78, 7,89.
[0491]
Пример 139: 3-[2-[5-[3-(бензолсульфонамидо)фенил]-3,3-дифторпентокси]фенил]пропановая кислота
[0492]
[Формула 57]
[0493]
Проводили ту же самую предусмотренную процедуру, что и в примере 33, используя вместо 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановой кислоты, применявшейся в примере 33, соединение, полученное в примере 138. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,20 (гексан:этилацетат=1:2);
1H-ЯМР (CDCl3): δ 2,14-2,47, 2,67-2,74, 2,76-2,84, 2,88-2,98, 4,13-4,21, 6,79-6,88, 6,89-7,07, 7,11-7,25, 7,42, 7,52, 7,79.
[0494]
Пример 140: (S)-5-((2-(2,2-диметил-1,3-диоксолан-4-ил)этил)тио)-1-фенил-1H-тетразол
1-Фенил-1H-тетразол-5-тиол (регистрационный номер CAS: 86-93-1) (3,66 г), трифенилфосфин (5,38 г) и DIAD (1,10 г) добавляли к раствору 2-[(S)-2,2-диметил-1,3-диоксолан-4-ил]этанола (регистрационный номер CAS: 32233-43-5) (2,00 г) в THF (25 мл) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 1 ч. Реакционный раствор концентрировали при пониженном давлении и затем очищали хроматографией на колонке с силикагелем (гексан:этилацетат=7:1 → 2:1). Тем самым получали указанное в заголовке соединение (4,14 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97.
[0495]
Пример 141: (S)-5-((2-(2,2-диметил-1,3-диоксолан-4-ил)этил)сульфонил)-1-фенил-1H-тетразол
Тетрагидрат молибдата аммония (1,57 г) и 30% масс. водного раствора перекиси водорода (8,3 мл) добавляли к раствору соединения, полученного в примере 140 (4,14 г), в ацетонитриле (15 мл) и этаноле (15 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 16 ч. Реакционный раствор концентрировали при пониженном давлении, и полученный водный слой экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток растворяли в 2,2-диметоксипропане (8,3 мл), затем к раствору добавляли моногидрат п-толуолсульфоновой кислоты (129 мг) при комнатной температуре, и полученный раствор перемешивали при той же температуре в течение 1 ч. Реакционный раствор разбавляли этилацетатом, и полученный раствор промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:1 → 2:1). Тем самым получали указанное в заголовке соединение (3,96 г), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,96.
[0496]
Пример 142: (S, E)-N-(3-(4,5-дигидроксипент-1-ен-1-ил)фенил)бензолсульфонамид
Бис(триметилсилил)амид калия (0,5 М раствор в толуоле, 15,3 мл) добавляли к раствору соединения, полученного в примере 141 (1,04 г), в 1,2-диметоксиэтане (15 мл) при -78°C, и полученный раствор перемешивали при той же температуре в течение 10 мин. Раствор N-(3-формилфенил)бензолсульфонамида (регистрационный номер CAS: 151721-35-6) (800 мг) в 1,2-диметоксиэтане (5 мл) добавляли к реакционному раствору при -78°C, и полученный раствор перемешивали при комнатной температуре в течение 1 ч. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:1). Полученный остаток растворяли в метаноле (3 мл), затем к раствору добавляли 2 M соляную кислоту (3 мл) при комнатной температуре, и полученный раствор перемешивали при 50°C в течение 30 мин. Реакционный раствор охлаждали льдом, затем нейтрализовали 2 М водным раствором гидроксида натрия и экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:0 → 9:1). Тем самым получали указанное в заголовке соединение (675 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,73.
[0497]
Пример 143: (S, E)-1-гидрокси-5-(3-(фенилсульфонамид)фенил)пент-4-ен-2-илбензоат
Трет-бутилдиметилхлорсилан (0,7 М раствор в DMF, 2 мл) добавляли по каплям к раствору соединения, полученного в примере 142 (450 мг), и имидазола (131 мг) в DMF (5 мл) в течение 5 мин при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 24 ч. Реакционный раствор охлаждали льдом, затем к раствору добавляли имидазол (131 мг) и трет-бутилдиметилхлорсилан (213 мг), и полученный раствор перемешивали при комнатной температуре в течение 5 ч. К реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (5 мл), и затем к раствору добавляли пиридин (0,42 мл), бензоилхлорид (215 мг) и DMAP (15,7 мг) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч. Реакционный раствор охлаждали льдом, затем к раствору добавляли бензоилхлорид (215 мг), и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:1 → 2:1). Полученный остаток растворяли в THF (3 мл) и уксусной кислоте (0,30 мл), затем к раствору добавляли TBAF (1,0 М раствор в THF, 1,6 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 12 ч. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:1 → 2:1). Тем самым получали указанное в заголовке соединение (292 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,97.
[0498]
Пример 144: (S, E)-1-йод-5-(3-(фенилсульфонамидо)фенил)пент-4-ен-2-илбензоат
Имидазол (68,6 мг) и трифенилфосфин (106 мг) добавляли к раствору соединения, полученного в примере 143 (147 мг), в DMF (1 мл) при комнатной температуре. К реакционному раствору при охлаждении льдом добавляли йод (102 мг), и полученный раствор перемешивали при 50°C в течение 1,5 ч. Реакционный раствор охлаждали льдом, затем к раствору добавляли трифенилфосфин (26,0 мг) и йод (25,0 мг), и полученный раствор перемешивали при 50°C в течение 30 мин. Реакционный раствор очищали колоночной хроматографией на силикагеле (гексан:этилацетат=7:1 → 3:2). Тем самым получали указанное в заголовке соединение (121 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,20.
[0499]
Пример 145: (S, E)-1-(2-(3-изопропокси-3-оксопропил)фенокси)-5-(3-(фенилсульфонамид)фенил)пент-4-ен-2-илбензоат
Гидрид натрия (60% в минеральном масле, 13,1 мг) добавляли к раствору соединения, полученного в примере 1 (68,4 мг), в DMF (0,5 мл) при охлаждении льдом, и полученный раствор перемешивали при комнатной температуре в течение 15 мин. Раствор соединения, полученного в примере 144 (60 мг), в DMF (0,5 мл) добавляли к реакционному раствору при комнатной температуре, и полученный раствор перемешивали при 60°C в течение 2 ч. Реакционный раствор охлаждали до комнатной температуры и затем очищали хроматографией на колонке с силикагелем (гексан: этилацетат=7:1 → 3:2). Тем самым получали указанное в заголовке соединение (12,1 мг), имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,29.
[0500]
Пример 146: 3-[2-[(E,2S)-5-[3-(бензолсульфонамидо)фенил]-2-гидроксипент-4-енокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 57, используя вместо (R, E)-5-(2-((E)-3-метокси-3-оксопроп-1-ен-1-ил)фенокси)-1-(3-(фенилсульфонамид)фенил)пент-1-ен-3-илбензоата, применявшегося в примере 57, соединение, полученное в примере 145. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,95
1H-ЯМР (CD3OD): δ 2,50, 2,59-2,65, 2,95-2,99, 3,95-4,02, 4,09, 6,29, 6,43, 6,86-6,96, 7,08-7,10, 7,12-7,20, 7,44-7,48, 7,54, 7,75-7,77.
[0501]
Пример 147: 2-(3-нитрофенэтокси)уксусная кислота
Раствор 2-(3-нитрофенил)этанола (регистрационный номер CAS: 52022-77-2) (2,00 г) в DMF (4 мл) охлаждали до 0°C, затем гидрид натрия (60% в минеральном масле, 0,7 г) добавляли к раствору, и полученный раствор перемешивали при 0°C в течение 15 мин. К раствору по каплям добавляли изопропилбромацетат (2,6 г), и полученный раствор перемешивали при 0°C в течение 1 ч, и затем при комнатной температуре в течение 2 ч. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 2:1). Тем самым получали сложноэфирное соединение (1,80 г). Сложноэфирное соединение растворяли в метаноле (15 мл), затем к раствору добавляли гидроксид натрия (2 н. водный раствор, 10 мл), и полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 2 М соляную кислоту, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (1,15 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 3,05-3,07, 3,84-3,87, 4,14, 7,48, 7,58-7,60, 8,09-8,14.
[0502]
Пример 148: 2-(3-нитрофенэтокси)этан-1-ол
Раствор соединения, полученного в примере 147 (1,15 г), и 4-метилморфилина (0,8 мл) в THF (10 мл) охлаждали до 0°C, и затем к раствору по каплям добавляли изобутилхлорформиат (0,8 мл). Полученный раствор перемешивали при комнатной температуре в течение 30 мин для получения белого твердого вещества, и белое твердое вещество отфильтровывали. Фильтрат охлаждали до 0°C, затем к фильтрату добавляли боргидрид натрия (1,15 г), затем полученный раствор перемешивали при 0°C в течение 10 мин, затем к раствору добавляли небольшое количество воды, и полученный раствор перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (1,15 г), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 1,82, 3,00-3,03, 3,56-3,58, 3,69-3,78, 7,47, 7,56-7,58, 8,07-8,13.
[0503]
Пример 149: 3-[2-[2-[2-[3-(бензолсульфонамидо)фенил]этокси]этокси]фенил]пропановая кислота
[0504]
[Формула 58]
[0505]
Проводили те же самые предусмотренные процедуры, что и в примере 54 → примере 55 → примере 56 → примере 11, используя соединение, полученное в примере 148, вместо (R, E)-5-гидрокси-1-(3-нитрофенил)пент-1-ен-3-илбензоата, применявшегося в примере 54, и используя соединение, полученное в примере 1, вместо метил-(E)-3-(2-гидроксифенил)проп-2-еноата, применявшегося в примере 54. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 0,99;
1H-ЯМР (ДМСО-d6): δ 2,70-2,80, 3,17-3,18, 3,56-3,60, 3,68-3,71, 4,05-4,08, 6,84-6,96, 7,09-7,19, 7,50-7,60, 7,74-7,76.
[0506]
Пример 150: трет-бутил-(S)-2-(3-(1-гидрокси-2-фенилэтил)фенил)ацетат
Бром-(2-трет-бутокси-2-оксоэтил)цинк (0,5 М раствор в THF, 9 мл) и бис(три-трет-бутилфосфин)палладий (76 мг) добавляли к раствору (1S)-1-(3-бромфенил)-2-фенилэтанола (412 мг) в THF (0,5 мл), и полученный раствор перемешивали при 70°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (296 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,40 (гексан:этилацетат=4:1).
[0507]
Пример 151: трет-бутил-2-(3-((1S)-2-фенил-1-((тетрагидро-2H-пиран-2-ил)окси)этил)фенил)ацетат
3,4-Дигидро-2H-пиран (239 мг) и 4-толуолсульфонат пиридиния (71 мг) добавляли к раствору соединения, полученного в примере 150 (296 мг), в дихлорметане (2 мл), и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (341 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,60 (гексан:этилацетат=4:1).
[0508]
Пример 152: 2-(3-((1S)-2-фенил-1-((тетрагидро-2H-пиран-2-ил)окси)этил)фенил)этан-1-ол
Воду (0,15 мл) и боргидрид лития (187 мг) добавляли к раствору соединения, полученного в примере 151 (341 мг) в THF (4 мл), и полученный раствор перемешивали при 40°C в течение 16 ч. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1). Тем самым получали указанное в заголовке соединение (236 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,50 (гексан:этилацетат=1:1).
[0509]
Пример 153: трет-бутил-2-(3-((1S)-2-фенил-1-((тетрагидро-2H-пиран-2-ил)окси)этил)фенэтокси)ацетат
Трет-бутилбромацетат (424 мг) и гидрид натрия (60% в минеральном масле, 87 мг) добавляли к раствору соединения, полученного в примере 152 (236 мг) в DMF (2 мл), и полученный раствор перемешивали при комнатной температуре в течение 2,5 ч. К реакционной смеси добавляли насыщенный водный раствор хлорида натрия, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (250 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,60 (гексан:этилацетат=4:1).
[0510]
Пример 154: 2-(3-((1S)-2-фенил-1-((тетрагидро-2H-пиран-2-ил)окси)этил)фенэтокси)этан-1-ол
Воду (0,1 мл) и боргидрид лития (123 мг) добавляли к раствору соединения, полученного в примере 153 (250 мг) в THF (0,5 мл), и полученный раствор перемешивали при 40°C в течение 2,5 ч. К реакционной смеси добавляли воду, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=1:1). Тем самым получали указанное в заголовке соединение (107 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,30 (гексан:этилацетат=1:1).
[0511]
Пример 155: изопропил-(S)-3-(2-(2-(3-(1-гидрокси-2-фенилэтил)фенэтокси)этокси)фенил)пропанoат
Соединение, полученное в примере 1 (90 мг), трифенилфосфин (114 мг) и 1,1- (азодикарбонил)дипиперидин (110 мг), добавляли к раствору соединения, полученного в примере 154 (107 мг), в дихлорметане (1 мл), и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=5:1) с получением сложноэфирного соединения (181 мг). Воду (0,8 мл) и уксусную кислоту (3,2 мл) добавляли к раствору сложноэфирного соединения (181 мг) в THF (0,6 мл), и полученный раствор перемешивали при 50°C в течение 7 ч. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1). Тем самым получали указанное в заголовке соединение (97 мг), имеющее значения физических свойств, показанные ниже.
ТСХ: Rf 0,20 (гексан:этилацетат=4:1).
[0512]
Пример 156: 3-[2-[2-[2-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]этокси]этокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, соединение, полученное в примере 155. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,10;
1H-ЯМР (CDCl3): δ 2,59-2,63, 2,90-2,94, 3,00-3,03, 3,76-3,80, 3,84-3,86, 4,10-4,13, 4,88, 6,82, 7,13-7,21, 7,22-7,32.
[0513]
Пример 157: 3-[2-[2-[2-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]этокси]этокси]фенил]пропановая кислота
Проводили те же самые предусмотренные процедуры, что и в примере 150 → примере 151 → примере 152 → примере 153 → примере 154 → примере 155 → примере 11, используя вместо (1S)-1-(3-бромфенил)-2-фенил-этанола, применявшегося в примере 150, соединение, полученное в примере 21. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,00;
1H-ЯМР (CDCl3): δ 2,58-2,62, 2,90-2,95, 2,99-3,06, 3,77-3,81, 3,84-3,86, 4,10-4,13, 4,88, 6,82, 6,88, 7,13-7,21, 7,25-7,32.
[0514]
Пример 158: трет-бутил(транс-4-(3-гидроксипропил)циклогексил)карбамат
Раствор метил-транс-3-[4-(трет-бутоксикарбониламино)циклогексил]пропаноата (500 мг) в THF (5 мл) охлаждали до 0°C, затем раствор боргидрида лития (72,8 мг) в THF (1 мл) добавляли к раствору, и полученный раствор перемешивали при комнатной температуре в течение 15 мин, затем при 50°C в течение 3,5 ч. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (429 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,95-1,28, 1,44, 1,53-1,60, 1,75-1,78, 1,98-2,01, 2,27-2,31, 3,36, 3,62, 4,36.
[0515]
Пример 159: трет-бутил(транс-4-(3-оксопропил)циклогексил)карбамат
Раствор соединения, полученного в примере 158 (429 мг) в дихлорметане (8,3 мл), охлаждали до 0°C, затем к раствору добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он (848 мг), и полученный раствор перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (429 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,96-1,28, 1,44, 1,53-1,60, 1,62-1,75, 1,98-2,01, 2,42-2,46, 3,36, 4,38.
[0516]
Пример 160: этил(E)-5-(транс-4-((трет-бутоксикарбонил)амино)циклогексил)пент-2-еноат
Раствор этилдиэтилфосфоноацетата (747 мг) в THF (5 мл) охлаждали до 0°C, затем к раствору добавляли гидрид натрия (60% в минеральном масле, 145 мг), и полученный раствор перемешивали при 0°C в течение 15 мин. К реакционной смеси добавляли раствор соединения, полученного в примере 159 (429 мг) в THF (5 мл), и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 1:1). Тем самым получали указанное в заголовке соединение (270 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,95-1,38, 1,44, 1,53-1,59, 1,74-1,77, 1,98-2,01, 2,17-2,31, 3,36, 4,09-4,17, 4,35, 5,78-5,83, 6,91-7,00.
[0517]
Пример 161: этил-5-(транс-4-((трет-бутоксикарбонил)амино)циклогексил)пентаноат
Палладий на угле (54 мг) добавляли к раствору соединения, полученного в примере 160 (270 мг) в этаноле (10 мл), и полученный раствор перемешивали при комнатной температуре в течение 1,5 ч в атмосфере водорода. Реакционный раствор фильтровали через целит (торговое наименование), и фильтрат концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (282 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,95-1,38, 1,44, 1,53-1,59, 1,74-1,77, 1,98-2,01, 2,17-2,31, 3,36, 4,09-4,17, 4,35, 5,78-5,83, 6,91-7,00.
[0518]
Пример 162: трет-бутил(транс-4-(5-гидроксипентил)циклогексил)карбамат
Раствор соединения, полученного в примере 161 (282 мг) в THF (5 мл), охлаждали до 0°C, к раствору добавляли боргидрид лития (36 мг), и полученный раствор перемешивали при 50°C в течение 3 ч. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия, и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (270 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,92-1,32, 1,44, 1,53-1,60, 1,73-1,78, 1,98-2,01, 2,26-2,31, 3,36, 3,64, 4,36.
[0519]
Пример 163: 5-(транс-4-аминоциклогексил)пентaн-1-ол гидрохлорид
Хлористый водород (4,0 М раствор в диоксане, 6 мл) добавляли к соединению, полученному в примере 162 (140 мг), и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, и затем концентрировали. Тем самым получали указанное в заголовке соединение (180 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (ДМСО-d6): δ 0,88-0,97, 1,15-1,42, 1,73-1,76, 1,90-1,93, 2,91, 3,36-3,75, 7,86.
[0520]
Пример 164: 5-(транс-4-(фенилсульфонамид)циклогексил)пентилбензолсульфонат
Раствор соединения, полученного в примере 163 (180 мг), в пиридине (2 мл) и дихлорметане (2 мл) охлаждали до 0°C и затем к раствору добавляли DMAP (5 мг). К реакционному раствору по каплям добавляли бензолсульфонилхлорид (0,14 мл), и полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 1 М соляную кислоту и полученный раствор экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Тем самым получали указанное в заголовке соединение (180 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,84-0,89, 1,07-1,83, 3,04-3,09, 3,98-4,27, 7,51-8,07.
[0521]
Пример 165: изопропил-3-(2-((5-(транс-4-(фенилсульфонамид)циклогексил)пентил)окси)фенил)пропанoат
Карбонат цезия (377 мг) добавляли к раствору соединения, полученного в примере 164 (180 мг), в 1-метил-2-пирролидоне (2 мл), и реакционную смесь перемешивали при 50°С в течение 2 ч. Реакционную смесь выливали в воду, и полученный раствор экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, затем сушили над сульфатом натрия и далее концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=10:0 → 2:1). Тем самым получали указанное в заголовке соединение (60 мг), имеющее значения физических свойств, показанные ниже.
1H-ЯМР (CDCl3): δ 0,83-0,92, 1,07-1,84, 2,53-2,57, 2,89-2,93, 3,04-3,12, 3,92-3,95, 4,26-4,27, 4,96-5,02, 6,79-6,86, 7,13-7,17, 7,48-7,59, 7,87-7,89.
[0522]
Пример 166: 3-[2-[5-[4-(бензолсульфонамид)циклогексил]пентокси]фенил]пропановая кислота
Проводили ту же самую предусмотренную процедуру, что и в примере 11, используя вместо пропaн-2-ил-3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропанoата, применявшегося в примере 11, сложноэфирное соединение, полученное в примере 165. Тем самым получали указанное в заголовке соединение, имеющее значения физических свойств, показанные ниже.
Время удерживания ВЭЖХ (мин): 1,20;
1H-ЯМР (CDCl3): δ 0,83-0,92, 1,07-1,83, 2,64-2,68, 2,92-2,96, 3,05-3,13, 3,93-3,96, 4,42-4,43, 6,80-6,88, 7,14-7,20, 7,48-7,59, 7,87-7,89.
[0523]
Ниже будут описаны примеры биологических экспериментов. Действие соединений настоящего изобретения было подтверждено этими экспериментальными способами.
[0524]
Биологический эксперимент, пример 1: испытание in vitro с использованием шванновских клеток
(Способ испытания)
(1) Получение шванновских клеток крысы
Дорсальный корешковый ганглий (далее сокращенно обозначаемый «DRG») вырезали из новорожденной крысы в возрасте 0-2 дней в стерильном боксе и собирали в DMEM. После сбора пробирку центрифугировали при 400 g при комнатной температуре в течение 3 мин, затем супернатант удаляли и добавляли 0,25% раствор коллагеназы. Полученный раствор инкубировали при 37°C в течение 30 мин для диспергирования и отделения вырезанного DRG, и затем центрифугировали при комнатной температуре при 400 g в течение 3 мин, затем супернатант удаляли, и далее добавляли 0,25% Трипсин/EDTA и ДНКазу I. После инкубации при 37°C в течение 30 мин трипсин инактивировали DMEM с добавлением 10% FBS (10% FBS-DMEM), и центрифугирование проводили при комнатной температуре при 400 g в течение 3 мин. Супернатант удаляли, затем к остатку добавляли 10% FBS-DMEM для приготовления клеточной суспензии и затем клеточную суспензию пропускали через фильтр (диаметр: 70 мкм). Количество клеток в клеточной суспензии, прошедшей через фильтр, подсчитывали для приготовления раствора, имеющего концентрацию 2,0 × 105 клеток/мл, и суспензию высевали в покрытый поли-D-лизином черный с прозрачным дном 96-луночный планшет в количестве 100 мкл/лунка и затем статически культивировали в инкубаторе с CO2 в условиях, включающих 5% CO2, 95% воздуха и 37°C.
(2) Добавление соединения
Культуральную среду в планшете для клеточной культуры удаляли отсасыванием с использованием аспиратора, и затем добавляли DMEM с добавлением 1% диализированной FBS и 100 мкмоль/л дибутирилциклического АМФ. Затем добавляли раствор соединения настоящего изобретения, растворенного в ДМСО, и полученный раствор статически культивировали в инкубаторе с CO2 в условиях, включающих 5% CO2, 95% воздуха и температуру 37°C. Конечная концентрация соединения настоящего изобретения в каждой лунке планшета для клеточной культуры доводилась до 0,1, 0,3, 1 или 3 мкмоль/л.
(3) Иммуноокрашивание клеток
Через три дня после обработки соединением в каждую лунку планшета для клеточной культуры добавляли формальдегид, и планшет для клеточной культуры оставляли стоять при комнатной температуре в течение 30 мин или дольше. Супернатант удаляли, и затем в каждую лунку добавляли 0,3% раствор тритона X-100, и затем планшет для клеточной культуры оставляли стоять при комнатной температуре в течение 20 мин или дольше. Супернатант удаляли, затем в каждую лунку добавляли раствор 5 мкг/мл анти-миелин-ассоциированного гликопротеинового антитела (анти-MAG антитела), и далее планшет для клеточной культуры оставляли стоять при комнатной температуре в течение 60 мин или дольше или при 4°С (допустимый диапазон: 1-9 °C) в течение ночи. Каждую лунку трижды промывали 0,1% раствором тритона X-100, затем в каждую лунку добавляли 10 мкг/мл раствора антитела против мышиного IgG с Alexa fluor 488, и затем планшет для клеточной культуры оставляли стоять при комнатной температуре в течение 60 мин или дольше или при 4°С в течение ночи. Каждую лунку четырежды промывали 0,1% раствором тритона X-100, и затем в каждую лунку добавляли 1 мкг/мл раствора Hoechst33342 для окрашивания ядер.
[0525]
(Способ оценки)
Определяли MAG-положительную область и число клеточных ядер на флуоресцентном изображении. Применительно к каждой MAG-положительной области и числу клеточных ядер, определяли общую сумму значений, полученных в 5 полях зрения на лунку. Эти значения использовали в качестве значения для MAG-положительной области и значения для количества клеточных ядер, соответственно, в каждой лунке. Затем вычисляли значение, определенное путем деления значения для MAG-положительной области в каждой лунке на значение числа клеточных ядер в лунке (т.е. численное значение MAG/клеточные ядра). Показатель стимулирования дифференцировки шванновских клеток определяли для каждого из носителей в соответствии со следующей формулой.
[0526]
[Математическая формула 1]
Показатель стимулирования дифференцировки шванновских клеток для носителя (%) = {(численное значение MAG соединения по изобретению/клеточные ядра) - A}/(B - A) × 100
A: численное значение MAG/клеточные ядра в необработанном планшете
B: численное значение MAG/клеточные ядра носителя
[0527]
(Результаты)
Показатель стимулирования дифференцировки шванновских клеток (% носителя) для носителей в случае, когда каждое из соединений настоящего изобретения добавляли в концентрации 0,3 мкмоль/л или 3 мкмоль/л, показаны ниже. На основе этих результатов было признано, что соединения настоящего изобретения обладают сильной нейропротекторной и/или нейровосстанавливающей активностью.
[0528]
[Таблица 1]
[0529]
Биологический эксперимент, пример 2: Испытание с использованием индуцированной стрептозотоцином крысиной модели
Для оценки терапевтического эффекта каждого из соединений настоящего изобретения на диабетическую периферическую нейропатию было проведено испытание in vivo с использованием стрептозотоциновой модели.
(Способ испытания)
(1) Получение модели
Модель получали путем внутривенного введения крысе стрептозотоцина (далее сокращенно обозначаемого «STZ») однократно в дозе 55 мг/кг.
(2) Измерение ноцицептивного порога
Крысу помещали в прозрачную акриловую клетку для измерения один или более раз на 10 мин или дольше, пока не начиналось введение STZ. Тем самым крысу акклиматизировали к условиям измерения. Восемь нитей фон Фрея, имеющих соответственно вес 0,4 г, 0,6 г, 1 г, 2 г, 4 г, 6 г, 8 г и 15 г, прикладывали вертикально к задней лапе крысы из-под металлического сетчатого пола. Когда наблюдалась быстрая реакция избегания или отдергивания, определялось, что произошла положительная реакция (т.е. «наблюдался отклик»). Каждое из соединений настоящего изобретения вводили перорально один раз в день в период с 14 по 28 день после введения STZ, при этом величина дозы каждого из соединений составляла 0,03 мг/кг, 0,3 мг/кг или 3 мг/кг. Ноцицептивный порог измеряли через 2 ч после введения каждого из соединений настоящего изобретения в моменты времени до введения STZ, через 14 дней после введения STZ (т.е. в день начала введения каждого из соединений настоящего изобретения), через 21 день после введения STZ (т.е. через 7 дней после начала введения соединения), через 28 дней после введения STZ (т.е. через 14 дней после начала введения соединения), и через 35 дней после введения STZ (т.е. через 7 дней после отмены введения соединения).
[0530]
(Способ оценки)
Ноцицептивный порог измеряли методом «вверх-вниз» в соответствии со способом Chaplan et. al. (J Neurosci Methods. 1994;53:55-63). Показатель улучшения ноцицептивного порога рассчитывали в соответствии со следующей формулой.
[0531]
[Математическая формула 2]
Показатель улучшения ноцицептивного порога (%) = (ноцицептивный порог на каждом из числа дней, прошедших после введения STZ - B)/(A- B) × 100
A: Ноцицептивный порог перед введением STZ
B: Ноцицептивный порог через 14 дней после введения STZ
[0532]
(Результаты)
Результаты ноцицептивных порогов и показателей улучшения ноцицептивных порогов, полученные, когда каждое из соединений настоящего изобретения вводилось в дозе 0,3 мг/кг, показаны на фиг.1 и в таблице 2, соответственно. Что касается всех соединений, - наблюдался сильный обезболивающий эффект по отношению к периферической нейропатии. Что касается соединения примера 11, например, улучшение ноцицептивного порога наблюдали через 7 дней после начала введения соединения, и этот эффект продолжался даже через 7 дней после отмены введения. Таким образом, был подтвержден длительный обезболивающий эффект.
[0533]
[Таблица 2]
[0534]
Биологический эксперимент, пример 3: Испытание на измерение реакционноспособного метаболита
Комплекс реакционноспособного метаболита каждого из соединений настоящего изобретения и глутатиона четвертичного аммония (QA-GSH) определяли полуколичественно с помощью ЖХ/МС/МС (Soglia JR et al., Chem. Res. Toxicol. 19(3), 480-490, 2006), и измеряли количество NADPH-зависимого реакционноспособного метаболита.
В 100 мМ фосфатный буфер (рН 7,4) (187,5 мкл) добавляли 20 мг/мл микросом печени человека (Xenotech) в количестве 12,5 мкл (конечная концентрация: 1 мг/мл), 10 ммоль/л QA-GSH в количестве 25 мкл (конечная концентрация: 1 ммоль/л), и 0,5 ммоль/л раствора каждого из соединений настоящего изобретения (ДМСО:ацетонитрил:вода=5:38:57) в количестве 5 мкл (конечная концентрация соединения: 10 мкмоль/л). Полученный раствор предварительно инкубировали на водяной бане при 37°C в течение 3 мин и затем к раствору добавляли 25 ммоль/л NADPH в количестве 20 мкл (конечная концентрация: 2 ммоль/л) для инициирования реакции. После проведения реакции в течение 1 ч в реакционный раствор добавляли 500 мкл IS-содержащего ацетонитрила для прекращения реакции. Комплекс реакционноспособного метаболита и QA-GSH (т.е. аддукт QA-GS), полученный в образце с завершенной реакцией, анализировали с помощью ЖХ/МС/МС. Измерения также проводили на веществе внутреннего стандарта (IS) для аддукта QA-GS.
[0535]
Концентрацию аддукта QA-GS рассчитывали в соответствии со следующей формулой.
[0536]
[Математическая формула 3]
Концентрация аддукта QA-GS = (площадь пика, соответствующего аддукту QA-GS)/(площадь пика, соответствующего IS) × (концентрация IS)
[0537]
(Результаты)
Концентрация аддукта QA-GS каждого из соединений настоящего изобретения была низкой. Например, все концентрации аддуктов QA-GS соединений примеров 11, 36, 37, 74(13), 84 и 149 составляли 200 нмоль/л или менее.
[0538]
Биологический эксперимент, пример 4: испытание Hand-1EST
Репродуктивную и эмбриотоксичность каждого из соединений настоящего изобретения измеряли с использованием POCA (зарегистрированный товарный знак) Hand1-EST (DS Pharma Biomedical Co., Ltd.), используя в качестве показателей число живых клеток и эффективность дифференцировки в процессе дифференцировки от мышиной ES-клетки к клеткам сердечной мышцы (Le Coz F et al.,J. Toxicol., 40(2):251-61. 2015).
[0539]
Готовили раствор 1000 мг/мл каждого из соединений настоящего изобретения в ДМСО. Раствор 1000 мг/мл каждого из соединений настоящего изобретения в ДМСО разбавляли культуральной средой для дифференцировки в кардиомиоциты с получением 1000 мкг/мл раствора соединения (конечная концентрация ДМСО: 0,1%). Раствор последовательно трижды разбавляли культуральной средой для дифференцировки в кардиомиоциты (конечная концентрация ДМСО: 0,1%), подтверждая наличие или отсутствие осадков невооруженным глазом, и концентрация, при которой не наблюдалось осаждения, регистрировалась как максимальная растворимость.
[0540]
Размороженные Hand1-ES клетки (мышиные ES-клетки, каждая из которых была трансфицирована промоторной областью для гена маркера дифференцировки сердечной мышцы Hand1 и гена люциферазы, расположенного ниже промоторной области, используя pGL4.17 в качестве вектора) были суспендированы в поддерживающей недифференцированное состояние культуральной среде, и полученный раствор высевали в покрытую желатином 60 мм чашку и затем культивировали в течение 2-3 дней. После проведения культивирования в течение 2-3 дней обработанные трипсином Hand1-ES клетки субкультивировали при концентрации 2 × 106 клеток/5 мл в покрытой желатином 60 мм чашке и затем культивировали в течение ночи. После этого, обработанные трипсином Hand1-ES клетки суспендировали в культуральной среде для дифференцировки в кардиомиоциты, и полученный раствор высевали в круглодонный 96-луночный планшет PrimeSurface (зарегистрированный товарный знак) в концентрации 750 клеток/50 мкл/лунка и затем культивировали в течение 2 ч. Через 2 ч добавляли 50 мкл культуральной среды для дифференцировки в кардиомиоциты, содержащей каждое из соединений настоящего изобретения или вещество положительного контроля 5-FU (конечная концентрация соединения настоящего изобретения: 1000 мкг/мл, 333 мкг/мл, 111 мкг/мл, 37,0 мкг/мл, 12,3 мкг/мл, 4,12 мкг/мл и 1,37 мкг/мл; конечная концентрация 5-FU: 1 мкг/мл, 0,333 мкг/мл, 0,111 мкг/мл, 0,0370 мкг/мл, 0,0123 мкг/мл, 0,00412 мкг/мл и 0,00137 мкг/мл; конечная концентрация ДМСО: 0,1%) в течение 5 дней. После того, как соединения настоящего изобретения или 5-FU экспонировались с клетками в течение 5 дней, для определения количества живых клеток добавляли CellTiter-Fluor (зарегистрированный товарный знак) (Promega) и измеряли флуоресценцию при длине волны возбуждения Ex, равной 390 нм, и длине волны флуоресценции Em, равной 505 нм, с использованием планшет-ридера SpectraMax M5e (Molecular Devices). Кроме того, для определения эффективности дифференцировки добавляли Steady-Glo (зарегистрированный товарный знак) (Promega) и измеряли флуоресценцию с помощью планшет-ридера SpectraMax M5e. Максимальная растворимость, концентрация, при которой количество живых клеток ингибировалось на 50%, и концентрация, при которой эффективность дифференцировки ингибировалась на 50%, которые были определены выше, вводились в специальное программное обеспечение POCA Hand1-EST Analysis Software для определения тератогенного риска. Критерии определения были следующими: низкий риск: вероятность менее 0,52; высокий риск: вероятность 0,52 или более (Nagahori et al., Toxicology Letters 259,44-51).
[0541]
(Результаты)
Среди соединений настоящего изобретения каждое из соединений примеров 84, 86 и 87 имело вероятность менее 0,52, и соответственно, было установлено, что эти соединения имеют низкий тератогенный риск.
[0542]
[Примеры композиций]
Пример композиции 1
Компоненты, представленные ниже, смешивали друг с другом обычным образом, и смесь прессовали в таблетки. Таким образом получали 10000 таблеток, каждая из которых содержит 10 мг активного компонента на таблетку.
3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота: 100 г
Карбоксиметилцеллюлоза калия: 20 г
Стеарат магния: 10 г
Микрокристаллическая целлюлоза: 870 г
[0543]
Пример композиции 2
Компоненты, представленные ниже, смешивали друг с другом обычным образом, затем смесь фильтровали через фильтр для улавливания пыли, затем фильтрат упаковывали в ампулы в объеме 5 мл на ампулу, и ампулы термически стерилизовали в автоклаве. Таким образом получали 10000 ампул, каждая из которых содержала активный ингредиент в количестве 20 мг/ампула.
3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановая кислота: 200 г
Маннит: 20 г
Дистиллированная вода: 50 л
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0544]
Соединение настоящего изобретения обладает сильной нейропротекторной и/или нейровосстанавливающей активностью и поэтому может использоваться для профилактики и/или лечения заболеваний, связанных с нейропатиями.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ 8-АЗАПРОСТАГЛАНДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, АГЕНТ ДЛЯ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2306309C2 |
| ПРОИЗВОДНЫЕ 2-ПИРИДОНА | 2010 |
|
RU2551847C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ S1P5 | 2019 |
|
RU2781541C2 |
| ФЕНИЛТЕТРАГИДРОИЗОХИНОЛИНОВОЕ СОЕДИНЕНИЕ, ЗАМЕЩЕННОЕ ГЕТЕРОАРИЛОМ | 2015 |
|
RU2703456C2 |
| Аналоги сплицеостатина | 2013 |
|
RU2618523C2 |
| ТИАЗОЛИЛФЕНИЛБЕНЗОЛСУЛЬФОНАМИДОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2012 |
|
RU2606497C2 |
| ПРОИЗВОДНОЕ ТЕТРАГИДРОКАРБОЛИНА | 2011 |
|
RU2572818C2 |
| СОЕДИНЕНИЕ, СПОСОБНОЕ К СВЯЗЫВАНИЮ С РЕЦЕПТОРОМ S1P, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2390519C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2315746C2 |
| БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ МЕДИЦИНСКИХ ЦЕЛЕЙ | 2010 |
|
RU2540330C2 |
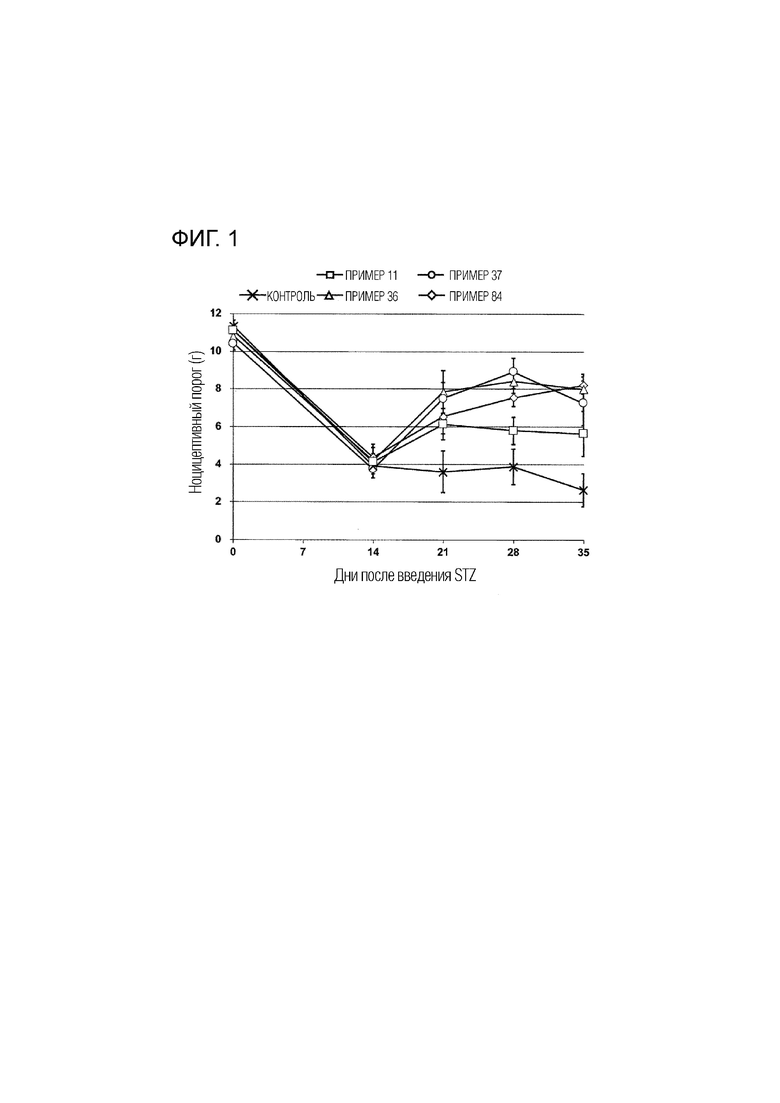
Настоящее изобретение относится к соединению, представленному общей формулой (I), или к его фармацевтически приемлемой соли, которые могут быть использованы для лечения и/или профилактики периферической нейропатии и/или центральной нейропатии:
[Формула 1]
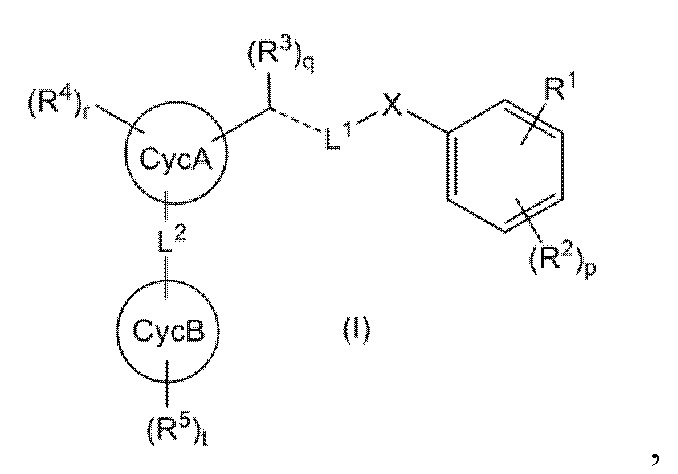
где: R1 представляет собой (1) -R11-COOR12, (2) -R13-CONR14R15, (3) -R17-CN, (4) -R18-CONHS(O)2-R19, (5) -R20-CycD, или
[Формула 2]
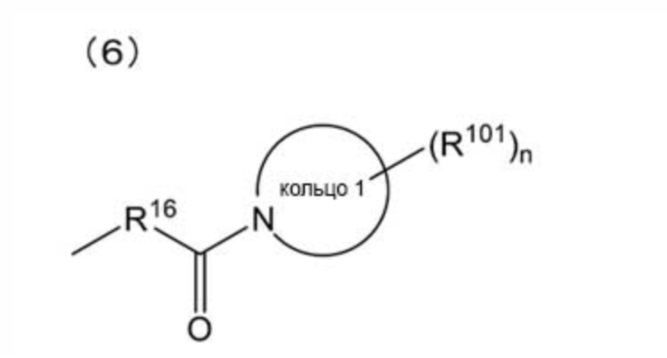
(где: кольцо 1 представляет собой морфолин и n представляет собой целое число 0); R2 представляет собой (1) атом галогена или (2) C1-4 алкильную группу, и p представляет целое число от 0 или 1; X представляет собой (1) CH2 или (2) атом кислорода; L1 представляет собой (1) линейную C3-7 алкиленовую группу, которая может быть замещена 1-2 RL1a, или (4) (линейную C1-3 алкиленовую группу)-O-(линейную C1-3 алкиленовую группу); R3 представляет собой (1) атом водорода, (2) атом галогена или (4) C1-2 алкильную группу, и q представляет целое число от 0 до 2, при этом: когда
[Формула 4]
представляет собой одинарную связь и q равно 2, множество R3 могут быть одинаковыми или отличными друг от друга; и когда по меньшей мере один из R3 представляет собой метильную группу, метильная группа может образовывать циклопропан в сочетании с атомом углерода в соседнем L1; CycA представляет собой (1) C6 моноциклическое карбоциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее гетероатом, выбранный из атома кислорода, атома азота и атома серы; R4 представляет собой (1) атом галогена, (2) гидроксильную группу, (3) C1-4 алкильную группу, (4) C1-4 галогеналкильную группу; (7) цианогруппу или (8) -SO2-C1-2 алкильную группу, и r представляет целое число от 0 до 3, при этом, когда r равно 2 или более, множество R4 могут быть одинаковыми или отличными друг от друга; L2 представляет собой -R31-L3-R32-; CycB представляет собой (1) C5-6 моноциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее гетероатом, выбранный из атома кислорода, атома азота и атома серы; и R5 представляет собой (1) атом галогена, (2) C1-6 алкильную группу, (5) C1-6 галогеналкильную группу или (8) C1-6 алкоксигруппу, и t представляет целое число 0 или 1, а R11-R20, R31,R32, L3, CycD имеют значения, указанные в формуле изобретения. Технический результат – получение соединения, обладающего нейропротекторной и/или нейровосстанавлиявающей активностью. 9 н. и 11 з.п. ф-лы, 1 ил., 2 табл., 273 пр.
1. Соединение, представленное общей формулой (I)
[Формула 1]
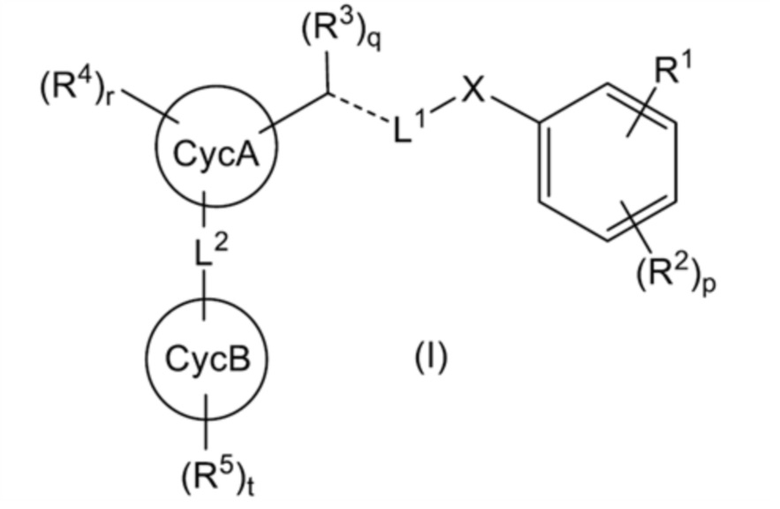
где:
R1 представляет собой (1) -R11-COOR12, (2) -R13-CONR14R15, (3) -R17-CN, (4) -R18-CONHS(O)2-R19, (5) -R20-CycD, или
[Формула 2]
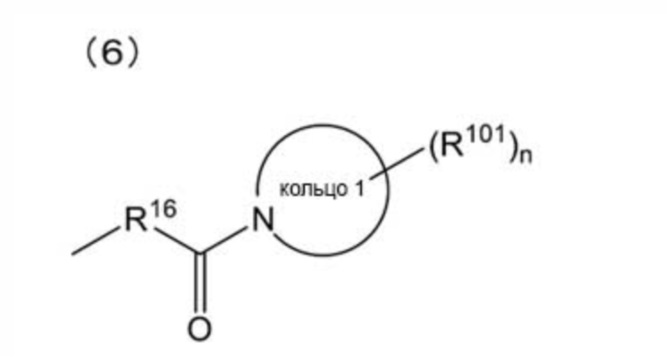
(где: кольцо 1 представляет собой морфолин и n представляет собой целое число 0);
каждый из R11, R13, R16, R17, R18 и R20 независимо представляет собой (1) C1-6 алкиленовую группу, (2) C2-6 алкениленовую группу, которая может быть замещена 1-3 атомами галогена, при этом, когда алкиленовая группа или алкениленовая группа являются разветвленными, две C1-2 алкильные группы, разветвленные от одного атома углерода, могут вместе образовывать C3-5 насыщенное карбоциклическое кольцо;
каждый из R12, R14, R15 и R19 независимо представляет собой (1) атом водорода, (2) C1-4 алкильную группу;
CycD представляет собой триазол или тетразол;
R2 представляет собой (1) атом галогена, или (2) C1-4 алкильную группу, и p представляет целое число от 0 или 1;
X представляет собой (1) CH2 или (2) атом кислорода;
L1 представляет собой (1) линейную C3-7 алкиленовую группу, которая может быть замещена 1-2 RL1a, или (4) (линейную C1-3 алкиленовую группу)-O-(линейную C1-3 алкиленовую группу);
RL1a представляет собой (1) атом галогена, (2) гидроксильную группу или (3) оксогруппу, при этом: когда присутствуют по меньшей мере два RL1a, множество RL1a могут быть одинаковыми или отличными друг от друга;
[Формула 3]
представляет собой одинарную связь, двойную связь или тройную связь;
R3 представляет собой (1) атом водорода, (2) атом галогена или (4) C1-2 алкильную группу, и q представляет целое число от 0 до 2, при этом: когда
[Формула 4]
представляет собой одинарную связь и q равно 2, множество R3 могут быть одинаковыми или отличными друг от друга; и когда по меньшей мере один из R3 представляет собой метильную группу, метильная группа может образовывать циклопропан в сочетании с атомом углерода в соседнем L1;
CycA представляет собой (1) C6 моноциклическое карбоциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее гетероатом, выбранный из атома кислорода, атома азота и атома серы;
R4 представляет собой (1) атом галогена, (2) гидроксильную группу, (3) C1-4 алкильную группу, (4) C1-4 галогеналкильную группу; (7) цианогруппу или (8) -SO2-C1-2 алкильную группу, и r представляет целое число от 0 до 3, при этом, когда r равно 2 или более, множество R4 могут быть одинаковыми или отличными друг от друга;
L2 представляет собой -R31-L3-R32-;
L3 представляет собой (1) -NR201-S(O)-, (2) -NR202-S(O)2-, (3) -NR203-C(O)-, (4) -CR204(OH)-, (5) -NR205-, или (7) -S(O)2-;
каждый из R201, R202, R203, R204 и R205 независимо представляет собой (1) атом водорода, (2) C1-4 алкильную группу или (3) C1-4 галогеналкильную группу, при этом алкильная группа или галогеналкильная группа может быть замещена (1) гидроксильной группой, (3) C3-6 моноциклическим карбоциклическим кольцом или (4) 3-6-членным моноциклическим гетероциклическим кольцом, содержащим гетероатом, выбранный из кислорода;
каждый из R31 и R32 независимо представляет собой (1) связь или (2) C1-3-алкиленовую группу;
CycB представляет собой (1) C5-6 моноциклическое кольцо или (2) 5-10-членное моноциклическое или бициклическое гетероциклическое кольцо, содержащее гетероатом, выбранный из атома кислорода, атома азота и атома серы; и
R5 представляет собой (1) атом галогена, (2) C1-6 алкильную группу, (5) C1-6 галогеналкильную группу или (8) C1-6 алкоксигруппу, и t представляет целое число 0 или 1, или его фармацевтически приемлемая соль.
2. Соединение или его фармацевтически приемлемая соль по п. 1, где в общей формуле (I) группа:
[Формула 5]

представляет собой (1) =CH-(линейную C2-6 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, (2) -(линейную C3-7 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, или (3) -(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-O-(линейную C1-3 алкиленовую группу, которая может быть замещена 1-2 RL1a)-, (в (1)-(3) RL1a имеет такое же значение, как указано в п. 1).
3. Соединение или его фармацевтически приемлемая соль по п. 1 или 2, где R1 представляет собой -R11-COOR12.
4. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-3, где L2 представляет собой (1) -NR202-S(O)2- или (2) -CR204(OH)-CH2-.
5. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-4, где CycA представляет собой C5-6 моноциклическое карбоциклическое кольцо.
6. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-5, где CycВ представляет собой C5-6 моноциклическое карбоциклическое кольцо.
7. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-6, где общая формула (I) является общей формулой (I-1)
[Формула 6]
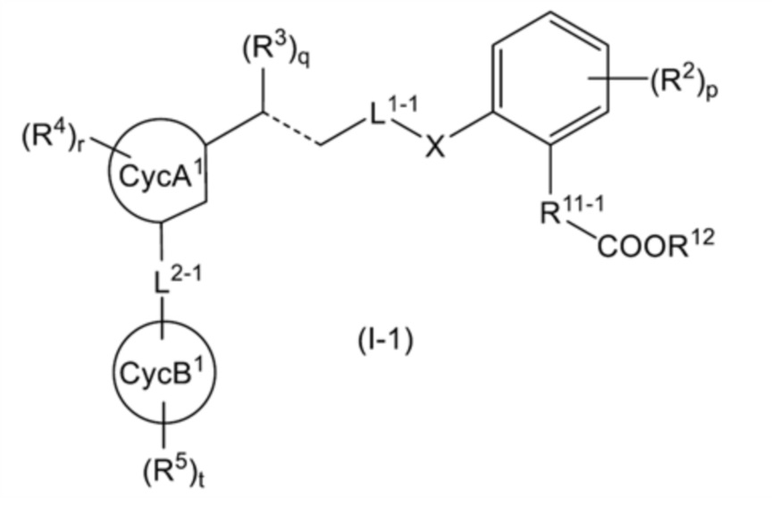
где: R11-1 представляет собой C2-4 алкиленовую группу; L1-1 представляет собой линейную C3-4 алкиленовую группу, которая может быть замещена 1-2 RL1a; каждый из CycA1 представляет собой C6 моноциклическое карбоциклическое кольцо; CycB1 представляет собой C5-6 моноциклическое карбоциклическое кольцо; L2-1 представляет собой (1) -NH-S(O)2- или (2) -CH(OH)-CH2-; и другие символы имеют такое же значение, как указано в п. 1.
8. Соединение или его фармацевтически приемлемая соль по любому из пп. 1-7, где Х представляет собой атом кислорода.
9. Соединение или его фармацевтически приемлемая соль по п. 1, где соединение или его соль представляет собой
(1) 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(2) 3-[2-[(3S)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановую кислоту,
(3) 3-[2-[(3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипентокси]фенил]пропановую кислоту,
(4) 3-[2-[(E,3R)-5-[4-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(5) 3-[2-[(E,3R)-5-[3-(циклопентилсульфониламино)фенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(6) 3-[2-[(E,3R)-5-[3-(бензолсульфонамидо)-2-метилфенил]-3-гидроксипент-4-енокси]фенил]пропановую кислоту,
(7) 4-[2-[(E,3R)-5-[3-(бензолсульфонамидо)фенил]-3-гидроксипент-4-енокси]фенил]бутановую кислоту,
(8) 3-[2-[(E)-4-[3-(бензолсульфонамидо)фенил]-2-гидроксибут-3-енокси]фенил]пропановую кислоту,
(9) (R)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановую кислоту,
(10) (S)-3-[2-[(E)-6-[3-(бензолсульфонамидо)фенил]-4-гидроксигекс-5-енил]фенил]пропановую кислоту,
(11) 3-[2-[(E)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропановую кислоту,
(12) 3-[2-[5-[3-(бензолсульфонамидо)фенил]пентокси]фенил]пропановую кислоту,
(13) 3-[2-[(3S)-3-гидрокси-5-[3-[(1R)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановую кислоту,
(14) 3-[2-[(3S)-3-гидрокси-5-[3-[(1S)-1-гидрокси-2-фенилэтил]фенил]пентокси]фенил]пропановую кислоту,
(15) 3-[2-[2-[2-[3-(бензолсульфонамидо)фенил]этокси]этокси]фенил]пропановую кислоту,
(16) 3-[2-[6-[3-(бензолсульфонамидо)фенил]-4-оксогексил]фенил]пропановую кислоту, или
(17) 3-[2-[5-[3-(бензолсульфонамидо)фенил]-3,3-дифторпентокси]фенил]пропановую кислоту.
10. Фармацевтическая композиция для лечения и/или профилактики периферической нейропатии и/или центральной нейропатии, содержащая эффективное количество соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1.
11. Средство для стимулирования дифференцировки шванновских клеток, содержащее эффективное количество соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1.
12. Профилактическое и/или терапевтическое средство при периферической нейропатии, содержащее эффективное количество соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1.
13. Средство по п. 12, где периферическая нейропатия представляет собой хроническую воспалительную демиелинизирующую полинейропатию, синдром Гийена-Барре, узелковый периартериит, аллергический васкулит, диабетическую периферическую нейропатию, компрессионную нейропатию, периферическую нейропатию, связанную с болезнью Шарко-Мари-Тута, периферическую нейропатию, связанную с инфекционным заболеванием, медикаментозную периферическую нейропатию, связанную с введением противосудорожного средства, противомикробного средства, химиотерапевтического препарата или седативного средства, мультифокальную моторную нейропатию или токсическую периферическую нейропатию, связанную с попаданием внутрь тяжелых металлов, органического растворителя, токсичного вещества или спирта.
14. Средство по п. 13, где медикаментозная периферическая нейропатия представляет собой периферическую нейропатию, связанную с введением химиотерапевтического препарата.
15. Профилактическое и/или терапевтическое средство при центральной нейропатии, содержащее эффективное количество соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1.
16. Средство по п. 15, где центральная нейропатия представляет собой амиотрофический боковой склероз.
17. Способ для профилактики и/или лечения периферической нейропатии и/или центральной нейропатии, включающий введение эффективного количества соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1 млекопитающему.
18. Применение соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1, для предотвращения и/или лечения периферической нейропатии и/или центральной нейропатии.
19. Применение соединения, представленного общей формулой (I), или его фармацевтически приемлемой соли по п. 1 для получения профилактического и/или терапевтического средства для периферической нейропатии и/или центральной нейропатии.
20. 3-[2-[(Е)-5-[3-(бензолсульфонамидо)фенил]пент-4-енокси]фенил]пропановая кислота или ее фармацевтически приемлемая соль:
| CN 105622488 A, 01.06.2016 | |||
| WO 2009062883 A1, 22.05.2009 | |||
| WO 2017068070 A1, 27.04.2017 | |||
| WO 2006113471 A2, 26.10.2006 | |||
| WO 2003016254 A1, 27.02.2003 | |||
| EA 201001639 A1, 30.06.2011. |
Авторы
Даты
2024-01-17—Публикация
2019-07-30—Подача