Предлагаемое изобретение относится к области органической химии, а именно, к химии энергоемких гетероциклических соединений, конкретно, к новым, неописанным в литературе, солям 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей структурной формулы:
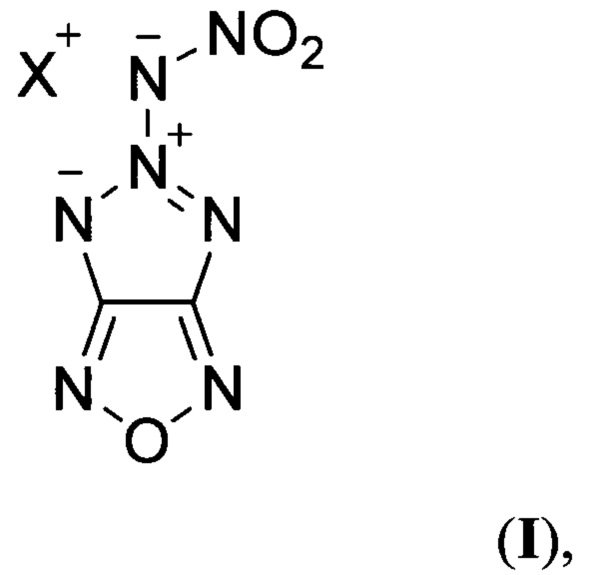
где X = NH4 (Ia) или N2H5 (Iб),
и к способу их получения. Соединения общей формулы I могут найти применение в качестве энергоемких наполнителей смесевых твердых ракетных топлив (СТРТ) и других энергетических конденсированных систем. В литературе описана структурно аналогичная К-соль 2-(нитроамино)бензо[d][1,2,3]триазола (по данным базы SciFinder CAS American Chemical Society) формулы:
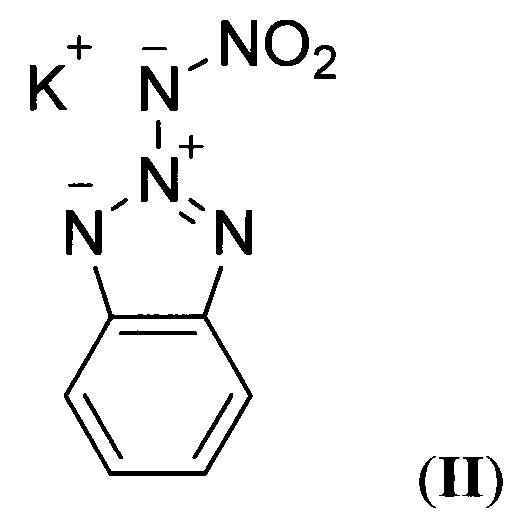
(A.R. Katritzky, J.W. Mitchell, 'W-oxides and related compounds. Part XLIII. Formation of N-nitroimides by base-catalysed nitration", J. Chem. Soc, Perkin Trans. 1,1973, 2624-2626).
Описанная структурно аналогичная К-соль 2-(нитроамино)бензо[d][1,2,3]триазола формулы II не является энергоемким соединением.
Также в литературе описаны структурно аналогичные соли 4Н-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (по данным базы SciFinder CAS American Chemical Society), общей формулы:
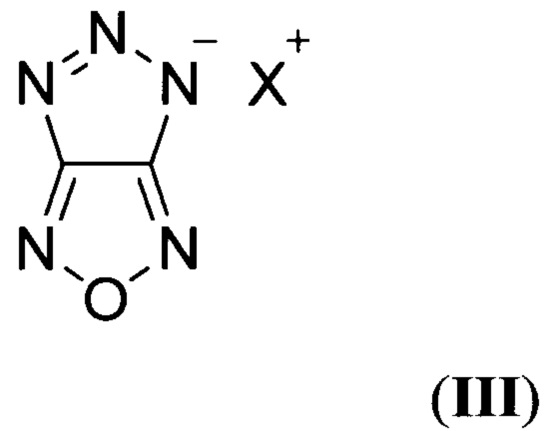
где X = NH4 (IIIa), N2H5 (IIIб)
(X. Li, В. Wang, Y. Li, H. Li, С.Zhou, Y. Zhang, P. Lian "Synthesis of 5Я-[l,2,3]Triazolo[4,5-c][1,2,5]oxadiazole and Its Energetic Derivatives", Chin J. Energy Mater., 2013, 21, 717-720).
Известные соли [1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы III являются энергоемкими соединениями, однако в литературе отсутствуют данные по плотностям и энтальпиям образования в твердой фазе этих соединений, а также они характеризуются очень низкими значениями коэффициента избытка окислителя (α = 0.15-0.17), что делает малоэффективным применение соединений общей формулы III в качестве энергоемких наполнителей.
Также в литературе описаны структурно аналогичные соли 4Н-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол-5-оксида (по данным базы SciFinder CAS American Chemical Society), общей формулы:
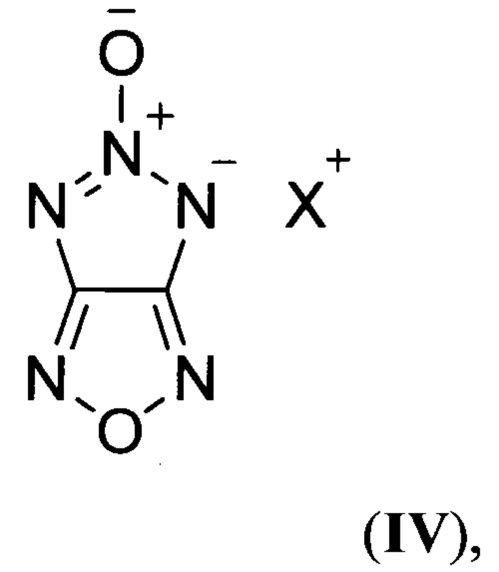
где X = NH4 (IVa), N2H5 (IVб)
(A.A. Voronin, I.V. Fedyanin, A.M. Churakov, A.N. Pivkina, N.V. Muravyev, Y.A. Strelenko, M.S. Klenov, D.B. Lempert, V.A. Tartakovsky "4Н-[1,2,3]Triazolo[4,5-c][1,2,5]oxadiazole 5-oxide and Its Salts: Promising Multipurpose Energetic Materials", ACS Appl. Energ. Mat, 2020, 9, 9401-9407).
Соединения общей формулы IV характеризуются приемлемыми значениями энтальпии образования в твердой фазе и плотности, но при этом обладают невысокими значениями коэффициента избытка окислителя (α = 0.31-0.33), что делает малоэффективным применение этих соединений в качестве энергоемких наполнителей СТРТ.
Технической задачей предлагаемого изобретения является изыскание новых энергоемких соединений ряда 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола, характеризующихся сочетанием оптимального значения коэффициента избытка окислителя, высокой энтальпии образования в твердой фазе и высокой плотности, что обеспечит эффективность их применения в качестве энергоемких наполнителей СТРТ, а также разработка способа их получения.
Поставленная техническая задача достигается новыми, неописанными в литературе, солями 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы:
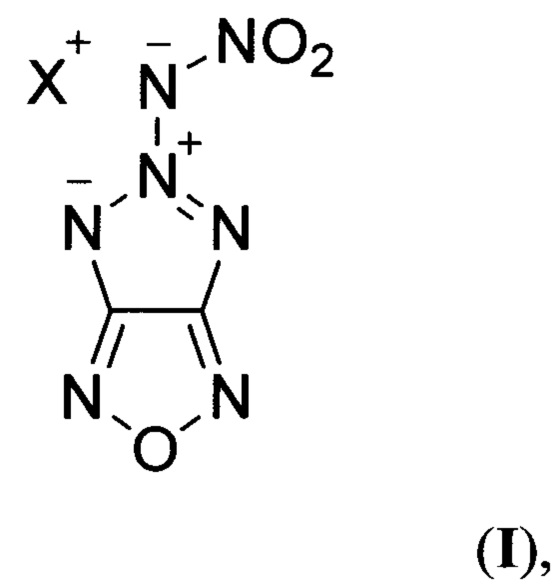
где X = NH4 (Ia) или N2H5 (Iб), и способом их получения.
Предлагаемые соединения общей формулы I являются первыми энергоемкими веществами, в которых нитрамидный фрагмент связан с высокоэнтальпийным [1,2,3]триазоло[4,5-с][1,2,5]оксадиазольным фрагментом, что обеспечивает большее значение коэффициента избытка окислителя (α > 0.4) по сравнению с соединениями общей формулы III и общей формулы IV (α = 0.15-0.33), высокую энтальпию образования в твердой фазе 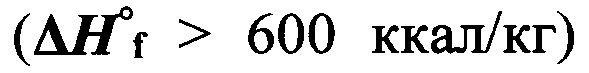 и высокую плотность (d > 1.70 г/см3).
и высокую плотность (d > 1.70 г/см3).
Соединения общей формулы I могут найти применение в качестве энергоемких наполнителей (СТРТ) и других энергетических конденсированных систем.
В таблице представлены физико-химические и энергетические характеристики солей 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia,б) в сравнении с солями [1,2,3]триазоло[4,5-с][1,2,5]оксадиазол-5-оксида (IVa,б) и октогеном - наиболее эффективным штатным энергоемким наполнителем смесевых твердых ракетных топлив.
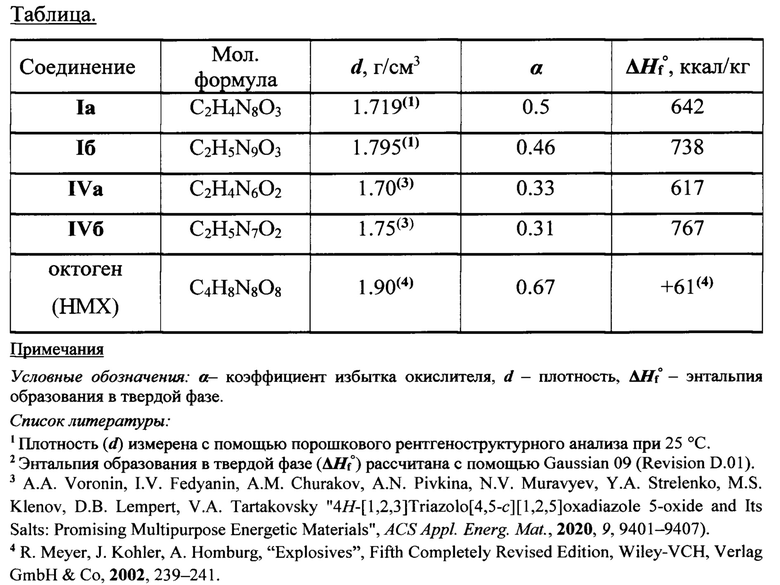
Как видно из данных таблицы, предлагаемые соединения формулы Ia и Iб превосходят соответствующие структурные аналоги по значениям коэффициента избытка окислителя и плотности, а эффективный штатный энергоемкий наполнитель СТРТ октоген по энтальпии образования в твердой фазе.
Предложен также способ получения солей 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы:
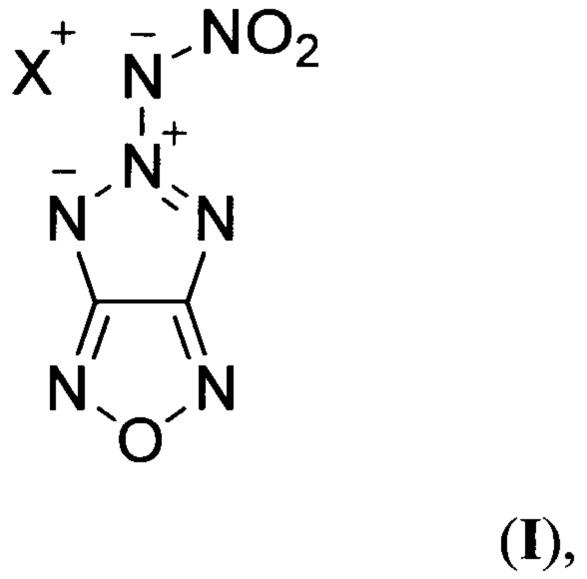
где X = NH4 (Ia) или N2H5 (Iб), заключающийся в том, что 4-азидо-3-амино-[1,2,5]оксадиазол (V) подвергают взаимодействию с нитрозирующим реагентом в среде органической кислоты при пониженной температуре с последующей обработкой реакционной смеси бис(2-цианоэтил)амином в среде полярного апротонного органического растворителя, образующийся при этом 3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрил (VI) подвергают нагреванию, полученный при этом 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VII) обрабатывают основанием в среде полярного протонного органического растворителя, образующийся при этом 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VIII) подвергают обработке нитрующим реагентом в среде полярного апротонного органического растворителя с последующей обработкой реакционной смеси гидроксидом калия в среде полярного протонного органического растворителя при пониженной температуре, образующуюся при этом калиевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) обрабатывают нитратом серебра в воде, с последующим выделением полученной при этом серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) и далее, при необходимости получения аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia), полученное соединение X обрабатывают хлоридом аммония в воде, либо, при необходимости получения гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб), соединение X обрабатывают моногидрохлоридом гидразина в воде. Процессы получения целевых продуктов Ia и Iб протекают по следующей схеме:
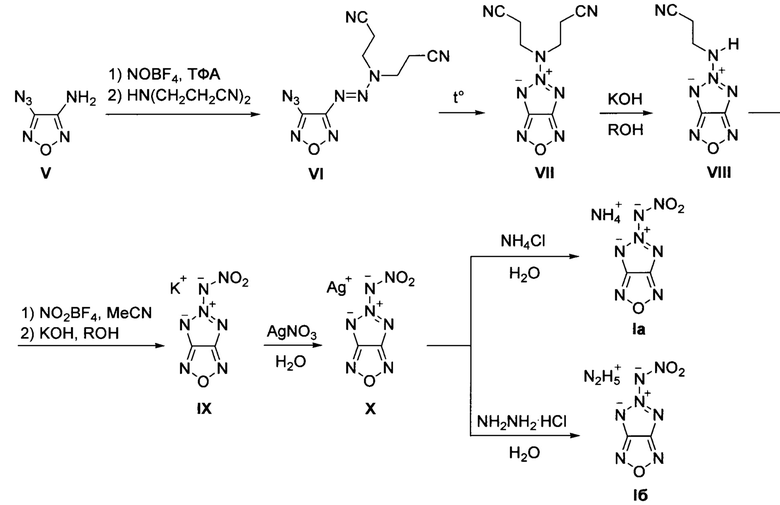
В качестве нитрозирующего реагента на стадии получения 3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрила (VI) используют, например, тетрафторборат нитрозония (NOBF4X в качестве органической кислоты, например, трифторуксусную кислоту, а в качестве полярного апротонного органического растворителя используют, например, хлористый метилен, хлороформ. Процесс проводят при пониженной температуре, преимущественно, при температуре -35-5°С. На стадии получения 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VII) процесс проводят при нагревании, преимущественно, при температуре 60-70°С без растворителя, либо при кипячении в среде полярного апротонного органического растворителя, например, ацетонитрила.
В качестве основания на стадии получения 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII) используют, например, гидроксид калия, а в качестве полярного протонного органического растворителя используют, например, метанол, этанол. Процесс проводят преимущественно при комнатной температуре.
В качестве нитрующего реагента при нитровании 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII) используют, например, тетрафторборат нитрония (NO2BF4), а в качестве полярного апротонного растворителя используют, например, ацетонитрил.
В качестве полярного протонного органического растворителя при получении калиевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) используют, например, метанол, этанол. Процесс нитрования и получения калиевой соли проводят при низкой температуре, преимущественно, при температуре -30°С.
Полученную калиевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) обрабатывают нитратом серебра в воде с последующим выделением серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X). Полученная серебряная соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) является новым соединением и которую используют в дальнейшем для получения как аммониевой соли обработкой хлоридом аммония в воде, так и гидразиниевой обработкой соединения X моногидрохлоридом гидразина в воде. Исходный 4-азидо-3-амино-[1,2,5]оксадиазол (V) получен из 3,4-диамино-[1,2,5]оксадиазола по опубликованной методике (О. А. Ракитин, О. А. Залесова, А. С.Куликов, Н. Н. Махова, Т. И. Годовикова, Л. И. Хмельницкий, "Синтез и реакционная способность фуразанил- и фуроксанилдиазониевых солей", Изв. АН, Сер. Хим., 1993,11, 1949-1953).
Техническим результатом настоящего изобретения является создание энергоемких солей нового типа 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы I, где X = NH4 (Ia) или N2H5 (Iб) и разработка способа их получения. Соединения Ia и Iб имеют оптимальные значения коэффициента избытка окислителя (α = 0.5 и 0.46, соответственно), высокие значения энтальпии образования в твердой фазе (642 и 738 ккал/кг, соответственно), хорошую плотность (1.719 и 1.795 г/см3, соответственно). Благодаря такому сочетанию характеристик соли 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола Ia,б могут представить интерес в качестве энергоемких наполнителей перспективных высокоимпульсных СТРТ.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с] [1,2,5]оксадиазола (Ia).
Стадия 1. Получение (E)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрила (VI).
NOBF4 (760 мг, 6.5 ммоль) добавили к интенсивно перемешиваемому раствору 4-азидо-3-амино-[1,2,5]оксадиазола (V) (760 мг, 6 ммоль) в трифторуксусной кислоте (ТФА) (4 мл) при 0-5°С в атмосфере аргона. Реакционную массу выдерживали при этой температуре в течение 3 ч, после чего трифторуксусную кислоту удалили в вакууме масляного насоса при 0-5°С.К полученному остатку, охлажденному до -35°С, добавили одной порцией охлажденный до -35°С раствор бис(2-цианоэтил)амина (3 г, 24.4 ммоль) в CH2Cl2 (10 мл) при интенсивном перемешивании. Реакционную массу плавно нагрели до комнатной температуры, растворитель удалили в вакууме, остаток очистили колоночной хроматографией на силикагеле (элюент: EtOAc / петролейный эфир, 1:1). Получили (E)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрил (VI) (825 мг, (53%) в виде белых кристаллов. ДСК (5°С-мин-1): Тпл.=79°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 278.1221 [М+NH4]+. C8H8N10O. Вычислено: m/z: 278.1221 [M+NH4]+. ИК-спектр (KBr), v/cm-1: 592, 631, 748, 766, 889, 916, 943, 1014, 1146, 1173, 1190, 1279, 1307, 1340, 1349, 1382, 1404, 1438, 1470, 1495, 1561, 2140, 2166, 2254, 2935, 2963, 3012. Спектр ЯМР 1H (ацетон-d6, δ, м.д., 500.1 МГц): 3.03, 3.15 (т, 4 Н, CH2CH2CN, J=6.7 Гц), 4.29, 4.39 (т, 4 Н, CH2CH2CN, J=6.7 Гц). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.8 МГц): 13.1, 16.6 (оба CH2CH2CN), 43.7, 51.2 (оба CH2CH2CN), 117.0, 117.1 (оба CN), 148.1, 154.5 (С(3) и С(4)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.1 МГц): -130 (N3, v½=670 Гц), -144(N3, v½=70 Гц).
Стадия 2. Получение 5-(бис(2-цианоэтил)амино)-[1,2,3] триазоло [4,5-с][1,2,5]оксадиазола (VII).
Раствор (E)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)-дипропионитрила (VI) (870 мг, 3.35 моль) в ацетонитриле (30 мл) кипятили в течение 24 ч, после чего охладили до комнатной температуры. Растворитель удалили в вакууме, остаток очистили колоночной хроматографией на силикагеле (элюент: EtOAc / петролейный эфир, 1:1). Получили 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VII) (770 мг, количественный выход) в виде бежевых кристаллов. ДСК (5°С⋅мин-1): Тпл.=139°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 255.0705 [M+Na]+. C8H8N8O. Вычислено: m/z: 255.0713 [M+Na]+. ИК-спектр (KBr), v/cm-1: 676, 771, 794, 811, 924, 967, 1014, 1041, 1120, 1192, 1330, 1363, 1392, 1421, 1436, 1480, 1540, 2251, 2938, 2971, 3021. Спектр ЯМР 1H (ацетон-d6, δ, м.д., 500.1 МГц): 3.22 (т, 4 Н, CH2CH2CN, J=6.7 Гц), 4.62 (т, 4 Н, CH2CH2CN, J=6.7 Гц). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 125.8 МГц): 14.8 (оба CH2CH2CN), 50.4 (оба CH2CH2CN), 117.2 (оба CN), 162.2 (С(3а) и С(6а)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.1 МГц): -52 (N(5), v½=140 Гц), -130 (N(4) и N(6), v½=590 Гц).
Стадия 3. Получение 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII).
Раствор KOH (500 мг, 8.88 ммоль) в МеОН (15 мл) прибавили по каплям к интенсивно перемешиваемому раствору 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VII) (1.03 г, 4.44 ммоль) в МеОН (70 мл). Затем реакционную массу перемешивали в течение 30 мин до полного исчезновения исходного соединения (контроль ТСХ), после чего растворитель удалили в вакууме, остаток очистили хроматографией на силикагеле (элюент: EtOAc). Получили 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VIII) (742 мг, (93%) в виде бледно-желтых кристаллов. ДСК (5°C⋅мин-1): Тнир.=127°С. Масс-спектр высокого разрешения (ESI): Найдено: m/z: 178.0481 [М-H]-. C5H5N7O. Вычислено: m/z: 178.0483 [M-H]-. ИК-спектр(KBr), v/см-1: 782, 795, 810, 938, 1028, 1051, 1138, 1339, 1360, 1432, 1458, 1548, 2270, 2966, 3015, 3201, 3468. Спектр ЯМР 1Н (ацетон-d6, δ, м.д., 600.1 МГц): 3.14 (т, 2 Н, CH2CH2CN, J=6.3 Гц), 4.26 (т, 2 Н, CH2CH2CN, J=6.3 Гц). Спектр ЯМР 13С (ацетон-d6, δ, м.д., 150.9 МГц): 15.7 (CH2CH2CN), 43.6 (CH2CH2CN), 117.2 (CN), 162.4 (С(3а) и С(6а)). Спектр ЯМР 14N (ацетон-d6, δ, м.д., 36.1 МГц): -52 (N(5), v½=70 Гц), -132 (N(4) и N(6) v½=620 Гц). Стадия 4. Получение калиевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX).
NO2BF4 (642 мг, 4.8 ммоль) прибавили одной порцией к интенсивно перемешиваемому раствору 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII) (720 мг, 4.0 ммоль) в сухом MeCN (10 мл) при -30°С в атмосфере аргона. Реакционную смесь выдержали при этой температуре в течение 15 мин (контроль ТСХ), после чего к ней добавили охлажденный (-30°С) раствор KOH (717 мг, 12.8 ммоль) в МеОН (10 мл). Реакционной смеси дали нагреться до комнатной температуры, растворитель удалили в вакууме. Остаток очистили хроматографией на силикагеле (элюент: EtOAc / МеОН, 5:1). Полученный после хроматографии продукт сушили при 80°С в вакууме масляного насоса в течение 2 ч, что дало калиевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) (614 мг, 89%) в виде желтых кристаллов. ДСК (5°С⋅мин-1): Тнир.=152°С. Элементный анализ для C2N7O3K: Найдено: С, 11.59; N, 46.61. C2N7O3K. Вычислено: С 11.48; N, 46.88. ИК-спектр (KBr), v/см-1: 656, 751, 829, 1029, 1054, 1178, 1241, 1311, 1446. Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 125.8 МГц): 163.0 (С(3а) и С(6а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 36.1 МГц): -9 (NO2, v½=40 Гц), -48 (N(5), v½=180 Гц).
Стадия 5. Получение серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X).
К раствору калиевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) (321 мг, 2.4 ммоль) в H2O (10 мл) прибавили AgNO3 (0.6 г, 3.6 ммоль) при комнатной температуре и интенсивном перемешивании. Реакционную смесь выдержали при этой температуре в течение 30 мин, выпавший осадок отфильтровали, промыли водой (2×5 мл), высушили в эксикаторе над Р4О10. Получили серебряную соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) (0.61 г, 95%) в виде бежевых кристаллов, которую далее использовали без дополнительной очистки. Тразл.=148°С. Элементный анализ для C2N7O3Ag: Найдено: С, 8.70; N, 35.08. C2H4N8O3. C2N7O3Ag. Вычислено: 8.64; N, 35.28. Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 125.8 МГц): 163.0 (С(3а) и С(6а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 36.1 МГц): -9 (NO2, v½=45 Гц), -48 (N(5), v½=190 Гц).
Стадия 6. Получение аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia).
К суспензии серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) (0.61 г, 2.2 ммоль) в воде (20 мл) при комнатной температуре и интенсивном перемешивании прибавили хлорид аммония (118 мг, 2.2 ммоль). Реакционную смесь перемешивали при данной температуре в течение 4 ч. Осадок отфильтровали, промыли водой (4×5 мл), фильтрат сконцентрировали в вакууме. Получили аммониевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia) (405 мг, 98%) в виде желтых кристаллов. ДСК (5°С-мин-1): Тпл.=149°С (разл.). Элементный анализ для C2H4N8O3: Найдено: Н, 2.19; С, 12.70; N, 59.07. C2H4N8O3. Вычислено: Н, 2.14; С, 12.77; N, 59.57. ИК-спектр (KBr), v/см-1: 656, 751, 829, 1029, 1054, 1178, 1241, 1311, 1446. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., 600.1 МГц): 7.07 (т, 4 Н, NH4, J=50.6 Гц). Спектр ЯМР 13С (ДМСО-d6, δ, м.д., 150.9 МГц): 163.1 (С(3а) и С(6а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 43.4 МГц): -9 (NO2, v½=37 Гц), -48 (N(5), v½=160 Гц), -359 (м, NH4, J=50.6 Гц).
Пример 2. Получение гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с] [1,2,5]оксадиазола (Iб).
Стадия 1. Получение (Е)-3,3'-(3-(4-Азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрила (VI).
Процесс получения (Е)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрила (VI) проводят аналогично примеру 1. Стадия 2. Получение 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VII).
Процесс получения 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VII) проводят аналогично примеру 1. Стадия 3. Получение 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII).
Процесс получения 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VIII) проводят аналогично примеру 1. Стадия 4. Получение калиевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX).
Процесс получения калиевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) проводят аналогично примеру 1. Стадия 5. Получение серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X).
Процесс получения серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) проводят аналогично примеру 1. Стадия 6. Получение гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с] [1,2,5]оксадиазола (Iб).
К суспензии серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) (0.61 г, 2.2 ммоль) в воде (20 мл) при комнатной температуре и интенсивном перемешивании прибавили моногидрохлорид гидразина (150 мг, 2,2 ммоль). Реакционную смесь перемешивали при данной температуре в течение 4 ч. Осадок отфильтровали, промыли водой (4x5 мл), фильтрат сконцентрировали в вакууме. Получили гидразиниевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб) (440 мг, 98%) в виде желтых кристаллов.
ДСК (5°С⋅мин-1): Тнир.=97°С. Элементный анализ для C2H5N9O3: Найдено: Н, 2.50; С, 11.90; N, 61.76. C2H5N9O3. Вычислено: Н, 2.48; С, 11.83; N, 62.06. ИК-спектр (KBr), v/см-1: 769, 811, 835, 960, 1053, 1088, 1105, 1128, 1193, 1227, 1308, 1429, 1611, 2146, 3067, 3168, 3275, 3316. Спектр ЯМР 13С (CD3OD, δ, м.д., 125.8 МГц): 163.0 (С(3а) и С(6а)). Спектр ЯМР 14N (ДМСО-d6, δ, м.д., 36.1 МГц): -8 (NO2, v½=25 Гц), -53 (N(5), v½=125 Гц), -335 (м, N2H5, v½=510 Гц).
Пример 3. Получение аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia).
Процесс получения аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia) проводят аналогично примеру 1, но на стадии 1 получения (E)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрила (VI) вместо CH2Cl2 используют хлороформ, на стадии 3 вместо метанола используют этанол, а на стадии 4 вместо метанола используют этанол. Получили аммониевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia) с суммарным выходом по всем стадиям равным 39%. Продукт идентичен (по ИК, ЯМР 1Н, 13С) соединению 1а, полученному по примеру 1.
Пример 4. Получение гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб).
Процесс получения гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб) проводят аналогично примеру 3, а на стадии 6 процесс проводят по примеру 2. Получили гидразиниевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб) с суммарным выходом по всем стадиям равным 39%. Продукт идентичен (по ИК, ЯМР 1Н, 13С) соединению Iб, полученному по примеру 2.
Пример 5. Получение аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia).
Процесс получения аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia) проводят аналогично примеру 1, но на стадии 2 получения 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (VII) процесс проводят без растворителя, нагревая (Е)-3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрил (VI) в колбе до 70°С в течение 1 ч (контроль ТСХ). Получили 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VII) с выходом 81%. Продукт идентичен (по ИК, ЯМР 1Н, 13С) соединению VII, полученному по примеру 1. Получили аммониевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia) с суммарным выходом по всем стадиям равным 33%. Продукт идентичен (по ИК, ЯМР 1Н, 13С) соединению 1а, полученному по примеру 1.
Пример 6. Получение гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб).
Процесс получения гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб) проводят аналогично примеру 5, а на стадии 6 процесс проводят по примеру 2. Получили гидразиниевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб) с суммарным выходом по всем стадиям равным 33%. Продукт идентичен (по ИК, ЯМР 1Н, 13С) соединению 16, полученному по примеру 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| Соли 3-амино-4-(1Н-тетразол-5-ил-NNO-азокси)фуразана и способы их получения | 2023 |
|
RU2804394C1 |
| Производные 3-(5-нитратометил-1Н-1,2,3-триазол-1-ил)-4-нитро-1,2,5-оксадиазола и способ их получения | 2023 |
|
RU2817968C1 |
| Замещенные [(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразаны и способ их получения | 2020 |
|
RU2747110C1 |
| 3-(4-Нитратометил-1Н-1,2,3-триазол-1-ил)-4-нитро-1,2,5-оксадиазол и способ его получения | 2023 |
|
RU2813466C1 |
| ПРОИЗВОДНЫЕ (1,2,3-ТРИАЗОЛИЛ)-1,2,5-ОКСАДИАЗОЛА, ПОТЕНЦИРУЮЩИЕ NO-ЗАВИСИМУЮ АКТИВАЦИЮ РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 2000 |
|
RU2158265C1 |
| 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения | 2017 |
|
RU2643363C1 |
| ПРОИЗВОДНЫЕ 4Н-БИС[1,2,5]ОКСАДИАЗОЛО[3,4-b:3',4'-f]АЗЕПИН-8,9-ДИАМИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2499799C2 |
| 3-(ТРИНИТРОМЕТИЛ-ONN-АЗОКСИ)-4-НИТРАМИНОФУРАЗАНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2485108C1 |
| ((3β-АЦЕТОКСИ-УРС-12-ЕН-28-ОИЛ-ОКСИАЦЕТОКСИ)МЕТИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ) МЕТИЛ)-4-МЕТИЛ-1,2,5-ОКСАДИАЗОЛ-2-ОКСИД, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2020 |
|
RU2739559C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДРАЗОНОВ 4-R-1,2,5-ОКСАДИАЗОЛ-3-КАРБОНОВОЙ КИСЛОТЫ | 2014 |
|
RU2557659C1 |
Изобретение относится к способу получения солей 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы (I), где X = NH4 (Ia) или N2H5 (Iб), заключающемуся в том, что 4-азидо-3-амино-[1,2,5]оксадиазол (V) подвергают взаимодействию с нитрозирующим реагентом в среде органической кислоты при пониженной температуре с последующей обработкой реакционной смеси бис(2-цианоэтил)амином в среде полярного апротонного органического растворителя, образующийся при этом 3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрил (VI) подвергают нагреванию, полученный при этом 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VII) обрабатывают основанием в среде полярного протонного органического растворителя, образующийся при этом 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VIII) подвергают обработке нитрующим реагентом в среде полярного апротонного органического растворителя с последующей обработкой реакционной смеси гидроксидом калия в среде полярного протонного органического растворителя при пониженной температуре, образующуюся при этом калиевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) обрабатывают нитратом серебра в воде, с последующим выделением полученной при этом серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) и далее, при необходимости получения аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia), полученное соединение X обрабатывают хлоридом аммония в воде, либо, при необходимости получения гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб), соединение X обрабатывают моногидрохлоридом гидразина в воде. Технический результат – разработан способ получения новых солей 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (I) с высоким выходом, которые могут найти применение в качестве энергоемких соединений могут представить интерес в качестве энергоемких наполнителей перспективных высокоимпульсных СТРТ и других энергетических конденсированных систем. 1 табл., 6 пр.
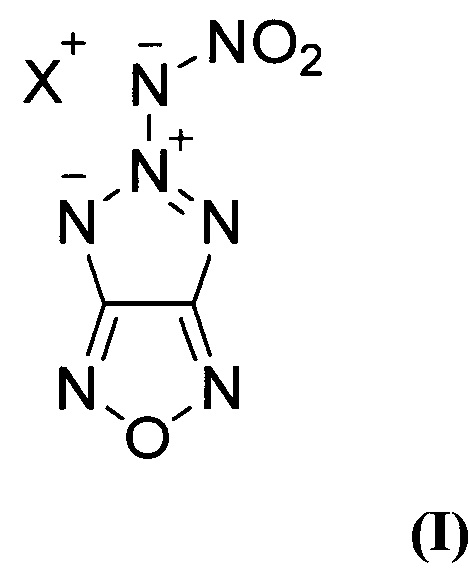
Способ получения солей 5-нитрамино-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола общей формулы
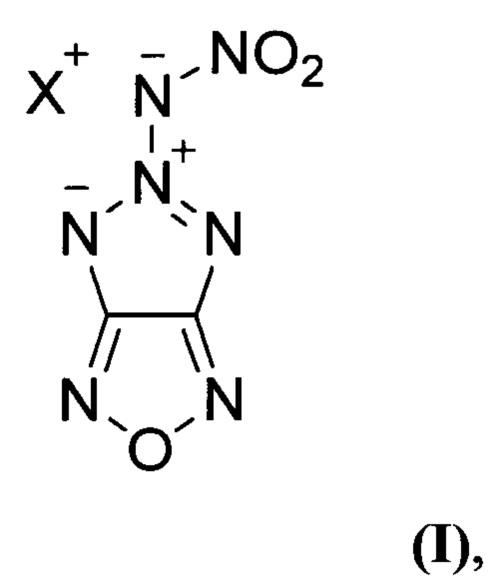
где X = NH4 (Ia) или N2H5 (Iб), заключающийся в том, что 4-азидо-3-амино-[1,2,5]оксадиазол (V) подвергают взаимодействию с нитрозирующим реагентом в среде органической кислоты при пониженной температуре с последующей обработкой реакционной смеси бис(2-цианоэтил)амином в среде полярного апротонного органического растворителя, образующийся при этом 3,3'-(3-(4-азидо-1,2,5-оксадиазоло-3-ил)триаз-2-ен-1,1-диил)дипропионитрил (VI) подвергают нагреванию, полученный при этом 5-(бис(2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VII) обрабатывают основанием в среде полярного протонного органического растворителя, образующийся при этом 5-((2-цианоэтил)амино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазол (VIII) подвергают обработке нитрующим реагентом в среде полярного апротонного органического растворителя с последующей обработкой реакционной смеси гидроксидом калия в среде полярного протонного органического растворителя при пониженной температуре, образующуюся при этом калиевую соль 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (IX) обрабатывают нитратом серебра в воде, с последующим выделением полученной при этом серебряной соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (X) и далее, при необходимости получения аммониевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Ia), полученное соединение X обрабатывают хлоридом аммония в воде, либо, при необходимости получения гидразиниевой соли 5-(нитрамино)-[1,2,3]триазоло[4,5-с][1,2,5]оксадиазола (Iб), соединение X обрабатывают моногидрохлоридом гидразина в воде.
| БАЛАБАНОВА С.П., ВОРОНИН А.А., Успехи в химии и химической технологии | |||
| ТОМ XXXVI, номер 13, 2022, стр | |||
| Питательный кран для вагонных резервуаров воздушных тормозов | 1921 |
|
SU189A1 |
| ALEXEY VORONIN ET AL, ACS Appl | |||
| Energ | |||
| Mat, vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| УПЛОТНЯЮЩЕЕ ПРИСПОСОБЛЕНИЕ К КАТКОВЫМ ИЛИ КОЛЕСНЫМ ЩИТОВЫМ ЗАТВОРАМ ГИДРОТЕХНИЧЕСКИХ СООРУЖЕНИЙ | 1927 |
|
SU9401A1 |
| X | |||
| LI ET AL, Chin J | |||
| Energy Mater., vol | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| КОЛЬЦЕВОЙ ПОДПЯТНИК | 1923 |
|
SU717A1 |
| 3-Амино-4-{ [4-(нитро-NNO-азокси)фуразан-3-ил]-NNO-азокси} фуразан и способ его получения | 2021 |
|
RU2768870C1 |
| 7-Нитро-3-(нитро-NNO-азокси)[1,2,4]триазоло[5,1-с][1,2,4]триазин-4-амин и способ его получения | 2019 |
|
RU2697843C1 |
| Замещенные [(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразаны и способ их получения | 2020 |
|
RU2747110C1 |
| 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения | 2017 |
|
RU2643363C1 |
Авторы
Даты
2024-01-30—Публикация
2023-03-16—Подача