1. Область изобретения
Настоящее изобретение относится к области химии функциональных производных карбоновых кислот, более конкретно настоящее изобретение относится к области синтеза амидразонов карбоновых кислот, 4-R-замещенных 1,2,5-оксадиазол-3-карбоновых кислот.
Также настоящее изобретение относится к области химии гетероциклических соединений, более конкретно к области производных 1,2,5-оксадиазола, включающих в свою структуру амидразоновый фрагмент, которые могут быть использованы в синтезе различных гетероциклических соединений, в частности производных 1,2,3-триазола, 1,2,4-триазола, тетразола 1,2,4-триазина, включающих в свой состав 1,2,5-оксадиазольный цикл.
2. Описание известного уровня техники
Амидразоны находят применение в производстве термостойких полимеров, фотоматериалов, представляют интерес как комплексоны, отдельные амидразоны обладают различного вида биологической активностью. Особенно ценны амидразоны в синтезе разнообразных гетероциклических соединений [1, 2, 3, 4, 5]. С другой стороны, производные 1,2,5-оксадиазола также представляют собой весьма интересные объекты для исследования не только с точки зрения многообразия и нетривиальности их химических превращений, проявляемой биологической активности [6, 7, 8, 9, 10, 11], но и с точки зрения использования их в качестве высокоэнтальпийных и высокоплотных энергоемких соединений [12, 13, 14].
В ряду производных 4-R-замещенных 1,2,5-оксадиазол-3-карбоновых кислот известно сравнительно ограниченное число примеров синтеза соответствующих амидразонов [15, 16, 17, 18, 19]. Во всех случаях синтез амидразонов 1,2,5-оксадиазол-3-карбоновых кислот основан на высокой лабильности цианогруппы 3-циано-1,2,5-оксадиазолов. Синтез амидразонов 1,2,5-оксадиазол-3-карбоновых кислот может быть проведен как в одну стадию при непосредственном взаимодействии цианогруппы с гидразином, так и в две стадии через промежуточное получение иминоэфиров.
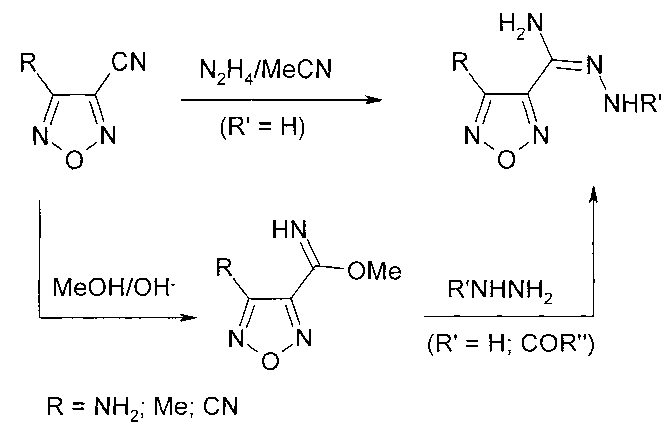
Необходимые для синтеза 3-циано-4-R-1,2,5-оксадиазолы получены окислением тетраацетатом свинца амидоксима 4-амино-1,2,5-оксадиазол-3-карбоновой кислоты (R=NH2) [15], или дегидратацией амидов 1,2,5-осадиазолкарбоновых кислот хлорокисью фосфора (R=NH2) [18], фосфорным ангидридом (R=Ме, CN) [20].
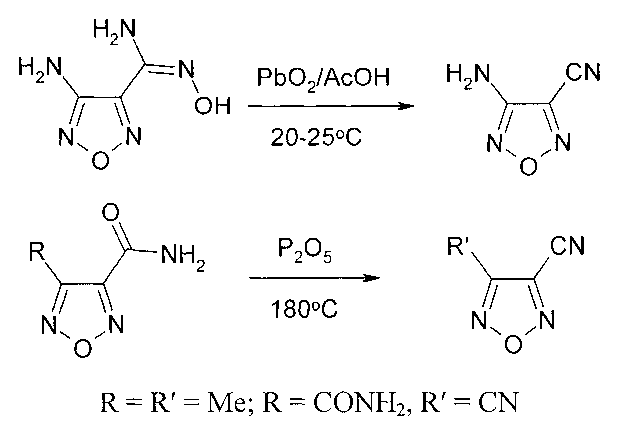
Амидразон 4-амино-1,2,5-оксадиазол-3-карбоновой кислоты был использован для синтеза таких энергоемких соединений, как 3-амино-(4-тетразол-5-ил)-1,2,5-оксадиазол, его солей, а также 3,3′-бис(тетразол-5-ил)-4,4′-азофуразана [21, 22, 23]. Также на основе амидразонов 1,2,5-оксадиазол-3-карбоновой кислоты был синтезирован ряд соединений, являющихся ингибиторами протеинкиназы [24].
3. Сущность изобретения
Основной недостаток известных способов получения амидразонов 4-R-производных 1,2,5-оксадиазол-3-карбоновой кислоты, заключающихся в присоединении гидразина к нитрильной группе соответствующих 3-цианозамещенных 1,2,5-оксадиазолов связан с низкой технологичностью используемых для введения в молекулу 1,2,5-оксадиазола нитрильной группы химических превращений (в частности, применение оксида свинца (IV) [15], гидролитической нестабильностью и сложностями выделения 4-амино-3-циано-1,2,5-оксадиазола или использованием высоких температур при получении потенциально взрывчатых других производных цианофуразана, а также малой доступностью амидов прочих 4-11-замещенных 1,2,5-оксадиазол-3-карбоновых кислот.
Способов получения амидразонов 4-R-производных 1,2,5-оксадиазол-3-карбоновой кислоты реакцией раскрытия 1,2,4-оксадиазольного цикла в литературе не найдено.
Задача, на решение которой направлено предложенное изобретение, состоит в получении целевых соединений, представляющих собой амидразоны 4-R-замещенных 1,2,5-оксадиазол-3-карбоновой кислоты менее трудоемким способом, пригодным для масштабирования, с большим выходом, улучшении экологичности синтеза, связанной с отсутствием образования в ходе проведения синтеза отходов солей, состоящих из соединений тяжелых металлов, в частности ацетатов свинца (II, IV), а также в повышении экономических показателей процесса.
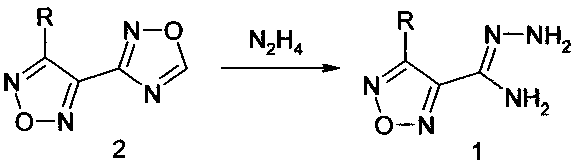
В настоящем изобретении защищается способ получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновых кислот восстановительным раскрытием незамещенного по атому С-5 1,2,4-оксадиазольного цикла при взаимодействии с гидразином замещенных по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола при температуре 20-60°C.
Для получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновых кислот в качестве замещенных по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола используют 3-R-4-(l,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолы (2), где заместитель R выбран из числа таких заместителей, как алкоксигруппа, аминогруппа, замещенная аминогруппа, морфолиногруппа.
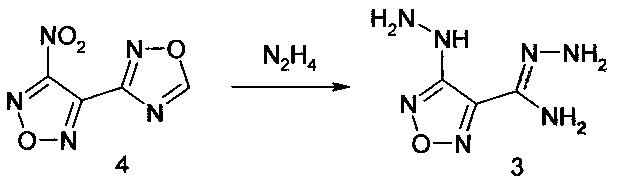
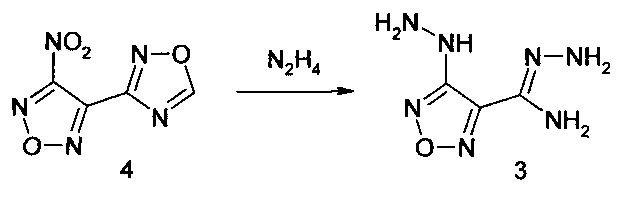
Для получения амидразона 4-гидразино-1,2,5-оксадиазол-3-карбоновой кислоты в качестве замещенного по атому С-3 1,2,5-оксадиазольного цикла производного 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола используют 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол (4).
В настоящем изобретении предложен способ получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновых кислот восстановительным раскрытием незамещенного по атому С-5 1,2,4-оксадиазольного цикла замещенных по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола при взаимодействии последних с гидразином. Необходимый для проведения данного синтеза гидразин может быть использован также в виде коммерчески более доступного гидразингидрата, а также в виде его растворов в воде и/или органических растворителях, таких как, например, низшие спирты (метанол, этанол, пропанол-1, пропанол-2), ацетонитриле и других растворителях, индифферентных к действию гидразина.
Инертность в аналогичных условиях 3-R-4-(5-метил-1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолов к действию гидразина позволяет предположить, что раскрытию незамещенного по атому С-5 1,2,4-оксадиазольного цикла предшествует образование соответствующего карбаниона, стабилизированного за счет значительного электроноакцепторного влияния 1,2,5-оксадиазольного цикла. Возможными интермедиатами описанных превращений могут выступать нитрилы 4-R-замещенных 1,2,5-оксадиазол-3-карбоновых кислот.
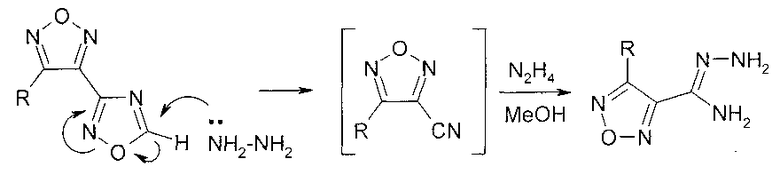
3-Амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол получен реакцией циклизации амидоксима 4-амино-1,2,5-оксадиазол-3-карбоновой кислоты при обработке триэтилортоформиатом в присутствии каталитических количеств Et2O·BF3 [25]. Проведение реакции в органическом растворителе (пропанол-2, толуол) позволяет использовать стехиометрическое количество триэтилортоформиата.
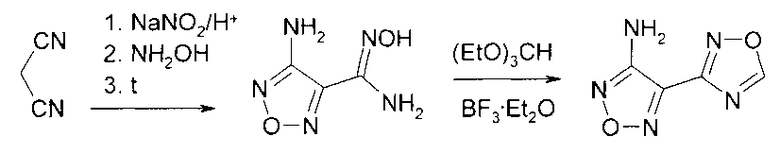
Синтез прочих 3-R замещенных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолов основан на замещении нитрогруппы 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола на нуклеофил. Необходимое для синтеза нитропроизводное получено окислением аминогруппы 3-амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола пероксидом водорода в серной кислоте при повышенной температуре.
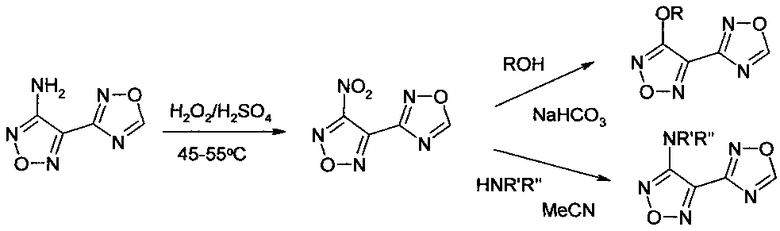
Таким образом, взаимодействие с гидразином синтетически доступных 3-R замещенных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолов представляет собой приемлемый и доступный с точки зрения укрупненных наработок способ получения амидразонов 1,2,5-оксадиазол-3-карбоновых кислот.
Варьирование химической структуры нуклеофила, вводимого в реакцию замещении нитрогруппы в 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазоле, позволяет применять защищаемый способ получения амидразонов 1,2,5-оксадиазол-3-карбоновых кислот для синтеза амидразонов различных 4-R-замещенных 1,2,5-оксадиазол-3-карбоновых кислот, выбор заместителя R которых определяется возможностями синтеза соответствующих 3-R-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолов, а также инертностью заместителя R к действию гидразина, и включает такие заместители R, как алкоксигруппа, моно- и дизамещенная аминогруппа, морфолиногруппа.
В другом варианте исполнения настоящего изобретения результат реакции 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола с гидразином является следствием следующих двух процессов: замещение нитрогруппы на гидразиновую и образование амидразоновой группы при раскрытии 1,2,4-оксадиазольного цикла в реакции с гидразином. В этом случае обработка 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола избытком гидразина непосредственно приводит к получению амидразона 4-гидразино-1,2,5-оксадиазол-3-карбоновой кислоты, т.е. наряду с протеканием процесса раскрытия 1,2,4-оксадиазольного цикла протекает реакция замещения нитрогруппы 1, 2, 5-оксадиазольного цикла на гидразиновую группу.
Амидразоны 4-R-1,2,5-оксадиазол-3-карбоновой кислоты могут быть использованы для синтеза различных гетероциклических соединений, включающих в качестве одного из заместителей 1,2,5-оксадиазольный цикл, например тетразолов, 1,2,4-триазолов, 1,2,4-диазинов, представляющих интерес как биологически активные, а также энергоемкие соединения.
Вполне очевидно, что настоящее изобретение не ограничено вышеописанными вариантами, и возможны и другие варианты в пределах объема изобретения (который ограничен формулой изобретения). Нижеследующие Примеры приведены для лучшего понимания настоящего изобретения и никоим образом не ограничивают область его применения. В ряде примеров приведены методики синтеза некоторых исходных соединений, необходимых для синтеза соответствующих 4-R-замещенных амидразонов 1,2,5-оксадиазол-3-карбоновой кислоты, часть примеров также приведена в качестве иллюстрации некоторых синтетических возможностей, получаемых согласно предложенному способу синтеза амидразонов 4-R-1,2,5-оксадиазол-3-карбоновой кислоты, синтез которых в настоящее время иными способами не известен. Специалисты в данной области техники должны понимать, что в предложенных методиках могут быть сделаны различные изменения, которые не изменяют объема и сущности настоящего изобретения. Все публикации, упомянутые в настоящем описании, доступны по уровню специалистам в той области техники, к которой принадлежит настоящее изобретение. Оптимальное время проведения реакций, указанных в Примерах, может быть определено посредством традиционных хроматографических способов слежения за ходом реакции. Выбор растворителя обычно некритичен, если применяемый растворитель инертен по отношению к происходящей реакции и растворяет реагенты в достаточной степени для осуществления реакции.
Примеры конкретного исполнения
Пример 1
3-Амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
1.43 кг (10 моль) амидоксима 4-амино-1,2,5-оксадиазол-3-карбоновой кислоты добавили при перемешивании к 1.6 кг (10.8 моль) триэтилортоформиата. К смеси прилили 10 мл эфирата трехфтористого бора и медленно нагрели при интенсивном перемешивании до начала кипения. В случае невозможности перемешивания реакционную массу можно разбавить безводным пропанолом-2. Смесь перемешивали при температуре кипения 1 ч. Разбавили в 2 раза горячей водой, нагрели до кипения и оставили кристаллизоваться. Осадок отфильтровали и перекристаллизовали из пропанола-2. Выход: 1.38 кг (90%), т.пл. 126-127°С (из воды).
1H ЯМР, δ, м.д.: 10.00 (1Н, с., СН); 6.50 (2Н, с., NH2). 13С ЯМР, δ, м.д.: 168.7; 158.6; 156.0; 137.4. ИК спектр (KBr), ν, см-1: 3480; 3320 (NH2); 3120 (СН); 1647 (NH2); 1014 (фуразан). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 154 (2.5) [М+1]+; 153 (100.0) [М]+; 123 (23.1) [Μ-NO]+; 96 (94.0); 69 (19.5); 58 (90.5); 54 (13.1); 53 (27.8); 42 (14.6); 30 (55.3) [NO]+; 29 (41.3) [СНО]+
Пример 2
3-Нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
765 г (5 моль) 3-амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола прибавили при интенсивном перемешивании при температуре 50-55°С к смеси, приготовленной из 1.5 л 36%-го раствора H2O2 и 1.7 л 94-96% H2SO4. По окончании экзотермической реакции смесь выдержали при температуре 50-55°С 30 мин, охладили до комнатной температуры, добавили 4 л воды и экстрагировали 2×1 л CH2Cl2. Органические слои промыли водой, упарили в вакууме, твердый остаток перекристаллизовали из метанола.
Выход: 769 г (84%), т.пл. 54-55°С (CCl4).
1H ЯМР, δ, м.д.: 10.08 (1Н, с., СН). 13С ЯМР, δ, м.д.: 169.2 (СН); 160.0 (CNO2); 156.5; 141.1. ИК спектр (KBr), ν, см-1: 3430; 3138; 1609; 1564; 1539; 1505; 1422; 1408; 1307; 1270; 1116; 1035; 965; 910; 883; 823; 773; 742; 616; 586; 475; 418; 404. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 183 (1.2) [М]+; 137 (1.6) [M-NO2]+; 77 (21.7); 46 (100); 38 (13.4); 30 (98.8) [NO]+.
Пример 3
3-Метокси-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
К раствору 18.3 г (0.1 моль) 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола в 75 мл метанола добавили 15.1 г (1.8 моль) NaHCO3. Реакционную массу перемешивали при 20-25°С 8 ч. Смесь отфильтровали от осадка неорганических солей и упарили до 1/3 первоначального объема в вакууме. Добавили 100 мл воды. Выпавший осадок отфильтровали и перекристаллизовали из смеси метанол-вода 1:1 (по об.). Выход: 11.4 г (68%), т.пл. 103-104°С.
1H ЯМР, δ, м.д.: 9.98 (3Н, с. СН); 4.19 (3Н, с., ОСН3). 13С ЯМР, δ, м.д.: 168.9; 164.7; 157.6; 137.7; 60.64. Масс-спектр, m/z (Iотн, %): 168 (5.2) [М]+; 138 (8.7) [Μ-NO]+; 83 (19.0); 82 (19.6); 54 (17.9); 43 (60.1); 38 (12.1); 30 (100) [NO]+; 29 (43.6). ИК спектр (KBr), ν, см-1: 3122; 3036; 2954; 2919; 1621; 1566; 1521; 1450; 1415; 1349; 1272; 1200; 1127; 1094; 1030; 1016; 982; 958; 893; 868; 767; 705; 616; 434.
Пример 4
3-R,R′-амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолы
К раствору 18.3 г (0.1 моль) 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола в 100 мл ацетонитрила при интенсивном перемешивании и охлаждении до 5-10°С добавили по каплям 0.21 моль соответствующего амина (газообразные при комнатной температуре амины использовали в виде 27-33% водных растворов). После дозировки амина смесь перемешивали при комнатной температуре 1-2 ч, затем отогнали растворитель в вакууме, остаток обработали холодной водой. Выпавший осадок отфильтровали и перекристаллизовали из смеси метанол-вода 1:1 (по об.).
а) 3-N-Метиламино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
(R=СН3, R′=Н)
Выход: 10.5 г (63%), т.пл. 206-207°С (МеОН).
1H ЯМР, δ, м.д.: 10.01 (1Η, с., СН); 6.4 (1Н, д., J4.02 Гц, NH); 2.91 (3Н, д., J5.02 Гц, СН3). 13С ЯМР, δ, м.д.: 168.7; 158.5; 17.0; 136.7; 31.31. Масс-спектр, m/z, Iотн.: 168 (7.3) [М+1]+; 167 (100.0) [М]+; 138 (20.1); 96 (44.7); 82 (39.6); 72 (90.8); 68 (15.1); 55 (16.1); 53 (39.6); 42 (99.3); 30 (58.6); 29 (35.6). ИК спектр (KBr), ν, см-1: 3432; 3410; 3371; 3312; 3075; 2957; 1659; 1634; 1570; 1547; 1417; 1331; 1217; 1185; 1028; 1010; 942; 866; 819; 573; 462; 436
б) 3-N,N-Диметиламино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
(R=R′=СН3)
Выход: 12.5 г (69%), светло-желтая подвижная жидкость, nD 25=1.514.
1H ЯМР, δ, м.д.: 9.95 (1Н, с., СН); 2.91 (6Н, с, 2СН3). 13С ЯМР, δ, м.д.: 169.2; 168.8; 168.7; 159.5; 158.8; 137.6; 41.05 (СН3). ИК спектр (KBr), ν, см-1: 3127; 2965; 2924; 2884; 2811; 1596; 1570; 1526; 1453; 1426; 1343; 1282; 1213; 1111; 1061; 1015; 963; 894; 874; 823; 764; 614; 570; 457. Масс-спектр, m/z, Iотн.: 182 (1.2) [М+1]+; 181 (22.3) [М]+; 152 (17.6); 110 (16.9); 86 (19.2); 82 (25.1); 69 (30.3); 67 (32.1); 56 (64.6); 43 (17.9); 42 (58.3) [CH2=NCH2]+; 30 (100) [NO]+; 29 (66.8).
в) 3-Морфолино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол
(R,R′=(С2Н4)2O)
Выход: 18.7 г (84%), т.пл. 135-136°С.
1H ЯМР, δ, м.д.: 10.00(1Н, с, СН); 3.73(3Н, м., СН2ОСН2); 3.30(3Н, м., CH2NCH2). 13СЯМР, δ, м.д.: 169.0(СН); 159.4; 158.6; 138.8; 66.72; 49.38. Масс-спектр, m/z, /отн.: 224(7.2) [М+1]+; 223(100.0) [М]+; 192(44.4); 180(52.8); 166(10.4); 138(23.5); 135(23.6); 108(11.0); 107(15.8); 86(25.9) [0(C2H4)2N]+; 72(10.6); 70(22.5); 69(12.6); 68(10.7); 66(13.9); 56(57.4); 55(41.4); 54(53.2); 53(19.8); 45(45.8); 43(27.9); 42(38.1); 41(27.1); 40(20.6); 30(58.0); 29(47.6). ИК спектр (КВг), ν, см-1: 3123; 3035; 2983; 2913; 2870; 2849; 1593; 1535; 1524; 1449; 1439; 1283; 1266; 1139; 1112; 1088; 1050; 1016; 966; 895; 842; 770; 723; 696; 613; 556; 411.
Пример 5
N,N-бис[4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол-3-ил]этан-1,2-диамин
К раствору 18.3 г (0.1 моль) 3-(4-нитро-1,2,5-оксадиазол-3-ил)-1,2,4-оксадиазола в 100 мл ацетонитрила при интенсивном перемешивании и охлаждении до 5-10°С добавили по каплям в течение 1 ч раствор 6.5 г (0.108 моль) этилендиамина в 30 мл ацетонитрила. По окончании дозировки смесь перемешивали при комнатной температуре 1-2 ч, подкислили АсОН до рН 7 и отогнали растворитель в вакууме, остаток обработали холодной водой. Выпавший осадок отфильтровали и перекристаллизовали из смеси метанол/уксусная кислота 1:1 (по об.).
Выход: 10.6 г (64%), т.пл. 235-236°С (АсОН).
1H ЯМР, δ, м.д.: 9.99 (2Н, с., 2СН); 6.56 (2Н, с., 2NH); 3.60 (4Н, м., СН2СН2). 13С ЯМР, δ, м.д.: 168.7 (СН); 158.5; 156.4; 137.0; 43.13 (СН2). Масс-спектр, m/z, Iотн.: 332 (0.2) [М]+; 179 (13.7); 167 (12.6); 166 (46.7) [М/2]+; 136 (13.0); 123 (11.3); 96 (13.6); 69 (19.5); 55 (28.6); 54 (4.1); 53 (15.6); 43 (42.9); 42 (31.7); 41 (36.4); 40 (10.1); 30 (100) [NO]+; 29 (41.9). ИК спектр (KBr), ν, см-1: 3383; 3107; 3036; 2991; 2945; 1624; 1586; 1524; 1499; 1454; 1330; 1284; 1229; 1139; 1096; 1020; 963; 901; 872; 765; 714; 612; 584; 575; 522; 421. Вычислено, %: С 36.15, Η 2.43, N 42.16. C10H8N10O4. Найдено, %: С 36.43, Η 2.66, N 42.02.
Пример 6
N,N-бис[4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол-3-ил]пиперазин
К раствору 18.3 г (0.1 моль) 3-(4-нитро-1,2,5-оксадиазол-3-ил)-1,2,4-оксадиазола в 100 мл ацетонитрила присыпали 10 г (0.12 моль) NaHCO3 и затем при интенсивном перемешивании и охлаждении до 5-10°С добавили по каплям в течение 1 ч раствор 10.7 г (0.0505 моль) пиперазин-гексагидрата в 30 мл ацетонитрила. По окончании дозировки смесь перемешивали при комнатной температуре 1-2 ч, подкислили АсОН до рН 7. Смесь разбавили 100 мл воды и отогнали часть ацетонитрила (≈50 мл) в вакууме. Выпавший осадок отфильтровали и перекристаллизовали уксусной кислоты 1:1.
Выход: 14.1 г (79%), т.пл. 235-236°С (АсОН).
1H ЯМР, δ, м.д.: 10.0 (1Н, с., 2СН); 3.48 (8Н, с., 4СН2). 13С ЯМР, δ, м.д.: 168.9 (СН); 159.2; 158.6; 139.0; 48.31 (СН2). Масс-спектр, m/z, Iотн.: 359 (4.9) [М+1]+; 358 (30.6) [М]+; 221 (67.8); 192 (61.9); 180 (21.3); 110 (30.8); 96 (20.2); 81 (34.9); 70 (22.7); 69 (37.4); 68 (35.4); 56 (87.8); 55 (52.6); 54 (67.5); 53 (28.2); 43 (31.8); 42 (78.3); 41 (41.9); 40 (28.4); 30 (100) [NO]+; 29 (55.2). ИК спектр (К-Br), ν, см-1: 3118; 3037; 2973; 2918; 2888; 2855; 1590; 1541; 1525; 1445; 1437; 1390; 1282; 1262; 1143; 1098; 1044; 1014; 965; 894; 767; 697; 613; 562; 444. Вычислено, %: С 40.23, Η 2.81, N 39.10. C12H10N10O4. Найдено, %: С 40.02, Η 2.94, N 38.95.
Пример 7
Амидразон 4-амино-1,2,5-оксадиазол-3-карбоновой кислоты
В 1 л метанола присыпали 200 г (1.3 моль) 3-амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола, смесь нагрели до 40-45°С и при этой температуре добавили 13 мл (0.26 моль) гидразингидрата. После окончания тепловыделения смесь перемешивали при 40-45°С 30 мин, упарили 2/3 растворителя в вакууме, добавили 50 мл горячей воды, нагрели до кипения и после охлаждения до комнатной температуры отфильтровали выпавший осадок.
Выход: 15.5 г (84%), т.пл. 170-171°С (лит. [18] 171°С).
1H ЯМР, δ, м.д.: 6.39 (2Н, с, NH2); 5.84 (2Н, с., NH2); 5.69 (2Н, с., NH2) (лит. [18] 6.31 (2Н, с., NH2); 5.73 (2Н, с., NH2); 5.60 (2Н, с., NH2)). 13С ЯМР, δ, м.д.: 155.1 (С-4); 141.2; 137.2. Масс-спектр, m/z, Iотн.: 143 (3.1) [М+1]+; 142 (100.0) [М]+; 85 (73.0); 68 (22.0); 58 (19.5); 55 (13.5); 53 (21.5); 43 (24.2); 42 (15.6); 31 (17.0); 30 (25.7) [NO]+; 29 (14.9). ИК спектр (KBr), ν, см-1: 3470; 3415; 3354; 3333; 2918; 2849; 1660; 1611; 1555; 1466; 1440; 1405; 1323; 1194; 1144; 1049; 992; 871; 841; 787; 754; 721; 574; 419 (лит. [18] 3480, 3418, 3320, 3223 (ΝΗ2, ΝΗ), 1660 (ΝΗ2), 1612 (C=N)).
Пример 8
Амидразоны 4-R,R′-амино-1,2,5-оксадиазол-3-карбоновой кислоты
К подогретому до 50-60°С раствору 0.1 моль соответствующего 3-R,R′-амино-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола в 50 мл метанола добавили по каплям 11 г (0.22 моль) гидразингидрата. После окончания тепловыделения смесь перемешивали при 40-45°С 30 мин. Реакционную массу разбавили в 2 раза водой и отогнали большую часть метанола в вакууме до начала кристаллизации продукта. Охладили до 10-15°С, отфильтровали выпавший осадок.
а) Амидразон 4-N-метиламино-1,2,5-оксадиазол-3-карбоновой кислоты ((R=СН3, R′=Н)
Выход: 11.5 г (73%), т.пл. 126-127°С (МеОН).
1H ЯМР, δ, м.д.: 6.42 (1Н, кв., J4.52 Гц, NH); 5.86 (2Н, с., NH2); 5.67 (2Н, с., NH2); 2.86 (3Н, д., J 5.27 Гц, СН3). 13С ЯМР, δ, м.д.: 156.4; 140.8; 137.0; 30.80. Масс-спектр, m/z, Iотн.: 157 (0.8) [М+1]+; 156 (33.8) [М]+; 85 (100); 68 (36.1); 58 (27.3); 57 (13.8); 55 (24.4); 53 (49.1); 43 (35.7); 42 (66.7); 41 (18.8); 40 (20.9); 31 (43.7); 30 (75.8); 29 (35.8). ИК спектр (KBr), ν, см-1: 3402; 3377; 3322; 3226; 2949; 2915; 2814; 1659; 1632; 1614; 1579; 1557; 1417; 1330; 1295; 1147; 1032; 1000; 875; 864; 792; 563; 482; 425; 403.
б) Амидразон 4-N,N-диметиламино-1,2,5-оксадиазол-3-карбоновой кислоты ((R=R′=СН3)
Выход: 13.3 г (78%), т.пл. 149-151°С (МеОН).
1H ЯМР, δ, м.д.: 5.88 (2Н, уш.с., NH2); 5.39 (2Н, уш.с., NH2); 2.90 (6Н, с., 2СН3). 13С ЯМР, δ, м.д.: 159.3; 144.3; 135.2; 40.86. Масс-спектр, m/z, Iотн.: 171 (5.2) [М+1]+; 170 (66.7) [М]+; 154 (16.0); 127 (36.2); 110 (12.2); 85 (17.8); 83 (10.6); 71 (16.2); 70 (27.0); 69 (50.3); 69 (50.3); 67 (52.8); 58 (30.3); 57 (24.5); 56 (46.9); 55 (25.1); 54 (16.5); 53 (22.8); 44 (76.4); 43 (36.1); 42 (100) [CH2=N=CH2]+; 41 (23.6); 32 (87.7); 31 (35.9); 30 (64.1); 29 (55.7). ИК спектр (К-Вк), ν, см-1: 3382; 3323; 3166; 2956; 2872; 2799; 1658; 1605; 1575; 1536; 1448; 1427; 1405; 1328; 1212; 1154; 1061; 1012; 905; 785; 639; 600; 561; 520; 420
в) Амидразон 4-Т-морфолино-1,2,5-оксадиазол-3-карбоновой кислоты ((R,R′=(С2Н4)2O))
Выход: 17.4 г (82%), т.пл. 136-137°С (МеОН).
1H ЯМР, δ, м.д.: 5.81 (2Н, с., NH2); 5.52 (2Н, с., NH2); 3.70 (4Н, м., СН2ОСН2); 3.31 (4Н, м., CH2NCH2). 13С ЯМР, δ, м.д.: 158.8; 144.6; 135.0; 65.82; 49.22. Масс-спектр, m/z, Iотн.: 213 (2.2) [M+1]+; 212 (24.6) [М]+; 197 (16.3); 196 (57.4); 181 (15.6); 179 (10.6); 140 (16.1); 127 (35.7); 111 (15.8); 110 (25.9); 97 (17.4); 97 (17.4); 86 (78.5) [O(C2H4)2N]+; 85 (21.4); 84 (19.0); 70 (31.6); 69 (27.3); 69 (19.6); 67 (27.9); 66 (24.3); 58 (42.2); 57 (31.8); 56 (54.3); 55 (57.0); 54 (60.4); 53 (29.0); 52 (12.0); 45 (69.7); 44 (35.1); 43 (72.3); 42 (89.8); 41 (66.2); 40 (35.9); 39 (14.8); 31 (62.8); 30 (100); 29 (100). ИК спектр (KBr), ν, см-1: 3438; 3359; 2999; 2960; 2931; 2877; 2849; 1647; 1547; 1509; 1448; 1314; 1269; 1223; 1192; 1120; 1075; 1029; 995; 925; 846; 770; 704; 572; 557.
Пример 9
Амидразон 4,4′-(этан-1,2-диилдиимино)бис(1,2,5-оксадиазол-3-карбоновой кислоты)
К подогретому до 50-60°С раствору 3.3 г (0.01 моль) N,N′-бис[4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол-3-ил]этан-1,2-диамина в 25 мл метанола добавили по каплям 2.2 г (0.044 моль) гидразингидрата. После окончания тепловыделения смесь перемешивали при 40-45°С 30 мин. Реакционную массу разбавили в 2 раза водой и отогнали большую часть метанола в вакууме до начала кристаллизации продукта. Охладили до 10-15°С, отфильтровали выпавший осадок.
Выход: 2.1 г (68%), т.пл. 223-224°С (с разл.) (МеОН).
1H ЯМР, δ, м.д.: 6.70 (2Н, с., 2NH); 5.89 (4Н, с., 2NH2); 5.66 (4Н, с., 2NH2); 3.46 (4Н, с., 2СН2). 13С ЯМР, δ, м.д.: 155.6; 140.8; 137.0; 42.99. Масс-спектр, m/z, Iотн.: 311 (2.4) [М+1]+; 310 (21.5) [М]+; 155 (100) [М/2]+; 138 (12.3); 85 (26.3); 68 (11.4); 58 (10.8); 43 (18.1); 42 (11.7); 31 (15.1); 30 (18.5) [NO]+; 29 (10.2). ИК спектр (KBr), ν, см-1: 3403; 3362; 3230; 3141; 2933; 1643; 1599; 1557; 1452; 1331; 1316; 1241; 1201; 1141; 1038; 890; 865; 789; 754; 733; 695; 647; 586; 563; 512; 429; 417.
Пример 10
Амидразон 4,4′-(пиперазин-1,4-диилбис(1,2,5-оксадиазол-3-карбоновой кислоты)
К подогретой до 50-60°С суспензии 3.6 г (0.01 моль) N,N-бис[4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол-3-ил]пиперазина в 50 мл метанола добавили по каплям 2.2 г (0.044 моль) гидразингидрата. После окончания тепловыделения смесь перемешивали при 40-45°С 30 мин. Реакционную массу разбавили в 2 раза водой и отфильтровали выпавший продукт.
Выход: 2.9 г (87%), т.пл. 221-222°С (МеОН).
1H ЯМР, δ, м.д.: 5.82 (4Н, с., 2NH2); 5.57 (4Н, с., 2NH2); 3.45 (8Н, с., 4СН2). 13С ЯМР, δ, м.д.: 158.7; 144.6; 134.9; 48.16 (СН2). Масс-спектр, m/z, Ioтн.: 337 (0.7) [М+1]+; 336 (8.8) [М]+; 321 (27.5) [M-NH]+; 320 (16.3); 181 (38.4); 179 (13.1); 169 (12.3); 155 (100); 110 (13.7); 85 (28.3); 84 (19.4); 81 (16.8); 70 (14.4); 69 (23.8); 68 (20.8); 67 (20.7); 58 (29.7); 57 (21.6); 56 (42.3); 55 (31.5); 54 (33.1); 53 (18.4); 44 (21.6); 43 (28.5); 42 (54.2); 41 (26.3); 31 (26.5); 30 (42.5); 29 (23.4). ИК спектр (KBr), ν, см-1: 3377; 3298; 3239; 3192; 3001; 2973; 2915; 2868; 1666; 1509; 1448; 1439; 1384; 1275; 1269; 1180; 1145; 1006; 927; 892; 865; 781; 718; 485; 440. Вычислено, %: С 35.71, Η 4.80, N 49.98. C10H16N12O2. Найдено, %: С 35.38, Η 4.98, N 49.64.
Пример 11
Амидразон 4-метокси-1,2,5-оксадиазол-3-карбоновой кислоты
К подогретому до 50°С раствору 16.8 г (0.1 моль) 3-метокси-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола в 100 мл метанола добавили по каплям 11 г (0.22 моль) гидразингидрата, поддерживая температуру в реакционной смеси не выше 55°С. По окончании дозировки гидразингидрата реакционную массу оставили охлаждаться на воздухе до комнатной температуры. Реакционную массу разбавили в 2 раза водой и отогнали метанол в вакууме. Выпавший осадок отфильтровали, промыли водой и перекристаллизовали из метанола.
Выход: 11.1 г (71%), т.пл. 111 -112°С (МеОН).
1H ЯМР, δ, м.д.: 5.74 (2Н, с., NH2); 5.66 (2Н, с., NH2); 4.03 (3Н, с., ОСН3). 13С ЯМР, δ, м.д.: 164.1; 142.5; 133.9; 59.69 (ОСН3). Масс-спектр, m/z, Iотн.: 158 (2.6) [М+1]+; 157 (53.6) [М]+; 126 (3.3) [M-NO]+; 84 (13.9); 69 (11.9); 67 (13.0); 58 (72.2); 57 (30.4); 56 (15.1); 55 (25.3); 54 (31.7); 53 (33.0); 44 (48.6); 43 (37.7); 42 (34.4); 41 (22.3); 40 (18.2); 31 (70.0); 30 (100); 29 (67.9). ИК спектр (KBr), ν, см-1: 3410; 3394; 3219; 2999; 2944; 2920; 1652; 1570; 1538; 1437; 1372; 1211; 1174; 1043; 983; 920; 874; 785; 701; 659; 579; 431.
Пример 12
4-R-3-(тетразол-5-ил)-1,2,5-оксадиазолы
К 20 мл уксусной кислоты добавили 0.02 моль соответствующего амидразона 4-R-1,2,5-оксадиазол-3-карбоновой кислоты. Реакционную массу охладили до 10°С и при этой температуре при интенсивном перемешивании добавили по каплям раствор 1.5 г (0.0217 моль) NaNO2 в 5 мл воды. По окончании дозировки нитрита натрия реакционную массу перемешивали при 10-15°С 30 мин, подкислили конц. HCl до рН1. Растворитель отогнали в вакууме, к остатку добавили 20 мл воды. Выпавший осадок отфильтровали и перекристаллизовали из метанола. Если продукт выпадает в виде масла, тетразол выделяли в виде аммониевой соли. В этом случае выпавшее масло экстрагировали 2×20 мл CH2Cl2. Объединенные органические слои промыли водой (2×20 мл) и экстрагировали 20 мл 10%-го водного раствора аммиака. Водный слой отделили, упарили в вакууме, остаток перекристаллизовали из метанола.
а) 4-Амино-3-(тетразол-5-ил)-1,2,5-оксадиазол
Выход: 2.3 г (75%), т.пл. 211-212°С (лит. [18] 211-212°С, [26] 215.79°С, 1H ЯМР, δ, м.д.: 6.60 (2Н, с., NH2). 13С ЯМР, δ, м.д.: 155.2; 147.7; 136.3. Масс-спектр, m/z, Iотн.: 11.1 (153) [М]+; 125 (6.7) [M-N2]+; 96(36.4) [M-2N2]+; 58 (16.7); 54 (21.4); 53 (70.1); 44 (34.5); 43 (30.2); 40 (23.5); 39 (23.6); 38 (24.8); 30 (100) [NO]+; 29 (48.3). ИК спектр (KBr), ν, см-1: 3459; 3357; 3122; 3029; 2939; 2840; 2777; 2725; 2629; 2575; 2483; 1699; 1641; 1622; 1503; 1450; 1408; 1392; 1187; 1086; 1034; 996; 982; 883; 516; 481; 419.
б) 4-N-Метиламино-3-(тетразол-5-ил)-1,2,5-оксадиазол
Продукт выделен без перевода в аммонийную соль.
Выход: 2.1 г (63%), т.пл. 145-146°С (МеОН).
1H ЯМР, δ, м.д.: 7.51 (1Н, уш.с., NH); 6.57 (1Н, уш.с., NH); 2.94 (3Н, с., СН3). 13С ЯМР, δ, м.д.: 156.9; 147.7; 136.1; 31.26. Масс-спектр, m/z, Iотн.: 167 (16/1) [М]+; 139 (0.5) [M-N2]+; 96 (27.4); 82 (10.1); 72 (28.7); 68 (18.5); 67 (21.5); 55 (19.5); 53 (67.2); 52 (12.2); 44 (27.8); 43 (16.2); 42 (100); 41 (21.0); 40 (18.2); 39 (17.7); 38 (21.7); 30 (91.6); 29 (49.6). ИК спектр (KBr), ν, см-1: 3382; 3087; 3035; 2997; 2918; 2901; 2881; 2831; 2803; 1626; 1598; 1528; 1497; 1418; 1322; 1225; 1180; 1038; 1019; 989; 882; 583; 573; 522; 425; 410.
в) 4-N,N-Диметиламино-3-(тетразол-5-ил)-1,2,5-оксадиазол (аммониевая соль)
Выход 2.2 г (56%), т.пл. 170-171°С (i-PrOH).
1H ЯМР, δ, м.д.: 7.21 (4Н, уш.с., NH4 +); 2.81 (6Н, с., 2СН3). 13С ЯМР, δ, м.д.: 159.9; 150.2; 142.6; 40.90. Масс-спектр, m/z, Iотн.: 182 (0.8) [М+1]+; 181 (25.6) [М]+; 153 (1.3) [M-N2]+; 152 (16.4) [M-N2-Н]+; 86 (16.6); 82 (48.2); 69 (34.5); 67 (46.7); 56 (45.8); 55 (18.0); 54 (11.1); 53 (24.9); 52 (17.6); 44 (46.8); 43 (39.0); 42 (100); 41 (24.2); 40 (21.9); 39 (14.1); 38 (15.4); 30 (98.3); 29 (62.9). ИК спектр (KBr), ν, см-1: 3226; 3169; 2965; 2851; 1587; 1563; 1466; 1439; 1410; 1144; 1134; 1038; 1001; 933; 889; 591; 577.
в) 4-Морфолино-3-(тетразол-5-ил)-1,2,5-оксадиазол
Продукт выделен без перевода в аммонийную соль.
Выход 4.0 г (89%), т.пл. 201-203°С (с разл.) (МеОН).
1H ЯМР, δ, м.д.: 17.0 (1Н, уш.с., NH); 3.72 (4Н, м., СН2ОСН2); 3.32 (4Н, м., CH2NCH2). 13С ЯМР, δ, м.д.: 160.3; 159.3; 142.6; 65.73; 49.32. Масс-спектр, m/z, Iотн.: 223 (0.8) [М]+; 155 (10.4) [M-CHN4]+; 125 (11.8); 96 (33.7); 86 (28.5) [N(C2H4)2O]+; 85 (19.3); 70 (20.2); 69 (12.8); 67 (14.4); 66 (26.5); 57 (16.0); 56 (78.3); 55 (55.8); 54 (59.1); 45 (80.7); 44 (71.1); 42 (86.4); 41 (50.8); 40 (50.8); 39 (13.8); 30 (100). ИК спектр (KBr), ν, см-1: 3457; 2931; 2850; 2733; 2685; 2576; 1739; 1551; 1498; 1453; 1376; 1323; 1311; 1267; 1153; 1106; 1068; 1052; 1014; 919; 879; 837; 748; 566; 555.
г) 4-Метокси-3-(тетразол-5-ил)-1,2,5-оксадиазол (аммониевая соль)
Выход: 2.5 г (68%), т.пл. 184-185°С (i-PrOH).
1H ЯМР, δ, м.д.: 6.80 (4Н, уш.с., NH4 +); 4.12 (2Н, с., ОСН3); 3.78 (1Н, с., ОСН3). 13С NMR: 164.7; 149.0; 141.0; 138.7; 108.4; 59.87; 57.25 (2:1). Масс-спектр, m/z, Iотн.: 168(0.5) [М]+; 167 (6.1); 140 (15.8) [M-N2]+; 67 (11.1); 55 (19.1); 54 (26.6); 53 (13.5); 45 (19.9); 44 (17.3); 43 (42.4); 42 (18.0); 39 (11.5); 38 (24.0); 36 (30.3); 30 (100); 29 (57.8). ИК спектр (KBr), ν, см-1: 3156; 3045; 3035; 2837; 1629; 1570; 1512; 1452; 1396; 1214; 1180; 1153; 1040; 993; 982; 866; 813; 709; 700; 582; 447; 430; 409.
д) 1,4-бис[4-(2H-тетразол-5-ил)-1,2,5-оксадиазол-3-ил]пиперазин
Выход: 6.4 г (90%), т.пл. 236-237°С (АсОН).
1H ЯМР, δ, м.д.: 5.35 (2Н, уш.с., 2NH); 3.56 (8Н, с., 4СН2). 13С ЯМР, δ, м.д.: 159.0; 148.1; 138.6; 48.22 (СН2). Масс-спектр, m/z, Iотн.: 192 (54.2); 180 (14.40); 179 (14.6) [М/2]+; 166 (31.3); 69 (23.9); 68 (12.3); 67 (35.8); 56 (39.4); 55 (50.3); 53 (19.9); 52 (16.6); 44 (91.2); 43 (39.8); 42 (93.5); 41 (38.4); 40 (13.9); 30 (100) [NO]+; 29 (54.0). ИК спектр (KBr), ν, см-1: 3469; 2919; 2853; 1608; 1552; 1451; 1422; 1407; 1271; 1141; 1068; 1059; 1016; 981; 573; 486.
Пример 13
4-R-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазолы
К 10 мл уксусного ангидрида добавили 0.01 моль соответствующего амидразона 4-R-1,2,5-оксадиазол-3-карбоновой кислоты и 1 каплю конц. H2SO4. Реакционную массу выдержали при 50-60°С 30 мин, разбавили 20 мл метанола и упарили в вакууме. Остаток промыли водой и перекристаллизовали из метанола.
а) 4-N-Ацетиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
Выход 1.9 г (91%), т.пл. 288-289°С (МеОН).
1H ЯМР, δ, м.д.: 14.41 (1Η, с., NH); 10.32 (1Н, с., NH); 2.48 (3Н, с., СН3); 2.19 (3Н, с., СОСН3). 13С ЯМР, δ, м.д.: 168.9 (00); 155.0 (С4-триазол); 150.4; 149.7; 143.0; 23.78 (COCH3); 11.98 (CH3). Масс-спектр, m/z, Iотн.: 208 (4.5) [М]+; 193 (12.3); 166 (22.0); 109 (74.6); 43 (100) [СН3СО]+; 42 (46.5); 32 (25.7); 30 (19.6); 29 (10.5). ИК спектр (KBr), ν, см-1: 3396; 3302; 3220; 1703; 1563; 1546; 1532; 1373; 1320; 1237; 1173; 1048; 1035; 979; 889; 874; 839; 675; 665; 592; 524.
б) 4-Амино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
К смеси 5 мл метанола, 5 мл воды и 0.5 мл конц. HCl добавили 1.6 г (7.5 ммоль) 4-N-ацетиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазола. Реакционную массу нагрели до кипения и кипятили с обратным холодильником 1 ч. Затем из полученного раствора отогнали метанол при атмосферном давлении и оставили кристаллизоваться. Отфильтровали выпавший осадок и перекристаллизовали из метанола.
Выход 1.1 г (87%), т.пл. 232-233°С.
1H ЯМР, δ, м.д.: 16.0-13.0 (1Н, уш.с., NH); 8.0-5.0 (2Н, уш.с., NH2); 2.47 (3Н, с., СН3). 13С ЯМР, δ, м.д.: 155.7 (C-NH2); 155.1; 151.2; 139.9; 12.02. Масс-спектр, m/z, Iотн.: 167 (0.7) [М+1]+; 166 (12.4) [М]+; 109 (100); 95 (17.0); 69 (16.6); 56 (12.6); 53 (19.9); 42 (64.1); 41 (10.1); 40 (10.0); 30 (42.6); 29 (20.4). ИК спектр (KBr), ν, см-1: 3499; 3393; 3154; 2919; 2850; 1635; 1603; 1445; 1402; 1375; 1179; 1137; 1058; 1011; 981; 892; 854; 567; 411.
в) 4-N-Ацетил-N-метиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
Выход: 1.6 г (74%), т.пл. 206-207°С (МеОН).
1H ЯМР, δ, м.д.: 14.39 (1Н, уш.с., NH); 3.35 (1Н, с., СН3); 3.17 (2Н, уш.с., СН3); 2.46 (3Н, с., СН3); 2.19 (1Н, уш.с., СН3); 1.84 (2Н, уш.с., СН3). 13С ЯМР, δ, м.д.: 169.5 (00); 155.3; 149.9; 145.9; 35.36 (NCH3); 22.22 (COCH3); 12.02 (СН3). Масс-спектр, m/z, Iотн.: 222 (2.9) [М]+; 180 (20.6) [M-СН2СО]+; 109 (58.7); 43 (100) [СН3СО]+; 42 (36.9); 30 (19.1). ИК спектр (KBr), ν, см-1: 3374; 3135; 3026; 2920; 2851; 1696; 1563; 1539; 1439; 1372; 1310; 1292; 1215; 1157; 1125; 1087; 1057; 1016; 987; 891; 868; 729; 701; 653; 594; 562; 499; 478; 434.
г) 4-N-Метиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
К смеси 5 мл метанола, 5 мл воды и 0.5 мл конц. НС1 добавили 0.9 г (4 ммоль) 4-N-ацетил-N-метиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазола. Реакционную массу нагрели до кипения и кипятили с обратным холодильником 1 ч. Затем из полученного раствора отогнали метанол при атмосферном давлении и оставили кристаллизоваться. Отфильтровали выпавший осадок и перекристаллизовали из метанола.
Выход 0.58 г (81%), т.пл. 227-228°С (МеОН).
1H ЯМР, δ, м.д.: 14.34 (1Н, с., NH-триазол); 6.30 (1Н, кв., J 3.51 Гц, NH); 2.93 (3Н, д., J 5.02 Гц, NCH3); 2.47 (3Н, с., СН3). 13С ЯМР, δ, м.д.: 157.0; 155.0; 151.4; 139.4; 31.20; 11.98. Масс-спектр, m/z, Iотн.: 181(2.1) [М+1]+; 180 (25.3) [М]+; 110 (10.4); 109 (100); 56 (14.6); 55 (12.7); 53 (21.0); 42 (75.8); 30 (37.0); 29 (17.2). ИК спектр (KBr), ν, см-1: 3422; 3399; 3153; 3024; 2923; 2806; 1621; 1586; 1568; 1438; 1414; 1310; 1182; 1141; 1061; 1006; 985; 901; 857; 572; 427; 412.
д) 4-N,N-Диметиламино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
Выход 1.4 г (73%), т.пл. 213-214°С (МеОН).
1H ЯМР, δ, м.д.: 14.24 (1Н, уш.с., NH); 2.87 (6Н, с., 2СН3); 2.46 (3Н, с., СН3). 13С ЯМР, δ, м.д.: 159.7; 154.8; 151.0; 141.6; 11.98. Масс-спектр, m/z, Iотн.: 195(2.7) [M+1]+; 194 (35.8); 151 (79.1); 125 (13.5); 121 (77.1); 109 (27.3); 69 (35.7); 67 (22.0); 56 (69.2); 55 (18.0); 54 (11.3); 53 (16.6); 52 (14.2); 44 (100); 43 (21.6); 42 (94.2); 41 (17.7); 40 (18.7); 30 (53.75); 29 (59.3). ИК спектр (KBr), ν, см-1: 3141; 3028; 2962; 2918; 2850; 2807; 2718; 1584; 1570; 1542; 1442; 1425; 1374; 1198; 1160; 1113; 1059; 1018; 985; 883; 704; 575; 478
е) 4-Морфолино-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
Выход 1.9 г (82%), т.пл. 238-239°С (МеОН).
1H ЯМР, δ, м.д.: 14.31 (1Н, с., NH); 3.71 (4Н, м., СН2ОСН2); 3.31 (4Н, м., CH2NCH2); 2.45 (3Н, м., СН3). 13С ЯМР, δ, м.д.: 159.3; 154.9; 150.9; 142.2; 65.74; 49.25; 12.00 (СН3). Масс-спектр, m/z, Iотн.: 236 (3.6) [М]+; 218 (21.4); 206 (2.1) [M-NO]+; 151 (22.3); 148 (21.7); 121 (47.4); 109 (30.3); 86 (23.2) [N(C2H4)2O]+; 69 (10.0); 68 (18.6); 67 (10.0); 56 (64.7); 55 (38.1); 54 (43.0); 53 (18.2); 52 (17.2); 45 (41.8); 44 (14.2); 43 (35.4); 42 (100); 41 (49.5); 40 (35.4); 39 (11.0); 30 (90.7); 29 (86.5). ИК спектр (KBr), ν, см-1: 3437; 3144; 3005; 2972; 2919; 2853; 1577; 1533; 1451; 1275; 1264; 1176; 1123; 1064; 1016; 985; 918; 887; 705; 554.
ж) 4-Метокси-3-(5-метил-1,2,4-триазол-3-ил)-1,2,5-оксадиазол
Выход: 1.4 г (76%), т.пл. 235-236°С (МеОН).
1H ЯМР, δ, м.д.: 14.27 (1Н, с., NH); 4.13 (3Н, с., ОСН3); 2.45 (3Н, с., СН3). 13С ЯМР, δ, м.д.: 164.6; 155.0; 149.9; 140.5; 60.14; 11.93. Масс-спектр, m/z, Iотн.: 181 (12.9) [М]+; 180 (53.2) [М-Н]+; 125 (13.8); 121 (24.6); 109 (15.9); 82 (15.9); 56 (55.5); 43 (40.1); 42 (57.9); 32 (46.5); 30 (100); 29 (53.4). ИК спектр (KBr), ν, см-1: 3437; 3146; 3036; 3002; 2950; 2854; 2824; 1616; 1569; 1549; 1449; 1419; 1373; 1199; 1170; 1132; 1059; 1020; 995; 897; 869; 718; 581; 451
Пример 14
4-Амино-3-(1,2,4-триазин-3-ил)-1,2,5-оксадиазол
3 г (0.046 моль) 40%-го водного раствора глиоксаля растворили в 7 мл воды, раствор подщелочили до рН6 добавлением кристаллического K2CO3, добавили 10 мл метанола. В полученный раствор присыпали 2 г (0.014 моль) амидразона 3-амино-1,2,5-оксадиазол-4-карбоновой кислоты. Реакционную массу нагрели до 40°С и перемешивали при этой температуре 2 ч. Охладили до комнатной температуры, осадок отфильтровали и перекристаллизовали из смеси уксусная кислота-пропанол-2 (1:1 об.).
Выход: 1.6 г (71%), т.пл. 196-197°С (АсОН)
1H ЯМР, δ, м.д.: 9.57 (1Н, с., СН); 9.07 (1Н, с., СН); 6.71 (2Н, с., NH2). 13С ЯМР, δ, м.д.: 157.7; 156.4; 151.1; 150.6; 143.6. Масс-спектр, m/z, Iотн.: 164 (20.7) [М]+; 136 (13.7); 110 (49.2); 107 (40.3); 58 (50.3); 54 (20.1); 53 (100); 52 (31.6); 38 (21.4); 30 (96.6); 29 (16.4). ИК спектр (KBr), ν, см-1: 3413; 3307; 3243; 3188; 3102; 3037; 2920; 2853; 1756; 1642; 1620; 1534; 1404; 1337; 1131; 1090; 1059; 1003; 970; 881; 865; 770; 724; 566; 510; 402.
Пример 15
Амидразон 4-гидразино-1,2,5-оксадиазол-3-карбоновой кислоты
К раствору 10 г (0.055 моль) 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола в 50 мл ацетонитрила при интенсивном перемешивании и охлаждении при температуре 20-25°С добавили по каплям 11 мл (0.22 моль) гидразингидрата. После окончания экзотермической реакции и выделения газов образовавшуюся суспензию перемешивали 1 час при 40°С. Затем разбавили 100 мл воды, охладили до комнатной температуры и отфильтровали осадок. Осадок промыли водой и перекристаллизовали из ДМФА/МеОН 1:1 (по об.).
Выход 6.2 г (72%).
1H ЯМР, δ, м.д.: 7.24 (1Н, с., NH); 5.84 (2Н, с., NH2); 4.74 (4Н, уш.с., 2NH2). 13С ЯМР, δ, м.д.: 158.9 (С-4); 140.5; 136.8. Масс-спектр, m/z, Iотн.: 158 (7.7) [М+1]+; 157 (100.0) [М]+; 140 (10.9); 111 (15.4); 85 (37.3); 68 (19.1); 67 ёё(11.5); 58 (11.7); 53 (16.0); 43 (31.9); 42 (12.4); 32 (29.0); 31 (22.8); 30 (27.8); 29 (17.4). ИК спектр (KBr), ν, см-1: 3380; 3336; 3154; 1664; 1605; 1572; 1544; 1322; 1289; 1193; 1102; 953; 856; 650; 417.
Источники информации
1. D.G. Neilson, R. Roger, J.W.M. Heatlie, L.R. Newlands. Chemistry of amidrazones. Chem. Rev., 1970, 70(1), 151-170.
2. А.Л. Русанов. Химия незамещенных моно- и бисамидразонов. Усп. химии, 1974, 43, 1669 [Russ. Chem. Rev., 1974, 43 (9), 795-804].
3. К.M. Watson, D.G. Neilson. The chemistry of amidrazones in Amidines and Imidates, in PATAI′S Chemistry of Functional Groups. Amidines and Imidates: Volume 1 (1975) (ed S. Patai), John Wiley & Sons, Ltd., Chichester, UK. - 677 p., p. 492-545.
4. K.H. Зеленин, О.В. Солод, В.А. Хрусталев. Амидразоны в синтезе гетероциклов (обзор). ХГС, 1989, 7, 867-887 [Chem. Heterocl. comp., 1989, 25(7), 717-737).
5. A.A. Aly, А.М. Nour-El-Din, Functionality of amidines and amidrazones. ARKIVOC, 2008(i), 153-194.
6. В.Г. Андрианов, А.В. Еремеев. Аминофуразаны, ХГС, 1984, (9), 1155-1170 [Chem. Heterocycl. comp 1984, 20(9), 937-951].
7. W. Sliwa, The Chemistry of Furazans, Heterocycles, 1984, 22(7), 1571-1589.
8. R.M. Paton, 1,2,5-Oxadiazoles and their Benzo Derivatives, in: Comprehensive Heterocyclic Chemistry (Eds. A.R. Katritzky, C.W. Rees, E.F.V. Scriven), Pergamon Press, Oxford, 1984, Vol. 6, p. 393-426.
9. R.M. Paton, 1,2,5-Oxadiazoles, in: Comprehensive Heterocyclic Chemistry-II (Eds. A.R. Katritzky, C.W. Rees, E.F.V. Scriven), Pergamon Press, Oxford, 1996, Vol. 4, p. 229-265.
10. А.Б. Шереметев. Химия фуразанов, конденсированных с шести- и семичленным гетероциклами с одним гетероатомом. Усп. химии, 1999, 68(2) 154-166. [Russ. Chem. Rev. 1999, 68, 137-148].
11. Α.Β. Sheremetev, Ν.N. Makhova, W. Friedrichsen. Monocyclic Furazans and Furoxans. Adv. Heterocycl. Chem., Academic Press, 2001, 78, 65-188.
12. А.Б. Шереметев. Нитро- и нитраминофуразаны. Российский хим. журн. (Журн. Росс. хим. общества им. Д.И. Менделеева), 1997, 41(2), 43-54.
13. А.А. Астратьев, А.И. Степанов, Д.В. Дашко, B.C. Санников. Успехи в химии производных трис-1,2,5-оксадиазола. Изв. СПбГТИ(ТУ), 2013, 21(47), 4-15.
14. Мельникова С.Ф., Целинский И.В., Производные 1,2,5-оксадиазола как энергонасыщенные соединения. Изв. СПбГТИ(ТУ), 2013, 21(47), 25-29.
15. В.Г. Андрианов, А.В. Еремеев. Синтез и свойства 4-амино-3-цианофуразана. ХГС, 1994, 5, 693-696 [Chem. Heterocycl. comp., 1994, 30(5), 608-611].
16. И.В. Целинский, С.Ф. Мельникова, C.B. Пирогов, А.В. Сергиевский. О синтезе и свойствах иминоэфира 3-аминофуразан-4-карбоновой кислоты. Журн. орг.химии, 1999, 35(2), 315-319 [Russ. J. Org. Chem., 1999, 35(2), 296-300].
17. Т.И. Годовикова, С.К. Воронцова, Л.Д. Конюшкин, С.И. Фирганг, О.А. Ракитин. Синтез 3-метил-4-(5-R-1H-1,2,4-триазол-3-ил)-1,2,5-оксадиазолов, Изв. АН, сер. хим., 2009, 2, 400-403 [Russ. Chem. Bull, Int. Edn., 2009, 58(2), 406-409].
18. Т.И. Годовикова, С.К. Воронцова, Л.Д. Конюшкин, С.И. Фирганг, О.А. Ракитин, Синтез 5-(1,2,5-оксадиазол-3-ил)-1H-тетразолов из 3-циано-1,2,5-оксадиазолов. Изв. АН, сер. хим., 2010, 2, 473-475 [Russ. Chem. Bull., Int. Edn., 2010, 59(2) 483-485].
19. A.B. Сергиевский, С.В. Пирогов, С.Ф. Мельникова, И.В. Целинский. Реакции метил 4-аминофуразан-3-карбоксимидата с азотсодержащими нуклеофилами. Журн. орг.химии, 2001, 37(5), 755-758 [Russ. J. Org. Chem., 2001, 37(5), 717-720].
20. Т.И. Годовикова, С.К. Воронцова, Л.Д. Конюшкин, С.И. Фирганг, О.А. Ракитин, Синтез 5-(1,2,5-оксадиазол-3-ил)-1H-тетразолов из 3-циано-1,2,5-оксадиазолов // Изв. АН, сер. хим., 2008, 11, 2390-2392 [Russ. Chem. Bull., Int. Edn., 2008, 57(11), 2440-2442].
21. R. Wang, Y. Guo Y., Z. Zeng, B. Twamley, J.M. Shreeve, Furazan-Functionalized Tetra-zolate Based Salts: A New Family of Insensitive Energetic Materials. Chem. Eur. J., 2009, 15, 2625-2634.
22. H. Gao, J.M. Shreeve, Azole-Based Energetic Salts. Chem. Rev., 2011, 111(11), 7377-7436.
23. В. Wang, G. Zhang, G. Huo, Y. Fan, X. Fan, Synthesis, Characterization and Thermal Properties of Energetic Compounds Derived from 3-Amino-4-(tetrazol-5-yl)furazan. Chin. J. Chem., 2011, 29(5), 919-924.
24. J.H. Come, J. Green, С Marhefka, S. L. Harbeson. Aminofurazan compounds as protein kinase inhibitors, EP 1660467, 20.08.2003.
25. В.Г. Андрианов, Ε.H. Рожков, A.B. Еремеев. Реакции циклизации 4-аминофуразан-3-карбоксиамидоксимов. ХГС, 1994, 4, 534-538 [Chem. Heterocycl. Comp., 1994, 30(4), 470-474].
| название | год | авторы | номер документа |
|---|---|---|---|
| 3-(ТРИНИТРОМЕТИЛ-ONN-АЗОКСИ)-4-НИТРАМИНОФУРАЗАНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2485108C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛИРОВАННЫХ АМИДОВ | 2013 |
|
RU2549901C1 |
| Замещенные [(3-нитро-1Н-1,2,4-триазол-1-ил)-NNO-азокси]фуразаны и способ их получения | 2020 |
|
RU2747110C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| 1,4,7(8,9)-Тритиа 2,9(10,11)-диазациклоалкан 1,1-диоксиды и способ их получения | 2020 |
|
RU2773315C2 |
| 8,10-Динитро-дегидро-1,5-5Н,11Н-[1,2,3,4]тетразино[5',6':4,5][1,2,3]триазоло-[2,1-a][1,2,3]бензотриазол-1,3-диоксид и способ его получения | 2017 |
|
RU2643363C1 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| Производные 3-(5-нитратометил-1Н-1,2,3-триазол-1-ил)-4-нитро-1,2,5-оксадиазола и способ их получения | 2023 |
|
RU2817968C1 |
| 16-(1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-15,16-ЭПОКСИЛАБДАНОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2011 |
|
RU2473550C1 |
Изобретение относится к способу получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновой кислоты, который основан на реакции раскрытия 1,2,4-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолов при взаимодействии с гидразином. Способ позволяет снизить трудоемкость процесса, увеличить выход и повысить экономические показатели процесса. 2 з.п. ф-лы, 15 пр.
1. Способ получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновых кислот, где заместитель R выбран из числа таких заместителей, как алкоксигруппа, аминогруппа, замещенная аминогруппа, гидразиногруппа и морфолиногруппа, восстановительным раскрытием незамещенного по атому С-5 1,2,4-оксадиазольного цикла при взаимодействии с гидразином замещенных по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола при температуре 20-60°C.
2. Способ получения амидразонов 4-R-1,2,5-оксадиазол-3-карбоновых кислот по п. 1, где в качестве замещенных по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола используют 3-R-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазолы (2), где заместитель R выбран из числа таких заместителей, как алкоксигруппа, аминогруппа, замещенная аминогруппа и морфолиногруппа.
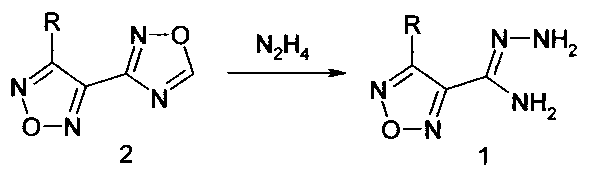
3. Способ получения амидразона 4-гидразино-1,2,5-оксадиазол-3-карбоновой кислоты (3) по п. 1, где в качестве замещенного по атому С-3 1,2,5-оксадиазольного цикла производных 4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазола используют 3-нитро-4-(1,2,4-оксадиазол-3-ил)-1,2,5-оксадиазол (4).
| 3,4-БИС(4-НИТРОФУРАЗАН-3-ИЛ)-ФУРАЗАН | 2012 |
|
RU2496779C1 |
| А.А | |||
| Астратьев и др., "Успехи а химии производных трис[1,2,5]оксадиазола", Известия СПбГТИ(ТУ), 2013, т | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| А.И | |||
| Степанов и др., "Использование амидооксима 4-аминофуразан-3-карбоновой кислоты в | |||
Авторы
Даты
2015-07-27—Публикация
2014-07-29—Подача