ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к пептиду, ингибирующему образование комплекса SNARE, и к его применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Комплексы SNARE (Soluble N-ethylmaleimide-sensitive factor attachment protein receptor - рецептор растворимого белка присоединения фактора, чувствительного к N-этилмалеимиду) представляют собой комплексы, включающие в себя SNAP-25, синтаксин и VAMP2, участвующие в высвобождении нейромедиаторов. Высвобождение нейромедиаторов в синапсах требует различных белков, участвующих и функционирующих вместе при слиянии нейрональной плазматической мембраны синаптических везикул для образования синаптических комплексов слияния. Эти белки в совокупности называются белками SNARE, включающими SNAP-25, синтаксин и синаптобревин. Синаптобревин также называют VAMP2 (vesicle-associated membrane protein 2 - ассоциированным с везикулами мембранным белком 2). VAMP2 расположен в мембране синаптических везикул, тогда как SNAP-25 и синтаксин связаны с плазматической мембраной. Экскреция кальция вызывает образование комплексов и подтягивает синаптические везикулы близко к плазматической мембране, вызывая слияние плазматических мембран. При слиянии нейромедиаторы, содержащиеся в везикулах, высвобождаются в синапс. Нейромедиаторы могут включать в себя ацетилхолин или норадреналин. В качестве пептида, полученного из VAMP2, по-прежнему востребован пептид, способный эффективно ингибировать образование комплекса SNARE, но SNARE белок имеет недостаток, заключающийся в том, что он не может эффективно воздействовать на кожу из-за защитной функции кожи.
Однако при доставке лекарственного средства или белка для лечения в клетки предпринимается попытка доставить лекарственное средство в клетки с применением пептида, который действует как переносчик, способный транспортировать целевой белок в клетки. Однако не все белки образуют слитый белок с транспортным доменом белка и проникают в клетки. Например, существуют опубликованные в статьях результаты исследований, согласно которым белок, связанный с сайтом трансдукции Tat, вводится в клетку, но не демонстрирует активности (Sengoku, Т. et al. Experimental Neurology 188(2004) 161-170, Falnes P.O. et al. Biochemistry 2001 Apr 10;40(14):4349-4358, and Daniele Peroni et al., Neuroscience letters 421(2007) 110-114). To есть из слияния домена белкового транспорта с белком, который нелегко вводить в клетки, не может быть сделано заключение, что слитый белок проявляет достоверную активность после введения в клетку.
ОПИСАНИЕ ВОПЛОЩЕНИЙ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Согласно аспекту осуществления данного изобретения предложен пептид, в котором проникающий через клеточную мембрану пептид слит с белком VAMP2 или его фрагментом.
Согласно другому аспекту осуществления данного изобретения предложены полинуклеотид, кодирующий данный пептид, а также вектор и клетка-хозяин, содержащие этот полинуклеотид.
Согласно другому аспекту осуществления данного изобретения предложены композиция или набор для отбеливания кожи или уменьшения морщин.
В соответствии с другим аспектом осуществления данного изобретения предложен способ отбеливания кожи или уменьшения морщин у субъекта путем введения данного пептида субъекту.
В соответствии с другим аспектом осуществления данного изобретения предложен способ получения композиции для отбеливания кожи или уменьшения морщин с использованием этого пептида.
Согласно другому аспекту осуществления данного изобретения предложено применение данного пептида в изготовлении отбеливающего кожу агента или уменьшающего морщины агента.
Согласно другому аспекту осуществления данного изобретения предложен пептид для применения в качестве отбеливающего кожу агента или уменьшающего морщины агента.
РЕШЕНИЕ ЗАДАЧИ
Согласно аспекту осуществления данного изобретения предложен пептид, в котором проникающий через клеточную мембрану пептид слит с белком VAMP2 или его фрагментом.
Белок VAMP2 может состоять из аминокислотной последовательности SEQ ID NO: 13. Фрагмент может быть N-концевым фрагментом белка VAMP2. Фрагмент может содержать аминокислотную последовательность SEQ ID NO: 7 (последовательность с 30го по 43ий аминокислотный остаток в SEQ ID NO: 13). Фрагмент может состоять по существу из аминокислотной последовательности SEQ ID NO: 7. Фрагмент может состоять из аминокислотной последовательности SEQ ID NO: 7. Фрагмент может содержать аминокислотную последовательность SEQ ID NO: 4 (последовательность с 30го по 46ой аминокислотный остаток в SEQ ID NO: 13). Фрагмент может состоять по существу из аминокислотной последовательности SEQ ID NO: 4. Фрагмент может состоять из аминокислотной последовательности SEQ ID NO: 4. Аминокислота может быть D- или L-аминокислотой.
Термин " содержащий" в настоящем изобретении используется как синоним терминов "включающий в себя " или "отличающегося тем, что" и не исключает дополнительных составляющих элементов или стадий способа, не упомянутых в композиции или способе. Термин "состоит из" относится к исключению дополнительных элементов, этапов или компонентов, если не упомянуто иное. Термин "состоит по существу из" предназначен для охвата составных элементов или этапов и т.д., которые, в дополнение к описанным составным элементам или этапам, не влияют существенно на их основные свойства.
N-концевая или С-концевая аминокислота пептида может быть с обратимой химической модификацией. Модификация может включать этерификацию карбоксильных групп глутаминовой кислоты и аспарагиновой кислоты. Посредством модификации отрицательный заряд аминокислоты может быть убран, и гидрофобность аминокислоты может быть усилена. Модифицированные таким образом пептиды могут обладать повышенной биодоступностью, включая стабильность и жирорастворимость, и могут обеспечивать легкое прохождение через гематоэнцефалический барьер и эпителиальные ткани. Также данная модификация может включать амидирование карбоксильной группы аминокислоты. Аминокислота на N-конце пептида может быть ацетилирована. Аминокислота на С-конце пептида может быть амидирована. Модификация может быть гидролизована в организме внутриклеточной эстеразой.
Пептид может ингибировать образование комплексов SNARE, включающих в себя SNAP-25, синтаксин и VAMP2, для ингибирования высвобождения нейромедиаторов. Высвобождение нейромедиаторов в синапсах требует различных белков, участвующих и функционирующих вместе при слиянии нейрональной плазматической мембраны синаптических везикул с образованием синаптических комплексов слияния. Эти белки в совокупности называются белками SNARE, включающими SNAP-25, синтаксин и синаптобревин. Синаптобревин также известен как VAMP2. VAMP2 расположен в мембране синаптических везикул, тогда как SNAP-25 и синтаксин связаны с плазматической мембраной. Экскреция кальция вызывает образование комплексов и подтягивает синаптические везикулы близко к плазматической мембране, вызывая слияние плазматических мембран. При слиянии нейромедиаторы, содержащиеся в везикулах, высвобождаются в синапс. Нейромедиаторы могут включать в себя ацетилхолин или норэпинефрин. Пептид может ингибировать образование комплекса SNARE, имитируя VAMP2, тем самым ингибируя высвобождение нейромедиаторов в синапс. Соответственно, пептид может ослаблять или устранять различные симптомы, вызванные высвобождением нейромедиатора в синапс. Пептид может улучшать отбеливание кожи или уменьшать морщины. Кроме того, пептид может быть использован для облегчения или лечения симптомов, опосредованных нейрональным экзоцитозом. Симптомы могут быть спастическими состояниями. Спастическими состояниями могут быть дистония, страбизм, тики, блефароспазм или лицевой сколиоз.
Пептид может быть получен с использованием традиционного способа твердофазного химического синтеза пептидов. Кроме того, пептид может быть получен с использованием способа, основанного на технологии рекомбинантной ДНК. Например, способ может включать введение полинуклеотида, кодирующего пептид, в соответствующую плазмиду или вектор, введение плазмиды или вектора в клетку-хозяина, культивирование полученной клетки таким образом, чтобы пептид образовывался в культуре, и, возможно, очистку пептида.
Пептид может быть слит с проникающим через клеточную мембрану пептидом. Проникающий через клеточную мембрану пептид может усиливать проникновение слитого пептида через плазматическую мембрану. Слитый пептид может представлять собой пептид, в котором С-конец проникающего через клеточную мембрану пептида слит с N-концом белка VAMP2 или его фрагмента. Проникающий через клеточную мембрану пептид может быть выбран из группы, состоящей из TD1, IMT-P8, Transkin, VP2-2, RBD-1, SN25-2, STX-1 и TDb-1. IMT-P8 может состоять по существу из аминокислотной последовательности SEQ ID NO: 8. IMT-P8 может состоять из аминокислотной последовательности SEQ ID NO: 8.
В контексте данного документа подразумевают, что пептид включает в себя пептид, а также его соль. Соль может быть фармацевтически или косметически приемлемой солью пептида.
Согласно другому аспекту осуществления данного изобретения, предложена композиция для отбеливания кожи или уменьшения морщин, содержащая пептид в качестве активного ингредиента.
Композиция может дополнительно содержать фармацевтически или косметически приемлемый носитель. Носитель может представлять собой разбавитель или эксципиент. Носитель может представлять собой антиоксидант, стабилизатор, солюбилизатор, витамин, пигмент или ароматизатор. Разбавитель может представлять собой воду, буфер или солевой раствор.
Кроме того, композиция может дополнительно включать в себя фармацевтически или косметически приемлемый адъювант.
Композиция может быть косметической, фармацевтической или пищевой композицией.
Композиция может быть в форме любого препарата, например, любого состава, выбранного из водного раствора, суспензии, эмульсии, пасты, геля, крема, лосьона, порошка, мыла, очищающего средства, содержащего поверхностно-активное вещество, масла, порошковой основы, эмульсионной основы, восковой основы и спрея.
Когда состав представляет собой пасту, крем или гель, в качестве компонента носителя могут быть включены одно или несколько из животных масел, растительного масла, воска, парафина, крахмала, трагаканта, производного целлюлозы, полиэтиленгликоля, силикона, бентонита, диоксида кремния, талька и оксида цинка.
Когда состав представляет собой порошок или спрей, носителем может быть один или несколько из лактозы, талька, диоксида кремния, гидроксида алюминия, силиката кальция и порошка полиамида. Когда состав представляет собой аэрозоль, композиция может дополнительно включать в себя пропелленты, такие как хлорфторуглеводороды, пропан/бутан и диметиловый эфир.
Когда состав представляет собой раствор или эмульсию, носитель может включать в себя один или несколько выбранных из растворителя, солюбилизатора и эмульгатора. Носителем может быть, например, по меньшей мере один, выбранный из этанола, изопропанола, этил карбоната, этилацетата, бензилового спирта, бензилбензоата, пропиленгликоля, 1,3-бутилгликолевого масла, алифатического эфира глицерина, полиэтиленгликоля и сложного эфира сорбитана и жирных кислот.
Когда состав представляет собой суспензию, носителем может быть по меньшей мере один, выбранный из жидкого разбавителя, такого как вода, этанол и пропиленгликоль; суспендирующего агента, такого как этоксилированный изостеариловый спирт, сложный эфир полиоксиэтилена и сорбита и сложный эфир полиоксиэтилена и сорбитана; микрокристаллической целлюлозы; метагидроксида алюминия; бентонита; агара и трагаканта.
Количество пептида может быть количеством, эффективным для улучшения отбеливания кожи или уменьшения морщин. Количество может составлять, например, от примерно 0,001% до примерно 95%, от примерно 0,001% до примерно 70%, от примерно 0,001% до примерно 50% или от примерно 0,01% до примерно 50%, в пересчете на массу композиции.
Согласно другому аспекту осуществления данного изобретения, предложен набор для отбеливания кожи или уменьшения морщин, который содержит указанный пептид.
Набор может дополнительно содержать по меньшей мере одно, выбранное из группы, состоящей из носителя и адъюванта. Кроме того, набор может дополнительно включать в себя инструкцию, которая описывает процедуру использования пептида для отбеливания кожи или уменьшении морщин.
В соответствии с другим аспектом осуществления данного изобретения предложен способ улучшения отбеливания кожи и уменьшения морщин у субъекта, включающий введение этому субъекту эффективного количества пептида для улучшения отбеливания кожи и уменьшения морщин.
Пептид может быть в виде самого себя или композиции, описанной выше.
Введение пептида может быть проведено путем введения любым путем. Введение может быть пероральным или парентеральным. Введение может быть выполнено путем нанесения пептида в носовую полость, на слизистую оболочку или кожу. Субъектом может быть человек или животное, не являющееся человеком, например, млекопитающее. Способ может быть косметическим способом.
В соответствии с другим аспектом осуществления данного изобретения предложен полинуклеотид, кодирующий указанный пептид.
В соответствии с другим аспектом осуществления изобретения предложен вектор, содержащий этот полинуклеотид. Вектор может включать в себя любой вектор, используемый для доставки полинуклеотид а. Вектор может включать в себя нуклеиново-кислотную конструкцию, плазмиду или вектор, полученный из вируса. Вектор может быть экспрессионным вектором, например, экспрессионным вектором, который может экспрессироваться в млекопитающем.
Согласно другому аспекту осуществления данного изобретения предложена рекомбинантная клетка-хозяин, содержащая этот полинуклеотид. Клетка-хозяин может быть бактериальной или животной клеткой. Животная клетка может быть известной животной клеткой, такой как СНО (Chinese hamster ovary cell - клетка яичника китайского хомяка).
В соответствии с другим аспектом осуществления данного изобретения предложена композиция для ингибирования образования комплексов SNARE, включающих в себя SNAP-25, синтаксин и VAMP2, которая содержит этот пептид в качестве активного ингредиента. Композиция может дополнительно содержать носитель или адъювант. Композиция может быть косметической, фармацевтической или пищевой композицией.
Композиция может быть использована для облегчения или лечения симптомов, опосредованных экзоцитозом нейронов. Симптомы могут быть спастическими состояниями. Спастическими состояниями могут быть дистония, страбизм, тики, блефароспазм или лицевой сколиоз.
Количество пептида и носителя или адъюванта такое же, как описано выше.
Согласно другому аспекту осуществления изобретения предложен набор для ингибирования образования комплексов SNARE, включающих в себя SNAP-25, синтаксин и VAMP2, содержащий этот пептид в качестве активного ингредиента. Набор может дополнительно содержать по меньшей мере одно, выбранное из носителя и адъюванта.
Согласно другому аспекту осуществления изобретения предложен способ ингибирования образования комплексов SNARE у субъекта, включающий введение этого пептида этому субъекту.
Способ может быть использован для облегчения или лечения симптомов, опосредованных экзоцитозом нейронов. Симптомы могут быть спастическими состояниями. Спастическими состояниями могут быть дистония, страбизм, тики, блефароспазм или лицевой сколиоз.
Пептид может быть в форме пептида или композиции, содержащей этот пептид. Количество вводимого пептида может быть количеством, эффективным для ингибирования образования комплексов SNARE у субъекта.
Согласно другому аспекту осуществления изобретения предложен способ получения композиции для отбеливания кожи или уменьшения морщин, включающий смешивание пептида по меньшей мере с одним, выбранным из группы, состоящей из разбавителя, эксципиента, носителя и адъюванта.
Согласно другому аспекту осуществления данного изобретения предложено применение пептида в изготовлении отбеливающего кожу агента для или уменьшающего морщины агента.
Согласно другому аспекту осуществления данного изобретения предложен пептид для применения в качестве отбеливающего кожу агента или уменьшающего морщины агента.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Пептид согласно варианту осуществления изобретения может быть использован для отбеливания кожи и уменьшения морщин.
Согласно варианту осуществления изобретения для получения пептида могут быть использованы полинуклеотид, кодирующий этот пептид, а также вектор и клетка-хозяин, содержащая такой полинуклеотид.
Композиция или набор, включающие в себя пептид в соответствии с вариантом осуществления изобретения, могут быть использованы для отбеливания кожи или уменьшения морщин, или облегчения или лечения симптомов, опосредованных нейрональным экзоцитозом.
Когда применяют способ согласно варианту осуществления изобретения, у субъекта может произойти отбеливание кожи или уменьшение морщин, или могут быть облегчены или эффективно лечиться симптомы, опосредованные нейрональным экзоцитозом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
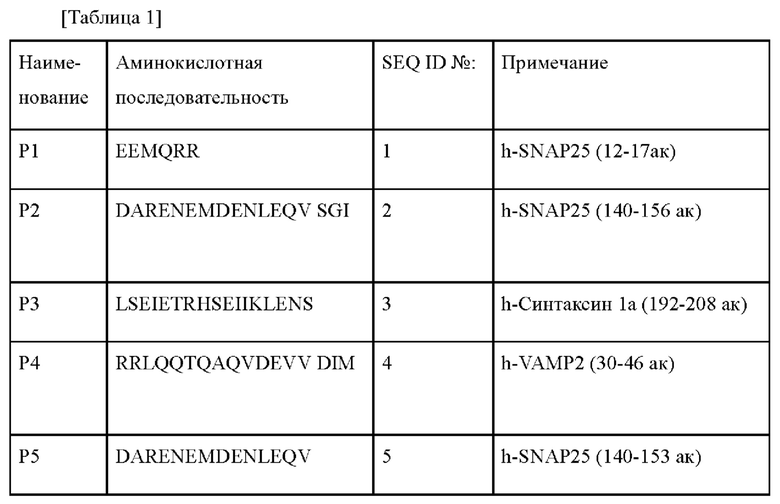
Фиг. 1 представляет собой график, иллюстрирующий влияние 7 слитых пептидов на секрецию норэпинефрина в клетках PC12.
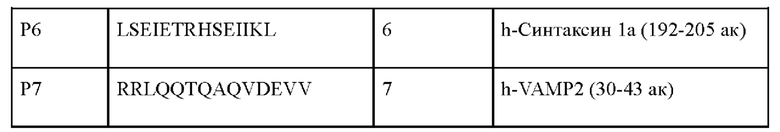
Фиг. 2 представляет собой график, иллюстрирующий влияние слитых пептидов С2-Р4 и Р4 на секрецию норэпинефрина в клетках PC12.
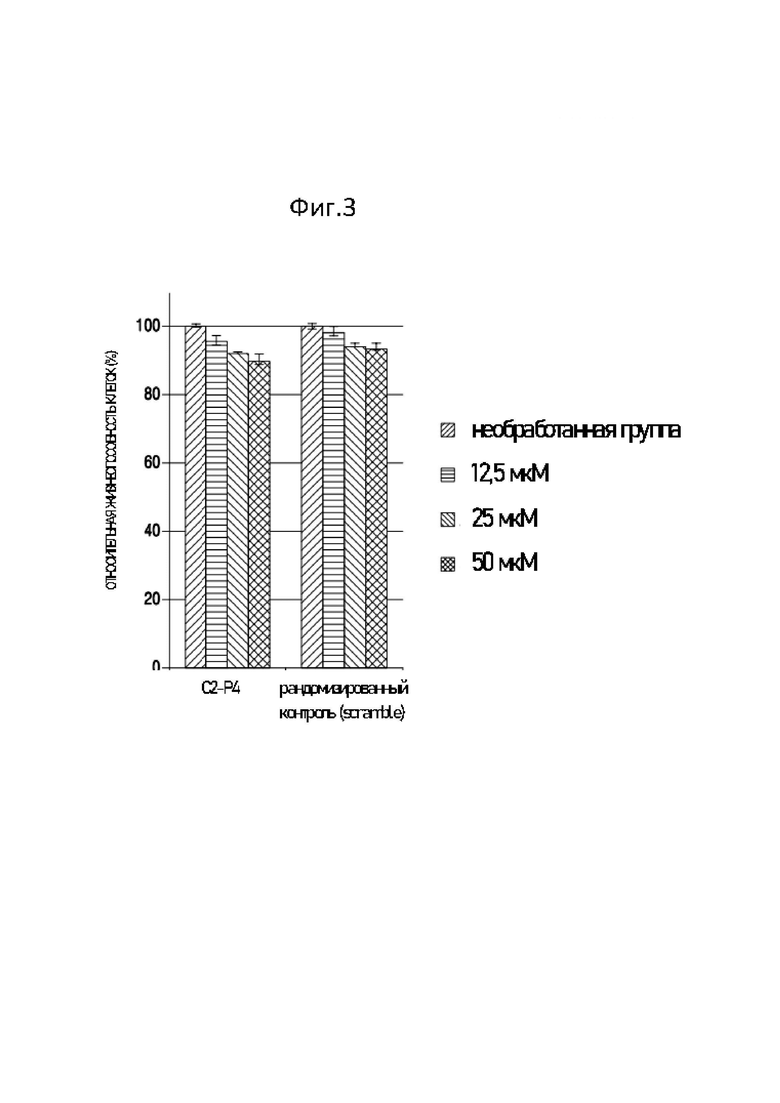
Фиг. 3 представляет собой график, демонстрирующий результаты теста на цитотоксичность С2-Р4.
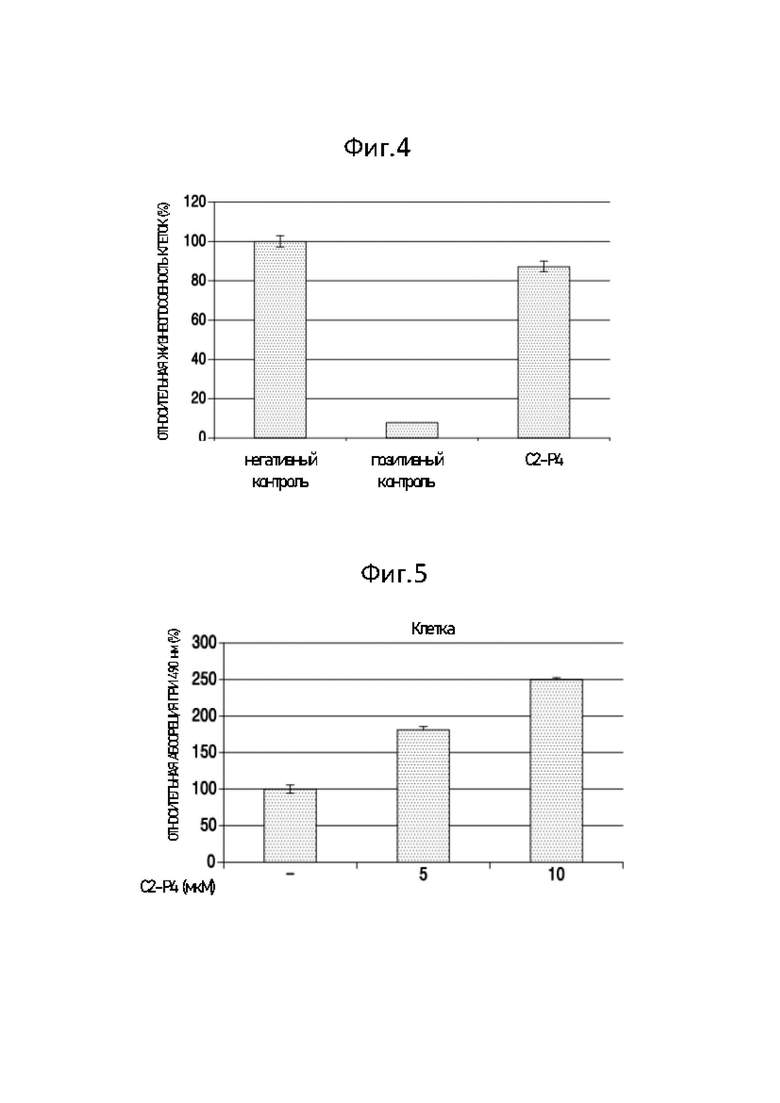
Фиг. 4 представляет собой график, демонстрирующий результаты измерения влияния С2-Р4 на раздражение кожи.
Фиг. 5 представляет собой график, демонстрирующий результаты измерения влияния С2-Р4 на уровень меланина в клетках.
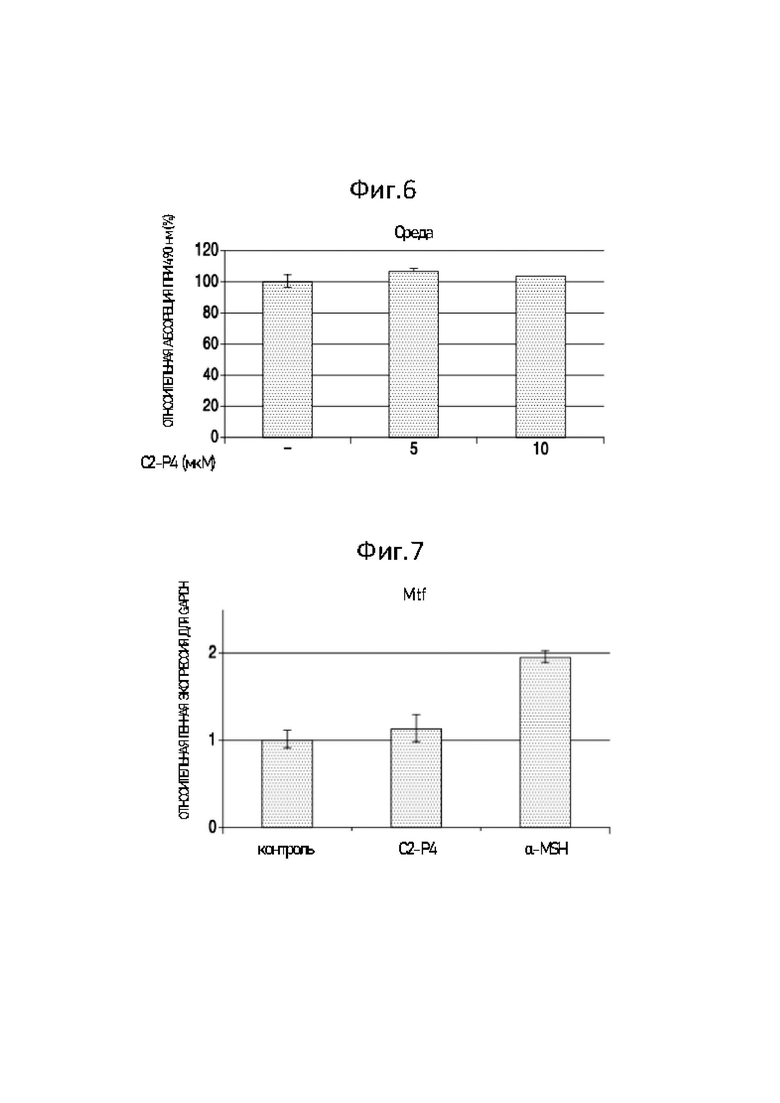
Фиг. 6 представляет собой график, демонстрирующий результаты измерения влияния С2-Р4 на уровень меланина в среде.
Фиг. 7 представляет собой график, демонстрирующий уровень экспрессии мРНК гена MITF в присутствии С2-Р4 и α-MSH.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Здесь и далее данное изобретение будет описано более подробно со ссылкой на следующие примеры. Однако нижеследующие примеры предлагаются только в иллюстративных целях и объем данного изобретения никоим образом не должен ограничиваться ими.
Примеры и сравнительные примеры: Выбор кандидатного пептида, обладающего ингибиторной способностью в отношении секреции нейромедиатора.
Семь пептидных фрагментов были отобраны из SNAP25, Sytaxinla и VAMP2, которые являются белками, образующими SNARE-комплекс. В Таблице 1 приведены семь кандидатных пептидов и пептидов для сравнения. Р1 является аминокислотной последовательностью аргирелина.
Как показано в Таблице 1, все пептиды от Р1 до Р7 являлись пептидами, состоящими из 6-17 аминокислот, полученными из аминокислотных последовательностей человеческого SNAP25 (ассоциированный с синаптосомами белок 25), синтаксина 1а и VAMP2. Цифры в круглых скобках отображают расположение первой и последней аминокислот пептида в аминокислотной последовательности каждого из белков. Также были получены слитые пептиды, обладающие С-концом проникающего в клетки пептида, соединенным с N-концом пептидов с P1 по Р7. В частности, проникающий через клеточную мембрану пептид представлял собой пептид IMT-P8, образованный из аминокислотной последовательности SEQ ID NO: 8. Эти слитые пептиды были названы С2-Р1, С2-Р2, С2-Р3, С2-Р4, С2-Р5, С2-Р6 и С2-Р7. Пептиды с P1 по Р7 были химически синтезированы в Lugen Sci (Южная Корея). Кроме того, слитые пептиды С2-Р1, С2-Р2, С2-Р3, С2-Р4, С2-Р5, С2-Р6 и С2-Р7 были получены посредстовом способа химического синтеза в Lugen Sci (Южная Корея) (С2-Р4: SEQ ID NO: 14 и С2-Р7: SEQ ID NO: 15).
Экспериментальный пример 1: Измерение ингибиторной способности нейромедиаторов
7 слитых пептидов были ингибированы против образования комплекса SNARE, с целью подтверждения, ингибируют ли они секрецию нейромедиаторов. В качестве нейромедиатора был выбран норэпинефрин.
(1) Влияние 7 слитых пептидов на секрецию норэпинефрина в нейронах Клетки PC12 (Корейский банк клеточных линий) культивировали в среде RPMI 1640, содержащей 10% лошадиной сыворотки и 25 мкг/мл антибиотика-антимикотика (Gibco, пенициллин 10000 ед./мл, стрептомицин 10000 мкг/мл, Fungizone® (амфотерицин В)) в матрасах Т-75, покрытых матригелем, при температуре 37°С в течение 72 часов. Клетки PC12 представляют собой клеточную линию, полученную из феохромоцитомы, возникшей в мозговом веществе надпочечников крыс. Поскольку хромаффинные клетки, которые выполняют роль секреции катехоламинов в мозговом веществе надпочечников, уже дифференцированы и не делятся, культивируемые клетки PC12 часто используются для изучения хромаффинных клеток.
После культивирования клетки PC-12 отделяли от матраса с использованием трипсин- EDTA (этилендиаминтетрауксусная кислота), а затем центрифугировали при 1500 об./мин в течение 3 минут для сбора клеток. Собранные клетки инокулировали в 1 мл среды RPMI 1640, содержащей 10% лошадиной сыворотки и антибиотик, в концентрации 1×105 клеток/лунку и инкубировали при 37°С в течение 24 часов в 48-луночном планшете, покрытом матригелем. После этого пептид каждой экспериментальной группы, т.е. каждый из 7 слитых пептидов, добавляли в концентрации 20 мкМ в среду RPMI 1640, в которую ничего не было добавлено, и культивировали в течение 2 часов. Каждую экспериментальную группу дважды промывали буфером Кребса (118 мМ NaCl, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 5 мМ KCl, 24 мм NaHCO2, 2 мМ KH 2РО4, 11 мМ декстроза, рН 7,4) и инкубировали в буфере Кребса с высоким содержанием ионов калия (56 мМ NaCl, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 68 мМ KCl, 24 мМ NaHCO3, 2 мМ KH2 РО4, 11 мМ декстроза, рН 7,4) при 37°С в течение 30 минут для индукции деполяризации. Количество секретированного норэпинефрина измеряли путем постановки ELISA (иммуноферментный анализ) на индуцированном деполяризацией образце с использованием ELISA набора на норэпинефрин (Abnova Cat# KA1891). В частности, после промывки индуцированного деполяризацией образца среду удаляли из лунок планшета, оставляя только клетки. Чтобы деполяризовать клетки, в планшет для искусственного высвобождения нейромедиаторов добавляли буферный раствор Кребса, содержащий ионы калия, а нейромедиаторы, высвобожденные из клеток в буфер Кребса, измеряли с помощью ELISA.
Результаты показаны на Фиг. 1. Фиг. 1 представляет собой график, иллюстрирующий влияние 7 слитых пептидов на секрецию норэпинефрина в клетках PC12. Как показано на Фиг. 1, было подтверждено, что скорости секреции нейромедиаторов группы, обработанной пептидом С2-Р4 и пептидом С2-Р7, по сравнению с необработанной группой были заингибированы до 35% и 56%, соответственно. Пептид С2-Р4 среди 7 слитых пептидов ингибировал секрецию нейромедиаторов в наибольшей степени.
(2) Сравнение способности ингибироватъ внутриклеточную секрецию нейромедиаторов между С2-Р4 и Р4.
Клетки PC 12 (Корейский банк клеточных линий) культивировали в среде RPMI 1640, содержащей 10% лошадиной сыворотки и 25 мкг/мл антибиотика-антимикотика (Gibco, пенициллин 10000 ед./мл, стрептомицин 10000 мкг/мл, Fungizone® (амфотерицин В)) в матрасах Т-75, покрытых матригелем, при температуре 37°С в течение 72 часов. Клетки PC12 представляют собой клеточную линию, полученную из феохромоцитомы, возникшей в мозговом веществе надпочечников крыс. Поскольку хромаффинные клетки, которые выполняют роль секреции катехоламинов в мозговом веществе надпочечников, уже дифференцированы и не делятся, культивируемые клетки PC12 часто используются для изучения хромаффинных клеток.
После культивирования клетки PC-12 отделяли от матраса с использованием трипсин- EDTA, а затем центрифугировали при 1500 об./мин в течение 3 минут для сбора клеток. Собранные клетки инокулировали в 1 мл среды RPMI 1640, содержащей 10% лошадиной сыворотки и антибиотик, в концентрации 1×105 клеток/лунку и инкубировали при 37°С в течение 24 часов в 48-луночном планшете, покрытом матригелем. После этого каждый из слитых пептидов Р4 и С2-Р4 добавляли в концентрации 20 мкМ в среду RPMI 1640, в которую ничего не было добавлено, и культивировали в течение 2 часов. Каждую экспериментальную группу дважды промывали буфером Кребса (118 мМ NaCl, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 5 мМ KCl, 24 мм NaHCO2, 2 мМ KH 2РО4, 11 мМ декстроза, рН 7,4) и инкубировали в буфере Кребса с высоким содержанием ионов калия (56 мМ NaCl, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 68 мМ KCl, 24 мМ NaHCO3, 2 мМ KH2 РО4, 11 мМ декстроза, рН 7,4) при 37°С в течение 30 минут для индукции деполяризации. Количество секретированного норэпинефрина измеряли путем постановки ELISA на индуцированном деполяризацией образце с использованием ELISA набора на норэпинефрин (Abnova Cat# КА1891). В частности, после промывки индуцированного деполяризацией образца среду удаляли из лунок планшета, оставляя только клетки. Чтобы деполяризовать клетки, в планшет для искусственного высвобождения нейромедиаторов добавляли буферный раствор Кребса, содержащий ионы калия, а нейромедиаторы, высвобожденные из клеток в буфер Кребса, измеряли с помощью ELISA.
Результаты показаны на Фиг. 2. Фиг. 2 представляет собой график, иллюстрирующий влияние слитых пептидов С2-Р4 и Р4 на секрецию норэпинефрина в клетках PC12. Как показано на Фиг. 2, скорости секреции нейромедиатора пептидов Р4 и С2-Р4 по сравнению с необработанной группой составили 75% и 41%, соответственно. То есть скорость секреции нейромедиатора для С2-Р4, с котором был слит проникающий через клеточную мембрану пептид, была на 34% ниже, чем у Р4, с которым проникающий через клеточную мембрану пептид не был слит.
Экспериментальный пример 2: Подтверждение токсичности отобранного пептида
(1) Тест сырого материала на токсичность: МТТ анализ
Клетки B16-F10, приобретенные в Корейском банке клеточных линий, инокулировали 100 мкл среды DMEM, содержащей 10% FBS, в концентрации 1×104 клеток/лунку в 96-луночный планшет и культивировали в течение 48 часов. Клетки В16-F10 представляют собой клеточную линию меланомы мыши, полученную от мышей. Данные клетки являются адгезивными и обладают эпителиальной морфологией. После этого пептид С2-Р4 разводили в культуральной среде DMEM в концентрациях 12,5 мкМ, 25 мкМ и 50 мкМ для замены среды и клетки культивировали в течение 48 часов. После центрифугирования планшета при 1000 об./мин в течение 10 минут раствор культуральной среды удаляли. Каждую лунку дважды промывали в PBS и добавляли к ней 0,5 мг/мл раствор МТТ (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия), разведенный в среде DMEM. Клетки культивировали в инкубаторе при 37°С и 5% СО2 в течение 2 часов. После центрифугирования планшета при 1000 об./мин в течение 10 минут раствор МТТ удаляли. Каждую лунку дважды промывали в PBS и добавляли 150 мкл DMSO (диметилсульфоксид) для растворения полученного формазана. Планшет помещали в спектрометр (Spectra MAX i3) и измеряли абсорбцию образца в каждой лунке при 590 нм.
Результаты представлены на Фиг. 3. Фиг. 3 представляет собой график, показывающий результаты теста на цитотоксичность С2-Р4. Как показано на Фиг. 3, в МТТ тесте С2-Р4 показывал аналогичную жизнеспособность клеток по сравнению с негативным контролем, представлявшим собой рандомизированный пептид, и цитотоксичности не было.
(2) Тест на раздражение кожи
1xPBS (забуференный фосфатом физиологический раствор) и 5%-ный SDS (додецилсульфат натрия) равномерно наносили на искусственную кожу (Neoderm-ED), приобретенную в Tegoscience (Южная Корея), для получения негативного и позитивного контроля соответственно. Экспериментальную группу равномерно покрывали 20 мкл 100 мкг/мл пептида С2-Р4. После того, как образцам позволили прореагировать при комнатной температуре в течение 15 минут, полученные продукты переносили в лунки 12-луночного культурального планшета и культивировали в инкубаторе при 37°С и 5% СО2 в течение 15 минут. После завершения реакции искусственную кожу дважды промывали в PBS и переносили в лунки нового 12-луночного культурального планшета и культивировали в течение 42 часов. После завершения культивирования добавляли 2 мл раствора МТТ 0,3 мг/мл и культивировали клетки в течение 3 часов. Образец в каждой лунке планшета обесцвечивали путем добавления 0,04 н. HCl-изопропанол и помещали в Spectra MAX i3, причем абсорбцию образца в каждой лунке измеряли при 580 нм.
Результаты представлены на Фиг. 4. Фиг. 4 представляет собой график, показывающий результаты измерения влияния С2-Р4 на раздражение кожи. Как показано на Фиг. 4, пептид С2-Р4 демонстрировал жизнеспособность клеток около 85% и, таким образом, не вызывал раздражения. Здесь, когда жизнеспособность клеток образца составляла 50% или более, было определено, что образец не имеет раздражения.
Экспериментальный пример 3: Подтверждение эффекта отбеливания кожи у выбранного пептида
(1) Измерение количества меланина в клетках после обработки С2-Р4
Клетки B16-F10, приобретенные в Корейском банке клеточных линий, инокулировали в 1 мл среды DMEM, содержащей 10% FBS, в концентрации 1×104 клеток/лунку в 24-луночном планшете и культивировали в инкубаторе при 37°С и 5% СО2 в течение 48 часов для образования клеточного монослоя. После этого среду заменяли на DMEM (без фенолового красного) с 10% FBS, к которой добавляли 5 мкМ или 10 мкМ пептида С2-Р4, и клетки культивировали в инкубаторе при 37°С и 5% СО2 в течение 48 часов. После завершения культивирования экспериментальную группу дважды промывали PBS и клетки снимали с помощью трипсин-EDTA. Клеточный монослой в каждой лунке помещали в 1 н. раствор NaOH с добавлением к нему 10% DMSO и инкубировали при 95°С в течение 20 минут для растворения меланина и клеток, а затем помещали в Spectra MAX i3, и измеряли абсорбцию образца в каждой лунке при 490 нм.
Результаты представлены на Фиг. 5. Фиг. 5 представляет собой график, показывающий результаты измерения влияния С2-Р4 на уровень меланина в клетках. Как показано на Фиг. 5, когда пептид С2-Р4 присутствовал в концентрациях 5 мкМ и 10 мкМ, абсорбция составляла около 180% и 250% по сравнению с негативным контролем, соответственно, и, таким образом, присутствие пептида С2-Р4 значительно увеличивало уровень меланина в клетках.
(2) Измерение количества меланина в среде после обработки С2-Р4
Кроме того, культуральную среду, из которой клетки были удалены через 48 часов культивирования (1) помещали в 1 н. раствор NaOH, к которому добавляли 10% DMSO, и меланин и клетки растворяли при 95°С в течение 20 минут, а затем измеряли абсорбцию образца при 490 нм.
Результаты представлены на Фиг. 6. На Фиг. 6 представлен график, показывающий результаты измерения влияния С2-Р4 на уровень меланина в среде. Как показано на Фиг. 6, когда пептид С2-Р4 присутствовал в концентрациях 5 мкМ и 10 мкМ, абсорбция составляла около 107% и 105% по сравнению с негативным контролем, соответственно, и, таким образом, уровень меланина в среде не увеличивался.
Согласно Фиг. 5 и 6, в присутствии пептида С2-Р4 уровень меланина в клетках повышался, в то время как уровень меланина в среде не увеличивался, и, таким образом, это указывает на то, что секреция меланина наружу из клеток подавляется пептидом С2-Р4.
(3) Измерение активности zenaMITF после обработки С2-Р4
Клетки B16-F10, приобретенные в Корейском банке клеточных линий, инокулировали в 3 мл среды DMEM, содержащей 10% FBS, в концентрации 1×105 клеток/лунку в 6-луночный планшет и культивировали в инкубаторе при 37°С и 5% СО2 в течение 24 часов для образования клеточного монослоя. Среду в негативном контроле заменяли средой DMEM, а среду в экспериментальных группах, обработанных пептидами, и экспериментальных группах, содержащих α-MSH (α-меланоцитстимулирующий гормон), заменяли средой, содержащей 10 мкМ каждого из пептидов и 50 нМ α-MSH соответственно, а затем клетки культивировали в течение 48 часов. Каждую экспериментальную группу дважды промывали PBS, клетки снимали с помощью трипсин-EDTA и центрифугировали при 1500 об./мин в течение 5 минут для выделения клеток. РНК экстрагировали из выделенных клеток с использованием тризола, и каждые 1000 нг кДНК синтезировали с помощью обратной транскриптазы. Уровни экспрессии GAPDH (глицеральдегид-3-фосфатдегидрогеназа) и a-MSH были подтверждены с помощью ПЦР в реальном времени с использованием 100 нг каждой из синтезированных кДНК. Праймерами, использованными для ПЦР в реальном времени, были последовательности SEQ ID NO: 9 и 10. В качестве альтернативы применяли наборы полинуклеотидов последовательностей SEQ ID NO: 11 и 12.
Результаты приведены на Фиг. 7 и в Таблице 2. Фиг. 7 представляет собой график, демонстрирующий уровень экспрессии мРНК гена MITF в присутствии С2-Р4 и α-MSH.
Как показано на Фиг. 7 и в Таблице 2, было подтверждено, что выработка меланина пептидом С2-Р4 в клетках B16-F10 значительно не изменялась, тогда как секреция меланина клетками ингибировалась пептидом С2-Р4. Известно, что связанный с микрофтальмией фактор транскрипции (MITF, Microphthalmia-associated transcription factor) регулирует экспрессию различных генов, важных для нормального синтеза меланина в меланоцитах человека. Как показано на Фиг. 7 и в Таблице 2, пептид С2-Р4 не оказывал существенного влияния на экспрессию гена MITF, который оказывает значительное влияние на образование меланина. Это указывает на то, что пептид С2-Р4 вызывает накопление меланина внутри клетки путем ингибирования секреции меланина из клетки, а не увеличения выработки меланина.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Medytox Inc.
<120> ПЕПТИД, ИНГИБИРУЮЩИЙ ОБРАЗОВАНИЕ КОМПЛЕКСА SNARE,
И ЕГО ПРИМЕНЕНИЕ
<130> 32-ZZ-PCT-1
<150> KR 10-2020-0011344
<151> 2020-01-30
<160> 15
<170> KoPatentIn 3.0
<210> 1
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> P1
<400> 1
Glu Glu Met Gln Arg Arg
1 5
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> P2
<400> 2
Asp Ala Arg Glu Asn Glu Met Asp Glu Asn Leu Glu Gln Val Ser Gly
1 5 10 15
Ile
<210> 3
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> P3
<400> 3
Leu Ser Glu Ile Glu Thr Arg His Ser Glu Ile Ile Lys Leu Glu Asn
1 5 10 15
Ser
<210> 4
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> P4
<400> 4
Arg Arg Leu Gln Gln Thr Gln Ala Gln Val Asp Glu Val Val Asp Ile
1 5 10 15
Met
<210> 5
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> P5
<400> 5
Asp Ala Arg Glu Asn Glu Met Asp Glu Asn Leu Glu Gln Val
1 5 10
<210> 6
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> P6
<400> 6
Leu Ser Glu Ile Glu Thr Arg His Ser Glu Ile Ile Lys Leu
1 5 10
<210> 7
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> P7
<400> 7
Arg Arg Leu Gln Gln Thr Gln Ala Gln Val Asp Glu Val Val
1 5 10
<210> 8
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> IMT-P8
<400> 8
Arg Arg Trp Arg Arg Trp Asn Arg Phe Asn Arg Arg Arg Cys Arg
1 5 10 15
<210> 9
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 9
catggacttt cccttatcc 19
<210> 10
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 10
gtgagatcca gagttgtc 18
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 11
agcaatgcct cctgcaccac caac 24
<210> 12
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 12
ccggaggggc catccacagt ct 22
<210> 13
<211> 116
<212> PRT
<213> Homo sapiens
<400> 13
Met Ser Ala Thr Ala Ala Thr Ala Pro Pro Ala Ala Pro Ala Gly Glu
1 5 10 15
Gly Gly Pro Pro Ala Pro Pro Pro Asn Leu Thr Ser Asn Arg Arg Leu
20 25 30
Gln Gln Thr Gln Ala Gln Val Asp Glu Val Val Asp Ile Met Arg Val
35 40 45
Asn Val Asp Lys Val Leu Glu Arg Asp Gln Lys Leu Ser Glu Leu Asp
50 55 60
Asp Arg Ala Asp Ala Leu Gln Ala Gly Ala Ser Gln Phe Glu Thr Ser
65 70 75 80
Ala Ala Lys Leu Lys Arg Lys Tyr Trp Trp Lys Asn Leu Lys Met Met
85 90 95
Ile Ile Leu Gly Val Ile Cys Ala Ile Ile Leu Ile Ile Ile Ile Val
100 105 110
Tyr Phe Ser Thr
115
<210> 14
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> C2-P4
<400> 14
Arg Arg Trp Arg Arg Trp Asn Arg Phe Asn Arg Arg Arg Cys Arg Arg
1 5 10 15
Arg Leu Gln Gln Thr Gln Ala Gln Val Asp Glu Val Val Asp Ile Met
20 25 30
<210> 15
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> C2-P7
<400> 15
Arg Arg Trp Arg Arg Trp Asn Arg Phe Asn Arg Arg Arg Cys Arg Arg
1 5 10 15
Arg Leu Gln Gln Thr Gln Ala Gln Val Asp Glu Val Val
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| СЛИТАЯ МОЛЕКУЛА, СПОСОБНАЯ ИНДУЦИРОВАТЬ НЕВОСПАЛИТЕЛЬНЫЙ ФАГОЦИТОЗ | 2022 |
|
RU2823919C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| Эпитоп тиоредоксина-1, специфично связывающийся с моноклональным антителом | 2018 |
|
RU2804772C2 |
| Эпитоп тиоредоксина-1 и моноклональное антитело, специфически связывающееся с ним | 2018 |
|
RU2797266C2 |
| ЭПИТОП ТИОРЕДОКСИНА-1, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЙСЯ С МОНОКЛОНАЛЬНЫМ АНТИТЕЛОМ | 2018 |
|
RU2804126C2 |
| ЭПИТОП ТИОРЕДОКСИНА-1, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЙСЯ С МОНОКЛОНАЛЬНЫМ АНТИТЕЛОМ | 2023 |
|
RU2802944C1 |
| ТЕРАПЕВТИЧЕСКОЕ И КОСМЕТИЧЕСКОЕ ПРИМЕНЕНИЕ НЕЙРОТОКСИНА БОТУЛИНА СЕРОТИПА E | 2019 |
|
RU2800604C2 |
| Слитый белок, содержащий вариант CCL3, и его применение | 2017 |
|
RU2727715C2 |
| Моноклональное антитело, специфично связывающееся с эпитопом тиоредоксина-1, его получение и применение | 2018 |
|
RU2790687C2 |
Изобретение относится к пептиду, ингибирующему образование комплекса SNARE, и его применению. Предложен пептид, в котором проникающий через клеточную мембрану пептид слит с фрагментом белка VAMP2 (ассоциированный с везикулами мембранный белок 2). Пептид может быть использован в качестве отбеливающего кожу агента или уменьшающего
морщины агента. 7 н. и 1 з.п. ф-лы, 7 ил., 2 табл., 3 пр.
1. Пептид, в котором проникающий через клеточную мембрану пептид слит
с фрагментом белка VAMP2 (ассоциированный с везикулами мембранный белок 2), где
указанный фрагмент состоит из аминокислотной последовательности SEQ ID NO: 4 или
7, а проникающий через клеточную мембрану пептид состоит из аминокислотной
последовательности SEQ ID NO: 8, где C-конец проникающего через клеточную
мембрану пептида слит с N-концом указанного фрагмента, и где N-конец пептида может
быть ацетилированным, С-конец пептида может быть амидированным.
2. Пептид по п. 1, который состоит из аминокислотной последовательности
SEQ ID NO: 14 или SEQ ID NO: 15.
3. Композиция для отбеливания кожи, содержащая пептид по п. 1 или 2 в
качестве активного ингредиента.
4. Применение пептида по п. 1 или 2 в изготовлении отбеливающего кожу
агента.
5. Применение пептида по п. 1 или 2 в качестве отбеливающего кожу агента.
6. Композиция для уменьшения морщин, содержащая пептид по п. 1 или 2 в
качестве активного ингредиента.
7. Применение пептида по п. 1 или 2 в изготовлении уменьшающего
морщины агента.
8. Применение пептида по п. 1 или 2 в качестве уменьшающего морщины
агента.
| WO 2008026852 A1, 06.03.2008 | |||
| KR 1020090041066 A (SUNGKYUNKWAN UNIVERSITY FOUNDATION FOR CORPORATE COLLABORATION ), 28.04.2009 | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2024-01-30—Публикация
2021-01-22—Подача