Эта работа поддержана Кампанией инновационного бизнеса для нерегулируемых специальных зон, финансируемой Министерством малого и среднего предпринимательства и начинающих компаний (Корея) [Promotion of Innovative Businesses for Regulation-Free Special Zones funded by the Ministry of SMEs and Startups (MSS, Korea)].
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эпитопу антигена тиоредоксина-1 (Trx1) и моноклональному антителу, специфично связывающемуся с ним, и, конкретнее, к эпитопу, моноклональному антителу, специфично связывающемуся с ним, его антигенсвязывающему фрагменту, молекуле нуклеиновой кислоты, кодирующей тяжелую цепь и/или легкую цепь указанного антитела или его антигенсвязывающего фрагмента, рекомбинантному вектору, содержащему указанную молекулу нуклеиновой кислоты, клетке-хозяину, содержащей указанный рекомбинантный вектор, способу получения указанного антитела или его антигенсвязывающего фрагмента, набору для диагностики рака молочной железы и способу предоставления информации, необходимой для диагностики рака молочной железы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Тиоредоксин (Trx) представляет собой небольшой окислительно-восстановительный белок массой приблизительно 12 кДа, который присутствует в восстановленном состоянии благодаря NADPH-зависимому восстановлению тиоредоксинредуктазой и у млекопитающих включает тиоредоксин-1 (Trx1) и тиоредоксин-2 (Trx2). Тиоредоксин действует как фактор роста, удаляет перекись водорода, токсичную для клеток, стимулирует связывание критических факторов, связанных с ролью рибонуклеотидредуктазы и транскрипцией у бактерий, с ДНК и влияет на активность транскрипционных факторов, таких как ядерный транскрипционный фактор kB (NF-kB), в эукариотических клетках. Таким образом, тиоредоксин влияет на гибель клеток и опухолей и поэтому играет ключевую роль в регуляции роста раковых клеток, а также расщепляет дисульфидную связь в другом окисленном белке, способствуя поддержанию активности в восстановленном состоянии. Тиоредоксин-1- и тиоредоксин-2-редуктазы удаляют оксид азота из цистеинов в клетках млекопитающих, что влияет на гибель клеток, и обладают потенциальной значимостью при различных заболеваниях, включая воспалительное заболевание, сердечный приступ и рак. Кроме того, иммуногистохимический анализ с использованием антитела против тиоредоксина демонстрирует экспрессию тиоредоксина в раковых тканях у человека, включая печень, толстую кишку, поджелудочную железу и шейку матки, и такая экспрессия указывает на возможную роль тиоредоксина в развитии опухолей.
В этих обстоятельствах авторы изобретения изучили маркер для диагностики рака молочной железы, который позволяет проводить диагностику рака молочной железы или его раннее прогнозирование; экспрессия тиоредоксина-1 была низкой в нормальной ткани молочной железы, но очень высокой в ткани рака молочной железы, демонстрируя, что тиоредоксин-1 полезен в качестве маркера для диагностики рака молочной железы (патент Кореи №10-1058230).
Для разработки диагностики in vitro (IVD) на основе твердофазного иммуноферментного анализа (ELISA) с высокой точностью и высокой прецизионностью необходима пара антител к одному и тому же антигенному белку, имеющих разные сайты с разными значениями аффинности. Более того, необходима система получения антител, обладающих определенной аффинностью, не требующая больших затрат. В настоящем изобретении для выявления тиоредоксина-1 (Trx1), присутствующего в человеческой сыворотке, были разработаны два типа высокоэффективных рекомбинантных моноклональных антител, которые связываются с тиоредоксином-1 с очень высокой специфичностью и, таким образом, могут быть полезны для скрининга, направленного на выявление пациентов с раком молочной железы. Кроме того, определением сайта антигена человеческого Trx1, с которым связываются два указанных типа антител, настоящее изобретение было завершено.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Настоящее изобретение предложено для решения указанных выше проблем и направлено на обеспечение моноклонального антитела или его антигенсвязывающего фрагмента, позволяющего диагностировать рак молочной железы с высокой чувствительностью и специфичностью.
Настоящее изобретение также направлено на обеспечение молекулы нуклеиновой кислоты, кодирующей тяжелую цепь и/или легкую цепь указанного моноклонального антитела или его антигенсвязывающего фрагмента.
Настоящее изобретение также направлено на обеспечение рекомбинантного вектора, содержащего указанную молекулу нуклеиновой кислоты.
Настоящее изобретение также направлено на обеспечение клетки-хозяина, содержащей указанный рекомбинантный вектор.
Настоящее изобретение также направлено на обеспечение эпитопа антигена человеческого Trx1, с которым связывается моноклональное антитело или его связывающий фрагмент, молекулы нуклеиновой кислоты, кодирующей указанный эпитоп, рекомбинантного вектора, содержащего указанную молекулу нуклеиновой кислоты, и клетки-хозяина, содержащей указанный рекомбинантный вектор.
Настоящее изобретение также направлено на обеспечение способа получения моноклонального антитела, специфично связывающегося с Trx1, или его антигенсвязывающего фрагмента, включающего культивирование указанной клетки-хозяина.
Настоящее изобретение также направлено на обеспечение набора для диагностики рака молочной железы, содержащего описанное выше моноклональное антитело или его антигенсвязывающий фрагмент.
Настоящее изобретение также направлено на обеспечение способа предоставления информации, необходимой для диагностики рака молочной железы, с использованием описанного выше моноклонального антитела или его антигенсвязывающего фрагмента.
Техническое решение
Для решения описанных выше проблем согласно настоящему изобретению предложены моноклональное антитело, специфично связывающееся с Trx1, или его антигенсвязывающий фрагмент, содержащие вариабельную область легкой цепи, содержащую CDR1 (определяющий комплементарность участок 1) легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 1, CDR2 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 2, и CDR3 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область тяжелой цепи, содержащую CDR1 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 4, CDR2 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 5, и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 6.
Согласно одному типичному воплощению настоящего изобретения, антитело может содержать вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 13, и вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 14.
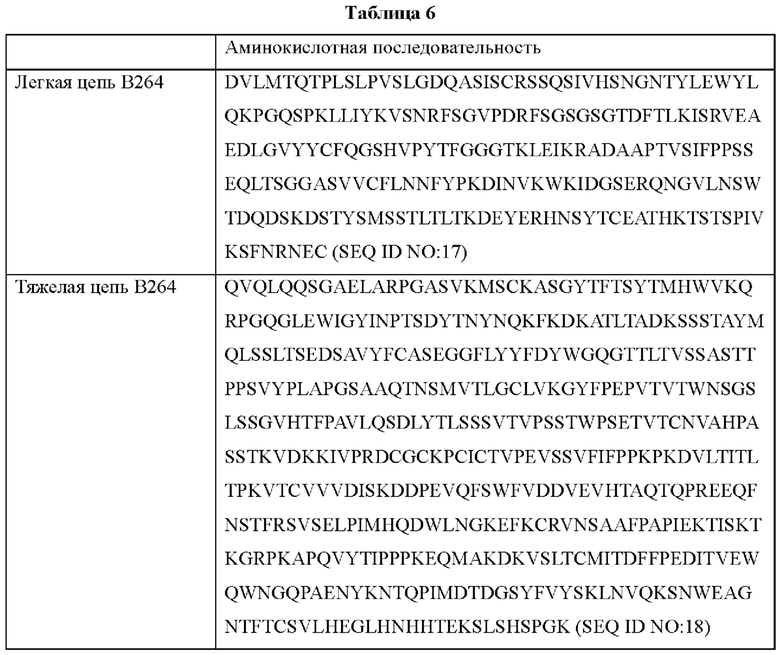
Согласно другому типичному воплощению настоящего изобретения, антитело может содержать легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 17, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 18.
Согласно настоящему изобретению также предложены моноклональное антитело, специфично связывающееся с Trx1, или его антигенсвязывающий фрагмент, содержащие вариабельную область легкой цепи, содержащую CDR1 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 7, CDR2 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 8, и CDR3 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 9, и вариабельную область тяжелой цепи, содержащую CDR1 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 10, CDR2 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 11, и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 12.
Согласно одному типичному воплощению настоящего изобретения, антитело может содержать вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 15, и вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 16.
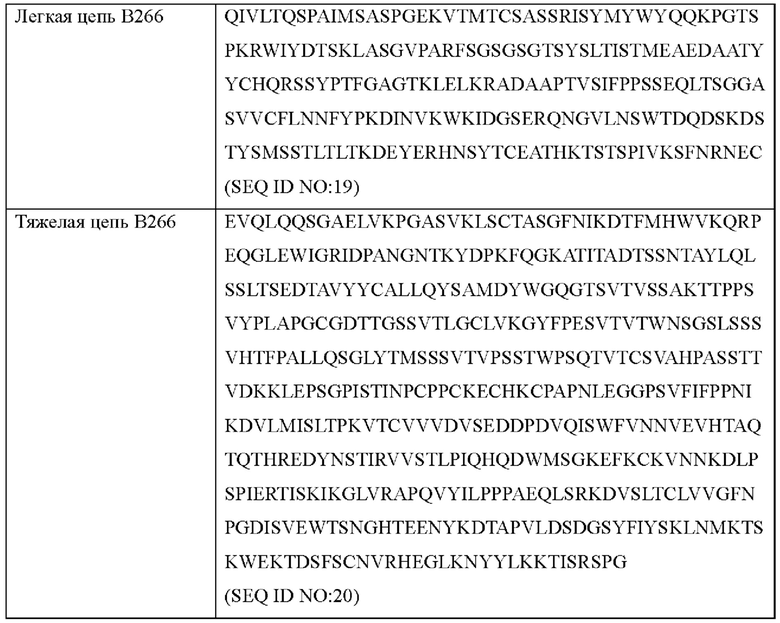
Согласно другому типичному воплощению настоящего изобретения, антитело может содержать легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 19, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 20.
Согласно еще одному типичному воплощению настоящего изобретения, антитело может содержать легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 25, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 26.
Согласно еще одному типичному воплощению настоящего изобретения, антитело может содержать тяжелую цепь IgG1 и легкую цепь каппа (κ).
Согласно еще одному типичному воплощению настоящего изобретения, антигенсвязывающий фрагмент может представлять собой Fab, F(ab'), F(ab')2, Fv или молекулу одноцепочечного антитела.
Согласно еще одному типичному воплощению настоящего изобретения, антитело может представлять собой химерное антитело, гуманизированное антитело или человеческое антитело.
Согласно настоящему изобретению также предложена молекула нуклеиновой кислоты, кодирующая тяжелую цепь и/или легкую цепь описанного выше антитела или его антигенсвязывающего фрагмента.
Согласно одному типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты, кодирующая легкую цепь, может состоять из нуклеотидной последовательности SEQ ID NO: 21, нуклеотидной последовательности SEQ ID NO: 23 или нуклеотидной последовательности SEQ ID NO: 27.
Согласно одному типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты, кодирующая тяжелую цепь, может состоять из нуклеотидной последовательности SEQ ID NO: 22, нуклеотидной последовательности SEQ ID NO: 24 или нуклеотидной последовательности SEQ ID NO: 28.
Согласно настоящему изобретению также предложены рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую тяжелую цепь, нуклеиновую кислоту, кодирующую легкую цепь, или обе из молекул нуклеиновых кислот, кодирующих тяжелую цепь и легкую цепь, и клетка-хозяин, содержащая указанный рекомбинантный вектор.
Согласно настоящему изобретению также предложены эпитоп антигена человеческого Trx1, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 32-34 и 172-176, и молекула нуклеиновой кислоты, кодирующая указанный эпитоп.
Согласно одному типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты может состоять из любой нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 35-37 и 177-181.
Согласно настоящему изобретению также предложены рекомбинантный вектор, содержащий указанную молекулу нуклеиновой кислоты, и клетка-хозяин, содержащая указанный рекомбинантный вектор.
Согласно настоящему изобретению также предложен способ получения моноклонального антитела, специфично связывающегося с Trx1, или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина, содержащей рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую тяжелую цепь описанного выше антитела, нуклеиновую кислоту, кодирующую его легкую цепь, или обе из молекул нуклеиновых кислот, кодирующих его тяжелую цепь и легкую цепь.
Согласно настоящему изобретению также предложен набор для диагностики рака молочной железы, содержащий описанное выше антитело или его антигенсвязывающий фрагмент.
Согласно одному типичному воплощению настоящего изобретения, набор может представлять собой набор для твердофазного иммуноферментного анализа (ELISA).
Согласно другому типичному воплощению настоящего изобретения, ELISA может представлять собой любое, выбранное из группы, состоящей из прямого ELISA, непрямого ELISA, прямого сэндвич-ELISA и непрямого сэндвич-ELISA.
Согласно настоящему изобретению также предложен способ предоставления информации, необходимой для диагностики рака молочной железы, включающий: (а) приведение описанного выше моноклонального антитела или его антигенсвязывающего фрагмента в контакт с биологическим образцом, выделенным от субъекта с подозрением на рак молочной железы; (б) измерение уровня экспрессии белка Trx1, связывающегося с моноклональным антителом или его антигенсвязывающим фрагментом в указанном биологическом образце через образование комплекса антиген-антитело; и (в) сравнение уровня экспрессии белка Trx1, измеренного на стадии (б), с контрольным и, если уровень экспрессии белка превышает контрольный, определение субъекта как пациента с раком молочной железы.
Кроме того, согласно настоящему изобретению предложен способ предоставления информации, необходимой для диагностики рака молочной железы, включающий: (а) покрытие твердой подложки моноклональным антителом или его антигенсвязывающим фрагментом, содержащим CDR1-CDR3 легкой цепи и CDR1-CDR3 тяжелой цепи антитела В266 или В266-1, моноклональным антителом или его антигенсвязывающим фрагментом, содержащим вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела В266 или В266-1, или антителом В266 или В266-1 или его антигенсвязывающим фрагментом; (б) нанесение биологического образца, выделенного от субъекта с подозрением на рак молочной железы, на твердую подложку с покрытием; (в) удаление несвязанного образца; (г) нанесение моноклонального антитела или его антигенсвязывающего фрагмента, содержащего CDR1-CDR3 легкой цепи и CDR1-CDR3 тяжелой цепи антитела В264, моноклонального антитела или его антигенсвязывающего фрагмента, содержащего вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела В264, или антитела В264 или его антигенсвязывающего фрагмента на твердую подложку; (д) удаление несвязанного моноклонального антитела или его антигенсвязывающего фрагмента; (е) измерение уровня экспрессии белка Trx1; и (ж) сравнение уровня экспрессии белка Trx1, измеренного на стадии (е), с контрольным и, если уровень экспрессии белка превышает контрольный, определение субъекта как пациента с раком молочной железы.
Согласно одному типичному воплощению настоящего изобретения, уровень экспрессии белка Trx1 может быть измерен любым методом, выбранным из группы, состоящей из вестерн-блоттинга, ELISA, сэндвич-ELISA, радиоиммунного анализа, радиоиммунодиф фузии, иммунодиффузии по Оухтерлони, анализа иммунопреципитации, анализа фиксации комплемента, иммунохроматографического анализа, FACS (сортировки флуоресцентно-активированных клеток) и анализа на белковых чипах.
Согласно другому типичному воплощению настоящего изобретения, выделенный биологический образец может представлять собой любое одно или более чем одно, выбранное из группы, состоящей из цельной крови, сыворотки, плазмы, ткани молочной железы и клеток молочной железы.
Если не определено иное, все технические и научные термины, использованные в данном описании, имеют то же значение, в котором их обычно понимает специалист в области, к которой относится данное изобретение. В целом, номенклатура, использованная здесь, хорошо известна и широко применяется в данной области.
В данной заявке использованы следующие определения ключевых терминов.
Термин «антиген» относится к молекуле, которая может быть связана антителом и может быть использована у животного для получения антитела, способного связываться с эпитопом антигена или частью его молекулы. Антиген может иметь один или более чем один эпитоп.
Термин «антитело» или «Ab» представляет собой молекулу иммуноглобулина, которая может распознавать определенную мишень или антиген, например углевод, полинуклеотид, липид или полипептид, через один или более чем один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина, и связываться с ней. Термин «антитело», используемый здесь, может относиться с любому типу антитела, включая, без ограничения: моноклональное антитело; поликлональное антитело; «антигенсвязывающий фрагмент» антитела, обладающий способностью к специфичному связыванию с определенным антигеном (например, Trx1), например, Fab, Fab', F(ab')2, Fd, Fv, Fc и так далее; выделенный участок, определяющий комплементарность (CDR); биспецифичное антитело; гетероконъюгированное антитело или его мутант; антитело или слитый белок, имеющий антигенсвязывающий фрагмент (например, однодоменное антитело); одноцепочечный вариабельный фрагмент (ScFv) и однодоменное антитело (например, антитела акулы и представителей семейства Верблюдовых); макситело, минитело, интратело, диатело, триатело, тетратело, v-NAR и bis-scFv; гуманизированное антитело; химерное антитело; и все другие модифицированные конфигурации молекулы иммуноглобулина, содержащие сайт распознавания антигена с необходимой специфичностью (включая гликозилированные варианты антитела, варианты аминокислотной последовательности антитела и ковалентно модифицированное антитело). Антитело может иметь происхождение из мыши, крысы, человека или любого другого источника (включая химерное или гуманизированное антитело).
Антитело или полипептид, «специфично связывающиеся» с определенной мишенью или антигеном (например, белком Trx1), представляют собой термин, общепонятный в области, к которой относится данное изобретение, и методы определения такого специфичного связывания также широко известны в этой области. Определенную молекулу рассматривают как обладающую «специфичным связыванием», когда она взаимодействует или связывается с определенной клеткой или веществом чаще, быстрее, постояннее и/или с более высокой аффинностью, чем с клетками или веществами другого типа. Определенное антитело «специфично связывается» с определенной мишенью или антигеном с более высокой аффинностью, более высокой связывающей активностью, быстрее и/или постояннее, чем при связывании с другими веществами.
Термин «аффинность связывания» или «KD», используемый здесь, относится к равновесной константе диссоциации при взаимодействии антитела с определенным антигеном. KD представляет собой отношение скорости диссоциации (также называемой «скоростью высвобождения» или «kd») к скорости связывания, или «скорости ассоциации», или «ka (константа скорости ассоциации)». Таким образом, KD представляет собой kd/ka, выраженное как молярная концентрация (М). Из этого следует, что чем ниже KD, тем выше аффинность связывания. Таким образом, KD 1 мкМ указывает на меньшую аффинность связывания, чем KD 1 нМ. Значение KD антитела может быть определено с применением метода, широко известного в данной области. В одном методе определения KD антитела обычно применяют поверхностный плазмонный резонанс с использованием биосенсорной системы, например системы Biacore®.
Термин «вектор» включает молекулу нуклеиновой кислоты, способную доставлять связанную с ней другую нуклеиновую кислоту. Одним типом вектора является «плазмида», представляющая собой кольцевую петлю из двуцепочечной ДНК, в которую может быть лигирован дополнительный фрагмент ДНК. Другим типом вектора является вирусный вектор, и в таком случае дополнительный фрагмент ДНК может быть присоединен к вирусному геному. Некоторые векторы способны к саморепликации в клетках-хозяевах, в которые они введены (например, бактериальный вектор, имеющий бактериальный репликатор, и эписомный вектор для клеток млекопитающих). Другие векторы (например, неэписомный вектор для клеток млекопитающих) могут быть интегрированы в геном клеток-хозяев при введении в клетки-хозяева и, таким образом, проходить репликацию вместе с геномом хозяина. Кроме того, некоторые векторы могут управлять экспрессией функционально связанных генов. В данном описании векторы называют «рекомбинантными векторами экспрессии» (или просто «векторами экспрессии»). Обычно вектор экспрессии, полезный в методике рекомбинантных ДНК, часто присутствует в форме плазмиды. «Плазмида» и «вектор», используемые здесь, являются типами векторов, которые используются чаще всего, и, таким образом, могут быть использованы взаимозаменяемо. Тем не менее, настоящее изобретение включает различные типы векторов экспрессии, выполняющих одинаковые функции, например вирусные векторы (например, дефектные по репликации ретровирус, аденовирус и аденоассоциированный вирус).
Термин «клетки-хозяева» использован для обозначения трансформированных клеток или клеток, трансформированных последовательностью нуклеиновой кислоты для экспрессии выбранного гена, представляющего интерес. Данный термин включает потомков материнских клеток независимо от того, идентичны ли они исходной клетке в морфологическом или генетическом аспекте, при условии присутствия в них выбранного гена.
Полезные эффекты
Моноклональное антитело по настоящему изобретению обладает превосходной аффинностью связывания с тиоредоксином-1, что позволяет ему очень специфично связываться с тиоредоксином-1, и обладает очень высокой чувствительностью и специфичностью, что позволяет эффективно использовать его при скрининге, направленном на выявление пациентов с раком молочной железы. Кроме того, выявление тиоредоксина-1 с использованием моноклонального антитела, специфично связывающегося с тиоредоксином-1, по настоящему изобретению, а не выявление с использованием традиционного диагностического биомаркера рака молочной железы СА15-3, демонстрирует исключительно высокую чувствительность и специфичность, что позволяет значительно повысить точность и надежность диагностики рака молочной железы. Эпитопная область антигена человеческого Trx1, с которой связывается антитело по настоящему изобретению, может быть эффективно использована при разработке улучшенного антитела для повышения аффинности связывания антитела против Trx1.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 показана карта расщепления рекомбинантного вектора, экспрессирующего антиген тиоредоксин-1 и результат изотипирования антитела, полученного в Примере 1. bp - п.о. (пар оснований); Ampicillin - ампициллин.
На ФИГ. 2 показаны аминокислотные последовательности легкой цепи (а) и тяжелой цепи (b) антитела 9G7(AB1), полученного в Примере 1.
На ФИГ. 3 показаны аминокислотные последовательности легкой цепи (а) и тяжелой цепи (b) антитела 2 В4(АВ2), полученного в Примере 1.
На ФИГ. 4 показаны карты расщепления рекомбинантного вектора, экспрессирующего легкую цепь (а) и тяжелую цепь (b) антитела В264 с высокой аффинностью.
На ФИГ. 5 показаны карты расщепления рекомбинантного вектора, экспрессирующего легкую цепь (а) и тяжелую цепь (b) антитела В266 с высокой аффинностью.
На ФИГ. 6 показаны результаты определения восстановленных (+) и невосстановленных (-) состояний антител с применением SDS-PAGE, где на (а) представлен результат для антитела В264, а на (b) представлен результат для антитела В266.
На ФИГ. 7 показаны результаты определения восстановленного (+) и невосстановленного (-) состояния антитела В266-1 с применением SDS-PAGE, где антитело В266-1 получено посредством модификации Fc-части антитела В266 на Fc человеческого IgG1.
На ФИГ. 8A-8D показаны результаты IMTG-выравнивания с разрывами для легкой цепи и тяжелой цепи антитела В266-1 и легкой цепи и тяжелой цепи антитела В264 по порядку.
На ФИГ. 9 показаны результаты анализа аффинности антител В266-1 и В264, где на (А) показан показатель взаимодействия в соответствии с концентрацией антитела, а на (В) показан результат анализа аффинности антител с применением программы Prism.
На ФИГ. 10 представлен график, на котором показаны чувствительность и специфичность, полученные при ROC-анализе результатов ELISA с использованием антител В266-1 и В264.
На ФИГ. 11 показано сравнение гомологии аминокислотных последовательностей человеческого Trx1 и Trx1 Chrysochloris asiatica. PREDICTED: thioredoxin-like - предполагаемая последовательность: тиоредоксиноподобный; Sequence ID - идентификатор последовательности; Length - длина; Number of Matches - число совпадений; Query - рассматриваемая последовательность; human - человеческий; Sbject - последовательность сравнения; Range - диапазон; Score - показатель; Expect - ожидание; Method - метод; Identities - идентичные; Positives - положительные; Gaps - разрывы.
На ФИГ. 12 показан результат электрофореза для подтверждения успешного клонирования посредством клонирующей плазмиды CaTrx1 и обработки рестриктазами (Sfi I и Xho I), где на дорожке 1 показана клонирующая плазмида CaTrx1, а на дорожке 2 показана плазмида, обработанная рестриктазами.
На ФИГ. 13 показан результат анализа степени экспрессии белка CaTrx1, секретируемого клеточной линией, после трансфекции клетки животного плазмидой CaTrx1.
На ФИГ. 14 показаны результаты анализа аффинности антител В266-1 и В264 в отношении hTrx1 и CaTrx1.
На ФИГ. 15А показано сравнение аминокислотных последовательностей CaTrx1 и hTrx1. Translation of Chrysochloris asiatica- трансляция Chrysochloris asiatica; Translation of human TRX - Трансляция человеческого TRX.
На ФИГ. 15В показано расположение мутаций согласно сравнению аминокислотных последовательностей CaTrx1 и hTrx1.
На ФИГ. 15С представлена схема ПЦР (полимеразная цепная реакция) слияния для получения мутантного гена hTrx1, являющегося результатом амплификации фрагмента ДНК, и ПЦР с перекрывающимися праймерами, проводимых друг за другом.
На ФИГ. 15D показан результат амплификации фрагментов ДНК для определения расположения мутаций.
На ФИГ. 15Е показан результат получения кассет посредством ПЦР с перекрывающимися праймерами с использованием полученных фрагментов ДНК.
На ФИГ. 15F показана экспрессия 8 типов мутантных генов hTrx1 после трансформации 293F плазмидами, клонирующими каждый мутантный ген hTrx1.
На ФИГ. 16 показаны белки, секретированные в культуральный раствор после трансдукции человеческих клеток HEK293 генами, полученными посредством трансформации, показанной на ФИГ. 15, и их культивирования, выявленные посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). Поскольку размер Trx1 составляет приблизительно 12 кДа, выявляли белок соответствующего размера, подтвердив экспрессию 8 типов трансформированных генов и их секрецию в виде белков в культуральный раствор.
На ФИГ. 17 показан результат анализа степени экспрессии 8 типов мутантных белков hTrx1, выявленных на ФИГ. 16, после очистки.
На ФИГ. 18А-18С показаны результаты анализа силы связывания антитела против Trx1 в отношении 8 типов мутантных белков hTrx1 по настоящему изобретению.
На ФИГ. 19 представлена схема, на которой показан общий принцип выявления эпитопов с применением сканирования перекрывающихся пептидов, примененного в Примере 17.
На ФИГ. 20 представлено изображение миниматриц, полученное с использованием одного из образцов антител, описанных в Примере 17.
На ФИГ. 21A-21D представлена диаграмма с тепловой картой, на которой показана степень взаимодействия контролей, взаимодействующих с образцами антител и всеми пептидами-зондами, где по оси у показаны последовательности пептидов библиотеки, а по оси x показаны концентрации нанесенных образцов антител. Значения ММС2 показаны цветовым кодом, диапазон которого включает белый (0 или низкая интенсивность), желтый (средняя интенсивность) и красный (высокая интенсивность). Mouse IgG - мышиный IgG; Control-Spot - контрольная точка; Control mouse IgG - контрольный мышиный IgG; ug/mL - мкг/мл.
На ФИГ. 22A-22F представлены изображения, подтверждающие расположение эпитопа в трехмерной структуре белка hTrx1.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретения будет описано подробно.
Как описано выше, в предшествующих исследованиях авторы изобретения подтвердили, что тиоредоксин-1 экспрессируется в нормальной ткани молочной железы на низком уровне, но в ткани рака молочной железы уровень его экспрессии очень высок. Таким образом, доказано, что тиоредоксин-1 является полезным в качестве маркера для диагностики рака молочной железы.
Поэтому в последующих исследованиях авторы изобретения разработали моноклональное антитело, связывающееся с тиоредоксином-1 очень специфично и полезное при скрининге, направленном на выявление пациентов с раком молочной железы. Моноклональное антитело по настоящему изобретению очень специфично связывается с тиоредоксином-1 благодаря превосходной аффинности связывания с тиоредоксином-1 и обладает очень высокой чувствительностью и специфичностью, таким образом, что его можно эффективно использовать при скрининге, направленном на выявление пациентов с раком молочной железы. Кроме того, выявление тиоредоксина-1 с использованием моноклонального антитела по настоящему изобретению, специфично связывающегося с тиоредоксином-1, а не выявление СА15-3, другого биомаркера, традиционно используемого для диагностики рака молочной железы, демонстрирует превосходную чувствительность и специфичность, благодаря чему можно значительно повысить точность и надежность диагностики рака молочной железы. Кроме того, эпитопная область антигена человеческого Trx1, с которой связывается указанное антитело, может быть эффективно использована при разработке улучшенного антитела для повышения аффинности связывания антитела против Trx1.
Согласно настоящему изобретению предложено моноклональное антитело, связывающееся с тиоредоксином-1 (Trx1), или его антигенсвязывающий фрагмент.
Моноклональное антитело по настоящему изобретению может быть получено с применением множества методов, известных в данной области, таких как технологии гибридом, рекомбинации и фагового дисплея, и комбинацией указанных методов. Например, моноклональное антитело может быть получено с применением гибридомной методики, известной в данной области. Термин «моноклональное антитело», использованный здесь, не ограничен антителом, полученным с применением гибридомной методики. Термин «моноклональное антитело» относится к антителу, имеющему происхождение от какого-либо одного эукариотического, прокариотического или фагового клона, но не относится к способу его получения.
Метод получения и скрининга конкретного антитела с применением гибридомной методики распространен и хорошо известен в данной области. В качестве неограниченного примера, мышь можно иммунизировать целевым антигеном или клетками, экспрессирующими его. При выявлении иммунной реакции, например при выявлении антитела, специфичного в отношении антигена, в сыворотке мыши, у мыши извлекают селезенку для выделения клеток селезенки. Затем известным методом проводят слияние клеток селезенки с любыми подходящими миеломными клетками, например P3U1, P3X63-Ag8, P3X63-Ag8-U1, P3NS1-Ag4, SP2/0-Ag14 или P3X63-Ag8-653. Проводят отбор гибридомы и ее клонирование методом лимитирующих разведений. Затем методом, известным в данной области, гибридомный клон оценивают на предмет его способности быть клеткой, секретирующей антитело, способное связываться с антигеном. Обычно асцитическую жидкость, содержащую высокий уровень антител, можно получить посредством инъекции положительных гибридомных клонов в брюшную полость мыши. В типичном воплощении настоящего изобретения антиген Trx1 получают посредством трансфекции Е. coli рекомбинантным вектором, карта расщепления которого представлена на ФИГ. 1(a). Затем выделяют селезенку крысы, иммунизированной антигеном, и клетки, слитые с миеломными клетками (sp2/0) для получения антитела, взаимодействующего с Trx1, определяют посредством ELISA.
Типичное моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут содержать (а) или (б), как указано ниже, и могут быть названы В264 или В266-1, соответственно:
(а) вариабельную область легкой цепи, содержащую CDR1 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 1, CDR2 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 2, и CDR3 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область тяжелой цепи, содержащую CDR1 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 4, CDR2 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 5, и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 6; или
(б) вариабельную область легкой цепи, содержащую CDR1 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 7, CDR2 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 8, и CDR3 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 9, и вариабельную область тяжелой цепи, содержащую CDR1 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 10, CDR2 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 11, и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 12.
Термин «участок, определяющий комплементарность (CDR)», использованный здесь, относится к аминокислотной последовательности гипервариабельного участка тяжелой цепи или легкой цепи иммуноглобулина. Каждая тяжелая цепь (CDRH1, CDRH2 и CDRH3) и легкая цепь (CDRL1, CDRL2 и CDRL3) имеет три CDR, и эти CDR обеспечивают ключевые контактные остатки, когда антитело связывается с антигеном или эпитопом.
Типичное моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут содержать (в) или (г), как указано ниже, и могут быть названы В264 или В266-1, соответственно:
(в) вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 13, и вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 14; или
(г) вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 15, и вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 16.
Типичное моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент могут содержать (д) или (е), как указано ниже, и могут быть названы В264 или В266, соответственно:
(д) легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 17, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 18; или
(е) легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 19, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 20.
Типичное моноклональное антитело по настоящему изобретению называют В264, В265, В266, В267, В268 или В269 и, наиболее предпочтительно, В264 или В266-1. В266-1 представляет собой моноклональное антитело, в котором Fc-часть В266 модифицирована на Fc человеческого IgG1.
Структурная единица встречающегося в природе антитела обычно содержит тетрамер. Тетрамер обычно состоит из двух пар идентичных полипептидных цепей, и каждая пара имеет одну полноразмерную легкую цепь (обычно имеющую молекулярную массу приблизительно 15 кДа) и одну полноразмерную тяжелую цепь (обычно имеющую молекулярную массу приблизительно от 50 до 70 кДа). Амино-конец каждой легкой цепи и тяжелой цепи обычно содержит вариабельную область из приблизительно 100-110 или более аминокислот, вовлеченную в распознавание антигена. Карбокси-конец каждой цепи определяет константную область, которая обычно вовлечена в эффекторную функцию. Человеческие легкие цепи обычно классифицируют как легкие цепи κ и λ. Тяжелые цепи обычно классифицируют как тяжелые цепи μ, δ, γ, α и ε, которые определяют изотипы антител, такие как IgM, IgD, IgG, IgA и IgE, соответственно. IgG имеет, без ограничения, некоторые подклассы, включающие IgG1, IgG2, IgG3 и IgG4. IgM имеет, без ограничения, подклассы, включающие IgM1 и IgM2. Сходным образом, IgA классифицируют, без ограничения, на подклассы, включающие IgA1 и IgA2. В полноразмерных легких и тяжелых цепях вариабельные и константные области обычно соединены «J-областью» из приблизительно 12 или более аминокислот, а тяжелая цепь также содержит «D-область» из приблизительно 10 или более аминокислот. Вариабельная область каждой пары «легкая цепь/тяжелая цепь» обычно образует сайт связывания антигена. Согласно одному типичному воплощению настоящего изобретения, в моноклональном антителе по настоящему изобретению тяжелая цепь может представлять собой изотип IgG1, IgG2a, IgG2b, IgG3, IgA или IgM, а легкая цепь может представлять собой цепь κ или цепь λ, и предпочтительны легкая цепь κ и тяжелая цепь IgG1.
В моноклональном антителе по настоящему изобретению или его антигенсвязывающем фрагменте «его антигенсвязывающий фрагмент» обозначает фрагмент, выполняющий функцию связывания с антигеном, и включает Fab, F(ab'), F(ab')2, Fv или молекулу одноцепочечного антитела. Среди антигенсвязывающих фрагментов антител, Fab представляет собой структуру, имеющую вариабельные области легкой и тяжелой цепи, константную область легкой цепи и первую константную область (СН1) тяжелой цепи, и содержит один сайт связывания антигена. F(ab') отличается от Fab тем, что у него есть шарнирная область, содержащая один или более чем один остаток цистеина на С-конце домена СН1 тяжелой цепи. F(ab')2 образуется посредством дисульфидной связи между остатками цистеина шарнирных областей Fab'. Fv является наименьшим фрагментом антитела, имеющим только вариабельную область тяжелой цепи и вариабельную область легкой цепи. Такой фрагмент антитела может быть получен с использованием протеазы, предпочтительно с применением технологии рекомбинации генов. Например, Fab может быть получен посредством, например, расщепления целого антитела папаином, а F(ab')2-фрагмент может быть получен посредством расщепления целого антитела пепсином.
Типичное антитело по настоящему изобретению может представлять собой химерное антитело, гуманизированное антитело или полностью человеческое антитело.
Химерное антитело может быть получено посредством рекомбинантного сочетания вариабельных доменов легкой цепи и тяжелой цепи (VL и VH), полученных от одного типа продуцирующих антитела клеток, и константных доменов легкой цепи и тяжелой цепи, полученных из антитела другого типа. Обычно в химерном антителе использован вариабельный домен грызуна или кролика и человеческий константный домен с получением антитела, обычно имеющего человеческий домен. Получение такого химерного антитела широко известно в данной области и может быть осуществлено стандартными средствами. Следует также учитывать, что человеческая константная область химерного антитела по настоящему изобретению может быть выбрана из константной области IgG1, IgG2, IgG3, IgG4, IgG5, IgG6, IgG7, IgG8, IgG9, IgG10, IgG11, IgG12, IgG13, IgG14, IgG15, IgG16, IgG17, IgG18 или IgG19.
Гуманизированное антитело сконструировано таким образом, что оно содержит домен иммуноглобулина, еще более сходный с человеческим, и содержит определяющий комплементарность участок антитела животного происхождения. Этого достигают посредством тщательного изучения последовательности гипервариабельной петли вариабельной области моноклонального антитела и адаптации последовательности к структуре цепи человеческого антитела.
Полностью человеческое антитело представляет собой молекулу антитела, содержащую CDR таким образом, что последовательности как легкой цепи, так и тяжелой цепи полностью имеют происхождение от человеческого гена.
Согласно настоящему изобретению также предложена(ы) молекула(ы) нуклеиновой кислоты, кодирующая(ие) тяжелую цепь и/или легкую цепь моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента.
Термин «молекула нуклеиновой кислоты», используемый здесь, включает молекулы ДНК (гДНК и кДНК) и РНК, и в молекуле нуклеиновой кислоты нуклеотид, являющийся ее основной единицей, также включает аналог, в котором модифицирована сахарная или основная часть, а также естественный нуклеотид. Последовательности молекул нуклеиновых кислот, кодирующих вариабельные области тяжелой цепи и легкой цепи по настоящему изобретению, могут быть модифицированы. Модификация включает присоединения, делеции или неконсервативные или консервативные замены нуклеотидов.
Следует пояснить, что молекула нуклеиновой кислоты по настоящему изобретению также включает нуклеотидную последовательность, в существенной степени идентичную нуклеотидной последовательности, описанной выше. Существенная идентичность относится к нуклеотидной последовательности, демонстрирующей по меньшей мере 80%-ю гомологию, в одном конкретном примере по меньшей мере 90%-ю гомологию или, в другом конкретном примере, по меньшей мере 95%-ю гомологию при выравнивании нуклеотидной последовательности по настоящему изобретению с другой последовательностью для их максимального возможного соответствия и анализе выровненных последовательностей с применением алгоритма, обычно используемого в данной области.
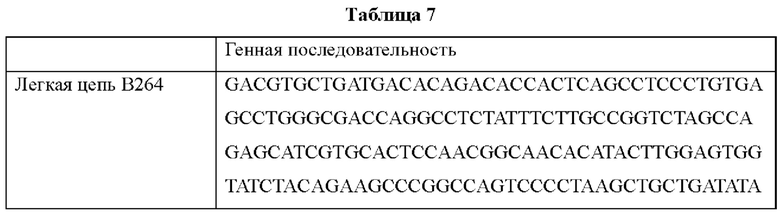
Согласно одному типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты, кодирующая легкую цепь моноклонального антитела по настоящему изобретению, может состоять из нуклеотидной последовательности SEQ ID NO: 21, а молекула нуклеиновой кислоты, кодирующая тяжелую цепь моноклонального антитела по настоящему изобретению, может состоять из нуклеотидной последовательности SEQ ID NO: 22.
Согласно другому типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты, кодирующая тяжелую цепь моноклонального антитела по настоящему изобретению, может состоять из нуклеотидной последовательности SEQ ID NO: 23, а молекула нуклеиновой кислоты, кодирующая легкую цепь моноклонального антитела по настоящему изобретению, может состоять из нуклеотидной последовательности SEQ ID NO: 24.
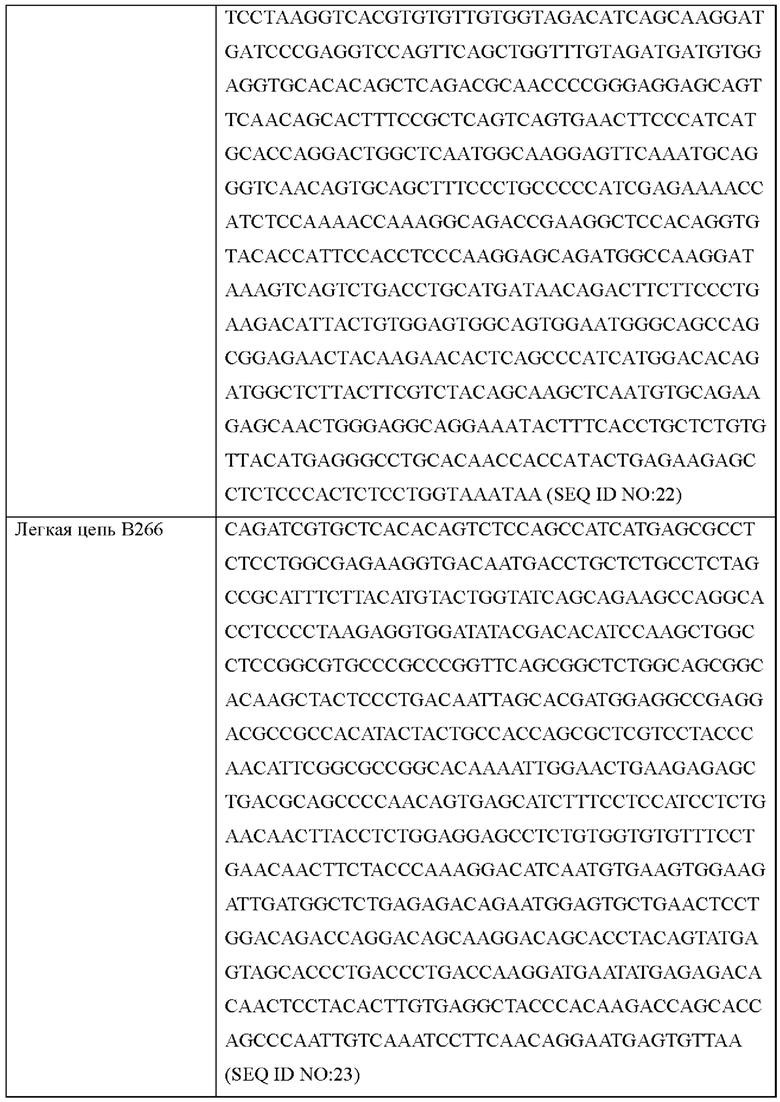
Согласно другому типичному воплощению настоящего изобретения, молекула нуклеиновой кислоты, кодирующая легкую цепь моноклонального антитела по настоящему изобретению, может состоять из нуклеотидной последовательности SEQ ID NO: 27, а молекула нуклеиновой кислоты, кодирующая его тяжелую цепь, может состоять из нуклеотидной последовательности SEQ ID NO: 28.
Согласно настоящему изобретению также предложен рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую тяжелую цепь, молекулу нуклеиновой кислоты, кодирующую легкую цепь моноклонального антитела, или обе эти молекулы нуклеиновых кислот.
Рекомбинантная векторная система по настоящему изобретению может быть сконструирована различными методами, известными в данной области. В типичном случае вектор по настоящему изобретению может быть сконструирован как вектор для клонирования или вектор для экспрессии. Кроме того, вектор по настоящему изобретению может быть сконструирован с использованием прокариотических или эукариотических клеток в качестве хозяина. Например, вектор по настоящему изобретению является вектором экспрессии, и при использовании прокариотических клеток в качестве хозяина вектор обычно содержит сильный промотор, способный осуществлять транскрипцию (например, промотор tac, промотор lac, промотор lacUV5, промотор 1рр, промотор pLλ, промотор pRλ, промотор rac5, промотор amp, промотор recA, промотор SP6, промотор trp или промотор Т7), сайт связывания рибосом для инициации трансляции и последовательности терминации транскрипции/трансляции. Когда в качестве клетки-хозяина используют Е. coli (например, НВ101, BL21, DH5α и так далее), в качестве регуляторных областей могут быть использованы промоторные и операторные области пути биосинтеза триптофана Е. coli и промотор pLλ. Когда в качестве клетки-хозяина используют Bacillus, в качестве регуляторной области может быть использован промотор гена токсичного белка Bacillus thuringiensis или любой промотор, способный к экспрессии у Bacillus.
В то же время, рекомбинантный вектор по настоящему изобретению может быть получен посредством манипуляций с плазмидой, используемой в данной области (например, pCL, pSC101, pGV1106, pACYC177, ColE1, pKT230, pME290, pBR322, pUC8/9, pUC6, pBD9, pHC79, pIJ61, pLAFR1, pHV14, серия pGEX, серия pET или pUC19), фагом (например, λgt4 λB, λ-Charon, λΔz1 или M13) или вирусом (например, SV40).
Когда вектор по настоящему изобретению представляет собой вектор экспрессии, а в качестве хозяина используют эукариотические клетки, вектор обычно имеет промотор, имеющий происхождение из генома клеток млекопитающих (например, промотор металлотионеина, промотор β-актина, промотор человеческого гемоглобина или промотор человеческого мышечного креатина), или промотор, имеющий происхождение из вируса млекопитающих (например, поздний промотор аденовируса, промотор 7.5K вируса коровьей оспы, промотор SV40, промотор цитомегаловируса (CMV), промотор tk HSV, промотор вируса опухоли молочной железы мыши (MMTV), промотор LTR HIV (вирус иммунодефицита человека), промотор вируса Молони, промотор вируса Эпштейна-Барр (EBV) или промотор вируса саркомы Рауса (RSV)), и последовательность полиаденилирования в качестве последовательности терминации транскрипции.
Рекомбинантный вектор по настоящему изобретению может быть слит с другой последовательностью для облегчения очистки антитела, экспрессированного с рекомбинантного вектора. Слитая последовательность может представлять собой, например, глутатион-S-трансферазу (Amersham Pharmacia Biotech, США); мальтозосвязывающий белок (NEB, США); FLAG (IBI, США); последовательность-метку, такую как 6х His (гексагистидин; Qiagen, США), Pre-S1 или с-Мус; или лидерную последовательность, такую как ompA или pelB. Кроме того, поскольку белок, экспрессированный с вектора по настоящему изобретению, представляет собой антитело, экспрессированное антитело может быть легко очищено с использованием колонки с белком А без дополнительной последовательности для очистки.
В то же время, рекомбинантный вектор по настоящему изобретению содержит ген резистентности к антибиотику, обычно используемый в данной области в качестве селективного маркера, например ген резистентности к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину или тетрациклину.
Вектор, экспрессирующий антитело по настоящему изобретению, может представлять собой векторную систему, экспрессирующую как легкую цепь, так и тяжелую цепь с использованием одного вектора, или векторную систему, экспрессирующую легкую цепь и тяжелую цепь с использованием двух векторов, соответственно. В последнем случае два вектора вводят в клетки-хозяева посредством котрансформации и направленной трансформации. Котрансформация представляет собой метод отбора клеток, экспрессирующих как легкую цепь, так и тяжелую цепь, после введения векторных ДНК, соответственно кодирующих легкую цепь и тяжелую цепь, в клетки-хозяева. Направленная трансформация представляет собой метод отбора клеток, трансформированных вектором, содержащим легкую цепь (или тяжелую цепь), трансформации отобранных клеток, экспрессирующих легкую цепь, вектором, содержащим тяжелую цепь (или легкую цепь), и, в завершение, отбора клеток, экспрессирующих как легкую цепь, так и тяжелую цепь.
Согласно настоящему изобретению также предложены клетки-хозяева, содержащие рекомбинантный вектор по настоящему изобретению. Клетки-хозяева представляют собой клетки, трансформированные рекомбинантным вектором по настоящему изобретению. Клетки-хозяев а, способные к стабильному и непрерывному клонированию и экспрессии вектора по настоящему изобретению, могут представлять собой любые клетки-хозяева, известные в данной области, и включают прокариотические клетки-хозяева, например Bacillus sp., такие штаммы, как Escherichia coli, Bacillus subtilis и Bacillus thuringiensis, Streptomyces, Pseudomonas (например, Pseudomonas putida), Proteus mirabilis или Staphylococcus (например, Staphylococcus carnosus), но настоящее изобретение не ограничено указанными клетками-хозяевами.
В качестве эукариотических клеток-хозяев, подходящих для вектора, могут быть использованы многоклеточные грибы, такие как штаммы Aspergillus sp., принадлежащие к отделу Ascomycota, и Neurospora crassa, и одноклеточные грибы, содержащие ферменты, такие как дрожжи, такие как Pichia pastoris, Saccharomyces cerevisiae и Schizosaccharomyces, другие низшие эукариотические клетки, высшие эукариотические клетки, такие как клетки, имеющие происхождение из насекомых, и клетки, имеющие происхождение из растений или млекопитающих.
Термин «трансфекция», используемый здесь, относится к введению интересующего гена в клетки-хозяева с использованием рекомбинантного вектора по настоящему изобретению и использован в том же значении, что «трансформация». Таким образом, «трансфекция» и/или «трансформация» клеток-хозяев могут быть проведены с применением подходящей стандартной технологии, известной в данной области, в соответствии с клетками-хозяевами, включая методы введения нуклеиновой кислоты в организм, клетки, ткани или орган. Такие методы включают электропорацию, слияние протопласта, преципитацию с фосфатом кальция (CaPO4), преципитацию с хлоридом кальция (CaCl2), перемешивание с использованием карбидокремниевого волокна, трансформацию, опосредованную агробактериями, трансформацию, опосредованную PEG (полиэтиленгликоль), сульфатом декстрана, липофектамином и сушкой/ингибированием, но настоящее изобретение не ограничено указанными методами.
Согласно настоящему изобретению также предложен эпитоп антигена человеческого Trx1, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 32-34 и 172-176.
Авторы изобретения подтвердили, что hTrx1 и CaTrx1 имеют аминокислотную гомологию 82%, два типа антител против hTrx1 по настоящему изобретению не связываются с CaTrx1 (ФИГ. 11 и 15А). Соответственно, были определены восемь частей, в которых аминокислотные последовательности hTrx1 и CaTrx1 различаются (ФИГ. 15В), и для клонирования генов были получены генные кассеты для экспрессии мутантных белков hTrx1 (ФИГ. 15C-15F). Клонированными генами трансформировали клеточную линию N293F, подтверждали экспрессию 8 типов мутантных белков hTrx1 (ФИГ. 16) и проводили очистку каждого мутантного белка (ФИГ. 17) с последующим подтверждением силы связывания с антителом В266-1 (hTrx1-hlgG1) и с антителом В264 (hTrx1-mlgG1).
Как показано на ФИГ. 18А-18С, было подтверждено снижение связывания антитела В266-1 и мутантного белка М4 (YSNVIFGNMV) по сравнению с hTrx1 и связывания антитела В264 и мутантных белков M1 (QIESKTAEIEGKED), М2 (QEALDAHAALSS) и М4 по сравнению с hTrx1. Таким образом, было подтверждено, что антитела В266-1 и В264, вероятнее всего, имеют общий сайт связывания М4.
Кроме того, был проведен микроматричный анализ с использованием 108 пептидов, полученных посредством наложения аминокислотной последовательности белка hTrx1 со сдвигом на один аминокислотный остаток (ФИГ. 19 и 20), и эпитопы антител В266-1 и В264 были определены посредством анализа тепловой карты в соответствии с ФИГ. 21A-21D. Результаты показаны в Таблице 25 (ФИГ. 22A-22F).
Согласно настоящему изобретению также предложены молекула нуклеиновой кислоты, кодирующая описанный выше эпитоп антигена Trx1, рекомбинантный вектор, содержащий указанную молекулу нуклеиновой кислоты, и клетка-хозяин, содержащая указанный рекомбинантный вектор.
Молекула нуклеиновой кислоты эпитопа антигена Trx1 по настоящему изобретению может состоять из любой аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 32-34 и 172-176.
Описания молекулы нуклеиновой кислоты, кодирующей описанный выше эпитоп, рекомбинантного вектора, содержащего указанную молекулу нуклеиновой кислоты, и клетки-хозяина, содержащей указанный рекомбинантный вектор, являются такими же, как описания, относящиеся к антителу по настоящему изобретению, приведенные выше, и поэтому будут опущены.
Согласно настоящему изобретению также предложен способ получения моноклонального антитела, специфично связывающегося с тиоредоксином-1, или его антигенсвязывающего фрагмента, включающий культивирование клеток-хозяев.
Культивирование клеток-хозяев для получения антитела или его антигенсвязывающего фрагмента может быть проведено в подходящей среде, известной в данной области, в условиях культивирования. Специалист в данной области может легко адаптировать методику культивирования может к используемому штамму. Клеточную культуру классифицируют как суспензионную культуру или адгезивную культуру в зависимости от метода выращивания и как периодическую культуру, подпитываемую культуру или постоянную культуру по методу культивирования. Среда, используемая для культивирования, должна подходящим образом соответствовать требованиям для конкретных штаммов.
Среда, используемая при культивировании животных клеток, содержит различные источники углерода, источники азота и микроэлементы. Примерами источников углерода, используемых здесь, могут быть углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; липиды, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Эти источники углерода могут быть использованы независимо друг от друга или в комбинации. Примеры источников азота, используемых здесь, включают органические источники азота, такие как пептоны, дрожжевые экстракты, мясные бульоны, солодовые экстракты, жидкий кукурузный экстракт (CSL) и соевая мука; и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота могут быть использованы независимо друг от друга или в комбинации. Среда может содержать дигидрофосфат калия, гидрофосфат калия и соответствующие натрийсодержащие соли в качестве источника фосфора. Кроме того, среда может содержать соли металлов, такие как сульфат магния или сульфат железа. Кроме того, в нее могут быть включены аминокислоты, витамины и подходящие предшественники.
Во время культивирования для коррекции рН клеточной культуры в нее можно подходящим образом добавлять такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Кроме того, образование пузырьков во время культивирования можно уменьшить добавлением пеногасителя, такого как полигликолевый эфир жирной кислоты. Кроме того, для поддержания аэробного состояния клеточной культуры в нее можно вводить кислород или кислородсодержащий газ (например, воздух). Температура клеточной культуры обычно составляет от 20 до 45°С и предпочтительно от 25 до 40°С.
Антитело, полученное посредством культивирования клеток-хозяев, может быть использовано без очистки или может быть использовано посредством очистки до высокой степени чистоты с применением различных традиционных методов, например диализа, солевой преципитации и хроматографии. Из этих способов хроматография находит наиболее широкое применение, и в соответствии с характеристиками антитела или метода культивирования можно выбрать типы и порядок колонок для ионообменной хроматографии, эксклюзионной хроматографии или аффинной хроматографии.
Согласно настоящему изобретению предложен набор для диагностики рака молочной железы, содержащий моноклональное антитело по настоящему изобретению или его антигенсвязывающий фрагмент, и способ предоставления информации, необходимой для диагностики рака молочной железы, с его использованием.
Термин «диагностика», используемый здесь, относится к подтверждению наличия или признака патологического состояния. Для задач настоящего изобретения диагностику проводят для подтверждения того, присутствует ли рак молочной железы или нет.
Белок тиоредоксин-1 является диагностическим маркером рака молочной железы, экспрессия которого в ткани рака молочной железы является высокой по сравнению с нормальной тканью молочной железы.
Согласно одному типичному воплощению настоящего изобретения, набор для диагностики рака молочной железы может представлять собой набор для твердофазного иммуноферментного анализа (ELISA) и, предпочтительно, одного или более, выбранного из группы, состоящей из прямого ELISA, непрямого ELISA, прямого сэндвич-ELISA и непрямого сэндвич-ELISA. В типичном воплощении настоящего изобретения два типа антител, включенные в набор для сэндвич-ELISA, включают моноклональное антитело В266-1 в качестве покрывающего антитела и моноклональное антитело В264 в качестве выявляющего антитела.
Набор для диагностики рака молочной железы по настоящему изобретению может дополнительно содержать, помимо антитела против Trx1, средство или реагент, известные в данной области и используемые в иммунологическом анализе.
Здесь иммунологический анализ может быть проведен любым из методов, позволяющих оценивать связывание антитела с антигеном. Такие методы известны в данной области и включают, например, вестерн-блоттинг, ELISA, радиоиммунопреципитацию, радиальную иммунодиффузию, иммунофлуоресцентный анализ, иммуноблоттинг, иммунодиффузию по Оухтерлони, ракетный иммуноэлектрофорез, иммуногистохимическое окрашивание, анализ иммунопреципитации, анализ фиксации комплемента, иммунохроматографический анализ, FACS и анализ на белковых чипах, но настоящее изобретение не ограничено указанными методами.
В качестве средства или реагента, используемого в иммунологическом анализе, могут быть включены подходящие носитель или подложка, маркер, способный производить сигнал, поддающийся выявлению, солюбилизатор, очищающий агент или стабилизатор. Когда маркер представляет собой фермент, подходящие носители включают субстрат, позволяющий измерять активность фермента, подходящий буферный раствор, вторичное антитело, меченное хромогенным ферментом или флуоресцентным веществом, хромогенный субстрат или агент для остановки реакции, но настоящее изобретение не ограничено указанными вариантами.
Антитело против Trx1, включенное в набор по настоящему изобретению, предпочтительно фиксировано на подходящем носителе или подложке с применением различных способов, раскрытых в документе, и примеры подходящих носителей и подложек включают PBS, полистирол, полиэтилен, полипропилен, полиэфир, полиакрилонитрил, фторсодержащую смолу, агарозу, целлюлозу, нитроцеллюлозу, декстран, сефадекс, сефарозу, липосому, карбоксиметилцеллюлозу, полиакриламид, полистирол, габбро, фильтровальную бумагу, ионообменную смолу, пластиковую пленку, пластиковую пробирку, сополимер полиаминметилвинилового эфира и малеиновой кислоты, аминокислотный сополимер, сополимер этилена и малеиновой кислоты, нейлон, металл, стекло, стеклянная гранула и магнитная частица. Другие твердые подложки включают планшет для культивирования клеток, планшет для ELISA, пробирку и полимерную пленку. Подложка может иметь любую возможную форму, например сферическую (гранула), цилиндрическую (пробирка или внутренняя поверхность лунки) или плоскую (лист или тест-полоска) форму.
Маркер, способный производить сигнал, поддающийся выявлению, позволяет проводить качественную или количественную оценку образования комплекса антиген-антитело и может представлять собой, например, фермент, флуоресцентное вещество, лиганд, люминесцентное вещество, микрочастицу, окислительно-восстановительную молекулу или радиоизотоп. В качестве фермента могут быть использованы β-глюкуронидаза, β-D-глюкозидаза, уреаза, пероксидаза (например, пероксидаза хрена), щелочная фосфатаза, ацетилхолинэстераза, глюкозооксидаза, гексокиназа, малатдегидрогеназа, глюкозо-6-фосфатдегидрогеназа, инвертаза или люцифераза. В качестве флуоресцентного вещества могут быть использованы флуоресцеин, изотиоцианат, родамин, фикоэритрин, фикоцианин, аллофикоцианин или изотиоцианат флуоресцеина. В качестве лиганда может быть использовано производное биотина, а в качестве люминесцентного вещества может быть использован эфир акридиния или люциферин. В качестве микрочастицы могут быть использованы коллоидное золото или окрашенный латекс, а в качестве окислительно-восстановительной молекулы могут быть использованы ферроцен, рутениевый комплекс, виологен, хинон, ион Ti, ион Cs, диимид, 1,4-бензохинон или гидрохинон. В качестве радиоизотопа могут быть использованы 3Н, 14С, 32Р, 35S, 36С1, 51Cr, 57Со, 58Со, 59Fe, 90Y, 125I, 131I или 186Re. Тем не менее, помимо веществ, перечисленных выше, может быть использовано любое другое вещество, которое можно использовать в иммунологическом анализе.
В качестве хромогенного субстрата фермента, например, при выборе пероксидазы хрена (HRP) в качестве ферментного маркера, может быть использован раствор, содержащий 3-амино-9-этилкарбазол, 5-аминосалициловую кислоту, 4-хлор-1-нафтол, о-фенилендиамин, 2,2'-азино-бис(3-этилбензотиазолин-6-сульфоновую кислоту), 3,3-диаминобензидин, 3,3',5,5'тетраметилбензидин, о-дианизидин или 3,3-диметоксибензидин. Кроме того, при выборе щелочной фосфатазы в качестве ферментного маркера, в качестве субстрата может быть использован раствор, содержащий 5-бром-4-хлор-3-индолилфосфат, нитросиний тетразолий или n-нитрофенилфосфат. Кроме того, при выборе β-D-галактозидазы в качестве ферментного маркера, в качестве субстрата может быть использован раствор, содержащий о-нитрофенил-β-D-галактозид или 5-бром-4-хлор-3-индолил-β-D-галактопиранозид. Помимо этих, могут быть использованы различные другие ферменты и хромогенные субстраты ферментов, известные в данной области.
Согласно одному типичному воплощению настоящего изобретения, способ предоставления информации, необходимой для диагностики рака молочной железы, по настоящему изобретению может быть осуществлен посредством следующих стадий:
(а) приведение любого одного типа моноклонального антитела по настоящему изобретению или его антигенсвязывающего фрагмента в контакт с биологическим образцом, выделенным от субъекта с подозрением на рак молочной железы;
(б) измерение уровня экспрессии белка тиоредоксина-1, связывающегося с моноклональным антителом или его антигенсвязывающим фрагментом в указанном биологическом образце через образование комплекса антиген-антитело; и
(в) сравнение уровня экспрессии белка тиоредоксина-1, измеренного на стадии (б), с контрольным и, если уровень экспрессии белка превышает контрольный, определение субъекта как пациента с раком молочной железы.
Согласно другому типичному воплощению настоящего изобретения, способ предоставления информации, необходимой для диагностики рака молочной железы, по настоящему изобретению может быть осуществлен посредством следующих стадий:
(а) покрытие твердой подложки моноклональным антителом или его антигенсвязывающим фрагментом, содержащим CDR1-CDR3 легкой цепи и CDR1-CDR3 тяжелой цепи антитела В266 или В266-1, моноклональным антителом или его антигенсвязывающим фрагментом, содержащим вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела В266 или В266-1, или антителом В266 или В266-1 или его антигенсвязывающего фрагментом;
(б) нанесение биологического образца, выделенного от субъекта с подозрением на рак молочной железы, на твердую подложку с покрытием;
(в) удаление несвязанного образца;
(г) нанесение моноклонального антитела или его антигенсвязывающего фрагмента, содержащего CDR1-CDR3 легкой цепи и CDR1-CDR3 тяжелой цепи антитела В264, моноклонального антитела или его антигенсвязывающего фрагмента, содержащего вариабельную область легкой цепи и вариабельную область тяжелой цепи антитела В264, или антитела В264 или его антигенсвязывающего фрагмента на твердую подложку;
(д) удаление несвязанного моноклонального антитела или его антигенсвязывающего фрагмента;
(е) измерение уровня экспрессии белка Trx1; и
(ж) сравнение уровня экспрессии белка Trx1, измеренного на стадии (е), с контрольным и, если уровень экспрессии белка превышает контрольный, определение субъекта как пациента с раком молочной железы.
Термин «выделенный биологический образец», используемый здесь, включает ткань (ткань молочной железы), клетки (клетки молочной железы), цельную кровь, плазму, сыворотку, кровь, слюну, синовиальную жидкость, мочу, мокроту, лимфу, спинномозговую жидкость, аутопсийный образец ткани (головного мозга, кожи, лимфатических узлов, спинного мозга или тому подобного), супернатант клеточной культуры или лизированные эукариотические клетки, где уровень экспрессии белка Trx1, являющегося маркером рака молочной железы, отличается, и включает образец, полученный из первичного очага или метастатического очага. Эти биологические образцы, после проведенных манипуляций или без предшествующих манипуляций, могут быть подвергнуты взаимодействию с моноклональным антителом по настоящему изобретению для подтверждения уровня экспрессии белка Trx1.
Термин «субъект», используемый здесь, включает млекопитающих, включая корову, свинью, овцу, курицу, собаку и человека, птиц и так далее, и, без ограничения, любого субъекта с подозрением на рак молочной железы.
Далее настоящее изобретение будет подробно описано со ссылкой на примеры для облегчения понимания настоящего изобретения. Тем не менее, примеры настоящего изобретения могут быть модифицированы во множество различных форм, и последующие примеры не следует толковать как ограничивающие объем настоящего изобретения. Примеры настоящего изобретения приведены для более полного объяснения настоящего изобретения специалистам в данной области.
ПРИМЕРЫ
Пример 1
Получение антигена человеческого тиоредоксина-1 (Trx1)
1-1. Получение вектора экспрессии Trx1
Исходя из использования кодонов у Е. coli, был синтезирован ген для экспрессии гена, кодирующего человеческий белок тиоредоксин-1, в Е. coli. Последовательность синтезированного гена человеческого тиоредоксина-1 показана в Таблице 1 ниже.
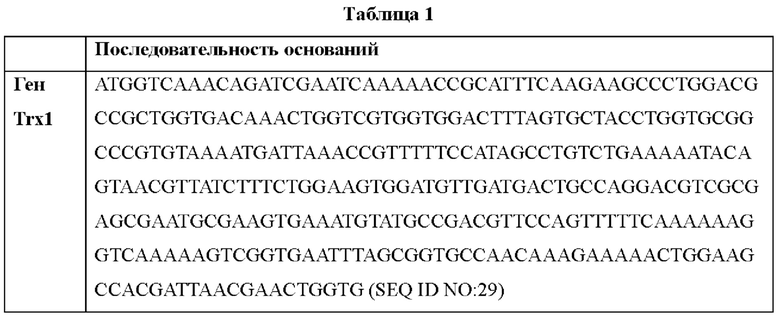
Последовательность праимеров, использованных для амплификации гена человеческого тиоредоксина-1 показана в Таблице 2 ниже.

Для амплификации гена, клонируемого в плазмиду, проводили полимеразную цепную реакцию (ПЦР). Смешивали 10 пмоль синтезированного гена в качестве матрицы, по 10 пмоль каждого из праймеров (hTrx1-For и hTrx1-Rev), dNTP (по 2,5 мМ каждого), taq-полимеразу Exprime и буферный раствор. Этот раствор подвергали взаимодействию на протяжении 35 циклов при 95°С в течение 2 минут, при 95°С в течение 30 секунд, при 55°С в течение 30 секунд и при 70°С в течение 20 секунд с дополнительным взаимодействием при 70°С на протяжении 2 минут, после чего реакцию останавливали. Амплифицированный ген очищали и затем для клонирования сайта EcoRV, присутствующего в множественном сайте клонирования (MCS) плазмиды pUC57, плазмиду обрабатывали соответствующей рестриктазой и очищали. Плазмиду, обработанную очищенным геном и рестриктазой, лигазу и буферный раствор смешивали и подвергали взаимодействию. Для трансформации Е. coli DH5α полученной плазмидой компетентную клеточную линию Е. coli DH5α нагревали при 4°С, смешивали с раствором, с которым была смешана плазмида, и подвергали взаимодействию при 4°С на протяжении 30 минут. После взаимодействия клетки подвергали тепловому шоку при 42°С на протяжении 30 секунд, стабилизировали при 4°С на протяжении 2 минут, распределяли по твердой среде Лурия-Бертани (LB), содержавшей антибиотик (50 мкг/мл ампициллина), для равномерного поглощения и культивировали при 37°С на протяжении 16 часов или более. Проводили скрининг колоний, выращенных на культуральной среде, на предмет плазмиды, имеющей ген человеческого тиоредоксина-1.
1-2. Экспрессия и очистка Trx1
Плазмиду, имеющую ген человеческого тиоредоксина-1, выявленную при скрининге, очищали и затем, для экспрессии белка, штамм Е. coli BL21 трансформировали очищенной плазмидой по методу, описанному выше. Для экспрессии белка тиоредоксина-1 трансформированным штаммом этот штамм культивировали в жидкой среде LB, содержавшей антибиотик, до OD600 (оптическая плотность при 600 нм) 0,5 при 37°С, после чего культивировали его еще 3 часа с добавлением изопропил-β-D-тиогалактопиранозида (IPTG) до концентрации 1 мМ. Затем проводили SDS-PAGE для подтверждения экспрессии белка. Для очистки белка полученную клеточную линию лизировали с применением ультразвука и затем центрифугировали (12000 об/мин, 30 мин, 4°С), получая таким образом супернатант. В полученный супернатант добавляли имеющееся в продаже антитело против тиоредоксина-1 (LF-MA0055, Abfrontier) для связывания с экспрессированным тиоредоксином-1, вносили агарозу с белком A/G (Protein A/G PLUS-agarose, sc-2003, Santa Cruz), которая связывалась с антителом, для их взаимодействия, после чего проводили центрифугирование и очистку. Затем чистоту и молекулярную массу полученного продукта подтверждали посредством SDS-PAGE.
Пример 2
Получение и очистка моноклонального антитела, специфичного в отношении Trx1
2-1. Иммунизация мыши
Очищенный человеческий белок тиоредоксин-1 смешивали с адъювантом, затем вводили его мыши (BALB/c), осуществляли забор мышиной крови и подвергали ее ELISA для подтверждения образования антител. После двух иммунизаций было подтверждено нужное нарастание титра антител (1:5000).
2-2. Слияние клеток и получение гибридомы
Из селезенки, полученной у иммунизированной мыши, выделяли В-лимфоциты и проводили их слияние с культивированными миеломными клетками (sp2/0). Слитые клетки культивировали в среде (среда HAT), содержавшей гипоксантин, аминоптерин и тимидин, и проводили селективное культивирование клеток (гибридом), полученных в результате слияния только миеломной клетки и В-лимфоцита.
2-3. Отбор гибридомных клеток, продуцирующих антитело, специфичное в отношении Trx1
Посредством ELISA у полученных гибридомных клеток были подтверждены три типа антител, взаимодействующих с человеческим белком тиоредоксином-1. Отбор гибридомы, образующей антитело, взаимодействующее с антигеном, из ELISA-положительных клеток проводили методом лимитирующих разведений.
2-4. Получение и очистка моноклонального антитела
Полученные гибридомы трех типов вводили мышам, после чего у каждой мыши получали асцитическую жидкость и проводили ее очистку с применением аффинной хроматографии с белком А. Очищенное антитело определяли посредством SDS-PAGE.
Пример 3
Определение изотипа моноклонального антитела
Изотипы трех антител, полученных в Примере 2, были подтверждены с использованием набора для ELISA для быстрого определения изотипа мышиных моноклональных антител (Rapid ELISA Mouse mAbs Isotyping Kit, Pierce, номер по каталогу 37503).
В результате, как показано на ФИГ. 1(b), было подтверждено, что тяжелая цепь моноклонального антитела 2В4 представляет собой IgG1, тяжелая цепь моноклонального антитела 8F3 представляет собой IgG2a, тяжелая цепь моноклонального антитела 9G7 представляет собой IgG2b, а все легкие цепи относятся к типу каппа.
Пример 4
Анализ аминокислотных последовательностей моноклональных антител 9G7(АВ1) и 2 В4(AB2)
Был проведен анализ аминокислотных последовательностей тяжелых цепей и легких цепей моноклональных антител 9G7(AB1) и 2 В4(АВ2) из трех типов моноклональных антител, полученных в Примере 2. Аминокислотную последовательность определяли как последовательность, способную к слиянию с Fc-областью, подходящей для обратной трансляции и рекомбинантной экспрессии. Проводили выравнивание и гипермутацию последовательности, определенной IMTG-выравниванием с разрывами, и полноразмерные участки CDR3 обнаруживали с использованием таблицы гипермутации. Последовательности определяли с использованием карт точной массы пептидов (ФИГ. 2 и 3), а гипермутацию и CDR3 подтверждали с использованием MS/MS-спектров.
Пример 5
Сравнение аффинности и определение антитела с применением ELISA
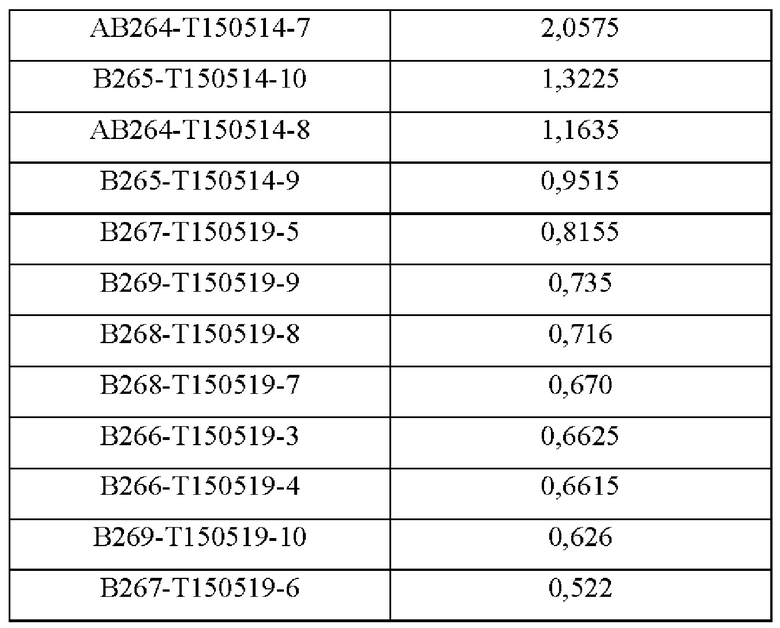
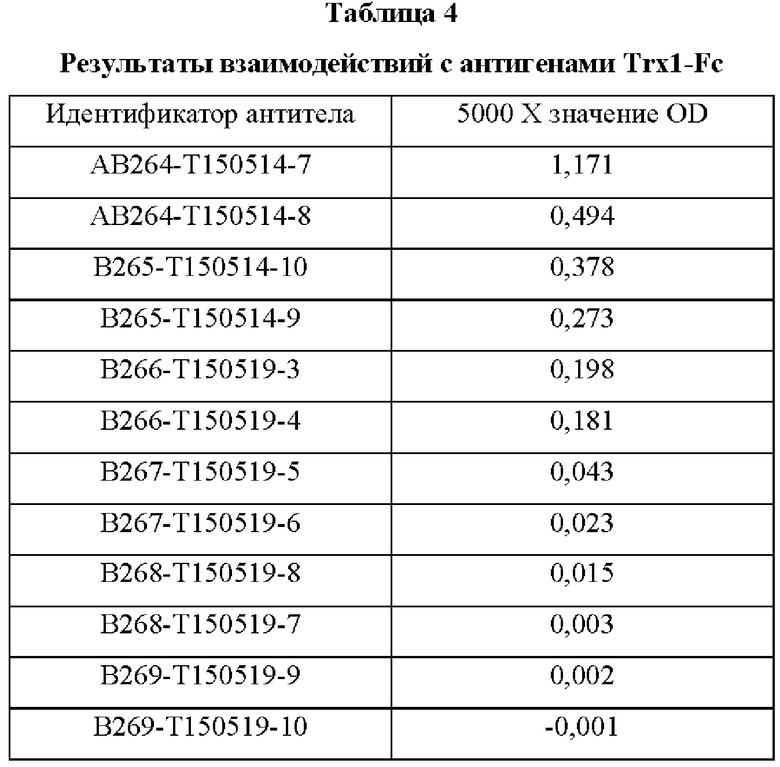
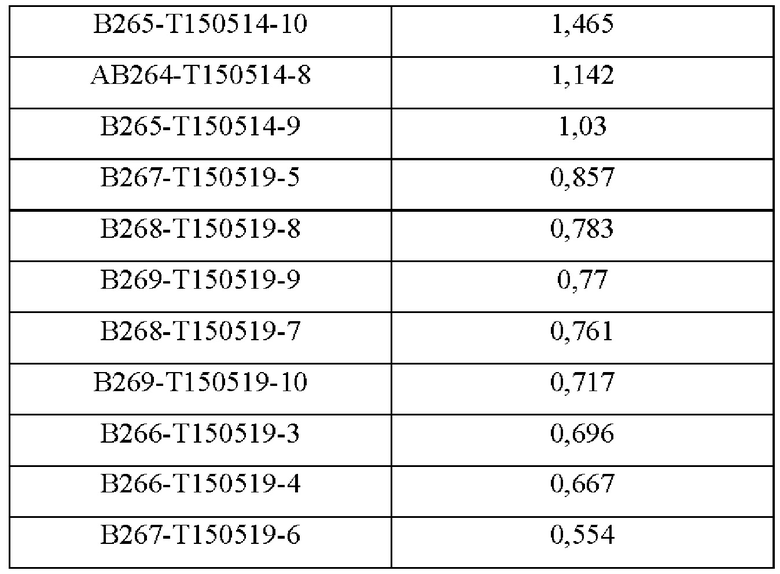
В аминокислотной последовательности, полученной описанным выше образом, было определено положение, доступное для гипермутации, и, таким образом, были синтезированы гены посредством изменения аминокислотных последовательностей четырех типов (В266, В297, В268 и В269) 9G7(AB1) и двух типов (В264 и В265) 2В4(АВ2). Шесть типов антител, полученные выше (В264-В269), экспрессировали и затем аффинность каждого антитела в отношении антигена подтверждали посредством ELISA (цифры после «Т» в Таблицах 3-5 отражают соответствующие номера полученных партий).
Аффинность в отношении трех типов антигенов, то есть свободного Trx1, Fc-связанного Trx1 (Trx1-Fc) и His-меченного Trx1 (Trx1-His), определяли прямым ELISA, и результаты последовательно показаны в Таблицах 3-5. Как показано в Таблицах 3-5, В264 в форме IgG1(κ) и В266 в форме IgG2b(κ) продемонстрировали самую высокую аффинность в отношении трех типов антигенов.


Аминокислотные последовательности антител В264 и В266 с высокой аффинностью показаны в Таблице 6 ниже.
Пример 6
Получение антител В264 и В266
6-1. Получение плазмид, экспрессирующих антитела В264 и В266
Поскольку аминокислотные последовательности антител В264 и В266 определены, как показано в Таблице 6, возможен химический синтез генов, соответствующих легким цепям и тяжелым цепям соответствующих антител. Синтезированные генные последовательности показаны в Таблице 7 ниже. Синтезированные гены клонировали в pcDNA3.0.



6-2. Экспрессия и очистка антител В264 и В266
Клеточную линию HEK293 котрансфицировали pcDNA3-SSJ11-L и pcDNA3-SSJ11-H для экспрессии антитела В264 или pcDNA3-SSJ12-L и pcDNA3-SSJ12-H для экспрессии антитела В266 и культивировали на протяжении 7 суток. Клеточную линию культивировали и проводили сбор рекомбинантных моноклональных антител, секретированных в культуральную среду, и их очистку посредством хроматографии с белком А. Элюент, содержащий рекомбинантные моноклональные антитела, концентрировали посредством ультрафильтрации и антитела с высокой степенью чистоты получали с использованием стерильного 0,2 мкм фильтра.
Степень чистоты и размер очищенных антител определяли посредством SDS-PAGE. По результатам SDS-PAGE, как показано на ФИГ. 6, была подтверждена экспрессия антител В264 и В266 размерами, например, 47 кДа для тяжелой цепи и 25 кДа для легкой цепи в восстанавливающих условиях и 150 кДа в невосстанавливающих условиях, что указывает на соответствие размеров экспрессированных антител расчетным размерам.
Пример 7
Подтверждение спаривания двух типов моноклональных антител при сэндвич-ELISA
100 мкл буфера для покрытия (0,015 М Na2CO3, 0,035 М NaHCO3, 0,003 М NaN3, рН 9,6) и 100 нг антитела для покрытия (В266) смешивали, вносили в каждую лунку и проводили взаимодействие O/N (в течение ночи) при 4°С. В каждую лунку вносили по 200 мкл PBS (забуференный фосфатом физиологический раствор), содержащего 1% BSA (PBSA; блокирующий буфер), и проводили взаимодействие при комнатной температуре на протяжении 60 минут. Затем вносили 20 мкл антигена (50, 25, 12,5 или 0 нг), 80 мкл выявляющего антитела (В264, меченное биотином; В264-В) и полученную смесь подвергали взаимодействию при 37°С на протяжении 90 минут. Реакционный раствор удаляли и проводили отмывку, внося по 200 мкл PBS, содержащего 0,05% Tween 20 (PBST; отмывочный буфер), в каждую лунку. Описанные выше действия проводили три раза.
В каждую лунку вносили по 100 мкл стрептавидина-HRP, разведенного 1:200, и проводили взаимодействие при 37°С на протяжении 30 минут. После удаления реакционного раствора проводили отмывку, внося по 200 мкл PBS, содержащего 0,05% Tween 20 (PBST; отмывочный буфер), в каждую лунку. Описанные выше действия проводили три раза.
В каждую лунку вносили по 100 мкл раствора ТМВ (3,3',5,5'-тетраметилбензидин) и проводили взаимодействие в темноте при комнатной температуре на протяжении 10 минут, вносили по 100 мкл 2,5 М раствора серной кислоты (H2SO4; останавливающий буфер) в каждую лунку и результат подтверждали при 450 нм.
В результате, как показано в Таблице 8, показатель взаимодействия возрастает в соответствии с концентрацией антигена, демонстрируя выявление антигена этими антителами. Тем не менее, ввиду высокого значения OD в отсутствие антигена, с антителами необходимо провести эксперименты по улучшению их рабочих характеристик.

Пример 8
Изменение изотипа Fc-части для улучшения рабочих характеристик антитела
Поскольку система экспрессии антитела представляет собой транзиторную трансфекцию с использованием рекомбинантной плазмиды, а не гибридому, то, среди этих рекомбинантных плазмид, плазмида, имеющая тяжелую цепь, была котрансфицирована с плазмидой, имеющей тяжелую цепь другого изотипа. То есть проводили котрансфекцию плазмидой, имеющей ген, кодирующий другую тяжелую цепь, а не pcDNA3-SSJ12H из pcDNA3-SSJ12-L и pcDNA3-SSJ12-H, использованных для экспрессии 9G7(AB1).
Описанным выше способом было получено антитело (В266-1), в котором Fc-часть В266 заменена на Fc человеческого IgG1. Характеристики антитела определяли посредством SDS-PAGE (ФИГ. 7).
Последовательности CDR отобранных в итоге моноклональных антител В264 и В266-1 определяли посредством слияния с Fc-областью, подходящей для обратной трансляции и рекомбинантной экспрессии.
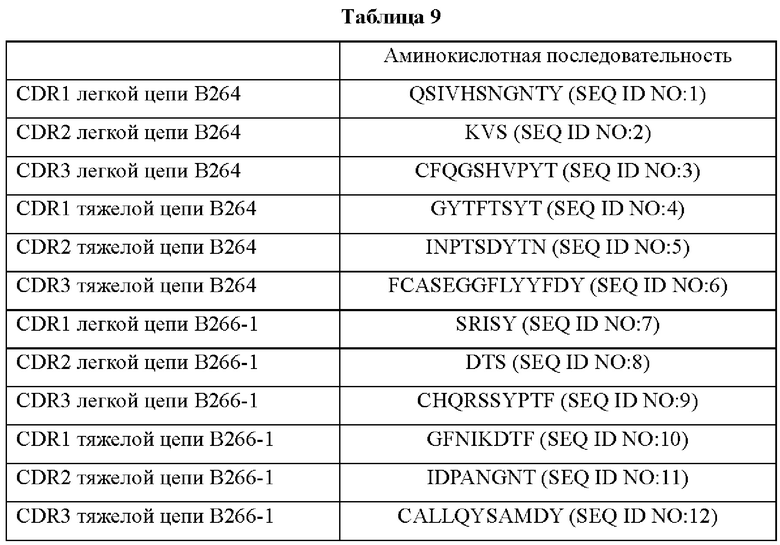
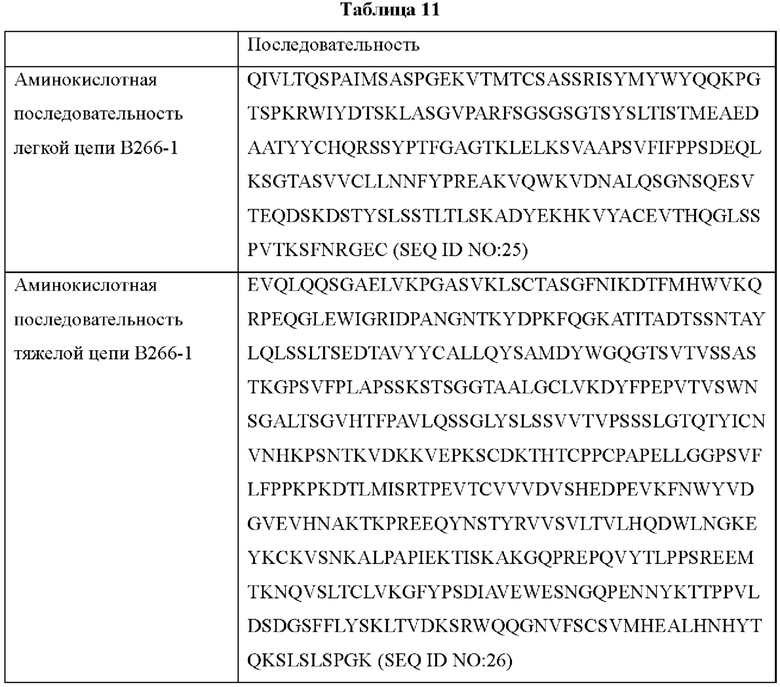
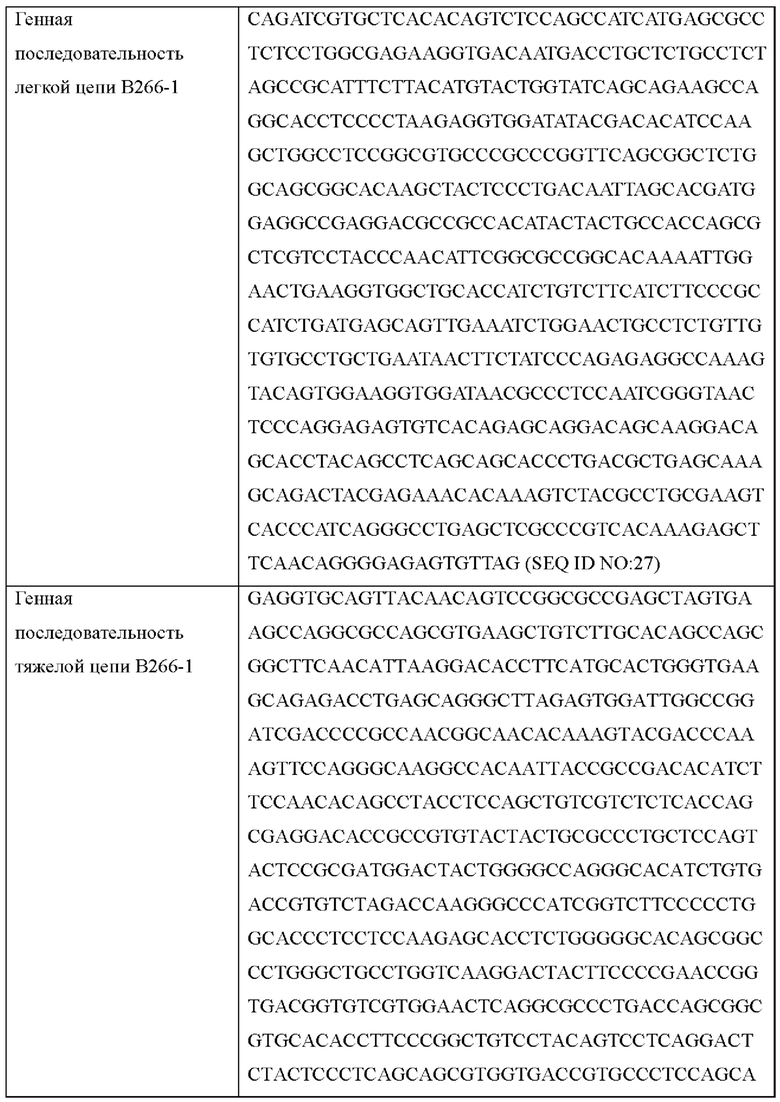
IMTG-выравнивание с разрывами представляет собой выравнивание базы данных IMTG и «определенной последовательности», и при поиске в базе данных определяли наиболее близкую последовательность эмбрионального типа и гипермутацию. Результаты IMTG-выравнивания с разрывами, полученные для легкой цепи и тяжелой цепи каждого из антител В266-1 и В264, показаны на ФИГ. 8A-8D, аминокислотные последовательности CDR1-CDR3 легкой цепи и CDR1-CDR3 тяжелой цепи показаны в Таблице 9, а аминокислотные последовательности вариабельной области легкой цепи и вариабельной области тяжелой цепи показаны в Таблице 10. Кроме того, аминокислотные и генные последовательности легкой цепи и тяжелой цепи В266-1 показаны в Таблице 11.



Пример 9
Подтверждение спаривания моноклональных антител В266-1 и В264, полученного при сэндвич-ELISA
100 мкл буфера для покрытия и 100 нг покрывающего антитела (В266-1) смешивали, вносили в каждую лунку и проводили взаимодействие O/N (в течение ночи) при 4°С. Проводили отмывку, внося 200 мкл отмывочного буфера. Описанные выше действия проводили два раза.
В каждую лунку вносили по 200 мкл PBSA и проводили взаимодействие при комнатной температуре на протяжении 120 минут, и затем вносили 20 мкл антигена (25 или 0 нг), вносили 80 мкл выявляющего антитела (В264-В) и проводили взаимодействие при 37°С на протяжении 90 минут. Реакционный раствор удаляли и затем проводили отмывку, внося по 200 мкл отмывочного буфера в каждую лунку. Описанные выше действия проводили три раза.
В каждую лунку вносили по 100 мкл стрептавидина-HRP, разведенного 1:200, и проводили взаимодействие при 37°С на протяжении 30 минут, реакционный раствор удаляли и затем проводили отмывку, внося по 200 мкл отмывочного буфера в каждую лунку. Описанные выше действия проводили три раза.
В каждую лунку вносили по 100 мкл раствора ТМВ, проводили взаимодействие в темноте при комнатной температуре на протяжении 10 минут, вносили по 100 мкл останавливающего буфера в каждую лунку и результат подтверждали при 450 нм.
В результате, как показано в Таблице 12, было подтверждено, что антитела подходящим образом взаимодействовали с антигенами, а значение отрицательного контроля было снижено по сравнению с антителами, использованными в Примере 6.

Пример 10
Анализ аффинности моноклонального антитела в отношении антигена
Два типа моноклональных антител, специфично действующих на антиген Trx1, экспрессировали с применением системы транзиторной трансфекции с использованием плазмиды, что обеспечивало их стабильное продуцирование. Для подтверждения аффинности в отношении антигена проводили анализ посредством ELISA (ФИГ. 9(a)).
100 мкл буфера для покрытия и 100 нг Trx1 смешивали и вносили в каждую лунку, после чего проводили взаимодействие при 4°С на протяжении 16 часов или более. После удаления реакционного раствора в каждую лунку вносили по 200 мкл PBSA и проводили взаимодействие при 37°С на протяжении 120 минут. После удаления реакционного раствора полученное антитело В266-1 или В264 разводили 1/5 от 0,1 мкМ и вносили в каждую лунку в объеме 100 мкл, после чего проводили взаимодействие при 37°С на протяжении 120 минут. После удаления реакционного раствора проводили отмывку, внося по 200 мкл отмывочного буфера в каждую лунку. Описанные выше действия проводили два раза.
Проводили взаимодействие с использованием 100 мкл противочеловеческого IgG-HRP (в разведении 1:4000) в случае антитела В266-1 и 100 мкл противомышиного IgG-HRP (в разведении 1:4000) в случае антитела В264 при 37°С на протяжении 60 минут. После удаления реакционного раствора проводили отмывку, внося по 200 мкл отмывочного буфера в каждую лунку. Описанные выше действия проводили три раза.
В каждую лунку вносили по 100 мкл раствора ТМВ, проводили взаимодействие в темноте при комнатной температуре на протяжении 10 минут, вносили по 100 мкл останавливающего буфера в каждую лунку и результат подтверждали при 450 нм. Полученные значения анализировали с применением Prism (Graphpad) (ФИГ. 9(b)).
По результатам анализа аффинности покрывающего антитела В266-1 и выявляющего антитела В264 было подтверждено высокое значение отрицательного контроля, обусловленное реактивностью В266-1, но степень связывания В266-1 и В264 возрастает по мере повышения концентрации антигена. Это указывает на связывание В266-1 и В264 с антигеном. При расчете значения равновесной константы диссоциации (KD) в рамках анализа, проводимого с применением программы Prism, KD В266-1 составила 1,1×10-11, a KD В264 составила 1,3×10-10. При значении KD от 10-10 до 10-12 было оценено, что антитело имело пикомолярный (пМ) уровень чувствительности к антигену, что указывает на высокий уровень чувствительности В266-1 и В264 к антигену.
Пример 11
Сэндвич-ELISA сыворотки пациента с раком молочной железы
Сэндвич-ELISA с использованием покрывающего антитела (В266-1) проводили следующим образом.
Раствор покрывающего антитела получали, смешивая 100 мл буфера для прикрытия и 0,1 мл 1 мг/мл В266-1. В каждую лунку 96-луночного планшета вносили по 100 мкл полученного раствора покрывающего антитела и проводили взаимодействие при 4°С на протяжении 12 часов. Раствор антитела удаляли и проводили отмывку, внося по 200 мкл 0,05%-го PBST в каждую лунку. Отмывку проводили три раза. В каждую лунку вносили по 200 мкл PBSA и взаимодействие (процесс блокирования) проводили при 4°С на протяжении 4 часов. PBSA удаляли и затем 96-луночный планшет сушили в термогигростате (20°С, относительная влажность 30%) на протяжении 3 часов.
После этого проводили биотинилирование выявляющего антитела (В264), как описано ниже.
Диметилсульфоксид (DMSO) смешивали с 20 мг/мл биотин-7-NHS, получая при этом 2 мг/мл биотин-7-NHS. 15 мкл (30 мкг) 2 мг/мл биотин-7-NHS добавляли к антителу В264, 1 мг/мл, и проводили взаимодействие при 15-25°С на протяжении 2 часов. Реакционный раствор вносили в AMICON Ultra-15 (Millipore), заполняли его раствором PBS до конечного объема и центрифугировали при 3600×g до остаточного объема 0,5 мл. Эти действия проводили три раза. Раствор антитела (биотинилированное В264; В264-В), оставшийся в фильтре AMICON, переносили в пробирку объемом 1,5 мл и заполняли ее PBSA до конечной концентрации 0,3 мг/мл.
Затем проводили выявление антигена человеческого Trx1 в сыворотке пациента с раком молочной железы, как описано ниже.
В первый столбец 96-луночного планшета с покрывающим антителом вносили стандартный раствор антигена. Вносили 20 мкл сыворотки, полученной у пациента с раком молочной железы, после чего вносили 80 мкл (0,3 мг/мл) раствора В264-В. Затем, после взаимодействия при 37°С на протяжении 60 минут, реакционный раствор антигена-антитела удаляли, после чего проводили отмывку, внося по 200 мкл PBST в каждую лунку. Отмывку проводили три раза. Вносили 100 мкл стрептавидина-HRP (R&D Systems) в разведении 1:400 и проводили взаимодействие при 37°С на протяжении 30 минут. После взаимодействия реакционный раствор удаляли и проводили отмывку, внося по 200 мкл PBST в каждую лунку. Отмывку проводили три раза. Вносили 100 мкл раствора ТМВ (Sure Blue) и проводили взаимодействие при комнатной температуре на протяжении 15 минут в темноте. Вносили 100 мкл 2 н. раствора H2SO4 и измеряли поглощение при 450 нм с использованием устройства для прочтения микропланшетов.
В завершение, проводили ROC-анализ, как описано ниже.
Чувствительность и специфичность рассчитывали, анализируя результат ELISA с использованием моноклональных антител В266-1 и В264 против Trx1. При значении отсечки 10,8 нг/мл чувствительность составила 93,0%, и чувствительность составила 97,4% (ФИГ. 10).
Пример 12
Сравнительный анализ с использованием другого набора для ELISA для диагностики рака молочной железы
В данном примере для оценки рабочих характеристик рекомбинантных моноклональных антител В266-1 и В264 был проведен сравнительный анализ с другим набором для ELISA для выявления другого биомаркера СА15-3 для диагностики рака молочной железы (Таблица 13).
В результате, как показано в Таблице 13, при использовании моноклональных антител, специфично связывающихся с Trx1, чувствительность и специфичность были намного выше, чем таковые в случае СА15-3.

Пример 13
Экспрессия белка Trx1 Chrysochloris asiatica
13-1. Сравнение последовательностей человеческого Trx1 (hTrx1) и Trx1 Chrysochloris asiatica (CaTrx1)
В результате сравнения аминокислотных последовательностей hTrx1 и Trx1 Chrysochloris asiatica, которые структурно сходны, но имеют низкую степень сходства аминокислотных последовательностей, было подтверждено, что они имеют гомологию 82% (ФИГ. 10).
С использованием известной последовательности оснований CaTrx1 (регистрационный номер в NCBI ХМ 006863001.1) был синтезирован ген, и для его хранения в Е. coli ген клонировали в плазмиду pUCIDT-AMT. Плазмиду для клонирования гена обрабатывали рестриктазами Sfi I и Xho I с последующим электрофорезом. В результате, как показано на ФИГ. 12, в плазмиде, обработанной рестриктазами (дорожка 2), был идентифицирован фрагмент ДНК размером 357 п.о., отщепленный от плазмиды, что указывает на успешный синтез гена CaTrx1 (стрелка на ФИГ. 12).
13-2. Экспрессия белка CaTrx1
После трансфекции клетки животного плазмидой CaTrx1, полученной в Примере 13-1, CaTrx1, секретированный клеточной линией, очищали и белок подтверждали посредством 15% SDS-PAGE; результат показан на ФИГ. 13. На ФИГ. 13 на дорожках 1 и 2 общее количество белка в растворе клеточной культуры трансформанта CaTrx1 составляло 5 мкг и 10 мкг, соответственно; на дорожке 3 количество контрольного белка (BSA; бычий сывороточный альбумин) составляло 3 мкг, подтверждая, что продуктивность очищенного белка CaTrx1 составляла 28,75 мг/мл.
Пример 14
Подтверждение аффинности двух типов антител в отношении hTrx1 и CaTrx1
В данном примере анализировали аффинность связывания двух типов антител, В266-1 (Trx1-hIgG1) и В264 (Trx1-mIgG1), с CaTrx1.
Для подтверждения аффинности связывания В266-1 (Trx1-hIgG1) и В264 (Trx1-mIgG1) с hTrx1 и CaTrx1 96-луночный планшет для ELISA покрывали по 200 нг hTrx1 или 10 мкг CaTrx1, в каждую лунку вносили по 200 мкл блокирующего буфера (4%-е снятое молоко / 1x PBS) с последующим взаимодействием на протяжении 1 часа при 37°С. После удаления реакционного раствора в каждую лунку, покрытую соответствующим антигеном вносили по 100 мкл каждого из В266-1 (Trx1-hIgG1) и В264 (Trx1-mIgG1) и позволяли им взаимодействовать при 37°С на протяжении 2 часов. Реакционный раствор удаляли с последующей пятикратной отмывкой с использованием 200 мкл 1x PBST. В каждую из лунок, обработанных В266-1 (Trx1-hIgG1) или В264 (Trx1-mIgG1), вносили по 100 мкл антитела против человеческого Fc, конъюгированного с HRP, и противомышиного антитела, конъюгированного с HRP, в разведении 1:4000, соответственно, с последующим взаимодействием при 37°С на протяжении 2 часов. Реакционный раствор удаляли и проводили пятикратную отмывку с использованием 200 мкл 1x PBST. В каждую лунку вносили по 100 мкл окрашивающего реагента, а после 10 минут взаимодействия в каждую лунку вносили по 50 мкл 2,5 М H2SO4. После проявления окраски степень окрашивания оценивали с использованием устройства для прочтения ELISA-планшетов.
В результате подтверждения аффинности связывания В266-1 (Trx1-hIgG1) и В264 (Trx1-mIgG1) с hTrx1, как показано в Таблице 14 ниже, для 200 нг антигена было подтверждено, что KD для В266-1 составляла 2,1×10-10 М, а аффинность для В264 была определена при KD 1,7×10-10 М. Кроме того, как видно на ФИГ. 14А, по сравнению с В266-1, при связывании с В264 показатель взаимодействия (OD490) был ниже и составлял приблизительно на 50%.
В результате подтверждения аффинности связывания антител В266-1 и В264 с 10 мкг CaTrx1, как показано на ФИГ. 14В и в Таблице 14, наблюдали, что ни один из этих двух типов антител не связывается с CaTrx1.
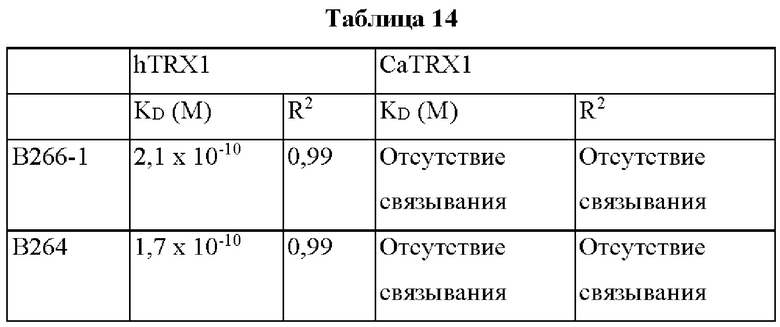
Пример 15 Получение мутантного антигена hTrx1
15-1. Определение расположения мутаций посредством аминокислотного секвенирования hTrx1 и CaTrx1
Известную аминокислотную последовательность hTrx1 (регистрационный номер в NCBI NP_003320.2) сравнивали с аминокислотной последовательностью CaTrx1 (регистрационный номер NCBI ХР_006863063.1). Как показано на ФИГ. 15А, несмотря на то, что гомология аминокислотных последовательностей hTrx1 и CaTrx1 составляла 82%, аффинность связывания антител с антигеном существенно различалась, и, таким образом, было 8 различных частей, в которых hTrx1 и CaTrx1 имеют различные аминокислотные последовательности (ФИГ. 15В).
15-2. ПЦР слияния и клонирование для экспрессии мутантных белков
А) ПЦР фрагментов
В 8 частях, в которых аминокислотные последовательности hTrx1 и CaTrx1 различаются, определенных в Примере 15-1, последовательность hTrx1 заменяли последовательностью CaTrx1, и затем амплифицировали фрагмент ДНК кассеты для получения мутанта (ФИГ. 15D).
Конкретно, для получения гена для экспрессии каждого мутантного белка необходимо амплифицировать два фрагмента ДНК для ПЦР слияния. Таким образом, получали два типа праймеров (F2 и R1; ФИГ. 15С и Таблица 15), содержащие часть, для которой необходима мутация последовательности оснований, и фрагменты ДНК амплифицировали с использованием двух пар праймеров, F1 с R1 и F2 с R2. Для амплификации фрагментов ДНК матричную ДНК (100-200 нг) и по 1 мкл каждого из прямого и обратного праймеров (по 10 пмоль каждого) добавляли к 25 мкл смеси 2×EF-Taq PCR Smart (0.5Х Band Doctor) (Solgent, SEF02-M50h), доводили до конечного объема стерильной очищенной водой, после чего тщательно перемешивали и проводили амплификацию с использованием устройства для ПЦР (термоциклер Т100).
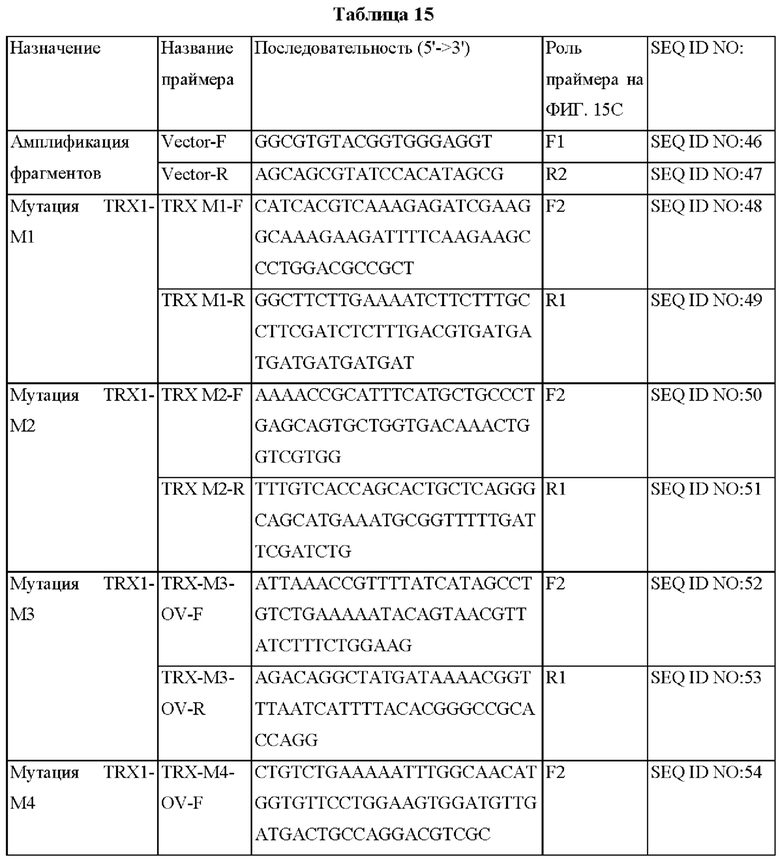
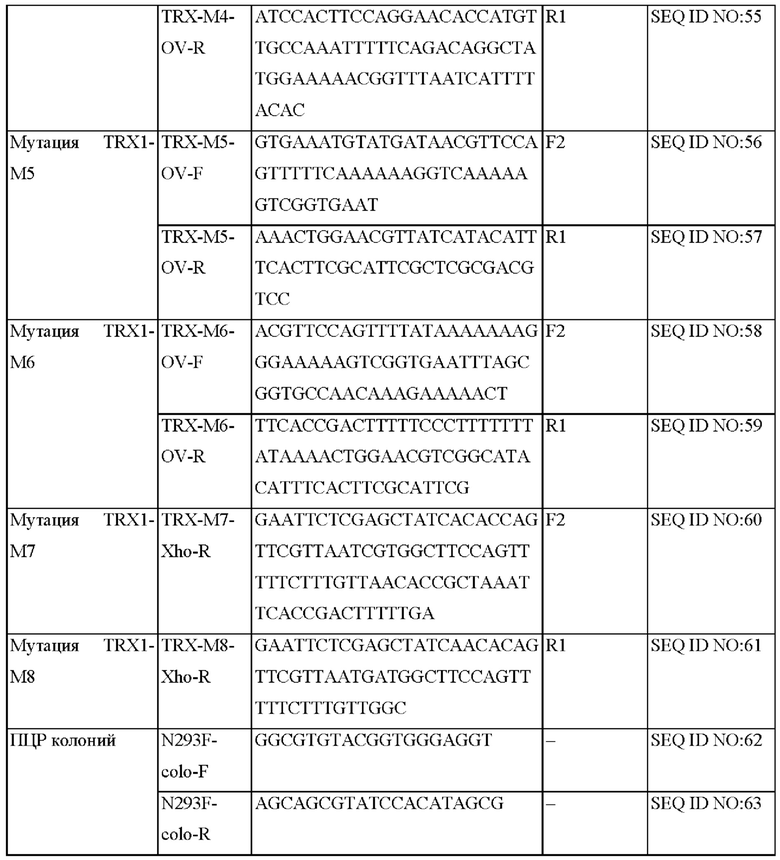
ПЦР проводили в условиях 1 цикла предварительной денатурации при 95°С на протяжении 2 мин, 30 циклов 3-стадийной амплификации при 95°С на протяжении 20 сек, 62°С на протяжении 40 сек и 72°С на протяжении 1 мин и 1 цикла завершающего удлинения при 72°С на протяжении 5 мин, после чего реакцию прекращали. Амплифицированный фрагмент ДНК подтверждали с использованием 1%-го агарозного геля (ФИГ. 15D). Очистку гена проводили с использованием набора QIAquick Gel Extraction Kit (QIAGEN, 28704), следуя протоколу изготовителя.
В) ПЦР слияния для слияния двух типов фрагментов ДНК и очистка продукта ПЦР
Для слияния амплифицированных фрагментов ДНК проводили ПЦР с использованием двух фрагментов ДНК и праймеров F1 и R2 (ФИГ. 15С). ПЦР-смесь для ПЦР слияния получали, добавляя от 100 до 150 нг каждого из двух типов фрагментов ДНК и по 1 мкл каждого из прямого и обратного праймеров (по 10 пмоль каждого) к 25 мкл смеси 2×EF-Taq PCR Smart (0.5Х Band Doctor) (Solgent, SEF02-M50h), доводили до конечного объема стерильной очищенной водой, после чего тщательно перемешивали и проводили амплификацию с использованием устройства для ПЦР. ПЦР проводили в условиях 1 цикла предварительной денатурации при 95°С на протяжении 2 мин, 30 циклов 3-стадийной амплификации при 95°С на протяжении 20 сек, 62°С на протяжении 40 сек и 72°С на протяжении 1 мин и 1 цикла завершающего удлинения при 72°С на протяжении 5 мин, после чего реакцию прекращали. После прекращения реакции продукт ПЦР подтверждали с использованием 1%-го агарозного геля (ФИГ. 15Е).
По завершении ПЦР слияния полученный продукт ПЦР очищали с применением осаждения этанолом. 3 М ацетат натрия (рН 5,2) и 100%-й этанол добавляли к амплифицированному продукту ПЦР в количестве 1/10 и 2 общих объемов продукта ПЦР, соответственно, тщательно перемешивали и проводили взаимодействие при -70°С в низкотемпературной морозильной камере на протяжении 10 минут. После этого полученную смесь центрифугировали при 13000 об/мин на протяжении 10 минут, супернатант удаляли, добавляли 1 мл 70%-го этанола и затем полученную смесь перемешивали с последующим центрифугированием при 13000 об/мин на протяжении 10 минут. Супернатант удаляли, остатки этанола удаляли, проводя взаимодействие в термостате при 70°С на протяжении 3 минут, и осажденную ДНК тщательно растворяли в 50 мл дистиллированной воды.
С) Клонирование продукта ПЦР
Для клонирования очищенного продукта ПЦР в плазмиду N293F проводили обработку рестриктазами. Конкретно, к 50 мкл продукта ПЦР и плазмиды N293F добавляли 7 мкл Kpn I и 8 мкл 10х буфера и доводили общий объем до 80 мкл. После тщательного перемешивания полученную смесь подвергали взаимодействию при 37°С на водяной бане на протяжении 3 часов. По завершении взаимодействия полученную смесь очищали с применением осаждения этанолом. После этого очищенную смесь обрабатывали 7 мкл Xho I и 8 мкл 10х буфера и доводили общий объем до 80 мкл. После тщательного перемешивания полученный продукт подвергали взаимодействию при 37°С на водяной бане на протяжении 3 часов. Для очистки ДНК, полученной по завершении взаимодействия, проводили эксперимент с использованием набора QIAquick Gel Extraction Kit (QIAGEN, 28704), следуя протоколу изготовителя.
Для клонирования очищенного фрагмента ДНК в N293F, 20 нг N293F, обработанной фрагментом ДНК (100 нг для 1 т.п.о. (тысяч пар оснований) или менее, 300 нг для 3 т.п.о. или менее) и рестриктазами, обрабатывали 1 мкл ДНК-лигазы Т4 (Thermo Scientific, EL0011) и добавляли 1 мкл 10х буфера и доводили общий объем до 10 мкл дистиллированной водой. Полученную смесь подвергали взаимодействию на протяжении 16 часов при 22°С. По завершении взаимодействия выделяли компетентные клетки Е. coli DH5, подлежащие трансформации, и растворяли их на льду. 2 мкл продукта лигирования тщательно перемешивали с компетентными клетками DH5α и затем проводили взаимодействие на льду на протяжении 30 минут. Затем продукт взаимодействия подвергали взаимодействию при 42°С на водяной бане на протяжении 90 секунд и дополнительно подвергали взаимодействию на льду на протяжении 3 минут. К продукту взаимодействия добавляли 500 мкл среды SOC (20 г триптона Bacto, 5 г дрожжевого экстракта Bacto и 0,5 г NaCl на литр) и инкубировали при 37°С в шейкер-инкубаторе на протяжении 30 минут. После инкубирования 100 мкл продукта взаимодействия распыляли и распределяли по среде LB с добавлением 100 мкг/мл ампициллина (10 г триптона Bacto, 5 г дрожжевого экстракта Bacto и 10 г NaCl на литр) и проводили инкубацию при 37°С в инкубаторе на протяжении 12-16 часов.
D) ПЦР колоний и секвенирование для подтверждения трансформации
Для подтверждения присутствия или отсутствия клонирующей плазмиды проводили ПЦР колоний. ПЦР-смесь для ПЦР слияния получали, добавляя по 0,5 мкл каждого из прямого и обратного праймеров (по 10 пмоль каждого) к 12,5 мкл смеси 2×EF-Taq PCR Smart (0.5Х Band Doctor) (Solgent, SEF02-M50h), доводили до конечного объема стерильной дистиллированной водой, после чего тщательно перемешивали и проводили амплификацию посредством ПЦР. ПЦР проводили в условиях 1 цикла предварительной денатурации при 95°С на протяжении 2 мин, 25 циклов 3-стадийной амплификации при 95°С на протяжении 20 сек, 62°С на протяжении 40 сек и 72°С на протяжении 1 мин и 1 цикла завершающего удлинения при 72°С на протяжении 5 мин, после чего реакцию прекращали.
После прекращения реакции амплифицированный продукт подтверждали с использованием 1%-го агарозного геля (ФИГ. 15F). Амплифицированный продукт очищали и для секвенирования использовали Neoprobe Corp. Данные, полученные при секвенировании, показаны в Таблице 16 ниже. Мутированные последовательности выделены подчеркнутым и полужирным шрифтом.
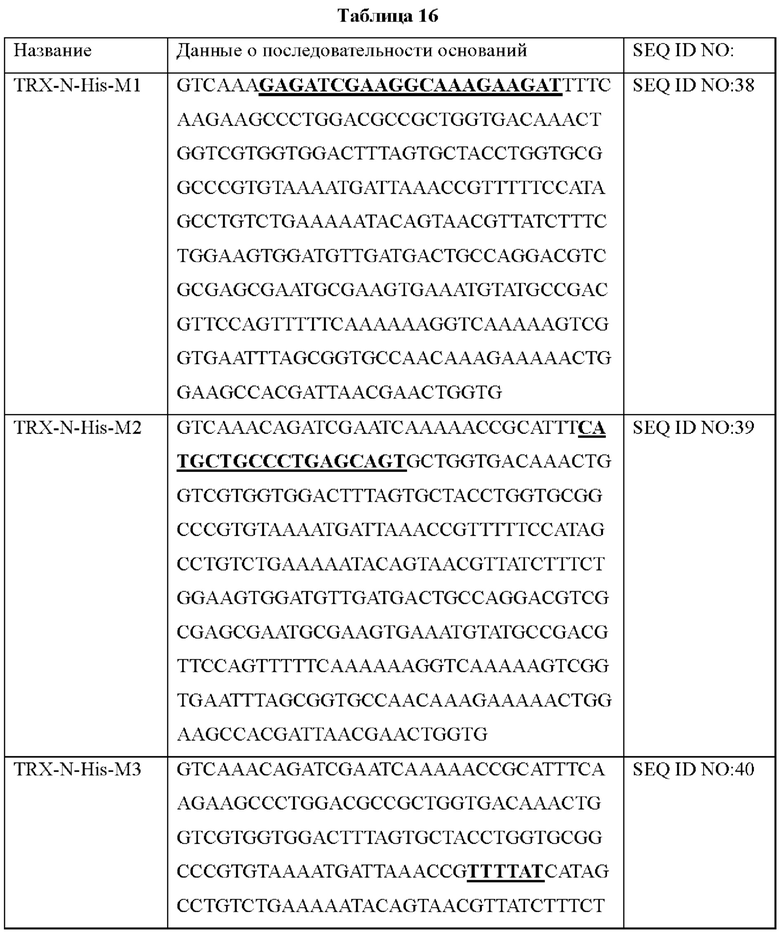
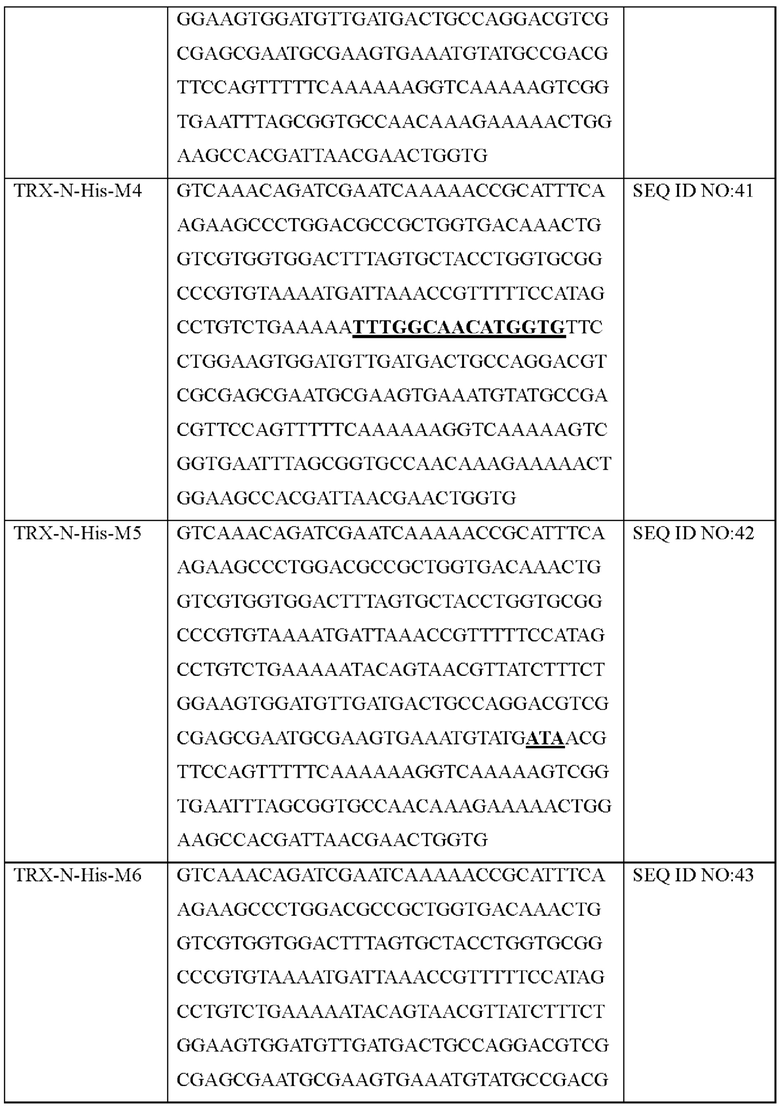

E) Получение плазмид (Midi-получение)
Колонии, содержавшие секвенированные плазмиды, засевали в 100 мл среды 2×YT (17 г триптона, 10 г дрожжевого экстракта и 5 г NaCl на литр), содержавшей 100 мкг/мл ампициллина, и инкубировали при 37°С и 210 об/мин на протяжении 16 часов. Инкубированные бактерии получали путем центрифугирования при 4500 об/мин на протяжении 8 минут. Для получения очищенной плазмиды использовали NucleoBond® Xtra Midi (Macherey-Nagel, номер по каталогу 740410.100) и эксперимент проводили, следуя протоколу изготовителя.
F) Культивирование животных клеток
19,4 г порошка Freestyle™ 293 Expression Medium AGT™ (AG100009, Thermo Scientific) растворяли в 1 л деионизированной воды и стерилизовали. 35 мл среды Freestyle™ 293 Expression Medium AGT™, которую нагревали на водяной бане при 37°С на протяжении 30 минут, помещали в колбу Эрленмейера объемом 125 мл (СС-431143, Corning). После размораживания замороженной клеточной линии 293F (510029, Invitrogen) на водяной бане при 37°С на протяжении приблизительно 1-2 минут размороженную клеточную линию смешивали с 5 мл среды Freestyle™ 293 Expression Medium AGT™ и вносили в колбу Эрленмейера, содержавшую 35 мл среды, с последующей инкубацией в шейкер-инкубаторе при 8% CO2, 37°С и 85 об/мин. После 2-3 суток инкубации 10 мкл клеточной линии смешивали с 10 мкл трипанового синего, 10 мкл полученной смеси вносили в чип для подсчета клеток Luna (L12002, Biosystems) и жизнеспособность и количество клеток подтверждали с использованием автоматического счетчика клеток Luna™ (L10001, Biosystems). После суспендирования 4-7×105 клеток/мл в 40 мл среды полученную суспензию центрифугировали при 100×g на протяжении 5 минут для удаления супернатанта. После удаления супернатанта клеточный осадок смешивали с 10 мл среды для ресуспендирования осадка и затем 30 мл среды вносили в колбу Эрленмейера объемом 125 мл. Клетки инкубировали в шейкер-инкубаторе при 8% CO2, 37°С и 85 об/мин и описанные выше действия проводили два или более раз.
G) Трансфекция животных клеток
Аликвоту клеток, 5,5×105 клеток/мл, объемом 40 мл помещали в пробирку и центрифугировали при 100×g на протяжении 5 минут. После удаления культурального раствора осадок суспендировали с использованием 10 мл среды Freestyle™ 293 Expression Medium AGT™ и вносили в колбу Эрленмейера объемом 125 мл. Клетки инкубировали в шейкер-инкубаторе при 8% CO2, 37°С и 85 об/мин. С использованием автоматического счетчика клеток Luna™ было подтверждено, что количество и жизнеспособность клеток составляли 1×106 клеток/мл и 90% или более, соответственно. Исходя из объема культурального раствора 40 мл, 25 мкг ДНК для трансфекции и 100 мкг PEI (полиэтиленимин) (23966, Polysciences) перемешивали на вихревой мешалке с последующим центрифугированием при 10000 об/мин на протяжении 1 секунды. ДНК и PEI, смешанные с 800 мкл среды Freestyle™ 293 Expression Medium AGT™, перемешивали и позволяли им взаимодействовать при комнатной температуре на протяжении 20 минут. После взаимодействия смесь ДНК-PEI вносили в колбу объемом 125 мл, в которой инкубировали клеточную линию. Через 24 часа вносили добавки до 5 г/л. После этого клетки дополнительно инкубировали в течение 5 суток и отбирали культуральный раствор.
H) Эксперимент для подтверждения экспрессии в культуральной среде
После 5 суток культивирования 500 мкл отобранного культурального раствора вносили в пробирки. Одну из пробирок помещали в штатив для центрифужных пробирок на 20 минут, использовали супернатант (образец, который не центрифугировали), а другие пробирки центрифугировали при 10000 об/мин на протяжении 2 минут для удаления клеток и использовали только супернатант (образец, который центрифугировали). 10 мкл 5х восстанавливающего буфера для образцов смешивали с 40 мкл супернатанта с последующим кипячением при 100°С на протяжении 5 минут. Полученный образец подтверждали посредством 15% SDS-PAGE с использованием Mini-PROTEAN® Tetra Cell (BR165-8029, Bio-Rad) (ФИГ. 16).
I) Очистка с применением аффинной хроматографии (Ni-NTA)
Трансформированную клеточную линию инкубировали на протяжении 6 суток и центрифугировали при 4800 об/мин на протяжении 30 минут для удаления супернатанта. Колонку PolyPrep (731-1553, Bio-Rad) промывали с использованием промывочного буфера с 10 мМ имидазола (рН 7,4) и заполняли гранулами Ni-Sepharose™ 6 Fast Flow (17-5318-02, GE Healthcare). Затем колонку промывали промывочным буфером с 10 мМ имидазола (рН 7,4) два раза. Когда в колонке оставалось приблизительно 2-3 мл промывочного буфера с 10 мМ имидазола (рН 7,4), колонку промывали еще раз 20 мл промывочного буфера с 10 мМ имидазола (рН 7,4). В промытую колонку добавляли среду. Гранулы промывали промывочным буфером с 10 мМ имидазола (рН 7,4) и проводили элюирование элюирующим буфером с 500 мМ имидазола (рН 7,4). 10 мкл образца смешивали с 200 мкл реагента для выявления белков Coomassie Plus™ (1856210, Thermo Scientific) и проводили элюирование до появления синей окраски образца. Раствор для очистки элюированного белка концентрировали с использованием ультрацентрифуги Amicon® (UFC901096, Millipore) и заменяли буфер, повторяя реконцентрацию раствором PBS по меньшей мере два раза. Определяли концентрацию белка с использованием Nano-drop и разводили до 0,3-0,5 мг/мл. 3 мкг каждого белка подтверждали посредством SDS-PAGE (ФИГ. 17).
Кроме того, оценивали концентрации и продуктивность 8 типов мутантных белков hTrx1, и полученные результаты показаны в Таблице 17 ниже. В Таблице 17 видно, что 8 типов мутантных белков hTrx1 экспрессированы в диапазоне концентраций от 3,15 до 5,31 мг/мл.
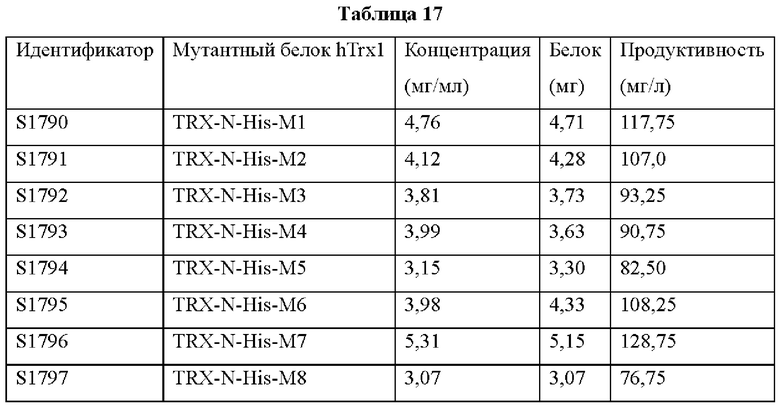
Пример 16
ELISA для подтверждения аффинности связывания
В данном примере была подтверждена аффинность связывания каждого из антител В266-1 и В264 с 8 типами мутантных белков hTrx1, полученных в Примере 15.
8 типов мутантных белков hTrx1, полученных в Примере 3, растворяли в буфере для покрытия (DPBS; LB001-02, Welgene) в концентрации 2 мкг/мл, получая таким образом растворы антигенов, раствор каждого антигена вносили в 96-луночный планшет по 100 мкл на лунку и планшет накрывали запечатывающей лентой с последующим взаимодействием при 4°С на протяжении 16 часов. После удаления раствора антигена в каждую лунку вносили по 200 мкл блокирующего буфера (1×PBS с 4%-м снятым молоком) и планшет накрывали запечатывающей лентой с последующим взаимодействием в инкубаторе при 37°С на протяжении 1 часа. По завершении взаимодействия блокирующий буфер удаляли, в каждую лунку вносили по 100 мкл раствора антитела, разведенного до определенной концентрации, и планшет накрывали запечатывающей лентой с последующим взаимодействием в инкубаторе при 37°С на протяжении 2 часов. Раствор антитела удаляли и процесс внесения и удаления 200 мкл раствора отмывочного буфера (1×PBST) на лунку повторяли в общей сложности 5 раз. Антитела, конъюгированные с HRP (антитело против человеческого Fc, конюгированное с HRP, против В266; антитело против мышиного Fc, конъюгированное с HRP, против В264), разводили 1:4000 в растворе для разведения антител (1×PBS с 1%-м снятым молоком), по 100 мкл полученного раствора вносили в каждую лунку и планшет накрывали запечатывающей лентой с последующим взаимодействием в инкубаторе при 37°С на протяжении 2 часов. Раствор антитела удаляли и процесс внесения и удаления 200 мкл раствора отмывочного буфера (1×PBST) повторяли в общей сложности пять раз. 10 мкл Н2О2 добавляли к окрашивающему реагенту (одна таблетка OPD (ортофенилендиамин), 10 мл буфера PC (5,1 г С6Н8О7 ⋅ Н2О и 7,3 г Na2HPO4 на литр)) и затем по 100 мкл полученной смеси вносили в каждую лунку с последующим взаимодействием в темноте на протяжении 10 минут. В каждую лунку вносили по 50 мкл останавливающего буфера (2,5 М H2SO4) и измеряли OD при 490 нм.
В результате, как показано на ФИГ. 18А, было подтверждено, что антитело В266-1 (hTrx1-hIgG1) имело сниженную силу связывания в отношении белка, имеющего мутацию сайта М4 (YSNVIFGNMV), а антитело В264 (hTrx1-mIgG1) имело сниженную силу связывания в отношении белка, имеющего мутации сайтов M1, М2 и М4 (M1: QIESKTAEIEGKED; М2: QEALDAHAALSS; и М3: YSNVIFGNMV).
В приведенных ниже Таблицах 18 и 19 показаны оригинальные аминокислотные последовательности и последовательности оснований сайтов M1, М2 и М4, имеющих мутации в hTrx1.


Исходя из представленных выше результатов, было подтверждено, что антитело В266-1 и антитело В264, вероятно, имеют общую часть М4 (YSNVI) сайта связывания с антигеном.
Пример 17
Профилирование антител с использованием пептидных микроматриц
В данном примере точную аминокислотную последовательность определяли посредством анализа картирования эпитопов антигена Trx1 с использованием антител В266-1 и В264. Конкретно, применяли технологию пептидных микроматриц PepStar™ (JPT Peptide Technologies (Германия)), как показано на ФИГ. 19, и эпитопы выявляли с применением сканирования перекрывающихся пептидов.
17-1. Последовательности
Эксперименты по профилированию антител проводили с использованием пептидной библиотеки, состоявшей из 108 пептидов. Полный перечень пептидов показан в Таблицах 20-22 ниже. Здесь SEQ ID NO: 64-81, соответствующие пептидам 001-018 (с Peptide_001 по Peptide_018), не являются нативными формами и содержат области рекомбинантных вставок. В качестве известной аминокислотной последовательности белка hTrx1 была использована последовательность с регистрационным номером в GenBank AAF87085.1.
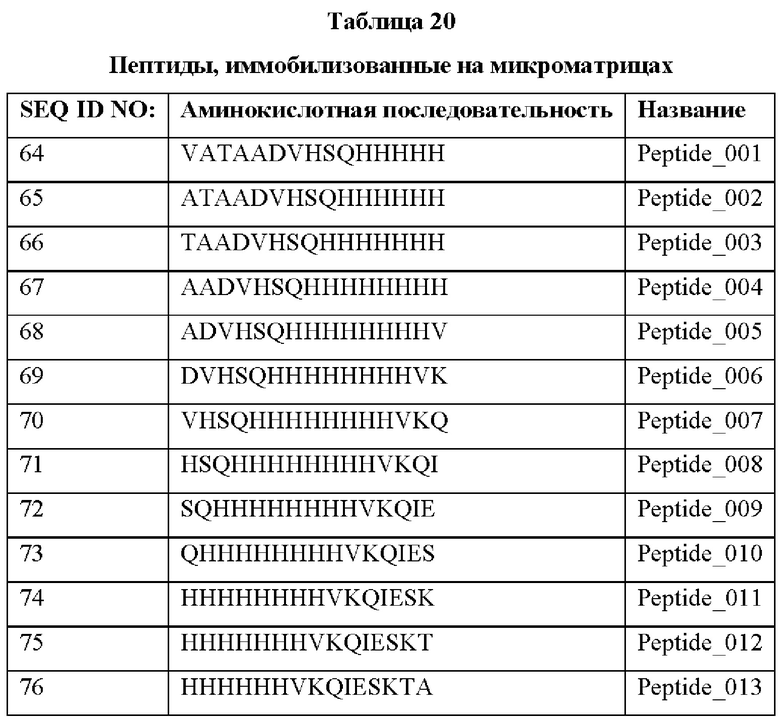
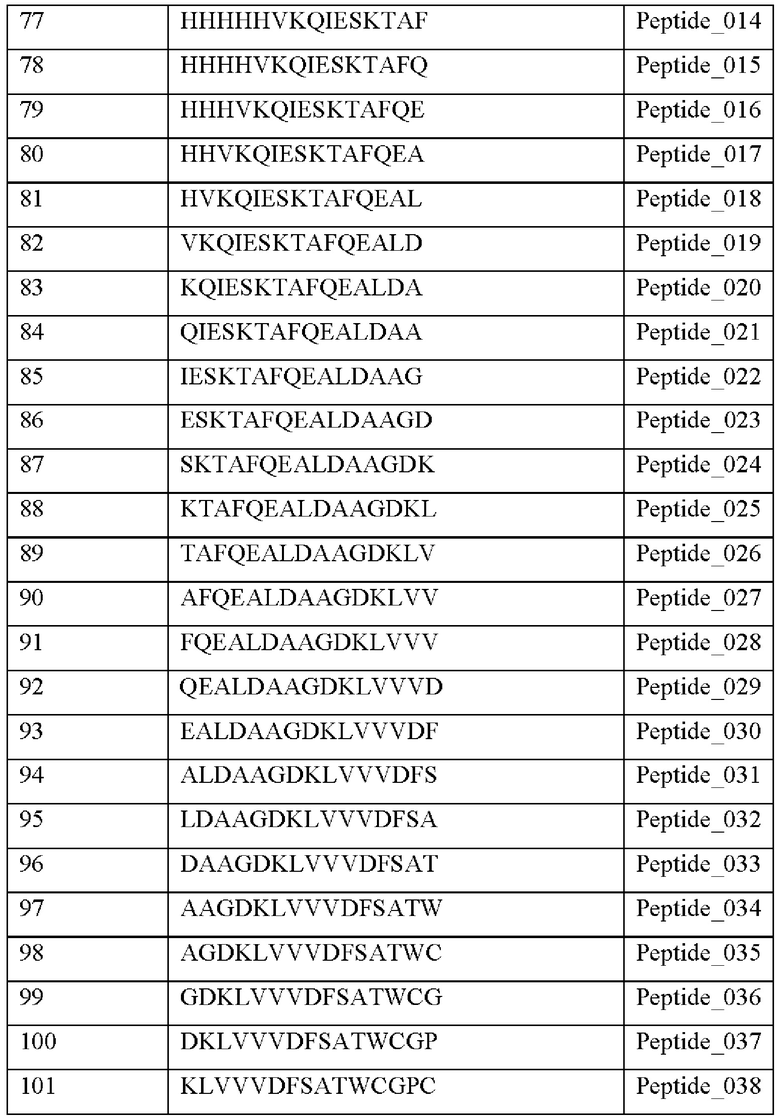

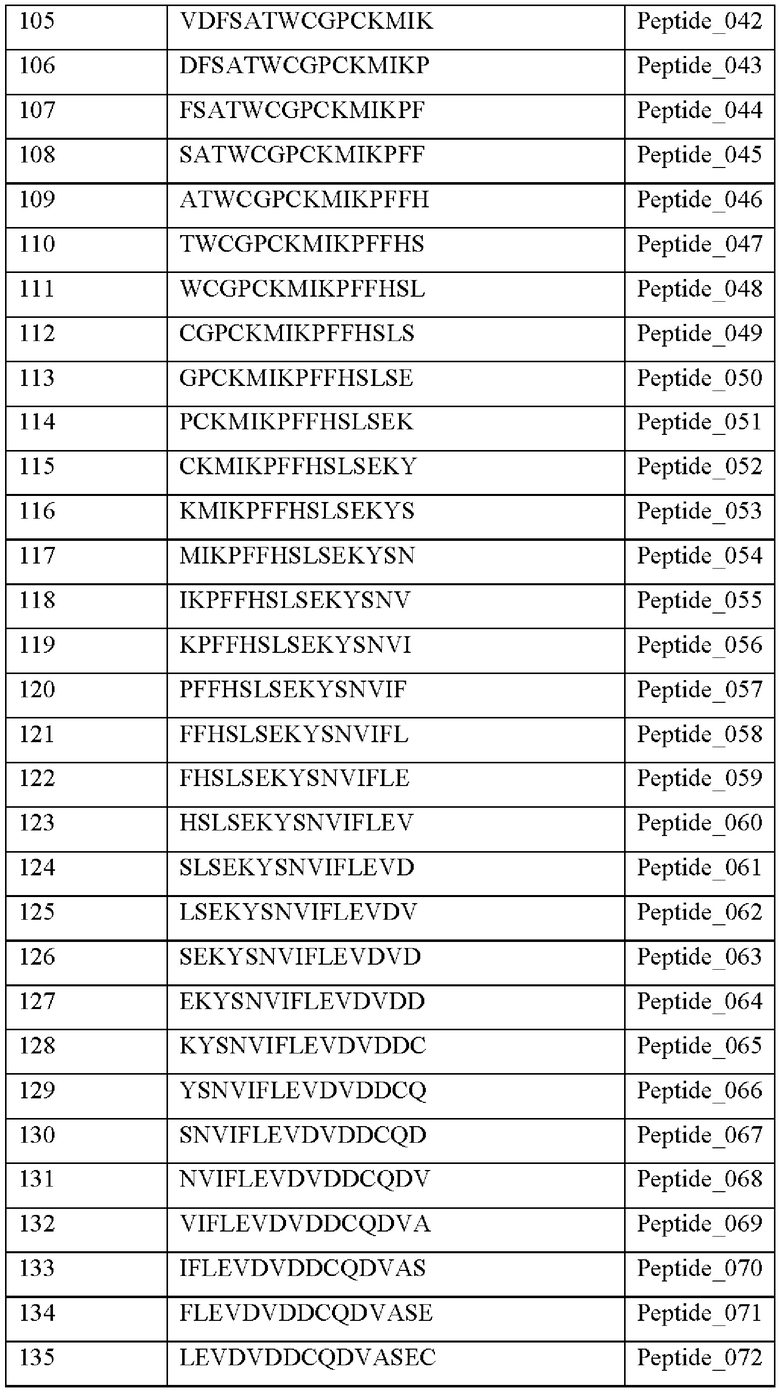

В качестве аналитического контроля на микроматричной панели был также иммобилизован полноразмерный мышиный IgG, и дополнительную последовательность включили в пептидную библиотеку посредством JPT в качестве внутреннего контроля процесса.
17-2. Условия анализа
Эксперименты по профилированию проводили с использованием в общей сложности двух образцов антител (В266-1 и В264), разведенных в блокирующем буфере (Pierce International, Superblock TBS T20, номер для заказа 37536). Серийные разведения 5, 1, 0,2, 0,04, 0,008 и 0,0016 мкг/мл инкубировали на одной многолуночной микроматричной панели при 30°С на протяжении 1 часа. Панель содержит 21 отдельную миниматрицу (по одной миниматрице на каждое разведение образца).
После инкубирования с образцами в соответствующие лунки вносили 1 мкг/мл флуоресцентно меченного вторичного антитела против мышиного IgG (anti-mouse IgG(H+L) (Thermo 84545)) с последующим взаимодействием на протяжении 1 часа. В качестве метки использовали DyLight 650. Ложноположительное связывание с пептидами оценивали, выполняя одно дополнительное контрольную инкубирование, при котором на ту же микроматричную панель наносили только вторичное антитело. Перед проведением каждой стадии микроматрицы отмывали отмывочным буфером.
После отмывки и сушки панель сканировали с использованием 635 нм лазерного сканера высокого разрешения (Axon GenePix Scanner 4300 SL50), получая профили интенсивности флуоресценции, и проводили количественный анализ полученного изображения с применением программного обеспечения для распознавания точек GenePix, рассчитывая среднее значение пикселя для каждого пептида. Для каждой точки получали среднюю интенсивность сигнала (световые единицы от 0 до 65535).
17-3. Изображение обработанных матриц
Типичное изображение, на котором показана флуоресценция миниматрицы, культивированной с одним из образцов антител, показано на ФИГ. 20. Для всех образцов были отмечены низкие фоновые значения. Черный цвет указывает на отсутствие сигнала, красная тень указывает на рост интенсивности выявляемого сигнала, белый цвет указывает на насыщение детектора, и каждая отдельная субматрица выделена зеленым цветом.
17-4. Анализ тепловых карт
Для визуализации полученных результатов и сравнения областей связывания для отдельных культур рассчитывали диаграммы с тепловыми картами, как показано на ФИГ. 21A-21D. На ФИГ. 21A-21D интенсивность флуоресценции показана цветовым кодом, белый цвет указывает на отсутствие связывания, а красный - на сильное связывание. Во всех анализах для каждого пептида рассчитывали ММС2-значение средней флуоресценции пикселя.
ММС2 представляет собой среднее значение всех трех точек на микроматрице, за исключением тех случаев, когда коэффициент вариации (CV), представляющий собой отношение стандартного отклонения к среднему значению, превышает 0,5. В таком случае за ММС2 принимают среднее двух ближайших значений (МС2). Толстой черной линией на тепловой карте показана контрольная культура с использованием только вторичного антитела против мышиного IgG. Культуры отдельных образцов антител обозначены тонкой синей линией.
В случае антитела В266-1, как показано в Таблице 23, наиболее высокий сигнал, приблизительно в 8 раз превышающий средний фоновый уровень, был выявлен для пептидов 004 и 005 (Peptide_004 и Peptide_005) (SEQ ID NO: 67 и 68). Однако, поскольку пептиды 004 и 005 не являются нативными формами, эти пептиды были исключены из группы возможных эпитопов.
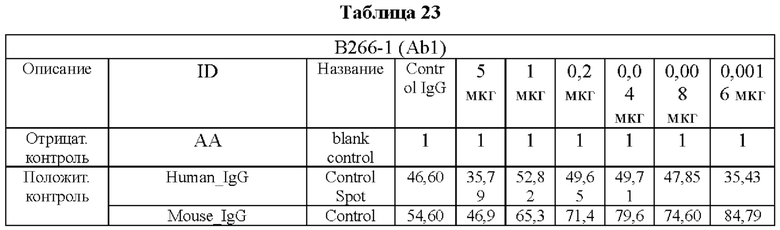
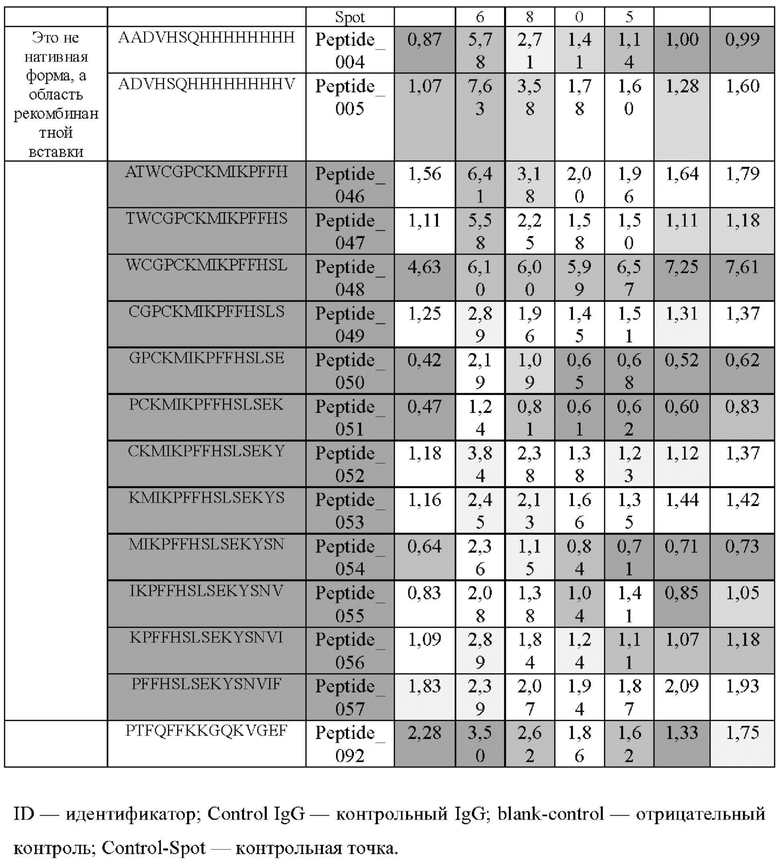
Антитело В264 продемонстрировало зависимый от концентрации профиль сигнала и весьма сильные взаимодействия с некоторыми пептидами. Наиболее существенное связывание было получено с пептидами, перечисленными в Таблице 24 ниже, в частности при двух наиболее высоких концентрациях образцов.
Как показано в Таблице 24, наиболее высокий сигнал, приблизительно в 7 раз превышающий средний фоновый уровень, был измерен для пептидов 012 и 018 (Peptide_012 и Peptide_018) (SEQ ID NO: 75 и 81). Однако, поскольку пептиды 012 и 018 не являются нативными формами, они были исключены из группы возможных эпитопов.
Впоследствии ожидали, что пептиды SEQ ID NO: 82-88, соответствующие пептидам 019-025 (с Peptide_019 по Peptide_025), для которых был измерен наиболее сильный сигнал, являются сайтами связывания антитела В264, и, в завершение, эпитоп антитела В264 был определен как «VKQIESKTAFQEALDAAGDKL» (SEQ ID NO: 179).
Впоследствии ожидали, что пептиды SEQ ID NO: 109-120, соответствующие пептидам 046-057 (с Peptide_046 по Peptide_057), для которых был измерен наиболее сильный сигнал, являются сайтами связывания антитела В264, имеющего такой же эпитоп, как сайт связывания В266-1.
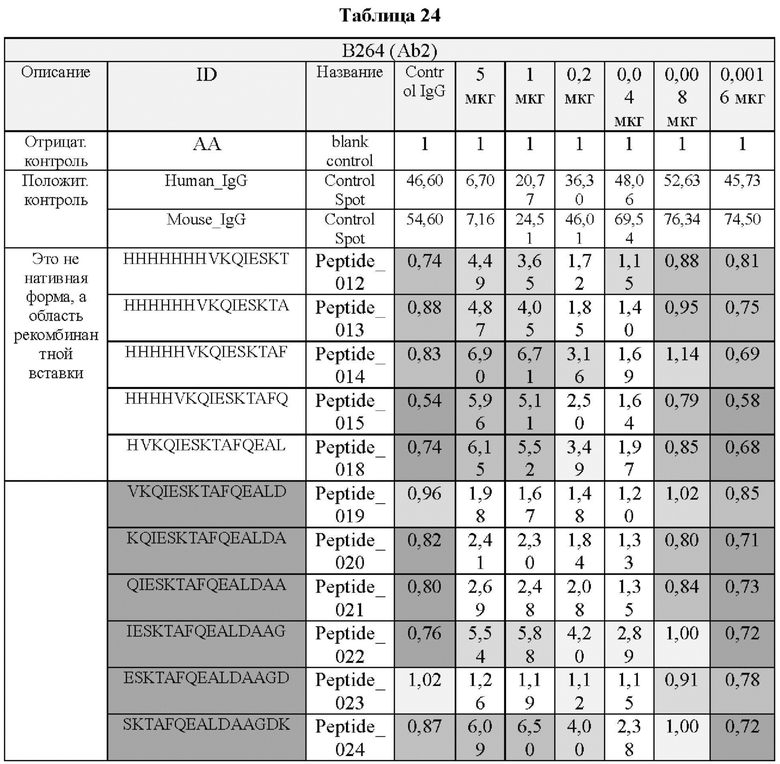
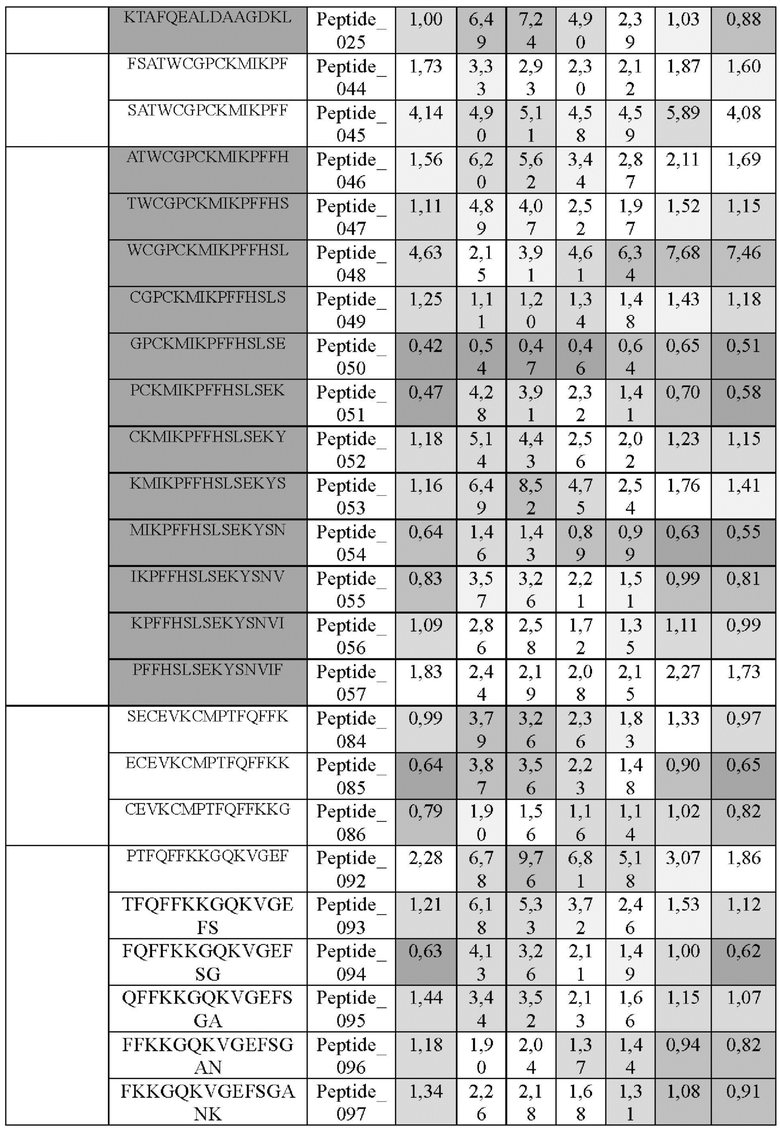

Не было выявлено существенного связывания в культуре контрольного вторичного антитела. Сильные сигналы, вплоть до уровня насыщения, были получены в контрольной точке, содержащей полноразмерный мышиный IgG, во всех культурах, что указывает на превосходное проведение анализа.
Эпитопные области, полученные описанным выше способом, показаны в Таблице 25 ниже, и, по результатам 3D-моделирования с подтверждением третичных (3D) структур посредством загрузки NMR-последовательности hTrx1, подтвержденной по белковой базе данных (PDB), как показано на ФИГ. 22A-22F, применительно к нативным формам, их последовательности расположены на поверхности указанных структур, что подтверждает возможность функционирования этих пептидов в качестве эпитопов.
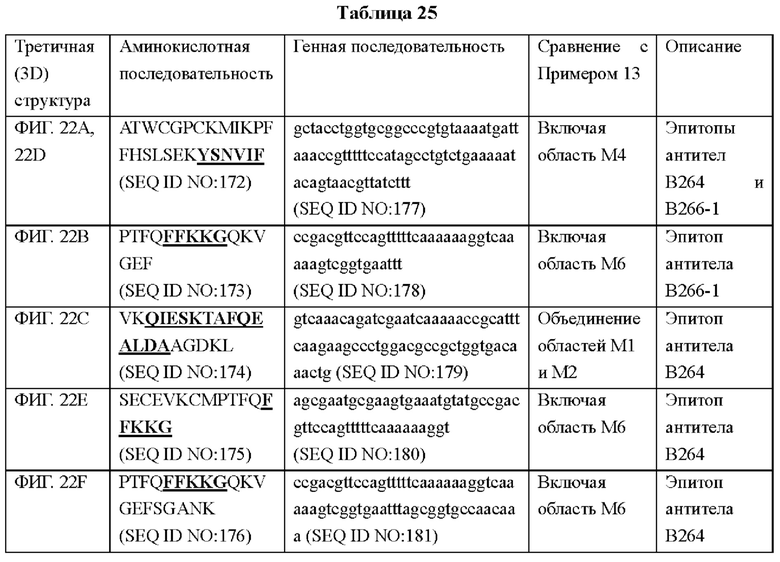
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Моноклональное антитело по настоящему изобретению может очень специфично связываться с Trx1 благодаря превосходной аффинности связывания с ним и может быть эффективно использовано при скрининге, направленном на выявление пациентов с раком молочной железы, благодаря исключительно высокой чувствительности и специфичности. Кроме того, точность и надежность диагностики рака молочной железы могут значительно повышаться, поскольку выявление моноклональным антителом по настоящему изобретению, специфично связывающимся с Trx1, а не выявление СА15-3, другим традиционным диагностическим биомаркером рака молочной железы, демонстрирует исключительно высокую чувствительность и специфичность. Эпитопная область антигена человеческого Trx1, с которой связывается антитело по настоящему изобретению, может быть эффективно использована при разработке улучшенного антитела для повышения аффинности связывания антитела против Trx1.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> E&S Healthcare Co., Ltd.
<120> Эпитоп тиоредоксина-1 и моноклональное антитело, специфично
связывающееся с ним
<130> 1064685
<150> KR 10-2017-0132536
<151> 2017-10-12
<160> 181
<170> PatentIn version 3.2
<210> 1
<211> 11
<212> PRT
<213> Artificial
<220>
<223> CDR1 легкой цепи B264
<400> 1
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 2
<211> 3
<212> PRT
<213> Artificial
<220>
<223> CDR2 легкой цепи B264
<400> 2
Lys Val Ser
1
<210> 3
<211> 10
<212> PRT
<213> Artificial
<220>
<223> CDR3 легкой цепи B264
<400> 3
Cys Phe Gln Gly Ser His Val Pro Tyr Thr
1 5 10
<210> 4
<211> 8
<212> PRT
<213> Artificial
<220>
<223> CDR1 тяжелой цепи B264
<400> 4
Gly Tyr Thr Phe Thr Ser Tyr Thr
1 5
<210> 5
<211> 9
<212> PRT
<213> Artificial
<220>
<223> CDR2 тяжелой цепи B264
<400> 5
Ile Asn Pro Thr Ser Asp Tyr Thr Asn
1 5
<210> 6
<211> 14
<212> PRT
<213> Artificial
<220>
<223> CDR3 тяжелой цепи B264
<400> 6
Phe Cys Ala Ser Glu Gly Gly Phe Leu Tyr Tyr Phe Asp Tyr
1 5 10
<210> 7
<211> 5
<212> PRT
<213> Artificial
<220>
<223> CDR1 легкой цепи B266-1
<400> 7
Ser Arg Ile Ser Tyr
1 5
<210> 8
<211> 3
<212> PRT
<213> Artificial
<220>
<223> CDR2 легкой цепи B266-1
<400> 8
Asp Thr Ser
1
<210> 9
<211> 10
<212> PRT
<213> Artificial
<220>
<223> CDR3 легкой цепи B266-1
<400> 9
Cys His Gln Arg Ser Ser Tyr Pro Thr Phe
1 5 10
<210> 10
<211> 8
<212> PRT
<213> Artificial
<220>
<223> CDR1 тяжелой цепи B266-1
<400> 10
Gly Phe Asn Ile Lys Asp Thr Phe
1 5
<210> 11
<211> 8
<212> PRT
<213> Artificial
<220>
<223> CDR2 тяжелой цепи B266-1
<400> 11
Ile Asp Pro Ala Asn Gly Asn Thr
1 5
<210> 12
<211> 11
<212> PRT
<213> Artificial
<220>
<223> CDR3 тяжелой цепи B266-1
<400> 12
Cys Ala Leu Leu Gln Tyr Ser Ala Met Asp Tyr
1 5 10
<210> 13
<211> 112
<212> PRT
<213> Artificial
<220>
<223> Вариабельная область легкой цепи B264
<400> 13
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 14
<211> 119
<212> PRT
<213> Artificial
<220>
<223> Вариабельная область тяжелой цепи B264
<400> 14
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Thr Ser Asp Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Glu Gly Gly Phe Leu Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 15
<211> 105
<212> PRT
<213> Artificial
<220>
<223> Вариабельная область легкой цепи B266-1
<400> 15
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Arg Ile Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Thr Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Thr Phe
85 90 95
Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 16
<211> 117
<212> PRT
<213> Artificial
<220>
<223> Вариабельная область тяжелой цепи B266-1
<400> 16
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Phe Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Leu Gln Tyr Ser Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 17
<211> 219
<212> PRT
<213> Artificial
<220>
<223> Легкая цепь B264
<400> 17
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 18
<211> 443
<212> PRT
<213> Artificial
<220>
<223> Тяжелая цепь B264
<400> 18
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Thr Ser Asp Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Glu Gly Gly Phe Leu Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 19
<211> 212
<212> PRT
<213> Artificial
<220>
<223> Легкая цепь B266
<400> 19
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Arg Ile Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Thr Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Thr Phe
85 90 95
Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala Pro Thr
100 105 110
Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala
115 120 125
Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val
130 135 140
Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu Asn Ser
145 150 155 160
Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr
165 170 175
Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys
180 185 190
Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn
195 200 205
Arg Asn Glu Cys
210
<210> 20
<211> 452
<212> PRT
<213> Artificial
<220>
<223> Тяжелая цепь B266
<400> 20
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Phe Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Leu Gln Tyr Ser Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Gly Cys Gly Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Ser Val Thr Val Thr Trp Asn Ser
145 150 155 160
Gly Ser Leu Ser Ser Ser Val His Thr Phe Pro Ala Leu Leu Gln Ser
165 170 175
Gly Leu Tyr Thr Met Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp
180 185 190
Pro Ser Gln Thr Val Thr Cys Ser Val Ala His Pro Ala Ser Ser Thr
195 200 205
Thr Val Asp Lys Lys Leu Glu Pro Ser Gly Pro Ile Ser Thr Ile Asn
210 215 220
Pro Cys Pro Pro Cys Lys Glu Cys His Lys Cys Pro Ala Pro Asn Leu
225 230 235 240
Glu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Asn Ile Lys Asp Val
245 250 255
Leu Met Ile Ser Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Val
260 265 270
Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val
275 280 285
Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser
290 295 300
Thr Ile Arg Val Val Ser Thr Leu Pro Ile Gln His Gln Asp Trp Met
305 310 315 320
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ser
325 330 335
Pro Ile Glu Arg Thr Ile Ser Lys Ile Lys Gly Leu Val Arg Ala Pro
340 345 350
Gln Val Tyr Ile Leu Pro Pro Pro Ala Glu Gln Leu Ser Arg Lys Asp
355 360 365
Val Ser Leu Thr Cys Leu Val Val Gly Phe Asn Pro Gly Asp Ile Ser
370 375 380
Val Glu Trp Thr Ser Asn Gly His Thr Glu Glu Asn Tyr Lys Asp Thr
385 390 395 400
Ala Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Ile Tyr Ser Lys Leu
405 410 415
Asn Met Lys Thr Ser Lys Trp Glu Lys Thr Asp Ser Phe Ser Cys Asn
420 425 430
Val Arg His Glu Gly Leu Lys Asn Tyr Tyr Leu Lys Lys Thr Ile Ser
435 440 445
Arg Ser Pro Gly
450
<210> 21
<211> 660
<212> DNA
<213> Artificial
<220>
<223> Легкая цепь B264
<400> 21
gacgtgctga tgacacagac accactcagc ctccctgtga gcctgggcga ccaggcctct 60
atttcttgcc ggtctagcca gagcatcgtg cactccaacg gcaacacata cttggagtgg 120
tatctacaga agcccggcca gtcccctaag ctgctgatat acaaggtgtc taaccgcttc 180
tccggcgtgc ccgacaggtt ctctggcagc ggctctggca ccgacttcac cctcaaaata 240
tctagggtgg aggccgagga cctgggcgtg tactactgct tccagggctc ccacgttcca 300
tacacattcg gcggcggcac aaagttggaa attaagcgcg ctgacgcagc cccaacagtg 360
agcatctttc ctccatcctc tgaacaactt acctctggag gagcctctgt ggtgtgtttc 420
ctgaacaact tctacccaaa ggacatcaat gtgaagtgga agattgatgg ctctgagaga 480
cagaatggag tgctgaactc ctggacagac caggacagca aggacagcac ctacagtatg 540
agtagcaccc tgaccctgac caaggatgaa tatgagagac acaactccta cacttgtgag 600
gctacccaca agaccagcac cagcccaatt gtcaaatcct tcaacaggaa tgagtgttaa 660
<210> 22
<211> 1332
<212> DNA
<213> Artificial
<220>
<223> Тяжелая цепь B264
<400> 22
caggtgcagc tccagcagtc cggcgccgaa ctggccagac ctggcgccag cgtgaagatg 60
agctgcaagg cctccggcta cacattcaca tcttacacca tgcactgggt gaagcagaga 120
cccggccagg gcctggagtg gattggctac attaacccaa catccgacta cacaaactac 180
aaccagaagt tcaaggacaa ggccacactc accgccgaca agtcttctag cacagcctac 240
atgcagctgt ctagcctgac aagcgaggac tctgccgtgt acttctgcgc ctctgagggc 300
ggcttcctgt actacttcga ctactggggc cagggcacca ccctgaccgt gtcctctgcc 360
aaaacgacac ccccatctgt ctatccactg gcccctggat ctgctgccca aactaactcc 420
atggtgaccc tgggatgcct ggtcaagggc tatttccctg agccagtgac agtgacctgg 480
aactctggat ccctgtccag cggtgtgcac accttcccag ctgtcctgca gtctgacctc 540
tacactctga gcagctcagt gactgtcccc tccagcacct ggcccagcga gaccgtcacc 600
tgcaacgttg cccacccggc cagcagcacc aaggtggaca agaaaattgt gcccagggat 660
tgtggttgta agccttgcat atgtacagtc ccagaagtat catctgtctt catcttcccc 720
ccaaagccca aggatgtgct caccattact ctgactccta aggtcacgtg tgttgtggta 780
gacatcagca aggatgatcc cgaggtccag ttcagctggt ttgtagatga tgtggaggtg 840
cacacagctc agacgcaacc ccgggaggag cagttcaaca gcactttccg ctcagtcagt 900
gaacttccca tcatgcacca ggactggctc aatggcaagg agttcaaatg cagggtcaac 960
agtgcagctt tccctgcccc catcgagaaa accatctcca aaaccaaagg cagaccgaag 1020
gctccacagg tgtacaccat tccacctccc aaggagcaga tggccaagga taaagtcagt 1080
ctgacctgca tgataacaga cttcttccct gaagacatta ctgtggagtg gcagtggaat 1140
gggcagccag cggagaacta caagaacact cagcccatca tggacacaga tggctcttac 1200
ttcgtctaca gcaagctcaa tgtgcagaag agcaactggg aggcaggaaa tactttcacc 1260
tgctctgtgt tacatgaggg cctgcacaac caccatactg agaagagcct ctcccactct 1320
cctggtaaat aa 1332
<210> 23
<211> 639
<212> DNA
<213> Artificial
<220>
<223> Легкая цепь B266
<400> 23
cagatcgtgc tcacacagtc tccagccatc atgagcgcct ctcctggcga gaaggtgaca 60
atgacctgct ctgcctctag ccgcatttct tacatgtact ggtatcagca gaagccaggc 120
acctccccta agaggtggat atacgacaca tccaagctgg cctccggcgt gcccgcccgg 180
ttcagcggct ctggcagcgg cacaagctac tccctgacaa ttagcacgat ggaggccgag 240
gacgccgcca catactactg ccaccagcgc tcgtcctacc caacattcgg cgccggcaca 300
aaattggaac tgaagagagc tgacgcagcc ccaacagtga gcatctttcc tccatcctct 360
gaacaactta cctctggagg agcctctgtg gtgtgtttcc tgaacaactt ctacccaaag 420
gacatcaatg tgaagtggaa gattgatggc tctgagagac agaatggagt gctgaactcc 480
tggacagacc aggacagcaa ggacagcacc tacagtatga gtagcaccct gaccctgacc 540
aaggatgaat atgagagaca caactcctac acttgtgagg ctacccacaa gaccagcacc 600
agcccaattg tcaaatcctt caacaggaat gagtgttaa 639
<210> 24
<211> 1359
<212> DNA
<213> Artificial
<220>
<223> Тяжелая цепь B266
<400> 24
gaggtgcagt tacaacagtc cggcgccgag ctagtgaagc caggcgccag cgtgaagctg 60
tcttgcacag ccagcggctt caacattaag gacaccttca tgcactgggt gaagcagaga 120
cctgagcagg gcttagagtg gattggccgg atcgaccccg ccaacggcaa cacaaagtac 180
gacccaaagt tccagggcaa ggccacaatt accgccgaca catcttccaa cacagcctac 240
ctccagctgt cgtctctcac cagcgaggac accgccgtgt actactgcgc cctgctccag 300
tactccgcga tggactactg gggccagggc acatctgtga ccgtgtctag cgccaagacc 360
accccaccat ccgtgtaccc actcgcccca ggctgcggcg acaccacagg ctctagcgtg 420
acactgggct gcctggtgaa gggctacttc cccgagtctg tgacagtgac ctggaactct 480
ggctctctgt ctagctctgt gcacaccttc cccgccctgc tgcaatccgg cctgtacaca 540
atgtcttctt ctgtgacagt gcctagctct acatggccat ctcagacagt gacatgctct 600
gtggcccacc ccgcctctag cacaaccgtg gacaagaagc tggagccatc cggccctatt 660
tctacaatta acccttgccc tccttgcaaa gaatgccaca agtgccccgc cccaaacctg 720
gagggcggcc cttctgtgtt cattttccct cctaacatta aggacgtgct gatgatcagc 780
ctcaccccaa aggtgacatg cgtggtggtg gacgtgtccg aggacgaccc tgacgtgcag 840
atttcttggt tcgtgaacaa cgtggaggtg cacaccgccc agacccagac ccaccgggag 900
gactacaact ccaccattcg ggtggtgtct acactgccta ttcagcacca ggactggatg 960
agcggcaaag agttcaagtg caaggtgaac aacaaggacc tgccatctcc tattgagaga 1020
acaatttcta agattaaggg cctggtgcgc gcccctcagg tgtacattct gcctcctccc 1080
gccgagcagc tgagccggaa ggacgtgtcc ctcacatgcc tcgtggtggg cttcaaccct 1140
ggcgacatta gcgtggagtg gacatctaac ggccacacag aagaaaacta caaggacaca 1200
gcccctgtgc tcgactccga cggctcttac ttcatatact ctaagctgaa catgaaaaca 1260
tctaagtggg aaaagaccga ctctttctct tgcaacgtgc ggcacgaggg cctgaagaac 1320
tactacctca agaaaaccat tagcagaagt ccaggctaa 1359
<210> 25
<211> 211
<212> PRT
<213> Artificial
<220>
<223> Легкая цепь B266-1
<400> 25
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Arg Ile Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Thr Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Thr Phe
85 90 95
Gly Ala Gly Thr Lys Leu Glu Leu Lys Ser Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu Cys
210
<210> 26
<211> 447
<212> PRT
<213> Artificial
<220>
<223> Тяжелая цепь B266-1
<400> 26
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Phe Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Leu Gln Tyr Ser Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 27
<211> 633
<212> DNA
<213> Artificial
<220>
<223> Легкая цепь B266-1
<400> 27
cagatcgtgc tcacacagtc tccagccatc atgagcgcct ctcctggcga gaaggtgaca 60
atgacctgct ctgcctctag ccgcatttct tacatgtact ggtatcagca gaagccaggc 120
acctccccta agaggtggat atacgacaca tccaagctgg cctccggcgt gcccgcccgg 180
ttcagcggct ctggcagcgg cacaagctac tccctgacaa ttagcacgat ggaggccgag 240
gacgccgcca catactactg ccaccagcgc tcgtcctacc caacattcgg cgccggcaca 300
aaattggaac tgaaggtggc tgcaccatct gtcttcatct tcccgccatc tgatgagcag 360
ttgaaatctg gaactgcctc tgttgtgtgc ctgctgaata acttctatcc cagagaggcc 420
aaagtacagt ggaaggtgga taacgccctc caatcgggta actcccagga gagtgtcaca 480
gagcaggaca gcaaggacag cacctacagc ctcagcagca ccctgacgct gagcaaagca 540
gactacgaga aacacaaagt ctacgcctgc gaagtcaccc atcagggcct gagctcgccc 600
gtcacaaaga gcttcaacag gggagagtgt tag 633
<210> 28
<211> 1337
<212> DNA
<213> Artificial
<220>
<223> Тяжелая цепь B266-1
<400> 28
gaggtgcagt tacaacagtc cggcgccgag ctagtgaagc caggcgccag cgtgaagctg 60
tcttgcacag ccagcggctt caacattaag gacaccttca tgcactgggt gaagcagaga 120
cctgagcagg gcttagagtg gattggccgg atcgaccccg ccaacggcaa cacaaagtac 180
gacccaaagt tccagggcaa ggccacaatt accgccgaca catcttccaa cacagcctac 240
ctccagctgt cgtctctcac cagcgaggac accgccgtgt actactgcgc cctgctccag 300
tactccgcga tggactactg gggccagggc acatctgtga ccgtgtctag accaagggcc 360
catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca gcggccctgg 420
gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac tcaggcgccc 480
tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc tactccctca 540
gcagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc tgcaacgtga 600
atcacaagcc cagcaacacc aaggtggaca agaaagttga gcccaaatct tgtgacaaaa 660
ctcacacatg cccaccgtgc ccagcacctg aactcctggg gggaccgtca gtcttcctct 720
ttcccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc acatgcgtgg 780
tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg gacggcgtgg 840
aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg taccgtgtgg 900
tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac aagtgcaagg 960
tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc aaagggcagc 1020
cccgagaacc acaggtgtac accctgcccc catcccggga ggagatgacc aagaaccagg 1080
tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg gagtgggaga 1140
gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac tccgacggct 1200
ccttcttcct ctacagcaag ctcaccgtgg acaagagcag gtggcagcag gggaacgtct 1260
tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag agcctctccc 1320
tgtctccggg taaatga 1337
<210> 29
<211> 315
<212> DNA
<213> Artificial
<220>
<223> Ген Trx1
<400> 29
atggtcaaac agatcgaatc aaaaaccgca tttcaagaag ccctggacgc cgctggtgac 60
aaactggtcg tggtggactt tagtgctacc tggtgcggcc cgtgtaaaat gattaaaccg 120
tttttccata gcctgtctga aaaatacagt aacgttatct ttctggaagt ggatgttgat 180
gactgccagg acgtcgcgag cgaatgcgaa gtgaaatgta tgccgacgtt ccagtttttc 240
aaaaaaggtc aaaaagtcgg tgaatttagc ggtgccaaca aagaaaaact ggaagccacg 300
attaacgaac tggtg 315
<210> 30
<211> 22
<212> DNA
<213> Artificial
<220>
<223> Праймер hTrx1-For
<400> 30
taatggtcaa acagatcgaa tc 22
<210> 31
<211> 31
<212> DNA
<213> Artificial
<220>
<223> Праймер hTrx1-Rev
<400> 31
caccagttcg ttaatcgtgg taatgaaagc t 31
<210> 32
<211> 7
<212> PRT
<213> Artificial
<220>
<223> hTrx1 M1
<400> 32
Gln Ile Glu Gly Ser Thr Ala
1 5
<210> 33
<211> 6
<212> PRT
<213> Artificial
<220>
<223> hTrx1 M2
<400> 33
Gln Glu Ala Leu Asp Ala
1 5
<210> 34
<211> 5
<212> PRT
<213> Artificial
<220>
<223> hTrx1 M4
<400> 34
Tyr Ser Asn Val Ile
1 5
<210> 35
<211> 21
<212> DNA
<213> Artificial
<220>
<223> hTrx1 M1
<400> 35
cagatcgaat caaaaaccgc a 21
<210> 36
<211> 18
<212> DNA
<213> Artificial
<220>
<223> hTrx1 M2
<400> 36
caagaagccc tggacgcc 18
<210> 37
<211> 15
<212> DNA
<213> Artificial
<220>
<223> hTrx1 M4
<400> 37
tacagtaacg ttatc 15
<210> 38
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M1
<400> 38
gtcaaagaga tcgaaggcaa agaagatttt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 39
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M2
<400> 39
gtcaaacaga tcgaatcaaa aaccgcattt catgctgccc tgagcagtgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 40
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M3
<400> 40
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
tatcatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 41
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M4
<400> 41
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atttggcaac atggtgttcc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 42
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M5
<400> 42
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatga taacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 43
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M6
<400> 43
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gttttataaa 240
aaaagggaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 44
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M7
<400> 44
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gttaacaaag aaaaactgga agccacgatt 300
aacgaactgg tg 312
<210> 45
<211> 312
<212> DNA
<213> Artificial
<220>
<223> TRX-N-His-M8
<400> 45
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctggtcgtgg tggactttag tgctacctgg tgcggcccgt gtaaaatgat taaaccgttt 120
ttccatagcc tgtctgaaaa atacagtaac gttatctttc tggaagtgga tgttgatgac 180
tgccaggacg tcgcgagcga atgcgaagtg aaatgtatgc cgacgttcca gtttttcaaa 240
aaaggtcaaa aagtcggtga atttagcggt gccaacaaag aaaaactgga agccatcatt 300
aacgaactgt gt 312
<210> 46
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Праймер Vector-F
<400> 46
ggcgtgtacg gtgggaggt 19
<210> 47
<211> 20
<212> DNA
<213> Artificial
<220>
<223> Праймер Vector-R
<400> 47
agcagcgtat ccacatagcg 20
<210> 48
<211> 57
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX M1-F
<400> 48
catcacgtca aagagatcga aggcaaagaa gattttcaag aagccctgga cgccgct 57
<210> 49
<211> 58
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX M1-R
<400> 49
ggcttcttga aaatcttctt tgccttcgat ctctttgacg tgatgatgat gatgatga 58
<210> 50
<211> 52
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX M2-F
<400> 50
aaaaccgcat ttcatgctgc cctgagcagt gctggtgaca aactggtcgt gg 52
<210> 51
<211> 54
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX M2-R
<400> 51
tttgtcacca gcactgctca gggcagcatg aaatgcggtt tttgattcga tctg 54
<210> 52
<211> 58
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M3-OV-F
<400> 52
attaaaccgt tttatcatag cctgtctgaa aaatacagta acgttatctt tctggaag 58
<210> 53
<211> 50
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M3-OV-R
<400> 53
agacaggcta tgataaaacg gtttaatcat tttacacggg ccgcaccagg 50
<210> 54
<211> 65
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M4-OV-F
<400> 54
ctgtctgaaa aatttggcaa catggtgttc ctggaagtgg atgttgatga ctgccaggac 60
gtcgc 65
<210> 55
<211> 73
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M4-OV-R
<400> 55
atccacttcc aggaacacca tgttgccaaa tttttcagac aggctatgga aaaacggttt 60
aatcatttta cac 73
<210> 56
<211> 55
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M5-OV-F
<400> 56
gtgaaatgta tgataacgtt ccagtttttc aaaaaaggtc aaaaagtcgg tgaat 55
<210> 57
<211> 49
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M5-OV-R
<400> 57
aaactggaac gttatcatac atttcacttc gcattcgctc gcgacgtcc 49
<210> 58
<211> 65
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M6-OV-F
<400> 58
acgttccagt tttataaaaa aagggaaaaa gtcggtgaat ttagcggtgc caacaaagaa 60
aaact 65
<210> 59
<211> 64
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M6-OV-R
<400> 59
ttcaccgact ttttcccttt ttttataaaa ctggaacgtc ggcatacatt tcacttcgca 60
ttcg 64
<210> 60
<211> 84
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M7-Xho-R
<400> 60
gaattctcga gctatcacac cagttcgtta atcgtggctt ccagtttttc tttgttaaca 60
ccgctaaatt caccgacttt ttga 84
<210> 61
<211> 59
<212> DNA
<213> Artificial
<220>
<223> Праймер TRX-M8-Xho-R
<400> 61
gaattctcga gctatcaaca cagttcgtta atgatggctt ccagtttttc tttgttggc 59
<210> 62
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Праймер N293F-colo-F
<400> 62
ggcgtgtacg gtgggaggt 19
<210> 63
<211> 20
<212> DNA
<213> Artificial
<220>
<223> Праймер N293F-colo-R
<400> 63
agcagcgtat ccacatagcg 20
<210> 64
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_001
<400> 64
Val Ala Thr Ala Ala Asp Val His Ser Gln His His His His His
1 5 10 15
<210> 65
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_002
<400> 65
Ala Thr Ala Ala Asp Val His Ser Gln His His His His His His
1 5 10 15
<210> 66
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_003
<400> 66
Thr Ala Ala Asp Val His Ser Gln His His His His His His His
1 5 10 15
<210> 67
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_004
<400> 67
Ala Ala Asp Val His Ser Gln His His His His His His His His
1 5 10 15
<210> 68
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_005
<400> 68
Ala Asp Val His Ser Gln His His His His His His His His Val
1 5 10 15
<210> 69
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_006
<400> 69
Asp Val His Ser Gln His His His His His His His His Val Lys
1 5 10 15
<210> 70
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_007
<400> 70
Val His Ser Gln His His His His His His His His Val Lys Gln
1 5 10 15
<210> 71
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_008
<400> 71
His Ser Gln His His His His His His His His Val Lys Gln Ile
1 5 10 15
<210> 72
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_009
<400> 72
Ser Gln His His His His His His His His Val Lys Gln Ile Glu
1 5 10 15
<210> 73
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_010
<400> 73
Gln His His His His His His His His Val Lys Gln Ile Glu Ser
1 5 10 15
<210> 74
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_011
<400> 74
His His His His His His His His Val Lys Gln Ile Glu Ser Lys
1 5 10 15
<210> 75
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_012
<400> 75
His His His His His His His Val Lys Gln Ile Glu Ser Lys Thr
1 5 10 15
<210> 76
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_013
<400> 76
His His His His His His Val Lys Gln Ile Glu Ser Lys Thr Ala
1 5 10 15
<210> 77
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_014
<400> 77
His His His His His Val Lys Gln Ile Glu Ser Lys Thr Ala Phe
1 5 10 15
<210> 78
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_015
<400> 78
His His His His Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln
1 5 10 15
<210> 79
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_016
<400> 79
His His His Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu
1 5 10 15
<210> 80
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_017
<400> 80
His His Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala
1 5 10 15
<210> 81
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_018
<400> 81
His Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu
1 5 10 15
<210> 82
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_019
<400> 82
Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp
1 5 10 15
<210> 83
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_020
<400> 83
Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala
1 5 10 15
<210> 84
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_021
<400> 84
Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala
1 5 10 15
<210> 85
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_022
<400> 85
Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly
1 5 10 15
<210> 86
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_023
<400> 86
Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp
1 5 10 15
<210> 87
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_024
<400> 87
Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys
1 5 10 15
<210> 88
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_025
<400> 88
Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu
1 5 10 15
<210> 89
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_026
<400> 89
Thr Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu Val
1 5 10 15
<210> 90
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_027
<400> 90
Ala Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu Val Val
1 5 10 15
<210> 91
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_028
<400> 91
Phe Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu Val Val Val
1 5 10 15
<210> 92
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_029
<400> 92
Gln Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu Val Val Val Asp
1 5 10 15
<210> 93
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_030
<400> 93
Glu Ala Leu Asp Ala Ala Gly Asp Lys Leu Val Val Val Asp Phe
1 5 10 15
<210> 94
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_031
<400> 94
Ala Leu Asp Ala Ala Gly Asp Lys Leu Val Val Val Asp Phe Ser
1 5 10 15
<210> 95
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_032
<400> 95
Leu Asp Ala Ala Gly Asp Lys Leu Val Val Val Asp Phe Ser Ala
1 5 10 15
<210> 96
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_033
<400> 96
Asp Ala Ala Gly Asp Lys Leu Val Val Val Asp Phe Ser Ala Thr
1 5 10 15
<210> 97
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_034
<400> 97
Ala Ala Gly Asp Lys Leu Val Val Val Asp Phe Ser Ala Thr Trp
1 5 10 15
<210> 98
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_035
<400> 98
Ala Gly Asp Lys Leu Val Val Val Asp Phe Ser Ala Thr Trp Cys
1 5 10 15
<210> 99
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_036
<400> 99
Gly Asp Lys Leu Val Val Val Asp Phe Ser Ala Thr Trp Cys Gly
1 5 10 15
<210> 100
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_037
<400> 100
Asp Lys Leu Val Val Val Asp Phe Ser Ala Thr Trp Cys Gly Pro
1 5 10 15
<210> 101
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_038
<400> 101
Lys Leu Val Val Val Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys
1 5 10 15
<210> 102
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_039
<400> 102
Leu Val Val Val Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys
1 5 10 15
<210> 103
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_040
<400> 103
Val Val Val Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys Met
1 5 10 15
<210> 104
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_041
<400> 104
Val Val Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys Met Ile
1 5 10 15
<210> 105
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_042
<400> 105
Val Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys
1 5 10 15
<210> 106
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_043
<400> 106
Asp Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro
1 5 10 15
<210> 107
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_044
<400> 107
Phe Ser Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe
1 5 10 15
<210> 108
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_045
<400> 108
Ser Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe
1 5 10 15
<210> 109
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_046
<400> 109
Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His
1 5 10 15
<210> 110
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_047
<400> 110
Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser
1 5 10 15
<210> 111
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_048
<400> 111
Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser Leu
1 5 10 15
<210> 112
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_049
<400> 112
Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser Leu Ser
1 5 10 15
<210> 113
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_050
<400> 113
Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser Leu Ser Glu
1 5 10 15
<210> 114
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_051
<400> 114
Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser Leu Ser Glu Lys
1 5 10 15
<210> 115
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_052
<400> 115
Cys Lys Met Ile Lys Pro Phe Phe His Ser Leu Ser Glu Lys Tyr
1 5 10 15
<210> 116
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_053
<400> 116
Lys Met Ile Lys Pro Phe Phe His Ser Leu Ser Glu Lys Tyr Ser
1 5 10 15
<210> 117
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_054
<400> 117
Met Ile Lys Pro Phe Phe His Ser Leu Ser Glu Lys Tyr Ser Asn
1 5 10 15
<210> 118
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_055
<400> 118
Ile Lys Pro Phe Phe His Ser Leu Ser Glu Lys Tyr Ser Asn Val
1 5 10 15
<210> 119
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_056
<400> 119
Lys Pro Phe Phe His Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile
1 5 10 15
<210> 120
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_057
<400> 120
Pro Phe Phe His Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe
1 5 10 15
<210> 121
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_058
<400> 121
Phe Phe His Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu
1 5 10 15
<210> 122
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_059
<400> 122
Phe His Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu
1 5 10 15
<210> 123
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_060
<400> 123
His Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu Val
1 5 10 15
<210> 124
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_061
<400> 124
Ser Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu Val Asp
1 5 10 15
<210> 125
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_062
<400> 125
Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu Val Asp Val
1 5 10 15
<210> 126
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_063
<400> 126
Ser Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu Val Asp Val Asp
1 5 10 15
<210> 127
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_064
<400> 127
Glu Lys Tyr Ser Asn Val Ile Phe Leu Glu Val Asp Val Asp Asp
1 5 10 15
<210> 128
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_065
<400> 128
Lys Tyr Ser Asn Val Ile Phe Leu Glu Val Asp Val Asp Asp Cys
1 5 10 15
<210> 129
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_066
<400> 129
Tyr Ser Asn Val Ile Phe Leu Glu Val Asp Val Asp Asp Cys Gln
1 5 10 15
<210> 130
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_067
<400> 130
Ser Asn Val Ile Phe Leu Glu Val Asp Val Asp Asp Cys Gln Asp
1 5 10 15
<210> 131
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_068
<400> 131
Asn Val Ile Phe Leu Glu Val Asp Val Asp Asp Cys Gln Asp Val
1 5 10 15
<210> 132
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_069
<400> 132
Val Ile Phe Leu Glu Val Asp Val Asp Asp Cys Gln Asp Val Ala
1 5 10 15
<210> 133
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_070
<400> 133
Ile Phe Leu Glu Val Asp Val Asp Asp Cys Gln Asp Val Ala Ser
1 5 10 15
<210> 134
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_071
<400> 134
Phe Leu Glu Val Asp Val Asp Asp Cys Gln Asp Val Ala Ser Glu
1 5 10 15
<210> 135
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_072
<400> 135
Leu Glu Val Asp Val Asp Asp Cys Gln Asp Val Ala Ser Glu Cys
1 5 10 15
<210> 136
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_073
<400> 136
Glu Val Asp Val Asp Asp Cys Gln Asp Val Ala Ser Glu Cys Glu
1 5 10 15
<210> 137
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_074
<400> 137
Val Asp Val Asp Asp Cys Gln Asp Val Ala Ser Glu Cys Glu Val
1 5 10 15
<210> 138
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_075
<400> 138
Asp Val Asp Asp Cys Gln Asp Val Ala Ser Glu Cys Glu Val Lys
1 5 10 15
<210> 139
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_076
<400> 139
Val Asp Asp Cys Gln Asp Val Ala Ser Glu Cys Glu Val Lys Cys
1 5 10 15
<210> 140
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_077
<400> 140
Asp Asp Cys Gln Asp Val Ala Ser Glu Cys Glu Val Lys Cys Met
1 5 10 15
<210> 141
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_078
<400> 141
Asp Cys Gln Asp Val Ala Ser Glu Cys Glu Val Lys Cys Met Pro
1 5 10 15
<210> 142
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_079
<400> 142
Cys Gln Asp Val Ala Ser Glu Cys Glu Val Lys Cys Met Pro Thr
1 5 10 15
<210> 143
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_080
<400> 143
Gln Asp Val Ala Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe
1 5 10 15
<210> 144
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_081
<400> 144
Asp Val Ala Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln
1 5 10 15
<210> 145
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_082
<400> 145
Val Ala Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe
1 5 10 15
<210> 146
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_083
<400> 146
Ala Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe
1 5 10 15
<210> 147
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_084
<400> 147
Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys
1 5 10 15
<210> 148
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_085
<400> 148
Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys
1 5 10 15
<210> 149
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_086
<400> 149
Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys Gly
1 5 10 15
<210> 150
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_087
<400> 150
Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln
1 5 10 15
<210> 151
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_088
<400> 151
Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys
1 5 10 15
<210> 152
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_089
<400> 152
Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val
1 5 10 15
<210> 153
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_090
<400> 153
Cys Met Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly
1 5 10 15
<210> 154
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_091
<400> 154
Met Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu
1 5 10 15
<210> 155
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_092
<400> 155
Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe
1 5 10 15
<210> 156
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_093
<400> 156
Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser
1 5 10 15
<210> 157
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_094
<400> 157
Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser Gly
1 5 10 15
<210> 158
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_095
<400> 158
Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser Gly Ala
1 5 10 15
<210> 159
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_096
<400> 159
Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser Gly Ala Asn
1 5 10 15
<210> 160
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_097
<400> 160
Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser Gly Ala Asn Lys
1 5 10 15
<210> 161
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_098
<400> 161
Lys Lys Gly Gln Lys Val Gly Glu Phe Ser Gly Ala Asn Lys Glu
1 5 10 15
<210> 162
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_099
<400> 162
Lys Gly Gln Lys Val Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys
1 5 10 15
<210> 163
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_100
<400> 163
Gly Gln Lys Val Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu
1 5 10 15
<210> 164
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_101
<400> 164
Gln Lys Val Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu
1 5 10 15
<210> 165
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_102
<400> 165
Lys Val Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala
1 5 10 15
<210> 166
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_103
<400> 166
Val Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr
1 5 10 15
<210> 167
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_104
<400> 167
Gly Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr Ile
1 5 10 15
<210> 168
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_105
<400> 168
Glu Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr Ile Asn
1 5 10 15
<210> 169
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_106
<400> 169
Phe Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr Ile Asn Glu
1 5 10 15
<210> 170
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_107
<400> 170
Ser Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr Ile Asn Glu Leu
1 5 10 15
<210> 171
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Peptide_108
<400> 171
Gly Ala Asn Lys Glu Lys Leu Glu Ala Thr Ile Asn Glu Leu Val
1 5 10 15
<210> 172
<211> 26
<212> PRT
<213> Artificial
<220>
<223> Эпитоп B264 и B266-1
<400> 172
Ala Thr Trp Cys Gly Pro Cys Lys Met Ile Lys Pro Phe Phe His Ser
1 5 10 15
Leu Ser Glu Lys Tyr Ser Asn Val Ile Phe
20 25
<210> 173
<211> 15
<212> PRT
<213> Artificial
<220>
<223> Эпитоп B266-1
<400> 173
Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe
1 5 10 15
<210> 174
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Эпитоп B264
<400> 174
Val Lys Gln Ile Glu Ser Lys Thr Ala Phe Gln Glu Ala Leu Asp Ala
1 5 10 15
Ala Gly Asp Lys Leu
20
<210> 175
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Эпитоп B264
<400> 175
Ser Glu Cys Glu Val Lys Cys Met Pro Thr Phe Gln Phe Phe Lys Lys
1 5 10 15
Gly
<210> 176
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Эпитоп B264
<400> 176
Pro Thr Phe Gln Phe Phe Lys Lys Gly Gln Lys Val Gly Glu Phe Ser
1 5 10 15
Gly Ala Asn Lys
20
<210> 177
<211> 78
<212> DNA
<213> Artificial
<220>
<223> Эпитоп B264 и B266-1
<400> 177
gctacctggt gcggcccgtg taaaatgatt aaaccgtttt tccatagcct gtctgaaaaa 60
tacagtaacg ttatcttt 78
<210> 178
<211> 45
<212> DNA
<213> Artificial
<220>
<223> Эпитоп B266-1
<400> 178
ccgacgttcc agtttttcaa aaaaggtcaa aaagtcggtg aattt 45
<210> 179
<211> 63
<212> DNA
<213> Artificial
<220>
<223> Эпитоп B264
<400> 179
gtcaaacaga tcgaatcaaa aaccgcattt caagaagccc tggacgccgc tggtgacaaa 60
ctg 63
<210> 180
<211> 51
<212> DNA
<213> Artificial
<220>
<223> Эпитоп B264
<400> 180
agcgaatgcg aagtgaaatg tatgccgacg ttccagtttt tcaaaaaagg t 51
<210> 181
<211> 60
<212> DNA
<213> Artificial
<220>
<223> Эпитоп B264
<400> 181
ccgacgttcc agtttttcaa aaaaggtcaa aaagtcggtg aatttagcgg tgccaacaaa 60
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Эпитоп тиоредоксина-1, специфично связывающийся с моноклональным антителом | 2018 |
|
RU2804772C2 |
| Эпитоп тиоредоксина-1 и моноклональное антитело, специфически связывающееся с ним | 2018 |
|
RU2797266C2 |
| ЭПИТОП ТИОРЕДОКСИНА-1, СПЕЦИФИЧНО СВЯЗЫВАЮЩИЙСЯ С МОНОКЛОНАЛЬНЫМ АНТИТЕЛОМ | 2023 |
|
RU2802944C1 |
| Моноклональное антитело, специфично связывающееся с эпитопом тиоредоксина-1, его получение и применение | 2018 |
|
RU2790687C2 |
| Моноклональное антитело, специфично связывающееся с эпитопом тиоредоксина-1, его получение и применение | 2018 |
|
RU2791264C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С ТИОРЕДОКСИНОМ-1, И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2747929C2 |
| АНТИТЕЛА ПРОТИВ БЕЛКА-1 ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ (PD-1) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725950C1 |
| Композиция для предупреждения и лечения заболевания кожи, содержащая вещество, специфично связывающееся с пептидом, имеющим происхождение из виментина | 2018 |
|
RU2751486C1 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2819627C1 |
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
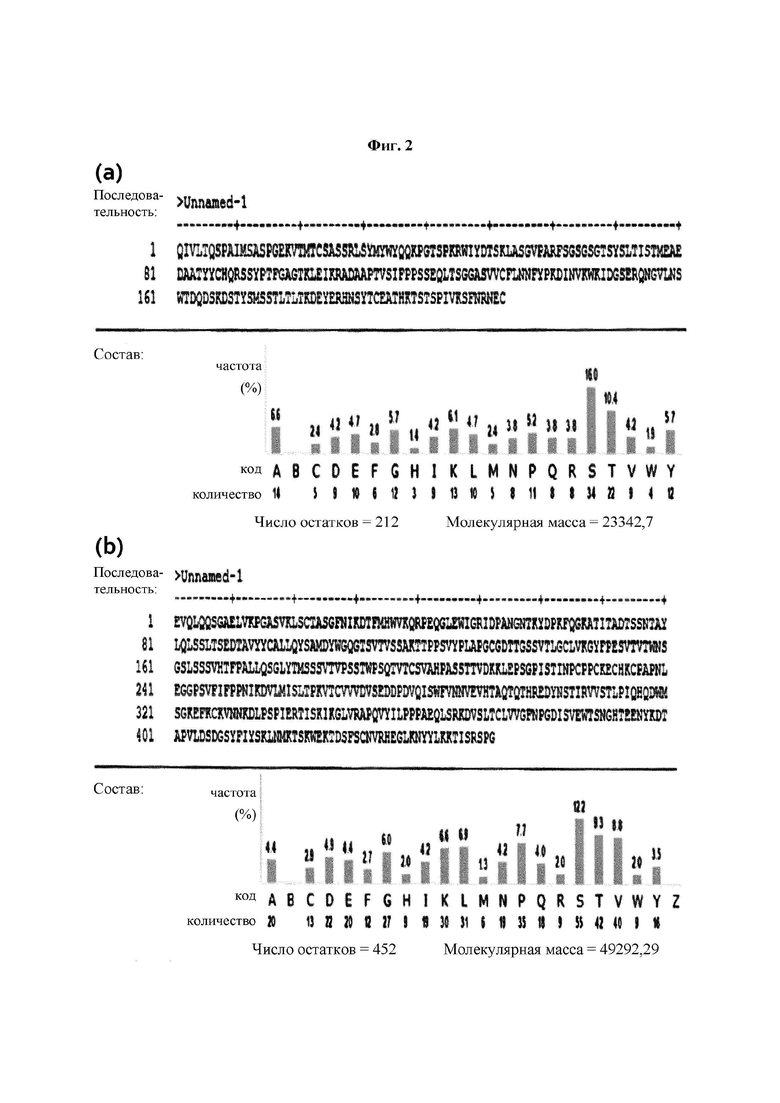


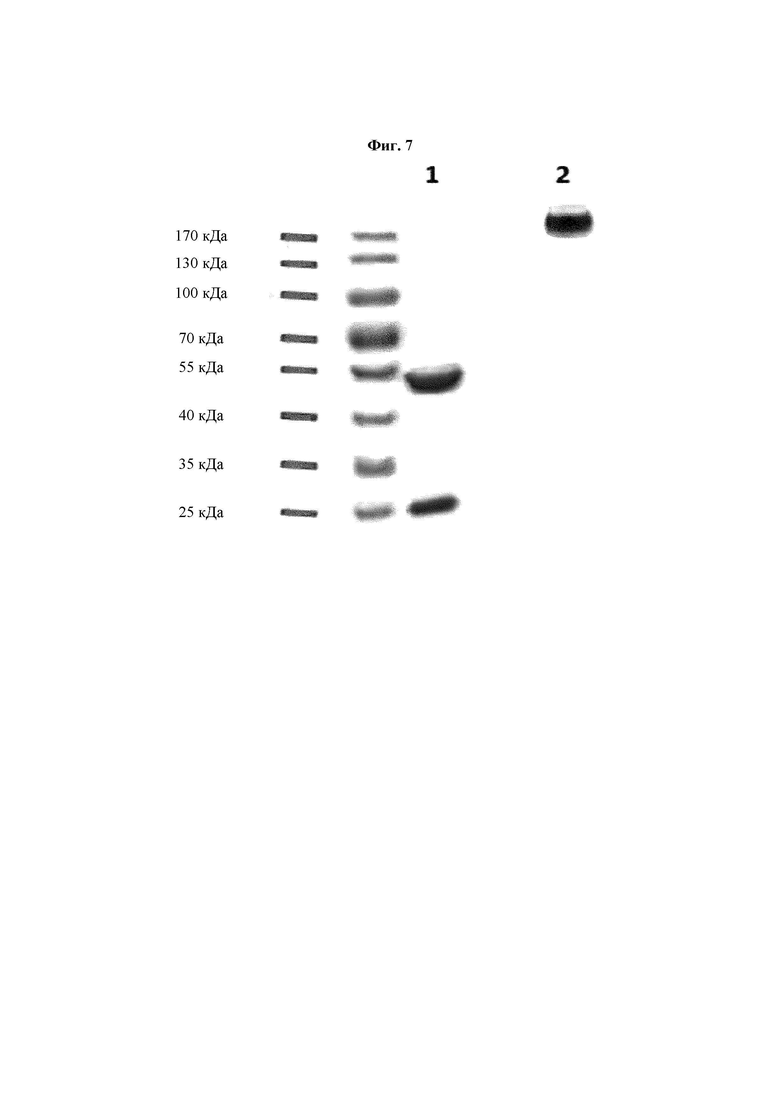
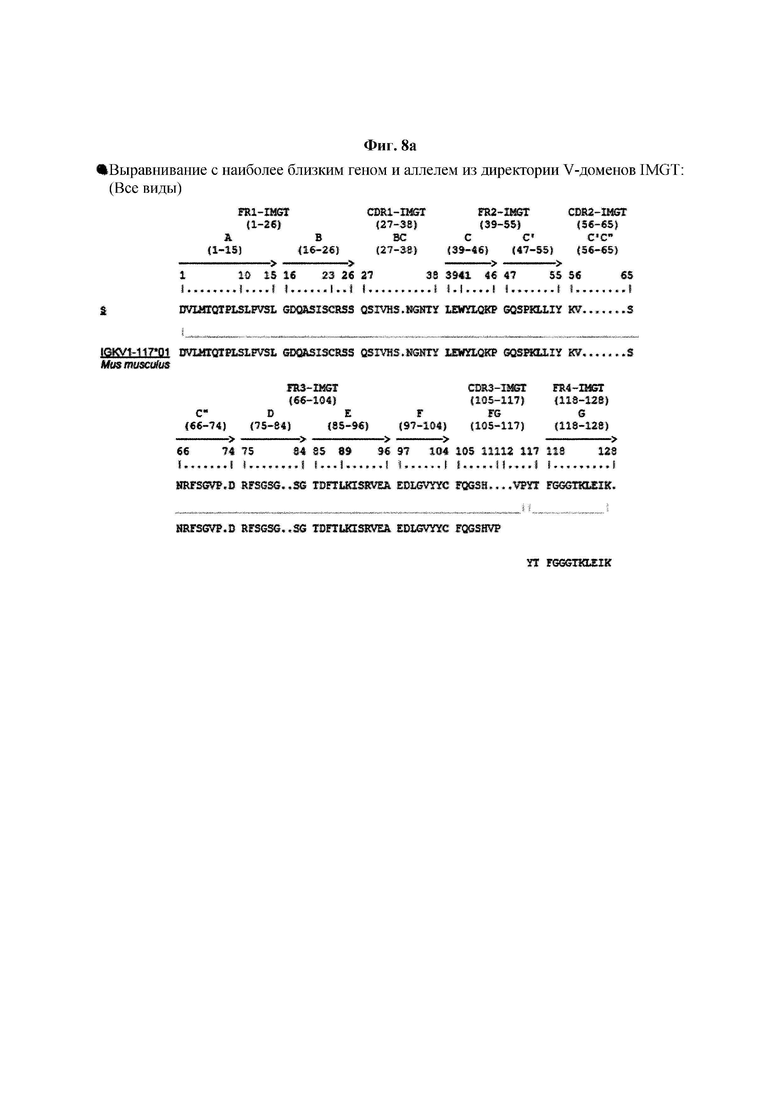
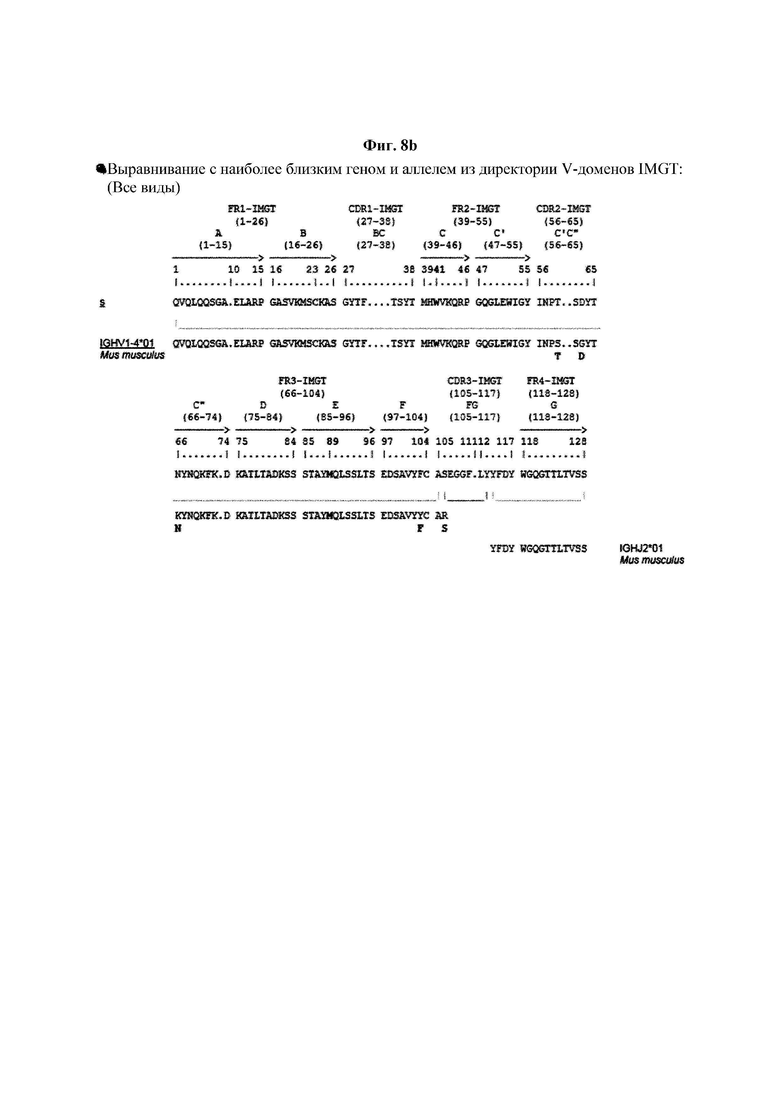
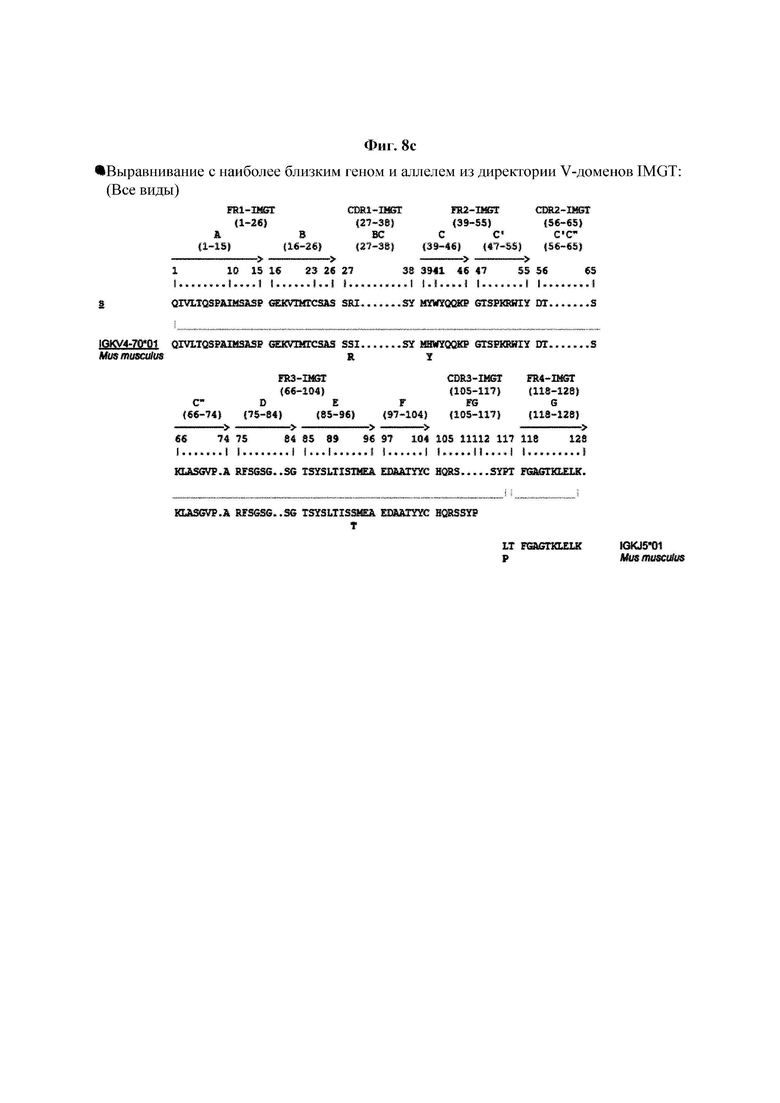
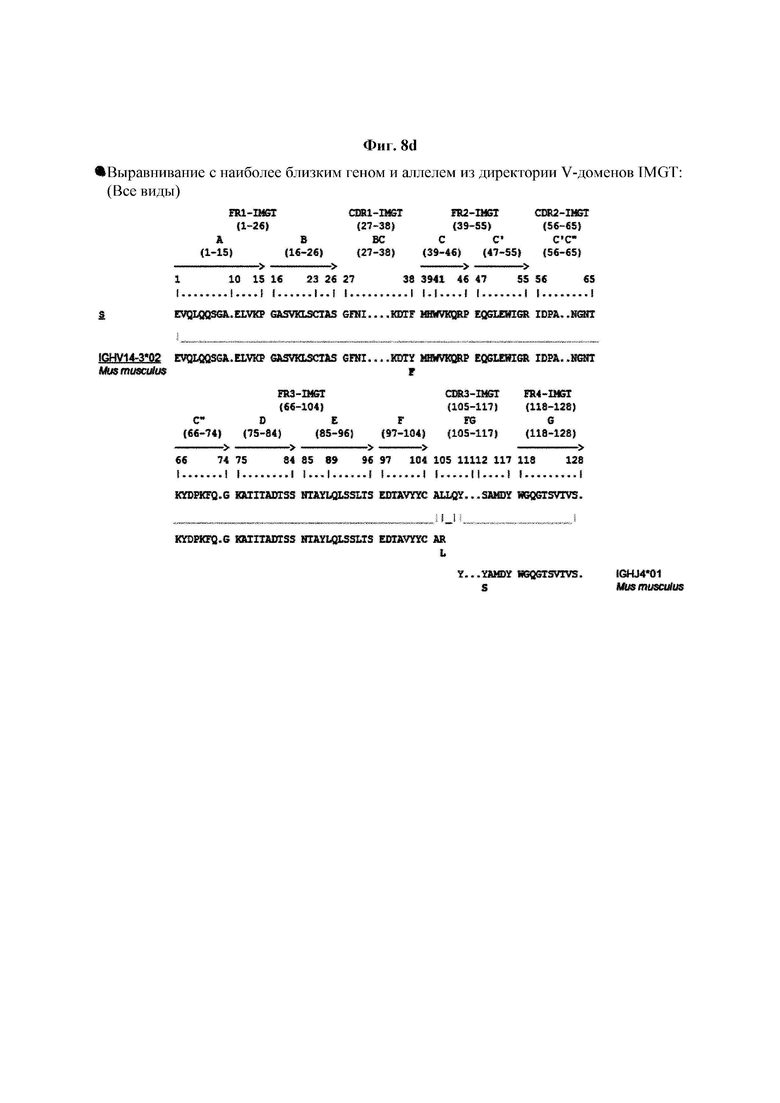
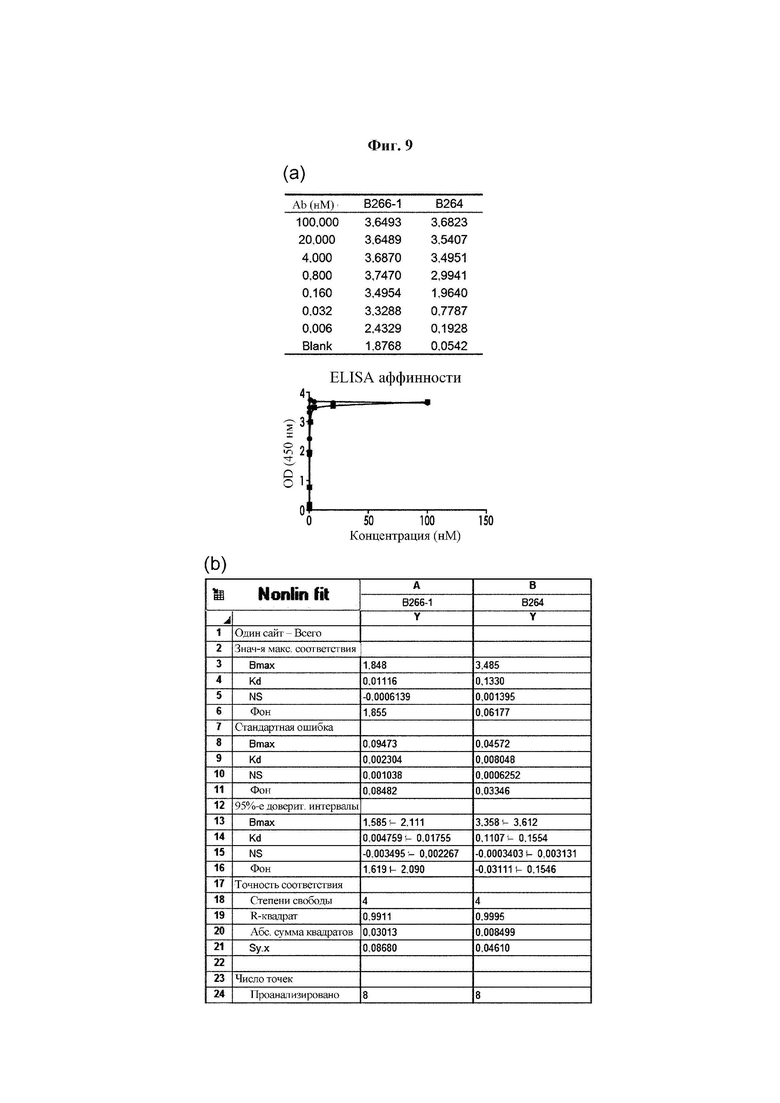
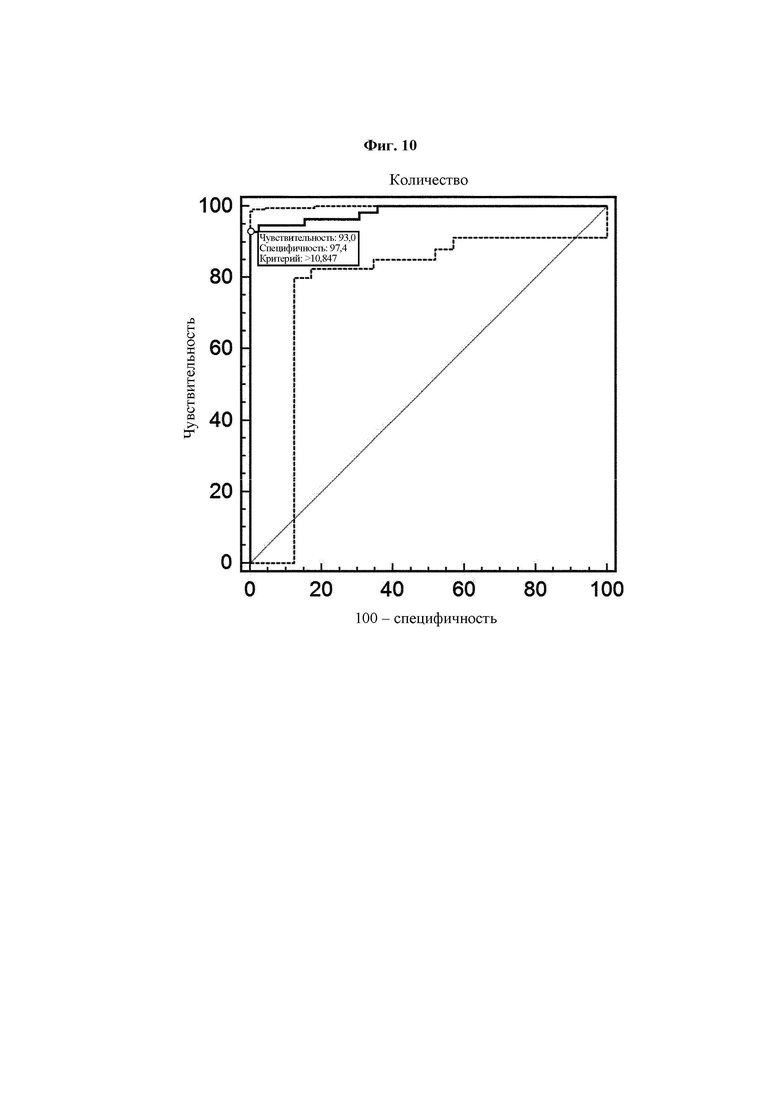

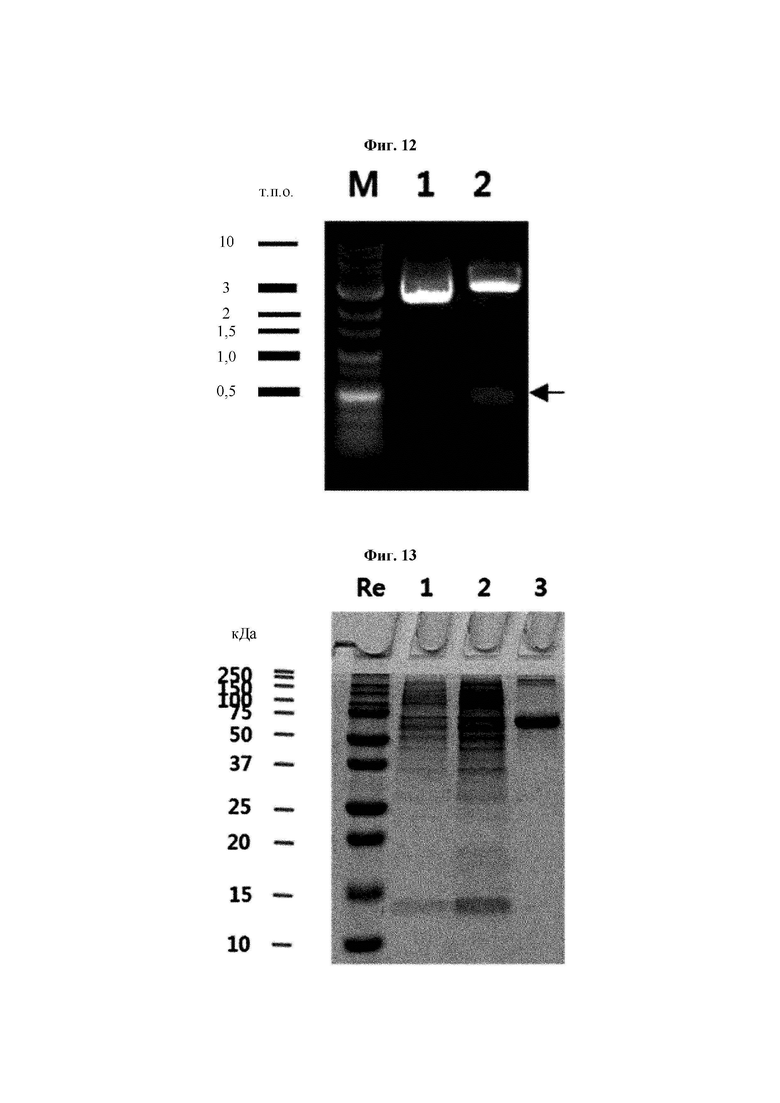
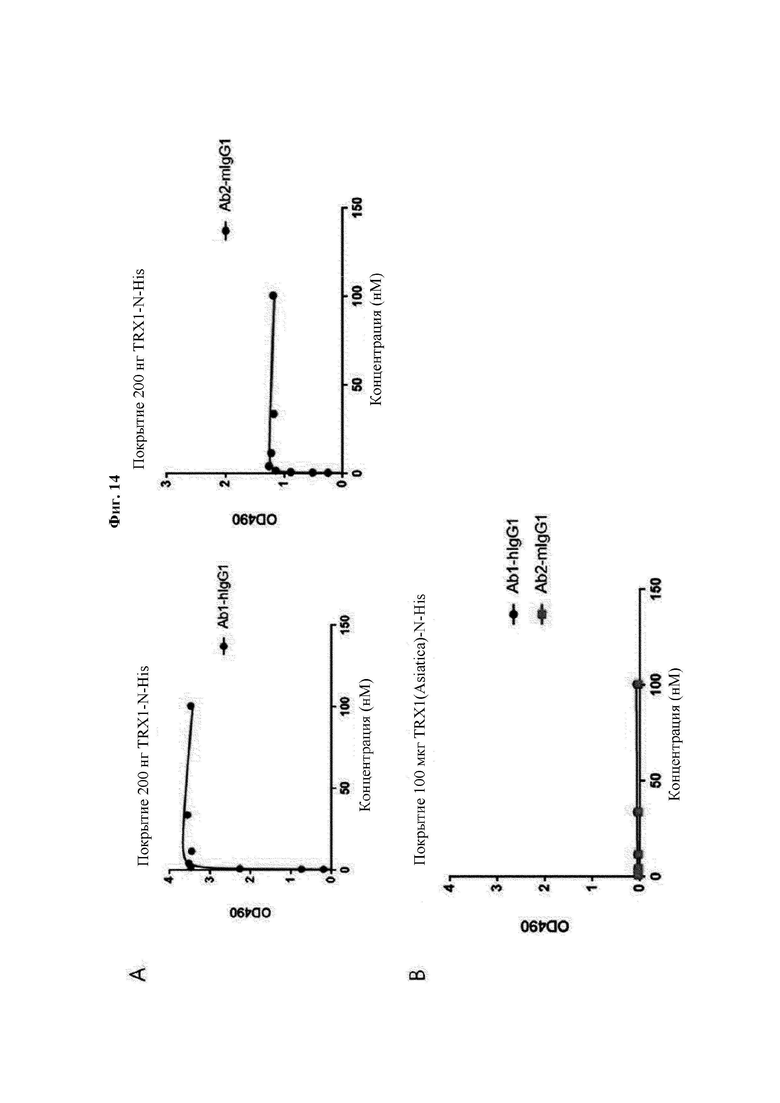
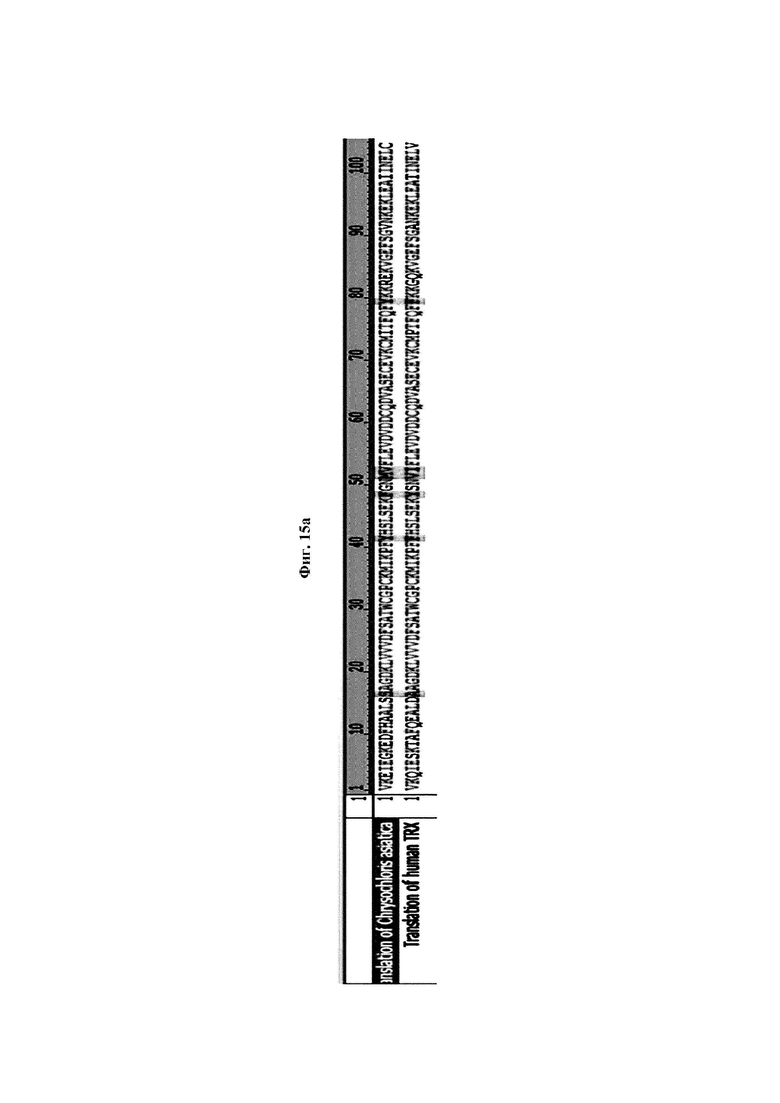
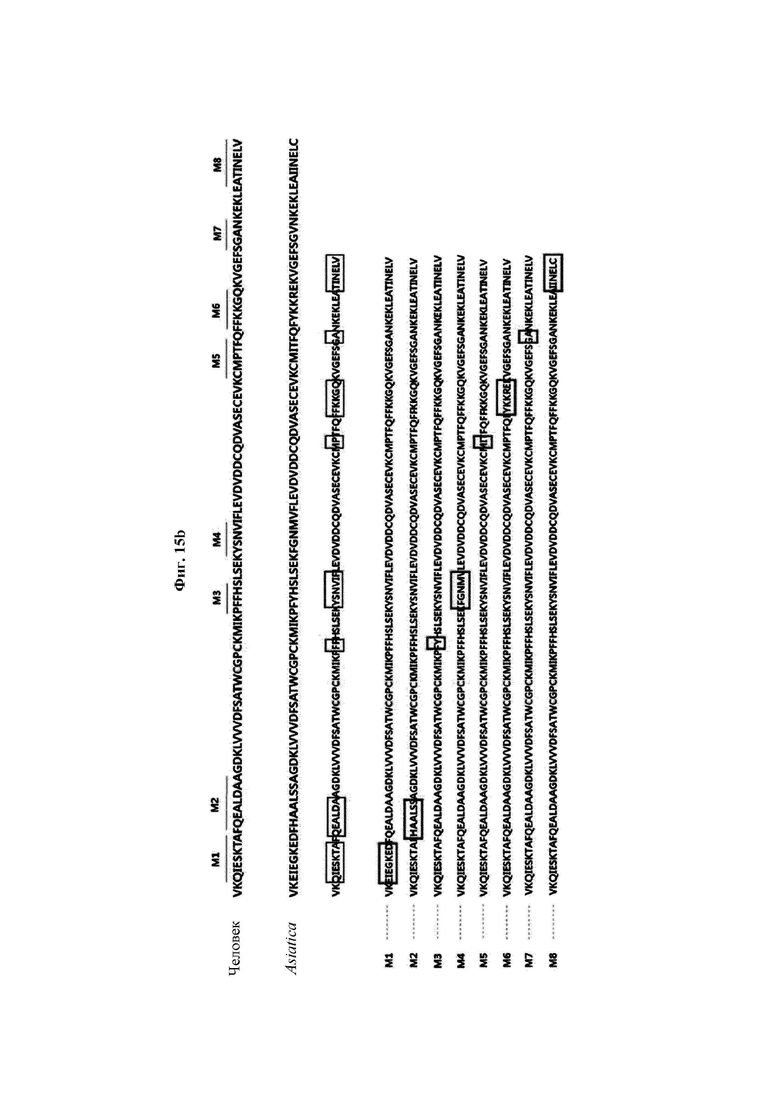
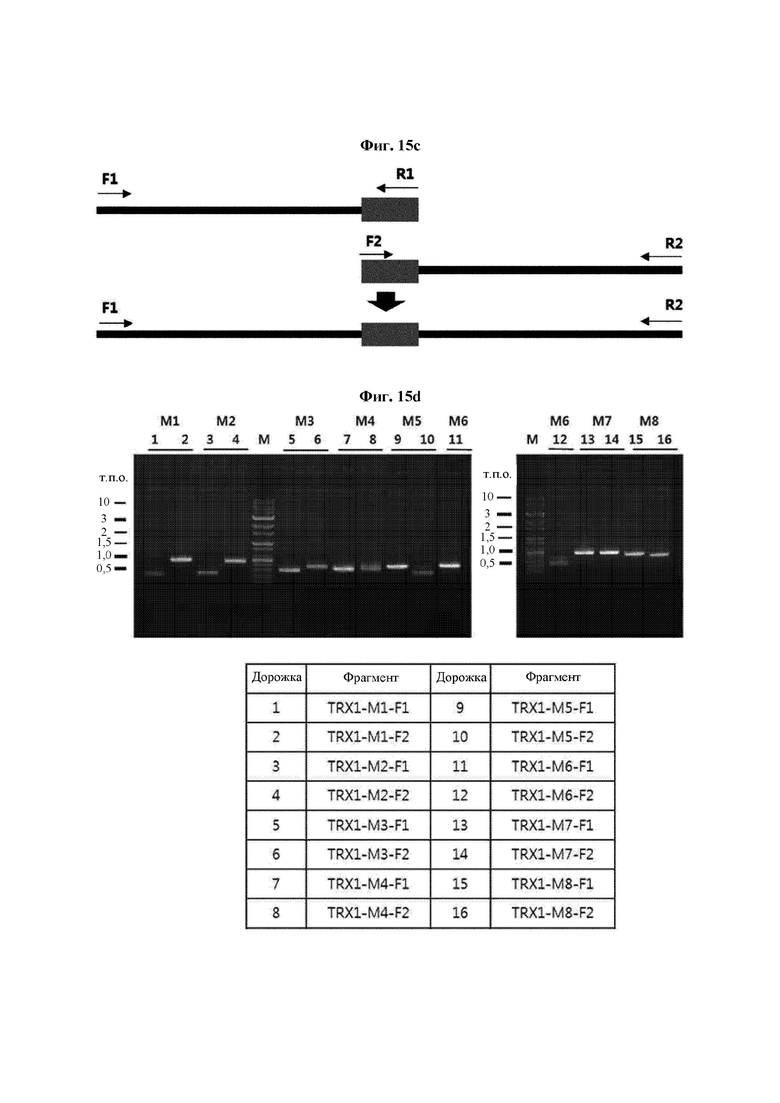
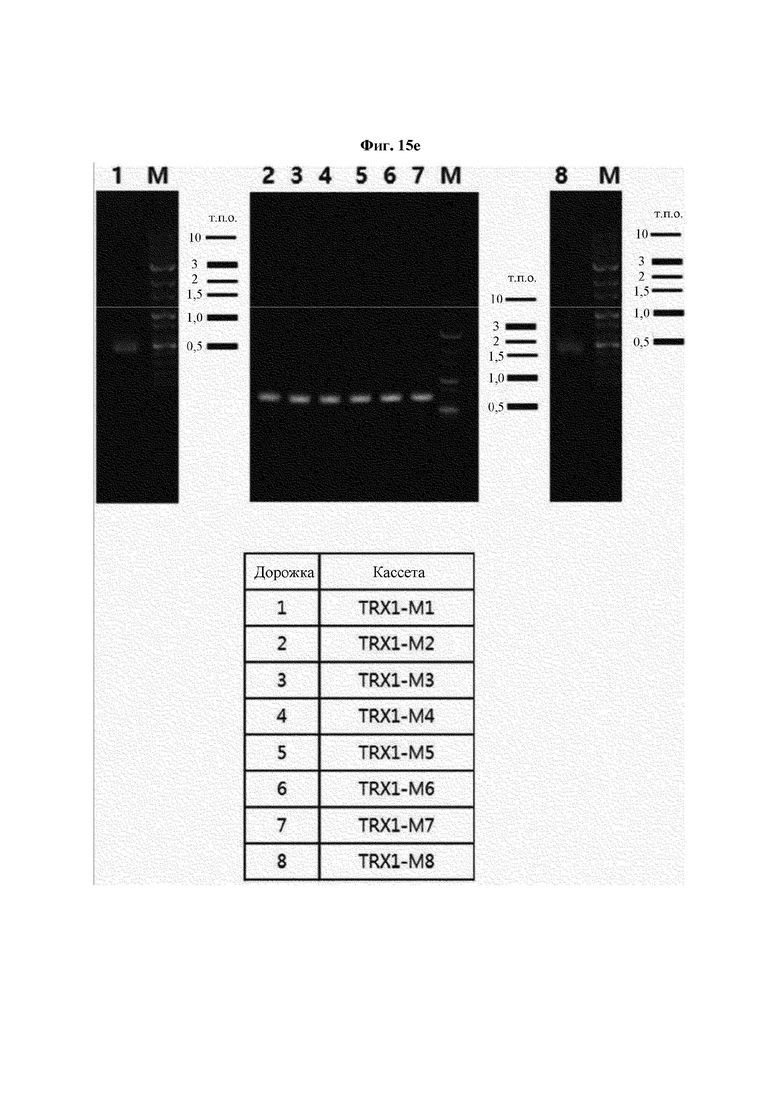

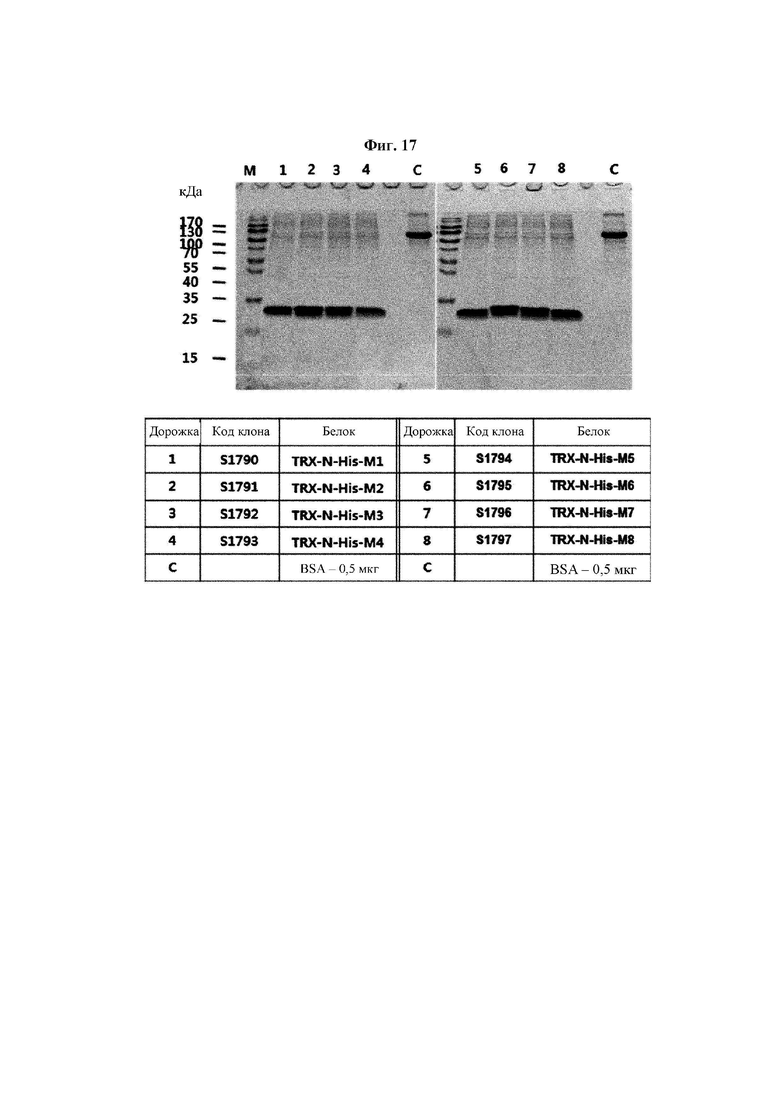
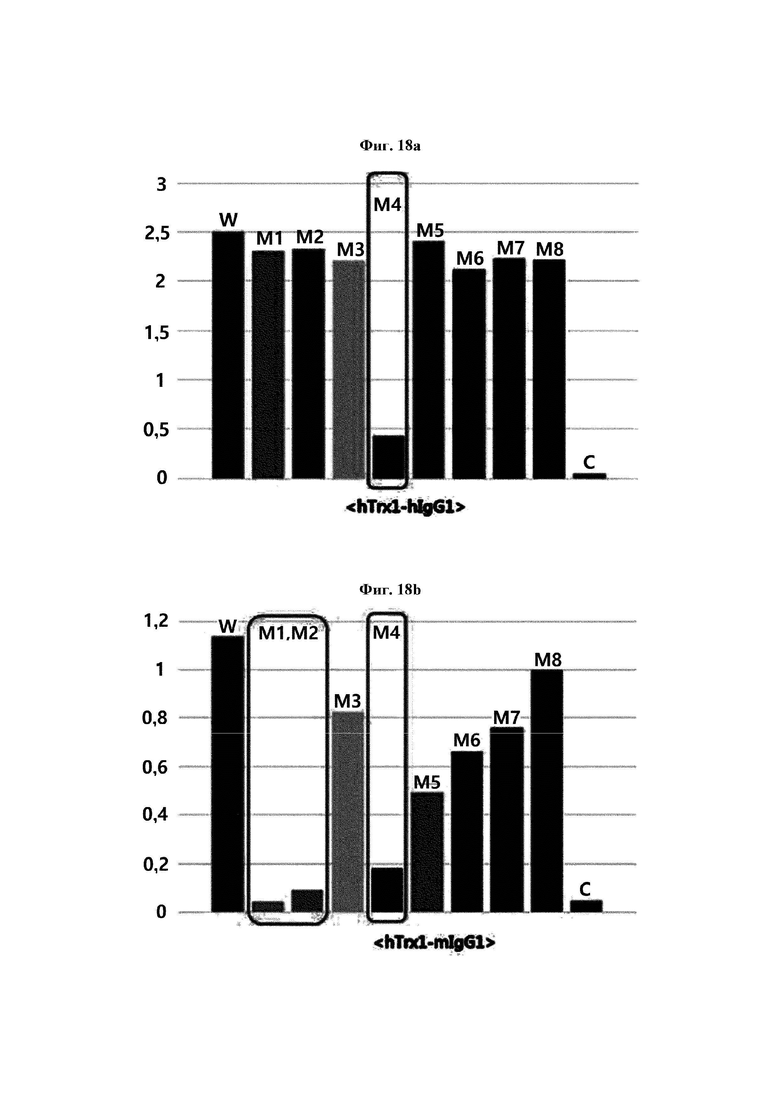
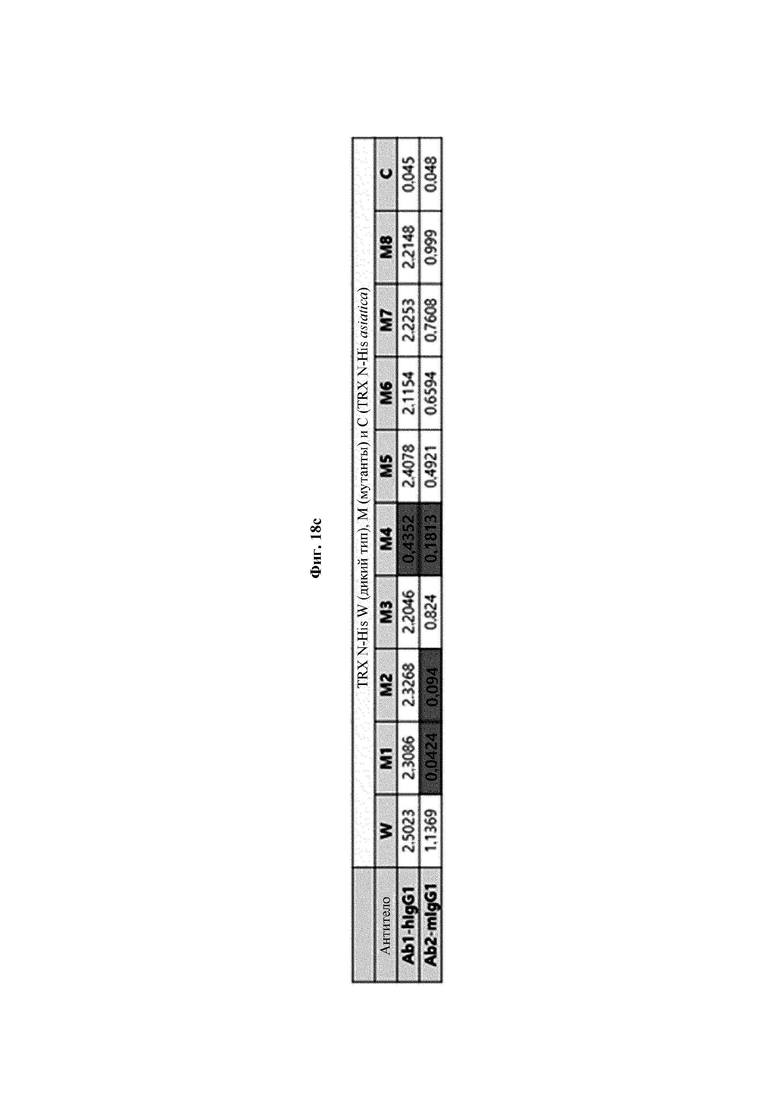
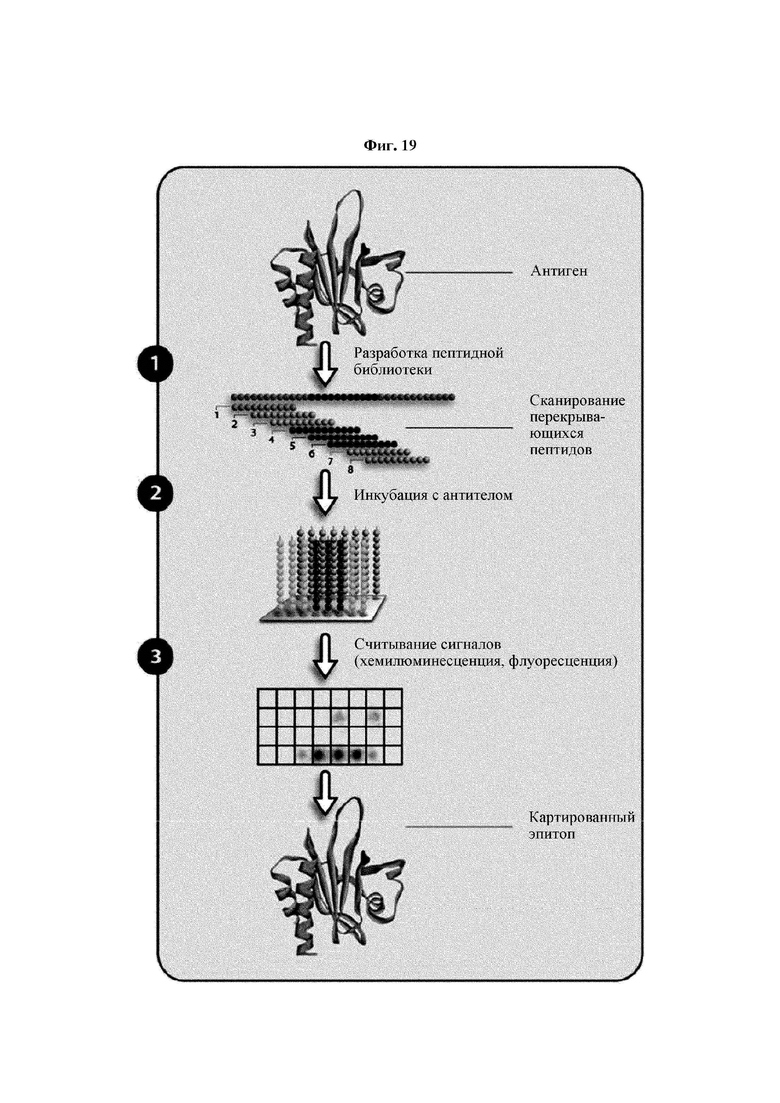


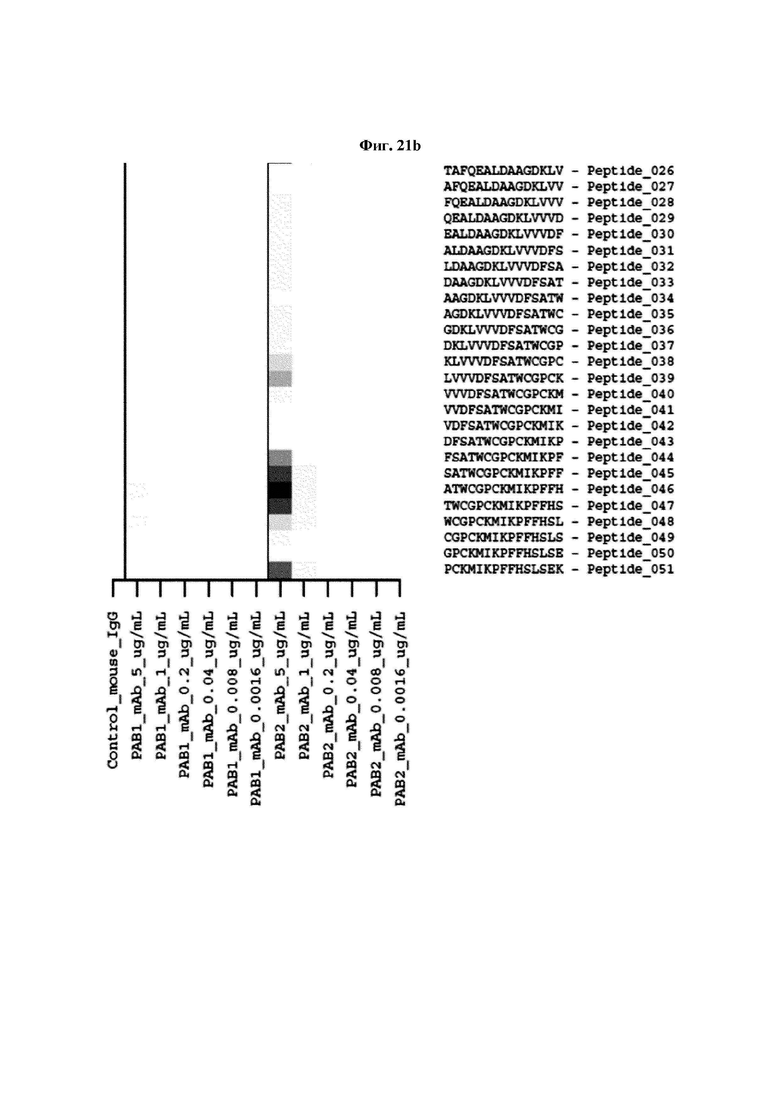


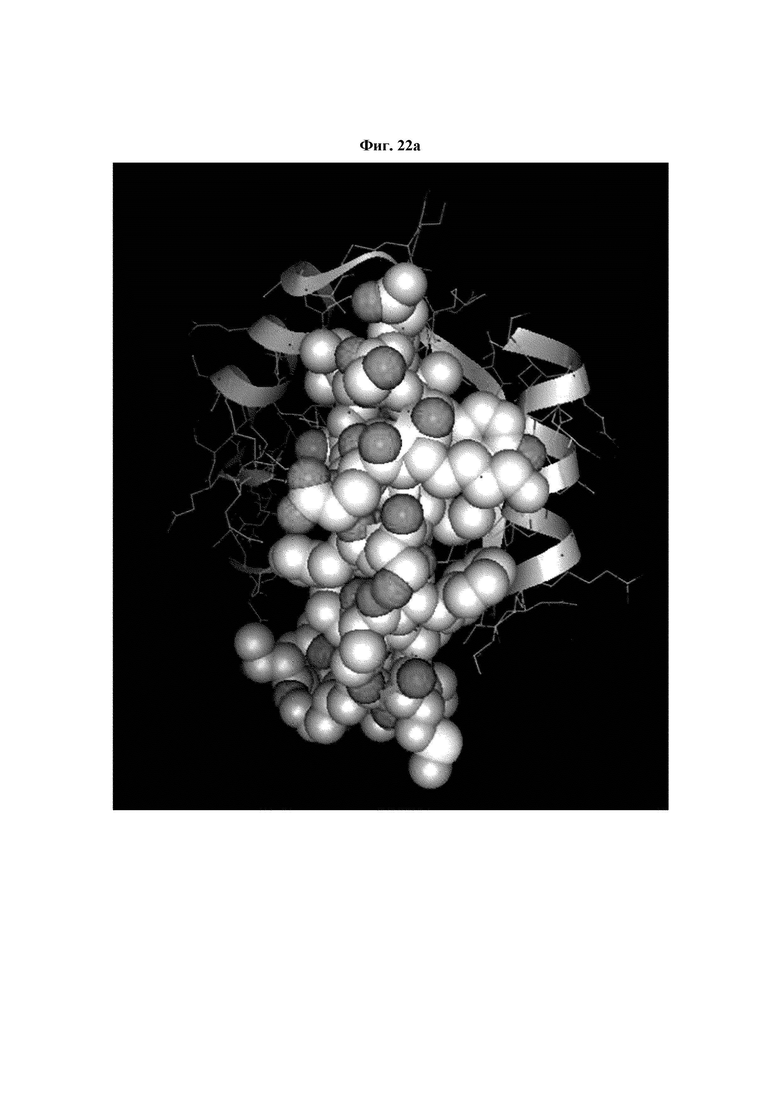
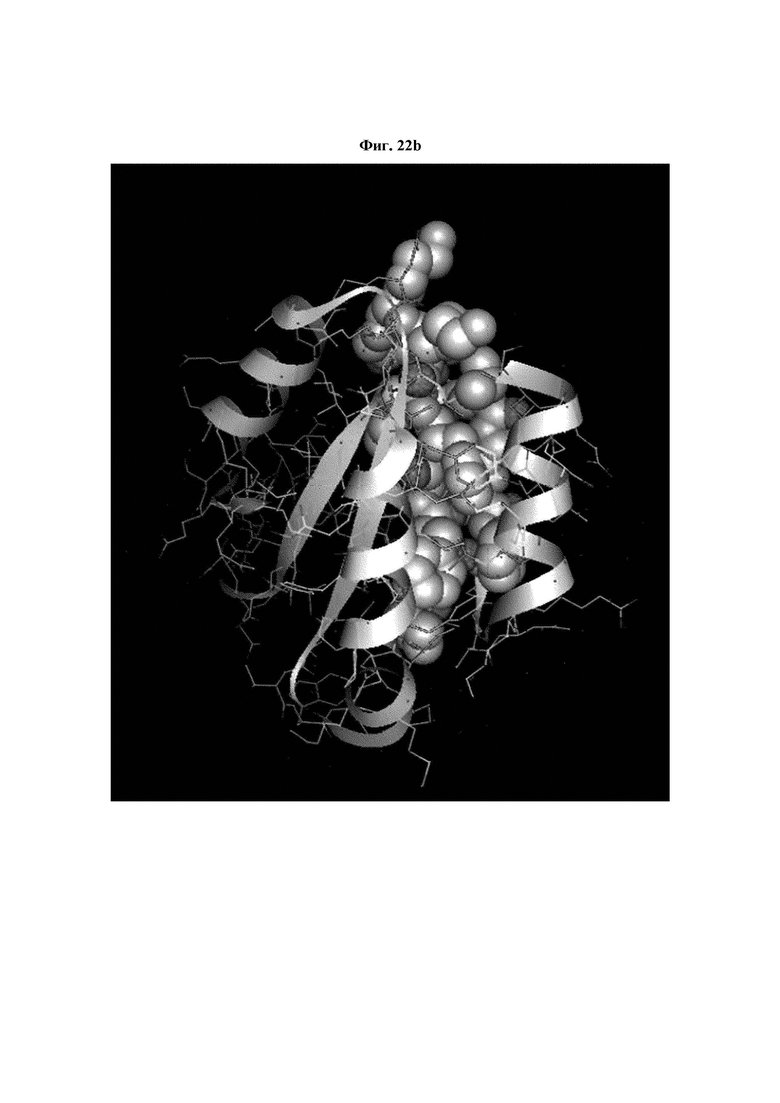
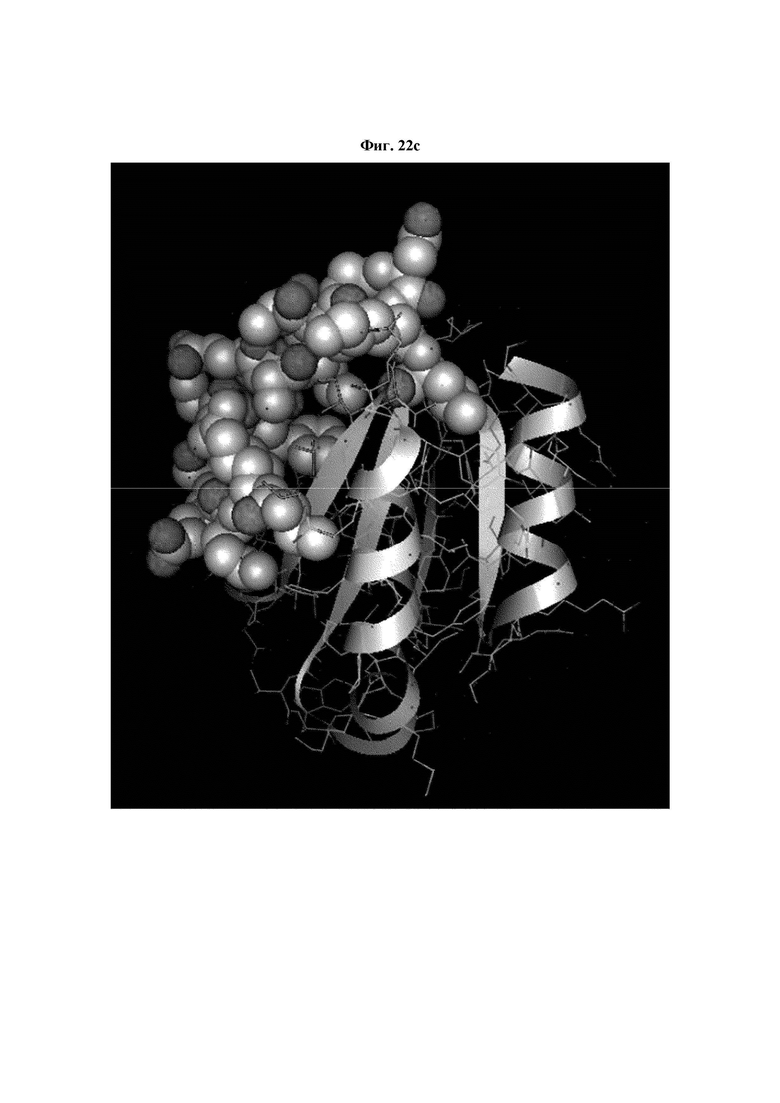
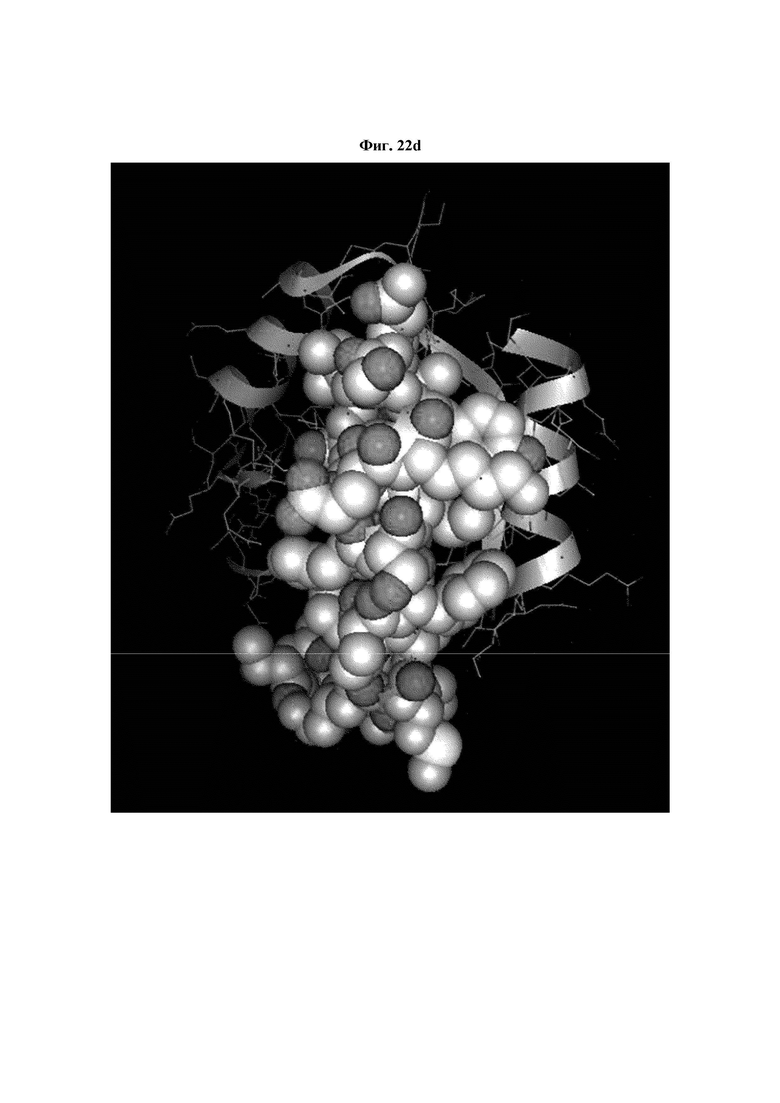
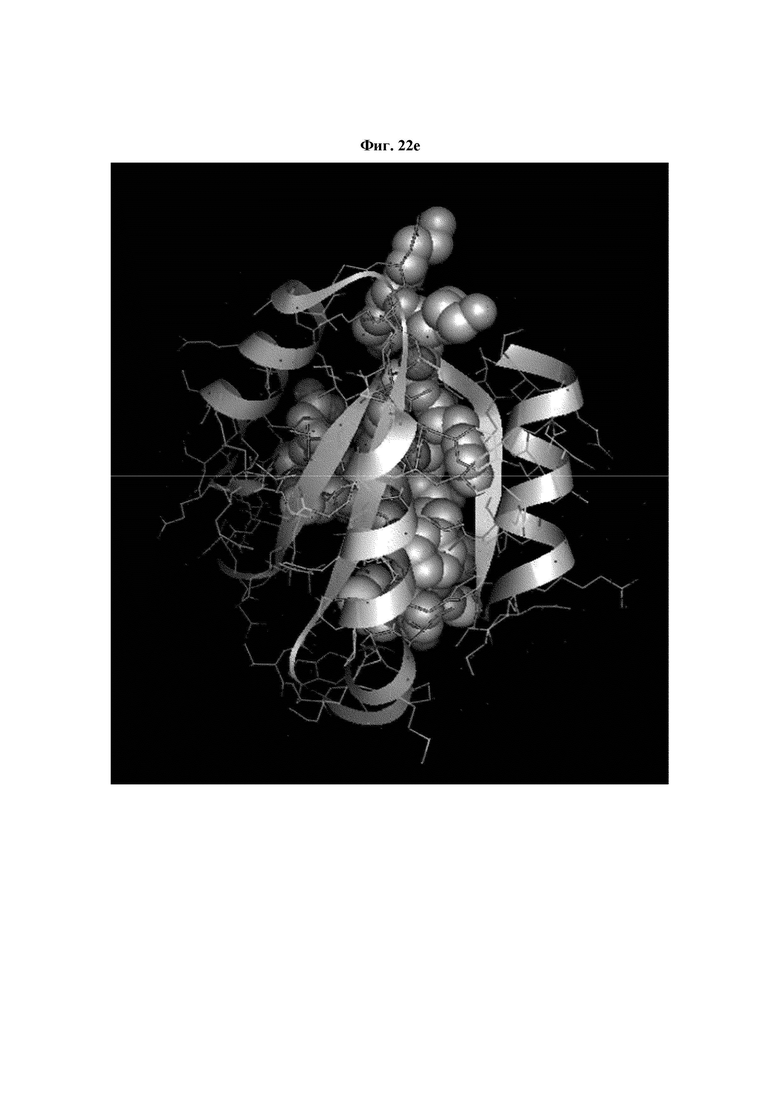
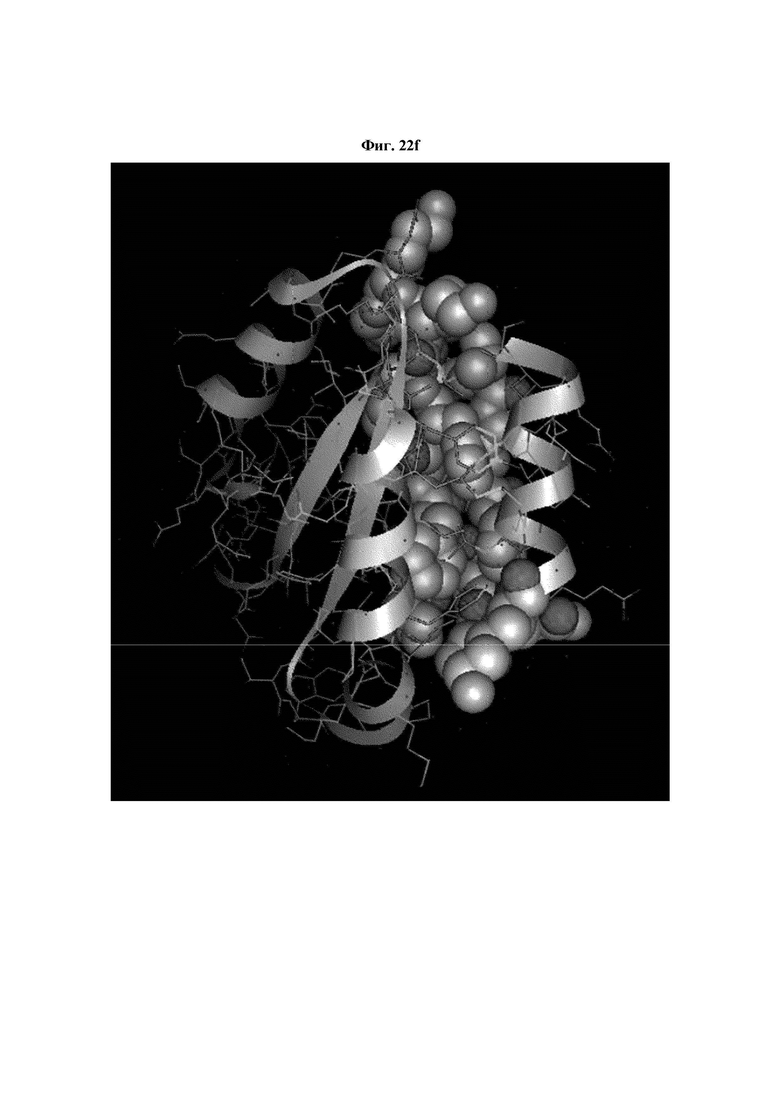
Группа изобретений относится к биотехнологии. Предложены эпитоп антигена тиоредоксина-1 (Trx1), молекула нуклеиновой кислоты, кодирующая эпитоп, рекомбинантный вектор экспрессии и клетка-хозяин для получения эпитопа. Эпитопная область антигена человеческого Trx1 состоит из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 32, 33, 34, 172, 175 и 176. Эпитоп может быть использован для разработки антитела с улучшенной аффинностью связывания Trx1, высоким уровнем чувствительности и специфичности, которое полезно для диагностики рака молочной железы. 4 н. и 3 з.п. ф-лы, 22 ил., 25 табл., 17 пр.
1. Эпитоп антигена человеческого тиоредоксина-1 (Trx1), специфично связывающийся с моноклональным антителом или его антигенсвязывающим фрагментом, состоящий из любой аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 32, 33, 34, 172, 175 и 176, где указанное моноклональное антитело содержит: вариабельную область легкой цепи, содержащую CDR1 (определяющий комплементарность участок 1) легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 1, CDR2 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 2, и CDR3 легкой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область тяжелой цепи, содержащую CDR1 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 4, CDR2 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 5, и CDR3 тяжелой цепи, состоящий из аминокислотной последовательности SEQ ID NO: 6.
2. Эпитоп по п. 1, где указанное антитело содержит вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 13, и вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 14.
3. Эпитоп по п. 1, где указанное антитело содержит легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 17, и тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO: 18.
4. Молекула нуклеиновой кислоты, кодирующая эпитоп по п. 1.
5. Молекула нуклеиновой кислоты по п. 4, состоящая из любой нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 35-37, 177, 180 и 181.
6. Рекомбинантный вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 5.
7. Клетка-хозяин для получения эпитопа по п. 1, содержащая рекомбинантный вектор по п. 6.
| SCHELLENS I | |||
| M., et al | |||
| Comprehensive Analysis of the Naturally Processed Peptide Repertoire: Differences between HLA-A and B in the Immunopeptidome | |||
| PLoS One | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 2002102654 A1, 01.08.2002 | |||
| WO 2010107158 A1, 23.09.2010 | |||
| JPH 06261783 A, 20.09.1994 | |||
| PARK, B | |||
| J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-09-26—Публикация
2018-10-12—Подача