Область техники, к которой относится изобретение
Настоящее изобретение касается слитого белка, содержащего вариант CCL3, с лучшей устойчивостью in vivo, стабильностью белка и фармакологической активностью, и его применения, более конкретно слитого белка, содержащего вариант CCL3 и Fc-область иммуноглобулина, и его применения в качестве терапевтического средства от лимфопении, рака или инфекции, причем у варианта CCL3 удалена N-концевая аминокислота CCL3α или CCL3β дикого типа, а аминокислоты в определенных положениях заменены другими аминокислотами в тех же положениях CCL3α или CCL3β дикого типа.
Уровень техники
Хемокины секретируются различными иммунными клетками в виде хемотаксических цитокинов и связываются с хемокиновыми рецепторами, которые экспрессируются в иммунных клетках и стимулируют подвижность иммунных клеток in vivo. Среди хемокинов лиганд-3 типа CC (CCL3) является тем хемокином, который секретируется из иммунных клеток, включая макрофаги, и задействован в подвижности таких иммунных клеток, экспрессирующих рецептор CCR1/CCR5 типа CC, как дендритные клетки, Т-клетки, моноциты и нейтрофилы (Cytokine & Growth Factor Reviews (2002) 13: 455-481).
CCL3, известный как воспалительный белок 1α макрофагов (MIP-1α), имеет только один подтип у мыши, но два подтипа у человека (Cytokine & Growth Factor Reviews (2002) 13: 455-481). Соответственно, CCL3 включает в себя α-тип (LD78α или CCL3α, в дальнейшем CCL3α), гомологичный таковому у мыши, и β-тип (LD78β или CCL3β, в дальнейшем CCL3β), образовавшийся при мутации генов в процессе эволюции.
В данной области известно, что CCL3 ингибирует деление и дифференцировку незрелых стволовых клеток крови в костном мозге мыши и может повышать концентрацию иммунных клеток в крови (Nat Rev Immunol. (2006) 6(2): 159-64). Вследствие этого CCL3 использовался в качестве мишени терапевтических средств для лечения лимфопении, которая проявляется у различных противораковых средств (Exp. Hematol. (1999) 27: 195-202; Cytokine & Growth Factor Reviews (2002) 13: 455- 481). Кроме того, поскольку CCL3 проявляет эффект повышения концентрации дендритных клеток в крови, то CCL3 может оказаться новым иммунным противораковым средством в сочетании с методом лечения, способным раскрывать опухолеспецифичные антигены в крови (Clin Cancer Res. (2008) 14(4): 1159-1166; European Journal of Cancer (1998) 34 (7): 1023-1029).
Между тем, поскольку CCL3 имеет очень короткий период полужизни и склонен легко выпадать в осадок, то CCL3 не подходит для применения в качестве биотерапевтического средства без модификаций. Поскольку период полувыведения CCL3 in vivo при внутривенном введении в организм человека составляет всего 1,7 часа или меньше, при разработке CCL3 в качестве противоракового средства или терапевтического средства от лимфопении его необходимо вводить ежедневно (European Journal of Cancer (1998) 34(7): 1023-1029). Кроме того, CCL3 выпадает в осадок с образованием полимерного вещества уже при концентрации всего лишь 0,1 мг/мл.
Следовательно, для разработки CCL3 в качестве лекарственного средства или иммунного противоопухолевого средства нужно получить вариант CCL3 (вариант CCL3) путем замены или удаления некоторых аминокислот из CCL3 дикого типа и/или получить слитый белок путем сочетания полимера или другого белка с CCL3. Известно, что при сочетании с полимером или другим белком может увеличиться период полужизни. Например, активный белок можно связать с альбумином человека или полиэтиленгликолем (ПЭГ). Однако при связывании с альбумином человека время пребывания повышается лишь незначительно, а при связывании с ПЭГ может снижаться сродство связывания с рецептором из-за стерических препятствий.
Учитывая это, недавно проводились исследования и разработки для увеличения периода полужизни in vivo посредством слитого белка, полученного с использованием иммуноглобулина (Ig). Ig человека (hIg) включает в себя различные классы, как-то IgG, IgM, IgA, IgD и IgE, и может еще подразделяться на различные подтипы, известные как IgG1 человека (hIgG1), IgG2 человека (hIgG2), IgG3 человека (hIgG3) и IgG4 человека (hIgG4).
Иммуноглобулин содержит четыре полипептидные цепи; две тяжелые цепи и две легкие цепи соединяются дисульфидными связями с образованием тетрамера. Каждая цепь содержит вариабельную область и константную область. Константная область тяжелой цепи еще подразделяется на три участка, а именно CH1, CH2 и CH3, или четыре участка, а именно CH1, CH2, CH3 и CH4, согласно изотипам, и включает шарнирный домен и домены CH2, CH3 и/или CH4.
Согласно техническому обоснованию авторы настоящего изобретения установили, что у слитого белка, содержащего вариант CCL3 и Fc-область иммуноглобулина, повышается период полужизни in vivo, улучшается стабильность и лекарственная эффективность, причем у варианта CCL3 удалена N-концевая аминокислота CCL3α или CCL3β дикого типа, а аминокислоты в определенных положениях заменены другими аминокислотами в тех же положениях CCL3α или CCL3β дикого типа.
Сущность изобретения
Настоящим изобретением предусмотрен слитый белок, содержащий вариант CCL3 и Fc-область иммуноглобулина, причем у варианта CCL3 заменены и удалены некоторые аминокислоты CCL3 дикого типа.
Настоящим изобретением предусмотрена нуклеиновая кислота, кодирующая этот слитый белок, вектор, содержащий эту нуклеиновую кислоту, и клетки, трансформированные с помощью этого вектора.
Настоящим изобретением предусмотрен способ получения этого слитого белка.
Настоящим изобретением предусмотрена фармацевтическая композиция, содержащая этот слитый белок.
Настоящим изобретением предусмотрен вариант CCL3β, причем у варианта CCL3β заменены и удалены некоторые аминокислоты CCL3 дикого типа.
Настоящим изобретением предусмотрен слитый белок, содержащий вариант CCL3, включающий следующие мутации, и Fc-область иммуноглобулина, причем мутации включают: (1) делецию одной или двух аминокислот из N-конца CCL3 дикого типа; и (2) замену аспарагиновой кислоты в положении аминокислоты 27 на N-конце CCL3 дикого типа аланином.
Настоящим изобретением предусмотрена нуклеиновая кислота, кодирующая этот слитый белок.
Настоящим изобретением предусмотрен вектор, содержащий эту нуклеиновую кислоту.
Настоящим изобретением предусмотрены клетки, трансформированные этим вектором.
Настоящим изобретением предусмотрен способ получения этого слитого белка.
Настоящим изобретением предусмотрена фармацевтическая композиция, содержащая этот слитый белок.
Настоящим изобретением предусмотрен вариант лиганда 3β типа CC (CCL3β), включающий следующие мутации: (1) делецию одной или двух аминокислот из N-конца CCL3β дикого типа; и (2) замену аспарагиновой кислоты в положении аминокислоты 27 с N-конца CCL3 дикого типа на аланин.
Слитый белок настоящего изобретения, содержащий вариант CCL3, обладает требуемым фармакокинетическим профилем, так как у варианта CCL3 сведено к минимуму снижение активности, низок риск иммуногенности, а период полужизни in vivo повышен без проблем со стабильностью, при этом улучшается сохранность in vivo, физические свойства и фармакологическая эффективность белка. Фармацевтическая композиция, включающая слитый белок, содержащий вариант CCL3, может применяться в качестве терапевтического средства от лимфопении, рака или инфекции.
Краткое описание фигур
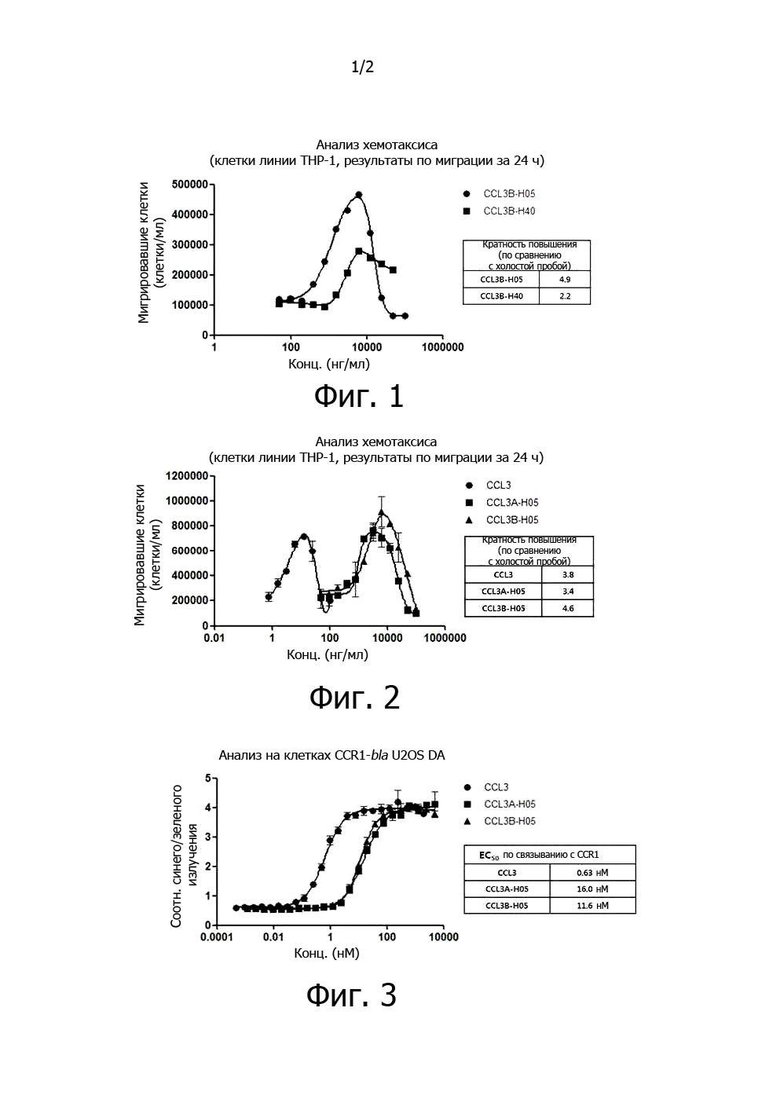
Фиг. 1. График по результатам измерения хемотаксиса in vitro у слитых с вариантом CCL3 белков CCL3B-H05 и CCL3B-H40 на клетках линии THP-1.
Фиг. 2. График по результатам измерения хемотаксиса in vitro у слитых с CCL3 и вариантом CCL3 белков CCL3A-H05 и CCL3B-H05 на клетках линии THP-1.
Фиг. 3. Результаты измерения активности in vitro у слитых с CCL3 и вариантом CCL3 белков CCL3A-H05 и CCL3B-H05 на клетках линии, в которой экспрессируется CCR1, для оценки реактивности слитых белков с рецепторами CCR1.
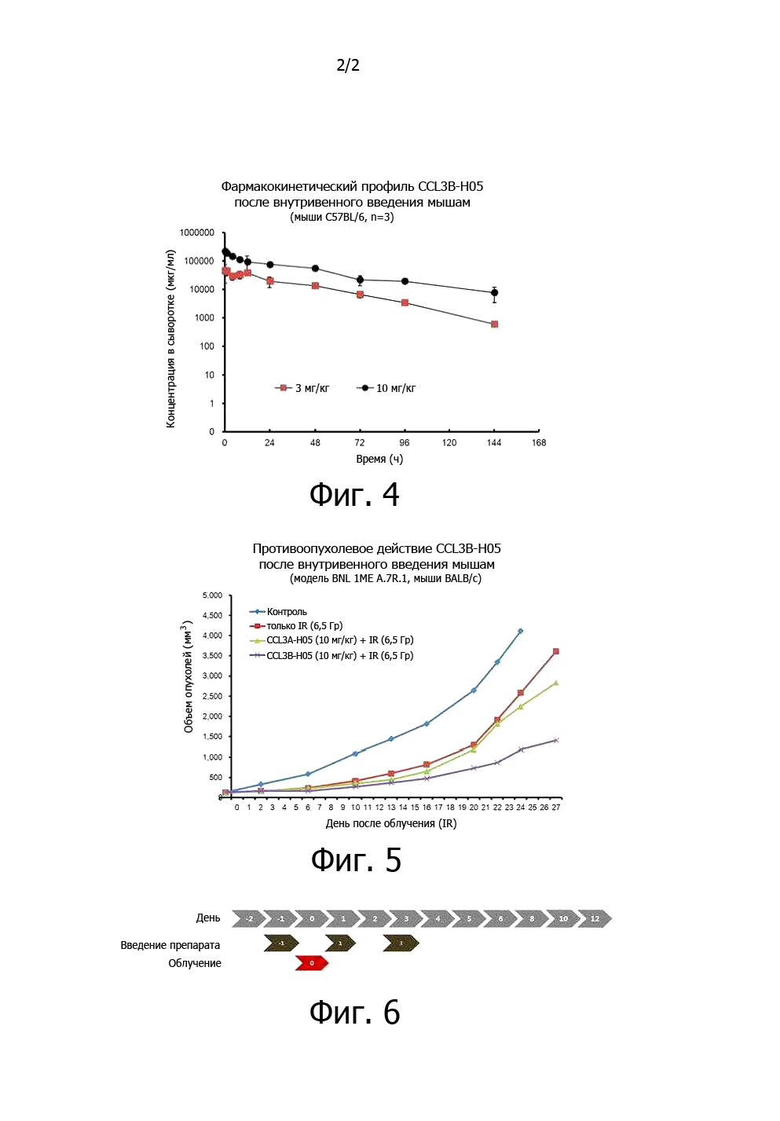
Фиг. 4. Результаты вычисления фармакокинетических параметров по измерениям концентрации CCL3B-H05 в образцах крови вплоть до 144 часов после внутривенного введения слитого с вариантом CCL3 белка CCL3B-H05 мышам в дозах 3 мг/кг и 10 мг/кг, соответственно.
Фиг. 5. Эффект ингибирования роста опухолей у слитого с вариантом CCL3 белка CCL3B-H05 при раке печени у мышей.
Фиг. 6. Схема приема препарата в экспериментальном примере 4.
Раскрытие сущности изобретения
Если не указано иначе, все технические и научные термины, используемые в этом описании, имеют такие значения, которые обычно понимаются специалистами в данной области. В общем, номенклатура, используемая в этом описании, хорошо известна и обычно используется в данной области.
Среди различных технологий длительного действия для повышения периода полужизни распространенных белков наиболее широко применяется технология слияния с Fc, поскольку она может повышать период полужизни in vivo с меньшими опасениями о таких побочных эффектах, как токсичность или индукция иммунного ответа. Разработка слитого с Fc CCL3 и/или его варианта в качестве лекарственного средства для непрерывного лечения должна удовлетворять некоторым условиям следующим образом.
Во-первых, снижение активности in vitro при слиянии должно быть небольшим. В общем, известно, что при слиянии с Fc, имеющим сравнительно большие размеры, таких небольших белков, как хемокины, активность сильно зависит от места слияния и линкера. Соответственно, активность CCL3 и/или его варианта и слитого с Fc белка может варьироваться в зависимости от наличия слияния или места слияния.
Во-вторых, учитывая, что большинство биофармацевтических препаратов могут вызывать иммуногенность у пациентов, риск иммуногенности, вызванной линкерами для слияния или мутациями, должен быть низким.
В-третьих, не должно быть проблем со стабильностью, вызванных местом слияния или введением мутации.
В-четвертых, поскольку нежелательный иммунный ответ может зависеть от изотипа пришиваемого иммуноглобулина, требуется альтернатива изотипу пришиваемого иммуноглобулина.
Хотя авторы настоящего изобретения и предпринимали попытки улучшить физиологическую активность и физические свойства CCL3 с учетом вышеупомянутых условий, оказалось, что искусственное удаление N-концевой аминокислоты, введение мутаций в определенные положения CCL3 и слияние с Fc-областью иммуноглобулина может вызвать повышение активности CCL3 с увеличением степени экспонирования и периода полужизни in vivo и улучшением фармакологической эффективности.
Исходя из этого, один из аспектов настоящего изобретения касается слитого белка, содержащего вариант лиганда-3 типа CC (CCL3), включающий следующие мутации, и Fc-область иммуноглобулина, причем мутации означают (1) делецию одной или двух аминокислот из N-конца CCL3 дикого типа; и (2) замену аспарагиновой кислоты на аланин в положении аминокислоты 27 с N-конца CCL3 дикого типа.
Хемокин CCL3, как известно, играет важную роль в гомеостазе подвижности дендритных клеток и таких иммунных клеток, как Т-клетки, моноциты и нейтрофилы, и может быть получен из таких млекопитающих, как люди, мыши, свиньи и обезьяны. К примеру, у людей существует два подтипа. Два подтипа - это α-тип (в дальнейшем именуется CCL3α), имеющий гомологию с молекулой мыши, и β-тип (в дальнейшем именуется CCL3β), образовавшийся при мутации генов в процессе эволюции. В частности, CCL3 дикого типа может представлять собой, к примеру, белок CCL3α дикого типа человека, имеющий последовательность по SEQ ID NO: 1, или белок CCL3β дикого типа человека, имеющий последовательность по SEQ ID NO: 3.
В одном примере вариант CCL3 может включать вариант CCL3α, причем вариант CCL3α получают путем удаления аланина, то есть первой аминокислоты с N-конца, и замены аспарагиновой кислоты, то есть аминокислоты 27 с N-конца, на аланин в CCL3α дикого типа человека, имеющем последовательность SEQ ID NO: 1. Вариант CCL3α может включать, к примеру, последовательность SEQ ID NO: 2.
В другом примере вариант CCL3 может включать вариант CCL3β, причем вариант CCL3β получают путем удаления аланина и пролина (AP), то есть первых двух аминокислот с N-конца, и замены аспарагиновой кислоты, то есть аминокислоты 27 с N-конца, на аланин в CCL3β дикого типа человека, имеющем последовательность SEQ ID NO: 3. Вариант CCL3β может включать, к примеру, последовательность SEQ ID NO: 4.
Термин "Fc-область" здесь означает белок без вариабельных областей в тяжелых и легких цепях и константной области 1 в легкой цепи (CL1) иммуноглобулина, причем Fc-область может представлять собой гибридный Fc, содержащий по меньшей мере одну Fc-область, выбранную из группы, состоящей из IgG1, IgG2, IgG3, IgG4 и IgD и их фрагментов либо их комбинаций.
В одном примере, к примеру, гибридный Fc может включать Fc-область IgG4 и Fc-область IgD. Кроме того, гибридная Fc-область может включать в себя часть шарнирного участка и CH2 из Fc IgD и участки CH2 и CH3 из Fc IgG4, например, последовательность по SEQ ID NO: 14. Гибридный Fc может быть равен, к примеру, гибридной форме Fc, раскрытой в Korean Patent Registration No. 0897938, которая включена в настоящее описание в виде ссылки.
В другом примере Fc-область может представлять собой гибридный Fc, содержащий по меньшей мере одну Fc-область, выбранную из группы, состоящей из IgG1, IgG2, IgG3 и IgG4 и их фрагментов либо их комбинаций.
Fc-область может включать всю Fc-область, входящую в состав иммуноглобулина, или же фрагмент либо вариант Fc-области. Fc-область также может включать вариант Fc-области, полученный путем замены некоторых аминокислот или сочетания различных типов Fc-области. Вариант Fc-области может быть модифицирован для предотвращения расщепления в шарнирном участке. Кроме того, может быть заменена часть аминокислотной последовательности шарнирного участка Fc с тем, чтобы уменьшить антитело-зависимую клеточную цитотоксичность (ADCC) или комплемент-зависимую цитотоксичность (CDC). Кроме того, в шарнирном участке Fc может быть заменена часть аминокислотной последовательности с тем, чтобы ингибировать перегруппировку Fab-области. Кроме того, может быть удален лизин (K) на С-конце Fc-области.
Кроме того, Fc-фрагмент по настоящему изобретению может иметь углеводную цепь дикого типа, большую углеводную цепь по сравнению с диким типом, меньшую углеводная цепь по сравнению с диким типом или форму, у которой удалена углеводная цепь. Увеличение, уменьшение или удаление углеводной цепи может осуществляться общими методами, известными в данной области, как-то химическим методом, энзиматическим методом или методом генной инженерии с использованием микроорганизмов.
Fc-область иммуноглобулина может быть формой, в которой вариант CCL3 непосредственно связан с N-концом или C-концом Fc-области или же связан с N-концом или C-концом Fc-области через линкер. Когда Fc-область иммуноглобулина непосредственно связана с вариантом CCL3, к примеру, как в настоящем изобретении, то вариант CCL3α по SEQ ID NO: 2 или вариант CCL3β по SEQ ID NO: 4 может быть связан с N-концом или С-концом Fc-области по SEQ ID NO: 14. Связанная форма CCL3 и Fc может быть представлена формой, в которой CCL3 связан с N-концом Fc-области.
Когда Fc-область иммуноглобулина связывается через линкер, то линкер может связываться с N-концом, С-концом или свободным радикалом Fc-фрагмента и с N-концом, С-концом или свободным радикалом варианта CCL3. Когда линкером является пептидный линкер, то связывание может происходить в любой части. Например, линкер может быть связан с С-концом Fc-области иммуноглобулина и N-концом варианта CCL3.
После того, как линкер и Fc по отдельности экспрессируются, а затем связываются друг с другом, линкером может быть сшивающий реагент, известный в данной области. Сшивающим реагентом может быть, к примеру, N-гидроксисукцинимидный эфир типа 1,1-бис(диазоацетил)-2-фенилэтана, глутаровый альдегид и 4-азидосалициловая кислота, имидоэфиры, включая дисукцинимидиловые эфиры типа 3,3'-дитиобис(сукцинимидилпропионата), и бифункциональные малеимиды типа бис-N-малеимидо-1,8-октана, но не ограничиваются этим.
Кроме того, линкером может быть пептид. В частности, линкером может быть пептид, состоящий из 10-30 аминокислотных остатков. В одном примере Fc-область иммуноглобулина может быть связана с вариантом CCL3 через линкер, приведенный ниже в формуле 1:
(RNT)nGRGG(EEKKK)m.
В формуле 1 n и m равны от 1 до 5, соответственно. В формуле 1 n означает количество повторов аминокислот аргинин-аспарагин-треонин, m означает количество повторов аминокислот глутамат-глутамат-лизин-лизин-лизин, и предпочтительно n и m могут составлять от 1 до 3, соответственно.
В одном примере, учитывая, что n и m могут составлять от 1 до 3, соответственно, линкер может включать любую последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-13.
Один конкретный пример настоящего изобретения включает структуру, в которой Fc-область иммуноглобулина связана с вариантом CCL3 через линкер, содержащий последовательность RNTGRGGEEKKK (SEQ ID NO: 5). Один экспериментальный пример настоящего изобретения показал, что слитый белок варианта CCL3, связанного с Fc иммуноглобулина через линкер, содержащий последовательность SEQ ID NO: 5, обладает превосходной активностью хемотаксиса.
Слитый белок может быть представлен формой, в которой с Fc-областью иммуноглобулина связан димер или мультимер варианта CCL3, причем димер или мультимер варианта CCL3 образуется, когда один или несколько вариантов CCL3 связываются друг с другом. Кроме того, слитый белок может быть представлен димерной или мультимерной формой, причем с димерной или мультимерной формой могут быть связаны две или несколько Fc-областей, причем Fc-области иммуноглобулина содержат соединенный с ними вариант CCL3.
Другой аспект настоящего изобретения касается нуклеиновой кислоты, кодирующей слитый белок, содержащий вариант CCL3.
Нуклеиновая кислота, кодирующая слитый белок, содержащий вариант CCL3, может быть выделена для рекомбинантного вырабатывания слитого белка, содержащего вариант CCL3. Нуклеиновую кислоту выделяют и вставляют в реплицируемый вектор для проведения дополнительного клонирования или экспрессии. Исходя из этого, другой аспект настоящего изобретения касается вектора, содержащего нуклеиновую кислоту.
Термин "нуклеиновая кислота" в настоящем изобретении имеет всеобъемлющее значение, включающее молекулы ДНК (гДНК и кДНК) и РНК, а нуклеотиды в качестве основного строительного блока нуклеиновой кислоты включают не только природные нуклеотиды, но и их аналоги, содержащие модифицированные цепи сахаров или оснований. Последовательность нуклеиновой кислоты, кодирующая слитый белок, содержащий вариант CCL3 настоящего изобретения, может быть модифицирована. Модификации включают добавления, делеции либо неконсервативные замены или консервативные замены нуклеотидов.
В настоящем изобретении термин "нуклеиновая кислота" включает нуклеотидные последовательности, существенно идентичные по отношению к данной последовательности. Существенная идентичность означает то, что аминокислотная последовательность по меньшей мере на 80%, более предпочтительно по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% гомологична при анализе, который проводится путем совмещения последовательности нуклеиновой кислоты настоящего изобретения так, чтобы она как можно больше соответствовала какой-либо другой последовательности, а затем анализа совмещенной последовательности при помощи алгоритмов, обычно используемых в данной области.
ДНК, кодирующая слитый белок, содержащий вариант CCL3, легко выделяется или синтезируется способом, обычно используемым в данной области.
Термин "вектор" в настоящем изобретении относится к средствам для экспрессии целевого гена в клетках хозяина и охватывает плазмидные векторы; космидные векторы; вирусные векторы типа бактериофаговых векторов, аденовирусных векторов, ретровирусных векторов и аденоассоциированных вирусных векторов; и т.п. Приемлемые компоненты векторов обычно включают одну или несколько сигнальных последовательностей, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции, но не ограничиваются этим.
В векторе нуклеиновая кислота, кодирующая слитый белок, содержащий вариант CCL3, функционально связана с промотором.
Термин "функционально связанный" в настоящем изобретении обозначает функциональную связь между регуляторной последовательностью экспрессии нуклеиновой кислоты (к примеру, промотором, сигнальной последовательностью или матрицей по месту связывания регулятора транскрипции) и другой последовательностью нуклеиновой кислоты, которую регуляторная последовательность регулирует посредством функциональной связи с транскрипцией и/или трансляцией этой другой нуклеиновой кислоты.
При использовании прокариотических клеток в качестве хозяина, как правило, включается и сильный промотор (к примеру, промотор tac, промотор lac, промотор lacUV5, промотор lpp, промотор pL2, промотор rac5, промотор amp, промотор recA, промотор SP6, промотор trp, промотор T7 и др.), сайт связывания рибосомы для запуска трансляции и последовательность терминации транскрипции/трансляции. Кроме того, к примеру, при использовании эукариотических клеток в качестве хозяина можно использовать промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина, промотор β-актина, гепатобластный промотор человека и промотор мышечного креатина человека), или промоторы, полученные из вирусов млекопитающих (к примеру, аденовирусный промотор поздней фазы, промотор 7.5K вируса коровьей оспы, промотор SV40, промотор цитомегаловируса (CMV), tk-промотор HSV, промотор вируса рака молочной железы мыши (MMTV), LTR-промотор ВИЧ, промотор вируса Moloney, промотор вируса Эпштейна-Барра (EBV) и промотор вируса розацекомы (RSV)), а последовательность полиаденилирования обычно включают в качестве последовательности терминации транскрипции.
В некоторых случаях вектор может быть слит с другой последовательностью с тем, чтобы облегчить очистку экспрессируемого из него слитого белка, содержащего вариант CCL3. Последовательность для слияния включает, к примеру, глутатион-S-трансферазу (Pharmacia, США), мальтозо-связывающий белок (NEB, США), FLAG (IBI, США), 6xHis (гексагистидин, Quiagen, США) и др.
Векторы в качестве селектируемого маркера содержат гены устойчивости к антибиотикам, обычно используемым в данной области, типа генов, придающих устойчивость к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину и тетрациклину.
Другой аспект настоящего изобретения касается клеток, трансформируемых вышеупомянутым вектором. Клетки могут быть прокариотическими, дрожжевыми или клетками высших эукариот, но не ограничиваются этим.
Можно использовать клетки таких прокариотических хозяев, как Escherichia coli, различные виды Bacillus типа Bacillus subtilis и Bacillus tulignensis, Streptomyces, Pseudomonas (к примеру, Pseudomonas putida), Proteus mirabilis, и Staphylococcus (к примеру, Staphylococcus carnosus).
Однако наибольший интерес представляют клетки животных, а примеры полезных линий клеток хозяина представлены COS-7, BHK, CHO, CHOK1, DXB-11, DG-44, CHO/-DHFR, CV1, COS-7, HEK293, BHK, TM4, VERO, HELA, MDCK, BRL 3A, W138, Hep G2, SK-Hep, MMT, TRI, MRC5, FS4, 3T3, RIN, A549, PC12, K562, PER.C6, SP2 / 0, NS-0, U20S или HT1080, но не ограничиваются этим.
Другой аспект настоящего изобретения касается способа получения слитого белка, содержащего вариант CCL3, причем способ включает (а) культивирование клеток; и (b) сбор слитого белка в культивируемых клетках.
Клетки можно культивировать в различных средах. В качестве культуральной среды можно использовать коммерчески доступные среды, без ограничения. Можно включать все другие необходимые добавки, известные специалистам в данной области, в соответствующей концентрации. Специалистам в данной области должно быть известно, как выбрать оптимальные условия культивирования, к примеру, температуру, рН и т.п., при культивировании клеток хозяина.
Извлечение слитого белка, содержащего вариант CCL3, может проводиться путем удаления примесей, к примеру, путем центрифугирования или ультрафильтрации, и очистки полученного продукта, к примеру, методом аффинной хроматографии и т.п.. Можно использовать и другие методы очистки, к примеру, методы анионо- или катионообменной хроматографии, гидрофобной хроматографии, хроматографии на гидроксиапатите и т.п.
Другой аспект настоящего изобретения касается фармацевтической композиции, включающей слитый белок, содержащий вариант CCL3.
Фармацевтическая композиция может включать слитый белок, содержащий вариант CCL3, в эффективном количестве для лечения, и фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" относится к материалам, которые можно добавлять к активному компоненту, способствующим составлению или стабилизации лекарственной формы и не вызывающим значительного вредного токсического воздействия на пациента.
Носитель означает носитель или разбавитель, не раздражающий пациента и не ингибирующий биологическую активность и характеристики. Фармацевтический носитель, приемлемый для композиции, составленной в виде жидкого раствора, подходит для стерилизации и является биосовместимым. Можно использовать солевые растворы, стерильную воду, раствор Рингера, забуференный физраствор, раствор для инъекций с альбумином, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол и смеси одного или нескольких из них, а при необходимости и другие распространенные добавки, как-то антиоксиданты, буферы и бактериостатики. Кроме того, фармацевтический носитель может быть составлен в виде раствора для инъекций типа водных растворов, суспензий, эмульсий и т.п., пилюль, капсул, гранул или таблеток, также с добавлением разбавителей, диспергаторов, поверхностно-активных веществ, связующих и смазывающих веществ.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления экстемпорально стерильных растворов или дисперсий для инъекций. Применение таких сред и веществ для фармацевтически активного вещества известно в данной области. Композиции предпочтительно составляются для парентерального введения. Композиции могут быть составлены в виде растворов, микроэмульсий, липосом или других упорядоченных структур, подходящих для высокой концентрации препарата. Носителем может быть растворитель или диспергирующая среда, содержащая, к примеру, воду, этанол, полиол (напр., глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), и соответствующие смеси. В некоторых случаях в состав композиций могут входить изотонические агенты, к примеру, сахара, полиспирты типа маннита и сорбита или хлорид натрия. Стерильные растворы для инъекций могут быть получены путем смешивания требуемого количества активного соединения в подходящем растворителе с одним или несколькими из вышеприведенных компонентов по потребности и стерильной микрофильтрации полученной смеси. Обычно дисперсионные среды получают добавлением активного соединения в стерильный носитель, содержащий основу дисперсионной среды и другие необходимые компоненты из числа описанных выше. Некоторые способы получения стерильных растворов для инъекций из стерильных порошков включают вакуумную сушку и сушку вымораживанием для получения порошка активного компонента и любых других нужных компонентов из их растворов, которые были заранее простерилизованы и профильтрованы.
Кроме того, настоящее изобретение касается композиций для лечения или профилактики связанных с CCL3 заболеваний, включающих слитый белок, содержащий вариант CCL3, или же касается способов лечения или профилактики связанных с CCL3 заболеваний, включающих введение слитого белка, содержащего вариант CCL3, нуждающимся в лечении субъектам.
Связанные с CCL3 заболевания могут включать, к примеру, лимфопению, различные раковые заболевания и инфекции. Слитый белок, содержащий вариант CCL3 по настоящему изобретению, может индуцировать гибель раковой ткани и/или раковых клеток вследствие активации иммунных реакций в связи с гибелью раковых клеток, вызванной облучением. Исходя из этого, в одном примере настоящего изобретения слитый белок может входить в состав композиции в сочетании с или при использовании лучевой терапии для лечения или профилактики рака.
Облучение могут быть представлено, к примеру, гамма-лучами или рентгеновским излучением, без ограничения, а облучение может проводиться в дозах от 0,1 до 50 Гр, предпочтительно от 0,1 до 10 Гр. Доза облучения может подбираться в соответствующем диапазоне, с учетом ухудшения иммунитета и пр. из-за побочных эффектов облучения.
Слитый белок, содержащий вариант CCL3, можно вводить различными способами. Например, слитый белок, содержащий вариант CCL3, может вводиться животным непосредственно (к примеру, путем инъекции, имплантации или местного введения слитого белка в часть ткани, локально) или системно (к примеру, парентерально или перорально) при помощи любого подходящего средства.
В случае парентерального введения типа внутривенного, подкожного, глазного, внутрибрюшинного, внутримышечного, перорального, ректального, внутриглазничного, интрацеребрального, внутричерепного, интраспинального, внутрижелудочкового, интратекального, интрацистенального, интракапсулярного, интраназального или аэрозольного введения, к примеру, в состав может входить водная или физиологически совместимая суспензия или раствор типа жидкой среды организма. Соответственно, поскольку носитель или жидкий носитель является физиологически приемлемым, то к вводимому пациентам слитому белку можно добавлять носитель или жидкий носитель. Так, в качестве носителя типа жидкой среды организма для лекарственных форм, как правило, можно использовать солевой раствор.
Частота дозирования варьируется в соответствии с фармакокинетическими параметрами слитого белка, содержащего вариант CCL3, в используемой рецептуре. Как правило, врач-клиницист может вводить слитый белок до достижения дозы, вызывающей требуемый эффект. Соответственно, слитый белок можно вводить в виде разовой дозы, в виде двух или нескольких доз (содержащих одинаковое или неодинаковое количество целевого слитого белка) с интервалом времени или же в виде непрерывного вливания через вставленное устройство или катетер. Дополнительное уточнение надлежащей дозы обычно проводится специалистом в данной области в соответствии с профилем работы специалиста.
Единица дозы составляет от 0,01 мкг/кг до 100 мг/кг, в частности, от 1 мкг/кг массы до 30 мг/кг массы человека. Доза является оптимальной дозой, но может зависеть от заболеваний, подлежащих лечению, и наличия побочных эффектов, а оптимальная доза может быть определена путем проведения стандартных проб. Введение слитого белка может осуществляться посредством периодических болюсных инъекций или непрерывного внутривенного, подкожного или внутрибрюшинного введения из внешнего резервуара (напр., капельницы) или внутреннего резервуара (напр., биоразрушимого имплантата).
Частота введения зависит от тяжести заболевания. Частота введения может составлять от 3 раз в неделю до 1 раза в неделю или раз в две недели.
В некоторых случаях слитый белок, содержащий вариант CCL3, можно подводить к целевому рецептору вместе с другими биологически активными молекулами. Однако оптимальная комбинация, дозовая форма и количество слитого белка и других молекул может быть определено при помощи стандартных проб, хорошо известных в данной области.
Термин "эффективное количество для лечения" в настоящем изобретении означает количество, достаточное для лечения заболевания при разумном соотношении польза/риск в применении к медицинскому лечению, а также количество слитого белка, содержащего вариант CCL3 по настоящему изобретению. Точное количество зависит от многих факторов, включая компоненты и физические характеристики терапевтической композиции, предполагаемую популяцию пациентов, особенностей индивидуальных пациентов и т.п., но не ограничивается этим и легко определяется специалистами в данной области. С учетом всех этих факторов нужно вводить минимальное количество, достаточное для достижения максимального эффекта без побочных эффектов, а доза легко определяется специалистами в данной области.
Дозировка фармацевтических композиций настоящего изобретения не имеет особых ограничений, но меняется в зависимости от различных факторов, включая состояние здоровья и вес пациента, тяжесть заболевания, вид препарата, способ введения и время введения. Композиции можно вводить млекопитающим, включая крыс, мышей, домашний скот, людей и т.п., один или несколько раз в день типичным приемлемым способом, напр., перорально, интраректально, внутривенно, подкожно, внутриматочно или интрацереброваскулярно.
Следующий аспект настоящего изобретения касается варианта лиганда 3β типа CC (CCL3β), включающего следующие мутации: (1) делецию одной или двух аминокислот из N-конца CCL3β дикого типа; и (2) замену аспарагиновой кислоты в положении аминокислоты 27 с N-конца CCL3 дикого типа на аланин.
В одном примере настоящего изобретения вариант CCL3β может включать, к примеру, последовательность, приведенную в SEQ ID NO: 4. Вариант CCL3β настоящего изобретения также охватывает вышеупомянутые структуры, а описание для сдвоенных конфигураций также применимо к варианту CCL3β по изобретению.
Если не определено иначе в технических и научных терминах, используемых в настоящем изобретении, настоящее изобретение имеет такие значения, которые обычно понятны специалистам в данной области. Кроме того, будет опущено повторное описание таких же технических характеристик и операций, как и на предшествующем уровне техники.
Примеры
Далее настоящее изобретение будет описано более подробно на примерах. Однако специалистам в данной области должно быть ясно, что настоящее изобретение не ограничивается следующими примерами и могут проводиться различные модификации и изменения в пределах сущности и объема настоящего изобретения.
Препаративный пример 1. Получение и очистка слитых белков, содержащих варианты CCL3
Проводили исследование мутаций в CCL3 для улучшения физических свойств и профилей активности CCL3 в структуре CCL3-Fc.
В частности, чтобы установить, будут ли сохраняться отличия по активности между α-типом (в дальнейшем именуется CCL3α) и β-типом (в дальнейшем именуется CCL3β) белка CCL3 даже после слияния с Fc, конструировали различные варианты. Кроме того, чтобы ингибировать выпадение в осадок CCL3 у слитого с Fc белка, был разработан вариант, у которого аспарагиновая кислота в положении 27 была заменена на аланин.
Положения, информация о последовательности, цели и ожидаемые эффекты по каждой мутации, введенной в CCL3, приведены ниже в табл. 1.
Таблица 1
тельности
последова-
тельность
последова-
тельности
свойств за счет ингибирования осаждения
свойств
фармакологического
действия
В экспрессирующем векторе кодировали аминокислоты для экспрессии трех составных частей в следующем порядке: вариант CCL3, линкер и носитель слияния из N-конца в C-конец. Ниже в табл. 2 приведены обозначения слитых белков вариантов CCL3, последовательности мутаций, введенных в CCL3, последовательности носителей слияния и последовательности линкеров.
Таблица 2
последовательности
CCL3
(SEQ ID No: 2)
(SEQ ID No: 15)
(SEQ ID No: 2)
(SEQ ID No: 16)
(SEQ ID No: 4)
(SEQ ID No: 17)
(SEQ ID No: 4)
Для получения слитых с вариантами CCL3 белков синтезировали кодирующие последовательности нуклеотидов на основе аминокислотной последовательности слитых белков вариантов CCL3 на фирме Bioneer Co., Ltd. (Корея). На 5'-концы и 3'-концы последовательностей нуклеотидов, кодирующих каждый слитый белок варианта CCL3, добавляли последовательности рестрикционных ферментов NyI и NotI, соответственно, а начальный кодон для трансляции белка и последовательность для внеклеточной секреции экспрессируемого белка вставляли после последовательности рестрикционных ферментов на 5'-концах. После последовательности нуклеотидов, кодирующей каждый слитый с вариантом CCL3 белок, вставляли кодон терминации. Последовательности нуклеотидов, кодирующие каждый слитый белок варианта CCL3, клонировали в экспрессирующий вектор pTrans-empty, используя последовательности двух рестрикционных ферментов NheI и NotI. Экспрессирующий вектор pTrans-empty, полученный от CEVEC Corporation в Германии, - это простой по структуре экспрессирующий вектор, содержащий промотор CMV, начало репликации из pUC, начало репликации из SV40 и ген устойчивости к ампициллину.
Препаративный пример 1-2. Получение плазмидной ДНК для экспрессии слитых белков вариантов CCL3
Получали большое количество плазмидной ДНК для экспрессии путем трансформации клеток E. coli каждым экспрессирующим вектором, полученным в препаративном примере 1-1. Каждый экспрессирующий вектор трансдуцировали посредством теплового шока в E. coli с ослабленной клеточной стенкой, а полученные трансдуцированные клетки E. coli штриховали на чашках с LB для получения колоний. Полученные колонии инокулировали в среду LB и культивировали при 37°C в течение 16 часов, получая 100 мл E. coli с соответствующими экспрессирующими векторами в клетках, соответственно. После удаления культуральной среды путем центрифугирования к E.coli добавляли растворы P1, P2 и P3 (QIAGEN, кат. № 12963), получая мутный раствор ДНК при разрушении клеточной стенки и высвобождении белка и ДНК. Из полученного мутного раствора ДНК выделяли плазмидную ДНК, используя колонки Qiagen для очистки ДНК. Элюированные плазмидные ДНК проверяли методом электрофореза в агарозном геле и использовали для экспрессии после измерения концентрации и чистоты на приборе Nanodrop (Thermo Scientific, Nanodrop Lite).
Препаративный пример 1-3. Экспрессия слитых белков в клетках CAP-T
Каждой плазмидной ДНК, выделенной в препаративном примере 1-2, трансформировали линию клеток человека. Каждую плазмидную ДНК трансдуцировали в клетки CAP-T (CEVEC), культивировавшиеся в среде PEM (Life Technologies), с помощью раствора PEI (Polyplus, кат. № 101-10N). Смесь растворов ДНК и раствора PEI смешивали с суспендированными клетками, используя экспрессионную среду Freestyle 293 фирмы Invitrogen Corporation, культивировали при 37°C в течение 5 часов, а затем добавляли среду PEM. После культивирования при 37°C в течение 5-7 дней клетки удаляли центрифугированием, получая супернатант, содержащий слитый белок варианта CCL3.
Препаративный пример 1-4. Очистка слитых белков вариантов CCL3
Из супернатантов культур, содержащих слитые белки вариантов CCL3, удаляли примеси с помощью фильтра на 0,2 мкм, а затем колонку для аффинной хроматографии с белком A (GE Healthcare) уравновешивали с буфером 1×PBS (рН 7,4). Колонку промывали буфером 1×PBS (pH 7,4), а затем элюировали белок 100 мМ глициновым буфером (pH 3,0). Слитый белок CCL3A-H05 (SEQ ID NO: 15), полученный с помощью аффинной хроматографии, очищали на колонке с гидроксиапатитом I типа (Ceramic Hydroxyapatite type I, 40 мкм, Bio-Rad), а слитый белок CCL3B-H05 (SEQ ID NO: 16) и слитый белок CCL3B-H40 (SEQ ID NO: 17) очищали на колонке с гидроксиапатитом II типа (Ceramic Hydroxyapatite type II, 40 мкм, Bio-Rad). Колонку с гидроксиапатитом уравновешивали с 20 мМ натрий-фосфатным буфером (рН 7,2), а затем наносили элюированный при аффинной хроматографии слитый белок варианта CCL3. В частности, колонку промывали 20 мМ натрий-фосфатным буфером (рН 7,2), пропускали градиент концентрации с 20 мМ натрий-фосфатным буфером (рН 7,2), а затем анализировали элюированные фракции. Каждую фракцию анализировали методом эксклюзионной хроматографии (SEC-HPLC), собирая фракции, содержащие слитый белок варианта CCL3 с высокой степенью чистоты, а затем диализировали в течение ночи при 4°C в заключительном буфере 1×PBS. Полученный при диализе разбавленный раствор белка концентрировали при 3000 об/мин при 4°C с помощью центрифужного фильтра с отсечением по молекулярной массе в 30 000. Концентрацию слитого белка вариантов CCL3 измеряли количественным методом BCA.
Экспериментальный пример 1. Результаты измерения активности слитых белков in vitro
Экспериментальный пример 1-1. Результаты измерения активности в зависимости от последовательности линкера
Измеряли активность in vitro слитых белков вариантов CCL3 - CCL3B-H05 (SEQ ID NO: 16) и CCL3B-H40 (SEQ ID NO: 17), полученных в приведенном выше препаративном примере.
В частности, для оценки активности in vitro слитых белков использовали клетки линии THP-1 из АТСС, в которой экспрессируются рецепторы CCL3 - CCR1 и CCR5. Для оценки активности готовили двукратные серийные разведения концентратов, содержащих слитые белки, полученные в препаративном примере в концентрации 100 мкг/мл, используя среду для анализа (0,01% BSA в среде RPMI 1640), а клетки THP-1 переносили в среду для анализа и разбавляли до 5 000 000 клеток/мл. Для проведения реакции использовали систему поликарбонатных транслунок Transwell (Costar, кат. № 3422), внося в нижние лунки по 600 мкл разбавленного слитого белка, а в верхние вставки - по 100 мкл разведения клеток THP-1, а затем содержали систему в инкубаторе с 5% CO2 при 37°C. Через 24 часа вставки вынимали, а клетки окрашивали раствором трипанового синего (Sigma, кат. № T8154-100ML) и измеряли количество перемещенных клеток с помощью счетчика клеток (Luna, Invitrogen). Активности сравнивали, вычисляя увеличение максимального количества мигрировавших клеток по сравнению с количеством клеток в контрольной группе, обработанной средой для анализа, а результаты представлены на фиг. 1.
Как видно из фиг. 1, результаты по измерению активности в зависимости от линкера показали, что хемотаксис у слитого белка CCL3B-H05 был выше, чем у CCL3B-H40.
Экспериментальный пример 1-2. Измерение активности в зависимости от варианта CCL3
Измеряли активность in vitro слитого белка CCL3A-H05 с последовательностью SEQ ID NO: 15 и слитого белка CCL3B-H05 с последовательностью SEQ ID NO: 16, полученных в приведенном выше препаративном примере.
В частности, в концентратах, содержащих слитые белки, полученные в препаративном примере, измеряли хемотаксис у слитых белков таким же способом, как и в экспериментальном примере 1-1, а результаты представлены на фиг. 2.
Экспериментальный пример 1-3. Результаты измерения активности в зависимости от варианта CCL3
Измеряли активность in vitro слитого белка CCL3A-H05 с последовательностью SEQ ID NO: 15 и слитого белка CCL3B-H05 с последовательностью SEQ ID NO: 16, полученных в приведенном выше препаративном примере.
В частности, для оценки сродства к рецепторам CCR1 у слитых белков использовали линию клеток Tango™ CCR1-bla U2OS DA, в которой экспрессируется рецептор CCR1 для слитых белков, и набор для анализа (Invitrogen, кат. № K1793). Для оценки активности клетки Tango™ CCR1-bla U2OS DA разбавляли основной средой (среда для экспрессии FreeStyle™) до концентрации в 312 500 клеток/мл, по 32 мкл разбавленных клеток вносили в 384-луночный планшет (Corning, кат. № 3712), а затем содержали в инкубаторе с 5% CO2 от 16 до 24 часов. Концентраты, содержащие слитые белки, полученные в препаративном примере, разбавляли до концентрации 10 мкМ для CCL3 и 25 мкМ для CCL3A-H05, то есть в 5 раз выше, чем концентрации при обработке, используя среду для анализа (0,5% DMSO в среде для экспрессии FreeStyle™). Приготовленные слитые белки вносили в лунки, содержащие клетки, по 8 мкл в каждую лунку, для обработки клеток двукратными серийными разведениями слитых белков при фактической концентрации в 2 мкМ для CCL3 и 5 мкМ для CCL3A-H05 и CCL3B- H05, а обработанные клетки содержали в инкубаторе с 5% CO2 при 37°C в течение 5 часов для реакции. Готовили смешанный раствор субстрата 6X (6 мкл 1 мМ субстрата LiveBLAzer™-FRET B/G (CCF4-AM) + 60 мкл раствора B + 904 мкл раствора C + 30 мкл раствора D), используя раствор, содержащийся в наборе для анализа, а затем вносили по 8 мкл полученного смешанного раствора в каждую лунку 384-луночного планшета, обработанного слитым белком, а затем клетки содержали 2 часа при комнатной температуре для реакции. Измеряли и вычисляли соотношение (соотношение синего и зеленого излучения) прореагировавших клеток и непрореагировавших клеток на считывающем устройстве для микропланшетов (FlexStation 3, Molecular Devices), а результаты представлены на фиг. 3.
Как видно из фиг. 3, сродство к рецепторам CCR1 было на уровне 0,63 нМ у CCL3, 16,0 нМ у CCL3A-H05 и 11,6 нМ у CCL3B-H05.
Экспериментальный пример 2. Оценка физических свойств слитого белка
Экспериментальный пример 2-1. Экспериментальный метод оценки устойчивости
Для определения количества белковых агрегатов в исходном состоянии образца измеряли содержание (% HMW) высокомолекулярных агрегатов методом эксклюзионной хроматографии (SEC-HPLC).
В частности, метод SEC-HPLC выполнялся на колонке TSX-GEL G3000SWXL фирмы Tosoh. Для уравновешивания колонки через нее пропускали буфер 1×PBS со скоростью потока 1 мл/мин. Исходный раствор белка CCL3B-H05, полученный в препаративном примере 1-4, концентрировали при 3000 об/мин и 4°C до целевой концентрации 9,5 мг/мл или выше с помощью центрифужного фильтра с отсечением по молекулярной массе в 30 000. Концентрацию каждого образца измеряли количественным методом ВСА, а затем образцы хранили при -70°C в течение 5 недель для оценки стабильности. Для измерения доли высокомолекулярных агрегатов (% HMW) образец в 9,57 мг/мл разбавляли 1×PBS до концентрации 1 мг/мл и определяли долю высокомолекулярных агрегатов путем инъекции 100 мкл разбавленного образца на колонку SEC-HPLC.
Как видно из табл. 3, результаты подтверждают, что % HMW у CCL3B-H05 был низким, а физические свойства слитого белка варианта CCL3 улучшались без нарушения при слиянии с Fc, так как при введении мутации D27A значительно снижался % HMW.
Таблица 3. Стабильность (% HMW) CCL3B-H05 при концентрации 9,5 мг/мл
Как видно из табл. 3, содержание HMW на исходной стадии хранения (0 дней хранения) не повышалось, а сохранялось после 5 недель хранения при -70°C. Видно, что стабильность слитого белка CCL3B-H05 сохраняется независимо от мутации.
Экспериментальный пример 3. Измерение фармакокинетики слитого белка
Экспериментальный пример 3-1. Экспериментальный метод измерения фармакокинетики
Приобретенных у фирмы Orient BIO Corporation в Корее 7-недельных самцов мышей C57BL/6 разделяли на группы (n = 3 на время сбора крови) с одинаковым средним весом за день до введения препаратов, а затем вводили образцы по 3 мг/кг и 10 мг/кг внутривенно один раз, соответственно, и брали пробы крови через 0,083, 0,5, 1, 4, 8, 12, 24, 48, 72, 96 и 144 часа. Для измерения концентрации слитого белка в крови в этом эксперименте использовали набор Quantikine для ELISA Human CCK3/MIP-1 (R&D Systems, кат. № SMA00), обладающий иммунореактивностью к CCL3. Фармакокинетические параметры рассчитывали путем измерения концентрации CCL3B-H05 в крови в пробах вплоть до 144 часов после внутривенного введения мышам слитого белка.
Экспериментальный пример 3-2. Результаты измерения фармакокинетики по активности
Фармакокинетические параметры рассчитывали из графиков концентрации в крови (фиг. 4) в зависимости от времени после внутривенного введения слитого белка мышам, а результаты вычисления представлены ниже в табл. 4.
Таблица 4
Фармакокинетический профиль слитого белка сравнивали и оценивали, исходя из площади под кривой (AUC), которая указывает на степень экспозиции с препаратом.
Как видно из табл. 4, при внутривенном введении CCL3B-H05 мышам в дозах 3 и 10 мг/кг экспозиция организма обычно повышалась пропорционально дозе, а клиренс (CL) и объем распределения (Vdss) почти не зависели от дозы, поэтому при дозах в 3 до 10 мг/кг проявлялась линейная ФК. Результаты также показали, что период полужизни (t1/2) CCL3B-H05 составлял 20,4 ч и 45,6 ч для доз в 3 и 10 мг/кг и возрастал примерно в 12-27 раз по сравнению с периодом полужизни (в пределах 1,7 часа при внутривенном введении у человека) самого CCL3. Учитывая, что период полужизни в мышах обычно короче периода полужизни в людях, повышение периода полужизни CCL3B-H05 по сравнению с периодом полужизни CCL3 должно быть больше у мышей.
Экспериментальный пример 4. Оценка активности слитого белка на мышах
Экспериментальный пример 4-1. Экспериментальный метод определения противоракового действия на мышах с аллотрансплантатами рака печени BNL 1ME A.7R.1
Приобретенных у фирмы Orient BIO Corporation в Корее 7-недельных самцов мышей Balb/c акклиматизировали в течение 1 недели, а затем вводили в правую заднюю лапку 1×107 клеток BNL 1ME A.7R.1 (ATCC), то есть линии клеток рака печени мыши. В то время, когда объем опухолей составлял от 120 до 150 мм3, их разделяли на группы так, чтобы объемы опухолей были одинаковыми. Экспериментальные группы и схемы введения препаратов для каждой группы представлены в табл. 5 и фиг. 6, соответственно. С первого дня введения препаратов измеряли объем опухолей при помощи кронциркуля каждые 3-4 дня для отслеживания ингибирующего действия препарата на опухоли (объем опухоли = длинная ось × (короткая ось)2/2).
Таблица 5
Экспериментальный пример 4-2. Результаты оценки противоракового действия на мышах с аллотрансплантатами рака печени BNL 1ME A.7R.1
Проверяли ингибирующее действие на рост опухолей у слитого белка CCL3A-H05, включающего последовательность SEQ ID NO: 15, и слитого белка CCL3B-H05, включающего последовательность SEQ ID NO: 16, полученных в приведенном выше препаративном примере, на мышах с раком печени BNL 1ME A.7R.1. Как видно из фиг. 5, ингибирующее действие на рост опухолей составляло примерно 25% в группе, получавшей CCL3A-H05 10 мг/кг, и примерно 72% в группе, получавшей CCL3B-H05 10 мг/кг, по сравнению с группой, получавшей только однократное облучение 6,5 Гр, через 1 месяц после облучения.
Хотя определенная часть настоящего изобретения была описана подробно, специалистам в данной области должно быть ясно, что такое конкретное описание является лишь предпочтительным воплощением, а объем настоящего изобретения этим не ограничивается. Так, существенный объем настоящего изобретения должен определяться прилагаемой формулой изобретения и ее эквивалентами.
--->
<110> YUHAN CORPORATION
<120> FUSION PROTEIN COMPRISING CCL3 VARIANT AND USE THEREOF
CROSS-REFERENCE TO RELATED APPLICATIONS
<130> PP-B1850
<150> KR 10-2016-0053018
<151> 2016-04-29
<160> 17
<170> KopatentIn 2.0
<210> 1
<211> 70
<212> PRT
<213> human CCL3 alpha
<400> 1
Ala Ser Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr
1 5 10 15
Ser Arg Gln Ile Pro Gln Asn Phe Ile Ala Asp Tyr Phe Glu Thr Ser
20 25 30
Ser Gln Cys Ser Lys Pro Gly Val Ile Phe Leu Thr Lys Arg Ser Arg
35 40 45
Gln Val Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser
50 55 60
Asp Leu Glu Leu Ser Ala
65 70
<210> 2
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> CCL3 alpha variant
<400> 2
Ser Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser
1 5 10 15
Arg Gln Ile Pro Gln Asn Phe Ile Ala Ala Tyr Phe Glu Thr Ser Ser
20 25 30
Gln Cys Ser Lys Pro Gly Val Ile Phe Leu Thr Lys Arg Ser Arg Gln
35 40 45
Val Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp
50 55 60
Leu Glu Leu Ser Ala
65
<210> 3
<211> 70
<212> PRT
<213> human CCL3 beta
<400> 3
Ala Pro Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr
1 5 10 15
Ser Arg Gln Ile Pro Gln Asn Phe Ile Ala Asp Tyr Phe Glu Thr Ser
20 25 30
Ser Gln Cys Ser Lys Pro Ser Val Ile Phe Leu Thr Lys Arg Gly Arg
35 40 45
Gln Val Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser
50 55 60
Asp Leu Glu Leu Ser Ala
65 70
<210> 4
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> CCL3 beta variant
<400> 4
Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser Arg
1 5 10 15
Gln Ile Pro Gln Asn Phe Ile Ala Ala Tyr Phe Glu Thr Ser Ser Gln
20 25 30
Cys Ser Lys Pro Ser Val Ile Phe Leu Thr Lys Arg Gly Arg Gln Val
35 40 45
Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp Leu
50 55 60
Glu Leu Ser Ala
65
<210> 5
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 5
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys
1 5 10
<210> 6
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 6
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Glu Lys Lys
1 5 10 15
Lys
<210> 7
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 7
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Glu Lys Lys
1 5 10 15
Lys Glu Glu Lys Lys Lys
20
<210> 8
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 8
Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys
1 5 10 15
<210> 9
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 9
Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu
1 5 10 15
Glu Lys Lys Lys
20
<210> 10
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 10
Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu
1 5 10 15
Glu Lys Lys Lys Glu Glu Lys Lys Lys
20 25
<210> 11
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 11
Arg Asn Thr Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys
1 5 10 15
Lys Lys
<210> 12
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 12
Arg Asn Thr Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys
1 5 10 15
Lys Lys Glu Glu Lys Lys Lys
20
<210> 13
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker
<400> 13
Arg Asn Thr Arg Asn Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys
1 5 10 15
Lys Lys Glu Glu Lys Lys Lys Glu Glu Lys Lys Lys
20 25
<210> 14
<211> 233
<212> PRT
<213> Artificial Sequence
<220>
<223> HyFc
<400> 14
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
1 5 10 15
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
20 25 30
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
35 40 45
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
50 55 60
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
65 70 75 80
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
85 90 95
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
100 105 110
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
115 120 125
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
130 135 140
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
145 150 155 160
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
165 170 175
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
180 185 190
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
195 200 205
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
210 215 220
Lys Ser Leu Ser Leu Ser Leu Gly Lys
225 230
<210> 15
<211> 314
<212> PRT
<213> Artificial Sequence
<220>
<223> CCL3A-H05
<400> 15
Ser Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser
1 5 10 15
Arg Gln Ile Pro Gln Asn Phe Ile Ala Ala Tyr Phe Glu Thr Ser Ser
20 25 30
Gln Cys Ser Lys Pro Gly Val Ile Phe Leu Thr Lys Arg Ser Arg Gln
35 40 45
Val Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp
50 55 60
Leu Glu Leu Ser Ala Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys
65 70 75 80
Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro
85 90 95
Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro
100 105 110
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
115 120 125
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
130 135 140
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
145 150 155 160
Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
165 170 175
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
180 185 190
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
195 200 205
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
210 215 220
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
225 230 235 240
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
245 250 255
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
260 265 270
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
275 280 285
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
290 295 300
Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
305 310
<210> 16
<211> 313
<212> PRT
<213> Artificial Sequence
<220>
<223> CCL3B-H05
<400> 16
Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser Arg
1 5 10 15
Gln Ile Pro Gln Asn Phe Ile Ala Ala Tyr Phe Glu Thr Ser Ser Gln
20 25 30
Cys Ser Lys Pro Ser Val Ile Phe Leu Thr Lys Arg Gly Arg Gln Val
35 40 45
Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp Leu
50 55 60
Glu Leu Ser Ala Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys
65 70 75 80
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
85 90 95
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
100 105 110
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
115 120 125
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
130 135 140
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
145 150 155 160
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
165 170 175
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
180 185 190
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
195 200 205
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
210 215 220
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
225 230 235 240
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
245 250 255
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
260 265 270
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
275 280 285
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
290 295 300
Lys Ser Leu Ser Leu Ser Leu Gly Lys
305 310
<210> 17
<211> 301
<212> PRT
<213> Artificial Sequence
<220>
<223> CCL3B-H40
<400> 17
Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser Arg
1 5 10 15
Gln Ile Pro Gln Asn Phe Ile Ala Ala Tyr Phe Glu Thr Ser Ser Gln
20 25 30
Cys Ser Lys Pro Ser Val Ile Phe Leu Thr Lys Arg Gly Arg Gln Val
35 40 45
Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp Leu
50 55 60
Glu Leu Ser Ala Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr
65 70 75 80
Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu
85 90 95
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
100 105 110
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
115 120 125
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
130 135 140
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
145 150 155 160
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
165 170 175
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
180 185 190
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
195 200 205
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
210 215 220
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
225 230 235 240
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
245 250 255
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
260 265 270
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
275 280 285
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
290 295 300
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТАЯ МОЛЕКУЛА, СПОСОБНАЯ ИНДУЦИРОВАТЬ НЕВОСПАЛИТЕЛЬНЫЙ ФАГОЦИТОЗ | 2022 |
|
RU2823919C1 |
| СЛИТЫЕ С FGF21 БЕЛКИ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741087C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| АНТИТЕЛА ПРОТИВ БЕЛКА-1 ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ (PD-1) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725950C1 |
| СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ ВАРИАНТЫ ЧЕЛОВЕЧЕСКОГО БЕЛКА LEFTY А, И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2793631C2 |
| БЕЛКИ С ДВОЙНОЙ ФУНКЦИЕЙ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741345C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ГЕПАТИТА, ФИБРОЗА ПЕЧЕНИ И ЦИРРОЗА ПЕЧЕНИ, ВКЛЮЧАЮЩАЯ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2795548C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
| Антитела против TIGIT и их применение | 2019 |
|
RU2750705C1 |
Изобретение относится к области биотехнологии, конкретно к слитым белкам, и может быть использовано в медицине для ингибирования роста опухоли. Получен слитый белок, включающий область Fc иммуноглобулина; и вариант лиганда-3 типа CC (CCL3), имеющий последовательность SEQIDNO: 3, в которой A или AP делетированыс N-конца и аспарагиновая кислота в положении аминокислоты 27 с N-конца CCL3 заменена на аланин. В полученной конструкции слитого белка вариант CCL3 связан c Fc областью иммуноглобулина через линкер, содержащим последовательность SEQIDNO: 5, в порядке от N-конца к С-концу: вариант CCL3, линкер, область Fc иммуноглобулина. Изобретение обеспечивает получение слитого белка, обладающего связывающей активностью CCL3. 5 н. и 4 з.п. ф-лы, 5 табл., 4 пр., 6 ил.
1. Слитый белок, обладающий связывающей активностью лиганда-3 типа CC (CCL3), включающий:
область Fc иммуноглобулина; и
вариант лиганда-3 типа CC (CCL3), имеющий последовательность SEQ ID NO: 3, где:
(1) A или AP делетированы с N-конца; и
(2) аспарагиновая кислота в положении аминокислоты 27 с N-конца CCL3 заменена на аланин, и
где вариант CCL3 связан c Fc-областью иммуноглобулина через линкер, содержащим последовательность SEQ ID NO: 5,
в порядке от N-конца к С-концу: вариант CCL3, линкер, область Fc иммуноглобулина.
2. Слитый белок по п. 1, при этом вариант CCL3 включает последовательность SEQ ID NO: 4.
3. Слитый белок по п. 1, при этом Fc-область иммуноглобулина представляет собой Fc-область из IgG1, IgG2, IgG3, IgG4 или IgD, или является гибридом Fc-области, содержащим комбинацию Fc-областей из IgG1, IgG2, IgG3, IgG4 или IgD, или Fc-область является фрагментом Fc-области из IgG1, IgG2, IgG3, IgG4 или IgD.
4. Слитый белок по п. 3, при этом гибридный Fc включает часть Fc-области из IgG4 или ее фрагмент и часть Fc области из IgD либо ее фрагмент.
5. Слитый белок по п. 1, при этом Fc-область иммуноглобулина включает последовательность SEQ ID NO: 14.
6. Нуклеиновая кислота, кодирующая слитый белок по любому из пп. 1-5.
7. Вектор для экспрессии слитого белка согласно любому из пп. 1-5, содержащий нуклеиновую кислоту по п. 6.
8. Клетка, за исключением зародышевой или эмбриональной клетки человека, для получения слитого белка по любому из пп. 1-5, которая трансформирована вектором по п. 7.
9. Фармацевтическая композиция для ингибирования роста опухоли, включающая слитый белок по любому из пп. 1-5 в эффективном количестве.
| US6730296 B2, 04.05.2004 | |||
| REN M | |||
| et al., Polymerization of MIP-1 chemokine (CCL3 and CCL4) and clearance of MIP-1 by insulin-degrading enzyme, The EMBO Journal, 2010, v | |||
| Солесос | 1922 |
|
SU29A1 |
| US7638319 B2, 29.12.2009 | |||
| СЛИТНЫЕ БЕЛКИ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2530168C2 |
Авторы
Даты
2020-07-23—Публикация
2017-04-19—Подача