Область техники
Изобретение относится к медицине, а именно к иммунологии и онкоурологии, и может быть использовано для модулирования иммунных реакций у пациентов с раком мочевого пузыря.
Уровень техники
Белок запрограммированной гибели клеток-1 (PD-1) представляет собой рецептор контрольной точки, который экспрессируется всеми Т-клетками во время активации, а также обнаруживается на поверхности некоторых других иммунных клеток (макрофагов, В-лимфоцитов, дендритных клеток, моноцитов, миелоидных клеток и естественных киллеров). Лигандами для PD-1 являются представители семейства В7: PD-L1 (В7-Н1) и PD-L2 (B7-DC). Физиологическая роль сигнального пути PD-1 заключается в ограничении иммунопатологических ответов в тканях хозяина путем уменьшения активации и функции потенциально патогенных самореактивных CD4+ и CD8+ Т-клеток, а также путем содействия разрешению воспаления и восстановлению иммунного гомеостаза. Кроме того, было показано, что PD-L1 широко экспрессируется в опухолевых клетках. Проведенные исследования показали, что взаимодействие PD-1 и PD-L1 является одним из важнейших механизмов, с помощью которого опухоли человека ускользают от иммунного ответа [Tang Q, Chen Y, Li X, Long S, Shi Y, Yu Y, Wu W, Han L, Wang S. Theroleof PD-1/PD-L1 and application of immune-checkpoint inhibitors in human cancers. Front Immunol. 2022 Sep13; 13:964442. doi: 10.3389/fimmu.2022.964442. PMID: 36177034; PMCID: PMC9513184]. Благодаря изучению данного феномена, был разработан новый класс препаратов для противоопухолевой терапии, основанных на ингибировании сигнального пути PD-1.
Все препараты данного класса, в настоящий момент разрешенные к применению, представляют собой моноклональные антитела, блокирующие взаимодействиеPD-1/PD-L1:ниволумаб (антитела против PD-1, Bristol-MyersSquibb, США), пембролизумаб (антитела против PD-1, Merck, США), атезолизумаб (антитела против PD-L1, Genentech, США), авелумаб (антитела против PD-L1, EMD Serono, США) и дурвалумаб (антитела против PD-L1, AstraZeneca, США). Препараты были одобрены для терапевтического применения при различных видах рака, включая меланому, немелкоклеточный рак легкого, плоскоклеточный рак головы и шеи, почечно-клеточный рак, лимфому Ходжкина, рак мочевого пузыря, клеточная карцинома Меркеля и опухолей с высокой микросателлитной нестабильностью.
В патенте RU 2 766 582 C2 предложены выделенные антитела и их антигенсвязывающие фрагменты, специфично связывающие лиганд 1 белка программируемой смерти клеток (PD-L1), кодирующие их нуклеиновые кислоты, а также векторы и клетки-хозяева для получения указанных антител.
Известен способ лечения уротелиальной карциномы у субъекта (RU 2 742 312 C1), включающий введение субъекту терапевтически эффективного количества ингибитора взаимодействия рецептора PD-1 и его лиганда PD-L1, где ингибитор является антителом против PD-L1.
Известен способ лечения немелкоклеточного рака легких у субъекта (RU 2 714 233 C2), включающий введение субъекту терапевтически эффективного количества ингибитора взаимодействия рецептора PD-1 и его лиганда PD-L1, где ингибитор является антителом против PD-L1
Известно применение комбинации тасквинимода или его фармацевтически приемлемой соли и антитела против PD-1 и/или PD-L1, для блокирования пролиферации опухоли синергичным образом (RU 2 742 373 C2).
Известна фармацевтическая комбинация для лечения гиперпролиферативных расстройств (RU 2 774 838 C2), которая содержит регорафениб или его гидрат, сольват, или фармацевтически приемлемую соль, или его полиморфную форму, и ингибитор PD-1/PD-L1(2) в синергетически эффективном количестве. Изобретение обеспечивает улучшение противоопухолевой и/или антиметастатической эффективности.
Из изобретения RU 2 752 562 C2 известно антитело, которое специфически связывает PD-1 человека. Изобретение позволяет эффективно лечить заболевания, ассоциированные с нарушением сигнального пути PD-1.
Известно изобретение RU 2 750 675 C1, которое относится к антителу, специфически связывающемуся с PD-1, или к его антигенсвязывающему фрагменту, содержащей его фармацевтической композиции, а также к способу получения указанного антитела и его фрагмента. Также раскрыта выделенная молекула нуклеиновой кислоты для получения антитела или антигенсвязывающей части, а также содержащие ее вектор и клетка-хозяин. Изобретение также относится к способу повышения иммунитета у пациента с использованием вышеуказанного антитела или его фрагмента. Изобретение эффективно для лечения рака у пациента.
Из изобретения известно использование бициклических соединений в качестве ингибиторов взаимодействия/активации PD-1/PD-L1(RU 2020 132 944 A).
Несмотря на то, что ингибиторы контрольных точек иммунного ответа изменили ландшафт лечения пациентов со многими видами злокачественных новообразований, тем не менее частота ответа на данные препараты колеблется от 15–30% пациентов (при большинстве солидных опухолей) до 45–60% пациентов (при меланоме и опухолях MSI-H). Это создает необходимость в поиске новых способов ингибирования сигнального пути PD-1/PD-L1.
Раскрытие изобретения
Целью данного изобретения является расширение арсенала способов ингибирования сигнального пути PD-1/PD-L1.
Технический результат заключается в повышении эффективности адъювантной терапии рака мочевого пузыря.
Указанный технический результат достигается тем, что использован вакцинный штамм Mycobacterium bovis БЦЖ-1.
При этом указанный способ может осуществляться как in vitro, так и in vivo.
Осуществление изобретения
Краткое описание фигур.
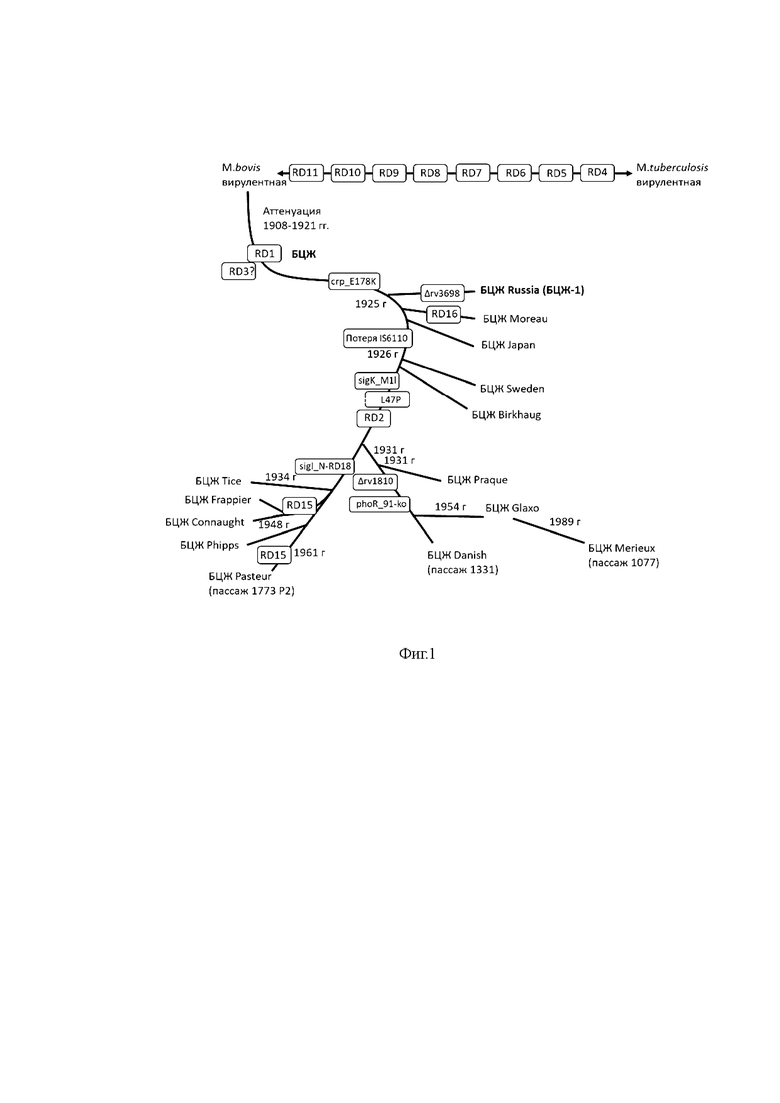
На фиг. 1 представлено филогенетическое дерево штаммов БЦЖ.
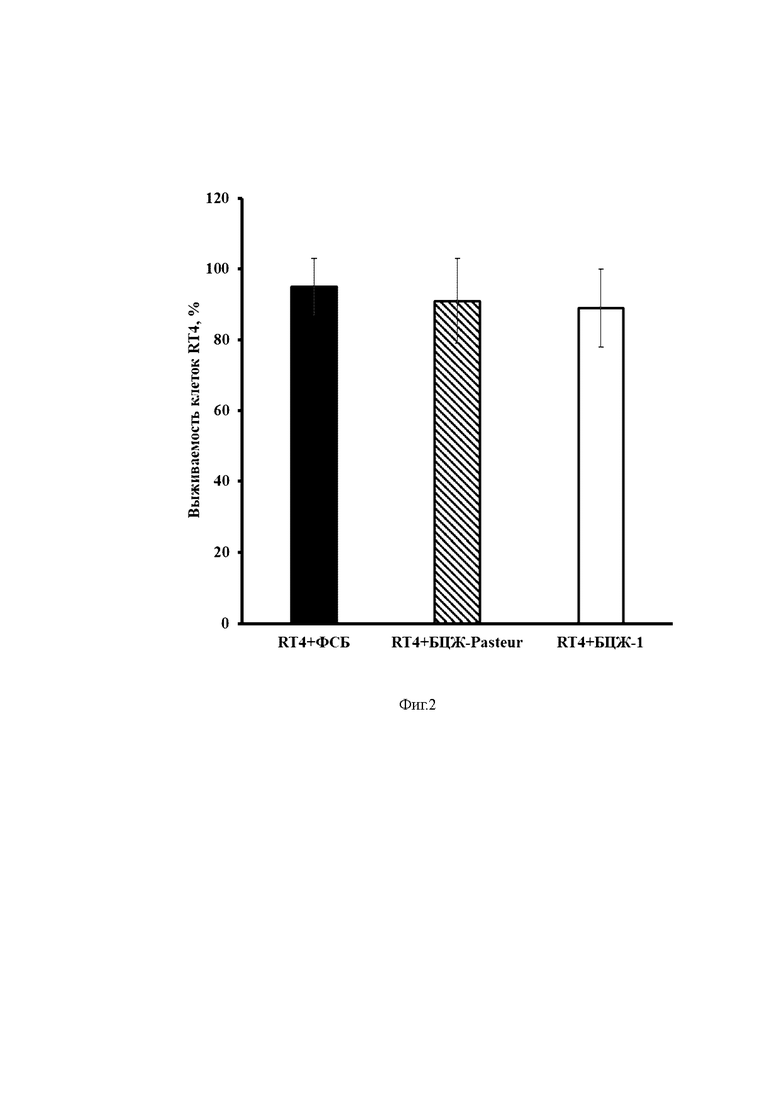
На фиг. 2 представлена выживаемость клеток RT4 после взаимодействия с различными штаммами БЦЖ или Фосфатно-солевым буфером.
Ось ординат – выживаемость клеток RT4, %.
Ось абсцисс – экспериментальные группы.
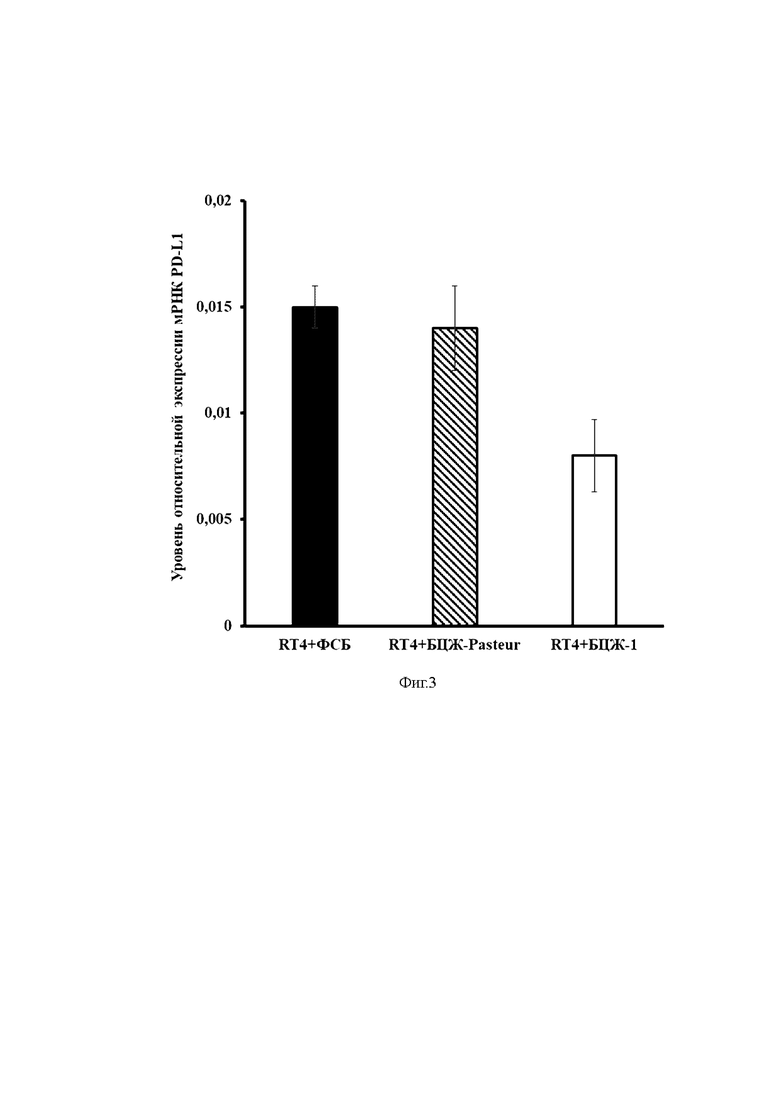
На фиг. 3 представлен уровень относительной экспрессии мРНК PD-L1 в раковых клетках мочевого пузыря человека RT4 после взаимодействия с различными штаммами БЦЖ или Фосфатно-солевым буфером.
Ось ординат – уровень относительной экспрессии мРНК PD-L1 в клетках RT-4.
Ось абсцисс – экспериментальные группы.
На фиг. 4 представлен уровень относительной экспрессии мРНК PD-L1 в клетках мочевого пузыря мышей с раком мочевого пузыря MB49 после взаимодействия с БЦЖ-1 или Фосфатно-солевым буфером.
Ось ординат – уровень относительной экспрессии мРНК PD-L1 в клетках мочевого пузыря мышей.
Ось абсцисс – экспериментальные группы.
На фиг. 5 представлена выживаемость мышей с раком мочевого пузыря MB49, после терапии БЦЖ, антителами против PD-L1 и обоими средствами.
 Группа животных, которым вводили ФСБ;
Группа животных, которым вводили ФСБ;
 Группа животных, которым вводили антитела против PD-L1;
Группа животных, которым вводили антитела против PD-L1;
 Группа животных, которым вводили БЦЖ-1;
Группа животных, которым вводили БЦЖ-1;
 Группа животных, которым вводили БЦЖ-1 и PD-L1.
Группа животных, которым вводили БЦЖ-1 и PD-L1.
БЦЖ (Бацилла Кальмета-Герена) представляет собой ослабленные бактерии Mycobacterium bovis, которые были получены А. Кальметом и К. Гереном путем 230 рекультиваций в особых условиях в течение 13 лет. В 1921 году ученые продемонстрировали, что полученная бацилла не только непатогенна на животных моделях, но и защищает от заражения туберкулезом у вакцинированных животных. БЦЖ стала активно применяться для вакцинации против туберкулеза. А через некоторое время в ряде исследований была продемонстрирована потенциальная эффективность БЦЖ для лечения различных видов рака.
Вакцина БЦЖ была передана в различные страны мира. Штамм БЦЖ, переданный в СССР (BCG Russia),был зарегистрирован в нашей стране как БЦЖ-1. Лаборатории в разных странах в течение десятилетий повторно культивировали микобактерии в соответствии со своими регламентами хранения и производства. Таким образом, образовалось несколько субштаммов БЦЖ (Фиг 1).
Генетическое сравнение различных субштаммов БЦЖ показало делецию некоторых участков их геномов, включение однонуклеотидных полиморфизмов или инсерционных последовательностей, а также появление тандемных дупликаций. Изменения генетического фона приводили в ряде случаев к разным фенотипам микобактерий. Одной из основных характеристик микобактерий является их клеточная стенка, которая содержит длинные цепи миколовых кислот, образующих высокогидрофобную и непроницаемую стенку, а также гликолипиды, липопротеины, гликаны и белки. Некоторые из этих липидов, такие как миколовые кислоты, фтиоцеролдимикоцерозаты или фенольные гликолипиды, которые были связаны с взаимодействием с клетками-хозяевами, не одинаково представлены на поверхности субштаммов БЦЖ. Например, субштаммы БЦЖ Moreau и Japan не содержат фтиоцеролдимикоцерозатов и фенольных гликолипидов, что связано уменьшением их вирулентности и реактогенности. И наоборот, субштаммы БЦЖRussia (БЦЖ-1), Sweden, Birkhaug, Frappier, Pasteur, Phipps, Tice, Copenhagen, Prague и Connaught содержат фтиоцеролдимикоцерозаты или фенольные гликолипиды. Только ранние штаммы БЦЖ содержат три типа миколовых кислот (альфа-, метокси- и кетомиколаты), тогда как более поздние штаммы содержат только альфа- и кетомиколаты. Важность присутствия упомянутых липидов заключается в различной способности вызывать активацию иммунной системы через липидные иммунные рецепторы. Точно так же соответствующие белковые антигены, такие как MPT64 или MBP70, по-разному экспрессируются среди субштаммов БЦЖ. Таким образом, различные субштаммы БЦЖ кардинально отличаются по своим генетическим и фенотипическим свойствам, что обуславливает существенные различия в их вирулентности и иммуномодулирующих свойствах.
БЦЖ-1 является древним вакцинным субштаммом, наиболее близким к M. bovis AF2122/97 дикого типа [Keller, P.M., Böttger, E.C. & Sander, P. Tuberculosis vaccine strain Mycobacterium bovis BCG Russia is a natural recA mutant. BMC Microbiol 8, 120 (2008). https://doi.org/10.1186/1471-2180-8-120]. Он обладает высокой геномной стабильностью, в результате чего сохранил множество элементов присущих родительского штамму БЦЖ. Благодаря этому субштамм БЦЖ-1 обладает уникальными иммуногенными свойствами.
Авторы патента обнаружили, что субштамм БЦЖ-1 обладает максимальной ингибирующей способностью в отношении сигнального пути PD-1/PD-L1, по сравнению с другими штаммами БЦЖ. Причем эффект реализуется как in vitro, так и in vivo. Кроме того, было обнаружено, что при комбинировании ингибитора экспрессииPD-L1 на опухолевых клетках (БЦЖ-1), и агента блокирующего связывание PD-1/PD-L1 (антитела, блокирующие сигнальный путь PD-1/PD-L1) достигается потенциирование эффекта ингибирования сигнального пути PD-1/PD-L1, что в свою очередь приводит к многократному увеличению выживаемости животных в модели рака мочевого пузыря.
Разработанное техническое решение может использоваться для повышения эффективности адъювантной терапии рака мочевого пузыря (например, гамма-интерфероном), которое реализуется за счет уменьшения толерантности иммунной системы к опухолевым антигенам.
Настоящее изобретение представлено способом ингибирования сигнального пути PD-1/PD-L1 в раковых клетках мочевого пузыря путем взаимодействия с вакцинным штаммом Mycobacterium bovis БЦЖ-1. При этом способ ингибирования сигнального пути PD-1/PD-L1 в раковых клетках мочевого пузыря, в котором перед взаимодействием с Mycobacterium bovis вакцинный штамм БЦЖ-1, раковые клетки мочевого пузыря взаимодействуют с антителами, блокирующими сигнальный путь PD-1/PD-L1, чем достигается эффект потенциирования.
Кроме того, изобретение также представляет собой применение вакцинного штамма Mycobacterium bovis БЦЖ-1 для ингибирования сигнального пути PD-1/PD-L1 в раковых клетках мочевого пузыря.
Пример 1. Влияние БЦЖ на экспрессию PD-L1 в раковых летках мочевого пузыря in vitro.
Для данного эксперимента была выбрана клеточная линия переходно-клеточной карциномы мочевого пузыряRT4 (из коллекции ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). Клетки культивировали в среде RPMI 1640 (Hyclone)с добавлением 10% фетальной бычьей сыворотки (Hyclone), пенициллина/стрептомицина (Панэко), глутамина (Панэко) в инкубаторе при 37 °C, 5% CO2.
В день эксперимента клетки рассевали на два 12 луночных планшета в концентрации 106 клеток на лунку. Через 4 часа лиофилизированные микобактерии штамм БЦЖ-1 (вакцина Имурон-вак, производитель: филиал Медгамал ФГБУ «НИЦЭМ им Н.Ф. Гамалеи» Минздрава России) растворяли в стерильном фосфатно-солевом буферном растворе и добавляли в лунки каждого планшета в 3 повторах в концентрации 2*105 клеток/лунку. Также лиофилизированные микобактерии штамм Pasteur (из коллекции ФГБУ «НИЦЭМ им Н.Ф. Гамалеи» Минздрава России) растворяли в стерильном фосфатно-солевом буферном растворе и добавляли в лунки каждого планшета в 3 повторах в концентрации 2*105 клеток/лунку. В контрольные лунки каждого планшета добавляли стерильный фосфатно-солевой буфер (ФСБ) в 3 повторах. Оставшиеся 3 лунки были интактными.
Через 24 часа в одном планшете определяли жизнеспособность клеток путем окрашивания МТТ. Метод основан на способности МТТ восстанавливаться до окрашенного формазана в присутствии митохондриальных ферментов живых клеток. В каждую лунку планшета добавляли раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромида (МТТ) в фосфатно-солевом буфере до конечной концентрации 0,5 мг/мл. После 2-часовой инкубации из лунок удаляли среду и добавляли 150 мкл диметилсульфоксида. Далее измеряли оптическую плотность раствора формазана, при длине волны 590 нм, с помощью планшетного спектрофотометра. Затем определяли среднее значение в каждой группе. Выживаемость клеток подсчитывали путем деления значения в экспериментальной группе на значение, полученное в группе интактных клеток и умножения на 100. Результаты представлены на фиг.2. Как видно из представленных данных, выживаемость клеток, к которым добавляли БЦЖ-1 или БЦЖ Pasteur, достоверно не отличалась от выживаемости в контрольной группе (ФСБ).
Другой планшет использовали оценки экспрессии PD-L1. Нуклеиновые кислоты выделяли путем фенол-хлороформной экстракции, далее обрабатывали ДНКазой свободной от РНКаз. Выделенную и очищенную РНК использовали для получения кДНК (Reverse Transcriptionkit, Promega). Для определения экспрессии гена PD-L1 была проведена ПЦР в реальном времени. Уровень относительной экспрессии мРНК PD-L1 представлен на фиг.3.
Как видно из представленных данных между группой клеток, в которые добавляли БЦЖ Pasteur и контрольной группой клеток не наблюдалось статистически достоверной разницы в экспрессии PD-L1. Тогда как после добавления БЦЖ-1 экспрессия PD-L1 в клетках RT4 была достоверно снижена.
Таким образом, результаты данного эксперимента показывают, что Mycobacterium bovis штамм БЦЖ-1 (но не БЦЖ Pasteur) способны эффективно ингибировать сигнальный путь PD-1/PD-L1 в раковых клетках мочевого пузыря.
Пример 2. Влияние БЦЖ на экспрессию PD-L1 в раковых летках мочевого пузыря in vivo.
Для исследования была выбрана модель на лабораторных мышах линии C57BL/6, являющихся сингенными для клеточной линии рака мочевого пузыря МВ49 (mouse bladder-49). Клеточная линия МВ49 является на данный момент одной из наиболее востребованных в исследованиях, касающихся терапии рака мочевого пузыря. Данная линия клеток берет своё начало от канцероген-индуцированного рака эпителия мочевого пузыря мыши линии C57BL/6. Основное преимущество клеточной линии МВ49 состоит в сходстве с раковыми клетками мочевого пузыря человека, в частности – сходство в поверхностно-клеточных маркерах, чувствительности к апоптозу и иммунологическом профиле. Поскольку была выбрана ортотопическая модель необходимо было внутрипузырно инстиллировать опухолевые клетки МВ49 в мочевой пузырь мышей. За основу был взят протокол Chia-Suei Hung и соавт. (A murine model of urinary tract infection, Nature protocols, 2009, Vol4#8 1230-1242).
Для получения модели рака мочевого пузыря были использованы мыши линии C57/Bl6 весом 18 г. Перед началом работы все используемые инструменты (хирургические ножницы, пинцет), а также катетер для мочевого пузыря мыши были обработаны 70% этиловым спиртом и ультрафиолетовым излучением в ламинарном шкафу в течение 30 минут. Далее отмеряли необходимое количество катетера (около 3 см) и нанизывали его на иглу инсулинового шприца. Внешнюю сторону катетера смазывали стерильным вазелиновым маслом. Для анестезии животных использовали препараты Zoletil (действующие вещества тилетамин и золазепам) и Рометар (действующее вещество ксилазин). Препараты использовали из расчета Zoletil 45 мг/кг и Рометар 20 мг/кг.
Перед началом эксперимента готовили стоковый раствор наркоза, из расчета 100 мкл раствора на мышь. Препарат вводили внутримышечно. Миорелаксация и анальгезия наступали через 1-2 минуты. Глубокая седация наступала через 5 минут.
Перед началом катетеризации необходимо было освободить мочевой пузырь от остатков мочи, поскольку она может мешать введению жидкости через катетер. Для этого сгибали задние лапы животных и производили надавливание в область мочевого пузыря.
Далее животных переворачивали на спину и промывали паховую область дезинфицирующим раствором. Катетер вводили в мочеиспускательный канал в направлении сверху вниз вращательными движениями. Далее с помощью катетера внутрипузырно сначала вводили раствор поли-Д-лизина на 20 минут в количестве 100 мг/мышь, затем освобождали мочевой пузырь мыши от раствора поли-Д-лизина и вводили опухолевые клетки.
Клеточную линию MB49 культивировали на питательной среде DMEM с 10% фетальной бычьей сывороткой. В день эксперимента клетки снимали раствором Трипсина-ЭДТА и далее добавляли 5 мл свежей среды DMEM с 10% фетальной бычьей сывороткой (для инактивации фермента). Затем клеточную суспензию помещали в пробирку и центрифугировали (100g). Надосадочную жидкость удаляли, а осадок разводили в фосфатном буфере. Центрифугирование повторяли два раза, конечный объем суспензии составил 1 мл. Далее клетки подсчитывали в камере Горяева и делали стоковую клеточную суспензию. Животным через катетер вводили 50 мкл стоковой клеточной суспензии (1*106 кл/мышь).
Далее всех животных делили на группы по 5 мышей:
1) Внутрипузырные инстилляции ФСБ производили через 7 дней после имплантации опухолевых клеток;
2) Внутрипузырные инстилляции БЦЖ-1производили через 7 дней после имплантации опухолевых клеток;
3) Интактные животные.
Через 24 часа, животных усыпляли и выделяли мочевой пузырь. Орган гомогенизировали с ингибиторами РНКаз. Нуклеиновые кислоты выделяли путем фенол-хлороформной экстракции, далее обрабатывали ДНКазой свободной от РНКаз. Выделенную и очищенную РНК использовали для получения кДНК (Reverse Transcriptionkit, Promega). Для определения экспрессии гена PD-L1 была проведена ПЦР в реальном времени. Уровень относительной экспрессии мРНК PD-L1представлен на фиг.4.
Как видно из представленных данных, в группе животных, которым вводили БЦЖ-1 наблюдалось достоверное снижение экспрессии PD-1L.
Пример 3. Оценка эффекта потенциирования ингибирования сигнального пути PD-1/PD-L1 в группе животных с раком мочевого пузыря, которым вводили БЦЖ и/или антитела против PD-L1.
Для получения модели рака мочевого пузыря были использованы мыши линии C57/Bl6 весом 18 г. Перед началом работы все используемые инструменты (хирургические ножницы, пинцет), а также катетер для мочевого пузыря мыши были обработаны 70% этиловым спиртом и ультрафиолетовым излучением в ламинарном шкафу в течение 30 минут. Далее отмеряли необходимое количество катетера (около 3 см) и нанизывали его на иглу инсулинового шприца. Внешнюю сторону катетера смазывали стерильным вазелиновым маслом. Для анестезии животных использовали препараты Zoletil (действующие вещества тилетамин и золазепам) и Рометар (действующее вещество ксилазин). Препараты использовали из расчета Zoletil 45 мг/кг и Рометар 20 мг/кг.
Перед началом эксперимента готовили стоковый раствор наркоза, из расчета 100 мкл раствора на мышь. Препарат вводили внутримышечно. Миорелаксация и анальгезия наступали через 1-2 минуты. Глубокая седация наступала через 5 минут.
Перед началом катетеризации необходимо было освободить мочевой пузырь от остатков мочи, поскольку она может мешать введению жидкости через катетер. Для этого сгибали задние лапы животных и производили надавливание в область мочевого пузыря.
Далее животных переворачивали на спину и промывали паховую область дезинфицирующим раствором. Катетер вводили в мочеиспускательный канал в направлении сверху вниз вращательными движениями. Далее с помощью катетера внутрипузырно сначала вводили раствор поли-Д-лизина на 20 минут в количестве 100 мг/мышь, затем освобождали мочевой пузырь мыши от раствора поли-Д-лизина и вводили опухолевые клетки.
Клеточную линию MB49 культивировали на питательной среде DMEM с 10% фетальной бычьей сывороткой. В день эксперимента клетки снимали раствором Трипсина-ЭДТА и далее добавляли 5 мл свежей среды DMEM с 10% фетальной бычьей сывороткой (для инактивации фермента). Затем клеточную суспензию помещали в пробирку и центрифугировали (100g). Надосадочную жидкость удаляли, а осадок разводили в фосфатном буфере. Центрифугирование повторяли два раза, конечный объем суспензии составил 1 мл. Далее клетки подсчитывали в камере Горяева и делали стоковую клеточную суспензию. Животным через катетер вводили 50 мкл стоковой клеточной суспензии (1*106 кл/мышь).
Далее всех животных делили на группы по 20 мышей:
4) Инъекции Фосфатно-солевого буферного раствора (ФСБ) через 1, 7, 14 дней после имплантации опухолевых клеток и внутрипузырные инстилляции ФСБ через 2, 8, 15 дней после имплантации опухолевых клеток;
5) Внутрипузырные инстилляции БЦЖ через 2, 8, 15 дней после имплантации опухолевых клеток;
6) Инъекции антител против PD-L1 через 1, 7, 14 дней после имплантации опухолевых клеток;
7) Инъекции антител против PD-L1 через 1, 7, 14 дней после имплантации опухолевых клеток и внутрипузырные инстилляции БЦЖ через 2, 8, 15 дней после имплантации опухолевых клеток.
Выживаемость животных оценивали в течение 60 дней.
Результаты эксперимента представлены на фиг.5.
Как видно из представленных данных, к 60 дню эксперимента все мыши в контрольной группе погибли, тогда как в группе животных, которым вводили БЦЖ-1 или антитела против PD-L1 выживаемость составила 30% или 20%, соответственно. В группе животных, которым вводили оба терапевтических средства БЦЖ-1 и антитела против PD-L1, наблюдался эффект потенциирования ингибирования сигнального пути PD-1/PD-L1, который приводил к повышению выживаемости животных в данной группе до 95%.
Промышленная применимость
Разработанный способ уменьшения экспрессии PD-L1 в раковых клетках мочевого пузыря может быть использован при разработки новых лекарственных средств против рака мочевого пузыря, а также новых схем лечения рака мочевого пузыря.
| название | год | авторы | номер документа |
|---|---|---|---|
| ABX196 ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2018 |
|
RU2778812C2 |
| КОМБИНАЦИЯ ТАСКВИНИМОДА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ И ИНГИБИТОРА PD-1 И/ИЛИ PD-L1 ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2742373C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ НЕОПЛАЗМЫ МОЧЕВЫХ ПУТЕЙ | 2017 |
|
RU2766358C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТАМИ СИГНАЛЬНОГО ПУТИ PD-1, И ТАКСАНОВ | 2014 |
|
RU2719487C2 |
| ИНГИБИТОР КОНТРОЛЬНЫХ ТОЧЕК И ЦЕЛЬНОКЛЕТОЧНАЯ МИКРОБАКТЕРИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ ПРИ ЛЕЧЕНИИ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2014 |
|
RU2719934C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К PD-L1 | 2017 |
|
RU2665790C1 |
| БИОМАРКЕРЫ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С PD-1 И PD-L1 СОСТОЯНИЙ | 2014 |
|
RU2820869C1 |
| ПРОТИВОТУБЕРКУЛЕЗНАЯ ВАКЦИНА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2004 |
|
RU2342400C2 |
| ИНГИБИТОР КОНТРОЛЬНЫХ ТОЧЕК И ЦЕЛЫЕ КЛЕТКИ МИКОБАКТЕРИЙ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ РАКА | 2016 |
|
RU2733033C2 |
| БИОМАРКЕРЫ И СПОСОБЫ ЛЕЧЕНИЯ СВЯЗАННЫХ С PD-1 И PD-L1 СОСТОЯНИЙ | 2014 |
|
RU2701378C2 |


Изобретение относится к биотехнологии. Описан способ ингибирования сигнального пути PD-1/PD-L1 в раковых клетках мочевого пузыря путем взаимодействия с вакцинным штаммом Mycobacterium bovis БЦЖ-1. Технический результат заключается в повышении эффективности адъювантной терапии рака мочевого пузыря. Указанный технический результат достигается тем, что использован вакцинный штамм Mycobacterium bovis БЦЖ-1. При этом указанный способ может осуществляться как in vitro, так и in vivo. Разработанный способ уменьшения экспрессии PD-L1 в раковых клетках мочевого пузыря может быть использован при разработке новых лекарственных средств против рака мочевого пузыря, а также новых схем лечения рака мочевого пузыря. 3 з.п. ф-лы, 5 ил., 3 пр.
1. Способ ингибирования сигнального пути PD-1/PD-L1 в раковых клетках мочевого пузыря путем взаимодействия с вакцинным штаммом Mycobacterium bovis БЦЖ-1.
2. Способ по п.1, при котором in vitro происходит уменьшение экспрессии PD-L1.
3. Способ по п.1, при котором in vivo происходит уменьшение экспрессии PD-L1.
4. Способ по п.3, в котором перед взаимодействием с вакцинным штаммом Mycobacterium bovis БЦЖ-1 раковые клетки мочевого пузыря взаимодействуют с антителами, блокирующими сигнальный путь PD-1/PD-L1.
| WO 2022049001 A1, 10.03.2022 | |||
| RU 2018102547 A, 24.07.2019 | |||
| А.И | |||
| ГОРЕЛОВ, А.С | |||
| СИМБИРЦЕВ и др., Ингибиторы PD-1/PD-L1 в лечении рака мочевого пузыря: от медиатора иммунного ответа к таргетной терапии, УРОЛОГИЧЕСКИЕ ВЕДОМОСТИ, 2018, Том 8, N2, стр.64-72. |
Авторы
Даты
2024-02-02—Публикация
2023-10-03—Подача