Изобретение относится к области фторорганической химии, а именно к способу получения полифторированного гидроксиэфира, который может найти применение в качестве поверхностно-активного вещества, модификатора полимерных материалов для повышения термической и гидролитической устойчивости, огне-, свето- и износостойкости, придания масло- и водоотталкивающих свойств.
Известен способ получения гидроксиэфиров реакцией переэтерификации диэтоксиорганопроизводных кремния гликолями при повышенной температуре с одновременной отгонкой этанола при 150-180°С (А.с. 305172, МПК C08G31/32. Опубл. 04.06.1971).
К недостаткам указанного способа относятся малая гидрофобность получаемого гидроксиэфира, многостадийность процесса, технологические сложности, заключающиеся в необходимости отгонки спирта, высокая температура.
Известен способ получения гидроксиэфиров реакцией стереоселективного восстановления кетогруппы дигидроксикетопредшественнике с последующей селективной этерификацией первичного гидроксила, либо селективную этерификацию первичного гидроксила дигидроксикетопредшественника с последующим стереоселективным восстановлением кетогруппы (Пат. 2266961 РФ, МПК С12Р7/62, С07С69/675, C12N9/20. Опубл. 27.12.2005).
К недостаткам указанного способа относятся применение мультиферментных систем и дрожжевых препаратов, затрудняющих выделение и очистку конечного продукта.
Известен способ получения гидроксиэфира взаимодействием спирта, эпихлоргидрина и амина (А.с. 1574587, МПК С07С217/00, C07D295/08. Опубл. 30.06.1990).
К недостаткам указанного способа относятся малая гидрофобность получаемого гидроксиэфира, необходимость введения в реакционную массу амина, технологические сложности, заключающиеся в необходимости охлаждения реакционной смеси льдом для последующего отфильтровывания образовавшегося гидрохлорида амина.
Известен способ получения гидроксиэфира реакцией диметилацетиленилкарбинола с окисью этилена в присутствии третичных оснований в качестве катализаторов (А.с. 76370, МПК C07C 43/178, C07C 41/03. Опубл. 01.01.1949).
К недостаткам указанного способа относятся высокая температура процесса, приводящая к частичной дегидратации образующегося гидроксиэфира, необходимость использования автоклавного оборудования, длительность процесса.
Известен способ получения гидроксиэфира конденсацией гидроксилсодержащих соединений (алифатическими спиртами, эфирами этиленгликолей и т.д.) в жидкой фазе с окисью этилена (Пат. 2063955 РФ, МПК C07C41/02, C07C43/02. Опубл. 20.07.1996).
К недостаткам указанного способа относятся технологические трудности, связанные с подачей исходных веществ и отвода реакционной массы из вертикального вытеснительного аппарата колонного типа.
Известны способы получения полифторированных гидроксиэфиров взаимодействием фторсодержащего спирта и эпоксидов различного химического строения (Кнунянц И. Л., Кильдишева О. В., Петров И. П. О Взаимодействии алифатических окисей с фтористым водородом // Журнал общей химии. 1949. Т. 19. Вып. 1. С. 95-100; Синтезы фторорганических соединений. (Мономеры и промежуточные продукты) // Под ред. акад. И. Л. Кнунянца и Г. Г. Якобсона. М. Химия. 1977. 251 с.).
К недостаткам указанных способов относятся высокая температура процесса и продолжительность реакции, образование побочных продуктов.
Известен способ получения полифторированных гидроксиэфиров присоединением полифторированных спиртов к окиси этилена в присутствии гидроксида калия (Brey M. L., Tarrant P. The preparation and properties of some vinyl and glycidyl fluoroethers // Journal of the American Chemical Society. 1957, V. 79. No 24. Р. 6533-6536).
К недостаткам указанного способа относятся применение гигроскопичного гидроксида калия, автоклавного оборудования и необходимости охлаждения смесью сухого льда и ацетона.
Известны способы получения полифторированных гидроксиэфиров взаимодействием полифторированных спиртов и эпоксидов (Sianesi D., Pasetti A., Tarli F. The chemistry of hexafluoropropene epoxide // The Journal of Organic Chemistry. 1966. V. 31. No 7. Р. 2312-2316; Sianesi D., Pasetti A., Tarli F. Derivatives of fluorinated carboxylic acids and process for their preparation. Patent US 3535369. 1970).
К недостаткам указанных способов относятся применение гигроскопичного гидроксида натрия, пожаровзрывоопасных растворителей, образование побочных продуктов олигомеризации эпоксидов.
Известен способ получения полифторированных гидроксиэфиров взаимодействием диэпоксида со спиртом в присутствии каталитических количеств эфирата трифторида бора (Církva V., Gaboyard M., Paleta O. Fluorinated epoxides: 5. Highly selective synthesis of diepoxides from α,ω-diiodoperfluoroalkanes. Regioselectivity of nucleophilic epoxide-ring opening and new amphiphilic compounds and monomers // Journal of Fluorine Chemistry. 2002. No 102. P.349-361).
К недостаткам указанного способа относятся применение пожаровзрывоопасных растворителей и образование побочных продуктов олигомеризации эпоксида.
Наиболее близким является способ получения полифторированного гидроксиэфира взаимодействием полифторалкилсодержащих эпоксидов с 2,2,3,3-тетрафторпропан-1-олом в основной среде (Бажин Д. Н. Синтез и свойства полифторалкилсодержащих оксиранов: диссертация ... кандидата химических наук: 02.00.03; [Место защиты: Ур. гос. техн. ун-т].- Екатеринбург. 2009. 150 с.).
К недостаткам указанного способа относятся применение металлического натрия, методики межфазного катализа, токсичных, пожаровзрывоопасных растворителей и катализаторов (эфирата трифторида бора), образование побочных олигомерных продуктов, многостадийность процесса, сложности выделения продукта реакции, высокая температура реакции.
Задача: разработка технологичного способа получения полифторированного гидроксиэфира с повышенной гидрофобизирующей способностью, обладающего многофункциональными свойствами.
Техническим результатом заявляемого способа является повышение выхода продукта реакции, ускорение реакции и мягкие условия ее протекания, а также упрощение реакции за счет отказа от использования токсичных и пожаровзрывоопасных растворителей и катализаторов.
Поставленный технический результат достигается в способе получения полифторированного гидроксиэфира общей формулы
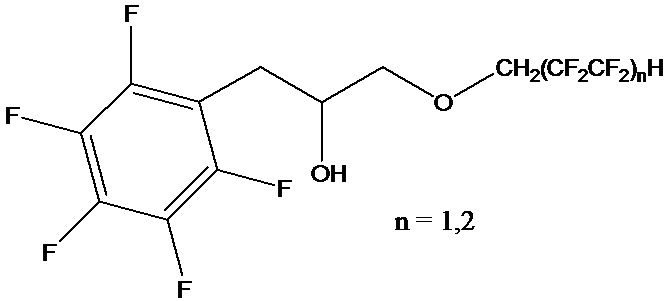 ,
,
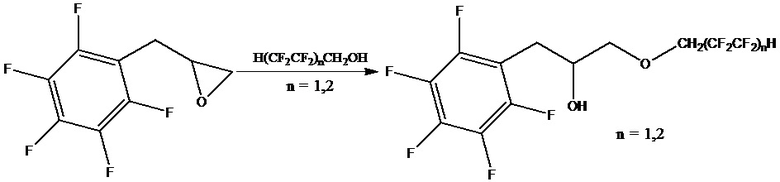
включающем обработку эпоксида полифторированным спиртом при нагревании, с последующим отделением продукта реакции, при этом в качестве эпоксида используют 2-(пентафторбензил)оксиран, а реакцию ведут в запаянной ампуле при 80°С, под воздействием ультразвука частотой 40 кГц в течение 5 часов в присутствии органомодифицированного монтмориллонита с полифторалкильными группами при мольном соотношении 2-(пентафторбензил)оксирана, полифторированного спирта и органомодифицированного монтмориллонита равном 1:1:0,1, соответственно.
К преимуществам заявленного способа получения полифторированного гидроксиэфира следует отнести проведение процесса обработки эпоксида полифторированным спиртом при более низких температурах в отсутствии растворителей, вследствие чего наблюдается снижение доли побочных процессов дегидратации и дегидрофторирования, и повышается выход целевых продуктов.
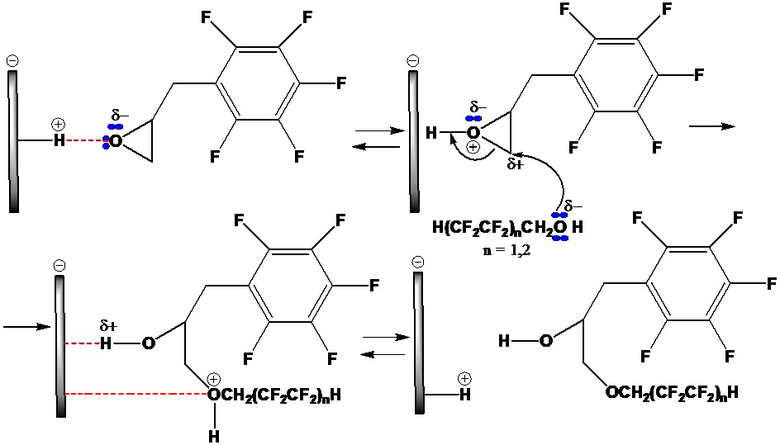
Уменьшение времени реакции и температуры проведения процесса обусловлено каталитическим влиянием органомодифицированного монтмориллонита с полифторалкильными группами, который являясь кислотой Бренстеда способствует протонированию 2-(пентафторбензил)оксирана с последующей нуклеофильной атакой (по механизму бимолекулярного нуклеофильного замещения SN2) на менее замещенный атом углерода эпоксида, завершающаяся депротонированием продукта:
Входящие в состав органомодифицированного монтмориллонита с полифторалкильными группами полифторированные алкоголяты металлов (преимущественно Na+), которые образуются in situ при получении органомодифицированного монтмориллонита, способны (по механизму SN2) участвовать в раскрытии эпоксидного цикла:
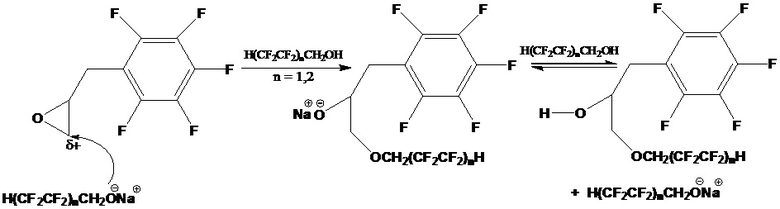
Получение полифторированного гидроксиэфира наиболее эффективно при 80°С в течение 5 часов при частоте ультразвука 40 кГц и заданном мольном соотношении эпоксида, полифторированного спирта и органомодифицированного монтмориллонита с полифторалкильными группами 1:1:0,1 соответственно, что приводит к отсутствию побочных реакций олигомеризации эпоксида, дегидратации и дегидрофторирования полифторированного спирта и конечного продукта, обеспечивает получение полифторированного гидроксиэфира с повышенной гидрофобизирующей способностью, обладающего многофункциональными свойствами, обусловленное наличием в его структуре одновременно реакционноспособной гидрофильной гидроксильной и гидрофобной полифторалкильной групп, способных вступать в химические и физико-химические превращения с макромолекулами полимеров при введении в их состав полифторированного гидроксиэфира, сообщая им повышенную термическую и гидролитическую устойчивость, огне-, свето- и износостойкость, масло- и водоотталкивающие свойства.
Заявленный способ осуществляется следующим образом.
В ампулу помещают эпоксид, полифторированный спирт и органомодифицированный монтмориллонит с полифторалкильными группами, которые нагревают до 80°С и выдерживают 5 часов при ультразвуковом диспергировании, затем отделяют образовавшийся продукт.
Способ получения полифторированного гидроксиэфира иллюстрируется следующими примерами.
Пример 1. 1-(перфторфенил)-3-(2,2,3,3-тетрафторпропокси)пропан-2-ол. В стеклянную ампулу помещают 1 моль (161 мл) 2-(пентафторбензил)оксирана, 1 моль (91 мл) 2,2,3,3-тетрафторпропан-1-ол (n = 1) и 0,1 моль (0,24 г) органомодифицированного монтмориллонита с полифторалкильными группами, предварительно полученный по примеру 3. Ампулу запаивают и термостатируют при 80°С в течение 5 ч при частоте ультразвука 40 кГц. Реакционную массу после термостатирования подвергают фракционной вакуумной перегонке с извлечением непрореагировавших компонентов и продукта реакции. Выход продукта 64 %. Соломенно-желтое маслообразное вещество. Т. кип. 81-83°С (10 мм рт. ст). Степень превращения полифторированного спирта 71 %. ИК спектр (в тонком слое), см-1: 3451-3547 (νО-Н), 2804-2817 (νC-Н), 1193-1224 (νC-F).
Пример 2. 1-(2,2,3,3,4,4,5,5-октафторпентилокси)-3-(перфторфенил)-пропан-2-ол. В стеклянную ампулу помещают 1 моль (161 мл) 2-(пентафторбензил)оксирана, 1 моль (139 мл) 2,2,3,3,4,4,5,5-октафторпентан-1-ол (n = 2) и 0,1 моль (0,24 г) органомодифицированного монтмориллонита с полифторалкильными группами, предварительно полученный по примеру 4. Далее процесс ведут по примеру 1. Выход продукта 48 %. Желтое маслообразное вещество. Т. кип. 88-91°С (10 мм рт. ст). Степень превращения полифторированного спирта 60 %. ИК спектр (в тонком слое), см-1: 3448-3541 (νО-Н), 2802-2824 (νC-Н), 1191-1220 (νC-F).
Был использован органомодифицированный монтмориллонит с полифторалкильными группами в виде смеси трех основных фракций: 50-100 нм - 10 % масс., менее 1 мкм - 80 % масс., менее 10 мкм - 10 % масс.
Получение органомодифицированного монтмориллонита с полифторалкильными группами иллюстрируется следующими примерами.
В стеклянную ампулу помещают монтмориллонит и полифторированный спирт, которые затем термостатируют. Полученный продукт выдерживают под вакуумом в течение 60 мин.
Пример 3. В стеклянную ампулу помещают 100 масс. ч. монтмориллонита и 8 масс. ч. 2,2,3,3-тетрафторпропан-1-ола (n = 1). После чего, указанную смесь термостатируют при температуре 120°С в течение 60 мин. Полученный органомодифицированный монтмориллонит с полифторалкильными группами выдерживают под вакуумом при 25°С в течение 60 мин.
Органомодифицированный монтмориллонит с полифторалкильными группами (n = 1). ИК спектр, см-1: 2801-2812 (νC-Н), 1193-1216 (νC-F). Рентгенофазовый анализ: содержание алкоголятной фазы 81 % об.
Пример 4. В стеклянную ампулу помещают 100 масс. ч. монтмориллонита и 8 масс. ч. 2,2,3,3,4,4,5,5-октафторпентан-1-ола (n = 2). Далее процесс ведут по примеру 3.
Органомодифицированный монтмориллонит с полифторалкильными группами (n = 2). ИК спектр, см-1: 2800-2829 (νC-Н), 1190-1207 (νC-F). Рентгенофазовый анализ: содержание алкоголятной фазы 93 % об.
ИК спектры веществ снимали на спектрометре «Specord-M82» (Carl Zeiss). Рентгенофазовый анализ проводили на дифрактометре ДРОН-3, излучение CuK? (λ = 1,5418 Å).
Использовались промышленно производимые полифторированные спирты-теломеры 2,2,3,3-тетрафторпропан-1-ол HCF2CF2CH2OH и 2,2,3,3,4,4,5,5-октафторпентан-1-ол H(CF2CF2)2CH2OH, соответствующие ТУ 2421-151-05807960-2005 (АО «ГалоПолимер Пермь»). 2-(пентафторбензил)оксиран (ЗАО «ПиМ Инвест», Москва) имел т. кип. 75-77°С (10 мм рт. ст). Высокодисперсный натриевый монтмориллонит обладал емкостью катионного обмена 100 мг-экв/100 г (ТОО «B-Clay», Казахстан).
Таким образом, способ получения полифторированного гидроксиэфира заявленной формулы, заключающийся в обработке 2-(пентафторбензил)оксирана полифторированным спиртом в запаянной ампуле при 80°С, под воздействием ультразвука частотой 40 кГц в течение 5 часов в присутствии органомодифицированного монтмориллонита с полифторалкильными группами при мольном соотношении 2-(пентафторбензил)оксирана, полифторированного спирта и органомодифицированного монтмориллонита равном 1:1:0,1, соответственно, с последующим отделением продукта реакции, обеспечивает повышение выхода продукта реакции, ускорение реакции и мягкие условия ее протекания, а также упрощение реакции за счет отказа от использования токсичных и пожаровзрывоопасных растворителей и катализаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ каталитического N-полифторалкилирования полиэтиленполиамина полифторированным спиртом | 2024 |
|
RU2830371C1 |
| Способ получения органомодифицированного монтмориллонита с полифторалкильными группами | 2016 |
|
RU2626414C1 |
| Способ получения органомодифицированного монтмориллонита с полифторалкильными группами | 2023 |
|
RU2807191C1 |
| Способ получения органомодифицированного монтмориллонита с полифторалкильными группами | 2016 |
|
RU2629300C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОСТЫХ ПОЛИФТОРАЛКИЛОВЫХ ЭФИРОВ | 2007 |
|
RU2346926C1 |
| Эксфолиированный полиуретановый нанокомпозит с полифторалкильными группами | 2016 |
|
RU2711458C2 |
| СПОСОБ МОДИФИКАЦИИ МОНТМОРИЛЛОНИТА | 2010 |
|
RU2430883C1 |
| КОМПОЗИЦИОННЫЙ АНТИФРИКЦИОННЫЙ ТВЕРДЫЙ СМАЗОЧНЫЙ МАТЕРИАЛ | 2010 |
|
RU2444562C1 |
| Фторсодержащая полиамидная композиция с пониженной горючестью | 2016 |
|
RU2637955C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОРГАНОФИЛЬНОЙ САПОНИТОВОЙ ГЛИНЫ | 2024 |
|
RU2837427C1 |
Настоящее изобретение относится к способу получения полифторированного гидроксиэфира общей формулы 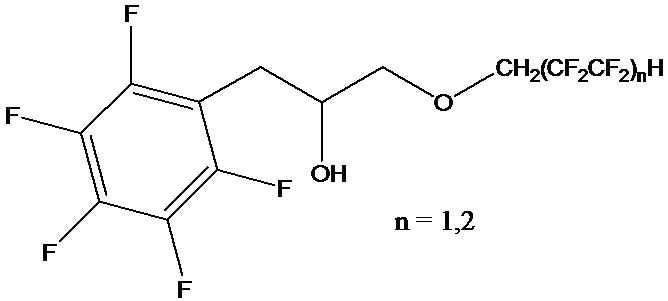 , включающему обработку эпоксида полифторированным спиртом при нагревании, с последующим отделением продукта реакции, в качестве эпоксида используют 2-(пентафторбензил)оксиран, а реакцию ведут в запаянной ампуле при 80 °С, под воздействием ультразвука частотой 40 кГц в течение 5 ч в присутствии органомодифицированного монтмориллонита с полифторалкильными группами при мольном соотношении 2-(пентафторбензил)оксирана, полифторированного спирта и органомодифицированного монтмориллонита равном 1:1:0,1, соответственно. Технический результат: разработка нового способа получения полифторированного гидроксиэфира с высоким выходом, характеризующегося ускоренным протеканием реакции в более мягких условиях, а также не требующим использования токсичных и пожаровзрывоопасных растворителей и катализаторов. 4 пр.
, включающему обработку эпоксида полифторированным спиртом при нагревании, с последующим отделением продукта реакции, в качестве эпоксида используют 2-(пентафторбензил)оксиран, а реакцию ведут в запаянной ампуле при 80 °С, под воздействием ультразвука частотой 40 кГц в течение 5 ч в присутствии органомодифицированного монтмориллонита с полифторалкильными группами при мольном соотношении 2-(пентафторбензил)оксирана, полифторированного спирта и органомодифицированного монтмориллонита равном 1:1:0,1, соответственно. Технический результат: разработка нового способа получения полифторированного гидроксиэфира с высоким выходом, характеризующегося ускоренным протеканием реакции в более мягких условиях, а также не требующим использования токсичных и пожаровзрывоопасных растворителей и катализаторов. 4 пр.
Способ получения полифторированного гидроксиэфира общей формулы
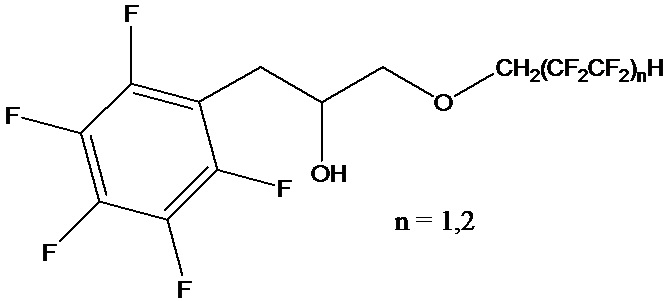 ,
,
включающий обработку эпоксида полифторированным спиртом при нагревании, с последующим отделением продукта реакции, отличающийся тем, что в качестве эпоксида используют 2-(пентафторбензил)оксиран, а реакцию ведут в запаянной ампуле при 80 °С, под воздействием ультразвука частотой 40 кГц в течение 5 ч в присутствии органомодифицированного монтмориллонита с полифторалкильными группами при мольном соотношении 2-(пентафторбензил)оксирана, полифторированного спирта и органомодифицированного монтмориллонита равном 1:1:0,1, соответственно.
| БАЖИН Д | |||
| Н | |||
| Синтез и свойства полифторалкилсодержащих оксиранов: дис | |||
| - Уральский государственный технический университет, 2009, автореферат | |||
| GALLO J | |||
| M | |||
| R., TEIXEIRA S., SCHUCHARDT U | |||
| Synthesis and characterization of niobium modified montmorillonite and its use in the acid-catalyzed synthesis of β-hydroxyethers | |||
| Applied Catalysis A: General, |
Авторы
Даты
2024-02-15—Публикация
2023-11-17—Подача