Область изобретения
Настоящее изобретение относится к области здравоохранения. Более конкретно изобретение относится к применению гексапептида для снижения уровней внеклеточного белка HMGB1 при воспалительных заболеваниях.
Сведения о предшествующем уровне техники
HMGB1 (англ. high-mobility group box 1; рус. бокс 1 группы высокой мобильности; также известный как HMG1; HMG-1; HMG 1; amphoterin; p30), представляет собой высококонсервативный белок с высокой электрофоретической подвижностью из группы ядерных негистоновых белков HMG (группы высокой мобильности), имеющий молекулярную массу около 30 кДа. Биологические свойства HMGB1 зависят от его локализации. В норме HMGB1 локализован в ядре клеток благодаря двум сайтам ядерной локализации NLS1 (28-44aa) и NLS2 (179-185aa) в виде комплексов с ДНК. Однако, под действием провоспалительных стимулов остатки лизина в сайтах NLS1 и NLS2 подвергаются пост-трансляционному ацетилированию, после чего HMGB1 теряет положительный заряд, его комплексы с ДНК разрушаются, HMGB1 переходит в цитоплазму и далее во внеклеточную среду. Bonaldi T et al. EMBO J. 2003, 22(20):5551-60. Внеклеточный HMGB1 играет роль мощного медиатора воспаления, который может взаимодействовать по меньшей мере с двенадцатью рецепторами (TLR2, TLR4, TLR9, RAGE, Integrin (Mac-1 αVβ3), α-synuclein, proteoglycans, CD24, TIM-3, CXCR4, NMDAR, TREM1) и высокие уровни которого способствуют прогрессу многих, если не всех аутоиммунных заболеваний, и являются ключевым фактором, который вызывает дальнейшее воспаление и ухудшает симптомы воспалительного заболевания. Gorgulho C.M. et al. Front Immunol. 2019, 10:1561. Kang R. et al. Mol Aspects Med. 2014, 40:1-116. Роль внеклеточного HMGB1 как медиатора воспаления установлена при многих заболеваниях, включая заболевания респираторной системы, такие как хронический риносинусит, аллергический ринит, астма, хроническое обструктивное заболевание легких (ХОБЛ), острый респираторный дистресс-синдром (ОРДС), муковисцидоз, пневмония, рак легких; такие заболевания почек как гломерулонефрит, волчаночный нефрит, диабетическая нефропатия, аутосомно-доминантный поликистоз почек, хроническая дисфункция аллотрансплантата, хроническая болезнь почек; такие заболевания сердечно-сосудистой системы, как сердечная недостаточность, острый коронарный синдром; такие заболевания сосудов, как системный васкулит, атеросклероз, аневризма брюшной аорты; такие заболевания пожелудочной железы, как панкреатит, рак поджелудочной железы; такие заболевания центральной нервной системы, как рассеянный склероз, боковой амиотрофический склероз, оптический нейромиелит, невропатическая боль, менингит, черепно-мозговая травма, расстройства аутического спектра; такие заболевания печени, как вирусный гепатит, неалкогольная жировая болезнь печени, фиброз печени, гепатоцеллюлярная карцинома, и травма печени, вызванная лекарственными препаратами; такие метаболические заболевания как сахарный диабет 2 типа, осложнения диабета, ожирение; такие заболевания пищеварительной системы, как пародонтит, гастрит, воспаление кишечника, колоректальный рак, травма слизистой оболочки желудка, рак желудка; такие аутоиммунные заболевания как ревматоидный артрит, системная красная волчанка, миозит, сахарный диабет 1 типа; такие инфекционные заболевания, как сепсис, H1N1 2009, COVID-19, ВИЧ-1, туберкулез, гепатит Б; травма, в том числе ожоговая травма, механическая травма. Kang R et al. Mol Aspects Med. 2014, 40:1-116. HMGB1 вносит вклад в тромбоз глубоких вен и синдром диссиминированного внутрисосудистого свертывания. Dyer M.R. et al. Sci Rep. 2018, 8(1):2068. Vogel S. et al. J Clin Invest. 2015, 125(12):4638-54. Stark K. et al. Blood. 2016, 128(20):2435-2449. Wu H. et al. Cell Physiol Biochem. 2018, 47(4):1319-1337. Таким образом, существует необходимость в эффективных и безопасных агентах, снижающих уровни внеклеточного HMGB1 для лечения вышеуказанных воспалительных, аутоиммунных, и онкологических заболеваний.
Уровни внеклеточного HMGB1 у млекопитающих могут регулироваться опиоидами. Селективный агонист мю (μ) опиоидных рецепторов морфин вызывал у млекопитающих повышение уровней внеклеточного HMGB1. Qian J et al. Neurotherapeutics. 2020, 17(2):722-742. Grace P.M. et al. Brain Behav Immun. 2018, 72:45-50. Zhang P. et al. Front Immunol. 2020, 11:1455. Селективный агонист дельта (δ) опиоидных рецепторов пентапептид DADLE (D-Ala2, D-Leu5]-enkephalin), напротив, снижал уровни внеклеточного HMGB1 при введении в высокой дозе 5 мг/кг. Tang C.W. et al. Tohoku J Exp Med. 2011, 224(1):69-76.
Гексапептид H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH является смешанным агонистом дельта (δ) и мю (μ) опиоидных рецепторов. Yarygin KN. Collect. Czech. Chem. Commun. 1990, 55:2328. Гексапептид используется в форме нетоксичных солей с кислотами, преимущественно в форме ацетата, для лечения заболеваний пищеварительной системы, в частности острого панкреатита, язв желудка и двенадцатиперстной кишки, с историей клинического применения более 30 лет. Гексапептид имеет широкий спектр биологической активности в диапазоне доз от 1 до 1000 мкг/кг массы тела млекопитающего. Применение гексапептида раскрыто в патентах RU 2032422, 2241488, 2198641, 2104717, 2270025, 2351334, 2343885, 2405534, 2363455, 2515550, 2180598, 2635083, 2436588, 2473325, 2144831, 2646569, 2200026, 2146530, 2155608, 2185176, 2139725, 2266130, 2326661, 2299742, 2218896, 2416398, 2318503, 2430753, 2299438, 2258529, 2099077, 2122415, 2261713, 2006039, 2366416, 2228762, 2185849, 2496493, 2366417, 2017488, 2167671, 2181564, 2284192, 2290203, 2286793, 2366432, 2299065, 2429002, 2196603, 2142814, 2285522, 2203693, 2230549, 2180591, 2142736, 2113856, 2217139, 2266752, 2261722, 2362580, 2223741, 222814869, 2217186, 2266130, 2326661, 2299742, 2218896, 2657416, 2416398, 2318503, 2430753, 2299438, 2258529, 2099077, 2122415, 2261713, 2006039, 2366416 2728821, 2278938, 2733269, 2737799, 2737800, 2739573. Однако способность гексапептида H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH снижать уровни внеклеточного HMGB1 неизвестна из уровня техники.
Авторы настоящего изобретения неожиданно обнаружили, что введение гексапептида H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH млекопитающим снижает уровни внеклеточного HMGB1 при воспалении, причем этот эффект наблюдался в низкой дозе 0,1 мг/кг, что в 50 раз меньше эффективной дозы 5 мг/кг пентапептида DADLE (Tang CW et al. 2011), несмотря на примерно равную афинность гексапептида и DADLE к δ-опиоидным рецепторам и дополнительное наличие у гексапептида H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH μ-опиоидной активности, которая должна была бы приводить к повышению уровней внеклеточного HMGB1 в свете публикаций Qian J. et al. 2020, Grace P.M. et al. 2018 и Zhang P. et al. 2020. Таким образом, нами обнаружена высокая функциональная селективность гексапептида H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH в отношении снижения уровней внеклеточного HMGB1, неожиданная в свете Qian J. et al. 2020; Grace P.M. et al. 2018; Zhang P. et al. 2020; и Tang C.W. et al. 2011. Функциональная селективность, определяемая также как «лиганд-зависимая эффективность», широко известна из уровня техники для G-белок-сопряженных рецепторов (GPCR), к которым относятся опиоидные рецепторы. Лиганд-зависимая эффективность основана на том, что GPCR рецептор может существовать в нескольких конформационных состояниях, поэтому связываясь с рецептором, индивидуальные агонисты могут инициировать селективные, отличающиеся конформации рецептора, которые, в свою очередь, могут активировать выборочно один из нескольких нижестоящих сигнальных путей, что может приводить к разным биологическим ответам для разных агонистов одного и того же рецептора. Pradhan A.A. et al. Br J Pharmacol. 2012, 167(5):960-9. Vicente-Sanchez A and Pradhan A.A. Handb Exp Pharmacol. 2018, 247:73-85. Galandrin S. et al. Trends Pharmacol Sci. 2007, 28(8):423-30. Согласно текущим представлениям, из-за существования явления функциональной селективности наличие афинности к определенному рецептору является недостаточным для обоснованного ожидания определенного биологического эффекта, и требуется специальный анализ связанных с рецептором нижележащих сигнальных путей. Kenakin T, Christopoulos A. Nat Rev Drug Discov. 2013, 12(3):205-16. Morse M et al. BMC Pharmacol Toxicol. 2013, 14:17. Публикации Qian J. et al. 2020; Grace P.M. et al. 2018; Zhang P. et al. 2020; и Tang C.W. et al. 2011 не содержат сведений о конформациях рецепторов и сигнальных путях, приводящих селективно к модуляции уровней HMGB1 у млекопитающих и, таким образом, высокая функциональная селективность гексапептида H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH в снижении уровней внеклеточного HMGB1 является неожиданной в контексте Qian J et al. 2020; Grace PM et al. 2018; Zhang P et al. 2020; и Tang CW et al. 2011.
Описание изобретения
Настоящее изобретение относится к гексапептиду формулы (I): H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH (I) или его фармацевтически приемлемой соли для использования в снижении уровней внеклеточного HMGB1 в млекопитающем, нуждающемся в этом.
Кроме того, настоящее изобретение относится к способу снижения уровней внеклеточного HMGB1 в млекопитающем, нуждающемся в этом, включающему введение этому млекопитающему эффективного количества гексапептида формулы (I): H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH (I) или его фармацевтически приемлемой соли.
Техническим результатом настоящего изобретения является то, что введение гексапептида формулы (I) млекопитающему эффективно снижает уровни внеклеточного HMGB1, медиатора воспаления, ухудшающего течение воспалительного заболевания.
Гексапептид формулы (I) имеет химическое название тирозил-D-аланил-глицил-фенилаланил-лейцил-аргинин, брутто-формулу C35H51N9O8, молекулярную массу 725,84 дальтон и регистрационный номер CAS 81733-79-1 в качестве идентификатора.
Настоящее изобретение относится ко всем фармацевтически приемлемым солям и сольватам гексапептида формулы (I). Неисключительные примеры таких фармацевтически приемлемых солей включают хлорид, бромид, сульфат, ацетат, пируват, сукцинат, малат, фумарат и цитрат. В предпочтительном варианте осуществления изобретения, фармацевтически приемлемой солью гексапептида формулы (I) является ацетат.
Гексапептид формулы (I) может быть получен любым способом, известным в данной области, в частности твердофазным синтезом. Гексапептид формулы (I), его соли и сольваты коммерчески доступны, например, в каталоге Bachem № 4030569.0100. Гексапептид (I) ацетат представляет собой коммерчески доступный активный фармацевтический ингредиент, который выпускается несколькими производителями в Российской Федерации.
Термин «HMGB1» относится к нативному белку бокс 1 группы высокой мобильности (англ. high-mobility group box 1), также известному как HMG1, HMG-1, HMG 1, amphoterin, и p30), сокращеное общепринятое наименование HMGB1, любого вида, включая мышь, крысу, собаку, кошку, лошадь, и человека, предпочтительно человека, а также к любым посттрансляционным модификациям HMGB1, включая без ограничения модификации полученные ацетилированием, фосфорилированием, метилированием, окислением, восстановлением, а также дисульфидные прозводные HMGB1 со связью -S-S-, или производные HMGB1 с восстановленны vb группами -SH.
Термин «внеклеточный HMGB1» относится к белку HMGB1, который находится во внеклеточной среде. Неэксклюзивные примеры внеклеточной среды включают любую внеклеточную жидкость, в том числе цельную кровь, плазму крови, сыворотку крови, лимфу, мокроту респираторного тракта, бронхолегочную жидкость, интерстициальную (тканевую) внеклеточную и внесосудистую жидкость, цереброспинальную жидкость, синовиальную жидкость, слезу и слюну.
При осуществлении изобретения, уровни внеклеточного HMGB1 могут быть измерены количественно с использованием любых коммерчески доступных методов анализа, например, с использованием Human High Mobility Group Protein B1 (HMGB1) ELISA Kit (Abbexa Ltd, UK); Mouse HMGB1/HMG-1 ELISA Kit (Novus Biologicals, LLC, USA); Dog HMG1 / HMGB1 (Sandwich ELISA) ELISA Kit - LS-F6302 (LSBio, USA).
Термин «введение» относится к введению лекарственного средства в виде инъекций, внутривенных инфузий, внутрилегочных ингаляций, глазных капель, а также интраназально, перорально, буккально, сублингвально, ректально, интратекально, интрадермально.
Термин «ингаляция», используемый в настоящем изобретении относится к вдыханию паров или дисперсии твердых или жидких частиц содержащих лекарственное средство. В конкретных примерах вдыхание может происходить через распылитель или другое устройство для доставки аэрозоля.
В одном из воплощений настоящего изобретения, для снижения уровней внеклеточного HMGB1 млекопитающему вводят эффективные количества гексапептида (I) ингаляционно в виде аэрозоля с помощью небулайзера однократно или многократно, в течение одних суток или нескольких суток до снижения уровней внеклеточного HMGB1, например, в мокроте или бронхолегочной жидкости.
Термин «небулайзер» обозначает устройство для ингаляций, обеспечивающее преобразование жидкого лекарственного средства для распыления в дисперсию в газовой среде для доставки действующего вещества в легкие. Примеры небулайзеров включают компрессорные, ультразвуковые, либо небулайзеры иного типа.
В предпочтительном варианте осуществления изобретения, гексапептид (I) или его фармацевтически приемлемую соль вводят в легкие в форме аэрозоля с размером частиц от 0,1 до 10,0 микрон, более предпочтительно от 1 до 5 микрон.
Используемый здесь термин «млекопитающее» относится к любому животному, классифицированному как млекопитающее, например, мыши, крысе, собаке, кошке, лошади и человеку. Предпочтительным млекопитающим является человек.
При осуществлении изобретения, гексапептид формулы (I) или его фармацевтически приемлемая соль могут быть использованы в качестве активного фармакологического ингредиента в составе фармацевтической композиции, которая может быть приготовлена в виде твердого вещества, полутвердого вещества или жидкости.
Используемый здесь термин «эффективное количество» относится к количеству активного фармацевтического ингредиента, которое является достаточным для того, чтобы вызвать уменьшение уровней внеклеточного HMGB1 у млекопитающего, нуждающегося в этом, сцелью обращения, облегчения или ингибирования развития заболевания, или одного или нескольких симптомов заболевания, от которого страдает это млекопитающее. Неэксклюзивные примеры заболеваний, связанных с необходимостью снижения уровней внеклеточного HMGB1 включают любое заболевание выбранное из группы состоящей из хронического риносинусита, аллергического ринита, астмы, хронического обструктивного заболевания легких (ХОБЛ), острого респираторного дистресс-синдрома (ОРДС), муковисцидоза, пневмонии, рака легких, гломерулонефрита, волчаночного нефрита, диабетической нефропатии, аутосомно-доминантного поликистоза почек, хронической дисфункции аллотрансплантата, хронической болезни почек, сердечной недостаточности, острого коронарного синдрома, системного васкулита, атеросклероза, аневризмы брюшной аорты, панкреатита, рака поджелудочной железы, бокового амиотрофического склероза, оптического нейромиелита, невропатической боли, вирусного гепатита, неалкогольной жировой болезни печени, фиброза печени, гепатоцеллюлярной карциномы, сахарного диабета 1 и 2 типов, осложнения сахарного диабета, ожирения, пародонтита, гастрита, воспаления кишечника, колоректального рака, травмы слизистой оболочки желудка, рака желудка, ревматоидного артрита, системной красной волчанки, миозита, сепсиса, H1N1, COVID-19, ВИЧ-1, туберкулеза, гепатита Б, ожоговой травмы, механической травмы, тромбоза глубоких вен и синдрома диссиминированного внутрисосудистого свертывания.
Эффективные количества гексапептида (I) зависят от вида млекопитающего, способа введения, и заболевания, и составляют от 0,001 до 1 мг/кг, предпочтительно 0,01-0,1 мг/кг веса тела млекопитающего.
При осуществлении изобретения, эффективное количество гексапептида формулы (I) или его фармацевтически приемлемой соли можно вводить в млекопитающего один или два раза в день в течение одного дня или дольше.
Следующие примеры демонстрируют изобретение. Примеры иллюстрируют изобретение и не предназначены для ограничения объема изобретения тем или иным образом.
Пример 1.
Пример иллюстрирует эффективность гексапептида (I) в снижении уровней внеклеточного HMGB1 в бронхолегочной жидкости при остром воспалительном поражении легких у млекопитающих.
Острое воспалительное поражение легких индуцировали у мышей C57Bl/6 ингаляционным введением α-галактозилцерамида (50 мкг/кг) и последующей через 24 часа интратрахеальной инъекцией 15 мг/кг липополисахарида (LPS) E.coli 055:B5 (Sigma-Aldrich, Merck, St. Louis, MO, USA), как детально описано в D'Alessio FR. “Mouse Models of Acute Lung Injury and ARDS,” Methods in Molecular Biology 2018, 1809: 341-350. Мышей рандомизировали в две группы. Через 30 мин после введения LPS мыши в первой группе получили однократно гексапептид (I) ингаляционно, в дозе 0,1 мг/кг (n=27), а мыши во второй контрольной группе получили однократно ингаляционно физ. раствор (n=29). Образцы бронхолегочного лаважа были получены через 0,25; 0,75; 1,5; 3; 12; 18; 24; 48; и 72 часа после введения гексапептида (I) или физ.раствора от мышей после эвтаназии (n=3-4 на каждую временную точку), причем все операции проводили под общим наркозом. Исследования выполняли в соответствии с Приказом Минздрава России «Об утверждении Правил надлежащей лабораторной практики», в соответствии с этическими принципами и нормативными документами, рекомендованными Европейской конвенцией о защите позвоночных животных. Уровни внеклеточного HMGB1 в образцах бронхолегочного лаважа измеряли с использованием коммерчески доступного набора High Mobility Group Protein 1 ELISA kit (Cloud-Clone, Wuhan, China) согласно инструкциям производителя. Результаты представлены в таблице 1 как среднее ± средняя ошибка (SEM) концентрации внеклеточного HMGB1 в бронхолегочном лаваже в указанных временных точках в течение 72 часов. Статистические отличия между группами анализировали двухфакторным анализом (two-way ANOVA) с последующим тестом множественного сравнения Бонферрони. Уровень достоверности был установлен на 95% (p<0,05).

Анализ (two-way ANOVA) выявил статистически значимый основной эффект гексапептида (I) (F1,38=5,640, p=0,0227) и времени (F8,38=3,716, p=0,0027) на концентрации внеклеточного HMGB1 в бронхолегочном лаваже у мышей с острым воспалительным поражением легких. Пост-тест Бонферрони показал, что гексапептид статистически значимо снижает пик внеклеточного HMGB1 на 48 часов (p < 0.05), по сравнению с контролем (физ.раствор). Таким образом, введение гексапептида (I) млекопитающему с острым воспалительным заболеванием в дозе 0,1 мг/кг достоверно снижает уровень внеклеточного HMGB1.
Пример 2.
Пример иллюстрирует, что функциональная селективность гексапептида (I) в снижении уровней внеклеточного HMGB1 достигается через усиление экспрессии деацетилазы сиртуин 1.
Острое воспалительное поражение легких индуцировали у мышей C57Bl/6 как описано в примере 1. Мышей рандомизировали в две группы. Через 30 мин после введения LPS мыши в первой группе получили однократно гексапептид (I) ингаляционно, в дозе 0,1 мг/кг, а мыши во второй контрольной группе получили однократно ингаляционно физ. раствор. Образцы ткани легкого, полученные через 6 часов после введения гексапептида (I) или физ.раствора использовали для определения экспрессии деацетилазы сиртуина 1 (SIRT1) методом RT-PCR, праймеры - forward: 5'-TCC TTG GAG ACT GCG ATG TT-3', reverse: 5'-ATG AAG AGG TGT TGG TGG CA-3', probe: ROX-TGA GTT GTG TCA TAG GCT AGG TGG T-BHQ2. Экспрессию мРНК определяли относительно GADPH. Результаты представлены в таблице 2 как среднее ± средняя ошибка (SEM) изменение мРНК SIRT1 в группах.
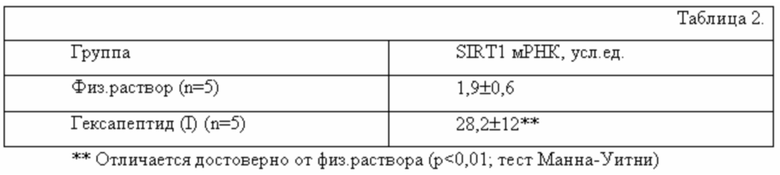
Таблица 2 показывает, что гексапептид (I) статистически значимо повышал экспрессию SIRT1 в легких мышей с острым воспалительным поражением легких по сравнению с контролем (физ.раствор). Известно, что HMGB1 является мишенью сиртуина 1, который деацетилирует HMGB1, препятствуя его выходу из клетки во внеклеточную среду. Rabadi et al. Kidney International 2015, 87(1): 95-108. Таким образом, функциональная селективность гексапептида (I) в снижении уровней внеклеточного HMGB1 достигается через усиление экспрессии деацетилазы сиртуин 1.
Пример 3.
Пример иллюстрирует, что функциональная селективность гексапептида (I) в снижении уровней внеклеточного HMGB1 достигается через деацетилирование сайтов ядерной локализации в HMGB1.
Острое воспалительное поражение легких индуцировали у мышей C57Bl/6 как описано в примере 1. Мышей рандомизировали в две группы. Через 30 мин после введения LPS мыши в первой группе получили однократно гексапептид (I) ингаляционно, в дозе 0,1 мг/кг, а мыши во второй контрольной группе получили однократно ингаляционно физ. раствор. Образцы бронхоальвеолярного лаважа, полученные через 48 часов после введения гексапептида (I) или физ.раствора использовали для определения соотношения ацетилированной к неацетилированной формы HMGB1 по лизину 28 в сайте ядерной локализации NLS1. Для этого образцы подвергали трипсинолизу с использованием Trypsin/Lys-C kit (Promega, Madison, WC, USA) согласно инструкциям производителя. Соотношение ацетилированного к неацетилированному (ацетил-К28/К28) триптического пептида EHKK, фрагмента HMGB1 (26-29), определяли методом LC-MS/MS по соотношению интенсивностей пиков в масс-спектре. Результаты представлены в таблице 3 как среднее±средняя ошибка (SEM) соотношение ацетил-К28/К28 в группах. Для сравнения приведены соотношения ацетил-К28/К28 у наивных мышей.

Таблица 3 показывает, что острое воспалительное поражение легких вызывает многократное увеличение ацетилирования HMGB1 (группа физ.раствор) по сравнению с наивными здоровыми животными. Анализ (one-way ANOVA) выявил статистически значимое отличие между группами (F2,12=122,1; p<0,0001). Пост-тест Тьюки показал, что гексапептид статистически значимо снижает ацетилирование лизина 28 (сайт NLS1) в составе внеклеточного HMGB1 (p<0.0001), по сравнению с контролем (физ. раствор). Известно, что ацетилирование HMGB1 по сайту NLS1 является причиной секреции HMGB1 из клетки во внеклеточное пространство. Bonaldi T et al. EMBO J. 2003, 22(20): 5551-60. Таким образом, функциональная селективность гексапептида (I) в снижении уровней внеклеточного HMGB1 достигается через вызываемое гексапептидом (I) снижение ацетилирования сайтов ядерной локализации в HMGB1, препятствуя выходу HMGB1 во внеклеточную среду.
| название | год | авторы | номер документа |
|---|---|---|---|
| Амиды гептапептида для лечения HMGB1-зависимых заболеваний | 2021 |
|
RU2760133C1 |
| Способ лечения болезней легких ингаляционным введением мезенхимальных стромальных клеток и гексапептида | 2022 |
|
RU2770364C1 |
| Биомедицинский клеточный продукт на основе мезенхимальных стромальных клеток млекопитающих и гексапептида | 2022 |
|
RU2781968C1 |
| Ингаляционный гексапептид для лечения респираторных заболеваний, связанных с интерлейкином-6 | 2020 |
|
RU2737799C1 |
| Блокаторы рецептора гормона роста при предупреждении заболеваний и лечении | 2016 |
|
RU2726254C2 |
| Лечение боли | 2009 |
|
RU2712166C2 |
| СЛИТЫЕ БЕЛКИ IL-10/FC, ПРИГОДНЫЕ В КАЧЕСТВЕ ЭНХАНСЕРОВ ИММУНОТЕРАПИИ | 2020 |
|
RU2825306C1 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ M971 | 2018 |
|
RU2770411C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ В ВИДЕ СУППОЗИТОРИЯ, СОДЕРЖАЩАЯ ГЕКСАПЕПТИД | 2020 |
|
RU2737800C1 |
| ПРИМЕНЕНИЕ ДАЛАРГИНА ДЛЯ ПРОИЗВОДСТВА СРЕДСТВ ЛЕЧЕНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 | 2020 |
|
RU2728939C1 |
Изобретение относится к области здравоохранения. Раскрыто применение гексапептида формулы (I): H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH (I) или его фармацевтически приемлемой соли для снижения уровней внеклеточного HMGB1 у млекопитающего, нуждающемся в этом. Изобретение обеспечивает снижение уровня внеклеточного HMGB1, медиатора воспаления, ухудшающего течение воспалительного заболевания. 2 з.п. ф-лы, 3 табл., 3 пр.
1. Применение гексапептида формулы (I):
H-Tyr-D-Ala-Gly-Phe-Leu-Arg-OH (I)
или его фармацевтически приемлемой соли для снижения уровней внеклеточного HMGB1 у млекопитающего, нуждающегося в этом.
2. Применение гексапептида по п.1, где млекопитающий страдает от заболевания, выбранного из группы, состоящей из хронического риносинусита, аллергического ринита, астмы, хронического обструктивного заболевания легких (ХОБЛ), острого поражения легких, острого респираторного дистресс-синдрома (ОРДС), муковисцидоза, пневмонии, рака легких, гломерулонефрита, волчаночного нефрита, диабетической нефропатии, аутосомно-доминантного поликистоза почек, хронической дисфункции аллотрансплантата, хронической болезни почек, сердечной недостаточности, острого коронарного синдрома, системного васкулита, атеросклероза, аневризмы брюшной аорты, панкреатита, рака поджелудочной железы, бокового амиотрофического склероза, оптического нейромиелита, невропатической боли, вирусного гепатита, неалкогольной жировой болезни печени, фиброза печени, гепатоцеллюлярной карциномы, сахарного диабета 1 и 2 типов, осложнения сахарного диабета, ожирения, пародонтита, гастрита, воспаления кишечника, колоректального рака, травмы слизистой оболочки желудка, рака желудка, ревматоидного артрита, системной красной волчанки, миозита, сепсиса, H1N1, COVID-19, ВИЧ-1, туберкулеза, гепатита Б, ожоговой травмы, механической травмы, тромбоза глубоких вен и синдрома диссиминированного внутрисосудистого свертывания.
3. Применение гексапептида по п.1 или 2, где фармацевтически приемлемая соль - это ацетат.
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСС-СИНДРОМА ДАЛАРГИНОМ И ЛЕГОЧНЫМ СУРФАКТАНТОМ | 2020 |
|
RU2728821C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ В ВИДЕ СУППОЗИТОРИЯ, СОДЕРЖАЩАЯ ГЕКСАПЕПТИД | 2020 |
|
RU2737800C1 |
| US 20190322701 A1, 24.10.2019 | |||
| BORSKY P | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| КУЗНИК Б.И | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Эпигенетические механизмы регуляции // Успехи Физиологических Наук, | |||
Авторы
Даты
2024-02-19—Публикация
2021-07-20—Подача