Область техники
Настоящее изобретение относится к стабилизированному препарату с чрескожной абсорбцией, содержащему донепезил, который стабилизирован для уменьшения образования примесей.
Уровень техники
«Руководство по качеству чрескожных пластырей», выпущенное Европейским Агентством по Лекарственным Средствам, рекомендует контролировать стандарт примесей в чрескожных препаратах в соответствии с руководящими принципами ICH Q3B, опубликованными Международным Советом по Гармонизации Технических Требований к Фармацевтическим Препаратам для Использования Человеком (ICH). ICH Q3B представляет общие рекомендации по примесям, основанные на ежедневной дозировке. Критерии приемлемости для примесей могут быть повышены или понижены в зависимости от степени токсичности конкретной субстанции.
Донепезил, ингибитор ацетилхолинэстеразы был разработан с целью лечения болезни Альцгеймера. Он коммерчески доступен в виде пероральных таблеток Арисепт®. Донепезил может разлагаться под воздействием тепла, света или влаги и выделять различные сопутствующие вещества (примеси). Поэтому Фармакопея США имеет определенный стандарт по примесям для таблеток, содержащих донепезил, и запрещает использование таблеток донепезила, которые превышают максимальный предел по примесям.
Примеси, образующиеся в результате разложения основного компонента вещества, обычно оценивают с помощью жидкостной хроматографии. Аналитические условия (напр., колонки, условия подвижной фазы, длина волны поглощения) определяют виды примесей, которые могут быть проанализированы. Фармакопея США представляет два способа анализа донепезила на наличие примесей.
Первый способ (здесь и далее именуемый «Процедура 1») может быть использован для обнаружения дезбензил донепезила, открытого кольца донепезила и N-оксида донепезила. Фармакопея США рекомендует, чтобы каждая из этих примесей составляла менее 0,5%, а другие неизвестные примеси - менее 0,2%.
Второй способ («Процедура 2») может быть использован для обнаружения дезбензила донепезила, пиридинового аналога донепезила, четвертичной соли донепезила, инденового аналога донепезила и дезоксидонепезила. Фармакопея США рекомендует, чтобы каждая из этих пяти примесей составляла менее 0,15%, другие неизвестные примеси - менее 0,1%, а общее количество примесей - менее 1,0%. Процедура 2 рекомендуется, если существует вероятность того, что препарат донепезила может содержать любую из пяти вышеупомянутых примесей.
Однако известно, что пероральные препараты, содержащие донепезил, вызывают различные побочные эффекты, такие как тошнота, рвота и диарея из-за быстрого повышения концентрации в крови. Еще одна известная проблема с пероральными препаратами донепезила заключается в том, что их нелегко принимать пожилым пациентам с нарушенной глотательной способностью. Для преодоления этих недостатков в Корее и во всем мире были проведены различные исследования и разработки препаратов для чрескожной абсорбции, содержащих донепезил. Большинство исследований такого рода сосредоточено на улучшении проницаемости кожи (которая очень низкая) для чрескожных препаратов, содержащих донепезил. Усилия по повышению стабильности донепезила раскрыты в патенте США No. 6,372,760, Патентной Регистрации Кореи No. 10-0866720, Патентной Регистрации Кореи No. 10-1408500 и Патентной Регистрации Кореи No. 10-1408454.
В Патенте США No. 6,372,760 пытались улучшить стабильность донепезила путем добавления органической кислоты. Патентная Регистрация Кореи No. 10-0866720 относится к способу повышения стабильности донепезила путем добавления высокомолекулярного кислотного вещества и высокомолекулярного основного вещества для пероральных препаратов и сиропов. Однако в нем не раскрыто применение стабилизатора для чрескожного препарата.
Также в Патентной Регистрации Кореи No. 10-1408500 и 10-1408454 раскрыты способы ингибирования образования примесей донепезила в препаратах для чрескожной абсорбции с использованием комбинации двух стабилизаторов, выбранных из группы, состоящей из изоаскорбиновой кислоты, 2-меркаптобензимидазола, соли металла гидроксиметансульфоновой кислоты, рутина, 2,6-ди-трет-бутил-4-метилфенола, аскорбиновой кислоты и их метабисульфитной соли металла. Согласно литературе предшествующего уровня техники, упомянутой выше, один стабилизатор не может эффективно ингибировать два типа примесей (N-оксид донепезила и дезбензил донепезила) и общие примеси. Вышеупомянутый уровень техники показывает, что использование комбинации двух типов стабилизаторов может успешно ингибировать два типа примесей (N-оксид донепезила и дезбензил донепезила) и общее содержание примесей. Однако оценка примесей проводилась с использованием только одной из двух процедур, описанных Фармакопеей США. Поэтому трудно сказать, что она эффективно подавляла все различные потенциальные примеси, получаемые из донепезила.
Настоящие изобретатели при изучении чрескожного препарата, содержащего донепезил, обнаружили, что использование монотиоглицерина, соли металла тиоцианата (предпочтительно соли калия) или диметилтиомочевины в качестве единственного стабилизатора может эффективно ингибировать все различные типы примесей, образующиеся в результате разложения донепезила, что приводит к завершению настоящего изобретения.
Техническая проблема
Целью настоящего изобретения является обеспечение стабильного чрескожного препарата, содержащего донепезил, путем уменьшения образования примесей донепезила.
Техническое решение
Для достижения вышеуказанной цели в настоящем изобретении предоставляется препарат для чрескожной абсорбции, содержащий донепезил, для лечения деменции, содержащий слой подложки, содержащий лекарственное средство слой и слой высвобождения, где содержащий лекарственное средство слой содержит донепезил или его фармацевтически приемлемую соль в качестве активного ингредиента; монотиоглицерин, соль металла тиоцианата (предпочтительно калиевую соль) или диметилтиомочевину в качестве стабилизатора; и чувствительный к давлению адгезив.
Настоящее изобретение дополнительно описано ниже.
Донепезил является ингибитором ацетилхолинэстеразы и может быть использован в форме свободного основания или в виде его фармацевтически приемлемой соли. Среди фармацевтически приемлемых солей донепезила полезны соли присоединения кислоты, образованные фармацевтически приемлемой свободной кислотой. Предпочтительными солями присоединения кислоты являются полученные из неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота, бромоводородная кислота, азотистая кислота и фосфорная кислота, или нетоксичных органических кислот, таких как алифатические моно- и ди-карбоксилаты, фенилзамещенные алканоаты, гидроксиалканоаты, гидроксиалкандиоаты, ароматические кислоты, алифатические и ароматические сульфокислоты. Такие фармацевтически нетоксичные соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфата хлорид, бромид, йодид, фторид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутен-1,4-диоат, гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, р-гидроксибутират, гликолят, малат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат и манделат.
С точки зрения диспергируемости и чрескожной рассасываемости донепезил в виде свободного основания может быть предпочтительным в содержащем лекарственное средство слое. Хотя никаких особых ограничений на концентрацию донепезила в препарате для чрескожной абсорбции по настоящему изобретению не установлено, для лучшего диспергирования и чрескожной абсорбции донепезила из содержащего лекарственное средство слоя предпочтительный диапазон содержания донепезила составляет 1-20% мас. (от массы слоя, содержащего лекарственное средство), предпочтительно 1,5-15% мас. и более предпочтительно 2-10% мас.
«Стабилизатором» в настоящем изобретении является монотиоглицерин, соль металла тиоцианата (предпочтительно калиевая соль) или диметилтиомочевина. Можно использовать один или несколько стабилизаторов.
Стабилизатор содержится в содержащем лекарственное средство слое и не налагается никаких особых ограничений на массовый процент стабилизатора до тех пор, пока он не оказывает отрицательного влияния на физические свойства содержащего лекарственное средство слоя. При определении предпочтительного примера верхнего предела отношения стабилизаторов к массе содержащего лекарственное средство слоя (т.е. общей массы содержания твердых веществ комбинации, используемой при формировании содержащего лекарственное средство слоя), учитывалось несколько факторов. При содержании более 5% мас. физические свойства содержащего лекарственное средство слоя, такие как адгезивность, могут быть нарушены. При содержании менее 0,005% мас. достаточный стабилизирующий эффект может не быть достигнут. Поэтому предпочтительный диапазон массового процента стабилизатора составляет от 0,0005% мас. до 5% мас., предпочтительно от 0,005% мас. до 3% мас. и более предпочтительно от 0,05% мас. до 2% мас. Содержащий лекарственное средство слой может дополнительно содержать известный стабилизатор.
Чувствительный к давлению адгезив в настоящем изобретении особым образом не ограничен. Примеры включают акриловый адгезив, чувствительный к давлению; адгезивы на основе резины, чувствительные к давлению, такие как силикон, полиизопрен, стирол-бутадиен, блок-сополимер стирол-изопрен-стирол; силиконовый адгезив; и полимерные адгезивы на основе винила, такие как поливиниловый спирт, поливинилалкиловый эфир и поли(винилацетат).
Более предпочтительным примером чувствительных к давлению адгезивов в настоящем изобретении является блок-сополимер стирол-изопрен-стирол. Свойства блок-сополимера стирол-изопрен-стирол широко варьируются в зависимости от содержания стирола, содержания диблока, температуры плавления и вязкости раствора.
Блок-сополимер стирол-изопрен-стирол, используемый в настоящем изобретении, особым образом не ограничен. Предпочтительно, чтобы вязкость его раствора была выше 0,5 Па*с, предпочтительно 0,7 Па*с и более предпочтительно 0,9 Па*с, как измерено в соответствии с «Методом измерения вязкости блок-сополимера стирол-изопрен-стирол», описанным в издании 2013 года Японские Фармацевтические Эксципиенты. Верхний предел вязкости раствора особым образом не ограничен, но предпочтительно он ниже 2,0 Па*с и более предпочтительно 1,8 Па*с.
Если содержащий лекарственное средство слой не содержит достаточного количества чувствительного к давлению адгезива, содержащий лекарственное средство слой может не поддерживать свою форму. Если используется слишком много адгезива, проницаемость кожи лекарственным средством снижается. Поэтому содержание адгезива в содержащем лекарственное средство слое по настоящему изобретению предпочтительно составляет от 10% мас. до 70% мас., более предпочтительно 15% мас. - 65% мас., еще более предпочтительно 20% мас. - 60% мас. и еще более предпочтительно 25% мас. - 55% мас.
Чувствительная к давлению адгезивная композиция в составе для чрескожной абсорбции может содержать пластификатор. Примеры пластификаторов, которые могут быть использованы в настоящем изобретении, включают, но без ограничения парафиновые технологические масла, нафтеновые технологические масла, ароматические технологические масла, оливковое масло, масло камелии, талловое масло, касторовое масло, изопропилмиристат, гексиллаурат, минеральное масло, октилдодецилмиристат, пролиленгликоль и монокаприлат пропиленгликоля. Может быть использована комбинация двух или более вышеупомянутых пластификаторов. Количество пластификаторов, которые должны быть включены, составляет предпочтительно от 10% мас. до 80% мас. для поддержания достаточной когезионной прочности препарата для чрескожной абсорбции. Более предпочтительно оно составляет 20% мас. - 75% масс., более предпочтительно 25% мас. - 70% мас. и еще более предпочтительно 30% масс. - 65% мас.
К содержащему лекарственное средство слою по настоящему изобретению может быть добавлена повышающая клейкость смола для того, чтобы регулировать адгезивность препарата для чрескожной абсорбции. Повышающие клейкость смолы, которые могут быть использованы в настоящем изобретении, включают, но без ограничения, производные канифоли, алициклическую насыщенную углеводородную смолу и алифатическую углеводородную смолу. Хотя терпеновая смола использовалась в примерах по настоящему изобретению, она не должна толковаться как ограничивающая объем настоящего изобретения.
Если в содержащий лекарственное средство слой включен усилитель клейкости, то содержание усилителя клейкости предпочтительно составляет 20% мас. или ниже для того, чтобы уменьшить раздражение кожи. Более предпочтительно, чтобы он был ниже 15% мас., более предпочтительно 10% мас. и еще более предпочтительно 8% мас. Наиболее предпочтительным является отсутствие какого-либо усилителя клейкости. То есть с точки зрения сцепляемости с кожей пластыря содержание усилителя клейкости может регулироваться в зависимости от смешиваемого соотношения донепезила, блок-сополимера стирол-изопрен-стирол, солюбилизатора и пластификатора в содержащем лекарственное средство слое. Усилитель клейкости может вообще не понадобиться, если без него достигается достаточная адгезия с кожей.
Никаких особых ограничений на способ получения препарата для чрескожной абсорбции не налагается. Используются обычные способы получения препарата для чрескожной абсорбции, такие как описанные в Корейской Фармакопее, то есть растворение или диспергирование чувствительного к давлению адгезивного агента, донепезила, стабилизатора и пластификатора; нанесение раствора или дисперсии на поверхность слоя высвобождения; сушка и ламинирование на него подложки.
Одним из примеров варианта выполнения настоящего изобретения является способ получения препарата для чрескожной абсорбции донепезила, включающий следующие этапы:
i) растворение донепезила и монотиоглицерина, соли металла тиоцианата или диметилтиомочевины в органическом растворителе;
ii) нанесение раствора, полученного в (i), на слой высвобождения и его сушку с образованием содержащего лекарственное средство слоя; и
iii) ламинирование содержащего лекарственное средство слоя, полученного в (ii), со слоем подложки.
Примеры возможных растворителей, которые могут быть использованы в вышеупомянутом способе согласно настоящему изобретению, включают этилацетат, толуол, гексан, 2-пропанол, метанол, этанол, метиленхлорид и тетрагидрофуран. Температура, при которой адгезив растворяется или диспергируется в растворителе, особым образом не ограничена. Однако более высокие температуры могут увеличить вероятность испарения растворителя и могут увеличить разложение донепезила, вызывая образование большего количества примесей. Поэтому предпочтительный диапазон температур составляет 80°С или ниже и более предпочтительно 60°С или ниже.
Кроме того, описанный выше способ нанесения раствора или дисперсии на разделительный слой, его сушки и ламинирования подложки для настоящего изобретения может следовать обычным способам получения препарата для чрескожной абсорбции.
Положительные эффекты
Настоящее изобретение относится к препарату для чрескожной абсорбции донепезила, который обладает высокой стабильностью за счет ингибирования разложения донепезила и, таким образом, уменьшения образования примесей.
Описание вариантов выполнения изобретения
Настоящее изобретение далее описано ниже с примерами и экспериментальными примерами. Приведенные ниже примеры и экспериментальные примеры приведены для дальнейшего подробного описания настоящего изобретения для квалифицированного специалиста и не должны толковаться как ограничивающие объем настоящего изобретения.
Примеры 13. Препарат для чрескожной абсорбции согласно настоящему изобретению
Растворяют 16 г блок-сополимера стирол-изопрен-стирол, 4,7 г октилдодецилмиристата, 3 г терпеновой смолы, 6,5 г монокаприлата пропиленгликоля и 1,3 г донепезила в 27 г этилацетата с получением раствора этилацетата, содержащего донепезил. Затем растворяют 0,13 г стабилизатора, указанного в Таблице 1, в 1 г метанола и смешивают его с раствором этилацетата с предыдущей стадии. Наносят эту смесь на ПЭТ-пленку с силиконовым покрытием и высушивают ее в течение 30 минут в печи при 80°С. После этого ламинируют его наружной пленкой. Полученные результаты являются Примерами с 1 по 3 настоящего изобретения.
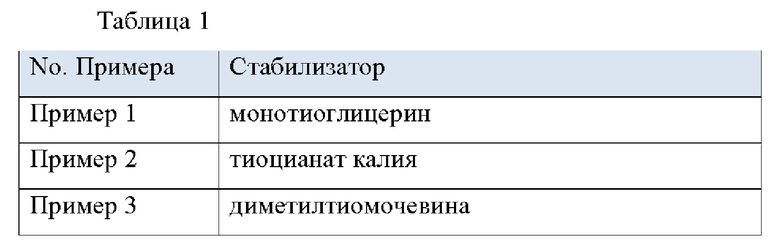
Сравнительный Пример 1. Препарат для чрескожной абсорбции без стабилизатора
Сравнительный пример 1 представляет собой препарат для чрескожной абсорбции, который идентичен примеру 1 по составу и способу получения за исключением того, что он не содержит стабилизатор.
Сравнительный Пример 2. Препарат для чрескожной абсорбции с лимонной кислотой в качестве стабилизатора
Сравнительный пример 2 представляет собой препарат для чрескожной абсорбции, который идентичен примеру 1 по составу и способу получения за исключением того, что он содержит лимонную кислоту в качестве стабилизатора. Лимонная кислота была выбрана из стабилизаторов, раскрытых в Патенте США No. 6,372,760.
Сравнительные Примеры 3 15. Препараты для чрескожной абсорбции с различными стабилизаторами
Сравнительные примеры с 3 по 15 представляют собой препараты для чрескожной абсорбции, полученные в соответствии с тем же составом и способом получения, что и пример 1, с добавлением различных известных стабилизаторов, как указано в Таблице 2 ниже.
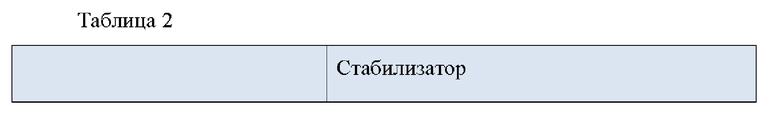

Сравнительные Примеры 16-19. Препарат для чрескожной абсорбции с двумя стабилизаторами
Четыре пары стабилизаторов были выбраны из группы стабилизаторов, раскрытых в Регистрации Патента Кореи No. 10-1408500, которые наиболее эффективно ингибировали образование N-оксида донепезила, дезбензил донепезила и общего содержания примесей.
Препараты для чрескожной абсорбции готовили в соответствии с тем же составом и способом получения, что и в примере 1, с добавлением двух стабилизаторов (0,13 г для каждого стабилизатора), как указано в Таблице 3 ниже. Полученные препараты были помечены как сравнительные примеры с 16 по 19.

Сравнительный Пример 20. Препарат для чрескожной абсорбции с двумя стабилизаторами
Препарат для чрескожной абсорбции был получен в соответствии с тем же составом и способом получения, что и пример 1, с добавлением аскорбиновой кислоты и метабисульфита натрия (по 0,13 г каждого), которые являются стабилизаторами, раскрытыми в Регистрации Патента Кореи No. 10-1408454. Полученный препарат был помечен как сравнительный пример 20.
Экспериментальный Пример 1. Тестирование примесей с помощью Процедуры 1 после 48 часов хранения при 70°С
Препараты для чрескожной абсорбции по примерам и сравнительным примерам были протестированы на наличие примесей донепезила в соответствии с Процедурой 1, как показано ниже, после 48 часов хранения при 70°С.
1. Анализ примесей по Процедуре 1
Каждый препарат для чрескожной абсорбции растворяли в этилацетате. Добавляли метанол и полученный раствор перемешивали в течение 30 минут и центрифугировали в течение 5 минут.Полученный супернатант использовали в качестве образца раствора для Процедуры 1 по Фармакопее США. Стандартный раствор готовили так, чтобы концентрация стандартного донепезила гидрохлорида составляла 0,8 мкг/мл с использованием смеси растворителей этилацетат: метанол=15: 85 (объемное соотношение).
Процедура 1: Условия жидкостной хроматографии
Колонка: Inertsil октадецилсилан-2 (4,6 X 150 мм, С18, 5 мкм)
Подвижная фаза: Растворяют 2,5 г 1-декансульфоната натрия 2,5 г в 650 мл очищенной воды. Затем добавляют 1 мл 70% раствора перхлорной кислоты и 350 мл ацетонитрила.
Температура колонки: 35°С
Скорость потока: 1,4 мл/мин
Размер инъекции: 20 мкл
УФ-абсорбциометр: 271 нм
Расчет:
% Примеси=(Ru/Rs) X (Cs/Cu) X (1/F) X 100
Ru: пиковый ответ любой отдельной примеси из раствора образца
Rs: пиковый ответ донепезила из раствора стандарта
Cs: концентрация в растворе стандарта (мг/мл)
Cu: концентрация в растворе образца (мг/мл)
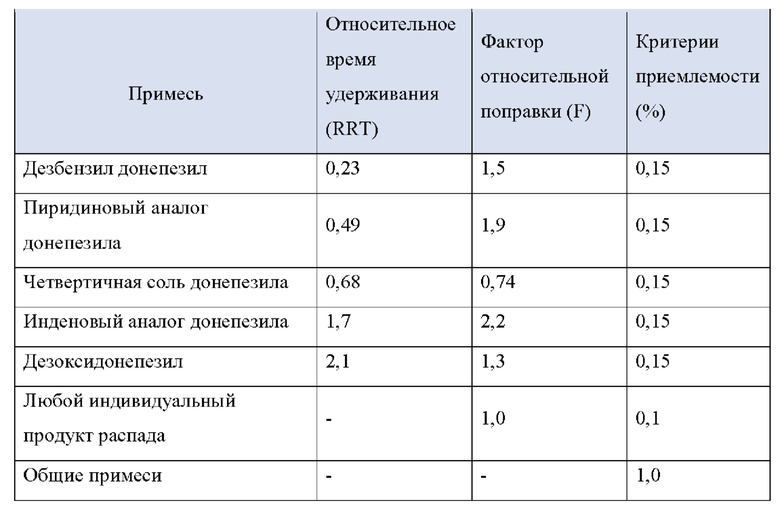
F: фактор относительной поправки для каждой примеси
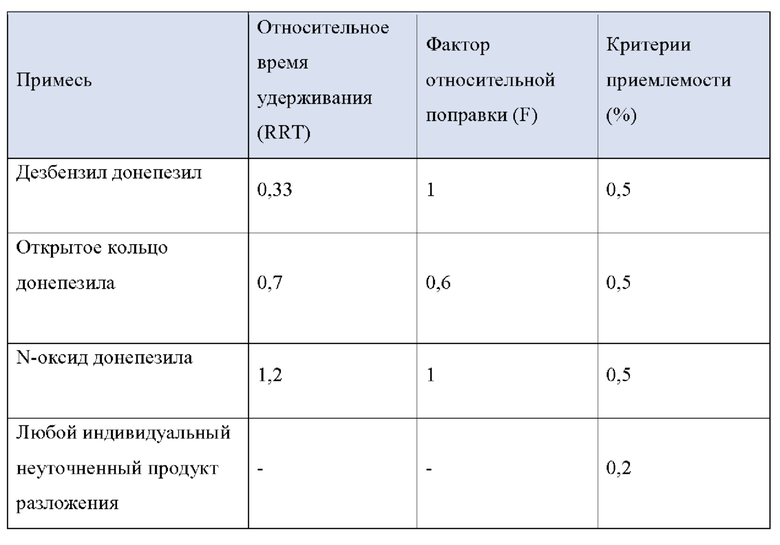
2. Анализ примесей по Процедуре 1 после 48 часов хранения при 70°С
Препараты для чрескожной абсорбции по примерам согласно настоящему изобретению и сравнительным примерам хранили в течение 48 часов при 70°С и затем проверяли на наличие примесей в соответствии с Процедурой 1. Результаты приведены в Таблице 4.
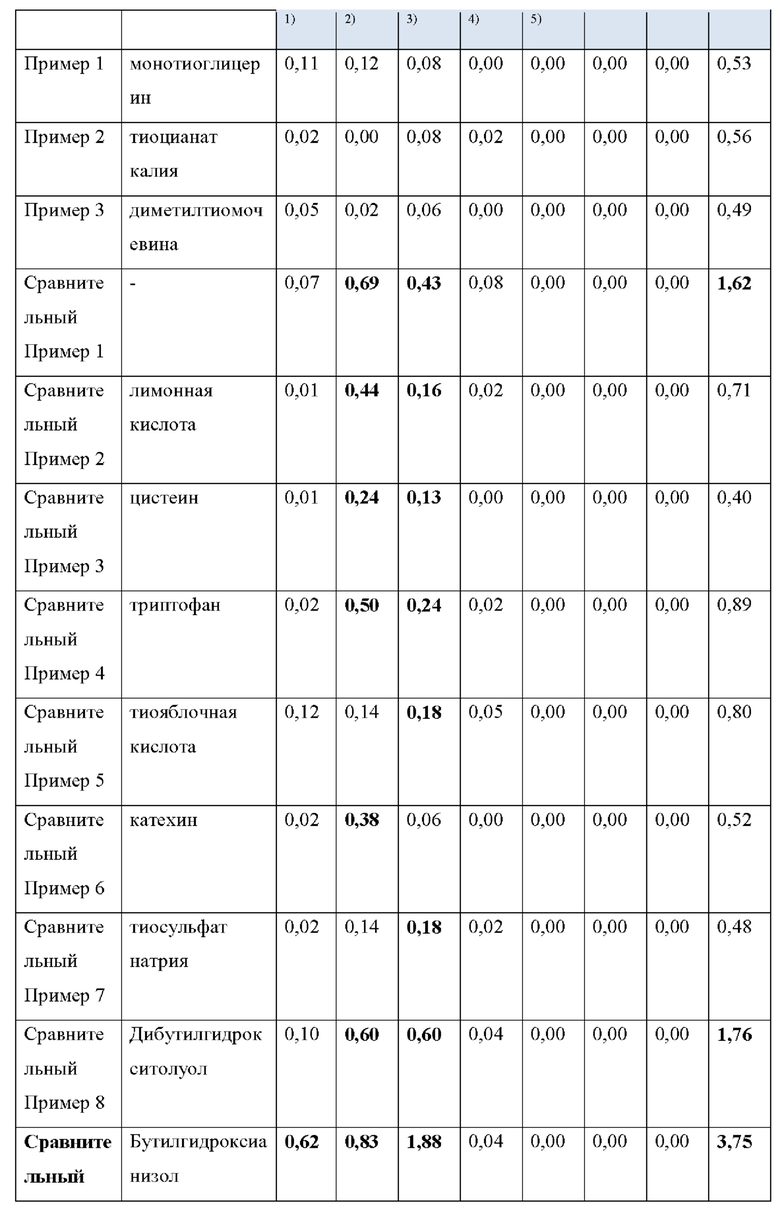
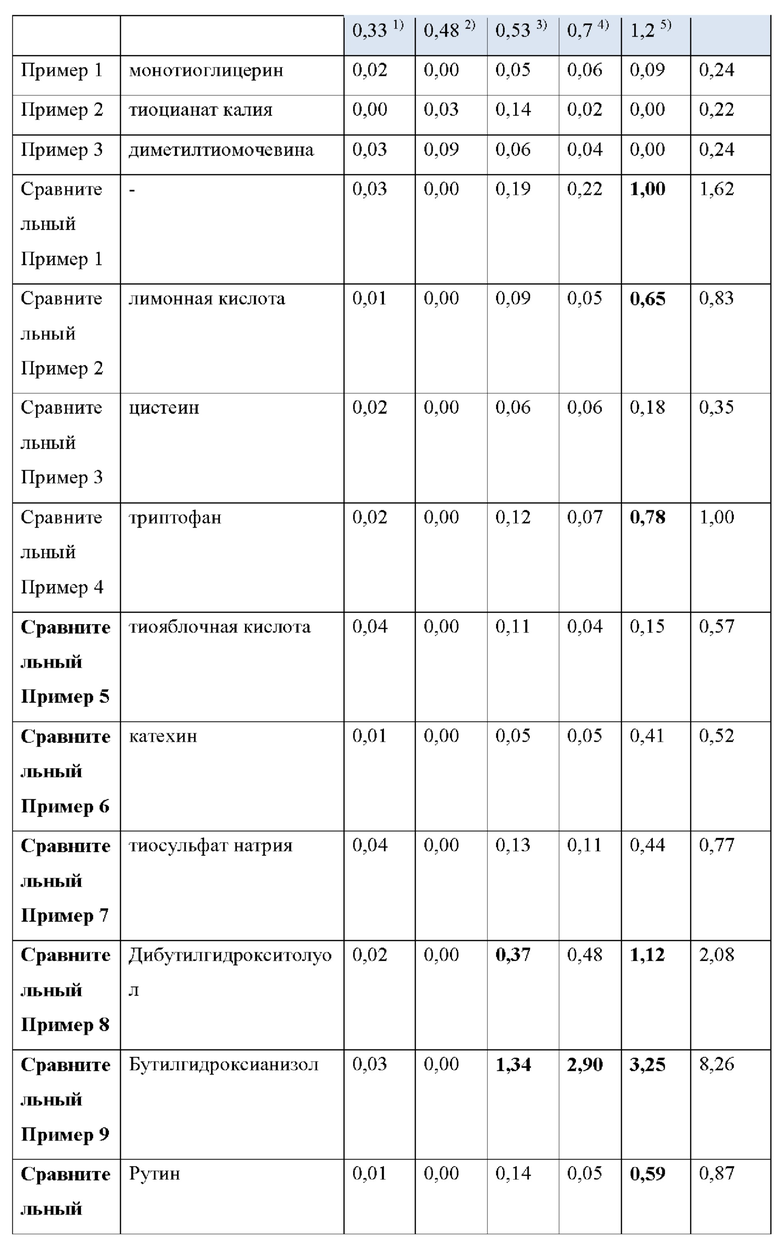
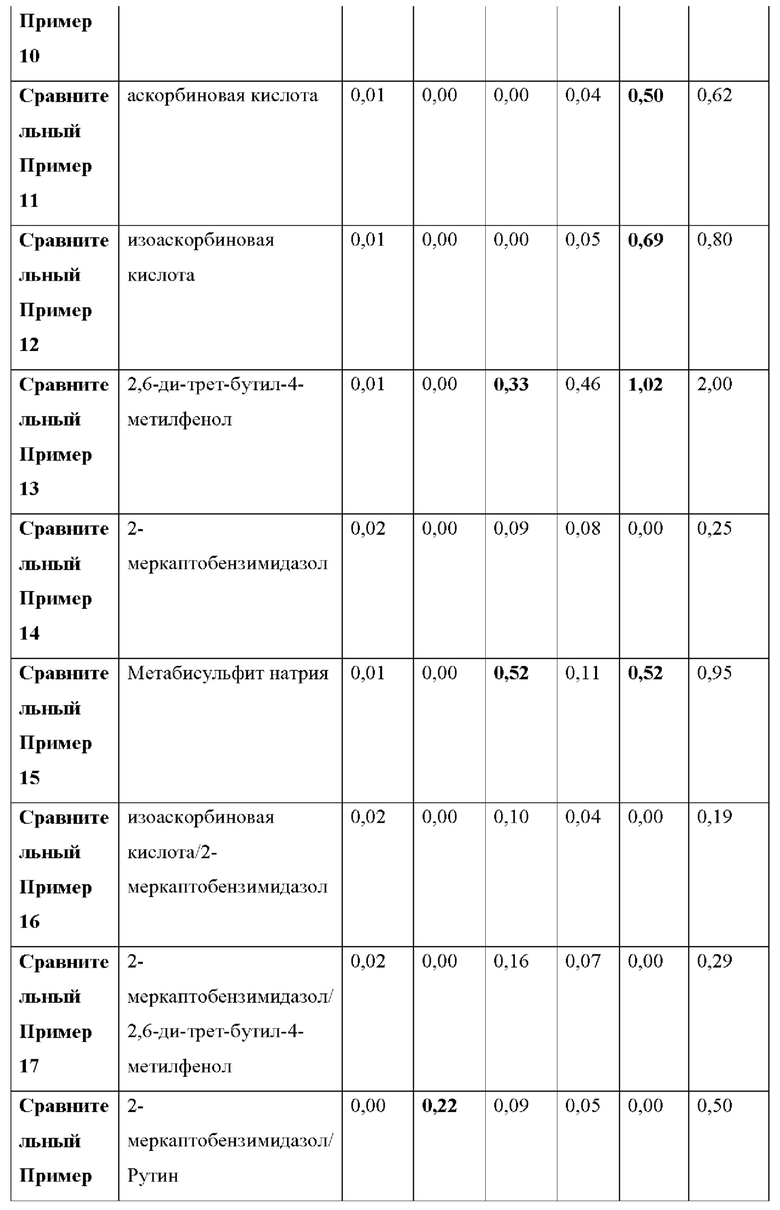
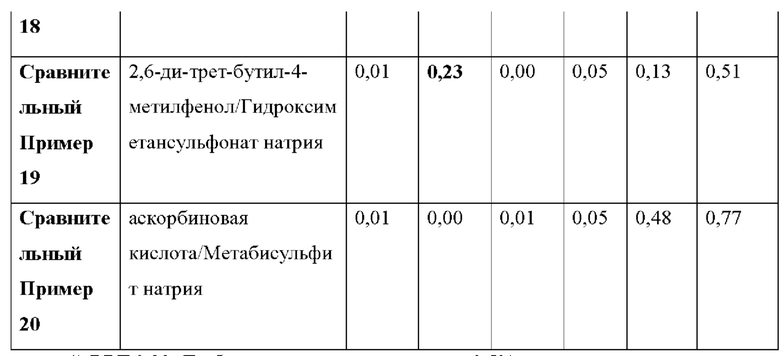
Как видно из Таблицы 4 ниже, в сравнительном примере 1 без стабилизатора наблюдалось значительное разложение донепезила при относительных временах удерживания (RRT) 0,53 (неидентифицированная примесь), 0,7 (открытое кольцо донепезила) и 1,2 (N-оксид донепезила), а также для общего содержания примесей - что свидетельствует о необходимости стабилизаторов в препаратах для чрескожной абсорбции донепезила.
Сравнительный пример 2, в котором использовалась лимонная кислота (органическая кислота, раскрытая в Патенте США No. 6372760), не соответствовала критериям, представленным Фармакопеей США при относительном времени удерживания (RRT) 1.2 (N-оксид донепезила).
Что касается сравнительных примеров с 3 по 15, которые представляют собой препараты для чрескожной абсорбции с известными стабилизаторами, сравнительный пример 3 (цистеин), сравнительный пример 5 (тиояблочная кислота), сравнительный пример 7 (тиосульфат натрия) и сравнительный пример 14 (2-меркаптобензимидазол) действительно соответствовали критериям Фармакопеи США. Однако сравнительный пример 6 (катехин), сравнительный пример 11 (аскорбиновая кислота), сравнительный пример 12 (изоаскорбиновая кислота) и сравнительный пример 15 (метабисульфит натрия) произвели избыточную примесь при RTT 1,2 (N-оксид донепезила), а сравнительный пример 4 (триптофан) и сравнительный пример 10 (Рутин) не соответствовали критериям для 1,2 (N-оксид донепезила), как в сравнительном примере 2. Сравнительный пример 8 (Дибутилгидрокситолуол), сравнительный пример 9 (Бутилгидроксианизол) и сравнительный пример 13 (2,6-ди-трет-бутил-4-метилфенол) не соответствовали критериям для большинства примесей, а также для общего количества примесей.
Сравнительный пример 16 (аскорбиновая кислота/2-меркаптобензимидазол), сравнительный пример 17 (2-меркаптобензимидазол/2,6-ди-трет-бутил-4-метилфенол), сравнительный пример 18 (2-меркаптобензимидазол/рутин), сравнительный пример 19 (2,6-ди-трет-бутил-4-метилфенол/гидроксиметансульфонат натрия) и сравнительный пример 20 (аскорбиновая кислота/метабисульфит натрия), в которых использовалась комбинация двух стабилизаторов, выбранных из стабилизаторов, раскрытых в Регистрации Патента Кореи No. 10-1408500 и Регистрации Патента Кореи No. 10-1408454, соответствовали критериям Фармакопеи США для всех RRT, за исключением сравнительного примера 19 для RRT 0,48 (неидентифицированная примесь).
Напротив, примеры 1-3 согласно настоящему изобретению соответствовали критериям, представленным в Фармакопее США, несмотря на то, что каждый из них содержал только один стабилизатор, демонстрируя выдающийся стабилизирующий эффект монотиоглицерина, соли металла тиоцианата (предпочтительно соли калия) или диметилтиомочевины.

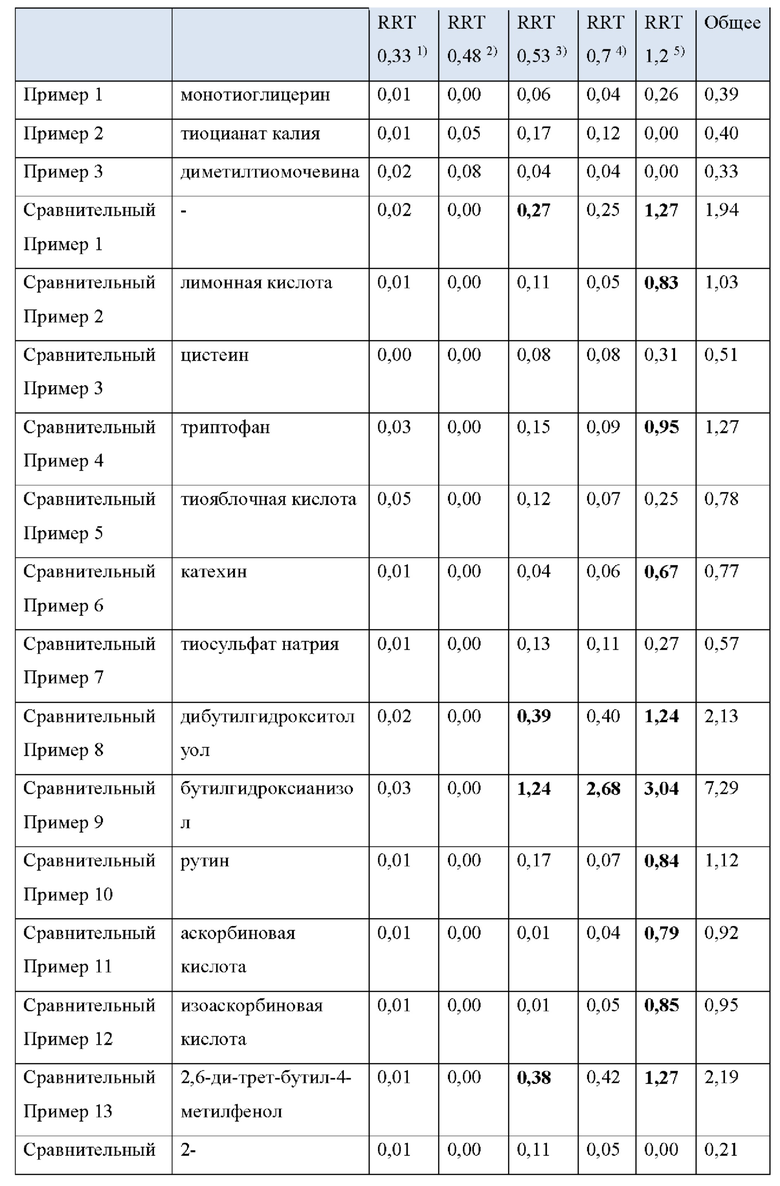
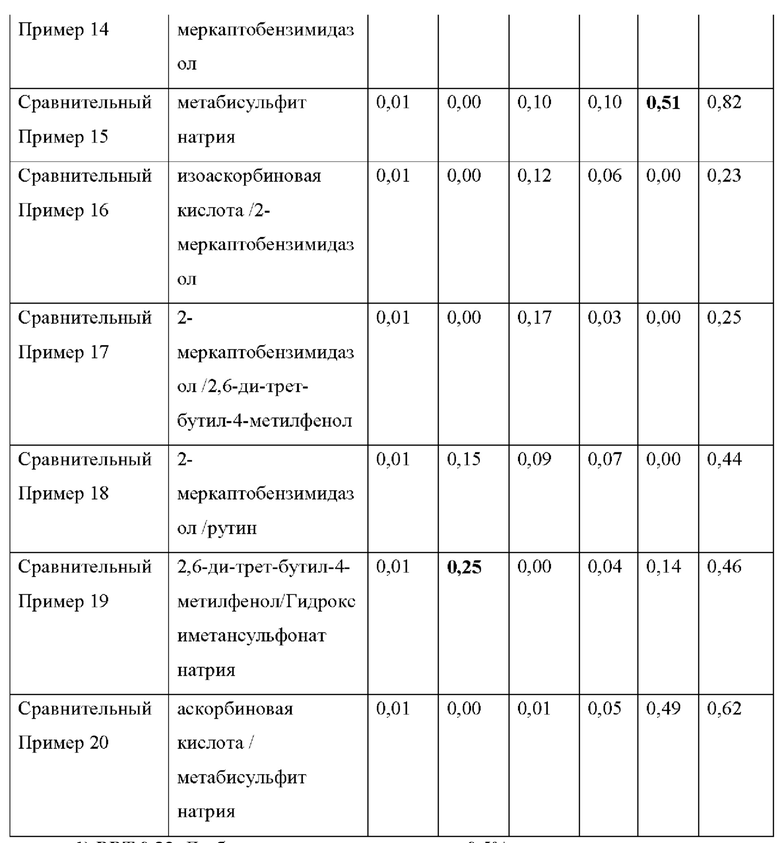
1) RRT 0,33: Дезбензилдонепезил, в пределах 0,5%
2) RRT 0,48: Неидентифицированная примесь, в пределах 0,2%
3) RRT 0,53: Неидентифицированная примесь, в пределах 0,2%
4) RRT 0,7: Открытое кольцо донепезила, в пределах 0,5%
5) RRT 1,2: N-оксид допенезила, в пределах 0,5%
Экспериментальный Пример 2. Анализ примесей по Процедуре 2 после 48 часов хранения при 70°С
Для тестирования на наличие примесей донепезила, препарат для чрескожной абсорбции примеров и сравнительных примеров хранили в течение 48 часов при 70°С и анализировали на наличие примесей в соответствии с Процедурой 2, описанной ниже.
1. Анализ примесей по Процедуре 2
Каждый препарат для чрескожной абсорбции растворяли в этилацетате. Затем добавляли смесь раствора 0,1 н. соляной кислоты и метанола в соотношении 25:75 и полученную смесь перемешивали в течение 30 минут и центрифугировали в течение 5 минут. Полученный супернатант использовали в качестве раствора образца для Процедуры 2 по Фармакопее США. Раствор стандарта готовили так, чтобы концентрация стандарта донепезила гидрохлорида составляла 10 мкг/мл с использованием смеси растворителей этилацетат : метанол : 0,1н. соляная кислота = 100:675:225 (объемное соотношение).
<Процедура 2: Условия жидкостной хроматографии>
Колонка: Capcellpak (4,6 X 250 мм, С 18,5 мкм)
Подвижная фаза А: Добавляют 1 мл фосфорной кислоты в 1 л очищенной воды. Доводят с помощью триэтиламина до рН 6,5. Пропускают через фильтр, удаляют пузырьки и используют в качестве подвижной фазы.
Подвижная фаза В: ацетонитрил
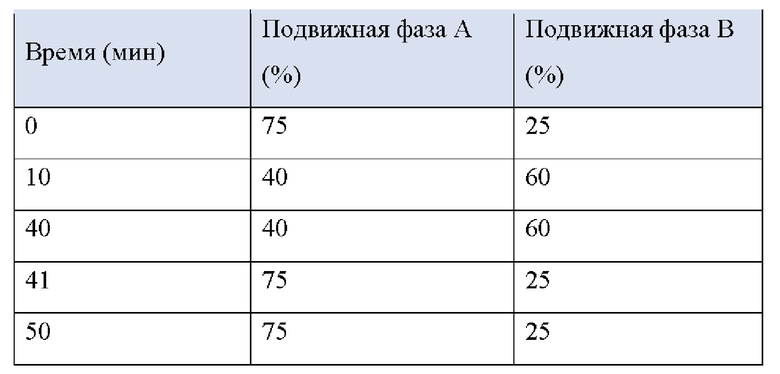
Температура колонки: 50°С
Скорость потока: 1,5 мл/мин
Размер инъекции: 20 мкл
УФ-абсорбциометр: 286 нм
Расчет:
% Примеси = (Ru/Rs) X (Cs/Cu) X (1/F) X 100
Ru: пиковый ответ любой отдельной примеси из раствора образца
Rs: пиковый ответ донепезила из раствора стандарта
Cs: концентрация в растворе стандарта (мг/мл)
Cu: концентрация в растворе образца (мг/мл)
F: фактор относительной поправки для каждой примеси
2. Анализ примесей по Процедуре 2 после 48 часов хранения при 70°С
Препараты для чрескожной абсорбции примеров согласно настоящему изобретению и сравнительных примеров хранили в течение 48 часов при 70°С и затем проверяли на наличие примесей в соответствии с Процедурой 2. Результаты приведены в Таблице 5.
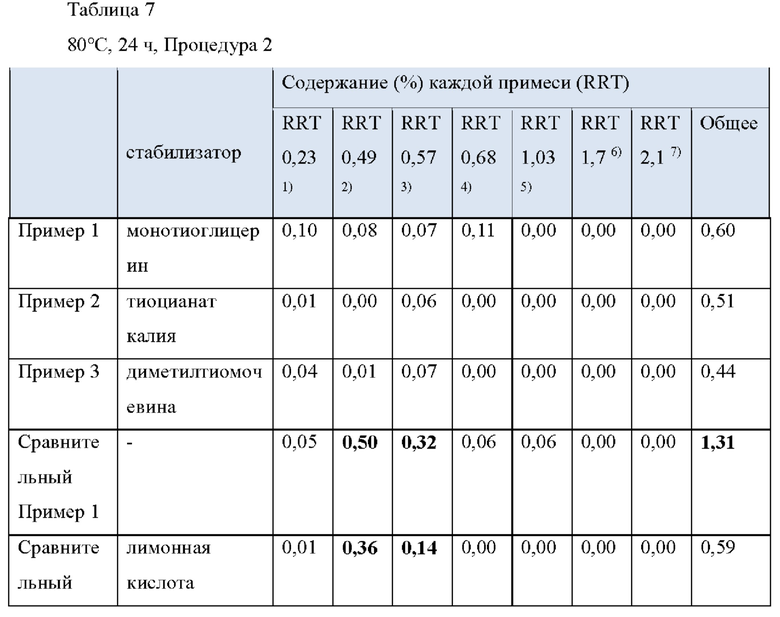
Как видно из Таблицы 5 ниже, в сравнительном примере 1 без стабилизатора с Процедурой 2 наблюдалось значительное разложение донепезила при относительном времени удерживания (RRT) 0,49 (пиридиновый аналог донепезила), 0,57 (неидентифицированная примесь) и общем содержании примесей, что свидетельствует о необходимости стабилизаторов в препаратах для чрескожной абсорбции донепезила.
Что касается сравнительного примера 2, в котором использовалась лимонная кислота (органическая кислота, раскрытая в Патенте США No. 6,372,760), RTT 0,49 (пиридиновый аналог донепезила) и 0,57 (неидентифицированная примесь) не соответствовали критериям, представленным Фармакопеей США.
В отличие от Процедуры 1, ни один из сравнительных примеров с 3 по 15, которые являются препаратами для чрескожной абсорбции с известными стабилизаторами, вообще не соответствовал критериям Фармакопеи США с Процедурой 2. То есть сравнительный пример 6 (катехин), сравнительный пример 11 (аскорбиновая кислота) и сравнительный пример 12 (изоаскорбиновая кислота) произвели избыточную примесь при RRT 0,49 (пиридиновый аналог донепезила). Сравнительный пример 5 (тиоябл очная кислота) и сравнительный пример 7 (тиосульфат натрия) произвели избыточную примесь при RRT 0,57 (неидентифицированная примесь). Сравнительный пример 8 (дибутилгидрокситолуол), сравнительный пример 9 (бутилгидроксианизол), сравнительный пример 13 (2,6-ди-трет-бутил-4-метилфенол) и сравнительный пример 14 (2-меркаптобензимидазол) не соответствовали критериям для 1-3 примесей, а также по общему содержанию примесей.
Сравнительный пример 16 (аскорбиновая кислота/2-меркаптобензимидазол), сравнительный пример 17 (2-меркаптобензимидазол/2,6-ди-трет-бутил-4-метилфенол), сравнительный пример 18 (2-меркаптобензимидазол/рутин) и сравнительный пример 19 (2,6-ди-трет-бутил-4-метилфенол/гидроксиметансульфонат натрия), в котором использовалась комбинация двух стабилизаторов, выбранных из стабилизаторов, раскрытых в Регистрации Патента Кореи No 10-1408500, не соответствовали критериям Фармакопеи США. Сравнительные примеры с 16 по 18 также не соответствовали критериям для общего содержания примесей.
Сравнительный пример 20 (аскорбиновая кислота/Метабисульфит натрия), в котором использовалась комбинация двух стабилизаторов, выбранных из стабилизаторов, раскрытых в Регистрации Патента Кореи No. 10-140854, не соответствовал критериям Фармакопеи США для RRT 0,49 (пиридиновый аналог донепезила).
Напротив, примеры с 1 по 3 по настоящему изобретению успешно соответствовали критериям, представленным в Фармакопее США, несмотря на то, что каждый из них содержал только один стабилизатор-таким образом, демонстрируя выдающийся стабилизирующий эффект монотиоглицерина, соли металла тиоцианата (предпочтительно соли калия) или диметилтиомочевины.
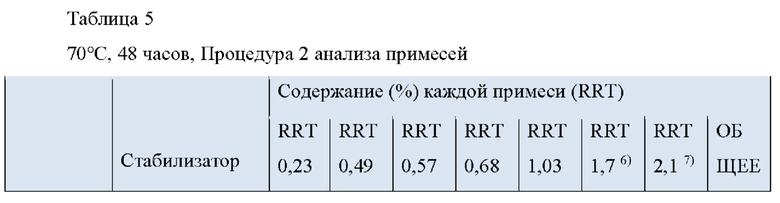
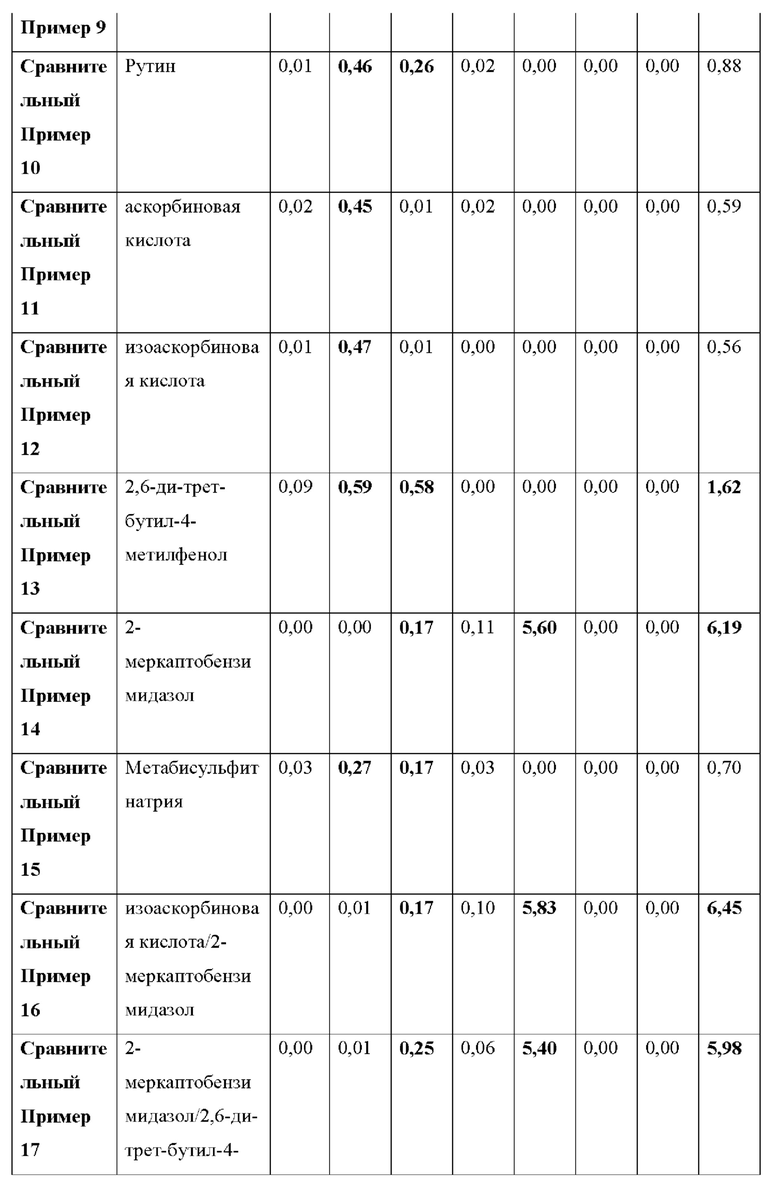
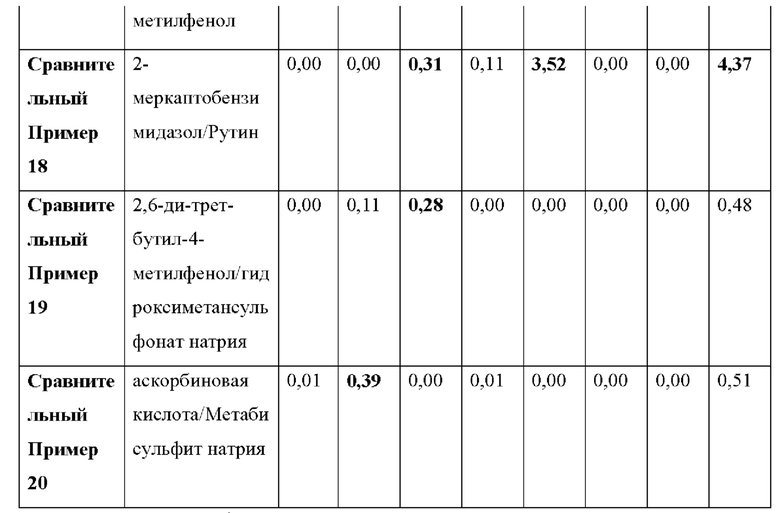
1) RRT 0,23: Дезбензилдонепезил, в пределах 0,15%
2) RRT 0,49: Пиридиновый аналог донепезила, в пределах 0,15%
3) RRT 0,57: Неидентифицированная примесь, в пределах 0,1%
4) RRT 0,68: Четвертичная соль донепезила, в пределах 0,15%
5) RRT 1,03: Неидентифицированная примесь, в пределах 0,1%
6) RRT 1,7: Инденовый аналог донепезила, в пределах 0,15%
7) RRT 2,1: Дезоксидонепезил, в пределах 0,15%
Экспериментальный Пример 3. Анализ примесей с помощью Процедур 1 и 2 после 24 часов хранения при 80°С
Препараты для чрескожной абсорбции примеров и сравнительных примеров были протестированы на наличие примесей донепезила в соответствии с Процедурой 1 и Процедурой 2 после 24 часов хранения при 80°С.
1. Анализ примесей по Процедуре 1 после 24 часов хранения при 80°С
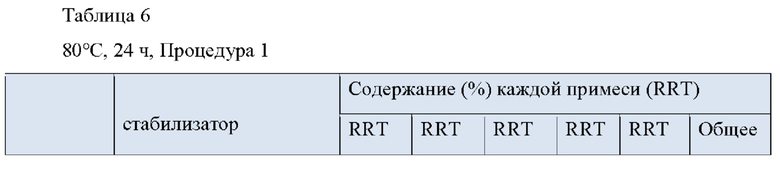
1) RRT 0,33: Дезбензилдонепезил, в пределах 0,5%
2) RRT 0,48: неидентифицированная примесь, в пределах 0,2%
3) RRT 0,53: неидентифицированная примесь, в пределах 0,2%
4) RRT 0,7: Открытое кольцо донепезила, в пределах 0,5%
5) RRT 1,2: N-оксид допенезила, в пределах 0,5%
2. Анализ примесей по Процедуре 2 после 24 часов хранения при 80°С
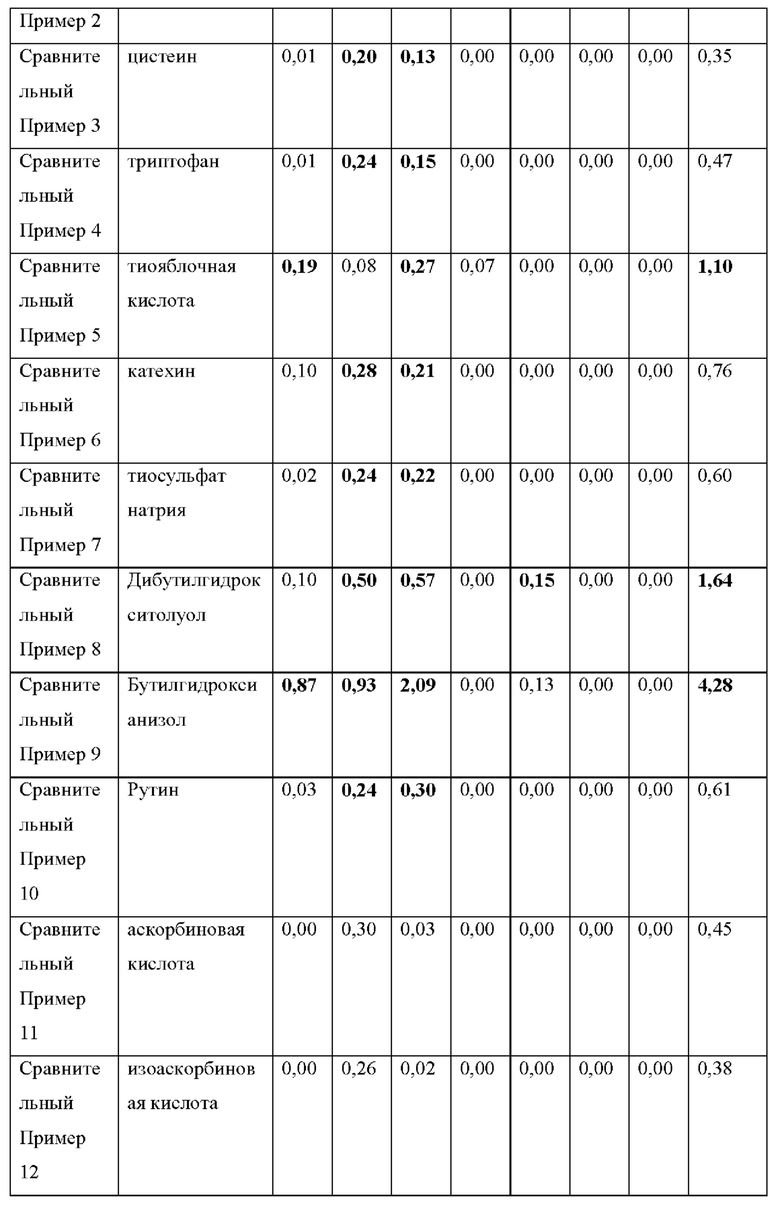
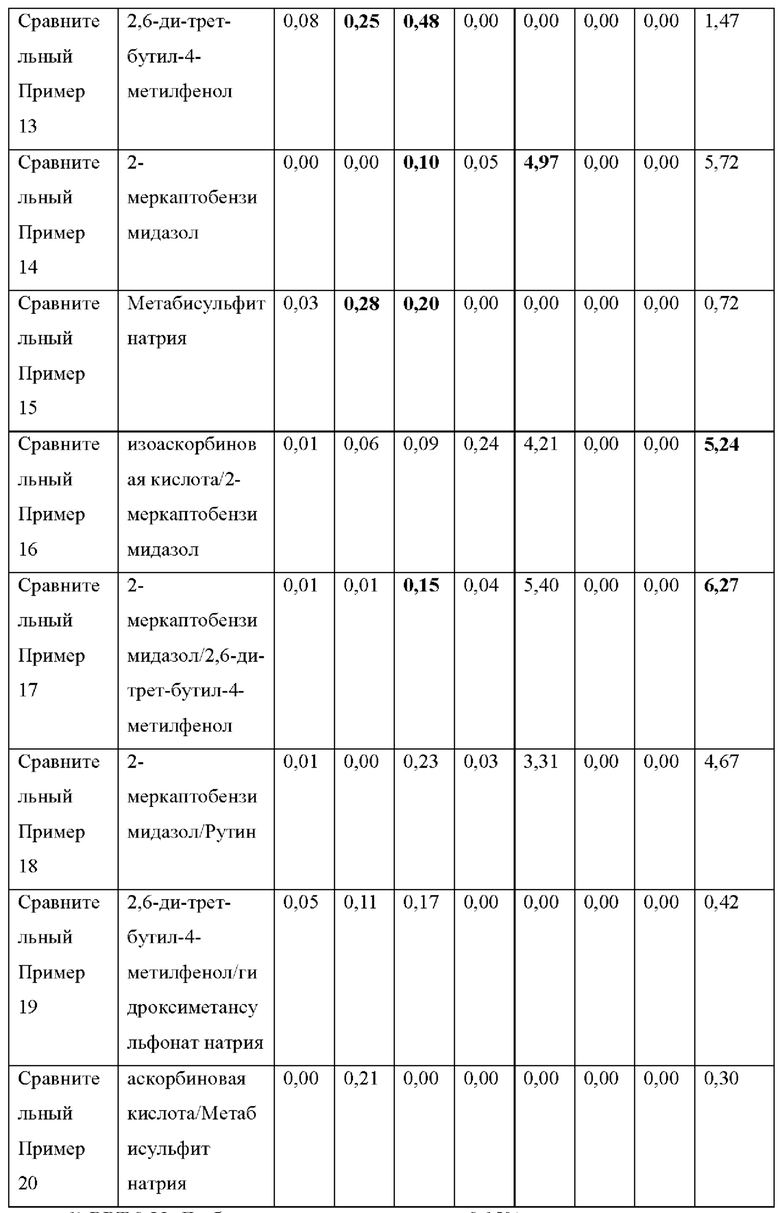
1) RRT 0,23: Дезбензилдонепезил, в пределах 0,15%
2) RRT 0,49: Пиридиновый аналог донепезила, в пределах 0,15%
3) RRT 0,57: Неидентифицированная примесь, в пределах 0,1%
4) RRT 0,68: Четвертичная соль донепезила, в пределах 0,15%
5) RRT 1,03: Неидентифицированная примесь, в пределах 0,1%
6) RRT 1,7: Инденовый аналог донепезилп, в пределах 0,15%
7) RRT 2,1: Дезоксидонепезил, в пределах 0,15%
Как видно из Таблицы 6 и Таблицы 7 выше, результат содержания примесей в экспериментальном примере 3 был аналогичен результату экспериментальных примеров 1 и 2 даже при различных условиях.
В приведенных выше результатах только подмножество препаратов для чрескожной абсорбции донепезила, содержащих ранее известные стабилизаторы, было признано приемлемым в соответствии с Процедурой 1, и ни один из них не соответствовал критериям приемлемости Процедуры 2. Кроме того, сравнительный пример 2, с 16 по 20 (которые являются примерами предшествующего уровня техники) были в основном приемлемы в соответствии с Процедурой 1, но не приемлемы в соответствии с Процедурой 2.
Напротив, примеры с 1 по 3 согласно настоящему изобретению соответствовали критериям приемлемости как по Процедуре 1, так и по Процедуре 2, представленным в Фармакопее США, несмотря на то, что каждый из них содержал только один стабилизатор, демонстрируя, что добавление монотиоглицерина, соли металла тиоцианата (предпочтительно соли калия) или диметилтиомочевины, в отличие от предшествующего уровня техники, может успешно уменьшить количество примесей, образующихся при разложении донепезила в препаратах для чрескожной абсорбции.
Из примесей донепезила, раскрытых в Фармакопее США, три могут быть идентифицированы с помощью Процедуры 1 и пять могут быть идентифицированы с помощью Процедуры 2. Только одна примесь, дезбензил донепезила, идентифицируется как по Процедуре 1, так и по Процедуре 2. Остальные примеси, идентифицированные по Процедурам 1 и 2, не перекрываются друг с другом. Критерии приемлемости для контроля этих примесей устанавливаются на основе токсичности каждой примеси.
Изобретатели настоящего изобретения обнаружили, что использование только одного из двух способов (Процедуры 1 и 2) анализа примесей донепезила не может успешно протестировать все различные примеси, которые образуются в результате разложения донепезила. Действительно, сравнительный пример 16 соответствовал всем критериям приемлемости Процедуры 1, в то же время превышая предел для неидентифицированной примеси с Процедурой 2. Введение препарата донепезила, содержащего такую неидентифицированную примесь, может привести к проблемам, связанным с потенциальной токсичностью неидентифицированной примеси.
Поэтому изобретатели настоящего изобретения признали необходимость в стабилизаторе, который может эффективно уменьшить все примеси донепезила, протестированные как Процедурой 1, так и Процедурой 2. Настоящие изобретатели обнаружили, что добавление монотиоглицерина, соли металла тиоцианата (предпочтительно соли калия) или диметилтиомочевины в качестве стабилизатора, как в Примерах с 1 по 3, может успешно и эффективно ингибировать образование примесей донепезила, охватываемых как Процедурой 1, так и Процедурой 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ДЛЯ ЧРЕСКОЖНОЙ АБСОРБЦИИ С УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ, ВКЛЮЧАЮЩИЙ ДОНЕПЕЗИЛ | 2021 |
|
RU2829135C1 |
| Трансдермальный препарат для лечения деменции, содержащий донепезил | 2018 |
|
RU2775315C2 |
| ЧРЕСКОЖНЫЙ ПЛАСТЫРЬ С МИКРОИГЛАМИ, СОДЕРЖАЩИЙ ДОНЕПЕЗИЛ | 2018 |
|
RU2735835C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПАЛОНОСЕТРОН В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2017 |
|
RU2732407C1 |
| АДГЕЗИВНЫЙ СОСТАВ, СОДЕРЖАЩИЙ СЕЛЕГИЛИН | 2011 |
|
RU2561044C2 |
| СПОСОБ ПОДАВЛЕНИЯ ВЫЦВЕТАНИЯ СО ВРЕМЕНЕМ АДГЕЗИВНОЙ КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ ДОНЕПЕЗИЛ | 2007 |
|
RU2460521C2 |
| ИНЪЕЦИРУЕМАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2020 |
|
RU2777316C1 |
| ПРЕПАРАТ ДЛЯ НАРУЖНОГО ПРИМЕНЕНИЯ | 2020 |
|
RU2814569C2 |
| СТАБИЛИЗИРОВАННАЯ АДГЕЗИВНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДОНЕПЕЗИЛ | 2007 |
|
RU2445953C2 |
| СТАБИЛИЗИРОВАННАЯ АДГЕЗИВНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДОНЕПЕЗИЛ | 2007 |
|
RU2452474C2 |
Настоящее изобретение относится к содержащему донепезил препарату для чрескожной абсорбции для лечения деменции. Более конкретно настоящее изобретение относится к препарату для чрескожной абсорбции для лечения деменции, содержащему слой подложки, содержащий лекарственное средство слой и слой высвобождения, где содержащий лекарственное средство слой содержит донепезил или его фармацевтически приемлемую соль в качестве активного ингредиента; соль металла тиоцианата (предпочтительно калиевую соль) или диметилтиомочевину в качестве стабилизатора; и чувствительный к давлению адгезив. Настоящее изобретение обеспечивает препарат для чрескожной абсорбции для лечения деменции с уменьшенным образованием примесей донепезила. 2 н.п. ф-лы, 7 табл.
1. Препарат для чрескожной абсорбции, содержащий слой подложки, содержащий лекарственное средство слой и слой высвобождения, где:
содержащий лекарственное средство слой содержит донепезил в качестве активного ингредиента и стабилизатор, выбранный из группы, состоящей из соли тиоцианата металла и диметилтиомочевины, где соль тиоцианата металла представляет собой тиоцианат калия.
2. Способ получения препарата для чрескожной абсорбции, содержащего донепезил, в котором способ включает этапы:
i) растворения донепезила и адгезива в органическом растворителе, выбранном из группы, состоящей из этилацетата, толуола, гексана, метиленхлорида и тетрагидрофурана, и растворения соли тиоцианата металла или диметилтиомочевины в 2-пропаноле, метаноле или этаноле, смешивания их с вышеуказанным раствором, включающим донепезил, где соль тиоцианата металла представляет собой тиоцианат калия;
ii) нанесения раствора, полученного на этапе i), на слой высвобождения и сушку с образованием содержащего лекарственное средство слоя; и
iii) ламинирования содержащего лекарственное средство слоя, полученного на этапе ii), со слоем подложки.
| WO 2008066180 A1, 2008.06.05 | |||
| KR 20160074433 A, 2016.06.28 | |||
| WO 2008066185 A1, 2008.06.05 | |||
| ТРАНСДЕРМАЛЬНО АБСОРБИРУЕМЫЙ СОСТАВ, СОДЕРЖАЩИЙ ДОНЕПЕЗИЛ | 2010 |
|
RU2545696C2 |
Авторы
Даты
2024-02-21—Публикация
2019-09-05—Подача