Предпосылки изобретения
Область техники
Настоящее изобретение предусматривает способы лечения заболеваний, нарушений, состояний или синдромов, например, травматического повреждения мозга, у пациента, нуждающегося в этом, путем введения терапевтически эффективного количества DL-лейцина или его фармацевтически приемлемой соли, D-лейцина или его фармацевтически приемлемой соли, L-лейцина или его фармацевтически приемлемой соли, сложного этилового эфира L-лейцина или его фармацевтически приемлемой соли, ацетил-DL-лейцина или его фармацевтически приемлемой соли, ацетил-D-лейцина или его фармацевтически приемлемой соли, или ацетил-L-лейцина или его фармацевтически приемлемой соли.
Уровень техники
Ацетил-DL-лейцин использовался во Франции для лечения острого головокружения с 1957 года. Исследование FDG-μPET на модели острой односторонней лабиринтэктомии на крысах (Zwergal et al. (2016) Brain Struct Funct; 221 (1):159-70) показали значительный эффект L-энантиомера, N-ацетил-L-лейцина, на постуральную компенсацию за счет активации вестибуло-мозжечка и дезактивации заднебокового таламуса (Gunther et al. (2015) PLoS One; 10 (3):e0120891). Симптоматическое улучшение мозжечковой атаксии с использованием ацетил-DL-лейцина было показано в серии случаев с мозжечком пациентов (Strupp et al. (2013) J Neurol; 260(10): 2556-61). Другая серия случаев не показала положительных результатов (Pelz et al. (2015) J Neurol; 262(5): 1373-5). Количественный анализ походки показал, что ацетил-DL-лейцин улучшает временную изменчивость походки у пациентов с мозжечковой атаксией (Schniepp et al. (2015) Cerebellum; 3:8). В одномесячном исследовании с участием 12 пациентов с болезнью Ниманна-Пика типа C (NPC) было показано симптоматическое улучшение атаксии (Bremova et al. (2015) Neurology; 85(16): 1368-75). Кроме того, исследование ПЭТ у пациентов с атаксией, получавших ацетил-DL-лейцин, продемонстрировало повышенный метаболизм в среднем мозге и нижнем стволе головного мозга у "ответивших" на терапию пациентов (Becker-Bense et al. (2015) Abstract EAN).
В WO 2018/029657 и WO 2018/029658 описано использование лейцина и ацетиллейцина для лечения определенных нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), рассеянный склероз (РС), болезнь Паркинсона (БП) и боковой амиотрофический склероз (БАС) и определенные лизосомальные болезни накопления (LSD). В WO 2018/029658 модель мыши с болезнью Ниманна-Пика типа C (NPC) показала, что в мозге мышей с NPC1 наблюдается накопление LC3-II, а введение ацетил-DL-лейцина было связано со снижением уровня LC3-II, свидетельствует о частичном восстановлении аутофагического потока.
Воспаление, вызванное выработкой провоспалительных цитокинов, например, IL-1β, и хемокинов, является краеугольным камнем различных нейродегенеративных, нейровоспалительных, митохондриальных и других заболеваний. См., например, Chakrabarti et al., Curr Alzheimer Res. 15(10):894–904 (2018); Cherry et al., Journal of Neuroinflammation 11:98 (2014); Inácio et al., Journal of Neuroinflammation 12:211 (2015); Lappalainen et al., Am J Respir Cell Mol Biol 32:311–318 (2005); Coccia et al., J. Exp. Med. 209;1595-1609 (2012); Ray, Journal of the American College of Cardiology 63:1735-1438 (2014); Ren et al., Brain Res Rev. 60(1):57–64 (2009); Frank-Cannon et al., Molecular Neurodegeneration 4:47 (2009); DiSabato et al., J Neurochem 139(Suppl 2):136–153 (2016); Amor et al., Immunology 142:151–166 (2013); Chen et al., Molecular Medicine Reports 13:3391-3396 (2016); Tuttolomondo et al., Drug Design, Development and Therapy 8:2221–2239 (2014); Hong et al., Int Neurourol J 20 Suppl 1:S2-7 (2016); Gu et al., Journal of Biological Regulators & Homeostatic Agents 29:787-791 (2015); Belarbi et al., Journal of Neuroinflammation 9:23 (2012); Abdulkhaleq et al., Veterinary World, EISSN: 2231-0916 (available atwww.veterinaryworld.org/Vol.11/May-2018/9.pdf); Frankola et al., CNS Neurol Disord Drug Targets 10(3):391–403 (2011); Habbas et al., Cell 163:1730–1741 (2015); Debray et al., Current Opinion in Pediatrics 20:471–482 (2008); Niyazov et al., Mol Syndromol 7:122–137 (2016).
Например, травматическое повреждение мозга («TBI») представляет собой разрушительное заболевание, связанное со значительной заболеваемостью и смертностью. Случаи TBI продолжают расти ввиду роста населения и увеличения числа связанных с травмами событий, таких как дорожно-транспортные происшествия. Другие чрезвычайные ситуации, такие как стихийные бедствия, спортивные травмы, падения, нападения и военные конфликты, значительно способствуют возникновению случаев TBI. По оценкам, только в Соединенных Штатах ежегодно более 1,5 миллиона человек страдают от TBI. Тяжесть TBI варьируется от легкой до умеренной, до тяжелой и может быть очаговой или диффузной. Очаговые повреждения возникают в определенном месте, тогда как диффузные повреждения связаны с потенциально широко распространенной дисфункцией аксонов и повреждением сосудов.
Повреждение головного мозга от TBI происходит в две фазы. Исходная первичная фаза представляет собой само событие травмы головы, которое необратимо и поддается только профилактическим мерам, чтобы минимизировать степень повреждения, за которой следует продолжающаяся вторичная фаза, которая начинается во время травмы и продолжается в последующие дни или недели до нескольких лет. Эта вторичная фаза приводит к множеству физиологических, клеточных и молекулярных реакций, направленных на восстановление гомеостаза поврежденной ткани, что может привести к вторичному повреждению головного мозга.
В данной области существует потребность в фармацевтических средствах для лечения заболеваний, чувствительных к модуляции экспрессии провоспалительного медиатора.
Краткое изложение изобретения
Заявитель неожиданно обнаружил, что ацетил-L-лейцин модулирует экспрессию провоспалительных медиаторов в модели травматического повреждения мозга, индуцированного контролируемым воздействием на корковый слой (CCI), у мышей. Таким образом, в одном аспекте настоящее изобретение предусматривает способы лечения заболевания, нарушения, состояния или синдрома, причем модуляция одного или нескольких провоспалительных медиаторов обеспечивает преимущество. В первую очередь среди этих заболеваний, нарушений, состояний или синдромов находятся нейровоспалительные, неврологические, аутоиммунные, нейродегенеративные протеинопатические, психиатрические и митохондриальные заболевания, нарушения, состояния или синдромы.
Не желая быть связанными какой-либо конкретной теорией, считается, что лейцин, ацетил-DL-лейцин, ацетил-D-лейцин и ацетил-L-лейцин модулируют нейровоспаление, которое является путем борьбы с молекулярными каскадами, способствующими развитию нейровоспалительных и других заболеваний, нарушений, состояний или синдромов. Например, вторичное повреждение головного мозга у пациентов с TBI может характеризоваться гиперреактивным ответом, при котором избыток провоспалительных цитокинов может играть роль в поддержании функции мозга, а также в восстановлении после TBI. Повреждение головного мозга, вызванное травмой головы, может вызвать чрезмерное и/или неконтролируемое высвобождение этих цитокинов, особенно интерлейкина (IL)-1β, IL-6 и фактора некроза опухоли (TNF)α, что может привести к значительному повреждению головного мозга. Сообщается, что провоспалительные цитокины играют роль в патофизиологии нейродегенеративных заболеваний, таких как БА, РС, БП и БАС (Wei-Wei et al., Mol. Med. Rep. 2016; 13 (4):3391-3396), и было установлено, что они являются признаком генетически нейродегенеративных нарушений, таких как ганглиозиды GM1 и GM2 (Jeyakumar et al., Brain 2003; 126 (Pt 4):974-87). Кроме того, нарушение нормальной лизосомной функции при лизосомных болезнях накопления (LSD) было связано с аномалиями воспаления, такими как аномально повышенные провоспалительные цитокины (Simonaro, Journal of Inborn Errors of Metabolism & Screening, Vol. 4: 1-8 (2016)).
Кроме того, не желая ограничиваться какой-либо конкретной теорией, в соответствии с настоящим описанием также считается, что DL-лейцин, L-лейцин, D-лейцин, сложный этиловый эфир L-лейцина, ацетил-DL-лейцин, ацетил-D-лейцин и ацетил-L-лейцин модулируют связанный с микротрубочками тау-белок (который является субстратом аутофагии) и/или конъюгат 3-фосфатидилэтаноламина (LC3-II) связанного с микротрубочками белка 1A/1B легкой цепи, который может быть маркерами TBI. LC3-II является маркером образования аутофагосом, и повышенные уровни LC3-II могут отражать нарушение очистки аутофагических вакуолей. Аутофагосомы образуются, но не очищаются. Аутофагия нарушается при БА, и в головном мозге при БА обнаруживаются повышенные уровни LC3-II.
В одном аспекте настоящее изобретение предусматривает способы лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, перечисленных в таблицах 1-17, см. ниже. «Соединение по изобретению» в совокупности относится к DL-лейцину («DLL»), L-лейцину («LL»), D-лейцину («DL»), сложному этиловому эфиру L-лейцина («LLE» или «LEE»), ацетил-DL-лейцину («ADLL»), ацетил-D-лейцину («ADL») или ацетил-L-лейцину («ALL», «NAL» или «NALL») и их фармацевтически приемлемым солям.
В другом аспекте настоящее изобретение предусматривает способы лечения TBI у субъекта, нуждающегося в этом, или лечения симптома TBI у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом аспекте настоящее изобретение предусматривает соединение по изобретению для применения в лечении заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для применения в лечении симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, перечисленных в таблицах 1-17, см. ниже.
В другом аспекте настоящее изобретение предусматривает соединение по изобретению для применения в лечении TBI у субъекта, нуждающегося в этом, или для применения в лечении симптома TBI у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение предусматривает применение соединения по изобретению для производства лекарственного препарата для лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для производства лекарственного препарата для лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, перечисленных в таблицах 1-17, см. ниже.
В другом аспекте настоящее изобретение предусматривает применение соединения по изобретению для производства лекарственного препарата для лечения TBI у субъекта, нуждающегося в этом, или для производства лекарственного препарата для лечения TBI у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую соединение по изобретению, и фармацевтически приемлемый носитель для применения в лечении заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для применения в лечении симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, перечисленных в таблицах 1-17, см. ниже.
В другом аспекте настоящее изобретение обеспечивает способ модуляции экспрессии провоспалительных медиаторов, например провоспалительных цитокинов и провоспалительных хемокинов у субъекта, у нуждающегося в этом субъекта, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту. В другом аспекте провоспалительные медиаторы включают, но не ограничиваются ими, NOS2, IL-18, IFNb, IL-1β, TNFα, NOX2, NLRP3, SOCS3, ARG1, IL-10, IL-4ra и/или YM1.
Следует понимать, что как приведенное выше краткое изложение, так и последующее подробное описание являются только иллюстративными и пояснительными и не ограничивают заявленное изобретение.
Подробное описание графических материалов
На фиг. 1 представлена схема, показывающая дозирование NAL и схему эксперимента для модели с TBI, вызванным воздействием на корковый слой. Мышам перорально вводили NAL, а кортикальные ткани собирали на 1, 3 и 7 дни после TBI для биохимических анализов.
На фиг. 2 представлена столбчатая диаграмма, показывающая изменение массы тела мышей через 7 дней после обработки NAL (N-ацетил-L-лейцин или ацетил-L-лейцин) с последующим TBI.
На фиг. 3 представлена столбчатая диаграмма, показывающая оценку пространственной памяти у мышей через 7 дней после обработки NAL после TBI с использованием критерия Y-лабиринта.
На фиг. 4 представлена столбчатая диаграмма, показывающая экспрессию IL-16 у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 5 представлена столбчатая диаграмма, показывающая экспрессию IL-1β у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 6 представлена столбчатая диаграмма, показывающая экспрессию INFb у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 7 представлена столбчатая диаграмма, показывающая экспрессию Arg1 у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 8 представлена столбчатая диаграмма, показывающая экспрессию SOCS3 у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 9 представлена столбчатая диаграмма, показывающая экспрессию TNF у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 10 представлена столбчатая диаграмма, показывающая экспрессию IL-18 у мышей через 3 дня после обработки NAL с последующим CCI.
На фиг. 11 представлена оценка вестерн-блот анализа аутофагии и гибели клеток после обработки NAL с последующим CCI.
На фиг. 12 представлена столбчатая диаграмма, показывающая уровни фодрина/b-актина после обработки NAL с последующим CCI.
На фиг. 13 представлена столбчатая диаграмма, показывающая уровни LC3-II/b-актина после обработки NAL с последующим CCI.
На фиг. 14 представлена гистограмма отношения экспрессии LC3-II к βIII-тубулину в мозжечке мозга NPC1 мыши в возрасте 9-12 недель, получавших ADLL, ALL, ADL, DLL, LL, DL, LLE и миглустат (мигл.) в течение 3 недель относительно необработанного мозжечка NPC1 (n = 4, среднее значение ± стандартная ошибка среднего).
На фиг. 15 представлена гистограмма отношения APP-CTF: полноразмерной экспрессии APP в мозжечке мозга NPC1 мыши в возрасте 9-12 недель, получавших ADLL, ALL, ADL, DLL, LL, DL, LLE и миглустат (мигл.) в течение 3 недель относительно необработанного мозжечка NPC1 (n = 4, среднее значение ± стандартная ошибка среднего).
На фиг. 16 представлена гистограмма отношения APP-CTF-6: полноразмерной экспрессии APP в мозжечке мозга NPC1 мыши в возрасте 9-12 недель, получавших ADLL, ALL, ADL, DLL, LL, DL и LLE в течение 3 недель относительно необработанного мозжечка NPC1.
На фиг. 17 представлена гистограмма отношения APP-CTF-7: полноразмерной экспрессии APP в мозжечке мозга NPC1 мыши в возрасте 9-12 недель, получавших ADLL, ALL, ADL, DLL, LL, DL и LLE в течение 3 недель относительно необработанного мозжечка NPC1 (n = 4, среднее значение ± стандартная ошибка среднего).
На фиг. 18 представлена гистограмма отношения LC3-II, нормализованного к βIII-тубулину (выраженному как процент необработанных (n = 1)) в первичных кортикальных нейронах крыс, получавших U18666A (2 мкг/мл, 24 часа) в отсутствие или в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 24 часа).
На фиг. 19 представлена гистограмма отношения APP-CTF -6 и -7, нормализованных к их соответствующим CTF в необработанных клетках (выраженное как процент необработанных (n = 1) в первичных кортикальных нейронах крыс, получавших U18666A (2 мкг/мл, 24 часа) в отсутствие или в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 24 часа).
На фиг. 20 представлены восемь вестерн-блотов тау-белка (5E2), синаптофизина и βIII-тубулина в первичных кортикальных нейронах крыс (культуры, обогащенные нейронами (NE) и нейроглией (NG)) в отсутствие и в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 5 дней).
На фиг. 21 представлена гистограмма отношения полноразмерного тау-белка, нормализованного к βIII-тубулину в культурах NE при DIV14 в отсутствие и в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 5 дней).
На фиг. 22 представлена гистограмма отношения усеченного тау-белка (клон 5E2), нормализованного к βIII-тубулину в культурах NG при DIV14 в отсутствие и в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 5 дней).
На фиг. 23 представлена гистограмма отношения синаптофизина, нормализованного к βIII-тубулину в культурах NE при DIV14 (выраженное как процент от необработанных контрольных лизатов; n = 4, среднее значение ± SEM) в отсутствие и в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 5 дней).
На фиг. 24 представлена гистограмма отношения синаптофизина, нормализованного к βIII-тубулину в культурах NG при DIV14 (выраженное как процент от необработанных контрольных лизатов; n = 4, среднее значение ± SEM) в отсутствие и в присутствии ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 5 дней).
На фиг. 25 представлена столбчатая диаграмма, показывающая объем лизосом у клеток дикого типа и нуль-клеток NPC1 яичника китайского хомячка, обработанных ALL в течение семи дней в указанных концентрациях (n = 4).
На фиг. 26 представлена столбчатая диаграмма, показывающая объем лизосом у клеток дикого типа и нуль-клеток NPC1 яичника китайского хомячка, обработанных LEE в течение семи дней в указанных концентрациях (n = 4).
На фиг. 27 представлена столбчатая диаграмма, показывающая объем лизосом у клеток дикого типа и нуль-клеток NPC1 яичника китайского хомячка, обработанных LL в течение семи дней в указанных концентрациях (n = 3).
На фиг. 28 представлена оценка вестерн-блот анализа лизата кортикальной ткани фиктивных мышей и мышей с TBI, получавших NALL или носитель, для обнаружения продуктов распада α-фодрина.
На фиг. 29 представлена столбчатая диаграмма, показывающая денситометрический анализ α-фодрина относительно актина. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, **p<0,01 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 30 представлена серия из четырех изображений кортикальных срезов мозга мышей с TBI, получавших носитель или NALL, окрашенных для TUNEL. Данные представлены как среднее значение ± стандартная ошибка среднего. n=3 для мышей с TBI, получавших носитель, и 4 для мышей с TBI, получавших NALL.
На фиг. 31 представлена столбчатая диаграмма, показывающая количественное определение площади для кортикальных срезов мозга мышей с TBI, окрашенных для TUNEL. Данные представлены как среднее значение ± стандартная ошибка среднего. n=3 для мышей с TBI, получавших носитель, и 4 для мышей с TBI, получавших NALL.
На фиг. 32 представлена столбчатая диаграмма, показывающая количественное определение клеток для кортикальных срезов мозга мышей с TBI, окрашенных для TUNEL. Данные представлены как среднее значение ± стандартная ошибка среднего. n=3 для мышей с TBI, получавших носитель, и 4 для мышей с TBI, получавших NALL.
На фиг. 33 представлена оценка вестерн-блот анализа лизата кортикальной ткани фиктивных мышей и мышей с TBI, получавших NALL или носитель, для аутофагосомного маркера LC3 и аутофагических грузовых белков p62/SQSTM1.
На фиг. 34 представлена столбчатая диаграмма, показывающая денситометрический анализ LC3-II относительно актина. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 35 представлена столбчатая диаграмма, показывающая денситометрический анализ p62 относительно актина. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 36 представлена столбчатая диаграмма, показывающая относительные уровни мРНК NOS2 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 37 представлена столбчатая диаграмма, показывающая относительные уровни мРНК NLRP3 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 38 представлена столбчатая диаграмма, показывающая относительные уровни мРНК IL-1β в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 39 представлена столбчатая диаграмма, показывающая относительные уровни мРНК TNF-α в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 40 представлена столбчатая диаграмма, показывающая относительные уровни мРНК IFN-β в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 41 представлена столбчатая диаграмма, показывающая относительные уровни мРНК NOX2 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 42 представлена столбчатая диаграмма, показывающая относительные уровни мРНК SOCS3 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 43 представлена столбчатая диаграмма, показывающая относительные уровни мРНК YM-1 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 44 представлена столбчатая диаграмма, показывающая относительные уровни мРНК IL-4ra в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 45 представлена столбчатая диаграмма, показывающая относительные уровни мРНК Arg-1 в коре головного мозга фиктивных мышей и мышей TBI, получавших NALL или носитель. Данные представлены как среднее значение ± стандартная ошибка среднего. n=5, ***p<0,001, *p<0,05 (двухфакторный дисперсионный анализ с посттестами Бонферрони).
На фиг. 46 представлено изображение, показывающее потерю клеток Пуркинье мозжечка, прогрессирующую от передней к задней доле, и активацию микроглии у необработанных мышей Npc1-/- и мышей Npc1-/-, получавших ADLL, ALL и ADL. Мозжечок окрашивали кальбиндином-b (клетки Пуркинье) или CD68 (активированная микроглия).
На фиг. 47 представлена диаграмма рассеяния, показывающая выживаемость клеток Пуркинье в возрасте 59 дней у необработанных Npc1-/- мышей и Npc1-/- мышей, получавших ADLL, ALL и ADL.
На фиг. 48 представлена диаграмма рассеяния, показывающая частоту положительно активированной микроглии CD68 в возрасте 59 дней у необработанных Npc1-/- мышей и Npc1-/- мышей, получавших ADLL, ALL и ADL. Плотность клеток CD68 измеряли в мозжечке. n = 5 животных в группе. Среднее значение ± стандартное отклонение, *** p<0,0009 (однофакторный дисперсионный анализ).
На фиг. 49 представлен линейный график, показывающий результат двигательной функции (обход луча) в модели TBI с контролируемым воздействием на корковый слой, причем мыши получали NAL.
На фиг. 50 представлена столбчатая диаграмма, показывающая результат пространственной памяти (Y-лабиринт) в модели TBI с контролируемым воздействием на корковый слой, причем мыши получали NAL.
На фиг. 51 представлена гистограмма, показывающая результат распознавания нового объекта (NOR) в модели контролируемого коркового воздействия TBI с мышами, получавшими NAL.
Подробное описание изобретения
Используемый в данном документе термин «субъект» может быть позвоночным, млекопитающим или домашним животным. Следовательно, композиции согласно данному описанию можно использовать для лечения любого млекопитающего, например домашнего скота (например, лошади, коровы, овцы или свиньи), домашних животных (например, кошки, собаки, кролика или морской свинки), лабораторного животного (например, мыши или крысы), или может использоваться в других ветеринарных целях. В одном варианте осуществления субъектом является человек. «Субъект» и «пациент» используются взаимозаменяемо.
В контексте данного документа слова в единственном числе означают также и множественное число.
Термины «приблизительно» и «около» означают почти то же самое, что и ссылочное число или значение, включая приемлемую степень ошибки для измеряемой величины с учетом характера или точности измерений.
В контексте настоящего описания термины «приблизительно» и «около» следует понимать как включающие ± 20% от указанного количества, частоты или значения. Приведенные в данном документе числовые величины являются приблизительными, если не указано иное, что означает, что термин «около» или «приблизительно» может подразумеваться, если явно не указано.
Термины «вводить», «введение» или «вводимый» в контексте настоящего изобретения относятся к (1) обеспечению, предоставлению, дозированию и/или назначению либо практикующим врачом, либо его уполномоченным агентом, либо под его руководством соединения по изобретению и (2) включение, прием или употребление пациентом или самим лицом соединения по изобретению. Любая ссылка на «лейцин», «ацетил-DL-лейцин» и «ацетил-L-лейцин» или любое другое соединение по изобретению включает их фармацевтически приемлемые соли, даже если не указано явно.
Если не указано иное, термин «лейцин» относится к L-лейцину.
«Фармацевтически приемлемая соль», как упоминается в данном документе, представляет собой любой солевой препарат, который подходит для использования в фармацевтических целях. Фармацевтически приемлемые соли включают, но не ограничиваются ими, соли аминов, такие как N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенэтиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин, трис(гидроксиметил)аминометан и т.п.; соли щелочных металлов, такие как литий, калий, натрий и т.п.; соли щелочно-земельных металлов, такие как барий, кальций, магний и т.п.; соли переходных металлов, такие как цинк, алюминий и т.п.; соли других металлов, такие как гидрофосфат натрия, фосфат динатрия и т.п.; минеральные кислоты, такие как гидрохлориды, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты, фумараты и т.п.
Соединение по изобретению может быть составлено и введено субъекту в соответствии с известными идеями в данной области. Например, DL-лейцин, L-лейцин, D-лейцин, сложный этиловый эфир L-лейцина, ацетил-DL-лейцин, ацетил-D-лейцин или ацетил-L-лейцин могут быть составлены в виде фармацевтической композиции. Фармацевтическая композиция может содержать DL-лейцин, L-лейцин, D-лейцин, сложный этиловый эфир L-лейцина, ацетил-DL-лейцин, ацетил-D-лейцин или ацетил-L-лейцин и фармацевтически приемлемый носитель. Ссылка на фармацевтическую композицию охватывает только активный агент, то есть DL-лейцин, L-лейцин, D-лейцин, сложный этиловый эфир L-лейцина, ацетил-DL-лейцин, ацетил-D-лейцин или ацетил-L-лейцин, или в форме фармацевтической композиции.
Фармацевтическая композиция может принимать любую из множества различных форм, в частности, в зависимости от способа ее использования. Таким образом, например, она может быть в форме порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, спрея, мицеллярного раствора, трансдермального пластыря, суспензии липосом или любой другой подходящей форме, которую можно вводить человеку или животному, нуждающемуся в лечении.
«Фармацевтически приемлемый носитель», как упоминается в данном документе, представляет собой любое известное соединение или комбинацию известных соединений, например, вспомогательные вещества, носители и т.д., которые известны специалистам в данной области как полезные при составлении фармацевтических композиций. Следует понимать, что носитель фармацевтической композиции должен быть переносимым субъектом, которому он вводится.
В одном варианте осуществления фармацевтически приемлемый носитель может представлять собой твердое вещество, а композиция может находиться в форме порошка или таблетки. Твердый фармацевтически приемлемый носитель может включать, но не ограничивается ими, одно или более веществ, которые также могут действовать как ароматизаторы, буферы, смазывающие вещества, стабилизаторы, солюбилизаторы, суспендирующие средства, смачивающие вещества, эмульгаторы, красители, наполнители, смазывающие вещества, вспомогательные добавки для прессования, инертные связующие, подсластители, консерванты, красители, покрытия или вещества для улучшения распадаемости таблеток. Носитель также может быть инкапсулирующим материалом. В порошках носитель может представлять собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченными активными агентами по изобретению. В таблетках активный агент может быть смешан с носителем, имеющим необходимые свойства прессирования, в подходящих пропорциях и уплотнен до желаемой формы и размера. Порошки и таблетки, например, могут содержать до 99% активных агентов. Подходящие твердые носители включают в себя, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидин, легкоплавкие воски и ионообменные смолы. В другом варианте осуществления фармацевтически приемлемый носитель может быть гелем, а композиция может находиться в форме крема или тому подобного.
Носитель может включать, без ограничения, одно или несколько вспомогательных веществ или разбавителей. Примерами таких вспомогательных веществ являются желатин, камеди, лактоза, микрокристаллическая целлюлоза, крахмал, натрия крахмалгликолят, гидрофосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п.
В другом варианте осуществления фармацевтически приемлемый носитель может быть жидкостью. В одном варианте осуществления фармацевтическая композиция находится в форме раствора. Жидкие носители используются при приготовлении растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Соединение по изобретению может быть растворено или суспендировано в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смесь обоих или фармацевтически приемлемых масел или жиров. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, ароматизаторы, суспендирующие агенты, загущающие агенты, красители, регуляторы вязкости, стабилизаторы или осмотические регуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащую добавки, как указано выше, например, производные целлюлозы, такие как раствор карбоксиметилцеллюлозы натрия), спирты (включая одноатомные спирты и многоатомные спирты, например гликоли) и их производные, а также масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель также может представлять собой маслянистый эфир, такой как этилолеат и изопропилмиристат. Стерильные жидкие носители применимы в стерильных жидких композициях для парентерального введения. Жидкий носитель для композиций под давлением может быть галогенированным углеводородом или другим фармацевтически приемлемым пропеллентом.
Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, можно использовать, например, путем внутримышечной, интратекальной, эпидуральной, внутрибрюшинной, внутривенной и подкожной инъекции. Активный агент может быть приготовлен в виде стерильной твердой композиции, которую можно растворять или суспендировать во время введения с использованием стерильной воды, физиологического раствора или другой подходящей стерильной среды для инъекций.
Композиции могут вводиться перорально в форме стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, достаточно физиологического раствора или глюкозы, чтобы сделать раствор изотоническим), солей желчных кислот, камеди, желатина, монолеат сорбита, полисорбата 80 (олеатные эфиры сорбита и его ангидриды, сополимеризованные с оксидом этилена) и тому подобное. Композиции также можно вводить перорально либо в жидкой, либо в твердой форме композиции. Композиции, подходящие для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Лекарственные формы, пригодные для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
В качестве альтернативы композиции можно вводить путем ингаляции (например, интраназально). Композиции также могут быть составлены для местного применения. Так, например, кремы или мази можно наносить на кожу.
Соединение по изобретению может быть включено в устройство с медленным или отсроченным высвобождением. Такие устройства можно, например, вводить на кожу или под кожу, и лекарство может высвобождаться в течение недель или даже месяцев. Такие устройства могут быть полезными, когда требуется длительное лечение соединением по изобретению, используемым согласно настоящему изобретению, и которое может требовать частого введения (например, по меньшей мере ежедневное введение).
В одном варианте осуществления фармацевтическая композиция представляет собой твердую пероральную лекарственную форму, такую как таблетка. В таблетках активный агент может быть смешан с носителем, таким как фармацевтически приемлемый носитель, имеющим необходимые свойства прессования, в подходящих пропорциях и уплотнен до желаемой формы и размера. Таблетки могут содержать до 99% по массе активных агентов.
Фармацевтические композиции в твердой пероральной лекарственной форме, такой как таблетки, можно приготовить любым способом, известным в области фармации. Фармацевтические композиции обычно готовят путем смешивания активного агента с обычными фармацевтически приемлемыми носителями.
Таблетки могут быть приготовлены, как известно в данной области. Tanganil®, например, включает пшеничный крахмал, прежелатинизированный маисовый (кукурузный) крахмал, карбонат кальция и стеарат магния в качестве наполнителей. Такие же или подобные наполнители, например, могут быть использованы в настоящем изобретении.
Состав каждой таблетки 700 мг Tanganil® следующий: 500 мг ацетил-DL-лейцина, 88 мг пшеничного крахмала, 88 мг прежелатинизированного кукурузного крахмала, 13 мг карбоната кальция и 11 мг стеарата магния. Такие же таблетки, например, можно использовать в способах по настоящему изобретению.
Как обсуждалось выше, соединение по изобретению может быть составлено и введено в виде фармацевтической композиции в любом количестве различных форм. Например, соединение по изобретению может быть составлено в виде фармацевтической композиции для облегчения его доставки через гематоэнцефалический барьер. В качестве дополнительного примера соединение по изобретению может быть составлено в виде фармацевтической композиции для обхода гематоэнцефалического барьера. Составы, которые облегчают доставку через гематоэнцефалический барьер или которые подходят для введения способом, обходящим гематоэнцефалический барьер, могут использоваться для получения и введения лейцина (неацетилированного), как описано в данном документе.
В одном варианте осуществления фармацевтическая композиция, например, содержащая ацетил-L-лейцин или его соль, составлена для нанодоставки, например, систем коллоидного лекарственного средства-носителя. Подходящие примеры включают, но не ограничиваются ими, липосомы, наночастицы (например, полимерные, липидные и неорганические наночастицы), наногели, дендримеры, мицеллы, наноэмульсии, полимерсомы, экзосомы и квантовые точки. См., например, Patel et al., "Crossing the Blood-Brain Barrier: Recent Advances in Drug Delivery to the Brain," CNS Drugs 31:109-133 (2017); Kabanov et al., "New Technologies for Drug Delivery across the Blood Brain Barrier," Curr Pharm Des., 10(12):1355-1363 (2004); Cheng et al., "Highly Stabilized Curcumin Nanoparticles Tested in an In Vitro Blood–Brain Barrier Model and in Alzheimer's Disease Tg2576 Mice," The AAPS Journal, vol. 15, no. 2, pp. 324-336 (2013); Lähde et al. "Production of L-Leucine Nanoparticles under Various Conditions Using an Aerosol Flow Reactor Method," Journal of Nanomaterials, vol. 2008, article ID 680897 (2008).
В одном варианте осуществления фармацевтическая композиция, например, содержащая ацетил-L-лейцин или его соль, составлена для прямой доставки в центральную нервную систему (ЦНС), например, путем инъекции или инфузии. Составы и способы прямой доставки в ЦНС известны в данной области техники. См., например, патент США № 9283181. Примеры такого введения включают, но не ограничиваются ими, интраназальное, внутрижелудочковое, интратекальное, внутричерепное и доставку через трансплантацию слизистой оболочки носа.
В одном варианте осуществления фармацевтическая композиция составлена для (и вводится) интраназальной доставки. См., например, Hanson et al., "Intranasal delivery bypasses the blood-brain barrier to target therapeutic agents to the central nervous system and treat neurodegenerative disease," BMC Neurosci. 9(Suppl 3):S5 (2008). В одном варианте осуществления фармацевтическая композиция составлена для (и вводится) доставки посредством трансплантата слизистой оболочки носа. В одном варианте осуществления фармацевтическая композиция составлена для (и вводится) интрацеребровентрикулярной инъекции или инфузии. В другом варианте осуществления фармацевтическая композиция составлена для (и вводится) интратекальной интрацистернальной инъекции или инфузии. В одном варианте осуществления фармацевтическая композиция составлена для (и вводится) интратекальной люмбальной инъекции или инфузии.
Могут быть использованы различные методы, включая, без ограничения, инъекцию через отверстие, цистернальную или поясничную пункцию или тому подобное, как известно в данной области. Различные устройства, как внутренние (например, имплантированные), так и внешние, могут использоваться для доставки, как известно в данной области, например, насосы, катетеры, резервуары и т.д. В одном варианте осуществления интервал введения составляет один раз в две недели.
В одном варианте осуществления интервал введения составляет один раз в месяц. В одном варианте осуществления интервал введения составляет один раз в два месяца. В одном варианте осуществления интервал введения составляет дважды в месяц. В одном варианте осуществления интервал введения составляет один раз в неделю. В одном варианте осуществления интервал введения составляет дважды или несколько раз в неделю. В одном варианте осуществления интервал введения составляет каждый день. В одном варианте осуществления введение является непрерывным, например, непрерывная инфузия.
В одном варианте осуществления доза или эквивалент количества соединения по изобретению может регулироваться с учетом либо его прямой доставки в ЦНС, либо его доставки через гематоэнцефалический барьер.
Настоящее изобретению описывает соединение по изобретению, включая его фармацевтические композиции, для лечения различных заболеваний, нарушений, состояний и синдромов у субъекта, нуждающегося в этом.
В контексте настоящего описания термин «травматическое повреждение мозга» относится к любому повреждению головного мозга, имеющему начальную фазу, состоящую по меньшей мере из одного события травмы головы (т.е. попадание объекта в мозг и/или воздействие нагрузки или силы на мозг, заставляющее мозг перемещаться быстро и/или неестественно внутри черепа субъекта), и последующую вторичную фазу, которая включает физиологические, клеточные и/или молекулярные нарушения, возникающие в результате травмы головы. Примеры травм головы включают предметы, проникающие в череп, такие как пули, стрелы и другие физические предметы, которые проходят через череп и входят в мозг; ударные нагрузки или силы, приложенные к голове или другим частям тела пациента; травму, вызванную хирургическим вмешательством; сотрясения, создаваемые взрывами; сотрясения, вызванные невзрывоопасными средствами, например, спортивные травмы, дорожно-транспортные происшествия, обрушение зданий и землетрясения. Результаты TBI могут быть разных типов, и все формы TBI входят в объем настоящего изобретения. Например, TBI может варьироваться по степени тяжести от кратковременного изменения психического статуса или сознания до длительного периода бессознательного состояния или потери памяти. В одном варианте осуществления TBI было причинено посредством сотрясения мозга. В одном варианте осуществления TBI было причинено посредством ушиба. В одном варианте осуществления TBI было причинено посредством открытой травмы головы. В другом варианте осуществления TBI было причинено посредством закрытой травмы головы. В одном варианте осуществления TBI было причинено посредством фокального повреждения. В другом варианте осуществления TBI было причинено посредством диффузного повреждения. В одном варианте осуществления форма TBI представляет собой легкое TBI. В другом варианте осуществления форма TBI представляет собой умеренное TBI. В другом варианте осуществления форма TBI представляет собой тяжелое TBI.
"Субъект, нуждающийся в этом", как используется в данном документе, может быть субъектом, у которого есть заболевание, нарушение, состояние или синдром, например, заболевание, нарушение, состояние или синдром, предусмотренные в любой из таблиц 1-17. У субъекта может быть или не быть диагностировано заболевание, нарушение, состояние или синдром. Например, субъект может еще не иметь диагноз (клинического или другого) TBI, но может иметь один или несколько симптомов TBI. Субъект также может иметь биохимический или другой идентифицируемый маркер TBI.
«Терапевтически эффективное количество» соединения по изобретению представляет собой любое количество, которое при введении субъекту представляет собой количество, необходимое для получения желаемого эффекта, который для настоящего изобретения может быть терапевтическим и/или профилактическим. Доза может быть определена в соответствии с различными параметрами, такими как конкретное используемое соединение по изобретению; возраст, вес и состояние пациента, подлежащего лечению; способ введения и необходимая схема лечения. Врач сможет определить необходимый способ введения и дозировку для каждого конкретного пациента. Например, суточная доза может составлять от около 10 до около 225 мг на кг, от около 10 до около 150 мг на кг или от около 10 до около 100 мг на кг массы тела.
Используемый в данном документе термин «получающий лечение» или «лечение» относится к любым признакам успеха в предотвращении, остановке или облегчении заболевания, нарушения, состояния или синдрома, например заболевания, нарушения, состояния или синдрома, предусмотренного в любой из таблиц 1-17, у субъекта, и/или предотвращении, остановке или облегчении любого одного или нескольких симптомов заболевания, нарушения, состояния или синдрома, например заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, включая любой объективный или субъективный параметр, такой как уменьшение боли; ремиссия; предотвращение, уменьшение, подавление или устранение одного или нескольких симптомов; повышение переносимости заболевания, нарушения, состояния или синдрома для субъекта; замедление обострения заболевания, нарушения, состояния или синдрома; или улучшение физического или психического благополучия субъекта, нуждающегося в этом.
Термины «получающий лечение» или «лечение» также включают, например, индуцирование подавления, регрессии или стаза заболевания, нарушения, состояния или синдрома. Например, лечение пациента или субъекта, нуждающегося в лечении TBI, включает уменьшение симптома TBI у субъекта, индукцию клинического ответа, подавление или снижение прогрессирования TBI или подавление или уменьшение осложнения TBI.
Предотвращение, остановка или облегчение повреждения или патологии заболевания, нарушения, состояния или синдрома, например предотвращение, уменьшение, подавление или устранение одного или нескольких симптомов заболевания, нарушения, состояния или синдрома, может быть основано на объективных и/или субъективных параметрах, включая, например, результаты медицинского(-их) осмотра(-ов), неврологического(-их) осмотра(-ов) и/или психиатрической(-их) оценки (оценок). Успех лечения некоторых заболеваний, перечисленных в таблицах 1-17, например, TBI, можно определить или оценить, например, путем сравнения тяжести заболевания (например, объективных и/или субъективных параметров TBI) до начала лечения с помощью соединения по изобретению с учетом тяжести заболевания (например, объективных и/или субъективных параметров TBI) после начала лечения соединением по изобретению. Например, степень тяжести TBI можно оценить с помощью шкалы, индекса, рейтинга или баллов. В одном варианте осуществления описанное в данном документе лечение улучшает такую оценку от значения или степени, характерной для симптоматического субъекта, до значения или степени, характерной для бессимптомного субъекта. В одном варианте осуществления описанное в данном документе лечение улучшает такую оценку по сравнению с исходным уровнем. Исходным уровнем может быть, например, состояние субъекта до начала любого лечения заболевания, например, TBI, или до начала лечения заболевания с помощью соединения по изобретению. В качестве альтернативы исходным уровнем может быть, например, состояние субъекта после определенного периода времени лечения заболевания. В одном варианте осуществления лечение соединением по изобретению, как описано в данном документе, улучшает оценку субъекта (например, шкалу, индекс, рейтинг или оценку объективных и/или субъективных параметров) по сравнению с исходным уровнем по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%. В одном варианте осуществления оценка улучшена на по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или 100%.
Например, в одном варианте осуществления тяжесть заболевания пациента, например, TBI, может быть определена количественно по шкале комы Глазго (GCS). GCS – это совокупный балл по трем областям исследования: глазная, вербальная и двигательная функция. При обследовании глаз пациента оценивают от 1 до 4 следующим образом: 1 - глаз не открывается при любой стимуляции, 2 - глаза открываются только в ответ на боль, 3 - глаза открываются при разговоре и 4 - глаза открываются спонтанно. При вербальном обследовании пациента оценивают от 1 до 5 следующим образом: 1 - нет словесной реакции, 2 - непонятные звуки, 3 - несоответствующие слова, 4 - сбит с толку и 5 - ориентирован. Для обследования движения пациента оценивают от 1 до 6 следующим образом: 1 - отсутствие двигательной реакции, 2 - растяжение при боли, 3 - аномальное сгибание при боли, 4 - отдергивание при боли, 5 - локализация боли и 6 - выполняет команды. Оценка GCS – это сумма трех оценок, полученных за глазную, вербальную и двигательную реакции. В целом, TBI классифицируется как легкое, умеренное или тяжелое на основе шкалы комы Глазго: легкое: GCS>13, умеренное: GCS 9-12 и тяжелое: GCS<8. Уровень выздоровления пациентов с TBI может быть количественно оценен по шкале результатов Глазго (GOS). Шкала результатов Глазго представляет собой 5 -уровневую шкалу: 1 - смерть, 2 - вегетативное состояние, 3 - тяжелая инвалидность, 4 - инвалидность средней степени и 5 - хорошее восстановление. GOS часто делится на «благоприятные» исходы (инвалидность средней степени и хорошее восстановление) и «неблагоприятные» исходы (смерть, вегетативное состояние и тяжелая инвалидность).
«Симптом» заболевания, нарушения, состояния или синдрома включает любое клиническое или лабораторное проявление, связанное с заболеванием, нарушением, состоянием или синдромом, и не ограничивается тем, что субъект может чувствовать или наблюдать. Например, симптомы некоторых заболеваний, перечисленных в таблицах 1-17, например, TBI, включают, помимо прочего, потерю сознания, спутанность сознания, беспокойство, возбуждение, дезориентацию, потерю памяти, головную боль, предобморочное состояние, головокружение, помутнение зрения или уставшие глаза, утомляемость или вялость, изменение режима сна, перепады поведения или настроения, проблемы с памятью, концентрацией, вниманием и/или мышлением, повторяющуюся тошноту или рвоту, судороги или припадки, неспособность проснуться от сна, невнятную речь, слабость или онемение конечностей и потерю координации.
В одном варианте осуществления соединение по изобретению может быть введено, например, в дозе в диапазоне от около 500 мг до около 30 г в день или в диапазоне от около 500 мг до около 15 г в день, например, в диапазоне от около 1,5 г до около 10 г в день, необязательно путем перорального введения твердой формы или перорального введения жидкой формы. Соединение по изобретению может вводиться, например, в дозе, соответствующей дозе Tanganil®, который назначают взрослым в дозе от 1,5 г до 2 г в день, 3-4 таблетки в двух дозах, утром и вечером.
Если вводится один энантиомер, то есть L-лейцин, ацетил-D-лейцин или ацетил-L-лейцин, дозы могут быть соответственно уменьшены. Например, если только ацетил-L-лейцин или только ацетил-D-лейцин вводят, доза может быть в диапазоне от около 250 мг до около 15 г в день, от около 250 мг до около 10 г в день или от около 250 мг до около 5 г в день, например, от около 0,75 г до около 5 г в день.
В одном варианте осуществления вводимые дозы находятся в диапазоне от около 1 г до около 30 г в день, от около 1 г до около 15 г в день, от около 1 г до около 10 г в день или от около 1,5 г до около 7 г в день, от 15,1 г до около 30 г в день, от 16 г до около 30 г в день, от 17 г до около 30 г в день, от 18 г до около 30 г в день, от 19 г до около 30 г в день или от 20 г до около 30 г в день. Она может составлять от около 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 г до около 15 г в день. Она может составлять от около 2, 3, 4, 5, 6, 7, 8 или 9 г до около 10 г в день. Она может составлять от 15,1, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 25, 27, 28 или 29 г до около 30 г в день. Она может составлять более около 1,5 г в день, но менее около 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 г в день. В одном варианте осуществления доза находится в диапазоне от около 4 г до около 6 г в день. В одном варианте осуществления доза находится в диапазоне от около 4 г до около 5 г в день. В одном варианте осуществления доза составляет около 4,5 г в день. В одном варианте осуществления доза составляет около 5 г в день. В одном варианте осуществления доза составляет около 1 г в день, около 2 г в день, около 3 г в день, около 4 г в день, около 5 г в день, около 6 г в день, около 7 г в день, около 8 г в день, около 9 г в день, около 10 г в день, около 11 г в день, около 12 г в день, около 13 г в день, около 14 г в день или около 15 г в день. В другом варианте осуществления доза составляет около 16 г в день, около 17 г в день, около 18 г в день, около 19 г в день или около 20 г в день. В другом варианте осуществления доза составляет около 21 г в день, около 22 г в день, около 23 г в день, около 24 г в день, около 25 г в день, около 26 г в день, около 27 г в день, около 28 г в день, около 29 г в день или около 30 г в день. В одном варианте осуществления эти дозы вводят в твердой лекарственной форме для перорального применения, особенно в таблетках. В другом варианте осуществления эти дозы представлены для ацетиллейцина, если он в рацемической форме. Дозы ацетиллейцина при наличии энантиомерного избытка могут быть ниже, например, на около 50% ниже. Таким образом, указанные выше диапазоны доз при уменьшении вдвое также явно охватываются настоящим изобретением.
В одном варианте осуществления общая суточная доза может быть распределена между несколькими введениями, т.е. введение может происходить два или более раз в день для достижения общей суточной дозы. В качестве примера необходимое количество таблеток для обеспечения общей суточной дозы соединения по изобретению можно разделить на два введения (например, утром и вечером) или три введения (например, утром, в полдень и вечером). Каждую дозу можно подходящим образом вводить с пищей или без нее. Например, ацетил-L-лейцин или ацетил-DL-лейцин можно вводить в дозе за около 1 или около 2 часа до приема пищи, например, за по меньшей мере около 20 минут, по меньшей мере около 30 минут, по меньшей мере около 40 минут, или по меньшей мере около 1 часа до приема пищи, или можно вводить за около 1, около 2 или около 3 часа после приема пищи, например, ожидая по меньшей мере около 20 минут, по меньшей мере около 30 минут, по меньшей мере около 1 часа, по меньшей мере около 1,5 часа, по меньшей мере около 2 часов или по меньшей мере около 2,5 часа после приема пищи. Например, общая суточная доза 4,5 г ацетил-DL-лейцина может быть введена в виде трех таблеток Tanganil® (или его эквивалента) до, во время или после завтрака, трех дополнительных таблеток до, во время или после обеда и еще трех таблеток до, во время ужина или после него.
В одном варианте осуществления, что касается TBI, введение соединения по изобретению в соответствии с настоящим изобретением начинают в момент или приблизительно (например, в пределах 24 часов) в момент травмы головы. В одном варианте осуществления введение начинают через период времени (например, дни, недели, месяцы или даже годы) после травмы головы. В одном варианте осуществления введение начинают после того, как у субъекта диагностируется (клинически или иным образом) TBI. В одном варианте осуществления введение начинают после того, как у субъекта диагностируется TBI с использованием шкалы комы Глазго (GCS). В одном варианте осуществления субъект имеет оценку GCS 13-15. В другом варианте осуществления субъект имеет оценку GCS 9-12. В другом варианте осуществления субъект имеет оценку GCS 3-8. В одном варианте осуществления введение начинают до травмы головы (или до последующей травмы головы, если одна или несколько травм головы уже произошли) субъекту с риском возникновения TBI. В одном варианте осуществления введение начинают во время, около или после того, как у субъекта обнаруживается биохимический или другой аналогичный идентифицируемый маркер TBI. В одном варианте осуществления введение начинают во время, около или после того, как субъект испытывает один или несколько симптомов TBI.
Продолжительность лечения любого из заболеваний, перечисленных в таблицах 1-17, может составлять, например, около семи дней или более, около двух недель или более, около трех недель или более, около одного месяца или более, около шести недель или более, около семи недель или более, или около двух месяцев или более. В одном варианте осуществления она составляет около трех месяцев или более, около четырех месяцев или более, около пяти месяцев или более или около шести месяцев или более. Продолжительность лечения может составлять около 1 года или более, около 2 лет или более, около 4 лет или более, около 5 лет или более или около 10 лет или более. Продолжительность лечения может соответствовать продолжительности жизни субъекта.
Любые и все комбинации лекарственной формы, количества дозы, схемы дозирования и продолжительности лечения предусмотрены и охвачены описанием. В одном варианте осуществления доза составляет от около 4 г до около 10 г в день, принимаемых за одно, два или три приема в день, для продолжительности лечения около двух месяцев или более. В другом варианте осуществления доза составляет более 4 г, но не более 5 г в день, принимаемая за одно, два или три приема в день, для продолжительности лечения около шести месяцев или более. Лекарственная форма может представлять собой твердую пероральную лекарственную форму, особенно таблетки.
Соединение по изобретению может использоваться в качестве монотерапии (например, использование одного активного агента) для лечения заболевания, нарушения, состояния или синдрома, например заболевания, нарушения, состояния или синдрома, представленных в любой из таблиц 1-17, у субъекта. Альтернативно соединение по изобретению может использоваться в качестве дополнения к другим известным способам лечения или в комбинации с ними для лечения заболевания, нарушения, состояния или синдрома, например заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17.
Также раскрыт набор для лечения заболевания, нарушения, состояния или синдрома, например заболевания, нарушения, состояния или синдрома, представленных в любой из таблиц 1-17, у субъекта, содержащий средства для диагностики или прогнозирования заболевания, нарушения, состояния или синдрома и соединение по изобретению.
Набор может дополнительно содержать буферы или водные растворы. Набор может дополнительно включать инструкции по применению соединения по изобретению согласно способу по настоящему изобретению.
Все признаки, описанные в данном документе (включая любую прилагаемую формулу изобретения, реферат и графические материалы), и/или все этапы любого раскрытого таким образом способа, могут быть объединены с любым из вышеупомянутых аспектов в любой комбинации, за исключением комбинаций, где по меньшей мере некоторые из таких признаков и/или этапов являются взаимоисключающими.
Фраза «заболевание, нарушение, состояние или синдром, при котором модуляция одного или нескольких провоспалительных медиаторов обеспечивает пользу» и т.п. относится к (i): заболеванию, нарушению, состоянию или синдрому, при котором один или несколько провоспалительных медиаторов важны или необходимы, например, для начала, развития или проявления этого заболевания, нарушения, состояния или синдрома, или (ii) заболеванию, нарушению, состоянию или синдрому, которые, как известно, реагируют на модуляцию провоспалительного медиатора. Примеры таких заболеваний включают, но не ограничиваются ими, нейровоспалительные заболевания, неврологические заболевания, аутоиммунные заболевания, нейродегенеративные протеинопатические, психиатрические состояния, например, депрессию, и митохондриальные заболевания. Провоспалительные медиаторы хорошо известны в уровне техники. См., например, "Really Essential Medical Immunology," 2nd ed., Rabson, Roitt, Delves (Blackwell, 2005). Типичные неограничивающие провоспалительные медиаторы включают цитокины, например, интерлейкин (IL)-1β, IL-8, фактор некроза опухоли альфа (TNF-α), IL-6 и IL-12, хемокины и факторы роста.
В одном варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 1.
Таблица 1
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 2.
Таблица 2
В одном варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 3.
Таблица 3
В другом варианте осуществления настоящее изобретение предусматривает способ лечения нейровоспалительного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома нейровоспалительного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 4.
Таблица 4
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 5. В другом варианте осуществления настоящее изобретение предусматривает способ лечения травматического повреждения мозга.
Таблица 5
В другом варианте осуществления настоящее изобретение предусматривает способ лечения неврологического заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома неврологического заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 6.
Таблица 6
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 7.
Таблица 7
В другом варианте осуществления настоящее изобретение предусматривает способ лечения аутоиммунного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома аутоиммунного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 8.
Таблица 8
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 9.
Таблица 9
В другом варианте осуществления настоящее изобретение предусматривает способ лечения нейродегенеративного протеиноболезненного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома нейродегенеративного протеиноболезненного заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 10.
Таблица 10
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 11.
Таблица 11
В другом варианте осуществления настоящее изобретение предусматривает способ лечения психиатрического заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома психиатрического заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 12.
Таблица 12
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 13.
Таблица 13
В другом варианте осуществления настоящее изобретение предусматривает способ лечения митохондриального заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома митохондриального заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 14.
Таблица 14
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 15.
Таблица 15
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 16.
Таблица 16
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 17.
Таблица 17
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение от около 1 г до около 30 г соединения по изобретению субъекту в день. В другом варианте осуществления от около 2 г до около 15 г соединения по изобретению вводят субъекту в день. В другом варианте осуществления от около 3 г до около 10 г соединения по изобретению вводят субъекту в день. В другом варианте осуществления от около 4 г до около 8 г соединения по изобретению вводят субъекту в день. В другом варианте осуществления от около 4 г до около 5 г соединения по изобретению вводят субъекту в день. В другом варианте осуществления от около 15,1 г до около 30 г соединения по изобретению вводят субъекту в день. В другом варианте осуществления около 5 г соединения по изобретению вводят субъекту в день.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества DL-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества L-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества D-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества сложного этилового эфира L-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество сложного этилового эфира L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество сложного этилового эфира L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества ацетил-DL-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества ацетил-D-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение предусматривает способ лечения заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, у субъекта, нуждающегося в этом, или лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества ацетил-L-лейцина или его фармацевтически приемлемой соли субъекту. В другом варианте осуществления терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома. В другом варианте осуществления терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
В другом варианте осуществления настоящее изобретение обеспечивает способ модуляции экспрессии одного или нескольких провоспалительных медиаторов, например провоспалительных цитокинов и провоспалительных хемокинов у субъекта, у нуждающегося в этом субъекта, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту. В другом варианте осуществления провоспалительные медиаторы могут представлять собой любой один или несколько из NOS2, IL-18, IFNb, IL-1β, TNFα, NOX2, NLRP3, SOCS3, ARG1, IL-10, IL-4ra или YM1.
В другом варианте осуществления введение соединения по изобретению снижает или подавляет нейровоспаление у субъекта, нуждающегося в этом. В другом варианте осуществления уменьшение или подавление нейровоспаления включает снижение или подавление избыточных провоспалительных цитокинов. В другом варианте осуществления нейровоспаление подавляется или снижается по сравнению с нейровоспалением у субъекта, страдающего от заболевания, нарушения, состояния или синдром, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению.
В другом варианте осуществления введение соединения по изобретению модулирует повышенные уровни связанного с микротрубочками тау-белка и/или конъюгата 3-фосфатидилэтаноламина (LC3-II) связанного с микротрубочками белка 1A/1B легкой цепи у субъекта, нуждающегося в лечении от TBI. В одном варианте осуществления повышенные уровни тау-белка и/или LC3-II модулируются по сравнению с повышенными уровнями тау-белка и/или LC3-II у субъекта, страдающего от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению.
В другом варианте осуществления введение соединения по изобретению эффективно для улучшения выздоровления субъекта, нуждающегося в этом. В другом варианте осуществления восстановление улучшается по сравнению с восстановлением субъекта, страдающего от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению.
В другом варианте осуществления восстановление оценивается с использованием шкалы результатов Глазго (GOS). В одном варианте осуществления введение лейцина, ацетиллейцина или любого другого соединения по изобретению или его фармацевтически приемлемой соли эффективно для увеличения процента субъектов с «благоприятным» исходом по GOS на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 50% или по меньшей мере 70% по сравнению с исходным уровнем, например, по сравнению с пациентами, страдающими TBI, которым не вводили лейцин, ацетиллейцин или их фармацевтически приемлемую соль. В одном варианте осуществления субъект оценивается с помощью GOS через три месяца после нанесения травмы. В другом варианте осуществления субъект оценивается с помощью GOS через шесть месяцев после нанесения травмы. В другом варианте осуществления субъект оценивается с помощью GOS через 12 месяцев или более после нанесения травмы.
В другом варианте осуществления введение соединения по изобретению эффективно для улучшения когнитивной функции у субъекта, нуждающегося в этом. В другом варианте осуществления когнитивная функция улучшается по сравнению с когнитивной функцией субъекта, страдающего от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению. В одном варианте осуществления когнитивная функция представляет собой память. В одном варианте осуществления память представляет собой долговременную память. В другом варианте осуществления когнитивная функция представляет собой обучение. В другом варианте осуществления когнитивная функция представляет собой ориентацию в пространстве.
В другом варианте осуществления введение соединения по изобретению снижает или подавляет по меньшей мере один симптом заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, у субъекта, нуждающегося в этом. В другом варианте осуществления по меньшей мере один симптом снижается или подавляется по сравнению с симптомом(-ами) у субъекта, страдающего от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению. В другом варианте осуществления состояние представляет собой TBI, и по меньшей мере один симптом TBI представляет собой спутанность сознания, головокружение, дезориентацию, потерю координации, потерю памяти, неспособность формировать новые воспоминания, нарушения сна, изменения поведения или настроения, повышенное возбуждение, депрессию, судороги и/или припадки.
В другом варианте осуществления введение соединения по изобретению уменьшает тяжесть по меньшей мере одного симптома заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, на по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 70%, по меньшей мере 90% или 100% по сравнению с исходным уровнем, например, по сравнению с субъектом, страдающим от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, которому не вводили лейцин, ацетиллейцин или их фармацевтически приемлемую соль.
В другом варианте осуществления введение соединения по изобретению эффективно для повышения уровня физической и/или умственной активности субъекта. В другом варианте осуществления восстановление улучшается по сравнению с восстановлением субъекта, страдающего от заболевания, нарушения, состояния или синдрома, например, заболевания, нарушения, состояния или синдрома, предусмотренных в любой из таблиц 1-17, например, TBI, без введения соединения по изобретению.
В другом варианте осуществления введение соединения по изобретению эффективно для лечения энцефалита. В другом варианте осуществления энцефалит представляет собой инфекционный энцефалит. В другом варианте осуществления энцефалит представляет собой аутоиммунный энцефалит. Симптомы энцефалита включают, но не ограничиваются ими, головную боль, легкие симптомы гриппа (боли, усталость, небольшое повышение температуры), чувствительность к свету, жесткость шеи, сонливость или апатичность, повышенную раздражительность, судороги, изменения бдительности, спутанность сознания или галлюцинации, потерю энергии, потерю аппетита, неустойчивую походку, тошноту и рвоту, изменения личности и проблемы с речью и/или изменения речи. В некоторых вариантах осуществления симптомами энцефалита являются аномальные движения (хорея, нарушение координации движений), атипичные двигательные симптомы, например, атаксия или гемипарез, или судороги.
В некоторых вариантах осуществления энцефалит вызван инфекцией верхних дыхательных путей, заболеванием, вызывающим диарею, тошноту и рвоту, корью, свинкой, краснухой, ветряной оспой, вирусом простого герпеса, вирусом Западного Нила, бешенством, болезнью Лайма, туберкулезом, сифилисом, инфекцией, вызванной паразитами, например, токсоплазмозом, или аутоиммунной реакцией у субъекта. Таким образом, в некоторых вариантах осуществления настоящее изобретение предусматривает способ предотвращения энцефалита у субъекта, нуждающегося в этом, причем способ включает введение терапевтически эффективного количества соединения по изобретению субъекту, при этом субъект имеет инфекцию верхних дыхательных путей, заболевание, вызывающее диарею, тошноту и рвоту, корь, свинку, краснуху, ветряную оспу, вирус простого герпеса, вирус Западного Нила, бешенство, болезнь Лайма, туберкулез, сифилис, инфекцию, вызванную паразитами, например, токсоплазмоз, или аутоиммунную реакцию.
В другом варианте осуществления введение соединения по изобретению является эффективным для лечения расстройства сна, связанного с травматическим повреждением мозга, например, трудности с засыпанием и/или бессонницей, утомляемость, сонливость, апноэ во сне, нарколепсия и/или сонливость, например, чрезмерная дневная сонливость.
В другом варианте осуществления введение соединения по изобретению эффективно для лечения нарушения метаболизма в ЦНС. В другом варианте осуществления введение соединения по изобретению эффективно для лечения симптомов и/или заболеваний, связанных с нарушением метаболизма в ЦНС. В другом варианте осуществления нарушение метаболизма представляет собой нарушение метаболизма глюкозы. В другом варианте осуществления нарушение метаболизма представляет собой нарушение метаболизма глюкозы в мозжечке. В другом варианте осуществления введение соединения по изобретению увеличивает метаболизм глюкозы, например, в мозжечке, в ЦНС.
Изобретение также предоставляет следующие конкретные варианты осуществления.
Вариант осуществления I. Лейцин, ацетиллейцин или их фармацевтически приемлемая соль для применения в способе лечения травматического повреждения мозга (TBI) у субъекта, нуждающегося в этом.
Вариант осуществления II. Лейцин, ацетиллейцин или их фармацевтически приемлемая соль для применения в способе согласно варианту осуществления I, причем способ включает введение субъекту терапевтически эффективного количества лейцина, ацетиллейцина или их фармацевтически приемлемой соли.
Вариант осуществления III. Лейцин, ацетиллейцин или их фармацевтически приемлемая соль для применения в способе согласно любому из вариантов осуществления I и II, в котором лейцин представляет собой DL-лейцин или ацетиллейцин представляет собой ацетил-DL-лейцин.
Вариант осуществления IV. Лейцин, ацетиллейцин или их фармацевтически приемлемая соль для применения в способе согласно любому из вариантов осуществления I и II, причем лейцин или ацетиллейцин имеет энантиомерный избыток L-энантиомера или D-энантиомера.
Вариант осуществления V. Лейцин, ацетиллейцин или их фармацевтически приемлемая соль для применения в способе согласно любому из вариантов осуществления I-IV, причем способ включает введение ацетиллейцина субъекту, нуждающемуся в этом, в терапевтически эффективном количестве от около 1 г до около 15 г в день, от около 1 г до около 10 г в день, от около 1,5 г до около 7 г в день, от около 4 г до около 6 г в день или от около 4 г до около 5 г в день.
Вариант осуществления VI. Способ подавления или уменьшения одного или нескольких симптомов травматического повреждения мозга (TBI) у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества лейцина, ацетиллейцина или их фармацевтически приемлемой соли субъекту.
Вариант осуществления VII. Способ согласно варианту осуществления VI, в котором лейцин представляет собой DL-лейцин или ацетиллейцин представляет собой ацетил-DL-лейцин.
Вариант осуществления VIII. Способ согласно варианту осуществления VI, в котором лейцин или ацетиллейцин имеет энантиомерный избыток L-энантиомера или D-энантиомера.
Вариант осуществления IX. Способ согласно любому из вариантов осуществления VI-VIII, в котором терапевтически эффективное количество составляет от около 1 г до около 15 г в день, от около 1 г до около 10 г в день, от около 1,5 г до около 7 г в день, от около 4 г до около 6 г в день или от около 4 г до около 5 г в день.
Изобретение также предоставляет следующие конкретные варианты осуществления.
Вариант осуществления 1. Соединение по изобретению для применения в лечении заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для применения в лечении симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 1.
Вариант осуществления 2. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 2.
Вариант осуществления 3. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 3.
Вариант осуществления 4. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 4.
Вариант осуществления 5. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 5.
Вариант осуществления 6. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевание, нарушение, состояние или синдром представляет собой травматическое повреждение мозга.
Вариант осуществления 7. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 6.
Вариант осуществления 8. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 7.
Вариант осуществления 9. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 8.
Вариант осуществления 10. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 9.
Вариант осуществления 11. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 10.
Вариант осуществления 12. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 11.
Вариант осуществления 13. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 12.
Вариант осуществления 14. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 13.
Вариант осуществления 15. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 14.
Вариант осуществления 16. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 15.
Вариант осуществления 17. Соединение по изобретению для применения согласно варианту осуществления 1, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 16.
Вариант осуществления 18. Соединение по изобретению для применения согласно любому из вариантов осуществления 1-17, причем от около 1 г до около 30 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 19. Соединение по изобретению для применения согласно варианту осуществления 18, причем от около 2 г до около 15 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 20. Соединение по изобретению для применения согласно варианту осуществления 19, причем от около 3 г до около 10 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 21. Соединение по изобретению для применения согласно варианту осуществления 20, причем от около 4 г до около 8 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 22. Соединение по изобретению для применения согласно варианту осуществления 21, причем от около 4 г до около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 23. Соединение по изобретению для применения согласно варианту осуществления 22, причем около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 24. Соединение по изобретению для применения согласно любому из вариантов осуществления 1-23, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 25. Соединение по изобретению для применения согласно варианту осуществления 24, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 26. Соединение по изобретению для применения согласно варианту осуществления 24, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 27. Соединение по изобретению для применения согласно любому из вариантов осуществления 1-23, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 28. Соединение по изобретению для применения согласно варианту осуществления 27, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 29. Соединение по изобретению для применения согласно варианту осуществления 27, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 30. Соединение по изобретению для применения согласно любому из вариантов осуществления 1-23, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 31. Соединение по изобретению для применения согласно варианту осуществления 30, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 32. Соединение по изобретению для применения согласно варианту осуществления 30, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 32A. Соединение по изобретению для применения согласно любому из вариантов осуществления 1-23, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 32B. Соединение по изобретению для применения согласно варианту осуществления 32A, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 32C. Соединение по изобретению для применения согласно варианту осуществления 32A, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 33. Применение соединения по изобретению для производства лекарственного препарата для лечения заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для производства лекарственного препарата для лечения симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 1.
Вариант осуществления 34. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 2.
Вариант осуществления 35. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 3.
Вариант осуществления 36. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 4.
Вариант осуществления 37. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 5.
Вариант осуществления 38. Применение согласно варианту осуществления 37, причем заболевание, нарушение, состояние или синдром представляет собой травматическое повреждение мозга.
Вариант осуществления 39. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 6.
Вариант осуществления 40. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 7.
Вариант осуществления 41. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 8.
Вариант осуществления 42. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 9.
Вариант осуществления 43. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 10.
Вариант осуществления 44. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 11.
Вариант осуществления 45. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 12.
Вариант осуществления 46. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 13.
Вариант осуществления 47. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 14.
Вариант осуществления 48. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 15.
Вариант осуществления 49. Применение согласно варианту осуществления 33, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 16.
Вариант осуществления 50. Применение согласно любому из вариантов осуществления 33-49, в котором от около 1 г до около 30 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 51. Применение согласно варианту осуществления 50, в котором от около 2 г до около 15 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 52. Применение согласно варианту осуществления 51, в котором от около 3 г до около 10 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 53. Применение согласно варианту осуществления 52, в котором от около 4 г до около 8 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 54. Применение согласно варианту осуществления 53, в котором от около 4 г до около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 55. Применение согласно варианту осуществления 54, в котором около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 56. Применение согласно любому из вариантов осуществления 33-55, в котором терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 57. Применение согласно варианту осуществления 56, в котором терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 58. Применение согласно варианту осуществления 56, в котором терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 59. Применение согласно любому из вариантов осуществления 33-55, в котором терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 60. Применение согласно варианту осуществления 59, в котором терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 61. Применение согласно варианту осуществления 59, в котором терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 62. Применение согласно любому из вариантов осуществления 33-55, в котором терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 63. Применение согласно варианту осуществления 62, в котором терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 64. Применение согласно варианту осуществления 62, в котором терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 64A. Применение согласно любому из вариантов осуществления 33-55, в котором терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 64B. Применение согласно варианту осуществления 64A, в котором терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 64C. Применение согласно варианту осуществления 64A, в котором терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 65. Фармацевтическая композиция, содержащая соединение по изобретению и фармацевтически приемлемый носитель, для применения в лечении заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, или для применения в лечении симптома заболевания, нарушения, состояния или синдрома у субъекта, нуждающегося в этом, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 1.
Вариант осуществления 66. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 2.
Вариант осуществления 67. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 3.
Вариант осуществления 68. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 4.
Вариант осуществления 69. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 5.
Вариант осуществления 70. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевание, нарушение, состояние или синдром представляет собой травматическое повреждение мозга.
Вариант осуществления 71. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 6.
Вариант осуществления 72. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 7.
Вариант осуществления 73. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 8.
Вариант осуществления 74. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 9.
Вариант осуществления 75. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 10.
Вариант осуществления 76. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 11.
Вариант осуществления 77. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 12.
Вариант осуществления 78. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 13.
Вариант осуществления 79. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 14.
Вариант осуществления 80. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 15.
Вариант осуществления 81. Фармацевтическая композиция для применения согласно варианту осуществления 65, причем заболевания, нарушения, состояния или синдромы представляют собой любое одно или несколько из заболеваний, нарушений, состояний или синдромов, предусмотренных в таблице 16.
Вариант осуществления 82. Фармацевтическая композиция для применения согласно любому из вариантов осуществления 65-81, причем от около 1 г до около 30 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 83. Фармацевтическая композиция для применения согласно варианту осуществления 82, причем от около 2 г до около 15 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 84. Фармацевтическая композиция для применения согласно варианту осуществления 83, причем от около 3 г до около 10 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 85. Фармацевтическая композиция для применения согласно варианту осуществления 84, причем от около 4 г до около 8 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 86. Фармацевтическая композиция для применения согласно варианту осуществления 85, причем от около 4 г до около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 87. Фармацевтическая композиция для применения согласно варианту осуществления 86, причем от около 5 г соединения по изобретению вводят субъекту в день.
Вариант осуществления 88. Фармацевтическая композиция для применения согласно любому из вариантов осуществления 65-87, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 89. Фармацевтическая композиция для применения согласно варианту осуществления 88, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 90. Фармацевтическая композиция для применения согласно варианту осуществления 88, причем терапевтически эффективное количество лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 91. Фармацевтическая композиция для применения согласно любому из вариантов осуществления 65-87, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 92. Фармацевтическая композиция для применения согласно варианту осуществления 91, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 93. Фармацевтическая композиция для применения согласно варианту осуществления 91, причем терапевтически эффективное количество ацетил-DL-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 94. Фармацевтическая композиция для применения согласно любому из вариантов осуществления 65-87, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 95. Фармацевтическая композиция для применения согласно варианту осуществления 94, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 96. Фармацевтическая композиция для применения согласно варианту осуществления 94, причем терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
Вариант осуществления 96A. Фармацевтическая композиция для применения согласно любому из вариантов осуществления 65-87, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту.
Вариант осуществления 96B. Фармацевтическая композиция для применения согласно варианту осуществления 96A, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения заболевания, нарушения, состояния или синдрома.
Вариант осуществления 96C. Фармацевтическая композиция для применения согласно варианту осуществления 96A, причем терапевтически эффективное количество ацетил-D-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома заболевания, нарушения, состояния или синдрома.
ПРИМЕРЫ
ПРИМЕР 1
Пациенту мужского пола, страдающему травматической травмой мозга, вводили ацетил-DL-лейцин в дозе 3 г в день в течение первой недели, а затем в дозе 5 г в день. Терапевты и медсестры сообщили, что пациент проявлял более активное поведение после лечения ацетил-DL-лейцином. Позднее прием лекарства был прекращен, и уровень активности пациента вернулся к исходному уровню до лечения ацетил-DL-лейцином.
ПРИМЕР 2
Эффективность N-ацетил-L-лейцина в модели CCI TBI у мышей
Модель контролируемого воздействия на корковый слой
TBI, вызванное контролируемым воздействием на корковый слой (CCI), было проведено на самцах мышей C57BL6/J (20-25 г). Вкратце, после того, как над черепом был сделан 10-миллиметровый разрез по средней линии, кожа и фасция были втянуты, и 4-миллиметровая трепанация черепа была сделана на центральной части левой теменной кости мышей под хирургической анестезией (2-3% изофлурана испаряется в газовой смеси, содержащей 70% N2O и 30% O2). Умеренное повреждение обнаженного мозга было вызвано специальным управляемым микропроцессором и управляемым сжатым воздухом пневматическим импактором с наконечником диаметром 3,5 мм со скоростью удара 6 м/с и глубиной деформации 2 мм.
Обработка NAL
N-Ацетил-L-лейцин («NAL» или «NALL») растворяли в этаноле с получением раствора 50 мг/мл, который затем разбавляли водой с получением раствора 10 мг/мл. Около 0,25 мл раствора NAL (10 мг/мл) вводили мышам перорально в дозе 10 мг/кг (2,5 мг NAL/25 г мыши) через желудочный зонд каждый день после TBI, вызванного CCI, в течение 4 дней. Мышей также кормили NAL в дозе 0,5 мг/кг в виде порошка, смешанного с пищевым гелем, в течение до 7 дней после травмы. См. фиг. 1. Не наблюдалось значительной разницы в потреблении пищи между фиктивными мышами и мышами с TBI, получавшими NALL (данные не показаны). В то время как небольшое уменьшение массы тела было обнаружено у мышей с TBI, получавших носитель, не наблюдалось заметного изменения массы тела у мышей с TBI, получавших NALL (данные не показаны).
Гибель клетки после TBI
Уровень продуктов расщепления α-фодрина в корковом слое мышей, получавших NALL, получавших носитель, и с TBI, определяли с помощью вестерн-блоттинга и анализа TUNEL, чтобы оценить, снижает ли обработка NALL гибель клеток коркового слоя после TBI.
Вестерн-блот анализ
Около 5 мм ткани ипсилатеральной коры вокруг места повреждения у мышей с TBI или соответствующей ткани того же объема вокруг той же корковой области у фиктивных мышей были вскрыты и обработаны. Лизаты тканей были разделены на 4-20% гелях SDS-PAGE (Bio-Rad, 5671095) и перенесены на PVDF-мембрану (Millipore, IPVH00010) с использованием полусухого переноса (Bio-Rad), заблокированы 5% обезжиренным молоком в tris-забуференном физиологическом растворе с 0,05% tween 20 (TBST), отобраны с первичными антителами в 1% BSA в TBST в течение ночи при 4°C и инкубированы с конъюгированными с HRP вторичными антителами (KPL, 474–1506, 474–1806, 14–16–06 и 14–13–06) в блокирующем растворе при комнатной температуре в течение 1 часа. Полосы белка детектировали с помощью набора для хемилюминесценции (Pierce, 34076) и визуализировали с помощью системы Chemi-doc (Bio-Rad). Интенсивность полосы анализировали с использованием программного обеспечения Image Lab (Bio-Rad) и нормализовали к контролю нагрузки (β-актин). Первичные антитела: LC3 (1:1000; Novus, NB100-2220), p62/SQSTM1 (1:1000; BD Bioscience, 610832), β-актин/ACTB (1: 10000; A1978) и фодрин/спектрин (1:5000; Enzo Life Science International, BML-FG6090).
Анализ TUNEL
Замороженные срезы (20 мкм) вырезали из мозга фиктивных мышей и мышей с TBI, получавших носитель или NAL, фиксированного 4% параформальдегидом (PFA, pH 7,4) и защищенного 30% сахарозой. Анализ TUNEL проводили на замороженных срезах головного мозга с использованием набора для обнаружения апоптоза ApopTag In situ (Millipore, S7165) в соответствии с протоколом производителя. Изображения после анализа TUNEL получали с использованием флуоресцентного горизонтально повернутого микроскопа Nikon Ti-E при 20-кратном увеличении (CFI Plan APO VC 20X NA 0,75 WD 1 мм).
TBI индуцирует опосредованное кальпаином и каспазой расщепление α-фодрина с образованием фрагментов 145–150 кДа и 150–120 кДа соответственно. Наблюдали более низкий уровень фрагментов α-фодрина 145-150 кДа в корковых слоях мышей, получавших NALL, по сравнению с корковыми слоями мышей, получавших носитель после TBI, что указывает на защитное преимущество NALL в предотвращении гибели клеток коркового слоя. См. фиг. 28 и 29. Также были обнаружены более низкие уровни TUNEL-положительных клеток в срезах мозга травмированных мышей, получавших NALL, по сравнению с мышами с TBI, получавшими носитель, что указывает на защитную роль NALL в ослаблении гибели клеток после TBI. См. фиг. 30, 31 и 32.
Аутофагический поток после TBI
Аутофагия представляет собой процесс клеточной деградации, зависимый от лизосом, который нарушается из-за повреждения лизосом после TBI. См., например, Sarkar et al., Autophagy 10:2208-2222 (2014); Sarkar et al., Autophagy, 1-20 (2019). Оценивали, опосредуется ли ослабление гибели клеток после получения NALL у мышей с TBI посредством восстановления аутофагического потока. Результаты представлены на фиг. 11-13 и 33-35.
Уровни LC3-II и p62/SQSTM1 в лизатах кортикальной ткани, полученных от мышей, ранее не использовавшихся в опытах, и мышей с TBI, получавших носитель и NAL, определяли с помощью вестерн-блоттинга. Снижение уровней LC3-II в мозге мышей, получавших NALL, по сравнению с мышами, получавшими носитель, в 1 день после обнаружения TBI. См. фиг. 33 и 34. Также наблюдалось снижение уровня p62/SQSTM1 в корковом слое мышей, получавших NALL, по сравнению с мышами, получавшими носитель, после TBI. См. фиг. 33 и 35. Эти результаты демонстрируют, что NALL улучшает аутофагический поток и тем самым восстанавливает ее нейропротекторную функцию в корковом слое мышей после TBI.
Воспалительные цитокины в мозге мышей с TBI
Уровень экспрессии провоспалительных маркеров M1-типа Nos2, Nlrp3, IL-1β, TNF, IFNβ и Nox2 в перилезионной области, расположенный по периферии патологического очага, коркового слоя мышей с TBI определяли с помощью ОТ-ПЦР в реальном времени. Также определяли уровень экспрессии маркеров M2-типа Socs3, YM-1, IL4ra и Arg-1 в кортикальной ткани. Результаты представлены на фиг. 2-10 и 36-45.
ПЦР в реальном времени
Вся РНК, выделенная из ипсилатерального коркового слоя с использованием мини-набора miRNeasy (Qiagen, № по каталогу 217004), была преобразована в кДНК с использованием набора «РНК высокой емкости в кДНК» (Applied Biosystem, № кат. 4387406) в соответствии с инструкциями производителя. Универсальный мастер-микс для кДНК TaqMan® II (Applied Biosystems, № по каталогу 4440040) использовали для проведения количественной ПЦР-амплификации в реальном времени, как описано ранее, с использованием 20-кратного анализа экспрессии генов TaqMan® (Applied Biosystems) для следующих генов мыши: Gapdh (Mm99999915_g1), NLRP3 (Mm00840904_m1), NOX2 (Mm01287743_m1), iNOS (Mm00440502_m1), TNFα (Mm00443258_m1), IFnβ1 (Mm00439552_s1), IL-10 (Mm01288386_m1), IL1b (Mm00434228_m1), Arg1 (Mm00475988_m1), SOCS3 (Mm00545913_s1), YM-1 (Mm00657889_mH) и IL-4ra (Mm01275139_m1) (Applied Biosystems). Реакции были амплифицированы и количественно определены с использованием системы быстрой ПЦР в реальном времени 7900HT и соответствующего программного обеспечения (Applied Biosystems). Относительную экспрессию гена, нормализованную к Gapdh, рассчитывали на основе сравнительного метода Ct.
Наблюдались повышенные уровни всех маркеров провоспалительных маркеров M1-типа, которые начинались с 1-го дня и достигали пика на 3-й день после травмы во всех корковых слоях мышей с TBI, независимо от обработки. См. фиг. 36-41. Но наблюдалось снижение уровня мРНК IFNβ и Nox2 в корковом слое мышей, получавших NAL, по сравнению с корковым слоем мышей с TBI, получавших носитель.
Подобно маркерам M1-типа, более высокая экспрессия маркеров M2-типа Socs3, YM-1, IL4ra и Arg-1 наблюдалась в кортикальной ткани всех мышей с TBI по сравнению с фиктивными животными. См. фиг. 42-45. Среди этих маркеров обработка NAL снижала уровни Arg-1 в корковом слое травмированных мышей по сравнению с мышами с TBI, получавшими носитель. Уровни Socs3, YM-1 и IL-4ra оставались неизменными в корковом слое мышей, получавших NAL, по сравнению с фиктивными мышами.
Эти результаты демонстрируют, что NAL снижает экспрессию нескольких воспалительных маркеров, что указывает на общее снижение нейровоспаления после TBI у мышей.
Статистика
Все данные представлены как среднее значение ± стандартная ошибка среднего (SEM). Выполняли однофакторный дисперсионный анализ с последующим соответствующим ретроспективным анализом (критерий Тьюки), как указано в подписях к фигурам. Для данных только с двумя группами использовался 2-сторонний t-критерий Стьюдента с равной дисперсией. Значение p≤0,05 считалось статистически значимым.
ПРИМЕР 3
Поток EAL у мышей с NPC
Отложение амилоида-β и накопление аутофагических вакуолей являются патологическими признаками болезни Альцгеймера (БА). Нарушение регуляции эндосомно-аутофаго-лизосомного пути (EAL), которое нарушает процессинг белка-предшественника амилоида, является одним из самых ранних изменений при БА. Xu and Ren, Annu Rev Physiol. 77:57-80 (2015). Заболевания лизосомного накопления, такие как NPC, также проявляют аутофагическую дисфункцию с патологическими изменениями, напоминающими особенности, наблюдаемые при БА, такие как дистрофические аксоны, эктопические дендриты, нейрофибриллярные клубки и накопление амилоида. Boland et al., The Journal of Biological Chemistry 285: 37415–37426 (2010).
Исследована эффективность ADLL, ALL, ADL, DLL, LL, DL и LLE в уменьшении нарушения потока EAL у мышей с NPC1. Ацетил-DL-лейцин (ADLL) и сложный этиловый эфир L-лейцина (LLE) были эффективны в восстановлении аутофагического потока в отношении снижения уровней LC3-II (фиг. 14). Но снижение уровней LC3-II, вызванное ADLL и LLE, не сопровождалось сопутствующим снижением APP-CTF, особенно CTF-6 и -7 (фиг. 15). Не желая быть связанными какой-либо конкретной теорией, возможно, что ADL и LLE уменьшали накопление аутофагической вакуоли (AV) путем ингибирования образования аутофагосом, возможно, посредством активации mTORC1. Несмотря на их способность снижать накопление AV, их неспособность снижать повышенные уровни APP-CTF предполагает, что ADL и LLE сами по себе не улучшают пищеварительную способность лизосом. Неожиданным образом, L-лейцин действительно снижал накопление CTF-6 у мышей с NPC1 (фиг. 16). Кроме того, ацетил-L-лейцин (ALL), ацетил-D-лейцин (ADL) и L-лейцин (LL) снижали экспрессию CTF-7, указывая на некоторое улучшение лизосомального протеолиза (фиг. 17). Положительные эффекты ацетил-D-лейцина, ацетил-L-лейцина и D-лейцина на клиренс CTF-7 у мышей с NPC1 позволяют предположить, что они могут способствовать слиянию эндосомы и лизосомы, не влияя на клиренс аутофагосом и лизосом.
ПРИМЕР 4
Слияние лизосом в первичных кортикальных нейронах
Нейроны имеют неоднородное распределение органелл, которые принадлежат пути EAL, от клеточной сомы до дистальных нейритов. К ним относятся аутофагосомы, эндосомы и амфисомы (эндосомы, слитые с аутофагосомами). U18666A представляет собой фармакологический агент, который индуцирует NPC1-подобный фенотип в клетках, ингибируя белок NPC1 и предотвращая эндосомно-лизосомное слияние. Опосредованная U18666A отмена аутофагосомно-лизосомного слияния и эндосомно-лизосомного слияния вызывает увеличение LC3-II и APP-CTF от -1 до -5, предотвращая при этом выработку CTF -6 и -7. Boland et al., The Journal of Biological Chemistry 285: 37415–37426 (2010).
Была исследована эффективность ADLL, ALL, ADL, DLL, LL, DL и LLE в облегчении U18666A-опосредованного нарушения аутофагосомно-лизосомного слияния и эндосомно-лизосомного слияния. В этом клеточном анализе нарушенного потока EAL повторное появление базальных уровней APP CTF -6 и -7 обеспечило указание на улучшенное эндосомно-лизосомное слияние.
В первичных кортикальных нейронах крыс (DIV14), обработанных U18666A (2 мкг/мл, 24 часа), полностью отсутствовали CTF-6 и -7 (фиг. 18). Обработка U18666A в течение 24 часов не вызвала увеличения накопления LC3-II (фиг. 18).
Нейроны обрабатывали совместно с U18666A (2 мкг/мл) вместе с ADLL, ALL, ADL, DLL, LL, DL и LLE (1 мМ, 24 ч). Все культуры нейронов, которые были совместно обработаны, показали признаки улучшенного эндосомно-лизосомного слияния, о чем свидетельствует повторное появление базальных количеств CTF-6 и -7 в этих клетках (фиг. 18). ADLL, ALL и ADL снижали уровни LC3-II ниже базальных уровней (фиг. 18). Это предполагает, что эти три соединения усиливают как аутофагосомно-лизосомное слияние, так и эндосомно-лизосомное слияние в первичных кортикальных нейронах.
ПРИМЕР 5
Усеченные формы тау в совместных культурах нейронов и глии
Была исследована эффективность ADLL, ALL, ADL, DLL, LL, DL и LLE в снижении уровней усеченного тау в культурах нейроглии (NG). Результаты этого исследования представлены на фиг. 20-24. Одной из целей этого исследования было определить, обеспечивают ли ADLL, ALL, ADL, DLL, LL, DL и LLE внутреннюю нейрозащиту, поддерживая функцию нейронов в условиях чрезмерного клеточного роста, или действовали ли они косвенно, через неавтономную модуляцию глиальных клеток. Независимо от того, действуют ли соединения прямо или косвенно на нейроны, предотвращение образования усеченного тау-белка оказывает положительное влияние на целостность нейронов.
Культуры обрабатывали в течение пяти дней (DIV 9-14) 1 мМ ADLL, ALL, ADL, DLL, LL, DL или LLE, а затем оценивали количество нейрон-специфических маркеров, которые могли обеспечить данные о здоровье нейронов: βIII-тубулин, полноразмерный тау-белок, усеченный тау-белок (антитело 5E2) и синаптофизин. ADLL, ALL, ADL, DLL, LL, DL и LLE хорошо переносились культурами NE и NG, о чем свидетельствует неизменно равные уровни синаптофизина и βIII-тубулина, обнаруженные в необработанных (контрольных) и обработанных лекарственными препаратами образцах (фиг. 20, 23 и 24). Ни одно из ADLL, ALL, ADL, DLL, LL, DL и LLE не снижало базальные уровни усеченного тау-белка в культурах NG на DIV14 (фиг. 20 и фиг. 22). Эти данные предполагают, что ADLL, ALL, ADL, DLL, LL, DL и LLE особенно полезны для лечения нейродегенеративных состояний, которые включают накопление субстрата в сети EAL.
ПРИМЕР 6
Объемы лизосом, измеренные с помощью проточной цитометрии
Клетки дикого типа и NPC1-нулевые клетки яичника китайского хомячка (СНО) выращивали в культуральных колбах Т75 и обрабатывали в течение 7 дней N-ацетил-L-лейцином (ALL), гидрохлоридом сложного этилового эфира L-лейцина (LEE) или L -лейцином (1 или 5 мМ закуплен у Sigma-Aldrich) перед экстракцией. Клетки трипсинизировали, центрифугировали (270 x g, 5 мин., дважды промывали 1x PBS, снова центрифугировали и окрашивали 100 нМ LysoTracker-green DND-26 (Invitrogen) в PBS в течение 20 минут при комнатной температуре. После инкубации клетки центрифугировали (800 мкг, 5 мин), ресуспендировали в 0,5 мл буфера FACS (0,1% BSA, 0,02 M NaN3 в 1×PBS) и хранили на льду для анализа проточной цитометрии (BD Biosciences FACSCanto II или Accuri C6 Plus). Цитометр калибровали с использованием настроек цитометра и отслеживающих гранул (BD), и компенсацию выполняли с использованием клеток, окрашенных Lysotracker или пропидия йодидом с использованием программного обеспечения BD FACSDiva (BD) или BD Accuri C6 Plus (BD) перед анализом. Эксперимент и анализ были проведены на 10 000 зарегистрированных клеток, чтобы получить средние значения для дальнейшего статистического анализа. Результаты показаны на фиг. 25-27.
ПРИМЕР 7
Выживание клеток Пуркинье
Npc1-/- мыши обнаруживают прогрессирующую нейродегенерацию с потерей клеток Пуркинье мозжечка, прогрессирующей от передней к задней долям, сопровождающейся активацией микроглии (фиг. 46). Обработка ADLL увеличивала выживаемость клеток Пуркинье в возрасте 59 дней по сравнению с необработанными Npc1-/- однопометниками: на 133% больше клеток Пуркинье присутствовало в долях I и II (p = 0,0027) и на 402% больше клеток Пуркинье в доле III (p = 0,0108). Другие методы лечения не улучшили выживаемость клеток Пуркинье в каких-либо долях мозжечка (Npc1-/- ALL доля I-II p = 0,107, доля III p = 0,157, доля IV-V p = 0,533; Npc1-/- ADL доля I-II p = 0,60, доля III p = 0,11, доля IV-V p = 0,766, по сравнению с Npc1-/- UT) (фиг. 46 и 47). Кроме того, обработка ALL снижала (на 20%, p = 0,0177) частоту CD68-положительной активированной микроглии. Другие методы лечения не оказали влияния (p = 0,1353 для Npc1-/-ADLL, p = 0,0553 для Npc1-/-ADL по сравнению с Npc1-/- UT) (фиг. 46 и 48). ADL не оказывал каких-либо долгосрочных нейропротекторных эффектов. Сочетание повышенной выживаемости нейронов и менее воспалительной среды в мозге может улучшить функцию мозга, качество жизни и замедлить прогрессирование заболевания у людей.
ПРИМЕР 8
Модель контролируемого воздействия на корковый слой
Мышей подвергали умеренному TBI с контролируемым воздействием на корковый слой ЧМТ или фиктивной операции. Мышам, получавшим NAL, вводили перорально NAL, начиная с первоначального выздоровления после операции (через пероральный желудочный зонд, ежедневно в течение 4 дней) и продолжая в течение всего эксперимента (в пищу, по мере необходимости). Мыши, получавшие носитель, получали эквивалентное введение носителя через желудочный зонд с последующим стандартным кормлением. Группа: фиктивная + носитель = 5 мышей; фиктивная + NAL = 4 мыши; TBI + носитель = 10 мышей; и TBA + NAL = 9 мышей. Функциональные результаты оценивались в срок до 28 дней после операции с использованием методов обхода пучка (двигательная функция), Y-лабиринта (пространственная память) и распознавания новых объектов (NOR, непространственная память). Результаты представлены на фиг. 49, 50 и 51 соответственно.
Следует понимать, что вышеупомянутые варианты осуществления и примеры не предназначены для ограничения в каком-либо отношении объема изобретения, и что формула, представленная в данном документе, предназначена для охвата всех вариантов осуществления и примеров, независимо от того, представлены они здесь явно или нет.
Все патенты и публикации, цитируемые в данном документе, полностью включены в качестве ссылки во всей полноте.

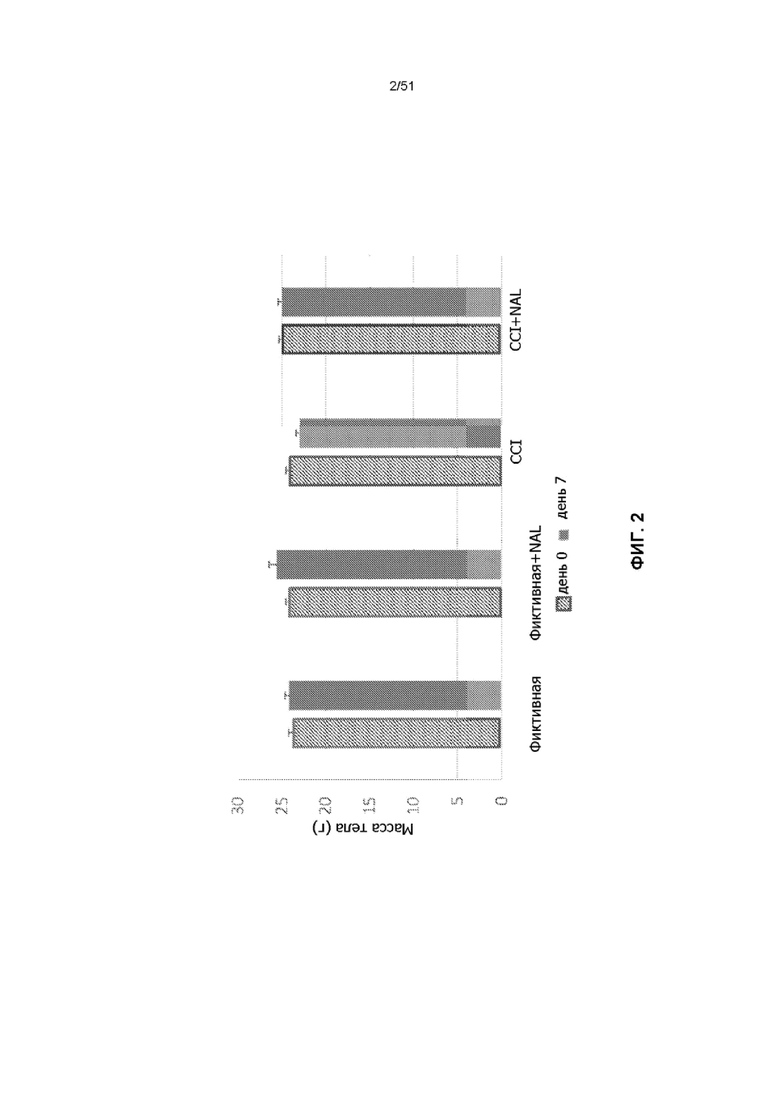

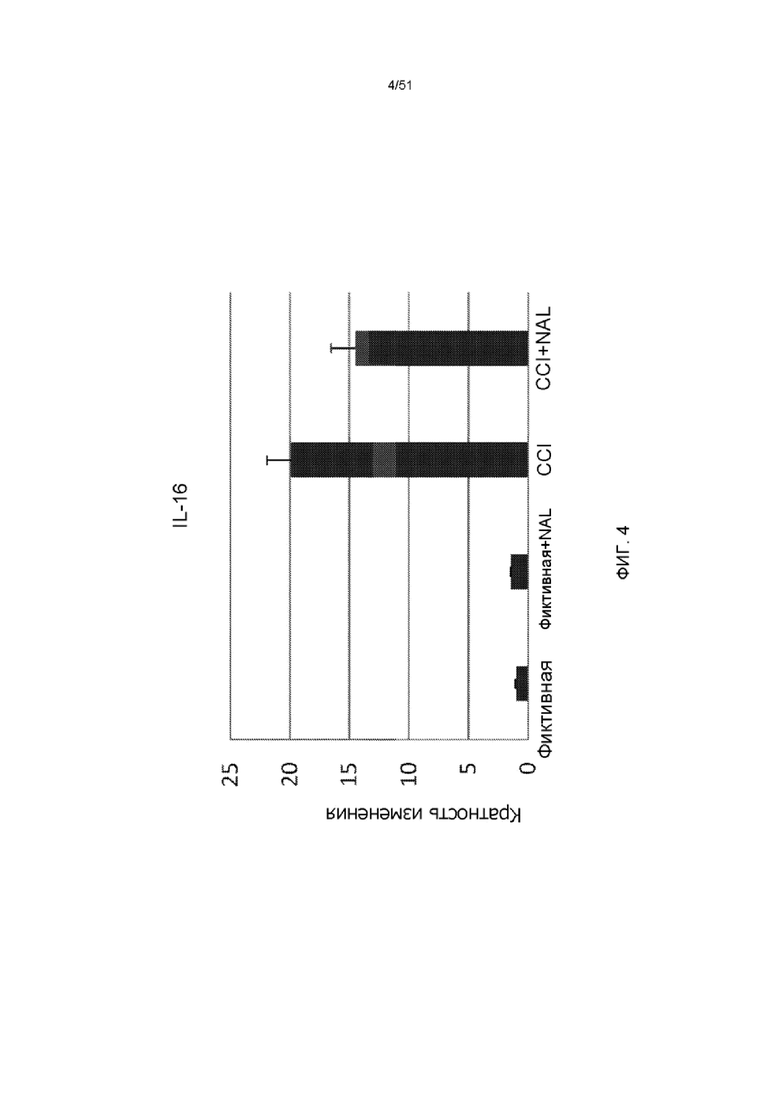


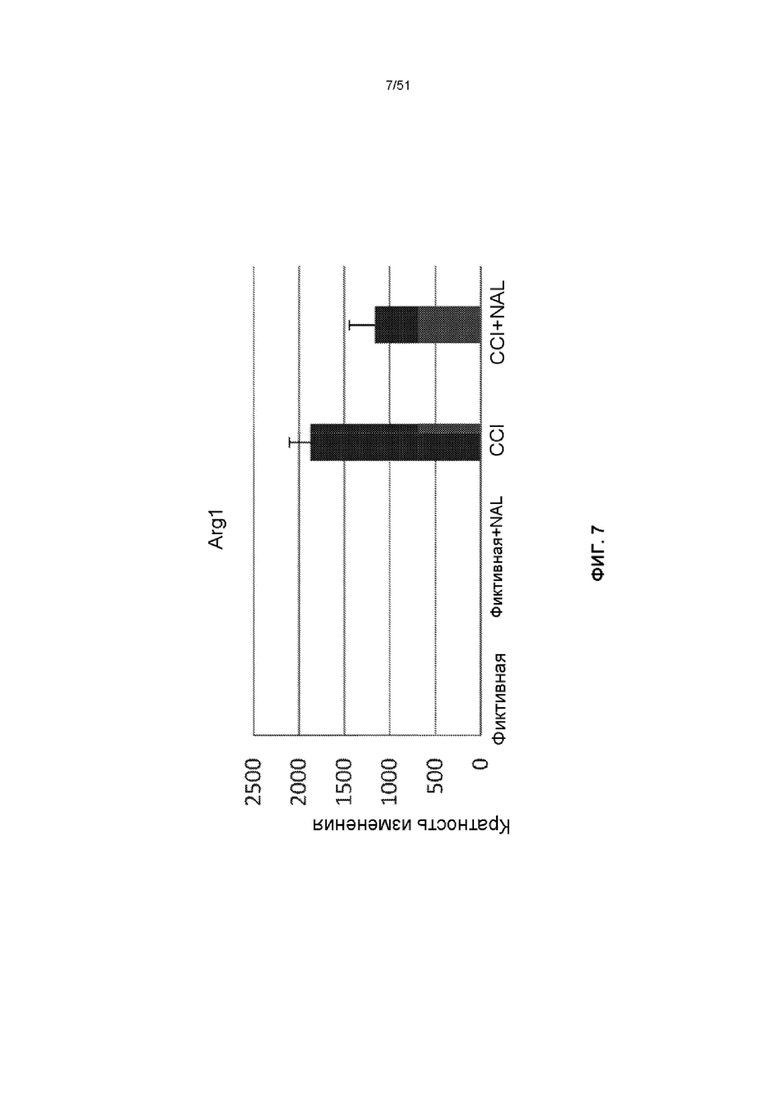

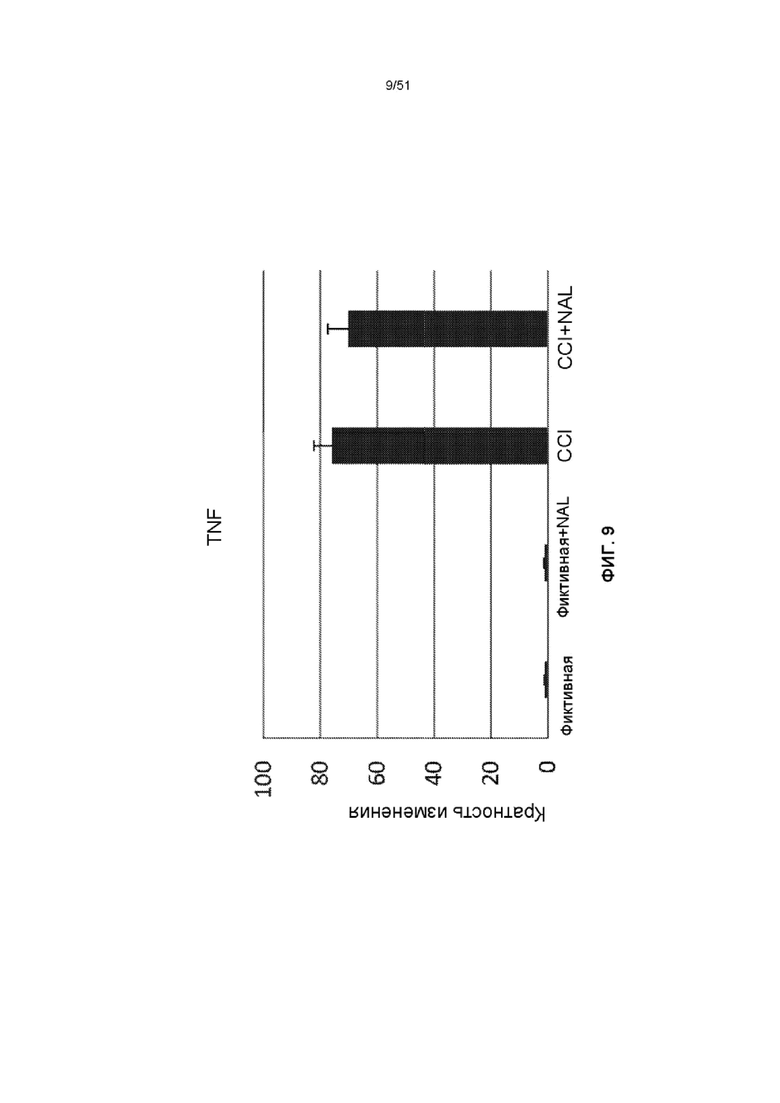
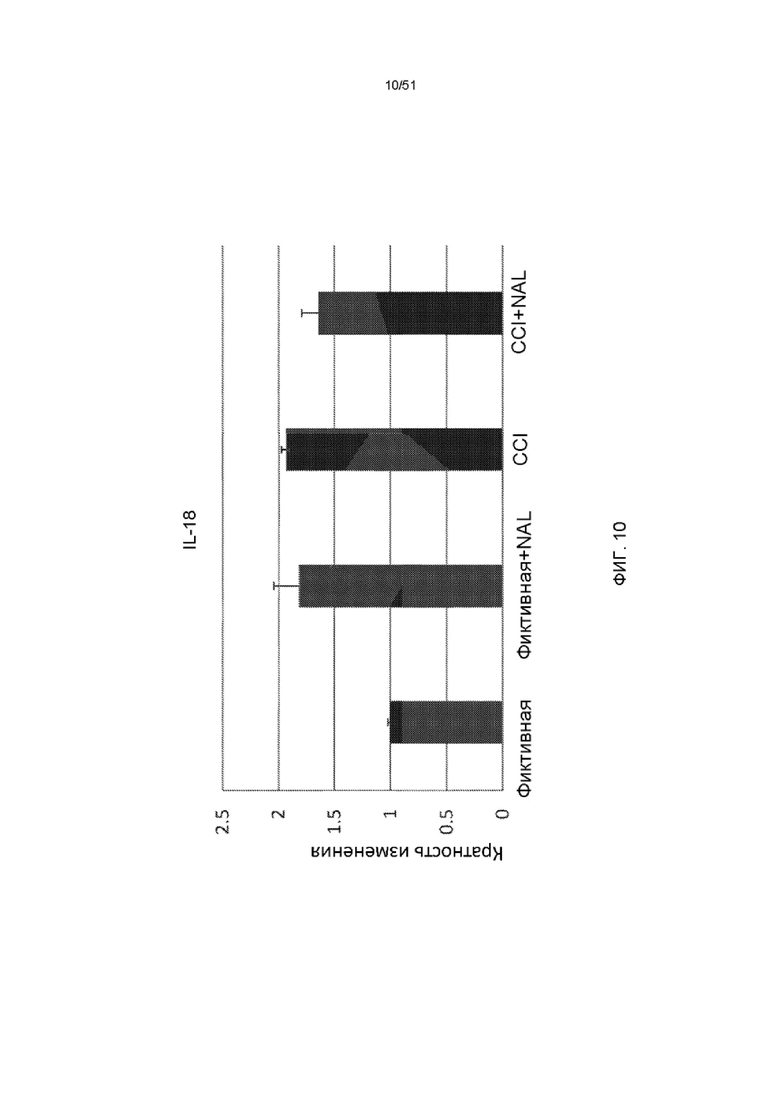

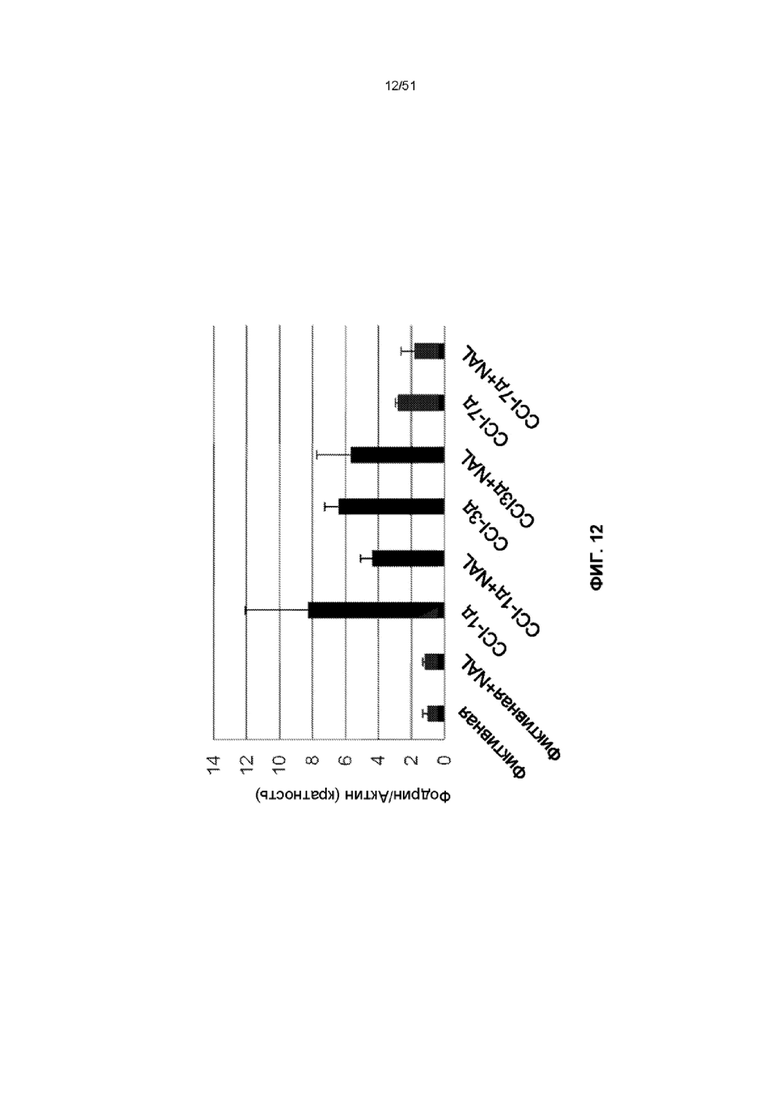

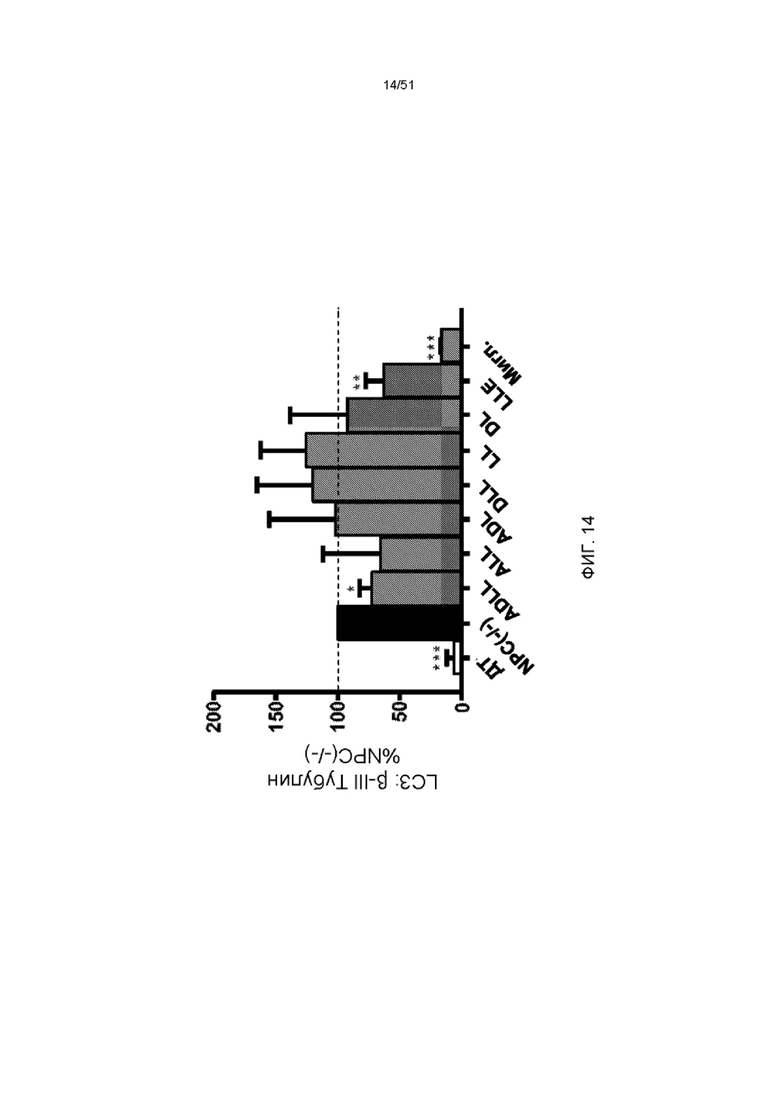
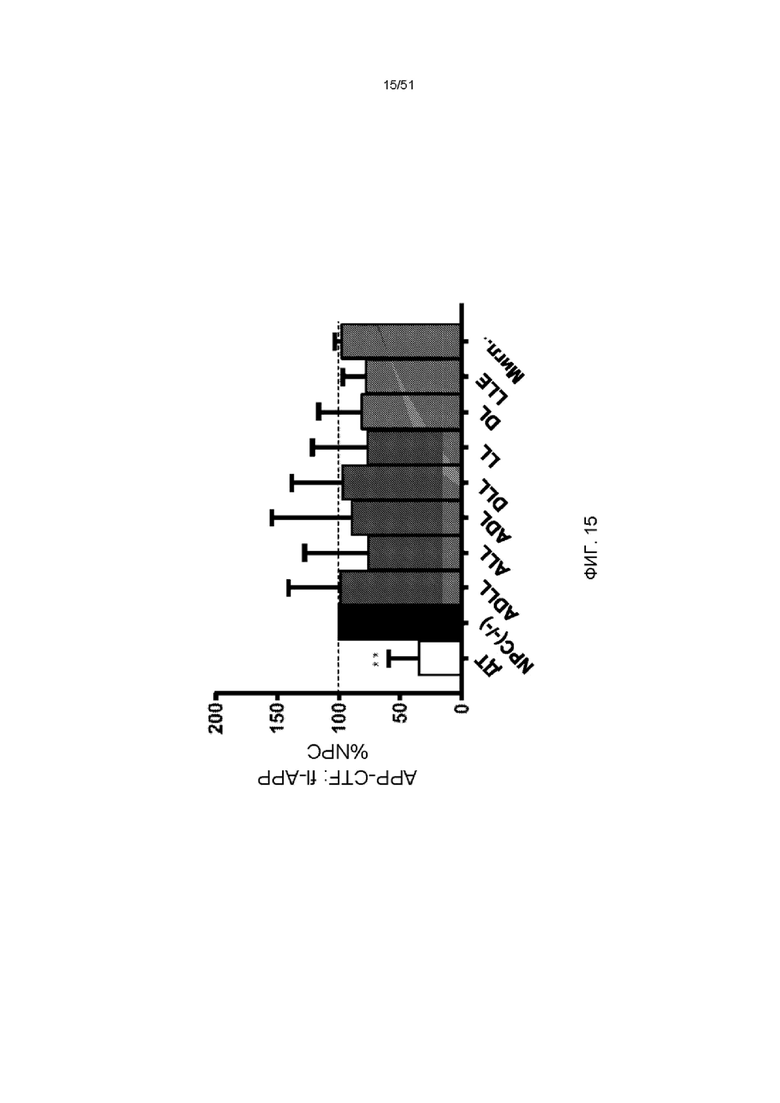

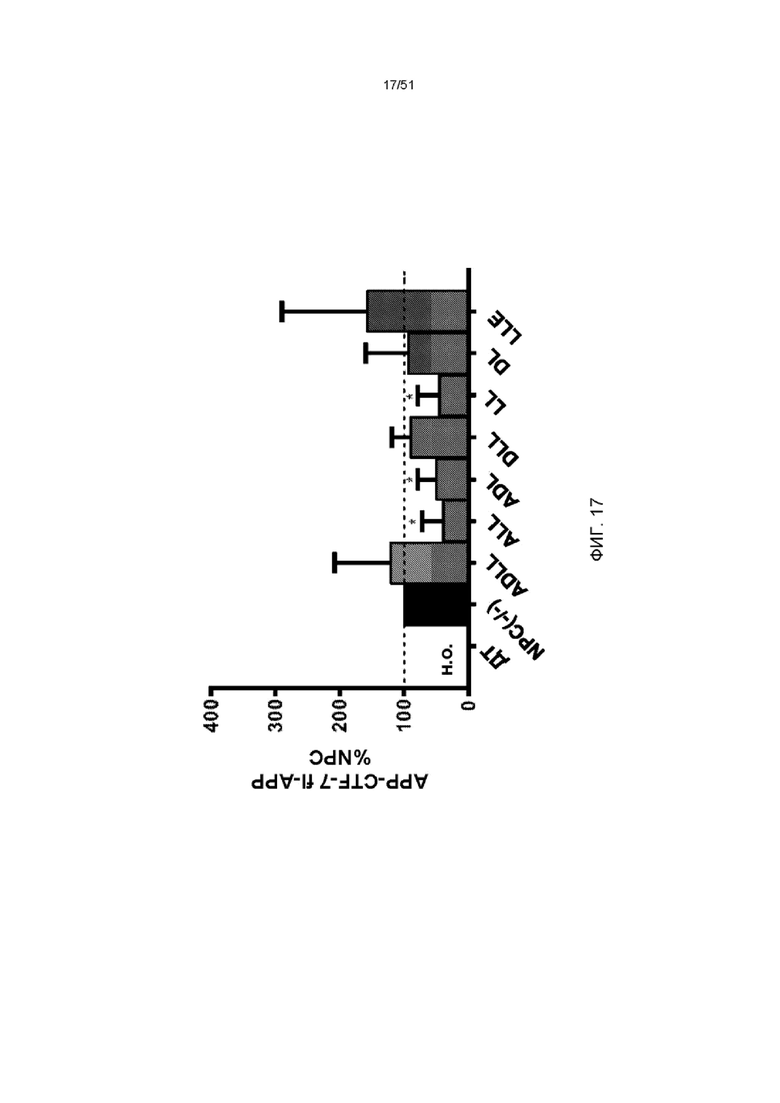

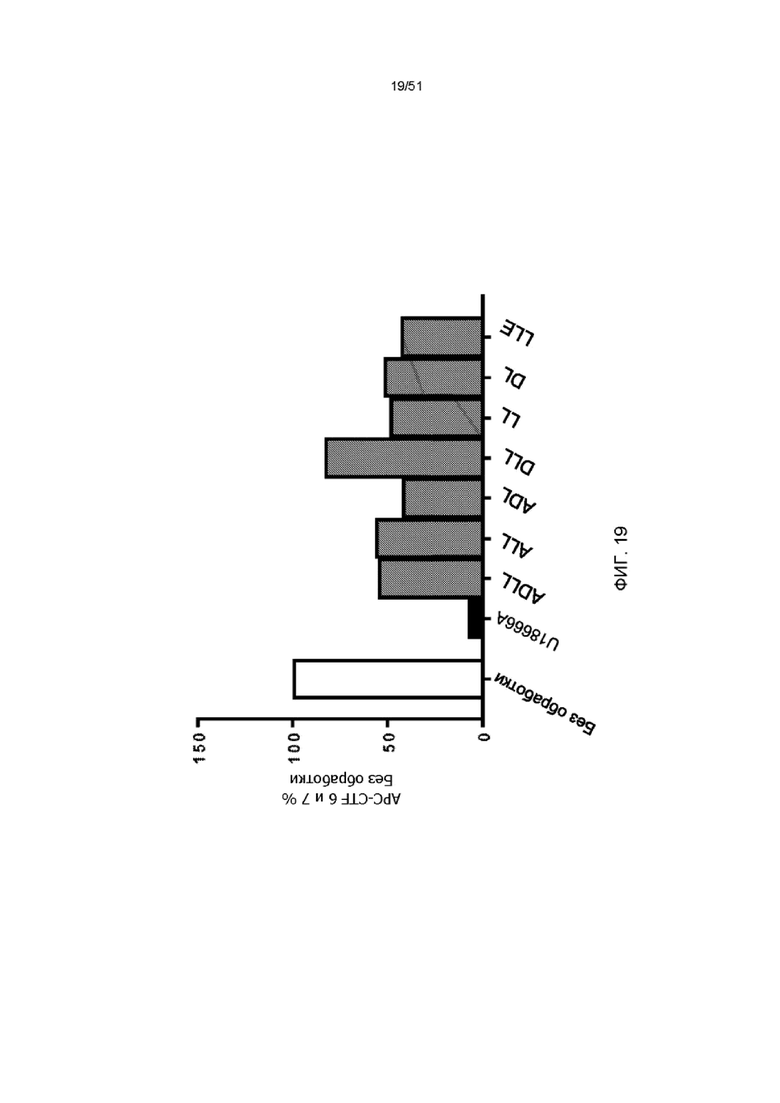




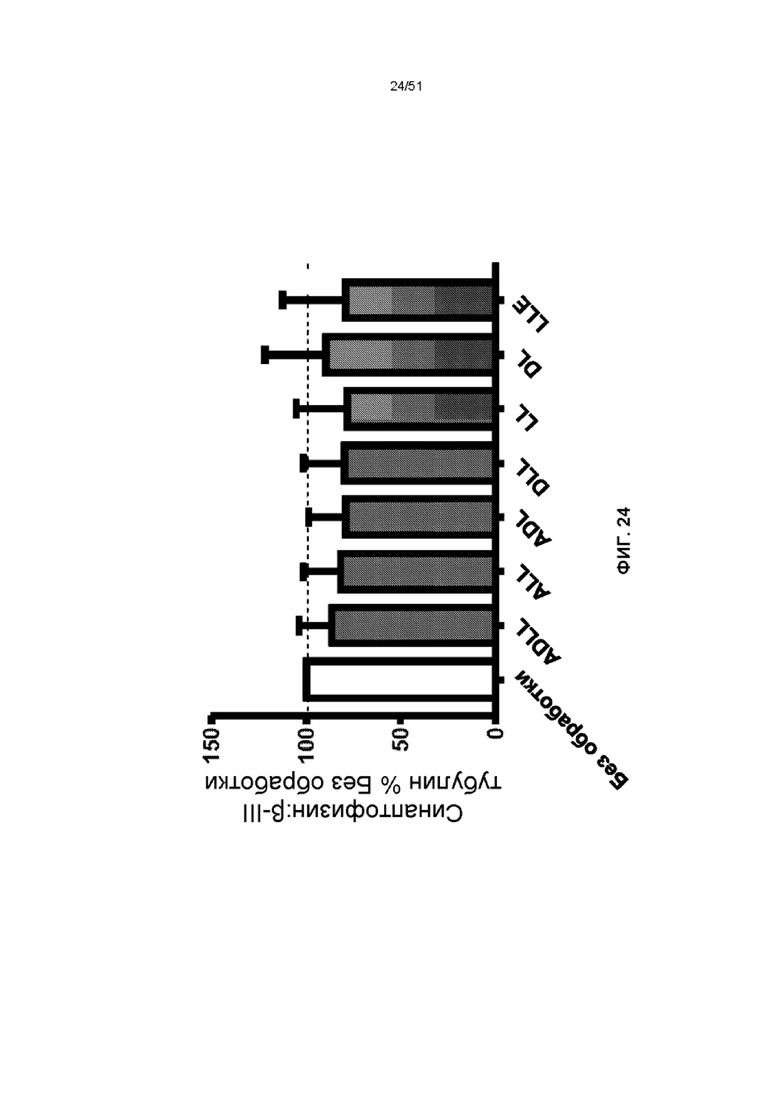



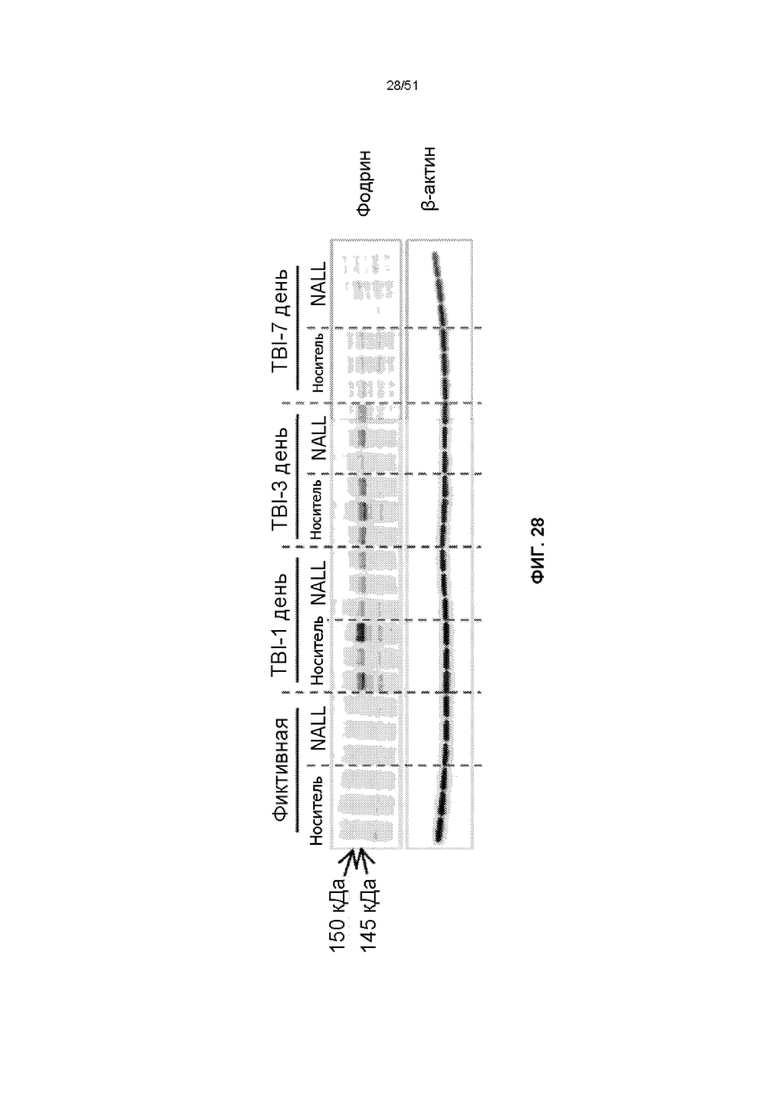
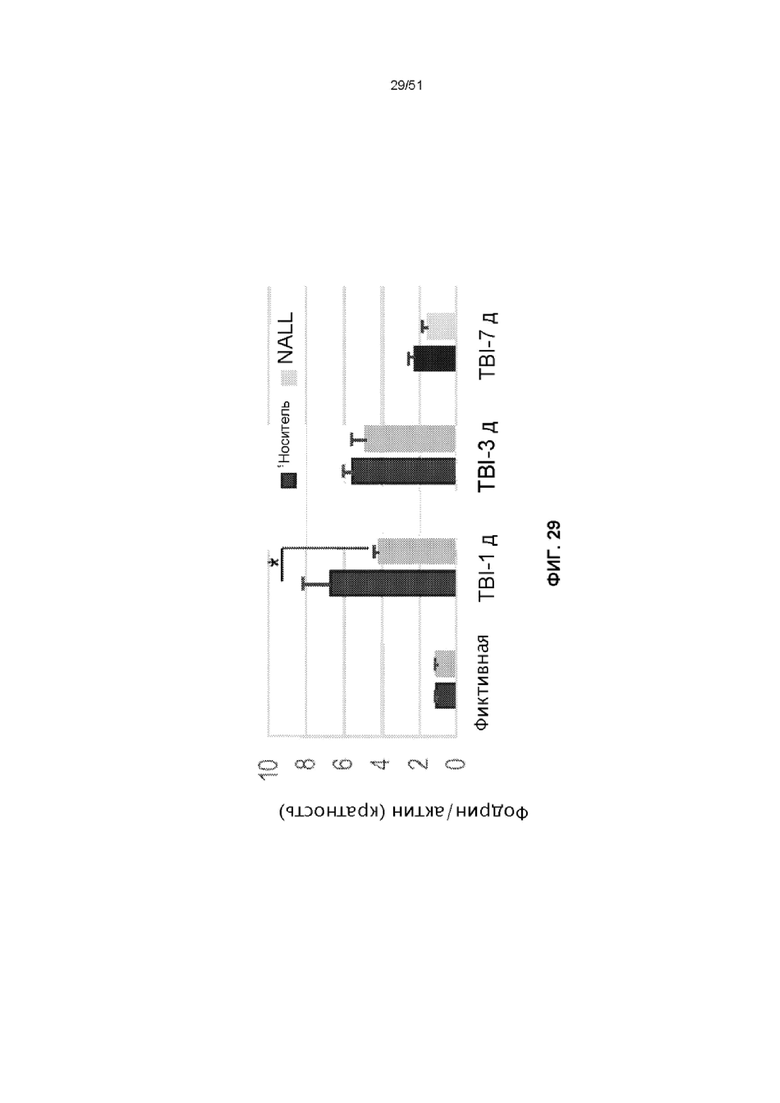



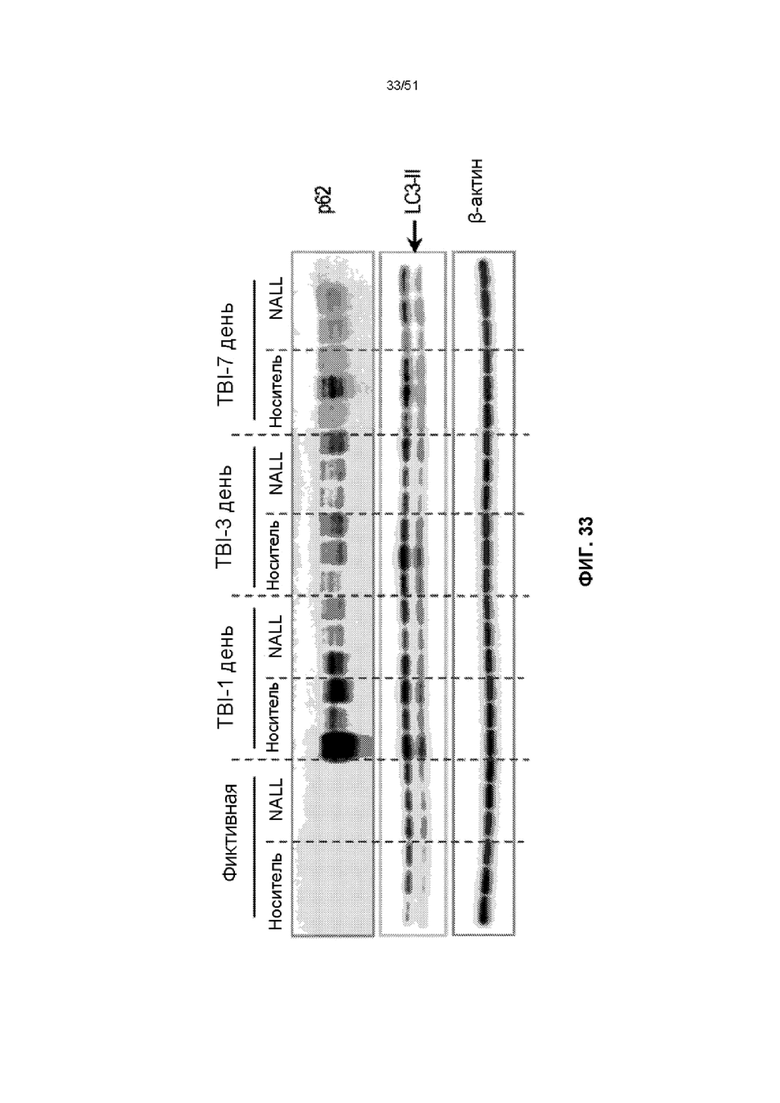


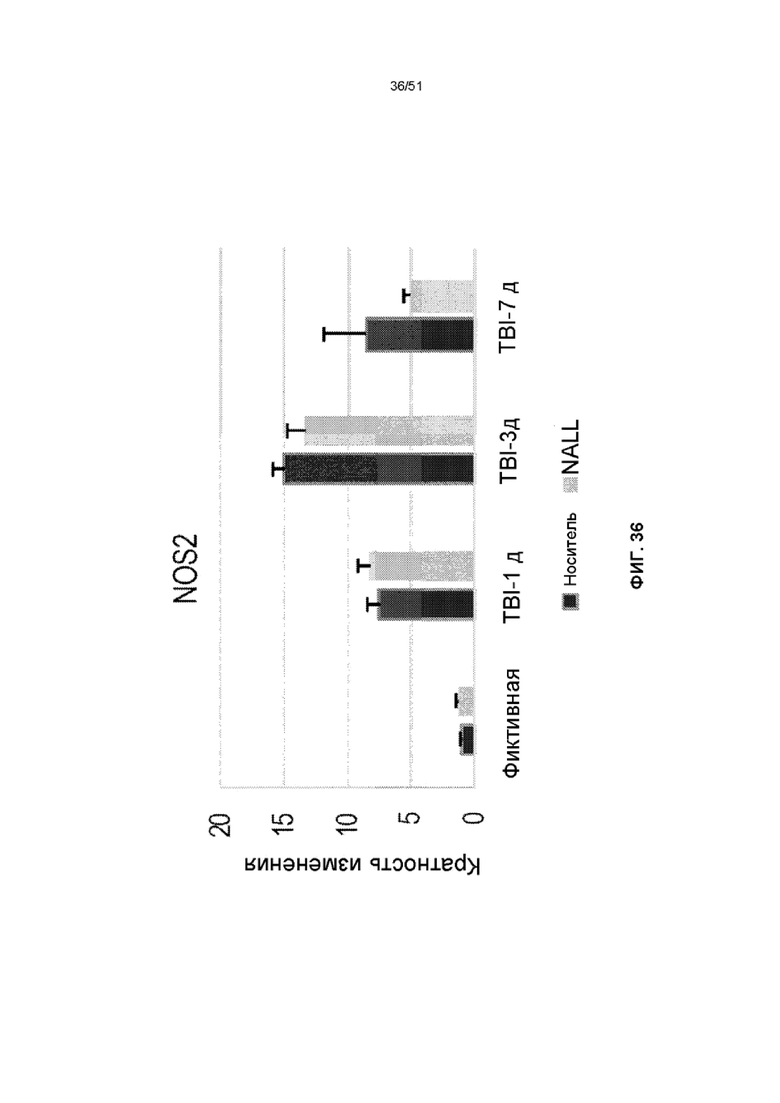

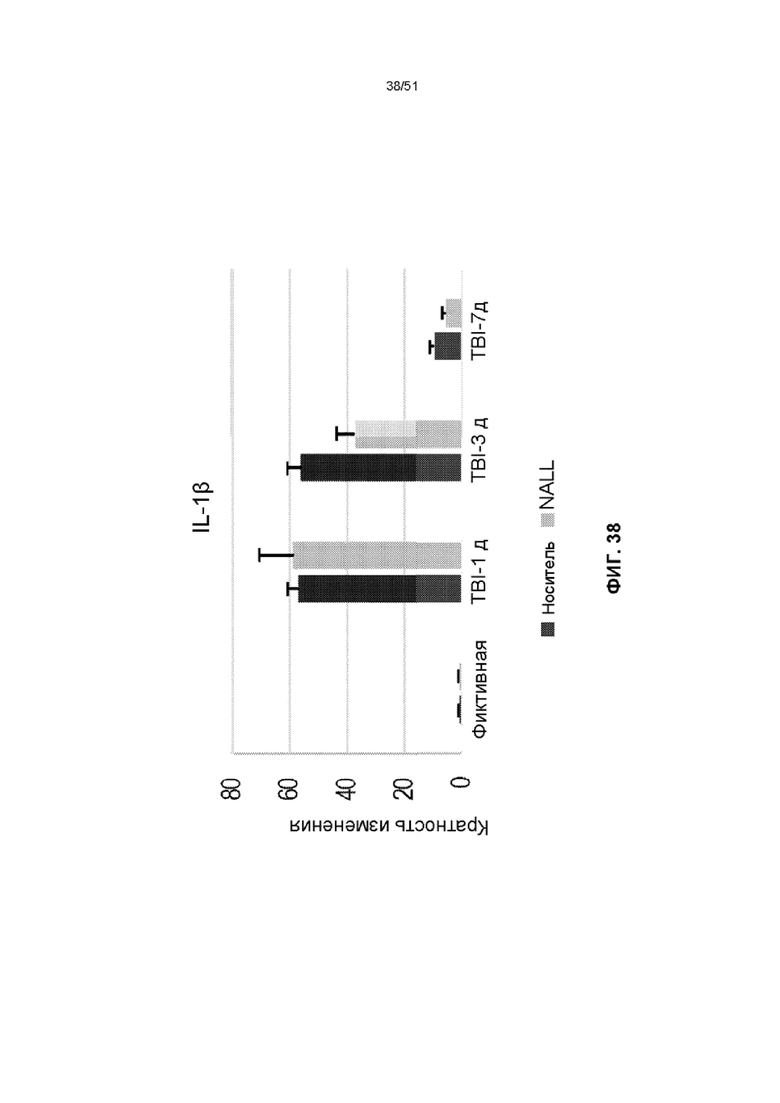
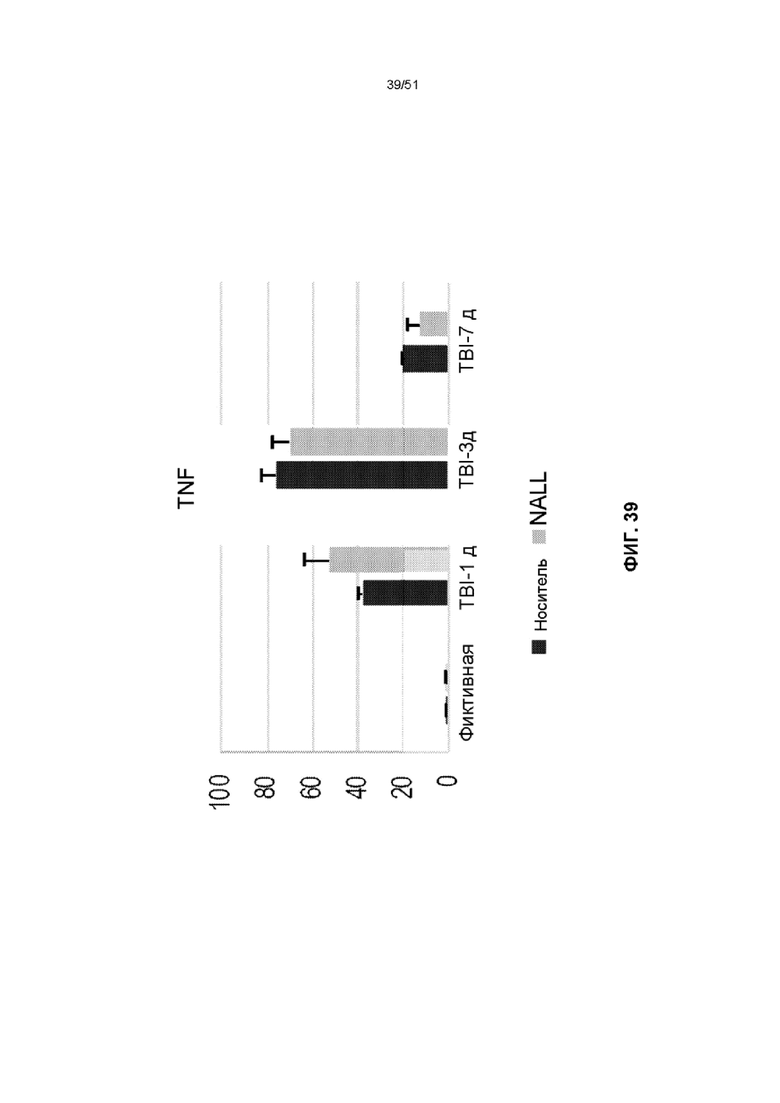


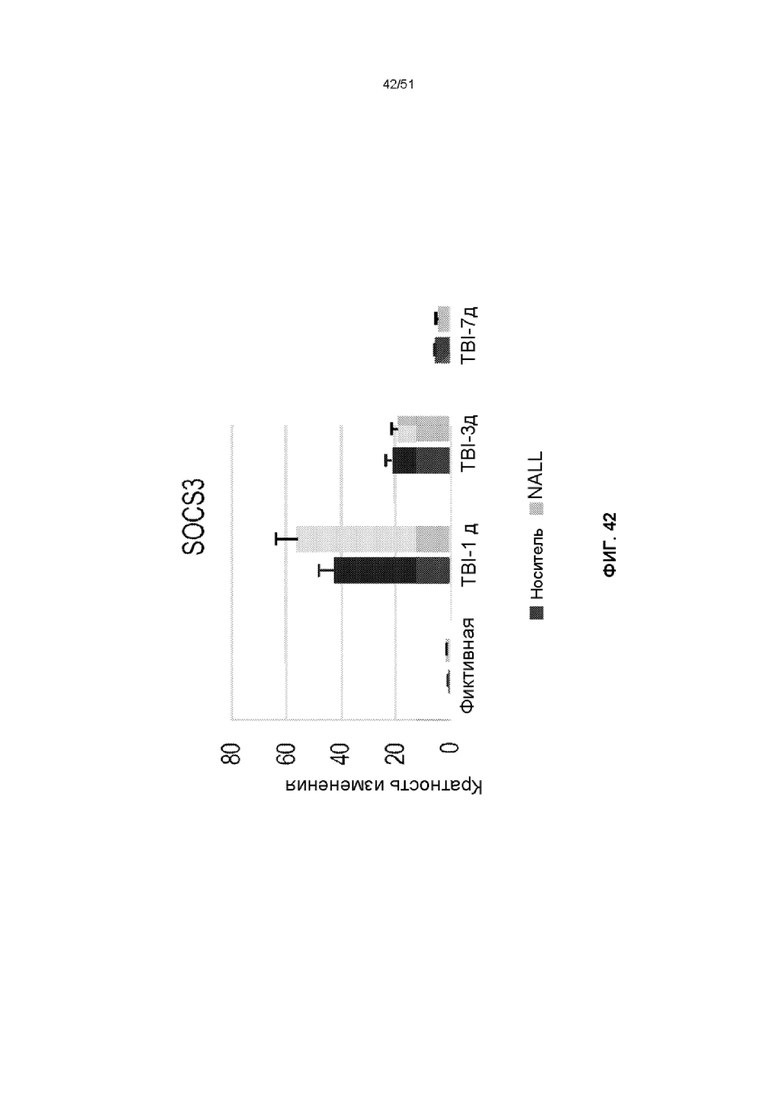

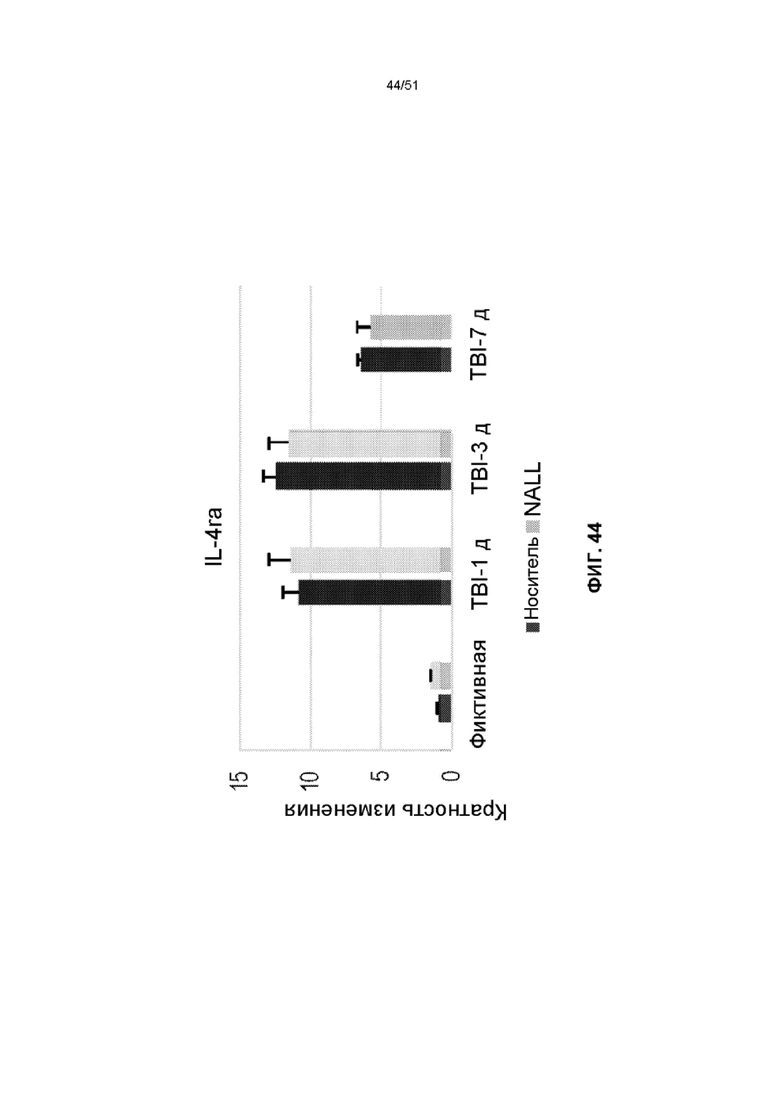
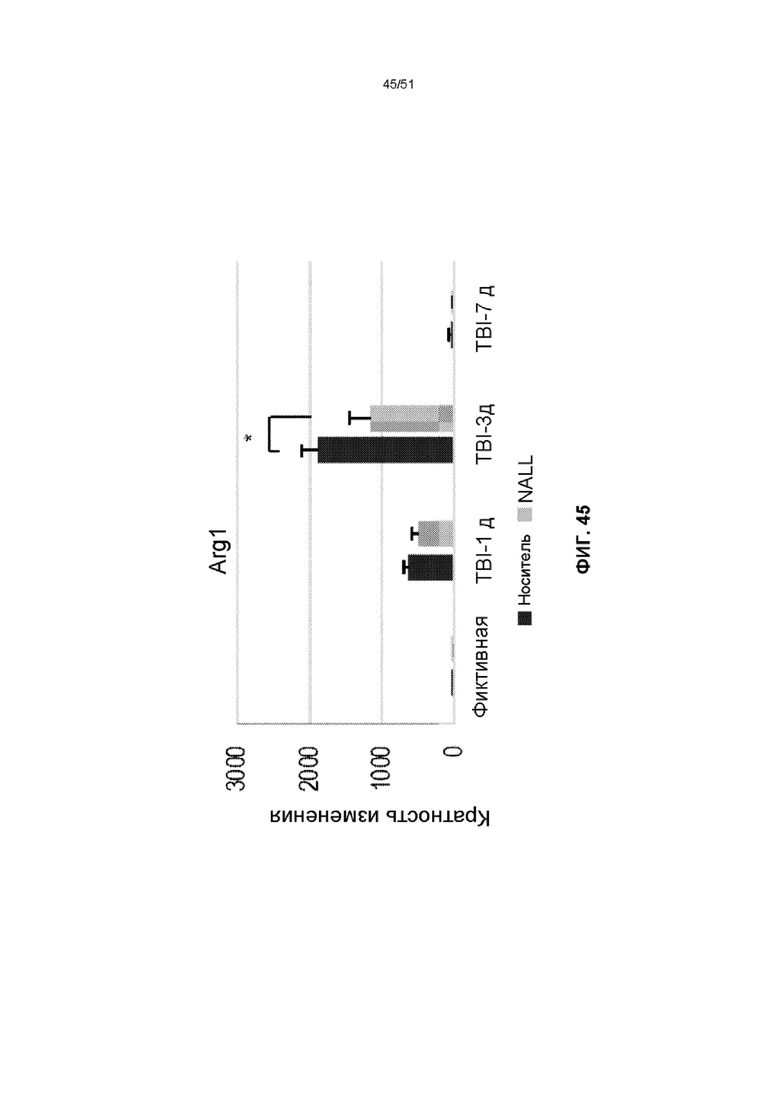




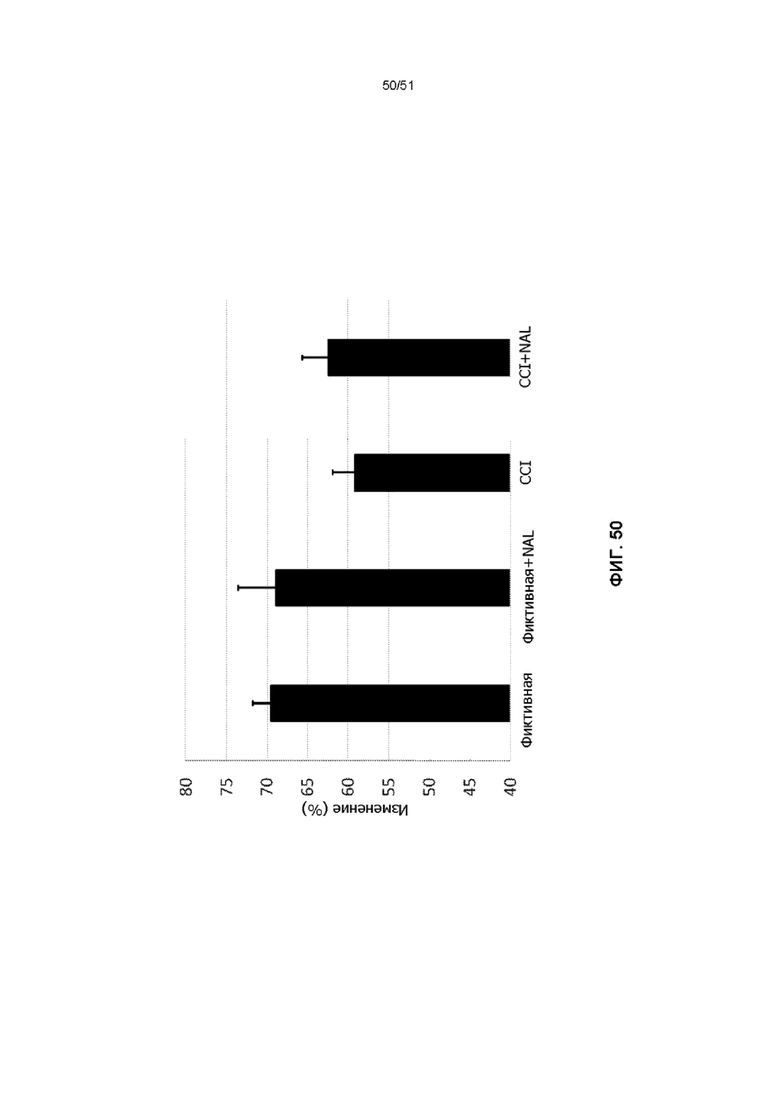

Группа изобретений относится к области фармацевтической промышленности, а именно к способу лечения травматического повреждения мозга и способу модуляции экспрессии одного или нескольких провоспалительных медиаторов. Способ лечения травматического повреждения мозга у нуждающегося в этом субъекта или лечения симптома травматического повреждения мозга у нуждающегося в этом субъекта, который включает введение терапевтически эффективного количества ацетил-L-лейцина или его фармацевтически приемлемой соли субъекту, где субъекту в день вводят от около 1 г до около 30 г ацетил-L-лейцина или его фармацевтически приемлемой соли. Способ модуляции экспрессии одного или нескольких провоспалительных медиаторов у субъекта с травматическим повреждением мозга, причем способ включает введение терапевтически эффективного количества ацетил-L-лейцина или его фармацевтически приемлемой соли субъекту. Использование группы изобретений позволяет лечить травматическое повреждение мозга и симптом травматического повреждения мозга. 2 н. и 8 з.п. ф-лы, 51 ил., 17 табл., 8 пр.
1. Способ лечения травматического повреждения мозга у нуждающегося в этом субъекта или лечения симптома травматического повреждения мозга у нуждающегося в этом субъекта, который включает введение терапевтически эффективного количества ацетил-L-лейцина или его фармацевтически приемлемой соли субъекту, где субъекту в день вводят от около 1 г до около 30 г ацетил-L-лейцина или его фармацевтически приемлемой соли.
2. Способ по п. 1, в котором от около 2 г до около 15 г ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту в день.
3. Способ по п. 2, в котором от около 3 г до около 10 г ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту в день.
4. Способ по п. 3, в котором от около 4 г до около 8 г ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту в день.
5. Способ по п. 4, в котором от около 4 г до около 5 г ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту в день.
6. Способ по п. 5, в котором около 5 г ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту в день.
7. Способ по любому из пп. 1-6, в котором терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения травматического повреждения мозга.
8. Способ по любому из пп. 1-6, в котором терапевтически эффективное количество ацетил-L-лейцина или его фармацевтически приемлемой соли вводят субъекту для лечения симптома травматического повреждения мозга.
9. Способ модуляции экспрессии одного или нескольких провоспалительных медиаторов у субъекта с травматическим повреждением мозга, причем способ включает введение терапевтически эффективного количества ацетил-L-лейцина или его фармацевтически приемлемой соли субъекту.
10. Способ по п. 9, в котором один или несколько провоспалительных медиаторов представляют собой NOS2, IL-18, IFNb, IL-1β, TNFα, NOX2, NLRP3, SOCS3, ARG1, IL-10, IL-4ra или YM1.
| US 2019046486 A1, 14.02.2019 | |||
| КОМБИНАЦИИ АЦЕТИЛЛЕЙЦИНА ДЛЯ ЛЕЧЕНИЯ ГОЛОВОКРУЖЕНИЯ | 2017 |
|
RU2680413C1 |
| WO 2008032222 A2, 20.03.2008 | |||
| TIGHILET B | |||
| et al | |||
| Comparative analysis of pharmacological treatments with N-acetyl-DL-leucine (Tanganil) and its two isomers (N-acetyl-L-leucine and N-acetyl-D-leucine) on vestibular compensation: Behavioral investigation in the cat | |||
| Eur J Pharmacol., 2015, | |||
Авторы
Даты
2024-03-13—Публикация
2020-03-02—Подача