Область техники, к которой относится изобретение
Настоящее раскрытие относится к лечению нейродегенеративных заболеваний, включающему введение ацетиллейцина или его фармацевтически приемлемой соли.
Настоящая заявка притязает на преимущество приоритета UK 1613829.9, поданной 11 августа 2016, UK 1702555.1, поданной 16 февраля 2017, UK 1705766.2, поданной 10 апреля 2017, и UK 1706867.7, поданной 28 апреля 2017, которые все полностью включены в настоящее описание в качестве ссылок.
Уровень техники
Нейродегенеративные заболевания являются заболеваниями, которые поражают нейроны. Дегенеративный процесс может включать прогрессирующую потерю структуры нейронов, прогрессирующую потерю функции нейронов или прогрессирующую гибель нервных клеток. Такая прогрессирующая нейродегенерация обычно приводит к нетрудоспособности и психическому расстройству. Многие нейродегенеративные заболевания являются опасно прогрессирующими и упорными, и существует мало способов куративного лечения, если вообще существует.
Хотя процесс нейродегенерации не вполне понятен, полагают, что терапевтические средства, которые показаны как нейропротекторы широкого спектра действия, вообще применимы при нейродегенеративных заболеваниях. Кроме того, многие нейродегенеративные заболевания ассоциируются с лизосомной дисфункцией. Она включает как нейродегенеративные лизосомные болезни накопления (ЛБН (LSD)), так и многие другие нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Паркинсона, связь которых с лизосомными недостатками предполагается.
Настоящее раскрытие связано с необходимостью разработки и широкого применения способов лечения нейродегенеративных заболеваний. В частности, в настоящем раскрытии описывается ацетиллейцин для лечения у субъекта нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания. Нейродегенеративное заболевание может, но необязательно, ассоциироваться с лизосомной дисфункцией.
В одном воплощении раскрывается ацетиллейцин или его фармацевтически приемлемая соль для применения в способе лечения у субъекта, нуждающегося в этом, нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, ассоциированных с нейродегенеративным заболеванием, причем нейродегенеративное заболевание не является мозжечковой атаксией или болезнью Ниманна-Пика типа С.
В одном воплощении настоящего раскрытия ацетиллейцин или его фармацевтически приемлемая соль раскрываются для применения в способе лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, причем субъект является бессимптомным.
В одном воплощении настоящего раскрытия ацетиллейцин или его фармацевтически приемлемая соль раскрываются для применения в способе задержки появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как можно ожидать, проявятся согласно типичному развитию заболевания,
В другом воплощении настоящее раскрытие включает ацетиллейцин или его фармацевтически приемлемая соль для применения в способе лечения у субъекта, нуждающегося в этом, нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, ассоциированных с нейродегенеративным заболеванием, причем способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
В одном воплощении настоящее раскрытие описывает ацетиллейцин или его фармацевтически приемлемую соль для применения в способе задержки развития со временем нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, ассоциированных с нейродегенеративным заболеванием, по сравнению с типичным развитием болезни, причем способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
В другом воплощении ацетиллейцин или его фармацевтически приемлемая соль раскрываются для применения в способе реверсии развития со временем нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, ассоциированных с нейродегенеративным заболеванием, причем способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
В другом воплощении ацетиллейцин или его фармацевтически приемлемая соль раскрываются для применения в способе улучшения со временем у субъекта, нуждающегося в этом, биохимического маркера нейродегенеративного заболевания, причем способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
В другом воплощении настоящее раскрытие включает ацетиллейцин или его фармацевтически приемлемую соль для применения в способе снижения тяжести нейродегенеративного заболевания или снижения тяжести или устранения одного или нескольких симптомов нейродегенеративного заболевания, ассоциированных с нейродегенеративным заболеванием, у субъекта, нуждающегося в этом, причем нейродегенеративное заболевание не является мозжечковой атаксией или болезнью Ниманна-Пика типа С.
В другом воплощении настоящее раскрытие включает ацетиллейцин или его фармацевтически приемлемую соль для применения в способе обеспечения нейрозащиты у субъекта, имеющего, с подозрением на наличие или в опасности появления нейродегенеративного заболевания, причем способ включает введение субъекту терапевтически эффективного количества ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
Другие воплощения настоящего раскрытия включают ацетиллейцин или его фармацевтически приемлемую соль для применения в способе задержки развития у субъекта нейродегенеративного заболевания или лизосомной болезни накопления (ЛБН). В другом воплощении раскрываются ацетиллейцин или его фармацевтически приемлемая соль для применения в способе обеспечения нейрозащиты у субъекта, имеющего, с подозрением на наличие или в опасности появления нейродегенеративного заболевания или ЛБН. В одном воплощении ацетиллейцин находится в форме рацемата, в энантиомерном избытке L-энантиомера или энантиомерном избытке D-энантиомера. В другом воплощении способы также включают введение ацетиллейцина в дозе от 1,5 г до 10 г в день. Кроме того, в одном воплощении способы включают введение ацетиллейцина для лечения в течение периода в две недели или более. Например, способы включают введение ацетиллейцина или его фармацевтически приемлемой соли до появления симптома заболевания или расстройства, от которого лечат. Еще в одном воплощении способы также включают назначение другой терапии или средства, предназначенных для предупреждения или лечения заболевания или расстройства, от которого лечат. Одно воплощение настоящего раскрытия относится к набору для задержки развития нейродегенеративного заболевания или ЛБН у субъекта, причем набор включает средства для диагностики или прогнозирования нейродегенеративного заболевания или ЛБН и ацетиллейцин или его фармацевтически приемлемую соль. Например, набор включает средства для диагностики или прогнозирования нейродегенеративного заболевания или ЛБН, и ацетиллейцин или его фармацевтически приемлемую соль. Еще одним воплощением настоящего раскрытия является применение ацетиллейцина или его фармацевтически приемлемой соли в качестве нейропротектора для субъекта, имеющего нейродегенеративное заболевание или ЛБН. В другом воплощении способов, наборов или применений нейродегенеративное заболевание ассоциируется с дефектами лизосомного накопления. В одном воплощении способов, наборов или применений нейродегенеративным заболеванием является алкоголизм, болезнь Александера, болезнь Альперса, болезнь Алльцгеймера, боковой амиотрофический склероз (ALS), атаксия-телеангиэктазия, нейрональный цероидный липофусциноз, болезнь Баттена, бычья спонгиформная энцефалопатия (BSE), болезнь Канавана, церебральный паралич, синдром Коккейна, кортикобазальная дегенерация, болезнь Крейтцфельда-Якоба, лобно-височная дегенерация, болезнь Гентингтона, ВИЧ-ассоциированная деменция, болезнь Кеннеди, деменция с тельцами Леви, нейроборрелиоз, болезнь Мачадо-Джозефа, мультисистемная атрофия, рассеянный склероз, множественная сульфатазная недостаточность, муколипидоз, нарколепсия, болезнь Ниманна-Пика, болезнь Паркинсона, болезнь Пика, болезнь Помпе, первичный боковой склероз, прионные болезни, прогрессирующий надъядерный паралич, болезнь Рефсума, болезнь Шилдера, подострая комбинированная дегенерация спинного мозга, вторичная к пернициозной анемии, болезнь Шпильмейера-Фогта-Шегрена-Баттена, спиноцеребеллярная атаксия, спинальная мышечная атрофия, болезнь Стила-Ричардсона-Ольшевского или сухотка спинного мозга. В другом воплощении способов, наборов или применений ЛБН представляет собой болезнь Ниманна-Пика типа С (дефект NPC1 и/или NPC2), синдром Смита-Лемли-Опица (SLOS), врожденное нарушение синтеза холестерина, болезнь Танжера, болезнь Пелицеуса-Мерцбахера, нейрональный цероидный липофусциноз, первичный гликосфинголипидоз, болезнь Фарбера или множественную сульфатазную недостаточность. Например, в способах, наборах или применениях первичный гликосфинголипидоз представляет собой болезнь Гоше, болезнь Фабри, ганглиозидоз GM1, ганглиозидоз GM2, болезнь Краббе или метахроматическую лейкодистрофию (MLD). В другом примере в способах, наборах или применениях ЛБН представляет собой NPC, болезнь Тея-Сакса, болезнь Сандхоффа, ганглиозидоз GM1, болезнь Фабри, нейродегенеративный мукополисахаридоз, MPS I, MPS IH, MPS IS, MPS II, MPS III, MPS IIIA, MPS IIIB, MPS IIIC, MPS HID, MPS, IV, MPS IV A, MPS IV B, MPS VI, MPS VII, MPS IX, болезнь с вторичным лизосомным поражением, SLOS или болезнь Танжера. В другом воплощении способов, наборов или применений нейродегенеративное заболевание представляет собой мозжечковую атаксию, болезнь Ниманна-Пика, паркинсонизм, нейропатическую болезнь Гоше, болезнь Сандхоффа, снндром Луи-Бар, болезнь Альцгеймера, болезнь Паркинсона, мультисистемную атрофию, лобно-височную деменцию или синдром Паркинсона нижней части тела. В еще одном воплощении способов, наборов или применений нейродегенеративное заболевание представляет собой мозжечковую атаксию, болезнь Ниманна-Пика, болезнь Ниманна-Пика типа С, болезнь Ниманна-Пика типа А, болезнь Тея-Сакса, болезнь Сандхоффа, боковой амиотрофический склероз (ALS), мультисистемную атрофию церебеллярного типа (MSA-C), лобно-височную деменцию с паркинсонизмом, синдром кортикобазальной дегенерации, прогрессирующий надъядерный паралич или «бьющий» вниз мозжечковый нистагм. В одном воплощении способов, наборов или применений ЛБН представляет собой болезнь Ниманна-Пика, болезнь Ниманна-Пика типа С, болезнь Ниманна-Пика типа А, болезнь Тея-Сакса, болезнь Сандхоффа или муколипидоз типа II.
Краткое описание фигур
Фигура 1 показывает фотографии обработанных (фигура А) и необработанных (фигура В) Npc1−/− мышей в возрасте девяти недель.
Фигуры 2А и 2В показывают данные о массе для Npc1−/− мышей в сравнении с мышами дикого типа (Npc1+/+) с обработкой ацетил-DL-лейцином и без из числа отлученных от матерей.
Фигуры 3А-3G показывают данные анализа походки для Npc1−/− мышей в сравнении с мышами дикого типа (Npc1+/+) с обработкой ацетил-DL-лейцином и без из числа отлученных от матерей. Например, данные по поддержке диагонали, ритму и последовательности шагов приводятся на фигурах 3А-3С соответственно. Фигуры 3D и 3Е показывают данные для передних лап (FP) (средняя стойка и шаговый цикл на панели D; рабочий цикл на панели Е). Фигуры 3F и 3G показывают данные для задних лап (НP) (средняя стойка и шаговый цикл на панели F; рабочий цикл на панели G).
Фигуры 4А-4Н показывают данные анализа двигательной функции Npc1−/− мышей в сравнении с мышами дикого типа (Npc1+/+) с обработкой ацетил-DL-лейцином и без из числа отлученных от матерей. Сосредоточное вставание (centre rearing), активность, вставание и число вперед-назад (FR) показаны на фигурах 4A-4D, соответственно. Активное время, время движения, время вставания и общее число вставаний, подсчитанное вручную, показаны на фигурах 4Е-4Н, соответственно.
Фигура 5 показывает, что обработка ацетил-DL-лейцином (0,1 г/кг от возраста 3 недели) ассоциируется с небольшим, но статистически значимым увеличением продолжительности жизни Npc1−/− мыши.
Фигуры 6А и 6В показывают уменьшение объема лизосом в ненейрональных NPC клетках после обработки ацетил-DL-лейцином. Фигуры 6С-6Н показывают влияние обработки ацетил-DL-лейцином на объем лизосом в фибробластах пациента с NPA, MLII, MPS IIIB, аспартилглюкозаминурией, MLIIIA и MPS VII, соответственно.
Фигура 7А показывает кривую выживания, представляющую смертность у необработанных или обработанных ацетиллейцином мышей дикого типа и с болезнью Сандхоффа. Фигура 7В показывает время шагового цикла для необработанных и обработанных ацетиллейцином мышей моделей болезни Сандхоффа, оцененных в возрасте 12 недель.
Фигуры 8А-8С показывают влияние обработки ацетил-DL-лейцином на уровни гликосфинголипида (GSL) в фибробластах пациента с ганглиозидозом GM2 (болезнью Тея-Сакса, болезнью Сандхоффа и АВ вариантом болезни Тея-Сакса, соответственно).
Фигура 9 показывают матрицу анализа походки для 75-летнего пациента с диагнозом синдром кортикобазальной дегенерации до и во время лечения ацетиллейцином, где более мелкие площади с точками на матрице показывают улучшение по сравнению с походкой до обработки.
Фигуры 10А и 10В показывают влияние обработки ацетил-DL-лейцином со временем на общую клиническую оценку тяжести (CSS) и общую клиническую годовую оценку увеличения тяжести (ASIS), соответственно, у десяти пациентов с NPC.
Фигуры 11А-11J показывают влияние обработки ацетил-DL-лейцином со временем на субоценки CSS для каждого из десяти пациентов с NPC.
Фигуры 12А и 12В показывают влияние обработки ацетил-DL-лейцином Npc1−/− мышей дикого типа на уровни С-концевых фрагментов предшественника амилоидного белка (АРР-CTF) и уровни конъюгата белок 1А, ассоциированный с микротрубочками/3-фосфатидилэтаноламин 1β-легкой цепи (LC3-II), соответственно.
Фигуры 13А-13С показывают, что после лечения ацетил-DL-лейцином пациент, у которого диагностирован «бьющий» вниз мозжечковый нистагм, может частично подавлять нистагм визуальной фиксацией.
Раскрытие изобретения
Ацетиллейцин в рацемической форме (ацетил-DL-лейцин) и соответствующие соли эффективны при лечении головокружения различного происхождения, особенно головокружения Меньера и головокружения воспалительного (вестибулярный неврит) или токсического происхождения. Например, ацетиллейцин продается Pierre Fabre Medicament в рацемической форме как лекарство против головокружения под торговым названием танганил®. Клинические результаты по танганилу®, сообщенные различными авторами, показывают улучшение в симптоматологии головокружения в более 95% случаев, включая исчезновение приступов головокружения.
Ацетил-DL-лейцин применяется во Франции для лечения острого головокружения с 1957 и имеет превосходный профиль безопасности, но его длительная безопасность при хроническом применении не определялась. Несмотря на многие гипотезы, включая стабилизацию мембранного потенциала, его фармакологические и электрофизиологические типы действия остаются неясными (Vibert et al. (2001), Eur. J. Neurosci., 13(4): 735-48; Ferber-Viart et al. (2009), Audiol. Neurootol., 14(1): 17-25). Исследование FDG-µPET на крысиной модели срочной односторонней лабиринэктомии (Zwergal et al. (2016), Brain Struct. Func., 221(1): 159-70) показало существенное действие L-энантиомера N-ацетил-L-лейцина на постуральную компенсацию путем активации вестибулярного мозжечка и дезактивации постеролатерального таламуса (Gunther et al. (2015), PLoS One; 10(3): e0120891). Симптоматическое улучшение при мозжечковой атаксии при использовании ацетил-DL-лейцина видно у ряда пациентов с болезнями мозжечка (Strupp et al. (2013), J. Neurol., 260(10): 2556-61). В другом случае улучшение не наблюдалось (Pelz et al. (2015), J. Neurol., 262(5): 1373-5). Качественный анализ походки показал, что ацетил-DL-лейцин улучшает преходящую изменчивость походки у пациентов с мозжечковой атаксией (Schniepp et al. (2015), Cerebellum, 3:8). Показано симптоматическое улучшение атаксии в одномесячном исследовании с участием 12 пациентов с болезнью Ниманна-Пика типа С (NPC) (Bremova et al. (2015), Neurology, 85(16): 1368-75). Кроме того, исследование методом PET пациентов с атаксией, получавших ацетил-DL-лейцин, показало у них усиленный метаболизм в среднем мозгу и пониженный в мозговом стволе (Becker-Bense et al. (2015), Abstract EAN).
Однако неизвестно, что ацетиллейцин лечит нейродегенеративные заболевания, которые, как правило, развиваются на протяжении десятилетий. Настоящее раскрытие неожиданно показывает, что ацетиллейцин или его фармацевтически приемлемую соль можно применять в способе лечения нейродегенеративного заболевания у субъекта, нуждающегося в этом, например, путем задержки появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, могут проявиться согласно типичному развитию болезни, и/или путем задержки или реверсии развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания на длительный период по сравнению с типичным развитием болезни. Эти примеры применения согласно настоящему раскрытию, а также другие, описанные в настоящем описании, стали неожиданными, так как на известном уровне техники благоприятное действие не наблюдали и не могли делать выводы. Как явствует из примеров, которые показывают эффективность ацетиллейцина при многих нейродегенеративных заболеваниях, авторы изобретения полагают, что ацетиллейцин действует как нейропротектор и таким образом ингибирует нейродегенерацию, проявление которой можно ожидать в ином случае. Кроме того, многие нейродегенеративные заболевания ассоциируются с дефектами в лизосомном накоплении, и лизосомная дисфункция, например, аберрантно высокие уровни лизосомного накоплении, может быть причиной дисфункции и гибели нейронов. Как явствует из примеров, но без связи с какой-либо определенной теорией, авторы настоящего изобретения обнаружили, среди прочего, что ацетиллейцин может снижать клеточную дисфункцию (например, уменьшая объем лизосом до контрольных величин) и обеспечивать нейрозащиту.
Следовательно настоящее раскрытие относится к ацетиллейцину или его фармацевтически приемлемой соли для применения в способе лечения нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания у субъекта, нуждающегося в этом.
«Субъект» при использовании в настоящем описании может представлять собой позвоночное, млекопитающее или домашнее животное. Следовательно, композиции по настоящему раскрытию можно использовать для лечения любого млекопитающего, например, домашнего скота (например, лошадей, коров, овец или свиней), домашних животных (например, кошек, собак, кроликов или морских свинок), лабораторных животных (например, мышей или крыс), или можно использовать в других ветеринарных применениях. В одном воплощении субъектом является человек.
Термин «нейродегенеративное заболевание», используемый в настоящем описании, относится к любому расстройству, которое поражает нейроны, и включает прогрессирующую утрату структуры нейронов, прогрессирующую утрату функции нейронов или прогрессирующую гибель нервных клеток.
Используемые в настоящем описании формы единственного числа включают ссылку и на множественное число.
Термины «приблизительно» и «примерно» обозначают почти одинаковое с приведенным числом или величиной, включая приемлемую степень ошибки для измеренного количества, заданную характером или точностью измерений.
Используемые в настоящем описании термины «приблизительно» и «примерно» вообще должны пониматься как охватывающие ±20% конкретного количества, частоты или величины. Численные количества, приведенные в настоящем описании, являются приблизительными, если не указано иное, что означает, что термин «примерно» или «приблизительно» может предполагаться, когда количество не установлено точно.
Термины «вводить», «введение» или «вводимый» при использовании в настоящем описании относятся к (1) обеспечению, подаче, дозированию и/или выписыванию медицинским работником или его уполномоченным представителем или под его руководством композиции согласно раскрытию, и (2) прием внутрь, получение или потребление пациентом или самим человеком композиции согласно раскрытию.
Ссылки на «ацетиллейцин» во всем описании включают его фармацевтически приемлемые соли, если не установлено точно.
Ацетиллейцин может находиться в рацемической форме, что означает, что соединение включает примерно равные количества энантиомеров. С другой стороны, он может присутствовать в энантиомерном избытке или L-энантиомера или D-энантиомера. Ацетиллейцин может находиться в одной энантиомерной форме – или L-энантиомера или D-энантиомера. В одном воплощении единственной энантиомерной формой является L-энантиомер. Рацемическую и энантиомерные формы можно получить согласно процедурам, известным в технике.
«Фармацевтически приемлемая соль» в связи с настоящим описанием представляет собой любую соль, которая подходит для использования в фармацевтическом применении. Фармацевтически приемлемые соли включают, но без ограничения, соли аминов, таких как N,N'-дибензилэтилендиамин, хлорпрокаин, холин, аммиак, диэтаноламин и другие гидроксиалкиламины, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенетиламин, 1-пара-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин и другие алкиламины, пиперазин, трис(гидроксиметил)аминометан и т.п.; соли щелочных металлов, таких как литий, калий, натрий и т.п.; соли щелочноземельных металлов, таких как барий, кальций, магний и т.п.; соли переходных металлов, таких как цинк, алюминий и т.п.; другие соли металлов, такие как гидрофосфат натрия, динатрийфрсфат и т.п.; соли неорганических кислот, такие как гидрохлориды, сульфаты и т.п.; и соли органических кислот, такие как ацетаты, лактаты, малаты, тартраты, цитраты, аскорбаты, сукцинаты, бутираты, валераты, фумараты и т.п..
Ацетиллейцин или его фармацевтически приемлемая соль могут быть включены в композиции и введены субъекту согласно указаниям, известным в технике. Например, ацетиллейцин или его фармацевтически приемлемая соль могут быть включены в фармацевтическую композицию. Фармацевтическая композиция может включать ацетиллейцин или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Название «фармацевтическая композиция» заключает в себе один активный агент или форму фармацевтической композиции.
Фармацевтическая композиция может принимать любую форму из ряда различных форм в зависимости, в частности, от способа ее использования. Так, например, она может находиться в форме порошка, таблетки, капсулы, жидкости, мази, крема, геля, гидрогеля, аэрозоля, спрея, мицеллярного раствора, трансдермального пэтча, липосомной суспензии или любой другой подходящей форме, которую можно ввести человеку или животному, нуждающемуся в лечении.
«Фармацевтически приемлемый носитель», упоминаемый в настоящем описании, представляет собой любое известное соединение или комбинацию известных соединений, которые известны специалистам в данной области техники как применимые при составлении фармацевтических композиций. Следует иметь в виду, что носитель в фармацевтической композиции должен являться носителем, который переносится субъектом, который его получает.
В одном воплощении фармацевтически приемлемый носитель может представлять собой твердое вещество, и композиция может находиться в форме порошка или таблетки. Твердый фармацевтически приемлемый носитель может включать, но без ограничения, одно или несколько веществ, которые также могут действовать как корригенты, буферы, лубриканты, стабилизаторы, солюбилизаторы, суспендирующие агенты, смачиватели, эмульгаторы, красители, наполнители, глиданты, вспомогательные вещества при прессовании, инертные связующие, подсластители, консерванты, покрытия или агенты, способствующие распадаемости таблетки. Носитель также может представлять собой инкапсулирующий материал. В порошках носитель может представлять собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченными активными агентами, соответствующими изобретению. В таблетках активный агент может быть в подходящих пропорциях смешан с носителем, имеющим необходимые компрессионные свойства, и спрессован в желательной форме и нужного размера. Порошки и таблетки могут, например, содержать до 99% активных агентов. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахара, лактозу, декстрин, крахмал, желатин, целлюлозу, поливинилпирролидон, низкоплавкие воски и ионообменные смолы. В другом воплощении фармацевтически приемлемый носитель может представлять собой гель, и композиция может находиться в форме крема или подобной форме.
Носитель может включать, но без ограничения, один или несколько эксципиентов или разбавителей. Примерами таких эксципиентов являются желатин, аравийская камедь, лактоза, микрокристаллическая целлюлоза, крахмал, натрия крахмал гликолят, гидрофосфат кальция, стеарат магния, тальк, коллоидальный диоксид кремния и т.п..
В другом воплощении фармацевтически приемлемый носитель может представлять собой жидкость. В одном воплощении фармацевтическая композиция находится в форме раствора. Жидкие носители используют при получении растворов, суспензий, эмульсий, сиропов, эликсиров и композиций под давлением. Ацетиллейцин может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, смесь двух или больше фармацевтически приемлемых масел или жиров. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, консерванты, подсластители, корригенты, суспендирующие агенты, загустители, красители, регуляторы вязкости, стабилизаторы или осморегуляторы. Подходящие примеры жидких носителей для перорального и парентерального введения включают воду (частично содержащую добавки, указанные выше, например, производные целлюлозы, например, раствор натрия карбоксиметилцеллюлозы), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные и масла (например, фракционированное кокосовое масло и арахисовое масло). Для парентерального введения носитель также может представлять собой эфир жирной кислоты, такой как этилолеат и изопропилмиристат. В стерильных композициях в жидкой форме для парентерального введения применяют стерильные жидкие носители. Жидкий носитель для композиций под давлением может представлять собой галогенированный углеводород или другой фармацевтически приемлемый пропеллент.
Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут использоваться путем, например, внутримышечной, интратекальной, эпидуральной, интраперитонеальной, внутривенной и особенно подкожной инъекции. Активный агент можно получить в виде стерильной твердой композиции, которую можно растворить или суспендировать во время введения, используя стерильную воду, физиологический раствор или другую соответствующую стерильную среду для инъекции.
Композиции можно вводить перорально в форме стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, достаточно соли или глюкозы для придания раствору изотоничности), соли желчных кислот, аравийскую камедь, желатин, моноолеат сорбитана, полисорбат 80 (олеаты сорбитола и его ангидриды, сополимеризованные с этиленоксидом) и т.п.. Композиции также можно вводить перорально в форме или жидкой или твердой композиции. Композиции, подходящие для перорального введения, включают твердые формы, такие как пилюли, капсулы, гранулы, таблетки и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формы, применимые для парентерального введения, включают стерильные растворы, эмульсии и суспензии.
С другой стороны, ацетиллейцин и включающие его композиции можно вводить ингаляцией (например, интраназально). Также можно получить композиции для топического применения. Например, кремы и мази можно наносить на кожу.
Ацетиллейцин можно включить в устройство с замедленным или отсроченным высвобождением. Такие устройства можно, например, встроить на или под кожу, и лекарственное средство может высвобождаться в течение недель или даже месяцев. Такие устройства могут быть выгодны, когда требуется применение длительного лечения ацетиллейцином согласно настоящему раскрытию, и которое обычно требует частого введения (например, по меньшей мере ежедневного введения).
В одном воплощении фармацевтическая композиция находится в форме таблетки. В таблетках активный агент может быть смешан в подходящих пропорциях со средой, такой как фармацевтически приемлемый носитель, имеющий необходимые компрессионные свойства, и спрессован в нужную форму и размер. Таблетки могут содержать до 99 мас.% активных агентов.
Например, ацетиллейцин или его фармацевтически приемлемую соль можно предоставить в твердой лекарственной форме, подходящей для перорального введения, особенно в форме таблетки.
Фармацевтические композиции в твердой пероральной лекарственной форме, такой как таблетки, можно получить любым способом, известным в фармации. Фармацевтические композиции обычно получают путем смешивания ацетиллейцина или его фармацевтически приемлемой соли с обычными фармацевтически приемлемыми носителями.
Таблетка может быть получена так, как известно в технике. «Танганил®», например, включает пшеничный крахмал, прежелатинизированный маисовый (кукурузный) крахмал, карбонат кальция и стеарат магния в качестве эксципиентов. Такие же или подобные эксципиенты, например, можно использовать в настоящем раскрытии.
Композиция каждой 700-мг таблетки танганила® следующая: 500 мг ацетил-DL-лейцина, 88 мг пшеничного крахмала, 88 мг прежелатинизированного маисового (кукурузного) крахмала, 13 мг карбоната кальция и 11 мг стеарата магния. Такие же таблетки, например, можно использовать в настоящем раскрытии.
В настоящем раскрытии описывается ацетиллейцин, включающие его композиции и способы для лечения нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания у субъекта, нуждающегося в этом. Субъект, нуждающийся в этом, может иметь генетический, биохимический или другой подобный идентифицируемый маркер нейродегенеративного заболевания. Например, маркером нейродегенеративного заболевания может быть клеточный маркер. Субъект, нуждающийся в этом, может быть диагностирован как имеющий нейродегенеративное заболевание. Например, субъект может иметь диагноз нейродегенеративного заболевания в соответствии с генетическим, биохимическим или другим подобным идентифицируемым маркером. У субъекта, нуждающегося в этом, может подозреваться наличие или опасность появления нейродегенеративного заболевания. Например, субъект может иметь генетическую предрасположенность к нейродегенеративному заболеванию (например, у субъекта может быть один или несколько членов семьи с нейродегенеративным заболеванием). Субъект, нуждающийся в этом, может быть симптоматическим (т.е., иметь один или несколько симптомов, связанных с нейродегенеративным заболеванием). Субъект, нуждающийся в этом, может быть бессимптомным. Следует иметь в виду, что термины «симптоматический» и «бессимптомный» используются в связи с симптомами нейродегенеративного заболевания. Субъекты, имеющие генетический, биохимический или другой подобный идентифицируемый маркер нейродегенеративного заболевания, такие как субъекты, которым поставлен диагноз нейродегенеративного заболевания на основании генетического, биохимического или другого подобного идентифицируемого маркера, но у которых нет других симптомов болезни, для целей настоящего раскрытия включаются в группу «бессимптомных».
При использовании в настоящем описании выражение «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» и подобные относятся к задержке появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, проявятся согласно типичному развитию заболевания, снижению тяжести нейродегенеративного заболевания или снижению тяжести или устранению одного или нескольких имеющихся симптомов, связанных с нейродегенеративным заболеванием, задержке развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем по сравнению с типичным развитием заболевания, и/или реверсии развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем. «Лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» также может относиться к улучшению биохимического маркера нейродегенеративного заболевания.
При использовании в настоящем описании выражения «типичное развитие заболевания», «развитие заболевания, которое обычно можно ожидать» и подобные относятся к типичному или ожидаемому развитию нейродегенеративного заболевания, одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, или биохимического маркера нейродегенеративного заболевания, если субъекта не лечат. Типичное или ожидаемое развитие заболевания может быть основано, например, на известной шкале, индексе, рейтинге или оценке или другом подходящем тесте для оценки развития нейродегенеративного заболевания, одного или нескольких симптомов нейродегенеративного заболевания или биохимического маркера нейродегенеративного заболевания, таких, как описанные в качестве примеров в настоящем описании. Шкала, индекс, рейтинг, оценка или другой подходящий тест могут соответствовать развитию нейродегенеративного заболевания в целом или развитию одного или нескольких симптомов, связанных с заболеванием. Например, типичное или ожидаемое развитие заболевания можно оценить на основе типичного или ожидаемого начала или тяжести нейродегенеративного заболевания или появления симптома или набора симптомов, связанных с нейродегенеративным заболеванием. Типичное или ожидаемое развитие заболевания можно определить на основании сравнения субъектов или на основании того, что типично наблюдают или ощущают большое число субъектов, пораженных нейродегенеративным заболеванием, такое как популяция или субпопуляция субъектов. Субпопуляции могут включать, например, группы населения одного пола, одного или схожего возраста, одного и того же или схожего времени появления одного или нескольких симптомов и т.д..
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к задержке появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, могут проявляться согласно типичному развитию заболевания. При использовании в настоящем описании выражение «задержка появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» и подобные относятся к увеличению времени до или предотвращению появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания. Например, можно сказать, что появление задержано, когда время до проявления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания становится по меньшей мере на 5% более длительным, чем время, наблюдаемое согласно типичному развитию заболевания. Также для примера, наблюдают возрастание времени по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%. В одном воплощении субъект является бессимптомным. Введение ацетиллейцина на момент, когда субъект является бессимптомным, может вызвать задержку появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, могут проявиться согласно типичному развитию заболевания. В другом воплощении субъект является симптоматическим. Введение ацетиллейцина можно начинать во время, когда субъект имеет несколько симптомов, для того, чтобы задержать появление одного или нескольких дополнительных симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, могут проявиться согласно типичному развитию заболевания. Субъект, нуждающийся в этом, может продолжать получать лечение ацетиллейцином согласно длительностям лечения, описанным в настоящем описании. В одном воплощении лечение предотвращает появление одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как ожидается, могут проявиться согласно типичному развитию заболевания.
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к снижению тяжести нейродегенеративного заболевания или снижению тяжести или устранению одного или нескольких симптомов, связанных с нейродегенеративным заболеванием. Тяжесть нейродегенеративного заболевания или существующего(их) симптома(ов) можно оценить с использованием известных шкалы, индекса, рейтинга или оценки, таких как в примерах, описанных в настоящем описании как примеры, или другого теста, подходящего для оценки тяжести. Например, шкала, индекс, рейтинг, оценка или другой подходящий тест могут соответствовать тяжести нейродегенеративного заболевания в целом или тяжести одного или нескольких симптомов, связанных с нейродегенеративным заболеванием. В одном воплощении лечение улучшает такую оценку от величины или степени, характерной для симптоматического пациента, до величины или степени, характерной для бессимптомного пациента.
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к задержке развития со временем нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративного заболевания, по сравнению с типичным развитием заболевания, или реверсии развития со временем нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием. Время, в течение которого лечение задерживает или реверсирует развитие заболевания, может соответствовать длительности лечения, описанной в настоящем описании. Лечение может задержать или реверсировать развитие на протяжении, например, примерно семи дней или дольше, примерно двух недель или дольше, примерно трех недель или дольше, примерно одного месяца или дольше, примерно шести недель или дольше, примерно семи недель или дольше или примерно двух месяцев или дольше. Например, лечение может задержать или реверсировать развитие на протяжении примерно трех месяцев или дольше, примерно четырех месяцев или дольше, примерно пяти месяцев или дольше или примерно шести месяцев или дольше. Оно может задержать или реверсировать развитие на протяжении, например, примерно 1 года или дольше, примерно 2 лет или дольше, примерно 3 лет или дольше, примерно 4 лет или дольше, примерно 5 лет или дольше или 10 лет или дольше. Лечение может задерживать или реверсировать развитие нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, на протяжении всей жизни пациента.
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к задержке развития со временем нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания по сравнению с типичным развитием заболевания. Используемое в настоящем описании выражение «задержка развития со временем нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием» и подобные относятся к замедлению и/или прекращению развития заболевания или одного или нескольких симптомов заболевания (например, замедлению и/или прекращению усугубления или усиления тяжести заболевания или одного или нескольких симптомов заболевания) во временем. Развитие заболевания можно определить, например, с использованием известных шкалы, индекса, рейтинга или оценки, таких как в примерах, описанных в настоящем описании, или другого теста, подходящего для оценки тяжести. Например, шкала, индекс, рейтинг, оценка или другой подходящий тест могут соответствовать развитию заболевания в целом или развитию одного или нескольких симптомов, связанных с заболеванием. В одном воплощении «задержка развития со временем нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием» означает, что оценка тяжести заболевания у субъекта (например, общей тяжести или тяжести одного или нескольких симптомов), определенная по известной шкале, индексу, рейтингу, оценке и т.д. или другому подходящему тесту для оценки тяжести, возросла несущественно (например, по меньшей мере остается по существу постоянной). В одном воплощении «задержка развития со временем нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» означает предотвращение достижения субъектом или возрастание времени для достижения субъектом (например, снижение скорости изменения возрастания тяжести) оценки тяжести по известной шкале, индексу, рейтингу, оценке и т.д. или другому подходящему тесту для оценки развития по сравнению с оценкой, соответствующей типичному развитию заболевания. Например, можно сказать, что развитие задерживается, когда время до достижения оценки тяжести становится по меньшей мере на 5% более длительным, чем время, наблюдаемое согласно типичному развитию заболевания. Также для примера, наблюдают возрастание времени по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100%. Время, в течение которого лечение задерживает развитие нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, может соответствовать длительности лечения, описанной в настоящем описании. В одном воплощении лечение задерживает развитие в течение по меньшей мере примерно трех месяцев, по меньшей мере примерно четырех месяцев, по меньшей мере примерно пяти месяцев или по меньшей мере примерно шести месяцев. Лечение может задерживать развитие в течение по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет, по меньшей мере примерно 3 лет, по меньшей мере примерно 4 лет, по меньшей мере примерно 5 лет или по меньшей мере 10 лет. Лечение может задерживать развитие на протяжении всей жизни пациента.
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к реверсии развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем. Используемое в настоящем описании выражение «реверсия развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем» и подобные относятся к прекращению развития и снижению тяжести заболевания или одного или нескольких симптомов заболевания со временем. Развитие и тяжесть заболевания можно определить, например, с использованием известных шкалы, индекса, рейтинга или оценки, таких как в примерах, описанных в настоящем описании, или другого теста, подходящего для оценки развития и тяжести. Например, шкала, индекс, рейтинг, оценка или другой подходящий тест могут соответствовать развитию и тяжести заболевания в целом или развитию и тяжести одного или нескольких симптомов, связанных с заболеванием. В одном воплощении «реверсия развития со временем нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» означает, что оценка тяжести заболевания у субъекта (например, общей тяжести или тяжести одного или нескольких симптомов), определенная по известной шкале, индексу, рейтингу, оценке и т.д. или другому подходящему тесту для оценки тяжести, улучшается со временем (т.е., показывает снижение тяжести со временем). Время, в течение которого лечение реверсирует развитие нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, может соответствовать длительности лечения, описанной в настоящем описании. В одном воплощении лечение реверсирует развитие в течение по меньшей мере примерно трех месяцев, по меньшей мере примерно четырех месяцев, по меньшей мере примерно пяти месяцев или по меньшей мере примерно шести месяцев. В другом воплощении лечение реверсирует развитие в течение по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет, по меньшей мере примерно 3 лет, по меньшей мере примерно 4 лет, по меньшей мере примерно 5 лет или по меньшей мере 10 лет. Лечение может реверсировать развитие на протяжении всей жизни пациента.
В одном воплощении «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» относится к улучшению у субъекта биохимического маркера нейродегенеративного заболевания (например, повышенных уровней накопления метаболита(ов) или вторичных биохимических изменений, являющихся результатом первичного накопления). Биохимический маркер представляет собой сигнал активности заболевания и может предоставить текущие показания тяжести и развития заболевания со временем. В одном воплощении биохимический маркер улучшается с учетом контрольной величины. В одном воплощении биохимический маркер выбирают из повышенного объема лизосом, повышенных уровней гликосфинголипида (GSL), повышенных уровней конъюгата белок 1А, ассоциированный с мекротрубочками/3-фосфатидилэтаноламин 1β-легкой цепи (LC3-II), и повышенных уровней С-концевого фрагмента предшественника амилоидного белка (АРР-CTF). В одном воплощении биохимический маркер представляет собой повышенный объем лизосом, и лечение уменьшает объем лизосом у субъекта. В одном воплощении биохимический маркер представляет собой повышенные уровни гликосфинголипида (GSL), и лечение снижает уровни GSL у субъекта. В одном воплощении биохимический маркер представляет собой повышенные уровни конъюгата белок 1А, ассоциированный с мекротрубочками/3-фосфатидилэтаноламин 1β-легкой цепи, (LC3-II), и лечение снижает уровни LC3-II у субъекта. В одном воплощении биохимический маркер представляет собой повышенные уровни С-концевого фрагмента предшественника амилоидного белка (АРР-CTF), и лечение снижает уровни АРР-CTF у субъекта. В одном воплощении лечение улучшает биохимический маркер со временем. Например, в одном воплощении улучшение биохимического маркера со временем означает, что лечение улучшает биохимический маркер со временем относительно контрольной величины, предотвращает развитие биохимического маркера со временем и/или задерживает развитие биохимического маркера со временем по сравнению с типичным развитием при заболевании. Время, в течение которого лечение улучшает биохимический маркер, может соответствовать длительности лечения, описанной в настоящем описании. В одном воплощении лечение улучшает биохимический маркер в течение по меньшей мере примерно трех месяцев, по меньшей мере примерно четырех месяцев, по меньшей мере примерно пяти месяцев или по меньшей мере примерно шести месяцев. Лечение может улучшать биохимический маркер в течение по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет, по меньшей мере примерно 3 лет, по меньшей мере примерно 4 лет, по меньшей мере примерно 5 лет или по меньшей мере 10 лет. Лечение может улучшать биохимический маркер на протяжении всей жизни пациента.
«Симптом» нейродегенеративного заболевания включает любое клиническое или лабораторное проявление, связанное с нейродегенеративным заболеванием, и не ограничивается тем, что сам пациент может чувствовать или наблюдать. Симптомы, описанные в настоящем описании, включают, но без ограничения, неврологические симптомы и психотические симптомы. Примеры неврологических симптомов включают атаксию, другие нарушения движения, такие как гипокинезия, мышечная ригидность, тремор или дистония, центральные глазодвигательные расстройства, такие как вертикальный и горизантальный надъядерный паралич саккад/взора, и нейропсихологические дефекты, такие как деменция. Примеры психотических симптомов включают депрессию, поведенческие расстройства или психоз. Появление симптомов может колебаться от рождения до взрослого состояния.
Развитие нейродегенеративного заболевания со временем или в ходе лечения можно контролировать, например, используя один или несколько известных тестов в два или больше моментов времени и сравнивая результаты. Развитие и/или тяжесть заболевания можно оценить, например, используя шкалу для оценки и рейтинга атаксии (SARA), функциональный индекс спиноцеребеллярной атаксии (SCAFI), Международную кооперативную рейтинговую шкалу атаксии (ICARS), краткую рейтинговую шкалу атаксии (BARS), модифицированную шкалу оценки инвалидности (mDRS), визуальную аналоговую шкалу (VAS) EuroQol 5Q-5D-5L (EQ-5D-5L), нейропсихологические тесты, такие как пересмотренная шкала интеллекта взрослых (WAIS-R), пересмотренная шкала интеллекта детей-IV (WISC-IV), монреальская когнитивная оценка (MoCA), а также шкалы, используемые при нарушении движения, такие как унифицированная рейтинговая шкала болезни Паркинсона (UPRS) или унифицированная рейтинговая шкала мультисистемной атрофии (UMSARS), или другие подходящие тесты. Для некоторых ЛБН, таких как NPC, разработаны отдельные оценки и утверждены в течение последних десятилетий, например, клиническая оценка тяжести (CSS) и годовая оценка увеличения тяжести (ASIS) (см. Yanjanin et al., “Linear Clinical Progression, Independent of Age of Onset, in Niemann–Pick Disease, Type C,” Am. J. Med. Genet. Part B, 153B: 132–140), и модифицированная шкала оценки инвалидности 6-Domain NP-C (оценка mDRS). Например, тяжесть NPC у пациента можно оценить количественно, оценивая CSS, которая оценивает различные параметры заболевания (способность передвигаться, припадки, движение глаз и т.д.), и дает оценку каждого параметра до 5. Более высокая оценка равнозначна большей тяжести. ASIS оценивает количественно степень изменения CSS и вычисляет путем деления CSS на возраст пациента. В этом отношении некоторые оценки в таких тестах являются характеристиками симптоматических пациентов с нейродегенеративным заболеванием и доказательством развития и/или тяжести заболевания.
Таким образом, «лечение нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания», например, можно прировнять к достижению улучшенной оценки, такой, какие описаны в настоящем описании, оценке по SARA, SCAFI, ICARS, BARS, mDRS, EQ-5D-5L VAS, WAIS-R, WISC-IV, CSS, UPRS. UMSARS и/или MoCA, или результату другого теста, подходящего для характеризации пациента с нейродегенеративным заболеванием. Например, в одном воплощении «снижение тяжести нейродегенеративного заболевания или снижение тяжести или устранение одного или нескольких существующих симптомов нейродегенеративного заболевания» означает улучшение оценки по SARA, SCAFI, ICARS, BARS, mDRS, EQ-5D-5L VAS, WAIS-R, WISC-IV, CSS, UPRS. UMSARS и/или MoCA или результату другого теста, подходящего для оценки тяжести, такое как улучшение оценки или результата от оценки тяжести, характерной для симптоматического субъекта, до величины, характерной для бессимптомного субъекта. В другом воплощении «задержка развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания» означает, что оценка субъекта по SARA, SCAFI, ICARS, BARS, mDRS, EQ-5D-5L VAS, WAIS-R, WISC-IV, CSS, UPRS. UMSARS и/или MoCA или результату другого теста, подходящего для оценки развития, существенно не возрастает (например, по меньшей мере остается по существу постоянной). В другом воплощении «задержка развития нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием» означает предотвращение оценки субъекта по SARA, SCAFI, ICARS, BARS, mDRS, EQ-5D-5L VAS, WAIS-R, WISC-IV, CSS, UPRS. UMSARS и/или MoCA или результату другого теста, подходящего для оценки развития, от достижения, или возрастание времени, взятого для достижения, величины, сравнимой с величиной при типичном развитии заболевания. В другом воплощении «реверсия развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем» означает, что оценка у субъекта по SARA, SCAFI, ICARS, BARS, mDRS, EQ-5D-5L VAS, WAIS-R, WISC-IV, CSS, UPRS. UMSARS и/или MoCA или результату другого теста, подходящего для оценки развития, улучшается со временем (т.е., показывает снижение тяжести со временем).
Например, для того, чтобы оценить общий неврологический статус по mDRS, можно применить четырехпараметрическую шкалу (способность передвигаться, манипуляция, речь и глотание). Функцию мозжечка можно оценить с использованием SARA – восьмипозиционной клинической рейтинговой шкалы (походка, положение стоя, положение сидя, речь, функция мелкой моторики и таксис; интервал 0–40, где 0 - наилучший неврологический статус и 40 наихудший), и SCAFI, включающей 8-m-Walking-Time (8MW; выполняется путем прохождения пациентами настолько быстро, насколько возможно, дважды от одной линии до другой, включая поворот), тестом 9-Hole-Peg-Test (9HPT) и рядом “PATA” повторений в течение 10 с. Субъективное улучшение и качество жизни можно оценить с использованием опросника EQ-5D-5L и VAS. Для того, чтобы оценить глазодвигательную функцию, можно использовать 3-мерную видеоокулографию (EyeSeeCam) для измерения максимальной скорости саккад, улучшения плавного слежения, максимальной скорости медленной фазы вызванного взглядом нистагма (функция удерживания взгляда), максимальной скорости медленной фазы оптокинетического нистагма и улучшения горизонтального вестибулоокулярного рефлекса. Для того, чтобы оценить когнитивное состояние, можно использовать WAIS-R или WISC-IV и MoCA, оценивающие различные когнитивные домены, включая внимание и концентрацию, исполнительные функции, память, речь, зрительно-конструктивные навыки, концептуальное мышление, вычисление и ориентацию максимально по 30 точкам и с пороговой оценкой 26. Специалисту будет известно, как выполнять эти и другие подобные тесты.
Ацетиллейцин или его фармацевтически приемлемую соль можно вводить, например, в дозе, колеблющейся от примерно 500 мг до примерно 15 г в день, или колеблющейся от примерно 500 мг до примерно 10 г в день, такой как колеблющаяся от примерно 1,5 г до примерно 10 г в день, необязательно, оральным путем в твердом веществе или жидкости. Ацетиллейцин или его фармацевтически приемлемую соль можно вводить, например, в дозе, соответствующей танганилу®, который прописывают взрослым в дозе 1,5 г – 2 г в сутки, 3-4 таблетки в двух дозах утром и вечером.
Если вводят один энантиомер, дозы соответственно могут быть уменьшены. Например, если вводят только один ацетил-L-лейцин, или если вводят только один ацетил-D-лейцин, доза может колебаться от примерно 250 мг до примерно 15 г в день, колебаться от примерно 250 мг до примерно 10 г в день или колебаться от примерно 250 мг до примерно 5 г в день, например, от примерно 0,75 г до примерно 5 г в день.
В одном воплощении вводимая доза колеблется от примерно 1 г до примерно 15 г в день, от примерно 1 г до примерно 10 г в день или от примерно 1,5 г до примерно 7 г в день. Она может составлять от примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 г до примерно 15 г в день. Она может составлять от примерно 2, 3, 4, 5, 6, 7, 8 или 9 г до примерно 10 г в день. Она может составлять более примерно 1,5 г в день, но меньше примерно 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 г в день. В одном воплощении доза колеблется от примерно 4 г до примерно 6 г в день. В одном воплощении доза колеблется от примерно 4 г до примерно 5 г в день. В одном воплощении доза составляет примерно 4,5 г в день. В одном воплощении доза составляет примерно 5 г в день. В одном воплощении такие дозы вводят в твердой пероральной лекарственной форме, особенно в таблетках. В другом воплощении такие дозы являются дозами, когда ацетиллейцин находится в своей рацемической форме. Дозы ацетиллейцина, когда существует энантиомерный избыток, могут быть ниже, чем дозы, указанные в настоящем описании, например, примерно на 50% ниже. Таким образом, вышеуказанные интервалы доз, когда делятся пополам, также недвусмысленно охватываются настоящим раскрытием.
Общая дневная доза может быть распределена на несколько введений, т.е., введение может происходить два или больше раз в день для достижения общей дневной дозы. Как пример, требуемое число таблеток для обеспечения полной дневной дозы ацетиллейцина можно разделить на два введения (например, утром и вечером) или три введения (например, утром, в полдень и вечером). Каждую дозу можно вводить соответственно с пищей или без нее. Например, ацетиллейцин можно принимать примерно за 1 или примерно за 2 часа до еды, например, по меньшей мере примерно за 20 минут, по меньшей мере примерно за 30 минут, по меньшей мере примерно за 40 минут или по меньшей мере примерно за 1 час до еды, или можно принимать через примерно 1, примерно 2 или примерно 3 часа после еды, например, выжидая по меньшей мере примерно 20 минут, по меньшей мере примерно 30 минут, по меньшей мере примерно 1 час, по меньшей мере примерно 1,5 часа, по меньшей мере примерно 2 часа или по меньшей мере примерно 2,5 часа после еды. Например, общую дневную дозу в 4,5 г ацетил-DL-лейцина можно принять в виде трех таблеток танганила® (или эквивалента) до, с или после завтрака, три другие таблетки до, с или после ланча и три другие таблетки до, с или после обеда.
Введение ацетиллейцина согласно настоящему раскрытию можно начинать до или после того, как найдут, что субъект имеет генетический, биохимический или другой подходящий идентифицируемый маркер нейродегенеративного заболевания, например, в первом случае, когда подозревают, что субъект имеет или находится в опасности появления нейродегенеративного заболевания. Введение можно начинать во время или примерно во время, когда обнаружат, что у субъекта имеется генетический, биохимический или другой подходящий идентифицируемый маркер нейродегенеративного заболевания. Подобным образом, введение можно начинать до или примерно в момент или после того, как у субъекта диагностируют нейродегенеративное заболевание, например, до или примерно в момент или после того, как обнаружат, что субъект имеет генетический, биохимический или другой подходящий идентифицируемый маркер нейродегенеративного заболевания. Введение ацетиллейцина можно начинать, когда субъект является симптоматическим или бессимптомным. В частности, одним из преимуществ лечения ацетиллейцином согласно настоящему раскрытию является то, что введение ацетиллейцина можно начинать рано в момент после того, как обнаружат, что субъект имеет генетический и/или биохимический маркер нейродегенеративного заболевания, но до того, как у субъекта проявятся симптомы нейродегенеративного заболевания (другие, чем генетический и/или биохимический маркер нейродегенеративного заболевания, т.е., субъект является бессимптомным), или до того, как у субъекта проявятся один или несколько симптомов, считающихся признаками заболевания. Лечение может задержать появление нейродегенеративного заболевания или одного или нескольких симптомов, ассоциированных с нейродегенеративным заболеванием, как описано в настоящем описании. Лечение также может продолжаться длительно, как описано в настоящем описании.
Как обсуждалось в настоящем описании, преимуществом лечения ацетиллейцином согласно настоящему раскрытию является то, что ацетиллейцин можно вводить в течение продолжительного периода времени для того, например, чтобы задержать или даже реверсировать развитие нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания у субъекта по сравнению с типичным развитием заболевания. Длительность лечения может составлять, например, примерно семь дней или дольше, примерно две недели или дольше, примерно три недели или дольше, примерно один месяц или дольше, примерно шесть недель или дольше, примерно семь недель или дольше или примерно два месяца или дольше. В одном воплощении длительность лечения составляет примерно три месяца или дольше, примерно четыре месяца или дольше, примерно пять месяцев или дольше или примерно шесть месяцев или дольше. Длительность лечения может составлять примерно 1 год или дольше, примерно 2 года или дольше, примерно 4 года или дольше, примерно 5 лет или дольше или примерно 10 лет или дольше. Длительность лечения может составлять всю жизнь пациента.
Любая и все комбинации лекарственной формы, количества дозы, схемы приема и длительности лечения предусмотрены и охватываются изобретением. В одном воплощении доза составляет от примерно 4 г до примерно 10 г в день, принимаемая за одно, два или три введения в день, при длительности лечения примерно два месяца или дольше. В другом воплощении доза составляет больше 4 г, но меньше 5 г в день, принимаемая за одно, два или три введения в день, при длительности лечения примерно шесть месяцев или дольше. Лекарственная форма может представлять собой твердую пероральную лекарственную форму, особенно таблетки.
Фармацевтическую композицию можно использовать как монотерапию (например, применять одно активное вещество) для лечения нейродегенеративного заболевания у субъекта. С другой стороны, фармацевтическую композицию можно использовать как вспомогательную или в комбинации с другими известными терапиями, например, для лечения нейродегенеративного заболевания у субъекта.
Нейродегенеративное заболевание может, но необязательно, ассоциироваться с лизосомной дисфункцией (например, лизосомным дефектом накопления). Нейродегенеративные заболевания, согласно настоящему раскрытию, неассоциированные с лизосомной дисфункцией, включают, но без ограничения, болезнь Александера, болезнь Альперса, церебральный паралич, синдром Коккейна, кортикобазальную дегенерацию, ВИЧ-ассоциированную деменцию, болезнь Кеннеди, нейроборрелиоз, первичный боковой склероз, болезнь Рефсума, болезнь Шилдера, подострую комбинированную дегенерацию спинного мозга, вторичную к пернициозной анемии, наследственную моторную и сенсорную невропатию с проксимальным доминированием, синдром шатающегося ежа (WHS), прогрессирующую мышечную атрофию (мышечная атрофия Дюшенна-Арана), прогрессирующий бульбарный паралич, псевдобульбарный паралич, ВИЧ-ассоциированные нейрокогнитивные нарушения (HAND), сосудистый паркинсонизм, синдром Паркинсона нижней части тела, мозжечковый «бьющий» вниз нистагм и мозжечковую атаксию, которая включает спиноцеребеллярную атаксию (SCA) 4, спиноцеребеллярную атаксию (SCA) 5 (атаксия Линкольна), спиноцеребеллярную атаксию (SCA) 8, спиноцеребеллярную атаксию (SCA) 10, спиноцеребеллярную атаксию (SCA) 11, спиноцеребеллярную атаксию (SCA) 12, спиноцеребеллярную атаксию (SCA) 13, спиноцеребеллярную атаксию (SCA) 14, спиноцеребеллярную атаксию (SCA) 15/16, спиноцеребеллярную атаксию (SCA) 18 (сенсорная/моторная невропатия с атаксией), спиноцеребеллярную атаксию (SCA) 19/22, спиноцеребеллярную атаксию (SCA) 20, спиноцеребеллярную атаксию (SCA) 21, спиноцеребеллярную атаксию (SCA) 23, спиноцеребеллярную атаксию (SCA) 25, спиноцеребеллярную атаксию (SCA) 26, спиноцеребеллярную атаксию (SCA) 27, спиноцеребеллярную атаксию (SCA) 29, спиноцеребеллярную атаксию (SCA) 30, спиноцеребеллярную атаксию (SCA) 31, спиноцеребеллярную атаксию (SCA) 32, спиноцеребеллярную атаксию (SCA) 35, спиноцеребеллярную атаксию (SCA) 36, эпизодическую атаксию (EA) 1, эпизодическую атаксию (EA) 2, эпизодическую атаксию (EA) 3, эпизодическую атаксию (EA) 4, эпизодическую атаксию (EA) 5, эпизодическую атаксию (EA) 6, эпизодическую атаксию (EA) 7, спиноцеребеллярную атаксию (SCA) 28, спиноцеребеллярную атаксию (SCA) 24 (спиноцеребеллярную аутосомно-рецессивную атаксию типа 4 (SCAR4); спиноцеребеллярную атаксию с саккадическими интрузиями), сухотку спинного мозга, атаксию с окуломоторной апраксией типа 1 (AOA1), атаксию с окуломоторной апраксией типа 2 (AOA2), атаксию с окуломоторной апраксией типа 4 (AOA4), спиноцеребеллярную аутосомно-рецессивную атаксию типа 10 (SCAR 10), синдром митохондриальной рецессивной атаксии (MIRAS), миоклоническую эпилепсию, миопатиию и сенсорную атаксию (MEMSA), сенсорную атактическую невропатию, дизартрию, офтальмопарез (SANDO), начавшуюся в детстве спиноцеребеллярную атаксию, наследственную спастическую параплегию 7 (ген HSP SPG7), митохондриальную миопатияю, энцефалопатию, лактацидоз, синдром инсульта (MELAS), миоклоническую эпилепсию с рваными красными волокнами (MERRF), нейрогенную мышечную слабость, атаксию и пигментный ретинит (NARP), синдром Керса-Сейра(KSS), тремор/атаксию, ассоциированные с ломкой Х хромосомой (FXTAS), синдром Арта, Х-сцепленную спиноцеребеллярную атаксию 1, Х-сцепленную спиноцеребеллярную атаксию 2, Х-сцепленную спиноцеребеллярную атаксию 3, X-сцепленную спиноцеребеллярную атаксию 4 или Х-сцепленную спиноцеребеллярную атаксию 5, Х-сцепленную синдромальную умственную отсталость, тип Христиансена, Х-сцепленную сидеробластную анемию, идиопатическую мозжечковую атаксию с поздним началом, спорадическую атаксию взрослых неизвестной этиологии (SAOA) и мозжечковую атаксию, невропатию, синдром вестибулярной арефлексии (CANVAS). В одном воплощении нейродегенеративным заболеванием, неассоциированным с лизосомной дисфункцией, является кортикобазальная дегенерация, SCA 28 и АОА4.
Как упоминалось выше, многие нейродегенеративные заболевания ассоциируются с лизосомной дисфункцией, которые включают как нейродегенеративные лизосомные болезни хранения (ЛБН), так и многие другие нейродегенеративные заболевания, где предполагаются связи с с лизосомными дефектами. См., например, Boman et al., Journal of Parkinson’s Disease, vol. 6, no. 2, pp. 307-315 (May 2016); Makioka et al., Neurorepor.t, 23(5): 270-276 (March 2012); Orr et al., Alzheimer’s Research & Therapy, 5:53 (Oct. 2013); Barlow et al., Proc. Nat’l. Acad. Sci. USA, 18;97(2): 871-6 (2000).
В одном воплощении нейродегенеративное заболевание ассоциируется с лизосомной дисфункцией (например, лизосомным дефектом накопления). Нейродегенеративные заболевания согласно настоящему раскрытию, ассоциированные с лизосомной дисфункцией, включают, но без ограничения, алкоголизм, болезнь Альцгеймера, боковой амиотрофический склероз (ALS), болезнь Канавана, лобно-височную лобарную дегенерацию, болезнь Гентингтона, деменцию с тельцами Леви, мультисистемную атрофию (MSA-P/MSA-C), рассеянный склероз, нарколепсию, болезнь Паркинсона, синдром Смита-Лемли-Опица (SLOS) (врожденная ошибка синтеза холестерина), болезнь Танжера, болезнь Пелицеуса-Мерцбахера, болезнь Пика, лобно-височную деменцию и паркинсонизм, сцепленные с хромосомой 17, прионные болезни, включая скрепи, трансмиссивную энцефалопатию норок, хроническую изнуряющую болезнь, бычью спонгиоформную энцефалопатию (BSE), спонгиоформную энцефалопатию кошачьих, энцефалопатию экзотических копытных, болезнь Крейтцфельда-Якоба, синдром Герстмана-Штраусслера-Шейнкера и фатальную семейную бессонницу, прогрессирующий надъядерный паралич, спинальную мышечную атрофию, нейродегенеративные ЛБН и мозжечковую атаксию, которая включает спиноцеребеллярную атаксию (SCA) 1, спиноцеребеллярную атаксию (SCA) 2, спиноцеребеллярную атаксию (SCA) 3 (болезнь Мачадо-Джозефа), спиноцеребеллярную атаксию (SCA) 6, спиноцеребеллярную атаксию (SCA) 7, спиноцеребеллярную атаксию (SCA) 17, дентатурбо-паллидолюисову атрофию, аутосомно-рецессивную спастическую атаксию Шарлевуа-Сагенэ (ARSACS), аутосомно-рецессивную мозжечковую атаксию типа 1 (рецессивная атаксия Бёса (RAB), мутация SYNE-1). аутосомно-рецессивную мозжечковую атаксию типа 2 (спиноцеребеллярная атаксия аутосомно-рецессивная 9, SCAR 9), атаксию с недостаточностью витамина Е (AVED), атаксию-телеангиэктазию (болезнь Луи-Бар), атаксию Фрейдреха (FRDA) и атаксию с недостаточностью кофермента Q10. В одном воплощении нейродегенеративное заболевание, ассоциированное с лизосомной дисфункцией, выбирают из алкоголизма, болезни Альцгеймера, амиотрофического бокового склероза (ALS), болезни Канавана, лобно-височной лобарной дегенерации, болезни Гентингтона, мультисистемной атрофии (MSA-P/MSA-C), рассеянного склероза, нарколепсии, болезни Паркинсона, синдрома Смита-Лемли-Опица (SLOS) (врожденная ошибка синтеза холестерина), болезни Танжера, болезни Пелицеуса-Мерцбахера, болезни Пика, лобно-височной деменции, лобно-височной деменции с паркинсонизмом, прионных болезнией, прогрессирующего надъядерного паралича и спинальной мышечной атрофии. В одном воплощении нейродегенеративное заболевание, ассоциированное с лизосомной дисфункцией, выбирают из ALS, MSA-P, MSA-C, лобно-височной деменции с паркинсонизмом, прогрессирующего надъядерного паралича, SCA 28, SCA 1 и болезни Альцгеймера.
Нейродегенеративные ЛБН характеризуются накоплением непереваренных или частично переваренных макромолекул, что приводит к клеточной дисфункции, которая обычно является прогрессирующей, приводя к инвалидности и/или умственной деградации. Они имеют тенденцию появляться в первые несколько лет жизни, и тяжелое развитие приводит к частой госпитализации. Если пациенты остаются без лечения, они часто умирает в подростковом возрасте. Также описаны пациенты с началом во взрослом состоянии. Нейродегенеративные ЛБН согласно настоящему раскрытию включают, но без ограничения, нейрональный цероидный липофусциноз (типы 1-10), болезнь Гоше, тип 2/3 (невропатический), болезнь Краббе, множественную сульфатазную недостаточность, муколипидозы, включая муколипидоз I, муколипидоз II муколипидоз IV, болезнь Ниманна-Пика типа А, болезнь Ниманна-Пика типа В, болезнь Ниманна-Пика типа С, инфантильную болезнь Помпе, болезнь Помпе с поздним началом, болезнь Тея-Сакса, болезнь Сандхоффа, болезнь Фарбера, галактосиалидоз, болезнь Фабри, болезнь Шиндлера, ганглиозидоз GM1, вариант АВ ганглиозидоза GM2, метахроматическую лейкодистрофию (MLD), мукополисахаридозы, включая MPS IH, MPS IS, MPS IH-S, MPS II, MPS IIIA, MPS IIIB, MPS IIIC, MPS IIID и MPS VII, бета-маннозидоз, аспартилглюкозаминурию, фукозидоз, болезнь Салла, инфантильную болезнь накопления свободной сиаловой кислоты (ISSD) и болезнь Данона. В одном воплощении нейродегенеративную ЛБН выбирают из NPC, NPA, муколипидоза II, MPS IIIB, аспартилглюкозаминурии, муколипидоза IIIA, MPS VII, болезни Сандхоффа, болезни Тея-Сакса, варианта АВ болезни Тея-Сакса и ганглиозидоза GM1. В одном воплощении нейродегенеративное заболевание выбирают не из нейродегенеративной ЛБН.
В одном воплощении нейродегенеративное заболевание представляет собой болезнь двигательного нейрона. В одном воплощении болезнь двигательного нейрона выбирают из первичного бокового склероза, прогрессирующей мышечной атрофии, прогрессирующего бульбарного паралича, псевдобульбарного паралича, ALS, болезни Альцгеймера, болезни Канавана, лобно-височной лобарной дегенерации, болезни Гентингтона, рассеянного склероза, нарколепсии, болезни Паркинсона, болезни Пелицеуса-Мерцбахера и спинальной мышечной атрофии.
В одном воплощении нейродегенеративное заболевание представляет собой мозжечковую атаксию. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Ниманна-Пика. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Ниманна-Пика типа С. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Ниманна-Пика типа А. В одном воплощении нейродегенеративное заболевание представляет собой паркинсонизм. В одном воплощении нейродегенеративное заболевание представляет собой невропатическую болезнь Гоше. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Тея-Сакса. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Сандхоффа. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Фабри. В одном воплощении нейродегенеративное заболевание представляет собой ганглиозидоз GM1. В одном воплощении нейродегенеративное заболевание представляет собой синдром Луи-Бар. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Альцгеймера. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Паркинсона. В одном воплощении нейродегенеративное заболевание представляет собой мультисистемную атрофию. В одном воплощении нейродегенеративное заболевание представляет собой мультисистемную атрофию типа С (MSA-C). В одном воплощении нейродегенеративное заболевание представляет собой мультисистемную атрофию типа Р (MSA-Р). В одном воплощении нейродегенеративное заболевание представляет собой лобно-височную деменцию. В одном воплощении нейродегенеративное заболевание представляет собой лобно-височную деменцию с паркинсонизмом. В одном воплощении нейродегенеративное заболевание представляет собой болезнь Паркинсона нижней части тела. В одном воплощении нейродегенеративное заболевание представляет собой амиотрофический боковой склероз (ALS). В одном воплощении нейродегенеративное заболевание представляет собой синдром кортикобазальной дегенерации. В одном воплощении нейродегенеративное заболевание представляет собой прогрессирующий надъядерный паралич. В одном воплощении нейродегенеративное заболевание представляет собой мозжечковый «бьющий» вниз нистагм. В одном воплощении нейродегенеративное заболевание представляет собой SCA 28. В одном воплощении нейродегенеративное заболевание представляет собой атаксию-телиангиэктазию. В одном воплощении нейродегенеративное заболевание представляет собой SCA 1. В одном воплощении нейродегенеративное заболевание представляет собой АОА 4.
Основные симптомы болезни Паркинсона (PD) включают ригидность, тремор и замедленное движение. Существуют другие заболевания, при которых преобладают такие симптомы. Такие заболевания и сама PD подпадают под наиболее широкий термин «паркинсонизм». PD можно назвать первичным паркинсонизмом. Другие примеры паркинсонизма включают мультисистемную атрофию, прогрессирующий надъядерный паралич, гидроцефалию нормального давления и сосудистый или артериосклеротический паркинсонизм. Такие заболевания, которые можно классифицировать как паркинсонизм, но являющиеся PD, также можно отнести к «синдромам паркинсонизм-плюс». В отличие от пациентов с PD, индивидуумы с синдромами паркинсонизма-плюс не реагируют на L-допу. Термин «паркинсонизм», используемый в настоящем описании, можно отнести к синдрому двигательных нарушений, основными симптомами которых являются тремор покоя, ригидность, замедление движений и постуральная неустойчивость. Паркинсоновские синдромы можно разделить на четыре подтипа согласно их происхождению: первичные или идиопатические, вторичные или приобретенные, наследственный паркинсонизм и синдромы паркинсонизма-плюс или мультсистемная дегенерация.
В одном воплощении паркинсонизм представляет собой синдром паркинсонизма-плюс или мультисистемную дегенерацию.
В одном воплощении паркинсонизм представляет собой сосудистый (артериосклеротический) паркинсонизм, паркинсонизм нижней части тела, мультисистемную атрофию с доминирующим паркинсонизмом (MSA-P), мультисистемную атрофию с признаками мозжечковой атрофии (MSA-С; спорадическая оливопонтоцеребеллярная атрофия (ОРСА)), синдром Шая-Дрейджера, прогрессирующий надъядерный паралич (синдром Стила-Ричардсона-Ольшевского), деменцию с тельцами Леви, болезнь Пика или лобно-височную деменцию и паркинсонизм, сцепленные с хромосомой 17.
Болезни Ниманна-Пика представляют собой разнородную группу аутосомно-рецессивных ЛБН. Общие клеточные признаки включают анормальное накопление сфингомиелина (SM) в мононуклеарных фагоцитах и паренхимной ткани, а также (гепато)спленомегалию. Среди этих трех основных подгрупп болезни Ниманна-Пика (A-C) NPC (ранее классифицированная как NPC и NPD, а теперь признана как являющаяся одной болезнью) классифицируется как фатальная нейровисцеральная ЛБН, вызванная анормальным внутриклеточным переносом холестерина – вызванная накоплением неэтерифицированного холестерина в полостях поздних эндосом/лизосом. Вне ЦНС клеточные характеристики NPC включают анормальное накопление неэтерифицированного холестерина и других липидов (например, GSL) в ячейках поздних эндосом/лизосом. Напротив, не имеется чистого повышения холестерина в ЦНС (хотя имеется измененное распределение), но имеются сильно повышенные уровни GSL. Прогрессирующая нейродегенерация определенно характеризуется последующей дегенерацией нейронов GABAergic Пуркинье, которая проходит параллельно с началом и развитием мозжечковой атаксии, и другими аспектами неврологических дисфункций, видных в ходе NPC. Генетические исследования показали, что болезнь NPC вызвана мутациями в генах Npc1 или Npc2. Точная механистическая связь между этими двумя генами остается неизвестной, и функциональные роли этих белков остаются загадкой. NPC1 кодирует мультиохватывающий мембранный белок ограничивающей мембраны поздней эндосомы/лизосомы, в то время как NPC2 представляет собой растворимый связывающий холестерин белок лизосомы. Когда NPC1 инактивирован, сфингозин является первым липидом для накопления, предполагая, что NPC1 играет роль в транспорте сфингозина из лизосомы, где он обычно генерируется как часть сфинголипидного катаболизма. Повышенный сфингозин в свою очередь вызывает дефект в поступлении кальция в кислотные резервы, что приводит к существенно заниженному высвобождению кальция из его ячейки. Далее это предотвращает слияние поздней эндосомы-лизосомы, которое является кальцийзависимым процессом, и вызывает вторичное накопление липидов (холестерина, сфингомиелина и гликосфинголипидов), которые являются перевозчиками в транзите через поздний путь эндоцитоза. Другие вторичные последствия ингибирования функции NPC1 включают несовершенный эндоцитоз и недостаточность четких аутофагических вауколей. Показано, что клеточный путь NPC1/NPC2 таргетируется патогенными микобактериями, промотируя их выживание в поздних эндосомах.
Мышиная модель NPC разделяет ряд патологических признаков с, например, болезнью Альцгеймера (AD). Ранее сообщалось, что на мыши с NPC оценены уровни конъюгата белок 1A, ассоциированный с микротрубочками/3-фосфатидилэтаноламин 1B-легкой цепи (LC3-II). LC3-II является маркером образования аутофагосом, и повышенные уровни LC3-II могут отображать ухудшенную четкость аутофагических вауколей. Аутофагосомы образуются, но не являются четкими. Аутофагия ослабляется при AD, и головной мозг при AD показывает повышенные уровни LC3-II. Кроме того, предшественник амилоидного белка (APP) является молекулой предшественником, при протеолизе которой генерируется бета-амилоид (Aβ). Бляшки Aβ являются признаком головного мозга с AD и, как предполагается, являются причинным фактором в патологии заболевания. С-Концевые фрагменты предшественника амилоидного белка (APP-CTF), которые являются промежуточными в протеолизе APP до Aβ, накапливаются в головном мозгу при AD и также прогрессивно накапливаются в головном мозгу мышей NPC1.
Болезнь Тея-Сакса является фатальным наследственным нарушением липидного метаболизма, характеризующимся особенно в ткани ЦНС из-за недостаточности А изозима β-гексозаминидазы. Мутации в гене HEXA, который кодирует α-субъединицу β-гексозаминидазы, вызывает недостаточность изозима A. Болезнь Тея-Сакса является прототипом группы расстройств ганглиозидозов GM2, характеризующихся неполным разрушением ганглиозида GM2. Ганглиозид GM2 (моносиалилированный ганглиозид 2) накапливается в нейронах, начиная уже с жизни плода.
Болезнь Сандхоффа является результатом недостаточности как А, так и В изозимов β-гексозаминидазы. Мутации в гене НЕХЕВ, который кодирует β-субъединицу β-гексозаминидазы, вызывают недостаточность изозима В.
Ганглиозидоз GM1 вызывается недостаточностью β-галактозидазы, которая приводит к лизосомному накоплению ганглиозида GM1 (моносиалилированного ганглиозида 1).
Болезнь Фабри вызывается недостаточностью α-галактозидазы, которая приводит к лизосомному накоплению церамидтригексозида.
В одном воплощении нейродегенеративное заболевание не является мозжечковой атаксией. В одном воплощении нейродегенеративное заболевание не является болезнью Ниманна-Пика. В одном воплощении нейродегенеративное заболевание не является болезнью Ниманна-Пика типа С. В одном воплощении нейродегенеративное заболевание не является мозжечковой атаксией или болезнью Ниманна-Пика (например, болезнью Ниманна-Пика типа С).
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат потерю массы, ухудшение походки и/или истощение функций, связанных с болезнью Ниманна-Пика (например, болезнью Ниманна-Пика типа С или А) или муколипидозом типа II. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие потери массы, ухудшения походки и/или истощение функций, связанных с болезнью Ниманна-Пика (например, болезнью Ниманна-Пика типа С или А) или муколипидозом типа II. В одном воплощении потеря массы, ухудшение походки и/или истощение функций связаны с болезнью Ниманна-Пика типа А или муколипидозом типа II.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат ухудшение походки, ухудшение двигательной функции и/или уменьшенную подвижность, связанные с болезнью Сандхоффа. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие ухудшения походки, ухудшения двигательной функции и/или уменьшенной подвижности, связанных с болезнью Сандхоффа.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат пониженную координацию, треморы, уменьшенную подвижность, когнитивное ухудшение и/или ухудшение походки, связанные с болезнью Тея-Сакса. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие пониженной координации, треморов, сниженной подвижности, когнитивного ухудшения и/или ухудшения походки, связанных с болезнью Тея-Сакса.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат ухудшение речи (например, плавности речи и/или модуляцию голоса), ухудшение походки, уменьшенную подвижность, пониженные глотательные функции и/или парезы, связанные с амиотрофическим боковым склерозом (ALS). Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие ухудшения речи (например, плавности речи и/или модуляции голоса), ухудшения походки, уменьшенной подвижности, пониженных глотательных функций и/или парезов, связанных с ALS. В другом воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат пониженное качество сна, связанное с ALS. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие пониженного качества сна, связанного с ALS.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат ухудшение речи, ухудшение походки и/или повышенную склонность к падению, связанные с мультисистемной атрофией мозжечкового типа (MSA-С). Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие ухудшения речи, ухудшения походки и/или склонности к падению, связанных с MSA-С.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат ухудшение походки, повышенную склонность к падению и/или ухудшение речи, связанные с лобно-височной деменцией с паркинсонизмом. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие ухудшения походки, повышенной склонности к падению и/или ухудшения речи, связанных с лобно-височной деменцией с паркинсонизмом.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат повышенную склонность к падению и/или ухудшение походки, связанные с синдромом кортикобазальной дегенерации. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие повышенной склонности к падению и/или ухудшения походки, связанных с синдромом кортикобазальной дегенерации.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат ухудшение походки, связанное с прогрессирующим надъядерным параличом. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие ухудшения походки, связанного с прогрессирующим надъядерным параличом.
В одном воплощении ацетиллейцином или его фармацевтически приемлемой солью лечат осциллопсию, ухудшение пространственной ориентации, ухудшение остроты зрения и/или усиление постурального тремора «взмаха крыльев», связанные с мозжечковым «бьющим» вниз нистагмом. Например, ацетиллейцин или его фармацевтически приемлемая соль могут задержать появление, снизить тяжесть или устранить или задержать или реверсировать развитие осциллопсии, ухудшения пространственной ориентации, ухудшения остроты зрения и/или усиления постурального тремора «взмаха крыльев», связанных с мозжечковым «бьющим» вниз нистагмом.
Настоящее раскрытие также относится к способу лечения нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания у субъекта, нуждающегося в этом, причем способ включает введение субъекту терапевтически эффективного количества ацетиллейцина или его фармацевтически приемлемой соли.
«Терапевтически эффективное количество» средства представляет собой любое количество, которое, когда введено субъекту, является количеством средства, которое необходимо для получения нужного действия, которое, в случае настоящего раскрытия, может быть терапевтическим и/или профилактическим. Дозу можно определить согласно различным параметрам, таким как специфическая форма используемого ацетиллейцина; возраст, масса и состояние пациента, которого лечат; тип заболевания; путь введения и требуемая схема введения. Врач сможет определить требуемый путь введения и дозировку для любого определенного пациента. Например, дневная доза может составлять от примерно 10 до примерно 225 мг на кг, от примерно 10 до примерно 150 мг/кг или от примерно 10 до примерно 100 мг на кг массы тела.
Раскрытие также относится к набору для лечения нейродегенеративного заболевания у субъекта, включающему средства для диагностики или прогнозирования заболевания и ацетиллейцин или его фармацевтически приемлемую соль.
Средства для диагностики или прогнозирования нейродегенеративного заболевания могут включать специфический связывающий агент, зонд, праймер, пару или комбинацию праймеров, фермент или антитело, включая фрагмент антитела, которые способны обнаруживать или способствовать обнаружению нейродегенеративного заболевания, определенного в настоящем описании. Набор может включать LysoTracker®, который является флуоресцентным маркером и доступен коммерчески как от Invitrogen, так также и от Lonza. LysoTracker® может быть синим, бело-голубым, желтым, зеленым или красным.
Набор также включает ацетиллейцин или его фармацевтически приемлемую соль, определенные в настоящем описании. Набор также может включать буферы или водные растворы. Набор также может включать инструкции по применению ацетиллейцина или его фармацевтически приемлемой соли в способе по изобретению.
В другом воплощении раскрывается ацетиллейцин или его фармацевтически приемлемая соль для применения в способе обеспечения нейрозащиты у субъекта, имеющего, с подозрением на наличие или в опасности появления нейродегенеративного заболевания.
«Нейрозащита» и похожие термины, используемые в настоящем описании, относятся к предупреждению, замедлению и/или реверсии развития нейродегенерации, включая, но без ограничения, прогрессирующую потерю структуры нейронов и/или прогрессирующую гибель нейронов. Обеспечение нейрозащиты может привести к задержке появления нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как можно ожидать, проявятся согласно типичному развитию заболевания, снижению тяжести нейродегенеративного заболевания или снижению тяжести одного или нескольких существующих симптомов, связанных с нейродегенеративным заболеванием, задержке развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем по сравнению с типичным развитием заболевания, и/или реверсии развития нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания со временем. Время, в течение которого обеспечивается нейрозащита, может совпадать с длительностью лечения. Лечение может обеспечить нейрозащиту в течение периода времени, например, примерно семи дней или дольше, примерно двух недель или дольше, примерно трех недель или дольше, примерно одного месяца или дольше, примерно шести недель или дольше, примерно семи недель или дольше или примерно двух месяцев или дольше. Также, например, лечение обеспечивает нейрозащиту на протяжении, например, примерно трех месяцев или дольше, примерно четырех месяцев или дольше, примерно пяти месяцев или дольше или примерно шести месяцев или дольше. Оно может обеспечивать нейрозащиту на протяжении, например, примерно 1 года или дольше, примерно 2 лет или дольше, примерно 3 лет или дольше, примерно 4 лет или дольше, примерно 5 лет или дольше или примерно 10 лет или дольше. Лечение может обеспечивать нейрозащиту на протяжении всей жизни пациента.
В одном воплощении способ обеспечения нейрозащиты у субъекта, нуждающегося в этом (например, имеющего, с подозрением на наличие или опасностью появления нейродегенеративного заболевания), включает введение субъекту терапевтически эффективного количества ацетиллейцина или его фармацевтически приемлемой соли.
Раскрытие также относится к набору для обеспечения нейрозащиты у субъекта, нуждающегося в этом (например, имеющего, с подозрением на наличие или опасностью появления нейродегенеративного заболевания), включающему средства для диагностики или прогнозирования заболевания/расстройства и ацетиллейцин или его фармацевтически приемлемую соль.
Настоящее раскрытие также относится к применению ацетиллейцина или его фармацевтически приемлемой соли в качестве нейрозащитного агента для субъекта, нуждающегося в этом (например, имеющего, с подозрением на наличие или опасностью появления нейродегенеративного заболевания).
Все особенности, описанные в настоящем описании (включая любые сопутствующие пункты формулы изобретения, реферат и чертежи), и/или все стадии любого способа, раскрытые таким образом, можно объединять с любым из описанных выше аспектов в любой комбинации, за исключением комбинаций, в которых по меньшей мере некоторые из таких особенностей и/или стадий являются взаимоисключающими.
Примеры
Изобретение теперь будет поясняться подробнее в следующих далее примерах, которые демонстрируют полезность ацетиллейцина при лечении нейродегенеративного заболевания у субъекта и обеспечении нейрозащиты у указанного субъекта.
Пример 1
Исследование на мышах in vivo – методы
Мышиная модель
В этом исследовании используют аутентичную мышиную модель NPC, мышь Npc1−/− (BALB/cNctr-Npc1m1N/J), которая недействительна для белка NPC1 и отображает все клинические признаки заболевания (Loftus, 1997).
Этот мутантный штамм появился спонтанно и имеет время жизни в интервале 10-14 недель, и поэтому имеет ход заболевания более острый, как у огромного числа пациентов. Мутантную мышь успешно используют не только для определения онтогенеза заболевания и лежащих в основе патогенных механизмов, но также для оценки экспериментальных терапий. Анализы с использованием таких мышей приняты для всех животных на клеточных и молекулярных уровнях (Baudry, 2003; Smith, 2009; Cologna, 2014; Cologna, 2012). Наиболее интенсивно исследуют животную модель NPC.
До возраста примерно 4–5 недель Npc1−/− мыши не имеют заметных поведенческих указаний о заболевании, что отличает их от таких же детенышей дикого типа. Первые указания о поведенческих нарушениях, таких как тремор и атаксическая походка, появляются в 5-6 недель; в 7-8 недель нарушения в двигательной координации становятся более явными, и в 9-11 недель атаксия прогрессирует и сопровождается возросшей потерей массы и плохим состоянием шерстного покрова, когда еда и питье становятся затруднительными (применяют гуманную конечную точку) (Smith, 2009).
Детенышей дикого типа Npc1+/+ используют в качестве контроля.
Протокол обработки
Группу мышей Npc1−/− и группу мышей Npc1+/+, отлученных от матери (возраст три недели), обрабатывают 0,1 г/кг ацетил-DL-лейцина, подмешивая в мышиный корм, Отдельные группы мышей Npc1−/− и Npc1+/+ оставляют необработанными в качестве контрольных.
Состояние шерстного покрова
Состояние шерстного покрова мышей Npc1−/−, обработанных и необработанных ацетил-DL-лейцином, сравнивают путем простого наблюдения мышей в возрасте девяти недель.
Данные о массе
Животных взвешивают дважды в неделю. Массы усредняют (вычисляют среднее) по всем мышам в каждой группе и сравнивают.
Анализ походки
Анализ походки выполняют на мышах в возрасте восьми недель, используя систему CatWalk® 15,0 согласно инструкциям изготовителя (Noldus, Nottingham, UK). Регистрируют пять проходов на животное.
Измеряемыми параметрами CatWalk® являются:
1) средняя стойка (Stand Mean): средняя длительность (с) контакта лап со стеклянной площадкой;
2) шаговый цикл (Step Cycle): длительность (с) между двумя последовательными контактами одной и той же лапы;
3) рабочий цикл (Duty Cycle): процент времени контакта лап с площадкой по сравнению с полным шаговым циклом;
4) последовательность шагов (Step Sequence) (AB): процент времени, затраченного на прогулку по схеме LF-RH-RF-LH (LF: левая передняя; RH: правая задняя; RF: правая передняя; LH левая задняя);
5) ритм (Cadence): шаг на секунды в испытании;
6) поддержка диагонали (Diagonal Support): процент времени одновременного контакта диагональных лап со стеклянной площадкой (RF и LH или RH и LF).
Анализ двигательной функции
Анализ двигательной функции выполняют на мышах в возрасте восьми и девяти недель с использованием монитора Open Field Activity Monitor согласно инструкциям изготовителя (Linton Instruments, программа Amlogger). Каждую мышь помещают в пластиковую клетку с подстилкой, и проводят анализ в течение пяти минут. Вставания подсчитывают вручную.
Измеряемыми параметрами двигательной функции являются:
1) сосредоточенное вставание (Centre Rearing): мыши встают на задние лапы без поддержки;
2) вставание (Rearing): мыши встают на задние лапы, опираясь и не опираясь на стенки клетки;
3) активность: постоянное перемещение животного, включающее ходьбу;
4) число вперед-назад (Front to Back) (FR) count): перемещение животного от передней стенки клетки к задней;
5) активное время: длительность (с/мин) активности независимо от перемещения;
6) мобильное время: длительность (с/мин) подвижности;
7) время вставания (Rearing Time): длительность любого вставания.
Результаты
Состояние шерстного покрова
Фигура 1 В показывает необработанного детеныша Npc1−/− соответствующего возраста. Мышей Npc1−/− наблюдают как имеющих плохое состояние шерстного покрова в возрасте девяти недель, когда еда и питье становятся затруднительными (см. фигуру 1B).
С отчетливым контрастом фигура 1A показывает мышь Npc1−/−, обработанную ацетил-DL-лейцином из числа отнятых от матерей. Мыши Npc1−/−, обработанные-DL-лейцином, имеют гладкий и блестящий шерстный покров, напоминающий покров детенышей дикого типа (Npc1+/+) (см. фигуру 1A).
Данные по массе
Как можно видеть из фигуры 2А, мыши дикого типа (Npc1+/+) постоянно прибавляют в весе на протяжении исследования, т.е., от трехнедельного до 10-недельного возраста. Далее, фигура 2A показывает среднюю массу в группе мышей в каждый момент времени (Npc1−/− – необработанные, n = 1; Npc1−/− – ацетил-DL-лейцин 0,1 г/кг, n = 3; Npc1+/+ – необработанные, n = 3; Npc1+/+ – ацетил-DL-лейцин 0,1 г/кг, n = 2).
Обработка ацетил-DL-лейцином оказывает незначительное действие на этот прирост массы.
Мыши Npc1−/− сначала прибавляют в весе в значительной степени так же, как контрольные мыши Npc1+/+. Однако затем мыши Npc1−/− начинают терять в весе с шестинедельного возраста. В конце исследования (возраст 10 недель) мыши весят почти так же мало, как в возрасте четырех недель.
Обработка ацетил-DL-лейцином задерживает эти симптомы потери массы на две недели по сравнению с необработанной группой.
Сравнение изменений массы у мышей Npc1−/− с и без обработки ацетил-DL-лейцином показано на фигуре 2В. В частности, фигура 2В показывает изменение массы (%) на группу мышей в каждый момент времени только для мышей Npc1−/−. Благоприятное действие обработки ацетил-DL-лейцином – задержка потери массы явно следует из этой фигуры.
Анализ походки
Результаты анализа походки показаны на фигуре 3. Данные по поддержке диагонали, ритму и последовательности шагов показаны на фигурах 3A-3C, соответственно. Фигуры 3D и 3E показывают данные для передних лап (FP) (средняя стойка и шаговый цикл на фигуре 3D; рабочий цикл на фигуре 3E). Фигуры 3F и 3G показывают данные для задних лап (HP) (средняя стойка и шаговый цикл на фигуре 3F; рабочий цикл на фигуре 3G). Данные приводятся как среднее ± SEM; n=3 для необработанных Npc1+/+, n=2 для обработанных Npc1+/+, n=1 для необработанных Npc1−/− (поэтому статистический анализ не выполнялся), n=3 для обработанных Npc1−/−.
Первый столбик на каждой диаграмме показывает свойства походки мышей дикого типа (Npc1+/+).
Второй столбик на каждой диаграмме показывает свойства походки мышей дикого типа (Npc1+/+), обработанных ацетил-DL-лейцином. Не имеется существенного различия в свойствах походки между этими мышами и такими же необработанными детенышами.
Третий столбик на каждой диаграмме показывает свойства походки мыши Npc1−/−. В целом эта мышь показывает плохую походку по сравнению с мышами Npc1+/+. Мышь тратит крайне мало времени, если тратит, на поддержку диагонали (фигура 3A) или последовательность шагов (фигура 3C), и функции ее задних лап в средней стойке (фигура 3F) и рабочем цикле (фигура 3G) также радикально затруднены.
Четвертый столбик на каждой диаграмме показывает свойства походки мышей Npc1−/−, обработанных ацетил-DL-лейцином. Эти мыши демонстрируют существенно улучшенную походку по сравнению с такими же необработанными детенышами. Фактически они показывают свойства походки, схожие с мышами Npc1+/+.
Анализ двигательной функции
Анализ на восьминедельных мышах не показал различия в свойствах двигательной функции между мышами Npc1−/− и дикого типа (Npc1+/+) (данные не приводятся).
Однако в девятинедельном возрасте появились нарушения в двигательной координации.
Результаты анализа двигательной функции в девять недель показаны на фигуре 4. Сосредоточенное вставание, вставание и число взад-вперед (FR) показаны на фигурах 4A-4D, соответственно. Активное время, мобильное время, время вставания, общее число вставаний при подсчете вручную показаны на фигурах 4E-4H, соответственно. Данные представлены как среднее ± SEM; n=3 для необработанных Npc1+/+, n=2 для обработанных Npc1+/+, n=1 для необработанных Npc1−/− (поэтому статистический анализ не выполняли), n=3 для обработанных Npc1−/−.
Первый столбик на каждой диаграмме показывает свойства двигательной функции мышей дикого типа (Npc1+/+).
Второй столбик на каждой диаграмме показывает свойства двигательной функции мышей дикого типа (Npc1+/+), обработанных ацетил-DL-лейцином. Не имеется существенного различия в свойствах двигательной функции между этими мышами и такими же необработанными детенышами.
Третий столбик на каждой диаграмме показывает свойства двигательной функции мыши Npc1−/−. В целом эта мышь показывает плохую двигательную функцию по сравнению с мышами Npc1+/+. Мышь тратит крайне мало времени, если тратит, на вставание (панель Н) особенно на свои задние лапы без опоры (панель А).
Четвертый столбик на каждой диаграмме показывает свойства двигательной функции мышей Npc1−/−, обработанных ацетил-DL-лейцином. Эти мыши демонстрируют существенно улучшенную двигательную функцию по сравнению с такими же необработанными детенышами. Фактически они показывают свойства двигательной функции, схожие с мышами Npc1+/+.
Продолжительность жизни
Также наблюдают, что обработка мышей Npc1-/- ацетил-DL-лейцином (0,1 г/кг от возраста 3 недели) связана со статистически значимым увеличением продолжительности жизни (фигура 5). Эти данные также показывают влияние ацетиллейцина на задержку начала заболевания.
Выводы
Когда мыши Npc1−/− имеют различимый признак заболевания, который отличает их от таких же мышей дикого типа в возрасте 5-6 недель, детеныши Npc1−/−, обработанные ацетил-DL-лейцином, из отнятых от матерей, не отображают таких симптомов дольше двух недель или долее. Обработка мышей Npc1−/− ацетил-DL-лейцином задерживает появление и развитие симптомов NPC и показывает свидетельство нейрозащиты.
Разумно ожидать, что так как ацетил-DL-лейцин обеспечивает общую нейрозащиту, результаты, наблюдаемые при NPC, также будут наблюдаться при других нейродегенеративных расстройствах и нейродегенеративных расстройствах, которые связаны с дефектами лизосомного накопления.
Пример 2
Методы
Клеточную линию фибробластов пациента с NPC обрабатывают в течение 3 дней N-ацетил-DL-лейцином (1 мM), и определяют количественно относительный объем лизосом с помощью LysoTracker – флуоресцентного красителя, который накапливается в органеллах с кислым содержимым. Более интенсивная флуоресценция LysoTracker является показателем возрастания размера и/или числа лизосом и является признаком клеток NPC.
Кроме того, фибробласты, полученные от пациентов с болезнью Ниманна-Пика А (NPA), муколипидозом типа II (MLII), мукополисахаридозом типа IIIB (MPS IIIB), аспартилглюкозаминурией, муколипидозом типа IIIA (MLIIIA) и мукополисахаридозом типа VII (MPS VII), обрабатывают ацетил-DL-лейцином (1 мM) в течение 6 дней, и с помощью LysoTracker определяют количественно объем лизосом.
Результаты
Обработка фибробластов, полученных от пациента с NPC средней клинической тяжести, 1 мM N-ацетил-DL-лейцином ассоциируется с существенным снижением интенсивности флуоресценции LysoTracker, показывающим снижение объема лизосом со временем (фигура 6A). Такие данные воспроизводятся в фибробластах, полученных от пациентов с другими NPC различной клинической тяжести, обработанных 1 мM N-ацетил-DL-лейцином в течение 72 часов (фигура 6B).
Наблюдают, что фибробласты, полученные от пациентов с NPA, MLII, MPS IIIB, аспартилглюкозаминурией, MLIIIA и MPS VII, имеют повышенные уровни флуоресценции с LysoTracker относительно соответствующих по возрасту контролей дикого типа (фигуры 6C-6H). Это является показателем увеличенной лизосомы в результате накопления липидов по сравнению с фибробластами от здоровых индивидуумов. Обработка ацетиллейцином ассоциируется со статистически значимым ослаблением флуоресценции LysoTracker относительно контрольного уровня в фибробластах при NPA, MLII и MPS IIIB относительно необработанных фибробластов при NPA, MLII и MPS IIIB, соответственно (фигуры 6C-6E), и ассоциируется со склонностью к ослаблению флуоресценции LysoTracker относительно контрольного уровня в фибробластах при аспартилглюкозаминурии, MLIIIA и MPS VII относительно необработанных фибробластов при аспартилглюкозаминурии, MLIIIA и MPS VII, соответственно (фигуры 6F-6H). Ослабление флуоресценции с LysoTracker является показателем снижения объема лизосом (фигуры 6C-6H и 6D). Данные, представленные на фигурах 6A-6D, показывают результаты после 6 дней обработки 1 мМ ацетиллейцином для каждой клеточной линии, соответственно, по объему лизосом, выраженном в кратном изменении относительно необработанных фибробластов дикого типа. Звездочки (*/****) показывают p-величины (<0,05/0,001) против необработанных фибробластов при заболевании.
Вывод
Обработка N-ацетил-DL-лейцином ассоциируется с очищением от нарушенного лизосомного накопления путем уменьшения объема лизосом и таким образом непосредственно корректирует фенотип таких болезней лизосомного накопления. Такие заболевания представляют различные классы ЛБН, и таким образом, такие результаты также подтверждают полезность действия ацетиллейцина против широкого ряда болезней лизосомного накопления.
Пример 3
Болезнь Сандхоффа представляет собой расстройство, которое может являться результатом аутосомно-рециссивного наследования мутаций в гене НЕХЕВ, который кодирует бета-субъединицу бета-гексозаминидазы. В результате этого ганглиозид GM2 не в состоянии разрушаться и накапливается в лизосомах в клетках периферической и центральной нервной системы (ЦНС).
В этом исследовании используется мышиная модель болезни Сандхоффа мышь Hexb−/−, как описано в Jeyakumar et al. (Jeyakumar M. et al. (1999), Proc. Natl. Acad. Sci. USA, 96: 6388-6393).
Мыши дикого типа (Hexb+/+) используются в качестве контроля.
Продолжительность жизни
Обработка ацетил-DL-лейцином ассоциируется со статистически значимым увеличением продолжительности жизни у мышей с болезнью Сандхоффа (фигура 7А). На фигуре 7А обработанных ацетилейцином мышей обрабатывали 0,1 г/кг ацетилейцина с возраста 3 недели. Звездочка (*) показывает p-величину <0,05 vs необработанных мышей с болезнью Сандхоффа. Данные представляют среднее n=6 мышей на группу. Без обработки среднее время выживания мышей с болезнью Сандхоффа составляет 112 дней. Обработка ацетиллейцином (0,1 г/кг массы тела с возраста 3 недели) увеличивает среднюю продолжительность жизни до 120 дней.
Двигательная функция
Обработка мышей с болезнью Сандхоффа ацетиллейцином приводит к улучшениям двигательной функции, как показывает переход по бруску (bar crossing) и исследования шагового цикла.
Тест переход по бруску
Тест переход по бруску является методом оценки двигательной функции у мышей, в котором мышь подвешивают в центре горизонтального бруска за ее передние конечности. Мышь дикого типа с нормальной двигательной функцией будет способна зацепиться своими задними конечностями и посредством этого двигаться к одной из платформ у любого конца бруска и таким образом завершить испытание.
Необработанная мышь с болезнью Сандхоффа способна выполнять тест до возраста примерно 11 недель. После этой точки двигательная функция и подвижность/зацепление задних конечностей ухудшаются до точки, в которой мышь не может выполнить тест и будет падать с бруска на мягкую подстилку внизу.
Обработка мышиной модели болезни Сандхоффа ацетил-DL-лейцином (0,1 г/кг массы тела с возраста 3 недели) ассоциируется с улучшенной двигательной функцией и подвижностью/зацеплением задних конечностей при оценке тестом переход по бруску (фигура 7B). На фигуре 7B обработка ацетиллейцином при 0,1 г/кг массы тела представлена с возраста 3 недели. Обработанные ацетиллейцином мыши с болезнью Сандхоффа сохраняют способность выполнять тест до возраста 13 недель (включительно). Данные представляют среднее для 6 мышей на группу. Обработанные мыши с болезнью Сандхоффа сохраняют способность выполнять тест до возраста 13 недель (включительно).
Шаговый цикл
Шаговый цикл представляет собой промежуток времени, занимаемый во время локомоции конечностью, от времени, когда она отрывается от земли, до времени, когда она отрывается от земли в следующем случае.
Шаговый цикл оценивают в возрасте 12 недель на необработанной и обработанной ацетиллейцином мышиной модели болезни Сандхоффа. Обработка ацетиллейцином включает 0,1 г ацетиллейцина на кг массы тела с возраста 3 недели.
Обработка ацетиллейцином мышиной модели болезни Сандхоффа ассоциируется со значительно более коротким временем переднего шагового цикла (p<0,05 vs необработанной мыши с SH), со значительно более коротким временем заднего шагового цикла (p<0,01 vs необработанной мыши с SH) и значительно более коротким временем среднего шагового цикла (p<0,001 vs необработанной мыши с SH) (фигура 7C). На фигуре 7C обработка ацетиллейцином при 0,1 г/кг массы тела представлена с возраста 3 недели. Термин «передний шаговый цикл» относится к подъему передних конечностей мыши, «задний шаговый цикл» относится к подъему задних конечностей мыши, и средний шаговый цикл учитывает все конечности мыши. Звездочки (*/**/***) показывают p-величины \<0,05/0,01/0,001 против необработанной мыши с болезнью Сандхоффа. Данные приводятся как среднее ± ст.откл..
Таким образом, обработка ацетиллейцином мышиной модели болезни Сандхоффа ассоциируется с более быстрым шаговым циклом, что может указывать на улучшение в двигательной функции.
Выводы
Эти исследования показывают, что обработка ацетиллейцином мышиной модели болезни Сандхоффа может вызвать улучшения в двигательной функции при оценке двумя независимыми экспериментами, а также существенно увеличивает продолжительность жизни.
Пример 4
Ганглиозидозы GM2 представляют собой группу лизосомных болезней накопления, возникающих из недостатков в активности β-гексозаминидазы. Группа охватывает болезнь Тея-Сакса, болезнь Сандхоффа и вариант АВ болезни Тея-Сакса.
Фибробласты, полученные от пациентов с GM2 (болезнью Тея-Сакса, болезнью Сандхоффа и вариантом АВ болезни Тея-Сакса) и контрольных здоровых индивидуумов, обрабатывают ацетил-DL-лейцином (1 мM в течение 6 дней) перед экстрагированием и количественным определением уровней гликосфинголипида (GSL) высокоэффективной жидкостной хроматографией (ВЭЖХ).
В отсутствие обработки фибробласты, полученные от пациентов со всеми 3 разновидностями ганглиозидоза GM2, показывают повышенные уровни GSL при сравнении с необработанными контрольными дикого типа. Во всех 3 случаях обработка ацетил-DL-лейцином (1 мM в течение 6 дней) ассоциируется со снижением накопления GSL. В случае болезни Тея-Сакса это снижение является статистически значимым (p<0,05). В случае болезни Сандхоффа и варианта АВ болезни Тея-Сакса имеется тенденция к понижению уровней GSL в связи с обработкой. Данные, представленные на фигурах 8A–8C, показывают результаты обработки каждой клеточной линии, соответственно, с уровнями GSL, отрегулированными для содержания белка, и выражены в кратном изменении относительно уровней необработанных фибробластов дикого типа.
Пример 5
Пациент 1
Пациентом в этом исследовании является 28-летний мужчина, у которого генетически диагностирована болезнь Тея-Сакса, и который показывает дизастрофонию, тремор, атаксию в положении стоя и походки, парапарез и мышечные атрофии. В частности, пациент не способен стоять или ходить, может сделать отдельные шаги при хорошей поддержке, имеет явную постулярную неустойчивость, нарушение движения глаз, дисфагию и дизартрию и умеренное нарушение когнитивной функции. Первые симптомы наблюдались в возрасте 16 лет.
До начала лечения проверка пациента по шкале оценки и рейтинга атаксии (SARA) показала 15,5/40. Кроме того, для пациента получены результаты анализа функционального индекса спиноцеребеллярной атаксии (SCAFI):
тест средняя 8-meters Walking (8MW): 21.6 с;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 48,3 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 44,9 с;
тест MW PATA Word Test: 20;
монреальская когнитивная оценка (MoCA): 18/30.
Также записывается видео пациента для последующего сравнения.
На следующий день после этой проверки пациенту начали терапию ацетиллейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно.
Через один месяц и четыре месяца соответственно пациента проверяют повторно, продолжая лечение. Через один месяц у пациента улучшилась мелкая моторика и снизился тремор кистей рук, например, во время еды или питья. Ходьба заметно не изменилась. Через четыре месяца у пациента стабильное состояние с несколько улучшенной когнитивной функцией, но нарушениями положения стоя, походки и мелкой моторики. Оценки SARA пациента и результаты анализов SCAFI пациента приводятся ниже в сравнении с базовыми.
Таблица 1. Параметры оценки пациента
В целом пациент показывает улучшение симптомов после лечения ацетиллейцином.
Пациент 2
В этом исследовании пациентом является 32-летняя женщина, у которой генетически диагностирована болезнь Тея-Сакса, и которая показывает атаксию положения стоя и походки, нарушение мелкой моторики, парапарез нижних конечностей и мышечные атрофии. В частности, пациентка не может ходить без поддержки, и пациентка страдает от дисфагии и нарушения речи, нарушения движения глаз и умеренного нарушения когнитивной функции. Первые симптомы наблюдались в возрасте 7 лет.
До начала лечения проверка пациентки по шкале оценки и рейтинга атаксии (SARA) показала 10,5/40. Кроме того, для пациентки получены результаты анализа функционального индекса спиноцеребеллярной атаксии (SCAFI):
тест средняя 8-meters Walking (8MW): 12.5 с;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 21,5 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 35,5 с;
тест MW PATA Word Test: 18;
монреальская когнитивная оценка (MoCA): 21/30.
Также записывается видео пациентки для последующего сравнения.
В день проверки пациентке начали терапию ацетиллейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно.
Через один месяц пациентку проверяют повторно, продолжая лечение, и отмечают улучшенное произношение, улучшенную постуральную устойчивость и улучшенную когнитивную функцию. Положение стоя и ходьба стали возможны без поддержки. Оценки SARA пациентки и результаты анализов SCAFI пациентки приводятся ниже в сравнении с базовыми.
Таблица 2. Параметры оценки пациентки
Пациент 3
В этом исследовании пациентом является 8-летний мальчик, у которого генетически диагностирована болезнь Тея-Сакса, и у которого имеются эпилептические судороги (большие, примерно 10 секунд, самоограниченные) почти каждый день до засыпания, нарушение движения глаз, анартрия, различные проблемы когнитивной функции и концентрирования (неврологическая проверка невозможна), не способный стоять или ходить сам и с очень ограниченными повседневными действиями (еда, умывание или одевание самим невозможно). Первые симптомы наблюдались в возрасте 9 месяцев.
До начала лечения проверка пациента по шкале оценки и рейтинга атаксии (SARA) показала 36/40, оценка по mRDS 18/24, визуальной шкале EQ-5D-5L 50 и 8MWT 18,1 (только при хорошей поддержке).
Пациенту начали терапию ацетиллейцином в дозе 1,5 г в день в течение первой недели и затем 3 г в день в течение второй недели поступательно.
Через один месяц пациента проверяют повторно, продолжая лечение, и отмечают улучшенную мелкую моторику (способен брать мелкие предметы), возросшую подвижность (чаще пытался гулять сам), улучшенную постуральную устойчивость, походку и положение стоя и способность произносить отдельные слова. Оценки пациента по SARA, mRDS, визуальной шкале EQ-5D-5L и 8MWT приводятся ниже в сравнении с базовыми.
Таблица 3. Параметры оценки пациента
EQ-5D-5L
Пример 6
В этом исследовании пациентом является 13-летний мальчик, у которого генетически диагностирован ганглиозидоз GM1, и который не может сам стоять или ходить, и с ограниченными повседневными действиями (еда, умывание или одевание самостоятельно невозможны), и имеет нарушение движения глаз, анартрию и различные проблемы когнитивной функции и концентрирования (неврологическая проверка невозможна). Первые симптомы наблюдались в возрасте 2 лет.
До начала лечения проверка пациента по шкале оценки и рейтинга атаксии (SARA) показала 35/40, оценка по mRDS 15 и визуальной шкале EQ-5D-5L 50.
Пациенту начали терапию ацетиллейцином в дозе 1,5 г в день в течение первой недели и затем 3 г в день в течение второй недели поступательно.
Через один месяц пациента проверяют повторно, продолжая лечение, и отмечают общее стабильное состояние, улучшенную походку (более плавную) и устойчивое положение стоя в естественном позиции. Оценки пациента по SARA, mRDS и визуальной шкале EQ-5D-5L приводятся ниже в сравнении с базовыми.
Таблица 4. Параметры оценки пациента
Пример 7
Пациент 1
Пациентом в этом исследовании является 73-летний мужчина, у которого ранее диагностирован амиотрофический боковой склероз (ALS).
Симптоматология пациента характеризуется прогредиентной дизартрией (гнусавая и невнятная речь) и слабостью правого тыльного сгибателя с отвислой стопой в результате на протяжении предыдущих трех лет.
Клинически пациент показывает бульбарную речь, парез 3/5 правых тыльных сгибателей и большого левого пальца, генерализованные преувеличенные рефлексы и спастическое повышение тонуса правой нижней конечности. ЭМГ показывает спонтанную активность, и cMRT не показывает какую-либо патологию.
Медикаментозное лечение пациента рилузолом начали примерно во время установления диагноза ALS. Однако клиническая симптоматология остается неизменной.
Затем пациенту начинают терапию ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно. Результаты регистрируют на видео.
После 15 дней лечения проводят проверку, на которой пациент сообщает о значительном улучшении речи. Пациент способен говорить более плавно и способен модулировать свой голос лучше по сравнению с периодом до лечения (что подтверждено с помощью видео).
После еще 20 дней лечения проводят дополнительный осмотр, на котором пациент сообщает о дополнительном улучшении речи. Кроме того, пациент сообщает об улучшении походки. Парез правых тыльных сгибателей и отвислая стопа в результате существенно ослабли и клинически почти не обнаруживаются. Кроме того, пациент сообщает об улучшении сна, более быстром засыпании, более продолжительном сне и что утром отчетливо чувствует себя более отдохнувшим.
Пациент продолжает лечение в течение приблизительно еще 30 дней. Примерно через 7 дней после прекращения лечения проводят проверку, на которой пациент не сообщает о дополнительном субъективном улучшении речи или ослаблении пареза правого тыльного сгибателя. Также ухудшается сон. Через примерно еще 1-2 дополнительные недели без лечения ацетиллейцином пациент сообщает об ухудшении речи. В это время пациент возобновляет лечение, и примерно двумя месяцами позже сообщает об устойчивой симптоматологии. По сравнению со временем, когда лечение ацетиллейцином инициировали первый раз, наблюдают небольшое ухудшение речи.
Так как у пациента не наблюдалось никакого улучшения речи, пациент попросил прервать лекарственное лечение. Приблизительно через 2-3 недели пациент снова сообщает об ухудшении речи после прекращения лечения ацетиллейцином. Пациент возобновляет лечение и сообщает об улучшении симптоматологии, в частности, речи.
В целом пациент показывает улучшение в симптомах после лечения ацетиттейцином.
Пациент 2
Пациентом в этом исследовании является 74-летний мужчина, у которого ранее диагностирован ALS.
Симптоматология пациента характеризуется прогредиентной дизартрией (гнусавая и невнятная речь) и сопутствующей дисфагией и слабостью при ходьбе в течение года, и парезом верхней левой конечности в течение приблизительно четырех месяцев. ЭМГ показывает генерализованную многофазную активность и хроническое нейрогенное ухудшение в бульбарном, цервикальном и поясничном сегменте.
Клинический осмотр пациента показывает тяжелую дизартрию, гипокинезию языка, парез 2/5-3/5 левой руки с ухудшением мелкой моторики, генерализованные преувеличенные рефлексы и фасцикуляцию. Лечение рилузолом начато одним месяцем ранее.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно.
Приблизительно через 2 месяца пациента снова осматривают, и он сообщает о прогредиентном ухудшении двигательной функции левой ноги, но дискретном улучшении при ходьбе. Кроме того, остаются стабильными глотательные функции.
Пациент 3
Пациентом в этом исследовании является 66-летний мужчина, у которого ранее диагностирован ALS.
Симптоматология пациента характеризуется прогредиентной слабостью и атрофией обеих проксимальных частей верхних конечностей, небольшим ухудшением мелкой моторики и генерализованными фасцикуляциями и судорогами. ЭМГ показывает патологическую спонтанную активность, MRT головного мозга и шейного отдела не показывает какую-либо патологию. Начинают лечение рилузолом.
Примерно двумя месяцами позже медосмотр показывает парезы 3/5-4/5 обоих плечей и проксимальных частей рук и замедление мелкой моторики, генерализованные фасцикуляции и нормальные рефлексы. Пациенту начинают лечение ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно.
Через один месяц пациент не сообщает об улучшении симптоматологии и не сообщает об улучшении силы мышц верхних конечностей. Лекарственное лечение приостанавливают и просят пациента сообщать об ухудшении симптоматологии.
Пациент 4
Пациентом в этом исследовании является 66-летний мужчина, у которого диагностирован ALS. Симптоматология пациента характеризуется прогрессирующей слабостью и атрофией обеих проксимальных частей верхних конечностей, небольшим ухудшением мелкой моторики и генерализованными фасцикуляциями и судорогами. ЭМГ показывает патологическую спонтанную активность и хроническое нейрогенное изменение, MRT головного мозга и шейного отдела не показывает какую-либо патологию. Начинают лечение рилузолом.
Медосмотр показывает парезы 3/5-4/5 обоих плечей и проксимальных частей рук, замедление мелкой моторики, генерализованные фасцикуляции и нормальные рефлексы, и оценку ALS-FRS 44/48.
Пациенту начинают лечение ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день в течение второй недели поступательно.
Примерно через один месяц пациент сообщает о субъективном улучшении дисфагии и меньшей гиперсаливации. Сравнение его результатов показывает улучшенное и более живое выражение лица. Слабость конечностей не изменяется. Терапию приостанавливают до дней, когда пациент сообщает об ухудшении симптоматологии, в частности, субъективном ухудшении дисфагии и гиперсаливации. Пациенту возобновляют непрерывное лечение.
Пациента снова осматривают примерно через 8 недель, и симптоматология остается стабильной. Оценка пациента ALS-FRS составляет 44/48. По сравнению с симптоматологией примерно на момент установления диагноза имеется только небольшое развитие слабости в походке и верхних конечностей.
Пример 8
Лечение ацетиллейцином показывает появление улучшений у 3 пациентов, которым поставлен диагноз мулльтисистемная атрофия церебеллярного типа (MSA-C).
Пациент 1
В этом исследовании пациентом является женщина в возрасте под 60, у которой стала видна прогрессирующая атаксия с проблемами речи и проблемы ходьбы в предыдущие три года.
При медосмотре пациентки обнаруживаются центральные церебеллярные газодвигательные симптомы, умеренная дизартрофония, легкая атаксия конечностей и умеренная атаксия в положении стоя и походки. Кроме того, MRT пациентки показывает атрофию мозжечка и ствола головного мозга, в частности, варолиевого моста и среднего мозга. Пациентка соответственно диагностирована как имеющая MSA-C.
Пациентку начинают лечить ацетил-DL-лейцином в дозе 5 г в день (2 г после сна, 1,5 г перед ланчем и 1,5 г перед ужином).
После одной недели лечения пациентка уже показывает значительное улучшение речи.
Пациент 2
В этом исследовании пациентом является 77-летний мужчина, у которого диагностирована MSA-C.
Симптоматология пациента характеризуется прогрессирующими затруднениями при ходьбе и неуверенной походкой со склонностью к падению (пациент падает приблизительно 10 раз в месяц). Пациент показывает головокружение, гипокинетико-ригидный синдром, саккадические движения глаз, дисметрию в тесте на координацию и автономную дисфункцию, например, эриктильную дисфункцию, ортостатическую гипотензию и неполное опорожнение мочевого пузыря в течение последних четырех лет.
До начала лечения симптомы у пациента оставались неизменными по меньшей мере в течение трех месяцев.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день.
После 3 недель лечения проводят дополнительный осмотр. Пациент и его жена сообщают о существенном улучшении походки: пациент ходит более уверенно и падения полностью прекратились. Кроме того, головокружение, испытываемое пациентом, значительно ослабло.
Пациенту дают указание о прекращении лекарственного лечения, и через одну неделю пациент сообщает об ухудшении походки и головокружения. Пациент сообщает об ощущении более неуверенной ходьбе с сильной склонностью к падению.
Затем пациенту дают указание о возобновлении лекарственного лечения, которое продолжается в течение 40 дней, и затем снова прекращается. После медосмотра через 7 дней после прекращения лекарственного лечения пациент подтверждает прогрессирующее ухудшение походки и головокружение через два дня после прекращения лечения и очень сильную склонность к падению через 5 дней после прекращения лечения. Пациент снова возвращается к непрерывному лечению.
Пациент 3
В этом исследовании пациентом является 76-летний мужчина, у которого диагностирована малосимптомная MSA-C.
Симптоматология пациента характеризуется прогрессирующими затруднениями при ходьбе и неуверенной походкой (без падения), а также головокружением.
Клинически пациент показывает саккадические движения глаз и дисметрию в тестах на координацию. cMRI показывает атрофию среднего мозга, и FDC-PET головного мозга показывает сниженный метаболизм в полосатом теле и мозжечке. Результаты постурографического теста пациента являются паталогическими с высокой склонностью к падению.
До начала лечения клиническая симптоматология пациента оставалась неизменной по меньшей мере в течение одного года.
Выполняют анализ походки, который показывает атактическую походку и уменьшенную скорость и увеличенную ширину дорожки по сравнению с нормальным интервалом и флюктуации ходьбы. Затем пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем дозой 5 г в день в течение второй недели поступательно.
После лечения в течение одного месяца выполняют дополнительный осмотр. Анализ походки показывает улучшение скорости ходьбы и уменьшение ширины дорожки и флюктуаций ходьбы.
Таблица 5. Параметры анализа походки
Пациент получает указание прекратить лекарственное лечение, и он сообщает о прогрессирующем ухудшении походки и головокружении приблизительно на второй-третьей неделе после прекращения лечения.
Затем пациент снова возвращается к непрерывному лечению, и симптоматология снова улучшается. Лечение снова приостанавливают, и пациента оценивают тремя неделями позже. Пациент сообщает об ухудшении симптомов, особенно головокружения. Анализ походки показывает возросшую ширину шага по сравнению с с состоянием перед терапией.
Таблица 6. Параметры анализа походки
Пример 9
Пациентом в этом исследовании является 59-летний мужчина с проградиентным изменением личности, характеризующимся апатией, летаргией и безразличием. Кроме того, пациент показывает гипокинетико-ригидный синдром главным образом с левой стороны с ухудшением мелкой моторики и уменьшенной резонацией левой руки. Кроме того, пациент показывает генерализованную брадикинезию и нарушение походки с мелкими шагами и 2-3 падениями в месяц. Пациент также показывает невнятную речь и когнитивные недостаточности, касающиеся психомоторной заторможенности, и сниженную семантическую беглость речи.
У пациента диагностируют лобно-височную деменцию с паркинсонизмом, и Datscan обнаруживает уменьшение дофаминовых рецепторов, поддерживая даигноз. FDC-PET головного мозга показывает в основном сниженный метаболизм фронтальной доли.
Пациент показывает небольшое улучшение во время лечения L-допой и ропиниролом.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем дозой 5 г в день в течение 4 недель.
После лечения ацетиллейцином приблизительно в течение одного месяца лекарственное лечение прекращают, и пациента снова осматривают через 13 дней.
Пациент, его жена и дочь сообщают о значительном улучшении походки после терапии ацетиллейцином, и кроме того, пациент перестал падать. Пациент также показывает улучшение речи, которая становится менее невнятной, более понятной и субъективно значительно более регулируемой. После приостановки лечения симптомы ухудшаются.
Пример 10
Пациентом в этом исследовании является 75-летний мужчина с прогрессирующей неуверенной походкой и головокружением, приводящим к падениям назад. Кроме того, у пациента имеется в основном левосторонний гипокинетико-ригидный синдром с апраксией и феномен «чужой» конечности.
У пациента диагностирован кортикобазальный синдром. Datscan обнаруживает уменьшение дофаминовых рецепторов, и MRI показывает атрофическую моторную кору правого полушария, поддерживая диагноз.
Пациент не показывает улучшения во время лечения L-допой.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем дозой 5 г в день. Перед началом лечения выполняют анализ походки.
После 20 дней лечения ацетиллейцином пациента снова осматривают. Улучшения симптомов головокружения и существенное снижение частоты падений не отмечают.
Таблица 7. Параметры анализа походки
Имеется объективное улучшение в параметрах анализа походки, например, в скорости, максимальной скорости, ритме и уменьшенном двойном стоянии (таблица 2 и фигура 9).
После 8 недель лечения ацетиллейцином лекарственное лечение прекращают, и спустя 6 дней пациента снова осматривают.
Пациент сообщает об усилении симптомов головокружения через два дня после приостановки лечения (ощущение выпившего).
Затем пациент возобновляет непрерывное лечение.
Пример 11
Пациент 1
В этом исследовании пациентом является 76-летняя женщина с головокружением, которое происходит главным образом при ходьбе. О падениях не сообщается. Пациентка также показывает нарушение походки с мелкими шагами и генирализованной брадикинезией и паралич вертикального взора с ухудшением мелкой моторики.
Пациентке диагностируют прогрессирующий надъядерный паралич. Datscan обнаруживает уменьшение дофаминовых рецепторов, и FDC-PET головного мозга показывает в основном сниженный метаболизм фронтальной доли, поддерживая диагноз.
Пациентка показывает небольшое улучшение во время лечения L-допой.
Пациентку начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение одной недели и затем дозой 5 г в день в течение 4 недель. После 27 дней лечения ацетиллейцином лекарственное лечение прекращают, и пациентку снова осматривают через 60 дней.
Пациентка сообщает о значительном уменьшении головокружений и небольшом улучшении походке после терапии ацетиллейцином. После приостановки лечения симптомы ухудшаются.
Пациентку снова осматривают примерно через два месяца, и сообщается об устойчивой симптоматологии лежащего в основе прогрессирующего надъядерного паралича без клинического прогресса. Оценка PSSRS остается стабильной, и ослабление головокружения все еще значительное.
Пациент 2
В этом исследовании пациентом является 66-летний мужчина с симметричным гипокинетико-ригидным синдромом, нарушением походки с неуверенными и мелкими шагами (сильная склонность к падению) и вертикальным параличом взора, с ухудшением мелкой моторики. У пациента диагностируют прогрессирующий надъядерный паралич. Datscan обнаруживает уменьшение дофаминовых рецепторов, и FDC-PET головного мозга показывает в основном сниженный метаболизм фронтальной доли, поддерживая диагноз. Реакции на леводопу нет.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день. Перед началом лечения выполняют анализ походки. После 17 дней лечения лекарственное лечение прекращают, и пациента снова осматривают через 4 дня. Пациент не сообщает о существенном улучшении походки или гипокинетико-ригидного синдрома.
Таблица 8. Параметры анализа походки
Снова выполняют оценку пациента через примерно два месяца, и он не сообщает об ухудшении симптомов после прекращения лекарственного лечения.
Пациент 3
В этом исследовании пациентом является 56-летний мужчина с симметричным гипокинетико-ригидным синдромом, неуверенной походкой с падениями и вертикальным параличом взора, с ухудшением мелкой моторики. У пациента диагностируют прогрессирующий надъядерный паралич. Datscan обнаруживает уменьшение дофаминовых рецепторов, и FDC-PET головного мозга показывает сниженный метаболизм в лобномезиальной и височно-теменной области, поддерживая диагноз. Реакции на леводопу нет.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день. Перед началом лечения выполняют анализ походки. После 17 дней лечения лекарственное лечение прекращают, и пациента снова осматривают через 4 дня. Пациент не сообщает о существенном улучшении походки или гипокинетико-ригидного синдрома.
Таблица 9. Параметры анализа походки
Снова выполняют оценку пациента через примерно два месяца, и он не сообщает об ухудшении симптомов после прекращения лекарственного лечения.
Пациент 4
В этом исследовании пациентом является 76-летний мужчина с прогредиентным нарушением походки, неуверенными и мелкими шагами (сильная склонность к падению), камптокормией, медленными и гипометрическими саккадами и ухудшением мелкой моторики. У пациента диагностируют прогрессирующий надъядерный паралич. MRI показывает небольшую атрофию среднего мозга (симптом Микки Мауса). Имеется слабая реакции на леводопу.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели и затем 5 г в день. Перед началом лечения выполняют анализ походки. После трех недель лечения лекарственное лечение прекращают, и пациента снова осматривают. Пациент сообщает о походке с возросшей субъективной уверенностью и уменьшенной частотой падений. Анализ походки показывает улучшение походки с возросшей скоростью и длиной шагового цикла и уменьшением ширины дорожки, двойного стояния и коэффициента вариаций.
Таблица 10. Параметры анализа походки
Через три месяца без лекарственного лечения у пациента регистрируют развитие гипокинетико-ригидного синдрома. Походка ухудшилась с большей частотой падений
Пример 12
Пациент 1
В этом исследовании пациентом является 42-летний инженер, который страдает от головокружения и постурального дисбаланса в течение почти одного года.
Пациенту диагностировали «бьющий» вниз нистагм: пациенту стало значительно хуже за счет затуманенного зрения (осциллопсия) из-за нистагма и трудностей при чтении и письме. Острота зрения у пациента следующая: правый 0,75, левый 0,67, бинокулярное 0,83, и «бьющий» вниз нистагм подтвержден видеоокулографией. Пациент также проявляет качание тела, которое подтверждено постурографией.
Лечение 4-аминопиридином (фампира, 10 мг дважды в день) в течение четырех недель не дает какого-либо благоприятного результата.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день (1 г после пробуждения, 1 г перед ланчем и 1 г перед ужином) в течение одной недели и затем дозой 5 г в день (2 г после пробуждения, 1,5 г перед ланчем и 1,5 г перед ужином).
Через 10 дней пациент сообщает о значительном улучшении и что эффект постепенно развивается. Пациент продолжает лечение в указанной дозировке и в результате без какого-либо побочного действия. Временная приостановка лекарственного лечения ведет к значительному ухудшению.
Пациента снова осматривают приблизительно через 14 недель после начала лечения ацетиллейцином, во время которого пациент был весьма доволен благоприятным действием.
Чтение и письмо у пациента стали значительно лучше, поскольку осциллопатия ослабла: изображение визуального окружения стабильно. Пациент способен подавить нистагм фиксацией взора. Кроме того, улучшилась пространственная ориентация пациента.
Клиническая проверка двумя независимыми экспертами обнаруживает снижение нистагма, и видиоокулография показывает, что пациент может подавить нистагм фиксацией взора. Острота зрения пациента: правый 0,83, левый 1,0, бинокулярное 1.
Постурография показывает снижение постурального качания.
В целом исследование в этом случае показывает ослабление симптомов у пациента для такого показания.
Пациент 2
Пациенту в исследовании в этом случае диагностирован «бьющий» вниз нистагм. Пациент показывает постуральный дисбаланс и головокружение. Пациенту не становится лучше от фампиры®.
Пациент начинает принимать ацетил-DL-лейцин (3 г/день в течение первой недели, затем 5 г/день) и в последствии показывает улучшение походки со способностью проходить более длинные расстояния (один час) и улучшенную расторопность. У пациента также ослаб «бьющий» вниз нистагм (подтверждено видеоокулографией). Пациент может частично подавить нистагм фиксацией взора при оценке с использованием таргет-центра (точка, поставленная в центре дисплея на 30 секунд, фигура 13А) и в полной темноте с использованием защитных очков, покрытых специальными стеклами, в течение 45 секунд (фигура 13В). Результаты (среднее скорости медленной фазы, SРV) следующие: таргет-центр – горизонтальный -0,02 °/с, вертикальный 2,41°/с; полная темнота – горизонтальный 0,05 °/с, вертикальный 3,27°/с (фигура 13С). Пациент способен минимизировать движение глаз усилием фиксации, как показано на фигуре 13А.
Анализ походки показывает повышение самовыбранной скорости ходьбы от 56 до 85 см/с и максимальной скорости ходьбы от 122 до 155 см/с. Затем лекарственное лечение приостанавливают. Примерно через один месяц после прекращения лечения ацетил-DL-лейцином симптоматология пациента ухудшается. Анализ походки показывает снижение самовыбранной скорости ходьбы с 85 до 72 см/с и максимальной скорости ходьбы с 155 см/с до 113 см/с.
Пример 13
Пациент 1
В этом исследовании пациентом является 70-летняя женщина с кинетико-ригидным синдромом в основном с правой стороны и тремором, antecollis, частыми падениями, ортостатической дисфункцией и неудержанием.
Пациентке диагоностирована мультисистемная атрофия с паркинсонизмом (MSA-P). Datscan обнаруживает в основном левостороннее снижение дофаминовых рецепторов, и FDC-PET головного мозга показывает снижение метаболизма главным образом в теменно-затылочной области. Имеется слабая реакция на леводопу (100/25 мг 3 × ежедневно).
Пациентка начинает принимать ацетил-DL-лейцин (3 г/день в течение первой недели; затем 5 г/день). После 3 недель на ацетил-DL-лейцине пациентку осматривают и не регистрируют существенных улучшений в походке, сокращения падений или улучшения в кинетико-ригидным синдроме. Лекарственное лечение прекращают.
Через 6 недель пациентка не сообщает об ухудшении симптомов после прекращения лекарственного лечения.
Пациент 2
В этом исследовании пациентом является 78-летний мужчина с диагнозом мультисистемная атрофия с паркинсонизмом (MSA-P). Симптоматология пациента характеризуется прогрессирующим кинетико-ригидным синдромом, ортостатической дисфункцией и последующим головокружением и нарушением равновесия. Пациент показывает саккадическое движение глаз и симметричную ригидность мышц обеих верхних конечностей. Балансирование на воображаемом канате ассоциируется с ненадежностью и потерей равновесия. FDC-PET головного мозга показывает снижение метаболизма как в теменной, так и в затылочной области коры головного мозга, что напоминает деменцию с тельцами Леви.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г вдень в течение первой недели затем 5 г в день. Перед началом лечения пациента осматривают и видят клиническую симптоматологию, описанную выше, с весьма выраженной неуверенностью походки и головокружением.
После одного месяца лечения лекарственное лечение прекращают, и проводят оценку пациента. Пациент сообщает о субъективном улучшении в отношении головокружения, и клиническая проверка показывает улучшение равновесия на воображаемом канате, что пациент выполняет без каких-либо трудностей по сравнению с предыдущей проверкой. Выполняют анализ походки.
После одного месяца без лечения пациент регистрирует стабильную симптоматологию. Не сообщается об ухудшении в связи с головокружением или неуверенности походки. Выполняют анализ походки.
После двух месяцев без лечения выполняют анализ походки и видят снижение скорости ходьбы, уменьшение длины шага и ухудшение оценки FGA. У пациента регистрируют ухудшение общей симптоматологии, включая прогрессирующую слабость ног и возросшую неуверенность походки.
Таблица 11. Параметры анализа походки
Пациент 3
В этом исследовании пациентом является 78-летний мужчина с диагнозом мультисистемная атрофия с паркинсонизмом (MSA-P). Симптоматология пациента характеризуется прогрессирующим кинетико-ригидным синдромом, недержанием мочи, начинающейся когнитивной дисфункцией и нарушением походки с мелкими шагами и 2-3 падениями в месяц. Когнитивные недостатки характеризуются психомоторной заторможенностью и периодической спутанностью сознания. Datscan обнаруживает снижение дофаминовых рецепторов, что поддерживает диагноз. FDC-PET головного мозга показывает сниженный метаболизм главным образом в области полосатого тела. Терапию леводопой прекращают из-за побочного действия.
Пациента начинают лечить ацетил-DL-лейцином в дозе 3 г в день в течение первой недели, затем 5 г в день. После одного месяца на ацетил-DL-лейцине выполняют оценку пациента. Жена пациента сообщает о существенном улучшении когнитивной функции. Эпизоды спутанности сознания полностью исчезли. Когнитивная структура пациента оказывается более ясной и правильной. Улучшения функции ходьбы нет. Жена пациента поддерживает продолжение лекарственного лечения.
Пример 14
В этом исследовании пациентом является 45-летний мужчина с диагнозом спиноцеребеллярная атаксия 28 (SCA 28). Генетическое тестирование показывает известный патогенный вариант в AFC3L2. Симптоматология пациента характеризуется прогрессирующим мозжечковым синдромом с 30-летнего возраста, характеризуется невнятной речью, неустойчивой походкой, нарушением равновесия и головокружением. Отец и бабушка пациента страдали от схожей симптоматологии. Пациент показывает саккадические движения глаз и дисметрию в тестах на координацию, атаксическую походку, невнятную речь, преувеличенные рефлексы нижних конечностей, мышечную спастичность нижних конечностей и положительный симптом Бабинского слева. cMRI показывает заметную атрофию мозжечка.
Пациента начинают лечить ацетил-DL-лейцином в дозе 5 г в день. Перед началом лечения выполняют анализ походки. Примерно после одного месяца лечения лекарственное лечение прекращают, и выполняют оценку пациента. Пациент сообщает об улучшении симптоматологии, в частности, ослаблении головокружения (почти исчезло) и более устойчивой походке. Пациент сообщает, что больше не ходит подобно роботу и может всходить по ступенькам не используя перила. Выполняют анализ походки, который показывает улучшение параметров.
Таблица 12. Параметры анализа походки
Пример 15
Пациенты 1 и 2
Пациентами в этом исследовании являются 2 родные сестры в возрасте 24 года (пациентка 1) и 19 лет (пациентка 2), соответственно. Пациентки страдают от атаксии-телеангиэктазии.
Пациентка 1 показывает отставание в развитии. Пациентка не ходила до 2 лет и имела развитие признаков и симптомов мозжечковой атаксии, пароксизмы вместе с генерализацией, дистальную выраженную гипертонию и телеангиэктазию на глазах, ушах и грудной клетке. Диагноз установили в возрасте 9 лет. Глазодвигательная функция пациентки показывает «бьющий» вниз нистагм с взглядом перед собой и при взгляде влево больше, чем вправо, нистагм удерживания взгляда вверх, вертикальное и горизонтальное саккадическое плавное слежение и гипометрические горизонтальные и вертикальные саккады с ограниченной подвижностью при взгляде вверх.
До начала лечения проверка пациентки 1 по шкале оценки и рейтинга атаксии (SARA) показала 22/40. Результаты анализа функционального индекса спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): 21.8 с;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 90,2 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 125,8 с;
тест MW PATA Word Test: 12,5;
визуальная аналоговая шкала (оценка пациентки): 99.
Результаты видеоокулографии приводятся ниже.
Таблица 13. Параметры видеоокулографии
После проверки пациентка 1 начинает лечение ацетил-DL-лейцином (5 г/день). После одного месяца лечения пациентку проверяют повторно. Попечители сообщают об улучшении речи и походки. Сама пациентка не ощущает какого-либо изменения. Проверка по шкале оценки и рейтинга атаксии (SARA) показала 15,5/40. Результаты анализа функционального индекса спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): 18.5 с;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 77,9 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 101,3 с;
тест MW PATA Word Test: 13;
визуальная аналоговая шкала (оценка пациентки): 85.
Результаты видеоокулографии приводятся ниже.
Таблица 14. Параметры видеоокулографии
Показатели пациентки 1 по SARA и SCAF1 улучшились после лечения, и видеоокулография показывает существенное улучшение устойчивости фиксации и уменьшение интенсивности «бьющего» вниз нистагма.
Пациентка 2 показала отставание в развитии, пароксизмы в возрасте 1 года, генерализованную гипотонию, контрактуры нижних конечностей с двусторонней эквиноварусной деформацией стопы, арефлексию, острый лимфобластный лейкоз в возрасте 3 лет, небольшое увеличение селезенки, гиперхолестеринемию, гипохромную микроцитарную анемию, пигментный невус и витилиго. Первые симптомы родители заметили в возрасте 15 месяцев. Глазодвигательная функция пациентки 2 показывает квадратноволновые подергивания, нистагм удерживания взгляда при взгляде влево больше, чем вправо, с вертикальной компонентой, «бьющий» вниз нистагм, саккадическое плавное слежение, паралич вертикального взора вверх больше, чем вниз, и ухудшенную конвергенцию.
До начала лечения проверка пациентки 2 по шкале оценки и рейтинга атаксии (SARA) показала 28,5/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполнить без поддержки;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 300 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 299,2 с;
тест MW PATA Word Test: 13,5;
визуальная аналоговая шкала (оценка пациентки): 45.
Результаты видеоокулографии приводятся ниже.
Таблица 15. Параметры видеоокулографии
После проверки пациентка 2 начинает лечение ацетил-DL-лейцином (5 г/день). После одного месяца лечения пациентку проверяют повторно. Попечители сообщают об улучшении функции мелкой моторики, тремора рук и речи. Сама пациентка не ощущает какого-либо благоприятного действия. Проверка по шкале оценки и рейтинга атаксии (SARA) показала 23,5/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполнить без поддержки;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 300 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 300 с;
тест MW PATA Word Test: 14;
визуальная аналоговая шкала (оценка пациентки): 80.
Результаты видеоокулографии приводятся ниже.
Таблица 16. Параметры видеоокулографии
Видеоокулография показывает у пациентки 2 улучшение устойчивости фиксации и значительное уменьшение интенсивности «бьющего» вниз нистагма.
Пациент 3
В этом исследовании пациентом является 19-летняя женщина, страдающая от атаксии-телеангиэктазии с раннего детства, имеющая
- задержку моторного развития, признаки и симптомы мозжечковой атаксии, выраженную осевую гипотонию с периферической гипертонией, тяжелые контрактуры стоп с двусторонними деформациями «конская стопа» и transversoplanus и поэтому ограничена инвалидной коляской, дисдиадохокинезию и арефлексию нижних конечностей с пониженной пропириоцептивной чувствительностью; и
- неходжкинскую лимфому, полиморфизм MTHFR (C677T), лимфангиому нижней губы, холецистолитиаз, родовую кардиомиопатию, пигментный невус, тораколюмбарный кифосколиоз и склеральную телеангиэктазию на обоих глазах.
Глазодвигательная функция пациентки показывает нистагм удерживания взгляда вправо и влево, саккадические движения глаз, медленные саккады во всех направлениях, особенно в горизонтальном, патологический вестибулоокулярный рефлекс с корректирующими догоняющими саккадами и патологическое подавление вестибулоокулярного рефлекса фиксацией взора.
До начала лечения проверка пациентки по шкале оценки и рейтинга атаксии (SARA) показала 23/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполнить;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 150 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 161,6 с;
тест MW PATA Word Test: 14;
визуальная аналоговая шкала (оценка пациентки): 80.
Результаты видеоокулографии приводятся ниже.
Таблица 17. Параметры видеоокулографии
Пациентка начинает лечение ацетил-DL-лейцином (5 г/день) примерно через шесть месяцев после проверки. После почти 7 месяцев лечения пациентку проверяют повторно. Попечители и пациентка сообщают об общем улучшении здоровья без конкретного описания. Проверка по шкале оценки и рейтинга атаксии (SARA) показала 21,5/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполняться;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 124,5 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 147,5 с;
тест MW PATA Word Test: 10;
визуальная аналоговая шкала (оценка пациентки): 80.
Результаты видеоокулографии приводятся ниже.
Таблица 18. Параметры видеоокулографии
Пациентка показывает небольшое улучшение SARA и подмножества SCAF1 9HPT и существенное улучшение стабильности фиксации и уменьшение интенсивности нистагма удерживания взгляда во всех положениях.
Пациент 4
В этом исследовании пациентом является 15-летняя девочка, страдающая от атаксии-телеангиэктазии с 4-летнего возраста. С 7 лет пациентка показывает признаки и симптомы тяжелой мозжечковой атаксии, ухудшение мелкой моторики, мышечную гипотонию с арелексией, мышечную атрофию и подошвенную флексию с дискретными контрактурами. Пациентка ограничена инвалидной коляской, но способна ходить при постоянной поддержке. Пациентка имеет тяжелую гемолитическую анемию, гипогаммаглобулинемию, телеангиэктазию на склерах и грудной клетке, вторичный синдром Кушинга из-за приема кортикостероидов и предполагается, что имеет неходжкинскую лимфому ЦНС.
Глазодвигательная функция пациентки показывает слабое отклонение глаза вверх, «бьющий» влево нистагм в центральной позиции, нистагм удерживания взгляда во всех направлениях, горизонтальный с компонентой вниз, испуг при внезапном движении головы.
До начала лечения проверка пациентки по шкале оценки и рейтинга атаксии (SARA) показала 23,5/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполнить;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 124,5 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 52,3 с;
тест MW PATA Word Test: 14;
визуальная аналоговая шкала (оценка пациентки): 70.
Результаты видеоокулографии приводятся ниже.
Таблица 19. Параметры видеоокулографии
Пациентка начинает лечение ацетил-DL-лейцином (5 г/день) после проверки. После почти 1 месяца лечения пациентку проверяют повторно. Пациентка и ее мать сообщают об улучшении почерка, в особенности, из-за уменьшенного тремора рук и улучшения мелкой моторики. Пациентка также сообщает, что стало легче пить и больше не нужна соломинка. Члены семьи описывают улучшение походки с повышенной устойчивостью и меньшей потребностью в поддержке. Проверка по шкале оценки и рейтинга атаксии (SARA) показала 18,5/40. Результаты анализа пациентки на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может выполнить;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 93,5 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 101,7 с;
тест MW PATA Word Test: 15,5;
визуальная аналоговая шкала (оценка пациентки): 70.
Результаты видеоокулографии приводятся ниже.
Таблица 20. Параметры видеоокулографии
Пациентка показывает небольшое улучшение SARA и подмножества SCAF1 9HPT доминантной руки. Видеоокулография показывает общее улучшение стабильности фиксации и уменьшение интенсивности спонтанного и удерживания взгляда нистагма во всех положениях.
Пациент 5
В этом исследовании пациентом является 10-летний мальчик, страдающий от атаксии-телеангиэктазии с раннего детства, имеющий
- задержку психомоторного развития, неустойчивую ходьбу с 14 месяцев с повышенной частотой падений, признаки и симптомы тяжелой мозжечковой атаксии, дизартрию и дислалию, ухудшение мелкой моторики, нечасто случающийся тремор головы, медленный психомоторный темп, гипотонию с мышечной атрофией и гипорефлексией, антефлексию головы с кифозом в торакальной области, pedes tranversoplani, крыловидные лопатки, парасомнию с ночными страхами и аутизм; и
- значительную иммуносупрессию, телеангиэктазию на мягком небе, склерах, недержание и астеническое телосложение.
Пациент ограничен инвалидной коляской, но также способен сделать несколько шагов с сильной постоянной поддержкой. Глазодвигательная функция пациента показывает окуломоторную апраксию с выраженной антефлексией головы, движение головы и глаз «en bloc» при взгляде вправо и влево, паралич вертикального взора с медленными вертикальными саккадами и саккадическим плавным слежением, медленные горизонтальные саккады влево, паралич саккад при слежении вправо, ограниченную подвижность глаз, особенно вертикальную, и нстабильность фиксации во всех направлениях.
До начала лечения проверка пациента по шкале оценки и рейтинга атаксии (SARA) показала 24,5/40. Результаты анализа пациента на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может ходить без постоянной поддержки;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 102,7 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 116,8 с;
тест MW PATA Word Test: 6;
визуальная аналоговая шкала (оценка пациента): 90.
Результаты видеоокулографии приводятся ниже.
Таблица 21. Параметры видеоокулографии
Скорость медленной фазы (SPV) нистагма фиксации и удерживания взгляда [°/c]
Пациент начинает лечение ацетил-DL-лейцином (5 г/день) после проверки. После примерно 1 месяца лечения пациента проверяют повторно. Мать пациента описывает значительное улучшение устойчивости походки; до терапии он постоянного падал и должен был частично «перевозиться». После лечения он способен ходить только держась за руку сиделки.
Улучшилась мелкая моторика, удержание тела и снизилась интенсивность тремора рук. Улучшение мелкой моторики отражается на повседневных действиях, таких как еда и питье самостоятельно. Пациент прибавил в весе 1,5 кг и имеет более хороший аппетит. Проверка по шкале оценки и рейтинга атаксии (SARA) показала 20,5/40. Результаты анализа пациента на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): не может ходить без поддержки;
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 103,6 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 88,8 с;
тест MW PATA Word Test: 7,5;
визуальная аналоговая шкала (оценка пациента): 80.
Результаты видеоокулографии приводятся ниже.
Таблица 22. Параметры видеоокулографии
Скорость медленной фазы (SPV) нистагма фиксации и удерживания взгляда [°/c]
После почти 7 месяцев лечения пациента снова проверяют. Мать пациента описывает значительно более устойчивую походку; этот результат остается постоянным с первой оценки после лечения. Пациент может сам вставать и вообще стал более самостоятельным в повседневных действиях. Пациент с улучшенным аппетитом прибавил еще 3 кг и показывает улучшенную стабильность.
Проверка по шкале оценки и рейтинга атаксии (SARA) показала 17,5/40. Результаты анализа пациента на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): 15,3 с (держась за руку);
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 92,4 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 98,3 с;
тест MW PATA Word Test: 11;
визуальная аналоговая шкала (оценка пациента): 100.
Пациента снова оценивают после лечения в течение почти одного года и видят улучшенное социальное взаимодействие, активность и подвижность. Родители пациента сообщают об улучшении в связи с недержанием. У пациента развивается повторяющаяся фронтальная локализованная боль с рвотой по утрам. На основании семейного анамнеза предполагается, что локализованная боль может иметь место из-за детской мигрени.
Проверка по шкале оценки и рейтинга атаксии (SARA) показала 16,5/40. Результаты анализа пациента на функциональный индекс спиноцеребеллярной атаксии (SCAF1) следующие:
тест средняя 8-meters Walking (8MW): 13,9 с (может ходить сам, держится за руку матери);
тест MW 9-Hole Pegboard Test Dominant (9HPTD) (правые): 95,6 с;
тест MW 9-Hole Pegboard Test Non-Dominant (9HPTND): 127,6 с;
тест MW PATA Word Test: 14,5;
визуальная аналоговая шкала (оценка пациента): 95.
При лечении ацетил-DL-лейцином пациент показывает улучшенные оценки по SARA и SCAF1, улучшенное качество жизни, улучшенную в целом стабильность фиксации и снижение интенсивности спонтанного нистагма и нистагма удерживания взгляда, особенно в вертикальной плоскости (через 1 месяц).
Пациент 6
В этом исследовании пациентом является 10-летняя девочка, страдающая от атаксии-телеангиэктазии, у которой атаксическая походка и стояние, нарушение мелкой моторики с тремором рук, дисфагия и расстройство речи, глазодвигательное нарушение и проблемы с когнитивной функцией и концентрацией. Первые симптомы наблюдались в возрасте одного года.
После базового обследования пациентка начала лечиться ацетил-DL-лейцином по 1,5 г/день в течение первой недели и 3 г/день во вторую и последующие недели. Пациентке давали оценку после одного месяца и шести месяцев лечения соответственно. После лечения в течение одного месяца пациентка показывает улучшенную мелкую моторику с пониженным тремором рук, улучшенную постуральную стабильность и походку, улучшенное произношение и повышенную уверенность в себе. После лечения в течение шести месяцев пациентка имеет стабильное общее состояние, устойчивую походку и стояние и улучшенный почерк. Однако пациентка страдает от состояния тревоги, которая, как можно ожидать, отрицательно влияет на реакцию.
Оценки пациентки по SARA и SCAFI приводятся ниже.
Пример 16
В этом исследовании пациентом является женщина в возрасте немного за 60, которой генетически диагностирована спиноцеребеллярная атаксия (SCA) 1. До лечения у пациентки имелись серьезные проблемы с речью и глотанием, тремор обеих рук, спастичность и умеренная атаксия положения стоя и походки. У пациентки также имеются проблемы со сном.
После трехмесячного лечения ацетил-DL-лейцином (5 г/день) все симптомы значительно улучшились, как показала клиническая проверка, включая спастичность и ухудшение глазодвигательной функции.
Через три месца лекарственное лечение прекращают. Через две недели интенсивность признаков и симптомов стала такой же, как до терапии. Лечение начинают снова, и пациентка остается на лечении и затем продолжает его в течение двух лет в той же дозе без какого-либо побочного действия.
Дочь пациентки сообщает о значительном развитии заболевания со временем с устойчивым симптоматическим действием, которое еще наблюдается, что невероятно, при длительной симптоматической эффективности от лечения.
Пример 17
В этом исследовании пациентом является 70-летняя женщина с неуверенной походкой и частыми падениями, зрительными галлюцинациями по ночам, с расстройством REM. Пациентка имеет симметричный гипокинетико-ригидный синдром с ухудшением мелкой моторики и флуктациями внимания и осознавания.
У пациентки диагностировали деменцию с тельцами Леви. FDG-PET головного мозга показывает синаптическую дисфункцию в теменной и затылочной доле, и DATscan показывает дегенерацию пресинаптического транспорта дофамина, что поддерживает диагноз. Лечение леводопой, 100 мг 4 × в день, и кветиапином, 25 мг на ночь, улучшает симптоматологию.
Пациентка начинает принимать ацтеил-DL-лейцин (3 г/день в течение одной недели; затем 5 г/день), и ее состояние оценивают через четыре недели. Пациентка сообщает о возросшей усталости и нарушении равновесия и речи. Лекарственное лечение снижают до 3 г/день, и пациентку инструктируют по прекращению лекарственного лечения через две недели.
Пациентку снова проверяют примерно через один месяц после прекращения лекарственного лечения, и не регистрируют улучшения симптоматологии с пониженной дозой и ухудшения симптомов после прекращения лекарственного лечения.
Таблица 24. Параметры походки
Пример 18
В этом исследовании четыре пациента (братья) страдают от, и как позднее диагностировано, атаксии с глазодвигательной апраксией типа 4. Трем старшим братьям на момент начала заболевания было 12, 11 и 10 лет, соответственно. До начала лечения ацетил-DL-лейцином в возрасте 15/16 лет три старших брата ходили с приспособлением, как сообщила мать пациентов. Старшие братья начали лечение ацетиллейцином в возрасте 25, 23 и 19 лет, соответственно, и находились на лечении в течение приблизительно четырех лет. Нет доступных клинических данных за длительное время для этих трех пациентов.
Самому младшему брату было 11 лет на начало заболевания. Он начал лечение ацетил-DL-лейцином в возрасте 13 лет. На лечении самый младший брат не ходил с приспособлением до возраста около 18 лет, как сообщила мать пациента. Мать пациента также сообщила, что самый младший брат имел улучшенную мелкую моторику и улучшенную речь по сравнению с его старшими братьями. Нет доступных клинических данных за длительное время для самого младшего брата.
Пример 19
Тяжесть NPC у пациента можно оценить количественно клинической оценкой тяжести (CSS), которая оценивает различные параметры заболевания и дает оценку каждому параметру до 5 (большая оценка = большая тяжесть). См. Yanjanin et al., “Linear Clinical Progression, Independent of Age of Onset, in Niemann–Pick Disease, Type C,” Am. J. Med. Genet., Part B, 153B: 132–140. Для пациента, которого не лечат, обычно можно предсказать, как будет изменяться CSS у индивидуума со временем, так как оказывается, что развитие заболевания линейное. Например, если пациент А продвигается от CSS 8 к CSS 12 от 0 до 12 месяцев, можно предсказать, что в 36 месяцев пациент будет иметь CSS 20. Годовая оценка увеличения тяжести (ASIS) количественно определяет скорость изменения CSS за год, вычисляемую путем деления CSS пациента на возраст пациента. Например, если пациент В, которого не лечат, имеет CSS 8 в возрасте два года, ASIS пациента может составить 4. Можно ожидать, что каждый год у пациента CSS прогрессирует в 4 раза, так что в возрасте 4 года CSS пациента может стать 16. Если терапевтическое вмешательство замедляет или останавливает развитие заболевания, можно ожидать, что пациент после такой терапии будет иметь более низкую оценку ASIS, чем базовая.
Десяти пациентам с NPC вводят ацетиллейцин по 4,5 г/день в течение длительного периода. CSS определяют в начале (база) и в различные моменты времени для движения глаз, амбуляции, речи, глотания, мелкой моторики, познания, памяти и пароксизмов. Вычисляют общую CSS для базы и в каждый момент времени, складывая отдельные величины CSS для каждого параметра (движение глаз, амбуляция и т.д.). Число дней после начала терапии, когда определяют CSS, отличается для каждого пациента, как показано в таблице 25.
Таблица 25. Дни после начала введения ацетиллейцина, в которые оценивали CSS
Каждая из таблиц 26-34 ниже показывает CSS общую, для движения глаз, амбуляции, речи, глотания, мелкой моторики, познания, памяти и пароксизмов соответственно.
Таблица 26. Общая CSS
Таблица 27. CSS для движения глаз
Таблица 31. CSS для мелкой моторики
Таблица 32. CSS для познания
Таблица 33. CSS для памяти
Таблица 34. CSS для пароксизмов
ASSIS для базы и каждого момента времени вычисляют с использованием каждой CSS пациента и возраста на время оценки. Общая ASIS для каждого пациента в каждый момент времени приводится ниже в таблице 35.
Таблица 35. Общая ASSIS
Как видно из таблицы 26 и фигуры 10A, ни один из десяти пациентов не показывает общее повышение CSS в ходе эксперимента. Пациент 6 показывает повышенную CSS между базой и моментом времени 2, но возвращается к величине для базы в момент времени 3 и остается с ней на момент времени 4. Четверо из десяти пациентов (пациенты 2, 5, 6 и 7) имеют постоянную CSS в ходе эксперимента, что показывает, что у этих индивидуумов заболевание не прогрессирует. Шестеро из десяти пациентов (пациенты 1, 3, 4, 8, 9 и 10) показывают снижение CSS в ходе эксперимента, что показывает, что заболевание не прогрессирует и фактически становится менее тяжелым. Улучшения видны в различных субоценках: у пациента 1 для амбуляции; у пациента 3 для мелкой моторики; у пациента 4 для амбуляции и речи; у пациента 8 для движения глаз и мелкой моторики; у пациента 9 для памяти; у пациента 10 для познания. Данные, представленные на фигурах 11A-11J, показывают субоценки для каждого пациента соответственно в форме столбиковой диаграммы.
Как видно из таблицы 35 и фигуры 10В, все десять пациентов показывают снижение ASIS во время лечения относительно ASIS для базы. У пациентов 2, 5, 6 и 7 CSS остается такой же с возрастом, что приводит к небольшому снижению ASIS. У пациентов 1, 3, 4, 8, 9 и 10 снижение ASIS больше из-за снижения CSS с возрастом.
Пример 20
Мышиная модель болезни Ниманна-Пика типа C (NPC) делит ряд патологических особенностей с болезнью Альцгеймера (AD), как описано в настоящем описании. Мышей дикого типа NPC1-/- обрабатывают ацетил-dl-лейцином (0,1 г/кг массы тела в день) с возраста 3 недели. Мышей умервщляют в возрасте 8 недель. Оценивают уровни С-концевых фрагментов предшественника амилоидного белка (APP-CTF) относительно общих уровней предшественника амилоидного белка (APP) в мозжечке мышей дикого типа, необработанных мышей дикого типа NPC1-/- и AL-обработанных мышей дикого типа NPC1-/-. Также оценивают уровни конъюгата ассоциированный с микротрубочками белок 1A/3-фосфатидилэтаноламин 1β-легкой цепи (LC3-II) относительно уровней контроля с нагрузкой тубулина для мышей дикого типа, необработанных мышей дикого типа NPC1-/- и AL-обработанных мышей дикого типа NPC1-/-.
Данные APP-CTF приводятся на фигуре 12A. Данные повторяют отмеченное ранее накопление APP-CTF в головном мозгу мышей с NPC1. Обработка ацетил-dl-лейцином ассоциируется со снижением APP-CTF.
Данные LC3-II приводятся на фигуре 12B. Данные повторяют отмеченное ранее накопление LC3-II в головном мозгу мышей с NPC1. Обработка ацетил-dl-лейцином ассоциируется со снижением LC3-II, что указывает на частичное восстановление аутофагического потока.
Вывод
Обработка ацетиллейцином ассоциируется с улучшением в патологии AD в головном мозгу мышей с NPC1.

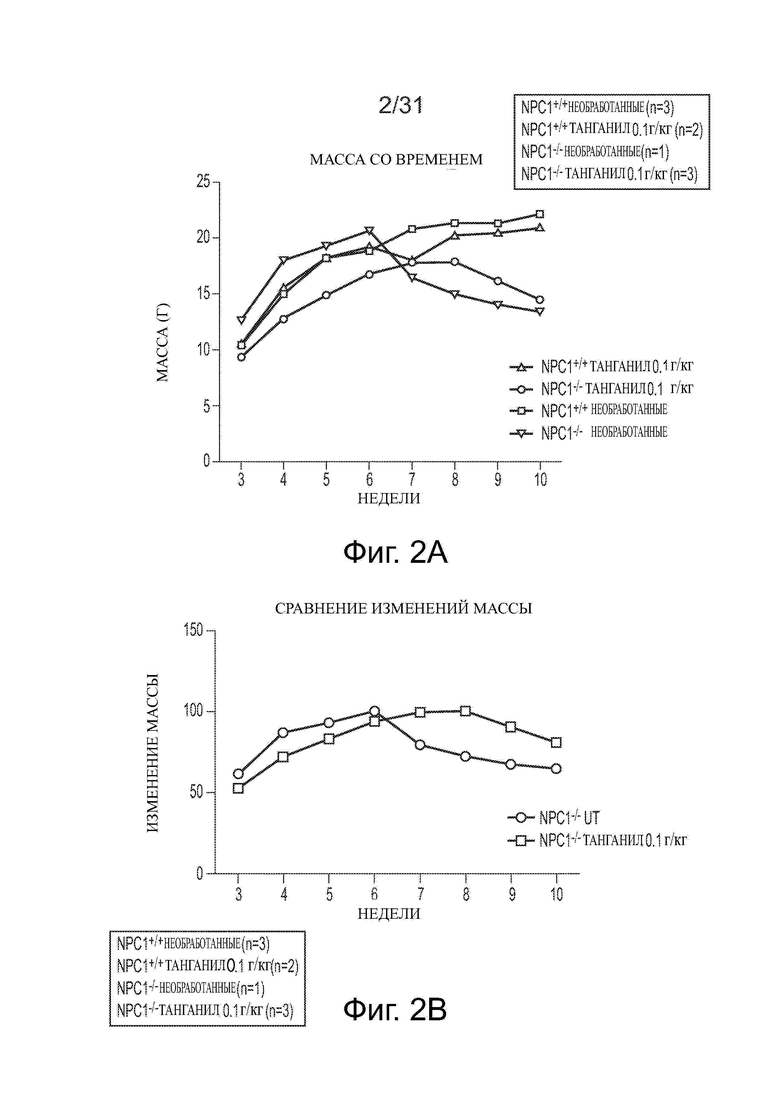
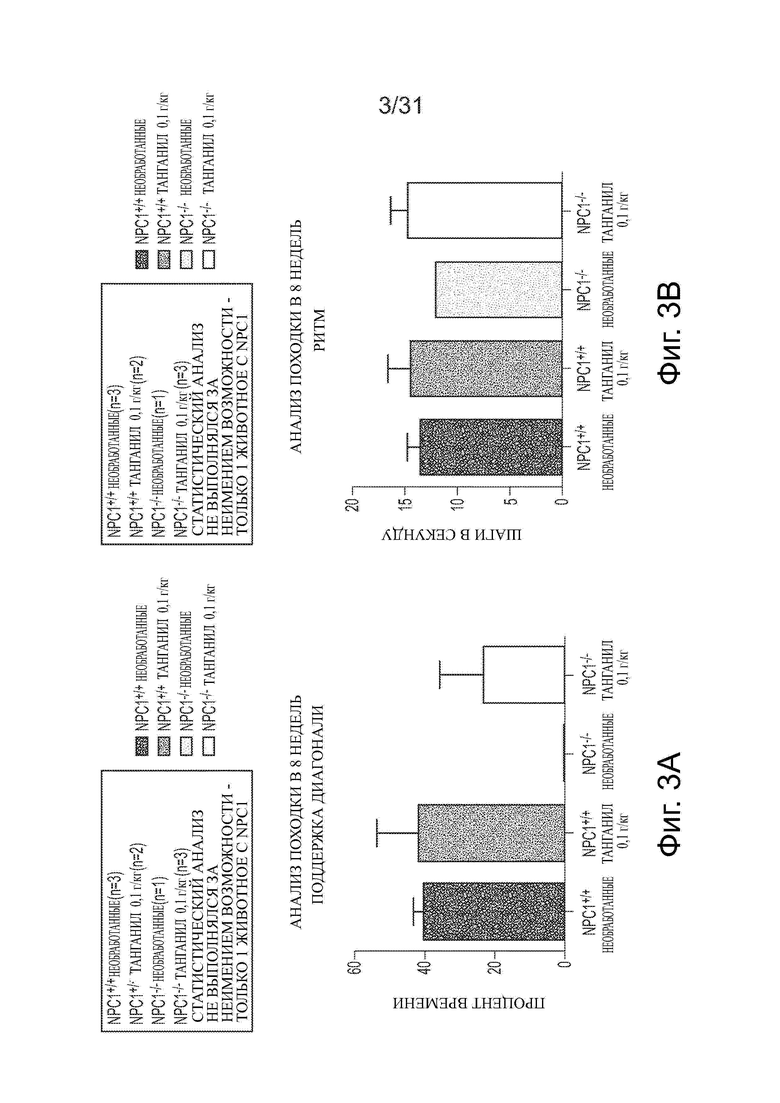
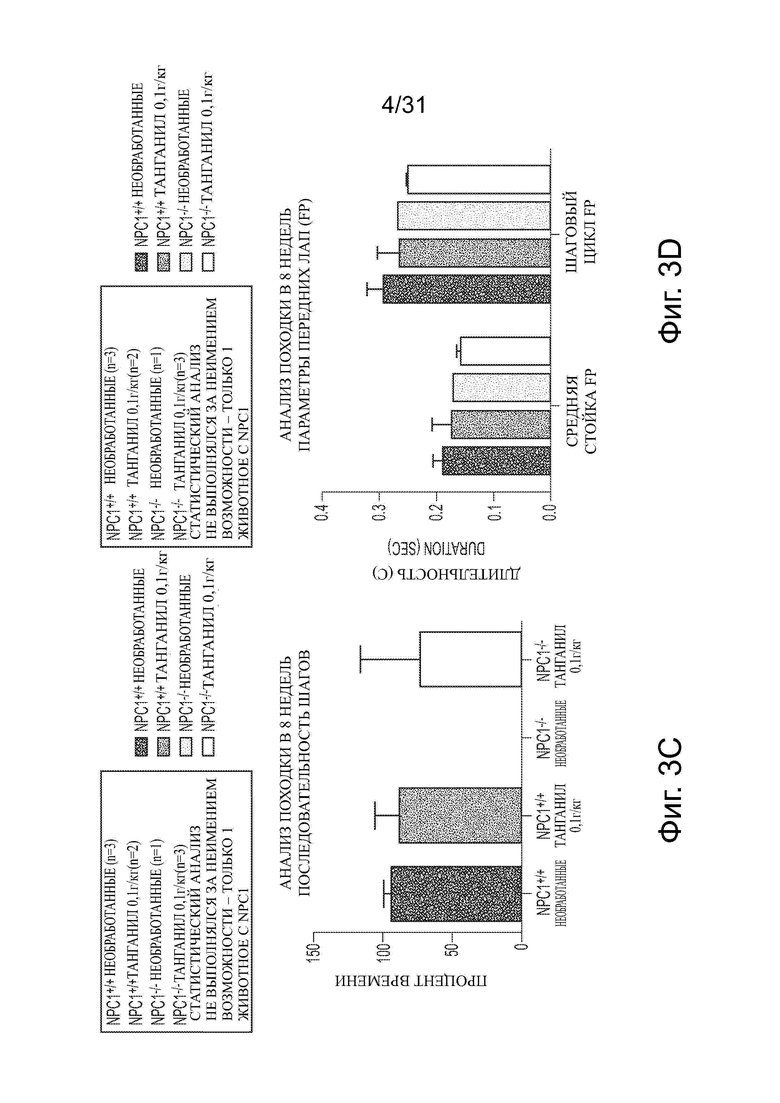
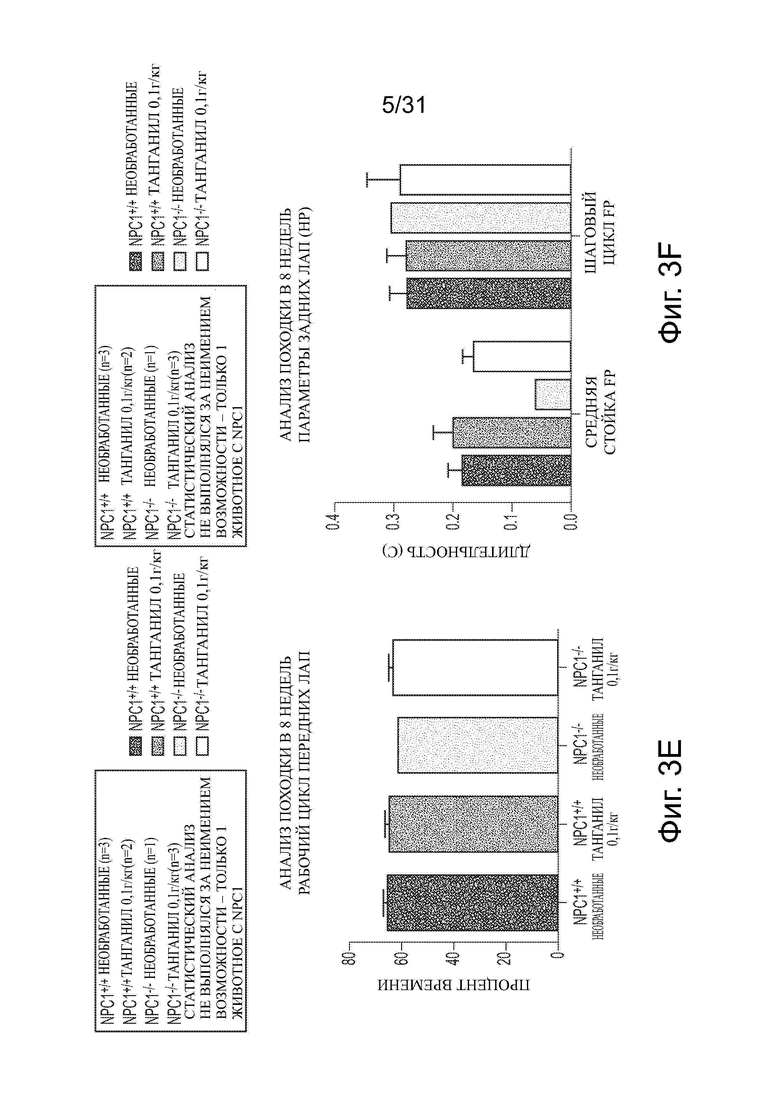
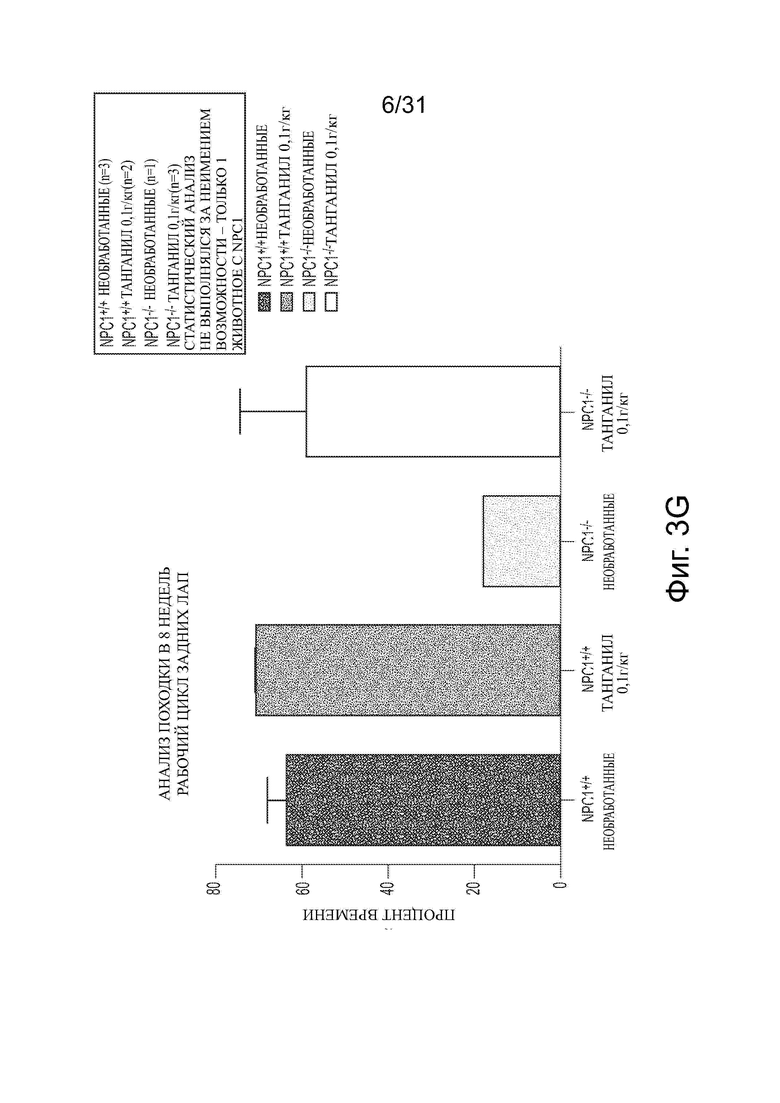
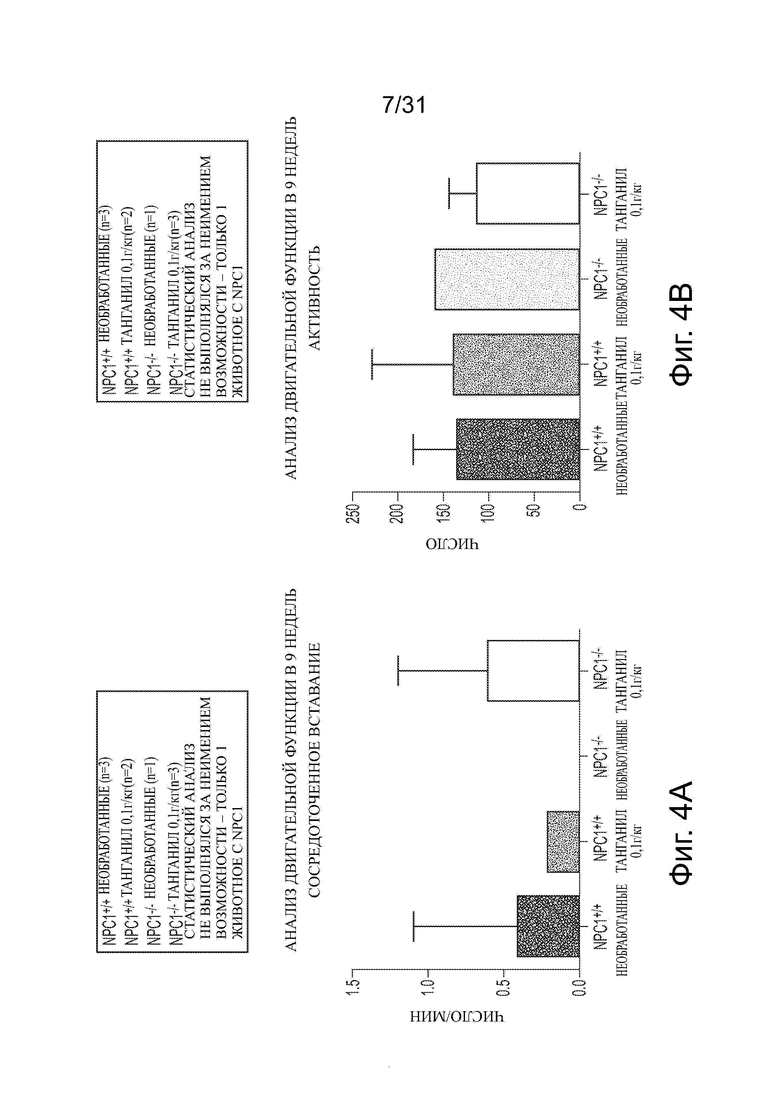
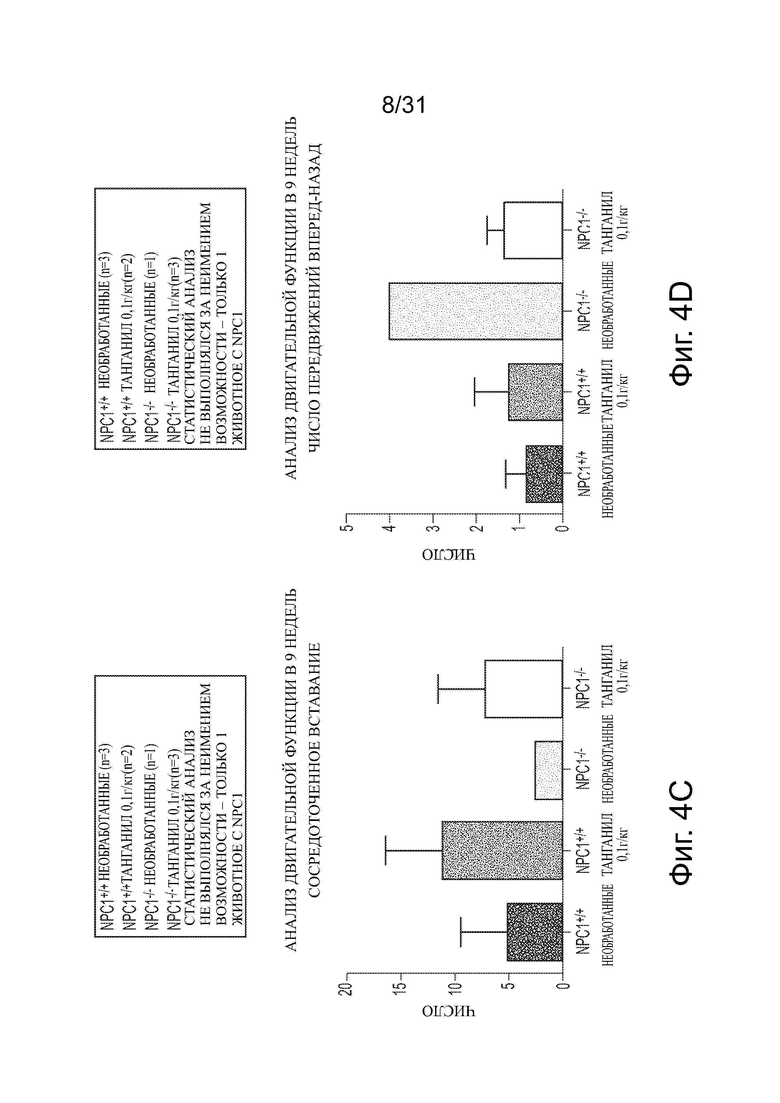
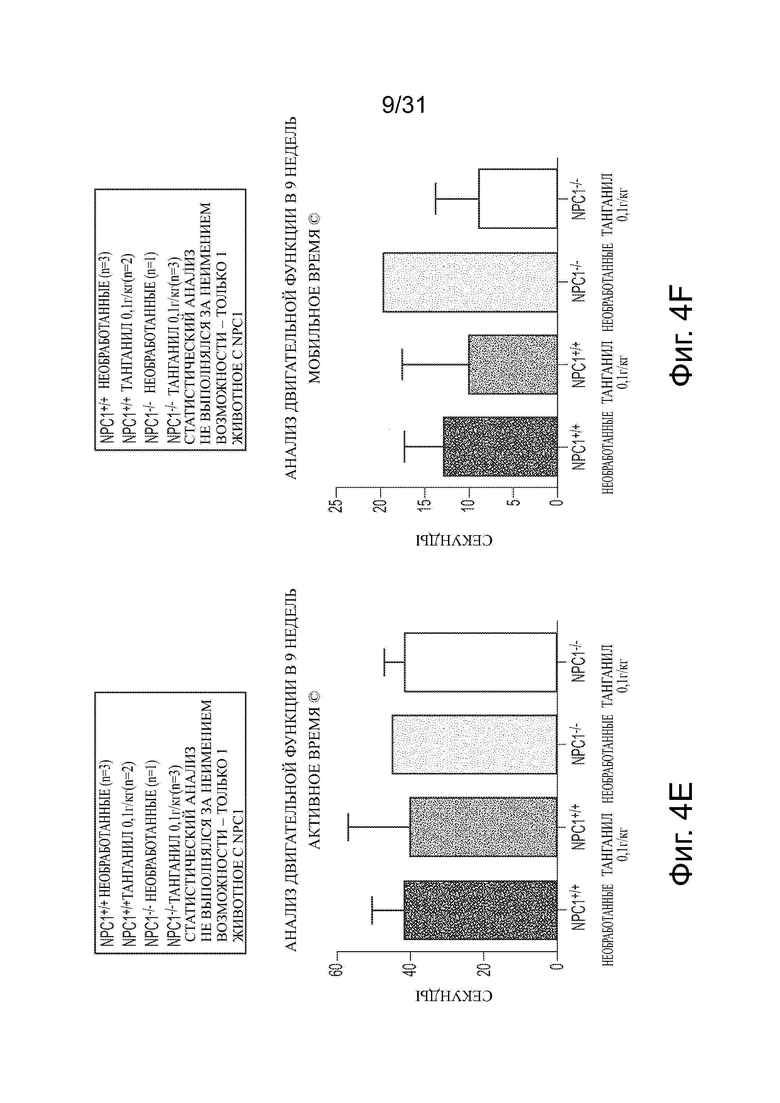
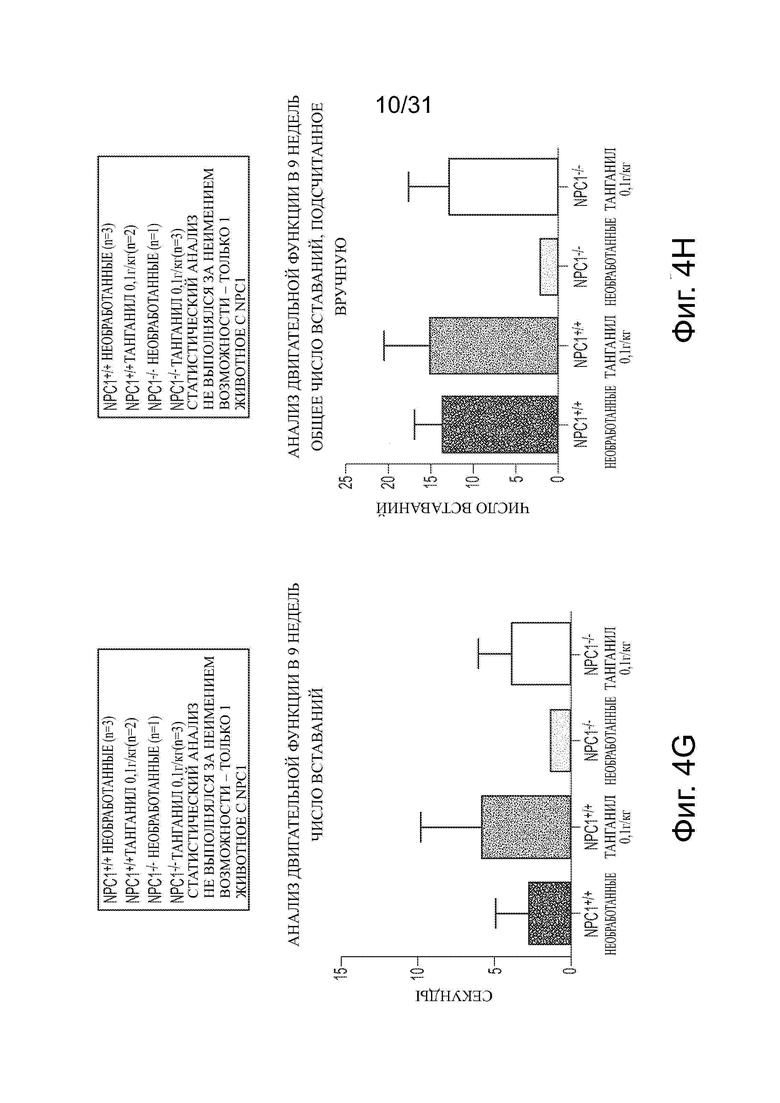
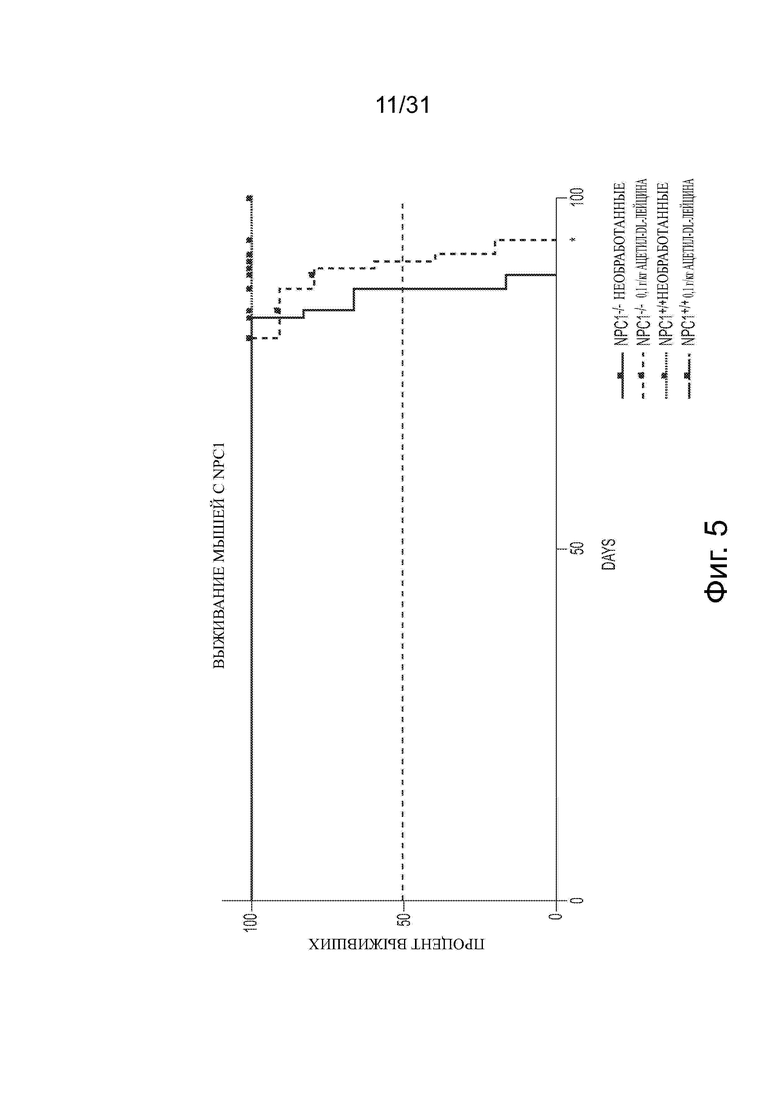
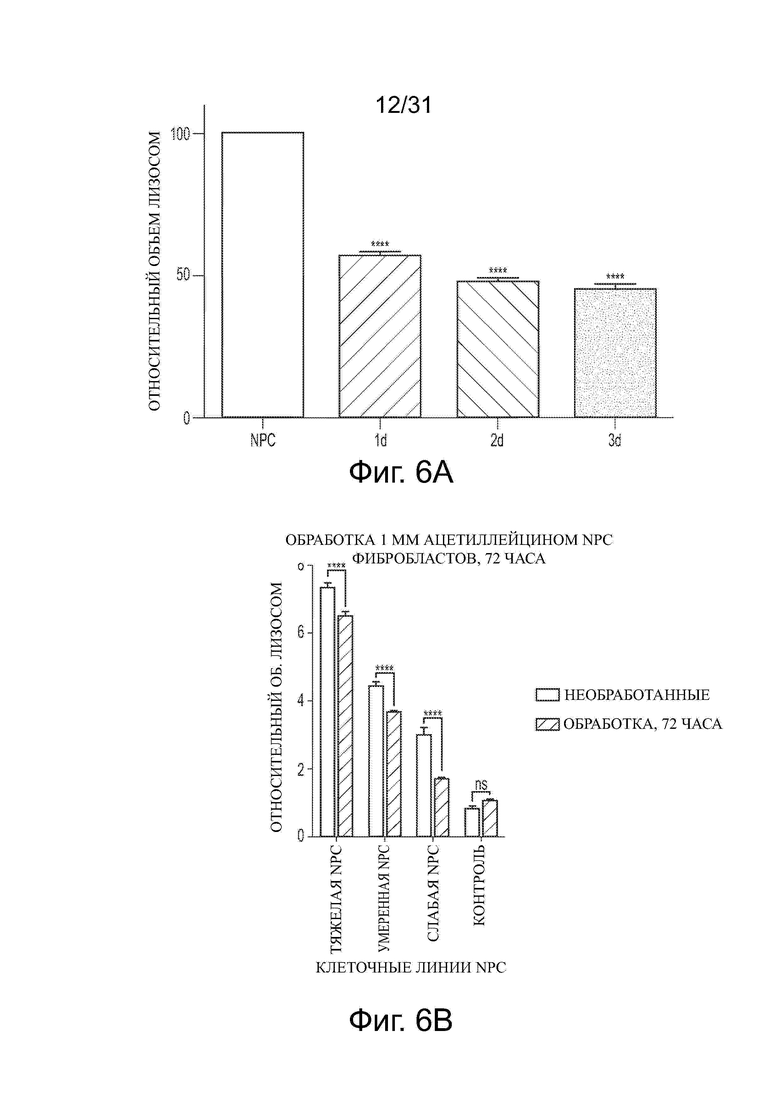
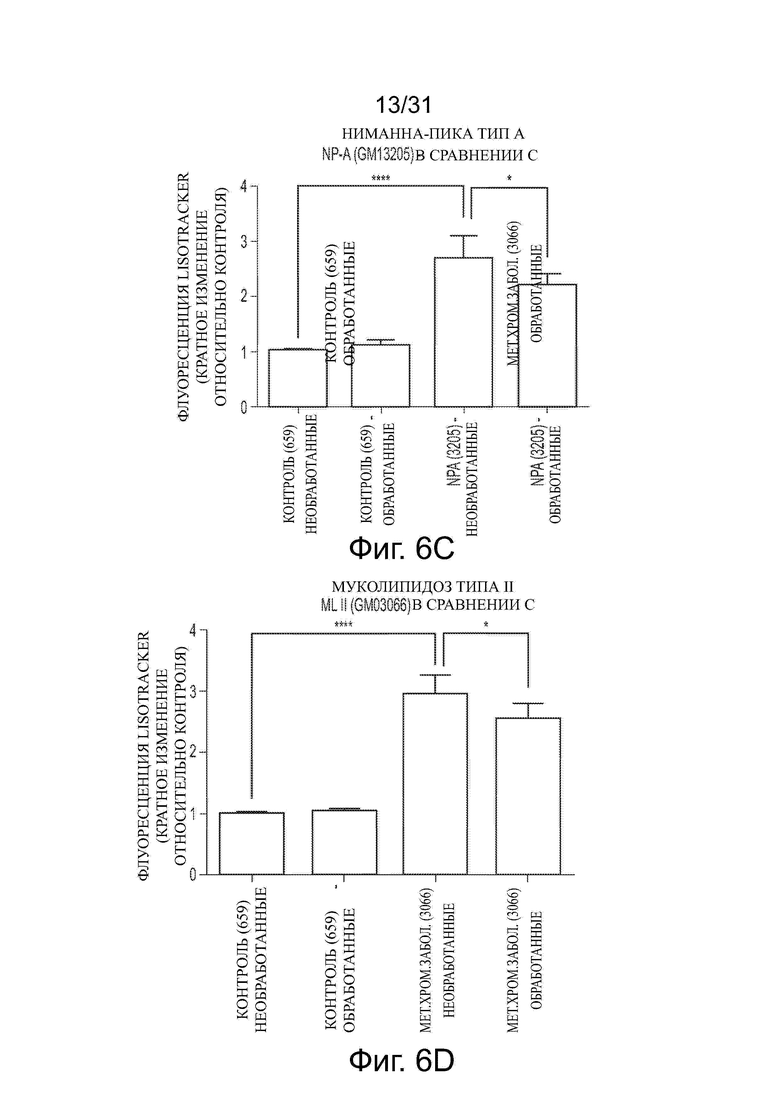
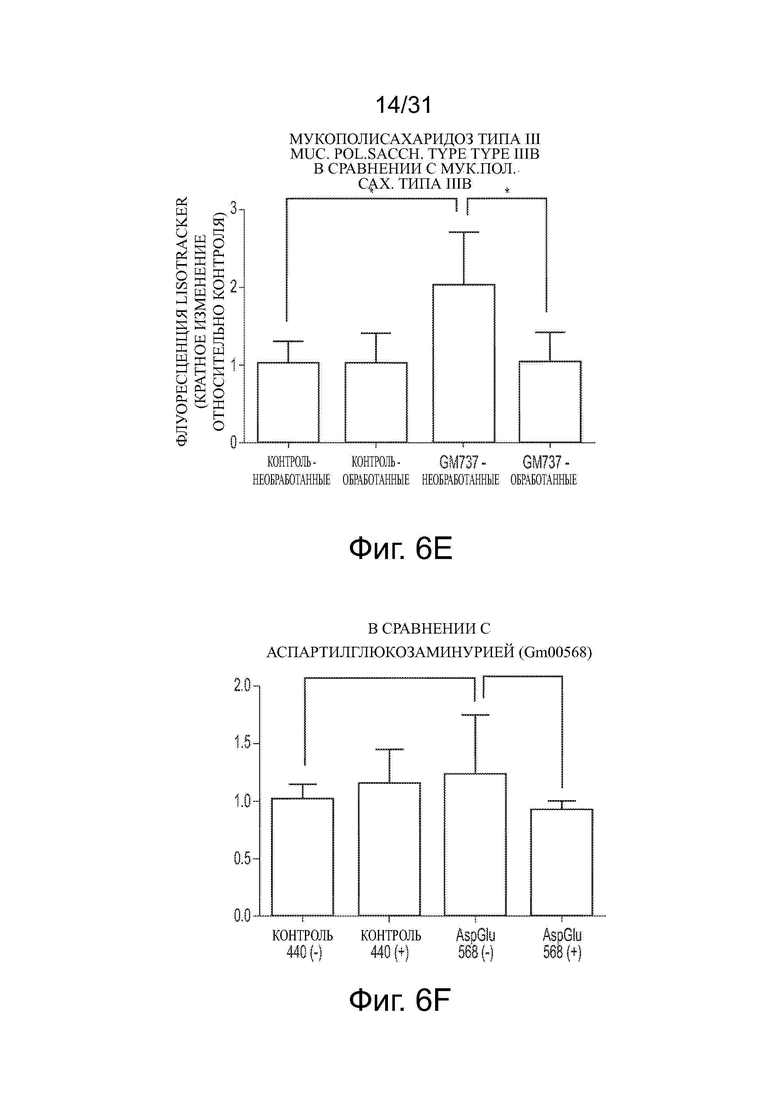
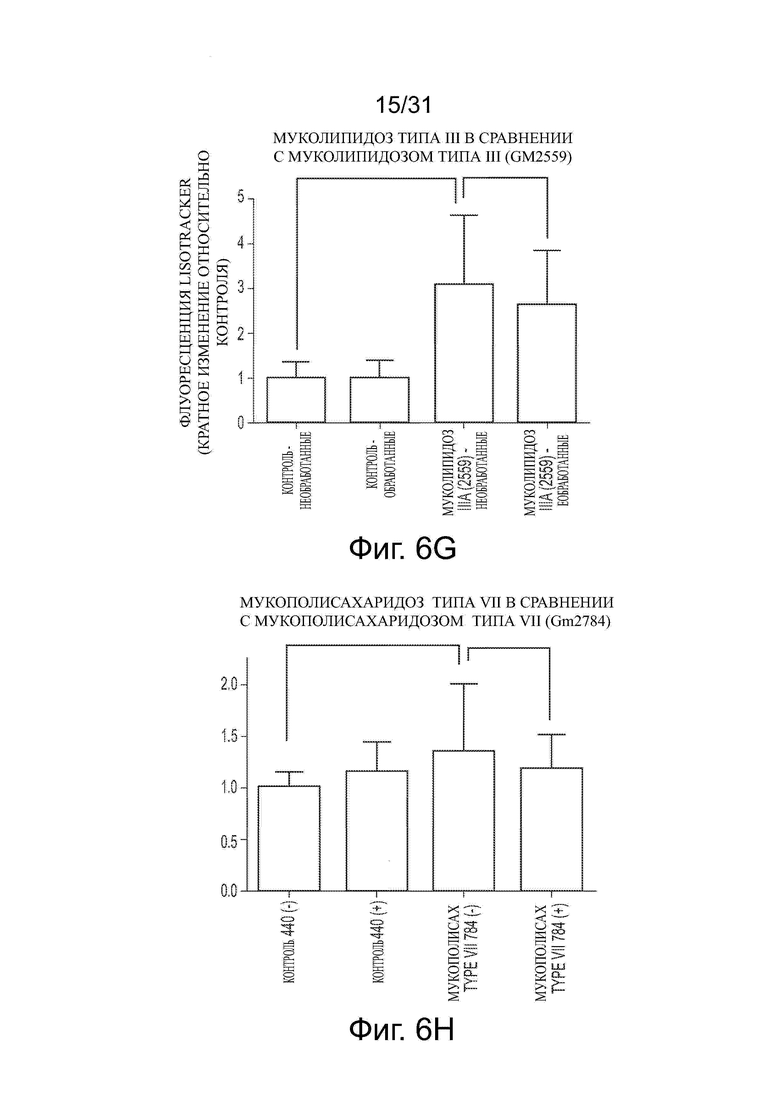
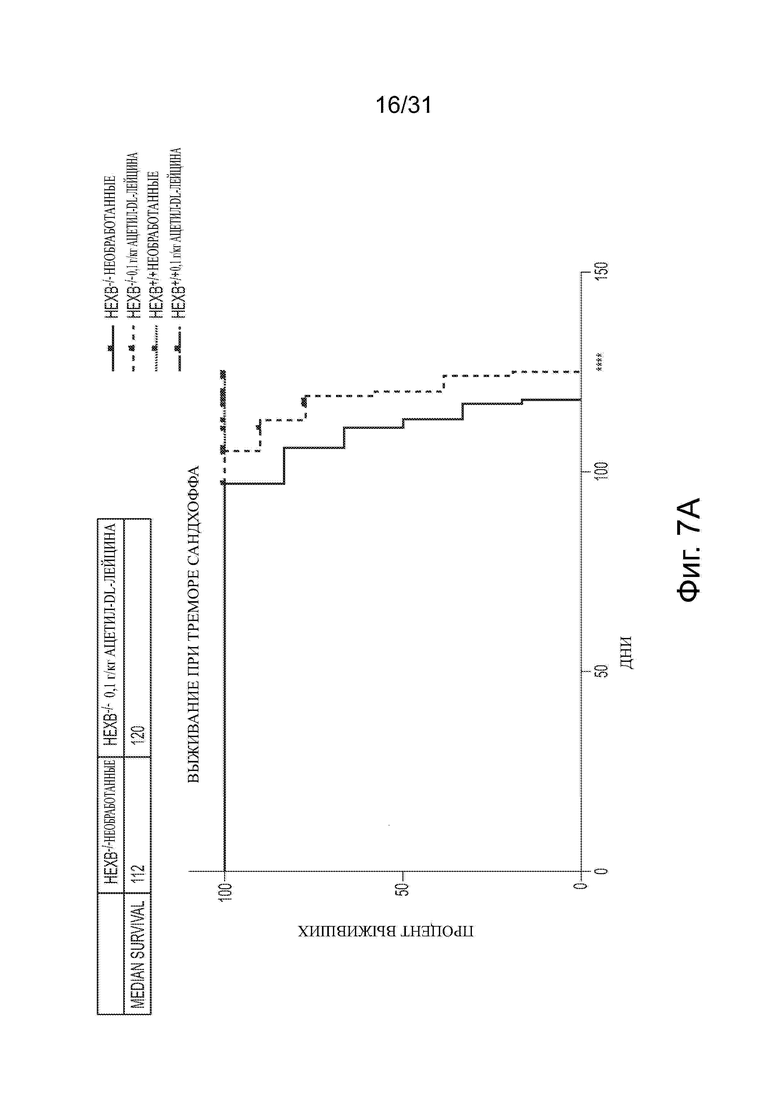
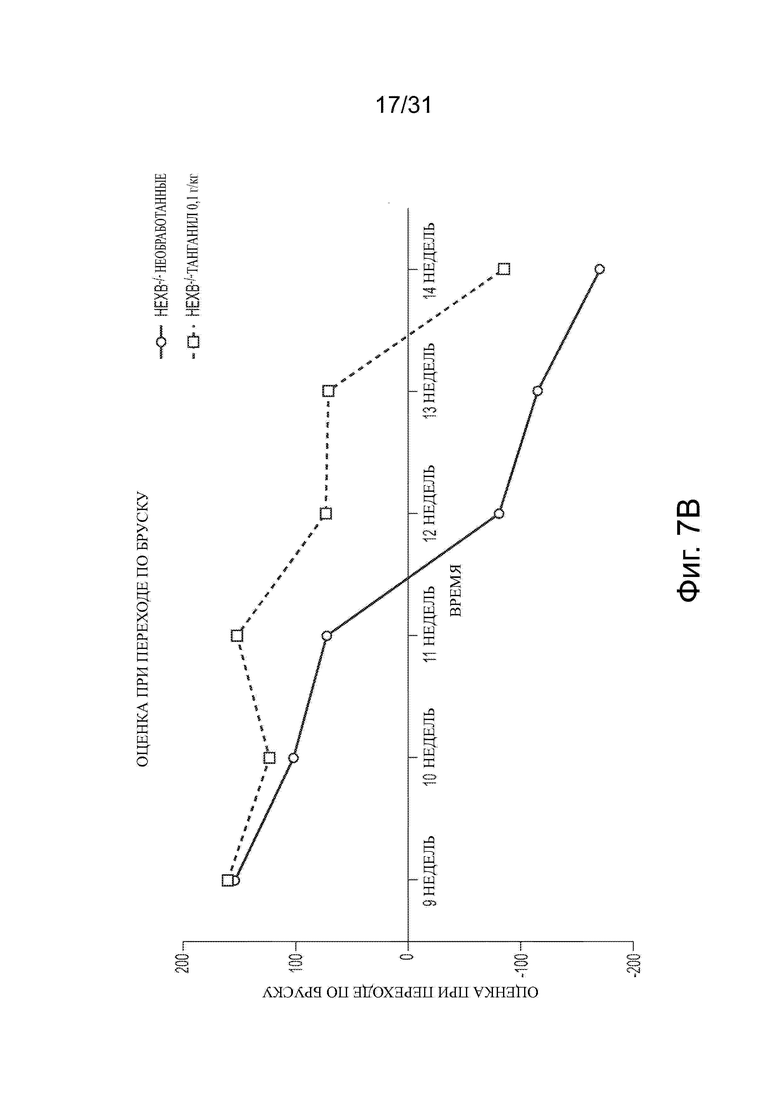
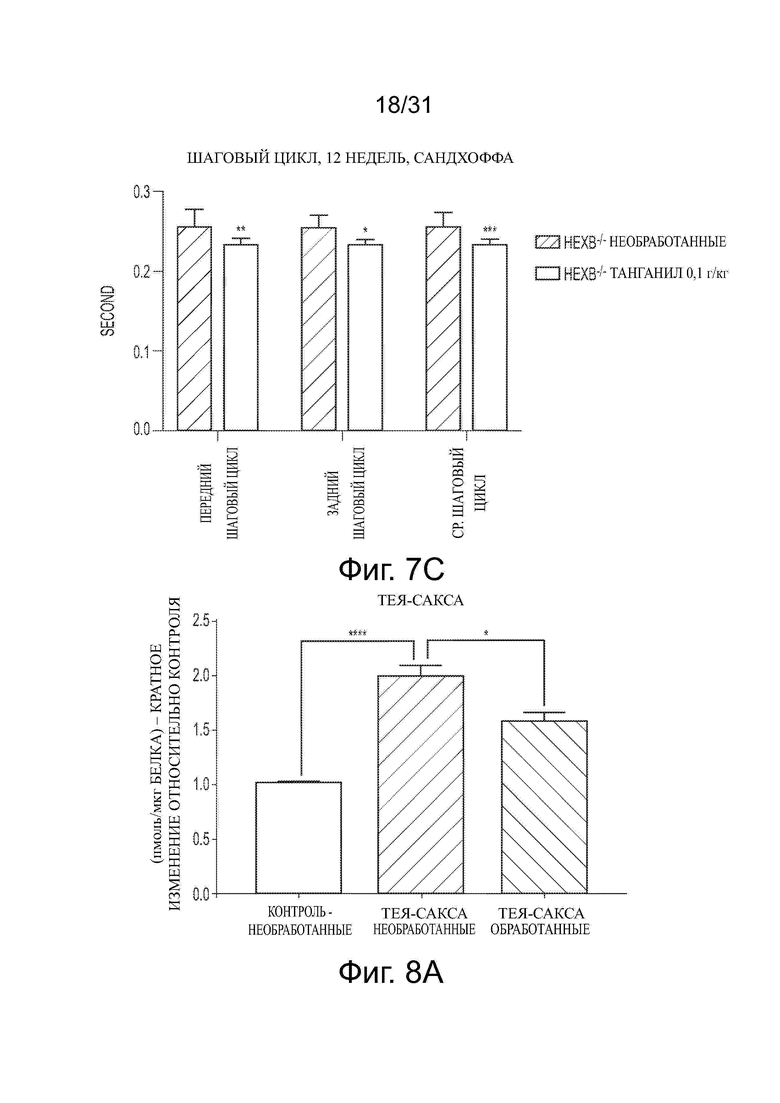
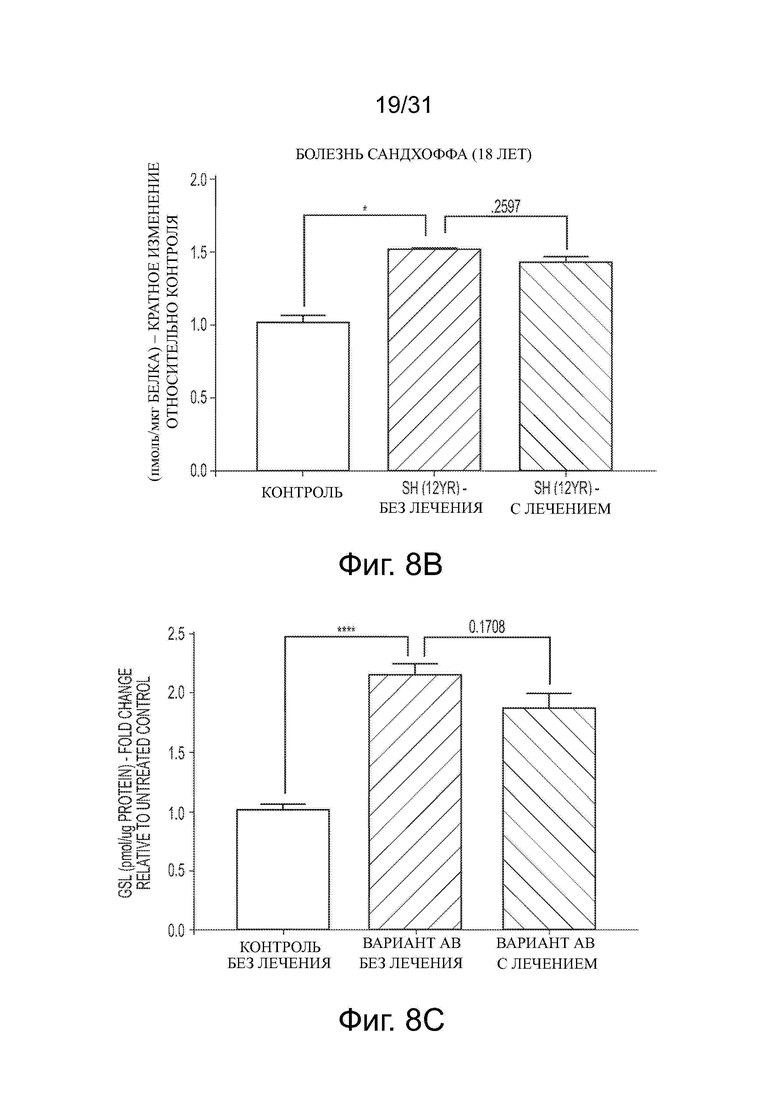
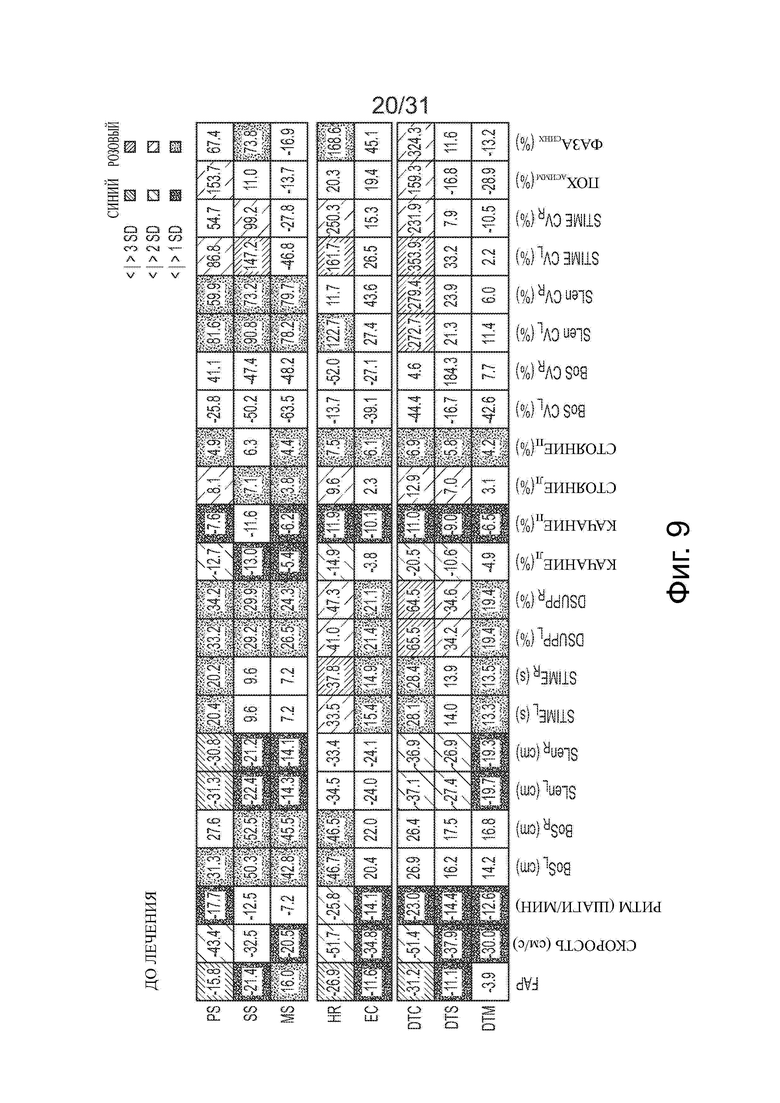

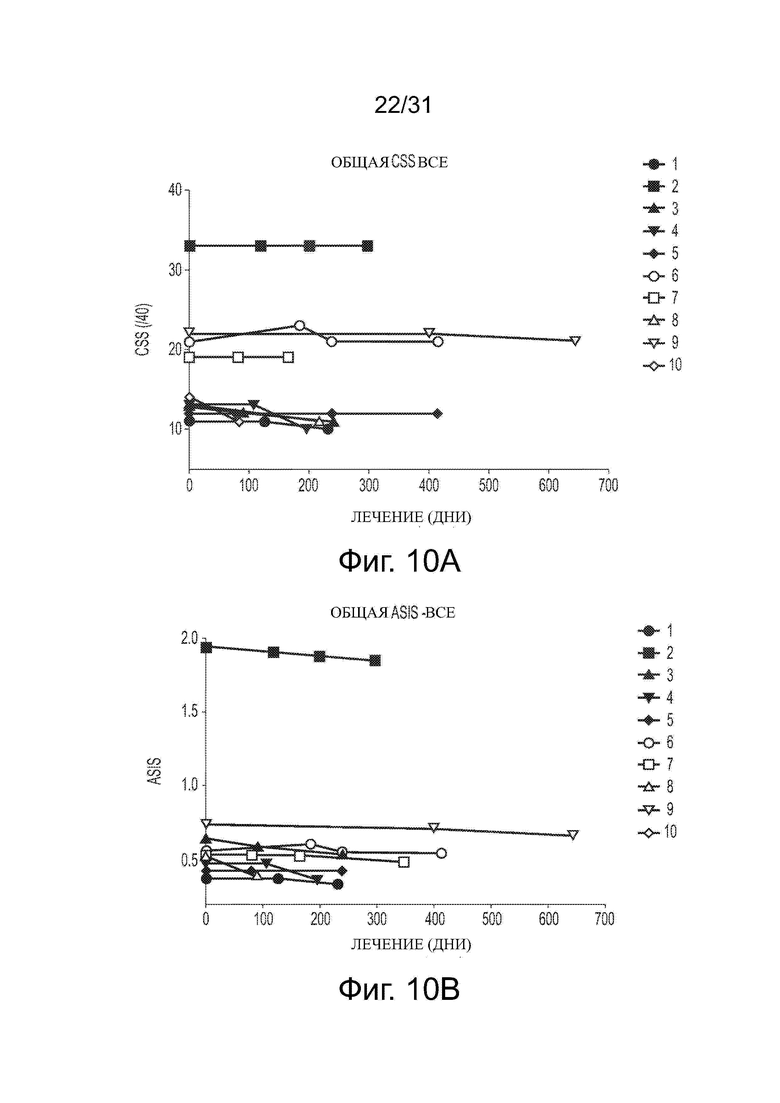
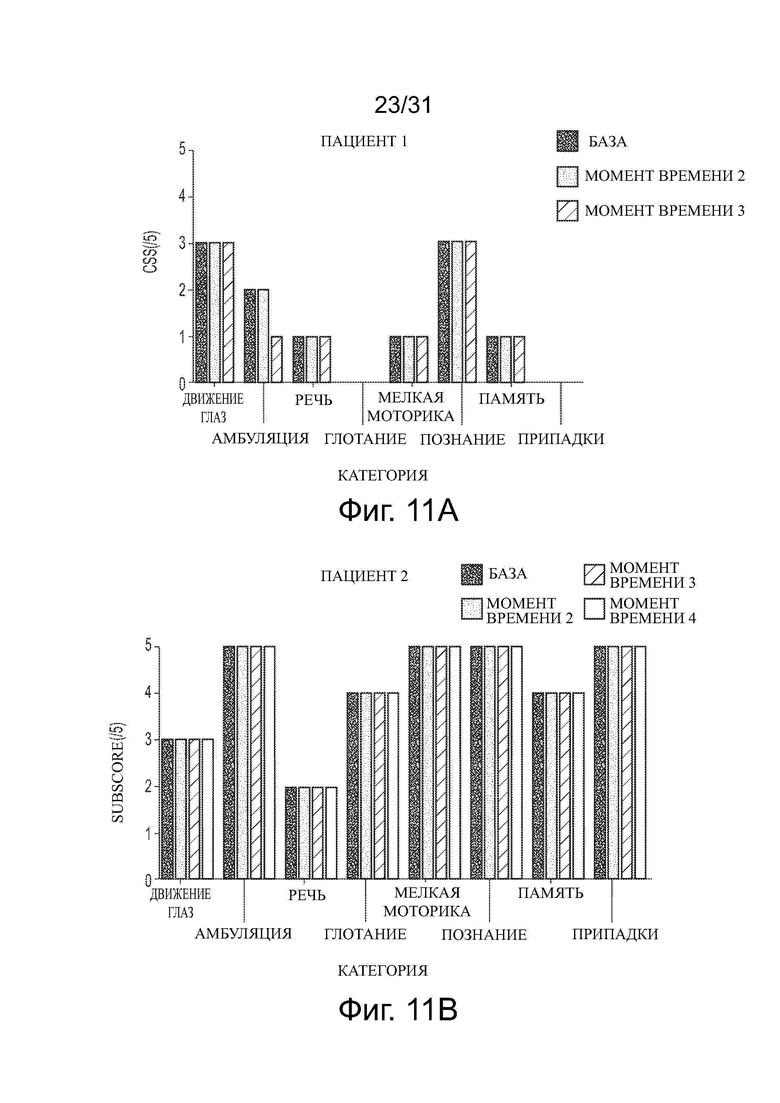
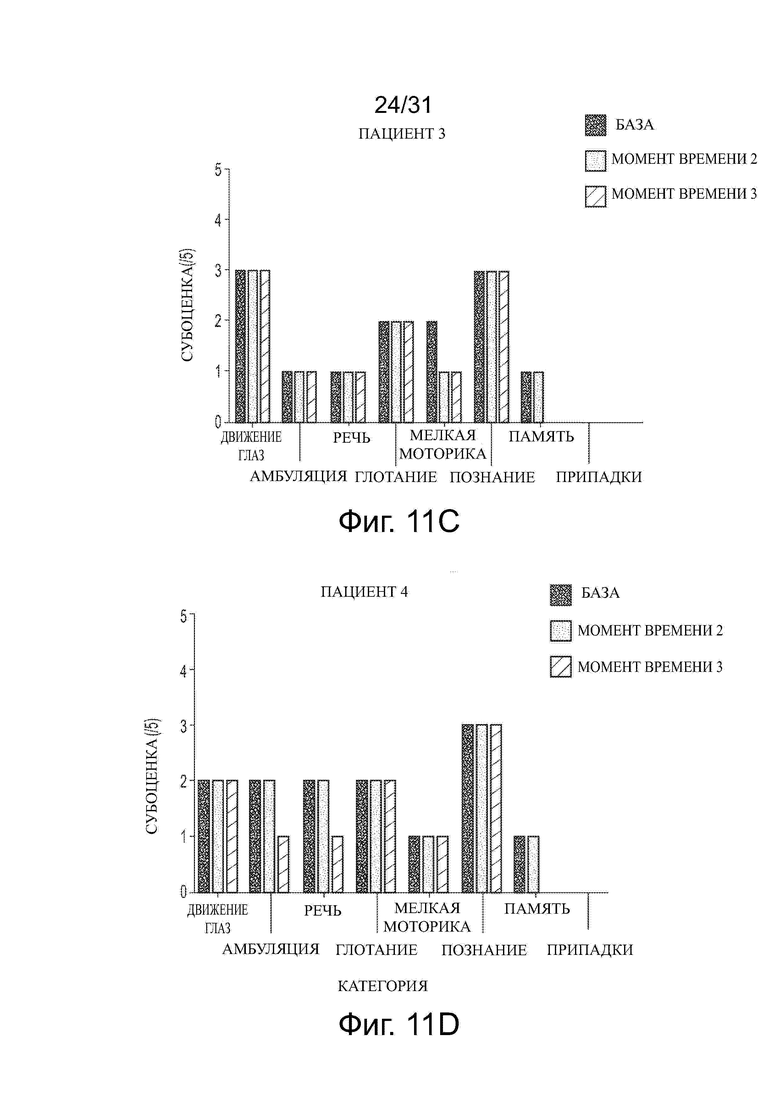
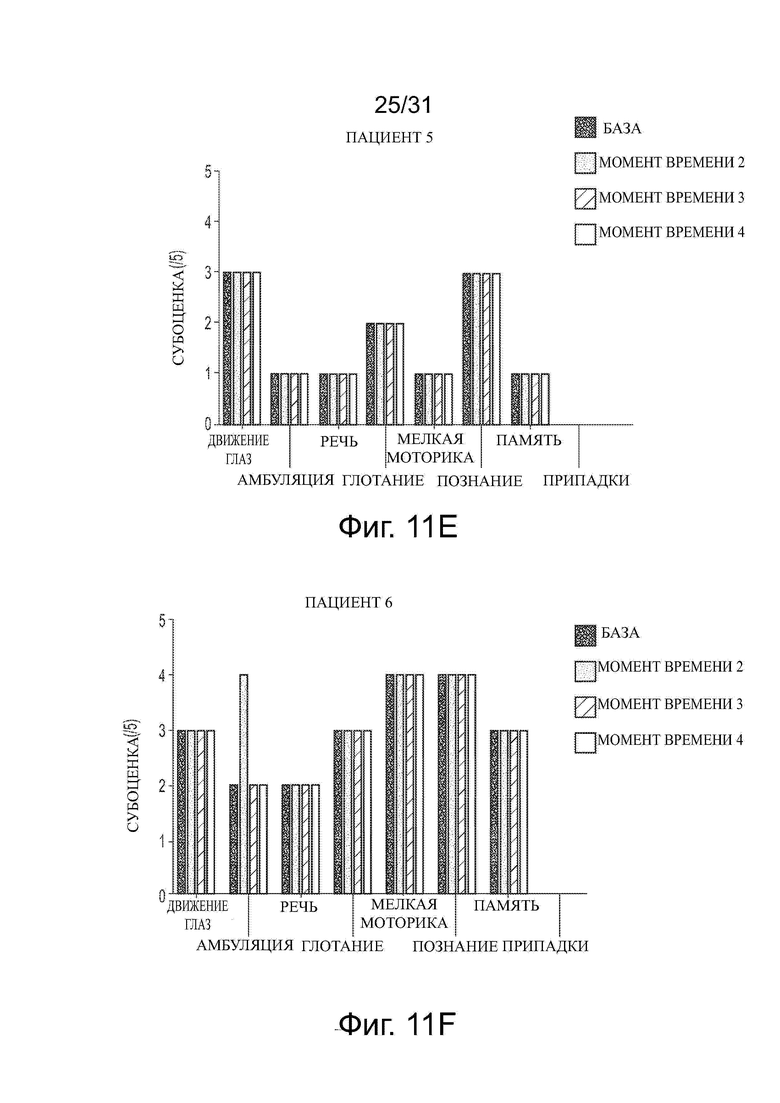
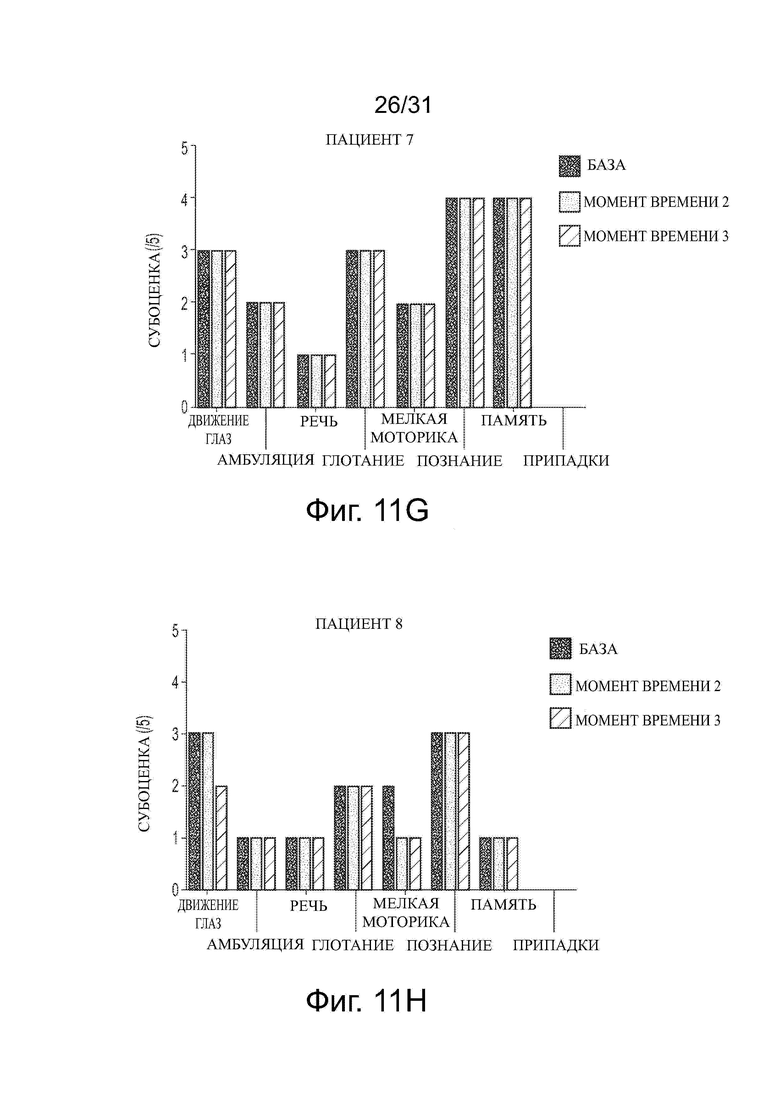
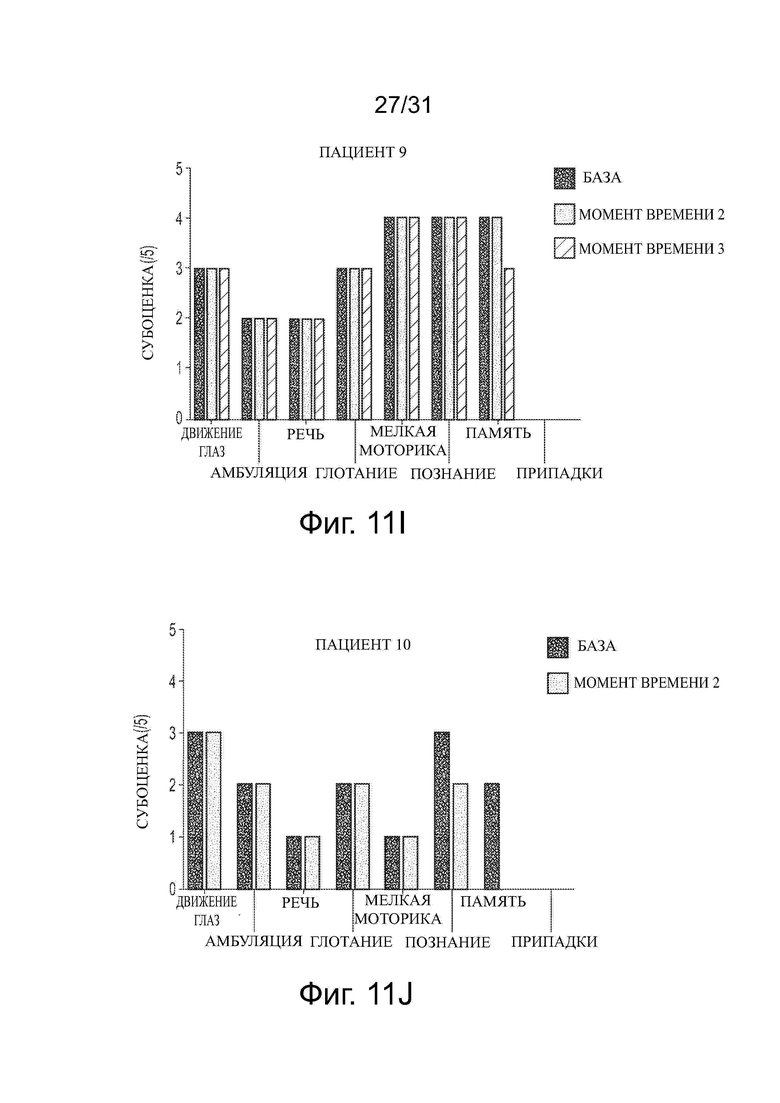
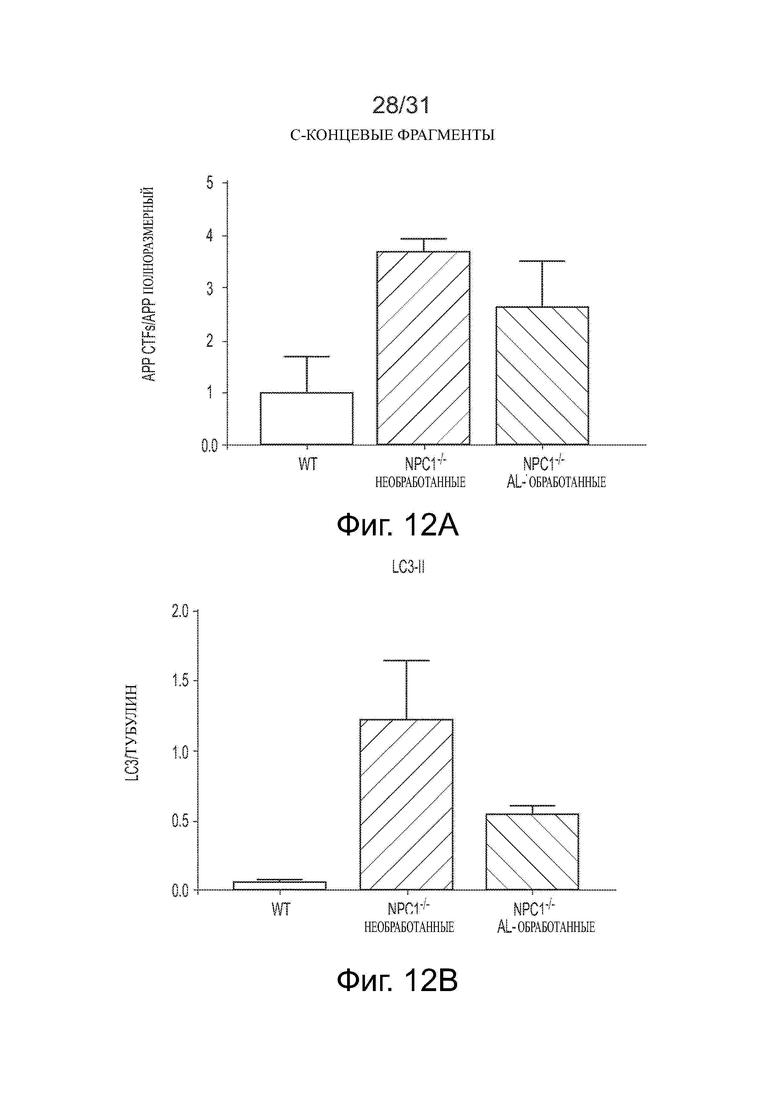
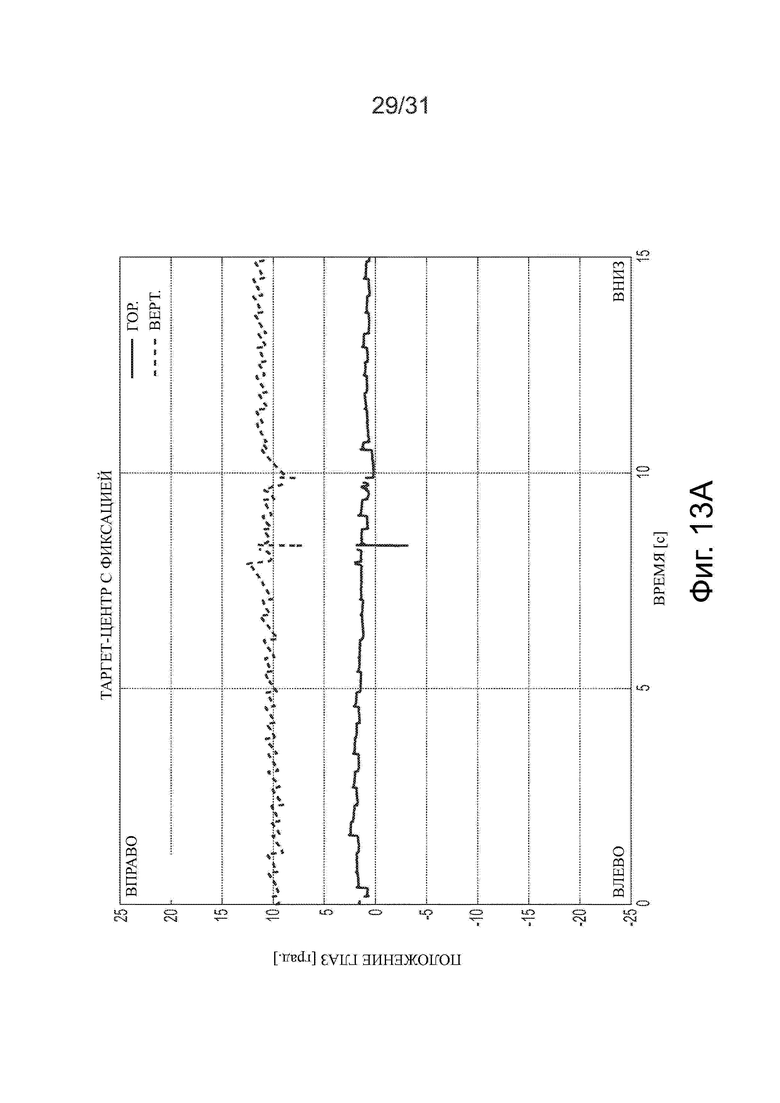
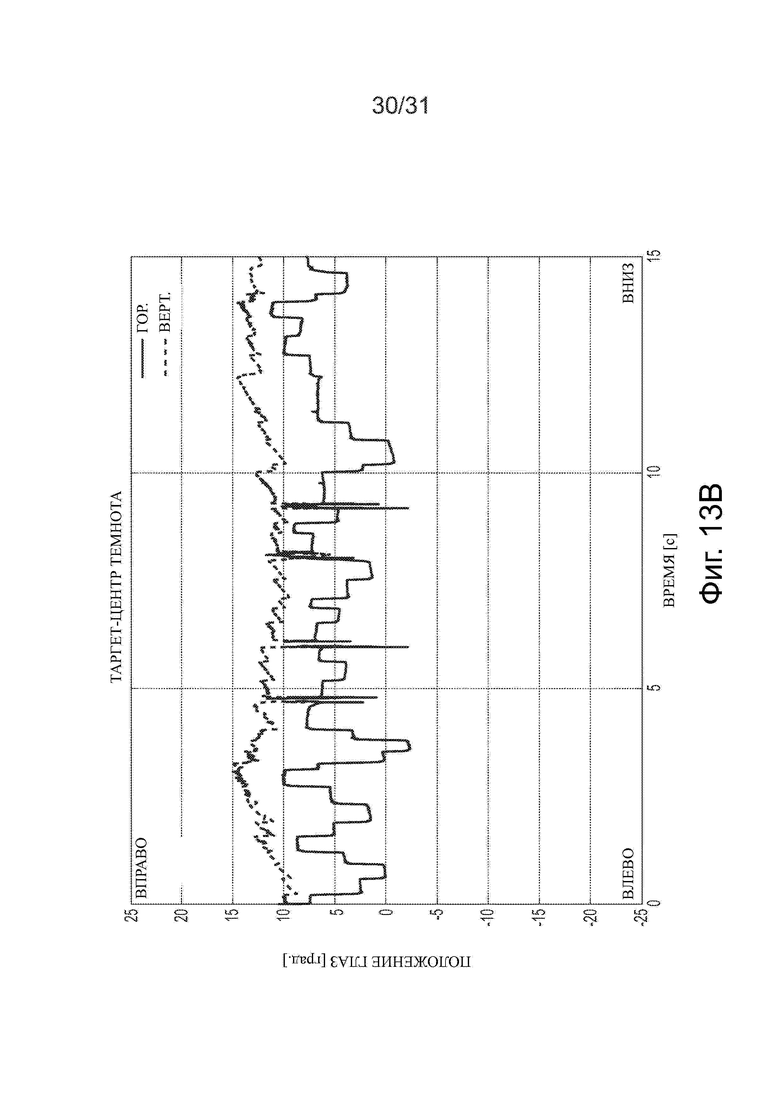
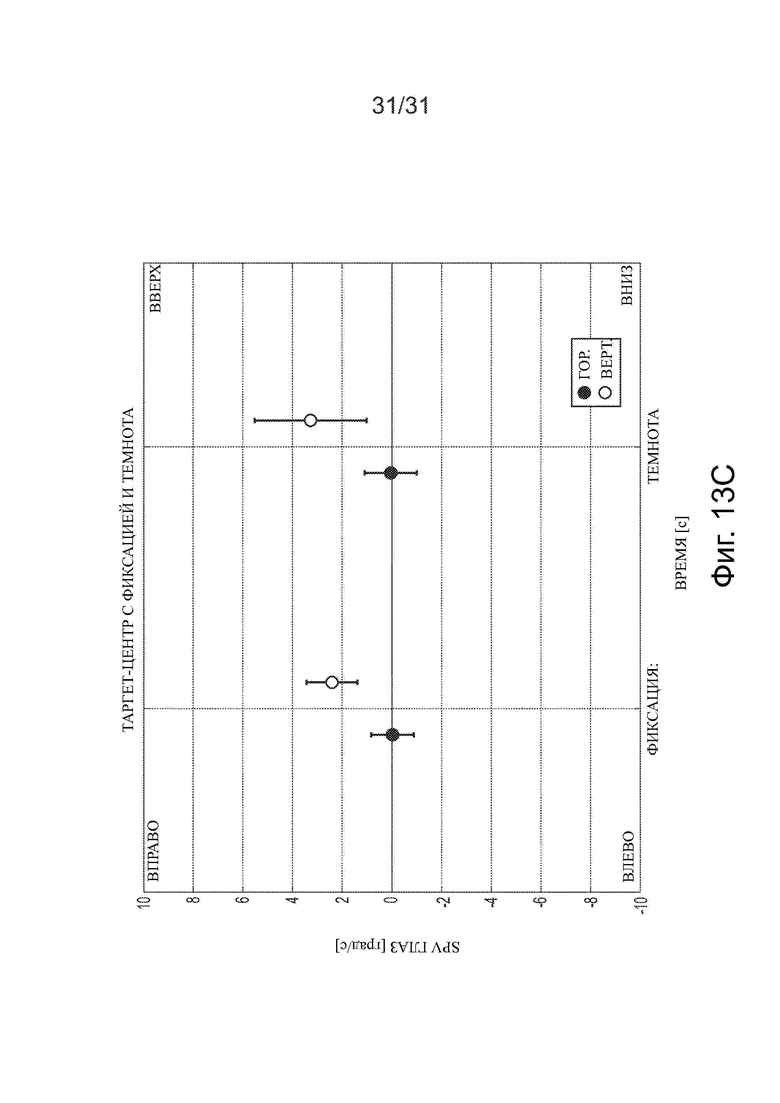
Изобретение относится к применению ацетиллейцина или его фармацевтически приемлемой соли в лечении нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, у субъекта, нуждающегося в этом. Нейродегенеративное заболевание выбрано из болезни Альцгеймера, бокового амиотрофического склероза (ALS), мультисистемной атрофии с доминирующим паркинсонизмом (MSA-P), мультисистемной атрофии мозжечкового типа (MSA-C), лобно-височной деменции с паркинсонизмом, прогрессирующего надъядерного паралича, кортикобазальной дегенерации, мозжечкового «бьющего» вниз нистагма, деменции с тельцами Леви и атаксии-телеангиэктазии (болезни Луи-Бар). Ацетиллейцин или его фармацевтически приемлемую соль вводят дважды в день для обеспечения полной дневной дозы от около 0,5 г до около 15 г. 16 з.п. ф-лы, 13 ил., 35 табл., 20 пр.
1. Применение ацетиллейцина или его фармацевтически приемлемой соли в лечении нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, у субъекта, нуждающегося в этом, причем нейродегенеративное заболевание выбрано из болезни Альцгеймера, бокового амиотрофического склероза (ALS), мультисистемной атрофии с доминирующим паркинсонизмом (MSA-P), мультисистемной атрофии мозжечкового типа (MSA-C), лобно-височной деменции с паркинсонизмом, прогрессирующего надъядерного паралича, кортикобазальной дегенерации, мозжечкового «бьющего» вниз нистагма, деменции с тельцами Леви и атаксии-телеангиэктазии (болезни Луи-Бар), и где ацетиллейцин или его фармацевтически приемлемую соль вводят дважды в день для обеспечения полной дневной дозы от около 0,5 г до около 15 г.
2. Применение по п. 1, в котором субъект является бессимптомным.
3. Применение по п. 1, в котором обнаружено, что у субъекта имеется генетический и/или биохимический маркер нейродегенеративного заболевания.
4. Применение по п. 1 для задержки появления указанного нейродегенеративного заболевания или одного или нескольких симптомов нейродегенеративного заболевания, которые в ином случае, как можно ожидать, проявятся согласно типичному развитию заболевания.
5. Применение по п. 1, в котором терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
6. Применение по п. 1 для задержки развития со временем указанного нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, по сравнению с типичным развитием заболевания, причем терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
7. Применение по п. 1 для реверсии развития со временем нейродегенеративного заболевания или одного или нескольких симптомов, связанных с нейродегенеративным заболеванием, причем терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
8. Применение по п. 1 для улучшения у субъекта, нуждающегося в этом, биохимического маркера нейродегенеративного заболевания со временем, причем терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
9. Применение по любому из пп. 1-8, где терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, когда субъект является бессимптомным.
10. Применение по п. 9, в котором начальное введение происходит после того, как обнаружат, что субъект имеет генетический и/или биохимический маркер нейродегенеративного заболевания.
11. Применение по любому из пп. 1-4, в котором терапевтически эффективное количество ацетиллейцина вводят субъекту, нуждающемуся в этом, в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
12. Применение по любому из пп. 1-11, в котором ацетиллейцин представляет собой ацетил-DL-лейцин.
13. Применение по любому из пп. 1-11, в котором ацетиллейцин имеет энантиомерный избыток или L-энантиомера, или D-энантиомера.
14. Применение по любому из пп. 1-4, в котором ацетиллейцин вводят субъекту, нуждающемуся в этом, в терапевтически эффективном количестве от примерно 0,5 г до примерно 15 г в день, от примерно 1 г до примерно 10 г в день, от примерно 1,5 г до примерно 7 г в день, от примерно 4 г до примерно 6 г в день или от примерно 4 г до примерно 5 г в день.
15. Применение по любому из пп. 5-11, в котором терапевтически эффективное количество ацетиллейцина составляет от примерно 0,5 г до примерно 15 г в день, от примерно 1 г до примерно 10 г в день, от примерно 1,5 г до примерно 7 г в день, от примерно 4 г до примерно 6 г в день или от примерно 4 г до примерно 5 г в день.
16. Применение по п. 1 для снижения тяжести нейродегенеративного заболевания или снижения тяжести или устранения одного или нескольких существующих симптомов, связанных с нейродегенеративным заболеванием, у субъекта, нуждающегося в этом.
17. Применение по п. 1 для обеспечения нейрозащиты у субъекта, имеющего подозрение на наличие или с риском появления нейродегенеративного заболевания, в котором субъекту, нуждающемуся в этом, вводят терапевтически эффективное количество ацетиллейцина в течение периода, выбранного из по меньшей мере примерно 3 месяцев, по меньшей мере примерно 6 месяцев, по меньшей мере примерно 1 года, по меньшей мере примерно 2 лет и по меньшей мере примерно 5 лет.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| R | |||
| SCHNIEPP et al., Acetyl-DL-leucine improves gait variability in patients with cerebellar ataxia-a case series, CEREBELLUM & ATAXIAS, 2016, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| T | |||
| BREMOVA et al., Acetyl-DL-leucine in Niemann-Pick type C: A case series, NEUROLOGY, 2015, vol | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| ПАРО-ГАЗОВЫЙ ДВИГАТЕЛЬ | 1924 |
|
SU1368A1 |
Авторы
Даты
2021-10-01—Публикация
2017-08-11—Подача