Область техники:
Изобретение относится к области мониторинга и диагностирования параметров воды при ее очистке, в частности отслеживания остаточного ресурса элементов промышленного объекта.
Например, для определения концентрации фенола в сточных водах нефтеперерабатывающего предприятия.
Уровень техники:
Одним из загрязняющих агентов, полученных в результате промышленной деятельности, является фенол. Фенол - побочный продукт промышленных процессов в различных отраслях промышленности, таких как нефтеперерабатывающая, газовая и коксохимическая промышленность, фармацевтика, производство взрывчатых веществ, производство фенолформальдегидных смол, производство пластмасс и лаков [1]. В связи с описанным выше, законы большинства стран ограничивают концентрацию фенолов в воде. При этом, для уменьшения влияния фенола на экосистему его концентрация в сточных промышленных водах также регламентирована. Допустимый предел содержания фенола составляет 1 мг/л для сброса промышленных стоков во внутренние поверхностные воды (IS: 2490-1974) и 5 мг/л для сброса в городскую канализацию (IS: 3306-1974) [2].
Для определения концентрации фенола в воде требуется быстрая, точная и чувствительная процедура. Эталонный метод основан на оксислительной реакции с 4-аминоантипирином (4-ААП) и измерении поглощения при 510 нм [3], при этом нижний предел обнаружения составляет 0,5 мкг/л при экстракции хлороформом и 1 мкг/л при прямом фотометрическом методе. Этот метод имеет недостатки: не может определять паразамещенные фенолы, а также требует предварительной перегонки пробы для отделения мешающих веществ и необходима дополнительная экстракция с применением органических растворителей, что значительно уменьшает скорость проведения анализа [4] (время экстракции от 1 до 2 часов).
Многие методы жидкостной или газовой хроматографии обладают низким пределом обнаружения и высокой селективностью, но при этом увеличивают время проведения анализа (от 30 до 200 мин) за счет многоэтапного отбора проб, необходимого для данного типа метода [5-8]. Разработка биосенсоров на базе микроорганизмов [9], иммобилизованных ферментов [10, 11] лишена этих недостатков и позволяет быстро проводить анализ, но либо обладает недостаточной чувствительностью (56 мкг/мл - 2,5 мг/мл), либо сложны в приготовлении/производстве и требуют дополнительного тех обслуживания.
Таким образом, для мониторинга концентрации фенола в промышленных сточных водах, требующего использования простых, быстрых и недорогих методов анализа, необходима разработка новых методов его детекции. В связи с чем, целью нашей работы является создание диагностической системы на базе иммобилизованной пероксидазы в СаСО3 микросферолите методом копреципетации [12].
Раскрытие изобретения:
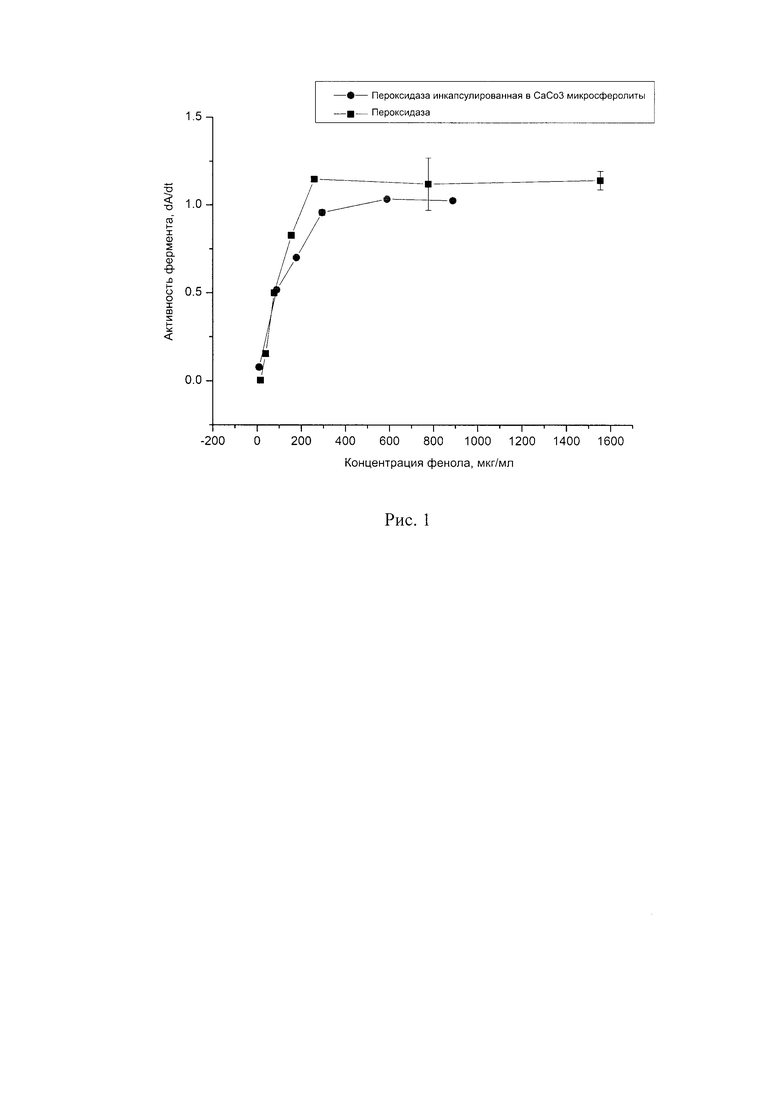
Диагностическую система представляет собой инкапсулированную пероксидазу в СаСО3 микросферолатих методом копреципитации. Каталитические характеристики пероксидазы иммобилизованной методом копреципитации в СаСО3 микросферолитах не отличаются от характеристик нативного фермента (рис. 1 Зависимость скорости ферментативного окисления фенола от его концентрации.).
Константы Михаэлиса равны 94 для свободного фермента и 90 для иммобилизованной. Данные значения практически совпадают, что говорит о том, что процесс инкапсуляции не влияет на его каталитическую функцию.
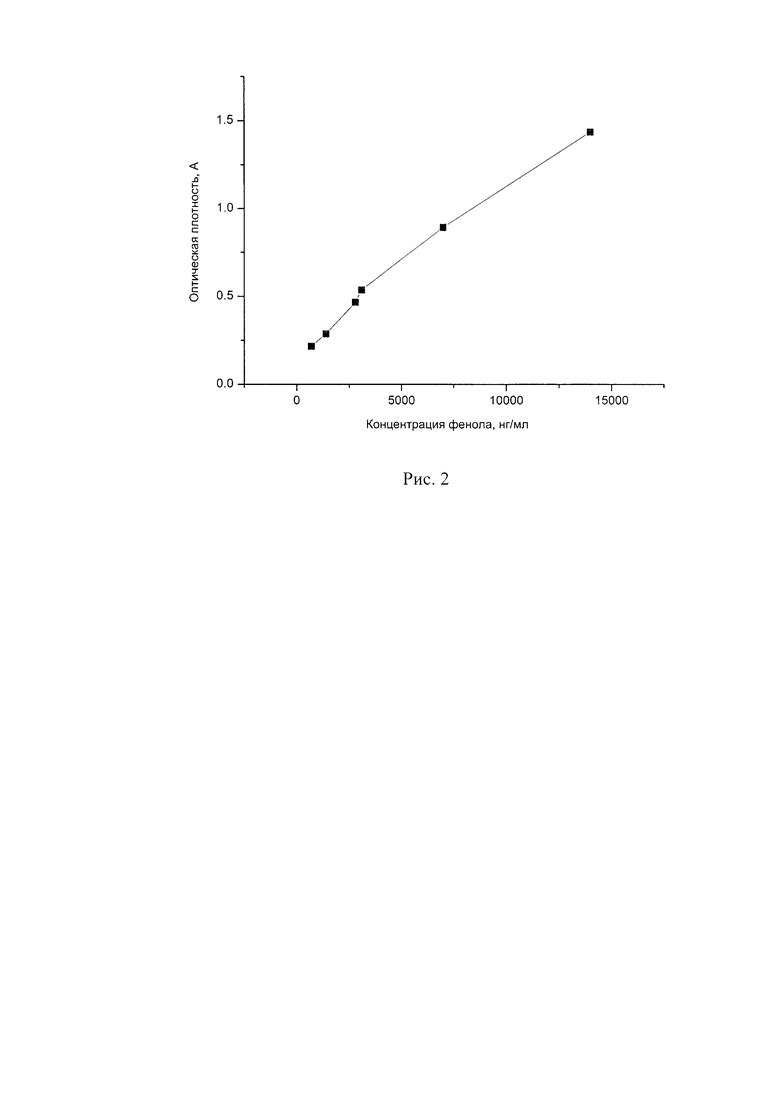
Линейный диапазон определяемых концентраций фенола при помощи иммобилизованной пероксидазы на СаСО3 микросферолитах представлен на рисунке 2 (Зависимость оптической плотности анализируемого раствора от концентрации фенола в нем через 10 минут инкубации). На рисунке представлена зависимость оптической плотности анализируемого раствора от концентрации фенола в нем через 10 минут инкубации иммобилизованной пероксидазы на СаСО3 микросферолитах.
Из рисунка видно, что оптическая плотность линейно возрастает с ростом концентрации фенола, при стандартном отклонении не превышающем 2%. Данный факт позволяет нам сделать вывод о том, что содержащие пероксидазу микросферолиты СаСО3 могут быть использованы для анализа содержания фенола в воде в диапазоне концентраций от 700 нг/мл до 14 мкг/мл.
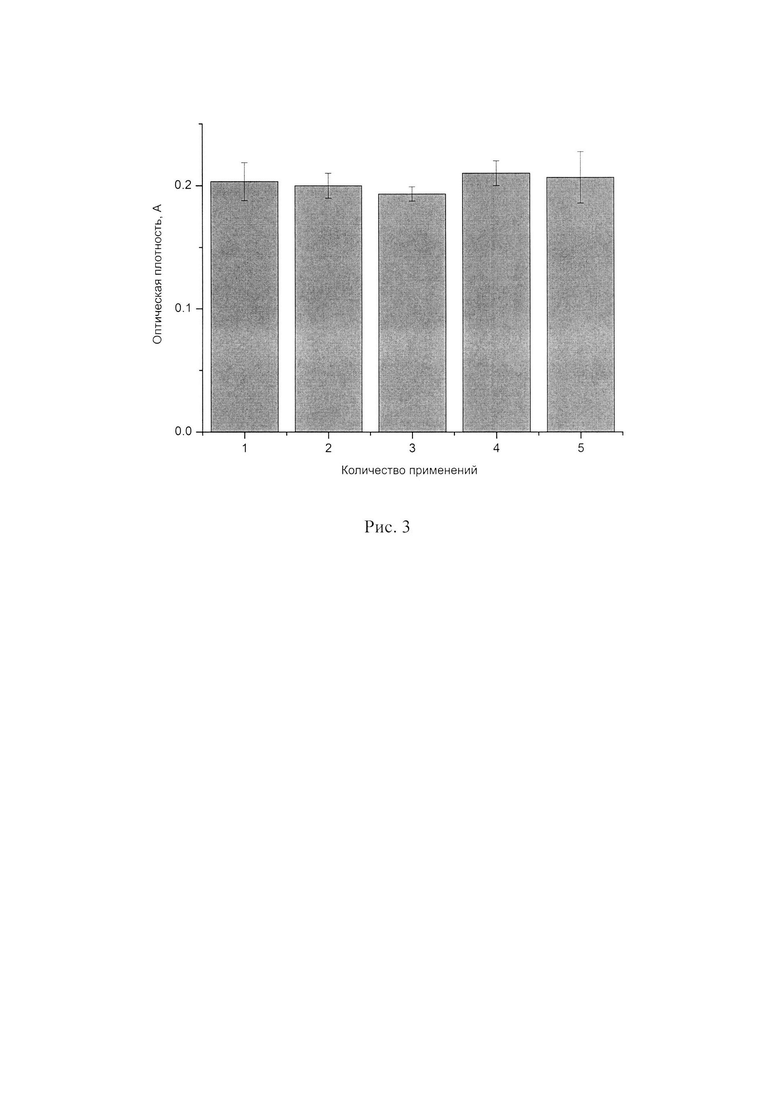
СаСО3 микросферолиты с иммобилизованной пероксидазой могут быть использованы многократно для определения концентрации фенола в растворе, что является значительным конкурентным преимуществом перед существующими аналогами. Одни и те же микросферолиты были проинкубированы 5 раз в различных растворах, содержащих 700 нг/мл фенола (рисунок 3 Оптические плотности раствора, содержащего 700 нг/мл фенола, при последовательной инкубации в нем одних и тех же микросферолитов с пероксидазой.).
Как видно из рисунка, значения оптических плотностей инкубаций отличаются друг от друга не более чем на 5%, что говорит нам о способности содержащих пероксидазу микросферолитов многократно определять концентрацию фенола в растворе.
Содержащие пероксидазу микросферолиты были использованы для определения концентрации фенола в фенолсодержащей жидкости (в краске). Значения оптической плотности анализируемой жидкости (содержащей фенол) получили с помощью свободного фермента в растворе и содержащих фермент микросферолитов. Полученные результаты в обоих случаях совпали и составили 0.54 А. Таким образом, можно сделать вывод о том, что содержащие пероксидазу микросферолиты могут быть использованы для определения концентрации фенола в фенолсодержащих жидкостях.
Осуществление изобретения:
Для создания диагностической системы на базе иммобилизованной пероксидазы на СаСО3 микросферолитах необходимо методом копреципитации заключить пероксидазы в СаСО3 микросферолитах. Для этого при перемешивании добавляли 0,33 М Na2CO3, 0,33 М CaCl2 и пероксидазу 6 мг/мл. Время перемешивания составляло 30 с. Суспензию выдерживали до полного осаждения образовавшихся частиц. Процесс «созревания» микросферолитов контролировали с помощью светового микроскопа. Затем надосадочную жидкость сливали, а осадок промывали водой. Были получены микрочастицы со средним диаметром 4,5±1 мкм. Размер и количество микрочастиц измеряли методом динамического светорассеяния на приборе Zetasizer nano ZS (Malvern, Великобритания).
Для определения концентрации фенола в растворе при помощи иммобилизованных на СаСО3 микросферолитах пероксидазы в раствор 0,1 М фосфатного буфера, содержащего аминоантипирин-4 0,3 ммоль/л, перекись водорода 4,68 ммоль/л и 2.7*106 СаСО3 микросферолитов с иммобилизованой пероксидазой, добавляли фенол необходимой концентрации и инкубировали на шейкере 10 минут. После инкубации центрифугированием осаждали суспензию микрокапсул (10000 об/мин 1 мин) и измеряли оптическую плотность раствора при 510 нм на спектрофотометре Cary 100.
Список литературы:
1. Albuquerque, B.R.; Heleno, S.A.; Oliveira, M.B.P.P.; Barros, L.; Ferreira, I.C.F.R. Phenolic compounds: current industrial applications, limitations and future challenges. Food Fund. 2021, 12, 14-29.
2. Hussain, A.; Dubey, S.K.; Kumar, V. Kinetic study for aerobic treatment of phenolic wastewater. Water Resour. Ind. 2015, 11, 81-90.
3. Campíns-falcó, P.; Tortajada-genaro, L.A.; Antequera-baixauli, R.; Bosch-reig, F. Spectrophotometric Determination of Phenols in Water Samples by the GHPSAM Method. Int. J. Environ. Anal. Chem. 2001, 79, 241-256.
4. Che Sulaiman, I.S.; Basri, M.; Fard Masoumi, H.R.; Chee, W.J.; Ashari, S.E.; Ismail, M. Effects of temperature, time, and solvent ratio on the extraction of phenolic compounds and the anti-radical activity of Clinacanthus nutans Lindau leaves by response surface methodology. Chem. Cent. J. 2017, 11, 54.
5. Martin, W.N.; Husband, R.M. Chromatography of Phenols, Especially Alkyl Phenols, on Paper Impregnated with Polyamides. Anal. Chem. 1961, 33, 840-842.
6. Ballesteros, E.; Gallego, M.; Valcárcel, M. Gas chromatographic determination of phenol compounds with automatic continuous extraction and derivatization. J. Chromatogr. A 1990, 518, 59-67.
7. Ferro, M.D.; Santos, S.A.O.; Silvestre, A.J.D.; Duarte, M.F. Chromatographic Separation of Phenolic Compounds from Extra Virgin Olive Oil: Development and Validation of a New Method Based on a Biphenyl HPLC Column. Int. J. Mol. Sci. 2019, 20, 201.
8. Krstonošić, M.A.; Hogervorst, J.C.; Mikulić, M.; Gojković-Bukarica, L. Development of HPLC method for determination of phenolic compounds on a core shell column by direct injection of wine samples. Acta Chromatogr. 2020, 32, 134-138.
9. Pasternak, G.; Hanczyc, M.M. Novel method for detecting and quantifying phenol with transient response of glycolytic oscillations of synchronised yeast cells. Sens. Bio-Sensing Res. 2019, 22, 100259.
10. Oliveira, D.P.C. de; Ribeiro, F.W.P.; Becker, H.; Lima-Neto, P.; Correia, A.N. AN ELECTROCHEMICAL BIOSENSOR BASED ON THE TYROSINASE ENZYME FOR THE DETERMINATION OF PHENOL IN WASTEWATER. Quim. Nova 2015.
11. Hashim, H.S.; Fen, Y.W.; Sheh Omar, N.A.; Abdullah, J.; Daniyal, W.M.E.M.M.; Saleviter, S. Detection of phenol by incorporation of gold modified-enzyme based graphene oxide thin film with surface plasmon resonance technique. Opt. Express 2020, 28, 9738.
12. Petrov, A.I.; Volodkin, D.V.; Sukhorukov, G.B. Protein-Calcium Carbonate Coprecipitation: A Tool for Protein Encapsulation. Biotechnol. Prog. 2008, 21, 918-925.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ХЛОРФЕНОЛОВ В ВОДНЫХ РАСТВОРАХ, ВКЛЮЧАЮЩИЙ СОРБЦИОННОЕ КОНЦЕНТРИРОВАНИЕ И ВЫСОКОЭФФЕКТИВНОЕ ЖИДКОСТНО-ХРОМАТОГРАФИЧЕСКОЕ ОПРЕДЕЛЕНИЕ | 2011 |
|
RU2461821C1 |
| СПОСОБ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АНТИГЕНОВ | 2005 |
|
RU2303783C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОБНАРУЖЕНИЯ БИОЛОГИЧЕСКИХ ТОКСИНОВ | 2004 |
|
RU2320994C1 |
| Способ сорбционной очистки сточных вод от гексацианоферратов калия K[Fe(CN)] или K[Fe(CN)] | 2023 |
|
RU2811614C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛЮКОЗЫ С ИСПОЛЬЗОВАНИЕМ ПОЛИМЕТАКРИЛАТНОЙ МАТРИЦЫ | 2023 |
|
RU2826378C1 |
| Метод непрямого конкурентного иммуноферментного анализа для определения содержания тетродотоксина и его аналогов в экстрактах морских организмов | 2020 |
|
RU2744705C1 |
| Способ определения массовых концентраций фенола и пирокатехина в крови методом высокоэффективной жидкостной хроматографии | 2022 |
|
RU2786509C1 |
| Способ количественного определения в вакцинном препарате антигена, адсорбированного на частицах гидроксида алюминия | 2019 |
|
RU2715899C1 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНТИБИОТИКОВ В МОЛОКЕ И МОЛОЧНЫХ ПРОДУКТАХ | 2009 |
|
RU2406090C2 |
| Крем, поглощающий ультрафиолетовое излучение, на основе калины красной и наночастиц серебра и способ его получения | 2022 |
|
RU2809099C1 |
Изобретение относится к области химии, в частности к способу определения концентрации фенола в жидкостях. Способ включает добавление пероксидазы, инкапсулированной в CaCO3 микросферолитах методом копреципитации, в раствор, содержащий аминоантипирин-4, фенол и перекись водорода, инкубирование и измерение оптической плотности раствора с установлением концентрации фенола в растворе в диапазоне от 700 нг/мл до 14 мкг/мл. Настоящее изобретение обеспечивает повышенную скорость проведения анализа и возможность многократного использования СаСО3 микросферолитов с иммобилизованной пероксидазой для определения концентрации фенола в растворе. 3 ил.
Способ определения концентрации фенола в жидкостях, включающий добавление пероксидазы, инкапсулированной в CaCO3 микросферолитах методом копреципитации, в раствор, содержащий аминоантипирин-4, фенол и перекись водорода, инкубирование и измерение оптической плотности раствора с установлением концентрации фенола в растворе в диапазоне от 700 нг/мл до 14 мкг/мл.
| JIANG Y., Preparation and Characterization of Porous Horseradish Peroxidase Microspheres for the Removal of Phenolic Compound and Dye, IND.ENG.CHEM.RES., 2014, v.53, pp.7591-7597 | |||
| ZIXIA, Zh | |||
| et.al | |||
| Horseradish peroxidase microcapsules based on layer-by-layer polyelectrolyte deposition | |||
| JOURNAL OF ENVIRONMENTAL SCIENCES | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2024-03-25—Публикация
2022-11-10—Подача