ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[001] Настоящая заявка испрашивает приоритет по предварительной заявке США № 62/848,939, поданной 16 мая 2019 г., которая в полном объеме включена в настоящую заявку путем отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[002] Настоящее изобретение относится к микроигольным матрицам и, в частности, к микроигольным матрицам, сформированным с элементами поднутрения, для, так называемой, кожной и некожной доставки лекарств, а также для липких аппликаторов на ткани тела.
УВЕДОМЛЕНИЕ О ГОСУДАРСТВЕННОЙ ПОДДЕРЖКЕ
[003] Настоящее изобретение создавалось с государственной поддержкой по грантам №№ AR071277 и AR074285, предоставленным Национальными институтами здравоохранения. Правительство обладает определенными правами на изобретение.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[004] Кожа является легкодоступной тканью с многочисленными различными функциями, например, защитного барьера и терморегулятора. Стоит отметить, что кожа действует как активный орган иммунной системы. Для достижения некоторых целей, таких как иммунизация, иммунотерапия рака и аллерговакцинация, кожа может быть предпочтительным целевым анатомическим местом, поскольку она содержит крупные популяции профессиональных антиген-представляющих клеток и А-клеток иммунной системы. Большую часть вакцин, иммуномодификаторов и противоопухолевых лекарств вводят с использованием инъекций иглами для подкожных инъекций. Однако, доставка лекарств с использованием традиционных шприцов сопряжена с рядом недостатков. Эти недостатки включают в себя потребность в обученном медицинском персонале для введения, трипанофобию (т.е. боязнь уколов иглой), плохое соблюдение пациентами инструкций по приему препарата, риск передачи болезни и травмы медработника от иглы и затраты на хранение и транспортировку в системе холодильной цепи.
[005] Кроме того, парентеральные инъекции не в состоянии воспроизводимо и точно доставлять бионагрузки в целевые кожные микросреды. Поэтому вакцины и лекарства, введенные посредством обычных инъекций, могут иметь следствием недостаточную эффективность. В совокупности, данные факторы препятствуют эффективному использованию вакцин, противоопухолевых лекарств или иммуномодуляторов и имеют следствием неэффективность стратегий кожной иммунизации и лечения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[006] В настоящей заявке раскрываются различные способы и системы, относящихся к изготовлению микроигольных матриц и, в частности, микроигольных матриц, сформированных с элементами поднутрения для кожной и некожной доставки лекарств, а также для липких аппликаторов на ткани тела.
[007] В некоторых из нижеописанных вариантов осуществления, способ формирования микроигольной матрицы содержит этап формирования производственной литьевой формы из гибкого материала, содержащей множество полостей, которые имеют форму для определения множества соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения, этап включения по меньшей мере одного биоактивного материала внутрь первого растворимого материала, чтобы обеспечить биоразлагаемую матрицу, этап доставки биоразлагаемой матрицы в по меньшей мере участок острия микроиглы, определяемый соответствующими полостями производственной литьевой формы, этап формирования множества микроигл в производственной литьевой форме, которые включают в себя биоразлагаемую матрицу, и этап извлечения микроигл из производственной литьевой формы посредством вытягивания микроигл из литьевой формы. Гибкий материал может иметь достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
[008] В других вариантах осуществления формируют микроигольную матрицу с использованием литьевой формы для извлечения одним вытягиванием, содержащую подложку, множество микроигл и по меньшей мере один биоактивный материал, объединенный с первым растворимым материалом для формирования биоразлагаемой матрицы. Множество микроигл содержит, в каждой микроигле, стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения.
[009] В еще одних вариантах осуществления, способ формирования литьевой матрицы содержит этап составления 3-мерного чертежа, построенного в системе автоматизированного проектирования, (3D-САПР чертежа) микроигольной матрицы, которая включает в себя множество микроигл с по меньшей мере одним элементом поднутрения, этап формирования базовой микроигольной матрицы с использованием 3D-САПР чертежа, этап формирования по меньшей мере одной реплики базовой микроигольной матрицы и этап формирования производственной литьевой формы микроигольной матрицы с использованием по меньшей мере одной реплики. Производственную литьевую форму формируют из гибкого материала.
[010] Вышеприведенные и другие цели, признаки и преимущества изобретения станут очевидными из нижеследующего подробного описания, которое использует ссылки на прилагаемые фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[011] Фиг.1 - изображение примерных конструкций микроигл, которые имеют, в приведенных примерах, заостренные конические наконечники, круглые стержни с поднутрениями и скругленные основания.
[011] Фиг.2A-C - изображения микроигольной матрицы, которая сформирована с податливой подложкой.
[013] Фиг.3A - чертеж, построенный в системе автоматизированного проектирования (САПР), представляющий примерные MNA, которые включают в себя острые иглы с элементами поднутрения и скругленными основаниями.
[014] Фиг.3B - 3D-САПР чертеж, представляющий примерную MNA со схемой 5×5 расположения игл.
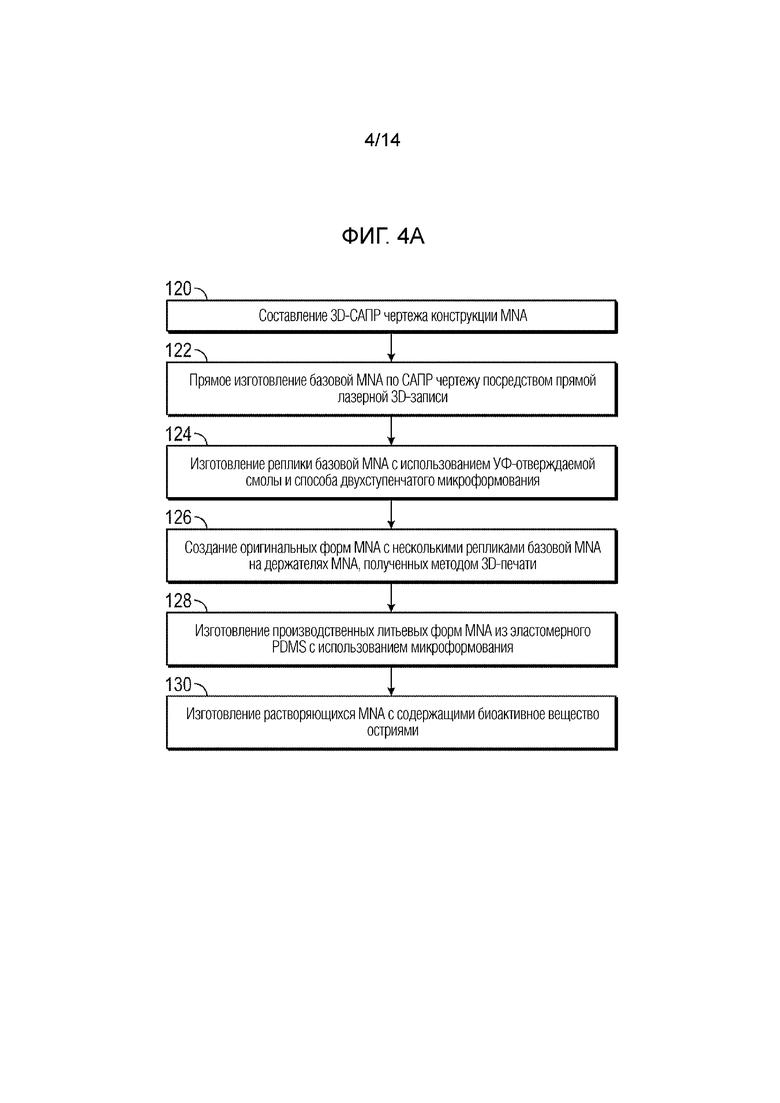
[015] Фиг.4A - блок-схема последовательности операций примерного процесса изготовления MNA.
[016] Фиг.4B - разные этапы примерного процесса изготовления MNA, представленного на фиг.4A.
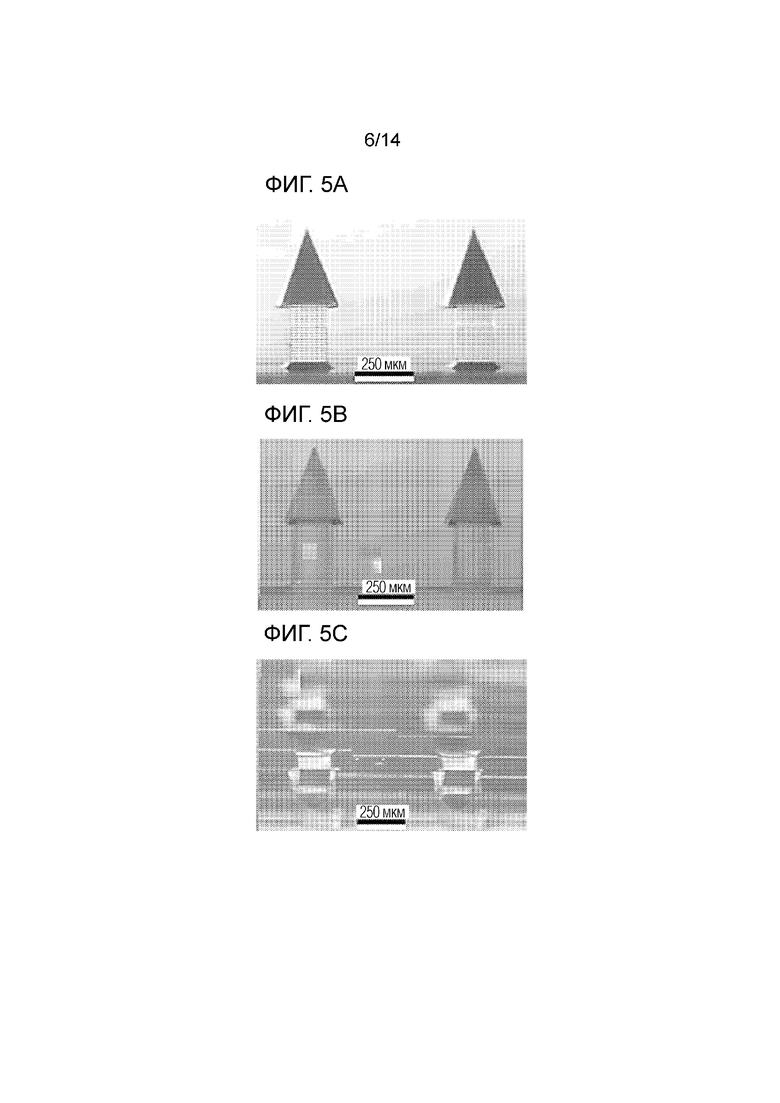
[017] Фиг.5A - изображение в оптическом микроскопе базовой MNA, созданной с использованием прямой лазерной 3D-записи.
[018] Фиг.5B - изображение в оптическом микроскопе реплики базовой MNA, созданной с использованием стратегии двухступенчатого микроформования.
[019] Фиг.5C - изображение в оптическом микроскопе загрузочных углублений микроигольчатой формы в производственных литьевых формах для MNA.
[020] Фиг.5D - изображение в оптическом микроскопе отдельной игле с поднутрением на базовой MNA, изготовленной методом 3D печати.
[021] Фиг.5E - изображение в оптическом микроскопе отдельной иглы с поднутрением на реплике базовой MNA.
[022] Фиг.6A - изображение в оптическом микроскопе окончательных растворяющихся MNA из (CMC (карбоксиметилцеллюлозы)/Treh (трегалозы)) (CMC/Treh-MNA), включающих в себя бионагрузки (например, OVA (яичный альбумин) + Poly(I:C) (сополимер полиинозиновой и полицитидиловой кислот)).
[023] Фиг.6B - изображение в оптическом микроскопе растворяющихся MNA из PVP (поливинилпирролидона)/PVA (поливинилового спирта) (PVP/PVA-MNA) с содержащими лекарство остриями и микроиглами с поднутрениями, включающих в себя OVA.
[024] Фиг.6C - изображение в оптическом микроскопе отдельной микроиглы из CMC/Treh с содержащим лекарство острием и поднутрением, включающей в себя доксорубицин в качестве окрашенного лекарства для облегчения визуализации.
[025] Фиг.7A - изображение матриц из PVP/PVA, включающих в себя декстран (с молекулярной массой около 40 кДа), окрашенный техасским красным, на остриях микроигл.
[026] Фиг.7B - изображение матриц из CMC/Treh с содержащими лекарство остриями, включающих в себя краситель Allura Red (красный очаровательный) R40 (с молекулярной массой около 500 кДа) в пирамидальной области микроигл.
[027] Фиг.7C - изображение матриц из PVP/PVA с содержащими лекарство остриями, включающих в себя несколько нагрузок, таких как декстран, окрашенный техасским красным, и краситель Allura Red R40.
[028] Фиг.7D - изображение матриц из PVP/PVA с содержащими лекарство остриями, включающих в себя несколько нагрузок, таких как декстран, окрашенный техасским красным, и микрочастицы (со средним диаметром 10 мкм) PLGA (полилактида-ко-гликолида), помеченные с помощью Alexa488.
[029] Фиг.8A - изображения разных конструкций микроигл, изготовленных из фоторезиста IP-S с использованием прямой лазерной 3D-записи.
[030] Фиг.8B - изображения напечатанных микроигл со скругленными основаниями.
[031] Фиг.9A - изображения в оптическом микроскопе матриц из PVP/PVA, включающих в себя краситель Allura Red до накладывания на кожу человека.
[032] Фиг.9B - изображение в светлопольном микроскопе следов микроигл с красителем Allura Red R40 на образцах живой человеческой кожи.
[033] Фиг.9C - изображения в оптическом микроскопе PVP/PVA-MNA, включающих в себя краситель Allura Red, после накладывания на кожу человека.
[034] Фиг.9D-I - изображение внутрикожной совместной доставки Poly(I:C), помеченного с помощью Alexa488, и OVA, помеченного с помощью Alexa555, из CMC/Treh-MNA с содержащими лекарство остриями. Оптическое увеличение 20 крат. Составные изображения, полученные флуоресцентным микроскопом, демонстрируют полости доставки, проникающие в эпидерму и верхнюю дерму, и доставку как антигена, так и адъюванта в намеченные кожные микросреды.
[035] Фиг.10A - изображения в оптическом микроскопе MNA, включающих в себя как OVA с Alexa555, так и Poly(I:C) с Alexa488, с флуоресцентным изображением, являющимся репрезентативным для пирамидального наконечника, содержащего обе нагрузки.
[036] Фиг.10B - репрезентативные изображения в оптическом микроскопе MNA, содержащих OVA с Alexa555 и Poly(I:C) с Alexa488 после накладывания in vivo на изображенную мышь.
[037] Фиг.10C и 10D - изображение эффективной совместной доставки Poly(I:C) с Alexa488 и OVA с Alexa555 в кожные микросреды с использованием новых MNA.
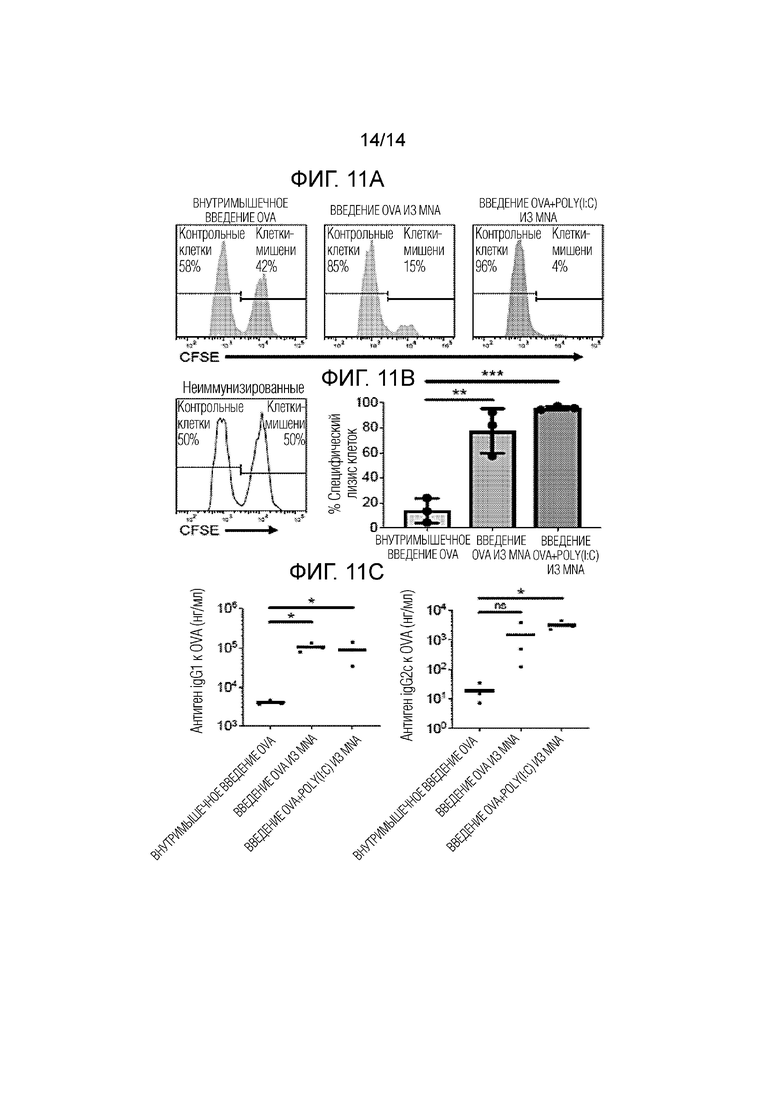
[038] Фиг.11A - репрезентативные гистограммы, полученные в результате анализа методом проточной цитометрии и показывающие остаточные клетки с метками CFSE (сукцинимидилового эфира карбоксифлуоресцеина) в селезенках иммунизированных и неиммунизированных мышей.
[039] Фиг.11B - количественное представление специфического лизиса клеток, при 100% лизисе, соответствующем полной элиминации клеток-мишеней, (среднее значение±стандартное отклонение, по 3 мыши в группе).
[040] Фиг.11C - сывороточные концентрации специфических антител IgG1 и IgG2c к OVA (столбики представляют средние значения, по 3 мыши в группе).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[041] Подробные описания в настоящей заявке характеризуют некоторые примерные варианты осуществления, относящиеся к изготовлению и применению микроигольных матриц (MNA). Хотя примерные варианты осуществления могут раскрывать конкретные типы MNA, следует понимать, что из раскрытых систем и способов можно извлечь пользу для MNA других типов.
[042] В контексте настоящего документа, термин «биопрепарат», «активный компонент», «бионагрузка» или «биоактивный материал» относится к фармацевтически активным веществам, таким как анальгезирующие средства, анестетики, противоастматические средства, антибиотики, антидепрессивные средства, противодиабетические средства, противогрибковые средства, гипотензивные средства, противовоспалительные средства, противоопухолевые средства, анксиолитические средства, ферментактивные средства, конструкции нуклеиновых кислот, иммуностимулирующие средства, иммунодепрессивные средства, вакцины и тому подобное. Биоактивный материал может содержать растворимые материалы, нерастворимые, но диспергируемые материалы, натуральные или составленные по рецепту макро-, микро- и наночастицы и/или смеси из двух или более растворимых, диспергируемых нерастворимых материалов и натуральных или составленных по рецепту макро-, микро- и наночастиц. В этой связи, хотя ряд примеров MNA, раскрытых в настоящей заявке, относится к вакцинам и иммунизациям, в конструкциях новых MNA можно использовать любой другой подходящий биоактивный материал, например, вышеописанные материалы.
[043] В контексте настоящего документа, выражение «предварительно сформированный» означает, что конструкция или элемент изготавливают, создают и/или формируют с приданием конкретной формы или конфигурации до использования. Соответственно, форма или конфигурация предварительно сформированной микроигольной матрицы является формой или конфигурацией данной микроигольной матрицы до введения одной или более из микроигл микроигольной матрицы в пациента.
[044] В контексте настоящего документа, термин «поднутрение» или «элемент поднутрения» относится к заглубленной поверхности, которая считается недоступной при использовании стандартных способов формования и, в частности, к элементу конструкции (например, углублению, выступу или другой геометрической форме), которые ограничивает или предотвращает извлечение формованной части, содержащей данный элемент, из обычной неразъемной формы.
[045] Системы и способы, описанные в настоящей заявке, и их отдельные компоненты нельзя трактовать как ограниченные каким- либо образом конкретными применениями или системами, описанными в настоящей заявке. Напротив, настоящее раскрытие относится ко всем новым и неочевидным признакам и аспектам различных раскрытых вариантов осуществления, по отдельности и в различных комбинациях и подкомбинациях друг с другом. Например, любые признаки или аспекты раскрытых вариантов осуществления можно использовать в различных комбинациях и подкомбинациях друг с другом, как будет обнаружено специалистом среднего уровня в соответствующей(их) области(ях), принимая во внимание информацию, раскрытую в настоящей заявке. Кроме того, раскрытые системы, способы и их компоненты не ограничиваются каким-либо конкретным аспектом или признаком или их комбинациями, а также раскрытые особенности и способы не нуждаются в том, чтобы хотя бы одно из конкретных преимуществ было представлено, или одна из конкретных проблем была решена. Заголовки приведены исключительно в целях удобочитаемости, и следует понимать, что элементы и/или этапы из одного раздела можно объединять с элементами и/или этапами, описанными под другими заголовками в настоящем раскрытии.
[046] В контексте настоящей заявки, формы единственного числа (выраженные артиклями) включают в себя формы множественного числа, если иное прямо не следует из контекста. Выражение «включает в себя» означает «содержит». Далее, в контексте настоящего документа, выражение «и/или» означает любой отдельный элемент или комбинацию элементов фразы. Кроме того, определение «примерный» означает неограничивающий(ую) пример, частный случай или иллюстрацию. В контексте настоящего документа, выражения «например» и «к примеру» включают в себя список из одного или более неограничивающих вариантов осуществления, примеров, частных случаев и/или иллюстраций.
[047] Хотя операции некоторых из раскрытых способов описаны в конкретном последовательном порядке для удобного представления, следует понимать, что данная манера описания включает перестановки, если только конкретный порядок не предусмотрен конкретной нижеприведенной формулировкой. Например, операции, описанные в последовательном порядке, можно в некоторых случаях переставить или выполнять одновременно. Кроме того, для упрощения, прилагаемые фигуры могут и не показывать, как раскрытые особенности и способы можно применить совместно с с другими особенностями и способами. Дополнительно, в описании иногда применяются выражения типа «обеспечивать», «производить», «определять» и «выбирать» для описания раскрываемого способа. Данные выражения являются высокоуровневыми описаниями фактических операций, которые выполняются. Фактические операции, которые соответствуют данным выражениям, будут изменяться в зависимости от конкретной реализации и легко заметными среднему специалисту в данной области техники, использующей преимущество настоящего изобретения.
[048] Примерные микроигольные матрицы
[049] Применение микроигольных матриц дает многочисленные преимущества по сравнению с обычными методами инъекций с помощью иглы. По данной причине, кожная вакцинация или доставка лекарств с использованием микроигольной матрицы предлагает надежный и приемлемый подход к эффективной иммунизации или иммунотерапии рака благодаря вышеупомянутым теоретическим благоприятным качествам кожи.
[050] В отличие от методов местной доставки, MNA физически проникают в роговой слой эпидермы, что избавляет от сложностей изготовления лекарственных форм и приводит к локальному накоплению вакцин или лекарств в кожных микросредах. В противоположность инъекциям традиционными иглами, микроиглы слабо действуют на болевые рецепторы, допуская минимально инвазивную безболезненную иммунизацию.
[051] Из других преимуществ, растворяющиеся MNA могут обеспечивать высокоэффективную вакцинацию благодаря их более высокой вместимости антигенов, регулируемой кинетике высвобождения, простоте изготовления и долговременной стабильности. Такие MNA можно создавать из водорастворимых полимеров, которые растворяются, когда введены в кожу. Микроиглы в MNA предпочтительно являются достаточно прочными в их сухом состоянии, чтобы внедряться в роговой слой эпидермы и затем быстро растворяться в жидкой среде кожи, с высвобождением, тем самым, вакцин. Точная доставка биоактивных материалов, таких как вакцины, в кожные микросреды может иметь следствием повышение эффективностей, в результате чего требуются относительно меньшие дозы по сравнению с традиционными игольными инъекциями.
[052] Как подробнее описано ниже, микроиглы с геометрическими элементами поднутрений, которые включают в себя растворимые и/или нерастворимые материалы, можно формировать с использованием новых способов и систем, описанных в настоящей заявке.
[053] В некоторых вариантах осуществления, новые MNA могут быть сформированы в ходе одноэтапного процесса микроформования, который использует гибкие материалы для производственной литьевой формы. Применение таких гибких материалов для производственной литьевой формы обеспечивает возможность производства множества геометрических конструкции, невозможных в ином случае. Гибкий материал для производственной литьевой формы может содержать, например, любой эластомер или другой гибкий материал, который обеспечивает извлекаемость микроигл требуемой конструкции (например, с требуемой величиной поднутрения и/или другой геометрической формы). Способность формовать множество геометрических форм, которые иначе трудно изготовить формованием, делает возможными новые и передовые функционально-градиентные MNA, например, такие, которые показаны на фиг.1, для адресной доставки многих различных биоактивных материалов в кожу и другие ткани (например, сердечную и глазную ткань).
[054] Фиг.1 изображает примеры разных конструкций микроигл, которые можно формировать с использованием способов и систем, описанных в настоящей заявке. На фиг.1 показаны четыре разных конструкции 10, 12, 14, 16 микроигл в производственной литьевой форме 18, которая сформирована из гибкого материала, например, гибкого эластомера.
[055] Микроигла 10 сформирована с растворимой подложкой 20, растворимым стержнем 22 и острием 24 микроиглы, которое заполнено биоактивным материалом. Таким образом, микроигла 10 целиком изготовлена из растворяющегося (или биоразлагаемого) материала. Биоактивный материал может быть подмешан в растворяющийся материал, но предпочтительно располагается на игольном острие, как показано на фиг.1, чтобы повышать эффективность доставки.
[056] Как показано на фиг.1, микроиглы 10, 12, 14, 16 могут иметь наконечник пирамидальной формы с остроконечным острием и стержень с поднутрением, который соединяется с подложкой посредством скругленного основания. Скругления 32 могут обеспечивать повышенные механические характеристики во время введения в ткань.
[057] MNA, описанные в настоящей заявке, могут быть изготовлены из любых формуемых растворяющихся, биоразлагаемых, и/или биосовместимых нерастворяющихся материалов, включающих в себя карбоксиметилцеллюлозу, трегалозу, поливинилпирролидон, поливиниловый спирт, мальтодекстрин, шелк, глюкозу, гиалуроновую кислоту, полиметилметакрилат, поликарбонат, сополимер молочной кислоты и гликолевой кислоты, полимолочную кислоту, быстро отверждающиеся смолы и их комбинации, чтобы включать любые биоактивные материалы, в том числе, косметические средства, кожные наполнители, статины, факторы роста, обезболивающие средства, антигистаминные средства, витамины, анестетики, средства от старения, низкомолекулярные лекарственные средства, гаптены, аллергены, противовоспалительные средства, белки, пептиды, микропузырьки, экзосомы, полиплексы (малые интерферирующие РНК, короткошпилечные РНК, комплексы ДНК-векторов), рекомбинантные вирусные вектора (т.е. аденовирус, лентивирус, вирус коровьей оспы, аденоассоциированный вирус и их разные серотипы), моноклональные и поликлональные антитела и живые или подвергшиеся лизису клетки.
[058] Микроигла 12 сформирована с нерастворимой подложкой 26, нерастворимым стержень 28 и острием 24 микроиглы, которое заполнено биоактивным материалом. Данные конструкции функционально-градиентных MNA с поднутрениями можно изготавливать из по меньшей мере двух материалов. Например, пирамидальный участок можно создать с использованием растворяющегося или биоразлагаемого материала, а стержневой участок и подложку изготавливают из нерастворяющегося материала, такого как нерастворяющегося биосовместимого жесткого полимера (например, полиметилметакрилата, поликарбоната, полимера VeroWhite и других отверждаемых ультрафиолетовым излучением (УФ-отверждаемых и термоотверждаемых смол).
[059] Следовательно, микроигла 12 может обеспечивать остроконечное игольное острие, вместе с повышенными механическими характеристиками благодаря скругленному основанию, возможность эффективного проникновения в ткань и пирамидальный наконечник, который служит дозированной лекарственной формой биоактивного материала, в которой биоактивный(ые) материал(ы) включены в матрицу растворяющегося или разлагающегося биоматериала. Стержневой участок с поднутрением повышает механические характеристики во время внедрения и при этом обеспечивает удерживание в ткани во время имплантации, и нерастворяющиеся стержневой участок с поднутрением предотвращает обратную диффузию внедренного(ых) биоактивного(ых) материала(ов) в ходе процессов как изготовления, так и имплантации. Нерастворимая подложка может также способствовать предотвращению впитывания влаги во время хранения, что может приводить к чрезмерному искривлению подложек и снижать эффективность применений MNA.
[060] Микроигла 14 является аналогичной микроиглам 12, 14 по форме, но дополнительно включает в себя другой растворяющийся слой 30. Например, пирамидальный участок создан с использованием растворяющегося или биоразлагаемого материала, и быстрее растворяющийся слой предусмотрен рядом с соединением стержня с острием иглы. Растворяющийся слой может быть сформирован, например, из быстро растворяющегося полимера с низкой молекулярной массой, такого как глюкоза, сахароза, трегалоза, мальтодекстрин, или поливинилпирролидон. Остальная часть стержневого участка и подложка могут быть сформированы из нерастворяющегося материала, такого как нерастворяющийся биосовместимый жесткий полимер типа сложных полиэфиров, модифицированных акриловой смолой, эпоксидных смол, УФ-отверждаемых мономеров, смол, силиконов.
[061] Следовательно, микроигла 14 обеспечивает остроконечное игольное острие, вместе с повышенными механическими характеристиками благодаря скругленному основанию, возможность эффективного проникновения в ткань, пирамидальный наконечник, который служит дозированной лекарственной формой биоактивного материала, в которой биоактивный(ые) материал(ы) включены в матрицу растворяющегося или разлагающегося биоматериала, стержневой участок с поднутрением, который повышает механические характеристики во время внедрения и при этом обеспечивает удерживание в ткани во время имплантации, и быстро растворяющийся слой, который вместе с механическим рассогласованием между растворяющимся и нерастворяющимся слоями способствует быстрому отделению пирамидальных остриев.
[062] Микроигла 16 подобна микроигле 14, но дополнительно содержит податливую подложку 34, которая может быть нерастворимой. В частности, микроигла 16 может быть сформирована с пирамидальным участком, который создан с использованием растворяющегося или биоразлагаемого материала, быстро растворяющийся слой может быть сформирован как описано выше, остальная часть стержневого участка может быть изготовлена из нерастворяющегося материала, и подложка может быть изготовлена из податливого материала, такого как нерастворяющийся податливый полимер (силиконы, УФ-отверждаемые полимеры, эластомеры).
[063] Следовательно, микроигла 16 может обеспечить остроконечное игольное острие, вместе с повышенными механическими характеристиками благодаря скругленному основанию, возможность эффективного проникновения в ткань, пирамидальный наконечник, который служит дозированной лекарственной формой биоактивного материала, в которой биоактивный(ые) материал(ы) включены в матрицу растворяющегося или разлагающегося биоматериала, и стержневой участок с поднутрением, который повышает механические характеристики во время внедрения и при этом обеспечивает удерживание в ткани во время имплантации. Как в случае с микроиглой 14, быстро растворяющийся слой может, вместе с механическим рассогласованием между растворяющимся и нерастворяющимся слоями, способствовать быстрому отделению пирамидальных остриев, и нерастворяющиеся стержневой участок с поднутрением предотвращает обратную диффузию внедренного биоактивного материала в ходе процессов как изготовления, так и имплантации. В этом варианте осуществления, подложка может плотнее прилегать к неравномерной геометрической форме поверхности кожи, и, если не растворяется, подложка может способствовать предотвращению впитывания влаги во время хранения, что может приводить к чрезмерному искривлению подложек и снижать эффективность применений MNA.
[064] Фиг.2A-2C поясняют способность микроигольной матрицы 50, которая содержит микроиглы 52 и податливую подложку 34, изгибаться и, после изгиба, возвращаться в первоначальное состояние или по меньшей мере состояние, которое ближе по форме к первоначальному состоянию, чем изогнутое состояние.
[065] Следует понимать, что предполагается возможной любая комбинация признаков, раскрытых как на фиг.1, так и по всей настоящей заявке. Например, податливую подложку микроиглы 16 и быстро растворяющийся слой 30 микроигл 14, 16 можно применять в комбинации с любой из других конструкций, раскрытых в настоящей заявке, (например, микроиглами 10, 12).
[066] Кроме того, процессы, раскрытые в настоящей заявке, можно применять для создания микроиглы, которая сформирована целиком из нерастворяющихся материалов для использования в форме MNA с покрытием, тканевых липких накладок (аппликаторов) и/или микрозубцов. Геометрические формы нерастворяющегося микрозубца или микроиглы с поднутрением уже создавали ранее с использованием технологических процессов аддитивного производства или механической микрообработки. Однако, высокопроизводительное изготовление таких геометрических форм сдерживалось отсутствием эффективных процессов микроформования.
[067] Микроаддитивная технология изготовления MNA
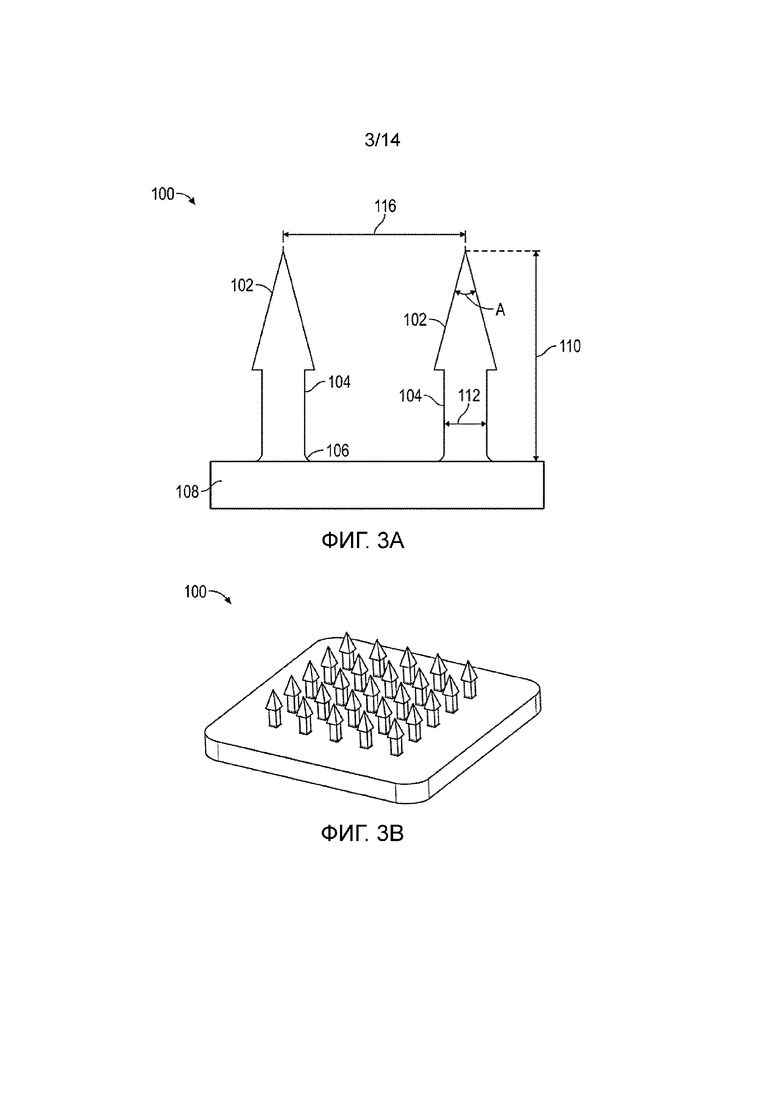
[068] В некоторых вариантах осуществления, MNA могут быть сформированы с использованием аддитивной технологии изготовления (AM), включая методы микроаддитивной технологии изготовления (µAM). Способы и системы, описанные в настоящей заявке, могут позволить медикам-исследователям с низкой квалификацией в области микротехнологий непосредственно производить их конструкции MNA по чертежу, построенному в САПР, без комплексных требований субтрактивной технологии изготовления. Методы µAM, описанные в настоящей заявке, обеспечивают эффективное средство для изготовления новых MNA, спроектированных специально для эффективной кожной и некожной доставки лекарств.
[069] В некоторых вариантах осуществления, раскрытых в настоящей заявке, конструкции MNA включали в себя уникальные по форме иглы микрометрических размеров, которые содержат остроконечные пирамидальные наконечники и стержни с поднутрениями и со скругленными основаниями, чтобы обеспечивать эффективное внедрение в кожу и удерживание в ней. В отличие от обычных MNA, MNA, раскрытые в настоящей заявке, изготавливают посредством трехмерной (3D) µAM, с помощью прямой лазерной 3D-записи, что предлагает потенциал преобразований в области MNA, с распараллеливанием уровня простоты и возможностей проектирования.
[070] Как подробно описано ниже, в некоторых вариантах осуществления, реплики базовых MNA можно получать из механически прочной, формуемой смолы в два этапа микроформования с высокой точностью воспроизведения. Затем эти реплики можно применять для приготовления производственных литьевых форм, таких как производственные литьевой формы из полидиметилсилоксана (PDMS), которые позволяли изготавливать новые растворимые MNA с содержащими лекарство остриями и имеющими поднутрения микроиглами. В некоторых вариантах осуществления, полученные MNA являются полностью растворяющимися MNA с выраженными элемента поднутрения для эффективной кожной доставки лекарств.
[071] Как показано на фиг.1, в некоторых вариантах осуществления можно напечатать множество базовых MNA, можно быстро получить реплики базовых MNA, и затем множество реплик можно собрать для создания MNA больших размеров.
[072] В некоторых вариантах осуществления, MNA могут объединять модельный антигенный яичный альбумин (OVA)±модельный адъювантный Poly(I:C) из биорастворимой композиции материалов (70%CMC/30%Treh), с использованием способа центробежного литья. Кроме того, предложенные конструкции MNA, вместе с подходящими материалами для форм, обеспечивали стратегически важную возможность этапов непосредственного изготовления, без помех процессам формования. Изготовленные MNA особенно эффективно проникают сквозь роговой слой эпидермы живой человеческой кожи для доставки бионагрузок в кожные микросреды. Данные уникальные MNA соответствуют требованиям к геометрической форме и механической прочности для эффективного внедрения в кожу для кожной вакцинации, обеспечивая, тем самым, альтернативный перспективный подход для методик адресной иммунизации в кожу.
[073] Примерные микроиглы и матрицы и системы их изготовления
[074] Фиг.3A и 3B изображают примерную микроигольную матрицу (100) (MNA), которая содержит микроиглы с заостренным пирамидальным наконечником (102) и стержневым участком с поднутрением (104). Кроме того, микроиглы включают в себя скругленное основание (106).
[075] Способы и системы, раскрытые в настоящей заявке, допускают повторяемое изготовление высококачественных растворяющихся MNA с содержащими лекарство остриями и элементами поднутрения из разных и широко применяемых растворяющихся материалов для микроигл, таких как CMC, PVP (поливинилпирролидон), шелк, HA (гиалуроновая кислота), CMC/трегалоза, CMC/глюкоза, CMC/сахароза, PVP/PVA, и любые другие формуемые биорастворимые композиции.
[076] В данном варианте осуществления, микроигла имеет высоту (110), которая составляет 50-1500 мкм, например, высоту 750 мкм, и угол (A) при вершине пирамидального наконечника, который составляет 10°-60°, например, 30°.
[077] В одном варианте осуществления, стержневой участок микроиглы может иметь ширину (112), которая составляет 50-500 мкм, например, 150 мкм. Стержневой участок (104) может продолжаться от нижнего края трехмерного (3D) пирамидального наконечника до подложки (108) микроиглы со скругленным соединением, которое имеет длину 15-75 мкм, например, 35 мкм. Ширина (114) нижнего края пирамидального наконечника может составлять, например, 100-400 мкм, например, образовать базовый участок 250 мкм × 250 мкм.
[078] В некоторых вариантах осуществления, расстояние (116) между остриями микроигл в матрице может составлять 100-800 мкм, например, 650 мкм. В некоторых вариантах осуществления, MNA может включать в себя 1-1000 микроигл, например, 25 микроигл в конфигурации матрицы 5×5 на подложке с площадью 4,75 мм × 4,75 мм.
[079] Скругление в основании (106) микроиглы содействовать снижению сопутствующих концентраций механических напряжений в острых углах, что, в свою очередь, повышает характеристики микроиглы в ходе выполнения процессов изготовления и введения в кожу. Угол при вершине, ширину и высоту микроигл выбирали, чтобы обеспечить более совершенную механику введения в кожу и сократить число неудовлетворительных результатов при внедрении.
[080] Поднутрение или закрепляющий элемент конструкции может оптимизировать удерживание в коже во время накладывания и, при использовании новых способов и систем, раскрытых в настоящей заявке, может быть получен также без создания помех этапам обработки, что допускает прямое снятие MNA с литьевых форм.
[081] Описанный здесь подход на основе трехмерной микроаддитивной технологии изготовления (3D-µAM) предусматривает создание уникальных конструкций MNA по 3D-САПР чертежу. К тому же, технология 3D-µAM может позволить медикам-исследователям с низкой квалификацией в области микротехнологий или без такой квалификации проектировать и изготавливать платформы на основе MNA для доставки лекарств, с оптимизацией, ориентированной на конкретные применения.
[082] Примерный системы и процессы изготовления представлены на блок-схеме последовательности операций на фиг.4A и графически изображены на фиг.4B. Как показано на фиг.4A и 4B, процесс может содержать следующие этапы для создания новых быстро растворяющихся MNA, при одновременном обеспечении высокой производительности изготовления. На первом этапе можно составить 3D-САПР чертеж (132) конструкции MNA (этап 120 процесса). На втором этапе можно выполнить прямое изготовление базовой MNA (134) по чертежу САПР посредством прямой лазерной 3D-записи с использованием нерастворяющейся смолы (например, фоторезиста IP-S) (этап 122 процесса). Технологическая система 3D-µAM может быть, например, система (136) Nanoscribe для 3D-печати.
[083] На третьем этапе может быть быстро выполнено изготовление высокоточной реплики базовой MNA с использованием УФ-отверждаемой смолы (например, VeroWhitePlus, Tangoblack, Digital Materials) и способа двухступенчатого микроформования (этап 124 процесса). Данный подход может включать в себя негативную эластомерную литьевую форму (138) для формования реплики (140) базовой MNA.
[084] На четвертом этапе могут быть созданы оригинальные формы MNA с несколькими репликами базовой MNA (например, шестью репликами) на держателях MNA, полученных методом 3D-печати (этап 126 процесса). Держатель (142) MNA, полученный методом 3D-печати, может быть сформирован из, например, полимерного материала. Объединение множества реплик базовой MNA на, например, держателях MNA, полученных методом 3D-печати, может допускать создание MNA большего размера и повышать производительность.
[085] На пятом этапе могут быть изготовлены производственные литьевые формы (144) MNA из эластомерного PDMS (полидиметилсилоксана) с использованием микроформования (этап 128 процесса). На шестом этапе можно изготовить растворяющиеся MNA (150) с содержащими лекарство остриями (этап 130 процесса). MNA могут иметь микроиглы с поднутрением, включающие в себя один или более биоактивных материалов, таких как вакцина или любой другой биоактивный материал, изготовленные из водорастворимого биосовместимого материала (например, композиции из CMC и Treh) способом многоступенчатого центробежного литья с использованием центрифуги.
[086] Например, биоактивный компонент (например, вакцина) можно центробежно отливать на острия производственных литьевых форм из PDMS, и растворимый гидрогель (например, CMC/трегалозу) можно центробежно отливать в производственные литьевой формы для выполнения функции конструкционного материала микроигл и формирования подложки MNA. В некоторых вариантах осуществления, базовую MNA, оригинальные формы MNA, включающиеся в себя реплики базовой MNA, и эластомерные производственные литьевой формы можно использовать многократно в течение большого числа технологических циклов, что значительно снижает стоимость изготовления MNA с уникальными конструкциями и повышает производительность.
[087] Фиг.5A-5E представляют конечные изделия, соответствующие разным этапам изготовления или обработки. Фиг.5A представляет изображение в оптическом микроскопе базовой MNA (134), созданной с использованием прямой лазерной 3D-записи, и фиг.5D представляет изображение в оптическом микроскопе отдельной иглы с поднутрением на базовой MNA (134), изготовленной методом 3D-печати. В частности, базовую MNA изготовили из фоторезиста IP-S методом прямой лазерной 3D-записи. Смола IP-S является специальным материалом, предназначенным для лазерной 3D-литографии и обеспечивает высокое разрешение и механическую целостность микро- и наноструктур. Лазерная 3D-литография, основанная на двухфотонной полимеризации, обеспечила эффективное средство для изготовления конструкций MNA с поднутрениями, с гладкими кромками и остроконечными остриями, и без каких-либо нежелательных остатков (например, станочной стружки).
[088] Фиг.5B представляет изображение в оптическом микроскопе реплики (140) базовой MNA, созданной по методике двухступенчатого микроформования: формование эластомерной композиции в сочетании с микроформованием с УФ-отверждением, и фиг.5E представляет изображение в оптическом микроскопе отдельной иглы с поднутрением на реплике (140) базовой MNA. Базовую MNA изготовили с использованием процесса двухступенчатого микроформования. Базовую MNA из смолы IP-S использовали для изготовления гибкой литьевой формы из PDMS посредством формования эластомерной композиции, и затем литьевую форму из PDMS использовали для изготовления нескольких реплик MNA из смолы VeroWhite посредством микроформования с УФ-отверждением. Смола VeroWhite является износостойким, акриловым фотополимером, который пригоден для применения 3D-принтерами Polyjet.
[089] Для обеспечения масштабируемого изготовления новых MNA, реплики MNA затем использовали для создания оригинальных форм MNA, которые включают в себя несколько MNA (например, шесть реплик MNA). Окончательные оригинальные формы MNA подвергали постобработке в вакуумной печи, чтобы облегчить успешное отверждение PDMS на поверхности литьевой формы, и затем из PDMS изготавливали эластомерные производственные литьевой формы MNA, которые состояли из загрузочных углублений микроигольчатой формы. Фиг.5C представляет изображение в оптическом микроскопе загрузочных углублений микроигольчатой формы в производственных литьевая формах (144) MNA.
[090] По существу, данные технологические этапы, вместе с большими геометрическими возможностями прямой лазерной 3D-записи, имели следствием стратегию масштабируемого и эффективного изготовления MNA. К тому же, быстрое изготовление реплик базовой MNA, изготовленной методом 3D печати, с использованием износостойкого материала для форм значительно повышало производительность. Возможны также другие элементы поднутрения, при использовании других материалов микроигл и эластомерных литьевых форм, совместимых с процессами и системами, описанными в настоящей заявке.
[091] После изготовления оригинальных форм MNA с шестью репликами MNA изготавливали растворяющиеся MNA, которые включают вакцину в участке острия игл, с использованием обычной стратегии трехступенчатого изготовления от оригинальной формы к производственной литьевой форме и к окончательным растворимым MNA.
[092] Как подробнее описано ниже, растворяющиеся MNA, которые включают вакцину (10 мкг OVA±25 мкг Poly(I:C)) на участке острия игл с поднутрениями, изготавливали по технологии центробежного литья из двух разных композиций материалов (т.е. CMC/трегалозы и PVP/PVA). Кроме того, для облегчения визуализации и демонстрации совместимости с химиотерапевтическими средствами изготовили MNA из CMC/трегалозы с содержащими лекарство остриями и микроиглами с поднутрениями, включающие в себя окрашенное модельное лекарство (например, доксорубицин). Системы и способы, описанные в настоящей заявке, создали возможность эффективного и быстрого изготовления растворяющихся MNA с содержащими лекарство остриями и микроиглами с поднутрениями из разных растворимых композиций материалов.
[093] Фиг.6A является изображением в оптическом микроскопе окончательных растворяющихся CMC/Treh-MNA, включающих в себя бионагрузки (например, OVA+Poly(I:C)). Фиг.6B является изображением в оптическом микроскопе растворяющихся PVP/PVA-MNA с содержащими лекарство остриями и микроиглами с поднутрениями, включающих в себя OVA, и фиг.4C является изображением в оптическом микроскопе отдельной микроиглы из CMC/Treh с содержащим лекарство острием и поднутрением, включающей в себя доксорубицин в качестве окрашенного лекарства для облегчения визуализации.
[094] Пример 1 - Изготовление примерных MNA
[095] Примерный процесс создания MNA описан в настоящей заявке.
[096] Изготовление базовой MNA. Уникальная конструкция MNA была непосредственно создана по 3D-САПР чертежу, представленному на фиг.1, с использованием лазерной 3D-печати (на литографе Nanoscribe Photonic Professional, GT) с помощью фотополимерного резиста IP-S. Система печати Nanoscribe была оборудована лазерным генератором, шкафом оптической связи, оптическим микроскопом Цейса, присоединенным к линзе для фокусировки лазерного пучка, гальванометрической зеркальной системой для управления сканированием лазерного пучка, пьезоэлектрическим столиком для прецизионного управления перемещением и рабочим программным обеспечением (Nanowrite) для выполнения 3D-печати. Система целиком размещалась на оптическом столе для гашения вибраций в процессе печати.
[097] Для изготовления базовой MNA, конструкцию MNA преобразовали в формат файла «STL» (стереолитографии). Затем, файл STL загружали в специализированное программное обеспечение (DeScribe, Германия) системы Nanoscribe, чтобы выбрать режим обработки (т.е. расстояние получения слоев, гравировку и разделение). И наконец, файл STL преобразовали в формат «GWL» (литография общей записи), подлежащий экспорту в программное обеспечение Nanowrite для печати базовой MNA. Базовую MNA изготавливали с использованием режима гальванометрического сканирования в плоскости XY и пьезоэлектрического сканирования в направлении Z. Базовую MNA разделили на блоки размером 220 мкм × 220 мкм × 200 мкм в пределах рабочего диапазона и затем составляют. Мощность лазера и скорость записи устанавливали равными 100 мВт и 6 см/с, соответственно. Минимальное и максимальное расстояния между слоями были 0,3 мкм и 0,5 мкм, соответственно. Затем базовую MNA печатали посредством двухфотонной полимеризации фоторезиста IP-S с помощью фемтосекундного импульсного лазера с длиной волны 750 нм, при использовании уникального режима с погружением в жидкость, с 25-кратным объективом и числовой апертурой 0,8, в режиме оболочки и каркаса.
[098] После печати, базовую MNA проявляли в растворителе фоторезиста на основе пропиленгликоля метил эфир ацетата (PGMEA) в течение 30 мин и затем промывали 5 мин в изопропиловом спирте (IPA). После воздушной сушки базовой MNA, ее облучали УФ-светом (365 нм) с интенсивностью 16 мВт/см2 в течение 30 мин, чтобы дополнительно поперечно сшить деталь для усиления структуры MNA.
[099] Изготовление реплик базовой MNA. Для изготовления реплик базовой MNA с высокой точностью воспроизведения, с использованием УФ-отверждаемой смолы, выполняли способ двухступенчатого микроформования. Сначала, методом микроформования изготавливали эластомерную литьевую форму, которая является обратной для базовой MNA, из полидиметилсилоксана (PDMS). Формование эластомерной композиции, использующей PDMS, обеспечивает точное и воспроизводимое изготовление реплик с высокоточными структурами микрометрических размеров. Короче говоря, базовую MNA устанавливали в чашку Петри диаметром 5 см, и PDMS получали с использованием двухкомпонентного отверждаемого силиконового эластомера SYLGARD® 184 (Dow Corning) путем смешивания основного материала с отверждающим средством в пропорции 10:1, SYLGARD® к отверждающему средству. После этого, смесь наливали на базовую MNA, установленную в чашку Петри, и дегазировали в течение 15 мин. Затем, базовую MNA с дегазированной смесью помещали в печь и отверждали при 70°C в течение 1 часа. Отвержденный PDMS охлаждали до комнатной температуры в течение 5 мин и затем отделяли от базовой MNA, чтобы получить негативную литьевую форму из PDMS.
[0100] На втором этапе технологической обработки, негативную литьевую форму из PDMS использовали для изготовления позитивных реплик MNA из УФ-отверждаемой смолы (Stratasys®, VeroWhiteplus-RGD835). Для каждой литьевой формы из PDMS, 20 мкл жидкой (неотвержденной) смолы наливали на литьевые формы, и затем литьевые формы помещали в центрифугу, чтобы заполнить загрузочные углубления микроигольчатой формы смолой в режиме со скоростью 4500 об/мин и при 20°C в течение 1 мин. Затем смолу отверждали УФ-светом (365 нм) с интенсивностью 21,7 мВт/см2 в течение 5 мин с каждой из верхней и нижней сторон, для отверждения как основания, так и остриев микроигл. Чтобы обеспечить плоскостность подложек реплик базовой MNA, дополнительно заливали 50 мкл УФ-отверждаемой смолы на литьевую форму из PDMS, что было избытком по отношению к остающемуся доступному объему. На верх литьевой формы помещали предметное стекло, чтобы избавиться от избыточной смолы VeroWhite, с созданием, тем самым, равномерной плоской поверхности на основании. После этого жидкую смолу отверждали с верхней стороны в течение 5 мин и затем извлекали из литьевой формы, чтобы получить реплики базовой MNA.
[0101] Создание оригинальных форм MNA. Для облегчения масштабируемого изготовления растворяющихся MNA, оригинальные формы MNA создавали путем сборки шести реплик базовой MNA на держателях MNA, изготовленных по технологии Stratasys® из нерастворяющегося фотополимера (VeroWhite) с использованием высокоразрешающей (16-мкм) системы 3D-печати Polyjet (принтер Objet Connex 500, с совмещением нескольких материалов). 3D-модель держателей MNA создали с использованием программного обеспечения САПР SolidWorks 2018 и затем преобразовали в формат файла «STL» (стереолитографии). Далее, специализированное программное обеспечение (Objet Studio) разрезало данную 3D-модель на 2D (2-мерные) поперечные слои, с созданием компьютерного файла, который передавался в систему 3D принтера. В держателе MNA, полученном методом 3D-печати, были запроектированы и изготовлены каналы, чтобы служить выступающими камерами в производственных литьевых формах MNA для присутствия в качестве вспомогательных резервуаров как для биоактивной нагрузки (например, вакцины), так и для конструктивного гидрогелевого материала растворяющихся MNA в процессе центробежного литья. Созданные оригинальные формы MNA подвергали термообработке при 80°C всю ночь в вакуумной печи, чтобы облегчить эффективное изготовление эластомерных производственных литьевых форм MNA.
[0102] Изготовление производственных литьевых форм MNA. Производственные литьевые формы MNA, которые включали в себя загрузочные углубления микроигольчатой формы, изготавливали из широко применяемого эластомерного полидиметилсилоксана (PDMS), как описано для изготовления реплик оригинала MNA. Основной материал смешивали с отверждающим средством в пропорции 10:1, SYLGARD® к отверждающему средству. После этого, смесь наливали на оригинальную форму MNA, помещенную в чашку Петри диаметром 10 см и дегазировали в течение 15 мин. Затем оригинальную форму с дегазированной смесью помещали в печь для отверждения PDMS при 70°C в течение 1 часа. После охлаждения отвержденного PDMS до комнатной температуры, его отделяли от оригинальной формы MNA, чтобы изготовить производственные литьевые формы MNA из PDMS.
[0103] Производство растворяющихся MNA. Для изготовления растворяющихся MNA с содержащими лекарство остриями и микроиглами с поднутрением, включающих в себя OVA±Poly(I:C), использовали композицию из биорастворимых материалов, которая включала в себя карбоксиметилцеллюлозу (CMC, № C5678 по каталогу, Sigma-Aldrich, Сент-Луис, шт. Миссури) и трегалозу (Treh, № T9531 по каталогу, Sigma-Aldrich). Для приготовления гидрогелевой формы конструкционного материала растворяющихся MNA, порошки CMC и Treh тщательно смешивали в массовом отношении 70% и 30%, соответственно. Затем данную порошковую смесь вводили в воду, не содержащую эндотоксинов, (воду для приготовления питательных сред для культур клеток (HyClone HyPure Cell Culture Grade Water)) и тщательно перемешивали для получения концентрации 30% по массе. Приготовленный гидрогель охлаждали при 4°C в течение 24 ч для приведения смеси в равновесное состояние. Затем, из CMC/Treh изготавливали уникальные конструкции MNA с содержащими лекарство остриями по методу многоступенчатого центробежного литья с использованием центрифуги (Thermo Fisher Scientific Sorvall Legend XTR с ротором Swinging Bucket Rotor TX-750).
[0104] И наконец, 5 мкл раствора OVA (25 мг/мл OVA в воде, не содержащей эндотоксинов) вносили на каждую из MNA на производственных литьевых формах из PDMS, и производственные литьевые формы центрифугировали в течение 1 мин при 20°C и со скоростью 4500 об/мин, чтобы заполнить полости в форме микроигл. После того, как производственные литьевые формы заполнялись, из резервуара извлекали избыточный раствор OVA. Производственные литьевые формы снова центрифугировали в течение 30 мин при 20°C и со скоростью 4500 об/мин, чтобы обеспечить нахождение нагрузки OVA на участке острия полостей в форме микроигл в производственных литьевых формах.
[0105] В случае MNA, включающих OVA+Poly(I:C), после заполнения OVA, 5 мкл раствора Poly(I:C) (62,5 мг/мл Poly(I:C) в воде, не содержащей эндотоксинов) вносили на каждую из MNA на производственных литьевых формах из PDMS, и производственные литьевые формы центрифугировали в течение 1 мин при 20°C и со скоростью 4500 об/мин, чтобы заполнить полости в форме микроигл. После того, как производственные литьевые формы заполнялись, из резервуара извлекали избыточный раствор Poly(I:C). Производственные литьевые формы снова центрифугировали в течение 30 мин при 20°C и со скоростью 4500 об/мин, чтобы обеспечить также нахождение нагрузки Poly(I:C) на пирамидальном участке полостей в форме микроигл в производственных литьевых формах. После помещения бионагрузок в остриях микроигл, 40 мкг гидрогеля (30% по массе композиции 70:30 CMC:Treh) закладывали на каждую из MNA на производственных литьевых формах из PDMS, чтобы заполнить геометрические формы микроигл в производственных литьевых формах и сформировать подложки MNA. Затем производственные литьевые формы, заполненные гидрогелем, центрифугировали в течение 5 ч при 20°C и со скоростью 4500 об/мин, чтобы получить растворяющиеся MNA, содержащие 10 мкг OVA±25 мкг Poly(I:C). Благодаря специальной геометрии производственных литьевых форм MNA, на каждой операции изготовления реплик одновременно получали шесть матриц в виде растворяющихся MNA, содержащих OVA±Poly(I:C).
[0106] Для демонстрации изготовления растворяющихся MNA, содержащих микроиглы с поднутрениями, из другого водорастворимого материала, (т.е. возможных материалов), для изготовления MNA с разными бионагрузками использовали также биорастворимую полимерную композицию из поливинилпирролидона (PVP) и поливинилового спирта (PVA) (40% по весу композиции 60:40 PVP:PVA). Чтобы оценить геометрическую целостность новых микроигл с элементами поднутрения, методом светлопольной оптической микроскопии получали изображения изготовленных базовых MNA, реплик MNA, эластомерных производственных литьевых форм MNA и растворяющихся MNA, содержащих OVA± Poly(I:C).
[0107] Кожная доставка с использованием примерных MNA
[0108] Приготовление ex vivo эксплантатов человеческой кожи. Эксплантаты человеческой кожи приготавливали от деидентифицированных здоровых доноров, подвергавшихся пластической операции, получали через учреждение Pitt Biospecimen Core и использовали в соответствии с руководством Медицинского центра питтсбургского университета. Ткань промывали в 70% этаноле и затем в фосфатно-солевом буферном растворе (PBS). Эксплантаты человеческой кожи (толщиной около 1 мм) брали для исследования с использованием миниатюрного ножа Silver для пересадки кожи (Padgett, Integra Miltex, Плейнсборо, шт. Нью-Джерси) и затем разрезали на квадратные лоскуты 20 мм × 20 мм. Полученные образцы человеческой кожи состояли из неизмененной эпидермы и тонкого слоя подстилающей дермы и поддерживались в качестве эксплантатов в нормальном физиологическом состоянии культурой на границе раздела воздуха и текучей среды.
[0109] Анализ изображений. Для оценки внутрикожной доставки биоактивных материалов (например, вакцины) из MNA в живые эксплантаты человеческой кожи, выполнили несколько анализов изображений. По вышеописанной методике изготовили CMC/Treh-MNA, с содержащими лекарство остриями, включающими окрашенную нагрузку (т.е. краситель Allura Red R40). Перед применением MNA на эксплантатах человеческой кожи получили изображения MNA с использованием метода светлопольной оптической микроскопии.
[0110] Затем, MNA накладывали на эксплантаты человеческой кожи и снимали через 10 мин. После этого, целевые области человеческой кожи исследовали под светлопольным микроскопов для получения изображений картин осаждения в человеческую кожу окрашенной бионагрузки из CMC/Treh-MNA. Материалы, остающиеся в MNA, также визуализировали методом оптической микроскопии после применения на человеческой коже. Для дополнительной количественной оценки внутрикожной доставки вакцины из MNA в человеческую кожу изготовили CMC/Treh-MNA, которые включали как OVA, помеченный с помощью Alexa555, так и Poly(I:C), помеченный с помощью Alexa488, внедряли эти матрицы в человеческую кожу на 10 мин и извлекали. Затем эксплантаты человеческой кожи анализировали гистологическим методом. Вкратце, образцы человеческой кожи, прошедшие процедуру с MNA, фиксировали в 2% параформальдегиде, после чего вымачивали в растворе сахарозы, с 3 сменами данного раствора, в течение 24 ч. Затем тканевые срезы быстро замораживали в гистологическом соединении с оптимальной температурой резания (OCT) и криосекционировали на срезы толщиной около 10 мкм. Срезанные образцы человеческой кожи контрастно окрашивали ядерным флуоресцентным красителем DAPI (4',6-диамидино-2-фенилиндолом). Затем получали изображения окрашенных срезов с помощью просвечивающего флуоресцентного микроскопа Nikon, чтобы обнаружить OVA с Alexa555 и Poly(I:C) с Alexa488 в поперечных срезах человеческой кожа, а также с помощью светлопольного микроскопа, чтобы лучше показать проход сквозь роговой слой эпидермы.
[0111] Кожная иммунизация in vivo с помощью MNA
[0112] Содержание мышей и животных. Самок мышей C57BL/6J приобрели в лаборатории Jackson Laboratory (Бар Харбор, шт. Мэн) и использовали в возрасте 8-10 недель. Мышей содержали в специальных непатогенных условиях в Питтсбургском университете, и все эксперименты проводили в соответствии с руководством Институционального комитета по уходу и использованию животных (IACUC).
[0113] Визуализация in vivo по технологии IVIS. Внутрикожную доставку вакцины in vivo с помощью новых растворяющихся MNA продемонстрировали на мыши C57BL/6J. CMC/Treh-MNA с содержащими лекарство остриями, включающие как OVA, помеченный с помощью Alexa555, так и Poly(I:C), помеченный с помощью Alexa488, изготавливали по вышеописанной технологии и накладывали на живот мыши, которую временно анестезировали ингаляцией фторированного простого эфира в течение 10 мин. Затем, MNA снимали, и мышь возвращали в нормальное активное состояние. Изображения MNA, содержащих OVA+Poly(I:C), получали до и после применения in vivo. Изображения мыши, прошедшей процедуру с MNA, получали с помощью систем визуализации in vivo IVIS 200 (PerkinElmer), с использованием фильтров для анализа на флуоресцентно меченые Poly(I:C) и OVA в месте накладывания MNA. Изображение подвергали постобработке с использованием программного обеспечения Living Image (PerkinElmer).
[0114] Клеточно-опосредованные и гуморальные иммунные ответы. Для демонстрации кожной вакцинации с помощью новых MNA, с содержащими лекарство остриями, CMC/Treh-MNA, включающие 10 мкг OVA±25 мкг Poly(I:C) подготовили, как описано выше. Мышей иммунизировали методом кожной вакцинации с помощью MNA (10 мкг OVA±25 мкг Poly(I:C), при этом MNA накладывали на правую и левую стороны живота, по две MNA на мышь), или методом двух внутримышечных инъекций 10 мкг OVA в растворе PBS в икроножную мышцу задней конечности или оставляли без терапии (т.е. не использовали в опытах). Иммунизации выполняли в 0 и 7 сутки в качестве первичной и дополнительной доз, соответственно. Затем мышей анализировали на in vivo OVA-специфическую цитотоксическую активность T-клеток и OVA-специфический гуморальный иммунный ответ через 5 суток после дополнительной доз, с использованием общепринятых методов.
[0115] Для анализа на OVA-специфический гуморальный иммунный ответ, из анестезированных мышей брали кровь в момент умерщвления посредством пункции сердца, и выделяли сыворотку с использованием сывороточного сепаратора BD Microtainer (BD Biosciences, Сан-Хосе, шт. Калифорния). Содержание OVA-специфических антител IgG1 и IgG2c в сыворотке измеряли посредством непрямых твердофазных иммуноферментных анализов (ELISA). Планшеты Costar для EIA/RIA (иммунноферментного анализа /радиоиммунного анализа) (Corning Inc., Корнинг, шт. Нью-Йорк) покрывали OVA (100 мкг/мл в 0,5-M карбонатно-бикарбонатном буфере, с уровнем pH 9,6; Sigma) посредством инкубации в течение всей ночи при 4°C. Планшеты промывали (3-кратно) 0,05% растворов Tween20 в PBS и закупоривали 1% козьей сывороткой в PBS на 1 час при 37°C. Пробы сыворотки и стандартные пробы (IgG1 к OVA от Cayman Chemical, Энн-Арбор, шт. Мичиган; IgG2c к OVA от Chondrex, Редмонд, шт. Вашингтон) разбавляли 1% козьей сывороткой, добавляли на планшеты и инкубировали 2 часа при 37°C. После промывки (3-кратной), планшеты инкубировали в течение 1 часа при 37°C с биотинилированными вторичными антителами (козьими антителами к IgG1 или IgG2c мыши, 1:20000 в 1% козьей сыворотке; Jackson ImmunoResearch, Вест-Гроув, шт. Пенсильвания). Затем планшеты промывали (3-кратно) и инкубировали в течение 30 мин со стрептавидином-HRP (1:1000 в 1% козьей сыворотке; BD Biosciences). Планшеты снова промывали (3-кратно) и инкубировали при комнатной температуре с субстратом из 4,4’,5,5’-тетраметилбензидина (TMB) пероксидазы (Sigma) в течение 2-3 минут, и реакцию гасили 1,0-M раствором H2SO4. Для всех ELISA, поглощение на длине волны 450 нм (OD450) замеряли с помощью спектрофотометра SpectraMax 340PC для прочтения планшетов (Molecular Devices, Саннивейл, шт. Калифорния), и концентрации в сыворотке вычисляли по стандартным кривым.
[0116] Для оценки OVA-специфической цитотоксической активности T-клеток, спленоциты от мышей, не использованных в опытах, сенсибилизировали раствором 2 мкг/мл пептида OVA257-264 (SIINFEKL) или оставляли несенсибилизированными в течение 1 часа. Спленоциты, сенсибилизированные антигеном, промывали и окрашивали высококонцентрированным раствором сукцинимидилового эфира карбоксифлуоресцеина (CFSE, 10 мкМ), а несенсибилизированные спленоциты метили низкоконцентрированным CFSE (1 мкМ) в течение 15 мин при 37°C. Смесь 1:1 из сенсибилизированных клеток-мишеней и несенсибилизированных контрольных клеток (по 107 каждой) вводили внутривенно (IV) иммунизированным мышам и мышам, не использованных в опытах. Через двадцать четыре часа после адоптивного переноса отделяли селезенки мышей, и лизис клеток-мишеней оценивали путем сравнения сенсибилизированных антигеном и несенсибилизированных популяций методом проточной цитометрии, чтобы количественно определить OVA-специфический лизис SIINFEKL-сенсибилизированных клеток-мишеней, меченных высококонцентрированным раствором CFSE. Специфический лизис вычисляли и выражали в процентах от максимального лизиса в виде % Лизис={1 − [(среднее отношение CFSEнизкоконцентрированный/CFSEвысококонцентрированный у невакцинированных мышей/(отношение CFSEнизкоконцентрированный/CFSEвысококонцентрированный у вакцинированной мыши)]} × 100.
[0117] Внутрикожное и некожное применения
[0118] В дополнение к кожной вакцинации, MNA, описанные в настоящей заявке, можно использовать в широком диапазоне применений для внутрикожной и некожной (например, в глазную и сердечную ткани) доставки лекарств. Как показано на фиг.7A-D, представляющую интерес бионагрузку можно поместить на самом острие микроигл в процессе центробежного литья (т.е. на участке пирамиды), или вся пирамидальная область может быть заполнена бионагрузкой в зависимости от требований к дозе. Фиг.7A представляет PVP/PVA-MNA, содержащие декстран (с молекулярной массой около 40 кДа), окрашенный техасским красным, на остриях микроигл, а фиг.7B представляет CMC/Treh-MNA, содержащие краситель Allura Red R40 (с молекулярной массой около 500 кДа) в пирамидальной области микроигл.
[0119] Кроме того, для изготовления высококачественных MNA с микроиглами с поднутрениями, которые включают несколько нагрузок в их пирамидальных областях можно выполнить несколько повторяемых этапов центробежного литья (фиг.7C и 7D). Фиг.7C представляет PVP/PVA-MNA с содержащими лекарство остриями, включающие несколько нагрузок, например, декстран, окрашенный техасским красным, и краситель Allura Red R40, и фиг.7D представляет PVP/PVA-MNA с содержащими лекарство остриями, включающие несколько нагрузок, например, декстран, окрашенный техасским красным, и микрочастицы (со средним диаметром 10 мкм) PLGA, помеченные с помощью Alexa488.
[0120] По существу, предложенные подхлж и новые конструкции MNA являются совместимыми с моно- и комбинированной терапиями в нескольких вариантах кожных и некожных применений. Важно отметить, что одни и те же производственные литьевые формы можно использовать для эффективного изготовления растворяющихся MNA с микроиглами с поднутрениями в течение нескольких циклов (например, фиг.7A и 7C изображают MNA, полученные после, соответственно, первого и двенадцатого циклов с использованием одинаковой технологии). Важно отметить, что в настоящем исследовании показаны применения MNA, содержащих одну нагрузку (OVA) и несколько нагрузок (OVA+Poly(I:C)), для кожной вакцинации in vivo.
[0121] Аддитивная технология изготовления или 3D-печать, применяемая в системах и способах, описанных в настоящей заявке, обеспечивает точное и воспроизводимое изготовление сложных 3D геометрических форм, без конструктивных ограничений, и предлагает высокую степень гибкости и контроля проектирования. При использовании описанных здесь систем и способов, возможно сокращение времени с проектирования по изготовление для оптимальных специализированных систем доставки лекарств.
[0122] Разнообразные геометрические формы игл
[0123] Как описано выше, системы и способы, раскрытые в настоящей заявке, предлагают беспрецедентный уровень гибкости проектирования конструкций MNA. Для демонстрации диапазона геометрических возможностей прямой лазерной 3D-запись изготовили конструкции микроигл с разнообразными геометрическими формами.
[0124] Фиг.8A-8B показывают, что данная технология позволяет изготавливать микроиглы с геометрическими формами в широком диапазоне и с высокой точностью, с целью оптимизации соответственно применению. К тому же, как показано на фиг.8A-8B, это допускает изменение конструкций в широком диапазоне, включая высоту, ширину, угол при вершине и геометрию микроигл, без потребности в сложных и специальных этапах технологической обработки. По существу, данная технология прокладывает путь к проектированию и изготовлению уникальных конструкций MNA для специальных применений.
[0125] Внутрикожная доставка вакцины из MNA в человеческую кожу.
[0126] Для оценки характеристик кожной доставки бионагрузок из MNA с иглами с поднутрениями изготовили MNA с содержащими лекарство остриями и красителем Allura Red R40, с использованием представленных методов изготовления. Эксплантаты человеческой кожи подготавливали, как описано выше. MNA, содержащие краситель Allura Red R40, налагали на эксплантаты живой человеческой кожи и снимали через 10 мин. Изображения упомянутых MNA до (фиг.9A) и после (фиг.9B) накладывания демонстрировали высокое качество MNA и полное растворение микроигл, соответственно. Соответствующие отложения нагрузки, внедренной в MNA, (например, красителя Allura Red R40) в целевой коже показаны на фиг.9C.
[0127] Успешная доставка вакцины через роговой слой эпидермы в кожные микросреды с иммунными клетками имеет огромное значение для эффективной внутрикожной иммунизации. Для анатомической оценки доставки OVA и Poly(I:C) в человеческую кожу, CMC/Treh-MNA, содержащие как OVA, помеченного с помощью Alexa555, так и Poly(I:C), помеченного с помощью Alexa488, налагали на эксплантаты человеческой кожи на 10 мин и затем снимали. Целевую человеческую кожу криосекционировали и визуализировали с помощью просвечивающего флуоресцентного микроскопа Nikon. Гистология продемонстрировала микроигл, проникающие сквозь эпидерму в дерму (фиг.9G), и доставку флуоресцентно меченых OVA и Poly(I:C) в целевые человеческие кожные микросреды (фиг.9D-I: окраска ядерным красителем DAPI, Poly(I:C), помеченный с помощью Alexa488, OVA, помеченный с помощью Alexa555, светлое поле, наложение 3 разных флуоресцентных цветов, объединенное изображение всех флуоресцентных изображений со светлопольным изображением, соответственно). На фиг.9D-I, масштабные линейки соответствуют 100 мкм.
[0128] Совместно, данные изображения предполагают, что предлагаемые уникальные MNA выполняли требования к геометрии (т.е. остроконечные острия и гладкие кромки) и механической прочности для безопасного проникновения в человеческую кожу (т.е. прохода сквозь роговой слой эпидермы и живую эпидерму epidermis) и требования к материалам для эффективного растворения в водной среде кожи, и, следовательно, представляют платформу для эффективной кожной доставки лекарств и вакцин.
[0129] Кожная иммунизация in vivo из MNA
[0130] Для исследования внутрикожной доставки in vivo вакцины в мышей с использованием новых MNA были изготовлены, как описано выше, CMC/Treh-MNA с высокоточными микроиглами с поднутрениями, содержащие как OVA, помеченный с помощью Alexa555, так и Poly(I:C), помеченный с помощью Alexa488. Перед применением получили изображения MNA, содержащих OVA с Alexa555+Poly(I:C), методом светлопольной оптической микроскопии и эпифлюоресцентной микроскопии (фиг.10A). Затем MNA накладывали на мышь и снимали через 10 мин. С использованием светлопольной оптической микроскопии получили также изображение остающегося материала в MNA после накладываний (фиг.10B). Изображения мышей, прошедших процедуру с MNA, получали с использованием системы IVIS 200 для визуализации живых животных, с фильтрами как для Poly(I:C) с Alexa488, так и для OVA с Alexa555. Совместная доставка Poly(I:C) и OVA из MNA показана на фиг.10C и 10D, соответственно. Вместе взятые, упомянутые изображения продемонстрировали успешное применение in vivo новых MNA на мышах и, в свою очередь, эффективную кожную доставку лекарств и вакцин из MNA, с использованием новых конструкций MNA.
[0131] После демонстрации успешной внутрикожной доставки вакцин in vivo, авторы изобретения специально оценили иммунногенность антигена±адьюванта, содержащихся в MNA, и сравнили иммунизацию с использованием MNA с вакцинацией с использованием клинически распространенного метода внутримышечных (IM) инъекций. С этой целью изготовили CMC/Treh-MNA с 10 мкг OVA±25 мкг Poly(I:C) в каждой MNA, как описано выше. Авторы изобретения и другие исследователи ранее показали, что растворяющиеся белки, объединенные в MNA, поддерживали их целостность. Для иммунизации выполняли режим вакцинации, описанный в разделе способов, для иммунизации мышей как внутримышечно, так и из MNA, через отделы на животе. Ответные реакции OVA-специфических цитотоксических T-клеток (CTL) и антител количественно определяли с использованием стандартного литического анализа in vivo и ELISA, соответственно. Кожная вакцинация с помощью MNAs вызывала надежные антиген-специфические клеточные иммунные ответы (фиг.11A-B). Как и ожидалось, из мышей, не использованных в опытах или неиммунизированных, выделяли эквивалентные количества антиген-сенсибилизированных (CFSEвысокая концентрация) клеток-мишеней и несенсибилизированных (CFSEнизкая концентрация) клеток-мишеней (фиг.11A), что свидетельствует об отсутствии антиген-специфической цитолитической активности. Напротив, специфический лизис антиген-сенсибилизированных клеток-мишеней резко усиливался в иммунизированных мышах, как показано сниженной выживаемостью OVA-сенсибилизированных мишеней по сравнению с несенсибилизированными мишенями. В частности, в то время, как у внутримышечно OVA-иммунизированных мышей наблюдались минимальные различия между выделениями двух популяций (фиг.11A), мыши, иммунизированные OVA из MNA, демонстрировали более интенсивный OVA-специфический лизис in vivo, при значительно (по сравнению с внутримышечным введением OVA) меньшем выживании и выделении OVA-сенсибилизированных мишеней, чем несенсибилизированных мишеней (фиг.11A). Иммунизация с помощью OVA+Poly(I:C) дополнительно повышала эффективность вакцинации (фиг.11A). Количественное определение антиген-специфического лизиса стандартными методами подтвердило, что иммунизация с использованием MNA вызывала сильный иммунитет, создаваемый CTL (цитотоксическими T-клетками), (фиг.11B), который дополнительно усиливался включением адьюванта Poly(I:C). Внутримышечная иммунизация вызывала слабые ответы по сравнению с неиммунизированными контрольными образцами. В сочетании, приведенные результаты показали, что упомянутые MNA могут эффективно доставлять антигены±адьюванты в микросреды с APC (антиген-презентирующими клетками) внутри кожи, чтобы вызывать сильные иммунные ответы, создаваемый CTL.
[0132] Кроме иммунитета, создаваемого CTL, кожная вакцинация с помощью MNA вызывала надежные антиген-специфические гуморальные иммунные ответы (фиг.11C). Хотя вакцинация мышей как с помощью MNA, и внутримышечно приводила к образованию IgG, мыши, вакцинированные растворяющимися MNA, имели значительно более высокие титры IgG, что показывает важность технологии MNA для работ по иммунизации. И наконец, представленные новые MNA обеспечивают уникальную возможность для специфической и точной доставки заложенных антигена±адьюванта в заданные микросреды внутри кожи. Например, авторы изобретения и другие исследователи показали, что кожа содержит большое количество дендритных клеток и других антиген-презентирующих клеток (APC), определяющих вакцинальную стимуляцию иммунной системы. Следовательно, прицельно воздействие на кожные APC с помощью MNA может быть эффективной стратегией для вакцинации в общем и, в частности, для вызова клеточно-опосредованных иммунных ответов, включая иммунные реакции цитотоксических T-клеток (CTL), важные для предотвращения или лечения многих инфекционных заболеваний и рака. По существу, предлагаемая технология MNA могла предоставлять возможности, подходящие для множества стратегий вакцинации.
[0133] Соответственно, разработка и применение новых растворяющихся MNA с микроиглами с поднутрениями обеспечивают эффективную внутрикожную вакцинацию. Уникальные конструкции MNA включают в себя пирамидальные наконечники и области поднутрения стержней со скругленными основаниями. Способ изготовления для создания MNA с поднутрениями принципиально включал в себя лазерную 3D-печать и ряд процессов микроформования. Успешное и воспроизводимое изготовление растворимых MNA с иглами с поднутрениями, которые включают в себя большое число бионагрузок, обеспечивали с использованием разных биосовместимых и водорастворимых полимеров. Важно отметить, что беспрецедентный уровень геометрических возможностей лазерной 3D-печати был показан с целью демонстрации конструкций MNA специального применения для нескольких прикладных задач кожной и некожной доставки лекарств. Предложенные новые MNA с элементами поднутрения выполняли требования к прочности для безопасного проникновения в кожу людей и мышей и успешно доставляли бионагрузки в целевые кожные микросреды. Важно отметить, что кожная вакцинация с использованием модельных MNA с содержанием антигенов (OVA-MNA) вызывала более сильные антиген-специфические клеточные и гуморальные иммунные ответы, чем вакцинации, получаемые традиционным методом вакцинации внутримышечной инъекцией (IM-OVA). Что особенно важно, совместная доставка антигена (OVA) с адьювантом (Poly(I:C)) из MNA усиливала иммуногенность вакцины по сравнению с внутримышечной вакцинацией, что указывает на повышенную эффективность кожной вакцинации с помощью MNA. В целом, представленный подход обеспечивает эффективное средство изготовления новых растворяющихся MNA для широкого спектра прикладных задач кожной и некожной доставки лекарств.
[0134] Принимая во внимание многочисленные возможные варианты осуществления, к которым можно применить принципы раскрытого изобретения, следует признать, что показанные варианты осуществления являются только предпочтительными примерами изобретения и не должны считаться ограничивающими объем изобретения. Напротив, объем изобретения определяется последующей формулой изобретения. Поэтому авторы изобретения заявляют своим изобретением все, что входит в пределы объема и существа данной формулы изобретения.










Изобретение относится к медицинской технике, а именно к способам формирования микроигольной матрицы из производственной литьевой формы, которая содержит гибкий материал для форм. Производственная литьевая форма включает в себя множество полостей, которые имеют форму для определения множества соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения. Гибкий материал имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание без повреждения целостности формы микроигл, определяемой литьевой формой, а также с сохранением целостности литьевой формы при многократных применениях. Микроиглы могут иметь множество разнообразных геометрических конструкций и могут включать в себя разные растворимые и нерастворяющиеся слои, а также разные типы подложек. Раскрытый способ можно применять для воспроизводимого изготовления растворимых микроигольных матриц с покрытием и с поднутрениями и скругленными основаниями, а также нерастворяющихся микроигольных матриц с поднутрениями, подлежащих применению в качестве липких аппликаторов на ткань. 9 н. и 36 з.п. ф-лы, 11 ил.
1. Способ формирования микроигольной матрицы, содержащий этапы, на которых:
формируют производственную литьевую форму, при этом производственная литьевая форма содержит полости, которые имеют форму для определения соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения,
включают по меньшей мере один биоактивный материал в первый растворимый материал, чтобы обеспечить биоразлагаемую матрицу,
доставляют биоразлагаемую матрицу в по меньшей мере участок острия микроиглы, определяеемый соответствующими полостями производственной литьевой формы;
формируют микроиглы в производственной литьевой форме, которые содержат биоразлагаемую матрицу; и
извлекают микроиглы из производственной литьевой формы посредством вытягивания микроигл из литьевой формы,
причем производственную литьевую форму формируют из материала, который имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
2. Способ по п.1, в котором упомянутый по меньшей мере один элемент поднутрения находится непосредственно под острием микроиглы.
3. Способ по п.1 или 2, в котором стержень формируют из первого растворимого материала.
4. Способ по п.1 или 2, в котором стержень формируют из нерастворяющегося материала.
5. Способ по любому из пп.1-4, в котором формирование микроигольных матриц содержит подачу второго растворимого материала в производственную литьевую форму, чтобы сформировать растворяющийся слой на участке стержня, который находится рядом с острием микроиглы.
6. Способ по п.5, в котором второй растворимый материал растворяющегося слоя выбирают из материала, который растворяется быстрее, чем биоразлагаемая или биорастворимая матрица, которая содержит биоактивный материал.
7. Способ по любому из пп.1-6, дополнительно содержащий этап формирования подложки вблизи нижнего участка стержня.
8. Способ по п.7, в котором подложку формируют из растворимого материала.
9. Способ по п.7, в котором подложку формируют из нерастворимого материала.
10. Способ по п.7, в котором подложку формируют из материала, который выполнен с возможностью гнуться, деформироваться или изгибаться для плотного прилегания к неравномерной геометрической форме поверхности кожи.
11. Способ по любому из пп.1-10, в котором первый растворимый материал содержит карбоксиметилцеллюлозу, трегалозу, поливинилпирролидон, мальтодекстрин, шелк, гиалуроновую кислоту, поливиниловый спирт, полиэтиленгликоль, сополимер молочной кислоты и гликолевой кислоты, полимолочную кислоту или их комбинацию.
12. Способ по п.5, в котором второй растворимый материал содержит быстро растворяющийся полимер с низкой молекулярной массой.
13. Способ по п.12, в котором второй растворимый материал является глюкозой, трегалозой, сахарозой, мальтодекстрином, поливинилпирролидоном или их комбинацией.
14. Способ по п.10, в котором упомянутый материал является нерастворяющимся полимером.
15. Способ по любому из пп.1-14, в котором упомянутый по меньшей мере один биоактивный материал содержит два или более биоактивных материалов.
16. Способ по любому из пп.1-15, в котором упомянутые один или более биоактивных материалов содержат косметические средства, кожные наполнители, статины, факторы роста, обезболивающие средства, антигистаминные средства, витамины, анестетики, средства от старения, низкомолекулярные лекарственные средства, гаптены, аллергены, противовоспалительные средства, белки, пептиды, микропузырьки, экзосомы, полиплексы (малые интерферирующие РНК, короткошпилечные РНК, комплексы ДНК-векторов), рекомбинантные вирусные вектора (т.е. аденовирус, лентивирус, вирус коровьей оспы, аденоассоциированный вирус, и их разные серотипы), моноклональные и поликлональные антитела и живые или подвергшиеся лизису клетки.
17. Способ по любому из пп.1-16, в котором микроигла имеет форму, которая включает круглую иглу, квадратную иглу, скошенную иглу, пирамиду на квадратном стержне, стреловидную форму на стержне, пирамидальный наконечник на квадратном игольчатом стержне, конический наконечник на круглом игольчатом стержне, квадратную иглу, 45° пирамиду или 30° пирамиду.
18. Способ по любому из пп.1-17, в котором микроигла дополнительно содержит скругленный участок в месте пересечения подложки и стержня.
19. Микроигольная матрица, сформированная способом по любому из пп.1-18.
20. Микроигольная матрица, сформированная с использованием литьевой формы для извлечения одним вытягиванием, содержащая:
подложку;
микроиглы; и
по меньшей мере один биоактивный материал, объединенный с первым растворимым материалом для формирования биоразлагаемой матрицы,
при этом микроиглы содержат, каждая, стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения.
21. Микроигольная матрица по п.20, в которой элемент поднутрения располагается в месте пересечения стержня и острия микроиглы.
22. Микроигольная матрица по п.20 или 21, в которой стержень сформирован из первого растворимого материала.
23. Микроигольная матрица по п.20 или 21, в которой стержень сформирован из нерастворимого материала.
24. Микроигольная матрица по любому из пп.20-23, в которой микроиглы содержат, каждая, второй растворимый материал, который формирует быстро растворяющийся слой на участке стержня, который находится рядом с острием микроиглы.
25. Микроигольная матрица по п.24, в которой второй растворимый материал растворяющегося слоя выбран из материала, который растворяется быстрее, чем биоразлагаемая матрица, которая сождержит биоактивный материал.
26. Микроигольная матрица по пп.20-25, в которой подложка сформирована из растворимого материала.
27. Микроигольная матрица по пп.20-25, в которой подложка сформирована из нерастворимого материала.
28. Микроигольная матрица по пп.20-27, в которой подложка сформирована из материала, который выполнен с возможностью изгибаться для плотного прилегания к неравномерной геометрической форме поверхности кожи.
29. Микроигольная матрица по пп.20-28, в которой первый растворимый материал содержит карбоксиметилцеллюлозу, трегалозу, поливинилпирролидон, мальтодекстрин, щелк, гиалуроновую кислоту, сополимер молочной кислоты и гликолевой кислоты, полимолочную кислоту, поливиниловый спирт, полиэтиленгликоль или их комбинацию.
30. Микроигольная матрица по пп.24 или 25, в которой второй растворимый материал содержит быстро растворяющийся полимер с низкой молекулярной массой.
31. Микроигольная матрица по п.30, в которой второй растворимый материал является глюкозой, трегалозой, сахарозой, поливинилпирролидоном, мальтодекстрином или их комбинацией.
32. Микроигольная матрица по п.28, в которой упомянутый материал является нерастворяющимся полимером.
33. Микроигольная матрица по пп.20-32, в которой упомянутый по меньшей мере один биоактивный материал содержит два или более биоактивных материалов.
34. Микроигольная матрица по пп.20-33, в которой упомянутые один или более биоактивных материалов содержат косметические средства, кожные наполнители, статины, факторы роста, обезболивающие средства, антигистаминные средства, витамины, анестетики, средства от старения, низкомолекулярные лекарственные средства, гаптены, аллергены, противовоспалительное средство, белки, пептиды, микропузырьки, экзосомы, полиплексы (малые интерферирующие РНК, короткошпилечные РНК, комплексы ДНК-векторов), рекомбинантные вирусные вектора (т.е. аденовирус, лентивирус, вирус простого герпеса, вирус коровьей оспы, аденоассоциированный вирус и их разные серотипы), моноклональные и поликлональные антитела и живые или подвергшиеся лизису клетки.
35. Микроигольная матрица по пп.20-34, в которой микроигла имеет форму, которая включает в себя круглую иглу, квадратную иглу, скошенную иглу, пирамиду на квадратном стержне, стреловидную форму на стержне, пирамидальный наконечник на квадратном игольчатом стержне, конический наконечник на круглом игольчатом стержне, квадратную иглу, 45° пирамиду или 30° пирамиду.
36. Микроигольная матрица по пп.20-35, в которой микроигла дополнительно содержит скругленный участок в месте пересечения подложки и стержня.
37. Способ формирования литьевой формы, содержащий следующие этапы:
создают 3D-САПР чертеж микроигольной матрицы, которая содержит микроиглы с по меньшей мере одним элементом поднутрения;
формируют базовую микроигольную матрицу с использованием 3D-САПР чертежа;
формируют по меньшей мере одну реплику базовой микроигольной матрицы; и
формируют производственную литьевую форму микроигольной матрицы с использованием упомянутой по меньшей мере одной реплики,
при этом производственную литьевую форму формируют из материала, который имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
38. Способ по п.37, в котором упомянутая по меньшей мере одна реплика включает в себя реплики, и формирование производственной литьевой формы содержит формирование держателя микроигольной матрицы и объединение реплик на держателе микроигольной матрицы.
39. Способ по п.37 или 38, в котором держатель микроигольной матрицы формируют из полимерного материала.
40. Способ формирования липкого аппликатора для ткани тела, содержащий этапы, на которых:
формируют производственную литьевую форму, причем производственная литьевая форма содержит полости, которые имеют форму для определения соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения,
включают по меньшей мере один биоактивный материал в первый растворимый материал, чтобы обеспечить биоразлагаемую матрицу,
доставляют биоразлагаемую матрицу в по меньшей мере участок острия микроиглы, определяемый соответствующими полостями производственной литьевой формы;
формируют микроиглы в производственной литьевой форме, которые содержат биоразлагаемую матрицу; и
извлекают микроиглы из производственной литьевой формы посредством вытягивания микроигл из литьевой формы,
при этом производственную литьевую форму формируют из материала, который имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
41. Способ формирования липкого аппликатора для ткани тела или матрицы микрозубцов, содержащий этапы, на которых:
формируют производственную литьевую форму, причем производственная литьевая форма содержит полости, которые имеют форму для определения соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения,
включают по меньшей мере один биоактивный материал в первый растворимый материал, чтобы обеспечить биоразлагаемую матрицу,
доставляют биоразлагаемую матрицу в по меньшей мере участок острия микроиглы, определяемый соответствующими полостями производственной литьевой формы;
формируют микроиглы в производственной литьевой форме, которые содержат биоразлагаемую матрицу; и
извлекают микроиглы из производственной литьевой формы посредством вытягивания микроигл из литьевой формы,
при этом производственную литьевую форму формируют из материала, который имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
42. Способ формирования микроигольной матрицы, содержащий этапы, на которых:
формируют производственную литьевую форму, причем производственная литьевая форма содержит полости, которые имеют форму для определения соответствующих микроигл, каждая из которых имеет стержень, острие микроиглы, скругленное основание и по меньшей мере один элемент поднутрения,
формируют микроиглы в производственной литьевой форме;
извлекают микроиглы из производственной литьевой формы посредством вытягивания микроигл из литьевой формы; и
покрывают по меньшей мере участок микроигл биоактивным компонентом,
при этом производственную литьевую форму формируют из материала, который имеет достаточную эластичность, чтобы допускать извлечение формованной микроигольной матрицы из производственной литьевой формы за одно вытягивание, без повреждения целостности формы микроигл, определяемой литьевой формой.
43. Способ по п.42, в котором микроиглу покрывают биоактивным компонентом методом покрытия окунанием, распыления сжатым воздухом или их комбинацией.
44. Способ использования любой из микроигольных матриц, сформированных согласно одному из пп.20-36, при этом способ содержит этап, на котором:
накладывают микроигольную матрицу на целевую зону кожи для внутрикожной доставки по меньшей мере одного биоактивного компонента.
45. Способ использования любой из микроигольных матриц, сформированных согласно одному из пп.20-36, при этом способ содержит этап, на котором:
накладывают микроигольную матрицу на некожную ткань для доставки по меньшей мере одного биоактивного компонента в некожную ткань.
| US 2013338632 A1, 19.12.2013 | |||
| US 2016158512 A1, 09.06.2016 | |||
| МИКРОИГЛА, ФОРМА ДЛЯ ЕЕ ИЗГОТОВЛЕНИЯ И СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОИГЛЫ | 2014 |
|
RU2679107C2 |
Авторы
Даты
2024-04-02—Публикация
2020-05-15—Подача