Настоящее изобретение относится к микроигольчатой системе (сокращенно MNS) для доставки интерферона внутрикожно.
Интерфероны – это эндогенные мессенджеры, посредством которых разные клетки иммунной системы взаимодействуют друг с другом. Бета-интерферон «бета-1а» получают генноинженерным способом, и он отличатся лишь незначительно от человеческого бета-интерферона. Активное начало применяется при рецидивирующем и вторично прогрессирующем рассеянном склерозе. Предполагается, что при использовании бета-интерферона затормаживается активность автореактивных Т-клеток (защитных клеток, действующих против эндогенной ткани) и вследствие этого замедляется повреждение миелина, образующего защитную оболочку нервных волокон.
Применяемые в настоящее время в терапии рассеянного склероза препараты бета-интерферона (например, Avonex®, Rebif®) несколько раз в неделю вводят внутримышечно или подкожно. Вследствие самолечения пациентов с рассеянным склерозом, сопровождающегося связанными с этим рисками инфекций и ранений при уколе иглой, соблюдение больным режима и схемы лечения при лечении бета-интерфероном с применением растворимой микроматрицы существенно улучшается. Другое преимущество внутрикожного применения бета-интерферона, по мнению экспертов, может заключаться в непосредственном выделении активного вещества вблизи от иммунокомпетентных целевых клеток в верхних слоях кожи, что в свою очередь, в противоположность парентеральному применению активного вещества (например, в виде подкожной инфекции), могло бы привести к снижению случаев часто происходящих нежелательных побочных эффектов (подобные гриппу симптомы, рост определённых показателей функции печени).
Кожа состоит из нескольких слоёв. Самый верхний слой кожи, Stratum Corneum (роговой слой), обладает известными защитными свойствами, предупреждающими проникновение сторонних веществ в организм и выход собственных веществ из него. Stratum Corneum, представляющий собой сложную структуру из уплотнённых кератозных остаточных клеток толщиной около 10-30 мкм, образует водонепроницаемую мембрану для защиты организма. Естественная непроницаемость рогового слоя препятствует введению большинства фармацевтических активных веществ, а также других веществ через кожный барьер в качестве компонента формы для трансдермальной доставки. Клетки Лангерганса непрерывно обнаруживаются в базальном гранулатном слое эпителия и играют важную роль в начальной защите иммунной системы от проникающих организмов.
Микроигольчатые системы (MNS), состоящие из набора микроигл (MNA) и при необходимости дополнительных компонентов, посредством усилия нажатия способны прижимать микроиглы (также упоминаемых как элементы для проникания через кожу) набора (MNA) к месту доставки на коже для проникания через роговой слой и, следовательно, для формирования канала для текучей среды, в результате чего интерферон может быть введен внутрикожно. Такие наборы микроигл (MA) микроигольчатых систем (MS), а также их изготовление описаны в уровне техники и обозначены также как пластыри на основе наборов микроигол.
Также из уровня техники известно, что протеины, в том числе интерферон, можно вводить посредством микроигольчатых систем (например, WO 2007030477 А2). Согласно WO 2007030477 А2 предусмотрено применение частиц активного вещества, центрифугируемых на остриё перфоратора.
Поэтому задачей настоящего изобретения является обеспечение внутрикожного введения интерферона посредством MNS, содержащей MNA на основе соответствующей композиции.
Неожиданным образом была установлена особая пригодность поливинилпирролидона (сокращенно PVP) для приготовления полностью растворимой композиции для MNA для внутрикожного введения интерферона.
Композиция согласно изобретению обладает достаточной концентрацией и полной растворимостью, вследствие чего для интерферона достигается достаточная стабильность даже при отсутствии стабилизаторов – при применении и растворении MNA¸ а также при абсорбции и распределении активного начала в организме.
Композиция согласно изобретению характеризуется наряду с обеспечением пригодности MNA для непосредственного внутрикожного применения интерферона также своей стабильностью при хранении при использовании для содержащей интерферон микроматрицы, в частности, при комнатной температуре в течение 3 месяцев и более.
Кроме того, композиция согласно изобретению была применена в рамках биологического испытания in vitro на человеческой линии модельных клеток рака шейки матки. Было успешно подтверждено, что несмотря на введение вируса Enzephalomyokarditis (EMCV) лизиса человеческих клеток не происходило. Интерферон, заключенный в MNA в составе композиции согласно изобретению надёжно ведёт себя как противовирусное средство и обладает эффективностью, сопоставимой с эффективностью оригинальных препаратов. Поэтому можно рассчитывать на успешное одинаковое лечение, как и при введении интерферона (подкожно или внутримышечно), см. фиг. 1-4.
Поэтому согласно изобретению данная задача решается посредством набору микоигол (MNA) по пункту 1 формулы изобретения, содержащей композицию, включающую поливинилпирролидон, для применения при внутрикожной доставке интерферона, при этом поливинилпирролидон является основным компонентом композиции.
Поэтому также предметом изобретения служит микроигольчатая система, содержащая MNA для применения при внутрикожной доставке интерферона, причём поливинилпирролидон является основным компонентом композиции.
Таким образом, изобретение содержит продукт, включающий в себя набор микроигл, содержащих композицию, включающую поливинилпирролидон для применения для внутрикожной доставки интерферона, при этом поливинипирролидон является основным компонентом композиции.
Таким продуктом является, например, фармацевтический продукт, содержащий упомянутый выше набор микроигл (MNA) для применения при внутрикожной доставке интерферона, в частности, для лечения рассеянного склероза (MS) или для терапии посредством интерферона.
Особенно предпочтителен набор микроигол согласно изобретению, содержащий интерферон в количестве от 0,1 до 200 мкг на один MNA, в частности, от 10 до 100 мкм на один MNA.
Понятие «внутрикожная доставка» (синоним – «интрадермальная доставка») означает согласно изобретению введение интерферона из MNA в кожу, для чего требуется проникание микроигл в кожу.
Понятие «интерферон» охватывает все виды или один или несколько видов интерферона, альфа-, бета-, гамма-интерферон, интерферон-тау, в частности, интерфероны beta-1, интерферон beta-1a, для лечения рассеянного склероза (MS). Бета-интерфероны согласно изобретению являются предпочтительными. Интерфероны представляют собой протеины или гликопротеины, которые оказывают иммуностимулирующее, прежде всего противовирусное и противоопухолевое действия, и представляют собой эндогенные цитокины.
Выражение «причём поливинилпирролидон является основным компонентом композиции» означает, что наряду с другими адъювантами и активным началом интерфероном поливинилпиррролидон является по количеству мас. % основным компонентом, т.е. большая часть процентов веса состава полностью растворимой композиции приходится на поливинилпирролидон.
Объектом изобретения является также способ проведения внутрикожной доставки интерферона, включающий в себя:
а) фиксацию микроигольчатой системы согласно изобретению на коже, и
б) проникание в кожу набора микроигл, содержащих полностью растворимую композицию, включающую поливинилпирролидон, причём поливинилпирролидон является основным компонентом композиции.
В рамках настоящего изобретения микроигольчатая система представляет собой такую систему, которая содержит устройство, посредством которого должен обеспечиваться на коже набор микроигл для введения интерферона и доставки внутрикожно.
Согласно предпочтительному варианту выполнения микроигольчатая система может содержать аппликатор, такой, как пусковое устройство, управляемый электрически или механически. Аппликатор может содержать, например, поршень, посредством которого набор микроигл помещается на кожу или размещается на коже, в результате чего микроиглы проникают в кожу.
Так, например, пусковое устройство может содержать насос, шприц или пружину, вследствие чего ударение поршнем может происходить с достаточной энергией. Поршень может быть разной формы и природы и должен прежде всего обеспечить, чтобы набор микроигл могла переместиться из первого положения во второе положение на коже для введения интерферона. Кроме того, аппликатор может содержать нажимную кнопку или иной пусковой механизм.
Набор микроигл может содержать множество микроигл для введения интерферона через или внутрь кожи больного, причём набор микроигл размещается на коже больного. Предпочтительно каждая микроигла набора микроигл имеет тело вытянутой формы с двумя концами; один конец тела является основанием микроиглы, с помощью которого микроигла закрепляется на плоском носителе или утоплена в нём. Противоположный основанию конец тела выполнен предпочтительно заострённым для обеспечения по возможности лёгкого проникновения микроиглы в кожу.
Микроиглы могут иметь тело круглого или же не круглого сечения, например, треугольного, четырёхугольного или пятиугольного сечения. В теле может быть выполнен один или несколько проходов, простирающихся от основания иглы до её вершины или почти до вершины. Микроиглы могут быть выполнены в виде (рыболовного) крючка, причём одна или несколько из этих микроигл содержат один или несколько таких крючков. Кроме того, микроиглы могут быть винтообразными и располагаться с возможностью вращения и в результате этого при вращательном движении облегчается проникновение в кожу и создаётся зацепление в ней (DE 103 53 629 А1), в частности, на требуемой глубине проникновения в эпидермис.
Диаметр микроиглы составляет обычно от 1 до 1000 мкм, предпочтительно от 10 до 100 мкм. Длина микроиглы составляет обычно от 5 до 6000 мкм, в частности, от 100 до 700 мкм.
Своим основанием микроиглы закреплены на плоском носителе или утоплены в нём. Предпочтительно микроиглы расположены вертикально, по существу перпендикулярно поверхности носителя. Микроиглы могут располагаться равномерно или неравномерно. Компоновка из нескольких микроигл может содержать микроиглы разного профиля, разного диаметра и/или разной длины. Компоновка из нескольких микроигл может содержать, например, только полые микроиглы.
Набор микроигл может содержать плоский носитель, причём носитель имеет по существу дискообразную, пластинчатую или плёночную форму. Основание носителя может быть выполнено из разных материалов, например, из металла, керамического материала, полупроводника, органического материала, полимера или композита.
Согласно другому предпочтительному варианту выполнения следующие вещества наряду с поливинилпирролидоном предпочтительно включать в композиции для изготовления микроигл, которые состоят или которые содержат: дисахарид, предпочтительно трегалозу, неионные ПАВ, предпочтительно полисорбат (этоксилированные сложные эфиры сорбитановой кислоты жирного ряда, например, твин), многоатомный спирт, в частности, глицерол (глицерин).
Предпочтительно, чтобы содержание поливинилпирролидона в качестве основного компонента композиции составляло более 35 мас. %, более 45 мас. %, более 55 мас. %, более 65 мас. %, более 75 мас. %, более 85 мас. %.
Предпочтительно, чтобы дисахарид, в частности, трегалоза, в качестве второстепенного компонента, содержалась в композиции в количестве более 15 мас. %, более 25 мас. %, более 35 мас. %.
Таблица 1
После сушки жидкой композиции, например, для получения набора микроигл (MNA) с остаточным содержанием воды от 0,1 до 20 % (м/м), получают изменившийся на величину потери воды состав MNA.
Приводимые ниже примеры и фигуры служат для более подробного пояснения изобретения, но без его ограничения.
Примеры и фигуры
Для изготовления микроигл согласно изобретению могут применяться известные способы, такие как : McCrudden MTC, Alkilani AZ, McCrudden CM, McAlister E, McCarthy HO, Woolfson AD, и др. Design and physicochemical characterization of novel dissolving polymeric microneedle arrays for transdermal delivery of high dose, low molecular weight drugs. J. Control Release. 2014; 180: 71-80.
Описанная выше композиция была применена в рамках доклинического исследования in vitro (опытная модель животных: гёттингенская минисвинья).
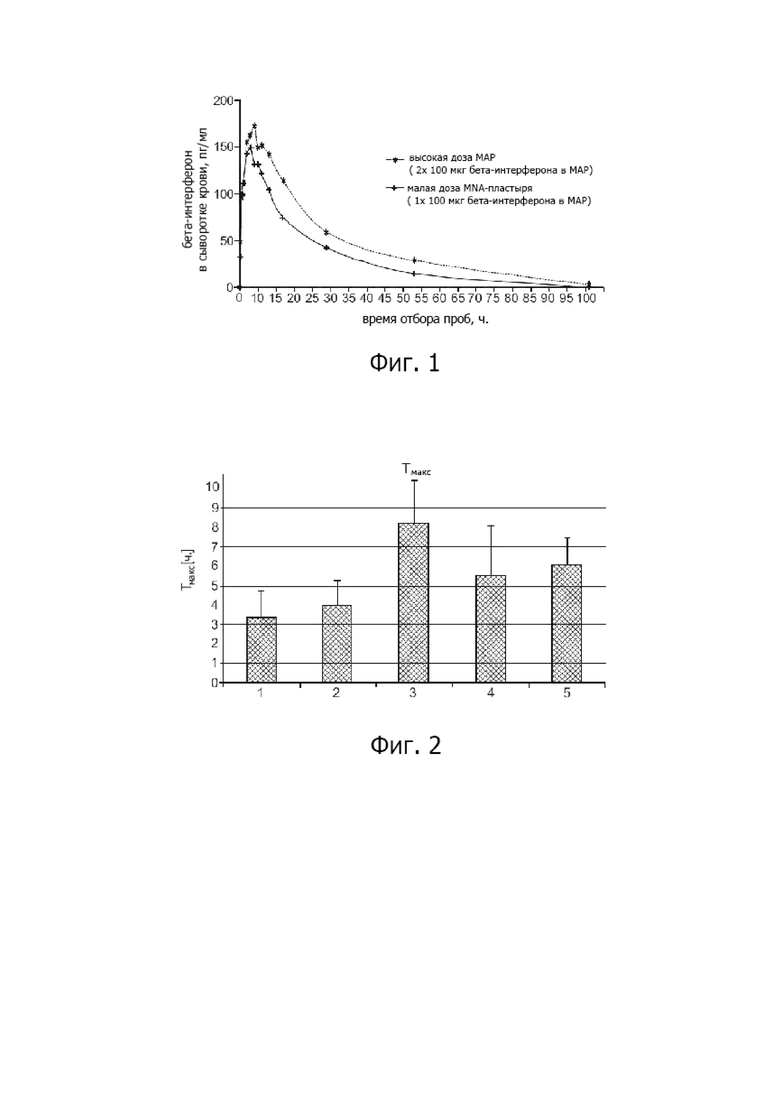
На фиг. 1 представлены после доставки набора микроигл показатели концентрации активного начала в сыворотке крови животных.
В рамках разработки клинического контрольного препарата для терапии с применением бета-интерферона был изготовлен растворимый микроигольчатый или микроматричный пластырь и опробован на животной модели «гёттенгенская минисвинья».
Исследование на животном подтвердило успешность применения микроматрицы, растворения, абсорбции и распределения активного начала в животной опытной модели. Следовательно, этим подтверждается пригодность композиции активного начала.
И хотя концентрация плазмы бета-интерферона при внутрикожной инъекции была ниже, чем при подкожной инъекции, занимающиеся исследованием рассеянного склероза специалисты считают, что в результате прямого высвобождения активного начала вблизи от иммунокомпетентных целевых клеток в верхних слоях кожи может быть достигнута более высокая эффективность. Более того, согласно экспертам при меньшей концентрации активного начала может быть достигнут сопоставимый успех лечения и могут быть заметно минимизированы часто возникающие нежелательные побочные эффекты. Обычно после инъекции бета-интерферона (подкожно или внутримышечно) весь кровоток больного перемещается в течение очень короткого времени при высокой концентрации цитокинов. Это можно исключить при внутрикожном применении активного начала, поскольку активное вещество сначала поступает только в интерстициальную жидкость и лимфатическую систему и вызывает здесь соответствующее действие, что проявляется в запуске инциации иммунных каскадов, действующих на ЦНС.
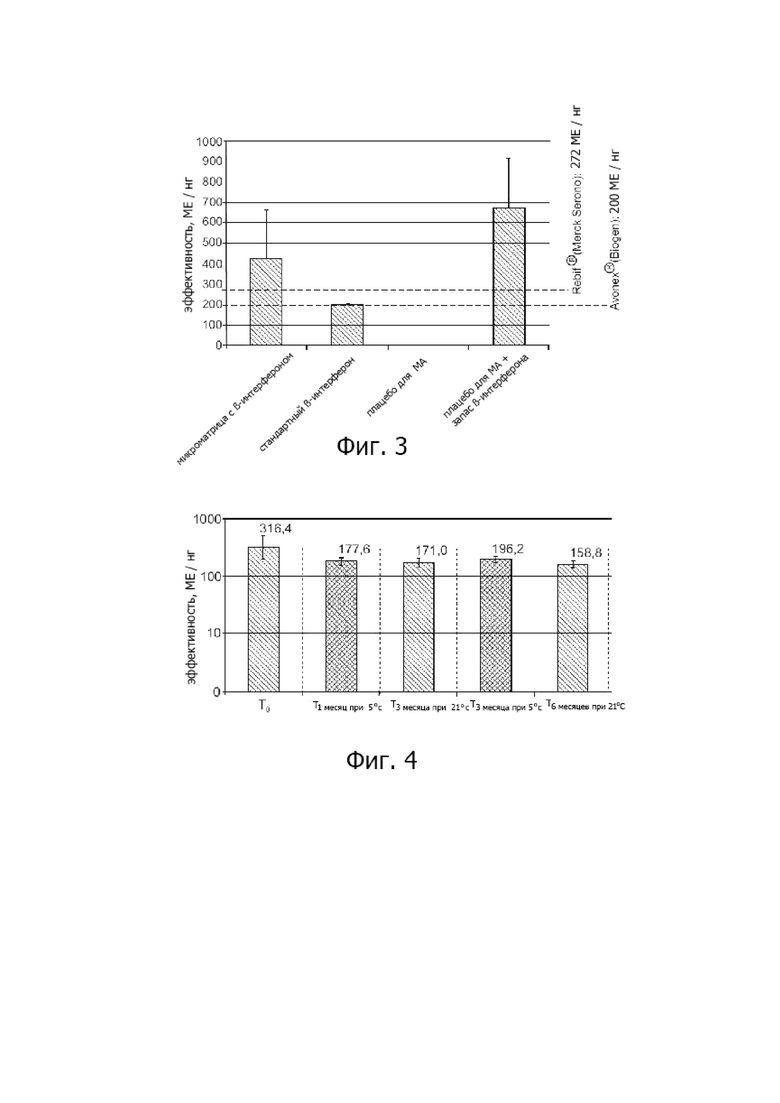
На фиг. 2 показаны моменты времени до достижения верхнего уровня бета-интерферона в плазме при внутрикожной доставке посредством микроматричного пластыря по сравнению с подкожной инъекцией.
На фиг. 3 показано противовирусное испытание активности бета-интерферона с применением клеток Нер-2С и инфекцирующего вируса EMCV согласно Европейской фармакопеи 5.2.3. Несмотря на абсолютное количественное равенство со стандартом набор микроигл (МА) c бета-интерфероном демонстрировал повышенную активность. Композиция с бета-интерфероном в полутвёрдой лекарственной форме при введении микроматрицы сохраняла активность in vitro.
Вследствие отсутствия необходимости в стабилизаторах и прочих адъювантах в составе продукта могут исключаться нежелательные побочные эффекты. Отличная стабильность активного начала в полутвёрдой аморфной микроматричной структуре проявилась без добавки часто применяемых стабилизаторов (например, маннитола, ЧСА или аргинина) в композиции MA. Кроме того, исследования стабильности показали, что входящий в состав набора микроигл бета-интерферон может храниться при комнатной температуре и обладает сопоставимой специфической активностью, что и другие хранимые в холоде препараты из бета-интерферона. Поэтому можно эффективно хранить и перевозить бета-интерферон в составе MNA без холодильной цепи.
На фиг. 4 показана стабильность при хранении микроматрицы с бета-интерфероном, а именно, анализ активности бета-интерферона in vitro после изготовления, по прошествии 1 месяца, 3 месяцев и 6 месяцев после помещения на хранение при комнатной температуре (21°С) и в холодильнике (5°С). Противовирусное действие бета-интерферона сохранялось после 6 месяцев хранения при температуре 21°С в том же диапазоне активности, что и в момент приготовления.
Пояснения к фигурам:
Фигура 1: усреднённая концентрация активного начала в сыворотке крови после доставки микроматрицы.
Фигура 2: моменты времени до достижения максимального уровня плазмы бета-интерферона для внутрикожной доставки посредством микроматричного пластыря по сравнению с подкожной инъекцией.
Пояснения: 1 B-IFN-MA, 100 г; 2 B-IFN-MA, 200 г; 3 лекарственное вещество, 40 г, подкожно; 4 Avonex, 30 г, подкожно; 5 Rebif, 44 г, подкожно.
Фигура 3: испытание на противовирусную активность бета-интерферона с применением клеток Hep-2C и инфекцирующего вируса EMCV в соответствии с Европейской фармакопеей 5.2.3. Микроматрица с бета-интерфероном (B-IFN-MA) показала, несмотря на абсолютное количественное равенство со стандартом, повышенную активность. Композиция с бета-интерфероном в полутвёрдой лекарственной форме при введении микроматрицы сохраняла активность in vitro.
Фигура 4: стабильность микроматрицы с бета-интерфероном при хранении. Анализ активности бета-интерферона in vitro после приготовления по прошествии 1 месяца, 3 месяцев и 6 месяцев при хранении при комнатной температуре (21°С) и в холодильнике (5°С). Противовирусное действие бета-интерферона в количестве 316,4, 177,6, 171,0, 196,2, 158,8 [МЕ/нг] сохранялось на одном и том же уровне, определяемом в логарифмических единицах, как в момент приготовления после 6 месяцев и при хранении при температуре 21°С.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОИГОЛЬНАЯ СИСТЕМА ДЛЯ ВВЕДЕНИЯ ВАКЦИНЫ ОТ ГЕПАТИТА | 2018 |
|
RU2814278C2 |
| МИКРОИГОЛЬНЫЕ МАТРИЦЫ С ЭЛЕМЕНТАМИ ПОДНУТРЕНИЯ ДЛЯ КОЖНОЙ И НЕКОЖНОЙ ДОСТАВКИ ЛЕКАРСТВ | 2020 |
|
RU2816629C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ИНЪЕКЦИОННАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ С ПРИЗНАКАМИ ИММУННОЙ НЕДОСТАТОЧНОСТИ НА ОСНОВЕ ТИЛОРОНА | 2007 |
|
RU2364390C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ИНЪЕКЦИОННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ТИЛОРОНА ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ДЕСТРУКТИВНЫХ ПРОЦЕССОВ С ПРИЗНАКАМИ ИММУННОЙ НЕДОСТАТОЧНОСТИ | 2007 |
|
RU2359664C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ НИЗКОМОЛЕКУЛЯРНОГО ИНДУКТОРА ИНТЕРФЕРОНА | 2007 |
|
RU2351322C1 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА | 2008 |
|
RU2492234C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА (ВАРИАНТЫ) | 2009 |
|
RU2393861C1 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ МЕСТНОГО И НАРУЖНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ НИЗКОМОЛЕКУЛЯРНОГО ИНДУКТОРА ИНТЕРФЕРОНА | 2007 |
|
RU2352330C1 |
| ОПТИМИЗИРОВАННЫЙ ГЕН, КОДИРУЮЩИЙ РЕКОМБИНАНТНЫЙ БЕЛОК - АНАЛОГ ИНТЕРФЕРОНА БЕТА ЧЕЛОВЕКА | 2015 |
|
RU2614264C2 |
| ЛЕКАРСТВЕННЫЕ СОСТАВЫ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ, ОСНОВАННЫЕ НА БЛОК-СОПОЛИМЕРАХ | 2006 |
|
RU2409348C2 |
Группа изобретений относится к микроигольчатой системе для доставки интерферона внутрикожно. Раскрыта растворимая матрица микроигл для внутрикожной доставки интерферона, полученная из полностью растворимой интрадермальной композиции, включающей интерферон в качестве активного начала и следующие адьюванты: интерферон – 0,1-200 мкг на 1 MNA (один набор микроигл); поливинилпирролидон – 45-95 мас.%; трегалоза – 0,1-45 мас.%; полисорбат – 0,001-10 мас.%; глицерин – 0,1-10 мас.%. Также раскрыты фармацевтический продукт и микроигольчатая система для внутрикожной доставки интерферона. Группа изобретений обеспечивает увеличенную стабильность интерферона по времени. 3 н. и 4 з.п. ф-лы, 4 ил., 1 табл., 1 пр.
1. Растворимая матрица микроигл для внутрикожной доставки интерферона, полученная из полностью растворимой интрадермальной композиции, включающей интерферон в качестве активного начала и следующие адьюванты:
2. Матрица микроигл по п.1, в которой содержание растворителя составляет от 0,01 до 10 мас.%.
3. Фармацевтический продукт для внутрикожной доставки интерферона, отличающийся тем, что содержит матрицу микроигл по п.1 или 2.
4. Фармацевтический продукт по п.3, применяемый при лечении рассеянного склероза.
5. Фармацевтический продукт по п.3, применяемый в терапии интерфероном.
6. Микроигольчатая система для внутрикожной доставки интерферона, отличающаяся тем, что содержит матрицу микроигл по п.1 или 2 и аппликатор.
7. Микроигольчатая система по п.6, где аппликатор имеет пусковое устройство.
| US 20160015952 A1, 21.01.2016 | |||
| US 20070292386 A9, 20.12.2007 | |||
| CHEN J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Dev | |||
| Ind | |||
| Pharm., 2016, V.42, pp | |||
| МУЗЫКАЛЬНЫЙ ПРИБОР С КАТОДНЫМИ ЛАМПАМИ | 1921 |
|
SU890A1 |
| US 20150216796 A1, 06.08.2015 | |||
| US 20140371713 A1, 18.12.2014 | |||
| US 20150283252 A1, 08.10.2015 | |||
| US 20170266427 A1, 21.09.2017 | |||
| МАТРИЦА ПОЛЫХ МИКРОИГЛ | 2010 |
|
RU2508135C2 |
Авторы
Даты
2024-06-20—Публикация
2019-04-23—Подача