ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому производному пиразола с превосходной ингибирующей оксидативный стресс активностью и, более конкретно, к новому производному пиразола, демонстрирующему способность предупреждения, улучшения течения или лечения различных заболеваний благодаря его превосходной ингибирующей оксидтаивный стресс активности, к его оптическому изомеру, его стереоизомеру, его сольвату его изотопному варианту, его таутомеру или его фармацевтически приемлемой соли, к способу их получения и к фармацевтической композиции, содержащей их.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Оксидативный стресс означает явление, при котором продуцирование активных форм кислорода или активных форм азота и механизм антиоксидантной защиты выходят из равновесия в биомолекулах, клетках и тканях in vivo, и продуцирование активных форм кислорода или активных форм азота становится относительно избыточным, и в этом случае обычно происходит повреждение клеток и тканей.
Активные формы кислорода (ROS) представляют собой свободные радикалы кислорода, образование которых обусловлено химическими свойствами кислорода и кислородсодержащих соединений, и в совокупности относятся супероксид-аниону (О2-), перекиси водорода (Н2О2), гидроксильной группе (ОН), алкоксильной группе (RO), пероксильной группе (ROO) и т.п.
Поскольку эти активные формы кислорода химически очень нестабильны и обладают высокой реакционной способностью, они вызывают ферментную каталитическую реакцию, перенос электронов в митохондриях, систему доставки клеточных сигналов и экспрессию генов, активацию факторов транскрипции и воспаление вокруг, вызывая обширное окислительное повреждение в биомолекулах, клетках, тканях и т.п. in vivo, и вовлечены в качестве основного фактора в фиброз тканей. Это окислительное повреждение вызывает различные заболевания во всех тканях человеческого организма. В частности, известно, что они вовлечены в возникновение рака в тканях, таких как кожа, почка, сердце, сустав, легкое, головной мозг, кровеносный сосуд, кишечный тракт, глаз и т.п. и прогрессирование возникшего рака, а также, как известно, играют важную роль почти во всех заболеваниях, включая сердечнососудистые заболевания, воспаление, фиброзные заболевания, диабет и т.п.
В последнее время стало известно, что взаимодействие между микроокружением опухоли и раковыми клетками играет важную роль в росте опухоли, метастазировании, экспрессии резистентности к противораковым агентам, в таком случае, ассоциированный с раком фибробласт (CAF) осуществляет важное действие. Известно, что ассоциированный с раком фибробласт активируется ROS, способствуя исчезновению иммунитета к опухоли, тем самым действуя на злокачественность и метастазирование рака. Поэтому в последнее время ассоциированный с раком фибробласт становится новой мишенью для лечения рака.
Сообщалось, что в ткани печени пациентов, испытывающих фиброз печени, увеличение продуцирования ROS гепатоцитами индуцируется стимуляцией TGF-β (трансформирующим фактором роста бета), затем увеличивается экспрессия коллагена и αSMA (гладкомышечного актина альфа), что важно для фиброза. Сообщалось, что ROS обостряют легочный фиброз в ткани легких пациентов с идиопатическим легочным фиброзом.
Головной мозг является тканью с высокой активностью метаболизма и поэтому очень уязвим для оксидативного повреждения. Поэтому было проведено много исследований по эффективному удалению ROS для лечения различных нейродегенеративных заболеваний (болезнь Паркинсона, болезнь Гентингтона, амиотрофический боковой склероз, болезнь Альцгеймера, рассеянный склероз, ишемическое и травматическое повреждение головного мозга и др.), но безуспешно. Недавно, поскольку было обнаружено, что ROS является важным фактором в этих заболеваниях головного мозга, сообщалось о возможности лечения посредством ингибирования ROS.
Келоид представляет собой тип доброкачественного опухолевого заболевания, при котором соединительная ткань кожи пролиферирует патологически с образованием твердых шишек, и эпидермис становится тонким, блестящим и красноватым. Сообщалось, что начало и обострение келоида также является одной из причин сверхэкспрессии фактора роста соединительной ткани (CTGF) под действием ROS, продуциррованных стимуляцией TGF-β.
В случае диабета такие осложнения, как диабетическая нефропатия и диабетическая ретинопатия, могут сопровождать долговременную гипергликемию, и ROS, как известно, играют важную роль в возникновении осложнений. Другими словами, высокий уровень сахара в крови вызывает увеличение продуцирования ROS, и в таком случае образовавшиеся ROS могут вызвать диабетическую нефропатию и диабетическую ретинопатию через ряд процессов, включающих гибель клеток почек и клеток сетчатки глаза.
Кроме того, сообщалось, что келоидное заболевание вызывает фиброз сетчатки глаза и дегенерацию желтого пятна и т.п., когда ген CTGF сверхэксперессируется в сетчатке глаза.
Поэтому авторы настоящего изобретения провели исследования, фокусируясь на том, что терапевтический агент против рака, воспалительного заболевания, фиброзного заболевания, нейродегенеративного заболевания, заболевания печени, заболевания кожи или заболевания сетчатки глаза или т.п., вызванного окисдативным стрессом, может быть разработан с использованием молекулярного механизма, ингибирующего создание оксидативного стресса, и, в результате, обнаружили, что новое производное пиразола по настоящему изобретению имеет превосходную ингибирующую продуцирование ROS активность, и подтвердили, что он может быть использован для лечения различных заболеваний, связанных с оксидативным стрессом, создав в итоге настоящее изобретение.
Предшествующий уровень техники
Патентный документ 1: WO 2016-207785
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Задача настоящего изобретения заключается в том, чтобы предоставить пиразольное соединение химической формулы I, его оптический изомер, его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемую соль.
Задача настоящего изобретения заключается в том, чтобы предоставить фармацевтическую композицию, содержащую соединение химической формулы I или его изомер, его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Задача настоящего изобретения заключается в том, чтобы предоставить способ контролирования продуцирования ROS с использованием соединения химической формулы I или его стереоизомера, его сольвата, его изотопного варианта, его таутомера или его фармацевтически приемлемой соли.
Задача настоящего изобретения заключается в том, чтобы предоставить способ лечения заболеваний, связанных с оксидативный стрессом, путем введения субъекту соединения химической формулы I или его стереоизомера, его сольвата, его изотопного варианта, его таутомера или его фармацевтически приемлемой соли.
Задача настоящего изобретения заключается в том, чтобы предоставить способ получения соединения химической формулы I или его стереоизомера, его сольвата, его изотопного варианта, его таутомера или его фармацевтически приемлемой соли.
Задача настоящего изобретения заключается в применении соединения химической формулы I, его сольвата, стереоизомера или фармацевтически приемлемой соли для приготовления фармацевтической композиции для предупреждения, реверсирования или лечения заболеваний, связанных с оксидативным стрессом.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Для решения вышеуказанных задач в одном аспекте настоящего изобретения может быть предложено новое производное пиразола, соединение, представленное химической формулой I, указанной ниже, или его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемая соль
Химическая формула I
В вышеуказанной формуле А, В и R такие, как определено ниже.
В одном из аспектов настоящего изобретения предложено соединение, представленное химической формулой I, его сольват, стереоизомер или фармацевтически приемлемая соль, применяемое для предупреждения, реверсирования или лечения заболеваний, связанных с оксидативным стрессом.
В одном из аспектов настоящего изобретения предложена фармацевтическая композиция для лечения заболеваний, связанных с оксидативным стрессом, содержащая соединение, представленное химической формулой I, его сольват, стереоизомер или фармацевтически приемлемую соль в качестве активного ингредиента и приемлемый носитель.
Кроме того, согласно настоящему изобретению предложен способ лечения заболеваний, связанных с оксидативным стрессом, включающий введение субъекту, нуждающемуся в таком лечении, соединения, представленного химической формулой I, его сольвата, стереоизомера или фармацевтически приемлемой соли в эффективном количестве.
Более того, согласно настоящему изобретению предложено применение соединения химической формулы I, его сольвата, стереоизомера или фармацевтически приемлемой соли для приготовления фармацевтической композиции для предупреждения или лечения заболеваний, связанных с оксидативным стрессом.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ
Новое производное пиразола и фармацевтическая композиция, содержащая таковое производное пиразола по настоящему изобретению, обеспечивают превосходный эффект в отношении заболеваний, связанных с оксидативным стрессом.
Кроме того, новое производное пиразола эффективно ингибирует оксидативный стресс и продуцирование αSMA в различных клетках и, в частности, имеет эффект эффективного реверсирования рака, воспалительного заболевания, фиброзного заболевания, нейродегенеративного заболевания, заболевания печени, кожного заболевания или заболевания сетчатки глаза или т.п., вызванного оксидативным стрессом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 демонстрирует эффект соединений из Примеров синтеза в ингибировании продуцирования ROS, индуцированного РМА ((форбол-12-миристат-13-ацетатом) в клетках LX-2 (звездчатые клетки печени) и NHLF (нормальные фибробласты легких человека).
ФИГ. 2 демонстрирует эффект соединения Примера синтеза 3 в ингибировании продуцирования ROS, индуцированного предварительно сформированными фибриллами альфа-синуклеина (PFF) в клетках N27.
ФИГ. 3а и ФИГ. 3b демонстрируют эффект соединений из Примеров синтеза (ФИГ. 3а: Соединения 1, 23 и 12, ФИГ. 3b: Соединения 5, 14 и 33) в ингибировании экспрессии αSMA, индуцированной TGF β1 в клетках HFF (фибробласты крайней плоти человека).
ФИГ. 4 демонстрирует эффект соединения Примера синтеза 1 в ингибировании экспрессии αSMA, индуцированной TGF β1 в различных клетках.
ФИГ. 5 демонстрирует эффект соединений из Примеров синтеза в ингибировании экспрессии IL6 в клетках P.CAF (фибробласты, ассоциированные с раком поджелудочной железы).
ФИГ. 6 демонстрирует эффект соединений из Примеров синтеза в ингибировании экспрессии IL8 в клетках P.CAF.
ФИГ. 7 демонстрирует эффект соединений из Примеров синтеза в ингибировании сжатия коллагенового геля, индуцированного TGF β1 в клетках HFF.
ФИГ. 8 демонстрирует эффект соединений из Примеров синтеза в ингибировании экспрессии IL1β, индуцированной LPS (липополисахаридом) в клетках LX2, NHLF, ARPE19 (клетки пигментного эпителия сетчатки глаза человека) и KEL-Fib (келоидные фибробласты).
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно.
Если не дано иного определения, все технические термины, использованные в данном документе, имеют значения, общепонятные специалистам в области, к которой относится настоящее изобретение. Кроме того, числовые значения, раскрытые в данном документе, включают значение "примерно", если прямо не указано иное. Все публикации и другие источники информации, упомянутые в данном документе, во всей их полноте включены в данный документ посредством ссылки.
Определения остатков в данном документе изложены ниже. Кроме того, если отсутствуют определения отдельных остатков, то они используются в значениях, общепонятных специалистам в данной области.
Использованный в данном документе термин "независимо" означает, что когда более чем один заместитель выбран из нескольких возможных заместителей, эти заместители могут быть идентичными или могут отличаться друг от друга.
Использованный в данном документе термин "алкил" относится к алифатическому углеводородному радикалу и означает линейную или разветвленную одновалентную насыщенную углеводородную группу. Если не дано иного определения, алкильная группа обычно содержит 1-10, 1-8, 1-6, 1-4 или 1-3 атомов углерода. Пример алкильной группы включает метил, этил, пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил и трет-бутил), пентил (например, н-пентил, изопентил и неопентил), н-гексил, н-гептил, н-октил, н-нонил и н-децил.
Использованный в данном документе термин "алкенил" относится к алифатическому углеводородному радикалу, содержащему одну или более углерод-углеродных двойных связей, и включает линейные и разветвленные углеводородные радикалы, например "алкенил" представляет собой винил, аллил, бут-1-енил или бут-2-енил.
Использованный в данном документе термин "алкинил" относится к алифатическому углеводородному радикалу, содержащему одну или более углерод-углеродных тройных связей, и включает все линейные и разветвленные углеводородные радикалы. Например, "алкинил" представляет собой этинил, пропинил или бутинил.
Использованный в данном документе термин "галогеналкил" означает алкильную группу, имеющую один или более галогеновых заместителей. Галогеналкил включает -CF3, -C2F5, -CHF2, -CCl3, -CHCl2 и -C2Cl5. Если не дано иного определения, галогеналкильная группа обычно включает в себя 1-6, 1-5, 1-4 или 1-3 атомов углерода и дополнительно может быть замещена другими заместителями.
Использованный в данном документе термин "алкокси" может представлять собой линейную цепь, разветвленную цепь или кольцевую цепь. Количество атомов углерода алкоксигруппы конкретно не ограничено, но предпочтительным является количество атомов углерода 1-10, 1-8, 1-6, 1-4 или 1-3. Конкретно, это может быть метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, втор-бутокси, н-пентилокси, неопентилокси, изопентилокси и т.п., но без ограничения ими.
Использованный в данном документе термин "гидрокси" или "гидроксил" означает -НО, один или в сочетании с другим термином.
Использованный в данном документе термин "амино" означает -NH2.
Использованные в данном документе термины "галоген", "галогено" и "галогенид(ы)" означают фтор, хлор, бром и йод.
В данном документе термин "циклоалкил" означает неароматическое карбоциклическое кольцо, включающее в себя циклические алкильные, алкенильные и алкинильные группы. Циклоалкильная группа может содержать моноциклическое или полициклическое кольцо. Полициклическое кольцо имеет, например, 2, 3 или 4 конденсированных кольца. Если не дано иного определения, циклоалкильная группа обычно содержит 3-10 или 3-7 атомов углерода в цикле. Циклоалкильная группа включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклогексадиенил, циклогептатриенил и т.п. и может быть дополнительно замещена другими заместителями.
В данном документе термин "арил" означает ароматическую углеводородную группу имеющую моноциклическое или полициклическое кольцо, и она может быть дополнительно замещена другими заместителями. В данном документе полициклическая группа означает группу, в которой арильная группа напрямую связана или конденсирована с другой циклической группой. В данном документе другая циклическая группа может представлять собой арильную группу, но она может быть циклической группой другого типа, например циклоалкильной группой, гетероарильной группой и т.п. Полициклическая группа может иметь, например, 2, 3 или 4 кольца. Если не дано иного определения, арильная группа обычно имеет 5-20, 6-15, 6-12 или 6-10 атомов углерода в цикле. Арильная группа включает, например, фенил, нафтил (например, нафтил-1-ил и нафтил-2-ил), бифенил, антраценил, фенантренил и т.п.
В данном документе "гетероцикл" представляет собой ароматическую, насыщенную или частично ненасыщенную моно-, би-, ди- или полициклическую систему, содержащую указанное количество атомов в цикле и один или более гетероатомов, выбранных из N, О и S. Член кольца, в данном документе гетероциклического кольца, соединен с основной молекулой через атом цикла (может быть С или N). Бициклическая система может быть связана посредством 1,1-слияния (спиро), 1,2-слияния (конденсированная) или 1,>2-слияния (мостиковая).
В данном документе термин "гетероарил" означает одновалентную ароматическую группу, имеющую один или более гетероатомов, выбранных из N, О и S, в качестве членов кольца. Гетероарильная группа включает моноциклическую или полициклическую структуру. Полициклическая структура может иметь, например, 2, 3 или 4 конденсированных кольца. Если не дано иного определения, гетероарильная группа обычно содержит 3-10, 3-7 или 3-5 атомов в цикле. Гетероарильная группа может содержать 1, 2 или 3 гетероатома. Гетероарильная группа включает, например, фуранил, пиридил, N-оксопиридил, пиримидинил, пиразинил, пиридазинил, триазинил, фурил, хинолил, изохинолил, дигидроизохинолил, тиенил, имидазолил, фуранил, тиазолил, индолил, пирил, оксазолил, бензофурил, бензотиенил, бензтиазолил, изоксазолил, пиразолил, триазолил, тетразолил, индазолил, 1,2,4-тиадиазолил, изотиазолил, бензотиенил, фуринил, бензимидазолил, индолинил и т.п. и может быть дополнительно замещена другими заместителями.
В данном документе "гетероциклоалкил" относится к моноциклическому, бициклическому, трициклическому или полициклическому алкилу, имеющему 3-10 членов карбоцикла, содержащему один или более, например 1-4, 1-3 или 1-2 гетероатома, выбранные из N, О и S. Кроме того, гетероцикл согласно настоящему изобретению может также представлять собой конденсированный или поперечносвязанный гетероциклоалкил. Примером неароматического кольца может быть азетидинил, оксетанил, тетрагидро, тетрагидрофуран, пиррол, пирролидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, дигидропиранил, тетрагидропиридинил, дигидропиридинил, дигидротиопиранил, тетрагидропиримидинил, тетрагидропиридазинил, дигидропиранил, тетрагидропиранил, тетрагидротиопиранил, тетрагидропиразолопиридинил, морфолинил, индолинил, азетиоморфолинил и т.п.
Присоединение гетероциклоалкильного заместителя может иметь место по атому углерода или по гетероатому. Гетероциклоалкильная группа может быть произвольно замещена по одной или более подходящим группами одной или более вышеупомянутыми группами. Если не дано иного определения, гетероциклоалкил относится к 4-12-членному гетероцикл о алкилу, предпочтительно 4-10-членному гетероциклоалкилу, более предпочтительно 4-7-членному гетероциклоалкилу.
В данном документе термин "арилалкил" представляет собой алкильную группу, замещенную арильной группой. "Арил" и "алкил" такие, как определено выше.
В данном документе термин "гетероарилалкил" представляет собой алкильную группу, замещенную гетероарильной группой. "Гетероарил" и "алкил" такие, как определено выше.
В данном документе термин "алкилгетероциклоалкил" представляет собой гетероциклоалкильную группу, замещенную алкильной группой. "Алкил" и "гетероциклоалкил" такие, как определено выше.
В данном документе "замещенная или незамещенная аминная группа" может быть выбрана из группы, состоящей из моноалкиламинной группы, -NH2 и диалкиламинной группы, и "алкил" такой, как определено выше. Конкретный пример замещенной или незамещенной аминной группы включает NH2, метиламинную группу, диметиламинную группу, этиламинную группу, диэтиламин и т.п., но без ограничения ими.
В данном документе, "алкиленовая группа" означает алкильную группу, имеющую два сайта связывания, то есть двухвалентную группу. Описание вышеупомянутой алкильной группы может быть применимо к таким группам за исключением того, что они являются двухвалентными соответственно.
В данном документе термин "замещение" означает, что атом водорода, связанный с атомом углерода соединения, замещен другим заместителем, и положение, которое должно быть замещено, не ограничено до тех пор, пока положение, в котором атом водорода замещен, то есть положение, где находится заместитель, не ограничено, и когда имеются 2 или более заместителей, эти 2 или более заместителей могут быть идентичными или разными, и 2 или более идентичных или разных заместителей могут быть соединены и замещены.
В данном документе термин "замещенный алкил" представляет собой форму, в которой следующий заместитель находится на атоме углерода C1-С10 линейного или разветвленного алкила. Конкретно, он представляет собой форму, в которой один или более заместителей или одинаковые или разные 2 или более заместителей соединены и замещены, которые выбраны из тяжелого водорода, водорода, галогена, циано, нитро, карбоксила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила или С5-С20гетероарила, С1-С5алкокси, С1-С5галогеналкила. В качестве иллюстративного заместителя может быть использован трифторметил, галоген, циано, метокси, карбоксил, метил, амино, нитро, диметиламино, циклопропил, замещенный имидазол, пиридин, замещенный или незамещенный сульфонил и т.п., но без ограничения ими.
В данном документе термин "замещенный циклоалкил" представляет собой форму, в которой один или более заместителей или одинаковые или разные 2 или более заместителей соединены с и замещены С3-С8циклоалкилом, которые выбраны из тяжелого водорода, водорода, галогена, циано, нитро, карбоксила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила или С5-С20гетероарила, С1-С5алкокси, C1-С5галогеналкила. В качестве иллюстративного заместителя может быть использован трифторметил, галоген, циано, метокси, карбоксил, метил, амино, нитро, диметиламино, циклопропил, замещенный имидазол, замещенный или незамещенный сульфонил и т.п., но без ограничения ими.
В данном документе термин "замещенный арил" или "замещенный гетероарил" представляет собой форму, в которой один или более заместителей или одинаковые или разные 2 или более заместителей соединены с и замещены С5-С20арилом или С5-С50гетероарилом, которые выбраны из тяжелого водорода, водорода, галогена, циано, нитро, карбоксила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила или С5-С20гетероарила, C1-С5алкокси, C1-С5галогеналкила, C1-С10алкила, С3-С8циклоалкила или С3-С8гетероциклоалкила, С3-С8циклоалкил-С1-С10алкила, С5-С20арил-С1-С10алкила. В качестве иллюстративного заместителя может быть использован трифторметил, галоген, циано, метокси, карбоксил, метил, амино, нитро, диметиламино, циклопропил, замещенный имидазол, замещенный или незамещенный сульфонил и т.п., но без ограничения ими.
В данном документе "соседняя" группа может означать заместитель, замещенный по атому, напрямую связанному с атомом, на котором соответствующий заместитель находится, заместитель, стерически ближайший к соответствующему заместителю, или другой заместитель, находящийся по атому, на котором соответствующий заместитель находится. Например, два заместителя в орто-положении бензольного кольца и два заместителя по одному и тому же атому углерода алифатического кольца можно интерпретировать как "соседние" друг с другом.
Используемая использовании по отношению к соединению "эффективная доза" представляет собой количество, эффективное для лечения или предупреждения заболевания у субъекта, как описано в данном документе.
Соединение
Для решения вышеуказанной задачи согласно настоящему изобретению предложено соединение химической формулы I, указанной ниже, или его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемая соль:
в этой формуле
А представляет собой замещенный или незамещенный 5-20-членный гетероарил или замещенный или незамещенный С5-С20арил; и
при этом 5-20-членный гетероарил или С5-С20арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, группы C1-С10алкокси, замещенного или незамещенного C1-С10алкила, замещенного или незамещенного С3-С8циклоалкила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила, замещенного или незамещенного 5-20-членного гетероарила и замещенного или незамещенного 5-20-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С10алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием замещенного или незамещенного ароматического углеводородного кольца, где ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо или С5-С10арильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S; и
R представляет собой водород, тяжелый водород, циано, галоген, нитро, галогеналкил, замещенный или незамещенный C1-С10алкил, замещенный или незамещенный С3-С8циклоалкил, замещенный или незамещенный С5-С20арил, замещенный или незамещенный 5-20-членный гетероарил или -C(=O)R2, и при этом R2 представляет собой С3-С8циклоалкил, C1-С10алкил, С2-С10алкенил или С6-С10арил; и
В представляет собой -NKM, или замещенный или незамещенный 5-20-членный гетероарил, или замещенный или незамещенный 5-20-членный гетероциклоалкил; и
K и М, каждый независимо, представляют собой водород, тяжелый водород, циано, галоген, нитро, галогеналкил, замещенный или незамещенный C1-С10алкил, замещенный или незамещенный C1-С10алкокси, замещенный или незамещенный С3-С8циклоалкил, замещенный или незамещенный С5-С20арил, замещенный или незамещенный С5-С20арил-С1-С10алкил, замещенный или незамещенный 5-20-членный гетероарил или замещенный или незамещенный 5-20-членный гетероарил-С1-С10алкил;
где C1-С10алкил является незамещенным или замещен 1, 2, 3 или 4 типами заместителей, выбранных из группы, состоящей из тяжелого водорода, галогена, гидрокси, циано, нитро, карбоксила, замещенного или незамещенного амино, замещенного или незамещенного C1-С10алкила, замещенного или незамещенного C1-С10галогеналкила, замещенного или незамещенного C1-С10гидроксиалкила, замещенного или незамещенного С3-С8циклоалкила, C1-С10алкокси, C1-С10алкилсульфонила, С5-С20арилсульфонила, С5-С20арилокси, замещенного или незамещенного С5-С20арила, замещенного или незамещенного 5-20-членного гетероарила и замещенного или незамещенного 5-20-членного гетероциклоалкил а; и
С3-С8циклоалкил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами заместителей, выбранных из группы, состоящей из тяжелого водорода, галогена, циано, нитро, карбоксила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила или 5-20-членного гетероарила, C1-С10алкокси и C1-С10галогеналкила; и
5-20-членный гетероарил, 5-20-членный гетероциклоалкил или С5-С20арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами заместителей, выбранных из группы, состоящей из тяжелого водорода, галогена, циано, нитро, -C(=O)R', -C(=O)OR', -NH-C(=O)R'', замещенного или незамещенного амино, замещенного или незамещенного C1-С10алкила, замещенного или незамещенного C1-С10алкокси, замещенного или незамещенного C1-С10галогеналкила, замещенного или незамещенного C1-С10гидроксиалкила, замещенного или незамещенного C1-С10алкилсульфонила, замещенного или незамещенного С5-С20арилсульфонила, замещенного или незамещенного С3-С8циклоалкила, замещенного или незамещенного С3-С8циклоалкил-С1-С10алкила, замещенного или незамещенного С5-С20арила, замещенного или незамещенного С5-С20арил-С1-С10алкила, замещенного или незамещенного 5-12-членного гетероциклоалкила, замещенного или незамещенного С1-С10алкил-С3-С8циклоалкила и замещенного или незамещенного С1-С10алкил-5-20-членного гетероциклоалкила, и
при этом R' и R'', каждый независимо, представляют собой водород, тяжелый водород, замещенный или незамещенный амин, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С2-С6алкинил, замещенный или незамещенный С3-С8циклоалкил, замещенный или незамещенный С6-С10арил или замещенный или незамещенный С6-С10арил-С1-С6алкил; и
замещенная аминогруппа замещена 1 типом или 2 типами C1-С10алкильных групп; и
гетероатом гетероциклоалкильного или гетероарильного кольца представляет собой один или более типов, выбранных из N, S и О.
В одном конкретном аспекте
А представляет собой незамещенный или замещенный 5-12-членный гетероарил или С6-С10арил, и при этом 5-12-членный гетероарил или С6-С10арил может быть замещен 1, 2, 3 или 4 типами заместителей, выбранных из группы, состоящей из циано, галогена, C1-С6галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С6алкила, C1-С6алкокси, С3-С6циклоалкила, амино, С6-С10арила, 5-12-членного гетероарила и 5-12-членного гетероциклоалкила, и при этом R1 представляет собой водород, тяжелый водород или C1-С6алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием замещенного или незамещенного ароматического углеводородного кольца, где ароматическое углеводородное кольцо может образовывать 5-7-членное гетероарильное кольцо или С6-С9арильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S.
В одном из конкретных аспектов А может представлять собой 5-10-членный гетероарил или С6-С9арил, имеющий 1, 2, 3 или 4 гетероатома, выбранными из группы, состоящей из N, О и S.
В одном из конкретных аспектов А может представлять собой пиридинил, пиримидинил, пиразинил, триазолил, тиазолил, фенил или тиено[3,2]пиридин.
В одном из конкретных аспектов А может быть замещен 1 типом, 2 типами, 3 типами или 4 типами из C1-С6алкила, C1-С6алкокси, F, Cl, Br, I, циано, амино, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, 5-12-членного гетероциклоалкила, и при этом Ra может представлять собой водород, тяжелый водород, C1-С6алкил.
В одном из конкретных аспектов А может быть замещен 1 типом, 2 типами, 3 типами или 4 типами из метила, этила, пропила, бутила, метокси, этокси, пропокси, бутокси, F, Cl, Br, I, циано, амино, нитро, -С(=O)ОН, -C(=O)CH3, -NH-C(=O)CH3, морфолино или пиперидине
В одном из конкретных аспектов R представляет собой водород, тяжелый водород, циано, галоген, нитро, незамещенный или замещенный С3-С6циклоалкилом C1-С6алкил, C1-С6галогеналкил, С3-С6циклоалкил, С6-С10арил, 5-12-членный гетероарил, -C(=O)R2, и при этом R2 представляет собой С3-С6циклоалкил, C1-С6алкил, С2-С6алкенил, или С6-С10арил.
В одном из конкретных аспектов R2 может представлять собой циклопропил, метил, этил, пропил, этенил, пропенил или фенил.
В одном из конкретных аспектов R может представлять собой водород, тяжелый водород, циано, галоген, нитро, метил, этил, пропил, бутил, циклопропил метил, CF3, -С(=O)-циклопропил, -С(=O)-этенил или бензоил.
В одном из конкретных аспектов В представляет собой -NKM или 5-12-членный гетероарил или 5-12-членный гетероциклоалкил, и при этом 5-12-членный гетероарил или 5-12-членный гетероциклоалкил является незамещенным или замещен 1, 2, 3 или 4 типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, -C(=O)R5, -SO2-R6, и
при этом C1-С6алкил, C1-С6алкокси или С6-С10арил может быть незамещенным или замещен 1, 2, 3 или 4 типами из гидрокси, C1-С6алкила, C1-С6алкокси, С6-С10арилокси, или незамещенного или замещенного C1-С6алкилом, С6-С10арил-С1-С6алкилом или C1-С6алкилкарбонилом 4-12-членного гетероциклоалкила, и
R3 и R4, каждый независимо, представляют собой водород, тяжелый водород, -C(=O)-Ra, C1-С6алкил или С6-С10арил, и C1-С6алкил или С6-С10арил является незамещенным или замещен 1, 2, 3 или 4 типами из галогена, гидрокси, C1-С6алкила, C1-С6алкокси или С6-С10арилокси, и при этом Ra представляет собой водород, тяжелый водород, C1-С6алкил или C1-С6галогеналкил; и
R5 представляет собой -ORb, -NRcRd, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С8циклоалкил, и при этом C1-С6алкил, С2-С6алкенил или С2-С6алкинил может быть незамещенным или замещен 1, 2, 3 или 4 типами из моно-С1-С6алкиламина или ди-C1-С6алкиламина, и при этом Rb, Rc и Rd, каждый независимо, представляют собой водород, тяжелый водород, С6-С10арил или С6-С10арил-C1-С6алкил, и
R6 представляет собой C1-С6алкил, незамещенный или замещенный 1, 2, 3 или 4 типами C1-С6алкила С6-С10арил, и
K и М, каждый независимо, представляют собой водород, тяжелый водород, циано, галоген, нитро, C1-С6галогеналкил, C1-С6алкил, C1-С6алкокси, С3-С8циклоалкил, С6-С10арил, С6-С10арил-С1-С6алкил-, 5-12-членный гетероарил, 5-12-членный гетероарил-С1-С6алкил, и при этом C1-С6алкил, C1-С6алкокси, С6-С10арил, С3-С8циклоалкил или 5-12-членный гетероарил может быть замещен 1, 2, 3 или 4 типами из циано, галогена, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C1-С6алкокси, C1-С6алкилсульфонила, С6-С10арилсульфонила, -NR7R8, -C(=O)R9, 5-12-членного гетероциклила, гидрокси, нитро, C6-С10арила, и при этом, 5-12-членный гетероциклил или С6-С10арил может быть незамещенным или замещен C1-С6алкилом, и
R9 представляет собой -ORe, -NReRf, незамещенный или замещенный 1, 2, 3 или 4 типами -NReRf С2-С6алкенил или С6-С10арил, и при этом Re и Rf, каждый независимо, представляют собой водород, тяжелый водород, C1-С6алкил, С6-С10арил, или C1-С6алкил.
В одном из конкретных аспектов В может представлять собой 5-10-членный гетероарил или 5-10-членный гетероциклоалкил, имеющий 1-3 типа гетероатомов, выбранных из группы, состоящей из N, О и S, и они могут быть замещены вышеупомянутыми заместителями или могут быть незамещенными.
В одном из конкретных аспектов В может представлять собой пирролидин, пиперазин, дигидроизохинолин, морфолин или пиперидин, и они могут быть замещены вышеупомянутыми заместителями или могут быть незамещенными.
В одном из конкретных аспектов соединение химической формулы I может представлять собой соединение химической формулы I-1, указанной ниже:
Химическая формула I-1

в этой формуле
определение K, М и R такое же, как для химической формулы I; и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, или J представляет собой CR14, N, О или S, но N, О и S присутствуют в количестве один или более; и
R10-R14 являются одинаковыми или разными и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С10алкокси, замещенного или незамещенного C1-С10алкила, замещенного или незамещенного С3-С8циклоалкила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила, замещенного или незамещенного 5-12-членного гетероарила и замещенного или незамещенного 5-12-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С10алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием замещенного или незамещенного ароматического углеводородного кольца, где ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо или С6-С10арильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S.
В одном из конкретных аспектов соединение химической формулы I может представлять собой соединение химической формулы I-2, указанной ниже:
Химическая формула I-2
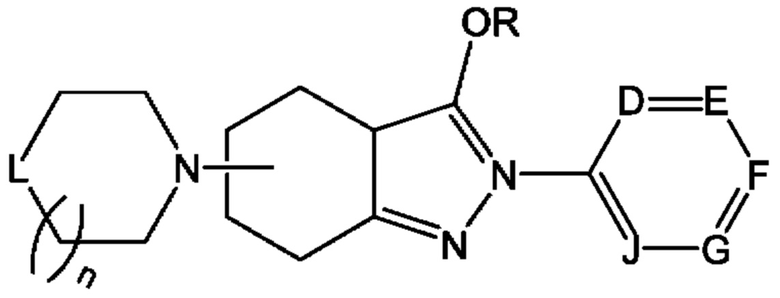
в этой формуле
определение R такое же, как для химической формулы I; и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, или J представляет собой CR14, N, О или S, но N, О и S присутствуют в количестве один или более; и
R10-R14 одинаковые или разные и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С10алкокси, замещенного или незамещенного C1-С10алкила, замещенного или незамещенного С3-С8циклоалкила, замещенного или незамещенного амина, замещенного или незамещенного С5-С20арила, замещенного или незамещенного 5-12-членного гетероарила и замещенного или незамещенного 5-12-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С10 алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием замещенного или незамещенного ароматического углеводородного кольца, где ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо или С6-С10арильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S, и
n представляет собой целое число 0, 1 или 2; и
L представляет собой СН2, NH или О; и
 может быть незамещенным или может быть замещен 1, 2, 3 или 4
может быть незамещенным или может быть замещен 1, 2, 3 или 4
типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, -C(=O)R5, -SO2-R6, и при этом, когда заместитель представляет собой 2 типа или более, две или более чем две соседние группы могут быть объединены друг с другом с образованием замещенного или незамещенного 5-20-членного гетероарила или замещенного или незамещенного 5-20-членного гетероциклоалкила с 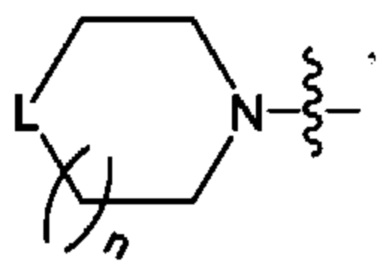 и
и
при этом C1-С6алкил, C1-С6алкокси или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из гидрокси, C1-С6алкила, C1-С6алкокси, С6-С10арилокси или незамещенного или замещенного C1-С6алкилом, С6-С10арил-C1-С6алкилом или C1-С6алкилкарбонилом 4-12-членного гетероциклоалкила, и
R3 и R4, каждый независимо, представляют собой водород, тяжелый водород, -C(=O)-Ra, C1-С6алкил или С6-С10арил, и C1-С6алкил или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из галогена, гидрокси, C1-С6алкила, C1-С6алкокси или С6-С10арилокси, и при этом Ra представляет собой водород, тяжелый водород, C1-С6алкил или C1-С6галогеналкил; и
R5 представляет собой -ORb, -NRcRd, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С8циклоалкил, и при этом C1-С6алкил, С2-С6алкенил или С2-С6алкинил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из моно-С1-С6алкиламина или ди-С1-С6алкиламина, и Rb, Rc и Rd, каждый независимо, представляют собой водород, тяжелый водород, С6-С10арил или C6-С10арил-C1-C6 алкил, и
R6 представляет собой C1-С6алкил, незамещенный или замещенный 1, 2, 3 или 4 типами C1-С6алкила С6-С10арил.
В одном из конкретных аспектов, когда L в 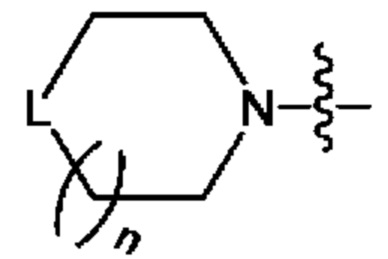 является замещенным, тогда L представляет собой СН2 или NH, и среди них один тип или 2 типа Н могут быть замещены вышеуказанными заместителями.
является замещенным, тогда L представляет собой СН2 или NH, и среди них один тип или 2 типа Н могут быть замещены вышеуказанными заместителями.
В одном из конкретных аспектов соединение химической формулы I может представлять собой соединение химической формулы I-3, указанной ниже:
Химическая формула I-3
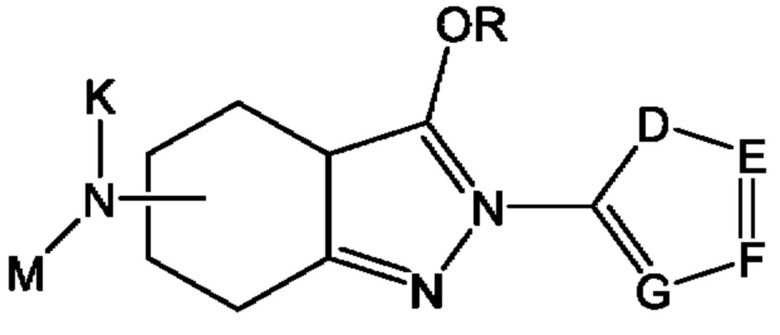
в этой формуле
определение K, М, R, D, Е, F и G такое же, как для химической формулы I-1.
В одном из конкретных аспектов соединение химической формулы I может представлять собой соединение химической формулы I-4, указанной ниже
Химическая формула I-4
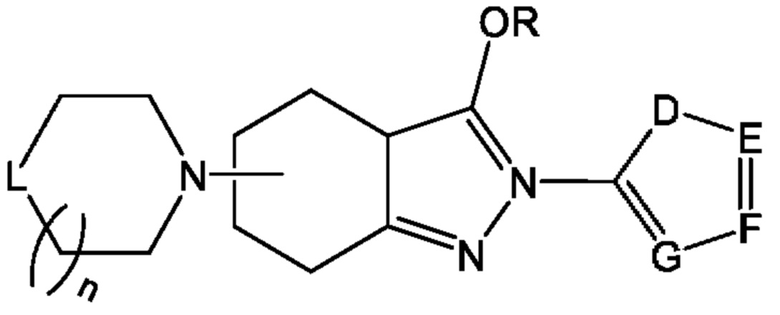
в этой формуле
определение L, n, R, D, Е, F и G такое же, как для химической формулы I-2.
В одном аспекте соединения химической формулы I по настоящему изобретению могут представлять собой одно или более соединений, выбранных из группы, состоящей из нижеследующих соединения 1-161, но без ограничения ими:
1) 5-(бензилметиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
2) 5-(бензилциклопропиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
3) 4-{[(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрил;
4) 5-[(4-фторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
5) 5-[(2,4-дифторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
6) 5-[(2-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
7) 5-[(3-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
8) 5-[метил-(4-трифторметилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
9) 5-[метил-(3-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
10) 5-[метил-(3-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
11) 5-[метил-(2-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
12) 5-[(4-метансульфонилбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
13) 5-[(3-метоксибензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
14) 5-пиперидин-1-ил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
15) 5-морфолино-4-ил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
16) 5-(4-метилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
17) 5-(4-(2-(2-гидроксиметокси)этил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
18) 5-(3,4-дигидро-1Н-изохинолин-2-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
19) 5-[(4-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
20) 5-(бензилэтиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
21) 5-(бензилпропиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
22) 5-(бензилбутиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
23) 5-[метил(3-метилсульфонилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
24) 5-[метил-(4-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
25) 3-{[(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрил;
26) 5-[(2-метоксибензил)-метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
27) 5-[(3-фторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
28) 5-[(4-метоксибензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
29) 5-[метил-(2-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
30) 5-[(2,4-дихлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
31) 5-[(3,4-дихлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
32) 5-(3,4-дифторфениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
33) 5-[метил(5,6,7,8-тетрагидрохинолин-8-ил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
34) 5-(((3-(гидроксиметил)-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил)метил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
35) 5-{[(3-(гидроксиметил)-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил)метил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
36) 5-{метил[3-метил-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
37) 5-{метил[5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
38) циклопропил[4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2-индазол-5-ил)пиперазин-1-ил]метанон;
39) 5-(бензилметиламино)-2-(5-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
40) 5-(бензилметиламино)-2-(5-хлорпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
41) 5-(бензилметиламино)-2-(6-(трифторметил)пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
42) 5-(бензилметиламино)-2-(6-метилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
43) 5-(бензилметиламино)-2-(3-фторпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
44) 6-(5-(бензилметиламино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)никотинонитрил;
45) 5-(бензилметиламино)-2-(6-метил-4-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
46) 5-(бензиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
47) 2-(пиридин-2-ил)-5-[(пиридин-2-илметил)амино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
48) 5-[метил(пиридин-2-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
49) 5-[метил(пиридин-4-илметил)амино]-2-(5-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
50) 2-(5-хлорпиридин-2-ил)-5-[метил(пиридин-4-илметил)амино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
51) 5-[метил(пиридин-4-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
52) 2-(4-бромфенил)-5-[метил(пиридин-4-илметил)амино]-4,5,6,7,-тетрагидро-2Н-индазол-3-ол;
53) 5-(бензилметиламино)-2-(тиено[3,2-с]пиридин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
54) 2-(6-аминопиридин-2-ил)-5-(бензилметиламино)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
55) 5-фениламино-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
56) 5-[(2,5-диметилфенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
57) 5-[(4-нитрофенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
58) 5-[(4-метоксифенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
59) 5-(фениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
60) 2-(пиридин-2-ил)-5-(хинолин-3-иламино)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
61) 5-[метил(нафталин-2-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
62) 5-[(изохинолин-3-илметил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
63) 5-[метил(хинолин-6-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
64) 5-[(изохинолин-3-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
65) 5-[метил(пиридин-2-илметил)амино]-2-фенил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
66) 5-[этил(пиридин-4-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
67) 5-[(3-диметиламинобензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
68) 5-[(4-диметиламинобензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-2-ол;
69) 5-[(3-диметиламинобензил)метиламино)]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
70) 5-[(4-диметиламино)бензилметиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
71) 5-[(2-диметиламино)бензилметиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
72) 5-(бензилметиламино)-2-фенил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
73) 4-[(5-бензилметиламино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил]бензойная кислота;
74) 5-(бензилметиламино)-2-(4-бромфенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
75) 5-(бензилметиламино)-2-(2-хлорфенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
76) 5-(бензилметиламино)-2-(2-метоксифенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
77) 2-(2-хлорфенил)-5-[(3-диметиламинобензил)метиламино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
78) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)бензойная кислота;
79) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)бензамид;
80) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)-N-метилбензамид;
81) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)-N,N-диметилбензамид;
82) 5-(4-метилпиперазин-1-ил)-2-(5-(трифторметил)пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
83) 2-(6-хлорпиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
84) 2-(6-метил-4-(трифторметил)пиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
85) 5-(4-метилпиперазин-1-ил)-2-(тиено[3,2-с]пиридин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
86) 2-(3-фторпиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
87) 2-(пиридин-2-ил)-5-(4-(пиридин-2-илметил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
88) 5-((4-метоксибензил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
89) 1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)бут-2-ен-1-он;
90) 2-(пиридин-2-ил)-5-(4-(хинолин-6-илметил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
91) 5-(4-этилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
92) 5-(фениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
93) 5-(фенетиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
94) 2-(4-хлорфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
95) 5-(4-метилпиперазин-1-ил)-2-(4-(трифторметил)фенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
96) 2-(пиридин-2-ил)-5-(пирролидин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
97) 1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)проп-2-ен-1-он;
98) (Е)-4-(диметиламино)-1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)бут-2-ен-1-он;
99) (Е)-4-(диметиламино)-N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-N-метилбут-2-енамид;
100) 5-(4-пропилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
101) 2-(4-бромфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
102) 2-(4-фторфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
103) 4-(3-гидрокси-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-2-ил)бензонитрил;
104) 5-(4-фенетилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
105) 5-(4-бензилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
106) 5-(4-(циклогексилметил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
107) 5-(4-(3-фенилпропил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
108) 5-(4-метилпиперазин-1-ил)-2-(пиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
109) 5-(пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
110) 5-(4-(метилсульфонил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
111) 5-(4-(фенилсульфонил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
112) 2-(пиридин-2-ил)-5-(4-тозилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
113) 4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-№фенилпиперазин-1-карбоксамид;
114) бензил-4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-карбоксилат;
115) 2-(1-метил-1Н-пиррол-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
116) 5-(4-метилпиперазин-1-ил)-2-(тиазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
117) 5-(4-метилпиперазин-1-ил)-2-(оксазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
118) 2-(1-метил-1Н-пиразол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
119) 2-(1-метил-1Н-имидазол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
120) 2-(1-метил-1Н-имидазол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
121) 5-(бензил(метил)амино)-2-(пиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
122) 5-(бензил(метил)амино)-2-(1-метил-1Н-пиррол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
123) 5-(бензил(метил)амино)-2-(1-метил-1Н-пиразол-5-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
124) 5-(бензил(метил)амино)-2-(1-метил-1Н-имидазол-5-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
125) 5-(бензил(метил)амино)-2-(оксазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
126) 2-(пиридин-2-ил)-5-(4-(пара-толил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
127) 5-(4-(4-гидроксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
128) 5-(4-(3,4-дифторфенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
129) 5-(4-(4-метоксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
130) 1-(4-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)фенил)этан-1-он;
131) 5-(4-(4-(метилсульфонил)фенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
132) 5-(4-(4-феноксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
133) 5-(4-(пиперидин-4-илметил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
134) 5-(4-((1-метилпиперидин-4-ил)метил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
135) 5-(4-((1-бензилпиперидин-4-ил)метил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
136) 1-(4-((4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)этан-1-он;
137) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)бензамид;
138) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-2-фенилацетамид;
139) 1-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-3-фенилмочевина;
140) 1-бензил-3-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)мочевина;
141) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)бензолсульфонамид;
142) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-4-метилбензолсульфонамид;
143) бензил-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)карбамат;
144) 2-(5-фтор-4-морфолинопиримидин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
145) N-бензил-3-метокси-N-метил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-амин;
146) N-бензил-3-(циклопропилметокси)-N-метил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-амин;
147) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илциклопропанкарбоксилат;
148) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илакрилат;
149) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илбензоат;
150) 2-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)пиримидин-5-карбоновая кислота;
151) метил-2-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)никотинат;
152) N-(6-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)пиридин-2-ил)ацетамид;
153) 5-(бензил(метил)амино)-2-(4,6-диметокси-1,3,5-триазин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
154) 5-(4-метилпиперазин-1-ил)-2-(пиримидин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
155) 2-(5-хлорпиридазин-3-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
156) 2-(пиридин-2-ил)-5-(4-(пиримидин-2-ил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
157) 5-(бензил(метил)амино)-2-(5-нитропиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
158) 5-((4-гидроксибензил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
159) 5-(метил(4-нитробензил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
160) 5-(3-(этил(метил)амино)пирролидин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол; и
161) 2,2,2-трифтор-N-(1-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пирролидин-3-ил)ацетамид.
Если конкретно не указано иное, химические формулы или названия, приведенные в настоящем описании изобретения и формуле изобретения, относятся к таутомерам и всем стереоскопическим, оптическим и геометрическим изомерам (например, энантиомерам, диастереомерам, E/Z изомерам и т.д.) и их рацематам, а также смесям энантиомеров в разных пропорциях, смесям диастереомеров или смесям любых вышеуказанных форм, в которых существуют изомеры и энантиомеры, и их фармацевтически приемлемым солям и сольватам, таким как гидраты, включающие, например, сольваты и гидраты свободного соединения или сольваты и гидраты солей соответствующего соединения.
В одном воплощении соединение по настоящему изобретению может присутствовать в форме фармацевтически приемлемой соли. Соль означает соль, обычно используемую в области медицины, к которой относится настоящее изобретение, и полезной является соль присоединения кислоты, образованная фармацевтически приемлемой свободной кислотой. Термин в настоящем изобретении "фармацевтически приемлемая соль" относится к любой соли присоединения органической или неорганической кислоты соединения, побочные эффекты которой, присущие этой соли, не уменьшают полезную эффективность соединения по настоящему изобретению в концентрации, обладающей эффективным действием, и которая является относительно нетоксичной и безвредной для пациента.
Соль присоединения кислоты получают общепринятым способом, например путем растворения соединения в избыточном количестве водного раствора кислоты и осаждения этой соли с использованием смешивающегося с водой органического растворителя, например метанола, этанола, ацетона или ацетонитрила. Равные молярные количества соединения и кислоты или спирта (например, моноэтилового эфира гликоля) в воде могут быть нагреты, и затем смесь может быть выпарена досуха, или осажденная соль может быть отфильтрована под разрежением.
Далее, в качестве свободной кислоты может быть использована органическая кислота и неорганическая кислота, и в качестве неорганической кислоты может быть использована соляная кислота, фосфорная кислота, серная кислота, азотная кислота, винная кислота и т.п., и в качестве органической кислоты может быть использована метансульфоновая кислота, пара-толуолсульфоновая кислота, уксусная кислота, трифторуксусная кислота, малеиновая кислота, янтарная кислота, щавелевая кислота, бензойная кислота, винная кислота, фумаровая кислота, миндальная кислота, пропионовая кислота, лимонная кислота, молочная кислота, гликолевая кислота, глюконовая кислота, галактуроновая кислота, глутаминовая кислота, глутаровая кислота, глюкуроновая кислота, аспарагиновая кислота, аскорбиновая кислота, угольная кислота, ванилиновая кислота, йодистоводородная кислота и т.п., но без ограничения ими.
Кроме того, используя основание, может быть образована фармацевтически приемлемая металлическая соль. Соль щелочного металла или соль щелочно-земельного металла получают, например, путем растворения соединения в избытке раствора гидроксида щелочного металла или гидроксида щелочно-земельного металла, отфильтровывания нерастворенной соли соединения и затем выпаривания и сушки фильтрата. Далее, металлическая соль представляет собой фармацевтически приемлемую соль натрия, калия или кальция, но без ограничения ими. Кроме того, соответствующая соль серебра может быть получена путем проведения реакции соли щелочного металла или соли щелочно-земельного металла с подходящей солью серебра (например, нитратом серебра).
Фармацевтически приемлемая соль соединения по настоящему изобретению, если не указано иное, включает соли, образуемые кислотными или основными группами, которые могут присутствовать в соединениях, описанных в химической формуле I, указанной выше. Например, в качестве фармацевтически приемлемой соли могут быть использованы соли натрия, кальция и калия, образуемые гидроксигруппами, и другая фармацевтически приемлемая соль, образуемая аминогруппой включает соли гидробромид, сульфат, гидросульфат, фосфат, гидрофосфат, дигидрофосфат, ацетат, сукцинат, цитрат, тартрат, лактат, манделат, метансульфонат (мезилат) и пара-толуолсульфонат (тозилат) и т.п., и они могут быть получены способом получения солей, известным в данной области.
В качестве соли соединения, описанного химической формулой I, указанной выше, по настоящему изобретению, может быть использована любая фармацевтически приемлемая соль, которая является солью соединения, описанного химической формулой I, указанной выше, демонстрирующая фармакологическую активность, равную активности соединения, описанного в Таблице 1, без ограничения.
Кроме того, соединение по настоящему изобретению может также существовать в форме его стереоизомера. Стереоизомер включает все стереоизомеры, такие как энантиомеры и диастереомеры. Соединение может представлять собой стереоизомерно чистую форму или смесь одного или более стереоизомеров, например рацемическую смесь. Разделение конкретных стереоизомеров может быть осуществлено одним из общепринятых способов, известных в данной области. Некоторые примеры соединения по настоящему изобретению могут оказывать более высокое ингибирующее воздействие на оксидативный стресс в форме конкретного стереоизомера. В этом случае, при использовании конкретного стереоизомера дозировка может быть снижена. Соответственно, можно выделить конкретный стереоизомер с высоким ингибирующим воздействием на оксидативный стресс, например энантиомер или диастереомер, и за счет этого осуществлять эффективное лечение заболеваний, связанных с оксидативным стрессом.
Соединение по настоящему изобретению может быть в форме его сольвата. "Сольват" означает комплекс или агрегат одной или более растворенных молекул, то есть соединения химической формулы I или его фармацевтически приемлемой соли, и одной или более молекул растворителя. Сольват может представлять собой, например, комплекс или агрегат, образованный молекулами различных растворителей, таких как вода, метанол, этанол, изопропанол или ацетат или т.п.
Сольваты, в которых вода представляет собой молекулу растворителя, называются гидратами. Гидрат включает композицию, содержащую стехиометрическое количество воды, а также композицию, содержащую варьирующее количество воды.
Соединение по настоящему изобретению может также существовать в форме его таутомера.
Термин "таутомер" или "таутомерная форма" означает видоизменяющиеся конституциональные изомеры разных энергий, которые способны к взаимному превращению через низкие энергетические барьеры. Некоторые неограничительные примеры протонных таутомеров (также известных как протонные таутомеры) включают взаимопревращение посредством переноса протона, такое как кето-енольная и имин-енаминная изомеризация. Валентные таутомеры включают взаимопревращение посредством перегруппировки некоторых электронов связи.
Соединение по настоящему изобретению может быть также в форме его изотопного варианта.
Термин "изотопный вариант" означает соединение, в котором по меньшей мере один атом имеет одинаковое количество атомов для любого соединения, но замещено другим атомом, имеющим атомную массу, отличающуюся от атомной массы, нормально и обычно встречающейся в природе.
Сольват, стереоизомер, таутомер и изотопный вариант соединения химической формулы I, указанной выше, могут быть получены из этого соединения, используя способ, известный в данной области.
В способе получения по настоящему изобретению в качестве реагентов, используемых в вышеуказанных реакционных формулах, коммерчески доступные соединения могут быть приобретены и использованы как есть, или они могут быть синтезированы путем проведения одной или более реакций, известных в данной области, как есть, или путем соответствующего их изменения. Например, они могут быть синтезированы путем проведения одной или более реакций в последовательном порядке с учетом наличия, типа и/или положения реакционноспособной функциональной группы и/или гетероэлемента, входящих в структуру, но без ограничения ими.
В одном воплощении соединения из Примеров синтеза по настоящему изобретению демонстрируют ингибирующее воздействие на продуцирование ROS 30%, 50%, 70% или более по сравнению с контрольной группой при обработке ROS, продуцированных РМА, в клетках HL-60 (клетки лейкоза человека), а также проявляют концентрация-независимую ингибирующую способность, и, следовательно, соединения по настоящему изобретению могут быть использованы для предупреждения или лечения заболеваний, связанных с оксидативным стрессом.
Сообщалось, что при дифференцировке фибробластов в миофибробласты образуются ассоциированные с раком фибробласты (CAF) или индуцируется фиброз различных тканей. В результате обработки соединениями из Примеров синтеза по настоящему изобретению клеток HFF-1 (фибробласты крайней плоти человека), в которых фиброз был индуцирован обработкой TGF-β1, был показан эффект ингибирования экспрессии αSMA, показателя фиброза. Таким образом, соединения по настоящему изобретению могут быть использованы для предупреждения или лечения заболеваний, связанных с фиброзом и могут быть использованы для лечения рака посредством регуляции ассоциированных с раком фибробластов, важного показателя взаимодействия опухолевого микроокружения.
При увеличении уровня ROS в нейрональных клетках индуцируется окисление липидов, и, как известно, это важный фактор в гибели нейрональных клеток. При одновременной обработке клеток N27 (допаминергические нейрональные клетки крысы) индуцирующим ROS МРР+ (1-метил-4-фенилпиридинием) и соединениями из Примеров синтеза был показан эффект эффективного ингибирования продуцирования ROS. Соответственно, соединения по настоящему изобретению могут быть использованы для предупреждения или лечения заболеваний, связанных гибелью нейрональных клеток вследствие оксидативного стресса.
Продуцирование внеклеточного матрикса, такого как коллаген типа I и т.п., CTGF (фактором роста соединительной ткани) из келоидных фибробластов является одной из причин кожных фиброзных заболеваний. При индуцировании фиброза путем обработки соединениями из Примеров синтеза и затем обработки TGF-β1 (трансформирующим фактором роста бета 1) клеток KEL-FIB (келоидные фибробласты) экспрессия гена CTGF и гена коллагена типа I эффективно ингибировалась. Следовательно, соединения по настоящему изобретению могут быть использованы для предупреждения или лечения кожных келоидных заболеваний.
Фармацевтическая композиция и применение в медицине
Соединение по настоящему изобретению, его оптический изомер, его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемая соль могут быть подходящими для предупреждения, улучшения течения или лечения различных заболеваний, вызванных оксидативным стрессом, в силу их биологических характеристик.
Фармацевтическую композицию по настоящему изобретению можно применять для лечения заболеваний, связанных с оксидативным стрессом. Заболевание может представлять собой рак, воспалительное заболевание, фиброзное заболевание, нейродегенеративное заболевание, неврологическое заболевание, заболевание печени, кожное заболевание, митохондриальное расстройство, старение, хронический алкоголизм, дисфункцию стволовых клеток, хромоту, метаболический синдром, синдром Дауна, бесплодие, сверхпродуцирование пероксидов липидов в ткани, мышечное заболевание, накопление пероксидов липидов в клеточных мембранах, хроническую усталость или заболевание сетчатки глаза.
Рак может быть выбран из группы, состоящей из рака печени, печеночноклеточной карциномы, желудочно-кишечной злокачественности, рака желудка, интракраниальной менингиомы, ассоциированной с нейрофибромой, рака поджелудочной железы, лейкоза, миелопролиферативного/миелодиспластического заболевания, дерматофибросаркомы, рака молочной железы, рака легкого, рака щитовидной железы, колоректального рака, рака предстательной железы, рака молочной железы, рака яичника, опухоли головного мозга, рака в области головы и шеи, глиобластомы и т.п. Кроме того, рак может представлять собой вторичный рак, метастазированный в другой орган из различных видов рака.
Метаболический синдром может представлять собой ожирение, диабет, высокое кровяное давление, гиперлипидемию, артериосклероз, периферическое сосудистое заболевание, ишемическую перфузию, инфаркт миокарда или инсульт или т.п.
Воспалительное заболевание может представлять собой сопровождающийся воспалением ревматоидный артрит, остеоартрит, пневмонию, гепатит, воспалительное колоректальное заболевание, энтерит кишечника, гломерулонефрит, гастрит, васкулит, панкреатит, перитонит, бронхит, кардиомиозит, энцефалит, воспаление при постишемическом реперфузионном повреждении, воспаление, полученное в результате отторжения тканевого и органного трансплантата, различное воспаление, возникающее на коже, такое как ожог, аллергический контактный дерматит и т.п., воспаление, полученное в результате полиорганных расстройств, диабетическое воспаление, включающее диабетическую нефропатию, инфекционное воспаление, вызванное вирусной или бактериальной инфекцией, или аутоиммунное заболевание, такое как атопическое заболевание, волчанка, псориаз, атеросклероз и т.п.
Фиброзное заболевание может представлять собой вызванный метаболическим заболеванием фиброз или цирроз печени, вызванный NAFLD фиброз или цирроз печени, вызванный NASH фиброз или цирроз печени, вызванный алкоголем фиброз или цирроз печени, вызванный лекарственными средствами фиброз или цирроз печени, вызванный инфекционным агентом фиброз или цирроз печени, вызванный паразитической инфекцией фиброз или цирроз печени, вызванный бактериальной инфекцией фиброз или цирроз печени, вызванный вирусной инфекцией фиброз или цирроз печени, вызванный HBV (вирус гепатита В)-инфекцией фиброз или цирроз печени, вызванный HCV (вирус гепатита С)-инфекцией фиброз или цирроз печени, вызванный HIV (вирус иммунодефицита человека)-инфекцией фиброз или цирроз печени, вызванный как HCV-, так и HIV-инфекцией фиброз или цирроз печени, вызванный облучением или химиотерапией фиброз или цирроз, фиброз желчных протоков, фиброз или цирроз печени, вызванный хроническим холестатическим заболеванием, фиброз пищеварительного тракта любой этиологии, фиброз, вызванный болезнью Крона, фиброз, вызванный неспецифическим язвенным колитом, фиброз тонкой кишки, фиброз ободочной кишки, желудочный фиброз, фиброз легких, фиброз кожи, эпидермальный фиброз, эндотелиальный фиброз, фиброз кожи, вызванный склеродермией/системным склерозом, хроническую обструктивную болезнь легких (COPD), астму, эмфизему, легкие курильщика, туберкулез, легочный фиброз, идиопатический легочный фиброз (IPF) с последующим фиброзом легких, фиброз сердца, фиброз почек, нефрогенный системный фиброз, мышечный фиброз, фиброз мягких тканей, миелофиброз, фиброз суставов, фиброз сухожилий, хондрофиброз, фиброз поджелудочной железы, фиброз матки, фиброз нервной системы, фиброз яичек, фиброз яичников, фиброз надпочечника, артериальный фиброз, венофиброз, глазной фиброз, эндомиокардиальный фиброз, фиброз средостения, миелофиброз, ретроперитониальный фиброз, прогрессирующий гигантский фиброз, который является осложнением пневмокониоза, пролиферативный фиброз, неопластический фиброз, периферический фиброз трансплантата, асбестоз, суставной фиброз или адгезивный капсулит.
Нейродегенеративное заболевание может представлять собой болезнь Альцгеймера (включая легкую или раннюю болезнь Альцгеймера, легкую-умеренную болезнь Альцгеймера, умеренную-промежуточную болезнь Альцгеймера, умеренную-тяжелую болезнь Альцгеймера, умеренно тяжелую болезнь Альцгеймера, тяжелую болезнь Альцгеймера и болезнь Альцгеймера с тельцами Леви), болезнь Паркинсона (включая болезнь Паркинсона, химически индуцированную воздействием агентов окружающей среды, таких как пестициды, инсектициды или гербициды и/или металлы, такие как марганец, алюминий, кадмий, медь или цинк, болезнь Паркинсона, ассоциированную с геном SNCA, спорадическую или идиопатическую болезнь Паркинсона или Паркинсон-или LRRK2-ассоциированную с болезнь Паркинсона), аутосомно-доминантную болезнь Паркинсона, болезнь диффузных телец Леви (DLBD) (также известная как деменция с тельцами Леви (DLB)), истинную вегетативную атаксию, дисфагию с тельцами Леви, случайную LBD, генетическую LBD (например, мутация гена альфа-синуклеина, PARK3 и PARK4), множественную системную атрофию (включая оливопонтоцеребеллярную атрофию, стриатонигральную дегенерацию, синдром Шая-Дреджера (MSA)), коплекс болезнь Альцгеймера и болезнь Паркинсона и/или MSA, болезнь Гентингтона, синуклеиновую болезнь, расстройство или состояние, характеризующееся наличием телец Леви, рассеянный склероз, амиотрофический боковой склероз (ALS), деменцию (включая сосудистую деменцию, деменцию с тельцами Леви, деменцию Паркинсона и лобно-височную деменция), психоз (включая тревожность, вызванную нейродегенеративным заболеванием или ассоциированную с допаминовой терапией, например психоз Паркинсона, психоз Альцгеймера, психоз при деменции с тельцами Леви (без ограничения ими), дискинезию (включая тревожность, вызванную нейродегенеративным заболеванием или ассоциированную с допаминовой терапией), тревожность (включая тревожность, вызванную нейродегенеративным заболеванием или ассоциированную с допаминовой терапией), состояние, ассоциированное с допаминовой терапией (включая миодистонию, миоклонию или тремор), синуклеиновое заболевание, заболевание, связанное с аномальной экспрессией α-синуклеина, ишемическую болезнь головного мозга, болезнь Крейцфельда-Якоба, болезнь Мачадо-Джозефа, или спино-церебеллярную атаксию, или болезнь Пика.
Заболевание печени может представлять собой метаболическое заболевание печени, неалкогольную жировую болезнь печени (NAFLD), неалкогольный стеатогепатит (NASH), вызванное лекарственными средствами заболевание печени, вызванное алкоголем заболевание печени, вызванное инфекционным агентом заболевание печени, воспалительное заболевание печени, опосредованное дисфункцией иммунной системы заболевание печени или дислипидемию.
Кожное заболевание может представлять собой келоидное заболевание, псориаз или лейкоплакию, и заболевание сетчатки глаза может представлять собой фиброз сетчатки глаза, дегенерацию желтого пятна, диабетическую ретинопатию, диабетическую дегенерацию желтого пятна, ретинопатию недоношенных, повреждение сетчатки глаза, ассоциированное с ишемической реперфузией, пигментный ретинит, катаракту или неоваскулярную глаукому.
Митохондриальное расстройство может представлять собой генетическое митохондриальное расстройство, болезнь Альперса, синдром Барта, хронический прогрессирующий паралич внешних мышц глаза (СРЕО), недостаточность длинноцепочечной ацил-КоА-дегидрогеназы (LCAD), синдром MELAS (митохондриальная энцефалопатия, лактоацидоз и инсультоподобные эпизоды), наследственную оптическую нейропатию Лебера (LHON), болезнь Ли, синдром Ли, болезнь Люфта, синдром Пирсона, невропатию, атаксию и пигментный ретинит (NARP), недостаточность Co-Q10, синдром MERRF (MERRF - миоклоническая эпилепсия с разорванными красными волокнами)), синдром истощения митохондриальной ДНК (MDS), летальную младенческую кардимиопатию (LIC), митохондриальную нейрогастроинтестинальную энцефаломиопатию, дефект бета-окисления, атаксию Фридрейха (Friedreich's Ataxia FA), синдром Кернса-Сейра (KSS) или лактоацидоз.
Неврологическое заболевание может представлять собой биполярное расстройство, расстройство развития, аутизм, синдром Аспергера, расстройство Ретта, нарушение зрения, оптическую невропатию, синдром нарушения внимания с гиперактивностью (ADHD), эпилепсию, расстройство настроения, синдром Туретта или шизофрению или т.п. Мышечное заболевание может представлять собой миопатию, мышечную дистрофию, кардиомиопатию, энцефаломиопатию или спинальную мышечную атрофию или т.п.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективную дозу соединения химической формулы I, определенной выше, или его фармацевтически приемлемой соли или сольвата или стереоизомера и фармацевтически приемлемый носитель.
В композиции по настоящему изобретению соединение или его фармацевтически приемлемая соль, или сольват, или стереоизомер такие, как описано выше.
В композиции по настоящему изобретению "фармацевтически приемлемый носитель" представляет собой вещество, обычно инертное вещество, используемое в комбинации с активным ингредиентом, чтобы способствовать применению активного ингредиента. Носитель включает обычный фармацевтически приемлемый эксципиент, добавку или разбавитель. Носитель может содержать одно или более, выбранное, например, из следующих: наполнитель, связывающее вещество, разрыхлитель, буфер, консервант, антиоксидант, глидант, корригент, загуститель, окрашивающий агент, эмульгатор, суспендирующий агент, стабилизатор, рН-регулирующий агент и изотонический агент.
В качестве разбавителя могут быть использованы сахар, крахмал, микрокристаллическое целлюлоза, лактоза (лактозы гидрат), глюкоза, ди-маннит, альгинат, соль щелочно-земельного металла, глина, полиэтиленгликоль, безводный гидрофосфат кальция или их смесь или т.п.; и в качестве связывающего вещества могут быть использованы крахмал, микрокристаллическая целлюлоза, в высокой степени диспергируемый диоксид кремния, маннит, ди-маннит, фруктоза, лактозы гидрат, полиэтиленгликоль, поливинилпирролидон (повидон), сополимер поливинилпирролидона (соповидон), гипромеллоза, гидроксипропилцеллюлоза, природная камедь, синтетическая камедь желатин или их смесь или т.п.
В качестве разрыхлителя могут быть использованы крахмал или модифицированный крахмал, такой как крахмал, модифицированный натриевой солью глюконовой кислоты, кукурузный крахмал, картофельный крахмал, преежелатинизированный крахмал или т.п.; глина, такая как бентонит, монтмориллонит или вигум или т.п.; целлюлоза, такая как микрокристаллическая целлюлоза, гидроксипропилцеллюлоза или карбоксил метил целлюлоза или т.п.; альгины, такие как альгинат натрия или альгинат или т.п.; поперечносшитые целлюлозы, такие как кроскармелоза или т.п.; камеди, такие как гуаровая камедь, ксантановая камедь или т.п.; поперечносшитые полимеры, такие как поперечносшитый поливинилпирролидон (кросповидон) или т.п.; шипучие агенты, такие как натрия бикарбонат, цитрат или т.п. или их смеси.
В качестве смазывающего вещества могут быть использованы тальк, стеарат, стеарат магния, стеарат кальция, лаурилсульфат натрия, гидрогенезированное растительное масло, бензоат натрия, стеарилфумарат натрия, глицерилмонолаурат, глицерилмоностеарат, глицерилпальмитостеарат, коллоидный диоксид кремния или их смеси или т.п.
В качестве рН-регулирующего агента могут быть использованы подкисляющие агенты, такие как ацетат, аскорбиновая кислота, аскорбат натрия, натриевая соль этериновой кислоты, яблочная кислота, янтарная кислота, винная кислота, фумаровая кислота, лимонная кислота (цитрат), и подщелачивающие агенты, такие как осажденный карбонат кальция, аммиачная вода, меглумин, карбонат натрия, оксид магния, карбонат магния, цитрат натрия и трехосновный фосфат кальция и т.п.
В качестве антиоксиданта могут быть использованы дибутилгидрокситолуол, бутилированный гидроксианизол, токоферола ацетат, токоферол, пропилгаллат, бисульфит натрия, пиросульфит натрия и т.п. В предшествующей категории по настоящему изобретению в качестве солюбилизатора могут быть использованы лаурилсульфат натрия, сложные эфиры жирных кислот и полиоксиэтиленсорбитана, такие как полисорбат, докузат натрия, полоксамер или т.п.
Кроме того, для получения агента длительного высвобождения в состав могут быть включены энтеросолюбильный полимер, нерастворимый в воде полимер, гидрофобное соединение и гидрофильный полимер.
Энтеросолюбильный полимер относится к полимеру, который нерастворим или стабилен в кислотных условиях при рН меньше 5 и растворяется или распадается в конкретных условиях рН 5 или более и, например, включает энтеросолюбильные производные целлюлозы, такие как ацетат-сукцинат гипромеллозы, фталат гипромеллозы (фталат гидроксипропилметилцеллюлозы), фталат гидроксиметилэтилцеллюлозы, фталат-ацетат целлюлозы, сукцинат-ацетат целлюлозы, малат-ацетат целлюлозы, фталат-бензоат целлюлозы, фталат-пропионат целлюлозы, фталат метилцеллюлозы, фталат карбоксиметилэтилцеллюлозы и этилгидроксиэтилцеллюлозы, метилгидроксиэтилцеллюлозу; энтеросолюбильные акрилатные сополимеры, такие как стирол-акрилатный сополимер, акрилат-метилакрилатный сополимер, акрилат-метилметакрилатный сополимер (например, арил-is), бутилакрилат-стирол-акрилатный сополимер и метилакрилат-метакрилат-октилакрилатный сополимер; энтеросолюбильные полиметакрилатные сополимеры, такие как сополимер поли(метакрилат-метилметакрилат) (например, Eudragit L, Eudragit S, Evonik, Германия), сополимер поли(метакрилатэтилакрилат) (например, Eudragit L100-55); энтеросолюбильные сополимеры малеиновой кислоты, такие как безводный сополимер винилацетата с малеиновой кислоты ангидридом, сополимер стирола с малеиновой кислотой, сополимер стирол-малеиновая кислота-моноэстерол, сополимер винилметиловый эфир-малеиновой кислоты ангидрид, сополимер этилен-малеиновой кислоты ангидрид, сополимер винилбутилового эфира с малеиновой кислоты ангидридом, сополимер акрилонитрил-метилакрилат-малеиновой кислоты ангидрид и сополимер бутилакрилат-стирол-малеиновой кислоты ангидрид; и энтеросолюбильные поливиниловые производные, такие как поливиниловый спирт-фталат, поливинилацетальфталат, поливинилбутилатфталат и поливинилацетацетальфталат.
Нерастворимый в воде полимер относится к фармацевтически приемлемому полимеру, контролирующему высвобождение лекарственного средства, который не растворяется в воде. Например, нерастворимый в воде полимер включает поливинилацетат (например, Kollicoat SR30D), нерастворимый в воде полиметакрилатный сополимер [например, сополимер поли(этилакрилат-метилметакрилат) (например, Eudragit NE30D, сополимер поли(этилакрилат-метилметакрилат-триметиламиноэтилметакрилат) (например, Eudragit RSPO) и т.д.), метилцеллюлозу, сложный эфир целлюлозы, простой эфир целлюлозы, ацилат целлюлозы, диацилат целлюлозы, триацилат целлюлозы, ацетат целлюлозы, диацетат целлюлозы и триацетат целлюлозы и т.п.
Гидрофобное соединение относится к фармацевтически приемлемому веществу, контролирующему высвобождение лекарственного средства, которое не растворяется в воде. Например, оно включает жирную кислоту и сложные эфиры жирных кислот, такие как глицерилпальмитостеарат, глицерилстеарат, глицерилбегенат, цетилпальмитат, глицерилмоноолеат и стеарат; жирные спирты, такие цетостеариловый спирт, цетиловый спирт и стеариловый спирт; воск, такой как карнаубский воск, цера и микрокристаллический воск; и минеральные вещества, такие как тальк, осажденный карбонат кальция, гидрофосфат кальция, оксид цинка, оксид титана, каолин, бентонит, монтмориллонит и вигум и т.п.
Гидрофильный полимер относится к фармацевтически приемлемому полимерному веществу, контролирующему высвобождение лекарственного средства, которое растворяется в воде. Например, он включает сахариды, такие как декстрин, полидекстрин, декстран, пектин и производные пектина, альгинат, полигалактуроновая кислота, ксилан, арабиноксилан, арабиногалактан, крахмал, гидроксипропилкрахмал, амилозу и амилопектин; производные целлюлозы, такие как гипромеллоза, гидроксипропилцеллюлоза, гидроксиметил целлюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза и натриевая соль карбоксиметилцеллюлозы; камедь, такую как гуаровая камедь, камедь бобов рожкового дерева, трагакант, каррагинан, гуммиарабик, аравийская камедь, геллановая камедь и ксантановая камедь; белки, такие как желатин, казеин и зеин; поливиниловые производные, такие как поливиниловый спирт, поливинилпирролидон и поливинилацетальдиэтиламиноацетат; гидрофильные полиметакрилатные сополимеры, такие как сополимер поли(бутилметакрилат-(2-диметиламиноэтил)метакрилат-метилметакрилат) (например, Eudragit E100, Evonik, Германия), сополимер поли(этилакрилат-метилметакрилат-триэтиламиноэтил-метакрилат хлорид) (например, Eudragit RL, RS, Evonik, Германия); производные полиэтилена, такие как полиэтиленгликоль и полиэтиленоксид; карбомер и т.п.
Кроме того, в качестве различных добавок, выбранных из окрашивающих агентов и корригентов, композиция по настоящему изобретению может быть приготовлена путем выбора и использования фармацевтически приемлемой добавки.
В настоящем изобретении диапазон добавок не ограничен использованием вышеуказанных добавок, и может быть приготовлена композиция, содержащая дозу в обычном диапазоне, путем выбора вышеуказанной добавки.
Фармацевтическую композицию по настоящему изобретению можно применять как приготовленную в форме пероральной композиции, такой как порошок, гранула, таблетка, капсула, суспензия, эмульсия, сироп и аэрозоль, и наружного препарата, суппозитория или стерильного инъекционного раствора.
Композицию по настоящему изобретению можно вводить перорально или парентерально, включая внутривенное, интраперитонеальное, подкожное, интраректальное и местное введение.
В другом аспекте настоящего изобретения предложен способ лечения заболевания у субъекта, включающий введение субъекту терапевтически эффективной дозы соединения химической формулы I или его фармацевтически приемлемой соли, или сольвата, или стереоизомера.
В способе специалисты в данной области могут соответствующим образом выбрать путь введения в соответствии с состоянием пациента. Введение может быть пероральным или парентеральным. Парентеральное введение включает внутривенное, внутрибрюшинное, подкожное, внутричерепное и местное введение.
В способе доза может быть по-разному изменена в зависимости от различных факторов, таких как состояние пациента, путь введения, суждение семейного врача и тому подобное. Эффективная доза может быть оценена по кривой доза-ответ, полученной в ходе эксперимента in vitro или тестирования в животной модели. Пропорция и концентрация соединения по настоящему изобретению, присутствующего в композиции, подлежащей введению, могут быть определены в зависимости от химических свойств, пути введения, терапевтической дозы и тому подобного. Дозу можно вводить субъекту в эффективной дозе от примерно 1 мкг/кг до примерно 1 г/кг/сутки или от примерно 0,1 мг/кг до примерно 500 мг/кг/сутки. Доза может быть изменена в зависимости от возраста субъекта, массы тела, чувствительности или симптомов.
Более того, фармацевтическую композицию, содержащую соединение по настоящему изобретению или его стереоизомер, его сольват, его изотопный вариант, его таутомер или его фармацевтически приемлемую соль в качестве активного ингредиента, можно применять в способе предупреждения или лечения заболевания, выбранного из группы, состоящей из рака; воспалительных заболеваний, выбранных из ревматоидного артрита, остеоартрита, пневмонии, гепатита, воспалительного колоректального заболевания, энтерита кишечника, гломерулонефрита, гастрита, васкулита, панкреатита, перитонита, бронхита, кардиомиозита, энцефалита, аллергического контактного дерматита, диабетического воспаления, инфекционного воспаления и аутоиммунного заболевания; фиброзных заболеваний, выбранных из печеночного фиброза, циррозы, фиброза тонкой кишки, фиброз толстой кишки, фиброза желудка, фиброза легкого, фиброза кожи, эпидермального фиброза, дермального склероза/системного склероза, фиброза сердца и фиброз почек; нейродегенеративных заболеваний, выбранных из болезни Паркинсона, болезни Гентингтона, амиотрофического бокового склероза, болезни Альцгеймера, рассеянного склероза, ишемического и травматического повреждения головного мозга; неврологических заболеваний, выбранных из биполярного расстройства, расстройства развития, аутистического расстройства, синдрома Аспергера, синдрома Ретта, нарушения зрения, оптической невропатии, расстройства дефицит внимания с гиперактивностью (ADHD), эпилепсии, расстройства настроения, синдрома Туретта и шизофрении; заболеваний печени; кожных заболеваний; митохондриальных расстройств, выбранных из генетического митохондриального расстройства, болезни Альперса, синдрома Барта, прогрессирующего паралича внешних мышц глаза (СРЕО), недостаточности длинноцепочечной ацил-КоА-дегидрогеназы (LCAD), синдрома MELAS (митохондриальная энцефалопатия, лактацидоз и инсультоподобные эпизоды), наследственной оптической нейропатии Лебера (LHON), болезни Ли, синдрома Ли, болезни Люфта, синдрома Пирсона, невропатии, атаксии и пигментного ретинита (NARP), недостаточности Co-Q10, синдрома MERRF (MERRF), синдрома истощения митохондриальной ДНК (MDS), летальной младенческой кардиомиопатии (LIC), митохондриальной нейрогастроинтестинальной энцефаломиопатии, дефекта бета-окисления, атаксии Фридрейха (Friedreich's Ataxia FA), синдрома Кернса-Сейра (KSS) или лактоацидоза; старения; хронического алкоголизма; дисфункции стволовых клеток; хромоты; метаболических синдромов, выбранных из ожирения, диабета, высокого кровяного давления, гиперлипидемии, артериосклероза, периферического сосудистого заболевания, ишемической перфузии, инфаркта миокарда и инсульта; синдрома Дауна; бесплодия; сверхпродуцирования пероксидов липидов в ткани; мышечных заболеваний, выбранных из миопатии, мышечной дистрофии, миокардиопатии, энцефаломиопатии и атрофии мышц спины; накопления пероксидов липидов в клеточных мембранах; хронической усталости; и заболеваний сетчатки глаза, выбранных из фиброза сетчатки, дегенерации желтого пятна, диабетической ретинопатии, катаракты и неоваскулярной глаукомы, включающем введение ее нуждающемуся в этом субъекту.
ПРИНЦИП ИЗОБРЕТЕНИЯ
Примеры
Далее настоящее изобретение будет описано более подробно с помощью примеров. Эти примеры предназначены для более конкретной иллюстрации настоящего изобретения, и специалистам в данной области очевидно, что объем настоящего изобретения не ограничен этими примерами.
Вспомогательный пример: Получение Промежуточных соединений 1-3
Промежуточное соединение 1: Получение метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилата
4-Диоксаспиро[4.5]декан-8-он (10,0 г, 64 ммоль) растворяли в 250 мл тетрагидрофурана и затем этом добавляли гидрид натрия (1,84 г, 77 ммоль, 1,2 экв.) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем добавляли диметилкарбонат (11,5 г, 128 ммоль, 2 экв.). После перемешивания при комнатной температуре в течение 12 часов в реакционную смесь добавляли 200 мл насыщенного водного раствора хлорида аммония. Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и соленой водой и сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир / этилацетат = 18/1) с получением указанного в заголовке соединения (6,94 г, 56%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3): δ 12.19 (s, 1H), 4.04 (s, 4Н), 3.79 (s, 3Н), 2.60-2.50 (m, 4Н), 2.30-2.05 (m, 1Н), 1.88 (t, J=4,8 Гц, 2H).
4-Диоксаспиро[4.5]декан-8-он (15,0 г, 96,04 ммоль) растворяли в 250 мл безводного тетрагидрофурана и затем добавляли гидрид натрия (9,22 г, 192,08 ммоль, 2 экв.) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником при 50°С в течение 30 минут и затем добавляли диметилкарбонат (17,3 г, 192,08 ммоль, 2 экв.). Реакционную смесь кипятили с обратным холодильником в течение 4 часов, затем охлаждали до комнатной температуры и затем нейтрализовали при 0°С 2М водным раствором соляной кислоты. Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и соленой водой, сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан / этилацетат = 3/1) с получением указанного в заголовке соединения в виде белого твердого вещества (18,10 г, 88%).
Промежуточное соединение 2: Получение 2'-(пиридин-2-ил)-2,'4,'6,'7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ола
Метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилат (2,0 г, 10,3 ммоль) растворяли в 20 мл этанола и затем добавляли 2-гидразинилпиридин (1,1 г, 10,3 ммоль, 1,0 экв.). Реакционную смесь кипятили с обратным холодильником в течение 12 часов и затем концентрировали при пониженном давлении. Остаток подвергали перекристаллизации из этилацетата с получением указанного в заголовке соединения в виде желтого твердого вещества (1,5 г, 54%).
1H ЯМР (400 МГц, DMSO-d6): δ 11.56 (s, 1Н), 8.41 (t, J=4,8 Гц, 2H), 7.88 (t, J=8,0 Гц, 1H), 7.19 (t, J=6,0 Гц, 1H), 3.95-3.90 (m, 4H), 2.60-2.52 (m, 2H), 2.38-2.33 (m, 2H), 1.89-1.84 (m, 2H).
Метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилат (18,1 г, 84,53 ммоль) растворяли в 120 мл этанола и затем добавляли 2-гидразинилпиридин (9,22 г, 84,53 ммоль, 1,0 экв.). Реакционную смесь кипятили с обратным холодильником при 100°С в течение 4 часов и затем концентрировали при пониженном давлении. Остаток подвергали перекристаллизации из этилацетата с получением указанного в заголовке соединения в виде желтого твердого вещества (16,39 г, 71%).
Промежуточное соединение 3: Получение 3-гидрокси-2-пиридин-2-ил-2,4,6,7-тетрагидроиндазол-5-она
2'-(Пиридин-2-ил)-2',4',6',7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ол (5,0 г, 18,3 ммоль, 1,0 экв.) растворяли в 40 мл дихлорметана и затем добавляли трифторацетат (80 мл). Реакционную смесь кипятили с обратным холодильником при 50°С в течение 12 часов и затем концентрировали при пониженном давлении. Реакционную смесь разбавляли дихлорметаном и затем ее доводили до рН 6, используя гидрокарбонат натрия. Реакционную смесь экстрагировали дихлорметаном и водой, затем сушили с использованием сульфата натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан / метанол = 20/1) с получением указанного в заголовке соединения в виде коричневого твердого вещества (2,3 г, 54,9%).
1H ЯМР (400 МГц, DMSO-d6): δ 8.48-8.40 (m, 1H), 8.31 (d, J=8,4 Гц, 1H), 8.00-7.90 (m, 1Н), 7.25-7.22 (m, 1H), 3.09 (s, 2H), 2.93 (t, J=6,8 Гц, 2H), 2.62 (t, J=6,8 Гц, 2H). MC (масс-спектрометрия): Вычислено: 229,2; MC: Найдено: 230,2 ([М+Н]+).
2'-(Пиридин-2-ил)-2',4',6',7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ол (12,99 г, 47,56 ммоль) растворяли в 120 мл дихлорметана и затем добавляли трифторацетат (240 мл). Реакционную смесь кипятили с обратным холодильником при 60°С в течение 12 часов и затем концентрировали при пониженном давлении. Реакционную смесь подвергали перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (10.88 г, 99%).
Примеры синтеза
Пример синтеза 1. Получение метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилата
4-Диоксаспиро[4.5]декан-8-он (10,0 г, 64 ммоль) растворяли в 250 мл тетрагидрофурана и затем добавляли гидрид натрия (1,84 г, 77 ммоль, 1,2 экв.) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут и затем добавляли диметилкарбонат (11,5 г, 128 ммоль, 2 экв.). После перемешивания при комнатной температуре в течение 12 часов 200 мл насыщенного водного раствора хлорида аммония добавляли для прекращения реакции. Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и соленой водой, сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (петролейный эфир / этилацетат = 18/1) с получением указанного в заголовке соединения в виде бесцветного масла (6,94 г, 56%).
1H ЯМР (400 МГц, CDCl3): δ 12.19 (s, 1H), 4.04 (s, 4Н), 3.79 (s, 3Н), 2.60-2.50 (m, 4Н), 2.30-2.05 (m, 1Н), 1.88 (t, J=4,8 Гц, 2H).
4-Диоксаспиро[4.5]декан-8-он (15,0 г, 96,04 ммоль) растворяли в 250 мл безводного тетрагидрофурана и затем добавляли гидрид натрия (9,22 г, 192,08 ммоль, 2 экв.) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником при 50°С в течение 30 минут и затем добавляли диметилкарбонат (17,3 г, 192,08 ммоль, 2 экв.). Реакционную смесь кипятили с обратным холодильником в течение 4 часов, затем охлаждали до комнатной температуры и затем нейтрализовали при 0°С 2М водным раствором соляной кислоты. Реакционную смесь экстрагировали этилацетатом (100 мл × 3) и соленой водой, сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан / этилацетат = 3/1) с получением указанного в заголовке соединения в виде белого твердого вещества (18,10 г, 88%).
Пример синтеза 2. Получение 2'-(пиридин-2-ил)-2',4',6',7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ола
Метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилат (2,0 г, 10,3 ммоль) растворяли в 20 мл этанола и затем добавляли 2-гидразинилпиридин (1,1 г, 10,3 ммоль, 1,0 экв.). Реакционную смесь кипятили с обратным холодильником в течение 12 часов и затем концентрировали при пониженном давлении. Остаток подвергали перекристаллизации из этилацетата с получением указанного в заголовке соединения в виде желтого твердого вещества (1,5 г, 54%).
1H ЯМР (400 МГц, DMSO-d6): δ 11.56 (s, 1H), 8.41 (t, J=4,8 Гц, 2Н), 7.88 (t, J=8,0 Гц, 1H), 7.19 (t, J=6,0 Гц, 1H), 3.95-3.90 (m, 4Н), 2.60-2.52 (m, 2Н),2.38-2.33 (m, 2Н), 1.89-1.84 (m, 2Н).
Метил-8-оксо-1,4-диоксаспиро[4,5]декан-7-карбоксилат (18,1 г, 84,53 ммоль) растворяли в 120 мл этанола и затем добавляли 2-гидразинилпиридин (9,22 г, 84,53 ммоль, 1,0 экв.). Реакционную смесь кипятили с обратным холодильником при 100°С в течение 4 часов. Остаток подвергали перекристаллизации из этилацетата с получением указанного в заголовке соединения в виде желтого твердого вещества (16,39 г, 71%).
Пример синтеза 3. Получение 3-гидрокси-2-пиридин-2-ил-2,4,6,7-тетрагидроиндазол-5-она
2'-(Пиридин-2-ил)-2',4',6',7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ол (5,0 г, 18,3 ммоль, 1,0 экв.) растворяли в 40 мл дихлорметана и затем добавляли трифторацетат (80 мл). Реакционную смесь кипятили с обратным холодильником при 50°С в течение 12 часов и затем концентрировали при пониженном давлении. Реакционную смесь разбавляли дихлорметаном, и затем ее доводили до рН 6, используя дихлорметан и воду. Реакционную смесь экстрагировали дихлорметаном и водой, затем сушили с использованием сульфата натрия и фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (растворитель: дихлорметан / метанол = 20/1) с получением указанного в заголовке соединения в виде желтого твердого вещества (2,3 г, 54,9%).
1H ЯМР (400 МГц, DMSO-d6): δ 8.48-8.40 (m, 1H), 8.31 (d, J=8,4 Гц, 1H), 8.00-7.90 (m, 1Н), 7.25-7.22 (m, 1H), 3.09 (s, 2H), 2.93 (t, J=6,8 Гц, 2H), 2.62 (t, J=6,8 Гц, 2H). MC: Вычислено: 229,2; MC: Найдено: 230,2 ([M+H]+).
2'-(Пиридин-2-ил)-2',4',6',7'-тетрагидроспиро[[1,3]диоксолан-2,5'-индазол]-3'-ол (12,99 г, 47,56 ммоль) растворяли в 120 мл дихлорметана и затем добавляли трифторацетат (240 мл). Реакционную смесь подвергали перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (10,88 г, 99%).
Пример синтеза 4. Получение 5-(бензилпропиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 21)
3-Гидрокси-2-пиридин-2-ил-2,4,6,7-тетрагидроиндазол-5-он (500 мг, 2,18 ммоль, 1,0 экв.) растворяли в 30 мл дихлорметана и затем в потоке азота медленно добавляли трет-бутилдиметилсилилхлорид (494 мг, 3,27 ммоль, 1,5 экв.) и триэтиламин (0,6 мл, 4,36 ммоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и затем экстрагировали водой и соленой водой. Органический слой сушили с использованием безводного сульфата натрия, и затем смесь использовали на следующей стадии без дополнительной очистки.
К соединению, полученному в результате реакции, добавляли N-бензилпропан-1-амин (649 мг, 4,36 ммоль, 2,0 экв.), триацетоксиборгидрид натрия (1,39 г, 6,54 ммоль, 3,0 экв.) и ацетат (4 капли), и затем смесь перемешивали при комнатной температуре в течение 12 часов. В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия (50 мл) для доведения рН до примерно 8, и затем ее экстрагировали дихлорметаном (30 мл × 3). Органический слой сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток первично очищали, пропуская через силикагелевую колонку (растворитель: дихлорметан / метанол = 20/1), с получением Смеси 6 (400 мг). Первично очищенную смесь вторично очищали разделительной высокоэффективной жидкостной хроматографией с получением указанного в заголовке соединения в виде желтого твердого вещества (104 мг, 13,1%).
1H ЯМР (400 МГц, CD3OD): δ 8.40 (s, 1H), 8.15-8.11 (m, 1H), 8.08-8.01 (m, 1H), 7.56-7.53 (m, 2Н), 7.41 (s, 3Н), 7.34 (t, J=6,4 Гц, 1H), 4.58-4.51 (m, 1Н), 4.38-4.31 (m, 1H), 3.72-3.68 (m, 1Н), 3.25-3.18 (m, 1H), 3.15-2.83 (m, 3Н), 2.80-2.70 (m, 2Н), 2.50-2.42 (m, 1H), 2.20-2.08 (m, 1H), 1.75-1.60 (m, 1H), 1.60-1.57 (m, 1H), 0.90-0.81 (m, 3Н). МС: Вычислено: 362,2; МС: Найдено: 363,3 ([М+Н]+).
Пример синтеза 5. Получение 5-(бензилэтиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 20)
Руководствуясь способом получения Соединения 21, указанное в заголовке соединение было получено в виде желтого твердого вещества (120 мг, 15,8%).
1Н ЯМР (400 МГц, CD3OD): δ 9.55-9.40 (m, 1H), 8.42 (d, J=4,0 Гц, 1H), 8.40-8.30 (br, 1Н), 7.92 (t, J=8,0 Гц, 1Н), 7.60-7.45 (m, 4Н), 7.23 (t, J=6,8 Гц, 1Н), 4.68 (t, J=13,6 Гц, 1H), 4.50-4.44 (m, 1H), 3.90-3.86 (m, 1H), 3.47-3.37 (m, 2Н), 3.20-3.02 (m, 2Н), 2.95-2.90 (m, 2H), 2.60-2.50 (m, 1H), 2.35-2.25 (m, 1H), 1.47-1.37 (m, 3H). MC: Вычислено: 347,5; MC: Найдено: 349,2 ([M+H]+).
Пример синтеза 6. Получение 5-(бензилбутиламино)-2-пиризин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 22)
Руководствуясь способом получения Соединения 21, указанное в заголовке соединение было получено в виде желтого твердого вещества (100 мг, 12,1%).
1Н ЯМР (400 МГц, CD3OD): δ 9.55-9.40 (m, 1H), 8.42 (d, J=4,0 Гц, 1H), 8.40-8.30 (br, 1H), 7.92 (t, J=8,0 Гц, 1H), 7.60-7.45 (m, 5Н), 7.23 (t, J=6,8 Гц, 1H), 4.61-4.50 (m, 1H), 4.40-4.35 (m, 1H), 3.66-3.50 (m, 2Н), 3.30-3.15 (m, 2Н), 3.10-2.90 (m, 1H), 2.80-2.55 (m, 4Н), 2.45-2.30 (m, 1Н), 2.15-1.80 (m, 1H), 1.75-1.60 (m, 1Н), 1.60-1.40 (m, 1H), 1.35-1.22 (m, 3Н). МС: Вычислено: 376,2; МС: Найдено: 377,2 ([М+Н]+).
Пример синтеза 7. Получение 5-[(2-метоксибензил)-метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 26)
3-Гидрокси-2-пиридин-2-ил-2,4,6,7-тетрагидроиндазол-5-он (500 мг, 2,18 ммоль, 1,0 экв.) растворяли в 30 мл дихлорметана и затем добавляли 1-(2-метоксифенил)-N-метилметанамин (658 мг, 4,36 ммоль, 2,0 экв.), триацетоксиборгидрид натрия (1,39 г, 6,54 ммоль, 3,0 экв.) и 4 капли ацетата. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов. В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия (50 мл), и затем ее экстрагировали дихлорметаном (50 мл × 2). После промывки органического слоя соленой водой его сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали разделительной высокоэффективной жидкостной хроматографией с получением указанного в заголовке соединения в виде желтого твердого вещества (200 мг, 34,0%). Соединения 39-60, 64-68, 72-76, 78-81, 121-125, 146-153 и 157-159 были получены вышеуказанным способом.
1Н ЯМР (400 МГц, CD3OD): δ 8.56 (d, J=5,2 Гц, 1H), 8.30-8.22 (m, 2Н), 7.59-7.52 (m, 3Н), 7.19 (d, J=8,4 Гц, 1Н), 7.10 (t, J=7,6 Гц, 1Н), 4.78 (dd, J1=12,8 Гц, J2=19.2 Гц, 1H), 4.20 (dd, J1=12,8 Гц, J2=27,6 Гц, 1Н), 4.00 (s, 3H), 3.90-3.85 (m, 1H), 3.15-3.08 (m, 2H), 3.00-2.85 (m, 5H), 2.60-2.50 (m, 1H), 2.40-2.10 (m, 1H). MC: Вычислено: 364,2; MC: Найдено: 365,3 ([M+H]+).
Пример синтеза 8. Получение 5-(бензилметиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 1)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (200 мг, 27,4%)
1H ЯМР (400 МГц, DMSO-d6): δ 10.8-10.50 (br, 1Н), 8.45-8.38 (m, 2H), 7.88 (t, J=11,2 Гц, 1H), 7.40-7.15 (m, 6H), 3.63 (q, J1=18,4 Гц, J2=34,4 Гц, 2H), 2.80-2.70 (m, 1H), 2.65-2.55 (m, 1H), 2.52-2.50 (m, 1H), 2.48-2.30 (m, 1H), 2.31-2.25 (m, 1H), 2.16 (s, 3H), 2.05-1.85 (m, 1H), 1.71-1.65 (m, 1H). МС: Вычислено: 334,2; МС: Найдено: 335,2 ([M+H]+).
Пример синтеза 9. Получение 5-(бензилциклопропиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 2)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде желтого твердого вещества (94 мг, 11,9%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.39 (s, 1H), 8.42-8.37 (m, 2Н), 7.92-7.85 (m, 1H), 7.31-7.15 (m, 6Н), 3.82 (s, 2Н), 2.80-2.70 (m, 1H), 2.60-2.52 (m, 1H), 2.50-2.35 (m, 2Н), 2.13-2.00 (m, 2Н), 1.77-1.72 (m, 1H), 0.48-0.43 (m, 2Н), 0.30-0.26 (m, 2Н). МС: Вычислено: 360,2; МС: Найдено: 361,0 ([М+Н]+).
Пример синтеза 10. Получение 4-{[(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрила (Соединение 3)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде желтого твердого вещества (103 мг, 16,4%).
1Н ЯМР (400 МГц, DMSO-d6): δ 8.40 (s, 1H), 7.96-7.60 (m, 4Н), 7.60-7.55 (m, 2Н), 7.22-7.18 (m, 0.5Н), 6.95-6.90 (m, 0.5Н), 3.80-3.62 (m, 2H), 2.90-2.75 (m, 1H), 2.75-2.60 (m, 2H), 2.50-2.22 (m, 2H), 2.21-2.04 (m, 3H), 2.05-1.92 (m, 1H), 1.75-1.62 (m, 1H). MC: Вычислено: 359,4; МС: Найдено: 360,2 ([M+H]+).
Пример синтеза 11. Получение 5-[(4-фторбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 4)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (189 мг, 30.8%).
1Н ЯМР (400 МГц, DMSO-d6): δ 8.40-8.33 (m, 2Н), 7.90-7.83 (m, 1H), 7.40-7.30 (m, 2Н), 7.22-7.10 (m, 3Н), 3.58 (q, J1=13,6 Гц, J2=30,0 Гц, 2Н), 2.75-2.60 (m, 2Н), 2.50-2.22 (m, 1H), 2.21-2.04 (m, 1Н), 2.15 (s, 3Н), 2.03-1.96 (m, 1H), 1.68-1.52 (m, 1H). МС: Вычислено: 352,2; МС: Найдено: 353,1 ([М+Н]+).
Пример синтеза 12. Получение 5-[(2,4-дифторбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 5)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (150 мг, 23,3%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.60-11.45 (br, 1H), 8.50-8.36 (m, 2H), 7.96-7.92 (m, 1H), 7.46 (q, J1=11,2 Гц, J2=20,4 Гц, 2H), 7.22-7.16 (m, 2H), 7.10-7.05 (m, 1H), 3.63 (q, J1=9,6 Гц, J2=28,0 Гц, 2H), 2.75-2.60 (m, 2H), 2.60-2.50 (m, 1H), 2.50-2.42 (m, 1H), 2.42-2.20 (m, 1H), 2.20 (s, 3H), 2.03-1.96 (m, 1H), 1.72-1.68 (m, 1H). MC: Вычислено: 370,2; MC: Найдено: 371,1 ([M+H]+)
Пример синтеза 13. Получение 5-[(2-хлорбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 6)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (270 мг, 42,0%).
1H ЯМР (400 МГц, DMSO-d6): δ 11.60-11.45 (br, 1Н), 8.50-8.38 (m, 2H), 7.92-7.90 (m, 1H), 7.53 (d, J=7,2 Гц, 1H), 7.42 (d, J=7,6 Гц, 1H), 7.40-7.35 (m, 1H), 7.35-7.30 (m, 1H), 7.20-7.17 (m, 1H), 3.76-3.68 (m, 2H), 2.85-2.70 (m, 2H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.42-2.20 (m, 2H), 2.20 (s, 3H), 2.03-1.96 (m, 1H), 1.72-1.68 (m, 1H). MC: Вычислено: 368,9; MC: Найдено: 369,1 ([M+H]+)
Пример синтеза 14. Получение 5-[(3-хлорбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 7)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (150 мг, 23,4%).
1H ЯМР (400 МГц, DMSO-d6): δ 11.50-11.42 (br, 1Н), 8.50-8.38 (m, 2H), 7.90-7.80 (m, 1H), 7.40-7.23 (m, 4H), 7.30-7.23 (m, 1H), 3.65 (q, J1=14,0 Гц, J2=32,0 Гц, 2H), 2.85-2.70 (m, 1H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.42-2.20 (m, 1H), 2.20 (s, 3H), 2.03-1.96 (m, 1H), 1.68-1.60 (m, 1H). MC: Вычислено: 368,1; MC: Найдено: 369,1 ([M+H]+)
Пример синтеза 15. Получение 5-[метил-(4-трифторметилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 8)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (304 мг, 43,5%).
1H ЯМР (400 МГц, DMSO-d6): δ11.43 (s, 1H), 8.44-8.38 (m, 2Н), 7.92-7.90 (m, 1Н) 7.67 (d, J=8,0 Гц, 2H), 7.58 (d, J=8,0 Гц, 2H), 7.17 (t, J=5,6 Гц, 1H), 3.70 (q, J1=14,4 Гц, J2=31,2 Гц, 2H), 2.85-2.70 (m, 1H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.42-2.30 (m, 1H), 2.30-2.20 (m, 1H), 2.20 (s, 3H), 2.03-1.96 (m, 1H), 1.72-1.68 (m, 1H). MC: Вычислено: 402,4; MC: Найдено: 403,1 ([M+H]+)
Пример синтеза 16. Получение 5-[метил-(3-метилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 9)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (103 мг, 17,0%).
1H ЯМР (400 МГц, DMSO-d6): δ 11.43 (s, 1H), 8.44-8.38 (m, 2Н), 7.92-7.90 (m, 1H), 7.21-7.04 (m, 4Н), 7.04-7.02 (m, 1H), 3.60-3.48 (m, 2Н), 2.80-2.72 (m, 1H), 2.70-2.66 (m, 1H), 2.48-2.40 (m, 1H), 2.29 (s, 3Н), 2.20-2.16 (m, 1H), 2.19 (s, 3H), 2.03-1.96 (m, 2H), 1.70-1.62 (m, 1H). МС: Вычислено: 348,4; МС: Найдено: 349,2 ([M+H]+)
Пример синтеза 17. Получение 5-[метил-(3-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 10)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (292 мг, 57,5%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.43 (s, 1Н), 8.44-8.38 (m, 2H), 7.92-7.90 (m, 1H), 7.71-7.52 (m, 4H), 7.19-7.16 (m, 1H), 3.70 (q, J1=12,0 Гц, J2=30,4 Гц, 2H), 2.85-2.70 (m, 1H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.45-2.20 (m, 2H), 2.20 (s, 3H), 2.03-1.96 (m, 1H), 1.73-1.68 (m, 1H). МС: Вычислено: 402,4; МС: Найдено: 403,2 ([M+H]+)
Пример синтеза 18. Получение 5-[метил-(2-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол (Соединение 11)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (117 мг, 16,7%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.52-11.47 (br, 1Н), 8.50-8.38 (m, 2H), 7.89-7.83 (m, 2H), 7.70-7.65 (m, 2H), 7.45 (t, J=7,6 Гц, 1H), 7.18 (br, 1H), 3.80 (q, J1=10,0 Гц, J2=25,0 Гц, 2H), 2.86-2.70 (m, 1H), 2.65-2.55 (m, 1H), 2.53-2.50 (m, 1H), 2.42-2.31 (m, 1H), 2.29-2.20 (m, 1H), 2.20 (s, 3H), 2.05-1.96 (m, 1H), 1.72-1.68 (m, 1H). МС: Вычислено: 402,4; МС: Найдено: 403,1 ([M+H]+)
Пример синтеза 19. Получение 5-[(4-метансульфонилбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 12)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (100 мг, 11,1%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.45 (s, 1H), 8.44-8.38 (m, 2Н), 7.89 (d, J=8,0 Гц, 3Н), 7.60 (d, J=8,0 Гц, 2Н), 7.19-7.16 (m, 1H), 3.72 (q, J1=14,8 Гц, J2=31,2 Гц, 2Н), 3.19 (s, 3Н), 2.84-2.80 (m, 1H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.42-2.32 (m, 1H), 2.28-2.20 (m, 1H), 2.20 (s, 3H), 2.05-1.98 (m, 1H), 1.72-1.68 (m, 1H). МС: Вычислено: 412,1; МС: Найдено: 413,1 ([M+H]+)
Пример синтеза 20. Получение 5-[(3-метансульфонилбензил)метиламино]-2-1-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 23)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (50 мг, 5,5%).
1Н ЯМР (400 МГц, DMSO-d6): δ 8.51-8.30 (m, 2Н), 7.95-7.85 (m, 2Н), 7.81 (d, J=8,0 Гц, 1H), 7.70 (d, J=8,0 Гц, 1H), 7.60 (t, J=8,0 Гц, 1H), 7.25-7.15 (m, 1H), 3.76 (dd, J1=14,0 Гц, J2=31,6 Гц, 2Н), 3.21 (s, 3Н), 2.90-2.80 (m, 1Н), 2.70-2.60 (m, 1H), 2.60-2.50 (m, 1H), 2.50-2.40 (m, 1H), 2.30-2.15 (m, 4H), 2.10-2.00 (m, 1H), 1.70-1.60 (m, 1H). MC: Вычислено: 412,5; MC: Найдено: 413,1 ([M+H]+).
Пример синтеза 21. Получение 5-[метил-(4-метилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 24)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде ярко-желтого твердого вещества (50 мг, 5,5%).
1Н ЯМР (400 МГц, CD3OD): δ 8.51-8.50 (m, 1H), 8.35-8.20 (m, 2Н), 7.65-7.47 (m, 3Н), 7.34 (d, J=8,0 Гц, 2Н), 4.63 (t, J=13,2 Гц, 1Н), 4.34 (t, J=13,6 Гц, 1Н), 3.90-3.70 (m, 1Н), 3.20-3.00 (m, 2Н), 3.00-2.75 (m, 5Н), 2.65-2.52 (m, 1H), 2.41 (s, 3Н), 2.25-2.10 (m, 1H). МС: Вычислено: 348,2; МС: Найдено: 349,2 ([М+Н]+).
Пример синтеза 22. Получение 5-[(3-метоксибензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол (Соединение 13)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (105 мг, 13,2%).
1Н ЯМР (400 МГц, CDCl3) 5 8.24 (br, 1H), 7.82 (m, 2Н), 7.26-7.22 (m, 1H), 7.14-7.02 (m, 1H), 7.00-6.90 (m, 2Н), 6.80-6.75 (m, 1H), 3.85-3.80 (m, 3Н), 3.65 (s, 2Н), 2.95-2.78 (m, 2Н), 2.65-2.52 (m, 2Н), 2.50-2.40 (m, 1H), 2.32-2.28 (m, 3Н), 2.27-2.16 (m, 1H), 1.72-1.58 (m, 1H). МС: Вычислено: 364,2; МС: Найдено: 365,1 ([М+Н]+)
Пример синтеза 23. Получение 5-пиперидин-1-ил-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 14)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (70 мг, 10,7%).
1Н ЯМР (400 МГц, DMSO-d6): δ 9.74 (br, 1H), 8.42 (d, J=4,4 Гц, 1H), 8.35 (d, J=8,0 Гц, 1Н),7.92 (t, J=8,4 Гц, 1H), 7.23 (t, J=6,8 Гц, 1H), 3.60-3.40 (m, 3Н), 3.12-3.02 (m, 2H), 2.75-2.60 (m, 3Н), 2.55-2.48 (m, 1H), 2.30-2.27 (m, 1H), 1.90-1.70 (m, 6H), 1.50-1.42 (m, 1H). MC: Вычислено: 298,2; MC: Найдено: 299,2 ([M+H]+)
Пример синтеза 24. Получение 5-морфолин-4-ил-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 15)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (80 мг, 11,3%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.65-11. 47 (br, 1H), 8.39-8.33 (m, 2Н), 7.89 (t, J=7,2 Гц, 1H), 7.18 (t, J=5,6 Гц, 1H), 3.59-3.53 (m, 4H), 2.60-2.55 (m, 2H), 2.55-2.45 (m, 4H), 2.45-2.40 (m, 1H), 2.20-2.05 (m, 1H), 2.01-1.98 (m, 1H), 1.62-1.50 (m, 1H). МС: Вычислено: 300,4; МС: Найдено: 301,2 ([M+H]+)
Пример синтеза 25. Получение 5-(4-метилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 16)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде серого твердого вещества (195 мг, 28,5%).
1Н ЯМР (400 МГц, DMSO-d6): δ 8.42 (d, J=4,4 Гц, 1H), 8.35 (d, J=8,4 Гц, 1H), 7.91 (t, J=7,6 Гц, 1H), 7.22 (t, J=5,6 Гц, 1H), 3.70-3.20 (br, 9H), 2.88 (s, 3Н), 2.74-2.51 (m, 3Н), 2.42-2.37 (m, 1H), 2.26-2.23 (m, 1H), 1.82-1.72 (m, 1H). МС: Вычислено: 313,4; МС: Найдено: 314,2 ([М+Н]+)
Пример синтеза 26. Получение 5-(3,4-дигидро-1Н-изохинолин-2-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 18)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (120 мг, 16,0%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.47 (s, 1H), 8.44-8.38 (m, 2Н), 7.91-7.88 (m, 1H), 7.19-7.16 (m, 1H), 7.10-7.04 (m, 4Н), 3.76 (s, 2Н), 2.91-2.50 (m, 7Н), 2.50-2.40 (m, 1H), 2.40-2.25 (m, 1H), 2.20-2.02 (m, 1H), 1.78-1.70 (m, 1H). МС: Вычислено: 346,2; МС: Найдено: 347,2 ([M+H]+)
Пример синтеза 27. Получение 3-{[(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрилгидрохлорида (Соединение 25)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде желтого твердого вещества (104 мг, 13,3%).
1Н ЯМР (400 МГц, CD3OD): δ 8.5 (d, J=6,0 Гц, 1H), 8.40-8.32 (m, 1H), 8.21 (d, J=8,4 Гц, 1H), 8.16-8.10 (m, 1H), 8.08-8.00 (m, 1H), 7.90 (d, J=8,0 Гц, 1H), 7.72 (t, J=8,0 Гц, 1Н), 7.66-7.56 (m, 1H), 4.80-4.75 (m, 1H), 4.62-4.45 (m, 1H), 4.00-3.80 (m, 1H), 3.25-3.00 (m, 2Н), 3.00-2.80 (m, 5Н), 2.70-2.60 (m, 1Н), 2.30-2.15 (m, 1H). МС: Вычислено: 359,1, МС: Найдено: 360,1 ([М+Н]+).
Пример синтеза 28. Получение 5-[(4-хлорбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 19)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде коричневого твердого вещества (144 мг, 22,5%).
1Н ЯМР (400 МГц, DMSO-d6): δ 11.42 (s, 1H), 8.44-8.38 (m, 2H), 7.87 (m, 1H), 7.39-7.33 (m, 4H), 7.19-7.16 (m, 1H), 3.72 (q, J1=13,6 Гц, J2=30,4 Гц, 2H), 2.83-2.80 (m, 1H), 2.65-2.55 (m, 1H), 2.55-2.50 (m, 1H), 2.42-2.32 (m, 1H), 2.28-2.20 (m, 1H), 2.16 (s, 3H), 2.05-1.98 (m, 1H), 1.72-1.68 (m, 1H). MC: Вычислено: 368,1; MC: Найдено: 369,1 ([M+H]+)
Пример синтеза 29. Получение 5-[(3-фторбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 27)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде желтого твердого вещества (95 мг, 12,3%).
1Н ЯМР (400 МГц, CD3OD): δ 8.44 (d, J=5,6 Гц, 1H), 8.25-8.15 (m, 1H), 8.15-8.10 (m, 1Н), 7.50-7.45 (m, 2Н), 7.39 (d, J=8,4 Гц, 2Н), 7.25-7.10 (m, 1H), 4.65-4.55 (m, 1H), 4.40-4.28 (m, 1Н), 3.80-3.65 (m, 1H), 3.10-2.90 (m, 2Н), 2.85-2.65 (m, 5Н), 2.50-2.40 (m, 1H), 2.15-2.00 (m, 1H). МС: Вычислено: 352,2; МС: Найдено: 353,1 ([М+Н]+).
Пример синтеза 30. Получение 5-[(4-метоксибензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 28)
Руководствуясь способом получения Соединения 26, of указанное в заголовке соединение было получено в виде желтого масла (80 мг, 10,7%).
1Н ЯМР (400 МГц, CD3OD): δ 8.44 (d, J=5,2 Гц, 1H), 8.30-8.20 (m, 1H), 8.15-8.05 (m, 1H), 7.55-7.40 (m, 3Н), 6.94 (d, J=8,4 Гц, 2Н), 4.50 (t, J=12,8 Гц, 1H), 4.22 (t, J=14,0 Гц, 1H), 3.76-3.64 (m, 4Н), 3.10-2.93 (m, 2Н), 2.92-2.70 (m, 5Н), 2.50-2.42 (m, 1H), 2.10-2.00 (m, 1Н). МС: Вычислено: 364,2; МС: Найдено: 365,2 ([М+Н]+).
Пример синтеза 31. Получение 5-[метил-(2-метилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 29)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (300 мг, 39,5%).
1Н ЯМР (400 МГц, CD3OD): δ 8.43 (d, J=5,2 Гц, 1H), 8.20-8.10 (m, 2Н), 7.50-7.37 (m, 2Н), 7.35-7.20 (m, 3Н), 4.68 (dd, J1=13,6 Гц, J2=23,6 Гц, 1H), 4.21 (dd, J1=13,2 Гц, J2=32,8 Гц, 1H), 3.90-3.73 (m, 1H), 3.10-2.85 (m, 2Н), 2.84-2.65 (m, 5Н), 2.51-2.45 (m, 1H), 2.43 (s, 3Н), 2.30-2.00 (m, 1Н). МС: Вычислено: 348,2; МС: Найдено: 349,2 ([М+Н]+).
Пример синтеза 32. Получение 5-[(2,4-дихлорбензил)метиламино]-2-1 шридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 30)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде белого твердого вещества (127 мг, 13,3%).
1Н ЯМР (400 МГц, CD3OD): δ 8.42 (d, J=5,2 Гц, 1H), 8.20-8.07 (m, 2Н), 7.71 (d, J=8,0 Гц, 1H), 7.61 (d, J=2,0 Гц, 1H), 7.49-7.35 (m, 2Н), 4.78-4.68 (m, 1H), 4.50-4.30 (m, 1Н), 3.90-3.70 (m, 1H), 3.10-2.90 (m, 2Н), 2.90-2.65 (m, 5Н), 2.55-2.45 (m, 1H), 2.30-2.05 (m, 1H). МС: Вычислено: 402,1; МС: Найдено: 403,1 ([М+Н]+).
Пример синтеза 33. Получение 5-[(3,4-дихлорбензил)метиламино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола гидрохлорида (Соединение 31)
Руководствуясь способом получения Соединения 26, указанное в заголовке соединение было получено в виде желтого твердого вещества (144 мг, 16,4%).
1Н ЯМР (400 МГц, CD3OD): δ 8.54 (d, J=5,2 Гц, 1H), 8.30-8.20 (m, 2Н), 7.93 (d, J=1,6 Гц, 1H), 7.75-7.60 (m, 2Н), 7.58-7.50 (m, 1H), 4.75-4.60 (m, 1H), 4.50-4.35 (m, 1H), 3.95-3.76 (m, 1Н), 3.20-3.00 (m, 2Н), 3.00-2.77 (m, 5Н), 2.62-2.55 (m, 1H), 2.23-2.15 (m, 1H). МС: Вычислено: 402,1; МС: Найдено: 403,1 ([М+Н]+).
Пример синтеза 34. Получение 5-(метил(5,6,7,8-тетрагидрохинолин-8-ил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 33)
1) Получение N-метил-5,6,7,8-тетрагидрохинолин-8-амина
6,7-Дигидрохинолин-8(5Н)-он (2,0 г, 13,59 ммоль) растворяли в 40 мл дихлорэтана и затем добавляли метиламин (3,39 мл, 27,18 ммоль, 2,0 экв.) и 7 капель ацетата. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли триацетоксиборгидрид натрия (5,7 г, 27,18 ммоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и затем добавляли 10%-ный водный раствор хлорида аммония для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (60 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,98 г, 90,0%).
1Н ЯМР (600 МГц, CDCl3): δ 8.33 (d, J=4,1 Гц, 1H), 7.25-7.32 (m, 1H), 7.01 (q, J=4,1 Гц, 1H), 3.66 (m, 1H), 2.73-2.78 (m, 1H), 2.66-2.70 (m, 1H), 2.49 (s, 3Н), 2.07-2.11 (гл, 1Н), 1.91-1.96 (m, 1Н), 1.66-1.76 (m, 2Н).
2) Получение 5-(метил(5,6,7,8-тетрагидрохинолин-8-ил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола
3-Гидрокси-2-(пиридин-2-ил)-2,4,6,7-тетрагидро-5Н-индазол-5-он (0,03 г, 0,13 ммоль) растворяли в 8 мл дихлорэтана и затем добавляли N-метил-3,6,7,8-тетрагидрохинолин-8-амин (0,02 г, 0,13 ммоль, 1,0 экв.) и 2 капли ацетата. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли цианоборгидрид натрия (0,01 г, 0,16 ммоль, 1,2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, и затем 10%-ный водный раствор хлорида аммония добавляли для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (дихлорметан / метанол = 5/1+0,1% триэтиламина) с получением указанного в заголовке соединения в виде коричневого твердого вещества (0,05 г, 11,0%).
1Н ЯМР (600 МГц, CDCl3): δ 8.50-8.44 (m, 1H), 8.23-8.17 (m, 1H), 7.90-7.70 (m, 2Н), 7.33 (d, J=7,4 Гц, 1H), 7.10-6.97 (m, 2Н), 4.20-4.12 (m, 1Н), 3.15-2.95 (m, 1H), 2.85-2.77 (m, 3Н), 2.71-2.65 (m, 1H), 2.60-2.42 (m, 2H), 2.29 (s, 3Н), 2.27-2.20 (m, 1H), 2.05-1.95 (m, 2H), 1.83-1.67 (m, 3Н). MC: Вычислено: 375,2; MC: Найдено: 376,1 ([M+H]+).
Пример синтеза 35. Получение циклопропил(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)метанона (Соединение 38)
3-Гидрокси-2-(пиридин-2-ил)-2,4,6,7-тетрагидро-5Н-индазол-5-он (2,5 г, 10,9 ммоль) растворяли в 100 мл смеси дихлорметан / дихлорэтан (1/1) и затем добавляли циклопропил(пиперазин-1-ил)метанона гидрохлорид (3,1 г, 16,4 ммоль, 1,5 экв.), диизопропилэтиламин (2,8 мл, 16,4 ммоль, 1,5 экв.), ацетат (1,0 мл, 16,4 ммоль, 1,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем добавляли триацетоксиборгидрид натрия (4,6 г, 21,8 ммоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, и затем 2 М водный раствор гидроксида натрия добавляли для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток первично очищали колоночной хроматографией на силикагеле (дихлорметан / метанол = 5/1) и затем подвергали перекристаллизации из диэтилового эфира с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (2,8 г, 70,0%).
1Н ЯМР (600 МГц, CDCl3): δ 8.23 (d, J=5,5 Гц, 1H), 7.82 (t, J=3,4 Гц, 2Н), 7.10 (q, J=4,1 Гц, 1H), 3.74-3.61 (m, 4H), 2.91-2.81 (m, 1H), 2.81-2.52 (m, 8H), 2.44-2.35 (m, 1H), 2.15-2.07 (m, 1H), 1.76-1.70 (m, 1H), 1.04-0.95 (m, 2H), 0.79-0.70 (m, 2H). MC: Вычислено: 367,2; МС: Найдено: 368,1 ([M+H]+).
Пример синтеза 36. Получение 5-((4-(диметиламино)бензил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 70)
3-Гидрокси-2-(пиридин-2-ил)-2,4,6,7-тетрагидро-5Н-индазол-5-он (0,70 г, 3,04 ммоль) растворяли в 40 мл смеси дихлорметан / дихлорэтан (1/1) и затем добавляли N,N-диметил-4-((метиламино)метил)анилин (0,50 г, 3,04 ммоль, 1,0 экв.) и ацетат (0,19 мл, 3,04 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли триацетоксиборгидрид натрия (0,64 г, 3,04 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, и затем добавляли 2 М водный раствор гидроксида натрия для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан / метанол = 5/1) с получением указанного в заголовке соединения в виде черного твердого вещества (0,094 г, 8,0%).
1Н ЯМР (600 МГц, CD3OD): δ 8.42-8.34 (m, 1H), 8.25 (d, J=8,8 Гц, 1H), 7.90-7.79 (m, 1Н), 7.27 (d, J=9,0 Гц, 2Н), 7.18 (dd, J=8.0, 5,4 Гц, 1H), 6.77 (d, J=9,1 Гц, 2Н), 4.11 (dd, J=23.9, 13,5 Гц, 2Н), 3.55-3.37 (m, 1Н), 2.93 (s, 6Н), 2.87-2.72 (m, 2Н), 2.63 (s, 3Н), 2.58-2.47 (m, 2Н), 2.34-2.25 (m, 1H), 2.02-1.92 (m, 1Н). МС: Вычислено: 377,2; МС: Найдено: 378,3 ([М+Н]+).
Пример синтеза 37. Получение 2-пиридин-2-ил-5-пирролидин-1-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 96)
3-Гидрокси-2-(пиридин-2-ил)-2,4,6,7-тетрагидро-5Н-индазол-5-он (0,30 г, 1,30 ммоль) растворяли в 10 мл дихлорметана и затем добавляли пирролидин (0,32 мл, 3,91 ммоль, 3,0 экв.) и ацетат (0,16 мл, 2,61 ммоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и затем добавляли триацетоксиборгидрид натрия (0,35 г, 1,65 ммоль, 1,3 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, и затем добавляли 10%-ный водный раствор гидрокарбоната натрия для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан / метанол = 5/1) с получением указанного в заголовке соединения в виде коричневого геля (0,085 г, 23,0%). Способом, указанным выше, были получены Соединения 17, 160 и 161.
1Н ЯМР (600 МГц, CDCl3): δ 10.45 (brs, 1H), 8.23 (s, 1H), 7.98-7.75 (m, 2H), 7.21-7.05 (m, 1H), 3.51-3.20 (m, 5H), 3.00-2.80 (m, 2H), 2.77-2.59 (m, 2H), 2.45-2.30 (m, 1H), 2.15-2.00 (m, 5H). MC: Вычислено: 284,2; MC: Найдено: 285,4 ([M+H]+).
Пример синтеза 38. Получение 5-(4-метоксибензиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 88)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде темно-серого твердого вещества (0,30 г, 39,3%).
1Н ЯМР (600 МГц, CDCl3): δ 8.23 (d, J=4,8 Гц, 1H), 7.93-7.85 (m, 1H), 7.83-7.77 (m, 1H), 7.36 (d, J=8,6 Гц, 2H), 7.09 (dd, J=7.5, 5,3 Гц, 1H), 6.86 (d, J=8,7 Гц, 2H), 3.93 (dd, J=50.4, 13,1 Гц, 2H), 3.06 (ddd, J=12.3, 5.1, 2,6 Гц, 1Н), 2.90 (dd, J=14.7, 5,0 Гц, 1H), 2.78 (ddd, J=16.7, 4.9, 3,9 Гц, 1H), 2.58 (ddd, J=16.8, 11.1, 5,7 Гц, 1H), 2.50 (dd, J=14.6, 9.6 Гц, 1H), 2.26-2.14 (m, 1H), 1.91-1.81 (m, 1H). MC: Вычислено: 350,2; MC: Найдено: 351,3 ([M+H]+).
Пример синтеза 39. Получение 5-фенетиламино-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 93)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде темно-серого твердого вещества (0,30 г, 39,3%).
1H ЯМР (600 МГц, DMSO-d6): δ 8.44-8.23 (m, 2Н), 7.85 (t, J=7,1 Гц, 1H), 7.27-7.23 (m, 2H), 7.21-7.18 (m, 2H), 7.15-7.12 (m, 2H), 2.90-2.75 (m, 3Н), 2.72-2.65 (m, 2H), 2.60-2.50 (m, 1H), 2.48-2.35 (m, 2H), 1.95-1.89 (m, 2H), 1.56-1.44 (m, 1H). MC: Вычислено: 334,2; MC: Найдено: 335,3 ([M+H]+).
Пример синтеза 40. Получение 5-фениламино-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 92)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,21 г, 53,2%).
1Н ЯМР (600 МГц, CDCl3OD): δ 8.27-8.21 (m, 1H), 7.87-7.79 (m, 2H), 7.20-7.13 (m, 2H), 7.13-7.03 (m, 1H), 6.74-6.66 (m, 1H), 6.66-6.58 (m, 2H), 3.90-3.73 (m, 1H), 2.95 (ddd, J=16.0, 9.0, 4,5 Гц, 1H), 2.85-2.69 (m, 2H), 2.45-2.33 (m, 1H), 2.23-2.07 (m, 1H), 1.95-1.79 (m, 1H). MC: Вычислено: 306,2; MC: Найдено: 307,3 ([M+H]+).
Пример синтеза 41. Получение 5-(3,4-дифторфениламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 32)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде темно-серого твердого вещества (0,22 г, 74,2%).
1Н ЯМР (600 МГц, DMSO-d6): δ 11.50 (s, 1H), 8.39 (d, J=8,4 Гц, 1H), 8.36 (d, J=4,0 Гц, 1H), 7.84 (t, J=7,2 Гц, 1H), 7.14 (dd, J=6.9, 5,2 Гц, 1H), 7.06 (q, J=9,7 Гц, 1H), 6.58 (ddd, J=13.7, 6.8, 2,4 Гц, 1Н), 6.37 (d, J=9,1 Гц, 1H), 5.80 (d, J=8,1 Гц, 1H), 3.62-3.50 (m, 1H), 2.64-2.55 (m, 2H), 2.51 (dd, J=15.1, 5,1 Гц, 1H), 2.06-2.00 (m, 1H), 2.00-1.93 (m, 1H), 1.64-1.53 (m, 1H). МС: Вычислено: 342,1; МС: Найдено: 343,2 ([M+H]+).
Пример синтеза 42. Получение 5-(4-этилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 91)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде коричневого геля (0,20 г, 47,0%).
1H ЯМР (600 МГц, CDCl3): δ 8.28-8.00 (m, 1H), 7.95-7.80 (m, 1H), 7.80-7.65 (m, 1H), 7.10-6.95 (m, 1Н), 2.85-2.50 (m, 12Н), 2.35-2.25 (m, 1Н), 2.15-2.05 (m, 1H), 2.05-1.95 (m, 2Н), 1.70-1.55 (m, 1H), 1.50-1.15 (m, 3Н). МС: Вычислено: 327,2; МС: Найдено: 328,4 ([М+Н]+).
Пример синтеза 43. Получение 5-(4-пропилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 100)
3-Гидрокси-2-(пиридин-2-ил)-2,4,6,7-тетрагидро-5Н-индазол-5-он (0,25 г, 1,09 ммоль) растворяли в 14 мл смеси дихлорметан / дихлорэтан (1/1) и затем добавляли 1-пропилпиперазина дигидробромид (0,41 г, 1,42 ммоль, 1,3 экв.) и диизопропилэтиламин (0,50 мл, 2,84 ммоль, 2,6 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли триацетоксиборгидрид натрия (0,30 г, 1,42 ммоль, 1,3 экв.). Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан / метанол = 5/1) с получением указанного в заголовке соединения в виде коричневого твердого вещества (0,11 г, 29,0%). Способом, указанным выше, были также получены Соединения 127 и 128.
1Н ЯМР (600 МГц, CDCl3OD): δ 8.28-8.16 (m, 1Н), 8.00-7.58 (m, 2Н), 7.17-6.97 (m, 1Н), 3.05-2.87 (m, 8Н), 2.85-2.75 (m, 2Н), 2.71 (dd, J=14.5, 4,7 Гц, 1H), 2.68-2.57 (m, 3Н), 2.39 (dd, J=14.3, 10,8 Гц, 1H), 2.21-2.12 (m, 1H), 1.75-1.65 (m, 3Н), 0.93 (t, J=7,4 Гц, 3Н). МС: Вычислено: 341,2; МС: Найдено: 342,4 ([М+Н]+).
Пример синтеза 44. Получение 5-(4-1-цилогексилметилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 106)
Руководствуясь способом получения Соединения 100, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,14 г, 33,1%).
1H ЯМР (600 МГц, CD3OD): δ 8.45-8.20 (m, 2Н), 7.87 (dd, J=12.7, 5,3 Гц, 1H), 7.19 (dd, J=7.1, 5,3 Гц, 1Н), 3.55-3.35 (m, 1Н), 3.09-2.53 (m, 10Н), 2.40-2.25 (m, 1H), 2.25-2.07 (m, 1H), 1.92-1.61 (m, 8Н), 1.37-1.28 (m, 4Н), 1.26-1.19 (m, 1H), 1.10-0.90 (m, 2Н). МС: Вычислено: 395,3; МС: Найдено: 396,3 ([М+Н]+).
Пример синтеза 45. Получение 5-(4-бензилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 105)
Руководствуясь способом получения Соединения 100, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,20 г, 47,1%).
1Н ЯМР (600 МГц, CDCl3): δ 8.22 (d, J=5,1 Гц, 1Н), 7.90-7.70 (m, 2Н), 7.39-7.27 (m, 5Н), 7.11 (dd, J=7.5, 5,4 Гц, 1H), 3.75 (brs, 2Н), 3.31-2.75 (m, ЮН), 2.74-2.61 (m, 2Н), 2.60-2.42 (m, 1H), 2.41-2.24 (m, 1H), 1.89-1.67 (m, 1Н). МС: Вычислено: 389,2; МС: Найдено: 390,3 ([М+Н]+).
Пример синтеза 46. Получение 5-(4-фенетилпиперазин-1-ил)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 104)
Руководствуясь способом получения Соединения 100, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,18 г, 40,9%).
1Н ЯМР (600 МГц, CDCl3): δ 10.24 (brs, 1H), 8.24-8.11 (m, 1H), 8.04-7.81 (m, 1H), 7.81-7.69 (m, 1H), 7.27-7.22 (m, 2Н), 7.18-7.14 (m, 3Н), 7.07-7.02 (m, 1H), 3.70 (ddd, J=6.6, 4.2, 2,5 Гц, 1Н), 2.88-2.64 (m, 12Н), 2.63-2.52 (m, 2Н), 2.36 (dd, J=14.3, 10,7 Гц, 1Н), 2.19-2.10 (m, 1H), 1.84-1.76 (m, 1H), 1.68 (ddd, J=23.9, 12.2, 5,2 Гц, 1H). МС: Вычислено: 403,2; МС: Найдено: 404,3 ([М+Н]+).
Пример синтеза 47. Получение 5-[4-(3-фенилпропил)-пиперазин-1-ил]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол. (Соединение 107)
Руководствуясь способом получения Соединения 100, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,11 г, 24,2%).
1Н ЯМР (600 МГц, CD3OD): δ 8.36 (ddd, J=5.0, 1.9, 0,9 Гц, 1H), 8.27 (d, J=8,4 Гц, 1Н), 7.83 (ddd, J=8.4, 7.4, 1,9 Гц, 1Н), 7.28-7.22 (m, 2Н), 7.21-7.12 (m, 4Н), 3.05-2.78 (m, 8Н), 2.75 (ddd, J=16.1, 5.3, 3,2 Гц, 3Н), 2.67-2.55 (m, 4Н), 2.31-2.23 (m, 1H), 2.13 (ddtdd, J =8.1, 5.4,2.7, 1.3, 0,6 Гц, 1H), 1.96-1.88 (m, 3Н), 1.76-1.66 (m, 1H). МС: Вычислено: 417,3; МС: Найдено: 418,3 ([М+Н]+).
Пример синтеза 48. Получение 5-((2-(диметиламино)бензил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 71)
5-(Метиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол (0,20 г, 0,82 ммоль) растворяли в 15 мл дихлорэтана и затем добавляли 2-(диметиламино)бензальдегид (0,18 г, 1,23 ммоль, 1,5 экв.) и 2 капли ацетата. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли триацетоксиборгидрид натрия (0,35 г, 1,63 ммоль, 2,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов и затем добавляли 2 М водный раствор гидроксида натрия. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол = 5/1) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (0,09 г, 29%). Способом, указанным выше, были также получены Соединения 69 и 77.
1H ЯМР (600 МГц, CD3OD): δ 8.38-8.35 (m, 1H), 8.23 (d, J=8,4 Гц, 1H), 7.86-7.81 (m, 1H), 7.44-7.37 (m, 2Н), 7.34 (d, J=7,4 Гц, 1H), 7.20-7.14 (m, 2Н), 4.31 (s, 2Н), 3.38 (tdd, J=5.2, 4.5, 2,7 Гц, 1H), 2.83 (ddd, J=16.8, 5.3, 2,5 Гц, 1H), 2.80-2.74 (m, 1H), 2.71 (s, 6Н), 2.69-2.64 (m, 1H), 2.65 (s, 3Н) 2.61 (dd, J=13.8, 11,1 Гц, 1H), 2.29 (ddd, J=7.0, 5.2, 2,7 Гц, 1H), 2.02 (qd, J=11.9, 5,5 Гц, 1Н). МС: Вычислено: 377,2; МС: Найдено: 378,3 ([М+Н]+).
Пример синтеза 49. Получение 5-(метилхинолин-6-илметиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 63)
5-Метиламино-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол (0,25 г, 1,02 ммоль) растворяли в 20 мл смеси дихлорметан/дихлорэтан (1/1) и затем добавляли хинолин-6-карбоксальдегид (0,24 г, 1,5 ммоль, 1,5 экв.) и ацетат (0,06 мл, 1,0 ммоль, 1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли триацетоксиборгидрид натрия (0,09 г, 1,5 ммоль, 1,5 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, и затем добавляли 10%-ный водный раствор гидроксида натрия для доведения рН до примерно 8,0. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол = 5/1+0,1% триэтиламина) с получением указанного в заголовке соединения в виде коричневого твердого вещества (0,058 г, 14,7%). Способом, указанным выше, было также получено Соединение 61.
1Н ЯМР (600 МГц, DMSO-d6): δ 11.42 (brs, 1H), 8.81 (dd, J=4.2, 1,8 Гц, 1H), 8.42-8.33 (m, 2H), 8.30 (d, J=7,7 Гц, 1H), 7.94 (d, J=8,6 Гц, 1H), 7.84 (s, 2H), 7.72 (dd, J=8.6, 1,7 Гц, 1H), 7.46 (dt, J=4.1, 3,0 Гц, 1H), 7.10-7.20 (m, 1H), 3.78 (dd, J=43.2, 13,9 Гц, 2H), 2.84 (ddd, J=10.8, 5.0, 2,7 Гц, 1H), 2.72-2.61 (m, 1H), 2.57-2.47 (m, 1H), 2.40 (tddd, J=7.9, 6.7,3.5, 2,1 Гц, 1H), 2.30-2.14 (m, lH), 2.19(s, 3H), 2.09-1.99 (m, 1H), 1.70 (qd, J=12.0, 5,4 Гц, 1H). MC: Вычислено: 385,2; MC: Найдено: 386,2 ([M+H]+).
Пример синтеза 50. Получение 5-(изохинолин-3-илметил-метиламино)-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 62)
Руководствуясь способом получения Соединения 63, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,02 г, 6,1%).
1Н ЯМР (600 МГц, DMSO-d6): δ 11.45 (brs, 1Н), 9.21 (s, 1H), 8.47-8.31 (m, 2H), 8.05 (d, J=8,2 Гц, 1H), 7.92 (d, J=8,2 Гц, 1H), 7.89-7.79 (m, 2H), 7.70 (t, J=7,5 Гц, 1H), 7.58 (t, J=7,4 Гц, 1H), 7.10-7.20 (m, 1H), 3.88 (dd, J=41.3, 14,7 Гц, 2H), 2.93-2.81 (m, 1H), 2.71-2.59 (m, 1H), 2.56-2.36 (m, 2H), 2.27 (s, 3H), 2.25-2.14 (m, 1H), 2.09-1.99 (m, 1H), 1.75-1.64 (m, 1H). MC: Вычислено: 385,2; MC: Найдено: 386,2 ([M+H]+).
Пример синтеза 51. Получение 5-(метил((5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил)метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 37)
5-(Метиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол (0,13 г, 0,55 ммоль) растворяли в 6 мл смеси дихлорметан/дихлорэтан (1/1) и затем добавляли 5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-карбальдегид (0,20 г, 0,82 ммоль, 1,5 экв.) и 3 капли ацетата. Реакционную смесь перемешивали при 45°С в течение 16 часов и затем добавляли цианоборгидрид натрия (0,07 г, 1,09 ммоль, 2,0 экв.). Реакционную смесь перемешивали при 45°С в течение 24 часов и затем добавляли 2 М водный раствор гидроксида натрия. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), и затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (растворитель : дихлорметан/метанол = 5/1) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (0,059 г, 15%). Способом, указанным выше, были также получены Соединения 35 и 36.
1H ЯМР (600 МГц, CD3OD): δ 8.39-8.33 (m, 1H), 8.27 (d, J=8,8 Гц, 1H), 7.88-7.78 (m, 1Н), 7.67 (s, 1H), 7.28 (ddd, J=31.9, 16.9, 6,7 Гц, 2Н), 7.15 (dd, J=8.1, 5,3 Гц, 1H), 6.52-6.40 (m, 1H), 3.94 (dd, J=26.0, 14,0 Гц, 2Н), 3.24-3.01 (m, 4Н), 3.02-2.93 (m, 1H), 2.82-2.56 (m, 7Н), 2.43 (s, 3Н), 2.37 (s, 3Н), 2.41-2.35 (m, 1H), 2.26-2.19 (m, 1H), 1.80 (qd, J=11.9, 5,4 Гц, 1H). МС: Вычислено: 472,2; МС: Найдено: 473,4 ([М+Н]+).
Пример синтеза 52. Получение 5-{метил-[6-(4-метил-пиперазин-1-ил)-пиримидин-4-илметил]-амино}-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 34)
Руководствуясь способом получения Соединения 37, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,03 г, 12,7%).
1Н ЯМР (600 МГц, CD3OD): δ 8.40-8.32 (m, 2Н), 8.27 (d, J=8,4 Гц, 1H), 7.87-7.79 (m, 1H), 7.16 (dd, J=7.2, 5,0 Гц, 1H), 6.87 (s, 1H), 3.76-3.54 (m, 6Н), 2.94-2.87 (m, 1H), 2.80-2.70 (m, 1Н), 2.65-2.53 (m, 2Н), 2.53-2.42 (m, 5Н), 2.35 (s, 3Н), 2.29 (s, 3Н), 2.15-2.08 (m, 1H), 1.81 (dtd, J=22.2, 11.0, 5,4 Гц, 1H). МС: Вычислено: 434,3; МС: Найдено: 435,5([М+Н]+).
Пример синтеза 53. Получение 1-[4-(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-пиперазин-1-ил]-2-бутин-1-она (Соединение 89)
1) Получение трет-бутил-4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-карбоксилата
3-Гидрокси-2-пиридин-2-ил-2,4,6,7-тетрагидроиндазол-5-он (1,55 г, 6,78 ммоль, 1,0 экв.) растворяли в 80 мл смеси дихлорметан/дихлорэтан (1/1) и затем в потоке азота добавляли трет-бутилпиперазин-1-карбоксилат (3,65 г, 16,97 ммоль, 2,5 экв.) и ацетат (0,4 мл, 6,77 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем при 0°С добавляли триацетоксиборгидрид натрия (4,31 г, 20,3 ммоль, 3,0 экв.) и затем перемешивали при комнатной температуре в течение 3 часов. В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия (20 мл) для доведения рН до примерно 7, и затем ее экстрагировали дихлорметаном (30 мл × 3). Органический слой сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали на силикагелевой колонке (растворитель: дихлорметан/метанол = 10/1) с получением указанного в заголовке соединения в виде желтого твердого вещества (1,59 г, 58,8%). Способом, указанным выше, было также получено Соединение 109.
1Н ЯМР (600 МГц, CDCl3) δ 8.23 (dt, J=5.0, 1,2 Гц, 1H), 7.81 (dd, J=11.0, 4,4 Гц, 2Н), 7.09 (dd, J=8.3, 5,1 Гц, 1H), 3.49 (brt, 4Н), 2.88-2.78 (m, 2Н), 2.73-2.61 (m, 6Н), 2.42-2.31 (m, 1Н), 2.15 (dd, J=8.4, 5,1 Гц, 1H), 1.77-1.64 (m, 1H), 1.46 (s, 9H).
2) Получение 5-(пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорида
трет-Бутил-4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-карбоксилат (1,59 г, 3,98 ммоль, 1,0 экв.) растворяли в 30 мл метанола и затем в потоке азота добавляли 10 мл 4,6 н. изопропанольного раствора соляной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 1 суток и концентрировали при пониженном давлении. Остаток подвергали перекристаллизации из этилового спирта и диэтилового эфира с получением указанного в заголовке соединения в виде желтого твердого вещества (1,31 г, 87,8%).
1Н ЯМР (600 МГц, CD3OD) δ 8.51-8.44 (m, 1H), 8.26 (dd, J=8.5, 0,8 Гц, 1H), 8.17-8.11 (m, 1H), 7.47-7.35 (m, 1H), 4.01-3.61 (m, 9Н), 3.08 (dd, J=14.2, 5,1 Гц, 1H), 3.01 (ddd, J=17.4, 5.4, 2,3 Гц, 1H), 2.89 (ddd, J=17.4, 11.6, 5,7 Гц, 1Н), 2.78-2.70 (m, 1H), 2.61-2.53 (m, 1H), 2.13 (qd, J=12.1, 5,5 Гц, 1H).
3) Получение 1-[4-(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-пиперазин-1-ил]-2-бутин-1-она
К 2,5-диоксопирролидин-1-иловому эфиру 2-бутеновой кислоты (0,12 г, 0,65 ммоль) добавляли 5-(пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорид (0,24 г, 0,65 ммоль, 1,0 экв.), растворенный в 5 мл ацетонитрила, и затем N,N-диизопропилэтиламин (0,6 мл, 3,25 ммоль, 5,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 суток, и затем ее экстрагировали водой и соленой водой. Реакционную смесь экстрагировали дихлорметаном (20 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол = 5/1) с получением указанного в заголовке соединения в виде зеленого твердого вещества (0,25 г, 92,6%).
1Н ЯМР (600 МГц, CDCl3): δ 8.22 (d, J=3,3 Гц, 1H), 7.80 (s, 2H), 7.08 (s, 1H), 3.74 (dd, J=10.3, 5,8 Гц, 2H), 3.70-3.58 (m, 2H), 2.89-2.69 (m, 2H), 2.69-2.51 (m, 6H), 2.40-2.27 (m, 1H), 2.07 (d, J=10,4 Гц, 1H), 2.01-1.92 (m, 3H), 1.69 (dt, J=11.4, 7,0 Гц, 1H). MC: Вычислено: 365,2; MC: Найдено: 367,2 ([M+H]+).
Пример синтеза 57a. Получение 1-[4-(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-пиперазин-1-ил]-пропенона (Соединение 97)
5-(Пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорид (0,038 г, 0,10 ммоль) растворяли в 3 мл дихлорметана и затем добавляли триэтиламин (0,04 мл, 0,30 ммоль, 3,0 экв.). Реакционную смесь перемешивали при 0°С в течение 10 минут. Добавляли акрилилхлорид (0,01 мл, 0,10 ммоль, 1,0 экв.) и перемешивали при 0°С в течение 30 минут, и затем водный раствор гидрокарбоната натрия использовали для нейтрализации. Реакционную смесь экстрагировали дихлорметаном (10 мл × 2), затем органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол = 5/1+1% аммиачной воды) с получением указанного в заголовке соединения в виде коричневого твердого вещества (19 мг, 53,7%).
1Н ЯМР (600 МГц, CDCl3): δ 8.23 (s, 1H), 7.82 (s, 2H), 7.10 (s, 1H), 6.64-6.48 (m, 1H), 6.28 (dd, J=16.8, 1,6 Гц, 1H), 5.76-5.59 (m, 1H), 3.85-3.40 (m, 4H), 2.95-2.50 (m, 7H), 2.44-2.28 (m, 1H), 2.09 (s, 1H), 1.84-1.61 (m, 1H), 0.86 (dd, J=17.6, 10,5 Гц, 1H). MC: Вычислено: 353,2; МС: Найдено: 354,3([M+H]+).
Пример синтеза 57b. Реакция синтеза амидных, карбонатных, мочевинных и сульфонамидных производных
5-(Пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорид (0,038 г, 0,10 ммоль) растворяли в смешанном растворе из 5 мл ацетонитрила и 1 мл воды и добавляли насыщенный раствор NaHCO3 (200 мкл). Для синтеза каждого производного один из карбоксилхлорида, хлорформиата, изоцианата и сульфонилхлорида добавляли при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 1 часа, и завершение реакции подтверждали методом ЖХ-МС (жидкостная хроматография/масс-спектрометрия), и затем добавляли 50 мл этилацетата и разбавляли и промывали смешанным насыщенным раствором соленой воды и NaHCO3. Продукт выделяли и очищали методом ТСХ (тонкослойная хроматография) для очистки, и выход находился в диапазоне 10-70%. Кроме того, описаны данные для соединений из Примеров синтеза, полученных согласно общему способу синтеза и способу синтеза с использованием конкретных веществ. Способом, указанным выше, были получены Соединения 110-114.
Пример синтеза 54. Получение 4-диметиламино-1-[4-(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-пиперазин-1-ил]-2-бутен-1-она (Соединение 98)
5-(Пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорид (0,37 г, 1,00 ммоль) растворяли в 15 мл дихлорметана и затем добавляли (Е)-4-(диметиламино)-2-бутеновой кислоты гидрохлорид (0,20 г, 1,20 ммоль, 1,2 экв.), гидроксибензотриазол (0,18 г, 1,30 ммоль, 1,3 экв.) и N,N-диизопропилэтиламин (1,74 мл, 10,0 ммоль, 10,0 экв.). Реакционную смесь перемешивали при 0°С в течение 10 минут, затем добавляли 1,3-диизопропилкарбодиимид (0,19 мл, 1,20 ммоль, 1,2 экв.), и смесь перемешивали при комнатной температуре в течение 8 часов. Для нейтрализации реакционной смеси использовали раствор гидрокарбоната натрия, и затем смесь экстрагировали дихлорметаном (10 мл × 2). Органический слой сушили с использованием безводного сульфата натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан/метанол = 5/1+0,1% аммиачной воды) с получением указанного в заголовке соединения в виде коричневого твердого вещества (0,27 г, 65,8%). Способом, указанным выше, было также получено Соединение 99.
1Н ЯМР (600 МГц, CDCl3): δ 8.25 (d, J=5,0 Гц, 1H), 7.83 (dt, J=14.3, 7,8 Гц, 2H), 7.13-7.07 (m, 1H), 6.84 (dt, J=15.2, 6,3 Гц, 1H), 6.50-6.43 (m, 1H), 3.70 (d, J=0,9 Гц, 2H), 3.52 (s, 2H), 3.30-3.22 (m, 2H), 2.84 (d, J=16,5 Гц, 1H), 2.77-2.69 (m, 1H), 2.69-2.60 (m, 4H), 2.57 (s, 2H), 2.41-2.33 (m, 7H), 2.11-2.04 (m, 1H), 1.70 (qd, J=12.1, 5,3 Гц, 1H). MC: Вычислено:410,2; MC: Найдено: 411,3([M+H]+).
Пример синтеза 55. Получение 5-(4-метилпиперазин-1-ил)-2-(5-(трифторметил)пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 82)
Метил-5-(4-метилпиперазин-1-ил)-2-оксоциклогексан-1-карбоксилат (0,19 г, 0,75 ммоль) растворяли в 15 мл этанола и затем добавляли 5 капель ацетата и 2-гидразинил-5-(трифторметил)пиридин (0,13 г, 0,75 ммоль, 1,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и при 100°С в течение 4 часов и концентрировали при пониженном давлении. Остаток подвергали перекристаллизации из смеси этилацетат/диэтиловый эфир с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (0,092 г, 32%). Способом, указанным выше, были также получены Соединения 115-120, 132, 137-145 и 154-156.
1Н ЯМР (600 МГц, CD3OD): δ 8.69 (s, 1H), 8.57 (d, J=8,5 Гц, 1H), 8.15 (dd, J=8.9, 2,4 Гц, 1H), 3.55-2.86 (m, 8Н), 2.84 (s, 3Н), 2.76 (dd, J=5.1, 3,3 Гц, 1H), 2.70-2.61 (m, 2Н), 2.59-2.51 (m, 1H), 2.31 (dd, J=14.5, 10,1 Гц, 1H), 2.16-2.09 (m, 1H), 1.80 (qd, J=11.2, 5,5 Гц, 1H). МС: Вычислено: 381,2; МС: Найдено: 382,3 ([M+H]+).
Пример синтеза 56. Получение 2-(6-хлор-пиридин-2-ил)-5-(4-метил-пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 83)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде ярко-серого твердого вещества (0,11 г, 59,8%).
1H ЯМР (600 МГц, D2O): δ 7.91 (d, J=8,2 Гц, 1H), 7.80 (t, J=7,9 Гц, 1H), 7.23 (d, J=7,9 Гц, 1Н), 3.82-3.30 (m, 8Н), 2.97-2.87 (m, 1H), 2.93 (s, 3Н), 2.84-2.75 (m, 2Н), 2.74-2.65 (m, 1H), 2.48-2.40 (m, 1H), 2.33 (dd, J=8.4, 3,3 Гц, 1H), 1.93 (qd, J=11.9, 5,6 Гц, 1H). МС: Вычислено: 347,1; МС: Найдено: 348,2 ([М+Н]+).
Пример синтеза 57. Получение 5-(4-метил-пиперазин-1-ил)-2-(6-метил-4-трифторметил-пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 84)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде серого твердого вещества (0,12 г, 73,8%).
1Н ЯМР (600 МГц, CD3OD): δ 8.41 (s, 1Н), 7.73 (s, 1H), 4.16-3.59 (m, 9Н), 3.30 (s, 3Н), 3.33-3.24 (m, 2Н), 3.19 (ddd, J=18.6, 10.1, 3,7 Гц, 1Н), 2.84 (s, 3Н), 2.91-2.77 (m, 1H), 2.74-2.67 (m, 1Н), 2.30 (qd, J=12.0, 5,6 Гц, 1H). МС: Вычислено: 395,2; МС: Найдено: 396,3 ([М+Н]+).
Пример синтеза 58. Получение 5-(4-метил-пиперазин-1-ил)-2-тиено[3,2-с]пиридин-4-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 85)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде серого твердого вещества (0,11 г, 43,0%).
1Н ЯМР (600 МГц, CD3OD): δ 8.22 (d, J=5,6 Гц, 1H), 8.03 (d, J=5,3 Гц, 1Н), 7.90 (d, J=5,6 Гц, 1H), 7.74 (d, J=5,7 Гц, 1Н), 3.22-2.86 (m, 9Н), 2.81 (ddd, J=16.9, 5.0, 3,2 Гц, 1Н), 2.76 (s, 3Н), 2.73-2.62 (m, 2Н), 2.42-2.34 (m, 1H), 2.19-2.12 (m, 1H), 1.79 (qd, J=11.6, 5,4 Гц, 1Н). МС: Вычислено: 369,1; МС: Найдено: 370,2 ([М+Н]+).
Пример синтеза 59. Получение 2-(3-фтор-пиридин-2-ил)-5-(4-метил-пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 86)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,41 г, 86,3%).
1H ЯМР (600 МГц, CD3OD): δ 8.34 (d, J=4,6 Гц, 1H), 7.81-7.76 (m, 1H), 7.51-7.43 (m, 1Н), 3.00-2.69 (m, 9Н), 2.68-2.59 (m, 2Н), 2.52 (s, 3Н), 2.32 (dd, J=14.8, 10,7 Гц, 1H), 2.20-2.13 (m, 1Н), 1.83-1.70 (m, 1H), 0.92-0.79 (m, 1Н). МС: Вычислено: 331,2; МС: Найдено: 332,3 ([М+Н]+).
Пример синтеза 60. Получение 2-пиридин-2-ил-5-(4-пиридин-2-илметил-пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 87)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,064 г, 23,6%).
1H ЯМР (600 МГц, CD3OD): δ 8.47 (d, J=4,4 Гц, 1H), 8.36 (d, J=4,6 Гц, 1Н), 8.26 (d, J=8,4 Гц, 1Н), 7.87-7.77 (m, 2Н), 7.52 (d, J=7,8 Гц, 1Н), 7.31 (dd, J=7.3, 5,2 Гц, 1Н), 7.16 (dd, J=7.1, 5,1 Гц, 1H), 3.69 (s, 2Н), 2.90-2.69 (m, 6Н), 2.69-2.50 (m, 6Н), 2.34-2.23 (m, 1H), 2.22-2.14 (m, 1H), 1.76-1.64 (m, 1Н). МС: Вычислено: 390,2; МС: Найдено: 391,3 ([М+Н]+).
Пример синтеза 61. Получение 2-пиридин-2-ил-5-(4-хинолин-6-илметилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 90)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,064 г, 23,6%).
1Н ЯМР (600 МГц, DMSO-d6): δ 11.40 (s, 1Н), 8.83 (dd, J=4.2, 1,8 Гц, 1H), 8.38 (d, J=8,5 Гц, 1H), 8.36-8.34 (m, 1H), 8.31 (d, J=8,2 Гц, 1H), 7.94 (d, J=8,6 Гц, 1H), 7.83 (d, J=10,9 Гц, 2H), 7.69 (dd, J=8.6, 1,6 Гц, 1H), 7.47 (dd, J=8.3, 4,1 Гц, 1H), 7.17-7.11 (m, 1H), 3.62 (s, 2H), 2.67-2.23 (m, 12H), 2.14-2.01 (m, 1H), 2.00-1.90 (m, 1H), 1.60-1.45 (m, 1H). MC: Вычислено: 440,2; MC: Найдено: 441,4 ([M+H]+).
Пример синтеза 62. Получение 2-(4-хлорфенил)-5-(4-метил-пиперазин-1-ил)-4,5,6,7-тетрагидрид-2Н-индазол-3-ол гидрохлорида (Соединение 94)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде бежевого твердого вещества (0,048 г, 39,8%).
1Н ЯМР (600 МГц, DMSO-d6): δ 12.47-11.52 (brd, 1Н), 7.72 (d, J=9,0 Гц, 2H), 7.45 (d, J=8,9 Гц, 2H), 3.79-3.24 (m, 10Н), 2.80 (s, 3Н), 2.75-2.65 (m, 1H), 2.60-2.55 (m, 1H), 2.47-2.40 (m, 1H), 2.38-2.21 (m, 1H), 1.90-1. 75 (m, 1H). MC: Вычислено: 382,1 (свободное основание: 346,2); MC: Найдено: 347,3 ([M+H]+).
Пример синтеза 63. Получение 5-(4-метил-пиперазин-1-ил)-2-(4-трифторметилфенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 95)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,072 г, 68,8%).
1Н ЯМР (600 МГц, CD3OD): δ 7.97 (d, J=8,3 Гц, 2Н), 7.70 (d, J=7,8 Гц, 2Н), 3.00-2.61 (m, 8Н), 2.77-2.66 (m, 4Н), 2.55 (s, 3Н), 2.41-2.11 (m, 2Н), 1.75-1.65 (m, 1Н). МС: Вычислено: 380,2; MC: Найдено: 381,2 ([М+Н]+).
Пример синтеза 64. Получение 2-(4-бромфенил)-5-(4-метил-пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 101)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,005 г, 6%).
1H ЯМР (600 МГц, CD3OD): δ 7.65 (d, J=8,9 Гц, 2Н), 7.50 (d, J=8,9 Гц, 2Н), 2.89-2.46 (m, 11 Гц), 2.34 (s, 3Н), 2.2-2.30 (m, 1H), 2.19-2.11 (m, 1Н),2.05-1.95 (m, 1H), 1.67 (qd, J=11.8, 5,4 Гц, 1Н). МС: Вычислено: 390,1; МС: Найдено: 391,2 ([М+Н]+).
Пример синтеза 65. Получение 2-(4-метил-пиперазин-1-ил)-2-(4-трифторметилфенил)-4,5,6,7-тетрагидро-2Н индазол-3-ола (Соединение 102)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,10 г, 55,8%).
1Н ЯМР (600 МГц, CD3OD): δ 8.53 (dd, J=9.1, 4,8 Гц, 2Н), 8.06-8.00 (m, 2Н), 3.76-3.61 (m, 4Н), 3.61-3.42 (m, 8Н), 3.26 (s, 3Н), 3.19-3.13 (m, 1H), 3.08-3.02 (m, 1Н), 2.59 (ddd, J=24.0, 11.5, 5,4 Гц, 1H). МС: Вычислено: 330,2; МС: Найдено: 331,4 ([М+Н]+).
Пример синтеза 66. Получение 4-[3-гидрокси-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-индазол-2-ил]-бензонитрила (Соединение 103)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,035 г, 17,6%).
1Н ЯМР (600 МГц, CD3OD): δ 8.04 (d, J=8,9 Гц, 2Н), 7.68 (d, J=8,9 Гц, 2Н), 2.78-3.00 (m, 5Н), 2.77-2.66 (m, 4Н), 2.66-2.52 (m, 3Н), 2.44 (s, 3Н), 2.34-2.22 (m, 1H), 2.11-2.17 (m, 1H), 1.69 (ddd, J=24.0, 11.8, 5,3 Гц, 1H). МС: Вычислено: 337,2; МС: Найдено: 338,2 ([М+Н]+).
Пример синтеза 67. Получение 5-(4-метилпиперазин-1-ил)-2-пиримидин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 108)
Руководствуясь способом получения Соединения 82, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,10 г, 40,5%).
1Н ЯМР (600 МГц, CD3OD): δ 8.71 (d, J=4,9 Гц, 2Н), 7.23 (t, J=4,9 Гц, 1H), 2.79-2.68 (m, 6Н), 2.67-2.52 (m, 5Н), 2.36 (s, 3Н), 2.34-2.23 (m, 2Н), 2.18-2.11 (m, 1H), 1.68 (ddd, J=23.9, 11.8, 5,3 Гц, 1H). МС: Вычислено: 314,2; МС: Найдено: 315,3 ([М+Н]+).
Пример синтеза 68. Получение 2-пиридин-2-ил-5-(4-пара-толилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 126)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде бежевого твердого вещества (0,14 г, 32,9%).
1H ЯМР (600 МГц, CDCl3): 5 8.40-8.34 (m, 1Н), 8.32-8.26 (m, 1H), 7.85 (ddd, J=8.6, 7.4, 1,9 Гц, 1H), 7.17 (ddd, J=7.3, 5.0, 0,8 Гц, 1H), 7.04 (d, J=8,3 Гц, 2H), 6.87 (d, J=8,6 Гц, 2H), 3.16 (t, J=5,0 Гц, 4H), 2.94-2.73 (m, 6H), 2.70-2.59 (m, 2H), 2.32 (dd, J=13.9, 10,9 Гц, 1H), 2.27-2.22 (m, 1H), 2.22 (s, 3H), 1.75 (qd, J=11.8, 5,4 Гц, 1H). МС: Вычислено: 389,2; МС: Найдено: 390,3 ([M+H]+).
Пример синтеза 69. Получение 5-[4-(4-метоксифенил)-пиперазин-1-ил]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 129)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде коричневого твердого вещества (0,10 г, 23,7%).
1Н ЯМР (600 МГц, CDCl3): δ 8.28-8.19 (m, 1Н), 7.90-7.70 (m, 2H), 7.10 (ddd, J=8.4, 4.3, 3,2 Гц, 1H), 6.91 (d, J=9,1 Гц, 2H), 6.83 (d, J=9,1 Гц, 2H), 3.76 (s, 3Н), 3.20-3.10 (m, 4H), 3.01-2.72 (m, 7H), 2.73-2.60 (m, 1H), 2.52-2.36 (m, 1H), 2.32-2.19 (m, 1H), 1.76 (qd, J=12.2, 5,1 Гц, 1H). МС: Вычислено: 405,2; МС: Найдено: 406,3 ([M+H]+).
Пример синтеза 70. Получение 1-{4-[4-(3-гидрокси-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-пиперазин-1-ил]-фенил}-этанона (Соединение 130)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде серого твердого вещества (0,14 г, 30,1%).
1H ЯМР (600 МГц, CDCl3): δ 8.30-8.22 (m, 1H), 7.89-7.75 (m, 4Н), 7.12-7.05 (m, 1H), 6.91-6.80 (m, 2Н), 3.40-3.30 (m, 4Н), 2.92-2.59 (m, 8Н), 2.50 (s, 3Н), 2.45-2.33 (m, 1Н), 2.19-2.07 (m, 1H), 1.80-1.65 (m, 1H). МС: Вычислено: 417,2; МС: Найдено: 418,3 ([M+H]+).
Пример синтеза 71. Получение 5-[4-(4-метансульфонилфенил)-пиперазин-1-ил]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 131)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение в виде было получено светло-серого твердого вещества (0,09 г, 18,1%).
1H ЯМР (600 МГц, CDCl3): δ 8.25-8.20 (m, 1H), 7.86-7.79 (m, 2Н), 7.76 (d, J=9,0 Гц, 2Н), 7.11 (ddd, J=6.8, 5.2, 2,0 Гц, 1H), 6.93 (d, J=9,0 Гц, 2Н), 3.43-3.27 (m, 4Н), 3.00 (s, 3Н), 2.91-2.83 (m, 1Н), 2.82-2.75 (m, 6H), 2.70-2.59 (m, 1H), 2.47-2.37 (m, 1H), 2.19-2.10 (m, 1H), 1.74 (dddd, J=12.6, 7.1, 3.3, 0,7 Гц, 1H). МС: Вычислено: 453,2; МС: Найдено: 454,2 ([M+H]+).
Пример синтеза 72. Получение 5-[4-(1-бензилпиперидин-4-илметил)-пиперазин-1-ил]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 135)
5-(Пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ола дигидрохлорид (0,70 г, 1,88 ммоль) растворяли в 30 мл смеси дихлорметан/дихлорэтан (1/1) и затем в потоке азота добавляли 1-бензилпиперидин-4-карбальдегид (0,35 мл, 1,88 ммоль, 1,0 экв.) и триэтиламин (0,77 мл, 5,64 ммоль, 3,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов после добавления триацетоксиборгидрида натрия (0,79 г, 3,76 ммоль, 2,0 экв.) при 0°С. В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия (20 мл) для доведения рН до примерно 7, и затем смесь экстрагировали дихлорметаном (30 мл × 3). Органический слой сушили с использованием безводного сульфата натрия и затем концентрировали при пониженном давлении. Остаток очищали на силикагелевой колонке (растворитель: хлороформ/метанол = 5/1+1% аммиачной воды) с получением указанного в заголовке соединения в виде коричневого твердого вещества (0,65 г, 70,3%). Способом, указанным выше, были также получены Соединения 133, 134 и 136.
1H ЯМР (600 МГц, CDCl3): δ 8.26-8.19 (m, 1H), 7.90-7.80 (m, 2Н), 7.27-7.17 (m, 5Н), 7.10-7.00 (m, 1Н), 3.51 (s, 2Н), 2.96-2.80 (m, 2Н), 2.80-2.27 (m, 11Н), 2.17 (d, J=7,1 Гц, 2Н), 2.00-1.90 (m, 3Н), 1.75-1.64 (m, 2Н), 1.55-1.40 (m, 1H), 1.34-1.16 (m, 5Н). МС: Вычислено: 486,3; МС: Найдено: 487,4 ([М+Н]+).
Пример синтеза 73. Получение 5-{4-[2-(2-гидроксиэтокси)-этил]-пиперазин-1-ил}-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ола (Соединение 17)
Руководствуясь способом получения Соединения 96, указанное в заголовке соединение было получено в виде желтого твердого вещества (0,15 г, 29,5%).
1Н ЯМР (600 МГц, CDCl3): 5 8.25-8.19 (m, 1H), 7.99-7.73 (m, 2Н), 7.11-7.02 (m, 1H), 3.76-3.50 (m, 6Н), 2.89-2.55 (m, 14Н), 2.39-2.30 (m, 1Н), 2.16-2.09 (m, 1H), 1.72-1.60 (m, 1Н). МС: Вычислено: 387,2; МС: Найдено: 388,3 ([М+Н]+).
Структуры, результаты МС и названия согласно IUPAC полученных соединений 1-161 из Примеров синтеза представлены в Таблице 1, приведенной ниже.
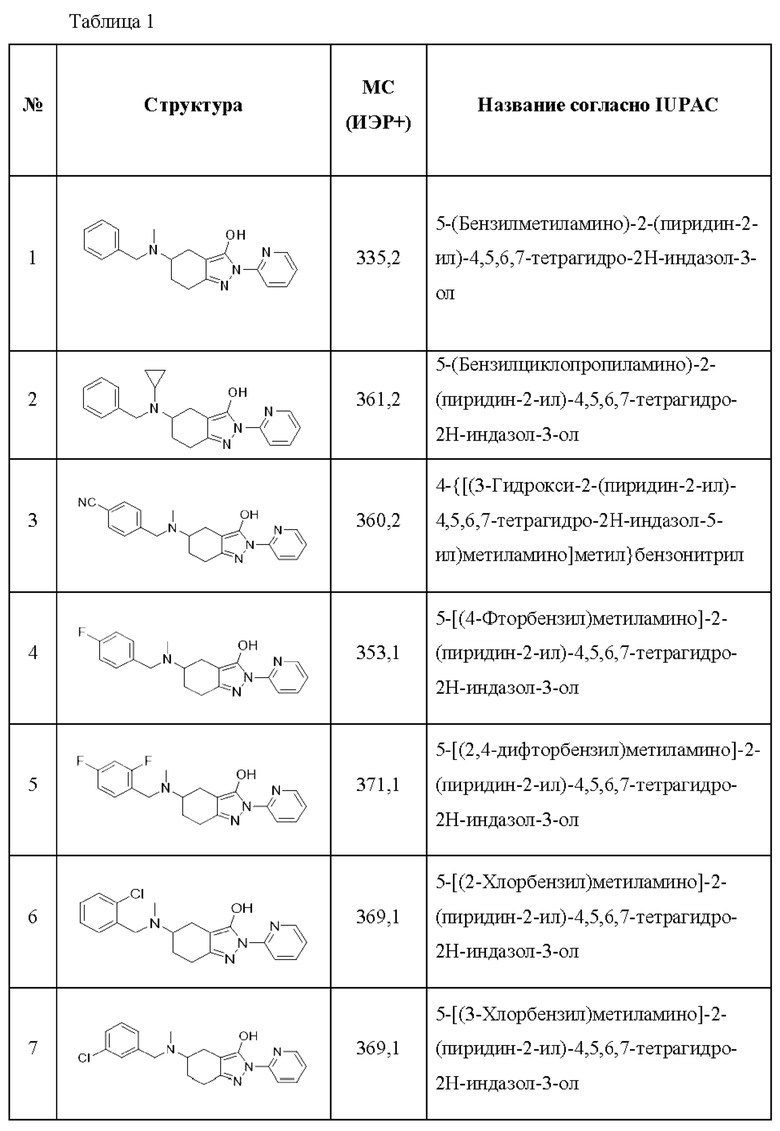
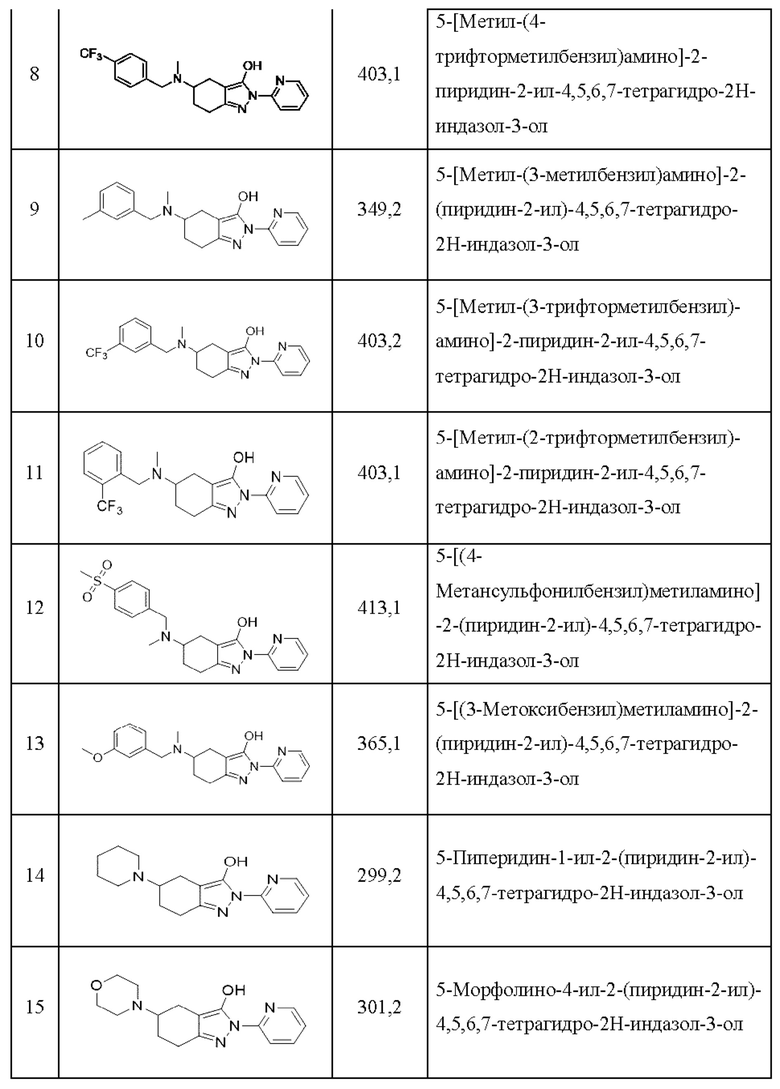

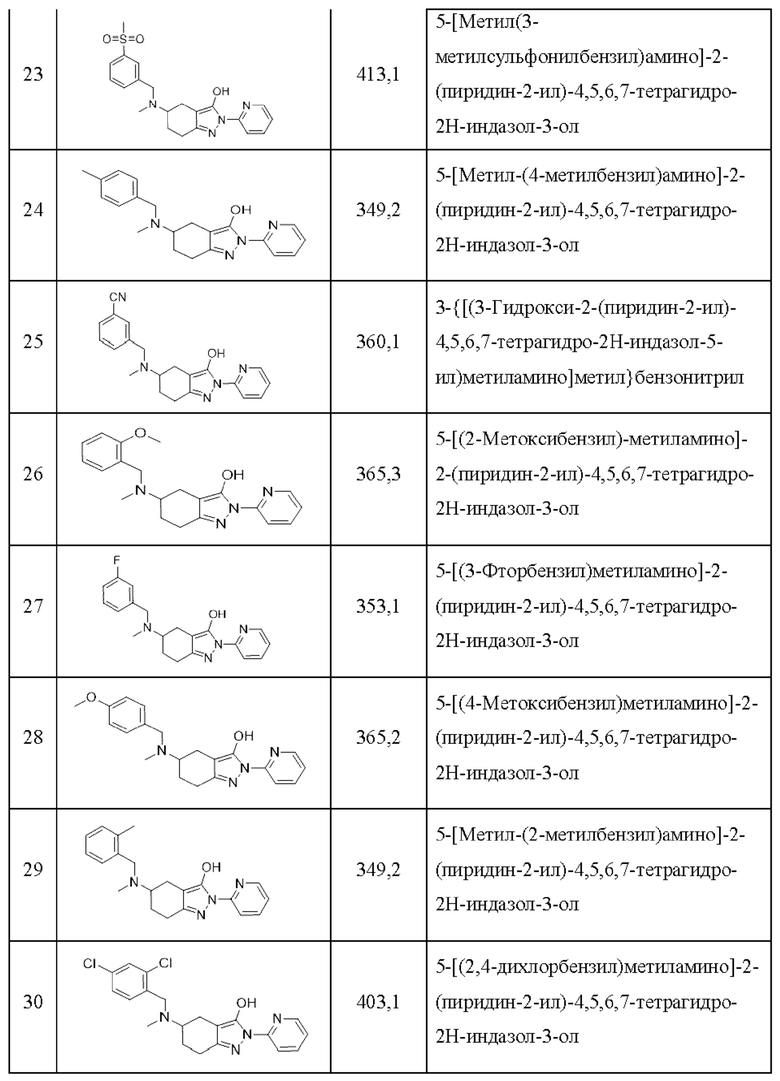
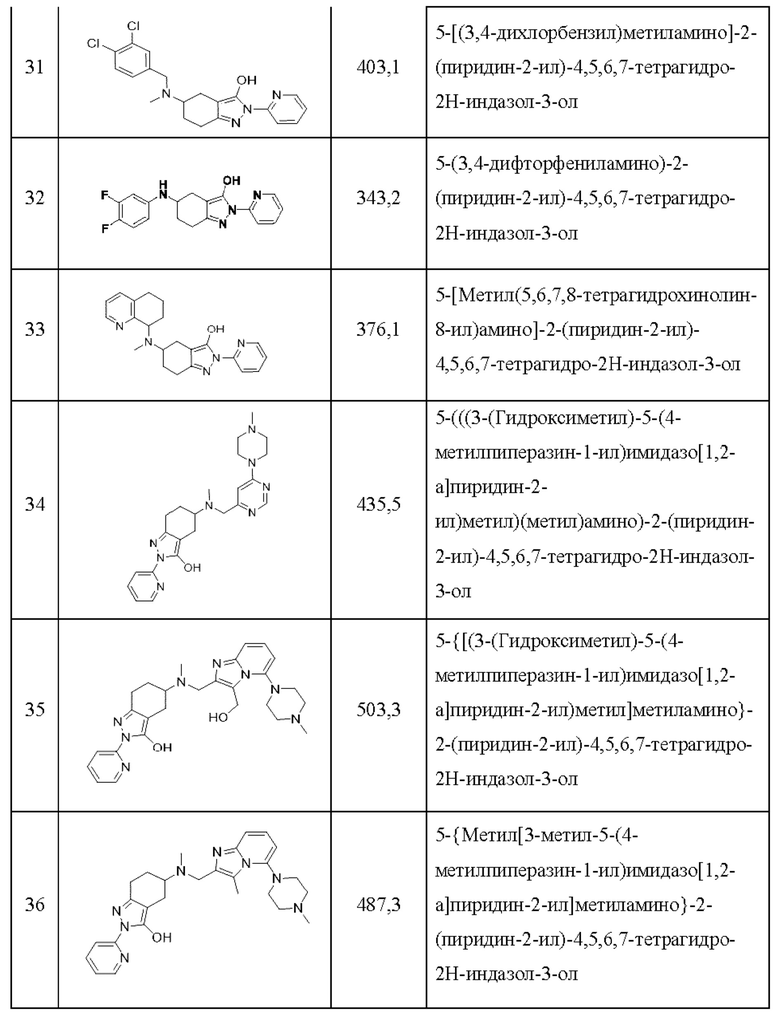
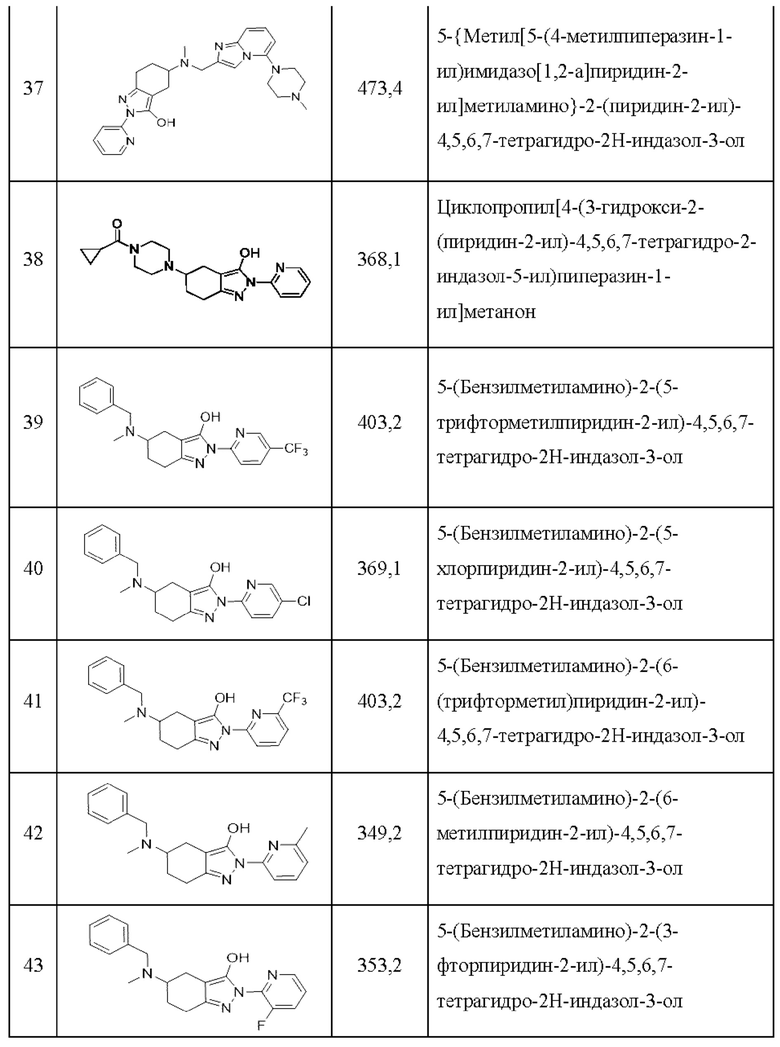

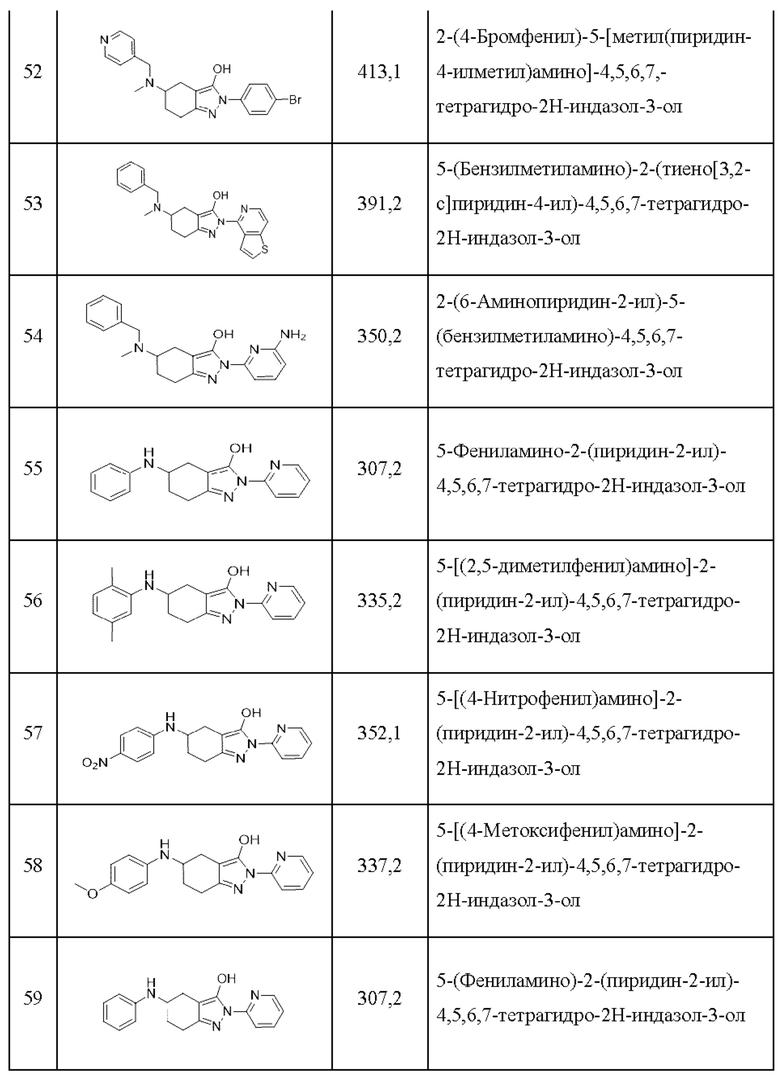
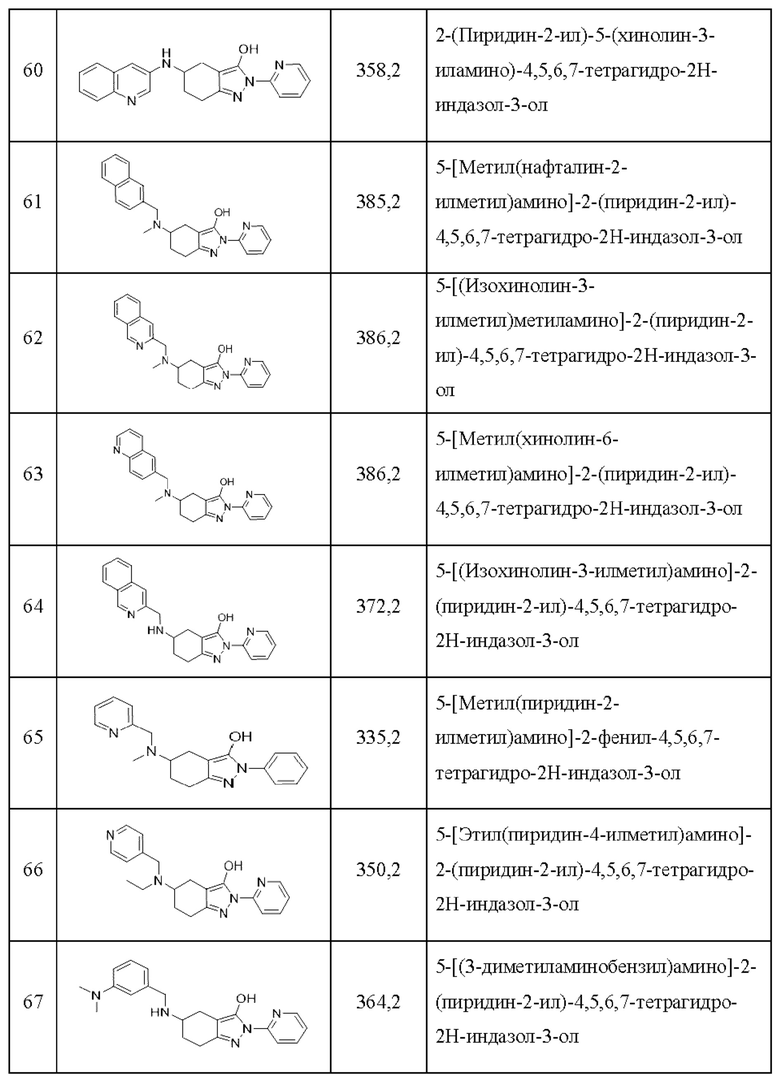
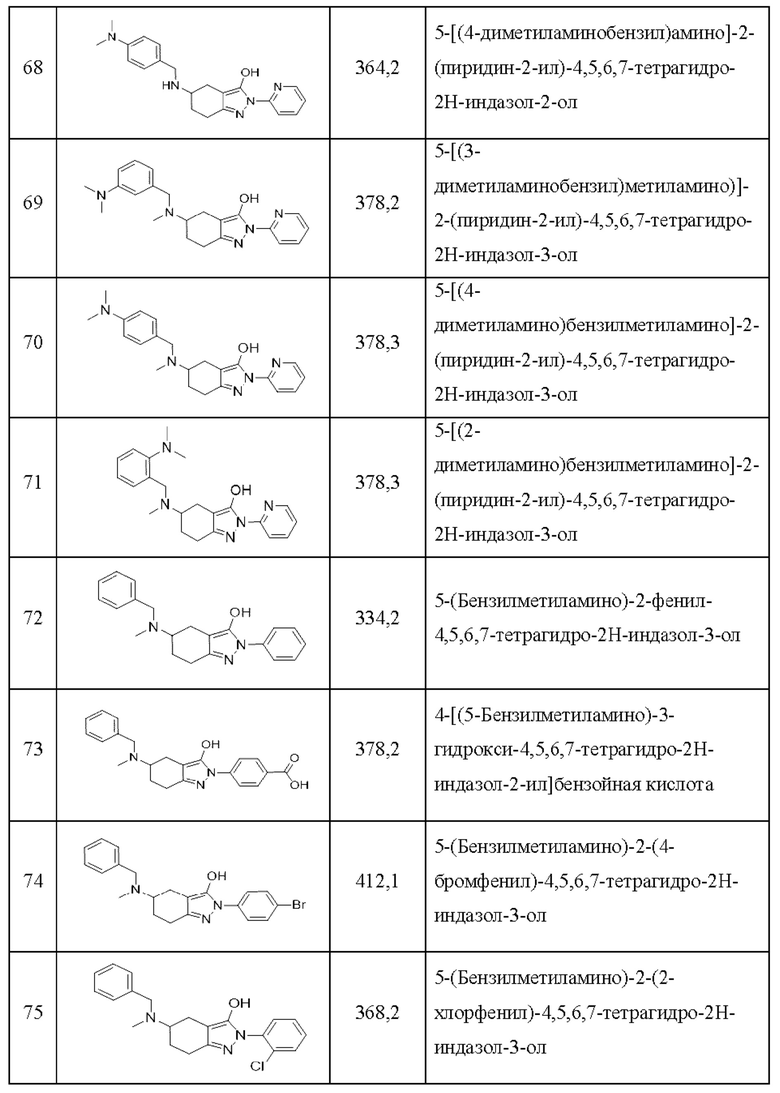
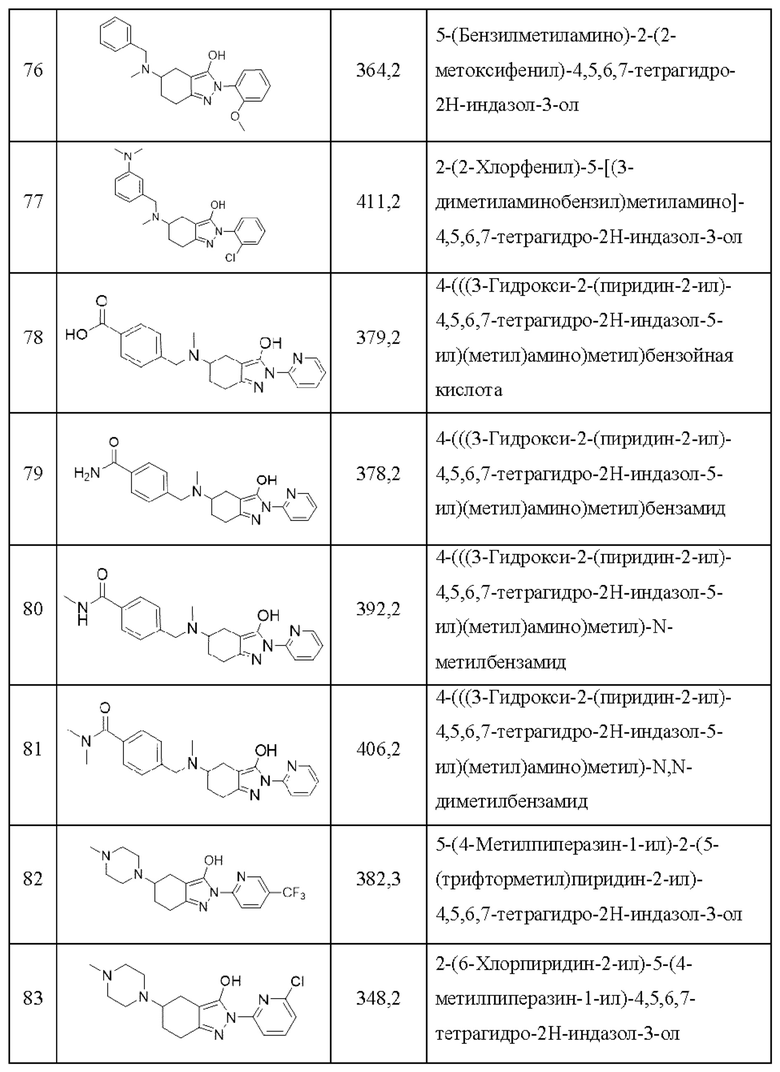
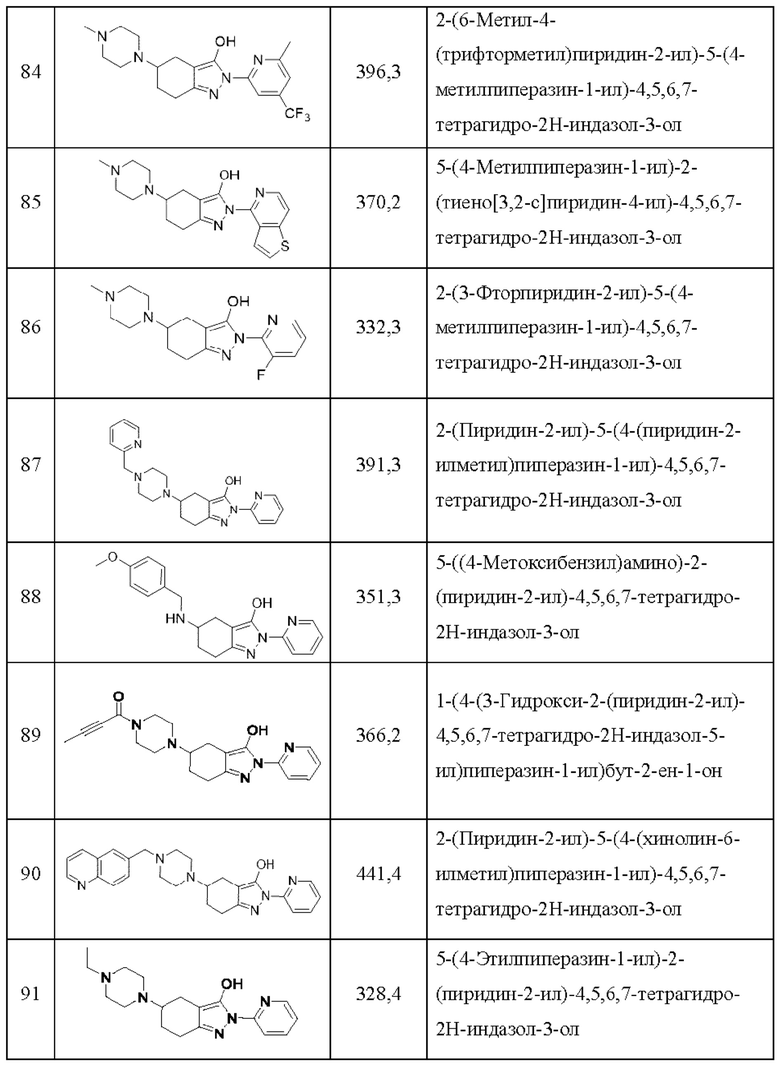
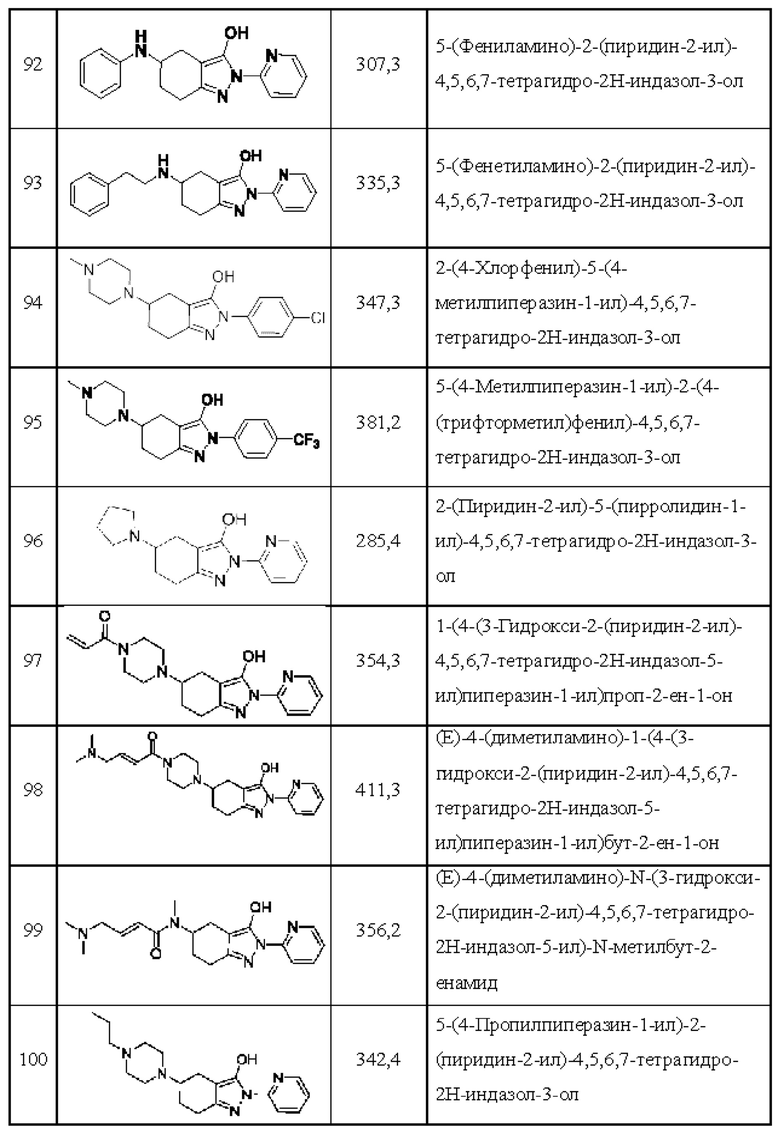
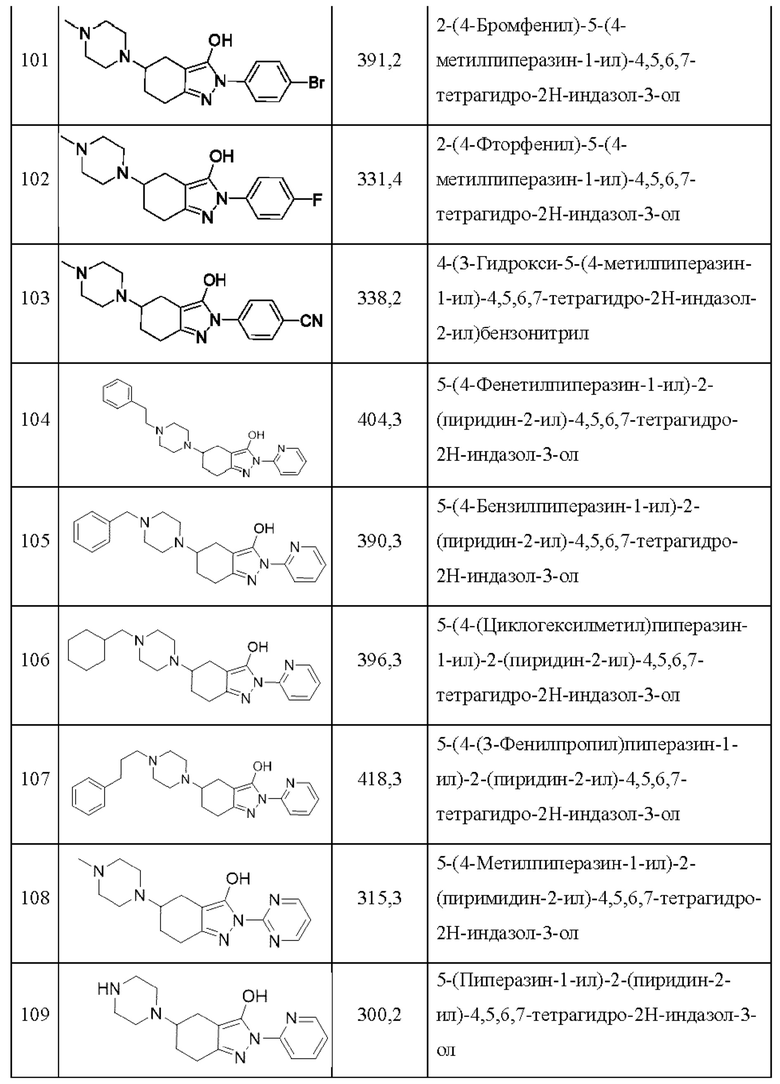

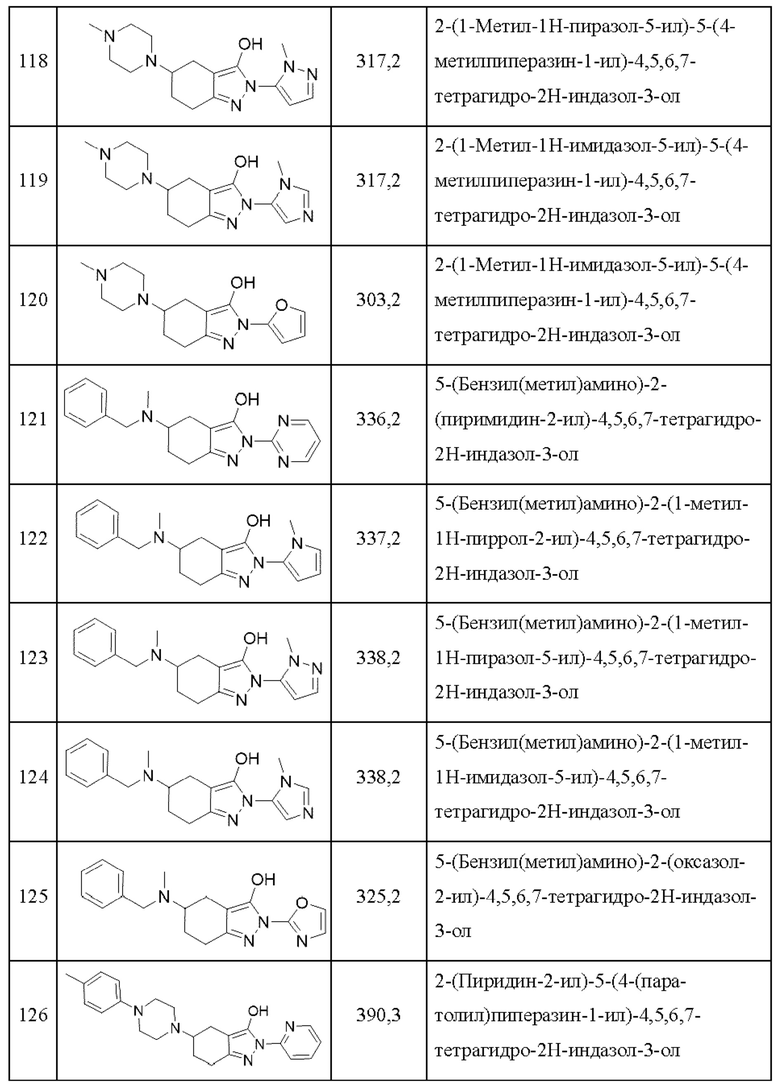
Пример 1. Анализ изменения продуцирования ROS, индуцированного обработкой РМА, в клетках HL-60, дифференцированных в клетки нейтрофилы путем обработки DMSO
Чтобы подтвердить эффект соединений из Примеров синтеза в отношении продуцирования ROS из фибробластов и специфических субстратных клеток, продуцирование ROS индуцировали путем стимуляции РМА (форбол-12-миристат-13-ацетатом), TGF-β1, пальмитатом или высококонцентрированной глюкозой или т.п. в клетках HL-60, дифференцированных в клетки нейтрофилы путем обработки DMSO (диметилсульфоксидом), в клетках NHLF (нормальные фибробласты легких человека, Lonza), LX-2 (звездчатые клетки печени человека, Sigma), ARPE19 (клетки пигментного эпителия сетчатки глаза человека, АТСС (Американская коллекция типовых культур)) и KEL-FIB (келоидные фибробласты, АТСС), и в этих условиях определяли ингибирующий эффект соединений из Примеров синтеза в отношении продуцирования ROS.
Клетки HL-60 (клетки лейкоза человека, АТСС) суспендировали в среде, содержащей 1,25% DMSO (RPMI+10% FBS (фетальная бычья сыворотка)), и культивировали в условиях 5% CO2, 37°С в течение 6 суток, индуцируя тем самым дифференцировку в клетки нейтрофилы. Клетки HL-60, дифференцированные в клетки нейтрофилы, аликвотами в концентрации 2×104 клеток на лунку наносили на 96-луночный планшет, и эти клетки обрабатывали соединениями из Примеров синтеза в концентрации 0,5 мМ в течение 30 минут. Затем в каждую лунку, содержащую клетки и лекарственное средство, вносили 200 нМ РМ А для индуцирования продуцирования ROS, и такое продуцирование ROS измеряли путем определения уровня люминесценции каждой лунки, используя 100 мкМ L-012.
Клетки NHLF (нормальные фибробласты легких человека, Lonza), LX-2 (звездчатые клетки печени человека, Sigma), ARPE19 (клетки пигментного эпителия сетчатки глаза человека, АТСС), KEL-FIB (келоидные фибробласты, АТСС) суспендировали в культуральной среде, содержащей 10% FBS, и аликвотами наносили на 96-луночный планшет и затем культивировали в условиях 5% CO2, 37°С в течение 24 часов. После предварительной обработки соединениями из Примеров синтеза в концентрациях 10, 20, 30, 40, 60 и 80 мкМ в течение от 30 минут до 1 часа стимулом ROS обрабатывали каждую лунку, содержащую клетки и лекарственное средство. После дополнительного культивирования в течение 48 часов уровень продуцирования ROS подтверждали, используя L-012 или DCF-DA (2',7'-дихлорфлуоресцина диацетат).
В результате эксперимента соединения из Примеров синтеза ингибировали стимулированное стимулом ROS продуцирование ROS во всех клетках: NHLF, LX-2, ARPE19, KEL-FIB. Конкретно, в Таблице 2 представлены результаты, которые показали, что продуцирование ROS, индуцированное РМА, ингибируется при обработке соединениями из Примеров синтеза 0,5 мкМ в клетках HL-60, дифференцированных в нейтрофилы. ФИГ. 1 демонстрирует результат, что продуцирование ROS, индуцированное РМА, ингибируется полностью при обработке клеток LX-2 и NHLF Соединением 1 и Соединением 17 из Примеров синтеза.
Соответственно, было подтверждено, что соединения из Примеров синтеза эффективно ингибируют продуцирование ROS при обработке ими дифференцированных клеток HL-60 или различных фибробластов или специфических субстратных клеток, в которых продуцирование ROS было индуцировано.

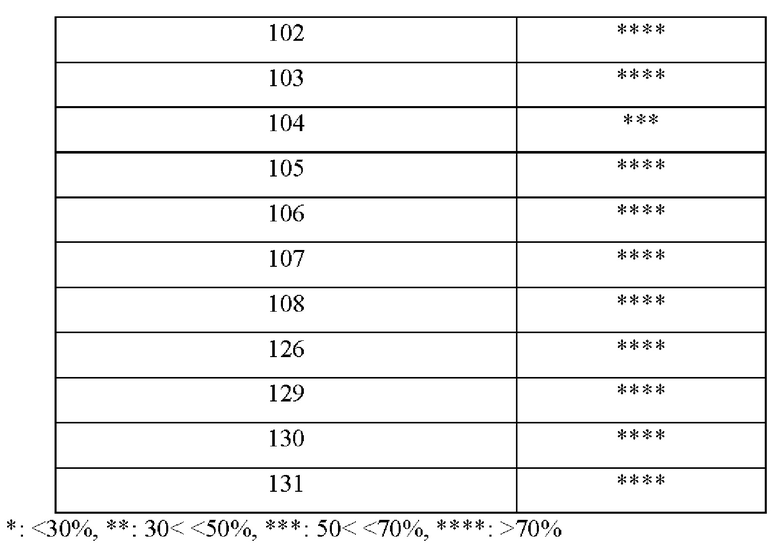
Пример 2. Анализ изменения экспрессии αSMA, индуцированной TGF-β1
Сообщалось, что ассоциированный с раком фибробласт (CAF) образуется, или фиброз различных тканей вызывается, когда фибробласт дифференцируется в миофибробласт.
Чтобы подтвердить, воздействуют ли соединения из Примеров синтеза по настоящему изобретению на дифференцировку фибробластов в миофибробласты, нужно определить ингибирующее воздействие соединений из Примеров синтеза на увеличение экспрессии αSMA (биомаркер для подтверждения дифференцировки в миофибробласты), индуцированной TGF-β1, на клетках HFF-1 (фибробласт крайней плоти человека, АТСС), NHLF (нормальный фибробласт легких человека, Lonza), LX-2 (звездчатые клетки печени человека, Sigma), ARPE19 (клетка пигментного эпителия сетчатки глаза человека, АТСС) и KEL-FIB (келоидный фибробласт, АТСС).
Каждый тип клеток суспендировали в среде DMEM (среда Игла, модифицированная по Дульбекко), содержащей 10% FBS, и аликвоты в концентрации от 1×104 до 1,5×105 клеток на лунку вносили в 4-луночную слайд-камеру (Nunc) и обрабатывали соединениями из Примеров синтеза и TGF-β1 (оба TGF β1 и TGF-β имеют одинаковое значение) для приготовления клеток, предназначенных для подтверждения экспрессии αSMA. Подтверждение экспрессии αSMA в приготовленных клетках осуществляли иммуноцитохимическим методом следующим образом. Осуществляли фиксацию клеток 4%-ным параформальдегидом в течение 10 минут и пермеабилизацию с использованием 0,1% Triton х-100, и затем процессы обработки первичным антителом (анти-αSMA Ab, 1:200, при 4°С в течение 16 часов) и вторичным антителом (А1еха-594 конъюгированное Ab, 1:800, при комнатной температуре в течение 1 часа) против αSMA совершали по порядку, и затем уровень экспрессии αSMA определяли с использованием флуоресцентного микроскопа.
ФИГ. 3 демонстрирует эффект обработки различными соединениями из Примеров синтеза 10, 20 и 40 мкМ после индуцирования экспрессии αSMA путем обработки клеток HFF TGF-β1 (10 нг/мл). Соединение 1, Соединение 23, Соединение 12, Соединение 5, Соединение 14 и Соединение 33 из Примеров синтеза все показали эффект ингибирования экспрессии αSMA 35%-70%, хотя было различие в степени.
Кроме того, также в клетках LX-2, NHLF, ARPE19, KEL-FIB было подтверждено, что увеличение экспрессии αSMA, индуцированной TGF-β1 (10 нг/мл), в значительной степени ингибируется обработкой 10 мкМ Соединения 1 из Примеров синтеза, что может подтвердить ФИГ. 4.
Пример 3. Анализ изменения сжатия геля, индуцированного TGF-β1
Чтобы подтвердить воздействие соединений из Примеров синтеза на дифференцировку фибробластов в миофибробласты, определяли ингибирующее воздействие соединений из Примеров синтеза на явление сжатия геля, индуцированное взаимодействием фибробластов крайней плоти человека (HFF-1, АТСС) и коллагена.
Смешанный раствор клеток HFF-1 и коллагена (бычий коллаген типа I), приготовленный в концентрации 3×106 клеток/мл, аликвотами вносили в 24-луночный планшет соответственно и затем культивировали в условиях 5% CO2, 37°С в течение 1 часа для индуцирования полимеризации геля. Затем после открепления геля, прикрепленного на планшете, с использованием ложки в каждую лунку добавляли среду, содержащую TGF-β1 и соединения из Примеров синтеза. После культивирования в течение 72 часов осуществляли обработку соединениями из Примеров синтеза по 10, 20, 30, 40, 60 и 80 мкМ для измерения размера геля и подтверждали степень сжатия геля в результате обработки лекарственным средством.
В результате эксперимента, как подтверждено на ФИГ. 7, было определено, что сжатие геля, индуцированное TGF-β1 (10 нг/мл), эффективно ингибировалось обработкой Соединением 1, Соединением 5, Соединением 12, Соединением 13, Соединением 14, Соединением 16, Соединением 23, Соединением 33, Соединением 38, Соединением 63 и Соединением 62 из Примеров синтеза.
Пример 4. Анализ изменения продуцирования ROS на допаминергических нейрональных клетках
Чтобы подтвердить эффект соединений Примеров синтеза в отношении продуцирования ROS в допаминергических нейрональных клетках, продуцирование ROS индуцировали путем стимуляции предварительно сформированными фибриллами альфа-синуклеина (PFF) в клетках N27 (допаминергические нейрональные клетки крысы, Sigma), и в этих условиях определяли ингибирующее воздействие соединений из Примеров синтеза на продуцирование ROS.
Клетки N27 культивировали в среде RPMI, содержащей 10% FBS, 1 мкМ ангиотнезина II, и аликвоты полученных клеток в концентрации 4×103 клеток на лунку наносили на 6-луночный планшет. Стимулятор продуцирования ROS PFF (предварительно сформированные фибриллы) и соединения из Примеров синтеза добавляли к клеткам. После обработки соединениями Примеров синтеза в течение 24 часов измеряли флуоресценцию каждой лунки, используя реагент CellROX-Deep Red, тем самым определяя степень продуцирования ROS.
В результате эксперимента, как подтверждено на ФИГ. 2, было определено, что продуцирование ROS, индуцированное PFF, эффективно ингибируется обработкой 0,001 мкМ Соединения 12, Соединения 16, Соединения 32 и Соединения 82 из Примеров синтеза.
Пример 5. Анализ изменения экспрессии IL-1β, индуцированной LPS
Чтобы подтвердить эффект соединений из Примеров синтеза по настоящему изобретению в отношении воспалительной реакции в фибробластах человека, определяли, ингибируют ли соединения из Примеров синтеза экспрессию IL-1β, увеличенную обработкой LPS (липополисахаридом), в фибробластах из различных тканей.
После инокуляции 2×105 клеток в 6-луночном планшете и последующего культивирования в течение 24 часов, их дополнительно культивировали в не содержащем сыворотку культуральном растворе в течение 16 часов, и затем предварительно обрабатывали Соединением 1 из Примеров синтеза в течение 20 минут согласно каждому условию, и воспалительную реакцию индуцировали LPS (1 мкг/мл) в течение 6 часов. Экспрессию IL-1β подтверждали с использованием РВ-ПЦР (полимеразная цепная реакция в режиме реального времени). Суммарную РНК выделяли из клеток с использованием мининабора RNeasy mini kit (Qiagen), и для выделенной РНК 2 мкг кДНК синтезировали с использованием набора для синтеза 1-й цепи кДНК PrimeScript™ II (TaKaRa), и затем осуществляли ПЦР с использованием AccuPower® PCR PreMix (Bioneer) для амплификации генов. Нуклеотидные последовательности для целевых праймеров следующие: IL-1β (прямая: 5'-CCACAGACCTTCCAGGAGAATG-3' (SEQ ID NO: 1), обратная: 5'-GTGCAGTTCAGTGATCGTACAGG-3' (SEQ ID NO: 2)); GAPDH (прямая: 5'-GTGGCTGGCTCAGAAAAAGG-3' (SEQ ID NO: 3), обратная: 5'-GGTGGTCCAGGGGTCTTACT-3' (SEQ ID NO: 4)); β-актин (прямая: 5'-CACCATTGGCAATGAGCGGTTC-3' (S EQ ID NO: 5), обратная: 5'-AGGTCTTTGCGGATGTCCACGT-3 '(SEQ ID NO: 6)). Продукт ПЦР подтверждали электрофорезом в 1,5%-ном агарозном геле.
В результате эксперимента, как подтверждено на ФИГ. 8, было определено, что обработка 10 мкМ Соединения 1 из Примеров синтеза эффективно ингибирует IL-1β, индуцированный LPS, концентрация-зависимым образом.
Пример 6. Анализ изменения экспрессии IL-6 и IL8 в ассоциированных с раком фибробластах
Чтобы подтвердить эффект соединений из Примеров синтеза по настоящему изобретению в отношении воспалительной реакции в ассоциированных с раком фибробластах, определяли, ингибируют ли соединения из Примеров синтеза экспрессию IL6 и IL8 в ассоциированных с раком поджелудочной железы фибробластах (P.CAF).
После инокуляции 1,5×105 клеток в 6-луночном планшете и последующего культивирования в полной среде в течение 48 часов P.CAF обрабатывали соединениями из Примеров синтеза по 10, 20, 30, 40, 60 и 80 мкМ в течение 48 часов согласно каждому условию, и затем экспрессию of IL-6 и IL-8 подтверждали путем осуществления ELISA (твердофазный иммуноферментный анализ) с использованием набора для ELISA Quantkine (R&D systems) следующим образом.
100 мкл культурального раствора, в котором выполняли обработку соединениями из Примеров синтеза в течение 48 часов, добавляли в микропланшет для анализа, содержащий 100 мкл разбавителя для анализа, и оставляли стоять при комнатной температуре в течение 2 часов, и затем содержимое извлекали, затем его промывали 400 мкл промывочного буфера 4 раза. Добавляли 200 мкл конъюгата IL-6 или IL-8 человека и оставляли стоять при комнатной температуре в течение 2 часов, и затем содержимое извлекали, и затем его промывали 400 мкл промывочного буфера 4 раза. Добавляли 200 мкл раствор субстрата и оставляли стоять при комнатной температуре в течение 20 минут и оставляли стоять при комнатной температуре в течение 20 минут, и затем добавляли 50 мкл стоп-раствора, и поглощение при длине волны 450 нм измеряли в пределах 30 минут для подтверждения уровня экспрессии IL-6 и IL-8.
В качестве результата эксперимента, как подтверждено на ФИГ. 5 и ФИГ. 6, было определено, что IL-6 и IL-8, экспрессированные в P.CAF, эффективно ингибировались обработкой Соединением 1, Соединением 5, Соединениями 12-16, Соединением 23, Соединением 33, Соединением 38, Соединением 63 и Соединением 62 из Примеров синтеза.
Пример 7. Подтверждение эффекта лечение повреждения головного мозга
Чтобы протестировать эффект предупреждения или лечения заболевания или расстройства головного мозга соединений из Примеров синтеза, его оценивали с использованием мышиной модели болезни Паркинсона с инъецированием предварительно сформированных фибрилл альфа-синуклеина (PFF).
Использовали мышей C57Bl/6, и всех мышей содержали в стандартных условиях. Эксперимент проводили, разделив экспериментальных животных на нормальную контрольную группу животных, которым перорально вводили дистиллированную воду (отрицательный контроль), группу животных, у которых индуцировали болезнь Паркинсона инъекцией предварительно сформированных фибрилл альфа-синуклеина (PFF) (контроль с носителем), и экспериментальную группу животных с индуцированной болезнью Паркинсона инъекцией предварительно сформированных фибрилл (PFF), которым перорально вводили 25 мг/кг Соединения 16 из Примеров синтеза ежесуточно (Пример синтеза), по 8 животных в каждой группе. Животным нормальной контрольной группы вводили физиологический раствор, и соединение из Примеров синтеза перорально вводили один раз в сутки в течение 7 недель, и затем проводили эксперимент по определению изменения поведения и гистопатологический эксперимент.
Изменение поведения анализировали по результатам теста на аппарате Rota-rod (тест на вращающемся стержне), теста на шесте и теста на сцепление задних конечностей, и измеряли среднее значение из 3 экспериментов на каждое животное.
После завершения тестирования животных анестезировали, и ткани головного мозга каждого индивидуума извлекали, и эти ткани фиксировали в 4%-ном нейтральном забуференном растворе формалина (10%-ный забуференный нейтральный формалин). После этого фиксированные ткани разрезали до определенной толщины, заделывали в парафин общим способом обработки тканей с получением срезов 4-5 мкм. Таким образом, для того, чтобы подтвердить, улучшился ли патологический индекс болезни Паркинсона в соответствии с уровнем агрегации белка в полосатом теле, его сначала метили фосфорилированным по серину-129 альфа-синуклеином, а затем проводили окрашивание Тиофлавином-Т (Thioflavin-T), чтобы сделать гистопатологические заключения.
В результате эксперимента, в результате анализа изменения поведения, такого как время спуска, Rota-rod, тест на шесте и сцепливание задних конечностей и т.п. в группе введения Соединения 16 из Примеров синтеза было определено, что симптомы паринсоноподобного поведения ослабляются на 50% или более, и агрегация и накопление α-синуклеина, важного патологического показателя болезни Паркинсона, снижаются на 50% или более.
В заключение, было подтверждено, что соединения из Примеров синтеза по настоящему изобретению эффективно улучшают течение болезни Паркинсона.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> APTABIO THERAPEUTICS INC.
<120> НОВЫЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА
<130> OPP20220759KR
<150> KR 10-2021-0025694
<151> 2021-02-25
<160> 6
<170> KoPatentIn 3.0
<210> 1
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой праймер IL-1 бета
<400> 1
ccacagacct tccaggagaa tg 22
<210> 2
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой праймер IL-1 бета
<400> 2
gtgcagttca gtgatcgtac agg 23
<210> 3
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой праймер GAPDH
<400> 3
gtggctggct cagaaaaagg 20
<210> 4
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой праймер GAPDH
<400> 4
ggtggtccag gggtcttact 20
<210> 5
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой прамер бета-актина
<400> 5
caccattggc aatgagcggt tc 22
<210> 6
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> прямой праймер бета-актина
<400> 6
aggtctttgc ggatgtccac gt 22
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
| ИНГИБИТОРЫ СИГМА-РЕЦЕПТОРА | 2005 |
|
RU2404972C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| ИНГИБИТОРЫ mTOR КИНАЗЫ ДЛЯ ОНКОЛОГИЧЕСКИХ ПОКАЗАНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С mTOR/PI3K/AKT ПУТЕМ МЕТАБОЛИЗМА | 2009 |
|
RU2546658C2 |
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИНОВЫХ КИНАЗ | 2013 |
|
RU2650501C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2015 |
|
RU2691389C2 |
| Спироконденсированные пирролидиновые производные в качестве ингибиторов деубиквитилирующих ферментов (DUB) | 2017 |
|
RU2730552C2 |
| СОЕДИНЕНИЕ, ИМЕЮЩЕЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ КИНАЗ | 2021 |
|
RU2831403C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
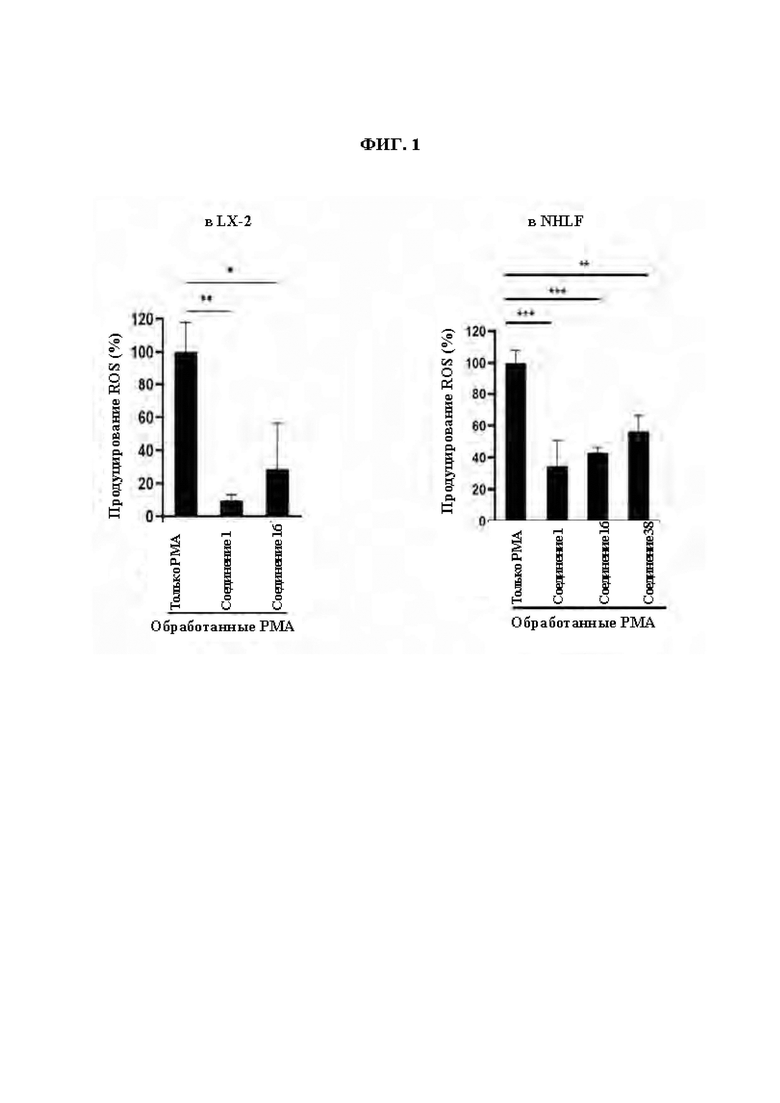
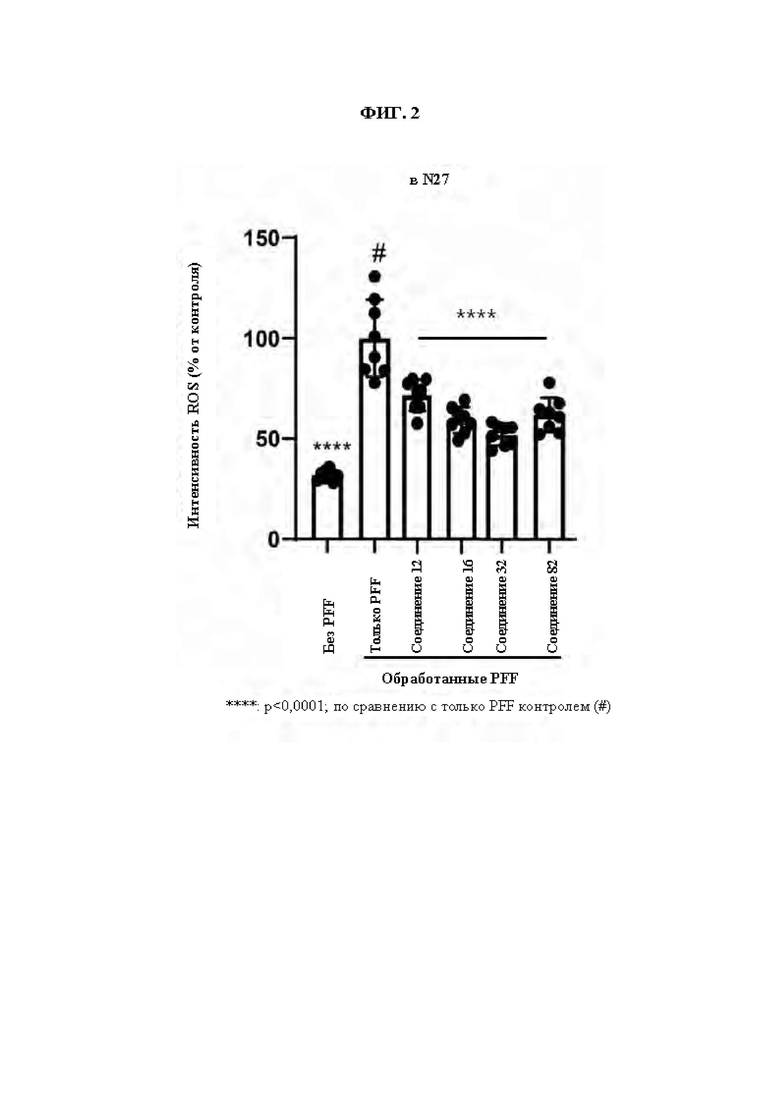
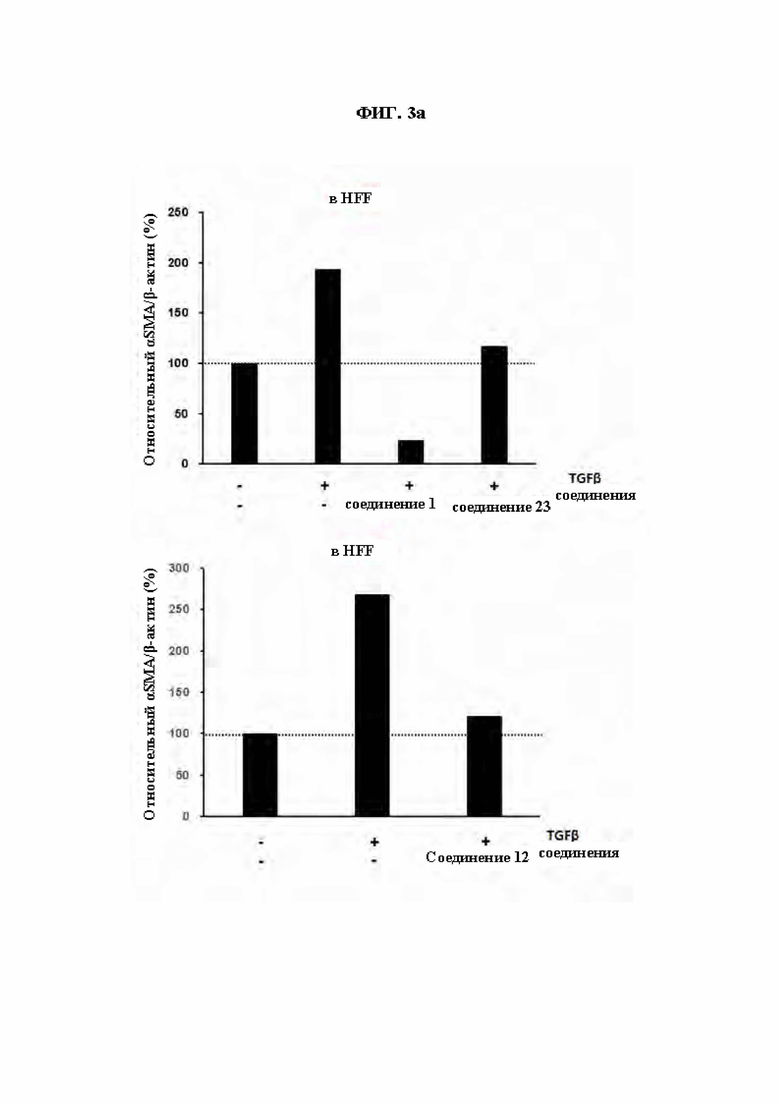
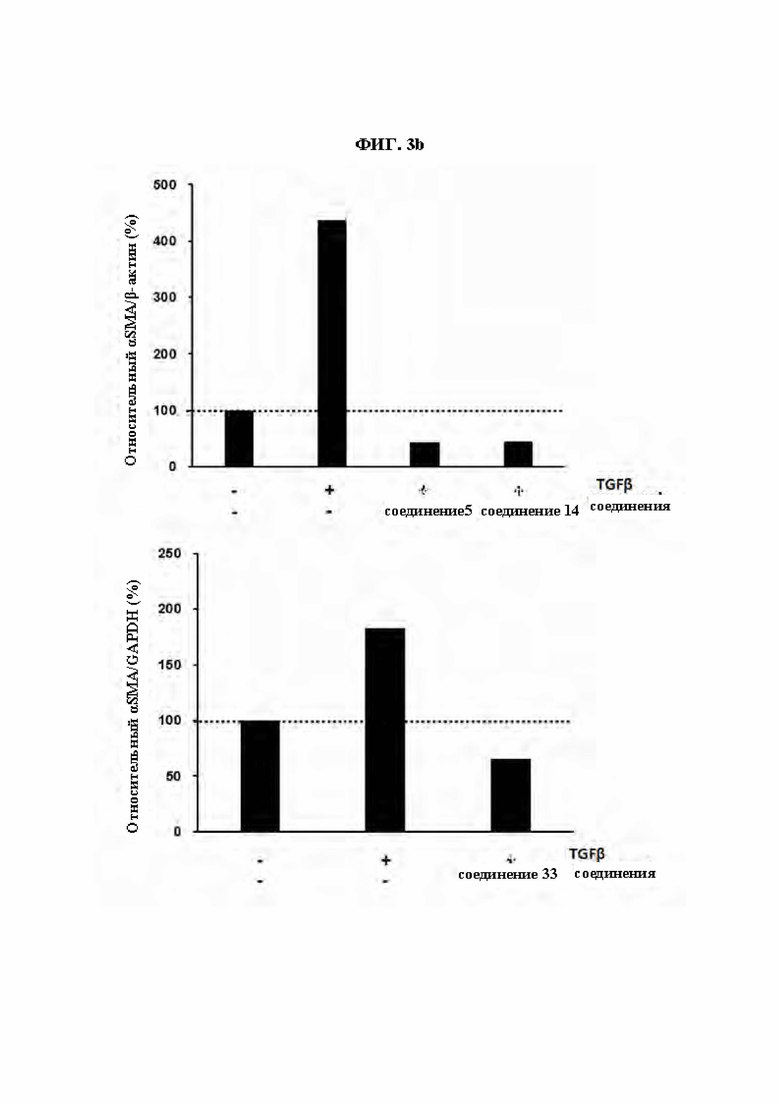
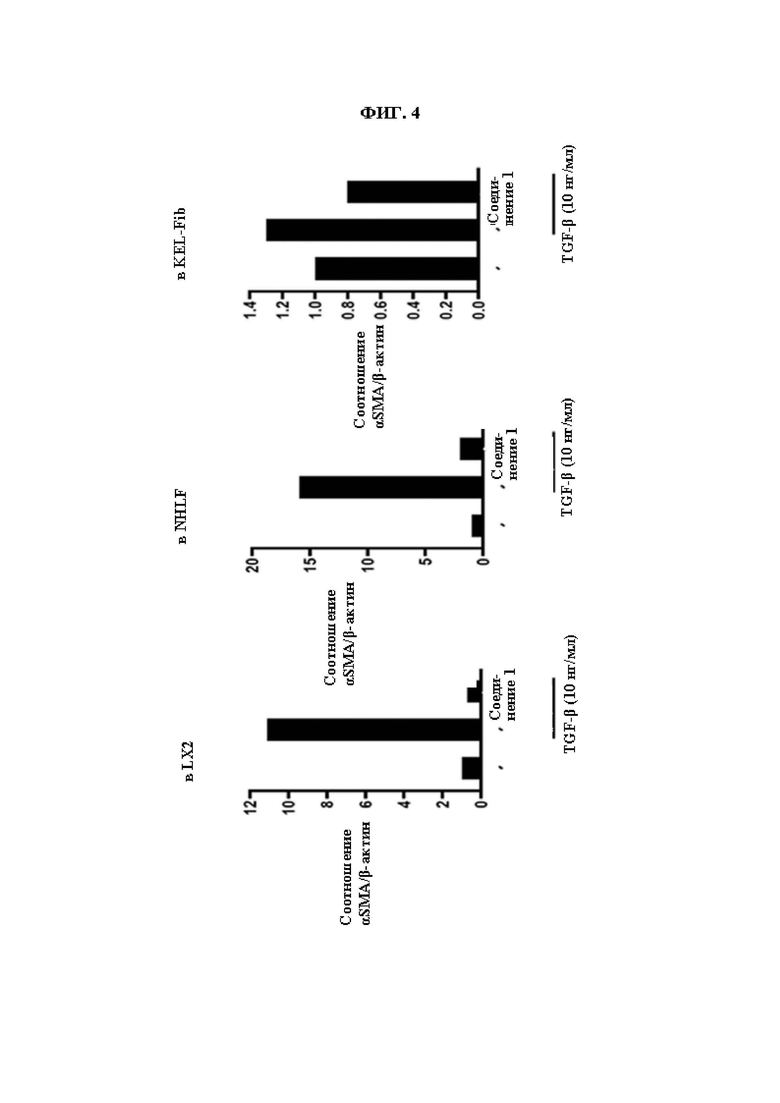
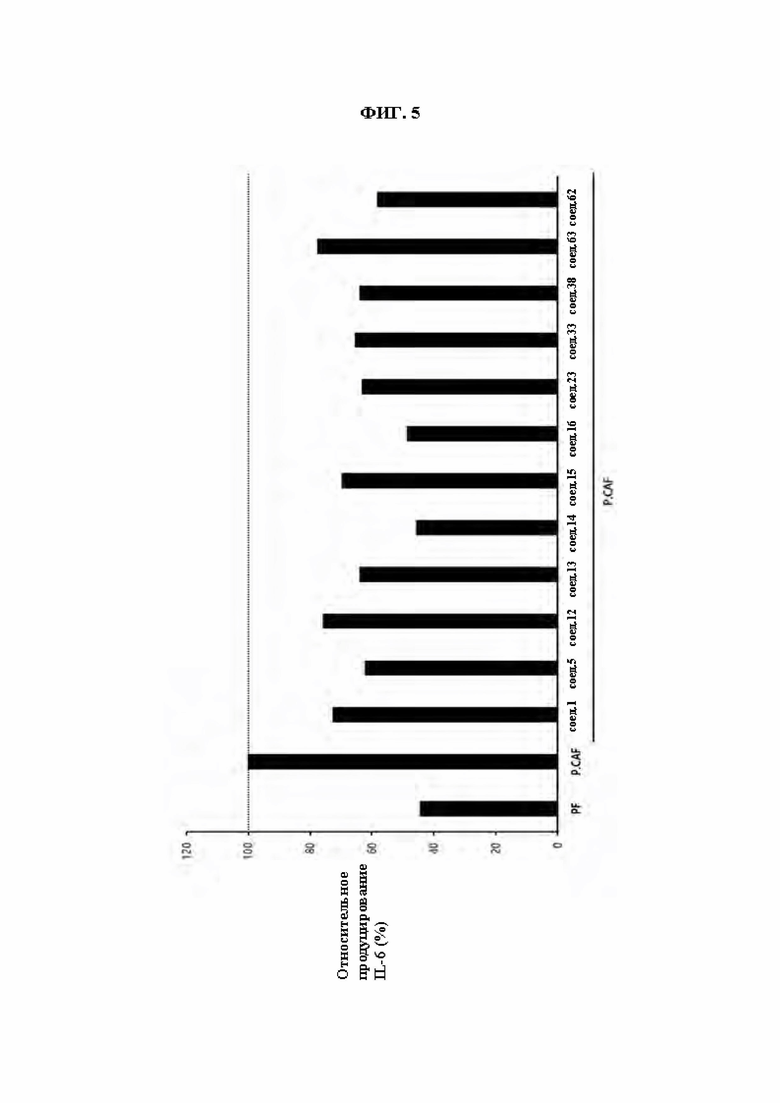
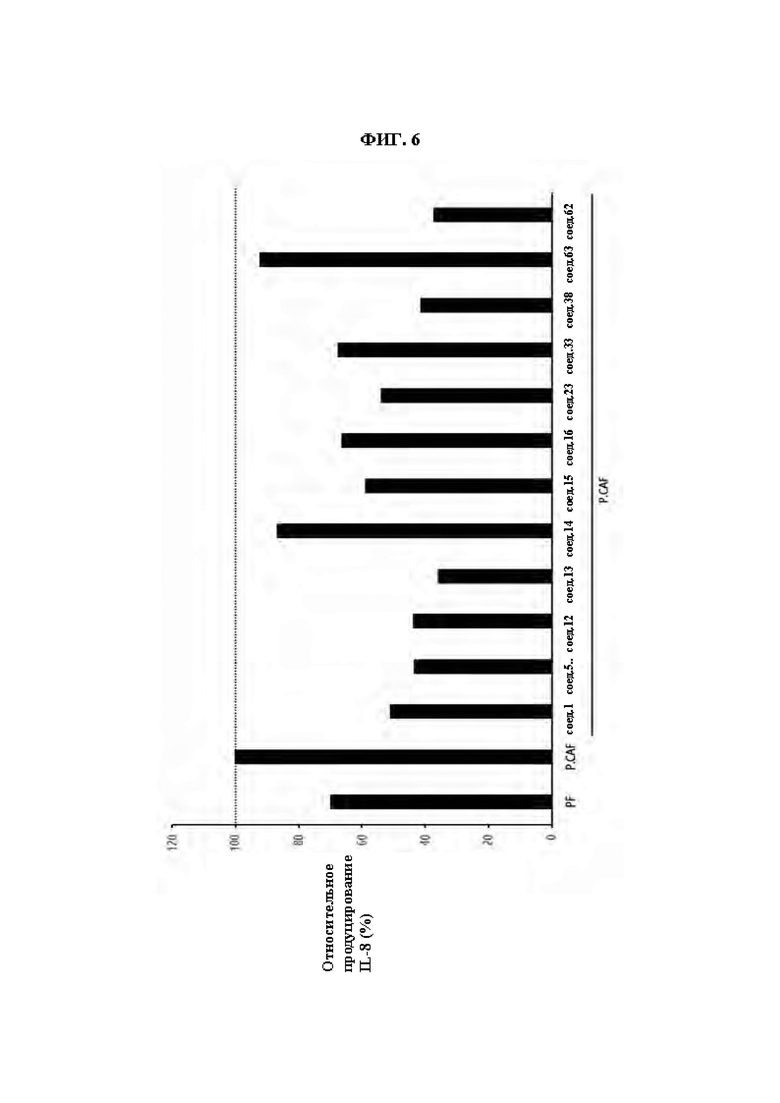
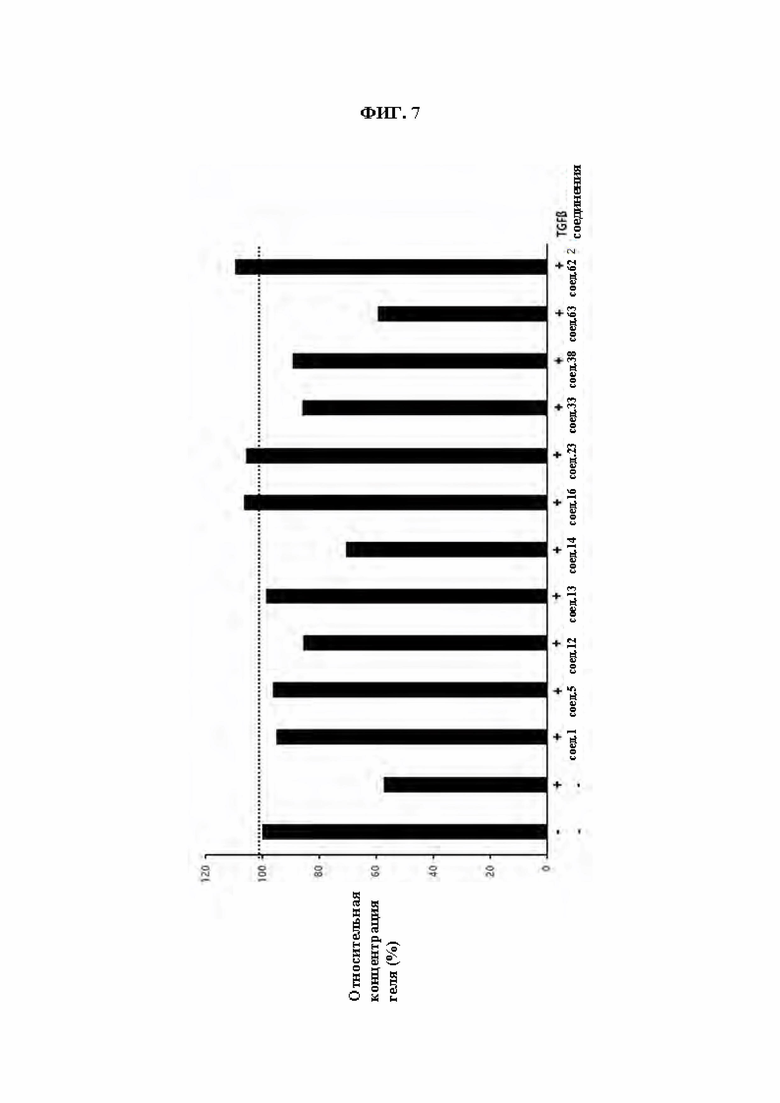
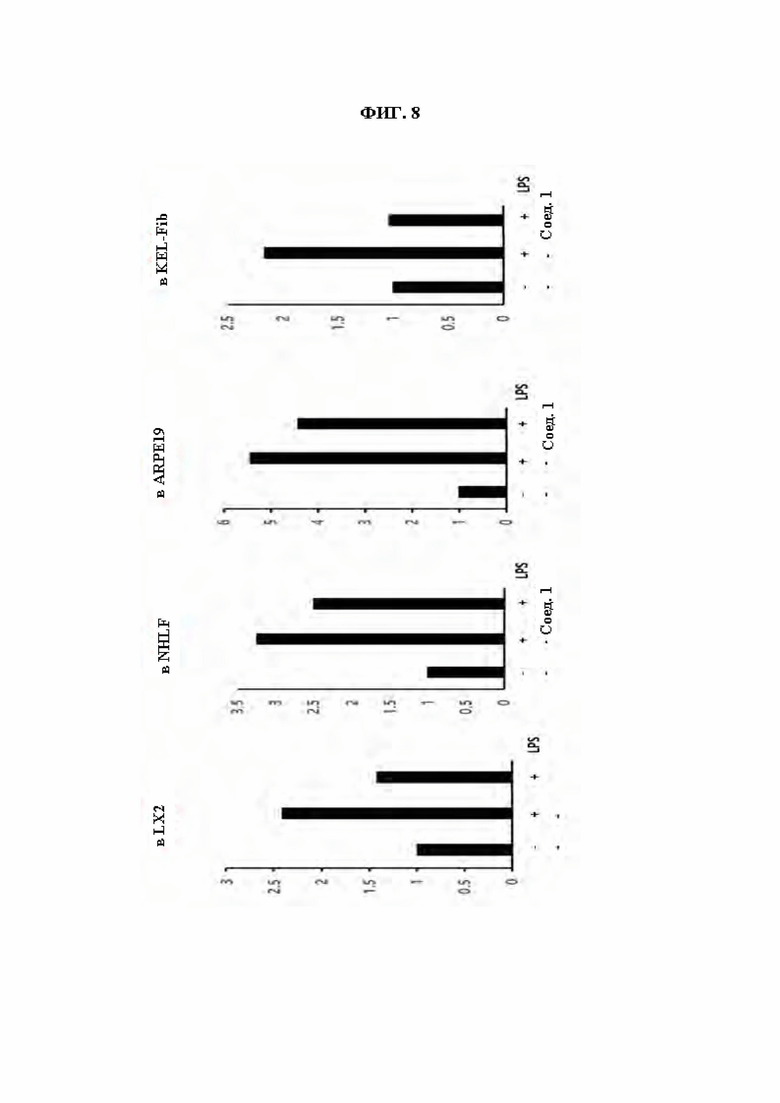
Изобретение относится к новым производным пиразола химической формулы I, где R, A и B определены в формуле изобретения, его стереоизомерам или фармацевтически приемлемым солям, и содержащей его фармацевтическую композицию для предупреждения, улучшения течения или лечения заболеваний, связанных с оксидативным стрессом. 2 н. и 7 з.п. ф-лы, 8 ил., 2 табл., 73 пр. 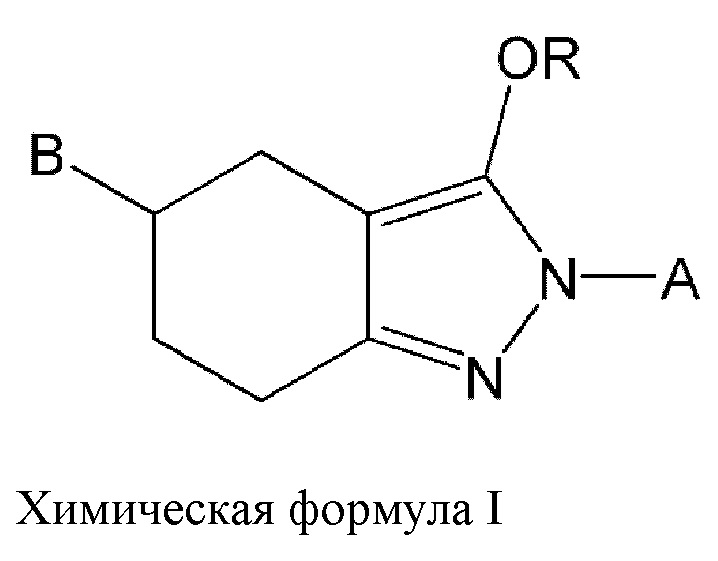
1. Соединение химической формулы I, указанной ниже, его стереоизомер или его фармацевтически приемлемая соль:

в этой формуле
А представляет собой 5-10-членный гетероарил или С6-С10арил, и где указанный 5-10-членный гетероарил или С6-С10арил возможно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из циано, галогена, C1-С6галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С6алкила, C1-С6алкокси, С3-С6циклоалкила, амино, С6-С10арила, 5-10-членного гетероарила и 5-10-членного гетероциклоалкила, и где R1 представляет собой водород, тяжелый водород или C1-С6алкил;
R представляет собой водород, тяжелый водород, циано, галоген, нитро, C1-С6алкил, возможно замещенный С3-С6циклоалкилом, C1-С6галогеналкил, С3-С6циклоалкил, С6-С10арил, 5-10-членный гетероарил или -C(=O)R2, и при этом R2 представляет собой С3-С6циклоалкил, C1-С6алкил, С2-С6алкенил или С6-С10арил; и
В представляет собой -NKM, или 5-10-членный гетероарил или 5-10-членный гетероциклоалкил;
где указанный 5-10-членный гетероарил или 5-10-членный гетероциклоалкил возможно замещен 1, 2, 3 или 4 заместителями из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, 5-12-членного гетероарила, -C(=O)R5 или -SO2-R6, где указанный C1-С6алкил, C1-С6алкокси или С6-С10арил возможно замещен 1, 2, 3 или 4 заместителями из гидрокси, галогена, C1-С6алкила, C1-С6алкокси, возможно замещенного гидрокси, С3-С8циклоалкила, С6-С10арила, 5-10-членного гетероарила, C(=O)R', C1-С10алкилсульфонила, С6-С10арилокси или 5-10-членного гетероциклоалкила, возможно замещенного C1-С6алкилом, С6-С10арил-С1-С6алкилом или C1-С6алкилкарбонилом, и
R3 и R4, каждый независимо, представляет собой водород, тяжелый водород, -C(=O)-Ra, C1-С6алкил или С6-С10арил, и указанный C1-С6алкил или С6-С10арил возможно замещен 1, 2, 3 или 4 заместителями из галогена, гидрокси, C1-С6алкила, C1-С6алкокси или С6-С10арилокси, и где Ra представляет собой водород, тяжелый водород, C1-С6алкил или C1-С6галогеналкил,
R5 представляет собой -ORb, -NRcRd, C1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С8циклоалкил, и где C1-С6алкил, С2-С6алкенил или С2-С6алкинил возможно замещен 1, 2, 3 из 4 заместителями из моно-С1-С6алкиламина или ди-С1-С6алкиламина, и где Rb, Rc и Rd, каждый независимо, представляют собой водород, тяжелый водород, С6-С10арил или С6-С10арил-С1-С6алкил, и
R6 представляет собой C1-С6алкил или С6-С10арил, возможно замещенный 1, 2, 3 или 4 заместителями C1-С6алкил,
K представляет собой водород, тяжелый водород, циано, галоген, нитро, C1-С6галогеналкил, C1-С6алкил, C1-С6алкокси, -C(=O)R', -C(=O)OR', -SO2-R'', С3-С8циклоалкил, С6-С10арил, С6-С10арил-С1-С6алкил-, 5-10-членный гетероарил или 5-10-членный гетероарил-С1-С6алкил, и где указанный C1-С6алкил, C1-С6алкокси, С6-С10арил, С3-С8циклоалкил или 5-10-членный гетероарил возможно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из амино, амино, замещенного 1 или 2 заместителями из C1-С10алкила, циано, галогена, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C1-С6алкокси, C1-С6алкилсульфонила, С6-С10арилсульфонила, -C(=O)R9, 5-10-членного гетероциклила, 5-10-членного гетероциклила, замещенного C1-С6алкилом, гидрокси, нитро, С6-С10арила или С6-С10арила, замещенного C1-С6алкилом,
М представляет собой циано, галоген, нитро, C1-С6галогеналкил, C1-С6алкил, C1-С6алкокси, -C(=O)R',-C(=O)OR', -SO2-R'', С3-С8циклоалкил, С6-С10арил, С6-С10арил-C1-С6алкил-, 5-10-членный гетероарил или 5-10-членный гетероарил-С1-С6алкил, и где указанный C1-С6алкил, C1-С6алкокси, С6-С10арил, С3-С8циклоалкил или 5-10-членный гетероарил возможно замещен 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из амино, амино, замещенного 1 или 2 заместителями из C1-С10алкила, циано, галогена, C1-С6алкила, C1-С6галогеналкила, C1-С6гидроксиалкила, C1-С6алкокси, C1-С6алкилсульфонила, С6-С10арилсульфонила, -C(=O)R9, 5-10-членного гетероциклила, 5-10-членного гетероциклила, замещенного C1-С6алкилом, гидрокси, нитро, или С6-С10арила или С6-С10арила, замещенного C1-С6алкилом, и
R9 представляет собой -ORe, -NReRf или С2-С6алкенил, возможно замещенный 1, 2, 3 или 4 из -NReRf, или С6-С10арил, и где Re и Rf, каждый независимо, представляют собой водород, тяжелый водород, C1-С6алкил или С6-С10арил,
где R' и R'', каждый независимо, представляют собой водород, тяжелый водород, амино, возможно замещенный 1 или 2 заместителями из С6-С10арила или С6-С10арил-С1-С6алкила, C1-С6алкил или С6-С10арил-С1-С6алкил,
гетероатом гетероциклоалкильного или гетероарильного кольца представляет собой один или более типов, выбранных из N, S и О.
2. Соединение, его стереоизомер или его фармацевтически приемлемая соль по п. 1,
где соединение химической формулы I представляет собой соединение химической формулы I-1, указанной ниже:
Химическая формула I-1
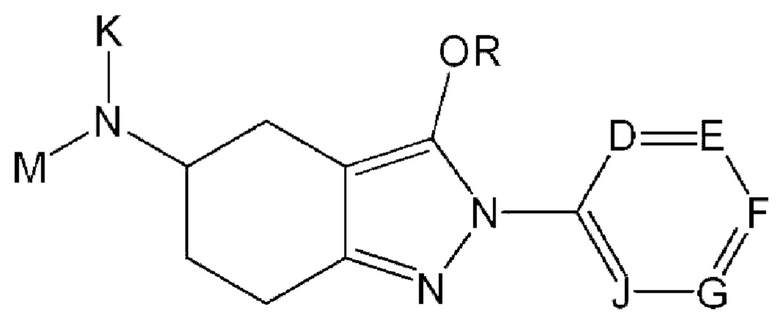
в этой формуле
определение K, М и R такое же, как для химической формулы I; и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, или J представляет собой CR14, N, О или S, но N, О и S присутствуют в количестве один или более; и
R10-R14 являются одинаковыми или разными и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, C1-С6галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С6алкокси, C1-С6алкила, С3-С6циклоалкила, амино, С6-С10арила, 5-10-членного гетероарила и 5-10-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С6алкил, и
две или более чем две соседние группы могут быть объединены друг с другом с образованием незамещенного ароматического углеводородного кольца, где это ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S, или С6-С10арильное кольцо.
3. Соединение, его стереоизомер или его фармацевтически приемлемая соль по п. 1,
где соединение химической формулы I представляет собой соединение химической формулы I-2, указанной ниже:
Химическая формула I-2
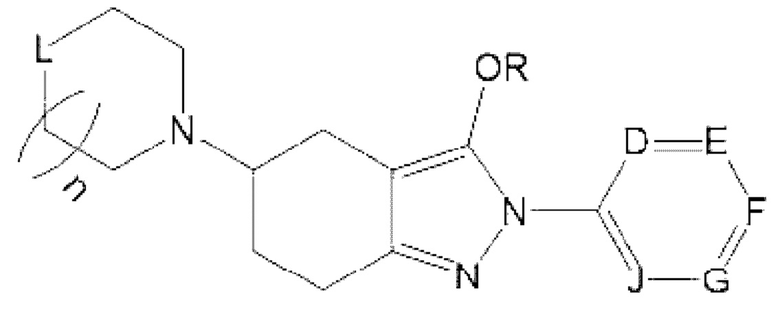
в этой формуле
определение R такое же, как для химической формулы I, и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, или J представляет собой CR14, N, О или S, но N, О и S присутствуют в количестве один или более, и
R10-R14 являются одинаковыми или разными и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, С1-С6 галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С6алкокси, C1-С6алкила, С3-С6циклоалкила, амино, С6-С10арила, 5-10-членного гетероарила и 5-10-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С6алкил, и
две или более чем две соседние группы могут быть объединены друг с другом с образованием незамещенного ароматического углеводородного кольца, где это ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S, или С6-С10арильное кольцо, и
n представляет собой целое число 0, 1 или 2; и
L представляет собой CH2, NH или О; и
 может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, 5-10-членного гетероарила, -C(=O)R5, -SO2-R6, и при этом, когда заместитель представляет собой 2 типа или более, две или более чем две соседние группы могут быть объединены друг с другом с образованием 5-10-членного гетероарила или 5-10-членного гетероциклоалкила с
может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, 5-10-членного гетероарила, -C(=O)R5, -SO2-R6, и при этом, когда заместитель представляет собой 2 типа или более, две или более чем две соседние группы могут быть объединены друг с другом с образованием 5-10-членного гетероарила или 5-10-членного гетероциклоалкила с  и
и
при этом C1-С6алкил, C1-С6алкокси или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из гидрокси, галогена, C1-С6алкила, C1-С6алкокси, С3-С8циклоалкила, С6-С10арила, 5-10-членного гетероарила, C(=O)R', C1-С10алкилсульфонила, С6-С10арилокси или незамещенного или замещенного C1-С6алкилом, С6-С10арил-С1-С6алкилом или C1-С6алкилкарбонилом 5-10-членного гетероциклоалкила, и
R3 и R4, каждый независимо, представляют собой водород, тяжелый водород, -C(=O)-Ra, C1-С6алкил или С6-С10арил, и указанный C1-С6алкил или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из галогена, гидрокси, C1-С6алкила, C1-С6алкокси или С6-С10арилокси, и при этом Ra представляет собой водород, тяжелый водород, C1-С6алкил или C1-С6галогеналкил; и
R5 представляет собой -ORb, -NRcRd, C1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С8циклоалкил, и при этом указанный С1-С6алкил, С2-С6алкенил или С2-С6алкинил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из моно-C1-С6алкиламина или ди-С1-С6алкиламина, и Rb, Rc и Rd, каждый независимо, представляют собой водород, тяжелый водород, С6-С10арил или С6-С10арил-С1-С6алкил, и
R6 представляет собой C1-С6алкил, незамещенный или замещенный 1, 2, 3 или 4 типами C1-С6алкила С6-С10арил.
4. Соединение, его стереоизомер или его фармацевтически приемлемая соль по п. 1,
где соединение химической формулы I представляет собой соединение химической формулы I-3, указанной ниже:
Химическая формула I-3
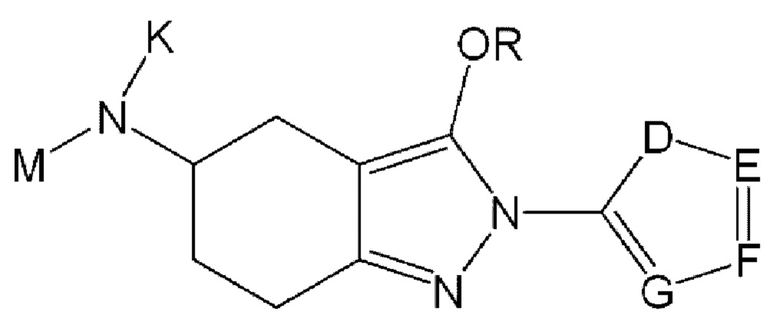
в этой формуле
определение K, М и R такое же, как для химической формулы I; и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, но N, О и S присутствуют в количестве один или более; и
R10-R13 являются одинаковыми или разными и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, C1-С6галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, C1-С10алкокси, C1-С10алкила, С3-С8циклоалкила, амино, С6-С10арила, 5-10-членного гетероарила и 5-10-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С10алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием ароматического углеводородного кольца, где это ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S, или С6-С10арильное кольцо.
5. Соединение, его стереоизомер или его фармацевтически приемлемая соль по п. 1,
где соединение химической формулы I представляет собой соединение химической формулы I-4, указанной ниже:
Химическая формула I-4
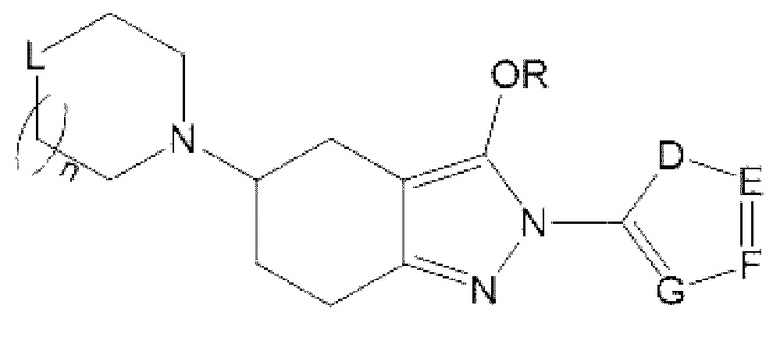
в этой формуле
определение R такое же, как для химической формулы I; и
D представляет собой CR10, N, О или S, или Е представляет собой CR11, N, О или S, или F представляет собой CR12, N, О или S, или G представляет собой CR13, N, О или S, но N, О и S присутствуют в количестве один или более; и
R10-R13 являются одинаковыми или разными и, каждый независимо, могут быть замещены 1, 2, 3 или 4 типами заместителей, состоящих из циано, галогена, C1-С6галогеналкила, нитро, -C(=O)R1, -C(=O)OR1, -NH-C(=O)R1, О-С10алкокси, C1-С10алкила, С3-С8циклоалкила, амино, С6-С10арила, 5-10-членного гетероарила и 5-10-членного гетероциклоалкила, и при этом R1 может представлять собой водород, тяжелый водород, C1-С10алкил; и
две или более чем две соседние группы могут быть объединены друг с другом с образованием ароматического углеводородного кольца, где ароматическое углеводородное кольцо может образовывать 5-10-членное гетероарильное кольцо, содержащее 0, 1, 2 или 3 гетероатома, выбранные из N, О и S, или С6-С10арильное кольцо, и
n представляет собой целое число 0, 1 или 2; и
L представляет собой СН2, NH или О; и
 может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, -C(=O)R5, -SO2-R6, и при этом, когда заместитель представляет собой 2 типа или более, две или более чем две соседние группы могут быть объединены друг с другом с образованием 5-10-членного гетероарила или 5-10-членного гетероциклоалкила с
может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из тяжелого водорода, галогена, циано, нитро, -NR3R4, C1-С6алкила, C1-С6алкокси, С6-С10арила, -C(=O)R5, -SO2-R6, и при этом, когда заместитель представляет собой 2 типа или более, две или более чем две соседние группы могут быть объединены друг с другом с образованием 5-10-членного гетероарила или 5-10-членного гетероциклоалкила с 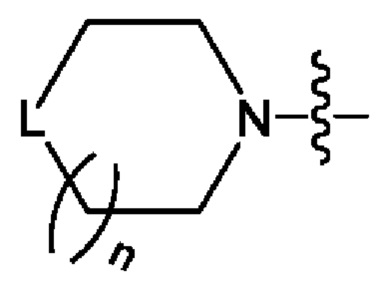 , и
, и
при этом C1-С6алкил, C1-С6алкокси или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из гидрокси, C1-С6алкила, C1-С6алкокси, С6-С10арилокси или незамещенного или замещенного C1-С6алкилом, С6-С10арил-C1-С6алкилом или C1-С6алкилкарбонилом 5-10-членного гетероциклоалкила, и
R3 и R4, каждый независимо, представляют собой водород, тяжелый водород, -C(=O)-Ra, C1-С6алкил или С6-С10арил, и этот C1-С6алкил или С6-С10арил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из галогена, гидрокси, C1-С6алкила, C1-С6алкокси или С6-С10арилокси, и при этом Ra представляет собой водород, тяжелый водород, C1-С6алкил или C1-С6галогеналкил; и
R5 представляет собой -ORb, -NRcRd, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С8циклоалкил, и при этом, C1-С6алкил, С2-С6алкенил или С2-С6алкинил может быть незамещенным или может быть замещен 1, 2, 3 или 4 типами из моно-С1-С6алкиламина или ди-С1-С6алкиламина, и при этом Rb, Rc и Rd, каждый независимо, представляют собой водород, тяжелый водород, С6-С10арил или С6-С10арил-С1-С6алкил, и
R6 представляет собой C1-С6алкил, незамещенный или замещенный 1, 2, 3 или 4 типами C1-С6алкила С6-С10арил.
6. Соединение, его стереоизомер или его фармацевтически приемлемая соль по п. 1,
где соединение, представленное химической формулой I, выбрано из соединений 1-161, указанных ниже:
1) 5-(бензилметиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
2) 5-(бензилциклопропиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
3) 4-{[(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрил;
4) 5-[(4-фторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
5) 5-[(2,4-дифторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
6) 5-[(2-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
7) 5-[(3-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
8) 5-[метил-(4-трифторметилбензил)амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
9) 5-[метил-(3-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
10) 5-[метил-(3-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
11) 5-[метил-(2-трифторметилбензил)-амино]-2-пиридин-2-ил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
12) 5-[(4-метансульфонилбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
13) 5-[(3-метоксибензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
14) 5-пиперидин-1-ил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
15) 5-морфолино-4-ил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
16) 5-(4-метилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
17) 5-(4-(2-(2-гидроксиметокси)этил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
18) 5-(3,4-дигидро-1Н-изохинолин-2-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
19) 5-[(4-хлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
20) 5-(бензилэтиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
21) 5-(бензилпропиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
22) 5-(бензилбутиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
23) 5-[метил(3-метилсульфонилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
24) 5-[метил-(4-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
25) 3-{[(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)метиламино]метил}бензонитрил;
26) 5-[(2-метоксибензил)-метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
27) 5-[(3-фторбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
28) 5-[(4-метоксибензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
29) 5-[метил-(2-метилбензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
30) 5-[(2,4-дихлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
31) 5-[(3,4-дихлорбензил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
32) 5-(3,4-дифторфениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
33) 5-[метил(5,6,7,8-тетрагидрохинолин-8-ил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
34) 5-(((3-(гидроксиметил)-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил)метил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
35) 5-{[(3-(гидроксиметил)-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил)метил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
36) 5-{метил[3-метил-5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
37) 5-{метил[5-(4-метилпиперазин-1-ил)имидазо[1,2-а]пиридин-2-ил]метиламино}-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
38) циклопропил[4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2-индазол-5-ил)пиперазин-1-ил]метанон;
39) 5-(бензилметиламино)-2-(5-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
40) 5-(бензилметиламино)-2-(5-хлорпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
41) 5-(бензилметиламино)-2-(6-(трифторметил)пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-инд азол-3-ол;
42) 5-(бензилметиламино)-2-(6-метилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
43) 5-(бензилметиламино)-2-(3-фторпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
44) 6-(5-(бензилметиламино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)никотинонитрил;
45) 5-(бензилметиламино)-2-(6-метил-4-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
46) 5-(бензиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
47) 2-(пиридин-2-ил)-5-[(пиридин-2-илметил)амино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
48) 5-[метил(пиридин-2-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
49) 5-[метил(пиридин-4-илметил)амино]-2-(5-трифторметилпиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
50) 2-(5-хлорпиридин-2-ил)-5-[метил(пиридин-4-илметил)амино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
51) 5-[метил(пиридин-4-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
52) 2-(4-бромфенил)-5-[метил(пиридин-4-илметил)амино]-4,5,6,7,-тетрагидро-2Н-индазол-3-ол;
53) 5-(бензилметиламино)-2-(тиено[3,2-с]пиридин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
54) 2-(6-аминопиридин-2-ил)-5-(бензилметиламино)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
55) 5-фениламино-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
56) 5-[(2,5-диметилфенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
57) 5-[(4-нитрофенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
58) 5-[(4-метоксифенил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
59) 5-(фениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
60) 2-(пиридин-2-ил)-5-(хинолин-3-иламино)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
61) 5-[метил(нафталин-2-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
62) 5-[(изохинолин-3-илметил)метиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
63) 5-[метил(хинолин-6-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
64) 5-[(изохинолин-3-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
65) 5-[метил(пиридин-2-илметил)амино]-2-фенил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
66) 5-[этил(пиридин-4-илметил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
67) 5-[(3-диметиламинобензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
68) 5-[(4-диметиламинобензил)амино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-2-ол;
69) 5-[(3-диметиламинобензил)метиламино)]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
70) 5-[(4-диметиламино)бензилметиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
71) 5-[(2-диметиламино)бензилметиламино]-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
72) 5-(бензилметиламино)-2-фенил-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
73) 4-[(5-бензилметиламино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил]бензойная кислота;
74) 5-(бензилметиламино)-2-(4-бромфенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
75) 5-(бензилметиламино)-2-(2-хлорфенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
76) 5-(бензилметиламино)-2-(2-метоксифенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
77) 2-(2-хлорфенил)-5-[(3-диметиламинобензил)метиламино]-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
78) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)бензойная кислота;
79) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)бензамид;
80) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)-N-метилбензамид;
81) 4-(((3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)(метил)амино)метил)-N,N-диметилбензамид;
82) 5-(4-метилпиперазин- 1-ил)-2-(5-(трифторметил)пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
83) 2-(6-хлорпиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
84) 2-(6-метил-4-(трифторметил)пиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
85) 5-(4-метилпиперазин-1-ил)-2-(тиено[3,2-с]пиридин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
86) 2-(3-фторпиридин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
87) 2-(пиридин-2-ил)-5-(4-(пиридин-2-илметил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
88) 5-((4-метоксибензил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
89) 1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)бут-2-ен-1-он;
90) 2-(пиридин-2-ил)-5-(4-(хинолин-6-илметил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
91) 5-(4-этилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
92) 5-(фениламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
93) 5-(фенетиламино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
94) 2-(4-хлорфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
95) 5-(4-метилпиперазин-1-ил)-2-(4-(трифторметил)фенил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
96) 2-(пиридин-2-ил)-5-(пирролидин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
97) 1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)проп-2-ен-1-он;
98) (Е)-4-(диметиламино)-1-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)бут-2-ен-1-он;
99) (Е)-4-(диметиламино)-N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-N-метилбут-2-енамид;
100) 5-(4-пропилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
101) 2-(4-бромфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
102) 2-(4-фторфенил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
103) 4-(3-гидрокси-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-2-ил)бензонитрил;
104) 5-(4-фенетилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
105) 5-(4-бензилпиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
106) 5-(4-(циклогексилметил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
107) 5-(4-(3-фенилпропил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
108) 5-(4-метилпиперазин-1-ил)-2-(пиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
109) 5-(пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
110) 5-(4-(метилсульфонил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
111) 5-(4-(фенилсульфонил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
112) 2-(пиридин-2-ил)-5-(4-тозилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
113) 4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-N-фенилпиперазин-1-карбоксамид;
114) бензил-4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-карбоксилат;
115) 2-(1-метил-1Н-пиррол-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
116) 5-(4-метилпиперазин-1-ил)-2-(тиазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
117) 5-(4-метилпиперазин-1-ил)-2-(оксазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
118) 2-(1-метил-1Н-пиразол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
119) 2-(1-метил-1Н-имидазол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
120) 2-(1-метил-1Н-имидазол-5-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
121) 5-(бензил(метил)амино)-2-(пиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
122) 5-(бензил(метил)амино)-2-(1-метил-1Н-пиррол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
123) 5-(бензил(метил)амино)-2-(1-метил-1Н-пиразол-5-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
124) 5-(бензил(метил)амино)-2-(1-метил-1Н-имидазол-5-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
125) 5-(бензил(метил)амино)-2-(оксазол-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
126) 2-(пиридин-2-ил)-5-(4-(пара-толил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
127) 5-(4-(4-гидроксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
128) 5-(4-(3,4-дифторфенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
129) 5-(4-(4-метоксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
130) 1-(4-(4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)фенил)этан-1-он;
131) 5-(4-(4-(метилсульфонил)фенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
132) 5-(4-(4-феноксифенил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
133) 5-(4-(пиперидин-4-илметил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
134) 5-(4-((1-метилпиперидин-4-ил)метил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
135) 5-(4-((1-бензилпиперидин-4-ил)метил)пиперазин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
136) 1-(4-((4-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пиперазин-1-ил)метил)пиперидин-1-ил)этан- 1-он;
137) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)бензамид;
138) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-2-фенилацетамид;
139) 1-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-3-фенилмочевина;
140) 1-бензил-3-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)мочевина;
141) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)бензолсульфонамид;
142) N-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)-4-метилбензолсульфонамид;
143) бензил-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)карбамат;
144) 2-(5-фтор-4-морфолинопиримидин-2-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
145) N-бензил-3-метокси-N-метил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-амин;
146) N-бензил-3-(циклопропилметокси)-N-метил-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-амин;
147) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илциклопропанкарбоксилат;
148) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илакрилат;
149) 5-(бензил(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-илбензоат;
150) 2-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)пиримидин-5-карбоновая кислота;
151) метил-2-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)никотинат;
152) N-(6-(5-(бензил(метил)амино)-3-гидрокси-4,5,6,7-тетрагидро-2Н-индазол-2-ил)пиридин-2-ил)ацетамид;
153) 5-(бензил(метил)амино)-2-(4,6-диметокси-1,3,5-триазин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
154) 5-(4-метилпиперазин-1-ил)-2-(пиримидин-4-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
155) 2-(5-хлорпиридазин-3-ил)-5-(4-метилпиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
156) 2-(пиридин-2-ил)-5-(4-(пиримидин-2-ил)пиперазин-1-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
157) 5-(бензил(метил)амино)-2-(5-нитропиримидин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
158) 5-((4-гидроксибензил)(метил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
159) 5-(метил(4-нитробензил)амино)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол;
160) 5-(3-(этил(метил)амино)пирролидин-1-ил)-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-ол и
161) 2,2,2-трифтор-N-(1-(3-гидрокси-2-(пиридин-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-5-ил)пирролидин-3-ил)ацетамид.
7. Соединение или его соль по п. 1,
где соль находится в форме соли, образованной одним или более типами кислот, выбранных из группы, состоящей из соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, азотной кислоты, уксусной кислоты, метансульфоновой кислоты, пара-толуолсульфоновой кислоты, трифторуксусной кислоты, малеиновой кислоты, янтарной кислоты, щавелевой кислоты, бензойной кислоты, винной кислоты, фумаровой кислоты, миндальной кислоты, пропионовой кислоты, лимонной кислоты, молочной кислоты, гликолевой кислоты, глюконовой кислоты, галактуроновой кислоты, глутаминовой кислоты, глутаровой кислоты, глюкуроновой кислоты, аспарагиновой кислоты, аскорбиновой кислоты, угольной кислоты, ванилиновой кислоты и йодистоводородной кислоты; натриевой соли; калиевой соли; кальциевой соли; соли серебра; гидробромида; гидросульфата; гидрофосфата; дигидрофосфата; сукцината; цитрата; мезилата или тозилата.
8. Фармацевтическая композиция для предупреждения, улучшения течения или лечения заболеваний, связанных с оксидативным стрессом, содержащая соединение или его фармацевтически приемлемую соль по любому из пп. 1-7 в качестве активного ингредиента и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п. 8,
где фармацевтически приемлемый носитель представляет собой один или более типов, выбранных из группы, состоящей из эксципиента, разбавителя, разрыхлителя, связывающего вещества, глиданта, поверхностно-активного вещества, эмульгатора, суспендирующего агента и разбавителя.
| EP 1582517 A1, 05.10.2005 | |||
| JP 2004123700 A, 22.04.2004 | |||
| JP 2005029573 A, 03.02.2005 | |||
| Сушильное устройство | 1927 |
|
SU15675A1 |
| Popova Gergana et al | |||
| Optimization of Tetrahydroindazoles as Inhibitors of Human Dihydroorotate Dehydrogenase and Evaluation of Their Activity and In Vitro Metabolic Stability, Journal of Medicinal Chemistry, 2020/04/23), vol | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2024-04-05—Публикация
2022-02-25—Подача