Данная заявка на патент претендует на приоритет предварительной заявки на патент США № 61/108627, поданной 27 октября 2008 года, содержание которой во всей полноте таким образом введено в данное описание в виде ссылки.
1. ОБЛАСТЬ ТЕХНИКИ
Данное изобретение предоставляет определенные гетероарильные соединения, композиции, включающие эффективное количество одного или нескольких таких соединений, и способы лечения или предупреждения рака, воспалительных, иммунологических, метаболических состояний, а также состояний, которые можно лечить или предотвращать ингибированием киназного метаболического пути, которые включают введение эффективного количества гетероарильного соединения пациенту, нуждающемуся в таком введении.
2. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Связь между патологическим фосфорилированием белка и причиной или следствием заболеваний известна уже в течение более 20 лет. Поэтому протеинкиназы стали очень важной группой мишеней для лекарственных средств (смотрите Cohen, Nature, 1:309-315 (2002)). Различные ингибиторы протеинкиназ нашли клиническое применение для лечения широкого спектра заболеваний, таких как рак и хронические воспалительные заболевания, включая диабет и инсульт (смотрите Cohen, Eur. J. Biochem., 268:5001-5010 (2001)).
Протеинкиназы представляют собой большое семейство различных ферментов, которые катализируют фосфорилирование белков и играют определяющую роль в передаче клеточных сигналов. Протеинкиназы могут оказывать положительные или отрицательные регуляторные эффекты в зависимости от их белка-мишени. Протеинкиназы вовлечены в специфические пути передачи сигнала, которые регулируют клеточные функции, такие как, но без ограничения, метаболизм, последовательность цикла деления клетки, клеточная адгезия, васкулярная функция, апоптоз и ангиогенез. Нарушения функции клеточной передачи сигнала были ассоциированы со множеством заболеваний, наиболее изученными из которых являются рак и диабет. Регуляция трансдукции сигнала цитокинами и ассоциация сигнальных молекул с протоонкогенами и опухоль-подавляющими генами была достаточно подробно описана. Была показана также связь между диабетом и сопутствующими патологическими состояниями и аномальными уровнями протеинкиназ (смотрите, например, Sridhar et al. Pharmaceutical Research, 17(11): 1345-1353 (2000)). Была также показана связь вирусных инфекций и сопутствующих патологических состояний с регуляцией протеинкиназ (смотрите Park et al. Cell 101 (7): 777-787 (2000)).
Протеинкиназы могут быть разделены на основные группы в соответствии с типом аминокислот(ы), которые(ая) являются(ется) их мишенью (серин/треонин, тирозин, лизин и гистидин). Например, тирозинкиназы включают рецепторные тирозинкиназы (receptor tyrosine kinases - RTK), такие как факторы роста, и нерецепторные тирозинкиназы, такие как семейство src киназ. Существуют также протеинкиназы двойной специфичности, мишенью которых являются тирозин и серин/треонин, такие как циклинзависимые киназы (cyclin dependent kinases - CDK) и митоген-активированные протеинкиназы (mitogen-activated protein kinases - MAPK)).
Поскольку протеинкиназы регулируют почти каждый клеточный процесс, включая метаболизм, клеточную пролиферацию, клеточную дифференциацию и клеточное выживание, они привлекают внимание исследователей в качестве мишеней для терапевтического вмешательства при различных болезненных состояниях. Например, контроль клеточного цикла и ангиогенез, в которых протеинкиназы играют основную роль, являются клеточными процессами, ассоциированными с рядом болезненных состояний, такими как, но без ограничения, рак, воспалительные заболевания, патологический ангиогенез и связанные с ним заболевания, атеросклероз, дегенерация желтого пятна, диабет, ожирение и боль.
Протеинкиназы привлекают интерес в качестве мишеней для лечения рака (Fabbro et al., Pharmacology & Therapeutics 93:79-98 (2002)). Было выдвинуто предположение, что вовлечение протеинкиназ в развитие злокачественных опухолей человека может осуществляться посредством (1) перегруппировок геномов (например, BCR-ABL при хроническом миелоидном лейкозе), (2) мутаций, приводящих к конститутивно активной киназной активности, при заболеваниях, таких как острый миелоидный лейкоз и желудочно-кишечные опухоли, (3) дерегуляцией киназной активности активацией онкогенов или потери функций подавления опухоли, например, в карциномах с онкогенными RAS, (4) дерегуляцией киназной активности посредством сверхэкспрессии, как в случае EGFR, и (5) эктопической экспрессией факторов роста, которые могут принимать участие в развитии и поддержании неопластического фенотипа (Fabbro et al., Pharmacology & Therapeutics 93:79-98 (2002)).
Объяснение запутанного переплетения метаболических путей протеинкиназ и сложности взаимосвязи и взаимодействия в ряду протеинкиназ и между различными протеинкиназами и метаболическими путями киназы подчеркивает важность развития фармацевтических средств, способных выступать в качестве модуляторов, регуляторов или ингибиторов протеинкиназ, которые обладают полезной активностью в отношении множества киназ или в отношении множества метаболических путей киназ. Поэтому сохраняется потребность в новых киназных модуляторах.
Белок под названием mTOR (mammalian target of rapamycin - мишень рапамицина у млекопитающих), другими названиями которого являются FRAP, RAFTI или RAPT1, представляет собой 2549-аминокислотную Ser/Thr протеинкиназу, которая, как было показано, является одним из наиболее важных белков в mTOR/PI3K/Akt метаболическом пути, регулирующим рост и пролиферацию клеток (Georgakis and Younes Expert Rev. Anticancer Ther. 6(1): 131-140 (2006)). mTOR существует в двух комплексах: mTORC1 и mTORC2. mTORC1 является чувствительным к аналогам рапамицина (таким как темсиролимус или эверолимус), а mTORC2 в значительной степени нечувствителен к рапамицину. Несколько mTOR ингибиторов прошли или проходят клинические испытания в качестве лекарственных средств для лечения рака. Темсиролимус в 2007 году был разрешен для применения в лечении рака почек, и эверолимус в 2009 году был утвержден для лечения пациентов с раком почек, у которых наблюдалось прогрессирование заболевания при лечении ингибиторами рецепторов факторов роста эндотелиальных сосудов. Кроме того, в 1999 году для предупреждения отторжения почечного трансплантата был резрешен к применению сиролимус. Интересный, но ограниченный клинический успех этих mTORC1 модуляторов показывает применимость ингибиторов mTOR в лечении рака и отторжения трансплантатов, а также повышенный потенциал ингибиторной активности этих соединений в отношении и mTORC1, и mTORC2.
Цитирование или определение любой ссылки в разделе 2 данной заявки не должно рассматриваться как указание на то, что упомянутая ссылка является предшествующим уровнем настоящего изобретения.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
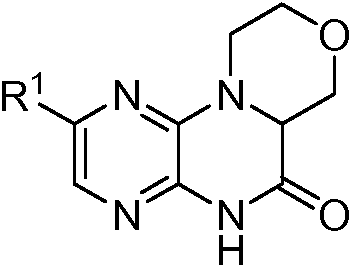
Настоящее изобретение предоставляет соединения общей формулы (I):
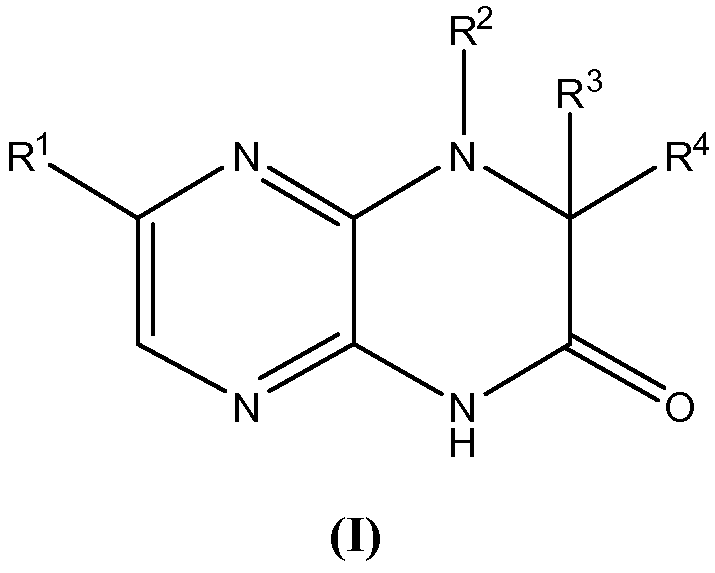
и их фармацевтически приемлемые соли, клатраты, сольваты, таутомеры, стереоизомеры и пролекарства, где R1-R4 принимают значения, определенные в описании.
Изобретение предоставляет также соединения общей формулы (II):

и их фармацевтически париемлемые соли, клатраты, сольваты, таутомеры, стереоизомеры и пролекарства, где R1, R2 и R3 принимают значения, определенные в описании.
Соединения формул (I) и (II) или их фармацевтически приемлемые соли, клатраты, сольваты, гидраты, стереизомеры, таутомеры или пролекарства (которые в данном описании называются «гетероциклические соединения») применимы для лечения или предупреждения рака, воспалительных состояний, иммунологических состояний, нейродегенеративных заболеваний, диабета, ожирения, неврологических расстройств, возрастных заболеваний и сердечнососудистых состояний, а также состояний, которые могут лечиться или предупреждаться ингибированием киназного метаболического пути. В одном варианте осуществления изобретения киназный метаболический путь представляет собой mTOR/PI3K/Akt метаболический путь. В другом варианте осуществления изобретения киназный метаболический путь представляет собой PI3Kα, PI3Kβ, PI3Kδ, KDR, GSK3α, GSK3β, ATM, ATX, ATR, cFMS и/или DNA-PK метаболический путь.
Изобретение предоставляет также композиции, включающие эффективное количество гетероарильного соединения, а также композиции, включающие эффективное количество гетероарильного соединения и фармацевтически приемлемый носитель или наполнитель. Композиции могут применяться для лечения или предупреждения рака, воспалительных состояний, иммунологических состояний, нейродегенеративных заболеваний, диабета, ожирения, неврологических расстройств, возрастных заболеваний или сердечнососудистых состояний, а также состояний, которые могут лечиться или предупреждаться ингибированием киназного метаболического пути, в одном варианте осуществления изобретения mTOR/PI3K/Akt метаболического пути.
Изобретение предоставляет также способы лечения или предупреждения рака, воспалительных состояний, иммунологических состояний, нейродегенеративных заболеваний, диабета, ожирения, неврологических расстройств, возрастных заболеваний или сердечнососудистых состояний, а также состояний, которые можно лечить или предотвращать ингибированием киназного метаболического пути, в одном варианте осуществления изобретения mTOR/PI3K/Akt метаболического пути, указанные способы включают введение эффективного количества гетероарильного соединения пациенту, нуждающемуся в лечении или предупреждении указанного заболевания.
Изобретение предоставляет также способы ингибирования киназы в клетке, экспрессирующей указанную киназу, способы включают контактирование клетки с эффективным количеством гетероарильного соединения, как описано в изобретении. В одном варианте осуществления изобретения киназа представляет собой mTOR, DNA-PK или PI3K или их сочетание.
Варианты осуществления настоящего изобретения могут быть более полно объяснены с помощью подробного описания и примеров, которые предназначены для иллюстрации вариантов осуществления изобретения, но не ограничивают его область.
4. ПОДРОБНОЕ ОПИСАНИЕ
4.1. Определения
«Алкильная» группа является насыщенным, частично насыщенным или ненасыщенным углеводородом с прямой или разветвленной нециклической цепью, содержащей от 1 до 10 атомов углерода, обычно от 1 до 8 атомов углерода или, в некоторых вариантах осуществления изобретения, от 1 до 6, от 1 до 4 или от 2 до 6 атомов углерода. Типичные алкильные группы включают, метил, этил, н-пропил, н-бутил, н-пентил и н-гексил; насыщенные разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и т.п. Примеры ненасыщенных алкильных групп включают, но без ограничения, винил, аллил, -CH=CH(CH3), -CH=C(CH3)2, -C(CH3)=CH2, -C(CH3)=CH(CH3), -C(CH2CH3)=CH2, -C≡CH, -C≡C(CH3), -C≡C(CH2CH3), -CH2C≡CH, -CH2C≡C(CH3) и -CH2C≡C(CH7CH3) и др. Алкильная группа может быть замещенной или незамещенной.
«Циклоалкильная» группа представляет собой насыщенную, частично насыщенную или ненасыщенную циклическую алкильную группу, содержащую от 3 до 10 атомов углерода и включающую единственное циклическое кольцо или множество конденсированных или связанных мостиковыми связями колец, которые могут быть необязательно замещенными от 1 до 3 алкильными группами. В некоторых вариантах осуществления изобретения циклоакликльная группа содержит от 3 до 8 членов в кольце, в то время как в других вариантах осуществления изобретения количество атомов углерода в кольце находится в интервале от 3 до 5, от 3 до 6 или от 3 до 7. Такие циклоалкильные группы включают, например, структуры с единственным кольцом, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, 1-метилциклопропил, 2-метилциклопентил, 2-метилциклооктил и т.п., или кольцевые структуры со множество конденсированных колец или колец, соединенных мостиковыми связями, таких как адамантил и т.п. Примеры ненасыщенных циклоалкильных групп включают циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил, гексадиенил и др. Циклоалкильная группа может быть зкамещенной или незамещенной. Такие замещенные циклоалкильные группы включают, например, циклогексанон и т.п.
«Арильная» группа представляет собой ароматическую карбоциклическую группу, содержащую от 6 до 14 атомов углерода и включающую единственный цикл (например, фенил) или несколько конценсировнных циклов (например, нафтил или антрил). В некоторых вариантах осуществления изобретения арильные группы содержат 6-14 атомов углерода, в других вариантах осуществления изобретения - от 6 до 12 или даже от 6 до 10 атомов углерода в циклических частях групп. Конкретные примеры арила включают фенил, бифенил, нафтил и т.п. Арильная группа может быть замещенной или незамещенной. Термин «арильные группы» включает также группы, содержащие конденсированные циклы, такие как конденсированные ароматические циклические системы (например, инданил, тетрагидронафтил и т.п.).
«Гетероарильная группа» представляет собой арильную циклическую систему, содержащую от одного до четырех гетероатомов в циклах гетероароматической циклической системы, остальные атомы которой представляют собой атомы углерода. В некоторых вариантах осуществления изобретения гетероарильные группы содержат от 5 до 6 атомов в цикле, в других - от 6 до 9 или даже от 6 до 10 атомов в циклических частях групп. Подходящие гетероатомы включают атомы кислорода, серы и азота. В некоторых вариантах осуществления изобретения гетероарильная циклическая система является моноциклической или бициклической. Примеры гетероарильных групп включают, но без ограничения, пирролил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, пиролил, пиридил, пиридазинил, пиримидинил, пиразинил, тиофенил, бензотиофенил, фуранил, бензофуранил (например, изобензофуран-1,3-диимин), индолил, азаиндолил (например, пирролопиридил или 1H-пирроло[2,3-b]пиридил), индазолил, бензимидазолил (например, 1H-бензо[d]имидазолил), имидазопиридил (например, азабензимидазолил, 3H-имидазо[4,5-b]пиридил или 1H-имидазо[4,5-b]пиридил), пиразолопиридил, триазолопиридил, бензотриазолил, бензоксазолил, бензотиазолил, бензотиадиазолил, изоксазолопиридил, тианафталинил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, тетрагидрохинолинил, хиноксалинил и хиназолинил.
«Гетероциклил» представляет собой ароматический (называемый также гетероарилом) или неароматический циклоалкил, в котором от одного до четырех атомов углерода в цикле независимо замещены гетероатомом из группы, включающей атомы О, S и N. В некоторых вариантах осуществления изобретения гетероциклические группы включают от 3 до 10 атомов в цикле, в то время как другие гетероциклические группы содержат от 3 до 5, от 3 до 6 или от 3 до 8 атомов в цикле. Гетероциклилы могут присоединяться к другим группам через любой атом цикла (то есть через любой атом углерода или гетероатом гетероциклического кольца). Гетероциклоалкильная группа может быть замещенной или незамещенной. Гетероциклильные группы включают ненасыщенные, частично насыщенные или насыщенные циклические системы, такие как, например, имидазолильная, имидазолинильная и имидазолидинильная группы. Термин «гетероциклил» включает конденсированные циклические группы, в том числе конденсированные ароматические и неароматические группы, такие как, например, бензотриазолил, 2,3-дигидробензо[1,4]диоксинил и бензо[1,3]диоксолил. Данный термин включает также мостиковые полициклические кольцевые системы, содержащие гетероатом, такие как, но без ограничения, хинуклидил. Типичные примеры гетероциклильной группы включают, но без ограничения, азиридинил, азетидинил, пирролидил, имидазолидинил, пиразолидинил, тиазолидинил, тетрагидротиофенил, тетрагидрофуранил, диоксолил, фуранил, тиофенил, пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, тетрагидропиранил (например, тетрагидро-2H-пиранил), тетрагидротиопиранил, оксатиан, диоксил, дитианил, пиранил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, дигидропиридил, дигидродитиинил, дигидродитионил, гомопиперазинил, хинуклидил, индолил, индолинил, изоиндолил, азаиндолил (пирролопиридил), индазолил, индолизинил, бензотриазолил, бензимидазолил, бензофуранил, бензотиофенил, бензтиазолил, бензоксадиазолил, бензоксазинил, бензодитиинил, бензоксатиинил, бензотиазинил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензо[1,3]диоксолил, пиразолопиридил, имидазопиридил (азабензимидазолил; например, 1H-имидазо[4,5-b]пиридил или 1H-имидазо[4,5-b]пиридин-2(3H)-онил), триазолопиридил, изоксазолопиридил, пуринил, ксантинил, аденинил, гуанинил, хинолинил, изохинолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, птеридинил, тианафталенил, дигидробензотиазинил, дигидробензофуранил, дигидроиндолил, дигидробензодиоксинил, тетрагидроиндолил, тетрагидроиндазолил, тетрагидробензимидазолил, тетрагидробензотриазолил, тетрагидропирролопиридил, тетрагидропиразолопиридил, тетрагидроимидазопиридил, тетрагидротриазолопиридил и тетрагидрохинолинил. Типичные замещенные гетероциклические группы могут быть монозамещенными или содержать более одного заместителя, например, но без ограничения, пиридильная или морфолинильная группы, которые являются 2-, 3-, 4-, 5- или 6-замещенными или дизамещенными различными заместителями, такими как описанные ниже заместители.
«Циклоалкилалкильная» группа представляет собой радикал формулы -алкил-циклоалкил, где алкил и циклоалкил представляют собой группы, определенные выше. Замещенные циклоалкилалкильные группы могут быть замещенными на алкильном, циклоалкильном или на алкильном и циклоалкильном фрагментах данной группы. Типичные циалоалкилалкильные группы включают, но без ограничения, циклопентилметил, циклопентилэтил, циклогексилметил, циклогексилэтил и циклогексилпропил. Типичные замещенные циклоалкилалкильные группы могут быть монозамещенными или содержать более одного заместителя.
«Аралкильная» группа представляет собой радикал формулы -алкил-арил, где алкил и арил представляют собой группы, определенные выше. Замещенные аралкильные группы могут быть замещенными по алкильному, арильному или алкильному и арильному фрагментам группы. Типичные аралкильные группы включают, но без ограничения, бензильную и фенэтильную группы и конденсированные (циклоалкиларил)алкильные группы, такие как 4-этилинданил.
«Гетероциклилалкильная» группа представляет собой радикал формулы -алкил-гетероциклил, где алкил и гетероциклил представляют собой группы, определенные выше. Замещенные гетероциклилалкильные группы могут быть замещенными по алкильному, гетероциклильному или алкильному и гетероциклильному фрагментам группы. Типичные гетероциклилалкильные группы включают, но без ограничения, 4-этилморфолинил, 4-пропилморфолинил, фуран-2-илметил, фуран-3-илметил, пиридин-3-илметил, (тетрагидро-2Н-пиран-4-ил)метил, (тетрагидро-2Н-пиран-4-ил)этил, тетрагидрофуран-2-илметил, тетрагидрофуран-2-илэтил и индол-2-илпропил.
«Галоген» представляет собой фтор, хлор, бром или йод.
«Гидроксиалкильная» группа представляет собой алкильную группу, которая определена выше, замещенную одной или несколькими гидроксильными группами.
«Алкоксигруппа» представляет собой -О-(алкил), где алкил представляет собой группу, определенную выше.
«Алкоксиалкильная» группа представляет собой -(алкил)-О-(алкил), где алкил представляет собой группу, определенную выше.
«Аминогруппа» представляет собой радикал формулы -NH2.
«Алкиламиногруппа» представляет собой радикал формулы -NH-алкил или -N(алкил)2, где каждый алкил независимо представляет собой группу, определенную выше.
«Карбоксигруппа» представляет собой радикал формулы -С(О)ОН.
«Аминокарбонильная» группа представляет собой радикал формулы -С(О)N(R#)2, -C(O)NH(R#) или -C(O)NH2, где каждый R# независимо представляет собой замещенную или незамещенную алкильную, циклоалкильную, арильную, аралкильную, гетероциклильную или гетероцикоалкильную группу, которые определены выше.
«Ациламиногруппа» представляет сбой радикал формулы -NHC(O)(R#) или -N(алкил)C(O)(R#), где каждый алкил и R# независимо представляют собой группы, определенные выше.
«Алкилсульфониламиногруппа» представляет собой радикал формулы -NHSO2(R#) или -N(алкил)SO2(R#), где каждый алкил и R# представляют собой группы, определенные выше.
«Мочевинная» или карбаминная группа представляет собой радикал формулы -N(алкил)C(O)N(R#)2, -N(алкил)C(O)NH(R#), -N(алкил)C(O)NH2, -NHC(O)N(R#)2, -NHC(O)NH(R#) или -NH(CO)NHR#, где каждый алкил и R# независимо представляют собой группы, определенные выше.
В одном варианте осуществления изобретения, когда группы, определенные в данном описании, называются «замещенными», они могут быть замещенными любым подходящим заместителем или заместителями. Типичными примерами заместителей являются заместители, указанные в типичных соединениях и вариантах осуществления изобретения, описанных в данном изобретении, а также галоген (хлор, йод, бром или фтор); алкил; гидроксил; алкокси; алкоксиалкил; амино; алкиламино; карбокси; нитро; циано; тиольная группа; простая тиоэфирная группа; имин; имид; амидин; гуанидин; енамин; аминокарбонил; ациламино; фосфонато; фосфин; тиокарбонил; сульфонил; сульфон; сульфонамид; кетон; альдегид; сложноэфирная группа; карбамид; уретан; оксим; гидроксиламин; алкоксиамин; аралкоксиамин; N-оксид; гидразин; гидразид; гидразон; азид; изоцианат; изотиоцианат; цианат; тиоцианат; кислород (=О); B(OH)2, O(алкил)аминокарбонил; циклоалкил, который может быть моноциклической или конденсированной либо неконденсированной полициклической группой (например, циклопропил, циклобутил, циклопентил или циклогексил), или гетероциклильная группа, которая может быть моноциклической или конденсированной либо неконденсированной полициклической (например, пирролидил, пиперидил, пиперазинил, морфолинил или тиазинил); моноциклическая или конденсированная либо неконденсированная полициклическая арильная или гетероарильная группа (например, фенил, нафтил, пирролил, индолил, фуранил, тиофенил, имидазолил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, пиразолил, пиридинил, хинолинил, изохинолинил, акридинил, пиразинил, пиридазинил, пиримидинил, бензимидазолил, бензотиофенил или бензофуранил); арилокси; аралкилокси; гетеоциклилокси; и гетероциклилалкокси.
Термин «фармацевтически приемлемая(ые) соль(и)», когда используется в настоящем изобретении, относится к соли, полученной из фармацевтически приемлемой нетоксичной кислоты или фармацевтически приемлемого нетоксичного основания, включая неорганическую кислоту и основание и органическую кислоту и основание. Подходящие фармацевтически приемлемые основно-аддитивные соли гетероарильных соединений включают, но без ограничения, соли металлов, таких как алюминий, кальций, литий, магний, калий, натрий и цинк, или органические соли, полученные из лизина, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метилглюкамина) и прокаина. Подходящие нетоксичные кислоты включают, но без ограничения, неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глютаминовая, гликолевая, бромистоводородная, хлористоводородная, изетионовая, молочная, яблочная, малеиновая, миндальная, метансульфоновая, слизевая, азотная, памоиновая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, сукциновая, сульфаниловая, серная, винная и п-толуолсульфоновая кислоты. Характерные нетоксичные кислоты включают хлористоводородную, бромистоводородную, фосфорную, серную и метансульфоновую кислоты. Таким образом, конкретные примеры солей включают гидрохлоридные и мезилатные соли. Другие соли, хорошо известные в данной области техники, представлены, например, в Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990); или Remington: The Science and Practice of Pharmacy, 19th eds., Mack Publishing, Easton PA (1995).
Термин «клатрат», когда используется в данном описании, за исключением особо оговоренных случаев, означает гетероарильное соединение или его соль, структура которого представлена в форме кристаллической решетки, которая содержит пространства (например, каналы), в которые включены внедренные в решетку молекулы (например, растворителя или воды), или в форме кристаллической решетки, в которую включены внедренные молекулы гетероарильного соединения.
Термин «сольват», когда используется в данном описании, за исключением особо оговоренных случаев, означает гетероарильное соединение или его соль, которое дополнительно включает стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. В одном варианте осуществления изобретения сольват представляет собой гидрат.
Термин «гидрат», когда используется в данном описании, за исключением особо оговоренных случаев, означает гетероарильное соединение или его соль, которое дополнительно включает количество воды, связанной нековалентными межмолекулярными силами.
Термин «пролекарство», когда используется в данном описании, за исключением особо оговоренных случаев, означает производное гетероарильного соединения, которое может гидролизоваться, окисляться или иным образом взаимодействовать в биологических условиях (in vitro или in vivo) с получением активного соединения, в частности, гетероарильного соединения. Примеры пролекарств включают, но без ограничения, производные или метаболиты гетероарильного соединения, которые включают разлагаемые биологическим способом фрагменты, такие как способные гидролизоваться биологическим способом амиды, способные гидролизоваться биологическим способом сложные эфиры, способные гидролизоваться биологическим способом карбаматы, способные гидролизоваться биологическим способом карбонаты, способные гидролизоваться биологическим способом уреиды и способные гидролизоваться биологическим способом фосфатные аналоги. В некоторых вариантах осуществления изобретения пролекарства соединений с карбоксильными функциональными группами представляют собой низшие алкиловые эфиры карбоновой кислоты. Сложные карбоксилатные эфиры удобно получают этерификацией любых фрагментов карбоновых кислот в молекуле. Пролекарства обычно могут быть получены с использованием хорошоизвестных способов, таких как описанные в публикациях Burger's Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и Design and Application of Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh).
Термин «стереоизомер» или «стереомерно чистый», когда используется в данном описании, за исключением особо оговоренных случаев, означает один стереоизомер гетероарильного соединения, который по существу свободен от других стереоизомеров данного соединения. Например, стереомерно чистое соединение, содержащее один хиральный центр, должно быть по существу свободно от зеркального антипода энантиомера данного соединения. Стереомерно чистое соединение, содержащее два хиральных центра, должно быть по существу свободно от других диастереомеров соединения. Типичное стереомерно чистое соединение включает более чем примерно 80% по массе одного стереоизомера соединения и менее чем примерно 20% по массе других стереоизомеров соединения, более чем примерно 90% по массе одного стереоизомера соединения и менее чем примерно 10% по массе других стереоизомеров соединения, более чем примерно 95% по массе одного стереоизомера соединения и менее чем примерно 5% по массе других стереоизомеров соединения, или более чем примерно 97% по массе одного стереоизомера соединения и менее чем примерно 3% по массе других стереоизомеров соединения. Гетероарильные соединения могут содержать хиральные центры и могут существовать в виде рацетамов, отдельных энантиомеров или диастереомеров и их смесей. Все такие изомерные формы охватываются вариантами осуществления изобретения, раскрытые в данном описании, включая их смеси. Применение стереомерно чистых форм таких гетероарильных соединений, а также применение смесей этих форм также охватывается вариантами осуществления изобретения, раскрытыми в данном описании. Например, смеси, включающие равные или неравные количества энантиомеров конкретного гетероарильного соединения, могут примеряться в способах и композициях, раскрытых в данном изобретении. Указанные изомеры могут быть получены асимметричным синтезом или разделением смесей с использованием стандартных методик, таких как хиральная колоночная хроматография или применение агентов хирального разделения (смотрите, например, Jacques, J., et al., Enantiomers, Racemates and Resolutions (Wiley-Interscience, New York, 1981); Wilen, S.H., et el., Tetrahedron 33:2725 (1977); Eliel, E.L., Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen, S.H., Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN, 1972).
Следует также отметить, что гетероарильные соединения могут включать Е- и Z-изомеры или их смеси, а также цис- и транс-изомеры или их смеси. В определенных вариантах осуществления изобретения гетероарильные соединения выделены в форме цис- или транс-изомера. В других вариантах осуществления изобретения гетероарильные соединения представляют собой смесь цис- и транс-изомеров.
Термин «таутомеры» относится к изомерным формам соединения, которые находятся в равновесном состоянии относительно друг друга. Концентрации изомерных форм будут зависеть от окружающей среды, в которой находится соединение, и могут быть различными в зависимости, например, от того, представлено ли соединение в твердой форме либо в растворе в органическом растворителе или в водной среде. Например, в водном растворе пиразолы могут давать представленные ниже изомерные формы, которые являются таутомерами
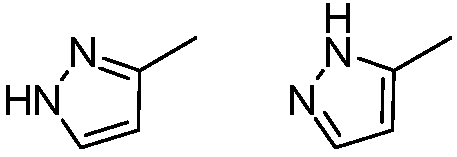 .
.
Специалисту в данной области техники понятно, что таутомерия характерна для широкого спектра функциональных групп и других структур, и все таутомеры соединений формулы (I) или формулы (II) включены в область настоящего изобретения.
Следует также подчеркнуть, что гетероарильные соединения могут содержать некоторое количество не встречающихся в природе атомных изотопов одного или нескольких атомов. Например, соединения могут быть помечены радиоактивными изотопами, такими как, например, тритий (3Н), йод-125 (125I), сера-35 (35S) или углерод-14 (14C), или обогащены изотопами, такими как дейтерий (2H), углерод-13 (13C) или азот-15 (15N). Термин «изотополог», когда используется в данном изобретении, относится к изотопно обогащенному соединению. Термин «изотопно обогащенный» относится к атому, изотопный состав которого отличен от природного изотопного состава данного элемента. Термин «изотопно обогащенное» может относиться к соединению, содержащему, по меньшей мере, один атом, с изотопным составом, отличным от природного изотопного состава данного элемента. Термин «изотопный состав» относится к каждому изотопу, присутствующему для данного элемента. Меченные радиоактивной меткой и изотопно обогащенные соединения могут применяться в качестве терапевтических средств, например, терапевтических средств для лечения рака и воспалительного состояния, в качестве реагентов, используемых для исследований, например, в качестве реагентов в опытах связывания, и в качестве диагностических реагентов, например, in vivo реагентов визуализации. Все изотопные разновидности гетероарильных соединений, которые описаны в изобретении, независимо от того, являются ли они меченными радиоактивными метками или нет, включены в область вариантов осуществления изобретения, представленных в данном описании. В некоторых вариантах осуществления изобретения представлены изотопологи гетероарильных соединений, например, изотопологи, которые представляют собой обогащенные дейтерием, углеродом-13 или азотом-15 гетероарильные соединения.
Термин «лечение», когда используется в данном описании, означает облечение, в целом или частично, симптомов, связанных с расстройством или заболеванием, или замедление или остановку прогрессирования или усугубления этих симптомов, или предотвращение или предупреждение заболевания или расстройства у пациента при существовании риска развития заболевания или расстройства.
Термин «эффективное количество», относящийся к гетероарильному соединению, означает количество, которое может облегчать в целом или частично симптомы, связанные с расстройством или заболеванием, или замедлять или останавливать дополнительные прогрессирования или усугубление этих симптомов, или предупреждать или предотвращать заболевание или расстройство у пациента при существовании риска развития заболевания или расстройства, которые описаны в изобретении, такого как рак, воспалительные состояния, иммунологические состояния, нейродегенеративные заболевания, диабет, ожирение, неврологические расстройства, возрастные заболевания или сердечнососудистые состояния, а также состояния, которые можно лечить или предотвращать ингибированием киназного метаболического пути, например, mTOR/PI3K/Akt метаболического пути. В одном варианте осуществления изобретения эффективное количество гетероарильного соединение представляет собой количество, которое ингибирует киназу в клетке, например, в опыте in vitro или in vivo. В одном варианте осуществления изобретения киназа представляет собой mTOR, DNA-PK, PI3K или их сочетание. В некоторых вариантах осуществления изобретения эффективное количество гетероарильного соединения ингибирует киназу в клетке на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 99% по сравнению с активностью киназы в необработанной клетке. Эффективное количество гетероарильного соединения, например, в фармацевтической композиции, может быть таким, которое будет обеспечивать желательный эффект, например, от примерно 0,005 мг/кг массы тела пациента до примерно 100 мг/кг массы тела пациента в стандартной дозе для перорального и парентерального введения. Как будет понятно специалисту в данной области техники, подразумевается, что эффективное количество гетероарильного соединения, описанного в данном изобретении, будет зависеть от симптома, подлежащего лечению, например, очевидно, что эффективное количество гетероарильного соединения для лечения пациентов, страдающих воспалительными состояниями, или пациентов с риском развития таких состояний должно отличаться от эффективного количества соединения для лечения пациентов, страдающих другим расстройством, например, раком или метаболическим расстройством, или пациентов с риском развития этих расстройств.
Термин «пациент» включает животное, в том числе, но без ограничения, такое как корова, обезьяна, лошадь, овца, свинья, цыпленок, индейка, перепелка, кошка, собака, мышь, крыса, кролик или морская свинка, в одном варианте осуществления изобретения это млекопитающее, в другом варианте осуществления изобретения - человек.
Термин «рак» относится к любой из разновидностей злокачественных опухолей, характеризующейся пролиферацией клеток, которые могут поражать окружающую ткань и метастазировать в новые сайты организма. Как доброкачественные, так и злокачественные опухоли классифицируются в соответствии с типом ткани, в которой они обнаружены. Например, фибромы представляют собой неоплазмы фиброзной соединительной ткани, а меланомы представляют собой патологические разрастания пигментных клеток (меланина). Злокачественные опухоли, образующиеся из эпителиальной ткани, например, в коже, бронхах и желудке, называются карциномами. Злокачественные опухоли эпителиальной гландулярной ткани, которые обнаруживаются в молочной железе, предстательной железе и ободочной кишке, известны как аденокарциномы. Злокачественные разрастания соединительной ткани, например, мышечной, хрящевой или лимфоидной, а также кости, называются саркомами. Лимфомы и лейкозы представляют собой злокачественные опухоли, возникающие в лейкоцитах. Посредством процесса метастазирования миграция опухолевых клеток приводит к образованию опухолей в других областях организма на удалении от места их начального появления. Костные ткани являются одним из наиболее предпочтительных сайтов метастаз злокачественных опухолей, встречающихся приблизительно в 30% всех случаев рака. Среди злокачественных опухолей, рак легкого, молочной железы, предстательной железы и т.п., как известно, с определенной вероятностью дают метастазы в кость.
Ингибирование опухоли, рака, роста опухоли или роста опухолевой клетки может быть оценено замедлением появления первичных или вторичных опухолей, замедлением развития первичных или вторичных опухолей, снижением возникновения первичных или вторичных опухолей, замедленным появлением вторичных эффектов заболевания или снижением их тяжести, остановкой роста опухоли и регрессом опухолей и т.д. Термин «полное ингибирование» в данном описании означает предотвращение возникновения опухоли или химиопрофилактику. В данном контексте термин «предупреждение (профилактика)» включает любое предотвращение появления клинически неопровержимой неоплазии в целом или предотвращение появления преклинических неопровержимой стадии неоплазии у пациентов с риском развития данного заболевания. Кроме того подразумевается, что данное определение включает предотвращение трансформации клеток в состоянии злокачественного перерождения в клетки злокачественного новообразования или остановку или полную остановку развития клеток в состоянии злокачественного перерождения до клеток злокачественного новообразования. Данное определение включает профилактическое лечение пациентов с риском развития неоплазии.
4.2. Гетероарильные соединения
Настоящее изобретение предоставляет соединения общей формулы (I):
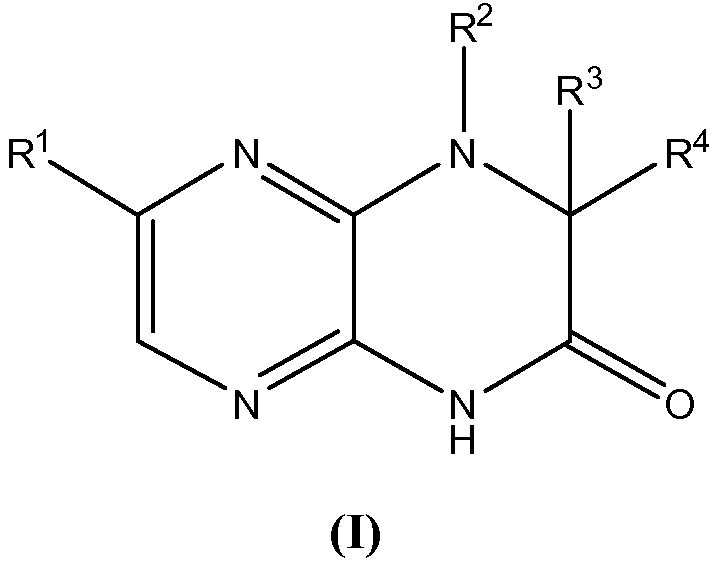
и их фармацевтически приемлемые соли, клатраты, сольваты, стереоизомеры, таутомеры и пролекарства, где:
R1 представляет собой замещенный или незамещенный C1-8 алкил, замещенный или незамещенный арил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил;
R2 представляет собой H, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный аралкил или замещенный или незамещенный циклоалкилалкил;
R3 и R4, каждый независимо представляет собой H, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный арил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный аралкил, замещенный или незамещенный циклоалкилалкил, или R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный циклоалкил или замещенный или незамещенный гетероциклил;
или R2 и один из R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероциклил;
при условии, что соединение не является соединением, представленным ниже, а именно:

6-(4-гидроксифенил)-4-(3-метоксибензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;

6-(4-(1H-1,2,4-триазол-5-ил)фенил)-3-(циклогексилметил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он; или
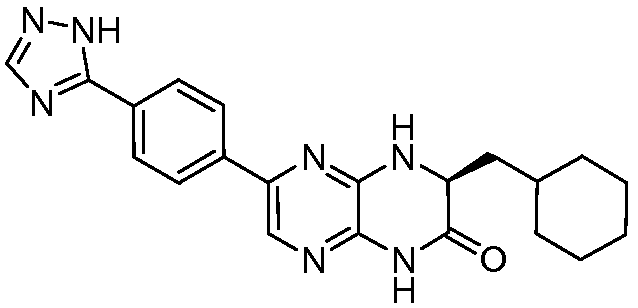
(R)-6-(4-(1H-1,2,4-триазол-5-ил)фенил)-3-(циклогексилметил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он.
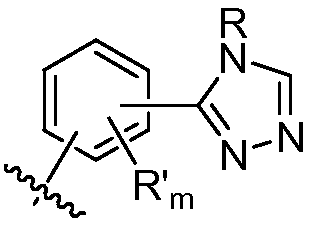
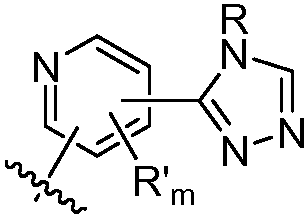
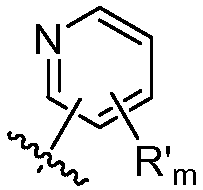
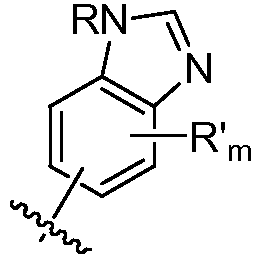
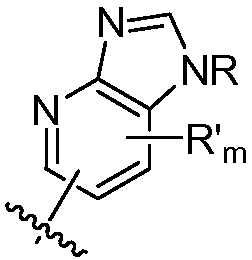
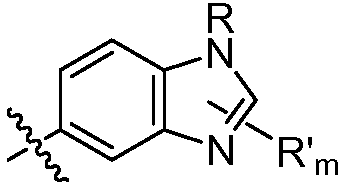
В некоторых вариантах осуществления соединений формулы (I) R1 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил. В одном варианте осуществления R1 представляет собой фенил, пиридил, пиримидил, бензимидазолил, индолил, индазолил, 1H-пирроло[2,3-b]пиридил, 1H-имидазо[4,5-b]пиридил, 1H-имидазо[4,5-b]пиридин-2(3H)-онил, 3H-имидазо[4,5-b]пиридил или пиразолил, каждый из которых является необязательно замещенным. В некоторых вариантах осуществления R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил (например, метил), замещенный или незамещенный гетероциклил (например, замещенный или незамещенный триазолил или пиразолил), галоген (например, фтор), аминокарбонил, циано, гидроксиалкил (например, гидроксипропил) и гидроксильную группу. В других вариантах осуществления R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил, замещенный или незамещенный гетероциклил (например, замещенный или незамещенный триазолил), галоген, аминокарбонил, циано, гидроксиалкил, -OR и -NR2, где каждый R независимо представляет собой H или замещенный или незамещенный C1-4 алкил. В других вариантах осуществления R1 представляет собой 1H-пирроло[2,3-b]пиридил или бензимидазолил, каждый из которых является необязательно замещенным одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил и -NR2, где каждый R независимо представляет собой H или замещенный или незамещенный C1-4 алкил.
В некоторых вариантах осуществления соединений формулы (I) R1 представляет собой
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  или
или
 ;
;
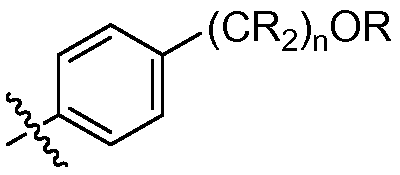
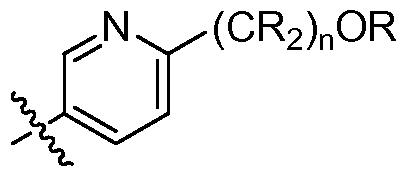
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил (например, метил); R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил, галоген (например, фтор), циано, -OR или -NR2; m равно 0-3; и n равно 0-3. Специалисту в данной области техники будет понятно, что любой из заместителей R' может присоединяться через любой подходящий атом любого цикла в конденсированных циклических системах. Специалисту в данной области техники также будет понятно, что связь, присоединяющая R1 к основной молекуле (обозначенная разделенной пополам волнистой линией), может присоединяться к любому из атомов в любом из циклов конденсированных циклических систем.
В некоторых вариантах осуществления соединений формулы (I) R1 представляет собой
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил; R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил, галоген, циано, -OR или -NR2; m равно 0-3; и n равно 0-3.
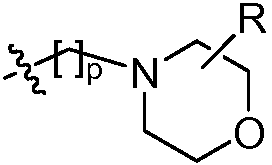
В некоторых вариантах осуществления соединений формулы (I) R2 представляет собой H, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный C1-4 алкилгетероциклил, замещенный или незамещенный C1-4 алкиларил или замещенный или незамещенный C1-4 алкилциклоалкил. Например, R2 представляет собой H, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, (C1-4 алкил)фенил, (C1-4 алкил)циклопропил, (C1-4 алкил)циклобутил, (C1-4 алкил)циклопентил, (C1-4 алкил)циклогексил, (C1-4 алкил)пирролидил, (C1-4 алкил)пиперидил, (C1-4 алкил)пиперазинил, (C1-4 алкил)морфолинил, (C1-4 алкил)тетрагидрофуранил или (C1-4 алкил)тетрагидропиранил, каждый из который является необязательно замещенным.
В других вариантах осуществления R2 представляет собой H, C1-4 алкил, (C1-4 алкил)(OR),
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил (например, метил); R' в каждом случае независимо представляет собой H, -OR, циано или замещенный или незамещенный C1-4 алкил (например, метил); и p равно 0-3.
В некоторых таких вариантах осуществления изобретения R2 представляет собой H, C1-4 алкил, (C1-4 алкил)(OR),
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-2 алкил; R' в каждом случае независимо представляет собой H, -OR, циано или замещенный или незамещенный C1-2 алкил; и p равно 0-1.
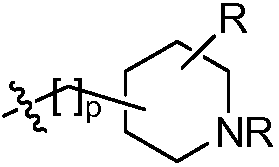
В некоторых других вариантах осуществления соединений формулы (I) R2 и один из R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероциклил. Например, в некоторых вариантах осуществления изобретения соединение формулы (I) представляет собой
 ,
,  ,
,  ,
,
 или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил; R" представляет собой H, OR или замещенный или незамещенный C1-4 алкил; и R1 принимает значения, определенные в описании.
В некоторых вариантах осуществления соединений формулы (I) R3 и R4, оба представляют собой H. В других вариантах один из R3 и R4 представляет собой H, а другой не является H. В других вариантах один из R3 и R4 представляет собой C1-4 алкил (например, метил), а другой представляет собой H. В других вариантах осуществления соединений формулы (I) R3 и R4, оба представляют собой C1-4 алкил (например, метил).
В некоторых таких вариантах осуществления изобретения, описанных выше, R1 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Например, R1 представляет собой фенил, пиридил, пиримидил, бензимидазолил, индолил, индазолил, 1H-пирроло[2,3-b]пиридил, 1H-имидазо[4,5-b]пиридил, 1H-имидазо[4,5-b]пиридин-2(3H)-онил, 3H-имидазо[4,5-b]пиридил или пиразолил, каждый из которых является необязательно замещенным. В некоторых вариантах осуществления изобретения R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил, замещенный или незамещенный гетероциклил, галоген, аминокарбонил, циано, гидроксиалкил и гидроксильную группу. В других вариантах R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей циано, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный гетероциклил, гидроксиалкил, галоген, аминокарбонил, -OR и -NR2, где каждый R независимо представляет собой H или замещенный или незамещенный C1-4 алкил. В других вариантах R1 представляет собой 1H-пирроло[2,3-b]пиридил или бензимидазолил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил и -NR2, где R независимо представляет собой H или замещенный или незамещенный C1-4 алкил.
В некоторых вариантах осуществления изобретения соединения формулы (I) содержат группу R1, определенную в описании, и группу R2, определенную в описании.
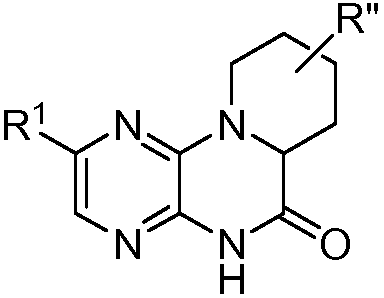
В некоторых вариантах соединений формулы (I) соединение в концентрации 10 мкМ ингибирует mTOR, DNA-PK или PI3K или их сочетание, по меньшей мере, примерно на 50%. Может быть показано, что соединения формулы (I) могут быть ингибиторами киназ, указанных выше, в подходящей системе биологического эксперимента, такой как системы, описанные в примерах данного изобретения.
В некоторых вариантах осуществления изобретения соединение формулы (I) представляет собой следующее соединение:
6-(1H-пирроло[2,3-b]пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((цис-4- метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
4-этил-6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(2-метоксиэтил)-6-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-(1Н-1,2,4-триазол-5-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
5-(8-(2-метоксиэтил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
3-(6-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
3-(6-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензонитрил;
5-(8-(транс-4-метоксициклогексил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
6-(1H-имидазо[4,5-b]пиридин-6-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1H-индазол-6-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
4-((1R,3S)-3-метоксициклопентил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1S,3R)-3-метоксициклопентил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1R,3R)-3-метоксициклопентил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1S,3S)-3-метоксициклопентил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-этил-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(1H-пирроло[2,3-b]пиридин-5-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1H-индол-6-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(1H-индол-5-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
4-(((1R,3S)-3-метоксициклопентил)метил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(((1S,3R)-3-метоксициклопентил)метил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(4-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1R,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1S,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1S,3S)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1R,3R)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1S,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1R,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1R,3S)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1S,3R)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-фтор-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'-((тетрагидро-2H-пиран-4-ил)метил)-1'H-спиро[циклопентан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-он;
7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'-((тетрагидро-2H-пиран-4-ил)метил)-1'H-спиро[циклобутан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-он;
4-(циклопропилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'Η-спиро[циклопентан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Η)-он;
7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'Η-спиро[циклобутан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Η)-он;
7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'Η-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Η)-он;
(R)-6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1H-индазол-5-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
4-(6-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
4-(2-метоксиэтил)-3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-этил-3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(1-гидроксиэтил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-4-метилпиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-4-метилпиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
3,3-диметил-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-2-метилпиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-2-метилпиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(1-гидроксиэтил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,3-диметил-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(цис-4-метоксициклогексил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(транс-4-метоксициклогексил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(2-метоксиэтил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(6-(4H-1,2,4-триазол-3-ил)-3-пиридил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он;
6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
5-(8-(цис-4-метоксициклогексил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-6-метилпиколинонитрил;
6-(6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-3-(2-метоксиацетил)-6,11,4a-тригидропиперазино[1,2-e]пиразино[2,3-b]пиразин-5-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4a-тригидропиперазино[1,2-e]пиразино[2,3-b]пиразин-5-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-3-(2-метоксиэтил)-6,11,4a-тригидропиперазино[1,2-e]пиразино[2,3-b]пиразин-5-он;
4-(циклопентилметил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(6-(4H-1,2,4-триазол-3-ил)-2-метил-3-пиридил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он;
4-(транс-4-гидроксициклогексил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(цис-4-гидроксициклогексил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-3-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(циклопентилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-неопентил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-изобутил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3-метил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(пиперидин-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-3-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
8-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)(3aS,2R)-2-метокси-5,10,3a-тригидропиразино[2,3-b]пирролидино[1,2-e]пиразин-4-он;
8-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)(2R,3aR)-2-метокси-5,10,3a-тригидропиразино[2,3-b]пирролидино[l,2-e]пиразин-4-он;
8-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)(2S,3aR)-2-метокси-5,10,3a-тригидропиразино[2,3-b]пирролидино[1,2-e]пиразин-4-он;
8-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)(2S,3aS)-2-метокси-5,10,3a-тригидропиразино[2,3-b]пирролидино[1,2-e]пиразин-4-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(3-метоксипропил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-3-метил-6,11,4a-тригидропиперазино[1,2-e]пиразино[2,3-b]пиразин-5-он;
9-(4-(4H-1,2,4-триазол-3-ил)фенил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4a-тригидропиперидино[1,2-e]пиразино[2,3-b]пиразин-5-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-фенэтил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(циклогексилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидрофуран-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидрофуран-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-фенил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-[6-(1-гидроксиизопропил)-3-пиридил]-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(2-амино-7-метил-1H-бензо[d]имидазол-5-ил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он;
6-(4-метил-2-(метиламино)-1H-бензо[d]имидазол-6-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
8-(4-(4H-1,2,4-триазол-3-ил)-2-метилфенил)-5,10,3a-тригидропиразино[2,3-b]пирролидино[1,2-e]пиразин-4-он;
6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-метил-1H-бензо[d]имидазол-6-ил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он; или
6-(4-(1H-1,2,4-триазол-5-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он.
Настоящее изобретение предоставляет также соединения общей формулы (II):
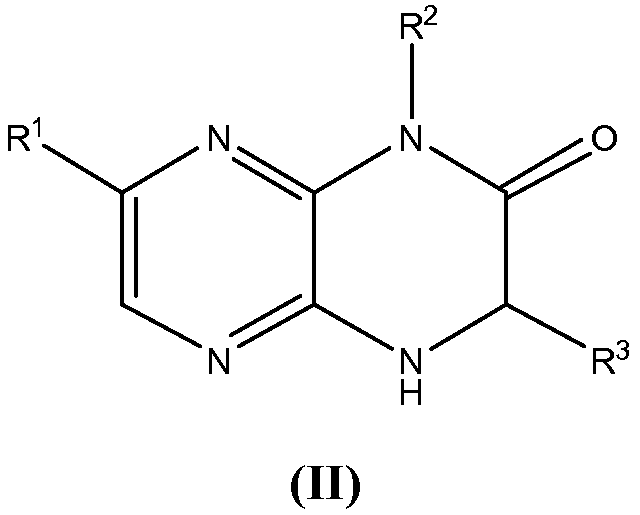
и их фармацевтически приемлемые соли, клатраты, сольваты, стереоизомеры, таутомеры и пролекарства, где
R1 представляет собой замещенный или незамещенный C1-8 алкил, замещенный или незамещенный арил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил или замещенный или незамещенный гетероциклилалкил;
R2 представляет собой H, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный аралкил или замещенный или незамещенный циклоалкилалкил;
R3 представляет собой H или замещенный или незамещенный C1-8 алкил;
при условии, что соединение формулы (II) не является 7-(4-гидроксифенил)-1-(3-метоксибензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-оном, который показан ниже:
 .
.
В некоторых вариантах осуществления соединений формулы (II) R1 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Например, R1 представляет собой фенил, пиридил, пиримидил, бензимидазолил, 1H-пирроло[2,3-b]пиридил, индазолил, индолил, 1H-имидазо[4,5-b]пиридил, 1H-имидазо[4,5-b]пиридин-2(3H)-онил, 3H-имидазо[4,5-b]пиридил или пиразолил, каждый из которых является необязательно замещенным. В некоторых вариантах осуществления R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил (например, метил), замещенный или незамещенный гетероциклил (например, замещенный или незамещенный триазолил или пиразолил), аминокарбонил, галоген (например, фтор), циано, гидроксиалкил и гидроксильную группу. В других вариантах осуществления изобретения R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил (например, метил), замещенный или незамещенный гетероциклил (например, замещенный или незамещенный триазолил), галоген, аминокарбонил, циано, гидроксиалкил (например, гидроксипропил), -OR и -NR2, где каждый R независимо представляет собой H или замещенный или незамещенный C1-4 алкил. В некоторых вариантах осуществления изобретения R1 представляет собой 1H-пирроло[2,3-b]пиридил или бензимидазолил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил и -NR2, где R независимо представляет собой H или замещенный или незамещенный C1-4 алкил.
В некоторых вариантах осуществления изобретения R1 представляет собой
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  или
или
 ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил (например, метил); R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил (например, метил), галоген (например, фтор), циано, -OR или -NR2; m равно 0-3; и n равно 0-3. Специалисту в данной области техники будет понятно, что любой из заместителей R' может присоединяться к любому подходящему атому любого из циклов конденсированных циклических систем.
В некоторых вариантах осуществления соединений формулы (II) R1 представляет собой
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-4 алкил; R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил, галоген, циано, -OR или -NR2; m равно 0-3; и n равно 0-3.
В некоторых вариантах осуществления соединений формулы (II) R2 представляет собой H, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклил, замещенный или незамещенный C1-4 алкилгетероциклил, замещенный или незамещенный C1-4 алкиларил или замещенный или незамещенный C1-4 алкилциклоалкил. Например, R2 представляет собой H, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, (C1-4 алкил)фенил, (C1-4 алкил)циклопропил, (C1-4 алкил)циклобутил, (C1-4 алкил)циклопентил, (C1-4 алкил)циклогексил, (C1-4 алкил)пирролидил, (C1-4 алкил)пиперидил, (C1-4 алкил)пиперазинил, (C1-4 алкил)морфолинил, (C1-4 алкил)тетрагидрофуранил или (C1-4 алкил)тетрагидропиранил, каждый из которых является необязательно замещенным.
В других вариантах осуществления изобретения R2 представляет собой H, C1-4 алкил, (C1-4 алкил)(OR),
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ;
;
где R в каждом случае независимо представляет собой H, или замещенный или незамещенный C1-4 алкил (например, метил); R' в каждом случае независимо представляет собой H, -OR, циано или замещенный или незамещенный C1-4 алкил (например, метил); и p равно 0-3.
В других вариантах осуществлений соединений формулы (II) R2 представляет собой H, C1-4 алкил, (C1-4 алкил)(OR),
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ;
;
где R в каждом случае независимо представляет собой H или замещенный или незамещенный C1-2 алкил; R' в каждом случае независимо представляет собой H, -OR, циано или замещенный или незамещенный C1-2 алкил; и p равно 0-1.
В других вариантах осуществления соединений формулы (II) R3 представляет собой H.
В некоторых таких вариантах, представленных в описании, R1 представляет собой замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Например, R1 представляет собой фенил, пиридил, пиримидил, бензимидазолил, 1H-пирроло[2,3-b]пиридил, индазолил, индолил, 1H-имидазо[4,5-b]пиридин, пиридил, 1H-имидазо[4,5-b]пиридин-2(3H)-онил, 3H-имидазо[4,5-b]пиридил или пиразолил, каждый из которых является необязательно замещенным. В некоторых вариантах R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил, замещенный или незамещенный гетероциклил, аминокарбонил, галоген, циано, гидроксиалкил и гидроксильную группу. В других вариантах R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, замещенный или незамещенный гетероциклил, галоген, аминокарбонил, циано, гидроксиалкил, -OR и -NR2, где каждый R независимо представляет собой H или замещенный или незамещенный C1-4 алкил. В других соединениях R1 представляет собой 1H-пирроло[2,3-b]пиридил или бензимидазолил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил и -NR2, где R независимо представляет собой H, или замещенный или незамещенный C1-4 алкил.
В некоторых вариантах осуществления изобретения соединения формулы (II) содержат группу R1, определенную в описании, и группу R2, определенную в описании.
В некоторых вариантах осуществления соединений формулы (II) соединение в концентрации 10 мкМ ингибирует mTOR, DNA-PK, PI3K или их сочетание, по меньшей мере, примерно на 50%. Может быть показано, что соединения формулы (II) могут быть ингибиторами киназ, указанных выше, в подходящей системе биологического эксперимента, такой как системы, описанные в примерах данного изобретения.
В некоторых вариантах осуществления соединений формулы (II) соединение представляет собой
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-пирроло[2,3-b]пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((цис-4- метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1H-пирроло[3,2-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-бензо[d]имидазол-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-пирроло[2,3-b]пиридин-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индол-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-этил-7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(2-гидроксипиридин-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-изопропил-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
5-(8-изопропил-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
7-(1H-индазол-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(2-аминопиримидин-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(2-аминопиридин-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(6-(метиламино)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-гидроксипиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(4-(1H-пиразол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индазол-4-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индазол-6-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиримидин-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(6-метоксипиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-(2-метоксиэтил)-7-(1H-пирроло[2,3-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1H-пирроло[2,3-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1H-индазол-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиридин-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-аминопиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-метил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
2-(2-гидроксипропан-2-ил)-5-(8-(транс-4-метоксициклогексил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)пиридин 1-оксид;
4-метил-5-(7-оксо-8-((тетрагидро-2H-пиран-4-ил)метил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)пиколинамид;
5-(8-((цис-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
7-(1H-пиразол-4-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-(транс-4-метоксициклогексил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3-((7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-2-оксо-3,4-дигидропиразино[2,3-b]пиразин-1(2H)-ил)метил)бензонитрил;
1-((транс-4-метоксициклогексил)метил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3-(7-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
5-(8-((транс-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
3-((7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-2-оксо-3,4-дигидропиразино[2,3-b]пиразин-1(2H)-ил)метил)бензонитрил;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1R,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1S,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1S,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1R,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индазол-6-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-гидроксициклогексил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(цис-4-гидроксициклогексил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-изопропил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(1H-имидазо[4,5-b]пиридин-6-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((цис-4-метоксициклогексил)метил)-7-(2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-гидроксициклогексил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(цис-4-гидроксициклогексил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(7-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
7-(1H-индазол-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1S,3R)-3-метоксициклопентил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1R,3R)-3-метоксициклопентил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1R,3S)-3-метоксициклопентил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1S,3S)-3-метоксициклопентил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индол-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
1-этил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(1H-индол-6-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((транс-4-метоксициклогексил)метил)-7-(2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(4-метил-2-(метиламино)-1H-бензо[d]имидазол-6-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(7-метил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-бензил-7-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-4-(4H-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(3-фтор-4-(4H-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-метоксициклогексил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(циклопентилметил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
(S)-7-(6-(1-гидроксиэтил)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-7-(6-(1-гидроксиэтил)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(4-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(3-метоксипропил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-метил-2-(метиламино)-1H-бензо[d]имидазол-6-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-амино-4-метил-1H-бензо[d]имидазол-6-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,3-диметил-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-амино-4-метил-1H-бензо[d]имидазол-6-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-4-(1H-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(1H-1,2,4-триазол-5-ил)фенил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(1-гидроксипропан-2-ил)-7-(2-метил-6-(1H-4,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он; или
1-(2-гидроксиэтил)-7-(2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он.
Типичные примеры гетероарильных соединений формулы (I) и формулы (II) представлены в таблице 1.
4.3. Способы получения гетероарильных соединений
Гетероарильные соединения могут быть получены специалистом в данной области техники с помощью стандартных методик органического синтеза и коммерчески доступных веществ. Гетероарильные соединения могут быть получены, например, но без ограничения, в соответствии со схемами 1-9, представленными ниже, а также способами, описанными в примерах, которые представлены в разделе 5.1. Следует отметить, что специалист в данной области техники для получения целевого продукта может вносить изменения в методики, представленные на иллюстративных схемах и в примерах.

Схема 1
Синтез соединений формулы (I) представлен на схеме 1. В исходный 5-бромпиразин-2-амин А R1 группа может вводиться с использованием подходящей бороновой кислоты или сложного боратного эфира (R+ представляет собой Н или вместе с атомом бора и атомами, к которым они присоединены, образуют циклический боронат), палладиевого катализатора (такого как, например, дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан), растворителя (такого как диметилформамид) и основания (такого как карбонат натрия) через сочетание по Сузуки или, альтернативно, с использованием подходящего станната (R++ представляет собой C1-4 алкил), палладиевого катализатора (такого как дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан или палладий(dba)2/три-o-толилфосфин) и растворителя (такого как диметилформамид с добавлением или без добавления основания, такого как триэтиламин) посредством методики сочетания Стилле. Типичные условия реакций и реагенты для реакций Сузуки и Стилле описаны в данном изобретении (смотрите также Rossi, et al. Synthesis 15:2419-2440 (2004), Buchwald et al. Accounts of Chemical Research, 41: 1461-1473 (2008), Fu. Accounts of Chemical Research, 41: 1555-1564 (2008), и Echavarren et al. Angew. Chem. Int. Ed., 43: 4704-4734 (2004), а также ссылки, приведенные в указанных публикациях). Полученный R1-замещенный аминопиразин В может подвергаться бромированию с использованием NBS или других стандартных условий бромирования для получения бромированного промежуточного соединения С, которое далее подвергается взаимодействию с 2-бромуксусным ангидридом для получения ацилированного промежутого соединения D. Заместитель R2 вводится посредством присоединения амина с последующим замыканием цикла в присутствии аминного основания (такого как, например, триэтиламин) с нагреванием в подходящем растворителе (таком как ацетонитрил) с получением целевых соединений.

Схема 2
Альтернативно, как показано на схеме 2, 3,5-дибромпиразин-2-амин E может подвергаться обработке 2-бромуксусным ангидридом, как описано выше, для получения промежуточного соединения F. Как описано выше, заместитель R2 вводится посредством присоединения амина к F с последующим закрытием цикла и получением промежуточного соединения G. Группа R1 может вводиться с использованием способов, описанных выше, в частности, взаимодействием с подходящей бороновой кислотой или сложным боратным эфиром в присутствии плалладиевого катализатора и основания через сочетание по Сузуки или, альтернативно, с использованием подходящего станнана в присутствии палладиевого катализатора в соответствии с методикой сочетания Стилле, как описано выше, с получением целевых соединений.

Схема 3
В соответствии с другим подходом (схема 3), 3,5-дибромпиразин-2-амин Е подвергается обработке 2-хлоруксусным ангидридом с последующей обработкой йодидом натрия для получения йод-замещенного промежуточного соединения F2. Промежуточное соединение F2 подвергается превращению в целевые соединения в соответствии с методиками, представленными на схеме 2 для получения F.

Схема 4
Для получения аналогов с замещением в альфа-положении относительно карбонила (схема 4) подходящая замещенная амино-защищенная аминокислота Н (PN представляет собой защитную группу амино-группы, такую как Вос) подвергается взаимодействию с 3,5-дибромпиразин-2-амином в присутствии конденсирующего агента, такого как, например, 1,1'-карбонилдиимидазол. Удаление защитной группы (например, когда PN представляет собой Вос, удаление защиты достигается, например, обработкой ТФА или HCl) с последующим замыканием цикла при использовании палладиевого катализатора (например, с применением бикарбоната натрия, ацетата палладия(II) и 4,5-бис(дифенилфосфино)-9,9-диметилксантена) для получения промежуточного соединения I. Как описано выше, группа R1 может вводиться с использованием подходящей бороновой кислоты или сложного боратного эфира, палладиевого катализатора, растворителя и основания по методике сочетания Сузуки или, альтернативно, с использованием подходящего станнана, палладиевого катализатора и растворителя посредством методики сочетания Стилле (описанных выше) с полученим целевых соединений. Данный способ также может применяться для получения аналогов, в которых R2 представляет собой водород. Кроме того, данный способ может применяться для получения соединений, в которых R1 и R4 вместе с атомами, к которым они присоединены, образуют спироцикл, при использовании подходящих исходных аминокислот.
Схема 5
Аналоги, в которых R2 и R3 вместе с атомами, к которым они присоединены, образуют цикл (смотрите схему 5), могут быть получены аналогично методике, представленной на схеме 4, исходя из подходящей циклической аминокислоты J.
Схема 6
Для получения целевых соединений реакционная способность конденсирующих реагентов может быть обращена. Например, как показано на схеме 6, промежуточное соединение I может превращаться в соответствующий станнат K посредством взаимодействия, например, с гексаметилдиоловом (R++ представляет собой метил) в присутствии палладиевого катализатора (такого как тетракис(трифенилфосфин)палладий), и группа R1 может вводиться с использованием подходящего галогена (такого как бромид) и растворителя в соответствии с методикой сочетания Стилле, как описано выше, c получением целевых соединений. Альтернативно, промежуточное соединение I может подвергаться превращению в соответствующий сложный боронатный эфир К2 посредством взаимодействия с 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) в присутствии палладиевого катализатора (такого как 1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан) и основания (такого как ацетат калия) в растворителе, таком как диоксан. Группа R1 может вводиться с использованием подходящего галогена (такого как бромид), палладиевого катализатора и растворителя с использованием методики сочетания Сузуки, которая описана выше, с получением целевых соединений.

Схема 7
Соединения формулы (II) могут быть получены как показано на схеме 7. Восстановительное аминирование 3,5-дибромпиразин-2-амина Е с помощью этил-2-оксоацетата (в присутствии, например, боргидрида натрия в качестве восстановителя), приводит к получению промежуточного соединения L. Альтернативно, 3,5-дибромпиразин-2-амин E может подвергаться превращению в промежуточное соединение L посредством взаимодействия с этил-2-хлорацетатом в основных условиях (с использованием, например, Cs2CO3). Заместитель R2 вводится посредством присоединения амина к L в присутствтии аминного основания, такого как диизопропилэтиламин, при нагреввании в подходящем растворителе (таком как ДМСО) и последующим замыканием цикла в присутствтии кислотного катализатора (с использованием, например, уксусной кислоты) с получением промежуточного соединения М. Альтернативно, замыкание цикла соединения присоединения амина к L может осуществляться в условиях основного катализа, таких как обработка трет-бутоксидом калия в подходящем растворителе. Как описано выше, группа R1 может вводиться с использованием подходящей бороновой кислоты или сложного боратного эфира, палладиевого катализатора, растворителя и основания посредством сочетания по методике Сузуки или, альтернативно, с использованием подходящего станнана, палладиевого катализатора и растворителя по методике сочетания Стилле (описанной выше) с получением целевых соединений.
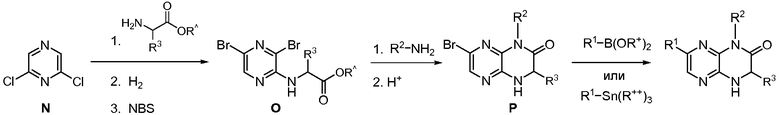
Схема 8
Альтернативный подход (схема 8) начинается со взаимодействия 2,6-дихлорпиразина N с подходящим сложным аминоэфиром (R^ представляет собой C1-3 алкил) с последующим восстановительным дегалогенированием с использованием водорода и палладиевого катализатора, такого как гидроксид палладия, основания, такого как карбонат калия, в растворителе, таком как этанол, и последующим бромированием взаимодействием с агентом бромирования, таким как NBS, с получением промежуточного соединения О. Как описано выше, заместитель R2 вводится через присоединение амина к О и последующее замыкание цикла с использованием кислотного катализатора с получением промежутоного соединения Р. Группа R1 может вводиться с использованием подходящей бороновой кислоты или сложного боратного эфира, палладиевого катализатора, растворителя или основания посредством методики сочетания Сузуки или, альтернативно, с использованием подходящего станнана, палладиевого катализатора и растворителя посредством методики сочетания Стилле с получением целевых соединений (описанных выше). Данный способ позволяет также синтезировать аналоги с R3 заместителем в альфа-положении относительно карбонильной группы.
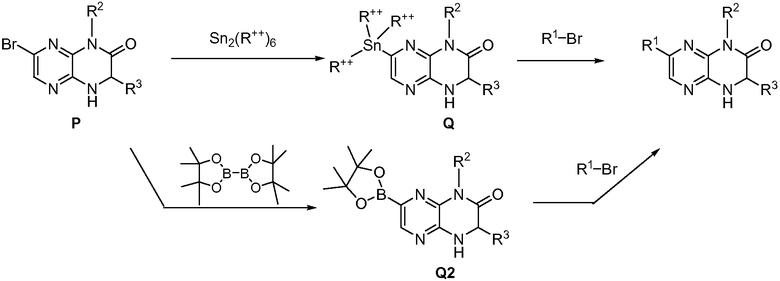
Схема 9
Как показано выше, для получения целевых соединений реакционная способность реагентов, принимающих участия в реакции сочетания, может обращаться (схема 9). Например, промежуточное соединение Р может подвергаться превращению в соответствующий станнан Q, и группа R1 может вводиться с использованием подходящего галогена, палладиевого катализатора и растворителя посредством методики сочетания Стилле, как описано выше, с получением целевых соединений. Альтернативно, промежуточное соединение Р может подвергаться превращению в соответствующий сложный боронатный эфир Q2, и группа R1 может вводиться с использованием подходящего галогена, палладиевого катализатора и растворителя посредством методики сочетания Сузуки, как описано выше, с получением целевых соединений.
Настоящее изобретение предоставляет способы получения соединения формулы (I)
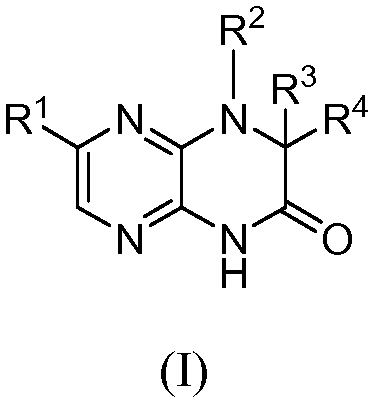
указанный способ включает контактирование соединения формулы (III)

c соединением R1-Y в растворителе в присутствии палладиевого катализатора, где указанное контактирование осуществляется в условиях, подходящих для получения соединения формулы (I), где R1, R2, R3 и R4 принимают значения, определенные в описании, и
а) когда Х представляет собой галоген (например, Br, Cl или I), тогда Y представляет собой B(OR+)2 или Sn(R++)3; или
b) когда Y представляет собой галоген (например, Br, Cl или I), тогда X представляет собой B(OR+)2 или Sn(R++)3;
где каждый R+ независимо представляет собой водород или замещенный или незамещенный C1-3 алкил, или каждый R+ вместе с атомом бора и атомами, к которым они присоединены, образуют циклический боронат; и R++ представляет собой C1-4 алкил.
Обычно растворитель представляет собой диметилформамид, изопропанол, диоксан, толуол, диметилацетамид, тетрагидрофуран, ацетонитрил, изопропилацетат, диметилсульфоксид, ацетон, метанол, метил-трет-бутиловый эфир или их сочетание с добавлением или без добавления воды; палладиевый катализатор представляет собой дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(IΙ) дихлорметан), палладий(dba)2/три-о-толилфосфин, дихлор[1,1'-бис(дитрет-бутилфосфино)ферроцен]палладий, дихлорбис(п-диметиламинофенилдибутилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0) или ацетат палладия(II)/4,5-бис(дифенилфосфино)-9,9-диметилксантен. В некоторых вариантах осуществления изобретения, когда X или Y являются галогеном, галоген представляет собой Br. В некоторых вариантах осуществления, когда X или Y представляет собой B(OR+)2, контактирование проводится в присутствии основания, такого как карбонат натрия, триэтиламин, диизопропилэтиламин, пиперидин, пиридин, карбонат цезия, карбонат калия, фосфат калия или гидроксид натрия. В некоторых таких вариантах осуществления изобретения B(OR+)2 представляет собой B(OH)2 или B(-OC(CH3)2C(CH3)2O-). В других вариантах осуществления изобретения, когда X или Y представляет собой Sn(R++)3, контактирование проводится необязательно в присутствии основания, такого как триэтиламин, карбонат натрия, диизопропилэтиламин, пиперидин, пиридин, карбонат цезия, карбонат калия, фосфат калия или гидроксид натрия. В некоторых таких вариантах осуществления изобретения R++ представляет собой метил или н-бутил.
Изобретение предоставляет также способы получения соединения формулы (III)

указанный способ включает контактирование соединения формулы (IV)
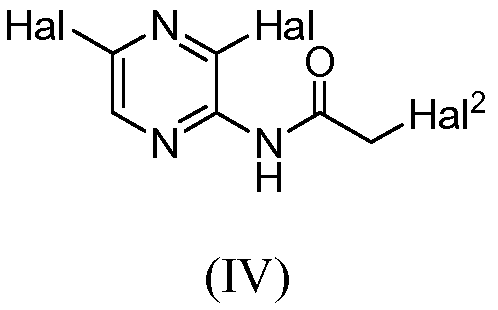
с R2-NH2 в растворителе, таком как ацетонитрил или тетрагидрофуран, в присутствии основания, такого как триэтиламин или диизопропилэтиламин, где указанное контактирование проводится в условиях, подходящих для получения соединения формулы (III), где R2 принимает значения, определенные в описании, R3 и R4 представляют собой H, X представляет собой галоген, такой как Br, Hal представляет собой галоген, такой как Br, и Hal2 представляет собой Br или I.
Изобретение предоставляет также способы получения соединения формулы (III)
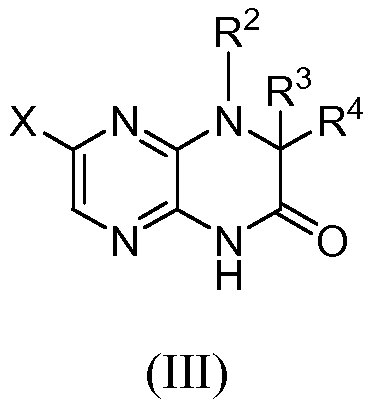
указанный способ включает циклизацию соединения формулы (V)

в растворителе, таком как ацетонитрил, в присутствии палладиевого катализатора, такого как ацетат палладия(II), лиганда, такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен, и основания, такого как бикарбонат натрия, где указанная циклизация проводится в условиях, подходящих для получения соединения формулы (III), где R2 принимает значения, определенные в описании, R3 и R4 принимают значения, определенные в описании, X представляет собой галоген, такой как Br, и Hal представляет собой галоген, такой как Br.
Изобретение предоставляет также способы получения соединения формулы (II)
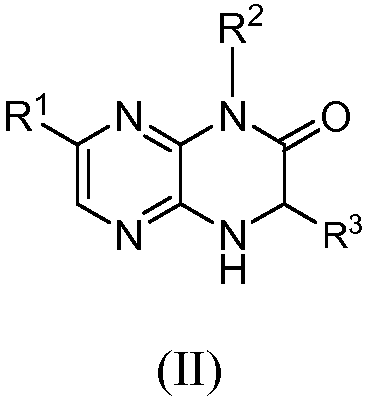
указанный способ включает контактирование соединения формулы (VI)
с R1-Y в растворителе в присутствии палладиевого катализатора, где указанное контактирование проводится в условиях, подходящих для получения соединения формулы (I), где R1, R2 и R3 принимают значения, определенные в описании, и
a) когда X представляет собой галоген (например, Br, Cl или I), тогда Y представляет собой B(OR+)2 или Sn(R++)3; или
b) когда Y представляет собой галоген (например, Br, Cl или I), тогда X представляет собой B(OR+)2 или Sn(R++)3;
где каждый R+ независимо представляет собой водород или замещенный или незамещенный C1-3 алкил, или каждый R+, вместе с атомом бора и атомами, к которым они присоединены, образуют циклический боронат; и каждый R++ представляет собой C1-3 алкил.
Обычно растворитель представляет собой диметилформамид, изопропанол, диоксан, толуол, диметилацетамид, тетрагидрофуран, ацетонитрил, изопропилацетат, диметилсульфоксид, ацетон, метанол, простой метил-трет-бутиловый эфир или их сочетание, с добавлением или без добавления воды, и палладиевый катализатор представляет собой дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(IΙ) дихлорметан), палладий(dba)2/три-о-толилфосфин, дихлор[1,1'-бис(ди-трет-бутилфосфино)ферроцен]палладий, дихлорбис(п-диметиламинофенилди-трет-бутилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0) или ацетат палладия(II)/4,5-бис(дифенилфосфино)-9,9-диметилксантен. В некоторых вариантах осуществления изобретения, когда X или Y представляет собой галоген, галоген представляет собой Br. В некоторых вариантах осуществления изобретения, когда X или Y представляет собой B(OR+)2, контактирование проводится в присутствии основания, такого как карбонат натрия, триэтиламин, диизопропилэтиламин, пиперидин, пиридин, карбонат цезия, карбонат калия, фосфат калия или гидроксид натрия. В некоторых таких вариантах осуществления изобретения B(OR+)2 представляет собой B(OH)2 или B(-OC(CH3)2C(CH3)2O-). В других вариантах осуществления, когда X или Y представляет собой Sn(R++)3, контактирование проводится необязательно в присутствии основания, такого как триэтиламин, карбонат натрия, диизопропилэтиламин, пиперидин, пиридин, карбонат цезия, карбонат калия, фосфат калия или гидроксид натрия. В некоторых таких вариантах осуществления изобретения R++ представляет собой метил или н-бутил.
Изобретение предоставляет также способы получения соединения формулы (VI)

указанный способ включает циклизацию соединения формулы (VII)
в присутствии основания, такого как бутоксид калия, или кислоты, такой как уксусная кислота, ТФА, HCl или фосфорная кислота, где указанная циклизация проводится в условиях, подходящих для получения соединения формулы (VI), R2 и R3 принимают значения, определенные в описании, Hal представляет собой галоген, такой как Br, и R представляет собой H или C1-4 алкил. Обычно циклизация проводится в растворителе, таком как, например, метанол или вода.
Изобретение предоставляет также способы получения соединения формулы (VII)

указанный способ включает контактрование соединения формулы (VIII)
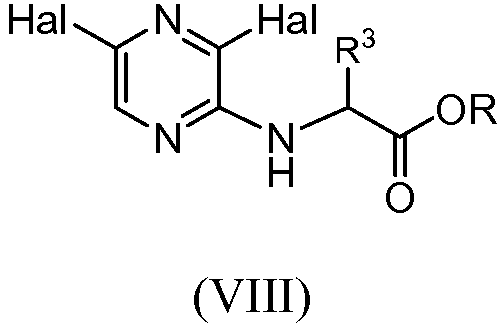
с R2-NH2 в растворителе, таком как диметилсульфоксид или N-метилпирролидинон, необязательно в присутствии основания, такого как триэтиламин или диизопропилэтиламин, где указанное контактирование проводится в условиях, подходящих для получения соединения формулы (VII), где R2 и R3 принимают значения, определенные в описании, и Hal представляет собой галоген, такой как Br.
Фармацевтически приемлемые соли гетероарильных соединений могут быть получены стандартными и известными способами, такими как взаимодействие гетероарильного соединения с подходящей кислотой, как описано выше. Такие соли обычно получают с высокими выходами при умеренных температурах и зачастую получают посредством выделения соединния из подходящего промывного кислотного раствора на конечной стадии синтеза. Солеобразующая кислота может растворяться в подходящем органическом растворителе или водном органическом растворителе, таком как алканол, кетон или сложный эфир. С одной стороны, если гетероарильное соединение желательно получить в форме свободного основания, оно может быть выделено из основного промывного раствора на конечной стадии в соответствии с известными методиками. Например, типичным методом получения гидрохлоридной соли является растворение свободного основания в подходящем растворителе с последующим полным удаление воды из раствора, например, с использованием молекулярных сит, и последующее барботирование через осушенный раствор газообразного хлористого водорода.
4.4. Способы применения
Гетероарильные соединения, описанные в данном изобретении, могут применяться в качестве фармацевтических средств для лечения или предотвращения заболевания у животных или людей. Далее, гетероарильные соединения, описанные в данном изобретении, обладают активностью в отношении киназ (например, протеинкиназ), включая киназы, которые вовлечены в рак, воспалительные состояния, иммунологические состояния, нейродегенеративные заболевания, диабет, ожирение, неврологические расстройства, возрастные заболевания или сердечнососудистые состояния. Без теоретических обоснований считается, что гетероарильные соединения эффективны для лечения и предупреждения указанных заболеваний и состояний вследствие их способности модулировать (например, ингибировать) киназы, которые вовлечении в этиологию указанных заболеваний и состояний. Соответственно, настоящее изобретение предоставляет способы применения гетероарильных соединений, включая лечение или предотвращение указанных заболеваний. Предоставленные в данном изобретении способы включают введение эффективного количества одного или нескольких гетероарильных соединений пациенту, который нуждается в этом. В некоторых вариантах осуществления изобретения способы дополнительно включают введение второго активного агента, как описано в данном изобретении.
Типичные примеры иммунологических состояний, для лечения или предотвращения которых могут применяться гетероарильные соединения, включают, но без ограничения, ревматоидный артрит, ревматоидный спондилит, остеоартрит, рассеянный склероз, волчанку, воспалительную болезнь кишечника, неспецифический язвенный колит, болезнь Крона, миастению, болезнь Грейвса, энцефаломиелит, диабет II типа, дерматомиозит и отторжение трансплантата (например, при лечении реципиентов трансплантатов, например, сердца, легкого, объединенного сердца-легкое, печени, почки, поджелудочной железы, кожи или роговицы; или реакции «трансплантант против хозяина», такой как реакция после пересадки костного мозга).
Типичные примеры воспалительных состояний, для лечения или предупреждения которых могут применяться гетероарильные соединения, включают, но без ограничения, псориаз, астму, аллергический ринит, бронхит, хроническую обструктивную болезнь легких, муковисцидоз, воспалительную болезнь кишечника, синдром раздраженной толстой кишки, болезнь Крона, слизистый колит, неспецифический язвенный колит и ожирение.
Типичные сердечнососудистые заболевания, для лечения или предупреждения которых могут применяться гетероарильные соединения, включают, но без ограничения, рестеноз, синдром Вольфа-Паркинсона-Уайта, инсульт, инфаркт миокарда или ишемическое поражение сердца, легкого, кишечника, почки, печени, поджелудочной железы, селезенки или мозга.
Типичные нейродегенеративные заболевания, для лечения или предупреждения которых могут применяться гетероарильные соединения, включают, но без ограничения, болезнь Хантингтона, болезнь Альцгеймера, болезнь Паркинсона, деменции, вызванные тау-мутациями, спиноцеребеллярную атаксию 3 типа, мотонейронное заболевание, вызванное мутациями SOD1, нейронный цероидный липофусциноз/болезнь Баттена (педиатрическая нейрогенная дегенерация) и энцефалит, связанный с ВИЧ.
Типичные возрастные заболевания, для лечения или предупреждения которых могут применяться гетероарильные соединения, включают, но без ограничения, рак, ожирение, сахарный диабет II типа, аутоиммунное заболевание, сердечнососудистые заболевания и нейронную дегенерацию.
В другом варианте осуществления изобретения настоящее изобретение предоставляет способы лечения или предупреждения фиброзных заболеваний и расстройств. В конкретном варианте осуществления изобретение предоставляет способы лечения или предупреждения склеродермы, идеопатического пневмофиброза, почечного фиброза, муковисцидоза, миелофиброза, фиброза печени, стеатофиброза и стеатогепатита.
Типичные злокачественные новообразования, для лечения или предотвращения которых могут применяться гетероарильные соединения, включают, но без ограничения, злокачественные новообразования головы, шеи, глаза, полости рта, горла, пищевода, бронха, гортани, глотки, грудной клетки, кости, легкого, ободочной кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, молочной железы, яичника, яичек или других репродуктивных органов, кожи, щитовидной железы, крови, лимфатических узлов, почки, печени, поджелудочной железы и мозга или центральной нервной системы. Гетероарильные соединение также могут применяться для лечения или предупреждения появления солидных опухолей и опухолей кроветворной системы.
Конкретные примеры злокачественных новообразований, которые могут лечиться способами согласно изобретению, включают злокачественные новообразования с метаболическими путями, в которые вовлечены mTOR, PI3K или Akt киназы или их мутанты или изоформы. Другие примеры злокачественных новообразований, которые можно лечить способами согласно изобретению, включают злокачественные образования, связанные с метаболическими путями PI3Kα, PI3Kβ, PI3Kδ, KDR, GSK3α, GSK3β, ATM, ATX, ATR, cFMS и/или DNA-PK киназ или их мутантами или изоформами. В некоторых вариантах осуществления изобретения злокачественные новообразования, связанные с mTOR/PI3K/Akt метаболическими путями, включают солидные и опухоли кроветворной системы, например, множественную миелому, лимфому клеток, одевающих спонгалий, диффузную крупноклеточную В-клеточную лимфому, острую миелоидную лимфому, фолликулярную лимфому, хронический лимфоцитарный лейкоз; рак молочной железы, легкого, эндометрия, яичников, желудка, шейки матки и предстательной железы; глиобластому; рак почки; гепатоцеллюлярную карциному; карциному толстой кишки; нейроэндокринные опухоли; опухоли головы и шеи; и саркомы.
В конкретном варианте осуществления изобретение предоставляет способы лечения и предотвращения заболевания или расстройства, связанного с активацией передачи mTOR сигнала, включая, но без ограничения, опухолевые синдромы, которые являются прямым или опосредованным результатом генетических врожденных пороков развития в PTEN (фосфатаза и гомолог тензина, удаленные на хромосоме 10), TSC1 (туберозного склероза 1), TSC2 (туберозного склероза 2), NF1 (нейрофибромина 1), AMPK (AMP-зависимой протеинкиназы STK11, серин/треонинкиназы 11), LKB1, VHL (болезни Фон Гиппеля-Линдау) и PKD1 (полицистина-1). Без теоретического обоснования считается, что генетические пороки развития, связанные с этими белками, приводят к гиперактивности mTOR/PI3K/Akt метаболического пути. Некоторые конкретные заболевания, которые можно лечить или предотвращать посредством ингибирования mTOR/PI3K/Akt метаболического пути, включают, но без ограничения, болезнь Коудена (Cowden's disease), синдром Коудена, синдром, подобный синдрому Коудена, синдром Банаяна-Зонана (Bannayan-Zonana syndrome), синдром Банаяна-Райли-Рувалькаба (Bannayan-Riley-Ruvalcaba syndrome), болезнь Лермитта-дуклоса (Lhermitte-Duclos disease), карцинома эндометрия, туберозный склерозный комплекс (tuberous sclerosis complex), лимфангиоматоз (lymphangioleiomyomatosis), нейрофиброматоз 1, синдром Пейтца-Егерса (Peutz-Jeghers syndrome), карцинома почки, болезнь Фон Гиппеля-Линдау, синдром Протея (Proteus syndrome) и поликистозную болезнь почек.
В конкретном варианте осуществления изобретение предоставляет способы лечения или предотвращения болезни или расстройства, связанного с mTOR, PI3K, Akt и/или DNA-PK передачей сигнала. Конкретные заболевания, которые можно лечить или предотвращать ингибированием mTOR/PI3K/Akt и/или DNA-PK передачей сигнала, включают, но без ограничения, ревматоидный артрит, ревматоидный спондилит; остеоартрит; подагру; астму, бронхит; аллергический ринит; хроническую обструктивную болезнь легких; муковисцидоз; воспалительное заболевание кишечника; синдром раздраженной толстой кишки; слизистый колит; неспецифический язвенный колит; болезнь Крона; болезнь Хантингтона; гастрит; эзофагит; гепатит; панкреатит; нефрит; рассеянный склероз; красную волчанку; атеросклероз; рестеноз после пластической операции на сосудах; левожелудочковую гипертрофию; инфаркт миокарда; инсульт; ишемические поражения сердца, легкого, пищеварительного тракта, почки, печени, поджелудочной железы, селезенки и мозга; острое или хроническое отторжение пересаженного органа; сохранение органа для трансплантации; недостаточность (отказ работы) органа или потерю конечности (например, включая, но без ограничения, потерю конечности в результате повреждения при восстановлении кровотока после ишемии, травмы, значительного телесного повреждения, автокатастрофы, разрушение тканей с утратой ими жизнеспособности или отторжение трансплантата); реакцию «трансплантат против хозяина»; эндотоксический шок; множественную органическую недостаточность; псориаз; ожог в результате воздействия пламени, химических веществ или радиации; экзему; дерматит; кожный трансплантат; ишемию; ишемические состояния, связанные с хирургической или травматической раной (например, дорожно-транспортный травматизм, огнестрельное ранение или дробление конечностей); эпилепсию; болезнь Альцгеймера; болезнь Паркинсона; иммунологическую реакцию на бактериальную или вирусную инфекцию; кахексию; ангиогенные и пролиферативные болезни (включая пигментный ретинит), солидные опухоли и злокачественные новообразования различных тканей, такие как рак ободочной кишки, прямой кишки, предстательной железы, печени, легкого, бронха, поджелудочной железы, мозга, головы, шеи, желудка, кожи, почки, шейки матки, крови, гортани, пищевода, полости рта, глотки, мочевого пузыря, яичника или матки.
Настоящее изобретение предоставляет также способы ингибирования киназы в клетке, экспрессирующей указанную киназу, указанные способы включают контактирование клетки с эффективным количеством гетероарильного соединения согласно изобретению. В одном варианте осуществления изобретения киназа представляет собой mTOR, DNA-PK или PI3K или их сочетание. В некоторых вариантах осуществления изобретения клетка находится в организме пациента.
Изобретение предоставляет также способы лечения и предотвращения состояния, которое может лечиться или предотвращаться ингибированием киназного метаболического пути, например, mTOR/PI3K/Akt и/или DNA-PK метаболического пути, указанные способы включают введение пациенту, нуждающемуся в таком введении, эффективного количества гетероарильного соединения, которое описано в изобретении. В некоторых вариантах осуществления состояния, которые можно лечить или предотвращать ингибированием mTOR/PI3K/Akt метаболического пути, включают солидные и опухоли кроветворной системы, например, множественную миелому, лимфому клеток, одевающих спонгалий, диффузную крупноклеточную В-клеточную лимфому, острую миелоидную лимфому, фолликулярную лимфому, хронический лимфоцитарный лейкоз; рак молочной железы, легкого, эндометрия, яичников, желудка, шейки матки и предстательной железы; глиобластому; карциному почки; гепатоцеллюлярную карциному; карциному толстой кишки; нейроэндокринные опухоли; опухоли головы и шеи; саркомы; опухолевые синдромы, которые являются прямым или опосредованным результатом генетических врожденных пороков развития в PTEN (фосфатаза и гомолог тензина, удаленные на хромосоме 10), TSC1 (туберозный склероз 1), TSC2 (туберозный склероз 2), NF1 (нейрофибромин 1), AMPK (AMP-зависимая протеинкиназа STK11, серин/треонинкиназа 11), LKB1, VHL (болезнь Фон Гиппеля-Линдау) и PKD1 (полицистин-1), болезнь Коудена, синдром Коудена, синдром, подобный синдрому Коудена, синдром Баннаяна-Зонана, синдром Баннаяна-Райли-Рувалькаба, болезнь Лермитта-Дуклоса, карцинома эндометрия, туберозный склерозный комплекс, лимфангиоматоз (lymphangioleiomyomatosis), нейрофиброматоз 1, синдром Пейтца-Егерса, карцинома почки, болезнь Фон Гиппеля-Линдау, синдром Протея и поликистозную болезнь почек; ревматоидный артрит, ревматоидный спондилит; остеоартрит; подагру; астму, бронхит; аллергический ринит; хроническую обструктивную болезнь легких; муковисцидоз; воспалительное заболевание кишечника; синдром раздраженной толстой кишки; слизистый колит; неспецифический язвенный колит; болезнь Крона; болезнь Хантингтона; гастрит; эзофагит; гепатит; панкреатит; нефрит; рассеянный склероз; красную волчанку; атеросклероз; рестеноз после пластической операции на сосудах; левожелудочковую гипертрофию; инфаркт миокарда; инсульт; ишемические поражения сердца, легкого, пищеварительного тракта, почки, печени, поджелудочной железы, селезенки и мозга; острое или хроническое отторжение пересаженного органа; сохранение органа для трансплантации; недостаточность (отказ работы) органа или потерю конечности (например, включая, но без ограничения, потерю конечности в результате повреждения при восстановлении кровотока после ишемии, травмы, значительного телесного повреждения, автокатастрофы, разрушение тканей с утратой ими жизнеспособности или отторжение трансплантата); реакцию «трансплантат против хозяина»; эндотоксический шок; множественную органическую недостаточность; псориаз; ожог в результате воздействия пламени, химических веществ или радиация; экзему; дерматит; кожный трансплантат; ишемию; ишемические состояния, связанные с хирургической или травматической раной (например, дорожно-транспортный травматизм, огнестрельное ранение или дробление конечностей); эпилепсию; болезнь Альцгеймера; болезнь Паркинсона; иммунологическую реакцию на бактериальную или вирусную инфекцию; кахексию; ангиогенные и пролиферативные болезни (включая пигментный ретинит), солидные опухоли и злокачественные новообразования различных тканей, такие как рак ободочной кишки, прямой кишки, предстательной железы, печени, легкого, бронха, поджелудочной железы, мозга, головы, шеи, желудка, кожи, почки, шейки матки, крови, гортани, пищевода, полости рта, глотки, мочевого пузыря, яичника или матки.
Более конкретно, злокачественные опухоли и связанные с ними расстройства, которые можно лечить или предотвращать способами и композициями согласно изобретению, включают, но не ограничиваются только ими, лейкозы, такие как, но без ограничения, острый лейкоз, острый лимфолейкоз, острые миелобластные лейкозы, такие как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный лейкозы, эритромиелоз и миелодиспластический синдром (или его симптом, такой как анемия, тромбоцитопения, нейтропения, бицитопения или панцитопения), рефрактерную анемию (refractory anemia - RA), RA с кольцевидными сидеробластами (RA with ringed sideroblasts - RARS), RA с избыточными бластными клетками (RA with excess blasts - RAEB), RAEB в трансформации (RAEB in transformation - RAEB-T), предлейкоз и хронический миеломоноцитарный лейкоз (chronic myelomonocytic leukemia - CMML), хронические лейкозы, такие как, но без ограничения, хронический миелоцитарный (гранулоцитарный) лейкоз (chronic myelocytic leukemia - CML), хронический лимфолейкоз (chronic lymphocytic leukemia - CLL), злокачественный ретикулоэндотелиоз; эритремию; лимфомы, такие как, но без ограничения, болезнь Ходжкина, форма лимфомы, которая не является болезнью Ходжкина; множественные миеломы, такие как, но без ограничения, тлеющая множественная миелома, несекреторная множественная миелома, остеосклеротическая миелома, плазмоклеточная миелома, солитарная плазмоцитома и экстрамедуллярная пласмацитома; болезнь Вальденстрема; моноклональную гипергаммаглобулинемию неопределенной достоверности (of undetermined significance); доброкачественную моноклональную гипергаммаглобулинемию; болезнь Н-цепи; саркомы кости и соединительной ткани, такие как, но без ограничения, саркома кости, остеосаркома, хондросаркома, саркома Юинга, злокачественная гигантоклеточная опухоль, фибросаркома кости, хордома, надкостничная саркома, саркомы мягких тканей, ангиосаркома (гемангиосаркома), фибросаркома, саркома Капоши, лейомиосаркома, липосаркома, лимфангиосаркома (lymphangiosarcoma), метастазирующие злокачественные опухоли, неврилеммома, рабдомиосаркома, синовиальная саркома; опухоли мозга, такие как, но без ограничения, глиома, астроцитома, глиома ствола головного мозга, эпендимоглиома, олигодендроглиома, неглиальная опухоль, невринома слухового нерва, краниофарингиома, медуллобластома, менингиома, пинеалома, пинеалобластома, первичная лимфома мозга; рак молочной железы, включая, но без ограничения, аденокарциному, дольчатый рак молочной железы, внутрипротоковая карцинома, медуллярный рак молочной железы, слизеобразующий рак молочной железы, тубулярный рак молочной железы, папиллярный рак молочной железы, первичные злокачественные опухоли (primary cancers), болезнь Педжета и воспалительный рак молочой железы; рак надпочечников, такой как, но без ограничения, феохромоцитома и адренокортикальная карцинома; рак щитовидной железы, такой как, но без ограничения, папиллярный или фолликулярный рак щитовидной железы, медуллярный рак щитовидной железы и анапластический рак щитовидной железы; рак поджелудочной железы, такой как, но без ограничения, инсулинома, ульцерогенная аденома поджелудочной железы, глюкагонома, випома, соматостатин-секретирующая опухоль, и карциноидная опухоль или аденома островковой ткани; питуитарные злокачественные опухоли, такие как, но без ограничения, болезнь Кушинга, простагландин-секретирующая опухоль, акромегалия и несахарный диабет; злокачественные опухоли глаз, такие как, но без ограничения, глазная меланома, такая как меланома радужной оболочки глаза, хориоидальная меланома и меланома цилиарного тела и ретинобластома; злокачественные опухоли влагалища, такие как плоскоклеточный рак, аденокарцинома и меланома; рак женских наружных половых органов, такой как эпидермоидный рак, меланома, аденокарцинома, базалиома и болезнь Педжета; злокачественные опухоли шейки матки, такие как, но без ограничения, плоскоклеточный рак и аденокарцинома; злокачественные опухоли матки, такие как, но без ограничения, рак эндометрия и саркома матки; злокачественные опухоли яичников, такие как, но без ограничения, эпителиальная саркома яичников, пограничная опухоль яичников, герминома и стромальная опухоль; злокачественные опухоли пищевода, такие как, но без ограничения, плоскоклеточный рак, аденокарцинома, аденокистозная карцинома, слизеобразующий плоскоклеточный рак, аденоидный плоскоклеточный рак, саркома, меланома, плазмацитома, сосочковая карцинома, и овсяно-клеточный (мелкоклеточный) рак; злокачественные опухоли желудка, такие как, но без ограничения, аденокарцинома, грибовидный (полипоидный) рак желудка, язвообразующий рак желудка, поверхностный рак желудка, диффузноинфильтративный рак желудка, лимфосаркома, липосаркома, фибросаркома и карциносаркома; злокачественные опухоли ободочной кишки; злокачественные опухоли прямой кишки; злокачественные опухоли печени, такие как, но без ограничения, гепатоцеллюлярный рак и злокачественная опухоль из эмбриональных печеночных клеток; злокачественные опухоли желчного пузыря, такие как аденокарцинома, холангиоцеллюлярные злокачественные опухоли, такие как, но без ограничения, папиллярная, нодозная и диффузная; злокачественные опухоли легких, такие как немелкоклеточный рак легких, плоскоклеточный рак (эпидермоидный рак), аденокарцинома, гигантоклеточный и мелкоклеточный рак легких; тестикулярные злокачественные опухоли, такие как, но без ограничения, гоноцитома, семинома, анапластический рак, классический рак (типичный), сперматоцитная семинома, несеминома, эмбриональный рак, тератокарцинома, хориокарцинома (yolk-sac tumor), злокачественные опухоли предстательной железы, такие как, но без ограничения, аденокарцинома, лейомиосаркома и рабдомиосаркома; злокачественные опухоли почек; злокачественные опухоли полости рта, такие как, но без ограничения, плоскоклеточный рак; базально-клеточный рак; злокачественные опухоли слюнной железы, такие как, но без ограничения, аденокарцинома, слизеобразующий плоскоклеточный рак и аденоидо-кистозный рак; злокачественные опухоли глотки, такие как, но без ограничения, плоскоклеточный рак и сосочковый рак полости рта; злокачественные опухоли кожи, такие как, но без ограничения, базалиома, плоскоклеточный рак и меланобластома, поверхностный рак, узелковая меланобластома, злокачественная лентигомеланома, акральная лентигиозная меланома; злокачественные опухоли почек, такие как, но без ограничения, рак почки, аденокарцинома, гпернефрома, фибросаркома, переходно-клеточный рак (рак почечных лоханок и/или маточно-яичниковый рак); опухоль Вильмса; злокачественные опухоли мочевого пузыря, такие как, но без ограничения, переходно-клеточный рак, плоскоклеточный рак, аденокарцинома, карциносаркома. Кроме того, злокачественные опухоли включают миксосаркому, остеогенную саркому, эндотелиальную саркому, лимфангиоэндотелиальную саркому, мезотелиому, синовиому, гемангиобластому, карциному эпителиальных тканей, цистаденокарциному, бронхогенный рак, рак потовой железы, рак сальных желез, папиллокарциному и папиллярные аденокарциномы (обзор указанных расстройств смотрите в публикациях Fishman et al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia и Murphy et al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, и Recovery, Viking Penguin, Penguin Books U.S.A., Inc., United States of America).
Соответственно, способы и композиции согласно изобретению также могут применяться для лечения и предотвращения различных злокачественных опухолей или других заболеваний, связанных с аномальной пролиферацией клеток, включая (но без ограничения) следующие заболевания: карцинома, в том числе карцинома мочевого пузыря, молочной железы, ободочной кишки, почки, печени, легкого, яичника, поджелудочной железы, желудка, шейки, щитовидной железы и кожы; в том числе плоскоклеточную карциному; гематобластозы лимфоидного происхождения, в том числе лейкоз, острый лимфолейкоз, острый лимфобластный лейкоз, B-клеточную лимфому, T-клеточную лимфому, лимфому Беркетта; гематобластозы миелоидного происхождения, в том числе острый и хронический миелоидные лейкозы и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; другие опухоли, включая меланому, семиному, тератокарциному, нейробластому и глиому; опухоли центральной и периферической нервной системы, включая астроцитому, мультиформную глиобластому, нейробластому, глиому и нервиномы; солидные и опухоли кроветворной системы; опухоли мезенхималного происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, пигментную ксенодерму, кератоакантому, семиному, фолликулярный рак щитовидной железы и тератокарциному. Также подразумевается, что злокачественные опухоли, вызванные аберрациями в апоптозе, также можно было бы лечить способами и композициями, раскрытыми в данном изобретении. Такие злокачественные опухоли могут включать, но без ограничения, фолликулярные лимфомы, карциномы с p53 мутациями, гормон-зависимые опухоли молочной железы, предстательной железы и яичника и предопухолевые состояния, такие как семейный аденоматозный полипоз, ювенильный полипозный синдром, синдром Берта-Хогга-Дьюба (Birt-Hogg-Dube - BHD) и миелодиспластические синдромы. В специфических вариантах осуществления изобретения злокачественное развитие болезни, диспролиферативные изменения (такие как метаплазии и дисплазии) или гиперпролиферативные расстройства лечатся или предотвращаются в яичнике, мочевом пузыре, молочной железе, ободочной кишке, в легком, в коже, поджелудочной железе, почке или матке. В других специфических вариантах осуществления изобретения лечат или предотвращают саркому, меланому или лейкоз.
В конкретном варианте осуществления изобретения способы и композиции согласно изобретению могут применяться для лечения, предотвращения или оказания помощи при различных типах лимфом (т.е. группе различных опухолей, возникающих в ретикулоэндотелиальных и лимфатических системах), таких как неходжкинские лимфомы (Non-Hodgkin's lymphoma - NHL) (т.е. злокачественная моноклональная пролиферация лимфоидных клеток в сайтах имуной системы, включая лимфатические узлы, костный мозг, селезенку, печень и желудочно-кишечный тракт). NHL, которые можно лечить или предотвращать с помощью гетероарильных соединений, включают, но без ограничения, лимфому клеток мантийной зоны, MCL, лимфоцитарная лимфома промежуточной дифференцировки, промежуточная лимфоцитарная лимфома (intermediate lymphocytic lymphoma), ILL, диффузная недифференцированная лимфоцитарная лимфома (diffuse poorly differentiated lymphocytic lymphoma), PDL, центроцитарная лимфома, диффузная мелкоклеточная неделящаяся лимфома, DSCCL, фолликулярная лимфома и любой тип лимфомы клеток мальтийной зоны, которые могут быть видны под микроскопом (узелковая, диффузная, blastic лимфома и лимфома мальтийной зоны).
В еще одном варианте осуществления способы и композиции согласно изобретению также применимы для введения пациентам, нуждающимся в лечении злокачественного заболевания (например, пациентам, страдающим острым лимфолейкозом, острым миелоидным лейкозом, хроническим миелоидным лейкозом, хроническим лимфолейкозом, миелодиспластическим синдромом («предлейкозом»), синдромом миносомии 7, неходжкинской лимфомой, нейробластомой, опухолями мозга, множественной миеломой, тестикулярными эмбрионально-клеточными опухолями, раком молочной железы, раком легкого, раком яичника, меланомой, глиомой, саркомой или другими солидными опухолями), а также пациентов, нуждающихся в лечении незлокачественных опухолей (например, пациентов, страдающих гематологическими расстройствами, врожденным иммунодефицитным состоянием, мукополисахаридозом, липидозами, остеопорозом, гистоцитозом из клеток Лангерганса, синдромом Леша-Найхана или гликогеновыми болезнями).
В еще одном варианте осуществления изобретение предоставляет способы лечения миелопролиферативных расстройств или миелодиспластических синдромов, указанные способы включают введение пациенту, нуждающемуся в таком введении, эффективного количества гетероарильного соединения или композиции, включающей указанное соединение. В некоторых вариантах осуществления изобретения миелопролиферативное расстройство представляет собой истинную первичную полицитемию; первичный тромбоцитоз; хронический миелоидный лейкоз; острый или хронический гранулоцитарный лейкоз; острый или хроничекий миелобластный лейкоз; эритромиефиброз (myelofibro-erythroleukemia); или ангиогенную миелоидную метаплазию.
В еще одном варианте осуществления изобретение предоставляет способы лечения рака и опухулей, устойчивых к другим ингибиторам киназы, таким как иматиниб мезилат (STI-571 или Gleevec™), указанные способы включают введение пациенту, нуждающемуся в таком введении, эффективного количество гетероарильного соединения или композиции, включающей указанное соединение. В конкретном варианте осуществления изобретение предоставляет способы лечения лейкозов, включая, но без ограничения, гастроинтестинальную стромальную опухоль (gastrointestinal stromal tumor - GIST), острый лимфолейкоз или хронический миелоцитарный лейкоз, устойчивый к иматиниба мезилату (STI-571 или Gleevec™), указанные способы включают введение пациенту, нуждающемуся в таком введении, эффективного количества гетероарильного соединения или композиции, включающей указанное соединение.
В специфическом варианте осуществления изобретение предоставляет способы лечения или предотвращения лейкоза (т.е. злокачественных неоплазм кроветворных тканей), включая, но без ограничения, хронический лимфолейкоз, хронический миелоцитарный лейкоз, острый лимфобластный лейкоз, острый миелоидный лейкоз и острый миелобластный лейкоз. Лезкоз может быть рецидицирующим, не поддающимся лечению или резистентным к традиционной терапии. Термин «рецидив» относится к ситуации, когда у пациентов наблюдается ремиссия лейкоза после терапии, есть обнаружение лейкозных клеток в костном мозге и уменьшение количества нормальных клеток в крови. Термин «не поддающийся лечению или резистентный» относится к случаю, когда у пациентов даже после интенсивного лечения сохраняются лезкозные клетки в костном мозге.
Различные типы злокачественных опухолей описаны в заявке на патент США № 2004/0029832, опубликованной 12 февраля 2004 года, содержание которой во всей полноте введено в данной описание в виде ссылки (смотрите, например, раздел 2.2. Типы злокачественных опухолей). Специфические злокачественные опухоли включают, но без ограничения, лейкозы, такие как хронический лимфолейкоз, хронический миелобластный лейкоз, остный лимфобластный лейкоз, острый миелоидный лейкоз и острый миелобластный лейкоз; прогрессированное злокачественное развитие болезни, амилоидоз, нейробластому, менингиому, гемангиоперицитому, множественные метастазы в головном мозге, мультиформную глиому, глиобластому, глиому ствола головного мозга, злокачественную опухоль головного мозга неблагоприятного прогноза, злокачественную шванному, рецидивную злокачественную шванному, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, аденокарциному толстой кишки, рак прямой и ободочной кишки по Дюку (Dukes) C&D, неаперабельный рак прямой и ободочной кишки, метастазирующую гепатоцеллюлярную карциному, саркому Капоши, karotype острый миелобластный лейкоз, лимфому Ходжкина, неходжкинскую лимфому, Т-клеточную лимфому кожи, B-клеточную лимфому кожи, диффузную крупноклеточную (В-клеточную) лимфому, фолликулярную лимфому с низкой степенью злокачественности, злокачественную меланому, злокачественную мезотелиому, синдром злокачественного мезотелиального плеврального выпота, перитонеальную карциному, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, кожный васкулит, гистиоцитоз из клеток Лангерганса, лейомиосаркому, прогрессирующую оссифицирующую фибродисплазию, гормон-резистентный рак предстательной железы, иссеченную саркому мягких тканей высокого риска (resected high-risk soft tissue sarcoma), неоперабельную гепатоцеллюлярную карциному, болезнь Вальденстрема, тлеющую миелому, вялотекущую миелому, рак фаллопиевой трубы, андроген-независимый рак предстательной железы, андроген независимый метастазирующий рак предстательной железы IV стадии, рак предстательной железы, нечувствителный к гормонам, рак предстательной железы, не чувствительный к химиотерапии, папиллярную карциному щетовидной железы, фолликулярную карциному щитовидной железы, медуллярную карциному щитовидной железы и лейомиому. В одном варианте осуществления изобретения рак является первичным или метастазирующим. В еще одном варианте осуществления изобретения рак является рецидивирующим, не поддающимся лечению или резистентным к химиотерапии или облучению; в частности, не поддающимся лечению талидомидом.
Изобретение предоставляет также способы лечения пациентов, которые ранее принимали лечение от рака, но которые являются невосприимчивыми к стандартным терапевтическим средствам, а также пациентов, которые ранее не подвергались лечению. Изобретение предоставляет также способы лечения пициентов, независимо от возраста пациента, хотя некоторые злокачественные опухоли более распространены в определенных возрастных группах. Изобртение предоставляет также способы лечения пациентов, которые перенесли хирургическую операцию в попытке лечения рассматриваемой злокачественной опухоли, а также пациентов, которые не подвергались операции. Поскольку у пациентов с раком наблюдаются разные клинические проявления заболеваний и различные клинические последствия болезни, лечение, назначенное пациенту, может изменяться в зависимости от его/ее прогноза. Квалифицированный клинический врач будет способен определить без излишнего экспериментирования специфические вторичные средства, типы оперативного вмешательства и типы стандартной терапии без применения лекарственных средств, котоые могут эффективно использоваться для лечения конкретного пациента, страдающего раком.
Кроме того, изобретение предоставляет способы лечения или предотвращения расстройств, тиких как легочная гипертензия, комплекс Карнея (Carney Complex), мышечное истощение (атрофия, кахексия), миопатии, такие как болезнь Данона, а также бактериальных, грибковых и вирусных инфекций (включая M. tuberculosis, стрептококки группы A, вирус простого герпеса HSV тип I и ВИЧ инфекции).
Гетероарильное соединение может объединяться с другими фармакологически активными соединениями («вторыми активными ингредиентами») в способах и композициях, описанных в данном изоретении. Считается, что некоторые сочетания могут рабобтать в лечении конкретных пиитов заболеваний или расстройств, и состояний и симптомов, связанных с такими заболеваниями или расстройствами. Гетероарильное соединение также может работать для облегчения неблагоприятных эффектов, связанных с определенными вторыми активными агентами и наоборот.
Один или несколько вторых активных ингредиентов или агентов могут применяться в способах и композициях, описанных в данном изобретении. Вторые активные ингредиенты могут представлять собой вещества с большими молекулами (например, белки) или маленькими молекулами (например, синтетические неорганические, металлорганические или органические молекулы).
Примеры вторых активных ингредиентов с большими молекулами включают, но без ограничения, гематопоэтические ростовые факторы, цитокины и моноклональные и поликлональные антитела. Конкретными примерами активных ингредиентов являются моноклональные антитела против CD40 (такие как, например, SGN-40); ингибиторы гистондиацетилазы (такое как, например, MGCD0103, SAHA и LAQ 824); гипометилирующие агенты (такие как Vidaza); иммуномодуляторные продукты торговой марки IMiDs® (такие как талидомид, леналидомид и помалидомид); ингибиторы белков теплового шока-90 (такие как, например, 17-AAG); ингибиторы киназ рецептора инсулиноподобного гормона роста; ингибиторы киназ рецептора васкулярного эндотелиального ростового фактора (такие как, например, PTK787); ингибиторы рецептора инсулинового ростового фактора; ингибиторы лизофосфатидовой кислоты-ацилтрансферазы; ингибиторы IkB киназы; p38MAPK ингибиторы; ингибиторы Pim киназы (такие как, например, SGI-1776, или описанные в WO/2008/106692); EGFR ингибиторы (такие как, например, гефитиниб и эрлотиниб HCL); HER-2 антитела (такие как, например, трастузумаб (Herceptin®) и пертузумаб (Omnitarg™), а также ингибиторы HER-2 киназы (такие как Lapatinib); антитела против VEGFR (такие как, например, бевацизумаб (Avastin™)); VEGFR ингибиторы (такие как, например, flk-1 специфические киназные ингибиторы, SU5416 и ptk787/zk222584); P13K ингибиторы (такие как, например, вортманнин); C-Met ингибиторы (такие как, например, PHA-665752); антиэстрогены (такие как, например, Letrozole, Fulvestrant, тамоксифен); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тоситумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и антитела против-TNF-α. Примеры активных ингредиентов с небольшими молекулами включают, но без ограничения, противораковые лекарственные средства и антибиотики с небольшими молекулами (например, кларитромицин).
Специфические вторые активные ингредиенты, которые могут объединяться с гетероарильным соединением, подбирают в зависимости от специфического показания, подлежащего лечению, предотвращению или облегчению (managed).
Например, для лечения, вторые активные ингредиенты для лечения, предотвращения или контроля рака включают, но без ограничения: анти-фолаты, такие как Premetrexed™; семаксаниб; циклоспорин; этанерцепт; доксициклин; бортезомиб; ацивицин; акларубицин; акодазола гидрохлорид; акронин; адозелесин; алдеслуйкин; алтретамин; амбомицин; аметантрона ацетат; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепу; азотомицин; батимастат; бензодепу; бикалутамид; бисантрена гидрохлорид; биснафида димезилат; бизелезин; блеомицина сульфат; бреквинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбобплатин; кармустин; карубицина гидрохлорид; карзелезин; кедефмгол (cedefmgol); целекоксиб; хлорамбуцил; циролемицин (cirolemycin); цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; дицитабин; дексармаплатин; дезаквианин (dezaguanine); дезаквианина мезилат; diaziquone; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона протионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; элсамитруцин (elsamitrucin); энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эсорубицина гидрохлорид; эстрамустин; эстрамустина фосфат натрия; этанидазол; этопозид; этопозида фосфат; этоприн; фадрозола гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; фторцитабин; фосквидон; фостриецин натрий; гемцитабин; гемцитабина гидрохлорид; гидроксимочевину; идарубицина гидрохлорид; ифосфамид; илмофозин; ипроплатин; иринотекан; иринотекана гидрохлорид; ленреотида ацетат; летрозол; лейпролида ацетат; лиарозола гидрохлорид; лометрексол натрий; лумустин, лозоксантрона гидрохлорид; мазопрокол; майтанзин; мехлоретамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркапторурин; метотрексат; метотрексат натрий; метоприн; метуредепу; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловая кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрона гидрохлорид; пликамицин; пломестан; парфимер натрий; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; сафингол; сафингола гидрохлорид; сумустин; симтразен; спарфосат натрий; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрепонигрин; стрептозоцин; сулофенур; талисомицин; текогалан натрий; таксотер; тегафур; телоксантрона гидрохлорид; темопорфм; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотера; тиазофурин; тирапазамин; торемифена цитрат; трестолона ацетат; трицирибина фосфат; триметрексат; триметрексата глукуронат; трипторелин; тубулозона гидрохлорид; uracil mustard; уредепу; вапреотид; вертепорфм; винбластина сульфат; винкристина сульфат; виндезин; виндезина сульфат; винепидина сульфат; виеноициеаиа сульфат; винлеурозина сульфат; винорелбина тартрат; винрозидина сульфат; винзолидина сульфат; ворозоле; зениплатин; зиностатин; и зорубицина гидрохлорид.
Другие вторые активные ингредиенты включают, но без ограничения: 20-эпи-1,25-дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфулвен; адеципенол; адозелизин; альдеслейкин; ALL-TK антагонисты; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; анти-дорзализационный морфогенетический белок 1; антиандроген рака предстательной железы; антиэстроген; антинеопластон; антисмысловые олигонуклнотиды; афидиколина глицинат; генных модуляторы апоптоза; регуляторы апоптоза; сединения, мишенью которых является метаболизм, такие как ресвератол; апуриновую кислоту; ara-CDP-DL-PTBA; аргининдеаминазу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; BCR/ABL антагонисты; бензохлоринз (benzochlorins); бензоилстауроспорин; производные бэта-лактама; бэта-алетин; бетакламицин B; бетулиновую кислоту; bFGF ингибитор; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен A; бизелезин; брефлат (breflate); бропиримин; будотитан; бутионина сульлфоксимин; кальципотриол; кальфостин C; производные камптотецина; капецитабин; карбоксамидаминотриазол; карбоксиамидотриазол; CaRest M3; CARN 700; cartilage derived inhibitor; карзелезин; ингибиторы казеинкиназы (casein kinase inhibitors - ICOS); кастаноспермин; цекропин B; цетрореликс; chlorlns; хлорхиноксалина сульфонамид; цикппрост; цис-порфирин; кладрибин; клатромицин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналоги комбрестатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин A; циклопентантрахиноны; циклоплатам; ципемицин; цитарабина окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; дезлорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; дидемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; 9-дигидротаксол; диоксамицин; бифенила спиромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; доксорубицин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эдельфосин; эдреколомаб; эфломитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопосида фосфат; экземестан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордауноруницина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафирин; азотнокислый галлий; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глютатиона; гепсульфам; херегулин; гексаметиленбисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофосин; иломастат; иматиниб (Geevec®); имиквимод; иммуностимулирующие пептиды; ингибитор рецепторов инсулиноподобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгван; иододоксомбицин; 4-ипомеанол; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итазетрон; ясплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; леинамицин; ленограстим; лентинана сульфат; лептолстатин; летрозол; фактор, ингибирующий лейкоз; альфа-интерферон лейкоцита; леупролид+эстроген+прогестерон; леупрорелин; левамизол; лиарозол; линейный аналог полиамина; липофильный пептид дисахарида; липофильные платиновые соединения; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; тексафирин лютеция; лизофиллин; лизирующие пептиды; маитансин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; матричные ингибиторы металлопротеиназы; меногарил; мербарон; метерелин; метиониназу; метоклопрамид; ингибитор MIF; мифепристон; милтефосин; миримостим; митогуазон, митоквазон; митолактол; аналоги митомицина; митонафид; митотоксин фактора роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостим; Erbitux, человеческий хориальный гонадотропин; монофосфорильный липид А+миобактериальной клеточной оболочки sk; мопидамол; ипритное антиопухолевое средство; микапероксид B; экстракт микобактериальной клеточной оболочки; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; низамицин; модуляторы оксида азота; антиоксидант нитроксида; нитруллин; облимерсен (Genasens®); O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; орацин; индуктор цитокина ротовой полости; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаз; пелдезин; пентозана полисульфат-натрий; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпина гидрохлорид; пирарубицин; пиритрексим; плацетин A; плацетин B; ингибитор активатора плазмогена; платиновый комплекс; платиновые соединения; платино-траминовый комплекс; порфимер натрия; порфиромицин; преднизолон; пропил бис-акридон; простагландин J2; ингибиторы протеасом; белок А-основного иммуномодулятора; ингибитор протеинкиназы C; микроалгальные ингибиторы протеинкиназы C; ингибиторы белка тирозинфосфатаз; ингибиторы фосфорилазы пуриновых нуклеозидов; пурпурины; пиразолоакридин; конъюгат пиридоксилированного гемоглобина с полиоксиэтиленом; raf антагонисты; ралтитрексед; рамозетрон; ингибиторы ras farnesyl протеинтрансферазы; ингибиторы ras; ras-GAP ингибитор; деметилированный ретеллиптин; этидронат рения Re 186; ризоксин; рибозимы; RII ретинамид; рогитукин; ромуртид; рохинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семустин; ингибитор старения 1; чувствительные олигонуклеотиды; ингибиторы сигнальной передачи; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; соматомедин, агрегирующий белки; сонермин; спарфосовую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; суперактивный вазоактивный антагонист интестинального пептида; сурадиста; сурамин; сваинзонин; таллимустин; тамоксифена метиодид; тауромустин; тазаротен; текогалан натрия; тегафур; теллурапириллий; ингибиторы теломеразы; темопорфин; темозоломид; тенипосид; тетрахлородекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; тромбопоэтинмиметик; тималфазин; агонист рецептора тимопоэтина; тимотринан; гормон, стимулирующий щитовидную железу; олова этил этиопурпурин; тирапазамин; титаноцена дихлорид; топсентин; торемифен; ингибиторы транслокации; третиноин; триацелилуридин; трицирибин; триметрексат; трипторелин; тропизетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; фактор, ингибирующий рост мочеполового синуса; антагонисты рецептора урокиназы; вапреотид; вариолин B; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; зиностатина стималамер.
Конкретные примеры вторых активных ингредиентов включают, но без ограничения, 2-метоксиэстрадиол, теломестатин, индукторы апоптоза в клетках множественной миеломы (такие как, например, TRAIL), бортезомид, статины, семаксаниб, циклоспорин, энанерцепт, доксициклин, бортезомид, облимерсен (Genasense®), ремикад, доцетаксел, целекоксиб, мелфалан, дексаметазон (Decadron®), стеоиды, гемцитабин, цисплатин, темозоломид, этопозид, циклофосфамид, методар, карбоплатин, покарбазин, глиадел, тамоксифен, топотекан, метотрексат, Arisa®, таксол, таксотер, фторурацил, лейковорин, иринотекан, кселода, CPT-11, интерферон альфа, пегилированный интерферон альфа (например, PEG INTRON-A), капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомный даунорубицин, цитарабин, доксетаксол, пацилитаксел (pacilitaxel), винбластин, IL-2, GM-CSF, дакарбазин, винореблин, золедроновую кислоту, палмитронат, биаксин, бисульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адриамицин, экстрамустин натрия фосфат (Emcyt®), сулиндак и этопозид.
Аналогично, конкретные примеры вторых активных ингредиентов согласно показаниям, подлежащим лечению, предупреждению или облегчению, можно найти в следующих публикациях, содержание которых введено в описание во всей полноте в виде ссылок: патенты США №№ 5635517, 6281230 и 7189740; и заявки на патенты США №№ 2004/0029832, 2004/0087546, 2004/0091455, 2005/0100529, 2005/0214328, 2005/0239842, 2006/0122228, 2006/0143344, 2006/0154880 и 2006/0188475.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, стандартные терапевтические средства, применяемые для лечения или предупреждения боли, такие как антидепрессанты, противосудорожные средства, гипотензивные средства, анксиолитические лекарственные средства, блокаторы кальциевых каналов, миорелаксанты, ненаркотические аналгетики, опиоидные аналгетики, противовоспалительные лекарственные средства, cox-2 ингибиторы, иммуномодуляторы, агонисты и антагонисты альфа-адренергического рецепторов, иммунодепрессиные средства, кортикостероиды, кислород под повышенным давлением, кетамин, другие анестетики, NMDA антагонисты и другие терапевтические средства, описанные, например, в публикации Physician's Desk Reference 2003. Конкретные примеры включают, но без ограничения, ацетат салициловой кислоты, ацетилсалициловая кислота (Aspirin®), целекоксиб (Celebrex®), Enbrel®, кетами, габапентин (Neurontin®), фенитоин (Dilantin®), карбамазепин (Tegretol®), оксакарбазепин (Trileptal®), вальпроевая кислота (Depakene®), морфина сульфат, гидроморфон, преднизон, гризеофульвин, пентоний (penthonium), алендронат, дифенгидрамид, гуанетидин, кеторолак (Acular®), тирокальцитонин, диметилсульфоксид (ДМСО), клонидин (Catapress®), бретилий, кетансерин, резерпин, дроперидол, атропин, фенотоламин, буписакаин, лидокаин, ацетаминофен, нортриптилин (Pamelor®), амитриптилин (Elavil®), имипрамин (Tofranil®), доксепин (Sinequan®), кломипрамин (Anafranil®), флуоксетин (Prozac®), сертралин (Zoloft®), нефазодон (Serzone®), венлафаксин (Effexor®), тразодон (Desyrel®), бупропион (Wellbutrin®), мексилетин, нифедипин, пропранолол, трамадол, ламотригин, зиконотид, кетамин, декстрометорфан, бензодиазепины, баклофен, тизанидин и феноксибензамин.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, стероид, фотохимический сенсибилизатор, интегрин, антиоксидант, интерферон, призводное ксантина, гормон роста, нейротрофин, регулятор образования новых сосудов, антитело против VEGF, простагландин, антибиотик, фитоэстроген, противовоспалительное соединение или противоангиогенное соединение или их сочетание. Конкретные примеры включают, но без ограничения, вертепорфм, рурлитин, ангиостатический стероид, rhuFab, интерферон-2γ, пентоксифиллин, этиопурпурин олова, мотексафин лутеция (motexafin lutetium), 9-фтор-11,21-дигидрокси-16,17-1-метилэтилидин-бис(окси)прегна-1,4-диен-3,20-дион, латапрост (смотрите патент США № 6225348), тетрациклин и его производные, рифамицин и его производные, макролиды, метронидазол (патенты США №№ 6218369 и 6015803), генестеин, генестин, 6'-О-Mal генистин, 6'-О-Ac генистин, даидзеин, даидзин, 6'-О-Mal даидзин, 6'-О-Ac даидзин, глицитеин, глицитин, 6'-О-Mal глицитин, биоханин А (biochanin A), формононетин (патент США № 6001368), триамцинолона ацетомид, дексаметаноз (патент США № 5770589), талидомид, глутатион (патент США № 5632984), основой фактор роста фибробластов (bFGF), трансформирующий фактор роста b (TGF-b), нейротропный фактор роста (BDNF), фактор активации плазминогенов 2 типа (PAI-2), EYE101 (Eyetech Pharmaceuticals), LY333531 (Eli Lilly), Miravant и RETISERT имплант (Bausch & Lomb). Содержания всех публикаций, цитированных выше, введены в настоящее описание во всей полноте в виде ссылки.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, кератолитики, ретиноиды, α-гидроксикислоты, антибиотики, коллаген, ботулинотоксин, интерферон и иммуномодуляторы. Конкретные примеры включают, но без ограничения, 5-фторурацил, мазопрокол, трихлоруксусную кислоту, салициловую кислту, молочную кислоту, лактат аммония, мочевину, третионоин, изотретиноин, антибиотики, коллаген, ботулинотоксин, интерферон, кортикостероид, транс-ретиноевую кислоту и коллагены, такие как человеческий плацентарный коллаген, животный плацентарный коллаген, Dermalogen, AlloDerm, Fascia, Cymetra, Autologen, Zyderm, Zyplast, Resoplast и Isolagen.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, антикоагулянты, диуретические средства, кардиотонические гликозиды, блокаторы кальциевых каналов, сосудорасширяющие средства, аналоги простациклина, антагонисты эндотелина, ингибиторы фосфодиэстразы (например, PDE V ингибиторы), ингибиторы эндопептидазы, средства, снижающие содержание липидов, ингибиторы тромбоксана и другие терапевтические средства, снижающие давление в легочной артерии. Конкретные примеры включают, но без ограничения, варфарин (Coumadin®), диуретическое средство, кардиотонический гликозид, дигоксин-кислород, дилтиазем, нифедипин, сосудорасширяющее средство, такое как простациклин (например, простагландин 12 (PG12), эпопростенол (EPO, Floran®), трепростинил (Remodulin®), оксид азота (NO), бозентан (Tracleer®), амлодипин, эпопростенол (Floran®), трепростинил (Remodulin®), простациклин, тадалафил (Cialis®), симвастатин (Zocor®), омапатрилат (Vanlev®), ирбесартан (Avapro®), правастатин (Pravachol®), дигоксин, L-аргинин, илопрост, бетапрост и силданафил (Viagra®).
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, антрациклин, платину, алкилирующий агент, облимерсен (Genasense®), цис-платину, циклофосфамид, темодар, карбоплатин, прокарбазин, глиадел, тамоксифен, топотекан, метотрексат, таксотер, иринотекан, капецитабин, цисплатин, тиотепу, флударабин, карбоплатин, липосомальный даунорубицин, цитарабин, доксетаксол, пацилитаксел (pacilitaxel), винбластин, IL-2, GM-CSF, дакарбазин, винорелбин, золедроновая кислота, пальмитронат (palmitronate), биаксин, бусульфан, преднизон, бисфосфонат, триоксид мышьяка, винкристин, доксорубицин (Doxil®), паклитаксел, ганцикловир, адрамицин, блеомицин, гуалуронидазу, митомицин C, мепакрин, тиотепу, тетрациклин и гемцитабин.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, хлорохин, гуинин (quinine), хинидин, пириметамин, сульфадиазин, доксициклин, клиндамицин, мефлохин, галофантрин, примахин, гидроксихлорохин, прогуанил, атоваквон, азитромицин, сурамин, пентамидин, меларсопрол, нифуртимокс, бензнидазол, амфотрицин B, пятивалентные соединения сурьмы (например, стибоглюкуронат натрия), интерферон гамма, итраконазол, комбинацию мертвых промастиготов и BCG, лейковорин, кортикостероиды, сульфонамид, спирамицин, IgG (серология), триметоприм и сульфаметоксазол.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, антибиотики (для терапевтического или профилактического применения), такие как, но без ограничения, ампициллин, кларитромицин, тетрациклин, пенициллин, цефалоспорины, стрептомицин, канамицин и эритромицин; противовирусные средства, такие как, но без ограничения, амантадин, римантадин, ацикловир рибавирин; иммуноглобулин; плазму; средства, повышающие иммунитет, такие как, но без ограничения, левамизол и изопринозин; биологические добавки, такие как, но без ограничения, гаммоглобулин, фактор переноса, интерлейкины и интерфероны; гормоны, такие как, но без ограничения, тимический гормон; и другие иммунологические средства, такие как, но без ограничения, стимуляторы B-клеток (например, BAFF/BlyS), цитокины (например, IL-2, IL-4 и IL-5), факторы роста (например, TGF-γ), антитела (например, против CD40 и IgM), олигонуклеотиды, содержащие неметилированные CpG мотивы, и вакцины (например, вирусные и противоопухолевые пептидные вакцины).
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, агонист или антагонист допамина, такой как, но без ограничения, Levodopa, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопу, мезилат перголида, Sinemet CR и Symmetrel; MAO ингибитор, такой как, но без ограничения, ипрониазид, клоргилин, фенелзин и изокарбоксазид; COMT ингибитор, такой как, но без ограничения, толкапон и энтакапон; ингибитор холинэстеразы, такой как, но без ограничения, физостигмина салицилат, физостигмина сульфат, физостигмина бромид, меостигмина бромид, неостигмина метилсульфат, амбенонима хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетила моноксим, эндрофоний, пиридостигмин и демекарий; противовоспалительное средство, такое как, но без ограничения, напроксен натрия, диклофенак натрий, диклофенак калий, целекоксиб, оксапрозин, дифлунисал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, Rho-D Immune Globulin, микофенилата мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенамовая кислота, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкоза, тиомалат золото-натрия, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензбромарон или бетаметазон и другие глюкокортикоиды; и противорвотное средство, такое как, но без ограничения, метоклопрамид, домперидон, проклорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биэтанаутин (bietanautine), бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металатал, метопимазин, набилон, оксиперидил (oxyperndyl), пипамазин, скополамин, сульпирид, тетрагидроканнабинол, тиэтилперазин, тиопроперазин, трописетрон и их смесь.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, иммуномодуляторы, иммунодепрессивные средства, гипотензивные средства, противосудорожные средства, фибринолитические средства, средства, препятствующие склеиванию тромбоцитов, нейролептические средства, антидепрессанты, бензодиазепины, буспирон, амантадин и другие известные или традиционные средства, используемые для лечения пациентов с травмой/повреждением ЦНС и связанными с ними синдромами. Конкретные примеры включают, но без ограничения, стероиды (например, глюкокортикоиды, такие как, но без ограничения, метилпреднизолон, дексаметазон и бетаметазон); противовоспалительное средство, в том числе, но без ограничения, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D Immune Globulin, микофенилата мофетил, циклоспорин, азатиоприн, такролимус, базиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, вивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглюкозу, тиомалат натрий-золота, ауранофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон и бензобромарон; cAMP аналог, включая, но без ограничения, db-cAMP; лекарственное средство на основе производного метилфенидата, например, l-трео-метилфенидат, d-трео-метилфенидат, dl-трео-метилфенидат, l-эритро-метилфенидат, d-эритро-метилфенидат, dl-эритро-метилфенидат и их смеси; и диуретическое средство, такое как, но без ограничения, маннитол, фуросемид, глицерин и мочевина.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, трициклический антидепрессант, селективный ингибитор поглощения серотонина, противосудорожное средство (габапентин, прегабалин, карбамазепин, окскарбамазепин, левитирацетам, топирамат), противоаритмическое средство, блокатор натриевых каналов, селективный ингибитор медиатора воспаления, опиодное средство, второй иммуномодулятор, средство комбинированной терапии, а также другие известные или традиционные лекарственные средства, используемые в лечении длительным сном. Конкретные примеры включают, но без ограничения, Neurontin, оксиконтин, морфин, топирамат, амитриптилин, нортриптилин, карбамазепин, Levodopa, L-DOPA, кокаин, α-метилтирозин, резерпин, тетрабеназин, бензотропин, паргилин, фенодолпама мезилат, каберголин, прамипексола дигидрохлорид, ропинорол, амантадина гидрохлорид, селегилина гидрохлорид, карбидопу, перголида мезилат, Sinemet CR, Symmetrel, ипрониазид, клоргилин, фенелзин, изокарбоксазид, толкапон, энтакапон, физостигмиа салицилат, физостигмина сульфат, физостигмина бромид, неостигмина бромид, неостигмина метилсульфат, амбенонима хлорид, эдрофония хлорид, такрин, пралидоксима хлорид, обидоксима хлорид, тримедоксима бромид, диацетил-моноксим, эндрофоний, пиридостигмин, демекарий, напроксен натрий, диклофенак натрий, диклофенак калий, целекоксиб, сулиндак, оксапрозин, дифлунизал, этодолак, мелоксикам, ибупрофен, кетопрофен, набуметон, рефекоксиб, метотрексат, лефлуномид, сульфасалазин, соли золота, RHo-D Immune Globulin, микофенилата мофетил, циклоспорин, азатиоприн, такролимус, басиликсимаб, даклизумаб, салициловую кислоту, ацетилсалициловую кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, ацетаминофен, индометацин, сулиндак, мефенаминовую кислоту, меклофенамат натрий, толметин, кеторолак, диклофенак, флурбипрофен, оксапрозин, пироксикам, мелоксикам, ампиолксикам, дроксикам, пивоксикам, теноксикам, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон, зилеутон, ауротиоглукозу, тиомалат золото-натрий, ауронофин, метотрексат, колхицин, аллопуринол, пробенецид, сульфинпиразон, бензбромарон, бетаметазон и другие глюкокортикоиды, метоклопрамид, домперидон, прохлорперазин, прометазин, хлорпромазин, триметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцина моноэтаноламин, ализаприд, азасетрон, бензхинамид, биетанаутин (bietanautine), бромприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон, меклизин, металлатал, метопимазин, набилон, оксиперидил, пипамазин, скополамин, сулпирид, тетрагидроканнабинол, триэтилперазин, тиопроперазин, трописетрон и их смесь.
Примеры дополнительных вторых активных ингредиентов включают, но без ограничения, интерлейкины, такие как IL-2 (включая рекомбинантный IL-II ("rIL2") и канарипокс IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2a, интерферон альфа-2b, интерферон альфа-n1, интерферон альфаa-n3, интерферон бета-Ia и интерферон гамма-Ib; и G-CSF; гидроксимочевину; бутираты или бутират-производные; оксид азота; HEMOXIN™ (NIPRISAN™; смотрите патент США № 5800819); антагонисты каналов Гардоса (Gardos channel), такие как клотримазол и производные триарилметана; Deferoxamine; белок C; и средства переливания крови или заменители крови, такие как Hemospan™ или Hemospan™ PS (Sangart).
Введение гетероарильного соединения и второго активного ингредиента пациенту может осуществляться одновременно или последовательно одинаковыми или различными способами введения. Возможность примнения конкретного способа введения для конкретного активного ингредиента будет зависеть от самого активного ингредиента (например, от того, может ли он вводиться перорально без разложения до поступления в ток крови) и заболевания, подлежащего лечению. Предпочтительным способом введения для гетероарильныхл соединений является пероральный способ введения. Предпочтительные способы введения вторых активных ингредиентов или ингредиентов согласно изобретению известны специалисту в данной области техники (смотрите, например, Physicians' Desk Reference, 1755-1760 (56th ed., 2002)).
В одном варианте осуществления изобретения второй активный ингредиент вводится внутривенно или подкожно один или два раза в сутки в количестве от примерно 1 до примерно 1000 мг, от примерно 5 до примерно 500 мг, от примерно 10 до примерно 350 мг или от примерно 50 до примерно 200 мг. Точное количество второго активного ингредиента будет зависеть от применяемого активного ингредиента, типа заболевания, подлежащего лечению или облегчению, тяжести и стадии заболевания и количеств(а) гетероарильного соединения и любых необязательных дополнительных активных ингредиентов, одновременно вводимых пациенту.
Изобретение дополнительно предоставляет способы снижения, лечения или предотвращения неблагоприятных или нежелательных эффектов, связанных с традиционной терапией, включая, но без ограничения, хирургическое вмешательство, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Гетероарильные соединения и другие активнее ингредиенты могут вводиться пациенту до, во время или после проявления неблагоприятного эффекта, связанного с традиционной терапией.
4.5. Фармацевтические композиции и способы их введения
Настоящее изобретение предоставляет композиции, включающие эффективное количество гетероарильного соединения, и композиции, включающие эффективное количество гетероарильного соединения и фармацевтически приемлемый носитель или разбавитель. В некоторых вариантах осуществления изобретения фармацевтическая композиция, описанная в данном изобретении, подходит для перорального, парентерального введения, для введения через слизистую оболочку, а также чрезкожного и местного введения.
Гетероарильные соединения могут вводиться пациенту перорально или парентерально в препаратах стандартной формы, таких как капсулы, микрокапсулы, таблетки, гранулы, порошок, пастилки, пилюли, суппозитории, препараты для инъекций, суспензии и сиропы. Подходящие препараты могут быть получены обычными способами с применением традиционных органических или неорганических добавок, таких как наполнитель (например, сахароза, крахмал, маннит, сорбит, лактоза, глюкоза, целлюлоза, тальк, фосфат кальция или карбонат кальция), связующее вещество (например, целлюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, полипропилпирролидон, поливинилпирролидон, желатин, гуммиарабик, полиэтиленгликоль, сахароза или крахмал), дезинтегрирующее вещество (например, крахмал, карбоксиметилцеллюлоза, гидроксипропилкрахмал, низшая замещенная гидроксипропилцеллюлоза, бикарбонат натрия, фосфат кальция или цитрат кальция), добавка, повышающая скольжение (например, стеарат магния, безводная кремниевая кислота, тальк или натрийлаурилсульфат), вкусовая добавка (например, лимонная кислота, ментол, глицин или порошок оранжевого цвета), консервант (например, бензоат натрия, бисульфит натрия, метилпарабен или пропилпарабен), стабилизатор (например, лимонная кислота, цитрат натрия или уксусная кислота), суспендирующая добавка (например, метилцеллюлоза, поливинилпирролидон или стеарат алюминия), диспергирующая добавка (например, гидроксипропилметилцеллюлоза), разбавитель (например, вода) и воскообразная основа (например, масло какао, вазелин или полиэтиленгликоль). Эффективное количество гетероарильного соединения в фармацевтической композиции может быть на уровне, который будет давать желаемый эффект; например, от примерно 0,005 мг/кг массы тела пациента до примерно 10 мг/мг массы тела пациента в стандартной дозе для перорального и парентерального введения.
Доза гетероарильного соединения, которая должна вводиться пациенту, может изменяться в широких пределах и может назначаться лечащим врачом. Обычно гетероарильные соединения могут вводиться пациенту от одного до четырех раз в сутки в дозе от примерно 0,005 мг/кг массы тела пациента до примерно 10 мг/кг массы тела пациента, но указанная выше дозировка может должным образом изменяться в зависимости от возраста, массы тела, состояния пациента, а также способа их введения. В одном варианте осуществления изобретения доза составляет от примерно 0,01 мг/кг массы тела пациента до примерно 5 мг/кг массы тела пациента, от примерно 0,05 мг/кг массы тела пациента до примерно 1 мг/кг массы тела пациента, от примерно 0,1 мг/кг массы тела пациента до примерно 0,75 мг/кг массы тела пациента или от примерно 0,25 мг/кг массы тела пациента до примерно 0,5 мг/кг массы тела пациента. В другом варианте осуществления изобретения доза вводится один раз в сутки. В любом случае, вводимое количество гетероарильного соединения будет зависеть от таких факторов, как растворимость активного ингредиента, тип препарата и способ его введения.
В еще одном варианте осуществления изобретение предоставляет способы лечения или предупреждения заболевания или расстройства, включающие введение пациенту, нуждающемуся в таком введении, от примерно 0,375 мг/сутки до примерно 750 мг/сутки, от примерно 0,75 мг/сутки до примерно 375 мг/сутки, от примерно 3,75 мг/сутки до примерно 75 мг/сутки, от примерно 7,5 мг/сутки до примерно 55 мг/сутки или от примерно 18 мг/сутки до примерно 37 мг/сутки гетероарильного соединения.
В еще одном варианте осуществления изобретение предоставляет способы лечения или предупреждения заболевания или расстройства, включающие введение пациенту, нуждающемуся в таком введении, от примерно 1 мг/сутки до примерно 1200 мг/сутки, от примерно 10 мг/сутки до примерно 1200 мг/сутки, от примерно 100 мг/сутки до примерно 1200 мг/сутки, от примерно 400 мг/сутки до примерно 1200 мг/сутки, от примерно 600 мг/сутки до примерно 1200 мг/сутки, от примерно 400 мг/сутки до примерно 800 мг/сутки или от примерно 600 мг/сутки до примерно 800 мг/сутки гетероарильного соединения. В конкретном варианте осуществления способы, описанные в данном изобретении, включают введение пациенту, нуждающемуся в таком введении, 400 мг/сутки, 600 мг/сутки или 800 мг/сутки гетероарильного соединения.
В еще одном варианте осуществления изобретение предоставляет препараты стандартной дозы, которые включают в интервале от примерно 1 мг до примерно 2000 мг, от примерно 1 мг до 200 мг, от примерно 35 мг до примерно 1400 мг, от примерно 125 мг до примерно 1000 мг, от примерно 250 мг до примерно 1000 мг или от примерно 500 мг до примерно 1000 мг гетероарильного соединения.
В конкретном варианте осуществления изобретение предоставляет препарат стандартной дозы, включающий примерно 100 мг или 400 мг гетероарильного соединения.
В еще одном варианте осуществления изобретение предоставляет препараты стандартной дозы, которые включают 1 мг, 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 30 мг, 35 мг, 50 мг, 70 мг, 100 мг, 125 мг, 140 мг, 175 мг, 200 мг, 250 мг, 280 мг, 350 мг, 500 мг, 560 мг, 700 мг, 750 мг, 1000 мг или 1400 мг гетероарильного соединения.
Гетероарильное соединение может вводиться один, два, три, четыре или более раз в сутки.
Гетероарильное соединение может вводиться перорально, поскольку это весьма удобный способ введения. В одном варианте осуществления изобретения гетероарильное соединение при пероральном введении вводится во время приема пищи и с водой. В еще одном варианте осуществления изобретения гетероарильное соединение диспергируется в воде или в соке (например, в яблочном или апельсиновом соке) и вводится перорально в виде суспензии. В еще одном варианте осуществления изобретения гетероарильное соединение при пероральном введении вводится натощак.
Гетероарильное соединение может вводиться внутрикожно, внутримышечно, интраперитонеально, внутрикожно, внутривенно, подкожно, назально, эпидурально, подъязычно, интрацеребрально, интравагинально, чрескожно, ректально, на слизистую оболочку, ингаляцией или местно в уши, нос, глаза или на кожу. Способ введения подбирается лечащим врачом и может в некоторой степени зависеть от сайта развития патологического процесса.
В одном варианте осуществления изобретение предоставляет капсулы, содержащие гетероарильное соединение без дополнительного носителя, наполнителя или разбавителя.
В еще одном варианте осуществления изобретение предоставляет композиции, включающие эффективное количество гетероарильного соединения и фармацевтически приемлемый носитель или разбавитель, где фармацевтически приемлемый носитель или разбавитель может включать наполнитель, растворитель или их смесь. В одном варианте осуществления изобретения композиция представляет собой фармацевтическую композицию.
Композиции могут быть представлены в форме таблетки, жевательной таблетки, капсулы, растворов, растворов для парентерального введения, пастилок, суппозиториев, суспензии и т.п. Композиции могут быть изготовлены для введения суточной дозы или стандартной части суточной дозы, в стандартной дозе, которая может представлять собой единственную таблетку или капсулу или стандартный объем жидкости. В одном варианте осуществления изобретения растворы приготовлены из растворимых в воде солей, таких как гидрохлоридная соль. Обычно все композиции получают способами, известными в области фармацевтической химии. Капсулы могут быть получены смешением гетероарильного соединения с подходящим носителем или разбавителем и введением подходящего количества полученной смеси в капсулы. Обычные носители и разбавители включают, но без ограничения, инертные порошкообразые вещества, такие как крахмал различных видов, порошкообразнач целлюлоза, в частности, кристаллическая и микрокристаллическая целлюлоза, сахара, такие как фруктоза, маннит и сахароза, различные виды зерновой муки и аналогичные съедобные порошки.
Таблетки могут быть получены прямым прессованием, влажным гранулированием или сухим гранулированием. Такие препараты обычно включают разбавители, связующие вещества, добавки, повышающие скольжение, и диперсанты, а также активное соединение. Типичные разбавители включают, например, крахмал различных типов, лактозу, маннит, каолин, фосфат кальция или сульфат, неорганические соли, такие как хлорид натрия, и порошкообразный сахар. Могут также применяться производные порошкообразной целлюлозы. В одном варианте осуществления изобретения фармацевтическая композиция не содержит лактозы. Типичные связующие вещества для таблеток представляет собой такие вещества как крахмал, желатин и сахара, например, лактозу, фруктозу, глюкозу и т.п. Природные и синтетические смолы, которые традиционно применяются, включают гуммиарабик, альгинаты, метилцеллюлозу, поливинилпирролидин и т.п. Полиэтиленгликоль, этилцеллюлоза и воски также могут выступать в качестве связующих веществ.
Вещество, повышающее скольжение, может быть необходимо в препарате в форме таблетки для защиты таблеток от спекания и от налипания к штампу. Вещество, повышающее скольжение, может быть выбрано из таких скользких твердых веществ, как тальк, стеарат магния и кальция, стеариновая кислота и гидрированные растительные масла. Дезинтегрирующие добавки для таблеток представляют собой вещества, которые набухают при смачивании для разрушения таблетки и высвобождения соединения. Они включают крахмалы, глины, целлюлозы, альгины и смолы. В частности, могут использоваться, например, кукурузный и картофельный крахмалы, метилцеллюлоза, агар, бентонит, древесная целлюлоза, порошкообразная природная губка, катионообменные смолы, альгиновая кислота, гуаровая смола, цитрусовая пульпа и карбоксиметилцеллюлоза, а также натрийлаурилсульфат. Таблетки могут быть покрыты сахаром в качестве вкусового вещества и уплотнительного материала или пленкообразующими защитными добавками для модификации свойств таблетки. Композиции также могут быть представлены в форме жевательной таблетки, например, посредством введения в препарат таких веществ, как маннит.
Когда требуется введение гетероарильного соединения в виде суппозитория, могут использоваться трационные основы для суппозиториев. Масло какао является традиционной основой для суппозиториев, которая может модифицироваться добавлением восков для небольшого повышения температуры плавления. Широко используются смешивающиеся с водой основы для суппозиториев, включающие, в частности, полиэтиленгликоли различных молекулярных масс.
Действие гетероарильного соединения может замедляться или продлеваться с помощью подходящего препарата. Например, медленно растворимый пеллет гетероарильного соединения может быть приготовлен и введен в таблетку или капсулу или в устройство для имплантации для медленного высвобождения действующего вещества. Данный способ включает также получение пеллет с несколькими различными скоростями растворения и заполнение капсул смесью указанных пеллет. Таблетки или капсулы могут быть покрыты пленкой, которая является стойкой к растворению в течение заданного периода времени. Даже препараты для парентерального введения могут быть получены в форме препаратов длительного действия посредством растворения или суспендирования гетероарильного соединения в масляном или эмульсионном разбавителе, который позволяет соединению медленно диспергироваться в сыворотке крови.
5. ПРИМЕРЫ
Для получения названий химических структур соединений использовали пограммное обеспечение Chem-4D Draw (ChemInnovation Software, Inc., San Diego, CA) или ChemDraw Ultra (Cambridgesoft, Cambridge, MA).
В описании и в примерах использовали следующие аббревиатуры:
AmPhos: п-диметиламинофенилди-трет-бутилфосфин
Boc: трет-бутоксикарбонил
dba: дибензилиденацетон
ДМСО: диметилсульфоксид
ESI: элекстронораспылительная ионизация
ВЭЖХ: высокоэффективная жидкостная хроматография
Т.пл.: температура плавления
MC: масс-спектрометрия
NBS: N-бромсукцинимид
ЯМР: ядерный магнитный резонанс
ТФА: трифторуксусная кислота
ТСХ: тонкослойная хроматография
MTBE: метил-трет-бутиловый эфир
Приведенные далее примеры представлены только для иллюстрации изобретения, но не для его ограничения.
5.1. ПРИМЕРЫ СИНТЕЗА
Пример 1: 7-(2-амино-4-метил-1Н-бензо[d]имидазол-6-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. Этил-2-(6-хлорпиразин-2-иламино)ацетат. К смеси 2,6-дихлорпиразина (50 г, 336 ммоль) и этил-2-аминоацетата (34,6 г, 336 ммоль) добавляют триэтиламин (140 мл, 1007 ммоль) и ацетонитрил (350 мл). Реакционную смесь нагревают при 80°C в течение 3 дней. Осажденные триэтиламинные соли удаляют фильтрацией и несколько раз промывают смесью этилацетат:гексан (1:1). Фильтрат и промывной раствор объединяют и концентрируют. Полученный желто-белый осадок собирают фильтрацией и промывают 20% раствором этилацетата в гексане, получая твердое не совсем белое вещество. Фильтрат снова подвергают такой же обработке, получая дополнительную порцию твердого не совсем белого вещества. Обе порции объединяют, получая указанное в заглавии соединение (35,5 г, 164 ммоль, выход 49%). MC (ESI) m/z 216,1 [M+1]+.
B. Этил-2-(пиразин-2-иламино)ацетат. Этил-2-(6-хлорпиразин-2-иламино)ацетат (23,6 г, 109 ммоль) растворяют в неденатурированном этаноле (250 мл) и к полученному раствору добавляют карбонат калия (15,13 г, 109 ммоль). Реакционную смесь помещают в атмосферу азота и к смеси добавляют гидроксид палладия (3,84 г, 5,47 ммоль). Реакционную смесь перемешивают в атмосфере водорода в течение 18 часов. К смеси добавляют дополнительную порцию гидроксида палладия (3,84 г, 5,47 ммоль) и через полученную смесь в течение ночи при перемешивании пропускают дополнительное количество водорода. Реакционную смесь отфильтровывают церез целит и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение (15,13 г, 84 ммоль, выход 76%). MC (ESI) m/z 182,3 [M+1]+.
C. Этил 2-(3,5-дибромпиразин-2-иламино)ацетат. Этил 2-(пиразин-2-иламино)ацетат (7,6 г, 41,9 ммоль) растворяют в диметилсульфоксиде (80 мл) и воде (4,00 мл) и полученную смесь охлаждают до 0°C. К полученной смеси медленно в течение 15 минут добавляют N-бромсукцинимид (18,66 г, 105 ммоль), реакционной смеси дают нагреться до комнатной температуры и смесь перемешивают в течение 48 часов. К смеси добавляют дополнительные 1,5 экв. N-бромсукцинимида и полученную смесь перемешивают в течение ночи. Реакционную смесь выливают в ледяную воду (200 мл) и экстрагируют этилацетатом (150 мл). Водный слой нейтрализуют медленным добавлением карбоната натрия до достижения pH~7 и экстрагируют этилацетатом (3×150 мл). Органические слои объединяют, промывают раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток растирают с 25-33% раствором этилацетата в гексане и полученный осадок собирают фильтрацией, получая твердый продукт желтого цвета. Остаток коричневого цвета очищают хроматографией (Biotage, силикагель, 0-60% этилацетат в гексане), получая еще одную порцию твердого вещества желтоватого цвета. Обе порции объединяют, получая 24 г указанного в заголовке соединения (24 г, 71 ммоль, выход 75%). MC (ESI) m/z 338,1 [M]+, 340,1 [M+2]+, 342,1 [M+4]+.
D. Этил-2-(5-бром-3-((тетрагидро-2H-пиран-4-ил)метиламино)пиразин-2-иламино)ацетат. Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (2,00 г, 5,90 ммоль), (тетрагидро-2H-пиран-4-ил)метанамин (0,713 г, 6,19 ммоль), N,N-диизопропилэтиламин (3,08 мл, 17,70 ммоль) и диметилсульфоксид (4 мл) объединяют в емкости для микроволновой обработки с магнитной мешалкой и выдерживают в микроволновом реакторе Biotage Emrys Optimizer при 150°C в течение 1 часа. Полученную смесь переносят в круглодонную колбу с метанолом. Метанол и N,N-диизопропилэтиламин удаляют при пониженном давлении и остаток очищают флэш-хроматографией (Biotage, 5-100% этилацетат в гексане). Фракции, содержащие целевой продукт, объединяют в делительной воронке и дважды промывают водой и один раз раствором соли. Органические слои сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток сушат в высоком вакууме при 50°C, получая неочищенный продукт (1,578 г) в виде воскообразного твердого вещества янтарного цвета, который используют на следующей стадии без дополнительной очистки. MC (ESI) m/z 373,4 [M]+, 375,4 [M+2]+.
E. 7-бром-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. Раствор этил-2-(5-бром-3-((тетрагидро-2H-пиран-4-ил)метиламино)пиразин-2-иламино)ацетата (1,474 г, 3,95 ммоль) в уксусной кислоте (13 мл) в герметичной емкости нагревают при 120°C на масляной бане в течение 2 часов. Уксусную кислоту удаляют при пониженном давлении. Остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия, встряхивают и слои разделяют. Водный слой дважды экстрагируют этилацетатом. Объединенные органические слои сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток переносят в дихлорметан и гексан и полученный твердый продукт собирают вакуумной фильтрацией. Твердый продукт промывают гексаном и сушат в вакууме, получая указанное в заголовке соединение (0,879 г, 2,688 ммоль, выход 68%) в виде твердого вещества темно-красного цвета. MC (ESI) m/z 327,1 [M]+, 329,0 [M+2]+.
F. 2-метил-6-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин. 4-бром-2-метил-6-нитроанилин (5 г, 21,64 ммоль), бис(пинаколято)дибор (5,50 г, 21,64 ммоль), ацетат калия (6,37 г, 64,9 ммоль) и N,N-диметилформамид (100 мл) объединяют и дегазируют в вакууме. К смеси добавляют ацетат палладия (0,243 г, 1,082 ммоль) и систему снова дегазируют. Реакционную смесь нагревают до 90°C в течение 2 часов. Реакционную смесь экстрагируют водой и дихлорметаном. Органический слой сушат над безводным сульфатом магния, отфильтровывают и концентрируют. Остаток очищают колоночной хроматографией (силикагель, 0-30% этилацетат в гексанах), получая твердый продукт желтого цвета (5,3 г, 19,0 ммоль, выход 88%). MC (ESI) m/z 279,0 [M+1]+.
G. 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензол-1,2-диамин. Через раствор 2-метил-6-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (5,3 г, 19,06 ммоль) в метаноле (50 мл) пропускают газообразный азот. В раствор добавляют палладий на угле (10 масс.%, 50 мг) и через реакционную смесь при перемешивании в течение 16 часов пропускают водород. Реакционную смесь отфильтровывают церез целит и осадок на фильтре промывают метанолом. Фильтрат концентрируют и полученный остаток очищают колоночной хроматографией (силикагель, 0-100% этилацетат в гексанах), получая темное масло. Масло растирают с 10% эфиром в гексанах, получая указанное в заголовке соединение в виде твердого вещества желтовато-коричневого цвета (4,2 г, 16,9 ммоль, выход 89%). MC (ESI) m/z 248,9 [M+1]+.
H. 7-(3,4-диамино-5-метилфенил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензол-1,2-диамин (0,523 г, 2,109 ммоль), 7-бром-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,600 г, 1,834 ммоль), комплекс [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,150 г, 0,183 ммоль), карбонат натрия (1 M в воде, 5,50 ммоль), 1,4-диоксан (4,1 мл) и изопропанол (1,4 мл) объединяют в герметичной закрывающейся емкости с магнитной мешалкой. Систему продувают азотом. Полученную смесь герметично закрывают, энергично перемешивают, нагревают при 100°C в течение 3,5 часа. Полученную смесь разбавляют 20% раствором метанола в дихлорметане и все летучие вещества удаляют при пониженном давлении. Остаток переносят в 20% раствор метанола в дихлорметане и концентрируют при пониженном давлении с силикагелем. Остаток очищают флэш-хроматографией (1-10% метанол в дихлорметане), получая указанное в заголовке соединение (0,669 г, 1,818 ммоль, выход 99%) в виде твердого вещества коричневого цвета. MC (ESI) m/z 369,1 [M+1]+.
I. 7-(2-амино-4-метил-1Н-бензо[d]имидазол-6-ил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Бромциан (0,059 г, 0,556 ммоль) в N,N-диметилформамиде (0,5 мл) добавляют в перемешиваемый раствор 7-(3,4-диамино-5-метилфенил)-1-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (0,195 г, 0,529 ммоль) в N,N-диметилформамиде (3 мл) при 0°C. Полученную смесь темно-коричневого цвета закрывают и перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь разбавляют метанолом, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (5-50% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют и большую часть растворителя удаляют при пониженном давлении. Остаток загружают в ионообменную колонку (Strata X-C от Phenomenex). Колонку промывают последовательно водой, ацетонитрилом, метанолом и 5% раствором гидроксида аммония в метаноле. Продукт элюируют 5% раствором гидроксида аммония в метаноле, концентрируют при пониженном давлении и сушат в высоком вакууме при 50°C, получая указанное в заголовке соединение (0,130 г, 0,331 ммоль, выход 62%) в виде твердого вещества оранжевого цвета.
1H-ЯМР (400 МГц, D2O и ДМСО-d6) δ (м.д.) 8,13 (с, 1H), 7,56 (с, 1H), 7,36 (с, 1H), 4,18 (с, 2H), 4,03 (д, J=6,64 Гц, 2H), 3,84-3,90 (м, 2H), 3,24 (т, J=11,32 Гц, 2H), 2,40 (с, 3H), 2,04-2,19 (м, 1H), 1,59 (д, J=12,10 Гц, 2H), 1,25-1,41 (м, 2H); MC (ESI) m/z 394,2 [M+1]+.
Пример 2: 3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 3-(4-бром-3-метилфенил)-4H-1,2,4-триазол. 4-бром-3- метилбензонитрил (10,0 г, 51,0 ммоль) растворяют в этаноле (200 мл) при перемешивании и охлаждают до 0°C в атмосфере азота. Газообразный хлористый водород барботируют через реакционную смесь в течение 20 минут. Полученную реакционную смесь закрывают и перемешивают, медленно нагревая до комнатной температуры, в течение 5,5 часа. Растворитель удаляют при пониженном давлении и остаток сушат в вакууме, получая 13,86 г твердого не совсем белого вещества. Полученный продукт, гидразид муравьиной кислоты (4,48 г, 74,6 ммоль), триэтиламин (28,0 мл, 199 ммоль) и этанол (90 мл) объединяют в герметично закрывающейся пробирке, нагревают с перемешиванием при 90°C в течение 6,5 часа. Весь растворитель удаляют при пониженном давлении и полученный остаток распределяют между этилацетатом и водой. Слои разделяют, органические слои промывают раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток растворяют в горячем этилацетате (13 мл), закрывают и оставляют при комнатной температуре на ночь. Растворитель отделяют от твердых веществ на дне колбы декантированием. Твердый осадок промывают этилацетатом и диэтиловым эфиром и сушат в вакууме при 45°C, получая указанное в заголовке соединение (7,47 г, 31,4 ммоль, выход 63%) в виде твердого вещества бледно-желтого цвета. MS (ESI) m/z 238,2 [M]+, 240,3 [M+2]+.
B. 3-(4-бром-3-метилфенил)-4-(тетрагидро-2H-пиран-2-ил)-4H- 1,2,4-триазол. 3-(4-бром-3-метилфенил)-4H-1,2,4-триазол (2,00 г, 8,40 ммоль) растворяют в перемешиваемом тетрагидрофуране (10 мл) при комнатной температуре в атмосфере азота. К раствору добавляют 3,4-дигидро-2H-пиран (3,80 мл, 42,0 ммоль) и метансульфоновую кислоту (0,027 мл, 0,42 ммоль), полученную смесь нагревают при 50°C с обратным холодильником в атмосфере азота в течение 20 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и раствором соли. Органические слои сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (10-30-50% этилацетат в гексанах), получая указанное в заголовке соединения (2,64 г, 8,22 ммоль, выход 98%) в виде масла желтого цвета. MC (ESI) m/z 322 [M]+, 324 [M+2]+.
C. 3-(3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол. 3-(4-бром-3-метилфенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол (2,294 г, 7,12 ммоль), бис(пинаколято)дибор (1,898 г, 7,48 ммоль), комплекс [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (291 мг, 0,36 ммоль), ацетат калия (2,096 г, 21,4 ммоль) и диметилсульфоксид (15 мл) объединяют в круглодонной колбе и перемешивают. Атмосферу колбы удаляют в вакууме и трижды заменяют ее азотом. Полученную смесь нагревают при 90°C в атмосфере азота в течение 4 часов. Реакционную смесь разбавляют этилацетатом и отфильтровывают через целит. Осадок на фильтре тщательно промывают этилацетатом. Фильтрат промывают дважды водой, один раз раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Флэш-хроматография (30-50% этилацетат в гексанах) приводит к получению воскообразного полутвердого вещества, которое растирают с гексаном при 45°C. Полученный твердый продукт сушат в вакууме, получая указанное в заголовке соединение (2,10 г, 5,69 ммоль, выход 80%) в виде порошка розового цвета. MC (ESI) m/z 370 [M+1]+.
D. Трет-бутил 1-(3,5-дибромпиразин-2-иламино)-2-метил-1-оксопропан-2-илкарбамат. 1,1'-карбонилдиимидазол (2,63 г, 16,24 ммоль) добавляют к перемешиваемому раствору 2-(трет-бутоксикарбониламино)-2-метилпропановой кислоты (3,00 г, 14,76 ммоль) в N,N-диметилформамиде (4 мл) и дихлорметане (8 мл) при комнатной температуре. Полученную прозрачную бесцветную смесь перемешивают при комнатной температуре в атмосфере азота в течение 3 часов. К смеси добавляют N,N-диизопропилэтиламин (3,86 мл, 22,14 ммоль) и затем 3,5-дибромпиразин-2-амин (5,60 г, 22,14 ммоль). Полученную реакционную смесь нагревают при 50°C с обратным холодильником в атмосфере азота в течение 71 часа. Дихлорметан удаляют при пониженном давлении. Остаток разбавляют этилацетатом и промывают водой. Водный слой экстрагируют этилацетатом. Объединенные органические слои промывают раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток растирают с 30% раствором этилацетата в гексане и твердые вещества собирают вакуумной фильтрацией. Фильтрат концентрируют при пониженном давлении и очищают флэш-хроматографией (5-50% этилацетат в гексане). Фракции, содержащие целевой продукт, объединяют с твердым веществом, полученным фильтрацией, и концентрируют при пониженном давлении. Остаток сушат в высоком вакууме, получая указанный в заголовке продукт (2,38 г, 5,43 ммоль, выход 37%) в виде твердого не совсем белого вещества. MS (ESI) m/z 439,3 [M+1]+, 461,1 [M+Na]+.
E. Трифторацетат N-(3,5-дибромпиразин-2-ил)-2-метил-2-(2-(тетрагидро-2H-пиран-4-ил)этиламино)пропанамида. К смеси трет-бутил-1-(3,5-дибромпиразин-2-иламино)-2-метил-1-оксопропан-2-илкарбамата (1,04 г, 2,374 ммоль) и дихлорметана (20 мл) при перемешивании добавляют ТФА (3,66 мл, 47,5 ммоль). Полученный прозрачный раствор желтого цвета перемешивают при комнатной температуре в течение 3 часов. Все летучие вещества удаляют при пониженном давлении и остаток сушат в высоком вакууме, получая продукт в виде полутвердого вещества желтого цвета. MC (ESI) m/z 339,1 [M+1]+. К полученному продукту добавляют сульфат натрия (1,686 г, 11,87 ммоль), 2-(тетрагидро-2H-пиран-4-ил)ацетальдегид (0,396 г, 3,09 ммоль) и 1,2-дихлорэтан (20 мл). Реакционную смесь энергично перемешивают и нагревают при 80°C с обратным холодильником в атмосфере азота в течение 2,5 часа. Добавляют дополнительное количество 2-(тетрагидро-2H-пиран-4-ил)ацетальдегида (0,100 г, 0,780 ммоль) и сульфата натрия (1,00 г, 7,04 ммоль) и смесь продолжают нагревать при 80°C в течение дополнительных 2 часов. Полученный раствор желтого цвета отделяют с помощью пипетки от твердого сульфата натрия и переносят в сухую круглодонную колбу объемом 250 мл, снабженную магнитной мешалкой. Полученную смесь энергично перемешивают и охлаждают до 0°C в атмосфере азота. К смеси медленно добавляют триацетоксиборгидрид натрия (0,553 г, 2,61 ммоль). Полученную смесь энергично перемешивают при 0°C в атмосфере азота в течение 30 минут. Охлаждающую баню удаляют и смесь перемешивают при комнатной температуре в атмосфере азота в течение 2 часов. Смесь охлаждают до 0°C и добавляют дополнительную порцию триацетоксиборгидрида натрия (0,250 г, 1,180 ммоль). Охлаждающую баню удаляют и полученную смесь перемешивают при комнатной температуре в атмосфере азота в течение 1,5 часа. Добавляют еще одну порцию триацетоксиборгидрида натрия (0,055 г, 0,260 ммоль). Полученную смесь энергично перемешивают при комнатной температуре в атмосфере азота в течение 1 часа и затем перемешивают в течение ночи при 0°C. Полученную смесь разбавляют метанолом и летучие вещества удаляют при пониженном давлении. Остаток переносят в метанол, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (10-40% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют и растворитель удаляют при пониженном давлении. Остаток сушат в вакууме, получая указанное в заголовке соединение (0,890 г, 1,978 ммоль, выход 67%) в форме пены бледно-желтого цвета. MC (ESI) m/z 451,3 [M+1]+.
F. 6-бром-3,3-диметил-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Трифторацетат N-(3,5-дибромпиразин-2-ил)-2-метил-2-(2-(тетрагидро-2H-пиран-4-ил)этиламино)пропанамида (0,856 г, 1,517 ммоль), N,N-диизопропилэтиламин (1,321 мл, 7,59 ммоль) и 1,4-диоксан (25 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом и полученную смесь герметично закрывают, энергично перемешивают, нагревают при 110°C в течение 2,5 часа. Реакционную смесь концентрируют при пониженном давлении и очищают флэш-хроматографией (5-50% этилацетат в гексане), получая указанное в заголовке соединение (0,394 г, 1,068 ммоль, выход 70%) в виде твердого вещества белого цвета. MS (ESI) m/z 369,4 [M]+, 371,3 [M+2]+.
G. 3,3-диметил-6-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 3-(3-метил-4-(4,4,5,5-тетраметил-l,3,2-диоксаборолан-2-ил)фенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол (1 экв.), 6-бром-3,3-диметил-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он (1 экв.), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,1 экв.), 1 M раствор карбоната натрия в воде (3 экв.), 1,4-диоксан и изопропанол объединяют и систему продувают азотом. Полученную смесь энергично перемешивают, нагревают при 100°C в течение 1,5 часа. Реакционную смесь охлаждают до комнатной температуры, разбавляют метанолом и летучие вещества удаляют при пониженном давлении. Остаток распределяют между дихлорметаном и водой, встряхивают и слои разделяют. Водный слой экстрагируют дихлорметаном. Объединенные органические слои сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (20-100% этилацетат в гексане, затем 0-10% метанол в дихлорметане), получая указанное в заголовке соединение (выход 97%). MC (ESI) m/z 532,7 [M+1]+.
H. 3,3-диметил-6-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b] пиразин-2(1Н)-он. 6 н. раствор хлористоводородной кислоты в воде добавляют к перемешиваемой смеси 3,3-диметил-6-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она в этаноле при 80°C. Полученную смесь энергично перемешивают и нагревают при 80°C с обратным холодильником в атмосфере азота в течение 70 минут. Полученную смесь отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (10-65% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют, нейтрализуют насыщенным водным раствором бикарбоната натрия и ацетонитрил удаляют при пониженном давлении. Твердые вещества собирают вакуумной фильтрацией, тщательно промывают водой и диэтиловым эфиром и сушат в высоком вакууме при 50°C, получая указанное в заголовке соединение (выход 48%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,32 (ушир.с, 1H), 8,44 (ушир.с, 1H), 7,96 (с, 1H), 7,90 (д, J=8,59 Гц, 1H), 7,70 (c, 1Н), 7,56 (д, J=7,81 Гц, 1Н), 3,78 (дд, J=2,93, 11,13 Гц, 2H), 3,52-3,64 (м, 2H), 3,23 (т, J=10,93 Гц, 2H), 2,48 (c, 3H), 1,51-1,66 (м, 5H), 1,49 (c, 6H), 1,11-1,26 (м, 2H); МС (ESI) m/z 448,3 [M+1]+.
Пример 3: Гидрохлорид 7-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она
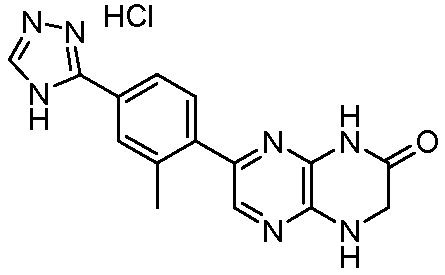
A. Этил-2-(5-бром-3-(2,4-диметоксибензиламино)пиразин-2- иламино)ацетат. Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (смотрите пример 1.C) (1,06 г, 3,13 ммоль), (2,4-диметоксифенил)метанамин (0,601 г, 3,60 ммоль), N,N-диизопропилэтиламин (1,63 мл, 9,38 ммоль) и диметилсульфоксид (1,6 мл) объединяют в емкости для микроволновой обработки с магнитной мешалкой и выдерживают в микроволновом реакторе при 150°C в течение 2 часов. Полученную смесь очищают флэш-хроматографией (5-60% этилацетат в гексане). Фракции, содержащие целевой продукт, объединяют и упаривают почти досуха при пониженном давлении. К остатку добавляют этилацетат (2 мл) и гексан (18 мл). Полученный твердый продукт собирают вакуумной фильтрацией, промывают гексаном и сушат в высоком вакууме, получая указанное в заголовке соединение (0,636 г, 1,495 ммоль, выход 48%) в виде твердого вещества светло-розового цвета.
1H-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 7,24 (с, 1Н), 7,19 (д, J=8,52 Гц, 1Н), 7,11 (т, J=5,63 Гц, 1Н), 6,84 (т, J=4,81 Гц, 1Н), 6,59 (д, J=2,47 Гц, 1Н), 6,50 (дд, J=2,20, 8,24 Гц, 1Н), 4,37 (д, J=4,67 Гц, 2H), 3,96-4,15 (м, 4H), 3,81 (с, 3H), 3,75 (с, 3H), 1,17 (т, 3H); МС (ESI) m/z 425,3 [M]+, 426,9 [M+2]+.
B. 7-бром-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он трифторацетат. Этил-2-(5-бром-3-(2,4-диметоксибензиламино)пиразин-2-иламино)ацетат (0,484 г, 1,138 ммоль), метанол (0,461 мл, 11,38 ммоль) и ТФА (7 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом. Полученную смесь герметично закрывают, энергично перемешивают и нагревают при 75°C на масляной бане в течение 25 минут. Реакционную смесь разбавляют водой (14 мл) и перемешивают при комнатной температуре в течение 5 минут. Твердые вещества собирают вакуумной фильтрацией, промывают водой и диэтиловым эфиром и сушат в высоком вакууме, получая указанное в заголовке соединение (0,375 г, 1,093 ммоль, выход 96%) в виде твердого вещества розового цвета. МС (ESI) m/z 229,0 [M]+, 231,3 [M+2]+.
C. 7-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 3-(3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол (смотрите пример 2.C) (0,465 г, 1,259 ммоль), трифторацетат 7-бром-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (0,432 г, 1,259 ммоль), комплекс [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,103 г, 0,126 ммоль), карбонат натрия (1 M раствор в воде, 3,78 мл, 3,78 ммоль), 1,4-диоксан (2,5 мл) и изопропанол (1 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом. Реакционную смесь герметично закрывают, энергично перемешивают и нагревают при 100°C в течение 70 минут. Реакционную смесь разбавляют водой и дихлорметаном и отфильтровывают через фильтровальную воронку. Твердые вещества промывают 20% раствором метанола в дихлорметане. Фильтрат и промывные растворы объединяют и растворитель удаляют при пониженном давлении. Остаток растирают с ацетонитрилом. Добавляют воду. Твердый осадок собирают вакуумной фильтрацией и тщательно промывают водой и диэтиловым эфиром. Затем твердый осадок промывают 20% раствором метанола в дихлорметане. Фильтрат и промывные растворы объединяют и растворитель удаляют при пониженном давлении. Остаток переносят в смесь горячего ДМСО и метанола, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (20-65% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют, нейтрализуют насыщенным водным раствором бикарбоната натрия и упаривают почти досуха при пониженном давлении. Твердый осадок собирают вакуумной фильтрацией, промывают водой и сушат в высоком вакууме, получая указанное в заголовке соединение (0,072 г, 0,184 ммоль, выход 15%) в виде твердого не совсем белого вещества. МС (ESI) m/z 392,1 [М+1]+.
D. Гидрохлорид 7-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она. К смеси 7-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (0,070 г, 0,179 ммоль) и этанола (3 мл) с перемешиванием при 80°C добавляют хлористоводородную кислоту (6 н. в воде, 0,149 мл, 0,894 ммоль). Систему продувают азотом. Полученную смесь герметично закрывают и нагревают при 80°C. Полученную смесь нагревают при 80°С в течение 25 минут и затем охлаждают до комнатной температуры. Твердые вещества собирают фильтрацией, промывают метанолом и сушат в высоком вакууме при 40°C, получая указанное в заголовке соединение (0,058 г, 0,169 ммоль, выход 94%) в виде твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 11,32 (с, 1Н), 8,66 (с, 1Н), 7,97 (с, 1Н), 7,92 (дд, J=1,37, 7,97 Гц, 1Н), 7,74 (с, 1Н), 7,50 (д, J=7,97 Гц, 1Н), 4,14 (с, 2H), 2,44 (с, 3H); МС (ESI) m/z 308,3 [М+1]+.
Пример 4: 6-(4-(2-гидроксипропан-2-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он
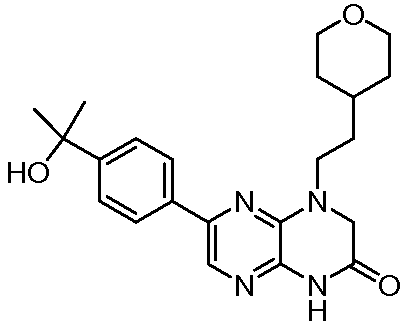
A. 2-бром-N-(3,5-дибромпиразин-2-ил)ацетамид. Раствор 2-амино-3,5-дибромпиразина (6,17 г, 23,7 ммоль) и бромуксусного ангидрида (3,0 г, 11,9 ммоль) в ацетонитриле (40 мл) перемешивают при 70°C. После полного исчезновения исходных веществ (при помощи ТСХ) раствор концентрируют и распределяют между водой и этилацетатоам (3×). Органические слои объединяют, сушат над сульфатом магния, отфильтровывают и растворитель удаляют при пониженном давлении. Полученный продукт очищают колоночной хроматографией (Biotage, 5-80% этилацетат в гексанах), получая указанное в заголовке соединение (3,78 г, 10,1 ммоль, выход 85%). МС (ESI) m/z 372,1 [M-2]+, 374,0 [M]+, 376,1 [M+2]+, 378,3 [M+4]+.
B. 6-бром-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. 2-бром-N-(3,5-дибромпиразин-2-ил)ацетамид (3,30 г, 8,83 ммоль) и гидрохлорид 2-(тетрагидро-2H-пиран-4-ил)этанамина (1,46, 8,83 ммоль) и диизопропилэтиламин (6,67 мл, 35,3 ммоль) объединяют и нагревают при 85°C. После полного исчезновения исходных веществ (при помощи ТСХ) реакционный раствор концентрируют и очищают хроматографией (Biotage, 0-100% этилацетат в гексанах), получая указанное в заголовке соединение (1,53 г, 4,48 ммоль, выход 50%). МС (ESI) m/z 341,4 [M]+, 343,1 [M+2]+.
C. 2-(4-бромфенил)пропан-2-ол. 1-(4-бромфенил)этанон (9,25 г, 46,5 ммоль) растворяют в тетрагидрофуране (200 мл). Раствор охлаждают на охлаждающей бане при -50°C. К охлажденному раствору в течение 15 минут добавляют метилмагнийбромид (3 M раствор в эфире, 46,5 мл, 139 ммоль). Реакционной смеси дают возможность нагреться до комнатной температуры и затем перемешивают в течение 20 часов. Реакцию гасят насыщенным раствором хлорида аммония и затем экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют, получая масло. Масло очищают колоночной хроматографией (силикагель, 0-20% этилацетат в гексанах), получая указанное в заголовке соединение в виде бесцветного масла (9,1 г, 46,2 ммоль, выход 91%). МС (ESI) m/z 197,1 [M]+, 199,1 [M+2]+.
D. 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропан-2-ол. Смесь 2-(4-бромфенил)пропан-2-ола (4,7 г, 21,85 ммоль), бис(пинаколято)дибора (6,66 г, 26,2 ммоль), ацетата калия (6,43 г, 65,6 ммоль) и диметилсульфоксида (50 мл) перемешивают и дегазируют в вакууме в течение 10 минут. Добавляют комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,892 г, 1,093 ммоль) и реакционную смесь еще раз дегазируют в течение дополнительных 5 минут. После этого реакционную смесь нагревают до 80°C в атмосфере азота в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и затем экстрагируют смесью эфир:этилацетат (1:1) и водой. Полученную эмульсию черного цвета отфильтровывают через рыхлый слой целита и фильтрат объединяют с экстракционными слоями. Органический слой сушат над сульфатом магния, отфильтровывают и очищают колоночной хроматографией (силикагель, 0-25% этилацетат в гексанах). Фракции, содержащие продукт, концентрируют и затем остаток растирают в гексанах, получая указанное в заголовке соединение в виде твердого вещества белого цвета (4,0 г, 15,3 ммоль, выход 70%). МС (ESI) m/z 263,3 [М+1]+.
E. 6-(4-(2-гидроксипропан-2-ил)фенил)-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 6-бром-4-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,250 г, 0,733 ммоль), 2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропан-2-ол (0,192 г, 0,733 ммоль) и комплекс дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) и дихлорметана (0,030 г, 0,037 ммоль) объединяют в диметилформамиде (1,0 мл). К смеси добавляют раствор карбоната натрия (0,311 г, 2,93 ммоль) в воде (0,2 мл) и реакционную смесь выдерживают в микроволновом реакторе Biotage Emrys Optimizer при 120°C в течение 15 минут. Охлажденный реакционный раствор отфильтровывают через целит и осадок на фильтре промывают этилацетатом. Фильтрат и промывной этилацетатный раствор объединяют и растворитель удаляют при пониженном давлении. Полученный продукт очищают колоночной хроматографией (Biotage, 0-5% метанол в этилацетате) и растирают с диметилформамидом и водой, получая указанное в заголовке соединение (0,074 г, 0,19 ммоль, 25%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 12,24 (с, 1Н), 7,98 (с, 1Н), 7,89 (д, J=8,39 Гц, 2H), 7,53 (д, J=8,39 Гц, 1Н), 5,04 (с, 1Н), 4,16 (с, 1H), 3,82 (дд, J=11,1, 2,39 Гц, 2H), 3,61 (т, J=7,59 Гц, 2H), 3,25 (т, J=9,59 Гц, 3H), 1,70 (с, 1Н), 1,66 (с, 1Н), 1,58 (м, 3H), 1,44 (с, 6H), 1,25 (м, 2H); МС (ESI) m/z 397,2 [М+1]+; т.пл. 210-212°C.
Пример 5: 6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 2-хлор-N-(3,5-дибромпиразин-2-ил)ацетамид. Смесь 2-амино-3,5-дибромпиразина (3,0 г, 11,9 ммоль) и хлоруксусного ангидрида (4,2 г, 8,7 ммоль) подвергают взаимодействию в ацетонитриле (10 мл) при 70°C в течение 16 часов. Полученную реакционную смесь конденсируют и разбавляют этилацетатом. Органические слои промывают смесью (1:1) насыщенного раствора бикарбоната натрия (насыщенного) и карбоната калия (1,75 M в воде) (4×). Органические слои объединяют, сушат над сульфатом магния, отфильтровывают и растворитель удаляют при пониженном давлении. Полученный твердый продукт растирают с 10% раствором этилацетата в гексанах, получая указанное в заголовке соединение (3,12 г, 9,3 ммоль, выход 72%). МС (ESI) m/z 328,3 [M-1]+, 330,4 [М+1]+, 332,3 [M+3]+.
B. N-(3,5-дибромпиразин-2-ил)-2-йодацетамид. К раствору 2-хлор-N-(3,5-дибромпиразин-2-ил)ацетамида (3,0 г, 9,11 ммоль) в ацетоне (40 мл) добавляют раствор йодида натрия (13,65 г, 91 ммоль) в ацетоне (20 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 16 часов. Полученную реакционную смесь конденсируют при пониженном давлении, разбавляют этилацетатом (500 мл) и затем промывают водой (5х) для удаления голубого окрашивания. Органические слои сушат над сульфатом магния, отфильтровывают и растворитель удаляют при пониженном давлении, получая неочищенный продукт. Твердый продукт разбавляют 10% раствором этилацетата в гексанах (40 мл) и обрабатывают ультразвуком, в процессе чего происходит очистка боковых поверхностей колбы. После этого раствор нагревают с помощью фена в течение 5 минут, затем охлаждают при ультразвоковой обработке до температуры окружающей среды. Полученный твердый продукт собирают фильтрацией, промывают дополнительным количеством гексанов и сушат в вакууме, получая указанное в заголовке соединение (3,0 г, 7,13 ммоль, выход 78%). МС (ESI) m/z 420,3 [M-1]+, 422,0 [М+1]+, 424,0 [M+3]+.
C. 6-бром-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. N-(3,5-дибромпиразин-2-ил)-2-йодацетамид (0,5 г, 1,188 ммоль), диизопропилэтиламин (0,415 мл, 2,376 ммоль) и 2-морфолиноэтанамин (0,162 г, 1,248 ммоль) объединяют в ацетонитриле (5 мл). Реакционную смесь нагревают до 45°C и выдерживают при указанной температуре в течение 1 часа. Раствор конденсируют и разбавляют 75% раствором этилацетата в гексанах. Полученный твердый продукт собирают фильтрацией, фильтрат конденсируют и очищают хроматографией (Biotage, 0-75% этилацетат в гексанах, затем 0-10% метанол в этилацетате), получая указанное в заголовке соединение (0,228 г, 0,67 ммоль, выход 56%). МС (ESI) m/z 342,4 [M]+, 344,4 [M+2]+.
D. 2-(5-бромпиридин-2-ил)пропан-2-ол. В круглодонную колбу объемом 100 мл загружают 2,5-дибромпиридин (1,04 г, 4,39 ммоль) и толуол (22 мл). Полученный раствор охлаждают до -78°C. К охладенному раствору по каплям добавляют н-бутиллитий (3,02 мл, 4,83 ммоль). Смесь перемешивают в течение 30 минут, затем к смеси добавляют ацетон (2 мл). Реакционную смесь перемешивают в течение 40 минут и затем дают возможность смеси нагреться до комнатной температуры. Смесь промывают хлоридом аммония (5% водн., 50 мл), водой (50 мл) и затем раствором соли (50 мл). Органический слой сушат над сульфатом натрия, отфильтровывают и концентрируют. Остаток очищают хроматографией (Biotage, 16% этилацетат в гексанах). Фракции, содержащие продукт, концентрируют, получая указанное в заголовке соеднинение (0,82 г, 3,78 ммоль, выход 86%). МС (ESI) m/z 216,0 [M]+, 218,1 [M+2]+.
E. 2-(5-(триметилстаннил)пиридин-2-ил)пропан-2-ол. 2-(5-бромпиридин-2-ил)пропан-2-ол (0,34 г, 1,574 ммоль), 1,1,1,2,2,2-гексаметилдистаннан (0,361 мл, 1,652 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,182 г, 0,157 ммоль) объединяют в толуоле (5 мл) в герметично закрывающейся колбе объемом 50 мл. Реакционную смесь перемешивают при 115°C в течение 1,5 часа. После этого смесь концентрируют до объема примерно 2 мл. Остаток очищают хроматографией (Biotage, 16% раствор этилацетата в гексанах). Фракции, содержащие продукт, концентрируют, получая указанное в заголовке соединение (0,33 г, 1,10 ммоль, выход 70%). МС (ESI) m/z 302,1 [М+1]+.
F. 6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 6-бром-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,228 г, 0,666 ммоль) и 2-(5-(триметилстаннил)пиридин-2-ил)пропан-2-ол (0,220 г, 0,733 ммоль) объединяют в диметилформамиде (3 мл). Раствор продувают газообразным азотом, затем добавляют комплекс дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном (0,109 г, 0,133 ммоль). Реакционную смесь нагревают до 100°C в течение 2 часов. Полученную реакционную смесь конденсируют при пониженном давлении и полученное масло очищают препаративной ВЭЖХ с обращенной фазой (5-60% ацетонитрил +0,1% ТФА в H2O +0,1% ТФА, в течение 30 минут), и полученные фракции, содержащие продукт, загружают в ионообменную колонку (Strata-XC). Колонку промывают последовательно водой, ацетонитрилом, метанолом и 5% раствором гидроксида аммония в метаноле. Продукт элюируют 5% раствором гидроксида аммония в метаноле, и концентрируют при пониженном давлении и сушат, получая указанное в заголовке соединение (0,070 г, 0,18 ммоль, выход 26%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,33 (ушир.с, 1Н), 9,05 (д, J=1,56 Гц, 1Н), 8,27 (дд, J=8,59, 2,34 Гц, 1Н), 8,06 (с, 1Н), 7,72 (д, J=8,59 Гц, 1Н), 5,27 (с, 1Н), 4,29 (с, 2H), 3,71 (т, J=6,44 Гц, 2H), 3,54 (т, J=4,49 Гц, 4H), 2,62 (т, J=6,44 Гц, 2H), 2,40-2,48 (м, 4H), 1,46 (с, 6H); МС (ESI) m/z 399,2 [М+1]+; т.пл. 239-241°C.
Пример 6: 1-(((транс)-4-метоксициклогексил)метил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 5-бром-4-метилпиколинонитрил. 2,5-дибром-4-метилпиридин (5,0 г, 19,9 ммоль), цианид меди (1,43 г, 15,9 ммоль), цианид натрия (0,801 г, 16,3 ммоль) и диметилформамид (30 мл) объединяют в герметично закрывающейся емкости, нагревают при 158°C в течение 3 часов. Реакционную смесь очищают колоночной хроматографией (силикагель, 0-80% этилацетат в гексанах). Полученный продукт снова очищают колоночной хроматографией (силикагель, 0-20% метанол в дихлорметане). Очищенные фракции объединяют и концентрируют, получая указанное в заголовке соединение в виде твердого вещества белого цвета (2,30 г, 11,6 ммоль, выход 58%). МС (ESI) m/z 198,0 [М+1]+.
B. Этил 2-(3,5-дибромпиразин-2-иламино)ацетат. В трехгорлую колбу объемом 2000 мл загружают 2-амино-3,5-дибромпиразин (172 г, 680 ммоль) и диметилформамид (860 мл) и полученную смесь охлаждают до 0-5°C. К смеси одной порцией добавляют карбонат цезия (288 г, 884 ммоль) и затем несколькими порциями добавляют этилхлорацетат (87 мл, 816 ммоль). Раствору дают возможность нагреться до 20-25°C, после чего нагревают до 55°C (наблюдается экзотермическое выделение теплоты, максимальная температура 76°C). Реакционной смеси дают возможность охладиться до 65°C и нагревают при 65°C в течение ~4 часов. Реакционную смесь охлаждают до 20-25°C и отфильтровывают через бумажный фильтр для удаления неорганических солей, твердый осадок на фильтре промывают диметилформамидом (3 об.). Фильтрат добавляют по каплям к 16 объемам смеси лед-вода (8 об. льда/8 об. воды) и полученную взвесь встряхивают в течение 12-24 часов. Осадок коричневого цвета собирают последующей фильтрацией и промывают водой (10 об.) и сушат на воздухе. Неочищенный продукт растворяют в простом метил-трет-бутиловом эфире (3,46 л, 15 об.). К раствору добавляют уголь (C-906 от Ecosorb, 20 масс.%, 46,1 г) и смесь нагревают с обратным холодильником в течение 1 часа. После охлаждения смеси до комнатной температуры уголь удаляют фильтрацией через слой целита и фильтрат концентрируют досуха. Неочищенный продукт растворяют в этилацетате (576 мл, 2,5 об.) и полученный раствор концентрируют до густой взвеси. К взвеси добавляют 2% раствор этилацетата в гептане (1,15 л, 5 об.) и смесь перемешивают при комнатной температуре в течение 30-60 минут. Продукт собирают фильтрацией, промывают гептаном (2-3 об.) и сушат в высоком вакууме при 35-40°C в течение 16 часов, получая указанное в заголовке соединение в виде твердого не совсем белого вещества (109 г, выход 47%). Вторую порцию продукта выделяют из маточной жидкости следующим образом: фильтрат концентрируют донеочищенного масла, добавляют этилацетат (1 об.). В полученный раствор вводят в качестве затравки выделенный ранее продукт, раствор охлаждают при 0-5°C в течение 1 часа. Полученный твердый продукт собирают фильтрацией и промывают охлажденной смесью этилацетат:гептан (1:1, <1 об.). Твердый продукт сушат как описано выше и объединяют с первой порцией продукта, получая указанное в заголовке соединение (132 г, общий выход 57%). МС (ESI) m/z 337,8 [M-1]+, 339,8 [М+1]+, 341,8 [M+3]+.
C. 7-бром-1-(((транс)-4-метоксициклогексил)метил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. Раствор этил-2-(3,5-дибромпиразин-2-иламино)ацетата (500 мг, 1,47 ммоль), ((транс)-4-метоксициклогексил)метанамина (317 мг, 2,21 ммоль) и диизопропилэтиламина (0,77 мл, 4,42 ммоль) в безводном диметилсульфоксиде (8,0 мл) загружают в емкость для микроволновой обработки (20 мл). Реакционную смесь нагревают до 150°C в течение 1 часа. Полученную реакционную смесь выливают в воду, экстрагируют этилацетатом (2×100 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют при пониженном давлении. Полученный продукт растворяют в уксусной кислоте (30 мл) и переносят в герметично закрывающуюся пробирку. Реакционную смесь нагревают до 120°C в течение ночи. Раствор охлаждают, концентрируют при пониженном давлении, нейтрализуют насыщенным раствором бикарбоната натрия, экстрагируют этилацетатом (3×100 мл), сушат над сульфатом натрия, отфильтровывают и адсорбируют на силикагель. Очистка флэш-хроматографией (50% этилацетат в гексанах) приводит к получению указанного в заголовке соединения в виде твердого вещества оранжевого цвета (400 мг, 1,12 ммоль, выход 76%). МС (ESI) m/z 355,2 [M+]+, 357,2 [M+2]+.
D. 1-(((транс)-4-метоксициклогексил)метил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-(((транс)-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (2,71 г, 7,63 ммоль), 1,1,1,2,2,2-гексаметилдистаннан (3,00 г, 9,15 ммоль) и тетракис(трифенилфосфин)палладий(0) (882 мг, 0,76 ммоль) объединяют в герметично закрывающейся пробирке с загруженным безводным диоксаном (40 мл) и смесь продувают газообразным азотом. Реакционную смесь нагревают до 100°C в течение 4 часов. Полученную реакционную смесь разбавляют этилацетатом, отфильтровывают через целит, целит промывают этилацетатом и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают флэш-хроматографией (0-50% этилацетат в гексане), фракции, содержащие продукт, объединяют и концентрируют, получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (2,32 г, 5,28 ммоль, выход 69%). МС (ESI) m/z 441,1 [М+1]+.
E. 5-(8-(((транс)-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинонитрил. 1-(((транс)-4-метоксициклогексил)метил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,721 г, 1,64 ммоль), 5-бром-4-метилпиколинонитрил (0,323 г, 1,64 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,150 г, 0,164 ммоль), триэтиламин (0,687 мл, 4,93 ммоль), три-орто-толилфосфин (0,100 г, 0,328 ммоль) и диметилформамид (8 мл) объединяют в герметично закрывающейся емкости. Через смесь в течение 5 минут барботируют азот, смесь нагревают при 100°C в течение 3 часов. Полученную реакционную смесь отфильтровывают, концентрируют и очищают колоночной хроматографией (силикагель, 0-80% этилацетат в гексанах). Фракции объединяют и концентрируют, получая неочищенное указанное в заголовке соединение, которое используют на следующей стадии без дополнительной очистки (0,607 г, 1,55 ммоль, выход 94%). МС (ESI) m/z 393,5 [М+1]+.
F. 5-(8-(((транс)-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид. 5-(8-(((транс)-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4- метилпиколинонитрил (0,607 г, 1,55 ммоль), трифторуксусную кислоту (2,0 мл, 26,0 ммоль) и серную кислоту (0,5 мл, 9,38 ммоль) объединяют, нагревают при 65°C в течение 1 часа. Значение pH реакционной смеси доводят до 10 добавлением карбоната натрия и полученный раствор экстрагируют этилацетатом (3×15 мл). Органические слои объединяют, сушат над сульфатом магния, концентрируют и очищают препаративной ВЭЖХ с обращенной фазой (10-100% ацетонитрил +0,1% ТФА в H2O +0,1% ТФА, в течение 30 минут). Чистые фракции объединяют, концентрируют при пониженном давлении и сушат в высоком вакууме, получая указанное в заголовке соединение в виде твердого вещества желтого цвета (0,425 г, 1,04 ммоль, выход 67%). МС (ESI) m/z 411,5 [М+1]+.
G. (Z)-N-((диметиламино)метилен)-5-(8-(((транс)-4- метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид. 5-(8-(((транс)-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид (0,412 г, 1,00 ммоль), диметилформамиддинеопентилацеталь (1,5 мл) и тетрагидрофуран (10 мл) объединяют, нагревают при 85°C в течение 3 часов. Реакционную смесь концентрируют в потоке азота, вводимом в реакционную емкость. Неочищенный продукт используют на следующей стадии без дополнительной очистки (0,467 г, 1,00 ммоль, выход 100%). МС (ESI) m/z 466,6 [М+1]+.
H. 1-(((транс)-4-метоксициклогексил)метил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. (Z)-N-((диметиламино)метилен)-5-(8-(((транс)-4-метоксициклогексил)метил)-7-оксо-5,6,7,8- тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид (0,467 г, 1,00 ммоль) добавляют к уксусной кислоте (6 мл). Реакционную смесь охлаждают до 0°C и к смеси по каплям добавляют гидразин (1,00 мл, 32 ммоль). Реакционную смесь перемешивают и дают ей возможность нагреться до 25оС в течение 10 минут. Реакционную смесь концентрируют в потоке азота, вводимом в реакционную емкость. В реакционную смесь добавляют воду (5 мл), продукт собирают фильтрацией и очищают с использованием полупрепаративной ВЭЖХ с обращенной фазой (20-70% ацетонитрил +0,1% ТФА в H2O +0,1% ТФА, в течение 30 минут). Чистые фракции объединяют, конденсируют при пониженном давлении и сушат в высоком вакууме, получая указанное в заголовке соединение в виде твердого вещества желтого цвета (0,046 г, 0,106 ммоль, выход 11%).
1H-ЯМР (400 МГц, металол-d4) δ (м.д.) 8,72 (с, 1Н), 8,62 (с, 1Н), 8,37 (с, 1Н), 7,93 (с, 1Н), 4,30 (с, 2H), 3,99 (д, J=7,03 Гц, 2H), 3,32 (с, 3H), 3,08-3,17 (м, 1Н), 2,71-2,76 (м, 3H), 2,06 (ушир.с, 2H), 1,80-1,89 (м, 1Н), 1,74 (ушир.с, 2H), 1,09 (д, J=11,32 Гц, 4H); МС (ESI) m/z 435,5 [М+1]+.
Пример 7: 7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. Этил-2-(5-бром-3-(изопропиламино)пиразин-2-иламино)ацетат. Смесь этил-2-(3,5-дибромпиразин-2-иламино)ацетата (смотрите пример 6.B) (1,5 г, 4,43 ммоль), изопропиламина (0,17 г, 4,87 ммоль), N,N-диизопропилэтиламина (1,14 г, 8,84 ммоль) и диметилсульфоксида (10 мл) в нагревают на масляной бане при 150°C в течение 16 часов. Смесь охлаждают до комнатной температуры, полученную смесь выливают в воду и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, отфильтровывают, упаривают при пониженном давлении и очищают колоночной хроматографией (силикагель, 10-20% этилацетат в пертолейном эфире), получая указанное в заголовке соединение (780 мг, выход 55,7%). МС (ESI) m/z 316,9 [М+1]+.
B. 7-бром-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Смесь этил-2-(5-бром-3-(изопропиламино)пиразин-2-иламино)ацетата (780 мг, 2,26 ммоль), метанола (5 мл) и ТФА (10 мл) в герметично закрывающейся емкости продувают азотом, герметично закрывают при энергичном перемешивании, нагревают на масляной бане при 90°C в течение 16 часов. Полученную смесь разбавляют метанолом и растворитель удаляют при пониженном давлении. К остатку добавляют метанол (10 мл) и растворитель снова удаляют при пониженном давлении. К остатку добавляют метанол (10 мл) и бикарбонат натрия. Полученную смесь перемешивают при комнатной температуре до достижения pH=6 (в воде), после чего растворитель удаляют при пониженном давлении. К остатку добавляют воду (20 мл). Смесь экстрагируют метиленхлоридом (20 мл ×3). Органический слой сушат над безводным сульфатом натрия, концентрируют, получая неочищенный продукт, который очищают колоночной хроматографией (диоксид кремния, 10-20% этилацетат в петролейном эфире), получая указанное в заголовке соединение (360 мг, выход 39,4%).
C. 1-изопропил-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,5 г, 1,844 ммоль), гексаметилдиолово (0,725 г, 2,213 ммоль), тетракис(трифенилфосфин)палладий(0) (0,213 г, 0,184 ммоль) и 1,4-диоксан (3 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Через раствор барботируют азот. Емкость герметично закрывают, энергично перемешивают и нагревают при 100°C в течение 2 часов. Полученную непрозрачную смесь черного цвета разбавляют этилацетатом, отфильтровывают и осадок на фильтре тщательно промывают этилацетатом. Фильтрат концентрируют при пониженном давлении и очищают колоночной флэш-хроматографией (силикагель, 20-80% этилацетат в гексанах), получая указанное в заголовке соединение (0,49 г, 1,38 ммоль, выход 75%) в виде твердого вещества бледно-желтого цвета. МС (ESI) m/z 357,4 [M+2]+.
D. 4-бром-2-фтор-5-метилбензамид. Раствор 4-бром-2-фтор-5-метилбензонитрила (40 г, 190 ммоль) в смеси серной кислоты (98%) и ТФА (об./об.=4:1, 480 мл) перемешивают при 80°C в течение 16 часов. Смесь охлаждают до комнатной температуры и полученную смесь выливают в ледяную воду. Полученный осадок собирают фильтрацией, промывают водой и сушат при пониженном давлении, получая указанное в заголовке соединение (41 г, выход 95%) в виде твердого вещества белого цвета. МС (ESI) m/z 232,0 [М+1]+.
E. 4-бром-N-((диметиламино)метилен)-2-фтор-5-метилбензамид. Раствор 4-бром-2-фтор-5-метилбензамида (20 г, 86 ммоль) в N,N-диметилформамиддиметилацетале (200 мл) перемешивают при 100°C в атмосфере азота в течение 3 часов. Полученную смесь концентрируют и сушат, получая указанное в заголовке соединение (24,6 г, выход 95%) в виде масла желтого цвета, которое используют на следующей стадии без дополнительной очистки. МС (ESI) m/z 287,0 [М+1]+.
F. 3-(4-бром-2-фтор-5-метилфенил)-1Н-1,2,4-триазол. К раствору 4-бром-N-((диметиламино)метилен)-2-фтор-5-метилбензамида (24,6 г, 86,2 ммоль) в уксусной кислоте (200 мл) при 0°C по каплям добавляют гидразингидрат (25 мл, 0,70 моль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь отфильтровывают, промывают водой (500 мл ×3) и сушат при пониженном давлении, получая указанное в заголовке соединение (15 г, выход 68%) в виде твердого вещества белого цвета. МС (ESI) m/z 256,0 [М+1]+.
G. 3-(4-бром-2-фтор-5-метилфенил)-1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол. Раствор 3-(4-бром-2-фтор-5-метилфенил)-1Н-1,2,4-триазола (15 г, 60 ммоль), толуол-4-сульфоновой кислоты (2,0 г, 12 ммоль) и 3,4-дигидро-2H-пирана (20 г, 240 ммоль) в тетрагидрофуране (200 мл) перемешивают при 80°C в атмосфере азота в течение 15 часов. Полученную смесь концентрируют и очищают колоночной хроматографией (силикагель, 1-25% этилацетат в петролейном эфире), получая защищенное триазол-производное (15 г, выход 75%) в виде твердого вещества белого цвета.
1H-ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) 8,83 (с, 1Н), 7,96 (д, J=7,6 Гц, 1Н), 7,66 (д, J=10,0 Гц, 1Н), 5,61 (дд, J1=2,4 Гц, J2=9,6 Гц, 1Н), 3,96 (д, J=1,6 Гц, 1Н), 3,69 (м, 1Н), 2,36 (с, 3H), 2,00 (м, 2H), 1,70 (м, 2H), 1,57 (м, 2H); МС (ESI) m/z 340,0 [М+1]+.
H. 7-(5-фтор-2-метил-4-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 1-изопропил-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он (300 мг, 0,84 ммоль), 3-(4-бром-2-фтор-5-метилфенил)-1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол (428 мг, 1,26 ммоль) и дихлорид бис(трифенилфосфин)палладия(II) (56 мг, 0,08 ммоль) объединяют в N,N-диметилформамиде (5 мл). Смесь дегазируют, нагревают при 140°C в атмосфере азота в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь отфильтровывают и фильтрат распределяют между этилацетатом (15 мл) и водой (15 мл). Органический слой отделяют и водный слой экстрагируют этилацетатом (10 мл ×2). Объединенный органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют при пониженном давлении и очищают препаративной ТСХ (15% метанол в дихлорметане), получая указанное в заголовке соединение (200 мг, выход 52%) в виде твердого вещества.
I. 7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Раствор 7-(5-фтор-2-метил-4-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (200 мг, 0,44 ммоль) в метанольном растворе хлористоводородной кислоты (20 мл, 2 M) перемешивают в течение 5 часов при комнатной температуре. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (25 мл) и водную смесь экстрагируют этилацетатом (25 мл ×2). Органическую фазу сушат над сульфатом натрия, отфильтровывают, упаривают при пониженном давлении и полученный остаток очищают колоночной хроматографией (силикагель, 50-100% этилацетат в петролейном эфире). Целевые фракции объединяют и концентрируют при пониженном давлении, получая указанное в заголовке соединение (75 мг, выход 46%).
1H-ЯМР (ДМСО-d6, 400 МГц): δ (м.д.) 14,25 (ушир.с, 1Н), 8,20 (ушир.с, 1Н), 7,90 (м, 2H), 7,58 (с, 1Н), 7,35 (с, 1Н), 5,24 (м, 1Н), 4,10 (с, 2H), 2,43 (с, 3H), 1,44 (д, J=7,2, 6H); МС (ESI) m/z 368,2 [M+1]+.
Пример 8: 7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'H-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Η)-он
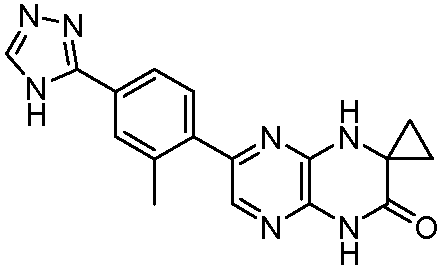
A. Трет-бутил-1-(3,5-дибромпиразин-2-илкарбамоил)циклопропилкарбамат. К раствору 1-(трет-бутоксикарбониламино)циклопропанкарбоновой кислоты (4,93 г, 24,50 ммоль) в N,N-диметилформамиде (6 мл) и дихлорметане (12 мл) при комнатной температуре с перемешиванием добавляют 1,1'-карбонилдиимидазол (4,37 г, 27,0 ммоль). Полученную прозрачную смесь желтого цвета перемешивают при комнатной температуре в атмосфере азота в течение 4 часов. К смеси добавляют N,N-диизопропилэтиламин (8,54 мл, 49,0 ммоль) и затем 3,5-дибромпиразин-2-амин (9,29 г, 36,8 ммоль). Полученную смесь нагревают с обратным холодильником при 50°C в атмосфере азота в течение 60 часов. Полученную реакционную смесь разбавляют этилацетатом и промывают водой. Слои разделяют и органический слой промывают раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток переносят в дихлорметан и очищают флэш-хроматографией (Biotage, 5-60% этилацетат в гексане). Фракции, содержащие целевой продукт, объединяют и концентрируют при пониженном давлении. Остаток растирают с 15% этилацетатом в гексане и сушат в высоком вакууме, получая указанное в заголовке соединение (5,349 г, 12,27 ммоль, выход 50%) в виде твердого не совсем белого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,92 (ушир.с, 1Н), 8,76 (с, 1Н), 7,70 (ушир.с, 1Н), 1,41 (с, 9H), 1,34-1,40 (м, 2H), 1,02-1,09 (м, 2H); МС (ESI) m/z 437,3 [М+1]+, 459,1 [M+Na]+.
B. Бис-трифторацетат 1-амино-N-(3,5-дибромпиразин-2-ил)циклопропанкарбоксамида. К смеси трет-бутил-1-(3,5-дибромпиразин-2-илкарбамоил)циклопропилкарбамата (3,410 г, 7,82 ммоль) и дихлорметана (20 мл) при перемешивании добавляют ТФА (6,02 мл, 78 ммоль). Полученный прозрачный раствор желтого цвета перемешивают при комнатной температуре в течение 4 часов. Все летучие вещества удаляют при пониженном давлении и остаток сушат в высоком вакууме при 40°C, получая указанное в заголовке соединение (4,42 г, 7,85 ммоль, выход 100%) в виде твердого воскообразного вещества желтого цвета. МС (ESI) m/z 337,1 [М+1]+.
C. 7'-бром-1'H-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-он. Бис-трифторацетат 1-амино-N-(3,5-дибромпиразин-2-ил)циклопропанкарбоксамида (0,394 г, 0,700 ммоль), N,N-диизопропилэтиламин (0,610 мл, 3,50 ммоль) и 1,4-диоксан (6 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом. Полученную смесь герметично закрывают, энергично перемешивают и нагревают при 110°C в течение 2 часов. Летучие вещества удаляют при пониженном давлении. Остаток растворяют в ДМСО и метаноле, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (10-65% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют, нейтрализуют насыщенным водным раствором бикарбоната натрия и большую часть растворителя удаляют при пониженном давлении. Твердые продукты собирают вакуумной фильтрацией, тщательно промывают водой и сушат в высоком вакууме, получая указанное в заголовке соединение (0,141 г, 0,553 ммоль, выход 79%) в виде твердого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,27 (с, 1Н), 8,04 (с, 1Н), 7,46 (с, 1Н), 1,29-1,38 (м, 2H), 0,91-1,01 (м, 2H); МС (ESI) m/z 255,1 [M]+, 257,0 [M+2]+.
D. Трифторацетат 7'-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-1'H-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-она. 3-(3-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол (смотрите пример 2.C) (0,201 г, 0,545 ммоль), 7'-бром-1'Η-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Η)-он (0,139 г, 0,545 ммоль), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,045 г, 0,054 ммоль), карбонат натрия (1 M в воде, 1,635 мл, 1,635 ммоль), 1,4-диоксан (1,2 мл) и изопропанол (0,4 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом. Реакционную смесь герметично закрывают, энергично перемешивают и нагревают при 100°C в течение 1 часа. Полученную смесь разбавляют водой и экстрагируют три раза дихлорметаном. Объединенные органические слои концентрируют при пониженном давлении. Остаток переносят в ДМСО и метанол, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (20-70% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют и растворитель удаляют при пониженном давлении. Остаток сушат в высоком вакууме, получая указанное в заголовке соединение (0,109 г, 0,205 ммоль, выход 38%) в виде твердого вещества оранжевого цвета. МС (ESI) m/z 418,4 [M+1]+.
E. 7'-(2-метил-4-(4H-1,2,4-триазол-3-ил)фенил)-1'H- спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-он. К смеси трифторацетата 7'-(2-метил-4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-1'Η-спиро[циклопропан-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-она (0,109 г, 0,205 ммоль) и этанола (4 мл) при 80°C с перемешиванием добавляют 6 н. раствор хлористоводородной кислоты в воде (0,171 мл, 1,025 ммоль). Реакционную смесь энергично перемешивают и нагревают с обратным холодильником при 80°C в атмосфере азота в течение 30 минут. Полученную смесь отфильтровывают и фильтрат очищают препаративной ВЭЖХ с обращенной фазой (10-60% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют, нейтрализуют насыщенным водным раствором бикарбонат натрия и большую часть растворителя удаляют при пониженном давлении. Твердый продукт собирают вакуумной фильтрацией, тщательно промывают водой и сушат в высоком вакууме при 45°C, получая указанное в заголовке соединение (0,027 г, 0,079 ммоль, выход 39%) в виде твердого вещества желтого цвета.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,22 (ушир.с, 1Н), 8,63 (ушир.с, 1Н), 7,93 (с, 1Н), 7,89 (д, J=7,81 Гц, 1Н), 7,62 (с, 1Н), 7,58 (с, 1Н), 7,47 (ушир.с, 1Н), 2,43 (с, 3H), 1,29-1,38 (м, 2H), 0,95-1,04 (м, 2H); МС (ESI) m/z 334,2 [М+1]+.
Пример 9: 7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((транс)-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он
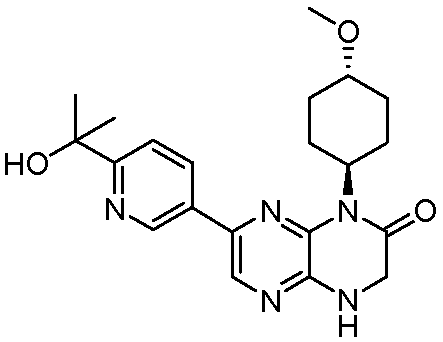
A. Этил-2-(5-бром-3-(транс-4-метоксициклогексиламино)пиразин-2-иламино)ацетат. Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (смотрите пример 6.B) (30,0 г, 88 ммоль), транс-4-метоксициклогексанамин (17,15 г, 133 ммоль), N,N-диизопропилэтиламин (30,8 мл, 177 ммоль) и диметилсульфоксид (70,8 мл) объединяют в реакционной емкости с магнитной мешалкой и смесь нагревают на масляной бане при 150°C в течение 16 часов с перемешиванием. Полученную смесь разбавляют этилацетатом и летучие вещества удаляют при пониженном давлении. Остаток очищают хроматографией (силикагель, Biotage SP1, 12% этилацетат в гексанах). Фракции, содержащие целевой продукт, объединяют и органические летучие вещества удаляют при пониженном давлении. Остаток растирают с 5% раствором этилацетата в гексане. Твердый продукт собирают вакуумной фильтрацией, промывают гексаном и сушат в вакууме, получая указанное в заголовке соединение (15,37 г, 39,7 ммоль, выход 44,8%) в виде твердого не совсем белого вещества. МС (ESI) m/z 387,0 [M]+, 389,0 [M+2]+.
B. 7-бром-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Реакцию проводят в 3 отдельных герметично закрывающихся пробирках и полученные реакционные смеси обрабатывают отдельно. Полученные после очистки продукты объединяют. Этил-2-(5-бром-3-(транс-4-метоксициклогексиламино)пиразин-2-иламино)ацетат (10 г, 25,7 ммоль), метанол (10,5 мл, 259 ммоль) и ТФА (100 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Систему продувают азотом и реакционную смесь герметично закрывают, при энергичном перемешивании нагревают при 90°C на масляной бане в течение 18,5 часа. Полученную смесь разбавляют метанолом и весь растворитель удаляют при пониженном давлении. К остатку добавляют метанол (100 мл) и весь растворитель снова удаляют при пониженном давлении. К остатку добавляют метанол (100 мл) и бикарбонат натрия (12,4 г, 147 ммоль). Полученную смесь перемешивают при комнатной температуре до достижения pH=6 (в воде). Смесь концентрируют почти досуха. К остатку добавляют воду (100 мл). Полученный твердый продукт коричневого цвета собирают вакуумной фильтрацией и промывают водой. Твердый продукт коричневого цвета растворяют в горячем метаноле и ацетонитриле и очищают колоночной флэш-хроматографией с обращенной фазой (С18, 20-100% ацетонитрил в воде). Фракции, содержащие целевой продукт, объединяют и концентрируют почти досуха при пониженном давлении. Твердый продукт собирают вакуумной фильтрацией, промывают водой и сушат в высоком вакууме, получая указанное в заголовке соединение (4,88 г, 14,3 ммоль, выход 55%) в виде твердого вещества светлого желто-коричневого цвета.
1H-ЯМР (400 МГц, ДМСО-d5) δ (м.д.) 7,71 (с, 1Н), 7,59 (с, 1Н), 4,66 (тт, J=3,61, 12,20 Гц, 1Н), 4,07 (д, J=1,56 Гц, 2H), 3,25 (с, 3H), 3,06-3,17 (м, 1Н), 2,42 (кв.д, J=3,51, 12,89 Гц, 2H), 2,10 (д, J=10,93 Гц, 2H), 1,61 (д, J=10,93 Гц, 2H), 1,10-1,24 (м, 2H); МС (ESI) m/z 341,3 [M]+, 343,1 [M+2]+.
C. 7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(транс-4- метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 2-(5-(триметилстаннил)пиридин-2-ил)пропан-2-ол (смотрите пример 5.E) (9,43 г, 31,4 ммоль), 7-бром-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (10,02 г, 29,4 ммоль), продукт присоединения [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) и дихлорметана (2,398 г, 2,94 ммоль) и N,N-диметилформамид (25 мл) объединяют в круглодонной колбе с магнитной мешалкой. Атмосферу в колбе удаляют в вакууме и заменяют ее газообразным азотом, повторяя эту процедуру три раза. Реакционную смесь энергично перемешивают и нагревают в атмосфере азота при 120°C в течение 35 миут. Полученную смесь очищают флэш-хроматографией, разделяя на 4 отдельные колонки (2-15% метанол в дихлорметане). Фракции, содержащие целевой продукт, объединяют и большую часть растворителя удаляют при пониженном давлении. Полученную смесь очищают препаративной ВЭЖХ с обращенной фазой (20-40% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут), разделяя на 6 потоков. Фракции, содержащие целевой продукт, объединяют и весь ацетонитрил и часть воды удаляют при пониженном давлении при 25°C. Оставшийся раствор желтого цвета загружают на 50 г ионообменнояй смолы (Strata X-C, Phenomenex). Колонку промывают последовательно водой, ацетонитрилом, метанолом и затем 5% раствором гидроксида аммония в метаноле. Продукт элюируют 5% раствором гидроксида аммония в метаноле, концентрируют при пониженном давлении и сушат в высоком вакууме, получая указанное в заголовке соединение (4,85 г, 12,20 ммоль, выход 42%) в виде твердой пены розового цвета.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,03 (д, J=1,56 Гц, 1Н), 8,28 (с, 1Н), 8,24 (дд, J=2,34, 8,20 Гц, 1Н), 7,74 (д, J=7,81 Гц, 1Н), 7,61 (с, 1Н), 5,26 (с, 1Н), 4,90 (тт, J=3,71, 12,10 Гц, 1Н), 4,13 (с, 2H), 3,28 (с, 3H), 3,20 (тт, J=4,00, 10,84 Гц, 1Н), 2,58 (кв.д, J=2,93, 12,82 Гц, 2H), 2,14 (д, J=10,15 Гц, 2H), 1,68 (д, J=10,93 Гц, 2H), 1,47 (с, 6H), 1,17-1,35 (м, 2H); МС (ESI) m/z 398,3 [М+1]+; т.пл. 196-198°C (нескорректированная).
D. 7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(транс-4- метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (альтернативный метод). Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (1 экв.), гидрохлорид транс-4- метоксициклогексанамина (1,5 экв.), NMP и DIEA объединяют и нагревают до 127°C и выдерживают при указанной температуре в течение 18 часов. После завершения реакции смесь охлаждают до 35°C в течение 4 часов. Реакционную смесь переносят в смесь этилацетата и 5% раствора соли. Водный слой удаляют и органический слой, содержащий продукт, промывают последовательно 5% раствором соли и водой. Органический слой, содержащий продукт, упаривают вакуумной отгонкой до малого объема, охлаждают до температуры окружающей среды и твердый продукт собирают вакуумной фильтрацией. Осадок на фильтре промывают MTBE и сушат в вакууме, получая этил-2-(5-бром-3-(транс-4-метоксициклогексиламино)пиразин-2-иламино)ацетат (выход 41%). Смесь этил-2-(5-бром-3-(транс-4-метоксициклогексиламино)пиразин-2-иламино)ацетата (1 экв.), воды и 85% фосфорной кислоты (3:1) нагревают до 80°C в течение 1 часа. Нагрев поддерживают в течение 18 часов до полного протекания реакции. После завершения реакции смесь охлаждают до 25°C и отфильтровывают, получая неочищенный продукт в виде твердого вещества желтовато-коричневого цвета. Полученный твердый продукт промывают водой, суспендируют в воде и отфильтровывают. Осадок на фильтре промывают водой до достижения значения pH фильтрата в интервале от 4 до 8. Полученный продукт сушат в вакууме, получая 7-бром-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (выход 89%). 7-бром-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1 экв.), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-(2-(триметилсилилокси)пропан-2-ил)пиридин (1 экв.), карбонат натрия (3 экв.) и PdCl2(AmPhos)2 (0,003 экв.) объединяют в изопропаноле и полученную смесь нагревают при 70°C в течение 1,5 часа. Стандартная обработка и очистка реакционной смеси приводят к получению защищенного соединения с 93% выходом. Удаление защитной группы в стандартных условиях удаления триметилсилильной группы и выделение продукта приводят к получению указанного в заголовке соединения.
Пример 10: 9-(6-(4H-1,2,4-триазол-3-ил)-2-метил-3-пиридил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он
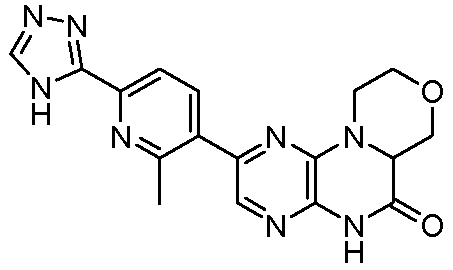
A. 5-бром-6-метилпиколинонитрил. 3,6-дибром-2-метилпиридин (4,9 г, 19,53 ммоль), цианид меди(I) (1,75 г, 19,53 ммоль) и N,N-диметилформамид (20 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Полученную смесь герметично закрывают, энергично перемешивают и нагревают при 110°C в течение 4 часов. Полученную смесь разбавляют этилацетатом, выливают в делительную воронку, содержащую воду, и слои разделяют. Водный слой дважды экстрагируют этилацетатом. Объединенные органические слои промывают раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Полученный твердый продукт очищают хроматографией (силикагель, 10% этилацетат в гексанах), получая указанное в заголовке соединение в виде твердого вещества белого цвета (1,88 г, 9,54 ммоль, выход 49%). МС (ESI) m/z 197,3 [M]+.
B. Трет-бутил-3-(3,5-дибромпиразин-2-илкарбамоил)морфолин-4- карбоксилат. Раствор 4-(трет-бутоксикарбонил)морфолин-3-карбоновой кислоты (1,500 г, 6,49 ммоль) и 1,1'-карбонилдиимидазола (1,578 г, 9,73 ммоль) в N,N-диметилформамиде (2 мл) и дихлорметане (6 мл) перемешивают в течение 4,5 часа при комнатной температуре в атмосфере азота. К смеси добавляют N,N-диизопропилэтиламин (2,260 мл, 12,97 ммоль) и затем 3,5-дибромпиразин-2-амин (3,28 г, 12,97 ммоль). Полученную смесь перемешивают и нагревают с обратным холодильником в атмосфере азота при 50°C в течение 2 дней. Реакционную смесь концентрируют при пониженном давлении. Остаток разбавляют водой и экстрагируют 3 раза этилацетатом. Объединенные органические слои промывают водой и раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (20-30-50% этилацетат в гексанах), получая указанное в заголовке соединение (2,136 г, 4,58 ммоль, выход 71%) в виде твердой пены светло-желтого цвета. МС (ESI) m/z 467 [M+1]+.
C. 9-бром-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он. Трет-бутил-3-(3,5-дибромпиразин-2-илкарбамоил)морфолин-4-карбоксилат (2,132 г, 4,57 ммоль) при комнатной температуре с перемешиванием растворяют в дихлорметане (45 мл). К раствору добавляют ТФА (9 мл), полученную смесь светло-желтого цвета закрывают и перемешивают при комнатной температуре в течение 2,5 часа. Растворитель удаляют при пониженном давлении и остаток сушат в высоком вакууме при 45°C, получая вязкое масло желтого цвета. Полученное масло растворяют в изопропаноле (влажном) (50 мл) при комнатной температуре с перемешиванием. К раствору добавляют бикарбонат натрия (3,84 г, 45,7 ммоль), ацетат палладия(II) (0,103 г, 0,457 ммоль) и 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,239 мл, 1,372 ммоль). Атмосферу в колбе удаляют и заменяют ее азотом. Полученную смесь энергично перемешивают и нагревают с обратным холодильником при 80°C в атмосфере азота в течение 2 часов. Полученную смесь охлаждают до комнатной температуры и разбавляют водой (30 мл). Полученный твердый продукт собирают вакуумной фильтрацией, тщательно промывают водой и диэтиловым эфиром и сушат в высоком вакууме, получая указанное в заголовке соединение с ~90% чистотой (1,441 г, 5,05 ммоль, выход 99%) в виде твердого вещества желтого цвета. МС (ESI) m/z 285 [M]+, 287 [M+2]+.
D. 9-(1,1-диметил-1-станнаэтил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он. 9-бром-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он (0,30 г, 1,052 ммоль), гексаметилдиолово (0,414 г, 1,263 ммоль), тетракис(трифенилфосфин)палладий(0) (0,122 г, 0,105 ммоль) и 1,4-диоксан (5 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Через раствор в течение пяти минут барботируют газообразный азот. Емкость герметично закрывают, реакционную смесь энергично перемешивают и нагревают при 100°C в течение 2 часов. Полученную мутную смесь черного цвета разбавляют этилацетатом, отфильтровывают и осадок на фильтре тщательно промывают этилацетатом. Фильтрат концентрируют при пониженном давлении и очищают флэш-хроматографией (Biotage, 20-80% этилацетат в гексанах), получая указанное в заголовке соединение (0,350 г, 0,948 ммоль, выход 90%) в виде твердого вещества желтоватого цвета. МС (ESI) m/z 369,5 [M]+.
E. 6-метил-5-(5-оксо-(6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-9-ил))пиридин-2-карбонитрил. 5-бром-6-метилпиколинонитрил (0,080 г, 0,406 ммоль), 9-(1,1-диметил-1-станнэтил)-6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он (0,150 г, 0,406 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,041 г, 0,045 ммоль), три-o-толилфосфин (0,027 г, 0,089 ммоль) и триэтиламин (0,170 мл, 1,219 ммоль) помещают в герметично закрывающуюся пробирку и к смеси добавляют N,N-диметилформамид (2 мл). Через реакционную смесь в течение пяти минут барботируют газообразный азот, реакционную смесь герметично закрываюти и нагревают при 100°C в течение 1 часа. Полученную мутную смесь черного цвета разбавляют метанолом, отфильтровывают и осадок на фильтре тщательно промывают метанолом. Фильтрат концентрируют при пониженном давлении и очищают флэш-хроматографией (Biotage, 50-100% этилацетат в гексанах), получая указанное в заголовке соединение (0,117 г, 0,363 ммоль, выход 89%). МС (ESI) m/z 323,5 [М+1]+
F. 6-метил-5-(5-оксо-(6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-9-ил))пиридин-2-карбоксамид. 6-метил-5-(5-оксо-(6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-9-ил))пиридин-2-карбонитрил (0,18 г, 0,558 ммоль) загружают в круглодонную колбу и при перемешивании добавляют смесь ТФА (1,6 мл) и серной кислоты (0,4 мл). Полученную суспензию перемешивают в течение 16 часов при комнатной температуре. Смесь выливают на лед и избыток кислоты осторожно нейтрализуют твердым гидроксидом калия. Полученный твердый продукт отфильтровывают, промывают водой и сушат в высоком вакууме, получая указанное в заголовке соединение (0,153 г, 0,450 ммоль, выход 81%) в виде твердого вещества красного цвета. МС (ESI) m/z 341,5 [М+1]+.
G. 9-(6-(4H-1,2,4-триазол-3-ил)-2-метил-3-пиридил)-6,11,4a- тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-5-он. 6-метил-5-(5-оксо-(6,11,4a-тригидроморфолино[4,3-e]пиразино[2,3-b]пиразин-9-ил))пиридин-2-карбоксамид (0,159 г, 0,467 ммоль), динеопентилацеталь N,N-диметилформамида (2 мл, 8,85 ммоль) и диметилсульфоксид (0,5 мл) загружают в колбу и смесь нагревают до 85°C в течение 1 часа. Раствор разбавляют уксусной кислотой (5 мл, 87 ммоль) и к раствору по каплям добавляют гидразин (0,468 мл, 14,90 ммоль). Реакционную смесь перемешивают при 25°C в течение 30 минут. Смесь концентрируют при пониженном давлении и остаток осторожно нейтрализуют насыщенным водным раствором карбоната натрия. Полученную смесь трижды экстрагируют этилацетатом, концентрируют при пониженном давлении и очищают полупрепаративной ВЭЖХ с обращенной фазой (5-50% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 20 минут), получая указанное в заголовке соединение (0,03 г, 0,082 ммоль, выход 17,63%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,96-8,04 (м, 2H), 7,88 (с, 1Н), 4,33 (дд, J=3,71, 10,74 Гц, 1Н), 4,15-4,23 (м, 2H), 3,98 (дд, J=3,51, 11,71 Гц, 1Н), 3,51-3,63 (м, 2H), 2,89-2,99 (м, 1Н), 2,70 (с, 3H); МС (ESI) m/z 365,5 [М+1]+.
Пример 11: 6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 6-бром-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. К раствору N-(3,5-дибромпиразин-2-ил)-2-йодацетамида (смотрите пример 5.B) (6,6 г, 15,8 ммоль) и диизопропилэтиламина (4,0 г, 31,6 ммоль) в ацетонитриле (50 мл) добавляют тетрагидро-2H-пиран-4-амин (6,4 г, 63,2 ммоль) и полученную смесь перемешивают при температуре окружающей среды в течение 16 часов. Растворитель удаляют при пониженном давлении и остаток очищают хроматографией (силикагель, 5-20% этилацетат в петролейном эфире), получая указанное в заголовке соединение (1,98 г, выход 40%). МС (ESI) m/z 313,1 [M+1]+.
B. 4-(тетрагидро-2H-пиран-4-ил)-6-(триметилстаннил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. Дегазированную смесь 6-бром-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (1,98 г, 6,35 ммоль), тетракис(трифенилфосфин)палладия (1,45 г, 1,27 ммоль) и гексаметилдиолова (4,0 г, 12,7 ммоль) в диоксане (10 мл) нагревают при 90°C в атмосфере азота в течение 3 часов. Реакционную смесь концентрируют при пониженном давлении и очищают колоночной хроматографией (силикагель, 10-20% этилацетат в петролейном эфире), получая указанное в заголовке соединение (1,07 г, выход 42,3%). МС (ESI) m/z 399,1 [M+1]+.
C. 6-(6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Смесь 4-(тетрагидро-2H-пиран-4-ил)-6-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (1 экв.), 5-бром-2-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридина (1,2 экв.), трис(дибензилиденацетон)дипалладия (0,1 экв.), три-o-толилфосфина (0,2 экв.), триэтиламина (3 экв.) и N,N-диметилформамида нагревают при 95°C в атмосфере азота в течение 3 часов. Полученную реакционную смесь концентрируют и остаток очищают хроматографией, получая указанное в заголовке соединение (выход 39%). МС (ESI) m/z 463,1 [М+1]+.
D. 6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Смесь 6-(6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2H-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она в метанольном растворе хлористоводородной кислоты перемешивают при комнатной температуре в течение 0,5 часа. Растворитель удаляют при пониженном давлении, получают неочищенный продукт, который промывают N,N-диметилформамидом, получая указанное в заголовке соединение в виде гидрохлоридной соли (выход 34%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ (м.д.) 11,44 (с, 1Н), 9,30 (с, 1Н), 8,59 (д, J=8,4 Гц, 1Н), 8,46 (с, 1Н), 8,22 (м, 2H), 4,70 (т, J=10 Гц, 1Н), 4,16 (с, 1Н), 3,99 (м, 4H), 3,51 (т, J=11,2 Гц, 2H), 1,86 (м, 2H), 1,69 (д, J=12,8 Гц, 2H); МС (ESI) m/z 379,1 [М+1]+.
Пример 12: 1-этил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он
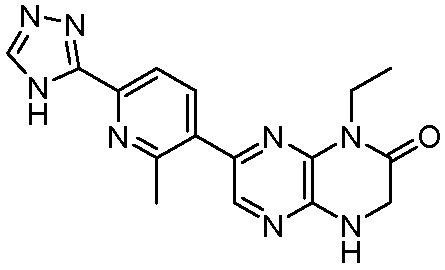
A. 7-бром-1-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Смесь этил-2-(3,5-дибромпиразин-2-иламино)ацетата (смотрите пример 6.B) (1 экв.), гидрохлорида этиламина (3,1 экв.), N,N-диизопропилэтиламина (4 экв.) в N-метилпирролидиноне нагревают при 105°C в атмосфере азота в течение 14 часов. Стандартная обработка этилацетатом/водой приводит к получению неочищенного продукта (выход 77%). Полученный продукт используют далее без дополнительной очистки. Неочищенный этил-2-(5-бром-3-(этиламино)пиразин-2-иламино)ацетат и уксусную кислоту объединяют в метаноле. Реакционную смесь кипятят с обратным холодильником при 60-62°C в атмосфере азота в течение 16 часов. Реакционную смесь концентрируют при пониженном давлении, полученный остаток разбавляют метанолом и смесь концентрируют. Полученный остаток растворяют в этилацетате, обрабатывают карбонатом натрия и перемешивают в течение 10 минут до достижения значения pH~7. Смесь отфильтровывают и промывают этилацетатом. Фильтрат концентрируют и очищают, пропуская через слой силикагеля (элюирование: 0-40% этилацетат в гексанах) и получая указанное в заголовке соединение в виде твердого вещества желтовато-коричневого цвета. Осадок на фильтре дополнительно суспендируют в воде для удаления карбоната калия. Полученый твердый продукт собирают фильтрацией. Общий выход продукта составляет 75%.
B. 1-этил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Смесь 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридина (1 экв.), бис(пинаколято)дибора (1,05 экв.), ацетата калия (2 экв.), карбоната калия (3 экв.), комплекса [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,1 экв.) в безводном диоксане дегазируют и нагревают при 90°C в течение 2 часов. Смесь охлаждают до <40°C и добавляют 7-бром-1-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1 экв.), воду и комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,05 экв.). Смесь дегазируют и нагревают при 65-70°C в атмосфере азота в течение 1 часа. Полученную реакционную смесь охлаждают до <40°C, разбавляют водой и этилацетатом. Стандартная обработка этилацетатом/водой с последующей колоночной флэш-хроматографией (0-5% метанол в дихлорметане) приводит к получению указанного в заголовке соединения (выход 57%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,99 (с, 2H), 7,93 (с, 1Н), 7,72 (с, 1Н), 4,22 (с, 2H), 4,05 (кв, J=6,77 Гц, 2H), 2,71 (с, 3H), 1,18 (т, J=7,03 Гц, 3H); МС (ESI) m/z 337,6 [М+1]+.
Пример 13: 4-((цис)-4-метоксициклогексил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 5-бром-6-метилпиколинамид. Раствор 5-бром-6- метилпиколинонитрила (1,8 г, 9,14 ммоль) в смеси ТФА и серной кислоты (30 мл, 4:1, об./об.) перемешивают при 40°C в течение 16 часов. Реакционную смесь выливают в ледяную воду. Полученный твердый продукт собирают фильтрацией, промывают водой и сушат, получая указанное в заголовке соединение в виде твердого вещества белого цвета (1,0 г, 4,65 ммоль, выход 54%). МС (ESI) m/z 217,1 [M+2]+.
B. 3-бром-2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин. 5-бром-6-метилпиколинамид (1 г, 4,65 ммоль) и диметилацеталь N,N-диметилформамида (20 мл) объединяют в круглодонной колбе объемом 100 мл с магнитной мешалкой и нагревают при 85°C с обратным холодильником в атмосфере азота в течение 3 часов. Полученную смесь концентрируют при пониженном давлении и сушат в вакууме, получая масло желтого цвета, которое используют на следующей стадии без дополнительной очистки. Масло разбавляют уксусной кислотой (10 мл), к смеси по каплям добавляют гидразин (2,5 мл, 70,3 ммоль) и смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь выливают в ледяную воду. Полученный твердый продукт собирают фильтрацией, промывают водой и сушат, получая указанное в заголовке соединение в виде твердого вещества белого цвета. Водный фильтрат экстрагируют дихлорметаном. Органический слой концентрируют при пониженном давлении почти досуха, получая дополнительную порцию продукта. Объединение двух полученных порций продукта дает общий выход указанного в заголовке соединения (0,7 г, 2,9 ммоль, выход 63%). МС (ESI) m/z 241,1 [M+2]+.
C. 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин. 3-бром-2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин (0,7 г, 2,93 ммоль) и 3,4-дигидро-2H-пиран (0,493 г, 5,86 ммоль) растворяют в тетрагидрофуране (20 мл). К полученному раствору добавляют ТФА (3,34 мг, 0,029 ммоль) и полученную смесь нагревают до 70°C в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом, отфильтровывают и выливают в делительную воронку, содержащую воду и этилацетат. Органический слой концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (0-60% этилацетат в гексане), получая указанное в заголовке соединение в виде твердого вещества белого цвета (0,40 г, 1,23 ммоль, выход 42%). МС (ESI) m/z 325,1 [M+2]+.
D. Гидрохлорид (цис)-4-метоксициклогексанамина. В круглодонную колбу в атмосфере азота загружают трет-бутил-(цис)-4-гидроксициклогексилкарбамат (7,8 г, 36,2 ммоль), суспендируют в безводном тетрагидрофуране (181,0 мл) и охлаждают до 0°C. К смеси добавляют гидрид натрия (2,174 г, 54,3 ммоль) и полученный раствор перемешивают в течение 5 минут. Во вторую колбу в атмосфере азота загружают метилйодид (2,265 мл, 36,2 ммоль) и суспендируют в безводном тетрагидрофуране (10,0 мл). Раствор метилйодида в тетрагидрофуране медленно по каплям в течение 3 минут добавляют в первую колбу. Реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Летучие органические вещества удаляют при пониженном давлении и остаток распределяют между этилацетатом (3×) и водой. Органические фракции объединяют, сушат над сульфатом магния, отфильтровывают и конденсируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель, 25-50% этилацетат в гексанах). Фракции, содержащие целевое соединение, объединяют, летучие органические вещества удаляют при пониженном давлении и к остатку добавляют хлористоводородную кислоту (4 M в 1,4-диоксане, 23,5 мл). Полученный раствор нагревают до 40°C в течение 1 часа, после чего органические летучие соединения удаляют при пониженном давлении, получая указанное в заголовке соединение (6,0 г, 36,2 ммоль, выход 100%). МС (ESI) m/z 130,1 [М+1]+.
E. 6-бром-4-((цис)-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. К раствору N-(3,5-дибромпиразин-2-ил)-2-йодацетамида (смотрите пример 5.B) (1,0 г, 2,376 ммоль) и диизопропилэтиламина (1,038 мл, 5,94 ммоль) в ацетонитриле (10 мл) добавляют гидрохлорид (цис)-4-метоксициклогексанамина (0,413 г, 2,495 ммоль). Раствор перемешивают при 55°C в течение 3 часов. Полученный осадок отфильтровывают и промывают ацетонитрилом, и сушат при пониженном давлении, получая указанное в заголовке соединение (0,442 г, 1,29 ммоль, выход 55%). МС (ESI) m/z 341,3 [M]+, 343,3 [M+2]+.
F. 4-((цис)-4-метоксициклогексил)-6-(триметилстаннил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. 6-бром-4-((цис)-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,442 г, 1,295 ммоль), тетракис(трифенилфосфин)палладий (0,225 г, 0,194 ммоль) и гексаметилдиолово (0,322 мл, 1,554 ммоль) объединяют в диоксане (5 мл). Раствор продувают газообразным азотом, нагревают до 90°C в пробирке с навинчивающейся крышкой в течение 3 часов. Раствор конденсируют при пониженном давлении и очищают колоночной хроматографией (Biotage, 0-50% этилацетат в гексанах), получая указанное в заголовке соединение (0,356 г, 0,837 ммоль, выход 65%). МС (ESI) m/z 426,5 [М+1]+, 427,5 [М+1]+.
G. 4-((цис)-4-метоксициклогексил)-6-(2-метил-6-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 4-((цис)-4-метоксициклогексил)-6-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,292 г, 0,687 ммоль), 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин (0,244 г, 0,756 ммоль), трис(дибензилиденацетон)дипалладий (0,063 г, 0,069 ммоль), три-o-толилфосфин (0,042 г, 0,137 ммоль), триэтиламин (0,287 мл, 2,061 ммоль) и диметилформамид (5,0 мл) объединяют в колбе с навинчивающейся крышкой и смесь нагревают до 95°C в течение 1 часа. Раствор конденсируют при пониженном давлении и очищают хроматографией (Biotage, 0-80% этилацетат в гексанах, затем 0-10% метанол в этилацетате), получая указанное в заголовке соединение (0,279 г, 0,687 ммоль, выход 80%). МС (ESI) m/z 505,6 [М+1]+.
H. 4-((цис)-4-метоксициклогексил)-6-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 4-((цис)-метоксициклогексил)-6-(2-метил-6-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,279 г, 0,553 ммоль) разбавляют этанолом (15 мл) и хлористоводородной кислотой (4,0 н. в диоксанах, 5 мл). Раствор перемешивают при 75°C в течение 1 часа и при 80°C в течение 2 часов. Раствор конденсируют до взвеси, разбавляют этанолом и подвергают обработке ультразвуком. Осадок отфильтровывают и промывают сначала дополнительным количеством этанола, затем ацетонитрилом. Неочищенный твердый продукт очищают полупрепаративной ВЭЖХ с обращенной фазой (10-100% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут), получая указанное в заголовке соединение (0,040 г, 0,095 ммоль, выход 17%).
1H-ЯМР (400 МГц, метанол-d4) δ (м.д.) 7,88-8,13 (м, 2H), 7,65 (с, 1Н), 4,58 (с, 1Н), 4,16 (с, 2H), 3,47 (ушир.с, 1Н), 3,22-3,32 (м, 66H), 2,73 (с, 3H), 2,08 (ушир.с, 2H), 1,91 (ушир.с, 2H), 1,56 (ушир.с, 4H); МС (ESI) m/z 421,2 [М+1]+, т.пл. 192-195°C.
Пример 14: 1-изопропил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 1-изопропил-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (смотрите пример 7.B) (0,5 г, 1,844 ммоль), гексаметилдиолово (0,725 г, 2,213 ммоль), тетракис(трифенилфосфин)палладий(0) (0,213 г, 0,184 ммоль) и 1,4-диоксан (3 мл) объединяют в герметично закрывающейся емкости с магнитной мешалкой. Через полученный раствор барботируют газообразный азот. Емкость герметично закрывают, реакционный раствор энергично перемешивают и нагревают при 100°C в течение 2 часов. Полученную мутную смесь черного цвета разбавляют этилацетатом, отфильтровывают и осадок на фильтре тщательно промывают этилацетатом. Фильтрат концентрируют при пониженном давлении и очищают колоночной флэш-хроматографией (силикагель, 20-80% этилацетат в гексанах), получая указанное в заголовке соединение (2,410 г, выход 77%) в виде твердого вещества бледно-желтого цвета. МС (ESI) m/z 357,4 [M+2]+
B. 1-изопропил-7-(2-метил-6-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. В колбу загружают 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин (0,446 г, 1,380 ммоль), 1-изопропил-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,490 г, 1,380 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,139 г, 0,152 ммоль), три-o-толилфосфин (0,092 г, 0,304 ммоль), триэтиламин (0,577 мл, 4,14 ммоль) и N,N-диметилформамид (3 мл). Через реакционную смесь в течение 5 минут барботируют газообразный азот и смесь нагревают до 100°C в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь отфильтровывают через целит, промывают метанолом и концентрируют досуха. Полученный остаток очищают колоночной флэш-хроматографией (силикагель, 0-80% этилацетат в гексанах, затем 0-10% метанол в дихлорметане), получая указанное в заголовке соединение (0,40 г, 0,921 ммоль, выход 66,7%). МС (ESI) m/z 435,5 [М+1]+.
C. 1-изопропил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. К перемешиваемой смеси 1-изопропил-7-(2-метил-6-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она (0,400 г, 0,921 ммоль) в этаноле (40 мл) при 50°C добавляют хлористоводородную кислоту (4 M в диоксане, 1,381 мл, 5,52 ммоль). Полученную смесь нагревают при 50°C в атмосфере азота в течение 1 часа. Суспензию концентрируют при пониженном давлении, полученный твердый продукт переносят в диметилсульфоксид и очищают хроматографией (силикагель, 0-10% насыщенный метанольный раствор аммиака в дихлорметане), получая указанное в заголовке соединение (0,200 г, 0,571 ммоль, выход 62,0%) в виде твердого вещества коричнево-красного цвета.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,10 (ушир.с, 1Н), 8,01 (ушир.с, 2H), 7,92 (с, 1Н), 5,26 (квин., J=6,93 Гц, 1Н), 4,14 (с, 2H), 3,58 (д, J=5,08 Гц, 3H), 1,47 (д, J=6,64 Гц, 6H); МС (ESI) m/z 351,5 [М+1]+.
D. 1-изопропил-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (альтернативный метод). 7-бром-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1 экв.), бис(пинаколято)дибор (1 экв.), ацетат калия (3 экв.) и бис(1,1'-бис(дифенилфосфино)ферроцен)палладий (0,01 экв.) объединяют в диоксане, дегазируют азотом и нагревают до 95°C в атмосфере азота. Смесь разбавляют этилацетатом, отфильтровывают через целит, концентрируют, остаток растирают с этилацетатом и гексанами, отфильтровывают и сушат, получая эфир бороновой кислоты с 60% выходом. Трет-бутил-3-(5-бром-6-метилпиридин-2-ил)-1Н-1,2,4-триазол-1-карбоксилат (1 экв.), 1-изопропил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1,2 экв.), тетракис(трифенилфосфин)палладий(0) (0,05 экв.), карбонат натрия (3 экв.) объединяют в смеси (3:1) диметилацетамида и воды. Смесь дегазируют и нагревают до 100°C в течение ночи. Стандартная обработка этилацетатом/водой и последующее растирание в этилацетате приводят к получению указанного в заголовке соединения с 41% выходом.
Пример 15: 7-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он
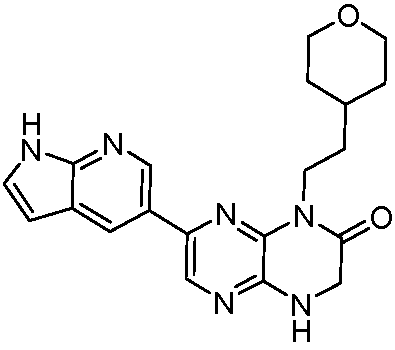
A. Этил-2-(5-бром-3-(2-(тетрагидро-2H-пиран-4-ил)этиламино)пиразин-2-иламино)ацетат. Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (смотрите пример 6.B) (1,0 г, 2,95 ммоль) и 2-(тетрагидро-2H-пиран-4-ил)этанамин (0,381 г, 2,95 ммоль) загружают в емкость для микроволновой обработки, добавляют диметилсульфоксид (2 мл) и полученную смесь нагревают в микроволновом реакторе (Biotage Emrys Optimizer) при 150°C в течение 3600 секунд. Неочищенную реакционную смесь очищают хроматографией (силикагель, 33% этилацетат в гексанах), получая указанное в заголовке соединение (0,5 г, 1,3 ммоль, выход 44%). МС (ESI) m/z 387,1 [M]+, 389,1 [M+2]+.
B. 7-бром-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. Этил-2-(5-бром-3-(2-(тетрагидро-2H-пиран-4-ил)этиламино)пиразин-2-иламино)ацетат (0,5 г, 1,291 ммоль) и хлористоводородную кислоту (6 M раствор в воде, 0,215 мл, 1,291 ммоль) объединяют в этаноле (2 мл), полученную смесь нагревают в микроволновом реакторе (Biotage Emrys Optimizer) при 100°C в течение 2400 секунд. Реакционную смесь концентрируют и очищают хроматографией (силикагель, 33% этилацетат в гексанах), получая указанное в заголовке соединение (количественный выход). МС (ESI) m/z 341,1 [M]+, 343,1 [M+2]+.
C. 1-(2-(тетрагидро-2H-пиран-4-ил)этил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,4 г, 1,29 ммоль), гексаметилдиолово (0,57 г, 1,75 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,2 г, 0,176 ммоль) загружают в герметично закрывающуюся пробирку с 1,4-диоксаном (5 мл). Из колбы удаляют воздух, продувают ее газообразным азотом, герметично закрывают и нагревают при 110°C в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, отфильтровывают через целит и промывают с этилацетатом. Фильтрат концентрируют, подвергают ультразвуковой обработке с небольшим количеством смесевого растворителя (50% гексан в этилацетате) и выделяют фильтрацией, получая указанное в заголовке соединение (0,34 г, 0,8 ммоль, выход 54,6%). МС (ESI) m/z 427 [M+2]+.
D. 7-(1Н-пирроло[2,3-b]пиридин-5-ил)-1-(2-(тетрагидро-2H-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 1-(2-(тетрагидро-2H-пиран-4-ил)этил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1,0 г, 2,352 ммоль), 5-бром-1Н-пирроло[2,3-b]пиридин (0,556 г, 2,82 ммоль), трис(дибензилиденацетон)палладий(0) (0,237 г, 0,259 ммоль), три-o-толилфосфин (0,158 г, 0,518 ммоль) и триэтиламин (0,984 мл, 7,06 ммоль) объединяют в герметично закрывающейся пробирке, к полученной смеси добавляют диметилформамид (5 мл). Атмосферу из пробирки удаляют в вакууме и заменяют ее газообразным азотом. Реакционную смесь нагревают до 100°C в течение 1 часа. После охлаждения до комнатной температуры реакционную смесь отфильтровывают через целит. Осадок на фильтре промывают этилацетатом. Промывной раствор и фильтрат объединяют и концентрируют почти досуха. Полученный твердый продукт растворяют в горячем метаноле, отфильтровывают через целит и очищают препаративной ВЭЖХ с обращенной фазой (5-80% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Чистые фракции собирают, нейтрализуют гидроксидом аммония и концентрируют досуха. Полученный твердый продукт отфильтровывают, промывают водой и сушат в высоком вакууме, получая указанное в заголовке соединение (0,10 г, 0,264 ммоль, выход 11,2%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,71 (ушир.с, 1Н), 8,81 (с, 1Н), 8,44 (с, 1Н), 8,26 (с, 1Н), 7,49 (д, J=10,54 Гц, 2H), 6,48 (ушир.с, 1Н), 4,18 (с, 2H), 4,13 (т, J=6,44 Гц, 2H), 3,82 (д, J=12,89 Гц, 2H), 3,27 (т, J=11,13 Гц, 2H), 1,71 (д, J=12,49 Гц, 2H), 1,60 (ушир.с, 3H), 1,24 (д, 2H); МС (ESI) m/z 379,2 [М+1]+; т.пл. 255-258°C.
Пример 16: 6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 6-бром-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4- дигидропиразино[2,3-b]пиразин-2(1Н)-он. N-(3,5-дибромпиразин-2-ил)-2-йодацетамид (смотрите пример 5.B) (8,0 г, 19,01 ммоль), (тетрагидро-2H-пиран-4-ил)метанамин (2,63 г, 22,81 ммоль) и диизопропилэтиламин (6,64 мл, 38,0 ммоль) загружают в круглодонную колбу объемом 250 мл, суспендируют в ацетонитриле (80,0 мл) и нагревают до 40°C в течение 16 часов. Твердый белый осадок отфильтровывают, промывают ацетонитрилом, гексанами и сушат в вакууме, получая указанное в заголовке соединение (4,89 г, 14,95 ммоль, выход 79%). МС (ESI) m/z 327,4 [M]+, 329,5 [M+2]+.
B. 6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 6-бром-4-((тетрагидро-2H-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (35,98 г, 110 ммоль), 2-(5-(триметилстаннил)пиридин-2-ил)пропан-2-ол (смотрите пример 5.E) (33,0 г, 110 ммоль) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (8,05 г, 11,00 ммоль) объединяют в герметично закрывающейся пробирке и суспендируют в N,N-диметилформамиде (288 мл). После этого реакционную смесь нагревают до 125°C в течение 2 часов. Реакционную смесь слегка охлаждают, теплую смесь выливают в колонку с силикагелем (Biotage SP1) и очищают (0-100% (5% метанол в этилацетате) в гексанах). Фракции, содержащие целевой продукт, объединяют и органические летучие вещества удаляют при пониженном давлении. Остаток растирают с 20% этилацетатом в гексанах и затем несколько раз промывают денатурированным этанолом. Полученное твердое вещество бледно-желтого цвета сушат при пониженном давлении, получая указанное в заголовке соединение (15,08 г, 39,3 ммоль, выход 35,8%).
1Н-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 11,32 (с, 1Н), 9,07 (д, J=1,56 Гц, 1Н), 8,29 (дд, J=8,59, 2,34 Гц, 1Н), 8,05 (с, 1Н), 7,72 (д, J=8,20 Гц, 1Н), 5,26 (с, 1Н), 4,21 (с, 2H), 3,83 (д, J=2,73 Гц, 2H), 3,51 (д, J=7,42 Гц, 2H), 3,27 (т, J=11,32 Гц, 2H), 2,09 (ушир.с, 1Н), 1,61 (д, J=11,3 Гц, 2H), 1,46 (с, 6H), 1,24-1,38 (м, 2H); МС (ESI) m/z 384,2 [М+1]+; т.пл. 268-269°C.
Пример 17: 7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 7-бром-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. Этил-2-(3,5-дибромпиразин-2-иламино)ацетат (смотрите пример 1.C) (1 экв.), 2-метоксиэтанамин (1 экв.) и диизопропилэтиламин (3 экв.) суспендируют в диметилсульфоксиде и нагревают в микроволновом реакторе Emrys Biotage при 150°C в течение 1 часа. Стандартная обработка этилацетатом/водой приводит к получению неочищенного продукта, который суспендируют в 99,7% уксусной кислоте. Реакционную смесь герметично закрывают, нагревают до 120°C перемешивают в течение 2 часов. Реакционную смесь экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором бикарбоната натрия, затем раствором соли и сушат над сульфатом магния. Концентрирование раствора с последующей колоночной флэш-хроматографией (0-100% этилацетат в гексанах) приводит к получению указанного в заголовке соединения с общим выходом двух стадий 27%. МС (ESI) m/z 287,4 [M]+, 289,4 [M+2]+.
B. 7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1 экв.), 2-(5-(триметилстаннил)пиридин-2-ил)пропан-2-ол (смотрите пример 5.E) (1 экв.) и дихлорбис(трифенилфосфин)палладий(II) (0,2 экв.) суспендируют в диметилформамиде. Реакционную смесь продувают азотом и нагревают до 140°C в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, отфильтровывают через целит и промывают этилацетатом. Летучие соединения удаляют при пониженном давлении и полученную взвесь пурпурного цвета очищают колоночной хроматографией (силикагель, 0-100% (5% метанол в этилацетате) в гексанах). Фракции, содержащие продукт, объединяют и органические летучие соединения удаляют при пониженном давлении. Твердый остаток растирают в 5% этилацетате в гексанах и промывают гексанами, получая указанное в заголовке соединение (выход 38%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 9,02 (д, J=1,6 Гц, 1Н), 8,27 (с, 1Н), 8,24 (дд, J=8,6, 2,3 Гц, 1Н), 7,71 (д, J=0,8 Гц, 1Н), 7,69 (с, 1Н), 5,25 (с, 1Н), 4,28 (т, J=6,2 Гц, 2H), 4,20 (д, 2H), 3,60 (т, J=6,2 Гц, 2H), 3,26 (с, 3H), 1,46 (с, 6H); МС (ESI) m/z 344,3 [М+1]+.
Пример 18: 7-(1Н-пирроло[2,3-b]пиридин-4-ил)-1-[2-(тетрагидропиран-4-ил)этил]-3,4-дигидро-1Н-пиразино[2,3-b]пиразин-2-он
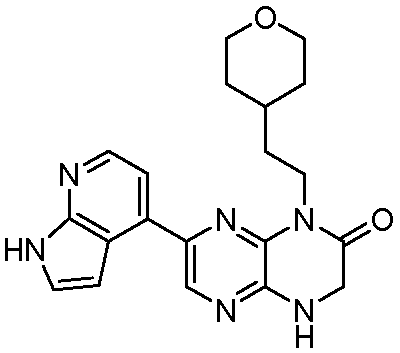
A. 7-(1Н-пирроло[2,3-b]пиридин-4-ил)-1-[2-(тетрагидропиран-4-ил)этил]-3,4-дигидро-1Н-пиразино[2,3-b]пиразин-2-он. Смесь 1-(2-(тетрагидро-2Η-пиран-4-ил)этил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-она (смотрите пример 15.C) (1 экв.), трет-бутилового эфира 4-бромпирроло[2,3-b]пиридин-1-карбоновой кислоты (1 экв.), трис(дибензилиденацетон)палладия (0,13 экв.), три-o-толилфосфина (0,25 экв.) и триэтиламина (2,8 экв.) в безводном диоксане продувают, дегазируют в течение 2 минут и перемешивают при 95°C в атмосфере азота в течение 3-4 часов. После завершения реакции (контроль с помощью ТСХ) летучие соединения удаляют при пониженном давлении и остаток очищают колоночной хроматографией, получая указанное в заголовке соединение (выход 35%). МС (ESI) m/z 479,7 [М+1]+. Трет-бутил 4-(7-оксо-8-(2-(тетрагидро-2H-пиран-4-ил)этил)-5,6,7,8- тетрагидропиразино[2,3-b]пиразин-2-ил)-1Н-пирроло[2,3-b]пиридин-1-карбоксилат перемешивают в метанольном растворе хлористоводородной кислоты при комнатной температуре. После завершения реакции (контроль с помощью ТСХ) растворитель удаляют при пониженном давлении и остаток очищают на силикагеле, получая указанное в заголовке соединение (выход 63%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ (м.д.) 11,72 (с, 1Н), 8,38 (с, 1Н), 8,25 (д, J=4,8 Гц, 1Н), 7,79 (с, 1Н), 7,53-7,51 (м, 2H), 6,97 (кв, J=1,6 Гц, 1Н), 4,23 (с, 2H), 4,14 (т, J=7,6 Гц, 2H), 3,81 (дд, J1=2,4 Гц, J2=11,2 Гц, 2H), 3,25 (д, J=10,8 Гц, 2H), 1,67 (д, J=13,2 Гц, 2H), 1,61 (м, 3H), 1,22 (м, 2H); МС (ESI): m/z 379,2 [М+1]+.
Пример 19: 1-(2-метоксиэтил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он

A. 1-(2-метоксиэтил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 7-бром-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (смотрите пример 17.A) (0,5 г, 1,741 ммоль), 1,1,1,2,2,2-гексаметилдистаннан (0,856 г, 2,61 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,201 г, 0,174 ммоль) объединяют в 1,4-диоксане (20 мл) и полученную смесь нагревают при 140°C в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и отфильтровывают через целит. Фильтрат концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (0-30% этилацетат в гексане), получая указанное в заголовке соединение в виде прозрачного масла (0,5 г, 1,34 ммоль, выход 77%). МС (ESI) m/z 373,0 [M+2]+.
B. 1-(2-метоксиэтил)-7-(2-метил-6-(4H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 1-(2-метоксиэтил)-7-(триметилстаннил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (0,5 г, 1,348 ммоль), 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин (0,436 г, 1,348 ммоль), трис(дибензилидинацетон)дипалладий(0) (0,123 г, 0,135 ммоль), три-o-толилфосфин (0,082 г, 0,270 ммоль), триэтиламин (0,584 мл, 4,04 ммоль) и N,N-диметилформамид (10 мл) объединяют в герметично закрывающейся колбе объемом 75 мл, атмосферу в колбе заменяют азотом. Смесь перемешивают при 130°C в течение 3 часов. Полученную реакционную смесь охлаждают до комнатной температуры и отфильтровывают. Органический слой концентрируют при пониженном давлении. Полученный остаток разбавляют метанолом и диметилсульфоксидом, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (10-30% ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 30 минут). Фракции, содержащие чистый продукт, пропускают через экстракционную колонку с твердей фазой Phenomenex Strata-X-C. Колонку промывают последовательно водой, ацетонитрилом, метанолом и 5% раствором гидроксида аммония в метаноле. Продукт элюируют 5% раствором гидроксида аммония в метаноле и концентрируют при пониженном давлении. Остаток растирают с этиловым эфиром в гексане, образующийся тонкий порошок сушат в вакууме при 50°C, получая указанное в заголовке соединение (0,05 г, 0,136 ммоль, выход 10%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,10 (ушир.с, 1Н), 7,98 (ушир.с, 1Н), 7,94 (с, 1Н), 7,73 (ушир.с, 1Н), 4,13-4,28 (м, 4H), 3,55 (т, J=6,25 Гц, 2H), 3,24 (с, 3H), 2,70 (ушир.с, 3H); МС (ESI) m/z 367,2 [M+1]+.
Пример 20: Гидрохлорид 6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она

A. 6-бром-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. К раствору 2-бром-N-(3,5-дибромпиразин-2-ил)ацетамида (смотрите пример 4.A) (1 экв.) и диизопропилэтиламина (3 экв.) в ацетонитриле добавляют гидрохлорид этанамина (1,05 экв.). Полученный раствор нагревают до 70°C в течение 30 минут. Реакционную смесь концентрируют при пониженном давлении и очищают колоночной хроматографией (0-75% этилацетат в гексанах), получая указанное в заголовке соединение (выход 36%). МС (ESI) m/z 257,5 [M]+, 259,4 [M+2]+.
B. 4-этил-6-(4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он. 6-бром-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он (1,1 экв.), 4-(тетрагидро-2H-пиран-2-ил)-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4H-1,2,4-триазол (1 экв.) и дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан (0,05 экв.) объединяют в 1,4-диоксане с последующим добавлением раствора карбоната натрия (3 экв.) в воде. Раствор нагревают в микроволновом реакторе (Biotage Emrys Optimizer) до 120°C в течение 30 минут. Реакционную смесь концентрируют при пониженном давлении и очищают колоночной хроматографией (0-10% метанол в этилацетате), получая указанное в заголовке соединение (выход 45%). МС (ESI) m/z 406,6 [М+1]+.
C. Гидрохлорид 6-(4-(4H-1,2,4-триазол-3-ил)фенил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-она. 4-этил-6-(4-(4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он в этаноле обрабатывают 2 н. раствором хлористоводородной кислоты в диоксане. Раствор перемешивают при 75°C в течение 1 часа. Раствор частично концентрируют и охлаждают. К полученной суспензии добавляют охлажденный этанол, полученный осадок отфильтровывают, промывают дополнительным количеством охлажденного этанола, затем гексанами, получая указанное в заголовке соединение в виде гидрохлоридной соли (выход 82%).
1H-ЯМР (400 МГц, метанол-d4) δ (м.д.) 9,18 (с, 1Н), 8,22 (д, J=8,59 Гц, 2H), 8,04-8,09 (м, 3H), 7,66-7,74 (м, 1Н), 7,58-7,64 (м, 1Н), 4,24 (с, 2H), 3,74 (кв, J=7,03 Гц, 2H), 1,29 (т, J=7,03 Гц, 4H), 0,79-0,98 (м, 4H); МС (ESI) m/z 322,2 [М+1]+.
СИНТЕЗ СТРУКТУРООБРАЗУЮЩИХ БЛОКОВ
Структурообразующие блоки, представленные ниже, получают и используют в способах получения, описанных в изобретении, или в их вариантах, известных в данной области техники.
Трет-бутил-4-бром-1Н-пирроло[2,3-b]пиридин-1-карбоксилат
A. 4-бром-1Н-пирроло[2,3-b]пиридин. Раствор ангидрида трифторметилсульфоновой кислоты (9,3 г, 33 ммоль) по каплям добавляют к смеси 1Н-пирроло[2,3-b]пиридин-7-оксида (3 г, 22 ммоль) и бромида тетрабутиламмония (10,8 г, 33 ммоль) в N,N-диметилформамиде (30 мл) при 0°C. Полученную смесь перемешивают при 0°C в течение 4 часов и при комнатной температуре в течение ночи. Реакцию гасят водой и нейтрализуют с 1 н. гидроксидом натрия до pΗ=7. Полученную смесь дважды экстрагируют смесью метиленхлорида и изопропанола (30 мл, метиленхлорид:изопропанол=4:1 об./об.). Органические слои объединяют, сушат над безводным сульфатом натрия, концентрируют и очищают препаративной ВЭЖХ с обращенной фазой (0-30%: ацетонитрил +0,1% ТФА в воде +0,1% ТФА, в течение 15 минут), получая указанное в заголовке соединение (1,5 г, выход 34,3%) МС (ESI) m/z 196,8 [М+1]+, 198,8 [M+3]+.
B. Трет-бутил-4-бром-1Н-пирроло[2,3-b]пиридин-1-карбоксилат. Смесь 4-бром-1Н-пирроло[2,3-b]пиридина (250 мг, 1,26 ммоль), ди-трет-бутилдикарбоната (302 мг, 1,38 ммоль), диметил-пиридин-4-иламина (7,6 мг, 0,06 ммоль) и триэтиламина (127 мг, 1,26 ммоль) в безводном метиленхлориде (15 мл) перемешивают при комнатной температуре в течение 3 часов. После завершения реакции (контроль с помощью ТСХ) летучие соединения удаляют при пониженном давлении и остаток очищают колоночной хроматографией (силикагель, 9-25% этилацетат в петролейном эфире), получая указанное в заголовке соединение (230 мг, выход 61%) в виде масла. МС (ESI) m/z 242,9 [M-56+1]+.
1-(тетрагидро-2H-пиран-2-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-индазол
A. 4-бром-1Н-индазол. К раствору 3-бром-2-метиланилина (5 г, 27 ммоль) в хлороформе (1 мл) при 0°C добавляют уксусный ангидрид (5 г, 27 ммоль), после этого смесь перемешивают при комнатной температуре в течение 1 часа. К смеси добавляют ацетат калия (0,75 г, 7,8 ммоль) и изоамилонитрил (0,78 г, 58 ммоль) и реакционную смесь кипятят с обратным холодильником в течение 18 часов. Летучие вещества удаляют при пониженном давлении и к остатку добавляют воду (0,65 мл). Смесь концентрируют, разбавляют концентрированной хлористоводородной кислотой (1 мл) и нагревают при 50°C в течение 2 часов. После охлаждения до комнатной температуры к смеси добавляют водный раствор гидроксида натрия (50%) до достижения pΗ=10. Водную смесь экстрагируют этилацетатом (100 мл ×3). Органические слои объединяют, промывают раствором соли (150 мл), сушат над безводным сульфатом натрия, отфильтровывают, упаривают и остаток очищают колоночной хроматографией (силикагель, 3% этилацетат в петролейном эфире), получая указанное в заголовке соединение (2,69 г, выход 34%) в виде твердого вещества. МС (ESI): m/z 197,0 [М+1]+.
B. 4-бром-1-(тетрагидропиран-2-ил)-1Н-индазол. Раствор 4-бром-1Н-индазола (1,82 г, 9,24 ммоль), 3,4-дигидро-2H-пирана (1,55 г, 18,48 ммоль) и толуол-4-сульфоновой кислоты (0,26 г, 1,39 ммоль) в безводном тетрагидрофуране (40 мл) нагревают при 80°C в атмосфере азота в течение ночи. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией (силикагель, 3% этилацетат в петролейном эфире), получая указанное в заголовке соединение (2,13 г, выход 81%) в виде твердого вещества желтого цвета. МС (ESI): m/z 280,9 [М+1]+.
C. 1-(тетрагидропиран-2-ил)-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1Н-индазол. Дегазированную смесь 4-бром-1-(тетрагидропиран-2-ил)-1Н-индазола (2,13 г, 7,45 ммоль), бис(пинаколято)дибора (3,73 г, 14,9 ммоль), фосфата калия (2,70 г, 12,67 ммоль), ацетата палладия (0,174 г, 0,75 ммоль) и трифенилфосфина (0,59 г, 2,24 ммоль) в 1,2-диметоксиэтане (50 мл) нагревают при 100°C в атмосфере азота в течение ночи. После охлаждения до комнатной температуры реакционную смесь отфильтровывают, концентрируют при пониженном давлении и очищают колоночной хроматографией (силикагель, 10-30% этилацетат в петролейном эфире), получая указанное в заголовке соединение (1,83 г, выход 74%) в виде твердого вещества. МС (ESI): m/z 329,2 [М+1]+.
3-(4-бром-2-фтор-3-метилфенил)-4-(тетрагидро-2Н-пиран-2-ил)-4Η-1,2,4-триазол
A. 4-бром-3-фтор-2-метиланилин. К раствору 3-фтор-2- метиланилина (25 г, 200 ммоль) в уксусной кислоте (140 мл) с перемешиванием при 0-5°C добавляют сначала бромистый водород (100 мл, 200 ммоль), затем медленно, по каплям диметилсульфоксид (72 мл) (реакция является экзотермической и при температуре выше 5-15°C приводит к образованию дибромизомера). Смесь перемешивают при 5-15°C в течение 12 часов (смесь становится прозрачным раствором). Полученный раствор охлаждают до 0°C и нейтрализуют гидроксидом натрия, затем бикарбонатом натрия до pH 7. Смесь экстрагируют этилацетатом. Органический слой концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (0-10% этилацетат в гексане), получая указанное в заголовке соединение в виде твердого вещества белого цвета (23,3 г, 114 ммоль, выход 57%).
1H-ЯМР (400 МГц, хлороформ-d) δ (м.д.) 7,11 (т, J=8,20 Гц, 1Н), 6,35 (д, J=8,98 Гц, 1Н), 3,72 (ушир.с, 2H), 2,07 (д, J=1,95 Гц, 3H).
B. 4-амино-2-фтор-3-метилбензонитрил. Смесь 4-бром-3-фтор-2-метиланилина (23 г, 113 ммоль) и цианида меди (20,19 г, 225 ммоль) в N,N-диметилформамиде (200 мл) нагревают до 140°C в течение 7 часов. После этого смесь охлаждают до комнатной температуры, отфильтровывают и выливают в делительную воронку, содержащую воду и этилацетат (1:1). Слои разделяют и органический слой концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (0-50% этилацетат в гексане), получая указанное в заголовке соединение (11,4 г, 76 ммоль, выход 67%) в виде твердого вещества коричневого цвета.
1H-ЯМР (400 МГц, хлороформ-d) δ (м.д.) 7,22 (т, 1Н), 6,45 (д, J=8,59 Гц, 1Н), 4,23 (ущ. с, 2H), 2,07 (с, 3H); МС (ESI) m/z 151,1 [M+1]+.
C. 4-бром-2-фтор-3-метилбензонитрил. Смесь диметилсульфоксида (400 мл) и нитрита калия (22,67 г, 266 ммоль) перемешивают до растворения нитрита калия, к полученному раствору добавляют 4-амино-2-фтор-3-метилбензонитрил (10 г, 66,6 ммоль) и бромид меди(I) (1,911 г, 13,32 ммоль). Водный 48% раствор бромистого водорода (33 мл, 266 ммоль), разбавленный диметилсульфоксидом (200 мл), по каплям добавляют к полученному раствору и реакционную смесь перемешивают в течение 2 часов. После полного исчезновения исходных веществ реакционную смесь выливают в ледяную воду и нейтрализуют до pH 7 охлажденным концентрированным гидроксидом натрия. Полученный твердый продукт собирают фильтрацией, получая указанное в заголовке соединение (11,4 г, 53,3 ммоль, выход 80%) в виде твердого вещества белого цвета.
1Н-ЯМР (400 МГц, хлороформ-d) δ (м.д.) 7.47 (д, J=9,37 Гц, 1Н), 7,33 (т, 1Н), 2,39 (д, J=2,34 Гц, 3H).
D. 4-бром-2-фтор-3-метилбензамид. 4-бром-2-фтор-3- метилбензонитрил (11 г, 51,4 ммоль) в 100 мл смеси ТФА и серной кислоты (4:1, об./об.) перемешивают при 40°C в течение 16 часов. После полной конверсии исходных веществ реакционную смесь выливают в ледяную воду. Полученный твердый продукт собирают фильтрацией, промывают водой и сушат, получая указанное в заголовке соединение (11,24 г, 48,4 ммоль, выход 94%) в виде твердого вещества белого цвета. МС (ESI) m/z 234,1 [M+2]+.
E. 3-(4-бром-2-фтор-3-метилфенил)-1Н-1,2,4-триазол. 4-бром-2-фтор-3-метилбензамид (11 г, 47,4 ммоль) и диметилацеталь N,N-диметилформамида (60 мл) объединяют в круглодонной колбе объемом 100 мл с магнитной мешалкой, нагревают с обратным холодильником при 55°C в атмосфере азота в течение 3 часов. Полученную смесь концентрируют при пониженном давлении и сушат в вакууме, получая масло желтого цвета, которое используют на следующей стадии без дополнительной очистки. Масло разбавляют уксусной кислотой (60 мл) при 0°C, к смеси по каплям добавляют моногидрат гидразина (20 мл) и смесь перемешивают при комнатной температуре в течение 5 часов. После полной конверсии исходных веществ реакционную смесь выливают в ледяную воду и нейтрализуют до pH 7 концентрированным раствором гидроксида натрия, охлажденным на ледяной бане. Полученный осадок собирают вакуумной фильтрацией. Твердый продукт растворяют в этилацетате (400 мл), раствор перемешивают в течение 15 минут, твердый осадок собирают фильтрацией, фильтрат сушат над сульфатом магния, отфильтровывают, концентрируют при пониженном давлении и сушат в вакууме, получая указанное в заголовке соединение в виде твердого вещества коричневого цвета без примесей (4,3 г, 16,79 ммоль, выход 35%), которое используют на следующей стадии без дополнительной очистки.
1H-ЯМР (400 МГц, хлороформ-d) δ (м.д.) 8,12 (с, 1Н), 7,97 (т, J=8,00 Гц, 1Н), 7,52 (д, J=8,59 Гц, 1Н), 2,44 (д, 3H).
F. 3-(4-бром-2-фтор-3-метилфенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол. Метансульфоновую кислоту (0,090 мл, 1,390 ммоль) добавляют к раствору 3-(4-бром-2-фтор-3-метилфенил)-1Н-1,2,4-триазола (7,0 г, 27,3 ммоль) и 3,4-дигидро-2H-пирана (12,68 мл, 139 ммоль) в тетрагидрофуране (33 мл) при перемешивании. Полученную смесь при перемешивании нагревают с обратным холодильником при 85°C в течение 20 часов. Смесь разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и раствором соли. Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (20-30-50% этилацетат в гексане). Фракции, содержащие продукт, объединяют и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение (8,8 г, выход 95%) в виде твердого вещества желтого цвета. МС (ESI) m/z 340,0 [M]+.
3-(4-бром-2-фторфенил)-4Н-1,2,4-триазол

A. 4-бром-2-фторбензамид. Раствор 4-бром-2-фторбензонитрила (10,0 г, 50,0 ммоль) в 70 мл смеси ТФА (56,0 мл, 727 ммоль) и серной кислоты (14,0 мл, 263 ммоль) (4:1 об./об.) перемешивают при 40°C в течение 16 часов. Теплую реакционную смесь выливают в ледяную воду. Твердый осадок собирают фильтрацией и сушат, получая 4-бром-2-фторбензамид (9,53 г, 43,7 ммоль, выход 87%) в виде твердого вещества белого цвета. МС (ESI) m/z 218,1 [M]+, 220,1 [M+2]+.
B. 3-(4-бром-2-фторфенил)-4H-1,2,4-триазол. 4-бром-2- фторбензамид (9,53 г, 43,7 ммоль) и диметилацеталь N,N-диметилформамида (75,0 мл) объединяют в круглодонной колбе объемом 500 мл и смесь продувают азотом. Реакционную смесь кипятят с обратным холодильником при 85°C в течение 2 часов. Полученную смесь упаривают при пониженном давлении и остаток сушат в вакууме, получая масло желтого цвета. Полученное масло суспендируют в концентрированной уксусной кислоте (75,0 мл) и охлаждают до 0°C. К полученной смеси по каплям добавляют гидрат гидразина (21,88 г, 437 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 5 часов. Теплую реакционную смесь выливают на лед и экстрагируют дихлорметаном (3×200 мл). Органические слои объединяют и летучие органические вещества удаляют при пониженном давлении, получая 3-(4-бром-2-фторфенил)-4H-1,2,4-триазол (7,20 г, 29,7 ммоль, выход 68,1%) в виде твердого вещества белого цвета. МС (ESI) m/z 241,9 [M]+, 243,9 [M+2]+.
2-(4-метил-5-(триметилстаннил)пиридин-2-ил)пропан-2-ол
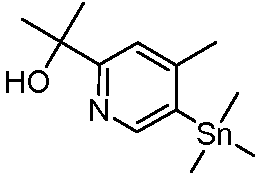
A. 2-(5-бром-4-метилпиридин-2-ил)пропан-2-ол. 2,5-дибром-4- метилпиридин (4,0 г, 15,94 ммоль) растворяют в толуоле (60,0 мл) и реакционную смесь охлаждают до -78°C. К реакционной смеси по каплям добавляют бутиллитий (7,01 мл, 17,54 ммоль) и реакционную смесь перемешивают в течение 30 минут. После этого к смеси добавляют ацетон (4,69 мл, 63,8 ммоль), смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 16 часов. Реакцию гасят насыщенным раствором хлорида аммония, экстрагируют этилацетатом (3×200 мл) и промывают сначала водой, затем раствором соли. Органические слои сушат над сульфатом магния и летучие вещества удаляют при пониженном давлении. Остаток очищают хроматографией (силикагель, 0-50% этилацетат в гексанах), получая 2-(5-бром-4-метилпиридин-2-ил)пропан-2-ол (2,33 г, 10,13 ммоль, выход 63,5%). МС (ESI) m/z 230,3 [M]+, 232,3 [M+2]+.
B. 2-(4-метил-5-(триметилстаннил)пиридин-2-ил)пропан-2-ол. 2-(5-бром-4-метилпиридин-2-ил)пропан-2-ол (2,33 г, 10,13 ммоль) и тетракис(трифенилфосфин)палладий(0) (1,045 г, 1,013 ммоль) загружают пробирку под давлением и суспендируют в 1,4-диоксане (33,8 мл). К смеси добавляют 1,1,1,2,2,2-гексаметилдистаннан (2,99 мл, 12,15 ммоль), полученную смесь нагревают до 150°C в течение 30 минут. Реакционную смесь охлаждают до комнатной температуры, отфильтровывают через целит и промывают этилацетатом. Органические летучие компоненты удаляют при пониженном давлении, остаток экстрагируют этилацетатом (3×200 мл) и водой. Органические летучие компоненты удаляют при пониженном давлении и остаток очищают колоночной хроматографией (Biotage, силикагель, 10-50% этилацетат в гексанах), получая 2-(4-метил-5-(триметилстаннил)пиридин-2-ил)пропан-2-ол (1,75 г, 5,57 ммоль, выход 55,0%).
1H-ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 8,31 (с, 1Н), 7,51 (с, 1Н), 5,25 (ушир.с, 1Н), 2,37 (с, 3H), 1,41 (с, 6H), 0,65 (ушир.с, 3H), 0,34 (с, 6H).
Трет-бутил-3-(5-бром-6-метилпиридин-2-ил)-1Н-1,2,4-триазол-1-карбоксилат
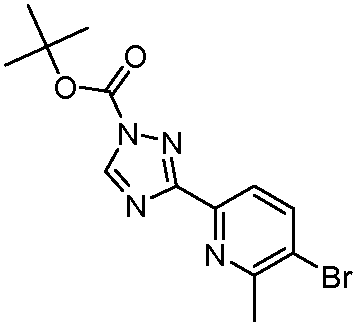
A. 5-бром-6-метилпиколинонитрил. В круглодонную колбу объемом 1 л, снабженную механической мешалкой и входным отверстием для ввода азота, загружают 3,6-дибром-2-метилпиридин (150 г, 0,59 моль), цианид меди(I) (42,8 г, 0,47 моль) и цианид натрия (23 г, 0,47 моль). К смеси добавляют N,N-диметилформамид (300 мл). Смесь нагревают до 95°C и перемешивают в течение 48 часов. Реакционную смесь охлаждают до температуры окружающей среды и выливают в этанол (3 л) при перемешивании. Смесь отфильтровывают через слой целита, фильтрат концентрируют при пониженном давлении и остаток распределяют между водой (3 л) и этилацетатом (3 л). Органический слой отделяют и промывают раствором соли (2×600 мл), сушат над безводным сульфатом натрия, отфильтровывают и концентрируют. Неочищенный продукт очищают, пропуская через слой силикагеля (0-5% этилацетат в гексанах), получая указанное в заголовке соединение (61,5 г, выход 45%) в виде твердого вещества белого цвета. Дополнительно выделяют 19,32 г (14%) смеси исходных веществ и продукта.
B. 5-бром-6-метилпиколингидразонамид. В трехгорлую колбу объемом 500 мл, снабженную механической мешалкой, загружают 5-бром-6-метилпиколинонитрил (101,5 г, 0,515 моль), этанол (122 мл) и гидрат гидразина (50 мл, 1,03 моль). Полученную вязкую смесь перемешивают при температуре окружающей среды в течение 24 часов. Добавляют еще одну порцию этанола (50 мл) и смесь перемешивают в течение уикэнда. Смесь отфильтровывают и промывают охлажденным этанолом (100 мл) и охлажденными гексанами (50 мл). Твердый осадок сушат в вакуумной печи, получая указанное в заголовке соединение (110 г, выход 93%) в виде твердого вещества не совсем белого цвета.
C. 3-бром-2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин. В трехгорлую колбу объемом 500 мл, снабженную механической мешалкой, термопарой, соединенной с регулятором температуры J-KEM, и обратным холодильником, загружают 5-бром-6-метилпиколиногидразонамид (100 г, 0,463 моль) и муравьиную кислоту (250 мл). Полученный раствор нагревают до 100°C и перемешивают в течение 48 часов. Муравьиную кислоту удаляют при пониженном давлении и полученную взвесь обрабатывают водой (1,5 л) при энергичном перемешивании. Смесь отфильтровывают и промывают водой (300 мл). Твердый осадок переносят в круглодонную колбу и обрабатывают водой (1 л) и 1 M раствором гидроксида натрия до достижения pH 7. Смесь перемешивают в течение 30 минут, отфильтровывают, промывают водой (300 мл) и сушат в вакуумной печи при 30-35°C в течение 48 часов, получая указанное в заголовке соединение (96 г, выход 92%) в виде твердого вещества белого цвета.
D. 3-бром-2-метил-6-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин. К суспензии 3-бром-2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридина (96,0 г, 0,4 моль) в тетрагидрофуране (780 мл) добавляют 3,4-дигидро-2H-пиран (72,5 мл, 0,8 моль) и метансульфоновую кислоту (3,2 мл). Смесь нагревают до 65°C и полученный раствор желтого цвета перемешивают при 65°C в течение 6 часов. Смесь охлаждают до температуры окружающей среды, гасят триэтиламином (23 мл), концентрируют при пониженном давлении и еще раз сушат в высоком вакууме в течение 1 часа. Полученное масло растворяют в ацетонитриле (250 мл) и полученный раствор выливают в воду (750 мл) при энергичном перемешивании. Добавляют еще одну порцию ацетонитрила (80 мл) и смесь перемешивают в течение 1 часа. Полученный твердый осадок отфильтровывают, промывают смесью 1:4 ацетонитрил/вода (800 мл) и сушат в вакуумной печи в течение 48 часов, получая указанное в заголовке соединение (110 г, выход 85%) в виде твердого вещества белого цвета. Продукт подвергают дополнительной очистке, пропуская через слой силикагеля (элиюрование: 1:1 гексаны/этилацетат), и получают 88 г чистого указанного в заголовке соединения в виде твердого вещества белого цвета и 16,2 г менее чистого продукта. МС (ESI) m/z 239,1 [M]+, 241,1 [M+2]+.
E. трет-бутил-3-(5-бром-6-метилпиридин-2-ил)-1Н-1,2,4-триазол-1-карбоксилат. К смеси 3-бром-2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридина (300 г, 1,25 моль) в диоксане (4 л) добавляют карбонат натрия (398 г, 3,75 моль) и затем воду (4 л). К полученной смеси добавляют ди-трет-бутилдикарбонат (274 г, 1,25 моль) и смесь перемешивают в течение 1 часа при комнатной температуре. После этого смесь разбавляют охлажденной водой (~10 л) и экстрагируют этилацетатом (4 л ×3). Объединенный этилацетатный слой промывают раствором соли, сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в заголовке соединение (254 г, выход 60%) в виде твердого вещества светло-желтого цвета.
4-(тетрагидро-2H-пиран-2-ил)-3-(4-(4,4,5,5-тетраметил-l,3,2-диоксаборолан-2-ил)фенил)-4Н-1,2,4-триазол

A. Гидрохлорид этил-4-бромбензимидата. Раствор 4-бромбензонитрила (17,65 г, 97 ммоль) в этаноле (500 мл) подкисляют газообразным хлористым водородом при 0°C в течение пятнадцати минут. Полученный раствор перемешивают в течение 16 часов. Раствор концентрируют при пониженном давлении, получая указанное в заголовке соединение (25,35 г, 99%). МС (ESI) m/z 228,1 [M]+, 230,4 [M+2]+.
B. 3-(4-бромфенил)-4H-1,2,4-триазол. Гидрохлрид этил-4-бромбензимидата (35,6 г, 135 ммоль), гидразид муравьиной кислотыд (16,16 г, 269 ммоль) и триэтиламин (75 мл, 538 ммоль) загружают в колбу с навинчивающейся крышкой и нагревают до 85°C в течение 16 часов. Реакционную смесь конденсируют при пониженном давлении, полученный твердый остаток распределяют между водой и этилацетатом (3×), сушат над сульфатом магния и растворитель удаляют при пониженном давлении. К полученному твердому продукту добавляют 20% раствор этилацетата в гексанах, смесь подвергают ультразвуковой обработке, отфильтровывают и сушат, получая указанное в заголовке соединение (14,6 г, 65,2 ммоль, выход 48%). МС (ESI) m/z 224,1 [M]+, 226,1 [M+2]+.
C. 3-(4-бромфенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол. Раствор 3-(4-бромфенил)-4H-1,2,4-триазола (14,1 г, 62,9 ммоль), 3,4-дигидро-2H-пирана (10,59 ммоль) и метансульфоновой кислоты (1,19 г, 6,29 ммоль) в тетрагидрофуране (150 мл) нагревают при 75°C в течение 2 часов. Раствор концентрируют и остаток распределяют между раствором бикарбоната натрия и этилацетатом (3×), органические слои сушат над сульфатом магния, отфильтровывают и растворитель удаляют при пониженном давлении. Твердый остаток растирают с 10% этилацетатом в гексанах, получая указанное в заголовке соединение (8,1 г, 26,3 ммоль, выход 70%). МС (ESI) m/z 308,4 [M]+, 310,5 [M+2]+.
D. 4-(тетрагидро-2H-пиран-2-ил)-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4H-1,2,4-триазол. 3-(4-бромфенил)-4-(тетрагидро-2H-пиран-2-ил)-4H-1,2,4-триазол (8,1 г, 26,3 ммоль), бис(пинаколято)дибор (6,67 г, 26,3 ммоль) и ацетат калия (10,32 г, 105 ммоль) объединяют в диметилформамиде (100 мл). Полученный раствор продувают газообразным азотом в течение 2 минут. К раствору добавляют дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан (1,07 г, 1,31 ммоль), раствор нагревают до 100°C в течение 16 часов. Раствор отфильтровывают через целит и фильтрат конденсируют при пониженном давлении, получая темное масло. Масло очищают хроматографией (Biotage, 0-70% этилацетат в гексанах), получая после сушки твердый продукт. Твердый продукт растворяют в гексанах, подвергают ультразвуковой обработке, отфильтровывают и сушат, получая указанное в заголовке соединение (7,1 г, 20,0 ммоль, выход 71%). МС (ESI) m/z 356,5 [М+1]+.
5-бром-2-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин

A. (E)-5-бром-N-((диметиламино)метилен)пиколинамид. Смесь 5-бромпиколинамида (0,500 г, 2,49 ммоль) и диметилацеталя диметилформамида (20 мл) нагревают до 85°C в течение 3 часов. Реакционную смесь концентрируют и полученный продукт используют на следующей стадии без дополнительной очистки (0,604 г, выход 95%). МС (ESI) m/z 257,1 [М+1]+.
B. 5-бром-2-(1Н-1,2,4-триазол-3-ил)пиридин. Смесь (E)-5-бром-N-((диметиламино)метилен)пиколинамида (0,604 мг, 2,36 ммоль) и гидразина (2,12 г, 66,1 ммоль) перемешивают при 25°C в течение 3 часов. Реакционную смесь концентрируют и к остатку добавляют воду. Твердый осадок собирают фильтрацией и сушат в вакууме, получая указанное в заголовке соединение (0,442 г, выход 83%). МС (ESI) m/z 226,1 [М+1]+.
C. 5-бром-2-(1-(тетрагидро-2H-пиран-2-ил)-1Н-1,2,4-триазол-3-ил)пиридин. Раствор 5-бром-2-(1Н-1,2,4-триазол-3-ил)пиридина (0,342 мг, 1,52 ммоль), 3,4-дигидро-2H-пирана (0,256 г, 3,04 ммоль) и 4-метилбензолсульфоновой кислоты (0,058 г, 0,30 ммоль) в тетрагидрофуране нагревают до 75°C в течение 6 часов. Реакционную смесь концентрируют и очищают колоночной хроматографией (Biotage, 0-20% метанол в дихлорметане), получая указанное в заголовке соединение в виде масла, содержащего примеси (0,614 г, 1,9 ммоль, выход >100%). Поученный продукт используют без дополнительной очистки. МС (ESI) m/z 309,4 [M]+, 311,1 [M+2]+.
Трет-бутил-6-бром-4-метил-2-(метиламино)-1Н-бензо[d]имидазол-1-карбоксилат

A. (6-бром-4-метилбензимидазол-2-ил)-N-метиламин. К раствору 5-бром-3-метилбензол-1,2-диамина (0,150 г, 0,746 ммоль) в N,N-диметилформамиде (1,5 мл) при 0°C с перемешиванием медленно по каплям добавляют раствор изотиоцианатометана (0,055 г, 0,746 ммоль) в N,N-диметилформамиде (1,0 мл). Охлаждающую баню удаляют, реакционную смесь закрывают и перемешивают при комнатной температуре в течение 48 часов. К реакционной смеси добавляют гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,157 г, 0,821 ммоль), реакционную смесь закрывают, нагревают при 40°C в течение ночи. Полученную смесь разбавляют метанолом, отфильтровывают и очищают препаративной ВЭЖХ с обращенной фазой (10-50% ацетонитрил +0,1% ТФА в H2O +0,1% ТФА, в течение 30 минут). Фракции, содержащие целевой продукт, объединяют и большую часть растворителя удаляют при пониженном давлении. К остатку добавляют ацетонитрил и полученную смесь загружают в ионообменную колонку (Strata). Колонку промывают последовательно водой, ацетонитрилом, метанолом и 5% раствором гидроксида аммония в метаноле. Продукт элюируют 5% раствором гидроксида аммония в метаноле, концентрируют при пониженном давлении и сушат в высоком вакууме, получая указанное в заголовке соединение (0,128 г, 0,53 ммоль, выход 72%) в виде воскообразного твердого вещества бледно-желтого цвета. МС (ESI) m/z 240 [M]+, 242 [M+2]+.
B. Трет-бутил-6-бром-4-метил-2-(метиламино)-1Н- бензо[d]имидазол-1-карбоксилат. (6-бром-4-метилбензимидазол-2-ил)-N-метиламин (0,128 г, 0,533 ммоль), диизопропилэтиламин (0,464 мл, 2,67 ммоль), ди-трет-бутилдикарбонат (0,349 г, 1,599 ммоль) и N,N-диметилформамид (5 мл) загружают в круглодонную колбу объемом 100 мл, колбу закрывают и реакционную смесь перемешивают при комнатной температуре в течение 21 часа. Полученную смесь распределяют между водой и этилацетатом. Слои разделяют и органические слои промывают водой и раствором соли. Органические слои сушат над сульфатом магния, отфильтровывают, концентрируют при пониженном давлении и очищают флэш-хроматографией (10-30% этилацетат в гексанах), получая указанное в заголовке соединение (0,092 г, 0,27 ммоль, выход 51%) в виде воскообразного твердого вещеста желтого цвета. МС (ESI) m/z 340 [M]+, 342 [M+2]+.
Трет-бутил-6-бром-4-метил-2-(метиламино)-1Н-бензо[d]имидазол-1-карбоксилат

A. 7-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-бензо[d]имидазол-2-амин. 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензол-1,2-диамин (смотрите пример 1.G) (500 мг, 2,015 ммоль) и цианобромид (0,484 мл, 2,418 ммоль) загружают в круглодонную колбу при комнатной температуре, смесь суспендируют в метаноле (10,0 мл) и перемешивают в течение 1,5 часа. Летучие компоненты удаляют при пониженном давлении, после чего добавляют насыщенный раствор бикарбоната натрия. Осадок собирают фильтрацией, промывают этилацетатом и сушат при пониженном давлении, получая указанное в заголовке соединение (557 мг, 2,039 ммоль, колич. выход). Продукт используют без дополнительной очистки или идентификации. МС (ESI) m/z 273,8 [М+1]+.
Трет-бутил-6-бром-4-метил-2-(метиламино)-1Н-бензо[d]имидазол-1-карбоксилат

A. 6-бром-4-метил-1-(тетрагидро-2H-пиран-2-ил)-1Н-бензо[d]имидазол. 6-бром-4-метил-1Н-бензо[d]имидазол (1,02 г, 4,83 ммоль) при комнатной температуре с перемешиванием растворяют в тетрагидрофуране (10 мл) в атмосфере азота. К раствору добавляют 3,4-дигидро-2H-пиран (3,5 мл, 38,4 ммоль) и метансульфоновую кислоту (0,032 мл, 0,48 ммоль) и полученную смесь нагревают при 75°C в течение 49 часов. Полученную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия и раствором соли. Органические слои сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (50-100% этилацетат в гексанах), получая указанное в заголовке соединение (1,32 г, 4,47 ммоль, выход 93%) в виде твердого вещества бледно-желтого цвета. МС (ESI) m/z 295,1 [M]+, 297,3 [M+2]+.
B. 4-метил-1-(тетрагидро-2H-пиран-2-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-бензо[d]имидазол. 6-бром-4-метил-1-(тетрагидро-2H-пиран-2-ил)-1Н-бензо[d]имидазол (1,320 г, 4,47 ммоль), бис(пинаколято)дибор (1,192 г, 4,70 ммоль), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (183 мг, 0,22 ммоль), ацетат калия (1,317 г, 13,4 ммоль) и диметилсульфоксид (9 мл) загружают в круглодонную колбу и перемешивают. Воздух из колбы удаляют в вакууме и заменяют его азотом, повторяя эту операцию три раза. Полученную смесь нагревают при 90°C в атмосфере азота в течение 1,5 часа. Полученную смесь разбавляют этилацетатом и отфильтровывают через целит. Осадок на фильтре тщательно промывают этилацетатом. Фильтрат промывают дважды водой, один раз раствором соли, сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (50-100% этилацетат в гексанах), получая указанное в заголовке соединение (чистота ~90%, 1,31 г, 3,83 ммоль, выход 77%) в виде твердой пены желтого цвета. МС (ESI) m/z 343,2 [М+1]+.
5.2. ПРИМЕРЫ БИОЛОГИЧЕСКИХ ИСПЫТАНИЙ
5.2.1. Биохимический анализ
mTOR HTR-FRET анализ. Представленный пример анализа может применяться для определения ингибиторной активности испытываемых соединений в отношении mTOR. Гетероарильные соединения растворяют в ДМСО, приготавливая исходные растворы с концентрацией 10 мМ, которые во время проведения экспериментов разбавляют подходящим образом. Реагенты приготавливают следующим образом:
«простой TOR буфер» (используется для разбавления высшей глицериновой фракции TOR): 10 мM Tris, pH 7,4, 100 мМ NaCl, 0,1% Tween-20, 1 мM DTT. Invitrogen mTOR (№ по каталогу PR8683A) разбавляют в данном буфере до опытной концентрации 0,200 мкг/мл.
ATP/субстратный раствор: 0,075 мM ATP, 12,5 мM MnCl2, 50 мM Hepes, pH 7,4, 50 мМ β-GOP, 250 нM Microcystin LR, 0,25 мM ЭДТА, 5 мM DTT и 3,5 мкг/мл GST-p70S6.
Раствор обнаружения реагента: 50 мM HEPES, pH 7,4, 0,01% Triton X-100, 0,01% BSA, 0,1 мM ЭДТА, 12,7 мкг/мл Cy5-αGST Amersham (№ по каталогу PA92002V), 9 нг/мл α-фосфо p70S6 (Thr389) (Cell Signaling Mouse Monoclonal #9206L), 627 нг/мл α-мышь Lance Eu (Perkin Elmer № по каталогу AD0077).
К 20 мкл простого буфера mTOR добавляют 0,5 мкл раствора испытываемого соединения в ДМСО. Для инициирования реакции к 20 мкл простого буфера TOR (контроль) или раствора испытываемого соединения, полученного выше, добавляют 5 мкл смеси ATP/субстратный раствор. Проведение анализа останавливают через 60 минут после добавления 5 мкл 60 мM раствора ЭДТА; после этого добавляют 10 мкл раствора обнаружения реагента и смесь оставляют, по меньшей мере, на 2 часа перед считыванием на планшет-ридере Perkin-Elmer Envision Microplate Reader для обнаружения LANCE Eu TR-FRET (возбуждение при 320 нм и излучение при 495/520 нм).
PI3K альфа- и гамма-анализы. PI3K альфа- и гамма-анализы проводят в соответствии с методиками, описанными в наборе для анализа Millipore PI3K assay kit (№ по каталогу 33-017). PI3K альфа- и гамма-ферменты получают от Invitrogen (№ по каталогу PV4788 и PV4786).
Ряд гетероарильных соединений проявляют или ожидается, что проявляют, IC50 ниже 10 мкM в данном анализе, некоторые соединения проявляют значения IC50 ниже 1 мкМ, а отдельные соединения проявляют значения IC50 ниже 0,10 мкM.
DNA-PK анализ. DNA-PK анализы проводят в соответствии с методиками набора для анализа Promega DNA-PK assay kit (№ по каталогу V7870). DNA-PK фермент приобретают от Promega (Promega № по каталогу V5811).
Выбранные гетероарильные соединения в данном испытании проявляют или ожидается, что проявляют, значения IC50 ниже 10 мкМ, некоторые соединения проявляют значения IC50 ниже 1 мкМ, а отдельные соединения проявляют значения IC50 ниже 0,10 мкМ.
5.2.2. Анализы не клеточном уровне
PC-3 p-S6 и p-Akt MesoScale анализ. Представленный пример анализа может применяться для определения противораковой активности испытываемого соединения. В анализе pS6 Mesoscale используют РС-3, клеточную линию аденокарциномы предстательной железы (#CRL-1435). Клетки выращивают в среде F-12 (модификация по Kaighns), снабженной 10% телячьей сывороткой крови и 1% смеси пенициллин/стрептомицин. Используют следующие буферные растворы: цельный Tris Lysis Buffer (при применении 10 мл: 100 мкл фосфатного ингибитора I (100× исходный раствор), 100 мкл фосфатного ингибитора II (100× исходный раствор), 1 таблетка цельного Mini (не содержит ЭДТА), 40 мкл PMSF, все компоненты тщательно смешивают в течение 5 минут при комнатной температуре); 1× Tris промывной буфер (для применения 250 мл: 25 мл 10× Tris промывного буфера, 225 мл деионизированной воды, хранится при комнатной температуре); MSD блокирующий раствор-A (для применения 20 мл: 20 мл 1× Tris промывного буфера и 600 мг MSD блокатора A, хранится на льду); буфер разбавления антител (для применения 3 мл: 1 мл блокирующего раствора A, 1,82 мл 1× Tris промывной буфер, 150 мкл 2% MSD блокатора D-M, 30 мкл 10% MSD блокатора D-R, хранится на льду).
В первый день во второй половине дня клетки помещают в 96-луночные микропланшеты с плоским дном для культур клеток с плотностью 20000 клеток/лунка в 180 мкл объема. На второй день утром испытваемые соединения разбавляют до нужной концентрации и добавляют к клеткам. Клетки подвергают обработке соединением в течение 1 часа при 37°C, 5% CO2. Среду осторожно удаляют, в каждую лунку добавляют 50 мкл 1× Tris Lysis Buffer, планшеты помещают на шейкер при 4°C в течение 1 часа для лизирования клеток. 35 мкл лизата из каждой лунки используют в анализе для определения уровней p-S6 с использованием методики, описанной в руководстве для MA6000 Phospho-S6RP (Ser235/236) Whole Cell Lysate Kit #K110DFD-3. Лизат анализируют для определения уровней содержания p-Akt с использованием методики, описанной в руководстве для MA6000 Phospho-Akt (Ser4730 whole cell lysate Kit (#K111CAD-3). Планшет считывают на пларшет-ридере Sector Imager. Значения IC50 вычисляют из кривых «доза-эффект».
Гетероарильные соединения проявляют или ожидается, что проявляют IC50 ниже 10 мкМ в данном анализе, некоторые соединения проявляют значения IC50 ниже 1 мкМ, а отдельные соединения проявляют значения IC50 ниже 0,10 мкМ.
Анализы транслокации Btk-PH, Akt-PH и FoxO-EGFP. Представленный пример анализа может применяться для определения противораковой активности испытываемого соединения. Клетки BTK-PH_CHO (Bioimage C007A) выращивают в среде Nut.MixF-12-Ham, снабженной 10% телячьей сывороткой крови, 1% смеси пенициллин/стрептомицин, 0,5 мг/мл Geneticin и 0,25% ДМСО. Клетки помещают при плотности 12000 клеток на лунку в 96-луточный микропланшет с черными прозрачными стенками. Клетки инкубируют в течение 24 часов, затем промывают буфером для промывки клеток и выдерживают в течение 1 часа в буфере для промывки клеток. После этого клетки обрабатывают контролем/испытываемыми соединениями и IGF-1 (инсулиноподобным фактором роста-1) в течение 4 минут при комнатной температуре. После этого клетки фиксируют, промывают и окрашивают Hoescht в PBS, содержащей 0,5% Triton X-100. Планшеты герметично закрывают и через 30 минут считывают на Cellomics. Клетки Akt-PH_CHO (Bioimage C006A) выращивают в такой же среде, что и клетки BTK-PH_CHO. Клетки помещают с плотностью 10000 клеток на лунку в 96-луночный микропланшет с черным прозрачным дном. Остальная часть методики анализа аналогична методики анализа Btk-PH (как описано выше). Клеточные линии U-2 OS, стабильно трансфицированные компонентом FoxO-EGFP, получают от Gary Chiang, Burnham Institute, La Jolla. Клетки выращивают в DMEM, снабженной 10% телячьей сывороткой крови и 1% смесью пенициллин/стрептомици. Клетки помещают с плотностью 20000 клеток на лунку в 96-луночный микропланшет с черным прозрачным дном. Клетки выдерживают в указанных условиях в течение ночи, после чего обрабатывают контролем/испытываемыми соединениями и инкубируют в течение 2 часов. Клетки фиксируют, промывают и окрашивают с помощью Hoescht. После этого планшеты промывают три раза PBS и затем 100 мкл PBS добавляют в каждую лунку. Далее планшет закрывают прозрачным покровным стеклом. Планшет считывают на Cellomics и значения IC50 вычисляют в сравнении с Wortmannin.
Выбранные гетероарильные соединения проявляют или ожидается, что проявляют, IC50 ниже 30 мкМ в данном анализе, некоторые соединения проявляют значения IC50 ниже 1 мкМ, а отдельные соединения проявляют значения IC50 ниже 0,10 мкМ.
Анализ клеточной пролиферации. Представленный далее пример анализа может применяться для определения противораковой активности испытываемого соединения. Данной анализ применяется для количественного определения клеточной пролиферации на основе определения метаболической активности посредством восстановления солей тетразолия до формазанов. WST-1 (Roche № по каталогу 11644807001) используется для количественного определения пролиферации клеток PC-3. Клетки PC-3 помещают 180 мкл ростовой среды (F-12, модифицированная по Kaighns, снабженная 10% телячьей сывороткой крови и 1% смесью пинициллин/стрептомицин) с плотностью 3000 клеток на лунку. Клетки в микропланшетах инкубируют в течение ночи в 5% CO2 при 37°C. Соединения разбавляют в ДМСО от 10 мM исходного раствора и затем в среде F-12, модифицированной по Kaighns. 20 мл разбавления соединений, включающие контроль ДМСО, добавляют к клеткам в 96-луночном микропланшете. Клетки инкубируют с соединением в течение 3 дней в 5% CO2 при 37°C. 20 мкл WST-1 добавляют в каждую лунку. Планшеты инкубируют в течение двух часов в 5% CO2 при 37°C. Планшеты считывают на планшет-ридере Victor 2 (Perkin Elmer) при 450 нм. Значения IC50 вычисляют по сравнению с контролем ДМСО.
Гетероарильные соединения проявляют или ожидается, что проявляют, IC50 ниже 30 мкM в данном анализе, некоторые соединения проявляют значения IC50 ниже 1 мкM, а отдельные соединения проявляют значения IC50 ниже 0,10 мкM.
IL-2 воспалительный анализ. Далее представлен пример анализа, который может применяться для определения противовоспалительной активности испытываемого соединения. IL-2 продуцирование из стимулированных первичных T-клеток анализируют с использованием IL-2 набора от Mesoscale (MA6000#L41AHB-1). Первичные T-клетки человека предварительно обрабатывают соединением в течение 30 минут и затем стимулируют гранулами anti-human CD3 и anti CD28 в течение 24 часов. После обработки клеток среду собирают. 25 мкл образца или калибровочного стандарта добавляют на планшет IL-2 cytokine Mesoscale Assay. Среду инкубируют в течение 1-2 часов со встряхиванием при комнатной температуре. Планшеты промывают три раза 1× PBS. 150 мкл 2× MSD буфера считывания Т клеток добавляют в каждую ячейку и планшет анализируют на планщет-ридере Mesoscale Discovery Sector Imager.
Гетероарильные соединения в данном анализе проявляют или ожидается, что проявляют, IC50 ниже 30 мкМ, некоторые соединения проявляют значения IC50 ниже 1 мкМ, а отдельные соединения проявляют значения IC50 ниже 0,10 мкМ.
5.2.3. Модели испытания in vivo
Модель повышенной чувствительности замедленного типа (delayed-type hypersensitivity - DTH). В 0 день мышей CD-1 активируют с использованием 3% оксазолона, нанося краску на бритую брюшную полость (сенсибилизация). На 5 день на правое ухо наносят 1% оксазолон, на левое ухо наносят разбавитель (ацетон:оливковое масло) (контроль). Обработку соединениями начинают за день до стадии выявления реакции 1% оксазолона. Соединения вводят перорально, интраперитонеально или внутривенно, используя одноразовое или двухразовое введение в сутки в течение исследования. На 6 день (через 24 часа после выявления) правое ухо необработанных животных показывает красноту (эритему) и припухлость (отек). Уши животных, обработанных соединениями, обследуют через 24, 48 и 72 часа после выявления. Различия между толщиной правого и левого уха, показывающее развитие DTH, определяют с помощью микрокаверномера.
В данной модели гетероарильные соединения проявляют или ожидается, что проявляют, ED50<100 мг/кг, некоторые соединения проявляют ED50<10 мг/кг, а отдельные соединения проявляют ED50<1 мг/кг.
Ксенотрансплантационная модель рака. Клеточные линии рака человека вводят инъекцией мышам с SCID (severe combined immunodeficiency - тяжелый комбинированный синдром иммунодефицита). Используя клетки, находящиеся in vitro, генерирование опухоли проводят инъекцией мышам точно определенных количеств клеток. Фрагменты опухолей от мышей-доноров, которые наилучшим образом репродуцируются in vivo, имплантируют небольшому количеству мышей для сохранения или большему количесту мышей для инициирования исследования. Типичная методика исследования эффективности включает введение одного или нескольких соединений онкологическим мышам. Кроме того, контрольные химиотерапевтические средства (положительный контроль) и отрицательные контрольные препараты аналогично вводятся и хранятся. Способы введения могут включать подкожный (SC), интраперитонеальный (IP), внутривенный (IV), внутримышечный (IM) и пероральный (PO). В процессе исследования проводят измерения размеров опухолей и масс тела и фиксируют заболеваемость и смертность животных. Для лучшего исследования течения болезни и действия лекарственных средств могут также проводиться аутопсия, гистопатология, бактериология, паразитология, серология и ПЦР.
Типичными клеточными линиями рака человека, которые используются или могут использоваться в ксенотрансплантационных моделях, являются: клеточные линии MDA MB-231, MCF7, MDA-MB-435 и T-47D для рака молочной железы; клеточные линии KM 12, HCT-15, COLO 205, HCT 116 и HT29 для рака ободочной кишки; клеточные линии NCI-H460 и A549 для рака легких; клеточные линии CRW22, LNCAP, PC-3 и DU-145 для рака предстательной железы; клеточные линии LOX-IMVI и A375 для меланомы; клеточные линии SK-O V-3 и A2780 для рака яичника; клеточные линии CAKI-I, A498 и SN12C для рака почек; и клеточная линия U-87MG для глиомы.
Таким образом, SCID мышам вводят соединения в дозах, например, от 100 мг/кг до 0,1 мг/кг с различными графиками приема доз, включая, но без ограничения, раз в день, два раза в день, три раза в день, пять раз в день и др. Соединения вводят в препарат, например, в смесь 0,5% CMC/0,25% Tween, и препарат вводят перорально. Мышам вводят дозы в течение 21 дня и каждые три дня проводят измерения объемов опухолей. Примеры ксенотрансплантатных моделей включают модели PC-3, HCT-116, A549, MDA MB-231 и U-87MG.
В данной модели гетероарильные соединения проявляют или ожидается, что проявляют ED50<100 мг/кг, некоторые соединения проявляют ED50<10 мг/кг, а отдельные соединения проявляют ED50<1 мг/кг.
5.3. АКТИВНОСТЬ ГЕТЕРОАРИЛЬНЫХ СОЕДИНЕНИЙ
Каждое из соединений, представленных в таблице 1, испытывают в анализе mTOR HTR-FRET и, как было установлено, указанные соединения проявляют активность, причем все соединения показывают значения IC50 менее 10 мкМ, некоторые соединения показывают значения IC50 в интервале от 0,005 нМ до 250 нМ (уровень активности D), другие соединения показывают значения IC50 в интервале от 250 нМ до 500 нМ (уровень активности С), некоторые другие показывают значения IC50 в интервале от 500 нМ до 1 мкМ (уровень активности В), а остальные показывают значения IC50 в интервале от 1 мкМ до 10 мкМ (уровень активности А).
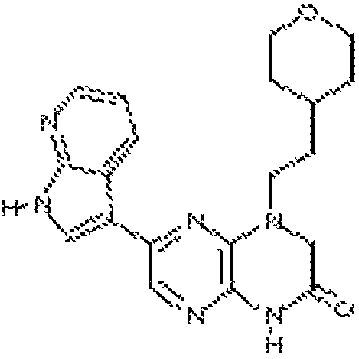







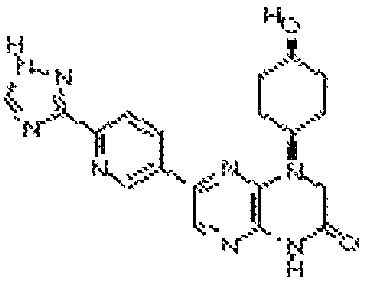
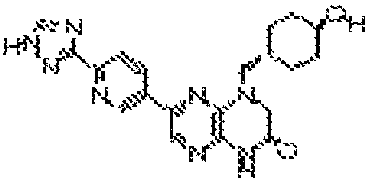



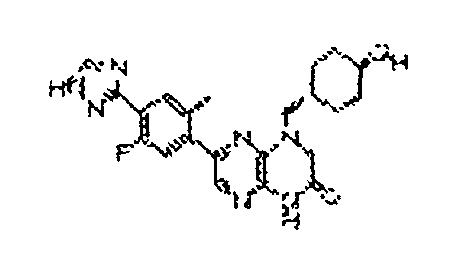

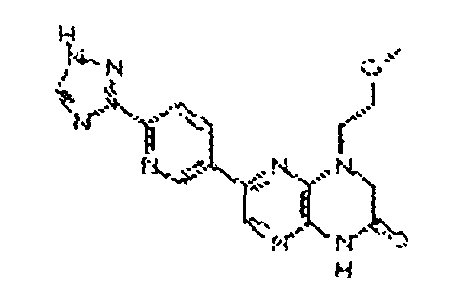


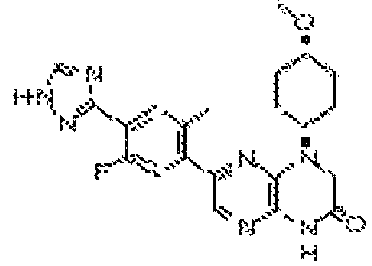
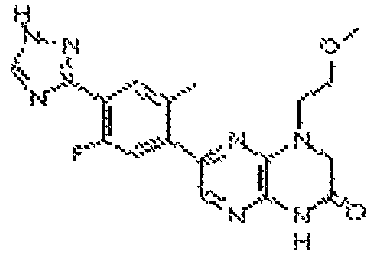
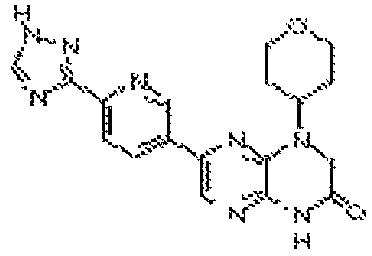
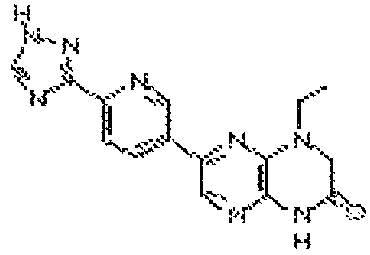

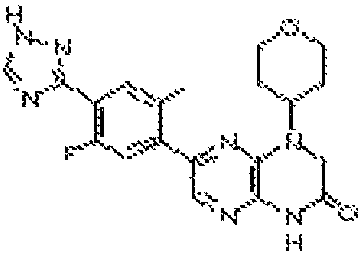

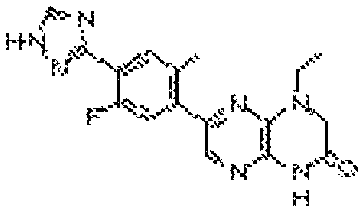

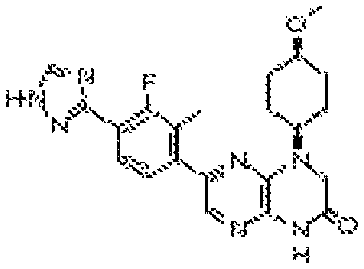

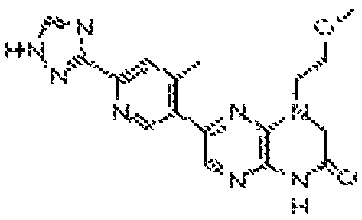



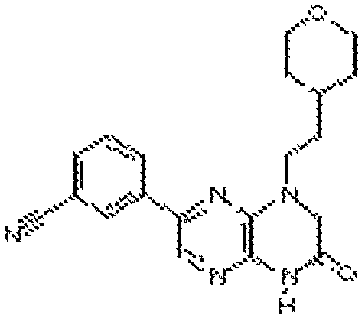
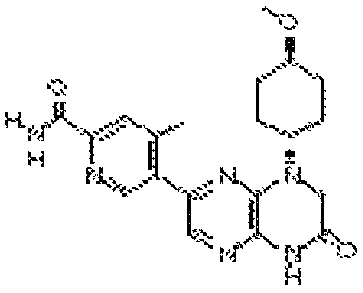
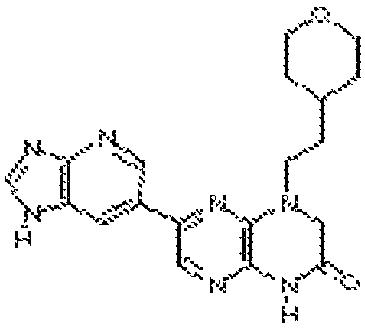

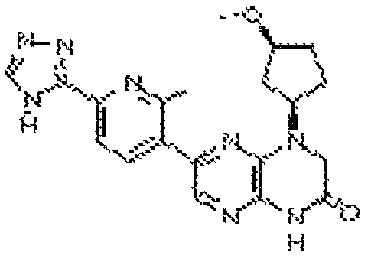

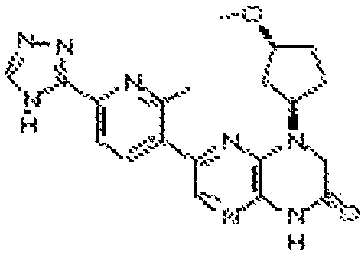

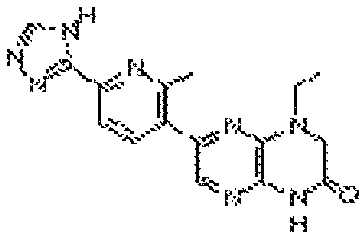
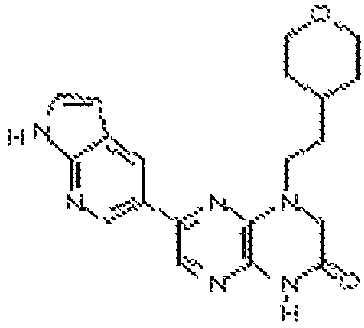

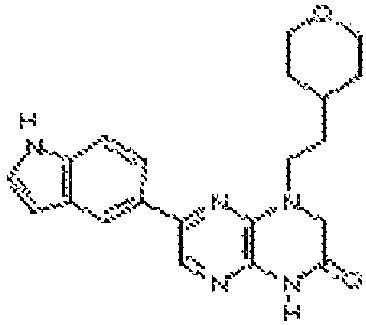
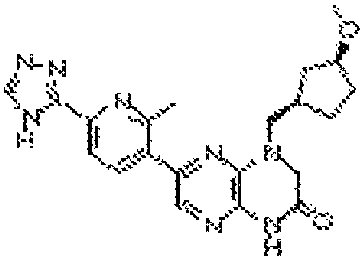
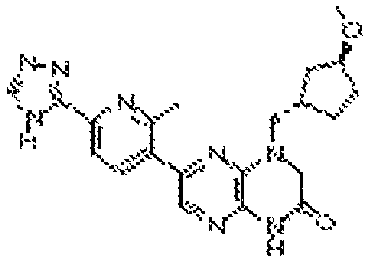
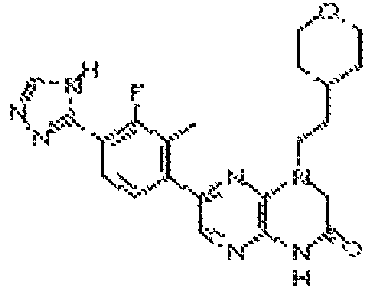

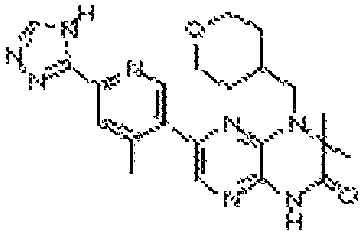

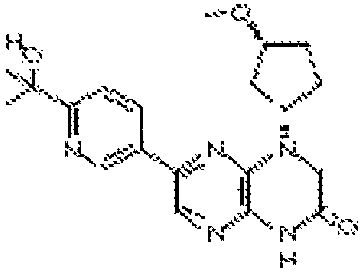


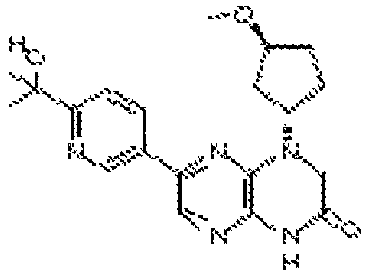





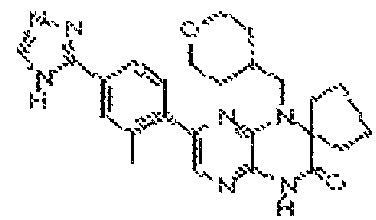



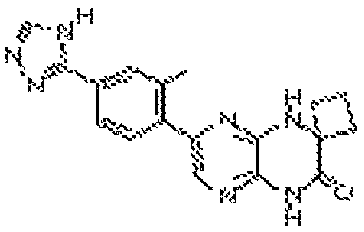
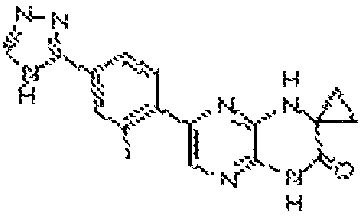

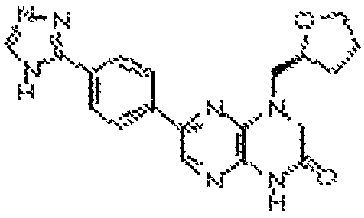
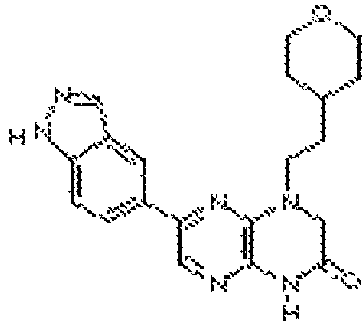



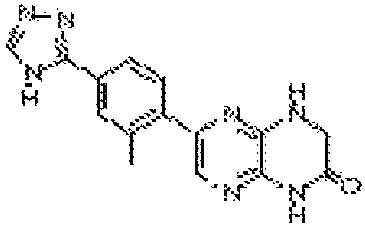
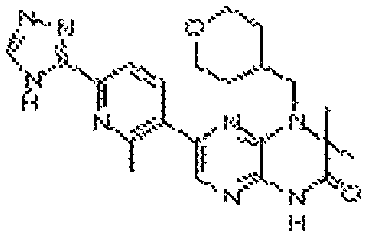
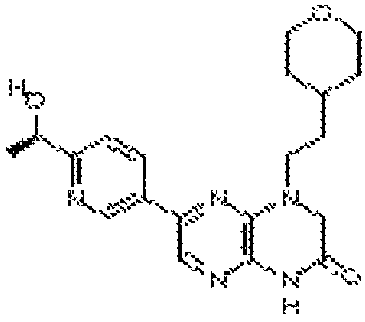
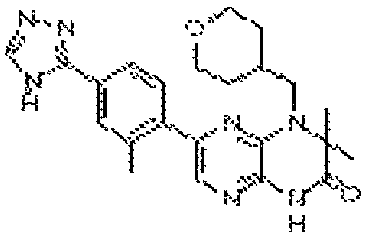
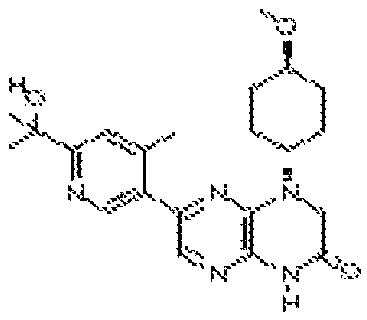

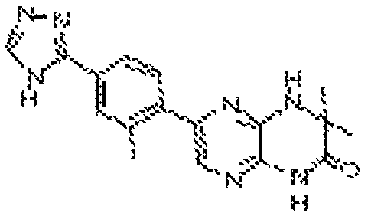

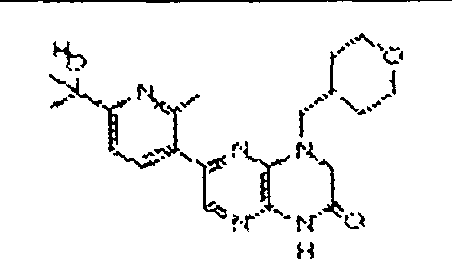

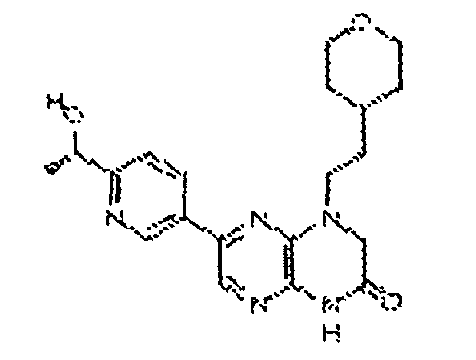


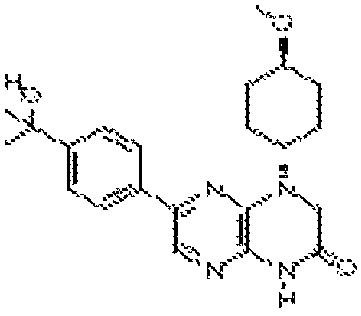
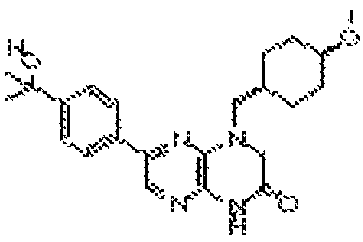
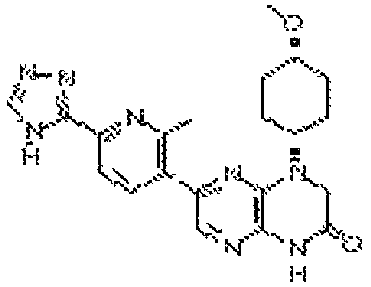
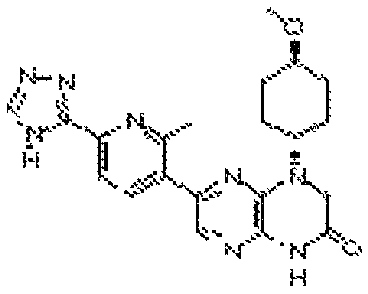
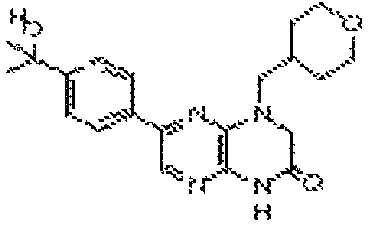

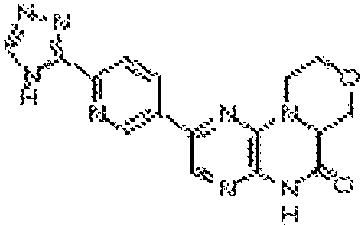
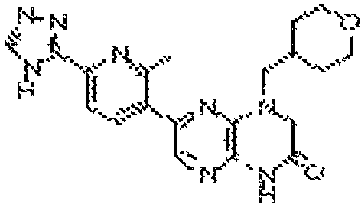

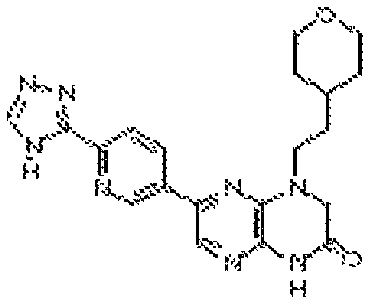



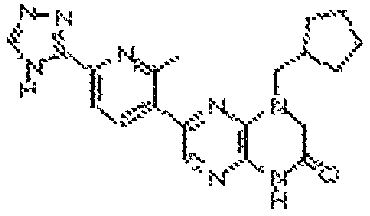
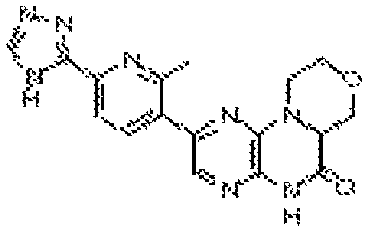
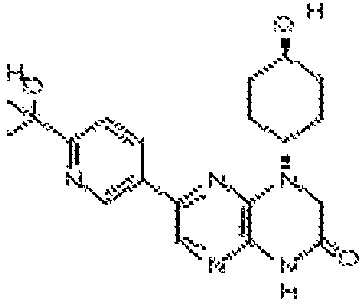
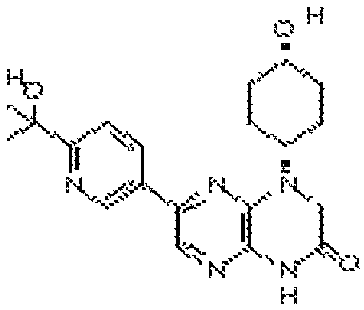
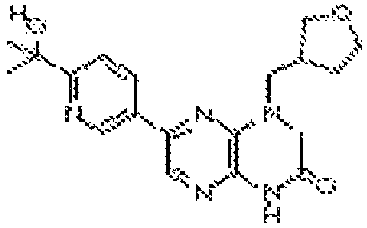
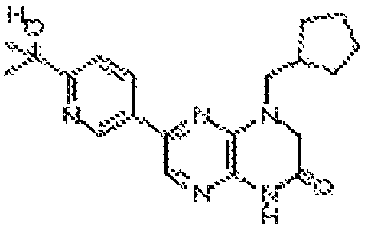
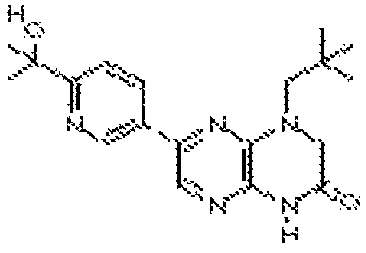
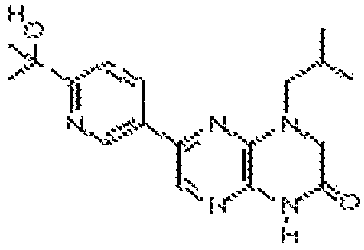
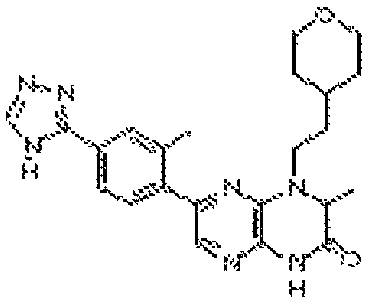
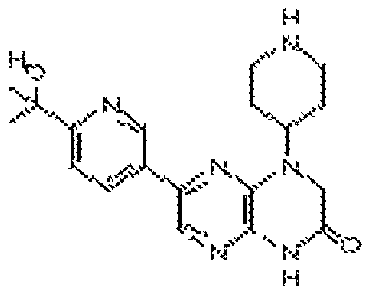






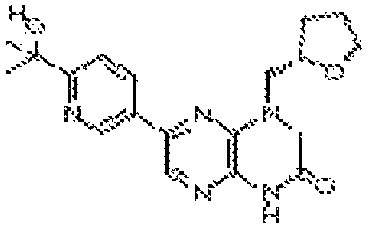
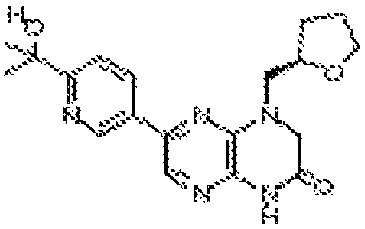






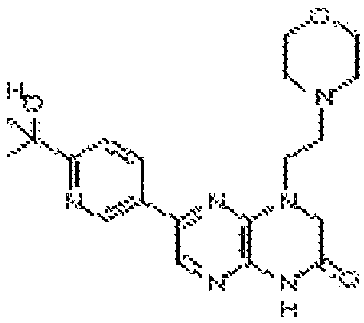
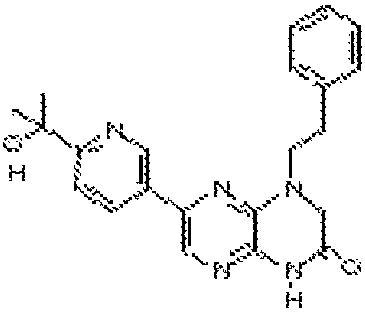







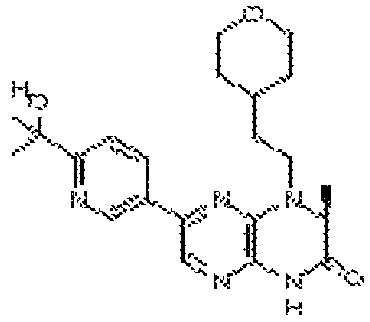
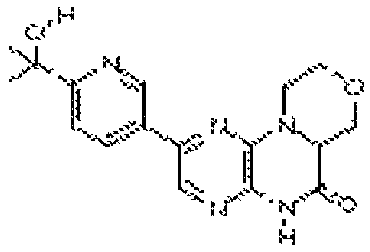

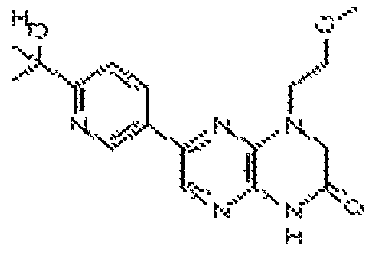
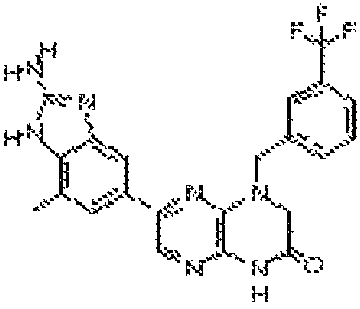




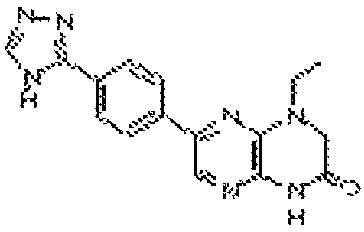



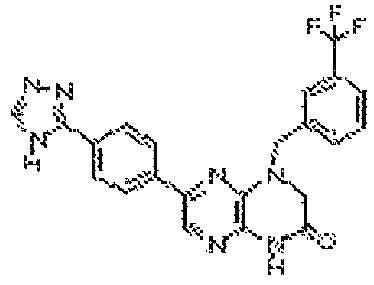






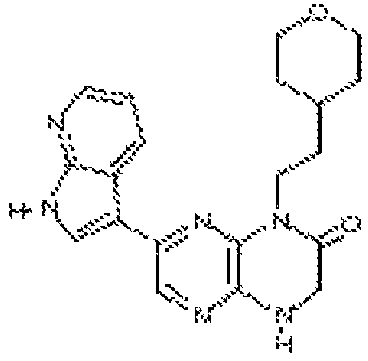

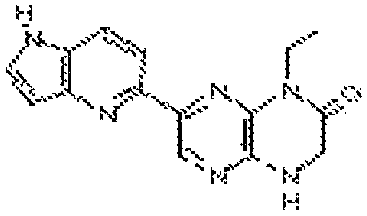


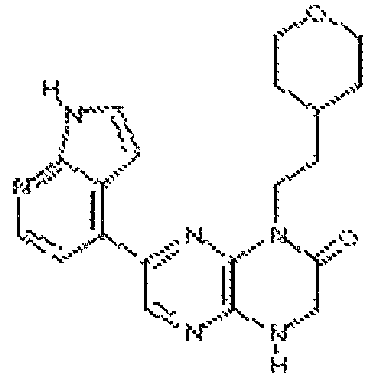



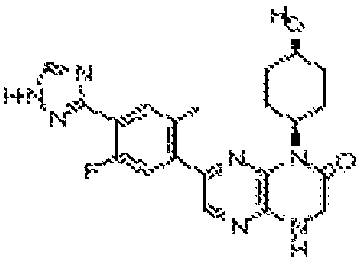


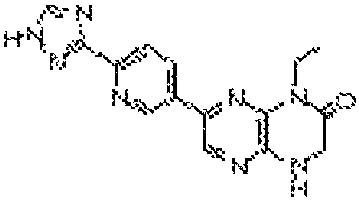




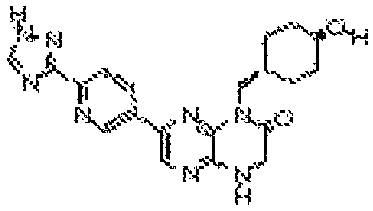

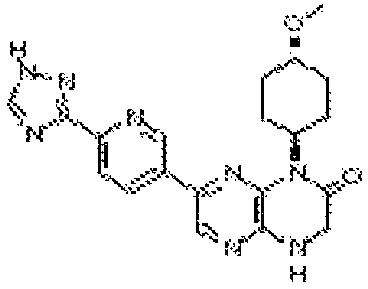
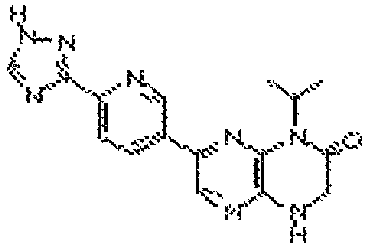

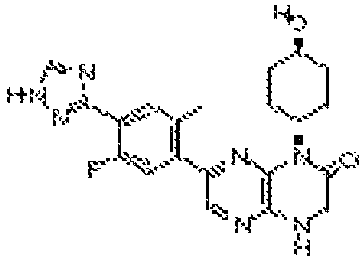

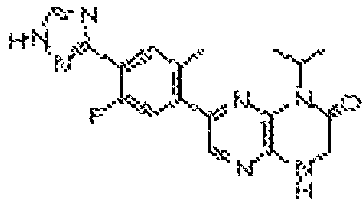


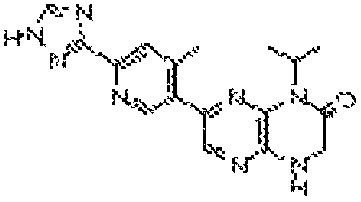
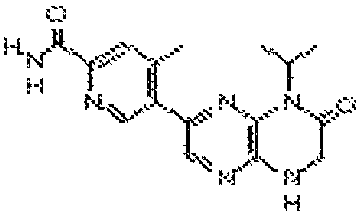
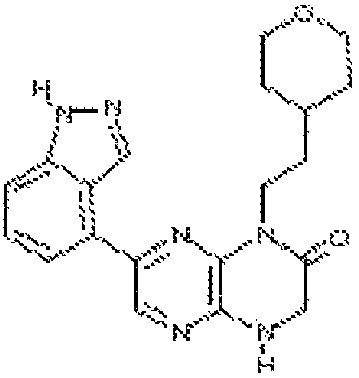
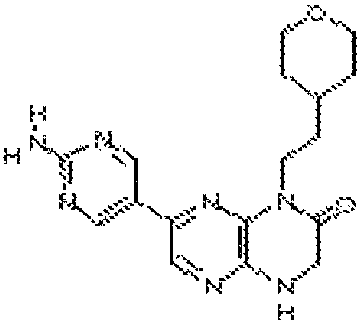
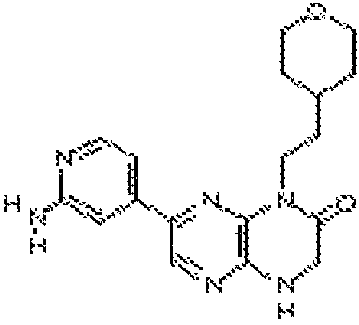
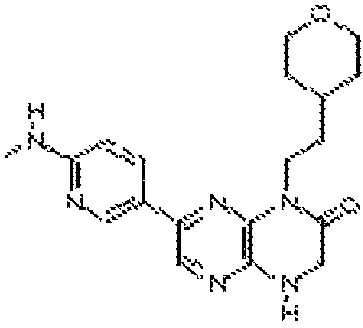
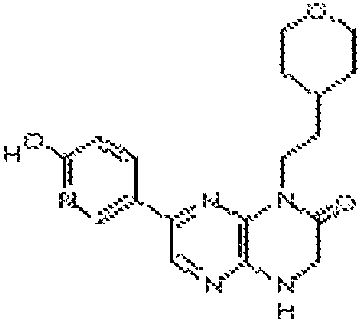
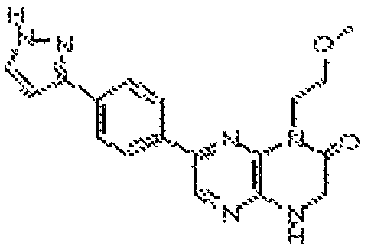
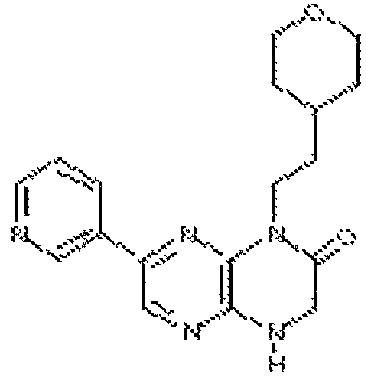

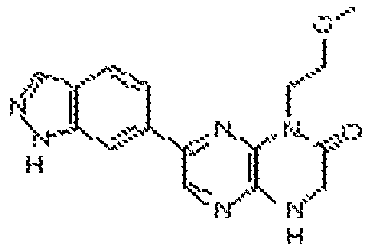
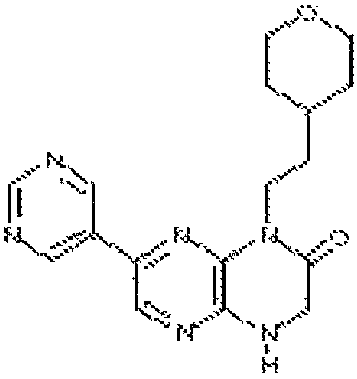
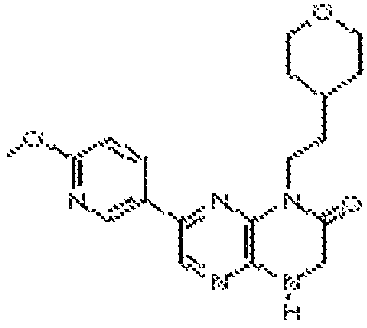

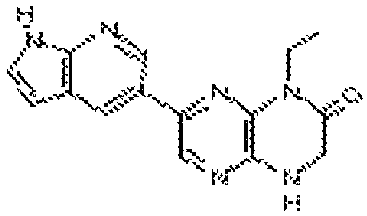
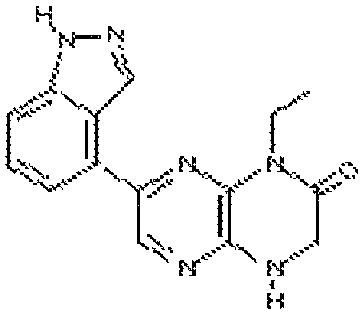
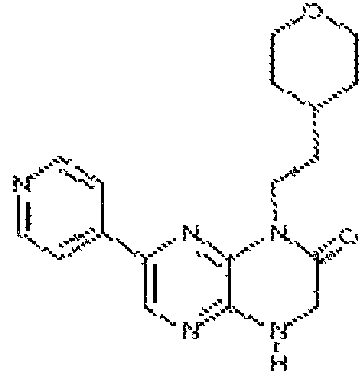


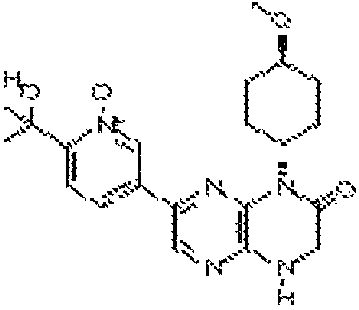
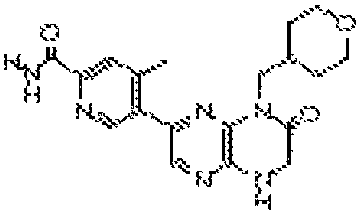

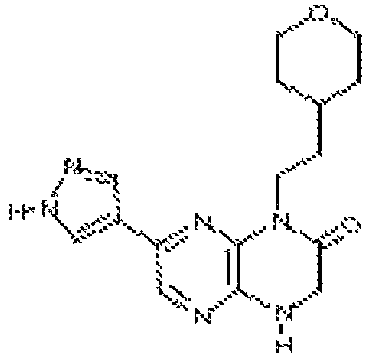

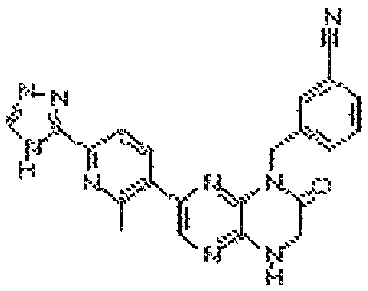
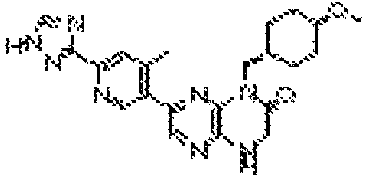

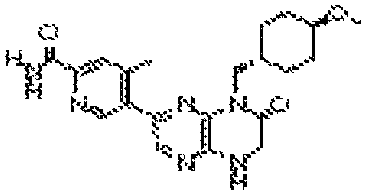

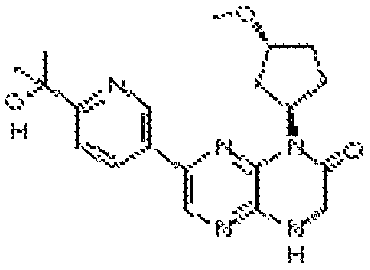
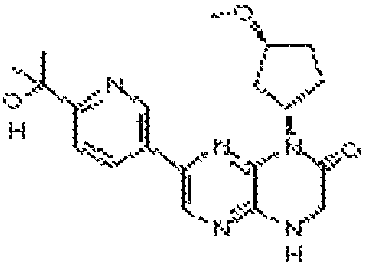

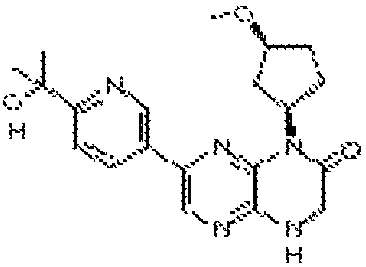
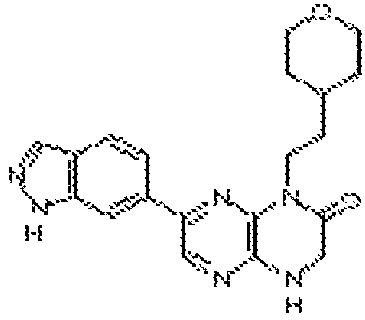
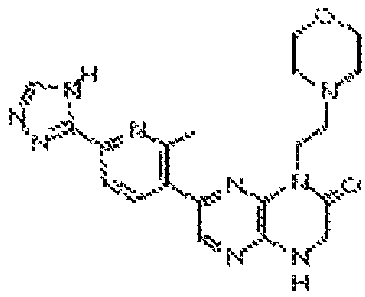


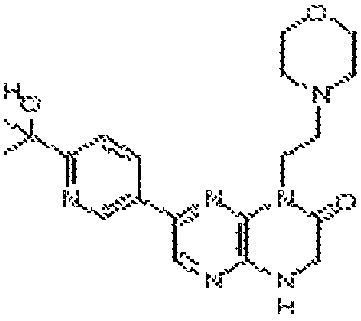

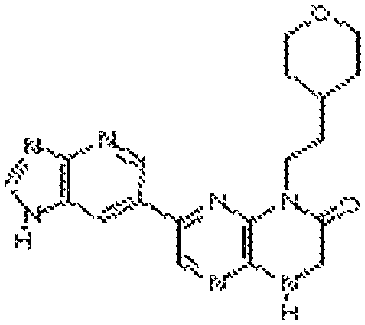
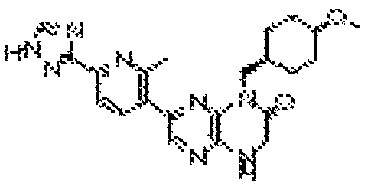
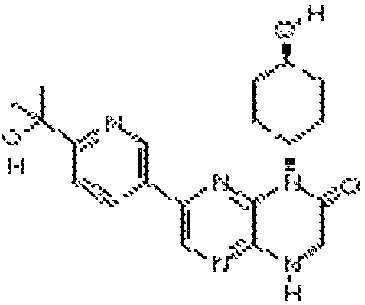


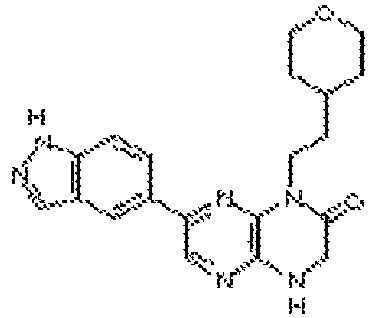

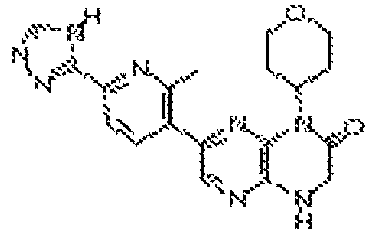
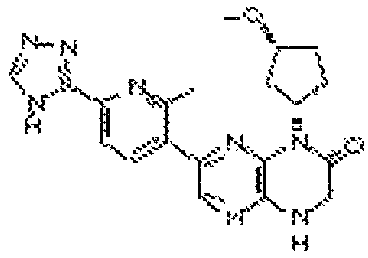
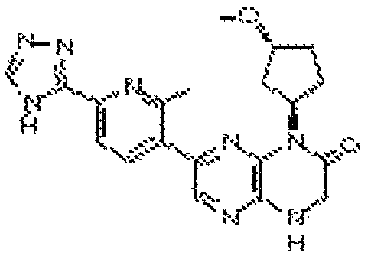
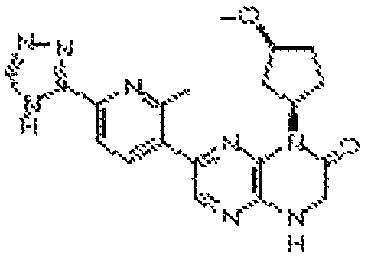

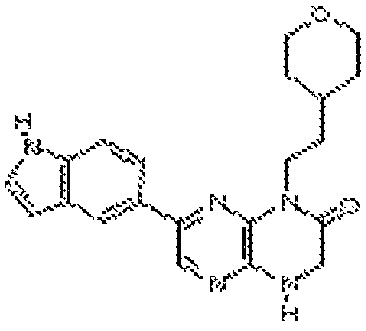

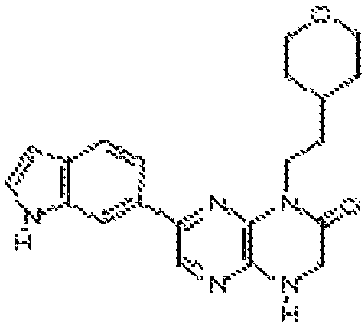
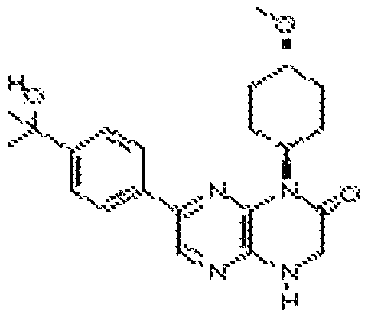
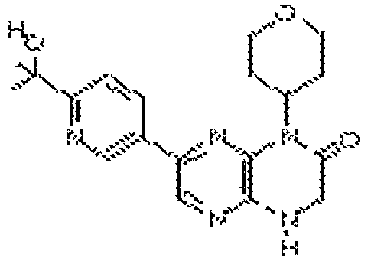
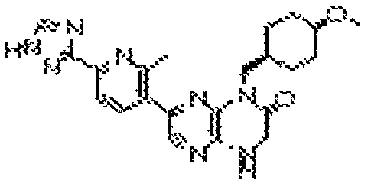





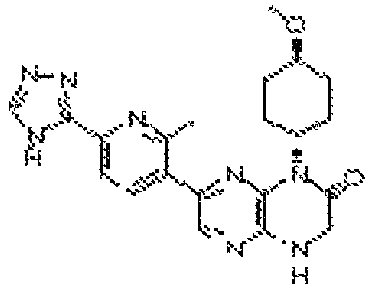


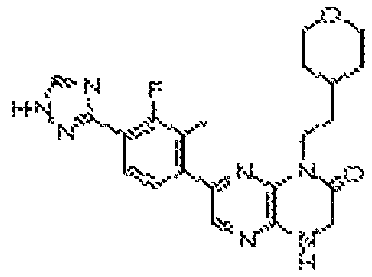


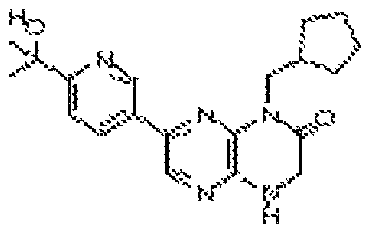

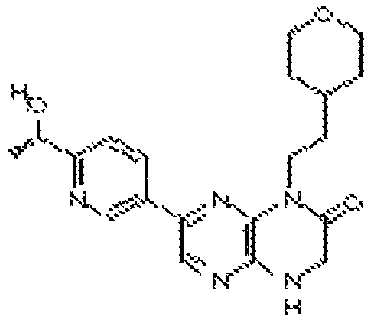


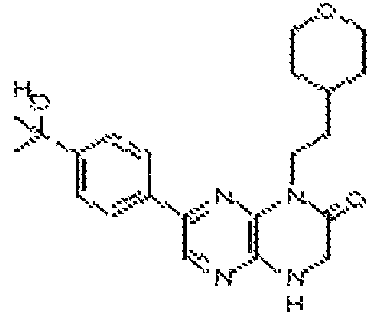


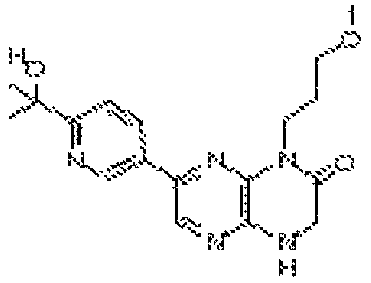
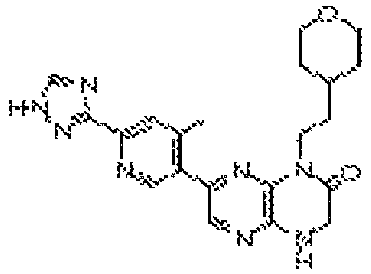
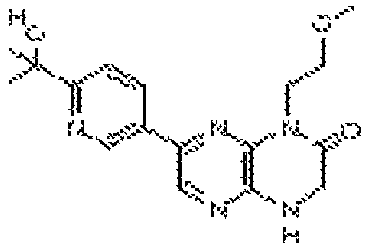
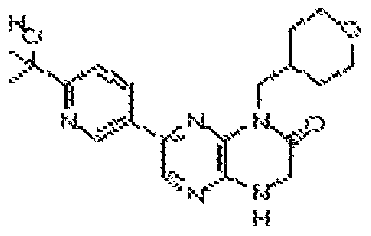




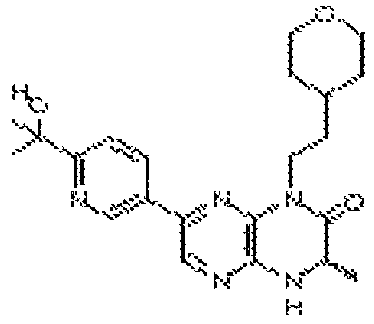
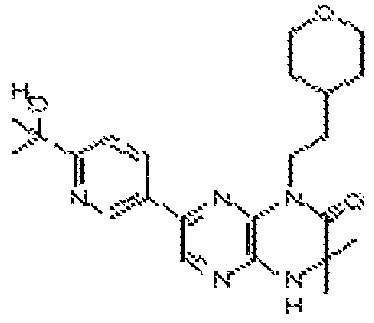
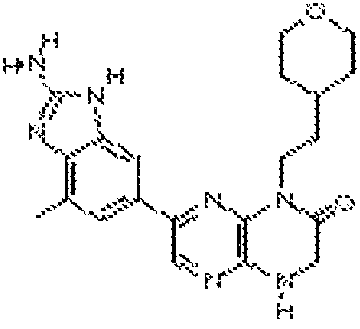
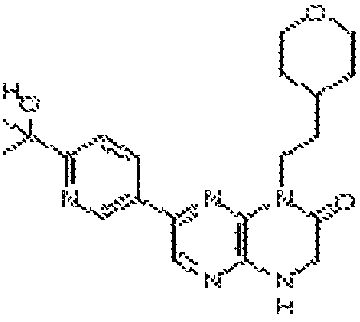

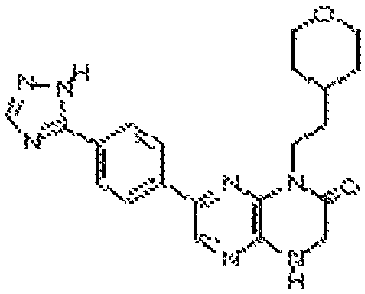
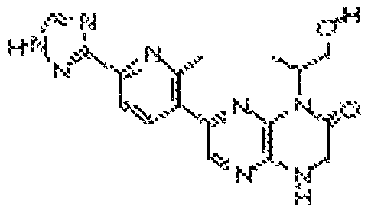

Варианты осуществления изобретения, раскрытые в описании, не ограничиваются специфическими вариантами, представленными в примерах, которые предназначены только для иллюстрации некоторых аспектов раскрытых в описании вариантов осущетвления изобретения, и любые варианты осуществления изобретения, которые являются функционально эквивалентными им, включены в область настоящего изобретения. В самом деле, различные модификации вариантов осуществления изобретения, раскрытые в описании, в дополнение к вариантам, показанным и раскрытым в описании, будут понятны специалисту в данной области техники и, как подразумевается, охватываются областью прилагаемой формулы изобретения.
Содержание ряда публикаций, которые были цитированы в описании, включено в описание во всей полноте в виде ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ mTOR КИНАЗЫ ДЛЯ ОНКОЛОГИЧЕСКИХ ПОКАЗАНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С mTOR/PI3K/AKT ПУТЕМ МЕТАБОЛИЗМА | 2009 |
|
RU2692796C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ И ОЧИСТКИ ГЕТЕРОАРИЛЬНЫХ СОЕДИНЕНИЙ | 2010 |
|
RU2557242C2 |
| БИОМАРКЕРНЫЙ АНАЛИЗ ДЛЯ ДЕТЕКТИРОВАНИЯ ИЛИ ИЗМЕРЕНИЯ ИНГИБИРОВАНИЯ АКТИВНОСТИ TOR-КИНАЗЫ | 2011 |
|
RU2587040C2 |
| ИДЕНТИФИКАЦИЯ МУТАЦИИ LKB1 В КАЧЕСТВЕ ПРОГНОСТИЧЕСКОГО БИОМАРКЕРА ЧУВСТВИТЕЛЬНОСТИ К ИНГИБИТОРАМ TOR-КИНАЗЫ | 2011 |
|
RU2565034C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| СОЕДИНЕНИЯ ИМИДАЗОТРИАЗИНОНА | 2011 |
|
RU2603140C2 |
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
| СПИРОЦИКЛИЧЕСКИЕ АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ | 2007 |
|
RU2468028C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2010 |
|
RU2579513C2 |
Изобретение относится к соединениям формулы (I) и (II), фармацевтической композиции на их основе и способу лечения или предупреждения рака, иммунологических состояний, диабета, ожирения, неврологических расстройств и возрастных заболеваний, способу ингибирования mTOR киназы в клетке, способу лечения или предупреждения состояния, которое можно лечить или предупреждать ингибированием mTOR киназного метаболического пути. В общих формулах R1 представляет собой замещенный фенил, замещенный или незамещенный гетероциклил, который представляет собой ароматический циклоалкил, содержащий от 6 до 10 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N, где указанные выше заместители выбраны из C1-8алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила; R2 представляет собой Н, замещенный или незамещенный C1-8алкил, замещенный C3-6циклоалкил, незамещенный гетероциклил, который представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N или О; незамещенный гетероциклилалкил, где гетероциклил представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N и О; замещенный или незамещенный фенилалкил или замещенный или незамещенный С3-6циклоалкилалкил, где указанные заместители выбирают из C1-4алкила, CF3, OR и NR2, где R представляет собой Н или C1-4алкил; R3 и R4, каждый независимо представляет собой Н, незамещенный C1-8 алкил, или R3 и R4 вместе с атомом, к которому они присоединены, образуют C3-6циклоалкил; или R2 и один из R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероциклил, содержащий от 5 до 6 атомов в цикле и который может содержать дополнительный гетероатом, выбранный из О; где заместители выбирают из -С(О)CH2OCH3, -CH2CH2OCH3, ОСН3 или СН3. 6 н. и 47 з.п. ф-лы, 1 табл., 20 пр.
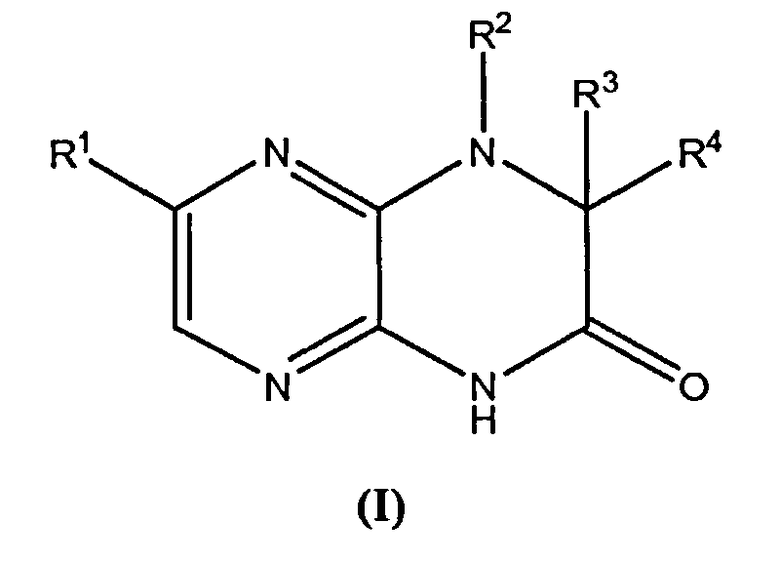

1. Соединение формулы (I)

или его фармацевтически приемлемая соль, таутомер или стереоизомер, где
R1 представляет собой замещенный фенил, замещенный или незамещенный гетероциклил, который представляет собой ароматический циклоалкил, содержащий от 6 до 10 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N, где указанные выше заместители выбраны из C1-8алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила;
R2 представляет собой Н, замещенный или незамещенный C1-8алкил, замещенный C3-6циклоалкил, незамещенный гетероциклил, который представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N или О; незамещенный гетероциклилалкил, где гетероциклил представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N и О; замещенный или незамещенный фенилалкил или замещенный или незамещенный С3-6циклоалкилалкил, где указанные заместители выбирают из C1-4алкила, CF3, OR и NR2, где R представляет собой Н или C1-4алкил;
R3 и R4, каждый независимо представляет собой Н, незамещенный C1-8 алкил, или R3 и R4 вместе с атомом, к которому они присоединены, образуют C3-6циклоалкил;
или R2 и один из R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероциклил, содержащий от 5 до 6 атомов в цикле и который может содержать дополнительный гетероатом, выбранный из О;
где заместители выбирают из -С(О)CH2OCH3, -CH2CH2OCH3, ОСН3 или СН3;
при условии, что соединение не является 6-(4-гидроксифенил)-4- (3-метоксибензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-оном, 6-(4-(1H-1,2,4-триазол-5-ил)фенил)-3-(циклогексилметил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-оном или (R)-6-(4-(1Н-1,2,4-триазол-5-ил)фенил)-3-(циклогексилметил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-оном.
2. Соединение по п.1, где R1 представляет собой замещенный фенил или группу, выбранную из замещенных или незамещенных пиридила, пиримидила, бензимидазолила, индолила, индазолила, 1Н-пирроло [2,3-b]пиридила, 1H-имидазо [4,5-b] пиридила, 1Н-имидазо [4,5-b] пиридин-2(3Н)-онила, 3Н-имидазо [4,5-b] пиридила или пиразолила, где указанные выше заместители выбраны из C1-8 алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила.
3. Соединение по п.2, где R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, триазолил, галоген, аминокарбонил, циано и гидроксиалкил.
4. Соединение по п.3, где заместитель представляет собой триазолил.
5. Соединение по п.2, где R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, триазолил, галоген, аминокарбонил, циано и гидроксиалкил.
6. Соединение по п.5, где заместитель представляет собой триазолил.
7. Соединение по п.2, где R1 представляет собой 1Н-пирроло[2,3-b]пиридил или бензимидазолил, каждый из которых необязательно замещен одним или несколькими заместителями, представляющими собой C1-8 алкил.
8. Соединение по п.1, где R1 представляет собой
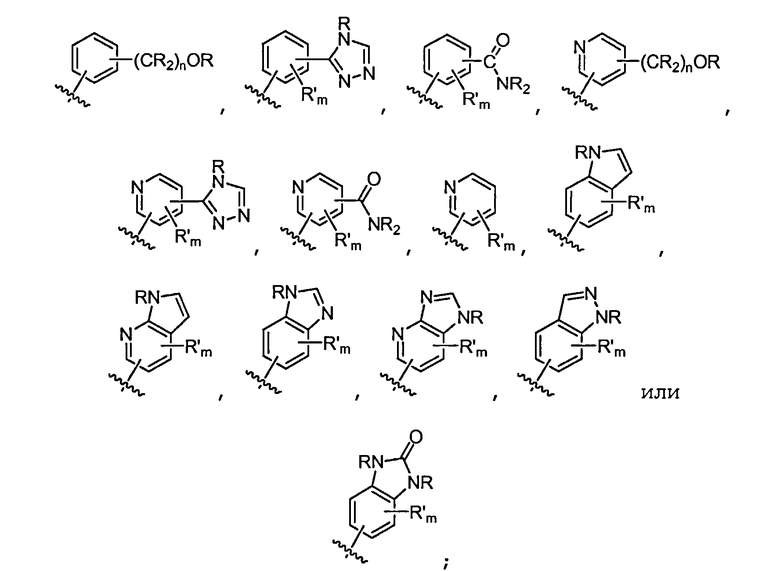
где R в каждом случае представляет собой Н; R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил, галоген или циано; m равно 0-3; и n равно 0-3.
9. Соединение по п.1, где R1 представляет собой
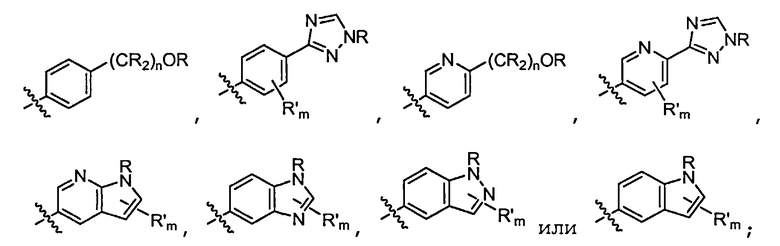
где R в каждом случае представляет собой Н; R' в каждом случае независимо представляет собой замещенный или незамещенный C1-4 алкил, галоген или циано; m равно 0-3; и n равно 0-3.
10. Соединение по п.1, где R2 представляет собой Н, замещенный или незамещенный C1-8 алкил, замещенный или незамещенный C3-6 циклоалкил, незамещенный гетероциклил, который представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N или О; незамещенный C1-4 алкилгетероциклил, где гетероциклил представляет собой неароматический циклоалкил, содержащий от 5 до 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N и О; замещенный или незамещенный фенилалкил или замещенный или незамещенный C3-6 циклоалкилалкил, где указанные заместители выбирают из C1-4алкила, CF3, OR и NR2, где R представляет собой Н или С1-4алкил.
11. Соединение по п.10, где R2 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, (C1-4 алкил)фенил, (C1-4 алкил) циклопропил, (C1-4 алкил) цикле бутил, (C1-4 алкил) циклопентил, (C1-4 алкил) циклогексил, (C1-4 алкил)пирролидил, (C1-4 алкил) пиперидил, (C1-4 алкил) пиперазинил, (C1-4 алкил)морфолинил, (C1-4 алкил) тетрагидрофуранил или (C1-4 алкил)тетрагидропиранил.
12. Соединение по п.10, где R2 представляет собой Н, C1-4 алкил, (C1-4 алкил) (OR),

где R в каждом случае независимо представляет собой Н или C1-4 алкил; R' в каждом случае независимо представляет собой Н, -OR или C1-4 алкил; и р равно 0-3.
13. Соединение по п.10, где R2 представляет собой Н, C1-4 алкил, (C1-4 алкил) (OR),
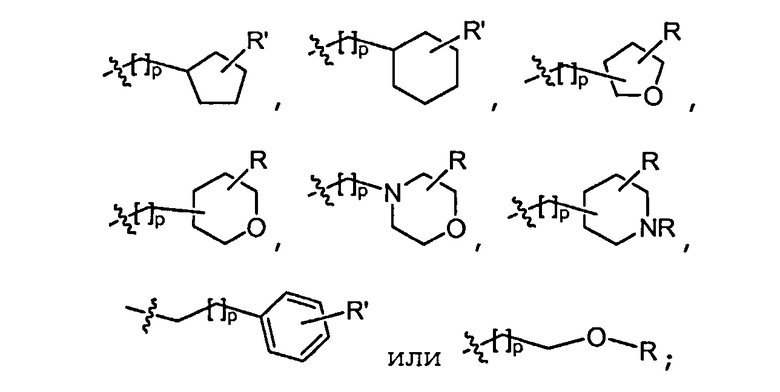
где R в каждом случае независимо представляет собой Н или C1-2 алкил; R' в каждом случае независимо представляет собой Н или C1-2 алкил; и р равно 0-1.
14. Соединение по п.1, где R2 и один из R3 и R4 вместе с атомами, к которым они присоединены, образуют замещенный или незамещенный гетероциклил, содержащий от 5 до 6 атомов в цикле и который может содержать дополнительный гетероатом, выбранный из О, где заместители выбирают из -С (О) СН2ОСН3, -СН2СН2ОСН3, ОСН3 или СН3.
15. Соединение по п.14, где соединение формулы (I) представляет собой

где R в каждом случае независимо представляет собой Н или C1-4 алкил; и R" представляет собой Н, OR или C1-4 алкил.
16. Соединение по п.1, где R3 и R4, оба представляют собой Н.
17. Соединение по п.1, где один из R3 и R4 представляет собой Н, а другой не является Н.
18. Соединение по п.1, где один из R3 и R4 представляет собой C1-4 алкил, а другой представляет собой Н.
19. Соединение по п.1, где R3 и R4, оба представляют собой C1-4 алкил.
20. Соединение по п.1, где R3 и R4 вместе с атомом, к которому они присоединены, образуют циклоалкил, выбранный из циклопропила, циклобутила, циклопентила или циклогексила.
21. Соединение по п.20, где R1 представляет собой замещенный фенил или группу выбранную из пиридила, пиримидила, бензимидазолила, индолила, индазолила, 1H-пирроло[2,3-b]пиридила, 1H-имидазо[4,5-b]пиридила, 1H-имидазо[4,5-b]пиридин-2(3H)-онила, 3H-имидазо[4,5-b]пиридила или пиразолила, каждый из которых необязательно замещен, где указанные выше заместители выбраны из C1-8 алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила.
22. Соединение по п.21, где R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей замещенный или незамещенный C1-8 алкил, триазолил, галоген, аминокарбонил, циано и гидроксиалкил.
23. Соединение по п. 21, где R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей циано, C1-8 алкил, триазолил, гидроксиалкил, галоген и аминокарбонил.
24. Соединение по п.1, где соединение в концентрации 10 мкМ ингибирует mTOR, по меньшей мере, примерно на 50%.
25. Соединение по п.1, где соединение представляет собой:
6-(1H-пирроло[2,3-b]пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((цис-4-метоксициклогексил) метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-изопропил-3, 4-дигидропиразино [2, 3-b] пиразин-2(1H)-он;
4-этил-6-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино [2,3-b]пиразин-2(1H)-он;
4-(2-метоксиэтил)-6-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-(1Н-1,2,4-триазол-5-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
5-(8-(2-метоксиэтил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
3-(6-оксо-8-(2-(тетрагидро-2Н-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
3-(6-оксо-8-(2-(тетрагидро-2Н-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензонитрил;
5-(8-(транс-4-метоксициклогексил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
6-(1Н-имидазо[4,5-b]пиридин-6-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино [2,3-b]пиразин-2(1Н)-он;
6-(1H-индазол-6-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1R,3S)-3-метоксициклопентил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1S,3R)-3-метоксициклопентил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1R,3R)-3-метоксициклопентил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-((1S,3S)-3-метоксициклопентил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-этил-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1H-пирроло[2,3-b]пиридин-5-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1H-индол-6-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1Н-индол-5-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(((1R,3S)-3-метоксициклопентил)метил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(((1S,3R)-3-метоксициклопентил)метил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(4-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1R,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1S,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1S,3S)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1R,3R)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1S,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((1R,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1R,3S)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(((1S,3R)-3-метоксициклопентил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
6-(3-фтор-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(3-фтор-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7'-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1'-((тетрагидро-2Н-пиран-4-ил)метил)-1'Н-спиро[циклопентан-1,21-пиразино[2,3-b]пиразин]-3'(4'Н)-он;
7'-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1'-((тетрагидро-2Н-пиран-4-ил)метил)-1'Н-спиро[циклобутан-1,21-пиразино[2,3-b]пиразин]-3'(4'Н)-он;
4-(циклопропилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7'-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1'Н-спиро[циклопентан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Н)-он;
7'-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1'Н-спиро[циклобутан-1,2'-пиразино[2,3-b]пиразин]-3'(4'Н)-он;
7'-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1'Н-спиро[циклопропане-1,2'-пиразино[2,3-b]пиразин]-3'(4'H)-он;
(R)-6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(1Н-индазол-5-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(6-оксо-8-(2-(тетрагидро-2Н-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
4-(2-метоксиэтил)-3,3-диметил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-этил-3,3-диметил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(1-гидроксиэтил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-4-метилпиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-4-метилпиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-2-метилпиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)-2-метилпиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(1-гидроксиэтил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3,3-диметил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,3-диметил-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(цис-4-метоксициклогексил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(транс-4-метоксициклогексил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(2-метоксиэтил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(6-(4Н-1,2,4-триазол-3-ил)-3-пиридил)-6,11,4а-тригидроморфолино[4,3-е]пиразино[2,3-b]пиразин-5-он;
6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
5-(8-(цис-4-метоксициклогексил)-6-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-6-метилпиколинонитрил;
6-(6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-3-(2-метоксиацетил)-6,11,4а-тригидропиперазино[1,2-е]пиразино[2,3-b]пиразин-5-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4а-тригидропиперазино[1,2-е]пиразино[2,3-b]пиразин-5-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-3-(2-метоксиэтил)-6,11,4а-тригидропиперазино[1,2-е]пиразино[2,3-b]пиразин-5-он;
4-(циклопентилметил)-6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(6-(4Н-1,2,4-триазол-3-ил)-2-метил-3-пиридил)-6,11,4а-тригидроморфолино[4,3-е]пиразино[2,3-b]пиразин-5-он;
4-(транс-4-гидроксициклогексил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(цис-4-гидроксициклогексил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-3-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(циклопентилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-неопентил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-изобутил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3-метил-6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(пиперидин-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-3-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
8-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)(3aS,2R)-2-метокси-5,10,3а-тригидропиразино[2,3-b]пирролидино[1,2-е]пиразин-4-он;
8-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)(2R,3aR)-2-метокси-5,10,3а-тригидропиразино[2,3-b]пирролидино[1,2-е]пиразин-4-он;
8-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)(2S,3aR)-2-метокси-5,10,3а-тригидропиразино[2,3-b]пирролидино[1,2-е]пиразин-4-он;
8-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)(2S,3aS)-2-метокси-5,10,3а-тригидропиразино[2,3-b]пирролидино[1,2-е]пиразин-4-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(3-метоксипропил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидрофуран-2-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-3-метил-6,11,4а-тригидропиперазино[1,2-е]пиразино[2,3-b]пиразин-5-он;
9-(4-(4Н-1,2,4-триазол-3-ил)фенил)-6,11,4а-тригидроморфолино[4,3-е]пиразино[2,3-b]пиразин-5-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4a-тригидропиперидино[1,2-е]пиразино[2,3-b]пиразин-5-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-фенэтил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(циклогексилметил)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидрофуран-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(тетрагидрофуран-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-[6-(1-гидроксиизопропил)-3-пиридил]-6,11,4а-тригидроморфолино[4,3-е]пиразино[2,3-b]пиразин-5-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-амино-7-метил-1Н-бензо[d]имидазол-5-ил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
9-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-6,11,4а-тригидроморфолино[4,3-е]пиразино[2,3-b]пиразин-5-он;
6-(4-метил-2-(метиламино)-1H-бензо[d]имидазол-6-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
8-(4-(4Н-1,2,4-триазол-3-ил)-2-метилфенил)-5,10,3а-тригидропиразино[2,3-b]пирролидино[1,2-е]пиразин-4-он;
6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2 (1Н)-он;
6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-метил-1Н-бензо[d]имидазол-6-ил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
6-(4-(2-гидроксипропан-2-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он; или
6-(4-(1Н-1,2,4-триазол-5-ил)фенил)-4-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он.
26. Соединение формулы (II)

или его фармацевтически приемлемые соли, стереоизомеры и таутомеры, где
R1 представляет собой замещенный C1-8 алкил, замещенный фенил, замещенный или незамещенный гетероциклил, который представляет собой ароматический циклоалкил, содержащий от 5 до 10 атомов в цикле и в котором от одного до трех атомов углерода в цикле независимо замещены на N, где указанные выше заместители выбраны из C1-8 алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила;
R2 представляет собой Н, замещенный или незамещенный C1-8 алкил, замещенный С3-6циклоалкил, незамещенный тетрагидропиранил, незамещенный гетероциклилалкил, где гетероциклил представляет собой неароматический циклоалкил, содержащий 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N и О; замещенный или незамещенный фенилалкил или замещенный или незамещенный С3-6циклоалкилалкил; где указанные заместители выбирают из С1-4алкила, CF3, OR и NR2, где R представляет собой Н или С1-4алкил;
R3 представляет собой Н или замещенный или незамещенный С1-8 алкил, где заместители выбирают из -С(О)СН2ОСН3, -CH2CH2OCH3, ОСН3 или СН3;
при условии, что соединение формулы (II) не является 7-(4-гидроксифенил)-1-(3-метоксибензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-оном.
27. Соединение по п.26, где R1 представляет собой замещенный фенил или замещенную или незамещенную группу, выбранную из пиридила, пиримидила, бензимидазолила, 1H-пирроло[2,3-b]пиридила, индазолила, индолила, 1H-имидазо[4,5-b]пиридила, 1Н-имидазо[4,5-b]пиридин-2(3H)-онила, 3H-имидазо [4,5-b] пиридила или пиразолила, где указанные выше заместители выбраны из C1-8 алкила, триазолила, галогена, аминокарбонила, циано или гидроксиалкила.
28. Соединение по п.27, где R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, триазолил, аминокарбонил, галоген, циано и гидроксиалкил.
29. Соединение по п.28, где заместитель представляет собой триазолил.
30. Соединение по п.27, где R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей С1-8 алкил, триазолил, галоген, аминокарбонил, циано и гидроксиалкил.
31. Соединение по п.30, где заместитель представляет собой триазолил.
32. Соединение по п.27, где R1 представляет собой 1Н-пирроло[2,3-b]пиридил или бензимидазолил, необязательно замещенный одним или несколькими заместителями, представляющими собой C1-8 алкил.
33. Соединение по п.26, где R1 представляет собой
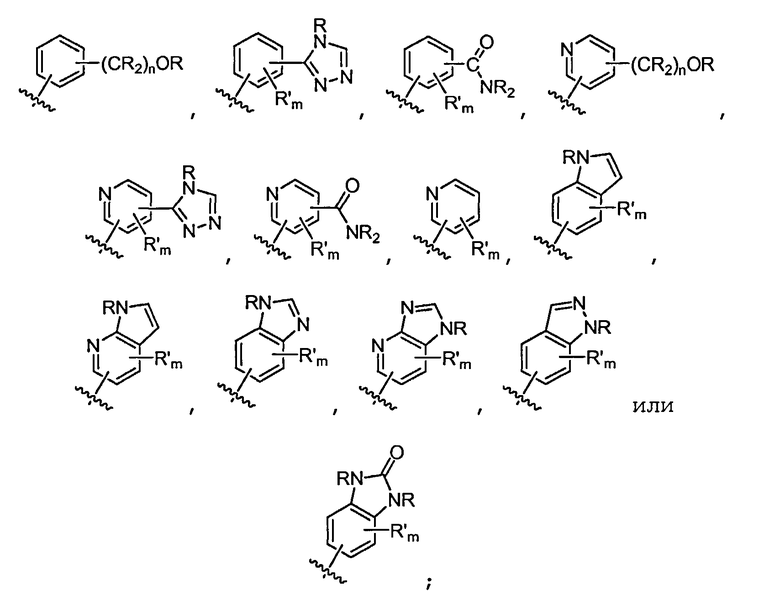
где R в каждом случае представляет собой Н; R' в каждом случае независимо представляет собой C1-4 алкил, галоген, циано; m равно 0-3; и n равно 0-3.
34. Соединение по п.26, где R1 представляет собой
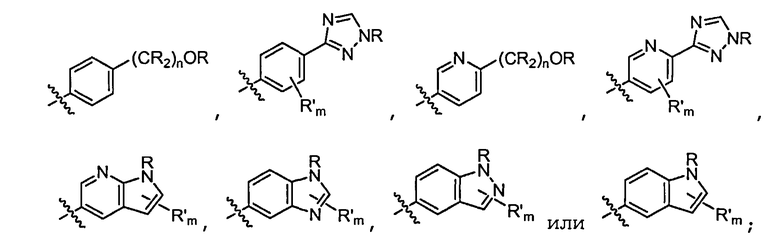
где R в каждом случае независимо представляет собой Н; R' в каждом случае независимо представляет собой C1-4 алкил, галоген, циано; m равно 0-3; и n равно 0-3.
35. Соединение по п.26, где R2 представляет собой Н, замещенный или незамещенный C1-8 алкил, замещенный С3-6циклоалкил, незамещенный тетрагидропиранил, незамещенный гетероциклилалкил, где гетероциклил представляет собой неароматический циклоалкил, содержащий 6 атомов в цикле и в котором от одного до двух атомов углерода в цикле независимо замещены на N и О; замещенный или незамещенный фенилалкил или замещенный или незамещенный С3-6циклоалкилалкил, где указанные заместители выбирают из C1-4алкила, CF3, OR и NR2, где R представляет собой Н или С1-4алкил.
36. Соединение по п.35, где R2 представляет собой Н, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, циклопентил, циклогексил, тетрагидрофуранил, тетрагидропиранил, (C1-4 алкил)фенил, (C1-4 алкил) циклопропил, (C1-4 алкил) циклобутил, (C1-4 алкил) циклопентил или (C1-4 алкил) циклогексил.
37. Соединение по п.35, где R2 представляет собой Н, C1-4 алкил, (C1-4 алкил) (OR),

где R в каждом случае независимо представляет собой Н или C1-4 алкил; R' в каждом случае независимо представляет собой Н, -OR или C1-4 алкил; и р равно 0-3.
38. Соединение по п.35, где R2 представляет собой Н, C1-4 алкил, (C1-4 алкил) (OR),
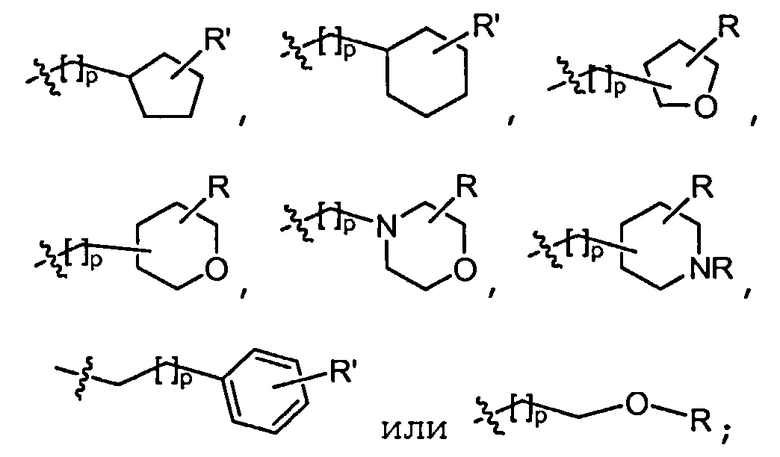
где R в каждом случае независимо представляет собой Н или C1-2 алкил; R' в каждом случае независимо представляет собой Н, -OR или C1-2 алкил; и р равно 0-1.
39. Соединение по п.26, где R3 представляет собой Н.
40. Соединение по п.26, где R1 представляет собой замещенный фенил или группу, выбранную из пиридила, пиримидила, бензимидазолила, 1H-пирроло[2,3-b]пиридила, индазолила, индолила, 1H-имидазо [4,5-b] пиридина, пиридила, 1H-имидазо[4,5-b]пиридин-2(3H)-онила, 3H-имидазо[4,5-b]пиридила или пиразолила, каждый из которых необязательно замещен, где заместители независимо выбраны из группы, включающей C1-8 алкил, триазолил, аминокарбонил, галоген, циано и гидроксиалкил.
41. Соединение по п.40, где R1 представляет собой фенил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, триазолил, аминокарбонил, галоген, циано и гидроксиалкил.
42. Соединение по п.40, где R1 представляет собой пиридил, замещенный одним или несколькими заместителями, независимо выбранными из группы, включающей C1-8 алкил, триазолил, галоген, аминокарбонил, циано и гидроксиалкил.
43. Соединение по п.26, где соединение в концентрации 10 мкМ ингибирует mTOR, по меньшей мере, примерно на 50%.
44. Соединение по п.26, где соединение представляет собой
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(цис-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-пирроло[2,3-b]пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1Н-пирроло[3,2-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-бензо[d]имидазол-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-пирроло[2,3-b]пиридин-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((транс-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(цис-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-этил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1Н-индол-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-((транс-4-гидроксициклогексил)метил) -3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((цис-4-гидроксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(транс-4-гидроксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-изопропил-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(5-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-гидроксипиридин-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-изопропил-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
5-(8-изопропил-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
7-(1Н-индазол-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-аминопиримидин-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-аминопиридин-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(метиламино)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-гидроксипиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(1H-пиразол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3Н-индазол-4-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индазол-6-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиримидин-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-метоксипиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(1H-пирроло[2,3-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1H-пирроло[2,3-b]пиридин-5-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(1Н-индазол-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(пиридин-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-аминопиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-метил-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
2-(2-гидроксипропан-2-ил)-5-(8-(транс-4-метоксициклогексил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)пиридин 1-оксид;
4-метил-5-(7-оксо-8-((тетрагидро-2Н-пиран-4-ил)метил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)пиколинамид;
5-(8-((цис-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
7-(1Н-пиразол-4-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-метоксициклогексил)-7-(4-метил-6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1H)-он;
3-((7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-2-оксо-3,4-дигидропиразино[2,3-b]пиразин-1(2Н)-ил)метил)бензонитрил;
1-((транс-4-метоксициклогексил)метил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
3-(7-оксо-8-(2-(тетрагидро-2Н-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
5-(8-((транс-4-метоксициклогексил)метил)-7-оксо-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)-4-метилпиколинамид;
3-((7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-2-оксо-3,4-дигидропиразино[2,3-b]пиразин-1(2Н)-ил)метил)бензонитрил;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1R,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1S,3R)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1S,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((1R,3S)-3-метоксициклопентил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индазол-6-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-гидроксициклогексил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(цис-4-гидроксициклогексил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-морфолиноэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-изопропил-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-имидазо[4,5-b]пиридин-6-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((цис-4-метоксициклогексил)метил)-7-(2-метил-6-(1H-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-гидроксициклогексил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(цис-4-гидроксициклогексил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
4-(7-оксо-8-(2-(тетрагидро-2Н-пиран-4-ил)этил)-5,6,7,8-тетрагидропиразино[2,3-b]пиразин-2-ил)бензамид;
7-(1Н-индазол-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1S,3R)-3-метоксициклопентил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1R,3R)-3-метоксициклопентил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1R,3S)-3-метоксициклопентил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((1S,3S)-3-метоксициклопентил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1Н-индол-5-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-этил-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(1H-индол-6-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(тетрагидро-2Н-пиран-4-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-((транс-4-метоксициклогексил)метил)-7-(2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((цис-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(4-метил-2-(метиламино)-1Н-бензо[d]имидазол-6-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(7-метил-2-оксо-2,3-дигидро-1Н-бензо[d]имидазол-5-ил)-1-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-бензил-7-(2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-4-(4Н-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-4-(4Н-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(транс-4-метоксициклогексил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(транс-4-метоксициклогексил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(5-фтор-2-метил-4-(4Н-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(3-фтор-2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(2-метоксиэтил)-7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((транс-4-метоксициклогексил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(циклопентилметил)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-7-(6-(1-гидроксиэтил)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-7-(6-(1-гидроксиэтил)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(2-гидроксипропан-2-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(4-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(3-(трифторметил)бензил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(3-метоксипропил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-метоксиэтил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-метил-2-(метиламино)-1H-бензо[d]имидазол-6-ил)-1-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-амино-4-метил-1Н-бензо[d]имидазол-6-ил)-1-((тетрагидро-2Н-пиран-4-ил)метил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-6-(4Н-1,2,4-триазол-3-ил)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(R)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
(S)-7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-3-метил-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-амино-4-метил-1Н-бензо[d]имидазол-6-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(6-(2-гидроксипропан-2-ил)пиридин-3-ил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(2-метил-4-(1Н-1,2,4-триазол-3-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
7-(4-(1Н-1,2,4-триазол-5-ил)фенил)-1-(2-(тетрагидро-2Н-пиран-4-ил)этил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он;
1-(1-гидроксипропан-2-ил)-7-(2-метил-6-(1H-4,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он; или
1-(2-гидроксиэтил)-7-(2-метил-6-(1Н-1,2,4-триазол-3-ил)пиридин-3-ил)-3,4-дигидропиразино[2,3-b]пиразин-2(1Н)-он.
45. Фармацевтическая композиция для лечения рака, воспалительных, иммунологических, метаболических состояний, а также состояний, которые можно предотвращать ингибированием киназного метаболического пути, включающая эффективное количество соединения по п.1 или 26.
46. Фармацевтическая композиция по п.45, подходящая для перорального, парентерального, мукозального, чрескожного или местного введения.
47. Способ лечения или предупреждения рака, иммунологических состояний, диабета, ожирения, неврологических расстройств и возрастных заболеваний, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1 или 26.
48. Способ по п.47, где рак представляет собой злокачественную опухоль головы, шеи, глаза, полости рта, горла, пищевода, бронха, гортани, глотки, грудной клетки, кости, легкого, ободочной кишки, прямой кишки, желудка, предстательной железы, мочевого пузыря, матки, шейки матки, молочной железы, яичника, яичек, кожи, щитовидной железы, крови, лимфатических узлов, почки, печени, поджелудочной железы, мозга, центральной нервной системы или солидные опухоли и злокачественные опухоли кроветворной системы.
49. Способ по п.47, где иммунологическое состояние представляет собой ревматоидный артрит, ревматоидный спондилит, остеоартрит, рассеянный склероз, волчанку, воспалительную болезнь кишечника, неспецифический язвенный колит, болезнь Крона, миастению, болезнь Грейвса, энцефаломиелит, диабет II типа, дерматомиозит или отторжение трансплантата.
50. Способ по п.47, где возрастное заболевание представляет собой рак, ожирение, сахарный диабет II типа или аутоиммунное заболевание.
51. Способ ингибирования mTOR киназы в клетке, экспрессирующей mTOR киназу, включающий контактирование указанной клетки с эффективным количеством соединения по п.1 или 26.
52. Способ лечения или предупреждения состояния, которое можно лечить или предупреждать ингибированием mTOR киназного метаболического пути, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1 или 26.
53. Способ по п.52, где состояние представляет собой множественную миелому, лимфому клеток, одевающих спонгалий, диффузную крупноклеточную В-клеточную лимфому, острую миелоидную лимфому, фолликулярную лимфому, хронический лимфоцитарный лейкоз; рак молочной железы, легкого, эндометрия, яичников, желудка, шейки матки или предстательной железы; глиобластому; карциному почки; гепатоцеллюлярную карциному; карциному толстой кишки; нейроэндокринные опухоли; опухоли головы и шеи; саркомы; опухолевые синдромы, которые являются прямым или опосредованным результатом врожденных генетических пороков развития в PTEN, TSC1, TSC2, NF1, АМРК, LKB1, VHL и PKD1; болезнь Коудена (Cowden's disease), синдром Коудена, синдром, подобный синдрому Коудена, синдром Банаяна-Зонана, синдром Банаяна-Райли-Рувалькаба, болезнь Лермитта-Дуклоса, карциному эндометрия, туберозный склерозный комплекс, лимфангиолейомиоматоз, нейрофиброматоз 1, синдром Пейтца-Егерса, карциному почки, болезнь Фон Гиппеля-Линдау, синдром Протея и поликистозную болезнь почек; ревматоидный артрит; ревматоидный спондилит; остеоартрит; болезнь Хантингтона; рассеянный склероз; красную волчанку; эпилепсию; иммунологическую реакцию на бактериальную или вирусную инфекцию; острое или хроническое отторжение пересаженного органа; реакцию «трансплантат против хозяина».
| WO 2008051493 А2, 02.05.2008 | |||
| US 5424311 A1, 13.06.1995 | |||
| ПРОИЗВОДНЫЕ 6-АРИЛПИРИДО[2,3-D]-ПИРИМИДИНЫ И -НАФТИРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ, ВЫЗЫВАЕМОЙ ПРОТЕИНОВОЙ ТИРОЗИНКИНАЗОЙ, И СПОСОБ ИНГИБИРОВАНИЯ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ | 1995 |
|
RU2191188C2 |
Авторы
Даты
2015-04-10—Публикация
2009-10-27—Подача