Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к средству для ингибирования поглощения железа клетками и средству для ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина.
Уровень техники
[0002] Было идентифицировано, что рецептор (TfR) трансферрина представляет собой структуру мембраны клетки для включения в клетки железа, которое было связано с трансферрином (Tf), которое присутствует на ретикулоцитах (непатентный документ 1). Известно, что TfR экспрессируется в клетках трофобласта плаценты, активированных лимфоцитах, опухолевых клетках и тому подобное.
[0003] В патентном документе 1 описано, что фаговые антитела (scFv антитела), реагирующие с TfR, присутствующим на раковых клетках, были получены в соответствии с библиотекой фагового дисплея человеческих антител, и такие scFv антитела были затем преобразованы в IgG, чтобы получить полные человеческие IgG антитела. В патентном документе 1 также описано, что по меньшей мере одна аминокислота была модифицирована в CDR вариабельной области полученного полного человеческого антитела против TfR для получения антитела против TfR, подходящего для клинического применения.
Документы уровня техники
Патентные документы
[0004] Патентный документ 1: Международная публикация WO 2014/073641
Непатентные документы
[0005] Непатентный документ 1: J Clin Invest 1963; 42, 314-326
Непатентный документ 2: Gene. 1991 Dec 15; 108(2): 193-9.
Сущность изобретения
Задача, решаемая с помощью изобретения
[0006] Задачей настоящего изобретения является получение средства для ингибирования поглощения железа клетками, причем средство нацелено на TfR, и средства для ингибирования связывания между человеческим Tf и человеческим TfR.
Средство решения задачи
[0007] В результате интенсивных исследований, направленных на достижение вышеупомянутой цели, авторы настоящего изобретения обнаружили, что антитело, которое распознает аминокислотную последовательность в заданном положении в человеческом TfR, может ингибировать связывание между человеческим Tf и человеческим TfR и может дополнительно ингибировать поглощение железа клетками, тем самым осуществив настоящее изобретение.
[0008] В частности, согласно настоящему изобретению, оно относится к следующему изобретению.
(1) Средство для ингибирования поглощения железа клетками, которое содержит антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина.
(2) Средство для ингибирования согласно (1), которое ингибирует связывание между человеческим трансферрином и рецептором человеческого трансферрина, чтобы ингибировать поглощение железа клетками.
(3) Средство для ингибирования согласно (1) или (2), в котором антитело имеет первую определяющую комплементарность область тяжелой цепи (VH CDR1), вторую определяющую комплементарность область тяжелой цепи (VH CDR2) и третью определяющую комплементарность область тяжелой цепи (VH CDR3), которые приведены в SEQ ID NO: 1, 2 и 3, соответственно, и первую определяющую комплементарность область легкой цепи (VL CDR1), вторую определяющую комплементарность область легкой цепи (VL CDR2) и третью определяющую комплементарность область легкой цепи (VL CDR3), которые приведены в SEQ ID NO: 4, 5 и 6, соответственно.
(4) Средство для ингибирования по любому из (1)-(3), в котором антитело имеет тяжелую цепь, приведенную в SEQ ID NO: 7, и легкую цепь, приведенную в SEQ ID NO: 8.
(5) Средство для ингибирования по любому из (1)-(4), в котором антитело представляет собой человеческое антитело или гуманизированное антитело.
(6) Средство для ингибирования по любому из (1)-(5), в котором антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечного антитела (scFv), димеризованной V-области (диатела), стабилизированной дисульфидными связями V-области (dsFv) и пептида, содержащего CDR.
(7) Средство для ингибирования по любому из (1)-(6), которое используют для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
(8) Средство для ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина, которое содержит антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина.
(9) Средство для ингибирования согласно (8), в котором антитело имеет первую определяющую комплементарность область тяжелой цепи (VH CDR1), вторую определяющую комплементарность область тяжелой цепи (VH CDR2) и третью определяющую комплементарность область тяжелой цепи (VH CDR3), которые приведены в SEQ ID NO: 1, 2 и 3, соответственно, и первую определяющую комплементарность область легкой цепи (VL CDR1), вторую определяющую комплементарность область легкой цепи (VL CDR2) и третью определяющую комплементарность область легкой цепи (VL CDR3), которые приведены в SEQ ID NO: 4, 5 и 6, соответственно.
(10) Средство для ингибирования согласно (8) или (9), в котором антитело имеет тяжелую цепь, приведенную в SEQ ID NO: 7, и легкую цепь, приведенную в SEQ ID NO: 8.
(11) Средство для ингибирования по любому из (8)-(10), в котором антитело представляет собой человеческое антитело или гуманизированное антитело.
(12) Средство для ингибирования по любому из (8)-(11), в котором антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечного антитела (scFv), димеризованной V-области (диатела), стабилизированной дисульфидными связями V-области (dsFv) и пептида, содержащего CDR.
(13) Средство для ингибирования по любому из (8)-(12), которое используют для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
[0009] (A) Изобретение относится к способу ингибирования поглощения железа клетками, который включает введение субъекту антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина.
(B) Изобретение относится к способу ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина, который включает введение субъекту антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина.
(C) Способ лечения заболевания или симптома, связанного с избыточным поглощением железа клетками, причем способ включает введение субъекту антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина.
(D) Антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для использования с целью ингибирования поглощения железа клетками.
(E) Антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для использования с целью ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина.
(F) Антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для применения в лечении заболевания или симптома, связанного с избыточным поглощением железа клетками.
(G) Применение антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для получения средства для ингибирования поглощения железа клетками.
(H) Применение антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для получения средства для ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина.
(I) Применение антитела, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, для получения средства лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
Преимущественные эффекты изобретения
[0010] Согласно настоящему изобретению, оно относится к средству для ингибирования поглощения железа клетками и средству для ингибирования связывания между человеческим Tf и человеческим TfR. Средство для ингибирования согласно настоящему изобретению может быть использовано для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками. Средство для ингибирования согласно настоящему изобретению можно использовать для подавления роста клеток, имеющих высокие потребности в железе, таких как эритробласты.
Краткое описание чертежей
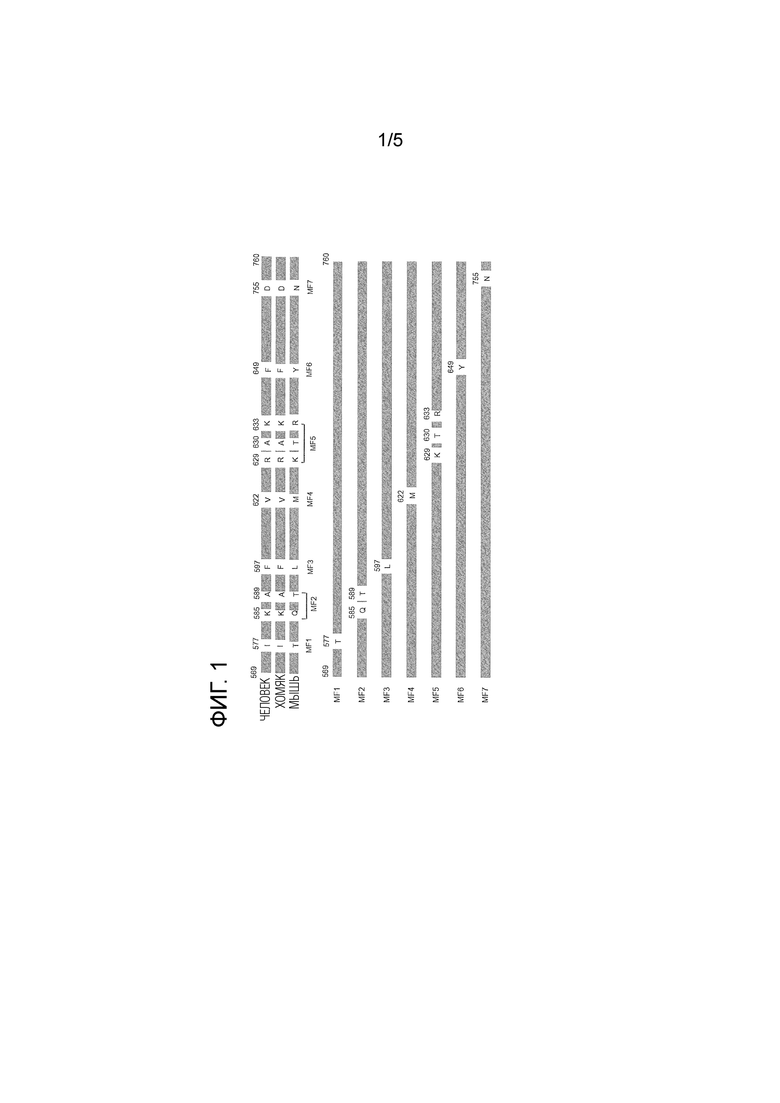
[0011] [Фиг. 1] На фиг. 1 представлены участки, в которых получена точечная мутация отдельных мутантных фрагментов TfR.
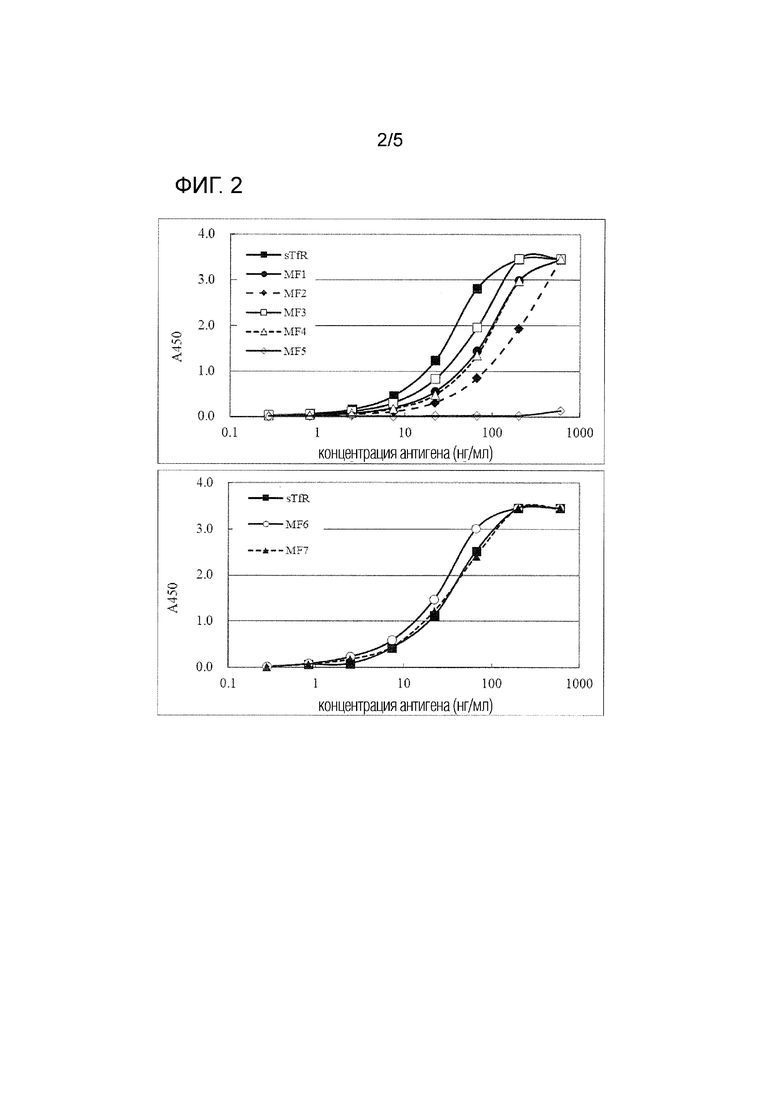
[фиг. 2] На фиг. 2 представлена реакционная способность TfR436 с растворимым TfR дикого типа (sTfR) и с мутантными фрагментами TfR.
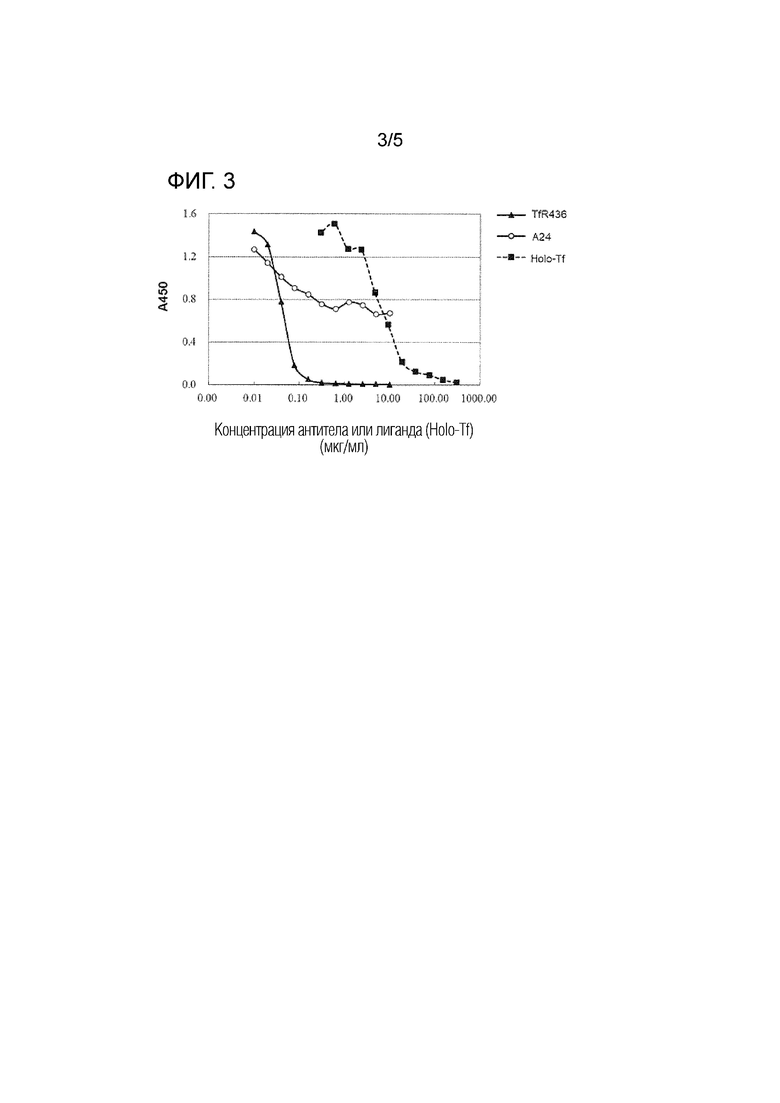
[фиг. 3] На фиг. 3 представлен активность TfR436 по ингибированию связывания Tf-TfR.
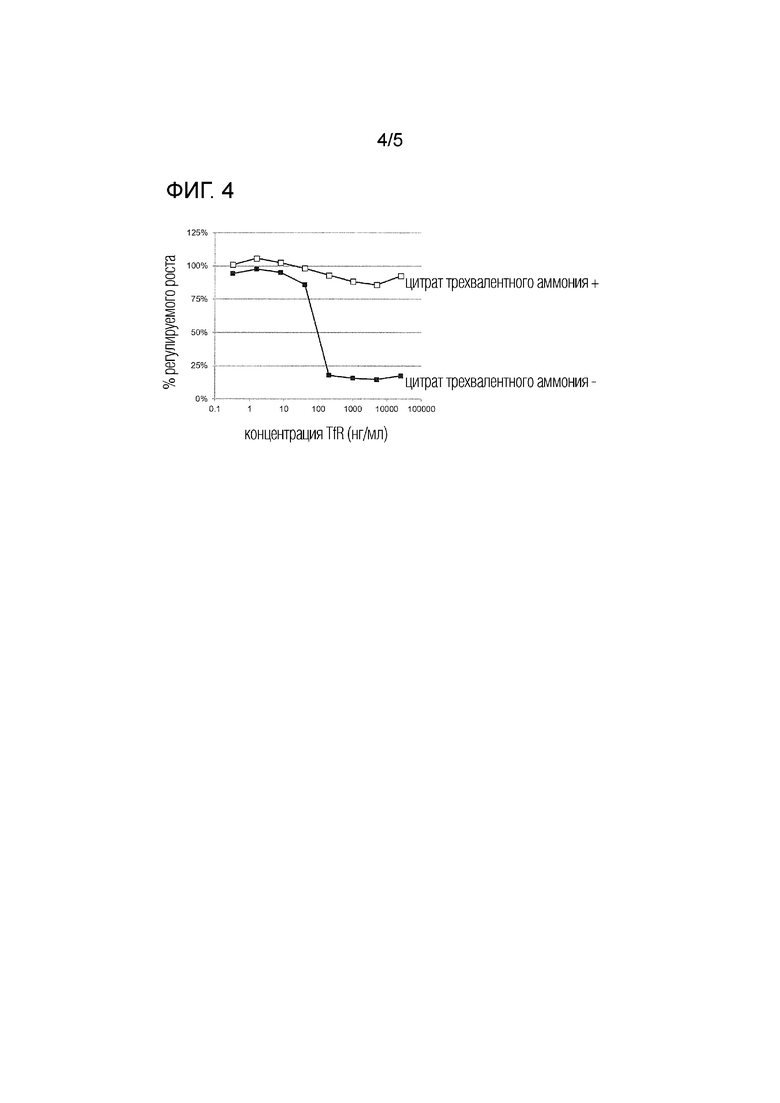
[фиг. 4] На фиг. 4 представлено влияние цитрата трехвалентного аммония на эффект подавления роста клеток антитела TfR436.
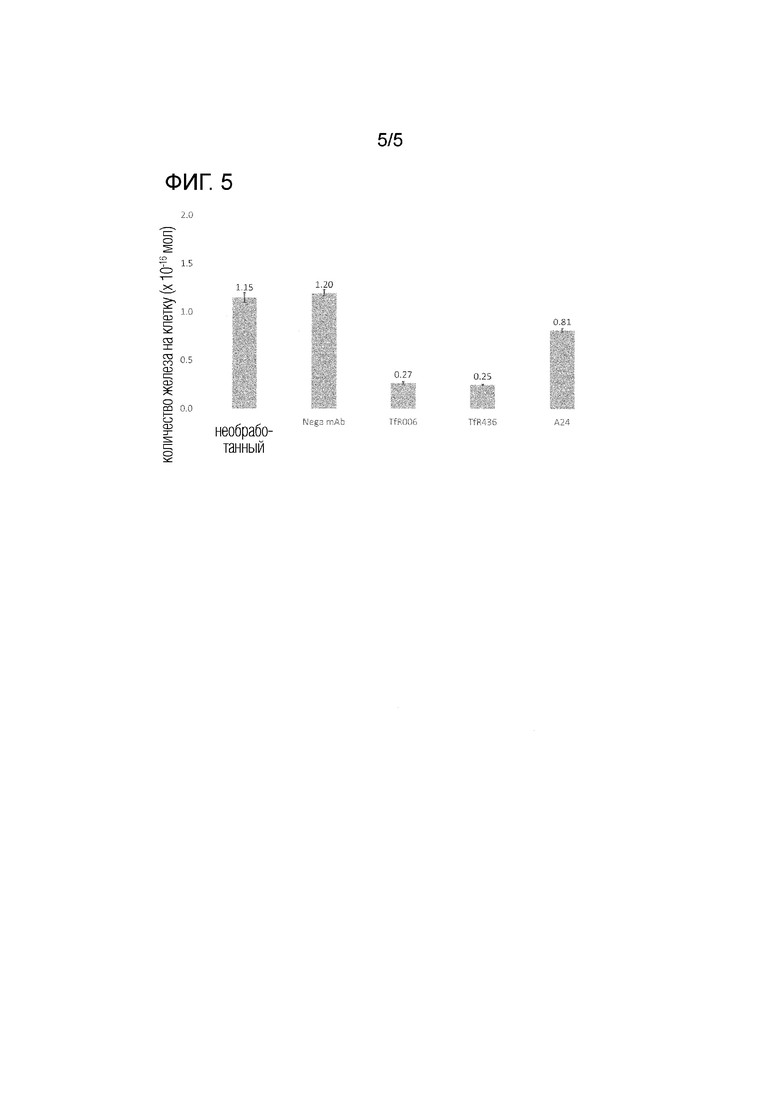
[фиг. 5] На фиг. 5 представлено изменение количества железа в клеточной линии K562 при добавлении антитела TfR436.
Подробное описание изобретения
[0012] Далее настоящее изобретение будет описано более подробно.
Определения и Общие методы
Если в настоящем описании не указано иное, научные термины, используемые в отношении настоящего изобретения, имеют значения, которые в общем понятны специалисту в данной области. В целом номенклатура и методы, применяемые к культуре клеток и тканей, в молекулярной биологии, иммунологии, микробиологии, генетике, химии белков и нуклеиновых кислот и гибридизации, которые описаны в настоящем описании, хорошо известны в данной области техники, и таким образом, обычно используются.
[0013] Способы и методы настоящего изобретения осуществляются в соответствии с обычными способами, которые хорошо известны в данной области техники, такими способами, которые описаны в различных общих справочных документах, цитируемых и обсуждаемых в настоящем описании и более конкретных справочных документах, если не указано иное.
[0014] TfR
Рецептор человеческого трансферрина (TfR) представляет собой однопроходный трансмембранный белок (SEQ ID NO: 9), содержащий 760 аминокислот, и он кодируется хромосомой 3 человека. Этот белок также известен как антиген CD71, и считается, что этот белок связан с включением железа в клетки и ростом клеток. TfR согласно настоящему изобретению особо не ограничен с точки зрения структуры. Таким образом, человеческий TfR включает в себя весь мономер, полимер, интактную форму, экспрессируемую на мембране клетки, растворимую форму, образованную во внеклеточной области, усеченную форму, мутантную форму, вызванную генетической мутацией, делецией и так далее, и форму, которая подверглась посттрансляционной модификации путем фосфорилирования и тому подобное.
[0015] Реакция и Реакционная способность
Термины «реакция» и «реакционная способность» в настоящем описании имеют одинаковые значения, если не указано иное. То есть эти термины означают, что антитело распознает антиген. Антиген, используемый в настоящем изобретении, может быть любым из интактного TfR, экспрессируемого на мембране клетки, усеченной формы и растворимой формы. Кроме того, антиген может быть либо TfR, имеющим трехмерную структуру, или денатурированным TfR. Примеры средств для исследования реакционной способности включают проточную цитометрию (FACS), твердофазный иммуноферментный анализ (ELISA), вестерн-блоттинг, метод измерения микрофлуоресценции (FMAT), поверхностный плазмонный резонанс (Biacore), иммуноокрашивание и иммунопреципитацию.
[0016] Антитело, используемое в проточной цитометрии, может быть либо антителом, меченным флуоресцентным веществом, таким как FITC или биотин, или немеченным антителом. Используют флуоресцентно-меченный авидин, флуоресцентно-меченное антитело против человеческого иммуноглобулина и тому подобное, в зависимости от наличия или отсутствия мечения используемого антитела и его типа. Реакционную способность можно оценить путем добавления достаточного количества антитела против TfR (обычно, имеющего конечную концентрацию от 0,01 до 10 мкг/мл) к аналиту, а затем путем сравнения полученной реакционной способности с реакционной способностью с антителом отрицательного контроля или антителом положительного контроля.
[0017] Антитело
В настоящем описании при необходимости используются следующие сокращения (в скобках) в соответствии с нормами.
Тяжелая цепь (H цепь), легкая цепь (L цепь), вариабельная область тяжелой цепи (VH), вариабельная область легкой цепи (VL), определяющая комплементарность область (CDR), первая определяющая комплементарность область (CDR1), вторая определяющая комплементарность область (CDR2), третья определяющая комплементарность область (CDR3), первая определяющая комплементарность область тяжелой цепи (VH CDR1), вторая определяющая комплементарность область тяжелой цепи (VH CDR2), третья определяющая комплементарность область тяжелой цепи (VH CDR3), первая определяющая комплементарность область легкой цепи (VL CDR1), вторая определяющая комплементарность область легкой цепи (VL CDR2) и третья определяющая комплементарность область легкой цепи (VL CDR3).
[0018] В настоящем описании термин «антитело» имеет такое же определение как иммуноглобулин, и его следует понимать, как обычно известно в данной области техники. В частности, термин «антитело» не ограничен каким-либо кокретным заданным способом получения антитела. Например, термин «антитело» включает в себя, но без ограничения, рекомбинантное антитело, моноклональное антитело и поликлональное антитело.
[0019] В настоящем описании термин «человеческое антитело использован для обозначения любого заданного антитела, в котором последовательности вариабельной области и константной области являются человеческими последовательностями. Этот термин включает в себя антитела, которые имеют человеческие последовательности и модифицированы, например, с удалением цистеина, который может вызвать возможное снижение иммуногенности, повышение аффинности и нежелательную укладку. Этот термин также включает в себя антитела, получаемые в нечеловеческих клетках путем рекомбинации, которые обеспечивают гликозилирование, не специфичное для клеток человека. Эти антитела можно получать различными способами.
[0020] В настоящем описании термин «гуманизированное антитело» означает антитело нечеловеческого происхождения, в котором аминокислотные остатки, характерные для последовательности нечеловеческого антитела заменены остатками, обнаруженными в положениях, соответствующих остаткам у человеческого антитела. Считается, что этот процесс «гуманизации» снижает иммуногенность полученного антитела у человека. Понятно, что антитело нечеловеческого происхождения может быть гуманизировано с использованием метода, хорошо известного в данной области техники. См., например, Winter et al., Immunol. Today 14: 43-46 (1993). Антитело-мишень может быть получено с помощью инженерного подхода с помощью метода рекомбинации ДНК, заключающегося в замене CH1, CH2, CH3, шарнирного домена и/или каркасного домена на те, которые относятся к соответствующей человеческой последовательности. Например, можно сослаться на WO 92/02190 и патенты США №№5530101 5585089 5693761 5693792 5714350 и 5777085. В настоящем описании термин «гуманизированное антитело» включает в себя химерное человеческое антитело и антитело с привитыми CDR, в пределах их определений.
[0021] Последовательность каркасной области (FR) в вариабельной области антитела отдельно не ограничена, если только она существенно не влияет на способность антитела к специфическому связыванию с соответствующим антигеном. Предпочтительно использовать FR-область человеческого антитела, но также возможно использовать FR-области других видов животных, кроме человека (например, мыши, крысы и так далее).
[0022] В одном аспекте антитела антитело содержит константную область, а также вариабельную область (например, IgG антитело). Последовательность такой константной области конкретно не ограничена. Например, можно использовать константную область известного человеческого антитела. Константная область тяжелой цепи (CH) человеческого антитела отдельно не ограничена, если она принадлежит человеческому иммуноглобулину (далее именуемому «hIgG»). Предпочтительны подклассы класса hIgG, и можно использовать любой из подклассов, принадлежащих к классу hIgG, например, hIgG1, hIgG2, hIgG3 или hIgG4. С другой стороны, константная область легкой цепи (CL) конкретно не ограничена, если она принадлежит hIg, и можно использовать области класса κ или класса λ. Кроме того, также можно использовать константные области других видов животных, кроме человека (например, мыши или крысы).
[0023] В настоящем описании термин «модифицированная форма» или «модифицированное антитело» используют для обозначения, что аминокислотная последовательность вариабельной области (последовательности CDR и/или последовательности FR) исходного антитела содержит замену, делецию, добавление и/или вставку одной или нескольких аминокислот.
В настоящем изобретении «исходное антитело» означает антитело TfR436, которое имеет VH, содержащую аминокислотную последовательность, показанную в SEQ ID NO: 7, и VL, содержащую аминокислотную последовательность, показанную в SEQ ID NO: 8. В аминокислотной последовательности одна или несколько (например, 1-8, предпочтительно 1-5, более предпочтительно 1-3, и особенно предпочтительно 1 или 2) аминокислот удаляют, добавляют, заменяют и/или вставляют. В качестве способа получения аминокислотной последовательности антитела, обладающего способностью связывания с TfR, который хорошо известен специалистам в данной области, известен способ введения мутации в белок. Например, такой специалист может получить модифицированное антитело, функционально эквивалентное антителу, обладающему активностью связывания TfR, путем соответствующего введения мутации в аминокислотную последовательность антитела, обладающего активностью связывания TfR, в соответствии с сайт-направленным мутагенезом (Hashimoto-Gotoh, T, Mizuno, T, Ogasahara, Y, and Nakagawa, M. (1995) An oligodeoxyribonucleotide-directed dual amber method for site-directed mutagenesis. Gene 152, 271-275, Zoller, MJ, and Smith, M. (1983) Oligonucleotide-directed mutagenesis of ДНК fragments cloned into M13 vectors. Methods Enzymol. 100, 468-500, Kramer, W, Drutsa, V, Jansen, HW, Kramer, B, Pflugfelder, M, and Fritz, HJ (1984) The gapped duplex ДНК approach to oligonucleotide-directed mutation construction. Nucleic Acids Res. 12, 9441-9456, Kramer W, and Fritz HJ (1987) Oligonucleotide-directed construction of mutations via gapped duplex ДНК Methods. Enzymol. 154, 350-367, Kunkel, TA (1985) Rapid and efficient site-specific mutagenesis without phenotypic selection. Proc Natl Acad Sci USA. 82, 488-492). Таким образом, также можно использовать антитело, содержащее мутацию одной или нескольких аминокислот в его вариабельной области или константной области и обладающее активностью связывания TfR.
[0024] В настоящем описании фразу «активность, эквивалентная активности исходного антитело» используют для обозначения, что активность связывания человеческого TfR некоторого антитела эквивалентна активности его исходного антитела. Термин «эквивалентный» не обязательно означает одинаковый уровень активности. Если антитело обладает активностью, активность может быть увеличена, или активность также может быть уменьшена. Антителом, обладающим пониженной активностью, может быть антитело, обладающее активностью, которая составляет, например, 30% или более, предпочтительно 50% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более, и особенно предпочтительно 95% или более активности исходного антитела.
[0025] Термин «активность связывания» означает активность антитела по распознаванию антигена. Этот антиген может быть интактным TfR, экспрессируемым на мембране клетки, усеченной формой или растворимой формой. Кроме того, антиген может быть либо TfR, имеющим трехмерную структуру или денатурированным TfR. Примеры средств для исследования активности связывания включают проточную цитометрию (FACS), твердофазный иммуноферментный анализ (ELISA), вестерн-блоттинг, метод измерения микрофлуоресценции (FMAT) и поверхностный плазмонный резонанс (Biacore).
[0026] Активность антитела по ингибированию связывания Tf-TfR может быть измерена в соответствии с методом, описанным в упомянутом ниже «Примере 2 (2): Сравнение между антителом TfR436 и антителом, разработанным другой компанией, с точки зрения ингибирования связывания Tf-TfR». Раствор TfR наносят на субстрат (96-луночный планшет и так далее), а затем оставляют в покое для иммобилизации и блокируют. Впоследствии в него дозируют раствор Tf, меченного HRP, и к нему дополнительно добавляют антитело с последующим проведением реакции при комнатной температуре. После этого субстрат промывают, а затем к нему добавляют красящий ресредство (TMB и так далее) для реакции. После этого измеряют оптическую плотность с помощью планшет-ридера. Путем выполнения описанных выше операций можно оценить активность антитела по ингибированию связывания Tf-TfR.
[0027] Ингибирующая активность антитела в отношении поглощения железа клетками может быть измерена в соответствии со способом, описанным в упомянутом ниже «Примере 3: Влияние цитрата трехвалентного аммония на эффект подавления роста клеток антитела TfR436». В частности, клетки суспендируют в культуральной среде, а затем суспензию высевают на субстрат (96-луночный планшет и так далее). Раствор готовят путем серийного разбавления антитела для получения подходящих концентраций, а затем приготовленный раствор добавляют к вышеописанным клеткам. Затем, к ним дополнительно добавляют цитрат трехвалентного аммония. Клетки культивируют в течение заданного периода времени, а затем отдельные лунки полностью перемешивают. После этого раствор культуры клеток переносят в другой планшет (например, 96-луночный планшет с V-образным дном и так далее). Аликвоту раствора отсасывают с использованием FACS Calibur (BD), а затем измеряют количество событий. Число, которое в четыре раза больше полученного числа событий, определяется как количество клеток на лунку. Среднее значение количества клеток в лунке, в которую не добавлены ни антитело, ни цитрат трехвалентного аммония, устанавливают равным 100%, и рассчитывают скорость роста при каждой обработке. Когда антитело подавляет рост клеток зависимым от концентрации образом, а прекращение роста клеток вызывают путем добавления цитрата трехвалентного аммония, показано, что антитело ингибирует поглощение железа клетками.
[0028] Происхождение антитела не ограничено, и это может быть антитело, полученное от любого животного, такое как человеческое антитело, мышиное антитело или крысиное антитело. Также настоящее антитело может быть химерным антителом или гуманизированным антителом. В предпочтительном аспекте антитела антитело согласно настоящему изобретению представляет собой человеческое антитело.
[0029] Антитела могут отличаться друг от друга с точки зрения аминокислотной последовательности, молекулярной массы, изоэлектрической точки, наличия или отсутствия сахарной цепи или ее формы и так далее, в зависимости от нижеупомянутых клеток или хозяев, которые продуцируют антитела, или метода очистки. Например, в настоящее изобретение также включено антитело, которое подвергается модификации после того, как оно было транслировано в аминокислотную последовательность, описанную в настоящем описании. Кроме того, в настоящее изобретение также включено антитело, которое претерпело посттрансляционную модификацию на сайте, отличном от сайтов для известной посттрансляционной модификации. Кроме того, когда обеспечивают экспрессию антитела в прокариотических клетках, таких как Escherichia coli, к N-концу аминокислотной последовательности исходного антитела добавляется остаток метионина. Такое антитело также можно использовать в настоящем изобретении. Также в настоящее изобретение включено антитело, которое претерпело посттрансляционную модификацию на сайте, отличном от сайтов известной посттрансляционной модификации.
[0030] Получение антитела
(1) Введение scFv в реакцию с антигеном с использованием библиотеки фагового дисплея
Антитело можно получить несколькими способами, известными в данной области техники. Например, с использованием метода фагового дисплея может быть предоставлена библиотека, содержащая репертуар антител, обладающих разной аффинностью к TfR. Впоследствии такая библиотека может быть подвергнута скринингу для идентификации и выделения антител против TfR. Предпочтительно фаговая библиотека представляет собой библиотеку фагового дисплея scFv, которую получают с использованием кДНК VL и VH человека, полученной из мРНК, выделенной из В-клеток человека. В данной области техники известен способ получения и скрининга такой библиотеки. Генетическое вещество получают из клонов фага, проявляющих реактивность, которые были скринированы с использованием человеческого TfR в качестве антигена. Путем анализа выбранного гена фага можно определить последовательности ДНК VH и VL, кодирующие вариабельную область связывания человеческого антитела с антигеном. Используя эту последовательность scFv, из scFv получают IgG, чтобы получить человеческое антитело.
[0031] (2) Получение IgG из scFv (получение человеческого антитела)
Получают вектор экспрессии H-цепи или L-цепи, а затем обеспечивают его экспрессию в клетке-хозяине. После этого секретированный супернатант извлекают, а затем очищают, чтобы получить человеческое антитело. Альтернативно, человеческое антитело также можно получить, обеспечивая экспрессию VH и VL в одном векторе (тандемный тип). Эти способы хорошо известны, и их можно выполнять со ссылкой на WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, W093/19172, WO 95/01438, WO 95/15388, WO 97/10354 и так далее
[0032] В частности, ДНК, кодирующую VH, лигируют с другой молекулой ДНК, кодирующей константную область тяжелой цепи (CH1, CH2 и CH3), чтобы получить полноразмерный ген тяжелой цепи. В данной области техники известна последовательность гена константной области тяжелой цепи человека (например, Kabat, E. A. et al., (1991) Sequences of Proteins of Immunological Interest, 5th edition, U. S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагмент ДНК, содержащий такую область, может быть получен с помощью стандартной амплификации ПЦР. Константная область тяжелой цепи может быть константной областью IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Наиболее предпочтительной константной областью является константная область IgG1 или IgG2. Последовательность константной области IgG1 может содержать любые заданные различные аллели или аллотипы, которые, как известно, генерируются у разных индивидуумов, такие как Gm (1), Gm (2), Gm (3) или Gm (17). Эти аллотипы соответствуют замене аминокислот, встречающейся в природе в константной области IgG1.
[0033] ДНК, кодирующую VL лигируют с другой молекулой ДНК, кодирующей константную область легкой цепи CL, чтобы получить полноразмерный ген L цепи (и ген легкой цепи Fab). В данной области техники известна последовательность гена константной области легкой цепи человека (например, Kabat, E. A. et al., (1991) Sequences of Proteins of Immunological Interest, 5th edition, U. S. Department of Health and Human Services, NIH Publication No. 91-3242), и ДНК фрагмент, содержащий такую область, может быть получен с помощью стандартной амплификации ПЦР. Константная область легкой цепи может быть константной областью κ или λ. Константная область κ может содержать любые заданные различные аллели, которые, как известно, генерируются у разных индивидуумов, таких как Inv (1), Inv (2) или Inv (3). Константная область λ может происходить из любого одного из трех генов λ.
[0034] Полученную таким образом ДНК, кодирующую H-цепь или L-цепь, вставляют в вектор для получения вектора экспрессии, а затем обеспечивают экспрессию полученного вектора экспрессии в клетке-хозяине. После этого секретированный супернатант извлекают и очищают для получения человеческого антитела. Примеры вектора экспрессии включают плазмиду, ретровирус, аденовирус, аденоассоциированный вирус (AAV), вирусы растений, такие как вирус мозаики цветной капусты или вирус мозаики табака, космиду, YAC и эписому, происходящую из EBV. Выбирают вектор экспрессии и регуляторную последовательность экспрессии, чтобы они подходили для клетки-хозяина, используемой для экспрессии. Ген легкой цепи антитела и ген тяжелой цепи антитела можно вставить в разные векторы, или два гена также можно вставить в один вектор экспрессии. ген антитела вставляют в вектор экспрессии с помощью стандартного способа (например, лигирования комплементарного сайта рестрикции на фрагменте гена антитела с вектором, или лигирования тупых концов, применяемого, когда сайты рестрикции отсутствуют).
[0035] Подходящий вектор кодирует функционально завершенную последовательность человеческого иммуноглобулина CH или CL, имеющую подходящий сайт рестрикции, который был получен с помощью инженерного подхода, так что любая заданная последовательность VH или VL может быть легко вставлена, а затем экспрессирована в ней, как описано выше. В таком векторе сплайсинг обычно происходит между донорным сайтом сплайсинга во вставленной J-области и акцепторным сайтом сплайсинга, предшествующим человеческому C-домену, или такой сплайсинг также происходит в области сплайсинга, существующей в экзоне CH человека. Полиаденилирование и терминация транскрипции происходят в естественном хромосомном участке ниже кодирующей области. Рекомбинантный вектор экспрессии может также кодировать сигнальный пептид, который способствует секреции цепи антитела, происходящей из клетки-хозяина. Ген цепи антитела можно клонировать в вектор, так что сигнальный пептид можно лигировать в рамке считывания с аминоконцом цепи иммуноглобулина. Сигнальный пептид может быть сигнальным пептидом иммуноглобулина или гетерогенным сигнальным пептидом (а именно, он может быть сигнальным пептидом, полученным не из иммуноглобулинового белка).
[0036] Вектор экспрессии, используемый для антитела, может также иметь последовательности, такие как последовательность для регуляции репликации вектора в клетке-хозяине (например, точка начала репликации) или последовательность селективного маркерного гена, а также ген антитела и регуляторную последовательность. Ген селективного маркера способствует отбору клетки-хозяина, в которую был введен вектор. Например, селективный маркер обычно придает клетке-хозяину, в которую был введен вектор, устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные селективные маркерные гены включают в себя ген дигидрофолатредуктазы (DHFR) (используемый при селекции/амплификации метотрексата в качестве клетки-хозяина dhfr), ген неомицинфосфотрансферазы (используемый при селекции G418) и ген глутаматсинтазы.
[0037] Клетку-хозяин трансформируют вектором экспрессии гена антитела, полученным описанным выше способом. В качестве клетки-хозяина можно использовать любой тип клетки, если он может продуцировать антитело согласно настоящему изобретению. Примеры такой клетки-хозяина включают бактерии, дрожжи, клетки животных, клетки насекомых и клетки растений. Среди этих клеток предпочтительны клетки животных. Примеры клеток животных включают клетки яичника китайского хомячка CHO/dhfr (-) и CHO/DG44, клетки COS обезьяны A. Wright & S. L. Morrison, J. Immunol. 160, 3393-3402 (1998)), and SP2/O cells (mouse myeloma) (K. Motmans et al., Eur. J. Cancer Prev. 5, 512-5199 (1996), R. P. Junghans et al., Cancer Res. 50, 1495-1502 (1990)). Для трансформации предпочтительно применяют липофектиновый метод (R. W. Malone et al., Proc. Natl. Acad. Sci. USA 86, 6007 (1989), P. L. Felgner et al., Proc. Natl. Acad. Sci. USA 84, 7413 (1987)), метод электропорации, метод фосфата кальция (FL Graham & AJ van der Eb, Virology 52, 456-467 (1973)), метод DEAE-декстран и тому подобное.
[0038] Трансформант культивируют, а затем человеческое антитело отделяют от клеток трансформанта или его культуральной среды. Для разделения/очистки антитела можно использовать такие методы, как центрифугирование, фракционирование сульфатом аммония, высаливание, ультрафильтрация, аффинная хроматография, ионообменная хроматография и гель-фильтрационная хроматография, путем их соответствующего сочетания.
[0039] Фрагменты антитела
Фрагмент антитела может быть получен на основе антитела или на основе информации о последовательности гена, кодирующего антитело. Примеры фрагмента антитела включают антитела Fab, Fab', F(ab')2, scFv и dsFv.
[0040] Fab получают путем расщепления IgG папаином в присутствии цистеина. Это фрагмент антитела с молекулярной массой приблизительно 50000, который состоит из вариабельных областей L-цепи и H-цепи, а также фрагментм H-цепи, состоящего из домена CH1 и части шарнирной области. В настоящем изобретении Fab можно получить путем расщепления описанного выше антитела папаином. Кроме того, Fab также можно получить, включая ДНК, кодирующую часть H-цепи и L-цепь вышеописанного антитела, в подходящий вектор, затем осуществляя трансформацию полученным вектором, а затем получая его из трансформанта.
[0041] Fab' представляет собой фрагмент антитела с молекулярной массой приблизительно 50000, который получают путем расщепления дисульфидной связи между H-цепями указанного ниже F(ab')2. В настоящем изобретении Fab' может быть получен путем расщепления описанного выше антитела пепсином с последующим расщеплением дисульфидной связи восстанавливающим средством. Кроме того, как и в случае с Fab, Fab' также можно получить с помощью генной инженерии с использованием ДНК, кодирующей Fab'.
[0042] F(ab')2 представляет собой фрагмент антитела с молекулярной массой приблизительно 100000, который получают путем связывания через дисульфидную связь одного фрагмента (Fab'), состоящего из вариабельных областей L-цепи и H-цепи, и фрагмента H-цепи, состоящего из домена CH1 и части шарнирной области с другим фрагментом (Fab'), который получают путем расщепления IgG пепсином. В настоящем изобретении F(ab')2 может быть получен путем расщепления описанного выше антитела пепсином. Кроме того, как и в случае с Fab, F(ab')2 также можно получить с помощью генной инженерии с использованием ДНК, кодирующей F(ab')2.
[0043] scFv представляет собой фрагмент антитела, полученный путем лигирования C-конца одной цепи Fv, состоящей из вариабельной области H-цепи и вариабельной области L-цепи, с N-концом ее другой цепи, с использованием подходящего пептидного линкера, чтобы образовать единую цепь. (GGGGS)3, обладающий высокой гибкостью, можно использовать, например, в качестве такого пептидного линкера. Например, ДНК, кодирующую вариабельную область H-цепи и вариабельную область L-цепи описанного выше антитела, и ДНК, кодирующую пептидный линкер, используют для конструирования ДНК, кодирующей scFv-антитело, а сконструированную таким образом ДНК затем включают в подходящий вектор. После этого scFv может быть получен из трансформанта, полученного трансформацией вышеупомянутым вектором.
[0044] dsFv представляет собой фрагмент Fv, полученный путем введения остатка Cys в подходящий сайт в каждой из вариабельной области H-цепи и вариабельной области L-цепи, а затем стабилизации вариабельной области H-цепи и вариабельной области L-цепи дисульфидной связью. Сайт в каждой цепи, в который должен быть введен остаток Cys, может быть определен на основе конформации, предсказанной молекулярным моделированием. В настоящем изобретении, например, конформация предсказывается на основании аминокислотных последовательностей вариабельной области H-цепи и вариабельной области L-цепи вышеописанного антитела, а затем конструируют ДНК, кодирующей каждую из вариабельной области H-цепи и вариабельной области L-цепи, в которую была введена мутация на основании такого прогноза. Сконструированную таким образом ДНК включают в подходящий вектор. После этого dsFv может быть получен из трансформанта, полученного трансформацией вышеупомянутым вектором.
[0045] Кроме того, также возможно лигировать антитело scFv, антитело dcFv и тому подобное с использованием подходящего линкера или слить такой фрагмент антитела со стрептавидином, чтобы мультимеризовать фрагмент антитела.
[0046] Фармацевтическая композиция и Препарат
Фармацевтическая композиция и препарат, которые содержат средство для ингибирования согласно настоящему изобретению, также включены в объем настоящего изобретения.
Средство для ингибирования согласно настоящему изобретению можно использовать для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
Заболеванием или симптомом, связанным с избыточным поглощением железа клетками, может быть, например, перенасыщение железом.
[0047] Фармацевтическая композиция и препарат предпочтительно содержат физиологически приемлемый разбавитель или носитель, а также антитело. фармацевтическая композиция и препарат также может представлять собой смесь с другим лекарственным средством. Примеры подходящего носителя, используемого в настоящем изобретении, могут включать нормальный физиологический раствор, забуференный фосфатом физиологический раствор, забуференный фосфатом физиологический раствор с глюкозой и забуференный физиологический раствор, но примеры этим не ограничены. В ином случае, антитело лиофилизируют, и при необходимости, к нему может быть добавлен вышеупомянутый забуференный водный раствор для восстановления антитела, а затем восстановленное таким образом антитело можно использовать. Примеры лекарственной формы препарата включают: пероральное введение, при котором используются таблетка, капсула, гранула, порошковое средство, сироп и так далее; и парентеральное введение, которое включает инъекции (подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию и так далее), чрескожное введение, трансмукозальное введение, трансназальное введение, транспульмональное введение, применение суппозитория и так далее. Препарат, содержащий фармацевтическую композицию согласно настоящему изобретению, можно вводить отдельно, или его также можно использовать в комбинации с другими лекарственными средствами.
[0048] Используемая доза средства для ингибирования согласно настоящему изобретению различается в зависимости от симптома, возраста, массы тела и так далее. В общем, в случае перорального введения средство для ингибирования вводят в дозе приблизительно от 0,01 до 1000 мг в день для взрослого человека в пересчете на количество содержащихся в нем антител. Такую дозу можно вводить однократно или разделить на несколько приемов в день. С другой стороны, в случае парентерального введения средство для ингибирования можно вводить в дозе приблизительно от 0,01 мг до 1000 мг для однократного введения посредством подкожной инъекции, внутримышечной инъекции или внутривенного введения.
[0049] Настоящее изобретение будет описано более подробно в следующих примерах. Однако эти примеры не предназначены для ограничения объема настоящего изобретения.
Примеры
[0050] В следующих примерах использовали антитело TfR436, описанное в параграфах 0090 и 0091 международной публикации WO 2014/073641.
[0051] Ниже показаны последовательности CDR антитела TfR436.
VH CDR1:SYGMH (SEQ ID NO: 1)
VH CDR2:VISYDGSNKYYADSVKG (SEQ ID NO: 2)
VH CDR3:DSNFWSGYYSPVDV (SEQ ID NO: 3)
VL CDR1:TRSSGSIASNSVQ (SEQ ID NO: 4)
VL CDR2:YEDTQRPS (SEQ ID NO: 5)
VL CDR3:QSYDSAYHWV (SEQ ID NO: 6)
[0052] Ниже показаны последовательность VH и последовательность VL антитела TfR436.
TfR436 VH (SEQ ID NO: 7)
DVQLVQSGGGVVQPGRSLRLSCAASGFPFKSYGMHWVRQAPGKGLEWVAVISYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRGEDTAVYYCARDSNFWSGYYSPVDVWGQGTTVTVSS
[0053] TfR436 VL (SEQ ID NO: 8)
NFMLTQPHSVSESPGKTVTISCTRSSGSIASNSVQWYQQRPGSAPITVIYEDTQRPSGVPDRFSGSIDSSSNSASLTISGLQTEDEADYYCQSYDSAYHWVFGGGTKLAVL
[0054] Пример 1: Идентификация участка связывания антитела TfR436
Антитело TfR436 не вступало в перекрестную реакцию с мышиным TfR, но демонстрировало перекрестную реакционную способность с TfR хомяка. Аминокислотную последовательность участка связывания трансферрина (TF) (аминокислоты в положениях 569-760) в человеческом TfR выравнивали с аминокислотными последовательностями TfR хомяка и TfR мыши. Подбирали аминокислоты последовательности TfR человека, которые были идентичны аминокислотам TfR хомяка, но отличались от аминокислот TfR мыши. Как показано на фиг. 1, подобранные аминокислоты подвергали точечной мутации, чтобы получить растворимые мутантные фрагменты TfR.
[0055] (1) Получение растворимых TfR дикого типа (sTfR) и мутантных фрагментов TfR (MF1-MF7)
Синтезировали нуклеотидную последовательность, кодирующую внеклеточный домен человеческого TfR (аминокислоты в положениях 89-760) или отдельные мутантные фрагменты TfR (MF1-MF7), показанные на фиг. 1, и AAARGGPEQKLISEEDLNSAVDHHHHHH (SEQ ID NO: 10). Синтезированные гены вставляли каждый в сайт множественного клонирования вектора, полученного путем включения гена устойчивости к неомицину и гена DHFR в вектор экспрессии pCAGGS (непатентный документ 2.: Niwa et al. 1991), чтобы получить плазмиду экспрессии pCAGGS-Neo-DHFR-sTFR-myc-his. Используя Expifectamine (Invitrogen), описанную выше плазмиду трансфицировали в клетки Expi293 (Invitrogen), и полученные клетки затем культивировали при 37°C, в 8% CO2, при 135 об/мин в течение 5 дней. После этого супернатант культуры собирали центрифугированием, и колонку HisTrapHP (GE Healthcare) затем соединяли с AKTA prime (GE Healthcare). После этого 20 мМ имидазол/DPBS использовали в качестве связывающего буфера, 500 мМ имидазол/DPBS использовали в качестве элюирующего буфера и очищали sTfR или каждый из MF1-MF7. Используя спин-колонку Zeba (Thermo Scientific), элюированный белок подвергали замене буфера на 30 мМ HEPES, 5% трегалозу, pH 7,2.
[0056] (2) Идентификация участка связывания антитела TfR436
Очищенный выше sTfR или каждый из MF1-MF7 разбавляли PBST (забуференный фосфатом физиологический раствор с Tween20, TaKaRa), чтобы подготовить 7 этапов серии разведений путем 3-кратного разбавления из 600 нг/мл. После этого разведенный раствор распределяли в количестве 100 мкл на лунку в 96-луночный планшет Ni-NTA HisSorb Strips (QIAGEN), планшет помещали на шейкер, и затем подвергали реакции при комнатной температуре. Через час планшет промывали буфером PBST пять раз, и антитело TfR436 (1 мкг/мл) распределяли в планшете в количестве 100 мкл/лунку, затем помещали на шейкер, а затем вводили в реакцию при комнатной температуре в течение 1 часа. После этого планшет пять раз промывали буфером PBST, и затем на планшет в количестве 100 мкл на лунку распределяли вторичное антитело, разведенное в 50000 раз, фрагмент F(ab')2 против человеческого IgG Fcγ (Jackson Immuno Research) с последующей реакцией при комнатной температуре в течение 1 часа. После этого планшет пять раз промывали буфером PBST, и растворимый реагент TMB (высокая чувствительность) (Scy Tek) вносили в планшет в количестве 100 мкл/лунку, а затем подвергали реакции при комнатной температуре в темном месте в течение 3 минут. После этого на планшет добавляли стоп-буфер TMB (Scy Tek) в количестве 100 мкл/лунку и затем встряхивали с помощью шейкера в течение 1 минуты. Затем измеряли оптическую плотность при 450 нм (то есть 620 нм), используя планшет-ридер.
[0057] В результате, как показано на фиг. 2, наблюдалось снижение реакционной способности антитела TfR436 с мутантным фрагментом MF5 TfR, но такое снижение реакционной способности антитела TfR436 не наблюдалось с другими мутантными фрагментами. То есть, если аминокислоты в положениях 629, 630 и 633 TfR заменены другими аминокислотами, антитело TfR436 не сможет распознать его как TfR. Было высказано предположение, что аминокислоты в положениях 629-633 представляют собой эпитоп, который распознается антителом TfR436.
[0058] Пример 2: Сравнение между антителом TfR436 и сравнительным антителом с точки зрения ингибирования связывания Tf-TfR
(1) Получение сравнительного антитела A24
В патентном документе US 2008/0193453 раскрыто антитело A24, вступающее в реакцию с человеческим TfR. Для сравнения антитела TfR436 с антителом A24 получили осажденные гибридомы, и получили антитело A24. В частности, гибридомы высевали в среду RPMI1640 (GIBCO) с добавлением 10% FBS до концентрации клеток от 1 до 2×105/мл, а затем культивировали при 37°C в инкубаторе с 5% CO2. После завершения размножения клеток клетки выделяли с помощью центрифугирования, а затем дважды промывали PBS. После этого полученные клетки дополнительно подвергали размножению в бессывороточной среде COSMEDIUM 005 (Cosmo Bio) с добавлением 0,5% Nutridoma-CS (Roche) до объема 550 мл. Через пять дней после того, как клетки стали конфлюэнтными, культуральный супернатант собирали с помощью центрифугирования.
[0059] Извлеченный супернатант наносили на носитель белка А (Ab-Capcher ExTra; ProteNova), и антитело, связавшееся с белком А, элюировали 0,1 М буфера глицин-HCl (pH 2,7) и быстро нейтрализовали 1 М буфера Трис-HCl (pH 8,5). После этого, используя диск для ультрафильтрации Ultracel (Merck Millipore), буфер заменяли на PBS.
[0060] (2) Сравнение между антителом TfR436 и антителом, полученным другой компанией, с точки зрения ингибирования связывания Tf-TfR
STfR, описанный в примере 1, доводили с помощью PBST до концентрации 5,0 мкг/мл, а затем разбавленный раствор дозировали в количестве 100 мкл/лунку в 96-луночный планшет MaxiSorp (Nunc). Планшет оставляли в покое при 4°С на ночь для иммобилизации. На следующий день твердофазную жидкость выбрасывали, и, используя 200 мкл/лунку 100% Block Ace (DS Pharma Biomedical), полученный продукт оставляли в покое при комнатной температуре для блокирования. Через час полученный планшет промывали буфером PBST пять раз, и затем на планшет вносили меченый HRP Tf (2 мкг/мл) в количестве 50 мкл/лунку. Далее в планшет добавляли антитело TfR436, антитело A24 (две стадии серии разведений от 10 мкг/мл) или holo-Tf (Sigma; две стадии серии разведений от 300 мкг/мл) в количестве 50 мкл/лунку. Реакцию проводили при комнатной температуре в течение 1 часа, а затем планшет пять раз промывали буфером PBST. После этого растворимый реагент TMB (высокая чувствительность) вносили в планшет в количестве 100 мкл на лунку, и затем он реагировал при комнатной температуре в темном месте. Через двадцать пять минут в планшет добавляли стоп-буфер TMB в количестве 100 мкл/лунку, а затем планшет встряхивали с помощью шейкера в течение 1 минуты. Затем измеряли оптическую плотность при 450 нм (эталон 620 нм), используя планшет-ридер.
[0061] В результате, как показано на фиг. 3, антитело TfR436 полностью ингибировало связывание Tf-TfR в чрезвычайно низкой дозе (100 нг/мл). С другой стороны, антитело A24 может не полностью ингибировать связывание Tf-TfR, даже если его использовали в дозе 10 мкг/мл, и может ингибировать только 50% связывания Tf-TfR. Таким образом, предположили, что антитело TfR436 превосходно ингибирует связывание Tf-TfR.
[0062] Пример 3: Влияние цитрата трехвалентного аммония на действие антитела TfR436 по подавлению роста клеток.
Как показано в описанных выше экспериментальных результатах, антитело TfR436 распознает аминокислоты в положениях 629-633 TfR и полностью ингибирует связывание Tf-TfR. В результате этого ингибирования поглощение железа клетками полностью подавляется. То есть антитело TfR436 является ингибитором поглощения железа клетками. Железо - это вещество, необходимое для выживания или роста клеток. Если в клетках возникает дефицит железа, происходит прекращение роста клеток или их гибель. Подавляет ли антитело TfR436 рост клеток, или такое подавление роста клеток вызвано дефицитом железа, было исследовано с использованием цитрата трехвалентного аммония, который известен как донор железа при поглощении железа, не связанного с трансферрином. В частности, клетки K562 суспендировали в культуральной среде (RPMI1640, 10% FBS и 1% P/S) таким образом, чтобы количество клеток составляло 5000 клеток/мл, а затем полученную суспензию засевали в количестве 100 мкл/лунку в 96-луночный планшет. Раствор готовили разбавлением антитела TfR436 5-кратным серийным разведением от 100 мкг/мл, и 50 мкл каждого разбавленного раствора добавляли к клеткам K562 (конечная концентрация: от 25 до 0,3 мкг/мл). После этого к ним дополнительно добавляли 50 мкл 120 мкМ цитрата трехвалентного аммония (Wako Pure Chemical Industries, Ltd.) (конечная концентрация: 30 мкМ). Полученные клетки культивировали при 37°C в инкубаторе с 5% CO2 в течение 96 часов, а затем отдельные лунки полностью перемешивали. После этого 150 мкл раствора культуры клеток переносили в 96-луночный планшет с V-образным дном (Corning), а затем отсасывали аликвоту (25 мкл) раствора культуры клеток, используя FACS Calibur (BD). После этого измеряли количество событий. Четыре раза полученное количество событий определяли как количество клеток. Среднее значение количества клеток в лунке, в которую не были добавлены ни антитело, ни цитрат трехвалентного аммония, устанавливали равным 100%, и затем рассчитывали скорость роста клеток при каждой обработке.
[0063] В результате, как показано на фиг. 4, антитело TfR436 подавляло рост клеток K562 зависимым от концентрации образом. Это прекращение роста клеток было вызвано добавлением цитрата трехвалентного аммония. На основании этих результатов было сделано предположение, что антитело TfR436 ингибирует поглощение железа клетками.
[0064] Пример 4: Изменение количества железа в клеточной линии путем добавления антитела TfR436.
Используя клеточную линию K562, исследовали изменение количества иона в клетках при добавлении антитела TfR436. В частности, антитело TfR436 добавляли в колбу T150 (IMDM+10% -FBS; 60 мл), в которую были засеяны клетки K562 в количестве 0,5×105 клеток/мл, так что конечная концентрация антитела TfR436 стала 5 мкг/мл. В качестве контролей получили антитело TfR006 (описанное в патенте Японии №5980202), антитело A24, человеческое моноклональное антитело IgG1 (Nega mAb) и буфер DPBS (необработанный), и эти контроли также добавляли в колбу как в случае антитела TfR436. Клетки культивировали при 37°C в инкубаторе с 5% CO2 в течение 96 часов. После этого подсчитывали количество клеток в каждом образце и выделяли 1,0×107 клеток. Извлеченные клетки промывали DPBS три раза, после чего к осадку клеток добавляли 250 мкл реагента Lysis M (Roche; каталожный №04 719 956 001) и 2,5 мкл 6 N HCl и смешивали с ним, а затем оставляли полученную таким образом смесь в покое при комнатной температуре на 1 час. После завершения центрифугирования извлеченный супернатант использовали для количественного определения железа. Количественное определение железа проводили в соответствии с измерением железа в металле LS (феррозиновый метод) (Metallogenics; каталожный номер FE31M). Результаты представлены на рис.5.
[0065] В результате, как показано на фиг. 5, количества железа в клетках K562, в которые был добавлен необработанный контроль, Nega mAb, TfR006, TfR436 и A24, составили 1,15, 1,20, 0,27, 0,25 и 0,81 нмоль соответственно. На основании этих результатов было сделано предположение, что поглощение железа трансферрином в клетки подавляется добавлением антитела против TfR и что количество железа в клетках снижается. Кроме того, стало ясно, что антитело TfR006 и антитело TfR436 обладают более сильным эффектом подавления поглощения железа, чем антитело A24. Более того, эти экспериментальные результаты демонстрируют, что антитело TfR436 имеет более высокий эффект подавления поглощения железа, чем антитело TfR006.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Perseus Proteomics Inc.
<120> СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ПОГЛОЩЕНИЯ ЖЕЛЕЗА КЛЕТКАМИ
<130> 191983A
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> белок
<213> человек
<400> 1
Ser Tyr Gly Met His
1 5
<210> 2
<211> 17
<212> белок
<213> человек
<400> 2
Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 14
<212> белок
<213> человек
400> 3
Asp Ser Asn Phe Trp Ser Gly Tyr Tyr Ser Pro Val Asp Val
1 5 10
<210> 4
<211> 13
<212> белок
<213> человек
<400> 4
Thr Arg Ser Ser Gly Ser Ile Ala Ser Asn Ser Val Gln
1 5 10
<210> 5
<211> 8
<212> белок
<213> человек
<400> 5
Tyr Glu Asp Thr Gln Arg Pro Ser
1 5
<210> 6
<211> 10
<212> белок
<213> человек
<400> 6
Gln Ser Tyr Asp Ser Ala Tyr His Trp Val
1 5 10
<210> 7
<211> 123
<212> белок
<213> человек
<400> 7
Asp Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Lys Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Gly Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ser Asn Phe Trp Ser Gly Tyr Tyr Ser Pro Val Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 8
<211> 111
<212> белок
<213> человек
<400> 8
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Ser Ile Ala Ser Asn
20 25 30
Ser Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ala Pro Ile Thr Val
35 40 45
Ile Tyr Glu Asp Thr Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Gln Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser
85 90 95
Ala Tyr His Trp Val Phe Gly Gly Gly Thr Lys Leu Ala Val Leu
100 105 110
<210> 9
<211> 760
<212> белок
<213> человек
<400> 9
Met Met Asp Gln Ala Arg Ser Ala Phe Ser Asn Leu Phe Gly Gly Glu
1 5 10 15
Pro Leu Ser Tyr Thr Arg Phe Ser Leu Ala Arg Gln Val Asp Gly Asp
20 25 30
Asn Ser His Val Glu Met Lys Leu Ala Val Asp Glu Glu Glu Asn Ala
35 40 45
Asp Asn Asn Thr Lys Ala Asn Val Thr Lys Pro Lys Arg Cys Ser Gly
50 55 60
Ser Ile Cys Tyr Gly Thr Ile Ala Val Ile Val Phe Phe Leu Ile Gly
65 70 75 80
Phe Met Ile Gly Tyr Leu Gly Tyr Cys Lys Gly Val Glu Pro Lys Thr
85 90 95
Glu Cys Glu Arg Leu Ala Gly Thr Glu Ser Pro Val Arg Glu Glu Pro
100 105 110
Gly Glu Asp Phe Pro Ala Ala Arg Arg Leu Tyr Trp Asp Asp Leu Lys
115 120 125
Arg Lys Leu Ser Glu Lys Leu Asp Ser Thr Asp Phe Thr Gly Thr Ile
130 135 140
Lys Leu Leu Asn Glu Asn Ser Tyr Val Pro Arg Glu Ala Gly Ser Gln
145 150 155 160
Lys Asp Glu Asn Leu Ala Leu Tyr Val Glu Asn Gln Phe Arg Glu Phe
165 170 175
Lys Leu Ser Lys Val Trp Arg Asp Gln His Phe Val Lys Ile Gln Val
180 185 190
Lys Asp Ser Ala Gln Asn Ser Val Ile Ile Val Asp Lys Asn Gly Arg
195 200 205
Leu Val Tyr Leu Val Glu Asn Pro Gly Gly Tyr Val Ala Tyr Ser Lys
210 215 220
Ala Ala Thr Val Thr Gly Lys Leu Val His Ala Asn Phe Gly Thr Lys
225 230 235 240
Lys Asp Phe Glu Asp Leu Tyr Thr Pro Val Asn Gly Ser Ile Val Ile
245 250 255
Val Arg Ala Gly Lys Ile Thr Phe Ala Glu Lys Val Ala Asn Ala Glu
260 265 270
Ser Leu Asn Ala Ile Gly Val Leu Ile Tyr Met Asp Gln Thr Lys Phe
275 280 285
Pro Ile Val Asn Ala Glu Leu Ser Phe Phe Gly His Ala His Leu Gly
290 295 300
Thr Gly Asp Pro Tyr Thr Pro Gly Phe Pro Ser Phe Asn His Thr Gln
305 310 315 320
Phe Pro Pro Ser Arg Ser Ser Gly Leu Pro Asn Ile Pro Val Gln Thr
325 330 335
Ile Ser Arg Ala Ala Ala Glu Lys Leu Phe Gly Asn Met Glu Gly Asp
340 345 350
Cys Pro Ser Asp Trp Lys Thr Asp Ser Thr Cys Arg Met Val Thr Ser
355 360 365
Glu Ser Lys Asn Val Lys Leu Thr Val Ser Asn Val Leu Lys Glu Ile
370 375 380
Lys Ile Leu Asn Ile Phe Gly Val Ile Lys Gly Phe Val Glu Pro Asp
385 390 395 400
His Tyr Val Val Val Gly Ala Gln Arg Asp Ala Trp Gly Pro Gly Ala
405 410 415
Ala Lys Ser Gly Val Gly Thr Ala Leu Leu Leu Lys Leu Ala Gln Met
420 425 430
Phe Ser Asp Met Val Leu Lys Asp Gly Phe Gln Pro Ser Arg Ser Ile
435 440 445
Ile Phe Ala Ser Trp Ser Ala Gly Asp Phe Gly Ser Val Gly Ala Thr
450 455 460
Glu Trp Leu Glu Gly Tyr Leu Ser Ser Leu His Leu Lys Ala Phe Thr
465 470 475 480
Tyr Ile Asn Leu Asp Lys Ala Val Leu Gly Thr Ser Asn Phe Lys Val
485 490 495
Ser Ala Ser Pro Leu Leu Tyr Thr Leu Ile Glu Lys Thr Met Gln Asn
500 505 510
Val Lys His Pro Val Thr Gly Gln Phe Leu Tyr Gln Asp Ser Asn Trp
515 520 525
Ala Ser Lys Val Glu Lys Leu Thr Leu Asp Asn Ala Ala Phe Pro Phe
530 535 540
Leu Ala Tyr Ser Gly Ile Pro Ala Val Ser Phe Cys Phe Cys Glu Asp
545 550 555 560
Thr Asp Tyr Pro Tyr Leu Gly Thr Thr Met Asp Thr Tyr Lys Glu Leu
565 570 575
Ile Glu Arg Ile Pro Glu Leu Asn Lys Val Ala Arg Ala Ala Ala Glu
580 585 590
Val Ala Gly Gln Phe Val Ile Lys Leu Thr His Asp Val Glu Leu Asn
595 600 605
Leu Asp Tyr Glu Arg Tyr Asn Ser Gln Leu Leu Ser Phe Val Arg Asp
610 615 620
Leu Asn Gln Tyr Arg Ala Asp Ile Lys Glu Met Gly Leu Ser Leu Gln
625 630 635 640
Trp Leu Tyr Ser Ala Arg Gly Asp Phe Phe Arg Ala Thr Ser Arg Leu
645 650 655
Thr Thr Asp Phe Gly Asn Ala Glu Lys Thr Asp Arg Phe Val Met Lys
660 665 670
Lys Leu Asn Asp Arg Val Met Arg Val Glu Tyr His Phe Leu Ser Pro
675 680 685
Tyr Val Ser Pro Lys Glu Ser Pro Phe Arg His Val Phe Trp Gly Ser
690 695 700
Gly Ser His Thr Leu Pro Ala Leu Leu Glu Asn Leu Lys Leu Arg Lys
705 710 715 720
Gln Asn Asn Gly Ala Phe Asn Glu Thr Leu Phe Arg Asn Gln Leu Ala
725 730 735
Leu Ala Thr Trp Thr Ile Gln Gly Ala Ala Asn Ala Leu Ser Gly Asp
740 745 750
Val Trp Asp Ile Asp Asn Glu Phe
755 760
<210> 10
<211> 28
<212> белок
<213> Искусственная последовательность
<220>
<223> Описание Искусственной последовательности: рекомбинантная метка
<400> 10
Ala Ala Ala Arg Gly Gly Pro Glu Gln Lys Leu Ile Ser Glu Glu Asp
1 5 10 15
Leu Asn Ser Ala Val Asp His His His His His His
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С TFR | 2019 |
|
RU2810756C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ БЕТА-АМИЛОИДУ/ЧЕЛОВЕЧЕСКОМУ РЕЦЕПТОРУ ТРАНСФЕРРИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2730682C1 |
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799547C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ CD20/ЧЕЛОВЕЧЕСКОМУ РЕЦЕПТОРУ ТРАНСФЕРРИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2753390C1 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2831724C2 |
| АНТИТЕЛА ПРОТИВ ТРАНСФЕРРИНОВОГО РЕЦЕПТОРА, ОБЛАДАЮЩИЕ ИНДИВИДУАЛИЗИРОВАННОЙ АФФИННОСТЬЮ | 2016 |
|
RU2729416C2 |
| ШАТТЛ ДЛЯ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2019 |
|
RU2754794C2 |
| МОДИФИЦИРОВАННЫЕ АНТИТЕЛА IGG, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА БЕТА-1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ | 2016 |
|
RU2728858C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ АНТАГОНИСТ IL-33, ДЛЯ ЛЕЧЕНИЯ ЭНДОМЕТРИОЗА | 2018 |
|
RU2791705C2 |
Изобретение относится к области биотехнологии. Предложено средство для ингибирования поглощения железа клетками, содержащее антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина. Также предложено средство для ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина, которое содержит указанное антитело. Изобретение может быть использовано для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками. 2 н. и 9 з.п. ф-лы, 5 ил., 4 пр.
1. Средство для ингибирования поглощения железа клетками, которое содержит антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, причем антитело имеет первую определяющую комплементарность область тяжелой цепи (VH CDR1), вторую определяющую комплементарность область тяжелой цепи (VH CDR2) и третью определяющую комплементарность область тяжелой цепи (VH CDR3), которые приведены в SEQ ID NO: 1, 2 и 3 соответственно, и первую определяющую комплементарность область легкой цепи (VL CDR1), вторую определяющую комплементарность область легкой цепи (VL CDR2) и третью определяющую комплементарность область легкой цепи (VL CDR3), которые приведены в SEQ ID NO: 4, 5 и 6 соответственно.
2. Средство для ингибирования по п. 1, которое ингибирует связывание между человеческим трансферрином и рецептором человеческого трансферрина, чтобы ингибировать поглощение железа клетками.
3. Средство для ингибирования по п. 1 или 2, в котором антитело имеет тяжелую цепь, приведенную в SEQ ID NO: 7, и легкую цепь, приведенную в SEQ ID NO: 8.
4. Средство для ингибирования по любому из пп. 1-3, в котором антитело представляет собой человеческое антитело или гуманизированное антитело.
5. Средство для ингибирования по любому из пп. 1-4, в котором антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечного антитела (scFv), димеризованной V-области (диатела), стабилизированной дисульфидными связями V-области (dsFv) и пептида, содержащего CDR.
6. Средство для ингибирования по любому из пп. 1-5, которое используют для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
7. Средство для ингибирования связывания между человеческим трансферрином и рецептором человеческого трансферрина, которое содержит антитело, которое распознает аминокислоты в положениях 629-633 рецептора человеческого трансферрина, причем антитело имеет первую определяющую комплементарность область тяжелой цепи (VH CDR1), вторую определяющую комплементарность область тяжелой цепи (VH CDR2) и третью определяющую комплементарность область тяжелой цепи (VH CDR3), которые приведены в SEQ ID NO: 1, 2 и 3 соответственно, и первую определяющую комплементарность область легкой цепи (VL CDR1), вторую определяющую комплементарность область легкой цепи (VL CDR2) и третью определяющую комплементарность область легкой цепи (VL CDR3), которые приведены в SEQ ID NO: 4, 5 и 6 соответственно.
8. Средство для ингибирования по п. 7, в котором антитело имеет тяжелую цепь, приведенную в SEQ ID NO: 7, и легкую цепь, приведенную в SEQ ID NO: 8.
9. Средство для ингибирования по п. 7 или 8, в котором антитело представляет собой человеческое антитело или гуманизированное антитело.
10. Средство для ингибирования по любому из пп. 7-9, в котором антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечного антитела (scFv), димеризованной V-области (диатела), стабилизированной дисульфидными связями V-области (dsFv) и пептида, содержащего CDR.
11. Средство для ингибирования по любому из пп. 7-10, которое используют для лечения заболевания или симптома, связанного с избыточным поглощением железа клетками.
| US 2015291697 A1, 15.10.2015 | |||
| WO 2014020140 A1, 06.02.2014 | |||
| DANIELS-WELLS T.R., PENICHET M.L., Transferrin receptor 1: a target for antibody-mediated cancer therapy, Immunotherapy, 2016, Volume 8, Issue 9, pp.991-994 | |||
| ЛУКИНА Е.А., ДЕЖЕНКОВА А.В., Метаболизм железа в норме и при патологии, КЛИНИЧЕСКАЯ ОНКОГЕМАТОЛОГИЯ, 2015, Том 8, Номер 4, |
Авторы
Даты
2024-04-11—Публикация
2019-11-19—Подача