Изобретение относится к рекомбинантной плазмидной ДНК pQE30-Ig-TIM1, обеспечивающей синтез рекомбинантного белка protIg-TIM1 аналога рецептора TIM-1/HAVCR-1 человека в клетках Е. Coli, и может быть использовано для диагностических и научных исследований в медицине, биотехнологии и белковой инженерии.
Рецептор Т-клеточный-иммуноглобулиновый-муциновый домен (TIM-1/HAVCR-1/KIM-1/CD365) играет значимую роль в регулировании активности иммунных клеток, при вирусных инфекциях и при социально-значимых заболеваниях [3-7, 9, 10]. HAVCR-1 был впервые открыт для вируса гепатита А [1]. KIM-1/TIM-1 (молекула повреждения почки) используется в качестве маркера повреждения при почечных заболеваниях [2]. Известно, что TIM-1 у людей опосредует проникновение в клетки вирусов гепатитов А и С, вирусов Эбола и Марбург, вируса денге, вируса клещевого энцефалита, SARS-CoV-2 [3-7]. Для проникновения в клетку вирусы используют способность иммуноглобулинового домена белка TIM-1/HAVCR-1 связывать фосфатидилсерин [8]. Значимость рецептора TIM-1 показана не только при вирусных инвазиях, но и в регуляции иммунного ответа, и при аутоиммунных и онкологических заболеваниях [9, 10].
Существуют коммерческие зарубежные препараты белков, кодируемые как частями гена TIM-1 человека, полноразмерным геном, так и синтетическими пептидами (https://www.sinobiological.com/category/tim-1-kim-1/proteins). Недостатком этих препаратов является дороговизна и возникшая недоступность препаратов для использования в России.
Наиболее близким аналогом (прототипом) является способ получения рекомбинантного белка, кодируемого последовательностью внеклеточной части гена TIM-1 человека с сигналом секреции IgK мыши (патент Китая, CN №101798351, МПК С07K 19/00, опубл. 11.08.2010 г.) [12]. Для повышения растворимости белка авторы конъюгировали его с фрагментом Fc иммуноглобулина человека, содержащим домены СН2 и СН3. Белок был получен в эукариотических клетках СНО после клонирования сначала в Е. Соli. К сожалению, нет подробностей конструирования плазмиды и в работе был использован синтетический ген TIM-1. Усложнение конструкции белка за счет сигнальной последовательности IgK мыши и фрагмента Fc приводит к повышению трудоемкости и удорожанию препарата.
Поиск по источникам научно-технической и патентной информации не выявил технических решений, раскрывающих генетические конструкции, обеспечивающие экспрессию иммуноглобулинового домена гена TIM-1/HAVCR-1 человека и технологии наработки рекомбинантных продуктов на его основе. Важно отметить, что на территории Российской Федерации подобных работ в настоящее время не выявлено.
В этой связи получение искусственного аналога рецептора, кодируемого геном TIM-1/HAVCR-1 человека, может быть актуально для решения проблемы импортозамещения и быть использовано для диагностических и научных исследований.
Техническим результатом настоящего изобретения является получение рекомбинантной плазмидной ДНК pQE30-Ig-TIM1, обеспечивающей экспрессию белка protIg-TIM1 аналога рецептора - TIM-1/HAVCR-1/KIM-1/CD365 (Т-клеточного иммуноглобулинового муцинового домена), кодируемого фрагментом гена TIM-1/HAVCR-1 человека, а именно иммуноглобулиновым доменом.
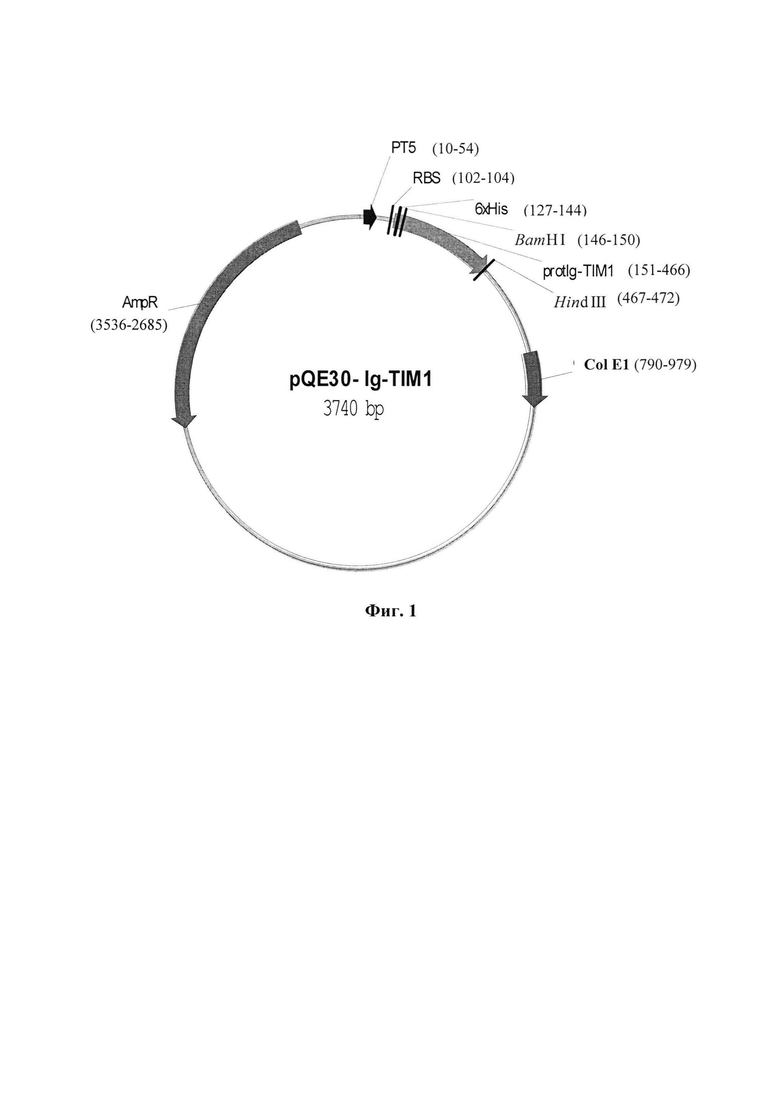
Указанный технический результат достигается тем, что создана рекомбинантная плазмидная ДНК pQE30-Ig-TIMl, имеющая размер 3740 п. н., обеспечивающая экспрессию белка protIg-TIM1 с аминокислотной последовательностью SEQ ID NO: 2 - аналога рецептора TIM-1/HAVCR- 1/KIM-1/CD365 Т-клеточного иммуноглобулинового муцинового домена человека, кодируемого фрагментом гена TIM-1/HAVCR-1, в прокариотических клетках Е. Coli, используемого для диагностических и научных исследований, и содержащая:
- промотор фага Т5, имеющий координаты 10-54 п. н.;
RBS-сайт связывания рибосом, имеющий координаты 102-104 п. н.;
6xHis-tag с координатами 127-144 п. н.; сайты узнавания эндонуклеаз рестрикции BamHI с координатами 146-150 п. н. и Hind III 467-472 п. н.;
целевую нуклеотидную последовательность SEQ ID NO: 1 плазмиды pQE30-Ig-TIM1, имеющую координаты 151-466 п. н.,
ColE1 - ориджин репликации, с координатами 790-979 п. н.; AmpR - ген β-лактамазы, с координатами 3536-2685 п. н.
Сконструированной рекомбинантной плазмидной ДНК pQE30-Ig-TIMl, содержащей последовательность иммуноглобулинового домена гена TIM-1/HAVCR-1 человека, трансформируют клетки Е. Coli штамма JM103 для обеспечения экспрессии рекомбинантного белка protIg-TIM1 - аналога рецептора.
Предлагаемое изобретение позволило получить высокоочищенный препарат белка protIg-TIM1 с чистотой 98%. Выход составил 5 мг из литра культуральной жидкости. Затем была проведена трехкратная иммунизация мышей белком protIg-TIM1 и получены поликлональные антитела, которые были протестированы наряду с коммерческими поликлональными антителами. Была показана специфичность полученных антител к белку, кодируемому иммуноглобулиновым доменом гена TIM-1 человека.
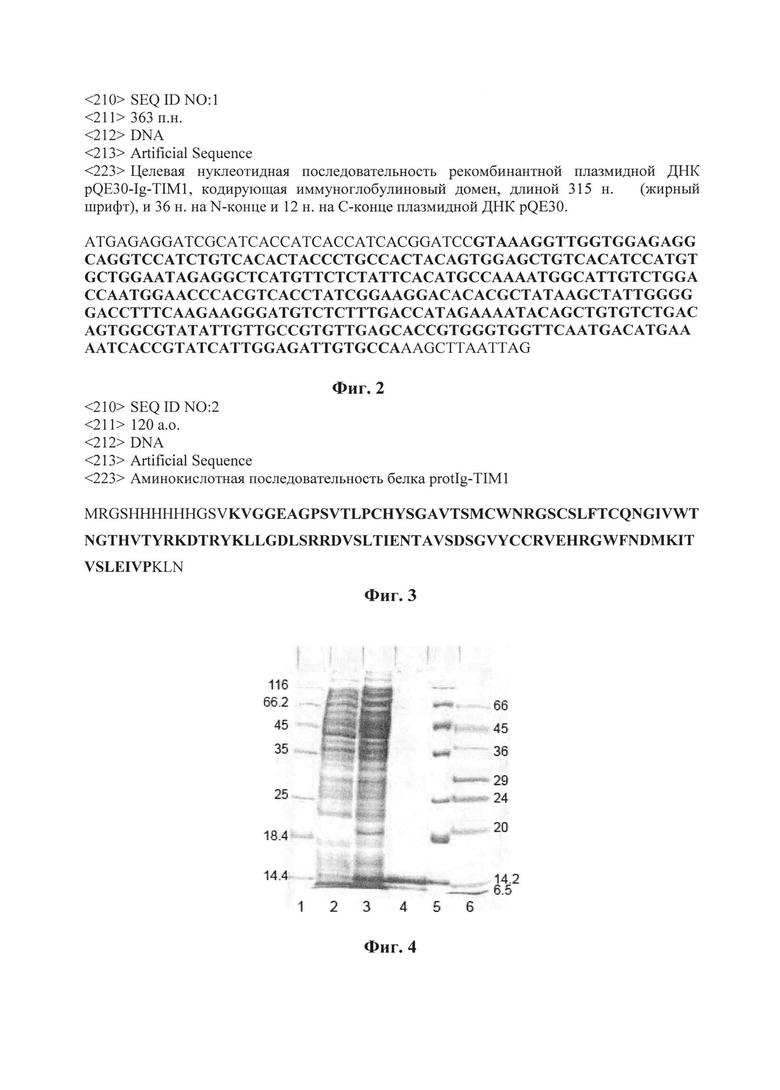
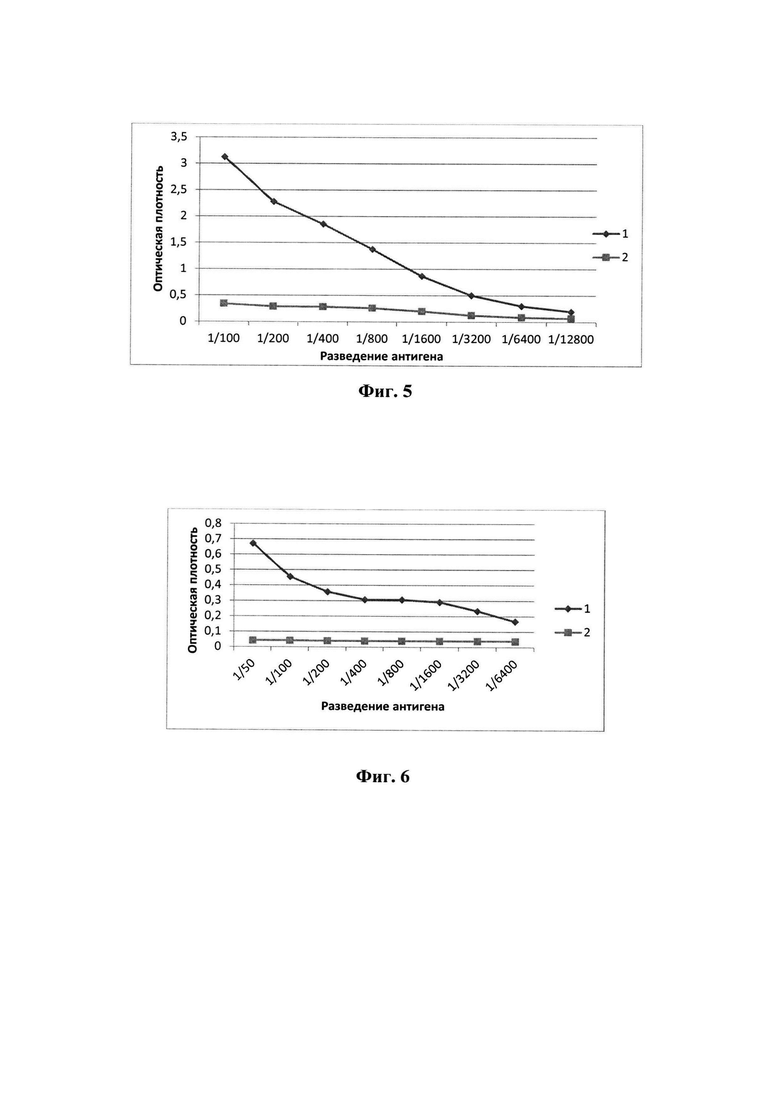
Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 представлена физическая карта плазмиды pQE30-Ig-TIM1 с указанием генетических маркеров. Основные генетические элементы: промотор фага Т5 (10-54 п. н.); RBS - сайт связывания рибосом (102-104 п. н.); 5'-кодирующая последовательность в область клонирования 6xHis-tag (127- 144 п. н.); сайты узнавания эндонуклеаз рестрикции BamHI (146-150 п. н.) и Hind III (467-472 п. н.) в районе множественных сайтов клонирования; целевая последовательность Ig-TIM1 (151-466 п.н., координаты соответствуют 280-592 п.н. по последовательности HAVCR-1 ХМ_024446022.1); ColE1 - ориджин репликации (790-979 п.н.); AmpR - ген β-лактамазы (3536-2685 п.н.). Полная нуклеотидная последовательность вектора pQE30 приведена на сайте www.qiagen.com. На фиг.2 представлена целевая нуклеотидная последовательность рекомбинантной плазмидной ДНК pQE30-Ig-TIM1, кодирующая иммуноглобулиновый домен. На фиг.3 приведена аминокислотная последовательность белка protIg-TIM1. На Фиг. 4 представлена электрофореграмма 15% ПААГ ДСН. Осветленные лизаты культуры клеток до индукции - 2 дорожка и после индукции - 3 дорожка; 4 дорожка - белок protIg-TIM1 после очистки. Маркеры молекулярных весов: 6 дорожка - M3913-1VL (6.5; 14.2; 20; 24; 29; 36; 45; 66 кДа) (Sigma, США); 1, 5 дорожки - #26610 (14.4; 18.4; 25; 35; 45; 66.2; 116 кДа) (Thermo Scientific, Литва). Фиг. 5 приведен график взаимодействия препарата очищенного рекомбинантного белка protIg-TIM1 (антиген) с антителами, полученными после иммунизации мышей данным белком в ИФА. Оптическую плотность ОП450 образцов определяли на спектрофотометре «Multiskan» (Thermo Scientific):
1 - protIg-TIM1 двухкратные разведения, начиная с 500 нг;
2 - лизат культуры клеток, трансформированный pQE30 (отрицательный контроль).
Примечания: антиген - protIg-TIM1 титровали антителами, полученными после иммунизации мышей, в разведении 1:1000.
На фиг.6 представлен график взаимодействия препарата очищенного рекомбинантного белка protIg-TIM1 (антиген) с коммерческими анти-TIM1 человека антителами козы (Invitrogen, США) в ИФА. Оптическую плотность ОП450 образцов определяли на спектрофотометре "Multiskan" (Thermo Scientific).
1. protIg-TIM1 двухкратные разведения, начиная с 1000 нг;
2. лизат культуры клеток, трансформированный pQE30 (отрицательный контроль).
Примечания: антиген - protIg-TIM1 титровали поликлональными анти-TIM1 человека антителами козы (Invitrogen, США), которые были использованы в концентрации 2 мкг/мл или 200 нг/лунка.
Для лучшего понимания сущности предлагаемого изобретения ниже представлены примеры его осуществления.
Пример 1. Получение рекомбинантной плазмидной ДНК pQE30-Ig-TIM1, кодирующей иммуноглобулиновый домен гена TIM-1/HAVCR-1 человека.
1.1. Дизайн и получение плазмидной ДНК pQE30-Ig-TIM1.
Плазмида pQE30-Ig-TIM1 была получена посредством встраивания ДНК иммуноглобулинового домена гена TIM-1 (третий экзон) по сайтам узнавания эндонуклеаз рестрикции BamHI и Hind III в векторную плазмиду pQE30 (Qiagen, Германия).
Так как известно, что экспрессия гена TIM-1 высока в культуре клеток А549 (клетки карциномы легкого человека) (10), исходя из этого источником РНК в данной работе была культура клеток А549, которая была получена из коллекции клеточных культур ФБУН ГНЦ ВБ «Вектор». Клетки отбирали в фазе логарифмического роста. В отличии от прототипного патента, где был использован синтетический фрагмент внеклеточной области гена TIM-1 человека, нами для встройки был использован ПНР фрагмент, кодирующий только иммуноглобулиновый домен гена TIM1 человека и полученный на основе РНК из культуры клеток А549.
Тотальная РНК была выделена с помощью комплекта для выделения ДНК/РНК (Евроген, РФ) и являлась матрицей для синтеза кДНК, построение которой проводили с использованием комплекта реагентов «PEBEPTA-L» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, РФ).
Амплификацию кДНК проводили с помощью олигодезоксирибонуклеотидов (в дальнейшем - праймеры) (1,2 таблица 1), в последовательность которых были заложены сайты узнавания эндонуклеаз рестрикции BamHI и Hind III и последовательности, фланкирующие третий экзон гена TIM1 человека, кодирующие иммуноглобулиновый домен (координаты по последовательности HAVCR-1 ХМ_024446022.1 из базы GenBank), так называемая целевая вставка/последовательность.
Продукты реакции амплификации были идентифицированы в 2% агарозном геле. Фрагменты ДНК необходимого размера были выделены/очищены с использованием набора diaGene (ДиаМ, РФ) для элюции ДНК из агарозного геля.

1.2. Получение рекомбинантной плазмидной ДНК pQE30-Ig-TIM1, кодирующей иммуноглобулиновый домен гена TIM-1/HAVCR-1 человека.
Полученный фрагмент, кодирующий иммуноглобулиновый домен гена TIM-1 человека, был клонирован в вектор pQE30 (Qiagen). Вектор предварительно был обработан эндонуклеазами рестрикции BamHI и Hind III, находящимися в районе множественных сайтов клонирования. Лигирование вектора и целевой вставки проводили с помощью T4DNA Ligase (Invitrogen). Соотношение генома вставки к вектору было 0.09. На фиг.1 представлена физическая карта плазмиды pQE30-Ig-TIM1 с указанием генетических маркеров, а на фиг.2 приведена нуклеотидная последовательность целевой вставки плазмиды pQE30-Ig-TIM1 SEQ ID NO: 1.
Пример 2. Получение рекомбинантного штамма E.coli JM103-Ig-TIM1, трансформированного плазмидой pQE30-Ig-TIM1 и получение целевого белка.
2.1. Трансформация компетентных клеток. Компетентные клетки E.coli штамма JM103, приготовленные с использованием CaCl2, были трансформированы «тепловым шоком» лигазной смесью из примера 1 пункт 1.2, и затем культивировались на твердом агаре в чашках Петри с ампициллином в качестве селективного маркера. Был отобран клон, содержащий плазмиду с целевой вставкой, которую выявляли с помощью ПЦР, используя праймеры, комплементарные нуклеотидной последовательности вектора pQE30 и последовательности HAVCR-1 ХМ_024446022.1 (табл.1).
Из отобранного клона была выделена плазмидная ДНК pQE30-Ig-TIM1. Достоверность вставки и векторной системы была подтверждена секвенированием методом Сэнгера на приборе ABI 3130x1 Genetic Analyzer (Applied Biosystems, Япония) с помощью набора BigDye v3.1 согласно инструкции производителя с помощью праймеров комплементарных последовательностям HAVCR-1 (3,4, табл.1) и вектора pQE30 (5, 6 табл.1). На фиг.1 представлена физическая карта плазмиды pQE30-Ig-TIM1 с указанием генетических маркеров, а на фиг.2 - нуклеотидная последовательность целевой вставки плазмиды pQE30-Ig-TIM1 SEQ ID NO:l.
2.2. Культивирование рекомбинантного штамма E.coli JM103-Ig-TIM1, трансформированного плазмидой pQE30-Ig-TIM1 и синтез рекомбинантного белка protIg-TIM1, кодируемого иммуноглобулиновым доменом гена TIM-1 человека.
Компетентные клетки E.coli штамм JM103 были трансформированы плазмидой pQE30-Ig-TIM1 и культивировались на среде LB с ампициллином в качестве селективного маркера. Был отобран клон, несущий плазмиду pQE30-Ig-TIM1, и таким образом был получен штамм E.coli JM103-Ig-TIM1, обеспечивающий экспрессию рекомбинантного белка, кодируемого иммуноглобулиновым доменом гена TIM-1 человека. Штамм хранился на твердом агаре в чашках Петри и был также помещен с глицерином (1:3) на минус 70°С.
Рекомбинантный штамм бактерий E.coli JM103-Ig-TIM1, обеспечивал при культивировании на жидких питательных средах биосинтез белка protIg-TIM1 (целевой белок) с уровнем экспрессии не ниже 5 мг рекомбинантного белка в одном литре культуральной жидкости.
Пример 3. Наработка и очистка рекомбинантного белка protIg-TIM1.
3.1. Наработка белка. Штамм E.coli JM103-Ig-TIM1 из аликвоты, замороженной с глицерином, растили в 500 мл среды LB с 50 мкг/мл ампициллина при 37°С до ОП600 - 0,6-0,7. Экспрессия рекомбинатного белка была индуцирована изопропил-D-тио-галактопиранозидом (ИПТГ, Медиген, РФ) в концентрации 0.2 мМ и продолжалась в течение 12 часов. Биомассу осаждали центрифугированием 20 мин при 4000 об/мин, ресуспендировали в 8М мочевине (рН 8,8) и после обработки на ультразвуковом дезинтеграторе LABSONIC 2000 (Германия) вновь центрифугировали 20 мин при 10000 об/мин. Полученный супернатант осветленного лизата клеток анализировали электрофорезом в ПААГ ДСН. На фиг.4 представлены образцы осветленных лизатов клеток до индукции (дорожка 2) и после индукции (дорожка 3), а также белок после очистки, с визуализацией полосы белка предсказанного размера 13.5 кДа (дорожка 4). Выход белка составил 5 мг/л индуцированной культуры клеток.
3.2. Очистка белка. Проводили очистку белка от примесей никельхелатной хроматографией смолой Ni-NTA-Superflow (Qiagen, Германия). Элюцию белка со смолы проводили в 8 М мочевине (Amresco, США) с 300 мМ имидазолом (ICN Biomedicals Inc., США), рН 6.0. Расчетная молекулярная масса белка protIg-TIM1 составила 13,5 кДа. Белок был растворим в 8М и 4М мочевине рН 8,8. Концентрация очищенного препарата белка была определена с помощью Protein Assay Kit (Invitrogen, USA) на приборе Qubit fluorimeter (Invitrogen, Сингапур) и составила 2.24 мг/мл.
Рекомбинантный белок имел минимальный размер рекомбинантной части из 13 аминокислотных остатков (а.о.) на N-конце, включающий шестигистидиновую последовательность, позволяющую проводить одностадийную очистку белка никельхелатной хроматографией. Причем фактически открытая рамка считывания после шестигистидинового тракта включала аминокислоты комплементарные целевому белку с 20 а.о. (координаты по последовательности протеина HAVCR-1 ХР_024301790.1), из которых два первых а.о. (GS) совпали с а.о., транслируемых с последовательности сайта эндонуклеазы рестрикции BamHI. На С-конце белок заканчивался 124 а.о. (координаты по последовательности протеина HAVCR-1 ХР_024301790.1) и в добавок трех аминокислот от векторной конструкции pQE30 и стоп ко дона. Таким образом, рекомбинантный белок protIg-TIM1 (20-124 а.о., координаты по последовательности протеина HAVCR-1 ХР_024301790.1), кодируемый иммуноглобулиновым доменом гена TIM-1 человека, имел 104 а.о. и в добавок 16 а.о. от pQE30. Итого белок protIg-TIM1 содержал 120 а.о.
Очищенный препарат белка расфасовывали по пробиркам, замораживали и хранили при минус 20°С. Чистоту белковых препаратов оценивали электрофорезом в 15%-ном ПААГ в присутствии ДСН.
Указанный технический результат достигается тем, что получен рекомбинантный белок protIg-TIM1, характеризующийся аминокислотной последовательностью SEQ ID NO: 2, представленной на фиг.3. Пример 4. Получение поликлональных мышиных антител к белку protIg-TIM1 и исследование их продукции иммуноферментным анализом.
Гипериммунные мышиные сыворотки получали трехкратной иммунизацией животных. Работа с животными проводилась в соответствии с принципами гуманной экспериментальной практики, сформулированной в Европейской директиве 2010/63/EU. Все эксперименты с животными были одобрены комитетом по биоэтике ФБУН ГНЦ ВБ «Вектор», Кольцово, Россия.
Иммунизацию самок мышей линии BALB/C (питомник ФБУН ГНЦ ВБ ГНЦ ВБ «Вектор»), массой 16-18 г., с интервалом в две недели, проводили подкожным введением 5 мкг/мышь очищенного белка protIg-TIM1 в смеси с полным адъювантом Фрейнда («Sigma», США) в объеме 200 мкл при первой инъекции, и в смеси с неполным адъювантом Фрейнда при второй и третьей инъекции. Кровь собирали после декапитации. Сыворотку выделяли после образования сгустка центрифугированием. Образцы инкубировали 30 мин при 56°С для инактивации комплемента.
Предварительно перед иммунизацией из группы мышей часть животных использовали для получения контрольной сыворотки. Температура хранения сыворотки от минус 15°С до минус 25°С.
4.1. Наработка антител. Наработку антител к белку protIg-TIM1 человека в сыворотке, полученной после иммунизации мышей, исследовали методом иммуноферментного анализа (ИФА).
ИФА проводили следующим образом: в полистероловые планшеты наносили 100 мкл антигена в лунку и сорбировали при 4°С в течение ночи. Места неспецифического связывания насыщали 0,5% раствором казеина в ЗФР-Твин, содержащем 0.1% Tween-20 («Serva», Германия), рН-7.4 при 37°С 60 минут. Затем инкубировали со специфической сывороткой ночь при 4°С. Специфическое связывание выявляли антивидовыми, мечеными пероксидазой антителами против IgG. Хромоген - раствор ТМВ (1 мг/мл tetramethylbiphenyl, 0.03% перекиси водорода) в цитратно-фосфатном буфере (0.2М лимонной кислоты, 0.5М Na2HPO4, рН 5.0). По окончании инкубации содержимое лунок удаляли с помощью вошера и промывали 0,01 М ФСБ-Т. Выдерживали 20 мин. в темноте, останавливали реакцию добавлением 100 мкл на лунку IN HCl и измеряли оптическую плотность образцов на спектрофотометре «Multiskan» (Thermo Scientific) с использованием светофильтра с максимумом пропускания 450 нм. В качестве отрицательного контроля использовали антиген, осветленный лизат бактерий, трансформированных векторной плазмидой pQE30 не содержащей целевой вставки. Результаты ИФА представлены на фиг.4-5.
Для титрования антигена очищенного рекомбинантного белка protIg-TIM1 готовили его 2-х кратные разведения. Первая точка соответствовала концентрации 500 нг белка protIg-TIM1 человека, при этом сыворотка мышей была разведена в 1000 раз. При титровании коммерческой поликлональной сывороткой козы антиТ1М-1 человека (Invitrogen, США) рекомбинантного белка первая точка соответствовала концентрации 1000 нг белка protIg-TIM1.
Препарат сыворотки козы был использован в концентрации 2 мкг/мл или 200 нг/лунка.
4.2. Исследование продукции антител иммуноферментным анализом. Полученный рекомбинантный белок protIg-TIM1 (20-126 а.о., координаты по последовательности протеина HAVCR-1 ХР024301790.1), кодируемый иммуноглобулиновым доменом гена TIM-1 человека взаимодействовал с антителами, полученными после иммунизации мышей (первая точка соответствовала 500 нг белка) (фиг.5). Параллельно белок protIg-TIM1 анализировали в ИФА (первая точка соответствовала 1000 нг) с анти-TIM1 человека антителами козы (коммерческий препарат - #РА5-46914 Invitrogen, США), полученной на белок, кодируемый внеклеточным фрагментом гена TIM-1 человека с координатами «Ser21-Thr288 п.н.» и полученным в культуре клеток миеломы мыши NS0 (фиг.6). Оптическую плотность образцов определяли на спектрофотометре "Multiskan" (Thermo Scientific) с использованием светофильтра с максимумом пропускания 450 нм. Графики взаимодействия препарата очищенного рекомбинантного protIg-TIM1 с антителами, полученными после иммунизации мышей данным белком и с коммерческими анти-TIM1 человека антителами козы (Invitrogen) на белок, полученный в культуре клеток миеломы мыши NS0, были аналогичны по характеру распределения, что доказывает специфичность рекомбинантного белка protIg-TIM1, полученного в прокариотической системе, и по свойствам сравнимым с коммерческим протеином, полученным в культуре клеток эукариот и кодируемым внеклеточным фрагментом гена TIM-1 человека.
Таким образом, была подтверждена специфичность полученных антител к рецептору TIM-1 человека.
Полученная плазмидная ДНК pQE30-Ig-TIM1, содержащая район иммуноглобулинового домена гена TIM-1 человека, предполагается к использованию в качестве положительного контроля при разработке ПЦР-систем для выявления ДНК иммуноглобулинового домена гена TIM-1 человека, что было предпринято нами ранее [11].
Штамм продуцент E.coli JM103-Ig-TIM1 может быть использован для продукции белка protIg-TIM1 аналога рецептора TIM-1. Белок protIg-TIM1 может быть применим как самостоятельно в тест системах для ИФА, так и для наработки антител. Возможно использование антител к белку protIg-TIM1 как в тест системах для ИФА, так и для блокирования рецептора при научных исследованиях.
Здесь представлена открытая, поэтапная и детальная процедура получения плазмидной ДНК pQE30-Ig-TIM1. На наш взгляд это даст специалистам в данной области воспроизвести данную процедуру. Синтез белков в прокариотической системе позволяет получать относительно недорогие, нетрудоемкие и большие количества препарата.
Специфичность антител к рекомбинантному белку protIg-TIM1, полученному в прокариотических культуре клеток и кодируемому иммуноглобулиновым доменом гена TIM-1 человека, была показана в сравнении с коммерческими антителами к протеину, наработанному в эукариотической культуре клеток и кодируемому внеклеточным фрагментом гена TIM-1 человека, что является доказательством сохранения желаемой биологической активности белка наработанного в прокариотической системе.
Источники научно-технической и патентной информации.
1. Kaplan G., Totsuka A., Thompson P., Akatsuka Т., Moritsugu Y., Feinstone S. M. Identification of a surface glycoprotein on African green monkey kidney cells as a receptor for hepatitis A virus. Embo j 1996 15, 4282-4296.
2. Moresco R. N., Bochi G. V., Stein C. S., De Carvalho J. A. M., Cembranel B. M., Bollick Y. S. Urinary kidney injury molecule-1 in renal disease. Clin Chim Acta. 2018 Dec; 487:15-21.
3. Wang J, Qiao L, Hou Z, Luo G. TIM-1 promotes hepatitis С virus cell attachment and infection. J Virol 2017 91: eO 1583-16.
4. Kondratowicz A. S., Lennemann N J., Sinn P. L., Davey R. A., Hunt C. L., Moller-Tank S., Meyerholz D. K., Rennert P., Mullins R. F., Brindley
M., Sandersfeld L. M., Quinn K., Weller M., McCray P. В., Jr., Chiorini J., Maury W. T-cell immunoglobulin and mucin domain 1 (TIM-1) is a receptor for Zaire Ebolavirus and Lake Victoria Marburgvirus. Proc Natl Acad Sci U S A. 2011 108, 8426-8431,42.
5. ChuL-W., YangC.-J., Peng K.-J., ChenP.-L., Wang S.-J., PingY.-H. TIM-1 As a Signal Receptor Triggers Dengue Virus-Induced Autophagy. Int J Mol Sci. 2019 Oct 2;20(19):4893.
6. Zhang X., Liang C, WangH., Guo Z., RongH., Pan J., Li W., Pei R., Chen X., Zhang Z., Zhang X.-E., CuimBio Z. T-Cell Immunoglobulin and Mucin Domain 1 (TIM-1) Is a Functional Entry Factor for Tick-Borne Encephalitis Virus 2022 Jan-Feb; 13(1): e02860-21.
7. YangC, Zhang Y., ZengX., ChenH., Chen Y., Yang D., Shen Z., Wang X., LiuX., XiongM., ChenH., HuangK. Kidney injury molecule-1 is a potential receptor for SARS-CoV-2. Journal of Molecular Cell Biology, 2021 Vol 13, Is 3, March, P. 185-196.
8. Freeman G. J., Casasnovas J. M., Umetsu D. Т., De Kruyff R. H. TIM genes: a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity. Immunol Rev 2010 May; 235:172-189.
9. Khademi M., Illes Z., Gielen A. W., Marta M., Takazawa N., Baecher-Allan C, Brundin L., Hannerz Jan, Martin C, Harris R. A., Hafler D. A., Kuchroo V. K., Olsson Т., Piehl F., Wallstrom E. T Cell Ig- and Mucin-Domain-Containing Molecule-3 (TIM-3) and TIM-1 Molecules Are Differentially Expressed on Human Th1 and Th2 Cells and in Cerebrospinal Fluid-Derived Mononuclear Cells in Multiple Sclerosis. J Immunol June 1, 2004, 172 (11) 7169-7176.
10. Zheng, X., Xu, K., Chen, L., Zhou, Y. & Jiang, J. Prognostic value of TIM-1 expression in human non-small cell lung cancer. J Transl Med 2019 17, 178.
11. Бондаренко Т. Ю., Святченко В.А., Терновой В.А. Анализ уровня экспрессии гена человека TIM-1 методом количественной ПЦР в реальном времени // Российский иммунологический журнал. - 2019. - Т. 22. - №2-2. - С.722-724.
12. Патент Китая, CN, №101798351, МПК С07K 19/00, опубл. 11.08.2010. Recombinant expression of human TIM-1-Fc fusion protein (прототип).
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Приложение
Рекомбинантная плазмидная ДНК pQE30-Ig-TIM1.xml" softwareName="WIPO
Sequence" softwareVersion="2.2.0" productionDate="2022-10-19">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-10-19</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>1</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1</ApplicationNumberText>
<FilingDate>2022-10-19</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное бюджетное учреждение
науки «Государственный научный центр вирусологии и биотехнологии
«Вектор» Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора)</ApplicantName>
<ApplicantNameLatin>State Research Center of Virology and
Biotechnology "Vector"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Рекомбинантная плазмидная ДНК
pQE30-Ig-TIM1 обеспечивающая экспрессию иммуноглобулинового домена
гена TIM-1/HAVCR-1 человека в прокариотической системе E.
Coli</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>363</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..363</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagaggatcgcatcaccatcaccatcacggatccgtaaaggttggtg
gagaggcaggtccatctgtcacactaccctgccactacagtggagctgtcacatccatgtgctggaatag
aggctcatgttctctattcacatgccaaaatggcattgtctggaccaatggaacccacgtcacctatcgg
aaggacacacgctataagctattgggggacctttcaagaagggatgtctctttgaccatagaaaatacag
ctgtgtctgacagtggcgtatattgttgccgtgttgagcaccgtgggtggttcaatgacatgaaaatcac
cgtatcattggagattgtgccaaagcttaattag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>120</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..120</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MRGSHHHHHHGSVKVGGEAGPSVTLPCHYSGAVTSMCWNRGSCSLFTCQ
NGIVWTNGTHVTYRKDTRYKLLGDLSRRDVSLTIENTAVSDSGVYCCRVEHRGWFNDMKITVSLEIVPKL
N</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к биотехнологии. Предложена рекомбинантная плазмидная ДНК pQE30-Ig-TIM1, имеющая размер 3740 п.н. и обеспечивающая экспрессию белка protIg-TIM1 с аминокислотной последовательностью SEQ ID NO: 2 - аналога рецептора TIM-1/HAVCR-1/KIM-1/CD365 Т-клеточного иммуноглобулинового муцинового домена человека, кодируемого фрагментом гена TIM-1/HAVCR-1, в прокариотических клетках Е. coli для диагностических и научных исследований. Указанная рекомбинантная плазмидная ДНК pQE30-Ig-TIM1 содержит промотор фага Т5, имеющий координаты 10-54 п.н., RBS-сайт связывания рибосом, имеющий координаты 102-104 п.н., 6xHis-tag с координатами 127-144 п.н., сайты узнавания эндонуклеаз рестрикции BamHI с координатами 146-150 п.н. и Hind III 467-472 п.н., целевую нуклеотидную последовательность SEQ ID NO: 1 плазмиды pQE30-Ig-TIM1, имеющую координаты 151-466 п.н., ColE1 - ориджин репликации, с координатами 790-979 п.н., AmpR - ген β-лактамазы, с координатами 3536-2685 п.н. Изобретение обеспечивает эффективную экспрессию белка protIg-TIM1 в клетках Е. coli. 6 ил., 1 табл., 4 пр.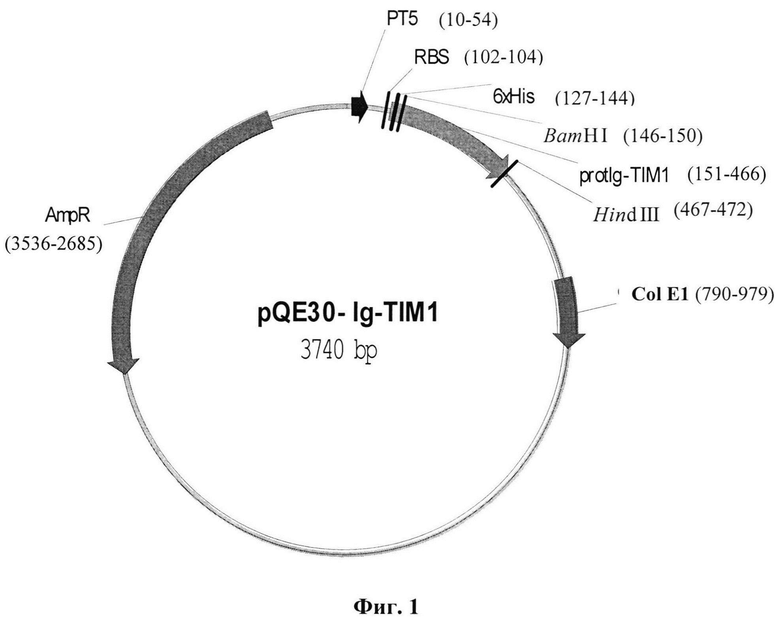
Рекомбинантная плазмидная ДНК pQE30-Ig-TIM1, имеющая размер 3740 п.н., обеспечивающая экспрессию белка protIg-TIM1 с аминокислотной последовательностью SEQ ID NO: 2 - аналога рецептора TIM-1/HAVCR-1/KIM-1/CD365 Т-клеточного иммуноглобулинового муцинового домена человека, кодируемого фрагментом гена TIM-1/HAVCR-1, в прокариотических клетках Е. coli для диагностических и научных исследований и содержащая:
- промотор фага Т5, имеющий координаты 10-54 п.н.;
- RBS-сайт связывания рибосом, имеющий координаты 102-104 п.н.;
- 6xHis-tag с координатами 127-144 п.н.;
- сайты узнавания эндонуклеаз рестрикции BamHI с координатами 146-150 п.н. и Hind III 467-472 п.н.;
- целевую нуклеотидную последовательность SEQ ID NO: 1 плазмиды pQE30-Ig-TIM1, имеющую координаты 151-466 п.н.;
- ColE1 - ориджин репликации, с координатами 790-979 п.н.;
- AmpR - ген β-лактамазы, с координатами 3536-2685 п.н.
| CN 101603047 A, 16.12.2009 | |||
| CN 101798351 A, 11.08.2010 | |||
| БОНДАРЕНКО Т.Ю | |||
| И ДР | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Российский иммунологический журнал, 2019, Т | |||
| Насос | 1917 |
|
SU13A1 |
| УСТРОЙСТВО ДЛЯ ПЕРЕРАБОТКИ СЫРОГО ТОРФА НА ТОРФЯНЫЕ КИРПИЧИ | 1918 |
|
SU722A1 |
| MINA EBRAHIMI ET AL | |||
| Development of a Stable Cell Line, Overexpressing Human T-cell Immunoglobulin Mucin | |||
Авторы
Даты
2024-04-15—Публикация
2023-03-06—Подача