Изобретение относится к области медицины и биотехнологии, конкретно к генетической инженерии, и представляет собой рекомбинантную плазмиду, несущую фрагмент генома аденовируса 5 типа с делецией в гене Е1В 55К, и полученный гомологичной рекомбинацией с использованием данной плазмиды мутантный штамм аденовируса человека Adel2, обладающий селективной противоопухолевой активностью.
Недавние исследования показали, что клетки различных типов человеческих злокачественных опухолей содержат делеции или мутации в гене р53, которые сопровождаются потерей некоторых функций кодируемого им белка [1]. Примерно 50% опухолей человека являются дефектными по р53, включая злокачественные опухоли легких (60%), кишечника (50%), груди (40%), яичников (60%), головы и шеи (60%) [2]. Мутации или делеции гена, кодирующего р53, представляют собой одну из основных причин, которая обуславливает устойчивость опухолевых клеток к стандартным терапевтическим воздействиям [3]. Ген-супрессор (tumor suppressor gene) p53 является одним из основных факторов, препятствующих размножению патологических клеток в организме. В ответ на различные повреждения, грозящие наследственно-передаваемыми изменениями генома (мутагенные воздействия, активация онкогенов, гипоксия и проч.), происходит активация p53, в результате которой клетка прекращает делиться либо погибает путем апоптоза [4, 5]. Однако ряд ДНК-содержащих вирусов, таких как аденовирусы, SV40 и вирус папиломы человека, кодируют белки, которые инактивируют р53 и тем самым позволяют им эффективно реплицироваться в нормальных клетках. Инактивация р53 обеспечивает жизнеспособность клетки в течение репродукции этих вирусов [4, 6, 8]. Район Е1В аденовирусного генома кодирует белок Е1В 55К, который связывает и инактивирует р53. Предполагается, что мутантные варианты вируса, которые не экспрессируют функциональный белок Е1В 55К будут неспособны эффективно реплицироваться в нормальных человеческих клетках, но будут сохранять репликативную активность в опухолевых клетках, дефектных по гену белка р53 и соответственно лизировать их.
В настоящее время в зарубежной литературе описаны различные варианты рекомбинантных штаммов аденовируса - как с делециями в различных участках генома, в том числе мутантный вариант аденовируса dl1520, несущий делецию 827 п.н. в области Е1В 55К гена [7, 9 - прототип], так и с клонированными в составе геномной ДНК генами, кодирующими рекомбинантные белки, обладающие антиопухолевой активностью [10, 11]. В работах J. R. Bischoff et аl. и С. Heise et аl. [9, 12] было показано, что мутантный вариант аденовируса dl1520 (другое название - ONYX-015) способен избирательно инфицировать и лизировать р53-дефектные опухолевые клетки человека in vitro, а также обладает онколитической активностью при интратуморальном и внутривенном введении бестимусным nu/nu мышам с привитыми опухолями человека. В настоящее время в США проводятся клинические испытания данного штамма на пациентах с различными формами злокачественных новообразований. Однако в более поздних исследованиях других авторов [13, 14], проведенных с мутантным штаммом dl1520, были получены результаты, противоречащие данным J.R. Bischoff и С. Heise. В этих работах на панели культур клеток, включающей как р53-дефектные и р53-позитивные опухолевые клетки человека, так и нормальные первичные линии клеток человека, было показано, что уровень репликативной активности dl1520 in vitro не коррелирует с р53 статусом использованных клеток. Более того, в работе Rothmann Т. et al. [14] отмечается, что мутантный штамм аденовируса dl1520 инфицирует и лизирует нормальные первичные клетки человека (МЕС - эпителиальные клетки грудной железы, FF105 - фибробласты крайней плоти) с эффективностью, близкой к дикому типу аденовируса. Таким образом, несмотря на то что dl1520 (ONYX-015) используется в настоящее время в клинической практике (фаза 1 клинических испытаний), существуют научно-обоснованные сомнения в его способности к избирательному инфицированию и лизису р53-дефектных опухолевых клеток человека.
Технической задачей изобретения является получение мутантного варианта аденовируса, несущего делецию в гене Е1В 55К, селективно реплицирующегося в р53-дефектных опухолевых клетках и обладающего онколитической активностью.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pAd5-f, несущей 3505 п.н. 5'-области геномной ДНК аденовируса с делецией 1118 п.н. в гене Е1В 55К, которая используется для получения мутантного варианта аденовируса Adel2 путем гомологичной рекомбинации.
Рекомбинантная плазмида pAd5-f характеризуется следующими признаками:
- имеет длину 6231 п.н. и молекулярную массу 4,05 кДа;
- содержит векторный фрагмент EcoRI-XbaI из плазмиды pRS-2 размером 2726 п.н.
- несет фрагмент EcoRI-XbaI 5'-области геномной ДНК аденовируса 5 типа размером 3505 п.н. с делецией после сайта терминации трансляции гена Е1В19К размером 1118 п. н. , содержащий сайт эндонуклеазы рестрикции SalI, непосредственно за которым введен сайт терминации трансляции гена Е1В 55К;
- несет следующие генетические маркеры: ген устойчивости к ампициллину;
- уникальные сайты эндонуклеаз рестрикции, имеющие следующие координаты:
SalI - 1604
EcoRI - 3945
Kpn2.1 - 3114
XhoI - 430
Способ конструирования плазмиды pAd5-f заключается во встраивании продуктов амплификации, полученных при использовании рассчитанных праймеров и матрицы аденовирусной ДНК 5 типа в плазмиду pRS-2 (производная от pUC18 с добавленными уникальными сайтами в полилинкере) по соответствующим сайтам полилинкера.
Схема конструирования описана в примере 1 и проиллюстрирована фиг.1. Для создания мутантного варианта аденовируса были проведены эксперименты по совместной контрансфекции плазмиды pAd5-f, линеаризованной по сайту EcoRI, и аденовирусной ДНК, обработанной эндонуклеазой рестрикции ClaI и щелочной фосфатазой CIAP. Трансфекцию проводили кальций-фосфатным методом преципитации. Отбор мутантных штаммов проводили с помощью ПЦР со специфическими праймерами. Продукт амплификации Adel2 был проверен рестриктным картированием и частичным секвенированием района, примыкающего к месту делеции.
Сущность изобретения заключается в том, что используя целевую плазмидную ДНК pAd5-f, несущую фрагмент 5'-области геномной ДНК аденовируса 5-го типа размером 3505 п.н. с делецией в гене Е1В 55К, размером 1118 п.н. после сигнала терминации трансляции гена Е1В 19К, имеющую сайт для эндонуклеазы рестрикции SalI, непосредственно за которым введен сигнал терминации трансляции гена Е1В 55К, получают путем гомологичной рекомбинации мутантный штамм аденовируса Adel2, обладающий специфичной противоопухолевой активностью для р53-дефектных опухолевых клеток.
Полученный мутантный вариант аденовируса 5 типа Adel2 отличается от прототипа мутантного аденовируса dl1520 протяженностью делеции в гене Е1В 55К (в прототипе 827 п.н., в заявляемом вирусе 1118 п.н.), а также наличием уникального сайта рестрикции SalI, позволяющего использовать его в дальнейшем для встройки специфичных нуклеотидных последовательностей, усиливающих селективность данного мутантного варианта. Полученный штамм Adel2 характеризуется следующими признаками:
Морфологические признаки.
Мутантный вариант Adel2 обладает всеми типичными морфологическими свойствами аденовирусов 5 типа.
Физико-биохимические признаки.
ДНК штамма Adel2 имеет длину 34817 п.н. (дикий тип аденовируса 5-го серотипа - 35935 п.н.), при этом нарушена открытая рамка считывания гена Е1В 55К, структурные белки не отличаются от белков вируса дикого типа.
Патогенность для животных.
Исследование биологических свойств штамма Adel2 на животных показало, что штамм не патогенен для лабораторных животных. В стандартных тестах на токсичность, безвредность и специфичность рекомбинантный штамм не отличается от исходного штамма аденовируса 5 типа (Ad5).
Репликативные свойства штамма.
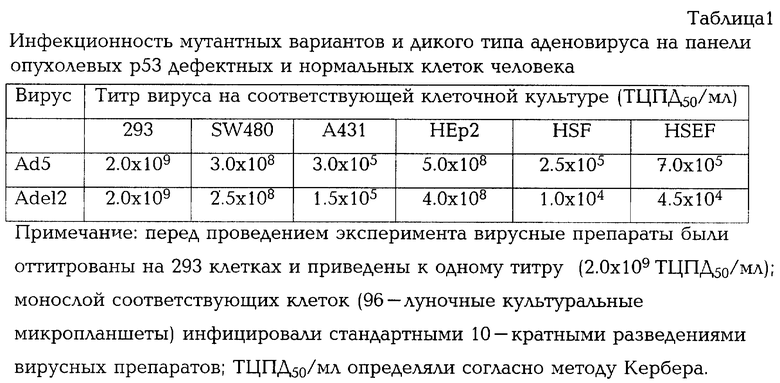
Мутантный вариант Adel2, несущий делецию гена Е1В 55К, обладает высокой степенью репликативной активности для комплементарных клеток 293 и р53-дефектных опухолевых клеток (А431, SW480 и НЕр2) и, в то же время, имеет существенные ограничения по репликации в нормальных фибробластах кожи взрослого человека (HSF) и эмбриональных фибробластах кожи человека (НSЕF) (табл.1).
Онколитическая активность штамма.
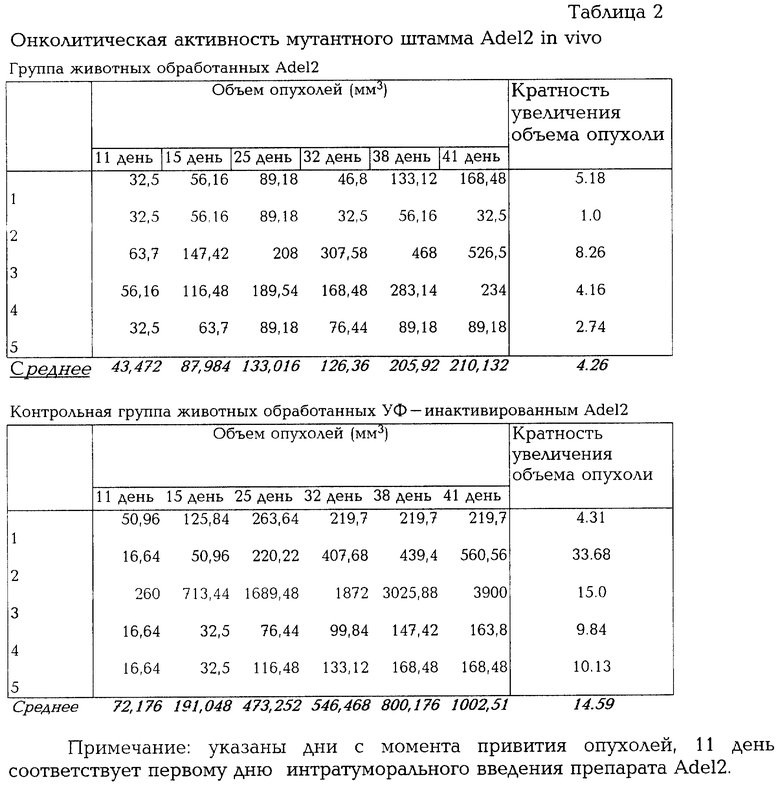
Штамм Adel2 обладает выраженным ингибирующим действием на развитие привитой nu/nu мышам опухоли человека (линия клеток А431). Штамм мутантного аденовируса Adel2 депонирован в НИИ ККМ ГНЦ ВБ "Вектор" под номером V-336.
Изобретение иллюстрируется следующими графическими изображениями:
Фиг. 1 - схема рекомбинантной плазмиды pAd5-f и способ ее конструирования.
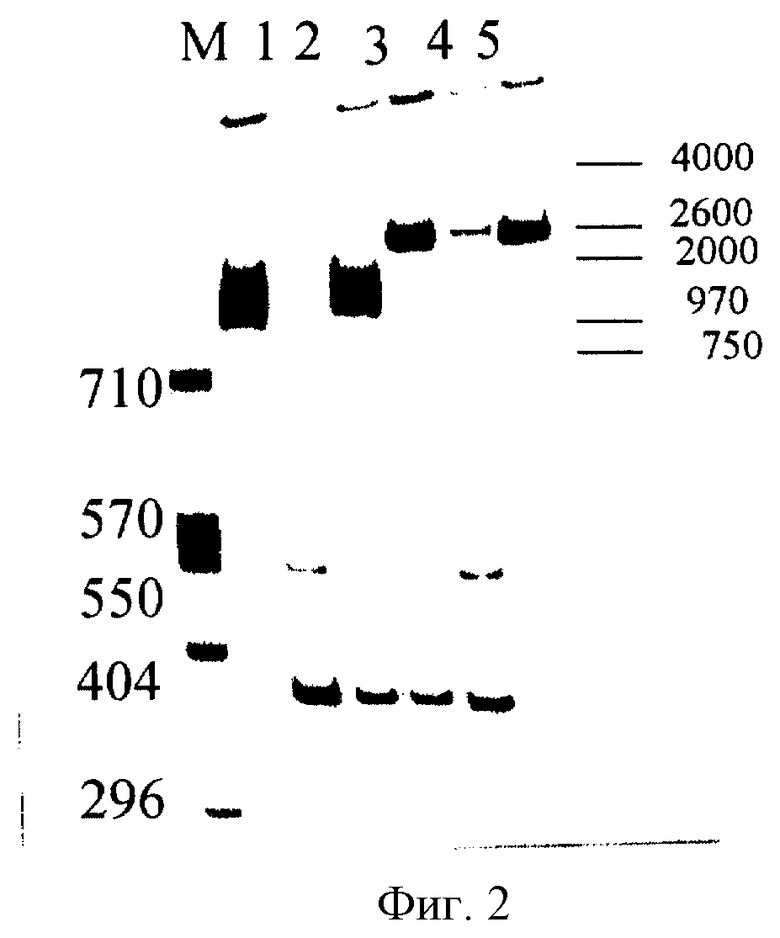
Фиг.2 - ПЦР-анализ ДНК мутантного аденовируса Adel2, где: М - маркеры, 1 - плазмида pAd5-f, 2 - контроль клеточной культуры, 3 - Adel2, 4, 5, 6 - дикий штамм аденовируса 5 типа.
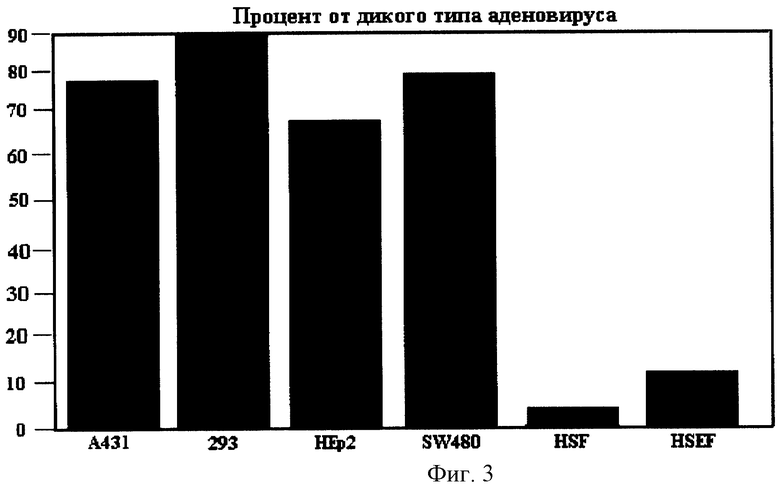
Фиг. 3 - уровень репродукции мутантного вируса Adel2 в р53-дефектных опухолевых и нормальных клетках, где А431, SW480 и Нер2 - р53-дефектные опухолевые клетки человека; 293 - эмбриональные клетки почки человека, трансформированные генами Е1А и Е1В аденовируса; HSF - фибробласты кожи человека; HSEF - эмбриональные фибробласты кожи человека.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмидной ДНК pAd5-f.
Процедуры обработки плазмидных ДНК эндонуклеазами рестрикции, ферментами модификации, электрофоретического разделения гидролизатов ДНК, полимеразной цепной реакции, выделения фрагментов ДНК из агарозного геля, проведения лигазных реакций, трансфекции эукариотических клеток, выделения плазмидных ДНК, секвенирования по методу Сэнгера проводят в соответствии со стандартными генно-инженерными методами.
Специфические олигонуклеотиды 603, 609, 610, 608, А, F рассчитывают по последовательности Ad5 с помощью программы Оligo 3,0.
Последовательности олигонуклеотидов:
603 5'-CGGAATTCGAGTGCCAGCGAGTAGAGТТТT-3'
609 5'-ACGCGTCGACCTCCCTCТТТACCCCCТТТAGC-3'
610 5'-ACGCGTCGACGTGATGCTGGATGTGACCGA-3'
608 5'-CGCGGATCCACAAGGGCGTCTCCAAGTT-3
А 5'-GCCAGCCTCGTGGCAGGTAAGATCG-3'
F 5'-CGGAATTCATCATCAATAATATACCTTAТТТTGG-3'
Выделение геномной ДНК аденовируса 5 типа для проведения полимеразной цепной реакции проводят следующим образом.
На первом этапе наработку дикого типа аденовируса человека 5-го серотипа (Ad5) осуществляют на субконфлюентной монослойной культуре клеток 293 (клетки почки эмбриона человека, трансформированные генами Е1А и Е1В Ad5). При достижении 70% цитопатогенного воздействия вируса на клеточную культуру клетки отбирают и концентрируют центрифугированием (1500 g, 5 мин). Гомогенат инфицированных клеток экстрагируют равным объемом фтористого углерода, затем водную фракцию, содержащую вирус, центрифугируют на градиенте хлористого цезия (1/45-1/33 г/мл, 2 ч при 90000 g). Для освобождения вируса от остаточных количеств клеточных компонентов проводят дополнительную очистку на преформированном градиенте хлористого цезия (1/45-1/33 г/мл, 6 ч при 100000 g). Фракцию, содержащую вирус, отбирают и разводят в соотношении 1:4 трис-ЭДТА буфером и проводят высокоскоростное центрифугирование для осаждения вируса, после чего осадок ресуспендируют в 3 мл трис-ЭДТА буфера (5 мМ трис-HCl, 1 мМ ЭДТА, рН 7,8).
На втором этапе из очищенного вируса выделяют вирусную ДНК. Для этого к вирусному препарату добавляют протеиназу-К до концентрации 20 мкг/мл и лаурилсаркозилат натрия до концентрации 0,5%, инкубируют при 37oС в течение 3 часов. Затем в пробирку вносят равный объем фенола, насыщенного буфером Трис-HCl; рН 8,0. Раствор перемешивают и центрифугируют 2000 g, 10 мин. Верхнюю водную фазу переносят в другую пробирку, ДНК осаждают добавлением 2х объемов этилового спирта с последующим центрифугированием 2000 g, 10 мин. Осадок растворяют в 100 мкл дистиллированной воды.
Для полимеразной цепной реакции используют геномную ДНК аденовируса 5 типа, выделенную фенольным методом. Применяют следующие температурные режимы с 1 по 36 цикл: 95oС - 20 с, 50oС - 20 с, 72oC - 30 с, 37 цикл 95oС - 20 с, 50oС - 20 с, 72oС - 7 мин. Продукт амплификации (10 мкг) 603/609 1827 п.н. обрабатывают эндонуклеазами рестрикции EcoRI-SalI ("СибЭнзим"). 2 мкг плазмидной ДНК pRS-2 обрабатывают рестриктриктазами EcoRI-SalI. Аликвоты ПЦР-фрагмента и плазмидной ДНК используют для проведения лигазной реакции в обьеме 20 мкл. 10 мкл лигазной смеси используют для трансформации компетентных клеток E.coli JM103. Трансформанты рассеивают на LB-агар, содержащий 100 мкг/мл ампициллина. Выросшие клоны используют для наработки и выделения рекомбинантных плазмидных ДНК. Плазмидные ДНК далее подвергают рестриктному картированию и клоны, несущие целевую вставку 1827 п.н. (pAd1), нарабатывают, выделяют и используют как вектор для клонирования второго продукта амплификации 610/608. Амплифицированный продукт 610/608 1157 п.н. (10 мкг) обрабатывают эндонуклеазами рестрикции SalI-BamHI. Плазмидная ДНК pAd1 (2 мкг) обрабатывается рестриктазами SalI-BglI, далее полученный гидролизат подвергают дефосфорилированию с использованием щелочной фосфатазы, выделяют векторную плазмидную ДНК. Аликвоты фрагмента ПЦР и векторной ДНК используют для проведения реакции лигирования в объеме 20 мкл, и 10 мкл лигазной смеси берут на трансформацию компетентных клеток. Клоны, несущие целевую вставку 2984 п. н. 5'-области аденовирусной ДНК (pAd5) нарабатывают и используют как вектор для встройки фрагмента ПЦР амплификации AF длиной 932 п.н. 2 мкг плазмидной ДНК pAd5 обрабатывают эндонуклеазами рестрикции EcoRI-Крn2,1; полученный гидролизат разделяют с помощью электрофореза в 1% агарозном геле; выделяют векторную часть плазмиды длиной 5421 п.н. 10 мкг продукта ПЦР-амплификации AF обрабатывают эндонуклеазами рестрикции EcoRI-Kpn2,1; полученный гидролизат разделяют с помощью электрофореза в 1,5% агарозном геле; выделяют фрагмент 827 п. н. Аликвоты фрагмента ПЦР и векторной ДНК используют для проведения реакции лигирования в объеме 20 мкл, и 10 мкл лигазной смеси берут на трансформацию компетентных клеток E.coli JM103. Трансформанты рассевают на LB-агар, содержащий 100 мкг/мл ампициллина. Выросшие клоны используют для наработки и выделения рекомбинантных плазмидных ДНК, которые анализируют рестриктным картированием и далее клоны, несущие целевую вставку 3505 п.н. нарабатывают для детального рестриктного картирования и секвенирования методом Сэнгера. Целевая плазмида pAd5-f включает фрагмент 5'-области геномной ДНК аденовируса 5 типа длиной 3505 п.н. с делецией в области гена Е1В 55К и содержит уникальный рестриктный сайт SalI. Схема плазмидной ДНК pAd5-f и способ ее конструирования представлены на фиг.1.
Сконструированную рекомбинантную плазмидную ДНК pAd5-f используют для гомологичной рекомбинации с аденовирусной ДНК и получения мутантного варианта вируса с делецией в гене Е1В 55К.
Пример 2. Получение мутантного аденовируса Adel2.
Для трансфекции культур клеток используют ДНК вируса Ad5, находящуюся в комплексе с терминальным белком, которую получают из очищенного вирусного препарата гуанидин-хлоридным методом. Для этого к вирусной суспензии добавляют равный объем 8 М гуанидин-хлорида, раствор перемешивают и наносят на хроматографическую колонку с сефарозой-4В, уравновешенную 4 М гуанидин-хлоридом. ДНК, выходящую в первом пике оптической плотности, собирают, диализуют против 0,01 М Трис-НСl буфера, содержащего 0,001 М ЭДТА, разливают по аликвотам, замораживают и хранят в жидком азоте.
Для котрансфекции 10 мкг плазмиды pAd5-f обрабатывают эндонуклеазами рестрикции EcoRI, 15 мкг ДНК аденовируса 5 типа обрабатывают эндонуклеазами рестрикции ClaI и ферментом модификации щелочной фосфатазой CIAP. Кубарики с монослоем перевиваемой линии клетки почки эмбриона человека, трансформированные генами Е1А и Е1В Ad5, промывают фосфатным буфером, и проводят совместную ко-трансфекцию 1 мкг вирусной ДНК в комплексе с терминальным белком в смеси с 10-кратным избытком плазмидной ДНК по стандартной кальций-фосфатной методике трансфекции. К 450 мкл смеси линеаризованной плазмидной ДНК pAd5-f и аденовирусной ДНК в стерильной деионизованной воде добавляют 50 мкл 2,5 М CaCl2. К 500 мкл буфера HEPES добавляют полученную смесь ДНК/СаСl2 и оставляют на 20 мин для формирования преципитата. Наносят на клеточный монослой преципитат и среду DMEM без сыворотки. Через сутки удаляют среду и добавляют нормальную ростовую среду DMEM с гентамицином и 10% FCS. Через пять суток после проведения трансфекции обнаруживается цитопатогенное воздействие на культуру клеток в случае трансфекции нативной ДНК и в случаях трансфекции клеток обработанной EcoRI аденовирусной ДНК совместно с линеаризованной плазмидой pAd5-f. Для предварительного подтверждения наличия целевых мутаций в геноме полученных в результате трансфекции вирусов проводят ПЦР-анализ. В качестве матрицы используются вирусные ДНК, выделенные из препаратов полученных вариантов аденовируса в результате трехкратного клонирования методом бляшек. При проведении ПЦР используются праймеры 605/608.
Последовательности праймеров
605: 5'-TCTGAGCGGGGGGTACCTGCTGGATT-3'
608: 5'-CGCGGATCCACAAGGGCGTCTCCAAGTT-3
В результате ПЦР амплифицируется продукт 1422 п.н. (в контроле с диким штаммом продукт ПЦР 2540 п.н.). Результаты ПЦР анализа, подтверждающие наличие целевой делеции в гене Е1В 55К, представлены на Фиг.2.
Препаративную наработку клонированного через бляшку мутантного варианта Adel2 проводят на культуре клеток 293. Полученный препарат вируса очищают в градиенте хлористого цезия, после чего фенольным методом выделяют соответствующую вирусную ДНК. На следующем этапе методом полимеразной цепной реакции с использованием в качестве матрицы геномной ДНК варианта Adel2 амплифицируют фрагмент генома, соответствующий Е1В 55К (2048-4582 п.н.). После чего амплифицированные фрагменты секвенируют согласно методу Сэнгера.
Определение нуклеотидной последовательности гена Е1В 55К мутантного варианта Adel2 показывает делецию 1118 п.н. (длина интактного гена 1488 п.н.) после сигнала терминации трансляции гена Е1В 19К. Кроме того, имеется сайт для эндонуклеазы рестрикции SalI, вносимый в процессе конструирования мутантного штамма Adel2. Непосредственно за сайтом для SalI расположен сигнал терминации трансляции гена Е1В 55К.
Пример 3. Характеристика репликативных свойств Adel2 на р53-дефектных опухолевых клетках и нормальных фибробластах человека.
Для культивирования клеточных культур и наработки вирусных штаммов используют среду Dulbecco modified Eagle medium (DMEM) и фетальную сыворотку (FCS) производства Life Technology (Gibco BRL, Germany). Клетки 293, HEp2, SW480 и А431 (р53-дефектные опухолевые клетки человека) культивируют как монослойные культуры на среде DMEM, содержащей 10% FCS с 80 мкг/мл гентамицина сульфата. Нормальные первичные фибробласты кожи человека и фибробласты кожи эмбриона человека (HSF и HSEF соответственно) культивируют как монослойные культуры на среде DMEM, содержащей 10% FCS с 80 мкг/мл гентамицина сульфата.
После дополнительного клонирования мутантного варианта Adel2 и подтверждения методом полимеразной цепной реакции отсутствия примеси дикого типа аденовируса в препаратах Adel2 проводят исследования инфекционности мутантного варианта для нормальных фибробластов человека и различных р53-дефектных опухолевых клеток в сравнении с диким типом аденовируса. Инфекционность Adel2 и дикого типа аденовируса оценивают по цитолитическому воздействию на культуры клеток и по их репродуктивной активности на панели исследуемых культур клеток. Исследование цитолитической активности мутантного варианта и дикого типа аденовируса на панели р53-дефектных опухолевых и нормальных клеток человека проводят микрометодом согласно Chanas et al. на 96-луночных культуральных планшетах (Costar); инфекционный титр вирусов для соответствующих типов клеток выражают через ТЦПД50 (50% тканевая цитопатогенная доза). Перед проведением эксперимента препараты Adel2 и дикого типа аденовируса титруют на 293 клетках и приводят к одному титру. Результаты представлены в табл.1. Для определения репродуктивных свойств вирусов нормальные фибробласты и р53-дефектные опухолевые клетки человека инфицируют Adel2 или диким типом аденовируса с множественностью 1 БОЕ/кл. Через 48 ч после инфицирования соответствующий вирус освобождают из клеток посредством трехкратного перемораживания; полученные после центрифугирования супернатанты титруют на 293 клетках. Количество Adel2, продуцированного через 48 ч после инфицирования, нормализуют против количества дикого типа аденовируса, продуцированного в той же клеточной линии за тот же период времени. Результаты представлены на фиг. 3. Мутантный вариант Adel2, несущий делецию гена Е1В 55К, инфицирует комплементарные клетки 293 и р53-дефектные опухолевые клетки (А431, SW480 и НЕр2) с эффективностью дикого типа аденовируса. В то же время, он имеет существенные ограничения по репликации в нормальных р53-позитивных фибробластах кожи взрослого человека и эмбриональных фибробластах кожи человека в сравнении с диким типом аденовируса.
Пример 4. Исследование онколитической активности мутантного штамма Adel2
Для исследования онколитической эффективности мутантного варианта Adel2 в экспериментах in vivo проводят его препаративную наработку с последующей очисткой в градиенте плотности хлористого цезия. Полученный препарат титруют на культуре клеток 293, инфекционные титры должны быть не менее 5•1010 БОЕ/мл.
Исследование онколитической активности проводят на 8-недельных бестимусных nu/nu мышах, прошедших предварительный двухнедельный карантин и содержащихся в асептических условиях. Для прививки животным используют культуру опухолевых клеток человека А431. Согласно литературным данным, эти опухолевые клетки человека эффективно формируют опухоли при подкожном введении nu/nu мышам. 1,0•107 клеток в 0,2 мл DMEM инъецируют подкожно в каждый бок nu/nu мышей. Объем опухолей определяют согласно следующей формуле: (максимальная длина) • (перпендикулярная ширина)2/2. Прививка мышам клеток А431 обычно приводит к прогрессивному росту опухолей у всех животных. По достижению опухолей А431 объема, который позволяет осуществить интратуморальное введение, опухоли обрабатывают препаратом Adel2. С этой целью в каждую опухоль инъецируют 109 БОЕ исследуемого препарата в 60 мкл DMEM (по 15 мкл в каждый квадрант опухоли). Инъекции проводят ежедневно в течение 5 дней. Контрольные опухоли (привитые контрольным животным) обрабатывают по той же схеме препаратом инактивированного ультрафиолетовым облучением Adel2. Результаты представлены в табл.2. Они свидетельствуют о том, что обработка опухолей препаратом Adel2 приводит к выраженному ингибированию роста опухолевых клеток как по средним значениям объемов опухолей, так и по кратности увеличения объемов с начала наблюдения до его завершения.
Таким образом, сконструирована рекомбинантная плазмидная ДНК pAd5-f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е1В 55К, и получен гомологичной рекомбинацией с использованием данной плазмиды мутантный штамм аденовируса человека Adel2, обладающий селективной противоопухолевой активностью.
ЛИТЕРАТУРА
1. Hollstein, M. , D. Sidnarsky, B. Vogelstein, and С.С. Harris (1991) p53 mutations in human cancers. Science 253: 49-53.
2. Chang, F., Syrianen, S. & Syrianen, K. (1995) Implications of the p53 tumor-suppressor gene in clinical oncology. J. Clin. Oncol. 13, 1009-1022.
3. Lowe, S.W. et al. (1994) p53 status and the efficacy of cancer therapy in vivo. Science 266, 807-810.
4. Debbas, M. & White, E. (1993) Wild-type p53 mediates apoptosis by E1A, which is inhibited by E1B. Genes Dev. 7, 546-554.
5. Lowe, S. W. , Ruley, H.T., Jacks, T. & Housman, D.E. (1993) p53-dependent apoptosis modulates the cytotoxicity of anticancer agents. Cell 74, 957-967.
6. Cannon, J.V. & Lane D.P. (1987) p53 and DNA polymerase alpha complete for binding to SV40 T antigen. Nature 329, 456-458.
7. Патент США N 5801029, кл. МПК 6 С 12 N 15/01, опубликовано в 1998 г.
8. Lechner, M.S. et al. (1992) Human papillomavirus E6 proteins bind p53 in vivo and abrogate p53-mediated repression of transcription. EMBO J. 11, 3045-3052.
9. Bischoff J. R., Kirn D.H., Williams A., Heise C., Horn S., Muna M., McCormick F. (1996) An adenovirus mutant that replicates selectively in p53-deficient human tumor cells. Science, 274, 373-376.
10. Li J.H., Lax S.A., Kim J., Klamut H., Liu F.F. (1999) The effects of combining ionizing radiation and adenoviral p53 therapy in nasopharyngeal carcinoma. Int. J. Radiat. Oncol. Biol. Phys. 43 (3), 607-616.
11. Marr R. A. , Hitt M., Muller W.J., Gauldie J., Graham F.L. (1998) Tumor therapy in mice using adenovirus vectors expressing human TNFa. Int. J. Oncol., 12 (3), 509-515.
12. С. Heise, A. Sampson-Johannes, A. Williams, F. McCormick, D. Von Hoff & D. Kien (1997) ONYX-015, an E1В gene-attenuated adenovirus, causes tumor-specific cytolysis and antitumoral efficacy that can be augmented by standard chemotherapeutic agents. Nature Medicine, 3 (6), 639-644.
13. F. Goodrum & D. Ornells (1998) p53 status does not determine replication of ONYX-015. J. Virol. 72 (12), 9479-9490.
14. Т. Rothmann, A. Hengstermann, N. Whitaker, M. Scheffner, & H. Hausen (1998) Replication of ONYX-015, a potential anticancer adenovirus, is independent of p53 status in tumor cells. J. Virol. 72 (12), 9470-9478.
Изобретение относится к медицине и биотехнологии, в частности к генной инженерии. Изобретение представляет собой рекомбинантную плазмидную ДНК рAd5-f и мутантный штамм аденовируса человека Ade12. Рекомбинантная плазмидная ДНК несет фрагмент генома аденовируса 5 типа с делецией в гене Е1В-55К. Мутантный штамм аденовируса, полученный гомологичной рекомбинацией с использованием плазмиды pAd5-f, обладает селективной противоопухолевой активностью. Штамм может быть использован в качестве основы для создания эффективного противоопухолевого препарата. 2 с.п.ф-лы, 3 ил., 2 табл.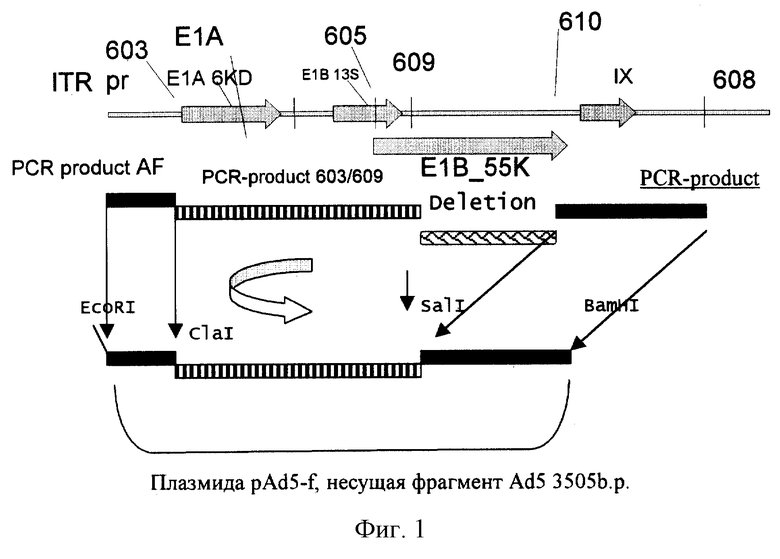
| US 6013638, 11.01.2000 | |||
| US 5589377, 31.12.1996 | |||
| Автоматическое устройство для выпуска конденсата из ресивера транспортного средства | 1985 |
|
SU1258742A1 |
| ШТАММ ADENOVIRUS CANIS 2 ДЛЯ ИЗГОТОВЛЕНИЯ И КОНТРОЛЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ АДЕНОВИРОЗА СОБАК | 1988 |
|
RU1568520C |
| ШТАММ "АДВ" ВИРУСА ГИДРОПЕРИКАРДИТА ПТИЦ СЕМЕЙСТВА ADENOVIRIDAE | 1996 |
|
RU2120993C1 |
Авторы
Даты
2002-12-20—Публикация
2001-03-05—Подача