Изобретение относится к области иммунохимической (молекулярно-биологической) диагностики аналитов, используемых в качестве клинически значимых маркеров инфекционных, соматических и генетических заболеваний. Данная технология позволяет проводить тестирование образцов биологической природы, включая цельную кровь, плазму, сыворотку, мочу, слюну, пот и другие биологические и физиологические жидкости (Schramm Е.С. et al. // Anal. Biochem. - 2015. - Vol. 477. - P. 78-85; Ang S.H., et al. // Biosens. Bioelectron. - 2015. - Vol. 78. - P. 187-193; Magambo K.A. et al. // J. Int. AIDS Soc. - 2014. - Vol. 17. - P. 19040; De Giovanni N. et al. // Curr. Med. Chem. - 2013. - Vol. 20. - P. 545-561).
В патенте (US 2020/0348298 A1, МПК: G01N 33/54388, публикация: 5.11.2020) описан способ определять точные концентрации аналитов, если в образце присутствует один или несколько аналитов в высокой концентрации и один или несколько аналитов в низкой концентрации. Использование данного формат может быть полезным для случая, когда необходимо провести анализ нескольких биоаналитов в одинаковых условиях, или анализ взаимозависимых биоаналитов. Каждый из выявляемых аналитов определяется на хроматографической мембране в виде окрашенной, люминесцирующей или магниточувствительной полосы в зоне специфического связывания искомого аналита (Zhang X. et al. // Journal of Agricultural and Food Chemistry. - 2017. - Vol. 65. N. 36. - P. 8063-8071). Мультиплексность подобных тестов, как правило, не превышает 4-5 аналитов при ширине аналитической зоны 1 мм и расстоянии между зонами 2 мм (Kong D. et al. // Nanoscale. - 2016. - Vol. 8. N. 9. - P. 5245-5253).
Для увеличения мультиплексности анализа и снижения расхода иммунореагентов используют зоны специфического связывания аналитов в виде микрозон (микроточек) на мембране, площадь которых существенно меньше, чем площадь реагентов нанесенных в виде аналитической полоски, перпендикулярной латеральному потоку жидкости пробы. Известны мультиплексные тест-системы с точечным нанесением иммунореагентов, позволяющие определять семь вирусных и один бактериальный фитопатоген (Safenkova I.V. et al. // Analytical and Bioanalytical Chemistry. - 2016. - Vol. 408. N. 22. - P. 6009-6017), четыре психоактивных вещества в моче (Taranova N.A. et al. // Microchimica Acta. - 2013. - Vol. 180. N. 11-12. - P. 1165-1172).
Формирование аналитических зон на хроматографической мембране в виде микрозон практически не ограничивает чувствительность анализа, так как удельный сигнал на единицу площади эквивалентен уровню сигнала, наблюдаемому при формировании аналитической зоны в виде полоски, расположенной перпендикулярно латеральному потоку жидкости.
Детектирование сигнала в микрозонах, как правило, осуществляется с помощью светопоглощающих или люминесцирующих наночастиц, содержащих на поверхности ковалентно связанные лиганды (антитела, антигены, олигонуклеотиды и т.п.). Существенно более высокую чувствительность (по сравнению со светопоглощающими материалами) обеспечивают люминесцирующие наночастицы. Известно применение флуоресцирующих наночастиц (Sakurai A. et al. // PLoS One. - 2015. - Vol. 10. N. 2. - P. e0116715), квантовых точек (Taranova N.A. et al. // Biosensors and Bioelectronics. - 2015. - Vol. 63. - P. 255-261), антистоксовых люминесцирующих наночастиц, а также наночастиц с длительно люминесцирующими соединениями, например комплексонами ионов европия, время затухания люминесценции которых составляет несколько сотен микросекунд (Chen K. et al. // Int J Environ Res Public Health. - 2021. - Vol. 18. N. 9. - P. 4574. doi: 10.3390/ijerph18094574; Valanne A. et al. // J. Clin. Virol. - 2005. - Vol. 33. - P. 217-223; Jaakohuhta S. et al. // Int. J. Food Microbiol. - 2007. - Vol. 114. - P. 288-294). Иммунохроматографический анализ с использованием наночастиц с комплексонами ионов европия в качестве проявляющего реагента нашел широкое применение в in vitro диагностике инфекционных и соматических заболеваний.
Наиболее близким аналогом предлагаемому нами способу является способ проведения иммунохроматографического анализа с использованием регистрации сигнала люминесценции ионов европия в режиме временного разрешения (Wang Q. et al. // Food Control - 2019, - Vol. 109, - P. 106894; Zhou, Y.L. et al. // Anal. Chim. Acta - 2012, - Vol. 722, - P. 95-99). На мировом рынке представлен ряд компаний выпускающих иммунохроматографические диагностические тесты и соответствующее оборудование для выявления инфекционных и соматических заболеваний на основе этой технологической платформы (Polysciences, Inc; Thermo Fisher Scientific Inc.; EPRUI Biotech Co. Ltd.; Innova Biosciences, Ltd; Novus Biologicals, LLC; Ocean NanoTech, LLC; Suzhou Vdo Biotech Co., Ltd; GeTein BioMedical Inc; Medisensor, Inc.; Precision Biosensor; Sugentech, Inc; Nano-Ditech Corp.; Quidel Corporation Headquarters; ABINGDON HEALTH; Bioscience (Tianjin) Diagnostic Technology Co., Ltd).
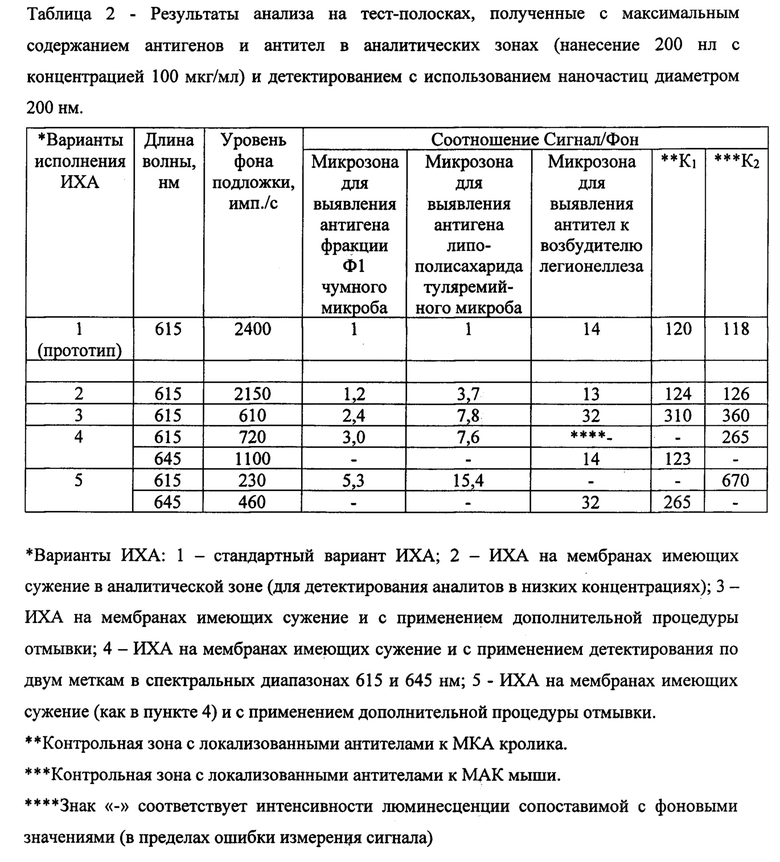
Способ проведения мультиплексного иммунохроматографического анализа определения нескольких аналитов в пробе, включает инкубацию пробы на мембранном хроматографическом композите (тест-полоске) и последующую регистрацию сигнала люминесценции от комплексов ионов европия в аналитических и контрольных микрозонах. Мембранный хроматографический композит (фигура 1) представляет собой узкую полоску пластика шириной 3-5 мм (позиция 1) на которой располагаются: стартовая всасывающая мембрана с нанесенными на нее наночастицами (позиция 3), содержащими комплексы ионов европия и специфичные к искомым аналитам биолиганды; контактирующая с ней хроматографическая нитроцеллюлозная мембрана (позиция 2) для тонкослойной хроматографии (длиной 4-5 см) на которой иммобилизованы реагенты для связывания аналитов в виде аналитических и контрольных микрозон размером 0,5-1 мм (позиции 4, 5, 6); и сорбирующая подушечка (позиция 7) необходимая для адсорбции пробы прошедшей по хроматографической тонкослойной мембране. Сорбирующая подушечка имеет свободный объем сопоставимый с объемом анализируемой пробы (100-150 мкл).
Регистрация сигнала осуществляется в режиме временного разрешения люминесценции, за счет чего существенно снижается фоновая люминесценция хроматографической мембраны и других компонентов пробы, люминесценция которых имеет более короткое время затухания. Режим временного разрешения обеспечивает более высокую чувствительность анализа по сравнению с использованием традиционных видов флуорохромов, время затухания которых не превышает (1-2)×10-7 с и регистрация сигналов которых осуществляется без режима временного разрешения.
Ключевой проблемой, ограничивающей чувствительность мультиплексного анализа с использованием длительно люминесцирующих наночастиц остается достаточно высокий уровень фоновой люминесценции самих проявляющих наночастиц, находящихся в свободном объеме мембраны. По оценке производителей иммунохроматографических мембран в свободном объеме (вне аналитических зон) может оставаться до 4% от общего количества проявляющих наночастиц. При проведении мультиплексного анализа концентрация наночастиц в свободном объеме мембраны возрастает пропорционально числу выявляемых аналитов, так как для каждого аналита используются наночастицы, покрытые биоспецифическими реагентами для связывания с данным аналитом и общее число наночастиц в пробе увеличивается пропорционально числу выявляемых аналитов и уровню их концентрации в пробе.
Проблема детектирования становится еще более сложной, когда в мультиплексном тесте необходимо выявлять аналиты кардинально различающиеся по их содержанию в пробе, например при анализе маркеров воспалительного процесса (С-реактивного белка (уровень нормы несколько мкг/мл) и прокальцитонина (уровень нормы не более 4 нг/мл), содержание которых в пробе различается на 3 порядка. Аналогичная проблема возникает при необходимости одновременного определения в пробе иммуноглобулинов (антител) и антигенов возбудителей инфекционных заболеваний. В этом случае, концентрация проявляющих наночастиц должна коррелировать с содержанием аналитов в пробе. При этом уровень фоновой люминесценции наночастиц для выявления аналитов в высокой концентрации (мкг/мл) оказывается столь высоким, что практически исключает регистрацию аналитов в низких концентрациях (нг/мл, пг/мл).
Проблема повышения чувствительности мультиплексного иммунохроматографического анализа и совмещения в формате одной тест-полоски анализа аналитов с высоким и низким уровнем их содержания может быть решена предлагаемым способом.
Суть предлагаемого способа заключается в использовании не одного, а нескольких видов длительно люминесцирующих соединений, отличающихся спектральными и временными характеристиками, исключающими или кардинально снижающими их взаимовлияние. Суть предлагаемого способа заключается также в том, что после инкубации иммунохроматографической тест-полоски с анализируемой пробой и проявляющими реагентами в буфере анализа, ее инкубируют с буфером анализа без проявляющих реагентов, чтобы кардинально снизить их концентрацию вне аналитических зон. При этом емкость сорбирующей подушечки (обеспечивающей за счет капиллярных сил движение пробы по аналитической части мембраны) подбирается с таким расчетом, чтобы впитать всю пробу, а также дополнительный объем промывающего буфера анализа. Суть предлагаемого способа заключается также в том, что хроматографическая мембрана в области расположения аналитических микрозон для выявления низких концентраций аналитов имеет ширину в 3-4 раза более узкую, чем ширина хроматографической мембраны до и после места расположения аналитических микрозон. Объем пробы проходящей через аналитическую микрозону в зауженной части мембраны увеличивается прямо пропорционально по сравнению с исходной шириной мембраны. Пропорционально увеличивается масса связавшихся аналитов в соответствующей микрозоне.
При необходимости определения аналитов как в высокой, так и в низкой концентрации аналитические микрозоны располагают соответственно либо в широкой (где взаимодействующий с аналитической микрозоной объем пробы меньше), либо зауженной (где взаимодействующий с аналитической микрозоной объем пробы больше).
Технический результат: совокупность предлагаемых приемов позволяет повысить отношение сигнала в аналитической зоне к сигналу фоновой люминесценции мембраны вне аналитических микрозон не менее чем в 10 раз, повысить чувствительность и расширить динамический диапазон выявляемых концентраций аналитов в формате мультиплексных тестов, аналитические реагенты которых нанесены на аналитическую мембрану в виде микрозон (микроточек).
Заявленный технический результат достигается за счет того, что в способе проведения мультиплексного иммунохроматографического анализа для определения нескольких аналитов в пробе, включающем инкубацию пробы с мембранным хроматографическим композитом и проявляющими реагентами и последующую регистрацию сигнала люминесценции в аналитических и контрольных микрозонах на хроматогрфической мембране в режиме временного разрешения, после инкубации мембранного композита с проявляющими реагентами вводится дополнительная стадия инкубации мембранного композита с промывающем буфером анализа при этом в качестве проявляющих реагентов используют смесь из конъюгатов лигандов с длительно люминесцирующими соединениями, люминесцентные характеристики которых отличаются по крайней мере длиной волны максимума эмиссии и постоянной времени затухания, а аналитическая мембрана в месте расположения аналитических микрозон выполнена зауженной по сравнению с шириной до и после места расположения аналитических микрозон, при этом сорбирующая подушечка для впитывания пробы после ее прохождения по аналитической мембране выполнена такого размера (объема), чтобы полностью впитать заданный объем пробы и впитать дополнительный объем жидкости при последующей инкубации с промывным буфером анализа. Регистрацию люминесценции осуществляют в стробоскопическом режиме в нескольких спектральных диапазонах, соответствующих максимумам эмиссии метчиков с выделением сигнала во временном интервале эквивалентном времени затухания соответствующего метчика. В качестве люминесцентных метчиков для коньюгатов с лигандами используют наночастицы диаметром 40-200 нм, включающие хелаты с ионами лантанидов, а также водорастворимые металлопорфирины с центральными атомами платины. Аналитические микрозоны мембранного композита получают нанесением на мембранный носитель, нитроцеллюлозу, антигенов или антител в количестве 20-200 нл с концентрацией 20-100 мкг/мл. Контрольные микрозоны мембранного композита получают нанесением на мембранный носитель, нитроцеллюлозу, антигенов или антвидовых антител в количестве 20-200 нл с концентрацией 20-100 мкг/мл.
Заявленная совокупность приемов является новой и позволяет выявлять в пробе с помощью одной тест-полоски несколько аналитов, различающихся по концентрации в 100 и более раз и обеспечивает повышение чувствительности обнаружения аналитов не менее чем в 10 раз.
Для реализации способа используют коммерчески выпускаемые компоненты для конструирования мембранных хроматографических композитов (тест-полосок), имеются регламенты получения биоспецифических реагентов с длительно люминесцирующими соединениями, включая наночастицы, для регистрации сигнала люминесценции от микрозон с аналитическими реагентами, а также выпускаются зарегистрированные в Росздравнадзоре РФ и серийно выпускаемые биочип-анализаторы ИФИ-03 и ИФИ-05 (Производитель ООО «ИММУНОСКРИН»). Предлагаемое изобретение отвечает критерию промышленной применимости.
На фигуре 1 представлен внешний вид мембранного хроматографического композита (тест-полоски) для мультиплексного иммунохроматографического анализа.
Тест-полоска, представленная на фигуре 1 имеет пластиковую основу (1) на которой размещена иммунохроматографическая мембрана из нитроцеллюлозы и мембрана для сорбции пробы (3). В узкой части мембраны размещают микрозоны с аналитическими реагентами для связывания аналитов в низкой концентрации (4), в широкой части размещают микрозоны или полоски для связывания аналитов с высокой концентрацией в пробе (5), а также контрольные микрозоны (6) и сорбирующую элюент подушечку (7).
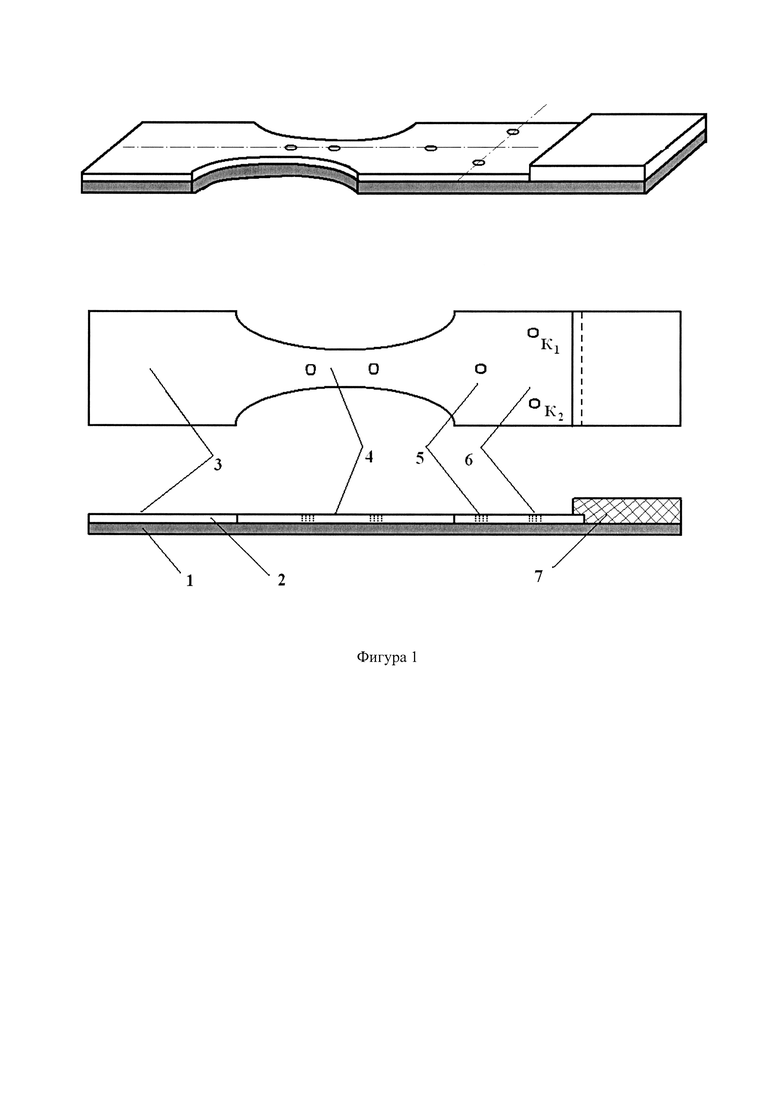
На фигуре 2 представлена схема способа проведения анализа на модели сыворотки крови, включающей антигены возбудителей чумного и туляремийного микроорганизмов и антитела к возбудителю легионеллеза. Обозначения на фигуре 2: антитела к антигену фракции Ф1 чумного микроба (4.1); антитела к антигену липополисахарида туляремийного микроба (4.2); антиген к возбудителю легионеллеза (5.1); контрольные микрозоны с локализованными антителами к моноклональным антителам кролика (К1) и мыши (К2).
Последовательность операций предлагаемого способа, представленная на фигуре 2, включает:
- приготовление на нитроцеллюлозной мембране тест-полоски микрозон с аналитическими реагентами для связывания аналитов в низкой и высокой концентрации и контрольными микрозонами для улавливания непрореагировавших длительно люминесцирующих лигандов (позиция 11);
- внесение тест-полоски свободным концом (без улавливающей мембраны) в емкость, содержащую анализируемую пробу (8), лиганды, меченные длительно люминесцирующими соединениями (9), буфер анализа (10) (позиция 12);
- инкубацию тест-полоски в емкости в течение 10-15 минут (позиция 12);
- внесение тест-полоски свободным концом (без улавливающей мембраны) в емкость содержащую буфер анализа (10) и инкубацию тест-полоски в емкости в течение 3-5 минут (позиция 13);
- регистрацию сигнала люминесценции при сканировании области расположения микрозон в режиме временного разрешения (позиция 14).
На фигуре 3 представлены диаграммы сканирования тест-полосок, изготовленных по предлагаемому способу, с использованием одного и двух типов метчиков и регистрации сигнала в двух спектральных диапазонах в режиме временного разрешения. Обозначения, представленные на фигуре 3 следующие: позиция 15 - использование для детектирования антигенов возбудителей чумного и туляремийного микроорганизмов и антител к возбудителю легионеллеза одной метки (на основе хелатов Eu), регистрация на 615 нм; позиция 16 - использование для детектирования двух меток (хелаты Eu для чумного и туляремийного микроорганизмов, комплексы Pt для выявления антител к возбудителю легионеллеза), регистрация на 615 нм; позиция 17 - использование для детектирования двух меток (аналогично позиции 16), но регистрация на 645 нм.
Результаты анализа на тест-полосках, полученные с минимальным содержанием антигенов и антител в аналитических зонах (нанесение 20 нл с концентрацией 20 мкг/мл) и детектированием с использованием хелатов Eu (хелаты Eu включены в наночастицы диаметром 40-50 нм) представлены в таблице 1.
Результаты анализа на тест-полосках, полученные с максимальным содержанием антигенов и антител в аналитических зонах (нанесение 200 нл с концентрацией 100 мкг/мл) и детектированием с использованием хелатов Eu (хелаты Eu включены в наночастицы диаметром 200 нм) представлены в таблице 2.
Результаты сканирования тест-полосок стандартной конфигурации и с конфигурацией по предлагаемому способу с использованием одного типа меток представлены в таблице 1 и таблице 2 (прототип (1) и варианты 2 и 3).
Результаты сканирования тест-полосок с использованием двух типов меток (по предлагаемому способу) представлены в таблице 1 и 2 (вариант 4).
Результаты сканирования тест-полосок подготовленных как в варианте 4, но с применением дополнительной процедуры отмывки представлены в таблице 1, 2 (вариант 5).
Из данных таблицы 1 и 2 следует, что предлагаемый способ обеспечивает повышение чувствительности (улучшение соотношения сигнал фон) по сравнению с прототипом при проведении мультиплексного иммунохроматографического анализа с содержанием аналитов в широком диапазоне концентраций.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ проведения биологического микроанализа | 2019 |
|
RU2710262C1 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА ДЛЯ ДЕТЕКТИРОВАНИЯ АНАЛИТОВ В ОБРАЗЦЕ | 2010 |
|
RU2420740C1 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО КОНКУРЕНТНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2022 |
|
RU2789545C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2007 |
|
RU2339953C1 |
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА, ОСНОВАННЫЙ НА ОБРАТИМОЙ ИММОБИЛИЗАЦИИ ИММУНОРЕАГЕНТОВ В МАГНИТНОМ ПОЛЕ | 2013 |
|
RU2575840C2 |
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА С ВЫСОКОЙ СТЕПЕНЬЮ ВЫЯВЛЕНИЯ МАРКЕРА | 2015 |
|
RU2623075C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| УНИВЕРСАЛЬНАЯ ТЕСТ-ПОЛОСКА ДЛЯ ВЫБОРОЧНОГО ОПРЕДЕЛЕНИЯ МИКОТОКСИНОВ МЕТОДОМ ИММУНОХРОМАТОГРАФИИ | 2021 |
|
RU2806175C2 |
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА С ДИССОЦИИРУЮЩЕЙ ФЛУОРЕСЦЕНТНОЙ МЕТКОЙ | 2012 |
|
RU2535061C2 |
| Способ конкурентного иммуноферментного анализа для детекции аналита в образце с помощью мультимодальных наночастиц | 2023 |
|
RU2836697C1 |

Изобретение относится к области лабораторной диагностики. Раскрыт способ проведения мультиплексного иммунохроматографического анализа определения нескольких аналитов в пробе, включающий инкубацию пробы с мембранным хроматографическим композитом в виде тест-полоски и проявляющими реагентами и последующую регистрацию сигнала люминесценции в аналитических и контрольных зонах на хроматографической мембране в режиме временного разрешения, и после инкубации мембранного композита с проявляющими реагентами вводится дополнительная стадия инкубации мембранного композита с промывающим буфером анализа, при этом в качестве проявляющих реагентов используют смесь из конъюгатов лигандов с длительно люминесцирующими метчиками, люминесцентные характеристики которых отличаются по крайней мере длиной волны максимума эмиссии и постоянной времени затухания, а аналитическая мембрана содержит микрозоны для связывания аналитов в низкой и высокой концентрации, при этом в месте расположения аналитических микрозон для выявления низких концентраций выполнена зауженной по сравнению с шириной до и после места расположения аналитических микрозон для выявления низких концентраций, при этом емкость сорбирующей подушечки обеспечивает впитывание всей пробы и дополнительного объема промывающего буфера анализа, регистрацию люминесценции осуществляют в стробоскопическом режиме в нескольких спектральных диапазонах, соответствующих максимумам эмиссии метчиков с выделением сигнала во временном интервале, эквивалентном времени затухания соответствующего метчика. Изобретение позволяет повысить чувствительность мультиплексного анализа и расширить динамический диапазон выявляемых концентраций аналитов. 4 з.п. ф-лы, 3 ил., 2 табл.
1. Способ проведения мультиплексного иммунохроматографического анализа определения нескольких аналитов в пробе, включающий инкубацию пробы с мембранным хроматографическим композитом в виде тест-полоски и проявляющими реагентами и последующую регистрацию сигнала люминесценции в аналитических и контрольных зонах на хроматографической мембране в режиме временного разрешения, и после инкубации мембранного композита с проявляющими реагентами вводится дополнительная стадия инкубации мембранного композита с промывающим буфером анализа, при этом в качестве проявляющих реагентов используют смесь из конъюгатов лигандов с длительно люминесцирующими метчиками, люминесцентные характеристики которых отличаются по крайней мере длиной волны максимума эмиссии и постоянной времени затухания, а аналитическая мембрана содержит микрозоны для связывания аналитов в низкой и высокой концентрации, при этом в месте расположения аналитических микрозон для выявления низких концентраций выполнена зауженной по сравнению с шириной до и после места расположения аналитических микрозон для выявления низких концентраций, при этом емкость сорбирующей подушечки обеспечивает впитывание всей пробы и дополнительного объема промывающего буфера анализа, регистрацию люминесценции осуществляют в стробоскопическом режиме в нескольких спектральных диапазонах, соответствующих максимумам эмиссии метчиков с выделением сигнала во временном интервале, эквивалентном времени затухания соответствующего метчика.
2. Способ по п. 1, отличающийся тем, что в качестве люминесцентных метчиков для конъюгатов с лигандами используют наночастицы диаметром 40-200 нм, включающие хелаты с ионами лантанидов.
3. Способ по п. 1, отличающийся тем, что в качестве люминесцентных метчиков для конъюгатов с лигандами используют водорастворимые металлопорфирины с центральными атомами платины (Pt).
4. Способ по п. 1, отличающийся тем, что аналитические микрозоны мембранного композита получают нанесением на мембранный носитель, нитроцеллюлозу, антигенов или антител в количестве 20-200 нл с концентрацией 20-100 мкг/мл.
5. Способ по п. 1, отличающийся тем, что контрольные микрозоны мембранного композита получают нанесением на мембранный носитель, нитроцеллюлозу, антигенов или антивидовых антител в количестве 20-200 нл с концентрацией 20-100 мкг/мл.
| WO 2021053206 A1, 25.03.2021 | |||
| Способ проведения биологического микроанализа | 2019 |
|
RU2710262C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2001 |
|
RU2184970C1 |
| СПОСОБ ПОДГОТОВКИ ЦИТРУСОВЫХ ПЛОДОВ К ИЗВЛЕЧЕНИЮ СОКА | 2002 |
|
RU2215450C1 |
| Цистерна для перевозки вязких нефтепродуктов | 2017 |
|
RU2666018C1 |
Авторы
Даты
2024-04-23—Публикация
2023-04-28—Подача