ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединениям Формулы I и их применению в способах лечения или предупреждения протозойной инфекции у субъекта с применением соединения Формулы I, к применению соединения Формулы I в производстве лекарственного средства для лечения протозойной инфекции у субъекта и к медицинским устройствам, используемым в способе лечения или предупреждения протозойной инфекции у субъекта.
УРОВЕНЬ ТЕХНИКИ
Жиардиаз, амебиаз и криптоспоридиоз являются наиболее распространенными протозойными паразитарными заболеваниями кишечного тракта человека, а также распространенной причиной кишечных заболеваний у животных. Для лечения указанных заболеваний используют различные лекарства, но многие из них имеют значительную степень ненадежности в отношении вывода паразитов из кишечника, и многие связаны с частым возникновением нежелательных побочных явлений, которые зачастую приводят к противопоказаниям применения в некоторых обстоятельствах. В данной области техники существует потребность в улучшенном лечении, для которого потребуется одна или очень незначительное количество доз, которое будет обеспечивать очень высокий уровень клиренса целевого протозойного агента, которое будет уничтожать кисты кишечника (для уменьшения заражения среды и источника повторного инфицирования), не будет вызывать или будет вызывать лишь слабые и хорошо переносимые побочные эффекты, не будет обладать предсуществующей резистентностью, будет безопасным для применения у беременных и кормящих женщин и других видов животных и/или будет подходить для применения в качестве профилактического препарата.
Многие существующие антипротозойные агенты, особенно для лечения жиардиаза, обладают не оптимальной действительной эффективностью. Для метронидазола терапевтические показатели в отношении жиардий могут быть высокими, но описаны также весьма низкие показатели на уровне 60 % (измеренные по клиренсу простейших) у взрослых людей и педиатрических пациентов при введении в течение 5-10 дней. Описано, что метронидазол и тинидазол обладают средней эффективностью на уровне около 89 %. Более современный противогардиазный агент, нитазоксанид, показал общую частоту положительного ответа 75 % (измеренную по клиренсу простейших), в диапазоне от 64 до 94 %.
Для улучшения соблюдения режима терапии весьма желательно, чтобы схема введения доз была простой и краткосрочной. Как описано выше, продолжительность введения доз метронидазола чаще всего составляет 5-10 дней, что допускает возможность пропуска лечения, недостаточного соблюдения режима терапии и снижения эффективности или безрезультатности лечения.
Приобретенная резистентность жиардий к доступным средствам лечения широко распространена и является все более частой причиной неэффективности лечения. Это неудивительно, поскольку большинство современных рекомендованных антипротозойных агентов используют в течение многих десятилетий. В обзоре антипротозойных агентов, одобренных FDA между 1987 и 2013 гг. (Kesselheim, A. S. and J. J. Darrow (2014). "Drug Development and FDA Approval, 1938–2013. "New England Journal of Medicine 370(26): e39) описаны только 7 новых агентов для всех протозойных заболеваний (мефлоквин в 1989 году, эфлорнитин в 1990 году, галофантрин и атоваквон в 1992 году, нитазоксанид в 2002 году, тинидазол в 2004 году и комбинация артеметера и лумефантрина в 2009 году). Среди указанных агентов только нитазоксанид и тинидазол используют для лечения жиардий, и оба препарата имеют среднюю эффективность менее 90%.
Зачастую профиль неблагоприятных эффектов ограничивает применение антипротозойных агентов. Существует множество побочных эффектов доступных в настоящее время антипротозойных агентов. Например, побочные эффекты для широко применяемого метронидазола включают металлический привкус, тошноту, головную боль, головокружение, лейкопению, бессонницу и раздражительность. Реже описывают случаи цитотоксичности в отношении ЦНС, особенно при высоких дозах, и при приеме метронидазола не рекомендовано употребление алкоголя из-за вероятности развития дисульфирам-подобной реакции. Было показано, что метронидазол является мутагенным в бактериях; на основании исследований на животных лекарство является канцерогенным при приеме в высоких дозах и в течение продолжительного периода. Неблагоприятные эффекты хинакрина включают головную боль, тошноту, рвоту и горький вкус, что приводит к неудовлетворительному соблюдению режима терапии. После введения также может наблюдаться пожелтение кожи, мочи и склеры. Также может возникать синяя или черная пигментация ногтей, уртикарная сыпь и шелушащийся дерматит. Другие описанные побочные эффекты представляют собой гемолиз у пациентов с дефицитом глюкоза-6-фосфат-дегидрогеназы (G6PD), токсический психоз и обострение псориаза. Хинакрин вместе с другими антипротозойными агентами может проходить через плаценту и достигать плода, в результате чего его применение противопоказано при беременности из-за возможной связи с врожденными пороками развития. Другие описанные тяжелые побочные эффекты включают психиатрические расстройства.
Для лечения криптоспоридий и амебиаза, вызванного амебами Entamoeba histolytica, доступное лечение имеет еще больше ограничений, чем лечение жиардий, при отсутствии стабильно эффективного и специфического лечения криптоспоридий (Cabada, M. M. and A. C. White, Jr. (2010). "Treatment of cryptosporidiosis: do we know what we think we know?" Curr Opin Infect Dis 23(5): 494-499).
Существует неудовлетворенная клиническая потребность в антипротозойных агентов с новым механизмом действия для дополнения и/или замены доступных в настоящее время антипротозойных агентов, эффективность которых постоянно снижается вследствие механизмов антипротозойной резистентности. Дополнительно сохраняется потребность в альтернативных антипротозойных агентах для лечения инфекции, вызванной мультирезистентными простейшими. Однако, как описано в публикации Pharmaceutical Research and Manufacturers of America в отчете 2013 года “Medicines in Development for Infectious Diseases”, не разработано ни одного нового антипротозойного агента, и не наблюдается никакого расширения ассортимента, обеспечивающего обнадеживающие результаты по сравнению с существующими средствами лечения.
Задача настоящего изобретения заключается в преодолении по меньшей мере одного из недостатков, присущих известному уровню техники.
Описание известного уровня техники, представленное выше, предназначено лишь для облегчения понимания настоящего изобретения. Представленное описание не является признанием или принятием того, что любой упомянутый материал является или являлся частью общедоступного знания на дату приоритета настоящей заявки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с одним из аспектов настоящего изобретения предложен способ лечения или предупреждения протозойной колонизации или инфекции у субъекта, включающий стадию введения терапевтически эффективного количества соединения Формулы I или его стереоизомера, таутомера, фармацевтически приемлемой соли или пролекарства субъекту, при этом протозойная инфекция вызвана протозойным агентом.
В одном из вариантов реализации настоящего изобретения соединение Формулы I представляет собой:
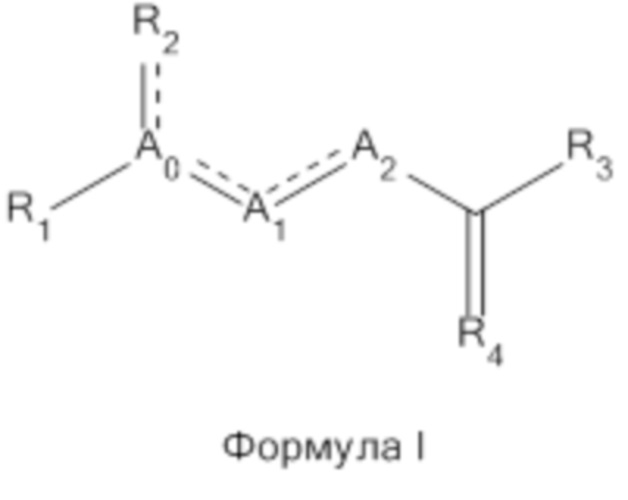
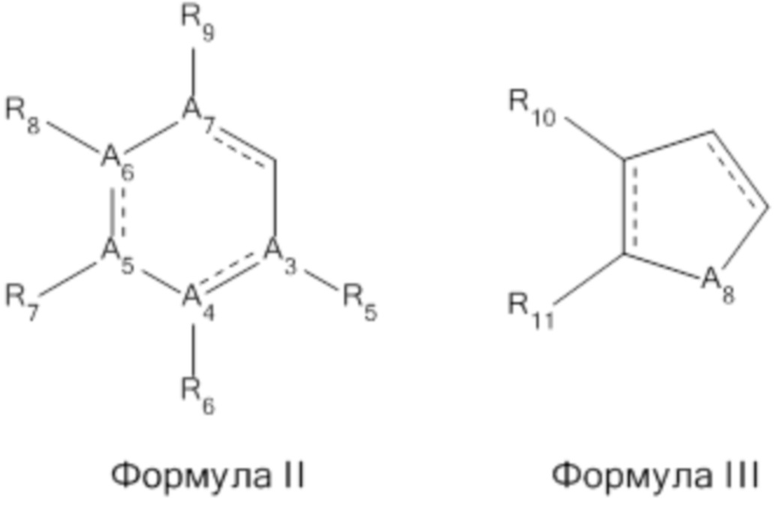
В другом варианте реализации изобретения R1 представляет собой H, циклоалкил, Формулу II или Формулу III;
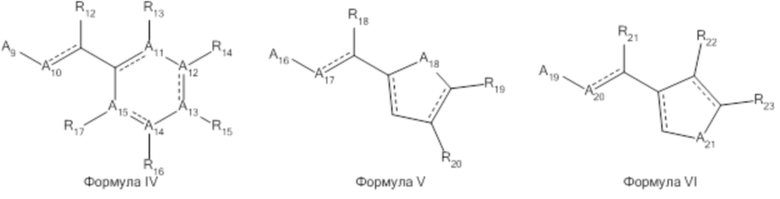
В другом варианте реализации изобретения R3 выбран из группы, состоящей из: H; NH2; NHNH2; O-CH2-CH3; NH-C(O)-фенила; N-CH-хлорфенила; NH-хлорфенила; NH-CH2-хлорфенила; NH-N-CH-циклоалкила; N и R4 представляет собой CH-N-CH-CCl- и R4 связан с R3; Формулы IV; Формулы V; и Формулы VI;
В другом варианте реализации изобретения A0 представляет собой N, C, CH или A0 представляет собой C и A0 связан с R4 с образованием триазольного кольца.
В другом варианте реализации R4 представляет собой CH-N-CH-CCl-. Предпочтительно, R4 связан с R3, если R3 представляет собой N.
В другом варианте реализации изобретения A1 представляет собой N, C, NH, -(CH)2-N-, -(C6H5)C-CH-N- или Формулу VII;
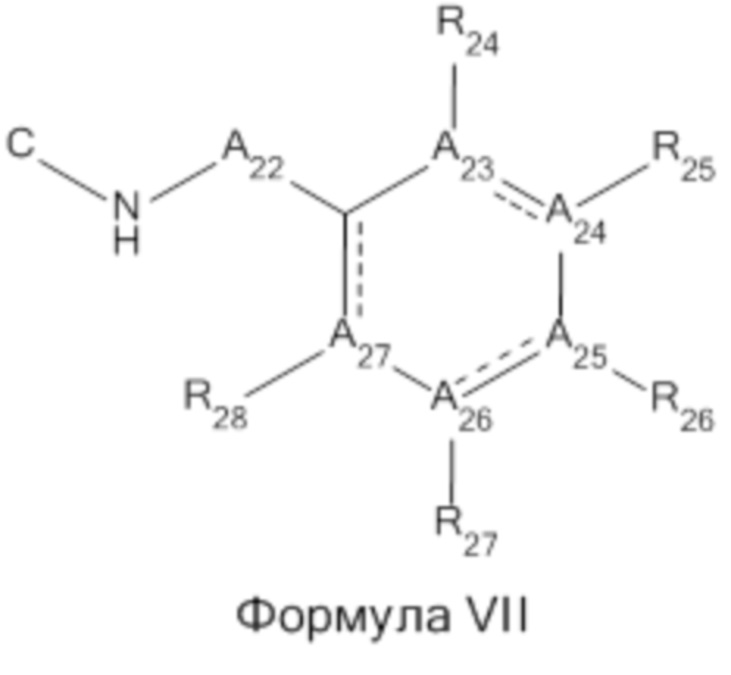
В другом варианте реализации изобретения A2 представляет собой N, C, NH, N-C(O)-фенил или Формулу VII, или (CH2)n, где n равен целому числу от 1 до 3, включительно.
В другом варианте реализации изобретения A3, A4, A5, A6, A7, A8, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21 A23, A24, A25, A26 и A27 независимо представляют собой C, O, N, NH, S.
В другом варианте реализации изобретения A9 представляет собой C, O, N, NH, N-C(O)-O-CH2-CH3, N-C(O)-O-CH(CH3)2, N-C(O)-NH-CH2-CH3, N-C(O)-NH-CH2-фенил, N-C(O)-CH2-CH2-CH2-CH2-CH2-CH3, N-C(O)-CH2-фуран-2-ил.
В другом варианте реализации изобретения A10 представляет собой C, NH, -N-(CH)2-, -N-CH-C(C6H5)-.
В другом варианте реализации изобретения A22 представляет собой -CH(CH3)-, -N-CH-, -N-C(CH3)-, N-C(CH2OH)-.
В другом варианте реализации изобретения R2 представляет собой H, COOH, CH2NH2, CH2OH, CH2NHNH2, метил, этил, пропил, бутил, пентил, гептил, циклопентил, CH2(циклогексил), (CH2)2(циклопентил) или Формулу VII, и R2 и R4 связаны вместе с образованием пиримидинового, пиразинового или триазинового кольца, или R2 и R9 связаны вместе с образованием пирролидинильного оксиндольного кольца.
В другом варианте реализации изобретения R4 представляет собой H2, N, NH, O, S, или R4 и A0 связаны вместе с образованием триазольного кольца, или R4 представляет собой N и R4 и R2 связаны вместе с образованием пиримидинового кольца.
В другом варианте реализации изобретения R7 представляет собой H, Cl, Br, F, OH, CH3, OCH3, SCH3, CN, CCH, CF3, OCF3, SCF3, NO2, бутил, трет-бутил, диметиламино, фенил, н-пропил, изо-пропил, -NH-C(O)-CH3, -(CH)2-COOH, пиперазин-1-ил или R7 и R8 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца.
В другом варианте реализации изобретения R6, R8, R14, R16, R25 и R27 независимо представляют собой H, OH, Cl, F, Br, CH3, CN, OCH3, COOH, NO2, CF3, R8 и R7 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, R14 и R15 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, R8 и R9 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R14 и R13 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца.
В другом варианте реализации изобретения R5, R9, R17, R24 и R28 независимо представляют собой H, O, OH, Cl, F, Br, NH2, CH3, CF3, OCH3, CN, NO2, фенил, -NH-CH(OH)-CH3, -NH-C(O)-CH3, или R9 и R8 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R13 и R14 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца.
В другом варианте реализации изобретения R10, R11, R19, R20, R22 и R23 независимо представляют собой H, Cl или Br, или R10 и R11 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R19 и R20 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, или R22 и R23 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца.
В другом варианте реализации изобретения R12, R18 и R21 независимо представляют собой H, COOH, CH2NH2, CH2OH, метил, этил, пропил, бутил, циклопентил или R12 и R13 связаны вместе с образованием пирролидинильного оксиндольного кольца.
В другом варианте реализации изобретения R15 и R26 независимо представляют собой H, Cl, Br, F, OH, CH3, OCH3, SCH3, CN, CF3, OCF3, SCF3, NO2, CCH, н-бутил, трет-бутил, диметиламино, фенил, н-пропил, изо-пропил, -NH-C(O)-CH3, -(CH)2-COOH, пиперазин-1-ил, или R15 и R14 связаны вместе с образованием замещенного или незамещенного, насыщенного или ненасыщенного алифатического кольца, гетероциклического кольца или бензольного кольца, и
В другом варианте реализации изобретения «----» представляет собой двойную связь или одинарную связь.
В другом варианте реализации изобретения соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемая соль или пролекарство выбрано из соединений, представленных на Фиг. 1.
В другом варианте реализации изобретения соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемая соль или пролекарство содержит следующие признаки:
где A0 представляет собой C;
где A1 представляет собой N; или Формулу VII;
где A2 представляет собой N; или NH;
где A3, A4, A6, A7, A11, A12, A14, A15 представляют собой N; или C;
где A5, A13, A23, A24, A25, A26 и A27 представляют собой C;
где A8 и A21 представляют собой S;
где A9 представляет собой NH;
где A10 представляет собой N;
где A22 представляет собой –N-CH-; -N-C(CH3)-; или –N-C(CH2OH)-;
где R1 представляет собой H; Формулу II; Формулу III; циклоалкил;
где R2 представляет собой H; метил; этил; CH2NHNH2; CH2OH; бутил; циклопентил; или Формулы VII, и R2 связан с R4 с образованием пиримидинового кольца;
где R3 представляет собой NH2; Формулу IV; Формулу V; Формулу V; Формулу VI; NH2, NH-N-CH-циклоалкил; или O-CH2-CH3;
где R4 представляет собой NH; O; S; или R4 представляет собой N и R4 и R2 связаны вместе с образованием пиримидинового кольца;
где R7 представляет собой H; F; Cl; CF3; метил; R7 и R8 связаны вместе с образованием незамещенного бензольного кольца; OH; трет-бутил; фенил; диметиламино; изо-пропил; н-пропил; CN; CCH; н-бутил; SCH3; R7 и R8 связаны вместе с образованием незамещенного, ненасыщенного гетероциклического кольца; OCH3; Br; OCF3; пиперазин-1-ил; или SCF3;
где R6, R8, R14 и R16 независимо представляют собой H; OH; F; OCH3; CF3; метил; Cl; CN; Br; R8 и R7 связаны вместе с образованием незамещенного бензольного кольца; R8 и R7 связаны вместе с образованием незамещенного, ненасыщенного гетероциклического кольца; R14 и R15 связаны вместе с образованием незамещенного бензольного кольца; или R14 и R15 связаны вместе с образованием незамещенного, ненасыщенного гетероциклического кольца;
где R5, R9, R13 и R17 независимо представляют собой H; OH; NH2; Cl; F; OCH3; OH; -NH-CH(OH)-CH3;
где R12 представляет собой H; метил; этил; CH2OH; или циклопентил;
где R15 представляет собой H; F; Cl; CF3; метил; R7 и R8 связаны вместе с образованием незамещенного бензольного кольца; OH; трет-бутил; фенил; диметиламино; изо-пропил; н-пропил; CN; CCH; н-бутил; SCH3; R15 и R14 связаны вместе с образованием незамещенного, ненасыщенного гетероциклического кольца; OCH3; Br; OCF3; пиперазин-1-ил; или SCF3;
где R24 и R28 независимо представляют собой H; OH; или Cl;
где R25 и R27 независимо представляют собой H; или OH;
где R26 представляет собой H; CH3; Br; Cl; OH; диметиламино; -O-P(O)(OEt)2; CF3; или F; и
где «----» независимо представляет собой одинарную или двойную связь.
В другом варианте реализации изобретения соединение выбрано из группы, содержащей: NCL008; NCL009; NCL023; NCL025; NCL026; NCL028; NCL029; NCL036; NCL037; NCL039; NCL040; NCL050; NCL061; NCL062; NCL064; NCL065; NCL068; NCL075; NCL076; NCL078; NCL079; NCL080; NCL081; NCL084; NCL085; NCL086; NCL088; NCL089; NCL090; NCL092; NCL094; NCL095; NCL097; NCL098; NCL099; NCL101; NCL104; NCL105; NCL106; NCL108; NCL111; NCL112; NCL114; NCL115; NCL116; NCL118; NCL119; NCL121; NCL122; NCL123; NCL124; NCL125; NCL126; NCL130; NCL131; NCL132; NCL133; NCL135; NCL136; NCL137; NCL138; NCL139; NCL140; NCL141; NCL144; NCL145; NCL146; NCL147; NCL148; NCL150; NCL152; NCL153; NCL154; NCL156; NCL157; NCL158; NCL159; NCL161; NCL162; NCL164; NCL165; NCL166; NCL167; NCL168; NCL169; NCL170; NCL171; NCL172; NCL173; NCL174; NCL176; NCL177; NCL178; NCL179; NCL180; NCL181; NCL183; NCL184; NCL185; NCL186; NCL187; NCL188; NCL189; NCL190; NCL193; NCL194; NCL195; NCL196; NCL197; NCL198; NCL199; NCL200; NCL201; NCL202; NCL203; NCL204; NCL205; NCL206; NCL207; NCL208; NCL209; NCL210; NCL211; NCL212; NCL213; NCL215; NCL216; NCL217; NCL218; NCL219; NCL220; NCL221; NCL222; NCL223; NCL223; NCL224; NCL225; NCL226; NCL227; NCL228; NCL229; NCL230; NCL231; NCL232; NCL233; NCL234; NCL235; NCL236; NCL237; NCL238; NCL239; NCL240; NCL241; NCL242; NCL243; NCL244; NCL245; NCL246; NCL247; NCL248; NCL249; NCL250; NCL251; NCL252; NCL253; NCL254; NCL255; NCL256; NCL257; NCL258; NCL259; NCL260; NCL261; NCL262; NCL263; NCL264; NCL265; NCL266; NCL267; NCL268; NCL269; NCL270; NCL271; NCL272; NCL273; NCL274; и NCL275.
В другом варианте реализации изобретения соединение выбрано из группы, содержащей: NCL028; NCL040; NCL062; NCL078; NCL079; NCL080; NCL081; NCL084; NCL088; NCL089; NCL097; NCL099; NCL123; NCL146; NCL157; NCL158; NCL177; NCL179; NCL188; NCL193; NCL195; NCL196; NCL197; NCL199; NCL202; NCL204; NCL205; NCL215; NCL216; NCL217; NCL219; NCL221; NCL245 и NCL246.
В предпочтительном варианте реализации изобретения соединение выбрано из группы, содержащей: NCL062; NCL078; NCL079; NCL080; NCL081; NCL084; NCL089; NCL097; NCL099; NCL157; NCL158; NCL179; NCL188; NCL193; NCL195; NCL196; NCL199; NCL204; NCL216; NCL217; NCL219; NCL221; NCL245 и NCL246.
В более предпочтительном варианте реализации изобретения соединение выбрано из группы, содержащей: NCL062; NCL089; NCL097; NCL099; NCL157; NCL179; NCL188; NCL193; NCL195; NCL196; NCL216; NCL219; и NCL221.
В более предпочтительном варианте реализации изобретения соединение выбрано из группы, содержащей: NCL062; NCL097; NCL099; NCL157; NCL179; NCL188; NCL195; и NCL196.
В другом варианте реализации изобретения соединение представляет собой хлоридную соль.
В другом варианте реализации изобретения соединение представляет собой соединение, выбранное из группы, содержащей: NCL812 и NCL062. В другом варианте реализации изобретения соединение не является соединением, выбранным из группы, содержащей: NCL812 и NCL062. Например, соединение представляет собой NCL099.
В другом варианте реализации изобретения соединение представляет собой соединение, выбранное из группы, содержащей: NCL020, NCL021, NCL024, NCL035, NCL072, NCL077, NCL107, NCL109, NCL134, NCL143, NCL143, NCL151, NCL155 и NCL160. В другом варианте реализации изобретения соединение не является соединением, выбранным из группы, содержащей: NCL020, NCL021, NCL024, NCL035, NCL072, NCL077, NCL107, NCL109, NCL134, NCL143, NCL143, NCL151, NCL155 и NCL160. Например, соединение представляет собой NCL099.
В другом варианте реализации изобретения субъект представляет собой животное, наиболее предпочтительно выбранное из группы, содержащей: человека, виды псовых, кошачьих, бычьих, овечьих, козьих, свиней, птиц, рыб и лошадиных.
В другом варианте реализации изобретения соединение вводят субъекту в диапазоне доз от 0,1 мг/кг до 250 мг/кг массы тела.
В другом варианте реализации изобретения протозойный агент выбран из группы семейства простейших, содержащей: Acanthamoeba, Babesia, Balamuthia, Balantidium, Besnoitia, Blastocystis, Chilomastix, Cochlosoma, Cryptosporidium, Cyclospora, Cystoisospora, Cytauxzoon, Dientamoeba, Eimeria, Endolimax, Entamoeba, Giardia, Haemoproteus, Hammondia Hartmannella, Hepatozoon, Hexamita, Histomonas, Isospora, Leishmania (включая подрод Viannia), Leucocytozoon, Naegleria, Neospora, Pentatrichomonas, Plasmodium (включая подрод Plasmodium (Bennettinia) (птицы); Plasmodium (Giovannolaia) (птицы); Plasmodium (Haemamoeba) (птицы); Plasmodium (Huffia) (птицы); Plasmodium (Laverania) (высшие приматы, включая Plasmodium falciparum); Plasmodium (Novyella) (птицы); Plasmodium (Paraplasmodium) (ящерицы); Plasmodium (Plasmodium) (высшие приматы, включая Plasmodium brasilianum, cynomolgi, inui, knowlesi, malariae]; Plasmodium (Sauramoeba) (ящерицы); Plasmodium (Vinckeia)), Sappinia, Sarcocystis, Tetratrichomonas, Theileria, Toxoplasma, Trichomonas, Tritrichomonas, Trypanosoma (подроды Duttonella, Herpetosoma, Nannomonas, Schizotrypanum, Trypanozoon), Tyzzeria и Wenyonella.
В другом варианте реализации изобретения протозойный агент выбран из группы простейших, перечисленных в таблице 1 (см. ниже).
В другом варианте реализации настоящего изобретения протозойный агент представляет собой резистентное простейшее.
В другом варианте реализации изобретения инфекция или колонизация вызвана смесью по меньшей мере двух протозойных агентов.
В другом варианте реализации изобретения протозойный агент является резистентным к одному или более соединениям, выбранным из группы, представленной в таблице 2 (см. ниже).
В другом варианте реализации изобретения протозойный агент является резистентным к указанному соединению при воздействии на данный протозойный агент соединения в диапазоне концентраций, выбранном из следующих: 0,001 мкг/мл - 10000 мкг/мл; 0,01 мкг/мл - 1000 мкг/мл; 0,10 мкг/мл - 100 мкг/мл; и 1 мкг/мл - 50 мкг/мл.
В другом варианте реализации изобретения протозойная инфекция или колонизация у субъекта представляет собой зооноз.
В другом варианте реализации изобретения протозойная инфекция или колонизация у субъекта по существу вызывает показание, выбранное из группы, содержащей: трипаносомоз (вызываемый отрядом Kinestoplastorida семейства Trypanosamidae); амебиаз (вызываемый подтипом Sarcodina отряда Amoebidorida семейства Endamoebidae); бабезиоз (вызываемый классом Piroplasmida семейства Babesiidae); балантидиоз (вызываемый типом Ciliphora отряда Trichostomatorida семейсива Balantidiidae); болезнь Шагаса (вызываемая отрядом Kinestoplastorida семейсива Trypanosomatidae); криптоспоридиоз (вызываемый подклассом Coccidea семейства Cryptosporidiidae); жиардиаз (вызываемый классом Zoomastigophora отряда Diplomonadida семейства Diplomonadida, включая Giardia lamblia); лейшманиоз (вызываемый классом Zoomastigophora семейства Trypanosomatidae рода Leishmania); Malaria (вызываемый родом Plasmodium, включая P. falciparum, P. vivax, P. ovale и P. malariae), саркоцистоз (вызываемый подклассом Coccidia отряда Eucoccidiorida семейства Sarcocystidae); токсоплазмоз (вызываемый подклассом Coccidia отряда Eucoccidiorida семейства Sarcocystidae, включая Toxoplasma gondii); циклоспориаз (вызываемый видами Cyclospora cayetanensis); инфекции, вызванные свободно живущими амебами (вызванные Naegleria, Acanthamoeba и/или Balamuthia); малярия у приматов, не являющихся человеком (вызванная родом Plasmodium); микроспоридиоз (вызванный Enterocytozzon bieneusi, Encephalitizoon intestinalis и/или E. cuniculi); атипический трипаносомоз человека (T. lewisi, T. evansi, T. brucei, T. vivax, и/или T. congolense); трихомоноз (вызванный Trichomonas vaginalis); амёбная дизентерия (вызванная Entamoeba histolyticum); и акантамебиаз (вызванный Acanthamoeba).
В другом варианте реализации изобретения терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли вводят субъекту посредством перорального введения.
В другом варианте реализации изобретения терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли вводят субъекту вместе со вторым антимикробным агентом, выбранным из группы, состоящей из соединений, перечисленных в таблице 2 (см. ниже).
В другом варианте реализации изобретения терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли вводят субъекту посредством парентерального введения.
В другом варианте реализации изобретения терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли вводят субъекту посредством местного введения.
В дополнительном аспекте настоящее изобретение включает антипротозойную фармацевтическую композицию, содержащую терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли и необязательно фармацевтически приемлемое вспомогательное вещество или носитель.
В дополнительном аспекте настоящее изобретение включает антипротозойную ветеринарную композицию, содержащую терапевтически эффективное количество соединения Формулы I или его терапевтически приемлемой соли и необязательно приемлемое для ветеринарии вспомогательное вещество или носитель.
В другом варианте реализации изобретения указанная композиция содержит дополнительный антимикробный агент, выбранный из группы, представленной в таблице 2 (см. ниже).
В другом варианте реализации изобретения композиция адаптирована для перорального введения.
В другом варианте реализации изобретения композиция адаптирована для парентерального введения.
В другом варианте реализации изобретения композиция адаптирована для местного введения.
В дополнительном аспекте настоящее изобретение включает применение соединения Формулы I или его терапевтически приемлемой соли в производстве лекарственного средства для лечения протозойной колонизации или инфекции у субъекта. В другом варианте реализации настоящего изобретения применение включает введение субъекту терапевтически эффективного количества соединения Формулы I или его терапевтически приемлемой соли. В другом варианте реализации изобретения соединение Формулы I вводят субъекту в диапазоне доз от 0,1 мг/кг до 250 мг/кг массы тела. В одном предпочтительном варианте реализации соединение вводят субъекту в дозе, находящейся в диапазоне, выбранном из группы, состоящей из: от 0,1 мг/кг до 100 мг/кг массы тела; от 0,1 мг/кг до 50 мг/кг массы тела; от 1 мг/кг до 20 мг/кг массы тела; от 1 мг/кг до 10 мг/кг массы тела; и от 2 мг/кг до 5 мг/кг массы тела. В одном предпочтительном варианте реализации соединение вводят субъекту в дозе, которая через 1 час обеспечивает достижение концентрации соединения в плазме в диапазоне, выбранном из группы, состоящей из: 0,01 мкг/мл - 100 мкг/мл; 0,1 мкг/мл - 10 мкг/мл; 1 мкг/мл - 8 мкг/мл. Предпочтительно, через 1 час доза обеспечивает достижение концентрации соединения в плазме более 8 мкг/мл. Предпочтительно, через 7 часов доза обеспечивает достижение концентрации соединения в плазме более 8 мкг/мл. Предпочтительно, через 24 часа доза обеспечивает достижение концентрации соединения в плазме более 8 мкг/мл.
В одном предпочтительном варианте реализации соединение вводят субъекту с частотой, выбранной из группы, состоящей из: каждые 30 минут; каждый час; каждые 2 часа; каждые 3 часа; каждые 4 часа; каждые 5 часов; каждые 6 часов; каждые 8 часов; каждые 12 часов; один раз в сутки; один раз в 2 дня; один раз в неделю; два раза в неделю; один раз в 2 недели; один раз в месяц; один раз в 2 месяца; один раз в 3 месяца; один раз в 4 месяца; один раз в 5 месяцев; один раз в 6 месяцев; один раз в год; один раз в 2 года; и однократно.
В другом варианте реализации изобретения лекарственное средство вводят субъекту посредством перорального введения. В другом варианте реализации изобретения лекарственное средство вводят субъекту посредством парентерального введения. В другом варианте реализации изобретения лекарственное средство вводят субъекту посредством местного введения.
В дополнительном аспекте настоящее изобретение включает медицинское устройство, используемое в способе лечения или предупреждения протозойной колонизации или инфекции у субъекта, при этом медицинское устройство содержит композицию согласно настоящему изобретению. В другом варианте реализации изобретения медицинское устройство представлено в форме, выбранной из группы, содержащей: пластырь, бандаж, повязку или имплантат, нанесенный на очаг протозойной колонизации или инфекции у субъекта.
В дополнительном аспекте настоящее изобретение включает способ уничтожения простейших, включающий стадию приведения простейшего в контакт с соединением Формулы I или его терапевтически приемлемой солью.
В дополнительном аспекте настоящее изобретение включает применение соединения Формулы I или его терапевтически приемлемой соли для уничтожения простейший, и указанное применение включает стадию приведения простейшего в контакт с соединением Формулы I или его терапевтически приемлемой солью.
В дополнительном аспекте настоящее изобретение включает по существу такой способ, композицию, устройство или применение, как описано в настоящем документе со ссылкой на сопроводительные примеры и фигуры.
В предпочтительном аспекте изобретения соединение Формулы I представляет собой робенидин (также упомянутый в настоящем описании как NCL812 и известный также как 1,3-бис[(E)-(4-хлорфенил)метиленамино]гуанидин), который имеет следующую структуру:
В одном предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой H; R4 представляет собой O; R8 и R14 представляют собой CF3; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL101):
В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N и A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2, R5, R6, R7 и R8 представляют собой H; R4 представляет собой NH; R9 представляет собой Cl; и «----» в Формуле I между A0 и A1 и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL015):
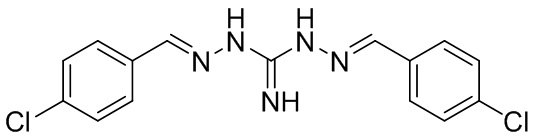
В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой F; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL021):
В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой F; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL023):
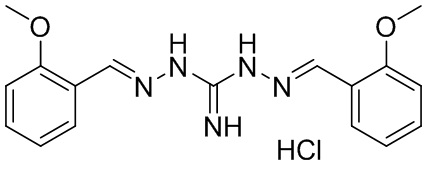
В другом предпочтительном варианте реализации изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R8, R12, R14, R15, R16, R17 представляют собой H; R4 представляет собой NH; R9 и R13 представляют собой OCH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL028):
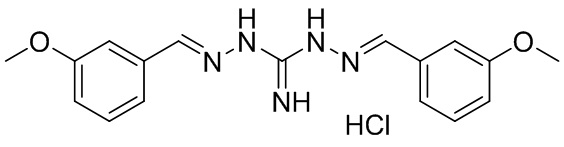
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой OCH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL029):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R8 и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL030):
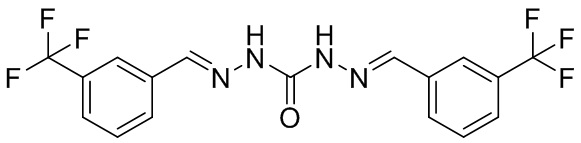
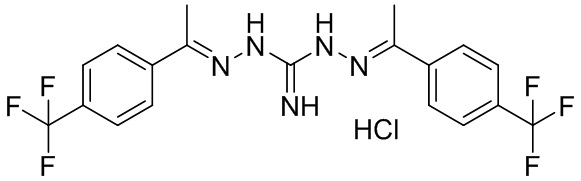
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL035):
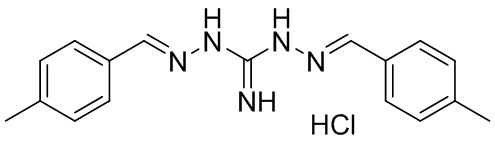
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой метил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL038):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R8, R12, R14, R15, R16, R17 представляют собой H; R4 представляет собой NH; R9 и R13 представляют собой метил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL039):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16 и R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой метил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL040):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой CF3; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL041):
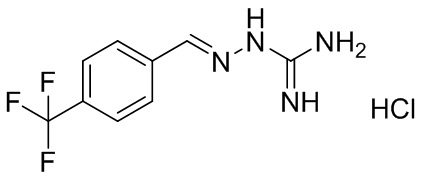
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R7, и R9 представляют собой H; R4 представляет собой NH; R8 представляет собой CF3; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL043):
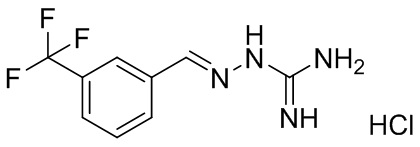
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой метил; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL044):
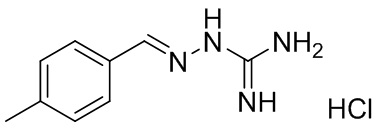
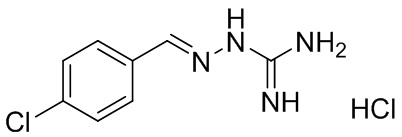
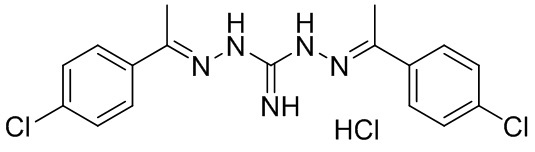
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R7, и R9 представляют собой H; R4 представляет собой NH; R8 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL052):
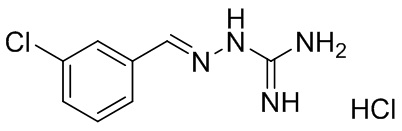
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, R17 представляют собой H; R4 представляет собой NH; R8 и R14 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL054):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL061):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL062):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NHNH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2 представляет собой метил, R5, R6, R8 и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL069):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R9, R12, R13, R15, R16, и R17 представляют собой H; R4 представляет собой S; R8 и R14 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL070):
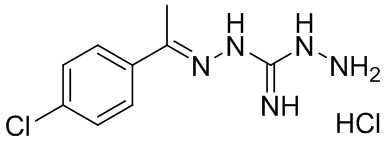
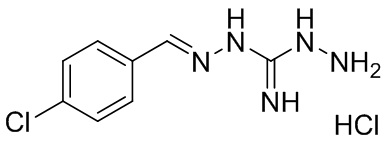
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2, R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL072):
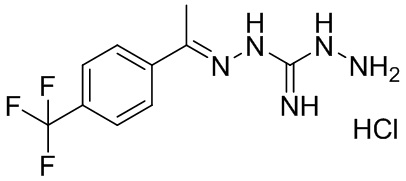
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NHNH2; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R2 представляет собой метил; R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой CF3; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL073):
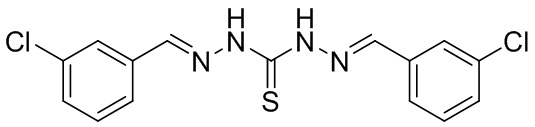
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7, R15 и R17 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL074):
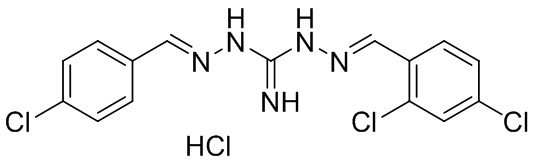
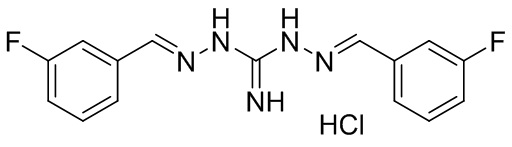
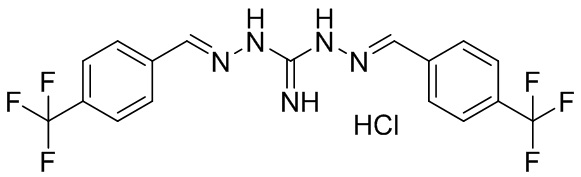
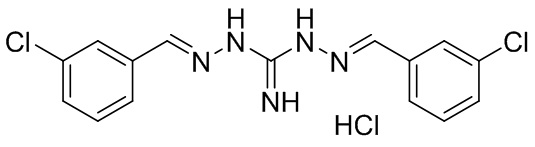
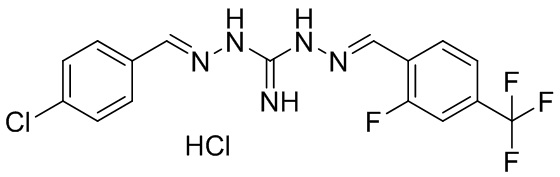
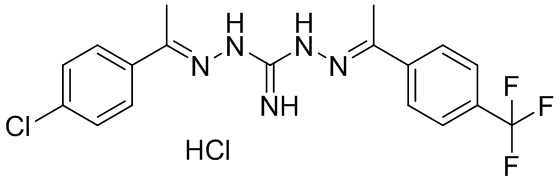
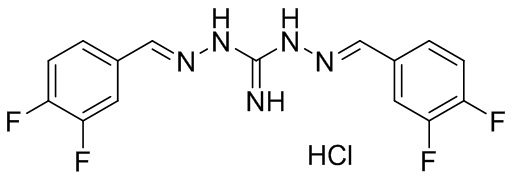
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой CF3; R17 представляет собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL078):
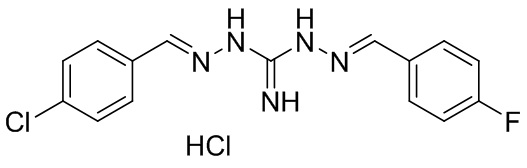
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL079):
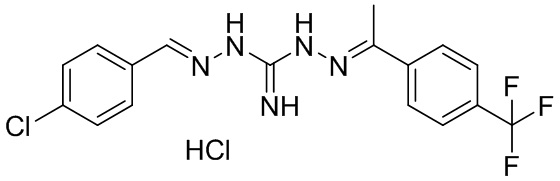
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R12 представляет собой метил; R15 представляет собой CF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL080):
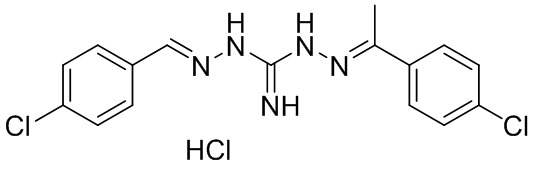
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R12 представляет собой метил; и «----» в Формуле I A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL081):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R7 и R17 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL082):
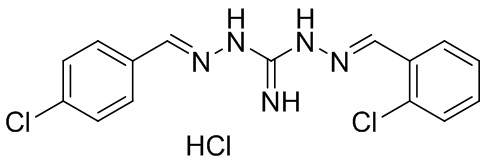
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R17 представляет собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL084):
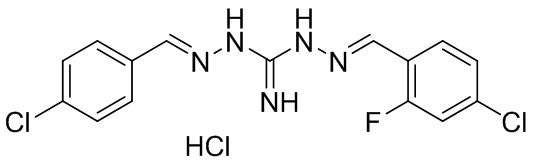
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R15, R16, и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R14 представляет собой CN; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL086):
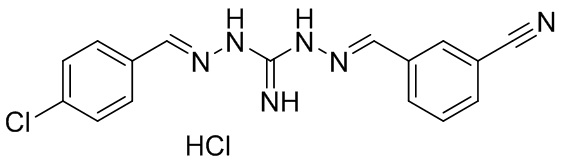
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R17 представляет собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL088):
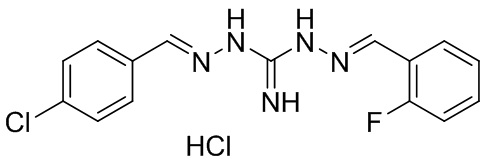
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; R15 представляет собой CF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL089):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R9, R12, R13, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R8 связаны вместе с образованием незамещенного бензольного кольца; R14 и R15 связаны вместе с образованием незамещенного бензольного кольца; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL093):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; A1 представляет собой N; A2 представляет собой NH; R1 представляет собой циклогексил; R3 представляет собой NH-N-CH-циклогексил; R4 представляет собой NH; R2 представляет собой H; и «----» в Формуле I между A0 и A1 представляет собой двойную связь. Пример соединения согласно данному варианту реализации изобретения включает (NCL094):
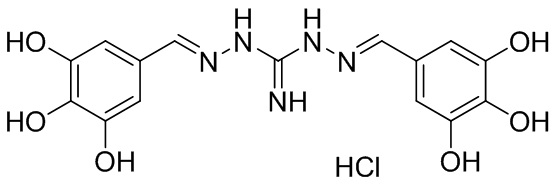
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7,, A12, A13, A14 и A15 представляют собой C; R2, R5, R9, R12, R13 и R17 представляют собой H; R4 представляет собой NH; R6, R7, R8, R14, R15, и R16 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL097):
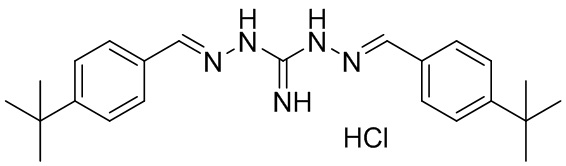
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой трет-бутил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL099):
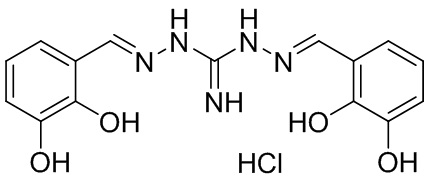
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R7, R8, R9, R12, R13, R14, и R15 представляют собой H; R4 представляет собой NH; R5, R6, R16, и R17 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL101):
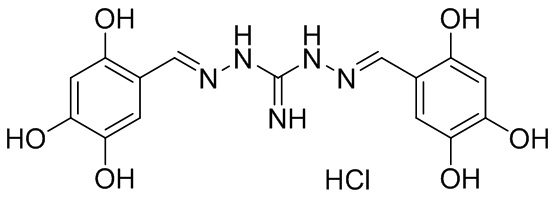
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R12, R14, и R17 представляют собой H; R4 представляет собой NH; R6, R7, R9, R13, R15, и R16 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL104):
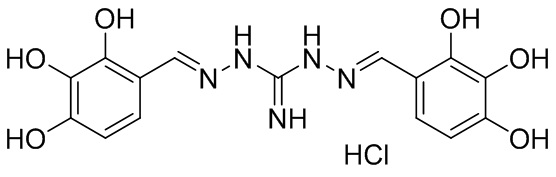
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R12, R16, и R17 представляют собой H; R4 представляет собой NH; R7, R8, R9, R13, R14, и R15 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL097):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R6, R7, R8, R9, R12, R13, R14, R15, и R16 представляют собой H; R4 представляет собой NH; R5 и R17 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL107):
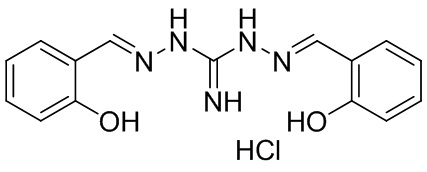
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R7, R8, R9, R12, R13, R14, R15, и R17 представляют собой H; R4 представляет собой NH; R6 и R16 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL108):
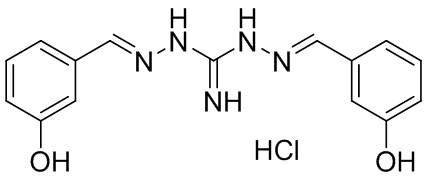
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой H; R4 представляет собой NH; R6, R7, R15, и R16 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL111):
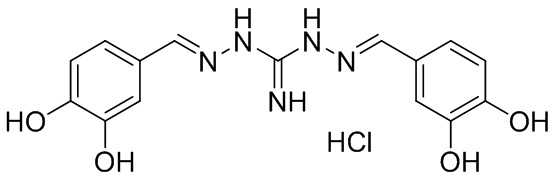
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой фенил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL112):
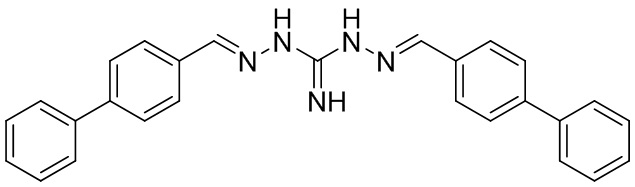
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой диметиламино; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL113):
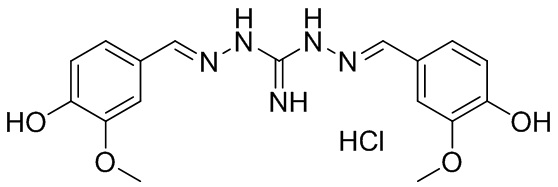
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой H; R4 представляет собой NH; R6 и R16 представляют собой OCH3; R7 и R15 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL117):
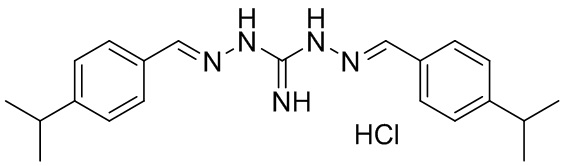
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой изо-пропил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL120):
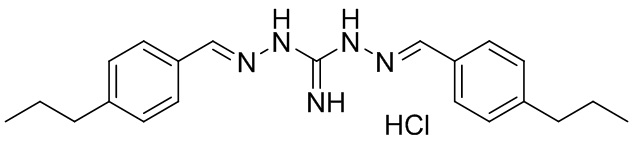
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой н-пропил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL121):
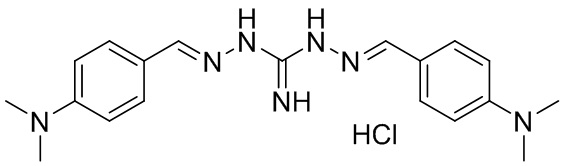
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R8, R9, R12, R13, R14, и R17 представляют собой H; R4 представляет собой NH; R6, R7, R15, и R16 представляют собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL123):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CCH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL126):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R7, R8, R9, R12, R13, R14, R15, и R17 представляют собой H; R4 представляет собой NH; R6 и R16 представляют собой Br; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL131):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой бутил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL136):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 представляет собой -C(C6H5)-CH-N- и A10 представляет собой -N-CH-C(C6H5)-; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R7, R8, R9, R12, R13, R14, R15, R16, и R17 представляют собой H; R4 представляет собой NH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL138):
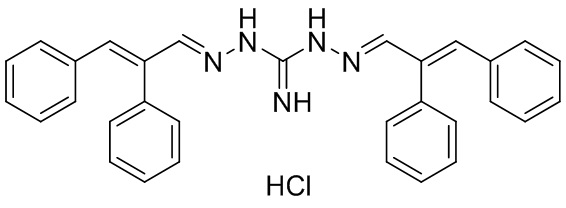
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CH3S; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL140):
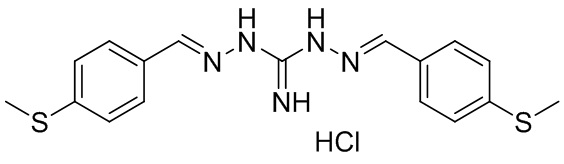
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу III; R3 представляет собой Формулу VI; A0 представляет собой C; R2 и R21 представляют собой H; A1 и A20 представляют собой N; A2 и A19 представляют собой NH; A8 и A21 представляют собой S; R4 представляет собой NH; R10 и R11 связаны вместе с образованием замещенного бензольного кольца; R22 и R23 связаны вместе с образованием замещенного бензольного кольца; и «----» в Формуле I между A0 и A1, и все «----» в Формуле III и Формуле VI представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL141):
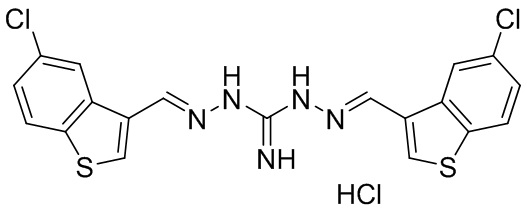
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R7, R8, R9, R13, R14, R15, R16, и R17 представляют собой H; R4 представляет собой NH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL143):
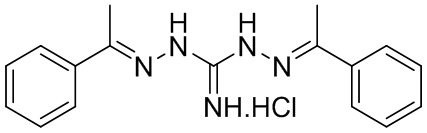
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R9, R12, R13, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R8 связаны вместе с образованием незамещенного гетероциклического кольца; R14 и R15 связаны вместе с образованием незамещенного, ненасыщенного гетероциклического кольца; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL146):
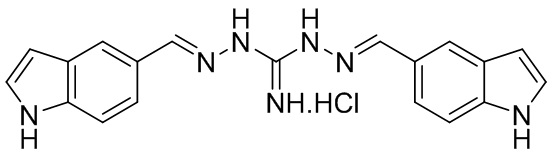
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 представляет собой -(CH)2-N- и A10 представляет собой –N-(CH)2-; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой OCH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL150):
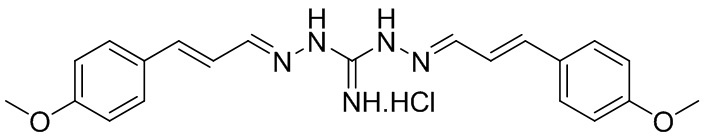
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой OH; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL151):
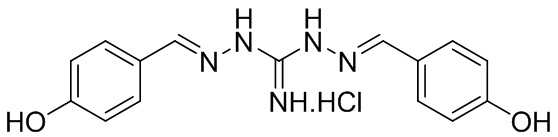
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой этил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL153):
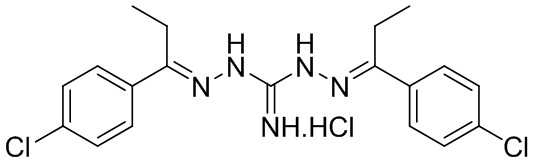
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Br; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL155):
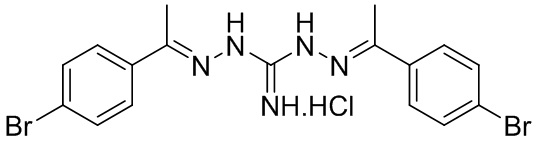
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R12, R14, R16, и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R9 и R13 представляют собой NH2; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL157):
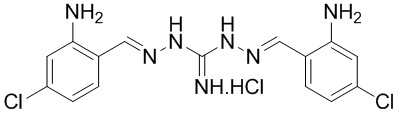
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой этил; R5 и R17 представляют собой OH; R6, R8, R9, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL158):
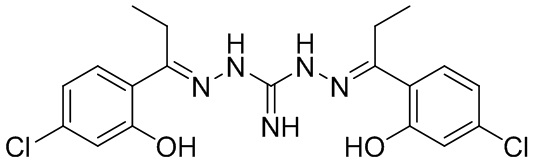
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой циклопентил; R5 и R17 представляют собой OH; R6, R8, R9, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL159):
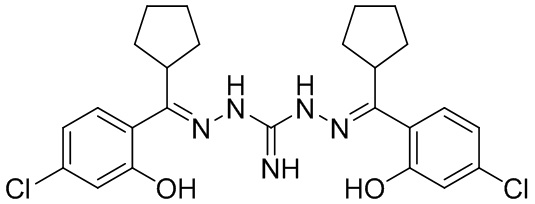
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой OCF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL160):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой пиперазин-1-ил; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL161):
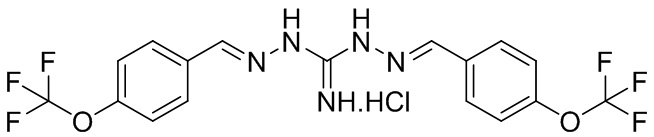
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой O-CH2-CH3; A1 представляет собой N; A2 представляет собой NH; A0, A3, A4, A5, A6 и A7 представляют собой C; R2 представляет собой метил; R5, R6, R8, и R9 представляют собой H; R4 представляет собой NH; R7 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL162):
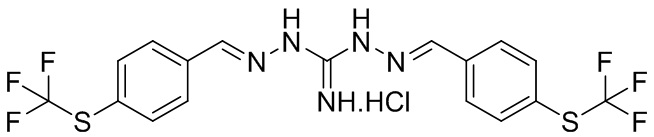
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R5, R6, R8, R9, R12, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой SCF3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL166):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R5 и R17 представляют собой -NH-CH(OH)-CH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL168):
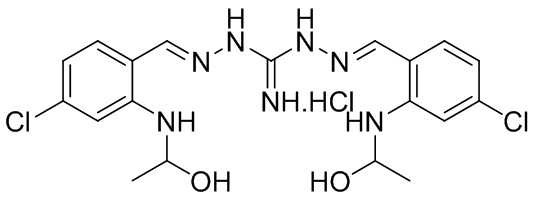
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой Cl. Пример соединения согласно данному варианту реализации изобретения включает (NCL179):
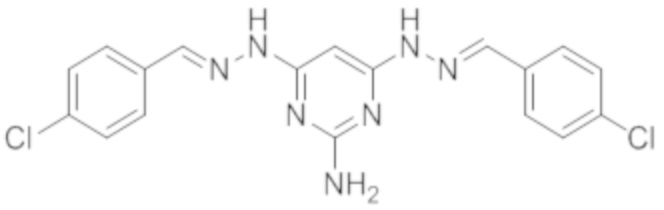
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой NH2; A1 представляет собой N; A2 и R4 представляют собой NH; A0, A3, A4, A5, A6, и A7 представляют собой C; R5, R6, R8, и R9 представляют собой H; R2 представляет собой бутил; R7 представляет собой Cl; и «----» в Формуле I между A0 и A1, и все «----» в Формуле II представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL188):
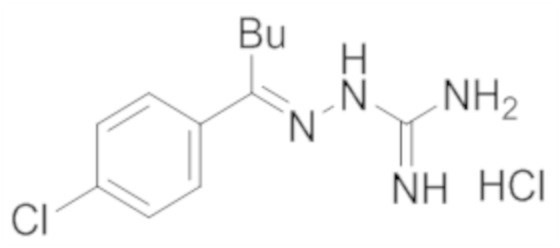
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой CH3. Пример соединения согласно данному варианту реализации изобретения включает (NCL195):
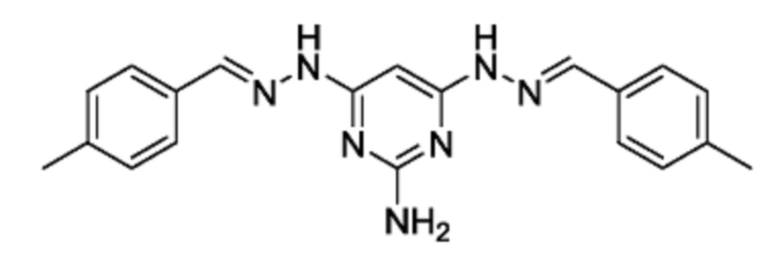
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой OH. Пример соединения согласно данному варианту реализации изобретения включает (NCL196):
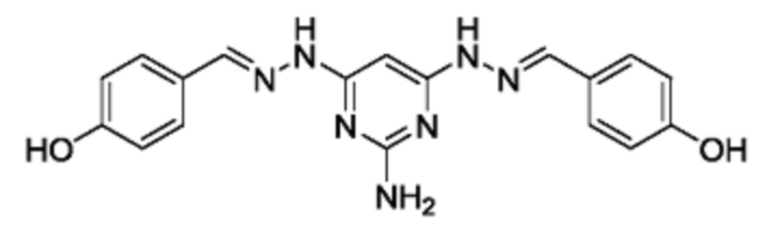
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой Br. Пример соединения согласно данному варианту реализации изобретения включает (NCL193):
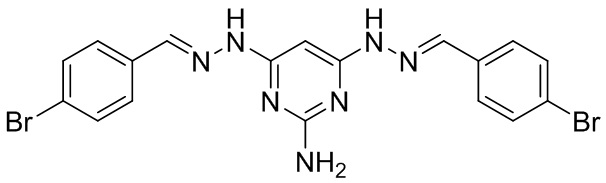
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R26, R27 и R28 представляют собой H; и A23, A24, A25, A26 и A27 представляют собой C. Пример соединения согласно данному варианту реализации изобретения включает (NCL199):
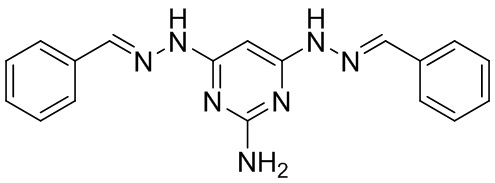
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-C(CH3)-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой Cl. Пример соединения согласно данному варианту реализации изобретения включает (NCL204):
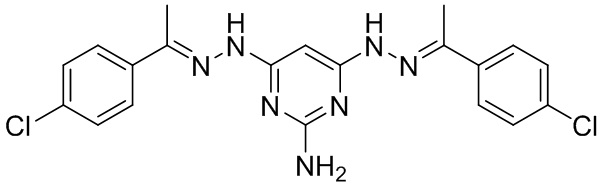
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2, R6, R8, R9, R12, R13, R14, и R16 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой Cl; R5 и R17 представляют собой F; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL216):
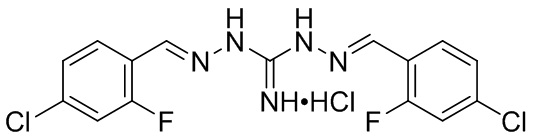
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL217):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где R1 представляет собой Формулу II; R3 представляет собой Формулу IV; A1 и A10 представляют собой N; A2 и A9 представляют собой NH; A0, A3, A4, A5, A6, A7, A11, A12, A13, A14 и A15 представляют собой C; R2 и R12 представляют собой метил; R5, R6, R8, R9, R13, R14, R16 и R17 представляют собой H; R4 представляет собой NH; R7 и R15 представляют собой CH3; и «----» в Формуле I между A0 и A1, все «----» в Формуле II и Формуле IV представляют собой двойные связи. Пример соединения согласно данному варианту реализации изобретения включает (NCL219):
В другом предпочтительном варианте реализации настоящего изобретения соединение представляет собой соединение Формулы I или его стереоизомер, таутомер, фармацевтически приемлемую соль или пролекарство, где A0 представляет собой C; R1 представляет собой H; A2 и R4 представляют собой N; R3 представляет собой NH2; A1 представляет собой Формулу VII; R2 представляет собой Формулу VII и R2 связан с R4, образуя пиримидиновое кольцо; «----» в Формуле I между R2 и A0, и между A1 и A2 представляют собой двойные связи; A22 представляет собой –N-CH-; R24, R25, R27 и R28 представляют собой H; A23, A24, A25, A26 и A27 представляют собой C; и R26 представляет собой CF3. Пример соединения согласно данному варианту реализации изобретения включает (NCL221):
В другом аспекте настоящее изобретение включает соединение, выбранное из списка соединений, представленных на Фиг. 1. В одном из предпочтительных вариантов реализации соединение представляет собой соединение, выбранное из следующих соединений: NCL231 - NCL275. В дополнительном аспекте настоящее изобретение включает композицию, содержащую соединение согласно настоящему изобретению. В дополнительном аспекте настоящее изобретение включает фармацевтическую композицию, содержащую соединение согласно настоящему изобретению вместе с фармацевтически приемлемым вспомогательным веществом и/или носителем. В дополнительном аспекте настоящее изобретение включает ветеринарную композицию, содержащую соединение согласно настоящему изобретению вместе с приемлемым вспомогательным веществом и/или носителем.
Термины, используемые в настоящем документе, имеют обычное значение, известное в данной области техники, если не указано иное. В данном контексте термин робенидин, NCL812 (также известный как 1,3-бис[(E)-(4-хлорфенил)метиленамино]гуанидин) относится к соединению, имеющему следующую химическую структуру:
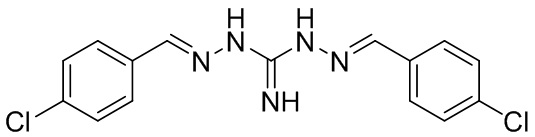
Предпочтительно, протозойный агент выбран из группы родов, подродов и видов, перечисленных в таблице 1.
Таблица 1
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Дополнительные признаки настоящего изобретения более подробно описаны в следующем описании некоторых не ограничивающих вариантов его реализации. Настоящее описание включено исключительно для целей иллюстрации настоящего изобретения. Его не следует понимать как ограничение широкой сущности изобретения, раскрытия или описания изобретения, изложенного выше. Представленное описание сделано со ссылкой на сопроводительные графические материалы, на которых:
На Фиг. 1 представлено химическое название и химическая структура соединений с NCL001 по NCL230;
На Фиг. 2 представлена диаграмма, иллюстрирующая активность NCL099 против Giardia duodenalis;
На Фиг. 3 представлена диаграмма, иллюстрирующая действие NCL812 и метронидазола на адгезию трофозоитов Giardia duodenalis;
На Фиг. 4 представлена диаграмма, иллюстрирующая активность NCL812 против Giardia duodenalis;
На Фиг. 5 представлена диаграмма, иллюстрирующая активность NCL062 против Giardia duodenalis;
На Фиг. 6 представлена диаграмма, иллюстрирующая активность метронидазола против Giardia duodenalis;
На Фиг. 7 представлена диаграмма, демонстрирующая лизис эритроцитов на основании n-кратной минимальной ингибирующей концентрации;
На Фиг. 8 представлены фотографии, демонстрирующие изменение ультраструктуры трофозоитов жиардий под действием NCL812. A-B: контроль, 0,1% ДМСО, C: контроль с метронидазолом, D-G: трофозоиты, обработанные NCL812 (1 час);
На Фиг. 9 представлена диаграмма, демонстрирующая кумулятивное высвобождение NCL812 и NCL099 из Лекарственной формы B в соответствии с примером 7;
На Фиг. 10 представлена диаграмма, демонстрирующая активность соединений NCL в концентрации 10 мкМ против T. brucei (черный) и L. donovani (серый);
На Фиг. 11 представлена таблица, иллюстрирующая физико-химические и метаболические характеристики девяти соединений NCL;
На Фиг. 12 представлена диаграмма, иллюстрирующая профили зависимости концентрации в плазме от времени для NCL026, NCL195, NCL259 и NCL812; и
На Фиг. 13 представлена диаграмма, иллюстрирующая концентрации NCL195 в плазме самцов швейцарских нелинейных мышей после внутрибрюшинного (IP) введения средней дозы 43 мг/кг.
ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Общее описание
Перед подробным описанием настоящего изобретения следует понимать, что настоящее изобретение не ограничено конкретными иллюстративными способами или композициями, описанными в настоящем документе. Также следует понимать, что терминология, используемая в настоящем документе, предназначена только для описания конкретных вариантов реализации изобретения и не предназначена для ограничения.
Все публикации, цитируемые в данном документе, включая патенты или патентные заявки, включены посредством ссылки во всей их полноте. Однако заявки, которые упомянуты в настоящем документе, включены лишь для описания и раскрытия способов, протоколов и реагентов, упомянутых в публикации, которые могут быть использованы в отношении настоящего изобретения. Цитирование публикаций, упомянутых в настоящем документе, не следует толковать как признание того, что настоящее изобретение не имеет права датировать такое описание более ранним числом в силу действия более раннего изобретения.
Кроме того, при осуществлении настоящего изобретения, если не указано иное, используют традиционные технологии микробиологии, которые соответствуют данной области техники. Такие традиционные технологии известны опытным специалистам.
В данном контексте и в прилагаемой формуле изобретения формы единственного числа включают множественное число, если из контекста очевидно не следует иное.
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно подразумевается обычным специалистом в данной области техники, к которой относится настоящее изобретение. Хотя любые материалы и способы, подобные или эквивалентные описанным в настоящем документе, могут быть использованы для осуществления настоящего изобретения, в настоящем документе описаны предпочтительные материалы и способы.
Изобретение, описанное в настоящем документе, может включать один или более диапазонов значений (например, размера, концентрации, дозы и т.д.). Диапазон значений следует понимать как включающий все значения в пределах диапазона, в том числе значения, определяющие диапазон, а также значения, примыкающие в указанному диапазону, которые приводят к такому же или по существу аналогичному результату, что и значения, расположенные непосредственно рядом со значением, которое определяет границу диапазона.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению могут быть введены в виде различных единичных доз, в зависимости от способа введения, сайта-мишени, физиологического состояния пациента и введения других лекарственных средств. Например, единичная лекарственная форма, подходящая для перорального введения, включает твердые лекарственные формы, такие как порошки, таблетки, пилюли и капсулы, и жидкие лекарственные формы, такие как эликсиры, сиропы, растворы и суспензии. Активные ингредиенты также могут быть введены парентерально в виде стерильных жидких лекарственных форм. Желатиновые капсулы могут содержать активный ингредиент и неактивные ингредиенты, такие как порошкообразные носители, глюкоза, сахароза, маннит, крахмал, целлюлоза или производные целлюлозы, стеарат магния, стеариновая кислота, сахарин натрия, тальк, карбонат магния и т.п.
Выражение «терапевтически эффективное количество» в данном контексте относится к количеству, достаточному для ингибирования роста простейших, связанного с протозойной инфекцией или колонизацией. Таким образом, ссылка на введение терапевтически эффективного количества соединения Формулы I в соответствии со способами или композициями настоящего изобретения относится к терапевтическому эффекту, при котором значительная протозоацидная или протозоастатическая активность вызывает существенное ингибирование протозойной инфекции. Термин «терапевтически эффективное количество» в данном контексте относится к достаточному количеству композиции для обеспечения требуемого биологического, терапевтического и/или профилактического результата. Требуемые результаты включают исключение протозойной инфекции или колонизации, или снижение и/или облегчение признаков, симптомов или причин заболевания, или любое другое требуемое изменение биологической системы. Эффективное количество в любом индивидуальном случае может быть определено специалистом в данной области техники с помощью стандартного экспериментирования. В отношении фармацевтической или ветеринарной композиции, эффективные количества могут представлять собой дозы, которые рекомендованы для модулирования болезненного состояния или его признаков или симптомов. Эффективные количества варьируется от используемой композиции и используемого способа введения. Эффективные количества обычно оптимизируют с учетом фармакокинетических и фармакодинамических характеристик, а также различных факторов конкретного пациента, таких как возраст, масса, пол и т. д., а также области, пораженной заболеванием или вызывающими заболевание микробами.
В данном контексте термины «лечить» или «лечение» относятся к полному или частичному устранению симптомов и признаков патологического состояния. Например, при лечении протозойной инфекции или колонизации лечение обеспечивает полное или частичное устранение признаков инфекции. Предпочтительно, при лечении инфекции лечение обеспечивает снижение или исключение инфицирующих протозойных патогенов, приводя к микробиологическому исцелению.
В данном контексте термин «простейшие» относится к членам крупного домена эукариотических одноклеточных микроорганизмов. Обычно нескольких микрометров в длину, простейшие имеют множество форм, от сфер до палочек и спиралей, и могут присутствовать в виде отдельных клеток или могут присутствовать в линейных цепях или кластерах с различным количеством и формой. Предпочтительно, термины «простейшие» и его прилагательные «протозойный», «протозойные» относятся к простейшим. Указанные термины могут относиться к штамму, восприимчивому к действию антипротозойных агентов, или к штамму, резистентному к действию антипротозойных агентов.
В данном контексте термин «резистентные простейшие» относится к протозойному изоляту, который демонстрирует устойчивость к любому из следующих антимикробных агентов, перечисленных в Таблице 2.
Таблица 2: Антимикробные агенты
Фармацевтически и ветеринарно приемлемые соли включают соли, которые сохраняют биологическую эффективность и свойства соединений согласно настоящему описанию и которые не являются биологически или иным образом нежелательными. Во многих случаях соединения, описанные в настоящем документе, могут образовывать соли с кислотами и/или основаниями за счет наличия аминогрупп и/или карбоксильных групп, или подобных им групп. Приемлемые соли присоединения оснований могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включая, лишь в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из органических оснований, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, таких как, лишь в качестве примера, алкиламины, диалкиламины, триалкиламины, замещенные алкиламины, ди(замещенный алкил)амины, три(замещенный алкил)амины, алкениламины, диалкениламины, триалкениламины, замещенные алкениламины, ди(замещенный алкенил)амины, три(замещенный алкенил)амины, циклоалкиламины, ди(циклоалкил)амины, три(циклоалкил)амины, замещенные циклоалкиламины, дизамещенные циклоалкиламины, тризамещенные циклоалкиламины, циклоалкениламины, ди(циклоалкенил)амины, три(циклоалкенил)амины, замещенные циклоалкениламины, дизамещенные циклоалкениламины, тризамещенные циклоалкениламины, ариламины, диариламины, триариламины, гетероариламины, дигетероариламины, тригетероариламины, гетероциклические амины, дигетероциклические амины, тригетероциклические амины, смешанные ди- и триамины, в которых по меньшей мере два заместителя в амине различны и выбраны из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, арила, гетероарила, гетероциклического фрагмента и т.п. Включены также амины, в которых два или три заместителя вместе с атомом азота аминогруппы образуют гетероциклическую или гетероарильную группу.
Фармацевтически и ветеринарно приемлемые соли присоединения кислоты могут быть получены из неорганических и органических кислот. Неорганические кислоты, которые могут быть использованы, включают, лишь в качестве примера, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, которые могут быть использованы, включают, лишь в качестве примера, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п.
Фармацевтически или ветеринарно приемлемые соли соединений, пригодные в настоящем описании, могут быть синтезированы из исходного соединения, которое содержит основной или кислотный фрагмент, с помощью обычных химических способов. Как правило, такие соли могут быть получены путем взаимодействия данных соединений в свободной кислотной или основной формах со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; в целом, предпочтительна неводная среда, такая как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Список подходящих солей представлен в Remington, Pharmaceutical Sciences. 17-ое изд.,Mack Publishing Company, Истон, штат Пенсильвания,(1985), с. 1418, описание которого включено в настоящий документ посредством ссылки. Примеры таких приемлемых солей представляют собой йодид, ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, γ-гидроксибутират, β-гидроксибутират, бутин-1,4-диоат, гексин-1,4-диоат, гексин-1,6-диоат, капроат, каприлат, хлорид, циннамат, цитрат, деканоат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацинат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, пропансульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и т.п.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению могут быть составлены обычным способом, при необходимости вместе с другими фармацевтически приемлемыми вспомогательными веществами, в виде форм, подходящих для перорального, парентерального или местного введения. Способы введения могут включать парентеральное, например, внутримышечное, подкожное и внутривенное введение, пероральное введение, местное введение и непосредственное введение в очаги инфекции, такое как внутриглазное, внутриушное, внутриматочное, интраназальное, интрамаммарное, интраперитонеальное, внутриочаговое и т.д.
Фармацевтические или ветеринарные композиции согласно настоящему изобретению могут быть составлены для перорального введения. Традиционные неактивные ингредиенты могут быть добавлены для обеспечения требуемого цвета, вкуса, стабильности, буферной емкости, диспергирования и других известных требуемых характеристик. Примеры включают красный оксид железа, силикагель, лаурилсульфат натрия, диоксид титана, съедобные белые красители и т.д. Для получения прессованных таблеток могут быть использованы стандартные разбавители. Таблетки и капсулы могут быть изготовлены в виде композиций с устойчивым высвобождением для непрерывного высвобождения лекарственного средства в течение определенного периода времени. Прессованные таблетки могут быть форме таблеток с сахарным покрытием или с пленочным покрытием, или в виде таблеток с энтеросолюбильным покрытием для селективного разложения в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать окрашивающие и/или ароматизирующие агенты для улучшения соблюдения пациентом режима терапии. Например, пероральная лекарственная форма, содержащая соединения согласно настоящему изобретению, может представлять собой таблетку, содержащую любое из следующих вспомогательных веществ или их комбинацию: безводный гидрофосфат кальция, микрокристаллическая целлюлоза, лактоза, гидроксипропилметилцеллюлоза и тальк.
Композиции, описанные в настоящем документе, могут быть представлены в жидкой лекарственной форме. Примеры предпочтительных жидких композиций включают растворы, эмульсии, растворы для инъекций, растворы, содержащиеся в капсулах. Жидкая лекарственная форма может содержать раствор, который содержит терапевтический агент, растворенный в растворителе. В целом, может быть использован любой растворитель, который обладает требуемым эффектом, в котором растворяется терапевтический агент и который может быть введен субъекту. В целом, может быть использована любая концентрация терапевтического агента, которая обладает требуемым эффектом. В некоторых вариантах реализации лекарственная форма представляет собой раствор, который является ненасыщенным, насыщенным или пересыщенным раствором. Растворитель может представлять собой чистый растворитель или может быть смесью жидких компонентов растворителей. В некоторых вариантах реализации образованный раствор представляет собой лекарственную форму, образующую гель in situ. Растворители и типы растворов, которые могут быть использованы, известны специалистам в области технологии доставки лекарств.
Композиции, описанные в настоящем документе, могут быть представлены в форме жидкой суспензии. Жидкие суспензии могут быть получены стандартными способами, известными в данной области техники. Примеры жидких суспензий включают микроэмульсии, образование комплексообразующих соединений и стабилизирующие суспензии. Жидкая суспензия может быть в неразбавленной или концентрированной форме. Жидкие суспензии для перорального применения могут содержать подходящие консерванты, антиоксиданты и другие вспомогательные вещества, которые, как известно в данной области техники, действуют в качестве одного или более из диспергирующих агентов, суспендирующих агентов, загустителей, эмульгаторов, увлажнителей, солюбилизирующих агентов, стабилизирующих агентов, ароматизаторов и подсластителей, окрашивающих агентов и т.п. Жидкая суспензия может содержать глицерин и воду.
Композиция, описанная в настоящем документе, может быть в форме пасты для перорального применения. Паста для перорального применения может быть получена стандартными способами, известными в данной области техники.
Композиция, описанная в настоящем документе, может быть представлена в жидкой лекарственной форме для инъекции, такой как внутримышечная инъекция, и может быть получена известными в данной области техники способами. Например, жидкая лекарственная форма может содержать поливинилпирролидон K30 и воду.
Композиция, описанная в настоящем документе, может быть в форме препаратов для местного применения. Препарат для местного применения может быть в форме лосьона или крема, полученного способами, известными в данной области техники. Например, лосьон может быть составлен с водной или масляной основной и может содержать одно или более вспомогательных веществ, которые, как известно в данной области техники, действуют в качестве загустителей, эмульгаторов, ароматизаторов или душистых веществ, консервантов, хелатообразующих агентов, модификаторов рН, антиоксидантов и т.п. Например, лекарственная форма для местного применения, содержащая одно или более соединений согласно настоящему изобретению, может представлять собой гель, содержащий любое из следующих вспомогательных веществ или их комбинацию: ПЭГ 8000, ПЭГ 4000, ПЭГ 200, глицерин, пропиленгликоль. Соединение NCL812 cможет быть дополнительно составлено в виде твердой дисперсии с применением SoluPlus (BASF, www.soluplus.com) и может быть составлено с любым из следующих вспомогательных веществ или их комбинацией: ПЭГ 8000, ПЭГ 4000, ПЭГ 200, глицерин и пропиленгликоль.
Для введения в виде аэрозоля композиция согласно настоящему изобретению представлена в виде тонкодисперсной формы вместе с нетоксичным поверхностно-активным веществом и распыляющим веществом. Поверхностно-активное вещество предпочтительно растворимо в распыляющем веществе. Такие поверхностно-активные вещества могут включать сложные эфиры или неполные сложные эфиры жирных кислот.
В альтернативном варианте композиции согласно настоящему изобретению могут быть составлены для доставки посредством инъекции. Например, соединение доставляют посредством инъекции одним из следующих способов: внутривенный, внутримышечный, интрадермальный, интраперитонеальный и подкожный.
В альтернативном варианте композиции согласно настоящему изобретению могут быть составлены с помощью нанотехнологических способов доставки лекарств, известных в данной области техники. Системы доставки лекарств на основе нанотехнологий имеют преимущество улучшения биодоступности, соблюдения пациентом режима терапии и уменьшения побочных эффектов.
Лекарственная форма композиции согласно настоящему изобретению включает препарат наночастиц в форме наносуспензий или наноэмульсий, на основании растворимости соединения. Наносуспензии представляют собой дисперсии наноразмерных частиц лекарства, полученные восходящей или нисходящей технологией и стабилизированные подходящими вспомогательными веществами. Такой подход может быть применен к соединениям согласно настоящему изобретению, которые могут обладать слабой растворимостью в воде и жирах, для улучшения растворимости при насыщении и улучшения характеристик растворения. Пример такой технологии описан в публикации Sharma and Garg (2010) (Pure drug and polymer-based nanotechnologies for the improved solubility, stability, bioavailability, and targeting of anti-HIV drugs. Advanced Drug Delivery Reviews, 62: с. 491-502). Растворимость при насыщении понимают как специфическую для соединения постоянную, которая зависит от температуры, свойств среды растворения и размера частиц (менее 1-2 мкм).
Композиция согласно настоящему изобретению может быть представлена в форме наносуспензии. Для наносуспензий увеличение площади поверхности может приводить к увеличению растворимости при насыщении. Наносуспензии представляют собой коллоидные системы доставки лекарств, состоящие из частиц размером менее 1 мкм. Композиции согласно настоящему изобретению могут быть в форме наносуспензий, включая нанокристаллические суспензии, твердые липидные наночастицы (SLN), полимерные наночастицы, нанокапсулы, полимерные мицеллы и дендримеры. Наносуспензии могут быть получены с помощью нисходящего подхода, в котором более крупные частицы могут быть уменьшены до нанометрового размера посредством различных технологий, известных в данной области техники, включая влажное измельчение и гомогенизацию при высоком давлении. В альтернативном варианте наносуспензии могут быть получены с помощью восходящей технологии, в которой может быть осуществлено контролируемое осаждение частиц из раствора.
Композиция согласно настоящему изобретению может быть представлена в форме наноэмульсии. Наноэмульсии, как правило, представляют собой прозрачные системы типа «масло в воде» или «вода в масле», с размером капель 100-500 нм, в которых рассматриваемые соединения присутствуют в гидрофобной фазе. Получение наноэмульсий может обеспечивать улучшение растворимости соединений согласно настоящему изобретению, описанных в данном документе, что приводит к улучшению биодоступности. Наноразмерные суспензии также могут содержать агенты для электростатической или стерической стабилизации, такие как полимеры и поверхностно-активные вещества. Композиции в форме SLN могут содержать биоразлагаемые липиды, такие как триглицериды, стероиды, воски, и эмульгаторы, такие как соевый лецитин, яичный лецитин и полоксамеры. Получение препарата SLN может включать растворение/диспергирование лекарства в расплавленном липиде с последующей горячей или холодной гомогенизацией. При использовании горячей гомогенизации расплавленная липидная фаза может быть диспергирована в водной фазе с получением эмульсии. Она может быть отверждена посредством охлаждения с получением SLN. При использовании холодной гомогенизации липидная фаза может быть отверждена в жидком азоте и измельчена до микронного размера. Полученный порошок может быть подвергнут гомогенизации при высоком давлении в водном растворе поверхностно-активного вещества.
Соединения Формулы I, описанные в настоящем документе, могут быть растворены в маслах/жидких липидах и стабилизированы с получением эмульсионной лекарственной формы. Наноэмульсии могут быть получены с помощью технологий высокоэнергетического и низкоэнергетического уменьшения размера капель. Высокоэнергетические способы могут включать гомогенизацию при высоком давлении, обработку ультразвуком и микрофлюидизацию. При использовании низкоэнергетического способа диффузия растворителя и инверсия фаз приводит к самопроизвольному образованию наноэмульсии. Липиды, используемые в наноэмульсиях, могут быть выбраны из группы, содержащей триглицериды, соевое масло, сафлоровое масло и кунжутное масло. Также могут быть добавлены другие компоненты, такие как эмульгаторы, антиоксиданты, модификаторы рН и консерванты.
Композиция может быть в форме лекарственного препарата с контролируемым высвобождением и может содержать разлагаемый или не разлагаемый полимер, гидрогель, органогель или другой физический конструкт, который модифицирует высвобождение соединения. Понятно, что такие лекарственные формы могут содержать дополнительные неактивные ингредиенты, которые добавляют для обеспечения требуемого цвета, стабильности, буферной емкости, диспергирования или других известных требуемых характеристик. Такие лекарственные формы могут дополнительно содержать липосомы, такие как эмульсии, пены, мицеллы, нерастворимые монослои, жидкие кристаллы, фосфолипидные дисперсии, чешуйчатые слои и т.п. Липосомы для применения в настоящем изобретении могут быть получены из стандартных липидов, образующих везикулы, обычно включающих нейтральные и отрицательно заряженные фосфолипиды и стерин, такой как холестерин.
Лекарственные формы согласно настоящему изобретению могут иметь преимущество повышенной растворимости и/или стабильности соединений, в частности, для лекарственных форм, полученных с помощью нанотехнологических способов. Такая повышенная стабильность и/или стабильность соединений Формулы I может улучшать биодоступность и усиливать воздействие лекарства для пероральных и/или парентеральных лекарственных форм.
В тексте настоящего описания, если из контекста не следует иное, термин «содержит» или его варианты, такие как «содержат» или «содержащий», следует понимать как включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел.
ПРИМЕРЫ
ПРИМЕР 1: Получение аналогов NCL812.
Материалы и способы
NCL812
Получали NCL812 аналитической степени чистоты с определенной эффективностью 960 мг/г (т. е. 96 %). Порошок хранили в закрытом контейнере для образцов в защищенном от прямого солнечного света месте и при комнатной температуре в исследовательском центре. Аликвоты (1 мл) исходного раствора (содержащего 25,6 мг/мл NCL812 в ДМСО) получали и хранили при минус 80 °С и размораживали непосредственно перед использованием.
Синтез и испытание аналогов NCL812
Аналоги NCL001-NCL275, указанные на Фиг. 1, синтезировали стандартными способами, известными в данной области техники. Например, для получения соединений NCL097; NCL157; NCL179; NCL188; NCL195; и NCL196 использовали следующие способы:
NCL 097 (2,2’-бис[(3,4,5-тригидроксифенил)метилен]карбонимидо-дигидразида гидрохлорид)
Суспензию 3,4,5-тригидроксибензальдегида (412,0 мг, 2,673 ммоль, 2,21 экв.) и N,N′-диаминогуанидина гидрохлорида (152,0 мг, 1,211 ммоль) в EtOH (5 мл) обрабатывали микроволновым излучением (150 Вт) при 100 °C в течение 10 минут. Затем реакционную смесь оставляли остывать до температуры окружающей среды. Полученный осадок собирали и промывали ледяным EtOH (5 мл) и Et2O (5 мл) с получением карбонимидо-дигидразида (369,0 мг, 77 %) в виде бледно-коричневого твердого вещества. Тпл. 292 °C (разлож.). 1H ЯМР (300 МГц, ДМСО-d6) δ 9,06 (ш с, 6H), 8,25 – 8,01 (м, 4H), 6,83 (с, 4H). 13C ЯМР (75 МГц, ДМСО-d6) δ 152,2, 149,7, 146,2, 136,5, 123,7, 107,4. МС-НР (ИЭР+): 361,95 [M + 1]+.
NCL157 (2,2’-бис[(2-амино-4-хлорфенил)метилен]карбонимидо-дигидразида гидрохлорид)
Синтез 2-амино-4-хлор-N-метокси-N-метилбензамида. К раствору 2-амино-4-хлорбензойной кислоты (5,6691 г, 33,041 ммоль, N,O-диметилгидроксиламина гидрохлорида (5,7504 г, 58,954 ммоль, 1,78 экв.), N-(3-диметиламинопропил)-N′-этилкарбодиимида гидрохлорида (7,7925 г, 40,649 ммоль, 1,23 экв.) и N-гидроксибензотриазола гидрата (5,2371 г, 38,793 ммоль) (в пересчете на безводное вещество), 1,17 экв.) в ДМФА (100 мл) добавляли диизопропилэтиламин (18,0 мл, 13,4 г, 104 ммоль, 3,15 экв.) и перемешивали коричневый раствор при комнатной температуре в течение 7 часов. Затем реакционную смесь концентрировали in vacuo, затем разбавляли 1M NaOH (100 мл) и экстрагировали CH2Cl2 (3 × 100 мл). Объединенные органические экстракты промывали 1M HCl (100 мл), затем сушили над MgSO4 и концентрировали in vacuo с получением коричневого сиропообразного вещества. Затем полученное маслянистое вещество дополнительно сушили при 60 °С под высоким вакуумом с получением неочищенного амида Вайнреба (7,021 г, 99 %) в виде коричневого сиропообразного вещества, которое кристаллизовалось при стоянии. Неочищенный материал использовали без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3) δ 7,24 (д, J = 8,4 Гц, 1H), 6,62 (д, J = 18 Гц, 1H), 6,54 (дд, J = 8,4, 1,9 Гц, 1H), 4,75 (с, 2H), 3,48 (с, 3H), 3,24 (с, 3H). 13C ЯМР (101 МГц, CDCl3) δ 169,2, 148,4, 137,1, 130,6, 116,6, 116,1, 115,0, 61,1, 34,0.
Синтез 2-амино-4-хлорбензальдегида. Неочищенный 2-амино-4-хлор-N-метокси-N-метилбензамид (751,1 мг, 3,532 ммоль) разделяли на партии примерно по120 мг и каждую растворяли в ТГФ (10 мл) и охлаждали до 0 °C, затем к каждой добавляли LiAlH4 (2M в ТГФ, 0,5 мл) и перемешивали растворы в течение 16 часов, оставляя реакционные смеси достигать комнатной температуры. Реакционные смеси гасили насыщенным раствором NH4Cl (1 мл), затем объединяли, разбавляли насыщенным раствором NaHCO3 (160 мл) и экстрагировали CHCl3 (2 × 150 мл, 1 × 75 мл). Объединенные органические слои сушили над MgSO4 и концентрировали in vacuo с получением неочищенного бензальдегида (463,3 мг, 85 %) в виде желто-оранжевых кристаллов. Материал использовали без дополнительной очистки. 1H (400 МГц, CD3OD) 9,77 (д, J = 0,7 Гц, 1H), 7,46 (д, J = 8,3 Гц, 1H), 6,83 – 6,71 (м, 1H), 6,63 (дд, J = 8,4, 1,9 Гц, 1H). 13C ЯМР (101 МГц, CD3OD) δ 194,6, 153,0, 142,5, 138,4, 118,3, 116,8, 116,1.
Синтез 2,2’-бис[(2-амино-4-хлорфенил)метилен]карбонимидо-дигидразида гидрохлорида. Суспензию 2-амино-4-хлорбензальдегида (128,0 мг, 0,823 ммоль, 1,78 экв.) и N,N′-диаминогуанидина гидрохлорида (58,0 мг, 0,462 ммоль) в EtOH (2 мл) обрабатывали микроволновым излучением (100 Вт) при 60 °C в течение 5 минут. Затем большую часть растворителя удаляли in vacuo, добавляли EtOH (1 мл) и переносили колбу в морозильную камеру для обеспечения кристаллизации. Полученный осадок собирали и промывали EtOH (1 мл) с получением карбонимидо-дигидразида (21,0 мг, 13 %) в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,71 (ш с, 2H), 8,40 (с, 2H), 8,37 (с, 2H), 7,29 (д, J = 8,4 Гц, 2H), 6,87 (д, J = 2,0 Гц, 2H), 6,73 (ш с, 4H), 6,59 (дд, J = 8,3, 2,0 Гц, 2H). 13C ЯМР (101 МГц, ДМСО-d6) δ 152,1, 151,5, 148,9, 136,0, 134,7, 115,1, 114,5, 112,8.
NCL179 (4,6-бис(2-(4-хлорбензилиден)гидразинил)пиримидин-2-амин)
Суспензию 2-амино-4,6-дигидразинилпиримидина (67,3 мг, 0,434 ммоль) и 4-хлорбензальдегида (198,8 мг, 1,414 ммоль, 3,26 экв.) в EtOH (25 мл) нагревали с обратным холодильником в течение 16 часов. В это время снимали холодильник и концентрировали раствор до объема около 1 мл, и полученный осадок отфильтровывали в горячем состоянии и промывали Et2O (10 мл) с получением аминопиримидина (42,8 мг, 25 %) в виде грязновато-белого аморфного порошка. Тпл. 275 °C (разлож.). 1H ЯМР (400 МГц, ДМСО) δ 10,70 (с, 2H), 8,02 (с, 2H), 7,67 (д, J = 8,4 Гц, 4H), 7,52 (д, J = 8,4 Гц, 4H), 6,28 (с, 1H), 5,85 (с, 2H). 13C ЯМР (101 МГц, ДМСО) δ 162,8, 162,6, 138,8, 134,1, 133,1, 128,9, 127,6, 73,5.
NCL188 ((E)-2-(1-(4-хлорфенил)пентилиден)гидразин-1-карбоксимидамида гидрохлорид)
Суспензию 1-(4-хлорфенил)пентанона (1,8319 г, 9,3146 ммоль, 1,95 экв.) и аминогуанидина гидрохлорида (527,6 мг, 4,773 ммоль) в EtOH (15 мл) нагревали при 65 °С в течение 16 часов. Неочищенную реакционную смесь охлаждали до комнатной температуры, затем разбавляли Et2O (60 мл) и охлаждали до 0 °C для осаждения не прореагировавшего аминогуанидина гидрохлорида (174,5 мг). Затем маточные растворы концентрировали in vacuo и растворяли остаток в Et2O (20 мл). Затем раствор кипятили и добавляли гексан (10 мл) с получением карбоксимидамида в виде твердого вещества кремового цвета. 1H ЯМР (400 МГц, ДМСО) δ 11,54 (с, 1H), 7,99 (д, J = 8,7 Гц, 2H), 7,90 (с, 3H), 7,47 (д, J = 8,6 Гц, 2H), 2,91 – 2,82 (м, 2H), 1,48 – 1,32 (м, 4H), 0,89 – 0,84 (м, 3H). 13C ЯМР (101 МГц, ДМСО) δ 156,2, 153,8, 134,8, 134,4, 128,7, 128,4, 28,1, 26,6, 22,0, 13,8
NCL195 (4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амин)
Суспензию 2-амино-4,6-дигидразинопиримидина (58,9 мг, 0,380 ммоль) и 4-метилбензальдегида (0,10 мл, 100 мг, 0,832 ммоль, 2,19 экв.) в EtOH (4 мл) нагревали с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, затем собирали грануловидный осадок, промывая Et2O (20 мл). Затем «гранулы» разрушали и дополнительно промывали твердое вещество Et2O (10 мл) с получением пиримидина (85,8 мг, 63 %) в виде белого «рыхлого» порошка. Тпл. 274-276 °C. 1H ЯМР (400 МГц, ДМСО) δ 10,51 (с, 2H), 8,00 (с, 2H), 7,54 (д, J = 8,0 Гц, 4H), 7,26 (д, J = 7,9 Гц, 4H), 6,26 (с, 1H), 5,77 (с, 2H), 2,34 (с, 6H). 13C ЯМР (101 МГц, ДМСО) δ 162,8, 162,6, 140,1, 138,4, 132,5, 129,4, 126,0, 73,3, 21,0.
NCL196 (4’,4'-((1E,1'E)-((2-аминопиридин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол)
Суспензию 2-амино-4,6-дигидразинопиримидина (70,4 мг, 0,454 ммоль) и 4-гидроксибензальдегида (140,3 мг, 1,149 ммоль, 2,53 экв.) в EtOH (3 мл) нагревали с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, затем собирали осадок, промывая Et2O (25 mL), с получением пиримидина (91,4 мг, 55 %) в виде грязновато-белого порошка. Тпл. 298 °C (разлож.). 1H ЯМР (400 МГц, ДМСО) δ 10,31 (с, 2H), 9,74 (с, 2H), 7,94 (с, 2H), 7,48 (д, J = 8,6 Гц, 4H), 6,83 (д, J = 8,6 Гц, 4H), 6,20 (с, 1H), 5,70 (с, 2H). 13C (101 МГц, ДМСО) δ 162,7, 162,5, 158,3, 140,5, 127,7, 126,3, 115,7, 73,0.
ПРИМЕР 2: Анализ адгезии жиардий
Цель. Целью данного исследования было определение анти-жиардиальной активности NCL099 и NCL812.
Способы. Штамм жиардий WB выращивали до слияния (выращивали и выдерживали в среде TYI-S-33 с 10% бычьей плодной сыворотки). Для анализа среду конфлюентной культуры заменяли свежей средой TYI-S-33. Затем культуры подвергали «холодному шоку» (на льду) в течение 40 минут для открепления трофозоитов. Плотность клеток в культурах регулировали до 1 × 106 клеток/мл, и 1 мл добавляли в каждую лунку 24-луночного планшета, уже содержащую 1 мл разбавленных соединений (см. ниже). На дно каждой лунки помещали покровное стекло и инкубировали аналитическую смесь в анаэробных условиях (в склянке для свечей) в течение 2,5 часов при 37 °С. После инкубации извлекали покровные стекла, сушили на воздухе и окрашивали красителем Дифф-Квик (вариант окраски по Романовскому). Покровные стекла устанавливали на стеклянные слайды с помощью монтажной среды Polymount. Получали изображения с 10х увеличением в 5 произвольных положениях каждого покровного стекла. Использовали бесплатное программное обеспечение Dotcount для подсчета количества клеток на изображении, и полученные данные анализировали с помощью GraphPad Prism версии 6. Исходные растворы соединений получали в ДМСО при 25,6 мг/мл. Соединения разбавляли 1: 100 в среде TYI-S-33. Затем проводили серийные разбавления 1: 2 в среде TYI-S-33 в 24-луночных планшетах.
Результаты. Результаты исследования представлены на Фиг. 2-3. На Фиг. 2 представлена активность NCL099 против Giardia duodenalis in vitro. Наблюдали значительное уменьшение количества адгезивных клеток при концентрациях NCL099 11 мкг/мл (P=0,0099), 38 мкг/мл (P=0,001) и 128 мкг/мл (P=<0,0001) по сравнению с контрольным образцом (Фиг. 2). По мере увеличения концентрации NCL099 наблюдали увеличение активности. На Фиг. 3 представлена активность NCL812 и метронидазола против Giardia duodenalis in vitro. Наблюдали значительное снижение количества адгезивных трофозоитов для метронидазола (P=0,0002) и NCL812 (P=<0,0001). Образцы выдерживали в течение 5 часов, а не 2,5 часов.
Вывод. В данном исследовании показано, что NCL099 и NCL812 ингибируют способность клеток Giardia к адгезии с поверхностью, тем самым ограничивая способность указанного патогена вызывать заболевания (поскольку адгезия необходима для инициации заболевания).
ПРИМЕР 3: Анализ восстановления резазурина
Цель. Определить активность NCL812 и NCL062 против Giardia duodenalis in vitro
Способы. Трофозоиты жиардий выращивали до конфлюентности. Среду заменяли на свежую среду и подвергали «холодному шоку» в течение 40 минут (как описано выше). Клетки разбавляли до концентрации примерно 500 000 клеток/мл и добавляли 100 мкл к каждой лунке аналитического планшета (за исключением лунки, содержащей только контрольный образец со средой). Аналитическую смесь инкубировали в анаэробных условиях (в склянке для свечей) в течение 42 часов при 37 °С. Добавляли Alamarblue™ в концентрации 10 % и инкубировали образцы в анаэробных условиях еще 6 часов. После инкубации считывали поглощение каждого образца при 570 и 630 нм. Рассчитывали процент восстановления резазурина (Alamarblue™) и анализировали данные с помощью программного обеспечения GraphPad Prism версии 6. Условия эксперимента: анализ проводили в 96-луночных планшетах в общем объеме 200 мкл. 100 мкл исходного раствора NCL812 или NCL062 (концентрация 25,6 мг/мл в ДМСО) или метронидазола (концентрация 5 мг/мл в ДМСО) добавляли к 9,9 мл среды TYI-S-33, затем серийно разбавляли 1:2 в той же среде. Клетки добавляли так, как описано выше.
Результаты. Результаты представлены на Фиг. 4-6. Все три исследованных соединения (NCL812, NCL062 и метронидазол) продемонстрировали уменьшение метаболической активности трофозоитов (показанное снижением процента восстановления резазурина). Оба соединения NCL продемонстрировали более высокую активность по сравнению с метронидазолом.
Вывод. Оба соединения NCL812 и NCL062 демонстрируют ингибирующую активность в отношении трофозоитов Giardia duodenalis in vitro.
ПРИМЕР 4: Анализ гемолиза эритроцитов
Цель. Целью данного исследование было определение токсичности in vitro NCL812, NCL099 и NCL062 против клеток млекопитающих.
Способы. Цельную кровь овец приобретали у компании Thermofisher scientific. Красные кровяные клетки отделяли от других компонентов крови посредством центрифугирования при 1500 g в течение 10 минут, и промывали солевым раствором 3 раза. Эритроциты разбавляли до концентрации примерно 1 × 1010 клеток/мл в солевом растворе. 50 мкл соединений NCL, разбавленных в ДМСО (см. ниже) добавляли в пробирки фирмы Eppendorf объемом 1,5 мл, и в каждую пробирку добавляли 500 мкл разбавленных красных кровяных клеток. Эритроциты инкубировали с соединениями в течение 30 минут при 37 °С при осторожном встряхивании (75 об./мин.). После инкубирования клетки на 5 минут помещали на лед, затем центрифугировали при 1500 об./мин. в течение 10 минут с получением клеточного осадка. Надосадочную жидкость удаляли и серийно разбавляли в солевом растворе. Поглощение надосадочной жидкости и разбавлений считывали при 550 нм. Лизис образца сравнивали с клетками, лизированными на 100 % в дистиллированной воде, и анализировали с помощью программного обеспечения GraphPad Prism версии 6.
Результаты. Результаты данного исследования представлены на Фиг. 7 (NCL062 испытывали от 1 до 128 мкг/мл, NCL812 испытывали от 2 до 256 мкг/мл, NCL099 испытывали от 8 до 124 мкг/мл). На Фиг. 7 представлен лизис эритроцитов как процент от положительного контроля (100 % лизированные клетки крови в воде) в различных концентрациях.
Вывод. В данном исследовании показано, что концентрация, необходимая для того, чтобы каждое соединение вызывало токсический эффект в клетках млекопитающих (эритроцитах), гораздо выше, чем концентрация, необходимая для воздействия на протозойные клетки (жиардий). В данном исследовании показано также, что NCL099 обладает более высокой селективностью в отношении бактериальных и протозойных клеток, чем в отношении клеток млекопитающих по сравнению с NCL812 и NCL062.
ПРИМЕР 5: Исследование просвечивающей электронной микроскопией
Цель. Определить влияние, которое NCL812 оказывает на ультраструктуру Giardia duodenalis.
Способы. Штамм Giardia WB выращивали до конфлюентности (как описано выше) и заменяли старую среду на новую среду, содержащую 6 мкг/мл NCL812, 25 мкг/мл метронидазола или 0,1% ДМСО (контроль). Образцы инкубировали при 37 °С в течение 1 часа (обработанные NCL) или 4 часов (обработанные метронидазолом и контрольные с ДМСО), затем подвергали «холодному шоку» для открепления трофозоитов. Обработанные образцы центрифугировали при 900 x g в течение 10 минут и дважды промывали холодным солевым раствором. Полученный клеточный осадок повторно суспендировали в предварительно охлажденном фиксаторе (1,25% глутеральдегида, 4% параформальдегида в PBS с 4% сахарозы, рН 7,2) и оставляли на ночь. Проводили последующую фиксацию образцов в 2% растворе тетраоксида осмия в течение 1 часа и дегидратировали с помощью изменяющихся серий этанола (70-100 %). Образцы заделывали в эпоксидную смолу и окрашивали уранилацетатом и цитратом свинца, затем рассматривали в просвечивающем электронном микроскопе FEI Tecnai G2 Spirit.
Результаты. Результаты исследования представлены на Фиг. 8. На данной фигуре показано существенное изменение ультраструктуры трофозоитов, обработанных NCL (D-G) по сравнению с контрольными образцами (A-C). Наблюдали развитие вакуолей и разрушение цитоплазматической мембраны.
Вывод. NCL812 вызывает существенные изменения ультраструктуры Giardia duodenalis.
ПРИМЕР 6: Лекарственные формы соединений
Получали следующие лекарственные формы, используя стандартные в данной области техники способы.
Лекарственная форма A – Лекарственная форма для местного применения - гель на основе ПЭГ с соединениями согласно изобретению
4,0 г ПЭГ 4000;
3,5 г ПЭГ 200;
0,6 г пропиленгликоля;
1,9 г воды; и
0,204 г Соединения (например, NCL099)
ПЭГ 4000, ПЭГ 200 и пропиленгликоль смешивали и нагревали до 150 °С и до растворения всех твердых кристаллов. Соединения добавляли к воде и обрабатывали ультразвуком в течение 30 минут до полного суспендирования. Раствор Соединения и растворы геля смешивали и оставляли остывать и затвердевать. Лекарственная форма A вероятно демонстрирует приемлемую вязкость, простоту нанесения на кожу, равномерное суспендирование и однородную и тонкую текстуру.
Лекарственная форма В – Лекарственная форма для местного применения - гель на основе ПЭГ с соединениями согласно изобретению
3,0 г ПЭГ 4000;
1,0 г ПЭГ 8000;
3,0 г ПЭГ 200;
1,0 г пропиленгликоля;
1,9 г воды; и
0,202 г Соединения (например, NCL099)
ПЭГ 4000, ПЭГ 8000, ПЭГ 200 и пропиленгликоль смешивали и нагревали до 150 °С и до растворения всех твердых кристаллов. Соединение (например, NCL099) добавляли к воде и обрабатывали ультразвуком в течение 30 минут до полного суспендирования. Раствор Соединения и растворы геля смешивали и оставляли остывать и затвердевать. Лекарственная форма В демонстрирует приемлемую вязкость, простоту нанесения на кожу, равномерное суспендирование и однородную и тонкую текстуру.
Лекарственная форма С – Лекарственная форма для местного применения - гель на основе ПЭГ с Соединением-Soluplus
2,5 г ПЭГ 4000;
4,0 г ПЭГ 200;
2,5 г пропиленгликоля;
1,0 г воды; и
1,8 г твердой дисперсии Соединения-Soluplus.
Soluplus приобретали у компании BASF (www.soluplus.com). Соединение-Soluplus получали стандартными в данной области техники способами. ПЭГ 4000, ПЭГ 200, Соединение-Soluplus и пропиленгликоль смешивали и нагревали до 150 °С и до растворения всех твердых кристаллов. Добавляли воду, а затем обрабатывали раствор ультразвуком. Раствор оставляли остывать и затвердевать. Лекарственная форма С демонстрирует приемлемую вязкость, простоту нанесения на кожу, равномерное суспендирование и однородную и тонкую текстуру.
Лекарственная форма D - Лекарственная форма таблетки
30 мг безводного гидрофосфата кальция;
80 мг микрокристаллической целлюлозы;
50 мг лактозы;
8 мг гидроксипропилметилцеллюлозы
1,5 мг талька
10 мг Соединения (например, NCL099)
Вспомогательные вещества взвешивали и перемешивали в течение 5 минут. Смесь загружали в загрузочную воронку таблеточного пресса и эксплуатировали автомат стандартным в данной области техники способом. Лекарственная форма D демонстрирует приемлемую твердость таблетки, распадаемость и истираемость.
Лекарственная форма E – пероральная суспензия
2,0 мл глицерина;
1,5 мл абсолютного этанола;
600 мг NCL812; и
До 60 мл носителя (Ora Sweet и Ora Plus, 1: 1).
Порошок NCL 812 просеивали через сито с размером отверстий 75 мкм. 600 мг просеянного NCL 812 смешивали с 2,0 мл глицерина и 1,5 мл абсолютного этанола. Смесь помещали в ступку и вручную измельчали до равномерного суспендирования NCL 812. Суспензию обрабатывали ультразвуком в течение 30 минут. Затем к суспензии добавляли носитель (55 мл смеси Ora Sweet и Ora Plus) и измельчали еще 10 минут. Объем доводили с помощью смеси Ora plus и Ora sweet до 60 мл, перенося смесь в мерный цилиндр.
Лекарственная форма E демонстрирует приемлемое суспендирование и приемлемую краткосрочную стабильность.
Лекарственная форма F – внутримышечная инъекция
20 мг/мл Поливинилпирролидон K30 (PVPK30);
0,09 мг/мл NCL812; и
50 мл вода.
Раствор PVP K30 с концентрацией два процента, мас./об., получали добавлением 1,0 г PVP K30 к 50 мл воды MilliQ. Затем раствор помещали в ультразвуковой диспергатор на 30 минут для уравновешивания и добавляли к раствору PVP 4,5 мг NCL 812, и помещали его в инкубатор-шейкер при максимальной скорости 10 об./мин. на 24 часа с контролируемой температурой 25±1°C. Раствор переносили в пробирки объемом 5 мл и проверяли на прозрачность, внешний вид, рН и краткосрочную стабильность. рН раствора составил 7,25.
Лекарственная форма F демонстрирует приемлемую прозрачность и краткосрочную стабильность.
ПРИМЕР 7: Высвобождение NCL812 и NCL099 из лекарственной формы B.
Цель: Цель данного исследования заключалась в измерении высвобождения NCL812 и NCL099 из лекарственной формы B, полученной в примере 6.
Методика: Диффузионные ячейки Франца использовали для количественного определения скорости высвобождения NCL 812 и NCL099 из их лекарственных форм для местного применения. В принимающую камеру загружали пять миллилитров абсолютного этанола, который выбрали в качестве требуемой среды высвобождения. Температуру принимающей жидкости поддерживали постоянной при 32±1°C с помощью водяной рубашки. Выбирали мембраны из ацетилцеллюлозы с размером пор 0,45 мкм (Pall Corporation) и помещали между донорной и рецепторной камерами. Затем в донорную камеру загружали ряд исследуемых образцов (лекарственная форма В). Один миллилитр рецепторной жидкости собирали с регулярными интервалами времени, составляющими 0,25, 0,50, 0,75, 1, 2, 3, 4, 5, 6, 7, 8 и 24 часа, через отверстие для отбора проб. В рецепторную камеру сразу возвращали один миллилитр свежего абсолютного спирта. Использовали УФ-ВЭЖХ для анализа содержимого собранных рецепторных жидкостей.
Результаты и выводы: На Фиг. 9 представлено кумулятивное высвобождение NCL812 и NCL099 с течением времени. В данном исследовании показано, что лекарственная форма B обеспечивает приемлемый профиль высвобождения NCL812 и NCL099.
ПРИМЕР 8: Список данных ЯМР спектроскопии для соединений NCL812, NCL001-NCL275
ЯМР спектроскопию проводили на соединениях NCL812, NCL001-NCL275, используя стандартные в данной области техники методы. Списки данных ЯМР спектроскопии представлены в таблице 3.
Таблица 3: Список данных ЯМР спектроскопии для соединений NCL812, NCL001-NCL275
73
1H ЯМР (400 МГц, ДМСО) δ 11,92 (ш с, 2H), 8,24 (с, 2H), 8,16 (с, 2H), 7,71 (д, J = 8,9 Гц, 4H), 6,74 (д, J = 8,9 Гц, 4H), 2,98 (с, 12H).
74
1H ЯМР (400 МГц, ДМСО) δ 12,12 (ш с, 2H), 8,21 (с, 2H), 7,97 (с, 2H), 7,54 – 7,47 (м, 6H), 7,42 – 7,36 (м, 6H), 7,31 – 7,21 (м, 8H), 6,84 (д, J = 9,8 Гц, 2H).
75
1H ЯМР (400 МГц, ДМСО) δ 7,73 (д, J = 8,8 Гц, 2H), 6,92 (д, J = 8,9 Гц, 2H), 3,22 – 3,13 (м, 4H), 2,99 – 2,86 (м, 4H), 2,24 (с, 3H).
76
1H ЯМР (400 МГц, ДМСО) δ 11,54 (с, 1H), 7,99 (д, J = 8,7 Гц, 2H), 7,90 (с, 3H), 7,47 (д, J = 8,6 Гц, 2H), 2,91 – 2,82 (м, 2H), 1,48 – 1,32 (м, 4H), 0,89 – 0,84 (м, 3H). 13C ЯМР (101 МГц, ДМСО) δ 156,2, 153,8, 134,8, 134,4, 128,7, 128,4, 28,1, 26,6, 22,0, 13,8.
77
1H ЯМР (400 МГц, ДМСО) δ 11,43 (с, 2H), 11,05 (с, 2H), 8,31 (с, 2H), 7,42 (с, 2H), 7,29 – 7,18 (м, 2H), 6,89 (т, J = 7,7 Гц, 4H), 6,74 (с, 2H).
*Широкие сигналы
78
1H ЯМР (400 МГц, ДМСО) δ 10,98 (с, 1H), 9,60 (с, 1H), 8,54 (с, 1H), 8,40 (с, 1H), 8,30 (с, 1H), 8,01 – 7,89 (м, 2H), 7,85 (д, J = 8,4 Гц, 2H), 7,64 – 7,59 (м, 1H), 7,54 – 7,47 (м, 4H), 6,42 (дд, J = 1,8, 3,3 Гц, 1H), 6,31 (м, 1H), 4,44 (д, J = 5,5 Гц, 2H).
*2D ЯМР анализ позволяет предположить, что сигналы двух четвертичных атомов углерода пиримидинового ядра возникают при 162,7 ppm.
80
1H ЯМР (400 МГц, ДМСО) δ 7,82 (д, J = 9,5 Гц, 1H), 7,47 (д, J = 7,5 Гц, 2H), 7,33 (т, J = 7,6 Гц, 2H), 7,23 (т, J = 7,3 Гц, 1H), 6,95 (дд, J = 16,0, 9,5 Гц, 1H), 6,72 (д, J = 16,0 Гц, 1H), 4,38 (с, 4H).
81
1H ЯМР (400 МГц, ДМСО) δ 12,09 (с, 1H), 8,34 (с, 1H), 8,24 – 8,17 (м, 2H), 7,96 (дд, J = 8,8, 4,6 Гц, 3H), 7,83 (с, 4H), 7,61 – 7,54 (м, 2H). 13C ЯМР (101 МГц, ДМСО) δ 155,42, 146,87, 133,90, 132,70, 131,23, 129,46, 128,35, 128,31, 127,81, 127,35, 126,82, 123,04.
*Определено с помощью 2D ЯМР анализа.
ПРИМЕР 9: Противогардиазная активность NCL аналогов 231 – 247 и NCL219.
Цель: Целью данного исследования было определить активность NCL219 и NCL231 – NCL247 против Giardia duodenalis in vitro с применением анализа восстановления резазурина.
Способы: Трофозоиты жиардий выращивали до конфлюентности. Среду заменяли на свежую среду и подвергали «холодному шоку» в течение 40 минут. Соединения получали в ДМСО и серийно 2-кратно разбавляли в ДМСО, начиная с разбавления исходного раствора 1/100 (например, первоначальное разбавление исходного раствора с концентрацией 128 мг/мл составит 128 мкг/мл). 2 мкл разбавлений добавляли в соответствующие лунки и в каждую лунку добавляли 198 мкл среды TYI-S-33. Клетки разбавляли до концентрации примерно 500 000 клеток/мл и добавляли 100 мкл к каждой лунке аналитического планшета (за исключением лунки, содержащей только контрольный образец со средой). Аналитическую смесь инкубировали в анаэробных условиях (в склянке для свечей) в течение 5 часов при 37 °С. Среду удаляли и заменяли на 100 мкл теплого PBS, затем добавляли Alamarblue™ до концентрации 10 %. Образцы инкубировали в анаэробных условиях до появления цвета. После инкубации считывали поглощение каждого образца при 570 и 630 нм. Рассчитывали процент восстановления резазурина (Alamarblue™) (по представленной ниже формуле) и анализировали данные с помощью программного обеспечения GraphPad Prism версии 6. Процентное восстановление Alamarblue рассчитывали по формуле: ((Eoxi630 × A570) – (Eoxi570 × A630))/((Ered570 × C630)-(Ered × C570)) × 100, где: Eoxi630 = 34798, Eoxi570 = 80586, A570 = поглощение при 570 нм, A630 = поглощение при 630 нм, Ered570 = 155677, Ered630 = 5494, C630 = поглощение в лунке с отрицательным контролем при 630 нм и C570 = поглощение в лунке с отрицательным контролем при 570 нм.
Результаты и выводы: Три из исследованных в данном анализе соединений продемонстрировали превосходную ингибирующую активность в отношении Giardia duodenalis in vitro, NCL245 (9,6 мкМ), NCL246 (5,4 мкМ) и NCL219 (1,03 мкМ). Результаты представлены в таблице 4.
Таблица 4
(мкг/мл)
(мкг/мл)
WB
(мкМ)
*IC50 не удалось вычислить
^только 1 повтор
IC50 через 5 часов, MIC через 24 часа, NC – не конвергируется
ПРИМЕР 10: Активность аналогов NCL против трипаносоматид
Общие сведения: Трипаносоматиды являются причиной значительной заболеваемости и смертности людей с оценочным количеством новых случаев 1,3 млн. в год, приводящих к примерно 30 000 смертей только из-за Leishmania sp. Помимо этого, трипаносоматиды, такие как Trypanosoma brucei (эндемичные для Африки), являются причиной значительной заболеваемости и смертности людей (поражено до 66 миллионов людей), а также существенных потерь в животноводческой отрасли промышленности (заболевание известно как нагана). В настоящее время химиотерапия, доступная для указанных организмов, ограничена и вызывает нежелательные токсичные побочные эффекты. В данном исследовании изучали in vitro эффективность 20 химических аналогов из серии NCL (подробности представлены в таблице 5) против проциклической стадии T. brucei и промастиготной стадии Leishmania donovani. Аналоги, демонстрировавшие перспективную in vitro активность против любого из указанных паразитов, испытывали in vitro на селективность в отношении клеточной линии макрофагов мышей (ATCC RAW 264. 7).
Цель: Целью данного исследования было: (1) оценить in vitro антипаразитарную активность 20 структурно родственных аминогуанидинов (из серии NCL) против T. brucei и L. donovani; и (2) определить селективность указанных соединений в отношении паразитов по сравнению с клетками млекопитающих.
Способы: Антимикробные агенты (таблица 5) растворяли в ДМСО до конечной концентрации 10 мМ. В качестве положительного контроля использовали пентамидин (Sigma), который готовили так же, как соединения NCL.
Таблица 5.
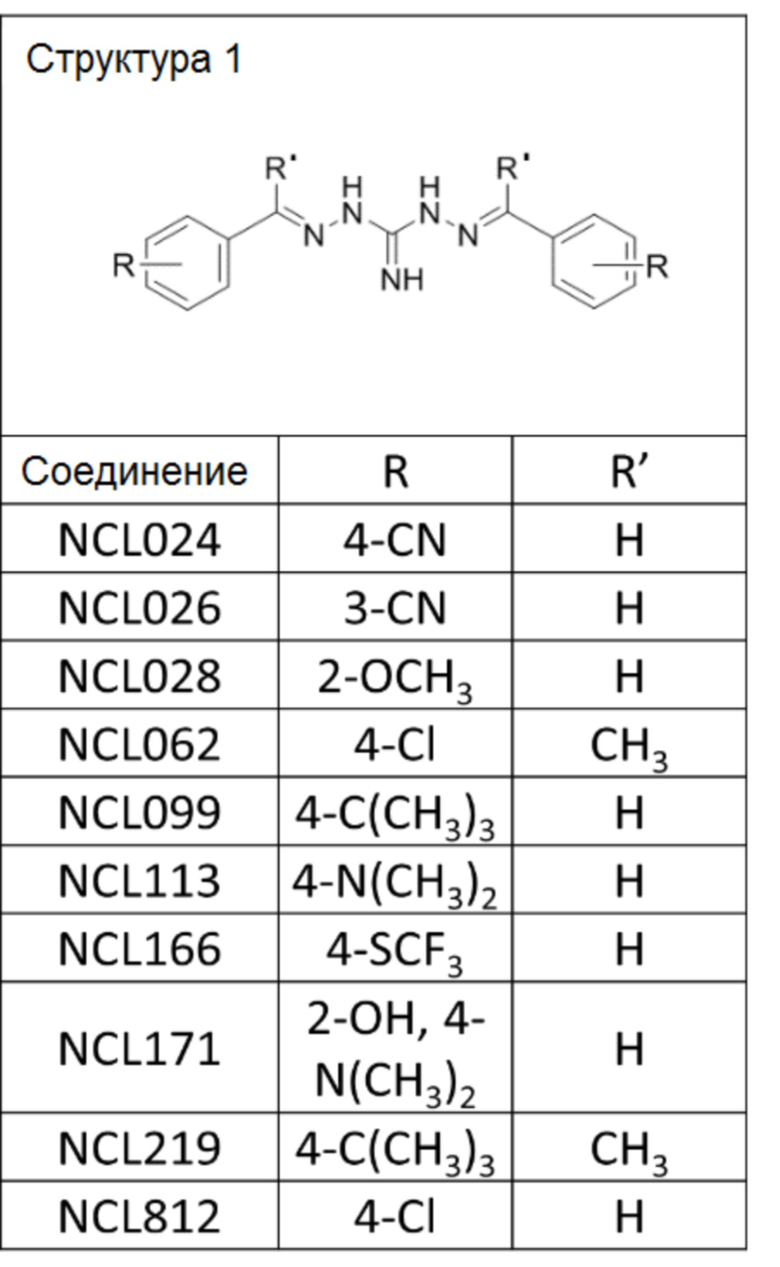
Скрининг L. donovani. Для всех анализов использовали проциклические промастиготы из экспоненциально выращенных культур, выдержанных в среде DME-L+ с добавлением Bob. Соединения первоначально проверяли на активность при 10 мкМ. Соединения разбавляли в культуральной среде до конечного объема 10 мкМ в 96-луночных планшетах. Промастиготы разбавляли до плотности примерно 8 × 105 клеток/мл, затем добавляли в аналитический планшет с получением конечной плотности клеток 4 × 105 клеток/мл в 96-луночных планшетах. Клетки инкубировали в течение 96 часов при 27 °С, затем добавляли Alamarblue (Thermofisher). Флуоресценцию считывали при возбуждении 530 нм и испускании 590 нм. Соединения, которые демонстрировали ингибирующую активность при 10 мкМ, дополнительно исследовали для определения значений IC50. Соединения серийно разбавляли в трех экземплярах в 96-луночном планшете в среде для выращивания клеток, так что концентрации варьировались от 0,005 до 10 мкМ, и добавляли промастиготы до конечной концентрации 1 × 106 клеток/мл. Клетки инкубировали при 27 °С в течение 72 часов, затем добавляли аламаровый синий. Флуоресценцию измеряли так, как описано выше.
Скрининг T. brucei. Для всех анализов использовали проциклические промастиготы из экспоненциально выращенных клеток, выдержанных в среде SDM-79. Соединения первоначально проверяли на активность при 10 мкМ. Соединения разбавляли в культуральной среде до концентрации 20 мкМ и добавляли в 96-луночный планшет; после добавления промастиготов (конечная концентрация 4 × 105 клеток/мл) концентрация соединений составляла 10 мкМ. Клетки инкубировали в течение 48 часов при 27 °С, затем добавляли аламаровый синий и измеряли флуоресценцию, как описано выше. Соединения, которые демонстрировали ингибирующую активность при 10 мкМ, дополнительно исследовали для определения значений IC50. Соединения серийно разбавляли в трех экземплярах в культуральной среде с получением конечных концентраций в диапазоне 0,004 – 10 мкМ. Промастиготы добавляли в конечной концентрации 4 × 105 клеток/мл. Клетки инкубировали при 27 °С в течение 48 часов, затем добавляли аламаровый синий. Кроме того, промастиготы в концентрации 8 × 105 обрабатывали соединением NCL026 в течение 1,5 часов, затем удаляли лекарственное вещество центрифугированием при 5000 об./мин. в течение 7 минут и повторно суспендировали клетки в культуральной среде. Клетки инкубировали в течение 96 часов при 27 °С и ежедневно наблюдали метаболическую активность (анализ с аламаровым синим) и морфологические изменения. Контрольную культуру обрабатывали ДМСО вместо NCL026.
Анализ клеточной токсичности. Мышиные макрофаги (RAW 264. 7) выращивали в среде RPMI1640 с добавлением L-глутамина и 10% эмбриональной бычьей сыворотки. Клетки трипсинизировали при 80% конфлюентности и пересевали каждые 3-4 дня. Для анализа цитотоксичности клетки разбавляли до конечной концентрации клеток 2 × 104 клеток/мл и добавляли 198 мкл в каждую лунку 96-луночного планшета. Клетки инкубировали в увлажненном инкубаторе в течение 2 часов при 37 °C с 5% CO2, затем добавляли соединения NCL (2 мкл/лунку, предварительно разбавленные в ДМСО). В качестве контрольных образцов использовали только кампотецин, тритон X и ДМСО. Клетки обрабатывали соединениями в течение 24 часов. Метаболическую активность клеток определяли с помощью аналитической системы WST-1 (Roche Life Science). Надосадочную жидкость удаляли, в каждую лунку добавляли 100 мкл PBS с 10% WST-1 и инкубировали в течение 1 часа, затем считывали поглощение при 450 нм. Коэффициент селективности соединений определяли делением IC50 макрофагов на IC50 против паразитов. IC50 определяли с помощью программного обеспечения Graphpad Prism.
Результаты: Проверяли активность робенидина и 19 структурных аналогов против проциклической промастиготной стадии L. donovani и T. brucei при 10 мкМ. Среди испытанных соединений 70 % демонстрировали ≥90% снижение метаболической активности в L. donovani, при этом 15% демонстрировали аналогичное снижение метаболической активности в T. brucei (см. Фиг. 10). Проциклическую стадию T. brucei и промастиготную стадию L. donovani обрабатывали указанными соединениями в течение 48 или 96 часов, соответственно, затем измеряли действие с помощью красителя резазурина. Анализы проводили в трех экземплярах. P = пентамидин. Погрешность ± СО.
Среди соединений, активных против L. donovani, NCL026, NCL028, NCL041, NCL042, NCL062, NCL099, NCL195, NCL201, NCL219 и NCL246 обладали наибольшей активностью, ингибирующей паразитов на 100 %. Наибольшим ингибирующим действием против T. brucei обладали NCL026, NCL062 и NCL246. NCL026, NCL062 и NCL246 были весьма эффективными против обоих видов паразитов. Проводили дополнительное исследование выбора соединений, обладающих активностью против паразитов, для определения значений IC50. Значения IC50 определяли для NCL028, NCL099, NCL166, NCL201, NCL245, NCL246 и NCL812 против L. donovani. IC50 варьировались от 0,37 мкМ (NCL028) до 6,48 мкМ (NCL245 и NCL246). Значение IC50 против T. brucei определяли для 6 наиболее эффективных аналогов NCL024, NCL026, NCL062, NCL171, NCL195 и NCL246. Среди указанных аналогов наиболее эффективными были NCL026, NCL171 и NCL195 со значениями IC50 1,7, 1,4 и 1,5 мкМ, соответственно. Наибольшее определенное значение IC50 составляло 4,2 мкМ для NCL246. Проводили анализ восстановления для определения способности T. brucei к восстановлению после кратковременного воздействия NCL026. Через 1,5 часа воздействия определяли GI50 или IC50. Коэффициент селективности (SI) определяли делением GI50 макрофагов на IC50 паразитов. При SI ≥10 соединение считали селективным в отношении паразита. Анализы проводили в трех экземплярах. Погрешность ± СО. На основании данного анализа, селективность соединений варьировалась от 0,57 до 27,9. В целом, считают, что коэффициент селективности меньше 10 означает относительное отсутствие селективности, тогда как коэффициент селективности больше 10 считают показателем селективности в отношении паразита. На основании такого правила, только соединение (NCL171) можно считать относительно селективным в отношении T. brucei, и 4 соединения являются высокоселективными в отношении L. donovani in vitro (NCL028, NCL 099, NCL113 и NCL219).
Таблица 6
Выводы. В данном исследовании показано, что некоторые из испытанных соединений продемонстрировали высокую ингибирующую активность против L. donovani или T. brucei in vitro. На основании коэффициента селективности in vitro NCL171 является наиболее перспективным против T. brucei, а NCL028, NCL099 и NCL219 являются наиболее перспективными против L. donovani.
ПРИМЕР 11: Физико-химические и метаболические свойства NCL026, NCL028, NCL099, NCL171, NCL177, NCL195, NCL217, NCL259 и NCL812.
Цель: Целью данного исследования было определить физико-химические и метаболические свойства NCL026, NCL028, NCL099, NCL171, NCL177, NCL195, NCL217, NCL259 и NCL812.
Физико-химические и метаболические характеристики девяти соединений оценивали с применением комбинации in silico и экспериментальных технологий, а результаты обобщены на Фиг. 11.
Рассчитанные физико-химические параметры каждого соединения, в целом, были в пределах, обычно ассоциирующихся с соединениями, обладающими свойствами «лекарств». Однако значения полярной площади поверхности NCL026 и NCL171 приближались к верхнему пределу, рекомендованному для хорошей проницаемости мембраны, что отражает относительно высокое количество гетероатомов в указанных двух структурах. Все соединения демонстрировали низкую кинетическую растворимость в условиях нейтрального рН, за исключением NCL259, растворимость которого была более умеренной. Большинство соединений демонстрировали высокую растворимость в кислотных условиях (рН 2), позволяя предположить увеличение ионизации при низком рН. Измеренные значения коэффициента распределения были относительно высокими при рН 7,4, со значениями LogD7,4 от 3,6 до более 5,3. Значения LogD были ниже в кислотных условиях (рН 3), однако их все еще можно считать умеренными или высокими (от 2,8 до 4,9). Наблюдаемые результаты рН-зависимой растворимости и коэффициента распределения согласуются с основными характеристиками соединений, предсказанными на основании их структур. Метаболическую стабильность девяти соединений оценивали в микросомах печени человека и мышей. Пять из указанных соединений, NCL026, NCL177, NCL195, NCL259 и NCL812, демонстрировали низкую скорость разложения в обоих видах печеночных микросом (значения EH менее 0,3). NCL099, NCL171 и NCL217 демонстрировали промежуточные или высокие скорости разложения (значения EH от 0,49 до 0,88), при этом скорости разложения каждого соединения в значительной степени сравнимы между видами. NCL028 продемонстрировало низкую скорость разложения в микросомах печени человека и высокую скорость разложения в микросомах печени мышей, что может свидетельствовать о существенной разнице метаболизма данного соединения у разных видов. Не наблюдали измеримого разложения любого из соединений в контрольных (без кофактора) инкубационных смесях в обоих видах, что позволяет предположить отсутствие независимого от главного кофактора метаболизма, способствующего общей скорости метаболизма.
Экспериментальные способы
Физико-химические параметры, рассчитанные с помощью программного обеспечения ChemAxon JChem
Теоретические физико-химические значения для каждого соединения рассчитывали с помощью химического картриджа ChemAxon в JChem для программного обеспечения Excel. Рассчитанные параметры и краткое пояснение их значения представлено ниже.
Молекулярная масса (MW): В идеале, MW должна быть менее 500 для хорошей проницаемости мембраны.
Полярная площадь поверхности (PSA): Рассчитывали с помощью упрощенного 2-мерного метода моделирования, правильность которого подтверждали, сравнивая с более сложной 3-мерной стратегией моделирования. Значение рассчитывали при рН 7,4, что учитывает ионизацию молекулы. Как правило, принято, что значения PSA менее, чем около 120 Å2, обеспечивают приемлемую пероральную абсорбцию лекарства и проницаемость мембраны.
Свободно вращающиеся связи: Количество одинарных связей, которые не расположены в кольцевой или стерически затрудненной системе и не связаны с атомом водорода. Для хорошей проницаемости мембраны количество свободно вращающихся связей (FRB) должно быть меньше или ровно 10 (см. D. Veber et al, J. Med. Chem. 2002, 45, 2615-2623).
Доноры / акцепторы водородной связи: Количество доноров и акцепторов водородной связи обеспечивает показатель способности молекулы к водородному связыванию, которая находится в обратной зависимости с проницаемостью мембраны. В идеале, количество доноров водородной связи должно быть меньше 5, а количество акцепторов водородной связи должно быть меньше 10.
рКа: Основная физико-химическая мера кислотности соединения. В контексте разработки лекарств сами эти значения указывают лишь на значимость ионизации в физиологических условиях.
Оценка растворимости с помощью нефелометрии
Соединения в ДМСО вносили либо в фосфатный буфер с рН 6,5, либо в 0,01 М HCl (рН около 2,0) с конечной концентрацией в ДМСО 1%. Затем образцы анализировали с помощью нефелометрии для определения диапазона растворимости. (См. C. D. Bevan and R. S. Lloyd, Anal. Chem. 2000, 72, 1781-1787).
Измерение LogD
Значения коэффициента распределения (LogD) исследуемых соединений оценивали по корреляции их свойств хроматографического удерживания и характеристик ряда стандартных соединений с известными значениями коэффициента распределения. Использованный способ представлял собой ВЭЖХ-модификацию способа, разработанную Lombardo (см. F. Lombardo et al, J. Med. Chem. 2001, 44, 2490-2497).
Микросомальная стабильность
Способы инкубации: Анализ метаболической стабильности проводили посредством инкубации каждого исследуемого соединения (при 1 мкМ) с микросомами печени человека и мышей (Xenotech, серия № 1210057 и 1310211, соответственно) при 37 °C и при концентрации белка 0,4 мг/мл. Метаболическую реакцию инициировали добавлением НАДФН-регенерирующей системы (т. е. НАДФН представляет собой кофактор, необходимый для CYP450-опосредованного метаболизма) и гасили в различные моменты времени в течение 60 минут периода инкубации, добавляя ацетонитрил, содержащий диазепам, в качестве внутреннего стандарта. Включали контрольные образцы (не содержащие НАДФН) (и гасили через 2, 30 и 60 минут) для контролирования возможного разложения в отсутствие кофактора. Аналитические условия: Прибор: Waters Micromass Xevo G2 QTOF, подключенный к прибору СВЭЖХ Waters Acquity; обнаружение: Режим положительной электрораспылительной ионизации при MSE; напряжение на конусе 30 В; колонка: амидная колонка Ascentis Express (50 × 2,1 мм, 2,7 мкм); условия ЖХ: Продолжительность цикла градиента: 4 минуты; вводимый объем: 5 мкл; скорость потока: 0,4 мл/мин.; подвижная фаза: градиент ацетонитрила-воды с 0,05% муравьиной кислоты; метаболит; определение: В данное исследование не включали скрининг метаболита, однако поскольку данные считывали в режиме MSE, который обеспечивает возможность одновременного получения МС спектров с низкой и высокой энергией столкновений, по полученным результатам позже может быть проведен поиск метаболита, если это оправдано.
Расчеты: Данные зависимости концентрации исследуемого соединения от времени подгоняли к функции экспоненциального затухания для определения константы скорости первого порядка для истощения субстрата. Если наблюдали очевидное отклонение от кинетики первого порядка, то для определения константы скорости разложения (k) использовали только первоначальную линейную часть профиля. Затем, используя стандартные в данной области техники способы, использовали константу скорости истощения каждого субстрата для расчета: [1] периода полуразложения, [2] собственного значения клиренса in vitro (CLint, in vitro); [3] прогнозируемого значения собственного клиренса в печени in vivo (CLint); [4] прогнозируемого значения клиренса в крови in vivo (CLblood); и [5] прогнозируемого коэффициента очищения печени in vivo (EH). В описанных выше расчетах учитывали следующие параметры масштабирования (таблица 7).
Таблица 7
a Ring et al. (2011) Journal of Pharmaceutical Sciences, 100:4090-4110.
Прогнозирование коэффициента очищения печени in vivo: Прогнозируемые на основе микросомальных данных коэффициенты очищения печени (EH), полученные на основании относительных скоростей разложения исследуемых соединений in vitro, использовали для классификации соединений на соединения с низким (менее 0,3), промежуточным (0,3 – 0,7), высоким (0,7 – 0,95) или очень высоким (более 0,95) клиренсом.
Результаты: Физико-химические и метаболические характеристики девяти соединений оценивали с применением комбинации in silico и экспериментальных технологий, а результаты обобщены на Фиг. 11.
ПРИМЕР 12: Воздействие NCL026, NCL195, NCL259 и NCL812 на самцов швейцарских нелинейных мышей после IV введения
Цель: Целью данного исследования было оценить системное воздействие NCL026, NCL195, NCL259 и NCL812 на самцов швейцарских нелинейных мышей после IV введения в дозе 5 мг/кг.
Способы: Системное воздействие NCL026, NCL195, NCL259 и NCL812 исследовали на не подверженных голоданию самцах швейцарских нелинейных мышей массой 26,2 – 32,1 г. Животным давали пищу и воду ad libitum в течение периода отбора образцов до и после введения дозы. Каждое соединение вводили IV посредством болюсной инъекции в хвостовую вену (носитель 20 % (об./об.) ДМСО в ПЭГ 400, объем дозы 1 мл/кг, n=8 мышей на одно соединение). После введения брали образцы крови через 5, 15, 30, 120, 240 и 480 минут после введения дозы (n = 2 на один момент времени для каждого соединения). У каждой мыши брали максимум два образца, при этом образцы брали либо субмандибулярной пункцией (около 120 мкл; образец брали у животных в сознании), либо терминальной сердечной пункцией (0,6 мл; при анестезии мышей с помощью ингаляции изофлурана). Образцы мочи не собирали, поскольку во время исследования мышей содержали в клетках с подстилкой. Кровь собирали непосредственно в полипропиленовые пробирки фирмы Eppendorf, содержащие гепарин в качестве антикоагулянта и стабилизирующий коктейль (содержащий Complete® (коктейль ингибитора протеазы с ЭДТА) и фторид калия) для минимизации возможного разложения исследуемых соединений ex vivo в образцах крови/плазмы. После отбора образцы крови сразу центрифугировали, удаляли надосадочную плазму и хранили при минус 80 °С до анализа с помощью ЖХ-МС известными в данной области техники методами.
Каждое соединение вводили в носителе, состоящем из 20 % (об./об.) ДМСО в ПЭГ 400. Лекарственные формы получали посредством растворения соединений в ДМСО перед добавлением ПЭГ 400. Лекарственные формы не фильтровали перед введением дозы и вводили мышам в течение 2,5 часов после получения. Средняя измеренная концентрация каждого соединения в аликвотах (n=2) их соответствующих лекарственных форм составляла 4,58, 4,31, 5,26 и 5,25 мг/мл для NCL026, NCL195, NCL259 и NCL812, соответственно. Дозу, вводимую каждой мыши, рассчитывали на основании измеренной концентрации в IV лекарственной форме, объема дозы и индивидуальной массы тела мыши. Зависимость концентрации от плазмы анализировали с помощью некомпартментных методов (WinNonlin версии 6. 3. 0. 395). Стандартные расчеты для каждого фармакокинетического параметра проводили стандартными в данной области техники способами.
Одна мышь, которой вводили дозу NCL812, демонстрировала ненормальное поведение (суматошное, гиперактивное), начавшееся через несколько минут после введения дозы; мышь усыпили и собрали кровь через 15 минут после введения дозы. Другие животные в данном исследовании не демонстрировали никаких неблагоприятных реакций или побочных эффектов, связанных с введенным соединением. Существуют данные о гемолизе, наблюдаемом в образцах плазмы, однако это вероятно обусловлено растворителями, использованными в IV лекарственных формах (20 (об./об.) ДМСО в ПЭГ 400), которые были необходимы вследствие ограниченной растворимости исследуемых соединений в водном носителе для лекарственной формы.
Результаты: Профили зависимости концентрации в плазме от времени для NCL026, NCL195, CL259 и NCL812 представлены на Фиг. 12. Фармакокинетические параметры представлены в таблице 8. Все соединения демонстрировали средний или большой кажущийся терминальный период полувыведения.
Таблица 8
a Концентрация в плазме в нулевой момент времени не может быть определена логарифмически линейной регрессией первых двух измерений, и поэтому принята равной первому наблюдаемому измерению. Следовательно, AUC от 0 до 5 минут (и, соответственно, AUC0-inf) будет занижена, и параметры, рассчитанные на основании AUC0-inf, представляют собой лишь приближения.
b Терминальная фаза выведения определена недостаточно, значение является лишь приближенным.
ПРИМЕР 13: Воздействие NCL195 на самцов швейцарских нелинейных мышей после IP введения.
Цель: Целью данного исследования было получить предварительный показатель воздействия NCL195 на плазму после IP введения в целевой дозе 50 мг/кг.
Способы: Лекарственную форму получали посредством растворения твердого NCL195 в ДМСО (до 20 % (об./об.) конечного объема) с последующим добавлением ПЭГ 400, с получением прозрачного желтого раствора, дозу которого вводили мышам в течение 30 минут после получения. Измеренная концентрация NCL195 в готовой лекарственной форме составляла 21,9 мг/мл, что обеспечивает среднюю введенную дозу 43 мг/кг. После введения собирали образцы крови в течение до 24 часов после введения дозы (n = 2 мышей на одну точку времени). У каждой мыши брали максимум два образца, при этом образцы брали либо субмандибулярной пункцией (около 120 мкл; образец брали у животных в сознании), либо терминальной сердечной пункцией (0,6 мл; при анестезии мышей с помощью ингаляции изофлурана). Образцы мочи не собирали, поскольку во время исследования мышей содержали в клетках с подстилкой. Кровь собирали непосредственно в полипропиленовые пробирки фирмы Eppendorf, содержащие гепарин в качестве антикоагулянта и стабилизирующий коктейль (содержащий Complete® (коктейль ингибитора протеазы), фторид калия и ЭДТА) для минимизации возможного ex vivo разложения NCL195 в образцах крови/плазмы. После отбора образцы крови сразу центрифугировали, удаляли надосадочную плазму и хранили при минус 20 °С до анализа с помощью ЖХМС известными в данной области техники методами.
Результаты: Ни у одной мыши не наблюдали никаких неблагоприятных реакций или связанных с введенным соединением побочных эффектов после IP введения NCL195 в дозе 43 мг/кг. Профиль зависимости концентрации в плазме от времени (Фиг. 13) показывает, что NCL195 быстро абсорбируется после введения дозы. В течение первых 7,5 часов после введения дозы концентрации в плазме оставались выше 3-4 мкг/мл, однако концентрации снижались до 0,2-0,5 мкг/мл в интервале от 7,5 до 24 часов после введения дозы. Принимая, что 2-кратное увеличение дозы приведет к пропорциональному увеличению воздействия NCL195, представленные данные позволяют предположить, что IP введение NCL195 в дозе 100 мг/кг (в виде лекарственной формы в форме раствора) приведет к по меньшей мере 7,5-часовому воздействию с концентрацией в плазме боле 8 мкг/мл.
ПРИМЕР 14: Активность аналогов NCL против Trypanosoma cruzi
Общие сведения: Болезнь Шагаса, также известная как американский трипаносомоз, является потенциально опасной для жизни болезнью, вызванной простейшими паразитами Trypanosoma cruzi (T. cruzi). T. cruzi передаются при инокуляции инфицированных фекалий переносчиков-триатоминов через место укуса или через неповрежденную слизистую оболочку хозяина-млекопитающего. Передача через переносчиков ограничена регионами Северной Америки, Центральной Америки и Южной Америки. В эндемичных и не эндемичных регионах другие пути инфицирования включают трансфузию, трансплантацию органов и костного мозга, а также передачу по наследству. Вспышки заболевания, приписываемые зараженной пище или питью, описаны в северной части Южной Америки с выраженными циклами передачи, включающими популяции диких переносчиков и млекопитающих резервуарных хозяев. При отсутствии эффективного лечения инфекция становится пожизненной. Наиболее серьезное последствие инфекции T. cruzi представляет собой кардиомиопатию, которая возникает в 20-30 % инфицированных субъектов. По оценкам Всемирной Организации Здравоохранения, в 2015 году во всем мире инфицировано около 6-7 миллионов людей, по большей части в Латинской Америке.
Существует только два лекарства, нифуртимокс, относящийся к нитрофуранам, и бензнидазол, относящийся к нитроимидазолам, которые являются достоверно эффективными против инфекции T. cruzi. Однако каждый из этих агентов имеет значительные ограничения по эффективности и безопасности.
У пациентов с острой болезнью Шагаса и у пациентов с врожденной болезнью Шагаса бензнидазол и нифуртимокс снижают тяжесть симптомов, сокращают клиническое время течения заболевания и уменьшают продолжительность паразитемии; но частота выздоровления в острой фазе составляет лишь порядка 80-90 %.
Исследования бензнидазола с участием детей с хронической инфекцией T. cruzi выявило частоту выздоровления лишь около 60 % на основании перевода в отрицательные результаты серологического испытания через 3-4 года после лечения.
Применение нифуртимокса связано с побочными эффектами со стороны желудочно-кишечного тракта (анорексия, потеря массы, тошнота и рвота) у 70 % пациентов. Неврологические токсические эффекты включают раздражительность, бессонницу, нарушение ориентации и тремор. Редкие, но более тяжелые побочные эффекты включают парестазию, полиневропатию и периферический неврит.
Применение бензнидазола зачастую связано с дерматологическими неблагоприятными эффектами, обычно умеренными высыпаниям, которые поддаются лечению антигистаминами. Однако тяжелый или шелушащийся дерматит, или дерматит, связанный с лихорадкой и лимфаденопатией, указывают на необходимость незамедлительного прекращения лечения. Дозозависимая периферическая нейропатия, возникающая на поздних стадиях курса терапии, требует незамедлительной отмены лечения. Хотя угнетение костного мозга является редким, его возникновение указывает на необходимость незамедлительного прекращения лечения.
Отсутствие безопасных и эффективных средств лечения обусловило классификацию болезни Шагаса как обделенной вниманием паразитарной инфекции со значительными осложнениями для здоровья людей. Мировые потери от болезни Шагаса оцениваются в более 7 млрд. долларов США (Lee, B. Y.,K. M. Bacon, M. E. Bottazzi and P. J. Hotez (2013). "Global economic burden of Chagas disease: a computational simulation model. "The Lancet Infectious Diseases 13(4): 342-348), и сохраняется крайняя и неудовлетворенная потребность в идентификации и разработке улучшенных средств лечения.
Цель и способы: В попытках идентификации новых агентов для лечения болезни Шагаса исследовали биологическую активность робенидина и 79 аналогов против Trypanosoma cruzi в in vitro анализе скрининга, проведенном в соответстсвии со способами, описанными авторами Keenan et al (Keenan, M.,M. J. Abbott, P. W. Alexander, T. Armstrong, W. M. Best, B. Berven, A. Botero, J. H. Chaplin, S. A. Charman, E. Chatelain, T. W. von Geldern, M. Kerfoot, A. Khong, T. Nguyen, J. D. McManus, J. Morizzi, E. Ryan, I. Scandale, R. A. Thompson, S. Z. Wang and K. L. White (2012). "Analogues of fenarimol are potent inhibitors of Trypanosoma cruzi and are efficacious in a murine model of Chagas disease. "Journal of medicinal chemistry 55(9): 4189-4204), Buckner и коллегами (Buckner, F. S., C. L. Verlinde, A. C. La Flamme and W. C. Van Voorhis (1996). "Efficient technique for screening drugs for activity against Trypanosoma cruzi using parasites expressing beta-galactosidase. "Antimicrobial Agents and Chemotherapy 40(11): 2592-2597) и авторами Van Voorhis и Eisen (Van Voorhis, W. C. and H. Eisen (1989). "Fl-160. A surface antigen of Trypanosoma cruzi that mimics mammalian nervous tissue. "The Journal of Experimental Medicine 169(3): 641-652).
In vitro анализ T. cruzi для определения IC50.
В анализе T. cruzi использовали трипомастиготы Tulahuen, экспрессирующие ген ß-галактозидазы. Паразитов выдерживали in vitro с серийным пересевом в клетках L6. Вкратце, клетки L6 помещали в 96-луночные плоскодонные планшеты для выращивания тканей и инкубировали при 37 °C в 5% CO2 в течение 24 часов для обеспечения возможности прикрепления клеток. Затем добавляли трипомастиготы T. cruzi при множественности заражения 3 и инкубировали планшеты еще 48 часов для обеспечения возникновения инфекции. Все стадии проводили в среде RPMI 1640 (без фенолового красного) с добавлением 10% эмбриональной бычьей сыворотки (FBS, Bovogen). Затем удаляли внеклеточные трипомастиготы и добавляли соединения NCL в семиточечных серийных разбавлениях, выполненных в трех экземплярах. В качестве контрольного образца включали бензнидазол (Epichem Pty Ltd.). Через 96 часов инкубации с соединениями добавляли колориметрический агент, хлорфеноловый красный-fl-D-галактопиранозид (CPRG, Roche) с 0,3% об./об. Nonidet P-40. Через 4-6 часов наблюдали изменение цвета после катаболизации реагента жизнеспособными T. cruzi и считывали поглощение при 530 нм с помощью микропланшет-ридера Dynex. % ингибирования рассчитывали по следующему уравнению: % ингибирования = 100 - [(T. cruzi с соединением - только соединение)/(только T. cruzi - только среда)] × 100. Для каждого соединения значения % ингибирования использовали для построения калибровочной кривой, по которой рассчитывали IC50. Каждый анализ проводили по меньшей мере дважды и использовали среднее значение.
Результаты: Значения IC50 80 соединений NCL представлены в таблице 9.
Таблица 9
мкМ
Вывод: Видно, что 6 соединений имели IC50 менее 10 мкМ, тогда как 30 соединений имели значения IC50 менее или ровно 20 мкМ. Серия NCL обеспечивает богатый источник агентов, обладающих активностью против Trypanosoma cruzi.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИМИДИНА | 2002 |
|
RU2320658C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788148C2 |
| ФОСФОИНДОЛЫ КАК ИНГИБИТОРЫ ВИЧ | 2005 |
|
RU2393163C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ И ПРИМЕНЕНИЕ | 2002 |
|
RU2288227C2 |
| ЗАМЕЩЕННЫЕ ДИАМИНОКАРБОКСАМИДНЫЕ И ДИАМИНОКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНОВ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПОМОЩЬЮ | 2012 |
|
RU2697712C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИЙ | 2018 |
|
RU2779024C2 |
| СУЛЬФОНАМИДНОЕ ПРОИЗВОДНОЕ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2607081C2 |
| ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ МСН | 2005 |
|
RU2373197C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2710743C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ BTK И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2703301C2 |
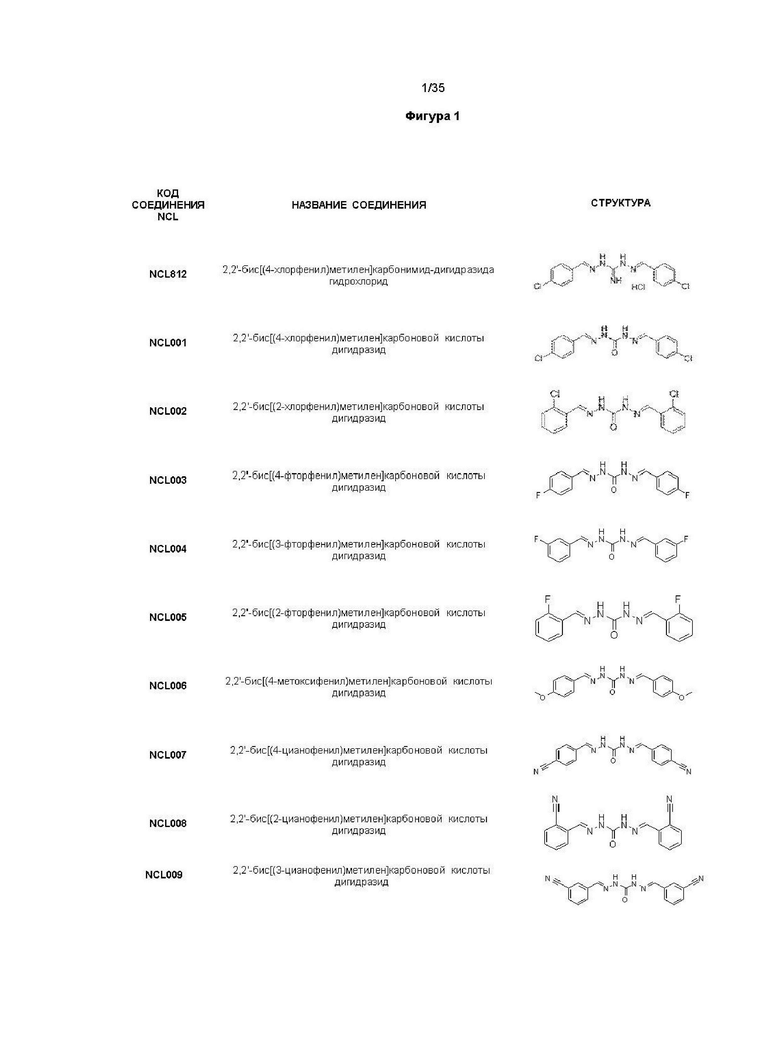
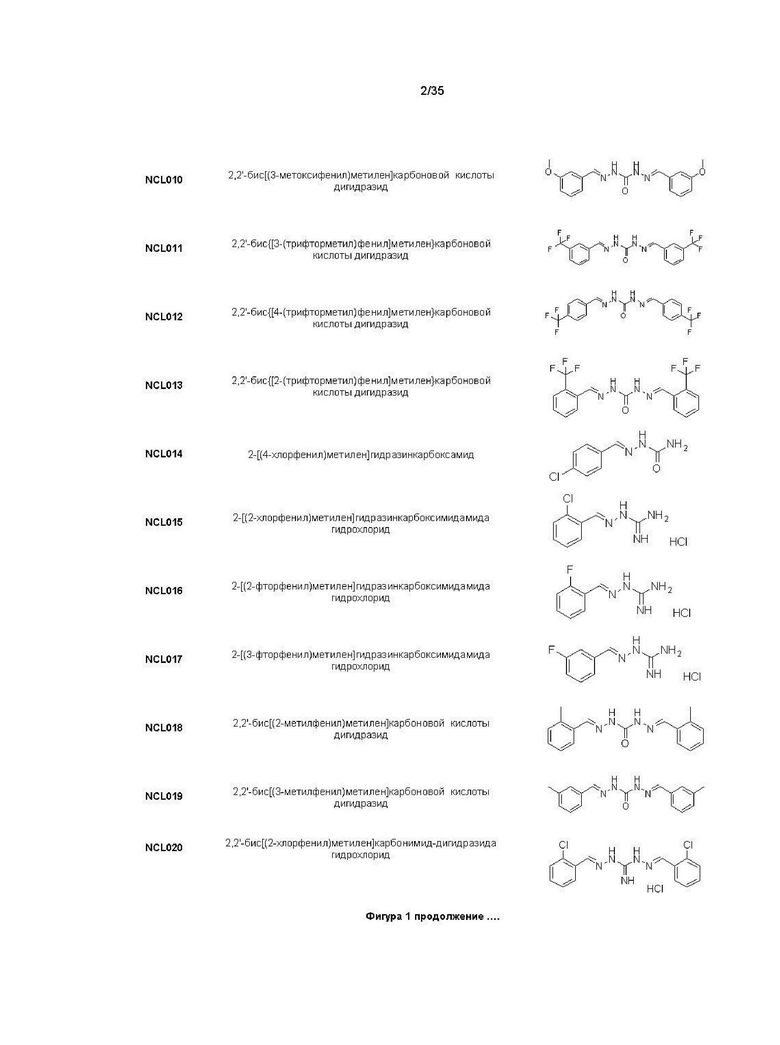
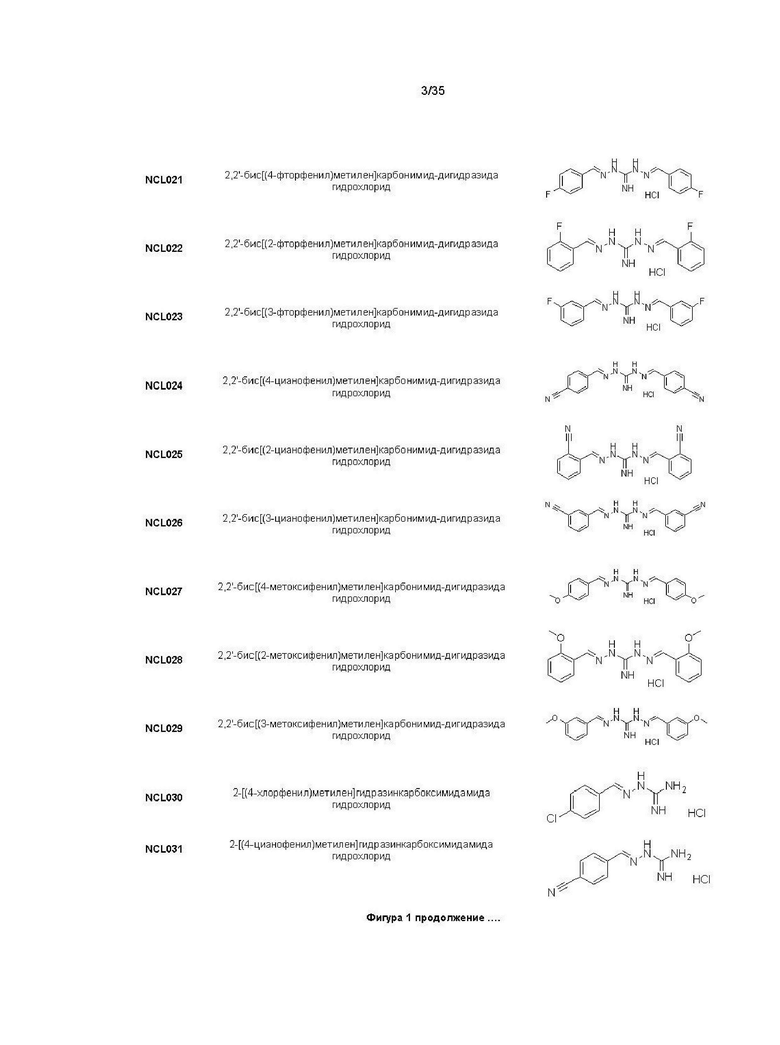
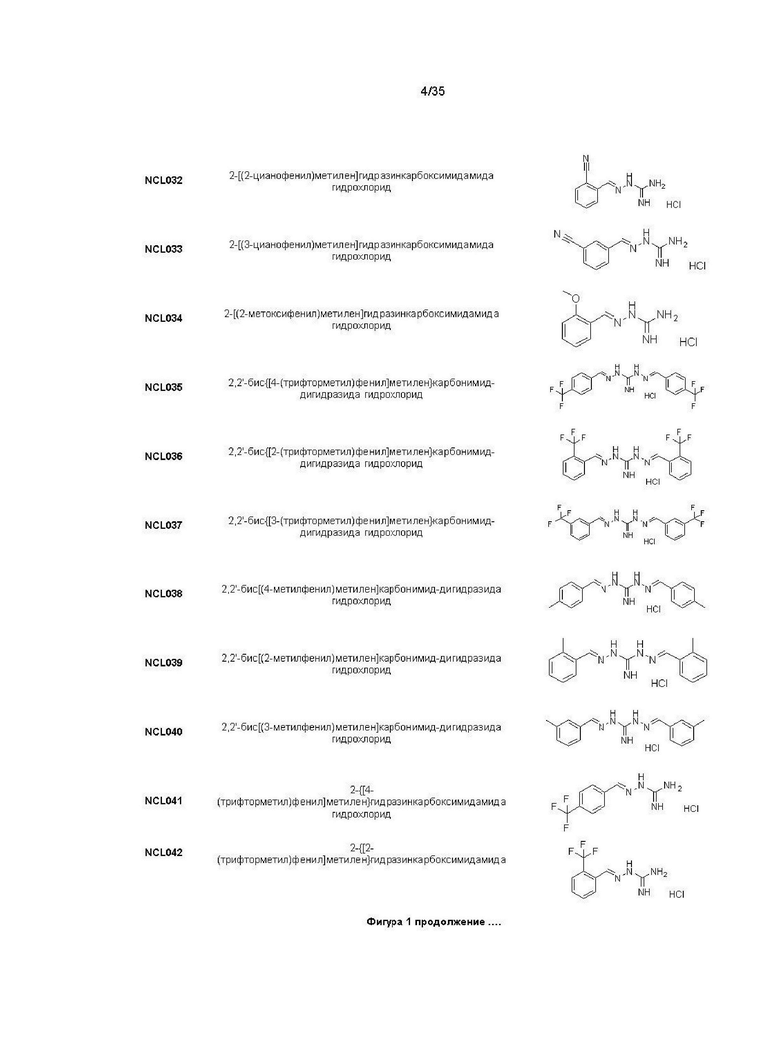
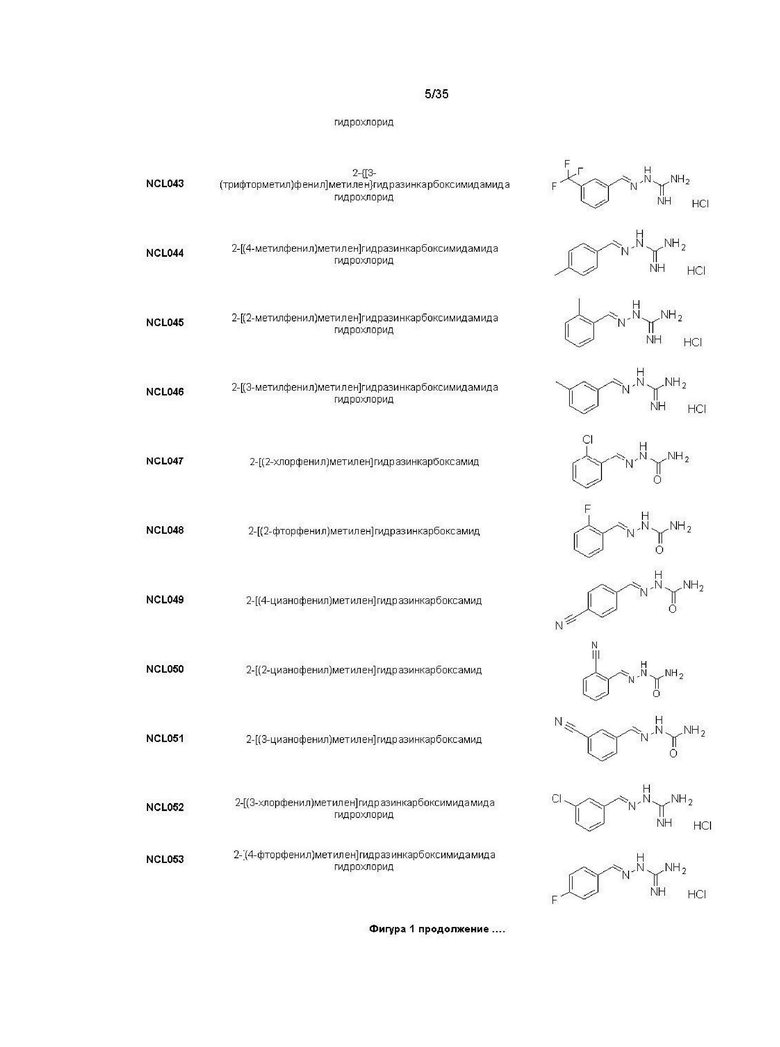
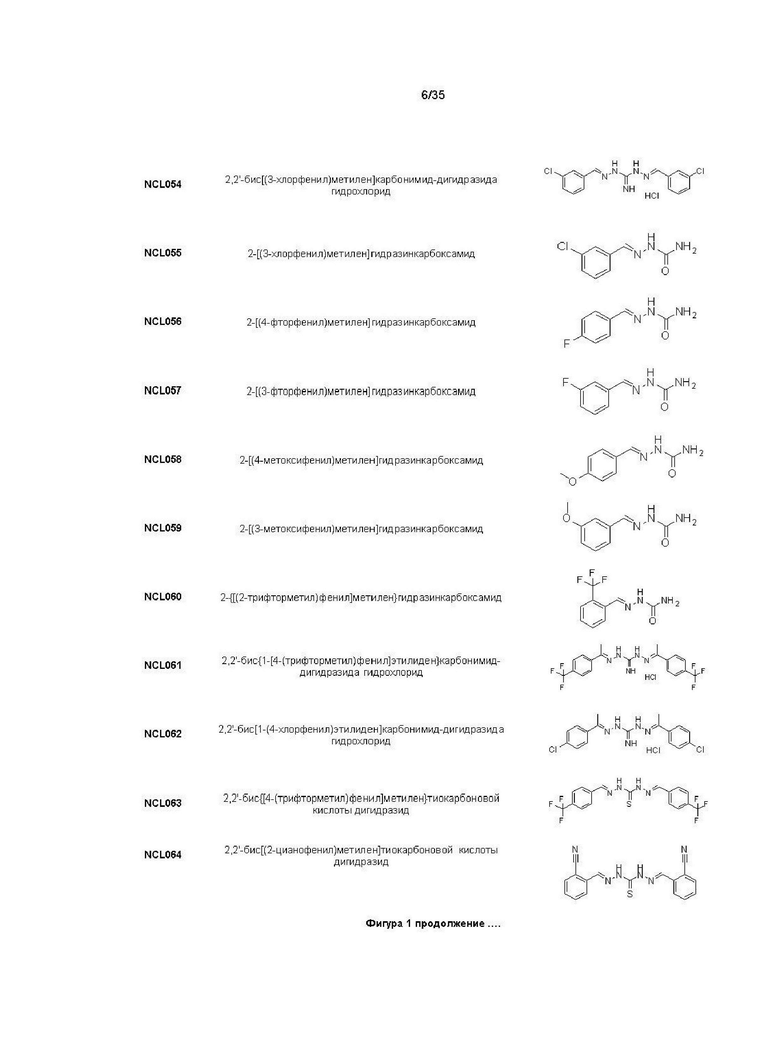

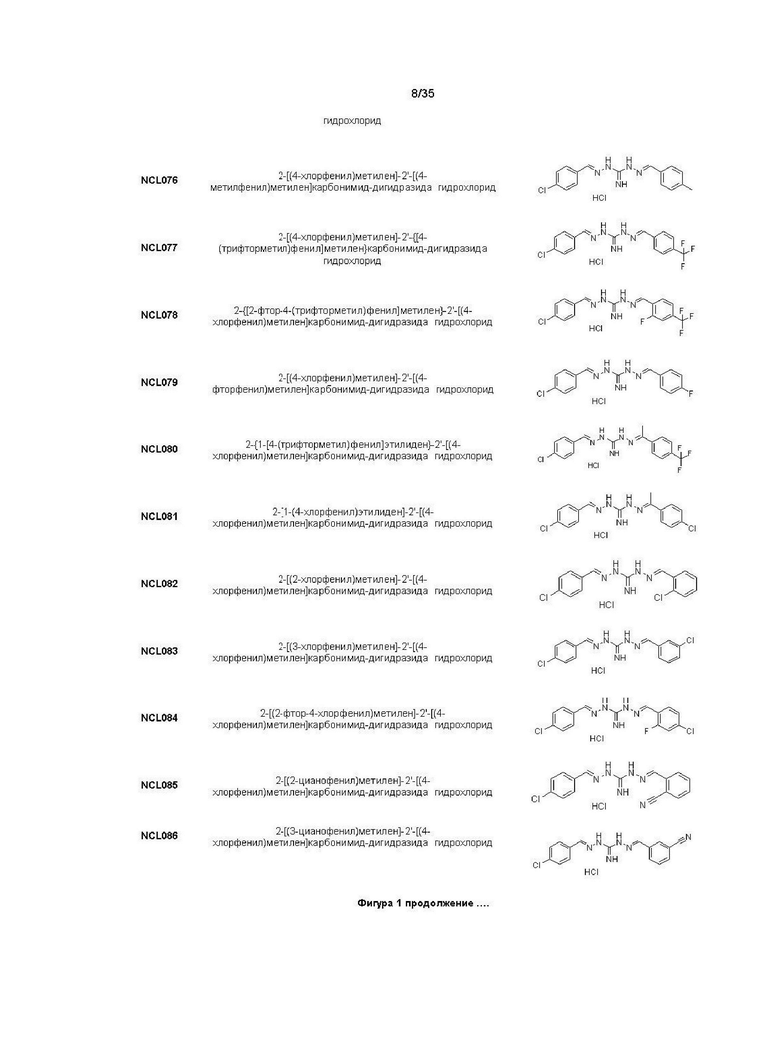
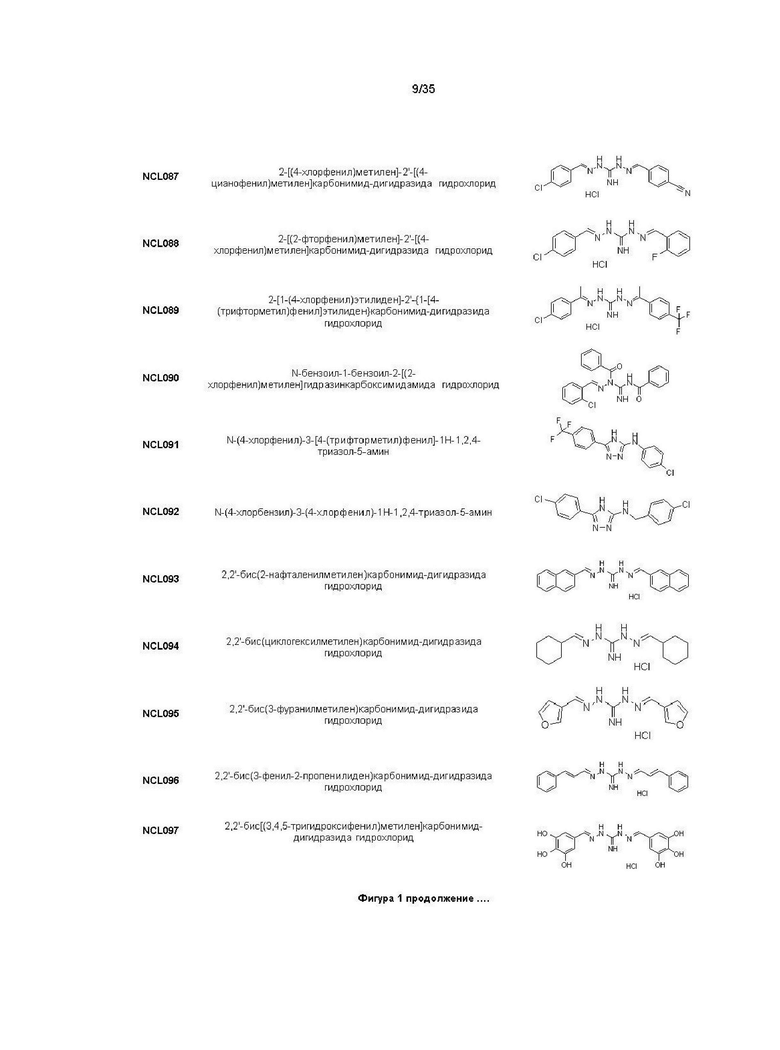

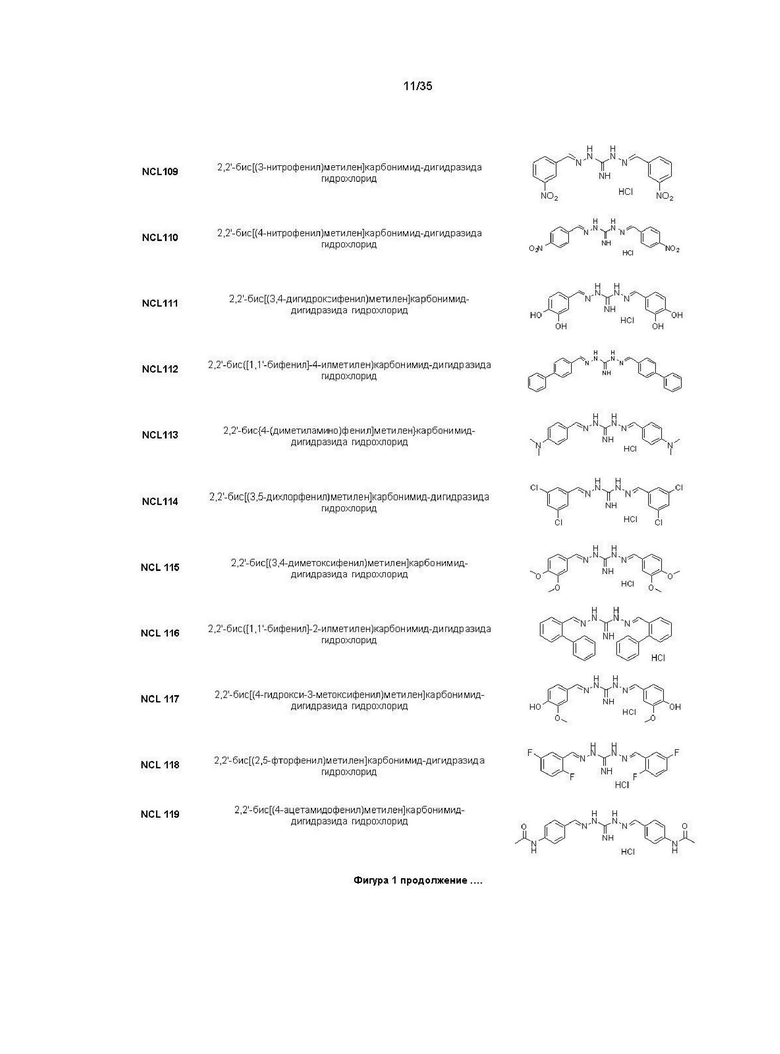
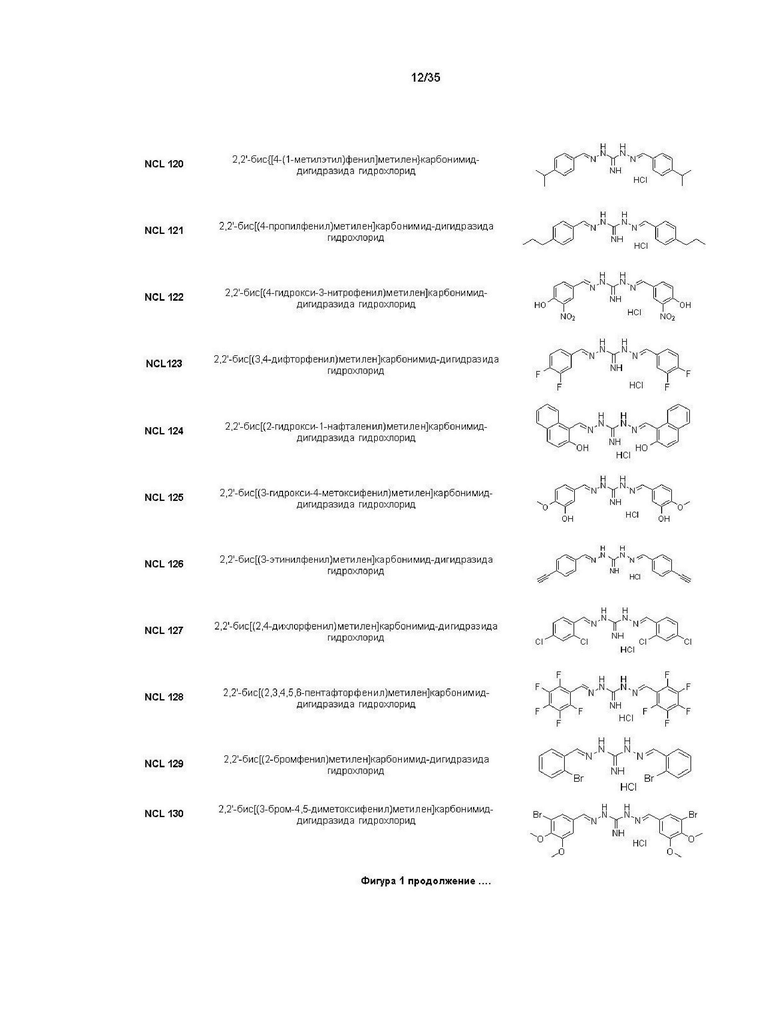
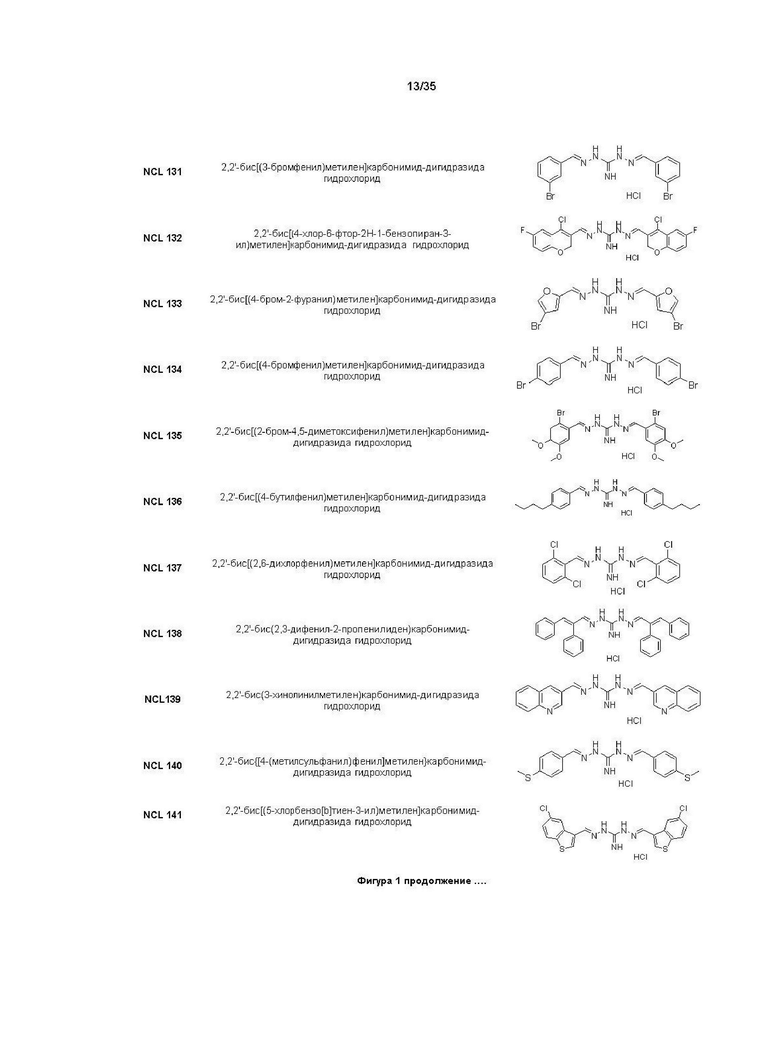
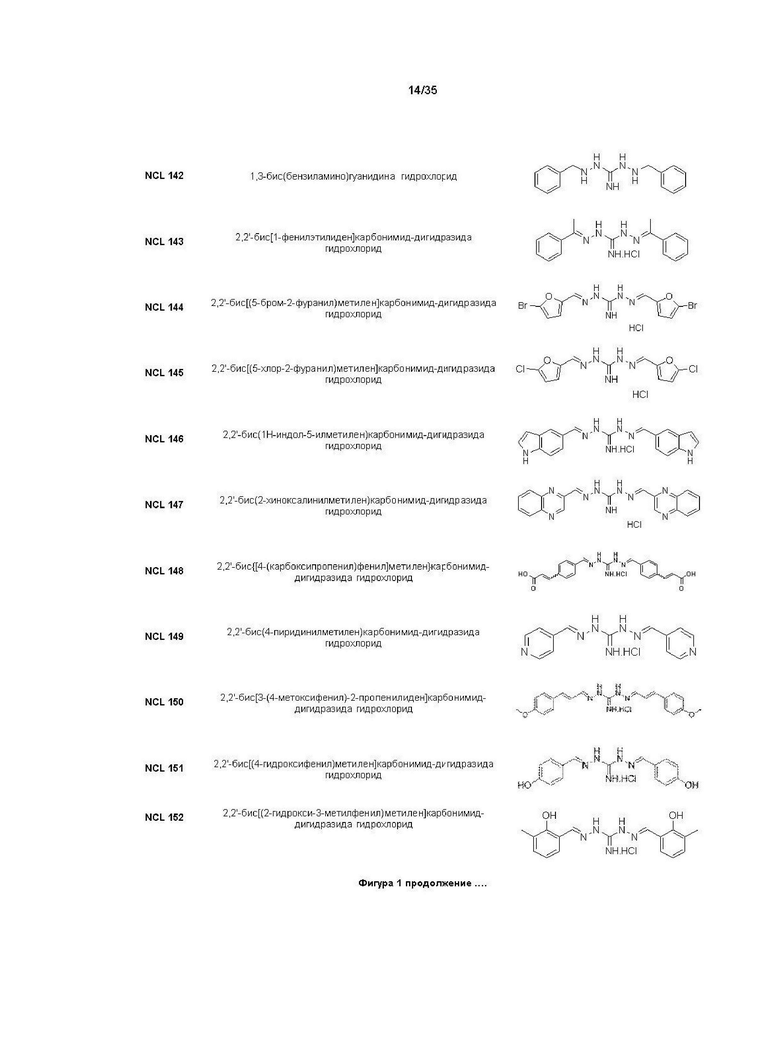
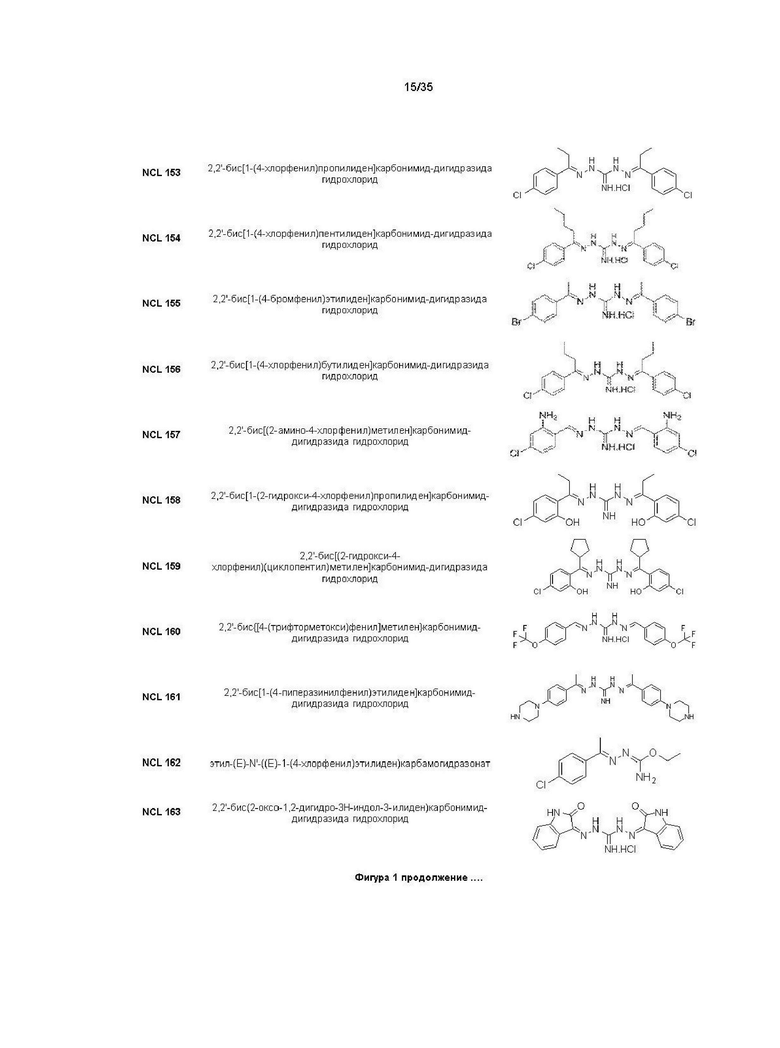
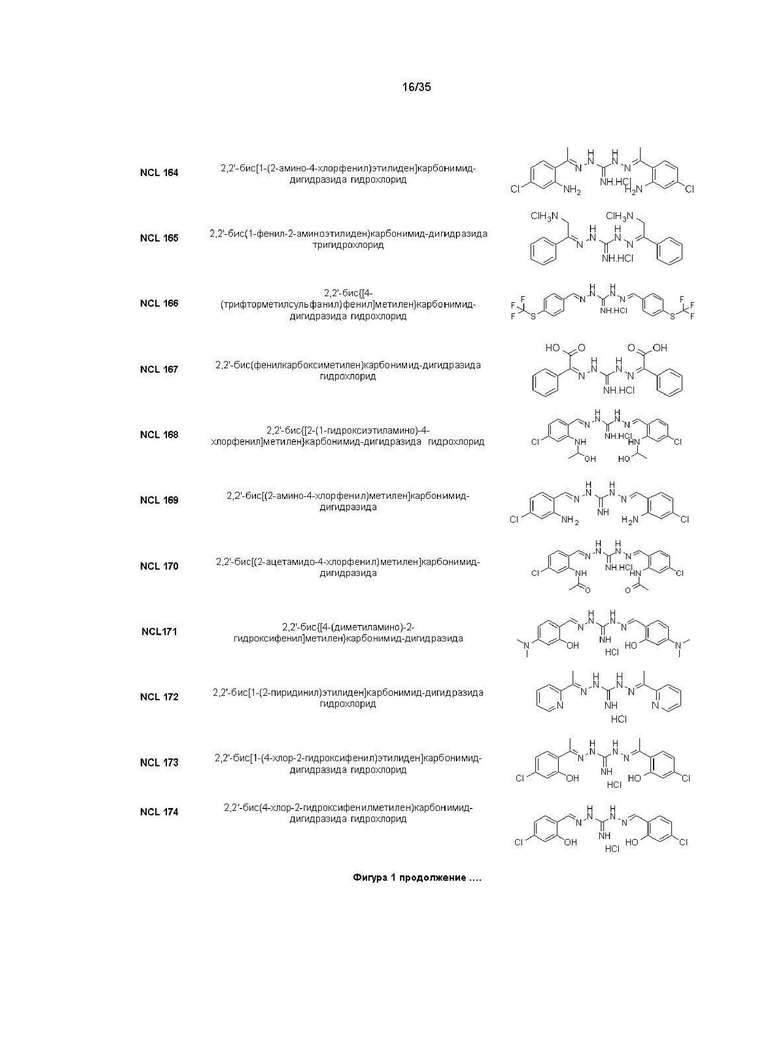
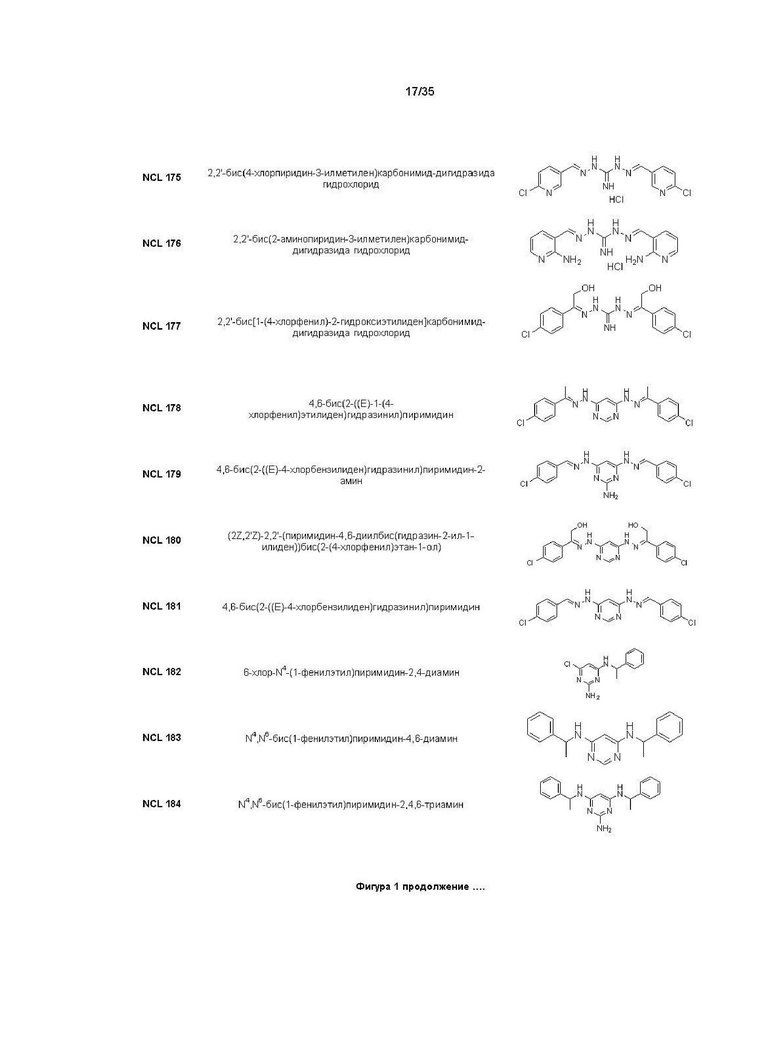
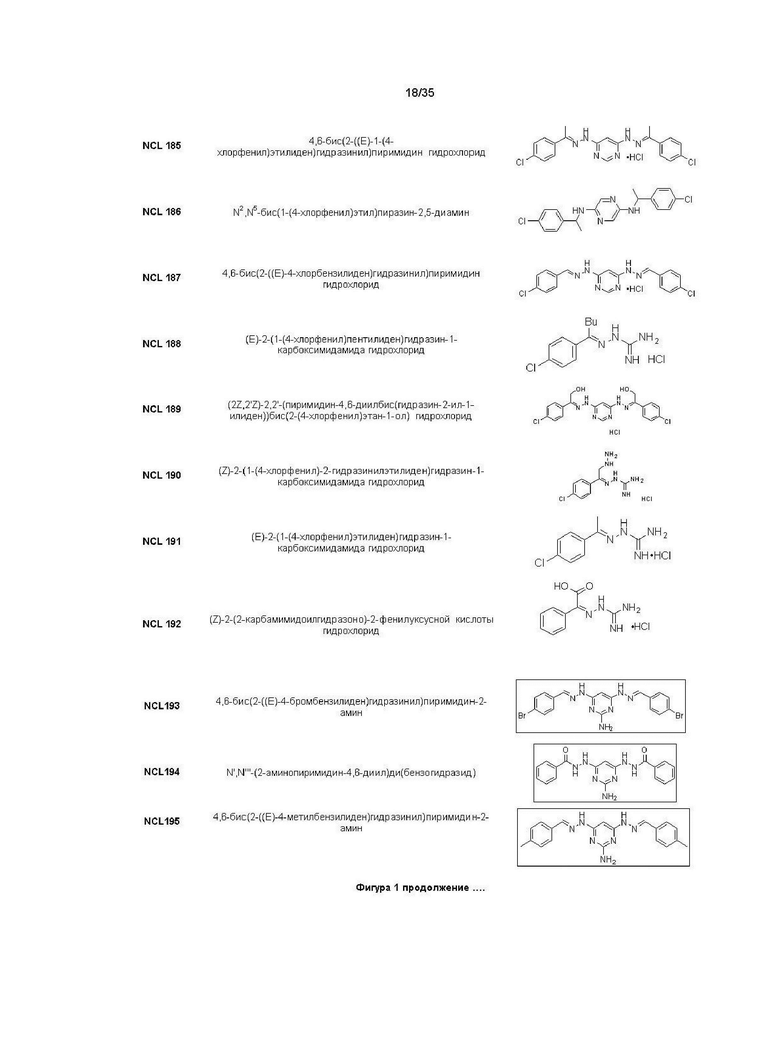
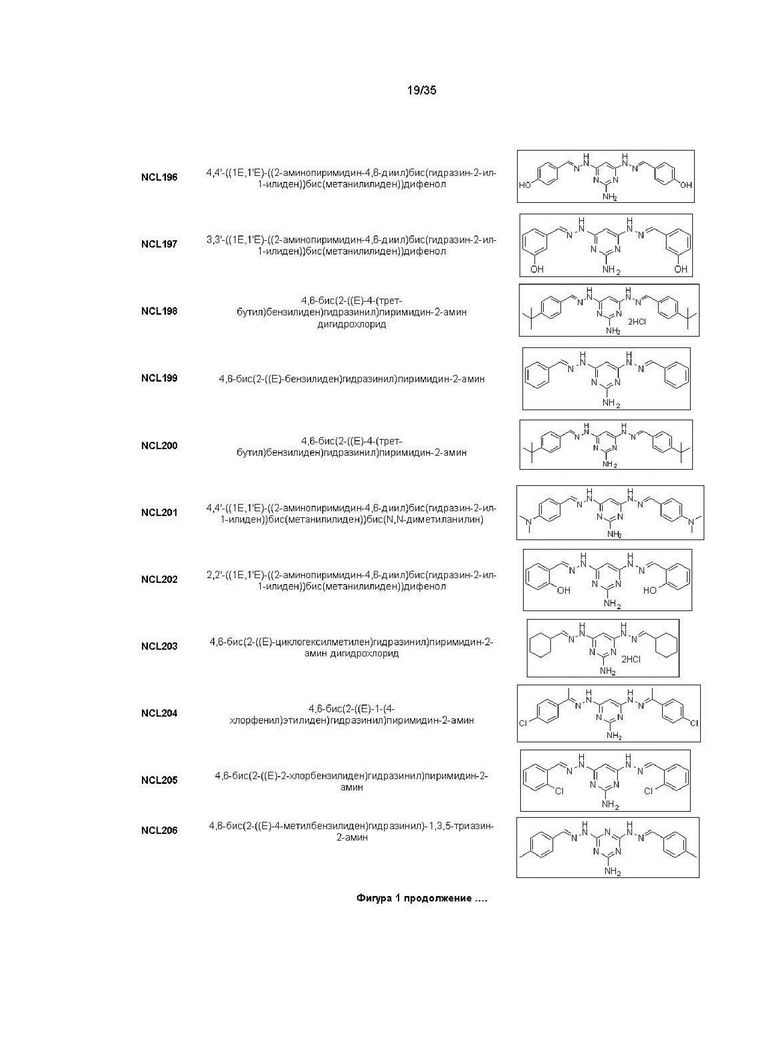


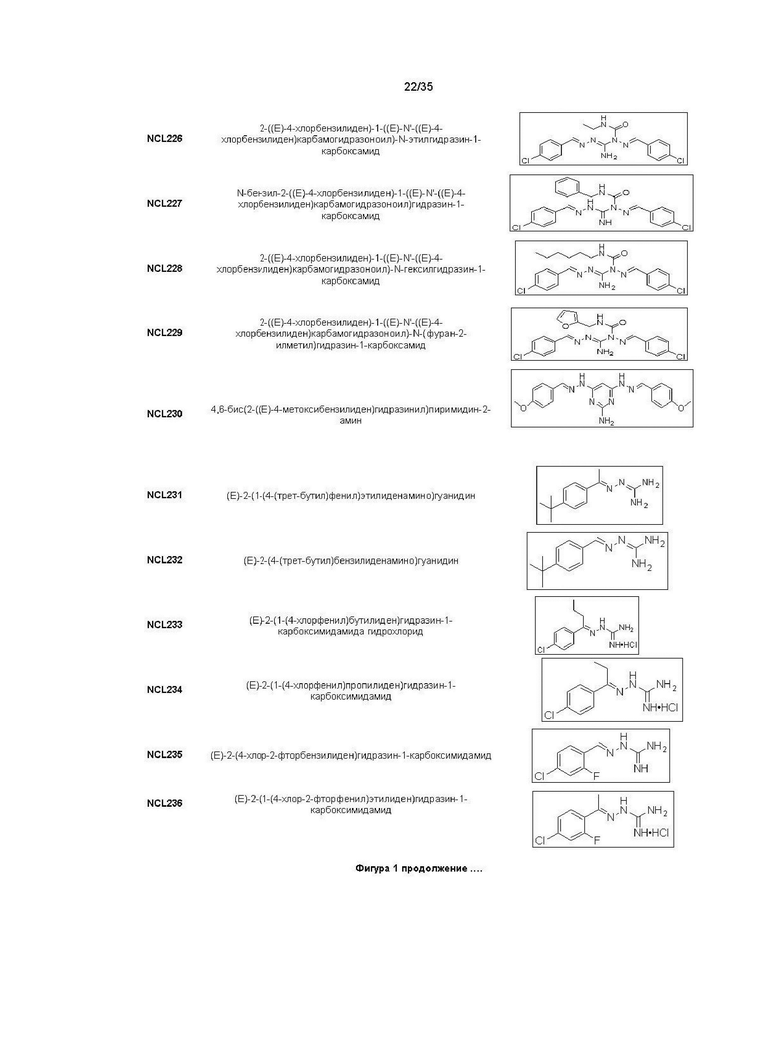
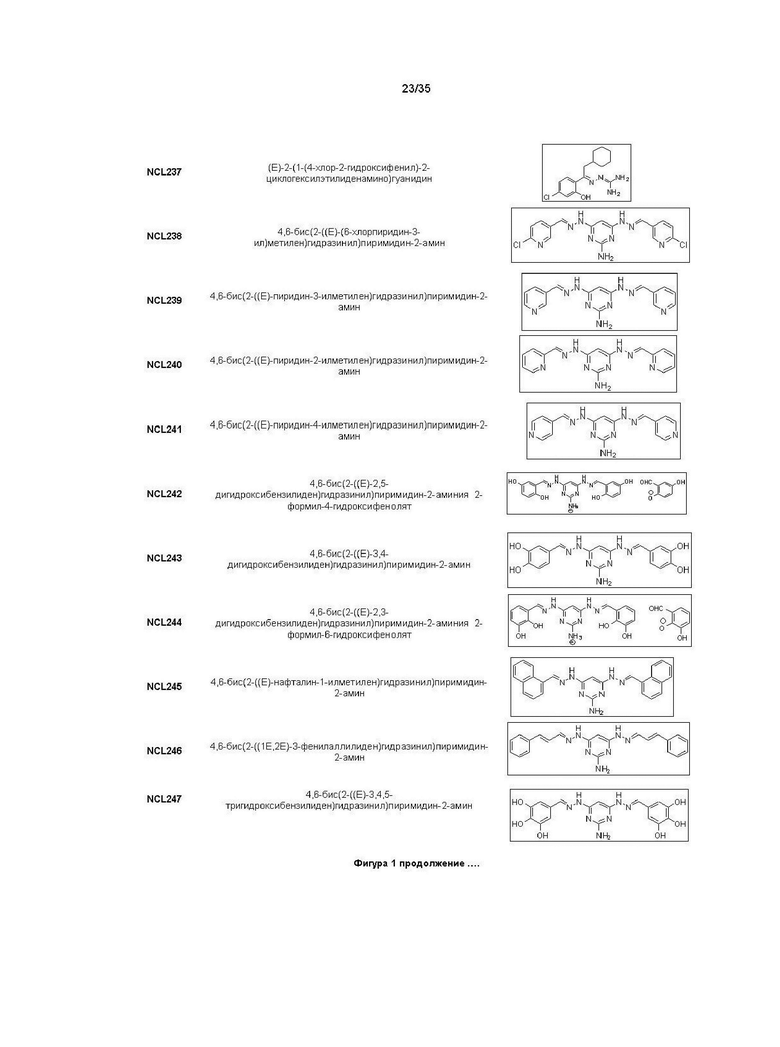


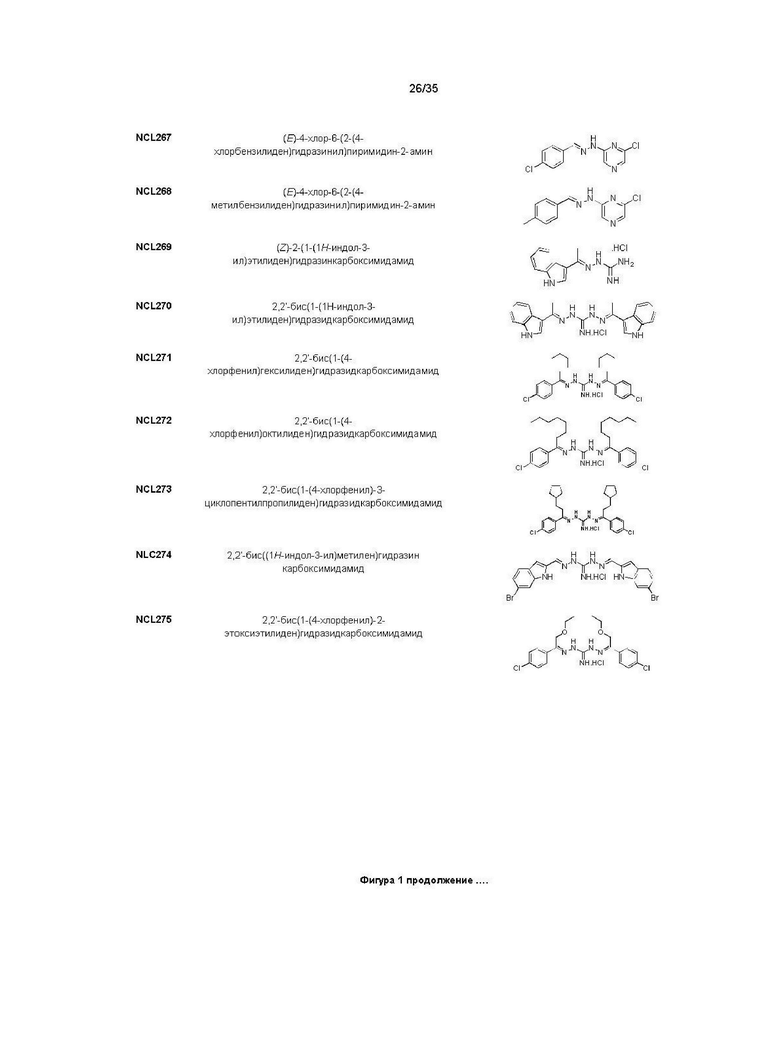
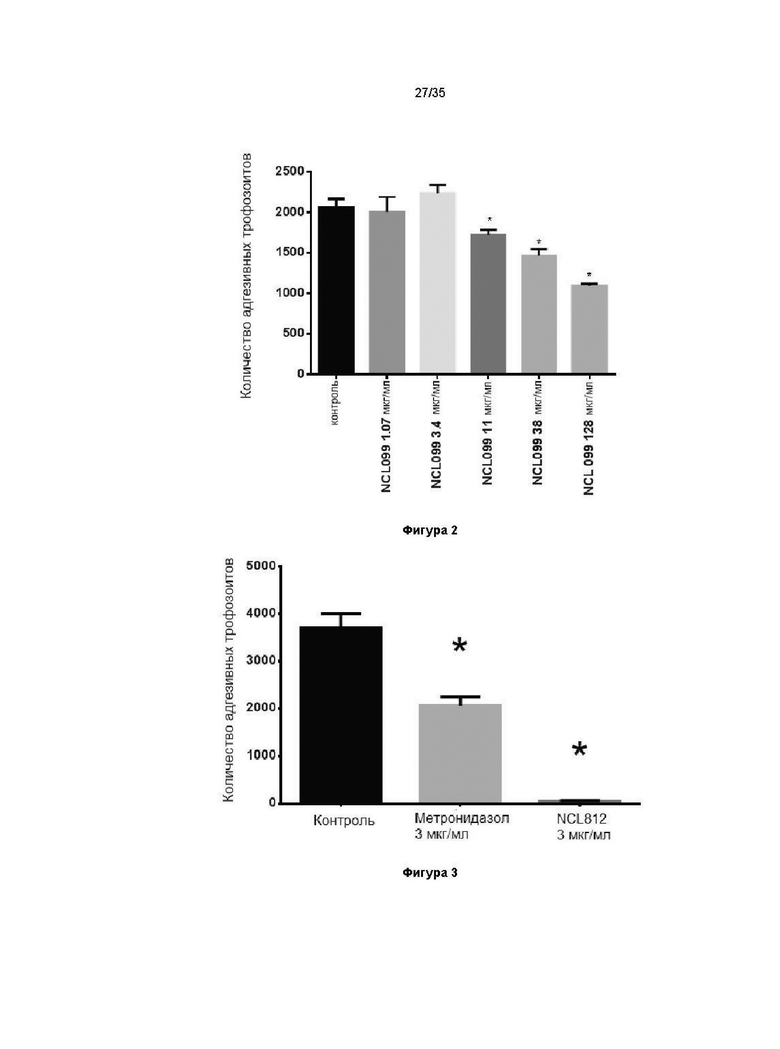
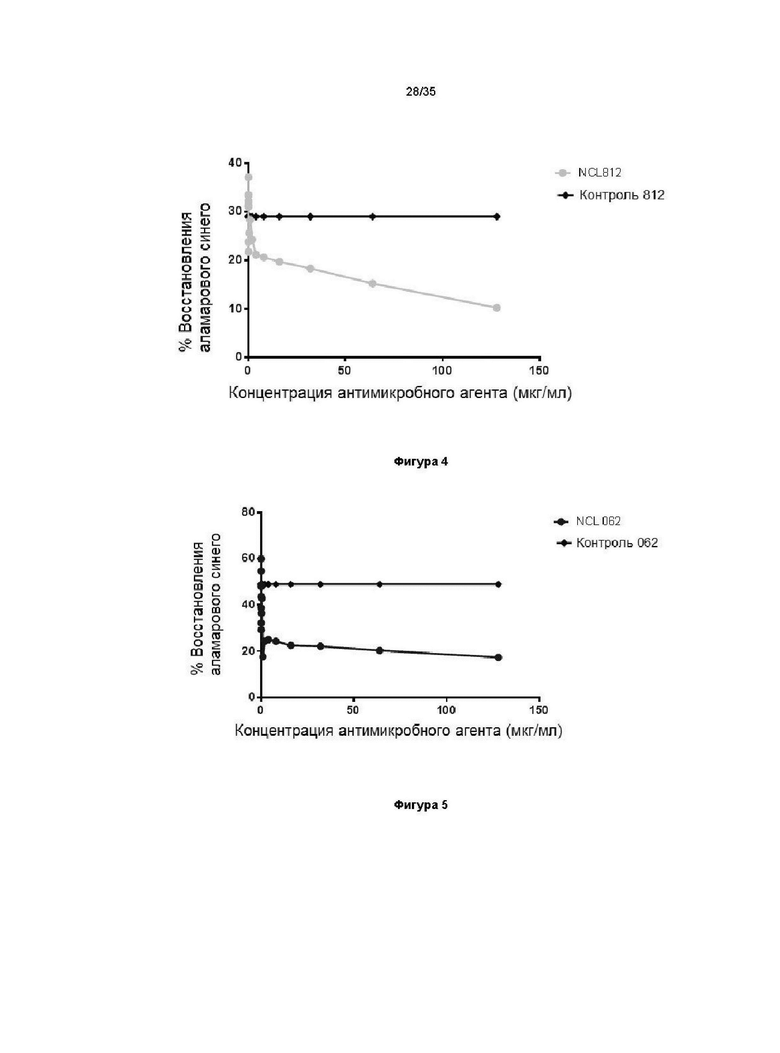
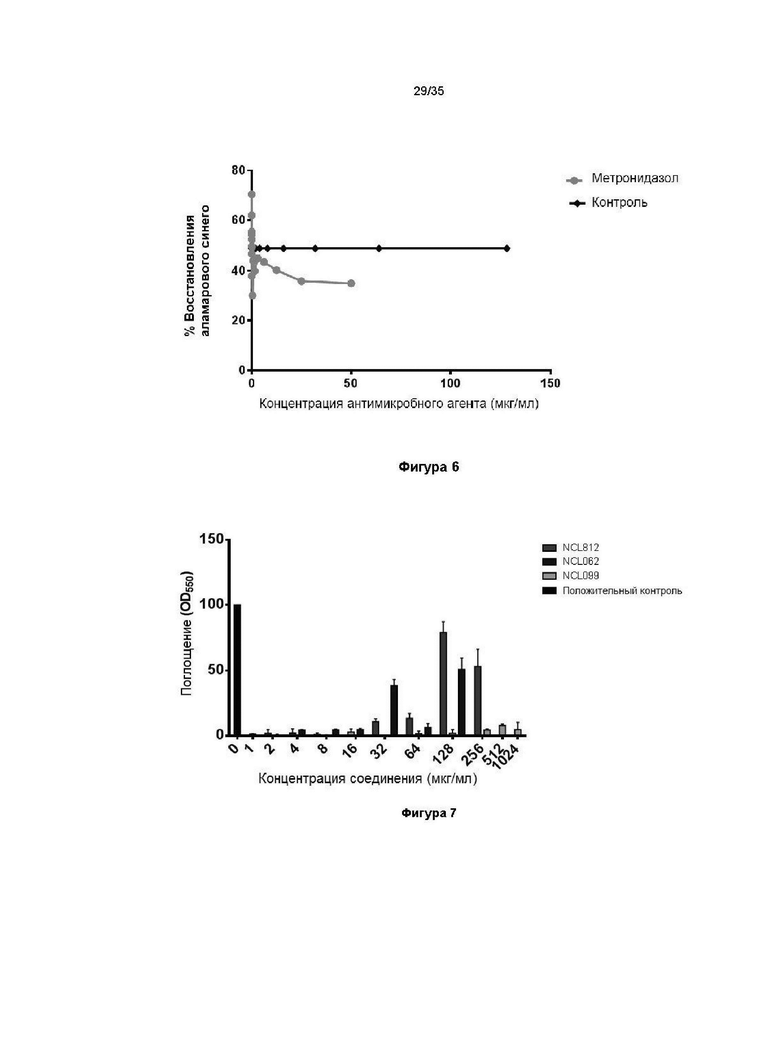
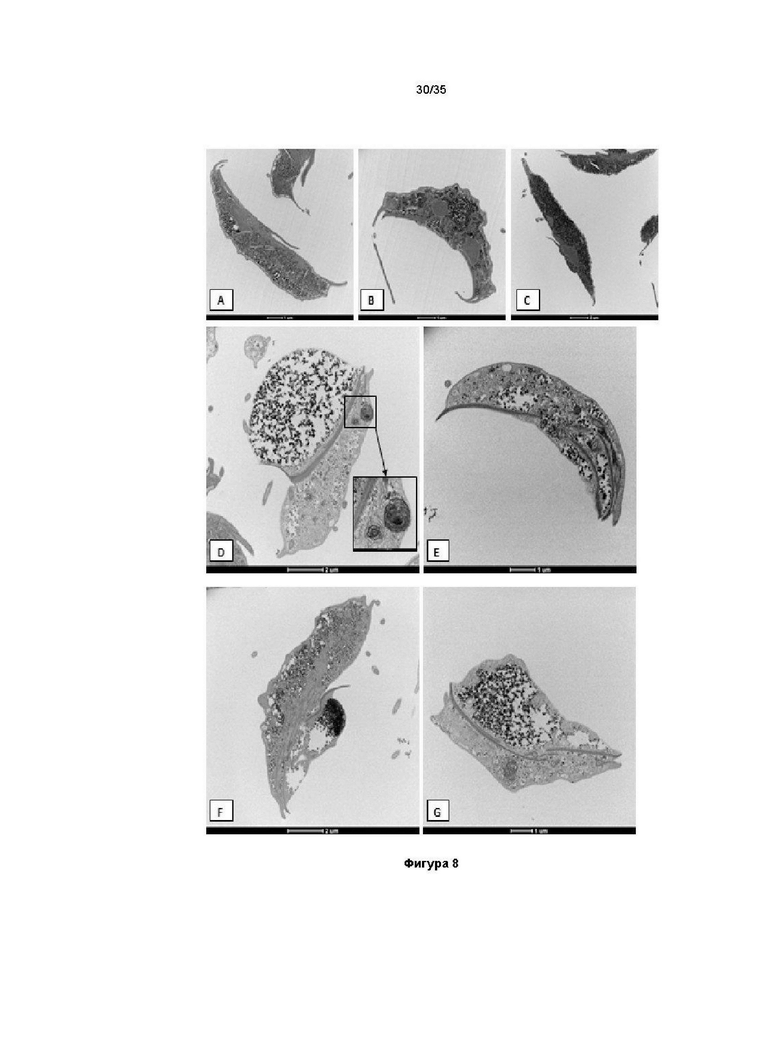
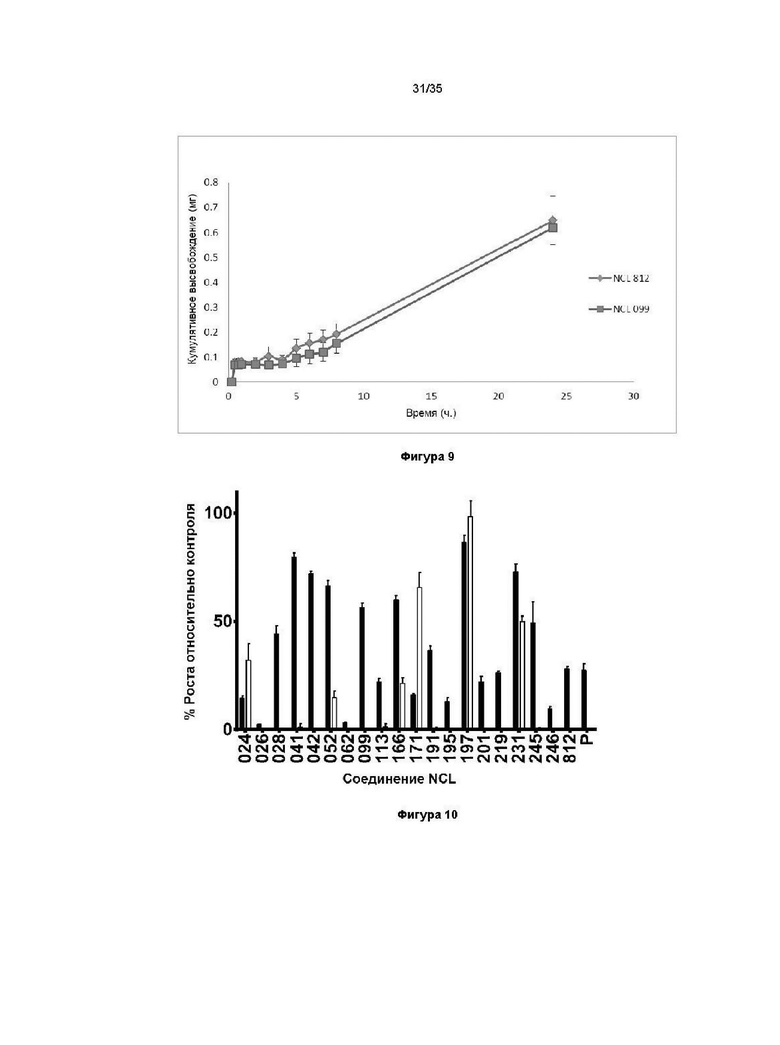
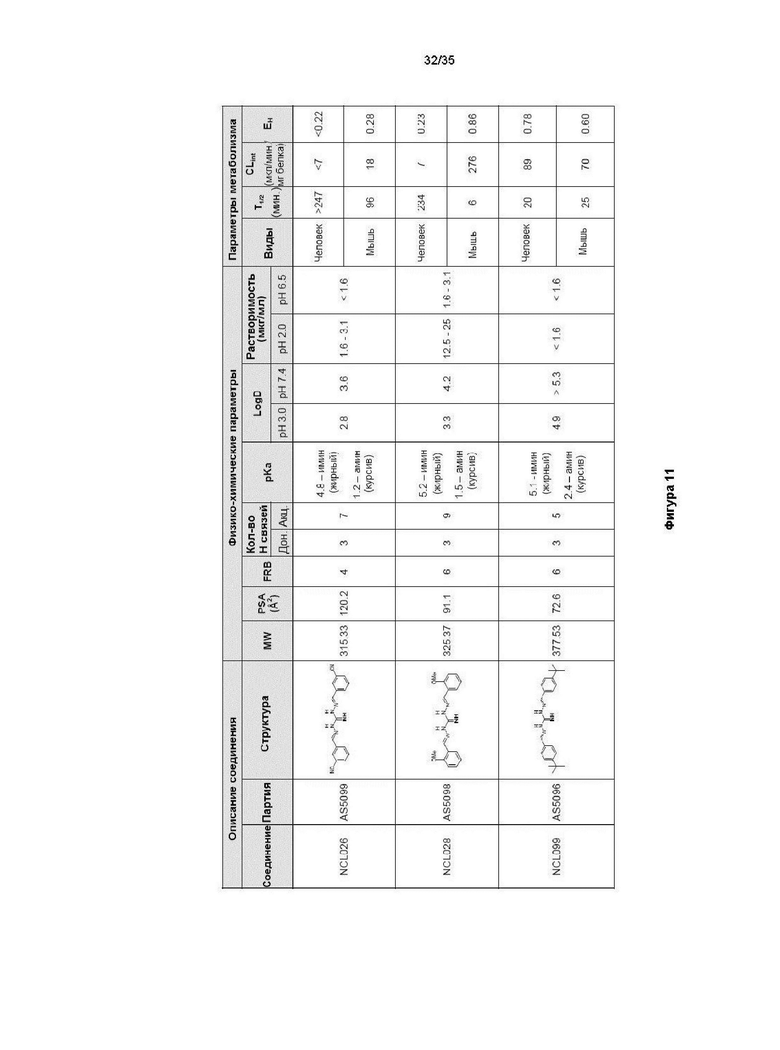
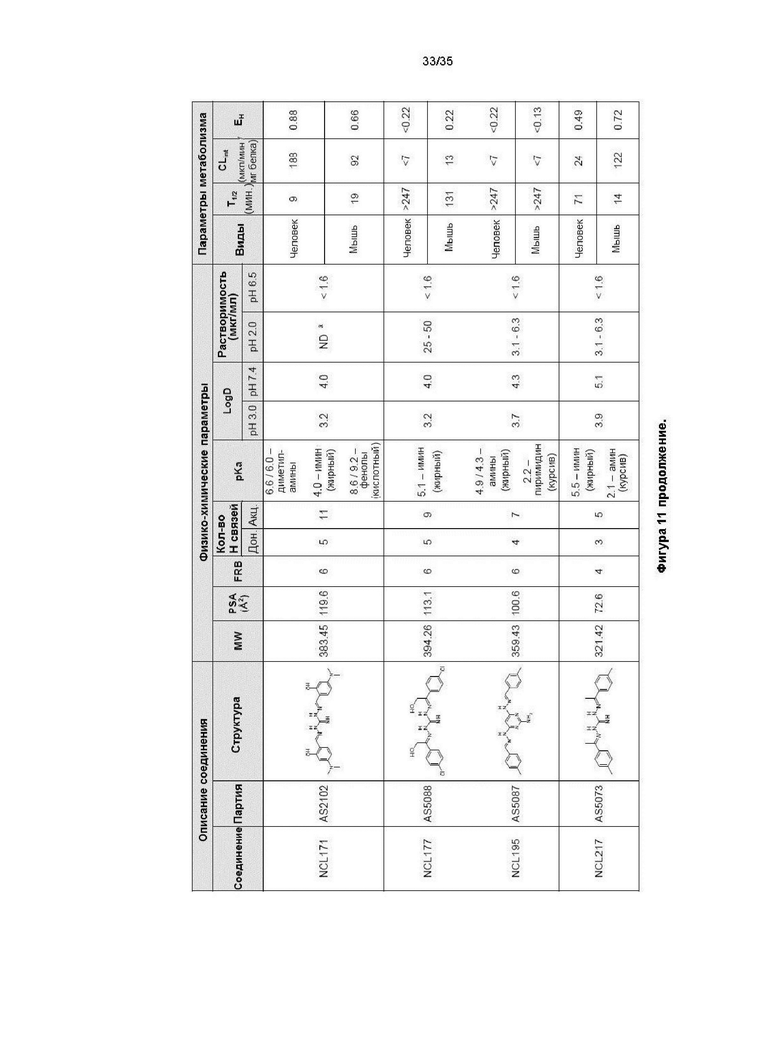
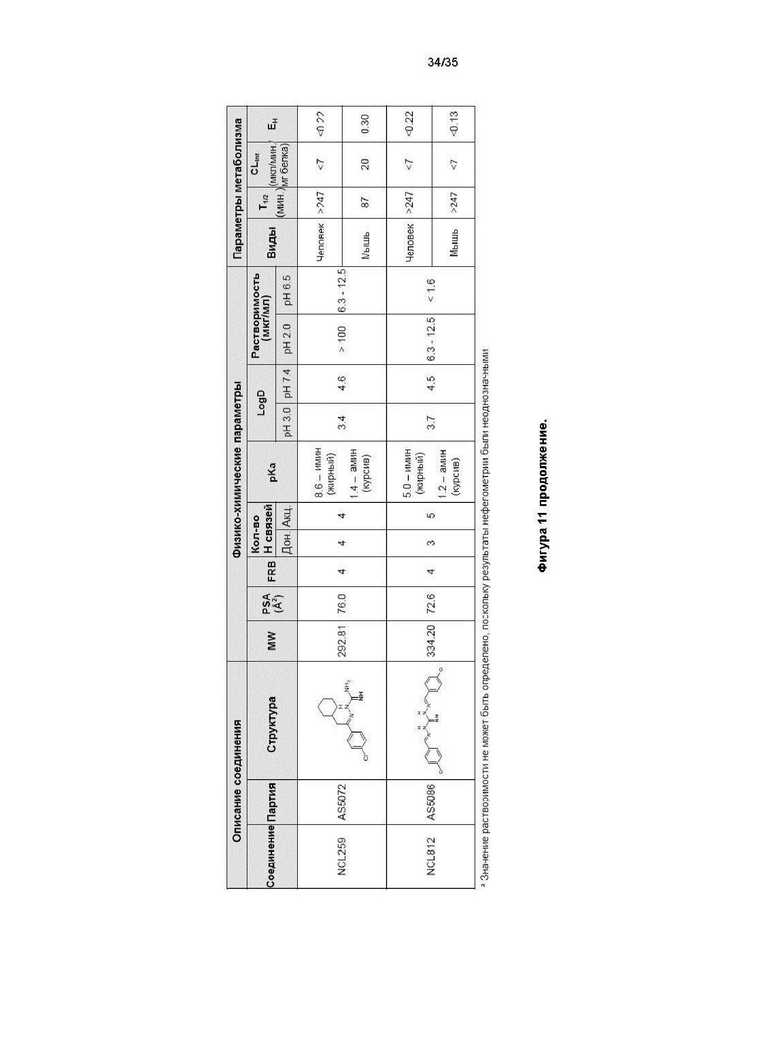
Группа изобретений относится к фармацевтической композиции для лечения или предупреждения инфекции или колонизации, вызванной протозойным агентом, у субъекта, где фармацевтическая композиция содержит терапевтически эффективное количество соединения или его фармацевтически приемлемой соли, выбранного из группы, состоящей из: NCL178, NCL179, NCL180, NCL181, NCL182, NCL183, NCL184, NCL185, NCL187, NCL189, NCL193, NCL194, NCL195, NCL196, NCL197, NCL198, NCL199, NCL200, NCL201, NCL202, NCL203, NCL204, NCL205, NCL206, NCL207, NCL208, NCL209, NCL210, NCL211, NCL212, NCL213, NCL214, NCL218, NCL220, NCL221, NCL222, NCL223, NCL230, NCL238, NCL239, NCL240, NCL241, NCL242, NCL243, NCL244, NCL245, NCL246, NCL247, NCL255, NCL256, NCL262, NCL264, также относится к медицинскому устройству для лечения или предупреждения колонизации или инфекции, вызванной протозойным агентом, у субъекта, где указанное медицинское устройство содержит фармацевтическую композицию и представлено в форме, выбранной из группы, содержащей пластырь, бандаж, повязку или имплантат, и также относится к соединению, выбранному из списка соединений или их фармацевтически приемлемых солей, состоящего из: 4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амина (NCL238); 4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амина (NCL239); 4,6-бис(2-((E)-пиридин-2-илметилен)гидразинил)пиримидин-2-амина (NCL240); 4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амина (NCL241); 4,6-бис(2-((E)-2,5-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-4-гидроксифенoлята (NCL242); 4,6-бис(2-((E)-3,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL243); 4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлята (NCL244); 4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амина (NCL245); 4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амина (NCL246); 4,6-бис(2-((E)-3,4,5-тригидроксибензилиден)гидразинил)пиримидин-2-амина (NCL247); 4,6-бис(2-((E)-[1,1'-бифенил]-4-илметилен)гидразинил)пиримидин-2-амина (NCL255); 4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL256); 4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амина (NCL262); 4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амина (NCL264). Группа изобретений обеспечивает расширение арсенала средств при лечении или предупреждении инфекции или колонизации, вызванной протозойным агентом. 4 н. и 22 з.п. ф-лы, 9 табл., 14 пр., 13 ил.
1. Применение фармацевтической композиции для лечения или предупреждения колонизации или инфекции, вызванной протозойным агентом, у субъекта, где фармацевтическая композиция содержит терапевтически эффективное количество соединения или его фармацевтически приемлемой соли, выбранного из группы, состоящей из:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидина (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амина (NCL179);
(2Z,2'Z)-2,2'-(пиримидин-4,6-диилбис(гидразин-2-ил-1-илиден))бис(2-(4-хлорфенил)этан-1-ола) (NCL180);
4,6-бис(2-((E)-4-хлорбензилиден)гидразинил)пиримидина (NCL181);
6-хлор-N4-(1-фенилэтил)пиримидин-2,4-диамина (NCL182);
N4,N6-бис(1-фенилэтил)пиримидин-4,6-диамина (NCL183);
N4,N6-бис(1-фенилэтил)пиримидин-2,4,6-триамина (NCL184);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин гидрохлорида (NCL185);
4,6-бис(2-((E)-4-хлорбензилиден)гидразинил)пиримидин гидрохлорида (NCL187);
(2Z,2'Z)-2,2'-(пиримидин-4,6-диилбис(гидразин-2-ил-1-илиден))бис(2-(4-хлорфенил)этан-1-ол) гидрохлорида (NCL189);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амина (NCL193);
N',N'''-(2-аминопиримидин-4,6-диил)ди(бензoгидрaзида) (NCL194);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амина (NCL195);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL196);
3,3'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL197);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорида (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амина (NCL199);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амина (NCL200);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилина) (NCL201);
2,2'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL202);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)пиримидин-2-амин дигидрохлорида (NCL203);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амина (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амина (NCL205);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL206);
2,2'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL207);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)-1,3,5-триазин-2-амина (NCL208);
3,3'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL209);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL210);
4,4'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL211);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL212);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)-1,3,5-триазин-2-амина (NCL213);
4,6-бис(2-((E)-бензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL214);
4-((E)-(2-(2-амино-6-(2-((E)-4-((диэтоксифосфорил)окси)бензилиден)гидразинил)пиримидин-4-ил)гидразоно)метил)фенилдиэтилфосфата (NCL218);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амина (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амина (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амина (NCL222);
N,N'-(((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(4,1-фенилен))диацетамида (NCL223);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амина (NCL230);
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амина (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амина (NCL239);
4,6-бис(2-((E)-пиридин-2-илметилен)гидразинил)пиримидин-2-амина (NCL240);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амина (NCL241);
4,6-бис(2-((E)-2,5-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-4-гидроксифенoлята (NCL242);
4,6-бис(2-((E)-3,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL243);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлята (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амина (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амина (NCL246);
4,6-бис(2-((E)-3,4,5-тригидроксибензилиден)гидразинил)пиримидин-2-амина (NCL247);
4,6-бис(2-((E)-[1,1'-бифенил]-4-илметилен)гидразинил)пиримидин-2-амина (NCL255);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амина (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амина (NCL264).
2. Применение по п. 1, где соединение или его фармацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL179);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амин (NCL193);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амин (NCL195);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL196);
3,3'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL197);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорид (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амин (NCL199);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилин) (NCL201);
2,2'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL202);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)пиримидин-2-амин дигидрохлорид (NCL203);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амин (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL205);
2,2'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL207);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL210);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL212);
4-((E)-(2-(2-амино-6-(2-((E)-4-((диэтоксифосфорил)окси)бензилиден)гидразинил)пиримидин-4-ил)гидразоно)метил)фенилдиэтилфосфат (NCL218);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амин (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амин (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амин (NCL222);
N,N'-(((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(4,1-фенилен))диацетамид (NCL223);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амин (NCL230);
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амин (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амин (NCL239);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амин (NCL241);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлят (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амин (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амин (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
3. Применение по п. 2, где соединение или его фармацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL179);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амин (NCL193);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амин (NCL195);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорид (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амин (NCL199);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилин) (NCL201);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амин (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL205);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL210);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL212);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амин (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амин (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амин (NCL222);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амин (NCL230);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
4. Применение по п. 3, где соединение или его фармацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
5. Применение по любому из пп. 1-4, где соединение представляет собой хлоридную соль.
6. Применение по любому из пп. 1-5, где субъект представляет собой животное, выбранное из группы, содержащей: человека, виды псовых, кошачьих, бычьих, овечьих, козьих, свиней, птиц, рыб и лошадиных.
7. Применение по любому из пп. 1-6, где композиция адаптирована для введения соединения субъекту в диапазоне доз от 0,1 до 250 мг/кг массы тела.
8. Применение по любому из пп. 1-7, где протозойный агент выбран из группы рода простейших, содержащей: Acanthamoeba, Babesia, Balamuthia, Balantidium, Besnoitia, Blastocystis, Chilomastix, Cochlosoma, Cryptosporidium, Cyclospora, Cystoisospora, Cytauxzoon, Dientamoeba, Eimeria, Endolimax, Entamoeba, Giardia, Haemoproteus, Hammondia Hartmannella, Hepatozoon, Hexamita, Histomonas, Isospora, Leishmania, Leucocytozoon, Naegleria, Neospora, Pentatrichomonas, Plasmodium, Sappinia, Sarcocystis, Tetratrichomonas, Theileria, Toxoplasma, Trichomonas, Tritrichomonas, Trypanosoma (подроды Duttonella, Herpetosoma, Nannomonas, Schizotrypanum, Trypanozoon), Tyzzeria и Wenyonella.
9. Применение по любому из пп. 1-8, где инфекция или колонизация вызвана смесью по меньшей мере двух протозойных агентов.
10. Применение по любому из пп. 1-9, где инфекция или колонизация, вызванная протозойным агентом, у субъекта представляет собой зооноз.
11. Применение по любому из пп. 1-10, где композиция адаптирована для перорального введения, парентерального введения или местного введения.
12. Фармацевтическая композиция для лечения или предупреждения инфекции или колонизации, вызванной протозойным агентом, у субъекта, содержащая терапевтически эффективное количество соединения или его фармацевтически приемлемой соли, выбранного из группы, состоящей из:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидина (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амина (NCL179);
(2Z,2'Z)-2,2'-(пиримидин-4,6-диилбис(гидразин-2-ил-1-илиден))бис(2-(4-хлорфенил)этан-1-ола) (NCL180);
4,6-бис(2-((E)-4-хлорбензилиден)гидразинил)пиримидина (NCL181);
6-хлор-N4-(1-фенилэтил)пиримидин-2,4-диамина (NCL182);
N4,N6-бис(1-фенилэтил)пиримидин-4,6-диамина (NCL183);
N4,N6-бис(1-фенилэтил)пиримидин-2,4,6-триамина (NCL184);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин гидрохлорида (NCL185);
4,6-бис(2-((E)-4-хлорбензилиден)гидразинил)пиримидин гидрохлорида (NCL187);
(2Z,2'Z)-2,2'-(пиримидин-4,6-диилбис(гидразин-2-ил-1-илиден))бис(2-(4-хлорфенил)этан-1-ол) гидрохлорида (NCL189);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амина (NCL193);
N',N'''-(2-аминопиримидин-4,6-диил)ди(бензoгидрaзида) (NCL194);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амина (NCL195);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL196);
3,3'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL197);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорида (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амина (NCL199);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амина (NCL200);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилина) (NCL201);
2,2'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL202);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)пиримидин-2-амин дигидрохлорида (NCL203);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амина (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амина (NCL205);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL206);
2,2'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL207);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)-1,3,5-триазин-2-амина (NCL208);
3,3'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL209);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL210);
4,4'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенола (NCL211);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL212);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)-1,3,5-триазин-2-амина (NCL213);
4,6-бис(2-((E)-бензилиден)гидразинил)-1,3,5-триазин-2-амина (NCL214);
4-((E)-(2-(2-амино-6-(2-((E)-4-((диэтоксифосфорил)окси)бензилиден)гидразинил)пиримидин-4-ил)гидразоно)метил)фенилдиэтилфосфата (NCL218);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амина (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амина (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амина (NCL222);
N,N'-(((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(4,1-фенилен))диацетамида (NCL223);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амина (NCL230);
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амина (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амина (NCL239);
4,6-бис(2-((E)-пиридин-2-илметилен)гидразинил)пиримидин-2-амина (NCL240);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амина (NCL241);
4,6-бис(2-((E)-2,5-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-4-гидроксифенoлята (NCL242);
4,6-бис(2-((E)-3,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL243);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлята (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амина (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амина (NCL246);
4,6-бис(2-((E)-3,4,5-тригидроксибензилиден)гидразинил)пиримидин-2-амина (NCL247);
4,6-бис(2-((E)-[1,1'-бифенил]-4-илметилен)гидразинил)пиримидин-2-амина (NCL255);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амина (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амина (NCL264).
13. Композиция по п. 12, где соединение или его фарацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL179);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амин (NCL193);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амин (NCL195);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL196);
3,3'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL197);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорид (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амин (NCL199);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилин) (NCL201);
2,2'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL202);
4,6-бис(2-((E)-циклогексилметилен)гидразинил)пиримидин-2-амин дигидрохлорид (NCL203);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амин (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL205);
2,2'-((1E,1'E)-((6-амино-1,3,5-триазин-2,4-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))дифенол (NCL207);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL210);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL212);
4-((E)-(2-(2-амино-6-(2-((E)-4-((диэтоксифосфорил)окси)бензилиден)гидразинил)пиримидин-4-ил)гидразоно)метил)фенилдиэтилфосфат (NCL218);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амин (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амин (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амин (NCL222);
N,N'-(((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(4,1-фенилен))диацетамид (NCL223);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амин (NCL230);
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амин (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амин (NCL239);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амин (NCL241);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлят (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амин (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амин (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
14. Композиция по п. 13, где соединение или его фарацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин (NCL178);
4,6-бис(2((E)-4-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL179);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)пиримидин-2-амин (NCL193);
4,6-бис(2-((E)-4-метилбензилиден)гидразинил)пиримидин-2-амин (NCL195);
4,6-бис(2-((E)-4-(трет-бутил)бензилиден)гидразинил)пиримидин-2-амин дигидрохлорид (NCL198);
4,6-бис(2-((E)-бензилиден)гидразинил)пиримидин-2-амин (NCL199);
4,4'-((1E,1'E)-((2-аминопиримидин-4,6-диил)бис(гидразин-2-ил-1-илиден))бис(метанилилиден))бис(N,N-диметиланилин) (NCL201);
4,6-бис(2-((E)-1-(4-хлорфенил)этилиден)гидразинил)пиримидин-2-амин (NCL204);
4,6-бис(2-((E)-2-хлорбензилиден)гидразинил)пиримидин-2-амин (NCL205);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL210);
4,6-бис(2-((E)-4-бромбензилиден)гидразинил)-1,3,5-триазин-2-амин (NCL212);
4,6-бис(2-((E)-4-фторбензилиден)гидразинил)пиримидин-2-амин (NCL220);
4,6-бис(2-((E)-4-(трифторметил)бензилиден)гидразинил)пиримидин-2-амин (NCL221);
4,6-бис(2-((E)-3,4-дифторбензилиден)гидразинил)пиримидин-2-амин (NCL222);
4,6-бис(2-((E)-4-метоксибензилиден)гидразинил)пиримидин-2-амин (NCL230);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
15. Композиция по п. 14, где соединение или его фарацевтически приемлемая соль выбрано из группы, содержащей:
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амин (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амин (NCL246);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амин (NCL264).
16. Композиция по любому из пп. 12-15, которая представляет собой ветеринарную композицию.
17. Композиция по любому из пп. 12-16, где соединение представляет собой хлоридную соль.
18. Композиция по любому из пп. 12-17, где субъект представляет собой животное, выбранное из группы, содержащей: человека, виды псовых, кошачьих, бычьих, овечьих, козьих, свиней, птиц, рыб и лошадиных.
19. Композиция по любому из пп. 12-18, где композиция адаптирована для введения соединения субъекту в диапазоне доз от 0,1 до 250 мг/кг массы тела.
20. Композиция по любому из пп. 12-19, где протозойный агент выбран из группы рода простейших, содержащей: Acanthamoeba, Babesia, Balamuthia, Balantidium, Besnoitia, Blastocystis, Chilomastix, Cochlosoma, Cryptosporidium, Cyclospora, Cystoisospora, Cytauxzoon, Dientamoeba, Eimeria, Endolimax, Entamoeba, Giardia, Haemoproteus, Hammondia Hartmannella, Hepatozoon, Hexamita, Histomonas, Isospora, Leishmania, Leucocytozoon, Naegleria, Neospora, Pentatrichomonas, Plasmodium, Sappinia, Sarcocystis, Tetratrichomonas, Theileria, Toxoplasma, Trichomonas, Tritrichomonas, Trypanosoma (подроды Duttonella, Herpetosoma, Nannomonas, Schizotrypanum, Trypanozoon), Tyzzeria и Wenyonella.
21. Композиция по любому из пп. 12-20, где инфекция или колонизация вызвана смесью по меньшей мере двух протозойных агентов.
22. Композиция по любому из пп. 12-21, где инфекция или колонизация, вызванная протозойным агентом, у субъекта представляет собой зооноз.
23. Композиция по любому из пп. 12-22, где композиция адаптирована для перорального введения, парентерального введения или местного введения.
24. Медицинское устройство для лечения или предупреждения колонизации или инфекции, вызванной протозойным агентом, у субъекта, где указанное медицинское устройство содержит фармацевтическую композицию по любому из пп. 12-23 и представлено в форме, выбранной из группы, содержащей: пластырь, бандаж, повязку или имплантат.
25. Соединение, выбранное из списка соединений или их фармацевтически приемлемых солей, состоящего из:
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амина (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амина (NCL239);
4,6-бис(2-((E)-пиридин-2-илметилен)гидразинил)пиримидин-2-амина (NCL240);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амина (NCL241);
4,6-бис(2-((E)-2,5-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-4-гидроксифенoлята (NCL242);
4,6-бис(2-((E)-3,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL243);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлята (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амина (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амина (NCL246);
4,6-бис(2-((E)-3,4,5-тригидроксибензилиден)гидразинил)пиримидин-2-амина (NCL247);
4,6-бис(2-((E)-[1,1'-бифенил]-4-илметилен)гидразинил)пиримидин-2-амина (NCL255);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амина (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амина (NCL264).
26. Соединение по п. 25, выбранное из списка соединений или их фармацевтически приемлемых солей, состоящего из:
4,6-бис(2-((E)-(6-хлорпиридин-3-ил)метилен)гидразинил)пиримидин-2-амина (NCL238);
4,6-бис(2-((E)-пиридин-3-илметилен)гидразинил)пиримидин-2-амина (NCL239);
4,6-бис(2-((E)-пиридин-4-илметилен)гидразинил)пиримидин-2-амина (NCL241);
4,6-бис(2-((E)-2,3-дигидроксибензилиден)гидразинил)пиримидин-2-аминия 2-формил-6-гидроксифенoлята (NCL244);
4,6-бис(2-((E)-нафталин-1-илметилен)гидразинил)пиримидин-2-амина (NCL245);
4,6-бис(2-((1E,2E)-3-фенилаллилиден)гидразинил)пиримидин-2-амина (NCL246);
4,6-бис(2-((E)-2,4-дигидроксибензилиден)гидразинил)пиримидин-2-амина (NCL256);
4,6-бис(2-((E)-3-фенилпропилиден)гидразинил)пиримидин-2-амина (NCL262);
4,6-бис(2-((E)-нафталин-2-илметилен)гидразинил)пиримидин-2-амина (NCL264).
| WO 2005028467 A1, 31.03.2005 | |||
| US 4015016 A, 29.03.1977 | |||
| US 3992446 A, 16.11.1976 | |||
| WO 1994006280 A1, 31.03.1994 | |||
| WO 2008014266 A2, 31.01.2008 | |||
| ЭЛЕКТРОННЫЙ МОНИТОР АРТЕРИАЛЬНОГО ДАВЛЕНИЯ, ВЫЧИСЛЯЮЩИЙ СРЕДНЕЕ ЗНАЧЕНИЕ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ | 2006 |
|
RU2332925C2 |
Авторы
Даты
2024-04-25—Публикация
2015-08-28—Подача