[Область техники]
Настоящее изобретение относится к новому гетероциклическому соединению, ингибирующему активность циклинзависимой киназы (CDK), и фармацевтической композиции, содержащей это соединение, в качестве действующего ингредиента.
[Уровень техники]
Цилин-зависимая киназа (CDK) представляет собой серин/треонин киназу и связывается с циклином с образованием комплекса, который обладает киназной активностью и субстратной специфичностью. CDK известна как киназа, регулирующая клеточный цикл посредством взаимодействия с различными циклинами. Кроме того, CDK также участвует в регуляции транскрипции, эпигенетической регуляции, регуляции метаболизма, самообновлении стволовых клеток, нейрональной функции и тому подобное (Lim S, et al., Development, 2013, 140(15): 3079-93).
Существует 16 изотопов CDK, и они играют важную роль в регуляции клеточного цикла или регуляции транскрипции в зависимости от изотипа. В частности, CDK1 и CDK2 среди CDK, регулирующих клеточный цикл, играют важную роль в митозе. CDK2 индуцирует синтез ДНК в S-фазе и прохождение через клеточный цикл. CDK1 участвует в формировании многих факторов для управления фазой M. Соответственно, нарушение CDK может вызывать различные виды рака. Противораковое средство, нацеленное на нарушение CDK, будет эффективно при лечении рака крови, включая острый лимфобластный лейкоз (ALL), хронический лимфобластный лейкоз (CLL), острый миелоидный лейкоз (AML), хронический миелоидный лейкоз (CML), множественную миелому (MM), лимфому Ходжкина и Неходжкинскую лимфому, и солидного рака, включая немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак желудка, рак поджелудочной железы, глиому, рак толстой кишки, рак молочной железы, плоскоклеточный рак головы и шеи, рак печени, меланому, рак матки, рак предстательной железы, рак яичников, рак щитовидной железы, рак желчных протоков, рак желчного пузыря, рак мочевого пузыря, рак почки, рак пищевода и тому подобное. (Pitts TM, et al., Pharmacol Ther., 2014, 142(2): 58-69).
CDK5, который не участвует в регуляции клеточного цикла или транскрипции, в основном распределяется в головном мозге и активируется связыванием с p25, который является стабильным в клетке, что приводит к постоянной активности и, следовательно, к различным дегенеративным заболеваниям головного мозга. Вещество, ингибирующее активность CDK5, будет полезно для лечения болезни Альцгеймера, болезни Паркинсона и болезни Хантингтона. В частности, болезнь Альцгеймера вызвана нейродегенерацией, которая является результатом образования нейрофибриллярных клубок (NFT) и амилоидных бляшек, а CDK5 важен для их образования. CDK5 фосфорилирует сериновые или треониновые остатки Thr181, Ser199, Ser202, Thr212, Ser214, Thr231, Ser235, Ser396 и Ser404 tau-белка, и tau-белок, гиперфосфорилированный CDK5, образует нейрофибриллярный клубок (NFT). Амилоидная бляшка образуется путем накопления Aβ (белок бета-амилоид), который вырабатывается деградацией белка-предшественника амилоида (APP) аспарагиновыми протеазами, β-секретазой и γ-секретазой в головном мозге. В этом отношении CDK5 фосфорилирует остаток Thr668 APP, так что APP может быть деградирован β-секретазой. Следовательно, необходимо разработать соединение, которое может ингибировать активность CDK5 и тем самым предотвращать и лечить дегенеративные заболевания головного мозга, такие как болезнь Альцгеймера, вызванная избыточным действием CDK5 (Cruz JC, et al., Trends Mol Med., 2004, 10(9): 452-8).
[Раскрытие сущности изобретения]
[Техническая задача]
Авторы настоящего изобретения провели обширные исследования с целью разработки нового ингибитора CDK. В результате они обнаружили, что гетероциклическое соединение следующей формулы (I) демонстрирует превосходный ингибирующий CDK эффект в эксперименте in vitro и экспериментальной модели на животных и, таким образом, может быть использовано для профилактики и лечения рака, дегенеративных заболеваний головного мозга, и тому подобное.
Таким образом, целью настоящего изобретения является создание соединения следующей формулы (I), обладающего превосходным ингибирующим CDK действием, или его фармацевтически приемлемой соли.
Другой целью настоящего изобретения является предоставление фармацевтической композиции, содержащей соединение вышеуказанной формулы (I) или его фармацевтически приемлемую соль.
[Техническое решение]
Один аспект настоящего изобретения относится к соединению следующей формулы (I) или его фармацевтически приемлемой соли.
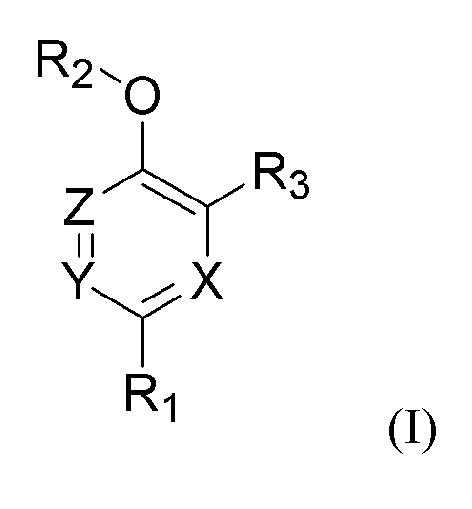 ,
,
где
X, Y и Z каждый независимо представляет собой углерод, азот, кислород или серу;
R1 представляет собой арил;
R2 представляет собой водород или C1-C6 алкил; и
R3 представляет собой арил.
Как используется в настоящем описании термин «C1-C6 алкил» означает линейный или разветвленный углеводород, имеющий от 1 до 6 атомов углерода, который включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил, изопентил, н-гексил и тому подобное, но ими не ограничивается.
Как используется в настоящем описании термин «арил» включает все ароматические группы, гетероароматические группы и их частично восстановленные производные. Ароматическая группа означает 5-15-членное простое или конденсированное кольцо. Гетероароматическая группа означает ароматическую группу, содержащую по меньшей мере один атом, выбранный из кислорода, серы и азота. Примеры арила включают фенил, нафтил, пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, фуранил, тиофенил, пирролил, индолил, хинолинил, имидазолинил, оксазолил, тиазолил, триазолил, тетрагидронафтил и тому подобное, но ими не ограничиваются.
Как используется в настоящем описании термин «C3-C10 циклоалкил» означает простой или конденсированный циклический углеводород, содержащий от 3 до 10 атомов углерода, который включает циклопропил, циклобутил, циклопентил, циклогексил и тому подобное, но ими не ограничивается.
Как используется в настоящем описании термин «C3-C10 гетероциклоалкил» означает простой или конденсированный циклический углеводород, содержащий от 3 до 10 атомов углерода, где один или несколько циклических атомов углерода замещены кислородом, серой или азотом, который включает тетрагидропиранил, пиперидинил, морфолино, пиперазинил, и тому подобное, но ими не ограничивается.
Один или несколько водородов C1-C6 алкила, C3-C10 циклоалкила, C3-C10 гетероциклоалкила и арила могут быть замещены C1-C6 алкилом, C2-C6 алкенилом, C2-C6 алкинилом, C3-C10 циклоалкилом, C3-C10 гетероциклоалкилом, C3-C10 гетероциклоалкилокси, C1-C6 галогеналкилом, C1-C6 алкокси, C1-C6 тиоалкокси, арилом, ацилом, гидрокси, тио, галогеном, амино, C1-C6 алкиламино, алкоксикарбонилом, карбокси, карбамоилом, циано, нитро и т.д.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X, Y и Z каждый независимо представляет собой углерод или азот;
R1 представляет собой 5- или 6-членную ароматическую или гетероароматическую группу, замещенную или незамещенную одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро;
R2 представляет собой водород или C1-C6 алкил; и
R3 представляет собой 5- или 6-членную ароматическую или гетероароматическую группу, замещенную или незамещенную одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X, Y и Z каждый независимо представляет собой углерод или азот;
R1 представляет собой 5- или 6-членную ароматическую или гетероароматическую группу, замещенную или незамещенную одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро;
R2 представляет собой водород или C1-C6 алкил; и
R3 представляет собой 5- или 6-членную гетероароматическую группу, замещенную или незамещенную одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X, Y и Z каждый независимо представляют собой углерод или азот;
R1 представляет собой фенил, пиридин или пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро;
R2 представляет собой водород; и
R3 представляет собой пиридин, пиримидин или тиазол, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 циклоалкил, C3-C10 гетероциклоалкил, гидрокси, C1-C6 алкокси, амино, C1-C6 алкиламино, галоген и нитро.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X, Y и Z каждый независимо представляют собой углерод или азот;
R1 представляет собой фенил, пиридин или пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, амино и галогена;
R2 представляет собой водород; и
R3 представляет собой пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, включающей C1-C6 алкил, C3-C10 гетероциклоалкил, амино, C1-C6 алкиламино и галоген.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X представляет собой азот; и
Y и Z представляют собой углерод.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
Y представляет собой азот; и
X и Z представляют собой углерод.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
Z представляет собой азот; и
X и Y представляют собой углерод.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X и Y представляют собой азот; и
Z представляет собой углерод.
В одном варианте осуществления настоящего изобретения соединение имеет формулу (I),
где
X и Z представляют собой азот; и
Y представляет собой углерод.
Фармацевтически приемлемая соль по настоящему изобретению может включать соли нетоксичной неорганической кислоты и органической кислоты, такие как гидрохлорид, фосфат, сульфат, нитрат, станнат, метансульфонат, п-толуолсульфонат, ацетат, трифторацетат, цитрат, малеат, сукцинат, оксалат, бензоат, тартрат, фумарат, манделат, пропионат, лактат, гликолят, глюконат, галактуронат, глутамат, глутарат, глюкуронат, аспартат, аскорбат, карбонат, ванилат, гидройод, малат, малонат и тому подобное.
Репрезентативные соединения по настоящему изобретению выбраны из следующей группы.
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол;
3,5-бис(2-аминопиримидин-4-ил)пиразин-2-ол;
4,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол;
2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2'-амино-2-(2-аминопиридин-4-ил)-[4,4'-бипиримидин]-5-ол;
3,5-бис(2-аминопиримидин-4-ил)пиридин-2-ол;
6'-амино-6-(2-аминопиримидин-4-ил)-[2,2'-бипиридин]-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2-(2-аминопиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
6-(2-аминопиримидин-4-ил)-[2,3'-бипиридин]-5-ол;
6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2-(2-аминопиримидин-4-ил)-6-(3-гидроксифенил)пиридин-3-ол;
6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(4-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
6-(3-аминофенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол;
6-(3-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(3-фтор-4-гидроксифенил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-3',5-диол;
6-(2-аминопиримидин-4-ил)-2-(4-(метиламино)тиазол-2-ил)пиридин-3-ол;
6-(2-аминопиримидин-4-ил)-6'-(метиламино)-[2,2'-бипиридин]-3-ол;
2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-метилпиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4ʹ-бипиридин]-5-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(3-аминофенил)пиридин-3-ол;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-хлорпиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-3'-фтор-6-(2-(метиламино)-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол 3гидрохлорид;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол оксалат;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол малонат;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол сульфат;
2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2малонат;
2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол 2гидрохлорид;
2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 5гидрохлорид;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-(6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2ацетат;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол малонат;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2ацетат;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид; и
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид.
Способы получения соединений по настоящему изобретению показаны на следующих схемах реакции 1-10. Однако те, которые проиллюстрированы на следующих схемах реакции, представляют собой только типичные способы, используемые в настоящем изобретении. Порядок операций, реагенты, условия реакции и тому подобное могут быть изменены без ограничения.
[Схема реакции 1]
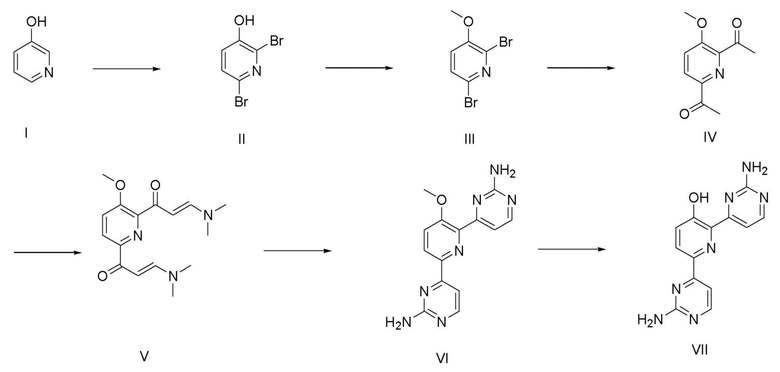
На схеме реакции 1 показан способ из шести стадий для получения соединения (VII) с использованием коммерчески доступного пиридинового спирта (I) в качестве исходного материала.
На стадии 1 1-5 эквивалентов брома добавляют к водному раствору 1-5 эквивалентов неорганических оснований, таких как КОН, NaOH и тому подобное, и затем соединение (I) добавляют к смеси для взаимодействия при 0°С до комнатной температуры с получением соединения (II). Используют 10-30% водного раствора неорганических оснований.
На стадии 2 соединение (II), полученное на стадии 1, подвергают взаимодействию с 1-5 эквивалентами иодметана (CH3I) в органическом растворителе в присутствии основания, такого как карбонат калия (K2CO3), карбонат натрия (Na2CO3), гидрокарбонат натрия (NaHCO3), и тому подобное, с получением соединения (III). Органический растворитель может быть ацетоном, ацетонитрилом, дихлорметаном, хлороформом, тетрагидрофураном, N,N-диметилформамидом и тому подобное. Основание можно использовать в количестве 1-3 эквивалента относительно соединения (I), и реакцию основания с соединением (I) можно проводить при комнатной температуре до температуры кипения с обратным холодильником. На стадии 3 соединение (III), полученное на стадии 2, палладиевый катализатор и 1,3-бис(дифенилфосфино)пропан (DPPP) перемешивали при нагревании с обратным холодильником в органическом растворителе или ионной жидкости в присутствии бутилвинилового эфира и триэтиламина с получением соединения (IV). Растворителем может быть этиленгликоль или ионная жидкость, такая как 1-бутил-3-метилимидазолия тетрафторборат ([bmim][BF4]), палладиевый катализатор представляет собой 0,1-1 мол.% ацетата палладия(II) (Pd(OAc)2), и лиганд может составлять 0,1-1 мол.% 1,3-бис(дифенилфосфино)пропана.
На стадии 4 соединение (IV), полученное на стадии 3, перемешивают при нагревании с обратным холодильником в присутствии 2-30 эквивалентов диметилацеталя N,N-диметилформамида (DMFDMA) с получением соединения (V).
На стадии 5 соединение (V), полученное на стадии 4, подвергают взаимодействию с 1-3 эквивалентами гидрохлорида гуанидина в органическом растворителе в присутствии 4-12 эквивалентов основания с получением соединения (VI). Основанием может быть метоксид натрия (NaOMe), этоксид натрия (NaOEt), гидроксид калия (KOH) и тому подобное, и растворителем может быть метанол, этанол и тому подобное.
На стадии 6 соединение (VI), полученное на стадии 5, подвергают взаимодействию с 5-30 эквивалентами пиридина гидрохлорида с получением соединения (VII). Температура реакции составляет 150°С-200°С.
[Схема реакции 2]
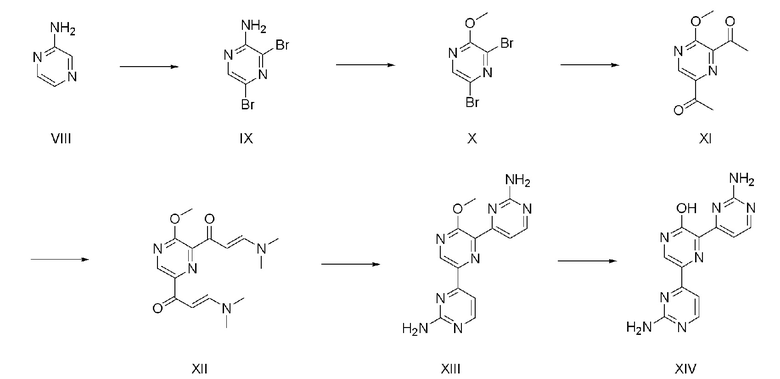
На схеме реакции 2 показан способ из шести стадий для получения соединения (XIV) с использованием коммерчески доступного аминопиразина (VIII) в качестве исходного материала.
На стадии 1 аминопиразин (VIII) подвергают взаимодействию с 2-4 эквивалентами N-бромсукцинимида (NBS) при 0°С до комнатной температуры с получением соединения (IX). Для реакции может быть использован реакционный растворитель, такой как смесь воды и диметилсульфоксида (ДМСО), ацетонитрил, дихлорметан или хлороформ.
На стадии 2 используют 1,5-5 эквивалентов изоамилнитрита в метанольном растворителе с получением соединения (X).
На стадии 3 соединение (XI) получают способом, аналогичным способу стадии 3 схемы реакции 1. На стадии 4 соединение (XII) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 5 соединение (XIII) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 6 соединение (XIV) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 3]
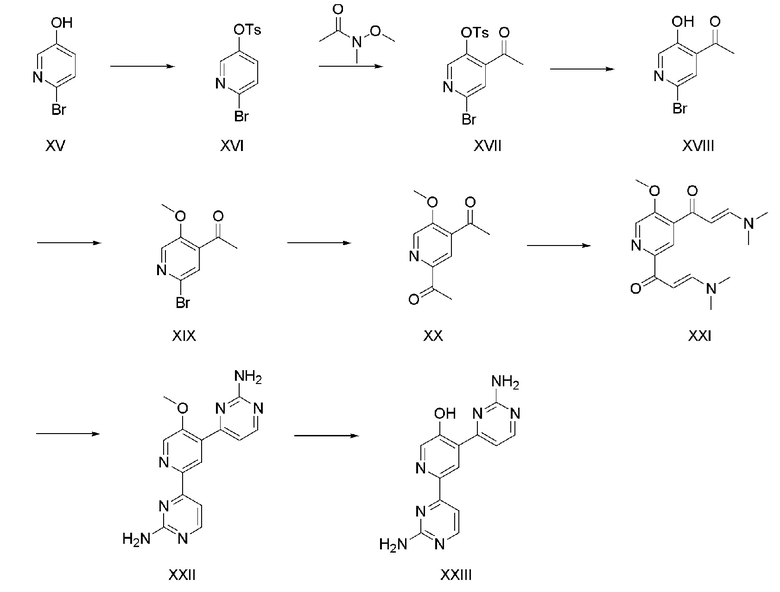
На схеме реакции 3 показан способ из восьми стадий для получения соединения (XXIII) с использованием коммерчески доступного 6-бром-пиридин-3-ола (XV) в качестве исходного материала.
На стадии 1 6-бром-пиридин-3-ол (XV) подвергают взаимодействию с 4-толуолсульфонилом хлоридом (TsCl) в органическом растворителе в присутствии 1-3 эквивалентов основания, такого как триэтиламин, с получением соединения (XVI). Органическим растворителем может быть дихлорметан, хлороформ и тому подобное, и 4-толуолсульфонилхлорид используют в количестве 1-2 эквивалента.
На стадии 2 соединение (XVI), полученное на стадии 1, растворяют в органическом растворителе, и затем 1-4 эквивалента основания, такого как диизопропиламид лития (LDA), н-бутиллитий (n-BuLi) и тому подобное и 1,5-5 эквивалентов N-метокси-N-метилацетамида используют для получения соединения (XVII). Органическим растворителем может быть тетрагидрофуран, диэтиловый эфир и тому подобное.
На стадии 3 соединение (XVII), полученное на стадии 2, растворяют в органическом растворителе и затем используют 1-4 эквивалента основания для получения соединения (XVIII). Органический растворитель представляет собой смесь тетрагидрофурана, метанола и воды, и основанием может быть гидроксид лития (LiOH), гидроксид натрия (NaOH), гидроксид калия (KOH) и тому подобное.
На стадии 4, соединение (XIX) получают способом, аналогичным способу стадии 2 схемы реакции 1. На стадии 5, соединение (XX) получают способом, аналогичным способу стадии 3 схемы реакции 1. На стадии 6, соединение (XXI) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 7, соединение (XXII) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 8, соединение (XXIII) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 4]
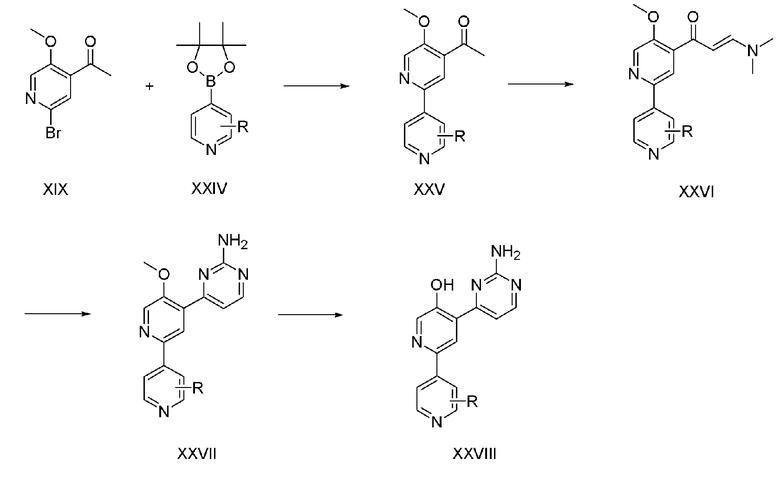
На схеме реакции 4 показан способ из четырех стадий для получения соединения (XXVIII) с использованием соединения (XIX), полученного на стадии 4 схемы реакции 3 в качестве исходного материала.
На стадии 1 соединение (XXV) получают посредством реакции Сузуки, используя соединение (XIX), полученное на стадии 4 схемы реакции 3, 0,5-3 эквивалента боронатного соединения (XXIV), которое является коммерчески доступным или легко получается, и 1-5 мол.% палладиевого катализатора. Палладиевым катализатором является тетракис(трифенилфосфин)палладий(0) и реакционный растворитель представляет собой смесь диметилового эфира этиленгликоля и воды.
На стадии 2 соединение (XXVI) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 3 соединение (XXVII) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 4 соединение (XXVIII) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 5]
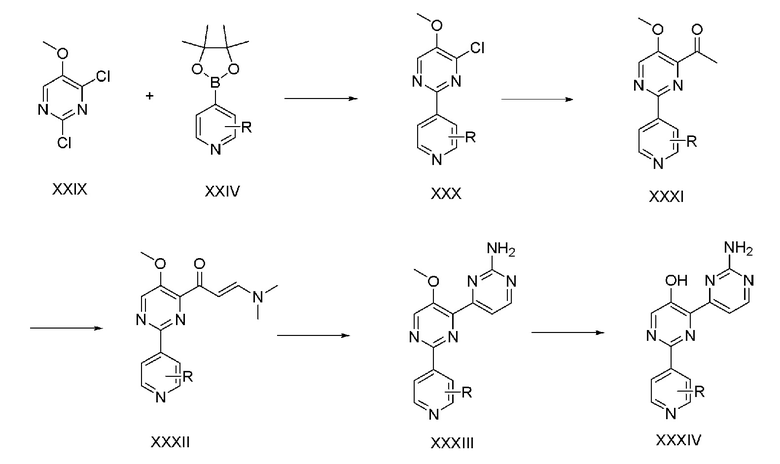
На схеме реакции 5 показан способ из пяти стадий для получения соединения (XXXIV) с использованием коммерчески доступного 2,4-дихлор-5-метоксипиримидина (XXIX) в качестве исходного материала.
На стадии 1, соединение (XXX) получают способом, аналогичным способу стадии 1 схемы реакции 4. На стадии 2, соединение (XXXI) получают способом, аналогичным способу стадии 3 схемы реакции 1. На стадии 3, соединение (XXXII) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 4, соединение (XXXIII) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 5, соединение (XXXIV) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 6]
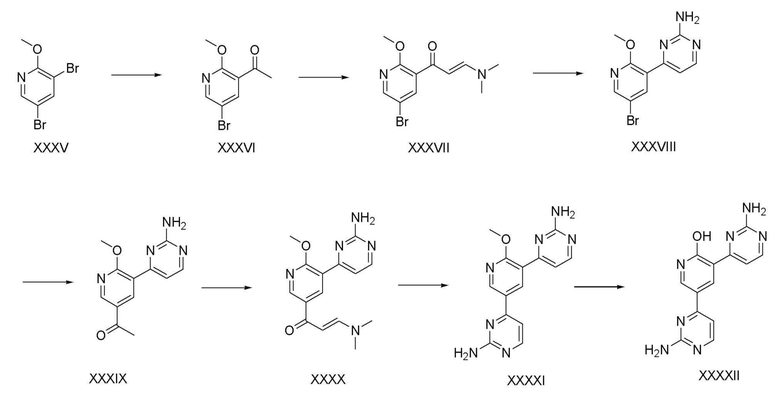
На схеме реакции 6 показан способ из семи стадий для получения соединения (XXXXII) с использованием коммерчески доступного 3,5-бром-2-метоксипиридина (XXXV) в качестве исходного материала.
На стадии 1, соединение (XXXVI) получают способом, аналогичным способу стадии 3 схемы реакции 1. На стадии 2, соединение (XXXVII) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 3, соединение (XXXVIII) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 4, соединение (XXXIX) получают способом, аналогичным способу стадии 3 схемы реакции 1. На стадии 5, соединение (XXXX) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 6, соединение (XXXXI) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 7, соединение (XXXXII) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 7]
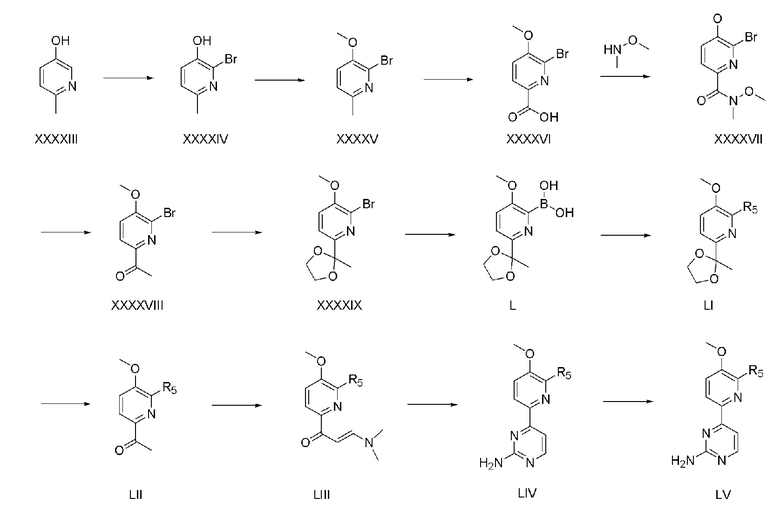
На схеме реакции 7 показан способ из двенадцати стадий для получения соединения (LV) с использованием коммерчески доступного 5-гидрокси-2-метилпиридина (XXXXIII) в качестве исходного материала.
На стадии 1 5-гидрокси-2-метилпиридин (XXXXIII) подвергают взаимодействию с 0,5-3 эквивалентами брома в пиридиновом растворителе с получением соединения (XXXXIV).
На стадии 2 соединение (XXXXV) получают способом, аналогичным способу стадии 2 схемы реакции 1.
На стадии 3 соединение (XXXXV), полученное на стадии 2, растворяют в воде и затем используют 2-5 эквивалентов перманганата калия (KMnO4) для получения соединения (XXXXVI).
На стадии 4 соединение (XXXXVI), полученное на стадии 3, растворяют в органическом растворителе и затем подвергают 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) реакции сочетания с N,O-диметилгидроксиамин гидрохлоридом с получением соединения (XXXXVII). Органическим растворителем может быть дихлорметан, N,N-диметилформамид и тому подобное.
На стадии 5 соединение (XXXXVII), полученное на стадии 4, растворяют в органическом растворителе и затем используют 1-3 эквивалента метилмагния бромида для получения соединения (XXXXVIII). Органическим растворителем может быть тетрагидрофуран, диэтиловый эфир и тому подобное.
На стадии 6 соединение (XXXXVIII), полученное на стадии 5, растворяют в органическом растворителе и затем ацетильную группу превращают в ацетальную группу с использованием избыточного количества этиленгликоля и 0,1-0,5 эквивалентов п-толуолсульфоновой кислоты с получением соединения (XXXXIX). Органическим растворителем может быть бензол, толуол и тому подобное.
На стадии 7 соединение (XXXXIX), полученное на стадии 6, растворяют в органическом растворителе и затем используют 2-3 эквивалента триизопропилбората для получения бороновой кислоты (L). Органическим растворителем может быть диэтиловый эфир, тетрагидрофуран и тому подобное.
На стадии 8 соединение (LI) получают способом, аналогичным способу стадии 1 схемы реакции 4.
На стадии 9 соединение (LI), полученное на стадии 8, растворяют в смеси воды и ацетона и затем подвергают взаимодействию с 0,1-0,7 эквивалентами пиридиний п-толуолсульфоната для удаления ацетальной группы с получением соединения (LII).
На стадии 10, соединение (LIII) получают способом, аналогичным способу стадии 4 хемы реакции 1. На стадии 11, соединение (LIV) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 12, соединение (LV) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 8]
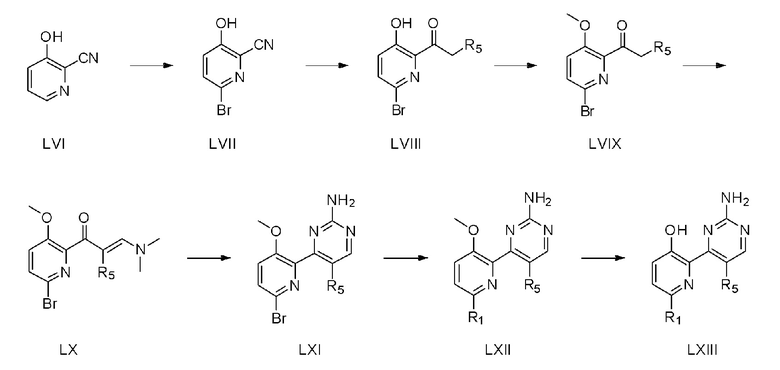
На схеме рекции 8 показан способ из семи стадий для получения соединения (LXIII) с использованием коммерчески доступного 2-циано-3-гидроксипиридина (LVI) в качестве исходного материала.
На стадии 1, 2-циано-3-гидроксипиридин (LVI) растворяют в дистиллированной воде и затем к полученному раствору добавляют 0,5-2 эквивалента N-бромсукцинимида (NBS) для получения соединения (LVII) с помощью реакции бромирования.
На стадии 2 соединение (LVII), полученное на стадии 1, растворяют в органическом растворителе и затем используют 1-4 эквивалента алкилмагний бромида или алкилмагний хлорида для введения алкилкарбонильной группы для получения соединения (LVIII). Органическим растворителем может быть тетрагидрофуран, диэтиловый эфир и тому подобное.
На стадии 3, соединение (LIX) получают способом, аналогичным способу стадии 2 схемы реакции 1. На стадии 4, соединение (LX) получают способом, аналогичным способу стадии 4 схемы реакции 1. На стадии 5, соединение (LXI) получают способом, аналогичным способу стадии 5 схемы реакции 1. На стадии 6, соединение (LXII) получают способом, аналогичным способу стадии 1 схемы реакции 4. На стадии 7, соединение (LXIII) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 9]
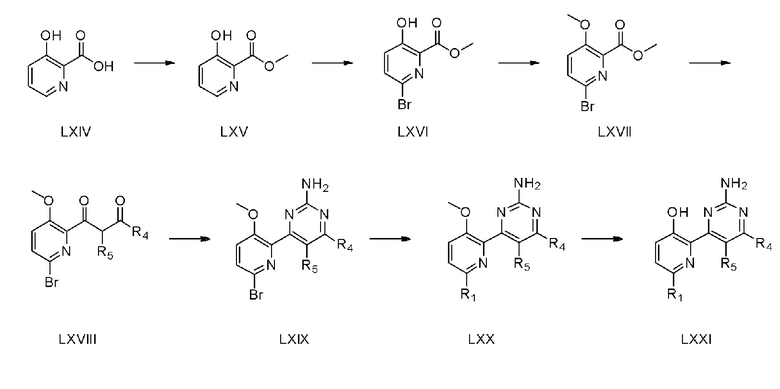
На схеме реакции 9 показан способ из семи стадий для получения соединения (LXXI) с использованием коммерчески доступной 3-гидроксипиколиновой кислоты (LXIV) в качестве исходного материала.
На стадии 1, 3-гидроксипиколиновую кислоту (LXIV) растворяют в метаноле и затем к полученному раствору добавляют 0,5 мл/1 г до 2 мл/1 г серной кислоты, получая соединение (LXV) с помощью этерификации.
На стадии 2 соединение (LXVI) получают способом, аналогичным способу стадии 1 схемы реакции 1. На стадии 3, соединение (LXVII) получают способом, аналогичным способу стадии 2 схемы реакции 1.
На стадии 4 соединение (LXVII), полученное на стадии 3, растворяют в органическом растворителе и затем вводят дикетон с использованием 1-3 эквивалентов алкилкетона с получением соединения (LXVIII). Органическим растворителем может быть тетрагидрофуран, диэтиловый эфир и тому подобное.
На стадии 5 соединение (LXVIII), полученное на стадии 4, подвергают взаимодействию с 1-3 эквивалентами карбоната гуанидина в органическом растворителе в присутствии 0-4 эквивалентов основания с получением соединения (LXIX). Основанием может быть карбонат калия (K2CO3), карбонат натрия (Na2CO3), метоксид натрия (NaOMe), этоксид натрия (NaOEt), гидроксид калия (KOH) и тому подобное, и растворителем может быть метанол, этанол и тому подобное.
На стадии 6, соединение (LXX) получают способом, аналогичным способу стадии 1 схемы реакции 4. На стадии 7, соединение (LXXI) получают способом, аналогичным способу стадии 6 схемы реакции 1.
[Схема реакции 10]
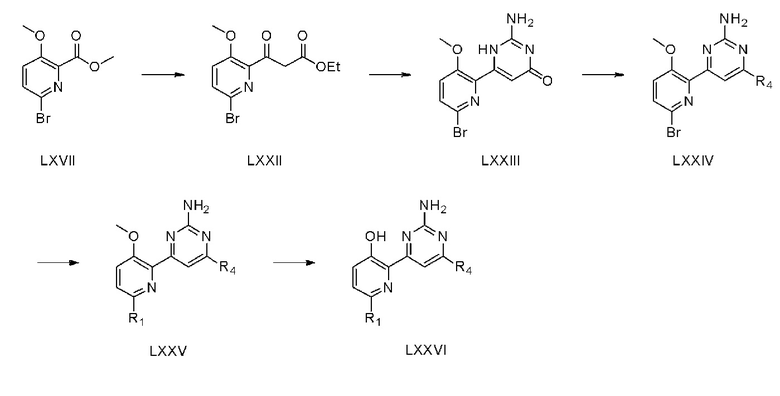
На схеме реакции 10 показан способ из пяти стадий для получения соединения (LXXVI) с использованием соединения (LXVII), полученного на стадии 3 схемы реакции 9, в качестве исходного материала.
На стадии 1 соединение (LXVII), полученное на стадии 3 схемы реакции 9, растворяют в этилацетате и затем используют основание для получения дикетона. Основанием может быть трет-бутоксид калия (t-BuOK), бис(триметилсилил)амид лития (LiHMDS), диизопропаламин лития (LDA) и тому подобное.
На стадии 2 соединение (LXXII), полученное на стадии 1, растворяют в органическом растворителе и затем подвергают взаимодействию с 1-4 эквивалентами карбоната гуанидина с получением соединения (LXXIII). Растворителем может быть метанол, этанол, изопропанол и тому подобное.
На стадии 3 соединение (LXXIII), полученное на стадии 2, растворяют в органическом растворителе, и затем 1-4 эквивалента (бензотриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфата (BOP) и 1-4 эквивалента 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU) добавляют по каплям к полученному раствору, и затем к раствору добавляют соединение амина с получением соединения (LXXIV). Растворителем может быть ацетонитрил, тетрагидрофуран и тому подобное, и амин может быть морфолином, пиперидином, пиперазином и тому подобное.
На стадии 4, соединение (LXXV) получают способом, аналогичным способу стадии 1 схемы реакции 4. На стадии 5, соединение (LXXVI) получают способом, аналогичным способу стадии 6 схемы реакции 1.
Соединения по настоящему изобретению, полученные, как описано выше, могут быть получены в виде фармацевтически приемлемой соли в соответствии с обычным способом в данной области.
В одном варианте осуществления настоящего изобретения полезной фармацевтически приемлемой солью может быть кислотно-аддитивная соль, образованная свободной кислотой. Кислотно-аддитивную соль можно получить обычным способом в данной области. Например, соединение растворяют в избыточном количестве водного раствора кислоты при комнатной температуре или при нагревании, и полученную соль осаждали смешивающимся с водой органическим растворителем, таким как метанол, этанол, ацетон или ацетонитрил. Или смесь выпаривали для сушки и перекристаллизации с получением соли.
Один аспект настоящего изобретения относится к фармацевтической композиции для ингибирования циклин-зависимой киназы (CDK), содержащей соединение вышеуказанной формулы (I) или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым носителем, в частности, фармацевтической композицией для профилактики или лечения рака или дегенеративных заболеваний головного мозга.
В одном варианте осуществления настоящего изобретения соединение вышеуказанной формулы (I) или его фармацевтически приемлемая соль индуцирует противоопухолевое действие посредством регуляции клеточного цикла путем ингибирования CDK и поэтому может быть использовано для лечения рака крови, включая острый лимфобластный лейкоз (ALL), хронический лимфобластный лейкоз (CLL), острый миелоидный лейкоз (AML), хронический миелоидный лейкоз (CML), множественную миелому (MM), лимфому Ходжкина и Неходжкинскую лимфому, и солидные раки, включая немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак желудка, рак поджелудочной железы, глиому, рак толстой кишки, рак молочной железы, плоскоклеточный рак головы и шеи, рак печени, меланому, рак матки, рак предстательной железы, рак яичников, рак щитовидной железы, рак желчных протоков, рак желчного пузыря, рак мочевого пузыря, рак почки, рак пищевода, и тому подобное.
Кроме того, соединение вышеуказанной формулы (I) или его фармацевтически приемлемая соль может проходить через гематоэнцефалический барьер (ВВВ) и поэтому может быть использовано для лечения глиомы, такой как астроцитома, анапластическая астроцитома и глиобластома, опухоли головного мозга, такой как аденома гипофиза, медуллобластома и менингиома, или метастатической опухоли головного мозга, метастазированной от рака легких, рака молочной железы, меланомы и тому подобное.
В одном варианте осуществления настоящего изобретения соединение вышеуказанной формулы (I) или его фармацевтически приемлемая соль ингибируют фосфорилирование tau-белка и образование Aβ, которые являются причинами болезни Альцгеймера, путем ингибирования CDK5. Следовательно, соединение вышеуказанной формулы (I) или его фармацевтически приемлемая соль может быть использовано для лечения болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона и тому подобное.
Фармацевтическую композицию по настоящему изобретению можно вводить перорально, например, путем проглатывания или путем ингаляции; или парентерально, например, путем инъекции, депонирования, имплантации или с помощью суппозиториев. Инъекция может быть, например, внутривенной, подкожной, внутримышечной или внутрибрюшинной. В зависимости от способа введения фармацевтическая композиция по настоящему изобретению может быть приготовлена в виде таблеток, капсул, гранул, мелких частиц, порошков, сублингвальных таблеток, суппозиториев, мазей, растворов для инъекций, эмульсий, суспензий, сиропов, аэрозолей и тому подобное. Вышеуказанные различные формы фармацевтической композиции по настоящему изобретению могут быть получены способом, хорошо известным в данной области, с использованием фармацевтически приемлемого носителя(ей), которые обычно используются для каждой формы. Примеры фармацевтически приемлемых носителей включают эксципиент, связующее вещество, дезинтегрирующее средство, смазывающее вещество, консервант, антиоксидант, изотонический агент, буфер, покрывающий агент, подсластитель, растворитель, основание, диспергирующий агент, смачивающий агент, суспендирующее средство, стабилизатор, краситель и тому подобное.
Фармацевтическая композиция по настоящему изобретению содержит 0,01-95% мас. соединения вышеуказанной формулы (I) или его фармацевтически приемлемой соли в зависимости от его формы.
Конкретное дозирование настоящей фармацевтической композиции может варьироваться в зависимости от видов млекопитающих, включая человека, массы тела, пола, тяжести заболевания, решения врача и тому подобное. Предпочтительно, когда 0,01-50 мг активного ингредиента вводят на кг массы тела в день для перорального применения, а 0,01-10 мг активного ингредиента вводят на кг массы тела в день для парентерального применения. Общую суточную дозу можно вводить один или в несколько раз в зависимости от тяжести заболевания, решения врача и тому подобное.
В одном варианте осуществления настоящего изобретения соединение вышеуказанной формулы (I) или его фармацевтически приемлемую соль можно вводить в комбинации с одним или несколькими противораковыми средствами, выбранными из группы, состоящей из капецитабина, 5-фторурацила, тиогуанина, хлорамбуцила, оксалиплатина, цисплатина, карбоплатина, паклитаксела, доцетаксела, иринотекана, доксорубицина, винорелбина, гемцитабина, пеметрекседа, этопозида, винкристина, цитарабина, циклофосфамида, ифосфамида, тамоксифена, анастрозола, ретрозола, эксеместана, фулвестранта, темозоломида, камустина, ломустина, эпирубицина, эрибулина, торемифена, гозерелина, мегестрола, винбластина, бендамустина, тиотепа, блеомицина, топотекана, лейковорина, трифлуридина, типирацила, митомицина С, альдеслейкина, темсиролимуса, эверолимуса, митоксантрона, метотрексата, трастузумаба, бевацизумаба, цетуксимаба, афлиберцепта, пертузумаба, рамуцирумаба, панитумумаба, ниволумаба, нецитумумаба, пембролизумаба, обинутузумаба, офатумумаба, эрлотиниба, гефитиниба, сорафениба, лапатиниба, палбоциклиба, регорафениба, иматиниба, сунитиниба, акситиниба, пазопаниба, апатиниба, церитиниба, кризотиниба, осимертиниба, босутиниба, дазатиниба, нилотиниба, понатиниба, гидроксимочевина и прокарбазина, или одним или несколькими лекарственными средствами для лечения дегенеративного заболевания головного мозга, выбранными из группы, состоящей из леводопы, бромокриптина, ропинирола, прамипексола, ротиготина, тригексифенидила, бензтропина, проциклидина, энтакапона, селегилина, разагилина, амантадина, тетрабеназина, донепезила, ривастигмина, галантамина и мемантина, в частности, темозоломида, для улучшения лечения. Конкретное дозирование и время введения можно варьировать в зависимости от комбинированного лекарственного средства.
[Полезные эффекты]
Соединение вышеуказанной формулы (I) по настоящему изобретению или его фармацевтически приемлемая соль может быть использовано в фармацевтической композиции для профилактики или лечения рака или дегенеративных заболеваний головного мозга и тому подобное, поскольку оно имеет эффект ингибирования активности CDK.
[Краткое описание фигур]
На фиг.1 показаны изменения в клеточном цикле, вызванные соединением по настоящему изобретению в раковой клетке и нормальной клетке.
Фиг.2 представляет собой график, показывающий ингибирующее действие на рост опухоли соединения по настоящему изобретению на животной модели.
Фиг.3 представляет собой график, показывающий ингибирующее действие на рост опухоли соединения по настоящему изобретению в комбинации с обычным противораковым лекарственным средством на животной модели.
На фиг.4 показано ингибирующее действие соединения по настоящему изобретению на фосфорилирование Tau-белка.
На фиг.5 показано ингибирующее действие соединения по настоящему изобретению на фосфорилирование белка APP.
На фиг.6 показано ингибирующее действие соединения по настоящему изобретению на образование Aβ.
[Лучший вариант]
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не должны толковаться как ограничивающие объем изобретения.
Пример 1: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ола (VII)
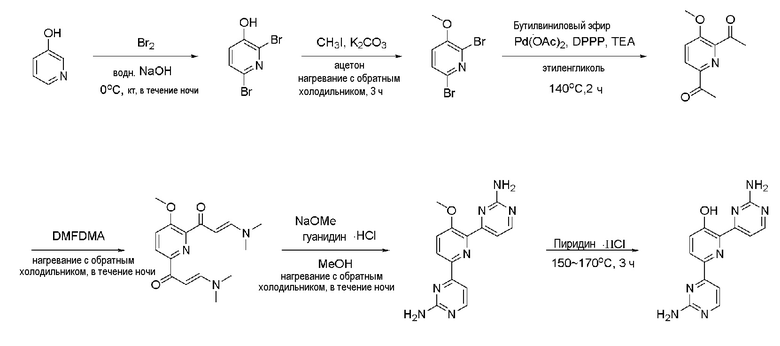
Пример 1-1: Получение 2,6-дибром-3-метоксипиридина (III)
Бром (1,62 мл, 63,09 ммоль) медленно добавляли по каплям к 25 мл 20% водного раствора гидроксида натрия (NaOH) при 0°С и смесь перемешивали при 0°С в течение 15 минут. Затем, 3-гидроксипиридин (I) (2,0 г, 21,03 ммоль), растворенный в 20% водном растворе гидроксида натрия (NaOH), медленно добавляли по каплям к этому при 0°С, и смесь перемешивали при 0°С в течение 2 часов и затем при комнатной температуре в течение 12 часов. Смесь фильтровали для удаления плавающего вещества и к полученному раствору медленно добавляли по каплям 2 н. хлористоводородную кислоту (HCl) для доведения значения рН до 1~2. Полученное твердое вещество фильтровали и сушили с получением белого твердого вещества. Твердое вещество растворяли в 60 мл ацетона и добавляли к этому по каплям карбонат калия (K2CO3) (2,64 г, 19,13 ммоль) и метанойодид (CH3I) (893,03 мкл, 14,34 ммоль) и раствор перемешивали при нагревании с обратным холодильником в течение 3 часов. Полученный раствор выпаривали при пониженном давлении до концентрата, разбавляли этилацетатом (EA) и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и затем выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=5/1) с получением указанного в заголовке соединения (1,04 г, 19%).
1H ЯМР (400 МГц, CDCl3) δ 7,38 (д, J=8,4 Гц, 1H), 7,04 (д, J=8,0 Гц, 1H), 3,91 (с, 3H).
Пример 1-2: Получение 1,1'-(3-метоксипиридин-2,6-диил)диэтанона (IV)
2,6-Дибром-3-метоксипиридин (III) (450 мг, 1,69 ммоль), ацетат палладия(II) (Pd(OAc)2) (15,14 мг, 67,44 мкмоль) и 1,3-бис(дифенилфосфино)пропан (DPPP) (55,63 мг, 134,87 мкмоль) растворяли в 3 мл этиленгликоля. К полученной реакционной смеси медленно добавляли по каплям бутилвиниловый эфир (1,09 мл, 8,43 ммоль) и триэтиламин (TEA) (704,94 мкл, 50,6 ммоль). Полученную смесь перемешивали при 125°С в течение 24 часов и охлаждали до комнатной температуры. К этому медленно добавляли по каплям 2 н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и смесь перемешивали в течение 30 мин и нейтрализовали. Полученный раствор разбавляли дихлорметаном и промывали водой. Затем, органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (120 мг, 37%).
1H ЯМР (400 МГц, CDCl3) δ 8,20 (д, J=8,8 Гц, 1H), 7,42 (д, J=8,8 Гц, 1H), 3,98 (с, 3H), 2,73 (с, 3H), 2,71 (с, 3H).
Пример 1-3: Получение 4,4'-(3-метоксипиридин-2,6-диил)бис(пиримидин-2-амин) (VI)
1,1'-(3-метоксипиридин-2,6-диил)диэтанон (IV) (80 мг, 414,08 мкмоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (831,6 мкл, 6,21 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Полученный раствор охлаждали и выпаривали, и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к этому добавляли по каплям 25% метоксид натрия (NaOMe) (757,4 мкл, 3,31 ммоль) и гидрохлорид гуанидина (118,67 мг, 1,24 ммоль). И затем полученную реакционную смесь перемешивали при нагревании с обратным холодильником в течение 24 часов и охлаждали. Полученный раствор разбавляли этилацетатом (EA), промывали водой и органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (65 мг, 53%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,37~8,32 (м, 3H), 7,75 (д, J=8,8 Гц, 1H), 7,36 (д, J=4,8 Гц, 1H), 6,84 (д, J=5,2 Гц, 1H), 6,73 (с, 2H), 6,69 (с, 2H), 3,87 (с, 3H).
Пример 1-4: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ола (VII)
4,4'-(3-метоксипиридин-2,6-диил)бис(пиримидин-2-амин) (VI) (15 мг, 50,80 мкмоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (58,70 мг, 507,96 мкмоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (6,4 мг, 45%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,52 (д, J=4,8 Гц, 1H), 8,37 (д, J=5,2 Гц, 1H), 8,32 (д, J=8,8 Гц, 1H), 7,69 (д, J=5,2 Гц 1H), 7,55 (д, J=4,8 Гц, 1H), 7,53 (д, J=8,4 Гц, 1H), 7,32 (с, 2H), 6,68 (с, 2H), 3,87 (с, 3H).
Пример 2: Получение 3,5-бис(2-аминопиримидин-4-ил)пиразин-2-ола (XIV)
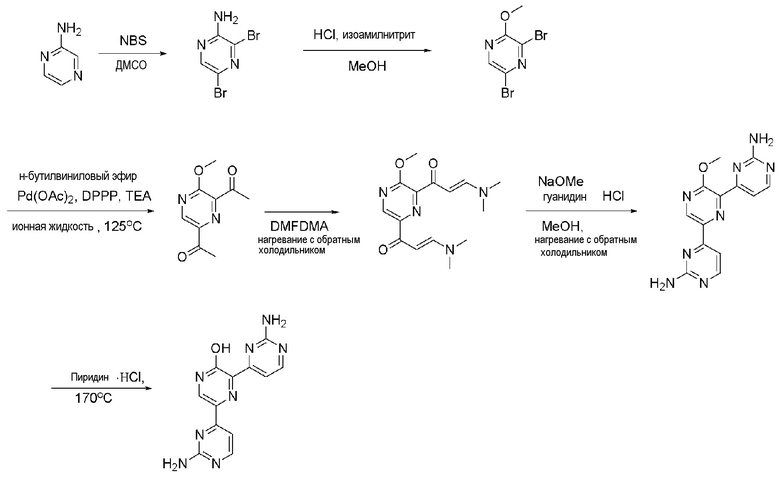
Пример 2-1: Получение 3,5-дибромпиразин-2-амина (IX)
Пиразин-2-амин (VIII) (1,91 г, 20,08 ммоль) растворяли в диметилсульфоксиде (ДМСО) (40 мл) и дистиллированной воде (1 мл). К полученному раствору медленно добавляли по каплям N-бромсукцинимид (NBS) (8,20 г, 46,07 ммоль) при 0°С и раствор перемешивали при комнатной температуре в течение 16 часов. К раствору добавляли лед и раствор перемешивали с получением желтого твердого вещества, которое фильтровали с получением указанного в заголовке соединения (3,40 мг, 67%).
1H ЯМР (400 МГц, CDCl3) δ 8,04 (с, 1H), 5,05 (ушир, 2H).
Пример 2-2: Получение 3,5-дибром-2-метоксипиразина (X)
3,5-Дибромпиразин-2-амин (IX) (1,0 г, 4,0 ммоль) растворяли в метаноле (MeOH) (10 мл), и 2,5M раствора HCl/MeOH (0,32 мл, 0,80 ммоль) и изоамилнитрит (1,5 мл, 12 ммоль) добавляли по каплям к полученному раствору и раствор перемешивали при нагревании с обратным холодильником в течение 2 часов. Реакционный раствор выпаривали и концентрировали при пониженном давлении, разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=5/1) с получением указанного в заголовке соединения (500 мг, 47%).
1H ЯМР (400 МГц, CDCl3) δ 8,14 (с, 1H), 4,04 (с, 3H).
Пример 2-3: Получение 1,1'-(3-метоксипиразин-2,6-диил)диэтанона (XI)
3,5-дибром-2-метоксипиразин (X) (600 мг, 2,24 ммоль), ацетат палладия(II) (Pd(OAc)2) (40,22 мг, 179,16 мкмоль) и 1,3-бис(дифенилфосфино)пропан (DPPP) (147,80 мг, 358,33 мкмоль) растворяли в 2,5 мл 1-бутил-3-метилимидазолия тетрафторбората ([bmim][BF4]). К полученному раствору медленно добавляли по каплям бутилвиниловый эфир (2,32 мл, 17,92 ммоль) и триэтиламин (TEA) (1,0 мл, 7,17 ммоль). Раствор перемешивали при 125°С в течение 24 часов и затем охлаждали до комнатной температуры. К раствору медленно добавляли по каплям 2н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и затем раствор перемешивали в течение 30 мин и нейтрализовали. Раствор разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (65 мг, 15%).
1H ЯМР (400 МГц, CDCl3) δ 8,98 (с, 1H), 4,15 (с, 3H), 2,73 (с, 3H), 2,70 (с, 3H).
Пример 2-4: Получение 4,4'-(3-метоксипиразин-2,6-диил)бис(пиримидин-2-амин) (XIII)
1,1'-(3-Метоксипиразин-2,6-диил)диэтанон (XI) (65 мг, 334,72 мкмоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (672,23 мкл, 5,02 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали и выпаривали при пониженном давлении до концентрата. Полученное желтое твердое вещество растворяли в метаноле (MeOH) (1 мл), и к раствору по каплям добавляли 25% метоксид натрия (NaOMe) (612,29 мкл, 2,68 ммоль) и гуанидин гидрохлорид (95,93 мг, 1,0 ммоль). И затем раствор перемешивали при нагревании с обратным холодильником в течение 24 часов и охлаждали. Раствор разбавляли этилацетатом (EA) и промывали водой, и органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (47 мг, 47%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,75 (с, 1H), 8,17 (д, J=5,2 Гц, 1H), 8,12 (д, J=5,6 Гц, 1H), 7,40 (д, J=5,2 Гц, 1H), 7,15 (д, J=5,2 Гц, 1H), 6,39 (с, 2H), 6,32 (с, 2H), 3,17 (с, 3H).
Пример 2-5: Получение 3,5-бис(2-аминопиримидин-4-ил)пиразин-2-ола (XIV)
4,4'-(3-Метоксипиразин-2,6-диил)бис(пиримидин-2-амин) (XIII) (47 мг, 158,62 мкмоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (11,3 мг, 40,03 мкмоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (7,6 мг, 17%).
1H ЯМР (400 МГц, CD3OD) δ 8,92 (с, 1H), 8,29 (д, J=5,2 Гц, 1H), 8,18 (д, J=5,6 Гц, 1H), 7,62 (д, J=4,8 Гц, 1H), 7,53 (д, J=5,6 Гц, 1H), 6,39 (с, 2H), 6,32 (с, 2H), 3,17 (с, 3H).
Пример 3: Получение 4,6-бис(2-аминопиримидин-4-ил)пиридин-3-ола (XXIII)
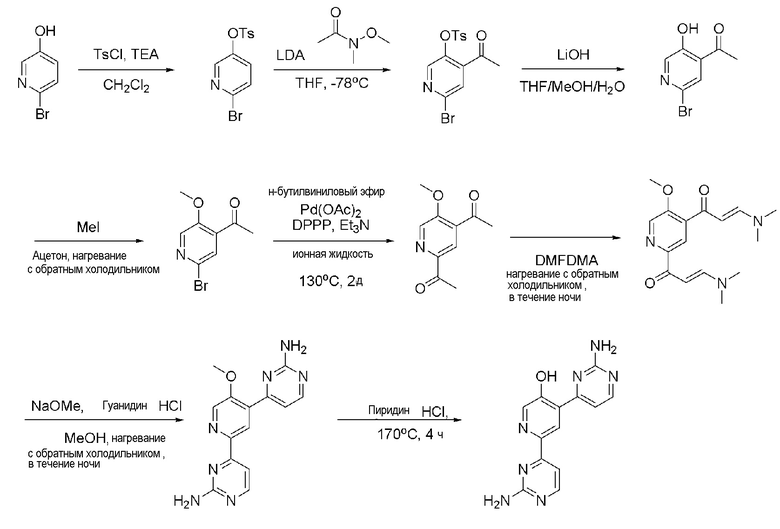
Пример 3-1: Получение 6-бром-пиридин-3-илового эфира толуол-4-сульфоновой кислоты (XVI)
6-Бромпиридин-3-ол (XV) (500 мг, 2,87 ммоль) растворяли в дихлорметане (3 мл). Затем, триэтиламин (TEA) (520 мкл, 3,74 ммоль) и 4-толуолсульфонил хлорид (TsCl) (657,41 мг, 3,45 ммоль) медленно добавляли по каплям к полученному раствору при 0°С и раствор перемешивали при комнатной температуре в течение 12 часов. Раствор разбавляли дихлорметаном, промывали водой и насыщенным гидрокарбонатом натрия (NaHCO3). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (980 мг, 100%).
1H ЯМР (400 МГц, CDCl3) δ 7,89 (д, J=3,2 Гц, 1H), 7,70 (д, J=8,0 Гц, 2H), 7,46 (д, J=8,8 Гц, 1H), 7,36-7,33 (м, 3H), 2,47 (с, 3H).
Пример 3-2: Получение 4-ацетил-6-бром-пиридин-3-илового эфира толуол-4-сульфоновой кислоты (XVII)
6-Бром-пиридин-3-иловый эфир толуол-4-сульфоновой кислоты (XVI) (980 мг, 2,99 ммоль) растворяли в тетрагидрофуране (THF) (3 мл) и полученный раствор охлаждали до -78°С. 2,0M Диизопропиламид лития (LDA) (2,24 мл, 4,48 ммоль), растворенного в тетрагидрофуране, медленно добавляли по каплям к раствору и раствор перемешивали при -78°С в течение 3 часов. И затем, N-метокси-N-метилацетамид (609,77 мкл, 5,97 ммоль) медленно добавляли по каплям к раствору и раствор перемешивали в течение 2 часов. К раствору добавляли по каплям насыщенный раствор гидрокарбоната натрия (NaHCO3) и раствор разбавляли этилацетатом (EA). Затем, органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=4/1) с получением указанного в заголовке соединения (570 мг, 52%).
1H ЯМР (400 МГц, CDCl3) δ 7,97 (с, 1H), 7,70 (д, J=8,0 Гц, 2H), 7,65 (с, 1H), 7,37 (д, J=8,0 Гц, 2H), 2,58 (с, 3H), 2,49 (с, 3H).
Пример 3-3: Получение 1-(2-бром-5-гидроксипиридин-4-ил)этанона (XVIII)
4-Ацетил-6-бром-пиридин-3-иловый эфир толуол-4-сульфоновой кислоты (XVII) (1,3 г, 3,51 ммоль) растворяли в смеси тетрагидрофурана (THF) (4 мл), метанола (MeOH) (4 мл) и воды (H2O) (2 мл). К полученному раствору добавляли по каплям гидроксид лития (LiOH) (294,68 мг, 7,02 ммоль) и раствор перемешивали при комнатной температуре в течение 12 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (620 мг, 82%).
1H ЯМР (400 МГц, CDCl3) δ 11,34 (с, 1H), 8,30 (с, 1H), 7,55 (с, 1H), 2,68 (с, 3H).
Пример 3-4: Получение 1-(2-бром-5-метоксипиридин-4-ил)этанона (XIX)
1-(2-Бром-5-гидроксипиридин-4-ил)этанон (XVIII) (365 мг, 1,69 ммоль) растворяли в 6 мл ацетона, и затем к этому добавляли по каплям карбонат калия (K2CO3) (373,63 мг, 2,70 ммоль) и иодметан (CH3I) (126,22 мкл, 2,03 ммоль). Полученный раствор перемешивали при нагревании с обратным холодильником в течение 3 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли этилацетатом (EA) и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=5/1) с получением указанного в заголовке соединения (381,0 мг, 98%).
1H ЯМР (400 МГц, CDCl3) δ 8,19 (с, 1H), 7,49 (с, 1H), 4,02 (с, 3H), 2,61 (с, 3H).
Пример 3-5: Получение 1,1'-(5-метоксипиридин-2,4-диил)диэтанона (XX)
1-(2-Бром-5-метоксипиридин-4-ил)этанон (XIX) (260 мг, 1,13 ммоль), ацетат палладия(II) (Pd(OAc)2) (10,15 мг, 45,20 мкмоль), и 1,3-бис(дифенилфосфино)пропан (DPPP) (37,29 мг, 90,41 мкмоль) растворяли в 1,0 мл 1-бутил-3-метилимидазолия тетрафторбората ([bmim][BF4]), и к этому медленно добавляли бутилвиниловый эфир (731,23 мкл, 5,65 ммоль) и триэтиламин (TEA) (252,03 мкл, 1,81 ммоль). Полученный раствор перемешивали при 125°С в течение 24 часов и затем охлаждали до комнатной температуры. К раствору медленно добавляли по каплям 2н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и раствор перемешивали в течение 30 мин и нейтрализовали. Раствор разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (54 мг, 25%).
1H ЯМР (400 МГц, CDCl3) δ 8,47 (с, 1H), 8,23 (с, 1H), 4,11 (с, 3H), 2,69 (с, 3H), 2,62 (с, 3H).
Пример 3-6: Получение 4,4'-(5-метоксипиридин-2,4-диил)бис(пиримидин-2-амин) (XXII)
1,1'-(5-метоксипиридин-2,4-диил)диэтанон (XX) (54 мг, 279,50 мкмоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (561,33 мкл, 4,19 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали и выпаривали и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к полученному раствору добавляли по каплям 25% метоксид натрия (NaOMe) (511,28 мкл, 2,24 ммоль) и гидрохлорид гуанидина (80,10 мг, 838,51 мкмоль). Затем раствор перемешивали при нагревании с обратным холодильником, охлаждали, разбавляли этилацетатом (EA) и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (23 мг, 28%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,56 (с, 1H), 8,52 (д, J=5,2 Гц, 1H), 8,46 (с, 1H), 8,36 (д, J=5,2 Гц, 1H), 7,37 (д, J=5,6 Гц, 1H), 7,30 (д, J=5,2 Гц, 1H), 6,72 (с, 2H), 6,66 (с, 2H), 4,03 (с, 3H).
Пример 3-7: Получение 4,6-бис(2-аминопиримидин-4-ил)пиридин-3-ола (XXIII)
4,4'-(5-метоксипиридин-2,4-диил)бис(пиримидин-2-амин) (XXII) (23 мг, 778,87 мкмоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (90 мг, 7,79 ммоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (9,8 мг, 45%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,71 (с, 1H), 8,53 (д, J=5,2 Гц, 1H), 8,42 (с, 1H), 8,34 (д, J=5,2 Гц, 1H), 7,39 (д, J=5,6 Гц, 1H), 7,33 (с, 2H), 7,30 (д, J=5,2 Гц, 1H), 6,66 (с, 2H).
Пример 4: Получение 2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ола (XXVIII)
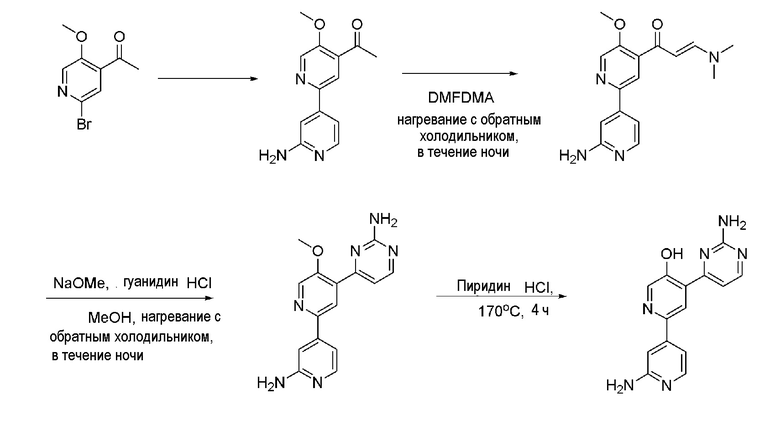
Пример 4-1: Получение 1-(2'-амино-5-метокси-[2,4']бипиридинил-4-ил)-этанона (XXV)
1-(2-Бром-5-метоксипиридин-4-ил)этанон (XIX) (1 г, 4,34 ммоль), полученный в примере 3-4, и [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-ил]-карбаминовая кислота- трет-бутиловый эфир (1,16 г, 3,62 ммоль) растворяли в растворе диметиловый эфир этиленгликоля/дистиллированная вода (10 мл/2 мл). К полученному раствору добавляли карбонат натрия (1,15 г, 10,86 ммоль) и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (125,6 мг, 0,109 ммоль) и раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением коричневого указанного в заголовке соединения (317,2 мг, 30,0%).
1H ЯМР (400 МГц, CDCl3) δ 8,55 (с, 1H), 8,43 (с, 1H), 7,85 (д, J=8,0 Гц, 1H), 7,80 (дд, J=8,0, 7,6 Гц, 1H), 7,34 (д, J=7,6 Гц, 1H), 4,10 (с, 3H), 2,70 (с, 3H).
Пример 4-2: Получение 4-(2-амино-пиримидин-4-ил)-5-метокси[2,4']бипиридинил-2'-иламина (XXVII)
1-(2'-амино-5-метокси-[2,4']бипиридинил-4-ил)-этанон (XXV) (317 мг, 1,303 ммоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (1,7 мл, 13,03 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Реакционный раствор охлаждали и выпаривали и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к полученному раствору добавляли 25% метоксид натрия (NaOMe) (186 мкл, 5,212 ммоль) и гидрохлорид гуанидина (498,0 мг, 5,212 ммоль). И затем раствор перемешивали при нагревании с обратным холодильником в течение 24 часов и охлаждали. Раствор разбавляли этилацетатом (EA) и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (111,2 мг, 29%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,70 (с, 1H), 8,53 (д, J=5,4 Гц, 1H), 8,42 (с, 1H), 8,34 (д, J=5,4 Гц, 1H), 7,51 (с, 1H), 7,39 (д, J=5,6 Гц, 1H), 7,32 (с, 2H), 7,30 (д, J=5,2 Гц, 1H), 6,63 (с, 2H).
Пример 4-3: Получение 2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ола (XXVIII)
4-(2-амино-пиримидин-4-ил)-5-метокси[2,4']бипиридинил-2'-иламин (XXVII) (30 мг, 0,102 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (100 мг, 1,019 ммоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Затем органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и затем выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (12,8 мг, 45%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,71 (с, 1H), 8,51 (д, J=5,2 Гц, 1H), 8,37 (с, 1H), 8,30 (д, J=5,2 Гц, 1H), 7,39 (д, J=5,6 Гц, 1H), 7,29 (с, 1H), 7,33 (с, 2H), 7,30 (д, J=5,2 Гц, 1H), 6,66 (с, 2H).
Пример 5: Получение 2'-амино-2-(2-аминопиридин-4-ил)-[4,4'-бипиримидин]-5-ола (XXXIV)
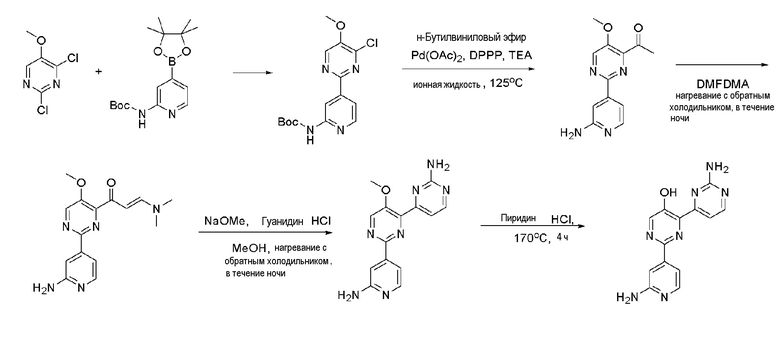
Пример 5-1: Получение [4-(4-хлор-5-метокси-пиримидин-2-ил)-пиридин-2-ил]-карбаминовой кислоты-трет-бутилового эфира (XXX)
2,4-Дихлор-5-метоксипиримидин (XXIX) (800 мг, 4,34 ммоль) и [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-ил]-карбаминовую кислоту-трет-бутиловый эфир (XXIV) (1,16 г, 3,62 ммоль) растворяли в растворе диметиловый эфир этиленгликоля/дистиллированная вода (10 мл/2 мл). Карбонат натрия (1,15 г, 10,86 ммоль) и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (125,6 мг, 0,109 ммоль) добавляли к полученному раствору и затем раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением коричневого указанного в заголовке соединения (302,1 мг, 28,0%).
1H ЯМР (400 МГц, CDCl3) δ 8,43 (с, 1H), 8,01 (с, 1H), 7,89 (д, J=8,0 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 3,99 (с, 3H), 1,48 (с, 9H).
Пример 5-2: Получение 1-[2-(2-амино-пиридин-4-ил)-5-метокси-пиримидин-4-ил]-этанона (XXXI)
[4-(4-хлор-5-метокси-пиримидин-2-ил)-пиридин-2-ил]-карбаминовая кислота-трет-бутиловый эфир (XXX) (200 мг, 1,13 ммоль), ацетат палладия(II) (Pd(OAc)2) (10,15 мг, 45,20 мкмоль) и 1,3-бис(дифенилфосфино)пропан (DPPP) (37,29 мг, 90,41 мкмоль) растворяли в 1,0 мл 1-бутил-3-метилимидазолия тетрафторбората ([bmim][BF4]). К полученному раствору медленно добавляли по каплям бутилвиниловый эфир (731,23 мкл, 5,65 ммоль) и триэтиламин (TEA) (252,03 мкл, 1,81 ммоль). Полученную смесь перемешивали при 125°С в течение 24 часов и затем охлаждали до комнатной температуры. К смеси медленно добавляли по каплям 2 н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и смесь перемешивали в течение 30 мин и нейтрализовали. Полученный раствор разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и затем выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (50 мг, 21%).
1H ЯМР (400 МГц, CDCl3) δ 8,42 (с, 1H), 8,03 (с, 1H), 7,89 (д, J=8,0 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 3,99 (с, 3H), 1,72 (с, 3H)
Пример 5-3: Получение 2'-(2-амино-пиридин-4-ил)-5'-метокси-[4,4']бипиримидинил-2-иламина (XXXIII)
1-[2-(2-амино-пиридин-4-ил)-5-метокси-пиримидин-4-ил]-этанон (XXXI) (200 мг, 1,404 ммоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (1,7 мл, 14,03 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали и выпаривали и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к полученному раствору по каплям добавляли 25% метоксид натрия (NaOMe) (186 мкл, 6,212 ммоль) и гидрохлорид гуанидина (498,0 мг, 6,212 ммоль). И затем раствор перемешивали при нагревании с обратным холодильником в течение 24 часов, охлаждали, разбавляли этилацетатом (EA) и промывали водой. Затем органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и затем выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (98,3 мг, 19%).
1H ЯМР (600 МГц, ДМСО-d6) δ 9,90 (с, NH), 8,63 (с, 1H), 8,63 (д, J=5,4 Гц, 1H), 8,36 (д, J=4,8 Гц, 1H), 7,82 (с, 1H), 7,56 (д, J=5,4 Гц, 1H), 7,43 (д, J=4,8 Гц, 1H), 6,68 (с, NH2), 3,98 (с, 3H).
Пример 5-4: Получение 2'-амино-2-(2-аминопиридин-4-ил)-[4,4'-бипиримидин]-5-ола (XXXIV)
2'-(2-Амино-пиридин-4-ил)-5'-метокси-[4,4']бипиримидинил-2-иламин (XXXIII) (30 мг, 0,111 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (114 мг, 1,011 ммоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (15,8 мг, 48%).
1H ЯМР (600 МГц, CD3OD) δ 14,88 (с, OH), 8,69 (с, 1H), 8,34 (с, 1H), 8,32 (д, J=4,8 Гц, 1H), 7,70 (дд, J=8,4, 7,8 Гц, 1H), 7,39 (д, J=4,8 Гц, 1H), 7,30 (д, J=7,8 Гц, 1H), 6,81 (с, NH2), 6,65 (с, NHJ2), 6,61 (д, J=8,4 Гц, 1H).
Пример 6: Получение 3,5-бис(2-аминопиримидин-4-ил)пиридин-2-ола (XXXXII)
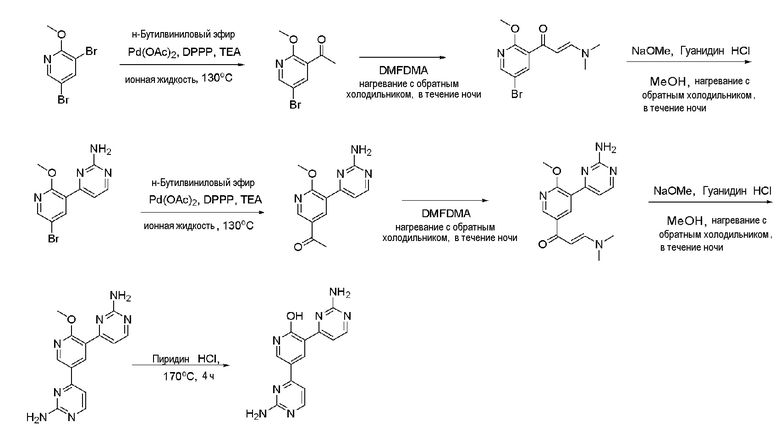
Пример 6-1: Получение 1-(5-бром-2-метокси-пиридин-3-ил)-этанона (XXXVI)
3,5-Бром-2-метоксипиридин (XXXV) (100 мг, 1,13 ммоль), ацетат палладия(II) (Pd(OAc)2) (5,03 мг, 25,04 мкмоль) и 1,3-бис(дифенилфосфино)пропан (DPPP) (14,4 мг, 45,3 мкмоль) растворяли в 1,0 мл 1-бутил-3-метилимидазолия тетрафторбората ([bmim][BF4]), и бутилвиниловый эфир (345 мкл, 2,56 ммоль) и триэтиламин (TEA) (125,03 мкл, 0,192 ммоль) медленно добавляли по каплям к полученному раствору. Полученную смесь перемешивали при 130°С в течение 24 часов и охлаждали до комнатной температуры. К смеси медленно добавляли по каплям 2н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и смесь перемешивали в течение 30 мин и нейтрализовали. Полученный раствор разбавляли дихлорметаном, промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (53 мг, 41%).
1H ЯМР (400 МГц, CDCl3) δ 7,85 (с, 1H), 7,06 (с, 1H), 3,89 (с, 3H), 2,48 (с, 3H).
Пример 6-2: Получение 4-(5-бром-2-метокси-пиридин-3-ил)-пиримидин-2-иламина (XXXVIII)
1-(5-бром-2-метокси-пиридин-3-ил)этанон (XXXVI) (200 мг, 1,404 ммоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (1,7 мл, 14,03 ммоль), и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали и выпаривали и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к полученному раствору по каплям добавляли 25% метоксид натрия (NaOMe) (186 мкл, 6,212 ммоль) и гидрохлорид гуанидина (498,0 мг, 6,212 ммоль). И затем раствор перемешивали при нагревании с обратным холодильником в течение 24 часов и охлаждали. Раствор разбавляли этилацетатом (EA) и промывали водой, и органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (20,3 мг, 55%).
1H ЯМР (400 МГц, CDCl3) δ 8,50 (с, 1H), 8,43 (с, 1H), 7,85 (д, J=8,0 Гц, 1H), 7,35 (д, J=7,6 Гц, 1H), 4,07 (с, 3H).
Пример 6-3: Получение 1-[5-(2-амино-пиримидин-4-ил)-6-метокси-пиридин-3-ил]-этанона (XXXIX)
4-(5-Бром-2-метокси-пиридин-3-ил)-пиримидин-2-иламин (XXXVIII) (200 мг, 2,22 ммоль), ацетат палладия(II) (Pd(OAc)2) (10,1 мг, 50,22 мкмоль) и 1,3-бис(дифенилфосфино)пропан (DPPP) (28,33 мг, 90,5 мкмоль) растворяли в 1,0 мл 1-бутил-3-метилимидазолия тетрафторбората ([bmim][BF4]). К полученному раствору медленно добавляли по каплям бутилвиниловый эфир (801 мкл, 5,02 ммоль) и триэтиламин (TEA) (250,4 мкл, 0,383 ммоль). Полученную смесь перемешивали при 125°С в течение 24 часов и затем охлаждали до комнатной температуры. К смеси медленно добавляли по каплям 2н хлористоводородную кислоту (HCl) для доведения значения рН до 1~2 и смесь перемешивали в течение 30 мин и нейтрализовали. Полученный раствор разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (н-гексан/EA=3/1) с получением указанного в заголовке соединения (101 мг, 70,2%).
1H ЯМР (400 МГц, CDCl3) δ 8,51 (с, 1H), 8,43 (с, 1H), 7,86 (д, J=8,0 Гц, 1H), 7,35 (д, J=7,6 Гц, 1H), 3,90 (с, 3H) 2,12 (с, 3H).
Пример 6-4: Получение 4,4'-(2-метоксипиридин-3,5-диил)бис(пиримидин-2-амин) (XXXXI)
1-[5-(2-амино-пиримидин-4-ил)-6-метокси-пиридин-3-ил]-этанон (XXXIX) (100 мг, 0,712 ммоль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (0,8 мл, 7,03 ммоль) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали и выпаривали и концентрировали при пониженном давлении с получением желтого твердого вещества. Твердое вещество растворяли в метаноле (MeOH) (1 мл) и к полученному раствору добавляли по каплям 25% метоксид натрия (NaOMe) (98 мкл, 3,111 ммоль) и гидрохлорид гуанидина (249,2 мг, 3,111 ммоль). И затем раствор перемешивали при нагревании с обратным холодильником в течение 24 часов и охлаждали. Раствор разбавляли этилацетатом (EA) и промывали водой, и органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (80 мг, 54%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,35~8,30 (м, 3H), 7,75 (д, J=8,2 Гц, 1H), 7,36 (д, J=4,8 Гц, 1H), 6,84 (д, J=5,2 Гц, 1H), 6,73 (с, 2H), 6,69 (с, 2H), 4,07 (с, 3H).
Пример 6-5: Получение 3,5-бис(2-аминопиримидин-4-ил)пиридин-2-ола (XXXXII)
4,4'-(2-метоксипиридин-3,5-диил)бис(пиримидин-2-амин) (XXXXI) (80 мг, 0,333 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (328 мг, 3,332 ммоль) и смесь перемешивали при 170°С в течение 4 часов. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали, и выпаривали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (43,3 мг, 32%).
1H ЯМР (400 МГц, ДМСО-d6) δ 8,60 (д, J=4,8 Гц, 1H), 8,33 (с, 1H), 8,32 (д, J=8,8 Гц, 1H), 7,69 (с, 1H), 7,55 (д, J=4,8 Гц, 1H), 7,50 (д, J=8,4 Гц, 1H), 7,30 (с, 2H), 6,66 (с, 2H), 3,88 (с, 3H).
Пример 7: Получение 6'-амино-6-(2-аминопиримидин-4-ил)-[2,2'-бипиридин]-3-ола (LV)
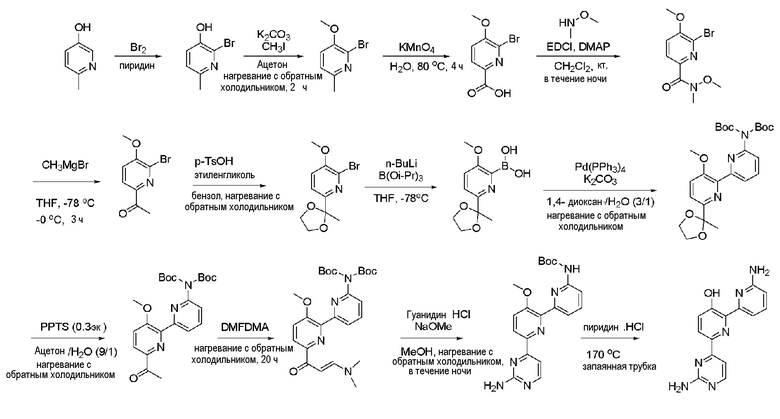
Пример 7-1: Получение 2-бром-6-метилпиридин-3-ола (XXXXIV)
5-гидрокси-2-метилпиридин (XXXXIII) (1,0 г, 9,16 ммоль) растворяли в 30 мл пиридина. К полученному раствору медленно добавляли бром (879 мг, 5,50 ммоль) при 0°С и раствор перемешивали при комнатной температуре в течение 16 часов. После удаления пиридина раствор экстрагировали 60 мл этилацетата (EA) и 60 мл воды. Органический слой обрабатывали сульфатом магния (MgSO4), фильтровали и концентрировали для следующей реакции.
Пример 7-2: Получение 2-бром-3-метокси-6-метилпиридина (XXXXV)
К 2-бром-6-метилпиридин-3-олу (XXXXIV) добавляли 50 мл ацетона, карбонат калия (K2CO3) (2,0 г, 14,66 ммоль) и иодметан (684 мкл, 10,99 ммоль), и полученную смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. После проведения ТСХ растворитель удаляли и смесь экстрагировали 60 мл этилацетата (EA) и 60 мл воды. Органический слой обрабатывали сульфатом магния (MgSO4) и фильтровали, и раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=10:1, об/об) с получением указанного в заголовке соединения в виде бледно-желтых кристаллов (772 мг, 3,82 ммоль, 42%).
1H ЯМР (400 МГц, CDCl3) δ 7,06 (с, 2H), 3,89 (с, 3H), 2,48 (с, 3H).
Пример 7-3: Получение 6-бром-5-метоксипиколиновой кислоты (XXXXVI)
2-бром-3-метокси-6-метилпиридин (XXXXV) 760 мг (3,76 ммоль) растворяли в 15 мл воды, и к полученному раствору добавляли перманганат калия (KMnO4) (1,49 г, 9,40 ммоль) и смесь нагревали при 80°С в течение 3 часов. После проведения ТСХ значение рН доводили до 4 с помощью 10% соляной кислоты (HCl) и фильтровали с помощью целита. Фильтрат экстрагировали 50 мл этилацетата (EA). Органический слой обрабатывали сульфатом магния (MgSO4) и фильтровали, и раствор концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (665 мг, 2,87 ммоль, 75%) без очистки.
1H ЯМР (400 МГц, ДМСО-d6) δ 13,22 (с, OH), 8,05 (д, J=8,0 Гц, 1H), 7,60 (д, J=8,0 Гц, 1H), 4,02 (с, 3H).
Пример 7-4: Получение 6-бром-N,5-диметокси-N-метилпиколинамида (XXXXVII)
6-бром-5-метоксипиколиновую кислоту (XXXXVI) (665 мг, 2,87 ммоль) растворяли в 10 мл дихлорметана. N,O-Диметилгидроксиамин гидрохлорид (336 мг, 3,44 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCI) (659 мг, 3,44 ммоль), 4-диметиламинопиридин (DMAP) (105 мг, 0,86 ммоль) и триэтиламин (TEA) (479 мкл, 3,44 ммоль) добавляли к полученному раствору и раствор перемешивали при комнатной температуре в течение 16 часов. Затем раствор экстрагировали 30 мл дихлорметана и 30 мл воды. Органический слой обрабатывали сульфатом магния (MgSO4) и фильтровали, и раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=3:1, об/об) с получением указанного в заголовке соединения в виде бесцветных кристаллов (515 мг, 1,87 ммоль, 65%).
1H ЯМР (400 МГц, CDCl3) δ 7,70 (д, J=8,4 Гц, 1H), 7,17 (д, J=8,4 Гц, 1H), 3,93 (с, 3H), 3,81 (с, 3H), 3,36 (с, 3H).
Пример 7-5: Получение 1-(6-бром-5-метоксипиридин-2-ил)этанона (XXXXVIII)
6-бром-N,5-диметокси-N-метилпиколинамид (XXXXVII) (2,29 г, 8,32 ммоль) растворяли в 30 мл тетрагидрофурана (THF) и полученный раствор охлаждали до -78°С. К раствору медленно добавляли метилмагний бромид (1,4M) (7,73 мл, 10,82 ммоль) и раствор перемешивали при 0°С в течение 1 часа. К раствору добавляли 60 мл насыщенного раствора хлорида аммония (насыщ.NH4Cl) и раствор экстрагировали 60 мл этилацетата (EA). Органический слой обрабатывали сульфатом магния (MgSO4), и фильтровали, и раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=3:1, об/об) с получением указанного в заголовке соединения в виде белого твердого вещества (1,88 г, 8,17 ммоль, 98%).
1H ЯМР (400 МГц, CDCl3) δ 8,03 (д, J=8,4 Гц, 1H), 7,18 (д, J=8,4 Гц, 1H), 3,97 (с, 3H), 2,66 (с, 3H).
Пример 7-6: Получение 2-бром-3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридина (XXXXIX)
1-(6-бром-5-метоксипиридин-2-ил)этанон (XXXXVIII) (3,22 г, 14,00 ммоль) растворяли в 30 мл бензола. К полученному раствору добавляли 3,9 мл этиленгликоля и п-толуолсульфоновой кислоты 3,9 (p-TsOH) (799 мг, 4,20 ммоль) и раствор перемешивали при нагревании с обратным холодильником в течение 40 часов. По окончании реакции растворитель концентрировали при пониженном давлении и экстрагировали 60 мл воды и 60 мл этилацетата. Органический слой обрабатывали сульфатом магния (MgSO4), и фильтровали, и раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=10:1, об/об) с получением указанного в заголовке соединения в виде белого твердого вещества (2,18 г, 7,95 ммоль, 57%).
1H ЯМР (400 МГц, CDCl3) δ 7,46 (д, J=8,0 Гц, 1H), 7,10 (д, J=8,0 Гц, 1H), 4,06-4,10 (м, 2H), 3,92 (с, 3H), 3,86-3,92 (м, 2H), 1,72 (с, 3H).
Пример 7-7: Получение (3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридин-2-ил)бороновой кислоты (L)
2-бром-3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридин (XXXXIX) (300 мг, 1,09 ммоль), полученный на стадии 6, растворяли в 10 мл тетрагидрофурана и полученный раствор охлаждали до -78°С. К раствору добавляли н-бутиллитий (n-BuLi) (820 мкл, 1,31 ммоль) и раствор перемешивали при той же температуре в течение 90 мин. Триизопропил борат (0,302 мл, 2,18 ммоль) добавляли к раствору и раствор перемешивали при той же температуре в течение 5 мин, а затем при комнатной температуре в течение 90 мин. После охлаждения до 0°С к раствору добавляли 5% гидроксид натрия (NaOH) и раствор перемешивали в течение 10 мин и экстрагировали небольшим количеством воды. После удаления органического слоя, водный слой нейтрализовали 2 н соляной кислотой (HCl) до рН 7 и использовали на следующей стадии.
Пример 7-8: Получение трет-бутил-(3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридин-2-ил)-[2,2'-пиридин]-6-ил)карбамата (LI)
К раствору (3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридин-2-ил)бороновой кислоты (L) (1,09 ммоль) добавляли 2-(6-хлор-2-пиридинил)-1,3-бис(1,1-диметилэтил)сложный эфир имидодикарбоновой кислоты (358 мг, 1,09 ммоль), тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (63 мг, 0,05 ммоль), и карбонат калия (K2CO3) (1,0 г, 7,30 ммоль). Затем полученную смесь нагревали с обратным холодильником вместе с 1,4-диоксаном в течение 3 часов. По окончании реакции раствор экстрагировали 50 мл воды и 50 мл этилацетата. Органический слой обрабатывали сульфатом магния (MgSO4), и фильтровали, и раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=1:1, об/об) с получением указанного в заголовке соединения в виде белого твердого вещества (120 мг, 0,25 ммоль, 23%).
1H ЯМР (400 МГц, CDCl3) δ 8,42 (с, 1H), 8,03 (с, 1H), 7,89 (д, J=8,0 Гц, 1H), 7,77 (дд, J=8,0, 8,0 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 4,02-4,10 (м, 2H), 3,99 (с, 3H), 3,80-3,95 (м, 2H), 1,72 (с, 3H) 1,48 (с, 18H).
Пример 7-9: Получение (6'-ацетил-3'метокси-[2,2']бипиридинил-6-ил)-имидокарбоновой кислоты-1,3-бис(1,1-диметилэтил)сложного эфира (LII)
Трет-бутил-(3-метокси-6-(2-метил-1,3-диоксолан-2-ил)пиридин-2-ил)-[2,2'-пиридин]-6-ил)карбамат (LI) (82 мг, 0,17 ммоль) растворяли в 3 мл ацетона и 330 мкл воды. К полученному раствору добавляли п-толуолсульфонат пиридиния (PPTS) (13 мг, 0,05 ммоль) и раствор нагревали с обратным холодильником в течение 20 часов. Раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=3:1, об/об) с получением указанного в заголовке соединения в виде белого твердого вещества (55 мг, 0,12 ммоль, 73%).
1H ЯМР (400 МГц, CDCl3) δ 8,56 (с, 1H), 8,44 (с, 1H), 7,85 (д, J=8,0 Гц, 1H), 7,79 (дд, J=8,0, 7,6 Гц, 1H), 7,35 (д, J=7,6 Гц, 1H), 4,08 (с, 3H), 2,70 (с, 3H), 1,50 (с, 18H).
Пример 7-10: Получение [6'-(3-диметиламино-акрилоил)-3'-метокси-[2,2']бипиридинил-6-ил-имидокарбоновой кислоты -1,3-бис(1,1-диметилэтил)сложного эфира (LIII)
(6'-ацетил-3'метокси-[2,2']бипиридинил-6-ил)-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (LII) (55 мг, 0,12 ммоль) добавляли к 3 мл диметилацеталя N,N-диметилформамида (DMFDMA) и полученную смесь перемешивали при нагревании с обратным холодильником в течение 20 часов. Затем смесь экстрагировали 30 мл воды и 30 мл этилацетата. Органический слой дважды промывали насыщенным солевым раствором. Органический слой обрабатывали сульфатом магния (MgSO4) и фильтровали, и полученный раствор концентрировали и очищали с помощью колоночной хроматографии на силикагеле (нормальный гексан:этилацетат=1:1, об/об) с получением указанного в заголовке соединения в виде твердого вещества (38 мг, 0,08 ммоль, 67%).
1H ЯМР (400 МГц, CD3OD) δ 8,60 (с, 1H), 8,40 (с, 1H), 7,87 (д, J=12,0 Гц, 1H), 7,72-7,82 (м, 2H), 7,20-7,32 (м, 1H), 6,41 (д, J=12,0 Гц, 1H), 4,08 (с, 3H), 3,16 (brs, 3H), 2,99 (brs, 3H), 1,47 (с, 18H).
Пример 7-11: Получение трет-бутил-(6'-(2-амино-пиримидин-4-ил)-3'-метокси-[2,2'-бипиридин]-6-ил)карбамата (LIV)
[6'-(3-диметиламино-акрилоил)-3'-метокси-[2,2']бипиридинил-6-ил-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (LIII) (38 мг, 0,08 ммоль) растворяли в 3 мл метанола, и гуанидин гидрохлорид (7,6 мг, 0,08 ммоль) и 25% метоксид натрия (NaOMe) (18 мкл, 0,08 ммоль) добавляли к полученному раствору и раствор перемешивали при нагревании с обратным холодильником в течение 20 часов. По окончании реакции растворитель концентрировали при пониженном давлении. Затем добавляли небольшое количество воды и полученный раствор подкисляли 4М хлористоводородной кислотой (HCl) до значения рН 4. Полученное твердое вещество фильтровали, получая указанное в заголовке соединение в виде твердого вещества (22 мг, 0,06 ммоль, 70%) без колоночной хроматографии с силикагелем.
1H ЯМР (600 МГц, ДМСО-d6) δ 9,89 (с, NH), 8,64 (с, 1H), 8,63 (д, J=5,4 Гц, 1H), 8,36 (д, J=4,2 Гц, 1H), 7,84 (дд, J=5,4, 5,4 Гц, 1H), 7,82 (с, 1H), 7,56 (д, J=5,4 Гц, 1H), 7,44 (д, J=4,2 Гц, 1H), 6,66 (с, NH2), 4,04 (с, 3H).
Пример 7-12: Получение 6'-амино-6-(2-аминопиримидин-4-ил)-[2,2'-бипиридин]-3-ола (LV)
Трет-бутил-(6'-(2-амино-пиримидин-4-ил)-3'-метокси-[2,2'-бипиридин]-6-ил)карбамат (LIV) (22 мг, 0,06 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (104 мг, 0,90 ммоль) в запаянной трубке при 170°С в течение 30 минут. Добавляли 2 н гидроксида натрия (NaOH) для нейтрализации полученной смеси до рН 7 и затем смесь экстрагировали 30 мл воды и 30 мл этилацетата. Органический слой обрабатывали сульфатом магния (MgSO4), и фильтровали, и полученный раствор концентрировали с получением указанного в заголовке соединения в виде желтого твердого вещества (6,7 мг, 0,02 ммоль, 33%) без колоночной хроматографии с силикагелем.
1H ЯМР (600 МГц, CD3OD) δ 14,88 (с, OH), 8,69 (с, 1H), 8,34 (с, 1H), 8,32 (д, J=4,8 Гц, 1H), 7,70 (дд, J=8,4, 7,8 Гц, 1H), 7,39 (д, J=4,8 Гц, 1H), 7,30 (д, J=7,8 Гц, 1H), 6,81 (с, NH2), 6,65 (с, NHJ2), 6,61 (д, J=8,4 Гц, 1H).
Пример получения 1: Получение 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновой кислоты-1,3-бис(1,1-диметилэтил)сложного эфира
Пример получения 1-1: Получение 4-хлор-3-фторпиридина
4-Хлор-3-фторпиридин гидрохлорид (50 г, 0,298 моль) растворяли в дистиллированной воде (200 мл) и 2 н водный раствор гидроксида натрия (NaOH) добавляли по каплям для подщелачивания полученного раствора (pH=14). Затем раствор экстрагировали диэтиловым эфиром, сушили над сульфатом магния (MgSO4) и концентрировали при пониженном давлении для использования в следующей реакции без выделения.
Пример получения 1-2: Получение 4-хлор-3-фтор-пиридин-2-карбоновой кислоты
2,2,6,6,-Тетраметилпиперидин (430 мл, 0,357 моль) добавляли по каплям к тетрагидрофурану (THF) (74 мл) при -78°С, и затем к этому добавляли по каплям 1,6 М раствор н-бутиллитий гексана (220 мл, 0,357 моль) и полученную смесь перемешивали в течение 30 мин. К смеси медленно добавляли по каплям раствор диэтилового эфира 4-хлор-3-фторпиридина, полученный в примере получения 1-1, и полученный раствор перемешивали при -78°С в течение 1 часа. Газообразный диоксид углерода пропускали через раствор при -78°С в течение 1 часа, раствор нагревали до комнатной температуры и затем перемешивали в течение 1 часа. После завершения реакции добавлением воды органический слой отделяли диэтиловым эфиром и водный слой подкисляли до значения рН 2, используя 2 н водный раствор соляной кислоты. И затем раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток перекристаллизовывали гексаном/этилацетатом (1/1) с получением белого указанного в заголовке соединения (13,06 г, 25,0%).
1H ЯМР (400 МГц, ДМСО) δ 8,47 (д, J=3,6 Гц, 1H), 7,95 (м, 1H).
Пример получения 1-3: Получение (4-хлор-3-фтор-пиридин-2-ил)-карбаминовой кислоты-трет-бутилового эфира
4-хлор-3-фтор-пиридин-2-карбоновую кислоту (13,06 г, 0,074 моль) растворяли в трет-бутаноле (370 мл) и температуру снижали до 0°С. К полученному раствору добавляли по каплям триэтиламин (15,56 мл, 0,112 моль). И затем, раствор перемешивали при комнатной температуре в течение 40 минут и температуру реакции понижали до 0°С. Дифенилфосфорилазид (DPPA) (24,09 мл, 0,112 моль) добавляли по каплям к раствору и раствор перемешивали при комнатной температуре в течение 1,5 часов и затем при нагревании с обратным холодильником в течение 18 часов. После завершения реакции раствор экстрагировали этилацетатом, промывали дистиллированной водой и затем сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=2/1) с получением коричневого указанного в заголовке соединения (5,51 г, 30,0%).
1H ЯМР (600 МГц, CDCl3) δ 9,76 (с, NH), 8,15 (д, J=6,0 Гц, 1H), 7,51 (м, 1H).
Пример получения 1-4: Получение 2-(3-фтор-4-хлорпиридинил)-имидокарбоновой кислоты-1,3-бис(1,1-диметилэтил)сложного эфира
(4-Хлор-3-фтор-пиридин-2-ил)-карбаминовую кислоту-трет-бутиловый эфир (5,51 г 0,022 моль) растворяли в ацетонитриле (110 мл), и ди-трет-бутил дикарбонат ((Boc)2O) (7,31 г, 0,033 моль), карбонат калия (K2CO3) (9,62 г, 0,67 моль) и 4-диметиламинопиридин (820 мг, 0,007 моль) добавляли к полученному раствору. Раствор перемешивали при комнатной температуре в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=3/1) с получением коричневого указанного в заголовке соединения (7,36 г, 95,0%).
1H ЯМР (600 МГц, CDCl3) δ 8,22 (д, J=4,2 Гц, 1H), 7,51 (м, 1H), 1,43 (м, 18H).
Пример получения 1-5: Получение 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложного эфира
2-(3-фтор-4-хлорпиридинил)-имидокарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (7,36 г, 0,021 моль) растворяли в 1,4-диоксане (20 мл) и бис(пинаколато)диборон (10,78 г, 0,042 моль), трис(дибензилиденацетон)дипалладий(0) (970 мг, 1,0 ммоль), трициклогексилфосфин (450 мг, 1,60 ммоль) и ацетат калия (8,33 г, 0,085 моль) добавляли к полученному раствору. Раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции твердое вещество удаляли через фильтр целита и растворитель сушили при пониженном давлении. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол=10/1) с получением коричневого указанного в заголовке соединения (2,05 г, 22,0%).
1H ЯМР (600 МГц, CDCl3) δ 8,28 (д, J=7,2 Гц, 1H), 7,58 (м, 1H), 1,42 (с, 18H), 1,37(с, 12H).
Пример получения 2: Получение 4-(6-бром-3-метокси-пиридин-2-ил)-пиримидин-2-иламина (LXI)
Пример получения 2-1: Получение 6-бром-3-гидрокси-пиридин-2-карбонитрила и 4,6-дибром-3-гидрокси-пиридин-2-карбонитрила (LVII)
2-Циано-3-гидроксипиридин (5 г, 0,042 моль) растворяли в смеси ацетонитрила (50 мл) и дистиллированной воды (10 мл) и полученный раствор охлаждали до 0°С. N-бромсукцинимид (6 г, 0,050 моль) медленно добавляли к раствору и раствор перемешивали при комнатной температуре в течение 24 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток промывали небольшим количеством этилацетата и гексана с получением белого указанного в заголовке соединения (8,28 г, 99,9%).
1H ЯМР (400 МГц, CDCl3) δ 11,03 (с, OH), 7,74 (д, J=6,0 Гц, 1H), 7,42 (д, J=6,0 Гц, 1H).
Пример получения 2-2: Получение 1-(6-бром-3-гидрокси-пиридин-2-ил)-этанона и 1-(4,6-дибром-3-гидрокси-пиридин-2-ил)-этанона (LVIII)
6-Бром-3-гидрокси-пиридин-2-карбонитрил и 4,6-дибром-3-гидрокси-пиридин-2-карбонитрил (8,28 г, 0,042 моль) растворяли в тетрагидрофуране (THF) (140 мл) и полученный раствор охлаждали до 0°С. К раствору добавляли 3М раствор метилмагнийбромида в тетрагидрофуране (THF) (40 мл) и раствор перемешивали при комнатной температуре в течение 3 часов. После завершения реакции 5 н водным раствором соляной кислоты (рН=2), водный слой подщелачивали насыщенным водным раствором бикарбоната натрия. Раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат/дихлорметан=10/2/3) с получением белого указанного в заголовке соединения (3,15 г, 35,0%).
1H ЯМР (400 МГц, CDCl3) δ 11,79 (с, OH), 7,54 (м, 1H), 7,42 (д, J=6,0 Гц, 1H), 2,70 (с, 3H).
Пример получения 2-3: Получение 1-(6-бром-3-метокси-пиридин-2-ил)-этанона (LVIX)
1-(6-бром-3-гидрокси-пиридин-2-ил)-этанон и 1-(4,6-дибром-3-гидрокси-пиридин-2-ил)-этанон (3,15 г, 0,012 моль) растворяли в ацетоне (60 мл). Карбонат калия (K2CO3) (6,04 г, 0,044 моль) и иодметан (CH3I) (1,81 мл, 0,026 моль) добавляли к полученному раствору и раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением белого указанного в заголовке соединения (3,18 г, 95,0%).
1H ЯМР (400 МГц, CDCl3) δ 7,77 (д, J=8,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 3,30 (с, 3H).
Пример получения 2-4: Получение 1-(6-бром-3-метокси-пиридин-2-ил)-3-диметиламино-пропенона (LX)
1-(6-бром-3-метокси-пиридин-2-ил)-этанон (3,18 г, 0,014 моль) растворяли в диметилацетале N,N-диметилформамида (DMFDMA) (18,53 мл) и раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции диметилацеталь N,N-диметилформамида (DMFDMA) удаляли с помощью сушки при пониженном давлении и полученный раствор перекристаллизовывали этилацетатом/гексаном с получением коричневого указанного в заголовке соединения (3,55 г, 90%).
1H ЯМР (400 МГц, CDCl3) δ 7,8-7,5(ушир, 1H), 7,42 (д, J=8,4 Гц, 1H), 7,16 (д, J=9,0 Гц, 1H), 5,61 (ушир, 1H), 3,85 (с, 3H).
Пример получения 2-5: Получение 4-(6-бром-3-метокси-пиридин-2-ил)-пиримидин-2-иламина (LXI)
1-(6-бром-3-метокси-пиридин-2-ил)-3-диметиламино-пропенон (3,55 г, 0,012 моль) растворяли в метаноле (60 мл). К полученному раствору добавляли 25% метоксид натрия (8,55 мл, 0,037 моль) и гуанидин гидрохлорид (1,79 г, 0,019 моль) и раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением коричневого указанного в заголовке соединения (2,98 г, 85,0%).
1H ЯМР (400 МГц, ДМСО) δ 8,31 (д, 1H), 7,66 (д, 1H), 7,84 (д, J=8,4 Гц, 1H), 7,16 (д, J=9,0 Гц, 1H), 5,61 (ушир, 1H), 3,85 (с, 3H).
Пример 8: Получение 2'-амино-6'-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXIII)
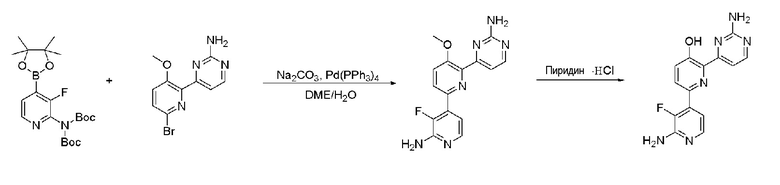
Пример 8-1: Получение 6-(2-амино-пиримидин-4-ил)-3'-фтор-5-метокси-[2,4']бипиридин-2'-иламина (LXII)
4-(6-бром-3-метокси-пиридин-2-ил)-пиримидин-2-иламин (830 мг, 2,95 ммоль), полученный в примере получения 2, и 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (1,0 г, 2,281 ммоль), полученный в примере получения 1, растворяли в растворе диметиловый эфир этиленгликоля/дистиллированная вода (10 мл/2 мл). Карбонат натрия (730 мг, 6,887 ммоль) и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (80 мг, 0,069 ммоль) добавляли к полученному раствору и раствор перемешивали при нагревании с обратным холодильником в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением коричневого указанного в заголовке соединения (210 мг, 30,0%).
1H ЯМР (400 МГц, ДМСО) δ 8,31 (д, J=3,2 Гц, 1H), 7,90 (дд, J=2,4 Гц, J=3,2 Гц, 1H), 7,71 (д, J=6,0 Гц, 1H), 6,98 (м, 1H), 6,82 (д, J=3,6 Гц, 1H), 3,87 (с, 3H).
Пример 8-2: Получение 2'-амино-6'-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXIII)
6-(2-амино-пиримидин-4-ил)-3'-фтор-5-метокси-[2,4']бипиридин-2'-илмин (LXII) (210 мг, 0,672 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (790 мг, 6,720 ммоль) и смесь перемешивали при 170°С в течение 1 часа. Смесь охлаждали до комнатной температуры, нейтрализовали 2 н. раствором гидроксида натрия (NaOH) и разбавляли этилацетатом (EA). Затем, органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата с получением указанного в заголовке соединения (170 мг, 85%).
1H ЯМР (400 МГц, ДМСО) δ 8,50 (д, J=3,6 Гц, 1H), 7,90 (д, J=5,6 Гц, 1H), 7,83 (д, J=3,2 Гц, 1H), 7,59 (дд, J=3,2 Гц, J=3,6 Гц, 1H), 7,51 (д, J=5,6 Гц, 1H), 7,31 (ушир, 2H), 7,12(м, 1H).
Пример 9: Получение 2-(2-аминопиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ола
Указанное в заголовке соединение в виде желтого твердого вещества (4,6 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-(4-метокси-фенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,54 (с, 1H), 9,62 (с, 1H), 8,47 (д, J=7,8 Гц, 1H), 7,93 (д, J=9,6 Гц, 1H), 7,86 (д, J=12,6 Гц, 1H), 7,64 (д, J=7,8 Гц, 1H), 7,37 (д, J=12,6 Гц, 1H), 7,22 (ушир, 2H), 6,84 (д, J=9,6 Гц, 1H).
Пример 10: Получение 2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (5,3 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин-2-иламин вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,56 (с, 1H), 9,66 (с, 1H), 8,49 (д, J=7,8 Гц, 1H), 7,94 (д, J=13,2 Гц, 1H), 7,88 (д, J=13,2 Гц, 1H), 7,66 (д, J=7,8 Гц, 1H), 7,39 (д, J=13,2 Гц, 1H), 7,25 (ушир, 2H), 6,85 (д, J=13,2 Гц, 1H)
Пример 11: Получение 6-(2-аминопиримидин-4-ил)-[2,3'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (8,8 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,81 (с, 1H), 9,29 (с, 1H), 8,58 (д, J=7,8 Гц, 1H), 8,48(м, 2H). 8,11 (д, J=12,6 Гц, 1H), 7,70 (д, J=7,2 Гц, 1H), 7,50 (м, 2H), 7,29 (ушир, 2H).
Пример 12: Получение 6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ола
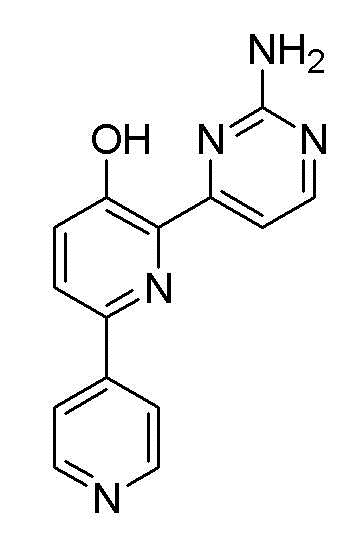
Указанное в заголовке соединение в виде желтого твердого вещества (7,3 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,99 (с, 1H), 8,69 (д, J=7,2 Гц, 1H), 8,52(д, J=7,8 Гц, 1H). 8,20 (д, J=13,2 Гц, 1H), 8,15 (д, J=9,0 Гц, 1H), 7,71 (д, J=7,8 Гц, 1H), 7,53 (д, J=13,2 Гц, 1H), 7,36 (ушир, 2H).
Пример 13: Получение 2-(2-аминопиримидин-4-ил)-6-(3-гидроксифенил)пиридин-3-ола

Указанное в заголовке соединение в виде желтого твердого вещества (11,2 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-(3-метокси-фенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО) δ 13,66 (с, 1H), 9,64 (с, 1H), 8,50 (д, J=5,2 Гц, 1H), 7,92 (д, J=8,8 Гц, 1H). 7,65 (д, J=4,8 Гц, 1H), 7,57(с, 1H), 7,48 (д, J=7,6 Гц, 1H), 7,43 (д, J=8,8 Гц, 1H), 7,26 (м, 3H), 6,80 (д, J=8,0 Гц, 1H).
Пример 14: Получение 6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
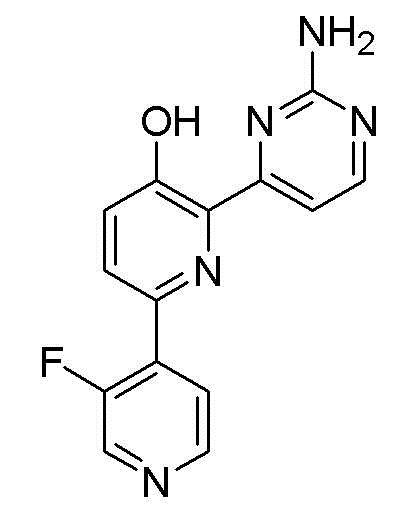
Указанное в заголовке соединение в виде желтого твердого вещества (10,4 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-пиридин вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, CD3OD) δ 8,55 (д, J=3,6 Гц, 1H), 8,49(д, J=4,8 Гц, 1H). 8,45 (д, J=5,4 Гц, 1H), 8,21 (м, 1H), 8,02 (дд, J=8,4 Гц, J=9,6 Гц, 1H), 7,80 (д, J=5,4 Гц, 1H), 7,47 (д, J=9,0 Гц, 1H).
Пример 15: Получение 6-(4-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ола
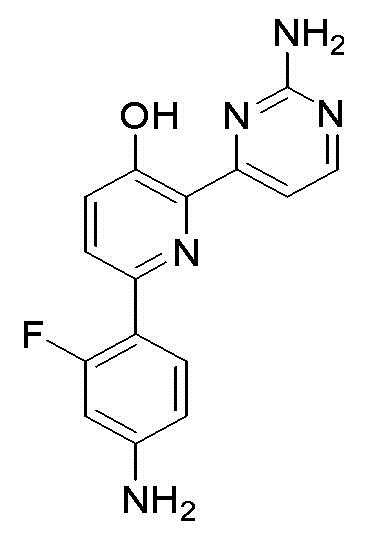
Указанное в заголовке соединение в виде желтого твердого вещества (7,9 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали N-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-2-фенил-ацетамид вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО) δ 13,49 (с, 1H), 8,44 (д, J=5,2 Гц, 1H), 7,73 (м, 1H), 7,63 (д, J=8,8 Гц, 1H). 7,56 (д, J=5,2 Гц, 1H), 7,34 (д, J=8,8 Гц, 1H), 7,18 (ушир, 2H), 6,47 (д, J=8,8 Гц, 1H), 6,35 (д, J=14,8 Гц, 1H), 5,62 (с, 2H).
Пример 16: Получение 6-(3-аминофенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ола
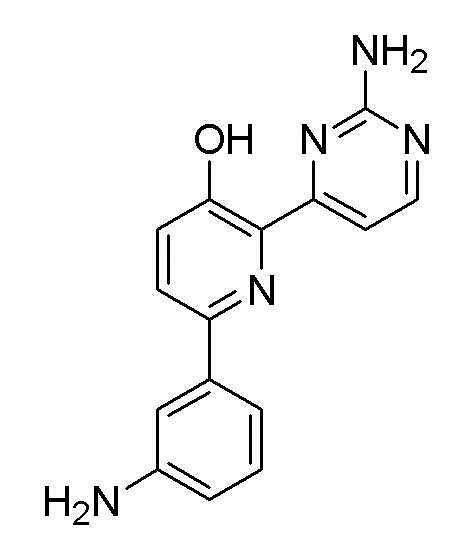
Указанное в заголовке соединение в виде желтого твердого вещества (5,2 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1,3-бис(1,1-диметилэтил)-сложный эфир-имидодикарбоновую кислоту вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО) δ 13,62 (с, 1H), 8,50 (д, J=5,2 Гц, 1H), 7,84 (д, J=8,8 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,48 (д, J=3,2 Гц, 1H). 7,35 (с, 1H), 7,25 (ушир, 2H), 7,19 (д, J=7,6 Гц, 1H), 7,11 (м, 1H), 6,59 (д, J=9,2 Гц, 1H), 6,35 (д, J=14,8 Гц, 1H), 5,16 (с, 2H).
Пример 17: Получение 2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ола
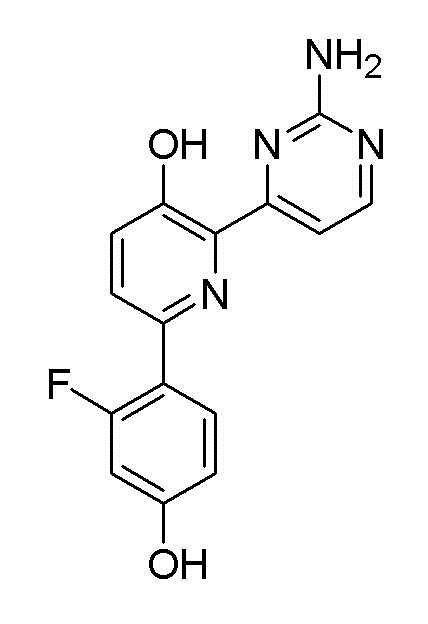
Указанное в заголовке соединение в виде желтого твердого вещества (27 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-(2-фтор-4-метокси-фенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,63 (с, 1H), 10,11 (с, 1H), 8,48 (д, J=7,8 Гц, 1H), 7,89 (м, 1H), 7,72 (д, J=13,2 Гц, 1H), 7,59 (д, J=7,8 Гц, 1H), 7,42 (д, J=12,6 Гц, 1H). 7,24 (ушир, 2H), 6,76 (д, J=12,6 Гц, 1H), 6,65 (д, J=19,8 Гц, 1H).
Пример 18: Получение 6-(3-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ола
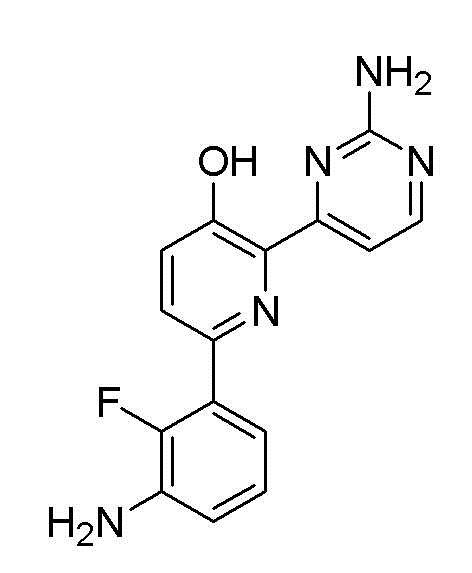
Указанное в заголовке соединение в виде желтого твердого вещества (26 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-фтор-3-[(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1,3-бис(1,1-диметилэтил)-сложный эфир-имидодикарбоновую кислоту вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО) δ 13,69 (с, 1H), 8,48 (д, J=7,8 Гц, 1H), 7,75 (д, J=13,2 Гц, 1H), 7,56 (д, J=7,8 Гц, 1H), 7,45 (д, J=13,2 Гц, 1H). 7,25 (ушир, 2H), 7,07 (м, 1H), 6,97 (м, 1H), 6,80 (м, 1H).
Пример 19: Получение 2-(2-аминопиримидин-4-ил)-6-(3-фтор-4-гидроксифенил)пиридин-3-ола
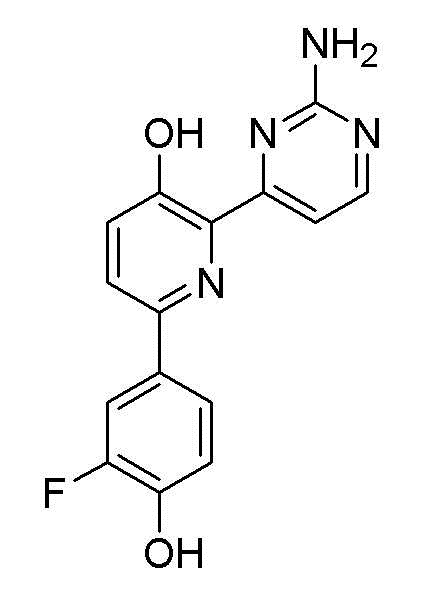
Указанное в заголовке соединение в виде желтого твердого вещества (50,2 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-(3-фтор-4-метокси-фенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО) δ 13,64 (с, 1H), 10,16 (с, 1H), 8,49 (д, J=3,6 Гц, 1H), 7,94 (д, J=5,6 Гц, 1H), 7,90 (д, J=8,8 Гц, 1H), 7,77 (д, J=6,0 Гц, 1H). 7,41 (д, J=5,6 Гц, 1H), 7,25 (ушир, 2H), 7,07 (м, 1H).
Пример 20: Получение 2-(2-аминопиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ола
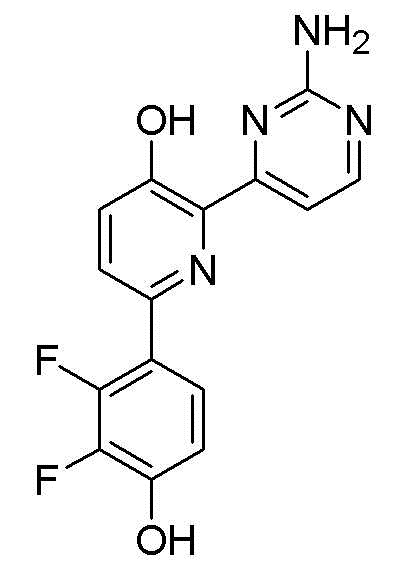
Указанное в заголовке соединение в виде желтого твердого вещества (12,6 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-(2,3-дифтор-4-метокси-фенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО) δ 13,71 (с, 1H), 10,50 (ушир, 1H), 8,49 (д, J=3,6 Гц, 1H), 7,75 (д, J=8,8 Гц, 1H), 7,66 (м, 1H), 7,59 (д, J=5,2 Гц, 1H). 7,46 (д, J=8,4 Гц, 1H), 7,28 (ушир, 2H), 6,92 (м, 1H).
Пример 21: Получение 2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-3',5-диола
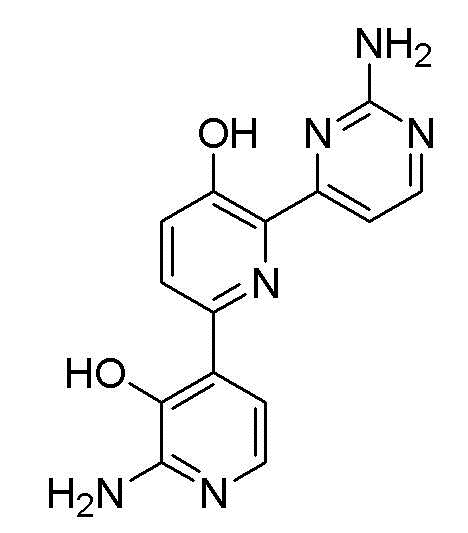
Указанное в заголовке соединение в виде желтого твердого вещества (2,1 мг) получали способом, аналогичным способу примера 8, за исключением того, что использовали 2-[3-гидрокси-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,61 (д, J=5,2 Гц, 1H), 8,28 (д, J=9,2 Гц, 1H), 7,68 (д, J=9,2 Гц, 1H), 7,51 (д, J=5,6 Гц, 1H), 7,46 (с, 2H), 7,15 (д, J=5,2 Гц, 1H), 7,13 (д, J=5,6 Гц, 1H), 5,96 (с, 2H).
Пример 22: Получение 6-(2-аминопиримидин-4-ил)-2-(4-(метиламино)тиазол-2-ил)пиридин-3-ола
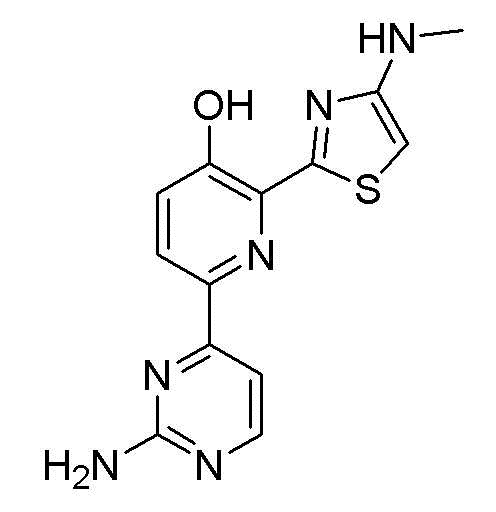
Указанное в заголовке соединение в виде желтого твердого вещества (3,2 мг) получали способом, аналогичным способу примера 7, за исключением того, что использовали (2-хлор-тиазол-4-ил)-метил-амин вместо 2-(6-хлор-2-пиридинил)-1,3-бис(1,1-диметилэтил)сложный эфир имидодикарбоновой кислоты в примере 7-8.
1H ЯМР (400 МГц, ДМСО-d6) δ 9,04 (с, 1H), 8,73 (д, J=3,2 Гц, 1H), 8,38 (д, J=4,4 Гц, 1H), 7,43 (д, J=5,2 Гц, 1H), 7,04 (с, 1H), 6,71 (с, 2H), 6,66 (д, J=5,2 Гц, 1H), 3,70 (с, 3H).
Пример 23: Получение 6-(2-аминопиримидин-4-ил)-6'-(метиламино)-[2,2'-бипиридин]-3-ола
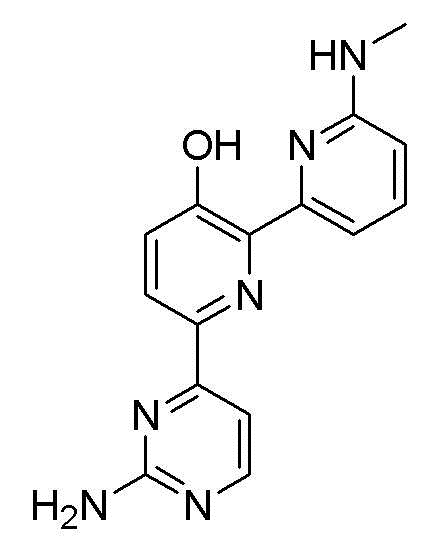
Указанное в заголовке соединение в виде желтого твердого вещества (8,4 мг) получали способом, аналогичным способу примера 7-12, используя побочный продукт [6'-(2-амино-пиримидин-4-ил)-3'метокси-[2,2']бипиридинил-6-ил]-метил-амин, полученный в примере 7-11.
1H ЯМР (600 МГц, CD3OD) δ 14,88 (с, OH), 8,69 (с, 1H), 8,34 (с, 1H), 8,32 (д, J=4,8 Гц, 1H), 7,70 (дд, J=8,4, 7,8 Гц, 1H), 7,39 (д, J=4,8 Гц, 1H), 7,30 (д, J=7,8 Гц, 1H), 6,81 (с, NH2), 6,65 (с, NH2), 6,61 (д, J=8,4 Гц, 1H), 3,48(с, 1H).
Пример получения 3: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-метилпиримидин-2-амина (LXIX)
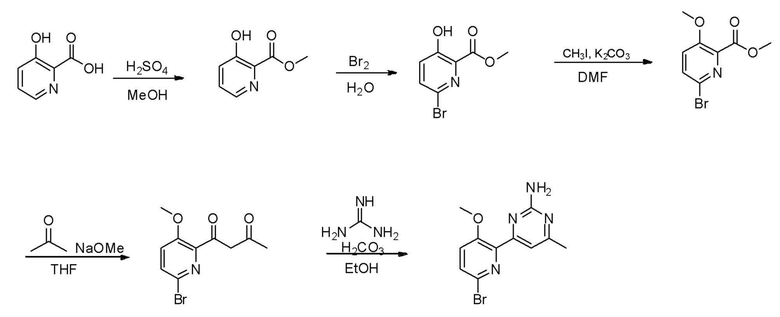
Пример получения 3-1: Получение метил-3-гидроксипиколината (LXV)
3-Гидроксипиколиновую кислоту (5,0 г, 35,94 ммоль) растворяли в метаноле (120 мл). К полученному раствору медленно добавляли по каплям серную кислоту (5,75 мл, 107,83 ммоль) при 0°С и раствор кипятили с обратным холодильником в течение 24 часов, охлаждали до комнатной температуры, и выпаривали при пониженном давлении. Полученный остаток разбавляли дихлорметаном и дистиллированной водой, нейтрализовали 6 н гидроксидом натрия и экстрагировали дихлорметаном. Органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением белого указанного в заголовке соединения (4,62 г, 83%).
1H ЯМР (600 МГц, CDCl3) δ 8,28 (дд, J=1,2, 2,4 Гц, 1H), 7,43 (дд, J=4,2, 4,2 Гц, 1H), 7,38, (дд, J=1,2, 7,2 Гц, 1H), 4,06 (с, 3H).
Пример получения 3-2: Получение метил 6-бром-3-гидроксипиколината (LXVI)
Метил 3-гидроксипиколинат (4,62 г, 30,17 ммоль) растворяли в дистиллированной воде (200 мл). К полученному раствору медленно добавляли по каплям бромную воду (1,7 мл, 33,18 ммоль) и раствор перемешивали при комнатной температуре в течение 4 часов. Раствор разбавляли этилацетатом и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=3/1) с получением белого указанного в заголовке соединения (5,07 г, 72%).
1H ЯМР (600 МГц, CDCl3) δ 7,55 (д, J=9,0 Гц, 1H), 7,27 (д, J=9,0 Гц, 1H), 4,04 (с, 3H).
Пример получения 3-3: Получение метил 6-бром-3-метоксипиколината (LXVII)
Метил 6-бром-3-гидроксипиколинат (5,07 г, 21,85 ммоль) растворяли в ацетоне (75 мл). К полученному раствору добавляли по каплям карбонат калия (K2CO3) (4,83 г, 34,96 ммоль) и иодметан (CH3I) (1,77 мл, 28,41 ммоль) и раствор нагревали с обратным холодильником в течение 3 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли EtOAc, и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=3/1) с получением белого указанного в заголовке соединения (4,18 г, 78%).
1H ЯМР (600 МГц, CDCl3) δ 7,57 (д, J=9,0 Гц, 1H), 7,26 (д, J=9,0 Гц, 1H), 3,95 (с, 3H), 3,92 (с, 3H).
Пример получения 3-4: Получение 1-(6-бром-3-метоксипиридин-2-ил)бутан-1,3-диона (LXVIII)
Метил 6-бром-3-метоксипиколинат (3,79 г, 15,40 ммоль) растворяли в тетрагидрофуране (THF). К полученному раствору добавляли ацетон (1,52 г 26,18 ммоль) и 30% метоксид натрия (30% NaOMe) (3,81 мл, 20,02 ммоль) и раствор перемешивали при комнатной температуре и выпаривали при пониженном давлении до концентрата. Полученный остаток разбавляли дистиллированной водой, подкисляли 2 н раствором хлористоводородной кислоты (HCl) и экстрагировали дихлорметаном. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением указанного в заголовке соединения (2,51 г, 60%).
1H ЯМР (400 МГц, CDCl3) δ 7,52 (дд, J=6,8 Гц, 1,2 Гц, 1H), 7,25 (дд, J=6,8 Гц, 1,2 Гц, 1H), 6,43 (с, 1H), 3,92 (с, 3H), 2,18 (с, 3H).
Пример получения 3-5: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-метилпиримидин-2-амина (LXIX)
1-(6-бром-3-метоксипиридин-2-ил)бутан-1,3-дион (2,51 г, 9,22 ммоль) и карбонат гуанидина (1,83 г, 20,28 ммоль) растворяли в этаноле (EtOH). Полученный раствор перемешивали при нагревании с обратным холодильником в течение 20 часов, охлаждали до комнатной температуры, и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол=9/1) с получением указанного в заголовке соединения (680 мг, 25%).
1H ЯМР (400 МГц, CDCl3) δ 7,48 (д, J=9,2 Гц, 1H), 7,24 (д, J=9,2 Гц, 1H), 6,93 (с, 1H), 5,07 (с, 2H), 3,85 (с, 3H), 2,39 (с, 3H).
Пример 24: Получение 2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXXI)
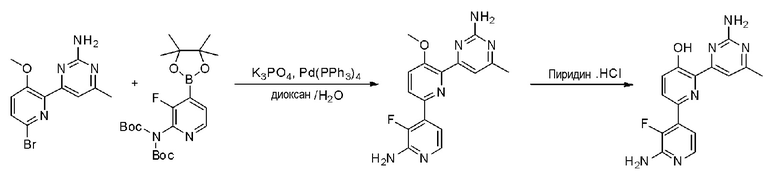
Пример 24-1: Получение 6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амина (LXX)
4-(6-бром-3-метоксипиридин-2-ил)-6-метилпиримидин-2-амин (2,34 г, 7,93 ммоль), полученный в примере получения 3, и 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир, полученный в примере получения 1 (5,21 г, 11,89 ммоль), растворяли в растворе диоксан/дистиллированная вода (6 мл/4 мл). К полученному раствору добавляли фосфат калия (5,48 г, 23,78 ммоль) и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (458 мг, 0,4 ммоль) и реакционный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов, охлаждали до комнатной температуры и фильтровали с помощью целита. Раствор выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (диметилхлорид/метанол=9/1) с получением указанного в заголовке соединения (1,94 г, 75%).
1H ЯМР (400 МГц, ДМСО-d6) δ 7,89 (д, J=9,0 Гц, 1H), 7,76 (д, J=5,4 Гц, 1H), 7,69 (д, J=9,0 Гц, 1H), 6,97 (т, 1H), 6,68 (с, 1H), 6,56 (с, 1H), 6,23 (с, 2H), 3,82 (с, 3H), 2,27 (с, 3H).
Пример 24-2: Получение 2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXXI)
6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амин (LXX) (1,94 г, 5,94 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (10 г) и смесь перемешивали при 170°С в течение 1 часа. Смесь охлаждали до комнатной температуры, нейтрализовали 6 н раствором гидроксида натрия (NaOH). Полученное твердое вещество фильтровали и сушили с получением указанного в заголовке соединения (1,67 г, 90%).
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,86 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 2,36 (с, 3H).
Пример 25: Получение 6-(2-амино-6-метилпиримидин-4-ил)-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (15,2 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО-d6) δ 13,77 (с, 1H), 9,61 (с, 1H), 7,93 (д, J=8,8 Гц, 2H), 7,84 (д, J=9,2 Гц, 1H), 7,54 (с, 1H), 7,35 (д, J=8,8 Гц, 1H), 7,12 (с, 2H), 6,84 (д, J=9,2 Гц, 1H), 2,36 (с, 3H).
Пример 26: Получение 6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (9,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 3-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,14 (с, 1H), 7,85 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,12 (т, 1H), 6,25 (с, 1H), 2,36 (с, 3H).
Пример 27: Получение 2-(2-амино-6-метилпиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ола
Указанное в заголовке соединение в виде желтого твердого вещества (6,1 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 2-(4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, ДМСО-d6) δ 13,77 (с, 1H), 9,61 (с, 1H), 7,93 (д, J=8,8 Гц, 2H), 7,84 (д, J=9,2 Гц, 1H), 7,54 (с, 1H), 7,35 (д, J=8,8 Гц, 1H), 7,12 (с, 2H), 6,84 (д, J=9,2 Гц, 1H), 2,36 (с, 3H).
Пример 28: Получение 2-(2-амино-6-метилпиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ола
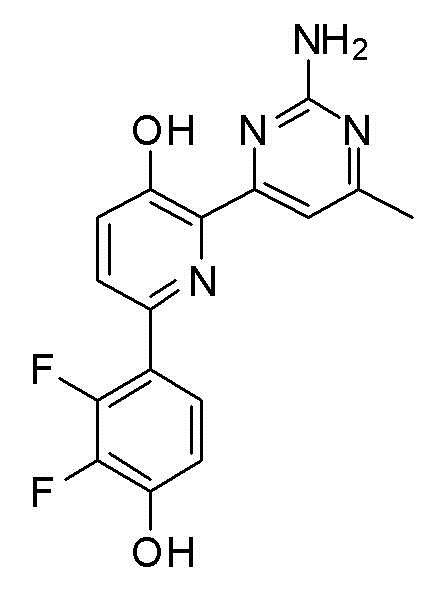
Указанное в заголовке соединение в виде желтого твердого вещества (6,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 2-(2,3-дифтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (400 МГц, CDCl3) δ 13,2 (с, 1H), 7,60 (с, 1H), 7,27 (м, 5H), 5,07 (с, 2H), 2,46 (с, 3H).
Пример 29: Получение 2-(2-амино-6-метилпиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ола
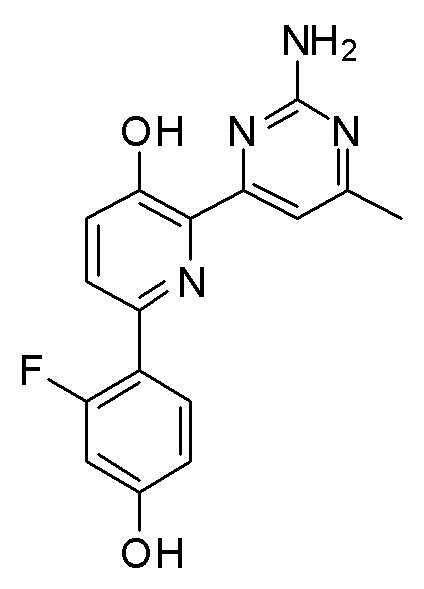
Указанное в заголовке соединение в виде желтого твердого вещества (6,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 2-(2-фтор-4-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,89 (т, 1H), 7,69 (д, J=8,4 Гц, 1H), 7,49 (с, 1H), 7,39 (д, J=8,4 Гц, 1H), 7,13 (с, 2H), 6,76 (дд, J=8,4 Гц, 1,8 Гц, 1H), 6,65 (дд, J=8,4 Гц, 1,8 Гц, 1H), 2,36 (с, 3H).
Пример 30: Получение 2-(2-амино-6-метилпиримидин-4-ил)-6-(3-аминофенил)пиридин-3-ола
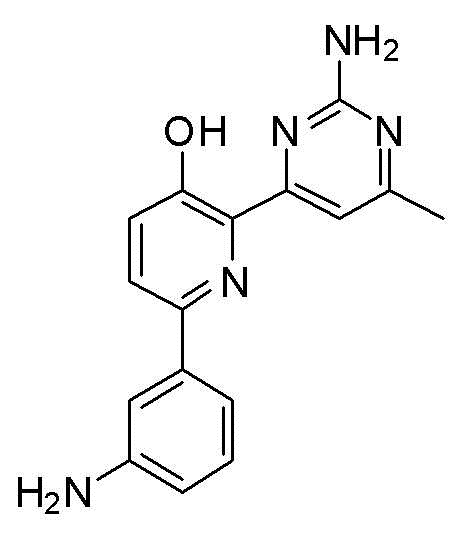
Указанное в заголовке соединение в виде желтого твердого вещества (6,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 2-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1,3-бис(1,1-диметилэтил)-сложный эфир-имидодикарбоновую кислоту вместо соединения, полученного в примере получения 1.
1H ЯМР (600 МГц, ДМСО-d6) δ 13,83 (с, 1H), 7,80 (д, J= 9,0 Гц, 1H), 7,55 (с, 1H), 7,38 (д, J=9,0 Гц, 1H), 7,33 (с, 1H), 7,18 (д, J= 7,8 Гц, 1H), 7,11 (с, 2H), 7,09 (т, 1H), 6,58 (д, J= 6,0 Гц, 1H)15,084 (с, 2H), 2,38 (с, 3H).
Пример получения 4: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-изопропилпиримидин-2-амина (LXIX)
Указанное в заголовке соединение в виде желтого твердого вещества (1,8 г) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 3-метилбутан-2-он вместо ацетона в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,31 (с, 1H), 7,65 (д, J= 13,8 Гц, 1H), 7,56 (д, J= 12,6 Гц, 1H), 7,23 (ушир, 2H), 3,76 (с, 3H), 2,37 (м, 1H), 1,02 (д, J= 10,8 Гц, 6H).
Пример 31: Получение 2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
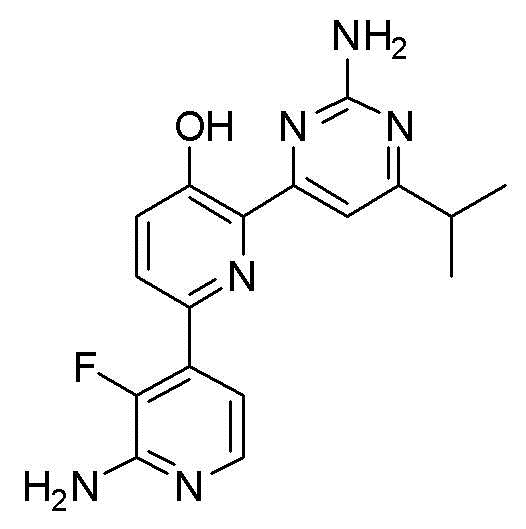
Указанное в заголовке соединение в виде желтого твердого вещества (8,1 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-6-изопропилпиримидин-2-амин, полученный в примере получения 4, вместо соединения, полученного в примере получения 3.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,86 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 2,15 (м, 1H), 0,99 (д, J=8,4 Гц, 6H).
Пример получения 5: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-(тетрагидро-2H-пиран-4-ил)пиримидин-2-амина (LXIX)
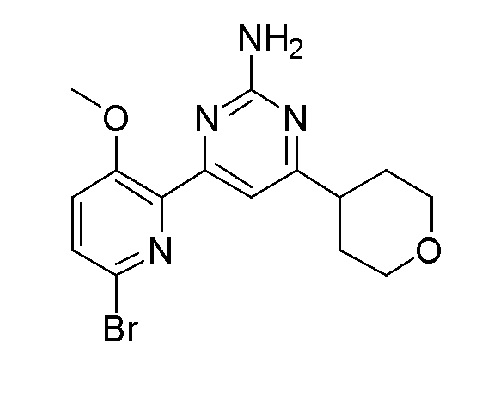
Указанное в заголовке соединение в виде желтого твердого вещества (6,4 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(тетрагидро-2H-пиран-4-ил)этанон вместо ацетона в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,71 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 1H), 3,89 (с, 3H).
Пример 32: Получение 2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
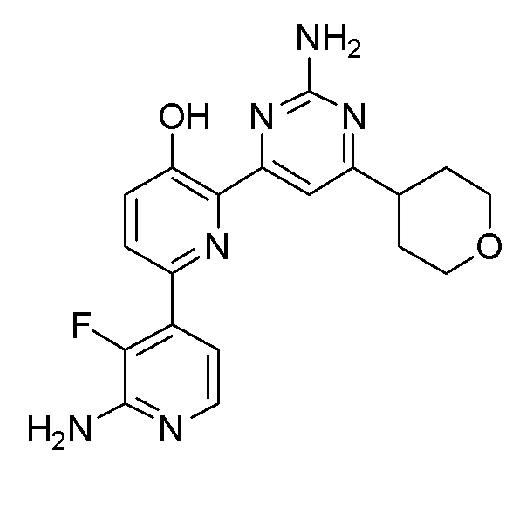
Указанное в заголовке соединение в виде желтого твердого вещества (8,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-6-(тетрагидро-2H-пиран-4-ил)пиримидин-2-амин, полученный в примере получения 5, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,82-7,80 (м, 2H), 7,41 (д, J=8,4 Гц, 1H), 7,14 (т, J=5,4 Гц, 1H), 7,03 (с, 1H), 6,82 (ушир, 2H), 6,25 (ушир, 2H), 3,70-3,68 (м, 4H), 3,64-3,63 (м, 4H).
Пример получения 6: Получение 1-(1-метилпиперидин-4-ил)этанона
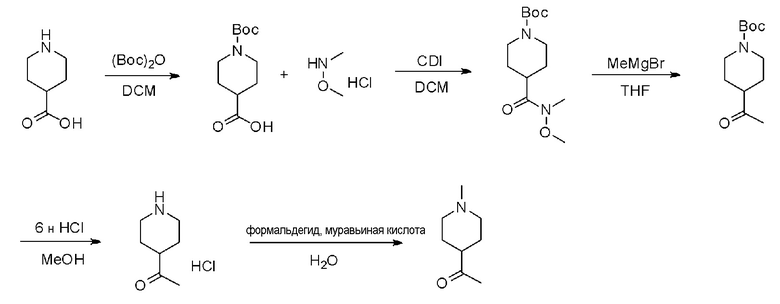
Пример получения 6-1: Получение 1-(1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты
Изонипекотиновую кислоту (5,51 г, 0,022 моль) растворяли в дихлорметане (110 мл). К полученному раствору добавляли ди-трет бутилдикарбонат ((Boc)2O) (7,31 г, 0,033 моль) и карбонат калия (K2CO3) (9,62 г, 0,67 моль) и раствор перемешивали при комнатной температуре в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали этилацетатом, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол, 10/1) с получением белого указанного в заголовке соединения (7,36 г, 95,0%).
1H ЯМР (400 МГц, CD3OD) δ 3,97 (м, 2H), 2,88 (ушир, 2H), 2,48 (м, 1H), 1,88 (м, 2H), 1,54 (м, 2H), 1,44 (с, 9H)
Пример получения 6-2: Получение трет-бутил-4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата
1-(1-(трет-бутоксикарбонил)пиперидин-4-карбоновую кислоту (6,51 г 0,022 моль) растворяли в дихлорметане (50 мл). К полученному раствору добавляли 1,1'-карбонилдиимидазол (CDI) (6,31 г, 0,033 моль) и N,O-диметилгидроксиламин гидрохлорид (9,62 г, 0,67 моль) и раствор перемешивали при комнатной температуре в течение 18 часов. После завершения реакции добавлением воды раствор экстрагировали дихлорметаном, промывали дистиллированной водой и сушили над сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол=10/1) с получением белого указанного в заголовке соединения (5,36 г, 95,0%).
1H ЯМР (400 МГц, CDCl3) δ 4,14 (м, 2H), 3,71 (с, 3H), 3,13 (с, 3H), 2,79 (м, 5H), 1,42 (с, 9H).
Пример получения 6-3: Получение трет-бутил 4-ацетилпиперидин-1-карбоксилата
Трет-бутил-4-(метокси(метил)карбамоил)пиперидин-1-карбоксилат (2,29 г, 8,32 ммоль) растворяли в 30 мл тетрагидрофурана (THF) и полученный раствор охлаждали до -78°С. К раствору медленно добавляли метилмагний бромид (3,0M) (7,73 мл, 10,82 ммоль) и раствор перемешивали при 0°С в течение 1 часа. После завершения реакции 2 н водным раствором хлористоводородной кислоты добавляли 6 н. раствор гидроксида натрия для доведения значения рН до 10 и затем раствор экстрагировали дихлорметаном. Органический слой обрабатывали сульфатом магния (MgSO4) и фильтровали, и раствор концентрировали. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол=10/1) с получением белого указанного в заголовке соединения (6,36 г, 94,0%).
1H ЯМР (400 МГц, CDCl3) δ 3,90 (м, 2H), 2,98 (с, 2H), 2,51 (с, 1H), 2,15(с, 3H), 1,67 (м, 4H), 1,49 (с, 9H).
Пример получения 6-4: Получение 1-(пиперидин-4-ил)этанона гидрохлорида
Трет-бутил 4-ацетилпиперидин-1-карбоксилат (3,29 г, 8,32 ммоль) растворяли в 30 мл метанола. К полученному раствору медленно добавляли 6 н водный раствор хлористоводородной кислоты и раствор перемешивали при комнатной температуре в течение 18 часов. После удаления растворителя добавляли ацетон и полученное твердое вещество фильтровали с получением белого указанного в заголовке соединения (4,36 г, 95,0%).
1H ЯМР (400 МГц, CDCl3) δ 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 2,40 (с, 3H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример получения 6-5: Получение 1-(1-метилпиперидин-4-ил)этанона
1-(Пиперидин-4-ил)этанон гидрохлорид (4,5 г, 8,32 ммоль) добавляли к 30 мл муравьиной кислоты и добавляли 30 мл формальдегида и смесь перемешивали при нагревании с обратным холодильником в течение 18 часов. Растворитель концентрировали при пониженном давлении и к раствору добавляли хлористоводородную кислоту и ацетон. Полученное твердое вещество фильтровали с получением белого указанного в заголовке соединения (6,36 г, 95,0%).
1H ЯМР (400 МГц, CDCl3) δ 2,80 (м, 2H), 2,21 (с, 3H), 2,16 (м, 1H), 2,09 (с, 3H), 1,94 (м, 2H), 1,80 (м, 2H), 1,63 (м, 2H).
Пример получения 7: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-(пиперидин-4-ил)пиримидин-2-амина (LXIX)
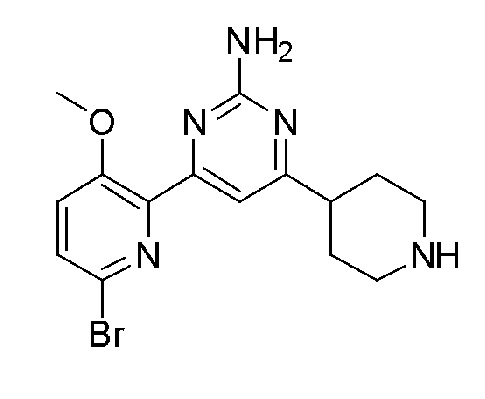
Указанное в заголовке соединение в виде желтого твердого вещества (21 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(пиперидин-4-ил)этанон, полученный в примере получения 6-4, вместо ацетона в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,70 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример 33: Получение 2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (6,8 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-6-(пиперидин-4-ил)пиримидин-2-амин, полученный в примере получения 7, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,80 (м, 2H), 7,41 (д, J=8,4 Гц, 1H), 7,14 (т, J=5,4 Гц, 1H), 7,03 (с, 1H), 6,82 (ушир, 2H), 6,25 (ушир, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример получения 8: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-(1-метилпиперидин-4-ил)пиримидин-2-амина (LXIX)
Указанное в заголовке соединение в виде желтого твердого вещества (21,7 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(1-метилпиперидин-4-ил)этанон, полученный в примере получения 6, вместо ацетона в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,71 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,88 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,49 (м, 2H).
Пример 34: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (11,5 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-6-(1-метилпиперидин-4-ил)пиримидин-2-амин, полученный в примере получения 8, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример 35: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
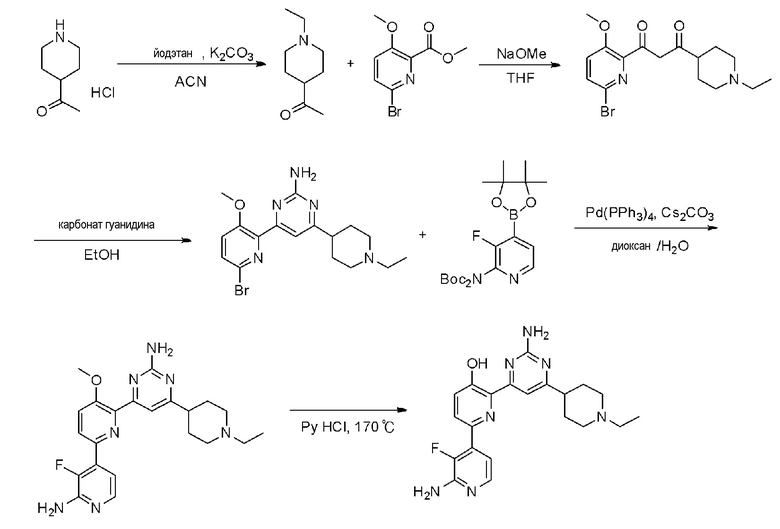
Пример 35-1: Получение 1-(1-этилпиперидин-4-ил)этанона
1-(Пиперидин-4-ил)этанон гидрохлорид (6,07 г 21,85 ммоль), полученный в примере получения 6-4, растворяли в ацетонитриле (75 мл). Карбонат калия (K2CO3) (5,83 г, 34,96 ммоль) и йодэтан (CH3CH2I) (2,77 мл, 28,41 ммоль) добавляли по каплям к полученному раствору и раствор перемешивали в течение 18 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли EtOAc, и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (диметилхлорид/метанол=10/1) с получением белого указанного в заголовке соединения (5,18 г, 76%).
1H ЯМР (400 МГц, CDCl3) δ 2,81 (м, 2H), 2,24 (с, 3H), 2,16 (м, 1H), 2,09 (м, 2H), 1,94 (м, 2H), 1,80 (м, 2H), 1,60 (м, 2H), 1,48 (м, 3H).
Пример 35-2: Получение 1-(6-бром-3-метоксипиридин-2-ил)-3-(1-этилпиперидин-4-ил)пропан-1,3-диона
Метил 6-бром-3-метоксипиколинат (4,79 г, 15,40 ммоль), полученный в примере получения 3-3, растворяли в тетрагидрофуране (THF). К полученному раствору добавляли 1-(1-этилпиперидин-4-ил)этанон (5,52 г 15,42 ммоль), полученный в примере 35-1, и 30% метоксид натрия (30% NaOMe) (4,81 мл, 20,02 ммоль) и раствор перемешивали при комнатной температуре. Раствор выпаривали при пониженном давлении до концентрата. Полученный остаток разбавляли дистиллированной водой, подкисляли 2 н раствором хлористоводородной кислоты (HCl) и экстрагировали дихлорметаном. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=1/1) с получением указанного в заголовке соединения (3,41 г, 61%).
1H ЯМР (400 МГц, CDCl3) δ 7,52 (д, J=6,8 Гц, 1H), 7,25 (д, J=6,8 Гц, 1H), 3,89 (с, 3H), 2,81 (м, 2H), 2,24 (с, 3H), 2,16 (м, 1H), 2,09 (м, 2H), 1,94 (м, 2H), 1,80 (м, 2H), 1,60 (м, 2H), 1,44 (м, 3H).
Пример 35-3: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-(1-этилпиперидин-4-ил)пиримидин-2-амина
1-(6-бром-3-метоксипиридин-2-ил)-3-(1-этилпиперидин-4-ил)пропан-1,3-дион (3,41 г, 9,22 ммоль) и карбонат гуанидина (2,75 г, 20,28 ммоль) растворяли в этаноле (EtOH) и полученный раствор перемешивали при нагревании с обратным холодильником в течение 20 часов. Раствор охлаждали до комнатной температуры и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол=10/1) с получением указанного в заголовке соединения (752 мг, 28%).
1H ЯМР (400 МГц, CDCl3) δ 7,50 (д, J=6,8 Гц, 1H), 7,25 (д, J=6,8 Гц, 1H), 7,24 (s 1H), 6,84 (с 2H), 3,89 (с, 3H), 2,81 (м, 2H), 2,24 (с, 3H), 2,16 (м, 1H), 2,09 (м, 2H), 1,94 (м, 2H), 1,80 (м, 2H), 1,60 (м, 2H), 1,45 (м, 3H).
Пример 35-4: Получение 6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амина
4-(6-бром-3-метоксипиридин-2-ил)-6-(1-этилпиперидин-4-ил)пиримидин-2-амин (2,34 г, 7,93 ммоль) и 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (5,21 г, 11,89 ммоль), полученный в примере получения 1, растворяли в растворе диоксан/дистиллированная вода (6 мл/4 мл). К полученному раствору добавляли карбонат цезия (Cs2CO3) (5,48 г, 23,78 ммоль) и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (458 мг, 0,4 ммоль) и полученный реакционный раствор перемешивали при нагревании с обратным холодильником в течение 24 часов. Раствор охлаждали до комнатной температуры и фильтровали с помощью целита. Растворитель выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (диметилхлорид/метанол=9/1) с получением указанного в заголовке соединения (1,94 г, 75%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 3H).
Пример 35-5: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амин (3,88 г, 21,88 ммоль) смешивали с пиридин гидрохлоридом (пиридин HCl) (20 г) и смесь перемешивали при 170°С в течение 1 часа. Смесь охлаждали до комнатной температуры и затем нейтрализовали 6 н. раствора гидроксида натрия (NaOH). Полученное твердое вещество фильтровали и сушили с получением указанного в заголовке соединения (3,34 г, 89%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 3H).
Пример 36: Получение 2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (14,5 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-йодпропан (CH3CH2CH2I) вместо йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,75 (д, J=8,4 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,51 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 3H).
Пример 37: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (27,5 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 2-йодпропан (CH3CH(I)CH3) вместо йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,75 (д, J=9,0 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 6H).
Пример получения 9: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-(1-метилпиперидин-3-ил)-пиримидин-2-амина (LXIX)
Указанное в заголовке соединение в виде желтого твердого вещества (45,3 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(1-метилпиперидин-3-ил)этанон вместо ацетона в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,14 (с, 2H), 3,88 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,48 (м, 2H).
Пример 38: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
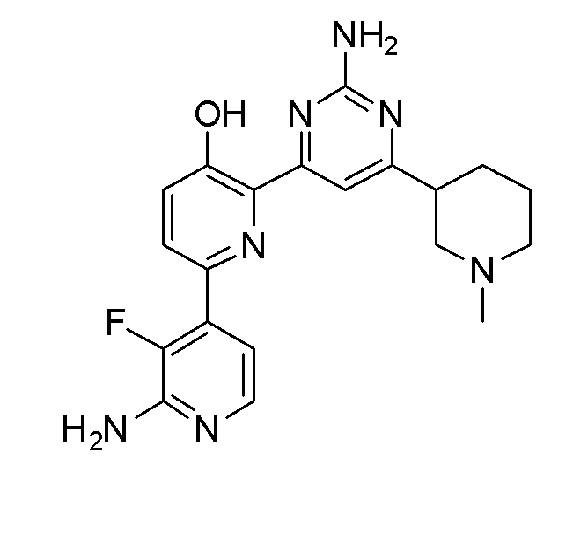
Указанное в заголовке соединение в виде желтого твердого вещества (12,8 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-6-(1-метилпиперидин-3-ил)-пиримидин-2-амин, полученный в примере получения 9, вместо соединения, полученного в Примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=8,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример 39: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (21,8 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-3-ил)этанон, вместо 1-(пиперидин-4-ил)этанон гидрохлорида в примере 35-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,74 (д, J=8,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H), 1,21 (м, 3H).
Пример 40: Получение 2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (3,8 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-3-ил)этанон и 1-йодпропан (CH3CH2CH2I) вместо 1-(пиперидин-4-ил)этанон гидрохлорида и йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,75 (д, J=8,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H), 1,20 (м, 3H).
Пример 41: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (32,5 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-3-ил)этанон и 2-йодпропан (CH3CH(I)CH3) вместо 1-(пиперидин-4-ил)этанон гидрохлорида и йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,75 (д, J=9,0 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,22 (м, 2H), 6,13 (с, 2H), 3,14 (м, 2H), 2,42 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H), 1,20 (м, 9H).
Пример получения 10: Получение 1-(1-метилпиперидин-4-ил)пропан-1-она
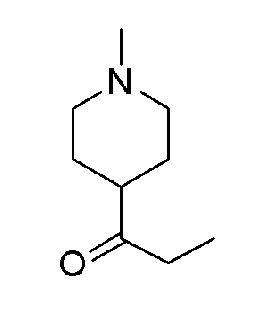
Указанное в заголовке соединение в виде желтого твердого вещества (3,5 г) получали способом, аналогичным способу примера получения 6, за исключением того, что использовали этилмагний бромид вместо метилмагния бромида в примере получения 6-3.
1H ЯМР (600 МГц, ДМСО-d6) δ 3,10 (м, 2H), 2,48 (м, 4H), 2,35 (с, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,23 (т, 3H).
Пример получения 11: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-2-амина (LXIX)
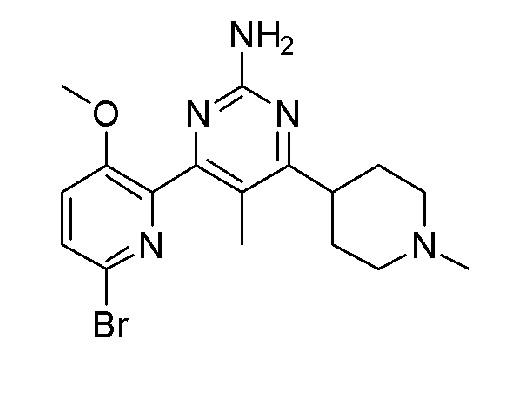
Указанное в заголовке соединение в виде желтого твердого вещества (26,2 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(1-метилпиперидин-4-ил)пропан-1-он, полученный в примере получения 10, вместо ацетона в примере получения 3-4.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,84 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,18 (с, 2H), 3,84 (с, 3H), 3,10 (м, 2H), 2,48 (с, 3H), 2,56 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H).
Пример 42: Получение 2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
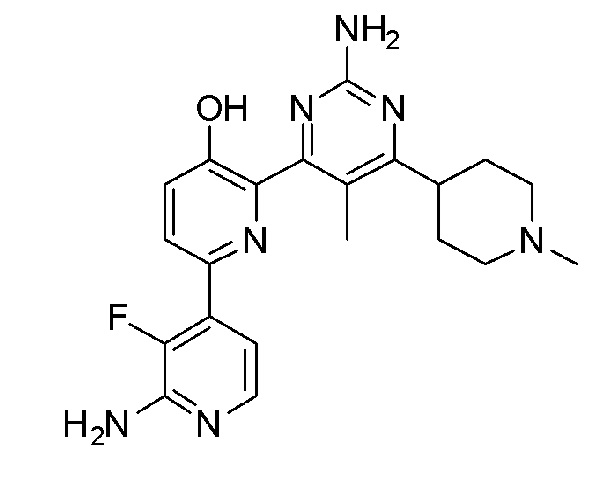
Указанное в заголовке соединение в виде желтого твердого вещества (11,3 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-2-амин, полученный в примере получения 11, вместо соединения, полученного в примере получения 3.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,86 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 3,10 (м, 2H), 2,48 (с, 3H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H).
Пример 43: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
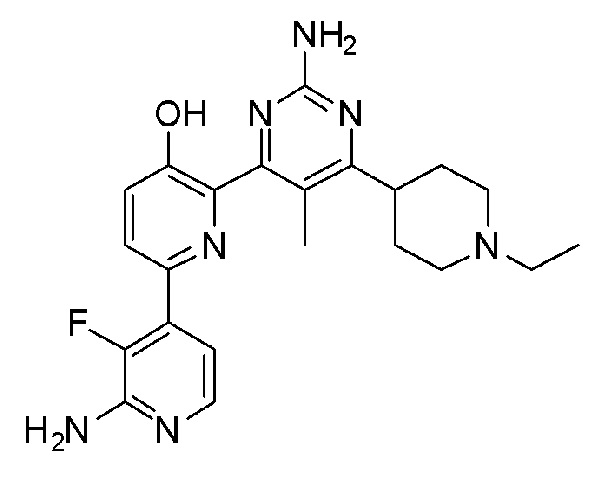
Указанное в заголовке соединение в виде желтого твердого вещества (42,1 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-4-ил)пропан-1-он вместо 1-(пиперидин-4-ил)этанон гидрохлорида в примере 35-1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,12 (с, 1H), 7,85 (д, J=7,8 Гц, 1H), 7,80 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 2H), 3,10 (м, 2H), 3,03 (м, 2H),2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 2,48 (т, 3H).
Пример 44: Получение 2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
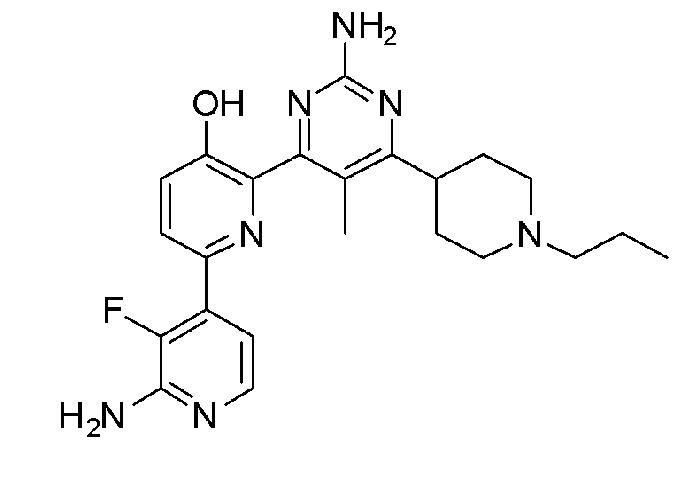
Указанное в заголовке соединение в виде желтого твердого вещества (44,8 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-4-ил)пропан-1-он и 1-йодпропан (CH3CH3CH3I) вместо 1-(пиперидин-4-ил)этанона гидрохлорида и йодэтана (CH3CH2I) в Примере 35-1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,12 (с, 1H), 7,85 (д, J=8,6 Гц, 1H), 7,80 (д, J=6,4 Гц, 1H), 7,47 (с, 1H), 7,45 (д, J=8,6 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 2H), 3,82 (м, 2H), 3,10 (м, 2H), 3,03 (м, 2H),2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,45 (т, 3H).
Пример 45: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
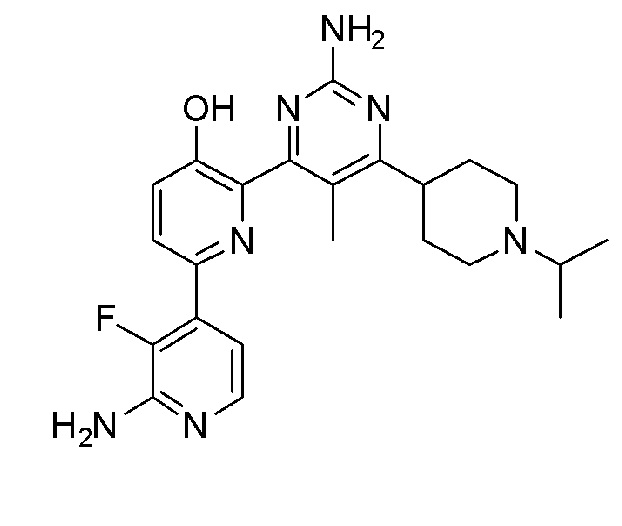
Указанное в заголовке соединение в виде желтого твердого вещества (54,1 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-4-ил)пропан-1-он и 2-йодпропан (CH3CH(I)CH3) вместо 1-(пиперидин-4-ил)этанона гидрохлорида и йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,12 (с, 1H), 7,85 (д, J=8,6 Гц, 1H), 7,80 (д, J=6,4 Гц, 1H), 7,46 (с, 1H), 7,46 (д, J=8,0 Гц, 1H), 7,18 (с, 2H), 7,18 (т, 1H), 6,25 (с, 2H), 3,10 (м, 2H), 2,54 (м, 1H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,15 (д, 6H).
Пример получения 12: Получение 1-(1-метилпиперидин-3-ил)пропан-1-она
Указанное в заголовке соединение в виде желтого твердого вещества (2,8 г) получали способом, аналогичным способу примера получения 6, за исключением того, что использовали нипекотиновую кислоту и этилмагний бромид вместо изонипекотиновой кислоты в примере получения 6-1 и метилмагния бромида в примере получения 6-3.
1H ЯМР (600 МГц, ДМСО-d6) δ 3,11 (м, 2H), 3,24 (м, 2H), 2,48 (м, 3H), 2,35 (с, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,23 (т, 3H).
Пример получения 13: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-2-амина (LXIX)
Указанное в заголовке соединение в виде желтого твердого вещества (1,42 г) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(1-метилпиперидин-3-ил)пропан-1-он, полученный в примере получения 12, вместо ацетона в примере получения 3-4.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,44 (д, J=7,8 Гц, 1H), 7,41 (д, J=6,0 Гц, 1H), 7,18 (с, 2H), 3,83 (с, 3H), 3,12 (м, 2H), 2,48 (с, 3H), 2,56 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,28 (м, 2H).
Пример 46: Получение 2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
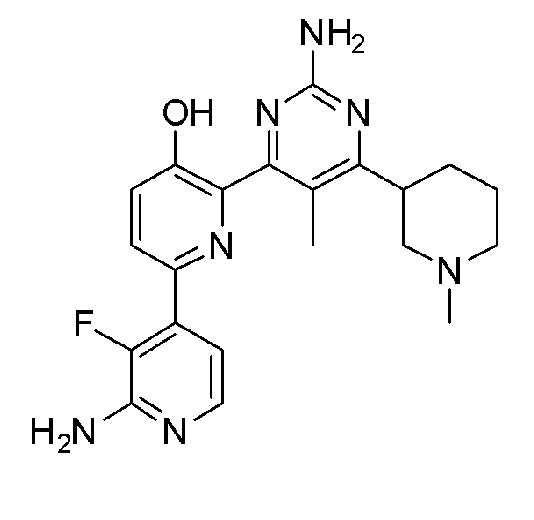
Указанное в заголовке соединение в виде желтого твердого вещества (33,8 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-2-амин, полученный в примере получения 13, вместо соединения, полученного в примере получения 3.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,86 (д, J=8,4 Гц, 1H), 7,81 (д, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 3,24 (м, 2H), 3,10 (м, 2H), 2,53 (с, 3H), 2,48 (м, 3H), 2,35 (с, 3H), 2,06 (м, 2H), 1,91 (м, 2H).
Пример 47: Получение 2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
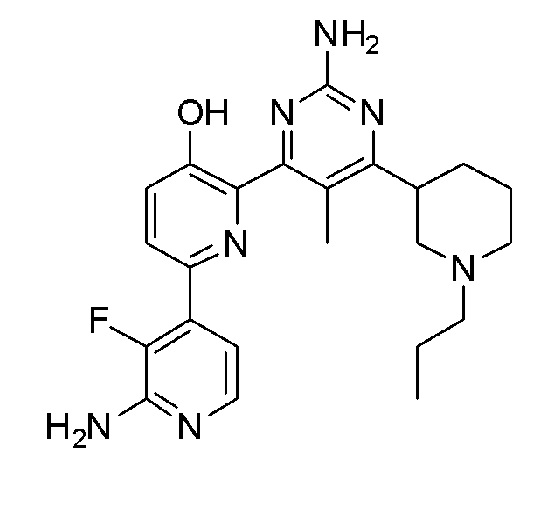
Указанное в заголовке соединение в виде желтого твердого вещества (18,2 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-3-ил)пропан-1-он и 1-йодпропан (CH3CH3CH3I) вместо 1-(пиперидин-4-ил)этанона гидрохлорида и йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,85 (д, J=8,4 Гц, 1H), 7,81 (д, J=8,0 Гц, 1H), 7,47 (с, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,13 (т, 1H), 6,25 (с, 1H), 3,23 (м, 2H), 2,35 (м, 2H), 3,10 (м, 2H), 2,48 (м, 3H), 2,35 (м, 2H), 2,06 (м, 2H), 1,91 (м, 2H), 1,23 (т, 3H).
Пример 48: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
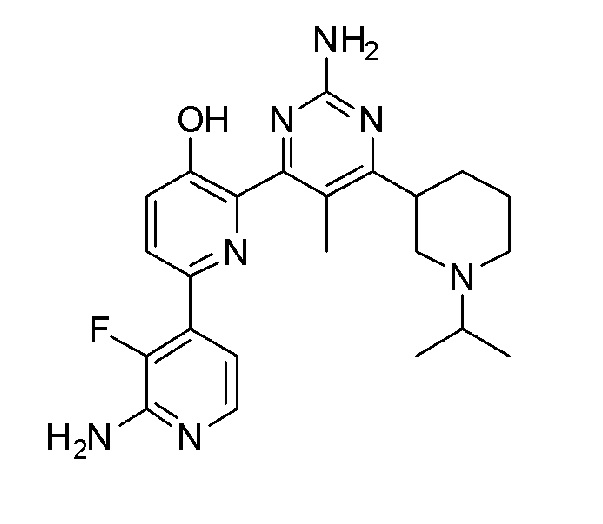
Указанное в заголовке соединение в виде желтого твердого вещества (32 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(пиперидин-3-ил)пропан-1-он и 2-йодпропан (CH3CH(I)CH3) вместо 1-(пиперидин-4-ил)этанона гидрохлорида и йодэтана (CH3CH2I) в примере 35-1.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,11 (с, 1H), 7,85 (д, J=9,0 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 7,47 (с, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,13 (т, 1H), 6,25 (с, 1H), 3,14 (м, 2H), 2,54 (м, 1H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,15 (д, 6H).
Пример получения 14: Получение 1-(1-изопропилпиперидин-4-ил)бутан-1-она
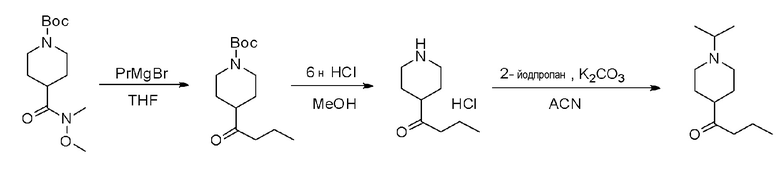
Пример получения 14-1: Получение трет-бутил 4-бутаноилпиперидин-1-карбоксилата
Указанное в заголовке соединение в виде желтого твердого вещества (10,5 г) получали способом, аналогичным способу примера получения 6-3, за исключением того, что использовали пропилмагнийбромид вместо метилмагний бромида в Примере получения 6-3.
1H ЯМР (400 МГц, CDCl3) δ 3,76 (м, 2H), 2,98 (с, 2H), 2,84 (с, 2H), 2,51 (с, 1H), 2,24 (м, 2H), 2,15 (м, 2H), 1,67 (м, 3H), 1,49 (с, 9H).
Пример получения 14-2: Получение 1-(пиперидин-4-ил)бутан-1-он гидрохлорида
Указанное в заголовке соединение в виде желтого твердого вещества (5,07 г) получали способом, аналогичным способу примера получения 6-4, за исключением того, что использовали трет-бутил 4-бутаноилпиперидин-1-карбоксилат вместо трет-бутил 4-ацетилпиперидин-1-карбоксилата в Примере получения 6-4.
1H ЯМР (400 МГц, CDCl3) δ 3,86 (м, 2H), 2,78 (с, 2H), 2,84 (с, 2H), 2,51 (с, 1H), 2,24 (м, 4H), 1,45 (м, 3H).
Пример получения 14-3: Получение 1-(1-изопропилпиперидин-4-ил)бутан-1-она
1-(Пиперидин-4-ил)бутан-1-он гидрохлорид (2,51 г, 10,9 ммоль), полученный в примере получения 14-2, растворяли в ацетонитриле (35 мл). К полученному раствору добавляли по каплям карбонат калия (K2CO3) (2,08 г, 18,9 ммоль) и 2-йодпропан (CH3CH(I)CH3) (0,99 мл, 14,2 ммоль) и раствор перемешивали в течение 18 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли EtOAc, и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (диметилхлорид/метанол=10/1) с получением белого указанного в заголовке соединения (2,09 г, 81%).
1H ЯМР (400 МГц, CDCl3) δ 3,88 (м, 2H), 3,79 (м, 2H), 2,84 (м, 2H), 2,51 (м, 3H), 2,31 (м, 1H), 2,24 (м, 4H), 1,45 (м, 3H), 1,24(д, 6H)
Пример 49: Получение 2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
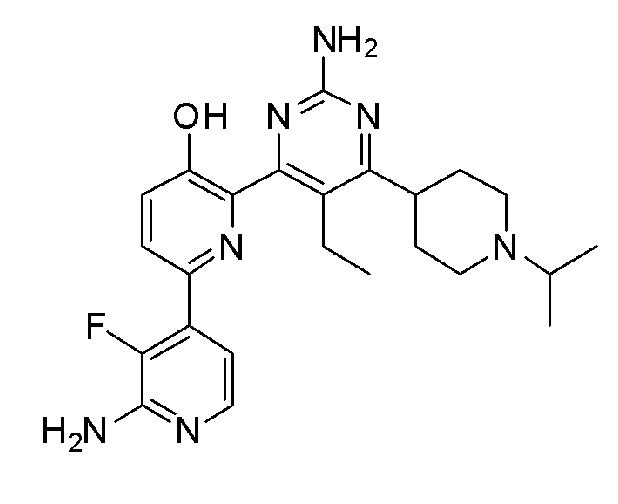
Указанное в заголовке соединение в виде желтого твердого вещества (21,5 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(1-изопропилпиперидин-4-ил)бутан-1-он, полученный в примере получения 14, вместо 1-(1-этилпиперидин-4-ил)этанона в примере 35-2.
1H ЯМР (400 МГц, MeOD-d4) δ 10,0 (с, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,85 (д, J=6,8 Гц, 1H), 7,66 (д, J=8,4 Гц, 1H), 7,26 (м, 1H), 3,08 (м, 2H), 2,93 (м, 3H), 2,74 (м, 1H), 2,24 (м, 2H), 2,00 (м, 2H), 1,62 (м, 2H), 1,25 (т, 3H), 1,04 (д, 6H).
Пример получения 15: Получение 1-(1-изопропилпиперидин-4-ил)пентан-1-она
Указанное в заголовке соединение в виде желтого твердого вещества (10,8 г) получали способом, аналогичным способу примера получения 14, за исключением того, что использовали бутилмагний хлорид вместо пропилмагнийбромида в Примере получения 14-1.
1H ЯМР (400 МГц, MeOD-d4) δ, 3,43 (м, 2H), 3,27 (м, 2H), 3,15 (м, 4H), 2,27 (м, 3H), 1,92 (м, 2H), 1,34 (м, 6H), 0,71 (м, 3H).
Пример 50: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
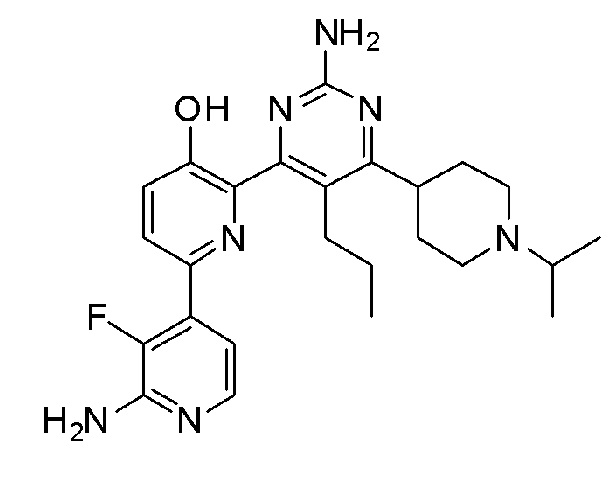
Указанное в заголовке соединение в виде желтого твердого вещества (32,1 мг) получали способом, аналогичным способу примера 35, за исключением того, что использовали 1-(1-изопропилпиперидин-4-ил)пентан-1-он, полученный в примере получения 15, вместо 1-(1-этилпиперидин-4-ил)этанона в Примере 35-2.
1H ЯМР (400 МГц, MeOD-d4) δ 10,1 (с, 1H), 8,01 (д, J=9,0 Гц, 1H), 7,84 (д, J=7,2 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,26 (м, 1H), 3,08 (м, 2H), 2,93 (м, 3H), 2,74 (м, 1H), 2,52 (м, 1H), 2,24 (м, 2H), 2,00 (м, 2H), 1,63 (м, 2H), 1,23 (т, 3H), 1,02 (д, 6H).
Пример 51: Получение 2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXXVI)
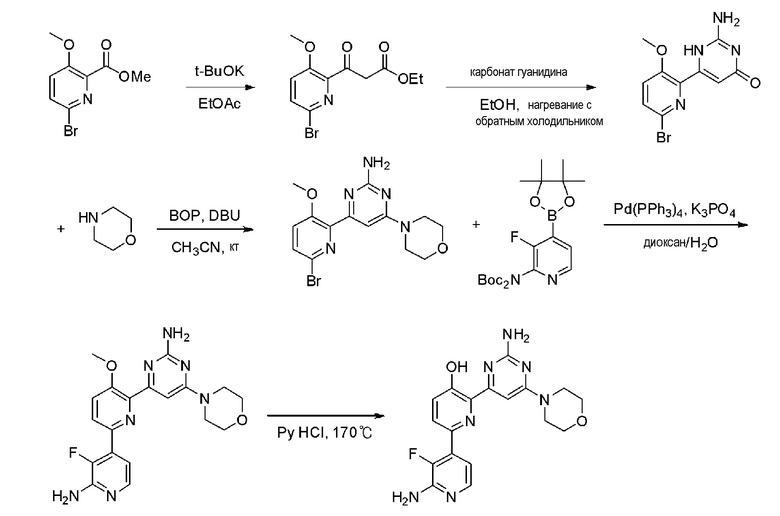
Пример 51-1: Получение этил 3-(6-бром-3-метоксипиридин-2-ил)-3-оксопропаноата (LXXII)
Метил 6-бром-3-метоксипиколинат (4,18 г, 16,99 ммоль), полученный в примере получения 3-3, растворяли в этаноле (85 мл). Полученный раствор охлаждали до 0°С и к нему добавляли по каплям трет-бутоксид калия (t-BuOK). Раствор перемешивали при комнатной температуре в течение 2 часов. К раствору добавляли по каплям дистиллированную воду и уксусную кислоту (5 мл) и раствор перемешивали в течение 10 мин. Раствор разбавляли этилацетатом и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=2/1) с получением белого указанного в заголовке соединения (3,41 г, 66%).
1H ЯМР (600 МГц, CDCl3) δ 7,58 (д, J=8,4 Гц, 1H), 7,28 (д, J=8,4 Гц, 1H), 4,18 (кв, J=7,2 Гц, 2H), 4,05 (с, 2H), 3,93 (с, 3H), 1,25 (т, J=7,2 Гц, 3H).
Пример 51-2: Получение 2-амино-6-(6-бром-3-метоксипиридин-2-ил)пиримидин-4-(1H)-она (LXXIII)
Этил 3-(6-бром-3-метоксипиридин-2-ил)-3-оксопропаноат (3,41 г, 11,29 ммоль) растворяли в этаноле (40 мл). К полученному раствору добавляли по каплям карбонат гуанидина (2,64 г, 14,67 ммоль) и раствор нагревали с обратным холодильником в течение 24 часов. Смесь охлаждали до комнатной температуры и выпаривали при пониженном давлении до концентрата. Полученный остаток разбавляли дистиллированной водой и нейтрализовали конц. HCl с получением твердого вещества. Твердое вещество фильтровали с получением указанного в заголовке соединения (3,47 г, 100%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,71 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 1H), 3,89 (с, 3H).
Пример 51-3: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-морфолинопиримидин-2-амина (LXXIV)
2-амино-6-(6-бром-3-метоксипиридин-2-ил)пиримидин-4-(1H)-он (100,0 мг, 336,58 мкмоль) растворяли в ацетонитриле (3,36 мл). К полученному раствору добавляли по каплям (бензотриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфат (BOP) (193,52 мг, 437,55 мкмоль), 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU) (75,5 мкл, 504,86 мкмоль) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. К смеси добавляли по каплям морфолин (44,43 мкл, 504,86 мкмоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Полученный раствор выпаривали при пониженном давлении до концентрата, разбавляли этилацетатом и промывали дистиллированной водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол=15/1) с получением указанного в заголовке соединения (98 мг, 80%).
1H ЯМР (600 МГц, MeOH-d4) δ 7,77 (д, J=9,0 Гц, 1H), 7,71 (д, J=8,4 Гц, 1H), 7,36 (с, 1H), 4,09 (с, 3H), 3,88 (м, 4H), 3,79 (м, 4H).
Пример 51-4: Получение 6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амина (LXXV)
4-(6-бром-3-метоксипиридин-2-ил)-6-морфолинопиримидин-2-амин (157,91 мг, 431,21 мкмоль) и 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (378 мг, 862,42 мкмоль), полученный в примере получения 1, растворяли в диоксане (4 мл). К полученному раствору добавляли по каплям фосфат калия (K3PO4) (274,6 мг, 1,29 ммоль), растворенный в дистиллированной воде (2 мл), и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (24,94 мг, 21,56 мкмоль). Раствор нагревали с обратным холодильником в течение 24 часов, охлаждали и выпаривали при пониженном давлении до концентрата. Раствор разбавляли дихлорметаном и промывали водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (этилацетат/гексан, 6/1) с получением указанного в заголовке соединения (47 мг, 27%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,88 (д, J=7,8 Гц, 1H), 7,78 (д, J=4,8 Гц, 1H), 7,66 (д, J=8,4 Гц, 1H) 6,99 (т, J=6,0 Гц, 1H), 6,23 (м, 5H), 3,85 (с, 3H), 3,65 (м, 4H), 3,53 (м, 4H).
Пример 51-5: Получение 2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXXVI)
6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-5-метокси-[2,4'-бипиридин]-2'-амин (120 мг, 301,95 мкмоль) и пиридин гидрохлорид (пиридин HCl) (523,41 мг, 4,53 ммоль) перемешивали в запаянной трубке при 170°С в течение 3 часов. Полученную смесь охлаждали до комнатной температуры, нейтрализовали 2 н раствором NaOH с получением твердого вещества. Твердое вещество фильтровали, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (72 мг, 62%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,82-7,80 (м, 2H), 7,41 (д, J=8,4 Гц, 1H), 7,14 (т, J=5,4 Гц, 1H), 7,03 (с, 1H), 6,82 (ушир, 2H), 6,25 (ушир, 2H), 3,70-3,68 (м, 4H), 3,64-3,63 (м, 4H).
Пример 52: Получение 2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
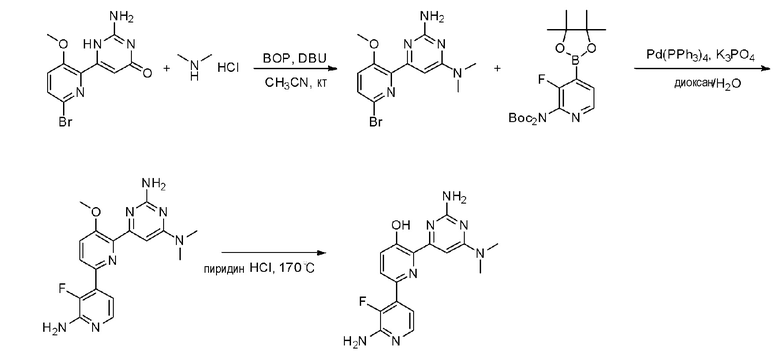
Пример 52-1: Получение 6-(6-бром-3-метоксипиридин-2-ил)-N4,N4-диметилпиримидин-2,4-диамина (LXXIV)
2-амино-6-(6-бром-3-метоксипиридин-2-ил)пиримидин-4(1H)-он (400,0 мг, 1,35 ммоль), полученный в примере 51-2, растворяли в ацетонитриле (136,5 мл). К полученному раствору добавляли по каплям (бензотриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфат (BOP) (774,09 мг, 1,75 ммоль) и 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU) (604,1 мкл, 4,04 ммоль) и раствор перемешивали при комнатной температуре в течение 10 минут. К раствору добавляли по каплям диметиламин гидрохлорид (164,69 мг, 2,02 ммоль) и раствор перемешивали при комнатной температуре в течение 24 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли этилацетатом и промывали дистиллированной водой. Органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (дихлорметан/метанол=15/1) с получением указанного в заголовке соединения (436 мг, 99%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,92 (д, J=9,0 Гц, 1H), 7,82 (д, J=9,0 Гц, 1H), 7,16 (с, 1H), 4,04 (с, 3H), 3,31 (с, 6H).
Пример 52-2: Получение 6-(2'-амино-3'-фтор-5-метокси-[2,4'-бипиридин]-6-ил-N4,N4-диметилпиримидин-2,4-диамина (LXXV)
6-(6-бром-3-метоксипиридин-2-ил)-N4,N4-диметилпиримидин-2,4-диамин (214,49 мг, 661,65 мкмоль) и 2-[3-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-пиридинил]-имидодикарбоновая кислота-1,3-бис(1,1-диметилэтил)сложный эфир (580 мг, 1,32 ммоль), полученный в примере получения 1, растворяли в диоксане (6 мл). К полученному раствору добавляли по каплям фосфат калия (K3PO4) (421,34 мг, 1,98 ммоль), растворенный в дистиллированной воде (3 мл), и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (38,26 мг, 33,08 мкмоль). Раствор нагревали с обратным холодильником в течение 24 часов, охлаждали, и выпаривали при пониженном давлении до концентрата. Раствор разбавляли дистиллированной водой и дихлорметаном и затем полученное твердое вещество фильтровали, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (96 мг, 41%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,93 (д, J=8,4 Гц, 1H), 7,80 (д, J=5,4 Гц, 1H), 7,74 (д, J=8,4 Гц, 1H), 7,03 (т, J=4,8 Гц, 1H), 6,59 (с, 2H), 6,41 (с, 1H), 6,28 (с, 2H), 3,90 (с, 3H), 3,08 (с, 6H).
Пример 52-3: Получение 2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола (LXXVI)
6-(2'-амино-3'-фтор-5-метокси-[2,4'-бипиридин]-6-ил-N4,N4-диметилпиримидин-2,4-диамин (96 мг, 270,13 мкмоль) и пиридин гидрохлорид (пиридин HCl) (936,5 мг, 8,10 ммоль) перемешивали в запаянной трубке при 170°С в течение 2 часов. Полученную смесь охлаждали до комнатной температуры и нейтрализовали 2 н раствором NaOH с получением твердого вещества. Твердое вещество фильтровали, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (22 мг, 24%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,82 (д, J=5,4 Гц, 1H), 7,80 (д, J=7,2 Гц, 1H), 7,39 (д, J=8,4 Гц, 1H), 7,12 (т, J=5,4 Гц, 1H), 6,94 (с, 1H), 6,72 (ушир, 2H), 6,25 (ушир, 2H), 3,11 (с, 6H).
Пример 53: Получение 2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
Указанное в заголовке соединение в виде желтого твердого вещества (28 мг) получали способом, аналогичным способу примера 52, за исключением того, что использовали 4-метилпиперазин вместо диметиламина гидрохлорида в примере 52-1.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,84-7,82 (м, 2H), 7,44 (д, J=9,0 Гц, 1H), 7,19 (т, J=4,8 Гц, 1H), 7,10 (с, 1H), 6,94 (ушир, 2H), 6,30 (ушир, 2H), 3,47 (м, 4H), 3,06 (м, 4H), 2,79 (с, 3H).
Пример 54: Получение 6-(2-амино-6-хлорпиримидин-4-ил)-[2,4'-бипиридин]-5-ола
Пример 54-1: Получение 4-(6-бром-3-метоксипиридин-2-ил)-6-хлорпиримидин-2-амина
2-амино-6-(6-бром-3-метоксипиридин-2-ил)пиримидин-4(1H)-он (100 мг, 336,58 моль), полученный в примере 51-2, растворяли в ацетонитриле (2 мл). К полученному раствору добавляли по каплям бензилтриэтиламмоний хлорид (TEBAC) (153,33 мг, 673,15 мкмоль), триэтиламин (93,82 мкл, 673,15 мкмоль) и фосфорилхлорид (POCl3) (313,72 мкл, 3,37 ммоль) и раствор кипятили с обратным холодильником в течение 4 часов и охлаждали до комнатной температуры. Раствор выпаривали при пониженном давлении до концентрата и нейтрализовали 6 н гидроксидом натрия. После экстракции раствора дихлорметаном, органический растворитель сушили над безводным сульфатом магния (MgSO4), фильтровали и выпаривали при пониженном давлении до концентрата. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (26 мг, 24%).
1H ЯМР (600 МГц, ДМСО-d6) δ 7,72 (д, J=9,0 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,28 (ушир, 2H), 6,93 (с, 1H).
Пример 54-2: Получение 4-хлор-6-(5-метокси-[2,4'-бипиридин]-6-ил)пиримидин-2-амина
4-(6-бром-3-метоксипиридин-2-ил)-6-хлорпиримидин-2-амин (26 мг, 82,39 мкмоль) и пиридин-4-илбороновую кислоту (12,15 мг, 98,87 мкмоль) растворяли в диоксане (300 мкл). К полученному раствору добавляли по каплям фосфат калия (K3PO4) (52,47 мг, 247,18 мкмоль), растворенный в дистиллированной воде (100 мкл), и тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4) (4,76 мг, 4,12 мкмоль). Раствор нагревали с обратным холодильником в течение 24 часов, охлаждали, выпаривали при пониженном давлении до концентрата и разбавляли дистиллированной водой и дихлорметаном. Полученное твердое вещество фильтровали, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (7,6 мг, 29%).
1H ЯМР (600 МГц, MeOD-d4) δ 8,60 (м, 2H), 8,16 (д, J=9,0 Гц, 1H), 8,10 (м, 2H), 7,74 (д, J=9,6 Гц, 1H), 7,15 (с, 1H), 3,98 (с, 3H).
Пример 54-3: Получение 6-(2-амино-6-хлорпиримидин-4-ил)-[2,4'-бипиридин]-5-ола
4-хлор-6-(5-метокси-[2,4'-бипиридин]-6-ил)пиримидин-2-амин (20 мг, 63,74 мкмоль) и пиридин гидрохлорид (пиридин HCl) (73,66 мг, 637,45 ммоль) перемешивали в запаянной трубке при 170°С в течение 3 часов. Смесь охлаждали до комнатной температуры и нейтрализовали 2 н раствором NaOH. Полученное твердое вещество фильтровали, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (6 мг, 31%).
1H ЯМР (600 МГц, ДМСО-d6) δ 8,64 (м, 2H), 8,16 (д, J=5,4 Гц, 2H), 8,05 (д, J=9,0 Гц, 1H), 7,41 (д, J=8,4 Гц, 1H), 6,97 (с, 1H).
Пример получения 16: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-метилпиримидин-2-амина (LXIX)
Указанное в заголовке соединение в виде желтого твердого вещества (4,1 г) получали способом, аналогичным способу примера получения 2, за исключением того, что использовали 3M раствор этилмагний бромида диэтилового эфира вместо 3M раствора метилмагний бромида в тетрагидрофуране (THF) в примере получения 2-2.
1H ЯМР (600 МГц, MeOH-d4) δ 7,77 (д, J=9,0 Гц, 1H), 7,71 (д, J=8,4 Гц, 1H), 7,36 (с, 1H), 3,87 (с, 3H), 2,45 (с, 3H).
Пример 55: Получение 2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
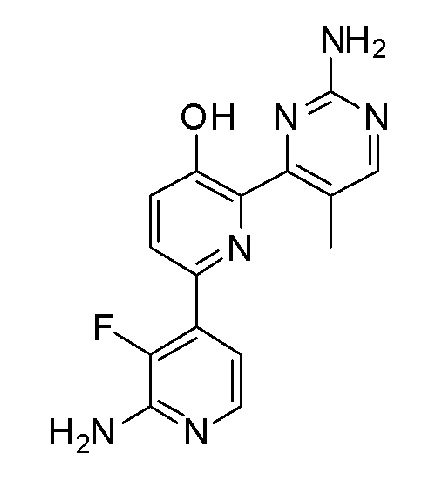
Указанное в заголовке соединение в виде желтого твердого вещества (8,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-метилпиримидин-2-амин, полученный в примере получения 16, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, CD3OD) δ 8,32 (с, 1H), 8,01 (д, J= 9,0 Гц, 1H), 7,78 (д, J=9,0 Гц, 1H), 7,49 (д, J=9,0 Гц, 1H), 7,41 (т, 1H), 2,64 (с, 3H).
Пример получения 17: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-этилпиримидин-2-амина (LXIX)
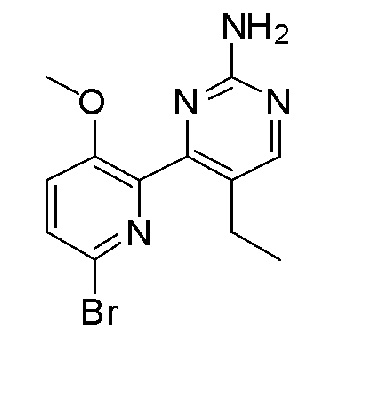
Указанное в заголовке соединение в виде желтого твердого вещества (451 мг) получали способом, аналогичным способу примера получения 2, за исключением того, что использовали 3M раствор пропилмагний бромида диэтилового эфира вместо 3M раствора метилмагний бромида в тетрагидрофуране (THF) в примере получения 2-2.
1H ЯМР (600 МГц, MeOH-d4) δ 7,76 (д, J=8,4 Гц, 1H), 7,71 (д, J=8,4 Гц, 1H), 7,36 (с, 1H), 3,87 (с, 3H), 2,89 (м, 2H), 0,73 (т, 3H).
Пример 56: Получение 2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
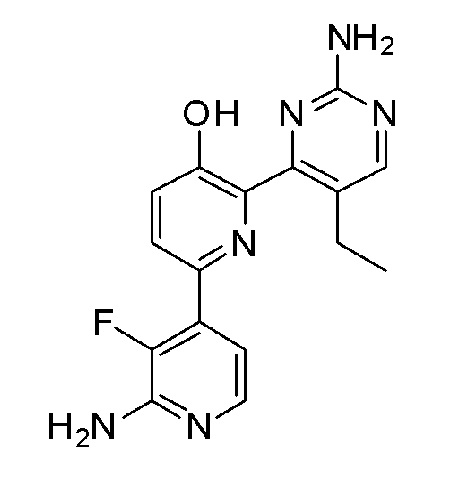
Указанное в заголовке соединение в виде желтого твердого вещества (18,9 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-этилпиримидин-2-амин, полученный в примере получения 17, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,32 (с, 1H), 7,85 (д, J= 9,0 Гц, 1H), 7,79 (д, J=9,0 Гц, 1H), 7,78 (с, 2H), 6,78 (м, 1H), 6,25 (с, 2H), 2,85 (м, 2H), 1,04(т, 3H).
Пример получения 18: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-пропилпиримидин-2-амина (LXIX)
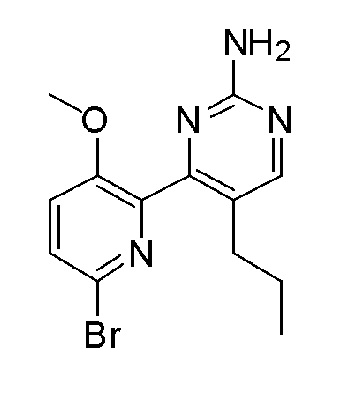
Указанное в заголовке соединение в виде желтого твердого вещества (28 мг) получали способом, аналогичным способу примера получения 2, за исключением того, что использовали 3M раствор бутилмагний хлорида диэтилового эфира вместо 3M раствора метилмагний бромида в тетрагидрофуране (THF) в примере получения 2-2.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,27 (с, 1H), 7,51 (д, J= 9,0 Гц, 1H), 7,42 (д, J=9,0 Гц, 1H), 3,85 (с, 3H), 2,85 (м, 2H), 1,44 (м, 2H), 1,04 (т, 3H)
Пример 57: Получение 2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
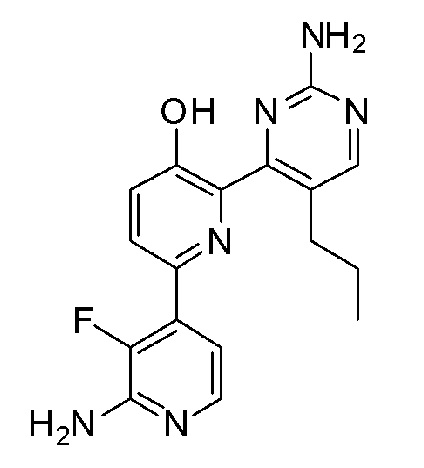
Указанное в заголовке соединение в виде желтого твердого вещества (6,4 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-пропилпиримидин-2-амин, полученный в примере получения 18, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 13,93 (с, 1H), 8,27 (с, 1H), 7,51 (д, J= 9,0 Гц, 1H), 7,42 (д, J=9,0 Гц, 1H), 6,98 (с, 2H), 6,78 (м, 1H), 6,25 (с, 2H), 2,85 (м, 2H), 1,44 (м, 2H), 1,04(т, 3H).
Пример получения 19: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5-изопропилпиримидин-2-амина (LXIX)
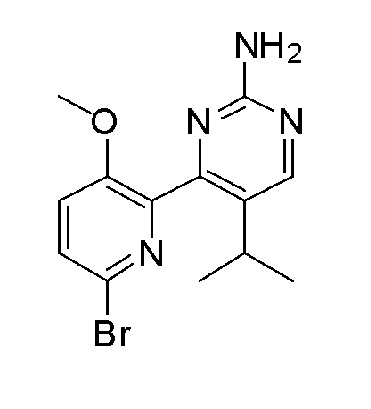
Указанное в заголовке соединение в виде желтого твердого вещества (120 мг) получали способом, аналогичным способу примера получения 2, за исключением того, что использовали 3M раствор изобутилмагний хлорида диэтилового эфира вместо 3M раствора метилмагний бромида в тетрагидрофуране (THF) в примере получения 2-2.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,11 (с, 1H), 7,54 (д, J= 9,0 Гц, 1H), 7,42 (д, J=9,0 Гц, 1H), 3,27 (м, 2H), 1,04 (д, 6H)
Пример 58: Получение 2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
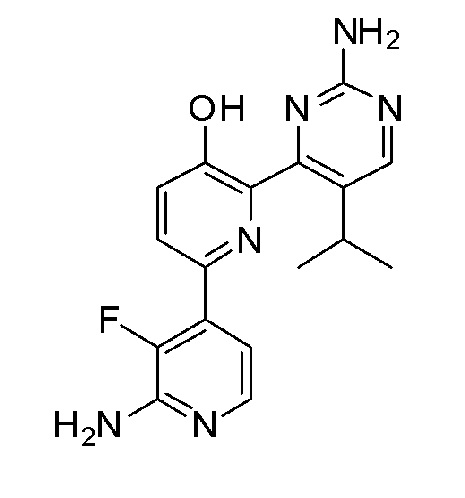
Указанное в заголовке соединение в виде желтого твердого вещества (21,8 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5-изопропилпиримидин-2-амин, полученный в примере получения 19, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 13,12 (с, 1H), 8,23 (с, 1H), 7,51 (д, J= 9,0 Гц, 1H), 7,40 (д, J=9,0 Гц, 1H), 6,98 (с, 2H), 6,78 (м, 1H), 6,25 (с, 2H), 3,26 (м, 2H), 1,11 (д, 6H).
Пример получения 20: Получение 4-(6-бром-3-метоксипиридин-2-ил)-N-метил-6-(1-метилпиперидин-4-ил)пиримидин-2-амина (LXIX)
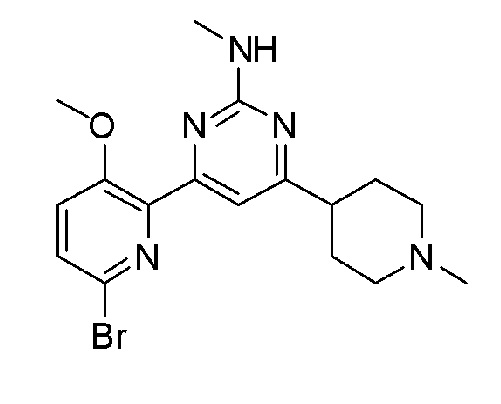
Указанное в заголовке соединение в виде желтого твердого вещества (331 мг) получали способом, аналогичным способу примера получения 3, за исключением того, что использовали 1-(1-метилпиперидин-4-ил)этанон, полученный в примере получения 6, вместо ацетона в примере получения 3-4 и с использованием 1-метилгуанидина вместо гуанидина в примере получения 3-5.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,56 (д, J=7,8 Гц, 1H), 7,41 (д, J=6,0 Гц, 1H), 7,38 (с, 2H), 7,32 (т, 1H), 3,48 (с, 3H), 3,10 (м, 2H), 2,48 (с, 3H), 2,42 (с, 3H), 2,35 (м, 3H), 2,14 (м, 2H), 1,28 (м, 2H).
Пример 59: Получение 2'-амино-3'-фтор-6-(2-(метиламино)-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-[2,4'-бипиридин]-5-ола
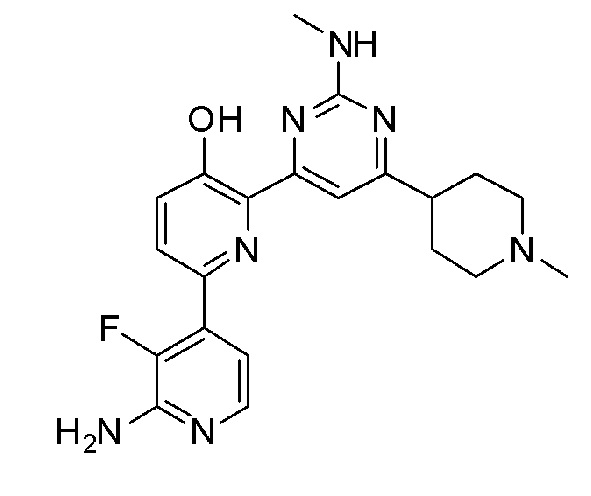
Указанное в заголовке соединение в виде желтого твердого вещества (29,9 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-N-метил-6-(1-метилпиперидин-4-ил)пиримидин-2-амин, полученный в примере получения 20, вместо соединения, полученного в примере получения 3.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 7,86 (д, J=7,8 Гц, 1H), 7,81 (д, J=6,0 Гц, 1H), 7,47 (с, 1H), 7,46 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 3,10 (м, 2H), 2,48 (с, 3H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H).
Пример получения 21: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5,6-диметилпиримидин-2-амина
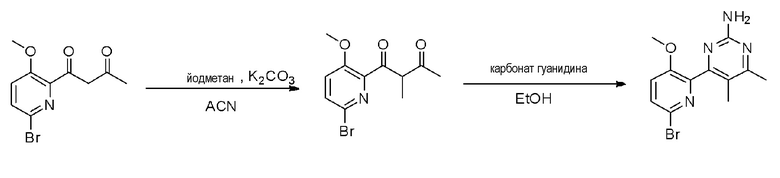
Пример получения 21-1: Получение 1-(6-бром-3-метоксипиридин-2-ил)-2-метилбутан-1,3-диона
1-(6-бром-3-метоксипиридин-2-ил)бутан-1,3-дион (15,41 г, 45,21 ммоль), полученный в примере получения 3-4, растворяли в ацетонитриле (100 мл). К полученному раствору добавляли по каплям карбонат калия (K2CO3) (16,88 г, 135,63 ммоль) и йодметан (CH3I) (4,56 мл, 90,42 ммоль) и раствор перемешивали в течение 18 часов. Раствор выпаривали при пониженном давлении до концентрата, разбавляли EtOAc и промывали водой. Промытый органический растворитель сушили над безводным сульфатом магния (MgSO4) до концентрата. Полученный остаток выделяли и очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=3/1) с получением белого указанного в заголовке соединения (15,18 г, 67%).
1H ЯМР (600 МГц, CDCl3) δ 7,57 (д, J=9,0 Гц, 1H), 7,26 (д, J=9,0 Гц, 1H), 3,95 (с, 3H), 2,85 (с, 3H), 2,45 (с, 3H).
Пример получения 21-2: Получение 4-(6-бром-3-метоксипиридин-2-ил)-5,6-диметилпиримидин-2-амина
Указанное в заголовке соединение в виде желтого твердого вещества (3,12 г) получали способом, аналогичным способу примера получения 3-5, за исключением того, что использовали 1-(6-бром-3-метоксипиридин-2-ил)-2-метилбутан-1,3-дион, полученный в примере получения 21-1, вместо соединения, полученного в примере получения 3-4.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,80 (д, J= 9,0 Гц, 1H), 7,38 (д, J=9,0 Гц, 1H), 3,95 (с, 3H), 2,85 (с, 3H), 2,45 (с, 3H).
Пример 60: Получение 2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола
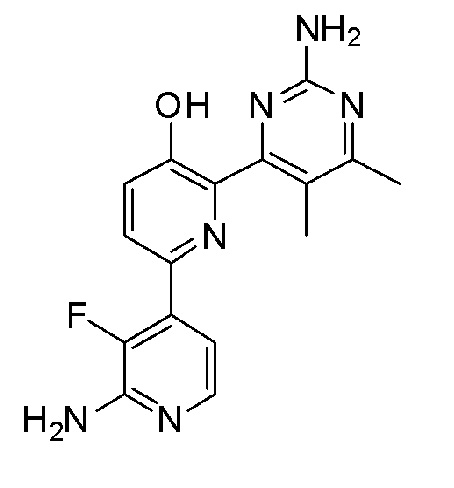
Указанное в заголовке соединение в виде желтого твердого вещества (34,8 мг) получали способом, аналогичным способу примера 24, за исключением того, что использовали 4-(6-бром-3-метоксипиридин-2-ил)-5,6-диметилпиримидин-2-амин, полученный в примере получения 21, вместо соединения, полученного в примере получения 3.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,94 (д, J= 9,0 Гц, 1H), 7,90 (д, J= 8,4 Гц, 1H), 7,54 (м, 1H), 7,11 (м, 1H), 6,96 (с, 2H), 6,79 (с, 2H), 2,44 (с, 3H), 2,22 (с, 3H).
Пример 61: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол 3гидрохлорида
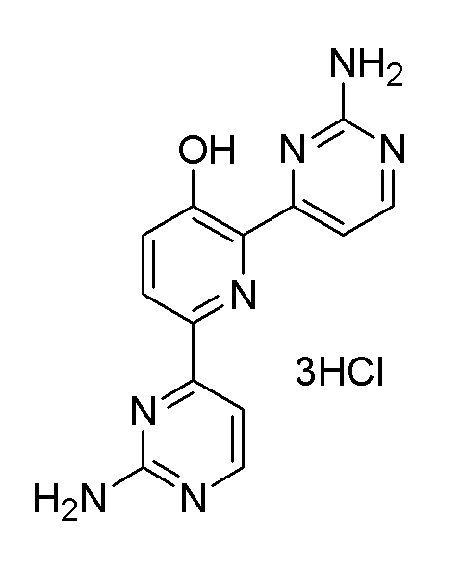
Указанное в заголовке соединение в виде желтого твердого вещества (4,6 мг) получали путем взаимодействия соединения, полученного в примере 1, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,56 (д, J=4,8 Гц, 1H), 8,49 (д, J=5,2 Гц, 1H), 8,39 (д, J=8,8 Гц, 1H), 7,86 (д, J=5,2 Гц 1H), 7,79 (д, J=4,8 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 3,97 (ушир, 7H).
Пример 62: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол оксалата
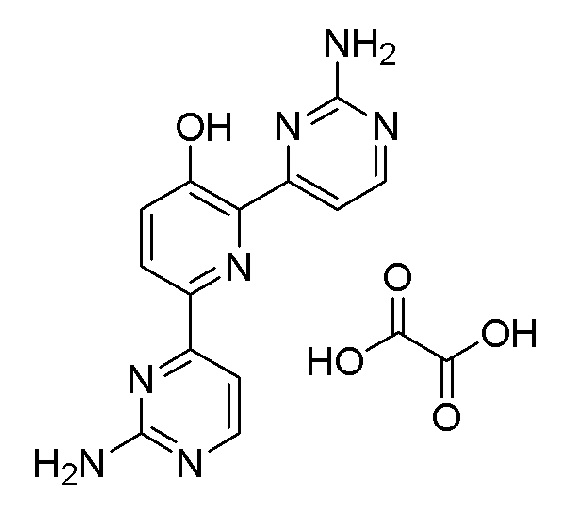
Указанное в заголовке соединение в виде желтого твердого вещества (3,2 мг) получали путем взаимодействия соединения, полученного в примере 1, с щавелевой кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,57 (д, J=4,8 Гц, 1H), 8,47 (д, J=5,2 Гц, 1H), 8,39 (д, J=8,8 Гц, 1H), 7,86 (д, J=5,2 Гц 1H), 7,79 (д, J=4,8 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H).
Пример 63: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол малоната
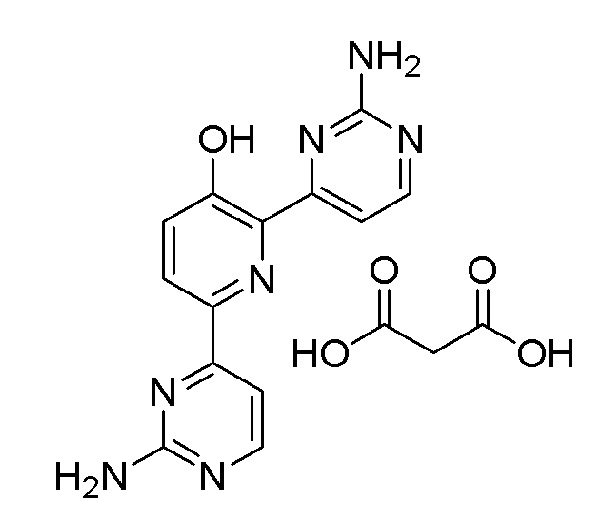
Указанное в заголовке соединение в виде желтого твердого вещества (4,9 мг) получали путем взаимодействия соединения, полученного в примере 1, с малоновой кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,57 (д, J=4,8 Гц, 1H), 8,47 (д, J=5,2 Гц, 1H), 8,39 (д, J=8,8 Гц, 1H), 7,86 (д, J=5,2 Гц 1H), 7,79 (д, J=4,8 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 3,17 (с, 2H).
Пример 64: Получение 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол сульфата
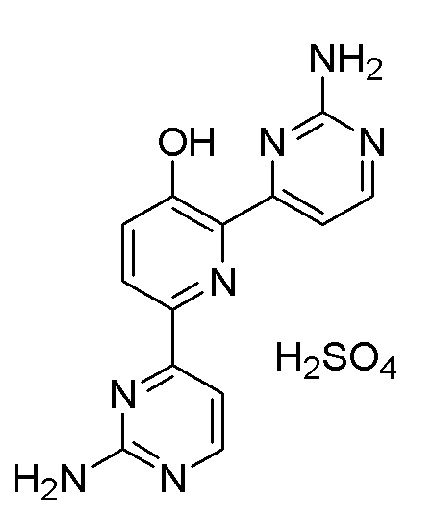
Указанное в заголовке соединение в виде желтого твердого вещества (3,2 мг) получали путем взаимодействия соединения, полученного в примере 1, с серной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,57 (д, J=4,8 Гц, 1H), 8,47 (д, J=5,2 Гц, 1H), 8,39 (д, J=8,8 Гц, 1H), 7,86 (д, J=5,2 Гц 1H), 7,79 (д, J=4,8 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H).
Пример 65: Получение 2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол оксалата
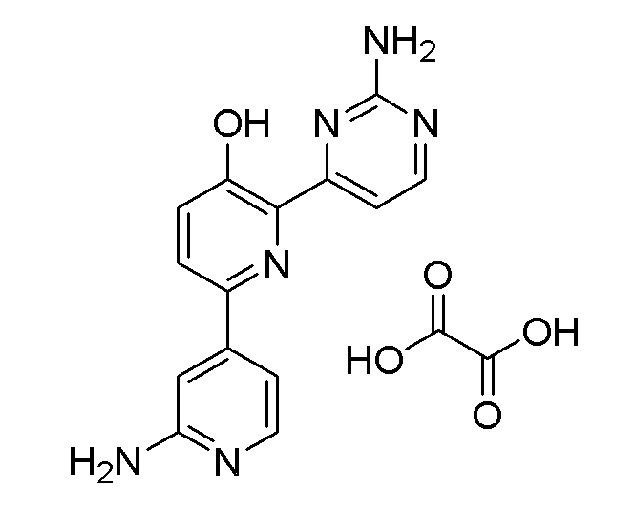
Указанное в заголовке соединение в виде желтого твердого вещества (1,9 мг) получали путем взаимодействия соединения, полученного в примере 10, с щавелевой кислотой.
1H ЯМР (600 МГц, ДМСО) δ 13,55 (с, 1H), 9,66 (с, 1H), 8,48 (д, J=7,8 Гц, 1H), 7,94 (д, J=13,2 Гц, 1H), 7,89 (д, J=13,2 Гц, 1H), 7,65 (д, J=7,8 Гц, 1H), 7,39 (д, J=13,2 Гц, 1H), 7,25 (ушир, 2H), 6,85 (д, J=13,2 Гц, 1H).
Пример 66: Получение 2'-амино-6'-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
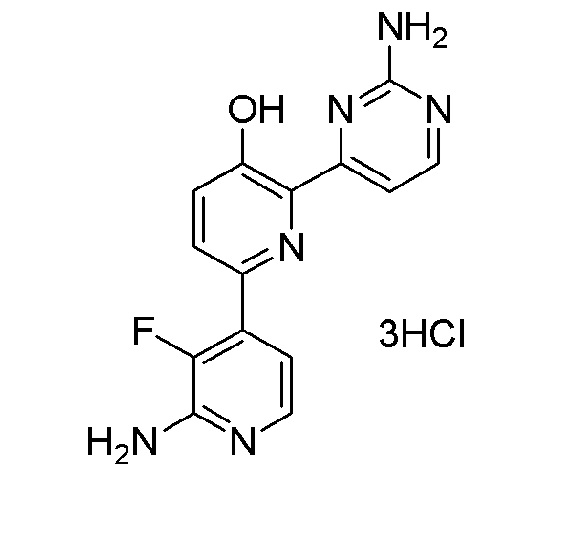
Указанное в заголовке соединение в виде желтого твердого вещества (58 мг) получали путем взаимодействия соединения, полученного в примере 8, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО) δ 14,10 (с, 1H), 8,55 (д, J=7,8 Гц, 1H), 8,03 (д, J=12,6 Гц, 1H), 7,88 (д, J=9,6 Гц, 1H), 7,61 (м, 2H), 7,46 (м, 3H).
Пример 67: Получение 2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетата
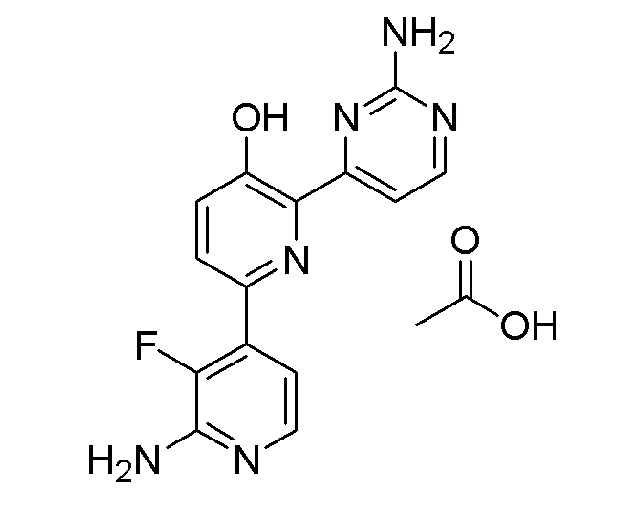
Указанное в заголовке соединение в виде желтого твердого вещества (12,5 мг) получали путем взаимодействия соединения, полученного в примере 8, с уксусной кислотой.
1H ЯМР (600 МГц, ДМСО) δ 14,11 (с, 1H), 8,53 (д, J=7,8 Гц, 1H), 8,01 (д, J=12,6 Гц, 1H), 7,88 (д, J=9,6 Гц, 1H), 7,60 (м, 2H), 7,45 (м, 3H), 2,12 (с, 3H).
Пример 68: Получение 2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалата
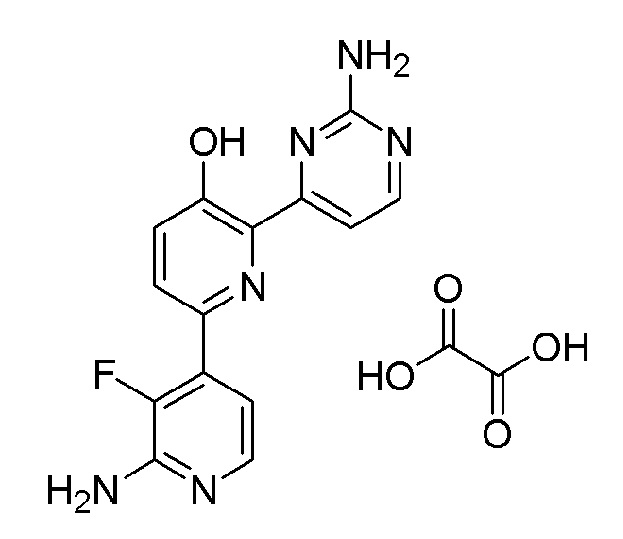
Указанное в заголовке соединение в виде желтого твердого вещества (12,4 мг) получали путем взаимодействия соединения, полученного в примере 8, с щавелевой кислотой.
1H ЯМР (600 МГц, ДМСО) δ 14,10 (с, 1H), 8,53 (д, J=7,8 Гц, 1H), 8,01 (д, J=12,6 Гц, 1H), 7,88 (д, J=9,6 Гц, 1H), 7,59 (м, 2H), 7,45 (м, 3H).
Пример 69: Получение 2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2малоната
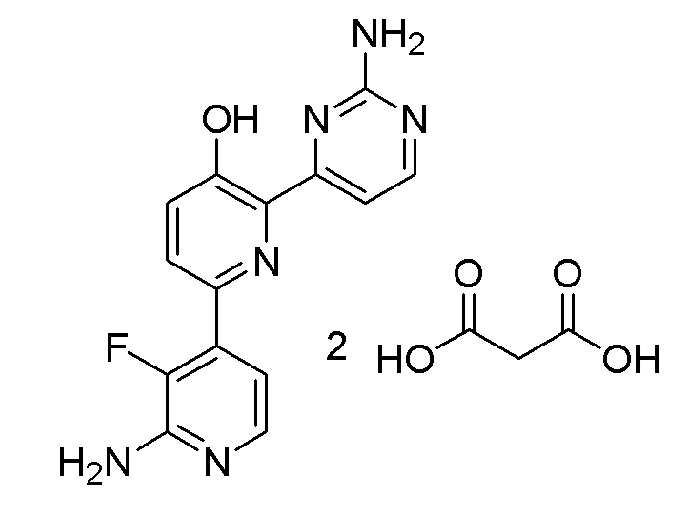
Указанное в заголовке соединение в виде желтого твердого вещества (9,1 мг) получали путем взаимодействия соединения, полученного в примере 8, с малоновой кислотой.
1H ЯМР (600 МГц, ДМСО) δ 14,11 (с, 1H), 8,53 (д, J=7,8 Гц, 1H), 8,01 (д, J=12,6 Гц, 1H), 7,88 (д, J=9,6 Гц, 1H), 7,60 (м, 2H), 7,45 (м, 3H), 3,12 (с, 3H).
Пример 70: Получение 2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол 2гидрохлорида
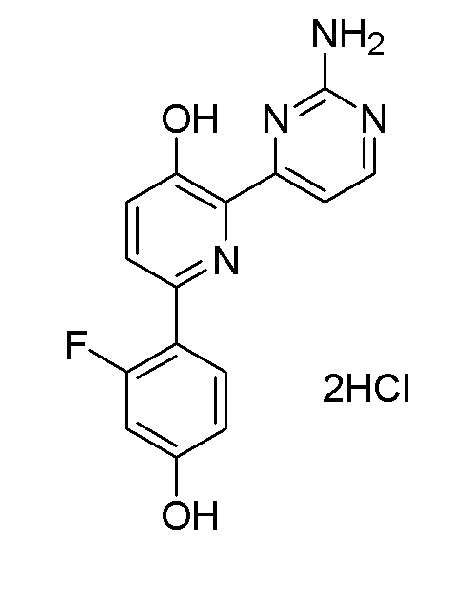
Указанное в заголовке соединение в виде желтого твердого вещества (10,1 мг) получали путем взаимодействия соединения, полученного в примере 17, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО) δ 10,18(с, 1H), 8,05 (с, 1H), 7,89 (м, 1H), 7,77 (м, 1H), 7,68 (м, 1H), 7,46 (м, 1H), 6,77 (д, J=7,8 Гц, 1H), 6,67 (д, J=13,2 Гц, 1H).
Пример 71: Получение 2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
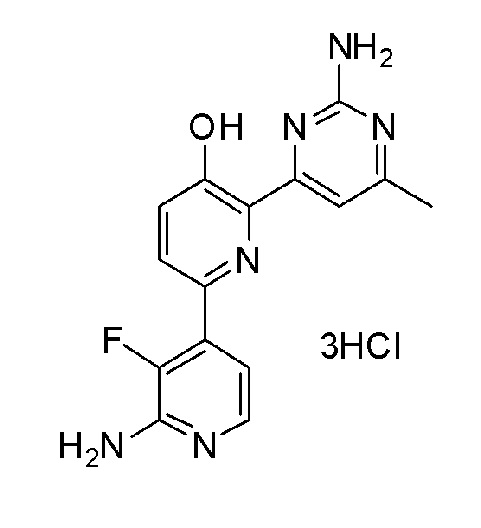
Указанное в заголовке соединение в виде желтого твердого вещества (10,1 мг) получали путем взаимодействия соединения, полученного в примере 24, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 7,84 (д, J=9,0 Гц, 1H), 7,82 (д, J=5,4 Гц, 1H), 7,48 (м, 2H), 7,20 (ушир, 2H), 7,13 (т, 1H), 6,28 (ушир, 2H), 2,38 (с, 3H).
Пример 72: Получение 2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
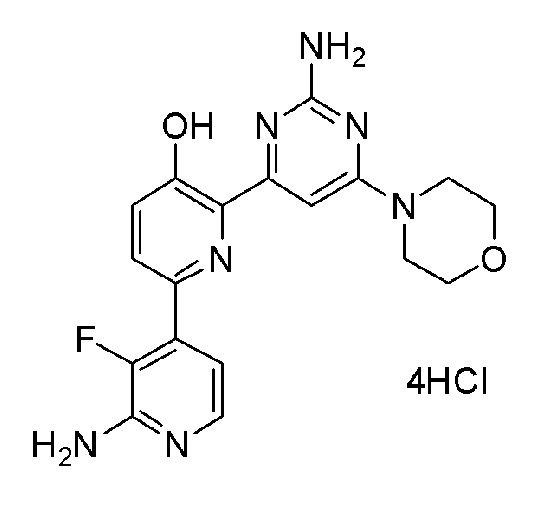
Указанное в заголовке соединение в виде желтого твердого вещества (203 мг) получали путем взаимодействия соединения, полученного в примере 51, с хлористоводородной кислотой.
1H ЯМР (600 МГц, MeOD-d4) δ 8,17 (дд, J=1,8, 8,4 Гц, 1H), 7,82 (д, J=7,2 Гц, 1H), 7,77 (т, J=7,2 Гц, 1H), 7,70 (д, J=9,0 Гц, 1H), 7,65 (с, 1H), 4,06 (м, 2H), 3,82-3,76 (м, 6H).
Пример 73: Получение 2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетата
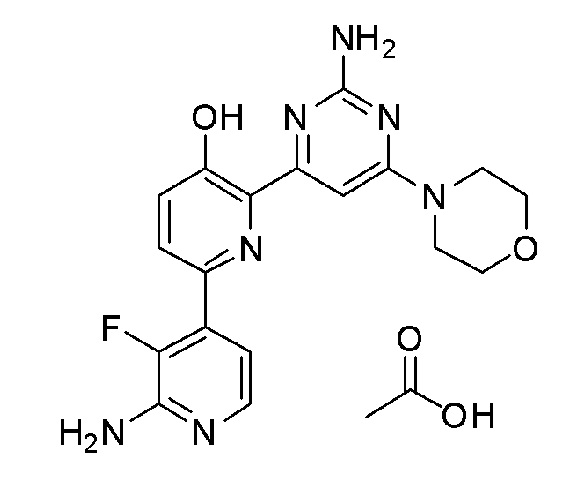
Указанное в заголовке соединение в виде желтого твердого вещества (203 мг) получали путем взаимодействия соединения, полученного в примере 51, с уксусной кислотой.
1H ЯМР (600 МГц, MeOD-d4) δ 7,84 (дд, J=2,4, 8,4 Гц, 1H), 7,78 (д, J=5,4 Гц, 1H), 7,34 (д, J=8,4 Гц, 1H), 7,26 (т, J=5,4 Гц, 1H), 7,23 (с, 1H), 3,78-3,72 (м, 8H), 1,99 (с, 3H).
Пример 74: Получение 2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
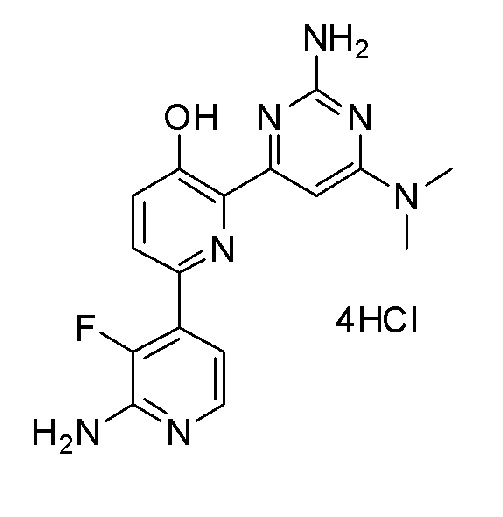
Указанное в заголовке соединение в виде желтого твердого вещества (242 мг) получали путем взаимодействия соединения, полученного в примере 52 с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,04 (д, J=5,4 Гц, 1H), 7,95 (д, J=7,2 Гц, 1H), 7,40 (д, J=8,4 Гц, 1H), 7,12 (т, J=5,4 Гц, 1H), 6,94 (с, 1H), 6,72 (ушир, 2H), 6,25 (ушир, 2H), 3,41 (с, 6H).
Пример 75: Получение 2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 5гидрохлорида
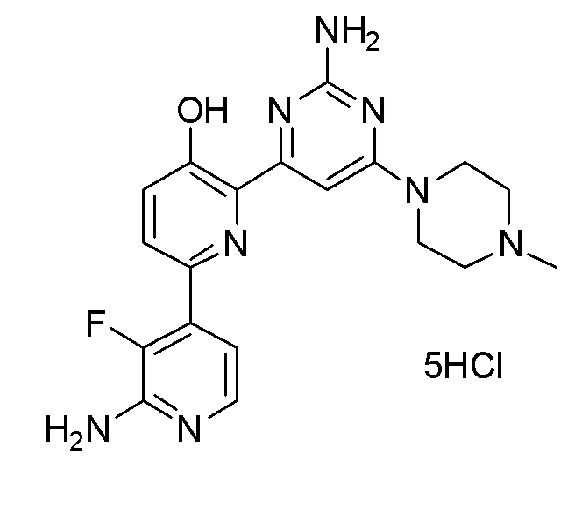
Указанное в заголовке соединение в виде желтого твердого вещества (48 мг) получали путем взаимодействия соединения, полученного в примере 53, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,04 (д, J=7,8 Гц, 1H), 7,87 (д, J=6,0 Гц, 1H), 7,73 (м, 1H), 7,63 (м, 1H), 7,34 (с, 1H), 3,72 (м, 4H), 3,56 (м, 2H), 3,13 (м, 2H), 2,81 (с, 3H).
Пример 76: Получение 2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетата
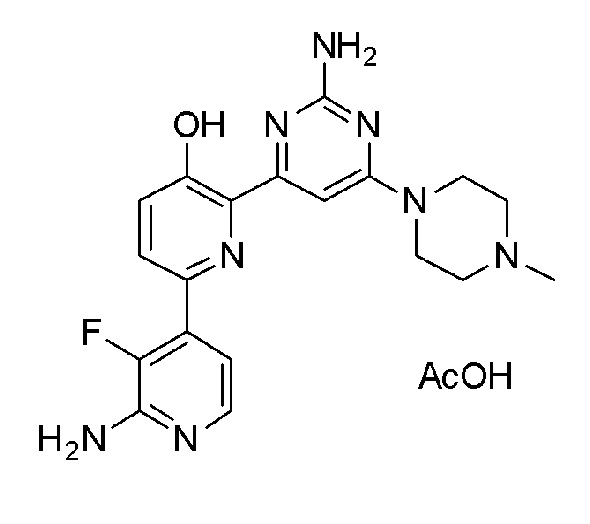
Указанное в заголовке соединение в виде желтого твердого вещества (32 мг) получали путем взаимодействия соединения, полученного в примере 53, с уксусной кислотой.
1H ЯМР (600 МГц, MeOD-d4) δ 7,94 (д, J=8,4 Гц, 1H), 7,85 (д, J=5,4 Гц, 1H), 7,58 (м, 1H), 7,37 (м, 1H), 7,22 (с, 1H), 3,53-3,37 (м, 6H), 3,18 (м, 2H), 2,81 (с, 3H).
Пример 77: Получение 2'-амино-6-(2-амино-(6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
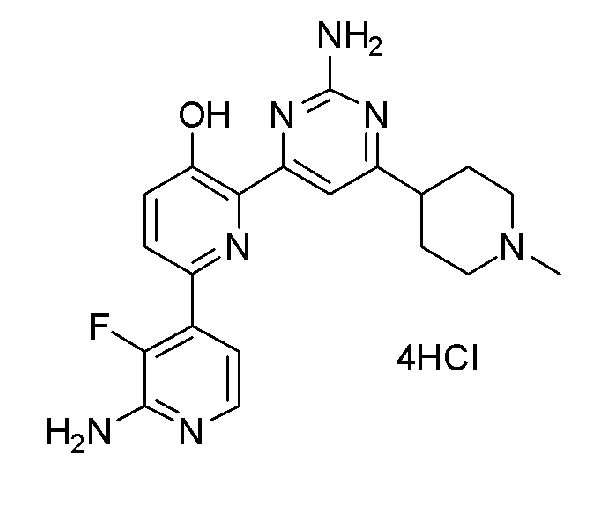
Указанное в заголовке соединение в виде желтого твердого вещества (32 мг) получали путем взаимодействия соединения, полученного в примере 34, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,04 (д, J=8,4 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,81 (с, 3H), 2,43 (с, 1H), 1,84 (м, 2H), 1,40 (м, 2H).
Пример 78: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2 ацетата
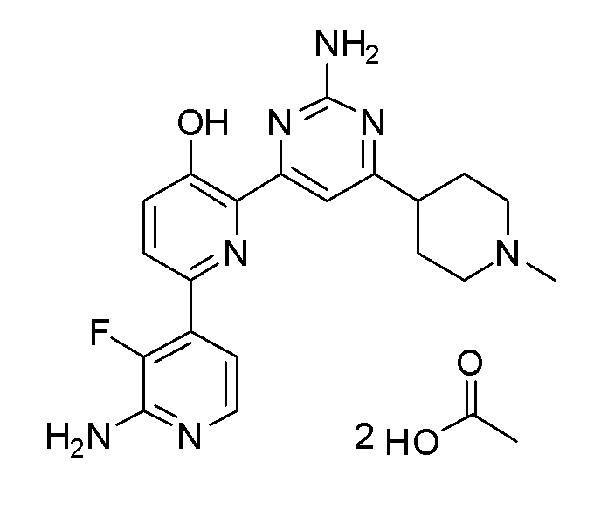
Указанное в заголовке соединение в виде желтого твердого вещества (31 мг) получали путем взаимодействия соединения, полученного в примере 34, с уксусной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,05 (д, J=9,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,22 (ушир, 2H), 6,22 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,98 (с, 2H), 1,85 (м, 2H), 1,49 (м, 2H).
Пример 79: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалата
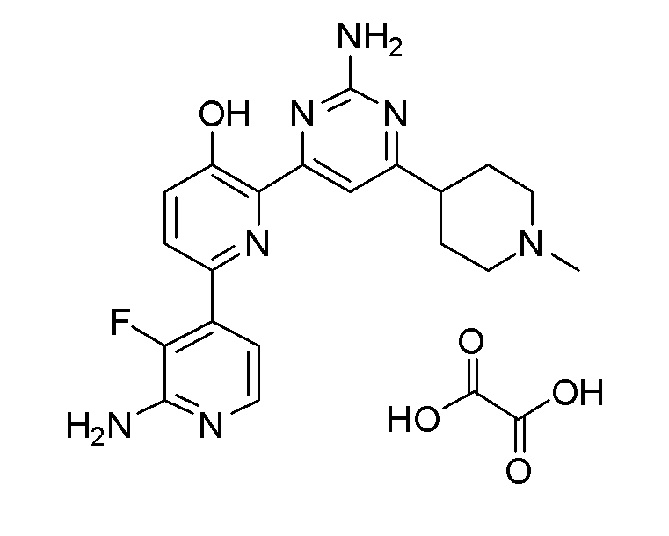
Указанное в заголовке соединение в виде желтого твердого вещества (21 мг) получали путем взаимодействия соединения, полученного в примере 34, с щавелевой кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,05 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H).
Пример 80: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол малоната
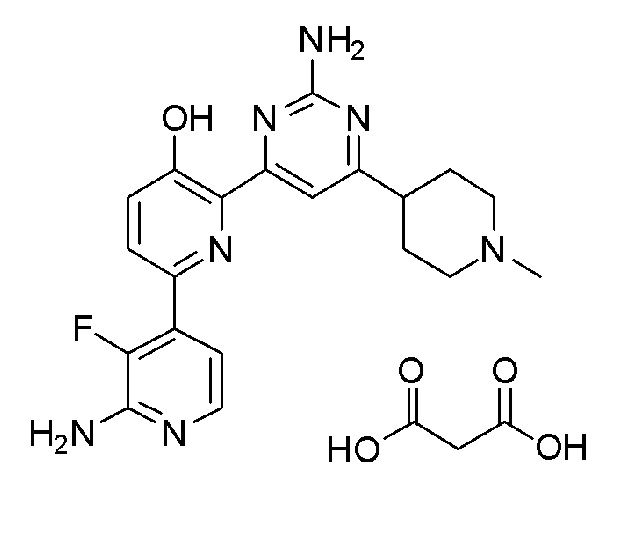
Указанное в заголовке соединение в виде желтого твердого вещества (19 мг) получали путем взаимодействия соединения, полученного в примере 34, с малоновой кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,05 (д, J=9,0 Гц, 1H), 7,64 (д, J=8,4 Гц, 1H), 7,22 (ушир, 2H), 6,13 (с, 2H), 4,02 (с, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,53 (м, 2H).
Пример 81: Получение 2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
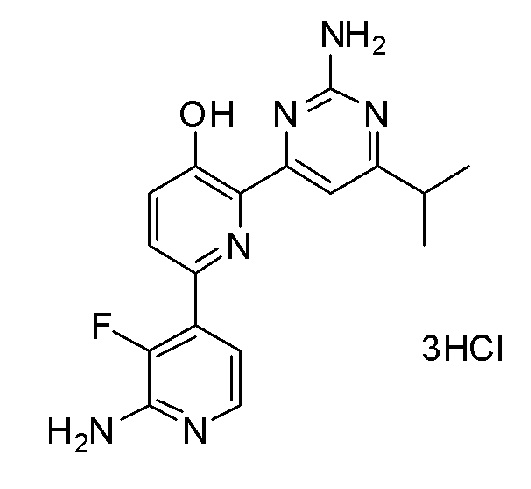
Указанное в заголовке соединение в виде желтого твердого вещества (45 мг) получали путем взаимодействия соединения, полученного в примере 31, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 8,02 (д, J=7,8 Гц, 1H), 7,92 (д, J=6,0 Гц, 1H), 7,56 (с, 1H), 7,48 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,12 (т, 1H), 6,25 (с, 1H), 2,15 (м, 1H), 0,97 (д, J=8,4 Гц, 6H).
Пример 82: Получение 2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2ацетата
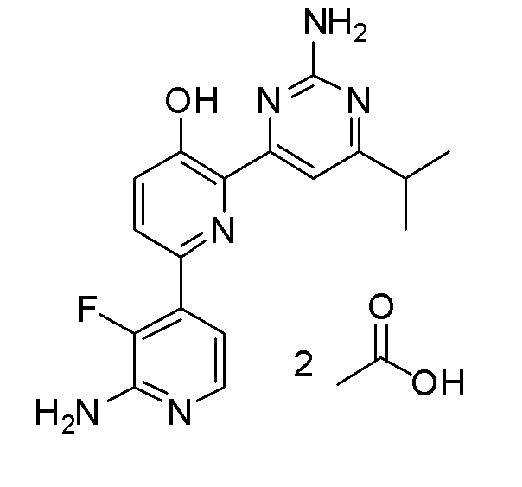
Указанное в заголовке соединение в виде желтого твердого вещества (28,3 мг) получали путем взаимодействия соединения, полученного в примере 31, с уксусной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,13 (с, 1H), 8,21 (д, J=8,6 Гц, 1H), 7,99 (д, J=6,0 Гц, 1H), 7,54 (с, 1H), 7,52 (д, J=8,4 Гц, 1H), 7,48 (с, 2H), 7,32 (т, 1H), 6,25 (с, 1H), 2,15 (м, 1H), 1,28 (д, J=8,0 Гц, 6H).
Пример 83: Получение 2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
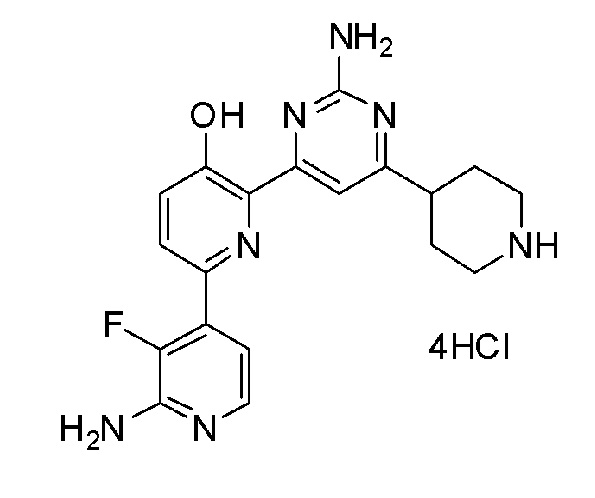
Указанное в заголовке соединение в виде желтого твердого вещества (12,5 мг) получали путем взаимодействия соединения, полученного в примере 33, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 7,80 (м, 2H), 8,00 (д, J=9,0 Гц, 1H), 7,54 (т, J=5,4 Гц, 1H), 7,32 (с, 1H), 6,99 (ушир, 2H), 6,25 (ушир, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,51 (м, 2H).
Пример 84: Получение 2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетата
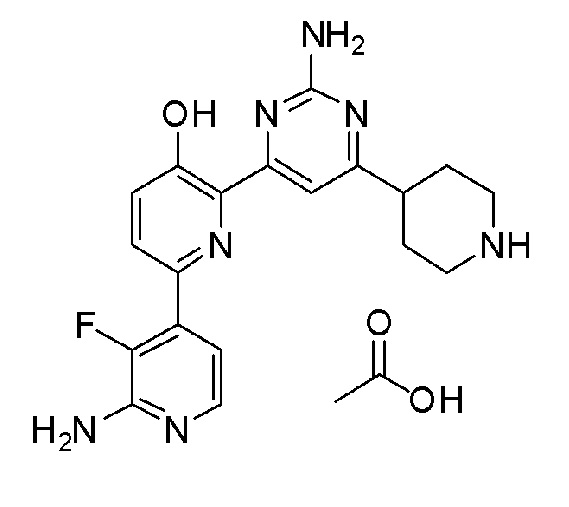
Указанное в заголовке соединение в виде желтого твердого вещества (9,8 мг) получали путем взаимодействия соединения, полученного в примере 33, с уксусной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,02 (м, 2H), 7,59 (д, J=8,4 Гц, 1H), 7,52 (т, J=5,4 Гц, 1H), 7,18 (с, 1H), 6,82 (ушир, 2H), 6,25 (ушир, 2H), 3,89 (с, 3H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (с, 1H), 1,85 (м, 2H), 1,22 (м, 2H).
Пример 85: Получение 2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
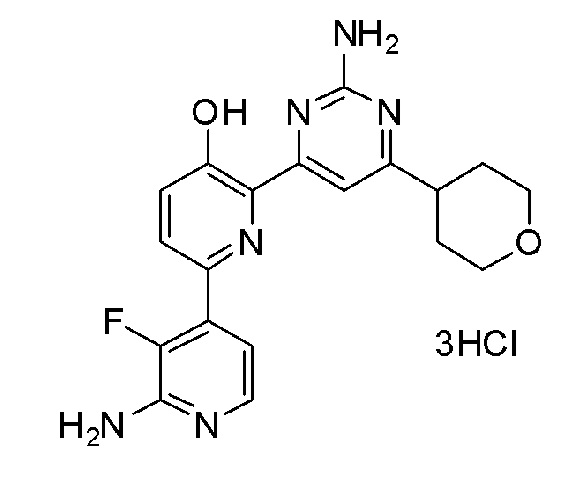
Указанное в заголовке соединение в виде желтого твердого вещества (8,2 мг) получали путем взаимодействия соединения, полученного в примере 32, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,02 (м, 2H), 7,55 (д, J=8,4 Гц, 1H), 7,44 (т, J=5,4 Гц, 1H), 7,03 (с, 1H), 6,82 (с, 2H), 6,33 (sr, 2H), 3,70 (м, 4H), 3,65 (м, 4H).
Пример 86: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
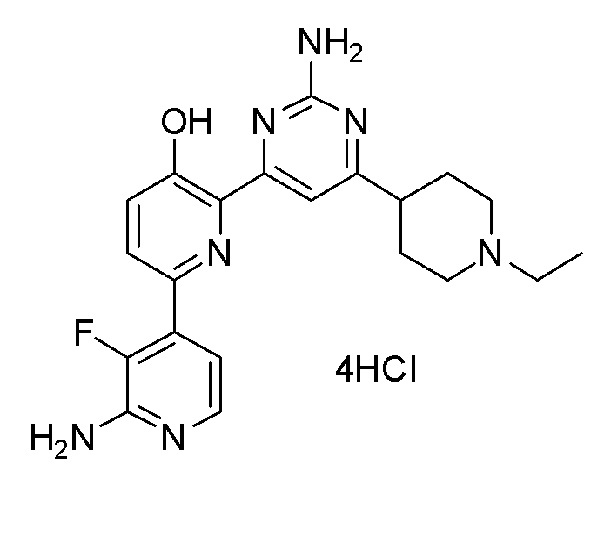
Указанное в заголовке соединение в виде желтого твердого вещества (18,6 мг) получали путем взаимодействия соединения, полученного в примере 35, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,02 (д, J=8,4 Гц, 1H), 7,84 (д, J=8,4 Гц, 1H), 7,81 (ушир, 2H), 222 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (м, 3H), 2,43 (м, 1H), 1,85 (м, 2H), 1,54 (м, 3H).
Пример 87: Получение 2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
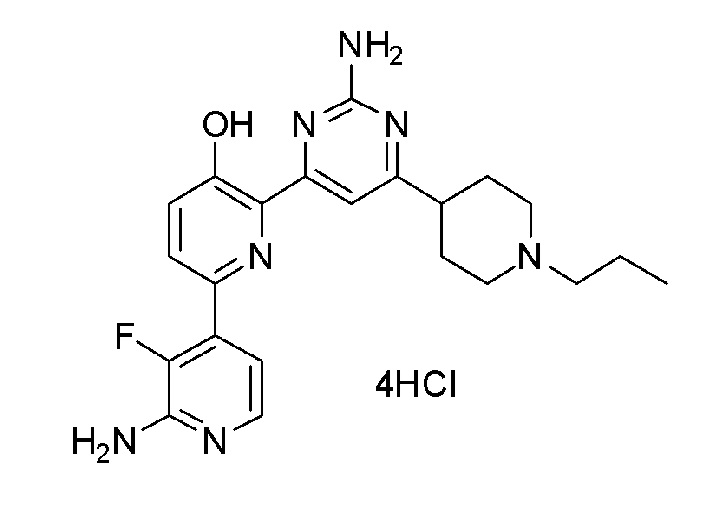
Указанное в заголовке соединение в виде желтого твердого вещества (11,8 мг) получали путем взаимодействия соединения, полученного в примере 36, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,01 (д, J=8,4 Гц, 1H), 7,65 (д, J=8,4 Гц, 1H), 7,51 (ушир, 2H), 7,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,51 (м, 2H), 2,49 (с, 3H), 2,43 (м, 1H), 1,85 (м, 2H), 1,23 (м, 3H).
Пример 88: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
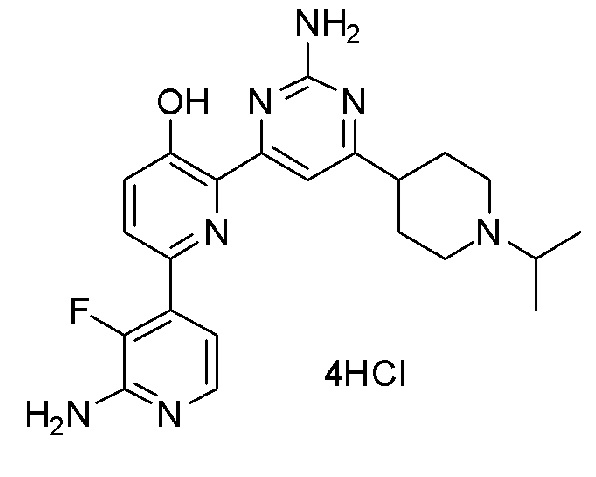
Указанное в заголовке соединение в виде желтого твердого вещества (11,4 мг) получали путем взаимодействия соединения, полученного в примере 37, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,01 (д, J=8,4 Гц, 1H), 7,63 (д, J=8,4 Гц, 1H), 7,54 (ушир, 2H), 7,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (м, 1H), 1,85 (м, 2H), 1,50 (м, 6H).
Пример 89: Получение 2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
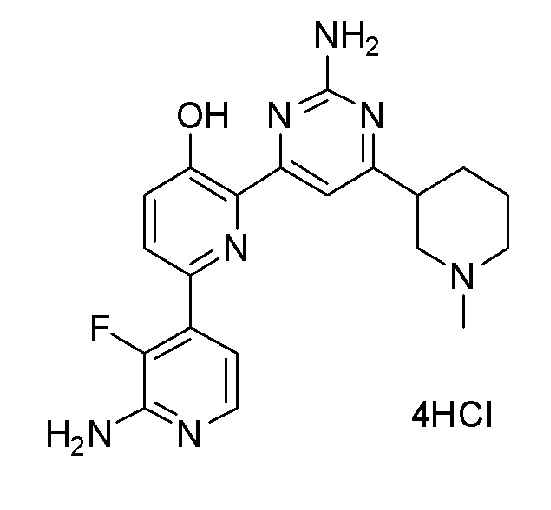
Указанное в заголовке соединение в виде желтого твердого вещества (9,8 мг) получали путем взаимодействия соединения, полученного в примере 38, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,04 (д, J=8,4 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,55 (ушир, 2H), 7,13 (ушир, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,49 (с, 3H), 2,43 (с, 1H), 1,85 (м, 2H), 1,50 (м, 2H)
Пример 90: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
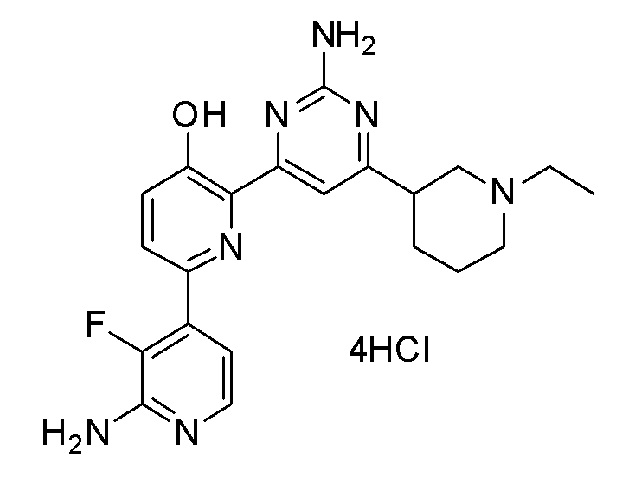
Указанное в заголовке соединение в виде желтого твердого вещества (9,2 мг) получали путем взаимодействия соединения, полученного в примере 39, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,02 (д, J=9,0 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,32 (ушир, 2H), 7,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (м, 1H), 1,85 (м, 2H), 1,50 (м, 2H), 1,21 (т, 3H).
Пример 91: Получение 2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
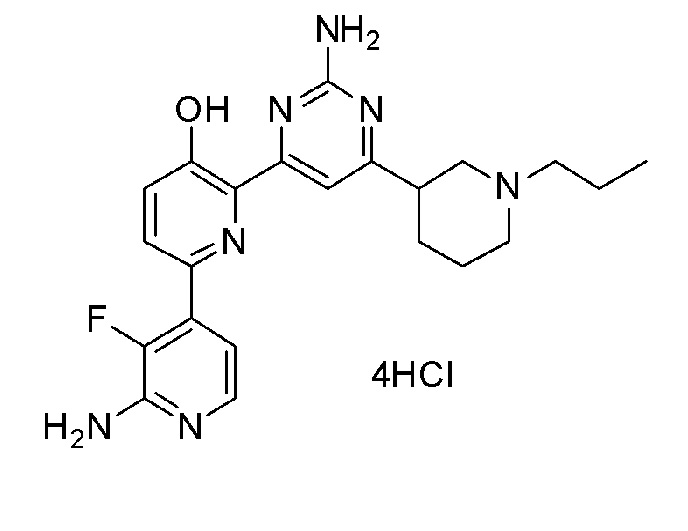
Указанное в заголовке соединение в виде желтого твердого вещества (18,6 мг) получали путем взаимодействия соединения, полученного в примере 40, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,03 (д, J=9,04 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,52 (ушир, 2H), 7,13 (с, 2H), 3,14 (м, 2H), 2,64 (м, 2H), 2,43 (м, 1H), 1,85 (м, 4H), 1,50 (м, 4H), 1,20 (т, 3H).
Пример 92: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор[2,4'-бипиридин]-5-ол 4гидрохлорида
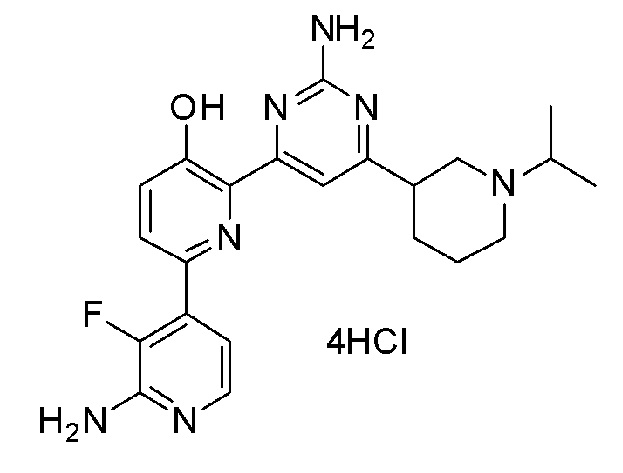
Указанное в заголовке соединение в виде желтого твердого вещества (25,1 мг) получали путем взаимодействия соединения, полученного в примере 41, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,03 (д, J=9,0 Гц, 1H), 7,64 (д, J=9,0 Гц, 1H), 7,62 (м, 2H), 7,13 (с, 2H), 3,14 (м, 2H), 2,42 (с, 1H), 1,85 (м, 4H), 1,50 (м, 4H), 1,20 (м, 9H).
Пример 93: Получение 2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
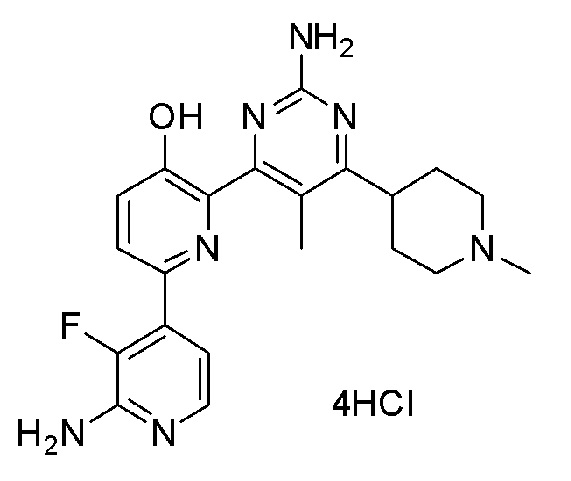
Указанное в заголовке соединение в виде желтого твердого вещества (28,9 мг) получали путем взаимодействия соединения, полученного в примере 42, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 14,00 (с, 1H), 8,04 (д, J=7,8 Гц, 1H), 7,85 (д, J=6,4 Гц, 1H), 7,67 (с, 1H), 754 (д, J=8,4 Гц, 1H), 7,33 (с, 2H), 7,30 (т, 1H), 6,25 (с, 1H), 3,10 (м, 2H), 2,48 (с, 3H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,84 (м, 2H).
Пример 94: Получение 2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
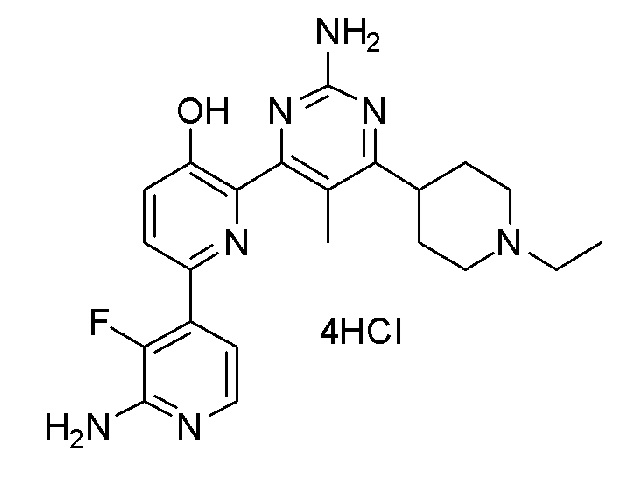
Указанное в заголовке соединение в виде желтого твердого вещества (42,1 мг) получали путем взаимодействия соединения, полученного в примере 43, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (д, J=7,8 Гц, 1H), 7,80 (д, J=6,0 Гц, 1H), 7,77 (с, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,32 (с, 2H), 7,12 (т, 1H), 6,25 (с, 2H), 3,10 (м, 2H), 3,03 (м, 2H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,24 (т, 3H).
Пример 95: Получение 2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
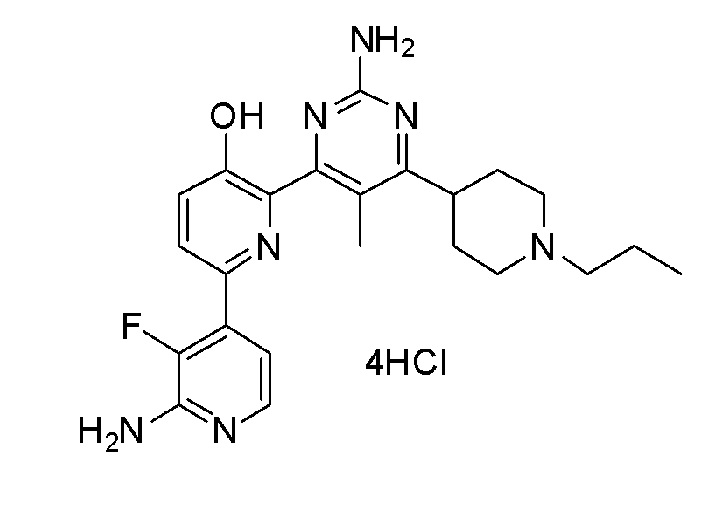
Указанное в заголовке соединение в виде желтого твердого вещества (45,9 мг) получали путем взаимодействия соединения, полученного в примере 44, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (д, J=6,4 Гц, 1H), 7,80 (д, J=6,4 Гц, 1H), 7,67 (с, 1H), 7,44 (д, J=8,6 Гц, 1H), 7,35 (с, 2H), 7,12 (т, 1H), 6,65 (с, 2H), 3,82 (м, 2H), 3,10 (м, 2H), 3,03 (м, 2H),2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,45 (т, 3H).
Пример 96: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
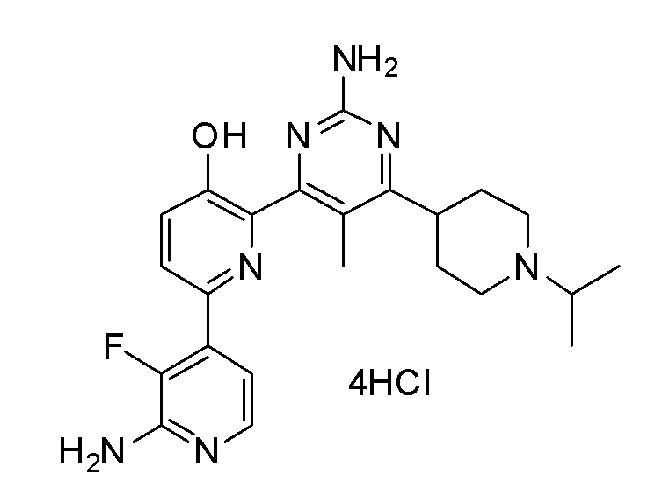
Указанное в заголовке соединение в виде желтого твердого вещества (84,3 мг) получали путем взаимодействия соединения, полученного в примере 45, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) 8,04 (д, J=6,4 Гц, 1H), 7,54 (д, J=6,4 Гц, 1H), 7,52 (с, 1H), 7,46 (д, J=8,0 Гц, 1H), 7,38 (с, 2H), 7,18 (т, 1H), 6,35 (с, 2H), 3,10 (м, 2H), 2,54 (м, 1H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,15 (д, 6H).
Пример 97: Получение 2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
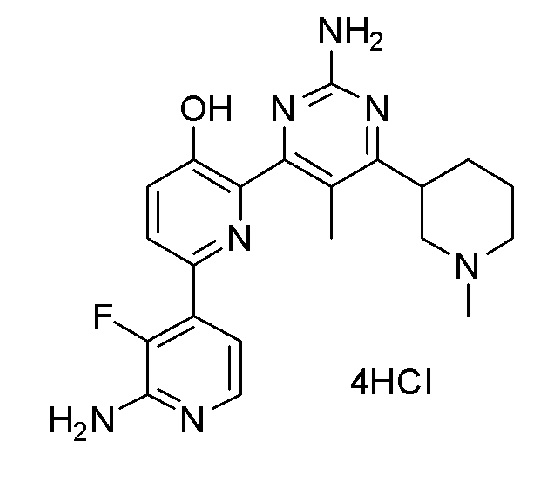
Указанное в заголовке соединение в виде желтого твердого вещества (28,1 мг) получали путем взаимодействия соединения, полученного в примере 46, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,03 (д, J=8,0 Гц, 1H), 7,81 (д, J=8,0 Гц, 1H), 7,56 (с, 1H), 7,51 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,13 (т, 1H), 7,01 (с, 1H), 3,24 (м, 2H), 3,10 (м, 2H), 2,53 (с, 3H), 2,48 (м, 3H), 2,35 (с, 3H), 2,06 (м, 2H), 1,23 (м, 2H).
Пример 98: Получение 2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ола 4гидрохлорида
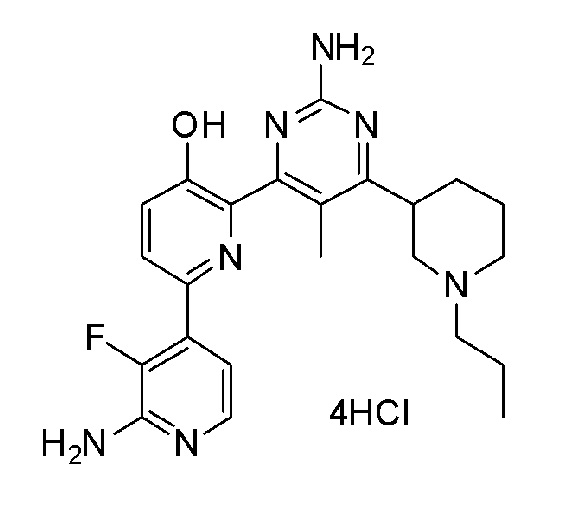
Указанное в заголовке соединение в виде желтого твердого вещества (33,6 мг) получали путем взаимодействия соединения, полученного в примере 47, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,03 (д, J=8,4 Гц, 1H), 7,80 (д, J=8,4 Гц, 1H), 7,47 (с, 1H), 7,45 (д, J=8,4 Гц, 1H), 7,18 (с, 2H), 7,13 (т, 1H), 7,01 (с, 1H), 3,23 (м, 2H), 2,35 (м, 2H), 3,10 (м, 2H), 2,48 (м, 3H), 2,35 (м, 2H), 2,06 (м, 2H), 1,91 (м, 2H), 1,23 (т, 3H).
Пример 99: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
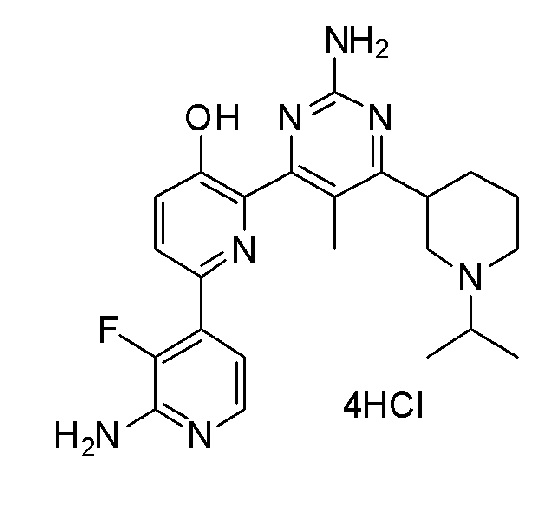
Указанное в заголовке соединение в виде желтого твердого вещества (21,4 мг) получали путем взаимодействия соединения, полученного в примере 48, с хлористоводородной кислотой.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (д, J=9,0 Гц, 1H), 7,54 (д, J=9,0 Гц, 1H), 7,50 (с, 1H), 7,48 (д, J=8,4 Гц, 1H), 7,28 (с, 2H), 7,23 (т, 1H), 7,02 (с, 1H), 3,14 (м, 2H), 2,54 (м, 1H), 2,36 (с, 3H), 2,35 (м, 3H), 2,06 (м, 2H), 1,91 (м, 2H), 1,08 (д, 6H).
Пример 100: Получение 2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
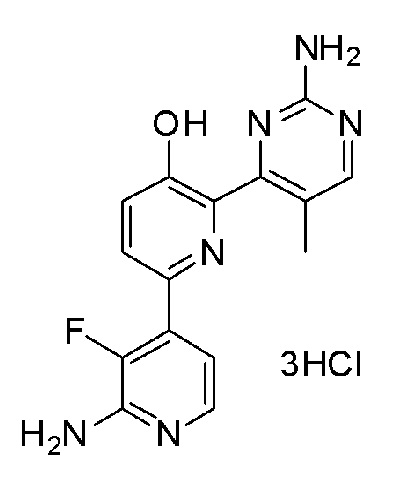
Указанное в заголовке соединение в виде желтого твердого вещества (22,2 мг) получали путем взаимодействия соединения, полученного в примере 55, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,02 (с, 1H), 8,01 (д, J= 9,0 Гц, 1H), 7,78 (д, J=9,0 Гц, 1H), 7,49 (д, J=9,0 Гц, 1H), 7,41 (т, 1H), 2,45 (с, 3H).
Пример 101: Получение 2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
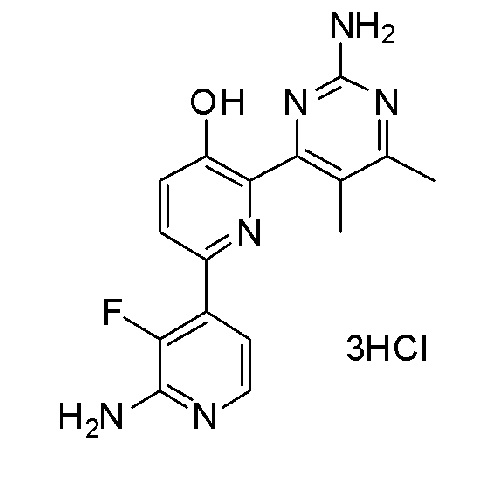
Указанное в заголовке соединение в виде желтого твердого вещества (18,7 мг) получали путем взаимодействия соединения, полученного в примере 60, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,03 (д, J= 9,0 Гц, 1H), 7,90 (д, J= 8,4 Гц, 1H), 7,57 (м, 1H), 7,54 (м, 1H), 7,23 (с, 2H), 7,01 (с, 2H), 2,49 (с, 3H), 2,25 (с, 3H).
Пример 102: Получение 2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
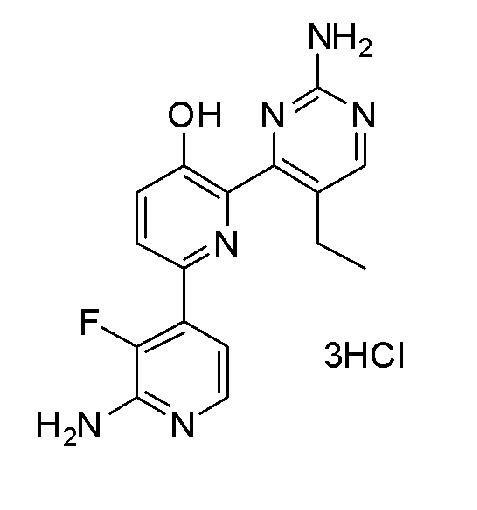
Указанное в заголовке соединение в виде желтого твердого вещества (13,0 мг) получали путем взаимодействия соединения, полученного в примере 56, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 10,0 (с, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,84 (д, J=6,8 Гц, 1H), 7,61 (д, J=8,4 Гц, 1H), 7,24 (м, 1H), 3,43 (м, 2H), 3,14 (м, 2H), 2,21 (м, 1H), 1,94 (м, 2H), 0,92 (м, 3H).
Пример 103: Получение 2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
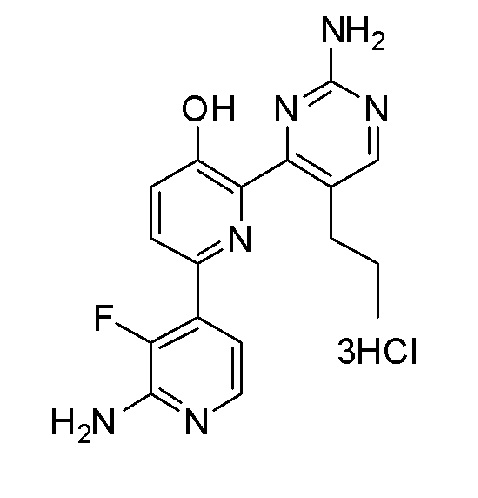
Указанное в заголовке соединение в виде желтого твердого вещества (28,4 мг) получали путем взаимодействия соединения, полученного в примере 57, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 10,0 (с, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,84 (д, J=6,8 Гц, 1H), 7,65 (д, J=8,4 Гц, 1H), 7,26 (м, 1H), 3,44 (м, 2H), 3,14 (м, 2H), 2,21 (м, 3H), 1,94 (м, 2H), 0,92 (м, 3H).
Пример 104: Получение 2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорида
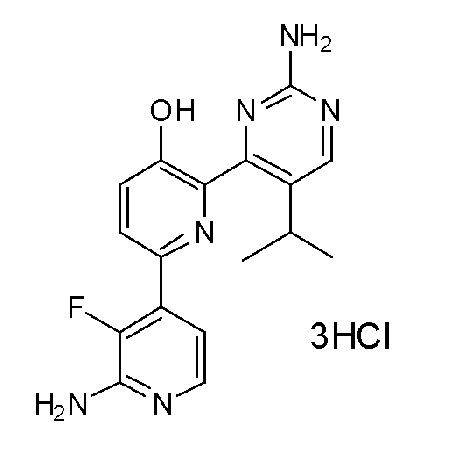
Указанное в заголовке соединение в виде желтого твердого вещества (22,2 мг) получали путем взаимодействия соединения, полученного в примере 58, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 8,62 (с, 1H), 8,04 (д, J=9,2 Гц, 1H), 8,87 (д, J=6,0 Гц, 1H), 7,69 (д, J=8,4 Гц, 1H), 7,27 (м, 1H), 2,92 (м, 1H), 1,14 (д, J=6,4 Гц, 6H).
Пример 105: Получение 2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиримидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
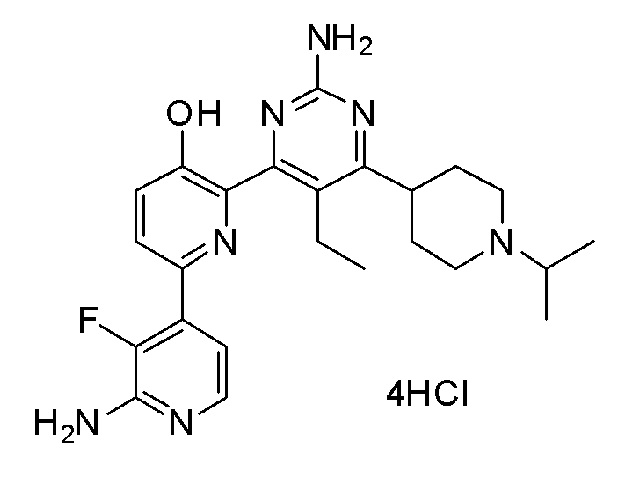
Указанное в заголовке соединение в виде желтого твердого вещества (65,3 мг) получали путем взаимодействия соединения, полученного в примере 49, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 9,98 (с, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,85 (д, J=6,8 Гц, 1H), 7,67 (д, J=8,4 Гц, 1H), 7,26 (м, 1H), 3,43 (м, 2H), 3,27 (м, 2H), 3,15 (м, 4H), 2,27 (м, 3H), 1,92 (м, 2H), 1,34 (д, J=6,4 Гц, 6H), 0,71 (м, 3H).
Пример 106: Получение 2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорида
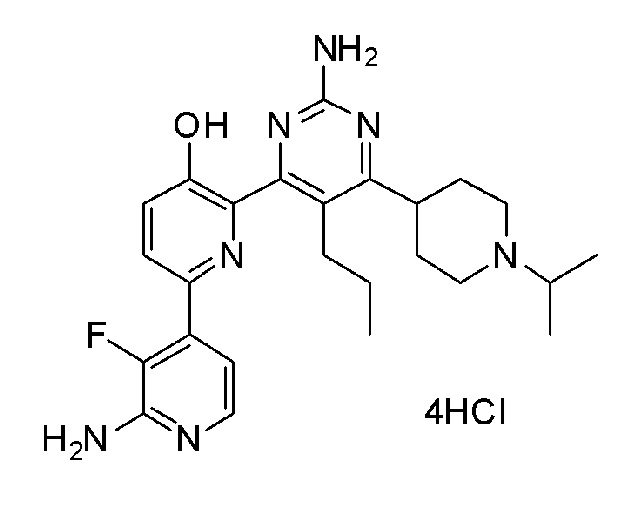
Указанное в заголовке соединение в виде желтого твердого вещества (18,8 мг) получали путем взаимодействия соединения, полученного в примере 50, с хлористоводородной кислотой.
1H ЯМР (600 МГц, ДМСО-d6) δ 10,0 (с, 1H), 8,01 (д, J=8,8 Гц, 1H), 7,85 (д, J=6,8 Гц, 1H), 7,66 (д, J=8,4 Гц, 1H), 7,26 (м, 1H), 3,44 (м, 2H), 3,28 (м, 2H), 3,14 (м, 4H), 2,21 (м, 3H), 1,93 (м, 2H), 1,34 (д, J=6,4 Гц, 6H), 0,95 (м, 3H).
Экспериментальный пример 1: Анализ ингибирования активности фермента CDK
Следующий эксперимент проводили для подтверждения того, что соединения по настоящему изобретению ингибируют активность CDK1, CDK2, CDK4, CDK5 и CDK6, которые являются изотипами CDK.
Испытуемые соединения получали путем растворения соединений, полученных в приведенных выше примерах, в диметилсульфоксиде (ДМСО) в концентрации 10 мМ. Испытуемые соединения разбавляли до 200 нМ, 50 нМ, 1,5 нМ, 3,13 нМ, 0,78 нМ и 0,2 нМ и использовали в ферментативной реакции.
Ферментативную реакцию CDK проводили в буфере, содержащем 50 мМ Tris-HCl (pH 7,5), 10 мM MgCl2, 1 мM EGTA, 1 мM EDTA и 2 мM DTT. Ферменты CDK1/циклинB, CDK2/циклинE, CDK5/p25 и CDK6/циклинD3, коммерчески доступные от Merck Millipore, использовали для ферментов CDK1, CDK2, CDK5 и CDK6, соответственно, и фермент CDK4/циклинD1, коммерчески доступный от Signalchem (US) использовали для CDK4. Для CDK1 реакцию осуществляли путем добавления 10 нМ CDK1/циклинB и 0,125 мг/мл субстрата гистона H1 (Merck Millipore) в буфер и затем добавления 10 мкМ ATP к этому. Для CDK2 реакцию осуществляли добавлением 10 нМ CDK2/циклинE и 0,125 мг/мл субстрата гистона H1 в буфер и затем добавлением к этому 10 мкМ ATP. Для CDK5 реакцию осуществляли добавлением 10 нМ CDK5/p25 и 0,125 мг/мл субстрата гистона H1 в буфер и затем добавлением к этому 10 мкМ ATP. Для CDK4 реакцию осуществляли добавлением 20 нМ CDK4/циклинD1 и 0,125 мг/мл белка Rb (Merck Millipore) в буфер и затем добавлением к этому 10 мкМ ATP. Для CDK6 реакцию осуществляли добавлением 50 нМ CDK6/циклинD3 и 0,125 мг/мл субстрата гистона H1 в буфер и затем добавлением к этому 10 мкМ ATP. Каждую ферментативную реакцию инкубировали при 30°С в течение 60 минут. Затем количество продуцируемого ADP измеряли с использованием прибора Victor X4 (Perkin Elmer) после генерирования люминесценции с использованием набора для анализа киназы ADP-Glo (Promega, US). Эффект ингибирования для каждого фермента был представлен в виде процента от значения люминесценции в присутствии тестируемых соединений относительно значения люминесценции без тестируемых соединений. IC50 (нМ) представляет собой концентрацию соединения для ингибирования 50% ферментативной активности. Результаты показаны в таблице 1 ниже.
Таблица 1
В таблицы 1, выше, показано, что соединения по настоящему изобретению эффективно ингибируют активность фермента CDK. Кроме того, также показано, что ингибирующая активность соединений по настоящему изобретению является более селективной для CDK1, CDK2 и CDK5.
Экспериментальный пример 2: Анализ ингибирования пролиферации раковых клеток
Cледующий эксперимент проводили для подтверждения того, соединения по настоящему изобретению ингибируют пролиферацию раковых клеток и, таким образом, проявляют противоопухолевый эффект.
Проводили тест для подтверждения того, могут ли соединения, полученные в приведенных выше примерах, ингибировать пролиферацию клеточной линии карциномы толстой кишки человека HCT116, клеточной линии глиобластомы U-87MG и T98G, клеточной линии нейробластомы SH-SY5Y и SK-N-SH и клеточной линии рака легких A549 и NCI-H23.
Клетки HCT116, U-87MG, SH-SY5Y, SK-N-SH и A549 культивировали в среде DMEM, содержащей 10% FBS. Клетки T98G культивировали в среде MEM, содержащей 10% FBS, и клетки NCI-H23 культивировали в среде RPMI1664, содержащей 10% FBS. Для анализа ингибирования пролиферации клетки HCT116 распределяли по 2000 клеток/лунку в 96-луночный планшет, и клетки SH-SY5Y, SK-N-SH, U-87MG, T98G, A549, и NCI-H23 распределяли по 3000 клеток/лунку в 96-луночный планшет. И затем клетки культивировали при 5% CO2 и 37°С в течение 16 часов, чтобы клетки могли прикрепиться к лункам. Соединения вышеуказанных примеров добавляли в каждую лунку при концентрации 0,004, 0,013, 0,04, 0,12, 0,37, 1,1, 3,3 и 10 мкМ и объем культуральной среды доводили до 100 мкл. Контрольную группу обрабатывали диметилсульфоксидом (ДМСО) при той же концентрации, 0,08%, как используется для обработки тестируемых соединений. Затем клетки культивировали при 5% СО2 и 37°С в течение 72 часов. Затем к каждой лунке добавляли 10 мкл раствора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид), растворенного в PBS при 5 мг/мл, для идентификации жизнеспособных клеток и клетки культивировали еще 2 часов. Культуральный раствор удаляли, добавляли 100 мкл ДМСО для растворения образовавшегося формазана и затем измеряли поглощение при 535 нм. На основе абсорбции контрольных клеток, не обработанных соединениями, рассчитывали количества жизнеспособных клеток в соответствии с концентрацией соединений. Значение GI50 (ингибирование роста 50), которое представляет собой концентрацию соединения для ингибирования пролиферации раковых клеток на 50%, рассчитывали с использованием программы Graphpad Prism 5.0. Результаты показаны в таблице 2 ниже.
Таблица 2
Как показано в таблице 2 выше, соединения по настоящему изобретению могут эффективно ингибировать пролиферацию раковых клеток. Поскольку соединения эффективно ингибируют нейробластому и глиобластому, а также клетки рака толстой кишки и клетки рака легких, соединения могут эффективно использоваться для лечения опухолей головного мозга.
Экспериментальный пример 3: Анализ изменения клеточного цикла
Следующий эксперимент проводили для подтверждения того, что соединения по настоящему изобретению останавливают клеточный цикл раковой клетки в фазе G2/M.
Клеточную линию карциномы толстой кишки HCT116 и нормальную линию клеток легкого человека MRC5 культивировали в среде DMEM, содержащей 10% FBS. Каждую культивированную клетку собирали, помещали в 6-луночный планшет при 1×106 клеток/лунку и культивировали при 5% СО2 и 37°С в течение 16 часов. Соединения вышеуказанных примеров при 75 нМ и 150 нМ в DMEM, содержащей 5% FBS, добавляли к клеткам в каждой лунке, и через 24 часа анализировали изменение клеточного цикла с помощью проточной цитометрии. Среду обработанных групп и контрольной группы удаляли, добавляли трипсин для выделения клеток из планшетов и клетки центрифугировали при 1000 g в течение 3 минут. Выделенные клетки дважды промывали холодным фосфатным буфером (PBS). Затем к клеткам добавляли 1 мл 70% этанола и клетки охлаждали до 4°С в течение 30 минут или более для фиксации клеток. Фиксированные клетки центрифугировали при 1000g в течение 3 мин для удаления этанола и промывали фосфатным буфером (PBS) два раза для полного удаления этанола. Промытые клетки суспендировали в 250 мкл PBS, 6,25 мкл 10 мг/мл RNaseA добавляли к суспензии и проводили реакцию в течение 15 мин при комнатной температуре для деградации всей РНК. Для окрашивания внутриклеточной ДНК добавляли 12,5 мкл 1 мг/мл иодида пропидия (PI, sigma). Клеточные циклы в 10000 окрашенных клеток измеряли, используя FACS calibur (Becton-Dickinson, USA) и количество клеток, присутствующих в фазах G1, S и G2/M, рассчитывали как процент, используя программу анализа клеточного цикла. В таблицах 3 и 4 показаны результаты анализа клеточного цикла для соединения, полученного в примере 1, в раковых клетках и нормальных клетках, соответственно.
Таблица 3
Таблица 4
Вышеприведенные таблицы 3 и 4 и фиг.1 показывают, что соединения по настоящему изобретению эффективно останавливают клеточный цикл раковой клетки в фазе G2/M. В частности, в то время как соединение при низкой концентрации 75 нМ останавливало клеточный цикл клеточной линии карциномы толстой кишки HCT116 в фазе G2/M, нормальная клеточная линия MRC5 показала клеточный цикл, аналогичный контрольной группе, даже при 150 нМ соединения. Таким образом, ожидается, что соединения по настоящему изобретению могут убить раковую клетку путем остановки клеточного цикла раковых клеток в фазе G2/M, но не могут влиять на клеточный цикл нормальной клетки и таким образом быть безопасными.
Экспериментальный пример 4: Анализ ингибирования роста опухоли на животной модели
Следующий эксперимент проводили для подтверждения того, что соединения по настоящему изобретению ингибируют рост опухоли на животной модели с инъецированными раковыми клетками.
Клеточную линию карциномы толстой кишки HCT116 5×106 клеток/0,1 мл (матригель:PBS=6:4) вводили подкожно в правый бок "голой" мыши Balb/c. Когда опухоль увеличилась до 220 мм3, в каждую группу распределяли по 5 мышей, так что размеры опухоли всех групп были сопоставимы, и тестируемое соединение вводили перорально ежедневно в течение 12 дней. Размер опухоли измеряли два раза в неделю с использованием калипера. Испытуемое соединение было получено в примере 61 при 1 мг/кг, 3 мг/кг, 10 мг/кг и 30 мг/кг. Контроль носителем составлял 20% пропиленгликоля (PG) и положительным контролем была кселода при 100 мг/кг. Размер опухоли (объем) рассчитывали по длине опухоли, измеренной у каждого животного, с использованием следующего уравнения 1.
[Уравнение 1]
Объем опухоли=(длина большой оси × длина малой оси2)/2
В таблице 5 ниже и на фиг.2 показаны фактические размеры опухоли, измеренные во времени, и ингибирование роста опухоли, TGI (%) на основе размера опухоли для каждой группы по сравнению с контрольной группой, получающей носитель.
Таблица 5
Как показано в приведенной выше таблице 5 и на фиг.2, после окончания введения, кселода при 100 мг/кг, используемая в качестве положительного контроля, проявила 46% ингибирования роста опухоли по сравнению с размером опухоли контроля носителем. Однако соединение примера 61 при 1 мг/кг, 3 мг/кг, 10 мг/кг и 30 мг/кг показало 41,3%, 58,0%, 64,9% и 78,1% ингибирования роста опухоли, соответственно, и, следовательно, показали превосходный эффект ингибирования роста опухоли по сравнению с кселодой, используемой в качестве положительного контроля.
Соответственно, можно предположить, что соединения по настоящему изобретению могут проявлять превосходный противоопухолевый эффект против различных видов рака, включая рак толстой кишки.
Экспериментальный пример 5: Анализ ингибирования роста опухоли при комбинированном введении на животных моделях
Следующий эксперимент проводили для подтверждения того, что соединения по настоящему изобретению проявляют синергическое противораковое действие при комбинированном введении на животной модели с инъецированной опухолевой клеткой.
Клеточную линию глиобластомы человека U-87MG 5×106 клеток/0,1 мл PBS вводили подкожно в правый бок "голой" мыши Balb/c. Когда опухоль увеличилась до 150 мм3, в каждую группу распределяли по 5 мышей, так что размеры опухоли всех групп были сопоставимы, и тестируемое соединение вводили перорально ежедневно. Размер опухоли измеряли три раза в неделю с использованием калипера. Испытуемое соединение было получено в примере 61 при 15 мг/кг и 30 мг/кг. Темозоломид (TMZ) при 2,5 мг/кг в качестве положительного контроля вводили перорально ежедневно в течение первых 5 дней. Кроме того, для того, чтобы проанализировать эффект комбинированного введения TMZ и соединения примера 61 проводили испытание ингибирования роста опухоли с группой TMZ при 2,5 мг/кг в комбинации с соединением примера 61 при 15 мг/кг и группы TMZ при 2,5 мг/кг в комбинации с соединением примера 61 при 30 мг/кг. Для комбинированного введения TMZ перорально вводили ежедневно в течение первых 5 дней. Для единственного введения соединение примера 61 перорально вводили ежедневно в течение 30 дней. Для комбинированного введения соединение примера 61 вводили перорально ежедневно в течение 34 дней. 20% пропиленгликоль (PG) использовали в качестве контроля носителя. Размер опухоли (объем) рассчитывали по длине опухоли, измеренной у каждого животного, с использованием следующего уравнения 1.
[Уравнение 1]
Объем опухоли=(длина большой оси × длина малой оси2)/2
В таблице 6 ниже и на фиг.3 показаны фактические размеры опухоли, измеренные во времени, и ингибирование роста опухоли, TGI (%) на основе размера опухоли для каждой группы по сравнению с контрольной группой, получающей носитель.
Таблица 6
Как показано в вышеприведенной таблице 6 и на фиг.3, соединение примера 61, вводимое отдельно при 15 мг/кг и 30 мг/кг, демонстрирует ингибирование роста опухоли 16,8% и 52,2%, соответственно, по сравнению с размером опухоли при контроле носителем, вводимым в течение 30 дней. Кроме того, TMZ, введенный отдельно при 2,5 мг/кг, казалось, уменьшал опухоль, но опухоль начинала расти снова через 23 дня. Соединение примера 61, вводимое при 15 мг/кг в комбинации с TMZ, уменьшало опухоль, но опухоль начинала расти снова через 32 дня. Однако соединение примера 61, вводимое при 30 мг/кг в комбинации с TMZ, уменьшало опухоль и не наблюдалось роста опухоли до 34 дней. Таким образом, подтверждено, что соединение примера 61 обладает противораковым действием для ингибирования роста опухоли глиобластомы. Кроме того, хотя темозоломид (TMZ) используют в качестве лекарственного средства для лечения глиобластомы, его вводят в течение 5 дней только при 28-дневном цикле введении, поскольку его эффективность слабая и он проявляет серьезные побочные эффекты из-за цитотоксичности. Подтверждено, что соединение примера 61 в комбинации с TMZ обладает синергическим эффектом ингибирования роста опухоли и задерживает рецидив раковых клеток.
Соответственно, соединения по настоящему изобретению могут использоваться в комбинации с различными противораковыми средствами, включая молекулярный таргетный препарат, цитотоксическое средство или гормональный препарат, а также в монотерапии. Кроме того, ожидается, что соединение покажет превосходный противораковый эффект при лечении опухолей головного мозга.
Экспериментальный пример 6: Анализ проникновения через гематоэнцефалический барьер
Проводили следующий эксперимент для подтверждения того, что соединения по настоящему изобретению проникают через гематоэнцефалический барьер и мигрируют в мозг.
Используя 9-недельных самцов мышей ICR, соединения, полученные в приведенных выше примерах, вводили перорально один раз в дозе 10 мг/кг или 30 мг/кг, и через 1 ч и 4 часа определяли концентрации соединений в крови и головном мозге мышей. В каждую группу включали 3 мыши ICR. Плазму отделяли от крови, полученной после умерщвления мышей в каждый момент времени, мозг мышей экстрагировали и кровь промывали PBS, затем измельчали ткань головного мозга. Кровь помещали в пробирку, содержащую гепарин, для предотвращения коагуляции, и затем центрифугировали при 12000 об/мин при 4°С в течение 3 минут с получением супернатанта, из которого собирали плазму. Ткань головного мозга взвешивали, и головной мозг измельчали с использованием гомогенизатора Dounce после добавления в 3 раза больше объема PBS чем масса мозга. Каждый из полученных аналитических образцов количественно анализировали с использованием жидкостной хроматографии с тандемной масс-спектрометрией (Tandem LC/MS/MS, API3000 & Agilent 1100 серии). Проницаемость в мозг соединения выражается как величина, полученная путем деления концентрации соединения в головном мозге на концентрацию соединения в плазме (отношение B/P), и когда отношение B/P больше 1, оно означает, что концентрация в мозге выше, чем концентрация в крови.
В таблице 7, ниже, показаны отношения B/P для типичных соединений, полученных в Примерах.
[Таблица 7]
- 30 мг/кг
- 10 мг/кг
- 30 мг/кг
- 10 мг/кг
- 10 мг/кг
- 30 мг/кг
- 10 мг/кг
- 10 мг/кг
Как показано в таблице 7, соединения по настоящему изобретению показывают отношение B/P более 1. Соответственно, подтверждено, что соединения по настоящему изобретению могут проникать в мозг через гематоэнцефалический барьер (ВВВ) после перорального введения. Кроме того, учитывая, что концентрации соединения в головном мозге снижаются через 4 часа, подтверждается, что соединения в головном мозге не накапливаются, но имеют клиренс, аналогичный таковому в крови.
Соответственно, можно предположить, что соединения по настоящему изобретению могут проникать в головной мозг через BBB и, таким образом, проявлять превосходный эффект при лечении опухолей головного мозга и дегенеративных заболеваний головного мозга, таких как болезнь Альцгеймера.
Экспериментальный пример 7: Анализ ингибирования фосфорилирования Tau-белка
Вестерн-блот-анализы проводили следующим образом, для подтверждения того, что соединения по настоящему изобретению могут ингибировать фосфорилирование tau-белка.
Клетки SH-SY5Y, экспрессирующие Tau-белок, культивировали в DMEM, содержащей 10% FBS. 2,5×106 клеток помещали в 6-луночный планшет и инкубировали при 5% СО2 и 37°С в течение 16 часов. Соединения, полученные в вышеуказанных примерах, серийно разведенные 1/3 от 3 мкМ до 0,5 нМ или соединения в концентрации 0,3, 0,1, 0,03, 0,01, 0,003 мкМ, обрабатывали в течение 4 часов в DMEM, содержащей 5% FBS. Через 4 часа культуральный раствор удаляли, промывали PBS и клетки лизировали добавлением 100 мкл буфера для лизиса. Буфер для лизиса состоял из 50 мМ Tris-HCl (pH 7,5), 150 мМ NaCl, 5 мМ EDT, 1 мМ EGTA, 50 мМ NaF, 1 мМ PMSF, 1 мМ Na3VO4, 2,5 мМ DTT, 1% Triton X-100 и ингибитора протеазы (Pierce). Лизированные клетки центрифугировали при 10000 об/мин и 4°С в течение 10 минут и количественно определяли белки в супернатанте. 25 мкг белков подвергали электрофорезу на геле SDS-PAGE и переносили на мембрану PVDF (Amersharm). Мембрану PVDF погружали в T-PBS, содержащую 10% обезжиренное молоко, и встряхивали в течение 1 часа при комнатной температуре. Первичное антитело, Phosph-Tau[pSer202] (Abcam), разбавленное 1:1500 в T-PBS растворе, содержащем 5% обезжиренного молока, подвергали взаимодействию с мембраной при комнатной температуре в течение 2 часов. Мембрану промывали T-PBS. Вторичное антитело, anti-rabbit IgG HRP, разбавленное 1:5000, добавляли к мембране, подвергали реакции при комнатной температуре в течение 1 часа и промывали. Результаты, полученные при воздействии мембраны на раствор ECL (Amersharm), показаны в таблице 8 ниже и на фиг. 4.
Таблица 8
Как показано в таблице 8 и на фиг.4, соединения по настоящему изобретению проявили превосходное ингибирующее действие на фосфорилирование tau-белка.
Соответственно, можно предположить, что соединения по настоящему изобретению могут ингибировать образование NFT в результате гиперфосфорилирования tau-белка и, таким образом, будут эффективны в профилактике и лечении болезни Альцгеймера, вызванной NFT.
Экспериментальный пример 8: Анализ ингибирования фосфорилирования APP и образования Aβ
Следующий эксперимент проводили для подтверждения того, что соединения по настоящему изобретению ингибируют фосфорилирование APP (белок-предшественник амилоида) для предотвращения образования Aβ (белок β-амилоид).
Ген APP вводили в клетки B103 так, чтобы APP можно было стабильно экспрессировать и полученные клетки B103/APP использовали для подтверждения ингибирования фосфорилирования APP и образования Aβ.
Для подтверждения эффекта ингибирования фосфорилирования APP соединениями, полученными в приведенных выше примерах, клетки 8×105 B103/APP культивировали в 6-луночном планшете в течение 16 часов в DMEM, содержащей 500 мкг/мл G418 и 5% FBS. Соединения, последовательно разбавленные 1/3 от 3 мкМ до 0,5 нМ или соединения в концентрации 0,1, 0,03, 0,01, 0,003, 0,001 мкМ, обрабатывали в течение 4 часов в DMEM, содержащей 5% FBS. Через 4 часа культуральный раствор удаляли, промывали PBS и клетки лизировали добавлением 100 мкл буфера для лизиса. 25 мкг белков подвергали электрофорезу в полиакриламидном геле и переносили на мембрану PVDF, и проводили Вестерн-блот-анализ таким же образом, как в Экспериментальном примере 7. Первичным антителом было Phospho-APP[pThr668] (технология клеточной сигнализации), разбавленное 1:1000, и вторичным антителом было anti-rabbit IgG HRP, разбавленное 1:5000. Результаты, полученные путем воздействия мембраны на раствор ECL, показаны на фиг.5.
Кроме того, для подтверждения того, что образование Aβ снижено из-за ингибирования фосфорилирования APP, клетки 5×105 B103/APP культивировали в 6-луночном планшете в течение 16 часов. Затем соединения, полученные в приведенных выше примерах, добавляли при 100 нМ, 75 нМ, 50 нМ, 25 нМ, 12,5 нМ к среде, содержащей 500 мкг/мл G418 и 0,5% FBS, и инкубировали в течение 72 часов. Через 72 часа количество Aβ определяли количественно с использованием среды с помощью набора Human Aβ42 ELISA (Invitrogen). Результаты показаны в таблице 9 ниже и на фиг. 6.
Таблица 9
Как показано в таблице 9 и на фиг. 5 и 6, было подтверждено, что фосфорилирование остатка Треонин 668 APP эффективно ингибировалось соединениями по настоящему изобретению, и, соответственно, ингибировалось образование Aβ. Соединение по настоящему изобретению предотвращает образование амилоидных бляшек путем ингибирования фосфорилирования остатка Треонин 668 APP и, соответственно, ингибирования образования Aβ.
Таким образом, предполагают, что соединения по настоящему изобретению обладают превосходной эффективностью в профилактике и лечении болезни Альцгеймера, одновременно ингибируя образование амилоидных бляшек и генерацию NFT, которые являются причинами болезни Альцгеймера.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ АМИНОАРИЛЬНОЕ ПРОИЗВОДНОЕ, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА ДИАЦИЛГЛИЦЕРОЛАЦИЛТРАНСФЕРАЗЫ 2, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2799819C1 |
| СУЛЬФОНАМИДНОЕ ПРОИЗВОДНОЕ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2607081C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2802185C2 |
| ПИРАНОДИПИРИДИНОВОЕ СОЕДИНЕНИЕ | 2016 |
|
RU2743998C2 |
| ИНГИБИТОРЫ TrkA КИНАЗЫ, ОСНОВАННЫЕ НА НИХ КОМПОЗИЦИИ И СПОСОБЫ | 2015 |
|
RU2672583C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
| БИЦИКЛИЧЕСКИЕ НИТРОИМИДАЗОЛЫ, КОВАЛЕНТНО СОЕДИНЕННЫЕ С ЗАМЕЩЕННЫМИ ФЕНИЛОКСАЗОЛИДИНОНАМИ | 2009 |
|
RU2504547C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ BTK И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2703301C2 |
| ЦИКЛОАЛКАНОВОЕ ПРОИЗВОДНОЕ | 2013 |
|
RU2635354C2 |
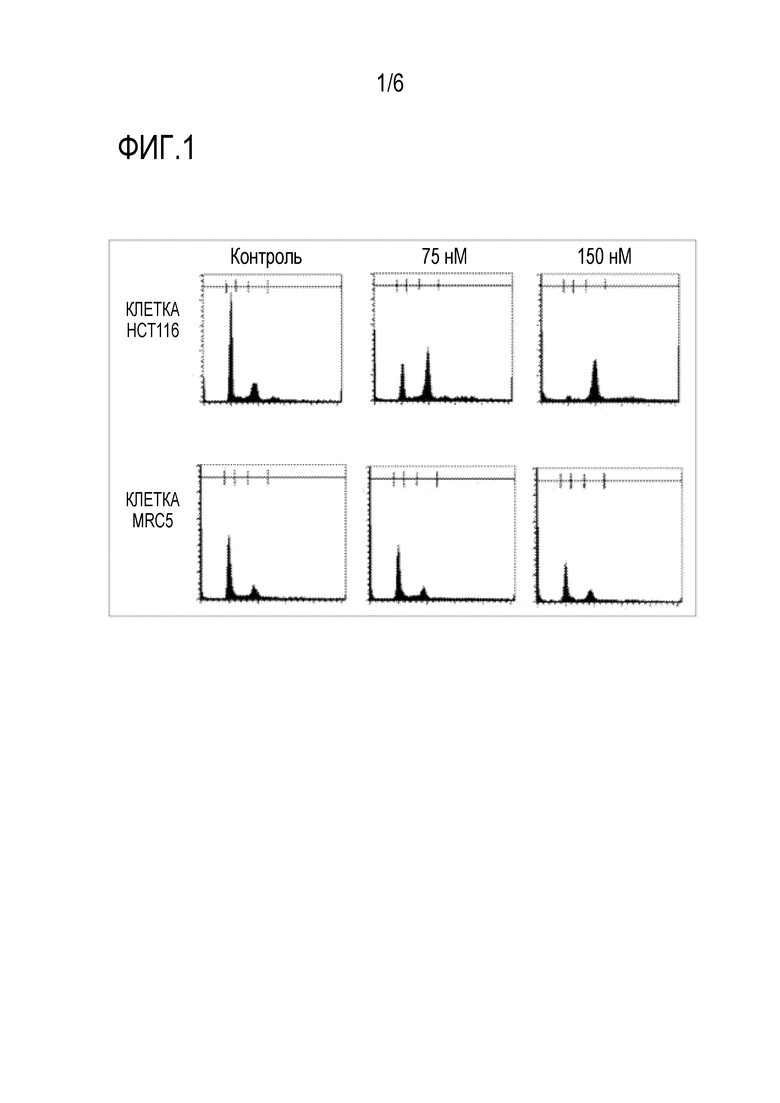
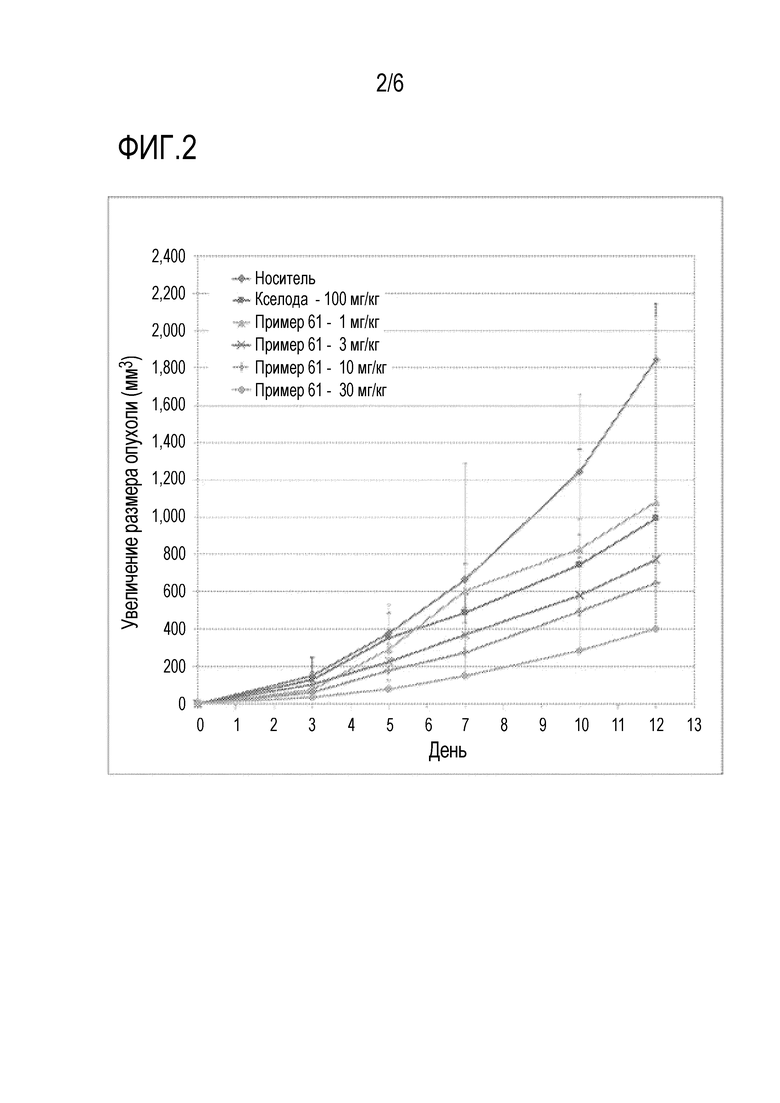
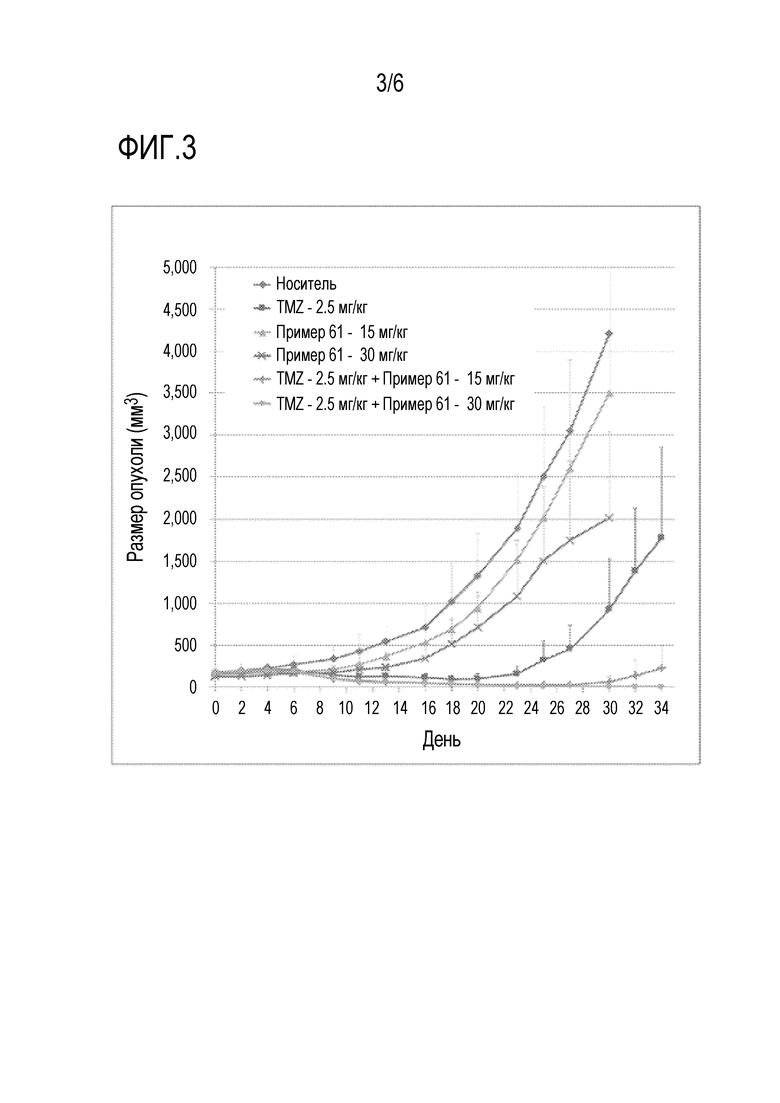
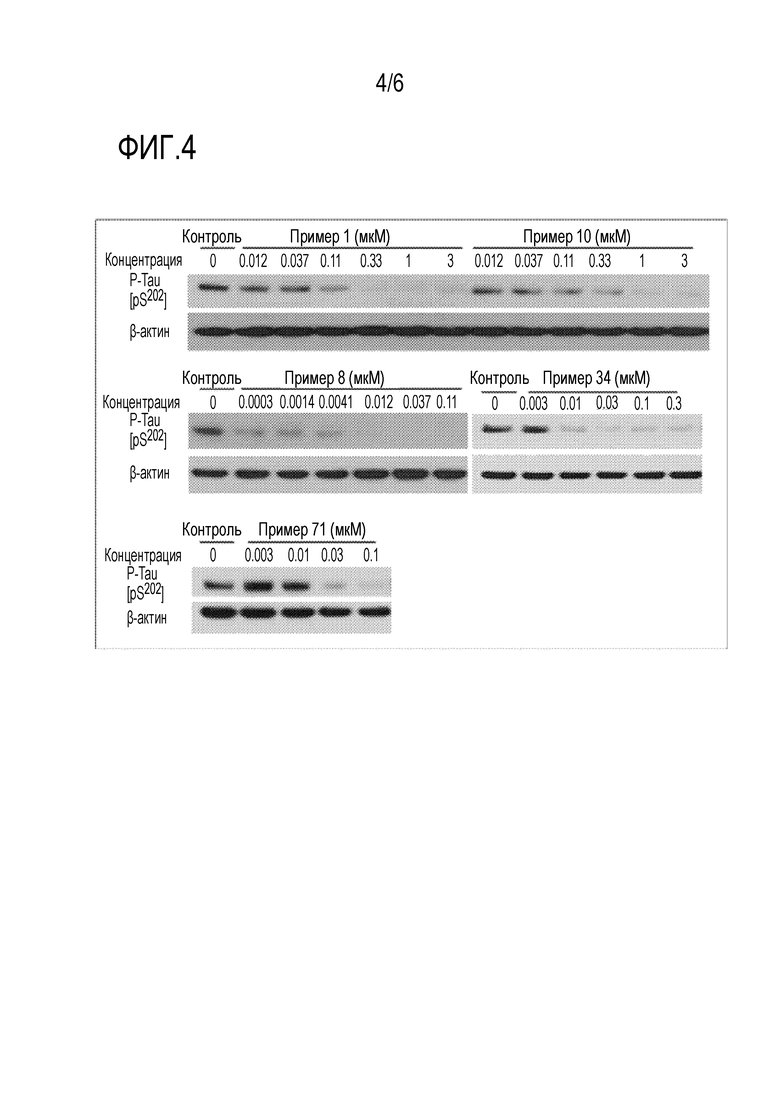
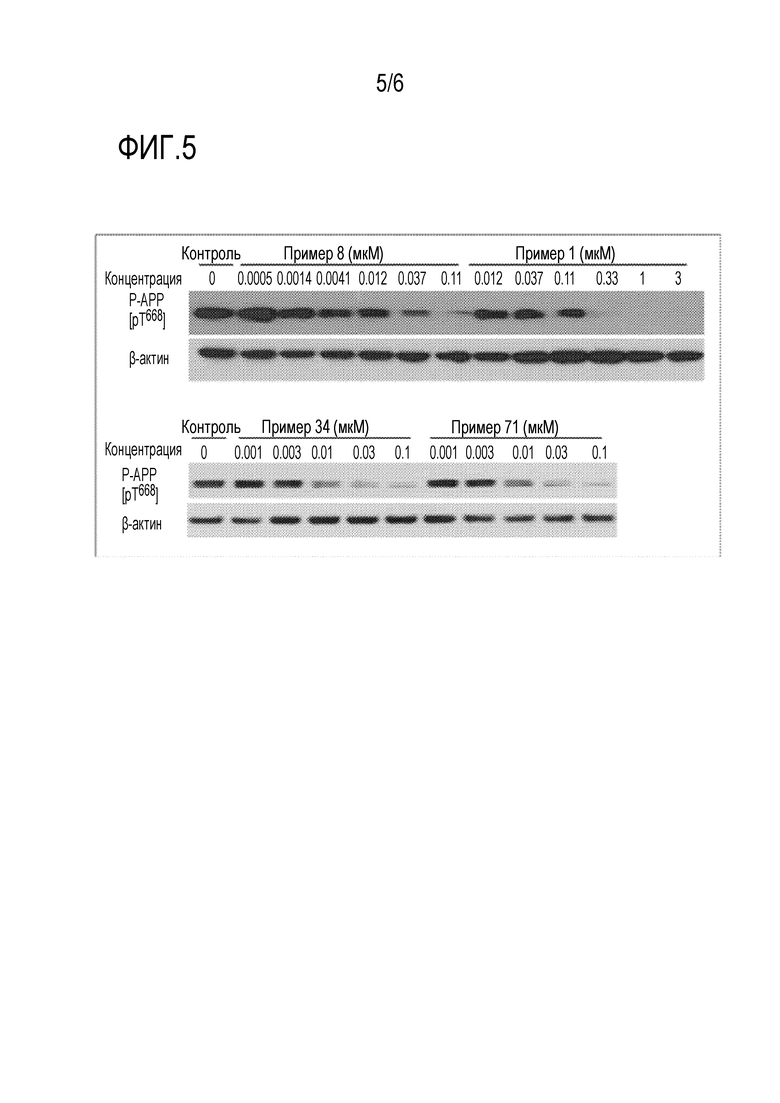
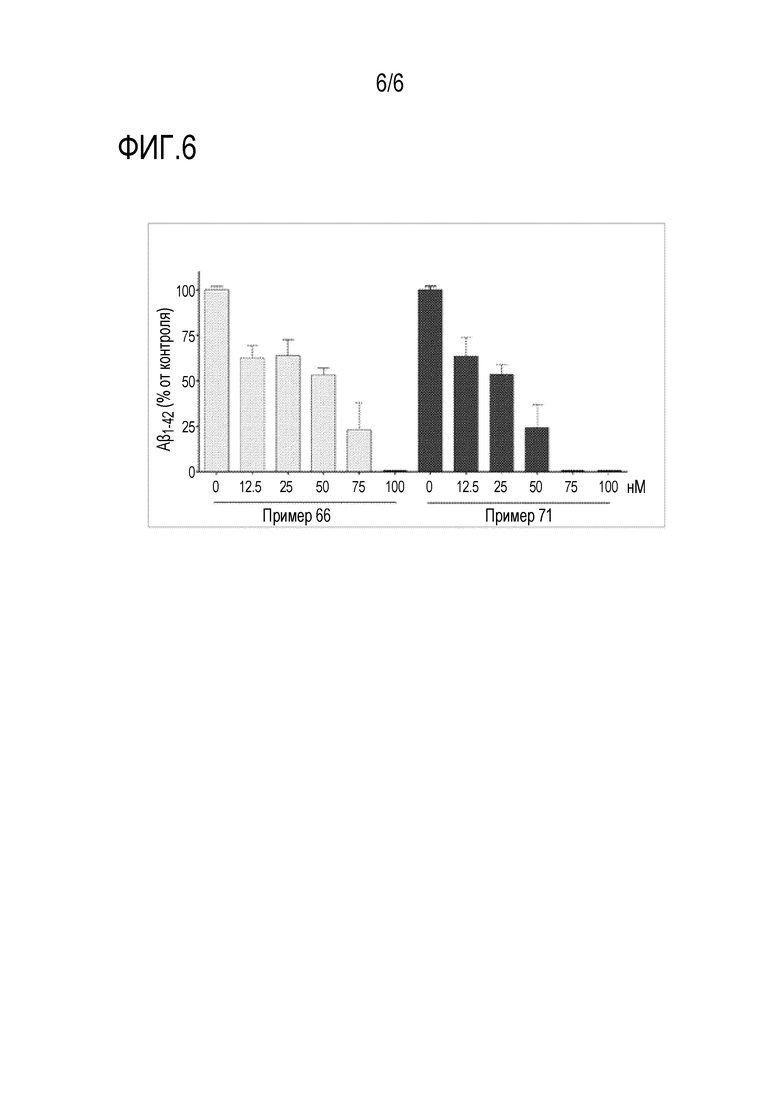
Изобретение относится к новым соединениям формулы I или его фармацевтически приемлемой соли, которые обладают свойствами ингибитора циклин-зависимой киназы (CDK). Соединения могут быть использованы для лечения или профилактики нейробластомы, глиобластомы, немелкоклеточного рака легкого, мелкоклеточного рака легкого или рака толстой кишки, а также дегенеративного заболевания головного мозга, например болезни Альцгеймера. В соединении формулы (I)
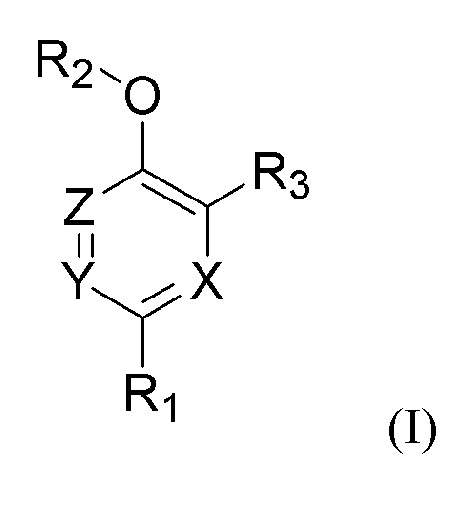 ,
,
X представляет собой азот, Y и Z представляют собой CH; R1 представляет собой фенил, пиридин или пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, амино и галогена; R2 представляет собой водород; и R3 представляет собой пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-C6 алкила, тетрагидропиранила, замещенного или незамещенного C1-C6 алкилом пиперидинила, морфолино, замещенного или незамещенного C1-C6 алкилом пиперазинила, амино, C1-C6 алкиламино и галогена. 2 н. и 6 з.п. ф-лы, 6 ил., 9 табл., 112 пр.
1. Соединение формулы (I) или его фармацевтически приемлемая соль
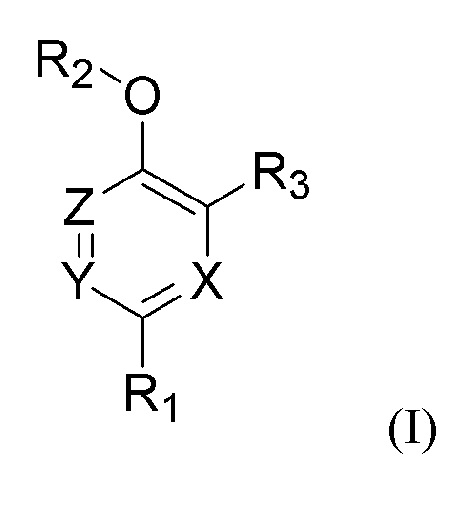 ,
,
где
X представляет собой азот, Y и Z представляют собой CH;
R1 представляет собой фенил, пиридин или пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, амино и галогена;
R2 представляет собой водород; и
R3 представляет собой пиримидин, замещенный или незамещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-C6 алкила, тетрагидропиранила, замещенного или незамещенного C1-C6 алкилом пиперидинила, морфолино, замещенного или незамещенного C1-C6 алкилом пиперазинила, амино, C1-C6 алкиламино и галогена.
2. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из группы, состоящей из следующих соединений:
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2-(2-аминопиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
6-(2-аминопиримидин-4-ил)-[2,3'-бипиридин]-5-ол;
6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2-(2-аминопиримидин-4-ил)-6-(3-гидроксифенил)пиридин-3-ол;
6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(4-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
6-(3-аминофенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол;
6-(3-амино-2-фторфенил)-2-(2-аминопиримидин-4-ил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(3-фтор-4-гидроксифенил)пиридин-3-ол;
2-(2-аминопиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ол;
2'-амино-6-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-3',5-диол;
2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-метилпиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(2,3-дифтор-4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол;
2-(2-амино-6-метилпиримидин-4-ил)-6-(3-аминофенил)пиридин-3-ол;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
6-(2-амино-6-хлорпиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2'-амино-3'-фтор-6-(2-(метиламино)-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-[2,4'-бипиридин]-5-ол;
2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол 3гидрохлорид;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол оксалат;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол малонат;
2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол сульфат;
2'-амино-4-(2-аминопиримидин-4-ил)-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-аминопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2малонат;
2-(2-аминопиримидин-4-ил)-6-(2-фтор-4-гидроксифенил)пиридин-3-ол 2гидрохлорид;
2'-амино-6-(2-амино-6-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-морфолинопиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-6-(диметиламино)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 5гидрохлорид;
2'-амино-6-(2-амино-6-(4-метилпиперазин-1-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-(6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2ацетат;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол оксалат;
2'-амино-6-(2-амино-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол малонат;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-изопропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 2ацетат;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(пиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол ацетат;
2'-амино-6-(2-амино-6-(тетрагидро-2H-пиран-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-метилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-этилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-метилпиперидин-3-ил)пиримидин-3-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метил-6-(1-пропилпиперидин-3-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-3-ил)-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид;
2'-амино-6-(2-амино-5-метилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5,6-диметилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-этилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-изопропилпиримидин-5-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 3гидрохлорид;
2'-амино-6-(2-амино-5-этил-6-(1-изопропилпиперидин-4-ил)пиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид; и
2'-амино-6-(2-амино-6-(1-изопропилпиперидин-4-ил)-5-пропилпиримидин-4-ил)-3'-фтор-[2,4'-бипиридин]-5-ол 4гидрохлорид.
3. Фармацевтическая композиция для ингибирования циклин-зависимой киназы (CDK), содержащая эффективное количество соединения по любому из пп.1-2 или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем.
4. Фармацевтическая композиция по п.3 для лечения или профилактики рака.
5. Фармацевтическая композиция по п.4 для лечения или профилактики нейробластомы, глиобластомы, немелкоклеточного рака легкого, мелкоклеточного рака легкого или рака толстой кишки.
6. Фармацевтическая композиция по п.3 для лечения или профилактики дегенеративного заболевания головного мозга.
7. Фармацевтическая композиция по п.6, где дегенеративным заболеванием головного мозга является болезнь Альцгеймера.
8. Фармацевтическая композиция по п.3, содержащая комбинацию соединения формулы (I), где соединение формулы (I) представляет собой 2,6-бис(2-аминопиримидин-4-ил)пиридин-3-ол или его гидрохлоридную соль, и дополнительно темозоломид в эффективном количестве.
| WO 2002096867 A2, 05.02.2002 & US 2003187007 A1, 02.10.2003 | |||
| SEONG Y.S et al., Characterization of a Novel Cyclin-Dependent Kinase 1 Inhibitor BMI-1026, Cancer Res | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| WO 2010018458 A2, 18.02.2010 | |||
| Burlatsky, | |||
Авторы
Даты
2020-01-10—Публикация
2016-02-02—Подача