Описание
Интерлейкин-12 (IL-12) является гетеродимерным цитокином (р70), состоящим из двух субъединиц (р35 и р40) и играет ключевую роль в иммунных реакциях посредством взаимосвязывания наследственной устойчивости и антиген-специфичного адаптивного иммунитета. Trinchieri (1993) Immunol Today 14: 335. Например, он стимулирует ответную реакцию хелперных клеток Т типа 1 (Th1) и, следовательно, опосредованный клетками иммунитет. Chan et al. (1991) J Exp Med 173: 869; Seder et al. (1993) Proc. Natl. Acad. Sci USA 90: 10188; Manetti et al. (1991) J Exp Med 177: 1199 и Hsieh et al. (1993) Science 260: 547. Сверхпродуцирование IL-12 вызывает избыточные ответные реакции Th1 и может привести к воспалительным нарушением, таким как инсулинзависимый сахарный диабет, рассеянный склероз, ревматоидный артрит, псориаз, болезнь Крона или сепсис. См., например, Gately et al. (1998) Annu Rev Immunol. 16:495; и Abbas et al. (1996) Nature 383: 787. Таким образом, ингибирование сверхпродуцирования IL-12 является подходом для лечения только что упомянутых заболеваний. Trembleau et al. (1995) Immunol. Today 16: 383; и Adorini et al. (1997) Chem. Immunol. 68: 175. Например, сверхпродуцирование IL-12 и являющиеся результатом этого избыточные ответные реакции типа Th1 могут быть подавлены модулированием продуцирования IL-12. Соединение, которое регулирует с понижением продуцирование IL-12, может быть использовано для лечения воспалительных заболеваний. Ma et al. (1998) Eur Cytokine Netw 9:54.
Краткое изложение сущности изобретения
В одном аспекте данного изобретения описаны производные пиримидина формулы (I):
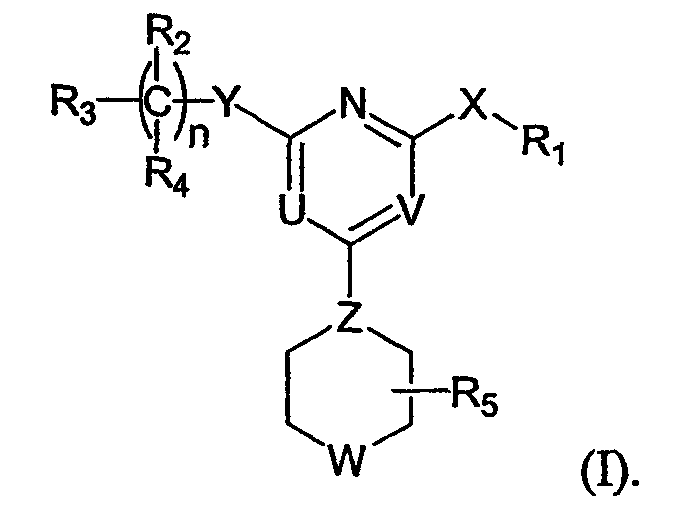
R1 представляет собой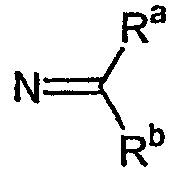 [обозначаемый в дальнейшем NC(RaRb)], арил или гетероарил; каждый из R2 и R4 независимо представляет собой Rc, галоген, нитро, циано, изотионитро, SRc или ORc; или R2 и R4, взятые вместе, представляют собой карбонил; R3 представляет собой Rc, алкенил, алкинил, ORc, OC(O)Rc, SO2Rc, S(O)Rc, S(O2)NRcRd, SRc, NRcRd, NRcCORd, NRcC(O)ORd, NRcC(O)NRcRd, NRcSO2Rd, CORc, C(O)ORc или C(O)NRcRd; R5 представляет собой Н или алкил; n равно 0, 1, 2, 3, 4, 5 или 6; X представляет собой О, S, S(O), S(O2) или NRc; Y представляет собой ковалентную связь, СН2, С(О), С=N-Rc, C=N=ORc, C=N-SRc, O, S, S(O), S(O2) или NRc; Z представляет собой N или СН; один из U и V представляет собой N, и другой представляет собой CRc, и W представляет собой О, S, S(O), S(O2), NRc или NC(O)Rc, где каждый из Ra и Rb представляет собой независимо Н, алкил, арил, гетероарил, и каждый из Rc и Rd представляет собой независимо Н, алкил, арил, гетероарил, циклил, гетероциклил или алкилкарбонил. Следует отметить, что левый атом, показанный в любой замещенной группе, описанной выше, является ближайшим к кольцу пиримидина. Следует также отметить, что, когда n равно 2 или больше, только что описанное производное пиримидина может иметь две или более разные группы С(R2R4), или, когда имеется более чем одна Rc-содержащая замещенная группа в производном пиримидина, группы Rc могут быть одинаковыми или разными. Такие же правила применяют для других аналогичных ситуаций. Далее следует отметить, что Rc может быть одновалентным или двухвалентным заместителем.
[обозначаемый в дальнейшем NC(RaRb)], арил или гетероарил; каждый из R2 и R4 независимо представляет собой Rc, галоген, нитро, циано, изотионитро, SRc или ORc; или R2 и R4, взятые вместе, представляют собой карбонил; R3 представляет собой Rc, алкенил, алкинил, ORc, OC(O)Rc, SO2Rc, S(O)Rc, S(O2)NRcRd, SRc, NRcRd, NRcCORd, NRcC(O)ORd, NRcC(O)NRcRd, NRcSO2Rd, CORc, C(O)ORc или C(O)NRcRd; R5 представляет собой Н или алкил; n равно 0, 1, 2, 3, 4, 5 или 6; X представляет собой О, S, S(O), S(O2) или NRc; Y представляет собой ковалентную связь, СН2, С(О), С=N-Rc, C=N=ORc, C=N-SRc, O, S, S(O), S(O2) или NRc; Z представляет собой N или СН; один из U и V представляет собой N, и другой представляет собой CRc, и W представляет собой О, S, S(O), S(O2), NRc или NC(O)Rc, где каждый из Ra и Rb представляет собой независимо Н, алкил, арил, гетероарил, и каждый из Rc и Rd представляет собой независимо Н, алкил, арил, гетероарил, циклил, гетероциклил или алкилкарбонил. Следует отметить, что левый атом, показанный в любой замещенной группе, описанной выше, является ближайшим к кольцу пиримидина. Следует также отметить, что, когда n равно 2 или больше, только что описанное производное пиримидина может иметь две или более разные группы С(R2R4), или, когда имеется более чем одна Rc-содержащая замещенная группа в производном пиримидина, группы Rc могут быть одинаковыми или разными. Такие же правила применяют для других аналогичных ситуаций. Далее следует отметить, что Rc может быть одновалентным или двухвалентным заместителем.
Что касается формулы (I), подгруппа производных пиримидина данного изобретения характеризуется тем, что R1 представляет собой NC(RaRb). В этих соединениях U может быть N, V может быть СН, Z может быть N и W может быть О. Кроме того, Х может быть О или NRc; Rc может быть Н, метилом, этилом или ацетилом; Y может быть ковалентной связью, О, S или СН2 и n может быть равно 0, 1, 2, 3 или 4. В некоторых вариантах осуществления R3 представляет собой арил, гетероарил (например, пиридинил), ORc, SRc, C(O)ORc, NRcRd или C(O)NRcRd. В других вариантах осуществления R3 представляет собой
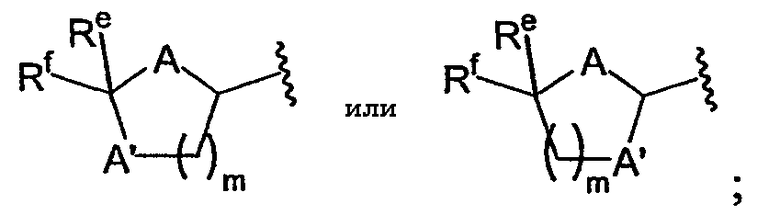
где каждый из А и А' независимо представляет собой О, S или NH; каждый из Rе и Rf независимо представляет собой Н, алкил, арил или гетероарил и m равно 1 или 2.
В этой подгруппе производных пиримидина Ra или Rb, предпочтительно представляет собой
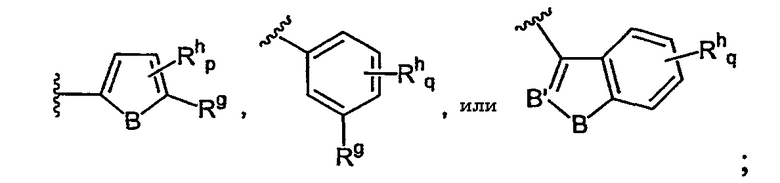
где В представляет собой NRi, O или S; B' представляет собой N или CRi; Rg представляет собой Н, галоген, CN, алкил, циклил, алкилокси, алкилкарбонил, алкилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, гидроксиалкил, алкиламино или алкиламинокарбонил; Rh представляет собой Н, галоген, NO2, CN, алкил, арил, гетероарил, ORc, OC(O)Rc, SO2Rc, S(O)Rc, S(O2)NRcRd, SRc, NRcRd, NRcCORd, NRcC(O)ORd, NRcC(O)NRcRd, NRcSO2Rd, CORc, C(O)ORc или C(O)NRcRd; Ri представляет собой Н, алкил или алкилкарбонил; р равно 0, 1 или 2 и q равно 0, 1, 2, 3 или 4,
Ra или Rb предпочтительно представляет собой
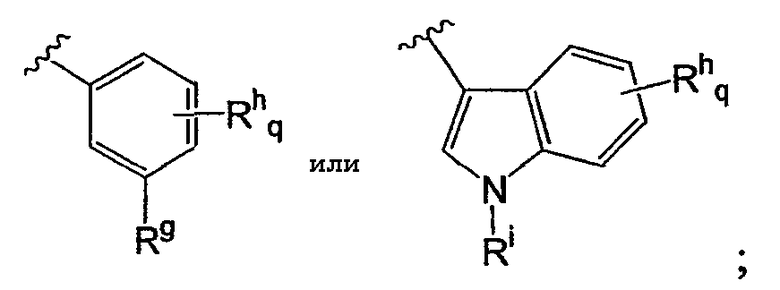
где Rg представляет собой Н, метил, этил, пропил, циклопропил, метокси, этокси, галоген или метоксикарбонил; Rh представляет собой F, Cl, CN, метил, метокси, этокси, ОС(О)СН3, ОС(О)С2Н5, С(О)ОН, С(О)ОС2Н5, С(О)NH2, NHC(O)CH3 или S(O2)NH2; Ri представляет собой Н, метил, этил или ацетил и q равно 0, 1 или 2.
Другая подгруппа производных пиримидина данного изобретения характеризуется тем, что R1 представляет собой арил или гетероарил. В этих соединениях U может быть N, V может быть CH, Z может быть N и W может быть О. Кроме того, Х может быть О или NRc; Rc может быть Н, метилом, этилом или ацетилом; Y может быть ковалентной связью, О, S или СН2 и n может быть равно 0, 1, 2, 3 или 4. В некоторых вариантах осуществления R3 представляет собой арил, гетероарил (например, пиридинил, такой как пиридин-2-ил или пиридин-3-ил), ORc, SRc, C(O)ORc, NRcRd или C(O)NRcRd. В других вариантах осуществления R3 представляет собой
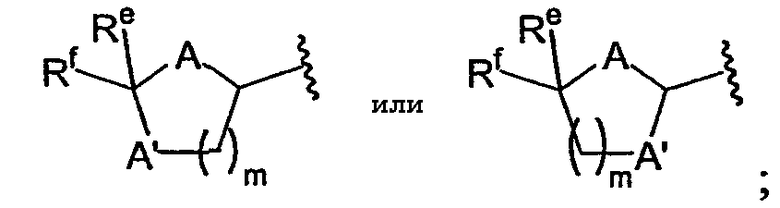
где каждый из А и А' независимо представляет собой О, S или NH; каждый из Re и Rf независимо представляет собой Н, алкил, арил или гетероарил и m равно 1 или 2.
В данной второй подгруппе производных пиримидина R1 предпочтительно представляет собой
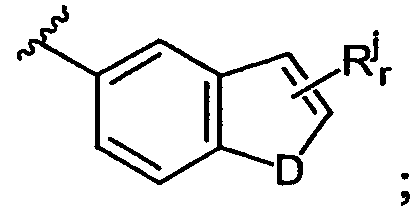
где D представляет собой О, S или NRm; Rj представляет собой бензо, галоген, CN, гидроксил, алкил, арил, гетероарил, алкоксил, арилоксил или гетероарилоксил; Rm представляет собой Н, алкил или алкилкарбонил и r равно 0, 1 или 2. Предпочтительно R1 представляет собой
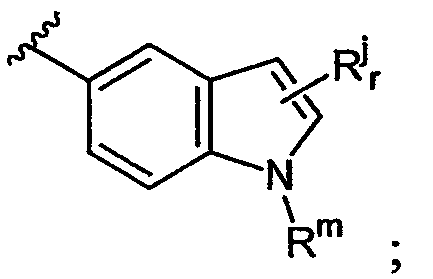
и Rj представляет собой метил, этил, пропил или бензо и r может быть равно 1 или 2.
Третья подгруппа производных пиримидина формулы (I) характеризуется тем, что R1 представляет собой NC(RaRb); каждый из R2 и R4 представляют собой Н; R3 представляет собой Н, алкил, арил, гетероарил, циклил, гетероциклил, алкилоксикарбонил, алкиламинокарбонил или алкилкарбонил; R5 представляет собой Н или алкил; n равно 0, 1, 2, 3, 4, 5 или 6; Х представляет собой NRc; Y представляет собой ковалентную связь, СН2, С(О), С=N-Rc, C=N-ORc, C=N-SRc, O, S, S(O), S(O2) или NRc; Z представляет собой N или СН; один из U и V представляет собой N и другой представляет собой CRc, и W представляет собой О, S, S(O), S(O2), NRc или NC(O)Rc, где каждый из Ra и Rb представляет собой независимо Н, алкил, арил, гетероарил и Rc представляет собой Н, алкил, арил, гетероарил, циклил, гетероциклил или алкилкарбонил.
В данной третьей подгруппе производных пиримидина предпочтительно один из Ra и Rb представляет собой Н или алкил и другой представляет собой арил или гетероарил, необязательно замещенный Rg и Rh q; причем Rg представляет собой галоген, CN, алкил, алкилокси, алкилкарбонил, алкилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, гидроксиалкил, алкиламино или алкиламинокарбонил; Rh представляет собой галоген, CN, гидроксил, алкил, арил, гетероарил, алкоксил, арилоксил или гетероарилоксил и q равно 0, 1, 2, 3 или 4. Предпочтительно один из Ra и Rb представляет собой Н или алкил, и другой представляет собой 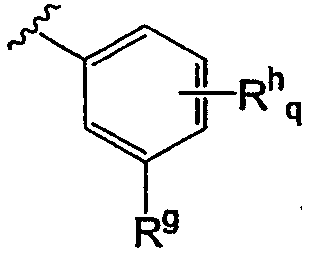 (например,
(например, 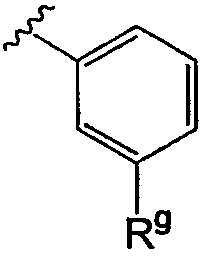 такой, как 3-мтилфенил);
такой, как 3-мтилфенил);
где Rg представляет собой Н, алкил, алкоксил, метоксикарбонил или галоген; Rh представляет собой галоген, CN, гидроксил, алкил, арил, гетероарил, алкоксил, арилоксил или гетероарилоксил и q равно 0, 1, 2, 3 или 4.
В некоторых вариантах осуществления Х представляет собой NH; Y представляет собой О; n равно 2 и R3 представляет собой гетероарил (например, пиридинил или 1-оксипиридинил) или гетероциклил (например, 1Н-пиридин-2-он). В других вариантах осуществления U представляет собой N; V представляет собой СН и R3 представляет собой гетероарил или гетероциклил. Предпочтительно Х представляет собой NH; Y представляет собой О; n равно 2 и один из Rа и Rb представляет собой Н, и другой представляет собой
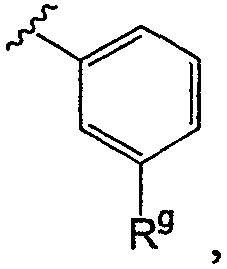
где Rg может быть CN, гидроксиалкилом, алкиламино, алкиламинокарбонилом, алкилоксикарбонилом (например, С(О)ОСН3) или галогеном (F, Cl, Br или I), когда R3 представляет собой гетероарил (например, пиридинил), или Rg может быть галогеном (например, I), алкилом (например, метилом) или алкилоксикарбонилом (например, метоксикарбонилом), когда R3 представляет собой гетероциклил (например, 1Н-пиридин-2-он).
Алкил, алкенил, алкинил, арил, гетероарил, циклил и гетероциклил, указанные выше, включают как замещенные, так и незамещенные группы. Термин «замещенный» относится к одному или нескольким заместителям (которые могут быть одинаковыми или разными), причем каждый заменяет атом водорода. Примеры заместителей включают, но не ограничиваются перечисленным, галоген (F, Cl, Br или I), гидроксил, амино, алкиламино, ариламино, диалкиламино, диариламино, циано, нитро, меркапто, карбонил, карбамидо, карбамоил, карбоксил, тиоуреидо, тиоцианато, сульфоамидо, алкил, алкенил, алкилокси, арил, гетероарил, циклил, гетероциклил, где алкил, алкенил, алкилокси, арил, гетероарил, циклил и гетероциклил являются необязательно замещенными алкилом, арилом, гетероарилом, галогеном, гидроксилом, амино, меркапто, циано или нитро.
Используемый здесь термин «алкил» относится к неразветвленной или разветвленной алкильной группе, содержащей 1-6 атомов углерода. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, трет-бутил и н-пентил. Подобным образом термин «алкенил» или «алкинил» относится к неразветвленной или разветвленной алкенильной или алкинильной группе, содержащей 1-6 атомов углерода.
Термин «арил» относится к углеводородной циклический системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо. Примеры арильных групп включают, но не ограничиваются перечисленным, фенил, нафтил и пиренил.
Термин «гетероарил» относится к углеводородной циклический системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом. Примеры гетероарильных групп включают, но не ограничиваются перечисленным, фурил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридинил, пиримидинил, хиназолинил и индолил.
Термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах. Гетероциклическое кольцо содержит один или несколько гетероатомов (например, О, N или S) как часть циклической системы, причем остальные атомы являются углеродом. Примерами циклильных и гетероциклильных колец являются циклогексан, пиперидин, пиперазин, морфолин, тиоморфолин, 1,4-оксазепан и 1Н-пиридин-2-он.
Термин «сульфанил» относится к тиогруппе.
Приведенные ниже соединения являются примерами соединений настоящего изобретения:
N-{2-[3-(3,4-диметоксифенил)пропил]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин (соединение 1)
N-(2-н-бутокси-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин (соединение 2)
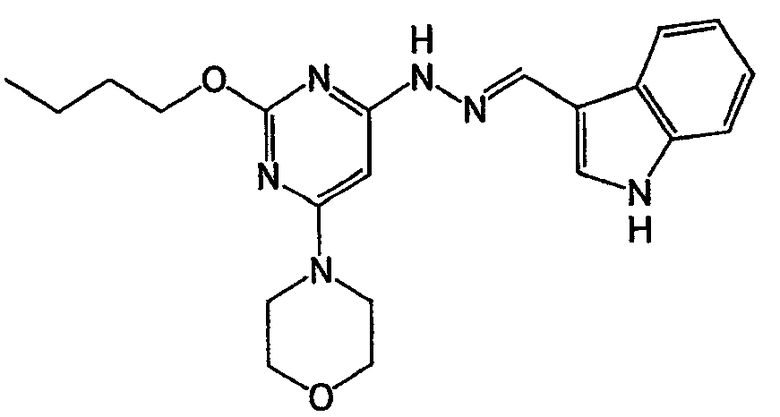
N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин (соединение 3)
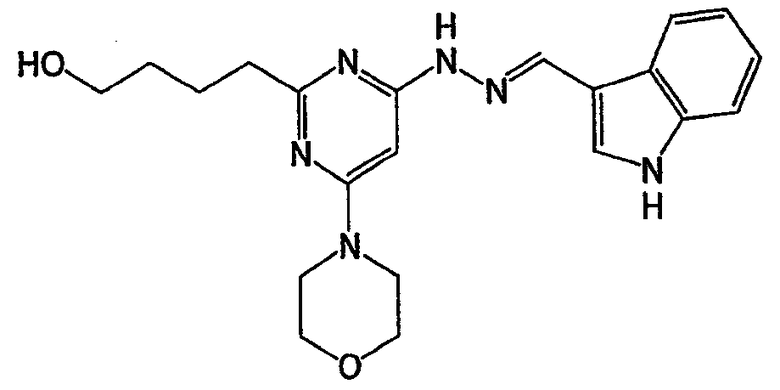
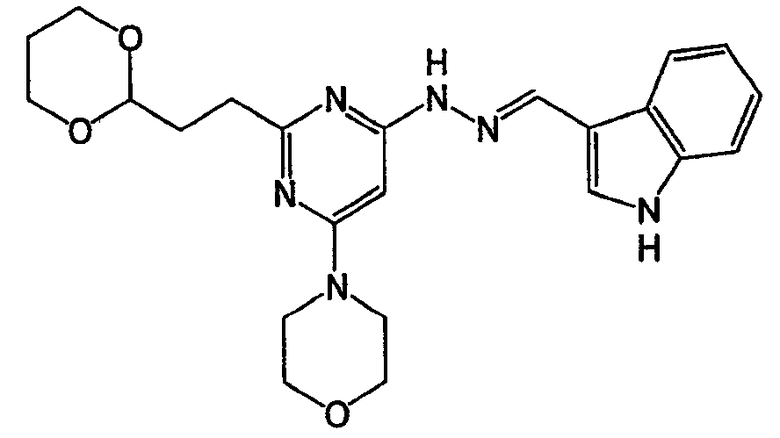
N-[2-(2-[1,3]диоксан-2-илэтил)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин (соединение 4)
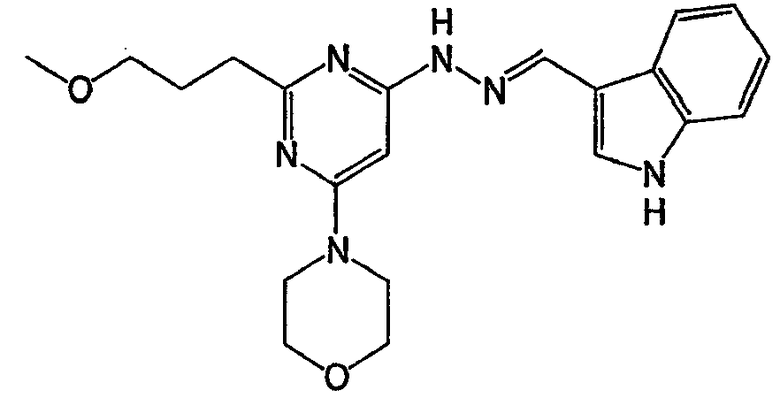
N-(1Н-индол-3-илметилен)-N'-[2-(3-метоксипропил)-6-морфолин-4-илпиримидин-4-ил]гидразин (соединение 5)
3-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-илсульфанил}пропан-1-ол (соединение 6)
3-{2-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-4-илсульфанил}пропан-1-ол (соединение 7)
N-[2-(2,2-диметил-[1,3]диоксолан-4-илметокси)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин (соединение 8)
N-{2-[2-(3,4-диметоксифенил)этокси]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин (соединение 9)
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 10)
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин (соединение 11)
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 12)
N-(3-этилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 13)
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин (соединение 14)
N-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]-N'-(1-м-толилэтилиден)гидразин (соединение 15)
N-[1-(1Н-индол-3-ил)этилиден]-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 16)
О-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 3-метилбензальдегида (соединение 17)
О-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 1Н-индол-3-карбальдегида (соединение 18)
N-(1Н-индол-3-илметилен)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин (соединение 19)
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин (соединение 20)
бутил-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-ил}амин (соединение 21)
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразин (соединение 22)
N-(3-метилбензилиден)-N'-(5-метил-6-морфолин-4-ил-2-фенилпиримидин-4-ил)гидразин (соединение 23)
N-(3-метилбензилиден)-N'-(2-фенил-6-тиоморфолин-4-ил-пиримидин-4-ил)гидразин (соединение 24)
(2,3-диметил-1Н-индол-5-ил)-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амин (соединение 25)
(2,3-диметил-1Н-индол-5-ил)-{4-морфолин-4-ил-6-[2-(пиридин-3-илокси)этокси]пиримидин-2-ил}амин (соединение 26)
этиловый эфир 3-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}пропионовой кислоты (соединение 27)
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразин (соединение 28)
1-(2-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он (соединение 29)
N-(3-иодбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 30)
N-(3-фторбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 31)
N-(3-хлорбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 32)
N-(3-бромбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин (соединение 33)
метиловый эфир 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты (соединение 34)
1-(2-{4-[N'-(3-иодбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он (соединение 35)
N-метиламид 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты (соединение 36)
(3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}фенил)метанол (соединение 37)
N,N-диэтил-4-{4-[N"-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}бутирамид (соединение 38)
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-1-(4-метилпиперазин-1-ил)бутан-1-он (соединение 39)
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илметилбутирамид (соединение 40)
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илбутирамид (соединение 41)
Их структуры представлены ниже:
Соединение 1:
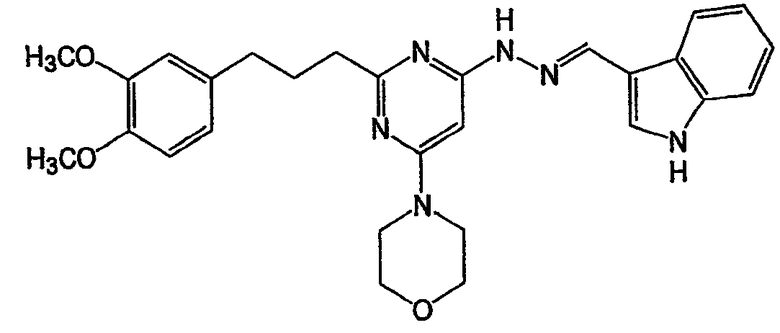
Соединение 2:
Соединение 3:
Соединение 4:
Соединение 5:
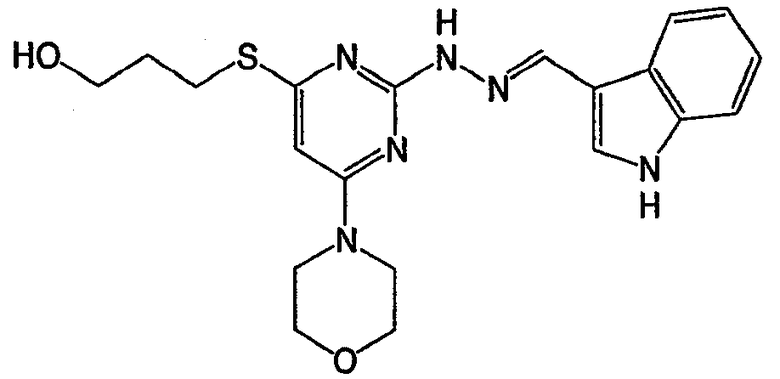
Соединение 6:
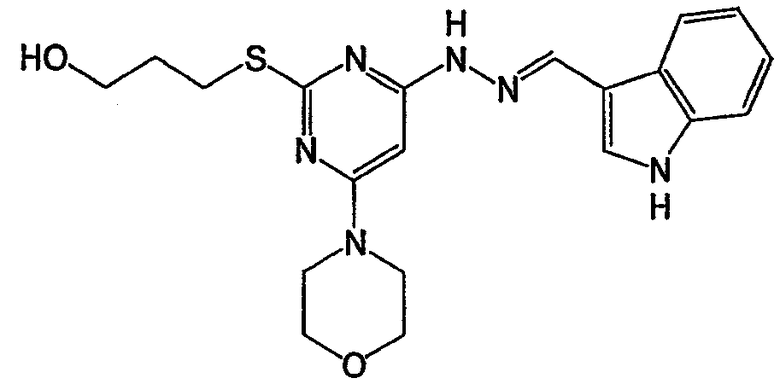
Соединение 7:
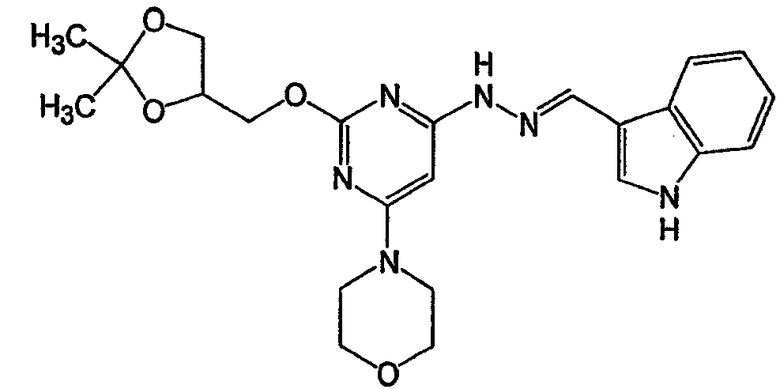
Соединение 8:
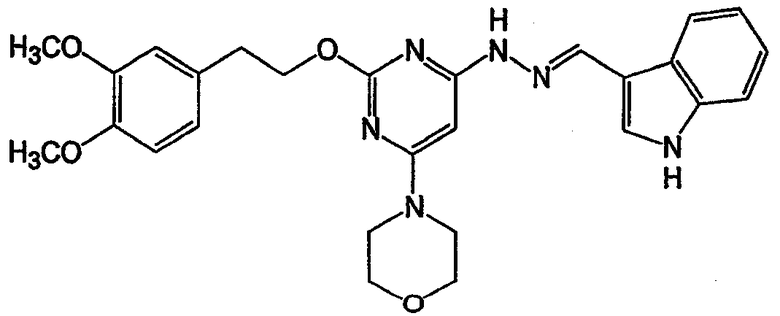
Соединение 9:
Соединение 10:
Соединение 11:
Соединение 12:
Соединение 13:
Соединение 14:

Соединение 15:
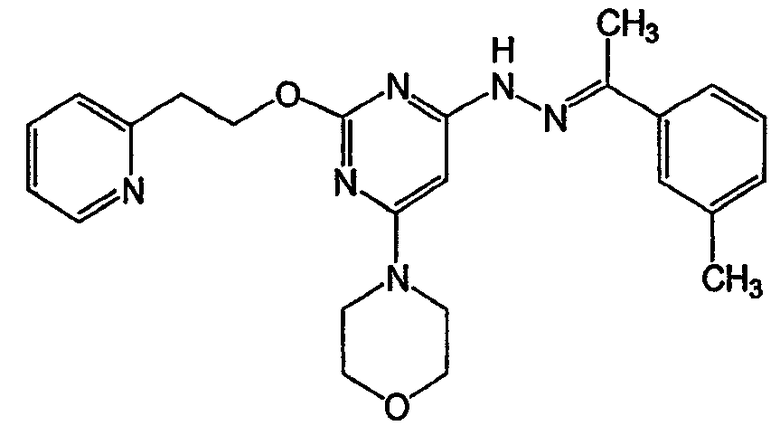
Соединение 16:
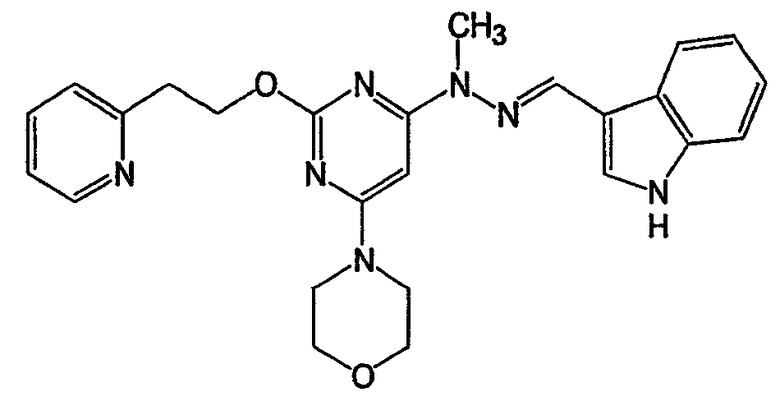
Соединение 17:
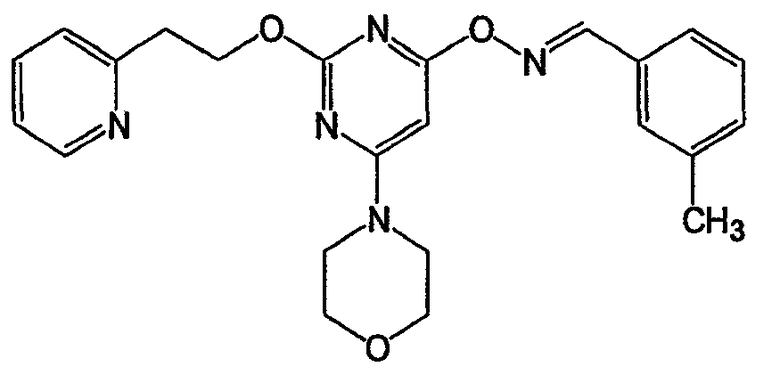
Соединение 18:
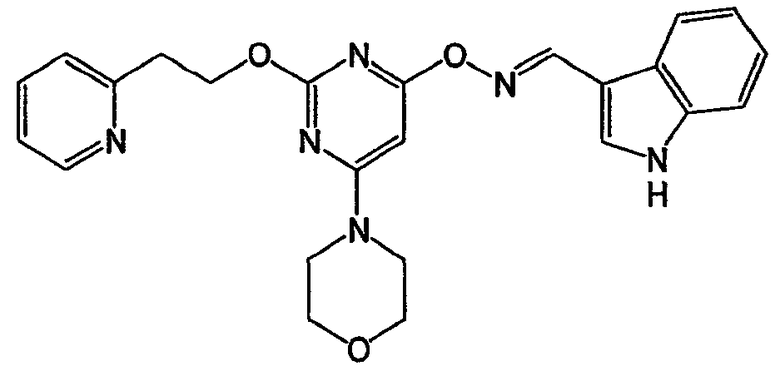
Соединение 19:
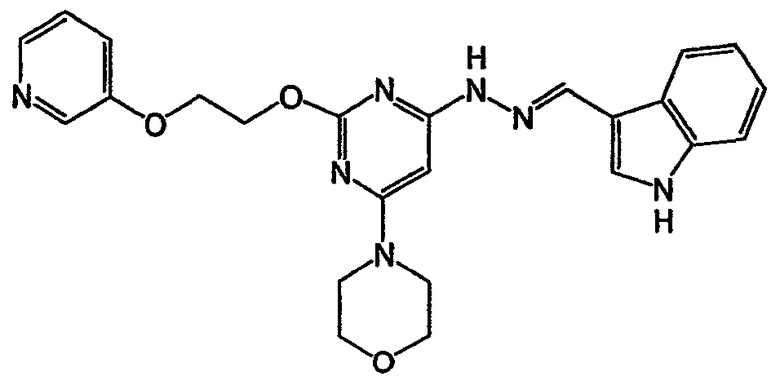
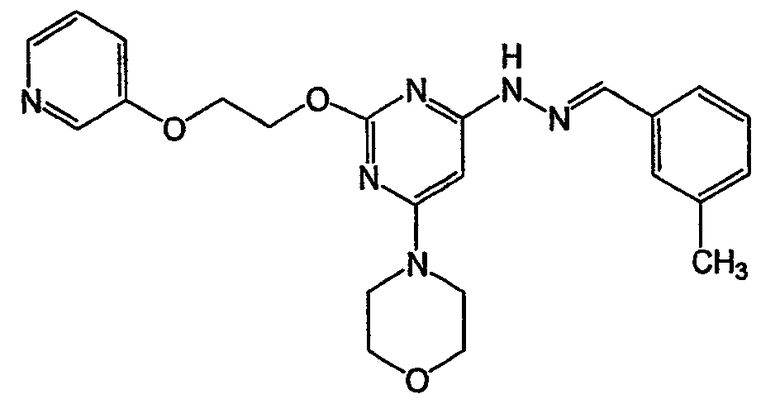
Соединение 20:
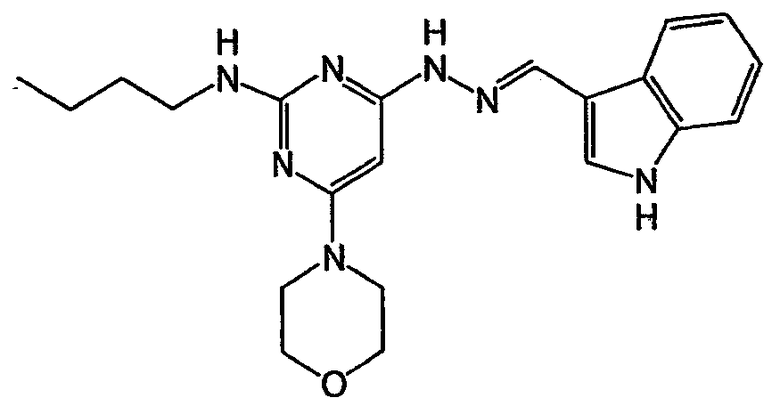
Соединение 21:
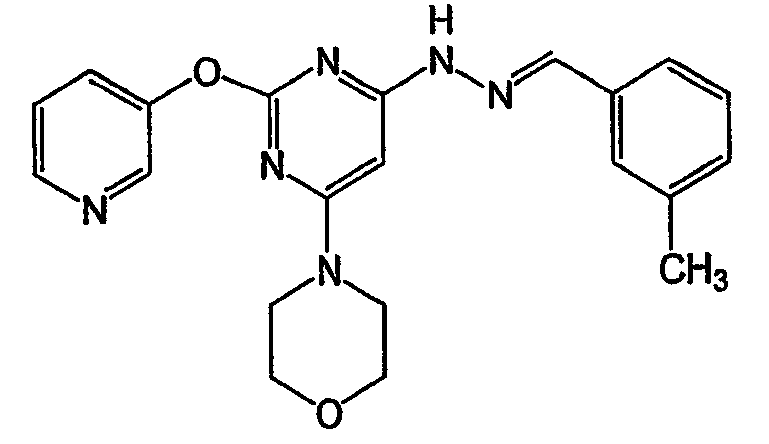
Соединение 22:
Соединение 23:
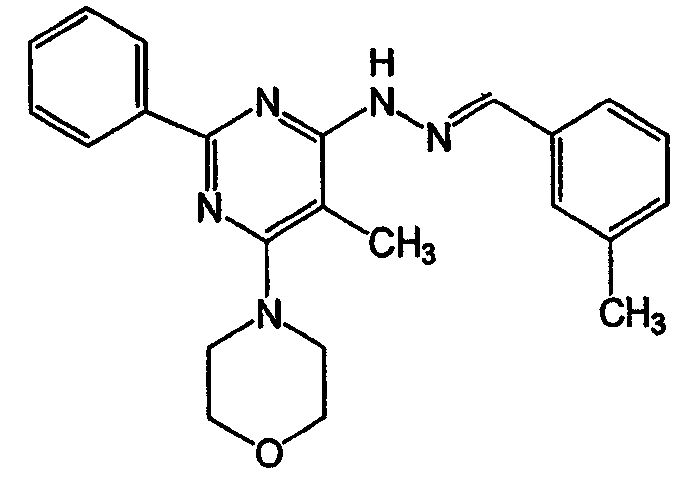
Соединение 24:
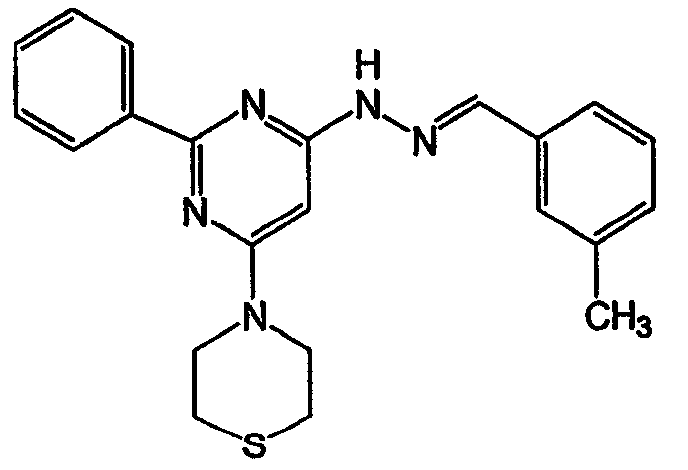
Соединение 25:
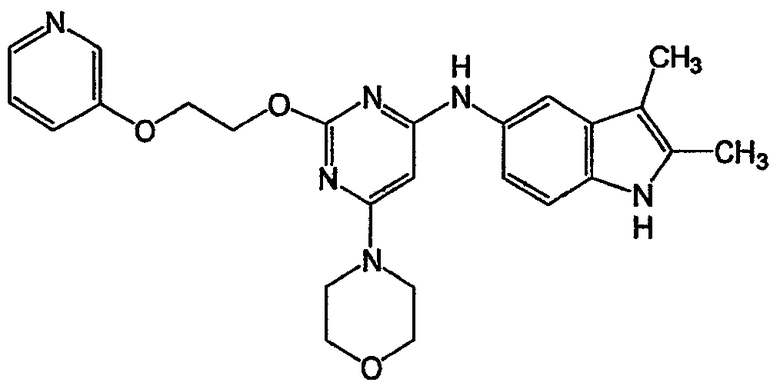
Соединение 26:
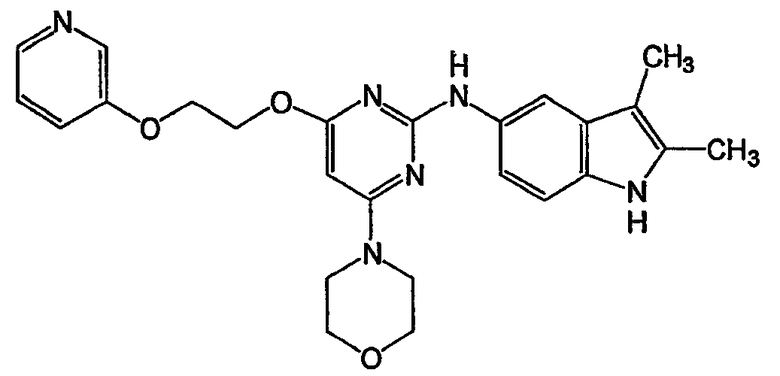
Соединение 27:
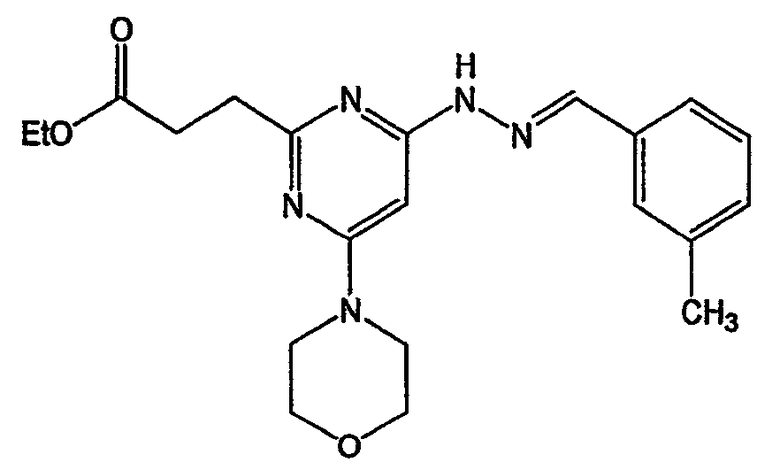
Соединение 28:
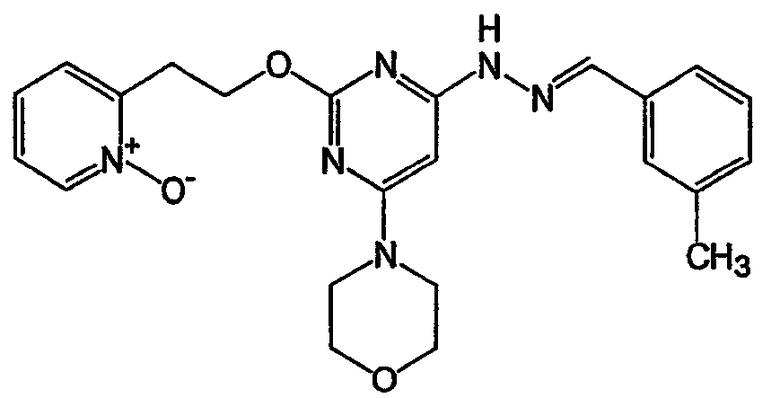
Соединение 29:
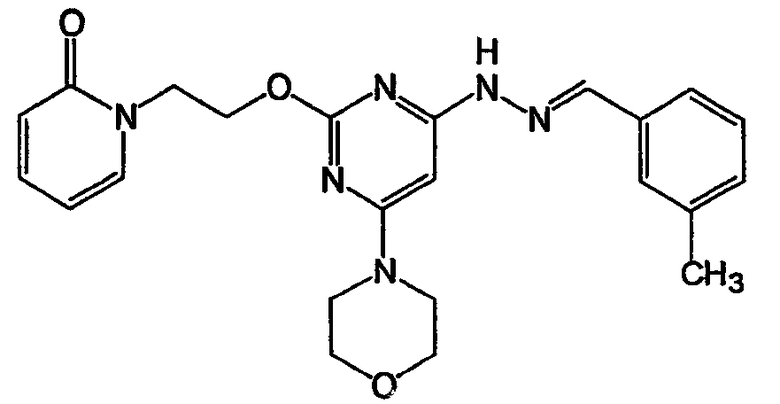
Соединение 30:
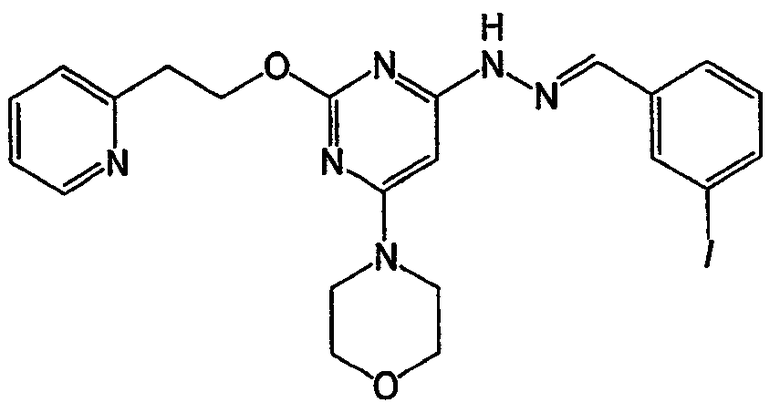
Соединение 31:
Соединение 32:
Соединение 33:
Соединение 34:
Соединение 35:
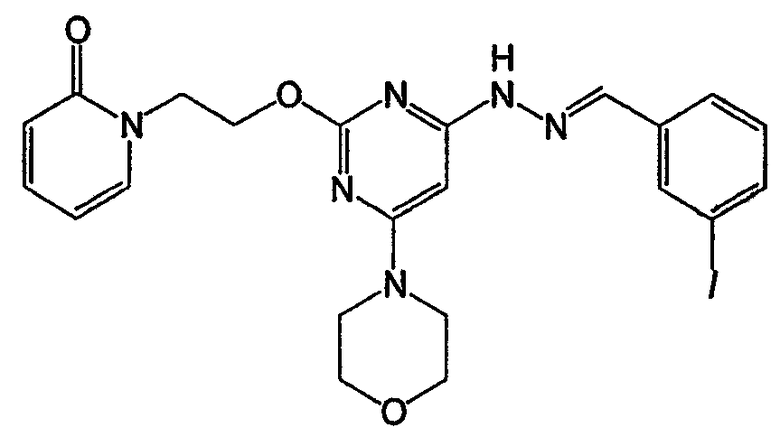
Соединение 36:
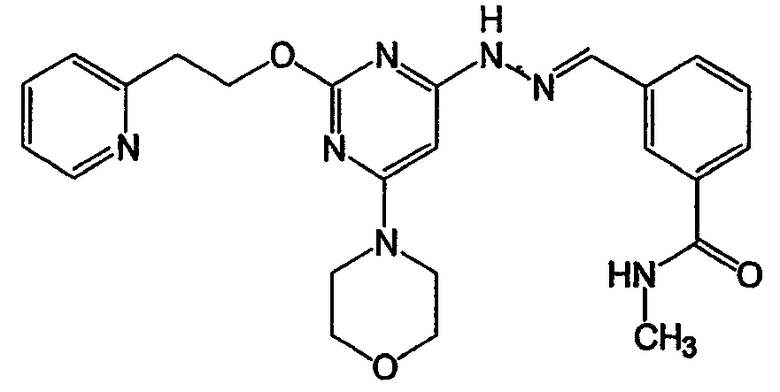
Соединение 37:
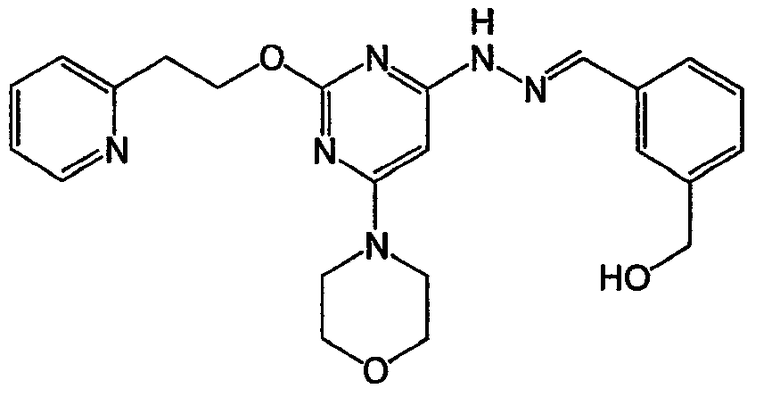
Соединение 38:
Соединение 39:
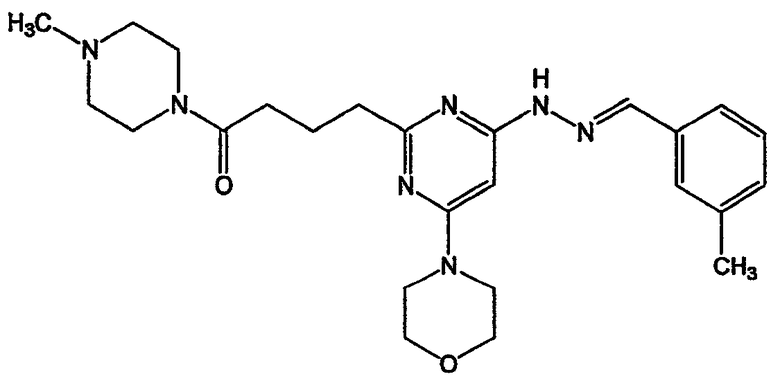
Соединение 40:
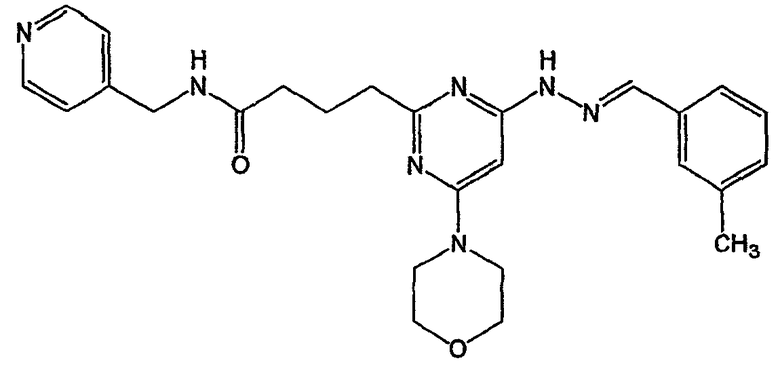
Соединение 41:
В другом аспекте данного изобретения описана фармацевтическая композиция, которая содержит фармацевтически приемлемый носитель и эффективное количество, по меньшей мере, одного из производных пиримидина данного изобретения.
В следующем аспекте настоящего изобретения описан способ лечения связанного со сверхпродуцированием IL-12 заболевания (например, ревматоидного артрита, сепсиса, болезни Крона, рассеянного склероза, псориаза или инсулинзависимого сахарного диабета). Способ включает введение субъекту (например, человеку или животному), нуждающемуся в этом, эффективного количества одного или нескольких производных пиримидина данного изобретения. Способ может также включать стадию определения того, нуждается ли субъект в лечении описанных выше заболеваний или нарушений. Определение может заключаться в суждении профессионала о пациенте или его здоровье и может быть субъективным (например, мнение специалиста) или объективным (например, измеряемым тестом или диагностическим способом).
Производные пиримидина данного изобретения включают сами соединения, а также их соли и их пролекарства, если они пригодны. Такие соли, например, могут быть образованы между положительно заряженным заместителем (например, амино) соединения и анионом. Подходящие анионы включают, но не ограничиваются перечисленным, хлорид, бромид, иодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат. Подобным же образом отрицательно заряженный заместитель (например, карбоксилат) соединения может образовывать соль с катионом. Подходящие катионы включают, но не ограничиваются перечисленным, ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Примеры пролекарств включают сложные эфиры и другие фармацевтически приемлемые производные, которые при введении субъекту способны образовывать производные пиримидина, описанные выше (см. Goodman and Gilman's, The Pharmacological basis of Therapeutics, 8th ed., McGraw-Hill, Int. Ed. 1992, "Biotransformation of Druds").
Кроме того, некоторые производные пиримидина данного изобретения имеют одну или несколько двойных связей или один или несколько асимметрических центров. Такие соединения могут существовать в виде рацематов, рацемических смесей, отдельных энантиомеров, индивидуальных диастереомеров, диастереомерных смесей и цис- или транс- или Е- или Z-изомерных форм у двойных связей.
Кроме того, вышеуказанные производные пиримидина включают также их N-оксиды. Термин «N-оксиды» относится к одному или нескольким атомам азота, которые, когда они присутствуют в производных пиримидина, находятся в форме N-оксида, т.е. N→O.
Комбинации заместителей и символов, рассматриваемые настоящим изобретением, являются только комбинациями заместителей и символов, которые приводят к образованию стабильных производных пиримидина. Термин «стабильный», используемый здесь, относится к соединениям, которые обладают стабильностью, достаточной для их получения, и которые сохраняют целостность в течение времени, достаточного для использования их для подробно описанных здесь целей (например, лечения связанных со сверхпродуцированием IL-12 нарушений, таких как ревматоидный артрит, сепсис, болезнь Крона, рассеянный склероз, псориаз или инсулинзависимый сахарный диабет).
В объем данного изобретения включена также композиция, содержащая одно или несколько производных пиримидина, описанных выше, и предназначенная для использования при лечении связанных со сверхпродуцированием IL-12 нарушений, и применение такой композиции для изготовления лекарственного средства для только что описанного использования.
Другие признаки, цели и преимущества изобретения будут очевидными из описания и формулы изобретения.
Подробное описание изобретения
Соединения, описанные выше, могут быть получены способами, хорошо известными в данной области, а также раскрытыми здесь синтетическими путями. Например, производное пиримидина может быть получено с использованием 2,4,6-трихлорпиримидина в качестве исходного материала. Три группы хлора могут быть заменены различными заместителями. Более определенно, первая группа хлора (например, в положении 6) может взаимодействовать, например, с морфолином с образованием морфолинилпиримидина. Дихлорпроизводные 2-арил- и 2-алкилпиримидинов могут быть также получены взаимодействием амидина с малоновым эфиром с последующей обработкой оксихлоридом фосфора. Вторая группа хлора может быть заменена взаимодействием с нуклеофилом, таким как спирт, в присутствии основания, например гидрида натрия. В других примерах соединение формулы (I), где Y представляет собой СН2 (например, соединение 1), может быть получено взаимодействием хлорида пиримидина с реактивом Гриньяра, оловоорганическим реагентом, медьорганическим реагентом, органоборной кислотой или цинкорганическим реагентом в присутствии палладийорганического соединения как катализатора. Могут быть получены изомерные формы. Требуемый изомерный продукт может быть отделен от других, например, высокоэффективной жидкостной хроматографией. Третью группу хлора подвергают реакции замещения, например, с гидразином, и первичный амин связанной гидразиновой группы далее взаимодействует с альдегидом, например, индол-3-карбоксальдегидом, с образованием гидразоновой связи. Таким образом получают производное пиримидина данного изобретения. В подходящих случаях аналогичными реакциями могут быть получены другие типы связей. Чувствительные группы на пиримидинилсодержащем промежуточном продукте и нуклеофиле могут быть защищены до проведения сочетания.
Химикаты, используемые в вышеописанных синтетических путях, могут включать, например, растворители, реагенты, катализаторы и реагенты, образующие защитную группу или удаляющие защитную группу. Способы, описанные выше, могут также дополнительно включать стадии либо до, либо после стадий, описанных здесь в частности, для присоединения или удаления подходящих защитных групп, чтобы в конце концов синтезировать производные пиримидина. Кроме того, различные синтетические стадии могут быть проведены в альтернативной последовательности или порядке, чтобы получить требуемые соединения. Методологии синтетических химических превращений и защитных групп (защита и снятие защиты), полезных в синтезе пригодных производных пиримидина, являются известными в данной области и включают, например, методологии, описанные в R. Larock, Comprehensive Organic Transformation, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Synthesis, John Wiley and Sons (1995)и последующих их изданиях.
Полученное таким образом производное пиримидина можно далее очистить флэш-колоночной хроматографией, высокоэффективной жидкостной хроматографией или кристаллизацией.
В объем данного изобретения включена также фармацевтическая композиция, которая содержит эффективное количество одного или нескольких производных пиримидина данного изобретения и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение включает способ введения эффективного количества такого соединения субъекту, нуждающемуся в лечении связанных со сверхпродуцированием IL-12 нарушений (например, ревматоидного артрита, сепсиса, болезни Крона, рассеянного склероза, псориаза или инсулинзависимого сахарного диабета). «Эффективное количество» относится к количеству соединения, которое требуется для создания терапевтического эффекта у подвергаемого лечению субъекта. Взаимосвязь доз для животных и людей (на основе миллиграммов на квадратный метр поверхности тела) описана в Freireich et al., (1966) Cancer Chemother Rep 50:219. Площадь поверхности тела может быть приблизительно определена из роста и массы пациента. См., например, Scientific Tables, Geigy Pharmaceutical, Ardley, N.Y., 1970, 537. Эффективное количество производного пиримидина данного изобретения может составлять приблизительно от 0,001 мг/кг до приблизительно 1000 мг/кг. Эффективные дозы могут также варьировать, как признается специалистами в данной области, в зависимости от подвергаемых лечению заболеваний, пути введения, использования эксципиентов и возможности совместного использования с другими терапевтическими лечениями, такими как использование других агентов.
Для осуществления на практике способа настоящего изобретения производное пиримидина как компонент фармацевтической композиции может быть введен перорально, парентерально, посредством ингаляционного спрея, местно, ректально, назально, трансбуккально, вагинально или через имплантированный резервуар. Используемый здесь термин «парентеральный» включает способы подкожной, внутрикожной, внутривенной, внутримышечной, интраартикулярной, внутриартериальной, внутрисуставной, внутригрудинной, внутриоболочечной, внутричерепной инъекции или инфузии и инъекции или инфузии в место повреждения.
Стерильную инъецируемую композицию, например стерильную инъецируемую водную или масляную суспензию, можно изготовить способами, известными в данной области, с использованием подходящих диспергирующих или смачивающих агентов (таких как, например, твин 80) и суспендирующих агентов. Стерильный инъецируемый препарат может также быть стерильным инъецируемым раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут быть использованы, имеются маннит, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные масла растительного или животного происхождения (например, синтетические моно- или диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются полезными при получении инъецируемых средств, когда они являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно их полиоксиэтилированные производные. Эти масляные растворы или суспензии могут также содержать разбавитель или диспергирующий агент в виде спирта с длинной цепью или карбоксиметилцеллюлозу или подобные диспергирующие агенты. Другие обычно используемые поверхностно-активные вещества, такие как твины или спаны или другие аналогичные эмульгирующие агенты или средства, повышающие биодоступность, которые обычно используют при изготовлении фармацевтически приемлемых твердых, жидких или других лекарственных форм, можно также использовать для целей получения композиции.
Композиция для перорального введения может быть любой перорально приемлемой дозированной формой, включающей, но не ограничивающейся перечисленным, капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток для перорального использования носители, которые обычно используют, включают лактозу и кукурузный крахмал. Обычно добавляют также лубриканты, такие как стеарат магния. Для перорального введения в форме капсулы полезные разбавители включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендирован или растворен в масляной фазе в комбинации с эмульгирующими или суспендирующими агентами. При желании могут быть добавлены некоторые подслащивающие средства, корригенты или красящие агенты. Назальный аэрозоль или ингаляционная композиция может быть получена способами, хорошо известными в области фармацевтической композиции, и может быть получена в виде растворов в насыщенном растворе соли при использовании бензилового спирта или других подходящих консервантов, активаторов абсорбции для повышения биодоступности, фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области. Производное пиримидина настоящего изобретения может быть также введено в форме суппозиториев для ректального введения.
Носитель в фармацевтической композиции должен быть «приемлемым» в смысле совместимости с активным ингредиентом композиции (и предпочтительно способности стабилизировать его) и отсутствия вреда для подвергаемого лечению субъекта. Например, солюбилизирующие агенты, такие как циклодекстрины, которые образуют специфичные, более растворимые комплексы с соединениями данного изобретения, или один или несколько солюбилизирующих агентов могут быть использованы в качестве фармацевтических эксципиентов для доставки производных пиримидина. Примеры других носителей включают коллоидальный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Yellow # 10.
Биологические активности производного пиримидина могут быть оценены рядом анализов на клеточной основе. Один из таких анализов может быть проведен с использованием клеток из мононуклеарных клеток периферической крови человека (РВМС) или линии моноцитарных клеток человека (ТНР-1). Клетки стимулируют комбинацией интерферона-γ человека (IFNγ) и липополисахарида или комбинацией IFNγ и Cowan I Staphylococcus aureus в присутствии испытуемого соединения. Уровень ингибирования продуцирования IL-12 может быть измерен посредством определения количества р70 с использованием «сэндвич»-анализа ELISA с антителами против человеческого IL-12. Затем может быть определен IC50 испытуемого соединения. В частности, клетки РВМС или ТНР-1 инкубируют с испытуемым соединением. Клеточную жизнеспособность анализируют с использованием биовосстановления MTS [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолия] (Promega, Madison, WI).
Производное пиримидина может быть также оценено исследованием животных. Например, одно из таких исследований включает способность испытуемого соединения лечить вызванный адъювантом артрит (т.е. нарушения, связанного со сверхпродуцированием IL-12) у крыс.
Считается, что без дальнейшего усовершенствования вышеприведенное описание адекватно делает приемлемым настоящее изобретение. Следующие определенные варианты осуществления должны, следовательно, рассматриваться только как иллюстративные и не ограничивающие остальную часть описания каким-либо образом. Все публикации, цитированные здесь, таким образом, включены здесь посредством ссылки во всей их полноте.
Пример 1. Получение соединения 1: N-{2-[3-(3,4-диметоксифенил)пропил]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразина
К раствору 3-(3,4-диметоксифенил)пропилиодида (1,224 г, 4,0 ммоль) в 20 мл сухого ТГФ добавляют очень активный цинк (суспензия в ТГФ, металл Rieke от Aldrich, 5,2 мл 0,05 г/мл, 4,0 ммоль) с образованием смеси. Смесь перемешивают при комнатной температуре на протяжении ночи. К смеси добавляют 2,4-дхлор-6-морфолинопиримидин (0,932 г, 4,0 ммоль) и транс-бензил(хлор)бис(трифенилфосфин)палладий(II) (0,03 г, 0,04 ммоль) и смесь перемешивают при 60°С в течение 2 дней. После обычной обработки смеси 4-хлор-2-[3-(3,4-диметоксифенил)пропил]-6-морфолинопиримидин (0,34 г, 0,90 ммоль, 22,4%) отделяют от 2-хлор-4-[3-(3,4-диметоксифенил)пропил]-6-морфолинопиримидина (0,45 г, 1,19 ммоль, 30%) очисткой флэш-хроматографией.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 6,70-6,80 (м, 3H); 6,32 (с, 1H); 3,87 (с, 3H); 3,85 (с, 3H); 3,73-3,78 (м, 4H); 3,60-3,64 (м, 4H); 2,76 (д, J=7,8 Гц, 2H); 2,63 (д, J=7,5 Гц, 2H); и 2,01-2,12 (м, 2H).
МС (ESI): м/z 380,2 (М+H).
Далее 4-хлор-2-[3-(3,4-диметоксифенил)пропил]-6-морфолинопиримидин (0,34 г, 0,90 ммоль) подвергают взаимодействию с гидразином (0,29 г, 9 ммоль), получая при этом 2-[3-(3,4-диметоксифенил)пропил]-4-гидразино-6-морфолинопиримидин в виде белого твердого вещества (0,30 г, 0,80 ммоль, 89%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 6,73-6,80 (м, 3H); 5,88 (с, 1H); 5,74 (с, 1H); 3,87 (с, 3H); 3,85 (с, 3H); 3,76-3,79 (м, 4H); 3,69 (д, J=0,6 Гц, 2H); 3,56-3,60 (м, 4H); 2,64 (д, J=7,5 Гц, 4H); и 2,00-2,15 (м, 2Н).
МС (ESI): м/z 374,2 (М-H).
5 мл раствора в метаноле, содержащего 2-[3-(3,4-диметоксифенил)пропил]-4-гидразино-6-морфолинопиримидин (0,177 г, 0,50 ммоль), индол-3-карбоксальдегид (0,073 г, 0,50 ммоль) и АсОН (20 мг, катал.), перемешивают при 70°С в течение 4 часов. Растворитель удаляют и сырой остаток очищают с использованием флэш-хроматографии, получая при этом соединение 1 в виде светло-коричневого твердого вещества (0,21 г, 0,42 ммоль, 84%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,57 (шир с, 1H); 8,45 (шир.с, 1H); 8,29-8,32 (м, 1H); 8,00 (с, 1H); 7,39-7,43 (м, 2Н); 7,23-7,34 (м, 2Н); 6,74-6,80 (м, 3Н); 6,30 (с, 1H); 3,86 (с, 3H); 3,85 (с, 3H); 3,78-3,84 (м, 4Н); 3,67-3,70 (м, 4Н); 2,63-2,71 (м, 4Н), и 2,03-2,13 (м, 2Н).
МС (ESI): м/z 501,2 (М+H).
Пример 2. Получение соединения 2: N-(2-н-бутокси-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразина
К раствору 2,4,6-трихлорпиримидина (25 г, 136 ммоль) в CH2Cl2 (500 мл) при -78°С медленно добавляют морфолин (11,89 мл, 136 ммоль), затем DIPEA (25 мл, 143 ммоль). Полученную реакционную смесь перемешивают при -78°С в течение 5 час и затем нагревают до комнатной температуры. Реакционную смесь промывают водой. Полученную органическую фазу сушат над Na2SO4. Растворитель удаляют при пониженном давлении. Сырой остаток, 2,4-дихлор-6-(морфолин-4-ил)пиримидин, перекристаллизовывают из EtOAc, получая при этом белые кристаллы (24,7 г, 77%).
1Н ЯМР (300 МГц, CDCl3) δ (м.д.): 6,40 (с, 1Н) и 4,0-3,5 (м, 8Н).
МС (ESI): m/z 234,0 (М+Н).
К раствору н-бутанола (0,633 г, 8,54 ммоль) в безводном ДМФ (50 мл) при 0°С в атмосфере N2 быстро добавляют NaH (0,307 г, 12,8 ммоль). Полученную суспензию перемешивают в течение 0,5 часа при 0°С. К суспензии добавляют 2,4-дихлор-6-(морфолин-4-ил)пиримидин (2 г, 8,54 ммоль). После нагревания суспензии до комнатной температуры и перемешивания в течение 12 час реакционную смесь гасят смесью лед/насыщенный раствор соли и экстрагируют 200 мл EtOAc. Экстракт промывают насыщенным раствором соли и сушат над Na2SO4. Растворитель удаляют при пониженном давлении. Сырой остаток очищают с использованием флэш-хроматографии (диоксид кремния; EtOAc/гексан: 1/6), получая при этом 1,4 г 2-н-бутокси-4-хлор-6-(морфолин-4-ил)пиримидина (белое твердое вещество, 60%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 6,20 (с, 1H); 4,26 (т, J=6,6 Гц, 2H); 3,78-3,70 (м, 4H); 3,66-3,56 (м, 4H); 1,80-1,68 (м, 2H); 1,54-1,40 (м, 2H); и 0,96 (т, J=6,9, 3H).
МС (ESI): м/z 272,1 (М+H).
К раствору 2-н-бутокси-4-хлор-6-(морфолин-4-ил)пиримидина (1,38 г, 5,1 ммоль) в диоксане (50 мл), добавляют безводный гидразин (1,6 мл, 50 ммоль). Полученную реакционную смесь нагревают до 95°С и перемешивают в течение 12 час в атмосфере N2. После охлаждения до комнатной температуры реакционную смесь гасят смесью лед-насыщенный раствор соли и экстрагируют EtOAc (200 мл). Органический экстракт промывают насыщенным раствором соли, водой и сушат над Na2SO4. Растворитель удаляют при пониженном давлении. Сырой остаток перекристаллизовывают из метанола, получая при этом 2-н-бутокси-4-гидразино-6-(морфолин-4-ил)пиримидин в виде белых кристаллов (1,10 г, 81%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 5,89 (шир.с, 1H), 5,49 (с, 1H), 4,26 (т, J=6,6, 2H), 3,84-3,78 (м, 6Н), 3,62-3,47 (м, 4Н), 1,82-1,67 (м, 2Н), 1,55-1,42 (м, 2H), и 0,96 (т, J=6,9, 3H).
МС (ESI): м/z 268,2 (М+H).
К раствору 2-н-бутокси-4-гидразино-6-(морфолин-4-ил)пиримидина (200 мг, 0,748 ммоль) в МеОН (20 мл) последовательно добавляют индол-3-карбоксальдегид (108,6 мг, 0,748 ммоль) и уксусную кислоту (каплю). Полученную реакционную смесь перемешивают при комнатной температуре в течение 12 час. Образуется белый осадок, который собирают и промывают 2 мл метанола, получая при этом 200 г соединения 2 (68%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,36 (шир.с, 1H), 8,30 (дд, J=6,6, 1,8, 1H), 8,05 (с, 1H), 8,00 (с, 1H), 7,44-7,40 (м, 2H), 7,33-7,24 (м, 2H), 6,13 (с, 1H), 4,26 (т, 2H, J=6,6), 3,84-3,78 (м, 4H), 3,70-3,64 (м, 4H), 1,80-1,70 (м, 2H), 1,54-1,42 (м, 2H), и 0,96 (т, J=6,9, 3H).
МС (ESI): м/z 395,2 (М+H).
Пример 3. Получение соединения 3: N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразина
Смесь 4-этокси-4-оксобутилцинкбромида (50 мл 0,5 М в ТГФ, 25 ммоль), 2,4-дихлор-6-морфолинопиримидина (4,68 г, 20,0 ммоль) и транс-бензил(хлор)бис(трифенилфосфин)палладия(II) (0,15 г, 0,2 ммоль) в ТГФ (общий объем 80 мл) перемешивают при 60°С в течение 2 дней. После обычной обработки проводят очистку флэш-хроматографией, получая при этом 4-хлор-2-(4-этокси-4-оксобутил)-6-морфолинопиримидин в виде белого твердого вещества (2,073 г, 6,60 ммоль, 33,0%).
К раствору 4-хлор-2-(4-этокси-4-оксобутил)-6-морфолинопиримидина (1,108 г, 3,54 ммоль) в 50 мл ТГФ при -78°С медленно добавляют раствор диизобутилалюминийгидрида (DIBAL) (4,72 мл 1,5 М раствора в толуоле, 7,08 ммоль). После добавления полученную реакционную смесь нагревают медленно до 0°С и выдерживают при 0°С в течение 10 мин. После обычной обработки проводят флэш-хроматографию, получая при этом 4-хлор-2-(4-гидроксибутил)-6-морфолинопиримидин (0,76 г, 2,80 ммоль, 79%) в виде светло-желтого твердого вещества.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 6,33 (с, 1H), 3,76-3,79 (м, 4Н); 3,61-3,68 (м, 6H); 2,76 (т, J=7,8 Гц, 2H); 1,81-1,91 (м, 2Н); и 1,60-1,74 (м, 3Н).
МС (ESI) м/z 370,2 (М+H).
По типичной процедуре 4-хлор-2-(4-гидроксибутил)-6-морфолинопиримидин (0,542 г, 2,00 ммоль, 1,00 эквив.) подвергают взаимодействию с гидразином и индол-3-карбоксальдегидом, получая при этом соединение 3 в виде не совсем белого твердого вещества (0,75 г, 1,90 ммоль, 95%).
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,47 (с, 1H); 10,64 (с, 1H); 8,25 (с, 1H); 8,18 (д, J=6,6 Гц, 1H); 7,71 (с, 1H); 7,43 (д, J=8,4 Гц, 1H); 7,17-7,20 (м, 2H); 6,16 (с, 1H), 4,37 (т, J=4,8 Гц, 1H); 3,72 (шир.с, 4H); 3,55 (шир.с, 4H); 3,41-3,45 (м, 2H); 2,49-2,54 (м, 2H), 1,66-1,76 (м, 2H); и 1,42-1,53 (м, 2H).
МС (ESI): м/z 395,1 (М+H).
Пример 4. Получение соединения 4: N-[2-(2-[1,3]диоксан-2-илэтил)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразина
Соединение 4 получают способом, аналогичным описанному в примере 1.
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,46 (с, 1H); 10,64 (с, 1H); 8,25 (с, 1H); 8,18 (д, J=6,6 Гц, 1H); 7,71 (с, 1H); 7,43 (д, J=6,0 Гц, 7,5 Гц, 1H); 7,16-7,19 (м, 2H); 6,15 (с, 1H), 4,58 (т, J=5,1 Гц, 1H); 4,00 (дд, J=11,4 Гц, 4,5 Гц, 2H); 3,64-3,72 (м, 6H); 3,54 (шир с, 4H); 2,50-2,59 (м, 2Н); 1,80-1,94 (м, 3Н), и 1,33 (д, J=9,6 Гц, 1H).
МС (ESI): м/z 437,2 (М+H).
Пример 5. Получение соединения 5: N-(1Н-индол-3-илметилен)-N'-[2-(3-метоксипропил)-6-морфолин-4-илпиримидин-4-ил]гидразина
По процедуре для синтеза N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразина (соединение 3) синтезируют 4-хлор-2-(3-гидроксипропил)-6-морфолинопиримидин (0,81 г, 3,15 ммоль), метилируют его обработкой гидридом натрия (0,48 г, 6,30 ммоль) в течение 10 мин и MeI (0,895 г, 6,30 ммоль) в течение 5 час в 30 мл ТГФ при 0°С, получая при этом 4-хлор-2-(3-метоксипропил)-6-морфолинопиримидин в виде бесцветного вязкого масла (0,792 г, 3,03 ммоль, 96%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 6,32 (с, 1H), 3,75-3,79 (м, 4H); 3,61-3,64 (м, 4H); 3,44 (т, J=6,6 Гц, 2H); 3,34 (с, 3H); 2,78 (т, J=7,8 Гц, 2H); и 2,00-2,09 (м, 2H).
МС (ESI): м/z 262,1 (М+H).
По типичной процедуре 4-хлор-2-(3-метоксипропил)-6-морфолинопиримидин (0,783 г, 3,00 ммоль) последовательно обрабатывают гидразином и индол-3-карбоксальдегидом, получая при этом 0,89 г соединения 5 (2,26 ммоль, 75%).
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,46 (с, 1H); 10,64 (с, 1H); 8,26 (с, 1H); 8,17-8,20 (м, 1H); 7,72 (д, J=2,4 Гц, 1H); 7,43 (дд, J=6,0 Гц, 2,4 Гц, 1H); 7,15-7,21 (м, 2H); 6,16 (с, 1H), 3,70-3,73 (м, 4H); 3,52-3,56 (м, 4H); 3,37 (т, J=6,9 Гц, 2H); 3,23 (с, 3H); 2,50-2,57 (м, 2H), и 1,88-1,97 (м, 2H).
МС (ESI): м/z 395,2 (М+H).
Пример 6. Получение соединения 6: 3-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-илсульфанил}пропан-1-ола
Соединение 6 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,48 (с, 1H); 10,68 (с, 1H); 8,26 (с, 1H); 8,15-8,18 (м, 1H); 7,73 (д, J=2,1 Гц, 1H); 7,42-7,44 (м, 1H); 7,16-7,20 (м, 2H); 6,04 (с, 1H), 4,53 (т, J=5,1 Гц, 1H); 3,65-3,71 (м, 4H); 3,48-3,56 (м, 6H); 3,06 (т, J=7,2 Гц, 2H), и 1,76-1,85 (м, 2H).
МС (ESI): м/z 413,1 (М+H).
Пример 7. Получение соединения 7: 3-{2-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-4-илсульфанил}пропан-1-ола
Соединение 7 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,34 (с, 1H); 10,48 (с, 1H); 8,45 (д, J=7,8 Гц, 1H); 8,25 (с, 1H); 7,64 (д, J=2,7 Гц, 1H); 7,40 (д, J=8,1 Гц, 1H); 7,05-7,19 (м, 2H); 6,08 (с, 1H), 4,60 (т, J=5,1 Гц, 1H); 3,50-3,68 (м, 10H); 3,20-3,30 (м, 2H); и 1,78-1,86 (м, 2H).
МС (ESI): м/z 413,1 (М+H).
Пример 8. Получение соединения 8: N-[2-(2,2-диметил-[1,3]диоксолан-4-илметокси)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразина
Соединение 8 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,38 (шир.с, 1H); 8,30 (дд, J=7,2, 1,8, 1H), 8,02 (шир.с, 1H); 8,00 (с, 1H); 7,44-7,41 (м, 2Н); 7,32-7,26 (м, 2Н); 6,14 (с, 1H); 4,51-4,42 (м, 2Н); 4,22-4,12 (м, 2Н); 3,96-3,91 (м, 1Н); 3,84-3,79 (м, 4H); 3,70-3,64 (м, 4H); 1,47 (с, 3H); и 1,38(c, 3Н).
МС (ESI): м/z 453,2 (М+H).
Пример 9. Получение соединения 9: N-{2-[2-(3,4-диметоксифенил)этокси]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразина
Соединение 9 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,43 (шир.с, 1H); 8,30 (д, J=7,5 Гц 1H); 8,2 (шир.с, 1H); 8,02 (д, J=2,7 Гц, 1H); 7,46-7,40 (м, 2Н); 7,30-7,26 (м, 2Н); 6,82 (д, J=1 Гц, 3H); 4,45 (д, J=3,6 Гц, 1H); 4,45 (т, J=5,2 Гц, 2H); 3,87 (д, J=3,9 Гц, 3H); 3,86 (д, J=3,9 Гц, 3H); 3,81 (с, 4H); 3,67 (с, 4H); и 3,04 (т, J=5,0 Гц, 2H).
МС (ESI): м/z 503,2 (М+H).
Пример 10. Получение соединения 10: N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 10 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 9,3 (шир.с, 1H); 8,66 (с, 1H); 8,55-8,53 (м, 1H); 8,28-8,26 (м, 1H); 8,04 (с, 1H); 7,62-7,57 (м, 1H); 7,41-7,10 (м, 6Н); 6,08 (с, 1H); 4,64 (т, J=6,6 Гц, 2H); 3,76 (с, 4H); 3,62 (с, 4H); и 3,26 (т, J=6,6 Гц, 2H).
МС (ESI): м/z 444,2 (М+H).
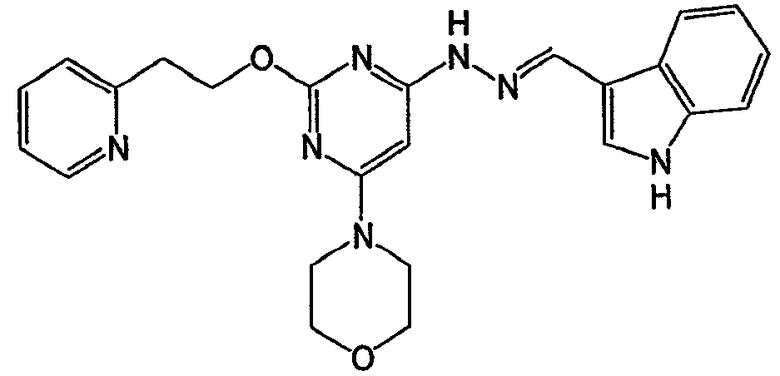
Пример 11. Получение соединения 11: N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразина
Соединение 11 получают способом, аналогичным описанному в примере 1.
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,47 (с, 1H); 10,65 (с, 1H); 8,50 (д, J=4,5 Гц, 1H); 8,26 (с, 1H); 8,20-8,18 (м, 1H); 7,72-7,68 (м, 2H); 7,45-7,42 (м, 1H); 7,29-7,18 (м, 4H); 6,17 (с, 1H); 3,73 (с, 4H); 3,5 (с, 4H); 2,79 (т, J=7,5 Гц, 2H); 2,58-2,51 (м, 2H); и 2,18-2,06 (м, 2H).
МС (ESI): м/z 442,2 (М+H).
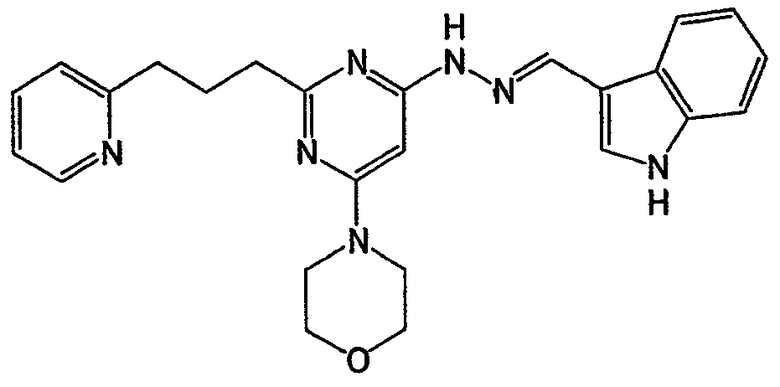
Пример 12. Получение соединения 12: N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 12 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,55-8,48 (м, 2H); 7,71 (с, 1H); 7,65-7,55 (м, 1H); 7,49-7,42 (м, 2H); 7,30-7,15 (м, 4H); 6,08 (с, 1H); 4,64 (т, J=6,6 Гц, 2H); 3,81-3,75 (м, 4H); 3,64-3,61 (м, 4H); 3,25 (т, J=7,0 Гц, 2H); и 2,38 (с, 3H).
МС (ESI): м/z 419,2 (М+H).
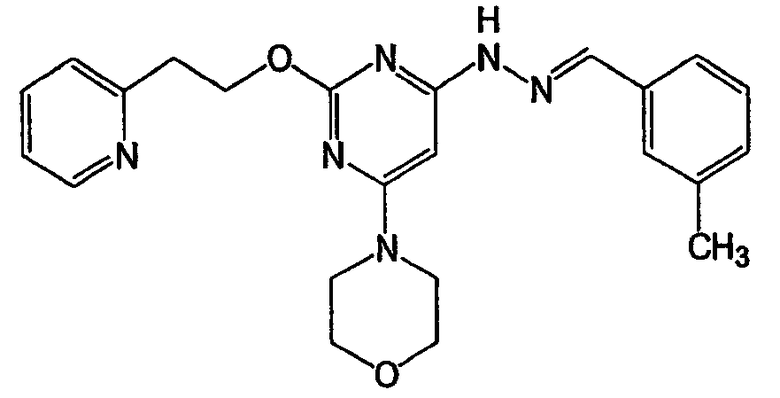
Пример 13. Получение соединения 13: N-(3-этилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 13 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,58-8,50 (м, 1H); 8,43 (с, 1H); 7,95 (с, 1H); 7,64-7,58 (м, 2H); 7,30-7,25 (м, 1H); 7,18-7,05 (м, 3H); 6,07 (с, 1H); 4,65 (т, J=6,9 Гц, 2H); 3,80-3,76 (м, 4H); 3,64-3,61(м, 4H); 3,26 (т, J=6,9 Гц, 2H); 2,40 (кв, J=7,6 Гц, 2H); и 1,45 (т, J=7,6 Гц, 3H).
МС (ESI): м/z 433,3 (М+H).
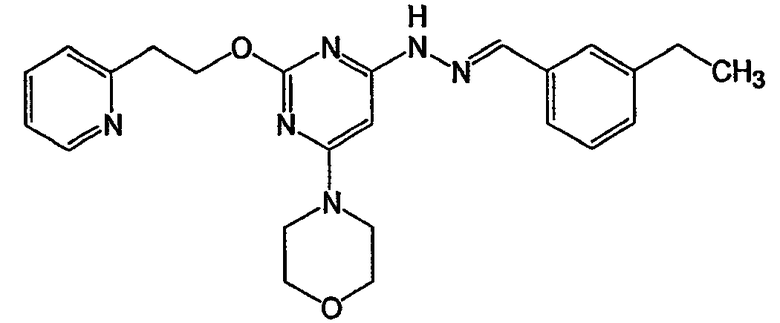
Пример 14. Получение соединения 14: N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразина
Соединение 14 получают способом, аналогичным описанному в примере 1.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 9,6 (шир.с, 1H); 8,53 (д, J=4,5 Гц, 1H); 7,76 (с, 1H); 7,56 (т, J=6 Гц, 1H); 7,49-7,47 (м, 2Н); 7,28 (м, 1Н); 7,18-7,06 (м, 3H); 6,26 (с, 1H); 3,81-3,79 (м, 4H); 3,69-3,67 (м, 4H); 2,89 (т, J=7,8 Гц, 2H); 2,71 (т, J=7,5 Гц, 2H); 2,39 (с, 3H); и 2,22 (т, J=7,5 Гц, 2H).
МС (ESI): м/z 417,2 (М+H).
Пример 15. Получение соединения 15: N-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]-N'-(1-м-толилэтилиден)гидразина
Соединение 15 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,56 (шир.с, 1H), 7,66-7,46 (м, 4H), 7,32-7,26 (м, 2H), 7,16-7,14 (м, 2H), 6,44 (с, 1H), 4,69 (т, J=6,9 Гц, 2H), 3,80-3,77 (м, 4H), 3,63-3,60 (м, 4H), 3,31 (т, J=6,9 Гц, 2H), 2,39 (с, 3H).
МС (ESI): м/z 433,2 (М+H).
Пример 16. Получение соединения 16: N-[1-(1Н-индол-3-ил)этилиден]-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 16 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 9,35 (шир.с, 1H); 8,54 (дд, J=0,9, 4,2 Гц, 1H); 8,33 (д, J=7,5 Гц, 1H); 7,93 (с, 1H); 7,58 (т, J=7,2 Гц, 1H); 7,36-7,33 (м, 2H); 7,27-7,120 (м, 4H); 6,49 (с, 1H); 4,68 (т, J=7,2 Гц, 2H); 3,76-3,73 (м, 4Н); 3,60-3,57 (м, 4H); 3,50 (с, 3H); и 3,33-3,28 (т, J=7,0 Гц, 2H).
МС (ESI): м/z 458,2 (М+H).
Пример 17. Получение соединения 17: О-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксима 3-метилбензальдегида
Соединение 17 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,56-8,53 (м, 1H); 8,45 (с, 1H); 7,62-7,50 (м, 3H); 7,38-7,26 (м, 3H); 7,18-7,10 (м, 1H); 6,17 (с, 1H); 4,68 (т, J=6,9 Гц, 2H); 3,80-3,76 (м, 4H); 3,67-3,64 (м, 4H); 3,29 (т, J=6,9 Гц, 2H); и 2,41 (с, 3H).
МС (ESI): м/z 420,1 (М+H).
Пример 18. Получение соединения 18: О-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксима 1Н-индол-3-карбальдегида
Соединение 18 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, ДМСО-d6), δ (м.д.): 11,82 (шир.с, 1H); 8,81 (с, 1H); 8,50 (д, J=4,5 Гц, 1H); 8,04 (д, J=6,9 Гц, 1H); 7,93 (с, 1H); 7,72 (т, J=6,9 Гц, 1H); 7,49 (д, J=6,9 Гц, 1H); 7,33 (д, J=7,8 Гц, 1H); 7,30-7,18 (м, 3H); 6,22 (с, 1H); 4,57 (т, J=6,3 Гц, 2H); 3,67 (с, 4H); 3,56 (с, 4H); и 3,15 (т, J=6,3 Гц, 2H).
МС (ESI): м/z 445,2 (М+H).
Пример 19. Получение соединения 19: N-(1Н-индол-3-илметилен)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразина
Соединение 19 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 9,20 (шир.с, 1H); 8,30 (шир с, 1H); 8,29 (т, J=3,3 Гц, 1H); 8,18-8,12 (м, 2Н); 7,44-7,41 (м, 2Н); 7,26-7,18 (м, 5Н); 6,08 (с, 1H); 4,66 (т, J=4,8 Гц, 2H); 4,29 (т, J=5,0 Гц, 2H); 3,80-3,76 (м, 4Н); и 3,67-3,62 (м, 4H).
МС (ESI): м/z 460,2 (М+H).
Пример 20. Получение соединения 20: N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразина
Соединение 20 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,55 (с, 1H); 8,34 (шир.с, 1H); 8,30-8,23 (м, 1H); 7,78 (с, 1H); 7,50-7,47 (м, 2Н); 7,32-7,24 (м, 1Н); 7,20-7,17 (м, 3Н); 6,14 (с, 1H); 4,66 (т, J=5,0 Гц, 2H); 4,35 (т, J=4,8 Гц, 2H); 3,83-3,80 (м, 4Н); 3,68-3,65 (м, 4H); и 2,40 (с, 3H).
МС (ESI): м/z 435,2 (М+H).
Пример 21. Получение соединения 21: бутил-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-ил}амина
Соединение 21 получают способом, аналогичным описанному в примере 2.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,41 (шир.с, 1H), 8,33-8,30 (м, 1H), 8,19 (шир.с, 1Н), 7,95 (с, 1H), 7,41-7,37 (м, 2H), 7,29-7,25 (м, 2H), 5,96 (с, 1H), 4,65 (т, J=4 Гц, 1H), 3,83-3,80 (м, 4H), 3,65-3,62 (м, 4H), 3,36 (дд, J=6,3, 13,5 Гц, 2H), 1,60-1,55 (м, 2Н), 1,35-1,33 (м, 4Н), 0,92-0,87 (м, 3Н).
МС (ESI): м/z 408,2 (М+H).
Пример 22. Получение соединения 22: N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразина
К раствору 3-гидроксипиридина (950 мг, 10 ммоль) в безводном ТГФ (50 мл) при 0°С при защите азотом добавляют NaH (60% в масле) (480 мг, 12 ммоль). Суспензию перемешивают в течение 0,5 часа при 0°С и добавляют 2,4,6-трихлорпиримидин (1,84 г, 10 ммоль). После нагревания смеси до комнатной температуры и перемешивания в течение 2 час реакционную смесь гасят смесью лед/насыщенный раствор соли и экстрагируют EtOAc (300 мл). Органическую фазу промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют, упаривают в вакууме. Сырой продукт очищают флэш-хроматографией на колонке силикагеля (EtOAc-гексан, 1:7). К продукту (1,80 г, 7,4 ммоль) в CH2Cl2 (150 мл) при 0°С медленно добавляют морфолин (2,5 г, 28 ммоль). Реакционную смесь перемешивают при 0°С в течение 1 часа и еще 1 час при комнатной температуре. Смесь промывают водой. Органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме, получая при этом три изомера. Изомеры разделяют флэш-хроматографией на колонке силикагеля (EtOAc-гексан, 1:7 и 1:3) с получением 4-[6-хлор-2-(пиридин-3-илокси)пиримидин-4-ил]морфолин (320 мг, 14,7%).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,51 (д, 1H, J=2,7 Гц), 8,44 (дд, 1Н, J=1,5, J=3,3 Гц), 7,53-7,49 (м, 1Н), 7,34-7,3 (м, 1H), 6,25 (с, 1H), 3,71-3,67 (м, 4H), 3,51-3,48 (м, 4H).
МС (ESI): м/z 293,1.
К раствору 4-[6-хлор-2-(пиридин-3-илокси)пиримидин-4-ил]морфолина (295 мг, 1 ммоль) в ТГФ (10 мл) добавляют безводный гидразин (0,320 мл, 10 ммоль) при защите атмосферой азота. Смесь нагревают при 70°С в течение 15 мин. После охлаждения до комнатной температуры реакционную смесь гасят смесью лед/насыщенный раствор соли и экстрагируют EtOAc (100 мл). Органическую фазу промывают насыщенным раствором соли (10 мл) и водой (10 мл х 2), сушат (Na2SO4), фильтруют, упаривают и очищают флэш-хроматографией на колонке силикагеля (CH2Cl2 и CH2Cl2-МеОН, 95:5), получая при этом [6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразин (180 мг) с выходом 62%. m/z (М+1) 289,2.
К раствору [6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразина (180 мг) (145 мг, 0,5 ммоль) и м-толилальдегида (72 мг, 0,6 ммоль) в МеОН (10 мл) добавляют уксусную кислоту (1 каплю). Реакционную смесь перемешивают при комнатной температуре в течение 12 час с осаждением белого твердого вещества. Образовавшийся осадок собирают фильтрованием и промывают небольшим количеством метанола, получая при этом 125 мг соединения 22 с выходом 64%.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,71 (с, 1Н), 8,57 (д, 1H, J=2,4 Гц), 8,44 (дд, 1H, J=1,5, 3,2 Гц), 7,78 (с, 1H), 7,56-7,52 (м, 1H), 7,46-7,43 (м, 2H), 7,34-7,26 (м, 2H), 7,17 (д, 1H, J=8,1 Гц), 6,17 (с, 1H), 3,76-3,73 (м, 4H), 3,57-3,54 (м, 4H), 2,38 (с, 3Н).
МС (ESI): м/z 391,2.
Пример 23. Получение соединения 23: N-(3-метилбензилиден)-N'-(5-метил-6-морфолин-4-ил-2-фенилпиримидин-4-ил)гидразина
Гидрохлорид бензамидина (7,06 г, 0,045 моль) и диметилметилмалонат (6,0 г, 0,041 моль) растворяют в метаноле (100 мл). Добавляют метоксид натрия (21,5 мл, 0,099 моль, 25 (мас.%) раствор в метаноле) и раствор перемешивают при комнатной температуре в течение 18 час. Объем растворителя снижают приблизительно до 50 мл при пониженном давлении, затем смесь выливают на ледяную воду. Раствор нейтрализуют НОАс с образованием белого осадка. Осадок собирают и сушат, получая при этом белое твердое вещество (6,1 г, 74%).
1Н ЯМР (ДМСО-d6) δ (м.д.) 1,68 (с, 3Н), 7,70-7,87 (м, 3Н), 8,21 (д, J=8,4 Гц).
МС (ESI): m/z 203,1 (М+Н)+.
5-Метил-2-фенилпиримидин-4,6-диол (3,3 г, 0,016 моль) и POCl3 нагревают до 60°С в течение 3 час. Раствору дают возможность охладиться до комнатной температуры, затем выливают на лед. Образовавшийся белый осадок фильтруют и сушат, получая при этом требуемое соединение в виде белого твердого вещества (810 мг, 21%).
1Н ЯМР (ДМСО-d6) δ (м.д.) 2,40 (с, 3Н), 7,51-7,56 (м, 3Н), 8,23 (д, 8,4 Гц).
МС (ESI): m/z 239,1 (М+Н)+.
4,6-Дихлор-5-метил-2-фенилпиримидин (2,5 г, 0,010 моль) и морфолин (2,93 г, 0,031 моль) растворяют в ТГФ (50 мл) и нагревают при температуре кипения с обратным холодильником в течение 3 час. Раствору дают возможность охладиться, затем добавляют EtOAc (100 мл) и воду (100 мл). Слой EtOAc промывают водой (3х100 мл), сушат над MgSO4, фильтруют и растворитель удаляют при пониженном давлении. Образовавшееся твердое вещество используют без дополнительной очистки (2,66 г, 92%).
МС (ESI): m/z 298,1 (М+Н)+.
4-(6-Хлор-5-метил-2-фенилпиримидин-4-ил)морфолин (439 мг, 1,51 ммоль) растворяют в ТГФ (50 мл). Добавляют гидразин (0,25 мл, 7,96 ммоль) и раствор нагревают при температуре кипения с обратным холодильником в течение 18 час. Реакционной смеси дают возможность охладиться и растворитель удаляют при пониженном давлении. Добавляют EtOAc (100 мл) и воду (100 мл). Слой EtOAc промывают водой (3х100 мл), сушат над MgSO4, фильтруют и растворитель удаляют при пониженном давлении, получая при этом белое твердое вещество (374 мг). Указанное твердое вещество снова растворяют в ТГФ (50 мл) и добавляют м-толуальдегид (157 мг, 1,31 ммоль). Раствор нагревают при температуре кипения с обратным холодильником в течение 4 час, затем ему дают возможность охладиться. Растворитель удаляют при пониженном давлении, затем добавляют EtOAc (100 мл) и воду (100 мл). Слой EtOAc промывают водой (3х100 мл), сушат над MgSO4, фильтруют и растворитель удаляют при пониженном давлении. Сырой продукт очищают колоночной хроматографией на силикагеле при элюировании 25% EtOAc/гексан, получая при этом чистый требуемый продукт в виде желтого твердого вещества (313 мг, 53%).
1Н ЯМР (ДМСО-d6) δ (м.д.) 2,26 (с, 3H), 2,36 (с, 3H), 3,35 (м, 4H), 3,75-3,78 (м, 4H), 7,20 (д, J=6,9 Гц), 7,33 (т, J=6,9 Гц), 7,47-7,52 (м, 5H), 8,19 (с, 1H), 8,35-8,38 (м, 2H), 10,60 (с, 1H).
МС (ESI): м/z 388,3 (М+H)+.
Пример 24. Получение соединения 24: N-(3-метилбензилиден)-N'-(2-фенил-6-тиоморфолин-4-илпиримидин-4-ил)гидразина
Соединение 24 получают способом, аналогичным описанному в примере 23.
1Н ЯМР (ДМСО-d6) δ 2,36 (с, 3H), 2,76 (с, 4H), 4,07 (с, 4H), 6,36 (с, 1H), 7,19 (д, J=8,1 Гц), 7,32 (т, J=8,1 Гц), 7,47-7,57 (м, 5H), 8,09 (с, 1H), 8,30-8,31 (м, 1H), 11,02 (с, 1H).
МС (ESI): м/z 389,1.
Пример 25. Получение соединения 25: (2,3-диметил-1Н-индол-5-ил)-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина
К раствору 2-(пиридин-3-илокси)этанола (3,48 г, 25 ммоль) в 40 мл безводного ТГФ при комнатной температуре в атмосфере N2 добавляют 2,4,6-трихлорпиримидин (4,56 г, 25 ммоль) с последующим добавлением по порциям NaH (60% суспензия в масле, 1,1 г, 27,5 ммоль). После 30 мин перемешивания реакционную смесь гасят водой, водный слой экстрагируют EtOAc, объединенные органические растворы промывают насыщенным раствором соли и сушат над MgSO4.
Очистка с использованием флэш-хроматографии (диоксид кремния; дихлорметан/ацетон/метанол: 3/1/0,1) дает смесь 4,6-дхлор-2- и -2,6-дихлор-4-[2-(пиридин-3-илокси)этокси]пиримидинов (3,72 г, 52%) (отношение изомеров по ЯМР 1:1,2) в виде масла.
К раствору вышеуказанной смеси (3,72 г, 13 ммоль) в 20 мл 1,4-диоксана добавляют DIPEA (2,49 мл, 14,3 ммоль), затем 2,3-диметил-5-аминоиндол (2,08 г, 13 ммоль) и смесь кипятят с обратным холодильником в течение 1 часа. Растворитель удаляют при пониженном давлении и реакционную смесь разделяют с использованием колоночной хроматографии (диоксид кремния; дихлорметан/ацетон, метанол: 3/1/0,1), получая при этом {6-хлор-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амин (2,07 г, 39%). Получают смесь {4-хлор-6-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина и {2-хлор-6-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина (2,5 г, 47%) и используют ее в другой реакции.
Раствор {6-хлор-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина (2,07 г, 5,05 ммоль) и морфолина (1,32 мл, 15,15 ммоль) в 1,4-диоксане нагревают при 110°С в течение 24 часов. Растворитель удаляют при пониженном давлении и реакционную смесь очищают с использованием флэш-хроматографии (диоксид кремния; дихлорметан/ацетон/метанол: 3/1/0,1), получая при этом соединение 25 (2 г, 86%) в виде бесцветного твердого вещества.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,34 (шир.с, 1H), 8,23 (дд, 1H, J=3,6, 2,1), 7,96 (шир.с, 1H), 7,34-7,21 (м, 4H), 6,98 (дд, 1Н, J=8,4, 1,8 Гц), 6,60 (шир.с, 1H), 5,36 (с, 1H), 4,65 (т, 2H, J=5,1 Гц), 4,34 (т, 2H, J=5,1 Гц), 3,66 (м, 4H), 3,42 (м, 4H), 2,37 (с, 3H) и 2,20 (с, 3H).
МС (ESI): м/z 461,5 (М+H).
Пример 26. Получение соединения 26: (2,3-диметил-1Н-индол-5-ил)-{4-морфолин-4-ил-6-[2-(пиридин-3-илокси)этокси]пиримидин-2-ил}амина
Взаимодействие смеси {4-хлор-6-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина и {2-хлор-6-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амина (2,5 г, 47%) и (2,5 г, 6,1 ммоль) с морфолином проводят, как описано в примере 24.
Очистка флэш-хроматографией и перекристаллизация из смеси эфир-пентан дает 0,3 г соединения 26.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,36 (шир.с, 1H), 8,24 (м, 1H), 7,85 (м, 1H), 7,70 (шир.с, 1H), 7,26-7,14 (м, 4H), 6,78 (шир с, 1H), 5,42 (с, 1H), 4,68 (т, 2H, J=5,1), 4,31 (т, 2H, J=5,1), 3,70 (м, 4H), 3,54 (м, 4H), 2,35(с, 3H), и 2,18 (с, 3H).
МС (ESI): м/z 461,5 (М+H).
Пример 27. Получение соединения 27: этилового эфира 3-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}пропионовой кислоты
Соединение 27 получают способом, аналогичным описанному в примере 1.
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 8,22 (с, 1H); 7,69 (с, 1H); 8,07 (с, 1H); 7,47 (м, 2H); 7,28 (т, J=7,5 Гц, 1H); 7,17 (д, J=7,5 Гц, 1H); 6,23 (с, 1H); 4,13 (кв, J=7,2 Гц, 2H); 3,78-3,81 (м, 4H); 3,62-3,65 (м, 4H); 2,98 (т, J=7,2 Гц, 2H); 2,77 (т, J=7,2 Гц, 2H); 2,39 (с, 3H); и 1,24 (т, J=7,2 Гц, 3H).
МС (ESI): м/z 398,2 (М+H).
Пример 28. Получение соединения 28: N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразина
К раствору 4-[6-хлор-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]морфолина (1,61 г, 5,0 ммоль) в CH2Cl2 (40 мл) добавляют метанол (10 мл) с последующим добавлением МСРВА (70%, 1,43 г, 5,8 ммоль) в виде одной порции. Реакционную смесь перемешивают на протяжении ночи при комнатной температуре, получая при этом прозрачный раствор. Раствор выливают в насыщенный водный NaHCO3 (35 мл), затем органическую фазу отделяют, промывают 10% водным Na2S2O3 (40 мл) и насыщенным раствором соли (40 мл) и сушат (Na2SO4), фильтруют и упаривают вакууме, получая при этом чистый продукт, 4-{6-хлор-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}морфолин, в виде белого твердого вещества (1,46 г, 86,7%).
1Н ЯМР (CDCl3) (м.д.), J(Гц): 8,25-8,23 (м, 1Н); 7,41-7,38 (м, 1Н); 7,20-7,16 (м, 2H); 6,14 (с, 1H); 4,71 (т, J=6,0, 2Н); 3,77-3,73 (т, 4H); 3,63-3,55 (м, 4H); и 3,40 (т, J=6,0, 2H).
Водный гидразин (0,640 мл, 20 ммоль) добавляют к раствору 4-{6-хлор-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}морфолина (1,35 г, 4,0 ммоль) в диоксане (15 мл) при защите атмосферой азота. Полученную смесь нагревают при 95-100°С в течение 2 час. После ее охлаждения растворитель выпаривают в вакууме до тех пор, пока не начнется осаждение белого твердого вещества (до половины первоначального объема), и затем добавляют Н2О (15 мл). Образовавшийся осадок собирают фильтрованием и промывают водой (до нейтрального рН). {6-Морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразин (1,02 г) получают с выходом 76,7%.
1Н ЯМР (ДМСО-d6) (м.д.), J (Гц): 8,25 (шир.с, 1H); 7,66 (с, 1H); 7,44-7,41 (м, 1H); 7,33-7,25 (м, 2H); 5,59 (с, 1H); 4,46 (т, J=6,0, 2H); 3,64-3,61 (м, 4Н); 3,41-3,38 (м, 4); и 3,17 (т, J=6, 2H).
К раствору {6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразина (820 мг, 2,46 ммоль) и м-толуальдегида (97%, 320 мг, 2,58 ммоль) в метаноле (7 мл) добавляют уксусную кислоту (2 капли). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 15 мин. После охлаждения до комнатной температуры образуется осадок и твердое вещество собирают фильтрованием, промывают небольшим количеством метанола и Et2O и сушат, получая при этом 950 мг (89%) N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразина в виде белого твердого вещества (т. пл. 187-188°С).
1Н ЯМР (300 МГц, CDCl3), δ (м.д.): 10,86 (с, 1H); 8,28-8,26 (м, 1Н); 7,98 (с, 1H); 7,50-7,43 (м, 3H); 7,33-7,26 (м, 3H); 7,17 (д, J=7,8 Гц, 1H); 6,05 (с, 1H); 4,53 (т, J=6,3 Гц, 2H); 3,68-3,64 (м, 4H); 3,54-3,50 (м, 4H); 3,21 (т, J=6,3, 2H); и 2,33 (с, 3H).
МС ES: вычислено для С23Н26N6O3: 434,21; найдено: 457,2 (М+Na)+.
Пример 29. Получение соединения 29: 1-(2-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-она
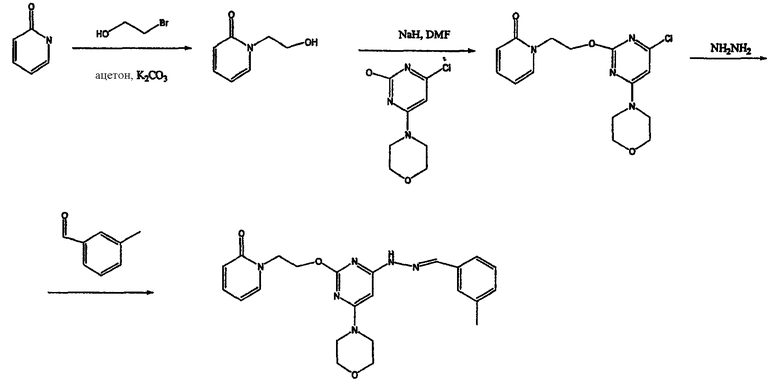
Как показано на приведенной выше схеме, 1-(гидроксиэтил)-1Н-пиридин-2-он (1,5 г, 10,7 ммоль) сочетают с 4-(2,6-дихлорпиримидин-4-ил)морфолином в присутствии гидрида натрия в ДМФ. После добавления воды осадок отфильтровывают, промывают водой и сушат, получая при этом почти чистый требуемый региоизомер (1,7 г, 47%). Полученный региоизомер кипятят с обратным холодильником с 3,5 эквивалентами гидразина в диоксане. К реакционной смеси добавляют воду с образованием осадка. Осадок собирают фильтрованием, промывают 3 раза водой и сушат, получая при этом производное гидразина (1,7 г, 85%). Конденсация с м-толилальдегидом дает указанное в заголовке соединение (2,1 г, 95%).
1Н ЯМР (ДМСО-d6): δ 10,90 (с, 1H), 7,98 (с, 1H), 7,62 (дд, J=6,8, 2,1 Гц, 1H), 7,49 (д, J=7,5 Гц, 1H), 7,48 (с, 1H), 7,41 (тд, J=7,8, 2,1 Гц, 1H), 7,29 (т, J=7,5 Гц, 1H), 7,17 (д, J=7,8 Гц, 1H), 6,39 (д, J=9,3 Гц, 1H), 6,20 (т, J=6,2 Гц, 1H), 6,05 (с, 1H), 4,43 (т, J=5,1 Гц, 2H),4,22 (т, J=5,2 Гц, 2H), 3,66 (м, 4Н), 3,52 (м, 4H), 2,34 (с, 3H).
МС ES: вычислено для С23Н26N6O3: 434,21; найдено: 457,2 (М+23)+.
Пример 30. Получение соединения 30: N-(3-иодбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 30 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 10,97 (с, 1H), 8,51 (д, J=4,5 Гц, 1H), 8,00 (с, 1H), 7,95 (с, 1H), 7,78-7,70 (м, 3Н), 7,34 (д, J=7,8 Гц, 1H), 7,26-7,18 (м, 2Н), 6,08 (с, 1H), 4,55 (т, J=6,6 Гц, 2H), 3,66 (м, 4H), 3,53 (м, 4H), 3,14 (т, J=6,6 Гц, 2H).
МС ES: вычислено для С22Н23IN6O2: 530,09; найдено: 531,1 (М+1)+.
Пример 31. Получение соединения 31: N-(3-фторбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 31 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 10,98 (с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,01 (с, 1H), 7,72 (тд, J=7,6, 1,8 Гц, 1H), 7,57 (шир.д, J=9,9 Гц, 1H), 7,51-7,40 (м, 2Н), 7,33 (д, J=7,2 Гц, 1H), 7,24 (дд, J=7,6, 5,2 Гц, 1H), 7,20 (шир.т, J=7,8 Гц, 1H); 6,11 (с, 1H), 4,54 (т, J=6,8 Гц, 2H), 3,65 (м, 4H), 3,54 (м, 4H), 3,14 (т, J=6,7 Гц, 2H).
МС ES: вычислено для С22Н23FN6O2: 422,19; найдено: 445,2 (М+23)+.
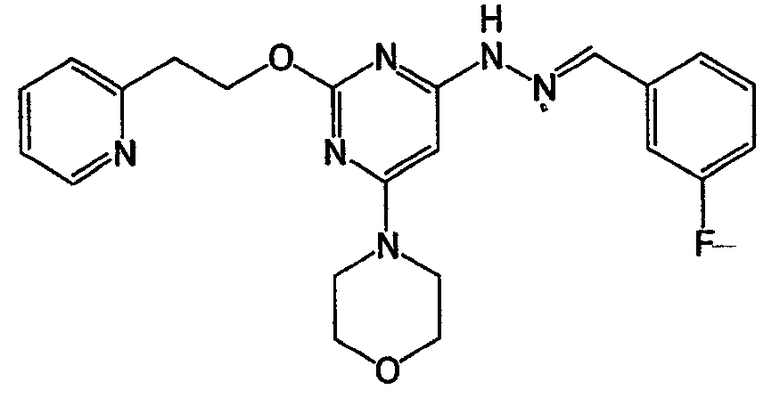
Пример 32. Получение соединения 32: N-(3-хлорбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 32 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 11,00 (с, 1H), 8,51 (д, J=4,5 Гц, 1H), 8,00 (с, 1H), 7,74-7,70 (м, 2Н), 7,65 (д, J=6,6 Гц, 1H), 7,45-7,41 (м, 2Н), 7,33 (д, J=7,8 Гц, 1H), 7,24 (дд, J=7,8, 4,8 Гц, 1H), 6,09 (с, 1H), 4,54 (т, J=6,6 Гц, 2H), 3,66 (м, 4H), 3,54 (м, 4H), 3,14 (т, J=6,6 Гц, 2H).
МС ES: вычислено для С22Н23ClN6O2: 438,16; найдено: 461,2 (М+23)+.
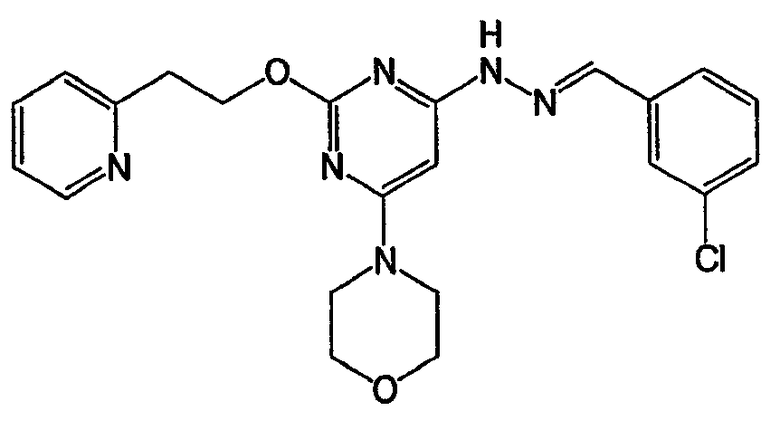
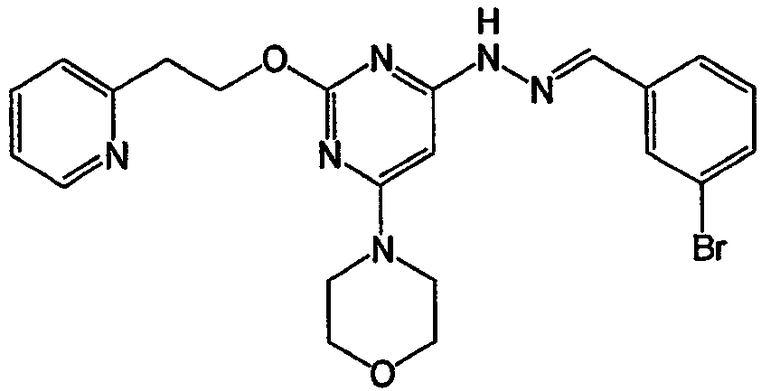
Пример 33. Получение соединения 33: N-(3-бромбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразина
Соединение 33 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 10,99 (с, 1H), 8,51 (д, J=4,2 Гц, 1H), 7,98 (с, 1H), 7,86 (с, 1H), 7,72 (т, J=8,5 Гц, 1H), 7,71 (д, J=8,1 Гц, 1H), 7,54 (д, J=7,5 Гц, 1H), 7,38-7,32 (м, 2H), 7,24 (дд, J=7,2, 4,8 Гц, 1Н), 6,09 (с, 1H), 4,54 (т, J=6,6 Гц, 2H), 3,66 (м, 4H), 3,53 (м, 4H), 3,14 (т, J=6,6 Гц, 2H).
МС ES: вычислено для С22Н23BrN6O2: 482,11; найдено: 505,10 (М+23)+.
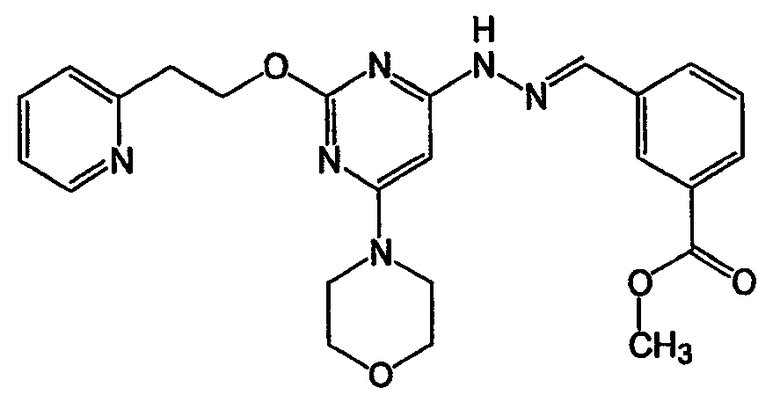
Пример 34. Получение соединения 34: метилового эфира 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты
Соединение 34 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 11,00 (с, 1H), 8,51 (д, J=5,4 Гц, 1H), 8,12 (с, 1H), 8,10 (с, 1H), 8,06 (д, J=8,1 Гц, 1H), 7,93 (д, J=6,6 Гц, 1H), 7,73 (т, J=7,6 Гц, 1H), 7,57 (т, J=8,0 Гц, 1H), 7,34 (д, J=7,8 Гц, 1H), 7,24 (дд, J=6,0, 4,5 Гц, 1H), 6,07 (с, 1H), 4,55 (т, J=6,4 Гц, 2H), 3,88 (с, 3H), 3,68 (м, 4H), 3,53 (м, 4H), 3,15 (т, J=6,6 Гц, 2H).
МС ES: вычислено для С24Н26N6O4: 462,20; найдено: 463,3 (М+1)+.
Пример 35. Получение соединения 35: 1-(2-{4-[N'-(3-иодбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-она
Соединение 35 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 11,02 (с, 1H), 8,00 (с, 1H), 7,93 (с, 1H), 7,75-7,69 (м, 2H), 7,61 (дд, J=7,0, 1,8 Гц, 1H), 7,41 (тд, J=7,9, 2,1 Гц, 1H), 7,20 (т, J=8,0 Гц, 1H), 6,38 (д, J=8,4 Гц, 1H), 6,19 (т, J=6,7 Гц, 1H), 6,06 (с, 1H), 4,43 (т, J=5,3 Гц, 2H), 4,22 (т, J=5,3 Гц, 2H), 3,66 (м, 4H), 3,53 (м, 4H), 3,14 (т, J=6,6 Гц, 2H).
МС ES: вычислено для С22Н23IN6O3: 546,09; найдено: 569,2 (М+23)+.
Пример 36. Получение соединения 36: N-метиламида 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты
Соединение 36 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 11,00 (с, 1H), 8,6 (с, 1H), 8,41 (д, J=5,4 Гц, 1H), 8,12 (с, 1H), 8,11 (с, 1H), 8,0 (д, J=8,1 Гц, 1H), 7,83 (д, J=6,8 Гц, 1H), 7,73 (т, J=7,2 Гц, 1H), 7,57 (т, J=8,0 Гц, 1H), 7,34 (д, J=7,8 Гц, 1H), 7,34 (дд, J=6,0, 4,5 Гц, 1H), 6,07 (с, 1H), 4,55 (т, J=6,4 Гц, 2H), 3,5-3,0 (м, 7H).
МС ES: вычислено для С24Н27N7O3: 461,2; найдено: 485,1 (М+Na)+.
Пример 37. Получение соединения 37: (3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}фенил)метанола
Соединение 37 получают способом, аналогичным описанному в примере 29.
1Н ЯМР (ДМСО-d6): δ 10,86 (с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,03 (с, 1H), 7,73 (тд, J=7,8 и 1,8 Гц, 1H), 7,39 (м, 2H), 7,39-7,32 (м, 3H), 7,24 (дд, J=6,3 и 4,8 Гц, 1H), 6,06 (с, 1H), 5,25 (т, J=5,7 Гц, 1H), 4,54 (т, J=6,8 Гц, 2H); 4,53 (д, J=6,5 Гц, 2H), 3,66 (м, 4H), 3,53 (м, 4H), 3,14 (т, J=6,9 Гц, 2H).
МС ES: вычислено для С23Н26N6O3: 434,49; найдено: 435,2 (М+1)+.
Соединения 38-41 получают следующим способом.
Гидрохлорид этилового эфира 4-карбамидоилмасляной кислоты получают по процедуре, исходящей из 4-цианобутирата (6,49 г, 43,9 ммоль), и сочетают с диэтилмалонатом в присутствии этилата натрия, получая при этом требуемый дигидроксипиримидин (1,27 г, 15%). Обработка дигидроксипиримидина оксихлоридом фосфора дает дихлорпроизводное (0,88 г, 60%), которое превращают в производное морфолина (0,89 г, 85%) после взаимодействия с DIPEA и морфолином в ТГФ. Дихлорпроизводное кипятят с обратным холодильником в диоксане с 4 эквивалентами гидразина, получая при этом производное гидразина (0,52 г, 59%), которое конденсируют с м-толилальдегидом, получая при этом гидразон (0,61 г, 88%). Гидразон гидролизуют КОН в метаноле, получая при этом кислоту: 4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил]масляную кислоту (0,47 г, 82%).
К раствору кислоты добавляют EDC, DMAP и подходящий амин в ДМФ. Полученную реакционную смесь перемешивают на протяжении ночи при комнатной температуре и распределяют между слоями дихлорметана и воды. Слой дихлорметана промывают два раза водой, насыщенным раствором соли и сушат. Полученный амид (выход 70-80%) выделяют колоночной хроматографией.
Пример 38. Получение соединения 38: N,N-диэтил-4-{4-[N"-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}бутирамида
1Н ЯМР (CDCl3): δ 8,38 (шир.с, 1H), 7,71 (с, 1H), 7,47 (м, 2H), 7,31-7,26 (м, 2H), 7,17 (д, J=7,5 Гц, 1H), 6,24 (с, 1H), 3,78 (м, 4Н), 3,66 (м, 4Н), 3,37 (кв, J=7,2 Гц, 2H), 3,30 (кв, J=7,2 Гц, 2H), 2,67 (т, J=7,4 Гц, 2H), 2,39 (м, 4Н), 2,13 (кв, J=7,4 Гц, 2H), 1,13 (т, J=7,4 Гц, 3H), 1,11 (т, J=7,4 Гц, 3H).
МС ES: вычислено для С24Н34N6O2: 438,27; найдено: 439,30 (М+1)+.
Пример 39. Получение соединения 39: 4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-1-(4-метилпиперазин-1-ил)бутан-1-она
1Н ЯМР (CDCl3): δ 8,36 (шир.с, 1H), 7,71 (с, 1H), 7,46 (м, 2Н), 7,31-7,26 (м, 2H), 7,17 (д, J=7,8 Гц, 1H), 6,25 (с, 1H), 3,80 (м, 4Н), 3,65 (м, 6Н), 3,46 (т, J=4,9 Гц, 2H), 2,67 (т, J=7,4 Гц, 2H), 2,42-2,34 (м, 8H), 2,30 (с, 3H), 2,11 (кв, J=7,5 Гц, 2H).
МС ES: вычислено для С25Н35N7O2: 465,29; найдено: 466,30 (М+1)+.
Пример 40. Получение соединения 40: 4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илметилбутирамида
1Н ЯМР (CDCl3): δ 8,59 (шир.с, 1H), 7,92 (с, 1H), 7,60 (м, 2Н), 7,37 (м, 2Н), 7,22-7,11 (м, 4H), 7,00 (м, 1H), 6,15 (с, 1H), 4,36 (д, J=5,7 Гц, 2H), 3,68 (м, 4Н), 3,53 (м, 4H), 2,62 (т, J=7,4 Гц, 2H), 2,31 (с, 3H), 2,25 (т, J=6,9 Гц, 2H), 2,05 (кв, J=6,8 Гц, 2H).
МС ES: вычислено для С26Н31N7O2: 473,25; найдено: 474,30 (М+1)+.
Пример 41. Получение соединения 41: 4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илбутирамида
1Н ЯМР (CDCl3): δ 9,43 (с, 1H), 8,68 (шир.с, 1H), 8,43 (д, J=4,8 Гц, 2H), 7,75 (с, 1H), 7,51 (д, J=5,4 Гц, 2H), 7,44 (м, 2Н), 7,27 (т, J=7,2 Гц, 1H), 7,16 (д, J=6,9 Гц, 1H), 6,23 (с, 1H), 3,77 (м, 4H), 3,64 (м, 4H), 2,72 (т, J=6,9 Гц, 2H), 2,46 (т, J=6,9 Гц, 2H), 2,37 (с, 3H), 2,15 (кв, J=6,9 Гц, 2H).
МС ES: вычислено для С25Н29N7O2: 459,24; найдено: 460,30 (М+1)+.
Пример 42. Анализы in vitro
Реагенты. Cowan I Staphylococcus aureus (SAC) был получен от Calbiochem (La Jolla, CA) и липополисахарид (LPS, Serratia marscencens) был получен от Sigma (St. Louis, MO). Человеческие и мышиные рекомбинантные IFNγ были куплены у Boehringer Mannheim (Mannheim, Germany) и Pharmingen (San Diego, CA), соответственно.
Анализ in vitro клеток человека. Человеческие мононуклеарные клетки периферической крови (РВМС) выделяли центрифугированием с использованием среды фиколл-пак (Pharmacia Biotech, Uppsala, Sweden) и приготовляли в среде RPMI, дополненной 10% фетальной сывороткой теленка (FCS), 100 Е/мл пенициллина и 100 мкг/мл стрептомицина. РВМС помещали в лунки 96-луночного планшета при концентрации 5х105 клеток/лунку и примировали добавлением IFNγ (30 Е/мл) в течение 22 час и стимулировали добавлением LPS (1 мкг/мл) или добавлением IFNγ (100 Е/мл) и затем стимулировали добавлением SAC (0,01%). Испытуемое производное пиримидина растворяли в ДМСО и добавляли в лунки 96-луночного планшета. Конечную концентрацию ДМСО доводили до 0,25% во всех культурах, включая контроль без испытуемого соединения. ТНР-1-клетки человека помещали в лунки, примировали добавлением IFNγ (100 Е/мл) в течение 22 час и стимулировали добавлением SAC (0,025%) в присутствии различных концентраций производного пиримидина. Свободные от клеток супернатанты отбирали через 18 час для измерения цитокинов. Жизнеспособность клеток анализировали с использованием биовосстановления MTS. Выживание клеток устанавливали определением отношения поглощения в группах, обработанных испытуемым соединением, к поглощению в контроле без испытуемого соединения.
Супернатант анализировали для определения количества IL-12p40, IL-12p70 или IL-10 посредством использования сэндвич-анализа ELISA с антителами против человеческого IL, т.е. набора ELISA человеческого IL-12p40 от R&D Systems (Berkeley, CA), и набора ELISA человеческого IL-12p70 или IL-10 от Endogen (Cambridge, MA). Анализы были основаны на инструкциях производителя.
Анализ in vitro мышиных клеток. Мышей Balb/c (Taconic, Germantown, NY) иммунизировали Mycobacterium tuberculosis H37Ra (Difco, Detroit, MI). Спленоциты собирали 5 дней и приготовляли в среде RPMI, дополненной 10% FCS и антибиотиками, в имеющем плоское дно 96-луночном планшете с 1х106 клетками/лунку. Спленоциты затем стимулировали комбинацией IFNγ (60 нг/мл) и SAC (0,025%) [или LPS (20 мкг/мл)] в присутствии испытуемого соединения. Супернатанты без клеток отбирали через 24 час для измерения цитокинов. Получение соединения и анализ жизнеспособности клеток проводили, как описано выше. Мышиные Il-12p70, IL-10, IL-1β и TNFα измеряли с использованием наборов ELISA от Endogen по инструкциям производителя.
Биологические активности производных пиримидина испытывали на человеческих клетках РВМС (мононуклеарные клетки периферической крови) или ТНР-1. Неожиданно было обнаружено, что некоторые из испытуемых соединений имеют величины IC50 < 1 нМ.
Пример 43. Анализы in vivo
Лечение адъювантного артрита у крыс: адъювантный артрит (АА) индуцировали у самок крыс Lewis подкожной инъекцией (в основание хвоста) 0,1 мл имеющей концентрацию 10 мг/мл бактериальной суспензии, изготовленной из термонейтролизованного микроорганизма Mycobacterium tuberculosis H37Ra почвы, суспендированного в неполном адъюванте Фрейнда. Крысам давали испытуемое соединение перорально один раз в день в течение 12 дней, начиная на следующий день после индукции. Мониторинг развития полиартрита проводили ежедневно макроскопическим осмотром и присваиванием индекса артрита каждому животному во время критического периода (дни 10-25 после иммунизации).
Интенсивность полиартрита оценивали в баллах по следующей схеме: (а) балл для каждой лапы от 0 до 3 на основе эритемы, опухания и деформации суставов: 0 для отсутствия эритемы или опухания; 0,5, если набухание обнаруживается, по меньшей мере, в одном суставе; 1 для слабого опухания и эритемы; 2 для опухания и эритемы как предплюсны, так и запястья, 3 для анкилоза и деформации костей. Максимальное число баллов для всех 4 лап было, таким образом, 12. (b) Балл для других частей тела: для каждого уха, 0,5 для покраснения и другой балл 0,5, если присутствуют припухлости; 1 для опухания соединительной ткани (седловидный нос) и 1 для присутствия припухлостей или изгибов в хвосте. Самый высокий возможный индекс артрита был 16.
Пероральное введение производных пиримидина данного изобретения (например, соединения 12) воспроизводимо снижало оценку в баллах артрита и задерживало развитие полиартрита дозозависимым образом. Оценка в баллах артрита, используемая в этой модели, была отражением воспалительного состояния структур, для которых проводят мониторинг, и результаты их показывают способность испытуемого соединения обеспечивать ослабление для этого аспекта патологии.
Лечение болезни Крона у крыс на моделях воспалительного синдрома кишечника, индуцированного динитробензолсульфоновой кислотой: использовали полученных от Wistar самцов или самок крыс, весящих 200±20 г и голодавших в течение 24 часов. Дистальный колит индуцировали инстилляцией в ободочную кишку 2,4-динитробензолсульфоновой кислоты (DNBS, 25 мг в 0,5 мл 30% этанола), после чего через канюлю осторожно инъецировали воздух (2 мл), чтобы быть уверенными в том, что раствор остался в ободочной кишке. Испытуемое соединение и/или наполнитель вводили перорально за 24 и 2 часа перед инстилляцией DNBS и затем ежедневно в течение 5 дней. Одну контрольную группу аналогично обрабатывали только наполнителем, тогда как другую обрабатывали наполнителем плюс DNBS. Животных умерщвляли через 24 часа после введения последней дозы испытуемого соединения и каждую ободочную кишку удаляли и взвешивали. Массовое отношение ободочной кишки к телу затем вычисляли для каждого животного по формуле: Ободочная кишка (г)/масса тела х 100. «Результирующее» повышение в отношении контрольной группы с наполнителем + DNBS к контрольной группе с наполнителем используют в качестве основы для сравнения с группами, обработанными испытуемым соединением, и выражают как «% дедукцию». Производные пиримидина данного изобретения (например, соединение 12) воспроизводимым образом имели приблизительно 30% дедукцию. 30% или большее снижение в массовом отношении ободочной кишки к телу относительно контрольной группы, обработанной наполнителем, считали значимым.
Крысы, обработанные испытуемым соединением перорально, проявляли заметное снижение в воспалительной ответной реакции. Эти эксперименты повторяли три раза и эффекты были воспроизводимыми.
Лечение болезни Крона на модели воссозданного CD4+CD45Rbhigh Т-клетками SCID-колита мышей. Клетки селезенки получали из организма нормальной самки мыши BALB/c. Для очистки клеток использовали следующие антимышиные антитела, чтобы метить не-CD4+-T-клетки: В220 (RAS-6B2), CD11b (M1/70) и CD8α (53-6.72). Все антитела получали от BioSource (Camarillo, CA). Покрытые антителом М450 антикрысиного иммуноглобулина IgG магнитные сферы (Dynal, Oslo, Norway) использовали для связывания антител и негативную селекцию выполняли с использованием магнитного концентратора МРС-1. Обогащенные CD4+ клетки затем метили для сортинга клеток FITC-конъюгированным CD45RB (16A, Pharmingen, San Diego, CA) и РЕ-конъюгированным CD4 (CT-CD4, Caltag, Burlingame, CA). Клетки CD4+CD45RBhigh операционно определяли как верхние 40% CD45Rb-окрашивающиеся CD4+-клетки и сортировали в стерильных условиях проточной цитометрией. Собранные клетки снова суспендировали при 4х106/мл в PBS и инъецировали в количестве 100 мкл внутрибрюшинным путем самке мыши C.B-17 SCID. Производные пиримидина данного изобретения (например, соединение 12) и/или наполнитель перорально вводили один раз в день, 5 дней в неделю, начиная со дня после трансплантации. Трансплантированных SCID-мышей взвешивали еженедельно и проводили мониторинг их клинического состояния.
Образцы ткани ободочной кишки фиксировали в 10% забуференном формалине и заливали парафином. Секции (4 мкм), собранные из восходящей, поперечной и нисходящей ободочной кишки, нарезали и окрашивали гематоксилином и эозином. Тяжесть состояния колита определяли на основе гистологического обследования дистальных секций ободочной кишки, посредством чего степень воспаления ободочной кишки была оценена по шкале 0-3 в каждом из четырех критериев: удлинение крипты, инфильтрация клеток, истощение бокаловидных клеток и число абсцессов крипты.
Лимфоциты LP выделяли из свежеполученных образцов ободочной кишки. После удаления пейеровых бляшек ободочную кишку промывали не содержащим Са/Mg HBSS, нарезали на кусочки 0,5 см и инкубировали дважды в HBSS, содержащем ЭДТУ (0,75 мМ), DTT (1 мМ) и антибиотики (2,5 мкг/мл амфотерицина, 50 мкг/мл гентамицина от Sigma) при 37°С в течение 15 мин. Затем ткань расщепляли далее в RPMI, содержащей 0,5 мг/мл коллагеназы D, 0,01 мг/мл DNase I (Boehringer Manheim) и антибиотики, при 37°С. Клетки LP затем наслаивали на градиент 40-100% Percoll (Pharmacia, Uppsala, Sweden) и обогащенные лимфоцитами популяции выделяли из клеток на поверхности раздела 40-100%.
Для измерения продуцирования цитокина 48-луночные планшеты покрывали 10 мкг/мл мышиного антитела против CD3ε (145-2C11) в карбонатном буфере (рН 9,6) на протяжении ночи при 4°С. 5х105 клеток LP затем культивировали в 0,5 мл полной среды в предварительно покрытых лунках в присутствии 1 мкг/мл растворимого антитела против CD28 (37.51). Очищенные антитела получали от Pharmingen. Супернатанты культуры удаляли через 48 час и анализировали на продуцирование цитокина. Мышиный IFNγ измеряли с использованием набора ELISA от Endogen (Cambridge, MA) в соответствии с инструкциями изготовителя.
Гистологический анализ показал, что пероральное введение производных пиримидина данного изобретения (например, соединения 12) снижает воспаление ободочной кишки по сравнению с контролем с наполнителем. Супрессивное действие было дозозависимым со значительным снижением при дозе 10 мг/кг. Вычисленное массовое отношение ободочной кишки к телу согласовывалось с гистологической оценкой в баллах, что показывало ослабление воспаления обработкой испытуемым соединением. Кроме того, анализ цитокинов из клеток LP в ответ на антитело против CD3 и антитело против CD28 демонстрировал, что клетки LP из контроля с наполнителем продуцировали повышенный уровень IFNγ, и обработка испытуемым веществом значительно снижала его продуцирование. Эти результаты явно демонстрируют потенциал испытуемого соединения при лечении воспалительного заболевания кишечника, представленного болезнью Крона.
Другие варианты осуществления
Все из признаков, описанных в данном описании, могут быть объединены в любой комбинации. Каждый признак, раскрытый в данном описании, может быть заменен альтернативным признаком, служащим такой же, эквивалентной или подобной цели. Таким образом, если явно не оговорено особо, каждый признак описывает только пример общего ряда эквивалентных или аналогичных признаков.
Из вышеприведенного описания специалист в данной области может легко выяснить основные характеристики настоящего изобретения и не выходя из существа и объема его может произвести различные изменения и модификации изобретения для адаптации его к различным применениям и условиям. Например, соединения, структурно аналогичные производному пиримидина, раскрытому в описании, могут быть также получены, отобраны по их способности ингибировать IL-12 и использованы на практике данного изобретения. Таким образом, другие варианты осуществления также входят в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИМИДИНГИДРАЗИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2008 |
|
RU2464262C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| ИНГИБИТОРЫ ЦИТОКИНОВ | 2004 |
|
RU2394029C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
| СОЕДИНЕНИЯ ИНДОЛА И ИНДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРА НЕКРОЗА КЛЕТКИ | 2008 |
|
RU2437883C1 |
| ИНГИБИТОРЫ Mcl-1 НА ОСНОВЕ 7-ЗАМЕЩЕННЫХ ИНДОЛОВ | 2008 |
|
RU2473542C2 |
| СЕЛЕКТИВНЫЕ К BCL-2 АГЕНТЫ, ВЫЗЫВАЮЩИЕ АПОПТОЗ, ДЛЯ ЛЕЧЕНИЯ РАКА И ИММУННЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2621052C2 |
| ПРОИЗВОДНЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-2-ИЛМОЧЕВИНЫ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2348636C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
Изобретение относится к соединению формулы (I), обладающему ингибирующим действием продуцирования интерлейкина-12 (IL-12),
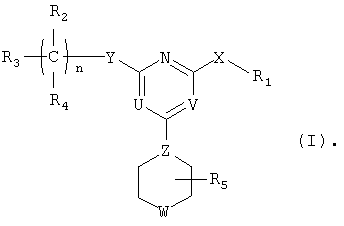
где R1 представляет собой 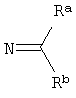 , арил или гетероарил; каждый из R2 и R4 независимо представляет собой водород, (С1-С6)алкил или (С1-С6)алкокси; R3 представляет собой Rc, алкенил, ORc, OC(О)Rc, SRc, NRcRd, NRcCORd, NRcC(О)ORd, NRcC(О)NRcRd, NRcSO2Rd, CORc, C(О)ORc или C(О)NRcRd; R5 представляет собой Н; n равно 0, 1, 2, 3, 4, 5 или 6; X представляет собой О или NRc; Y представляет собой ковалентную связь, СН2, О или NRc; Z представляет собой N; один из U и V представляет собой N, и другой представляет собой CRc, и W представляет собой О, S или S(O2), где каждый из Ra и Rb представляет собой независимо Н, (С1-С6)алкил, арил или гетероарил; каждый из Rc и Rb представляет собой независимо Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил или (С1-С6)алкилкарбонил, где термин «арил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо; термин «гетероарил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом; термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах, где гетероциклическое кольцо содержит один или несколько гетероатомов (например. О, N или S) как часть циклической системы, причем остальные атомы являются углеродом; при условии, что когда Х представляет собой NH, Y представляет собой ковалентную связь, n равно 0 и R3 представляет собой Н или СН3, то R1 не является тиазолилом или пиримидинилом. Изобретение также относится к фармацевтической композиции и способу лечения нарушения, связанного со сверхпродуцированием интерлейкина-12. 3 н. и 46 з.п. ф-лы.
, арил или гетероарил; каждый из R2 и R4 независимо представляет собой водород, (С1-С6)алкил или (С1-С6)алкокси; R3 представляет собой Rc, алкенил, ORc, OC(О)Rc, SRc, NRcRd, NRcCORd, NRcC(О)ORd, NRcC(О)NRcRd, NRcSO2Rd, CORc, C(О)ORc или C(О)NRcRd; R5 представляет собой Н; n равно 0, 1, 2, 3, 4, 5 или 6; X представляет собой О или NRc; Y представляет собой ковалентную связь, СН2, О или NRc; Z представляет собой N; один из U и V представляет собой N, и другой представляет собой CRc, и W представляет собой О, S или S(O2), где каждый из Ra и Rb представляет собой независимо Н, (С1-С6)алкил, арил или гетероарил; каждый из Rc и Rb представляет собой независимо Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил или (С1-С6)алкилкарбонил, где термин «арил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо; термин «гетероарил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом; термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах, где гетероциклическое кольцо содержит один или несколько гетероатомов (например. О, N или S) как часть циклической системы, причем остальные атомы являются углеродом; при условии, что когда Х представляет собой NH, Y представляет собой ковалентную связь, n равно 0 и R3 представляет собой Н или СН3, то R1 не является тиазолилом или пиримидинилом. Изобретение также относится к фармацевтической композиции и способу лечения нарушения, связанного со сверхпродуцированием интерлейкина-12. 3 н. и 46 з.п. ф-лы.
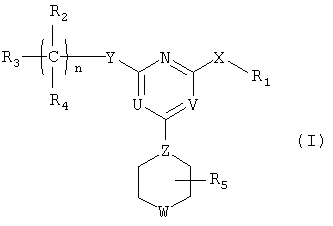
где R1 представляет собой 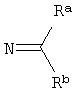 , арил или гетероарил;
, арил или гетероарил;
каждый из R2 и R4, независимо, представляет собой водород, (С1-С6)алкил или (С1-С6)алкокси;
R3 представляет собой Rc, алкенил, ORc, OC(О)Rc, SRc, NRcRd, NRcCORd, NRcC(О)ORd, NRcC(О)NRcRd, NRcSO2Rd, CORc, C(О)ORc или C(О)NRcRd;
R5 представляет собой Н;
n равно 0, 1, 2, 3, 4, 5 или 6;
X представляет собой О или NRc;
Y представляет собой ковалентную связь, CH2, О или NRc;
Z представляет собой N;
один из U и V представляет собой N, и другой представляет собой CRc, и
W представляет собой О, S или S(O2),
где каждый из Ra и Rb представляет собой, независимо, Н, (C1-С6)алкил, арил или гетероарил;
каждый из Rc и Rd представляет собой, независимо, Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил или (С1-С6)алкилкарбонил,
где термин «арил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо; термин «гетероарил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом; термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах, где гетероциклическое кольцо содержит один или несколько гетероатомов (например О, N или S) как часть циклической системы, причем остальные атомы являются углеродом;
при условии, что когда Х представляет собой NH, Y представляет собой ковалентную связь, n равно 0 и R3 представляет собой Н или СН3, то R1 не является тиазолилом или пиримидинилом.
 .
.
где каждый из А и А', независимо, представляет собой О, S или NH;
каждый из Re и Rf, независимо, представляет собой Н, (С1-С6)алкил, арил или гетероарил и
m равно 1 или 2.
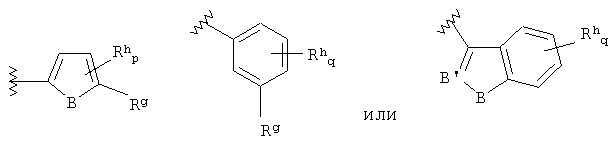
где В представляет собой NRi, О или S;
В' представляет собой N или CRi;
Rg представляет собой Н, галоген, CN, (С1-С6)алкил, циклил, (C1-С6)алкилокси, (С1-С6)алкилкарбонил, (С1-С6)алкилоксикарбонил, арилоксикарбонил, гетероарилоксикарбонил, гидроксиалкил, (C1-С6)алкиламино или (С1-С6)алкиламинокарбонил;
Rh представляет собой Н, галоген, NO2, CN, (С1-С6)алкил, арил, гетероарил, ORc, OC(O)Rc, SO2Rc, S(O)Rc, S(O2)NRcRd, SRc, NRcRd, NRcCORd, NRcC(O)ORd, NRcC(O)NRcRd, NRcSO2Rd, CORc, C(O)ORc или С(O)NRcRd;
Ri представляет собой Н, (С1-С6)алкил или (С1-С6)алкилкарбонил;
р равно 0, 1 или 2 и
q равно 0, 1, 2, 3 или 4.
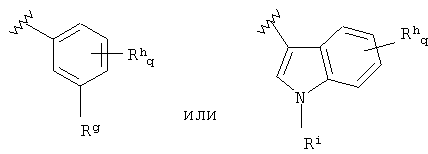
в которой Rg, Rh, Ri и q имеют значения, указанные в п.10; и другой из Ra и Rb представляет собой Н или (С1-С6)алкил.
Rg представляет собой Н, метил, этил, пропил, циклопропил, метокси, этокси, метоксикарбонил или галоген;
Rh представляет собой F, Cl, CN, метил, метокси, этокси, ОС(O)СН3, ОС(O)С2Н5, С(O)ОН, С(O)ОС2Н5, C(O)NH2, NHC(O)СН3 или S(O2)NH2;
Ri представляет собой Н, метил, этил или ацетил и
q равно 0, 1 или 2.
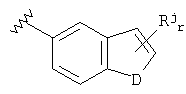
где D представляет собой О, S или NRm;
Rj представляет собой бензо, галоген, CN, гидроксил, (С1-С6)алкил, арил, гетероарил, (С1-С6)алкоксил, арилоксил или гетероарилоксил;
Rm представляет собой Н, (C1-C6)алкил или (C1-C6)алкилкарбонил и
r равно 0, 1 или 2.

где каждый из А и А', независимо, представляет собой О, S или NH;
каждый из Re и Rf, независимо, представляет собой Н, (С1-С6)алкил, арил или гетероарил и
m равно 1 или 2.
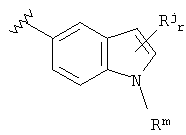
где Rm представляет собой Н, (С1-С6)алкил или (C1-C6)алкилкарбонил;
Rj представляет собой метил, этил, пропил или бензо и
r равно 1 или 2.
R1 представляет собой  ;
;
каждый из R2 и R4 представляет собой Н;
R3 представляет собой Н, (C1-C6)алкил, фенил, гетероарил, циклил, гетероциклил, (С1-С6)алкилоксикарбонил, (С1-С6)алкиламинокарбонил или (C1-C6)алкилкарбонил и
Х представляет собой NRc.
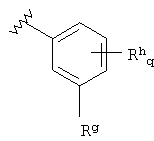
где Rg представляет собой Н, (С1-С6)алкил, (С1-С6)алкоксил, метоксикарбонил или галоген;
Rh представляет собой галоген, CN, гидроксил, (C1-C6)алкил, арил, гетероарил, (С1-С6)алкоксил, арилоксил или гетероарилоксил и
q равно 0, 1, 2, 3 или 4.
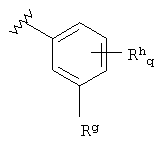
где Rg представляет собой Н, (С1-С6)алкил, (C1-C6)алкоксил, метоксикарбонил или галоген;
Rh представляет собой галоген, CN, гидроксил, (C1-C6)алкил, арил, гетероарил, (С1-С6)алкоксил, арилоксил или гетероарилоксил и
q равно 0, 1, 2, 3 или 4.
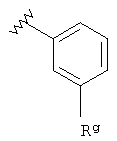
где Rg имеет значения, указанные в п.38.
N-{2-[3-(3,4-диметоксифенил)пропил]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-н-бутокси-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-[2-(2-[1,3]диоксан-2-илэтил)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[2-(3-метоксипропил)-6-морфолин-4-илпиримидин-4-ил]гидразин,
3-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-илсульфанил}пропан-1-ол,
3-{2-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-4-илсульфанил}пропан-1-ол,
N-[2-(2,2-диметил-[1,3]диоксан-4-илметокси)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-{2-[2-(3,4-диметоксифенил)этокси]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-этилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]-N'-(1-м-толилэтилиден)гидразин,
N-[1-(1H-индол-3-ил)этилиден]-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 3-метилбензальдегида,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 1Н-индол-3-карбальдегида,
N-(1Н-индол-3-илметилен)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин.
бутил-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-ил}амин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-(5-метил-6-морфолин-4-ил-2-фенилпиримидин-4-ил)гидразин,
N-(3-метилбензилиден)-N'-(2-фенил-6-тиоморфолин-4-ил-пиримидин-4-ил)гидразин,
(2,3-диметил-1Н-индол-5-ил)-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амин,
(2,3-диметил-1Н-индол-5-ил)-{4-морфолин-4-ил-6-[2-(пиридин-3-илокси)этокси]пиримидин-2-ил}амин,
этиловый эфир 3-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}пропионовой кислоты,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразин,
1-(2-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-(3-иодбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-фторбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-хлорбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-бромбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
метиловый эфир 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты,
1-(2-{4-[N'-(3-иодбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-метиламид 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты или
(3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}фенил)метанол,
N,N-диэтил-4-{4-[N"-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}бутирамид,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-1-(4-метилпиперазин-1-ил)бутан-1-он,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илметилбутирамид или
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илбутирамид.
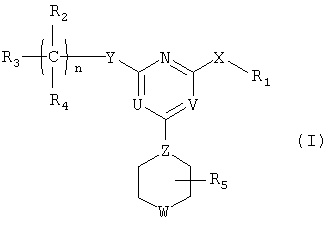
где R1 представляет собой  , арил или гетероарил;
, арил или гетероарил;
каждый из R2 и R4, независимо, представляет собой водород, (С1-С6)алкил или (С1-С6)алкокси;
R3 представляет собой Rc, алкенил, ORc, OC(О)Rc, SRc, NRcRd, NRcCORd, NRcC(О)ORd, NRcC(О)NRcRd, NRcSO2Rd, CORc, C(О)ORc или C(О)NRcRd;
R5 представляет собой Н;
n равно 0, 1, 2, 3, 4, 5 или 6;
X представляет собой О или NRc;
Y представляет собой ковалентную связь, CH2, О или NRc;
Z представляет собой N;
один из U и V представляет собой N, и другой представляет собой CRc, и
W представляет собой О, S или S(O2),
где каждый из Ra и Rb представляет собой, независимо, Н, (C1-С6)алкил, арил или гетероарил;
каждый из Rc и Rd представляет собой, независимо, Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил или (С1-С6)алкилкарбонил,
где термин «арил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо; термин «гетероарил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом; термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах, где гетероциклическое кольцо содержит один или несколько гетероатомов (например О, N или S) как часть циклической системы, причем остальные атомы являются углеродом;
при условии, что когда Х представляет собой NH, Y представляет собой ковалентную связь, n равно 0 и R3 представляет собой Н или СН3, то R1 не является тиазолилом или пиримидинилом.
R1 представляет собой  ;
;
каждый из R2 и R4 представляет собой Н;
R3 представляет собой Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил, (С1-С6)алкилоксикарбонил, (С1-С6)алкиламинокарбонил или (С1-С6)алкилкарбонил и
Х представляет собой NRc.
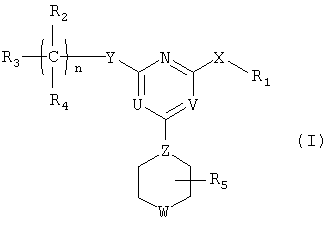
где R1 представляет собой  , арил или гетероарил;
, арил или гетероарил;
каждый из R2 и R4, независимо, представляет собой водород, (С1-С6)алкил или (С1-С6)алкокси;
R3 представляет собой Rc, алкенил, ORc, OC(О)Rc, SRc, NRcRd, NRcCORd, NRcC(О)ORd, NRcC(О)NRcRd, NRcSO2Rd, CORc, C(О)ORc или C(О)NRcRd;
R5 представляет собой Н;
n равно 0, 1, 2, 3, 4, 5 или 6;
X представляет собой О или NRc;
Y представляет собой ковалентную связь, CH2, О или NRc;
Z представляет собой N;
один из U и V представляет собой N, и другой представляет собой CRc, и
W представляет собой О, S или S(O2),
где каждый из Ra и Rb представляет собой, независимо, Н, (C1-С6)алкил, арил или гетероарил;
каждый из Rc и Rd представляет собой, независимо, Н, (C1-C6)алкил, фенил, гетероарил, циклил, гетероциклил или (С1-С6)алкилкарбонил,
где термин «арил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо; термин «гетероарил» относится к углеводородной циклической системе (моноциклической или бициклической), имеющей, по меньшей мере, одно ароматическое кольцо, которое содержит, по меньшей мере, один гетероатом, такой как О, N или S, как часть циклической системы, причем остальные атомы являются углеродом; термин «циклил» и «гетероциклил» относится к частично или полностью насыщенной моноциклической или бициклической системе, имеющей от 4 до 14 атомов в кольцах, где гетероциклическое кольцо содержит один или несколько гетероатомов (например. О, N или S) как часть циклической системы, причем остальные атомы являются углеродом;
при условии, что когда Х представляет собой NH, Y представляет собой ковалентную связь, n равно 0 и R3 представляет собой Н или СН3, то R1 не является тиазолилом или пиримидинилом.
R1 представляет собой  ;
;
каждый из R2 и R4 представляет собой Н;
R3 представляет собой Н, (С1-С6)алкил, фенил, гетероарил, циклил, гетероциклил, (C1-C6)алкилоксикарбонил, (С1-С6)алкиламинокарбонил или (С1-С6)алкилкарбонил и
Х представляет собой NRc.
N-{2-[3-(3,4-диметоксифенил)пропил]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-н-бутокси-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-[2-(2-[1,3]диоксан-2-илэтил)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[2-(3-метоксипропил)-6-морфолин-4-илпиримидин-4-ил]гидразин,
3-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-илсульфанил}пропан-1-ол,
3-{2-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-4-илсульфанил}пропан-1-ол,
N-[2-(2,2-диметил-[1,3]диоксан-4-илметокси)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-{2-[2-(3,4-диметоксифенил)этокси]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(1H-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-этилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]-N'-(1-м-толилэтилиден)гидразин,
N-[1-(1Н-индол-3-ил)этилиден]-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 3-метилбензальдегида,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 1Н-индол-3-карбальдегида,
N-(1Н-индол-3-илметилен)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин,
бутил-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-ил}амин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-(5-метил-6-морфолин-4-ил-2-фенилпиримидин-4-ил)гидразин,
N-(3-метилбензилиден)-N'-(2-фенил-6-тиоморфолин-4-ил-пиримидин-4-ил)гидразин,
(2,3-диметил-1Н-индол-5-ил)-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амин,
(2,3-диметил-1Н-индол-5-ил)-{4-морфолин-4-ил-6-[2-(пиридин-3-илокси)этокси]пиримидин-2-ил}амин,
этиловый эфир 3-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}пропионовой кислоты,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразин,
1-(2-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-(3-иодбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-фторбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-хлорбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-бромбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
метиловый эфир 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты,
1-(2-{4-[N'-(3-иодбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-метиламид 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты или
(3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}фенил)метанол,
N,N-диэтил-4-{4-[N"-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}бутирамид,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-1-(4-метилпиперазин-1-ил)бутан-1-он,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илметилбутирамид,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илбутирамид.
N-{2-[3-(3,4-диметоксифенил)пропил]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-н-бутокси-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-(2-(4-гидроксибутил)-6-морфолин-4-илпиримидин-4-ил)-N'-(1Н-индол-3-илметилен)гидразин,
N-[2-(2-[1,3]диоксан-2-илэтил)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[2-(3-метоксипропил)-6-морфолин-4-илпиримидин-4-ил]гидразин,
3-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-илсульфанил}пропан-1-ол,
3-{2-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-4-илсульфанил}пропан-1-ол,
N-[2-(2,2-диметил-[1,3]диоксолан-4-илметокси)-6-морфолин-4-илпиримидин-4-ил]-N'-(1Н-индол-3-илметилен)гидразин,
N-{2-[2-(3,4-диметоксифенил)этокси]-6-морфолин-4-илпиримидин-4-ил}-N'-(1Н-индол-3-илметилен)гидразин,
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(1Н-индол-3-илметилен)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-этилбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(3-пиридин-2-илпропил)пиримидин-4-ил]гидразин,
N-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]-N'-(1-м-толилэтилиден)гидразин,
N-[1-(1Н-индол-3-ил)этилиден]-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 3-метилбензальдегида,
O-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]оксим 1Н-индол-3-карбальдегида,
N-(1H-индол-3-илметилен)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}гидразин,
бутил-{4-[N'-(1Н-индол-3-илметилен)гидразино]-6-морфолин-4-илпиримидин-2-ил}амин,
N-(3-метилбензилиден)-N'-[6-морфолин-4-ил-2-(пиридин-3-илокси)пиримидин-4-ил]гидразин,
N-(3-метилбензилиден)-N'-(5-метил-6-морфолин-4-ил-2-фенилпиримидин-4-ил)гидразин,
N-(3-метилбензилиден)-N'-(2-фенил-6-тиоморфолин-4-илпиримидин-4-ил)гидразин,
(2,3-диметил-1Н-индол-5-ил)-{6-морфолин-4-ил-2-[2-(пиридин-3-илокси)этокси]пиримидин-4-ил}амин,
(2,3-диметил-1Н-индол-5-ил)-{4-морфолин-4-ил-6-[2-(пиридин-3-илокси)этокси]пиримидин-2-ил} амин,
этиловый эфир 3-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}пропионовой кислоты,
N-(3-метилбензилиден)-N'-{6-морфолин-4-ил-2-[2-(1-оксипиридин-2-ил)этокси]пиримидин-4-ил}гидразин,
1-(2-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-(3-иодбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-фторбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-хлорбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
N-(3-бромбензилиден)-N'-[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразин,
метиловый эфир 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты,
1-(2-{4-[N'-(3-иодбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-илокси}этил)-1Н-пиридин-2-он,
N-метиламид 3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}бензойной кислоты или
(3-{[6-морфолин-4-ил-2-(2-пиридин-2-илэтокси)пиримидин-4-ил]гидразонометил}фенил)метанол,
N,N-диэтил-4-{4-[N"-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}бутирамид,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-1-(4-метилпиперазин-1-ил)бутан-1-он,
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илметилбутирамид или
4-{4-[N'-(3-метилбензилиден)гидразино]-6-морфолин-4-илпиримидин-2-ил}-N-пиридин-4-илбутирамид.
Разноска приоритетов по пунктам формулы изобретения:
| US 5258513 А, 02.11.1993 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТРИСАМИНО-S-ТРИАЗИНА | 0 |
|
SU298115A1 |
Авторы
Даты
2008-03-27—Публикация
2002-11-27—Подача