Область техники, которой относится изобретение
Настоящее изобретение касается производного витамина D, его фармацевтически приемлемой соли и сольвата, которые могут применяться в качестве фармацевтического средства, содержащее их терапевтическое средство и содержащая их фармацевтическая композиция. Более конкретно, производное витамина D по настоящему изобретению представляет собой производное витамина D, содержащее циклический третичный амин в боковой цепи, и настоящее изобретение касается также стимулятора ремиелинизации и терапевтического средства, клинически применимого в качестве стимулятора ремиелинизации, содержащих такое производное витамина D или его фармацевтически приемлемую соль или сольват, и терапевтическое средство предназначено для лечения рассеянного склероза, нейромиелита зрительного нерва, прогрессирующей мультифокальной лейкоэнцефалопатии, множественной системной атрофии, острого рассеянного энцефаломиелита, атопического миелита, HTLV-1-ассоциированной миелопатии, ВИЧ-ассоциированной лейкоэнцефалопатии, болезни Краббе, синдрома Гийома-Барре, синдрома Фишера, хронической воспалительной демиелинизирующей полинейропатии, болезни Шарко-Мари-Тута, болезни Паркинсона, шизофрении, биполярного расстройства, большого депрессивного расстройства, расстройства аутистического спектра, синдрома дефицита внимания и гиперактивности, обсессивно-компульсивного синдрома, посттравматического стрессового расстройства, депрессии, вызванной зависимостью от препаратов, аутизма, деменции альцгеймеровского типа, синдрома Дауна, ишемического инсульта и т.п.
Предшествующий уровень техники
Олигодендроцит формирует миелиновую оболочку в нейронном аксоне, и его основная роль состоит в увеличении скорости проводимости путем индуцирования скачущей проводимости. Кроме того, олигодендроцит участвует в метаболизме нейрона.
Демиелинизация и дисмиелинизация отмечаются при некоторых воспалительных демиелинизирующих заболеваниях, нейродегенеративных заболеваниях и психиатрических заболеваниях. Демиелинизация представляет собой состояние, при котором миелиновая оболочка разрушается и исчезает, и исчезновение миелиновой оболочки вызывает различные неврологические симптомы. Рассеянный склероз представляет собой хорошо известное нейроиммунное заболевание, которое вызывает демиелинизацию, а другие известные воспалительные демиелинизирующие заболевания нервной системы, которые вызывают демиелинизацию, включают нейромиелит зрительного нерва, прогрессирующую мультифокальную лейкоэнцефалопатию, множественную системную атрофию, острый рассеянный энцефаломиелит, атопический миелит, HTLV-1-ассоциированную миелопатию, ВИЧ-ассоциированную лейкоэнцефалопатию, болезнь Краббе и т.п. Кроме того, известные демиелинизирующие заболевания периферической нервной системы включают синдром Гийома-Барре, синдром Фишера, хроническую воспалительную демиелинизирующую полинейропатию, болезнь Шарко-Мари-Тута и т.п. Кроме того, миелиновая оболочка часто повреждается при ишемическом инсульте, и нарушение миелиновой оболочки вызывает последующее функциональное угасание. Сообщалось также, что при нейродегенеративном заболевании, таком как болезнь Альцгеймера, нарушение миелиновой оболочки снижает пластичность миелиновой оболочки, приводя к ухудшению когнитивной функции.
Кроме того, дисмиелинизация была обнаружена в мозге пациентов с различными психиатрическими заболеваниями, такими как шизофрения, биполярное расстройство, большое депрессивное расстройство, расстройство аутистического спектра (ASD), синдром дефицита внимания и гиперактивности, обсессивно-компульсивный синдром, посттравматическое стрессовое расстройство (PTSD), депрессия, вызванная зависимостью от препаратов, и т.п., и было показано, что она ассоциирована с этими заболеваниями.
Из сказанного выше очевидно, что восстановление состояния демиелинизации и дисмиелинизации до нормального состояния важно для лечения нарушений центральной нервной системы или периферической нервной системы.
Недавно было обнаружено, что 1α,25-дигидроксивитамин D3 обладает стимулирующим действием на дифференциацию клеток-предшественников олигодендроцитов и нервных стволовых клеток в олигодендроциты (НПЛ 1 и 2). Известно два пути действия 1α,25-дигидроксивитамина D3 и его производного (НПЛ 3). Одним путем действия является регуляция экспрессии генов (геномное действие) путем связывания с рецептором витамина D (VDR), который является одним из ядерных рецепторов. Другое действие состоит в индуцировании передачи сигнала (негеномное действие) путем связывания с белком дисульфид-изомеразой A3 (PDIA3). Неясно - является ли стимулирование дифференциации олигодендроцита 1α,25-дигидроксивитамином D3, которое описано в НПЛ 1 и 2, результатом геномного действия или негеномного действия. С другой стороны, основное действие 1α,25-дигидроксивитамина D3 и его производного состоит в воздействии на метаболизм кальция-фосфора. В целом, производное витамина D, имеющее сильное геномное действие, которое выражается величиной транскрипция-стимулирующей активности, показывает высокую активность в отношении метаболизма кальция, что повышает концентрацию кальция в крови и вызывает гиперкальцемию. Поэтому дозировка ограничена, и ожидаемый фармакологический эффект может быть не достигнут.
Кроме того, сообщалось, что 1α,25-дигидроксивитамин D3 показывает очень низкую пенетрацию в центральную нервную систему (НПЛ 4 и 5). Согласно этим документам, достаточная концентрация 1α,25-дигидроксивитамина D3 в мозге требует очень высоких доз введения. Однако введение высоких дозировок 1α,25-дигидроксивитамина D3 вызывает рост концентрации кальция в крови и поэтому вызывает сложности.
Поэтому есть потребность в разработке производного витамина D, которое бы обладало хорошей пенетрацией в центральную нервную систему, чтобы вызывать нужный эффект в мозге, и, кроме того, в разработке производного витамина D, которое бы отделяло стимулирование регенерации миелина от повышения уровня кальция в крови, но такое производное пока еще не было описано в литературе.
Литература
Непатентная литература
[НПЛ 1] A. G. de la Fuente et al., Journal of Cell Biology, 2015, 211 (5), 975-985
[НПЛ 2] H. A. Shirazi et al., Experimental and Molecular Pathology, 2015, 98 (2), 240-245
[НПЛ 3] M. A. Zmijewski et al., Experimental Dermatology, 2020, 29, 876-884
[НПЛ 4] M. R. Durk et al., The Journal of Neuroscience, 2014, 34(21), 7091-7101
[НПЛ 5] E. C. Y. Chow et al., The American Journal of Physiology: Endocrinology and Metabolism, 2013, 304(9), E977-989
Краткое описание изобретения
Техническая проблема
Целью настоящего изобретения является разработка производного витамина D или его фармацевтически приемлемой соли или сольвата, которые обладают прекрасной пенетрацией в центральную нервную систему.
Другой целью настоящего изобретения является разработка производного витамина D или его фармацевтически приемлемой соли или сольвата, которые стимулируют дифференциацию клеток-предшественников олигодендроцитов или нервных стволовых клеток в олигодендроциты, и тем самым стимулируют регенерацию миелиновой оболочки.
Другой целью настоящего изобретения является разработка терапевтического средства, содержащего производное витамина D или его фармацевтически приемлемую соль или сольват в качестве действующего вещества, для лечения одного или больше заболеваний, выбранных из группы, состоящей из рассеянного склероза, нейромиелита зрительного нерва, прогрессирующей мультифокальной лейкоэнцефалопатии, множественной системной атрофии, острого рассеянного энцефаломиелита, атопического миелита, HTLV-1-ассоциированной миелопатии, ВИЧ-ассоциированной лейкоэнцефалопатии, болезни Краббе, синдрома Гийома-Барре, синдрома Фишера, хронической воспалительной демиелинизирующей полинейропатии, болезни Шарко-Мари-Тута, болезни Паркинсона, шизофрении, биполярного расстройства, большого депрессивного расстройства, расстройства аутистического спектра, синдрома дефицита внимания и гиперактивности, обсессивно-компульсивного синдрома, посттравматического стрессового расстройства, депрессии, вызванной зависимостью от препаратов, аутизма, деменции альцгеймеровского типа, синдрома Дауна и ишемического инсульта.
Кроме того, другой целью настоящего изобретения является разработка фармацевтической композиции, содержащей производное витамина D или его фармацевтически приемлемую соль или сольват.
Решение технической проблемы
В результате глубокого исследования для достижения перечисленных выше целей, авторы настоящего изобретения совершили описанное ниже изобретение.
То есть, в настоящем изобретении описано производное витамина D, представленное изображенной ниже формулой (1), или его фармацевтически приемлемая соль или сольват.
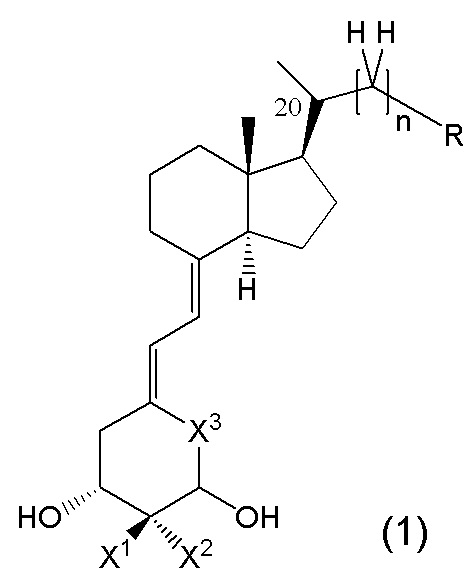
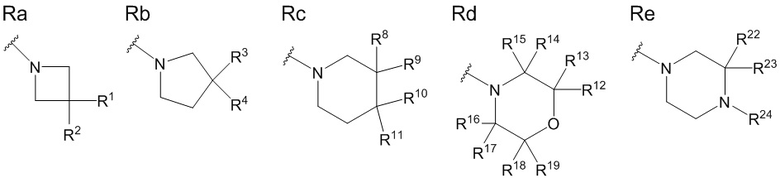
В данной формуле R представляет собой любую структуру из Ra, Rb, Rc, Rd или Re, формулы которых приведены ниже.
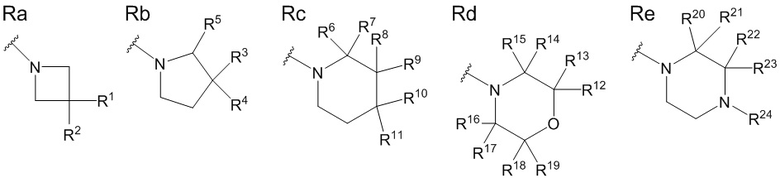
R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, атом галогена или атом водорода.
R2, R4, R9 и R11 каждый независимо представляют собой атом водорода, гидрокси-группу или C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов. (Где в случае, когда R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, или атом галогена, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, не является гидрокси-группой.)
R6, R7, R12, R13, R14, R15, R16, R17, R18, R19, R20, R21, R22 и R23 каждый независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, или C3 - C6 циклоалкильную группу.
Каждая пара из R1 и R2, R3 и R4, R6 и R7, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19, R20 и R21, и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры.
R5 представляет собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную OR501, или C3 - C6 циклоалкильную группу, необязательно замещенную -OR501, и R501 представляет собой атом водорода или C1 - C6 алкильную группу.
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу.
Стереохимия по C-2 в пирролидиновом кольце (Rb) соответствует (R) или (S) конфигурации.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5).
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой).
n представляет собой целое число от 1 до 3.
Стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.
Стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.
Кроме того, в настоящем изобретении описана фармацевтическая композиция, содержащая производное витамина D, представленное приведенной выше формулой (1), его фармацевтически приемлемую соль или сольват, и фармацевтически приемлемый носитель или основу.
Кроме того, в настоящем изобретении описан стимулятор ремиелинизации и терапевтическое средство, которое можно применять клинически в качестве стимулятора ремиелинизации, содержащее производное витамина D, представленное приведенной выше формулой (1), или его фармацевтически приемлемую соль или сольват, и данное терапевтическое средство предназначено для лечения одного или больше заболеваний, выбранных из рассеянного склероза, нейромиелита зрительного нерва, прогрессирующей мультифокальной лейкоэнцефалопатии, множественной системной атрофии, острого рассеянного энцефаломиелита, атопического миелита, HTLV-1-ассоциированной миелопатии, ВИЧ-ассоциированной лейкоэнцефалопатии, болезни Краббе, синдрома Гийома-Барре, синдрома Фишера, хронической воспалительной демиелинизирующей полинейропатии, болезни Шарко-Мари-Тута, болезни Паркинсона, шизофрении, биполярного расстройства, большого депрессивного расстройства, расстройства аутистического спектра, синдрома дефицита внимания и гиперактивности, обсессивно-компульсивного синдрома, посттравматического стрессового расстройства, депрессии, вызванной зависимостью от препаратов, аутизма, деменции альцгеймеровского типа, синдрома Дауна и ишемического инсульта.
Преимущества, обеспечиваемые настоящим изобретением
В настоящем изобретении описано новое производное витамина D или его фармацевтически приемлемая соль или сольват, которые эффективны для лечения различных заболеваний центральной нервной системы, таких как рассеянный склероз, нейромиелит зрительного нерва, прогрессирующая мультифокальная лейкоэнцефалопатия, множественная системная атрофия, острый рассеянный энцефаломиелит, атопический миелит, HTLV-1-ассоциированная миелопатия, ВИЧ-ассоциированная лейкоэнцефалопатия, болезнь Краббе, синдром Гийома-Барре, синдром Фишера, хроническая воспалительная демиелинизирующая полинейропатия, болезнь Шарко-Мари-Тута, болезнь Паркинсона, шизофрения, биполярное расстройство, большое депрессивное расстройство, расстройство аутистического спектра, синдром дефицита внимания и гиперактивности, обсессивно-компульсивный синдром, посттравматическое стрессовое расстройство, депрессия, вызванная зависимостью от препаратов, аутизм, деменция альцгеймеровского типа и ишемический инсульт.
Описание вариантов осуществления
Ниже даны определения терминам, использующимся в настоящем тексте в отдельности или в комбинации. Если не указано иное, определение каждого заместителя является общим для любого его расположения. Если переменная присутствует в нескольких компонентах, то ее определение в каждом случае является независимым от других компонентов. Кроме того, комбинации заместителей и переменных являются допустимыми только в тех случаях, когда такие комбинации дают химически устойчивые соединения. Когда заместитель сам имеет две или больше групп-заместителей, эти группы могут находиться у одного или разных атомов углерода, при условии образования стабильной структуры.
В настоящем изобретении, «атом галогена» означает атом фтора, атом хлора, атом брома и атом иода.
В настоящем изобретении, термин «C1 - C6 алкильная группа» означает одновалентную насыщенную линейную или разветвленную алифатическую углеводородную группу, содержащую 1 - 6 атомов углерода, и включает метильную группу, этильную группу, н-пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, т-бутильную группу, изопентильную группу, 2-метилбутильную группу, неопентильную группу, 1-этилпропильную группу, 4-метилпентильную группу, 3-метилпентильную группу, 2-метилпентильную группу, 1-метилпентильную группу, 3,3-диметилбутильную группу, 2,2-диметилбутильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу, 1-этилбутильную группу, 2-этилбутильную группу, трет-пентильную группу и изогексильную группу.
В настоящем изобретении, термин «метилиденовая группа» означает =CH2 группу.
В настоящем изобретении, термин «C3 - C6 циклоалкильная группа» означает циклоалкильную группу, содержащую 3 - 6 атомов углерода. Примеры циклических алкильных групп включают (но не ограничиваются только ими) циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
В настоящем изобретении, термин «C1 - C6 алкокси-группа» означает группу, состоящую из алкильной группы, содержащей 1 - 6 атомов углерода, из числа описанных выше «C1 - C6 алкильных групп» и окси-группу. Примеры включают метокси-группу, этокси-группу, н-пропилокси-группу, изопропилокси-группу, н-бутокси-группу, втор-бутокси-группу, 2-метилпропокси-группу, н-пентилокси-группу, изопентилокси-группу, 2-метилбутокси-группу, 1-этилпропокси-группу, 2,2-диметилпропокси-группу, н-гексилокси-группу, 4-метилпентокси-группу, 3-метилпентокси-группу, 2-метилпентокси-группу, 3,3-диметилбутокси-группу, 2,2-диметилбутокси-группу, 1,1-диметилбутокси-группу и трет-бутокси-группу.
В настоящем изобретении, термин «C1 - C6 алкилсульфонильная группа» означает группу, состоящую из описанной выше «C1 - C6 алкильной группы» и сульфонильной группы. Примеры включают метилсульфонильную группу, этилсульфонильную группу и изопропилсульфонильную группу.
В приведенных выше определениях, например, «C» в «C1» представляет собой атом углерода, и число после «C» означает число атомов углерода. Например, «C1 - C6» представляет собой диапазон от 1 до 6 атомов углерода. Разумеется, в настоящем изобретении, если изменяется число атомов углерода, это означает такую же группу с измененным числом атомов углерода. Например, «C1 - C3 алкильная группа» означает группу, содержащую 1 - 3 атомов углерода, из числа алкильных групп, входящих в определение «C1 - C6 алкильной группы». Это правило числа атомов углерода относится также и к другим группам.
В настоящем изобретении, «C1 - C6 алкильная группа, необязательно замещенная 1-3 атомами галогенов» означает C1 - C6 алкильную группу, которая может содержать 1 - 3 атомов галогенов в замещаемых положениях. Когда C1 - C6 алкильная группа замещена несколькими атомами галогенов, C1 - C6 алкильная группа может быть замещена одинаковыми или разными атомами галогенов. Это относится также к «C1 - C6 алкокси-группе, необязательно замещенной 1-3 атомами галогенов» и т.п.
В настоящем изобретении, «производное витамина D» означает соединение, имеющее секостероидную структуру (то есть, 4-(2-циклогексилиденэтилиден)октагидро- 1H-инденовую).
В приведенной выше формуле (1), X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH)2)m- (где m представляет собой целое число от 2 до 5.) Предпочтительно, X1 и X2 каждый независимо представляют собой атом водорода или метильную группу, или X1 и X2 вместе образуют метиленовую группу.
В приведенной выше формуле (1), X3 представляет собой CH2 или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
Предпочтительными примерами комбинаций X1, X2 и X3 являются (i) когда X1 представляет собой атом водорода или метильную группу, X2 представляет собой атом водорода, и X3 представляет собой C=CH2 группу; (ii) X1 и X2 представляют собой атом водорода, и X3 представляет собой CH2 группу; и (iii) X1 и X2 вместе образуют метиленовую группу, и X3 представляет собой CH2 группу.
В приведенной выше формуле (1), n представляет собой целое число от 1 до 3.
Стереохимия по C-20 в приведенной выше формуле (1) может соответствовать (R)-конфигурации или (S)-конфигурации.
Стереохимия по C-1 в приведенной выше формуле (1) может соответствовать (R)-конфигурации или (S)-конфигурации.
В приведенной выше формуле (1), R соответствует приведенным выше структурам Ra - Re. Среди них пирролидиновое кольцо (Rb), пиперидиновое кольцо (Rc) и морфолиновое кольцо (Rd) являются особенно предпочтительными структурами.
R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, атом галогена или атом водорода. Предпочтительные группы R1, R3, R8 и R10 включают C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами фтора, атом фтора или атом водорода, и более предпочтительные группы включают метильную группу, этильную группу, метокси-группу, этокси-группу, дифторметильную группу, 1,1-дифторэтильную группу, 2,2-дифторэтильную группу, дифторметокси-группу, 2,2-дифторэтокси-группу, 3,3-дифторпропильную группу и 2,2-дифторпропильную группу.
R2, R4, R9 и R11 каждый независимо представляют собой атом водорода, гидрокси-группу или C1 - C3 алкильную группу, необязательно замещенную 1-3 атомами галогенов. Среди них являются предпочтительными атом водорода, гидрокси-группа или C1 - C3 алкильная группа, необязательно замещенная 1-3 атомами фтора, и более предпочтительными являются атом водорода или гидрокси-группа. Когда R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, или атом галогена, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, в этом случае предпочтительно представляет собой не гидрокси-группу, а атом водорода.
R6, R7, R12, R13, R14, R15, R16, R17, R18 R19, R20, R21, R22 и R23, каждый независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, или C3 - C6 циклоалкильную группу. Среди них являются предпочтительными атом водорода, C1 - C6 алкильная группа, необязательно замещенная 1-3 атомами фтора, или C3 - C6 циклоалкильная группа, и более предпочтительные группы включают атом водорода, метильную группу, этильную группу и дифторметильную группу.
Также, каждая пара из R1 и R2, R3 и R4, R6 и R7, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19, R20 и R21, и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры. В данном случае 3-5-членная циклическая структура представляет собой углеводородное кольцо и может формировать циклопропильное кольцо, циклобутильное кольцо и циклопентильное кольцо вместе с атомом углерода, который несет заместители R1 и R2, R3 и R4, R6 и R7, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19, R20 и R21, и R22 и R23.
R5 представляет собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную -OR501, или C1 - C6 алкильную группу, необязательно замещенную -OR501. R501 представляет собой атом водорода или C1 - C6 алкильную группу. Среди них являются предпочтительными атом водорода или -C(CH3)2-OR501.
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу, и особенно предпочтительной является метилсульфонильная группа.
Кроме того, из предпочтительных примеров производного витамина D, представленного формулой (1), или его фармацевтически приемлемой соли или сольвата по настоящему изобретению, более частные примеры включают производное витамина D, представленное следующими формулами (1A), (1B) и (1B-4), или его фармацевтически приемлемая соль или сольват.
Производное витамина D, представленное формулой (1A), или его фармацевтически приемлемая соль или сольват
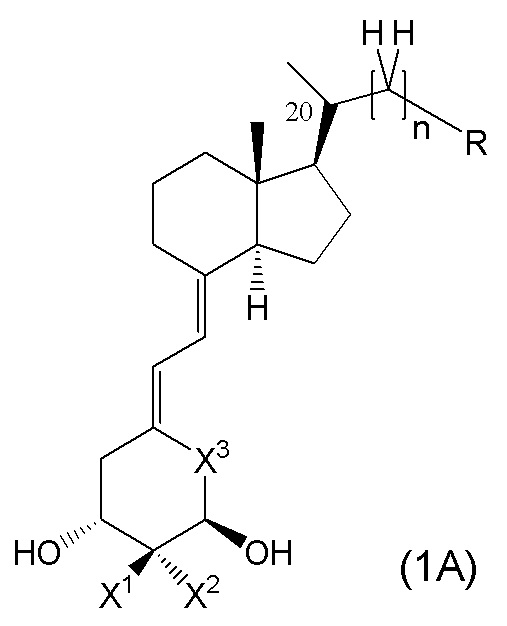
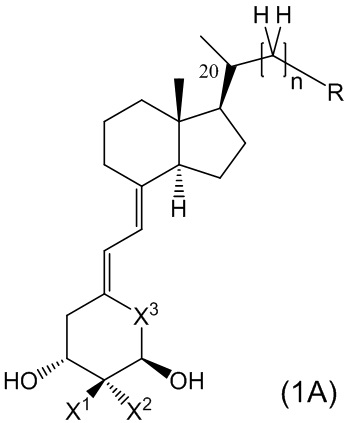
[В данной формуле R представляет собой любую структуру из Ra, Rb, Rc, Rd или Re, формулы которых приведены ниже.
R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, атом галогена или атом водорода.
R2, R4, R9 и R11 каждый независимо представляют собой атом водорода, гидрокси-группу или C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов. (Где в случае, когда R1, R3, R8 и R10 каждый независимо представляют собой C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами галогенов, или атом галогена, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, не является гидрокси-группой.)
R12, R13, R14, R15, R16, R17, R18, R19, R22 и R23 каждый независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, или C3 - C6 циклоалкильную группу.
Каждая пара из R1 и R2, R3 и R4, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19, и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры.
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5).
X3 представляет собой CH2 группу, или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой).
n представляет собой целое число от 1 до 3.
Стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.]
Каждый элемент из R1, R2, R3, R4, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19, R22, R23, R24, X1, X2, X3 и т.п. в производном витамина D, представленном формулами (1A) или его фармацевтически приемлемая соль или сольват может применяться напрямую из описанных в производном витамина D, представленном формулой (1), или в его фармацевтически приемлемой соли или сольвате. То есть, предпочтительная группа в производном витамина D, представленном формулой (1), является также предпочтительной в производном витамина D, представленном формулами (1A), и комбинация каждого предпочтительного элемента, описанного в производном витамина D, представленном формулой (1), является также предпочтительной в производном витамина D, представленном формулой (1A).
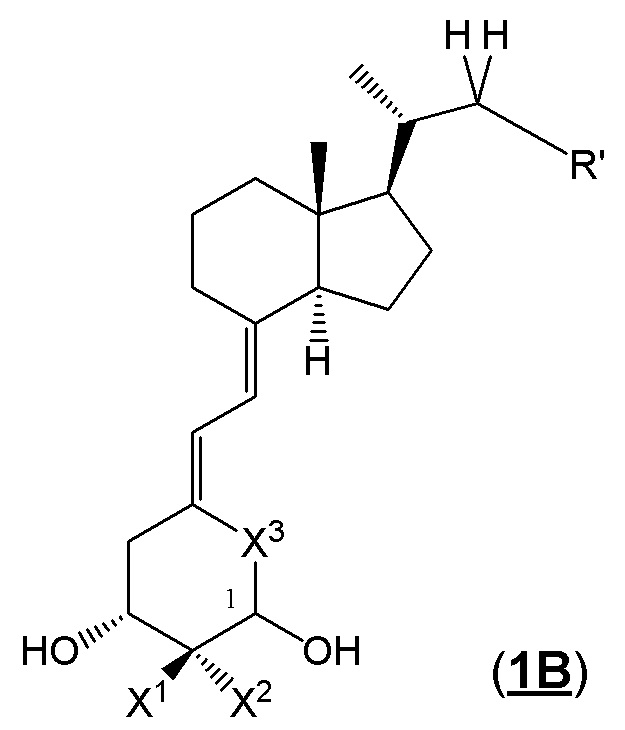
Производное витамина D, представленное формулой (1B), или его фармацевтически приемлемая соль или сольват
[В данной формуле R' представляет собой любую структуру из Rb', Rc' или Re', формулы которых приведены ниже.
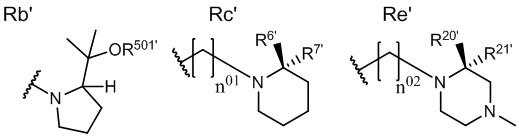
R6', R7', R20' и R21' каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода (для каждой пары из R6', R7', R20' и R21', за исключением случаев, когда оба одновременно представляют собой атомы водорода).
Каждая пара из R6' и R7', и R20' и R21' может быть связана между собой с образованием 3-5-членной циклической структуры.
R501' представляет собой атом водорода или C1 - C6 алкильную группу.
n01 и n02 каждый независимо представляют собой целое число, равное 0 или 1.
Стереохимия по C-2 в пирролидиновом кольце (Rb') соответствует (R) или (S) конфигурации.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5).
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.).
Стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.]
В приведенной выше формуле (1B), предпочтительными примерами комбинаций X1, X2 и X3 являются (i) когда X1 и X2 представляют собой атом водорода, и X3 представляет собой C=CH2 группу; (ii) X1 и X2 представляют собой атом водорода, и X3 представляет собой CH2 группу; и (iii) X1 и X2 вместе образуют метиленовую группу, и X3 представляет собой CH2 группу.
Предпочтительные группы R6', R7', R20' и R21' включают метильную группу, этильную группу, монофторметильную группу, дифторметильную группу, 1,1-дифторэтильную группу, 2,2-дифторэтильную группу и атом водорода.
Предпочтительные примеры 3-5-членной циклической структуры, образованной из каждой пары из R6' и R7', и R20' и R21' друг с другом включают циклопропильное кольцо и циклобутильное кольцо.
Предпочтительные группы R501' включают метильную группу, этильную группу и атом водорода.
Производное витамина D, представленное формулой (1B-4), или его фармацевтически приемлемая соль или сольват
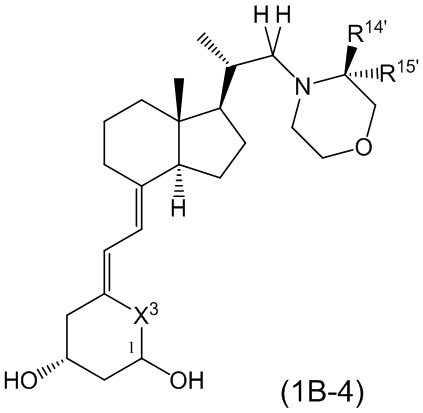
[В формуле (1B-4), R14' и R15' каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода. (За исключением случаев, когда R14' и R15' представляют собой атомы водорода одновременно.)
R14' и R15' могут быть связаны между собой с образованием 3-5-членной циклической структуры.
X3 представляет собой CH2 группу или C=CH2 группу.
Стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.]
В приведенной выше формуле (1B-4), предпочтительные группы R14' и R15' включают метильную группу, этильную группу, монофторметильную группу, дифторметильную группу, 1,1-дифторэтильную группу, 2,2-дифторэтильную группу и атом водорода.
Предпочтительные примеры 3-5-членной циклической структуры, образованной из пары R14' и R15' друг с другом, включают циклопропильное кольцо и циклобутильное кольцо.
Кроме того, из предпочтительных примеров производного витамина D, представленного формулой (1A), или его фармацевтически приемлемой соли или сольвата по настоящему изобретению, более частные примеры включают производное витамина D, представленное следующими формулами (1A-1), (1A-2) и (1A-3), или его фармацевтически приемлемую соль или сольват.
Производное витамина D, представленное формулой (1A-1), или его фармацевтически приемлемая соль или сольват
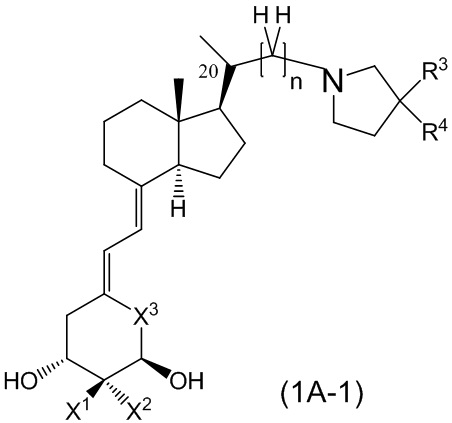
[В данной формуле R3 представляет собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами фтора, атом фтора или атом водорода.
R4 представляет собой атом водорода, гидрокси-группу или C1 - C3 алкильную группу, необязательно замещенную 1-3 атомами фтора. (Где в случае, когда R3 представляет собой C1 - C3 алкокси-группу, необязательно замещенную 1-3 атомами фтора, или атом фтора, R4 не является гидрокси-группой.)
R3 и R4 могут быть связаны между собой с образованием 3-5-членной циклической структуры.
X1 и X2 каждый независимо представляют собой атом водорода или метильную группу, или X1 и X2 вместе образуют метиленовую группу.
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.).
n представляет собой целое число от 1 до 3.
Стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.]
Производное витамина D, представленное формулой (1A-2), или его фармацевтически приемлемая соль или сольват.
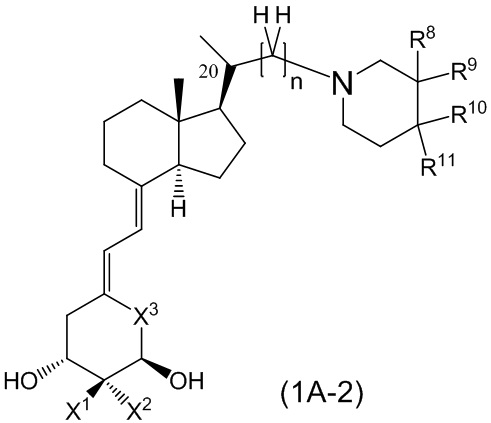
[В данной формуле R8 и R10 каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, C3 - C6 циклоалкильную группу, C1 - C6 алкокси-группу, необязательно замещенную 1-3 атомами фтора, атом фтора или атом водорода.
R9 и R11 каждый независимо представляют собой атом водорода, гидрокси-группу или C1 - C3 алкильную группу, необязательно замещенную 1-3 атомами фтора. (Где в случае, когда R8 и R10 каждый независимо представляют собой C1 - C3 алкокси-группу, необязательно замещенную 1-3 атомами фтора, или атом фтора, каждый из R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R8 или R10, не является гидрокси-группой.)
Каждая пара из R8 и R9, и R10 и R11 может быть связана между собой с образованием 3-5-членной циклической структуры.
X1 и X2 каждый независимо представляют собой атом водорода или метильную группу, или X1 и X2 вместе образуют метиленовую группу.
X3 представляет собой CH2 группу, или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
n представляет собой целое число от 1 до 3.
Стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.]
Производное витамина D, представленное формулой (1A-3), или его фармацевтически приемлемая соль или сольват.
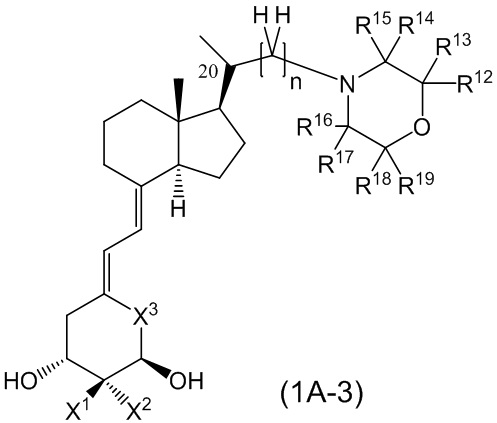
[В данной формуле R12, R13, R14, R15, R16, R17, R18 и R19 каждый независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, или C3 - C6 циклоалкильную группу.
Каждая пара из R12 и R13, R14 и R15, R16 и R17, и R18 и R19 может быть связана между собой с образованием 3-5-членной циклической структуры.
X1 и X2 каждый независимо представляют собой атом водорода или метильную группу, или X1 и X2 вместе образуют метиленовую группу.
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
n представляет собой целое число от 1 до 3.
Стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.]
Не всегда необходимо проводить различие между производным витамина D, представленным формулой (1A-3), и производным витамина D, представленным формулой (1B-4). Но когда необходимо провести различие между производным витамина D, представленным формулой (1A-3), и производным витамина D, представленным формулой (1B-4), в формуле (1A-3) исключается случай, когда X1 и X2 представляют собой атом водорода, n = 1, R12, R13, R18 и R19 представляют собой атом водорода, и любой из или оба из R14 и R15, или R16 и R17 каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, или C3 - C6 циклоалкильную группу.
Каждый элемент из R3, R4, R8, R9, R10, R11, R12, R13, R16, R17, R18, R19, X1, X2, X3 и т.п. в производном витамина D, представленном формулами (1A-1), (1A-2) и (1A-3), или в его фармацевтически приемлемой соли или сольвате может применяться напрямую из описанных для производного витамина D, представленного формулой (1A), или его фармацевтически приемлемой соли или сольвата. То есть, предпочтительная группа в производном витамина D, представленном формулой (1A), также является предпочтительной в производном витамина D, представленном формулами (1A-1), (1A-2) и (1A-3), и комбинация каждого предпочтительного элемента, описанного в производном витамина D, представленном формулой (1A), является также предпочтительной в производном витамина D, представленном формулами (1A-1), (1A-2) и (1A-3).
Кроме того, из предпочтительных примеров производного витамина D, представленного формулой (1B), или его фармацевтически приемлемой соли или сольвата по настоящему изобретению, более частные примеры включают производное витамина D, представленное следующими формулами (1B-1), (1B-2) и (1B-3), или его фармацевтически приемлемую соль или сольват.
Производное витамина D, представленное формулой (1B-1), или его фармацевтически приемлемая соль или сольват.
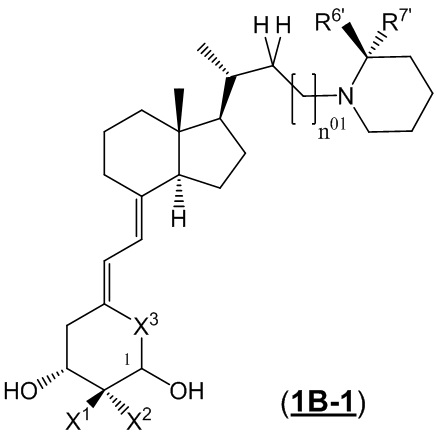
[В формуле (1B-1) стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5).
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
R6' и R7' каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода. (За исключением случаев, когда R6' и R7' представляют собой атомы водорода одновременно.)
R6' и R7' могут быть связаны между собой с образованием 3-5-членной циклической структуры.
n 01 представляет собой целое число, равное 0 или 1.]
Производное витамина D, представленное формулой (1B-2), или его фармацевтически приемлемая соль или сольват.
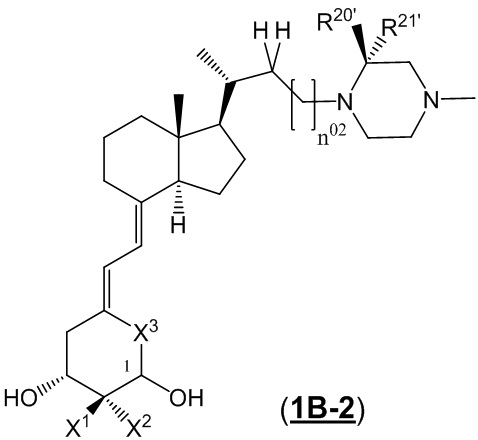
[В формуле (1B-2), стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5).
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
R20' и R21' каждый независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода. (За исключением случаев, когда R20' и R21' представляют собой атомы водорода одновременно.)
R20' и R21' могут быть связаны между собой с образованием 3-5-членной циклической структуры.
n02 представляет собой целое число, равное 0 или 1.]
Производное витамина D, представленное формулой (1B-3) или его фармацевтически приемлемая соль или сольват.
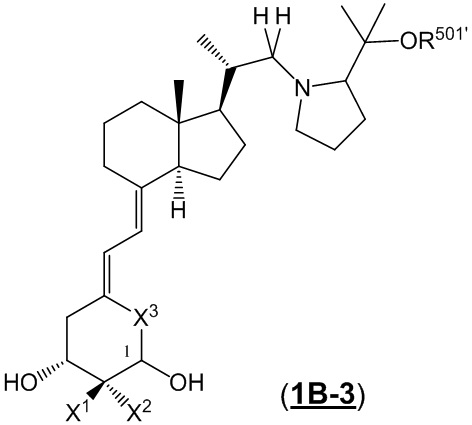
[В формуле (1B-3), стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации.
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу, или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5.)
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой.)
R501' представляет собой атом водорода или C1 - C6 алкильную группу.
Стереохимия по C-2 в пирролидиновом кольце (Rb') соответствует (R) или (S) конфигурации.]
Каждый элемент из R6', R7', R20', R21', R501', n01, n02, X1, X2, X3 и т.п. в производном витамина D, представленном формулами (1B-1), (1B-2) и (1B-3), или в его фармацевтически приемлемой соли или сольвате может применяться напрямую из описанных в производном витамина D, представленном формулой (1B), или в его фармацевтически приемлемой соли или сольвате. То есть, предпочтительная группа в производном витамина D, представленном формулой (1B), является также предпочтительной в производном витамина D, представленном формулами (1B-1), (1B-2) и (1B-3), и комбинация каждого предпочтительного элемента, описанного в производном витамина D, представленном формулой (1B), является также предпочтительной в производном витамина D, представленном формулами (1B-1), (1B-2) и (1B-3).
Предпочтительные частные примеры производного витамина D, представленного формулой (1) по настоящему изобретению, включают соединения, приведенные ниже в таблице.
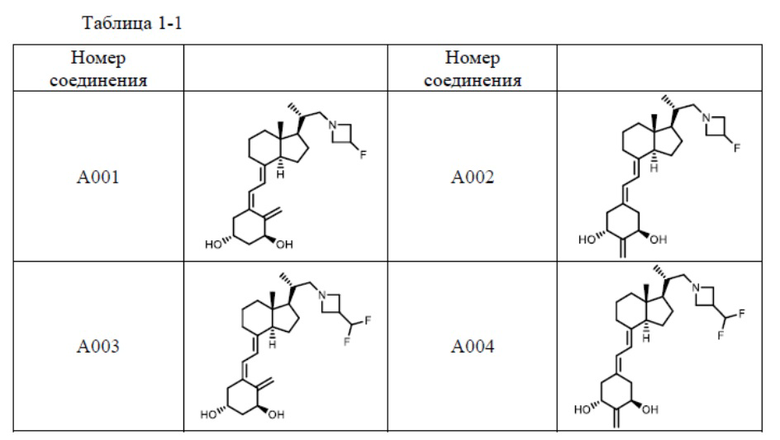
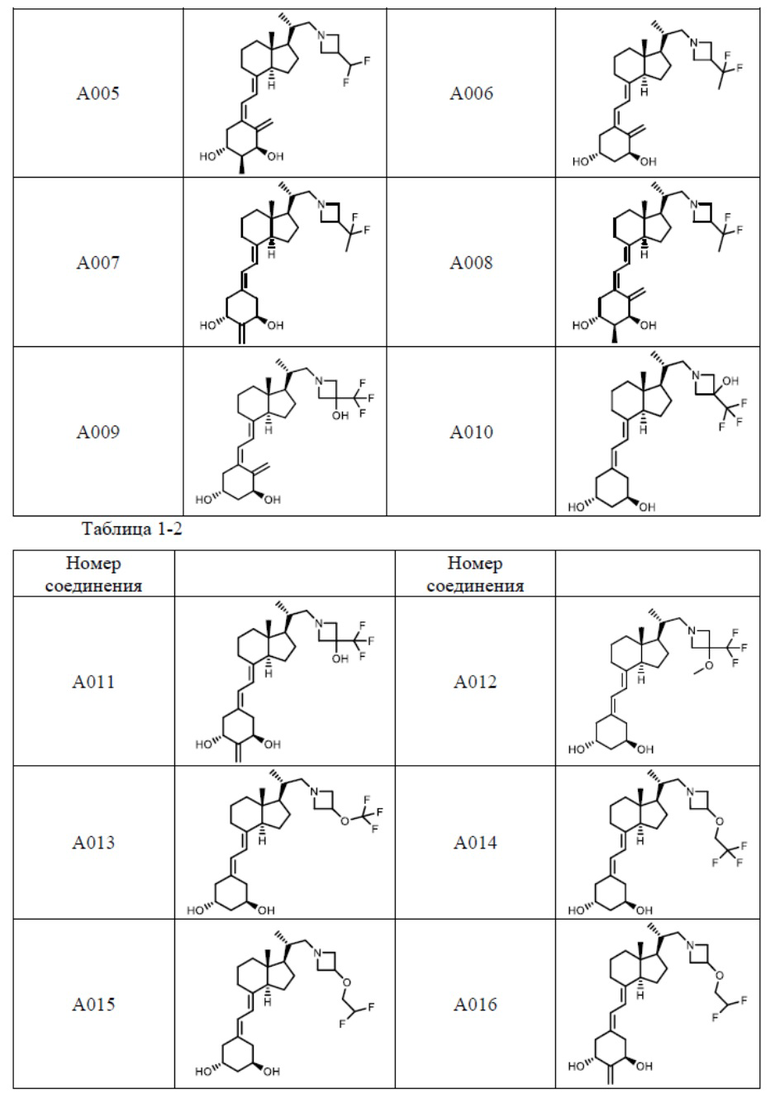
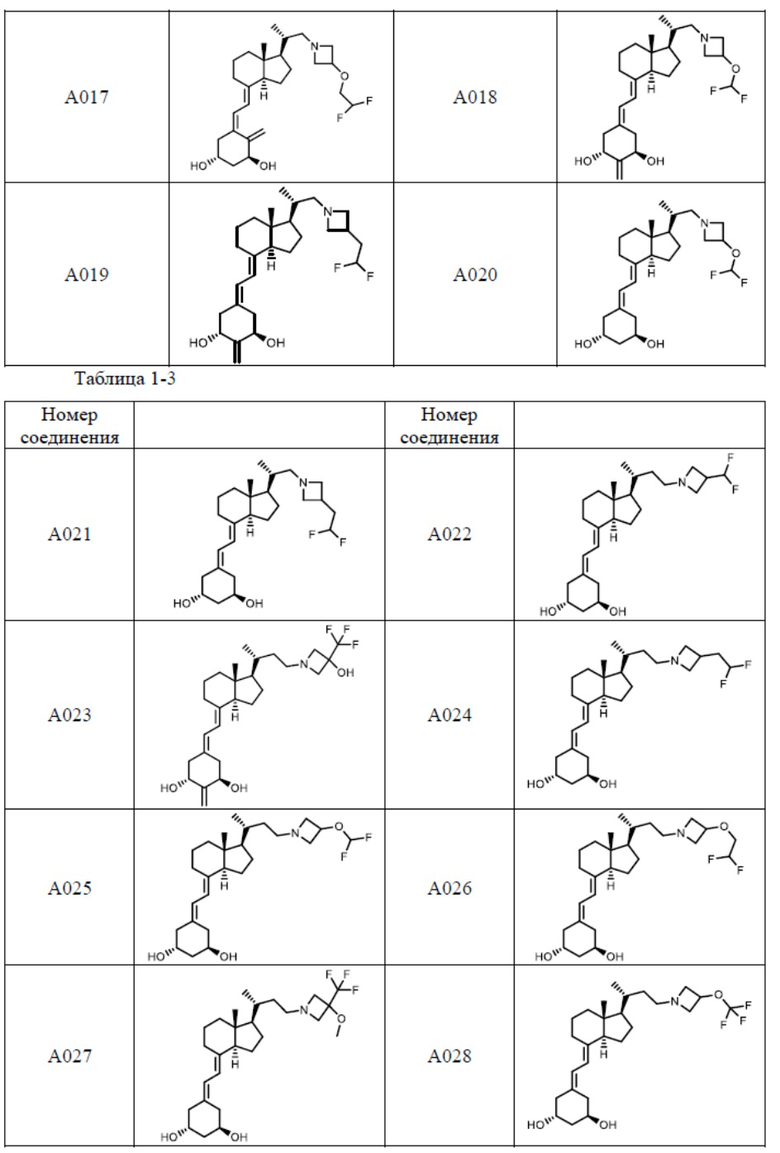
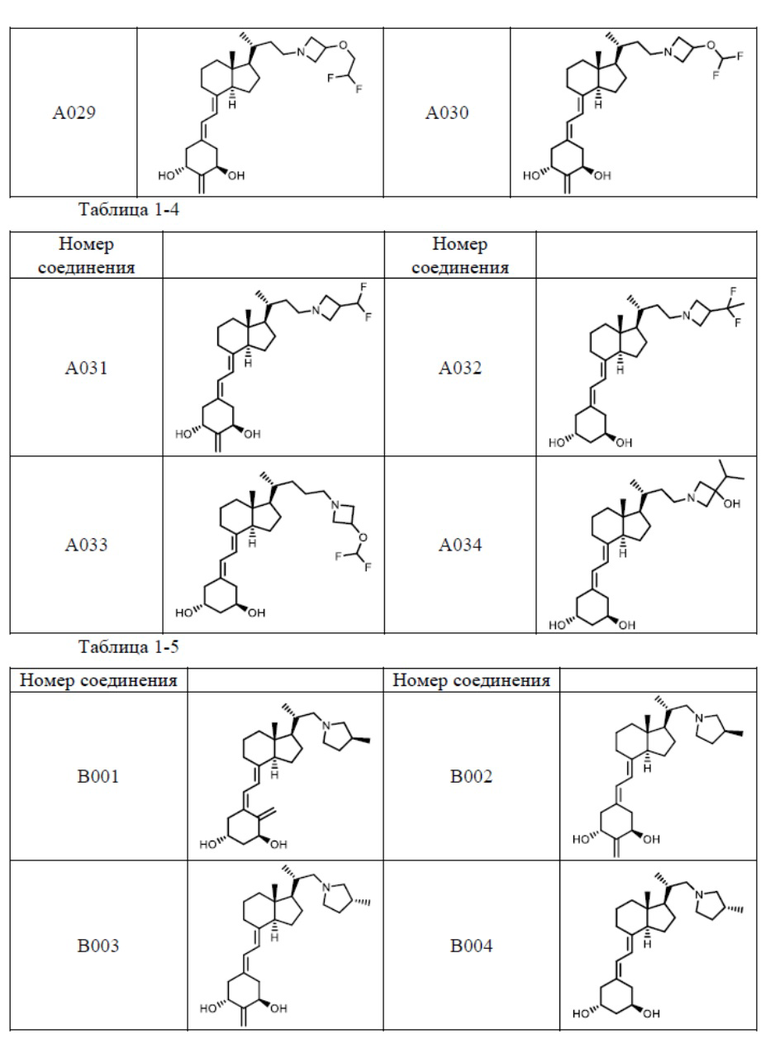
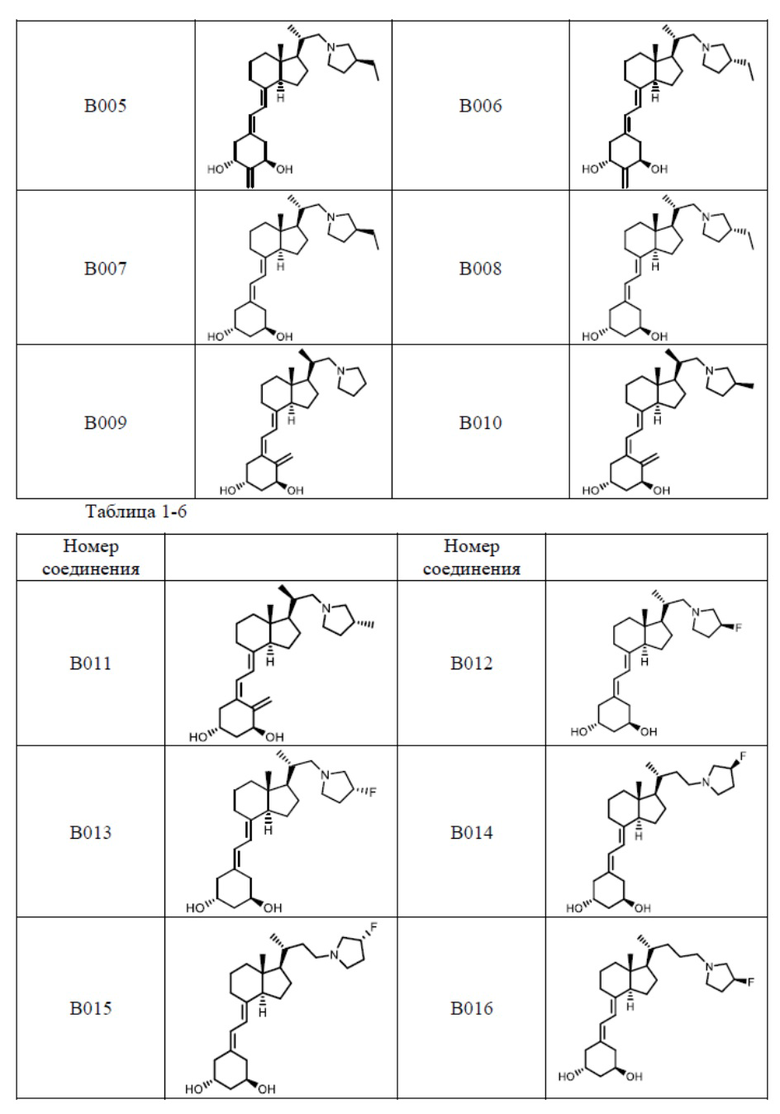
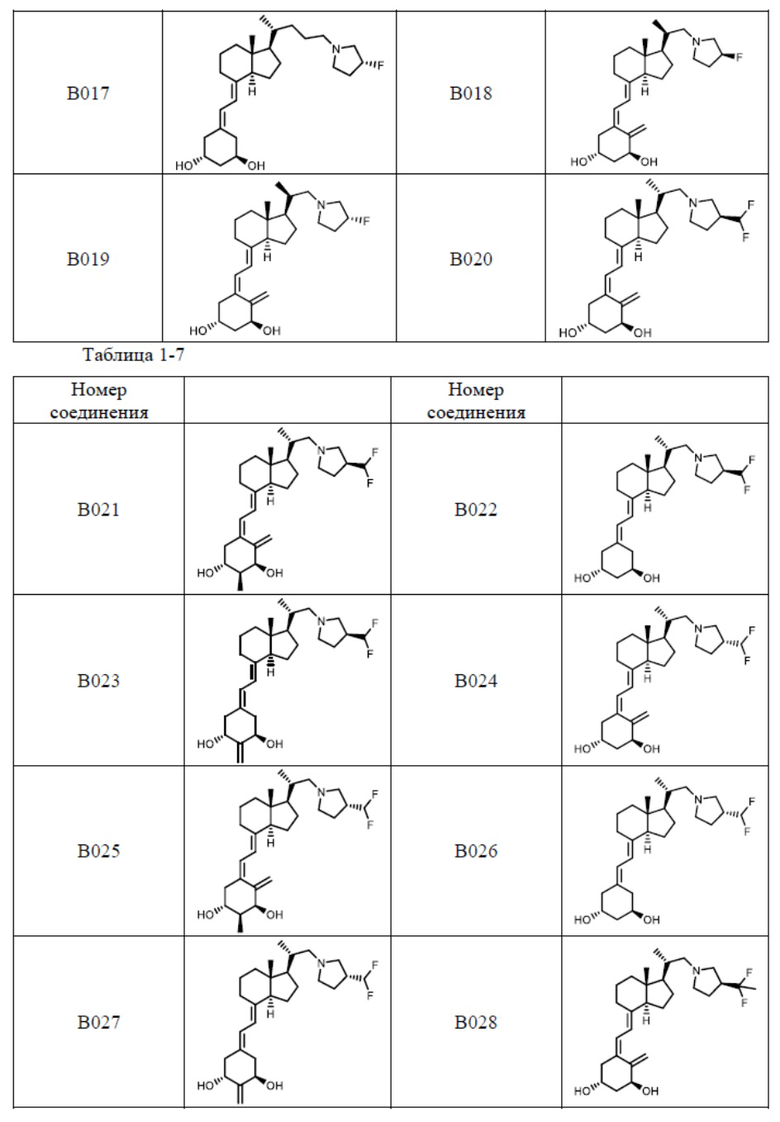
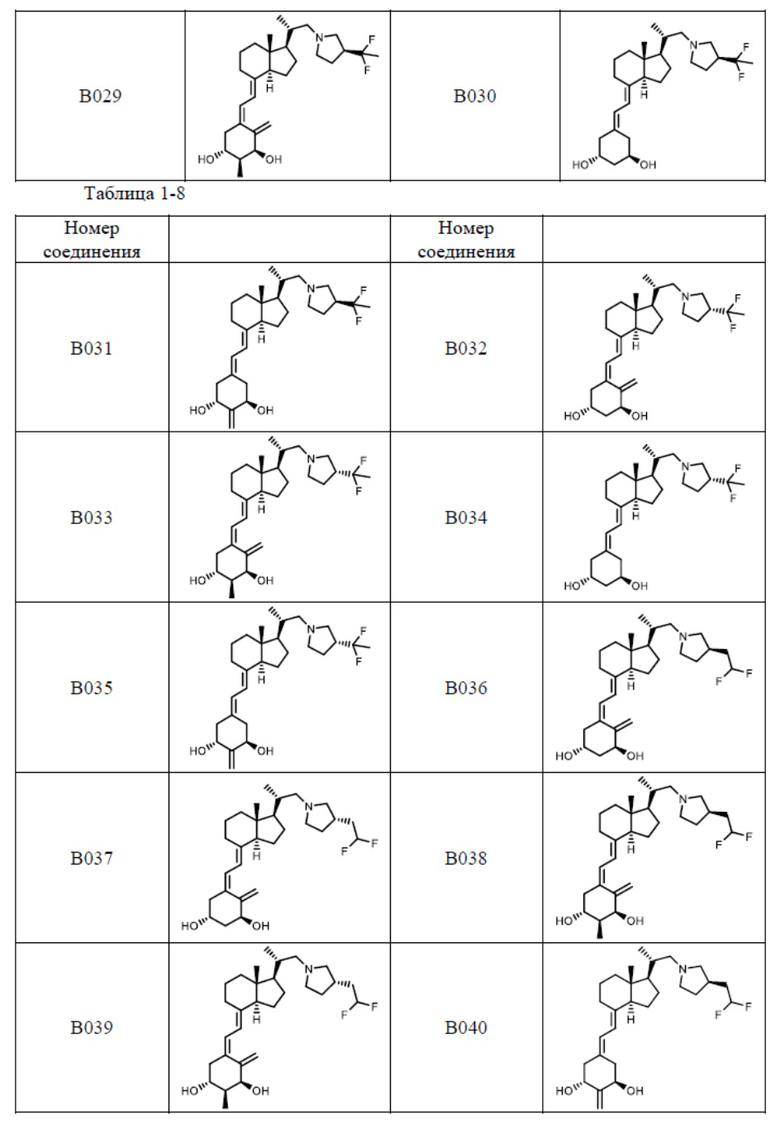
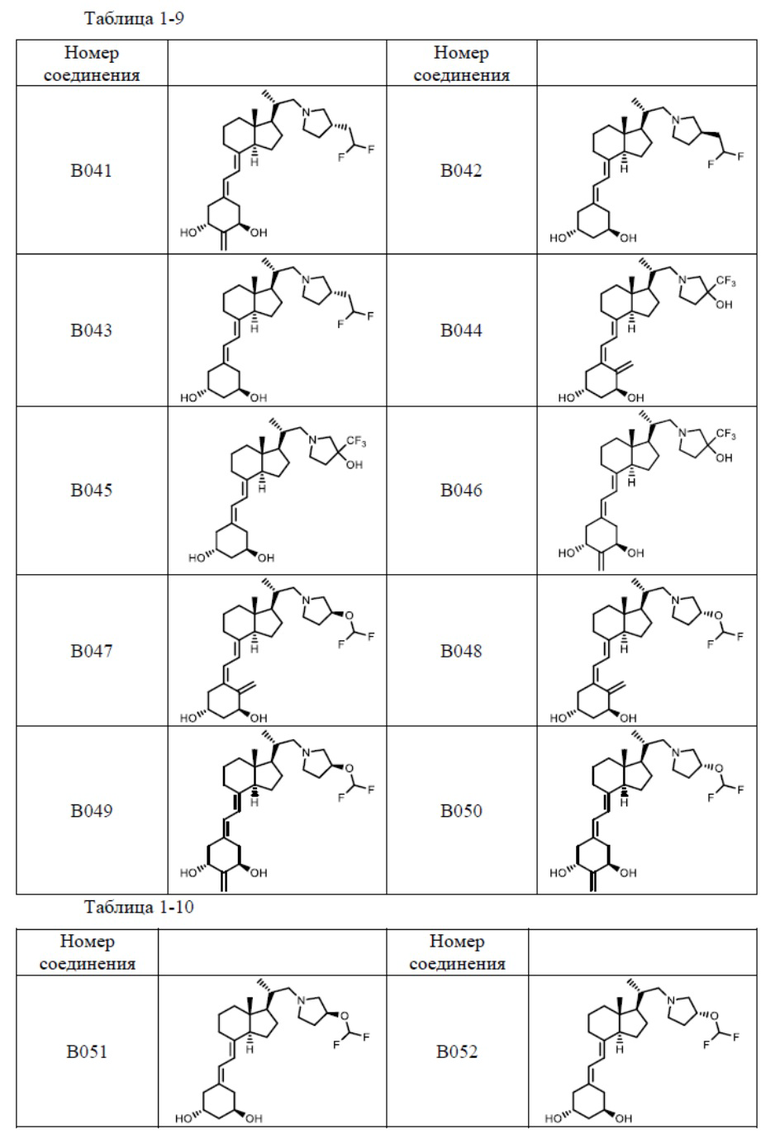
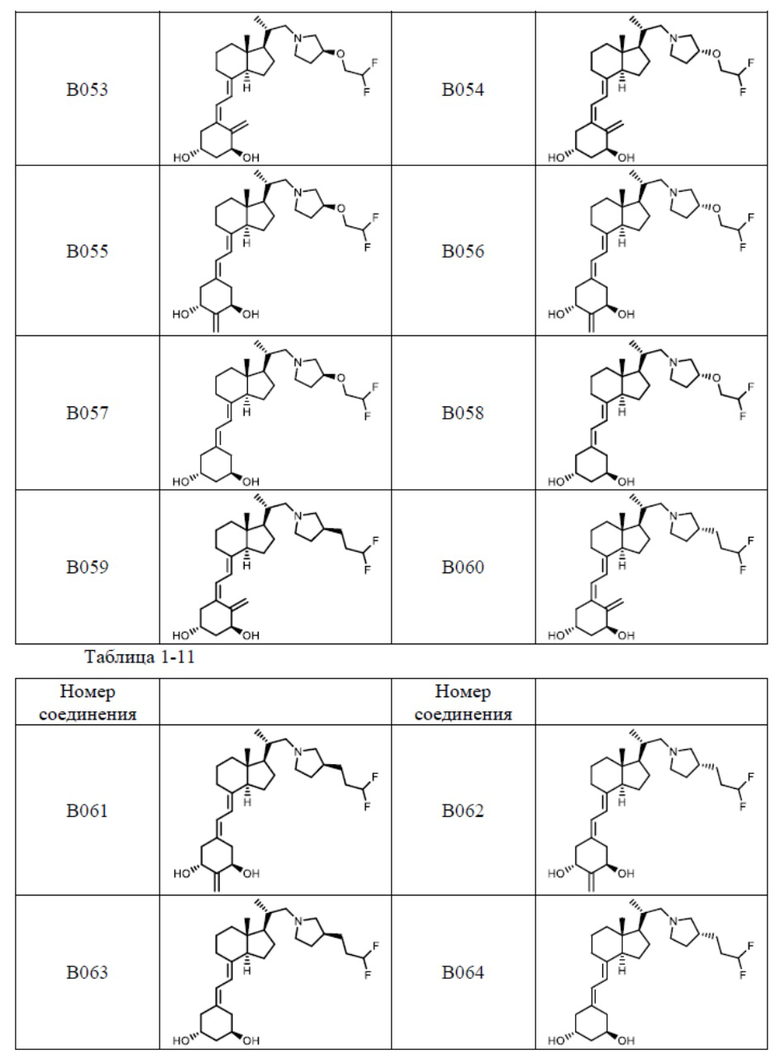
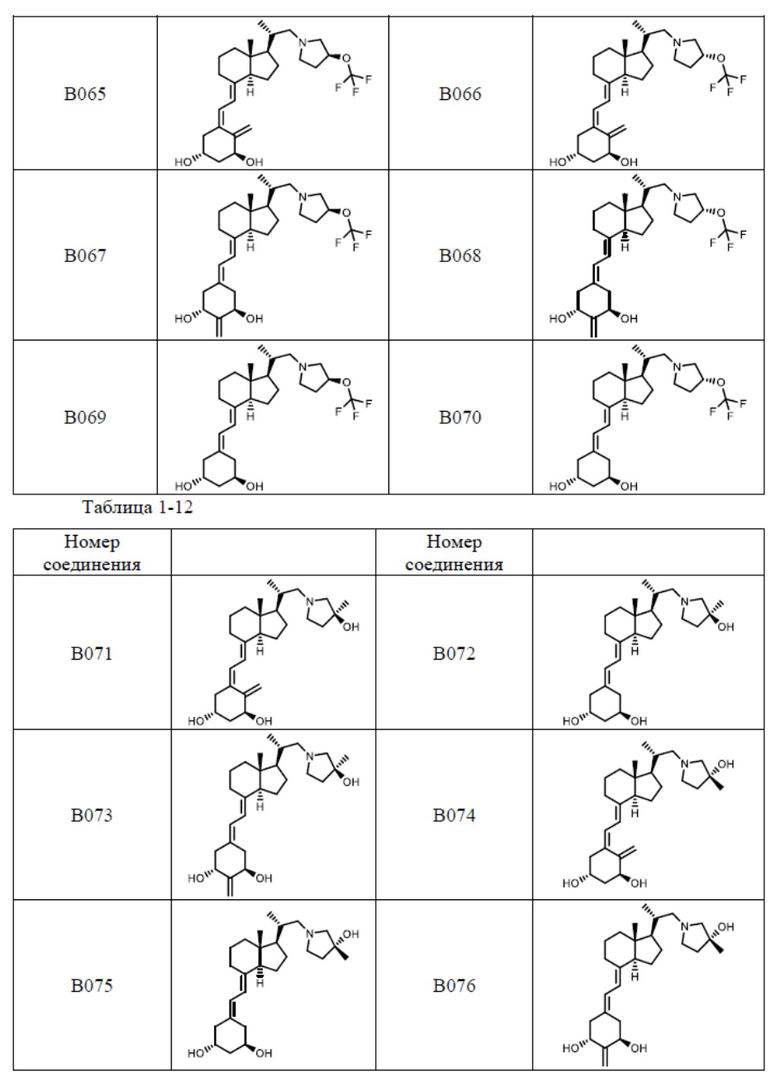
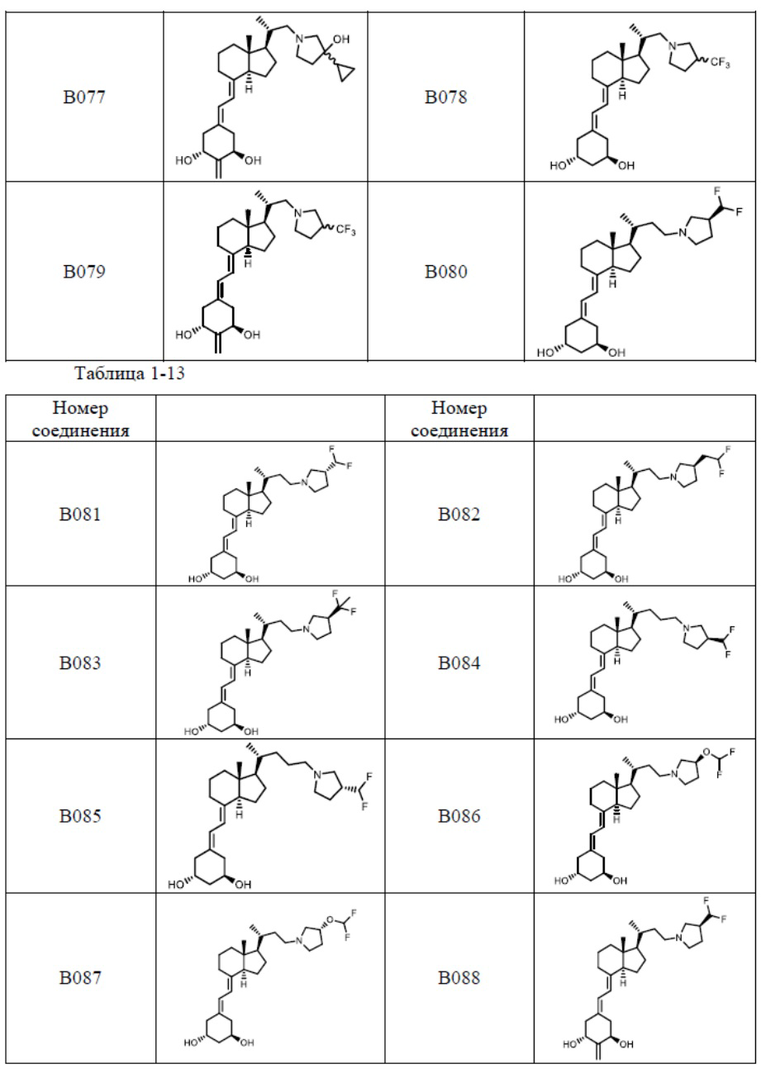
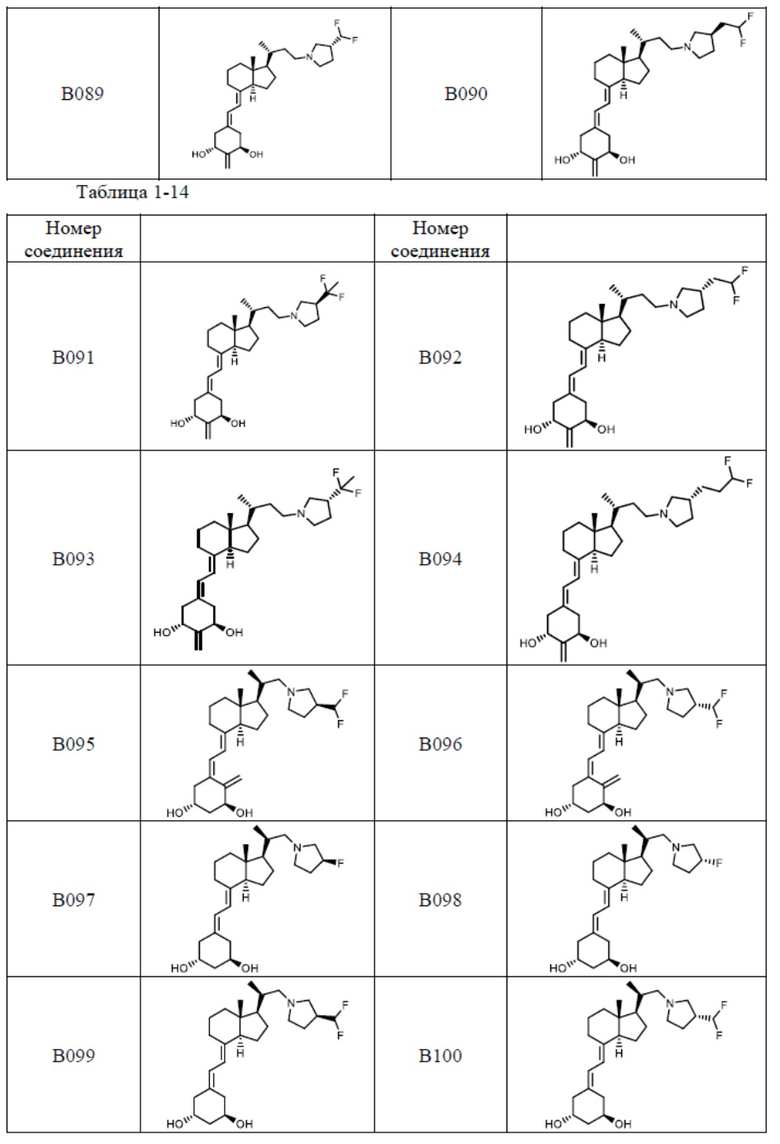
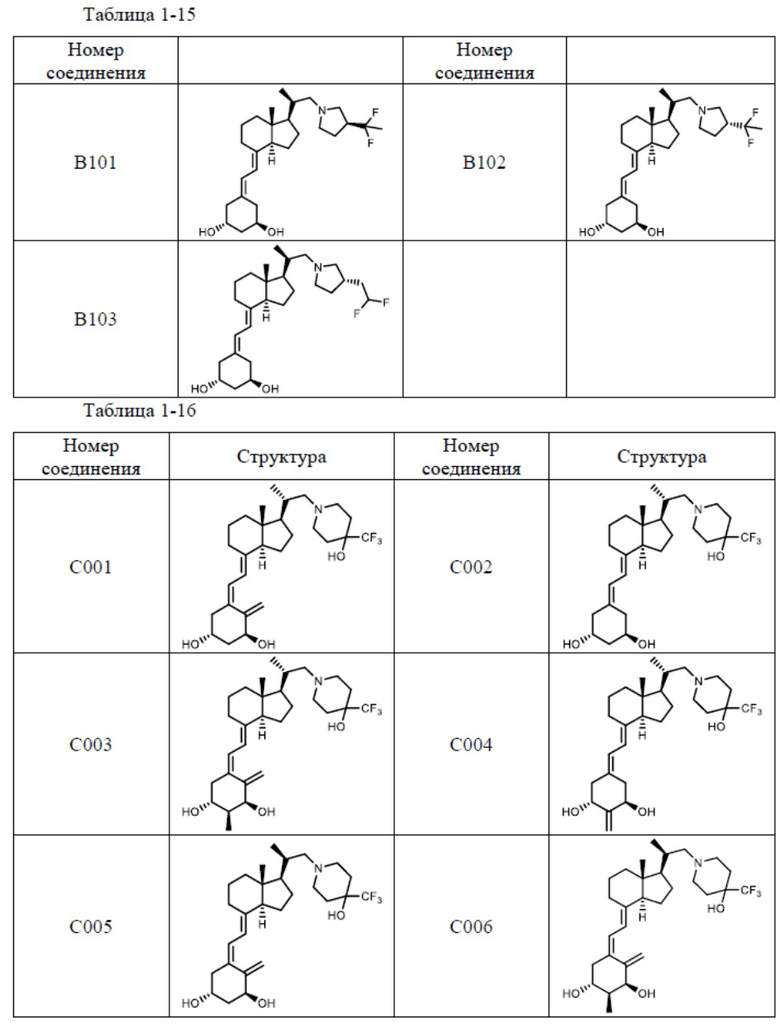
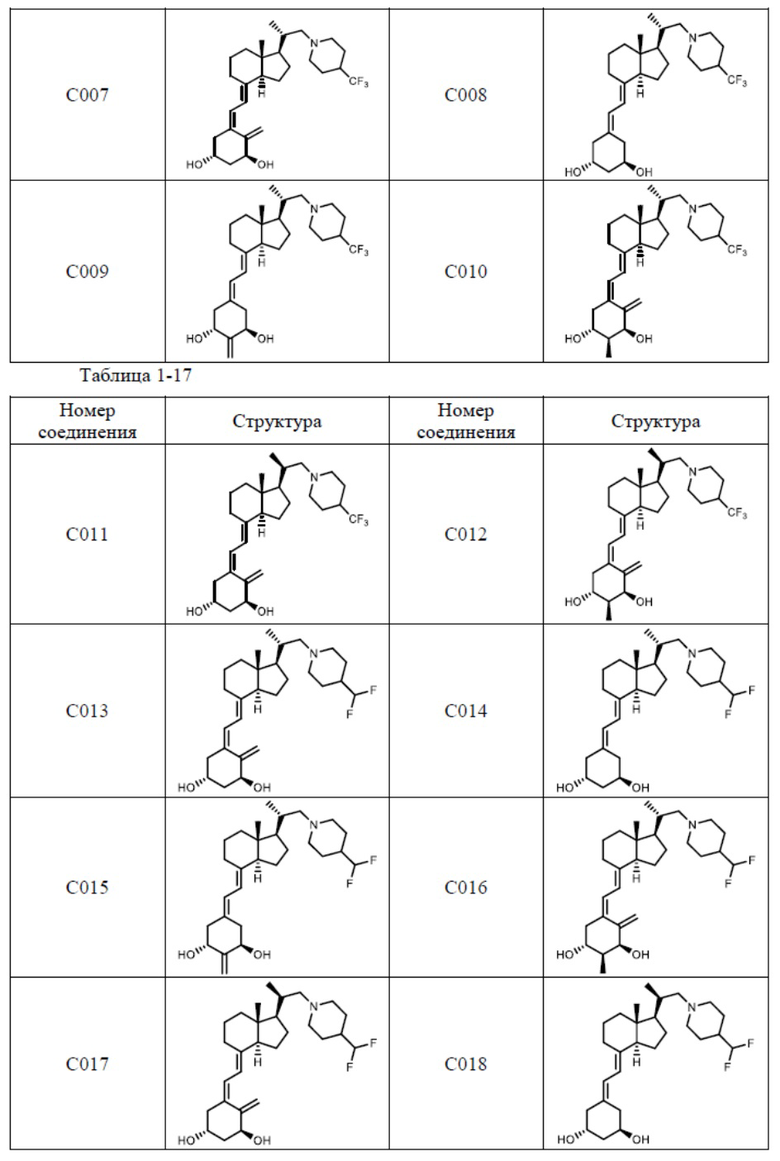
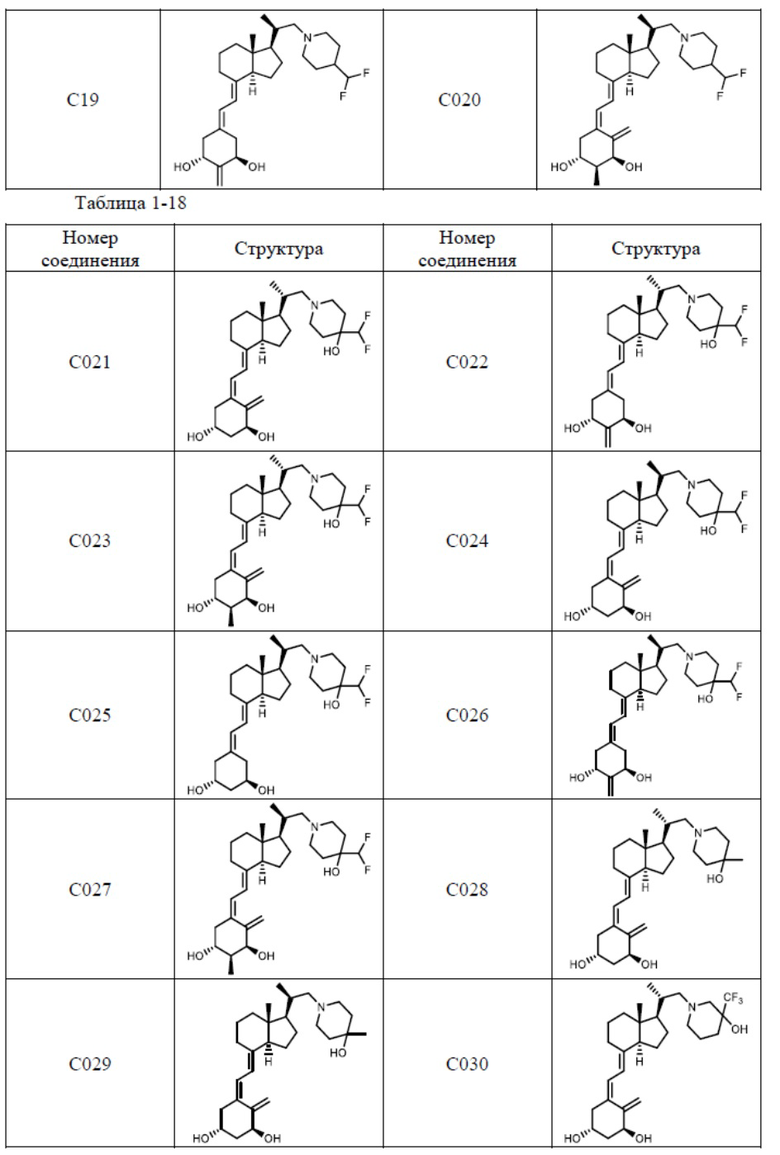
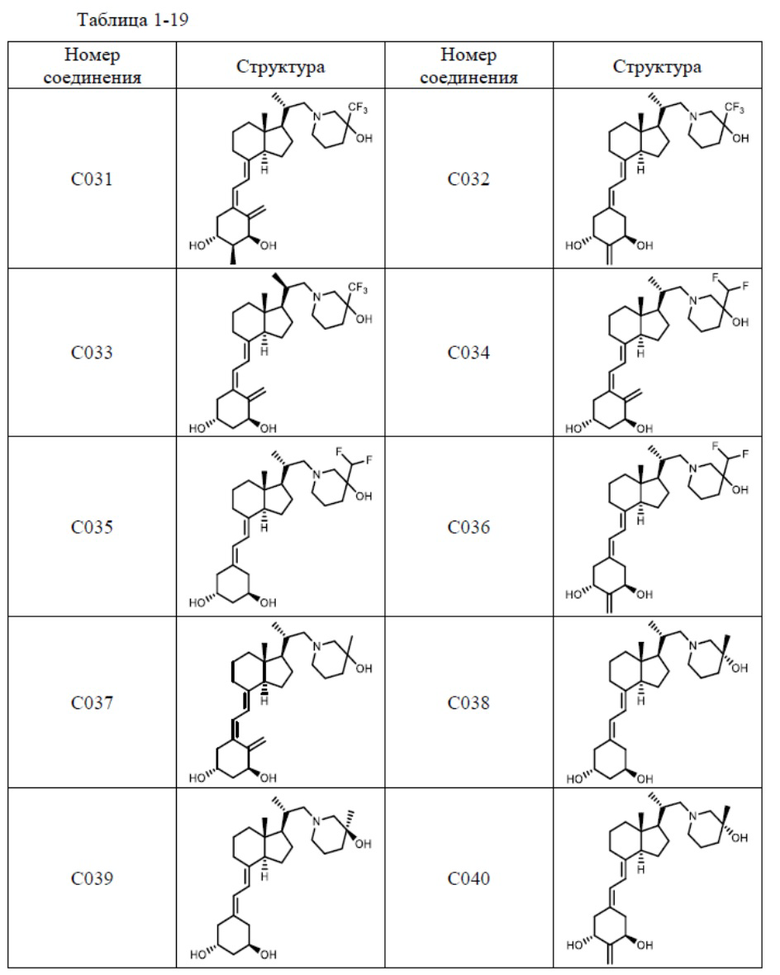
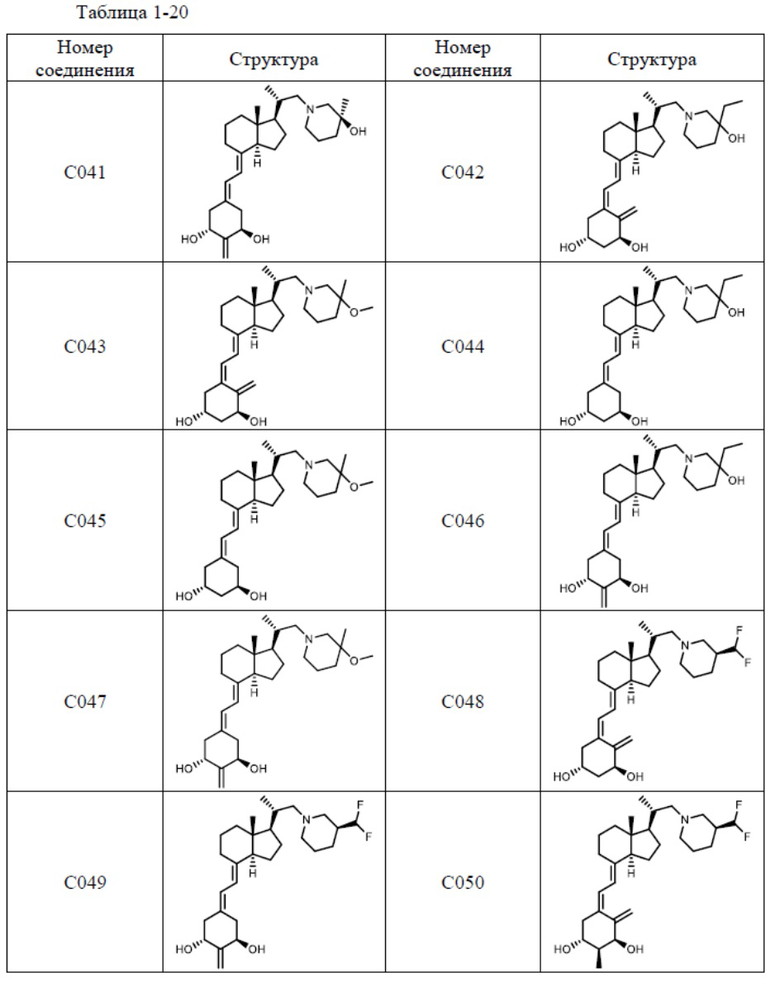
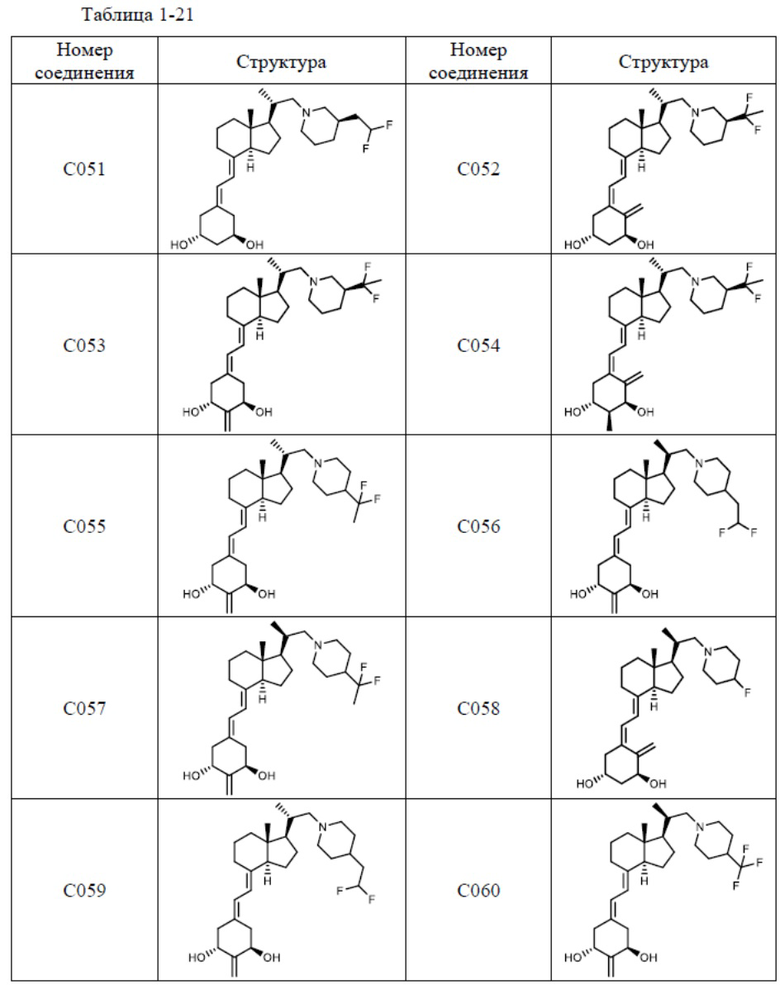
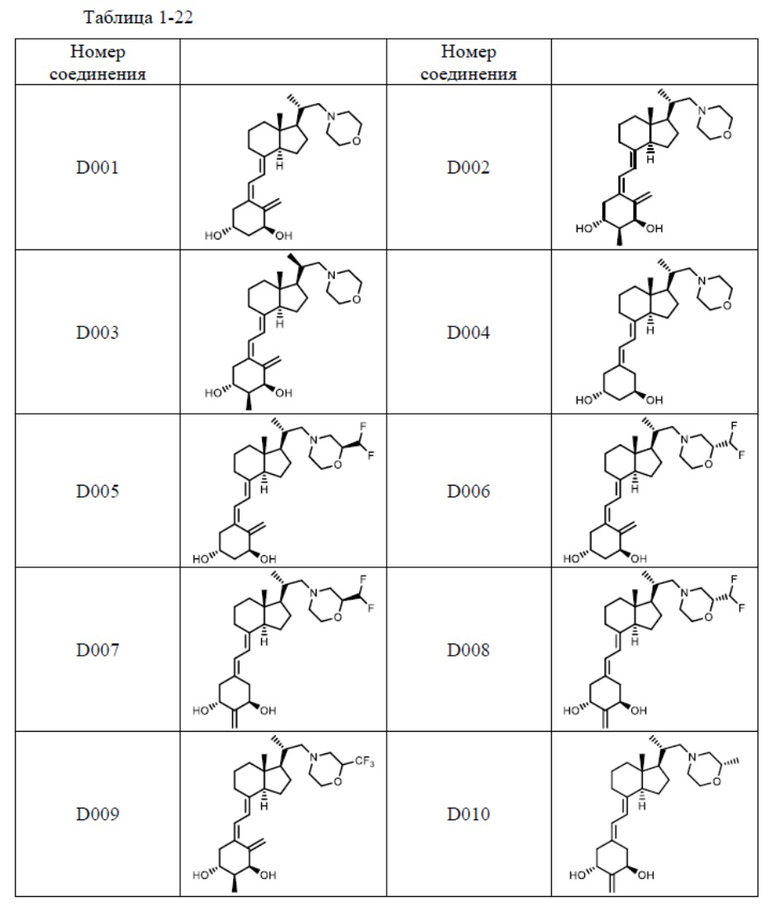
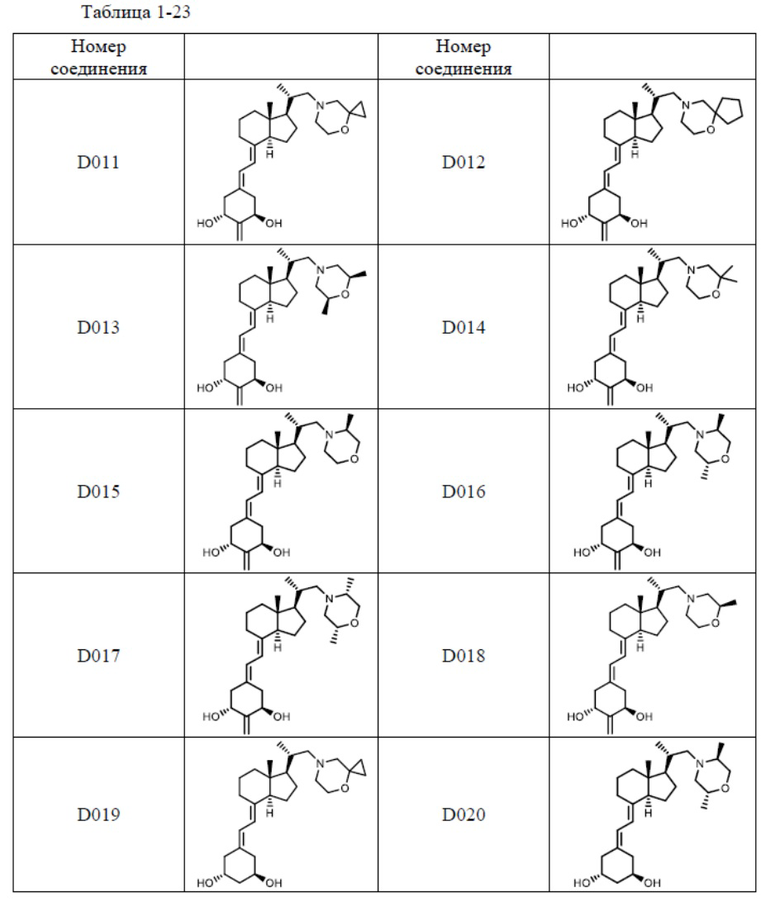
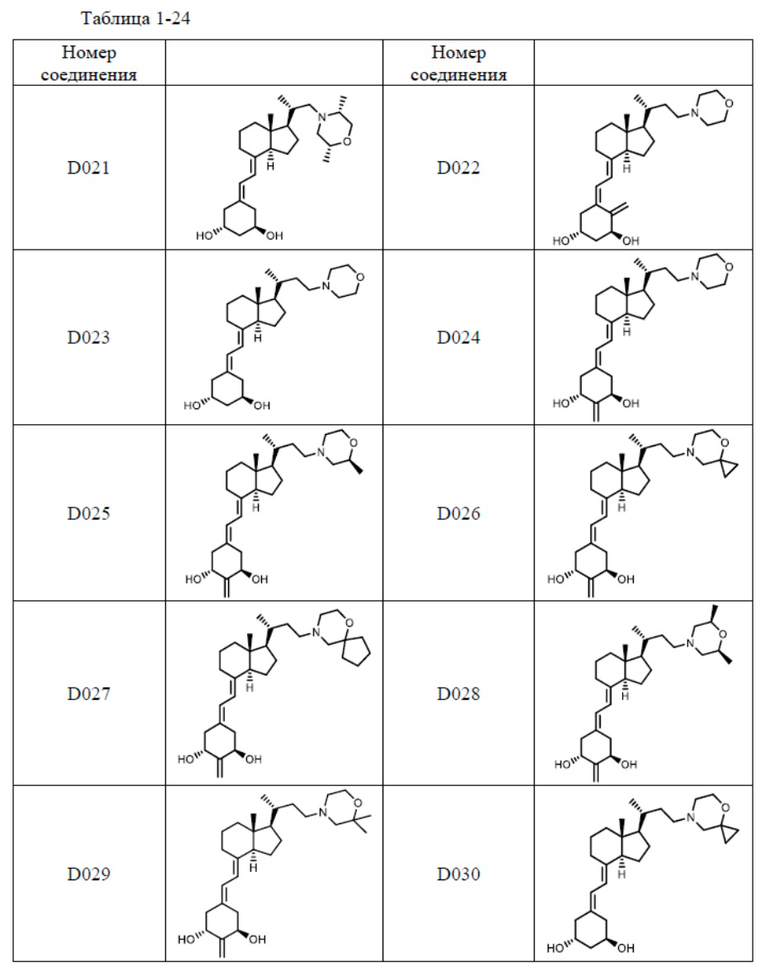
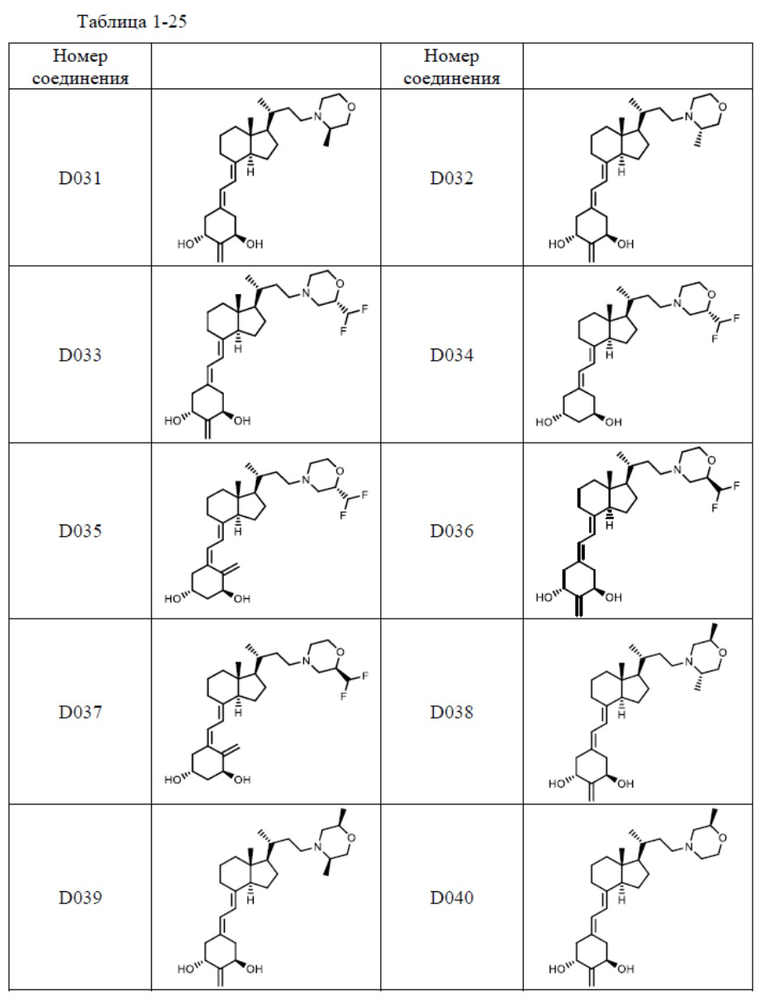
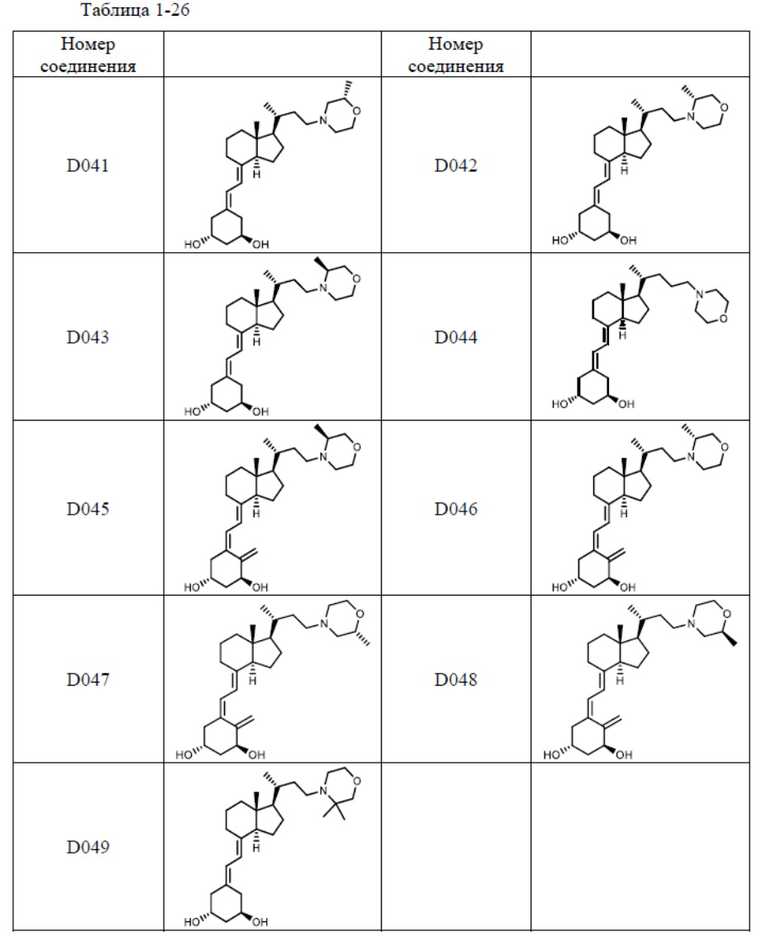
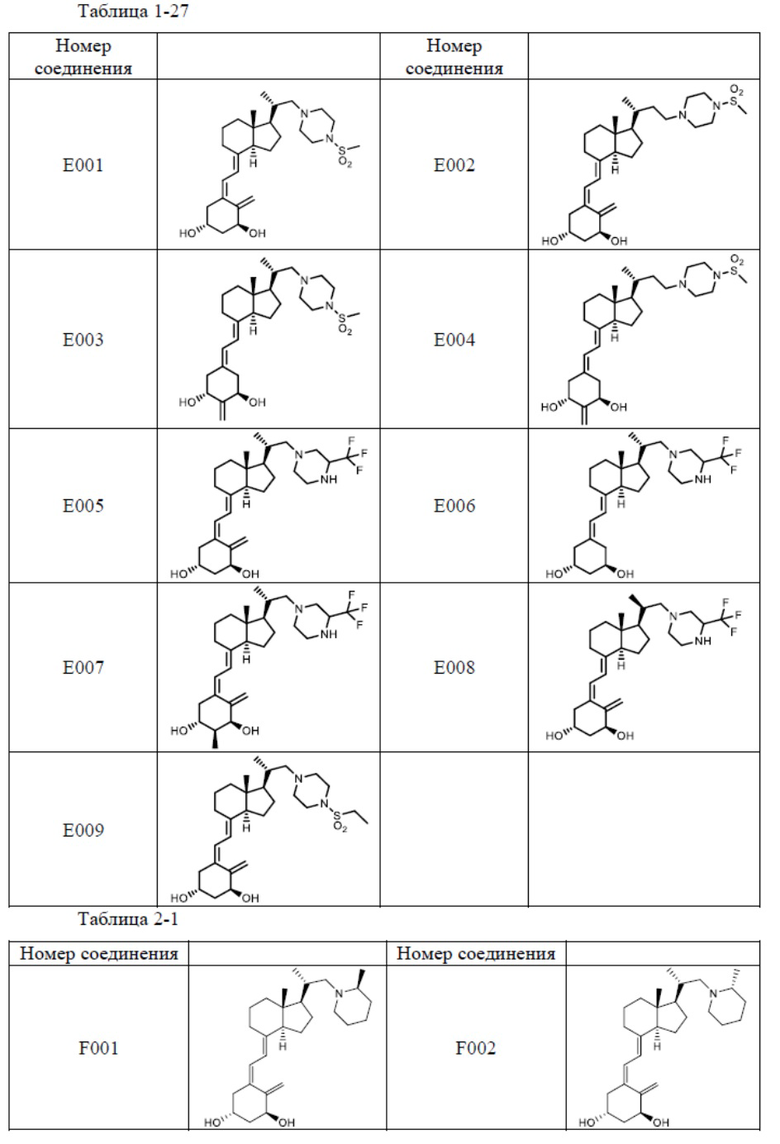
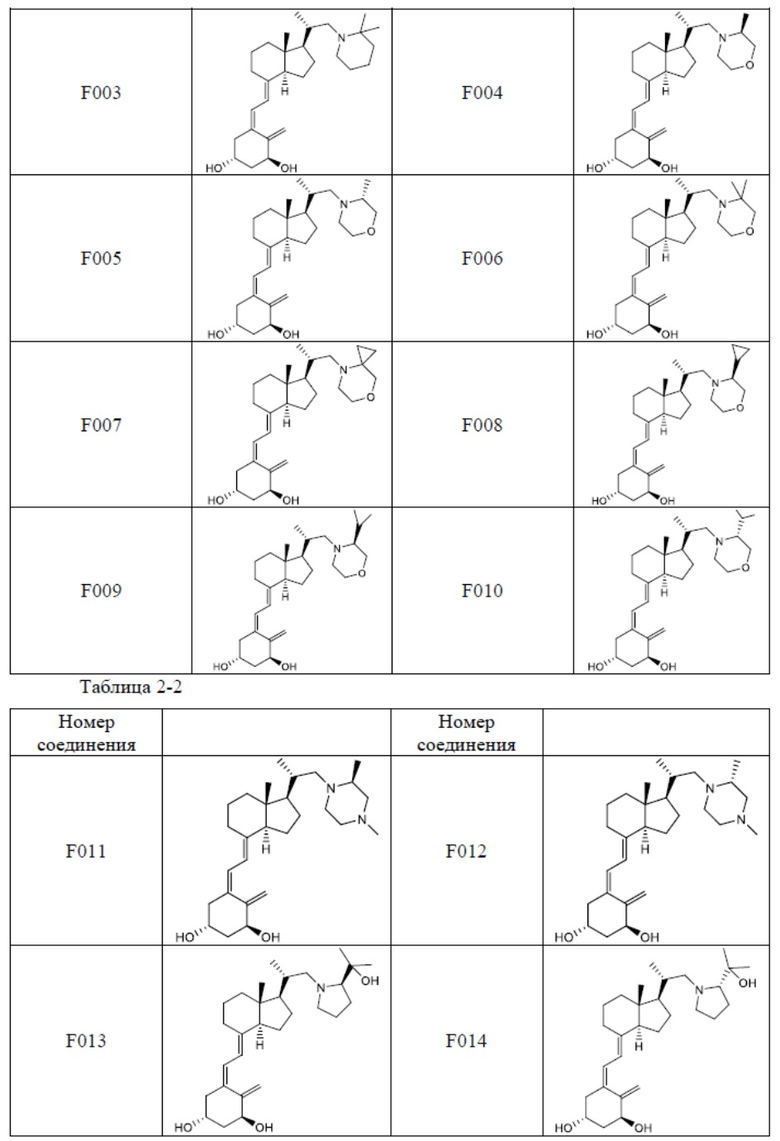
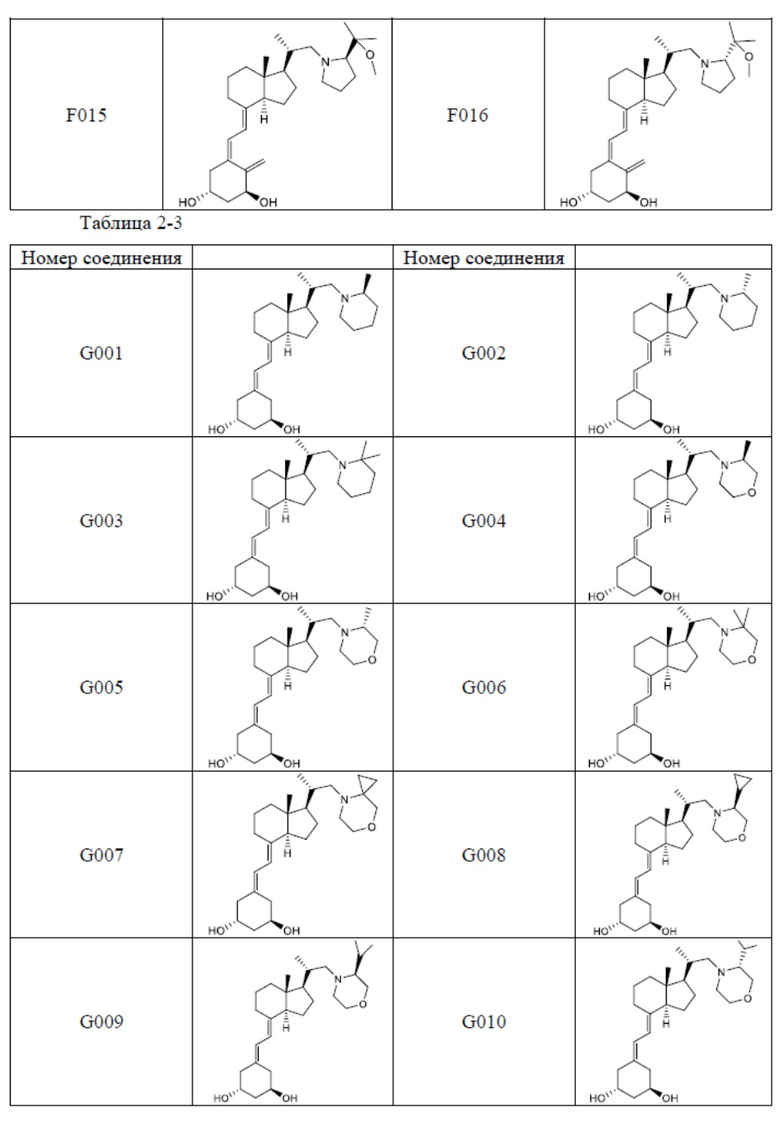

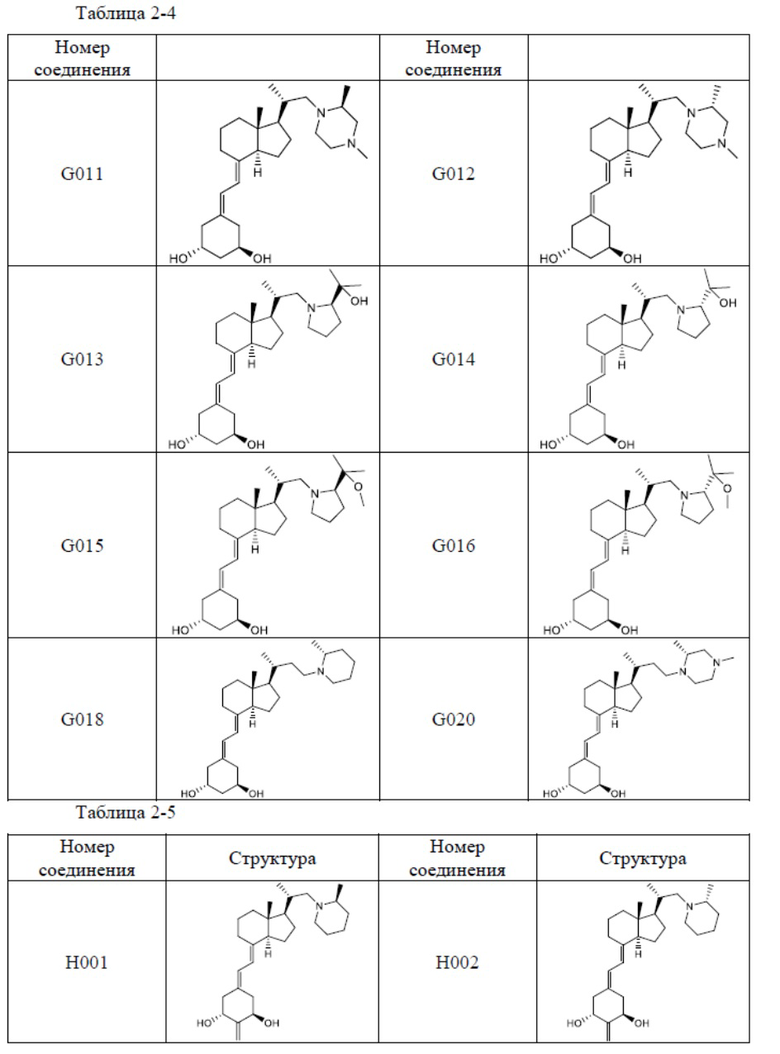

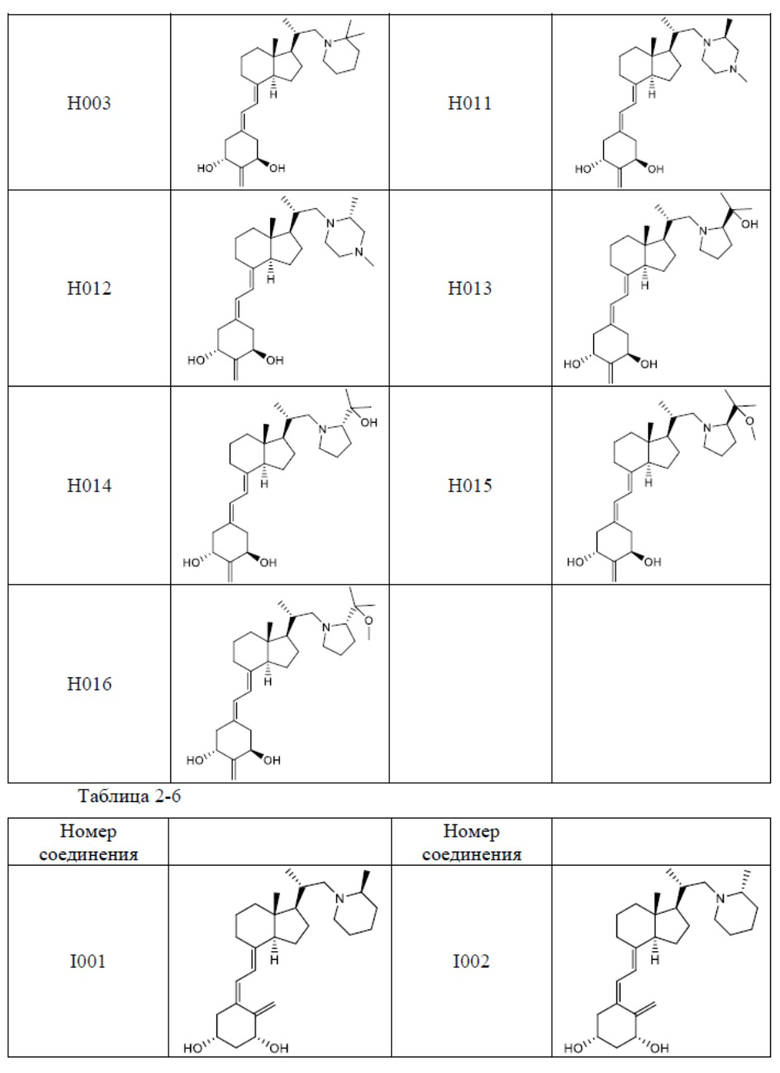
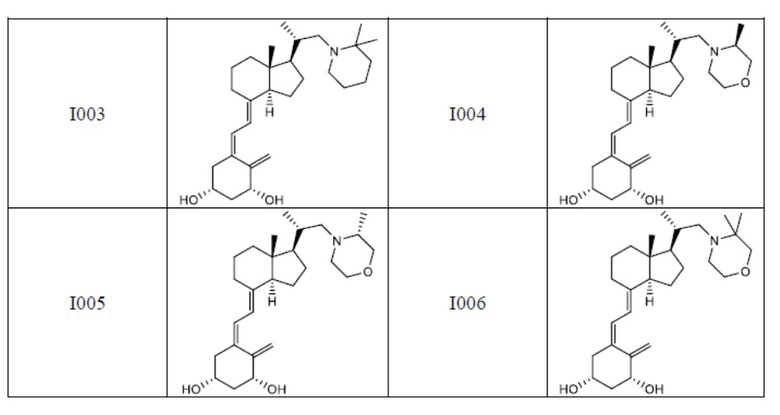
Из их числа, более предпочтительные соединения включают Соединение B001, B002, B003, B004, B005, B006, B007, B008, B018, B020, B021, B022, B023, B024, B025, B026, B027, B028, B029, B030, B031, B032, B033, B034, B035, B036, B037, B038, B039, B040, B041, B042, B043, B044, B045, B046, B047, B048, B049, B050, B051, B052, B053, B054, B055, B056, B057, B058, B059, B060, B061, B062, B063, B064, B080, B081, B086, B087, C001, C002, C005, C006, C019, C022, C036, C037, C039, C048, C049, C050, C051, C052, C053, C054, C055, C056, C057, C059, D004, D008, D010, D019, D022, D023, D024, D025, D031, D032, D033, D034, D035, D040, D041, D042, D043, D044, D045, D046, D047, D048, D049, F001, F002, F003, F004, F005, F006, F013, F014, F015, F016, G001, G002, G003, G004, G005, G006, G013, G014, G015, G016, G018, G020, H001, H002, H003, H013, H014, H015, H016, I001, I002, I003, I004, I005 и I006.
Производное витамина D по настоящему изобретению можно превратить в его фармацевтически приемлемую соль, если это необходимо. Примеры такой соли включают гидрохлорид, гидробромид, метансульфонат, пара-толуолсульфонат, ацетат, трифторацетат, фумарат, малеат, малат, сукцинат, оксалат, цитрат и бензоат. Особенно предпочтительные соли включают гидрохлорид, ацетат, фумарат, малеат, малат и сукцинат.
Кроме того, производное витамина D по настоящему изобретению можно превратить в его фармацевтически приемлемый сольват, если это необходимо. Примеры растворителя для этой цели включают воду, метанол, этанол, 1-пропанол, 2-пропанол, бутанол, ацетонитрил, ацетон, метилэтилкетон, метилацетат и этилацетат. Особенно предпочтительные растворители включают воду, метанол, этанол и ацетонитрил.
Общий пример синтеза
Производное витамина D, представленное приведенной выше формулой (1), можно синтезировать любым способом. Например, когда n = 1 в приведенной выше формуле (1), синтез можно провести согласно Схеме 1. То есть, целевой продукт (1) можно получить путем сочетания соединения (2) и циклического амина (3) в присутствии основания, с последующим снятием защитной группы с гидрокси-группы и очисткой.
[Схема 1]
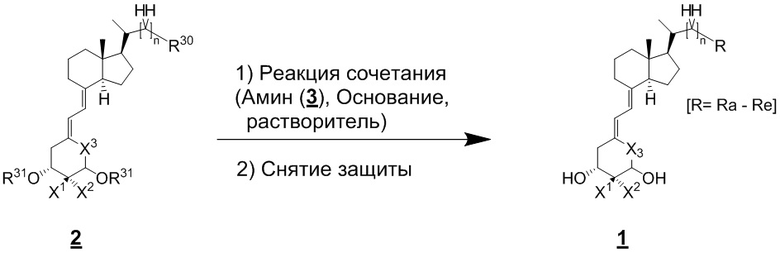
(Где R30 в соединении (2) на изображенной выше Схеме 1 представляет собой уходящую группу. Примеры уходящей группы включают атом хлора (Cl), атом брома (Br), атом иода (I), метансульфонильную группу (OMs) и пара-толуолсульфонильную группу (OTs). В частности, примеры предпочтительной уходящей группы включают атом иода и пара-толуолсульфонильную группу.
Кроме того, R31 в соединении (2) представляет собой защитную группу для гидрокси-группы. Примеры защитной группы включают триметилсилильную группу (TMS), триэтилсилильную группу (TES), т-бутилдиметилсилильную группу (TBS) и т-бутилдифенилсилильную группу (TBDPS) группу. Среди них предпочтительной является т-бутилдиметилсилильная группа (TBS).)
Циклический амин (3) который вводят в реакцию сочетания (стадия 1) с соединением (2), может находиться в форме свободного основания или в форме соли. Соединение (2) предпочтительно добавляют в количестве от 1 до 3 эквивалентов. Основание на этой стадии не ограничивается особым образом, и примеры предпочтительного основания включают карбонат калия, гидрокарбонат калия и карбонат цезия. Основание добавляют в количестве от 1 до 5 эквивалентов, и предпочтительно 3 - 5 эквивалентов. Кроме того, для ускорения реакции можно добавлять иодид калия иодид натрия в реакционную смесь. Количество добавляемого иодида калия или иодида натрия предпочтительно составляет от 1 до 2 эквивалентов. Растворитель также не ограничивается каким-либо особым образом, и примеры предпочтительного растворителя включают N,N-диметилформамид и N-метил-2-пирролидон. Реакцию сочетания предпочтительно проводят при температуре от 40°C до 70°C, и время реакции составляет от 6 часов до 48 часов.
Стадия 1 может переходит в стадию снятия защиты (стадия 2) после очистки, или она может переходит в стадию снятия защиты (стадия 2) с использованием сырого продукта со стадии 1.
Условия проведения стадии снятия защиты (стадия 2) на изображенной выше Схеме 1 не ограничиваются, при условии, что они соответствуют условиям снятия силильной защитной группы, и можно в качестве примера привести снятие защиты тетрабутиламмоний фторидом (TBAF) или снятие защиты соляной кислотой. Предпочтительные условия следующие: в тетрагидрофуране (ТГФ), добавление 1 - 3 эквивалентов тетрабутиламмоний фторида (TBAF) на гидрокси-группу, и перемешивание при температуре от комнатной до температуры кипения. Другие предпочтительные условия следующие: в ацетоне или 2-бутаноне, добавление 1 - 3 эквивалентов соляной кислоты на гидрокси-группу, и перемешивание при комнатной температуре. Концентрация соляной кислоты предпочтительно составляет от 1M до 6M. Производное витамина D (1) по настоящему изобретению можно получить после обработки реакционной смеси путем очистки обычно применяемым методом очистки, таким как колоночная хроматография на силикагеле или ВЭЖХ.
Соединение приведенной выше формулы (2) можно синтезировать, например, согласно следующей Схеме 2.
[Схема 2]
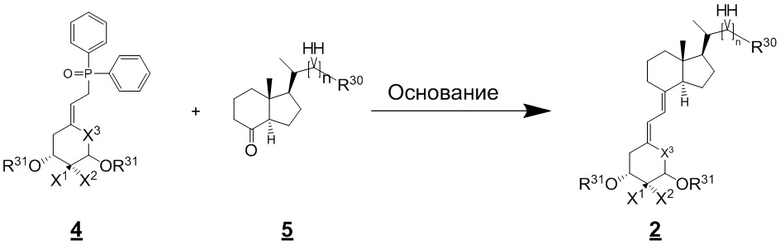
(Где X1, X2 и X3 на изображенной выше Схеме 2 такие же как в приведенной выше формуле (1). R30 и R31 такие же как на Схеме 1.)
То есть, соединение (2) можно получить путем реакции сочетания фосфиноксидного производного (4) и соединения (5) в основных условиях. Примеры предпочтительного основания в этой реакции сочетания включают гидрид натрия, н-бутиллитий, диизопропиламид лития (LDA), бис(триметилсилил)амид лития (LHMDS), бис(триметилсилил)амид калия (KHMDS) и бис(триметилсилил)амид натрия (NaHMDS). Количество основания предпочтительно составляет 1.1 - 2 эквивалентов относительно соединения 4. Реакцию предпочтительно проводят при температуре от -78 до -0°C в течение 1 - 3 часов.
В приведенной выше формуле (2), когда R30 представляет собой пара- толуолсульфонильную группу (OTs), и R31 представляет собой т-бутилдиметилсилильную группу (TBS), все соединения из комбинаций, показанных ниже в таблице, являются хорошо известными.
Если соединение в приведенной выше формуле (2) не является хорошо известным, его можно синтезировать как описано ниже.
Например, когда X1 представляет собой метильную группу, X2 представляет собой атом водорода, и X3 представляет собой C=CH2, соединение можно синтезировать как показано ниже на Схеме 3. То есть, в присутствии Pd-катализатора соединение (2g) можно синтезировать путем реакции сочетания хорошо известного соединения (6c) (CAS 173388-39-1) с хорошо известным соединением (7b) (CAS 203126-90-3). Целевое производное витамина D (1) можно получить, аналогично Схеме 1, из Соединения (2g) путем сочетания с циклическим амином (3) и снятия защиты.
[Схема 3]
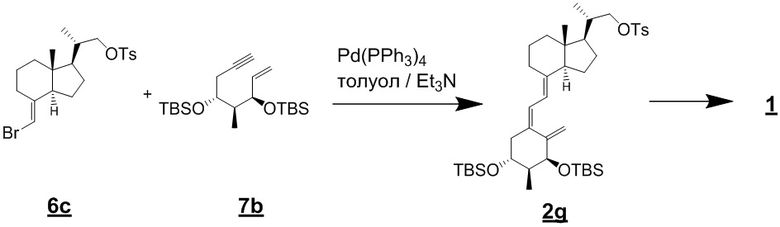
Производное витамина D, представленное приведенной выше формулой (1), можно получить другим методом синтеза: хорошо известное соединение (6c) и циклический амин (3) вводят в реакцию сочетания в присутствии основания, синтезируя соединение (8), соединение (8) вводят в реакцию сочетания с соединением (9) в присутствии Pd-катализатора, затем проводят реакцию снятия защиты.
[Схема 4]
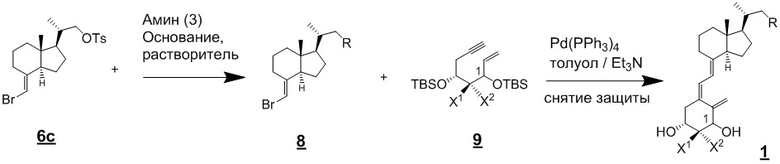
[Где R, X1 и X2 на изображенной выше Схеме такие же как в приведенной выше формуле (1). Стереохимия по C-1 в соединении (1) и соединении (9) соответствует (R)-конфигурации или (S)-конфигурации.]
Соединение с n = 2 в приведенной выше формуле (1) можно синтезировать, например, как показано ниже на Схеме 5. То есть, соединение (11) получают тозилированием первичной гидрокси-группы хорошо известного соединения (10) (CAS 300344-39-2), с последующим десилилированием и окислением. Соединение (11) и соединение (4), описанное на Схеме 2, вводят в реакцию сочетания, получая соединение (12). Используя соединение (12), циклический амин (3) вводят в реакцию сочетания и реакцию снятия защиты аналогично описанному на Схеме 1, получая производное витамина D (1) по настоящему изобретению.
[Схема 5]
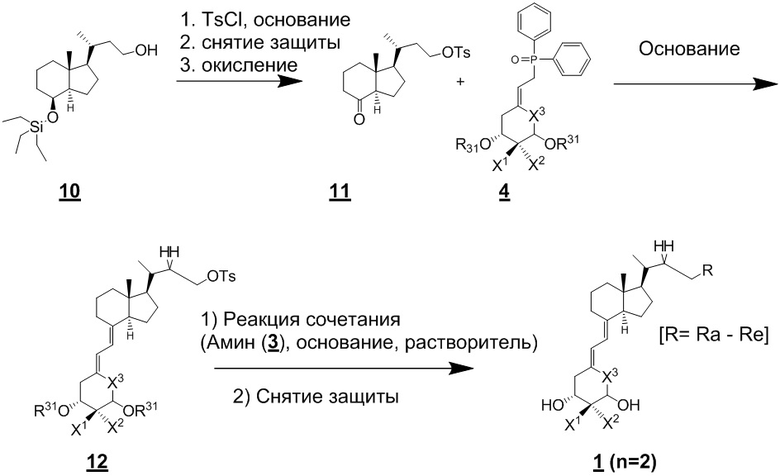
[Где R, X1, X2 и X3 на приведенной выше схеме такие же как в приведенной выше формуле (1), и R30 и R31 такие же как на Схеме 1. Для производного витамина D (1) на этой схеме, n = 2.]
Используя соединение (2) (n = 1) из Схемы 1, производное витамина D (1) (n = 2) можно синтезировать как описано ниже на Схеме 6. То есть, соединение (2) нитрилируют, получая соединение (13), соединение (13) вводят в реакцию с диизобутилалюминий гидридом (DIBAL-H), получая альдегидное соединение (14), альдегидное соединение (14) затем восстанавливают, получая спиртовое соединение (15). Соединение (15) тозилируют, получая OTs-соединение (16), и затем соединение (16) вводят в реакцию сочетания с циклическим амином (3) аналогично Схеме 1, затем проводят снятие защиты, получая целевое производное витамина D, представленное приведенной выше формулой (1). На Схеме 6 реакции цианирования, DIBAL-восстановления и восстановления альдегидной группы проводят в обычно использующихся условиях. Например, цианирование проводят путем реакции с 1 - 3 эквивалентами KCN и 0.1 - 0.3 эквивалентами 18-краун-6 в N,N-диметилформамиде. Температура реакции предпочтительно составляет от 80°C до 100°C. DIBAL-восстановление проводят в течение примерно 0.5 - 2 часов при добавлении 1 - 2 эквивалентов диизобутилалюминий гидрида (DIBAL-H) в толуоле при температуре от -78°C до 0°C. Восстановление альдегидной группы проводят путем реакции с 1 - 2 эквивалентами боргидрида натрия (NaBH4) при температуре от 0°C до комнатной, получая соединение (16).
[Схема 6]
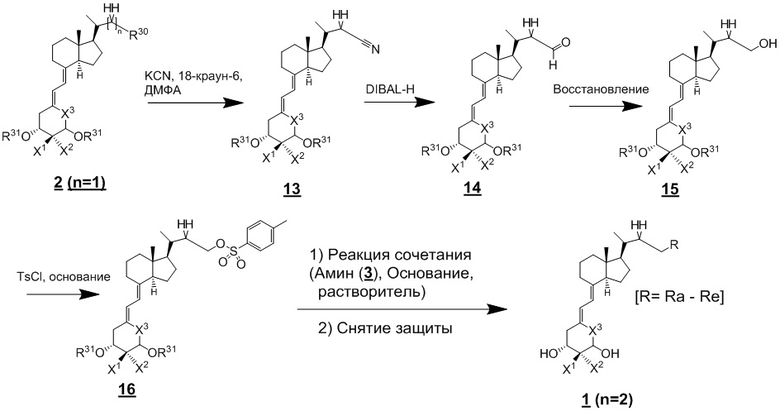
[Где R, X1, X2 и X3 на изображенной выше Схеме такие же как в приведенной выше формуле (1), и R30 и R31 такие же как на Схеме 1.]
Помимо приведенных выше схем, как показано ниже на Схеме 7, альдегидное соединение (14) вводят в реакцию восстановительного аминирования с циклическим амином (3), и затем снимают защиту, синтезируя производное витамина D, представленное приведенной выше формулой (1).
[Схема 7]
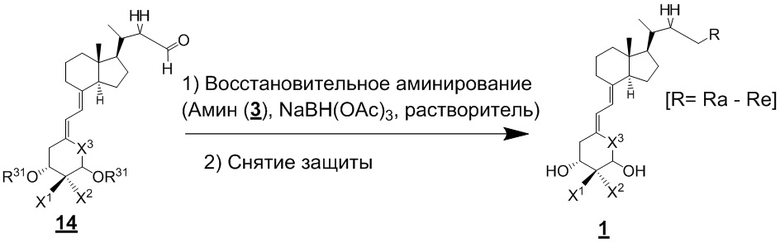
[Где R, X1, X2 и X3 на изображенной выше Схеме такие же как в приведенной выше формуле (1), и R31 такой же как на Схеме 1.]
Триацетоксиборгидрид натрия и цианоборгидрид натрия являются предпочтительным реагентом для восстановительного аминирования. Растворитель тоже не ограничивается каким-либо особым образом, и примеры предпочтительного растворителя включают ТГФ. Кроме того, циклический амин (3) может использоваться в качестве растворителя. Восстановительное аминирование проводят путем реакции соединения (14) с 1 - 5 эквивалентами амина (3) и восстановителем (1 - 3 эквивалента) в тетрагидрофуране (ТГФ) и последующего снятия защиты, получая соединение (1).
Кроме того, например, когда n01 = 1 и n02 = 1 для Rc' и Re' в приведенной выше формуле (1B), их можно синтезировать, например, как показано ниже на Схеме 8. То есть, тозильную группу соединения (2, R30=OTs) замещают циано-группой, получая соединение (13b), и затем получают соединение (14b) путем DIBAL-восстановления. Соединение (15) получают, вводя соединение (14b) в реакцию восстановительного аминирования с амином (3), и затем снимают защиту, получая производное витамина D (1B) (R' = Rc', Re') по настоящему изобретению. Реакции цианирования, DIBAL-восстановления и восстановительного аминирования на Схеме 8 проводят в условиях, аналогичных описанным на Схемах 6 и 7.
[Схема 8]

[Где R', X1, X2 и X3 на изображенной выше Схеме такие же как в приведенной выше формуле (1B), R31 такой же как на Схеме 1.]
Производное витамина D, представленное формулой (1) по настоящему изобретению, или его фармацевтически приемлемая соль или сольват, имеет прекрасную пенетрацию в центральную нервную систему, а также обладает прекрасной активностью в индуцировании/стимулировании дифференциации клеток-предшественников олигодендроцитов или нейрональных стволовых клеток в олигодендроциты. Благодаря своей прекрасной активности в индуцировании/стимулировании дифференциации в олигодендроциты, производное витамина D, представленное формулой (1) по настоящему изобретению, или его фармацевтически приемлемая соль или сольват могут применяться в качестве стимулятора ремиелинизации.
Производное витамина D, представленное формулой (1) по настоящему изобретению, или его фармацевтически приемлемая соль или сольват могут клинически применяться в качестве стимулятора регенерации демиелинизации, и могут применяться в качестве терапевтического средства против заболеваний, ассоциированных с демиелинизацией или дисмиелинизацией, таких как рассеянный склероз, нейромиелит зрительного нерва, прогрессирующая мультифокальная лейкоэнцефалопатия, множественная системная атрофия, острый рассеянный энцефаломиелит, атопический миелит, HTLV-1-ассоциированная миелопатия, ВИЧ-ассоциированная лейкоэнцефалопатия, болезнь Краббе, синдром Гийома-Барре, синдром Фишера, хроническая воспалительная демиелинизирующая полинейропатия, болезнь Шарко-Мари-Тута, болезнь Паркинсона, шизофрения, биполярное расстройство, большое депрессивное расстройство, расстройство аутистического спектра, синдром дефицита внимания и гиперактивности, обсессивно-компульсивный синдром, посттравматическое стрессовое расстройство, депрессия, вызванная зависимостью от препаратов, аутизм, деменция альцгеймеровского типа и ишемический инсульт.
Среди производных витамина D, представленных формулой (1) по настоящему изобретению, или их фармацевтически приемлемых солей или сольватов, производные витамина D, представленные формулами (1B) и (1B-4), или их фармацевтически приемлемые соли или сольваты, стимулируют дифференциацию клеток-предшественников олигодендроцитов (OPC), несмотря на свою слабую активность в отношении рецепторов витамина D.
Терапевтическое средство, содержащее в качестве действующего вещества производное витамина D по настоящему изобретению или его фармацевтически приемлемую соль или сольват, готовят в виде фармацевтической композиции, используя дополнительные компоненты, обычно применяющиеся для приготовления препаратов, такие как носитель, основание, вспомогательное вещество и другие добавки. Носитель, основание и вспомогательное вещество, использующиеся в фармацевтической композиции, могут быть твердыми или жидкими, и их примеры включают лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, какао-масло, этиленгликоль, триглицерид среднецепочечных жирных кислот и другие стандартно применяющиеся вещества. Введение можно осуществлять в любой форме, такой как пероральное введение с помощью таблеток, пилюль, капсул, мягких капсул, гранул, порошка, жидкости и т.п., или парентеральное введение с помощью инъекции, такой как внутривенная инъекция, внутримышечная инъекция и т.п., и посредством суппозиториев, чрезкожного и назального введения, и т.п.
Терапевтически эффективное количество действующего вещества в терапевтическом средстве по настоящему изобретению варьируется в зависимости от пути введения, возраста, пола и степени тяжести заболевания у пациента, но обычно составляет примерно от 0.1 до 10000 мкг/день, и число приемов обычно составляет от 1-3 раз в день до 1-3 раз в неделю, и препарат предпочтительно готовят так, чтобы соответствовать этим условиям. Однако поскольку дозировка существенно варьируется в зависимости от разных условий, то дозировка меньше вышеуказанной может быть достаточной, или иногда может потребоваться дозировка больше вышеуказанного диапазона.
Примеры
Далее изобретение будет описано более подробно с привлечением Примеров, но настоящее изобретение не ограничивается только ими.
В настоящем изобретении используются следующие аббревиатуры.
Boc = трет-бутоксикарбонил
DAST = диэтиламиносеры трифторид
DIBAL-H = диизобутилалюминий гидрид
ДМФА = N,N-диметилформамид
LHMDS = гексаметилдисилазан лития
MBP = основной белок миелина (myelin basic protein)
MS4A = молекулярные сита 4A
NMO = N-метилморфолин N-оксид
NMP = N-метил-2-пирролидон
ПТСХ = препаративная тонкослойная хроматография
TBAF = тетрабутиламмоний фторид
TBS = трет-бутилдиметилсилильная группа
TES = триэтилсилильная группа
TESCl = хлортриэтилсилан
ТГФ = тетрагидрофуран
TPAP = тетрапропиламмония перрутенат
Ts = п-толуолсульфонил
TsCl = п-толуолсульфонилхлорид
В описанных ниже примерах, когда соединение по настоящему изобретению выделяют методом препаративной ВЭЖХ, препаративные условия следующие.
Колонка: YMC-Pack ODS AM (внутренний диаметр 3-30 см) производства YMC Co., Ltd.
Подвижная фаза A: 5% ацетонитрил-вода (с 0.1% уксусной кислоты)
Подвижная фаза B: 95% ацетонитрил-вода (с 0.1% уксусной кислоты)
Объем ввода: Сырой продукт растворяли в 1.3 мл метанола и вводили.
Скорость потока: 12 мл/мин
УФ: 265 нм
Градиент:
0 - 5 минут: 5% фаза B /95% фаза A
5 - 45 минут: Градиент до 100% Фазы B за 40 минут
45 - 50 минут: 100% Фаза B
50 - 55 минут: Градиент до 5% Фаза B/95% Фаза A за 5 минут
Когда анализ проводили методом ВЭЖХ/МС в описанных ниже примерах, условия анализа были следующие.
Колонка: Gemini C18 (3 мкм, внутренний диаметр 4.6-30 мм) производства Phenomenex Inc.
Подвижная фаза A: 5% ацетонитрил-вода (с 0.1% трифторуксусной кислоты)
Подвижная фаза B: 95% ацетонитрил-вода (с 0.1% трифторуксусной кислоты)
Скорость потока: 1.2 мл/мин
УФ: 254 нм
Градиент:
0 - 0.01 минут: 2% Фаза B /98% Фаза A
0.01 - 0.3 минут: Градиент до 40% Фаза B /60% Фаза A
0.3 - 2.3 минут: Градиент до 100% Фаза B
2.3 - 4.2 минут: 100% Фаза B
4.2 - 4.3 минут: Градиент до 2% Фаза B/98% Фаза A
4.3 - 5.2 минут: 2% Фаза B/98% Фаза A
5.2 минут: Завершение анализа
Сравнительный пример 1
Синтез (2S)-2-((1R,3aS,7aR,E)-4-((Z)-2((3S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-2- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение (2a))
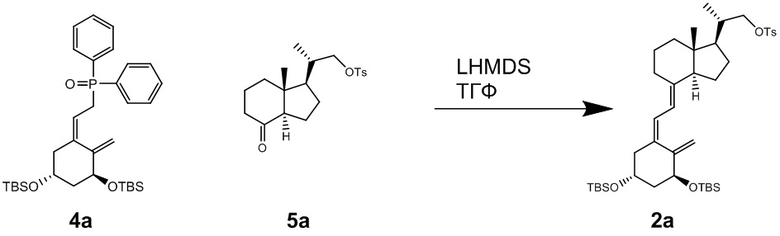
В атмосфере аргона добавляли LHMDS [1 M раствор в толуоле, 10 мл] в раствор ((Z)-2-((3S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-2-метиленциклооксилиден)этил) дифенилфосфин оксида (Соединение 4a, CAS 81522-68-1) [7.42 г, 12.7 ммоль] в ТГФ [50 мл], и полученную смесь перемешивали при -78°C в течение 1 часа. В полученную смесь добавляли раствор (2S)-2-((1R,3aR,7aR)-7a-метил-4-оксооктадегидро-1H-инден-1- ил)пропил 4-метилбензолсульфоната (Соединение (5a), CAS 342645-83-4) [3.6 г, 9.9 ммоль] в ТГФ [20 мл], и смесь дополнительно перемешивали при той же температуре в течение 1 часа. Реакционную смесь нагревали до комнатной температуры и перемешивали 30 минут. Добавляли в реакционную смесь насыщенный водный раствор хлорида аммония, и полученную смесь экстрагировали смесью растворителей гептан/этилацетат (1/1). Органический слой промывали водой и затем смесью 50% метанол-вода, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение (2a) [4.79 г, 6.57 ммоль] (выход = 67%).
1H-ЯМР (CDCl3) δ: 7.79 (2H, д, J = 8.2 Гц), 7.31 (2H, д, J = 8.2 Гц), 6.22 (1H, д, J = 11.0 Гц), 5.99 (1H, д, J = 11.0 Гц), 5.17 (1H, д, J = 2.0 Гц), 4.84 (1H, д, J = 2.0 Гц), 4.38-4.16 (2H, м), 3.98 (1H, дд, J = 9.1, 3.2 Гц), 3.80 (1H, дд, J = 9.1, 6.4 Гц), 2.83 (1H, д, J = 12.3 Гц), 2.45 (3H, с), 2.42 (1H, д, J = 4.1 Гц), 2.22 (1H, дд, J = 13.0, 7.5 Гц), 1.97-1.57 (8H, м), 1.53-1.15 (9H, м), 0.99 (3H, д, J = 6.4 Гц), 0.87 (9H, с), 0.86 (9H, с), 0.49 (3H, с), 0.06 (9H, с), 0.04 (3H, с).
Сравнительный пример 2
Синтез (2S)-2-((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси) циклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение 2b)
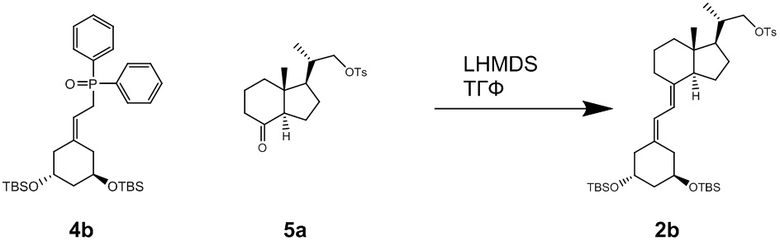
В атмосфере аргона добавляли LHMDS [1 M раствор в толуоле, 20 мл] в раствор (2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)циклогексилиден)этил)дифенилфосфин оксида (Соединение 4b, CAS 139356-39-1) [8.55 г, 15.0 ммоль] и (2S)-2-((1R,3aR,7aR)-7a- метил-4-оксооктадегидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (соединение (5a), CAS 342645-83-4) [5.06 г, 13.9 ммоль] в ТГФ [85 мл] при -78°C, и полученную смесь перемешивали при -78°C в течение 2 часов. Реакционную смесь нагревали до 0°C и перемешивали в течение 1 часа. Насыщенный водный раствор хлорида аммония добавляли в реакционную смесь при комнатной температуре, и смесь экстрагировали смесью растворителей гептан/этилацетат (1/1). Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Добавляли в остаток метанол, получая твердый осадок. Полученную суспензию перемешивали 2 часа. Твердый осадок отделяли и сушили, получая соединение (2b) [6.40 г, 8.92 ммоль] (выход = 64%).
1H-ЯМР (CDCl3) δ: 7.79 (2H, д, J = 8.2 Гц), 7.35 (2H, д, J = 8.2 Гц), 6.15 (1H, д, J = 11.0 Гц), 5.79 (1H, д, J = 11.4 Гц), 4.12-4.02 (2H, м), 3.98 (1H, дд, J = 9.1, 2.7 Гц), 3.81 (1H, дд, J = 9.1, 6.4 Гц), 2.80 (1H, дд, J = 12.1, 3.9 Гц), 2.46 (3H, с), 2.36 (2H, дд, J = 13.0, 4.8 Гц), 2.25 (1H, дд, J = 14.2, 2.7 Гц), 2.10 (1H, дд, J = 12.8, 8.2 Гц), 2.00-1.90 (2H, м), 1.80-1.60 (6H, м), 1.55-1.16 (6H, м), 0.99 (3H, д, J = 6.4 Гц), 0.87 (9H, с), 0.85 (9H, с), 0.50 (3H, с), 0.05 (3H, с), 0.05 (3H, с), 0.04 (6H, с).
Сравнительный пример 3
Синтез (S)-2-((1R,3aS,7aR,E)-4-(2-((3S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-4- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение 2c)
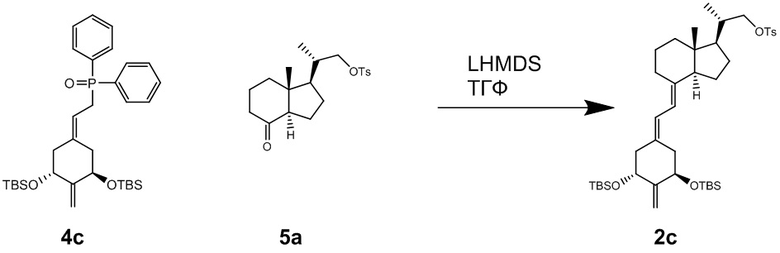
В атмосфере аргона добавляли LHMDS [1 M раствор в ТГФ, 8.5 мл] в раствор (2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)-4-метилциклогексилиден)этил)дифенил-фосфин оксида (Соединение (4c), CAS 213250-64-7, 2.50 г, 4.29 ммоль) и (2S)-2-((1R,3aR,7aR)-7a-метил-4-оксооктадегидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение (5a), CAS 342645-83-4, 2.35 г, 6.45 ммоль) в ТГФ [40 мл] при -78°C, и полученную смесь перемешивали при -78°C в течение 2 часов. Реакционную смесь нагревали до комнатной температуры и гасили добавлением насыщенного водного раствора хлорида аммония. Реакционную смесь экстрагировали этилацетатом, органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение (2c) (1.70 г, 2.30 ммоль) (выход = 54%).
1H-ЯМР (CDCl3) δ: 7.79 (2H, д, J = 8.8 Гц), 7.35 (2H, д, J = 7.8 Гц), 6.20 (1H, д, J = 11.2 Гц), 5.82 (1H, д, J = 11.2 Гц), 4.97 (1H, с), 4.92 (1H, с), 4.45-4.40 (2H, м), 3.99 (1H, дд, J = 9.3, 2.9 Гц), 3.81 (1H, дд, J = 9.0, 6.6 Гц), 2.81 (1H, дд, J = 12.2, 3.4 Гц), 2.54-2.42 (2H, м), 2.45 (3H, с), 2.32 (1H, дд, J = 13.2, 3.4 Гц), 2.17 (1H, дд, J = 12.7, 8.3 Гц), 2.02-1.90 (2H, м), 1.78-1.63 (4H, м), 1.55-1.15 (9H, м), 1.00 (3H, д, J = 6.3 Гц), 0.89 (9H, с), 0.85 (9H, с), 0.51 (3H, с), 0.07 (3H, с), 0.05 (3H, с), 0.04 (3H, с), 0.02 (3H, с).
Сравнительный пример 4
Синтез (S)-2-((1R,3aS,7aR,E)-4-((Z)-2-((3S,4S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-4- метил-2-метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил-4-метилбензолсульфоната (Соединение 2g)
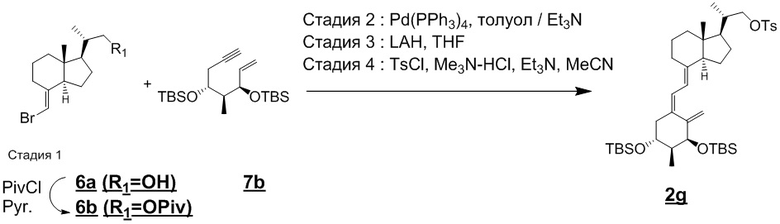
Стадия 1
Пивалоилхлорид [0.22 мл, 1.78 ммоль] добавляли в раствор (2S)-2- ((1R,3aS,7aR,E)-4-(бромметилен)-7a-метилоктагидро-1H-инден-1-ил)пропан-1-ола (соединение (6a), CAS 218437-70-8) [345 мг, 1.20 ммоль] в пиридине [7 мл] при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и переносили в насыщенный водный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 6b [415 мг, 1.12 ммоль] (выход = 93%).
1H-ЯМР (CDCl3) δ: 5.67 (1H, д, J = 1.5 Гц), 4.07 (1H, дд, J = 10.7, 3.0 Гц), 3.79 (1H, дд, J = 10.7, 7.3 Гц), 2.95-2.85 (1H, м), 2.02-1.59 (9H, м), 1.55-1.25 (7H, м), 1.21 (9H, с), 1.03 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Стадия 2
Соединение 6b [415 мг, 1.12 ммоль], полученное на стадии 1, (5R,6S,7R)- 2,2,3,3,6,9,9,10,10-нонаметил-5-(проп-2-ин-1-ил)-7-винил-4,8-диокса-3,9-дисилаундекан (Соединение (7b), CAS 203126-90-3) [513 мг, 1.34 ммоль], и тетракис(трифенилфосфин) палладий(0) [134.4 мг, 0.116 ммоль] добавляли в перемешиваемый раствор толуола [4 мл] и триэтиламина [4 мл], и смесь нагревали и перемешивали при 100°C в течение 3 часов в атмосфере азота. После охлаждения до комнатной температуры, добавляли в смесь насыщенный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая 0.82 г сырого продукта, содержащего продукт сочетания.
Стадия 3
Литийалюминийгидрид [LAH, 115 мг, 3.03 ммоль] добавляли при 0°C в раствор сырого продукта [0.82 г], полученного на стадии 2, в ТГФ [20 мл], и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили метанолом при 0°C, добавляли 5 М водный раствор гидроксида натрия [6 мл], и полученную смесь перемешивали при комнатной температуре 30 минут. Реакционную смесь экстрагировали этилацетатом, органический слой промывали последовательно насыщенным раствором хлорида натрия и насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая 0.47 г продукта со снятой защитой.
Стадия 4
пара-Толуолсульфонилхлорид [0.25 г, 1.3 ммоль] добавляли в раствор продукта со снятой защитой [0.47 г, 0.8 ммоль], полученного на стадии 3, триметиламина гидрохлорида [160 мг, 1.67 ммоль] и триэтиламина [0.3 мл, 2 ммоль] в ацетонитриле [10 мл] при комнатной температуре, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили метанолом и добавляли насыщенный раствор хлорида натрия. Реакционную смесь экстрагировали этилацетатом, органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 2g [0.43 г, 0.58 ммоль].
1H-ЯМР (CDCl3) δ: 7.79 (2H, д, J = 7.8 Гц), 7.34 (2H, д, J = 8.3 Гц), 6.22 (1H, д, J = 11.2 Гц), 6.01 (1H, д, J = 11.2 Гц), 5.12 (1H, д, J = 2.4 Гц), 4.86 (1H, д, J = 2.4 Гц), 4.20 (1H, д, J = 2.4 Гц), 3.98 (1H, дд, J = 9.0, 2.7 Гц), 3.83-3.78 (2H, м), 2.82 (1H, д, J = 12.2 Гц), 2.51-2.45 (5H, м), 2.16 (1H, дд, J = 13.2, 8.3 Гц), 1.97-1.63 (11H, м), 1.53-1.04 (10H, м), 0.99 (3H, д, J = 6.3 Гц), 0.95 (3H, д, J = 6.8 Гц), 0.88 (9H, с), 0.85 (9H, с), 0.49 (3H, с), 0.07 (3H, с), 0.05 (3H, с), 0.05 (3H, с), 0.02 (3H, с).
Пример 1
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(3-фторазетидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение A001)
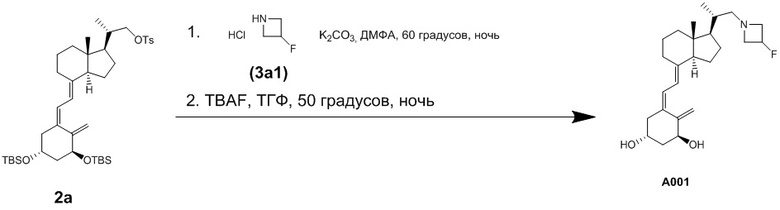
Стадия 1
Раствор соединения (2a) [90 мг, 0.123 ммоль], описанного в Сравнительном примере 1, 3-фторазетидин гидрохлорида (3a1) [50 мг, 0.448 ммоль] и K2CO3 [90 мг, 0.651 ммоль] в ДМФА [1 мл] нагревали и перемешивали при 60°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания частично очищали методом препаративной ТСХ, получая продукт сочетания [21.0 мг, 0.0332 ммоль].
Стадия 2
TBAF [1 M раствор в ТГФ, 0.3 мл, 0.3 ммоль] добавляли в раствор продукта сочетания [21.0 мг, 0.0332 ммоль], полученного на стадии 1, в ТГФ [1 мл], и смесь нагревали и перемешивали при 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом препаративной ВЭЖХ, получая соединение A001 [5.8 мг, 0.014 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.2, 1.2 Гц), 5.26-5.03 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.90-3.80 (2H, м), 3.54-3.40 (2H, м), 2.86 (1H, дд, J = 12.2, 3.9 Гц), 2.71 (1H, дд, J = 12.2, 2.9 Гц), 2.53-2.46 (2H, м), 2.25 (1H, дд, J = 13.4, 6.6 Гц), 2.05-1.97 (3H, м), 1.92-1.28 (14H, м), 1.00 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
LC-MS: Точная масса = 403.29 (C25H38FNO2), Набл. масса = 404.45 (M+H).
В описанных ниже примерах каждое соединение было синтезировано аналогично методу синтеза соединения A001, описанному в Примере 1. В каждом примере описано только использовавшееся исходное соединение и аминное соединение. В качестве основания применялся карбонат калия, как в Примере 1, и его эквивалентное количество меняли нужным образом в зависимости от применявшегося исходного вещества согласно условиям в Примере 1.
Пример 2
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-фторазетидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A002)
Соединение A002 [9.0 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-фторазетидин гидрохлорид [30 мг, 0.269 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.30-5.08 (1H, м), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 3.96-3.87 (2H, м), 3.61-3.48 (2H, м), 2.87-2.46 (5H, м), 2.31-2.25 (2H, м), 2.10-2.00 (2H, м), 1.70-1.28 (9H, м), 1.01 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 403.29 (C25H38FNO2), Набл. масса = 404.45 (M+H).
Пример 3
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(дифторметил)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение A003)
Соединение A003 [8.7 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(дифторметил)азетидин гидрохлорид [50 мг, 0.448 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 10.7 Гц), 6.22-5.93 (2H, м), 5.28 (1H, дд, J = 2.2, 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.85-3.60 (4H, м), 3.20-3.08 (1H, м), 2.86 (2H, дт, J = 12.2, 3.0 Гц), 2.60-2.48 (2H, м), 2.25 (1H, дд, J = 13.4, 6.6 Гц), 2.05-2.00 (3H, м), 1.93-1.27 (13H, м), 1.01 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 435.29 (C26H39F2NO2), Набл. масса = 436.45 (M+H)
Пример 4
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(3-(дифторметил)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A004)
Соединение A004 [7.8 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(дифторметил)азетидин гидрохлорид [30 мг, 0.269 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 6.08 (1H, тд, J = 56.5, 4.6 Гц), 5.91 (1H, д, J = 11.7 Гц), 5.05 (2H, д, J = 7.5 Гц), 4.42-4.36 (2H, м), 3.80 (2H, кв, J = 8.0 Гц), 3.66-3.61 (2H, м), 3.16-3.05 (1H, м), 2.86 (2H, дд, J = 12.2, 2.4 Гц), 2.66 (1H, дд, J = 13.2, 4.4 Гц), 2.57 (1H, дд, J = 12.2, 10.2 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.31-2.25 (2H, м), 2.10-2.00 (3H, м), 1.70-1.31 (10H, м), 1.01 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 435.29 (C26H39F2NO2), Набл. масса = 436.45 (M+H),
Пример 5
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(дифторметил)азетидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4-метиленциклогексан- 1,3-диола (Соединение A005)
Соединение A005 [4.5 мг, 0.010 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(дифторметил)азетидин гидрохлорид [30 мг, 0.269 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.23-5.90 (2H, м), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.78-3.68 (3H, м), 3.57 (2H, дд, J = 15.6, 6.8 Гц), 3.13-3.02 (1H, м), 2.88-2.78 (2H, м), 2.62-2.48 (2H, м), 2.17 (1H, дд, J = 13.2, 8.3 Гц), 2.02 (2H, дд, J = 12.4, 4.6 Гц), 1.91-1.26 (12H, м), 1.03 (3H, д, J = 6.8 Гц), 1.00 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 435.29 (C27H41F2NO2), Набл. масса = 436.45 (M+H).
Пример 6
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(1,1-дифторэтил)азетидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение A006)
Соединение A006 [6.8 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(1,1-дифторэтил)азетидин гидрохлорид [60 мг, 0.381 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.2, 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.08 (1H, м), 3.95-3.85 (2H, м), 3.68 (2H, кв, J = 8.5 Гц), 3.29-3.10 (2H, м), 2.88 (2H, тд, J = 12.0, 3.3 Гц), 2.61 (1H, дд, J = 12.2, 10.2 Гц), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.25 (1H, дд, J = 13.4, 6.6 Гц), 2.08-1.95 (4H, м), 1.93-1.26 (18H, м), 1.01 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.50 (M+H).
Пример 7
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(1,1-дифторэтил)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A007)
Соединение A007 [7.6 мг, 0.017 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(1,1-дифторэтил)азетидин гидрохлорид [30 мг, 0.19 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, дд, J = 7.0, 2.0 Гц), 4.43-4.34 (2H, м), 3.97-3.88 (2H, м), 3.75-3.65 (2H, м), 3.26-3.15 (1H, м), 2.93 (1H, дд, J = 12.4, 2.7 Гц), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.69-2.60 (2H, м), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.32-2.25 (2H, м), 2.11-2.00 (3H, м), 1.68-1.52 (9H, м), 1.42-1.30 (3H, м), 1.02 (3H, д, J = 6.8 Гц), 0.61 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.45 (M+H).
Пример 8
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(1,1-дифторэтил)азетидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение A008)
Соединение A008 [4.7 мг, 0.010 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(1,1-дифторэтил)азетидин гидрохлорид [60 мг, 0.38 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 10.7 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.92-3.83 (2H, м), 3.75-3.61 (3H, м), 3.27-3.12 (1H, м), 2.87 (2H, дд, J = 11.0, 3.7 Гц), 2.63-2.55 (2H, м), 2.20-2.00 (3H, м), 1.92-1.27 (15H, м), 1.03 (3H, д, J = 6.8 Гц), 1.01 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 463.32 (C28H43F2NO2), Набл. масса = 464.50 (M+H).
Пример 9
(1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-гидрокси-3-(трифторметил)азетидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение A009)
Соединение A009 [7.5 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(трифторметил)-3-азетидинол гидрохлорид [44 мг, 0.247 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.29 (1H, дд, J = 2.4, 1.5 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.16-4.10 (1H, м), 3.62 (2H, дд, J = 9.3, 2.9 Гц), 3.25 (2H, т, J = 8.8 Гц), 2.87 (1H, дд, J = 11.5, 4.1 Гц), 2.58 (1H, дд, J = 12.0, 3.2 Гц), 2.52 (1H, дд, J = 13.2, 3.4 Гц), 2.34-2.24 (2H, м), 2.06-2.04 (1H, м), 2.03-2.00 (3H, м), 1.93-1.20 (14H, м), 0.99 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 469.28 (C26H38F3NO3), Набл. масса = 470.60 (M+H).
Пример 10
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-гидрокси-3-(трифторметил)азетидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A010)
Соединение A010 [8.4 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(трифторметил)-3-азетидинол гидрохлорид [37 мг, 0.208 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.07-3.95 (2H, м), 3.62 (2H, дд, J = 9.3, 2.9 Гц), 3.25 (2H, т, J = 9.0 Гц), 2.84 (1H, дд, J = 12.7, 3.9 Гц), 2.62-2.57 (2H, м), 2.41 (1H, дд, J = 13.2, 3.4 Гц), 2.32 (1H, дд, J = 11.7, 9.8 Гц), 2.25-2.11 (2H, м), 2.05-2.00 (2H, м), 1.95-1.26 (13H, м), 1.00 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 457.28 (C25H38F3NO3), Набл. масса = 458.65 (M+H).
Пример 11
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-гидрокси-3-(трифторметил)азетидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A011)
Соединение A011 [11.0 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(трифторметил)-3-азетидинол гидрохлорид [40.2 мг, 0.226 ммоль].
Точная масса = 469.28 (C26H38F3NO3), Набл. масса = 470.35 (M+H).
Пример 12
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-метокси-3-трифторметилазетидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A012)
Соединение A012 [3.0 мг, 0.006 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-метокси-3-(трифторметил)-азетидин гидрохлорид [30 мг, 0.157 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.05-3.96 (2H, м), 3.45 (3H, с), 3.45 (3H, дд, J = 8.0, 3.0 Гц), 3.35 (4H, т, J = 12.1 Гц), 2.83 (1H, дд, J = 11.7, 3.9 Гц), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.52 (1H, дд, J = 11.9, 3.2 Гц), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.30-2.13 (3H, м), 2.04-1.28 (17H, м), 0.99 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.35 (M+H).
Пример 13
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(3-трифторметокси)азетидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A013)
Соединение A013 [1.5 мг, 0.003 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(трифторметокси)-азетидин гидрохлорид [50 мг, 0.169 ммоль].
Точная масса = 457.28 (C25H38F3NO3), Набл. масса = 458.25 (M+H).
Пример 14
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(3-(2,2,2-трифторэтокси)азетидин- 1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A014)
Соединение A014 [7.4 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(2,2,2-трифторэтокси)-азетидин гидрохлорид [30 мг, 0.193 ммоль].
1H-ЯМР (CD3OD) δ: 6.19 (1H, д, J = 11.0 Гц), 5.87 (1H, д, J = 11.0 Гц), 4.26-4.20 (1H, м), 4.05-3.93 (2H, м), 3.88 (2H, кв, J = 9.0 Гц), 3.61 (2H, кв, J = 7.6 Гц), 2.99 (1H, т, J = 6.9 Гц), 2.93 (1H, т, J = 6.9 Гц), 2.81 (1H, дд, J = 11.9, 4.1 Гц), 2.57 (1H, дд, J = 13.3, 3.7 Гц), 2.47 (1H, дд, J = 11.7, 3.0 Гц), 2.39 (1H, дд, J = 13.3, 3.2 Гц), 2.27 (1H, дд, J = 11.9, 9.6 Гц), 2.21-2.11 (2H, м), 2.02-1.25 (15H, м), 0.97 (3H, д, J = 6.4 Гц), 0.56 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Пример 15
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(2,2-дифторэтокси)азетидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A015)
Соединение A015 [12.8 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(2,2-дифторэтокси)-азетидин гидрохлорид [35 мг, 0.202 ммоль].
1H-ЯМР (CD3OD) δ: 6.16 (1H, д, J = 10.7 Гц), 5.85 (1H, тт, J = 3.5, 55.0 Гц), 5.84 (1H, д, J = 10.7 Гц), 4.17-4.11 (1H, м), 4.02-3.90 (2H, м), 3.63-3.52 (4H, м), 2.92 (2H, дт, J = 22.9, 6.8 Гц), 2.78 (1H, дд, J = 12.0, 3.7 Гц), 2.54 (1H, дд, J = 13.2, 3.4 Гц), 2.44 (1H, дд, J = 12.2, 2.9 Гц), 2.36 (1H, дд, J = 13.2, 3.4 Гц), 2.26-2.09 (3H, м), 1.99-1.24 (15H, м), 0.94 (3H, д, J = 6.3 Гц), 0.53 (3H, с).
Точная масса = 453.31 (C26H41F2NO3), Набл. масса = 454.25 (M+H).
Пример 16
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(2,2-дифторэтокси)азетидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A016)
Соединение A016 [20.6 мг, 0.044 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [100 мг, 0.137 ммоль] и 3-(2,2-дифторэтокси)-азетидин гидрохлорид [70 мг, 0.403 ммоль].
1H-ЯМР (CD3OD) δ: 6.24 (1H, д, J = 11.0 Гц), 6.03-5.74 (2H, м), 5.03 (2H, д, J = 6.9 Гц), 4.43-4.30 (2H, м), 4.20-4.14 (1H, м), 3.68-3.55 (4H, м), 2.97 (1H, т, J = 6.9 Гц), 2.92 (1H, т, J = 6.9 Гц), 2.83 (1H, дд, J = 11.9, 3.7 Гц), 2.65 (1H, дд, J = 13.3, 4.6 Гц), 2.49-2.42 (2H, м), 2.30-2.20 (3H, м), 2.03-1.87 (3H, м), 1.68-1.44 (6H, м), 1.40-1.25 (3H, м), 0.97 (3H, д, J = 6.4 Гц), 0.57 (3H, с).
Точная масса = 453.31 (C27H41F2NO3), Набл. масса = 454.25 (M+H).
Пример 17
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(2,2-дифторэтокси)азетидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение A017)
Соединение A017 [24.6 мг, 0.053 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [100 мг, 0.137 ммоль] и 3-(2,2-дифторэтокси)-азетидин гидрохлорид [70 мг, 0.403 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 6.04 (1H, д, J = 11.2 Гц), 5.85 (1H, тт, J = 55.4, 3.8 Гц), 5.24 (1H, д, J = 1.0 Гц), 4.85 (1H, с), 4.30 (1H, т, J = 5.9 Гц), 4.18-4.03 (2H, м), 3.63-3.50 (4H, м), 2.97-2.80 (3H, м), 2.49-2.41 (2H, м), 2.25-2.18 (2H, м), 1.96-1.20 (17H, м), 0.94 (3H, д, J = 6.3 Гц), 0.53 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.30 (M+H).
Пример 18
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-дифторметокси)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A018)
Соединение A018 [15 мг, 0.033 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(дифторметокси)-азетидин гидрохлорид [33 мг, 0.207 ммоль].
1H-ЯМР (CD3OD) δ: 6.43 (1H, т, J = 75.0 Гц), 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.8 Гц), 4.89-4.82 (1H, м), 4.40 (2H, ддд, J = 13.7, 7.1, 4.6 Гц), 3.98 (2H, кв, J = 7.5 Гц), 3.50 (2H, ддд, J = 18.8, 9.5, 6.1 Гц), 2.88-2.84 (1H, м), 2.80 (1H, дд, J = 12.2, 2.9 Гц), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.57 (1H, дд, J = 12.0, 10.0 Гц), 2.49 (1H, дд, J = 13.4, 3.7 Гц), 2.32-2.26 (2H, м), 2.09-2.00 (2H, м), 1.95-1.90 (1H, м), 1.71-1.49 (6H, м), 1.42-1.30 (3H, м), 1.02 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 451.30 (C26H39F2NO3), Набл. масса = 452.40 (M+H).
Пример 19
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(2,2-дифторэтил)азетидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A019)
Соединение A019 [10.1 мг, 0.0225 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(2,2-дифторэтил)-азетидин гидрохлорид [35 мг, 0.222 ммоль].
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.25 (M+H).
Пример 20
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-дифторметокси)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A020)
Соединение A020 [10.0 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(дифторметокси)-азетидин гидрохлорид [30 мг, 0.244 ммоль].
1H-ЯМР (CD3OD) δ: 6.36 (1H, т, J = 75.0 Гц), 6.21 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.74-4.68 (1H, м), 4.08-3.95 (2H, м), 3.65 (2H, кв, J = 6.8 Гц), 3.09 (1H, т, J = 6.8 Гц), 3.03 (1H, т, J = 6.8 Гц), 2.83 (1H, дд, J = 12.4, 3.7 Гц), 2.59 (1H, дд, J = 13.7, 3.9 Гц), 2.49 (1H, дд, J = 11.7, 2.9 Гц), 2.41 (1H, т, J = 6.6 Гц), 2.29 (1H, дд, J = 11.7, 9.3 Гц), 2.23-1.27 (18H, м), 0.99 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 439.29 (C25H39F2NO3), Набл. масса = 440.20 (M+H).
Пример 21
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3-(2,2-дифторэтил)азетидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A021)
Соединение A021 [12.2 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(2,2-дифторэтил)-азетидин гидрохлорид [35 мг, 0.222 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 6.00-5.69 (2H, м), 4.06-3.95 (2H, м), 3.52 (2H, дд, J = 17.2, 7.5 Гц), 2.93-2.78 (3H, м), 2.73-2.65 (1H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.48 (1H, дд, J = 11.9, 2.7 Гц), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.25-1.97 (7H, м), 1.95-1.72 (3H, м), 1.68-1.44 (6H, м), 1.38-1.23 (3H, м), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.35 (M+H).
Пример 22
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B001)
Соединение B001 [17.5 мг, 0.042 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(S)-метилпирролидин гидрохлорид [40 мг, 0.331 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.89 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, дд, J = 6.3, 5.4 Гц), 4.15-4.10 (1H, м), 3.55 (1H, дд, J = 11.0, 7.6 Гц), 3.42-3.35 (2H, м), 3.09 (1H, дд, J = 12.7, 2.9 Гц), 2.99 (1H, т, J = 12.0 Гц), 2.87 (1H, дд, J = 12.0, 3.7 Гц), 2.78 (1H, т, J = 10.0 Гц), 2.53-2.44 (2H, м), 2.30-2.16 (2H, м), 2.07-1.96 (4H, м), 1.90-1.30 (15H, м), 1.14 (3H, д, J = 6.6 Гц), 1.13 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 413.31 (C27H43NO2), Набл. масса = 414.45 (M+H).
Пример 23
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B002)
Соединение B002 [13.7 мг, 0.033 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-метилпирролидин гидрохлорид [20 мг, 0.235 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.44-4.35 (2H, м), 3.55 (1H, дд, J = 10.7, 7.8 Гц), 3.43-3.35 (2H, м), 3.10 (1H, дд, J = 12.7, 2.9 Гц), 2.99 (1H, т, J = 12.0 Гц), 2.89-2.75 (2H, м), 2.66 (1H, дд, J = 13.2, 4.4 Гц), 2.52-2.41 (2H, м), 2.32-2.17 (3H, м), 2.10-1.95 (3H, м), 1.89-1.34 (11H, м), 1.14 (3H, д, J = 6.6 Гц), 1.13 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 413.33 (C27H43NO2), Набл. масса = 414.45 (M+H).
Пример 24
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B003)
Соединение B003 [5.7 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-метилпирролидин гидрохлорид [30 мг, 0.247 ммоль].
Точная масса = 413.33 (C27H43NO2), Набл. масса = 414.25 (M+H).
Пример 25
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B004)
Соединение B004 [15.3 мг, 0.038 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [55.3 мг, 0.077 ммоль] и 3-(R)-метилпирролидин гидрохлорид [28.3 мг, 0.233 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 10.7 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.0, 3.7 Гц), 2.74-2.50 (5H, м), 2.46-2.12 (7H, м), 2.07-1.47 (17H, м), 1.35 (2H, ддд, J = 23.4, 10.7, 2.9 Гц), 1.26 (1H, дд, J = 18.5, 9.3 Гц), 1.05 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 401.33 (C26H43NO2), Набл. масса = 402.25 (M+H).
Пример 26
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-этилпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B005)
Соединение B005 [7.0 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-этилпирролидин гидрохлорид [30 мг, 0.221 ммоль].
Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.25 (M+H).
Пример 27
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-этилпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B006)
Соединение B006 [5.0 мг, 0.011 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-этилпирролидин гидрохлорид [30 мг, 0.221 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.4 Гц), 5.91 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 6.9 Гц), 4.41 (1H, дд, J = 6.4, 4.6 Гц), 4.37 (1H, дд, J = 7.8, 4.6 Гц), 2.85 (1H, дд, J = 11.9, 4.1 Гц), 2.74 (2H, кв, J = 7.6 Гц), 2.67 (1H, дд, J = 13.7, 4.6 Гц), 2.48 (1H, дд, J = 13.5, 3.9 Гц), 2.38-2.22 (5H, м), 2.12-1.92 (6H, м), 1.70-1.22 (12H, м), 1.05 (3H, д, J = 6.9 Гц), 0.90 (3H, т, J = 7.5 Гц), 0.60 (3H, с).
Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.25 (M+H).
Пример 28
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-этилпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B007)
Соединение B007 [9.4 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(S)-этилпирролидин гидрохлорид [37 мг, 0.273 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.08-3.95 (2H, м), 2.85-2.71 (3H, м), 2.59 (1H, д, J = 11.0 Гц), 2.42-2.28 (4H, м), 2.23-1.51 (16H, м), 1.45-1.23 (6H, м), 1.05 (3H, д, J = 5.9 Гц), 0.90 (3H, т, J = 7.5 Гц), 0.60 (3H, с).
Пример 29
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-этилпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B008)
Соединение B008 [8.6 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(R)-этилпирролидин гидрохлорид [39 мг, 0.288 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.07-3.95 (2H, м), 2.93 (1H, т, J = 8.0 Гц), 2.83 (1H, дд, J = 11.9, 3.7 Гц), 2.68 (1H, т, J = 7.5 Гц), 2.59 (1H, дд, J = 13.5, 3.7 Гц), 2.48-2.13 (6H, м), 2.10-1.20 (20H, м), 1.05 (3H, д, J = 6.9 Гц), 0.90 (3H, т, J = 7.3 Гц), 0.60 (3H, с).
Пример 30
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B012)
Соединение B012 [8.9 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(S)-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль].
1H-ЯМР (CD3OD) δ: 6.20 (1H, д, J = 11.0 Гц), 5.87 (1H, д, J = 11.4 Гц), 5.19-5.02 (1H, м), 4.05-3.93 (2H, м), 2.84-2.65 (4H, м), 2.59-2.54 (1H, м), 2.39 (1H, дд, J = 13.3, 3.2 Гц), 1.04 (3H, д, J = 6.4 Гц), 0.93 (1H, т, J = 7.3 Гц), 0.58 (3H, с).
Точная масса = 405.30 (C25H40FNO2), Набл. масса = 406.30 (M+H).
Пример 31
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B013)
Соединение B013 [8.4 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(R)-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль].
1H-ЯМР (CD3OD) δ: 6.20 (1H, д, J = 11.0 Гц), 5.87 (1H, д, J = 11.0 Гц), 5.20-5.03 (1H, м), 4.04-3.93 (2H, м), 2.92-1.47 (25H, м), 1.38-1.23 (4H, м), 1.04 (3H, д, J = 6.9 Гц), 0.58 (3H, с).
Точная масса = 405.30 (C25H40FNO2), Набл. масса = 406.30 (M+H).
Пример 32
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B020)
Соединение B020 [22.8 мг, 0.051 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(S)-(дифторметил)пирролидин гидрохлорид [60 мг, 0.381 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.89 (1H, тд, J = 56.7, 4.7 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.21 (1H, дд, J = 10.5, 8.5 Гц), 3.00-2.00 (14H, м), 1.90-1.27 (13H, м), 1.09 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.30 (M+H).
Пример 33
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B021)
Соединение B021 [3.8 мг, 0.008 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(S)-(дифторметил)пирролидин гидрохлорид [35 мг, 0.222 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.81 (1H, тд, J = 57.0, 5.7 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.88 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 2.98-2.83 (2H, м), 2.76-2.52 (5H, м), 2.44 (2H, д, J = 7.3 Гц), 2.17 (1H, дд, J = 13.2, 8.3 Гц), 2.07-1.93 (3H, м), 1.84-1.24 (11H, м), 1.06 (3H, д, J = 6.3 Гц), 1.03 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 463.32 (C28H43F2NO2), Набл. масса = 464.35 (M+H).
Пример 34
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B022)
Соединение B022 [10.5 мг, 0.024 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [55 мг, 0.077 ммоль] и 3-(S)-(дифторметил)пирролидин гидрохлорид [25 мг, 0.208 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 10.7 Гц), 5.78 (1H, тд, J = 57.0, 6.0 Гц), 4.06-3.95 (2H, м), 2.82 (2H, дд, J = 18.8, 10.0 Гц), 2.66-2.50 (4H, м), 2.44-1.92 (11H, м), 1.86-1.23 (13H, м), 1.05 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.35 (M+H).
Пример 35
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B023)
Соединение B023 [9.0 мг, 0.020 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-(дифторметил)пирролидин гидрохлорид [33 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 6.05-5.76 (2H, м), 5.05 (2H, д, J = 6.3 Гц), 4.42-4.36 (2H, м), 3.25 (1H, т, J = 9.5 Гц), 3.03 (2H, т, J = 7.1 Гц), 2.91-2.72 (5H, м), 2.66 (1H, дд, J = 13.7, 4.4 Гц), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.32-1.96 (7H, м), 1.93-1.29 (10H, м), 1.10 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.30 (M+H).
Пример 36
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B024)
Соединение B024 [7.2 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(R)-(дифторметил)пирролидин гидрохлорид [45 мг, 0.372 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.75 (1H, тд, J = 57.0, 5.0 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.89 (1H, дд, J = 2.4, 1.0 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.61-1.19 (27H, м), 1.04 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.45 (M+H).
Пример 37
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B0025)
Соединение B025 [7.0 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(R)-(дифторметил)пирролидин гидрохлорид [25 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 10.7 Гц), 5.75 (1H, тд, J = 57.3, 5.2 Гц), 5.22 (1H, д, J = 1.5 Гц), 4.89 (1H, с), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.4 Гц), 2.86 (1H, дд, J = 11.0, 4.0 Гц), 2.63-1.24 (29H, м), 1.04 (3H, д, J = 7.3 Гц), 1.04 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 463.32 (C28H43F2NO2), Набл. масса = 464.35 (M+H).
Пример 38
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B026)
Соединение B026 [7.2 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [55 мг, 0.077 ммоль] и 3-(R)-(дифторметил)пирролидин гидрохлорид [27 мг, 0.226 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 10.7 Гц), 5.76 (1H, тд, J = 57.0, 5.0 Гц), 4.06-3.96 (2H, м), 2.84 (1H, дд, J = 12.0, 3.8 Гц), 2.65-2.52 (5H, м), 2.47-1.49 (21H, м), 1.40-1.22 (4H, м), 1.05 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.3 (M+H).
Пример 39
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B027)
Соединение B027 [11.0 мг, 0.025 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-(дифторметил)пирролидин гидрохлорид [25 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 57.0, 5.0 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.43-4.34 (2H, м), 2.85 (1H, дд, J = 12.2, 3.9 Гц), 2.71-2.25 (11H, м), 2.07-1.92 (4H, м), 1.83-1.24 (10H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.45 (M+H).
Сравнительный пример 5
Синтез 3-(S)-(1,1-дифторэтил)пирролидин гидрохлорида (Соединение 3b6)
Стадия 1
При охлаждении до -78°C добавляли раствор диметилсульфоксида [4.1 мл, 58 ммоль] в дихлорметане [10 мл] в раствор оксалилхлорида [2.45 мл, 28.6 ммоль] в дихлорметане [25 мл], и полученную смесь перемешивали при той же температуре в течение 10 минут. Добавляли в смесь раствор т-бутил (S)-3-(гидроксиметил)пирролидин- 1-карбоксилата [3.84 г, 19.1 ммоль] в дихлорметане [15 мл]. Смесь перемешивали при -78°C в течение 45 минут. Триэтиламин [15 мл, 92 ммоль] добавляли в смесь и дополнительно перемешивали при той же температуре 30 минут. Реакционную смесь нагревали до 0°C и перемешивали при той же температуре 30 минут. Реакцию гасили водой и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил (S)-3-формилпирролидин-1-карбоксилат (Соединение 3b2) [3.78 г, 19.0 ммоль] (выход = 99%).
1H-ЯМР (CDCl3) δ: 9.69 (1H, J = 1.5 Гц), 3.72-3.65 (1H, м), 3.53-3.35 (3H, м), 3.03 (1H, с), 2.25-2.05 (2H, м), 1.46 (9H, с).
Стадия 2
Метилмагний бромид [1 M раствор в ТГФ, 15.1 мл, 15.1 ммоль] добавляли в раствор т-бутил (S)-3-формилпирролидин-1-карбоксилата (Соединение 3b2) [2.00 г, 10 ммоль] в ТГФ [40 мл] при -78°C в атмосфере азота, и реакционную смесь перемешивали при той же температуре в течение 1 часа. Смесь нагревали до 0°C и дополнительно перемешивали в течение 1 часа. Реакционную смесь гасили насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил (S)-3-(1-гидроксиэтил)пирролидин-1-карбоксилат (Соединение 3b3) [1.60 г, 7.41 ммоль] (выход = 74%).
1H-ЯМР(CDCl3) δ: 3.70-2.90 (5H, м), 2.15-2.03 (1H, м), 1.46 (9H, с), 1.30-1.21 (4H, м).
Стадия 3
При охлаждении до -78°C добавляли раствор диметилсульфоксида [1.6 мл, 23 ммоль] в дихлорметане [10 мл] в раствор оксалилхлорида [1 мл, 11.7 ммоль] в дихлорметане [10 мл], и полученную смесь перемешивали при той же температуре в течение 10 минут. Добавляли раствор т-бутил (S)-3-(1-гидроксиэтил)пирролидин-1- карбоксилата (Соединение 3b3) [1.60 г, 7.41 ммоль] в дихлорметане [10 мл]. Смесь перемешивали при -78°C в течение 45 минут. Триэтиламин [4.2 мл, 30 ммоль] добавляли в смесь и дополнительно перемешивали при той же температуре 30 минут. Реакционную смесь нагревали до 0°C и перемешивали при той же температуре 30 минут. Реакционную смесь гасили водой и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил (S)-3-ацетилпирролидин-1-карбоксилат (Соединение 3b4) [1.45 г, 6.80 ммоль] (выход = 91%).
1H-ЯМР(CDCl3) δ: 3.65-3.10 (5H, м), 3.14 (1H, с), 2.08 (3H, с), 2.05-1.95 (2H, м), 1.46 (9H, с).
Стадия 4
Раствор т-бутил (S)-3-ацетилпирролидин-1-карбоксилата (Соединение 3b4) [1.10 г, 5.16 ммоль] в дихлорметане [20 мл] охлаждали до 0°C. Добавляли DAST [0.93 мл, 2.5 ммоль]. Реакционную смесь перемешивали в течение ночи и нагревали до комнатной температуры. Реакционную смесь охлаждали в ледяной бане и осторожно гасили водой. Смесь экстрагировали дихлорметаном при комнатной температуре, и органический слой промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, и остаток очищали методом колоночной хроматографии на силикагеле, получая т-бутил (S)-3-(1,1-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b5) [0.58 г, 2.5 ммоль] (выход = 48%).
Стадия 5
Раствор описанного выше т-бутил (S)-3-(1,1-дифторэтил)пирролидин-1- карбоксилата (Соединение 3b5) [0.58 г, 2.5 ммоль] в 4М растворе хлороводорода в диоксане [10 мл] перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении, получая 3-(S)-(1,1-дифторэтил)пирролидин гидрохлорид (Соединение 3b6) [354 мг, 2.06 ммоль].
1H-ЯМР (ДМСО-d6) δ: 9.40 (2H, с), 3.40-3.0 (4H, м), 2.92-2.38 (1H, м), 2.05-2.00 (1H, м), 1.90-1.80 (1H, м), 1.65 (3H, т, J = 20 Гц).
Сравнительный пример 6
Синтез 3-(R)-(1,1-дифторэтил)пирролидин гидрохлорида (3b12)
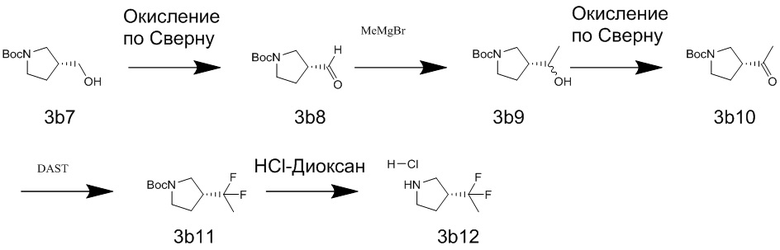
Стадия 1
т-бутил (R)-3-формилпирролидин-1-карбоксилат (Соединение 3b8) [2.42 г, 12.1 ммоль] получали путем проведения реакции аналогично стадии 1 в Сравнительном примере 5, используя т-бутил (R)-3-(гидроксиметил)пирролидин-1-карбоксилат (3b7) [3.16 г, 15.7 ммоль] в качестве исходного вещества.
Стадия 2
т-бутил (R)-3-(1-гидроксиэтил)пирролидин-1-карбоксилат (Соединение 3b9) [1.64 г, 7.62 ммоль] получали путем проведения реакции аналогично стадии 2 в Сравнительном примере 5, используя т-бутил (R)-3-формилпирролидин-1-карбоксилат (Соединение 3b8) [2.42 г, 12.1 ммоль] в качестве исходного вещества.
Стадия 3
т-бутил (R)-3-ацетилпирролидин-1-карбоксилат (Соединение 3b10) [1.50 г, 7.03 ммоль] получали путем проведения реакции аналогично стадии 3 в Сравнительном примере 5, используя т-бутил (R)-3-(1-гидроксиэтил)пирролидин-1-карбоксилат (Соединение 3b9) [1.64 г, 7.62 ммоль] в качестве исходного вещества. (выход = 92%)
Стадия 4
DAST [1.8 мл, 13.6 ммоль] добавляли в раствор т-бутил (R)-3-ацетилпирролидин-1-карбоксилата (Соединение 3b10) [1.50 г, 7.03 ммоль] в дихлорметане [30 мл] при 0°C, и полученную смесь перемешивали при комнатной температуре в течение ночи. На следующее утро дополнительно добавляли DAST [1.8 мл, 13.6 ммоль], и смесь дополнительно перемешивали при комнатной температуре 1 день. Реакционную смесь охлаждали до 0°C, гасили насыщенным водным раствором карбоната натрия и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил (R)-3-(1,1-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b11) [0.87 г, 3.7 ммоль] (выход = 53%).
Стадия 5
3-(R)-(1,1-дифторэтил)пирролидин гидрохлорид (3b12) [0.63 г, 3.7 ммоль] получали путем проведения реакции аналогично стадии 5 в Сравнительном примере 5, используя т-бутил (R)-3-(1,1-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b11) [0.87 г, 3.7 ммоль] в качестве исходного вещества. (выход = 100%)
1H-ЯМР (ДМСО-D6) δ: 9.60 (1H, ушир.с), 9.40 (1H, ушир.с), 3.37-3.30 (1H, ушир.м), 3.25-3.00 (3H, ушир.м), 2.96-2.81 (1H, м), 2.12-2.03 (1H, м), 1.91-1.77 (1H, м), 1.66 (3H, т, J = 19.3 Гц).
Пример 40
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B028)
Соединение B028 [12.7 мг, 0.027 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(S)-(1,1-дифторэтил)пирролидин гидрохлорид (3b6) [45 мг, 0.262 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.0 Гц), 4.33 (1H, д, J = 5.4 Гц), 4.14-4.09 (1H, м), 3.43 (1H, дд, J = 10.7, 8.3 Гц), 3.25-2.78 (8H, м), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.28-1.97 (7H, м), 1.92-1.28 (17H, м), 1.11 (3H, д, J = 6.3 Гц), 0.63 (3H, д, J = 7.3 Гц).
Пример 41
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B029)
Соединение B029 [5.8 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(S)-(1,1- дифторэтил)пирролидин гидрохлорид (3b6) [35 мг, 0.204 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 1.5 Гц), 4.89 (1H, д, J = 1.5 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 3.01 (1H, т, J = 9.0 Гц), 2.87 (1H, дд, J = 12.0, 3.7 Гц), 2.82-2.38 (8H, м), 2.17 (1H, дд, J = 13.2, 8.3 Гц), 2.06-1.94 (4H, м), 1.88-1.43 (13H, м), 1.39-1.24 (3H, м), 1.06 (3H, д, J = 6.8 Гц), 1.04 (3H, д, J = 7.3 Гц), 0.59 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.45 (M+H).
Пример 42
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B030)
Соединение B030 [13.5 мг, 0.030 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [55 мг, 0.077 ммоль] и 3-(S)-(1,1-дифторэтил)пирролидин гидрохлорид (3b6) [29.2 мг, 0.216 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 2.93 (1H, т, J = 9.0 Гц), 2.83 (1H, дд, J = 12.0, 3.2 Гц), 2.73-2.50 (4H, м), 2.42-2.31 (4H, м), 2.23-1.47 (20H, м), 1.41-1.22 (3H, м), 1.06 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.45 (M+H).
Пример 43
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2метиленциклогексан-1,3-диола (Соединение B031)
Соединение B031 [12.9 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-(1,1-дифторэтил)пирролидин гидрохлорид (3b6) [35 мг, 0.204 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.43-4.34 (2H, м), 3.42 (1H, дд, J = 10.7, 8.3 Гц), 3.24-2.78 (7H, м), 2.66 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.32-1.97 (7H, м), 1.83-1.30 (13H, м), 1.12 (3H, д, J = 6.8 Гц), 0.64 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.3 (M+H).
Пример 44
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B032)
Соединение B032 [12.7 мг, 0.027 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(R)-(1,1-дифторэтил)пирролидин гидрохлорид (3b12) [50 мг, 0.291 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.2, 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.12-3.00 (2H, м), 2.94-2.75 (5H, м), 2.66 (2H, д, J = 7.3 Гц), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.26 (1H, дд, J = 13.7, 6.8 Гц), 2.13-1.94 (5H, м), 1.90-1.23 (16H, м), 1.09 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.45 (M+H).
Пример 45
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B033)
Соединение B033 [6.8 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и 3-(R)-(1,1-дифторэтил)пирролидин гидрохлорид (3b12) [25 мг, 0.146 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 2.89-1.94 (16H, м), 1.88-1.22 (16H, м), 1.05 (6H, д, J = 6.8 Гц), 1.03 (6H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.5 (M+H).
Пример 46
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B034)
Соединение B034 [11.8 мг, 0.026 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [55 мг, 0.077 ммоль] и 3-(R)-(1,1-дифторэтил)пирролидин гидрохлорид (3b12) [28.2 мг, 0.164 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 10.7 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.0, 3.7 Гц), 2.74-2.50 (5H, м), 2.46-2.12 (7H, м), 2.07-1.47 (17H, м), 1.35 (2H, ддд, J = 23.4, 10.7, 2.9 Гц), 1.26 (1H, дд, J = 18.5, 9.3 Гц), 1.05 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.3 (M+H).
Пример 47
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B035)
Соединение B035 [12.9 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-(1,1-дифторэтил)пирролидин гидрохлорид (3b12) [26 мг, 0.152 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.43-4.34 (2H, м), 3.17-3.05 (2H, м), 2.99-2.64 (8H, м), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.31-2.25 (2H, м), 2.16-1.96 (5H, м), 1.78-1.28 (13H, м), 1.10 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.5 (M+H).
Сравнительный пример 7
Синтез 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорида (3b16)
Стадия 1
При охлаждении до -78°C добавляли раствор диметилсульфоксида [1.0 мл, 14 ммоль] в дихлорметане [10 мл] в раствор оксалилхлорида [0.66 мл, 7.7 ммоль] в дихлорметане [10 мл], и полученную смесь перемешивали при той же температуре в течение 10 минут. Добавляли раствор т-бутил-3-(R)-(2-гидроксиэтил)пирролидин-1- карбоксилата (Соединение 3b13) [1.0 г, 4.64 ммоль] в дихлорметане [10 мл]. Смесь перемешивали при -78°C в течение 1 часа. Триэтиламин [3.3 мл, 23 ммоль] добавляли в смесь и дополнительно перемешивали при той же температуре 40 минут. Реакционную смесь нагревали до 0°C и перемешивали при той же температуре 30 минут. Реакционную смесь гасили водой и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(2-оксоэтил)пирролидин-1-карбоксилат (Соединение 3b14) [0.85 г, 4.0 ммоль] (выход = 86%).
Стадия 2
DAST [0.7 мл, 5 ммоль] добавляли в раствор т-бутил-3-(R)-(2-оксоэтил) пирролидин-1-карбоксилата (Соединение 3b14) [0.85 г, 4.0 ммоль] в дихлорметане [20 мл] при 0°C, и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь охлаждали до 0°C, гасили водой и экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(2,2-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b15) [799 мг, 3.4 ммоль] (выход = 85%).
Стадия 3
Раствор т-бутил-3-(R)-(2,2-дифторэтил)пирролидин-1-карбоксилата (Соединение 3b15) [799 мг, 3.4 ммоль] в 4 М растворе хлороводорода в диоксане [6 мл] перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении и сушили, получая 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорид (Соединение 3b16) [562.7 ммоль] (выход = 96%).
1H-ЯМР (ДМСО-d6) δ: 9.88 (2H, ушир.с), 5.90 (1H, тт, J = 55.9, 3.8 Гц), 3.53 (2H, д, J = 40.5 Гц), 3.29 (1H, ушир.с), 2.95 (1H, ушир.с), 2.62-2.54 (1H, м), 2.33-2.20 (1H, м), 2.11-1.99 (2H, м), 1.80-1.65 (1H, м).
Сравнительный пример 8
Синтез 3-(S)-(2,2-дифторэтил)пирролидин гидрохлорида (3b20)
Стадия 1
т-бутил-3-(S)-(2-оксоэтил)пирролидин-1-карбоксилат (Соединение 3b18) [0.72 г, 3.4 ммоль] получали путем проведения реакции аналогично стадии 1 в Сравнительном примере 7, используя т-бутил-3-(S)-(2-гидроксиэтил)пирролидин-1-карбоксилат (Соединение 3b17) [1.0 г, 4.64 ммоль] в качестве исходного вещества. (выход = 73%)
Стадия 2
т-бутил-3-(S)-(2,2-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b19) [679 мг, 2.89 ммоль] получали путем проведения реакции аналогично стадии 2 в Сравнительном примере 7, используя т-бутил-3-(S)-(2-оксоэтил)пирролидин-1- карбоксилат (Соединение 3b18) [0.72 г, 3.4 ммоль] в качестве исходного вещества. (выход = 62%)
Стадия 3
3-(S)-(2,2-Дифторэтил)пирролидин гидрохлорид (Соединение 3b20) [524.9 мг, 3.06 ммоль] получали путем проведения реакции аналогично стадии 3 в Сравнительном примере 7, используя т-бутил-3-(S)-(2,2-дифторэтил)пирролидин-1-карбоксилат (Соединение 3b19) [679 мг, 2.89 ммоль] в качестве исходного вещества. (выход = колич.)
1H-ЯМР (ДМСО-d6) δ: 9.86 (2H, ушир.с), 5.91 (1H, тт, J = 55.9, 3.7 Гц), 3.53 (2H, д, J = 38.5 Гц), 3.29 (1H, ушир.с), 2.95 (1H, ушир.с), 2.65-2.50 (1H, м), 2.35-2.20 (1H, м), 2.15-2.00 (2H, м), 1.80-1.65 (1H, м).
Пример 48
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метилциклогексан- 1,3-диола (Соединение B036)
Соединение B036 [17.2 мг, 0.037 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорид (3b16) [50 мг, 0.292 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.12-5.81 (2H, м), 5.28 (1H, д, J = 1.0 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.45 (1H, дд, J = 10.2, 7.8 Гц), 3.23-3.18 (2H, м), 2.95-2.80 (3H, м), 2.74 (1H, т, J = 10.2 Гц), 2.59-2.45 (2H, м), 2.30-1.90 (8H, м), 1.89-1.31 (14H, м), 1.11 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.5 (M+H).
Пример 49
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B037)
Соединение B037 [24.1 мг, 0.052 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-(S)-(2,2-дифторэтил)пирролидин гидрохлорид (3b20) [50 мг, 0.292 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 10.7 Гц), 5.98 (1H, тт, J = 3.0, 56.0 Гц), 5.29 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.12 (1H, тд, J = 6.5, 3.3 Гц), 3.55 (1H, дд, J = 11.0, 8.1 Гц), 3.41-3.34 (2H, м), 3.08-2.93 (4H, м), 2.88 (1H, дд, J = 12.0, 3.7 Гц), 2.69-2.55 (1H, м), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.35-2.04 (8H, м), 2.01-1.96 (3H, м), 1.90-1.33 (16H, м), 1.13 (3H, д, J = 6.8 Гц), 0.63 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.5 (M+H).
Пример 50
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B038)
Соединение B038 [10.2 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [55 мг, 0.074 ммоль] и 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорид (3b16) [40 мг, 0.184 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.88 (1H, тт, J = 56.6, 4.6 Гц), 5.22 (1H, д, J = 1.5 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.2 Гц), 2.94 (1H, т, J = 8.3 Гц), 2.86 (1H, дд, J = 12.4, 4.1 Гц), 2.68-2.52 (3H, м), 2.33-2.03 (9H, м), 1.98-1.24 (20H, м), 1.05 (3H, д, J = 7.0 Гц), 1.03 (3H, д, J = 6.3 Гц), 0.96-0.87 (1H, м), 0.58 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.3 (M+H).
Пример 51
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение B039)
Соединение B039 [9.2 мг, 0.019 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [55 мг, 0.074 ммоль] и 3-(S)-(2,2-дифторэтил)пирролидин гидрохлорид (3b20) [40 мг, 0.184 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.87 (1H, тт, J = 56.6, 4.6 Гц), 5.22 (1H, д, J = 1.5 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.4 Гц), 2.86 (1H, дд, J = 12.4, 4.1 Гц), 2.79-2.68 (2H, м), 2.59 (1H, дд, J = 13.4, 4.1 Гц), 2.39-1.21 (23H, м), 1.04 (3H, д, J = 6.3 Гц), 1.03 (3H, д, J = 7.0 Гц), 0.58 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.35 (M+H).
Пример 52
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B040)
Соединение B040 [11.4 мг, 0.025 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорид (3b16) [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.96 (1H, тт, J = 56.5, 4.0 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.39 (2H, ддд, J = 14.3, 7.2, 4.5 Гц), 3.44 (1H, дд, J = 10.7, 7.8 Гц), 3.24-3.12 (2H, м), 2.94-2.82 (3H, м), 2.74 (1H, т, J = 10.2 Гц), 2.66 (1H, дд, J = 13.2, 4.4 Гц), 2.56 (1H, кв, J = 8.1 Гц), 2.48 (1H, дд, J = 13.7, 3.9 Гц), 2.34-2.17 (3H, м), 2.08-1.93 (5H, м), 1.83-1.28 (10H, м), 1.12 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 463.32 (C28H43F2NO2), Набл. масса = 464.35 (M+H).
Пример 53
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B041)
Соединение B041 [11.8 мг, 0.026 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-(2,2-дифторэтил)пирролидин гидрохлорид (3b20) [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.96 (2H, тт, J = 56.5, 4.0 Гц), 5.92 (2H, д, J = 11.2 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.39 (2H, ддд, J = 14.4, 7.1, 4.4 Гц), 3.37 (1H, дд, J = 10.2, 8.3 Гц), 3.26-3.20 (1H, м), 3.15-3.05 (1H, м), 2.92-2.74 (4H, м), 2.66 (1H, дд, J = 13.4, 4.1 Гц), 2.62-2.53 (1H, м), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.32-2.19 (3H, м), 2.08-1.92 (5H, м), 1.83-1.30 (10H, м), 1.11 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 463.32 (C28H43F2NO2), Набл. масса = 464.40 (M+H).
Пример 54
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B042)
Соединение B042 [14.2 мг, 0.031 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(R)-(2,2-дифторэтил)пирролидин гидрохлорид (3b16) [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.92 (1H, тт, J = 56.5, 4.2 Гц), 5.89 (1H, д, J = 10.0 Гц), 4.06-3.95 (2H, м), 3.17 (1H, т, J = 8.3 Гц), 2.97-2.80 (3H, м), 2.61-1.91 (15H, м), 1.86-1.26 (13H, м), 1.08 (3H, д, J = 6.8 Гц), 0.61 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.30 (M+H).
Пример 55
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B043)
Соединение B043 [8.3 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(S)-(2,2-дифторэтил)пирролидин гидрохлорид (3b20) [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.91 (1H, тт, J = 56.6, 4.0 Гц), 5.89 (1H, д, J = 10.7 Гц), 4.05-3.96 (2H, м), 3.05-2.80 (3H, м), 2.65-2.39 (8H, м), 2.23-1.90 (10H, м), 1.87-1.25 (14H, м), 1.07 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 56
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил) пирролидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение B044a, Соединение B044b)
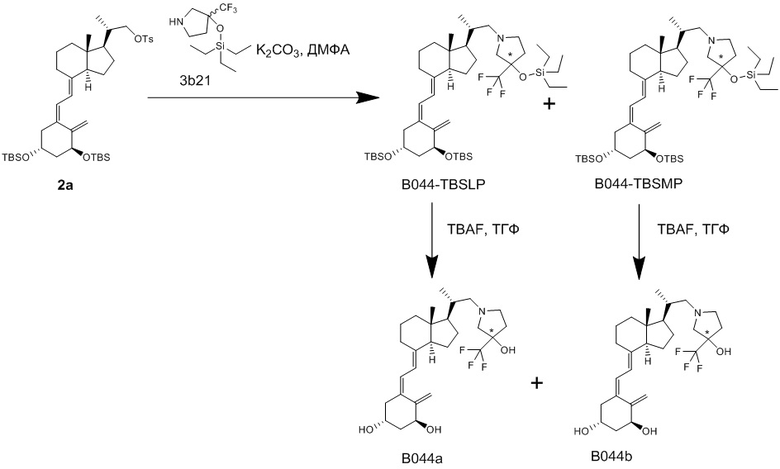
Стадия 1
Раствор соединения (2a) [100 мг, 0.137 ммоль], триэтил [3-(трифторметил)пирролидин-3-ил]оксисилана (Соединение 3b21) [80 мг, 0.297 ммоль] и карбоната калия [60 мг, 0.434 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая целевой продукт с низкой полярностью (Соединение B044-TBSLP) [32.2 мг, 0.039 ммоль] и целевой продукт с высокой полярностью (Соединение B044-TBSMP) [35.5 мг, 0.043 ммоль].
Стадия 2a
TBAF [1 M раствор в ТГФ, 0.5 мл, 0.5 ммоль] добавляли в раствор соединения B044-TBSLP [32.2 мг, 0.039 ммоль] в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь гасили насыщенным раствором гидрокарбоната магния, и органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом ВЭЖХ, получая соединение B044a [7.7 мг, 0.016 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 6.04 (1H, д, J = 11.2 Гц), 5.24 (1H, дд, J = 2.4, 1.5 Гц), 4.30 (1H, т, J = 6.0 Гц), 4.12-4.00 (1H, м), 2.92 (1H, д, J = 10.7 Гц), 2.84-2.73 (2H, м), 2.52-2.41 (3H, м), 2.28-2.08 (5H, м), 2.02-1.22 (18H, м), 1.00 (3H, д, J = 6.3 Гц), 0.55 (3H, с).
Точная масса = 483.3 (C27H40F3NO3), Набл. масса = 484.3 (M+H).
Стадия 2b
Соединение B044-TBSMP [35.5 мг, 0.043 ммоль] обрабатывали таким же образом, как на стадии 2a, получая Соединение B044b [10.0 мг, 0.021 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 6.04 (1H, д, J = 10.7 Гц), 5.24 (1H, дд, J = 2.4, 1.0 Гц), 4.30 (1H, т, J = 5.9 Гц), 4.08 (1H, дт, J = 10.9, 3.8 Гц), 2.84-2.41 (7H, м), 2.26-1.20 (24H, м), 1.00 (3H, д, J = 6.3 Гц), 0.55 (3H, с).
Точная масса = 483.3 (C27H40F3NO3), Набл. масса = 484.3 (M+H).
Пример 57
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B045a, Соединение B045b)
Соединение B045a [9.3 мг, 0.020 ммоль] и соединение B045b [7.9 мг, 0.017 ммоль] получали посредством проведения реакции аналогично Примеру 56, используя соединение 2b [100 мг, 0.139 ммоль] и триэтил[3-(трифторметил)пирролидин-3- ил]оксисилан (Соединение 3b21) [100.4 мг, 0.373 ммоль] в качестве исходных веществ.
Соединение B045a
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.94 (2H, м), 3.08 (1H, д, J = 11.2 Гц), 2.94 (1H, кв, J = 8.0 Гц), 2.83 (1H, дд, J = 11.2, 4.4 Гц), 2.74-2.55 (3H, м), 2.48-2.37 (3H, м), 2.26-2.03 (6H, м), 2.02-1.95 (2H, м), 1.94-1.24 (15H, м), 1.05 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Соединение B045b
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.06-3.94 (2H, м), 2.85-2.75 (4H, м), 2.66 (1H, дд, J = 15.6, 7.3 Гц), 2.61-2.13 (8H, м), 2.10-1.98 (2H, м), 1.93-1.24 (13H, м), 1.06 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Пример 58
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение B046a, Соединение B046b)
Соединение B046a [8.1 мг, 0.017 ммоль] и соединение B046b [5.6 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 56, используя соединение 2c [100 мг, 0.137 ммоль] и триэтил[3-(трифторметил)пирролидин-3- ил]оксисилан (Соединение 3b21) [144.3 мг, 0.536 ммоль] в качестве исходных веществ.
Соединение B046a
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.35 (2H, м), 3.03 (1H, д, J = 11.2 Гц), 2.91-2.83 (2H, м), 2.69-2.17 (10H, м), 2.08-2.00 (2H, м), 1.95-1.85 (2H, м), 1.70-1.49 (6H, м), 1.40-1.25 (3H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 483.3 (C27H40F3NO3), Набл. масса = 484.25 (M+H).
Соединение B046b
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 10.7 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.39 (2H, ддд, J = 13.9, 7.1, 4.6 Гц), 2.87-2.77 (4H, м), 2.71-2.65 (2H, м), 2.50-2.18 (6H, м), 2.09-2.00 (2H, м), 1.98-1.90 (2H, м), 1.71-1.52 (6H, м), 1.39-1.25 (3H, м), 1.06 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 483.3 (C27H40F3NO3), Набл. масса = 484.30 (M+H).
Пример 59
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B047)
Соединение B047 [14.5 мг, 0.031 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50 мг, 0.069 ммоль] и 3-(S)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.40 (1H, т, J = 75.0 Гц), 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.29 (1H, дд, J = 2.2, 1.2 Гц), 4.80-4.75 (1H, м), 4.35 (1H, т, J = 5.9 Гц), 4.17-4.10 (1H, м), 3.03 (1H, дд, J = 11.2, 5.9 Гц), 2.95-2.85 (2H, м), 2.74 (1H, дд, J = 11.0, 3.2 Гц), 2.67-2.60 (1H, м), 2.55-2.42 (3H, м), 2.30-2.20 (2H, м), 2.08-1.95 (4H, м), 1.93-1.83 (3H, м), 1.77-1.22 (10H, м), 1.08 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.30 (M+H).
Пример 60
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B048)
Соединение B048 [9.2 мг, 0.020 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50 мг, 0.069 ммоль] и 3-(R)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.39 (1H, т, J = 75.0 Гц), 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.29 (1H, дд, J = 2.4, 1.5 Гц), 4.80-4.73 (1H, м), 4.35 (1H, т, J = 6.1 Гц), 4.17-4.10 (1H, м), 2.90-1.94 (14H, м), 1.89 (3H, т, J = 5.4 Гц), 1.74-1.24 (10H, м), 1.07 (3H, д, J = 6.8 Гц), 0.61 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 61
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B049)
Соединение B049 [13.4 мг, 0.029 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(S)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.39 (1H, т, J = 75.0 Гц), 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, дд, J = 7.0, 2.0 Гц), 4.77-4.72 (1H, м), 4.40 (2H, ддд, J = 14.0, 7.0, 4.5 Гц), 2.96 (1H, дд, J = 11.0, 6.1 Гц), 2.90-2.76 (2H, м), 2.70-2.60 (2H, м), 2.54-2.18 (8H, м), 2.09-1.85 (4H, м), 1.71-1.50 (6H, м), 1.42-1.25 (3H, м), 1.07 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 62
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B050)
Соединение B050 [13.0 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 3-(R)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.44 (1H, т, J = 75.0 Гц), 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 5.9 Гц), 4.88-4.84 (1H, м), 4.40 (2H, ддд, J = 14.3, 7.2, 4.5 Гц), 3.08 (2H, д, J = 4.4 Гц), 3.06-2.85 (3H, м), 2.71-2.63 (3H, м), 2.49 (1H, дд, J = 13.4, 3.7 Гц), 2.35-1.98 (7H, м), 1.78-1.50 (6H, м), 1.41-1.28 (3H, м), 1.10 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 63
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B051)
Соединение B051 [7.6 мг, 0.017 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(S)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.42 (1H, т, J = 75.0 Гц), 6.22 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 4.84-4.79 (1H, м), 4.07-3.96 (2H, м), 3.12 (1H, дд, J = 11.7, 6.3 Гц), 3.03-2.96 (1H, м), 2.85 (2H, дд, J = 11.5, 3.2 Гц), 2.77-2.50 (4H, м), 2.41 (1H, дд, J = 13.7, 3.4 Гц), 2.33-1.96 (7H, м), 1.91-1.27 (12H, м), 1.09 (3H, д, J = 6.8 Гц), 0.62 (3H, с).
Точная масса = 453.31 (C26H41F2NO3), Набл. масса = 454.35 (M+H).
Пример 64
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B052)
Соединение B052 [6.6 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 3-(R)-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.173 ммоль].
1H-ЯМР (CD3OD) δ: 6.43 (1H, т, J = 75.0 Гц), 6.22 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 4.88-4.81 (1H, м), 4.07-3.95 (2H, м), 3.04-2.81 (5H, м), 2.65-2.55 (3H, м), 2.42 (1H, дд, J = 13.4, 3.2 Гц), 2.33-1.97 (7H, м), 1.91-1.27 (12H, м), 1.09 (3H, д, J = 6.8 Гц), 0.62 (3H, с).
Точная масса = 453.31 (C26H41F2NO3), Набл. масса = 454.35 (M+H).
Сравнительный пример 9
Синтез 3-(S)-(2,2-дифторэтокси)пирролидин гидрохлорида (Соединение 3b24)
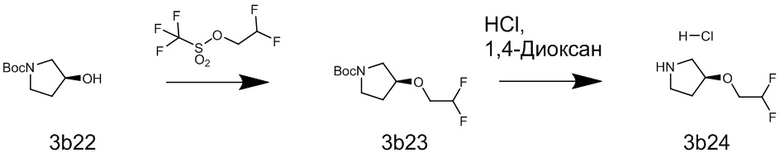
Стадия 1
Гидрид натрия [60% в масле, 0.32 г, 8 ммоль] добавляли в раствор т-бутил-3-(S)-гидроксипирролидин-1-карбоксилата (Соединение 3b22) [1.20 г, 6.41 ммоль] в ТГФ [17 мл] при 0°C, и реакционную смесь перемешивали при 0°C в течение 20 минут. В полученную смесь добавляли 2,2-дифторэтил трифторметансульфонат [1.65 г, 7.71 ммоль] и перемешивали при 0°C в течение 2 часов. Реакционную смесь гасили насыщенным водным раствором хлорида аммония и добавляли насыщенный раствор хлорида натрия. Смесь экстрагировали этилацетатом, органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(S)-(2,2-дифторэтокси)пирролидин-1-карбоксилат (Соединение 3b23) [1.51 г, 6.01 ммоль] (выход = 94%).
Стадия 2
Раствор т-бутил-3-(S)-(2,2-дифторэтокси)пирролидин-1-карбоксилата (Соединение 3b23) [1.51 г, 6.01 ммоль] в 4 М растворе хлороводорода в диоксане [15 мл] перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении и сушили, получая 3-(S)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b24) [1.12 г, 5.97 ммоль] (выход = 99%).
1H-ЯМР (ДМСО-D6) δ: 9.41 (2H, с), 6.14 (1H, тт, J = 54.9, 3.7 Гц), 4.34-4.27 (1H, м), 3.72 (2H, тд, J = 15.1, 3.9 Гц), 3.25-3.06 (4H, м), 2.08-2.02 (1H, м), 1.97-1.87 (1H, м).
Сравнительный пример 10
Синтез 3-(R)-(2,2-дифторэтокси)пирролидин гидрохлорида (Соединение 3b27)
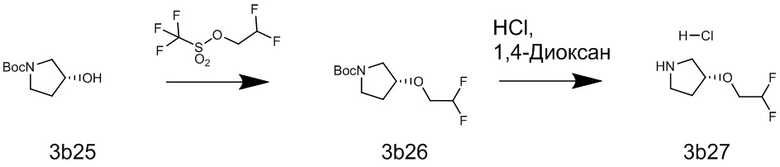
Стадия 1
т-бутил-3-(R)-(2,2-дифторэтокси)пирролидин-1-карбоксилат (Соединение 3b26) [1.37 г, 5.45 ммоль] получали путем проведения реакции аналогично стадии 1 в Сравнительном примере 9, используя т-бутил-3-(R)-гидроксипирролидин-1-карбоксилат (Соединение 3b25) [1.13 г, 6.04 ммоль] в качестве исходного вещества. (выход = 90%)
Стадия 2
3-(R)-(2,2-Дифторэтокси)пирролидин гидрохлорид (Соединение 3b27) [1.04 г, 5.54 ммоль] получали путем проведения реакции аналогично стадии 2 в Сравнительном примере 9, используя т-бутил-3-(R)-(2,2-дифторэтокси)пирролидин-1-карбоксилат (Соединение 3b26) [1.37 г, 5.45 ммоль] в качестве исходного вещества. (выход = 92%)
1H-ЯМР (ДМСО-D6) δ: 9.54 (2H, с), 6.14 (1H, тт, J = 54.9, 3.7 Гц), 4.31 (1H, дд, J = 5.1, 3.2 Гц), 3.72 (2H, тд, J = 15.1, 3.9 Гц), 3.24-3.06 (4H, м), 2.07-2.02 (1H, м), 1.98-1.86 (1H, м).
Пример 65
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B053)
Соединение B053 [13.8 мг, 0.029 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2a [50 мг, 0.069 ммоль] и 3-(S)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b24) [40 мг, 213 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.10 (1H, д, J = 11.2 Гц), 5.94 (1H, тт, J = 55.0, 4.0 Гц), 5.29 (1H, дд, J = 2.4, 1.0 Гц), 4.37-4.30 (2H, м), 4.17-4.10 (1H, м), 3.71 (2H, тдд, J = 14.5, 3.7, 2.8 Гц), 3.28-3.08 (4H, м), 2.92-2.83 (2H, м), 2.76 (1H, т, J = 11.5 Гц), 2.52 (1H, дд, J = 13.2, 3.4 Гц), 2.30-2.17 (2H, м), 2.12-2.00 (4H, м), 1.91-1.29 (13H, м), 1.11 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.4 (M+H).
Пример 66
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B054)
Соединение B054 [13.7 мг, 0.029 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2a [50 мг, 0.069 ммоль] и 3-(R)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b27) [35 мг, 187 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.89 (1H, тт, J = 55.4, 4.0 Гц), 5.28 (1H, дд, J = 1.2, 2.0 Гц), 4.89 (1H, д, J = 2.0 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.16-4.10 (2H, м), 3.69-3.54 (2H, м), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.68-2.23 (8H, м), 2.13-1.21 (17H, м), 1.04 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Пример 67
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B055)
Соединение B055 [15.0 мг, 0.031 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2c [50 мг, 0.069 ммоль] и 3-(S)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b24) [40 мг, 213 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.94 (1H, тт, J = 4.0, 55.0 Гц), 5.93 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 5.9 Гц), 4.43-4.29 (3H, м), 3.78-3.64 (2H, м), 3.28-3.07 (4H, м), 2.87 (2H, дд, J = 12.4, 2.7 Гц), 2.76 (1H, т, J = 11.5 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.49 (1H, дд, J = 13.2, 3.9 Гц), 2.33-2.04 (6H, м), 1.81-1.26 (9H, м), 1.12 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.35 (M+H).
Пример 68
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B056)
Соединение B056 [13.2 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2c [50 мг, 0.069 ммоль] и 3-(R)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b27) [35 мг, 187 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.89 (1H, тт, J = 56.0, 4.0 Гц), 5.05 (2H, д, J = 8.0 Гц), 4.42-4.36 (2H, м), 4.17-4.10 (1H, м), 3.70-3.55 (2H, м), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.69-2.24 (10H, м), 2.13-1.23 (15H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.35 (M+H).
Пример 69
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B057)
Соединение B057 [15.1 мг, 0.032 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2b [50 мг, 0.070 ммоль] и 3-(S)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b24) [40 мг, 214 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 10.7 Гц), 5.94 (1H, тт, J = 55.0, 4.0 Гц), 5.91 (1H, д, J = 10.7 Гц), 4.33-4.29 (1H, м), 4.07-3.96 (2H, м), 3.71 (2H, дтд, J = 3.0, 14.0, 4.0 Гц), 3.29-3.05 (4H, м), 2.86 (2H, д, J = 12.2 Гц), 2.75 (1H, т, J = 11.5 Гц), 2.60 (1H, дд, J = 13.4, 3.7 Гц), 2.42 (1H, дд, J = 13.4, 3.2 Гц), 2.26-1.95 (7H, м), 1.88-1.30 (11H, м), 1.11 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Пример 70
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B058)
Соединение B058 [10.3 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 2b [50 мг, 0.070 ммоль] и 3-(R)-(2,2-дифторэтокси)пирролидин гидрохлорид (Соединение 3b27) [35 мг, 187 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.89 (1H, тт, J = 55.0, 4.0 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.16-4.10 (1H, м), 4.06-3.95 (2H, м), 3.62 (2H, тт, J = 14.4, 4.0 Гц), 2.83 (1H, дд, J = 11.7, 3.9 Гц), 2.68-2.56 (4H, м), 2.49 (1H, кв, J = 7.8 Гц), 2.40 (1H, дд, J = 13.2, 3.4 Гц), 2.35-1.21 (21H, м), 1.04 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.25 (M+H).
Сравнительный пример 11
Синтез 3-(S)-(3,3-дифторпропил)пирролидин гидрохлорида (Соединение 3b32)
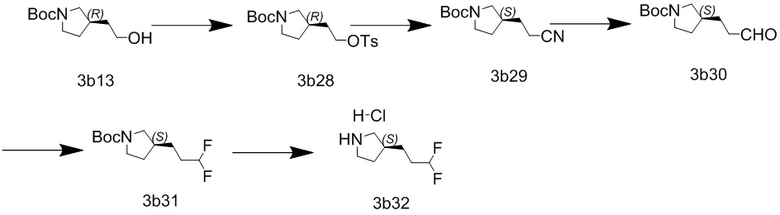
Стадия 1
Раствор т-бутил-3-(R)-(2-гидроксиэтил)пирролидин-1-карбоксилата (Соединение 3b13) [1.05 г, 4.88 ммоль] и п-толуолсульфонилхлорида [1.08 г, 5.66 ммоль] в пиридине [10 мл] перемешивали при комнатной температуре в течение ночи. Реакционную смесь переносили в насыщенный раствор хлорида натрия, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(2-(тозилокси)этил)пирролидин- 1-карбоксилат (Соединение 3b28) [1.46 г, 3.95 ммоль] (выход = 81%).
Стадия 2
Цианид калия [1.009 г, 15.50 ммоль] и 18-краун-6 [114 мг, 0.431 ммоль] добавляли в раствор т-бутил-3-(R)-(2-(тозилокси)этил)пирролидин-1-карбоксилата (Соединение 3b28) [1.46 г, 3.95 ммоль] в ДМФА [20 мл], и реакционную смесь перемешивали при 60°C в течение ночи. Реакционную смесь выливали в насыщенный раствор хлорида натрия при комнатной температуре, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(S)-(2-цианоэтил)пирролидин-1-карбоксилат (Соединение 3b29) [0.74 г, 3.3 ммоль] (выход = 68%).
Стадия 3
Раствор т-бутил-3-(S)-(2-цианоэтил)пирролидин-1-карбоксилата (Соединение 3b29) [0.74 г, 3.3 ммоль] в толуоле [30 мл] охлаждали до -78°C в атмосфере азота. В этот раствор добавляли раствор диизобутилалюминий гидрида (DIBAL-H) в толуоле [1.5 M, 4 мл, 6 ммоль], и полученную смесь перемешивали при той же температуре в течение 1.5 часов. Реакционную смесь нагревали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония. Добавляли 2М водный раствор гидроксида натрия [10 мл], и полученную смесь перемешивали при комнатной температуре 30 минут. Смесь экстрагировали этилацетатом, и органический слой промывали насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(S)-(2-оксопропил)пирролидин-1- карбоксилат (Соединение 3b30) [280 мг, 1.23 ммоль] (выход = 37%).
Стадия 4
Раствор т-бутил-3-(R)-(2-оксопропил)пирролидин-1-карбоксилата (Соединение 3b30) [280 мг, 1.23 ммоль] в дихлорметане [10 мл] охлаждали до 0°C, добавляли DAST [0.60 мл, 4.55 ммоль], и смесь перемешивали в течение ночи. На следующее утро, дополнительно добавляли в смесь DAST [0.60 мл, 4.55 ммоль] при 0°C, и смесь дополнительно перемешивали 1 день. Реакционную смесь охлаждали до 0°C, гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(S)-(3,3-дифторпропил)пирролидин-1- карбоксилат (Соединение 3b31) [230.1 мг, 0.923 ммоль] (выход = 75%).
Стадия 5
Раствор т-бутил-3-(S)-(3,3-дифторпропил)пирролидин-1-карбоксилата (Соединение 3b31) [230.1 мг, 0.923 ммоль] в 4М растворе хлороводорода в диоксане [5 мл, 20 ммоль] перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении и сушили, получая 3-(S)-(3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b32) [173.7 мг, 0.923 ммоль] (выход = 100%).
1H-ЯМР (ДМСО-D6) δ: 9.22 (2H, с), 6.07 (1H, тт, J = 56.7, 4.3 Гц), 3.35-3.15 (2H, м), 3.09-3.00 (1H, м), 2.68 (1H, дд, J = 11.4, 8.7 Гц), 2.23-2.11 (1H, м), 2.08-1.98 (1H, м), 1.91-1.76 (2H, м), 1.56-1.39 (3H, м).
Сравнительный пример 12
Синтез 3-(R)-(3,3-дифторпропил)пирролидин гидрохлорида (Соединение 3b37)

Стадия 1
Раствор т-бутил-3-(S)-(2-гидроксиэтил)пирролидин-1-карбоксилата (Соединение 3b17) [1.06 г, 4.92 ммоль], п-толуолсульфонилхлорида [1.08 г, 5.66 ммоль] и 4-диметиламинопиридина [20 мг, 0.163 ммоль] в пиридине [10 мл] перемешивали при комнатной температуре 1.5 часа. Реакционную смесь выливали в насыщенный раствор хлорида натрия, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(S)-(2-(тозилокси)этил)пирролидин-1-карбоксилат (Соединение 3b33) [1.28 г, 3.46 ммоль] (выход = 70%).
Стадия 2
Цианид калия [618 мг, 9.49 ммоль] и 18-краун-6 [97.2 мг, 0.368 ммоль] добавляли в раствор т-бутил-3-(S)-(2-(тозилокси)этил)пирролидин-1-карбоксилата (Соединение 3b33) [1.28 г, 3.46 ммоль] в ДМФА [20 мл], и реакционную смесь перемешивали при 60°C в течение ночи. Реакционную смесь выливали в насыщенный раствор хлорида натрия, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(2-цианоэтил) пирролидин-1-карбоксилат (Соединение 3b34) [0.81 г, 3.46 ммоль] (выход = 100%).
Стадия 3
Раствор т-бутил-3-(R)-(2-цианоэтил)пирролидин-1-карбоксилата (Соединение 3b34) [0.81 г, 3.46 ммоль] в толуоле [30 мл] охлаждали до -78°C в атмосфере азота. В этот раствор добавляли раствор диизобутилалюминий гидрида (DIBAL-H) в толуоле [1.5M, 5.4 мл, 8.1 ммоль], и смесь перемешивали при той же температуре в течение 1.5 часов. Реакционную смесь нагревали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония. Добавляли 2M водный раствор гидроксида натрия [10 мл], и полученную смесь перемешивали при комнатной температуре 30 минут. Смесь экстрагировали этилацетатом, органический слой промывали насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(2-оксопропил)пирролидин-1- карбоксилат (Соединение 3b35) [447.3 мг, 1.97 ммоль] (выход = 54%).
Стадия 4
Раствор т-бутил-3-(R)-(2-оксопропил)пирролидин-1-карбоксилата (Соединение 3b35) [447.3 мг, 1.97 ммоль] в дихлорметане [30 мл] охлаждали до 0°C, добавляли DAST [0.63 мл, 4.77 ммоль], и смесь перемешивали в течение ночи. На следующее утро дополнительно добавляли в смесь DAST [0.63 мл, 4.77 ммоль] при 0°C, и смесь дополнительно перемешивали 1 день. Реакционную смесь охлаждали до 0°C, гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-3-(R)-(3,3-дифторпропил)пирролидин-1- карбоксилат (Соединение 3b36) [269.7 мг, 1.08 ммоль].
Стадия 5
Раствор т-бутил-3-(R)-(3,3-дифторпропил)пирролидин-1-карбоксилата (Соединение 3b36) [269.7 мг, 1.08 ммоль] в 4М растворе хлороводорода в диоксане [5 мл, 20 ммоль] перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении и сушили, получая 3-(R)-(3,3-дифторпропил) пирролидин гидрохлорид (Соединение 3b37) [203.2 мг, 1.08 ммоль] (выход = 100%).
1H-ЯМР (ДМСО-D6) δ: 9.03 (2H, с), 6.03 (1H, тт, J = 56.8, 4.3 Гц), 3.24 (1H, дд, J = 11.2, 7.8 Гц), 3.19-3.13 (1H, м), 3.06-2.98 (1H, м), 2.65 (1H, дд, J = 11.2, 8.8 Гц), 2.18-2.10 (1H, м), 2.08-1.97 (1H, м), 1.87-1.73 (2H, м), 1.53-1.36 (3H, м).
Пример 71
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B059)
Соединение B059 [12.3 мг, 0.257 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50.0 мг, 0.069 ммоль] и 3-(S)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b32) [30 мг, 0.162 ммоль].
1H-ЯМР (CD3OD) δ: 6.30 (1H, д, J = 11.4 Гц), 6.07 (1H, д, J = 11.4 Гц), 5.83 (1H, тт, J = 56.9, 4.4 Гц), 5.27 (1H, дд, J = 2.3, 1.4 Гц), 4.33 (1H, т, J = 5.9 Гц), 4.13-4.07 (1H, м), 2.91-2.83 (2H, м), 2.65-2.58 (1H, м), 2.54-2.43 (2H, м), 2.28-1.20 (32H, м), 1.03 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.25 (M+H).
Пример 72
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B060)
Соединение B060 [13.4 мг, 0.28 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50.0 мг, 0.069 ммоль] и 3-(R)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b37) [35 мг, 0.189 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.85 (1H, тт, J = 56.0, 4.0 Гц), 5.28 (1H, дд, J = 2.0, 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 2.86 (1H, дд, J = 12.0, 4.6 Гц), 2.79-2.70 (2H, м), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.40-1.24 (28H, м), 1.05 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Пример 73
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B061)
Соединение B061 [14.7 мг, 0.31 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 3-(S)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b32) [30 мг, 0.162 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.0 Гц), 5.85 (1H, тт, J = 57.5, 4.0 Гц), 5.05 (2H, д, J = 6.4 Гц), 4.42-4.35 (2H, м), 2.92 (1H, т, J = 8.5 Гц), 2.85 (1H, дд, J = 12.1, 3.4 Гц), 2.70-2.60 (2H, м), 2.51-2.46 (2H, м), 2.31-2.25 (4H, м), 2.21-1.22 (22H, м), 1.05 (3H, д, J = 6.4 Гц), 0.61 (3H, с).
Пример 74
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B062)
Соединение B062 [17.7 мг, 0.037 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 3-(R)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b37) [30 мг, 0.205 ммоль].
1H-ЯМР (CD3OD) δ: 6.28 (1H, д, J = 11.2 Гц), 5.93 (1H, д, J = 11.2 Гц), 5.91 (2H, тт, J = 57.0, 4.0 Гц), 5.06 (2H, д, J = 5.9 Гц), 4.40 (2H, ддд, J = 14.4, 7.1, 4.4 Гц), 3.51 (1H, дд, J = 11.0, 8.1 Гц), 3.42-3.26 (3H, м), 3.07-2.85 (4H, м), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.49 (1H, дд, J = 13.7, 3.9 Гц), 2.45-2.20 (4H, м), 2.12-1.95 (3H, м), 1.90-1.33 (15H, м), 1.14 (3H, д, J = 6.8 Гц), 0.65 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 75
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B063)
Соединение B063 [9.8 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 3-(S)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b32) [30 мг, 0.162 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (2H, д, J = 11.0 Гц), 5.85 (1H, тт, J = 4.5, 57.0 Гц), 4.06-3.95 (2H, м), 2.92 (1H, т, J = 8.5 Гц), 2.83 (1H, дд, J = 11.7, 3.9 Гц), 2.68-2.55 (2H, м), 2.52-2.45 (1H, м), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.32-1.22 (31H, м), 1.05 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.30 (M+H).
Пример 76
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B064)
Соединение B064 [10.3 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 3-(R)- (3,3-дифторпропил)пирролидин гидрохлорид (Соединение 3b37) [40 мг, 0.215 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 5.85 (1H, тт, J = 57.0, 4.0 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.0, 3.7 Гц), 2.77-2.70 (2H, м), 2.59 (1H, дд, J = 13.4, 3.7 Гц), 2.42-1.21 (31H, м), 1.05 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.35 (M+H).
Пример 77
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-(трифторметокси) пирролидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение B065)
Соединение B065 [5.7 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50.0 мг, 0.069 ммоль] и 3-(S)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 1.8, 1.0 Гц), 4.89 (1H, дд, J = 1.8, 1.0 Гц), 4.86-4.80 (2H, м), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.05 (1H, м), 2.86 (2H, дд, J = 10.7, 5.9 Гц), 2.81-2.75 (1H, м), 2.62 (1H, дд, J = 10.7, 2.4 Гц), 2.51 (1H, дд, J = 13.2, 3.4 Гц), 2.38-2.16 (6H, м), 2.07-1.87 (7H, м), 1.73-1.21 (11H, м), 1.06 (3H, т, J = 8.1 Гц), 0.59 (3H, с).
Точная масса = 483.30 (C27H40F3NO3), Набл. масса = 484.35 (M+H).
Пример 78
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-(трифторметокси) пирролидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение B066)
Соединение B066 [6.1 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение [2a] [50.0 мг, 0.069 ммоль] и 3-(R)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.89 (1H, дд, J = 2.2, 1.5 Гц), 4.86-4.82 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.78 (1H, дд, J = 11.2, 2.4 Гц), 2.67-2.62 (2H, м), 2.55-2.43 (2H, м), 2.35-2.20 (4H, м), 2.07-1.91 (4H, м), 1.88 (2H, т, J = 5.9 Гц), 1.75-1.63 (2H, м), 1.60-1.21 (8H, м), 1.04 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 483.30 (C27H40F3NO3), Набл. масса = 484.20 (M+H).
Пример 79
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-(трифторметокси) пирролидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение B067)
Соединение B067 [5.7 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 3-(S)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.88-4.80 (2H, м), 4.42-4.36 (2H, м), 2.89-2.77 (3H, м), 2.65 (2H, тд, J = 13.0, 4.0 Гц), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.40-2.22 (7H, м), 2.07-1.90 (5H, м), 1.60 (7H, тт, J = 24.6, 8.1 Гц), 1.38-1.21 (4H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 483.30 (C27H40F3NO3), Набл. масса = 484.40 (M+H).
Пример 80
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-(трифторметокси) пирролидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение B068)
Соединение B068 [6.7 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 3-(R)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.86-4.83 (1H, м), 4.43-4.35 (2H, м), 2.87-2.79 (2H, м), 2.68-2.63 (3H, м), 2.49 (2H, дд, J = 15.9, 6.6 Гц), 2.37-2.20 (5H, м), 2.07-1.90 (4H, м), 1.70-1.21 (10H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 483.30 (C27H40F3NO3), Набл. масса = 484.30 (M+H).
Пример 81
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-(трифторметокси) пирролидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3- диола (Соединение B069)
Соединение B069 [6.8 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 3-(S)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.20 (1H, д, J = 11.0 Гц), 5.87 (1H, д, J = 11.0 Гц), 4.85-4.80 (1H, м), 4.04-3.93 (2H, м), 2.87-2.73 (3H, м), 2.66-2.53 (2H, м), 2.41-2.11 (7H, м), 2.05-1.47 (12H, м), 1.37-1.23 (3H, м), 1.03 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Пример 82
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-(трифторметокси)пирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B070)
Соединение B070 [6.2 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 3-(R)-(трифторметокси)пирролидин гидрохлорид [35 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.20 (1H, д, J = 11.4 Гц), 5.87 (1H, д, J = 11.0 Гц), 4.85-4.81 (1H, м), 4.04-3.93 (2H, м), 2.82 (1H, дд, J = 11.7, 3.9 Гц), 2.78 (1H, дд, J = 3.0, 12.0 Гц), 2.66-2.61 (2H, м), 2.57 (1H, дд, J = 13.3, 3.7 Гц), 2.46 (1H, кв, J = 7.9 Гц), 2.39 (1H, дд, J = 13.3, 3.2 Гц), 2.34-2.11 (5H, м), 2.05-1.71 (6H, м), 1.65-1.47 (6H, м), 1.38-1.21 (3H, м), 1.03 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Пример 83
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B071)
Соединение B071 [10.7 мг, 0.025 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50.0 мг, 0.069 ммоль] и (S)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 10.7 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.18-4.08 (2H, м), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.76 (1H, кв, J = 8.0 Гц), 2.63-2.40 (4H, м), 2.35-2.20 (4H, м), 2.07-1.25 (21H, м), 1.05 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.30 (M+H).
Пример 84
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпирролидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B072)
Соединение B072 [9.7 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и (S)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 11.7, 3.9 Гц), 2.77 (1H, дд, J = 16.6, 7.3 Гц), 2.61-2.13 (9H, м), 2.06-1.72 (7H, м), 1.69-1.48 (6H, м), 1.40-1.33 (2H, м), 1.33 (3H, с), 1.29-1.21 (1H, м), 1.05 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 417.32 (C26H43NO3), Набл. масса = 418.30 (M+H).
Пример 85
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B073)
Соединение B073 [9.6 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и (S)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.77 (1H, дд, J = 16.6, 7.3 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.63-2.40 (4H, м), 2.36-2.25 (4H, м), 2.10-1.90 (3H, м), 1.86-1.75 (2H, м), 1.72-1.50 (6H, м), 1.37 (2H, тд, J = 11.8, 3.1 Гц), 1.33 (3H, с), 1.30-1.21 (2H, м), 1.05 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.30 (M+H).
Пример 86
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-гидрокси-3-метилпирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B074)
Соединение B074 [10.3 мг, 0.024 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [50.0 мг, 0.069 ммоль] и (R)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 6.1 Гц), 4.16-4.05 (1H, м), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.75-2.53 (3H, м), 2.51 (1H, дд, J = 13.4, 3.7 Гц), 2.38 (1H, д, J = 9.8 Гц), 2.34-2.22 (3H, м), 2.07-1.77 (9H, м), 1.73-1.36 (9H, м), 1.33 (3H, с), 1.31-1.23 (3H, м), 1.05 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 429.32 (C27H43NO3). Набл. масса = 430.30 (M+H).
Пример 87
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-гидрокси-3-метилпирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B075)
Соединение B075 [9.5 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и (R)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 10.7 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.2, 3.4 Гц), 2.73-2.52 (4H, м), 2.42-2.13 (6H, м), 2.07-1.48 (14H, м), 1.42-1.35 (2H, м), 1.33 (3H, с), 1.31-1.22 (2H, м), 1.05 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 417.32 (C26H43NO3), Набл. масса = 418.30 (M+H).
Пример 88
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-гидрокси-3-метилпирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение B076)
Соединение B076 [13.3 мг, 0.031 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и (R)-3-метилпирролидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 2.85 (1H, дд, J = 12.2, 3.9 Гц), 2.73-2.62 (3H, м), 2.58 (1H, дд, J = 14.6, 8.3 Гц), 2.48 (1H, дд, J = 13.4, 3.7 Гц), 2.40-2.16 (5H, м), 2.07-1.77 (5H, м), 1.70-1.49 (6H, м), 1.43-1.23 (6H, м), 1.06 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 89
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-циклопропил-3-гидроксипирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (B077)
Соединение B077 [9.6 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 3-циклопропилпирролидин-3-ол гидрохлорид [30 мг, 0.183 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 2.99-2.24 (12H, м), 2.07-1.28 (16H, м), 1.08-1.00 (1H, м), 1.05 (3H, д, J = 6.3 Гц), 0.60 (3H, с), 0.45-0.30 (4H, м).
Точная масса = 455.34 (C29H45NO3), Набл. масса = 456.35 (M+H).
Пример 90
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(3-(трифторметил)пирролидин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B078)
Соединение B078 [7.2 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 3-трифторметилпирролидин гидрохлорид [48.3 мг, 0.275 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 2.99-2.81 (3H, м), 2.69-2.49 (4H, м), 2.45-2.10 (6H, м), 2.07-1.48 (14H, м), 1.39-1.20 (4H, м), 1.04 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 455.30 (C26H40F3NO2), Набл. масса = 456.30 (M+H).
Пример 91
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(3-(трифторметил)пирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B079)
Соединение B079 [11.4 мг, 0.024 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [100.0 мг, 0.137 ммоль] и 3-трифторметилпирролидин гидрохлорид [48.3 мг, 0.275 ммоль].
Точная масса = 467.30 (C27H40F3NO2), Набл. масса = 468.35 (M+H).
Пример 92
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C001)
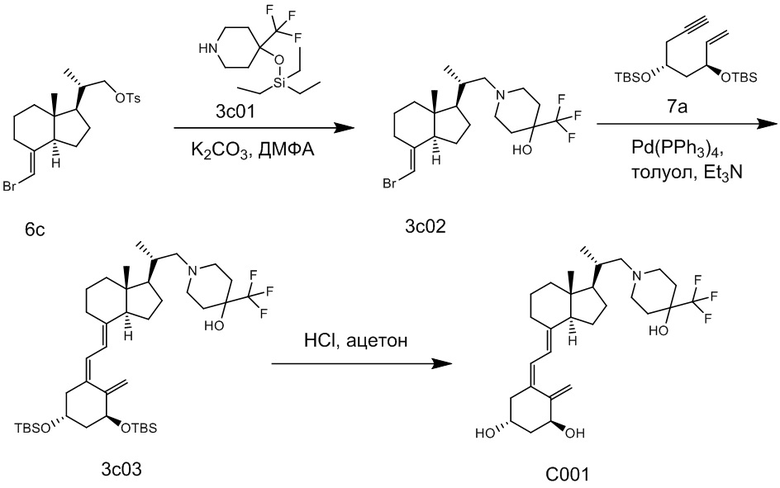
Стадия 1
Раствор (2S)-2-((1R,3aS,7aR,E)-4-(бромметилен)-7a-метилоктагидро-1H-инден-1- ил)пропил 4-метилбензолсульфоната (Соединение 6c, CAS 173388-39-1) [388 мг, 0.879 ммоль], триэтил-[[4-(трифторметил)-4-пиперидил]окси]силана (Соединение 3c01) [653 мг, 2.30 ммоль] и карбоната калия [551 мг, 3.99 ммоль] в ДМФА [2.5 мл] нагревали и перемешивали при 100°C в течение 4 часов. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая 1-((2S)-2-((1R,3aS,7aR,E)-4-(бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)-4-(трифторметил)пиперидин-4-ол (Соединение 3c02) [266.4 мг, 0.608 ммоль].
1H-ЯМР (CDCl3) δ: 5.65 (1H, с), 2.91-2.85 (1H, м), 2.80 (1H, д, J = 11.2 Гц), 2.63 (1H, дд, J = 5.9 Гц), 4.15-4.06 (1H, м), 2.89-2.81 (2H, м), 2.63 (1H, д, J = 11.2 Гц), 2.51 (1H, дд, J = 11.2, 4.0 Гц), 2.37 (1H, тд, J = 12.0, 2.3 Гц), 2.28 (1H, дд, J = 12.2, 3.4 Гц), 2.09-1.84 (8H, м), 1.68-1.23 (16H, м), 1.00 (3H, д, J = 6.9 Гц), 0.59 (3H, с).
Стадия 2
Соединение 3c02 [47.1 мг, 0.107 ммоль], синтезированное на стадии 1, (5R,7S)-2,2,3,3,9,9,10,10-октаметил-5-(проп-2-ин-1-ил)-7-винил-4,8-диокса-3,9- дисилаундекан (Соединение 7a, CAS 161055-41-0) [49.4 мг, 0.134 ммоль] и тетракис(трифенилфосфин) палладий(0) [12.4 мг, 0.011 ммоль] растворяли в смеси толуола [0.5 мл] и триэтиламина [0.5 мл], и раствор нагревали и перемешивали при 100°C в течение 3 часов в атмосфере азота. Реакционную смесь упаривали при пониженном давлении и грубо очищали методом тонкослойной хроматографии, получая сырой продукт [73.9 мг], содержащий соединение 3c03.
Стадия 3
Сырой продукт [73.9 мг], содержащий соединение 3c03, полученный на стадии 2, растворяли в ацетоне [1 мл], добавляли 6н. раствор соляной кислоты [0.2 мл], и полученную смесь перемешивали при комнатной температуре 8 часов. Реакционную смесь гасили, разбавляли насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом препаративной тонкослойной хроматографии, получая соединение C001 [6.3 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.06 (1H, м), 2.89-2.81 (2H, м), 2.63 (1H, д, J = 11.2 Гц), 2.51 (1H, дд, J = 13.2, 3.4 Гц), 2.41-2.23 (3H, м), 2.11-2.02 (3H, м), 1.98-1.21 (19H, м), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.4 (M+H).
Пример 93
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C002)
Соединение C002 [7.2 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [100 мг, 0.139 ммоль] и триэтил-[[4-(трифторметил)-4-пиперидил]окси]силан [86.4 мг, 0.305 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.06-3.95 (2H, м), 2.87-2.80 (2H, м), 2.65-2.57 (2H, м), 2.44-2.28 (3H, м), 2.23-1.48 (20H, м), 1.38-1.24 (4H, м), 1.03 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 485.31 (C27H42F3NO3), Набл. масса = 486.25 (M+H).
Пример 94
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил) пиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4-метиленциклогексан-1,3-диола (Соединение C003)
Соединение C003 [10.0 мг, 0.019 ммоль] получали по той же методике, как в стадиях 2 и 3 в Примере 92, используя соединение 3c02 [46.8 мг, 0.107 ммоль], полученное на стадии 1 в Примере 92, (5R,6S,7R)-2,2,3,3,6,9,9,10,10-нонаметил-5-(проп-2-ин-1-ил)- 7-винил-4,8-диокса-3,9-дисилаундекан (Соединение 7b) [50 мг, 0.131 ммоль] и тетракис(трифенилфосфин) палладий(0) [12.4 мг, 0.011 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.10 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.1 Гц), 3.17 (1H, д, J = 10.2 Гц), 3.00 (1H, д, J = 11.2 Гц), 2.89-2.75 (2H, м), 2.67 (1H, д, J = 12.7 Гц), 2.62-2.52 (2H, м), 2.42 (1H, т, J = 11.7 Гц), 2.19-1.97 (5H, м), 1.93-1.20 (13H, м), 1.08 (3H, д, J = 6.8 Гц), 1.03 (3H, д, J = 6.8 Гц), 0.61 (3H, с).
Точная масса = 511.33 (C29H44F3NO3), Набл. масса = 512.4 (M+H).
Пример 95
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C004)
Соединение C004 [18.7 мг, 0.038 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [60.0 мг, 0.082 ммоль] и триэтил-[[4-(трифторметил)-4-пиперидил]окси]силан [70 мг, 0.247 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.43-4.34 (2H, м), 3.28-3.24 (1H, м), 3.10 (1H, д, J = 11.7 Гц), 2.95-2.64 (5H, м), 2.56-2.46 (2H, м), 2.32-2.25 (2H, м), 2.12-1.96 (6H, м), 1.87-1.29 (12H, м), 1.10 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.4 (M+H).
Пример 96
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(трифторметил)пиперидин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C007)
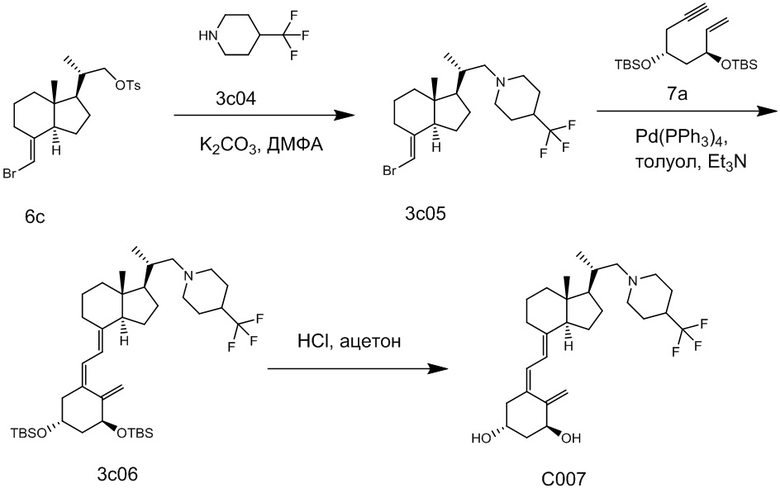
Стадия 1
1-((2S)-2-((1R,3aS,7aR,E)-4-(Бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)-4-(трифторметил)пиперидин (Соединение 3c05) [36.0 мг, 0.085 ммоль] получали по той же методике, как на стадии 1 в Примере 92, используя соединение 6c [62.1 мг, 0.141 ммоль] и 4-трифторметилпиперидин гидрохлорид (Соединение 3c04) [57.0 мг, 0.201 ммоль] в качестве исходных веществ.
Стадия 2, Стадия 3
Соединение C007 [5.5 мг, 0.011 ммоль] получали по той же методике, как в стадиях 2 и 3 в Примере 92, используя 3c05 [36.0 мг, 0.085 ммоль], соединение 7a [41.0 мг, 0.111 ммоль] и тетракис(трифенилфосфин) палладий(0) [12.4 мг, 0.011 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.7 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.12 (1H, ушир.с), 3.04 (1H, д, J = 11.2 Гц), 2.90-2.82 (2H, м), 2.53-2.49 (1H, м), 2.30-2.22 (3H, м), 2.09-1.22 (30H, м), 1.02 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 481.32 (C28H42F3NO2), Набл. масса = 482.4 (M+H).
Пример 97
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(трифторметил)пиперидин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C008)
Соединение C008 [9.8 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 4-трифторметилпиперидин гидрохлорид [30 мг, 0.196 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.4 Гц), 4.06-3.95 (2H, м), 3.04 (1H, д, J = 11.4 Гц), 2.88-2.80 (2H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.40 (1H, дд, J = 13.3, 3.7 Гц), 2.26 (1H, дд, J = 12.1, 3.0 Гц), 2.23-1.73 (13H, м), 1.67-1.48 (8H, м), 1.38-1.22 (4H, м), 1.02 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 469.32 (C27H42F3NO2), Набл. масса = 470.30 (M+H).
Пример 98
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(трифторметил)пиперидин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C009)
Соединение C009 [7.6 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [60.0 мг, 0.082 ммоль] и 4-трифторметилпиперидин гидрохлорид [50 мг, 0.326 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.43-4.35 (2H, м), 3.35-3.31 (1H, м), 3.14 (1H, д, J = 11.7 Гц), 2.86 (1H, дд, J = 12.4, 3.7 Гц), 2.69-2.04 (12H, м), 1.92-1.27 (13H, м), 1.07 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 481.32 (C28H42F3NO2), Набл. масса = 482.4 (M+H).
Пример 99
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(трифторметил) пиперидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C010)
Соединение C010 [12.0 мг, 0.024 ммоль] получали по методике, аналогичной описанной на стадиях 2 и 3 в Примере 92, используя соединение 3c05 [42.0 мг, 0.099 ммоль], полученное на стадии 1 в Примере 96, соединение 7b [50 мг, 0.131 ммоль] и тетракис(трифенилфосфин) палладий(0) [20.0 мг, 0.017 ммоль] в качестве исходных веществ.
1H-ЯМР (ДМСО-D6) δ: 6.19 (1H, д, J = 11.2 Гц), 5.99 (1H, д, J = 11.2 Гц), 5.17 (1H, д, J = 2.4 Гц), 4.75 (2H, дд, J = 11.7, 3.4 Гц), 4.57 (1H, д, J = 4.4 Гц), 4.15 (1H, т, J = 3.4 Гц), 3.63-3.59 (1H, м), 2.93 (1H, д, J = 11.2 Гц), 2.77 (2H, т, J = 12.7 Гц), 2.46 (1H, дд, J = 14.1, 3.4 Гц), 2.22-1.14 (27H, м), 0.95 (3H, д, J = 5.9 Гц), 0.85 (3H, д, J = 6.8 Гц), 0.52 (3H, с).
Точная масса = 495.33 (C29H44F3NO2), Набл. масса = 496.4 (M+H).
Пример 100
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)пиперидин-1-ил)пропан- 2-ил)-7a-метилциклогексан-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3- диола (Соединение C013)
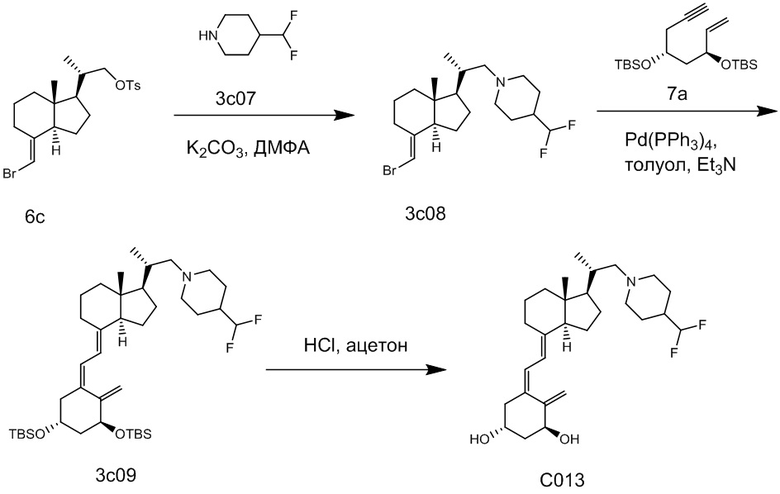
Стадия 1
1-((2S)-2-((1R,3aS,7aR,E)-4-(Бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)-4-(дифторметил)пиперидин (Соединение 3c08) [16.0 мг, 0.0394 ммоль] получали по той же методике, как на стадии 1 в Примере 92, используя соединение 6c [59.7 мг, 0.135 ммоль] и 4-дифторметилпиперидин гидрохлорид (Соединение 3c07) [79.4 мг, 0.294 ммоль] в качестве исходных веществ.
Стадия 2, Стадия 3
Соединение C013 [2.5 мг, 0.0054 ммоль] получали по той же методике, как в стадиях 2 и 3 в Примере 92, используя 3c08 [16.0 мг, 0.0394 ммоль], соединение 7a [20.0 мг, 0.0542 ммоль] и тетракис(трифенилфосфин) палладий(0) [10.0 мг, 0.0086 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.68 (1H, тд, J = 57.0, 5.0 Гц), 5.28 (1H, д, J = 1.5 Гц), 4.34 (1H, д, J = 5.9 Гц), 4.12 (1H, ушир.с), 3.05-2.82 (3H, м), 2.51 (1H, дд, J = 10.2, 5.1 Гц), 2.28-2.22 (2H, м), 2.06-1.22 (22H, м), 1.02 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.4 (M+H).
Пример 101
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C014)
Соединение C014 [8.3 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50.0 мг, 0.070 ммоль] и 4-дифторметилпиперидин гидрохлорид [30 мг, 0.222 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 5.65 (1H, тд, J = 56.8, 4.3 Гц), 4.05-3.95 (2H, м), 3.02 (1H, д, J = 11.0 Гц), 2.83 (2H, дд, J = 12.3, 3.0 Гц), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.40 (1H, дд, J = 13.3, 3.2 Гц), 2.27-2.13 (3H, м), 2.05-1.21 (22H, м), 1.02 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 102
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C015)
Соединение C015 [14.2 мг, 0.031 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 4-дифторметилпиперидин гидрохлорид [35 мг, 0.204 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.91 (2H, д, J = 10.7 Гц), 5.76 (2H, тд, J = 56.0, 5.0 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.48 (2H, т, J = 11.5 Гц), 2.88-2.00 (15H, м), 1.91-1.32 (13H, м), 1.10 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.40 (M+H).
Пример 103
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение C016)
Соединение C016 [8.0 мг, 0.017 ммоль] получали по той же методике, как в стадиях 2 и 3 в Примере 100, используя соединение 3c08 [35.7 мг, 0.093 ммоль], полученное на стадии 1 в Примере 100, соединение 7b [50 мг, 0.131 ммоль] и тетракис(трифенилфосфин) палладий(0) [20.0 мг, 0.017 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.67 (1H, тд, J = 56.8, 4.2 Гц), 5.22 (1H, д, J = 1.5 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 3.10 (1H, д, J = 11.2 Гц), 2.89 (2H, дд, J = 16.6, 11.7 Гц), 2.59 (1H, дд, J = 13.4, 4.1 Гц), 2.35 (1H, т, J = 6.1 Гц), 2.21-1.90 (7H, м), 1.86-1.26 (19H, м), 1.03 (6H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.4 (M+H).
Пример 104
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)-4-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C021)
Соединение C021 [18.3 мг, 0.038 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90.0 мг, 0.123 ммоль] и 4-(дифторметил)-4-((триметилсилил)окси)пиперидин [83.2 мг, 0.373 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.51 (1H, т, J = 56.4 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.89 (1H, д, J = 2.4 Гц), 4.34 (1H, т, J = 6.0 Гц), 4.16-4.09 (1H, м), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.79 (1H, д, J = 10.7 Гц), 2.60 (1H, д, J = 11.2 Гц), 2.51 (1H, дд, J = 13.2, 3.4 Гц), 2.45-2.36 (1H, м), 2.34-2.03 (7H, м), 1.98-1.27 (21H, м), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.4 (M+H).
Пример 105
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)-4-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C022)
Соединение C022 [13.4 мг, 0.028 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50.0 мг, 0.069 ммоль] и 4-(дифторметил)-4-((триметилсилил)окси)пиперидин [38.5 мг, 0.172 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.63 (1H, т, J = 56.1 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.42-4.35 (2H, м), 3.19-2.25 (11H, м), 2.09-1.96 (5H, м), 1.90-1.28 (13H, м), 1.11 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.30 (M+H).
Пример 106
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)-4- гидроксипиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4-метиленциклогексан-1,3-диола (Соединение C023)
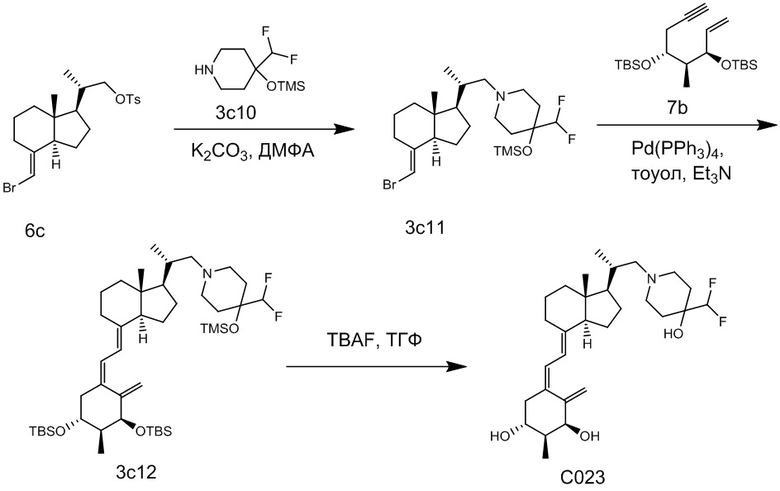
Стадия 1
1-((2S)-2-((1R,3aS,7aR,E)-4-(Бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)-4-(дифторметил)-4-((триметилсилил)окси)пиперидин (Соединение 3c11) [54.2 мг, 0.110 ммоль] получали по той же методике, как на стадии 1 в Примере 92, используя соединение 6c [89.2 мг, 0.202 ммоль] и 4-(дифторметил)-4- ((триметилсилил)окси)пиперидин [94.3 мг, 0.422 ммоль] в качестве исходных веществ.
Стадия 2, Стадия 3
Соединение C023 [16.4 мг, 0.033 ммоль] получали по той же методике, как в стадиях 2 и 3 в Примере 92, используя 3c11 [50.7 мг, 0.103 ммоль], соединение 7b [49.5 мг, 0.129 ммоль] и тетракис(трифенилфосфин) палладий(0) [23.0 мг, 0.020 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.51 (1H, т, J = 56.4 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.89 (1H, д, J = 2.4 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.78 (1H, д, J = 11.2 Гц), 2.59 (2H, дд, J = 13.2, 3.9 Гц), 2.40 (1H, тд, J = 11.6, 2.1 Гц), 2.30 (1H, дд, J = 12.2, 2.4 Гц), 2.19-1.20 (23H, м), 1.04 (6H, д, J = 8.0 Гц), 1.03 (6H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 493.34 (C29H45F2NO3), Набл. масса = 494.40 (M+H).
Пример 107
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение C028)
Соединение C028 [10.0 мг, 0.0225 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90.0 мг, 0.069 ммоль] и 4-метилпиперидин-4-ол [42 мг, 0.365 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.35 (1H, т, J = 6.1 Гц), 4.15-4.10 (1H, м), 3.50-3.18 (4H, м), 3.10-2.92 (2H, м), 2.89-2.86 (1H, м), 2.77 (1H, т, J = 12.0 Гц), 2.51 (1H, дд, J = 13.2, 3.4 Гц), 2.26 (1H, дд, J = 13.2, 6.8 Гц), 2.08-2.01 (3H, м), 1.95-1.30 (17H, м), 1.28 (3H, с), 1.12 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.40 (M+H).
Пример 108
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пиперидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C030a, Соединение C030b)
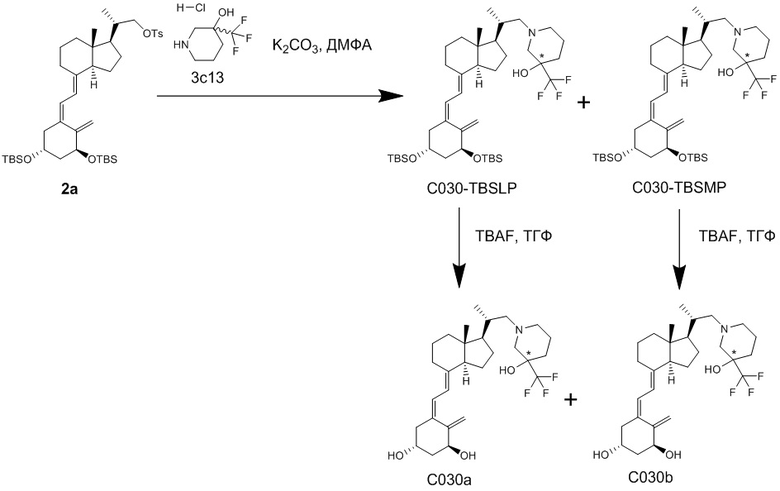
Стадия 1
Раствор соединения (2a) [100 мг, 0.137 ммоль], 3-(трифторметил)пиперидин-3-ол гидрохлорид (Соединение 3c13) [60 мг, 0.292 ммоль] и карбонат калия [60 мг, 0.434 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая целевой продукт с низкой полярностью (Соединение C030-TBSLP) [21.2 мг, 0.0292 ммоль] и целевой продукт с высокой полярностью (Соединение C030-TBSMP) [22.3 мг, 0.0307 ммоль].
Стадия 2a
TBAF [1M раствор в ТГФ, 0.5 мл, 0.5 ммоль] добавляли в раствор соединения C030-TBSLP [21.2 мг, 0.0292 ммоль] в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь гасили насыщенным раствором гидрокарбоната магния, органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом ВЭЖХ, получая соединение C030a [10.3 мг, 0.0207 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.05-2.93 (1H, м), 2.87 (1H, дд, J = 12.2, 3.4 Гц), 2.80 (1H, д, J = 11.7 Гц), 2.53-2.44 (4H, м), 2.25 (1H, дд, J = 13.2, 6.8 Гц), 2.13 (2H, т, J = 11.5 Гц), 2.07-2.00 (4H, м), 1.94-1.24 (20H, м), 1.06 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Стадия 2b
Соединение C030b [9.7 мг, 0.019 ммоль] получали из Соединения C030-TBSMP [22.3 мг, 0.0307 ммоль] проводя реакцию по методике. аналогичной описанной на стадии 2a2a.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 2.98 (1H, д, J = 11.2 Гц), 2.87 (2H, д, J = 11.2 Гц), 2.53 (2H, тд, J = 12.3, 3.1 Гц), 2.45-1.98 (9H, м), 1.92-1.23 (18H, м), 1.05 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Пример 109
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил) пиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4-метиленциклогексан-1,3-диола (Соединение C031a, Соединение C031b)
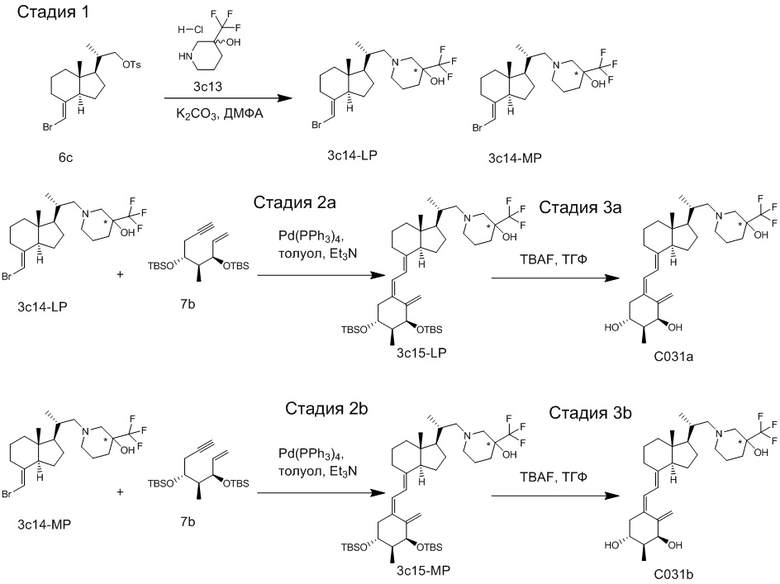
Стадия 1
Карбонат калия [390 мг, 2.82 ммоль] добавляли в раствор [4 мл] соединения 6c [220.6 мг, 0.500 ммоль] и 3-(трифторметил)пиперидин-3-ола гидрохлорида (соединение 3c13) [315 мг, 1.53 ммоль] в ДМФА [4 мл] при комнатной температуре, и полученную смесь нагревали и перемешивали при 60°C в течение 20 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в насыщенный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле получая соединение с низкой полярностью 3c14-LP [65.6 мг, 0.150 ммоль] и соединение с высокой полярностью 3c14-MP [57.2 мг, 0.130 ммоль].
Стадии 2a и 3a (Синтез Соединения C031a)
Стадия 2a
Тетракис(трифенилфосфин) палладий(0) [15 мг, 0.013 ммоль] добавляли в перемешиваемый раствор соединения 3c14-LP [29.9 мг, 0.0682 ммоль], полученного на стадии 1, и соединения 7b [38.7 мг, 0.101 ммоль] в смеси толуол [1 мл]/триэтиламин [1 мл], и смесь нагревали и перемешивали при 100°C в течение 2 часов в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь упаривали при пониженном давлении. Остаток от упаривания грубо очищали методом колоночной хроматографии на силикагеле, получая соединение 3c15-LP [38.5 мг].
Стадия 3a
TBAF [1M раствор в ТГФ, 0.6 мл, 0.6 ммоль] добавляли в раствор соединения 3c15-LP [38.5 мг, 0.052 ммоль] в ТГФ [1 мл], и смесь нагревали и перемешивали при 60°C в течение ночи. После охлаждения до комнатной температуры добавляли насыщенный водный раствор гидрокарбоната натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали, получая соединение C031a [10.5 мг, 0.0205 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.2 Гц), 2.97 (1H, д, J = 11.2 Гц), 2.86 (1H, дд, J = 11.7, 3.4 Гц), 2.77 (1H, д, J = 11.7 Гц), 2.59 (1H, дд, J = 13.4, 4.1 Гц), 2.47-2.41 (2H, м), 2.19-2.00 (5H, м), 1.94-1.23 (17H, м), 1.06 (3H, д, J = 6.3 Гц), 1.03 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 511.33 (C29H44F3NO3), Набл. масса = 512.4 (M+H).
Стадия 2b, Стадия 3b (Синтез Соединения C031b)
Соединение C031b [11.5 мг, 0.0225 ммоль] получали по той же методике, как в стадиях 2a и 3a, используя соединение 3c14-MP [26.6 мг, 0.0595 ммоль], полученное на стадии 1, и соединение 7b [33.2 мг, 0.0868 ммоль] в качестве исходных веществ.
1H-ЯМР (ДМСО-D6) δ: 6.19 (1H, д, J = 11.2 Гц), 5.99 (1H, д, J = 11.2 Гц), 5.58 (1H, с), 5.17 (1H, д, J = 2.4 Гц), 4.77 (1H, д, J = 2.9 Гц), 4.75 (1H, д, J = 4.4 Гц), 4.57 (1H, д, J = 3.4 Гц), 4.15 (1H, т, J = 2.4 Гц), 3.61 (1H, ушир.с), 2.79 (1H, дд, J = 12.7, 3.9 Гц), 2.66 (1H, д, J = 10.7 Гц), 2.46 (2H, дд, J = 14.9, 3.7 Гц), 2.18 (1H, дд, J = 12.2, 2.9 Гц), 2.11-1.13 (23H, м), 0.96 (3H, д, J = 6.3 Гц), 0.85 (3H, д, J = 6.8 Гц), 0.52 (3H, с).
Точная масса = 511.33 (C29H44F3NO3), Набл. масса = 512.4 (M+H).
Пример 110
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C032a, Соединение C032b)
Соединение C032a [11.0 мг, 0.0221 ммоль] и соединение C032b [14.4 мг, 0.0289 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2c) [110 мг, 151 ммоль] и 3-(трифторметил)пиперидин-3-ол гидрохлорид (Соединение 3c13) [125 mg 0.608 ммоль] в качестве исходных веществ.
Соединение C032a
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.39 (2H, ддд, J = 13.9, 7.1, 4.4 Гц), 3.00 (1H, д, J = 10.7 Гц), 2.88-2.77 (2H, м), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.50-2.46 (3H, м), 2.31-2.25 (2H, м), 2.16-2.00 (5H, м), 1.98-1.48 (12H, м), 1.39-1.21 (3H, м), 1.07 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Соединение C032b
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 7.0 Гц), 4.42-4.33 (2H, м), 3.03 (1H, д, J = 11.7 Гц), 2.93 (1H, д, J = 11.7 Гц), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.69-2.60 (2H, м), 2.50-2.25 (6H, м), 2.09-2.00 (4H, м), 1.93-1.25 (14H, м), 1.06 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Пример 111
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-(дифторметил)-3-гидроксипиперидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C034a, Соединение C034b)
Соединение C034a [8.2 мг, 0.017 ммоль] и соединение C034b [3.7 мг, 0.0077 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2a) [100 мг, 0.137 ммоль] и 3-(дифторметил)пиперидин-3-ол гидрохлорид [50 мг, 0.267 ммоль] в качестве исходных веществ.
Соединение C034a
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.85 (1H, т, J = 55.9 Гц), 5.29 (1H, дд, J = 2.4, 1.0 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.16-4.10 (1H, м), 2.90-2.75 (3H, м), 2.54-2.42 (4H, м), 2.32-2.18 (2H, м), 2.07-1.99 (3H, м), 1.94-1.24 (18H, м), 1.06 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.45 (M+H).
Соединение C034b
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.84 (1H, т, J = 55.9 Гц), 5.29 (1H, т, J = 1.2 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.16-4.10 (1H, м), 2.88 (1H, дд, J = 12.4, 3.2 Гц), 2.67-2.40 (6H, м), 2.26 (1H, дд, J = 13.4, 7.1 Гц), 2.15 (1H, т, J = 11.2 Гц), 2.09-1.98 (2H, м), 1.91-1.22 (17H, м), 1.04 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.35 (M+H).
Пример 112
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-(дифторметил)-3-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C035a, Соединение C035b)
Соединение C035a [15.5 мг, 0.033 ммоль] и соединение C035b [15.0 мг, 0.032 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2b) [116.1 мг, 0.162 ммоль] и 3-(дифторметил)пиперидин-3-ол гидрохлорид [70.0 мг, 0.373 ммоль] в качестве исходных веществ.
Соединение C035a
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 5.89 (1H, т, J = 56.0 Гц), 4.07-3.96 (2H, м), 2.84 (1H, дд, J = 11.5, 4.1 Гц), 2.67-2.55 (2H, м), 2.49-2.35 (2H, м), 2.29-2.04 (7H, м), 2.01-1.21 (19H, м), 1.02 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.35 (M+H).
Соединение C035b
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 5.85 (1H, т, J = 56.0 Гц), 4.06-3.94 (2H, м), 2.83 (1H, дд, J = 11.5, 3.7 Гц), 2.59 (1H, дд, J = 13.2, 3.4 Гц), 2.46-1.50 (28H, м), 1.37-1.25 (3H, м), 1.02 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.35 (M+H).
Пример 113
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-(дифторметил)-3-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C036a, Соединение C036b)
Соединение C036a [17.0 мг, 0.0354 ммоль] и соединение C036b [14.5 мг, 0.030 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2c) [100 мг, 0.137 ммоль] и 3-(дифторметил)пиперидин-3-ол гидрохлорид [49.8 мг, 329 ммоль] в качестве исходных веществ.
Соединение C036a
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.84 (1H, т, J = 57.0 Гц), 5.06 (2H, д, J = 6.3 Гц), 4.40 (2H, ддд, J = 14.1, 7.1, 4.4 Гц), 2.86 (1H, дд, J = 12.2, 3.4 Гц), 2.80 (2H, д, J = 11.7 Гц), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.56 (1H, дд, J = 11.7, 3.2 Гц), 2.51-2.45 (3H, м), 2.33-2.20 (3H, м), 2.10-2.00 (2H, м), 1.94-1.26 (14H, м), 1.07 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.40 (M+H).
Соединение C036b
1H-ЯМР (CD3OD) δ: 6.28 (1H, д, J = 10.7 Гц), 5.93 (1H, д, J = 10.0 Гц), 5.81 (1H, т, J = 55.0 Гц), 5.06 (2H, д, J = 7.0 Гц), 4.45-4.36 (2H, м), 3.01-1.99 (16H, м), 1.94-1.29 (14H, м), 1.07 (3H, д, J = 6.3 Гц), 0.65 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.40 (M+H).
Пример 114
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C037a, Соединение C037b)
Соединение C037a [8.1 мг, 0.018 ммоль] и соединение C037b [10.2 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2a) [90 мг, 0.123 ммоль] и 3-метилпиперидин-3-ол [42 мг, 0.365 ммоль] в качестве исходных веществ.
Соединение C037a
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.12-4.06 (1H, м), 2.87 (1H, дд, J = 12.3, 3.0 Гц), 2.51 (1H, дд, J = 13.3, 3.2 Гц), 2.28-1.21 (24H, м), 1.18 (3H, с), 1.03 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Соединение C037b
1H-ЯМР (ДМСО-D6) δ: 6.19 (1H, д, J = 11.4 Гц), 5.98 (1H, д, J = 11.4 Гц), 5.22 (1H, д, J = 1.4 Гц), 4.88 (1H, д, J = 5.0 Гц), 4.75 (1H, д, J = 1.8 Гц), 4.56 (1H, д, J = 3.7 Гц), 4.25-3.95 (3H, м), 2.79 (1H, дд, J = 11.0, 4.0 Гц), 2.36 (1H, д, J = 13.7 Гц), 2.18-1.15 (23H, м), 1.11 (3H, с), 0.96 (3H, д, J = 6.4 Гц), 0.52 (3H, с).
Пример 115
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-гидрокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C038)
Соединение C038 [13.9 мг, 0.032 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-3-метилпиперидин-3-ол гидрохлорид [30 мг, 0.198 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.05-3.94 (2H, м), 2.83 (1H, дд, J = 12.2, 3.9 Гц), 2.59 (1H, дд, J = 13.2, 3.4 Гц), 2.42-2.13 (7H, м), 2.07-1.21 (21H, м), 1.18 (3H, с), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.30 (M+H).
Пример 116
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C039)
Соединение C039 [10.9 мг, 0.025 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-3-метилпиперидин-3-ол [30 мг, 0.198 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.2, 3.4 Гц), 2.59 (1H, дд, J = 13.2, 3.4 Гц), 2.40 (1H, дд, J = 13.2, 3.4 Гц), 2.31-1.20 (26H, м), 1.18 (3H, с), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.30 (M+H).
Пример 117
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-гидрокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C040)
Соединение C040 [7.3 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-3-метилпиперидин-3-ол [30 мг, 0.198 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.35 (2H, м), 2.85 (1H, дд, J = 11.7, 3.4 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.43-2.25 (6H, м), 2.10-1.90 (5H, м), 1.76-1.21 (15H, м), 1.18 (3H, с), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 118
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C041)
Соединение C041 [8.2 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-3-метилпиперидин-3-ол [30 мг, 0.198 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 2.85 (1H, дд, J = 12.2, 3.4 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (2H, дд, J = 13.4, 3.7 Гц), 2.31-2.25 (4H, м), 2.15-1.88 (6H, м), 1.68-1.21 (14H, м), 1.18 (3H, с), 1.03 (3H, д, J = 6.3 Гц), 0.62 (3H, д, J = 14.6 Гц).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 119
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-этил-3-гидроксипиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C042a, Соединение C042b)
Соединение C042a [18.0 мг, 0.041 ммоль] и соединение C042b [5.7 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2a) [100 мг, 0.137 ммоль] и 3-этилпиперидин-3-ол [40 мг, 0.310 ммоль] в качестве исходных веществ.
Соединение C042a
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.10 (1H, м), 2.86 (1H, дд, J = 12.6, 3.0 Гц), 2.51 (2H, дд, J = 13.0, 3.0 Гц), 2.25 (3H, дд, J = 13.3, 6.4 Гц), 2.10-1.85 (8H, м), 1.73-1.25 (15H, м), 1.03 (3H, д, J = 6.4 Гц), 0.89 (3H, т, J = 7.5 Гц), 0.59 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Соединение C042b
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.07 (1H, м), 2.86 (1H, дд, J = 12.3, 4.6 Гц), 2.51 (1H, дд, J = 13.3, 3.2 Гц), 2.42-2.20 (5H, м), 2.07-1.20 (22H, м), 1.03 (3H, д, J = 6.4 Гц), 0.90 (3H, т, J = 7.5 Гц), 0.59 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Пример 120
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-метокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C043a, Соединение C043b)
Соединение C043a [5.2 мг, 0.011 ммоль] и соединение C043b [18.5 мг, 0.040 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2a) [100 мг, 0.310 ммоль] и 3-метокси-3-метилпиперидин [40 мг, 0.310 ммоль] в качестве исходных веществ.
Соединение C043a
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.22 (3H, с), 2.86 (1H, дд, J = 11.9, 3.7 Гц), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.42 (1H, ушир.с), 2.28-2.20 (5H, м), 2.07-1.87 (6H, м), 1.68-1.21 (13H, м), 1.17 (3H, с), 1.02 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Соединение C043b
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, д, J = 0.9 Гц), 4.34 (1H, т, J = 5.7 Гц), 4.13-4.08 (1H, м), 3.20 (3H, с), 2.86 (1H, дд, J = 12.1, 4.3 Гц), 2.58-2.48 (2H, м), 2.35-2.20 (4H, м), 2.07-1.21 (20H, м), 1.17 (3H, с), 1.03 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Пример 121
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-этил-3-гидроксипиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C044a, Соединение C044b)
Соединение C044a [15.8 мг, 0.035 ммоль] и соединение C044b [7.5 мг, 0.017 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2b) [100 мг, 0.139 ммоль] и 3-этилпиперидин-3-ол [40 мг, 0.310 ммоль] в качестве исходных веществ.
Соединение C044a
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 2.84 (1H, дд, J = 12.3, 3.2 Гц), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.29-1.20 (27H, м), 1.03 (3H, д, J = 6.4 Гц), 0.89 (3H, т, J = 7.3 Гц), 0.60 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Соединение C044b
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.0, 4.0 Гц), 2.59 (1H, дд, J = 14.0, 4.0 Гц), 2.42-1.21 (33H, м), 1.03 (3H, д, J = 6.4 Гц), 0.90 (3H, т, J = 7.3 Гц), 0.60 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 122
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-метокси-3-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C045a, Соединение C045b)
Соединение C045a [6.5 мг, 0.015 ммоль] и соединение C045b [18.4 мг, 0.041 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2b) [100 мг, 0.139 ммоль] и 3-метокси-3-метилпиперидин [40 мг, 0.310 ммоль] в качестве исходных веществ.
Соединение C045a
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 3.22 (3H, с), 2.83 (1H, дд, J = 12.1, 3.9 Гц), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.40 (2H, дд, J = 13.3, 3.7 Гц), 2.26-2.11 (6H, м), 2.07-1.51 (17H, м), 1.37-1.19 (4H, м), 1.17 (3H, с), 1.02 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Соединение C045b
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 3.21 (3H, с), 2.83 (1H, дд, J = 11.0, 4.6 Гц), 2.59 (2H, дд, J = 13.7, 3.7 Гц), 2.57-2.52 (2H, ушир.м), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.30-1.21 (26H, м), 1.17 (3H, с), 1.04 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 123
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-этил-3-гидроксипиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C046a, Соединение C046b)
Соединение C046a [16.8 мг, 0.037 ммоль] и соединение C046b [15.3 мг, 0.033 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2c) [100 мг, 0.137 ммоль] и 3-этилпиперидин-3-ол [60 мг, 0.464 ммоль] в качестве исходных веществ.
Соединение C046a
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.33 (2H, м), 2.85 (1H, дд, J = 12.2, 3.4 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.57-2.49 (1H, ушир.м), 2.48 (1H, дд, J = 10.0, 5.0 Гц), 2.31-1.88 (11H, м), 1.68-1.25 (16H, м), 1.03 (3H, д, J = 6.3 Гц), 0.89 (3H, т, J = 7.6 Гц), 0.60 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.35 (M+H).
Соединение C046b
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.45-4.35 (2H, м), 2.85 (1H, дд, J = 11.0, 3.8 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.42-2.25 (6H, м), 2.07-1.88 (6H, м), 1.76-1.21 (17H, м), 1.03 (3H, д, J = 6.3 Гц), 0.90 (3H, т, J = 7.6 Гц), 0.60 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.35 (M+H).
Пример 124
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-метокси-3-метилпиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C047a, Соединение C047b)
Соединение C047a [18.1 мг, 0.040 ммоль] и соединение C047b [14.9 мг, 0.033 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2c) [100 мг, 0.137 ммоль] и 3-метокси-3-метилпиперидин [60 мг, 0.464 ммоль] в качестве исходных веществ.
Соединение C047a
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.05 (2H, т, J = 3.9 Гц), 4.42-4.36 (2H, м), 3.22 (3H, с), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.40-1.85 (12H, м), 1.70-1.20 (15H, м), 1.17 (3H, с), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.35 (M+H).
Соединение C047b
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 3.20 (3H, с), 2.85 (1H, дд, J = 12.2, 3.9 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.56 (1H, с), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.31-1.20 (28H, м), 1.17 (3H, с), 1.04 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.35 (M+H).
Пример 125
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C048)
Соединение C048 [6.0 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и (S)-3-(дифторметил)пиперидин гидрохлорид (CAS 2227197-58-0) [90 мг, 0.524 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 56.7, 4.7 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.05-2.70 (3H, м), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.42 (1H, д, J = 9.8 Гц), 2.30-2.15 (3H, м), 2.10-1.96 (4H, м), 1.91-1.21 (18H, м), 1.04 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.50 (M+H).
Пример 126
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C049)
Соединение C049 [5.3 мг, 0.011 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-3- (дифторметил)пиперидин гидрохлорид [50 мг, 0.291 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (2H, д, J = 11.2 Гц), 5.74 (2H, тд, J = 56.5, 5.0 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.45-4.35 (2H, м), 2.92-2.82 (2H, м), 2.69-2.61 (2H, м), 2.48 (1H, дд, J = 12.9, 4.1 Гц), 2.31-1.21 (28H, м), 1.02 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.50 (M+H).
Пример 127
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение C050)
Соединение C050 [6.0 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и (S)-3- (дифторметил)пиперидин гидрохлорид [50 мг, 0.291 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.74 (1H, тд, J = 56.8, 4.9 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 2.92-2.80 (2H, м), 2.64-2.57 (2H, м), 2.27 (1H, дд, J = 12.2, 2.9 Гц), 2.21-1.93 (7H, м), 1.81-1.20 (17H, м), 1.03 (3H, д, J = 7.1 Гц), 1.02 (3H, д, J = 6.5 Гц), 0.59 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.50 (M+H).
Пример 128
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C051)
Соединение C051 [12.2 мг, 0.026 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-3-(2,2-дифторэтил)пиперидин гидрохлорид [35 мг, 0.189 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 6.10-5.79 (2H, м), 4.06-3.95 (2H, м), 2.90-2.81 (2H, м), 2.70-2.60 (1H, м), 2.59 (1H, дд, J = 13.7, 3.7 Гц), 2.41 (1H, дд, 13.3, 3.2 Гц), 2.27-2.13 (3H, м), 2.07-1.47 (20H, м), 1.37-1.20 (3H, м), 1.02 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.25 (M+H).
Пример 129
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C052)
Соединение C052 [13.9 мг, 0.029 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и (S)-3- (1,1-дифторэтил)пиперидин гидрохлорид [100 мг, 0.539 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 5.85 (1H, д, J = 10.7 Гц), 5.63 (1H, д, J = 11.2 Гц), 4.82 (1H, дд, J = 2.4, 1.5 Гц), 3.88 (1H, т, J = 6.1 Гц), 3.70-3.60 (1H, м), 2.78 (1H, д, J = 8.3 Гц), 2.57 (1H, д, J = 11.7 Гц), 2.41 (1H, дд, J = 12.0, 3.7 Гц), 2.15 (1H, дд, J = 12.7, 2.9 Гц), 2.05 (1H, дд, J = 13.2, 3.4 Гц), 1.94-1.53 (9H, м), 1.46-0.80 (22H, м), 0.60 (3H, д, J = 6.8 Гц), 0.16 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.50 (M+H).
Пример 130
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C053)
Соединение C053 [7.8 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-3-(1,1- дифторэтил)пиперидин гидрохлорид [50 мг, 0.269 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.5 Гц), 4.43-4.35 (2H, м), 3.20 (1H, д, J = 10.7 Гц), 2.99-2.93 (1H, м), 2.90-2.81 (1H, м), 2.69-1.94 (12H, м), 1.88-1.49 (13H, м), 1.40-1.20 (4H, м), 1.06 (3H, д, J = 6.8 Гц), 0.63 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.50 (M+H).
Пример 131
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение C054)
Соединение C054 [8.0 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2g) [50 мг, 0.067 ммоль] и (S)-3-(1,1- дифторэтил)пиперидин гидрохлорид [50 мг, 0.269 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.2 Гц), 3.13 (1H, д, J = 9.3 Гц), 2.87 (2H, д, J = 12.2 Гц), 2.59 (1H, дд, J = 13.7, 3.9 Гц), 2.43 (1H, д, J = 12.2 Гц), 2.31-1.98 (9H, м), 1.89-1.17 (27H, м), 1.04 (3H, д, J = 6.3 Гц), 1.04 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 491.36 (C30H47F2NO2), Набл. масса = 492.55 (M+H).
Пример 132
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(1,1-дифторэтил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C055)
Соединение C055 [25.0 мг, 0.0523 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [95.0 мг, 0.130 ммоль] и 4-(1,1- дифторэтил)пиперидин гидрохлорид [75.0 мг, 0.404 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.35 (2H, м), 3.15 (1H, д, J = 11.7 Гц), 2.98-2.83 (2H, м), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.39-1.92 (9H, м), 1.86-1.23 (19H, м), 1.04 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 477.34 (C29H45F2NO2) Obs. mass =478.45 (M+H).
Пример 133
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(2,2-дифторэтил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C059)
Соединение C059 [32.1 мг, 0.0672 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [95.0 мг, 0.130 ммоль] и 4-(2,2-дифторэтил)пиперидин гидрохлорид [75.0 мг, 0.404 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.99 (2H, тт, J = 57.0, 5.0 Гц), 5.92 (2H, д, J = 11.0 Гц), 5.05 (2H, д, J = 8.0 Гц), 4.43-4.35 (2H, м), 3.43 (1H, д, J = 12.7 Гц), 2.87-2.57 (6H, м), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.32-2.25 (2H, м), 2.09-1.96 (5H, м), 1.90-1.28 (16H, м), 1.10 (3H, д, J = 6.3 Гц), 0.64 (3H, с).
Точная масса = 477.34 (C29H45F2NO2) Obs. mass =478.45 (M+H).
Пример 134
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-морфолинопропан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D001)
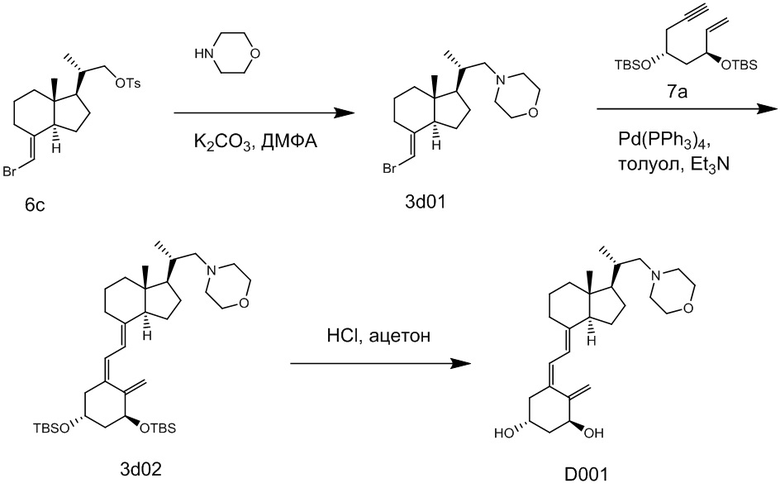
Стадия 1
4-((2S)-2-((1R,3aS,7aR,E)-4-(Бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)морфолин (Соединение 3d01) [317.6 мг, 0.891 ммоль] получали путем проведения реакции аналогично стадии 1 в Примере 92, используя соединение 6c [437.6 мг, 0.991 ммоль] и морфолин [0.26 мл, 3.0 ммоль] в качестве исходных веществ.
Стадия 2
Соединение D001 [7.7 мг, 0.019 ммоль] получали по той же методике, как на стадии 2 и стадия 3 в Примере 92, используя соединение 3d01 [38 мг, 0.107 ммоль], полученное на стадии 1, соединение 7a [53.2 мг, 0.144 ммоль] и тетракистрифенилфосфин палладий(0) [15.0 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.89 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.08 (1H, м), 3.76-3.66 (5H, м), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.72-2.64 (3H, м), 2.53-2.40 (5H, м), 2.27-2.16 (3H, м), 2.11-1.98 (3H, м), 1.93-1.84 (4H, м), 1.79-1.25 (12H, м), 1.08-1.06 (1H, м), 1.05 (3H, д, J = 6.0 Гц), 0.60 (3H, с).
Точная масса = 415.31 (C26H41NO3), Набл. масса = 416.40 (M+H).
Пример 135
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-морфолинопропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D002)
Соединение D002 [2.6 мг, 0.006 ммоль] получали по той же методике, как на стадии 2 и стадия 3 в Примере 92, используя соединение 3d01 [38 мг, 0.107 ммоль], полученное на стадии 1 в Примере 134, соединение 7b [55.7 мг, 0.146 ммоль] и тетракис(трифенилфосфин) палладий(0) [15.0 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.4 Гц), 4.89 (1H, с), 4.22 (1H, д, J = 3.4 Гц), 3.75-3.61 (6H, м), 2.87 (1H, д, J = 12.7 Гц), 2.59 (1H, дд, J = 13.7, 4.4 Гц), 2.54-2.46 (2H, м), 2.25 (3H, дд, J = 12.2, 2.9 Гц), 2.17 (1H, дд, J = 13.4, 8.1 Гц), 2.06-1.21 (14H, м), 1.03 (3H, д, J = 6.6 Гц), 1.03 (3H, д, J = 7.0 Гц), 0.59 (3H, д, J = 7.3 Гц).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.40 (M+H).
Пример 136
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-морфолинопропан-2-ил)- октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D004)
Соединение D004 [9.2 мг, 0.023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.07 ммоль] и морфолин [0.05 мл] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.12-3.95 (2H, м), 3.72-3.61 (4H, м), 2.83 (1H, дд, J = 13.4, 3.7 Гц), 2.59 (1H, дд, J = 13.4, 3.7 Гц), 2.53-2.49 (2H, м), 2.40 (1H, дд, J = 13.7, 3.4 Гц), 2.28-2.13 (5H, м), 2.06-1.21 (17H, м), 1.03 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 403.31 (C25H41NO3), Набл. масса = 404.30 (M+H).
Пример 137
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(дифторметил)морфолино)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D005)
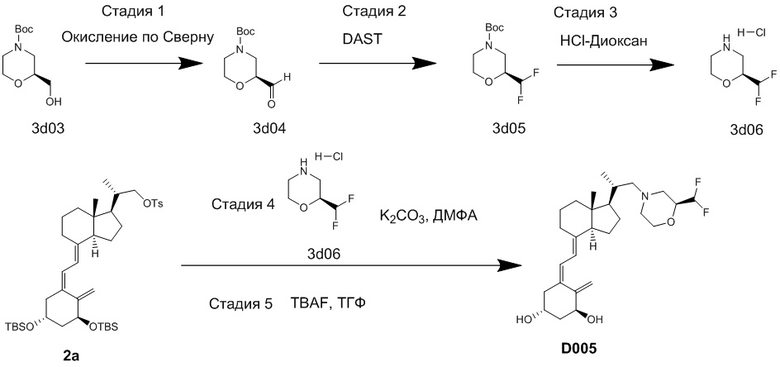
Стадия 1
При охлаждении до -78°C добавляли раствор диметилсульфоксида [1 мл, 14 ммоль] в дихлорметане [4 мл] в раствор оксалилхлорида [0.6 мл, 7 ммоль] в дихлорметане [9 мл], и полученную смесь перемешивали при той же температуре в течение 10 минут. Добавляли раствор т-бутил-(S)-2-(гидроксиметил)морфолин-4-карбоксилата (Соединение 3d03) [1.0 г, 4.6 ммоль] в дихлорметане [10 мл]. Смесь перемешивали при -78°C в течение 45 минут. Добавляли триэтиламин [3.3 мл, 23 ммоль], и смесь дополнительно перемешивали при той же температуре 30 минут. Реакционную смесь нагревали до 0°C и перемешивали при той же температуре 30 минут. Реакционную смесь гасили водой и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-(S)-2-формилморфолин-4- карбоксилат (Соединение 3d04) [0.72 г, 3.3 ммоль] (выход = 73%).
Стадия 2
Раствор т-бутил-(S)-2-формилморфолин-4-карбоксилата (Соединение 3d04) [0.72 г, 3.3 ммоль] в дихлорметане [20 мл] охлаждали до 0°C, добавляли диэтиламиносеры трифторид (DAST) [1 мл, 7.57 ммоль], и смесь перемешивали в течение ночи. Реакционную смесь охлаждали до 0°C, гасили водой и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая т-бутил-(S)-2-(дифторметил)морфолин-4- карбоксилат (Соединение 3d05) [0.58 г, 2.4 ммоль] (выход = 53%).
Стадия 3
4М раствор хлороводорода в диоксане [10 мл, 40 ммоль] добавляли к т-бутил-(S)-2-(дифторметил)морфолин-4-карбоксилату (Соединение 3d05) [0.58 г, 2.4 ммоль], и полученную смесь перемешивали в течение ночи. Реакционную смесь упаривали при пониженном давлении и сушили, получая (S)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d06) [382.5 мг, 2.20 ммоль] (выход = 90%).
1H-ЯМР (ДМСО-D6) δ: 9.79 (2H, с), 6.13 (1H, тд, J = 54.0, 3.3 Гц), 4.18-4.09 (1H, м), 4.03 (1H, дд, J = 12.7, 3.9 Гц), 3.85 (1H, тд, J = 12.4, 2.4 Гц), 3.27 (1H, д, J = 12.2 Гц), 3.20 (1H, д, J = 13.2 Гц), 2.99 (1H, тд, J = 12.4, 4.0 Гц), 2.92 (1H, т, J = 12.0 Гц).
Стадия 4 и стадия 5
Соединение D005 [6.0 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и соединение (3d06) [65 мг, 0.374 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 55.4, 4.2 Гц), 5.28 (1H, дд, J = 2.2, 1.2 Гц), 4.89 (1H, д, J = 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.09 (1H, м), 3.86 (1H, д, J = 10.7 Гц), 3.70-3.61 (2H, м), 2.89-2.80 (2H, м), 2.57-2.49 (2H, м), 2.31-2.23 (3H, м), 2.07-1.21 (18H, м), 1.04 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 138
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(дифторметил)морфолино) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D006)
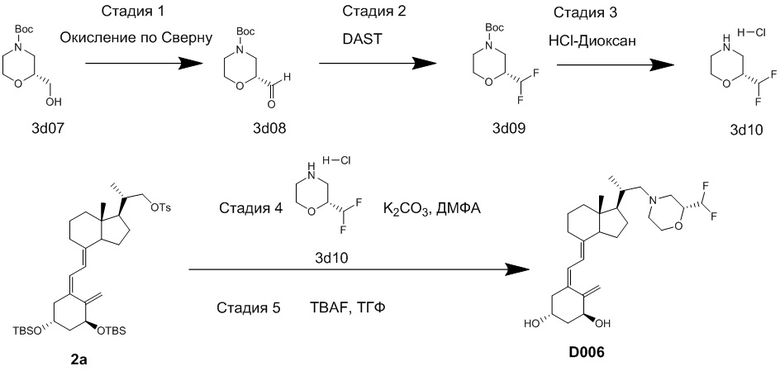
Стадия 1
т-бутил-(R)-2-формилморфолин-4-карбоксилат (Соединение 3d08) [0.70 г, 3.3 ммоль] получали по той же методике, как на стадии 1 в Примере 137, используя т-бутил-(R)-2-(гидроксиметил)морфолин-4-карбоксилат (Соединение 3d07) [1.00 г, 3.3 ммоль] в качестве исходного вещества. (выход = 71%)
Стадия 2
т-бутил-(R)-2-(дифторметил)морфолин-4-карбоксилат (Соединение 3d09) [0.55 г, 2.3 ммоль] получали по той же методике, как на стадии 2 в Примере 137, используя т-бутил-(R)-2-формилморфолин-4-карбоксилат (Соединение 3d08) [0.70 г, 3.3 ммоль] в качестве исходного вещества. (выход = 50%)
Стадия 3
(R)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d10) [384.8 мг, 2.22 ммоль] получали по той же методике, как на стадии 3 в Примере 137, используя т-бутил-(R)-2-(дифторметил)морфолин-4-карбоксилат (Соединение 3d09) [0.55 г, 2.3 ммоль] в качестве исходного вещества. (выход = 96%)
1H-ЯМР (ДМСО-D6) δ: 9.62 (2H, с), 6.13 (1H, тд, J = 54.0, 3.3 Гц), 4.11 (1H, тдд, J = 14.8, 7.6, 3.8 Гц), 4.03 (1H, дд, J = 12.7, 3.9 Гц), 3.83 (1H, тд, J = 12.4, 2.4 Гц), 3.28 (1H, д, J = 12.2 Гц), 3.20 (1H, дд, J = 12.0, 2.4 Гц), 3.00 (1H, тд, J = 12.0, 3.9 Гц), 2.93 (1H, т, J = 12.0 Гц).
Стадия 4 и стадия 5
Соединение D006 [7.6 мг, 0.016 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [90 мг, 0.123 ммоль] и соединение (3d10) [65 мг, 0.374 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.76 (1H, тд, J = 55.4, 4.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 6.1 Гц), 4.15-4.09 (1H, м), 3.88 (1H, дт, J = 11.4, 2.6 Гц), 3.78-3.69 (1H, м), 3.61 (1H, тд, J = 11.2, 2.4 Гц), 2.87 (1H, дд, J = 12.2, 3.4 Гц), 2.71 (2H, дд, J = 28.8, 11.2 Гц), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.31 (1H, дд, J = 12.2, 2.9 Гц), 2.25 (1H, дд, J = 13.7, 6.8 Гц), 2.16 (1H, т, J = 10.7 Гц), 2.07-1.99 (4H, м), 1.96-1.26 (14H, м), 1.04 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 139
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(дифторметил)морфолино)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D007)
Соединение D007 [17.0 мг, 0.037 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [90 мг, 0.123 ммоль] и соединение (3d06) [65 мг, 0.374 ммоль], описанное в Примере 137, в качестве исходных веществ.
1H-ЯМР (ДМСО-D6) δ: 6.14 (2H, д, J = 11.2 Гц), 6.02 (2H, тд, J = 55.0, 4.0 Гц), 5.82 (1H, д, J = 11.2 Гц), 4.93-4.75 (2H, м), 4.91 (2H, д, J = 6.0 Гц), 4.24 (2H, тд, J = 4.0, 16.0 Гц), 3.83 (1H, д, J = 10.7 Гц), 3.67-3.47 (2H, м), 2.78 (2H, д, J = 10.7 Гц), 2.55-2.50 (2H, м), 2.34 (1H, дд, J = 12.9, 3.7 Гц), 2.22-1.18 (21H, м), 0.98 (3H, д, J = 6.3 Гц), 0.54 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.35 (M+H).
Пример 140
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(дифторметил)морфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D008)
Соединение D008 [17.3 мг, 0.037 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [90 мг, 0.123 ммоль] и соединение (3d10) [65 мг, 0.374 ммоль], описанное в Примере 138, в качестве исходных веществ.
1H-ЯМР (ДМСО-D6) δ: 6.14 (2H, д, J = 11.2 Гц), 6.01 (2H, тд, J = 55.0, 4.0 Гц), 5.82 (1H, д, J = 11.2 Гц), 4.91 (2H, д, J = 10.0 Гц), 4.89-4.80 (1H, м), 4.28-4.21 (2H, м), 3.84 (1H, д, J = 11.2 Гц), 3.74-3.65 (1H, м), 3.58-3.45 (2H, м), 2.79-2.74 (1H, м), 2.69 (1H, д, J = 11.7 Гц), 2.62 (1H, д, J = 11.2 Гц), 2.53 (1H, д, J = 6.0 Гц), 2.34 (1H, дд, J = 13.2, 3.4 Гц), 2.23-1.77 (9H, м), 1.65-1.18 (10H, м), 0.98 (3H, д, J = 6.3 Гц), 0.53 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.40 (M+H).
Пример 141
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(2-(трифторметил) морфолино)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D009a, Соединение D009b)
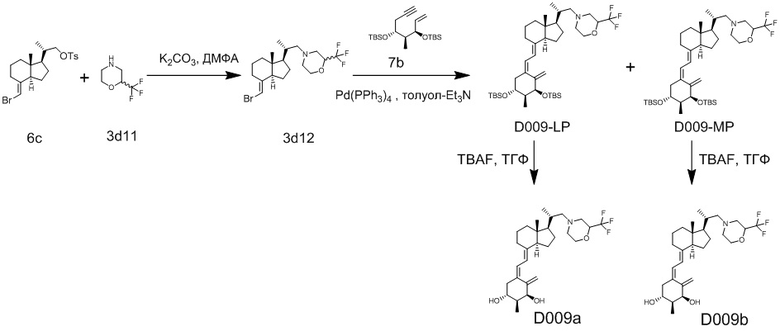
Стадия 1
Суспензию соединения 6c [203 мг, 0.46 ммоль], 2-(трифторметил)морфолина (соединение 3d11) [153 мг, 0.986 ммоль] и карбоната калия [227 мг, 1.64 ммоль] в ДМФА [5 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания частично очищали методом колоночной хроматографии на силикагеле, получая соединение 3d12 [92.3 мг, 0.218 ммоль] в виде смеси диастереомеров.
Стадия 2
Тетракис(трифенилфосфин) палладий(0) [25 мг, 0.021 ммоль] добавляли в перемешиваемый раствор соединения 3d12 [92.3 мг, 0.218 ммоль], полученного на стадии 1, и соединения 7b [90 мг, 0.235 ммоль] в смеси толуол [1 мл]/триэтиламин [1 мл], и смесь нагревали и перемешивали при 100°C в течение 2 часов в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь упаривали при пониженном давлении. Остаток от упаривания грубо очищали методом препаративной тонкослойной хроматографии, получая менее полярное соединение D009-LP [56.3 мг] и более полярное соединение D009-MP [42.0 мг].
D009-LP: Точная масса = 725.48 (C40H70F3NO3Si2), Набл. масса = 726.60 (M+H).
D009-MP: Точная масса = 725.48 (C40H70F3NO3Si2), Набл. масса = 726.60 (M+H).
Стадия 3a
TBAF [1M раствор в ТГФ, 1 мл] добавляли в раствор соединения D009-LP [56.3 мг], полученного на стадии 2, в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение D009a [16.7 мг, 0.0336 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.89 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 4.05-3.96 (1H, м), 3.92 (1H, дд, J = 11.0, 3.0 Гц), 3.72 (1H, тд, J = 8.1, 4.4 Гц), 3.63 (1H, тд, J = 11.3, 2.3 Гц), 2.87 (1H, дд, J = 11.0, 4.4 Гц), 2.77 (2H, д, J = 11.7 Гц), 2.59 (1H, дд, J = 13.4, 4.1 Гц), 2.32 (1H, дд, J = 12.2, 2.9 Гц), 2.23-2.14 (2H, м), 2.06-1.18 (18H, м), 1.03 (6H, д, J = 7.3 Гц), 0.58 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Стадия 3b
Соединение D009b [9.1 мг, 0.018 ммоль] получали по той же методике, как на стадии 3a, используя D009-MP [42.0 мг] в качестве исходного вещества.
1H-ЯМР (ДМСО-D6) δ: 6.19 (1H, д, J = 10.7 Гц), 5.99 (1H, д, J = 11.2 Гц), 5.17 (1H, д, J = 2.4 Гц), 4.77 (1H, д, J = 2.4 Гц), 4.75 (1H, д, J = 4.4 Гц), 4.57 (1H, д, J = 4.4 Гц), 4.15 (1H, т, J = 3.7 Гц), 4.10-4.00 (1H, м), 3.89 (1H, д, J = 10.2 Гц), 3.66-3.55 (2H, м), 2.88 (1H, д, J = 10.2 Гц), 2.79 (1H, д, J = 9.3 Гц), 2.56 (2H, д, J = 11.7 Гц), 2.25-1.16 (22H, м), 0.97 (3H, д, J = 5.9 Гц), 0.85 (3H, д, J = 6.8 Гц), 0.53 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Пример 142
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилморфолино)пропан-2- ил)-октагидро-4H-инден-4-илиден)этилиден)-2-метилен-циклогексан-1,3-диола (Соединение D010)
Соединение (D010) [11.6 мг, 0.027 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-2-метилморфолин гидрохлорид [30 мг, 0.297 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.35 (2H, м), 3.79 (1H, дд, J = 11.5, 1.7 Гц), 3.68-3.57 (2H, м), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.75 (1H, д, J = 11.7 Гц), 2.69-2.61 (2H, м), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.31-2.22 (3H, м), 2.07-1.82 (6H, м), 1.70-1.49 (6H, м), 1.38-1.25 (3H, м), 1.10 (3H, д, J = 6.3 Гц), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.35 (M+H).
Пример 143
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-окса-7-азаспиро[2.5]октан-7-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D011)
Соединение (D011) [11.3 мг, 0.0256 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 4-окса- 7-азаспиро[2,5]октан гидрохлорид [35 мг, 0.234 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.92 (1H, д, J = 10.7 Гц), 5.06 (2H, д, J = 7.3 Гц), 4.43-4.37 (2H, м), 3.80-3.68 (2H, м), 2.86 (1H, дд, J = 12.2, 3.9 Гц), 2.68 (1H, дд, J = 13.7, 4.4 Гц), 2.57-2.25 (8H, м), 2.08-1.90 (4H, м), 1.71-1.50 (6H, м), 1.40-1.26 (3H, м), 1.04 (3H, д, J = 6.3 Гц), 0.71 (2H, с), 0.61 (3H, с), 0.59-0.48 (2H, м).
Точная масса = 441.32 (C28H43NO3), Набл. масса = 442.35 (M+H).
Пример 144
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(6-окса-9-азаспиро[4.5]декан-9-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D012)
Соединение (D012) [9.9 мг, 21 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 6-окса-9- азаспиро[4,5]декан гидрохлорид [35 мг, 0.248 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.45-4.33 (2H, м), 3.72-3.60 (2H, м), 2.85 (1H, дд, J = 12.7, 3.4 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.39-2.19 (6H, м), 2.16-1.88 (5H, м), 1.84-1.25 (18H, м), 1.04 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 469.36 (C30H47NO3), Набл. масса = 470.35 (M+H).
Пример 145
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((2S,6R)-2,6-диметилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D013)
Соединение (D013) [17.6 мг, 0.040 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (2S,6R)-2,6-диметилморфолин [35 мг, 0.304 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, т, J = 3.9 Гц), 4.42-4.36 (2H, м), 3.73-3.59 (2H, м), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.79 (1H, д, J = 11.2 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.62 (1H, д, J = 11.2 Гц), 2.48 (1H, дд, J = 13.7, 3.9 Гц), 2.27 (2H, тд, J = 12.7, 6.0 Гц), 2.22 (1H, дд, J = 12.0, 3.2 Гц), 2.16-1.89 (4H, м), 1.79 (1H, дд, J = 25.9, 15.6 Гц), 1.70-1.21 (12H, м), 1.12 (3H, д, J = 5.0 Гц), 1.10 (3H, д, J = 5.0 Гц), 1.03 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 146
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D014)
Соединение (D014) [10.8 мг, 0.024 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 2,2-диметилморфолин [35 мг, 0.304 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.43-4.35 (2H, м), 3.75-3.64 (2H, м), 2.85 (1H, дд, J = 11.0, 3.9 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.40-1.88 (13H, м), 1.68-1.21 (18H, м), 1.04 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 147
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D015)
Соединение (D015) [2.0 мг, 0.0047 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-3-метилморфолин гидрохлорид [30 мг, 0.218 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 10.7 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.45-4.35 (2H, м), 3.75 (1H, дт, J = 11.4, 3.3 Гц), 3.60 (2H, ддд, J = 24.4, 11.2, 2.4 Гц), 3.21 (1H, дд, J = 11.0, 9.5 Гц), 2.84 (2H, тд, J = 11.3, 3.3 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.37 (1H, т, J = 11.5 Гц), 2.31-2.25 (3H, м), 2.08-2.02 (5H, м), 1.96 (1H, дд, J = 11.5, 8.1 Гц), 1.68-1.52 (6H, м), 1.32 (4H, дт, J = 32.9, 10.5 Гц), 1.02 (3H, д, J = 6.3 Гц), 0.93 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 148
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((2R,5S)-2,5-диметилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D016)
Соединение (D016) [5.0 мг, 0.011 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (2R,5S)-2,5-диметилморфолин [30 мг, 0.260 ммоль] в качестве исходных веществ.
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 149
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((2R,5R)-2,5-диметилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D017)
Соединение (D017) [8.2 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (2R,5R)-2,5-диметилморфолин [30 мг, 0.260 ммоль] в качестве исходных веществ
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 150
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D018)
Соединение (D018) [5.3 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-2-метилморфолин гидрохлорид [40 мг, 0.291 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.4 Гц), 5.91 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.42-4.36 (2H, м), 3.80-3.73 (1H, м), 3.67 (1H, тд, J = 11.3, 2.4 Гц), 3.62-3.53 (1H, м), 2.85 (1H, дд, J = 12.1, 3.9 Гц), 2.80 (1H, д, J = 11.0 Гц), 2.67 (1H, дд, J = 13.3, 4.1 Гц), 2.56 (1H, дд, J = 11.9, 1.8 Гц), 2.48 (1H, дд, J = 13.3, 4.1 Гц), 2.31-2.22 (3H, м), 2.17 (1H, тд, J = 11.5, 3.5 Гц), 2.07-1.89 (4H, м), 1.70-1.50 (7H, м), 1.38-1.21 (3H, м), 1.11 (3H, д, J = 5.9 Гц), 1.03 (3H, д, J = 6.4 Гц), 0.61 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.40 (M+H).
Пример 151
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-окса-7-азаспиро[2.5]октан-7-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D019)
Соединение (D019) [11.2 мг, 0.0261 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и 4-окса- 7-азаспиро[2,5]октан гидрохлорид [35 мг, 0.234 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 3.79-3.67 (2H, м), 2.83 (1H, дд, J = 11.0, 3.9 Гц), 2.62-2.50 (2H, м), 2.44-2.13 (8H, м), 2.07-1.48 (14H, м), 1.38-1.20 (4H, м), 1.03 (3H, д, J = 6.3 Гц), 0.70 (2H, с), 0.59 (3H, с), 0.57-0.49 (2H, м).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.30 (M+H).
Пример 152
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((2R,5S)-2,5-диметилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D020)
Соединение (D020) [4.3 мг, 0.010 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и (2R,5S)-2,5-диметилморфолин [30 мг, 0.260 ммоль] в качестве исходных веществ.
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.25 (M+H).
Пример 153
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((2R,5R)-2,5-диметилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D021)
Соединение (D021) [5.4 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2b) [50 мг, 0.070 ммоль] и (2R,5R)-2,5-диметилморфолин [30 мг, 0.260 ммоль] в качестве исходных веществ.
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.30 (M+H).
Пример 154
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(метилсульфонил)пиперазин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение E001)
Соединение (E001) [14.3 мг, 0.029 ммоль] получали посредством проведения реакции аналогично Примеру 92, используя 1-метилсульфонилпиперазин в качестве исходного вещества вместо триэтил-[[4-(трифторметил)-4-пиперидил]окси]силана на стадии 1 в Примере 92.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 6.1 Гц), 4.15-4.05 (1H, м), 3.25-3.15 (5H, м), 2.89-2.80 (4H, м), 2.66-2.03 (11H, м), 1.94-1.22 (13H, м), 1.04 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 492.30 (C27H44N2O4S), Набл. масса = 493.40 (M+H).
Пример 155
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-(4-(метилсульфонил)пиперазин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение E003)
Соединение (E003) [9.4 мг, 0.019 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2c) [50 мг, 0.069 ммоль] и 1-(метилсульфонил)пиперазин [40 мг, 0.254 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.42-4.35 (2H, м), 3.26-3.13 (4H, м), 2.88-2.80 (1H, м), 2.82 (3H, с), 2.70-2.58 (3H, м), 2.48 (1H, дд, J = 13.3, 4.1 Гц), 2.40-2.25 (5H, м), 2.09-2.00 (3H, м), 1.98-1.90 (1H, м), 1.75-1.52 (6H, м), 1.39-1.28 (3H, м), 1.04 (3H, д, J = 6.4 Гц), 0.61 (3H, с).
Точная масса = 492.30 (C27H44N2O4S), Набл. масса = 493.25 (M+H).
Пример 156
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(3-(трифторметил)пиперазин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединения E005a, E005b)
Соединение (E005a) [11.3 мг, 0.0234 ммоль] и соединение (E005b) [9.7 мг, 0.020 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2a) [100 мг, 0.137 ммоль] и 2-(трифторметил)пиперазин [50 мг, 0.324 ммоль] в качестве исходных веществ.
Соединение E005a
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.43-3.37 (1H, м), 3.00-2.95 (1H, м), 2.90-2.76 (4H, м), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.34-1.99 (7H, м), 1.94-1.21 (15H, м), 1.02 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 482.31 (C27H41F3N2O2), Набл. масса = 483.4 (M+H).
Соединение E005b
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.35-3.30 (1H, м), 2.95 (2H, д, J = 11.2 Гц), 2.85 (2H, тд, J = 11.7, 2.9 Гц), 2.63 (1H, д, J = 11.7 Гц), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.33-1.97 (7H, м), 1.94-1.21 (15H, м), 1.02 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 482.31 (C27H41F3N2O2), Набл. масса = 483.3 (M+H).
Пример 157
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(3-(трифторметил)пиперазин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединения E006a, E006b)
Соединение (E006a) [7.0 мг, 0.015 ммоль] и соединение (E006b) [7.0 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение (2b) [100 мг, 0.139 ммоль] и 2-(трифторметил)пиперазин [70 мг, 0.454 ммоль] в качестве исходных веществ.
Соединение E006a
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.93 (2H, м), 3.41-3.37 (1H, м), 2.97 (1H, д, J = 12.3 Гц), 2.86-2.74 (4H, м), 2.59 (1H, дд, J = 13.5, 3.4 Гц), 2.40 (1H, дд, J = 13.3, 3.7 Гц), 2.31 (1H, дд, J = 11.9, 3.2 Гц), 2.23-1.48 (17H, м), 1.38-1.21 (4H, м), 1.02 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 470.31 (C26H41F3N2O2), Набл. масса = 471.25 (M+H).
Соединение E006b
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.93 (2H, м), 3.36-3.30 (1H, м), 2.95 (2H, д, J = 11.9 Гц), 2.85 (2H, тд, J = 11.5, 2.9 Гц), 2.65-2.54 (2H, м), 2.40 (1H, дд, J = 13.3, 3.7 Гц), 2.31 (1H, дд, J = 12.1, 3.0 Гц), 2.23-1.49 (16H, м), 1.38-1.21 (4H, м), 1.03 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 470.31 (C26H41F3N2O2), Набл. масса = 471.25 (M+H).
Пример 158
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2S)-1-(3-(трифторметил) пиперазин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединения E007a, E007b)
Соединение (E007a) [20.9 мг, 0.042 ммоль] и соединение (E007b) [27.4 мг, 0.055 ммоль] получали посредством проведения реакции аналогично Примеру 109, используя соединение (6c) [264.5 мг, 0.599 ммоль] и 2-(трифторметил)пиперазин [220.7 мг, 1.43 ммоль] в качестве исходных веществ.
Соединение E007a:
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.0 Гц), 6.09 (1H, д, J = 11.0 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.88 (1H, ушир.с), 4.22 (1H, д, J = 3.4 Гц), 3.75-3.68 (1H, м), 3.47-3.30 (2H, м), 2.99-2.75 (6H, м), 2.59 (1H, дд, J = 13.7, 3.9 Гц), 2.33 (1H, дд, J = 12.0, 3.2 Гц), 2.19-2.01 (6H, м), 1.93-1.42 (12H, м), 1.38-1.21 (4H, м), 1.04 (3H, д, J = 6.3 Гц), 1.02 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Соединение E007b:
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.0 Гц), 6.09 (1H, д, J = 11.0 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.89 (1H, ушир.с), 4.22 (1H, д, J = 3.4 Гц), 3.75-3.69 (1H, м), 3.38-3.30 (1H, м), 2.98-2.80 (4H, м), 2.63-2.57 (2H, м), 2.30 (1H, дд, J = 12.2, 3.4 Гц), 2.17 (2H, дд, J = 11.2, 2.9 Гц), 2.06-1.97 (4H, м), 1.91-1.20 (13H, м), 1.04 (3H, д, J = 6.3 Гц), 1.02 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Пример 159
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(этилсульфонил)пиперазин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение E009)
Соединение (E009) [20.6 мг, 0.041 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (2a) [100 мг, 0.137 ммоль] и 4-(этилсульфонил)пиперазин [55 мг, 0.309 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.0 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.28-3.23 (3H, м), 3.02 (2H, кв, J = 7.3 Гц), 2.87 (1H, дд, J = 12.0, 3.7 Гц), 2.65-2.55 (2H, м), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.39-2.30 (3H, м), 2.25 (1H, дд, J = 13.4, 6.6 Гц), 2.10-1.99 (3H, м), 1.94-1.21 (17H, м), 1.03 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Сравнительный пример 13
Синтез (3R)-3-((1R,3aS,7aR,E)-4-((Z)-2-((3S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-2- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфоната (Соединение 16a)
Стадия 1
пара-Толуолсульфонилхлорид [1.6 г, 8.4 ммоль] добавляли в раствор (3R)-3- ((1R,4S,7aR)-7a-метил-4-((триэтилсилил)окси)октагидро-1H-инден-1-ил)бутан-1-ола (Соединение 10, CAS 300344-39-2) [2.37 г, 6.68 ммоль] в пиридине [12 мл], и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь переносили в насыщенный водный раствор хлорида натрия, и смесь экстрагировали этилацетатом. Органический слой промывали последовательно 1М раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий соединение 17.
Стадия 2
Описанный выше сырой продукт, содержащий соединение 17, растворяли в ацетоне [30 мл], затем в раствор добавляли 2М раствор соляной кислоты [10 мл, 20 ммоль] при комнатной температуре, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая
(3R)-3-((1R,4S,7aR)-4-гидрокси-7a-метилоктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфонат (Соединение 18) [1.37 г, 3.47 ммоль] (Выход за 2 стадии = 52%).
Стадия 3
Раствор соединения 18 [1.37 г, 3.47 ммоль], полученного на стадии 2, 4-метилморфолин N-оксида (NMO) [0.67 г, 5.0 ммоль] и молекулярные сита 4A (MS4A) [1.5 г] в дихлорметане [30 мл] перемешивали при 0°C в течение 1 часа. Добавляли тетрабутиламмония перрутенат (TPAP) [120 мг, 0.342 ммоль], и полученную смесь перемешивали при 0°C в течение 1 часа. Добавляли гептан [30 мл] при комнатной температуре, и реакционную смесь фильтровали через целит. Фильтрат промывали последовательно насыщенным водным раствором хлорида аммония и насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая (3R)-3-((1R,3aR,7aR)-7a-метил- 4-оксооктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфонат (Соединение 11) [1.15 г, 2.93 ммоль] (выход = 84%).
1H-ЯМР(CDCl3) δ: 7.79 (2H, д, J = 7.8 Гц), 7.35 (2H, д, J = 7.8 Гц), 4.06-3.94 (2H, м), 2.45 (3H, с), 2.43 (1H, дд, J = 12.2 7.8 Гц), 2.33-2.17 (2H, м), 2.11-1.65 (6H, м), 1.60-0.99 (9H, м), 0.91 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Стадия 4
В атмосфере азота добавляли LHMDS [1 M раствор в ТГФ, 5 мл, 5 ммоль] в раствор соединения 4a [2.1 г, 3.6 ммоль] в ТГФ [21 мл] при -78°C, и реакционную смесь перемешивали при той же температуре в течение 30 минут. Добавляли раствор соединения 11 [0.85 г, 2.2 ммоль], полученного на стадии 3, в ТГФ [10 мл], и реакционную смесь дополнительно перемешивали при той же температуре 1.5 часа. Реакционную смесь нагревали до комнатной температуры, добавляли насыщенный водный раствор хлорида аммония, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 16a [1.21 г, 1.63 ммоль] (выход = 72%).
1H-ЯМР (CDCl3) δ: 7.80 (2H, д, J = 8.2 Гц), 7.35 (2H, д, J = 8.2 Гц), 6.23 (1H, д, J = 11.0 Гц), 6.00 (1H, д, J = 11.4 Гц), 5.18 (1H, с), 4.86 (1H, д, J = 2.3 Гц), 4.37 (1H, дд, J = 7.0, 4.0 Гц), 4.23-4.16 (1H, м), 4.15-4.03 (2H, м), 2.82 (1H, д, J = 11.9 Гц), 2.48-2.41 (1H, м), 2.45 (3H, с), 2.21 (1H, дд, J = 13.0, 7.5 Гц), 1.96-1.58 (8H, м), 1.53-1.18 (10H, м), 0.88 (9H, с), 0.88 (9H, с), 0.84 (3H, д, J = 6.9 Гц), 0.49 (3H, с), 0.07 (3H, с), 0.06 (9H, с).
Сравнительный пример 14
Синтез (3R)-3-((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси) циклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфоната (Соединение 16b)
Стадия 1
Цианид калия [2.16 г, 33.2 ммоль] добавляли в раствор соединения 2b [11.94 г, 16.65 ммоль] и 18-краун-6 [0.45 г, 1.7 ммоль] в ДМФА [100 мл], и смесь нагревали и перемешивали при 60°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь выливали в насыщенный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 13b [8.02 г, 14.0 ммоль] (выход = 84.2%).
1H-ЯМР (CDCl3) δ: 6.16 (1H, д, J = 11.4 Гц), 5.82 (1H, д, J = 11.0 Гц), 4.11-4.02 (2H, м), 2.82 (1H, дд, J = 12.3, 2.7 Гц), 2.40-2.35 (3H, м), 2.30-2.22 (2H, м), 2.08 (2H, дт, J = 23.0, 7.9 Гц), 1.98-1.88 (2H, м), 1.82-1.59 (6H, м), 1.55-1.26 (8H, м), 1.18 (3H, д, J = 6.4 Гц), 0.87 (9H, с), 0.86 (9H, с), 0.56 (3H, с), 0.06 (3H, с), 0.05 (9H, с).
Стадия 2
В атмосфере азота добавляли раствор диизобутилалюминий гидрида (DIBAL-H) [1 M раствор в гексане, 42 мл, 42 ммоль] в раствор соединения 13b [8.02 г, 14.0 ммоль] в ТГФ [120 мл] при -10°C, и полученную смесь перемешивали при той же температуре в течение 1 часа. Реакцию гасили насыщенным водным раствором хлорида аммония. Добавляли насыщенный водный раствор калий-натрий тартрата (сегнетова соль), и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 14b [4.93 г, 8.57 ммоль] (выход = 61%).
1H-ЯМР (CDCl3) δ: 9.76 (1H, дд, J = 3.2, 1.4 Гц), 6.16 (1H, д, J = 11.4 Гц), 5.82 (1H, д, J = 11.4 Гц), 4.10-4.04 (2H, м), 2.82 (1H, дд, J = 11.7, 3.9 Гц), 2.48 (1H, дд, J = 15.3, 3.0 Гц), 2.42-2.35 (2H, м), 2.27-1.77 (9H, м), 1.70-1.60 (4H, м), 1.58-1.50 (3H, м), 1.40-1.25 (5H, м), 1.03 (3H, д, J = 6.9 Гц), 0.87 (9H, с), 0.86 (9H, с), 0.59 (3H, с), 0.06 (3H, с), 0.05 (6H, с).
Стадия 3
Соединение 14b [4.92 г, 8.56 ммоль] растворяли в смеси ТГФ [50 мл]/метанол [50 мл], добавляли боргидрид натрия [0.65 г, 17.0 ммоль] при 0°C, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили насыщенным водным раствором хлорида аммония при 0°C, выливали в насыщенный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 15b [4.32 г, 7.49 ммоль] (выход = 87%).
1H-ЯМР (CDCl3) δ: 6.17 (1H, д, J = 10.5 Гц), 5.82 (1H, д, J = 11.0 Гц), 4.12-4.03 (2H, м), 3.78-3.60 (2H, м), 2.81 (1H, д, J = 11.9 Гц), 2.42-2.35 (2H, м), 2.26 (1H, д, J = 13.3 Гц), 2.11 (1H, т, J = 10.1 Гц), 2.04-1.90 (3H, м), 1.82-1.60 (6H, м), 1.59-1.48 (4H, м), 1.35-1.22 (5H, м), 1.16 (1H, с), 0.99-0.92 (3H, м), 0.87 (9H, с), 0.86 (9H, с), 0.55 (3H, с), 0.08-0.03 (12H, м).
Стадия 4
TsCl [3.45 г, 18.1 ммоль] и 4-диметиламинопиридин [94 мг, 0.77 ммоль] добавляли в раствор соединения 15b [4.17 г, 7.23 ммоль] в пиридине [40 мл], и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в насыщенный раствор хлорида натрия, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 16b [4.60 г, 6.29 ммоль] (выход = 87%).
1H-ЯМР (CDCl3) δ: 7.80 (2H, д, J = 8.3 Гц), 7.35 (2H, д, J = 8.3 Гц), 6.16 (1H, д, J = 11.2 Гц), 5.80 (1H, д, J = 11.2 Гц), 4.17-4.01 (4H, м), 2.85-2.70 (1H, м), 2.45 (3H, с), 2.41-2.23 (2H, м), 1.98-1.60 (8H, м), 1.51-1.18 (10H, м), 0.87-0.85 (27H, м), 0.50 (3H, с), 0.05 (6H, с), 0.05 (6H, с).
Сравнительный пример 15
Синтез (3R)-3-((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)-4- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфоната (Соединение 16c)
Раствор (3R)-3-((1R,3aR,7aR)-7a-метил-4-оксооктагидро-1H-инден-1-ил)бутил 4-метилбензолсульфоната (Соединение 11) [1.24 г, 3.28 ммоль], описанного на стадии 3 в Сравнительном примере 13, и соединения 4c [1.3 г, 2.2 ммоль] в ТГФ [15 мл] охлаждали до -78°C в атмосфере азота. Добавляли в раствор по каплям LHMDS [1 M раствор в ТГФ, 4.5 мл, 4.5 ммоль], и полученную смесь перемешивали при той же температуре в течение 3 часов. Реакционную смесь нагревали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония. Смесь экстрагировали этилацетатом, органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 16c [0.83 г, 1.1 ммоль] (выход = 50%).
1H-ЯМР (CDCl3) δ: 7.80 (2H, д, J = 8.3 Гц), 7.35 (2H, д, J = 8.8 Гц), 6.21 (1H, д, J = 11.2 Гц), 5.83 (1H, д, J = 11.2 Гц), 4.97 (1H, с), 4.92 (1H, с), 4.43 (2H, дд, J = 7.6, 4.1 Гц), 4.11-4.02 (2H, м), 2.81 (1H, дд, J = 10.0, 3.8 Гц), 2.55-2.45 (2H, м), 2.45 (3H, с), 2.31 (1H, дд, J = 13.4, 3.2 Гц), 2.17 (1H, дд, J = 12.4, 8.5 Гц), 1.99-1.60 (6H, м), 1.52-1.18 (8H, м), 0.90 (9H, с), 0.87 (9H, с), 0.50 (3H, с), 0.07 (3H, с), 0.05 (3H, с), 0.03 (3H, с).
Пример 160
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(дифторметил)азетидин-1-ил)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A022)
Соединение (A022) [14.7 мг, 0.0336 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [100 мг, 0.137 ммоль] и 3-дифторметилазетидин гидрохлорид [60 мг, 0.418 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 6.00 (1H, тд, J = 57.0, 5.0 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.05 (2H, с), 4.05-3.94 (2H, м), 3.38 (2H, т, J = 8.3 Гц), 3.17 (2H, т, J = 7.3 Гц), 2.91 (1H, тд, J = 13.5, 7.3 Гц), 2.82 (1H, дд, J = 12.2, 3.9 Гц), 2.58 (1H, дд, J = 13.7, 3.4 Гц), 2.52 (1H, дд, J = 10.7, 4.9 Гц), 2.46-2.38 (2H, м), 2.22-2.12 (2H, м), 2.06-1.90 (3H, м), 1.86-1.27 (13H, м), 1.17-1.06 (1H, м), 0.96 (3H, д, J = 6.3 Гц), 0.57 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.25 (M+H).
Пример 161
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-гидрокси-3-(трифторметил)азетидин-1- ил)бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диола (Соединение A023)
Соединение A023 [9.8 мг, 0.020 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 3-гидрокси-3-(трифторметил)азетидин [30 мг, 0.213 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.8 Гц), 4.43-4.37 (2H, м), 3.70 (2H, д, J = 10.7 Гц), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.75-2.53 (3H, м), 2.49 (1H, дд, J = 13.2, 3.9 Гц), 2.32-2.25 (2H, м), 2.08-1.98 (2H, м), 1.95-1.13 (12H, м), 0.98 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 483.30 (C27H40F3NO3), Набл. масса = 484.25 (M+H).
Пример 162
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(2,2-дифторэтил)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A024)
Соединение A024 [17.0 мг, 0.376 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [100 мг, 0.137 ммоль] и 3-(2,2- дифторэтил)азетидин гидрохлорид [70 мг, 0.444 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 5.86 (1H, тт, J = 56.0, 4.5 Гц), 4.06-3.95 (2H, м), 3.49 (2H, т, J = 7.6 Гц), 2.87 (2H, дт, J = 3.0, 8.0 Гц), 2.83 (1H, дд, J = 13.0, 4.0 Гц), 2.75-2.63 (1H, м), 2.58 (1H, дд, J = 13.2, 3.9 Гц), 2.54-2.49 (1H, м), 2.44-2.36 (2H, м), 2.23-1.91 (7H, м), 1.87-1.44 (9H, м), 1.33 (3H, тд, J = 9.6, 6.0 Гц), 1.15-1.05 (1H, м), 0.96 (3H, д, J = 6.8 Гц), 0.57 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 163
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(дифторметокси)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A025)
Соединение A025 [21.6 мг, 0.476 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [100 мг, 0.137 ммоль] и 3-(дифторметокси)азетидин [70 мг, 0.444 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.38 (1H, т, J = 75.0 Гц), 6.21 (1H, д, J = 10.7 Гц), 5.88 (1H, д, J = 10.7 Гц), 4.76-4.70 (1H, м), 4.06-3.95 (2H, м), 3.64 (2H, тд, J = 6.1, 2.4 Гц), 3.12-3.07 (2H, м), 2.83 (1H, дд, J = 11.5, 4.1 Гц), 2.61-2.44 (3H, м), 2.40 (1H, дд, J = 13.7, 3.4 Гц), 2.23-2.13 (2H, м), 2.05-1.92 (3H, м), 1.87-1.73 (2H, м), 1.68-1.45 (7H, м), 1.38-1.28 (3H, м), 1.17-1.06 (1H, м), 0.96 (3H, д, J = 6.3 Гц), 0.57 (3H, с).
Точная масса = 453.31 (C26H41F2NO3), Набл. масса = 454.25 (M+H).
Пример 164
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(2,2-дифторэтокси)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A026)
Соединение A026 [12.8 мг, 0.0282 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [50 мг, 0.068 ммоль] и 3-(2,2- дифторэтокси)азетидин гидрохлорид [35 мг, 0.202 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.16 (1H, д, J = 10.7 Гц), 5.85 (1H, тт, J = 3.5, 55.0 Гц), 5.84 (1H, д, J = 10.7 Гц), 4.17-4.11 (1H, м), 4.02-3.90 (2H, м), 3.63-3.52 (4H, м), 2.92 (2H, дт, J = 22.9, 6.8 Гц), 2.78 (1H, дд, J = 12.0, 3.7 Гц), 2.54 (1H, дд, J = 13.2, 3.4 Гц), 2.44 (1H, дд, J = 12.2, 2.9 Гц), 2.36 (1H, дд, J = 13.2, 3.4 Гц), 2.26-2.09 (3H, м), 1.99-1.24 (15H, м), 0.94 (3H, д, J = 6.3 Гц), 0.53 (3H, с).
Пример 165
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-метокси-3-(трифторметил)азетидин-1- ил)бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A027)
Соединение A027 [1.6 мг, 0.0033 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [50 мг, 0.068 ммоль] и 3-метокси-3-(трифторметил)азетидин гидрохлорид [30 мг, 0.157 ммоль] в качестве исходных веществ.
Точная масса = 485.31 (C27H42F3NO3), Набл. масса = 486.25 (M+H).
Пример 166
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-(3-(трифторметокси)азетидин-1-ил) бутан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A028)
Соединение A028 [1.1 мг, 0.0023 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [50 мг, 0.068 ммоль] и 3-(трифторметокси)азетидин гидрохлорид [30 мг, 0.169 ммоль] в качестве исходных веществ.
Точная масса = 471.30 (C26H40F3NO3), Набл. масса = 472.25 (M+H).
Пример 167
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(2,2-дифторэтокси)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A029)
Соединение A029 [15.9 мг, 0.0332 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 3-(2,2- дифторэтокси)азетидин гидрохлорид [35 мг, 0.202 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.24 (1H, д, J = 11.4 Гц), 6.04-5.74 (2H, м), 5.03 (2H, д, J = 6.9 Гц), 4.42-4.32 (2H, м), 4.21-4.15 (1H, м), 3.62 (2H, дд, J = 14.4, 3.9 Гц), 3.59-3.56 (2H, м), 2.99-2.94 (2H, м), 2.83 (1H, дд, J = 12.3, 3.7 Гц), 2.65 (1H, дд, J = 13.3, 4.6 Гц), 2.57-2.40 (3H, м), 2.30-2.23 (2H, м), 2.05-1.85 (3H, м), 1.69-1.23 (10H, м), 1.16-1.06 (1H, м), 0.94 (3H, д, J = 6.4 Гц), 0.56 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.25 (M+H).
Пример 168
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(дифторметокси)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A030)
Соединение A030 [10.9 мг, 0.234 ммоль] получали посредством проведения реакции аналогично Примеру 5, используя соединение (16c) [50 мг, 0.067 ммоль] и 3-(дифторметокси)азетидин [30 мг, 0.244 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.38 (1H, т, J = 75.0 Гц), 6.26 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.76-4.70 (1H, м), 4.43-4.35 (2H, м), 3.68-3.60 (2H, м), 3.12-3.07 (2H, м), 2.84 (1H, дд, J = 4.0, 12.6 Гц), 2.66 (1H, дд, J = 12.6, 4.0 Гц), 2.60-2.42 (3H, м), 2.31-2.24 (2H, м), 2.07-2.00 (2H, м), 1.98-1.90 (2H, м), 1.69-1.40 (7H, м), 1.38-1.25 (3H, м), 1.17-1.09 (1H, м), 0.96 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 465.31 (C27H41F2NO3), Набл. масса = 466.25 (M+H).
Пример 169
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(дифторметил)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение A031)
Соединение A031 [9.4 мг, 0.021 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 3-(дифторметил)азетидин гидрохлорид [30 мг, 0.209 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 6.10 (1H, тд, J = 56.4, 4.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.8 Гц), 4.40 (2H, ддд, J = 14.3, 7.2, 4.5 Гц), 3.80 (2H, т, J = 9.3 Гц), 3.65 (2H, т, J = 8.1 Гц), 3.17-3.09 (1H, м), 2.89 (2H, ддд, J = 23.1, 11.6, 4.3 Гц), 2.78 (1H, тд, J = 11.3, 5.2 Гц), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.49 (1H, дд, J = 13.2, 3.9 Гц), 2.32-2.25 (2H, м), 2.11-1.97 (3H, м), 1.96-1.90 (1H, м), 1.72-1.18 (12H, м), 1.00 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.40 (M+H).
Пример 170
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-(1,1-дифторэтил)азетидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A032)
Соединение A032 [15.5 мг, 0.0343 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16b) [100 мг, 0.137 ммоль] и 3-(1,1- дифторэтил)азетидин гидрохлорид [70 мг, 0.444 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 3.43 (2H, т, J = 8.1 Гц), 3.12 (2H, тд, J = 7.9, 2.1 Гц), 3.04-2.93 (1H, м), 2.83 (1H, дд, J = 12.0, 3.7 Гц), 2.58 (1H, дд, J = 13.7, 3.9 Гц), 2.54-2.49 (1H, м), 2.46-2.36 (2H, м), 2.23-2.13 (2H, м), 2.05-1.91 (3H, м), 1.87-1.41 (13H, м), 1.38-1.28 (3H, м), 1.16-1.03 (1H, м), 0.96 (3H, д, J = 6.8 Гц), 0.57 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.30 (M+H).
Пример 171
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3-гидрокси-3-изопропилазетидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A034)
Соединение A034 [8.1 мг, 0.018 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и 3-изопропилазетидин-3-ол гидрохлорид [30 мг, 0.218 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.4 Гц), 4.06-3.95 (2H, м), 3.39 (1H, с), 3.37 (1H, с), 3.01 (1H, с), 2.99 (1H, с), 2.83 (1H, дд, J = 11.9, 3.7 Гц), 2.64-2.55 (2H, м), 2.49-2.36 (2H, м), 2.23-2.13 (2H, м), 2.05-1.29 (16H, м), 1.19-1.10 (1H, м), 0.97 (3H, д, J = 6.9 Гц), 0.90 (6H, д, J = 6.9 Гц), 0.57 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 172
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-фторпирролидин-1-ил)бутан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B014)
Соединение B014 [9.0 мг, 0.021 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (S)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль].
Точная масса = 419.32 (C26H42FNO2), Набл. масса = 420.30 (M+H).
Пример 173
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-фторпирролидин-1-ил)бутан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B015)
Соединение B015 [7.9 мг, 0.019 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (R)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль].
Точная масса = 419.32 (C26H42FNO2), Набл. масса = 420.30 (M+H).
Пример 174
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(дифторметил)пирролидин-1-ил)бутан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B080)
Соединение B080 [12.5 мг, 0.0277 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (S)-3-(дифторметил)пирролидин гидрохлорид [30 мг, 0.190 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 5.81 (1H, тд, J = 57.0, 5.0 Гц), 4.07-3.96 (2H, м), 2.84 (1H, дд, J = 12.0, 4.0 Гц), 2.80 (1H, т, J = 9.0 Гц), 2.71-2.39 (8H, м), 2.24-2.14 (2H, м), 2.07-1.92 (4H, м), 1.88-1.27 (15H, м), 0.99 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.30 (M+H).
Пример 175
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(дифторметил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B081)
Соединение B081 [12.4 мг, 0.0275 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (R)-3-(дифторметил)пирролидин гидрохлорид [30 мг, 0.190 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 5.80 (1H, тд, J = 56.5, 5.0 Гц), 4.07-3.96 (2H, м), 2.84 (1H, дд, J = 12.0, 3.7 Гц), 2.77-2.47 (8H, м), 2.41 (1H, дд, J = 13.4, 3.2 Гц), 2.24-2.14 (2H, м), 2.07-1.95 (4H, м), 1.92-1.27 (15H, м), 0.99 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.30 (M+H).
Пример 176
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B082)
Соединение B082 [8.4 мг, 0.018 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (R)-3-(2,2-дифторэтил)пирролидин гидрохлорид [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.97 (1H, тт, J = 56.0, 4.0 Гц), 5.90 (1H, д, J = 11.2 Гц), 4.07-3.95 (2H, м), 3.35 (1H, дд, J = 10.5, 8.1 Гц), 3.18-2.83 (5H, м), 2.70 (1H, т, J = 9.8 Гц), 2.60 (1H, дд, J = 13.4, 3.7 Гц), 2.56-2.48 (1H, м), 2.41 (1H, дд, J = 13.2, 3.4 Гц), 2.27-1.95 (9H, м), 1.88-1.29 (16H, м), 1.01 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.35 (M+H).
Пример 177
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B083)
Соединение B083 [9.3 мг, 0.020 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (S)-3-(1,1-дифторэтил)пирролидин гидрохлорид [30 мг, 0.175 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.07-3.96 (2H, м), 2.90 (1H, т, J = 9.3 Гц), 2.86-2.39 (9H, м), 2.24-2.14 (2H, м), 2.07-1.46 (15H, м), 1.59 (3H, т, J = 19.0 Гц), 1.39-1.28 (4H, м), 0.99 (3H, д, J = 6.8 Гц), 0.59 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.35 (M+H).
Пример 178
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(дифторметокси)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B086)
Соединение B086 [10.0 мг, 0.0214 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (S)-3-(дифторметокси)пирролидин гидрохлорид [25 мг, 0.182 ммоль].
1H-ЯМР (CD3OD) δ: 5.96 (1H, т, J = 75.0 Гц), 5.79 (1H, д, J = 11.4 Гц), 5.47 (1H, д, J = 11.4 Гц), 4.35-4.30 (1H, м), 3.65-3.53 (2H, м), 2.43-2.30 (4H, м), 2.19-1.97 (5H, м), 1.86-1.70 (3H, м), 1.64-0.85 (18H, м), 0.56 (3H, д, J = 6.4 Гц), 0.16 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.30 (M+H).
Пример 179
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(дифторметокси)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B087)
Соединение B087 [6.5 мг, 0.014 ммоль] получали, используя соединение (16b) [50 мг, 0.068 ммоль] и (R)-3-(дифторметокси)пирролидин гидрохлорид [26.5 мг, 0.153 ммоль].
1H-ЯМР (CD3OD) δ: 6.38 (1H, т, J = 75.0 Гц), 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.79-4.72 (1H, м), 4.06-3.95 (2H, м), 2.85-2.71 (4H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.48 (3H, дт, J = 14.2, 6.5 Гц), 2.41 (1H, дд, J = 13.5, 3.4 Гц), 2.27-2.13 (3H, м), 2.06-1.26 (18H, м), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.30 (M+H).
Пример 180
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(дифторметил)пирролидин-1-ил)бутан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B088)
Соединение B088 [12.1 мг, 0.0261 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-3-(дифторметокси)пирролидин гидрохлорид [30 мг, 0.190 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.93 (1H, дт, J = 6.0, 57.0 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 8.0 Гц), 4.40 (2H, ддд, J = 13.9, 7.1, 4.4 Гц), 3.23 (1H, дд, J = 11.2, 8.8 Гц), 3.10-2.80 (8H, м), 2.68 (1H, дд, J = 13.2, 4.4 Гц), 2.49 (1H, дд, J = 13.7, 3.9 Гц), 2.32-2.26 (2H, м), 2.20-1.91 (7H, м), 1.82-1.33 (12H, м), 1.01 (3H, д, J = 6.8 Гц), 0.60 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.40 (M+H).
Пример 181
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(дифторметил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B089)
Соединение B089 [10.0 мг, 0.0216 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-3-(дифторметокси)пирролидин гидрохлорид [33 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.90 (1H, тд, J = 56.0, 5.0 Гц), 5.05 (2H, д, J = 7.0 Гц), 4.43-4.36 (2H, м), 3.12 (1H, дд, J = 11.0, 9.0 Гц), 3.04-2.71 (8H, м), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.49 (1H, дд, J = 13.7, 3.9 Гц), 2.32-1.95 (7H, м), 1.92-1.32 (13H, м), 1.01 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.45 (M+H).
Пример 182
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B090)
Соединение B090 [8.2 мг, 0.017 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-3-(2,2-дифторэтил)пирролидин гидрохлорид [38 мг, 0.174 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.97 (1H, тт, J = 56.0, 4.0 Гц), 5.92 (1H, д, J = 10.7 Гц), 5.06 (2H, д, J = 6.3 Гц), 4.43-4.37 (2H, м), 3.41 (1H, дд, J = 10.7, 7.8 Гц), 3.24-3.12 (2H, м), 3.07 (1H, тд, J = 12.0, 4.7 Гц), 2.96 (1H, тд, J = 11.8, 4.7 Гц), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.78 (1H, т, J = 10.2 Гц), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.59-2.45 (2H, м), 2.33-2.20 (3H, м), 2.09-1.98 (5H, м), 1.81-1.33 (13H, м), 1.02 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.25 (M+H).
Пример 183
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B091)
Соединение B091 [12,7 мг, 0.0166 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-3-(1,1-дифторэтил)пирролидин гидрохлорид [35 мг, 0.161 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.3 Гц), 4.40 (2H, ддд, J = 14.0, 7.0, 4.5 Гц), 3.37-3.28 (1H, м), 3.21-2.84 (7H, м), 2.68 (1H, дд, J = 13.2, 4.4 Гц), 2.49 (1H, дд, J = 13.7, 3.9 Гц), 2.32-2.08 (4H, м), 2.02-1.95 (2H, м), 1.87-1.33 (15H, м), 1.02 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.25 (M+H).
Пример 184
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B092)
Соединение B092 [14.0 мг, 0.0293 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-3-(2,2-дифторэтил)пирролидин гидрохлорид [40 мг, 0.233 ммоль].
1H-ЯМР (CD3OD) δ: 6.28 (1H, д, J = 11.2 Гц), 5.99 (1H, тт, J = 56.0, 3.0 Гц), 5.93 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.3 Гц), 4.40 (2H, ддд, J 14.0, 7.0, 4.5 Гц), 3.49 (1H, дд, J = 11.0, 7.6 Гц), 3.31-3.23 (2H, м), 3.17-3.03 (2H, м), 2.95-2.80 (2H, тм), 2.68 (1H, дд, J = 13.2, 4.4 Гц), 2.62-2.54 (1H, м), 2.50 (1H, дд, J = 13.7 3.9 Гц), 2.33-1.99 (8H, м), 1.85-1.34 (12H, м), 1.02 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 185
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B093)
Соединение B093 [10.7 мг, 0.0224 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-3-(1,1-дифторэтил)пирролидин гидрохлорид [38 мг, 0.221 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.06 (2H, д, J = 6.3 Гц), 4.46-4.35 (2H, м), 3.22-2.85 (8H, м), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.49 (1H, дд, J = 13.4, 4.1 Гц), 2.33-1.97 (8H, м), 1.90-1.33 (16H, м), 1.02 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 186
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) бутан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение B094)
Соединение B094 [13.1 мг, 0.0266 ммоль] получали, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-3-(3,3-дифторпропил)пирролидин гидрохлорид [35 мг, 0.189 ммоль].
1H-ЯМР (CD3OD) δ: 6.28 (1H, д, J = 11.2 Гц), 5.93 (1H, д, J = 11.2 Гц), 5.91 (1H, тт, J = 57.5, 4.0 Гц), 5.06 (2H, д, J = 5.9 Гц), 4.40 (2H, ддд, J = 14.0, 7.1, 4.4 Гц), 3.47 (1H, дд, J = 11.2, 7.8 Гц), 3.31-3.25 (2H, м), 3.19-2.84 (4H, тм), 2.68 (1H, дд, J = 13.4, 4.1 Гц), 2.50 (1H, дд, J = 13.7 3.9 Гц), 2.42-1.94 (8H, м), 1.90-1.30 (17H, м), 1.02 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 491.36 (C30H47F2NO2), Набл. масса = 492.40 (M+H).
Пример 187
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро- 4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D022)
Соединение 16a [100 мг, 0.134 ммоль] растворяли в ТГФ [1 мл], добавляли в раствор морфолин [0.2 мл, 2 ммоль], и полученную смесь перемешивали при 60°C в течение ночи. Реакционную смесь охлаждали до 50°C, добавляли TBAF [1 M раствор в ТГФ, 0.4 мл, 0.4 ммоль], и смесь кипятили 4 часа. Реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом ВЭЖХ по методике, аналогичной описанной в Примере 1, получая соединение D022 [17.6 мг, 0.041 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.1-4.08 (1H, м), 3.75 (4H, т, J = 4.6 Гц), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.76-2.66 (6H, м), 2.60 (1H, тд, J = 11.7, 4.9 Гц), 2.51 (1H, дд, J = 13.7, 3.4 Гц), 2.25 (1H, дд, J = 13.2, 6.8 Гц), 2.11-2.00 (3H, м), 1.90-1.28 (17H, м), 1.04-0.99 (1H, м), 0.99 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.30 (M+H).
Пример 188
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро- 4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D023)
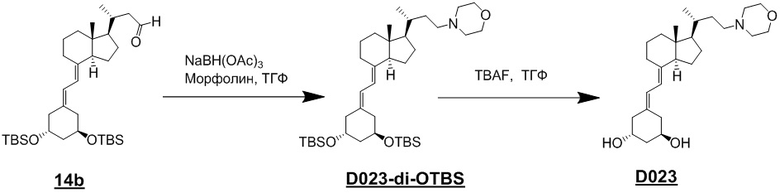
Стадия 1
Морфолин [0.2 мл] и триацетоксиборгидрид натрия [110 мг, 0.519 ммоль] добавляли в раствор соединения 14b [100 мг, 0.174 ммоль], описанного в стадии 2 в Сравнительном примере 14, в ТГФ [2 мл], и смесь нагревали и перемешивали при 60°C в течение ночи. Реакционную смесь охлаждали, переносили в насыщенный водный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий D023-ди-OTBS [81.1 мг]. Полученный сырой продукт использовали в следующей стадии без дополнительной очистки.
Стадия 2
TBAF [1 M раствор в ТГФ, 0.4 мл, 0.4 ммоль] добавляли в раствор описанного выше сырого продукта, содержащего D023-ди-OTBS [81.1 мг], в ТГФ [1 мл], и смесь нагревали и перемешивали при 60°C в течение 5 часов. Реакционную смесь охлаждали, выливали в насыщенный водный раствор гидрокарбоната натрия, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение D023 [22.1 мг, 0.053 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.4 Гц), 4.06-3.95 (2H, м), 3.69 (4H, т, J = 4.6 Гц), 2.83 (1H, дд, J = 11.9, 4.1 Гц), 2.59 (1H, дд, J = 13.7, 3.7 Гц), 2.50-2.37 (6H, м), 2.33 (1H, тд, J = 11.4, 5.3 Гц), 2.23-2.13 (2H, м), 2.06-1.93 (4H, м), 1.88-1.47 (9H, м), 1.39-1.27 (4H, м), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 417.32 (C26H43NO3), Набл. масса = 418.35 (M+H).
Пример 189
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро- 4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D024)
Соединение D024 [22.2 мг, 0.052 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение (16c) [120 мг, 0.097 ммоль] и морфолин [0.1 мл, 1.1 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, дд, J = 8.0, 1.0 Гц), 4.42-4.36 (2H, м), 3.71 (4H, т, J = 4.6 Гц), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.58-2.37 (7H, м), 2.31-2.24 (2H, м), 2.07-1.93 (3H, м), 1.49 (11H, ttt, J = 61.2, 17.2, 7.4 Гц), 0.99 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.35 (M+H).
Пример 190
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D025)
Соединение D025 [13.8 мг, 0.031 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-2-метилморфолин [30 мг, 0.297 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 8.0 Гц), 4.45-4.33 (2H, м), 3.82 (1H, дд, J = 10.2, 3.0 Гц), 3.66-3.55 (2H, м), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.82-2.75 (2H, м), 2.67 (1H, дд, J = 13.7, 4.4 Гц), 2.48 (1H, дд, J = 13.7, 3.9 Гц), 2.44-2.24 (4H, м), 2.08-1.93 (4H, м), 1.79 (1H, дд, J = 11.7, 10.2 Гц), 1.71-1.26 (11H, м), 1.11 (3H, д, J = 6.3 Гц), 0.98 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 191
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(4-окса-7-азаспиро[2.5]октан-7-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D026)
Соединение D026 [12.0 мг, 0.026 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 4-окса-7-азаспиро[2.5]октан [30 мг, 0.265 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 3.75 (2H, т, J = 4.9 Гц), 2.85 (1H, дд, J = 12.0, 3.7 Гц), 2.67 (1H, дд, J = 12.0, 4.0 Гц), 2.64-2.24 (9H, м), 2.07-1.96 (3H, м), 1.70-1.27 (11H, м), 0.98 (3H, д, J = 6.8 Гц), 0.77-0.70 (2H, м), 0.59-0.53 (2H, м), 0.58 (3H, с).
Точная масса = 455.34 (C29H45NO3), Набл. масса = 456.30 (M+H).
Пример 192
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(6-окса-9-азаспиро[4.5]декан-9-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D027)
Соединение D027 [18.0 мг, 0.037 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 6-окса-9-азаспиро[4.5]декан [30 мг, 0.212 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 10.7 Гц), 5.92 (1H, д, J = 10.7 Гц), 5.06 (2H, т, J = 3.9 Гц), 4.43-4.37 (2H, м), 3.73-3.63 (2H, м), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.67 (1H, дд, J = 13.4, 4.1 Гц), 2.49 (1H, дд, J = 13.4, 3.7 Гц), 2.40-2.25 (8H, м), 2.07-1.94 (3H, м), 1.81-1.18 (20H, м), 0.99 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 483.37 (C31H49NO3), Набл. масса = 484.35 (M+H).
Пример 193
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((2S,6R)-2,6-диметилморфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D028)
Соединение D028 [17.3 мг, 0.0378 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (2S,6R)-2,6-диметилморфолин [30 мг, 0.260 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.04 (2H, д, J = 6.8 Гц), 4.42-4.36 (2H, м), 3.69-3.63 (2H, м), 2.82 (3H, кв, J = 12.0 Гц), 2.66 (1H, дд, J = 13.2, 3.9 Гц), 2.48 (1H, дд, J = 13.4, 3.7 Гц), 2.43-2.24 (4H, м), 2.06-1.96 (3H, м), 1.74-1.26 (15H, м), 1.12 (3H, д, J = 6.1 Гц), 1.12 (3H, д, J = 6.0 Гц), 0.98 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 457.36 (C29H47NO33), Набл. масса = 458.35 (M+H).
Пример 194
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(2,2-диметилморфолино)бутан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D029)
Соединение D029 [13.6 мг, 0.030 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 2,2-диметилморфолин [30 мг, 0.260 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.39 (2H, дт, J = 15.0, 4.8 Гц), 3.70 (2H, ддд, J = 21.5, 12.0, 4.4 Гц), 2.85 (1H, дд, J = 12.2, 3.4 Гц), 2.66 (1H, дд, J = 13.2, 4.4 Гц), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.39-2.24 (7H, м), 2.16 (1H, д, J = 10.7 Гц), 2.08-1.92 (3H, м), 1.70-1.48 (8H, м), 1.38-1.31 (3H, м), 1.25-1.13 (8H, м), 0.98 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.35 (M+H).
Пример 195
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(4-окса-7-азаспиро[2.5]октан-7-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D030)
Соединение D030 [11.2 мг, 0.0252 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16b) [50 мг, 0.068 ммоль] и 4-окса-7-азаспиро[2.5]октан [30 мг, 0.265 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.88 (1H, д, J = 11.2 Гц), 4.06-3.95 (2H, м), 3.75 (2H, т, J = 4.9 Гц), 2.83 (1H, дд, J = 12.2, 3.4 Гц), 2.61-2.31 (9H, м), 2.23-2.13 (2H, м), 2.05-1.28 (18H, м), 0.98 (3H, д, J = 6.8 Гц), 0.74 (2H, т, J = 5.6 Гц), 0.62-0.55 (2H, м), 0.57 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 196
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D031)
Соединение D031 [14.9 мг, 0.0336 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-3-метилморфолин [30 мг, 0.297 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 10.7 Гц), 5.05 (2H, д, J = 8.0 Гц), 4.42-4.36 (2H, м), 3.77 (1H, дт, J = 11.4, 2.8 Гц), 3.68-3.58 (2H, м), 3.23 (1H, дд, J = 11.2, 9.3 Гц), 2.88-2.81 (2H, м), 2.77 (1H, дт, J = 11.9, 2.7 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.50-2.21 (6H, м), 2.08-1.93 (3H, м), 1.74-1.14 (13H, м), 1.00 (3H, д, J = 6.3 Гц), 0.99 (3H, д, J = 6.0 Гц), 0.58 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.30 (M+H).
Пример 197
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D032)
Соединение D032 [12.3 мг, 0.0277 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-3-метилморфолин [30 мг, 0.297 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 7.3 Гц), 4.43-4.33 (2H, м), 3.83-3.76 (1H, м), 3.62 (2H, ддд, J = 23.5, 13.5, 5.0 Гц), 3.23 (1H, дд, J = 11.2, 9.3 Гц), 2.87-2.64 (4H, м), 2.50-2.25 (6H, м), 2.07-1.91 (3H, м), 1.70-1.27 (11H, м), 1.00 (3H, д, J = 6.3 Гц), 0.98 (3H, д, J = 8.1 Гц), 0.59 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 198
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D033)
Соединение D033 [11.4 мг, 0.0238 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (S)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d06) [40 мг, 0.230 ммоль], описанный на стадии 3 в Примере 137.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 10.7 Гц), 5.91 (1H, д, J = 10.7 Гц), 5.77 (1H, тд, J = 55.0, 4.0 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.43-4.33 (2H, м), 3.91 (1H, д, J = 11.7 Гц), 3.75-3.62 (2H, м), 2.92-2.80 (2H, м), 2.75 (1H, дд, J = 12.0, 3.2 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.50-2.15 (7H, м), 2.07-1.91 (4H, м), 1.68-1.21 (12H, м), 0.99 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.30 (M+H).
Пример 199
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D034)
Соединение D034 [7.5 мг, 0.016 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16b) [50 мг, 0.068 ммоль] и (S)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d06) [40 мг, 0.230 ммоль], описанный на стадии 3 в Примере 137.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.89 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 55.0, 4.0 Гц), 4.06-3.95 (2H, м), 3.90 (1H, д, J = 10.0 Гц), 3.75-3.62 (2H, м), 2.88 (1H, д, J = 10.7 Гц), 2.83 (1H, дд, J = 10.7, 4.0 Гц), 2.75 (1H, дд, J = 11.7, 2.0 Гц), 2.58 (1H, дд, J = 13.2, 3.4 Гц), 2.48-2.35 (3H, м), 2.23-1.91 (7H, м), 1.87-1.26 (14H, м), 0.98 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.35 (M+H).
Пример 200
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метилоктагидро-1,3-диола (Соединение D035)
Соединение D035 [4.3 мг, 0.0090 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (S)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d06) [40 мг, 0.230 ммоль], описанный на стадии 3 в Примере 137.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 55.3, 4.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.09 (1H, м), 3.90 (1H, д, J = 11.7 Гц), 3.73-3.62 (2H, м), 2.87 (2H, дд, J = 10.7, 5.9 Гц), 2.74 (1H, д, J = 11.7 Гц), 2.53-2.34 (3H, м), 2.28-2.14 (2H, м), 2.03-1.87 (7H, м), 1.73-1.20 (16H, м), 0.98 (3H, д, J = 6.3 Гц), 0.57 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.35 (M+H).
Пример 201
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-2-(дифторметил)морфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D036)
Соединение D036 [10.3 мг, 0.0215 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и (R)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d10) [40 мг, 0.230 ммоль], описанный на стадии 3 в Примере 138.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.91 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 55.0, 4.0 Гц), 5.05 (2H, д, J = 6.8 Гц), 4.44-4.34 (2H, м), 3.91 (1H, д, J = 11.2 Гц), 3.74-3.61 (2H, м), 2.84 (2H, д, J = 11.7 Гц), 2.78 (1H, д, J = 11.7 Гц), 2.67 (1H, дд, J = 13.2, 4.4 Гц), 2.50-2.24 (5H, м), 2.18-1.96 (5H, м), 1.72-1.22 (13H, м), 0.99 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.35 (M+H).
Пример 202
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-2-(дифторметил)морфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D037)
Соединение D037 [2.0 мг, 0.0042 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (R)-2-(дифторметил)морфолин гидрохлорид (Соединение 3d10) [40 мг, 0.230 ммоль], описанный на стадии 3 в Примере 138.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.77 (1H, тд, J = 55.4, 4.1 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.08 (1H, м), 3.91 (1H, д, J = 10.2 Гц), 3.76-3.68 (1H, м), 3.63 (1H, тд, J = 11.5, 2.4 Гц), 2.88-2.73 (4H, м), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.47-1.87 (14H, м), 1.61-1.36 (18H, м), 0.98 (3H, д, J = 6.3 Гц), 0.56 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.30 (M+H).
Пример 203
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((2R,5S)-2,5-диметилморфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D038)
Соединение D038 [14.2 мг, 0.031 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.068 ммоль] и (2R,5S)-2,5-диметилморфолин [30 мг, 0.260 ммоль].
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.30 (M+H).
Пример 204
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((2R,5R)-2,5-диметилморфолино)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D039)
Соединение D039 [13.8 мг, 0.030 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.068 ммоль] и (2R,5R)-2,5-диметилморфолин [30 мг, 0.260 ммоль].
Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.30 (M+H).
Пример 205
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение D040)
Соединение D040 [43.7 мг, 0.101 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [100 мг, 0.136 ммоль], (R)-2-метилморфолин [0.2 мл] и ТГФ [2 мл].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 6.9 Гц), 4.43-4.35 (2H, м), 3.82 (1H, дд, J = 11.7, 2.1 Гц), 3.67-3.55 (2H, м), 2.88-2.81 (2H, м), 2.76 (1H, д, J = 11.9 Гц), 2.67 (1H, дд, J = 13.3, 4.1 Гц), 2.48 (1H, дд, J = 13.5, 3.9 Гц), 2.44-2.25 (4H, м), 2.10 (1H, тд, J = 11.7, 3.4 Гц), 2.04-1.93 (3H, м), 1.77-1.27 (12H, м), 1.12 (3H, д, J = 6.4 Гц), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 432.35 (M+H).
Пример 206
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D041)
Соединение D041 [30.0 мг, 0.070 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 188, используя соединение (14b) [100 мг, 0.174 ммоль], (S)-2-метилморфолин [0.2 мл] и ТГФ [2 мл].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.4 Гц), 4.06-3.95 (2H, м), 3.82 (1H, дд, J = 11.7, 2.1 Гц), 3.65-3.58 (2H, м), 2.85-2.76 (3H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.42-2.28 (3H, м), 2.23-2.13 (2H, м), 2.08-1.92 (4H, м), 1.87-1.25 (14H, м), 1.11 (3H, д, J = 6.4 Гц), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.35 (M+H).
Пример 207
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D042)
Соединение D042 [30.0 мг, 0.070 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 188, используя соединение (14b) [100 мг, 0.174 ммоль], (R)-3-метилморфолин [0.2 мл] и ТГФ [2 мл].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.04-3.96 (2H, м), 3.77 (1H, д, J = 11.4 Гц), 3.68-3.58 (2H, м), 3.23 (1H, дд, J = 11.2, 9.4 Гц), 2.88-2.80 (2H, м), 2.77 (1H, дт, J = 12.2, 3.0 Гц), 2.59 (1H, дд, J = 13.5, 3.0 Гц), 2.48-2.30 (3H, м), 2.28-2.13 (3H, м), 2.08-1.95 (4H, м), 1.88-1.17 (14H, м), 1.00 (6H, д, J = 6.8 Гц), 0.99 (6H, д, J = 5.7 Гц), 0.58 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.35 (M+H).
Пример 208
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D043)
Соединение D043 [40.9 мг, 0.095 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 188, используя соединение (14b) [100 мг, 0.174 ммоль], (S)-3-метилморфолин [0.2 мл] и ТГФ [2 мл].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.93 (2H, м), 3.78 (1H, дт, J = 11.4, 2.7 Гц), 3.68-3.55 (2H, м), 3.22 (1H, дд, J = 11.4, 9.6 Гц), 2.88-2.70 (3H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.42-2.13 (6H, м), 2.06-1.21 (18H, м), 0.99 (3H, д, J = 5.0 Гц), 0.98 (3H, т, J = 3.2 Гц), 0.58 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.35 (M+H).
Пример 209
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D045)
Соединение D045 [5.6 мг, 0.013 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (S)-3-метилморфолин [0.023 мл, 0.202 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, с), 4.89 (1H, д, J = 1.8 Гц), 4.35 (1H, т, J = 5.7 Гц), 4.12 (1H, кв, J = 6.1 Гц), 3.78 (1H, дт, J = 11.0, 3.5 Гц), 3.65 (1H, дд, J = 11.9, 3.2 Гц), 3.63-3.57 (1H, м), 3.23 (1H, дд, J = 11.2, 9.4 Гц), 2.88-2.70 (3H, м), 2.51 (1H, дд, J = 13.3, 3.2 Гц), 2.44-2.23 (4H, м), 2.10-1.92 (3H, м), 1.88 (2H, т, J = 5.5 Гц), 1.73-1.30 (12H, м), 0.99 (3H, д, J = 6.4 Гц), 0.98 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 210
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D046)
Соединение D046 [5.5 мг, 0.012 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (R)-3-метилморфолин [0.023 мл, 0.202 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, с), 4.89 (1H, д, J = 2.3 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.18-4.06 (1H, м), 3.77 (1H, д, J = 11.4 Гц), 3.68-3.55 (2H, м), 3.23 (1H, дд, J = 11.4, 9.1 Гц), 2.95-2.70 (3H, м), 2.55-2.15 (5H, м), 2.05-1.83 (5H, м), 1.73-1.16 (12H, м), 1.00 (3H, д, J = 6.4 Гц), 0.99 (3H, д, J = 6.4 Гц), 0.57 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 211
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D047)
Соединение D047 [6.7 мг, 0.015 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (R)-2-метилморфолин гидрохлорид [27.8 мг, 0.202 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.89 (1H, д, J = 1.8 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.10 (1H, м), 3.82 (1H, дд, J = 11.7, 2.1 Гц), 3.68-3.55 (2H, м), 2.89-2.73 (3H, м), 2.51 (1H, дд, J = 13.3, 3.7 Гц), 2.46-2.23 (3H, м), 2.11 (1H, тд, J = 11.7, 3.4 Гц), 2.04-1.92 (3H, м), 1.88 (2H, т, J = 6.0 Гц), 1.78-1.25 (12H, м), 1.11 (3H, д, J = 6.4 Гц), 0.98 (3H, д, J = 6.4 Гц), 0.57 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 212
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D048)
Соединение D048 [6.8 мг, 0.015 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [50 мг, 0.067 ммоль] и (S)-2-метилморфолин гидрохлорид [0.023 мл, 0.202 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.89 (1H, д, J = 2.3 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (2H, м), 3.82 (1H, дд, J = 11.7, 2.1 Гц), 3.65-3.59 (2H, м), 2.87 (1H, д, J = 11.4 Гц), 2.79 (2H, т, J = 9.4 Гц), 2.51 (1H, дд, J = 13.3, 3.7 Гц), 2.44-2.23 (3H, м), 2.09-1.92 (4H, м), 1.88 (2H, т, J = 5.5 Гц), 1.81 (1H, дд, J = 20.4, 9.8 Гц), 1.71-1.28 (12H, м), 1.11 (3H, д, J = 5.9 Гц), 0.98 (3H, д, J = 6.4 Гц), 0.57 (3H, с).
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.35 (M+H).
Пример 213
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3,3-диметилморфолино)бутан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D049)
Соединение D049 [9.3 мг, 0.021 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 188, используя соединение (14b) [50 мг, 0.087 ммоль] и 3,3-диметилморфолин [0.054 мл, 0.435 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.4 Гц), 4.04-3.95 (2H, м), 3.73-3.65 (2H, м), 2.83 (1H, дд, J = 12.1, 3.9 Гц), 2.61-2.52 (3H, м), 2.42-2.37 (3H, м), 2.23-2.13 (2H, м), 2.05-2.02 (1H, м), 1.96-1.93 (1H, м), 1.86-1.81 (1H, м), 1.78-1.72 (1H, м), 1.66-1.50 (6H, м), 1.38-1.32 (3H, м), 1.19-1.16 (1H, м), 1.01 (6H, д, J = 4.1 Гц), 0.97 (3H, д, J = 6.4 Гц), 0.57 (3H, с).
Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 214
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-(4-(метилсульфонил)пиперазин-1- ил)бутан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение E002)
Соединение E002 [11.2 мг, 0.022 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16a) [100 мг, 0.134 ммоль] и 4-(метилсульфонил)пиперазин [67 мг, 0.408 ммоль].
1H-ЯМР (CD3OD) δ: 6.40 (1H, д, J = 11.2 Гц), 6.16 (1H, д, J = 11.2 Гц), 5.36 (1H, дд, J = 2.4, 1.5 Гц), 4.43 (1H, т, J = 5.9 Гц), 4.22-4.15 (1H, м), 2.95 (1H, дд, J = 9.0, 4.0 Гц), 2.91 (3H, с), 2.68-2.39 (7H, м), 2.33 (1H, дд, J = 13.4, 6.6 Гц), 2.27-1.34 (19H, м), 1.06 (3H, д, J = 6.3 Гц), 0.65 (3H, с).
Пример 215
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-(4-(метилсульфонил)пиперазин-1- ил)бутан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение E004)
Соединение E004 [16.0 мг, 0.0316 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение (16c) [50 мг, 0.067 ммоль] и 4-(метилсульфонил)пиперазин [40 мг, 0.244 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 6.9 Гц), 4.43-4.35 (2H, м), 3.22 (4H, т, J = 5.0 Гц), 2.89-2.82 (4H, м), 2.83 (3H, с), 2.67 (1H, дд, J = 13.3, 4.1 Гц), 2.61-2.36 (7H, м), 2.31-2.25 (2H, м), 2.09-2.00 (2H, м), 1.98-1.90 (1H, м), 1.68-1.48 (7H, м), 1.40-1.25 (4H, м), 0.99 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 506.32 (C28H46N2O4S), Набл. масса = 507.25 (M+H).
Сравнительный пример 16
Синтез (4R)-4-((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси) циклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пентил 4-метилбензолсульфоната (Соединение 19b)
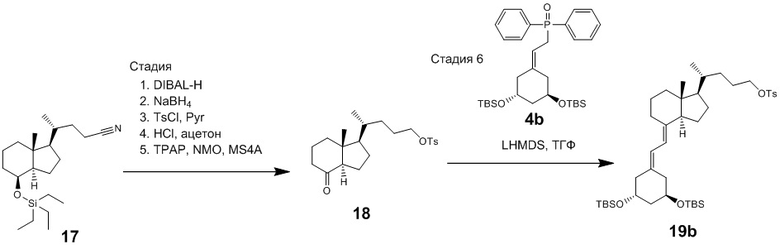
Стадия 1
DIBAL-H [1.5M раствор в толуоле, 10 мл] добавляли в раствор (4R)-4- ((1R,4S,7aR)-7a-метил-4-((триэтилсилил)окси)октагидро-1H-инден-1-ил)пентаннитрила [5.1 г, 15 ммоль] в толуоле [50 мл] при -78°C, и смесь перемешивали в течение 1.5 часов. Смесь нагревали до 0°C и перемешивали еще 1 час. Реакцию гасили метанолом. Добавляли 5 М водный раствор гидроксида натрия, и полученную смесь перемешивали при комнатной температуре 10 минут. Смесь выливали в насыщенный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания частично очищали методом колоночной хроматографии на силикагеле, получая (4R)-4-((1R,4S,7aR)-7a-метил-4-((триэтилсилил)окси)октагидро-1H-инден-1- ил)пентаналь [3.65 г].
Стадия 2
Описанное выше соединение [3.65 г], полученное на стадии 1, растворяли в смеси толуола [20 мл] и метанола [20 мл], затем в раствор добавляли тетрагидроборат натрия [0.88 г, 23 ммоль] при 0°C, и полученную смесь перемешивали при той же температуре в течение 30 минут. Реакционную смесь гасили насыщенным водным раствором хлорида аммония, выливали в насыщенный раствор хлорида натрия и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая (4R)-4-((1R,4S,7aR)-7a-метил-4-((триэтилсилил) окси)октагидро-1H-инден-1-ил)пентан-1-ол [2.37 г, 6.68 ммоль].
Стадия 3
пара-Толуолсульфонилхлорид [1.6 г, 8.4 ммоль] добавляли в раствор описанного выше соединения [2.37 г, 6.68 ммоль], полученного на стадии 2, в пиридине [12 мл], и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в насыщенный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении.
Стадия 4
Остаток, полученный на стадии 3, растворяли в ацетоне [30 мл], затем добавляли 2М раствор соляной кислоты [10 мл], и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая (4R)-4-((1R,4S,7aR)-4-гидрокси-7a-метилоктагидро-1H-инден-1-ил)пентил 4-метилбензолсульфонат [1.37 г, 3.47 ммоль].
Стадия 5
Раствор (4R)-4-((1R,4S,7aR)-4-гидрокси-7a-метилоктагидро-1H-инден-1-ил)пентил 4-метилбензолсульфоната [1.37 г, 3.47 ммоль], полученного на стадии 4, N-метилморфолин-N-оксид моногидрата [0.67 г, 5.0 ммоль] и молекулярные сита 4A [1.5 г] в дихлорметане [30 мл] перемешивали при 0°C в течение 1 часа. Добавляли тетрапропиламмония перрутенат [120 мг, 0.342 ммоль], и полученную смесь перемешивали при 0°C в течение 1 часа. Реакционную смесь разбавляли гептаном и фильтровали через целит. Фильтрат промывали насыщенным водным раствором хлорида аммония и затем насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая (4R)-4- ((1R,7aR)-7a-метил-4-оксооктагидро-1H-инден-1-ил)пентил 4-метилбензолсульфонат [1.15 г, 2.93 ммоль].
1H-ЯМР (CDCl3) δ: 7.79 (2H, т, J = 4.1 Гц), 7.35 (2H, д, J = 7.8 Гц), 4.06-3.94 (2H, м), 2.45 (3H, с), 2.43 (1H, дд, J = 12.2, 7.8 Гц), 2.33-2.17 (2H, м), 2.11-1.65 (6H, м), 1.60-0.99 (9H, м), 0.91 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Стадия 6
В атмосфере аргона при -78°C добавляли LHMDS [1 M раствор в ТГФ, 2.6 мл, 2.6 ммоль] в раствор (2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)циклогексилиден)этил) дифенилфосфин оксида (Соединение 4b, CAS 139356-39-1) [0.99 г, 1.7 ммоль] в ТГФ [10 мл], и смесь перемешивали в течение 15 минут. Добавляли раствор (4R)-4- ((1R,7aR)-7a-метил-4-оксооктагидро-1H-инден-1-ил)пентил 4-метилбензолсульфоната [1.15 г, 2.93 ммоль], полученного на стадии 5, в ТГФ [10 мл], и полученную смесь перемешивали при -78°C в течение 1.5 часов. Реакционную смесь снова нагревали до комнатной температуры, добавляли насыщенный водный раствор хлорида аммония экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая (4R)-4-((1R,3aS,7aR,E)-4-(2-((3R,5R)- 3,5-бис((т-бутилдиметилсилил)окси)циклогексилиден)этилиден)-7a-метилоктагидро-1H- инден-1-ил)пентил 4-метилбензолсульфонат (Соединение 19b) [0.67 г, 0.90 ммоль].
1H-ЯМР (CDCl3) δ: 7.80 (2H, д, J = 8.3 Гц), 7.35 (2H, д, J = 8.8 Гц), 6.16 (1H, д, J = 10.7 Гц), 5.81 (1H, д, J = 11.2 Гц), 4.10-3.99 (4H, м), 2.80 (1H, д, J = 11.7 Гц), 2.45 (3H, с), 2.40-2.07 (4H, м), 1.96-1.61 (10H, м), 1.53-1.21 (12H, м), 1.07-1.00 (1H, м), 0.87 (9H, с), 0.86 (9H, с), 0.50 (3H, с), 0.05 (6H, с), 0.05 (6H, с).
Пример 216
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-5-(3-(дифторметокси)азетидин-1-ил)пентан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение A033)
Соединение A033 [10.6 мг, 0.0227 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение 19b [50 мг, 0.067 ммоль], описанное в Сравнительном примере 16, и 3-дифторметоксиазетидин [30 мг, 0.244 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.38 (1H, т, J = 75.0 Гц), 6.21 (1H, д, J = 10.7 Гц), 5.88 (1H, д, J = 10.7 Гц), 4.76-4.70 (1H, м), 4.06-3.94 (2H, м), 3.65 (2H, дд, J = 9.0, 6.6 Гц), 3.11 (2H, дд, J = 9.0, 6.0 Гц), 2.83 (1H, дд, J = 12.0, 3.7 Гц), 2.59 (1H, дд, J = 13.4, 3.7 Гц), 2.52-2.38 (3H, м), 2.23-2.13 (2H, м), 2.03-1.27 (17H, м), 1.12-1.03 (1H, м), 0.95 (3H, д, J = 6.3 Гц), 0.57 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.30 (M+H).
Пример 217
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-5-((S)-3-фторпирролидин-1-ил)пентан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B016)
Соединение B016 [12.0 мг, 0.0277 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение 19b [50 мг, 0.067 ммоль], описанное в Сравнительном примере 16, и (S)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
Точная масса = 433.34 (C27H44FNO2), Набл. масса = 434.30 (M+H).
Пример 218
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-5-((R)-3-фторпирролидин-1-ил)пентан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B017)
Соединение B017 [14.0 мг, 0.0323 ммоль] получали посредством проведения реакции аналогично Примеру 1, используя соединение 19b [50 мг, 0.067 ммоль] и (R)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
Точная масса = 433.34 (C27H44FNO2), Набл. масса = 434.30 (M+H).
Пример 219
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-5-((S)-3-(дифторметил)пирролидин-1-ил) пентан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B084)
Соединение B084 [5.0 мг, 0.011 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение 19b [55 мг, 0.074 ммоль] и (S)-3-(дифторметил)пирролидин гидрохлорид [50 мг, 0.317 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 10.7 Гц), 5.89 (2H, д, J = 10.7 Гц), 5.81 (2H, тд, J = 56.0, 6.0 Гц), 4.13-3.96 (2H, м), 2.86-2.14 (13H, м), 2.05-1.29 (21H, м), 1.14-1.05 (1H, м), 0.98 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.40 (M+H).
Пример 220
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-5-((R)-3-(дифторметил)пирролидин-1-ил) пентан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B085)
Соединение B085 [14.7 мг, 0.0316 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение 19b [55 мг, 0.074 ммоль] и (R)-3-(дифторметил)пирролидин гидрохлорид [50 мг, 0.317 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.2 Гц), 5.89 (2H, д, J = 11.2 Гц), 5.80 (2H, тд, J = 58.0, 5.0 Гц), 4.07-3.96 (2H, м), 2.84 (1H, дд, J = 12.2, 3.4 Гц), 2.77 (1H, т, J = 9.0 Гц), 2.69-2.39 (8H, м), 2.24-2.14 (2H, м), 2.06-1.31 (20H, м), 1.15-1.05 (1H, м), 0.98 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 465.34 (C28H45F2NO2), Набл. масса = 466.40 (M+H).
Пример 221
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-5-морфолинопентан-2-ил)октагидро- 4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение D044)
Соединение D044 [15.1 мг, 0.0350 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 1, используя соединение 19b [55 мг, 0.074 ммоль] и морфолин [0.05 мл, 0.58 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 10.7 Гц), 5.89 (1H, д, J = 11.2 Гц), 4.07-3.96 (2H, м), 3.70 (4H, т, J = 4.6 Гц), 2.84 (1H, дд, J = 12.0, 3.7 Гц), 2.60 (1H, дд, J = 13.2, 3.4 Гц), 2.48-2.14 (9H, м), 2.05-1.30 (18H, м), 1.13-1.04 (1H, м), 0.98 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.30 (M+H).
Сравнительный пример 17
Синтез (2R)-2-((1R,3aS,7aR,E)-4-((Z)-2-((3S,5R)-3,5-дигидрокси-2- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение 23a)
Стадия 1
Гидрокарбонат натрия [1.43 г, 17.0 ммоль] добавляли в перемешиваемый раствор соединения 2a [4.15 г, 5.69 ммоль] в ДМСО [40 мл] и толуоле [50 мл], и реакционную смесь перемешивали при 100°C в течение 3 часов. После охлаждения до комнатной температуры, смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали гептаном. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая 2-((1R,3aS,7aR,E)-4-((Z)-2-((3S,5R)-3,5-бис((т-бутилдиметилсилил)окси)-2- метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропаналь (Соединение 20a) [2.37 г, 4.14 ммоль].
Стадия 2
Диазабициклоундецен (DBU) [1.5 мл] добавляли в раствор соединения 20a [2.37 г, 4.14 ммоль] в ТГФ [50 мл], и полученный раствор кипятили 38 часов. После охлаждения до комнатной температуры, реакционную смесь выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный сырой продукт использовали в следующей стадии без дополнительной очистки.
Стадия 3
Сырой продукт, полученный на стадии 2, растворяли в смеси ТГФ [50 мл] и метанола [50 мл], затем в раствор добавляли тетрагидроборат натрия [0.38 г, 10 ммоль] при 0°C, и полученную смесь перемешивали при той же температуре в течение 1 часа. Реакционную смесь гасили насыщенным водным раствором хлорида аммония, переносили в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая 2-((1R,3aS,7aR,E)-4-((Z)-2-((3S,5R)-3,5-бис ((т-бутилдиметилсилил)окси)-2-метиленциклогексилиден)этилиден)-7a-метилоктагидро- 1H-инден-1-ил)пропан-1-ол (Соединение 21a) [1.96 г, 3.41 ммоль].
Стадия 4
п-Толуолсульфонилхлорид [1.01 г, 5.30 ммоль] и 4-диметиламинопиридин (DMAP) [100 мг, 0.818 ммоль] добавляли в раствор соединения 21a [1.96 г, 3.41 ммоль], полученного на стадии 3, в пиридине [20 мл], и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении, разбавляли толуолом и промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный сырой продукт (Соединение 22a) использовали в следующей стадии без дополнительной очистки.
Стадия 5 и стадия 6
Сырой продукт (Соединение 22a), полученный на стадии 4, растворяли в ацетоне [120 мл], затем добавляли 3М раствор соляной кислоты [20 мл, 60 ммоль], и полученную смесь перемешивали при комнатной температуре 6 часов. Реакционную смесь гасили 5М добавлением водного раствора гидроксида натрия и насыщенного водного раствора гидрокарбоната натрия. Удаляли ацетон из реакционной смеси при пониженном давлении. Добавляли в остаток этилацетат, и смесь промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая смесь R и S диастереомеров C-20. Добавляли смесь растворителей [10 мл] гептан/этилацетат (1/10), и смесь обрабатывали ультразвуком 3 минуты. Твердый осадок [798 мг], образовавшийся в растворе под действием ультразвука, отделяли фильтрованием. Добавляли безводный метанол к части [545 мг] твердого продукта, и полученную суспензию кипятили 45 минут. Суспензию медленно охлаждали до комнатной температуры. Твердое вещество отделяли, получая (2R)-2-((1R,3aS,7aR,E)- 4-((Z)-2-((3S,5R)-3,5-дигидрокси-2-метиленциклогексилиден)этилиден)-7a- метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфонат (Соединение 23a) [342 мг, 683 ммоль].
1H-ЯМР (CD3OD) δ: 7.77 (2H, д, J = 8.2 Гц), 7.45 (2H, д, J = 8.2 Гц), 6.29 (1H, д, J = 11.0 Гц), 6.05 (1H, д, J = 11.0 Гц), 5.27 (1H, с), 4.33 (1H, т, J = 5.9 Гц), 4.14-4.07 (2H, м), 3.82 (1H, дд, J = 9.4, 6.6 Гц), 2.83 (1H, дд, J = 12.3, 3.2 Гц), 2.50 (1H, дд, J = 13.5, 3.4 Гц), 2.45 (3H, с), 2.24 (1H, дд, J = 13.3, 6.9 Гц), 1.96 (1H, дд, J = 11.7, 7.5 Гц), 1.89-1.27 (12H, м), 1.19 (1H, тд, J = 12.5, 3.8 Гц), 0.89 (3H, д, J = 6.9 Гц), 0.45 (3H, с).
Пример 222
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-(пирролидин-1-ил)пропан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B009)
Соединение 23a [40 мг, 0.080 ммоль] растворяли в пирролидине [0.6 мл], и полученный раствор перемешивали при 60°C в течение ночи. Реакционную смесь упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение B009 [16.0 мг, 0.040 ммоль].
Точная масса = 399.31 (C26H41NO2), Набл. масса = 400.25 (M+H).
Пример 223
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-((S)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B010)
Раствор соединения 23a [40 мг, 0.080 ммоль], (S)-3-метилпирролидин гидрохлорида [30 мг, 0.247 ммоль] и карбоната калия [60 мг, 0.434 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение B010 [14.6 мг, 0.0353 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, дд, J = 2.7, 1.4 Гц), 4.89 (1H, д, J = 2.7 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 2.86 (1H, дд, J = 11.9, 4.1 Гц), 2.78-2.67 (2H, м), 2.54-2.19 (7H, м), 2.07-1.85 (8H, м), 1.73-1.27 (12H, м), 1.02 (3H, д, J = 6.9 Гц), 0.94 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Пример 224
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-((R)-3-метилпирролидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B011)
Соединение B011 [13.0 мг, 0.0314 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23a [40 мг, 0.080 ммоль] и (R)-3-метилпирролидин гидрохлорид [30 мг, 0.247 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.28 (1H, дд, J = 2.3, 1.4 Гц), 4.89 (1H, д, J = 2.3 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 2.93-2.84 (2H, м), 2.71-2.65 (1H, м), 2.53-2.42 (3H, м), 2.29-2.17 (3H, м), 2.06-1.80 (8H, м), 1.73-1.28 (11H, м), 1.02 (3H, д, J = 6.9 Гц), 0.94 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Пример 225
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B018)
Соединение B018 [10.6 мг, 0.0254 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23a [40 мг, 0.080 ммоль] и (S)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, дд, J = 2.3, 1.1 Гц), 5.22-5.03 (1H, м), 4.89 (1H, д, J = 2.3 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.08 (1H, м), 2.95-2.83 (2H, м), 2.76 (1H, дд, J = 14.6, 7.8 Гц), 2.59-1.82 (14H, м), 1.73-1.28 (10H, м), 0.95 (3H, д, J = 6.9 Гц), 0.59 (3H, с).
Точная масса = 417.30 (C26H40FNO2), Набл. масса = 418.25 (M+H).
Пример 226
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((R)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение B019)
Соединение B019 [9.7 мг, 0.023 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23a [40 мг, 0.080 ммоль] и (R)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, д, J = 2.3 Гц), 5.21-5.03 (1H, м), 4.89 (1H, д, J = 2.3 Гц), 4.35 (1H, т, J = 5.7 Гц), 4.16-4.10 (1H, м), 2.88-2.65 (4H, м), 2.54-2.49 (2H, м), 2.36-1.84 (11H, м), 1.73-1.28 (10H, м), 0.95 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 417.30 (C26H40FNO2), Набл. масса = 418.20 (M+H).
Пример 227
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B095)
Соединение B095 [14.5 мг, 0.0323 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23a [40 мг, 0.080 ммоль] и (S)-3-(дифторметил)пирролидин гидрохлорид [40 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.74 (1H, тд, J = 57.3, 5.2 Гц), 5.28 (1H, дд, J = 2.3, 1.4 Гц), 4.89 (1H, дд, J = 2.3, 1.4 Гц), 4.35 (1H, т, J = 5.7 Гц), 4.15-4.10 (1H, м), 2.86 (1H, дд, J = 11.0, 4.0 Гц), 2.60-2.44 (7H, м), 2.35-2.20 (2H, м), 2.03-1.27 (16H, м), 0.94 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.25 (M+H).
Пример 228
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диола (Соединение B096)
Соединение B096 [12.0 мг, 0.0267 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23a [40 мг, 0.080 ммоль] и (R)-3-(дифторметил)пирролидин гидрохлорид [40 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.76 (1H, тд, J = 57.2, 5.9 Гц), 5.28 (1H, дд, J = 2.3, 1.4 Гц), 4.89 (1H, д, J = 1.4 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 2.86 (1H, дд, J = 12.1, 3.4 Гц), 2.71 (1H, т, J = 8.7 Гц), 2.60-2.23 (8H, м), 2.03-1.27 (16H, м), 0.94 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 449.31 (C27H41F2NO2), Набл. масса = 450.20 (M+H).
Сравнительный пример 18
Синтез (2R)-2-((1R,3aS,7aR,E)-4-(2-((3S,5R)-3,5-дигидроксициклогексилиден)этилиден)- 7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфонат (Соединение 23b)
Стадия 1
Соединение 20b [3.31 г, 5.90 ммоль] получали по той же методике, как на стадии 1 в Сравнительном примере 17, используя соединение 2b [4.70 г, 6.55 ммоль] в качестве исходного вещества.
Стадия 2 и стадия 3
Соединение 21b [3.12 г, 5.54 ммоль] получали по той же методике, как в стадиях 2 и 3 в Сравнительном примере 17, используя соединение 20b [3.31 г, 5.90 ммоль] в качестве исходного вещества.
Стадия 4
Соединение 22b [3.12 г, 5.54 ммоль] получали по той же методике, как на стадии 4 в Сравнительном примере 17, используя соединение 21b [3.12 г, 5.54 ммоль] в качестве исходного вещества.
Стадия 5
Десилилированный сырой продукт получали по той же методике, как на стадии 5 в Сравнительном примере 17, используя соединение 22b [3.12 г, 5.54 ммоль] в качестве исходного вещества. Полученный сырой продукт очищали методом препаративной ВЭЖХ, и выделяли высокополярное соединение, получая соединение 23b [0.66 г].
1H-ЯМР (CD3OD) δ: 7.77 (2H, д, J = 8.2 Гц), 7.44 (2H, д, J = 8.2 Гц), 6.19 (1H, д, J = 11.0 Гц), 5.86 (1H, д, J = 11.0 Гц), 4.09-3.95 (3H, м), 3.83 (1H, дд, J = 9.6, 6.9 Гц), 2.80 (1H, д, J = 13.3 Гц), 2.56 (1H, дд, J = 13.3, 3.7 Гц), 2.45 (3H, с), 2.40 (1H, дд, J = 14.4, 3.4 Гц), 2.22-2.12 (2H, м), 1.98 (1H, дд, J = 7.0, 12.0 Гц), 1.88-1.16 (14H, м), 0.90 (3H, д, J = 6.9 Гц), 0.45 (3H, с).
Пример 229
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B097)
Соединение B097 [9.0 мг, 0.022 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (S)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.4 Гц), 5.13 (1H, дт, J = 55.8, 5.7 Гц), 4.06-3.95 (2H, м), 2.94-2.74 (3H, м), 2.61-2.37 (6H, м), 2.32 (1H, т, J = 11.0 Гц), 2.23-1.27 (22H, м), 0.96 (3H, д, J = 6.9 Гц), 0.60 (3H, с).
Точная масса = 405.30 (C25H40FNO2), Набл. масса = 406.20 (M+H).
Пример 230
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((R)-3-фторпирролидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B098)
Соединение B098 [14.7 мг, 0.0362 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (R)-3-фторпирролидин гидрохлорид [30 мг, 0.239 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.4 Гц), 5.12 (1H, дт, J = 56.0, 5.4 Гц), 4.06-3.95 (2H, м), 2.85-2.65 (4H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.52 (1H, дд, J = 11.7, 4.8 Гц), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.36-1.28 (20H, м), 0.95 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 405.30 (C25H40FNO2), Набл. масса = 406.25 (M+H).
Пример 231
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B099)
Соединение B099 [10.0 мг, 0.0229 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (S)-3-(дифторметил)пирролидин гидрохлорид [35 мг, 0.222 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 5.74 (1H, тд, J = 57.5, 5.0 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 11.7, 4.3 Гц), 2.61-2.44 (6H, м), 2.40 (1H, дд, J = 13.3, 3.7 Гц), 2.30 (1H, т, J = 11.0 Гц), 2.23-2.13 (2H, м), 2.05-1.27 (15H, м), 0.95 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.20 (M+H).
Пример 232
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B100)
Соединение B100 [10.0 мг, 0.0229 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (R)-3-(дифторметил)пирролидин гидрохлорид [35 мг, 0.222 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 5.76 (1H, тд, J = 57.0, 5.0 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 12.3, 3.2 Гц), 2.71 (1H, т, J = 8.7 Гц), 2.61-2.37 (7H, м), 2.27 (1H, т, J = 10.7 Гц), 2.18 (2H, ддд, J = 25.6, 12.6, 5.3 Гц), 2.04-1.26 (16H, м), 0.95 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
Точная масса = 437.31 (C26H41F2NO2), Набл. масса = 438.25 (M+H).
Пример 233
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B101)
Соединение B101 [8.1 мг, 0.018 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (S)-3-(1,1-дифторэтил)пирролидин гидрохлорид [35 мг, 0.204 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 2.83 (1H, дд, J = 11.4, 3.2 Гц), 2.69-2.36 (7H, м), 2.31 (1H, т, J = 11.0 Гц), 2.23-2.13 (2H, м), 2.04-1.27 (20H, м), 0.95 (3H, д, J = 6.9 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 234
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B102)
Соединение B102 [11.3 мг, 0.0250 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (R)-3-(1,1-дифторэтил)пирролидин гидрохлорид [35 мг, 0.204 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 2.86-2.78 (2H, м), 2.70-2.55 (4H, м), 2.52-2.38 (4H, м), 2.30-2.13 (5H, м), 2.04-1.27 (24H, м), 0.95 (3H, д, J = 6.9 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 235
Синтез (1R,3S)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение B103)
Соединение B103 [14.7 мг, 0.0326 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 223, используя соединение 23b [40 мг, 0.082 ммоль] и (S)-3-(2,2-дифторэтил)пирролидин гидрохлорид [40 мг, 0.233 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 5.88 (1H, тт, J = 56.0, 5.0 Гц), 4.06-3.95 (2H, м), 2.90 (1H, т, J = 8.5 Гц), 2.83 (1H, дд, J = 11.7, 3.9 Гц), 2.67-1.28 (33H, м), 0.95 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.25 (M+H).
Пример 236
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-гидрокси-4-(трифторметил)пиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C005)
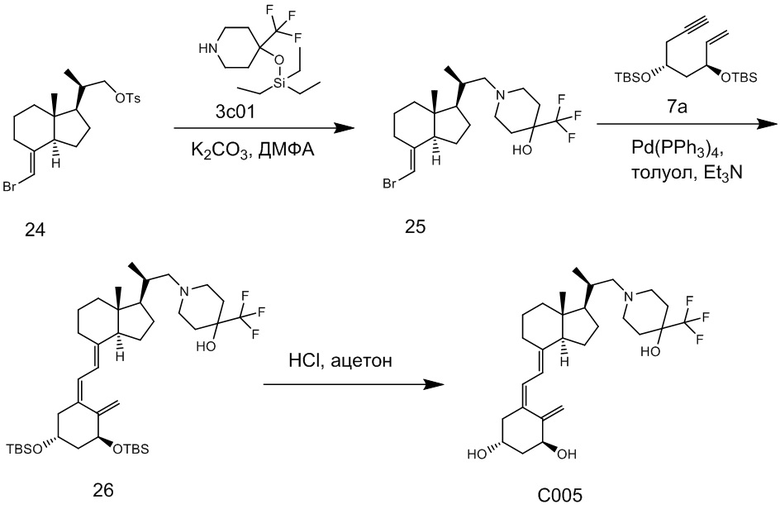
Стадия 1
1-((2R)-2-((1R,3aS,7aR,E)-4-(Бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил)-4-(трифторметил)пиперидин-4-ол (Соединение 25) [106.4 мг, 0.2427 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 92, используя (2R)-2-((1R,3aS,7aR,E)-4-(бромметилен)-7a-метилоктагидро-1H-инден-1-ил) пропил 4-метилбензолсульфонат [200.6 мг, 0.4545 ммоль] и триэтил-[[4-(трифторметил)-4-пиперидил]окси]силан [257.2 мг, 0.9075 ммоль] в качестве исходных веществ.
Стадия 2 и стадия 3
Соединение C005 [13.6 мг, 0.0273 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 92, используя соединение 25 [49 мг, 0.111 ммоль], полученное на стадии 1, соединение 7a [57.2 мг, 0.155 ммоль] и тетракис (трифенилфосфин)палладий(0) [23.2 мг, 0.0201 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.29 (1H, т, J = 1.2 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.23 (1H, д, J = 11.2 Гц), 3.09 (1H, д, J = 11.7 Гц), 2.96-2.83 (3H, м), 2.63 (1H, тд, J = 12.4, 2.8 Гц), 2.57-2.47 (2H, м), 2.26 (1H, дд, J = 13.7, 6.8 Гц), 2.10-1.97 (5H, м), 1.92-1.29 (17H, м), 0.99 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.3 (M+H).
Пример 237
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-гидрокси-4-(трифторметил) пиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C006)
Соединение C006 [15.8 мг, 0.0309 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 92, используя соединение 25 [49 мг, 0.111 ммоль], полученное на стадии 1 в Примере 236, и соединение 7b [55 мг, 0.144 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.10 (1H, д, J = 11.2 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.2 Гц), 3.23 (1H, д, J = 11.7 Гц), 3.09 (1H, д, J = 11.2 Гц), 2.95-2.83 (3H, м), 2.68-2.50 (3H, м), 2.17 (1H, дд, J = 13.2, 8.3 Гц), 2.09-1.98 (4H, м), 1.93-1.30 (15H, м), 1.04 (3H, д, J = 7.3 Гц), 0.98 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 511.33 (C29H44F3NO3), Набл. масса = 512.4 (M+H).
Пример 238
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-(4-(трифторметил)пиперидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C011)
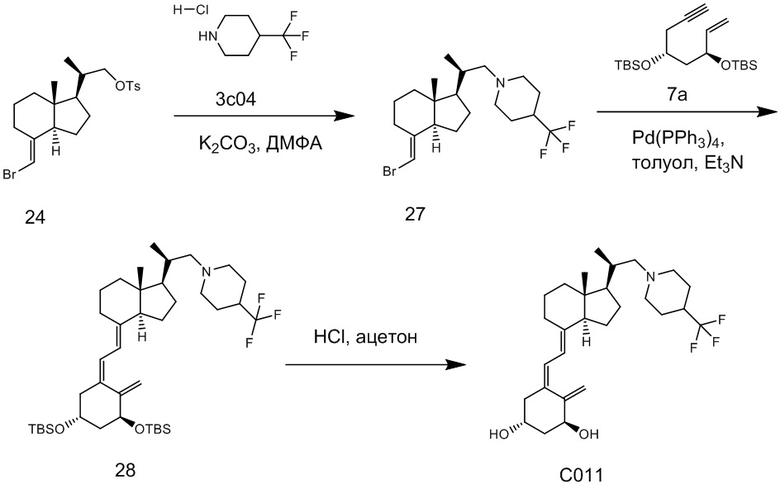
Стадия 1
Соединение 27 [105.7 мг, 0.250 ммоль] получали путем проведения реакции аналогично стадии 1 в Примере 236, используя соединение 24 [185 мг, 0.419 ммоль] и соединение 3c04 [215 мг, 1.40 ммоль] в качестве исходных веществ.
1H-ЯМР (CDCl3) δ: 5.65 (1H, т, J = 2.0 Гц), 2.98-2.86 (3H, м), 2.35 (1H, дд, J = 12.0, 5.1 Гц), 2.01-1.60 (15H, м), 1.56-1.21 (7H, м), 0.90 (3H, д, J = 6.8 Гц), 0.57 (3H, с).
Точная масса = 421.16 (C20H31BrF3N), Набл. масса = 422.20 (M+H).
Стадия 2 и стадия 3
Соединение C011 [15.9 мг, 0.033 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 92, используя соединение 27 [32 мг, 0.076 ммоль], полученное на стадии 1, соединение 7a [40.7 мг, 0.110 ммоль] и тетракис (трифенилфосфин)палладий(0) [15.0 мг, 0.013 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.07 (1H, м), 3.34 (1H, д, J = 10.2 Гц), 3.19 (1H, д, J = 11.7 Гц), 2.87 (1H, дд, J = 12.0, 3.7 Гц), 2.79 (1H, дд, J = 12.4, 4.1 Гц), 2.53-2.40 (3H, м), 2.35-2.23 (3H, м), 2.06-1.97 (2H, м), 1.93-1.28 (17H, м), 0.97 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 481.32 (C28H42F3NO2), Набл. масса = 482.4 (M+H).
Пример 239
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-(4-(трифторметил) пиперидин-1-ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C012)
Соединение C012 [15.8 мг, 0.0319 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 92, используя соединение 27 [33 мг, 0.078 ммоль], полученное на стадии 1 в Примере 238, соединение 7b [42.7 мг, 0.112 ммоль] и тетракис (трифенилфосфин)палладий(0) [15.0 мг, 0.013 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.11 (1H, д, J = 11.2 Гц), 5.23 (1H, д, J = 1.5 Гц), 4.23 (1H, д, J = 3.4 Гц), 3.73 (1H, тд, J = 8.1, 4.4 Гц), 3.34 (1H, д, J = 10.0 Гц), 3.19 (1H, д, J = 11.7 Гц), 2.88 (1H, дд, J = 12.2, 3.9 Гц), 2.80 (1H, дд, J = 12.2, 3.9 Гц), 2.60 (1H, дд, J = 13.7, 4.4 Гц), 2.52-1.99 (8H, м), 1.89-1.29 (17H, м), 1.05 (3H, д, J = 6.8 Гц), 0.98 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Точная масса = 495.33 (C29H44F3NO2), Набл. масса = 496.4 (M+H).
Пример 240
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C017)
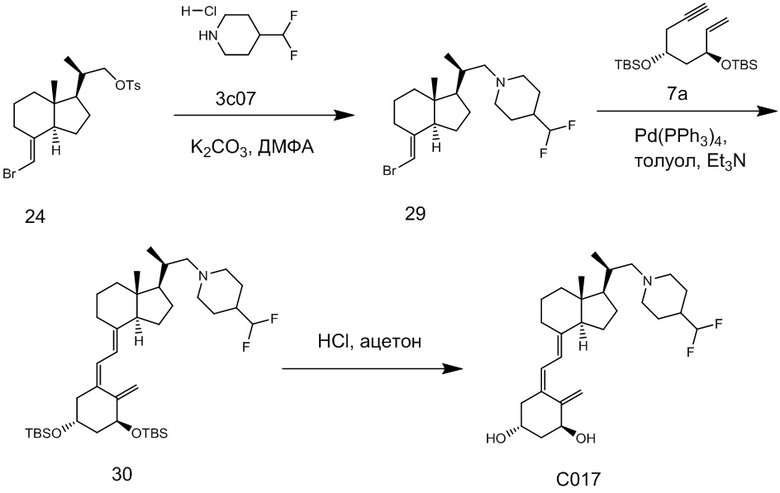
Стадия 1
Раствор соединения 24 [200 мг, 0.454 ммоль], соединения 3c07 [160 мг, 0.932 ммоль] и карбоната калия [250 мг, 1.81 ммоль] в ДМФА [1 мл] перемешивали при 80°C в течение 2 дней. После охлаждения до комнатной температуры, реакционную смесь переносили в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 29 [58.6 мг, 0.145 ммоль].
1H-ЯМР (CDCl3) δ: 5.65 (1H, т, J = 2.0 Гц), 5.56 (1H, тд, J = 57.0, 4.0 Гц), 2.98-2.80 (3H, м), 2.35 (1H, дд, J = 12.2, 4.9 Гц), 2.00-1.61 (12H, м), 1.58-1.21 (9H, м), 0.90 (3H, д, J = 6.8 Гц), 0.51 (3H, с).
Стадия 2 и стадия 3
Соединение C017 [13.5 мг, 0.029 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 92, используя соединение 29 [53 мг, 0.131 ммоль], полученное на стадии 1, (5R,7S)-2,2,3,3,9,9,10,10-октаметил-5-(проп-2-ин-1-ил)-7-винил- 4,8-диокса-3,9-дисилаундекан (Соединение 3c04) [65 мг, 0.176 ммоль] и тетракис (трифенилфосфин)палладий(0) [23.0 мг, 0.020 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 10.7 Гц), 5.76 (1H, тд, J = 56.5, 4.1 Гц), 5.29 (1H, т, J = 1.2 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.14-4.08 (1H, м), 3.47 (1H, д, J = 12.2 Гц), 3.00 (1H, дд, J = 12.4, 4.1 Гц), 2.87 (1H, дд, J = 12.3, 3.5 Гц), 2.75 (1H, тд, J = 12.3, 2.8 Гц), 2.64 (1H, т, J = 11.7 Гц), 2.53 (2H, дд, J = 13.4, 11.0 Гц), 2.26 (1H, дд, J = 13.7, 6.8 Гц), 2.10-1.98 (3H, м), 1.91-1.31 (18H, м), 1.00 (3H, д, J = 6.8 Гц), 0.62 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.3 (M+H).
Пример 241
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C018)
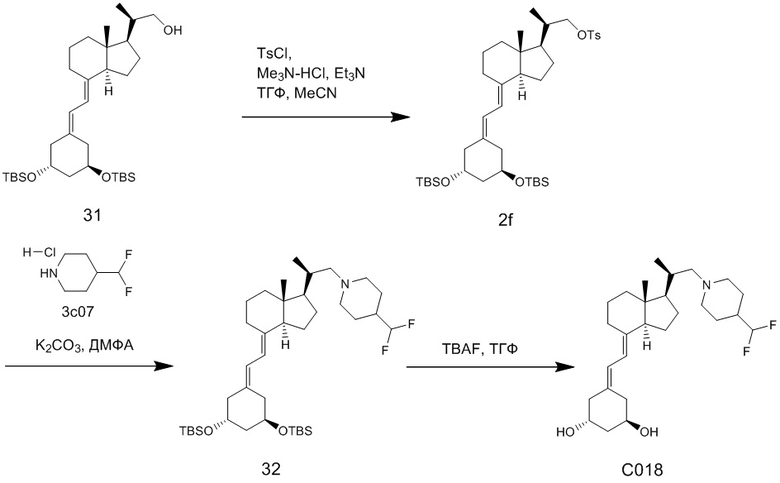
Стадия 1
TsCl [40.7 мг, 0.213 ммоль] добавляли в перемешиваемый раствор (2R)-2- ((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)циклогексилиден) этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропан-1-ола (Соединение 31, CAS 161970-22-5) [80.2 мг, 0.142 ммоль], триметиламин гидрохлорида [16.7 мг, 0.175 ммоль] и триэтиламина [0.08 мл, 0.57 ммоль] в смеси ТГФ [1 мл]/ацетонитрил [1 мл] при комнатной температуре, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили метанолом [0.2 мл] и упаривали при пониженном давлении. Остаток от упаривания разбавляли этилацетатом и промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом тонкослойной хроматографии [1 мм, гептан/EtOAc = 9/1], получая соединение 2f [90.2 мг, 0.126 ммоль].
1H-ЯМР (CDCl3) δ: 7.79 (2H, д, J = 8.3 Гц), 7.34 (2H, д, J = 8.3 Гц), 6.14 (1H, д, J = 11.2 Гц), 5.79 (1H, д, J = 11.2 Гц), 4.15-4.02 (4H, м), 3.82 (1H, дд, J = 9.3, 6.8 Гц), 2.85-2.75 (1H, м), 2.45 (3H, с), 2.36 (2H, дд, J = 13.4, 5.1 Гц), 2.25 (1H, дд, J = 13.7, 2.9 Гц), 2.09 (1H, дд, J = 13.2, 7.8 Гц), 1.95 (1H, т, J = 9.3 Гц), 1.88-1.71 (3H, м), 1.68-1.57 (4H, м), 1.55-1.18 (7H, м), 0.90 (3H, д, J = 6.3 Гц), 0.87 (9H, с), 0.85 (9H, с), 0.45 (3H, с), 0.05 (3H, с), 0.05 (3H, с), 0.04 (6H, с).
Стадия 2
Раствор соединения 2f [40 мг, 0.056 моль], полученного на стадии 1, 4-дифторметилпиперидин гидрохлорида [3c09, 28.7 мг, 0.167 ммоль] и карбоната калия [38.5 мг, 0.279 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания частично очищали методом тонкослойной хроматографии [1 мм, гептан/EtOAc = 9/1], получая соединение 32 [18.4 мг, 0.027 ммоль].
Точная масса = 679.50 (C39H71F2NO2Si2), Набл. масса = 680.6 (M+H).
Стадия 3
TBAF [1M раствор в ТГФ, 0.5 мл, 0.5 ммоль] добавляли в раствор соединения 32 [18.4 мг, 0.027 ммоль], полученного на стадии 2, в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение C018 [6.3 мг, 0.014 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.75 (1H, тд, J = 56.5, 4.0 Гц), 4.05-3.96 (2H, м), 3.41 (1H, д, J = 11.7 Гц), 3.26 (1H, д, J = 11.7 Гц), 2.93 (1H, дд, J = 12.4, 4.1 Гц), 2.85-1.97 (11H, м), 1.92-1.30 (16H, м), 0.99 (3H, д, J = 6.8 Гц), 0.62 (3H, д, J = 4.4 Гц).
Точная масса = 451.33 (C27H43F2NO2), Набл. масса = 452.40 (M+H).
Пример 242
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C019)
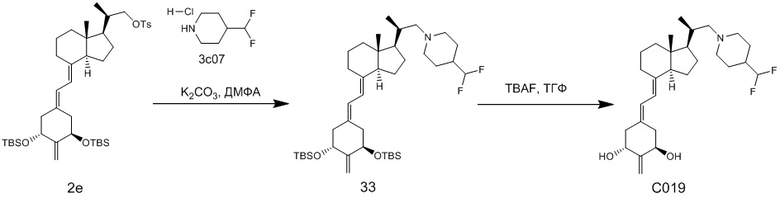
Стадия 1
Раствор (2R)-2-((1R,3aS,7aR,E)-4-(2-((3R,5R)-3,5-бис((т-бутилдиметилсилил)окси)- 4-метиленциклогексилиден)этилиден)-7a-метилоктагидро-1H-инден-1-ил)пропил 4-метилбензолсульфоната (Соединение 2e, CAS 1251827-23-2) [40 мг, 54.9 ммоль], 4-дифторметилпиперидина (Соединение 3c07) [30.2 мг, 0.176 ммоль] и карбоната калия [40 мг, 0.289 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания частично очищали методом препаративной тонкослойной хроматографии [1 мм, гептан/EtOAc = 9/1], получая соединение 33 [19.0 мг, 0.0274 ммоль].
Точная масса = 691.50 (C40H71F2NO2Si2), Набл. масса = 692.6 (M+H).
Стадия 2
TBAF [1M раствор в ТГФ, 0.2 мл, 0.2 ммоль] добавляли в раствор соединения 33 [19.0 мг, 0.0274 ммоль], полученного на стадии 1, в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение ночи. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение C019 [6.0 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (2H, д, J = 11.2 Гц), 5.75 (2H, тд, J = 55.0, 4.0 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.42-4.36 (2H, м), 3.43 (1H, д, J = 12.2 Гц), 2.94 (1H, дд, J = 12.7, 3.9 Гц), 2.86 (1H, дд, J = 12.4, 4.1 Гц), 2.69-2.24 (7H, м), 2.09-1.98 (3H, м), 1.89-1.28 (15H, м), 1.00 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 463.33 (C28H43F2NO2), Набл. масса = 464.50 (M+H).
Пример 243
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диола (Соединение C020)
Соединение C020 [15.1 мг, 0.0316 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 240, используя соединение 29 [34.7 мг, 0.086 ммоль], полученное на стадии 1 в Примере 240, соединение 7b [44.5 мг, 0.116 ммоль] и тетракис (трифенилфосфин)палладий(0) [17.0 мг, 0.015 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.10 (1H, д, J = 11.2 Гц), 5.76 (1H, тд, J = 56.4, 4.1 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.88 (1H, д, J = 2.4 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.1, 4.2 Гц), 3.47 (1H, д, J = 12.2 Гц), 3.33 (1H, с), 2.99 (1H, дд, J = 12.4, 4.1 Гц), 2.87 (1H, дд, J = 12.0, 3.7 Гц), 2.78-2.71 (1H, м), 2.67-2.49 (3H, м), 2.20-1.97 (4H, м), 1.91-1.31 (17H, м), 1.04 (3H, д, J = 7.3 Гц), 0.99 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 244
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)-4-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C024)
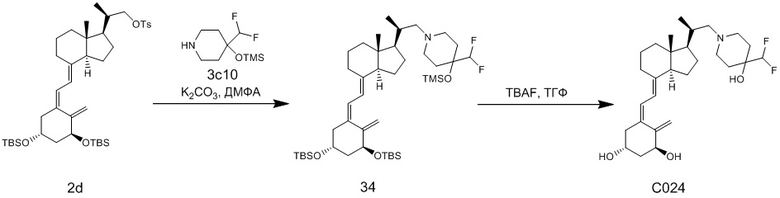
Соединение C024 [17.9 мг, 0.0373 ммоль] получали путем проведения реакции аналогично стадии 1 и стадии 2 в Примере 242, используя соединение (2d) [80.0 мг, 0.110 ммоль] и 4-(дифторметил)-4-((триметилсилил)окси)пиперидин [76.7 мг, 0.343 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 10.7 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.61 (1H, т, J = 56.1 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.24 (1H, д, J = 11.7 Гц), 3.09 (1H, д, J = 11.7 Гц), 2.99-2.85 (3H, м), 2.74-2.65 (1H, м), 2.59-2.49 (2H, м), 2.28-1.95 (5H, м), 1.91-1.28 (18H, м), 0.99 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.30 (M+H).
Пример 245
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)-4-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение C025)
Соединение C025 [6.5 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 242, используя соединение 2f [40 мг, 0.056 ммоль], описанное на стадии 1 в Примере 241, и 4-(дифторметил)-4-((триметилсилил)окси)пиперидин [37 мг, 0.166 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.2 Гц), 5.90 (1H, д, J = 11.2 Гц), 5.61 (1H, т, J = 56.1 Гц), 4.06-3.95 (2H, м), 3.29-3.24 (1H, м), 3.11 (1H, д, J = 11.2 Гц), 3.00-2.56 (7H, м), 2.41 (1H, дд, J = 13.2, 3.4 Гц), 2.23-1.95 (7H, м), 1.88-1.28 (16H, м), 1.00 (3H, д, J = 6.3 Гц), 0.62 (3H, с).
Точная масса = 467.32 (C27H43F2NO3), Набл. масса = 468.30 (M+H).
Пример 246
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)-4-гидроксипиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C026)
Соединение C026 [6.2 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 242, используя соединение 2e [40 мг, 0.055 ммоль] и 4-(дифторметил)-4-((триметилсилил)окси)пиперидин [40 мг, 0.171 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.62 (1H, т, J = 55.9 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.16 (1H, д, J = 12.2 Гц), 3.02 (2H, тд, J = 12.3, 2.6 Гц), 2.88-2.61 (4H, м), 2.48 (1H, дд, J = 13.4, 4.1 Гц), 2.32-1.97 (6H, м), 1.90-1.31 (13H, м), 1.01 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 479.32 (C28H43F2NO3), Набл. масса = 480.40 (M+H).
Пример 247
Синтез (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)-4- гидроксипиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4-метиленциклогексан-1,3-диола (Соединение C027)
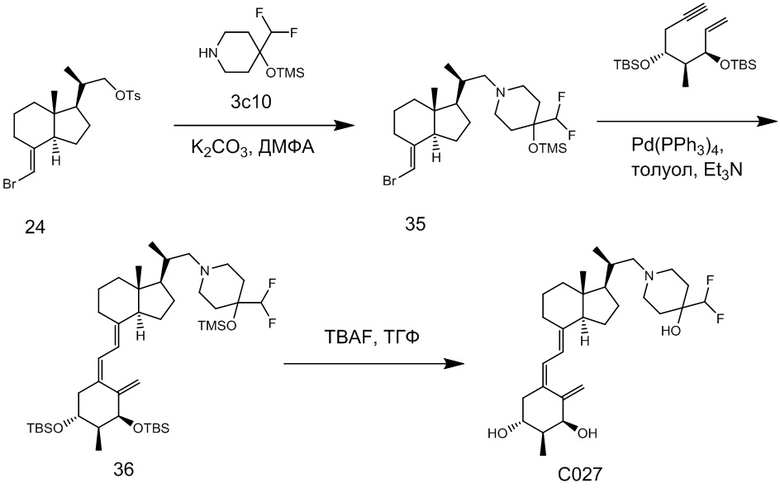
Стадия 1
Раствор соединения 24 [120 мг, 0.272 ммоль], соединения 3c10 [189 мг, 0.848 ммоль] и карбоната калия [183 мг, 1.32 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение ночи. Реакционную смесь гасили насыщенным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 35 [76.9 мг, 0.156 ммоль].
1H-ЯМР (CDCl3) δ: 5.65 (1H, с), 5.46 (1H, т, J = 56.1 Гц), 2.93-2.85 (1H, м), 2.63 (2H, дд, J = 35.4, 11.0 Гц), 2.45-2.22 (2H, м), 2.09-1.22 (25H, м), 0.90 (3H, д, J = 6.3 Гц), 0.58 (3H, с), 0.15 (9H, с).
Стадия 2, стадия 3
Раствор соединения 35 [70.5 мг, 0.143 ммоль], полученного на стадии 1, соединения 7b [65.3 мг, 0.171 ммоль] и тетракис(трифенилфосфин)палладия(0) [25.0 мг, 0.022 ммоль] в смеси толуол [1 мл]/триэтиламин [1 мл] перемешивали при 100°C в течение 2 часов в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь упаривали при пониженном давлении. Остаток от упаривания частично очищали методом препаративной тонкослойной хроматографии, получая 94.5 мг сырого продукта, содержащего соединение 36. Добавляли TBAF [1M раствор в ТГФ, 1 мл, 1 ммоль] в раствор сырого продукта в ТГФ [1 мл], и полученную смесь перемешивали при 50°C в течение 1 дня. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение C027 [24.1 мг, 0.0488 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.2 Гц), 6.09 (1H, д, J = 11.2 Гц), 5.51 (1H, т, J = 56.6 Гц), 5.22 (1H, д, J = 2.0 Гц), 4.22 (1H, д, J = 3.4 Гц), 3.72 (1H, тд, J = 8.2, 4.2 Гц), 2.86 (1H, дд, J = 12.0, 3.2 Гц), 2.78 (1H, д, J = 11.2 Гц), 2.65-2.57 (2H, м), 2.47 (1H, дд, J = 12.2, 4.4 Гц), 2.36 (1H, т, J = 10.7 Гц), 2.19-1.28 (27H, м), 1.04 (3H, д, J = 6.8 Гц), 0.92 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 493.34 (C29H45F2NO3), Набл. масса = 494.40 (M+H).
Пример 248
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-гидрокси-4-метилпиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C029)
Соединение C029 [17.4 мг, 0.039 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 242, используя соединение 2d [80 мг, 0.110 ммоль] и 4-гидрокси-4-метилпиперидин [45 мг, 0.391 ммоль] в качестве исходных веществ.
Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.40 (M+H).
Пример 249
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2R)-1-(3-гидрокси-3-(трифторметил)пиперидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение C033a, Соединение C033b)
Соединение C033a [10 мг, 0.020 ммоль] и соединение C033b [9.0 мг, 0.018 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 108, используя соединение 2d [105.4 мг, 0.145 ммоль] в качестве исходного вещества вместо соединения 2a в Примере 108.
Соединение C033a
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.09 (1H, м), 2.95-2.80 (3H, м), 2.63 (1H, дд, J = 12.2, 4.4 Гц), 2.51 (1H, дд, J = 13.4, 3.2 Гц), 2.28-2.19 (5H, м), 2.04-1.96 (3H, м), 1.90-1.28 (19H, м), 0.95 (3H, д, J = 6.3 Гц), 0.59 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Соединение C033b
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 10.7 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.09 (1H, м), 2.87 (2H, д, J = 11.2 Гц), 2.71 (1H, д, J = 11.2 Гц), 2.56-2.48 (2H, м), 2.34 (1H, д, J = 11.7 Гц), 2.25 (1H, дд, J = 13.2, 6.8 Гц), 2.05-1.97 (4H, м), 1.90-1.25 (21H, м), 0.94 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 497.31 (C28H42F3NO3), Набл. масса = 498.40 (M+H).
Пример 250
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(2,2-дифторэтил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C056)
Соединение C056 [8.2 мг, 0.017 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 242, используя соединение 2e [40 мг, 0.055 ммоль] и 4-(2,2-дифторэтил)пиперидин гидрохлорид [35 мг, 0.189 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.99 (2H, тт, J = 56.0, 4.0 Гц), 5.92 (2H, д, J = 11.2 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.49 (1H, д, J = 11.7 Гц), 3.35-3.30 (1H, м), 3.11 (1H, дд, J = 12.4, 4.1 Гц), 2.92-2.63 (5H, м), 2.48 (1H, дд, J = 13.2, 3.9 Гц), 2.32-1.94 (7H, м), 1.91-1.32 (14H, м), 1.02 (3H, д, J = 6.3 Гц), 0.63 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 251
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(1,1-дифторэтил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C057)
Соединение C057 [6.7 мг, 0.014 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 242, используя соединение 2e [40 мг, 0.055 ммоль] и 4-(1,1-дифторэтил)пиперидин гидрохлорид [37 мг, 0.200 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, т, J = 3.4 Гц), 4.42-4.36 (2H, м), 3.48 (1H, д, J = 12.2 Гц), 3.35-3.33 (1H, м), 2.99 (1H, дд, J = 12.7, 3.9 Гц), 2.86 (1H, дд, J = 12.0, 3.5 Гц), 2.79-1.94 (14H, м), 1.92-1.32 (17H, м), 1.01 (3H, д, J = 6.8 Гц), 0.63 (3H, с).
Точная масса = 477.34 (C29H45F2NO2), Набл. масса = 478.40 (M+H).
Пример 252
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(1-(4-фторпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение C058)
Соединение C058 [5.5 мг, 0.013 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 242, используя соединение 2d [40 мг, 0.055 ммоль] и 4-фторпиперидин гидрохлорид [23 мг, 0.165 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, дд, J = 2.4, 1.5 Гц), 4.89 (1H, с), 4.61 (1H, дт, J = 49.3, 3.4 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.09 (1H, м), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.64 (1H, с), 2.53-2.19 (7H, м), 2.07-1.96 (5H, м), 1.90-1.26 (17H, м), 0.92 (3H, д, J = 6.3 Гц), 0.58 (3H, с).
Точная масса = 431.32 (C27H42FNO2), Набл. масса = 432.30 (M+H).
Пример 253
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-(4-(трифторметил)пиперидин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение C060)
Соединение C060 [6.8 мг, 0.014 ммоль] получали путем проведения реакции по методике, аналогичной описанной в Примере 242, используя соединение 2e [40 мг, 0.055 ммоль] и 4-(трифторметил)пиперидин [30 мг, 0.196 ммоль] в качестве исходных веществ.
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.2 Гц), 5.92 (1H, д, J = 11.2 Гц), 5.05 (2H, д, J = 6.3 Гц), 4.42-4.36 (2H, м), 3.16 (1H, д, J = 11.7 Гц), 2.86 (1H, дд, J = 12.0, 3.7 Гц), 2.76 (1H, дд, J = 12.2, 4.4 Гц), 2.66 (1H, дд, J = 13.4, 4.1 Гц), 2.51-2.02 (8H, м), 1.93-1.28 (14H, м), 0.97 (3H, д, J = 6.3 Гц), 0.61 (3H, с).
Точная масса = 481.32 (C28H42F3NO2), Набл. масса = 482.40 (M+H).
Пример 254
Синтез (1R,2S,3S,Z)-2-метил-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-1-морфолинопропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение D003)
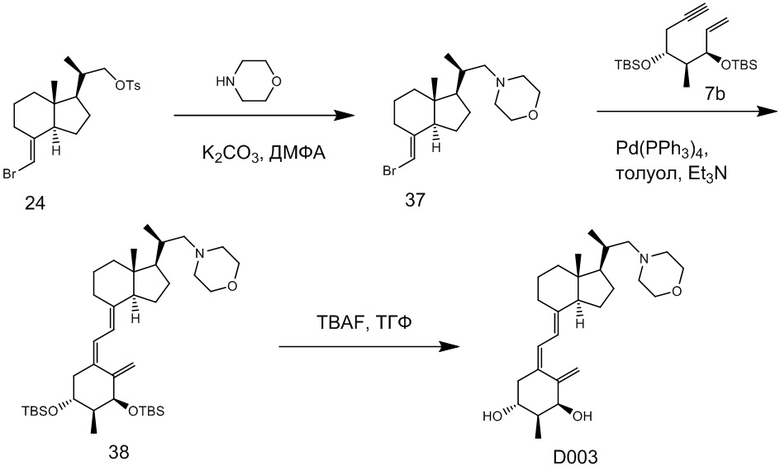
Стадия 1
Раствор соединения 24 [89.2 мг, 0.202 ммоль], морфолина [0.1 мл, 1.16 ммоль] и карбоната калия [156 мг, 1.13 ммоль] в ДМФА [1 мл] перемешивали при 60°C в течение 17 часов. Реакционную смесь гасили насыщенным водным раствором хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом колоночной хроматографии на силикагеле, получая соединение 37 [61.4 мг, 0.172 ммоль].
1H-ЯМР (CDCl3) δ: 5.65 (1H, д, J = 2.0 Гц), 3.75-3.64 (4H, м), 2.91-2.83 (1H, м), 2.47-2.41 (2H, м), 2.38 (1H, дд, J = 11.7, 4.9 Гц), 2.33-2.24 (2H, м), 2.01-1.19 (12H, м), 0.92 (3H, д, J = 6.8 Гц), 0.57 (3H, с).
Стадия 2 и стадия 3
Соединение D003 [14.1 мг, 0.033 ммоль] получали по той же методике, как на стадии 2 и стадии 3 в Примере 236, используя соединение 37 [29.9 мг, 0.084 ммоль], соединение 7b [38.5 мг, 0.101 ммоль] и тетракис(трифенилфосфин)палладий(0) [11.0 мг, 0.009 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.2 Гц), 6.10 (1H, д, J = 11.2 Гц), 5.23 (1H, д, J = 2.0 Гц), 4.23 (1H, д, J = 3.4 Гц), 3.78-3.68 (5H, м), 2.88 (1H, дд, J = 12.0, 3.7 Гц), 2.73-2.46 (7H, м), 2.27-2.10 (3H, м), 2.06-2.03 (1H, м), 2.01-1.97 (2H, м), 1.96-1.28 (14H, м), 1.04 (3H, д, J = 6.8 Гц), 0.96 (3H, д, J = 6.3 Гц), 0.60 (3H, с).
Пример 255
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((2R)-1-(3-(трифторметил)пиперазин-1- ил)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение E008a, Соединение E008b)
Соединение E008a [3.3 мг, 0.007 ммоль] и соединение (E008b) [7.0 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 108, используя соединение 24 [260 мг, 0.589 ммоль] и 2-(трифторметил)пиперазин [190 мг, 1.23 ммоль] в качестве исходных веществ.
Соединение E008a
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.2 Гц), 6.08 (1H, д, J = 11.2 Гц), 5.28 (1H, т, J = 1.2 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.08 (1H, м), 2.99-2.76 (7H, м), 2.53-1.21 (33H, м), 0.92 (3H, д, J = 6.8 Гц), 0.58 (3H, с).
Точная масса = 482.31 (C27H41F3N2O2), Набл. масса = 483.4 (M+H).
Соединение E008b
Точная масса = 482.31 (C27H41F3N2O2), Набл. масса = 483.4 (M+H).
Пример 301
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F001)
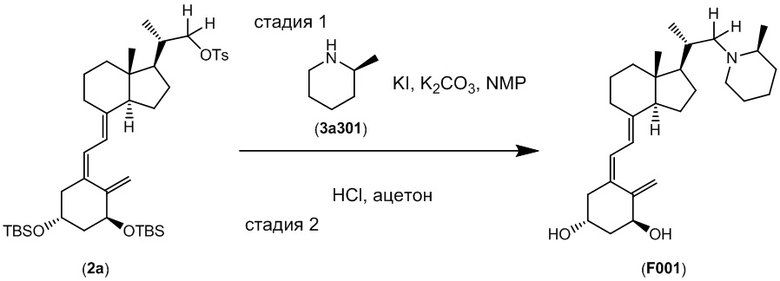
Стадия 1
Раствор соединения (2a) [50 мг, 0.069 ммоль] описанного в Сравнительном примере 1, (S)-2-метилпиперидин (3a301) [24.8 мл, 0.206 ммоль] иодида калия [22.8 мг, 0.137 ммоль] и карбоната калия [28.4 мг, 0.206 ммоль] в NMP [1 мл] нагревали и перемешивали при 60°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли насыщенный раствор хлорида натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий продукт сочетания.
Стадия 2
2М раствор соляной кислоты [0.2 мл, 0.4 ммоль] добавляли в раствор продукта сочетания, полученного на стадии 1, в ацетоне [0.6 мл], и полученную смесь перемешивали при комнатной температуре 4 часа. Реакционную смесь нейтрализовывали насыщенным водным раствором гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом препаративной ВЭЖХ, получая соединение F001 [5.4 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.10 (1H, д, J = 11.4 Гц), 5.30-5.27 (1H, м), 4.35 (1H, т, J = 5.7 Гц), 4.15-4.10 (1H, м), 3.56-3.52 (1H, м), 3.27-3.25 (1H, м), 3.08-3.03 (1H, м), 2.92-2.87 (3H, м), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.26 (1H, дд, J = 13.5, 6.6 Гц), 2.07-2.04 (2H, м), 1.90-1.86 (4H, м), 1.83-1.51 (11H, м), 1.43-1.28 (4H, м), 1.37 (3H, д, J = 9.0 Гц), 1.12 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.25 (M+H).
В описанных ниже примерах, каждое соединение было синтезировано по методике, аналогичной методу синтеза соединения, описанного в Примере 301. В каждом примере описано только использовавшееся исходное вещество и амин. Иодид калия и карбонат калия использовались как в Примере 301, и их эквивалентное количество нужным образом изменяли в зависимости от использовавшегося исходного вещества согласно условиям в Примере 301.
Пример 302
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F002)
Соединение F002 [19.2 мг, 0.0449 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-2-метилпиперидин [24.8 мл, 0.206 ммоль].
1H-ЯМР (CD3OD): 6.32 (1H, д, J = 11.0 Гц), 6.10 (1H, д, J = 11.0 Гц), 5.29-5.28 (1H, м), 4.35 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.42-3.39 (2H, м), 3.25-3.23 (1H, м), 3.12-3.09 (1H, м), 2.88 (1H, дд, J = 11.9, 3.7 Гц), 2.67 (1H, дд, J = 13.3, 10.5 Гц), 2.51 (1H, дд, J = 13.3, 3.7 Гц), 2.26 (1H, дд, J = 13.5, 6.7 Гц), 2.09-1.96 (4H, м), 1.91-1.51 (15H, м), 1.42-1.38 (3H, м), 1.36 (4H, д, J = 6.4 Гц), 1.15 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.20 (M+H).
Пример 303
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F003)
Соединение F003 [8.2 мг, 0.019 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и 2,2-диметилпиперидин гидрохлорид [30.79 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.10 (1H, д, J = 11.0 Гц), 5.29-5.28 (1H, м), 4.35 (1H, т, J = 5.9 Гц), 4.14-4.10 (1H, м), 3.46-3.44 (1H, м), 3.14-3.11 (1H, м), 2.88 (1H, дд, J = 11.9, 4.1 Гц), 2.51 (1H, дд, J = 14.2, 4.6 Гц), 2.26 (1H, дд, J = 13.3, 6.9 Гц), 2.08-1.96 (4H, м), 1.91-1.70 (12H, м), 1.62-1.51 (3H, м), 1.45-1.36 (10H, м), 1.17 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 441.36 (C29H47NO2), Набл. масса = 442.25 (M+H).
Пример 304
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F004)
Соединение F004 [6.2 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-3-метилморфолин [20.8 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.89 (1H, д, J = 1.8 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.77 (1H, д, J = 11.4 Гц), 3.67-3.56 (2H, м), 3.26-3.20 (1H, м), 2.88-2.84 (2H, м), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.41 (1H, т, J = 11.7 Гц), 2.37-2.31 (1H, м), 2.25 (1H, дд, J = 13.7, 6.9 Гц), 2.15-1.87 (8H, м), 1.73-1.21 (9H, м), 1.02 (3H, д, J = 6.4 Гц), 0.95 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 305
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F005)
Соединение F005 [9.6 мг, 0.022 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-3-метилморфолин [20.8 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.09 (1H, д, J = 11.0 Гц), 5.29-5.28 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.13-4.10 (1H, м), 3.77-3.69 (3H, м), 3.39 (1H, дд, J = 11.7, 7.5 Гц), 2.94-2.76 (4H, м), 2.71-2.65 (1H, м), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.26 (1H, дд, J = 13.5, 6.6 Гц), 2.12-1.99 (12H, м), 1.88 (2H, т, J = 5.5 Гц), 1.73-1.26 (10H, м), 1.10 (3H, д, J = 6.9 Гц), 1.08 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 306
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F006)
Соединение F006 [4.7 мг, 0.011 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и 3,3-диметилморфолин [15.8 мг, 0.137 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.29-5.27 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.09 (1H, м), 3.84-3.80 (1H, м), 3.69-3.62 (1H, м), 3.45-3.34 (2H, м), 2.89-2.80 (2H, м), 2.74-2.67 (1H, м), 2.51 (1H, дд, J = 13.3, 3.7 Гц), 2.39-2.35 (2H, м), 2.26 (1H, дд, J = 13.3, 6.9 Гц), 2.07-1.99 (3H, м), 1.90-1.87 (2H, м), 1.72-1.65 (2H, м), 1.58-1.45 (4H, м), 1.38-1.25 (3H, м), 1.11 (3H, с), 1.07-1.03 (6H, м), 0.60 (3H, с).
LC-MS: Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.20 (M+H).
Пример 307
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(7-окса-4-азаспиро[2.5]октан-4-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F007)
Соединение F007 [6.1 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и 7-окса-4-азаспиро[2.5]октан гидрохлорид [20 мг, 0.134 ммоль].
1H-ЯМР (CD3OD): 6.31 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, дд, J = 2.0, 1.1 Гц), 4.89 (1H, д, J = 2.0 Гц), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.11 (1H, м), 3.83-3.77 (1H, м), 3.65 (1H, д, J = 11.4 Гц), 3.55 (1H, дт, J = 11.0, 4.0 Гц), 3.17 (1H, д, J = 11.4 Гц), 2.98 (2H, т, J = 11.2 Гц), 2.86 (1H, дд, J = 12.0, 4.0 Гц), 2.75 (1H, ддд, J = 13.5, 4.6, 3.0 Гц), 2.51 (1H, дд, J = 13.3, 3.7 Гц), 2.25 (1H, дд, J = 13.3, 6.9 Гц), 2.18-1.26 (22H, м), 1.21-0.90 (3H, м), 0.93 (3H, д, J = 6.4 Гц), 0.74-0.69 (1H, м), 0.60-0.41 (2H, м), 0.57 (3H, с).
LC-MS: Точная масса = 441.32 (C28H43NO3), Набл. масса = 442.20 (M+H).
Пример 308
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-циклопропилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F008)
Соединение F008 [2.5 мг, 0.0055 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-3-циклопропилморфолин [26.2 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.09 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.35 (1H, т, J = 5.7 Гц), 4.13-4.11 (1H, м), 3.77 (2H, дд, J = 11.0, 3.2 Гц), 3.58 (1H, дд, J = 11.4, 9.1 Гц), 3.41-3.35 (1H, м), 3.02-2.82 (3H, м), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.27-2.24 (1H, м), 2.10-2.02 (5H, м), 1.89-1.86 (3H, м), 1.73-1.25 (11H, м), 1.06 (3H, д, J = 6.4 Гц), 0.70-0.66 (1H, м), 0.60 (3H, с), 0.51-0.44 (2H, м), 0.29-0.24 (1H, м), 0.11-0.07 (1H, м).
LC-MS: Точная масса = 455.34 (C29H45NO3), Набл. масса = 456.20 (M+H).
Пример 309
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-изопропилморфолино)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F009)
Соединение F009 [8.9 мг, 0.019 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-3-изопропилморфолин [27.0 мг, 0.210 ммоль].
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Пример 310
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-изопропилморфолино)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F010)
Соединение F010 [8.2 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-3-изопропилморфолин [26.6 мг, 0.206 ммоль].
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.25 (M+H).
Пример 311
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F011)
Соединение F011 [15.2 мг, 0.0343 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-2,4-диметилпиперазин дигидрохлорид [38.5 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.08 (1H, д, J = 11.4 Гц), 5.30-5.27 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.13-4.11 (1H, м), 3.15-3.02 (3H, м), 2.87 (1H, д, J = 11.9 Гц), 2.66 (1H, т, J = 10.5 Гц), 2.56 (4H, с), 2.51 (2H, д, J = 11.4 Гц), 2.42 (1H, т, J = 10.7 Гц), 2.30-2.16 (3H, м), 2.08-1.99 (3H, м), 1.90-1.86 (2H, м), 1.73-1.26 (9H, м), 1.11 (3H, д, J = 5.9 Гц), 1.03 (3H, д, J = 6.4 Гц), 0.61 (3H, с).
LC-MS: Точная масса = 442.36 (C28H46N2O2), Набл. масса = 443.20 (M+H).
Пример 312
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение F012)
Соединение F012 [18.7 мг, 0.0422 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-2,4-диметилпиперазин дигидрохлорид [38.5 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.31 (1H, д, J = 11.4 Гц), 6.08 (1H, д, J = 11.0 Гц), 5.28 (1H, с), 4.34 (1H, т, J = 5.9 Гц), 4.13-4.11 (1H, м), 2.97-2.62 (8H, м), 2.55 (3H, с), 2.53-2.46 (2H, м), 2.26 (1H, дд, J = 13.5, 6.6 Гц), 2.06-1.98 (4H, м), 1.89-1.87 (2H, м), 1.71-1.66 (2H, м), 1.57-1.21 (7H, м), 1.13 (3H, д, J = 6.4 Гц), 1.04 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
LC-MS: Точная масса = 442.36 (C28H46N2O2), Набл. масса = 443.20 (M+H).
Пример 313
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил) пирролидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение F013)
Соединение F013 [2.0 мг, 0.0044 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-2-(пирролидин-2-ил)пропан-2-ол гидрохлорид [34.1 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.09 (1H, д, J = 11.4 Гц), 5.29-5.27 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.14-4.11 (1H, м), 3.41 (1H, с), 3.20 (1H, с), 2.99-2.86 (4H, м), 2.51 (1H, дд, J = 13.5, 3.4 Гц), 2.26 (1H, дд, J = 13.3, 6.4 Гц), 2.06-1.94 (6H, м), 1.88-1.85 (3H, м), 1.74-1.68 (3H, м), 1.59-1.51 (3H, м), 1.40-1.31 (3H, м), 1.27 (3H, с), 1.24 (3H, с), 1.18 (3H, д, J = 6.4 Гц), 0.63 (3H, с).
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.20 (M+H).
Пример 314
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил) пирролидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение F014)
Соединение F014 [20.5 мг, 0.0448 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-2-(пирролидин-2-ил)пропан-2-ол гидрохлорид [34.1 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.4 Гц), 6.09 (1H, д, J = 11.0 Гц), 5.30-5.28 (1H, м), 4.34 (1H, т, J = 5.9 Гц), 4.15-4.10 (1H, м), 3.59-3.54 (1H, м), 3.49-3.39 (2H, м), 3.25-3.19 (1H, м), 2.89-2.79 (2H, м), 2.51 (1H, дд, J = 13.3, 3.2 Гц), 2.29-1.95 (9H, м), 1.90-1.87 (3H, м), 1.73-1.68 (2H, м), 1.60-1.50 (3H, м), 1.41-1.35 (3H, м), 1.29 (3H, с), 1.25 (3H, с), 1.19 (3H, д, J = 6.4 Гц), 0.64 (3H, с).
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.20 (M+H).
Пример 315
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил) пирролидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение F015)
Соединение F015 [18.4 мг, 0.039 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (R)-2-(1-метокси-1-метил-этил)пирролидин [30 мг, 0.209 ммоль].
1H-ЯМР (CD3OD): 6.23 (1H, д, J = 11.0 Гц), 6.02 (1H, д, J = 11.0 Гц), 5.26 (1H, с), 4.79 (1H, с), 4.25-4.20 (1H, м), 4.01 (1H, с), 3.12 (3H, с), 3.01-2.81 (2H, м), 2.54-2.49 (32H, м), 2.37 (2H, дд, J = 21.3, 11.2 Гц), 2.20 (1H, дд, J = 13.5, 5.7 Гц), 2.13-1.14 (20H, м), 1.10 (3H, с), 1.06 (3H, с), 1.03 (3H, с), 0.56 (3H, с).
LC-MS: Точная масса = 471.37 (C30H49NO3), Набл. масса = 472.20 (M+H).
Пример 316
Синтез (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил) пирролидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диола (Соединение F016)
Соединение F016 [25 мг, 0.053 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2a) [50 мг, 0.069 ммоль] и (S)-2-(1-метокси-1-метил-этил)пирролидин гидрохлорид [37.0 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.32 (1H, д, J = 11.0 Гц), 6.10 (1H, д, J = 11.0 Гц), 5.30-5.27 (1H, м), 4.89-4.88 (1H, м), 4.35 (1H, т, J = 5.9 Гц), 4.14-4.11 (1H, м), 3.60-3.52 (2H, м), 3.35 (1H, д, J = 12.8 Гц), 3.27-3.21 (1H, м), 2.90-2.78 (2H, м), 2.51 (1H, дд, J = 13.7, 3.7 Гц), 2.29-2.18 (2H, м), 2.10-1.97 (7H, м), 1.90-1.87 (2H, м), 1.73-1.68 (2H, м), 1.63-1.50 (3H, м), 1.42-1.35 (3H, м), 1.26 (3H, с), 1.25 (3H, с), 1.18 (3H, д, J = 6.4 Гц), 0.64 (3H, с).
LC-MS: Точная масса = 471.37 (C30H49NO3), Набл. масса = 472.20 (M+H).
Пример 317
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G001)
Соединение G001 [5.7 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-2-метилпиперидин [13.8 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.90 (1H, д, J = 11.0 Гц), 4.06-3.94 (2H, м), 3.55 (1H, д, J = 11.4 Гц), 3.27 (1H, с), 3.08-3.03 (1H, м), 2.93-2.83 (3H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.23-2.14 (2H, м), 2.10-2.03 (2H, м), 2.01-1.96 (1H, м), 1.89-1.88 (1H, м), 1.84-1.52 (11H, м), 1.43-1.32 (6H, м), 1.12 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 415.35 (C27H45NO2), Набл. масса = 416.20 (M+H).
Пример 318
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G002)
Соединение G002 [3.4 мг, 0.0082 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-2-метилпиперидин [13.8 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.91 (1H, д, J = 11.0 Гц), 4.05-3.94 (2H, м), 3.45-3.41 (2H, м), 3.25 (1H, с), 3.13-3.09 (1H, м), 2.87-2.83 (1H, м), 2.68 (1H, дд, J = 13.3, 10.5 Гц), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.41 (1H, дд, J = 13.5, 3.4 Гц), 2.23-2.15 (2H, м), 2.09-2.02 (3H, м), 1.86-1.51 (14H, м), 1.43-1.39 (3H, м), 1.36 (3H, д, J = 6.9 Гц), 1.15 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 415.35 (C27H45NO2), Набл. масса = 416.20 (M+H).
Пример 319
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G003)
Соединение G003 [3.5 мг, 0.0081 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и 2,2-диметилпиперидин гидрохлорид [20.9 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.90 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 3.45 (1H, с), 3.12 (1H, с), 2.87-2.83 (1H, м), 2.60 (1H, дд, J = 13.3, 3.7 Гц), 2.41 (1H, дд, J = 13.5, 3.4 Гц), 2.22-2.15 (2H, м), 2.10-2.01 (3H, м), 1.83-1.52 (14H, м), 1.44-1.35 (9H, м), 1.18 (3H, д, J = 6.4 Гц), 0.66 (3H, с).
LC-MS: Точная масса = 429.36 (C28H47NO2), Набл. масса = 430.20 (M+H).
Пример 320
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G004)
Соединение G004 [4.3 мг, 0.010 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-3-метилморфолин [21.2 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 3.77 (1H, д, J = 11.4 Гц), 3.67-3.56 (2H, м), 3.26-3.20 (1H, м), 2.88-2.81 (2H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.44-2.32 (3H, м), 2.23-1.51 (16H, м), 1.38-1.22 (3H, м), 1.03 (3H, д, J = 6.4 Гц), 0.95 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 417.32 (C26H43NO3), Набл. масса = 418.25 (M+H).
Пример 321
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G005)
Соединение G005 [6.3 мг, 0.015 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-3-метилморфолин [21.2 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 3.71-3.63 (3H, м), 3.33-3.28 (1H, м), 2.85-2.72 (3H, м), 2.61-2.46 (3H, м), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.23-2.13 (2H, м), 2.06-1.22 (16H, м), 1.05 (3H, д, J = 6.4 Гц), 1.02 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
LC-MS: Точная масса = 417.32 (C26H43NO3), Набл. масса = 418.20 (M+H).
Пример 322
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G006)
Соединение G006 [4.9 мг, 0.011 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и 3,3-диметилморфолин [16.1 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.06-3.94 (2H, м), 3.82-3.78 (1H, м), 3.65-3.59 (1H, м), 3.39 (1H, д, J = 11.0 Гц), 3.32 (1H, с), 2.85-2.81 (1H, м), 2.73-2.69 (1H, м), 2.62-2.56 (2H, м), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.33-2.13 (4H, м), 2.07-1.97 (3H, м), 1.87-1.81 (1H, м), 1.78-1.72 (1H, м), 1.67-1.50 (6H, м), 1.37-1.25 (3H, м), 1.06-1.04 (6H, м), 1.01 (3H, с), 0.60 (3H, с).
LC-MS: Точная масса = 431.34 (C27H45NO3), Набл. масса = 432.20 (M+H).
Пример 323
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(7-окса-4-азаспиро[2.5]октан-4-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G007)
Соединение G007 [2.2 мг, 0.0051 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и 7-окса-4-азаспиро[2.5]октан гидрохлорид [20.9 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.05-3.96 (2H, м), 3.83-3.78 (1H, м), 3.66 (1H, д, J = 11.4 Гц), 3.58-3.54 (1H, м), 3.18 (1H, д, J = 11.4 Гц), 3.03-2.97 (2H, м), 2.85-2.75 (2H, м), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.40 (1H, дд, J = 13.5, 3.4 Гц), 2.22-2.13 (2H, м), 2.05-1.98 (4H, м), 1.86-1.74 (2H, м), 1.69-1.50 (5H, м), 1.40-1.21 (4H, м), 0.93 (3H, д, J = 6.4 Гц), 0.73-0.70 (1H, м), 0.58 (3H, с), 0.55-0.49 (2H, м), 0.46-0.42 (1H, м).
LC-MS: Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.15 (M+H).
Пример 324
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-циклопропилморфолино)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G008)
Соединение G008 [13.7 мг, 0.0309 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-3-циклопропилморфолин [26.6 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.05-3.96 (2H, м), 3.84-3.79 (2H, м), 3.61 (1H, тд, J = 11.4, 2.3 Гц), 3.44 (1H, дд, J = 11.9, 10.1 Гц), 3.10-2.99 (2H, м), 2.84 (1H, дд, J = 11.9, 3.7 Гц), 2.59 (1H, дд, J = 13.3, 4.1 Гц), 2.41 (1H, дд, J = 13.5, 3.4 Гц), 2.25-2.15 (4H, м), 2.08-2.00 (2H, м), 1.94-1.92 (1H, м), 1.86-1.51 (9H, м), 1.39-1.29 (3H, м), 1.08 (3H, д, J = 6.4 Гц), 0.76-0.69 (1H, м), 0.61 (3H, с), 0.58-0.46 (2H, м), 0.35-0.29 (1H, м), 0.15-0.11 (1H, м).
LC-MS: Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.20 (M+H).
Пример 325
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-изопропилморфолино)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G009)
Соединение G009 [6.1 мг, 0.014 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-3-изопропилморфолин [27.0 мг, 0.209 ммоль].
LC-MS: Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.20 (M+H).
Пример 326
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-изопропилморфолино)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G010)
Соединение G010 [10.6 мг, 0.0238 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-3-изопропилморфолин [27.0 мг, 0.209 ммоль].
LC-MS: Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.20 (M+H).
Пример 327
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G011)
Соединение G011 [7.9 мг, 0.018 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (S)-1,3-диметилпиперазин дигидрохлорид [26.1 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 3.14-2.99 (3H, м), 2.84 (1H, дд, J = 12.6, 3.0 Гц), 2.65-2.50 (7H, м), 2.42-2.38 (2H, м), 2.28-2.15 (4H, м), 2.06-2.02 (2H, м), 1.85-1.82 (1H, м), 1.78-1.52 (6H, м), 1.38-1.26 (3H, м), 1.11 (3H, д, J = 5.9 Гц), 1.03 (3H, д, J = 6.4 Гц), 0.61 (3H, с).
LC-MS: Точная масса = 430.36 (C27H46N2O2), Набл. масса = 431.20 (M+H).
Пример 328
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G012)
Соединение G012 [10.3 мг, 0.0239 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-1,3-диметилпиперазин дигидрохлорид [26.1 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.89 (1H, д, J = 11.4 Гц), 4.05-3.95 (2H, м), 2.95 (3H, д, J = 11.0 Гц), 2.84 (2H, д, J = 11.4 Гц), 2.74-2.57 (4H, м), 2.54 (3H, с), 2.40 (2H, дд, J = 13.5, 3.9 Гц), 2.20-2.14 (2H, м), 2.05-2.00 (3H, м), 1.86-1.82 (1H, м), 1.79-1.73 (1H, м), 1.66-1.52 (6H, м), 1.43-1.25 (3H, м), 1.14 (3H, д, J = 6.4 Гц), 1.05 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
LC-MS: Точная масса = 430.36 (C27H46N2O2), Набл. масса = 431.20 (M+H).
Пример 329
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3- диола (Соединение G013)
Соединение G013 [5.8 мг, 0.013 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и 2-[(2R)-пирролидин-2-ил]пропан-2-ол гидрохлорид [34.7 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 3.01 (1H, с), 2.89-2.82 (3H, м), 2.73 (1H, с), 2.59 (1H, дд, J = 13.3, 3.7 Гц), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.18 (2H, тд, J = 14.1, 6.9 Гц), 2.06-1.48 (17H, м), 1.39-1.27 (3H, м), 1.22 (6H, д, J = 10.1 Гц), 1.16 (3H, д, J = 6.4 Гц), 0.62 (3H, с).
LC-MS: Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 330
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3- диола (Соединение G014)
Соединение G014 [14.2 мг, 0.0319 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и 2-[(2S)-пирролидин-2-ил]пропан-2-ол [27.0 мг, 0.209 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.4 Гц), 5.90 (1H, д, J = 11.4 Гц), 4.05-3.95 (2H, м), 3.61-3.55 (1H, м), 3.51-3.40 (2H, м), 3.26-3.20 (1H, м), 2.85-2.79 (2H, м), 2.59 (1H, дд, J = 13.5, 3.4 Гц), 2.40 (1H, дд, J = 13.5, 3.0 Гц), 2.22-1.34 (25H, м), 1.28 (6H, д, J = 16.9 Гц), 1.19 (3H, д, J = 6.4 Гц), 0.64 (3H, с).
LC-MS: Точная масса = 445.36 (C28H47NO3), Набл. масса = 446.30 (M+H).
Пример 331
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3- диола (Соединение G015)
Соединение G015 [15.6 мг, 0.0339 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-2-(1-метокси-1-метил-этил)-пирролидин [20.0 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.90 (1H, д, J = 11.0 Гц), 4.05-4.02 (1H, м), 3.99-3.95 (1H, м), 3.49-3.45 (2H, м), 3.10-3.04 (3H, м), 2.85 (1H, дд, J = 11.2, 3.4 Гц), 2.60 (1H, дд, J = 13.5, 3.9 Гц), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.21-2.12 (3H, м), 2.11-1.97 (6H, м), 1.89-1.52 (8H, м), 1.41-1.33 (3H, м), 1.28 (3H, с), 1.26 (3H, с), 1.18 (3H, д, J = 6.4 Гц), 0.64 (3H, с).
LC-MS: Точная масса = 459.37 (C29H49NO3), Набл. масса = 460.25 (M+H).
Пример 332
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G016)
Соединение G016 [5.6 мг, 0.012 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2b) [50 мг, 0.070 ммоль] и (R)-2-(1-метокси-1-метил-этил)-пирролидин гидрохлорид [25.1 мг, 0.139 ммоль].
1H-ЯМР (CD3OD) δ: 6.22 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.4 Гц), 4.06-4.03 (1H, м), 4.00-3.96 (1H, м), 3.60-3.52 (2H, м), 3.37 (1H, д, J = 11.9 Гц), 3.28-3.22 (1H, м), 2.87-2.79 (2H, м), 2.60 (1H, дд, J = 13.3, 3.7 Гц), 2.41 (1H, дд, J = 13.3, 3.2 Гц), 2.26-1.96 (11H, м), 1.88-1.83 (1H, м), 1.79-1.53 (6H, м), 1.42-1.35 (3H, м), 1.27 (3H, с), 1.26 (3H, с), 1.19 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 459.37 (C29H49NO3), Набл. масса = 460.25 (M+H).
Пример 333
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилпиперидин-1-ил)бутан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G017)
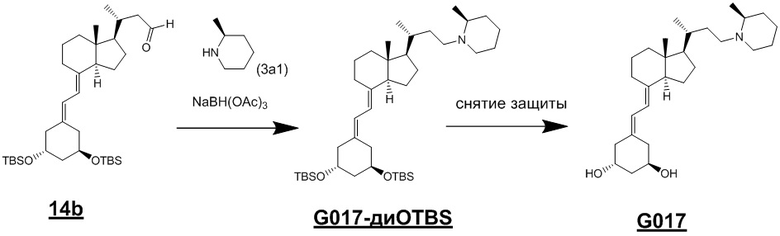
Стадия 1
Раствор соединения (14b), описанного в Сравнительном примере 14 [50 мг, 0.087 ммоль], (S)-2-метилпиперидина [43.2 мг, 0.435 ммоль] и триацетоксиборгидрида натрия [55.3 мг, 0.261 ммоль] в ТГФ [1 мл] перемешивали при комнатной температуре в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционную смесь, и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий соединение (G017-diOTBS).
Стадия 2
TBAF [1M раствор в ТГФ, 0.2 мл, 0.2 ммоль] добавляли в раствор сырого продукта, полученного на стадии 3, в ТГФ [1 мл], и полученную смесь перемешивали при 60°C в течение ночи. Добавляли насыщенный водный раствор гидрокарбоната натрия, и полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом обращенно-фазной ВЭЖХ, получая соединение (G017) [9.8 мг, 23 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.06-3.95 (2H, м), 2.89-2.81 (2H, м), 2.67-2.56 (2H, м), 2.50-2.38 (2H, м), 2.31 (1H, с), 2.24-2.13 (3H, м), 2.06-1.94 (3H, м), 1.87-1.18 (20H, м), 1.09 (3H, д, J = 6.4 Гц), 0.97 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
LC-MS: Точная масса = 429.36 (C28H47NO2), Набл. масса = 430.30 (M+H).
Пример 334
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилпиперидин-1-ил)бутан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G018)
Соединение G018 [8.3 мг, 0.019 ммоль] получали по методике, аналогичной описанной на стадиях 1 и 2 в Примере 333, используя соединение (14b) [50 мг, 0.087 ммоль], описанное в Сравнительном примере 14, (R)-2-метилпиперидин [43.2 мг, 0.435 ммоль] и триацетоксиборгидрид натрия [55.3 мг, 0.261 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.88 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 2.86-2.73 (3H, м), 2.59 (1H, дд, J = 13.5, 3.4 Гц), 2.42-2.34 (3H, м), 2.28-2.13 (3H, м), 2.06-1.95 (3H, м), 1.86-1.54 (12H, м), 1.39-1.29 (6H, м), 1.25-1.19 (1H, м), 1.09 (3H, д, J = 5.9 Гц), 0.98 (3H, д, J = 5.5 Гц), 0.57 (3H, с).
LC-MS: Точная масса = 429.36 (C28H47NO2), Набл. масса = 430.30 (M+H).
Пример 335
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2,4-диметилпиперазин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G019)
Соединение G019 [3.7 мг, 0.0083 ммоль] получали по методике, аналогичной описанной на стадиях 1 и 2 в Примере 333, используя соединение (14b) [50 мг, 0.087 ммоль], описанное в Сравнительном примере 14, (S)-1,3-диметилпиперазин дигидрохлорид [81.4 мг, 0.435 ммоль] и триацетоксиборгидрид натрия [55.3 мг, 0.261 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.06-3.94 (2H, м), 3.20-3.16 (1H, м), 2.99-2.82 (5H, м), 2.66-2.50 (4H, м), 2.43-2.39 (4H, м), 2.26-2.13 (3H, м), 2.07-2.00 (3H, м), 1.87-1.81 (1H, м), 1.78-1.72 (1H, м), 1.67-1.52 (7H, м), 1.40-1.34 (4H, м), 1.20 (3H, д, J = 6.4 Гц), 0.99 (3H, д, J = 6.4 Гц), 0.59 (3H, с).
LC-MS: Точная масса = 444.37 (C28H48N2O2), Набл. масса = 445.20 (M+H).
Пример 336
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-2,4-диметилпиперазин-1-ил)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диола (Соединение G020)
Соединение G020 [4.3 мг, 0.0097 ммоль] получали по методике, аналогичной описанной на стадиях 1 и 2 в Примере 333, используя соединение (14b) [50 мг, 0.087 ммоль], описанное в Сравнительном примере 14, (R)-1,3-диметилпиперазин дигидрохлорид [81.4 мг, 0.435 ммоль] и триацетоксиборгидрид натрия [55.3 мг, 0.261 ммоль].
1H-ЯМР (CD3OD) δ: 6.21 (1H, д, J = 11.0 Гц), 5.89 (1H, д, J = 11.0 Гц), 4.05-3.95 (2H, м), 3.16-3.13 (1H, м), 3.05 (1H, тд, J = 12.6, 4.4 Гц), 2.91-2.82 (4H, м), 2.74 (1H, т, J = 10.7 Гц), 2.60-2.50 (3H, м), 2.42-2.39 (4H, м), 2.27-2.13 (3H, м), 2.08-1.98 (3H, м), 1.86-1.82 (1H, м), 1.78-1.27 (12H, м), 1.21 (3H, д, J = 6.4 Гц), 1.01 (3H, д, J = 6.4 Гц), 0.58 (3H, с).
LC-MS: Точная масса = 444.37 (C28H48N2O2), Набл. масса = 445.20 (M+H).
Пример 337
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение H001)
Соединение H001 [19.9 мг, 0.0465 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-2-метилпиперидин [20.4 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.0 Гц), 5.93 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 5.5 Гц), 4.42-4.36 (2H, м), 3.55-3.52 (1H, м), 3.27-3.25 (1H, м), 3.08-3.05 (1H, м), 2.93-2.85 (3H, м), 2.66 (1H, дд, J = 13.3, 4.1 Гц), 2.48 (1H, дд, J = 13.5, 3.9 Гц), 2.32-2.25 (2H, м), 2.11-1.89 (6H, м), 1.83-1.50 (9H, м), 1.44-1.34 (3H, м), 1.38 (3H, д, J = 7.0 Гц), 1.12 (3H, д, J = 6.4 Гц), 0.66 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.20 (M+H).
Пример 338
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение H002)
Соединение H002 [26.4 мг, 0.0617 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-2-метилпиперидин [20.4 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.0 Гц), 5.93 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.45-3.41 (2H, м), 3.25 (1H, с), 3.12-3.08 (1H, м), 2.87 (1H, дд, J = 12.3, 3.7 Гц), 2.71-2.65 (2H, м), 2.48 (1H, дд, J = 13.3, 4.1 Гц), 2.31-2.25 (2H, м), 2.11-2.00 (3H, м), 1.89-1.76 (5H, м), 1.72-1.53 (7H, м), 1.44-1.39 (3H, м), 1.36 (3H, д, J = 6.9 Гц), 1.15 (3H, д, J = 6.4 Гц), 0.66 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.20 (M+H).
Пример 339
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение H003)
Соединение H003 [8.8 мг, 0.020 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и 2,2-диметилпиперидин гидрохлорид [30.8 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.0 Гц), 5.93 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.44 (1H, с), 3.12 (1H, с), 2.87 (1H, дд, J = 12.1, 3.4 Гц), 2.67 (1H, дд, J = 13.3, 4.1 Гц), 2.48 (1H, дд, J = 13.3, 4.1 Гц), 2.31-2.25 (2H, м), 2.12-2.03 (3H, м), 1.81-1.53 (11H, м), 1.45-1.36 (8H, м), 1.18 (3H, д, J = 6.4 Гц), 0.66 (3H, с).
LC-MS: Точная масса = 441.36 (C29H47NO2), Набл. масса = 442.20 (M+H).
Пример 340
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение H011)
Соединение H011 [14.9 мг, 0.0337 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-1,3-диметилпиперазин дигидрохлорид [38.5 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.0 Гц), 5.91 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 6.4 Гц), 4.42-4.36 (2H, м), 3.16-3.02 (3H, м), 2.86 (1H, дд, J = 11.7, 3.9 Гц), 2.67 (2H, дд, J = 13.3, 5.0 Гц), 2.56 (4H, с), 2.54-2.40 (3H, м), 2.31-2.17 (4H, м), 2.10-1.98 (3H, м), 1.68-1.52 (6H, м), 1.40-1.25 (3H, м), 1.12 (3H, д, J = 5.9 Гц), 1.03 (3H, д, J = 6.4 Гц), 0.62 (3H, с).
LC-MS: Точная масса = 442.36 (C28H46N2O2), Набл. масса = 443.20 (M+H).
Пример 341
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2,4-диметилпиперазин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диола (Соединение H012)
Соединение H012 [14.3 мг, 0.0323 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-1,3-диметилпиперазин дигидрохлорид [38.5 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.26 (1H, д, J = 11.4 Гц), 5.91 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 6.4 Гц), 4.42-4.35 (2H, м), 2.93-2.82 (5H, м), 2.69-2.62 (4H, м), 2.50 (3H, с), 2.46 (1H, д, J = 3.7 Гц), 2.31-2.25 (2H, м), 2.05-1.98 (3H, м), 1.68-1.52 (6H, м), 1.40-1.25 (3H, м), 1.13 (3H, д, J = 6.4 Гц), 1.05 (3H, д, J = 6.4 Гц), 0.60 (3H, с).
LC-MS: Точная масса = 442.36 (C28H46N2O2), Набл. масса = 443.20 (M+H).
Пример 342
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение H013)
Соединение H013 [12.0 мг, 0.0260 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-2-(пирролидин-2-ил)пропан-2-ол гидрохлорид [34.1 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.4 Гц), 5.92 (1H, д, J = 11.4 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.51-3.46 (1H, м), 3.33 (1H, с), 3.10-3.02 (3H, м), 2.86 (1H, дд, J = 12.1, 3.9 Гц), 2.67 (1H, дд, J = 13.3, 4.1 Гц), 2.48 (1H, дд, J = 13.5, 3.9 Гц), 2.31-2.25 (2H, м), 2.16-1.97 (6H, м), 1.90-1.80 (2H, м), 1.69-1.53 (5H, м), 1.41-1.34 (3H, м), 1.30 (3H, с), 1.26 (3H, с), 1.20 (3H, д, J = 6.4 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.20 (M+H).
Пример 343
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение H014)
Соединение H014 [14.0 мг, 0.0306 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-2-(пирролидин-2-ил)пропан-2-ол гидрохлорид [34.1 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.0 Гц), 5.92 (1H, д, J = 11.0 Гц), 5.05 (2H, д, J = 5.9 Гц), 4.42-4.36 (2H, м), 3.60-3.54 (1H, м), 3.49 (1H, т, J = 7.5 Гц), 3.42 (1H, д, J = 12.8 Гц), 3.26-3.20 (1H, м), 2.88-2.80 (2H, м), 2.67 (1H, дд, J = 13.3, 4.6 Гц), 2.48 (1H, дд, J = 13.5, 3.9 Гц), 2.31-1.95 (10H, м), 1.92-1.88 (1H, м), 1.69-1.35 (8H, м), 1.30 (3H, с), 1.26 (3H, с), 1.20 (3H, д, J = 6.9 Гц), 0.65 (3H, с).
LC-MS: Точная масса = 457.36 (C29H47NO3), Набл. масса = 458.20 (M+H).
Пример 344
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение H015)
Соединение H015 [15.2 мг, 0.0322 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (R)-2-(1-метокси-1-метил-этил)-пирролидин [30.0 мг, 0.209 ммоль].
LC-MS: Точная масса = 471.37 (C30H49NO3), Набл. масса = 472.20 (M+H).
Пример 345
Синтез (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2- метиленциклогексан-1,3-диола (Соединение H016)
Соединение H016 [25.2 мг, 0.0534 ммоль] получали посредством проведения реакции аналогично Примеру 301, используя соединение (2c) [50 мг, 0.069 ммоль] и (S)-2-(1-метокси-1-метил-этил)-пирролидин гидрохлорид [37.0 мг, 0.206 ммоль].
1H-ЯМР (CD3OD) δ: 6.27 (1H, д, J = 11.0 Гц), 5.93 (1H, д, J = 11.0 Гц), 5.06 (2H, д, J = 5.5 Гц), 4.43-4.36 (2H, м), 3.60-3.53 (2H, м), 3.38 (1H, д, J = 11.4 Гц), 3.28-3.22 (1H, м), 2.89-2.80 (2H, м), 2.67 (1H, дд, J = 13.3, 4.6 Гц), 2.49 (1H, дд, J = 13.5, 3.9 Гц), 2.31-2.21 (3H, м), 2.13-1.95 (7H, м), 1.72-1.54 (5H, м), 1.42-1.36 (3H, м), 1.27 (3H, с), 1.26 (3H, с), 1.19 (3H, д, J = 6.4 Гц), 0.66 (3H, с).
LC-MS: Точная масса = 471.37 (C30H49NO3), Набл. масса = 472.20 (M+H).
Пример 346
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I001)
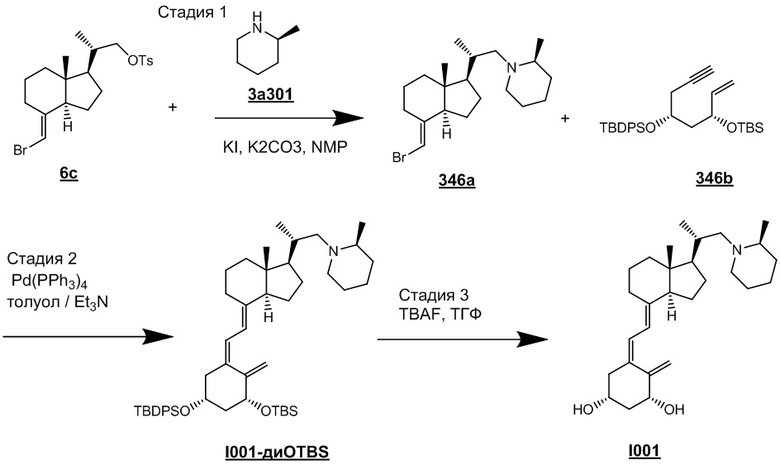
Стадия 1
Суспензию [1 мл] соединения (6c) [70 мг, 0.159 ммоль], (S)-2-метилпиперидина [47.2 мг, 0.476 ммоль], иодида калия [52.7 мг, 0.317 ммоль] и карбоната калия [65.8 мг, 0.476 ммоль] в NMP перемешивали при 60°C в течение ночи. Реакционную смесь переносили в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий соединение (346a).
Стадия 2
Смесь сырого продукта, содержащего соединение (346a), полученного на стадии 1, соединения (346b) [CAS 143681-90-7, 93.8 мг, 0.190 ммоль] тетракис(трифенилфосфин) палладия(0) [36.7 мг, 0.0318 ммоль] и смеси толуол-триэтиламин [1/1, 1 мл] перемешивали при 100°C в течение 1 часа. Реакционную смесь упаривали, разбавляли этилацетатом и промывали насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая сырой продукт, содержащий соединение (I001-diOTBS).
Стадия 3
Соединение (I001-diOTBS), полученное на стадии 2, растворяли в ТГФ [1 мл], затем добавляли в раствор TBAF [1M раствор в ТГФ, 0.5 мл, 0.5 ммоль], и полученную смесь перемешивали при 50°C в течение 3 часов. Реакционную смесь переносили в насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Остаток от упаривания очищали методом ВЭЖХ, получая соединение I001 [5.6 мг, 0.013 ммоль].
1H-ЯМР (CD3OD) δ: 6.34 (1H, д, J = 11.0 Гц), 6.03 (1H, д, J = 11.4 Гц), 5.36 (1H, т, J = 2.3 Гц), 3.98-3.95 (1H, м), 3.74-3.69 (1H, м), 3.56-3.52 (1H, м), 3.26 (1H, с), 3.08-3.02 (1H, м), 2.91-2.82 (4H, м), 2.57-2.54 (1H, м), 2.31-2.27 (1H, м), 2.16-2.04 (4H, м), 1.89-1.36 (24H, м), 1.15-1.10 (4H, м), 0.61 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.20 (M+H).
Пример 347
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I002)
Соединение I002 [7.0 мг, 0.016 ммоль] получали по методике, аналогичной описанной на стадиях 1 - 3 в Примере 346, используя соединение (6c) [70 мг, 0.159 ммоль] и (R)-2-метилпиперидин [47.2 мг, 0.476 ммоль].
1H-ЯМР (CD3OD) δ: 6.34 (1H, д, J = 11.0 Гц), 6.03 (1H, д, J = 11.0 Гц), 5.36 (1H, т, J = 2.3 Гц), 3.96 (1H, дд, J = 11.2, 4.8 Гц), 3.74-3.68 (1H, м), 3.43-3.38 (3H, м), 3.25 (1H, д, J = 12.8 Гц), 3.12-3.07 (1H, м), 2.90-2.85 (1H, м), 2.67 (1H, т, J = 11.9 Гц), 2.57-2.54 (1H, м), 2.31-2.29 (1H, м), 2.15-2.00 (5H, м), 1.88-1.34 (26H, м), 1.17-1.13 (4H, м), 0.61 (3H, с).
LC-MS: Точная масса = 427.35 (C28H45NO2), Набл. масса = 428.20 (M+H).
Пример 348
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I003)
Соединение I003 [2.6 мг, 0.0059 ммоль] получали по методике, аналогичной описанной на стадиях 1 - 3 в Примере 346, используя соединение (6c) [70 мг, 0.159 ммоль] и 2,2-диметилпиперидин гидрохлорид [47.2 мг, 0.476 ммоль].
1H-ЯМР (CD3OD) δ: 6.34 (1H, д, J = 11.4 Гц), 6.03 (1H, д, J = 11.0 Гц), 5.36 (1H, т, J = 2.1 Гц), 3.98-3.93 (1H, м), 3.73-3.68 (1H, м), 3.46-3.42 (2H, м), 3.12 (1H, с), 2.90-2.86 (1H, м), 2.57-2.54 (1H, м), 2.32-2.28 (1H, м), 2.16-2.03 (5H, м), 1.82-1.67 (14H, м), 1.56-1.35 (18H, м), 1.19-1.15 (4H, м), 0.62 (3H, с).
LC-MS: Точная масса = 441.36 (C29H47NO2), Набл. масса = 442.25 (M+H).
Пример 349
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I004)
Соединение I004 [10.5 мг, 0.024 ммоль] получали по методике, аналогичной описанной на стадиях 1 - 3 в Примере 346, используя соединение (6c) [70 мг, 0.159 ммоль] и (S)-3-метилморфолин [32.1 мг, 0.317 ммоль].
1H-ЯМР (CD3OD) δ: 6.34 (1H, д, J = 11.4 Гц), 6.01 (1H, д, J = 11.4 Гц), 5.37-5.35 (1H, м), 3.97 (1H, дд, J = 11.0, 4.6 Гц), 3.83-3.80 (1H, м), 3.74-3.60 (3H, м), 3.00 (1H, д, J = 12.3 Гц), 2.87 (1H, д, J = 12.3 Гц), 2.58-2.53 (3H, м), 2.32-2.25 (3H, м), 2.13-2.01 (4H, м), 1.94-1.90 (1H, м), 1.73-1.66 (4H, м), 1.55-1.30 (7H, м), 1.08-1.01 (7H, м), 0.58 (3H, с).
LC-MS: Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 350
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I005)
Соединение I005 [9.3 мг, 0.022 ммоль] получали по методике, аналогичной описанной на стадиях 1 - 3 в Примере 346, используя соединение (6c) [70 мг, 0.159 ммоль] и (R)-3-метилморфолин [32.1 мг, 0.317 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.4 Гц), 6.01 (1H, д, J = 11.4 Гц), 5.37-5.35 (1H, м), 3.97 (1H, дд, J = 11.0, 4.6 Гц), 3.72-3.68 (5H, м), 2.88-2.80 (3H, м), 2.65-2.53 (3H, м), 2.32-2.28 (1H, м), 2.16-1.99 (5H, м), 1.94-1.93 (1H, м), 1.73-1.25 (12H, м), 1.05 (7H, дд, J = 6.4, 2.3 Гц), 0.56 (3H, с).
LC-MS: Точная масса = 429.32 (C27H43NO3), Набл. масса = 430.25 (M+H).
Пример 351
Синтез (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диола (Соединение I006)
Соединение I006 [2.2 мг, 0.005 ммоль] получали по методике, аналогичной описанной на стадиях 1 - 3 в Примере 346, используя соединение (6c) [70 мг, 0.159 ммоль] и 3,3-диметилморфолин [36.5 мг, 0.317 ммоль].
1H-ЯМР (CD3OD) δ: 6.33 (1H, д, J = 11.0 Гц), 6.01 (1H, д, J = 11.0 Гц), 5.35 (1H, т, J = 2.1 Гц), 3.97 (1H, дд, J = 11.0, 4.6 Гц), 3.82-3.79 (1H, м), 3.74-3.60 (3H, м), 3.43-3.38 (1H, м), 3.34 (1H, с), 2.88-2.74 (3H, м), 2.65-2.61 (1H, м), 2.54 (1H, дд, J = 12.6, 2.5 Гц), 2.35-2.28 (4H, м), 2.16-1.99 (5H, м), 1.70-1.67 (3H, м), 1.55-1.45 (6H, м), 1.39-1.24 (4H, м), 1.07-1.02 (11H, м), 0.56 (3H, с).
LC-MS: Точная масса = 443.34 (C28H45NO3), Набл. масса = 444.20 (M+H).
Пример 352
Определение транскрипционной активности VDR в остеобластах человека (HOS клетки)
(1) Конструировали репортерный вектор, используя pGL4.26 вектор (Promega Corporation) и включая в него последовательность DR3 (×4) промоторного участка гена выше гена люциферазы. Экспрессионный вектор конструировали, вставляя ДНК-последовательность, кодирующую человеческий VDR и человеческий RXRα, в pcDNA3 вектор (Thermo Fisher Scientific, Inc.). Human RenillaLuc-CMV вектор (Promega Corporation) использовали для коррекции эффективности переноса гена. HOS клетки (ATCC) выращивали в среде DMEM, содержащей 10% фетальной бычьей сыворотки (PBS) при 37°C и 5% CO2, и пересевали каждые 2 или 3 дня.
(2) Пересеваемые клетки отделяли центрифугированием и диспергировали в среде DMEM без фенолового красного, содержащей деактивированную и обработанную 5% активированным углем фетальную бычью сыворотку (CSS), в концентрации 4×105 клеток/мл, и затем вводили различные векторы, описанные в (1), используя реагент Lipofectamine LTX (Thermo Fisher Scientific, Inc.) в соотношении 0.25 мл на 1 мл раствора клеток. HOS клетки, в которые был введен ген VDR, высевали на белый 384-луночный планшет (Aurora Inc.) в количестве 0.01 мл/лунку. После инкубирования в течение 3 часов при 37°C и 5% CO2, добавляли раствор (конечная концентрация: 200 нМ) 1α,25-дигидроксивитамина D3 в ДМСО и раствор (разные концентрации) тестируемого соединения в ДМСО так, чтобы конечная концентрация ДМСО составляла 0.1%. Лунки, содержащие только ДМСО, использовали как бланковые, а лунки, содержащие раствор (конечная концентрация: 200 нМ) 1α,25-дигидроксивитамина D3 в ДМСО, использовали как контроль.
(3) После инкубирования в течение 21 часа при 37°C и 5% CO2, определяли активность люциферазы с помощью многоканального счетчика EnVision (PerkinElmer, Inc.), используя набор Dual-Glo Luciferase Assay (Promega Corporation). В то же время определяли активность Renilla люциферазы и использовали эти данные для коррекции эффективности переноса гена. Активность люциферазы светлячка корректировали, используя значение активности Renilla люциферазы, вычисляли коэффициент транскрипционной активности (бланк: 0%, контроль: 100%) тестируемого соединения, и затем вычисляли значения EC50 с помощью Formula fit208 в XLfit (IDBS).
(4) Результат
Активность производных по настоящему изобретению, определенная с использованием описанной выше методики, показана ниже в таблице. Активность представлена в следующих символах:
* 100 нМ < EC50 ≤ 1000 нМ
** 10 нМ < EC50 ≤ 100 нМ
*** 1 нМ < EC50 ≤ 10 нМ
**** EC50 ≤ 1 нМ
Когда активность 1α,25-дигидроксивитамина D3 определяли несколько раз, используя описанную систему, значения активности EC50 составляли от 2.93 нМ до 11.30 нМ.
Таблица 4-2
Таблица 4-3
Результаты проведенного тестирования подтверждают, что производные витамина D по настоящему изобретению, показанные выше в таблице, воздействуют на рецептор витамина D (VDR).
С другой стороны, активность производных по настоящему изобретению (соединение F001 - I006) в используемой тестовой системе показала значение EC50 100 нМ или больше для всех производных, за исключением соединения G013. Когда активность 1α,25-дигидроксивитамина D3 оценивали несколько раз в данной тестовой системе, были получены значения активности EC50 от 2.93 нМ до 11.30 нМ. Эти результаты подтверждают, что производное витамина D по настоящему изобретению (соединения F001 - I006, за исключением соединения G013) имеют слабую активность (геномное действие) в отношении рецептора витамина D.
Пример 353
Определение стимулирующей активности в отношении дифференциации предшественников олигодендроцитов крыс 1
Для производных витамина D, которые показали активность в отношении рецептора витамина D (VDR) в Примере 352, определяли стимулирующую активность в отношении дифференциации предшественников олигодендроцитов крыс (OPC) по экспрессии гена MBP (мРНК).
(1) Получение клеток-предшественников олигодендроцитов крыс
Передний мозг, полученный от крыс SD (Charles River Japan, возраст 1 день) размалывали с помощью 70 мкм клеточного сита Cell Strainer (Falcon #352350), и получали суспензию клеток, собирая клетки в среде для выделения клеток-предшественников олигодендроцитов (20% FBS/2 мМ Glutamax (Gibco #35050-061)/1 мМ пируват натрия (Gibco #11360-070)/1% пенициллин-стрептомицин (Invitrogen #15140-122)/DMEM (Gibco #11960-044)). Суспензию клеток высевали в покрытую поли-D-лизином T75 колбу (Thermo Fisher Scientific #132704) и выращивали примерно 2 недели. После выращивания колбу встряхивали, используя ротационный шейкер (WAKENYAKU #WB-101SRC), в течение примерно 1 часа (37°C, 100 об/мин), и надосадочный раствор отбрасывали, чтобы удалить микроглию. Затем в колбу добавляли среду для выделения клеток-предшественников олигодендроцитов, и смесь встряхивали еще 22 часа (37°C, 200 об/мин), и надосадочный раствор собирали, получая клетки-предшественники олигодендроцитов.
(2) Оценка дифференциации клеток-предшественников олигодендроцитов
Полученные клетки-предшественники олигодендроцитов суспендировали в среде для дифференциации (2% B27 (Thermo Fisher Scientific, Inc. #17504-044)/1% пенициллин-стрептомицин (Invitrogen Corporation #15140-122)/10 нг/мл CNTF (PeproTech Inc. #AF-450-13)/DMEM (Gibco #11960-044)), и высевали в 96-луночный микропланшет, покрытый поли-L-орнитином (FUJIFILM Wako Pure Chemical Corporation #163-27421), в количестве 0.65×104 клеток/лунку, и в 384-луночный микропланшет в количестве 2×103 клеток/лунку, используя автоматический диспенсер (LABCYTE #Echo555). После высевания клеток добавляли тестируемое соединение (трииодтиронин (T3) = 30 нМ, производное витамина D по настоящему изобретению и GSK239512 = 1 мкМ) в среде для дифференциации, и клетки выращивали 4 дня. После окончания выращивания проводили иммуноокрашивание клеток, высеенных в 96-луночный планшет, относительно MBP, используя следующий метод: фиксирование (4%-ный раствор параформальдегида, 30 минут, комнатная температура), промывка PBS, обработка для проницаемости мембран (0.1% Trion X-100 (SIGMA #X100-100ML)/PBS, 3 минуты, комнатная температура), блокировка (3% BSA (SIGMA #A9647-10G)/PBS, 1 час, комнатная температура), реакция с первичным антителом (MBP антитело (abcam plc #ab40390), 2.5 мкг/мл, 4°C, 24 часа), промывка PBS, реакция с вторичным антителом (Alexa488 anti-rabbit IgG (Thermo Fisher Scientific, Inc. #A-11034), 5 мкг/мл, комнатная температура, 1 час), промывка PBS, и ядерное окрашивание (Hoechst33342 (DOJINDO #NU043), 10 мкг/мл, комнатная температура, 5 минут). Затем делали снимки каждой лунки, используя флуоресцентный микроскоп (KEYENCE CORPORATION #BZ-X800), подсчитывали число MBP-положительных клеток и Hoechst 33342-положительных клеток, используя приложение для анализа изображений (KEYENCE CORPORATION #BZ-X800 Analyzer), и затем вычисляли соотношение (число MBP-положительных клеток/число Hoechst33342-положительных клеток). Для клеток, высеенных в 384-луночный планшет, проводили ПЦР-анализ в реальном времени, используя набор Cells-to-CT 1-Step TaqMan Kit (Thermo Fisher Scientific, Inc. #A25602) и систему для проведения ПЦР-анализа в реальном времени QuantStudio 12K Flex Real-Time PCR System (Thermo Fisher Scientific, Inc. #4472380). Эксперимент проводили по методике, прилагающейся к набору. MBP (Thermo Fisher Scientific, Inc. #Assay ID Rn00690616_m1) и β актин (Thermo Fisher Scientific, Inc. #Assay ID Rn00667869_m1) использовали как праймеры, оценивали уровень экспрессии каждого и вычисляли соотношение (MBP/β актин). Анализ проводили, используя XLfit5 (IDBS), и относительные значения средних значений для лунок, в которые было добавлено каждое соединение, вычисляли путем вычитания среднего значения для лунок, в которые был добавлен только ДМСО, и принимая среднее значение для лунок, в которые был добавлен трииодтиронин (T3), гормон щитовидной железы, за 100%.
(3) Результат
В реферате WO2013/107336 сообщалось, что GSK239512 стимулирует дифференциацию клеток-предшественников олигодендроцитов (OPC). В тесте по настоящему изобретению, 1 мкМ GSK239512 показал в 1.8 раза более сильное повышение экспрессии гена MBP по сравнению с клетками, в которые был добавлен ДМСО. Эта интенсивность действия, выраженная в процентах (далее обозначается как T3-шкала), принимая среднее значение для ДМСО-группы за 0% и среднее значение для группы на трииодтиронине (T3) за 100%, соответствовала стимулирующей активности 18%. 1α,25-Дигидроксивитамин D3 показал отсутствие стимулирующей активности в данном тесте (стимулирующая активность 0% по T3-шкале). С другой стороны, производное по настоящему изобретению в концентрации 1 мкМ показало стимулирующую активность 20% или выше по T3-шкале в случае следующих соединений: A019, B002, B004, B005, B006, B007, B008, B020, B021, B022, B023, B024, B026, B027, B028, B029, B030, B031, B032, B034, B035, B036, B037, B040, B041, B042, B043, B047, B048, B049, B051, B053, B054, B055, B056, B057, B058, B059, B061, B062, B063, B064, B067, B070, B073 B080, B081, B082, B086, B087, C001, C019, C022, C035a, C035b, C036a, C037a, C037b, C045a, C045b, C049, C051, C052, C053, C054, C055, C056, C057, D003, D004, D007, D008, D010, D012, D015, D017, D019, D023, D024, D025, D029, D030, D031, D032, D037, D038, D041, D043, D044, D047, D048. Кроме того, стимулирующая активность 50% или выше по T3-шкале была обнаружена в случае следующих соединений: B005, B006, B007, B008, B020, B022, B023, B028, B029, B030, B031, B032, B034, B035, B036, B037, B041, B042, B043, B049, B053, B054, B056, B057, B058, B063, B064, B080, B081, B086, B087, C001, C019, C022, C036a, C037a, C049, C051, C053, C055, C056, C057, D019, D004, D010, D015.
Описанные выше результаты ясно показывают, что производное витамина D по настоящему изобретению обладает стимулирующей активностью, которая равна или превышает активность хорошо известного соединения GSK239512.
Пример 354
Определение стимулирующей активности в отношении дифференциации предшественников олигодендроцитов крыс 2
Стимулирующую активность производных витамина D в отношении дифференциации клеток-предшественников олигодендроцитов (OPC) оценивали методом иммуноокрашивания MBP.
(1) Получение клеток-предшественников олигодендроцитов крыс
Передний мозг, полученный от крыс SD (Charles River Japan, возраст 1 день) размалывали с помощью 70 мкм клеточного сита Cell Strainer (Falcon #352350), и получали суспензию клеток, собирая клетки в среде для выделения клеток-предшественников олигодендроцитов (20% FBS/2 мМ Glutamax (Gibco #35050-061)/1 мМ пируват натрия (Gibco #11360-070)/1% пенициллин-стрептомицин (Invitrogen #15140-122)/DMEM (Gibco #11960-044)). Суспензию клеток высевали в покрытую поли-D-лизином T75 колбу (Thermo Fisher Scientific #132704) и выращивали 10 дней. После выращивания колбу встряхивали, используя ротационный шейкер (WAKENYAKU #WB-101SRC), в течение примерно 1 часа (37°C, 100 об/мин), и надосадочный раствор отбрасывали, чтобы удалить микроглию. Затем в колбу добавляли среду для выделения клеток-предшественников олигодендроцитов, и смесь встряхивали еще примерно 22 часа (37°C, 200 об/мин), и надосадочный раствор собирали, получая клетки-предшественники олигодендроцитов
(2) Оценка дифференциации клеток-предшественников олигодендроцитов
Полученные клетки-предшественники олигодендроцитов суспендировали в среде для дифференциации (2% B27 (Thermo Fisher Scientific, Inc. #17504-044)/1% пенициллин-стрептомицин (Invitrogen Corporation #15140-122)/ 1% пируват натрия (FUJIFILM Wako Pure Chemical Corporation #191-03061)/ 10 нг/мл CNTF (PeproTech Inc. #AF-450-13)/DMEM (Gibco #11960-044)), и высевали в 96-луночный микропланшет, покрытый поли-L-орнитином (FUJIFILM Wako Pure Chemical Corporation #163-27421), в количестве 0.65×104 клеток/лунку. После высевания клеток добавляли тестируемое соединение (трииодтиронин (T3) = 30 нМ, производное витамина D по настоящему изобретению = 2 мкМ) в среде для дифференциации, и клетки выращивали 4 дня. После окончания выращивания проводили иммуноокрашивание клеток относительно MBP, используя следующий метод: фиксирование (4%-ный раствор параформальдегида, 30 минут, комнатная температура), промывка PBS, обработка для проницаемости мембран (0.1% Trion X-100 (SIGMA #X100-100ML)/PBS, 3 минуты, комнатная температура), блокировка (3% BSA (SIGMA #A9647-10G)/PBS, 1 час, комнатная температура), реакция с первичным антителом (MBP антитело (abcam plc #ab40390), 2.5 мкг/мл, 4°C, 24 часа), промывка PBS, реакция с вторичным антителом (Alexa488 anti-rabbit IgG (Thermo Fisher Scientific, Inc. #A-11034), 5 мкг/мл, комнатная температура, 1 час), промывка PBS, и ядерное окрашивание (Hoechst33342 (DOJINDO #NU043), 10 мкг/мл, комнатная температура, 5 минут). Затем делали снимки каждой лунки, используя флуоресцентный микроскоп (KEYENCE CORPORATION #BZ-X800), подсчитывали число MBP-положительных клеток и Hoechst 33342-положительных клеток, используя приложение для анализа изображений (KEYENCE CORPORATION #BZ-X800 Analyzer), и затем вычисляли соотношение (число MBP-положительных клеток/число Hoechst33342-положительных клеток).
(3) Результаты
Результаты показаны ниже в таблице и обозначены описанными ниже символами. Следует отметить, что достоверное отличие в таблицах было вычислено по t-тесту относительно группы на ДМСО.
* <0.05
** <0.01
*** <0.001
**** <0.0001
ns нет достоверного отличия
Тест 1
Тест 2
Тест 3
Тест 4
Тест 5
Тест 6
Тест 7
Тест 8
Тест 9
Как показано в таблицах 5-1 и 5-2, производные витамина D, для которых была подтверждена активность в отношении рецептора витамина D (VDR) в Примере 352, стимулировала дифференциацию OPC в тесте иммуноокрашивания MBP. Кроме того, как показано в таблицах от 5-3 до 5-9, производные витамина D, которые показали слабую активность в отношении рецептора витамина D (VDR) в Примере 352, также стимулировали дифференциацию OPC. Результаты данного исследования ясно показывают, что производные витамина D в настоящем изобретении стимулируют дифференциацию OPC независимо от активности в отношении рецептора витамина D (VDR).
Пример 355
Стимулирующая активность соединений по настоящему изобретению в отношении дифференциации олигодендроцитов нейрональных стволовых клеток мышей (mNSC)
Тест проводили описанным ниже образом согласно методике, описанной в НПЛ 2 (H. A. Shirazi et al., Experimental and Molecular Pathology, 2015, 98 (2), 240-245).
(1) Прекультура клеток
OriCell Strain C57BL/6 нейрональные стволовые клетки мышей (NSCs) (Cyagen Biosciences Inc., Cat. No. MUBNF-01001) использовали в качестве нейрональных стволовых клеток мышей. Среду OriCell NSC (Cyagen Biosciences Inc., Cat. No. GUXNX-90011) использовали в качестве среды для выращивания. В базовую среду NSC (100 мл), входящую в данный продукт, добавляли B27 (1 мл), пенициллин-стрептомицин (1 мл), глутамин (1 мл), bFGF (20 мкл), EGF (10 мкл) и гепарин (100 мкл) для приготовления среды для выращивания. Нейрональные стволовые клетки мышей разводили в колбе T-25, используя среду для выращивания, и они росли в виде нейросферы в суспензионной культуре. Клетки рассевали с индексом разведения = 1:2 в CO2 инкубаторе (5% CO2, 37°C, увлажн.), получая нужное количество клеток. В качестве реагента для рассевания использовали ACCUTASE (Innovative Cell Technologies, Cat. No. AT104).
(2) Приготовление образца
Среду для выращивания OriCell NSC (Cyagen, Cat. No. GUXNX-90011) использовали в качестве среды для дифференциации. В базовую среду NSC (100 мл), входящую в данный продукт, добавляли B27 (1 мл), пенициллин-стрептомицин (1 мл), глутамин (1 мл) и затем FBS (2 мл) (Cell Culture Bioscience, Cat. No. 171012) для приготовления среды для дифференциации. Среду для дифференциации, содержащую тестируемое соединение, готовили в целевой конечной концентрации путем разведения 20 мМ раствора соединения в ДМСО до 10-кратного добавлением ДМСО и затем до 2×105-кратного добавлением среды для дифференциации. Среду для дифференциации без добавок (для контроля) получали разведением ДМСО до 2×105-кратного путем добавления среды для дифференциации, так чтобы конечная концентрация составила 5×10-5%.
(3) Индуцирование дифференциации и обработка образцов
Нейрональные стволовые клетки мышей высевали на поли-L-лизин/ламинин-покрытый 96-луночный планшет в концентрации 2.0×104 клеток/100 мкл/лунку, используя среду для дифференциации, и запускали выращивание культуры в CO2 инкубаторе (5% CO2, 37°C, увлажн.). На следующий день среду заменяли на среду для дифференциации, содержащую тестируемое соединение, или на среду для дифференциации без добавок (для контроля), и начинали исследование тестируемого соединения (N = 5) (День 0). Среду заменяли через день в объеме 60% среды в лунке. В День 10 клетки фиксировали и подвергали иммуноокрашиванию.
(4) Иммуноокрашивание
После удаления среды, клетки фиксировали добавлением 100 мкл 4%-ного раствора параформальдегид-PBS и инкубировали при комнатной температуре 30 минут. Затем клетки промывали 3 раза PBS, добавляли 100 мкл 5% раствора козья сыворотка/PBS, и смесь инкубировали при комнатной температуре 30 минут для блокировки и обработки для проницаемости мембран. Затем раствор заменяли на 100 мкл раствора первичного антитела (в раствор 3% BSA/PBS добавлено 1/200 количество anti-GalC антитела (mouse IgG3, Millipore, Cat. No. MAB342)) и инкубировали при 4°C в течение ночи. Клетки промывали 3 раза раствором 3% BSA/PBS, затем раствор заменяли на 100 мкл раствора вторичного антитела (в раствор 3% BSA/PBS добавляли 1/500 количество вторичного антитела Alexa Fluor 488 Goat Anti-mouse IgG (H+L) (Thermo Fisher Scientific, Inc., Cat. No. A-11001) и 1/1000 количество Hoechst 33342 (Thermo Fisher Scientific, Inc., Cat. No. H3570)) и инкубировали при комнатной температуре в течение 2 часов. Клетки промывали 3 раза PBS, добавляли в лунки 100 мкл PBS, и лунки фотографировали через флуоресцентный микроскоп. Снимки делали в одинаковых для всех лунок условиях, и одновременно фотографировали синюю флуоресценцию и зеленую флуоресценцию.
(5) Количественная оценка степени дифференциации клеток
Используя программу подсчета гибридных клеток, поставляемую вместе с флуоресцентным микроскопом (Keyence, BZ-X700), экстрагировали со-локализованные споты с зеленой флуоресценцией и синей флуоресценцией, и число этих спотов определяли как общее число GalC-положительных клеток, и вычисляли степень дифференциации олигодендроцитов по следующему уравнению: общее число GalC-положительных клеток/число ядер (число спотов с синей флуоресценцией). Тест достоверного отличия проводили по методике t-теста между группой без добавок и группой с добавлением образца.
(6) Результаты
Полученные результаты приведены ниже в таблице. В этом эксперименте обработка нейрональных стволовых клеток (NSC) добавлением 1000 нМ 1α,25-дигидроксивитамина D3 (1α,25(OH)2D3) показала 1.5-кратную стимулирующую активность в дифференциации Gal/C-положительных олигодендроцитов. Это практически такой же результат, как в НПЛ 2. С другой стороны, производные по настоящему изобретению также показали стимулирующую активность в отношении дифференциации олигодендроцитов, которая равна или выше, чем у 1α,25(OH)2D3.
Тест 1
(нМ)
Среднее значение (стандартная ошибка)
(*: <0.05, **: <0.01, ***: <0.005)
Пример 356
Определение стимулирующей активности в отношении дифференциации клеток-предшественников олигодендроцитов, с использованием мышей с выключенным геном рецептора витамина D (VDR)
Оценивали стимулирующую активность производных витамина D в отношении дифференциации клеток-предшественников олигодендроцитов (OPC), используя клетки-предшественники олигодендроцитов от VDR-нокаут мышей.
(1) Получение нейрональных стволовых клеток VDR-нокаут мышей
Базальные ядра, полученные от VDRKO_Alop_fs1 (VDR V256fs) мышей (Университет Токушима, эмбриональный срок 16 дней) размалывали с помощью 70 мкм клеточного сита Cell Strainer (Falcon #352350) и готовили суспензию клеток в среде для выращивания нейрональных стволовых клеток мышей (2 мМ Glutamax (Gibco #35050-061)/1% B27 (Thermo Fisher Scientific #17504-044)/1% пенициллин-стрептомицин (Invitrogen #15140-122)/40 мкг/мл рекомбинантный человеческий основной фактор роста фибробластов (R&D #236-EG)/20 мкг/мл рекомбинантный человеческий эпидермальный фактор роста (R&D #233-FB/CF)/50 МЕ/мл гепарин натрия (FUJIFILM Wako Pure Chemical Corporation #081-00136)/DMEM/F-12, без глутамина (Gibco #21331-020)). Полученную суспензию клеток высевали в T75 колбу (Thermo Fisher Scientific #132704), и проводили наращивание клеток. Клетки, полученные в выращенной культуре, использовали как нейрональные стволовые клетки.
(2) Получение клеток-предшественников олигодендроцитов из нейрональных стволовых клеток VDR-нокаут мышей
Нейрональные стволовые клетки суспендировали в среде для дифференциации нейрональных стволовых клеток (2 мМ Glutamax (Gibco #35050-061)/2% B27 (Thermo Fisher Scientific #17504-044)/1% пенициллин-стрептомицин (Invitrogen #15140-122)/1% фетальная бычья сыворотка (SIGMA-ALDRICH #173012-500ML)/DMEM/F-12, без глутамина (Gibco #21331-020)), и высевали в концентрации 1.0×107 клеток на чашку в 15-сантиметровую чашку, покрытую поли-D-лизином (SIGMA-ALDRICH #P7886)/ламинин (SIGMA-ALDRICH #L2020). После высевания меняли среду каждые 3-4 дня, клетки выделяли после дифференциации культуры в течение 12 дней, и выделяли PDGFRα-положительные клетки, используя набор CD140a (PDGFRα) MicroBeads kit, mouse (Miltenyi Biotec #130-101-502), получая клетки-предшественники олигодендроцитов VDR-нокаут мышей.
(3) Оценка дифференциации клеток-предшественников олигодендроцитов
Полученные клетки-предшественники олигодендроцитов VDR-нокаут мышей суспендировали в среде для дифференциации клеток-предшественников олигодендроцитов (2% B27 (Thermo Fisher Scientific #17504-044)/ 1% пенициллин-стрептомицин (Invitrogen #15140-122)/10 нг/мл CNTF (PeproTech #AF-450-13)/DMEM/F-12, без глутамина (Gibco #21331-020)), и высевали в 96-луночный планшет, покрытый поли-L-орнитином (FUJIFILM Wako Pure Chemical Corporation #163-27421) в концентрации 2.0×104 клеток на лунку. После высевания клеток добавляли раствор тестируемого соединения (производное витамина D по настоящему изобретению = 1000 нМ) в описанной выше среде для дифференциации, и клетки выращивали 4 дня. После окончания выращивания клетки подвергали иммуноокрашиванию по MBP, используя следующий метод: фиксация (4%-ный раствор параформальдегида, 30 минут, комнатная температура), PBS промывка, обработка для проницаемости мембран (0.1% Trion X-100 (SIGMA-ALDRICH #X100-100ML)/PBS, 3 минуты, комнатная температура), блокировка (5% нормальная козья сыворотка (Abcam #ab7481)/PBS, 1 час, комнатная температура), реакция с первичным антителом (MBP антитело (BIO-RAD #MCA409S), 100-кратное разведение, 4°C, 24 часа), PBS промывка, реакция со вторичным антителом (Alexa488 anti-rat IgG (Thermo Fisher Scientific #A-11006), 4 мкг/мл, комнатная температура, 1 час), PBS промывка, ядерное окрашивание (Hoechst33342 (DOJINDO #NU043), 1 мкг/мл, комнатная температура, 15 минут). После этого делали снимки каждой лунки, используя флуоресцентный микроскоп (KEYENCE CORPORATION #BZ-X800), определяли число MBP-положительных клеток и Hoechst 33342-положительных клеток (общее количество клеток), используя приложение для анализа изображений (KEYENCE CORPORATION #BZ-X800 Analyzer), затем вычисляли соотношение число MBP-положительных клеток/число Hoechst33342-положительных клеток (общее число клеток), и затем в результате вычисляли соотношение данного параметра к аналогичному для группы на ДМСО.
(4) Результаты
Полученные результаты показаны ниже в таблице в виде символов. Необходимо отметить, что достоверное отличие в приведенной ниже таблице оценивали по t-тесту для группы на ДМСО «*», и достоверное отличие составляло <0.05.
Соединение по настоящему изобретению также стимулировало дифференциацию клеток-предшественников олигодендроцитов VDR-нокаут мышей. Результаты данного теста показывают, что VDR не является необходимым для дифференциации клеток-предшественников олигодендроцитов.
Пример 357
Оценка повышения уровня кальция у нормальных мышей
Оценивали активность повышения уровня кальция для производных витамина D по настоящему изобретению, у которых была подтверждена слабая активность (геномное действие) в отношении рецептора витамина D (VDR) в Примере 352.
После акклиматизации C57BL/6J мышей (возраст 7 недель, самцы) в течение 1 недели, мышей делили на группы по 5 мышей по весу тела, и начинали вводить соединение или носитель. Раствором для введения было соединение (в этаноле) или этанол, разведенные в 100 раз смесью 0.1% Trion X-100 (SIGMA #X100-100ML)/физраствор, и осуществляли повторяющееся пероральное введение один раз в день. После введения в течении 2 недель, проводили эвтаназию путем отбора всей крови под общим наркозом. Концентрацию кальция в полученных образцах плазмы крови определяли на автоматическом анализаторе (Hitachi automatic analyzer 7180).
Результаты
Активность повышения уровня кальция для соединений по настоящему изобретению приведена ниже в таблице.
Тест 1
(мкг/кг)
В этом тесте введение 1α,25-дигидроксивитамина D3 повышало концентрацию кальция в плазме крови, начиная с низкой дозы 0.6 мкг/кг, и диапазон флуктуации концентрации кальция составлял 4.0 мг/дл при дозе 2 мкг/кг, что приводило к состоянию гиперкальцемии. С другой стороны, соединение по настоящему изобретению, имеющее очень слабую активность (геномное действие) в отношении рецептора витамина D, не повышало концентрацию кальция даже в дозировке в 10 и более раз выше, чем дозировка 1α,25-дигидроксивитамина D3 (2.0 мкг/кг). Этот результат ясно показывает, что производное по настоящему изобретению не оказывает воздействия на уровень кальция.
Пример 358
Определение проницаемости в мозг у мышей
Тест 1 [исследование введения 1 мг/кг]
Тестируемое соединение (10 мг/мл в этаноле) разбавляли в 100 раз добавлением смеси 0.1% Trion X-100 (SIGMA #X100-100ML)/физраствор, готовя раствор для введения. Раствор для введения вводили перорально C57BL/6J мышам (возраст 8 недель, самцы, n = 3) в однократной дозе (1 мг/кг). Мышей умерщвляли в 6 точках времени: 0.25, 0.5, 1, 2, 4 и 8 часов после введения, и брали образцы плазмы крови и мозга. После получения гомогената отобранного образца мозга с использованием Tissue Lyser II (QIAGEN #85300), добавляли в гомогенат ацетонитрил, и гомогенат центрифугировали (12000 об/мин, 5 минут) для экстрагирования введенного тестируемого соединения, содержащегося в мозге. Аналогично добавляли ацетонитрил к плазме и проводили разделение на центрифуге для экстрагирования введенного тестируемого соединения, содержащегося в плазме крови. В каждом образце экстракта измеряли концентрацию введенного тестируемого соединения, используя метод LC/MS/MS (SHIMADZU UFLC/MS/MS (8050)).
В приведенной ниже таблице показаны результаты (среднее ± стандартное отклонение (S.D.)) измерения концентрации в крови и в мозге для каждого протестированного производного для максимального значения концентрации в мозге (Смакс в мозге). Кроме того, в таблице показано соотношение концентрация в мозге/концентрация в крови, которое вычисляли путем деления концентрации в мозге (среднее значение) на концентрацию в крови (среднее значение)).
в мозге/в крови
Тест 2 [исследование введения 0.2 мг/кг]
Тестируемое соединение (2 мг/мл в этаноле) разбавляли в 100 раз добавлением смеси 0.1% Trion X-100 (SIGMA #X100-100ML)/физраствор, готовя раствор для введения. Раствор для введения вводили перорально C57BL/6J мышам (возраст 8 недель, самцы, n = 3) в однократной дозе (0.2 мг/кг). Мышей умерщвляли в 6 точках времени: 0.25, 0.5, 1, 2, 4 и 8 часов после введения, и брали образцы плазмы крови и мозга. После получения гомогената отобранного образца мозга с использованием Tissue Lyser II (QIAGEN #85300), добавляли в гомогенат ацетонитрил, и гомогенат центрифугировали (12000 об/мин, 5 минут) для экстрагирования введенного тестируемого соединения, содержащегося в мозге. Аналогично добавляли ацетонитрил к плазме и проводили разделение на центрифуге для экстрагирования введенного тестируемого соединения, содержащегося в плазме крови. В каждом образце экстракта измеряли концентрацию введенного тестируемого соединения, используя метод LC/MS/MS (SHIMADZU UFLC/MS/MS (8050)).
В приведенной ниже таблице показаны результаты (среднее ± стандартное отклонение (S.D.)) измерения концентрации в крови и в мозге для каждого протестированного производного для максимального значения концентрации в мозге (Смакс в мозге). Кроме того, в таблице показано соотношение концентрация в мозге/концентрация в крови, которое вычисляли путем деления концентрации в мозге (среднее значение) на концентрацию в крови (среднее значение)).
в мозге/в крови
Все соединения по настоящему изобретению показали соотношение концентрация в мозге/концентрация в крови от 0.25 до 3.44 даже в условиях перорального введения. Согласно НПЛ 5, соотношение концентрация в мозге/концентрация в крови у 1α,25-дигидроксивитамина D3 составляло 0.007 ± 0.003. Таким образом, производные по настоящему изобретению обладают существенно улучшенной пенетрацией в центральную нервную систему, по сравнению с 1α,25-дигидроксивитамином D3.
Пример 359
Оценка стимулирования регенерации миелина в мышиной купризоновой модели
C57BL/6J мышей (возраст 8 недель, самцы) содержали на диете, содержащей 0.3% купризона (бис(циклогексанон)оксалидигидразон) (Research Diets, Inc. #D17042709) в течении 6 недель для индуцирования демиелинизации. Затем мышей делили на группы по 8 мышей по весу тела, питание переключали на диету без содержания купризона (Research Diets, Inc. #D10001), и начинали введение тестируемого соединения или носителя. Раствор для введения готовили следующим образом: соединение (в этаноле) или этанол разбавляли в 100 раз добавлением смеси 0.1% Trion X-100 (SIGMA #X100-100ML)/физраствор, и проводили повторяющиеся введения с частотой один раз в сутки. После введения в течении 4 недель, мышей умерщвляли, опрыскивали 4%-ным раствором параформальдегида и отбирали образцы мозга. Полученные образцы мозга заливали парафином для приготовления коронарных срезов на Bregma +1. Образцы окрашивали с помощью Luxor Fast Blue (LFB) для визуализации миелиновой оболочки, и делали снимки, используя флуоресцентный микроскоп (KEYENCE #BZ-X710). На снимках замеряли площадь мозолистого тела и LFB-положительно окрашенную площадь в мозолистом теле, используя приложение для анализа изображений (KEYENCE #BZ-H3C/BZ-H3XD), и вычисляли соотношение (LFB-положительно окрашенная площадь в мозолистом теле / площадь мозолистого тела). Интактная группа представляет собой непатогенную группу, и у интактной группы и контрольной группы брали образцы после содержания на диете с 0.3% купризона в течение 6 недель.
Результаты
Полученные результаты показаны в приведенной ниже таблице. В этой таблице соотношение LFB-положительно окрашенная площадь в мозолистом теле / площадь мозолистого тела для группы без введения тестируемого соединения, которую держали 6 недель на диете без купризона, принято за 100%. В результате, у контрольной группы, которую держали 6 недель на диете с купризоном, соотношение снижалось до 23.6%, и был подтвержден процесс демиелинизации. У группы, которую держали на диете с купризоном 6 недель и затем переводили на диету без купризона, и вводили только носитель, соотношение LFB-положительно окрашенная площадь в мозолистом теле / площадь мозолистого тела улучшалось до 50.1%. С другой стороны, из групп, которых держали на диете с купризоном 6 недель и затем переводили на диету без купризона, у группы с введением соединения B034, B043 и D023 соотношение LFB-положительно окрашенная площадь в мозолистом теле / площадь мозолистого тела улучшалось до 88.1%, 84.9% и 87.0%, соответственно, и существенно стимулировалась регенерация демиелинизации, по сравнению с 50.1% в группе с введением только носителя. Кроме того, в данном тесте исследовали также соединение GSK239512, описанное в WO2013/107336, и оно показало соотношение LFB-положительно окрашенная площадь в мозолистом теле / площадь мозолистого тела, равное 45.8%, и не наблюдалось стимулирующего действия на регенерацию демиелинизации по сравнению с группой, которой вводили только носитель.
окрашенная площадь / площадь мозолистого тела
Из описанных выше результатов ясно видно, что производное витамина D по настоящему изобретению обладает более высокой активностью стимулирования ремиелинизации, чем хорошо известное соединение (GSK239512), для которого сообщалось о стимулирующем действии на дифференциацию клеток-предшественников олигодендроцитов.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯТОРЫ SHIP1 И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2014 |
|
RU2679805C2 |
| НОВЫЕ АКТИВАТОРЫ РЕЦЕПТОРОВ ВИТАМИНА D И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2535448C2 |
| ИНГИБИТОРЫ RMT5 | 2019 |
|
RU2814198C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ГЛИКОЗИДАЗЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2609210C2 |
| ТРИТЕРПЕНОВЫЕ ПРОИЗВОДНЫЕ ЛУПЕОЛЬНОГО ТИПА КАК ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ | 2010 |
|
RU2561604C2 |
| ПРОНИЦАЕМЫЕ ИНГИБИТОРЫ ГЛИКОЗИДАЗЫ И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2707292C2 |
| НОВОЕ ПРОИЗВОДНОЕ 3-АЗАБИЦИКЛО[3.1.0]ГЕКСАНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2014 |
|
RU2701861C1 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ГЛИКОЗИДАЗЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2592285C2 |
Изобретение относится к производному витамина D формулы (1), фармацевтической композиции, стимулятору ремиелинизации, терапевтическому средству на его основе. Технический результат: получены новые производные витамина D, обладающие прекрасной миграцией в центральную нервную систему, которые стимулируют дифференциацию клеток-предшественников олигодендроцитов или нервных стволовых клеток в олигодендроциты и тем самым стимулируют регенерацию миелиновой оболочки. 4 н. и 18 з.п. ф-лы, 11 табл., 359 пр.
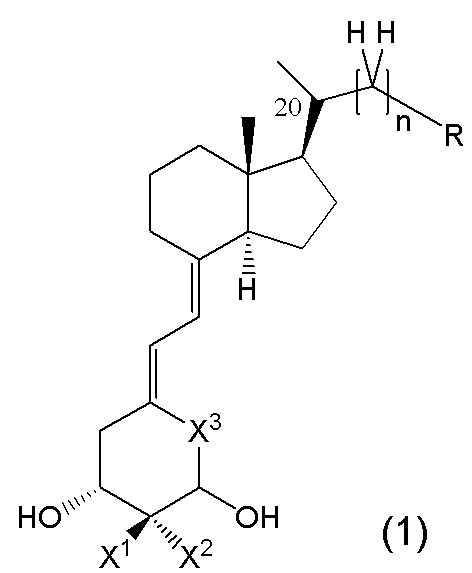
1. Производное витамина D, представленное изображенной ниже формулой (1), или его фармацевтически приемлемая соль или сольват:
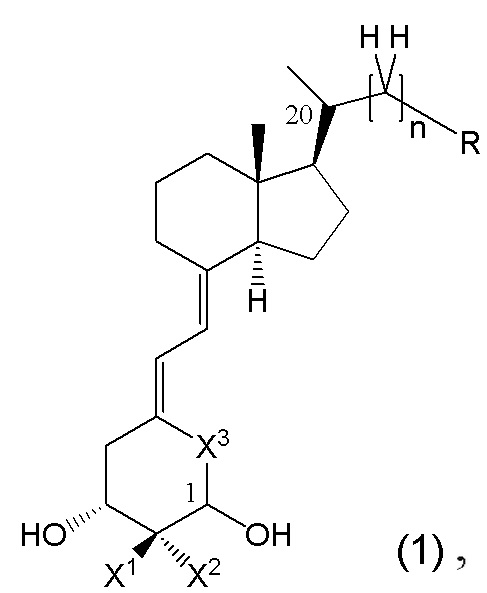
[в данной формуле R представляет собой любую структуру из Ra, Rb, Rc, Rd или Re, формулы которых приведены ниже:
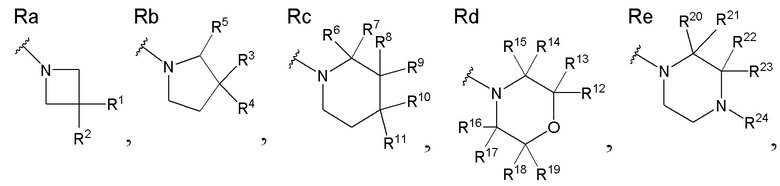
R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу, C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами галогенов, атом галогена или атом водорода;
R2, R4, R9 и R11, каждый, независимо представляют собой атом водорода, гидроксигруппу или C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов; (где в случае, когда R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами галогенов, или атом галогена, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, не является гидроксигруппой);
R6, R7, R12, R13, R14, R15, R16, R17, R18 R19, R20, R21, R22 и R23, каждый, независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, или C3 - C6 циклоалкильную группу;
каждая пара из R1 и R2, R3 и R4, R6 и R7, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19, R20 и R21 и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры;
R5 представляет собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную -OR501, или C3 - C6 циклоалкильную группу, необязательно замещенную -OR501, и R501 представляет собой атом водорода или C1 - C6 алкильную группу;
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу;
стереохимия по C-2 в пирролидиновом кольце (Rb) соответствует (R) или (S) конфигурации;
X1 и X2, каждый, независимо представляют собой атом водорода или C1 - C3 алкильную группу или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5);
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой);
n представляет собой целое число от 1 до 3;
стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации;
стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации].
2. Производное витамина D по п. 1 или его фармацевтически приемлемая соль или сольват, где
производное витамина D, представленное формулой (1), имеет изображенную ниже формулу (1A):
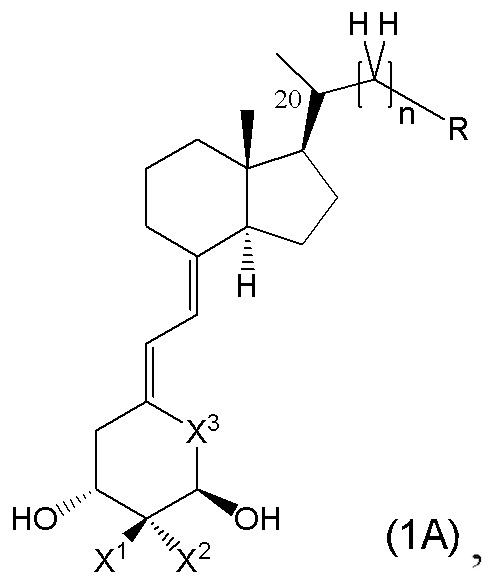
[в данной формуле R представляет собой любую структуру из Ra, Rb, Rc, Rd или Re, формулы которых приведены ниже:
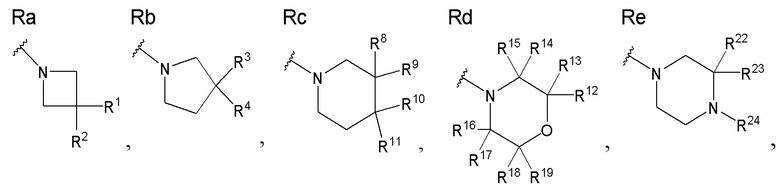
R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, a C3 - C6 циклоалкильную группу, C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами галогенов, атом галогена или атом водорода;
R2, R4, R9 и R11, каждый, независимо представляют собой атом водорода, гидроксигруппу или C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов; (где в случае, когда R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами галогенов, или атом галогена, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, не является гидроксигруппой);
R12, R13, R14, R15, R16, R17, R18, R19, R22 и R23, каждый, независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, или C3 - C6 циклоалкильную группу;
каждая пара из R1 и R2, R3 и R4, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19 и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры;
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу;
X1 и X2, каждый, независимо представляют собой атом водорода или C1 - C3 алкильную группу или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5);
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой);
n представляет собой целое число от 1 до 3;
стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации].
3. Производное витамина D по п. 2 или его фармацевтически приемлемая соль или сольват, где
в приведенной выше формуле (1)
R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, C3 - C6 циклоалкильную группу, C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами фтора, атом фтора или атом водорода;
R2, R4, R9 и R11, каждый, независимо представляют собой атом водорода, гидроксигруппу или C1 - C3 алкильную группу, необязательно замещенную 1-3 атомами фтора; (где в случае, когда R1, R3, R8 и R10, каждый, независимо представляют собой C1 - C6 алкоксигруппу, необязательно замещенную 1-3 атомами фтора, или атом фтора, каждый из R2, R4, R9 и R11, являющийся заместителем у одного и того же атома углерода вместе с R1, R3, R8 или R10, не является гидроксигруппой);
R12, R13, R14, R15, R16, R17, R18, R19, R22 и R23, каждый, независимо представляют собой атом водорода, C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами фтора, или C3 - C6 циклоалкильную группу;
каждая пара из R1 и R2, R3 и R4, R8 и R9, R10 и R11, R12 и R13, R14 и R15, R16 и R17, R18 и R19 и R22 и R23 может быть связана между собой с образованием 3-5-членной циклической структуры;
R24 представляет собой атом водорода, C1 - C3 алкильную группу или C1 - C3 алкилсульфонильную группу;
X1 и X2 каждый независимо представляют собой атом водорода или метильную группу или X1 и X2 вместе образуют метиленовую группу;
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой);
n представляет собой целое число от 1 до 3;
стереохимия расположения метильной группы у C-20 соответствует (R) или (S) конфигурации.
4. Производное витамина D по любому из пп. 1 - 3 или его фармацевтически приемлемая соль или сольват, где R представляет собой Ra.
5. Производное витамина D по любому из пп. 1 - 3 или его фармацевтически приемлемая соль или сольват, где R представляет собой Rb.
6. Производное витамина D по любому из пп. 1 - 3 или его фармацевтически приемлемая соль или сольват, где R представляет собой Rc.
7. Производное витамина D по любому из пп. 1 - 3 или его фармацевтически приемлемая соль или сольват, где R представляет собой Rd.
8. Производное витамина D по любому из пп. 1 - 3 или его фармацевтически приемлемая соль или сольват, где R представляет собой Re.
9. Производное витамина D по п. 1 или его фармацевтически приемлемая соль или сольват, где
производное витамина D, представленное формулой (1), имеет изображенную ниже формулу (1B):
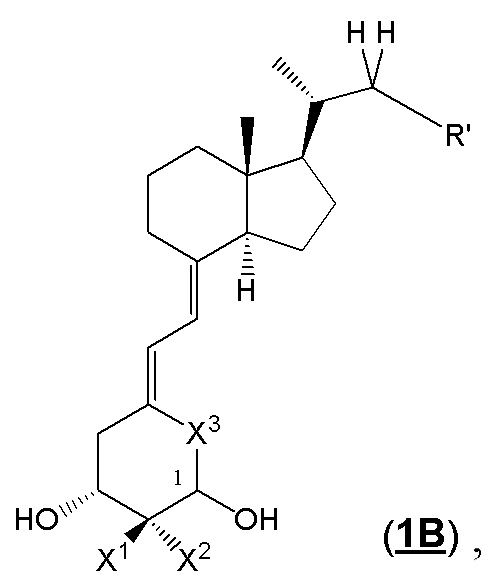
[в данной формуле R' представляет собой любую структуру из Rb', Rc' или Re', формулы которых приведены ниже:
R6', R7', R20' и R21', каждый, независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода (для каждой пары из R6', R7', R20' и R21', за исключением случаев, когда оба одновременно представляют собой атомы водорода);
каждая пара из R6' и R7' и R20' и R21' может быть связана между собой с образованием 3-5-членной циклической структуры;
R501' представляет собой атом водорода или C1 - C6 алкильную группу;
n01 и n02, каждый, независимо представляют собой целое число, равное 0 или 1;
стереохимия по C-2 в пирролидиновом кольце (Rb') соответствует (R) или (S) конфигурации;
X1 и X2 каждый независимо представляют собой атом водорода или C1 - C3 алкильную группу или X1 и X2 вместе образуют метиленовую группу или -(CH2)m- (где m представляет собой целое число от 2 до 5);
X3 представляет собой CH2 группу или C=CH2 группу (где в случае, когда X1 и X2 вместе образуют метиленовую группу, X3 не является C=CH2 группой);
стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации].
10. Производное витамина D по п. 9 или его фармацевтически приемлемая соль или сольват, где R' представляет собой Rb'.
11. Производное витамина D по п. 9 или его фармацевтически приемлемая соль или сольват, где R' представляет собой Rc'.
12. Производное витамина D по п. 9 или его фармацевтически приемлемая соль или сольват, где R' представляет собой Re'.
13. Производное витамина D по п. 1 или его фармацевтически приемлемая соль или сольват, где
производное витамина D, представленное формулой (1) имеет изображенную ниже формулу (1B-4):
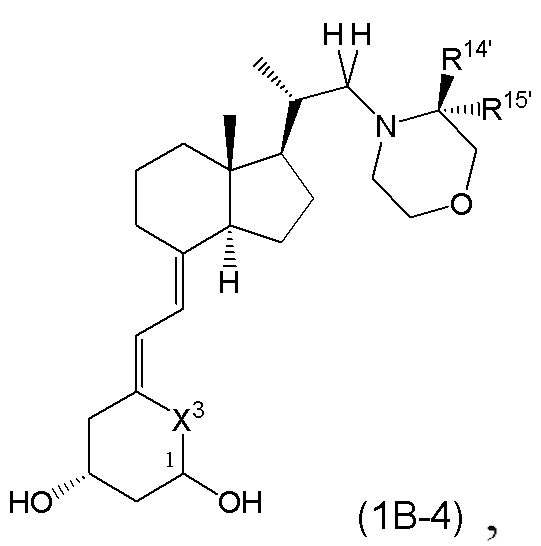
[в формуле (1B-4) R14' и R15,' каждый, независимо представляют собой C1 - C6 алкильную группу, необязательно замещенную 1-3 атомами галогенов, C3 - C6 циклоалкильную группу или атом водорода (за исключением случаев, когда R14' и R15' представляют собой атомы водорода одновременно);
R14' и R15' могут быть связаны между собой с образованием 3-5-членной циклической структуры;
X3 представляет собой CH2 группу или C=CH2 группу;
стереохимия расположения гидроксильной группы у C-1 соответствует (R) или (S) конфигурации].
14. Производное витамина D по любому из пп. 1 - 12 или его фармацевтически приемлемая соль или сольват, где X1 представляет собой атом водорода или метильную группу, X2 представляет собой атом водорода и X3 представляет собой C=CH2 группу.
15. Производное витамина D по любому из пп. 1 - 13 или его фармацевтически приемлемая соль или сольват, где X1 и X2 представляют собой атом водорода и X3 представляет собой C=CH2 группу.
16. Производное витамина D по любому из пп. 1 - 13 или его фармацевтически приемлемая соль или сольват, где X1 и X2 представляют собой атом водорода и X3 представляет собой CH2 группу.
17. Производное витамина D по любому из пп. 1 - 12 или его фармацевтически приемлемая соль или сольват, где X1 и X2 вместе образуют метиленовую группу и X3 представляет собой CH2 группу.
18. Производное витамина D по любому из предшествующих пунктов или его фармацевтически приемлемая соль или сольват:
(1) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилпирролидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение B001),
(2) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилпирролидин-1-ил)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B002),
(3) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилпирролидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B003),
(4) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилпирролидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B004),
(5) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-этилпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B005),
(6) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-этилпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B006),
(7) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-этилпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B007),
(8) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-этилпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B008),
(9) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-((S)-3-фторпирролидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение B018),
(10) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение B020),
(11) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B021),
(12) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B022),
(13) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B023),
(14) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B024),
(15) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B025),
(16) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B026),
(17) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметил)пирролидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B027),
(18) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B028),
(19) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B029),
(20) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B030),
(21) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пирролидин)-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B031),
(22) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B032),
(23) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B033),
(24) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B034),
(25) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(1,1-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B035),
(26) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B036),
(27) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B037),
(28) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B038),
(29) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение B039),
(30) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B040),
(31) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B041),
(32) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B042),
(33) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B043),
(34) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диол (Соединение B044),
(35) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B045),
(36) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-(трифторметил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение B046),
(37) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B047),
(38) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B048),
(39) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B049),
(40) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B050),
(41) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B051),
(42) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(дифторметокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B052),
(43) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B053),
(44) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B054),
(45) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B055),
(46) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B056),
(47) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B057),
(48) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтокси)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B058),
(49) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B059),
(50) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение B060),
(51) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B061),
(52) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение B062),
(53) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B063),
(54) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(3,3-дифторпропил)пирролидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B064),
(55) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(дифторметил)пирролидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B080),
(56) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(дифторметил)пирролидин-1-ил)бутан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B081),
(57) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-3-(дифторметокси)пирролидин-1-ил)бутан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B086),
(58) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-3-(дифторметокси)пирролидин-1-ил)бутан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение B087),
(59) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил)пиперидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диол (Соединение C001),
(60) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-гидрокси-4-(трифторметил)пиперидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение C002),
(61) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-гидрокси-4-(трифторметил) пиперидин-1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диол (Соединение C005),
(62) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-гидрокси-4-(трифторметил)пиперидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диол (Соединение C006),
(63) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение C019),
(64) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(дифторметил)-4-гидроксипиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение C022),
(65) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-(дифторметил)-3-гидроксипиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан- 1,3-диол (Соединение C036),
(66) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((2S)-1-(3-гидрокси-3-метилпиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение C037),
(67) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-гидрокси-3-метилпиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение C039),
(68) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение C048),
(69) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C049),
(70) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(дифторметил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение C050),
(71) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-3-(2,2-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение C051),
(72) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан- 1,3-диол (Соединение C052),
(73) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1-ил)пропан- 2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C053),
(74) (1R,2S,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-3-(1,1-дифторэтил)пиперидин-1-ил) пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метил-4- метиленциклогексан-1,3-диол (Соединение C054),
(75) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(1,1-дифторэтил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C055),
(76) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(2,2-дифторэтил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C056),
(77) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-1-(4-(1,1-дифторэтил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C057),
(78) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-(2,2-дифторэтил)пиперидин-1-ил)пропан-2- ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение C059),
(79) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-морфолинопропан-2-ил)-октагидро- 4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D004),
(80) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(дифторметил)морфолино)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D008),
(81) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилморфолино)пропан-2-ил)- октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D010),
(82) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(4-окса-7-азаспиро[2.5]октан-7-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D019),
(83) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро- 4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение D022),
(84) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро-4H- инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D023),
(85) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-морфолинобутан-2-ил)октагидро-4H- инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D024),
(86) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D025),
(87) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D031),
(88) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D032),
(89) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D033),
(90) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D034),
(91) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((S)-2-(дифторметил)морфолино)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метилоктагидро-1,3-диол (Соединение D035),
(92) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение D040),
(93) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D041),
(94) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D042),
(95) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D043),
(96) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-5-морфолинопентан-2-ил)октагидро-4H- инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D044),
(97) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение D045),
(98) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-3-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение D046),
(99) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилморфолино)бутан-2-ил) октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение D047),
(100) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((S)-2-метилморфолино)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение D048),
(101) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-(3,3-диметилморфолино)бутан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение D049),
(201) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F001),
(202) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F002),
(203) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F003),
(204) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F004),
(205) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F005),
(206) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F006),
(207) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил)пирролидин- 1-ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4- метиленциклогексан-1,3-диол (Соединение F013),
(208) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F014),
(209) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F015),
(210) (1R,3S,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение F016),
(211) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G001),
(212) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G002),
(213) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G003),
(214) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан-2-ил) октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G004),
(215) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан-2-ил) октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G005),
(216) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G006),
(217) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G013),
(218) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G014),
(219) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G015),
(220) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G016),
(221) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((R)-4-((R)-2-метилпиперидин-1-ил)бутан-2- ил)октагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G018),
(222) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((R)-4-((R)-2,4-диметилпиперазин-1-ил)бутан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)циклогексан-1,3-диол (Соединение G020),
(223) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H001),
(224) (1R,3R)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил)пропан- 2-ил)октагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H002),
(225) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H003),
(226) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-гидроксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H013),
(227) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-гидроксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H014),
(228) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((R)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H015),
(229) (1R,3R)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-((S)-2-(2-метоксипропан-2-ил)пирролидин-1- ил)пропан-2-ил)-7a-метилоктагидро-4H-инден-4-илиден)этилиден)-2-метиленциклогексан-1,3-диол (Соединение H016),
(230) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I001),
(231) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-2-метилпиперидин-1-ил) пропан-2-ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I002),
(232) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(2,2-диметилпиперидин-1-ил)пропан-2-ил)- 7a-метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I003),
(233) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((S)-3-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I004),
(234) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-7a-метил-1-((S)-1-((R)-3-метилморфолино)пропан-2- ил)октагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I005),
(235) (1R,3R,Z)-5-(2-((1R,3aS,7aR,E)-1-((S)-1-(3,3-диметилморфолино)пропан-2-ил)-7a- метилоктагидро-4H-инден-4-илиден)этилиден)-4-метиленциклогексан-1,3-диол (Соединение I006).
19. Производное витамина D по любому из пп. 1 - 18 или его фармацевтически приемлемая соль или сольват, характеризующееся стимулированием дифференциации клеток-предшественников олигодендроцитов в олигодендроциты посредством связывания с белком дисульфид-изомеразой A3 (PDIA3).
20. Фармацевтическая композиция, содержащая эффективное количество производного витамина D по любому из пп. 1 - 18 или его фармацевтически приемлемой соли или сольвата и фармацевтически приемлемый носитель или основу, характеризующаяся тем, что способствует дифференциации клеток-предшественников олигодендроцитов в олигодендроциты посредством связывания с белком дисульфид-изомеразой A3 (PDIA3)).
21. Стимулятор ремиелинизации, содержащий эффективное количество производного витамина D по любому из пп. 1 - 18 или его фармацевтически приемлемой соли или сольвата.
22. Терапевтическое средство, способствующее дифференциации клеток-предшественников олигодендроцитов в олигодендроциты посредством связывания с белком дисульфид-изомеразой A3 (PDIA3), содержащее производное витамина D по любому из пп. 1 - 18 или его фармацевтически приемлемую соль или сольват в качестве действующего вещества, предназначенное для лечения одного или больше заболеваний, выбранных из группы, состоящей из рассеянного склероза, нейромиелита зрительного нерва, прогрессирующей мультифокальной лейкоэнцефалопатии, множественной системной атрофии, острого рассеянного энцефаломиелита, HTLV-1-ассоциированной миелопатии, болезни Краббе, шизофрении, биполярного расстройства, большого депрессивного расстройства, расстройства аутистического спектра, синдрома дефицита внимания и гиперактивности, посттравматического стрессового расстройства, наркозависимой депрессии, деменции альцгеймеровского типа и ишемического инсульта.
| WO 2010053165 A1, 14.05.2010 | |||
| Alerie Guzman De La Fuente, Et Al., "Vitamin D receptor-retinoid X receptor heterodimer signaling regulates oligodendrocyte progenitor cell differentiation", The journal of cell biology, vol | |||
| Способ добывания бензина и иных продуктов из нефти, нефтяных остатков и пр. | 0 |
|
SU211A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Mengozzi Manuela, Hesketh Andrew, Bucca Giselda, Ghezzi Pietro, | |||
Авторы
Даты
2024-05-20—Публикация
2021-09-14—Подача