Предпосылки создания изобретения
PRMT5 (также известный как JBP1, SKB1, lBP72, SKB1his и HRMTIL5) представляет собой аргининметилтрансферазу типа II и впервые был идентифицирован в результате двухгибридного поиска белков, взаимодействующих с тирозинкиназой Janus (Jak2) (Pollack et al., 1999). PRMT5 играет важную роль в контроле и модуляции транскрипции генов. Среди прочего, PRMT5, как известно, симметрично метилирует гистон H3 по Arg-8 (сайт, отличный от сайта, метилированного PRMT4) и гистон H4 по Arg-3 (тот же сайт, который метилирован PRMT1). В соответствии с сообщениям, PRMT5 выполняет различные функции, включая, помимо прочего, влияние на жизнеспособность клеток, стволовость, репарацию повреждений ДНК и сплайсинг РНК (Clarke et al., Mol Cell (2017), Chiang et al., Cell Rep (2017), Gerhart et al. др., Sci Rep (2018)). В частности, ингибирование PRMT5 индуцирует альтернативный сплайсинг отрицательного регулятора p53, MDM4, что приводит к повышению экспрессии короткой изоформы MDM4 (MDM4-S), снижению экспрессии полноразмерной изоформы (MDM4-FL) и повышению активности p53 (Gerhart el al Sci Rep (2018)). Большинство физиологических функций p53 относят за счет его роли как активатора транскрипции, отвечающего на агенты, повреждающие ДНК. Статус p53 является диким типом примерно в половине случаев рака у человека. К ним относятся 94% случаев цервикального рака, 87% злокачественных новообразований крови, 85% случаев рака кости и эндокринных желез и 75% случаев первичного рака молочной железы. Восстановление p53 в раковых клетках, несущих p53 дикого типа, посредством механизмов ингибирования, которые подавляют его функцию, приводит к остановке роста и апоптозу и рассматривается как потенциально эффективное средство подавления опухоли.
В ответ на повреждение ДНК, вызываемое различными средствами, включая доксорубицин, камптотецин и УФ-свет, а также в ответ на лечение нутлином-3, нокдаун PRMT5 приводит к увеличению суб-G1 популяции и сопутствующему снижению количества G1 клеток и, в присутствии р53, значительному увеличению апоптоза. Нокдаун PRMT5 также приводил к увеличению уровня p21, ключевого гена-мишени p53, который регулирует остановку клеточного цикла во время ответа p53, и MDM2, убиквитинлигазы E3 p53, но не PUMA, NOXA, AlP1 и APAF1, являющихся генами-мишенями p53, связанными с апоптозом.
Нокдаун PRMT5 (но не PRMT1 или CARM1/PRMT4) приводит к снижению стабилизации p53, снижению базальных уровней p53, снижению олигомеризации p53, а также снижению экспрессии elF4E, основного компонента трансляционного механизма, участвующего в связывании рибосом с мРНК. Действительно, elF4E является сильным онкогеном, который, как было показано, способствует злокачественной трансформации in vitro и образованию рака у человека.
Роль PRMT5 в ответе на повреждение ДНК изучалась группами, сообщающими о роли PRMT5 в регуляции репарации ДНК, опосредованной высокоточной гомологичной рекомбинацией, в моделях как солидных (Clarke et al., Mol Cell (2017)), так и гематологических опухолей (Hamard et al. др., Cell Rep (2018)).
PRMT5 аберрантно экспрессируется примерно в половине случаев рака у человека, что дополнительно связывает этот механизм с раком. Сверхэкспрессия PRMT5 наблюдалась в образцах тканей пациентов и клеточных линиях рака предстательной железы (Gu et al., 2012), рака легких (Zhongping et al., 2012), меланомы (Nicholas et al., 2012), рака молочной железы (Powers et al., 2011), колоректального рака (Cho et al., 2012), рака желудка (Kim et al., 2005), карциномы пищевода и легких (Aggarwal et al., 2010), а также B-клеточных лимфом и лейкозов (Wang, 2008). Более того, было продемонстрировано, что повышенная экспрессия PRMT5 при меланоме, раке молочной железы и колоректальном раке коррелирует с плохим прогнозом.
Лимфоидные злокачественные новообразования, включая хронический лимфолейкоз (CLL), связаны со сверхэкспрессией PRMT5. PRMT5 сверхэкспрессируется (на уровне белка) в ядре и цитозоле в ряде полученных от пациентов клеточных линий лимфомы Беркитта; мантийноклеточной лимфомы (MCL); EBV-трансформированной лимфомы in vitro; лейкозных клеточных линий; и B-CLL по сравнению с нормальными CD19+ B-лимфоцитами (Pal et al., 2007; Wang et al., 2008). Интересно, что, несмотря на повышенные уровни белка PRMT5 в этих опухолевых клетках, уровни мРНК PRMT5 снижаются (в 2-5 раз). Трансляция мРНК PRMT5, однако, усиливается в клетках лимфомы, что приводит к повышению уровней PRMT5 (Pal et al., 2007; Wang et al., 2008).
Помимо геномных изменений, CLL, как почти все виды рака, имеет аберрантные эпигенетические аномалии, характеризующиеся глобальным гипометилированием и горячими точками репрессивного гиперметилирования промоторов, включая гены-супрессоры опухолей. В то время как роль эпигенетики в происхождении и прогрессировании CLL остается неясной, эпигенетические изменения, по-видимому, происходят на ранней стадии заболевания, а конкретные паттерны метилирования ДНК связаны с худшим прогнозом (Chen et al., 2009; Kanduri et al., 2010). Глобальное симметричное метилирование гистонов H3R8 и H4R3 повышено в трансформированных лимфоидных клеточных линиях и клинических образцах MCL (Pal et al., 2007), что коррелирует со сверхэкспрессией PRMT5, наблюдаемой в большом количестве лимфоидных раковых клеточных линий и клинических образцах MCL.
Поэтому PRMT5 является мишенью для идентификации новых терапевтических средств для лечения рака.
Гемоглобин является основным белком эритроцитов и необходим для транспортировки кислорода из легких в ткани. У взрослых людей наиболее распространенным типом гемоглобина является тетрамер, называемый гемоглобином А, состоящий из двух α и двух β субъединиц. У детей грудного возраста молекула гемоглобина состоит из двух цепей α и двух γ цепей. Гамма-цепи постепенно замещаются β-субъединицами по мере роста ребенка. Переключение в процессе развития в подтипе гена β-подобного глобина человека с фетального (γ) на взрослый (β), которое начинается при рождении, знаменует начало гемоглобинопатий β-талассемии или серповидно-клеточной анемии (SCD). При β-талассемии взрослые цепи не образуются. При SCD точечная мутация в кодирующей последовательности гена β-глобина приводит к продукции белка с измененными полимеризационными свойствами. Наблюдение, что повышенная экспрессия гена β-глобина у взрослых (в условиях наследственной персистенции мутаций фетального гемоглобина (HPFH)) значительно облегчает клиническую тяжесть β-талассемии и SCD, подсказало идею поиска терапевтических стратегий для реверсии сайленсинга гена γ-глобина. На сегодняшний день это достигается за счет фармакологической индукции с использованием соединений, которые широко влияют на эпигенетические модификации, включая метилирование ДНК и деацетилирование гистонов. Разработка более направленных терапий зависит от идентификации молекулярных механизмов, лежащих в основе сайленсинга фетального гена глобина. Эти механизмы остаются неясными, несмотря на обстоятельное исследование мутаций HPFH и значительный прогресс во многих других аспектах регуляции гена глобина.
PRMT5 играет критическую роль в запуске координированных репрессивных эпигенетических событий, которые начинаются с диметилирования аргинина 3 гистона H4 (H4R3me2s) и завершаются метилированием ДНК и транскрипционным сайленсингом γ-генов (Rank et al., 2010). Неотъемлемой частью синхронного установления репрессивных маркеров является сборка PRMT5-зависимого комплекса, содержащего ДНК-метилтрансферазу DNMT3A и другие репрессорные белки (Rank et al., 2010). DNMT3A непосредственно рекрутируется для связывания с PRMT5-индуцированной меткой H4R3me2s, и потеря этой метки из-за shRNA-опосредованного нокдауна PRMT5 или принудительной экспрессии мутантной формы PRMT5, лишенной метилтрансферазной активности, приводит к заметному повышению экспрессии γ-гена и полной отмене метилирования ДНК на γ-промоторе. Обработка человеческих эритроидных предшественников неспецифическими ингибиторами метилтрансферазы (Adox и MTA) также приводила к повышению экспрессии γ-гена (He Y, 2013). Таким образом, ингибиторы PRMT5 обладают потенциалом в качестве терапевтических средств при гемоглобинопатиях, таких как β-талассемия или серповидноклеточная болезнь (SCD).
Авторы настоящего изобретения разработали соединения, которые ингибируют активность PRMT5 и поэтому могут быть полезны при лечении состояний, улучшающихся за счет ингибирования активности PRMT5.
Сущность изобретения
Соединения формулы I
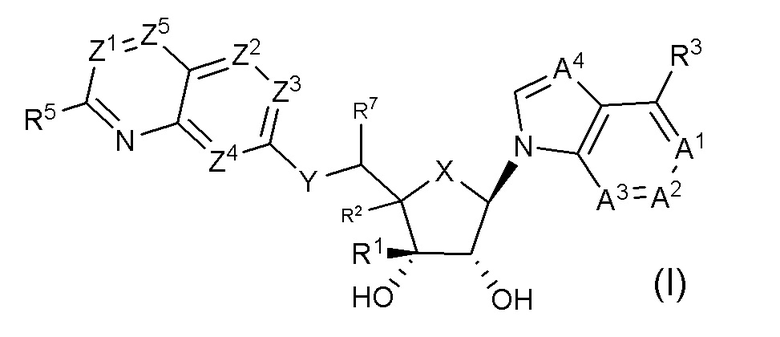
и их фармацевтически приемлемые соли, сложные эфиры и пролекарства, которые являются ингибиторами PRMT5. Также представлены способы получения соединений формулы I, фармацевтические композиции, включающие соединения формулы I, и способы применения этих соединений для лечения рака, серповидноклеточной болезни и мутаций, связанных с наследственным персистированием фетального гемоглобина (HPFH).
Подробное описание изобретения
Изобретение представляет собой соединение формулы
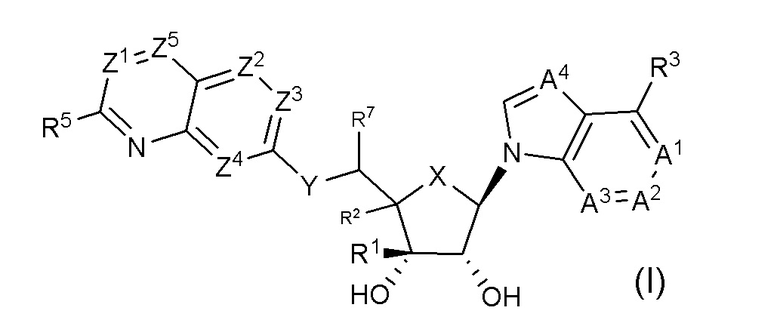
или его фармацевтически приемлемые соли, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
Z1 представляет собой CR4 или N;
Z2, Z3, Z4 и Z5 независимо выбраны из N или CR9;
A1 представляет собой CH или N;
A2 представляет собой CR10 или N;
A3 представляет собой CH или N;
A4 представляет собой CR8 или N;
R1, R2 и R7 представляют собой:
i) R1 представляет собой H, CCH или C1-3алкил, необязательно замещенный 1-2 галогенами; и R2 представляет собой H, галоген, OH, CH3, NH2, NHCH3, CH2OH, CH2F или CHF2, и R7 представляет собой H, при условии, что R1 и R2 не могут одновременно быть H; или
ii) R1 и R7 взяты вместе с образованием пяти-членного углеродного кольца, необязательно замещенного 1-3 галогенами, или пяти-членного гетероциклоалкильного кольца, включающего один O атом, и R2 представляет собой H, OH, CH3, CHF2 или F;
R3 представляет собой H, галоген, NH2, NHCH3, CN, OH, OCH3, C1-4алкил, необязательно замещенный 1-3 галогенами или OH, или C3-5циклоалкил, необязательно замещенный 1-3 галогенами или OH;
R5 представляет собой H, NH2 или NHR6; и R4, когда присутствует, представляет собой H, галоген, CH3, CHF2 или CF3; или
R4 и R5 взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 или CF2H;
R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил;
R8, когда присутствует, представляет собой H, галоген, C1-4алкил, необязательно замещенный 1-3 галогенами, C3-5циклоалкил, необязательно замещенный 1-3 галогенами, или арил, необязательно замещенный 1-3 галогенами;
каждый R9, когда присутствует, независимо выбран из H или галогена; и
R10, когда присутствует, представляет собой H, C1-6алкил, NH2 или галоген.
Вариант осуществления изобретения соединения формулы (I) или его фармацевтически приемлемой соли представляет собой соединение формулы (Ia);
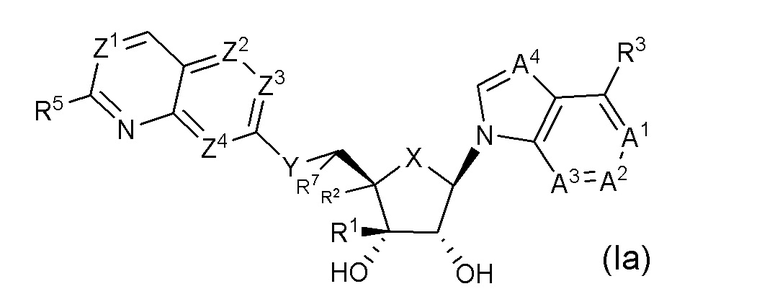
или его фармацевтически приемлемые соли, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
Z1 представляет собой CR4 или N;
Z2 представляет собой CH или N;
Z3 представляет собой CH или N;
Z4 представляет собой CH или N;
A1 представляет собой CH или N;
A2 представляет собой CH, N, CNH2 или CCH3;
A3 представляет собой CH или N;
A4 представляет собой CR8 или N;
R1, R2 и R7 представляют собой:
i) R1 представляет собой H, CCH или C1-3алкил, необязательно замещенный 1-2 галогенами; и R2 представляет собой H, галоген, OH, CH3, NH2, NHCH3, CH2OH, CH2F или CHF2, и R7 представляет собой H, при условии, что R1 и R2 не могут одновременно быть H; или
ii) R1 и R7 взяты вместе с образованием пяти-членного кольца, и R2 представляет собой H, OH, CH3, CHF2 или F;
R3 представляет собой H, галоген, CH3, C2H5, циклопропил, NH2, NHCH3, CN, CF3, OH, OCH3 или CHF2;
R4, когда присутствует, представляет собой H, галоген, CH3, CHF2 или CF3; и R5 представляет собой H, NH2 или NHR6; или
R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 или CF2H;
R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил; и
R8, когда присутствует, представляет собой H, C1-4алкил или галоген.
Вариант осуществления изобретения соединения формулы (I) или его фармацевтически приемлемой соли представляет собой соединение формулы (Ib);
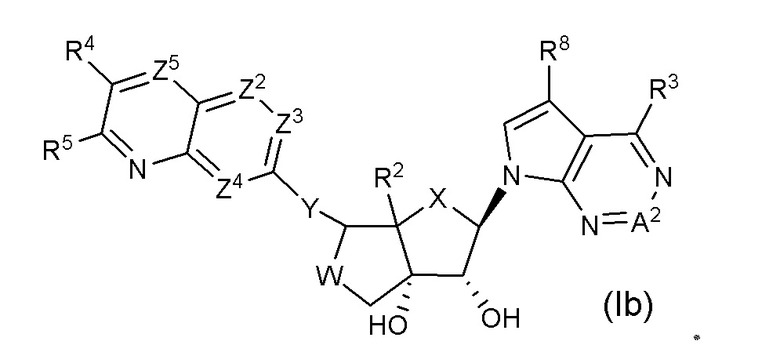
В одном субварианте осуществления изобретения формулы Ib X представляет собой CH2 или O.
В другом субварианте осуществления изобретения формулы Ib X представляет собой CH2.
В другом субварианте осуществления изобретения формулы Ib X представляет собой O.
В одном субварианте осуществления изобретения формулы Ib Y представляет собой CH2, NH или O.
В другом субварианте осуществления изобретения формулы Ib Y представляет собой CH2.
В другом субварианте осуществления изобретения формулы Ib Y представляет собой O.
В одном субварианте осуществления изобретения формулы Ib W представляет собой CR11R11 или O.
В одном субварианте осуществления изобретения формулы Ib W представляет собой O, CHF, CF2 или CH2.
В одном субварианте осуществления изобретения формулы Ib W представляет собой CHF.
В одном субварианте осуществления изобретения формулы Ib W представляет собой CF2.
В другом субварианте осуществления изобретения формулы Ib W представляет собой O.
В другом субварианте осуществления изобретения формулы Ib W представляет собой CH2.
В субварианте осуществления изобретения формулы Ib Z2, Z3, Z4 и Z5 независимо выбраны из N или CR9.
В одном субварианте осуществления изобретения формулы Ib A2 представляет собой CR10 или N.
В другом субварианте осуществления изобретения формулы Ib A2 представляет собой N, CH, CNH2, CF, CCl или CCH3.
В другом субварианте осуществления изобретения формулы Ib A2 представляет собой CH, CCl или CF.
В одном субварианте осуществления изобретения формулы Ib R2 представляет собой H, OH, CH3, CHF2 или F.
В другом субварианте осуществления изобретения формулы Ib R2 представляет собой H.
В одном субварианте осуществления изобретения R3 представляет собой H, галоген, NH2, NHCH3, CN, OH, OCH3, C1-4алкил, необязательно замещенный 1-3 галогенами или OH, или C3-5циклоалкил, необязательно замещенный 1-3 галогенами или OH.
В другом субварианте осуществления изобретения формулы Ib R3 представляет собой NH2, Cl, OCH3 или CH3.
В другом субварианте осуществления изобретения формулы Ib R3 представляет собой NH2 или CH3.
В одном субварианте осуществления изобретения формулы Ib R4 представляет собой H, галоген, CH3, CHF2 или CF3.
В другом субварианте осуществления изобретения формулы Ib R4 представляет собой H.
В другом субварианте осуществления изобретения формулы Ib R4 представляет собой галоген.
В другом субварианте осуществления изобретения формулы Ib R4 представляет собой H, Cl, F или Br.
В одном субварианте осуществления изобретения формулы Ib R5 представляет собой H, NH2 или NHR6.
В одном субварианте осуществления изобретения формулы Ib R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил.
В одном субварианте осуществления изобретения формулы Ib каждый R11, когда присутствует, независимо выбран из H или галогена.
В другом субварианте осуществления изобретения формулы Ib R5 представляет собой H.
В другом субварианте осуществления изобретения формулы Ib R5 представляет собой NH2.
В одном субварианте осуществления изобретения формулы Ib R8 представляет собой H, галоген, C1-4алкил, необязательно замещенный 1-3 галогенами, C3-5циклоалкил, необязательно замещенный 1-3 галогенами, или арил, необязательно замещенный 1-3 галогенами.
В другом субварианте осуществления изобретения формулы Ib R8 представляет собой H, CH3 или F.
В одном субварианте осуществления изобретения формулы Ib каждый R9, когда присутствует, независимо выбран из H или галогена.
В одном субварианте осуществления изобретения формулы Ib каждый R9, когда присутствует, независимо выбран из H, F или Cl.
В другом субварианте осуществления изобретения формулы Ib R9, когда присутствует, представляет собой H.
В другом субварианте осуществления изобретения формулы Ib R9, когда присутствует, представляет собой F.
В другом субварианте осуществления изобретения формулы Ib R9, когда присутствует, представляет собой Cl.
В одном субварианте осуществления изобретения формулы Ib R10, когда присутствует, представляет собой H, NH2, C1-6алкил или галоген.
В другом субварианте осуществления изобретения формулы Ib R10 представляет собой H.
В другом субварианте осуществления изобретения формулы Ib R10 представляет собой CH3.
В другом субварианте осуществления изобретения формулы Ib R10 представляет собой F.
Вариант осуществления изобретения соединения формулы (I) или его фармацевтически приемлемой соли представляет собой соединение формулы (Ic);
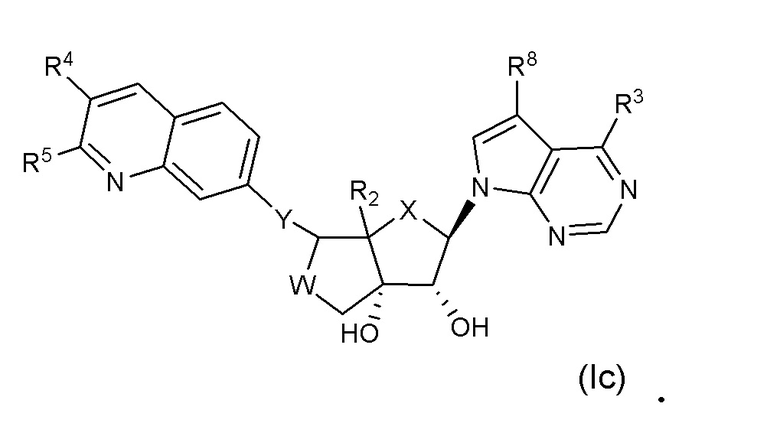
В одном субварианте осуществления изобретения формулы Ic X представляет собой CH2 или O.
В одном субварианте осуществления изобретения формулы Ic Y представляет собой CH2, NH или O.
В одном субварианте осуществления изобретения формулы Ic W представляет собой CH2 или O.
В одном субварианте осуществления изобретения формулы Ic R2 представляет собой H, OH, CH3, CHF2 или F.
В другом субварианте осуществления изобретения формулы Ic R2 представляет собой H.
В одном субварианте осуществления изобретения формулы Ic R3 представляет собой H, галоген, CH3, C2H5, циклопропил, NH2, NHCH3, CN, CF3, OH, OCH3 или CHF2.
В другом субварианте осуществления изобретения формулы Ic R3 представляет собой CH3, Cl, NH2 или OCH3.
В одном субварианте осуществления изобретения формулы Ic R4 представляет собой H, галоген, CH3, CHF2 или CF3.
В другом субварианте осуществления изобретения формулы Ic R4 представляет собой H или галоген.
В другом субварианте осуществления изобретения формулы Ic R4 представляет собой H или Br.
В одном субварианте осуществления изобретения формулы Ic R5 представляет собой H, NH2 или NHR6.
В другом субварианте осуществления изобретения формулы Ic R5 представляет собой H или NH2.
В другом субварианте осуществления изобретения формулы Ic R5 представляет собой NH2.
В одном субварианте осуществления изобретения для формулы Ic R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 или CF2H.
В одном субварианте осуществления изобретения формулы Ic R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил.
В другом субварианте осуществления изобретения формулы Ic R6, когда присутствует, представляет собой CH3.
В одном субварианте осуществления изобретения формулы Ic R8 представляет собой H, C1-4алкил или галоген.
В одном субварианте осуществления изобретения формулы Ic R8 представляет собой H.
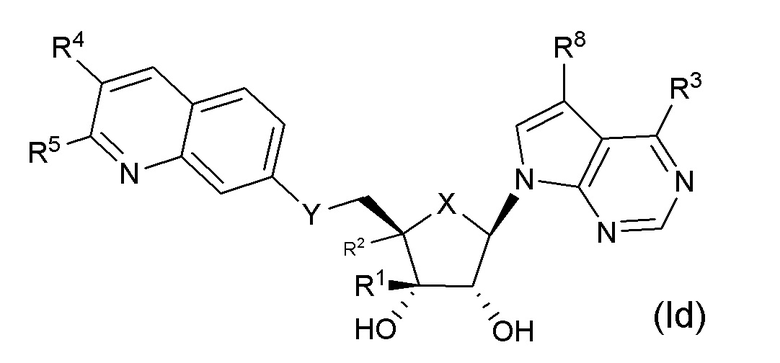
Субвариант осуществления изобретения соединения формулы (I) или его фармацевтически приемлемой соли представляет собой соединение формулы (Id);
 .
.
В одном субварианте осуществления изобретения формулы Id X представляет собой CH2 или O.
В одном субварианте осуществления изобретения формулы Id Y представляет собой CH2, NH или O.
В одном субварианте осуществления изобретения формулы Id R1 представляет собой H, CCH или C1-3алкил, необязательно замещенный 1-2 галогенами, и R2 представляет собой H, галоген, OH, CH3, NH2, NHCH3, CH2OH, CH2F или CHF2, при этом R1 и R2 не могут одновременно быть H.
В другом субварианте осуществления изобретения формулы Id R1 представляет собой H, CH3, CCH, CH2F или CHF2, и R2 представляет собой H или CH3, при этом R1 и R2 не могут одновременно быть H.
В другом субварианте осуществления изобретения формулы Id R1 представляет собой H, CH3 или CCH, при этом R1 и R2 не могут одновременно быть H.
В другом субварианте осуществления изобретения формулы Id R2 представляет собой H или CH3, при этом R1 и R2 не могут одновременно быть H.
В одном субварианте осуществления изобретения формулы Id R3 представляет собой H, галоген, CH3, C2H5, циклопропил, NH2, NHCH3, CN, CF3, OH, OCH3 или CHF2.
В другом субварианте осуществления изобретения формулы Id R3 представляет собой H, CH3, NH2, Cl, OH или OCH3.
В другом субварианте осуществления изобретения формулы Id R3 представляет собой CH3, Cl, OCH3 или NH2.
В одном субварианте осуществления изобретения формулы Id R4 представляет собой H, галоген, CH3, CHF2 или CF3.
В другом субварианте осуществления изобретения формулы Id R4 представляет собой H или галоген.
В другом субварианте осуществления изобретения формулы Id R4 представляет собой H или Br.
В одном субварианте осуществления изобретения формулы Id R5 представляет собой H, NH2 или NHR6.
В другом субварианте осуществления изобретения формулы Id R5 представляет собой H или NH2.
В другом субварианте осуществления изобретения формулы Id R5 представляет собой NH2.
В одном субварианте осуществления изобретения формулы Id R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил.
В другом субварианте осуществления изобретения формулы Id R6 представляет собой CH3.
В одном субварианте осуществления изобретения формулы Id R8 представляет собой H, C1-4алкил или галоген.
В другом субварианте осуществления изобретения формулы Id R8 представляет собой H.
В варианте осуществления изобретения соединение формулы I представляет собой:
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-этинилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол,
(1S,2R,3S,5R)-3-[2-(2-амино-3-бром-7-хинолинил)этил]-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-1,2-циклопентандиол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4R,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,8-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-хлор-5-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-хлор-8-фторхинолин-7-ил)метил]-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3,5-дифторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((6-амино-7-фтор-1,5-нафтиридин-3-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлор-8-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,6-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((7-амино-6-хлор-1,8-нафтиридин-2-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,5-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-хлорхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-фторхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-[(2-амино-3,5-дифторхинолин-7-ил)метил]-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-[(2-амино-3-хлор-5-фторхинолин-7-ил)метил]-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-бромхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)метил]-2-[4-амино-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол дигидрохлорид,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-хлорхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-(4-амино-5-фенил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-[4-амино-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил]-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-(4-амино-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-5,5-дифторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,5S,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-5-фторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,5S,6S,6aR)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]-5-фторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-((2,2,2-трифторэтил)амино)хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-((циклопропилметил)амино)хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-бромхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-этил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(трифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-[4-(гидроксиметил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-[4-(2-гидроксипропан-2-ил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-этил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-изопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(5-фтор-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(трифторметил)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-1-метил-3-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(5-фтор-4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метил-2-((хинолин-7-илокси)метил)тетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-2-((хинолин-7-илокси)метил)тетрагидрофуран-3,4-диол,
(1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол,
(1S,2R,3R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(((2-аминохинолин-7-ил)окси)метил)-3-метилциклопентан-1,2-диол,
(1S,2R,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)циклопентан-1,2-диол,
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-аминохинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(1R,2S,3R,5R)-5-(((2-аминохинолин-7-ил)окси)метил)-1-метил-3-(7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-метилхинолин-7-ил)окси)метил)-1-метил-3-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(1S,2R,3S,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1S,2R,3S,5R)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3R,5R)-3-(2-(2-амино-3-фторхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол,
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол,
(1R,2S,3S,4R)-1-(2-(2-амино-3-бромхинолин-7-ил)этил)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопентан-1,2,3-триол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)амино)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-метилхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3S,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метилциклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(3aS,4S,5R)-1-((2-амино-3-бромхинолин-7-ил)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол или
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
или его фармацевтически приемлемую соль.
Ссылка на соединения формулы I охватывает ссылку на формулу Ia, Ib, Ic или Id и все их субварианты осуществления, как описано ниже.
В одном варианте осуществления настоящее изобретение представляет собой композицию для лечения рака, включающую соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль.
В одном варианте осуществления настоящее изобретение представляет собой композицию для лечения рака, включающую соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В одном варианте осуществления настоящее изобретение представляет собой композицию для лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающую соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль.
В одном варианте осуществления настоящее изобретение представляет собой композицию для лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающую соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения рака, включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли.
Еще в одном варианте осуществления настоящее изобретение включает a способ лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения рака, включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения рака, включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающий введение пациенту, нуждающемуся в этом, соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения рака, включающий введение пациенту, нуждающемуся в этом, композиции, включающей соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Еще в одном варианте осуществления настоящее изобретение представляет собой способ лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD), включающий введение пациенту, нуждающемуся в этом, композиции, включающей соединение формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Еще в одном варианте осуществления настоящее изобретение представляет собой применение соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли для получения лекарственного средства для лечения рака.
Еще в одном варианте осуществления настоящее изобретение представляет собой применение соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли для получения лекарственного средства для лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD).
Еще в одном варианте осуществления настоящее изобретение включает применение соединений формулы I, Ia, Ib, Ic или Id для получения лекарственного средства для лечения рака или гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD).
Еще в одном варианте осуществления представлено применение соединений формулы I, Ia, Ib, Ic или Id для получения лекарственного средства для лечения рака. Еще в одном варианте осуществления представлено применение соединений формулы I, Ia, Ib, Ic или Id для получения лекарственного средства для лечения гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD). В субварианте осуществления рак представляет собой рак сердца, рак легкого, желудочно-кишечный рак, рак мочеполовых путей, рак печени, рак кости, рак нервной системы, гинекологический рак, гематологический рак, рак кожи или рак надпочечников.
Еще в одном варианте осуществления настоящее изобретение включает соединения формулы I, Ia, Ib, Ic или Id для применения в лечении рака или гемоглобинопатий, таких как β-талассемия или серповидноклеточная болезнь (SCD). В другом варианте осуществления настоящее изобретение включает соединения формулы I, Ia, Ib, Ic или Id для применения в лечении рака сердца, рака легкого, желудочно-кишечного рака, рака мочеполовых путей, рака печени, рака кости, рака нервной системы, гинекологического рака, гематологического рака, рака кожи или рака надпочечников.
В одном варианте осуществления соединение, раскрытое в настоящей заявке, выбрано из группы, состоящей из соединений, проиллюстрированных в настоящей заявке, например в Примерах 1-137, или их фармацевтически приемлемых солей.
Термин "композиция" предназначен для охвата продукта, включающего указанные ингредиенты в указанных количествах, а также любого продукта, который является результатом, непосредственно или опосредованно, комбинации указанных ингредиентов в указанных количествах. Термин “противораковое средство” означает препарат (лекарственное средство или фармацевтически активный ингредиент) для лечения рака. Термин “противоопухолевое средство” означает препарат (лекарственное средство или фармацевтически активный ингредиент) для лечения рака (т.е. химиотерапевтическое средство). Термин “по меньшей мере один” означает один или больше чем один. Значение “по меньшей мере одно” при ссылке на количество соединений по изобретению является независимым от значения при ссылке на количество химиотерапевтических средств. Термин “химиотерапевтическое средство” означает препарат (лекарственное средство или фармацевтически активный ингредиент) для лечения рака (т.е. противоопухолевое средство). Термин “соединение”, при ссылке на противоопухолевые средства, включает средства, которые представляют собой антитела. Термин “последовательно” означает один после другого. Термин “эффективное количество” означает “терапевтически эффективное количество”. Термин "терапевтически эффективное количество" означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский ответ в ткани, системе, у животного или человека, достижение которого добивается исследователь, ветеринар, врач или другой клиницист. Таким образом, например, в способах лечения рака, описанных в настоящей заявке, “эффективное количество” (или “терапевтически эффективное количество”) означает такое количество соединения (или лекарственного средства) или облучения, которое приводит к: (a) уменьшению, облегчению или исчезновению одного или нескольких симптомов, вызванных раком, (b) уменьшению размера опухоли, (c) ликвидации опухоли и/или (d) долговременной стабилизации опухолевого заболевания (остановке роста). Также, например, эффективное количество или терапевтически эффективное количество ингибитора PRMT5 (т.е. соединения по изобретению) представляет собой такое количество, которое приводит к уменьшению активности PRMT5. Термин “осуществление лечения рака” или “лечение рака” относится к введению млекопитающему, у которого имеется раковое состояние, и относится к эффекту, который облегчает раковое состояние путем киллинга раковых клеток, и также относится к эффекту, который приводит к ингибированию роста и/или метастазирования рака.
Изобретение также обеспечивает фармацевтическую композицию, включающую эффективное количество по меньшей мере одного соединения формулы I, Ia, Ib, Ic или Id и фармацевтически приемлемый носитель. Изобретение также обеспечивает фармацевтическую композицию, включающую эффективное количество по меньшей мере одного соединения формулы I, Ia, Ib, Ic или Id и эффективное количество по меньшей мере одного другого фармацевтически активного ингредиента (такого как, например, химиотерапевтическое средство) и фармацевтически приемлемый носитель.
Изобретение также обеспечивает способ ингибирования PRMT5 у пациента, нуждающегося в таком лечении, включающий введение указанному пациенту эффективного количества по меньшей мере одного соединения формулы I, Ia, Ib, Ic или Id. Изобретение также обеспечивает способ для лечения рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества по меньшей мере одного соединения формулы I, Ia, Ib, Ic или Id. Изобретение также обеспечивает способ для лечения рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества по меньшей мере одного соединения формулы I, Ia, Ib, Ic или Id в комбинации с эффективным количеством по меньшей мере одного химиотерапевтического средства. Способы по изобретению включают введение фармацевтической композиции, включающей по меньшей мере одно соединение по изобретению и фармацевтически приемлемый носитель. Изобретение также обеспечивает любой из вышеуказанных способов лечения рака, где рак является колоректальным. Изобретение также обеспечивает любой из вышеуказанных способов лечения рака, где рак представляет собой меланому. Способы лечения рака, описанные в настоящей заявке, необязательно могут включать введение эффективного количества облучения (т.е. способы лечения рака, описанные в настоящей заявке, необязательно включают применение лучевой терапии).
Способы лечения рака, описанные в настоящей заявке, включают способы лечения рака, которые включают введение терапевтически эффективного количества соединения по настоящему изобретению в комбинации с лучевой терапией и/или в комбинации со вторым соединением, выбранным из следующих: модулятор эстрогеновых рецепторов, модулятор андрогеновых рецепторов, модулятор ретиноидных рецепторов, цитотоксическое-цитостатическое средство, антипролиферативное средство, ингибитор пренил-протеинтрансферазы, ингибитор HMG-CoA редуктазы, ингибитор ВИЧ-протеазы, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-γ, агонисты PPAR-δ, ингибитор врожденной полилекарственной резистентности, противорвотное средство, средство, полезное в лечении анемии, средство, полезное в лечении нейтропении, иммуноукрепляющее средство, ингибитор клеточной пролиферации и сигналов выживания, бисфосфонат, ингибитор ароматазы, терапевтическое средство на основе миРНК, ингибиторы γ-секретазы и/или NOTCH, средства, которые противодействуют рецепторным тирозинкиназам (RTKs), средство, которое противодействует контрольной точке клеточного цикла, и любое из терапевтических средств, указанных в настоящей заявке.
В любом из способов лечения рака, описанных в настоящей заявке, если не указано иное, способы необязательно могут включать введение эффективного количества лучевой терапии. Что касается лучевой терапии, предпочтительным является γ-облучение.
Таким образом, еще один пример изобретения направлен на способ лечения рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение эффективного количества соединения формулы I, Ia, Ib, Ic или Id. Еще один пример изобретения направлен на способ лечения рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества соединения формулы I, Ia, Ib, Ic или Id и эффективного количества по меньшей мере одного химиотерапевтического средства.
Способы для безопасного и эффективного введения большинства из этих химиотерапевтических средств известны специалистам в данной области. Кроме того, их введение описано в справочной литературе. Например, введение многих химиотерапевтических средств описано в “Настольном справочнике врача” (PDR), например, 1996 года издания (Medical Economics Company, Montvale, NJ 07645-1742, USA), Настольном справочнике врача 56го издания, 2002 (опубликованном Medical Economics company, Inc. Montvale, NJ 07645-1742), Настольном справочнике врача 57го издания, 2003 (опубликованном Thompson PDR, Montvale, NJ 07645-1742), Настольном справочнике врача, 60го издания, 2006 (опубликованном Thompson PDR, Montvale, NJ 07645-1742) и Настольном справочнике врача 64го издания, 2010 г. (опубликованном PDR Network, LLC at Montvale, NJ 07645-1725), в настоящее время доступных через www.pdr.net; раскрытие которых включено в настоящую заявку посредством ссылки.
Если пациент отвечает или стабилен после завершения цикла терапии, цикл терапии может быть повторен в соответствии с заключением квалифицированного клинициста. После завершения циклов терапии пациент может продолжить прием соединений по изобретению в той же дозе, которую вводили в соответствии с протоколом лечения. Эту поддерживающую дозу можно продолжать вводить до тех пор, пока пациент не будет прогрессировать или не сможет больше переносить дозу (в этом случае доза может быть уменьшена, и пациент может продолжить прием уменьшенной дозы).
Специалистам в данной области будет понятно, что фактические дозировки и протоколы введения, используемые в способах по изобретению, могут варьироваться по усмотрению квалифицированного клинициста. Фактическая применяемая доза может варьироваться в зависимости от потребностей пациента и тяжести состояния, которое лечат. Определение подходящей дозировки для конкретной ситуации находится в компетенции специалистов в данной области. Решение об изменении дозировок и протоколов введения может приниматься после того, как квалифицированным клиницистом будут учтены такие факторы, как возраст, состояние и размер пациента, а также тяжесть рака, который лечат, и ответ пациента на лечение.
Количество и частота введения соединения формулы (1) и химиотерапевтических средств будут регулироваться в соответствии с заключением лечащего клинициста (врача) с учетом таких факторов, как возраст, состояние и размер пациента, а также тяжесть рака, который лечат.
Химиотерапевтическое средство можно вводить в соответствии с терапевтическими протоколами, хорошо известными в данной области. Для специалистов в данной области очевидно, что введение химиотерапевтического средства может варьироваться в зависимости от рака, который лечат, и известных эффектов химиотерапевтического средства на это заболевание. Кроме того, в соответствии со знаниями квалифицированного клинициста терапевтические протоколы (например, количества доз и время введения) могут варьироваться с учетом наблюдаемых эффектов вводимых терапевтических средств на пациента и с учетом наблюдаемых ответов рака на вводимые терапевтические средства.
Первоначальное введение можно осуществить в соответствии с установленными протоколами, известными в данной области, а затем на основании наблюдаемых эффектов квалифицированный клиницист может изменить дозировку, способы введения и время введения.
Конкретный выбор химиотерапевтического средства будет зависеть от диагноза лечащих врачей и их оценки состояния пациента и соответствующего протокола лечения.
Определение порядка введения и количества повторных введений химиотерапевтического средства во время протокола лечения находится в пределах компетенции квалифицированного врача после оценки подлежащего лечению рака и состояния пациента.
Таким образом, на основании своего опыта и знаний практикующий врач может изменять каждый протокол введения химиотерапевтического средства в соответствии с индивидуальными потребностями пациента по мере продолжения лечения. Все такие модификации входят в объем настоящего изобретения.
Лечащий врач при оценке эффективности лечения при вводимой дозировке будет учитывать общее самочувствие пациента, а также более определенные признаки, такие как облегчение симптомов, связанных с раком (например, боли), ингибирование роста опухоли, фактическое уменьшение опухоли или подавление метастазирования. Размер опухоли можно измерить стандартными методами, такими как радиологические исследования, например, компьютерная томография или магнитно-резонансная томография, и можно использовать последовательные измерения, чтобы судить, замедлился ли рост опухоли или даже имеет место его реверсия. Облегчение связанных с заболеванием симптомов, таких как боль, и улучшение общего состояния также можно использовать для оценки эффективности лечения.
Соединения, композиции и способы, представленные в настоящей заявке, полезны для лечения рака. Раковые заболевания, которые можно лечить соединениями, композициями и способами, раскрытыми в настоящей заявке, включают, но не ограничиваются этим: (1) Сердечные: саркома (ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома), миксома, рабдомиома, фиброма, липома и тератома; (2) легочные: бронхогенная карцинома (плоскоклеточная, недифференцированная мелкоклеточная, недифференцированная крупноклеточная, аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, саркома, лимфома, хондроматозная гамартома, мезотелиома, немелкоклеточная; (3) желудочно-кишечные: пищевод (плоскоклеточная карцинома, аденокарцинома, лейомиосаркома, лимфома), желудок (карцинома, лимфома, лейомиосаркома), поджелудочная железа (дуктальная аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома), тонкий кишечник (аденокарцинома, лимфома, карциноидные опухоли, саркома Капоши, лейомиома, гемангиома, липома, нейрофиброма, фиброма), толстый кишечник (аденокарцинома, тубулярная аденома, ворсинчатая аденома, гамартома, лейомиома), (4) мочеполовые пути: почки (аденокарцинома, опухоль Вильмса [нефробластома], лимфома, лейкоз), мочевой пузырь и уретра (плоскоклеточная карцинома, переходноклеточная карцинома, аденокарцинома), предстательная железа (аденокарцинома, саркома), мужские половые железы (семинома, тератома, эмбриональная карцинома, тератокарцинома, хориокарцинома, саркома, интерстициальноклеточная карцинома, фиброма, фиброаденома, аденоматоидные опухоли, липома); (5) печень: гепатомa (гепатоцеллюлярная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома, гемангиома; (6) кости: остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулярно-клеточная саркома), множественная миелома, злокачественная гигантоклеточная опухоль хордома, остеохронфрома (костнохрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма, остеоидная остеома и гигантоклеточные опухоли; (7) нервная система: череп (остеома, гемангиома, гранулема, ксантома, деформирующий остит), мозговые оболочки (менингиома, менингиосаркома, глиоматоз), головной мозг (астроцитома, медуллобластома, глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома, олигодендроглиома, шваннома, ретинобластома, врожденные опухоли), нейрофиброма спинного мозга, менингиома, глиома, саркома); (8) гинекологические: матка (карцинома эндометрия), шейка матки (карцинома шейки матки, предопухолевая дисплазия шейки матки), яичники (карцинома яичников [серозная цистаденокарцинома, муцинозная цистаденокарцинома, неклассифицированная карцинома], гранулезно-текально-клеточные опухоли, опухоли из клеток Сертоли-Лейдига, дисгерминома, злокачественная тератома), вульва (плоскоклеточная карцинома, интраэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалище (светлоклеточная карцинома, плоскоклеточная карцинома, ботриоидная саркома (эмбриональная рабдомиосаркома), фаллопиевы трубы 9карцинома), молочная железа; (9) гематологические: (миелолейкоз [острый и хронический], острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, хронический миеломоноцитарный (CMML), миелопролиферативные заболевания, множественная миелома, миелодиспластический синдром), болезнь Ходжкина, неходжкинская лимфома [злокачественная лимфома]; (10) кожные: злокачественная меланома, базально-клеточная карцинома, плоскоклеточная карцинома, саркома Капоши, родинки (диспластические невусы), липома, ангиома, дерматофиброма, келоиды, псориаз; и (11) надпочечники: нейробластома. Примеры рака, который можно лечить при помощи соединений, композиций и способов по изобретению, включают рак щитовидной железы, анапластическую карциному щитовидной железы, эпидермальный рак, рак головы и шеи (например, плоскоклеточный рак головы и шеи), саркому, тетракарциному, гепатому и множественную миелому. Таким образом, термин "раковая клетка", используемый в настоящей заявке, включает клетку, пораженную любым из указанных выше состояний.
В лечении рака молочной железы (например, постменопаузального и предменопаузального рака молочной железы, например, гормон-зависимого рака молочной железы) соединение формулы (1) можно использовать с эффективным количеством по меньшей мере одного антигормонального средства, выбранного из группы, состоящей из следующих: (a) ингибиторы ароматазы, (b) антиэстрогены и (c) аналоги LHRH; и, необязательно, с эффективным количеством по меньшей мере одного химиотерапевтического средства. Примеры ингибиторов ароматазы включают, но не ограничиваются этим: Анастрозол (например, Arimidex), Летрозол (например, Femara), Эксеместан (Aromasin), Фадрозол и Форместан (например, Lentaron). Примеры антиэстрогенов включают, но не ограничиваются этим: Тамоксифен (например, Nolvadex), Фулвестрант (например, Faslodex), Ралоксифен (например, Evista) и Аколбифен. Примеры аналогов LHRH включают, но не ограничиваются этим: Госерелин (например, Zoladex) и Лейпролид (например, Лейпролид Ацетат, такой как Lupron или Lupron Depot). Примеры химиотерапевтических средств включают, но не ограничиваются этим: Трастузумаб (например, Herceptin), Гефитиниб (например, Iressa), Эрлотиниб (например, Эрлотиниб HCl, такой как Tarceva), Бевацизумаб (например, Avastin), Цетуксимаб (например, Erbitux) и Бортезомиб (например, Velcade).
В одном примере изобретения подлежащий лечению рак представляет собой колоректальный рак (такой как, например, аденокарцинома толстой кишки и аденома толстой кишки). Таким образом, еще один пример изобретения направлен на способ лечения колоректального рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли. Еще один пример изобретения направлен на способ лечения колоректального рака у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли и эффективного количества по меньшей мере одного химиотерапевтического средства.
В одном примере изобретения подлежащий лечению рак представляет собой меланому. Таким образом, еще один пример изобретения направлен на способ лечения меланомы у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли. Еще один пример изобретения направлен на способ лечения меланомы у пациента, нуждающегося в таком лечении, при этом указанный способ включает введение указанному пациенту эффективного количества соединения формулы I, Ia, Ib, Ic или Id или его фармацевтически приемлемой соли и эффективного количества по меньшей мере одного химиотерапевтического средства.
Соединенияпо изобретению также полезны для получения лекарственного средства, которое полезно в лечении рака.
Соединения по изобретению также полезны в комбинации с терапевтическими, химиотерапевтическими и противораковыми средствами. Комбинации раскрытых в настоящей заявке соединений с терапевтическими, химиотерапевтическими и противораковыми средствами охватываются объемом изобретения. Примеры таких средств можно найти в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 9th edition (May 16, 2011), Lippincott Williams & Wilkins Publishers. Обычный специалист в данной области сможет определить, какие комбинации средств будут полезны, на основании конкретных характеристик лекарственных средств и конкретного типа рака. Такие средства включают следующие: модуляторы эстрогеновых рецепторов, ингибиторы белка 1 запрограммированной клеточной гибели (PD-1), ингибиторы лиганда 1 запрограммированной клеточной гибели (PD-L1), модуляторы андрогеновых рецепторов, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические средства, антипролиферативные средства, ингибиторы пренил-протеинтрансферазы, ингибиторы HMG-CoA редуктазы и другие ингибиторы ангиогенеза, ингибиторы ВИЧ-протеазы, ингибиторы обратной транскриптазы, ингибиторы клеточной пролиферации и сигналов выживания, бисфосфонаты, ингибиторы ароматазы, терапевтические средства на основе миРНК, ингибиторы γ-секретазы, средства, которые противодействуют рецепторным тирозинкиназам (RTKs), и средства, которые влияют на контрольные точки клеточного цикла. Соединения по изобретению особенно полезны при совместном введении с лучевой терапией.
Термин “модуляторы эстрогеновых рецепторов” относится к соединениям, которые препятствуют связыванию или ингибируют связывание эстрогена с рецептором, независимо от механизма. Примеры модуляторов эстрогеновых рецепторов включают, но не ограничиваются этим, тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фулвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4-метил-2-[4-[2-(1-пиперидинил)этокси]фенил]-2H-1-бензопиран-3-ил]-фенил-2,2-диметилпропаноат, 4,4’-дигидроксибензофенон-2,4-динитрофенил-гидразон и SH646.
Ингибиторы PD-1 включают пембролизумаб (ламбролизумаб), ниволумаб и MPDL3280A. Ингибиторы PDL-1 включают атезолизумаб, авелумаб и дурвалумаб.
Термин “модуляторы андрогеновых рецепторов” относится к соединениям, которые препятствуют связыванию или ингибируют связывание андрогенов с рецептором, независимо от механизма. Примеры модуляторов андрогеновых рецепторов включают финастерид и другие ингибиторы 5α-редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абитратерон ацетат.
Термин “модуляторы ретиноидных рецепторов” относится к соединениям, которые препятствуют связыванию или ингибируют связывание ретиноидов с рецептором, независимо от механизма. Примеры таких модуляторов ретиноидных рецепторов включают бексаротен, третиноин, 13-цис-ретиновевую кислоту, 9-цис-ретиновевую кислоту, α-дифторметилорнитин, ILX23-7553, транс-N-(4’-гидроксифенил)ретинамид и N-4-карбоксифенил ретинамид.
“Цитотоксические/цитостатические средства” относятся к соединениям, которые вызывают гибель клеток или ингибируют пролиферацию клеток, преимущественно непосредственно вмешиваясь в функционирование клетки, или ингибируют или вмешиваются в клеточный миоз, включая алкилирующие средства, факторы некроза опухоли, интеркаляторы, гипоксия-активируемые соединения, ингибиторы микротрубочек/средства, стабилизирующие микротрубочки, ингибиторы митотических кинезинов, ингибиторы гистон-деацетилазы, ингибиторы киназ, участвующих в митотической прогрессии, ингибиторы киназ, участвующих в путях передачи сигнала факторов роста и цитокинов, антиметаболиты, модификаторы биологического ответа, гормональные/антигормональные терапевтические средства, гематопоэтические факторы роста, терапевтические средства, целенаправленно доставляемые моноклональными антителами, ингибиторы топоизомеразы, ингибиторы протеосом, ингибиторы убиквитинлигазы и ингибиторы аврора-киназы.
Примеры цитотоксических/цитостатических средств включают, но не ограничиваются этим, сертенеф, кахектин, ифосфамид, тасонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдулцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, импросульфан тозилат, трофосфамид, нимустин, диброспидий хлорид, пумитепа, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофулвен, дексифосфамид, цис-аминдихлор(2-метил-пиридин)платина, бензилгуанин, глюфосфамид, GPX100, (транс, транс, транс)-бис-мю-(гексан-1,6-диамин)-мю-[диамин-платина(II)]бис[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3’-дезамино-3’-морфолино-13-дезоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755, 4-деметокси-3-дезамино-3-азиридинил-4-метилсульфонил-даунорубицин (см. WO 00/50032), ингибиторы Raf киназа (такие как Bay43-9006) и ингибиторы mTOR (такие как Wyeth’s CCI-779).
Примером гипоксия-активируемого соединения является тирапазамин.
Примеры ингибиторов протеасом включают, но не ограничиваются этим, лактацистин и MLN-341 (Velcade).
Примеры ингибиторов микротрубочек/микротрубочки-стабилизирующих средств включают паклитаксел, виндезин сульфат, 3’,4’-дидегидро-4’-дезокси-8’-норвинкалейкобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4-метоксифенил)бензол сульфонамид, ангидровинбластин, TDX258, эпотилоны (см. например Патенты США №№ 6284781 и 6288237) и BMS188797. В одном примере эпотилоны не включены в ингибиторы микротрубочек/микротрубочки-стабилизирующие средства.
Некоторые примеры ингибиторов топоизомеразы включают топотекан, гикаптамин, иринотекан, рубитекан, 6-этоксипропионил-3’,4’-O-экзо-бензилиден-картреусин, 9-метокси-N, N-диметил-5-нитропиразоло[3,4,5-kl]акридин-2-(6H)пропанамин, 1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12H-бензо[de]пиранo[3’,4’:b,7]-индолизино[1,2b]хинолин-10,13(9H,15H)дион, луртотекан, 7-[2-(N-изопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозид фосфат, тенипозид, собузоксан, 2’-диметиламино-2’-дезокси-этопозид, GL331, N-[2-(диметиламино)этил]-9-гидрокси-5,6-диметил-6H-пиридо[4,3-b]карбазол-1-карбоксамид, асулакрин, (5a, 5aB,8aa,9b)-9-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-5-[4-гидроОкси-3,5-диметоксифенил]-5,5a,6,8,8a,9-гексогидрофуро(3’,4’:6,7)нафто(2,3-d)-1,3-диоксол-6-он, 2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[c]-фенантридиний, 6,9-бис[(2-аминоэтил)амино]бензо[g]изогвинолин-5,10-дион, 5-(3-аминопропиламино)-7,10-дигидрокси-2-(2-гидроксиэтиламинометил)-6H-пиразоло[4,5,1-de]акридин-6-он, N-[1-[2(диэтиламино)этиламино]-7-метокси-9-оксо-9H-тиоксантен-4-илметил]формамид, N-(2-(диметиламино)этил)акридин-4-карбоксамид, 6-[[2-(диметиламино)этил]амино]-3-гидрокси-7H-индено[2,1-c] хинолин-7-он и димесна.
Примеры ингибиторов митотических кинезинов и, в частности, человеческого митотического кинезина KSP описаны в публикациях WO03/039460, WO03/050064, WO03/050122, WO03/049527, WO03/049679, WO03/049678, WO04/039774, WO03/079973, WO03/099211, WO03/105855, WO03/106417, WO04/037171, WO04/058148, WO04/058700, WO04/126699, WO05/018638, WO05/019206, WO05/019205, WO05/018547, WO05/017190, US2005/0176776. В одном примере ингибиторы митотических кинезинов включают, но не ограничиваются этим, ингибиторы KSP, ингибиторы MKLP1, ингибиторы CENP-E, ингибиторы MCAK и ингибиторы Rab6-KIFL.
Примеры “ингибиторов гистон-деацетилазы” включают, но не ограничиваются этим, SAHA, TSA, оксамфлатин, PXD101, MG98 и скриптаид. Другие ингибиторы гистон-деацетилазы можно найти в следующем документе: Miller, T.A. et al. J. Med. Chem. 46(24):5097-5116 (2003).
“Ингибиторы киназ, вовлеченных в митотическую прогрессию” включают, но не ограничиваются этим, ингибиторы aurora-киназы, ингибиторы Polo-подобных киназ (PLK; в частности ингибиторы PLK-1), ингибиторы bub-1 и ингибиторы bub-R1. Примером “ингибитора aurora-киназы” является VX-680 (тозасертиб).
“Антипролиферативные средства” включает антисмысловые РНК и ДНК олигонуклеотиды, такие как G3139, ODN698, GEM231 и INX3001, и антиметаболиты, такие как эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, фостеабин натрия гидрат, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2’-дезокси-2’-метилиденцитидин, 2’-фторметилен-2’-дезоксицитидин, N-[5-(2,3-дигидро-бензофурил)сульфонил]-N’-(3,4-дихлорфенил)мочевина, N6-[4-дезокси-4-[N2-[2(E),4(E)-тетрадекадиеноил]глициламино]-L-глицеро-B-L-манно-гептопиранозил]аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3H-пиримидинo[5,4-b][1,4]тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фторурацил, аланозин, эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,11-диазатетрацикло(7.4.1.0.0)-тетрадека-2,4,6-триен-9-илуксусной кислоты, свайнсонин, лометрексол, дексразоксан, метиониназа, 2’-циано-2’-дезокси-N4-пальмитоил-1-B-D-арабинофуранозил цитозин, 3-аминопиридин-2-карбоксальдегид тиосемикарбазон и трастузумаб.
Примеры терапевтических средств, целенаправленно доставляемых моноклональными антителами, включают такие терапевтические средства, которые содержат цитотоксические вещества или радиоизотопы, присоединенные к моноклональному антителу, специфическому в отношении раковой клетки или специфическому в отношении клетки-мишени. Примеры включают Bexxar.
Термин “ингибиторы HMG-CoA редуктазы” относится к ингибиторам 3-гидрокси-3-метилглутарил-CoA редуктазы. Примеры ингибиторов HMG-CoA редуктазы, которые можно использовать, включают, но не ограничиваются этим, ловастатин (MEVACOR®; см. Патенты США №№ 4231938, 4294926 и 4319039), симвастатин (ZOCOR®; см. Патенты США №№ 4444784, 4820850 и 4916239), правастатин (PRAVACHOL®; см. Патенты США №№ 4346227, 4537859, 4410629, 5030447 и 5180589), флувастатин (LESCOL®; см. Патенты США №№ 5354772, 4911165, 4929437, 5189164, 5118853, 5290946 и 5356896), аторвастатин (LIPITOR®; см. Патенты США №№ 5273995, 4681893, 5489691 и 5342952), розувастатин (CRESTOR® Заменяющий патент США RE37,314) и церивастатин (также известный как ривастатин и BAYCHOL®; см. Патент США № 5177080). Структурные формулы этих и дополнительных ингибиторов HMG-CoA редуктазы, которые можно использовать в способах по изобретению, описаны на стр. 87 M. Yalpani, "Cholesterol Lowering Drugs", Chemistry & Industry, pp. 85-89 (5 February 1996) и в Патентах США №№ 4782084 и 4885314. Термин ингибитор HMG-CoA редуктаза в контексте настоящей заявки включает все фармацевтически приемлемые лактоновые и открытые кислотные формы (т.е. где лактоновое кольцо раскрыто с образованием свободной кислоты), а также солевые и сложноэфирные формы соединений, которые обладают активностью ингибирования HMG-CoA редуктазы, и поэтому применение таких солей, сложных эфиров, открытых кислотных и лактоновых форм включено в объем изобретения.
“Ингибитор пренил-протеинтрансферазы” относится к соединению, которое ингибирует любой один или любую комбинацию ферментов пренил-протеинтрансфераз, включая фарнезил-протеинтрансферазу (FPTазу), геранилгеранил-протеинтрансферазу типа I (GGPTазу-I) и геранилгеранил-протеинтрансферазу типа-II (GGPTазу-II, также имеющую название Rab GGPTаза).
Примеры ингибиторов пренил-протеинтрансферазы можно найти в следующих публикациях и патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665, WO 98/28980, WO 98/29119, WO 95/32987, Патенты США №№ 5420245, 5523430, 5532359, 5510510, 5589485 и 5602098, публикация европейской патентной заявки 0 618 221, публикация европейской патентной заявки 0 675 112, публикация европейской патентной заявки 0 604 181, публикация европейской патентной заявки 0 696 593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, WO 95/10514, Патент США № No. 5661152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, Патент США № No. 5571792, WO 96/17861, WO 96/33159, WO 96/34850, WO 96/34851, WO 96/30017, WO 96/30018, WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252, WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920, WO 97/17070, WO 97/23478, WO 97/26246, WO 97/30053, WO 97/44350, WO 98/02436 и Патент США № 5532359. Что касается примера роли ингибитора пренил-протеинтрансферазы на ангиогенез, см. European J. of Cancer, Vol. 35, No. 9, pp.1394-1401 (1999).
Термин “ингибиторы ангиогенеза” относится к соединениям, которые ингибируют образование новых кровеносных сосудов, независимо от механизма. Примеры ингибиторов ангиогенеза включают, но не ограничиваются этим, ингибиторы тирозинкиназ, такие как ингибиторы тирозинкиназных рецепторов Flt-1 (VEGFR1) и Flk-1/KDR (VEGFR2), ингибиторы эпидермального фактора роста, факторов роста фибробластов или тромбоцитов, ингибиторы MMP (металлопротеиназы матрикса), блокаторы интегринов, интерферон-α, интерлейкин-12, пентосан полисульфат, ингибиторы циклооксигеназы, включая нестероидные противовоспалительные лекарственные средства (НСПВЛС), такие как аспирин и ибупрофен, а также селективные ингибиторы циклооксигеназы-2, такие как целекоксиб и рофекоксиб (PNAS, Vol. 89, p. 7384 (1992); JNCI, Vol. 69, p. 475 (1982); Arch. Opthalmol., Vol. 108, p.573 (1990); Anat. Rec., Vol. 238, p. 68 (1994); FEBS Letters, Vol. 372, p. 83 (1995); Clin, Orthop. Vol. 313, p. 76 (1995); J. Mol. Endocrinol., Vol. 16, p.107 (1996); Jpn. J. Pharmacol., Vol. 75, p. 105 (1997); Cancer Res., Vol. 57, p. 1625 (1997); Cell, Vol. 93, p. 705 (1998); Intl. J. Mol. Med., Vol. 2, p. 715 (1998); J. Biol. Chem., Vol. 274, p. 9116 (1999)), стероидные противовоспалительные лекарственные средства (такие как кортикостероиды, минералокортикоиды, дексаметазон, преднизон, преднизолон, метилпред, бетаметазон), карбоксиамидотриазол, комбретастатин A-4, скваламин, 6-O-хлорацетил-карбонил)-фумагиллол, талидомид, ангиостатин, тропонин-1, антагонисты ангиотензина II (см. Fernandez et al., J. Lab. Clin. Med. 105:141-145 (1985)) и антитела к VEGF (см. Nature Biotechnology, Vol. 17, pp.963-968 (October 1999); Kim et al., Nature, 362, 841-844 (1993); WO 00/44777; и WO 00/61186).
Другие терапевтические средства, которые модулируют или ингибируют ангиогенез и которые также можно использовать в комбинации с соединениями по изобретению, включают средства, которые модулируют или ингибируют системы коагуляции и фибринолиза (см. обзор в Clin. Chem. La. Med. 38:679-692 (2000)). Примеры таких средств, которые модулируют или ингибируют пути коагуляции и фибринолиза, включают, но не ограничиваются этим, гепарин (см. Thromb. Haemost. 80:10-23 (1998)), низкомолекулярные гепарины и ингибиторы карбоксипептидазы U (также известные как ингибиторы активный тромбин-активируемого ингибитора фибринолиза [TAFIa]) (см. Thrombosis Res. 101:329-354 (2001)). Ингибиторы TAFIa описаны в U.S. Ser. Nos. 60/310927 (поданный 8 августа 2001 г.) и 60/349925 (поданный 18 января 2002 г.).
“Средства, которые влияют на контрольные точки клеточного цикла” относятся к соединениям, которые ингибируют протеинкиназы, которые передают сигналы контрольной точки клеточного цикла, таким образом сенсибилизируя раковую клетку к повреждающим ДНК средствам. Такие средства включают ингибиторы ATR, ATM, the CHK1 и CHK2 киназ и ингибиторы cdk и cdc киназ, и конкретными примерами являются 7-гидроксистауроспорин, флавопиридол, CYC202 (Cyclacel) и BMS-387032.
“Средства, которые противодействуют рецепторным тирозинкиназам (RTKs)” относятся к соединениям, которые ингибируют RTK, и, следовательно, механизмы, вовлеченные в онкогенез и прогрессирование опухоли. Такие средства включают ингибиторы c-Kit, Eph, PDGF, Flt3 и c-Met. Другие средства включают ингибиторы RTK, описанные в Bume-Jensen and Hunter, Nature, 411:355-365, 2001.
“Ингибиторы клеточной пролиферации и сигнального пути выживания” относятся к соединениям, которые ингибируют каскады сигнальной трансдукции на пути ниже от рецепторой клеточной поверхности. Такие средства включают ингибиторы серин/треонинкиназ (включая, но не ограничиваясь этим, ингибиторы Akt, например описанные в WO 02/083064, WO 02/083139, WO 02/083140, US 2004-0116432, WO 02/083138, US 2004-0102360, WO 03/086404, WO 03/086279, WO 03/086394, WO 03/084473, WO 03/086403, WO 2004/041162, WO 2004/096131, WO 2004/096129, WO 2004/096135, WO 2004/096130, WO 2005/100356, WO 2005/100344, US 2005/029941, US 2005/44294, US 2005/43361, 60/734188, 60/652737, 60/670469), ингибиторы Raf киназы (например BAY-43-9006), ингибиторы MEK (например CI-1040 и PD-098059), ингибиторы mTOR (например Wyeth CCI-779) и ингибиторы PI3K (например LY294002).
Как описано выше, комбинации с НСПВЛС направлены на применение НСПВЛС, которые являются сильными COX-2 ингибирующими средствами. Для целей настоящего описания НСПВЛС является эффективным, если имеет значение IC50 для ингибирования COX-2 1 мкМ или меньше, измеренное в клеточном или микросомальном анализе.
Изобретение также охватывает комбинации с НСПВЛС, которые являются селективными ингибиторами COX-2. Для целей настоящего описания НСПВЛС, которые являются селективными ингибиторами COX-2, определены как обладающие специфичностью ингибирования COX-2 по меньшей мере в 100 раз большей по сравнению с COX-1, как измерено на основании отношения IC50 для COX-2 к IC50 для COX-1, определенного в клеточном или микросомальном анализе. Такие соединения включают, но не ограничиваются этим, соединения, раскрытые в Патенте США № 5474995, Патенте США № 5861419, Патенте США № 6001843, Патенте США № 6020343, Патенте США № 5409944, Патенте США № 5436265, Патенте США № 5536752, Патенте США № 5550142, Патенте США № 5604260, Патенте США № 5698584, Патенте США № 5710140, WO 94/15932, Патенте США № 5344991, Патенте США № 5134142, Патенте США № 5380738, Патенте США № 5393790, Патенте США № 5466823, Патенте США № 5633272 и Патенте США № 5932598,( которые все включены а настоящую заявку посредством ссылки.
Ингибиторы COX-2, которые особенно полезны в способе лечения по изобретению, представляют собой: 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5H)-фуранон; и 5-хлор-3-(4-метилсульфонил)-фенил-2-(2-метил-5-пиридинил)пиридин; или его фармацевтически приемлемую соль.
Соединения, которые описаны как специфические ингибиторы COX-2 и, следовательно, полезные в настоящем изобретении, включают, но не ограничиваются этим, следующие: рофекоксиб, эторикоксиб, парекоксиб, BEXTRA® и CELEBREX® или его фармацевтически приемлемую соль.
Другие примеры ингибиторов ангиогенеза включают, но не ограничиваются этим, эндостатин, украин, ранпирназу, IM862, 5-метокси-4-[2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат, ацетилдинаналин, 5-амино-1-[[3,5-дихлор-4-(4-хлорбензоил)фенил]метил]-1H-1,2,3-триазол-4-карбоксамид, CM101, скваламин, комбретастатин, RPI4610, NX31838, сульфатировунню маннопентаозу фосфат, 7,7-(карбонил-бис[имино-N-метил-4,2-пирролокарбонилимино[N-метил-4,2-пиррол]-карбонилимино]-бис-(1,3-нафталин дисульфонат) и 3-[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416).
Указанный выше термин “блокаторы интегринов” относится к соединениям, которые селективно антагонизируют, ингибируют или противодействуют связыванию физиологического лиганда с αvβ3 интегрином, к соединениям, которые селективно антагонизируют, ингибируют или противодействуют связыванию физиологического лиганда с αvβ5 интегрином, к соединениям, которые антагонизируют, ингибируют или противодействуют связыванию физиологического лиганда как с αvβ3 интегрином, так и с αvβ5 интегрином, и к соединениям, которые антагонизируют, ингибируют или противодействуют активности конкретного интегрина(интегринов), экспрессируемого на эндотелиальных клетках капилляров. Термин также относится к антагонистам αvβ6, αvβ8, α1β1, α2β1, α5β1, α6β1 и α6β4 интегринов. Термин также относится к антагонистам любой комбинации αvβ3, αvβ5, αvβ6, αvβ8, α1β1, α2β1, α5β1, α6β1 и α6β4 интегринов.
Некоторые конкретные примеры ингибиторов тирозинкиназ включают N-(трифторметилфенил)-5-метилизоксазол-4-карбоксамид, 3-[(2,4-диметилпиррол-5-ил)метилиденил)индолин-2-он, 17-(аллиламино)-17-деметоксигелданамицин, 4-(3-хлор-4-фторфениламино)-7-метокси-6-[3-(4-морфолинил)пропокси]хиназолин, N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин, BIBX1382, 2,3,9,10,11,12-гексагидро-10-(гидроксиметил)-10-гидрокси-9-метил-9,12-эпокси-1H-дииндолo[1,2,3-fg:3’,2’,1’-kl]пирроло[3,4-i][1,6]бензодиазоцин-1-он, SH268, генистеин, STI571, CEP2563, 4-(3-хлорфениламино)-5,6-диметил-7H-пирроло[2,3-d]пиримидинметан сульфонат, 4-(3-бром-4-гидроксифенил)амино-6,7-диметоксихиназолин, 4-(4’-гидроксифенил)амино-6,7-диметоксихиназолин, SU6668, STI571A, N-4-хлорфенил-4-(4-пиридилметил)-1-фталазинамин и EMD121974.
Комбинации с соединениями, отличными от противораковых соединений, также охватываются способами по изобретению. Например, комбинации заявленных согласно изобретению соединений с агонистами PPAR-γ (т.е. PPAR-гамма) и агонистами PPAR-δ (т.е. PPAR-дельта) полезны в лечении некоторых злокачественных заболеваний. PPAR-γ и PPAR-δ являются активируемыми пролифератором пероксисом ядерными рецепторами γ и δ. Экспрессия PPAR-γ на эндотелиальных клетках и его участие в ангиогенезе описаны в литературе (см. J. Cardiovasc. Pharmacol. 1998; 31:909-913; J. Biol. Chem. 1999; 274:9116-9121; Invest. Ophthalmol Vis. Sci. 2000; 41:2309-2317). Недавно было показано, что агонисты PPAR-γ ингибируют ангиогенный ответ на VEGF in vitro; как троглитазон, так и розиглитазон малеат ингибируют развитие неоваскуляризации сетчатки у мышей (Arch. Ophthamol. 2001; 119:709-717). Примеры агонистов PPAR-γ и агонистов PPAR-γ/α включают, но не ограничиваются этим, тиазолидиндионы (такие как DRF2725, CS-011, троглитазон, розиглитазон и пиоглитазон), фенофибрат, гемфиброзил, клофибрат, GW2570, SB219994, AR-H039242, JTT-501, MCC-555, GW2331, GW409544, NN2344, KRP297, NP0110, DRF4158, NN622, GI262570, PNU182716, DRF552926, 2-[(5,7-дипропил-3-трифторметил-1,2-бензизоксазол-6-ил)окси]-2-метилпропионовую кислоту (раскрытую в USSN 09/782856) и 2(R)-7-(3-(2-хлор-4-(4-фторфенокси)фенокси)пропокси)-2-этилхроман-2-карбоновую кислоту (раскрытую в USSN 60/235708 и 60/244697).
Еще одним примером настоящего изобретения является использование раскрытых в настоящей заявке соединений в комбинации с генной терапией для лечения рака. Обзор генетических стратегий для лечения рака см. в Hall et al., (Am. J. Hum. Genet. 61:785-789, 1997) и Kufe et al., (Cancer Medicine, 5th Ed, pp 876-889, BC Decker, Hamilton 2000). Генную терапию можно использовать для доставки любого опухоль-супрессорного гена. Примеры таких генов включают, но не ограничиваются этим, p53, который может быть доставлен через рекомбинантный вирус-опосредованный генный перенос (см., например, Патент США № No. 6069134), антагонист uPA/uPAR ("Adenovirus-Mediated Delivery of a uPA/uPAR Antagonist Suppresses Angiogenesis-Dependent Tumor Growth and Dissemination in Mice," Gene Therapy, August 1998;5(8):1105-13) и интерферон гамма (J. Immunol. 2000;164:217-222).
Соединения по изобретению также можно вводить в комбинации с ингибитором врожденной полилекарственной резистентности (MDR), в частности MDR, ассоциированной с высокими уровнями экспрессии транспортных белков. Такие ингибиторы MDR включают ингибиторы п-гликопротеина (P-gp), такие как LY335979, XR9576, OC144-093, R101922, VX853 и PSC833 (валсподар).
Соединение по настоящему изобретению можно использовать вместе с противорвотными средствами для лечения тошноты или рвоты, включая острую, замедленную, в поздней фазе и ожидаемую рвоту, которая может быть результатом применения соединения по настоящему изобретению отдельно или с лучевой терапией. Для предотвращения или лечения рвоты соединение по настоящему изобретению можно использовать вместе с другими противорвотными средствами, особенно антагонистами рецепторов нейрокинина-1, антагонистами рецепторов 5HT3, такими как ондансетрон, гранисетрон, трописетрон и затисетрон, агонистами рецепторов GABAB, такими как баклофен, кортикостероидом, таким как Decadron (дексаметазон), Kenalog, Aristocort, Nasalide, Preferid, Benecorten или другие, например, которые раскрыты в Патентах США №№ 2789118, 2990401, 3048581, 3126375, 3929768, 3996359, 3928326 и 3749712, антидопаминергическим средством, таким как фенотиазины (например, прохлорперазин, флуфеназин, тиоридазин и мезоридазин), метоклопрамид или дронабинол. Еще в одном примере комбинированная терапия с противорвотным средством, выбранным из антагониста рецептора нейрокинина-1, антагониста рецептора 5HT3 и кортикостероида, раскрыта для лечения или предовращения рвоты, которая может возникать после введения соединений по изобретению.
Антагонисты рецепторов нейрокинина-1 для применения вместе с соединениями по настоящему изобретению подробно описаны, например, в Патентах США №№ 5162339, 5232929, 5242930, 5373003, 5387595, 5459270, 5494926, 5496833, 5637699, 5719147; Европейских патентных публикациях №№ EP 0 360 390, 0 394 989, 0 428 434, 0 429 366, 0 430 771, 0 436 334, 0 443 132, 0 482 539, 0 498 069, 0 499 313, 0 512 901, 0 512 902, 0 514 273, 0 514 274, 0 514 275, 0 514 276, 0 515 681, 0 517 589, 0 520 555, 0 522 808, 0 528 495, 0 532 456, 0 533 280, 0 536 817, 0 545 478, 0 558 156, 0 577 394, 0 585 913,0 590 152, 0 599 538, 0 610 793, 0 634 402, 0 686 629, 0 693 489, 0 694 535, 0 699 655, 0 699 674, 0 707 006, 0 708 101, 0 709 375, 0 709 376, 0 714 891, 0 723 959, 0 733 632 и 0 776 893; Международных патентных публикациях PCT №№ WO 90/05525, 90/05729, 91/09844, 91/18899, 92/01688, 92/06079, 92/12151, 92/15585, 92/17449, 92/20661, 92/20676, 92/21677, 92/22569, 93/00330, 93/00331, 93/01159, 93/01165, 93/01169, 93/01170, 93/06099, 93/09116, 93/10073, 93/14084, 93/14113, 93/18023, 93/19064, 93/21155, 93/21181, 93/23380, 93/24465, 94/00440, 94/01402, 94/02461, 94/02595, 94/03429, 94/03445, 94/04494, 94/04496, 94/05625, 94/07843, 94/08997, 94/10165, 94/10167, 94/10168, 94/10170, 94/11368, 94/13639, 94/13663, 94/14767, 94/15903, 94/19320, 94/19323, 94/20500, 94/26735, 94/26740, 94/29309, 95/02595, 95/04040, 95/04042, 95/06645, 95/07886, 95/07908, 95/08549, 95/11880, 95/14017, 95/15311, 95/16679, 95/17382, 95/18124, 95/18129, 95/19344, 95/20575, 95/21819, 95/22525, 95/23798, 95/26338, 95/28418, 95/30674, 95/30687, 95/33744, 96/05181, 96/05193, 96/05203, 96/06094, 96/07649, 96/10562, 96/16939, 96/18643, 96/20197, 96/21661, 96/29304, 96/29317, 96/29326, 96/29328, 96/31214, 96/32385, 96/37489, 97/01553, 97/01554, 97/03066, 97/08144, 97/14671, 97/17362, 97/18206, 97/19084, 97/19942 и 97/21702; и в патентных публикациях Великобритании №№ 2 266 529, 2 268 931, 2 269 170, 2 269 590, 2 271 774, 2 292 144, 2 293 168, 2 293 169 и 2 302 689. Получение таких соединений подробно описано в вышеуказанных патентах и публикациях, которые включены в настоящую заявку посредством ссылки.
В одном примере антагонист рецепторов нейрокинина-1 для применения вместе с соединениями по настоящему изобретению выбран из: 2-(R)-(1-(R)-(3,5-бис(трифторметил)фенил)этокси)-3-(S)-(4-фторфенил)-4-(3-(5-оксо-1H,4H-1,2,4-триазолo)метил)морфолина или его фармацевтически приемлемой соли, который описан в Патенте США № 5719147.
Соединение по изобретению также можно вводить со средством, полезным в лечении анемии. Такое средство для лечения анемии, например, представляет собой активатор рецептора непрерывного эритропоэза (такой как эпоетин альфа).
Соединение по изобретению также можно вводить со средством, полезным в лечении нейтропении. Такое средство для лечения нейтропении, например, представляет собой гематопоэтический фактор роста, который регулирует продукцию и функцию нейтрофилов, такой как человеческий гранулоцитарный колониестимулирующий фактор, (G-CSF). Примеры G-CSF включают филграстим.
Соединение по изобретению также можно вводить с иммуноукрепляющим средством, таким как левамизол, изопринозин и Задаксин.
Соединение по изобретению также может быть полезным для лечения или профилактики рака в комбинации с ингибиторами P450 включая: ксенобиотики, хинидин, тирамин, кетоконазол, тестостерон, хинин, метирапон, кофеин, фенелзин, доксорубицин, тролеандомицин, циклобензаприн, эритромицин, кокаин, фурафилин, циметидин, декстрометорфан, ритонавир, индинавир, ампренавир, дилтиазем, терфенадин, верапамил, кортизол, итраконазол, мибефрадил, нефазодон и нелфинавир.
Соединение по изобретению также может быть полезным для лечения или профилактики рака в комбинации с ингибиторами Pgp и/или BCRP, включая: циклоспорин A, PSC833, GF120918, кремофор EL, фумитреморгин C, Ko132, Ko134, Иресса, Иматиниб мезилат, EKI-785, Cl1033, новобиоцин, диэтилстилбестрол, тамоксифен, респерпин, VX-710, трипростатин A, флавоноиды, ритонавир, саквинавир, нелфинавир, омепразол, хинидин, верапамил, терфенадин, кетоконазол, нифидепин, FK506, амилодарон, XR9576, индинавир, ампренавир, кортизол, тестостерон, LY335979, OC144-093, эритромицин, винкристин, дигоксин и талинолол.
Соединение по изобретению также может быть полезным для лечения или профилактики рака, включая рак кости, в комбинации с бисфосфонатами (подразумевается, что они включают бисфосфонаты, дифосфонаты, бисфосфоновые кислоты и дифосфоновые кислоты). Примеры бисфосфонатов включают, но не ограничиваются этим: этидронат (Didronel), памидронат (Aredia), алендронат (Fosamax), ризедронат (Actonel), золедронат (Zometa), ибандронат (Boniva), инкадронат или цимадронат, клодронат, EB-1053, минодронат, неридронат, пиридронат и тилудронат, включая любую и все фармацевтически приемлемые соли, производные, гидраты и их смеси.
Соединение по изобретению также может быть полезным для лечения или профилактики рака молочной железы в комбинации с ингибиторами ароматазы. Примеры ингибиторов ароматазы включают, но не ограничиваются этим: анастрозол, летрозол и эксеместан.
Соединение по изобретению также может быть полезным для лечения или профилактики рака в комбинации с терапевтическими средствами на основе миРНК.
Соединения по изобретению также можно вводить в комбинации с ингибиторами γ-секретазы и/или ингибиторами NOTCH сигнализации. Такие ингибиторы включают соединения, описанные в WO 01/90084, WO 02/30912, WO 01/70677, WO 03/013506, WO 02/36555, WO 03/093252, WO 03/093264, WO 03/093251, WO 03/093253, WO 2004/039800, WO 2004/039370, WO 2005/030731, WO 2005/014553, USSN 10/957,251, WO 2004/089911, WO 02/081435, WO 02/081433, WO 03/018543, WO 2004/031137, WO 2004/031139, WO 2004/031138, WO 2004/101538, WO 2004/101539 и WO 02/47671 (включая LY-450139).
Соединение по изобретению также может быть полезным для лечения или профилактики рака в комбинации с ингибиторами PARP.
Соединение по изобретению также может быть полезным для лечения рака в комбинации со следующими терапевтическими средствами: пембролизумаб (Keytruda®), абареликс (Plenaxis depot®); алдеслейкин (Prokine®); Алдеслейкин (Proleukin®); Алемтузумаб (Campath®); алитретиноин (Panretin®); аллопуринол (Zyloprim®); алтретамин (Hexalen®); амифостин (Ethyol®); анастрозол (Arimidex®); триоксид мышьяка (Trisenox®); аспарагиназа (Elspar®); азацитидин (Vidaza®); бевакузимаб (Avastin®); бексаротен капсулы (Targretin®); бексаротен гель (Targretin®); блеомицин (Bleoxane®); бортезомиб (Velcade®); бусульфан внутривенный (Busulfex®); бусульфан пероральный (Myleran®); калустерон (Methosarb®); капецитабин (Xeloda®); карбоплатин (Paraplatin®); кармустин (BCNU®, BiCNU®); кармустин (Gliadel®); кармустин с Полифепросаном 20 Имплант (Gliadel Wafer®); целекоксиб (Celebrex®); цетуксимаб (Erbitux®); хлорамбуцил (Leukeran®); цисплатин (Platinol®); кладрибин (Leustatin®, 2-CdA®); клофарабин (Clolar®); циклофосфамид (Cytoxane®, Neosar®); циклофосфамид (Cytoxane для инъекций®); циклофосфамид (Cytoxane таблетки®); цитарабин (Cytosar-U®); цитарабин липосомальный (DepoCyt®); дакарбазин (DTIC-Dome®); дактиномицин, актиномицин D (Cosmegen®); Дарбепоетин альфа (Aranesp®); даунорубицин липосомальный (Danuoxaome®); даунорубицин, дауномицин (Daunorubicin®); даунорубицин, дауномицин (Cerubidine®); денилейкин-дифтитокс (Ontak®); дексразоксан (Zinecard®); доцетаксел (Taxotere®); доксорубицин (Adriamycin PFS®); доксорубицин (Adriamycin®, Rubex®); доксорубицин (Adriamycin PFS Injection®); доксорубицин липосомальный (Doxil®); дромостанолон пропионат (Dromostanolone®); дромостанолон пропионат (Masterone для инъекций®); Elliott's B раствор (Elliott's B Solution®); эпирубицин (Ellence®); Эпоетин альфа (epogen®); эрлотиниб (Tarceva®); эстрамустин (Emcyt®); этопозид фосфат (Etopophos®); этопозид, VP-16 (Vepesid®); эксеместан (Aromasin®); Филграстим (Neupogen®); флоксуридин (интраартериальный) (FUDR®); флударабин (Fludara®); фторурацил, 5-FU (Adrucil®); фулвестрант (Faslodex®); гефитиниб (Iressa®); гемцитабин (Gemzar®); гемтузумаб озогамицин (Mylotarg®); госерелин ацетат (Zoladex Имплант®); госерелин ацетат (Zoladex®); гистрелин ацетат (Histrelin имплант®); гидроксимочевина (Hydrea®); Ибритумомаб Тиуксетан (Zevalin®); идарубицин (Idamycin®); ифосфамид (IFEX®); иматиниб мезилат (Gleevec®); интерферон альфа 2a (Roferon A®); Интерферон альфа-2b (Intron A®); иринотекан (Camptosar®); леналидомид (Revlimid®); летрозол (Femara®); лейковорин (Wellcovorin®, Leucovorin®); Лейпролид Ацетат (Eligard®); левамизол (Ergamisol®); ломустин, CCNU (CeeBU®); меклоретамин, азотистый иприт (Mustargen®); мегестрол ацетат (Megace®); мелфалан, L-PAM (Alkeran®); меркаптопурин, 6-MP (Purinethol®); месна (Mesnex®); месна (Mesnex tabs®); метотрексат (Methotrexate®); метокссален (Uvadex®); митомицин C (Mutamycin®); митотан (Lysodren®); митоксантрон (Novantrone®); нандролон фенпропионат (Durabolin-50®); неларабин (Arranon®); Нофетумомаб (Verluma®); Опредвекин (Neumega®); оксалиплатин (Eloxatin®); паклитаксел (Paxene®); паклитаксел (Taxol®); паклитаксел связанные с белком частицы (Abraxane®); палифермин (Kepivance®); памидронат (Aredia®); пегадемаза (Adagen (Pegademase Bovine)®); пегаспаргаза (Oncaspar®); Пегфилграстим (Neulasta®); пеметрексед динатрий (Alimta®); пентостатин (Nipent®); пипоброман (Vercyte®); пликамицин, митрамицин (Mithracin®); порфимер натрий (Photofrin®); прокарбазин (Matulane®); хинакрин (Atabrine®); расбуриказа (Elitek®); Ритуксимаб (Rituxan®); Ридафоролимус; сарграмостим (Leukine®); Сарграмостим (Prokine®); сорафениб (Nexavar®); стрептозоцин (Zanosar®); сунитиниб малеат (Sutent®); тальк (Sclerosol®); тамоксифен (Nolvadex®); темозоломид (Temodar®); тенипозид, VM-26 (Vumon®); тестолактон (Teslac®); тиогуанин, 6-TG (Thioguanine®); тиотепа (Thioplex®); топотекан (Hycamtin®); торемифен (Fareston®); Тозитумомаб (Bexxar®); Тозитумомаб/I-131 тозитумомаб (Bexxar®); Трастузумаб (Herceptin®); третиноин, ATRA (Vesanoid®); Азотистый Иприт (Uracil Mustard Капсулы®); валрубицин (Valstar®); винбластин (Velban®); винкристин (Oncovin®); винорелбин (Navelbine®); вориностат (Zolinza®) и золедронат (Zometa®).
В одном примере ингибитор ангиогенеза, который можно использовать в качестве второго соединения, выбран из ингибитора тирозинкиназы, ингибитора эпидермального фактора роста, ингибитора фактора роста фибробластов, ингибитора тромбоцитарного фактора роста, ингибитора MMP (металлопротеиназы матрикса), блокатора интегринов, интерферона-α, интерлейкина-12, пентосан полисульфата, ингибитора циклооксигеназы, карбоксиамидотриазола, комбретастатина A-4, скваламина, 6-O-хлорацетил-карбонил)-фумагиллола, талидомида, ангиостатина, тропонина-1 или антитела к VEGF. В одном примере модулятор эстрогеновых рецепторов представляет собой тамоксифен или ралоксифен.
Таким образом, объем изобретения охватывает применение заявленных согласно изобретению соединений в комбинации со вторым соединением, выбранным из следующих: модулятор эстрогеновых рецепторов, модулятор андрогеновых рецепторов, модулятор ретиноидных рецепторов, цитотоксическое/цитостатическое средство, антипролиферативное средство, ингибитор пренил-протеинтрансферазы, ингибитор HMG-CoA редуктазы, ингибитор ВИЧ-протеазы, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-γ, агонисты PPAR-δ, ингибитор врожденной полилекарственной резистентности, противорвотное средство, средство, полезное в лечении анемии, средство, полезное в лечении нейтропении, иммуноукрепляющее средство, ингибитор клеточной пролиферации и сигналов выживания, бисфосфонат, ингибитор ароматазы, терапевтическое средство на основе миРНК, ингибиторы γ-секретазы и/или NOTCH, средства, которые противодействуют рецепторным тирозинкиназам (RTK), средство, которое противодействует контрольной точке клеточного цикла, и любое из терапевтических средств, указанных выше.
Также объем формулы изобретения включает способ лечения рака, который включает введение терапевтически эффективного количества соединения по настоящему изобретению в комбинации с лучевой терапией и/или в комбинации со вторым соединением, выбранным из следующих: модулятор эстрогеновых рецепторов, модулятор андрогеновых рецепторов, модулятор ретиноидных рецепторов, цитотоксическое/цитостатическое средство, антипролиферативное средство, ингибитор пренил-протеинтрансферазы, ингибитор HMG-CoA редуктазы, ингибитор ВИЧ-протеазы, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонисты PPAR-γ, агонисты PPAR-δ, ингибитор врожденной полилекарственной резистентности, противорвотное средство, средство, полезное в лечении анемии, средство, полезное в лечении нейтропении, иммуноукрепляющее средство, ингибитор клеточной пролиферации и сигналов выживания, бисфосфонат, ингибитор ароматазы, терапевтическое средство на основе миРНК, ингибиторы γ-секретазы и/или NOTCH, средства, которые противодействуют рецепторным тирозинкиназам (RTKs), средство, которое противодействует контрольной точке клеточного цикла, и любое из терапевтических средств, указанных выше.
Еще одним примером изобретения является способ лечения рака, который включает введение терапевтически эффективного количества соединения по настоящему изобретению в комбинации с паклитакселом или трастузумабом.
Изобретение также охватывает способ лечения или профилактики рака, который включает введение терапевтически эффективного количества соединения по настоящему изобретению в комбинации с ингибитором COX-2.
Терапевтическую комбинацию, раскрытую в настоящей заявке, можно использовать в комбинации с одним или несколькими другими активными средствами, включая, но не ограничиваясь этим, другие противораковые средства, которые используют для профилактики, лечения, контроля, облегчения или уменьшени риска конкретного заболевания или состояния (например, клеточно-пролиферативных расстройств). В одном варианте осуществления соединение, раскрытое в настоящей заявке, используют в комбинации с одним или несколькими другими противораковыми средствами для применения в профилактике, лечении, контроле, облегчении или уменьшении риска конкретного заболевания или состояния, при котором полезны соединения, раскрытые в настоящей заявке. Такие другие активные средства можно вводить путем и в количестве, традиционно используемыми для этих средств, до введения, одновременно или последовательно с введением соединения по изобретению.
Изобретение также включает фармацевтическую композицию, полезную для лечения или профилактики рака, которая включает терапевтически эффективное количество соединения по настоящему изобретению и второе соединение, выбранное из следующих: модулятор эстрогеновых рецепторов, модулятор андрогеновых рецепторов, модулятор ретиноидных рецепторов, цитотоксическое/цитостатическое средство, антипролиферативное средств, ингибитор пренил-протеинтрансферазы, ингибитор HMG-CoA редуктазы, ингибитор ВИЧ-протеазы, ингибитор обратной транскриптазы, ингибитор ангиогенеза, агонист PPAR-γ, агонист PPAR-δ, ингибитор клеточной пролиферации и сигналов выживания, бисфосфонат, ингибитор ароматазы, терапевтическое средство на основе миРНК, ингибиторы γ-секретазы и/или NOTCH, средства, которые противодействуют рецепторным тирозинкиназам (RTK), средство, которое противодействует контрольной точке клеточного цикла, и любое из терапевтических средств, указанных выше.
Когда какая-либо переменная встречается в каком-либо компоненте более одного раза, ее определение в каждом случае является независимым от всех остальных случаев. Кроме того, комбинации заместителей и переменных допустимы, только если такие комбинации приводят к стабильным соединениям. Линии, проведенные в кольцевых системах от заместителей, показывают, что указанная связь может быть присоединена к любому из замещаемых кольцевых атомов. Если кольцевая система является бициклической, предполагается, что связь будет присоединена к любому из подходящих атомов в любом кольце бициклического фрагмента.
Должно быть понятно, что обычный специалист в данной области может выбрать заместители и паттерны замещения в соединениях по настоящему изобретению для получения соединений, которые являются химически стабильными и которые можно легко синтезировать способами, известными в данной области, а также способами, которые описаны ниже, из легко доступных исходных веществ. Если заместитель сам замещен более чем одной группой, понятно, что эти несколько групп могут находиться на одном и том же атоме углерода или на разных атомах углерода, при условии получения стабильной структуры. Также “необязательно замещенный” означает необязательное замещение указанными группами, радикалами или фрагментами.
Настоящее изобретение включает соединения структурной формулы I, Ia, Ib, Ic или Id, а также фармацевтически приемлемые соли, а также соли, которые не являются фармацевтически приемлемыми, когда они используются в качестве предшественников свободных соединений или их фармацевтически приемлемых солей или в других синтетических манипуляциях.
Соединения по настоящему изобретению можно вводить в форме фармацевтически приемлемой соли. Термин “фармацевтически приемлемая соль” относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания и неорганические или органические кислоты. Соли основных соединений, охватываемые термином “фармацевтически приемлемая соль”, относятся к нетоксичным солям соединений по изобретению, которые обычно получают взаимодействием свободного основания с подходящей органической или неорганической кислотой. Репрезентативные соли щелочных соединений по настоящему изобретению включают, но не ограничиваются этим, следующие: ацетат, аскорбат, адипат, альгинат, аспират, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, 4-бромбензолсульфонат, бутират, камфорат, камфорсульфонат, камсилат, карбонат, хлорид, клавуланат, цитрат, циклогексиламидосульфонат, циклопентанпропионат, диэтилацетат, диглюконат, дигидрохлорид, додецилсульфанат, эдетат, эдисилат, эстолат, эсилат, этансульфонат, формиат, фумарат, глуцептат, глюкогептаноат, глюконат, глюкуонат, глутамат, глицерофосфат, гликоллиларсанилат, гемисульфат, гептаноат, гексаноат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, 2-гидроксиэтансульфонат, гидроксинафтоат, йодид, изоникотинат, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, метилсульфонат, муцинат, 2-нафталинсульфонат, напсилат, никотинат, нитрат, аммониевая соль N-метилглюкамина, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, пектинат, персульфат, фосфат/дифосфат, соль пимелиновой кислоты, фенилпропилпропионат, полигалактуронат, пропионат, салицилат, стеарат, сульфат, субацетат, сукцинат, таннат, тартрат, теоклат, тиоцианат, тозилат, триэтиодид, трифторацетат, трифторметилсульфонат, п-толуолсульфонат, ундеконат, валерат и т.п.
Кроме того, если соединения по настоящему изобретению несут кислотный фрагмент, их подходящие фармацевтически приемлемые соли включают, но не ограничиваются этим, соли, полученные из неорганических оснований, включая алюминий, аммоний, кальций, медь, трехвалентное, двухвалентное железо, литий, магний, марганец, марганец, калий, натрий, цинк и т.п. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия.
С оснóвными реагентами, такими как гидроксиды, карбонаты, гидрокарбонаты, алкоксиды и аммиак, органическими основаниями, или альтернативно основными аминокислотами, соединения формулы I, Ia, Ib, Ic или Id образуют стабильные соли щелочных металлов, щелочноземельных металлов или необязательно замещенные аммониевые соли. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, циклических аминов, дициклогексиламинов и основных ионообменных смол, таких как аргинин, бетаин, кофеин, холин, N, N-дибензилэтилендиамин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этиламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, орнитин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин, трометамол, трометамин и т.п. Также включены основные азотсодержащие группы, которые могут быть кватернизованы такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутил- хлорид, бромиды и йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарил- хлориды, бромиды и йодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды, и другие.
Получение фармакологически приемлемых солей из соединений формулы I, Ia, Ib, Ic или Id, способных к образованию солей, включая их стереоизомерные формы, осуществляют известными методами, например, путем смешивания соединения по настоящему изобретению с эквивалентным количеством и раствором, содержащим желаемую кислоту, основание или т.п., и затем сбора желаемой соли путем фильтрования соли или отгонки растворителя. Соединения по настоящему изобретению и их соли могут образовывать сольваты с растворителем, таким как вода, этанол или глицерин. Соединения по настоящему изобретению могут образовывать кислотно-аддитивную соль и соль с основанием одновременно в зависимости от типа заместителя боковой цепи.
Настоящее изобретение охватывает все стереоизомерные формы соединений формулы I, Ia, Ib, Ic или Id. Центры асимметрии, которые присутствуют в соединениях формулы I, Ia, Ib, Ic или Id, могут все независимо друг от друга иметь (R) конфигурацию или (S) конфигурацию. Когда связи с хиральным углеродом изображены прямыми линиями в структурных формулах изобретения, должно быть понятно, что обе конфигурации (R) и (S) хирального углерода и, следовательно, оба энантиомера и их смеси, охватываются формулами. Подобным образом, когда название соединения приводится без хирального обозначения хирального углерода, подразумевается, что и (R), и (S) конфигурации хирального углерода и, следовательно, индивидуальные энантиомеры и их смеси охватываются этим названием. Получение конкретных стереоизомеров или их смесей может быть указано в примерах, в которых были получены такие стереоизомеры или смеси, но это никоим образом не ограничивает включение всех стереоизомеров и их смесей в объем изобретения.
Изобретение включает все возможные энантиомеры и диастереомеры и смеси двух или более стереоизомеров, например смеси энантиомеров и/или диастереомеров, во всех соотношениях. Таким образом, энантиомеры являются предметом изобретения в энантиомерно чистой форме, как левовращающие, так и правовращающие антиподы, в форме рацематов и в виде смесей двух энантиомеров во всех соотношениях. В случае цис/транс изомерии, изобретение включает как цис-форму, так и транс-форму, а также смеси этих форм во всех соотношениях. При желании, получение индивидуальных стереоизомеров можно осуществить путем разделения смеси обычными методами, например хроматографией или кристаллизацией, с использованием стереохимически однородных исходных веществ для синтеза или путем стереоселективного синтеза. Необязательно, дериватизацию можно осуществить перед разделением стереоизомеров. Разделение смеси стереоизомеров можно осуществить на промежуточной стадии во время синтеза соединения формулы I, Ia, Ib, Ic или Id, или это можно осуществить с конечным рацемическим продуктом. Абсолютная стереохимия может быть определена методом рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных продуктов, которые при необходимости дериватизируют с использованием реагента, содержащего стереогенный центр известной конфигурации. Когда соединения по изобретению способны к таутомеризации, все индивидуальные таутомеры, а также их смеси включены в объем изобретения. Настоящее изобретение включает все такие изомеры, а также соли, сольваты (включая гидраты) и сольватированные соли таких рацематов, энантиомеров, диастереомеров и таутомеров, и их смеси.
В соединениях по изобретению атомы могут демонстрировать свое естественное изотопное содержание, или один или несколько атомов могут быть искусственно обогащены конкретным изотопом, имеющим тот же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, преимущественно встречающихся в природе. Подразумевается, что настоящее изобретение включает все подходящие изотопные варианты конкретно и в общем виде описанных соединений. Например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий является преобладающим изотопом водорода, встречающимся в природе. Обогащение дейтерием может дать определенные терапевтические преимущества, такие как увеличение периода полужизни in vivo или снижение требований к дозировке, или может обеспечить соединение, используемое в качестве стандарта для характеристики биологических образцов. Соединения, обогащенные изотопами, могут быть получены без чрезмерного экспериментирования обычными методами, хорошо известными специалистам в данной области, или способами, аналогичными тем, которые описаны в общих схемах получения и примерах, представленных в настоящей заявке, с использованием соответствующих изотопно-обогащенных реагентов и/или промежуточных соединений.
Кроме того, соединения по настоящему изобретению могут существовать в аморфной форме и/или в одной или нескольких кристаллических формах, и, таким образом, предполагается, что все аморфные и кристаллические формы и их смеси соединений формулы I, Ia, Ib, Ic или Id включены в объем настоящего изобретения. Кроме того, некоторые из соединений настоящего изобретения могут образовывать сольваты с водой (т.е. гидрат) или обычными органическими растворителями. Такие сольваты и гидраты, особенно фармацевтически приемлемые сольваты и гидраты соединений по настоящему изобретению, также входят в объем изобретения вместе с несольватированными и безводными формами.
Настоящее изобретение включает соединения структурной формулы I, Ia, Ib, Ic или Id или любой другой общей структурной формулы или конкретное соединение, описанное или заявленное в настоящей заявке, и предназначено для охвата конкретного соединения или соединений, попадающих в объем формулы или варианта осуществления.
Настоящее изобретение включает соединения структурной формулы I, Ia, Ib, Ic или Id, а также их соли, особенно фармацевтически приемлемые соли, сольваты таких соединений и их сольватированные солевые формы, где такие формы возможны, если не указано иное.
За исключением случаев, указанных в данном описании, термин “алкил” предназначен для включения насыщенных алифатических углеводородных групп как с разветвленной, так и с прямой цепью, имеющих определенное количество атомов углерода. В описании используются обычно используемые сокращения для алкильных групп, например метил может быть представлен обычными сокращениями, включая «Me» или CH3, или символом, который представляет собой продленную связь в качестве концевой группы, например  , этил может быть представлен как “Et” или CH2CH3, пропил может быть представлен как “Pr” или CH2CH2CH3, бутил может быть представлен как “Bu” или CH2CH2CH2CH3, и т.д. “C1-4 алкил” (или “C1-C4 алкил”) например, означает алкильные группы с прямой или разветвленной цепью, включая все изомеры, имеющие указанное количество атомов углерода. Например, структуры
, этил может быть представлен как “Et” или CH2CH3, пропил может быть представлен как “Pr” или CH2CH2CH3, бутил может быть представлен как “Bu” или CH2CH2CH2CH3, и т.д. “C1-4 алкил” (или “C1-C4 алкил”) например, означает алкильные группы с прямой или разветвленной цепью, включая все изомеры, имеющие указанное количество атомов углерода. Например, структуры
имеют эквивалентные значения. C1-4 алкил включает н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. Если количество не указано, предполагается 1-4 атомов углерода для линейных или разветвленных алкильных групп.
“CCH” относится к атому углерода, связанному тройной связью с CH.
Также в случае, когда в соединениях по настоящему изобретению присутствует группа карбоновой кислоты (-COOH) или спиртовая группа, можно использовать фармацевтически приемлемые сложные эфиры производных карбоновой кислоты, такие как метил, этил или пивалоилоксиметил, или ацильные производные спиртов, такие как О-ацетил О-пивалоил, О-бензоил и О-аминоацил. Включены такие сложные эфиры и ацильные группы, которые известны в данной области техники для модификации характеристик растворимости или гидролиза для использования в виде композиций с замедленным высвобождением или композиций пролекарств.
Диатомит Celite® (Fluka) представляет собой диатомную землю и может называться "целит".
"Циклоалкил" относится к неароматической кольцевой системе, включающей от около 3 до около 5 кольцевых атомов углерода. Неограничивающие примеры моноциклических циклоалкилов включают циклопропил, циклобутил, циклопентил.
"Гетероцикл" относится к насыщенному, частично ненасыщенному или ароматическому кольцевому фрагменту, имеющему по меньшей мере один кольцевой гетероатом и по меньшей мере один кольцевой атом углерода. В одном варианте осуществления гетероатом представляет собой кислород, серу или азот. Гетероцикл, содержащий более одного гетероатома, может содержать разные гетероатомы. Гетероциклильные фрагменты включают как моноциклические, так и полициклические (например, бициклические) кольцевые фрагменты. Бициклические кольцевые фрагменты включают конденсированные, спироциклические и связанные мостиковой связью бициклические кольца и могут включать один или несколько гетероатомов в любом из колец. Кольцо, присоединенное к остальной части молекулы, может содержать или не содержать гетероатом. Любое кольцо бициклического гетероцикла может быть насыщенным, частично ненасыщенным или ароматическим. Гетероцикл может быть присоединен к остальной части молекулы через кольцевой атом углерода, кольцевой атом кислорода или кольцевой атом азота. Неограничивающие примеры гетероциклов описаны ниже.
"Гетероциклоалкил" относится к стабильной циклической группе, содержащей атомы углерода и от 1 до 3 гетероатомов, независимо выбранных из S, N или О. Термин "гетероциклоалкил" предназначен для включения как замещенных, так и незамещенных гетероциклоалкильных групп. Гетероциклоалкильные группы могут быть замещены 1-4 группами, такими как галоген, CH3, CF3 или CF2H. Термин "гетероциклоалкил" охватывает 5-членные кольца, имеющие одну углерод-углеродную двойную связь или одну углерод-азотную двойную связь в кольце (например, 2-пирролинил, 3-пирролинил и т.д.).
"Арил" относится к ароматическому моноциклическому или полициклическому кольцевому фрагменту, включающему от 6 до 14 атомов углерода в кольце, или, более конкретно, от 6 до 10 атомов углерода в кольце. Моноциклические арильные кольца включают, но не ограничиваются этим, фенил и нафтил. Мультициклические кольца включают, но не ограничиваются этим, нафтил и бициклические кольца, где фенил конденсирован с C5-7циклоалкильным или C5-7циклоалкенильным кольцом. Арильные группы могут быть необязательно замещены одним или несколькими заместителями, определенными в настоящей заявке. Связывание может происходить через любой из атомов углерода любого кольца.
"Гетероарил" относится к ароматическому моноциклическому или полициклическому кольцевому фрагменту, включающему кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из S, N или О. Гетероарильные бициклические кольцевые системы могут включать один или несколько гетероатомов в одном или обоих кольцах.
В некоторых вариантах осуществления гетероарильная группа представляет собой 5-10-членную ароматическую кольцевую систему, имеющую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5- 10-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-8-членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-8-членный гетероарил"). В некоторых вариантах осуществления гетероарильная группа представляет собой 5-6-членную ароматическую кольцевую систему, имеющую кольцевые атомы углерода и 1-4 кольцевых гетероатома, присутствующих в ароматической кольцевой системе, где каждый гетероатом независимо выбран из азота, кислорода и серы ("5-6-членный гетероарил"). В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-3 кольцевых гетероатома, независимо выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1-2 кольцевых гетероатома, независимо выбранных из азота, кислорода и серы. В некоторых вариантах осуществления 5-6-членный гетероарил имеет 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. В некоторых вариантах осуществления в каждом случае гетероарильная группа независимо необязательно замещена, например, является незамещенной ("незамещенный гетероарил") или замещена ("замещенный гетероарил") одним или несколькими заместителями. В некоторых вариантах осуществления гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых вариантах осуществления гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Примеры 5-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пирролил, фуранил и тиофенил. Примеры 5-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членных гетероарильных групп, содержащих три гетероатома, включают, без ограничения, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членных гетероарильных групп, содержащих четыре гетероатома, включают, без ограничения, тетразолил. Примеры 6-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пиридинил. Примеры 6-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, пиридазинил, пиримидинил и пиразинил. Примеры 6-членных гетероарильных групп, содержащих три или четыре гетероатома, включают, без ограничения, триазинил и тетразинил, соответственно. Примеры 7-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, азепинил, оксепинил и тиепинил. Примеры 5,6-бициклических гетероарильных групп включают, без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-бициклических гетероарильных групп включают, без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
"Необязательно замещенный" относится к "незамещенному или замещенному", и, следовательно, общие структурные формулы, описанные в настоящей заявке, охватывают соединения, содержащие указанный необязательный заместитель (заместители), а также соединения, которые не содержат необязательный заместитель (заместители). Каждый заместитель определяется независимо каждый раз, когда он встречается в определениях общей структурной формулы.
Термин "замещенный" означает, что один или несколько атомов водорода у обозначенных атомов заменены выбором из указанной группы, при условии, что нормальные валентности атомов в существующих условиях не превышаются, и что замещение приводит к стабильному соединению. Комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к стабильным соединениям.
Если соединения формулы I, Ia, Ib, Ic или Id одновременно содержат кислотные и основные группы в молекуле, изобретение также включает, помимо указанных солевых форм, внутренние соли или бетаины (цвиттерионы). Соли могут быть получены из соединений формулы I, Ia, Ib, Ic или Id обычными методами, которые известны специалисту в данной области, например, путем комбинации с органической или неорганической кислотой или основанием в растворителе или диспергирующей среде, или путем анионного или катионного обмена из других солей. Настоящее изобретение также включает все соли соединений формулы I, Ia, Ib, Ic или Id, которые из-за низкой физиологической совместимости не подходят непосредственно для использования в фармацевтических препаратах, но могут использоваться, например, в качестве промежуточных продуктов для химических реакций или для получения физиологически приемлемых солей.
Изобретение также включает производные соединения формулы I, Ia, Ib, Ic или Id, действующие как пролекарства и сольваты. Любая фармацевтически приемлемая модификация пролекарства соединения по изобретению, которая приводит к преобразованию in vivo в соединение, входящее в объем изобретения, также охватывается объемом изобретения. Пролекарства после введения пациенту преобразуются в организме в результате нормальных метаболических или химических процессов, таких как гидролиз в крови, в соединение формулы I, Ia, Ib, Ic или Id. Такие пролекарства включают пролекарства, которые демонстрируют повышенную биодоступность, тканевую специфичность и/или клеточную доставку для улучшения абсорбции лекарственного средства соединения формулы I, Ia, Ib, Ic или Id. Эффект таких пролекарств может быть результатом модификации физико-химических свойств, таких как липофильность, молекулярная масса, заряд и другие физико-химические свойства, которые определяют проницаемость лекарственного средства. Например, сложные эфиры необязательно можно получить путем этерификации доступной группы карбоновой кислоты или путем образования сложного эфира на доступной гидроксигруппе в соединении. Аналогичным образом можно получить лабильные амиды. Фармацевтически приемлемые сложные эфиры или амиды соединений по настоящему изобретению могут быть получены для действия в качестве пролекарств, которые могут быть гидролизованы обратно до кислоты (или -COO- в зависимости от pH жидкости или ткани, где происходит преобразование) или гидроксильной формы, в частности in vivo, и как таковые входят в объем изобретения. Примеры фармацевтически приемлемых модификаций пролекарств включают, но не ограничиваются этим, -C1-6алкиловые эфиры и -C1-6алкил, замещенный фениловыми эфирами.
Когда какая-либо переменная встречается более одного раза в любом компоненте или в формуле I, ее определение в каждом случае не зависит от ее определения в каждом другом случае. Кроме того, комбинации заместителей и/или переменных допустимы, только если такие комбинации приводят к стабильным соединениям.
Если не указано иное, термин "галоген" означает фтор, хлор, бром или иод.
Где кольцевые атомы представлены переменными, такими как “X”, например,
переменные определяются путем указания атома, расположенного в переменном положении кольца, без изображения кольцевых связей, связанных с этим атомом. Например, когда X в указанном выше кольце представляет собой азот, определение будет показывать "N" и не будет показывать связи, связанные с ним, например, не будет показывать "=N-". Аналогичным образом, когда X представляет собой атом углерода, замещенный бромидом, определение будет показывать "C-Br" и не будет показывать связи, связанные с ним, например, не будет показывать
 .
.
Изобретение также включает производные соединения формулы I, Ia, Ib, Ic или Id, действующие как пролекарства и сольваты. Пролекарства после введения пациенту преобразуются в организме в результате обычных метаболических или химических процессов, таких как гидролиз в крови, в соединение формулы I, Ia, Ib или Ic. Такие пролекарства включают пролекарства, которые демонстрируют повышенную биодоступность, тканевую специфичность и/или клеточную доставку для улучшения абсорбции лекарственного средства соединения формулы I, Ia, Ib или Ic. Эффект таких пролекарств может быть результатом модификации физико-химических свойств, таких как липофильность, молекулярная масса, заряд и другие физико-химические свойства, которые определяют проницаемость лекарственного средства.
Изобретение также относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I, Ia, Ib, Ic или Id и/или фармацевтически приемлемую соль соединения формулы I, Ia, Ib, Ic или Id и/или необязательно стереоизомерную форму соединения формулы I, Ia, Ib, Ic или Id, или фармацевтически приемлемую соль стереоизомерной формы соединения формулы I, Ia, Ib, Ic или Id, вместе с фармацевтически приемлемым носителем, добавкой и/или другими активными и вспомогательными веществами.
Лекарственные средства по изобретению можно вводить пероральным, ингаляционным, ректальным или трансдермальным путем или подкожной, интраартериальной, интраперитонеальной или внутривенной инъекцией. Пероральное введение является предпочтительным. Возможно использование соединений формулы I, Ia, Ib, Ic или Id для покрытия стентов и других поверхностей, контактирующих с кровью в организме.
Изобретение также относится к способу получения лекарственного средства, который включает получение подходящей формы для введения, включающей по меньшей мере одно соединение формулы I, Ia, Ib, Ic или Id, с использованием фармацевтически приемлемого носителя и, необязательно, других подходящих активных веществ, добавок или вспомогательных веществ.
Подходящие твердые или галеновые лекарственные формы представляют собой, например, гранулы, порошки, таблетки с покрытием, таблетки, (микро)капсулы, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекций и препараты с пролонгированным высвобождением активного вещества, для получения которых используются обычные эксципиенты, такие как носители, дезинтегранты, связующие, покрывающие агенты, агенты набухания, глиданты или смазывающие вещества, ароматизаторы, подсластители и солюбилизаторы. Часто используемые вспомогательные вещества, которые можно указать, включают карбонат магния, диоксид титана, лактозу, маннит и другие сахара, тальк, лактозу, желатин, крахмал, целлюлозу и ее производные, животные и растительные масла, такие как масло печени трески, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода и одно- или многоатомные спирты, такие как глицерин.
Режим дозирования с использованием соединений выбирают в соответствии с множеством факторов, включая тип, вид, возраст, массу тела, пол и состояние здоровья пациента; тяжесть состояния, подлежащего лечению; способ введения; функцию почек и печени пациента; и конкретное используемое соединение или его соль. Врач или ветеринар с обычной квалификацией может легко определить и прописать эффективное количество препарата, необходимое для предотвращения, противодействия или остановки прогрессирования заболевания.
Пероральные дозы соединений, при использовании для указанных эффектов, будут в пределах от около 0,01 мг на кг массы тела в день (мг/кг/день) до около 30 мг/кг/день, предпочтительно 0,025-7,5 мг/кг/день, более предпочтительно 0,1-2,5 мг/кг/день и наиболее предпочтительно 0,1-0,5 мг/кг/день (если не указано иное, количества активных ингредиентов указаны в расчете на свободное основание). Например, пациент с массой тела 80 кг должен получать между примерно 0,8 мг/день и 2,4 г/день, предпочтительно 2-600 мг/день, более предпочтительно 8-200 мг/день и наиболее предпочтительно 8-40 мг/кг/день. Соответствующим образом полученное лекарственное средство для введения один раз в день будет, таким образом, содержать между 0,8 мг и 2,4 г, предпочтительно между 2 мг и 600 мг, более предпочтительно между 8 мг и 200 мг и наиболее предпочтительно 8 мг и 40 мг, например, 8 мг, 10 мг, 20 мг и 40 мг. Предпочтительно соединения можно вводить в дробных дозах два, три или четыре раза в день. Для введения два раза в день соответствующим образом полученное лекарственное средство будет содержать между 0,4 мг и 4 г, предпочтительно между 1 мг и 300 мг, более предпочтительно между 4 мг и 100 мг и наиболее предпочтительно 4 мг и 20 мг, например, 4 мг, 5 мг, 10 мг и 20 мг.
При внутривенном введении пациент будет получать активный ингредиент в количествах, достаточных для доставки от около 0,01 мг/кг массы тела в день (мг/кг/день) до около 30 мг/кг/день, предпочтительно 0,025-7,5 мг/кг/день, более предпочтительно 0,1-2,5 мг/кг/день и еще более предпочтительно 0,1-0,5 мг/кг/день. Такие количества можно вводить различными подходящими способами, например большие объемы низких концентраций активного ингредиента в течение одного продолжительного периода времени или несколько раз в день, низкие объемы высоких концентраций активного ингредиента в течение короткого периода времени, например один раз в день. Как правило, можно получить обычную композицию для внутривенного введения, которая содержит концентрацию активного ингредиента примерно от 0,01 до 1,0 мг/мл, например 0,1 мг/мл, 0,3 мг/мл и 0,6 мг/мл, и которую вводят в количествах в день от 0,01 мл/кг массы тела пациента до 10,0 мл/кг массы тела пациента, например 0,1 мл/кг, 0,2 мл/ кг, 0,5 мл/кг. В одном примере пациент с массой тела 80 кг, получающий 8 мл дважды в день внутривенного препарата, имеющего концентрацию активного ингредиента 0,5 мг/мл, получает 8 мг активного ингредиента в день. В качестве буферов можно использовать глюкуроновую кислоту, L-молочную кислоту, уксусную кислоту, лимонную кислоту или любую фармацевтически приемлемую кислоту/сопряженное основание с разумной буферной емкостью в диапазоне pH, приемлемом для внутривенного введения. Выбор подходящего буфера и pH композиции в зависимости от растворимости вводимого лекарственного средства легко может осуществить специалист в данной области.
Соединения по настоящему изобретению можно получить, используя реакции, как показано на следующих схемах реакций, в дополнение к другим стандартным манипуляциям, которые известны из литературы или проиллюстрированы в экспериментальных процедурах. Поэтому приведенные ниже иллюстративные схемы реакций не ограничиваются перечисленными соединениями или какими-либо конкретными заместителями, используемыми для иллюстративных целей. Нумерация заместителей, показанная на реакционных схемах, не обязательно коррелирует с нумерацией, использованной в формуле изобретения, и часто для ясности показан один заместитель, присоединенный к соединению, где необязательно допускаются несколько заместителей в соответствии с определениями формул I, Ia, Ib, Ic или Id, которые приведены выше.
Способы получения соединений по настоящему изобретению
Общие способы
Соединения по настоящему изобретению можно легко получить из известных соединений или коммерчески доступных соединений, например, известными способами, описанными в опубликованных документах, и получить способами получения, описанными ниже. Настоящее изобретение не ограничивается способами получения, описанными ниже. Изобретение также включает способы получения соединений по изобретению.
Следует отметить, что, когда соединение структурной формулы I, Ia, Ib, Ic или Id имеет реакционноспособную группу, такую как гидроксильная группа, аминогруппа, карбоксильная группа или тиольная группа, в качестве заместителя, такая группа может быть адекватно защищена защитной группой на каждой стадии реакции, и защитная группа может быть удалена на соответствующей стадии. Процедуру для такого введения и удаления защитной группы соответствующим образом можно определить в зависимости от группы, которую необходимо защитить, и типа защитной группы, и такое введение и удаление осуществляют, например, с использованием процедур, описанных в обзорной части Greene, T.W., et. al., “Protective Groups in Organic Synthesis”, 2007, 4th Ed., Wiley, New York, или Kocienski, P., “Protecting Groups” 1994, Thieme.
Следует отметить, что, если существует несоответствие между химическим названием и структурой, преимущество имеет структура.
Объем настоящего изобретения не ограничивается конкретными вариантами осуществления, раскрытыми в примерах, которые предназначены для иллюстрации некоторых аспектов изобретения, и любые варианты осуществления, которые являются функционально эквивалентными, находятся в пределах объема этого изобретения. Действительно, различные модификации изобретения в дополнение к тем, которые показаны и описаны в настоящей заявке, станут очевидными для специалистов в соответствующей области техники, и предполагается, что они попадают в объем прилагаемой формулы изобретения.
Все используемые растворители коммерчески доступны, и их использовали без дополнительной очистки. Реакции обычно осуществляли с использованием безводных растворителей в инертной атмосфере азота.
Используемые исходные вещества были либо доступны из коммерческих источников, либо получены в соответствии с описанными в литературе процедурами и имели экспериментальные данные в соответствии с теми, которые указаны.
Используемые аббревиатуры являются традиционными в данной области техники, и представляют собой следующие.
Общие схемы синтеза
Хотя настоящее изобретение было описано в связи с конкретными примерами, изложенными выше, многие альтернативы, модификации и вариации его будут очевидны для специалистов в данной области техники. В некоторых случаях порядок осуществления стадий схем реакций может варьироваться для облегчения реакции, или чтобы избежать нежелательных продуктов реакции. Предполагается, что все такие альтернативы, модификации и вариации находятся в пределах сущности и объема настоящего изобретения. Исходные вещества и промежуточные соединения приобретены из коммерческих источников, получены известными способами или проиллюстрированы иным образом.
Если не указано иное, все переменные имеют значение, определенное выше. Во всех общих схемах Ar означает арил или гетероарил.
Схема 1 :
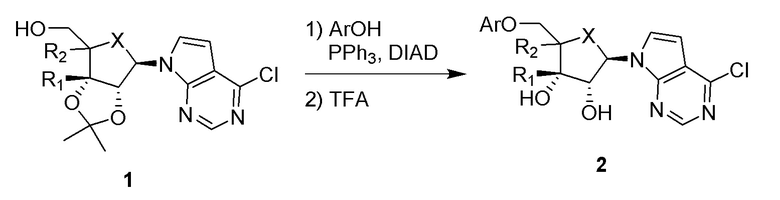
Как показано на схеме 1, подходящий ArOH в присутствии PPh3 и DIAD подвергали взаимодействию с соединением формулы 1, с последующим удалением защиты с использованием TFA, что давало соединение формулы 2.
Схема 2 :
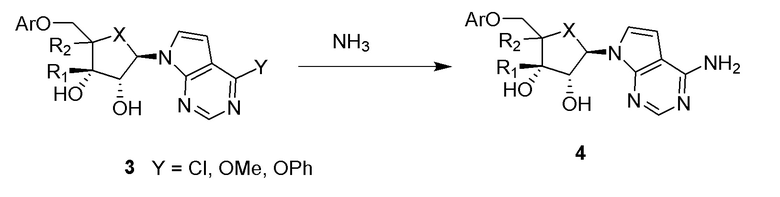
Как показано на схеме 2, удаляемую группу на нуклеоосновании замещали с использованием источника аммиака, что давало соединение формулы 4.
Схема 3 :
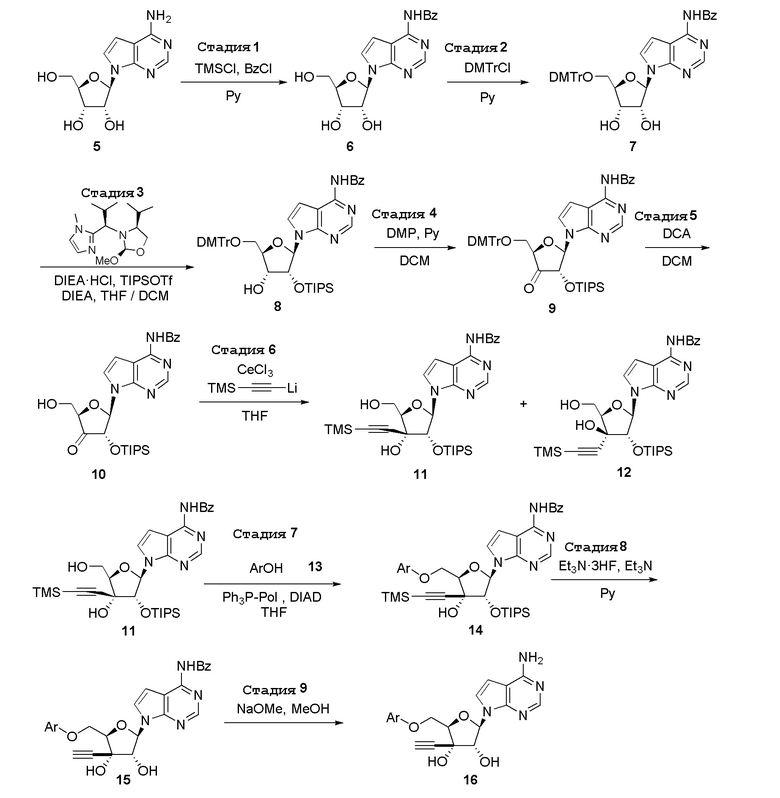
Схема 3 описывает трехстадийную последовательность для селективной защиты нуклеооснования и 2’-спирта, что дает 3’-спирт 8. 3’-спирт затем окисляли с последующим селективным удалением защиты 5’-спирта с получением кетона 10. TMS ацетилен добавляли к кетону 10 с последующим осуществлением реакции Мицунобу с соответствующе замещенным ароматическим или гетероароматическим спиртом с получением эфира 14. Удаление защиты на стадиях 8 и 9 давало соединение формулы 16.
Схема 4 :
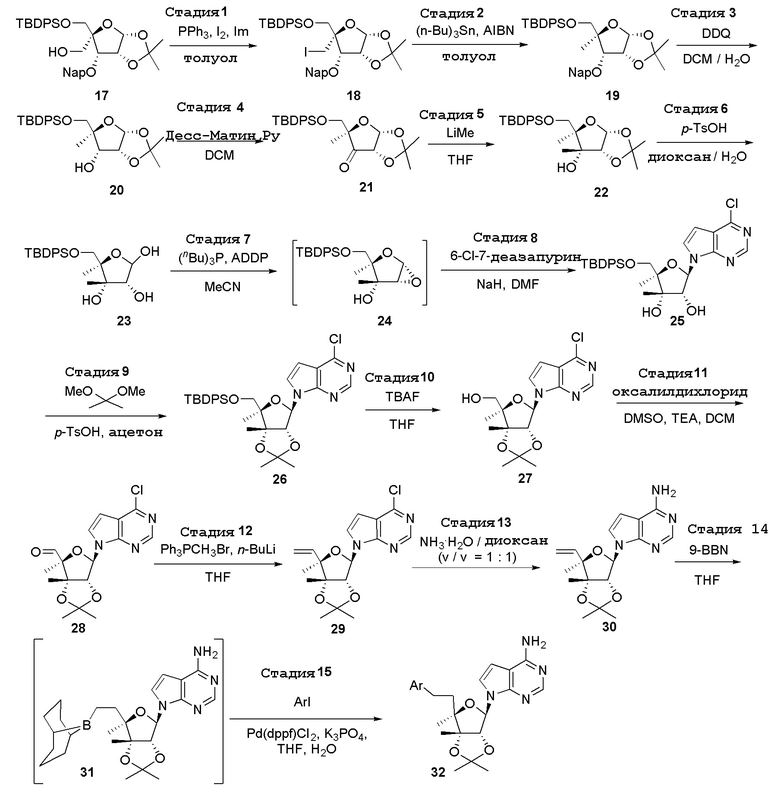
Схема 4 показывает получение 3,4-дизамещенной метилрибозы путем осуществления сначала преобразования спирта 17 в иодид 18, с последующим восстановлением с получением соединения 19. DDQ-опосредованное удаление нафтила с последующим окислением полученного спирта давало кетон 21. Обработка кетона 21 метиллитием давала третичный спирт 22, который обрабатывали п-толуолсульфоновой кислотой с получением триола 23. После образования эпоксида in situ в результате обработки трибутилфосфином и ADDP добавляли соответствующе замещенное нуклеооснование в щелочных условиях с получением диола 25. Диол 25 затем защищали 2,2-диметоксипропаном с последующим удалением силильной защитной группы путем обработки при помощи TBAF с получением спирта 27. Спирт 27 окисляли до альдегида 28 с последующим олефинированием с получением олефина 29. Обработка источником аммиака давала соединение 30. В завершение, образование алкилбороната, а затем реакция сочетания Сузуки давали соединение формулы 32.
Схема 5 :
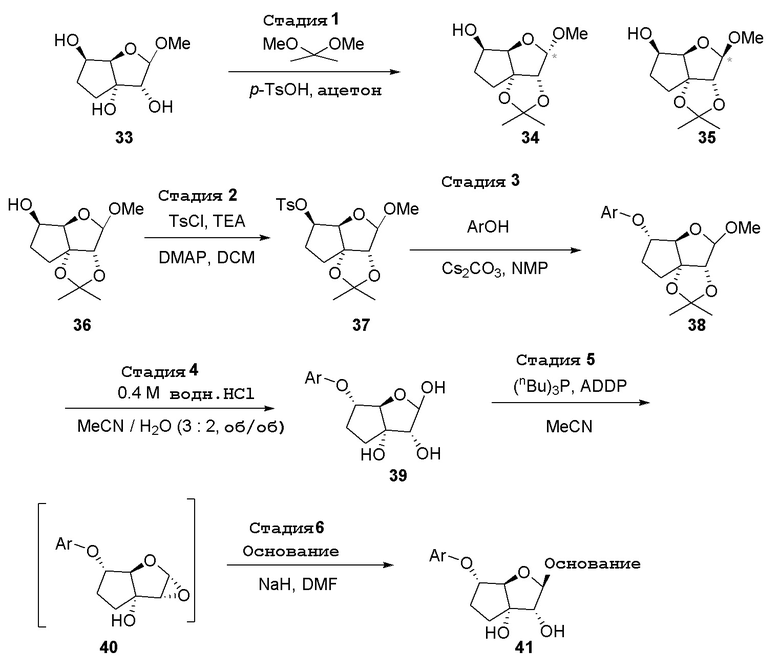
Как показано на схеме 5, после образования ацетонида в присутствии 2,2-диметоксипропана и п-толуолсульфоновой кислоты следовало образование тозилата в щелочных условиях, с получением тозилата 37. Замещение тозилата соответствующе замещенным ариловым или гетероариловым спиртом давало эфир 38, который подвергали процедуре удаления защиты в кислотных условиях с получением триола 39. После образования эпоксида in situ в результате обработки трибутилфосфином и ADDP добавляли соответствующе замещенное нуклеооснование (Основание) в щелочных условиях с получением соединения формулы 41.
Схема 6 :

Как показано на схеме 6, спирт 42 окисляли до кетона 43, олефинирование, образование алкилбороната с последующим катализируемым палладием сочетанием с соответствующе замещенным арил или гетероарилиодидом давали соединение 46. Кислотно-опосредованное удаление защиты, образование эпоксида in situ и затем добавление соответствующе замещенного нуклеооснования (Основание) в щелочных условиях давали соединение формулы 49.
Схема 7:
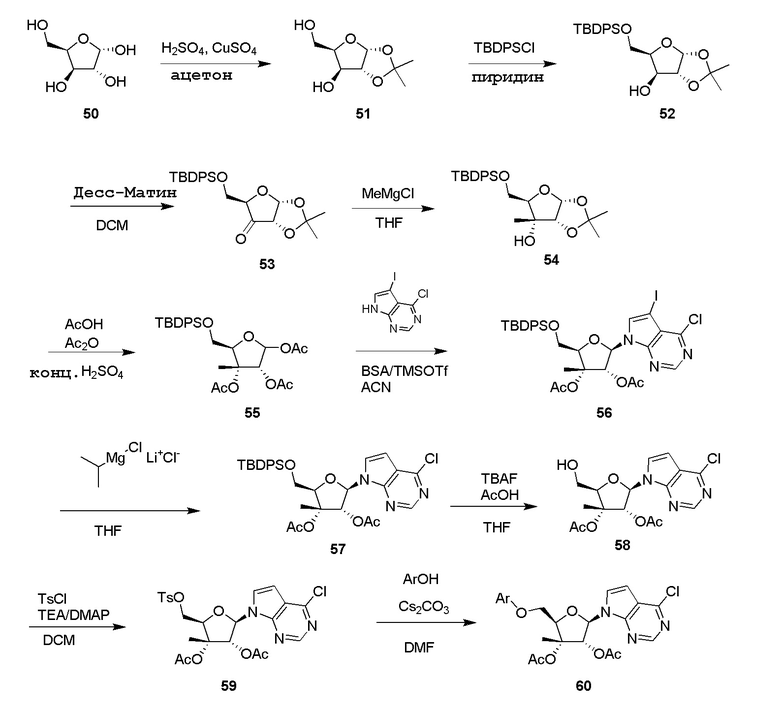
Как показано на схеме 7, образование ацетонида и силилового эфира давало спирт 52. После окисления и добавления метилмагнийбромида осуществляли в одном реакционном сосуде кислотно-опосредованное удаление ацетонидной защиты и образование ацетата с получением соединения 55. Катализируемое кислотой Льюиса добавление соответствующе замещенного нуклеооснования давало соединение 56. Восстановление иодида с последующим снятием защиты силильной группы давало соединение 58. Активация спирта в виде тозилатной удаляемой группы с последующим замещением соответствующе замещенным ариловым или гетероариловым спиртом давали соединение формулы 60.
Схема 8:
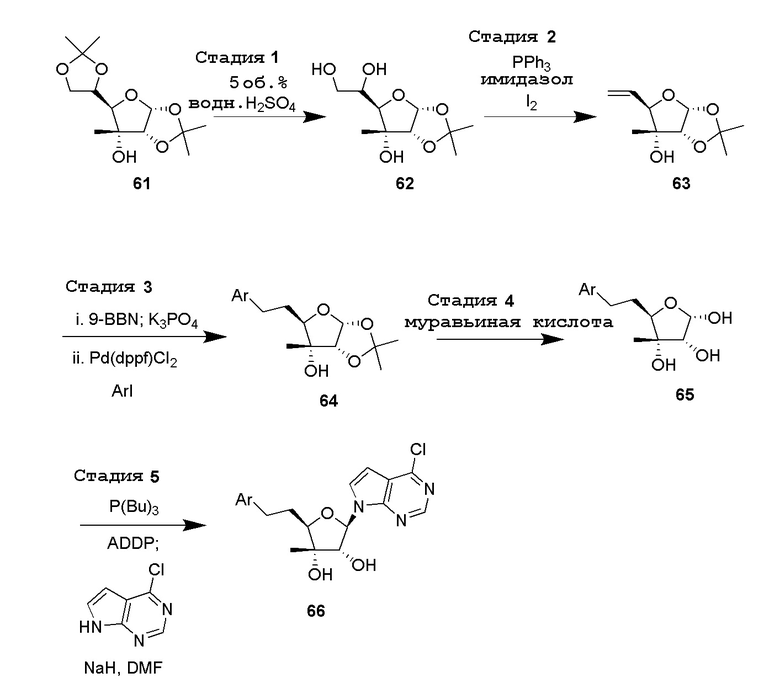
Как показано на схеме 8, один из кеталей в соединении 61 селективно подвергали процедуре снятия защиты и затем преобразовывали в олефин 63. Образование алкилбороната, катализируемое палладием сочетание с соответствующе замещенным арил или гетероарилиодидом, удаление оставшейся защитной группы кеталя, с последующим добавлением соответствующе замещенного нуклеооснования давали соединение формулы 66.
Схема 9:
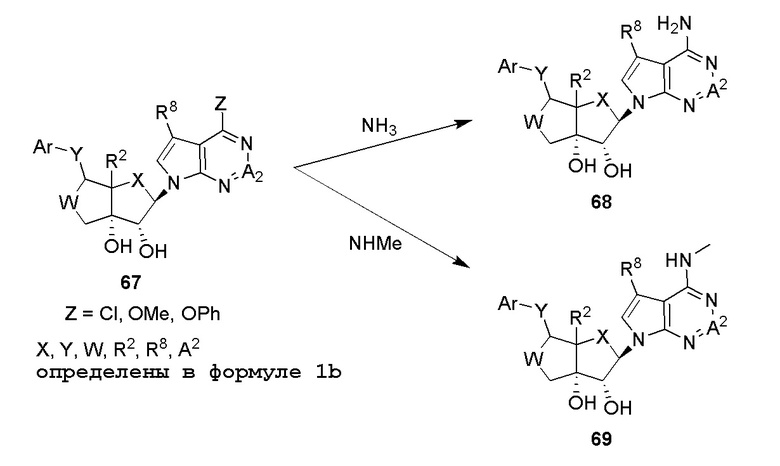
Соединения формул 68 и 69 могут быть получены в следующей последовательности (Схема 9). Соединение 68 получают из 67 путем аминолиза с использованием аммиака, а соединение 69 получают из 67 путем аминолиза с использованием метиламина.
Схема 10:
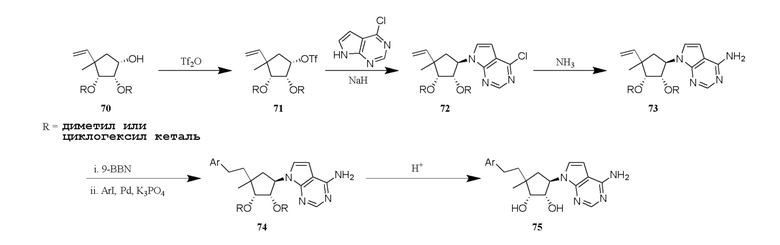
Соединения формулы 75 могут быть получены в следующей последовательности (Схема 10). Сначала получают трифлат 71, с последующим замещением ароматическим амином с получением соединения 72. Замещение хлорида аммиаком, образование алкилбороната, катализируемое палладием перекрестное сочетание и конечное удаление защиты при помощи кислоты давали соединение 75.
Схема 11:
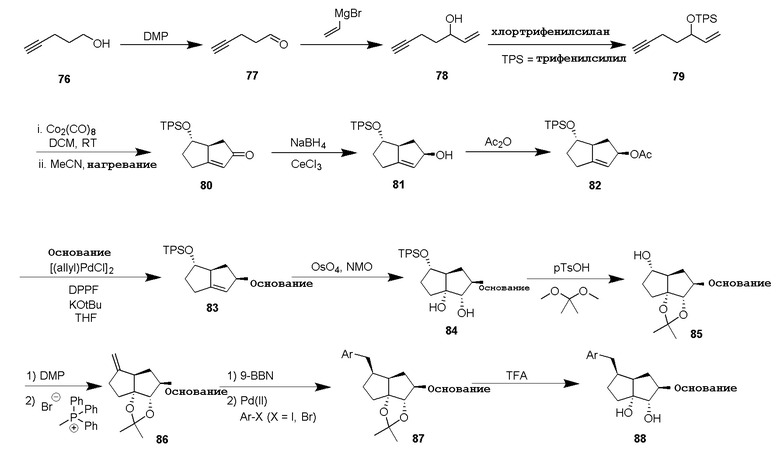
Соединения формулы 88 могут быть получены в следующей последовательности, показанной на схеме 11. Спирт 76 окисляют до альдегида 77 обработкой периодинаном Десса-Мартина, с последующей обработкой винилмагнийбромидом с получением аллилового спирта 78. Спирт 78 обрабатывают трифенилсилилхлоридом, затем осуществляют кобальт-катализируемую реакцию Паусона-Ханда с образованием бициклического енона 80. Енон 80 восстанавливают борогидридом натрия и обрабатывают уксусным ангидридом с получением аллилацетата 82. Аллилацетат 82 подвергают условиям палладий-катализируемого аллильного алкилирования в присутствии соответствующе замещенного нуклеооснования (Основание) с получением соединения 83. Полученный олефин подвергают дигидроксилированию с использованием тетроксида осмия с получением 84. После снятия защиты силилового эфира и образования ацетонида осуществляют окисление периодинаном Десса-Мартина и олефинирование с получением экзоциклического олефина 86. Образование алкилбороната с последующим палладий-катализируемым перекрестным сочетанием с арил или гетероарилгалогенидом давали соединение 87. Снятие защиты ацетонида кислотой давало соединение 88.
Схема 12:
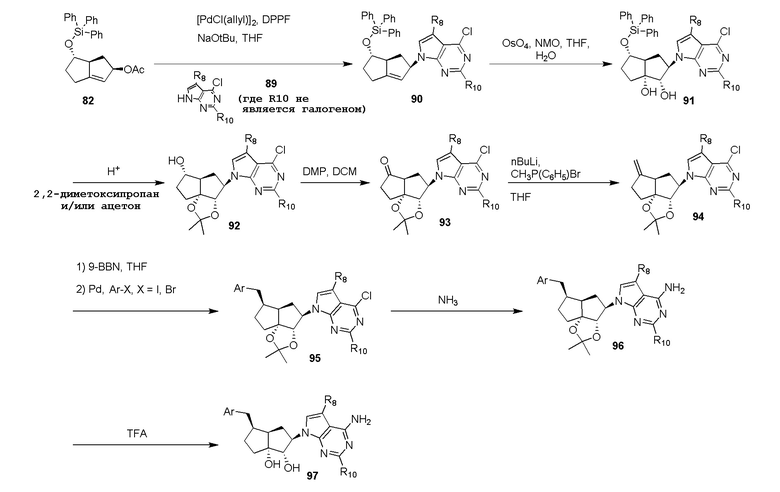
Соединения формулы 97 могут быть получены в следующей последовательности, показанной на схеме 12. Аллилацетат 82 подвергали условиям палладий-катализируемого аллильного алкилирования в присутствии соответствующе замещенного нуклеооснования (89) с получением соединения 90. Полученный олефин подвергали дигидроксилированию с использованием тетроксида осмия с получением 91. После снятия защиты силилового эфира и образования ацетонида осуществляли окисление периодинаном Десса-Мартина и олефинирование с получением экзоциклического олефина 94. Образование алкилбороната с последующим палладий-катализируемым перекрестным сочетанием с арил или гетероарилбромидом давали соединение 95. Замещение хлорида аммиаком с последующим снятием защиты ацетонида при помощи кислоты давали соединение 97.
Схема 13:
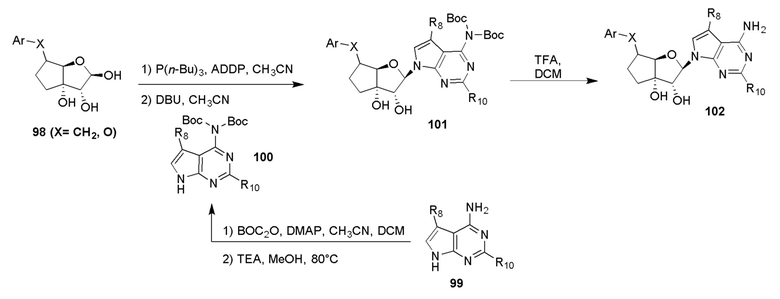
Соединения формулы 102 могут быть получены в следующей последовательности, показанной на схеме 13. Замещенное аминонуклеооснование 99 подвергали процедуре введения BOC-защиты. Соединение 98 подвергали реакции Мицунобу для введения защищенного нуклеооснования (100) с образованием соединения 101. Кислотно-опосредованное удаление защиты давало соединение 102.
Схема 14:
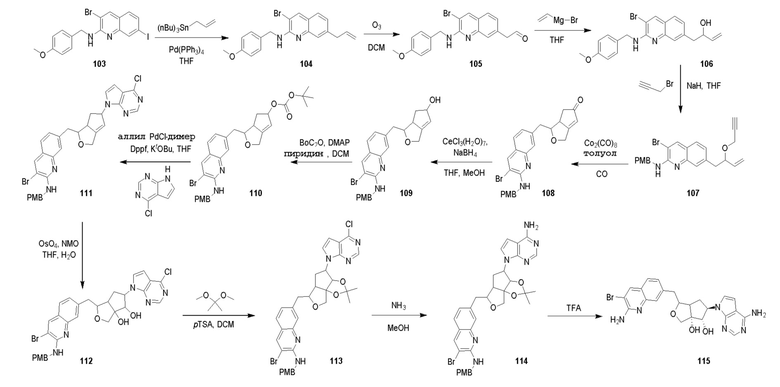
Соединения формулы 115 могут быть получены в следующей последовательности, показанной на схеме 14. Хинолиниодид 103 подвергали условиям реакции Стилле с получением олефина 104. Последующий озонолиз и добавление винила Гриньяра давали спирт 106. Алкилирование давало ен-ин 107, которые подвергали кобальт-катализируемой реакции Паусона-Ханда с получением енона 108. Восстановление и образование карбоната давали карбонат 110. Палладий-катализируемое аллильное алкилирование давало бицикл 111. Дигидроксилирование олефина и ацетонидная защита давали кеталь 113. Последующее замещение хлорида аммиаком и удаление защиты при помощи кислоты давали соединение 115.
Схема 15:
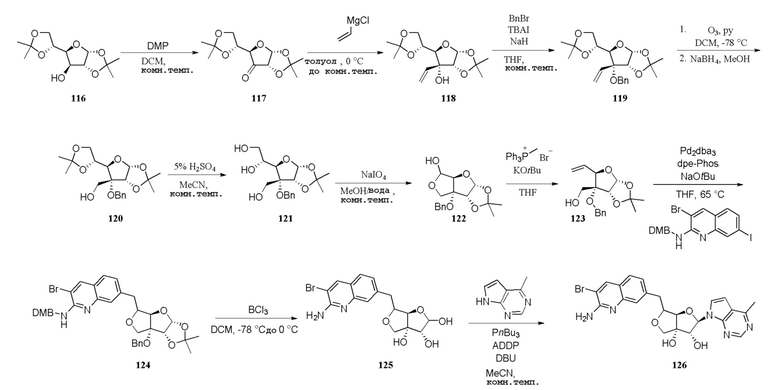
Соединения формулы 126 могут быть получены в следующей последовательности, показанной на схеме 15. Сахар 116 окисляли периодинаном Десса-Мартина с получением кетона 117. Добавление винила Гриньяра с последующей бензильной защитой давали олефин 119, который затем подвергали озонолизу и восстановлению с получением спирта 120. Селективное снятие ацетонидной защиты давало триол 121, который подвергали окислительному расщеплению и циклизации с получением лактола 122. Гомологизация Виттига давала олефин 123, который затем подвергали палладий-катализируемой циклизации/арилированию с получением бицикла 124. Глобальное удаление защиты при помощи BCl3 с последующим установлением нуклеооснования давали соединение 126.
Схема 16:
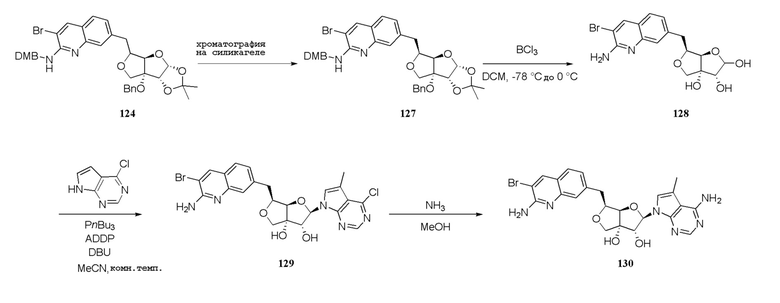
Соединения формулы 130 могут быть получены в следующей последовательности, показанной на схеме 16. Хроматографическая очистка соединения 124 давала бицикл 127. Глобальное удаление защиты при помощи BCl3 с последующим установлением нуклеооснования давали соединение 129. Замещение хлорида аммиаком давало соединение 130.
СИНТЕЗ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Схема синтеза промежуточного соединения 1
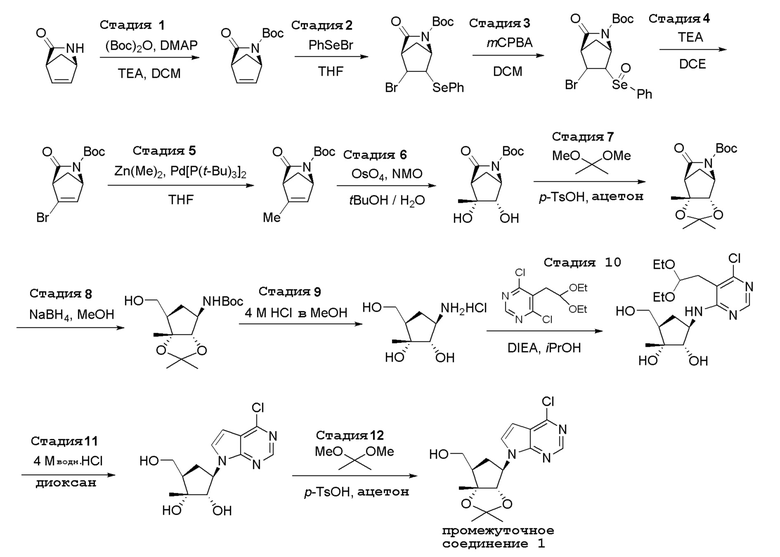
Промежуточное соединение 1: ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанол
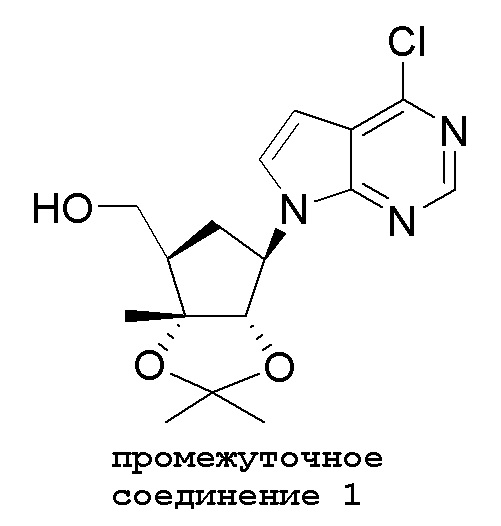
Стадия 1: К смеси (1R,4S)-2-азабицикло[2.2.1]гепт-5-ен-3-она (50 г, 458 ммоль), ди-трет-бутилдикарбоната (120 г, 550 ммоль) и N, N-диметилпиридин-4-амина (5,6 г, 45,8 ммоль) в DCM (500 мл) добавляли триэтиламин (69,5 г, 687 ммоль) при 25°C. Реакционную смесь перемешивали в течение 2 часов при 25°C. Реакцию гасили насыщенным водным раствором NaHCO3 (1500 мл) и экстрагировали при помощи EtOAc (2000 мл × 3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле и элюировали смесью 0-20% этилацетата в петролейном эфире с получением (1R,4S)-трет-бутил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата. MS: 154 (M-55).
Стадия 2: К раствору (1R,4S)-трет-бутил 3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (40 г, 191 ммоль) в THF (400 мл) добавляли фенилгипобромселеноит (49,6 г, 210 ммоль) в THF (1,0 л) по каплям при -78°C в атмосфере аргона. Смесь перемешивали в течение 2 часов при -78°C и затем медленно температуру повышали до 25°C. Реакционную смесь перемешивали при 25°C в течение 16 часов. Реакцию гасили насыщенным водным раствором NaHCO3 (500 мл) и экстрагировали при помощи DCM (500 мл × 3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле и элюировали смесью 1%-20% этилацетата в петролейном эфире с получением (1R,4R)-трет-бутил 5-бром-3-оксо-6-(фенилселанил)-2-азабицикло[2.2.1]гептан-2-карбоксилата (смесь двух изомеров). MS: 390/392 (M-55/M-53). 1H ЯМР (400 МГц, DMSO-d6) изомер 1: δ 7,73-7,59 (м, 2H), 7,44-7,26 (м, 3H), 4,65 (т, J=4,0 Гц, 1H), 4,38 (с, 1H), 3,55 (т, J=3,4 Гц, 1H), 3,05 (кв., J=1,8 Гц, 1H), 2,29-2,16 (м, 1H), 2,04 (дт, J=11,1, 1,4 Гц, 1H),1,31 (с, 9H). изомер 2: δ 7,73-7,59 (м, 2H), 7,44-7,26 (м, 3H), 4,73 (т, J=2,0 Гц, 1H), 4,33 (дд, J=3,6, 2,0 Гц, 1H), 4,24 (т, J=3,1 Гц, 1H), 3,05 (кв., J=1,8 Гц, 1H), 2,42 (дкв., J=10,7, 1,9 Гц, 1H), 2,29-2,16 (м, 1H), 1,36 (с, 9H).
Стадия 3: К раствору (1R,4R)-трет-бутил 5-бром-3-оксо-6-(фенилселанил)-2-азабицикло[2.2.1]гептан-2-карбоксилата (33 г, 74,1 ммоль) в DCM (150 мл) добавляли 3-хлорпербензойную кислоту (20,1 г, 82 ммоль) несколькими порциями при -78°C в атмосфере аргона. Полученную смесь перемешивали в течение 2 часов при -78°C. Реакцию гасили насыщенным водным раствором NaHCO3 (100 мл) и экстрагировали при помощи DCM (300 мл × 3). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного продукта (1R,4R)-трет-бутил 5-бром-3-оксо-6-(фенилселенинил)-2-азабицикло[2.2.1]гептан-2-карбоксилата. MS: 462/464 (M+1/M+3).
Стадия 4: К перемешиваемой смеси (1R,4R)-трет-бутил 5-бром-3-оксо-6-(фенилселенинил)-2-азабицикло[2.2.1]гептан-2-карбоксилата (127 г, 274 ммоль) в DCE (1000 мл) добавляли триэтиламин (76 мл, 549 ммоль) при 25°C. Полученную смесь перемешивали в течение 6 часов при 80°C. Реакционную смесь охлаждали до комнатной температуры и гасили водой (500 мл). Органические слои отделяли, промывали насыщенным солевым раствором (100 мл × 2), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле, элюировали смесью 0-10% этилацетата в петролейном эфире с получением (1R,4R)-трет-бутил 5-бром-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата. 1H ЯМР (400 МГц, DMSO-d6) δ 7,20 7,20 (д, J=2,6 Гц, 1H), 4,96 (т, J=2,6 Гц, 1H), 3,42 (т, J=2,8 Гц, 1H), 2,40 (т, J=1,8 Гц, 2H), 1,44 (с, 9H).
Стадия 5 (способ A): К перемешиваемому раствору (1R,4R)-трет-бутил 5-бром-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (15 г, 52,1 ммоль) в толуоле (50 мл) добавляли Pd(PPh3)4 (6,0 г, 5,2 ммоль) и тетраметилстаннан (28,9 мл, 208 ммоль) при 25°C. Смесь перемешивали в течение 6 часов при 100°C в герметично закрытой пробирке. Реакционную смесь гасили насыщенным раствором NaHCO3 (200 мл) и экстрагировали при помощи EtOAc (300 мл × 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле, элюировали смесью 0-3% EtOAc в смеси петролейный эфир/DCM (об.:об., 5/1) с получением (1R,4S)-трет-бутил 5-метил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата. 1H ЯМР (300 МГц, DMSO-d6) δ 6,51-6,42 (м, 1H), 4,78 (п, J=2,2 Гц, 1H), 3,12 (д, J=2,8 Гц,1H), 2,25 (д, J=8,4 Гц, 1H), 2,12-2,10 (м, 1H), 1,87 (с, 3H), 1,40 (с, 9H).
Стадия 5 (способ B): К перемешиваемому раствору (1R,4R)-трет-бутил 5-бром-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (26 г, 90 ммоль) в THF (250 мл) добавляли диметилцинк (1 M в толуоле, 180 мл, 180 ммоль) по каплям и бис(три-трет-бутилфосфин)палладий(0) (0,92 г, 1,8 ммоль) при 0°C. Полученную смесь перемешивали в течение 16 часов при 20°C. Реакцию гасили насыщенным водным раствором NH4Cl (400 мл) и экстрагировали при помощи DCM (500 мл × 2). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюировали смесью 0-3% EtOAc в смеси петролейного эфира и DCM (об./об. = 5:1) с получением (1R,4S)-трет-бутил 5-метил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата. 1H ЯМР (400 МГц, DMSO-d6) δ 6,53-6,47 (м, 1H), 4,82-4,80 (м, 1H), 3,16-3,14 (м, 1H), 2,28 (дт, J=8,4, 1,8 Гц, 1H), 2,12-2,10 (м, 1H), 1,90 (с, 3H), 1,43 (с, 9H).
Стадия 6: К раствору (1R,4S)-трет-бутил 5-метил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (5 г, 22,4 ммоль) в tBuOH (25 мл)/воде (25 мл) добавляли 4-метилморфолин 4-оксид (5,25 г, 44,8 ммоль) при 0°C в атмосфере аргона. Затем добавляли оксид осмия (VIII) (18,5 мл, 22,4 ммоль, 4% в вод) по каплям при 0°C. Смесь перемешивали в течение 16 часов при комнатной температуре. Реакцию гасили добавлением насыщенного водного раствора Na2S2O3 (30 мл), затем экстрагировали при помощи EtOAc (30 мл × 4). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле и элюировали смесью 0-70% этилацетата в петролейном эфире. Фракции, содержащие желаемый продукт, объединяли и концентрировали при пониженном давлении с получением (1R,4S,5R,6S)-трет-бутил 5,6-дигидрокси-5-метил-3-оксо-2-азабицикло[2.2.1]гептан-2-карбоксилата. 1H ЯМР (300 МГц, DMSO-d6) δ 5,54 (д, J=5,7 Гц, 1H), 4,96 (с, 1H), 4,04 (с, 1H), 3,49-3,37 (м, 1H), 2,37 (д, J=2,4 Гц, 1H), 2,11 (дд, J=10,5, 1,8 Гц, 1H), 1,98-1,80 (м, 1H), 1,45 (с, 9H), 1,21 (с, 3H).
Стадия 7: (1R,4S,5R,6S)-трет-бутил-5,6-дигидрокси-5-метил-3-оксо-2-азабицикло[2.2.1] гептан-2-карбоксилат (1,4 г, 5,4 ммоль) совместно упаривали с безводным толуолом (10 мл × 3) и затем снова растворяли в ацетоне (10 мл). К этому раствору добавляли 4-метилбензолсульфоновую кислоту (0,094 г, 0,5 ммоль), с последующим добавлением 2,2-диметоксипропана (2,83 г, 27,2 ммоль) при комнатной температуре. Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь нейтрализовали насыщенным водным раствором NaHCO3 до pH 7. Смесь концентрировали досуха. Неочищенный продукт очищали колоночной хроматографией на силикагеле и элюировали смесью 10-50% этилацетата в петролейном эфире с получением (3aS,4R,7S,7aR)-трет-бутил 2,2,7a-триметил-6-оксотетрагидро-4,7-methano[1,3]диоксолo[4,5-c]пиридин-5(6H)-карбоксилата. 1H ЯМР (400 МГц, Хлороформ-d) δ 4,39 (т, J=1,6 Гц, 1H), 4,21 (д, J=1,5 Гц, 1H), 2,71 (кв., J=1,6 Гц, 1H), 2,23-2,19 (м, 1H), 2,07-2,00 (м, 1H), 1,61 (с, 3H), 1,53 (с, 9H), 1,49 (с, 3H), 1,48 (с, 3H).
Стадия 8: К раствору (3aS,4R,7S,7aR)-трет-бутил 2,2,7a-триметил-6-оксотетрагидро-4,7-метано[1,3]диоксолo[4,5-c]пиридин-5(6H)-карбоксилата (2,9 г, 9,8 ммоль) в MeOH (58 мл) добавляли NaBH4 (0,74 г, 19,5 ммоль) при 0°C. Смесь перемешивали в течение 2 часов при 0°C. Реакционную смесь гасили насыщенным водным раствором NH4Cl (50 мл) и экстрагировали этилацетатом (60 мл × 3). Объединенные органические слои концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле и элюировали смесью 0-40% EtOAc в петролейном эфире. Собранные фракции объединяли и концентрировали в вакууме с получением трет-бутил ((3aS,4R,6R,6aR)-6-(гидроксиметил)-2,2,6a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)карбамата. 1H ЯМР (300 МГц, DMSO-d6) 7,05 (шир.с, 1H), 4,49 (т, J=5,0 Гц, 1H), 3,86 (д, J=2,8 Гц, 1H), 3,77-3,74 (м, 1H), 3,55-3,44 (м, 1H), 3,31-3,25 (м, 1H), 2,07-1,97 (м, 1H), 2,21-2,14 (м, 1H), 1,40 (с, 9H), 1,40-1,39 (м, 1H), 1,38 (с, 3H), 1,25 (с, 3H), 1,23 (с, 3H).
Стадия 9: Трет-бутил ((3aS,4R,6R,6aR)-6-(гидроксиметил)-2,2,6a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)карбамат (3,5 г, 11,6 ммоль) растворяли в HCl (30 мл, 4 M в метаноле). Полученный раствор перемешивали при температуре окружающей среды в течение 2 ч. Раствор концентрировали с получением неочищенного продукта (1R,2S,3R,5R)-3-амино-5-(гидроксиметил)-1-метилциклопентан-1,2-диол гидрохлорида. 1H ЯМР (300 МГц, DMSO-d6) δ 8,21 (шир.с, 3H), 5,21 (шир.с, 1H), 4,60-4,31 (м, 2H), 3,52 (д, J=9,0 Гц, 1H), 3,44 (дд, J=10,5, 5,1 Гц, 1H), 3,32-3,19 (м, 2H), 2,18-2,07 (м, 1H), 2,00-1,76 (м, 1H), 1,46-1,36 (м, 1H), 1,10 (с, 3H).
Стадия 10: К перемешиваемой смеси (1R,2S,3R,5R)-3-амино-5-(гидроксиметил)-1-метилциклопентан-1,2-диол гидрохлорида (1,85 г, 9,4 ммоль) и 4,6-дихлор-5-(2,2-диэтоксиэтил)пиримидина (2,73 г, 10,3 ммоль) в 2-пропанол (40 мл) добавляли N-этил-N-изопропилпропан-2-амин (2,42 г, 18,7 ммоль) при 25°C. Реакционную смесь перемешивали в течение 16 часов при 100°C. Реакционную смесь охлаждали до комнатной температуры и концентрировали досуха. Остаток очищали колоночной хроматографией на силикагеле (0-15% MeOH в DCM) с получением (1R,2S,3R,5R)-3-((6-хлор-5-(2,2-диэтоксиэтил)пиримидин-4-ил)амино)-5-(гидроксиметил)-1-метилциклопентан-1,2-диола. MS: 390 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,15 (с, 1H), 6,79 (д, J=7,5 Гц, 1H), 4,68-4,56 (м, 2H), 4,50-4,40 (м, 1H), 4,37-4,30 (м, 1H), 4,01 (с, 1H), 3,76-3,58 (м, 2H), 3,50-3,39 (м, 4H), 3,35-3,25 (м, 1H), 2,92-2,90 (м, 2H), 2,25-2,18 (м, 1H), 1,94-1,85 (м, 1H), 1,31-1,24 (м, 1H), 1,21-1,02 (м, 9H).
Стадия 11: К перемешиваемому раствору (1R,2S,3R,5R)-3-((6-хлор-5-(2,2-диэтоксиэтил)пиримидин-4-ил)амино)-5-(гидроксиметил)-1-метилциклопентан-1,2-диола (10 г, 25,6 ммоль) в 1,4-диоксане (80 мл) добавляли по каплям водный раствор HCl (20 мл, 80 ммоль, 4 M в воде) при комнатной температуре. Полученную смесь перемешивали в течение 0,5 часов при 50°C. Затем смесь охлаждали до 0°C на ледяной бане и нейтрализовали насыщенным водным раствором NaHCO3 до pH ~ 8-9. Полученную смесь концентрировали досуха и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью 0-10% MeOH в DCM, с получением (1R,2S,3R,5R)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)-1-метилциклопентан-1,2-диола. MS: 298 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,62 (с, 1H), 7,89 (д, J=3,6 Гц, 1H), 6,71 (д, J=3,6 Гц, 1H), 5,10 (кв., J=9,6 Гц, 1H), 4,86 (д, J=7,2 Гц, 1H), 4,73 (т, J=4,8 Гц, 1H), 4,27 (с, 1H), 4,05 (дд, J=9,6, 7,2 Гц, 1H), 3,54-3,51 (м, 2H), 2,41-2,33 (м, 1H), 2,05-1,95 (м, 1H), 1,73-1,66 (м, 1H), 1,21 (с, 3H).
Стадия 12: (1R,2S,3R,5R)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)-1-метилциклопентан-1,2-диол (2,03 г, 6,8 ммоль) совместно упаривали с безводным толуолом (10 мл × 3) и затем снова растворяли в ацетоне (20 мл). К этому раствору добавляли 4-метилбензолсульфоновую кислоту (0,12 г, 0,68 ммоль) с последующим добавлением 2,2-диметоксипропана (3,55 г, 34,1 ммоль). Полученную смесь перемешивали при 25°C в течение 1 часа. Затем раствор нейтрализовали насыщенным водным раствором NaHCO3 до pH ~7-8. Полученную смесь экстрагировали при помощи EtOAc (30 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле и элюировали смесью 0-70% этилацетата в петролейном эфире с получением ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола. MS: 338 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (с, 1H), 7,94 (д, J=3,6 Гц, 1H), 6,74 (д, J=3,6 Гц, 1H), 5,20-5,10 (м, 1H), 4,56 (т, J=5,2 Гц, 1H), 4,41 (д, J=4,4 Гц, 1H), 3,64 (дт, J=10,5, 5,2 Гц, 1H), 3,54-3,35 (м, 1H), 2,44-2,26 (м, 2H), 2,28-2,11 (м, 1H), 1,49 (с, 6H), 1,26 (с, 3H).
Схема синтеза промежуточного соединения 2
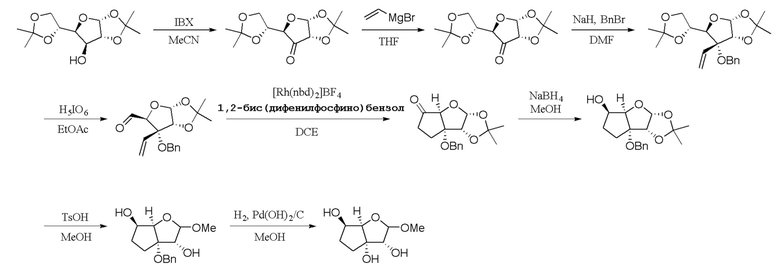
Промежуточное соединение 2: (3R,3aS,6R,6aR)-2-метоксигексагидро-3aH-циклопента[b]фуран-3,3a,6-триол
Стадия 1: К раствору (3aR,5S,6S,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (500 г, 1,92 моль) в MeCN (2,50 л) при 25°C медленно добавляли IBX (807 г, 2,88 моль) при 20~25°C. Реакционную смесь перемешивали при 85~90°C в течение 3 часов. Смесь фильтровали и концентрировали. Неочищенный продукт (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(5H)-он использовали на следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3) δ: 6,14 (д, J=4,4 Гц, 1H), 4,31-4,45 (м, 3H), 4,00-4,06 (м, 2H), 1,46 (с, 3H), 1,43 (с, 3H), 1,34 (с, 6H).
Стадия 2: К раствору (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(5H)-она (500 г, 1,94 моль) в безводном THF (2,50 л), охлажденному до 0~5°C, добавляли винилмагнийбромид (1 M, 3,87 л), поддерживая температуру при 0~5°C. Реакционную смесь нагревали до 15~20°C и перемешивали в течение 0,5 часа. Реакционную смесь гасили, выливая смесь в водный раствор NH4Cl (10 л) при 0~5°C. Водную фазу экстрагировали при помощи MTBE (3 л × 3). Объединенную органическую фазу промывали насыщенным солевым раствором (2 л), сушили безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (диоксид кремния, петролейный эфир/этилацетат=1/0 до 5/1) с получением (3aR,5R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола.
Стадия 3: К раствору NaH (105 г, 2,62 моль, 60% дисперсия в минеральном масле) в DMF (2,75 л) при 15~20°C добавляли (3aR,5R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (375 г, 1,31 моль) в DMF (1 л) по каплям при 15~20°C. Реакционную смесь перемешивали при 55~60°C в течение 1 ч, затем добавляли BnBr (336 г, 1,96 моль, 233 мл). Реакционную смесь перемешивали при 15~20°C еще в течение 5 часов. Реакцию гасили выливая смесь в ледяную воду (1,5 л). Полученную смесь экстрагировали этилацетатом (2 л × 3). Объединенную органическую фазу промывали водным раствором NaHCO3 (1,5 л), сушили безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол использовали без дополнительной очистки.
Стадия 4: К раствору (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксола (400 г, 1,06 моль) в EtOAc (2 л) при 15~20°C добавляли периодную кислоту (250 г, 1,09 моль) и полученную смесь перемешивали в течение 1 часа. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (диоксид кремния, петролейный эфир/этилацетат=20/1 до 0/1) с получением (3aR,5S,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбальдегида. 1H ЯМР (400 МГц, CDCl3) δ: 9,58 (с, 1H), 7,26-7,43 (м, 5H), 5,97 (д, J=3,20 Гц, 1H), 5,78-5,76 (м, 1H), 5,38-5,54 (м, 2H), 4,59-4,73 (м, 4H), 1,62 (с, 3H), 1,40 (с, 3H)
Стадия 5: К суспензии [Rh(nbd)2]BF4 (6,14 г, 16,4 ммоль) в DCE (60 мл) при 15~20°C в атмосфере N2 добавляли 1,2-бис(дифенилфосфино)бензол (6,10 г, 13,7 ммоль). Суспензию дегазировали при пониженном давлении, продували H2 три раза и H2 барботировали через раствор в течение 0,25 часа. Реакционную смесь снова продували N2 в течение 0,25 часа для удаления H2. (3aR,5S,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбальдегид (50,0 г, 164 ммоль) в DCE (60 мл) добавляли по каплям к полученному раствору при 15~20°C в атмосфере N2. Смесь перемешивали при 75~80°C в течение 12 часов. Смесь фильтровали и растворитель удаляли с получением неочищенного (3aR,4aS,7aS,7bR)-7a-(бензилокси)-2,2-диметилгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-она. 1H ЯМР: (400 МГц, CDCl3) δ: 7,5-7,25 (м, 5H), 5,94 (м, 1H), 4,69 (м, 1H), 4,63-4,57 (м, 2H), 4,18 (с, 1H), 2,40-2,56 (м, 3H), 1,68-1,74 (м, 1H), 1,61 (с, 3H), 1,40 (с, 3H)
Стадия 6: NaBH4 (37,3 г, 986 ммоль) добавляли к смеси (3aR,4aS,7aS,7bR)-7a-(бензилокси)-2,2-диметилгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-она (150 г, 493 ммоль) в MeOH (750 мл) при 0~5°C. Смесь перемешивали при 0~5°C в течение 1 часа. Остаток выливали в ледяную воду (250 мл) и водную фазу экстрагировали этилацетатом (250 мл × 3). Объединенные органические фазы промывали насыщенным солевым раствором (125 мл), сушили безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (диоксид кремния, петролейный эфир/этилацетат=20/1 до 0/1) с получением (3aR,4aR,5R,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ола. 1H ЯМР: (400 МГц, CDCl3) δ: 7,33-7,40 (м, 5H), 5,88 (д, J=3,6 Гц, 1H), 4,65 (д, J=10,8 Гц, 1H), 4,56 (д, J=3,2 Гц, 1H), 4,45-4,51 (м, 2H), 4,18-4,29 (м, 1H), 2,06-2,26 (м, 3H), 1,66-1,77 (м, 1H), 1,66-1,77 (м, 1H), 1,62 (с, 3H), 1,41 (с, 3H)
Стадия 7: К раствору TsOH (10,8 г, 62,7 ммоль) в MeOH (150 мл) при 15~20°C добавляли 3aR,4aR,5R,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ол (30,0 г, 97,9 ммоль). Смесь перемешивали при 15~20°C в течение 12 часов. Реакционную смесь выливали в ледяную воду (16 мл) и нейтрализовали водным раствором Na2CO3 (25 мл). Водную фазу экстрагировали этилацетатом (100 мл × 4). Объединенные органические фракции промывали насыщенным солевым раствором (100 мл), сушили безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (диоксид кремния, петролейный эфир/этилацетат=20/1 до 0/1) с получением (3R,3aS,6R,6aR)-3a-(бензилокси)-2-метоксигексагидро-2H-циклопента[b]фуран-3,6-диола. 1H ЯМР: (400 МГц, CDCl3) δ: 7,26-7,40 (м, 5H), 4,93-5,03 (м, 1H), 4,52-4,76 (м, 1H), 4,33-4,45 (м, 1H), 4,00-4,19 (м, 1H), 3,78-3,97 (м, 1H), 3,46 (д, J=7,6 Гц, 3H), 2,98-3,04 (м, 1H), 2,20-2,34 (м, 1H), 1,82-2,12 (м, 4H).
Стадия 8: Pd(OH)2/C (1,70 г, 2,42 ммоль, нагрузка 20% масс.) добавляли к (3R,3aS,6R,6aR)-3a-(бензилокси)-2-метоксигексагидро-2H-циклопента[b]фуран-3,6-диолу (17,0 г, 60,7 ммоль) в MeOH (150 мл) при 15~20°C в атмосфере N2 с последующим добавлением уксусной кислоты (2,98 г, 49,5 ммоль, 2,83 мл). Суспензию дегазировали при пониженном давлении и продували H2 несколько раз. Смесь затем перемешивали в атмосфере H2 (50 ф/дюйм2(3,515 кг/см2)) при 50~55°C в течение 12 часов. Реакционную смесь фильтровали и концентрировали при пониженном давлении с получением (3R,3aS,6R,6aR)-2-метоксигексагидро-3aH-циклопента[b]фуран-3,3a,6-триола. 1H ЯМР: (400 МГц, CDCl3) δ: 5,00 (д, J=4,0 Гц, 1H), 4,94 (д, J=2,0 Гц, 1H), 4,22-4,18 (м, 1H), 4,16-4,13 (м, 2H), 3,76-3,83 (м, 1H), 3,47 (д, J=13,8 Гц, 3H), 2,14-1,96 (м, 2H), 1,81-1,62 (м, 2H).
Схема синтеза промежуточного соединения 3
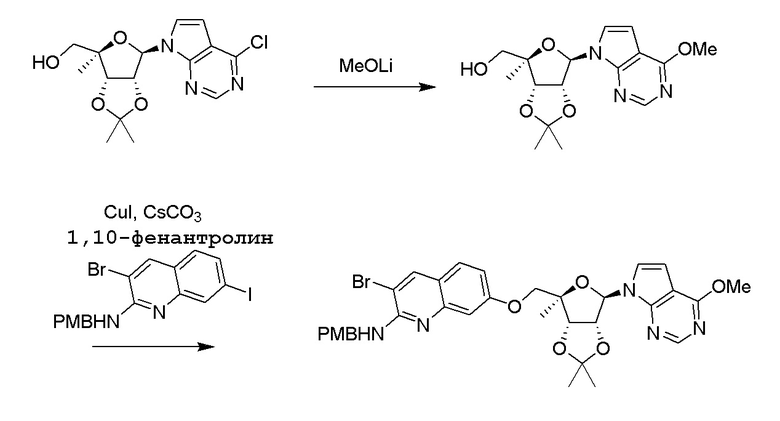
Промежуточное соединение 3: 3-бром-7-(((3aS,4R,6R,6aR)-6-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-N-(4-метоксибензил)хинолин-2-амин
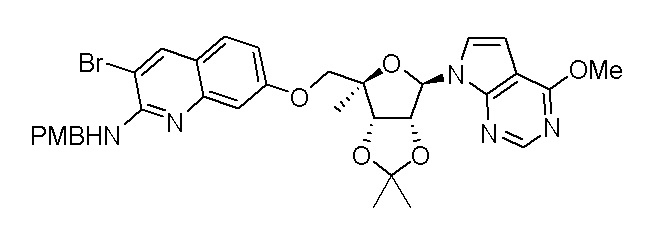
Стадия 1: К раствору ((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола (95,0 мг, 0,280 ммоль) в метаноле (1,0 мл) добавляли LiOMe (106 мг, 2,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут и затем разбавляли водой (10 мл). Полученную смесь экстрагировали при помощи DCM (10 мл) и органические слои сушили над Na2SO4. Органический растворитель удаляли при пониженном давлении с получением ((3aS,4R,6R,6aR)-6-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола. Продукт использовали на следующей стадии без дополнительной очистки. MS: 336 (M+1). 1H ЯМР (500 МГц, CDCl3) δ 8,43 (с, 1H), 7,07 (д, J=3,6 Гц, 1H), 6,89 (дд, J=12,1, 1,7 Гц, 1H), 6,51 (д, J=3,6 Гц, 1H), 5,74 (д, J=5,7 Гц, 1H), 5,35 (т, J=5,8 Гц, 1H), 5,01 (д, J=5,9 Гц, 1H), 4,12 (с, 3H), 3,80 (дд, J=12,2, 1,7 Гц, 1H), 3,63 (т, J=12,2 Гц, 1H), 1,65 (с, 3H), 1,37 (с, 3H), 1,35 (с, 3H).
Стадия 2: К раствору ((3aS,4R,6R,6aR)-6-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола (94,0 мг, 0,280 ммоль), 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (75,0 мг, 0,160 ммоль), иодида меди (3,05 мг, 0,0160 ммоль) и 1,10-фенантролина (5,77 мг, 0,0320 ммоль) в диоксане (0,250 мл) добавляли карбонат цезия (78,0 мг, 0,240 ммоль). Полученную смесь перемешивали при 110°C в течение 23 часов. Реакционную смесь непосредственно очищали колоночной флэш-хроматографией (EtOAc в гексане, 0-25%) с получением 3-бром-7-(((3aS,4R,6R,6aR)-6-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 676/678 (M+1/M+3). 1H-ЯМР (500 МГц, Хлороформ-d) δ 8,51 (с, 1H), 8,01 (с, 1H), 7,42 (д, J=8,8 Гц, 1H), 7,36 (д, J=8,6 Гц, 2H), 7,32 (д, J=3,7 Гц, 1H), 7,06 (д, J=2,4 Гц, 1H), 6,90 (д, J=8,7 Гц, 2H), 6,81 (дд, J=8,8, 2,5 Гц, 1H), 6,49 (д, J=3,7 Гц, 1H), 6,44 (д, J=3,7 Гц, 1H), 5,56 (т, J=5,1 Гц, 1H), 5,44 (дд, J=6,1, 3,8 Гц, 1H), 5,00 (д, J=6,2 Гц, 1H), 4,72 (д, J=5,1 Гц, 2H), 4,21 (д, J=9,7 Гц, 1H), 4,09 (с, 3H), 4,05 (д, J=9,7 Гц, 1H), 3,81 (с, 3H), 1,71 (с, 3H), 1,55 (с, 3H), 1,42 (с, 3H).
Схема синтеза промежуточного соединения 4
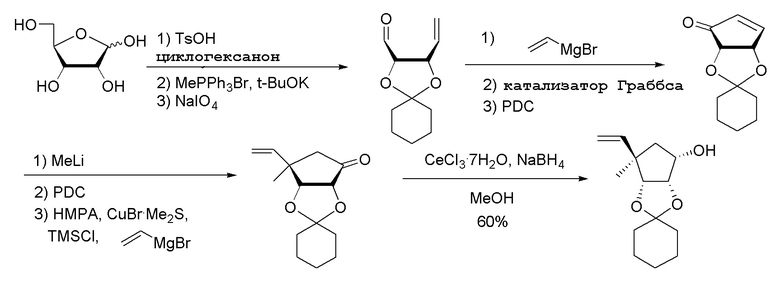
Промежуточное соединение 4: (3a'R,4'R,6'S,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ол
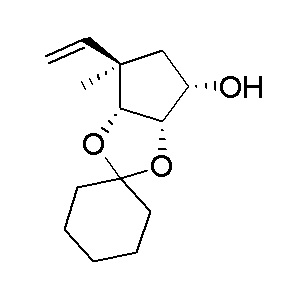
Стадия 1: В 10-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали D-рибофуранозу (970 г, 6,46 моль), циклогексанон (6,4 л) и 4-метилбензол-1-сульфоновую кислоту (22,8 г, 132 ммоль). Полученный раствор перемешивали в течение ночи при 25°C. Полученный раствор экстрагировали 5 л этилацетата и органические слои объединяли. Органические слои промывали 5 л насыщенного водного раствора NaHCO3 и 5 л H2O. Органические слои сушили над сульфатом натрия. Полученную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/петролейный эфир (1:1)) с получением 2,3-O-1,1-циклогександиил-D-рибофуранозы.
Стадия 2: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали MePPh3Br (1,83 кг, 5,13 моль) и тетрагидрофуран (12,7 л). Затем добавляли t-BuOK (657 г, 5,86 моль) при 0°C через 15 мин. К этой смеси добавляли 2,3-O-1,1-циклогександиил-D-рибофуранозу (422 г, 1,83 моль) при 0oC. Полученный раствор перемешивали в течение 1 часа при 25°C. Реакцию гасили добавлением 20 л воды. Полученный раствор экстрагировали 20 л этилацетата и органические слои объединяли и сушили над сульфатом натрия. Полученную смесь фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:3)) с получением (R)-1-((2R,3S)-3-винил-1,4-диоксаспиро[4,5]декан-2-ил)этан-1,2-диола.
Стадия 3: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (R)-1-((2R,3S)-3-винил-1,4-диоксаспиро[4,5]декан-2-ил)этан-1,2-диол (630 г, 2,76 моль) и дихлорметан (8,19 л). Затем осуществлляли добавление по каплям раствора периодата натрия (588 г, 2,75 моль) в воде (4,41 л). Полученную смесь перемешивали в течение 30 минут при 25°C. Твердые частицы отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хрматографией на силикагеле с использованием этилацетата/петролейного эфира (1:10). Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении с получением (2S,3S)-3-винил-1,4-диоксаспиро[4,5]декан-2-карбальдегида.
Стадия 4: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (2S,3S)-3-винил-1,4-диоксаспиро[4,5]декан-2-карбальдегид (637 г, 3,25 моль) и тетрагидрофуран (7,96 л). Затем осуществлляли добавление по каплям бром(этенил)магния (4,88 л, 1 M в THF) при перемешивании при 0°C. Полученную смесь перемешивали в течение 10 минут при 0°C и затем нагревали до комнатной температуре и оставляли для перемешивания еще в течение 1 часа при 25°C. Реакцию гасили добавлением 7 л насыщенного водного раствора NH4Cl. Полученный раствор экстрагировали 7 л этилацетата и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хрматографией на силикагеле с использованием смеси этилацетат/петролейный эфир (1:50) с получением (R)-1-((2S,3R)-3-винил-1,4-диоксаспиро[4,5]декан-2-ил)проп-2-ен-1-ола.
Стадия 5: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (R)-1-((2S,3R)-3-винил-1,4-диоксаспиро[4,5]декан-2-ил)проп-2-ен-1-ол (400 г, 1,78 моль), дихлорметан (12,8 л) и катализатор Граббса (24,3 г). Смесь перемешивали в течение 24 часов при 25°C. К смеси добавляли PDC (1,34 кг, 3,57 моль) и 4 Å молекулярные сита (400 г). Полученную смесь перемешивали в течение 4 часов при 25°C. Твердые частицы отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:40)) с получением (3a'S,6a'S)-3a',6a'-дигидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-она.
Стадия 6: В 10-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (3a'S,6a'S)-3a',6a'-дигидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-он (246 г, 1,27 моль) и тетрагидрофуран (3,44 л). К этой перемешиваемой смеси при -78oC добавляли метиллитий (1,74 л, 2,79 моль, 1,6 M в диэтиловом эфире) по каплям. Смесь перемешивали в течение 30 минут при -78oC, затем давали нагреться до комнатной температуры и продолжали перемешивать еще в течение 1 часа при 25°C. Реакцию гасили добавлением 3 л насыщенного водного раствора NH4Cl. Полученный раствор экстрагировали 3 л этилацетата и органические слои объединяли и сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:20)) с получением (3a'S,4'R,6a'S)-4'-метил-4',6a'-дигидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ола.
Стадия 7: В 10-л 3-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (3a'S,4'R,6a'S)-4'-метил-4',6a'-дигидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ол (192 г, 913 ммоль), дихлорметан (3,84 л), 4 Å молекулярные сита (192 г), PDC (688 г, 1,83 моль) и уксусный ангидрид (747 г, 7,3 моль). Смесь перемешивали в течение ночи при 25°C. Реакцию гасили добавлением 1 л насыщенного водного раствора Na2CO3. Полученный раствор экстрагировали 1 л дихлорметана и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:50)) с получением (3a'R,6a'R)-6'-метил-3a',6a'-дигидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-она.
Стадия 8: В 2-л 3-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали CuBrMe2S (8,43 г, 41,1 ммоль) и тетрагидрофуран (627 мл). Затем осуществлляли добавление по каплям бром(этенил)магния (548 мл, 2 M в THF, 548 ммоль) при перемешивании при -78°C. К этой смеси добавляли HMPA (294 г, 1,64 моль) при -78oC, затем (3a'R,6a'R)-6'-метил-3a',6a'-дигидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-он (57,0 г, 274 ммоль) и хлортриметилсилан (148 г, 1,36 моль). Полученную смесь перемешивали в течение 3 часов при -78 oC. Реакцию гасили добавлением 500 мл насыщенного водного раствора NH4Cl. Полученную смесь экстрагировали 1 л этилацетата, объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:100)) с получением (3a'R,6'R,6a'R)-6'-метил-6'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-она.
Стадия 9: В 2-л 3-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали (3a'R,6'R,6a'R)-6'-метил-6'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-он (32,2 г, 136 ммоль) и метанол (966 мл). К этой смеси добавляли CeCl3.7H2O (50,8 г) при -30°C, затем NaBH4 (10,3 г, 273 ммоль). Полученную смесь перемешивали в течение 15 минут при -30°C, затем давали нагреться до комнатной температуры и перемешивание продолжали еще в течение 30 минут при 25°C. Реакцию гасили добавлением 1 л смеси этилацетат/петролейный эфир (1:1). Твердые частицы отфильтровывали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир (1:70)) с получением (3a'R,4'R,6'S,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ол. 1H ЯМР (300 МГц, CDCl3) δ 5,72-5,66 (м, 1H), 5,03-4,99 (м, 2H), 4,45 (т, J=6,0 Гц, 1H), 4,32 (д, J=5,5 Гц, 1H), 4,03-3,99 (м, 1H), 2,51 (д, J=10,0 Гц, 1H), 1,98-1,94 (м, 1H), 1,72-1,52 (м, 9H), 1,43-1,38 (м, 2H), 1,12 (с, 3H).
Схема синтеза промежуточного соединения 5
Промежуточное соединение 5: 4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин
Стадия 1: К раствору бензо[d]тиазол-2-тиола (50 г, 300 ммоль) в 1,4-диоксане (125 мл) и воде (125 мл) добавляли гидроксид калия (30 г, 540 ммоль) при 0°C. Полученную смесь барботировали избыточным количеством хлордифторметана в течение 5ч. Реактор герметично закрывали и смесь перемешивали при комнатной температуре в течение 8 ч, затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (нейтрализовали триэтиламином) (0-30% этилацетата/гексан) с получением 2-((дифторметил)тио)бензо[d]тиазола. MS: 218 (M+1). 1H-ЯМР (300 МГц, Хлороформ-d) δ 8,05-8,02 (м, 1H), 7,89-7,86 (м, 1H), 7,67-7,41 (м, 3H). 19F-ЯМР (282 МГц, Хлороформ-d) δ -93,20 (с, CF2H).
Стадия 2: К раствору 2-((дифторметил)тио)бензо[d]тиазола (11,1 г, 51 ммоль) в смеси ACN/CCl4/вода (об.:об.:об. = 1:1:2, 222 мл) добавляли периодат натрия (34,2 г, 160 ммоль) и хлорид рутения(III) тригидрат (33 мг, 0,13 ммоль) по порциям. Полученный раствор перемешивали при комнатной температуре в течение 3 ч. Смесь разбавляли водой (800 мл) и экстрагировали при помощи DCM (1500 мл). Органическую фазу промывали насыщенным солевым раствором (800 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-20% этилацетата/DCM) с получением 2-((дифторметил)сульфонил)бензо[d]тиазола. MS: 250 (M+1). 1H-ЯМР (400 МГц, Хлороформ-d) δ 8,38-8,33 (м, 1H), 8,15-8,06 (м, 1H), 7,76-7,69 (м, 2H), 6,62 (т, J=52 Гц, 1H). 19F-ЯМР (376 МГц, Хлороформ-d) δ -121,39 (с, CF2H).
Стадия 3: К раствору 2-((дифторметил)сульфонил)бензо[d]тиазола (116,5 г, 467 ммоль) в этаноле (700 мл) добавляли борогидрид натрия (26,5 г, 700 ммоль) по порциям при комнатной температуре в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Неочищенное вещество растирали в порошок с гексаном (600 мл × 3) при комнатной температуре с получением дифторметансульфината натрия. 1H-ЯМР (400 МГц, Метанол-d4) δ 5,14 (т, J=56 Гц, 1H). 19F-ЯМР (376 МГц, Метанол-d4) δ -128,92 (с, CF2H).
Стадия 4: К раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (10 г, 65,1 ммоль) в DCM (150 мл) и воде (60 мл) добавляли дифторметансульфинат натрия (27 г, 195 ммоль) и TFA (10,0 мл, 130 ммоль) по порциям при 0°C. К этой смеси по каплям добавляли трет-бутилгидропероксид (5,5M в декане, 59 мл, 330 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 5 дней, затем гасили бикарбонатом натрия (2 M водн., 110 мл). Смесь экстрагировали при помощи DCM (200 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл × 3), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Продукт очищали колоночной хроматографией (0-20% этилацетата/гексан) с получением 4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидина. MS: 204 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 13,40 (шир.с, 1H), 8,73 (с, 1H), 7,31 (т, J=54 Гц, 1H), 7,00-7,00 (м, 1H). 19F-ЯМР (376 МГц, DMSO-d6) δ -112,14 (с, CF2H).
Схема синтеза промежуточного соединения 6
Промежуточное соединение 6: 2-(7H-пирроло[2,3-d]пиримидин-4-ил)пропан-2-ол
Метил 7H-пирроло[2,3-d]пиримидин-4-карбоксилат (0,52 г, 2,9 ммоль), растворенный в тетрагидрофуране (12 мл), продували азотом и охлаждали до -78°C. К раствору добавляли метилмагнийбромид (1,4 M, 4,6 мл, 6,5 ммоль) и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Через 2 часа добавляли дополнительное количество метилмагнийбромида (1,4 M, 4,6 мл, 6,5 ммоль) добавляли при -78°C и реакционную смесь перемешивали в течение 18 ч и нагревали до комнатной температуры. Реакцию гасили насыщенным водным раствором хлорида аммония и перемешивали в течение 1 ч. при комнатной температуре. Органические слои отделяли, промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворители удаляли при пониженном давлении с получением 2-(7H-пирроло[2,3-d]пиримидин-4-ил)пропан-2-ола, который использовали без дополнительной очистки. MS: 178 (M+1).
Схема синтеза промежуточного соединения 7
Промежуточное соединение 7: 4-Хлор-5-циклопропил-1H-пирроло[2,3-d]пиримидин
Стадия 1: К перемешиваемой смеси 4-хлор-5-иод-1H-пирроло[2,3-d]пиримидина (10,0 г, 35,8 ммоль) в THF (119 мл) добавляли триэтиламин (12,5 мл, 89,0 ммоль) и (2-(хлорметокси)этил)триметилсилан (7,60 мл, 42,9 ммоль) при 0°C. Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь обрабатывали водой и экстрагировали при помощи EtOAc. Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией на диоксиде кремния (0-10% EtOAc/DCM) с получением 4-хлор-5-иод-7-{[2-(триметилсилил)этокси]метил}-7H-пирроло[2,3-d]пиримидина. MS: 410 (M+1). 1H ЯМР (500 МГц, DMSO-d6) δ 8,69 (с, 1H), 8,13 (с, 1H), 5,60 (с, 2H), 3,57-3,45 (м, 2H), 0,87-0,75 (м, 2H), -0,10 (с, 9H).
Стадия 2: Смесь 4-хлор-5-иод-7-{[2-(триметилсилил)этокси]метил}-7H-пирроло[2,3-d]пиримидина (12,2 г, 29,8 ммоль), циклопропилтрифторбората калия (5,29 г, 35,7 ммоль), карбоната цезия (29,1 г, 89,0 ммоль) и [(ди(1-адамантил)-бутилфосфин)-2-(2′-амино-1,1′-бифенил)]палладий(II) метансульфоната (2,17 г, 2,98 ммоль) в толуоле (135 мл)/воде (13,5 мл) продували азотом и затем перемешивали при 100°C в течение 10 ч. Смесь охлаждали до комнатной температуры, разбавляли при помощи EtOAc и промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, концентрировали и очищали колоночной хроматографией на диоксиде кремния (0-20% EtOAc/DCM) с получением 4-хлор-5-циклопропил-7-{[2-(триметилсилил)этокси]метил}-7H-пирроло[2,3-d]пиримидина. MS: 324 (M+1).
Стадия 3: К перемешиваемому раствору 4-хлор-5-циклопропил-7-{[2-(триметилсилил)этокси]метил}-7H-пирроло[2,3-d]пиримидина (7,35 г, 22,7 ммоль) в DCM (91 мл) добавляли TFA (14,0 мл, 182 ммоль). Смесь перемешивали при 32°C в течение ночи. Смесь охлаждали до комнатной температуры, концентрировали, разбавляли при помощи EtOAc и промывали насыщенным раствором бикарбоната натрия. Органический слой сушили над сульфатом натрия, концентрировали и очищали хроматографией на силикагеле (0-100% EtOAc в DCM) с получением (4-хлор-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)метанола. MS: 224 (M+1). 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (с, 1H), 7,49-7,38 (м, 1H), 6,73-6,59 (м, 1H), 5,53 (д, J=4,6 Гц, 2H), 2,20-2,09 (м, 1H), 1,00-0,85 (м, 2H), 0,71-0,59 (м, 2H).
Стадия 4: К (4-хлор-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)метанолу (3,40 г, 15,2 ммоль) добавляли аммиак (7 N в MeOH, 58,6 мл, 410 ммоль). Раствор оставляли для перемешивания в течение 10 мин, концентрировали и очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/DCM) с получением 4-хлор-5-циклопропил-1H-пирроло[2,3-d]пиримидина. MS: 194 (M+1). 1H ЯМР (600 МГц, DMSO-d6) δ 12,23 (с, 1H), 8,51 (с, 1H), 7,34 (д, J=0,8 Гц, 1H), 2,17-2,09 (м, 1H), 0,91-0,86 (м, 2H), 0,68-0,62 (м, 2H).
Схема синтеза промежуточного соединения 8.
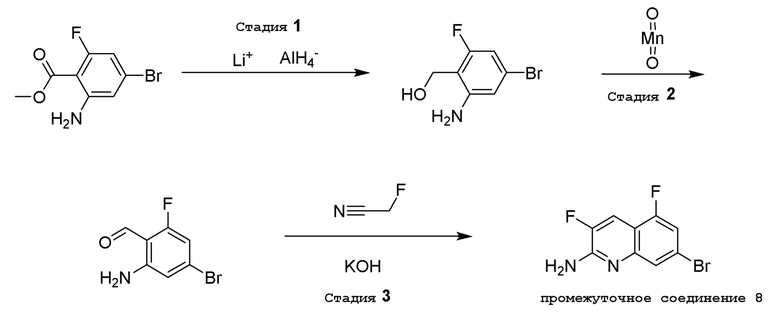
Промежуточное соединение 8: 7-бром-3,5-дифторхинолин-2-амин
Стадия 1: Метил 2-амино-4-бром-6-фторбензоат (5,0 г, 20 ммоль) растворяли в THF (40 мл) в атмосфере азота и охлаждали до 0°C. К перемешиваемому раствору добавляли по каплям литийалюминийгидрид (1M в THF, 40,3 мл, 40,3 ммоль). Реакционную смесь перемешивали в течение 3 ч и охлаждали до 0°C. Реакцию гасили путем последовательного добавления по каплям воды (2 мл), гидроксида натрия (1N в воде, 3 мл) и воды (6 мл). Затем добавляли сульфат магния и перемешивали в течение 30 минут. Раствор фильтровали через слой Целита® и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% DCM/ 3:1 EtOAc/EtOH) с получением (2-амино-4-бром-6-фторфенил)метанола. MS: 202/204 (M-18/M-16).
Стадия 2: Оксид марганца(IV) (4,27 г, 49,1 ммоль) добавляли к перемешиваемому раствору (2-амино-4-бром-6-фторфенил)метанола (2,7 г, 12,27 ммоль) в DCM (61 мл). Реакционную смесь перемешивали в течение 18 ч при 40°C. Реакционную смесь фильтровали через слой Целита® и промывали при помощи EtOAc и растворитель удаляли с получением 2-амино-4-бром-6-фторбензальдегида, который использовали без дополнительной очистки. MS: 218/220 (M+1/M+3).
Стадия 3: 2-Амино-4-бром-6-фторбензальдегид (1,20 г, 5,50 ммоль) растворяли в DMSO (11 мл). К перемешиваемому раствору добавляли 2-фторацетонитрил (1,2 мл, 22 ммоль) и гидроксид калия (0,055 мл, 0,83 ммоль). Реакционную смесь затем перемешивали при 80°C в течение 18 ч. Реакционную смесь затем разбавляли при помощи EtOAc, добавляли к воде и оставляли перемешиваться в течение нескольких минут. Водный слой отделяли и промывали при помощи EtOAc. Объединенные органические слои сушили над сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении. Вещество очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/Гексан) с получением 7-бром-3,5-дифторхинолин-2-амина. MS: 259/261 (M+1/M+3). 1H ЯМР (DMSO-d6) δ: 7,89 (д, J=11 Гц, 1H), 7,52 (с, 1H), 7,32 (дд, J=10, 1 Гц, 1H), 7,28 (с, 2H)
Промежуточные соединения 9-10: Промежуточные соединения 9-10 (показанные в Таблице 1) синтезировали с использованием протокола, описанного для промежуточного соединения 8, осуществляя соответствующее замещение арил-эфира на стадии 1 или бензилового спирта на стадии 2 или арил-альдегида на стадии 3. Используемые для замещения реагенты и исходное вещество были приобретены коммерческим путем, синтезированы, как описано выше, или синтезированы известными способами, описанными в литературе.
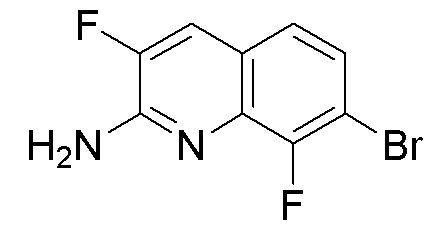
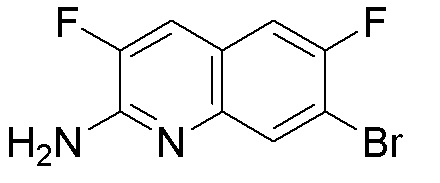
Схема синтеза промежуточного соединения 11
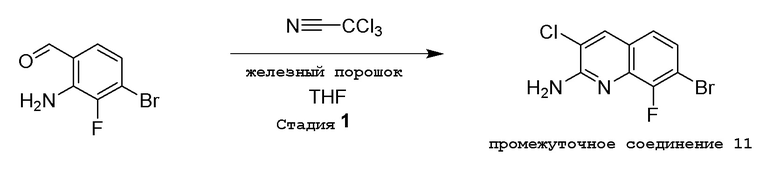
Промежуточное соединение 11: 7-бром-3-хлор-8-фторхинолин-2-амин
Колбу, содержащую 2-амино-4-бром-3-фторбензальдегид (1,8 г, 8,3 ммоль) и железный порошок (4,6 г, 80 ммоль), продували азотом, загружали THF (16,5 мл), трихлорацетонитрил (1,2 мл, 12 ммоль) и нагревали до 65°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали при помощи EtOAc. Органические слои концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/DCM). Фракции, содержащие продукт, концентрировали при пониженном давлении. Остаток растворяли в THF (50 мл), загружали N-пропилдиэтаноламин-функционализированный силикагель (0,84 ммоль/г) и оставляли для перемешивания в течение ночи. Силикагель отфильтровывали через слой Целита® и промывали при помощи THF (50 мл). Органические слои концентрировали при пониженном давлении с получением 7-бром-3-хлор-8-фторхинолин-2-амина. MS: 275/277 (M+1/M+3). 1H ЯМР (500 МГц, DMSO-d6) δ 8,32 (с, 1H), 7,48-7,45 (м, 1H), 7,41 (м, 1H), 7,26 (шир.с, 2H).
Промежуточное соединение 12: Промежуточное соединение 12 в Таблице 2 синтезировали с использованием протокола, описанного для промежуточного соединения 11, осуществляя соответствующее замещение арил-альдегида. Используемое для замены исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
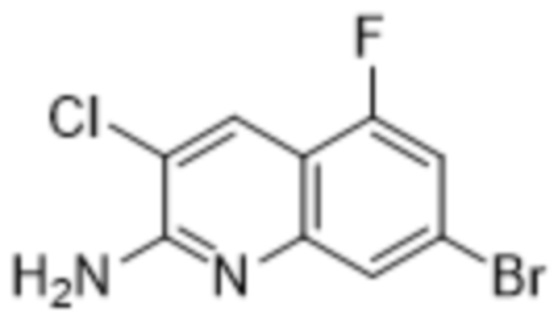
Схема синтеза промежуточного соединения 13
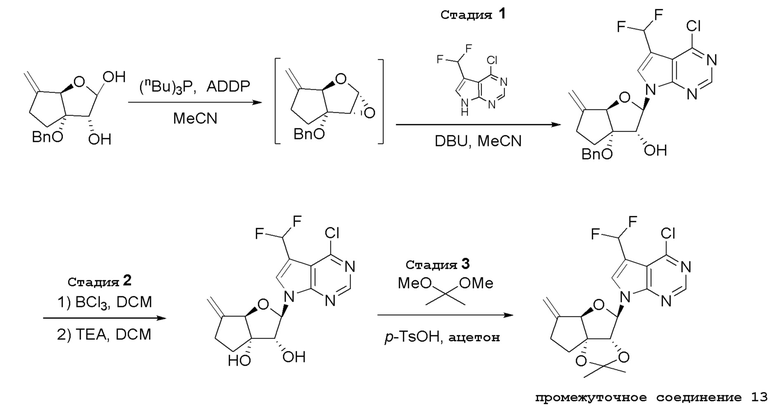
Промежуточное соединение 13: 4-хлор-5-(дифторметил)-7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин
Стадия 1: К перемешиваемому раствору (3R,3aS,6aR)-3a-(бензилокси)-6-метиленгексагидро-2H-циклопента[b]фуран-2,3-диола (1,0 г, 3,8 ммоль) в безводном ацетонитриле (60 мл) по каплям добавляли (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (1,54 г, 6,1 ммоль) при 0°C в атмосфере аргона с последующим добавлением трибутилфосфина (1,4 мл, 5,7 ммоль). Полученную смесь перемешивали при 35°C в течение 1 ч. В отдельный контейнер к перемешиваемому раствору 4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидина (1,1 г, 5,3 ммоль) в безводном ацетонитриле (25 мл) добавляли DBU (0,86 мл, 5,7 ммоль) в атмосфере аргона при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. DBU раствор переносили в указанный выше эпоксид-содержащий раствор с использованием шприца. Полученную смесь перемешивали при 35°C в течение 16 ч. Реакционную смесь гасили добавлением насыщенного водного раствора хлорида аммония (150 мл) и экстрагировали этилацетатом (100 мл × 3). Объединенный органический слой промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Продукт очищали колоночной хроматографией на диоксиде кремния (0-30% этилацетата/петролейный эфир) с получением (2R,3R,3aS,6aR)-3a-(бензилокси)-2-(4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3-ола. MS: 448(M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 8,84 (с, 1H), 7,61-7,21 (м, 7H), 6,16 (д, J=8,1 Гц, 1H), 5,77 (д, J=6,3 Гц, 1H), 5,21-5,14 (м, 3H), 4,94 (д, J=12,0 Гц, 1H), 4,72-4,66 (м, 2H), 2,85-2,75 (м, 1H), 2,59-2,54 (м, 1H), 2,28-2,25 (м, 1H), 2,07-2,00 (м, 1H). 19F ЯМР (282 МГц, DMSO-d6) δ -109,36 (д, 1F), -114,08 (д, 1F).
Стадия 2: К раствору (2R,3R,3aS,6aR)-3a-(бензилокси)-2-(4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3-ола (1,79 г, 4,00 ммоль) в DCM (20 мл) добавляли трихлорид бора (1M в DCM, 8,0 мл, 8,0 ммоль) при -78°C в атмосфере аргона. Смесь затем перемешивали при -78°C в течение 2 ч. Осторожно добавляли триэтиламин (2,2 мл, 16 ммоль) при -78°C для гашения реакции и смесь перемешивали при -78°C в течение 0,5 ч. Смесь выливали в насыщенный водный раствор бикарбоната натрия (100 мл) при 0°C. Смесь экстрагировали при помощи 200 мл этилацетата. Органическую фазу промывали водой (30 мл) и насыщенным солевым раствором (60 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-50% этилацетата/петролейный эфир) с получением (2R,3R,3aS,6aR)-2-(4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 358(M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,81 (с, 1H), 7,59-7,09 (м, 2H), 6,07-6,04 (м, 1H), 5,50-5,47 (м, 1H), 5,31 (д, J=4,4 Гц, 1H), 5,14-5,09 (м, 2H), 4,94-4,89 (м, 1H), 4,40 (д, J=4,0 Гц, 1H), 2,80-2,67 (м, 1H), 2,51-2,41 (м, 1H), 2,13-2,06 (м, 1H), 1,71-1,65 (м, 1H). 19F ЯМР (376 МГц, DMSO-d6) δ -108,88 (д, 1F), -114,52 (д, 1F).
Стадия 3: К смеси (2R,3R,3aS,6aR)-2-(4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диола (670 мг, 1,87 ммоль) в ацетоне (12 мл) добавляли 2,2-диметоксипропан (1,2 мл, 9,4 ммоль) и 4-метилбензолсульфоновую кислоту (32 мг, 0,19 ммоль) по порциям при температуре окружающей среды. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-30% этилацетата/петролейный эфир) с получением 4-хлор-5-(дифторметил)-7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина. MS: 398(M+1). 1H ЯМР (300 МГц, Метанол-d4) δ 8,74 (с, 1H), 7,40-7,05 (м, 2H), 6,27 (д, J=4,5 Гц, 1H), 5,76 (д, J=4,2 Гц, 1H), 5,09-5,06 (м, 2H), 4,63 (с, 1H), 2,94-2,72 (м, 2H), 2,57-2,50 (м, 1H), 2,19-2,08 (м, 1H), 1,62 (с, 3H), 1,44 (с, 3H). 19F ЯМР (282 МГц, Метанол-d4) δ -112,94 (д, 1F), -115,23 (д, 1F).
Схема синтеза промежуточного соединения 14
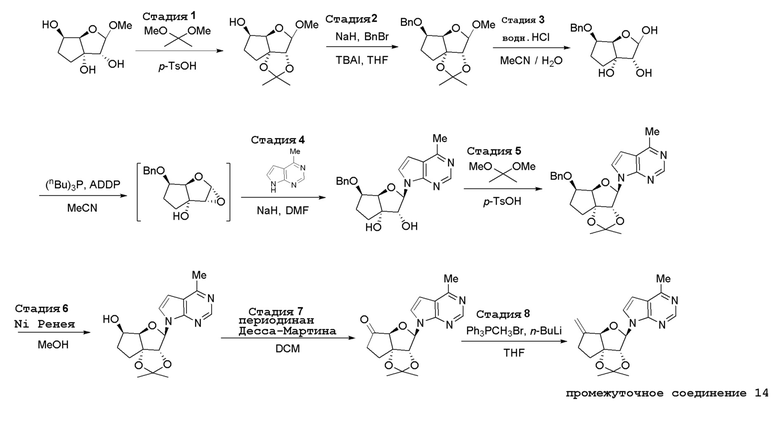
Промежуточное соединение 14: 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин
Стадия 1: (3R,3aS,6R,6aR)-2-метоксигексагидро-2H-циклопента[b]фуран-3,3a,6-триол (2 г, 10 ммоль) совместно упаривали с безводным толуолом (5 мл × 3) и затем снова растворяли в ацетоне (50 мл). К этому раствору добавляли 4-метилбензолсульфоновую кислоту (0,091 г, 0,53 ммоль) с последующим добавлением 2,2-диметоксипропана (2,74 г, 26,3 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 1 ч. pH полученного раствора доводили до 8 насыщенным водным раствором NaHCO3 (50 мл) при 0°C. Полученную смесь экстрагировали при помощи EtOAc (150 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир) с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола. MS: 248,20 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 4,96 (с, 1H), 4,41 (д, J=5,1 Гц, 1H), 4,17 (с, 1H), 4,10 (д, J=6,0 Гц, 1H), 3,88-3,79 (м, 1H), 3,33 (с, 3H), 2,04-1,92 (м, 1H), 1,76-1,62 (м, 3H), 1,39 (с, 3H), 1,31 (с, 3H). Колонку затем элюировали смесью 45-50% EtOAc в петролейном эфире с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола. MS: 248 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 4,92 (д, J=4,2 Гц, 1H), 4,72 (д, J=6,0 Гц, 1H), 4,35 (д, J=4,2 Гц, 1H), 4,00 (д, J = (5,4 Гц, 1H), 3,91-3,82 (м, 1H), 3,35 (с, 3H), 2,09-1,97 (м, 1H), 1,83-1,62 (м, 2H), 1,52-1,43 (м, 1H), 1,40 (с, 3H), 1,31 (с, 3H).
Стадия 2: К смеси гидрида натрия (60% масс. дисперсия в минеральном масле, 0,88 г, 22 ммоль) в безводном THF (20 мл) добавляли тетрабутиламмоний иодид (0,67 г, 1,8 ммоль) при температуре окружающей среды в атмосфере аргона. Смесь охлаждали до 0°C и добавляли раствор (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (4,2 г, 18 ммоль) в THF (15 мл). Смесь перемешивали в течение 0,5 ч при температуре окружающей среды. К смеси добавляли раствор (бромметил)бензола (2,6 мл, 22 ммоль) в THF (5 мл) при 0°C. Полученную смесь перемешивали при температуре окружающей среды в течение 12 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (100 мл) при 0°C. Полученную смесь экстрагировали при помощи EtOAc (2 × 300 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (100 мл) и насыщенным солевым раствором (100 мл). Органический слой сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на диоксиде кремния (0% -10% EtOAc/петролейный эфир) с получением (3aR,4S,5aR,6R,8aR)-6-(бензилокси)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола. MS: 343(M+Na). 1H ЯМР (300 МГц, DMSO-d6) δ 7,33-7,25 (м, 5H), 4,96-4,94 (м, 1H), 4,59 (д, J=11,7 Гц, 1H), 4,42 (д, J=11,7 Гц, 1H), 4,34 (д, J=6,0 Гц, 1H), 4,19-4,17 (м, 1H), 3,77-3,70 (м, 1H), 3,24 (с, 3H), 2,04-1,97 (м, 1H), 1,85-1,64 (м, 3H), 1,38 (с, 3H), 1,29 (с, 3H).
Стадия 3: К раствору (3aR,4S,5aR,6R,8aR)-6-(бензилокси)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола (5,7 г, 18 ммоль) в ацетонитриле (150 мл) и воде (100 мл) добавляли концентрированный водный раствор хлористоводородной кислоты (8,6 мл, 103 ммоль) по каплям при температуре окружающей среды. Реакционную смесь перемешивали при 90°C в течение 1 ч. Значение pH полученного раствора доводили до 7 при помощи 1 M водн. NaOH при 0°C. Смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% Метанол/DCM) с получением (3R,3aS,6R,6aR)-6-(бензилокси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола. MS: 284 (M+NH4).
Стадия 4: К перемешиваемой смеси (3R,3aS,6R,6aR)-6-(бензилокси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (1,7 г, 6,4 ммоль) в безводном ацетонитриле (100 мл) добавляли трибутилфосфин (2,55 мл, 10 ммоль) в атмосфере аргона с последующим добавлением (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (2,4 г, 9,6 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Полученный содержащий эпоксид раствор использовали непосредственно без какой-либо дополнительной обработки. В отдельную круглодонную колбу загружали раствор 4-метил-7H-пирроло[2,3-d]пиримидина (1,7 г, 13 ммоль) в безводном DMF (25 мл). К этой смеси добавляли гидрид натрия (60% масс. дисперсия в минеральном масле) (0,77 г, 19 ммоль) при 0°C в атмосфере аргона. Суспензию перемешивали при комнатной температуре в течение 30 минут и затем переносили в ранее полученный содержащий эпоксид раствор с использованием шприца. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили добавлением насыщенного водного раствора хлорида аммония (100 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой колоночной хроматографией на C18 (0-95% 5 мМ водн. NH4HCO3/ACN) с получением (2R,3R,3aS,6R,6aR)-6-(бензилокси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 382(M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,69 (с, 1H), 7,74 (д, J=3,6 Гц, 1H), 7,36-7,25 (м, 5H), 6,73 (д, J=3,9 Гц, 1H), 6,16 (д, J=8,4 Гц, 1H), 5,41 (д, J=6,9 Гц, 1H), 5,24 (с, 1H), 4,55-4,50 (м, 2H), 4,27-4,19 (м, 2H), 3,92-3,86 (м, 1H), 2,67 (с, 3H), 2,02-1,98 (м, 3H), 1,60-1,52 (м, 1H).
Стадия 5: К смеси (2R,3R,3aS,6R,6aR)-6-(бензилокси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (2,4 г, 6,3 ммоль) в 2,2-диметоксипропане (50 мл) в атмосфере аргона добавляли 4-метилбензолсульфоновую кислоту (0,11 г, 0,63 ммоль) при температуре окружающей среды. Смесь перемешивали при 70°C в течение 48 ч. Смесь гасили насыщенным водным раствором NaHCO3 (50 мл) и затем экстрагировали при помощи DCM (100 мл × 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/Петролейный эфир) с получением 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидина. MS: 422(M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,71 (с, 1H), 7,79 (д, J=4,0 Гц, 1H), 7,33-7,23 (м, 5H), 6,81 (д, J=3,6 Гц, 1H), 6,32 (д, J=4,4 Гц, 1H), 5,15 (д, J=4,8 Гц, 1H), 4,51 (кв., J=12,0 Гц, 2H), 4,42 (д, J=4,4 Гц, 1H), 3,93-3,87 (м, 1H), 2,67 (с, 3H), 2,47-2,41 (м, 1H), 2,03-1,99 (м, 1H), 1,95-1,83 (м, 2H), 1,55 (с, 3H), 1,36 (с, 3H).
Стадия 6: К раствору 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидина (1,2 г, 2,9 ммоль) в безводном MeOH (35 мл) в атмосфере аргона добавляли мокрый Ni Ренея (8 г, 50% масс. в воде) при температуре окружающей среды. Полученную смесь перемешивали при 60°C в течение 5 ч. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Продукт очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/петролейный эфир) с получением (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола. MS: 332(M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,70 (с, 1H), 7,83 (д, J=4,0 Гц, 1H), 6,83 (д, J=4,0 Гц, 1H), 6,29 (д, J=4,4 Гц, 1H), 5,10 (д, J=4,8 Гц, 1H), 4,92 (д, J=6,0 Гц, 1H), 4,15 (д, J=4,8 Гц, 1H), 3,98-3,94 (м, 1H), 2,68 (с, 3H), 2,43-2,35 (м, 1H), 1,90-1,84 (м, 3H), 1,55 (с, 3H), 1,36 (с, 3H).
Стадия 7: К смеси (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (2,0 г, 6,04 ммоль) в DCM (60 мл) добавляли периодинан Десса-Мартина (4,6 г, 11 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали при 25°C в течение 1,5 ч. Смесь гасили добавлением насыщенного водного раствора NaHCO3 (150 мл) и экстрагировали при помощи EtOAc (3 × 250 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/Петролейный эфир с получением (3aR,4R,5aS,8aS)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она. MS: 330 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,67 (с, 1H), 7,63 (д, J=3,6 Гц, 1H), 6,75 (д, J=3,6 Гц, 1H), 6,36 (д, J=2,4 Гц, 1H), 5,51 (д, J=2,8 Гц, 1H), 4,56 (с, 1H), 2,96-2,82 (м, 1H), 2,78-2,59 (м, 5H), 2,42-2,34 (м, 1H), 1,57 (с, 3H), 1,46 (с, 3H).
Стадия 8: К смеси бром(метил)трифенилфосфорана (5,8, 16 ммоль) в THF (30 мл) добавляли н-бутиллитий (2,5 M в гексане, 6 мл, 15 ммоль) при -10°C в атмосфере аргона. Полученную смесь перемешивали при -10°C в течение 0,5 ч. К этой смеси добавляли по каплям раствор (3aR,4R,5aS,8aS)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она (1,9 г, 5,8 ммоль) в THF (30 мл) при -10°C. Полученную смесь перемешивали при -10°C в течение 1 ч. Смесь гасили добавлением насыщенного водного раствора NH4Cl (150 мл), затем экстрагировали при помощи DCM (3 × 200 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/Петролейный эфир) с получением 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидина. 328(M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,70 (с, 1H), 7,68 (д, J=3,6 Гц, 1H), 6,80 (д, J=3,6 Гц, 1H), 6,32 (д, J=4,0 Гц, 1H), 5,27 (д, J=4,0 Гц, 1H), 5,13-5,11 (м, 2H), 4,61 (с, 1H), 2,67 (с, 3H), 2,61-2,40 (м, 3H), 2,05-1,95 (м, 1H), 1,56 (с, 3H), 1,38 (с, 3H).
Схема синтеза промежуточного соединения 15
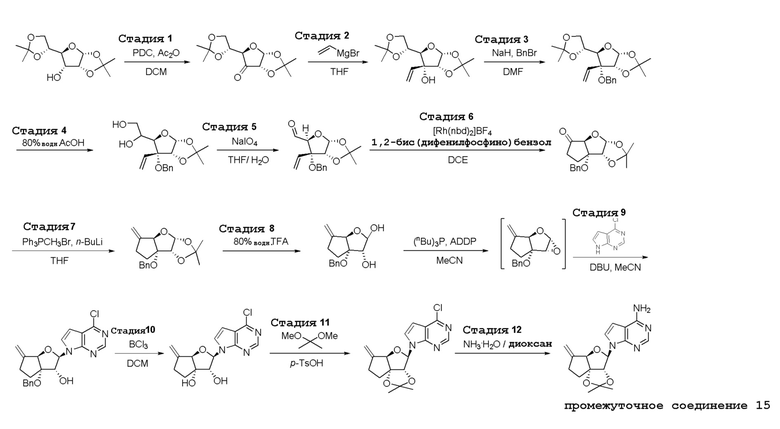
Промежуточное соединение 15: 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d] [1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин
Стадия 1: К перемешиваемому раствору (3aR,5S,6R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (200 г, 768 ммоль) в DCM (1000 мл) добавляли дихромат пиридиния (170 г, 760 ммоль) и уксусный ангидрид (220 мл, 2,3 моль) при комнатной температуре. Полученную смесь перемешивали при 40°C в течение 2 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-40% EtOAc/петролейный эфир с получением (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она. MS: 276 (M+NH4). 1H ЯМР (400 МГц, Хлороформ-d) δ 6,11 (д, J=4,5 Гц, 1H), 4,42-4,31 (м, 2H), 4,10-3,95 (м, 2H), 3,44-3,39 (м, 1H), 1,46-1,41 (м, 6H), 1,31 (с, 6H).
Стадия 2: К перемешиваемому раствору (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она (160 г, 600 ммоль) в THF (1500 мл) добавляли винилмагнийбромид (1 M в THF, 900 мл, 900 ммоль) при -78°C в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь гасили насыщенным водным раствором NH4Cl (500 мл). Смесь экстрагировали при помощи EtOAc (3 × 1000 мл). Объединенные органические слои промывали насыщенным солевым раствором (1000 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (1-15% EtOAc/петролейный эфир) с получением (3aR,5R,6R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола. MS: 304(M+NH4). 1H ЯМР (400 МГц, DMSO-d6) δ 5,81 (д, J=3,6 Гц, 1H), 5,77-5,67 (м, 1H), 5,40-5,36 (м, 1H), 5,29-5,26 (м, 1H), 5,24-5,19 (м, 1H), 4,20-4,16 (м, 1H), 4,08-4,06 (м, 1H), 4,02-3,96 (м, 1H), 3,79-3,69 (м, 2H), 1,49 (с, 3H), 1,36-1,20 (м, 9H).
Стадия 3: Гидрид натрия (60% масс. дисперсия в минеральном масле, 28 г, 700 ммоль) суспендировали в безводном DMF (1000 мл) в атмосфере аргона и смесь охлаждали до 0°C. Добавляли по каплям Раствор (3aR,5R,6R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (133 г, 465 ммоль) в безводном DMF (300 мл) в течение 45 мин. Смесь перемешивали при 50°C в течение 1 ч, затем охлаждали до 0°C. Добавляли по каплям бромметилбензол (160 г, 930 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (1300 мл) и экстрагировали при помощи EtOAc (3 × 1000 мл). Объединенные органические слои промывали насыщенным солевым раствором (2000 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (1-20% EtOAc/петролейный эфир) с получением (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксола. MS: 394(M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 7,40-7,24 (м, 5H), 5,89 (д, J=3,3 Гц, 1H), 5,86-5,76 (м, 1H), 5,49-5,36 (м, 2H), 4,79 (д, J=3,6 Гц, 1H), 4,55-4,46 (м, 2H), 4,14-4,02 (м, 2H), 3,90-3,85 (м, 1H), 3,74-3,69 (м, 1H), 1,50 (с, 3H), 1,30 (с, 3H), 1,27 (с, 3H), 1,24 (с, 3H).
Стадия 4: (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол (130 г, 350 ммоль) растворяли в 80% водном растворе уксусной кислоты (900 мл) и реакционную смесь перемешивали при 50°C в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении и совместно упаривали с толуолом (2 × 300 мл). Остаток распределяли между EtOAc (1000 мл) и насыщенным водным раствором NaHCO3 (900 мл). Органическую фазу объединяли и концентрировали при пониженном давлении с получением 1-((3aR,5R,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола. Продукт использовали без дополнительной очистки. MS: 354 (M+NH4).
Стадия 5: К перемешиваемому раствору 1-((3aR,5R,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола (60 г, 180 ммоль) в THF (100 мл) добавляли раствор периодата натрия (60 г, 270 ммоль) в воде (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду (200 мл) и полученную смесь экстрагировали при помощи DCM (3 × 300 мл). Объединенные органические слои промывали насыщенным солевым раствором (800 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-30% EtOAc/петролейный эфир с получением (3aR,5S,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбальдегида. MS: 322(M+NH4). 1H ЯМР (400 МГц, Хлороформ-d) δ 9,58 (с, 1H), 7,42-7,28 (м, 5H), 6,01-5,97 (м, 1H), 5,81-5,74 (м, 1H), 5,55-5,41 (м, 2H), 4,75-4,62 (м, 4H), 1,62 (с, 3H), 1,41 (с, 3H).
Стадия 6: Тетрафторборат бис(норборнадиен)родия (I) (0,74 г, 2,0 ммоль) и 1,2-бис(дифенилфосфино)бензол (1,1 г, 2,4 ммоль) суспендировали в DCE (70 мл). Смесь перемешивали при комнатной температуре в атмосфере аргона в течение 10 мин. Затем через раствор барботировали водород в течение 10 минут, затем снова продували аргоном в течение 20 мин. К полученному раствору добавляли по каплям (3aR,5S,6R,6aR)-6-(бензилокси)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбальдегид (6 г, 20 ммоль) в DCE (120 мл) и смесь перемешивали в течение 20 ч при 75°C. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (1-15% EtOAc/петролейный эфир) с получением (3aR,4aS,7aS,7bR)-7a-(бензилокси)-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она. MS: 322(M+NH4). 1H ЯМР (300 МГц, Хлороформ-d) δ 7,40-7,31 (м, 5H), 5,96 (д, J=3,6 Гц, 1H), 4,77 (д, J=10,8 Гц, 1H), 4,67-4,61 (м, 2H), 4,19 (с, 1H), 2,58-2,43 (м, 3H), 1,82-1,68 (м, 1H), 1,66 (с, 3H), 1,42 (с, 3H).
Стадия 7: К перемешиваемой смеси бром(метил)трифенилфосфорана (28,3 г, 79 ммоль) в THF (109 мл) добавляли н-бутиллитий (2,5 M в гексане, 28 мл, 71 ммоль) по каплям при -60°C в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в течение 0,5 ч. Затем к полученному раствору добавляли по каплям (3aR,4aS,7aS,7bR)-7a-(бензилокси)-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-он (8,6 г, 28,3 ммоль) в THF (110 мл) через шприц при -60°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь гасили насыщенным водным солевым раствором (200 мл) при 0°C. Смесь экстрагировали при помощи EtOAc (3 × 300 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/петролейный эфир) с получением (3aR,4aR,7aR,7bR)-7a-(бензилокси)-2,2-диметил-5-метиленгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксола. 1H-ЯМР (400 МГц, DMSO-d6) δ 7,34-7,25 (м, 5H), 5,87 (д, J=4,0 Гц, 1H), 5,23-5,22 (м, 1H), 5,10-5,09 (м, 1H), 4,68 (д, J=3,6 Гц, 1H), 4,59 (д, J=11,2 Гц, 1H), 4,51 (д, J=11,2 Гц, 1H), 4,44 (с, 1H), 2,49-2,39 (м, 2H), 2,22-2,16 (м, 1H), 1,63-1,55 (м, 1H), 1,51 (с, 3H), 1,32 (с, 3H).
Стадия 8: К (3aR,4aR,7aR,7bR)-7a-(бензилокси)-2,2-диметил-5-метиленгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксолу (6,8 г, 22 ммоль) добавляли раствор TFA (45 мл) в воде (11 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 0,25 ч. Смесь нейтрализовали 2 M водным раствором NaOH, затем экстрагировали при помощи EtOAc (4 × 200 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-70% EtOAc в петролейном эфире) с получением (3R,3aS,6aR)-3a-(бензилокси)-6-метиленгексагидро-2H-циклопента[b]фуран-2,3-диола в виде смеси двух диастереомеров на аномерном центре в соотношении 5:4. 1H-ЯМР (400 МГц, DMSO-d6) δ 7,37-7,24 (м, 5H), 6,51-6,06 (м, 1H), 5,25-4,87 (м, 4H), 4,68-4,36 (м, 3H), 3,87-3,76 (м, 1H), 2,57-2,33 (м, 2H), 2,10-1,72 (м, 2H).
Стадия 9: К перемешиваемому раствору (3R,3aS,6aR)-3a-(бензилокси)-6-метиленгексагидро-2H-циклопента[b]фуран-2,3-диола (5,0 г, 19 ммоль) в безводном ацетонитриле (63 мл) в атмосфере аргона добавляли по каплям (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (7,2 г, 29 ммоль) в ацетонитриле (63 мл) через шприц в течение 0,5 минут при комнатной температуре. Добавляли трибутилфосфин (7,6 мл, 31 ммоль) через шприц в течение 5 минут при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре около 5 мин. Реакционную смесь перемешивали при 46°C в течение 3 ч. Полученную содержащую эпоксид смесь использовали непосредственно. Параллельно, в отдельную круглодонную колбу загружали раствор 4-хлор-7H-пирроло[2,3-d]пиримидина (5,6 г, 36 ммоль) в безводном ацетонитриле (30 мл) и DBU (5,2 мл, 34 ммоль) при комнатной температуре в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Затем DBU-содержащий раствор переносили в указанную выше смесь, содержащую эпоксидное промежуточное соединение, с использованием шприца при комнатной температуре в атмосфере аргона. Полученную смесь перемешивали при 46°C в течение 2 ч и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/петролейный эфир) с получением (2R,3R,3aS,6aR)-3a-(бензилокси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3-ола. MS: 398(M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,71 (с, 1H), 7,96 (д, J=4,0 Гц, 1H), 7,45-7,28 (м, 5H), 6,80 (д, J=3,6 Гц, 1H), 6,30 (д, J=8,0 Гц, 1H), 5,83 (д, J=6,8 Гц, 1H), 5,14 (д, J=16,0 Гц, 2H), 4,92 (д, J=12,0 Гц, 1H), 4,71 (д, J=11,6 Гц, 1H), 4,67 (с, 1H), 4,61-4,58 (м, 1H), 2,84-2,78 (м, 1H), 2,56-2,51 (м, 1H), 2,19-2,13 (м, 1H), 2,09-2,04 (м, 1H).
Стадия 10: К раствору (2R,3R,3aS,6aR)-3a-(бензилокси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3-ола (690 мг, 1,7 ммоль) в DCM (10 мл) добавляли по каплям трихлорборан (1 M в DCM, 3,5 мл, 3,5 ммоль) при -78°C в атмосфере аргона. Полученный раствор перемешивали при -78°C в течение 3 ч. Реакционную смесь гасили добавлением TEA (1,0 мл, 7,0 ммоль), затем перемешивали при -78°C в течение 0,5 ч. Реакционный раствор выливали в насыщенный водный раствор NaHCO3 (150 мл) при 0°C при интенсивном перемешивании. Смесь экстрагировали EtOAc (3 × 200 мл). Органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Неочищенный остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением (2R,3R,3aS,6aR)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 308(M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,72 (с, 1H), 7,95 (д, J=4,0 Гц, 1H), 6,78 (д, J=4,0 Гц, 1H), 6,21 (д, J=8,0 Гц, 1H), 5,52 (д, J=7,2 Гц, 1H), 5,38 (с, 1H), 5,12-5,07 (м, 2H), 4,44-4,34 (м, 2H), 2,78-2,69 (м, 1H), 2,51-2,42 (м, 1H), 2,08-2,03 (м, 1H), 1,72-1,64 (м, 1H).
Стадия 11: К смеси (2R,3R,3aS,6aR)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диола (720 мг, 2,3 ммоль) в 2,2-диметоксипропане (2 мл) добавляли 4-метилбензолсульфоновую кислоту (40 мг, 0,23 ммоль) при температуре окружающей среды. Смесь перемешивали в течение 16 ч при температуре окружающей среды. Реакционную смесь гасили NaHCO3 (200 мг) при температуре окружающей среды. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/петролейный эфир) с получением 4-хлор-7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина. MS: 348 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,72 (с, 1H), 7,87 (д, J=4,0 Гц, 1H), 6,79 (д, J=4,0 Гц, 1H), 6,36 (д, J=3,6 Гц, 1H), 5,30 (д, J=3,6 Гц, 1H), 5,15-5,14 (м, 2H), 4,68 (с, 1H), 2,58-2,41 (м, 3H), 2,04-1,93 (м, 1H), 1,57 (с, 3H), 1,39 (с, 3H).
Стадия 12: К 4-хлор-7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидину (2,7 г, 7,76 ммоль) добавляли 1,4-диоксан (18 мл) и концентрированный водный раствор аммиака (28% масс., 18 мл) при комнатной температуре. Реакционный контейнер герметично закрывали и перемешивали при 90°C в течение 16 ч. Смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина. MS: 329 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,09 (с, 1H), 7,29 (д, J=3,6 Гц, 1H), 7,10 (с, 2H), 6,64 (д, J=3,6 Гц, 1H), 6,20 (д, J=4,4 Гц, 1H), 5,19 (д, J=4,0 Гц, 1H), 5,13-5,11 (м, 2H), 4,55 (с, 1H), 2,63-2,42 (м, 3H), 2,01-1,96 (м, 1H), 1,55 (с, 3H), 1,38 (с, 3H).
Схема синтеза промежуточного соединения 16:
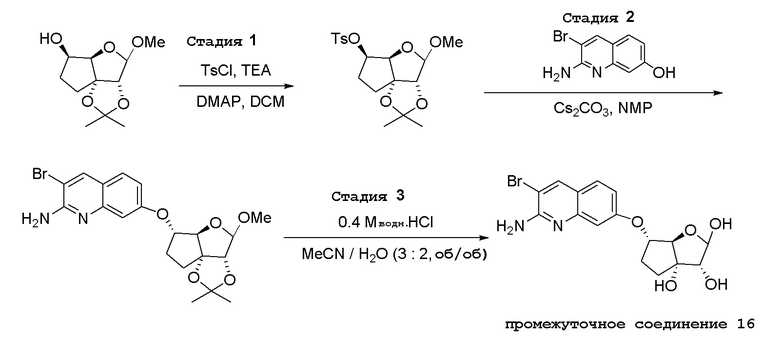
Промежуточное соединение 16: (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол
Стадия 1: К раствору (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (5,0 г, 22 ммоль) в DCM (40 мл) добавляли 4-диметиламинопиридин (2,9 г, 24 ммоль) при комнатной температуре. К смеси добавляли по каплям триэтиламин (2,4 г, 24 ммоль) с последующим добавлением п-толуолсульфонилхлорида (6,2 г, 33 ммоль). Реакционную смесь перемешивали при 25°C в течение 16 ч. Полученную смесь гасили насыщенным водным раствором NH4Cl (100 мл) и экстрагировали при помощи DCM (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл) и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-27% этилацетата/петролейный эфир) с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил 4-метилбензолсульфоната. MS: 402 (M+NH4). 1H-ЯМР (400 МГц, DMSO-d6) δ 7,84-7,82 (м, 2H), 7,52-7,49 (м, 2H), 4,87 (д, J=4,0 Гц, 1H), 4,77-4,72 (м, 1H), 4,40 (д, J=4,0 Гц, 1H), 3,93 (д, J=5,2 Гц, 1H), 3,24 (с, 3H), 2,44 (с, 3H), 2,13-2,08 (м, 1H), 1,91-1,86 (м, 1H), 1,78-1,57 (м, 2H), 1,36 (с, 3H), 1,28 (с, 3H).
Стадия 2: Смесь 2-амино-3-бромхинолин-7-ола (2,0 г, 8,2 ммоль) и (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил 4-метилбензолсульфоната (3,0 г, 7,8 ммоль) совместно упаривали с безводным толуолом (10 мл каждого, три раза) и снова растворяли в NMP (10 мл). К этому раствору добавляли карбонат цезия (7,6 г, 23 ммоль) при температуре окружающей среды. Полученную смесь перемешивали при 90°C в течение 1,5 ч. Реакционную смесь фильтровали и фильтрат очищали обращенно-фазовой колоночной хроматографией на C18 (0-95% 5 мМ водн. NH4HCO3/MeCN) с получением 3-бром-7-(((3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амина. MS: 451/453 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,30 (с, 1H), 7,60 (д, J=8,4 Гц, 1H), 6,91-6,86 (м, 2H), 6,62 (с, 2H), 4,95 (д, J=4,4 Гц, 1H), 4,66 (д, J=4,0 Гц, 1H), 4,54 (д, J=4,4 Гц, 1H), 4,19-4,18 (м, 1H), 3,37 (с, 3H), 2,26-1,98 (м, 4H), 1,36 (с, 3H), 1,28 (с, 3H).
Стадия 3: 3-бром-7-(((3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амин (4,9 г, 11 ммоль) растворяли в 0,4 M водн. HCl в MeCN/H2O (3:2, об./об.) (120 мл) при 0°C. Полученную смесь перемешивали при 90°C в течение 3 ч в герметично закрытой пробирке. Реакционную смесь охлаждали до 0°C. Значение pH раствора доводили до 7 ~ 8 при помощи 2 M водн. NaOH. Полученную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией на AQ-C18 (0-95% 5 мМ водн. NH4HCO3/MeCN) с получением (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триола. MS: 397/399 (M+1/M+3). 1H ЯМР (400 МГц, Метанол-d4) δ 8,22-8,21 (м, 1H), 7,57-7,54 (м, 1H), 7,12-7,03 (м, 1H), 6,98-6,94 (м, 1H), 5,35-5,20 (м, 1H), 4,94-4,64 (м, 1H), 4,36-4,18 (м, 1H), 3,80-3,62 (м, 1H), 2,36-2,02 (м, 4H).
Промежуточные соединения 17-21: Промежуточные соединения 17-21 в Таблице 3 синтезировали с использованием протокола, описанного для промежуточного соединения 16 (Схема синтеза промежуточного соединения 16), осуществляя соответствующее замещение 2-амино-3-бромхинолин-7-ола на стадии 2. Используемое для замены исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
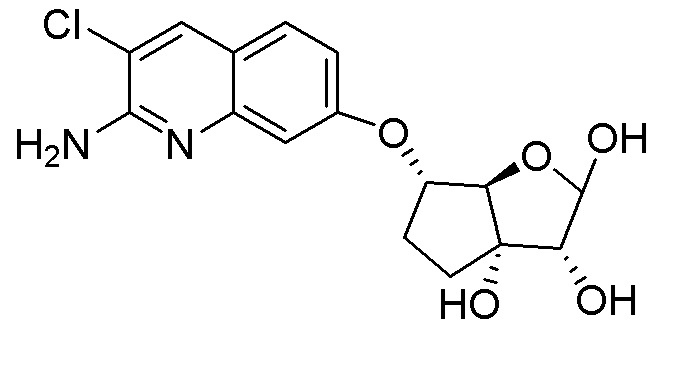
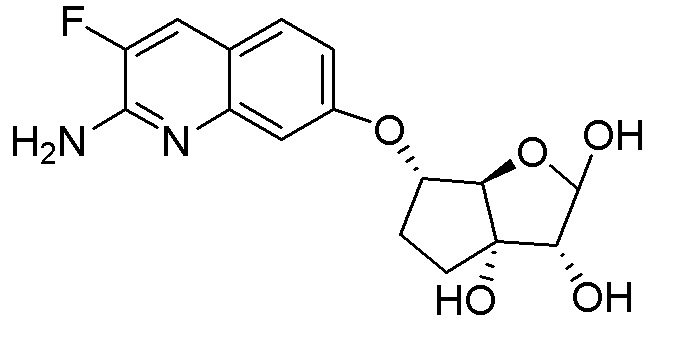
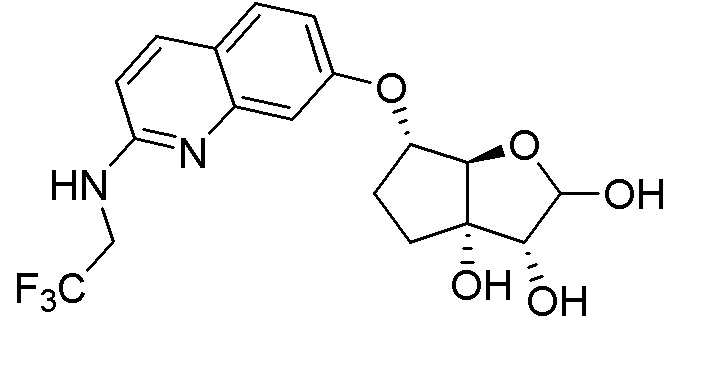
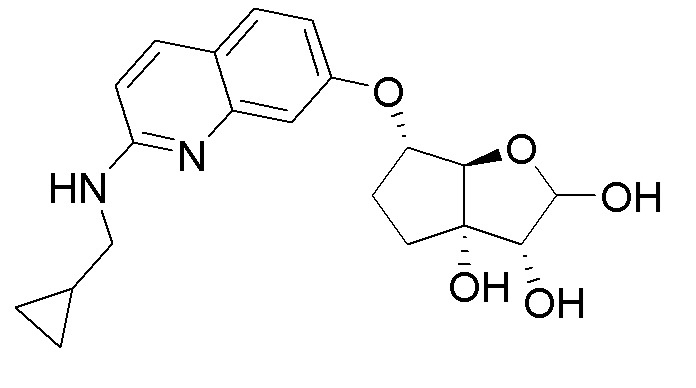
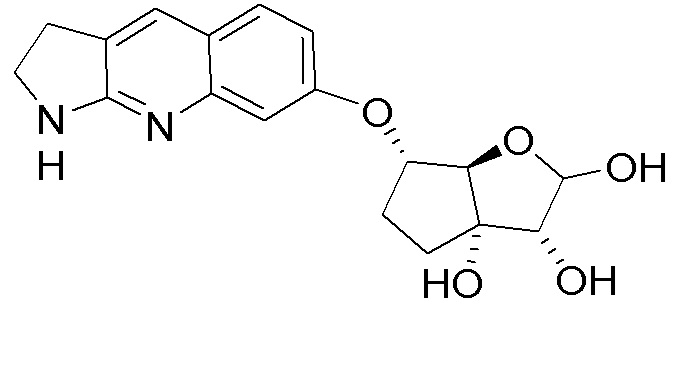
Схема синтеза промежуточного соединения 22
Промежуточное соединение 22: (3R,3aS,6S,6aR)-6-[(2-амино-3-хлорхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол
Стадия 1: К раствору (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (2,0 г, 8,7 ммоль) в безводном DCM (43 мл) при 0°C в атмосфере азота добавляли DMP (4,4 г, 10 ммоль) одной порцией. Смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли при помощи DCM (40 мл) и обрабатывали насыщенным водным раствором бикарбоната натрия (80 мл) и тиосульфатом натрия (10 г, 63 ммоль). Полученную смесь перемешивали в течение 10 минут при комнатной температуре. Органический слой отделяли и водную фазу экстрагировали при помощи DCM (40 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (80 мл), сушили безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/гексан) с получением (3aR,5aS,8aS)-4-метокси-2,2-диметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она. 1H ЯМР (600 МГц, DMSO-d6) δ 4,97 (с, 1H), 4,39 (с, 1H), 4,15 (с, 1H), 3,09 (с, 3H), 2,50-2,46 (м, 1H), 2,46-2,40 (м, 1H), 2,40-2,29 (м, 2H), 1,38 (с, 3H), 1,36 (с, 3H).
Стадия 2: К раствору метилтрифенилфосфоний бромида (5,26 г, 14,7 ммоль) в безводном THF (23 мл) при -78°C в атмосфере аргона добавляли н-бутиллитий (5,52 мл, 2,5 M в гексане, 13,8 ммоль) по каплям. Смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли по каплям раствор (3aR,5aS,8aS)-4-метокси-2,2-диметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она (1,05 г, 4,6 ммоль), растворенного в безводном THF (23 мл), при -78°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили насыщенным водным раствором хлорида аммония (50 мл) при 0°C. Смесь экстрагировали при помощи EtOAc (2 × 30 мл) и объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-40% EtOAc/гексан) с получением (3aR,4S,5aR,8aR)-4-метокси-2,2-диметил-6-метилиденгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола.
Стадия 3: В высушенную в печи колбу, содержащую (3aR,4S,5aR,8aR)-4-метокси-2,2-диметил-6-метилиденгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол (533 мг, 2,4 ммоль), растворенный в THF (6 мл), при 0°C в атмосфере аргона добавляли по каплям 9-BBN (24 мл, 0,5 M в THF, 12 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь охлаждали до 0°C и обрабатывали трехосновным фосфатом калия (12 мл, 1 M в воде, 12 ммоль). Смесь затем перемешивали в течение 30 минут при комнатной температуре. В отдельном сосуде, смесь 7-бром-3-хлорхинолин-2-амин (910 мг, 3,5 ммоль), THF (18 мл) и (2-дициклогексилфосфино-2′,6′-диизопропокси-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладий(II) метансульфоната (200 мг, 0,24 ммоль) продували азотом в течение 5 мин. В сосуд, содержащий боронат, добавляли перемешиваемую смесь хинолина. Эту реакционную смесь нагревали при 50°C в течение 1,5 ч. Смесь охлаждали до комнатной температуры и распределяли между насыщенным солевым раствором и EtOAc. Водную фазу экстрагировали при помощи EtOAc. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/гексан) с получением 3-хлор-6-{[(3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил]метил}хинолин-2-амина. MS: 405 (M+1).
Стадия 4: В сосуд, содержащий 3-хлор-6-{[(3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил]метил}хинолин-2-амин (600 мг, 1,48 ммоль), растворенный в ацетонитриле (6 мл), добавляли воду (4 мл) и HCl (355 мкл, 37% в воде, 4,33 ммоль). Смесь нагревали при 80°C в течение 2,5 ч и затем перемешивали в течение ночи при комнатной температуре. Смесь охлаждали до 0°C и гасили насыщенным водным раствором бикарбоната натрия (364 мг, 4,3 ммоль). Водный слой экстрагировали при помощи EtOAc и объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (3R,3aS,6S,6aR)-6-[(2-амино-3-хлорхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-2,3,3a-триола. MS: 351 (M+1). 1H ЯМР (DMSO-d6) δ: 8,14 (с, 1H), 7,57 (д, J=8,2 Гц, 1H), 7,34 (с, 1H), 7,13 (дд, J=8,2, 1,4 Гц, 1H), 6,65 (с, 2H), 5,96 (д, J=6,6 Гц, 1H), 5,16 (дд, J=6,6, 4,0 Гц, 1H), 4,66 (д, J=7,6 Гц, 1H), 4,46 (с, 1H), 3,92 (д, J=4,6 Гц, 1H), 3,48 (дд, J=7,5, 4,0 Гц, 1H), 2,82 (дд, J=13,4, 8,4 Гц, 1H), 2,66 (дд, J=13,4, 6,7 Гц, 1H), 2,26-2,12 (м, 1H), 1,83-1,73 (м, 1H), 1,62 (дт, J=12,6, 6,6 Гц, 1H), 1,57-1,46 (м, 1H), 1,31 (кв.д, J=12,1, 7,1 Гц, 1H).
Промежуточные соединения 23-25: Промежуточные соединения 23-25 в Таблице 4 синтезировали с использованием протокола, описанного для промежуточного соединения 22, осуществляя соответствующее замещение 7-бром-3-хлорхинолин-2-амина на стадии 3. Используемое для замены исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
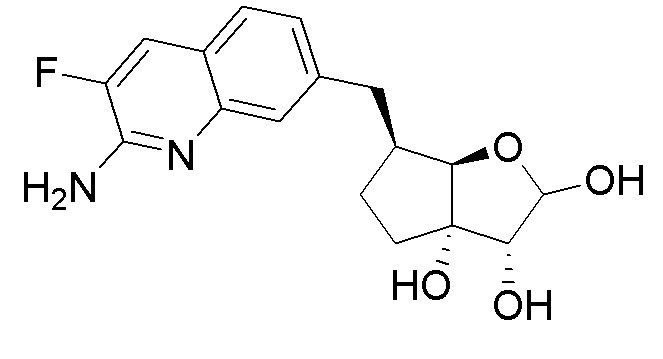
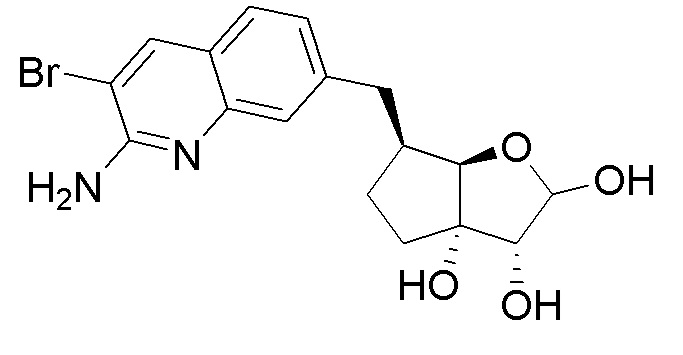
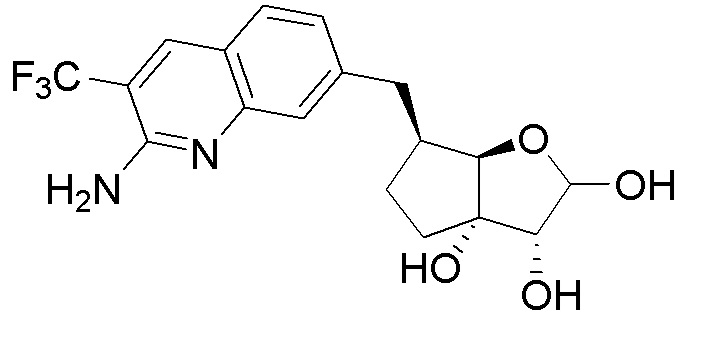
Схема синтеза промежуточного соединения 26
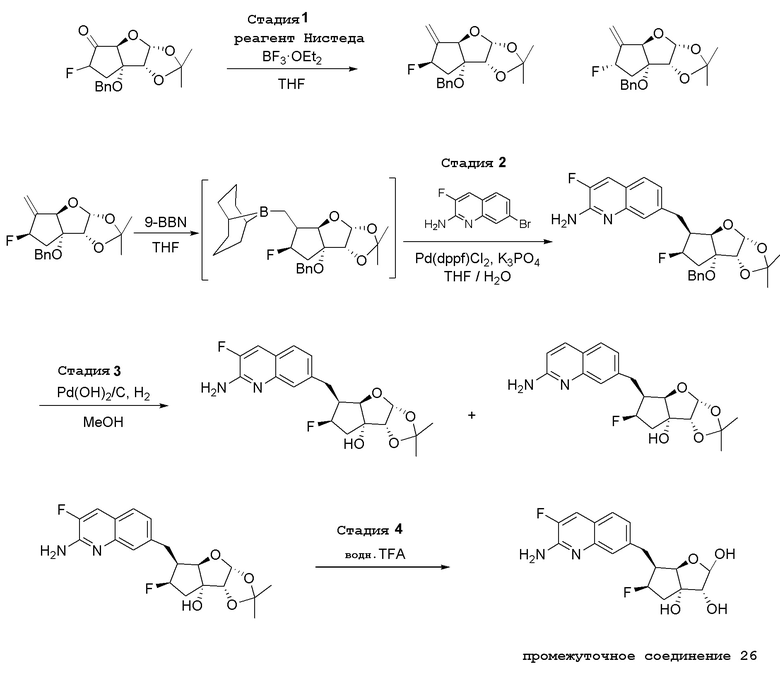
Промежуточное соединение 26: (3R,3aS,5R,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-5-фторгексагидро-2H-циклопента[b]фуран-2,3,3a-триол
Стадия 1: К смеси реагента Нистеда (6,37 г, 14,0 ммоль) в безводном THF (40 мл) добавляли по каплям диэтилэфират трифторида бора (1,8 мл, 14,0 ммоль) при 0°C в атмосфере аргона. Смесь перемешивали при 0°C в течение 5 минут. Добавляли раствор (3aR,4aS,7aS,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она (1,5 г, 4,7 ммоль) в безводном THF (35 мл) при 0°C. Полученную смесь перемешивали при температуре окружающей среды в течение 15 ч. Реакционную смесь гасили добавлением насыщенного водного раствора NaHCO3 (40 мл) при 0°C и затем распределяли между EtOAc/H2O (250 мл/50 мл). Органический слой отделяли и водный слой снова экстрагировали при помощи EtOAc (100 мл). Объединенные органические слои промывали водой (150 мл) и насыщенным солевым раствором (2 × 100 мл). Органический слой сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% EtOAc/петролейный эфир) с получением (3aR,4aR,6R,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксола. 1H-ЯМР (400 МГц, CDCl3) δ 7,38-7,29 (м, 5H), 5,99 (д, J=3,6 Гц, 1H), 5,68-5,64 (м, 2H), 5,57-5,39 (м, 1H), 4,78 (с, 1H), 4,72 (д, J=10,8 Гц, 1H), 4,64 (д, J=4,0 Гц, 1H), 4,57 (д, J=10,8 Гц, 1H), 2,79-2,72 (м, 1H), 1,96-1,85 (м, 1H), 1,67 (с, 3H), 1,43 (с, 3H). 19F-ЯМР (376 МГц, CDCl3) δ -169,53 (с, 1F). Хроматографическая стадия также давала (3aR,4aR,6S,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол. 1H-ЯМР (400 МГц, CDCl3) δ 7,45-7,44 (м, 2H), 7,44-7,27 (м, 3H), 5,87 (д, J=3,6 Гц, 1H), 5,72 (дд, J=4,4, 1,6 Гц, 2H), 5,58-5,42 (м, 1H), 4,85 (с, 1H), 4,66 (дд, J=17,2, 10,4 Гц, 2H), 4,61 (д, J=4,0 Гц, 1H), 2,67-2,56 (м, 1H), 2,02-1,89 (м, 1H), 1,66 (с, 3H), 1,42 (с, 3H). 19F-ЯМР (376 МГц, CDCl3) δ -164,53 (с, 1F).
Стадия 2: К раствору (3aR,4aR,6R,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксола (180 мг, 0,562 ммоль) в безводном THF (0,5 мл) добавляли по каплям 9-BBN в THF (0,5 M, 6,7 мл, 3,4 ммоль) при 0°C в атмосфере аргона и смесь перемешивали при 70°C в течение 1,5 ч. Смесь охлаждали до 0°C и добавляли раствор K3PO4 (1M в вод, 716 мг, 3,37 ммоль). Полученную смесь перемешивали в течение 0,5 ч при температуре окружающей среды. Затем к смеси добавляли раствор 7-бром-3-фторхинолин-2-амина (122 мг, 0,51 ммоль) в 3,5 мл безводного THF и Pd(dppf)Cl2 (41,1 мг, 0,056 ммоль). Смесь нагревали до 80°C в микроволновом реакторе в течение 3,0 ч. Органический слой отделяли и водный слой экстрагировали при помощи EtOAc (150 мл × 2). Объединенные органические слои промывали водой (50 мл) и насыщенным солевым раствором (80 мл). Органический слой сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-25% EtOAc/петролейный эфир) с получением 7-(((3aR,4aR,5S,6R,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-фторхинолин-2-амина. MS 483 (M+1). 1H-ЯМР (400 МГц, Хлороформ-d) δ 7,62-7,54 (м, 3H), 7,35-7,33 (м, 4H), 7,31-7,28 (м, 2H), 6,02 (д, J=3,6 Гц, 1H), 5,51 (с, 2H), 5,09-4,93 (м, 1H), 4,72-4,67 (м, 2H), 4,54 (д, J=4,0 Гц, 1H), 4,45 (д, J=10,8 Гц, 1H), 3,14-3,11 (м, 2H), 2,60-2,41 (м, 2H), 2,20-2,07 (м, 1H), 1,62 (с, 3H), 1,44 (с, 3H). 19F-ЯМР (376 МГц, Хлороформ-d) δ -137,96 (с, 1F), -182,37 (с, 1F).
Стадия 3: К смеси 7-(((3aR,4aR,5S,6R,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-фторхинолин-2-амина (180 мг, 0,37 ммоль) в MeOH (16 мл) и THF (2 мл) добавляли Pd(OH)2/C (20% масс., 500 мг, 0,71 ммоль) при температуре окружающей среды в атмосфере аргона. Суспензию дегазировали в вакууме и продували H2 несколько раз и затем перемешивали в атмосфере H2 при 1 атм при температуре окружающей среды в течение 6 ч. Смесь фильтровали и фильтровальную лепешку промывали MeOH/ концентрированным водным раствором аммиака (10:1) три раза (10 мл каждый). Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением (3aR,4aR,5S,6R,7aR,7bR)-5-((2-амино-3-фторхинолин-7-ил)метил)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-7a-ола. MS: 393(M+1).
Стадия 4: (3aR,4aR,5S,6R,7aR,7bR)-5-((2-амино-3-фторхинолин-7-ил)метил)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-7a-ол (40 мг, 0,10 ммоль) растворяли в TFA и H2O (2,0 мл, TFA/H2O=1:1) при 0°C и смесь перемешивали при температуре окружающей среды в течение 1,0 ч. Смесь совместно упаривали с толуолом (3 × 15,0 мл) досуха. Полученный остаток очищали обращенно-фазовой колоночной хроматографией на C18 (0-95% 5 мМ водн. NH4HCO3/ACN) с получением (3R,3aS,5R,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-5-фторгексагидро-2H-циклопента[b]фуран-2,3,3a-триола. MS: 353(M+1). 1H-ЯМР (300 МГц, CD3OD) δ 7,70 (д, J=11,4 Гц, 1H), 7,60-7,52 (м, 2H), 7,29 (д, J=8,1 Гц, 1H), 5,37 (д, J=4,2 Гц, 1H), 5,08-4,95 (м, 1H), 4,31-3,71 (м, 2H), 3,10-2,98 (м, 2H), 2,45-2,29 (м, 2H), 2,08-1,93 (м, 1H). 19F-ЯМР (282 МГц, CD3OD) δ -139,28 до -139,34 (м, 1F), -186,24 до -189,90 (м, 1F).
Схема синтеза промежуточного соединения 27
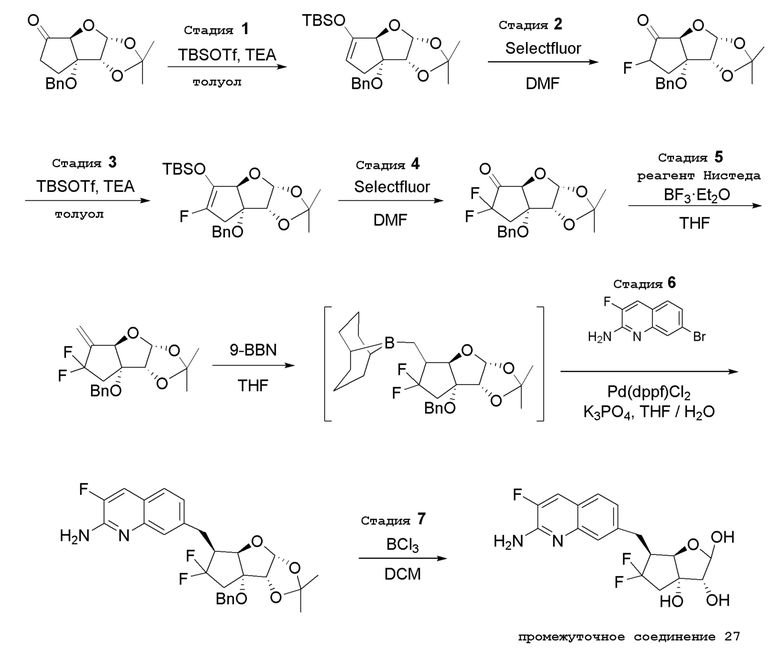
Промежуточное соединение 27: (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-5,5-дифторгексагидро-2H-циклопента[b]фуран-2,3,3a-триол
Стадия 1: К смеси (3aR,4aS,7aS,7bR)-7a-(бензилокси)-2,2-диметилгексагидро-5H-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-она (3,0 г, 9,9 ммоль) в толуоле (40 мл) добавляли триэтиламин (46,6 мл, 340 ммоль) при температуре окружающей среды в атмосфере аргона. Реакционную смесь нагревали до 100°C, затем обрабатывали трет-бутилдиметилсилил трифторметансульфонатом (5,21 г, 20. ммоль). Полученную смесь перемешивали при 100°C в течение 30 мин. После завершения реакции смесь охлаждали до комнатной температуры, разбавляли толуолом (300 мл) и промывали насыщенным водным раствором NaHCO3 (300 мл). Органический слой сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-15% EtOAc/петролейный эфир) с получением (((3aR,4aS,7aR,7bR)-7a-(бензилокси)-2,2-диметил-4a,7,7a,7b-тетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)окси)(трет-бутил)диметилсилана. 1H-ЯМР (300 МГц, DMSO-d6) δ 7,36-7,26 (м, 5H), 5,85 (д, J=3,3 Гц, 1H), 4,81-4,79 (м, 1H), 4,64-4,56 (м, 3H), 4,46 (с, 1H), 2,70-2,64 (м, 1H), 2,37-2,31 (м, 1H), 1,51 (с, 3H), 1,35 (с, 3H), 0,91 (с, 9H), 0,18 (с, 6H).
Стадия 2: К смеси (((3aR,4aS,7aR,7bR)-7a-(бензилокси)-2,2-диметил-4a,7,7a,7b-тетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)окси)(трет-бутил)диметилсилана (4,0 г, 9,6 ммоль) в безводном DMF (70 мл) добавляли 1-(хлорметил)-4-фтор-1,4-диазабицикло[2.2.2]октан-1,4-дииум тетрафторборат (3,72 г, 10,5 ммоль) при температуре окружающей среды в атмосфере аргона. Полученную смесь перемешивали при температуре окружающей среды в течение 2 ч. Реакционную смесь разбавляли толуолом (200 мл) и промывали водой (3 × 50 мл). Объединенный органический слой сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/петролейный эфир) с получением (3aR,4aS,7aS,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она. 1H ЯМР (400 МГц, DMSO-d6) δ 7,20-7,05 (м, 5H), 5,88-5,67 (м, 1H), 4,62-4,49 (м, 1H), 4,44-4,40 (м, 3H), 3,85-3,83 (м, 1H), 2,13-1,94 (м, 2H), 1,28-1,26 (м, 3H), 1,16-1,14 (м, 3H).
Стадия 3: К смеси (3aR,4aS,7aS,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она (2,0 г, 6,2 ммоль) в толуоле (10 мл) добавляли триэтиламин (21,4 г, 210 ммоль) при температуре окружающей среды в атмосфере аргона. Реакционную смесь нагревали до 100°C, затем обрабатывали трет-бутилдиметилсилил трифторметансульфонатом (3,28 г, 12,4 ммоль). Полученную смесь перемешивали при 100°C в течение 30 мин. После завершения реакции смесь охлаждали до комнатной температуры, разбавляли водой (150 мл) и экстрагировали при помощи EtOAc (3 × 150 мл). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% EtOAc/петролейный эфир) с получением (((3aR,4aS,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-4a,7,7a,7b-тетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)окси)(трет-бутил)диметилсилана. 1H-ЯМР (400 МГц, DMSO-d6) δ 7,17-7,07 (м, 5H), 5,70-5,56 (м, 1H), 4,52-4,42 (м, 3H), 4,39-4,32 (м, 1H), 2,68 (д, J=16,0 Гц, 1H), 2,51 (д, J=16,4 Гц, 1H), 1,30-1,29 (м, 3H), 1,16-1,15 (м, 3H), 0,72 (с, 9H), -0,04 (с, 6H).
Стадия 4: К смеси (((3aR,4aS,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-4a,7,7a,7b-тетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)окси)(трет-бутил)диметилсилана (2,6 г, 6,0 ммоль) в безводном DMF (60 мл) добавляли 1-(хлорметил)-4-фтор-1,4-диазабицикло[2.2.2]октан-1,4-дииум тетрафторборат (2,53 г, 7,2 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь разбавляли водой (300 мл) и экстрагировали при помощи EtOAc (3 × 300 мл). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/петролейный эфир) с получением (3aR,4aS,7aS,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она. 1H-ЯМР (400 МГц, Хлороформ-d) δ 7,42-7,34 (м, 5H), 5,96 (д, J=3,6 Гц, 1H), 4,78 (д, J=10,4 Гц, 1H), 4,62 (д, J=3,6 Гц, 1H), 4,54 (д, J=10,8 Гц, 1H), 4,38 (д, J=4,8 Гц, 1H), 2,90-2,77 (м, 1H), 2,47-2,38 (м, 1H), 1,61 (с, 3H), 1,46 (с, 3H).
Стадия 5: К перемешиваемому раствору реагента Нистеда (36,9 г, 16,2 ммоль, 20% масс. в THF) в THF (22 мл) добавляли диэтилэфират трифторида бора (2,29 г, 16,2 ммоль) при 0°C в атмосфере аргона. Смесь перемешивали при 0°C в течение 5 минут. К смеси добавляли по каплям раствор (3aR,4aS,7aS,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметилтетрагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5(4aH)-она (1,1 г, 3,2 ммоль) в безводном THF (33 мл) при 0°C. Полученную смесь перемешивали при температуре окружающей среды в течение 4 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (50 мл) при 0°C. Полученную смесь экстрагировали при помощи EtOAc (2 × 100 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (EtOAc:петролейный эфир=1:3) с получением (3aR,4aR,7aR,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксола. 1H-ЯМР (400 МГц, DMSO-d6) δ 7,37-7,26 (м, 5H), 5,97 (д, J=3,6 Гц, 1H), 5,87-5,84 (м, 2H), 4,77 (д, J=4,0 Гц, 1H), 4,70-4,69 (м, 1H), 4,63 (д, J=11,2 Гц, 1H), 4,53 (д, J=11,2 Гц, 1H), 2,98 (т, J=16,0 Гц, 1H), 2,35-2,23 (м, 1H), 1,53 (с, 3H), 1,34 (с, 3H).
Стадия 6: (3aR,4aR,7aR,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол (170 мг, 0,50 ммоль) растворяли в 9-BBN (6,029 мл, 3,01 ммоль, 0,5 M в THF) при температуре окружающей среды в атмосфере аргона. Полученный раствор перемешивали при 50°C в течение 1 ч. Смесь охлаждали до 0°C и обрабатывали раствором K3PO4 (533 мг, 2,50 ммоль) в 3,5 мл воды. Смесь перемешивали в течение 0,5 ч при температуре окружающей среды, затем к смеси добавляли раствор 7-бром-3-фторхинолин-2-амина (97 мг, 0,40 ммоль) в 5,0 мл безводного THF и Pd(dppf)Cl2 (37 мг, 0,05 ммоль). Смесь нагревали до 80°C в микроволновом реакторе в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (40 мл) и экстрагировали при помощи EtOAc (3 × 80 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (EtOAc:петролейный эфир=1:2) с получением 7-(((3aR,4aR,5S,7aR,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-фторхинолин-2-амина. MS: 501 (M+1). 1H-ЯМР (400 МГц, Хлороформ-d) δ 7,61 (с, 1H), 7,55 (д, J=3,6 Гц, 1H), 7,52 (с, 1H), 7,36-7,25 (м, 6H), 5,99 (д, J=3,6 Гц, 1H), 5,61 (с, 2H), 4,68 (д, J=10,4 Гц, 1H), 4,62 (д, J=3,6 Гц, 1H), 4,48 (д, J=10,8 Гц, 1H), 4,39 (дд, J=6,4 Гц, 3,2 Гц, 1H), 3,16-3,05 (м, 2H), 2,87-2,74 (м, 2H), 2,32-2,21 (м, 1H), 1,56 (с, 3H), 1,42 (с, 3H).
Стадия 7: К раствору 7-(((3aR,4aR,5S,7aR,7bR)-7a-(бензилокси)-6,6-дифтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-фторхинолин-2-амина (290 мг, 0,58 ммоль) в безводном DCM (6,0 мл) добавляли по каплям BCl3 (1 M в DCM, 1,7 мл, 1,74 ммоль) при -78°C в атмосфере аргона. Полученную смесь перемешивали при -78°C в течение 2 ч. Реакционную смесь гасили добавлением триэтиламина (0,32 мл, 2,3 ммоль) и полученную смесь поддерживали при -78°C в течение 0,5 ч. Затем реакционную смесь выливали в насыщенный водный раствор NaHCO3 (30 мл) при 0°C и полученную смесь перемешивали при 0°C еще в течение 0,5 ч. Полученную смесь экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой колоночной хроматографией на C18 (0-95% 5 мМ водн. NH4HCO3/MeCN) с получением (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-5,5-дифторгексагидро-2H-циклопента[b]фуран-2,3,3a-триола. MS: 371(M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 7,81 (д, J=12,0 Гц, 1H), 7,61 (д, J=8,1 Гц, 1H), 7,41 (с, 1H), 7,19 (д, J=8,1 Гц, 1H), 6,81-6,75 (м, 2H), 6,21 (д, J=7,2 Гц, 1H), 5,26-5,22 (м, 1H), 5,01-4,95 (м, 2H), 4,00-3,99 (м, 1H), 3,66-3,62 (м, 1H), 2,97-2,66 (м, 3H), 2,42-2,09 (м, 2H).
Схема синтеза промежуточного соединения 28
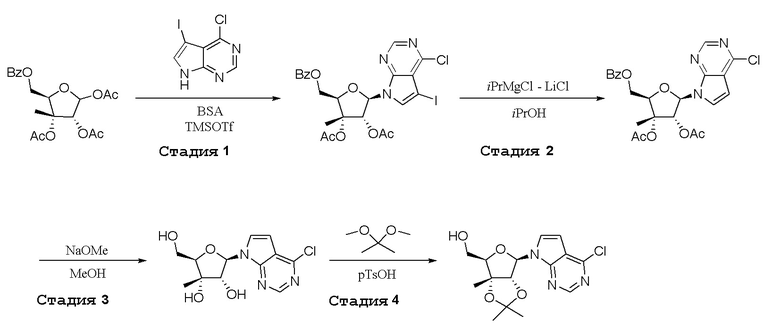
Промежуточное соединение 28: ((3aR,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанол
Стадия 1: Раствор 4-хлор-5иод-7H-пироло[2,3-d]пиримидина (1,417 г, 5,07 ммоль) в безводном ACN (10 мл) перемешивали с BSA (1,25 мл, 5,07 ммоль) при комнатной температуре в течение 15 минут. Добавляли (3R,4R,5R)-5-((бензоилокси)метил)-4-метилтетрагидрофуран-2,3,4-триил триацетат (2 г, 5,07 ммоль) в ACN (20 мл) с последующим добавлением TMSOTf (1,84 мл, 10,1 ммоль) и реакционную смесь перемешивали еще в течение 10 минут при комнатной температуре, затем в течение 3 ч при 80°C. Реакционную смесь охлаждали до комнатной температуры и разбавляли при помощи EtOAc (40 мл). Реакционную смесь затем промывали насыщенным водным раствором NaHCO3 (2 × 30 мл) и насыщенным солевым раствором (2 × 30 мл) и сушили. Остаток очищали колоночной хроматографией на силикагеле (PE/Et2O) с получением (2R,3R,4R,5R)-2-((бензоилокси)метил)-5-(4-хлор-5-иод-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата. MS: 614 (M+1)
Стадия 2: К перемешиваемому раствору (2R,3R,4R,5R)-2-((бензоилокси)метил)-5-(4-хлор-3-иод-1H-индол-1-ил)-3-метилтетрагидрофуран-3,4-диил диацетата (4,6 г, 7,5 ммоль) в безводном THF (45 мл) по каплям добавляли комплекс хлорид изопропилмагния-хлорид лития (7,21 мл, 9,37 ммоль) в течение 5 минут при -78°C. Смесь перемешивали при -78°C в течение 20 минут и затем гасили добавлением по каплям i-PrOH (0,808 мл, 10,5 ммоль) при -78°C. Реакционную смесь выливали в смесь льда и насыщенного водного раствора NH4Cl и экстрагировали при помощи DCM. Органические слои объединяли, сушили и концентрировали при пониженном давлении с получением (2R,3R,4R,5R)-2-((бензоилокси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата в виде масла. MS: 489 (M+1)
Стадия 3: При 0°C метоксид натрия (7,75 мл, 3,87 ммоль) добавляли к перемешиваемому раствору (2R,3R,4R,5R)-2-((бензоилокси)метил)-5-(4-хлор-1H-индол-1-ил)-3-метилтетрагидрофуран-3,4-диил диацетата (3,15g, 6,46 ммоль) в MeOH (100 мл). Смесь перемешивали при 0°C в течение 1 ч и затем при комнатной температуре в течение 2 ч. Реакционную смесь гасили при помощи Dowex до pH=6. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (0-10% MeOH/DCM) с получением (2R,3S,4R,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-(гидроксиметил)-3-метилтетрагидрофуран-3,4-диола в виде пенистого вещества. MS: 300 (M+1)
Стадия 4: Смесь (2R,3S,4R,5R)-5-(4-хлор-1H-индол-1-ил)-2-(гидроксиметил)-3-метилтетрагидрофуран-3,4-диола (443 мг, 1,48 ммоль), п-толуолсульфоновой кислоты моногидрата (562 мг, 2,96 ммоль) и 2,2-диметоксипропана (1,844 мкл, 14,78 ммоль) в ацетоне (35 мл) перемешивали при 65°C в течение ночи. Реакционную смесь экстрагировали при помощи DCM и органическую фазу промывали насыщенным водным раствором NaHCO3. Органическую фазу сушили, концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (C18, ACN/вода) с получением ((3aR,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола в виде пенистого вещества. MS: 363 (M+24)
Схема синтеза промежуточного соединения 29
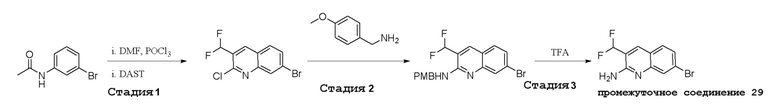
Промежуточное соединение 29: 7-бром-3-(дифторметил)хинолин-2-амин
Стадия 1: К DMF (16 мл) добавляли POCl3 (48,8 мл, 523 ммоль) по каплям через канюлю в течение 30 минут при 0°C и реакционную смесь перемешивали еще в течение 30 минут при этой температуре. Затем к смеси добавляли N-(3-бромфенил)ацетамид (16 г, 75 ммоль) и реакционную смесь перемешивали при 80°C в течение 2 ч. Растворитель затем удаляли при пониженном давлении с получением неочищенного остатка, который разбавляли 200 мл насыщенного водного раствора NaHCO3 и экстрагировали при помощи 1000 мл EtOAc. Органическую фазу промывали водой (600 мл), насыщенным солевым раствором (300 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 20% EtOAc/PE) с получением 7-бром-2-хлорхинолин-3-карбальдегида в виде твердого вещества. Затем 7-бром-2-хлорхинолин-3-карбальдегид (1,8 г, 6,65 ммоль) совместно упаривали с толуолом (5 мл) три раза. К раствору 7-бром-2-хлорхинолин-3-карбальдегида (1,8 г, 6,65 ммоль) в DCM (27 мл) добавляли DAST (1,76 мл, 13,31 ммоль) при 0°C и смесь затем перемешивали при 50°C в течение 1,5 ч. Реакционную смесь разбавляли 50 мл насыщенного водного раствора NaHCO3 при 0°C и экстрагировали при помощи 250 мл EtOAc. Органическую фазу промывали водой (100 мл), насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 30% DCM/PE) с получением 7-бром-2-хлор-3-(дифторметил)хинолина в виде твердого вещества. MS: 292/294 (M+1/M+3).
Стадия 2: Раствор 7-бром-2-хлор-3-(дифторметил)хинолина (960 мг, 3,28 ммоль) и (4-метоксифенил)метанамина (2,144 мл, 16,41 ммоль) в 1,4-диоксане (10 мл) перемешивали при комнатной температуре в герметично закрытой пробирке. Затем реакционную смесь нагревали при 90°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 20% EtOAc/PE) с получением 7-бром-3-(дифторметил)-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 393/395 (M+1/M+3).
Стадия 3: Раствор 7-бром-3-(дифторметил)-N-(4-метоксибензил)хинолин-2-амина (200 мг, 0,509 ммоль) в TFA (15 мл) перемешивали при 50°C в атмосфере аргона в течение 3ч. Реакционную смесь затем разбавляли 100 мл насыщенного водного раствора NaHCO3 при 0°C и экстрагировали при помощи 200 мл EtOAc. Органическую фазу промывали водой (50 мл), насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 20% EtOAc/PE) с получением 7-бром-3-(дифторметил)хинолин-2-амина в виде твердого вещества. MS: 273/275 (M+1/M+3).
Схема синтеза промежуточного соединения 30
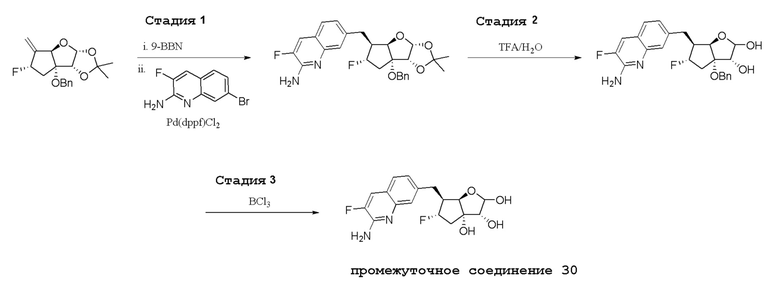
Промежуточное соединение 30: (3R,3aS,5S,6S)-6-((2-амино-3-фторхинолин-7-ил)метил)-5-фторгексагидро-2H-циклопента[b]фуран-2,3,3a-триол
Стадия 1: К раствору (3aR,4aR,6S,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметил-5-метиленгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксола (190 мг, 0,593 ммоль) в безводном THF (0,5 мл) добавляли 9-BBN (7,12 мл, 0,5M в THF, 3,56 ммоль) по каплям при комнатной температуре в атмосфере аргона. Смесь перемешивали при 70°C в течение 1,5 ч. Затем смесь охлаждали до 0°C и добавляли раствор K3PO4 (755 мг, 3,56 ммоль) в 2,5 мл H2O. Полученную смесь перемешивали еще в течение 0,5 ч при комнатной температуре. Затем к смеси добавляли раствор 7-бром-3-фторхинолин-2-амина (129 мг, 0,534 ммоль) в безводном THF (3 мл) и Pd(dppf)Cl2 (43,4 мг, 0,059 ммоль). Полученную реакционную смесь подвергали микроволновому облучению при 80°C в течение 3 ч. Органический слой затем отделяли и водный слой снова экстрагировали при помощи EtOAc (60 мл × 2). Объединенные органические слои промывали H2O (60 мл) и насыщенным солевым раствором (60 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (элюировали смесью 0-25% EtOAc/PE) с получением 7-(((3aR,4aR,5S,6S,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-фторхинолин-2-амина в виде твердого вещества. MS: 483 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 7,81 (д, J=11,7 Гц, 1H), 7,61 (д, J=8,1 Гц, 1H), 7,47-7,36 (м, 5H), 7,34-7,29 (м, 1H), 7,15-7,12 (м, 1H), 6,76 (шир.с, 2H), 5,86 (д, J=3,9 Гц, 1H), 5,42-5,34 (м, 1H), 4,68-4,65 (м, 2H), 4,57 (д, J=11,1 Гц, 1H), 4,22 (с, 1H), 3,02 (дд, J=14,1, 6,9 Гц, 1H), 2,86-2,78 (м, 1H), 2,70-2,64 (м, 2H), 2,08-1,90 (м, 1H), 1,40 (с, 3H), 1,30 (с, 3H).
Стадия 2: 7-(((3aR,4aR,5S,6S,7aR,7bR)-7a-(бензилокси)-6-фтор-2,2-диметилгексагидро-3aH-циклопента[4,5]фуро[2,3-°ммоль) растворяли в TFA и H2O (12,0 мл, 1:1 TFA /H2O) при 0°C и смесь затем перемешивали при комнатной температуре в течение 1 ч. Смесь совместно упаривали с толуолом (3 × 20 мл) при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюировали смесью 1-10% MeOH/DCM) с получением (3R,3aS,5S,6S)-6-((2-амино-3-фторхинолин-7-ил)метил)-3a-(бензилокси)-5-фторгексагидро-2H-циклопента[b]фуран-2,3-диола в виде твердого вещества. MS: 443 (M+1).
Стадия 3: К раствору (3R,3aS,5S,6S)-6-((2-амино-3-фторхинолин-7-ил)метил)-3a-(бензилокси)-5-фторгексагидро-2H-циклопента[b]фуран-2,3-диола (650 мг, 1,47 ммоль) в безводном DCM (20 мл) добавляли BCl3 (4,41 мл, 1M в DCM, 4,41 ммоль) по каплям при -78°C в атмосфере аргона. Полученный раствор перемешивали при -78°C в течение 1 ч. Реакционную смесь затем гасили триэтиламином (0,819 мл, 5,88 ммоль) и перемешивали при -78°C в течение 0,5 ч. Реакционную смесь выливали в ледяной насыщенный водный раствор NaHCO3 (50 мл) при 0°C и перемешивание продолжали в течение 0,5 ч. Смесь затем экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток и всю водную фазу очищали при помощи RP-Combi-Flash при комнатной температуре (ACN/вода с 5 мМ NH4CO3 модификатора) с получением (3R,3aS,5S,6S)-6-((2-амино-3-фторхинолин-7-ил)метил)-5-фторгексагидро-2H-циклопента[b]фуран-2,3,3a-триола в виде твердого вещества. MS: 353 (M+1). 1H ЯМР (300 МГц, CD3OD) δ 7,71 (д, J=11,4 Гц, 1H), 7,61 (д, J=8,1 Гц, 1H), 7,50 (с, 1H), 7,25 (д, J=8,1 Гц, 1H), 5,29-5,21 (м, 1H), 5,03-4,97 (м, 1H), 4,39-4,20 (м, 1H), 3,82-3,67 (м, 1H), 3,06-2,99 (м, 2H), 2,68-2,40 (м, 1H), 2,33-2,05 (м, 2H).
Схема синтеза промежуточного соединения 31
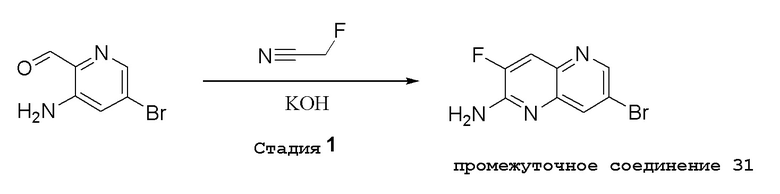
Промежуточное соединение 31: 7-бром-3-фтор-1,5-нафтиридин-2-амин
Стадия 1: 3-амино-5-бромпиколинальдегид (1000 мг, 4,97 ммоль) растворяли в DMSO (10 мл), загружали 2-фторацетонитрил (1108 мкл, 19,9 ммоль), 15M гидроксида калия (100 мкл, 1,49 ммоль) и нагревали до 80°C в течение 2 ч. Реакционную смесь выливали в 10 мл воды, разбавляли при помощи EtOAc (30 мл) и фильтровали через Целит. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/CH2Cl2) с получением 7-бром-3-фтор-1,5-нафтиридин-2-амина в виде твердого вещества. MS: 242/244 (M+1/3).
Схема синтеза промежуточного соединения 32
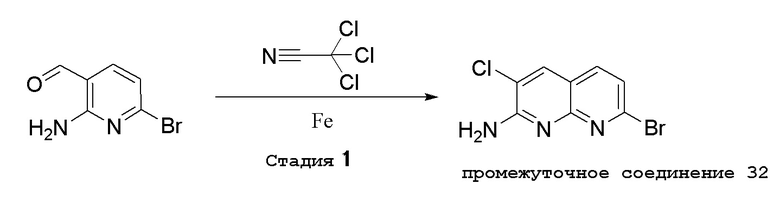
Промежуточное соединение 32: 7-бром-3-хлор-1,8-нафтиридин-2-амин
Стадия 1: Смесь 2-амино-6-бромникотинальдегида (2,6 г, 12,9 ммоль) и железного порошка (7,22 г, 129 ммоль) дегазировали в атмосфере азота и затем загружали THF (26 мл). Добавляли трихлорацетонитрил (1,95 мл, 19,4 ммоль) и смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь кипятили с обратным холодильником при 65°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и фильтровали через Целит с загрузкой 10 г силикагеля. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-50% 3:1 EtOAc:EtOH/гексан с 1% водного NH4OH модификатора). Полученное твердое вещество промывали 2 × 10 мл холодного Et2O с получением 7-бром-3-хлор-1,8-нафтиридин-2-амина в виде твердого вещества, используемого без дополнительной очистки. MS: 258/260 (M+1/3).
Схема синтеза промежуточного соединения 33
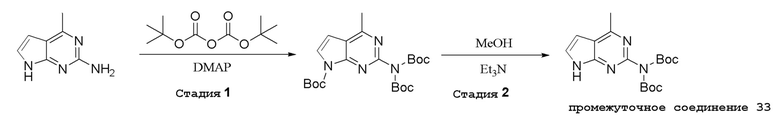
Промежуточное соединение 33: ди-трет-бутил (4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбонат
Стадия 1: К раствору 4-метил-7H-пирроло[2,3-d]пиримидин-2-амина (0,5 г, 3,4 ммоль) в ацетонитриле (8,5 мл)/DCM (8,5 мл) добавляли ди-трет-бутилдикарбонат (2,6 г, 12 ммоль) и 4-диметиламинопиридин (0,082 г, 0,68 ммоль). Раствор перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь концентрировали и очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/гексан) с получением трет-бутил 2-[бис(трет-бутоксикарбонил)амино]-4-метил-7H-пирроло[2,3-d]пиримидин-7-карбоксилата в виде твердого вещества. MS: 449 (M+1).
Стадия 2: К раствору трет-бутил 2-[бис(трет-бутоксикарбонил)амино]-4-метил-7H-пирроло[2,3-d]пиримидин-7-карбоксилата (0,6 г, 1,34 ммоль) в MeOH (2,2 мл) добавляли триэтиламин (1,87 мл, 13,4 ммоль) при комнатной температуре. Реакционную смесь затем нагревали до 60°C и перемешивали в течение 18 ч. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением ди-трет-бутил (4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбоната. MS: 349 (M+1).
Схема синтеза промежуточного соединения 34
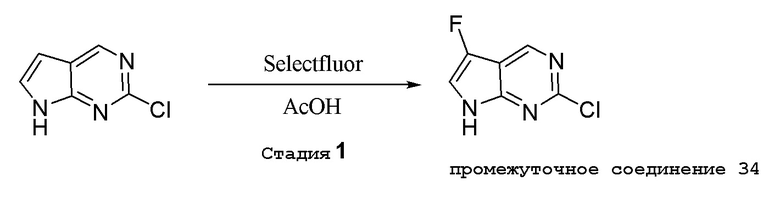
Промежуточное соединение 34: 2-хлор-5-фтор-1H-пирроло[2,3-d]пиримидин
К 2-хлор-1H-пирроло[2,3-d]пиримидину (335 мг, 2,18 ммоль) в ацетонитриле (11 мл) добавляли Selectfluor (1,16 г, 3,27 ммоль) и AcOH (1,1 мл). Смесь нагревали при 70°C в течение ночи. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разбавляли при помощи EtOAc и промывали водой (2×). Раствор сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния (20-50% EtOAc/гексан) с получением 2-хлор-5-фтор-1H-пирроло[2,3-d]пиримидина. MS: 172 (M+1).
Схема синтеза промежуточного соединения 35
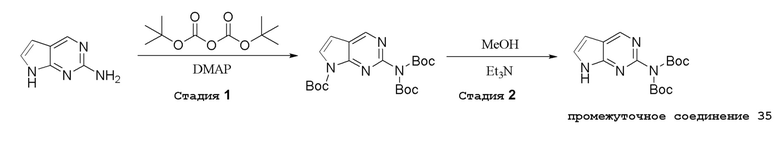
Промежуточное соединение 35: бис(2-метил-2-пропанил) 7H-пирроло[2,3-d]пиримидин-2-илимидодикарбонат
Стадия 1: К перемешиваемому раствору 7H-пирроло[2,3-d]пиримидин-2-амина (500 мг, 3,73 ммоль) в ацетонитриле (9 мл) и дихлорметане (9 мл) добавляли Boc-ангидрид (2,85 г, 13,1 ммоль) и DMAP (91 мг, 0,75 ммоль). Реакционную смесь перемешивали в течение ночи. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-40% EtOAc в Hex) с получением 2-метил-2-пропанил 2-(бис{[(2-метил-2-пропанил)окси]карбонил}амино)-7H-пирроло[2,3-d]пиримидин-7-карбоксилата. MS: 435 (M+1).
Стадия 2: К перемешиваемому раствору 2-метил-2-пропанил 2-(бис{[(2-метил-2-пропанил)окси]карбонил}амино)-7H-пирроло[2,3-d]пиримидин-7-карбоксилата (1,52 г, 3,50 ммоль) в MeOH (17,5 мл) добавляли TEA (4,88 мл, 35,0 ммоль). Раствор нагревали при кипячении с обратным холодильником в течение 2,5 ч. Смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (0-60% EtOAc в Hex) с получением бис(2-метил-2-пропанил) 7H-пирроло[2,3-d]пиримидин-2-илимидодикарбоната. MS: 335 (M+1). 1H ЯМР (500 МГц, DMSO-d6) δ 12,23 (с, 1H), 8,98 (с, 1H), 7,62 (д, J=3,5 Гц, 1H), 6,63 (д, J=3,5 Гц, 1H), 1,38 (с, 18H).
Схема синтеза промежуточного соединения 36
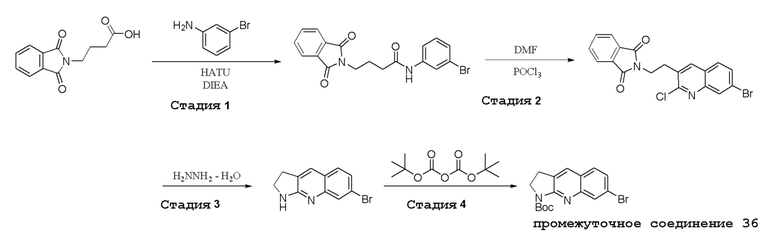
Промежуточное соединение 36: трет-бутил 7-бром-2,3-дигидро-1H-пирроло[2,3-b]хинолин-1-карбоксилат
Стадия 1: К раствору 4-(1,3-диоксоизоиндолин-2-ил)бутановой кислоты (7,73 г, 33,1 ммоль), HATU (15,1 г, 39,8 ммоль) и DIEA (17,4 мл, 99 ммоль) в DMF (50 мл) добавляли 3-броманилин (5,7 г, 33,1 ммоль) при 15°C. Смесь перемешивали в течение 0,5 ч. Добавляли воду (500 мл) и смесь экстрагировали при помощи EtOAc (200 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл) и концентрировали при пониженном давлении. Остаток очищали фильтрованием с использованием EtOAc с получением N-(3-бромфенил)-4-(1,3-диоксоизоиндолин-2-ил)бутанамида в виде твердого вещества. MS:387/389 (M+1/M+3)
Стадия 2: DMF (2,70 мл, 34,9 ммоль) добавляли по каплям к POCl3 (19,02 мл, 204 ммоль) при 5°C (температуру поддерживали при 5-15°C) и реакционную смесь перемешивали в течение 15 минут. К реакционной смеси добавляли N-(3-бромфенил)-4-(1,3-диоксоизоиндолин-2-ил)бутанамид (9 г, 23,24 ммоль) и нагревали до 80°C в течение 12 часов. Смесь охлаждали до комнатной температуры и выливали в воду (200 мл) и pH доводили до 9. Смесь экстрагировали при помощи EtOAc (100 мл × 3) и объединенные органические слои концентрировали при пониженном давлении. Остаток очищали фильтрованием при помощи EtOAc с получением 2-(2-(7-бром-2-хлорхинолин-3-ил)этил)изоиндолин-1,3-диона в виде твердого вещества. MS: 415/417 (M+1/M+3)
Стадия 3: Гидразин гидрат (0,905 мл, 18,2 ммоль) добавляли по каплям к 2-(2-(7-бром-2-хлорхинолин-3-ил)этил)изоиндолин-1,3-диону (6,3 г, 15,2 ммоль) в бутан-1-оле (60 мл) при 80°C. Реакционную смесь перемешивали при 100°C в течение 12 ч. Реакционную смесь концентрировали при пониженном давлении с получением 7-бром-2,3-дигидро-1H-пирроло[2,3-b]хинолина в виде твердого вещества. MS: 249/251 (M+1/M+3)
Стадия 4: В 5-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, добавляли 7-бром-2,3-дигидро-1H-пирроло[2,3-b]хинолин (100 г, 0,401 моль) и ди-трет-бутилдикарбонат (400 г, 1,83 моль). Полученный раствор перемешивали в течение 12 ч при 100°C. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (1:10 этилацетат/петролейный эфир) с получением трет-бутил 7-бром-2,3-дигидро-1H-пирроло[2,3-b]хинолин-1-карбоксилата в виде твердого вещества. MS: 349/351 (M+1/M+3).
Схема синтеза промежуточного соединения 37
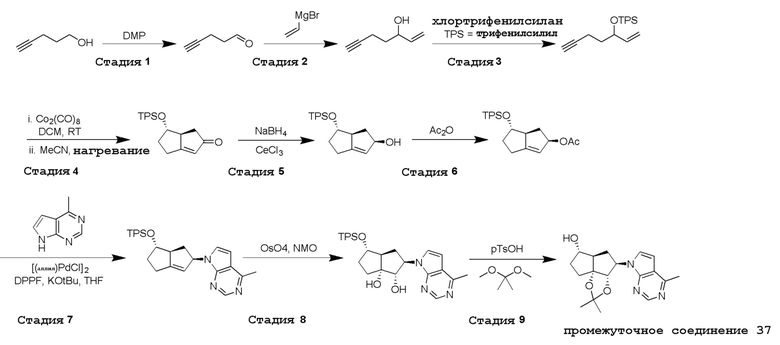
Промежуточное соединение 37: (3aS,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ол
Стадия 1: В колбу, содержащую раствор пент-4-ин-1-ол (2,4 мл, 25ммоль) в DCM (200 мл), добавляли периодинан Десса-Мартина (14 г, 33 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь медленно выливали в химический стакан, содержащий перемешиваемый раствор, включающий насыщенный водный раствор бикарбоната натрия и насыщенный водный раствор тиосульфата натрия. Смесь выливали в делительную воронку и экстрагировали. Органические слои объединяли, сушили над сульфатом магния, фильтровали через слой Целита® и концентрировали при пониженном давлении с получением пент-4-иналя, который использовали на следующей стадии без дополнительной очистки.
Стадия 2: В колбу, содержащую неочищенный пент-4-иналь, добавляли THF (200 мл). Реакционную смесь охлаждали до 0°C в атмосфере аргона. Добавляли винилмагнийбромид (50 мл, 1M, 50 ммоль) и реакционную смесь перемешивали при 0°C в течение 70 минут. Реакционную смесь затем выливали в делительную воронку, содержащую насыщенный водный раствор хлорида аммония, и экстрагировали при помощи EtOAc. Органические слои объединяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением гепт-1-ен-6-ин-3-ола, который использовали на следующей стадии без дополнительной очистки.
Стадия 3: В колбу, содержащую неочищенный гепт-1-ен-6-ин-3-ол в DCM (200 мл), добавляли пиридин (6,0 мл, 74 ммоль), DMAP (4,58 г, 37,5 ммоль) и трифенилхлорсилан (11,5 г, 37,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем выливали в делительную воронку, содержащую насыщенный водный раствор хлорида аммония, и экстрагировали. Органические слои объединяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией на диоксиде кремния (0-10% EtOAc/гексан) с получением (гепт-1-ен-6-ин-3-илокси)трифенилсилана. 1H ЯМР (600 МГц, CDCl3) δ 7,65-7,61 (м, 6H), 7,45-7,41 (м, 3H), 7,39-7,35 (м, 6H), 5,85-5,78 (м, 1H), 5,06-4,99 (м, 2H), 4,42 (кв., J=6,2 Гц, 1H), 2,27-2,15 (м, 2H), 1,87-1,78 (м, 2H), 1,77-1,70 (м, 1H).
Стадия 4: В колбу, содержащую раствор (гепт-1-ен-6-ин-3-илокси)трифенилсилана (4,72 г, 12,8 ммоль) в DCM (250 мл), добавляли дикобальт октакарбонил (5,25 г, 14,6 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь затем концентрировали при пониженном давлении и остаток растворяли в ацетонитриле (500 мл). Реакционную смесь затем нагревали до 83°C в атмосфере аргона в течение ночи. Реакционную смесь затем концентрировали при пониженном давлении, растирали в порошок с простым эфиром, фильтровали через слой Целита® и затем фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (10-30% EtOAc/гексан), затем хиральной СФХ (R, R’-Welk-O1 колонка, 20% MeOH водн./0,1% NH4OH в CO2) с получением (6R,6aR)-6-((трифенилсилил)окси)-4,5,6,6a-тетрагидропентален-2(1H)-она. 1H ЯМР (600 МГц, CDCl3) δ 7,65-7,61 (м, 6H), 7,47-7,43 (м, 3H), 7,42-7,37 (м, 6H), 5,80-5,78 (м, 1H), 3,93 (кв., J=8,8 Гц, 1H), 3,18-3,12 (м, 1H), 2,83-2,74 (м, 1H), 2,49-2,41 (м, 1H), 2,37 (дд, J=18,1, 6,2 Гц, 1H), 2,21-2,10 (м, 2H), 1,73 (дд, J=18,1, 3,1 Гц, 1H).
Стадия 5: В колбу, содержащую (6R,6aR)-6-((трифенилсилил)окси)-4,5,6,6a-тетрагидропентален-2(1H)-он (7,13 г, 18 ммоль), добавляли THF (100 мл) и метанол (80 мл). Раствор охлаждали на бане сухой лед/MeCN и затем добавляли хлорид церия(III) гептагидрат (6,70 г, 18,0 ммоль). Реакционную смесь перемешивали на бане в течение 20 минут, затем добавляли борогидрид натрия (0,817 г, 22 ммоль). Реакционную смесь перемешивали на охлаждающей бане еще в течение 20 минут, затем извлекали из бани. Затем через 5 минут реакционную смесь выливали в делительную воронку, содержащую EtOAc и 3:2:1 насыщенный раствор хлорида аммония:вода:насыщенный солевой раствор (200 мл). Водный слой отделяли и промывали два раза при помощи EtOAc. Объединенные органические слои затем сушили над сульфатом натрия, фильтровали через Целит® и концентрировали при пониженном давлении. Неочищенный (2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ол непосредственно использовали на следующей стадии.
Стадия 6: В колбу, содержащую неочищенный (2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ол в DCM (120 мл), добавляли пиридин (2,9 мл, 36 ммоль), DMAP (2,86 г, 23,4 ммоль) и уксусный ангидрид (2,2 мл, 23 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение трех дней. Реакцию затем гасили насыщенным водным раствором хлорида аммония (80 мл). Органический слой отделяли на фазовом разделителе, концентрировали при пониженном давлении и очищали колоночной хроматографией на диоксиде кремния (0-10% EtOAc/гексан) с получением (2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-илацетата. 1H ЯМР (600 МГц, CDCl3) δ 7,66-7,62 (м, 6H), 7,46-7,42 (м, 3H), 7,41-7,37 (м, 6H), 5,82-5,77 (м, 1H), 5,24-5,20 (м, 1H), 3,93 (кв., J=8,0 Гц, 1H), 2,98-2,91 (м, 1H), 2,49-2,43 (м, 1H), 2,40-2,32 (м, 1H), 2,20-2,12 (м, 1H), 2,09-2,04 (м, 2H), 1,99 (с, 3H), 1,14-1,08 (м, 1H).
Стадия 7: В колбу, содержащую димер аллилпалладий(II) хлорида (1,66 г, 4,45 ммоль), dppf (6,36 г, 11,1 ммоль), 4-метил-7H-пирроло[2,3-d]пиримидин (4,44 г, 33,4 ммоль) и трет-бутоксид калия (3,74 г, 33,4 ммоль), добавляли THF (100 мл) в атмосфере аргона. Раствор перемешивали при комнатной температуре в течение 10 минут. Затем добавляли раствор (2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-илацетата (9,8 г, 22 ммоль) в THF (100 мл) и реакционную смесь нагревали до 40°C в течение ночи. Реакционную смесь затем охлаждали до комнатной температуры, фильтровали через Целит® и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (10-50% EtOAc/гексан) с получением 4-метил-7-((2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ил)-7H-пирроло[2,3-d]пиримидина. MS: 514 (M+1). 1H ЯМР (600 МГц, CDCl3) δ 8,75 (с, 1H), 7,65-7,58 (м, 6H), 7,43-7,38 (м, 3H), 7,38-7,31 (м, 6H), 7,05 (д, J=3,7 Гц, 1H), 6,54 (д, J=3,6 Гц, 1H), 6,15 (с, 1H), 5,23-5,19 (м, 1H), 3,99 (кв., J=7,9 Гц, 1H), 3,17-3,11 (м, 1H), 2,78 (с, 3H), 2,63-2,58 (м, 1H), 2,49-2,42 (м, 1H), 2,29-2,22 (м, 1H), 2,20-2,12 (м, 2H), 1,22-1,15 (м, 1H).
Стадия 8: В колбу, содержащую раствор 4-метил-7-((2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ил)-7H-пирроло[2,3-d]пиримидина (13,2 г, 25,7 ммоль) в THF (300 мл), добавляли воду (150 мл). Раствор охлаждали до 0°C, затем добавляли NMO (6,02 г, 51,4 ммоль) с последующим добавлением оксида осмия (VIII) (7,8 мл, 4% в воде, 1,3 ммоль). Реакционную смесь перемешивали в течение ночи и баню оставляли нагреваться естественным образом. Реакцию гасили насыщенным водным раствором сульфит натрия (60 мл) и перемешивание продолжали при комнатной температуре в течение 30 минут. Реакционную смесь затем выливали в делительную воронку, содержащую воду и 25% IPA/хлороформ. Водный слой отделяли и промывали еще два раза 25% IPA/хлороформом. Объединенные органические слои сушили над сульфитом натрия, фильтровали через Целит® и концентрировали при пониженном давлении с получением неочищенного (1S,2R,3aR,4S,6aR)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((трифенилсилил)окси)гексагидропентален-1,6a(1H)-диола. Этот неочищенный продукт использовали непосредственно на следующей стадии.
Стадия 9: В колбу, содержащую неочищенный (1S,2R,3aR,4S,6aR)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((трифенилсилил)окси)гексагидропентален-1,6a(1H)-диол, добавляли DCM (200 мл) с последующим добавлением 2,2-диметоксипропана (35 мл, 290 ммоль) и моногидрата п-толуолсульфоновой кислоты (17,1 г, 90 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили насыщенным водным раствором бикарбоната натрия (100 мл). Органический слой отделяли на фазовом разделителе и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (50-100% EtOAc/гексан до 100% 3:1 EtOAc:EtOH)) с получением (3aS,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ола. MS: 330 (M+1).
Промежуточное соединение 38: Промежуточное соединение 38 в Таблице 5 синтезировали с использованием протокола, описанного для промежуточного соединения 37, осуществляя соответствующее замещение 4-метил-7H-пирроло[2,3-d]пиримидина на стадии 7. Используемое для замены исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
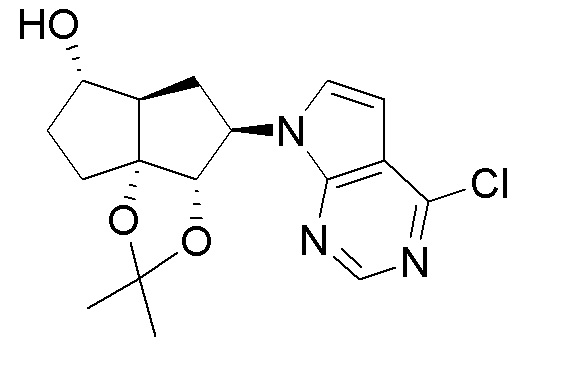
Промежуточное соединение 39: Промежуточное соединение 39 в Таблице 6 синтезировали с использованием протокола, описанного для промежуточного соединения 13, осуществляя соответствующее замещение 4-хлор-5-(дифторметил)-7H-пирроло[2,3-d]пиримидина на стадии 1. Используемое для замены исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
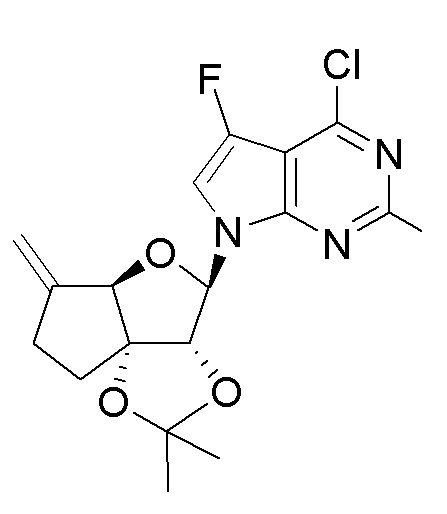
ПРИМЕРЫ
Следующие экспериментальные процедуры подробно представляют получение конкретных примеров настоящего изобретения. Примеры представлены только для иллюстративных целей и не предназначены для какого-либо ограничения объема изобретения.
Пример 1
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол
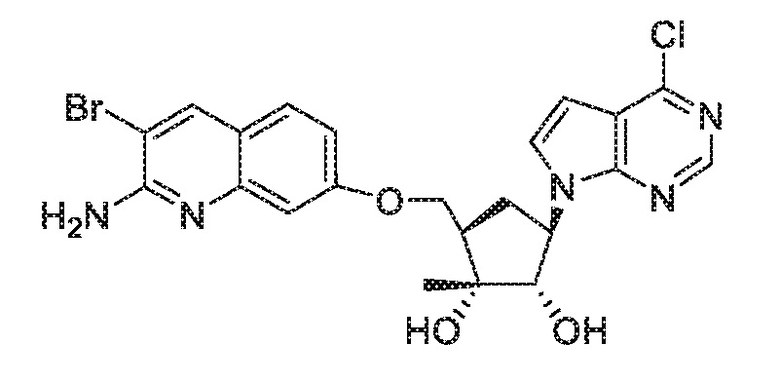
Стадия 1: Смесь ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (1,2 г, 3,6 ммоль), 2-амино-3-бромхинолин-7-ола (0,934 г, 3,91 ммоль) и трифенилфосфина (1,86 г, 7,10 ммоль) совместно упаривали с безводным толуолом (три раза, 10 мл каждый) и затем снова растворяли в безводном THF (20 мл). Реакционную смесь охлаждали до 0°C и добавляли по каплям (E)-диизопропилдиазен-1,2-дикарбоксилат (1,44 г, 7,10 ммоль) при 0°C. Смесь нагревалась до комнатной температуры естественным образом, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-10% MeOH в DCM). Фракции, содержащие желаемый продукт, объединяли и концентрировали при пониженном давлении с получением неочищенного твердого вещества. Неочищенное вещество затем очищали обращенно-фазовой колоночной хроматографией (0-100% 5 мМ водн. NH4HCO3/ацетонитрил) с получением 3-бром-7-(((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метокси)хинолин-2-амина. MS 558, 560 (M+1, M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,68 (д, J=1,2 Гц, 1H), 8,28 (с, 1H), 7,96 (д, J=3,6 Гц, 1H), 7,58 (д, J=8,8 Гц, 1H), 6,98 (д, J=2,4 Гц, 1H), 6,90 (дд, J=9,2, 2,4 Гц, 1H), 6,76 (д, J=3,6 Гц, 1H), 6,53 (с, 2H), 5,40-5,13 (м, 1H), 4,51 (д, J=4,0 Гц, 1H), 4,27 (дд, J=10,0, 6,0 Гц, 1H), 4,12 (т, J=8,8 Гц, 1H), 2,72-2,66 (м, 1H), 2,49-2,45 (м, 1H), 2,42-2,36 (м, 1H), 1,60 (с, 3H), 1,51 (с, 3H), 1,30 (с, 3H).
Стадия 2: К раствору 3-бром-7-(((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метокси)хинолин-2-амина (430 мг, 0,769 ммоль) в воде (8 мл) добавляли TFA (8 мл) при комнатной температуре. Реакционную смесь перемешивали при 25°C в течение 4 ч. Реакционную смесь охлаждали до 0°C. pH доводили до pH 7-8 насыщенным водным раствором бикарбоната натрия (50 мл). Полученную смесь экстрагировали при помощи EtOAc (50 мл × 5) и объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-15% MeOH в DCM) с получением (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диола. MS 518, 520 (M+1, M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,60 (с, 1H), 8,28 (с, 1H), 7,93 (д, J=4,0 Гц, 1H), 7,58 (д, J=8,8 Гц, 1H), 6,97 (с, 1H), 6,93 (д, J=8,8 Гц, 1H), 6,71 (д, J=3,6 Гц, 1H), 6,51 (шир.с, 2H), 5,13 (кв., J=9,2 Гц, 1H), 4,99 (д, J=7,2 Гц, 1H), 4,51 (с, 1H), 4,21-4,11 (м, 3H), 2,47-2,39 (м, 2H), 1,82-1,75 (м, 1H), 1,26 (с, 3H).
Пример 2
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол
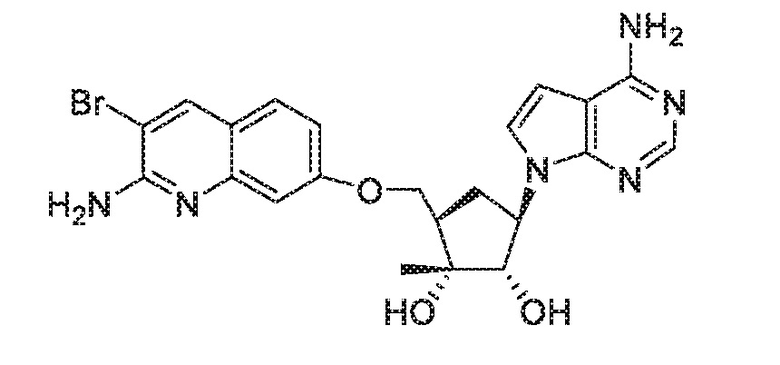
В герметично закрываемую пробирку (10 мл) добавляли (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол (350 мг, 0,675 ммоль), 1,4-диоксан (3 мл) и NH3·H2O (5 мл; 25%-28% масс./масс.) при комнатной температуре. Реакционную смесь плотно закрывали и затем перемешивали при 90°C в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (0-45% ацетонитрил/вода) с получением (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диола. MS 499, 501 (M+1, M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,28 (с, 1H), 8,02 (с, 1H), 7,58 (д, J=8,7 Гц, 1H), 7,30 (д, J=3,6 Гц, 1H), 6,96-6,89 (м, 4H), 6,57-6,53 (м, 3H), 4,97-4,91 (м, 2H), 4,41 (с, 1H), 4,19-4,10 (м, 3H), 2,45-2,37 (м, 2H), 1,72-1,66 (м, 1H), 1,24 (с, 3H).
Пример 3
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-этинилтетрагидрофуран-3,4-диол
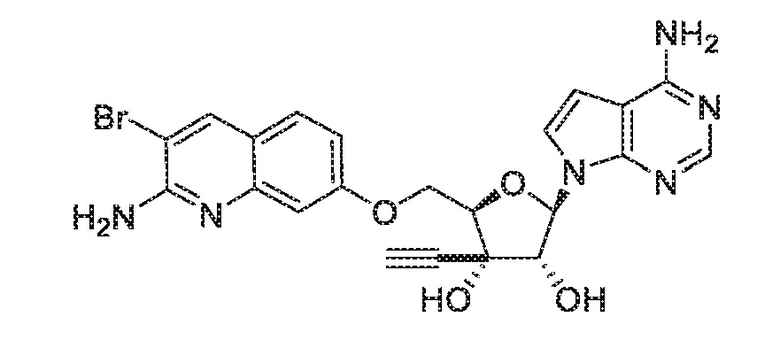
Стадия 1: (2R,3R,4S,5R)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)тетрагидрофуран-3,4-диол (2 г, 7,5 ммоль) совместно упаривали с безводным пиридином (10 мл × 3) и затем снова суспендировали в безводном пиридине (30 мл) при температуре окружающей среды в атмосфере аргона. К этой суспензии добавляли хлортриметилсилан (5,71 г, 52,6 ммоль) одной порцией при 0°C и смесь поддерживали при температуре окружающей среды в течение 1 часа. Затем к смеси добавляли бензоилхлорид (1,58 г, 11,3 ммоль) при 0°C. После перемешивания при температуре окружающей среды в течение 2 ч полученную смесь гасили при помощи H2O (8 мл) при 0°C. Затем добавляли по каплям водный раствор NH3 (15 мл, 25-28% масс.) при 0°C с последующим добавлением перемешиванием при температуре окружающей среды в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (6% MeOH в DCM) с получением N-(7-((2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 371 (M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 11,12 (с, 1H), 8,59 (с, 1H), 8,10-8,00 (м, 2H), 7,71 (д, J=3,8 Гц, 1H), 7,63 (т, J=7,3 Гц, 1H), 7,53 (дд, J=8,3, 6,6 Гц, 2H), 6,67 (д, J=3,8 Гц, 1H), 6,22 (д, J=6,1 Гц, 1H), 5,35 (д, J=6,4 Гц, 1H), 5,15 (д, J=4,8 Гц, 1H), 5,06 (т, J=5,4 Гц, 1H), 4,41 (дд, J=5,9 Гц, 1H), 4,10 (дд, J=4,5 Гц, 1H), 3,91 (д, J=3,7 Гц, 1H), 3,69-3,47 (м, 2H).
Стадия 2: N-(7-((2R,3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамид (2,1 г, 5,7 ммоль) совместно упаривали с безводным пиридином (10 мл × 3) и затем снова суспендировали в безводном пиридине (15 мл) при температуре окружающей среды в атмосфере аргона. К этой суспензии добавляли 4,4'-(хлор(фенил)метилен)бис(метоксибензол) (2,11 г, 6,24 ммоль) одной порцией при температуре окружающей среды и смесь поддерживали при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc в петролейном эфире) с получением N-(7-((2R,3R,4S,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-3,4-дигидрокситетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида в виде твердого вещества. MS: 673 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 11,13 (с, 1H), 8,59 (с, 1H), 8,15-7,94 (м, 2H), 7,68-7,48 (м, 4H), 7,37 (д, J=7,6 Гц, 2H), 7,31-7,15 (м, 7H), 6,84 (дд, J=8,7, 1,6 Гц, 4H), 6,65 (д, J=3,7 Гц, 1H), 6,25 (д, J=5,0 Гц, 1H), 5,47 (д, J=5,9 Гц, 1H), 5,19 (д, J=5,6 Гц, 1H), 4,46 (дд, J=5,5 Гц, 1H), 4,20 (дд, J=5,2 Гц, 1H), 3,99 (д, J=7,1 Гц, 1H), 3,71 (с, 6H), 3,23-3,19 (м, 2H).
Стадия 3: N-(7-((2R,3R,4S,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-3,4-дигидрокситетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамид (2,36 г, 3,51 ммоль), (2R,4S)-4-изопропил-2-метокси-3-((R)-2-метил-1-(1-метил-1H-имидазол-2-ил)пропил)оксазолидин (0,20 г, 0,70 ммоль) и N-этил-N-изопропилпропан-2-амин гидрохлорид (0,017 г, 0,105 ммоль) совместно упаривали с безводным толуолом (10 мл × 3) и затем снова суспендировали в безводном THF (21 мл) в атмосфере аргона. К суспензии добавляли N-этил-N-изопропилпропан-2-амин (2,13 г, 16,5 ммоль) одной порцией при 0°C. Затем добавляли триизопропилсилил трифторметансульфонат (4,62 г, 15,1 ммоль) в DCM (10 мл) при 0°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 40 мин. Реакционную смесь затем гасили водой (10 мл) и экстрагировали при помощи EtOAc (2 × 100 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (50 мл) и насыщенным солевым раствором (2 × 50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (25% EtOAc в петролейном эфире) с получением N-(7-((2R,3R,4R,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-4-гидрокси-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 829 (M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 11,10 (с, 1H), 8,55 (с, 1H), 8,19-7,95 (м, 2H), 7,68-7,48 (м, 4H), 7,45-7,35 (м, 2H), 7,25 (дд, J=7,2, 5,4 Гц, 7H), 6,89-6,80 (м, 4H), 6,68 (д, J=3,7 Гц, 1H), 6,32 (д, J=5,6 Гц, 1H), 5,11 (д, J=6,1 Гц, 1H), 4,77 (т, J=5,4 Гц, 1H), 4,26-4,06 (м, 2H), 3,71 (с, 6H), 3,28-3,17 (м, 2H), 0,98-0,87 (м, 12H), 0,82 (д, J=6,4 Гц, 9H).
Стадия 4: N-(7-((2R,3R,4R,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-4-гидрокси-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамид (1,95 г, 2,35 ммоль) совместно упаривали с безводным пиридином (10 мл × 3) и затем снова суспендировали в безводном DCM (30 мл) при температуре окружающей среды в атмосфере аргона. К этой суспензии добавляли периодинан Десса-Мартина (2,49 г, 5,88 ммоль) и пиридин (0,65 г, 8,2 ммоль) при температуре окружающей среды. Полученную смесь затем перемешивали при 0°C в течение 2 часов. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (10 мл) и затем экстрагировали при помощи EtOAc (100 мл × 2). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного N-(7-((2R,3S,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-4-оксо-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида, который использовали непосредственно на следующей стадии. MS: 827 (M+1).
Стадия 5: К раствору N-(7-((2R,3S,5R)-5-((бис(4-метоксифенил)(фенил)метокси)метил)-4-оксо-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамид (2,27 г, 2,74 ммоль) в DCM (40 мл) добавляли 2,2-дихлоруксусную кислоту (3,18 г, 24,7 ммоль) при температуре окружающей среды и затем перемешивали в течение 30 минут. К этой суспензии добавляли триэтилсилан (31,9 г, 274 ммоль). После перемешивания еще в течение 10 минут к смеси добавляли пиридин (1,5 мл). Затем смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (30% EtOAc в петролейном эфире) с получением N-(7-((2R,3S,5R)-5-(гидроксиметил)-4-оксо-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 525 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 11,20 (с, 1H), 8,65 (с, 1H), 8,14-8,04 (м, 2H), 7,89 (д, J=3,8 Гц, 1H), 7,71-7,62 (м, 1H), 7,61-7,53 (м, 2H), 6,84 (д, J=3,8 Гц, 1H), 6,53 (д, J=8,3 Гц, 1H), 5,39 (br, 1H), 5,00 (д, J=8,3 Гц, 1H), 4,44 (т, J=2,8 Гц, 1H), 3,74-3,70 (м, 2H), 0,91-0,87 (м, 12H), 0,78-0,73 (м, 9H).
Стадия 6: Хлорид церия (III) (3,04 г, 12,4 ммоль) сушили при 140°C при пониженном давлении в течение 1 ч. Полученный порошок охлаждали в атмосфере аргона. Добавляли безводный THF (20 мл). Полученную смесь охлаждали до -78°C и добавляли ((триметилсилил)этинил)литий (24,7 мл, 12,4 ммоль). Реакционную смесь перемешивали в течение 1 ч при -78°C. Затем быстро добавляли охлажденный раствор (-78°C) N-(7-((2R,3S,5R)-5-(гидроксиметил)-4-оксо-3-((триизопропилсилил)окси)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида (1,08 г, 2,06 ммоль) в безводном THF (20 мл) и перемешивание продолжали в течение 2 ч. Реакцию гасили насыщенным водным раствором хлорида аммония (40 мл). Смесь разбавляли EtOAc (300 мл) и промывали водой (100 мл × 2). Органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (0-95% 5 мМ водн. NH4HCO3/ацетонитрил) с получением N-(7-((2R,3R,4R,5R)-4-гидрокси-5-(гидроксиметил)-3-((триизопропилсилил)окси)-4-((триметилсилил)этинил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 623 (M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 11,08 (с, 1H), 8,56 (с, 1H), 8,06-8,03 (м, 2H), 7,80 (д, J=3,8 Гц, 1H), 7,69-7,41 (м, 3H), 6,71 (д, J=3,7 Гц, 1H), 6,29 (д, J=7,1 Гц, 1H), 5,80 (с, 1H), 5,18 (т, J=4,6 Гц, 1H), 4,98 (д, J=7,2 Гц, 1H), 3,98 (т, J=3,2 Гц, 1H), 3,87-3,60 (м, 2H),0,85-0,70 (м, 21H), 0,14 (с, 9H).
Стадия 7: К смеси N-(7-((2R,3R,4R,5R)-4-гидрокси-5-(гидроксиметил)-3-((триизопропилсилил)окси)-4-((триметилсилил)этинил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида (250 мг, 0,401 ммоль) в THF (8 мл) добавляли 2-амино-3-бромхинолин-7-ол (115 мг, 0,482 ммоль) и трифенилфосфин (368 мг, 1,41 ммоль) в атмосфере аргона. Затем добавляли по каплям (E)-диизопропил диазен-1,2-дикарбоксилат (203 мг, 1,00 ммоль) при 0°C. Смесь перемешивали при температуре окружающей среды в течение 12 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (50% EtOAc в петролейном эфире) с получением N-(7-((2R,3R,4R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-4-гидрокси-3-((триизопропилсилил)окси)-4-((триметилсилил)этинил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 843/845 (M+1/M+3).
Стадия 8: К смеси N-(7-((2R,3R,4R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-4-гидрокси-3-((триизопропилсилил)окси)-4-((триметилсилил)этинил)тетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида (90 мг, 0,11 ммоль) в пиридине (3 мл) добавляли триэтиламин (1,08 г, 10,7 ммоль) и триэтиламин тригидрофторид (860 мг, 5,33 ммоль) при температуре окружающей среды. Перемешивание затем продолжали при температуре окружающей среды в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (90% EtOAc в петролейном эфире) с получением N-(7-((2R,3R,4S,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-4-этинил-3,4-дигидрокситетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида. MS: 615/617 (M+1/M+3). 1H ЯМР (300 МГц, CD3OD) δ 8,57 (с, 1H), 8,21 (с, 1H), 8,06-8,00 (м, 2H), 7,73 (д, J=3,8 Гц, 1H), 7,68-7,60 (м, 1H), 7,58 (д, J=4,2 Гц, 1H), 7,56-7,53 (м, 1H), 7,52-7,32 (м, 1H), 7,10-7,00 (м, 2H), 6,88 (д, J=3,8 Гц, 1H), 6,50 (д, J=7,4 Гц, 1H), 4,94 (д, J=7,4 Гц, 1H), 4,54-4,41 (м, 3H), 3,15 (с, 1H).
Стадия 9: К смеси N-(7-((2R,3R,4S,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-4-этинил-3,4-дигидрокситетрагидрофуран-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил)бензамида (40 мг, 0,065 ммоль) в MeOH (2 мл) добавляли метанолят натрия (17,6 мг, 0,325 ммоль) при температуре окружающей среды. Перемешивание затем продолжали при температуре окружающей среды в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ водн. NH4HCO3 модификатора) с получением (2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-этинилтетрагидрофуран-3,4-диола. MS: 511/513 (M+1/M+3). 1H ЯМР (300 МГц, DMSO-d6) δ 8,30 (с, 1H), 8,10 (с, 1H), 7,60 (д, J=9,5 Гц, 1H), 7,45 (д, J=3,7 Гц, 1H), 7,22 (шир.с, 2H), 6,95-6,93 (м, 2H), 6,76-6,60 (м, 3H), 6,22 (с, 1H), 6,16 (д, J=7,5 Гц, 1H), 5,95 (д, J=7,3 Гц, 1H), 4,74 (т, J=7,3 Гц, 1H), 4,35-4,29 (м, 3H), 3,61 (с, 1H).
Пример 4
(2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диол
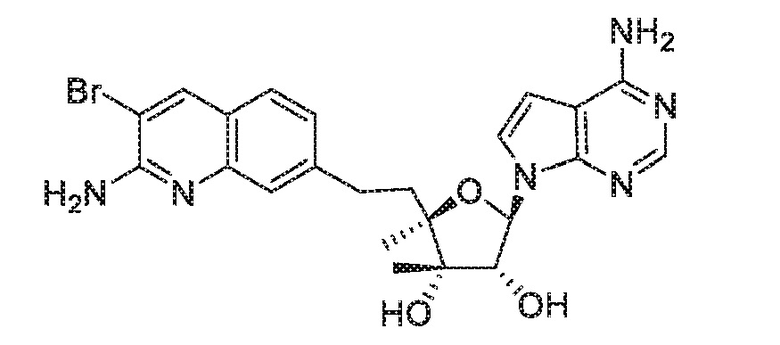
Стадия 1: К перемешиваемому раствору ((3aR,5R,6S,6aR)-5-((трет-бутилдифенилсилилокси)метил)-2,2-диметил-6-(нафтален-2-илметокси)-тетрагидрофуро[3,2-d][1,3]диоксол-5-ил)метанола (12 г, 20 ммоль) и имидазола (5,44 г, 80 ммоль) в толуоле (240 мл) добавляли PPh3 (21 г, 80 ммоль) при 25°C в атмосфере аргона. Затем к смеси добавляли по порциям I2 (10,1 г, 40 ммоль) при 60°C. Полученную смесь перемешивали при 80°C в течение 14 ч. Реакционную смесь охлаждали до 0°C, гасили насыщенным водным раствором Na2S2O3 (200 мл) и разбавляли при помощи EtOAc (300 мл). Органический слой промывали H2O (150 мл), насыщенным водным раствором NaHCO3 (150 мл × 2) и насыщенным солевым раствором (150 мл). Органический слой сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (10-40% EtOAc/петролейный эфир) с получением трет-бутил(((3aR,5R,6S,6aR)-5-(иодметил)-2,2-диметил-6-(нафтален-2-илметокси)-тетрагидрофуро[3,2-d][1,3]диоксол-5-ил)метокси)дифенилсилана. MS: 726 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6): δ 7,92-7,68 (м, 4H), 7,60-7,25 (м, 13H), 5,68 (д, J=3,6 Гц, 1H), 4,98-4,82 (м, 2H), 4,71 (д, J=12,3 Гц, 1H), 4,41 (д, J=2,4 Гц, 1H), 3,87 (д, J=12,0 Гц, 1H), 3,71-3,50 (м, 3H), 1,50 (с, 3H), 1,27 (с, 3H), 0,81 (с, 9H).
Стадия 2: Трет-бутил (((3aR,5R,6S,6aR)-5-(иодметил)-2,2-диметил-6-(нафтален-2-илметокси)-тетрагидрофуро[3,2-d][1,3]диоксол-5-ил)метокси)дифенилсилан (10,6 г, 14,6 ммоль) (совместно упаренный со свежеперегнанным толуолом (10 мл × 3)) растворяли в 200 мл толуола. (Z)-3,3'-(диазен-1,2-диил)бис(2,2-диметил-3-оксопропаннитрил) (615 мг, 3,85 ммоль) и (n-Bu)3SnH (11 г, 37 ммоль) добавляли при 60°C в атмосфере аргона одной порцией; затем температуру повышали до 120°C и реакционную смесь перемешивали при этой температуре в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли при помощи EtOAc (300 мл). Органический слой промывали H2O (150 мл), насыщенным водным раствором NaHCO3 (150 мл × 2) и насыщенным солевым раствором (150 мл). Органический слой сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (14% EtOAc/петролейный эфир) с получением трет-бутилдифенил(((3aR,5R,6S,6aR)-2,2,5-триметил-6-(нафтален-2-илметокси)-тетрагидрофуро[3,2-d][1,3]диоксол-5-ил)метокси)силана. MS: 600 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6): δ 7,91-7,84 (м, 4H), 7,56-7,49 (м, 7H), 7,45-7,34 (м, 6H), 5,70 (д, J=3,9 Гц, 1H), 4,94-4,83 (м, 2H), 4,67 (д, J=12,3 Гц, 1H), 4,16 (д, J=5,1 Гц, 1H), 3,41 (дд, J=21,0, 9,0 Гц, 2H), 1,52 (с, 3H), 1,30 (с, 3H), 1,26 (с, 3H), 0,82 (с, 9H).
Стадия 3: К раствору трет-бутилдифенил(((3aR,5R,6S,6aR)-2,2,5-триметил-6-(нафтален-2-илметокси)тетрагидрофуро[2,3-d][1,3]диоксол-5-ил)метокси)силана (5 г, 8,6 ммоль) в DCM (50 мл) и воде (12,5 мл) добавляли DDQ (3,90 г, 17,2 ммоль) при температуре окружающей среды. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (100 мл) и экстрагировали при помощи DCM (100 мл × 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (150 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (1-20% EtOAc/петролейный эфир) с получением (3aR,5R,6S,6aR)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола. MS: 460 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 7,61-7,42 (м, 10H), 5,65 (д, J=3,6 Гц, 1H), 5,11 (д, J=6,6 Гц, 1H), 4,57 (т, J=4,8 Гц, 1H), 4,16 (т, J=6,0 Гц, 1H), 3,49-3,40 (м, 2H), 1,48 (с, 3H), 1,25 (с, 3H), 1,14 (с, 3H), 0,99 (с, 9H).
Стадия 4: К перемешиваемому раствору (3aR,5R,6S,6aR)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (3,5 г, 7,91 ммоль) в DCM (80 мл) добавляли пиридин (2,24 мл, 27,7 ммоль) и периодинан Десса-Мартина (6,71 г, 15,8 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (50 мл) и экстрагировали при помощи EtOAc (80 мл × 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (80 мл) и насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (1-24% EtOAc/петролейный эфир) с получением (3aR,5R,6aS)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5-триметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она. MS: 458 (M+NH4). 1H ЯМР (300 МГц, Хлороформ-d) δ 7,68-7,65 (м, 2H), 7,59-7,56 (м, 2H), 7,45-7,36 (м, 6H), 6,27 (д, J=4,5 Гц, 1H), 4,53 (д, J=4,5 Гц, 1H), 3,66-3,55 (м, 2H), 1,51 (с, 3H), 1,44 (с, 3H), 1,26 (с, 3H), 1,00 (с, 9H).
Стадия 5: К перемешиваемому раствору (3aR,5R,6aS)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5-триметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она (3 г, 6,8 ммоль) в THF (25 мл) добавляли метиллитий (1,6 M в Et2O, 10,6 мл, 17,0 ммоль) по каплям при -78°C. Полученную смесь перемешивали при -78°C в течение 2 часов. Реакционную смесь гасили насыщенным водным раствором NH4Cl (50 мл) и экстрагировали диэтиловым эфиром (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (1-14% EtOAc/петролейный эфир) с получением (3aR,5R,6S,6aR)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5,6-тетраметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола. MS: 479 (M+Na). 1H ЯМР (400 МГц, DMSO-d6) δ 7,64-7,43 (м, 10H), 5,71(д, J=4,4 Гц, 1H), 4,58 (с, 1H), 4,26 (д, J=4,4 Гц, 1H), 3,55-3,44 (м, 2H), 1,49 (с, 3H), 1,29 (с, 3H), 1,24 (с, 3H), 1,12 (с, 3H), 1,00 (с, 9H).
Стадия 6: К раствору (3aR,5R,6S,6aR)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,5,6-тетраметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (2,3 г, 5,04 ммоль) в 1,4-диоксане (40 мл) и воде (10 мл) добавляли 4-метилбензолсульфоновую кислоту (0,173 г, 1,01 ммоль) при комнатной температуре. Полученную смесь перемешивали при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором NaHCO3 (50 мл) и экстрагировали при помощи EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (10-40% EtOAc/петролейный эфир) с получением (3R,4S,5R)-5-(((трет-бутилдифенилсилил)окси)метил)-4,5-диметилтетрагидрофуран-2,3,4-триола. MS: 439 (M+Na). 1H ЯМР (400 МГц, DMSO-d6) δ 7,75-7,39 (м, 10H), 5,65 (д, J=7,6 Гц, 1H), 5,04-5,01 (м, 1H), 4,66 (д, J=8,8 Гц, 1H), 4,35 (с, 1H), 4,06-4,01 (м, 2H), 3,40 (с, 1H), 1,22 (с, 3H), 1,04 (с, 3H), 0,98 (с, 9H).
Стадия 7: К перемешиваемому раствору (3R,4S,5R)-5-(((трет-бутилдифенилсилил)окси)метил)-4,5-диметилтетрагидрофуран-2,3,4-триола (1,45 г, 3,5 ммоль) (совместно упаренный с безводным MeCN 6 мл × 3) в ацетонитриле (20 мл) добавляли трибутилфосфин (1,13 г, 5,6 ммоль) и (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (1,41 г, 5,6 ммоль) при температуре окружающей среды в атмосфере аргона. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Полученную смесь, содержащую (1S,3R,4S,5R)-3-(((трет-бутилдифенилсилил)окси)метил)-3,4-диметил-2,6-диоксабицикло[3,1,0]гексан-4-ол, использовали на следующей стадии непосредственно без обработки или очистки.
Стадия 8: К перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (1,07 г, 6,96 ммоль) в DMF (4 мл) добавляли NaH (418 мг, 10,4 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. В эту систему добавляли раствор (1S,3R,4S,5R)-3-(((трет-бутилдифенилсилил)окси)метил)-3,4-диметил-2,6-диоксабицикло[3,1,0]гексан-4-ола (~3,5 ммоль) в MeCN (20 мл) (с предыдущей стадии) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 0,5 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (35 мл) и экстрагировали при помощи EtOAc (50 мл × 3). Объединенные органические слои промывали водой (100 мл) и насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (1-24% EtOAc/петролейный эфир) с получением (2R,3S,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диола. MS: 552 (M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 8,58 (с, 1H), 7,68-7,34 (м, 11H), 6,51 (д, J=3,6 Гц, 1H), 6,15 (д, J=8,4 Гц, 1H), 5,44 (д, J=7,2 Гц, 1H), 4,87 (с, 1H), 4,65-4,60 (м, 1H), 3,82 (д, J=10,8 Гц, 1H), 3,57 (д, J=11,1 Гц, 1H), 1,34 (с, 3H), 1,18 (с, 3H), 1,06 (с, 9H).
Стадия 9: К раствору (2R,3S,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диола (600 мг, 1,09 ммоль) в ацетоне (50 мл) добавляли 2,2-диметоксипропан (1,13 г, 10,9 ммоль) и 4-метилбензолсульфоновую кислоту (19 мг, 0,11 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 40°C в течение 5 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (40 мл) и ацетон удаляли при пониженном давлении. Водную фазу экстрагировали при помощи EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (0-40% EtOAc/петролейный эфир) с получением 7-((3aR,4R,6R,6aS)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6,6a-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина. MS: 592 (M+1). 1H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1H), 7,65-7,53 (м, 5H), 7,55-7,45 (м, 1H), 7,49-7,28 (м, 5H), 6,48 (д, J=3,7 Гц, 1H), 6,30 (д, J=2,7 Гц, 1H), 5,15 (д, J=2,8 Гц, 1H), 3,64 (д, J=10,8 Гц, 1H), 3,54 (д, J=10,8 Гц, 1H), 1,66 (с, 3H), 1,53 (с, 6H), 1,46 (с, 3H), 1,08 (с, 9H).
Стадия 10: К раствору 7-((3aR,4R,6R,6aS)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6,6a-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина (416 мг, 0,702 ммоль) в тетрагидрофуране (5 мл) в атмосфере аргона добавляли тетрабутиламмоний фторид (1 M в THF, 2,11 мл, 2,11 ммоль) при комнатной температуре. Реакционный раствор перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-20% MeOH/DCM) с получением ((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола. MS: 354 (M+1). 1H ЯМР (400 МГц, CDCl3) δ 8,69 (с, 1H), 7,41 (д, J=3,7 Гц, 1H), 6,67 (д, J=3,7 Гц, 1H), 6,10 (д, J=5,1 Гц, 1H), 5,14 (д, J=5,1 Гц, 1H), 4,84 (дд, J=8,9, 3,8 Гц, 1H), 3,74-3,55 (м, 2H), 1,71 (с, 6H), 1,59 (с, 3H), 1,38 (с, 3H).
Стадия 11: К раствору оксалилдихлорида (201 мг, 1,6 ммоль) в безводном DCM (5 мл) добавляли DMSO (309 мг, 3,96 ммоль) по каплям при -78°C в атмосфере аргона. Полученный раствор перемешивали при -78°C в течение 0,5 ч. Затем в эту реакционную систему добавляли по каплям раствор ((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола (140 мг, 0,40 ммоль) в безводном DCM (5 мл) при -78°C. Полученный раствор перемешивали при -78°C еще в течение 0,5 ч. Затем добавляли TEA (400 мг, 4 ммоль) при -78°C. Полученный раствор перемешивали в течение 0,5 ч при -78°C. Реакционный раствор гасили H2O (5 мл) при 0°C и разбавляли при помощи DCM (30 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (40 мл), насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении с получением (3aS,4S,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбальдегида, который использовали на следующей стадии непосредственно без дополнительной очистки. MS: 352 (M+1). 1H ЯМР (400 МГц, CDCl3) δ 9,52 (с, 1H), 8,68 (с, 1H), 7,46 (д, J=3,7 Гц, 1H), 6,73 (д, J=3,7 Гц, 1H), 6,34 (д, J=2,3 Гц, 1H), 5,29 (д, J=2,3 Гц, 1H), 1,73 (с, 3H), 1,67 (с, 3H), 1,51 (с, 3H), 1,49 (с, 3H).
Стадия 12: К раствору метилтрифенилфосфоний бромида (395 мг, 1,11 ммоль) в безводном тетрагидрофуране (5 мл) добавляли n-BuLi (2,5 M в THF, 0,411 мл, 1,03 ммоль) по каплям при -10°C в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Затем в эту реакционную систему добавляли по каплям раствор (3aS,4S,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-карбальдегида (139 мг, 0,396 ммоль) в безводном тетрагидрофуране (8 мл) при -10°C. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь гасили насыщенным водным раствором NH4Cl (20 мл) при 0°C. Реакционный раствор разбавляли EtOAc (100 мл), промывали H2O (20 мл) и насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-30% EtOAc/петролейный эфир) с получением 4-хлор-7-((3aR,4R,6R,6aS)-2,2,6,6a-тетраметил-6-винилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина. MS: 350 (M+1). 1H ЯМР (400 МГц, CDCl3) δ 8,72 (с, 1H), 7,42 (д, J=3,7 Гц, 1H), 6,70 (д, J=3,7 Гц, 1H), 6,50 (д, J=2,5 Гц, 1H), 5,88 (дд, J=17,3, 11,0 Гц, 1H), 5,21 (дд, J=17,3, 1,3 Гц, 1H), 5,13 (дд, J=11,0, 1,3 Гц, 1H), 4,89 (д, J=2,5 Гц, 1H), 1,66 (с, 3H), 1,58 (с, 3H), 1,55 (с, 3H), 1,47 (с, 3H).
Стадия 13: В герметично закрываемую пробирку (20 мл) добавляли 4-хлор-7-((3aR,4R,6R,6aS)-2,2,6,6a-тетраметил-6-винилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин (50 мг, 0,143 ммоль), 1,4-диоксан (8 мл) и NH3·H2O (8 мл, 25%-28% масс.) при комнатной температуре. Смесь плотно закрывали и затем перемешивали при 90°C в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-10% MeOH/DCM) с получением 7-((3aR,4R,6R,6aS)-2,2,6,6a-тетраметил-6-винилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина. MS: 331 (M+1). 1H ЯМР (400 МГц, CDCl3) δ 8,38 (с, 1H), 7,15 (д, J=3,7 Гц, 1H), 6,49 (д, J=2,6 Гц, 1H), 6,46 (д, J=3,7 Гц, 1H), 5,89 (дд, J=17,3, 11,0 Гц, 1H), 5,33 (с, 2H), 5,23 (дд, J=17,3, 1,4 Гц, 1H), 5,12 (дд, J=11,0, 1,4 Гц, 1H), 4,82 (д, J=2,5 Гц, 1H), 1,65 (с, 3H), 1,57 (с, 3H), 1,54 (с, 3H), 1,45 (с, 3H).
Стадия 14: К раствору 7-((3aR,4R,6R,6aS)-2,2,6,6a-тетраметил-6-винилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина (20 мг, 0,061 ммоль) в безводном THF (1,0 мл) добавляли 9-BBN в THF (0,605 мл, 0,303 ммоль, 0,5 M) по каплям при 0°C в атмосфере аргона. Реакционный раствор перемешивали при 50°C в течение 1 ч. Полученный раствор непосредственно использовали на следующей стадии.
Стадия 15: К полученному раствору добавляли трехосновный фосфат калия (64,3 мг, 0,303 ммоль) в воде (0,2 мл) по каплям при 0°C в атмосфере аргона. Реакционный раствор перемешивали при комнатной температуре в течение 0,5 ч. В эту реакционную систему добавляли соответственно 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амин (31,3 мг, 0,067 ммоль) в тетрагидрофуране (0,3 мл) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорида с дихлорметаном (4,95 мг, 6,06 мкмоль) при комнатной температуре. Реакционную смесь нагревали при 70°C в течение 2 ч в условиях микроволнового облучения. Реакционную смесь затем охлаждали до комнатной температуры, разбавляли водой (5 мл) и экстрагировали при помощи EtOAc (2 × 20 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (проявляли при помощи 10% MeOH в DCM) с получением 7-(2-((3aS,4R,6R,6aR)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина. MS: 673/675 (M+1/M+3). 1H ЯМР (400 МГц, CDCl3) δ 8,35 (с, 1H), 8,05 (с, 1H), 7,43-7,29 (м, 4H), 7,19 (д, J=3,7 Гц, 1H), 6,93 (д, J=8,6 Гц, 2H), 6,74 (д, J=8,1 Гц, 1H), 6,47 (д, J=3,7 Гц, 1H), 6,34 (д, J=2,4 Гц, 1H), 5,65-5,54 (м, 1H), 5,40-5,29 (м, 2H), 4,77 (д, J=5,0 Гц, 2H), 3,84 (с, 3H), 2,76-2,68 (м, 1H), 2,55-2,45 (м, 1H), 2,05-1,93 (м, 1H), 1,87-1,76 (м, 1H), 1,66 (с, 3H), 1,63 (с, 3H), 1,54 (с, 3H), 1,51 (с, 3H).
Стадия 16: Раствор 7-(2-((3aS,4R,6R,6aR)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина (40 мг, 0,059 ммоль) в TFA (2 мл, 26,0 ммоль) перемешивали при 60°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением неочищенного продукта N-(7-(2-((2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3,4-дигидрокси-2,3-диметилтетрагидрофуран-2-ил)этил)-3-бромхинолин-2-ил)-2,2,2-трифторацетамида, который использовали на следующей стадии непосредственно без дополнительной очистки.
Стадия 17: К раствору неочищенного N-(7-(2-((2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3,4-дигидрокси-2,3-диметилтетрагидрофуран-2-ил)этил)-3-бромхинолин-2-ил)-2,2,2-трифторацетамида (рассчитано как 0,059 ммоль) в метаноле (3 мл) добавляли K2CO3 (24,6 мг, 0,178 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 60°C в течение 1 ч. Твердое вещество фильтровали и промывали при помощи MeOH (0,5 мл). Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диола в виде твердого вещества. MS: 513/515 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,33 (с, 1H), 8,06 (с, 1H), 7,58 (д, J=8,0 Гц, 1H), 7,38 (д, J=4,0 Гц, 1H), 7,30 (с, 1H), 7,08 (д, J=8,4 Гц, 1H), 7,01 (шир.с, 2H), 6,64 (д, J=3,6 Гц, 1H), 6,58 (шир.с, 2H), 6,03 (д, J=8,0 Гц, 1H), 5,29 (шир.с, 1H), 4,79-4,77 (м, 1H), 4,72 (с, 1H), 2,66-2,59 (м, 2H), 2,20-2,15 (м, 1H), 1,70-1,63 (м, 1H), 1,25 (с, 3H), 1,17 (с, 3H).
Пример 5
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
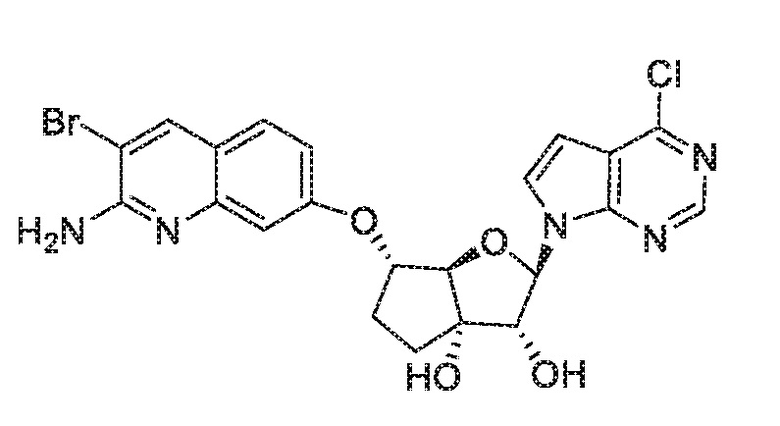
Стадия 1: (3R,3aS,6R,6aR)-2-метоксигексагидро-2H-циклопента[b]фуран-3,3a,6-триол (2 г, 10 ммоль) совместно упаривали с безводным толуолом (5 мл × 3) и затем снова растворяли в ацетоне (50 мл). К этому раствору добавляли 4-метилбензолсульфоновую кислоту (0,091 г, 0,53 ммоль) с последующим добавлением 2,2-диметоксипропана (2,74 г, 26,3 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 1 ч. pH полученного раствора доводили до 8 насыщенным водным раствором NaHCO3 (50 мл) при 0°C. Полученную смесь экстрагировали при помощи EtOAc (150 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир) с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола. MS: 248,20 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 4,96 (с, 1H), 4,41 (д, J=5,1 Гц, 1H), 4,17 (с, 1H), 4,10 (д, J=6,0 Гц, 1H), 3,88-3,79 (м, 1H), 3,33 (с, 3H), 2,04-1,92 (м, 1H), 1,76-1,62 (м, 3H), 1,39 (с, 3H), 1,31 (с, 3H). Колонку затем элюировали смесью 45-50% EtOAc в петролейном эфире с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола. MS: 248 (M+NH4). 1H ЯМР (300 МГц, DMSO-d6) δ 4,92 (д, J=4,2 Гц, 1H), 4,72 (д, J=6,0 Гц, 1H), 4,35 (д, J=4,2 Гц, 1H), 4,00 (д, J = (5,4 Гц, 1H), 3,91-3,82 (м, 1H), 3,35 (с, 3H), 2,09-1,97 (м, 1H), 1,83-1,62 (м, 2H), 1,52-1,43 (м, 1H), 1,40 (с, 3H), 1,31 (с, 3H).
Стадия 2: К раствору (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (748 мг, 3,25 ммоль) в DCM (30 мл) добавляли N, N-диметилпиридин-4-амин (437 мг, 3,57 ммоль) при комнатной температуре. Затем добавляли триэтиламин (362 мг, 3,57 ммоль) с последующим добавлением 4-метилбензол-1-сульфонилхлорида (929 мг, 4,87 ммоль). Реакционную смесь перемешивали в течение 16 ч при 25°C. Полученную смесь гасили насыщенным водным раствором NH4Cl (200 мл) и экстрагировали при помощи DCM (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл) и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир) с получением (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил 4-метилбензолсульфоната. MS: 402 (M+NH4). 1H ЯМР (300 МГц, Хлороформ-d) δ 7,85-7,81 (м, 2H), 7,35-7,32 (м, 2H), 4,94 (д, J=4,2 Гц, 1H), 4,74-4,67 (м, 1H), 4,35 (д, J=4,2 Гц, 1H), 4,15 (д, J=5,1 Гц, 1H), 3,38 (с, 3H), 2,44 (с, 3H), 2,18-1,75 (м, 4H), 1,49 (с, 3H), 1,37 (с, 3H).
Стадия 3: К раствору (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил 4-метилбензолсульфоната (400 мг, 1,04 ммоль) и 2-амино-3-бромхинолин-7-ола (249 мг, 1,04 ммоль) (подвергавшегося азеотропной перегонке с толуолом 2 мл × 3) в NMP (5 мл) добавляли Cs2CO3 (1,02 г, 3,12 ммоль). Реакционную смесь перемешивали при 90°C в течение 2 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором NH4Cl (60 мл) и экстрагировали при помощи DCM (60 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (60 мл) и сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир). Продукт дополнительно очищали обращенно-фазовой ВЭЖХ (ACN/вода) с получением 3-бром-7-(((3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амина. MS: 451/453 (M+1/M+3). 1H ЯМР (300 МГц, Хлороформ-d) δ 8,06 (с, 1H), 7,46 (д, J=9,0 Гц, 1H), 7,06 (д, J=2,4 Гц, 1H), 6,95 (дд, J=8,7, 2,4 Гц, 1H), 5,28 (с, 2H), 4,93 (д, J=4,2 Гц, 1H), 4,66 (д, J=4,2 Гц, 1H), 4,63-4,50 (м, 2H), 3,49 (с, 3H), 2,45-2,33 (м, 1H), 2,26-2,14 (м, 2H), 2,01-1,88 (м, 1H), 1,55 (с, 3H), 1,44 (с, 3H).
Стадия 4: Раствор 3-бром-7-(((3aR,5aR,6S,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амина (315 мг, 0,698 ммоль) в HCl (10 мл, 4,00 ммоль, 0,4 M в MeCN/H2O=3:2 (об./об.)) перемешивали при 90°C в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (50 мл) и экстрагировали при помощи DCM (50 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Объединенные остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода) с получением (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола. MS: 397/399 (M+1/M+3). 1H ЯМР (300 МГц, Метанол-d4) δ 8,20 (с, 1H), 7,56-7,52 (м, 1H), 7,11 (д, J=2,4 Гц, 1H), 7,02 (д, J=2,4 Гц, 1H), 6,97-6,92 (м, 1H), 5,34 (д, J=4,2 Гц, 1H), 5,20 (д, J=3,0 Гц, 1H), 4,76-4,74 (м, 1H), 4,64-4,62 (м, 1H), 4,36 (с, 1H), 4,18 (с, 1H), 3,79 (д, J=4,2 Гц, 1H), 3,63 (д, J=3,3 Гц, 1H), 2,46-1,81 (м, 4H).
Стадия 5: К перемешиваемому раствору (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (240 мг, 0,604 ммоль) в безводном MeCN (10 мл) добавляли трибутилфосфин (0,241 мл, 0,967 ммоль) с последующим добавлением (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (229 мг, 0,906 ммоль) при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды в течение 20 минут и раствор, содержащий неочищенный (1aS,2aR,3S,5aR,5bR)-3-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-5aH-циклопента[b]оксирено[2,3-d]фуран-5a-ол, концентрировали при пониженном давлении. Продукт использовали на следующей стадии без очистки.
Стадия 6: К перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (184 мг, 1,20 ммоль) в безводном DMF (4 мл) добавляли гидрид натрия (72 мг, 1,8 ммоль) при 0°C. Суспензию перемешивали при комнатной температуре в течение 30 минут, затем суспензию переносили в раствор, содержащий неочищенный (1aS,2aR,3S,5aR,5bR)-3-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-5aH-циклопента[b]оксирено[2,3-d]фуран-5a-ол в ACN (4 мл), через шприц. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (50 мл) и экстрагировали при помощи DCM (50 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 5мМ водн. бикарбоната аммония). Неочищенный продукт дополнительно очищали препаративной ТСХ, проявляли при помощи DCM:MeOH=10:1 (об.:об.) (rf=0,6) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 532/534 (M+1/M+3). 1H ЯМР (300 МГц, DMSO-d6) δ 8,72 (с, 1H), 8,27 (с, 1H), 8,18 (д, J=3,9 Гц, 1H), 7,57 (д, J=8,7 Гц, 1H), 6,88-6,83 (м, 3H), 6,61 (шир.с, 2H), 6,17 (д, J=8,4 Гц, 1H), 5,53 (д, J=7,2 Гц, 1H), 5,44 (с, 1H), 4,67 (д, J=4,8 Гц, 1H), 4,48 (т, J=7,8 Гц, 1H), 4,15 (с, 1H), 2,51-2,50 (м, 1H), 2,10-1,95 (м, 3H).
Пример 6
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
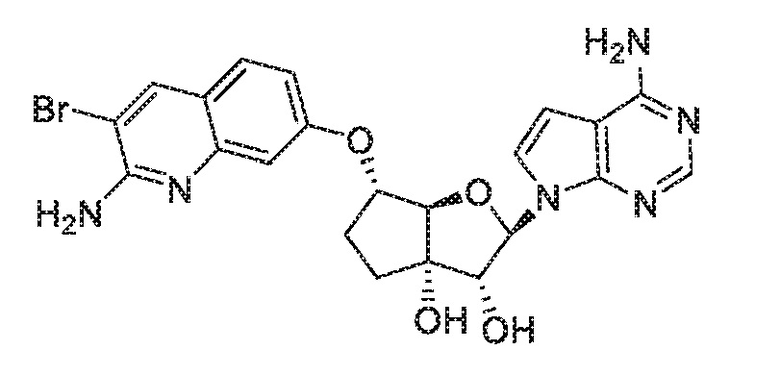
Стадия 1: Раствор (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (55 мг, 0,10 ммоль), 1,4-диоксана (15 мл) и NH3.H2O (15 мл) перемешивали в герметично закрытой пробирке при 90°C в течение 10 ч. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли насыщенным водным раствором NH4Cl (30 мл). Смесь экстрагировали при помощи DCM (25 мл × 5). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (MeOH/DCM) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 513/515 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,26 (с, 1H), 8,09 (с, 1H), 7,57 (д, J=8,8 Гц, 1H), 7,50 (д, J=3,6 Гц, 1H), 7,05 (шир.с, 2H), 6,87-6,83 (м, 2H), 6,66 (д, J=4,0 Гц, 1H), 6,53 (шир.с, 2H), 6,02 (д, J=8,8 Гц, 1H), 5,36 (д, J=7,2 Гц, 1H), 5,31 (с, 1H), 4,60 (д, J=4,8 Гц, 1H), 4,40 (т, J=7,6 Гц, 1H), 4,08 (с, 1H), 2,52-2,50 (м, 1H), 2,07-1,99 (м, 3H).
Пример 7
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
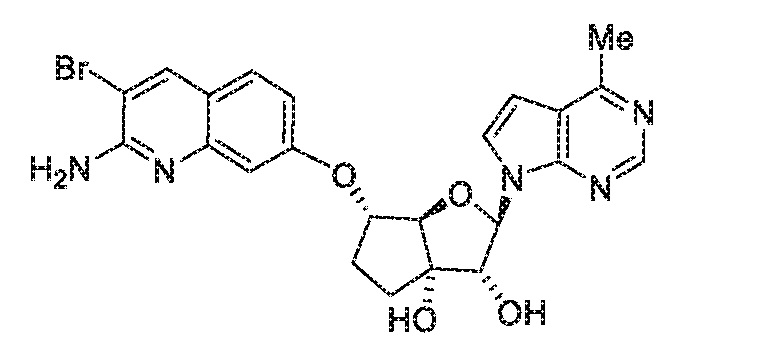
Стадия 1: К перемешиваемому раствору (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (1,0 г, 2,5 ммоль) в безводном MeCN (30 мл) в атмосфере аргона добавляли (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (1,13 г, 4,53 ммоль) и трибутилфосфин (1,20 мл, 4,78 ммоль) при 25°C. Полученную смесь перемешивали при 25°C в течение 40 минут. Этот раствор использовали на следующей стадии без выделения и определения характеристик.
Стадия 2: К перемешиваемому раствору 4-метил-7H-пирроло[2,3-d]пиримидина (0,671 г, 5,04 ммоль) (совместно упаривали с безводным толуолом 10 мл × 3, затем использовали) в безводном DMF (12 мл) добавляли гидрид натрия (0,302 г, 7,56 ммоль) при 0°C. Суспензию перемешивали при комнатной температуре в течение 30 минут. Суспензию переносили через шприц при температуре окружающей среды в раствор с предыдущей стадии, который содержал (1aS,2aR,3S,5aR,5bR)-3-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-1aH-циклопента[b]оксирено[2,3-d]фуран-5a-ол (рассчитано как ~2,52 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Реакцию гасили насыщенным водным раствором NH4Cl (40 мл) и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (0-100% ацетонитрил/вода с 5 мМ бикарбонат аммония в качестве модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 512/514 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,70 (с, 1H), 8,26 (с, 1H), 7,95 (д, J=4,0 Гц, 1H), 7,57 (д, J=8,8 Гц, 1H), 6,88-6,83 (м, 3H), 6,52 (шир.с, 2H), 6,15 (д, J=8,4 Гц, 1H), 5,45 (д, J=7,2 Гц, 1H), 5,39 (с, 1H), 4,64 (д, J=4,8 Гц, 1H), 4,48 (т, J=8,0 Гц, 1H), 4,14 (с, 1H), 2,69 (с, 3H), 2,56-2,50 (м, 1H), 2,10-1,99 (м, 3H).
Пример 8
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
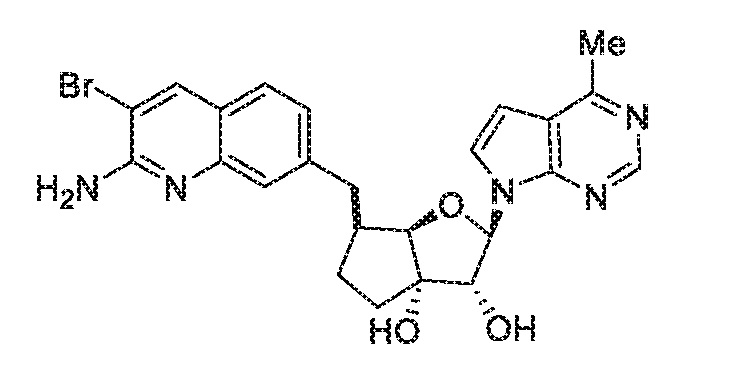
Стадия 1: К раствору оксалилдихлорида (1,47 мл, 17,4 ммоль) в безводном DCM (20 мл) добавляли DMSO (3,08 мл, 43,4 ммоль) в безводном DCM (2 мл) при -78°C в атмосфере аргона. Реакционную смесь перемешивали при -65°C в течение 0,5 ч. К полученному раствору добавляли раствор (3aR,5aR,6R,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (1,0 г, 4,34 ммоль) в безводном DCM (10 мл) при -65°C. Раствор перемешивали еще в течение 0,5 ч при -65°C. При этой температуре к реакционной смеси добавляли TEA (6,05 мл, 43,4 ммоль). Полученный раствор перемешивали в течение 0,5 ч при -65°C. Реакцию гасили H2O (50 мл) при 0°C и экстрагировали при помощи DCM (100 мл × 3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (40 мл) и насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении с получением (3aR,5aS,8aS)-4-метокси-2,2-диметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она, который подвергали азеотропной перегонке с толуолом (10 мл × 3) и использовали непосредственно на следующей стадии без очистки. 1H ЯМР (400 МГц, DMSO-d6) δ 5,77 (д, J=1,6 Гц, 1H), 4,98 (д, J=1,6 Гц, 1H), 4,40 (д, J=1,6 Гц, 1H), 4,16 (с, 1H), 3,10 (с, 3H), 2,50-2,30 (м, 3H), 1,39 (с, 3H), 1,37 (с, 3H).
Стадия 2: К раствору метилтрифенилфосфоний бромида (4,34 г, 12,2 ммоль) в безводном THF (20 мл) добавляли n-BuLi (2,5 M в THF) (4,52 мл, 11,3 ммоль) по каплям при -60°C в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Затем добавляли по каплям раствор (3aR,5aS,8aS)-4-метокси-2,2-диметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она (1,8 г, неочищенный, 4,3 ммоль) в безводном THF (20 мл) при -60°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили насыщенным водным раствором NH4Cl (50 мл) при 0°C. Смесь экстрагировали при помощи EtOAc (200 мл × 2) и объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/петролейный эфир) с получением (3aR,5aR,8aR)-4-метокси-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола. 1H ЯМР (400 МГц, Хлороформ-d) δ 5,17 (с, 1H), 5,07 (с, 1H), 5,02 (т, J=1,1 Гц, 1H), 4,64 (с, 1H), 4,30 (т, J=1,1 Гц, 1H), 3,29 (с, 3H), 2,75-2,59 (м, 1H), 2,44-2,33 (m,1H), 2,23-2,09 (м, 1H), 2,15-2,05 (м, 1H), 1,51 (с, 3H), 1,41 (с, 3H).
Стадия 3: К раствору (3aR,5aR,8aR)-4-метокси-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола (300 мг, 1 ммоль) в безводном THF (3 мл) добавляли 9-BBN (0,5 M в THF, 13,3 мл, 6,63 ммоль) по каплям при 0 °C в атмосфере аргона. Реакционную смесь перемешивали при 50°C в течение 1 ч. Этот раствор использовали на следующей стадии без определения характеристик.
Стадия 4: К раствору, содержащему борановое промежуточное соединение с предыдущей стадии, добавляли раствор трехосновного фосфата калия (1,41 г, 6,63 ммоль) в воде (3 мл) при 0°C в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (684 мг, 1,46 ммоль) и комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном (108 мг, 0,133 ммоль) в THF (5 мл) при комнатной температуре. Реакционную смесь перемешивали при 50°C в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры и распределяли между насыщенным солевым раствором (80 мл) и EtOAc (100 мл). Водную фазу обратно экстрагировали при помощи EtOAc (100 мл × 2). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир) с получением 3-бром-7-(((3aR,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-N-(4-метоксибензил)хинолин-2-амина. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. MS: 569/571 (M+1/M+3).
Стадия 5: Раствор 3-бром-7-(((3aR,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-N-(4-метоксибензил)хинолин-2-амин (890 мг неочищенный, 1,33 ммоль) в HCl (0,4 M в MeCN/H2O (3:2, об./об.), 10 мл, 4 ммоль) перемешивали при 90°C в течение 1 ч. Реакционную смесь охлаждали до 0°C и гасили насыщенным водным раствором Na2CO3 (60 мл) и экстрагировали при помощи EtOAc (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (60 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (MeOH/DCM) с получением (3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола. MS: 515/517 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,33 (с, 1H), 7,57 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,4 Гц, 3H), 7,13 (д, J=7,5 Гц, 2H), 6,88 (д, J=8,2 Гц, 2H), 5,93 (д, J=6,5 Гц, 1H), 5,20-5,12 (м, 1H), 4,64 (т, J=8,1 Гц, 3H), 4,46 (д, J=8,1 Гц, 1H), 3,93 (д, J=4,7 Гц, 1H), 3,72 (д, J=1,1 Гц, 3H), 3,49 (дд, J=7,5, 4,1 Гц, 1H), 2,87-2,76 (м, 1H), 2,65 (дд, J=13,6, 7,0 Гц, 1H), 2,20-1,19 (м, 5H).
Стадия 6: К перемешиваемому раствору (3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (250 мг, 0,486 ммоль) в безводном MeCN (9 мл) добавляли трибутилфосфин (176 мг, 0,869 ммоль) с последующим добавлением (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (206 мг, 0,815 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и раствор использовали непосредственно на следующей стадии без определени характеристик.
Стадия 7: К перемешиваемому раствору 4-метил-7H-пирроло [2, 3-d]пиримидина (129 мг, 0,970 ммоль) в безводном DMF (6 мл) добавляли гидрид натрия (60% дисперсия в минеральном масле) (58,2 мг, 1,46 ммоль) при 0°C. Суспензию перемешивали при комнатной температуре в течение 30 минут. Суспензию переносили в раствор с предыдущей стадии, содержащий эпоксидное промежуточное соединение, через шприц и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором хлорида аммония (30 мл) и экстрагировали при помощи EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (MeOH/DCM) с получением (2R,3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола. MS: 630/632 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,69 (с, 1H), 8,32 (д, J=6,0 Гц, 1H), 8,02 (с, 1H), 7,54 (д, J=8,2 Гц, 1H), 7,33 (д, J=8,4 Гц, 2H), 7,14-7,04 (м, 3H), 6,91-6,80 (м, 4H), 6,03(д, J=8,1 Гц, 1H), 5,30 (д, J=7,0 Гц, 1H), 5,12 (с, 1H), 4,61 (д, J=6,2 Гц, 2H), 4,22 (т, J=7,6 Гц, 1H), 4,04 (д, J=6,6 Гц, 1H), 3,72 (с, 3H), 2,83 (дд, J=13,7, 7,2 Гц, 1H), 2,69(с, 3H), 2,65 (с, 1H), 2,37-2,22 (м, 1H), 1,99-1,93 (м, 1H), 1,55 (д, J=6,5 Гц, 2H).
Стадия 8: Раствор (2R,3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола (150 мг, 0,21 ммоль) в TFA (2 мл) перемешивали при 60°C в течение 1 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (50 мл) и экстрагировали при помощи EtOAc (50 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ на диоксиде кремния (MeOH/DCM) с получением неочищенного продукта в виде твердого вещества. Неочищенный продукт дополнительно очищали обращенно-фазовой ВЭЖХ (ACN/вода с 5 мМ бикарбоната аммония в качестве модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 510/512 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,69 (с, 1H), 8,30 (с, 1H), 7,87 (д, J=3,6 Гц, 1H), 7,54 (д, J=8,4 Гц, 1H), 7,27 (с, 1H), 7,08 (дд, J=8,4, 1,6 Гц, 1H), 6,82 (д, J=3,6 Гц, 1H), 6,53 (шир.с, 2H), 6,01 (д, J=8,0 Гц, 1H), 5,30 (д, J=6,8 Гц, 1H), 5,11 (с, 1H), 4,22 (т, J=7,6 Гц, 1H), 4,00 (д, J=5,6 Гц, 1H), 2,83 (дд, J=13,6, 7,8 Гц, 1H), 2,70 (с, 3H), 2,64 (дд, J=13,6, 7,6 Гц, 1H), 2,35-2,24 (м, 1H), 1,97 (дд, J=12,4, 5,6 Гц, 1H), 1,79-1,68 (м, 2H), 1,55 (дт, J=12,4, 6,4 Гц, 1H).
Пример 9
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
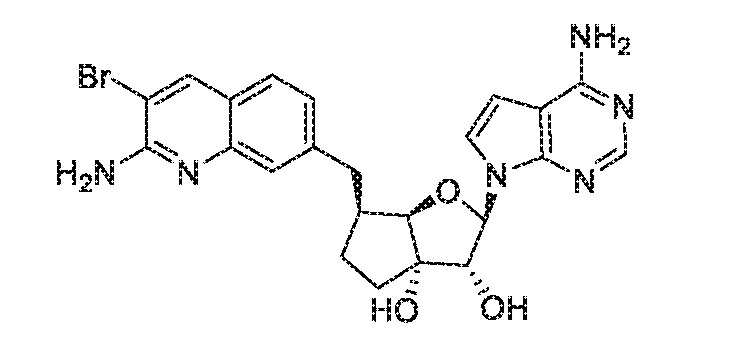
Стадия 1: К перемешиваемому раствору (3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (70 мг, 0,14 ммоль) в безводном MeCN (3 мл) добавляли (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (51,4 мг, 0,204 ммоль) в MeCN (0,3 мл) по каплям при 0°C в атмосфере аргона. Затем добавляли трибутилфосфин (0,054 мл, 0,22 ммоль) по каплям при 0°C. Затем реакционную смесь перемешивали при 35°C в течение 1 ч. Полученный раствор использовали непосредственно на следующей стадии без дополнительной очистки.
Стадия 2: К перемешиваемой суспензии 4-хлор-7H-пирроло[2,3-d]пиримидина (39,0 мг, 0,254 ммоль) в безводном ACN (3 мл) добавляли DBU (0,039 мл, 0,26 ммоль) при комнатной температуре в атмосфере аргона. Полученный раствор перемешивали при комнатной температуре в течение 30 минут. Затем раствор с предыдущей стадии переносили через шприц при комнатной температуре в атмосфере аргона. Полученную смесь перемешивали при 35°C в течение 2 ч. Реакцию гасили насыщенным солевым раствором (20 мл) и экстрагировали при помощи EtOAc (50 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (MeOH/DCM) с получением (2R,3R,3aS,6S,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 650/652 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,71 (д, J=1,6 Гц, 1H), 8,32 (с, 1H), 8,12 (д, J=4,0 Гц, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,37-7,29 (м, 4H), 7,10-7,05 (м, 1H), 6,86 (д, J=8,2 Гц, 2H), 6,84-6,79 (м, 1H), 6,04 (д, J=8,0 Гц, 1H), 5,37 (шир.с, 1H), 4,61 (д, J=6,0 Гц, 2H), 4,22 (д, J=8,0 Гц, 1H), 4,08-4,01 (м, 1H), 3,72 (с, 3H), 2,83 (дд, J= 13,6, 7,6 Гц, 1H), 2,64 (дд, J=14,6, 7,6 Гц, 1H), 2,37-2,26 (м, 2H), 1,96 (дд, J=12,4, 6,0 Гц, 1H), 1,85-1,75 (м, 1H), 1,71-1,63 (м, 1H), 1,56-1,50 (м, 1H).
Стадия 3: Раствор (2R,3R,3aS,6S,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (60 мг, 0,09 ммоль) в TFA (2 мл, 30 ммоль) перемешивали при 60°C в течение 1 ч. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток разбавляли при помощи EtOAc (100 мл) и промывали насыщенным водным раствором NaHCO3 (20 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (MeOH/DCM) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 530/532 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,72 (с, 1H), 8,31 (с, 1H), 8,11 (д, J=4,0 Гц, 1H), 7,55 (д, J=8,4 Гц, 1H), 7,29 (с, 1H), 7,10 (дд, J=8,4, 1,6 Гц, 1H), 6,83 (д, J=4,0 Гц, 1H), 6,57-6,51 (м, 3H), 6,03 (д, J=8,0 Гц, 1H), 5,39 (д, J=6,8 Гц, 1H), 5,17 (с, 1H), 4,24 (т, J=7,6 Гц, 1H), 4,05 (д, J=5,6 Гц, 1H), 2,84 (дд, J=13,6, 8,0 Гц, 1H), 2,71-2,60 (м, 1H), 2,37-2,15 (м, 1H), 2,03-1,92 (м, 1H), 1,88-1,63 (м, 1H), 1,62-1,49 (м, 1H).
Стадия 4: В герметично закрываемую пробирку (20 мл) добавляли (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол (30 мг, 0,06 ммоль), 1,4-диоксан (5 мл) и NH3·H2O (9 мл) при комнатной температуре. Сосуд герметично закрывали и реакционную смесь перемешивали при 90°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 5 мМ бикарбоната аммония в качестве модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола. MS: 511/513 (M+1/M+3). 1H ЯМР (400 МГц, DMSO-d6) δ 8,30 (с, 1H), 8,09 (с, 1H), 7,54 (д, J=8,4 Гц, 1H), 7,43 (д, J=4,0 Гц, 1H), 7,28 (с, 1H), 7,09 (д, J=8,4 Гц, 1H), 7,03 (шир.с, 2H), 6,67 (д, J=3,6 Гц, 1H), 6,54 (шир.с, 2H), 5,88 (д, J=8,0 Гц, 1H), 5,23 (д, J=7,2 Гц, 1H), 5,04 (с, 1H), 4,13 (т, J=7,6 Гц, 1H), 3,95 (д, J=6,0 Гц, 1H), 2,82 (дд, J=13,2, 8,0 Гц, 1H), 2,62 (дд, J=14,4, 7,2 Гц, 1H), 2,24-2,22 (м, 1H), 1,96-1,92 (м, 1H), 1,70-1,68 (м, 2H), 1,57-1,51 (м, 1H).
Пример 10 и 11
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол (Пример 10)
и
(2R,3S,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол (Пример 11)
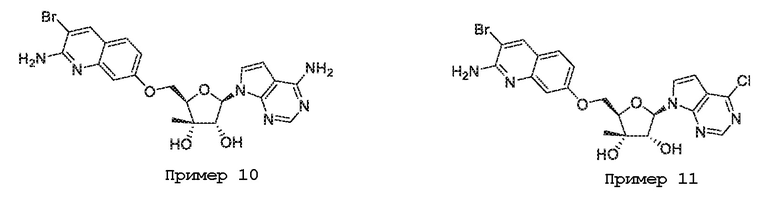
Стадия 1: В 10-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (5R,6S)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (951 г, 5 моль) в пиридине (7 л) и трет-бутил(хлор)дифенилсилан (1,4 кг, 5,1 моль). Полученный раствор перемешивали в течение ночи при комнатной температуре. Смесь разбавляли MeOH (600 мл) и затем концентрировали при пониженном давлении. Остаток разбавляли при помощи EtOAc, промывали HCl (0,5 M в вод), насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (5R,6S)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола в виде масла, которое использовали на следующей стадии без дополнительной очистки.
Стадия 2: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (5R,6S)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (2,1 кг, 5 моль) в DCM (15 л) и периодинан Десса-Мартина (3,18 кг, 7,50 моль). Полученный раствор перемешивали в течение ночи при комнатной температуре. Реакцию гасили добавлением насыщенного водного раствора бикарбоната натрия и раствор концентрировали при пониженном давлении. Остаток разбавляли диэтиловым эфиром и смесь фильтровали. Фильтрат концентрировали при пониженном давлении с получением (5R)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(5H)-она в виде масла, которое использовали на следующей стадии без дополнительной очистки.
Стадия 3: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (5R)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(5H)-она (2,1 кг, 5 моль) в THF (10 л). К этой смеси добавляли метилмагний хлорид (1,84 L, 3,0 M в THF) по каплям при перемешивании при 0oC. Полученный раствор перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь затем гасили добавлением насыщенного водного раствора хлорида аммония. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (5R,6R)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола в виде масла, которое использовали на следующей стадии без дополнительной очистки. 1H ЯМР (500 МГц, CDCl3) δ 7,73-7,70 (м, 4H), 7,46-7,39 (м, 6H), 5,79 (д, J=3,8 Гц, 1H), 4,16-4,10 (м, 2H), 3,92 (дд, J=6,4, 4,5 Гц, 1H), 3,85-3,84 (м, 2H), 2,56 (с, 1H), 2,07 (с, 1H), 1,38 (с, 3H), 1,28 (т, J=7,1 Гц, 2H), 1,14 (с, 3H), 1,09 (с, 8H).
Стадия 4: В 20-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (5R,6R)-5-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (2,2 кг, 5 моль) в AcOH (10 л). К этой смеси добавляли серную кислоту (49,2 г, 502 ммоль) по каплям при перемешивании при 10°C с последующим добавлением уксусного ангидрида (2,04 кг, 20,0 моль) по каплям при перемешивании при 10°C. Полученный раствор перемешивали в течение 3 ч при комнатной температуре. Смесь концентрировали при пониженном давлении и затем разбавляли при помощи EtOAc. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (элюируя смесью 1:1 этилацетат/петролейный эфир) с получением (3R,4R,5R)-5-(((трет-бутилдифенилсилил)окси)метил)-4-метилтетрагидрофуран-2,3,4-триил триацетата в виде масла.
Стадия 5: В 5-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали 4-хлор-5-иод-7H-пирроло[2,3-d]пиримидин (420 г, 1503 ммоль), BSA (305 г, 7,11 моль), раствор (3R,4R,5R)-5-(((трет-бутилдифенилсилил)окси)метил)-4-метилтетрагидрофуран-2,3,4-триил триацетата (795 г, 1,50 моль) в MeCN (7 л) и триметилсилил трифторметансульфонат (668 г, 3,00 моль). Полученный раствор перемешивали в течение 6 ч при 80°C. Смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и разбавляли при помощи EtOAc. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/петролейный эфир) с получением (2R,3R,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-5-иод-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата в виде масла. MS: 748 (M+1).
Стадия 6: В 5-л 4-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (2R,3R,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-5-иод-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата (225 г, 300. ммоль) в тетрагидрофуране (2,2 л). Раствор охлаждали до -78°C и добавляли по каплям комплекс хлорид изопропилмагния-хлорид лития (54,6 г, 376 ммоль) и раствор перемешивали в течение 2 ч при -78°C. Смесь гасили добавлением по каплям iPrOH (25,2 г, 420 ммоль) при -78°C. Эту холодную реакционную смесь выливали в смесь льда и насыщенного водного раствора хлорида аммония. Смесь экстрагировали при помощи DCM (2×) и объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (2R,3R,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата в виде масла, которое использовали как таковое без дополнительной очистки.
Стадия 7: В 5-л 3-горлую круглодонную колбу, которую продували и поддерживали инертную атмосферу азота, загружали раствор (2R,3R,4R,5R)-2-(((трет-бутилдифенилсилил)окси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата (186 г, 299 ммоль) в THF (1,8 л) и AcOH (90 г, 1,5 моль). Добавляли по каплям TBAF (600 мл, 2,00 экв., 1,0 M в THF) при перемешивании при комнатной температуре и раствор перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (MeOH/DCM) с получением (2R,3R,4R,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-(гидроксиметил)-3-метилтетрагидрофуран-3,4-диил диацетата в виде твердого вещества. MS: 384 (M+1).
Стадия 8: Смесь (2R,3R,4R,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-(гидроксиметил)-3-метилтетрагидрофуран-3,4-диил диацетата (542 мг, 1,41 ммоль), TEA (0,59 мл, 4,2 ммоль) и DMAP (34,5 мг, 0,28 ммоль) растворяли в DCM (11 мл). Добавляли 4-толуолсульфонилхлорид (538 мг, 2,8 ммоль) при 0°C и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли при помощи DCM и промывали водой. Водный слой экстрагировали при помощи DCM (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (EtOAc/гексан) с получением (2R,3R,4R,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-2-((тозилокси)метил)тетрагидрофуран-3,4-диил диацетат, который использовали как таковой без дополнительной очистки. MS: 538 (M+1).
Стадия 9: К раствору (2R,3R,4R,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-2-((тозилокси)метил)тетрагидрофуран-3,4-диил диацетата (380 мг, 0,71 ммоль) и 2-амино-3-бромхинолин-7-ола (169 мг, 0,71 ммоль) в DMF (5 мл) при 0°C добавляли карбонат цезия (460 мг, 1,4 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и затем гасили водой. Осадок собирали фильтрованием, промывали водой и сушили при пониженном давлении с получением (2R,3R,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата в виде твердого вещества. MS: 604/606 (M+1/M+3).
Стадия 10: К раствору (2R,3R,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диил диацетата (372 мг, 0,62 ммоль), растворенного в диоксане (4 мл), добавляли гидроксид аммония (4 мл, 51,8 ммоль, 30% в вод). Смесь нагревали при 85°C в течение ночи. Смесь охлаждали до комнатной температуры и реакционную смесь концентрировали при пониженном давлении. Остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% TFA модификатора) с получением:
Пример 10: (2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол. MS: 501/503 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,72-8,34 (м, 3H), 8,03-7,40 (м, 3H), 7,15-7,03 (м, 2H), 6,94 (д, J=3,0 Гц, 1H), 6,16 (д, J=7,9 Гц, 1H), 5,65-4,96 (м, 2H), 4,40-4,35 (м, 1H), 4,29-4,18 (м, 4H), 1,27 (с, 3H).
Пример 11: (2R,3S,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол. MS: 520/522 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,73-8,62 (м, 2H), 8,13 (с, 1H), 7,93 (д, J=3,4 Гц, 1H), 7,76 (д, J=8,7 Гц, 1H), 7,18-7,11 (м, 2H), 6,73 (д, J=3,5 Гц, 1H), 6,25 (д, J=8,0 Гц, 1H), 4,51-4,44 (м, 2H), 4,33-4,20 (м, 5H), 1,28 (с, 3H).
Пример 12
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол
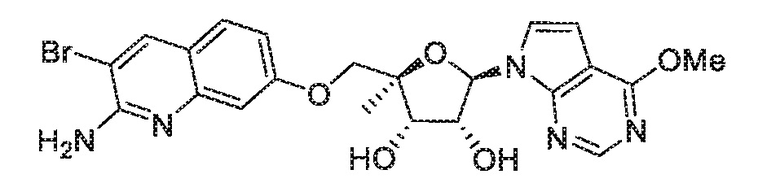
Раствор 3-бром-7-(((3aS,4R,6R,6aR)-6-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)-N-(4-метоксибензил)хинолин-2-амина (30 мг, 0,04 ммоль) в TFA (1,0 мл) перемешивали при 40°C в течение 3 дней. Реакционную смесь концентрировали в вакууме и остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% TFA модификатора) с получением (2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диола, TFA соли, в виде твердого вещества. MS: 516/518 (M+1/M+3). 1H-ЯМР (600 МГц, DMSO-d6) δ 8,66 (br, 1H), 8,43 (с, 1H), 7,75 (д, J=8,2 Гц, 1H), 7,63-7,59 (м, 1H), 7,16-7,09 (м, 2H), 6,59-6,54 (м, 1H), 6,23 (д, J=6,6 Гц, 1H), 4,88-4,81 (м, 1H), 4,27-4,19 (м, 2H), 4,11 (д, J=9,9 Гц, 1H), 4,03 (с, 3H), 1,36 (с, 3H).
Пример 13
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол
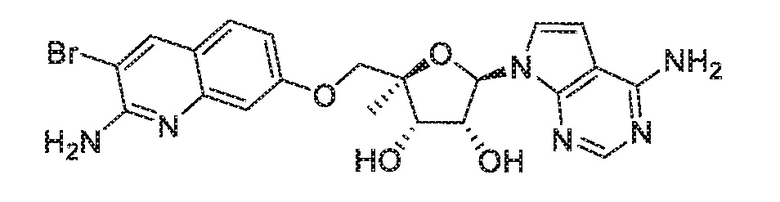
Раствор (2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диола TFA соли (10 мг, 0,019 ммоль) в 30% аммиака в воде (3 мл) перемешивали при 150°C в течение 4 ч в микроволновом реакторе. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хиральной СФХ (DIOL колонка, 35%/65% метанола/CO2) с получением (2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диола в виде твердого вещества. MS: 501/503 (M+1/M+3). 1H-ЯМР (500 МГц, CD3OD) δ 8,22 (с, 1H), 8,09 (с, 1H), 7,58 (д, J=9,0 Гц, 1H), 7,35 (д, J=3,7 Гц, 1H), 7,06-6,98 (м, 2H), 6,60 (д, J=3,3 Гц, 1H), 6,27 (д, J=6,7 Гц, 1H), 4,87-4,82 (м, 1H), 4,39 (д, J=5,4 Гц, 1H), 4,20 (д, J=10,2 Гц, 1H), 4,12 (д, J=10,2 Гц, 1H), 1,48 (с, 3H).
Пример 14
(2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол
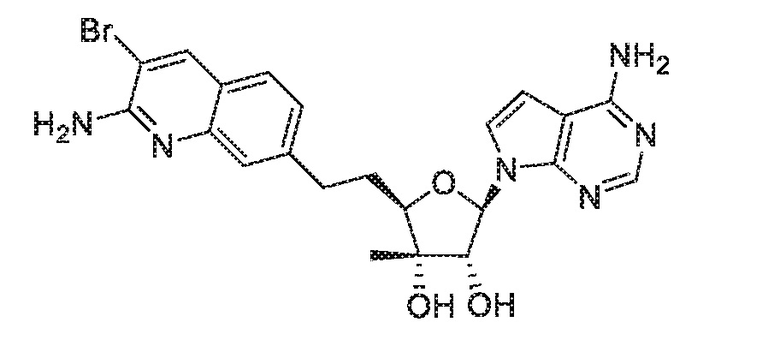
Стадия 1: В 500-мл круглодонную колбу загружали (3aR,5R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (10,0 г, 38,4 ммоль), который затем растворяли в DCM (100 мл). Затем добавляли по порциям периодинан Десса-Мартина (32,6 г, 77 ммоль) и мутно-белую реакционную смесь перемешивали при комнатной температуре в течение 80 мин. Добавляли DCM (100 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором тиосульфата натрия. После перемешивания в течение 1 ч слои экстрагировали и органический слой сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением неочищенного (3aR,5S,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она в виде масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. 1H-ЯМР (600 МГц, CDCl3) δ 6,14 (д, J=4,5 Гц, 1H), 4,39-4,38 (м, 1H), 4,38-4,34 (м, 2H), 4,04-4,01 (м, 2H), 1,46 (с, 3H), 1,43 (с, 3H), 1,35-1,32 (м, 6H).
Стадия 2: В колбу загружали неочищенный (3aR,5R,6aS)-5-((S)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-он (7,42 г, макс. 28,7 ммоль), снова заполняли аргоном и затем добавляли толуол (100 мл). Раствор охлаждали до 0°C и затем добавляли по каплям метилмагнийхлорид (3,0 M в THF, 14,4 мл, 43,2 ммоль) в атмосфере аргона. Через 5 минут реакционную смесь удаляли из ледяной бани и давали нагреться до комнатной температуры, перемешивали в течение ночи. Реакционную смесь выливали в делительную воронку, содержащую насыщенный раствор хлорида аммония и экстрагировали при помощи EtOAc. Органические слои объединяли и промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением (3aR,5R,6R,6aR)-5-((S)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки. 1H-ЯМР (600 МГц, CDCl3) δ 5,70 (д, J=3,6 Гц, 1H), 4,17 (д, J=3,7 Гц, 1H), 4,12-4,08 (м, 2H), 3,95-3,91 (м, 1H), 3,78 (д, J=7,4 Гц, 1H), 2,67 (с, 1H), 1,59 (с, 3H), 1,45 (с, 3H), 1,36 (с, 3H), 1,35 (с, 3H), 1,28 (с, 3H).
Стадия 3: В колбу загружали (3aR,5R,6R,6aR)-5-((S)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (5,82 г, 21,2 ммоль) и добавляли ацетонитрил (100 мл). Затем добавляли серную кислоту (10 мл, 188 ммоль) в виде раствора 5% об. в воде и реакционную смесь перемешивали при комнатной температуре в течение 4,5 ч. Реакционную смесь выливали в делительную воронку, содержащую насыщенный раствор бикарбоната натрия, и экстрагировали при помощи EtOAc. Органические слои объединяли и промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (S)-1-((3aR,5R,6R,6aR)-6-гидрокси-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола в виде твердого вещества, которое использовали в следующей реакции без дополнительной очистки. 1H-ЯМР (600 МГц, CDCl3) δ 5,73 (д, J=3,7 Гц, 1H), 4,16 (д, J=3,7 Гц, 1H), 3,85-3,81 (м, 2H), 3,75 (д, J=8,4 Гц, 1H), 3,72-3,68 (м, 1H), 2,87 (с, 1H), 2,53 (с, 1H), 2,02 (с, 1H), 1,59 (с, 3H), 1,36 (с, 3H), 1,33 (с, 3H).
Стадия 4: В колбу, содержащую раствор неочищенного (S)-1-((3aR,5R,6R,6aR)-6-гидрокси-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола (1,24 г, 5,30 ммоль) в толуоле (100 мл), последовательно добавляли имидазол (1,44 г, 21,2 ммоль) и трифенилфосфин (5,56 г, 21,2 ммоль). Колбу охлаждали до 0°C и затем добавляли иод (4,04 г, 15,9 ммоль). Ледяную баню оставляли нагреваться естественным образом и раствор затем перемешивали при комнатной температуре в атмосфере аргона в течение четырех дней. Реакционную смесь выливали в делительную воронку, содержащую 1M NaOH, и экстрагировали при помощи EtOAc. Органические слои объединяли и промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10-20-30% EtOAc/гексан) с получением (3aR,5R,6R,6aR)-2,2,6-триметил-5-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола в виде твердого вещества. 1H-ЯМР (600 МГц, CDCl3) δ 5,84-5,76 (м, 2H), 5,40 (дт, J=17,3, 1,5 Гц, 1H), 5,29 (дт, J=10,7, 1,4 Гц, 1H), 4,21 (д, J=5,9 Гц, 1H), 4,17 (д, J=3,9 Гц, 1H), 2,63 (с, 1H), 1,59 (с, 3H), 1,37 (с, 3H), 1,12 (с, 3H).
Стадия 5: В сосуд загружали (3aR,5R,6R,6aR)-2,2,6-триметил-5-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (200 мг, 0,999 ммоль) и 9-BBN (0,5M в THF, 6 мл, 3,00 ммоль) и перемешивали при 50°C в течение 2 ч в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и добавляли трифосфат калия (2M в вод, 2,5 мл, 5,00 ммоль). Смесь интенсивно перемешивали при комнатной температуре в течение 30 минут и затем добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (609 мг, 1,298 ммоль) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном (82 мг, 0,100 ммоль) в THF (3 мл). Верхнее пространство сосуда продували аргоном и реакционную смесь перемешивали при 50°C в течение ночи. Реакционную смесь затем разбавляли DCM и водой и пропускали через фазовый разделитель. Органические слои объединяли и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/гексан) с получением (3aR,5R,6R,6aR)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола в виде твердого вещества. MS: 543/545 (M+1/M+3).
Стадия 6: В сосуд, содержащий (3aR,5R,6R,6aR)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-2,2,6-триметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол (353,2 мг, 0,650 ммоль), добавляли воду (5 мл) с последующим добавлением чистой муравьиной кислоты (5 мл, 130 ммоль). Полученный раствор нагревали при 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и затем выливали в делительную воронку, содержащую воду, и экстрагировали смесью 25% изопропанола/хлороформ. Органические слои объединяли и сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (2S,3R,4S,5R)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-4-метилтетрагидрофуран-2,3,4-триола в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS: 503/505 (M+1/M+3).
Стадия 7: В сосуде 4-хлор-7H-пирроло[2,3-d]пиримидин (405 мг, 2,64 ммоль) растворяли в DMF (8 мл). Затем добавляли гидрид натрия (106 мг, 2,64 ммоль). Смесь перемешивали при комнатной температуре в атмосфере аргона в течение 75 минут. Одновременно, в другой сосуд добавляли раствор неочищенного (3R,4S,5R)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-4-метилтетрагидрофуран-2,3,4-триола (532 мг, 1,06 ммоль) в ацетонитриле (18 мл). Затем добавляли три-н-бутилфосфин (0,45 мл, 1,80 ммоль) с последующим добавлением 1,1'-(азодикарбонил)дипиперидина (400 мг, 1,58 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 25 минут, затем добавляли дополнительное количество 1,1'-(азодикарбонил)дипиперидина (130 мг). Через 20 минут снова добавляли три-н-бутилфосфин (0,5 мл). Эту смесь перемешивали при комнатной температуре еще в течение 15 мин. Затем раствор, содержащий 4-хлор-7H-пирроло[2,3-d]пиримидин и гидрид натрия, набирали в шприц и добавляли к раствору, изначально содержащему (3R,4S,5R)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-4-метилтетрагидрофуран-2,3,4-триол. Эту объединенную реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Реакционную смесь затем выливали в делительную воронку, содержащую воду, и экстрагировали при помощи EtOAc. Органические слои объединяли, промывали водой два раза и затем насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (20-90% EtOAc/гексан) с получением (2R,3S,4R,5R)-2-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диола в виде твердого вещества, которое использовали непосредственно на следующей стадии. MS: 638/640 (M+1/M+3).
Стадия 8: В сосуд добавляли раствор (2R,3S,4R,5R)-2-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диола (114 мг, 0,178 ммоль) в аммиаке (7 M в MeOH, 10 мл, 70,0 ммоль) и диоксане (2 мл). Этот раствор нагревали при 130°C в течение 4 ч в микроволновом реакторе. Весь раствор затем концентрировали при пониженном давлении с получением (2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-3-метилтетрагидрофуран-3,4-диола, который использовали на следующей стадии без дополнительной очистки. MS: 619/621 (M+1/M+3).
Стадия 9: В колбу, содержащую неочищенный (2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-3-метилтетрагидрофуран-3,4-диол (110 мг, 0,178 ммоль), добавляли DCM (9 мл). Затем добавляли трифторуксусную кислоту (1 мл, 12,98 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли TFA (5 мл) и реакционную смесь перемешивали при комнатной температуре еще в течение 1 ч. Добавляли TFA (2 мл) и реакционную смесь кипятили с обратным холодильником в течение 7 ч. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении. Остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% TFA модификатора) с получением (2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диола в виде твердой TFA соли. MS: 499/501 (M+1/M+3). 1H-ЯМР (600 МГц, DMSO-d6) δ 8,64 (с, 1H), 8,39 (с, 1H), 7,74 (д, J=3,7 Гц, 1H), 7,71 (д, J=8,2 Гц, 1H), 7,39 (с, 1H), 7,25 (д, J=8,0 Гц, 1H), 7,00 (д, J=3,7 Гц, 1H), 6,10 (д, J=7,7 Гц, 1H), 4,31 (д, J=7,7 Гц, 1H), 3,81 (дд, J=11,4, 2,9 Гц, 1H), 2,81 (ддд, J=13,8, 9,2, 4,7 Гц, 1H), 2,67 (дт, J=13,8, 8,1 Гц, 1H), 2,07-1,99 (м, 1H), 1,88-1,81 (м, 1H), 1,20 (с, 3H).
Пример 15
(1S,2R,3S,5R)-3-[2-(2-амино-3-бром-7-хинолинил)этил]-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-1,2-циклопентандиол
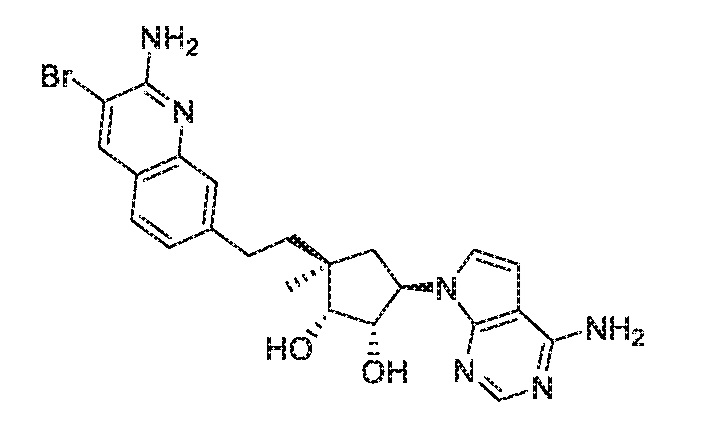
Стадия 1: К перемешиваемому раствору (3a'R,4'R,6'S,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ола (3,8 г, 16 ммоль) в DCM (80 мл) добавляли пиридин (6,45 мл, 80 ммоль). Смесь охлаждали до 0°C и обрабатывали трифторметансульфоновым ангидридом в DCM (23,92 мл, 23,92 ммоль) в течение 10 мин. Смесь перемешивали при 0°C в течение 30 минут и обрабатывали водой (5 мл). Органические слои отделяли и промывали насыщенным солевым раствором. Органические слои объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении. К остатку добавляли толуол (10 мл) и концентрировали с получением (3a'R,4'S,6'R,6a'R)-6'-метил-6'-винилтетрагидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ил трифторметансульфоната в виде масла. Остаток использовали на следующей стадии без дополнительной очистки.
Стадия 2: К перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (2,94 г, 19,1 ммоль) в DMF (35 мл) при 0°C добавляли гидрид натрия (0,893 г, 22,3 ммоль). Смесь перемешивали при этой температуре в течение 30 минут. В отдельной колбе (3a'R,4'S,6'R,6a'R)-6'-метил-6'-винилтетрагидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ил трифторметансульфонат (5,90 г, 15,9 ммоль) растворяли в DMF (10 мл). Этот раствор медленно добавляли к раствору натриевой соли в течение 10 минут. Полученную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь охлаждали до 0°C и обрабатывали водой. Смесь разбавляли при помощи EtOAc (500 мл) и промывали водой (3x) и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, концентрировали и очищали колоночной хроматографией на диоксиде кремния (0-20% EtOAc/DCM) с получением 4-хлор-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидина. MS: 374 (M+1). 1H-ЯМР (500 МГц, DMSO-d6) δ 8,66 (с, 1H), 8,03 (д, J=3,2 Гц, 1H), 6,73 (д, J=3,2 Гц, 1H), 6,00 (дд, J=17,4, 10,7 Гц, 1H), 5,32-5,26 (м, 1H), 5,10-4,99 (м, 3H), 4,63 (д, J=7,5 Гц, 1H), 2,46 (м, 1H), 2,08 (дд, J=12,7, 7,2 Гц, 1H), 1,75-1,71 (м, 2H), 1,63-1,28 (м, 8H), 1,17 (с, 3H).
Стадия 3: К перемешиваемому раствору 4-хлор-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидина (910 мг, 2,43 ммоль) в 1,4-диоксане (4 мл) добавляли гидроксид аммония (28%, 4 мл) в микроволновом сосуде. Реакционную смесь нагревали до 160°C в течение 5 ч в микроволновом реакторе. Смесь охлаждали до комнатной температуры и разбавляли EtOAc и водой. Водный слой экстрагировали при помощи EtOAc. Органические слои объединяли и промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин-4-амина. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. MS: 355 (M+1). 1H ЯМР (500 МГц, DMSO-d6) δ 8,06 (с, 1H), 7,37 (д, J=2,8 Гц, 1H), 6,99 (с, 2H), 6,57 (д, J=2,8 Гц, 1H), 5,98 (дд, J=17,4, 10,7 Гц, 1H), 5,18-4,93 (м, 4H), 4,59 (д, J=7,6 Гц, 1H), 2,37 (дд, J=12,3 Гц, 1H), 2,00-1,95 (м, 1H), 1,74-1,28 (м, 10H), 1,14 (с, 3H).
Стадия 4: К 7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин-4-амину (300 мг, 0,846 ммоль) добавляли 9-BBN (0,5 M в THF, 6,77 мл, 3,39 ммоль). Смесь нагревали до 50°C в течение 1 ч, охлаждали до комнатной температуры, обрабатывали трехосновным фосфатом калия (898 мг, 4,23 ммоль) и водой (0,9 мл) и оставляли для перемешивания в течение 30 минут. Смесь обрабатывали THF (1 мл), 3-бром-7-иодхинолин-2-амином (266 мг, 0,762 ммоль) и PdCl2(dppf) (61,9 мг, 0,085 ммоль), продували азотом в течение 5 минут и нагревали до 50°C в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли при помощи EtOAc и промывали водой и насыщенным солевым раствором. Органические слои объединяли и сушили над сульфатом натрия, концентрировали и очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением 7-(2-((3a'S,4'R,6'S,6a'R)-4'-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6'-метилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)этил)-3-бромхинолин-2-амина в виде твердого вещества. MS: 577/579 (M+1/M+3). 1H-ЯМР (500 МГц, DMSO-d6) δ 8,32 (с, 1H), 8,06 (с, 1H), 7,57 (д, J=8,1 Гц, 1H), 7,38 (с, 1H), 7,32 (с, 1H), 7,12 (д, J=8,1 Гц, 1H), 6,99 (с, 2H), 6,57 (с, 3H), 5,14-5,07 (м, 1H), 4,98-4,94 (м, 1H), 4,52 (д, J=7,5 Гц, 1H), 2,75-2,65 (м, 2H), 2,20 (дд J=12,4 Гц, 1H), 2,05-2,00 (м, 1H), 1,78-1,28 (м, 12H), 1,14 (с, 3H).
Стадия 5: К 7-(2-((3a'S,4'R,6'S,6a'R)-4'-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6'-метилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)этил)-3-бромхинолин-2-амину (320 мг, 0,399 ммоль) добавляли HCl (4M в MeOH, 10 мл). Смесь перемешивали в течение ночи и затем нагревали при 50°C в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 0,1% TFA модификатора) с получением (1S,2R,3S,5R)-3-[2-(2-амино-3-бром-7-хинолинил)этил]-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-1,2-циклопентандиола в виде TFA соли. MS: 497/499 (M+1/M+3). 1H ЯМР (500 МГц, DMSO-d6) δ 9,17 (шир.с, 1H), 8,72 (с, 1H), 8,65 (шир.с, 1H), 8,37 (с, 1H), 8,27 (шир.с, 2H), 7,76 (д, J=8,1 Гц, 1H), 7,70 (д, J=3,2 Гц, 1H), 7,46 (с, 1H), 7,34 (д, J=8,1 Гц, 1H), 6,94 (д, J=3,1 Гц, 1H), 5,00 (дд J=8,8 Гц, 1H), 4,89 (шир.с, 2H), 4,39-4,34 (м, 1H), 3,79 (д, J=5,9 Гц, 1H), 2,85-2,68 (м, 2H), 1,96-1,70 (м, 4H), 1,12 (с, 3H).
Пример 16
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол
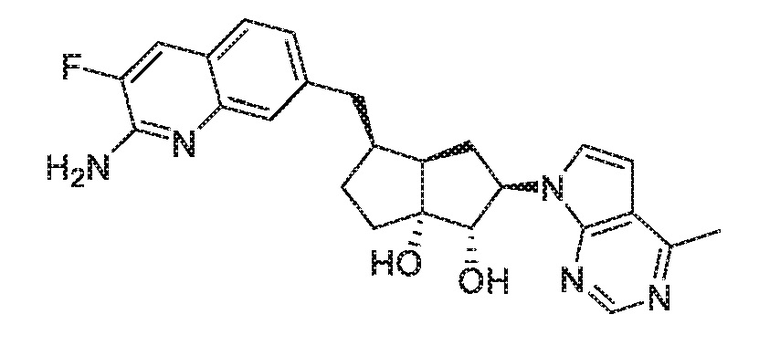
Стадия 1: В колбу, содержащую (3aS,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ол (6,0 г, 18 ммоль), добавляли DCM (200 мл) с последующим добавлением периодинана Десса-Мартина (10,25 г, 23,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили 1:1 насыщенным водным раствором бикарбоната натрия: насыщенным водным раствором тиосульфата натрия (160 мл) при интенсивном перемешивании. Органический слой отделяли на фазовом разделителе и концентрировали при пониженном давлении. Неочищенный (3aS,4R,5aS,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-6H-пенталено[1,6a-d][1,3]диоксол-6-он использовали непосредственно в следующей реакции.
Стадия 2: В колбу добавляли метилтрифенилфосфоний бромид (21,91 г, 60,1 ммоль) с последующим добавлением THF (100 мл) в атмосфере аргона. Смесь охлаждали до 0°C и затем добавляли nBuLi (22 мл, 2,5M, 55 ммоль). Реакционную смесь извлекали из охлаждающей бани и оставляли для интенсивного перемешивания при комнатной температуре в атмосфере аргона в течение 30 минут. Затем реакционную смесь снова охлаждали до 0°C и добавляли раствор (3aS,4R,5aS,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-6H-пенталено[1,6a-d][1,3]диоксол-6-она (5,96 г, 18,2 ммоль) в THF (100 мл). После добавления реакционную смесь извлекали из охлаждающей бани и оставляли для перемешивания при комнатной температуре в течение 70 мин. Реакционную смесь выливали в делительную воронку, содержащую EtOAc и насыщенный хлорид аммония. Водный слой отделяли и промывали два раза при помощи EtOAc. Органические слои объединяли, сушили над сульфатом магния, фильтровали через Целит® и концентрировали при пониженном давлении. Неочищенное вещество подвергали колоночной хроматографии на диоксиде кремния (10-100% EtOAc/гексан) с получением 7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидина. MS: 326 (M+1). 1H ЯМР (600 МГц, CDCl3) δ 8,76 (с, 1H), 7,24 (д, J=3,4 Гц, 1H), 6,55 (д, J=3,4 Гц, 1H), 5,16-5,10 (м, 1H), 5,00-4,97 (м, 1H), 4,87 (с, 1H), 4,80 (д, J=5,3 Гц, 1H), 3,08 (т, J=9,1 Гц, 1H), 2,73 (с, 3H), 2,71-2,61 (м, 2H), 2,58-2,51 (м, 1H), 2,32-2,24 (м, 2H), 2,15-2,08 (м, 1H), 1,58 (с, 3H), 1,36 (с, 3H).
Стадия 3: В колбу, содержащую 7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин (1,22 г, 3,7 ммоль), добавляли THF (20 мл). Затем добавляли раствор 9-BBN (23,0 мл, 0,5M в THF, 11,5 ммоль) в атмосфере аргона. Реакционную смесь затем перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем добавляли трифосфат калия (9,5 мл, 2M в воде, 19 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли раствор 7-бром-3-фторхинолин-2-амина (1,345 г, 5,60 ммоль) и метансульфонато(2-дициклогексилфосфино-2',6'-диизопропокси-1,1'-бифенил)(2'-метиламино-1,1'-бифенил-2-ил)палладий(II) (0,312 г, 0,373 ммоль) в THF (10 мл) и реакционную смесь нагревали до 50°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Неочищенное вещество очищали колоночной хроматографией на диоксиде кремния (80-100% EtOAc/гексан до 100% 3:1 EtOAc:EtOH), затем хиральной СФХ (OJ-H колонка, 30% MeOH водн./0,1% NH4OH в CO2) с получением 7-(((3aS,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3-фторхинолин-2-амина. MS: 488 (M+1).
Стадия 4: В колбу, содержащую 7-(((3aS,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3-фторхинолин-2-амин (2,03 г, 4,17 ммоль), добавляли DCM (50 мл), воду (16 мл) и трифторуксусную кислоту (40 мл, 520 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем концентрировали при пониженном давлении и очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатора) с получением (1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диола. MS: 448 (M+1). 1H ЯМР (600 МГц, DMSO) δ 8,60 (с, 1H), 7,82 (д, J=3,6 Гц, 1H), 7,75 (д, J=11,8 Гц, 1H), 7,55 (д, J=8,2 Гц, 1H), 7,29 (с, 1H), 7,10 (д, J=8,6 Гц, 1H), 6,71 (д, J=3,6 Гц, 1H), 6,67 (с, 2H), 4,84-4,74 (м, 2H), 4,67 (с, 1H), 3,95 (дд, J=10,2, 7,4 Гц, 1H), 2,76-2,66 (м, 2H), 2,65 (с, 3H), 2,49-2,42 (м, 1H), 2,18 (кв., J=9,4 Гц, 1H), 1,88-1,78 (м, 3H), 1,71-1,64 (м, 1H), 1,64-1,55 (м, 1H), 1,49-1,43 (м, 1H).
Примеры 17-18: Примеры 17-18 в Таблице 7 синтезировали таким же способом, как описано в примере 16, заменяя 7-бром-3-фторхинолин-2-амин подходящим арил-галогенидом на стадии 3. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
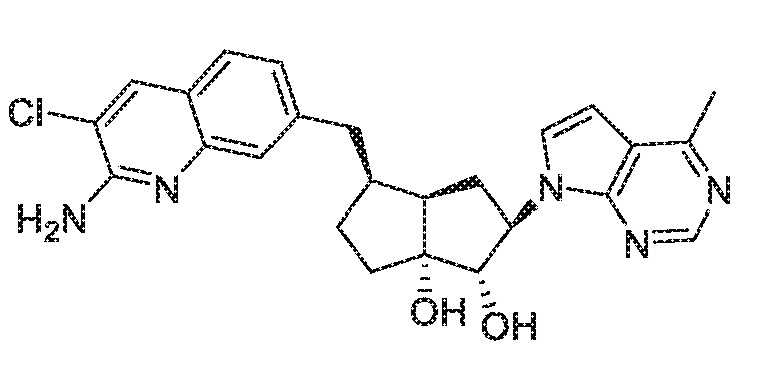
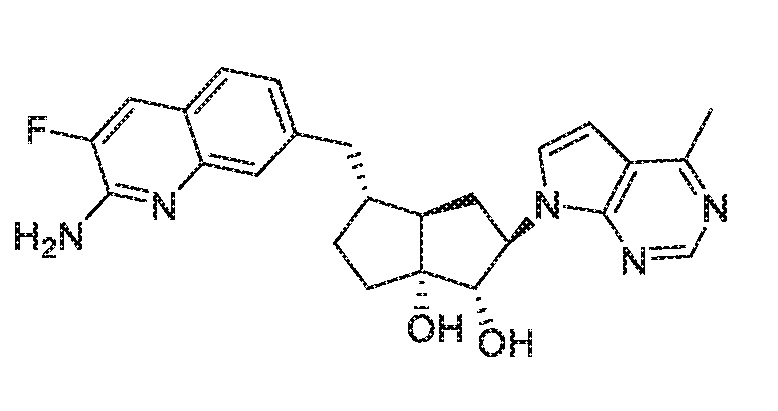
Примеры 19: Пример 19 в Таблице 8 синтезировали таким же способом, как описано в примере 16, заменяя стадию 3 стадией 1 в примере 25 и заменяя 7-бром-3,5-дифторхинолин-2-амин подходящим арил-галогенидом. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
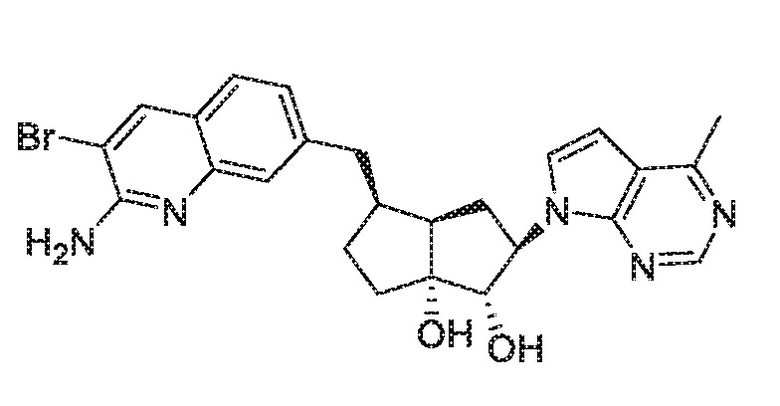
Примеры 20-24: Примеры 20-24 в Таблице 9 синтезировали таким же способом, как описано на стадиях 3-4 Примера 16, заменяя 7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин подходящим экзо-олефином, а 7-бром-3-фторхинолин-2-амин подходящим арил-галогенидом, и затем осуществляя хиральное разделение при помощи СФХ, при необходимости, на основании замещенного экзо-олефина. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
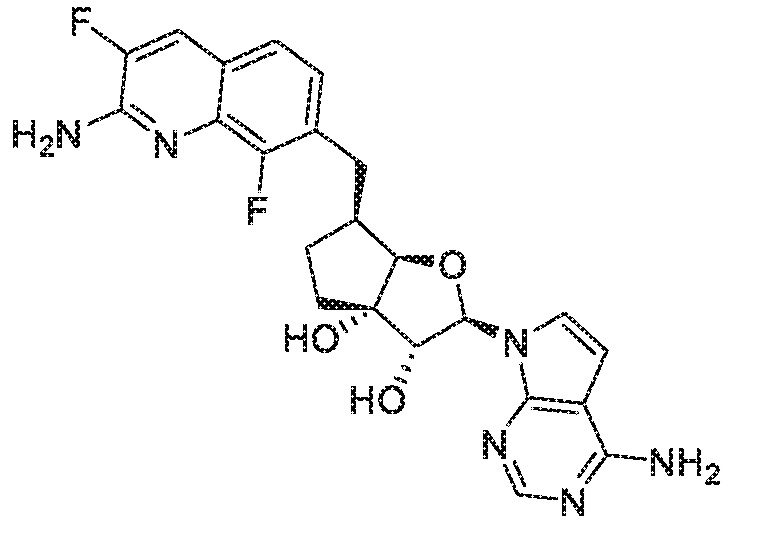
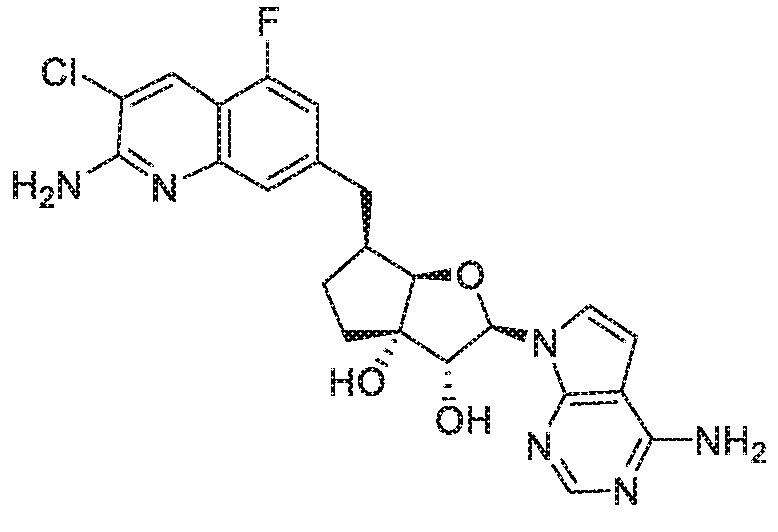
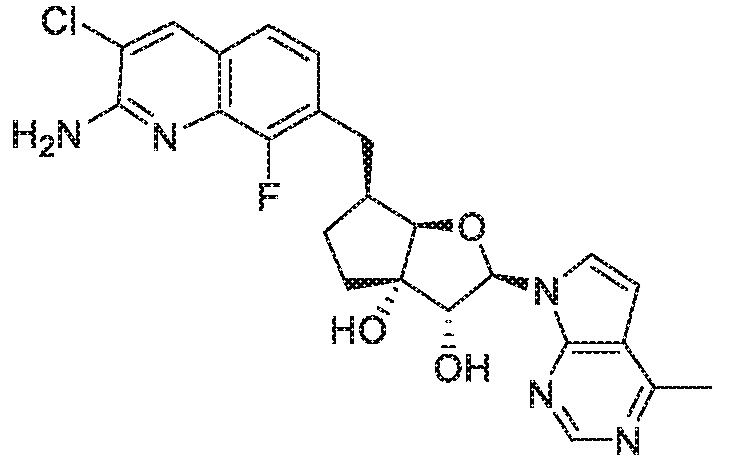
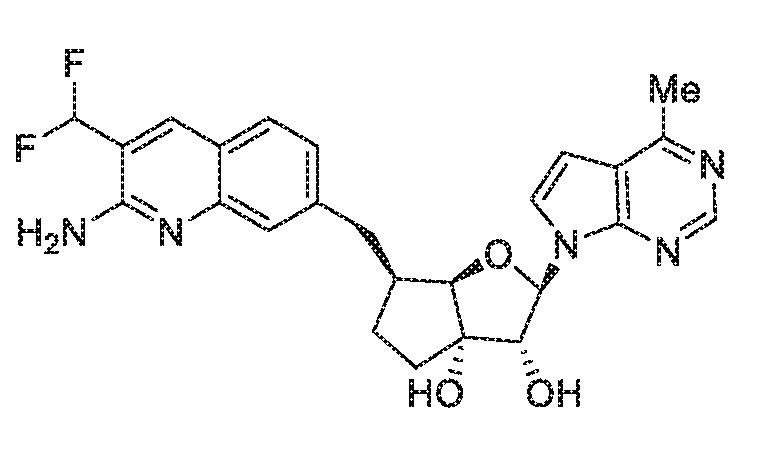
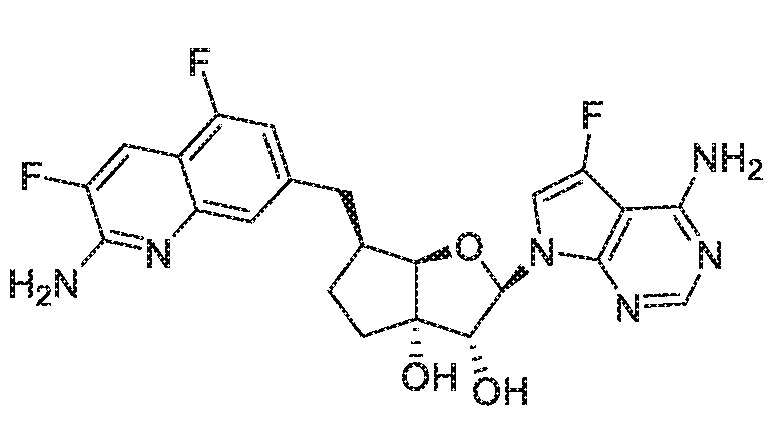
Пример 25
(2R,3R,3aS,6S,6aR)-6-((6-амино-7-фтор-1,5-нафтиридин-3-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол, 3HCl
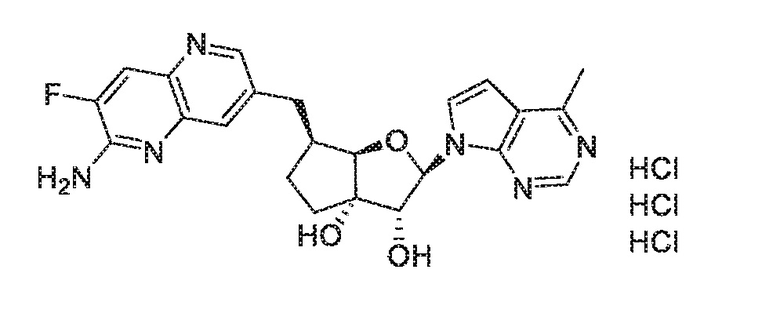
Стадия 1: В сосуд, содержащий 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин (0,070 г, 0,214 ммоль), добавляли THF (2,047 мл) с последующим добавлением 9-BBN (0,5 M в THF, 1,37 мл, 0,684 ммоль). Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем добавляли водный раствор трифосфата калия (1 M, 1,155 мл, 1,155 ммоль) и реакционную смесь интенсивно перемешивали при комнатной температуре в течение 1 ч. Затем добавляли раствор 7-бром-3-фтор-1,5-нафтиридин-2-амина (0,078 г, 0,321 ммоль) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (0,016 г, 0,021 ммоль) в THF (1,01 мл) и реакционную смесь нагревали до 50°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в делительную воронку, содержащую воду и EtOAc. После экстрагирования водный слой промывали при помощи EtOAc (x2). Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Вещество очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% TFA для модификатора) с получением 7-(((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-3-фтор-1,5-нафтиридин-2-амина в виде TFA соли. MS: 491 (M+1).
Стадия 2: К раствору 7-(((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-3-фтор-1,5-нафтиридин-2-амина (0,117 г, 0,239 ммоль) в MeOH (11,9 мл) добавляли по каплям хлористоводородную кислоту (2 M, 11,9 мл, 23,9 ммоль). Реакционную смесь перемешивали в течение 90 минут при комнатной температуре. Температуру повышали до 40°C и смесь оставляли для перемешивания в течение 18 ч. Реакционную смесь распределяли в два отдельных сосуда и концентрировали при пониженном давлении с получением (2R,3R,3aS,6S,6aR)-6-((6-амино-7-фтор-1,5-нафтиридин-3-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола, 3HCl. MS: 451 (M+1). 1H ЯМР (499 МГц, DMSO-d6) δ 9,19 (с, 1H), 8,66 (д, J=1,4 Гц, 1H), 8,34 (д, J=3,8 Гц, 1H), 8,20 (д, J=10,8 Гц, 1H), 8,10 (с, 1H), 7,32 (д, J=3,8 Гц, 1H), 6,12 (д, J=8,2 Гц, 1H), 4,21 (д, J=8,2 Гц, 1H), 4,10 (д, J=5,9 Гц, 1H), 3,02-2,91 (м, 3H), 2,87-2,80 (м, 1H), 2,45-2,35 (м, 1H), 2,05-1,95 (м, 1H), 1,89-1,79 (м, 1H), 1,78-1,70 (м, 1H), 1,62-1,52 (м, 1H).
Примеры 26-29: Примеры 26-29 в Таблице 10 синтезировали таким же способом, как описано на стадиях 1-2 Примера 25, заменяя 7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин подходящим экзо-олефином, а 7-бром-3-фторхинолин-2-амин подходящим арил-галогенидом и затем осуществляя хиральное разделение при помощи СФХ, при необходимости, на основании используемого экзо-олефина. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
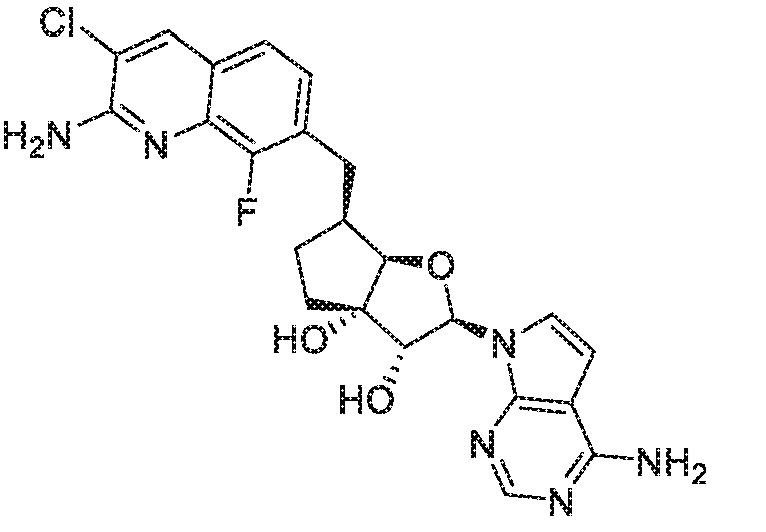
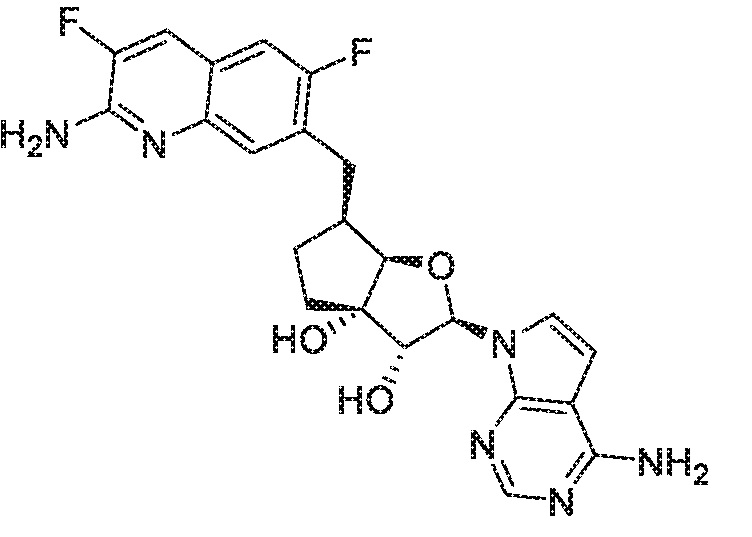
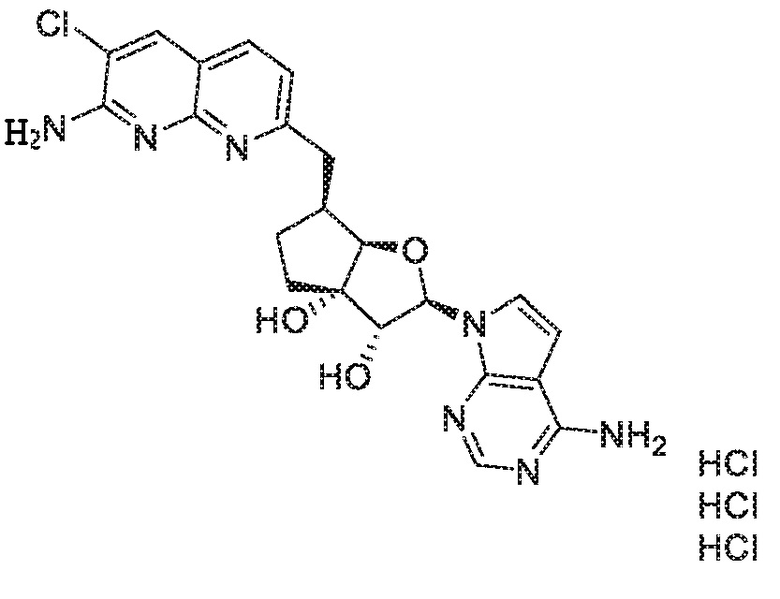
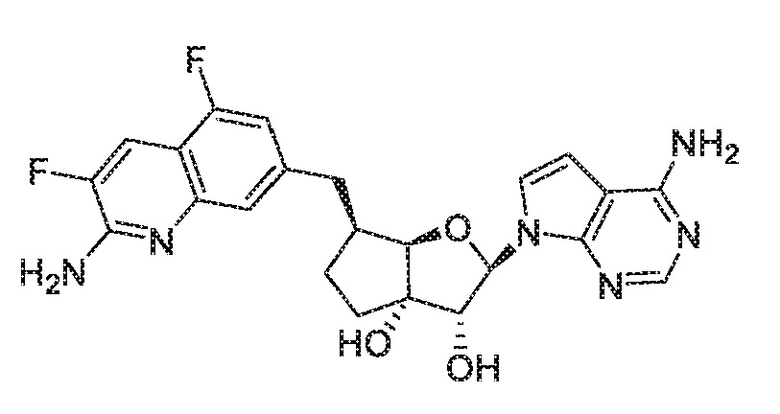
Пример 30
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол
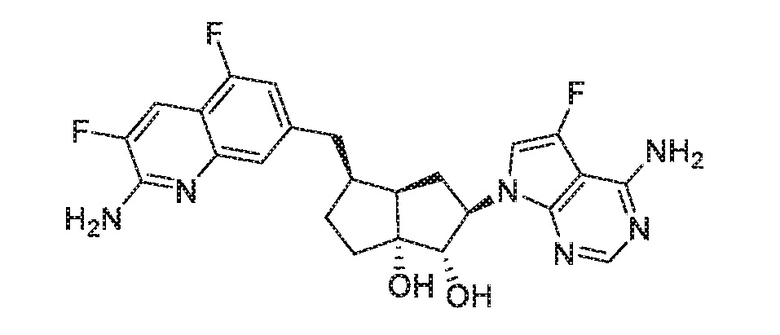
Стадия 1: В колбу, содержащую 1,1'-бис(дифенилфосфино)ферроцен (1,6 г, 2,8 ммоль), трет-бутоксид натрия (0,96 г, 8,4 ммоль), 4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин (1,4 г, 8,4 ммоль) и димер аллилпалладийхлорида (0,42 г, 1,1 ммоль) добавляли аргон-дегазированный THF (55 мл). Эту смесь перемешивали при комнатной температуре в течение 15 минут. Затем добавляли раствор (2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-илацетата (2,47 г, 5,61 ммоль) в дегазированном THF (23 мл). Реакционную смесь перемешивали в атмосфере аргона при 40°C в течение 3 ч. Смесь гасили водой и экстрагировали при помощи EtOAc (2x). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-15% EtOAc/гексан) с получением 4-хлор-5-фтор-7-((2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ил)-7H-пирроло[2,3-d]пиримидина. MS: 552 (M+1).
Стадия 2: В колбу, содержащую раствор 4-хлор-5-фтор-7-((2R,6S,6aS)-6-((трифенилсилил)окси)-1,2,4,5,6,6a-гексагидропентален-2-ил)-7H-пирроло[2,3-d]пиримидина (1,36 г, 2,46 ммоль) в THF (59 мл), добавляли воду (29 мл). Раствор охлаждали до 0°C и добавляли NMO (0,58 г, 4,9 ммоль) и оксид осмия (VIII) (0,75 мл, 4% в воде, 0,12 ммоль). Ледяную баню оставляли нагреваться естественным образом, перемешивая реакционную смесь в течение ночи. Реакцию гасили насыщенным водным раствором сульфита натрия (40 мл) и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь выливали в делительную воронку, содержащую воду и EtOAc. После разделения водный слой промывали два раза EtOAc и затем один раз смесью 3:1 хлороформ:IPA. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (1S,2R,3aR,4S,6aR)-2-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((трифенилсилил)окси)гексагидропентален-1,6a(1H)-диола. Это вещество использовали неочищенным непосредственно на следующей стадии без дополнительной очистки.
Стадия 3: В колбу, содержащую (1S,2R,3aR,4S,6aR)-2-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((трифенилсилил)окси)гексагидропентален-1,6a(1H)-диол (1,4 г, 2,4 ммоль), растворенный в ацетоне (24 мл), в атмосфере аргона добавляли серную кислоту (0,126 мл, 2,36 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь затем охлаждали до 0°C и гасили гидроксидом натрия (0,3 мл, 10 M в воде, 3 ммоль). Вещество разбавляли водой (20 мл) и экстрагировали при помощи EtOAc (3x) и объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (50% EtOAc/гексан) с получением (3aS,4R,5aR,6S,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ола. MS: 368 (M+1). 1H ЯМР (600 МГц, CDCl3) δ 8,60 (с, 1H), 7,05 (д, J=2,6 Гц, 1H), 4,91-4,85 (м, 1H), 4,70 (д, J=7,2 Гц, 1H), 4,11-4,08 (м, 1H), 2,59-2,52 (м, 2H), 2,41-2,34 (м, 1H), 2,25-2,19 (м, 1H), 2,13-2,06 (м, 1H), 2,06-1,93 (м, 2H), 1,59 (с, 3H), 1,38 (с, 3H).
Стадия 4: К раствору (3aS,4R,5aR,6S,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ола (270 мг, 0,734 ммоль) в безводном DCM (5 мл) при 0°C в атмосфере азота добавляли периодинан Десса-Мартина (374 мг, 0,881 ммоль) одной порцией. Смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили насыщенным водным раствором бикарбоната натрия (10 мл) и 1 г Na2S2O3. Полученную смесь перемешивали в течение 10 минут при комнатной температуре. Органический слой отделяли и водную фазу экстрагировали при помощи DCM (10 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (10 мл), сушили безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/гексан) с получением (3aS,4R,5aS,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-6H-пенталено[1,6a-d][1,3]диоксол-6-она. MS: 366 (M+1).
Стадия 5: В сосуд добавляли метилтрифенилфосфоний бромид (781 мг, 2,14 ммоль) с последующим добавлением THF (3,3 мл) в атмосфере аргона. Смесь охлаждали до 0°C и затем добавляли по каплям nBuLi (650 мкл, 2,5 M, 1,624 ммоль). Реакционную смесь извлекали из ледяной бани и оставляли для интенсивного перемешивания при комнатной температуре в течение 30 минут. Затем реакционную смесь снова охлаждали до 0°C и добавляли по каплям раствор (3aS,4R,5aS,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-6H-пенталено[1,6a-d][1,3]диоксол-6-она (238 мг, 0,650 ммоль) в THF (3,3 мл). Реакционную смесь извлекали из ледяной бани и оставляли для перемешивания при комнатной температуре в течение 70 минут. Реакцию гасили насыщенным водным раствором хлорида аммония (10 мл) при 0°C. Смесь экстрагировали при помощи EtOAc (2 × 10 мл) и объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/гексан) с получением 4-хлор-7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-5-фтор-7H-пирроло[2,3-d]пиримидина. MS: 364 (M+1).
Стадия 6: В продутый аргоном сосуд, содержащий 4-хлор-7-((3aS,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-4-ил)-5-фтор-7H-пирроло[2,3-d]пиримидин (201,6 мг, 0,554 ммоль), добавляли THF (4 мл). Затем добавляли раствор 9-BBN (3,4 мл, 1,700 ммоль, 0,5 M в THF). Реакционную смесь перемешивали в течение ночи при комнатной температуре под баллоном аргона. Затем добавляли трифосфат калия (1,4 мл, 2,80 ммоль, 2 M водн.) и реакционную смесь интенсивно перемешивали в течение ~35 мин. Затем добавляли трет-бутоксид калия (0,1 мл, 0,100 ммоль), затем быстро добавляли раствор хлор[ди(1-адамантил)-N-бутилфосфин)-2-(2-аминобифенил)] палладия(II) (60 мг, 0,085 ммоль) и 7-бром-3,5-дифторхинолин-2-амина (215 мг, 0,831 ммоль) в THF (4 мл). Реакционную смесь нагревали до 50 градусов в атмосфере аргона в течение 4 часов 40 мин. Реакционную смесь охлаждали до комнатной температуры и разбавляли DCM и водой. Смесь пропускали через фазовый разделитель. Органический слой концентрировали при пониженном давлении и неочищенное вещество подвергали флэш-хроматографии на силикагеле (20-40-60% EtOAc/гексан), затем хиральной СФХ (OJ-H колонка, 15% MeOH водн./0,1% NH4OH модификатора в CO2) с получением 7-(((3aS,4R,5aR,6S,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3,5-дифторхинолин-2-амина в виде пенистого вещества.
Стадия 7: В сосуд, содержащий 7-(((3aS,4R,5aR,6S,8aR)-4-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3,5-дифторхинолин-2-амин (21,4 мг, 0,039 ммоль), добавляли аммиак (l мл, 7 M в MeOH, 7 ммоль). Сосуд закрывали и реакционную смесь нагревали при 140°C в микроволновом реакторе в течение 5 ч. Смесь затем концентрировали при пониженном давлении с получением 7-(((3aS,4R,5aR,6S,8aR)-4-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3,5-дифторхинолин-2-амина, который использовали неочищенным без дополнительной очистки в следующей реакции.
Стадия 8: В сосуд, содержащий 7-(((3aS,4R,5aR,6S,8aR)-4-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-ил)метил)-3,5-дифторхинолин-2-амин (21 мг, 0,039 ммоль), добавляли DCM (600 мкл), воду (190 мкл) и затем TFA (454 мкл, 5,89 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь затем непосредственно концентрировали при пониженном давлении. Остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода градиент с 0,1% NH4OH модификатора) с получением (1S,2R,3aR,4S,6aR)-4-((2-амино-3,5-дифторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диола. MS: 485 (M+1). 1H ЯМР (600 МГц, DMSO) δ 8,69 (с, 2H), 8,29 (с, 1H), 7,98 (д, J=11,1 Гц, 1H), 7,87 (с, 1H), 7,68 (с, 2H), 7,19 (с, 1H), 7,06 (д, J=11,0 Гц, 1H), 4,84-4,77 (м, 1H), 3,76 (д, J=10,3 Гц, 1H), 2,79-2,66 (м, 2H), 2,49-2,42 (м, 1H), 2,16 (кв., J=9,0 Гц, 1H), 1,82 (дд, J=12,2, 5,8 Гц, 1H), 1,78-1,69 (м, 2H), 1,69-1,63 (м, 1H), 1,63-1,54 (м, 1H), 1,48-1,41 (м, 1H).
Примеры 31-34: Примеры 31-34 в Таблице 11 синтезировали таким же способом, как описано в примере 30, заменяя 4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин подходящим нуклеооснованием на стадии 1, и заменяя стадию 6 стадией 3 в примере 16, где используют подходящий арил-галогенид для замены 7-бром-3,5-дифторхинолин-2-амина. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
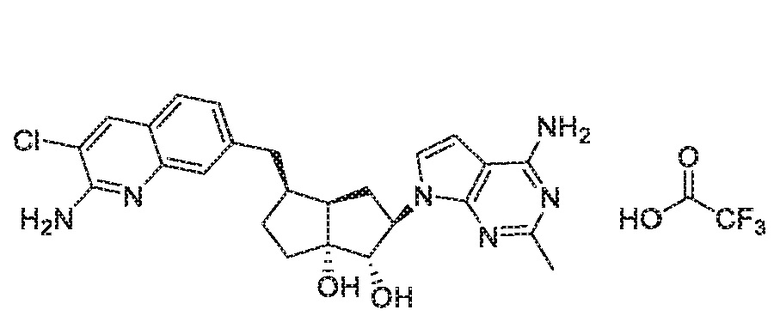
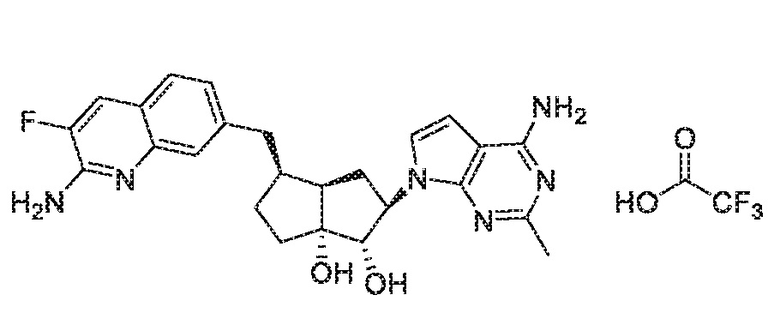
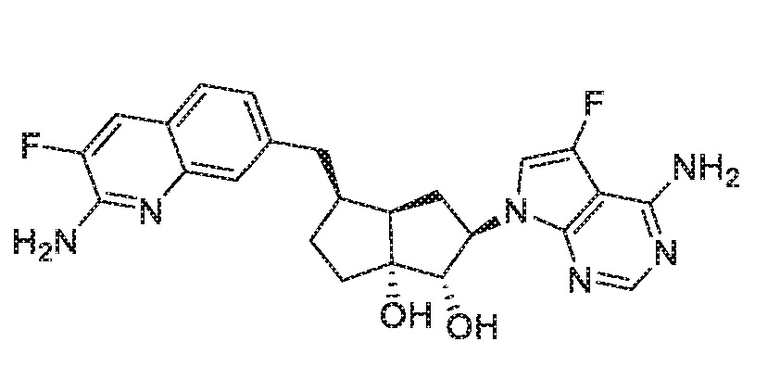
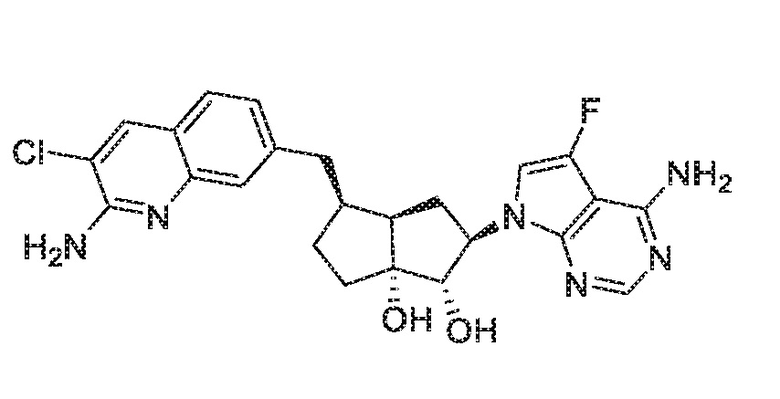
Примеры 35-42: Примеры 35-42 в Таблице 12 синтезировали таким же способом, как описано в примере 30, заменяя 4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин подходящим нуклеооснованием на стадии 1 и заменяя стадию 6 стадией 1 в примере 25, где используют подходящий арил-галогенид для замены 7-бром-3,5-дифторхинолин-2-амина. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
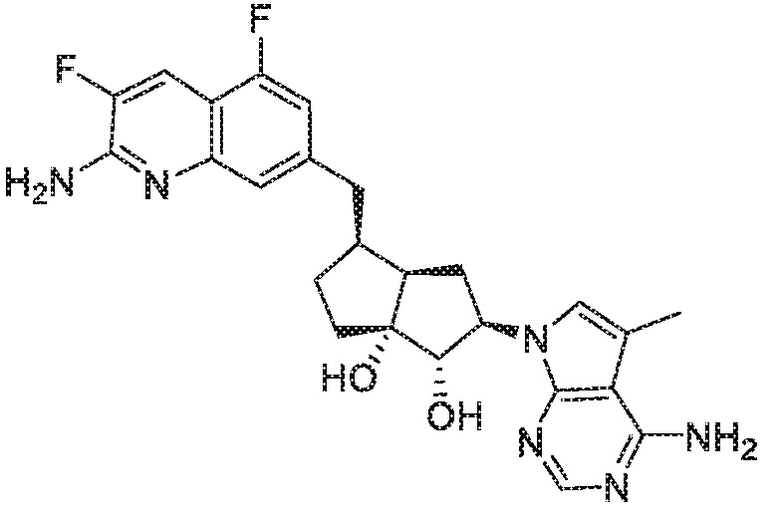
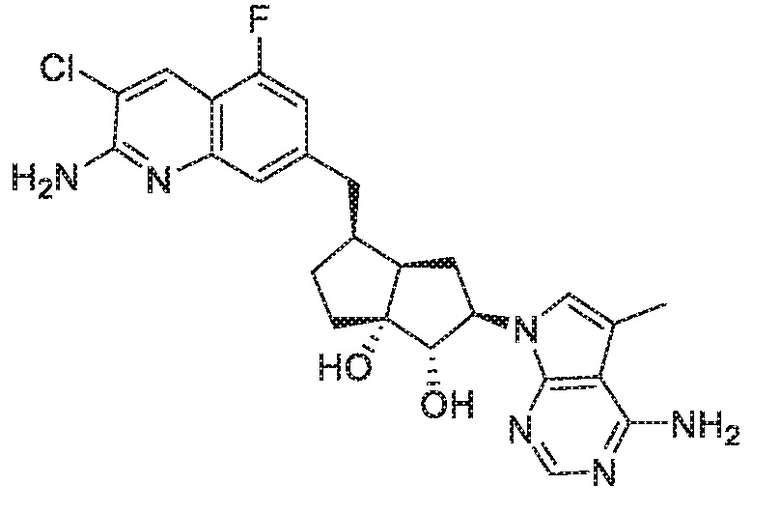
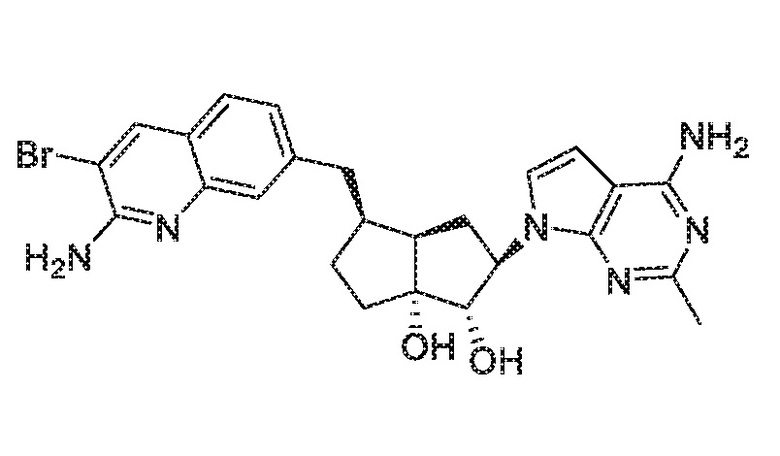
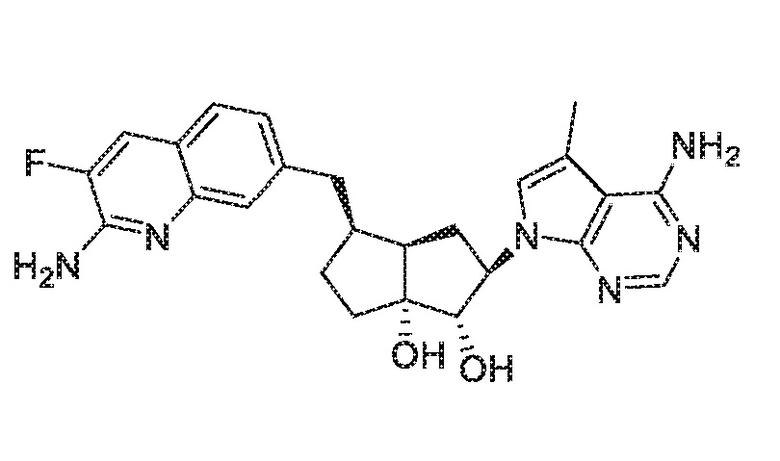
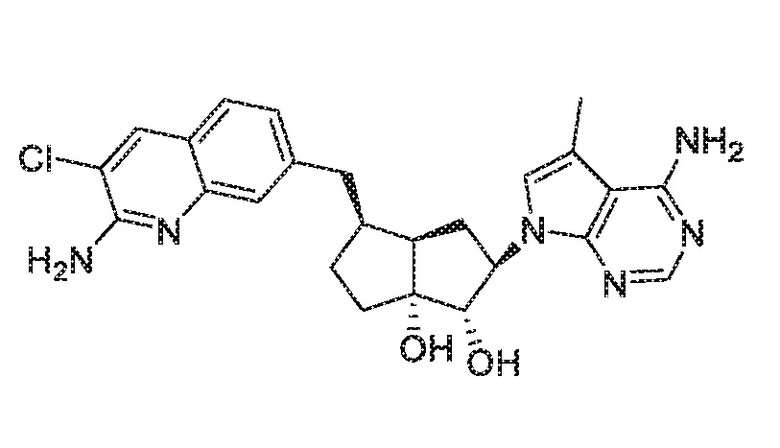
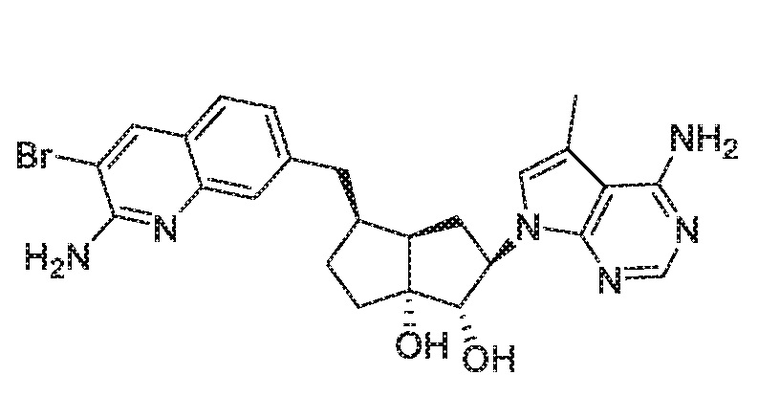
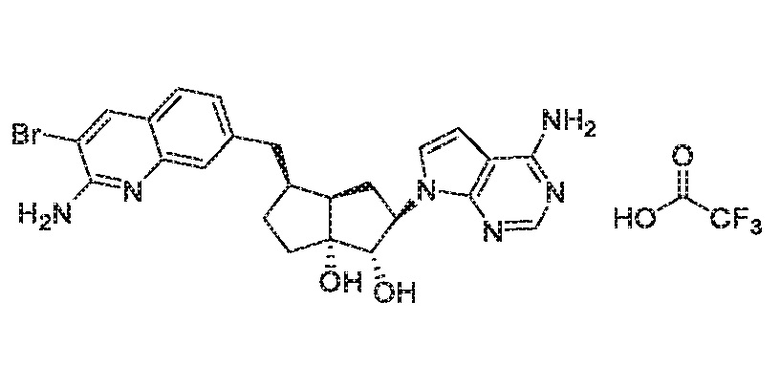
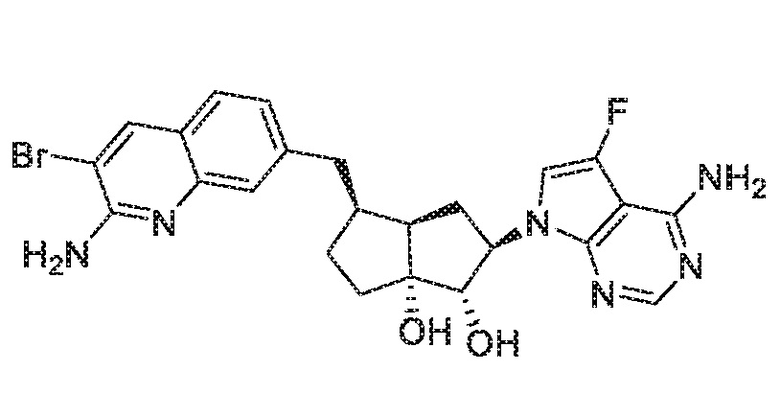
Примеры 43-44: Примеры 43-44 в Таблице 13 синтезировали с применением протоколов, описанных на стадиях 6-8 примера 30, заменяя 7-бром-3,5-дифторхинолин-2-амин подходящим арил-галогенидом на стадии 6. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
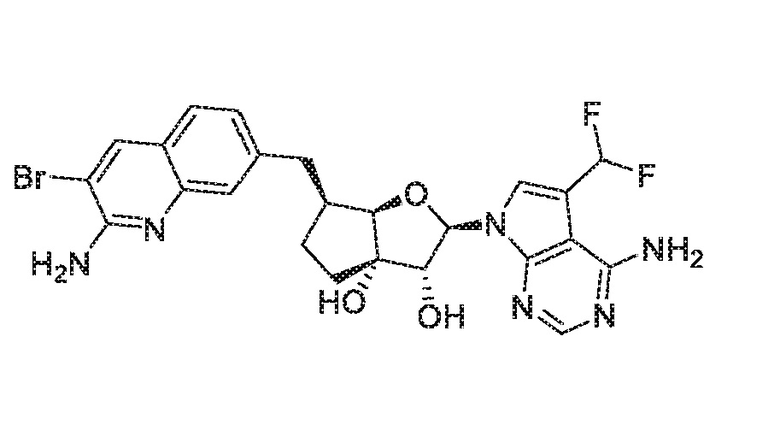
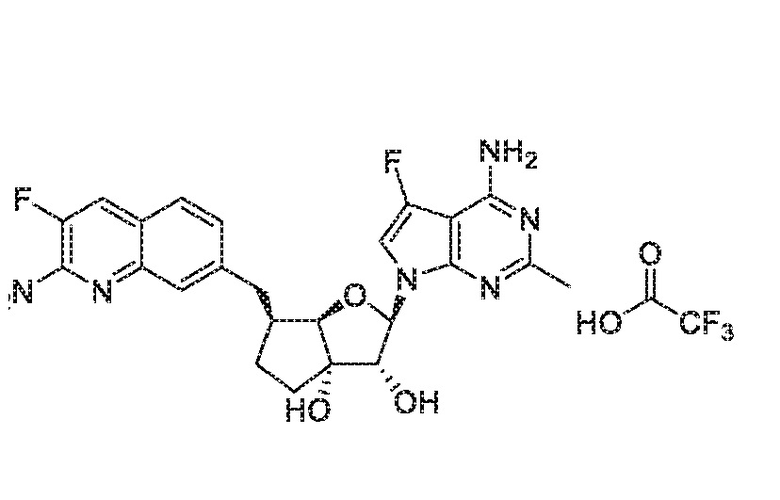
Пример 45
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
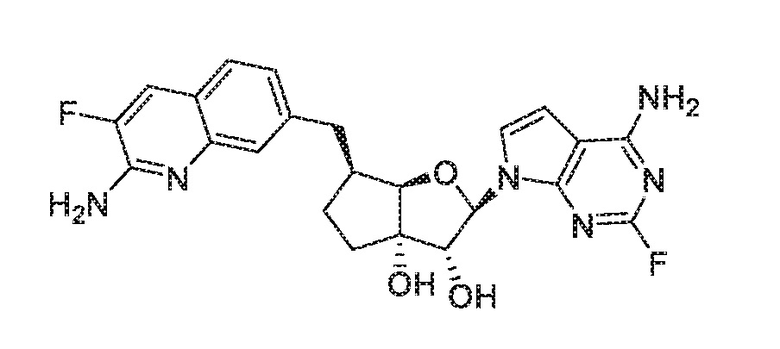
Стадия 1: К 2-фтор-7H-пирроло[2,3-d]пиримидин-4-амину (500 мг, 3,29 ммоль), растворенному в DCM (8 мл) и ацетонитриле (8 мл), добавляли ди-трет-бутилдикарбонат (2,5 г, 12 ммоль) и DMAP (80 мг, 0,66 ммоль). Раствор перемешивали при комнатной температуре в течение 1 ч. Смесь затем концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/гексан) с получением трет-бутил 4-[бис(трет-бутоксикарбонил)амино]-2-фтор-7H-пирроло[2,3-d]пиримидин-7-карбоксилата. MS: 453 (M+1). 1H ЯМР (600 МГц, CDCl3) δ 7,64 (д, J=4,1 Гц, 1H), 6,48 (д, J=4,1 Гц, 1H), 1,69 (с, 9H), 1,44 (с, 18H).
Стадия 2: К раствору трет-бутил 4-[бис(трет-бутоксикарбонил)амино]-2-фтор-7H-пирроло[2,3-d]пиримидин-7-карбоксилата (1,35 г, 2,98 ммоль) в MeOH (15 мл) добавляли TEA (4,15 мл, 29,8 ммоль) при комнатной температуре. Реакционную смесь нагревали до 60°C и перемешивали в течение ночи. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/гексан) с получением ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбоната. MS: 353 (M+1). 1H ЯМР (600 МГц, CDCl3) δ 9,34 (с, 1H), 7,28 (дд, J=3,5, 2,3 Гц, 1H), 6,50 (дд, J=3,6, 2,0 Гц, 1H), 1,47 (с, 18H).
Стадия 3: В сосуд, содержащий (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол (100 мг, 0,299 ммоль), растворенный в безводном ацетонитриле (5 мл), добавляли 1,1'-(азодикарбонил)дипиперидин (113 мг, 0,45 ммоль) с последующим добавлением три-н-бутилфосфина (120 мкл, 0,48 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч. В отдельный сосуд, содержащий ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат (211 мг, 0,598 ммоль), растворенный в безводном ацетонитриле (1 мл), добавляли DBU (90 мкл, 0,60 ммоль). Смесь перемешивали в течение 30 минут при комнатной температуре. Смесь затем добавляли к смеси, содержащей ранее образованный эпоксид, и реакционную смесь перемешивали в течение 2,5 ч при комнатной температуре. Смесь затем фильтровали и очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатора) с получением ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбоната. MS: 669 (M+1).
Стадия 4: К ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонату (97 мг, 0,14 ммоль), растворенному в DCM (3 мл), добавляли TFA (1,1 мл, 14,5 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода градиент с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-2-(4-амино-2-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола. MS: 469 (M+1). 1H ЯМР (600 МГц, DMSO) δ 7,75 (д, J=11,8 Гц, 1H), 7,59 (с, 2H), 7,54 (д, J=8,2 Гц, 1H), 7,40 (д, J=3,7 Гц, 1H), 7,30 (с, 1H), 7,09 (д, J=8,2 Гц, 1H), 6,78-6,62 (м, 3H), 5,72 (д, J=8,1 Гц, 1H), 5,26 (д, J=7,0 Гц, 1H), 5,08 (с, 1H), 4,09 (т, J=7,5 Гц, 1H), 3,96 (д, J=5,7 Гц, 1H), 2,82 (дд, J=13,6, 7,8 Гц, 1H), 2,62 (дд, J=13,6, 7,2 Гц, 1H), 2,28-2,20 (м, 1H), 1,92 (дд, J=12,7, 6,0 Гц, 1H), 1,76-1,64 (м, 2H), 1,55-1,48 (м, 1H).
Пример 46: Пример 45 в Таблице 14 синтезировали с применением протокола Мицунобу, описанного на стадии 3 синтеза примера 45, с последующим применением процедуры удаления защиты с использованием TFA, описанной на стадии 4 примера 45. Ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат и (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
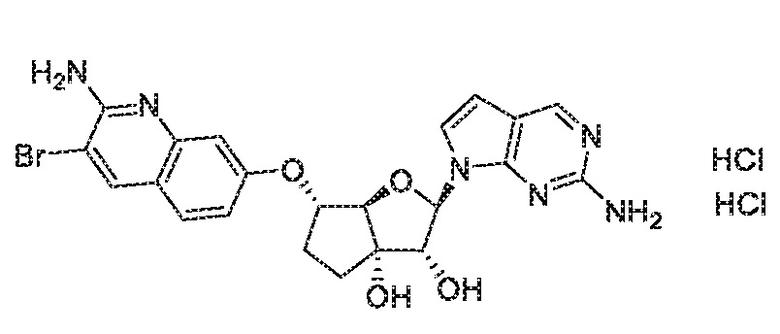
Примеры 47-48: Примеры 47-48 в Таблице 15 синтезировали таким же способом, как описано в примере 45, заменяя 2-фтор-7H-пирроло[2,3-d]пиримидин-4-амин подходящим нуклеооснованием на стадии 1, а (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол подходящим триолом на стадии 3. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
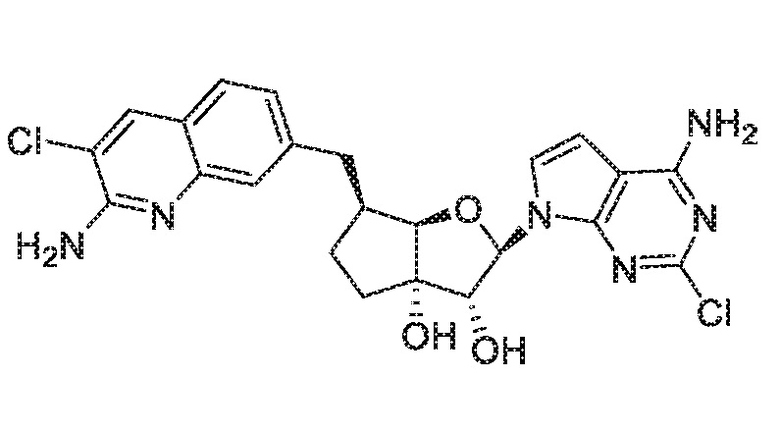
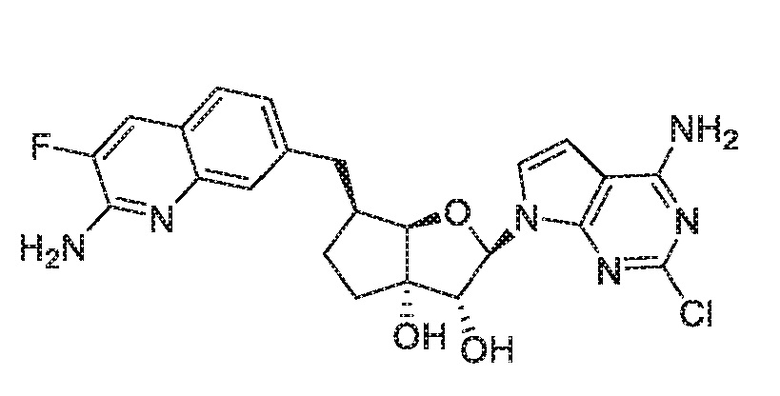
Примеры 49-66: Примеры 49-66 в Таблице 16 синтезировали с применением протокола Мицунобу, описанного на стадии 3 синтеза примера 45, с последующим применением протокола аминолиза, описанного на стадии 7 примера 30. Ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат и (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
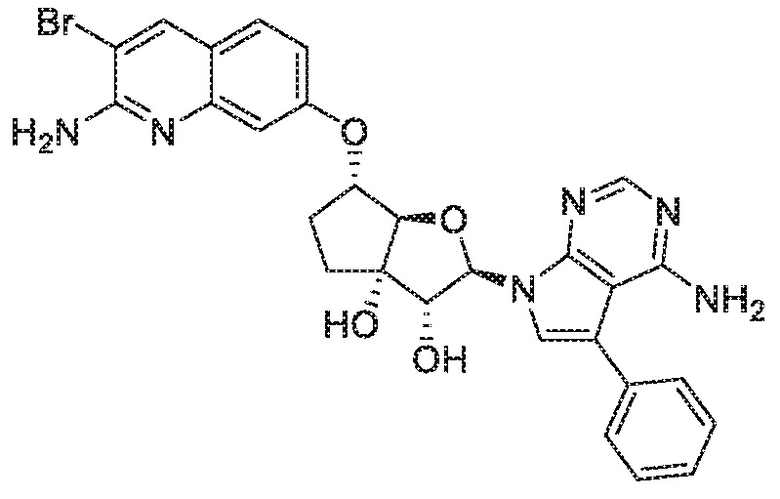
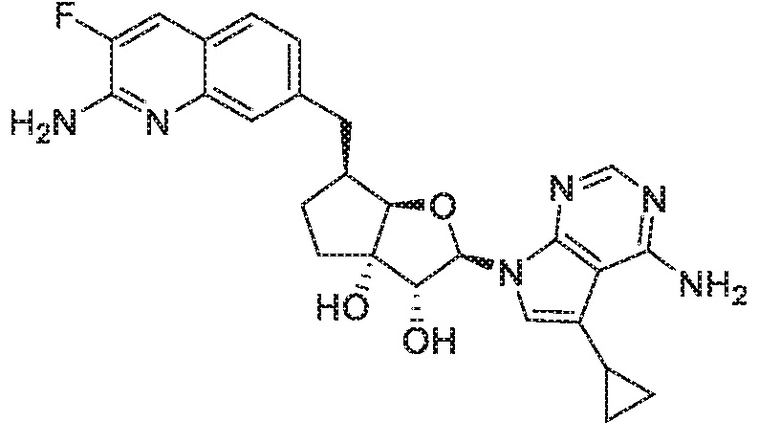
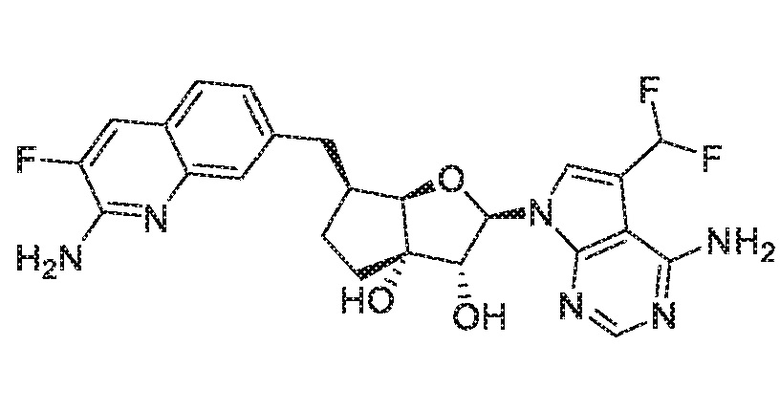
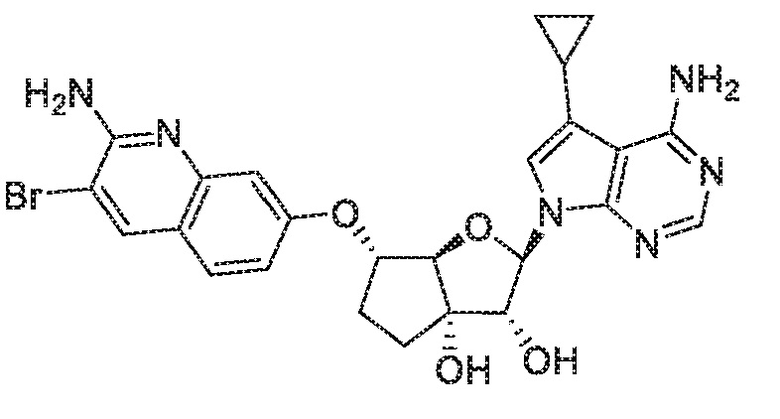
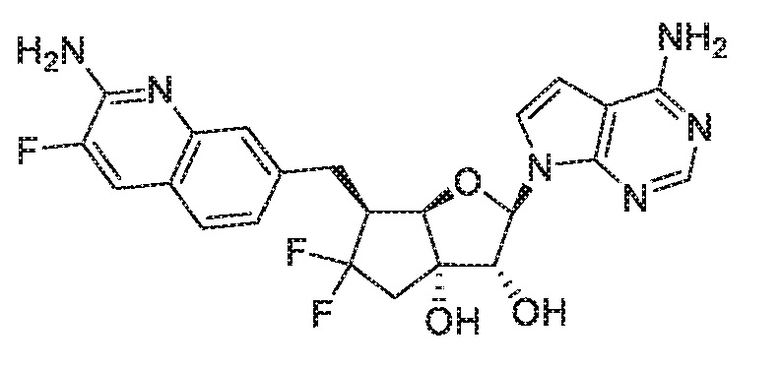
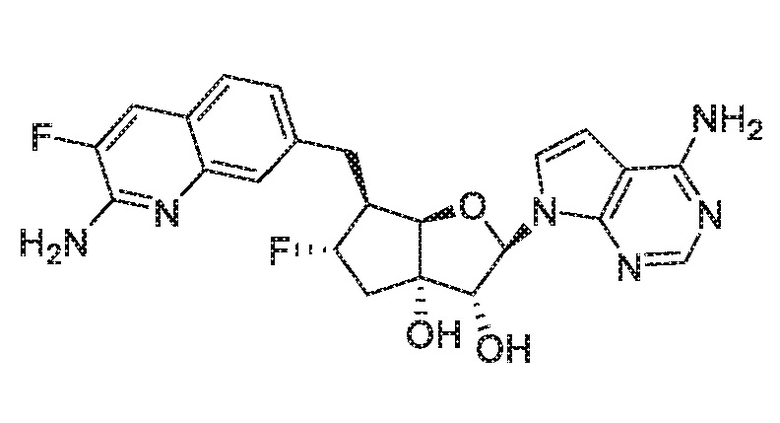
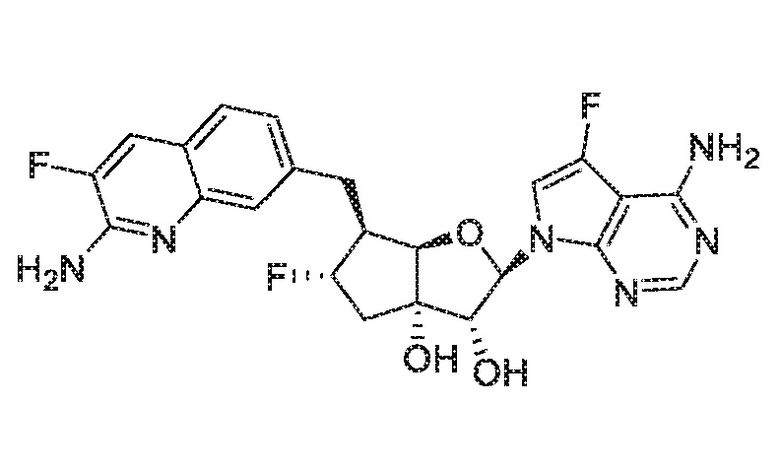
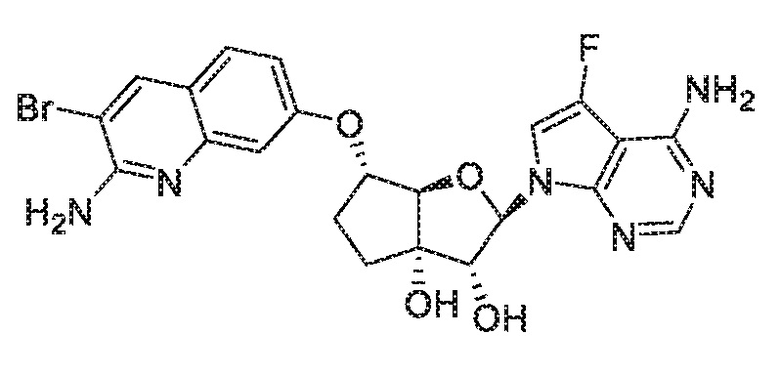
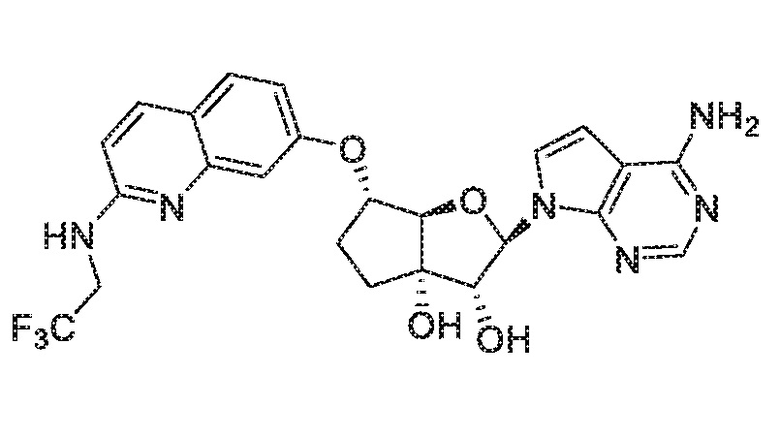
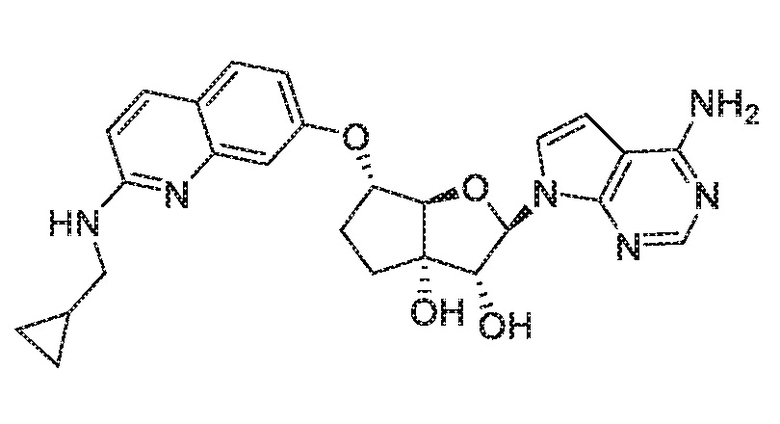
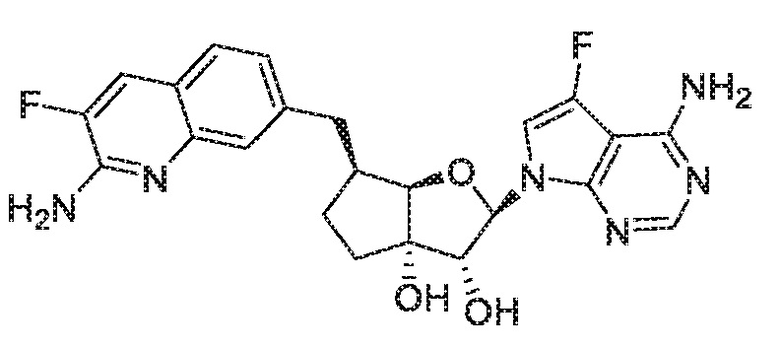
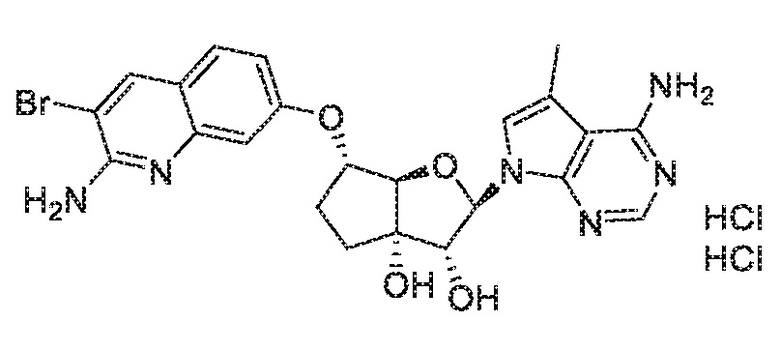
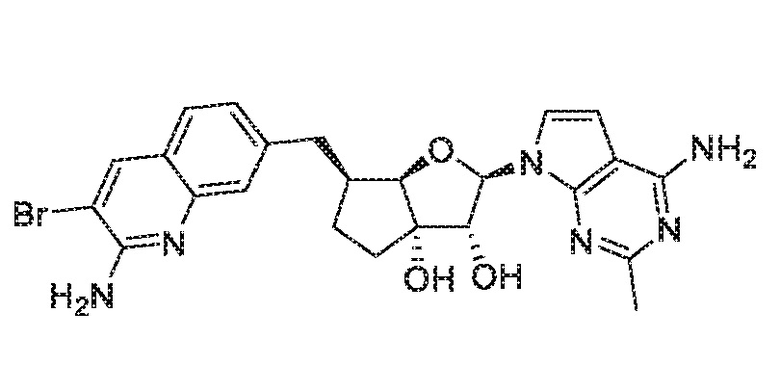
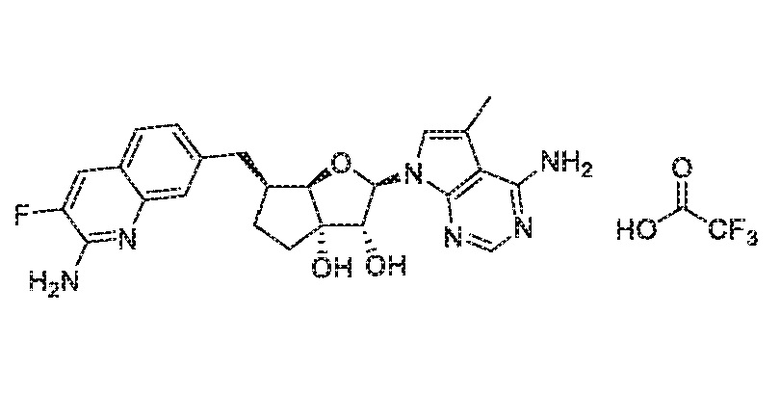
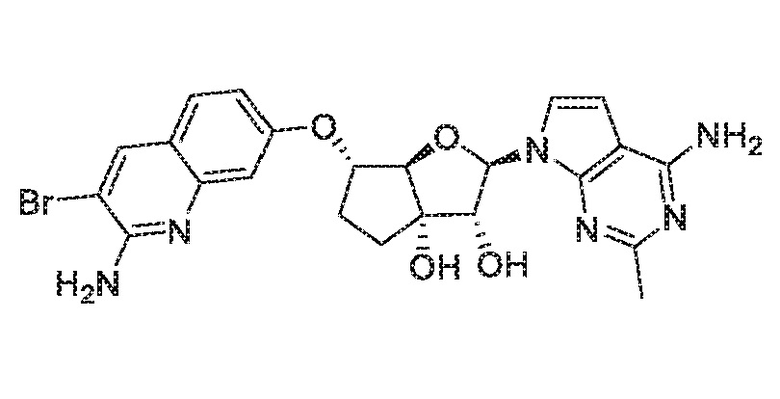
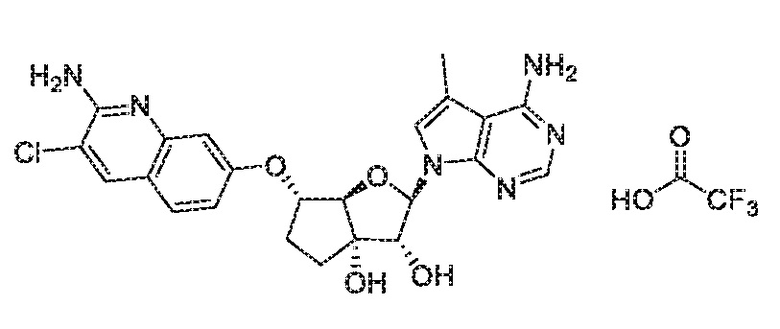
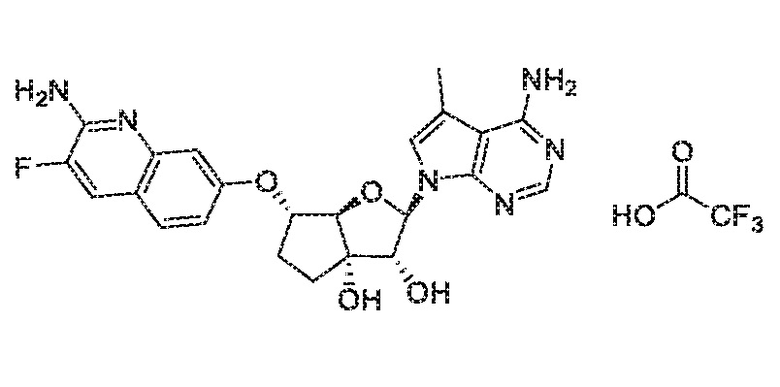
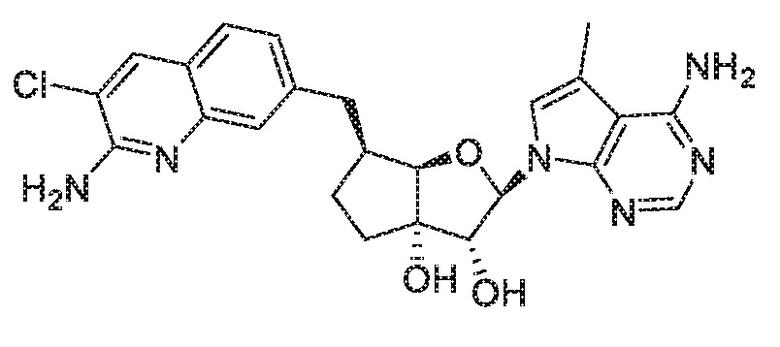
Примеры 67-70: Примеры 67-70 в Таблице 17 синтезировали с применением протокола Мицунобу, описанного на стадии 3 синтеза примера 45, с последующим применением протокола аминолиза, описанного на стадии 11 примера 10 & 11. Ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат и (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
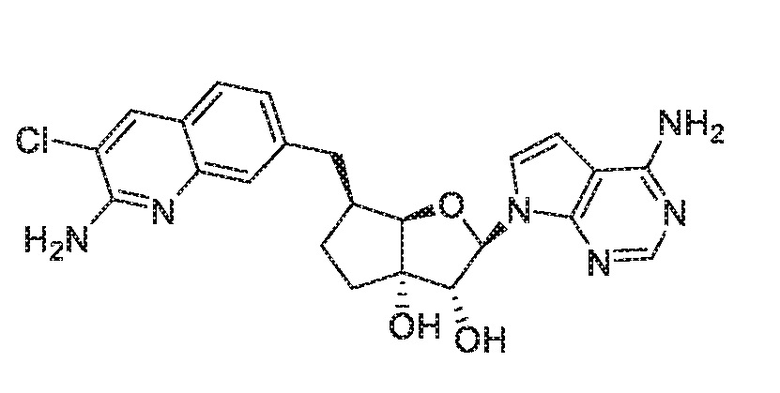
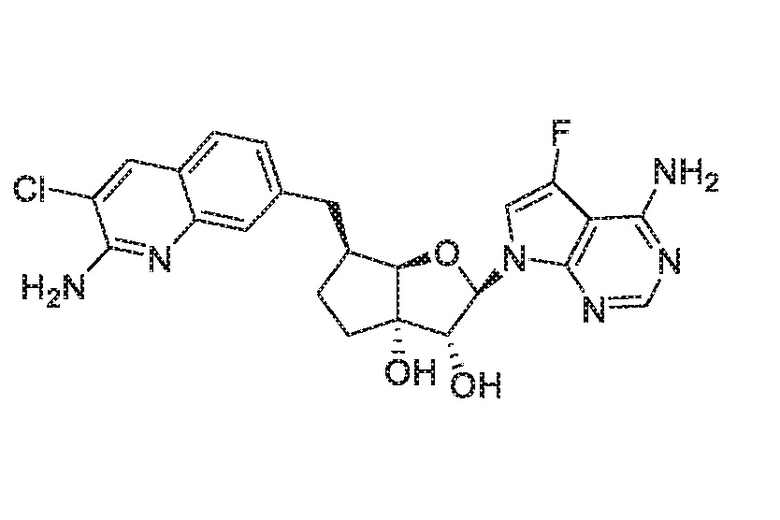
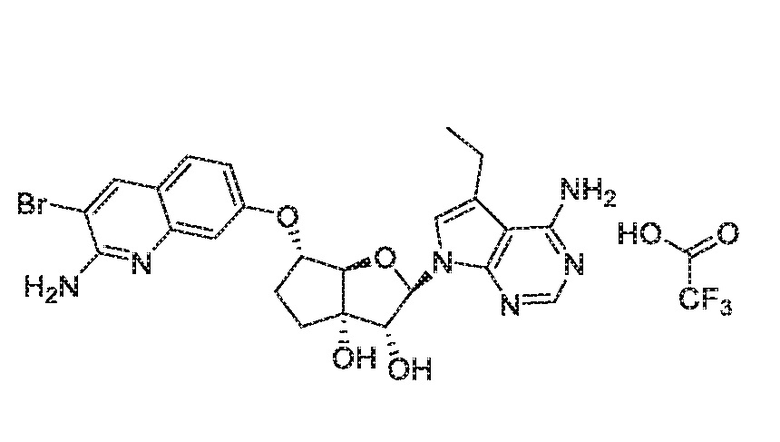
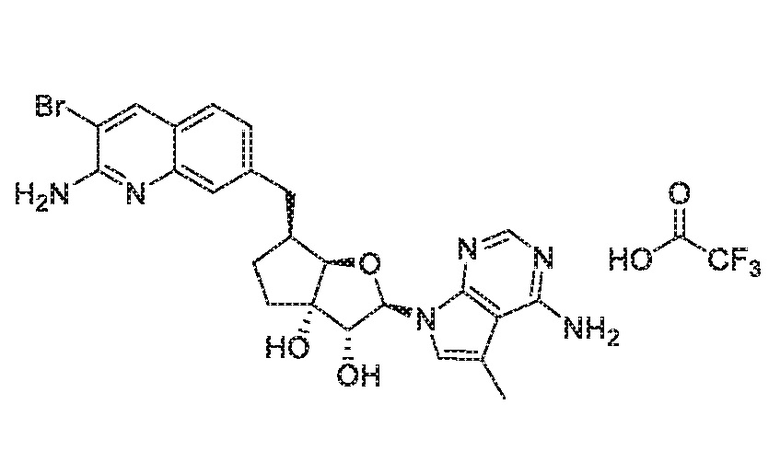
Примеры 71-75: Примеры 71-75 в Таблице 18 синтезировали с применением протокола Мицунобу, описанного на стадии 3 синтеза примера 45, с последующим применением протокола аминолиза, описанного на стадии 12 промежуточного соединения 15. Ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат и (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
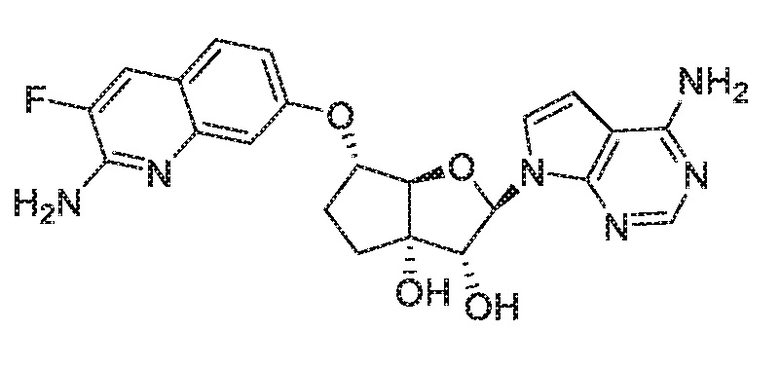
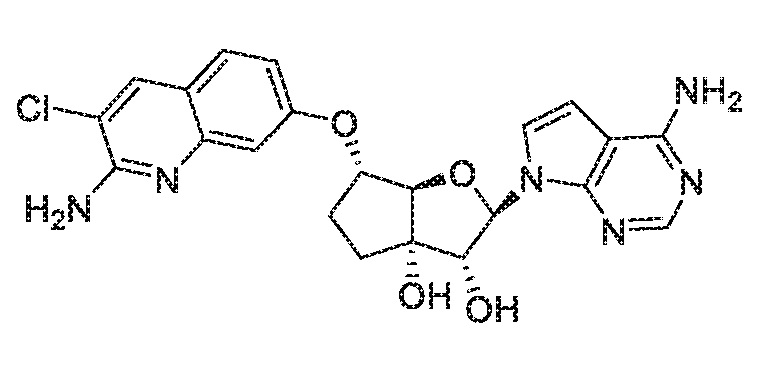
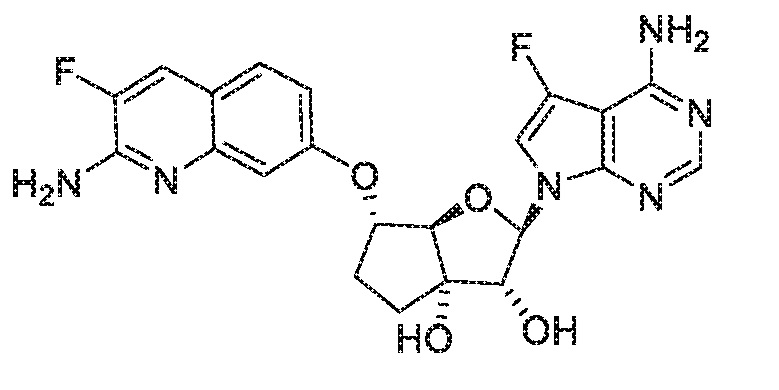
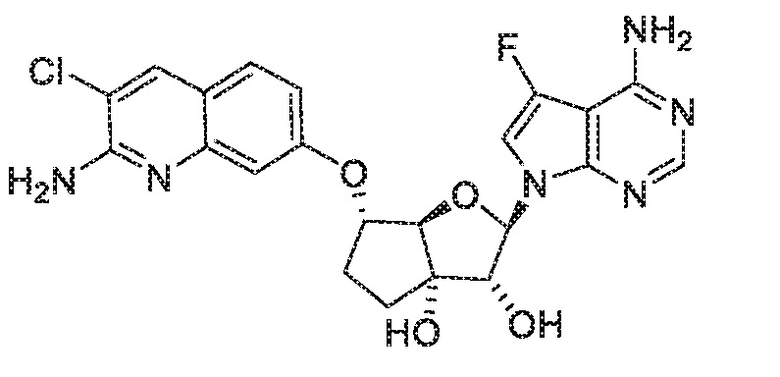
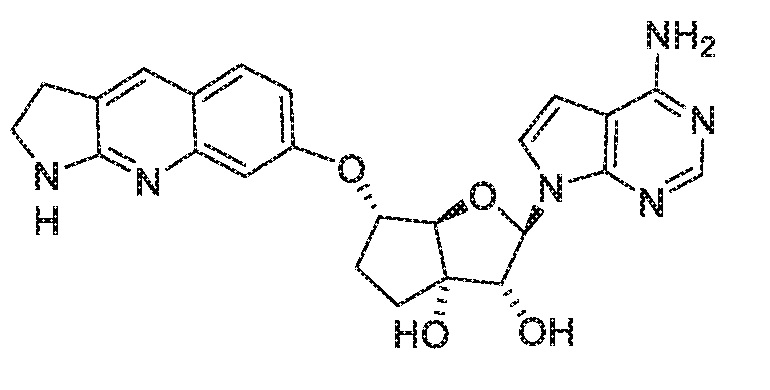
Пример 76: Пример 76 в Таблице 19 синтезировали с применением протокола Мицунобу, описанного на стадии 7 синтеза примера 14, с последующим применением протокола аминолиза, описанного на стадии 12 промежуточного соединения 15. 4-хлор-7H-пирроло[2,3-d]пиримидин и (3R,4S,5R)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-4-метилтетрагидрофуран-2,3,4-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
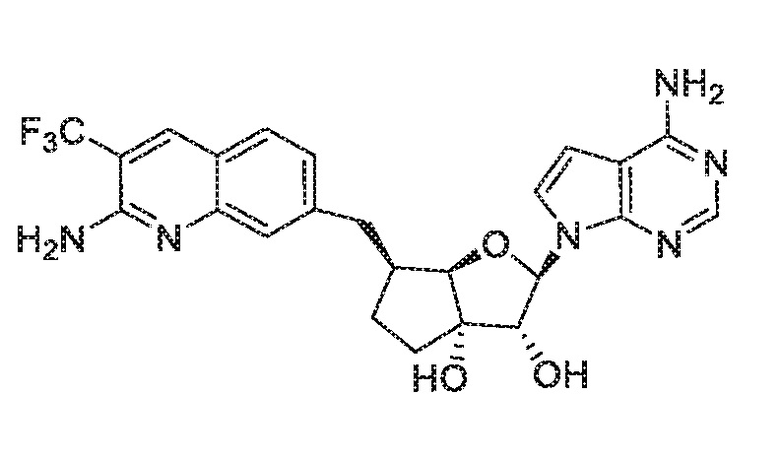
Примеры 77-84: Примеры 77-84 в Таблице 20 синтезировали с применением протокола Мицунобу, описанного на стадии 3 синтеза примера 45. Ди-трет-бутил (2-фтор-7H-пирроло[2,3-d]пиримидин-4-ил)имидодикарбонат и (3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
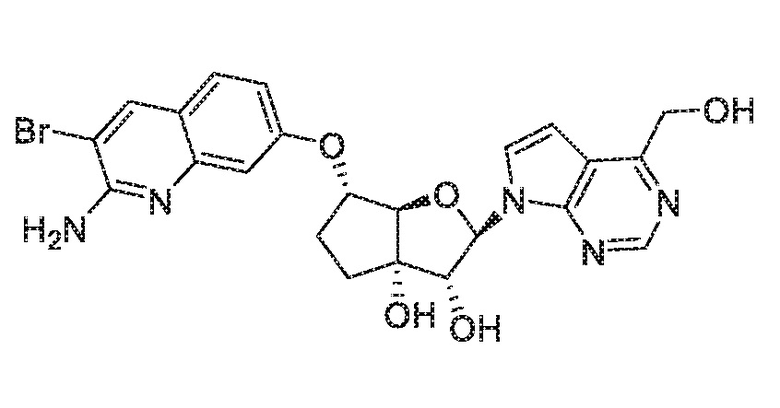
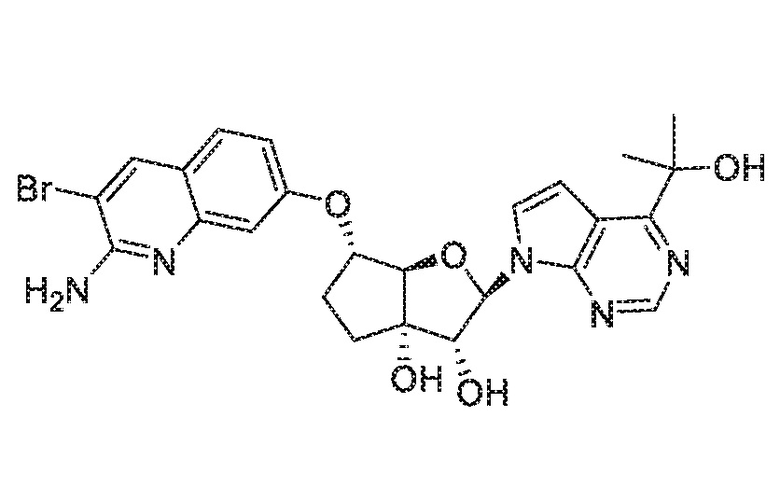
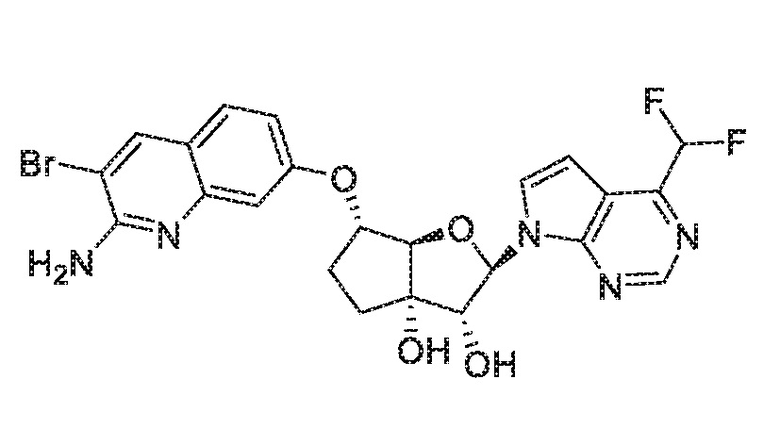
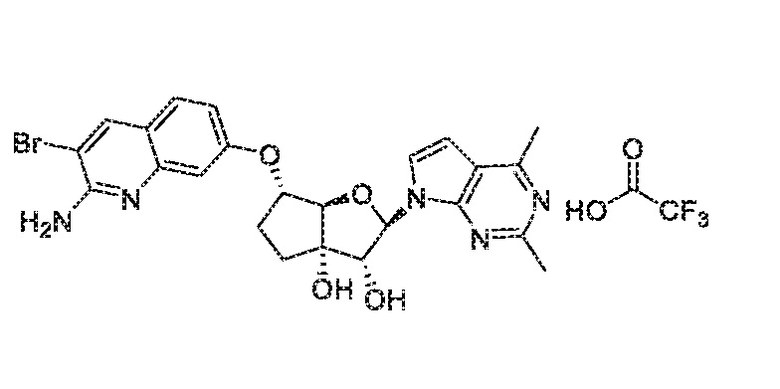
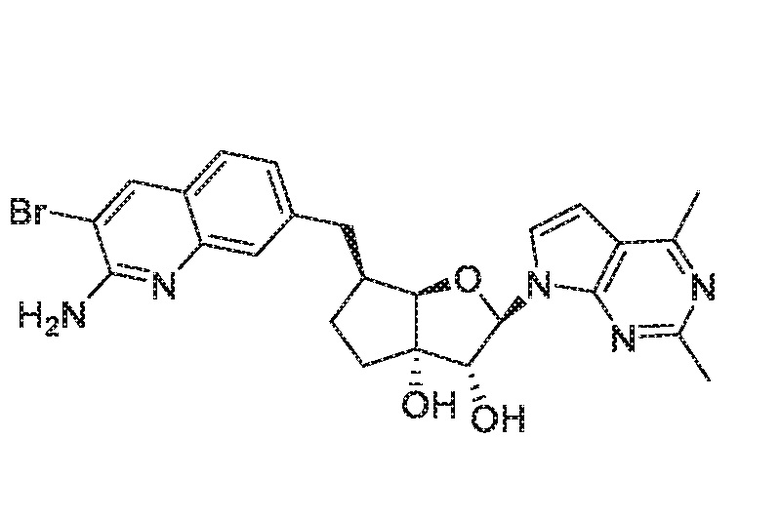
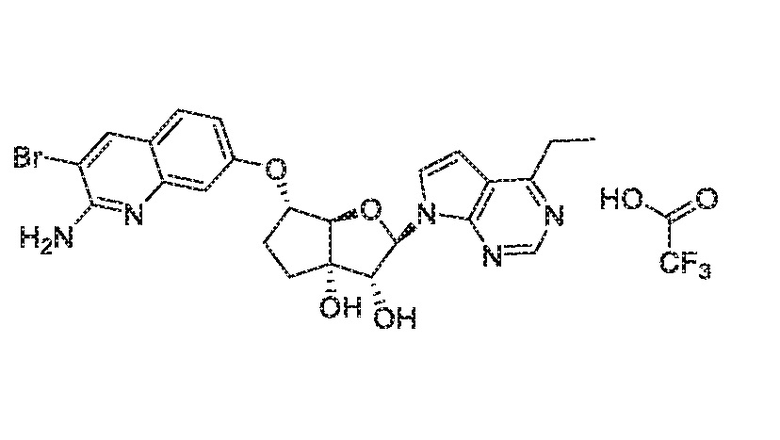
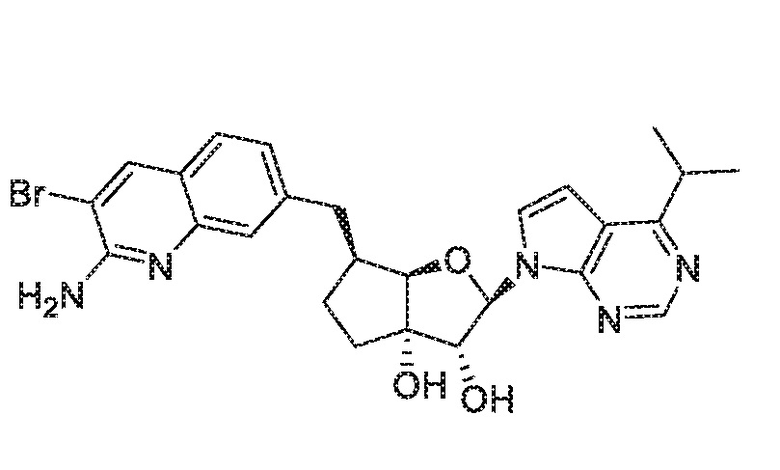
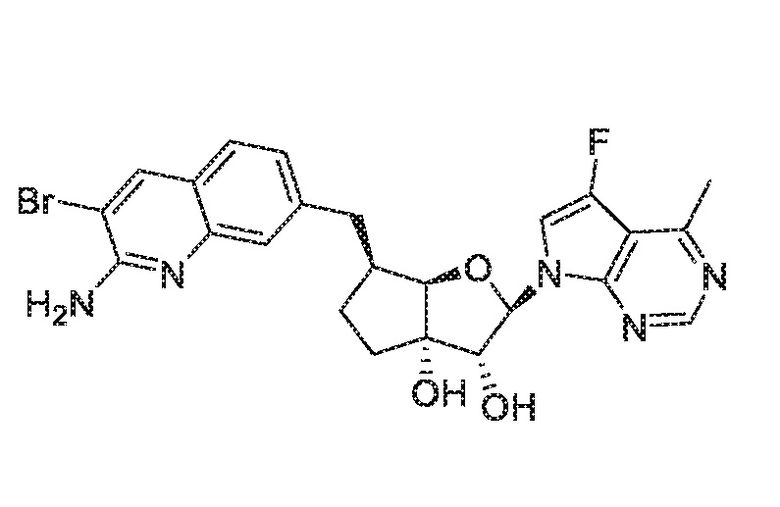
Примеры 85-91: Примеры 85-91 в Таблице 21 синтезировали с применением протокола Мицунобу, описанного на стадии 7 синтеза примера 14. 4-хлор-7H-пирроло[2,3-d]пиримидин и (3R,4S,5R)-5-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-4-метилтетрагидрофуран-2,3,4-триол в последовательности Мицунобу заменяли подходящим нуклеооснованием и триолом, соответственно. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
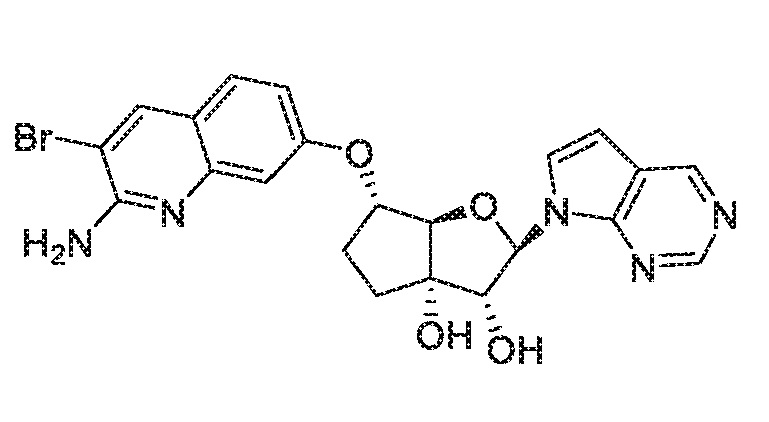
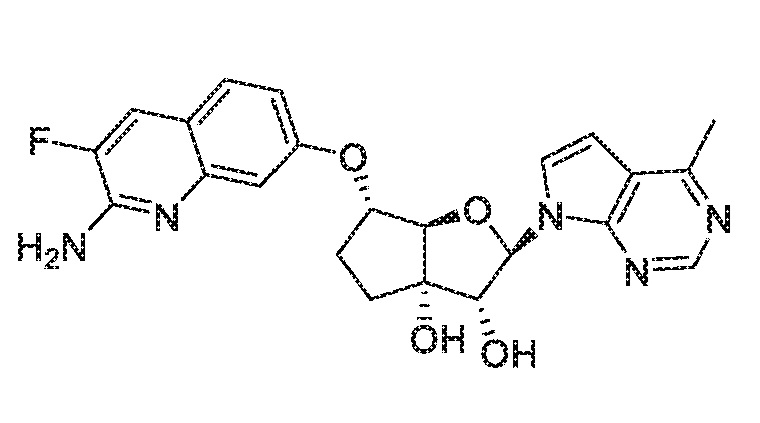
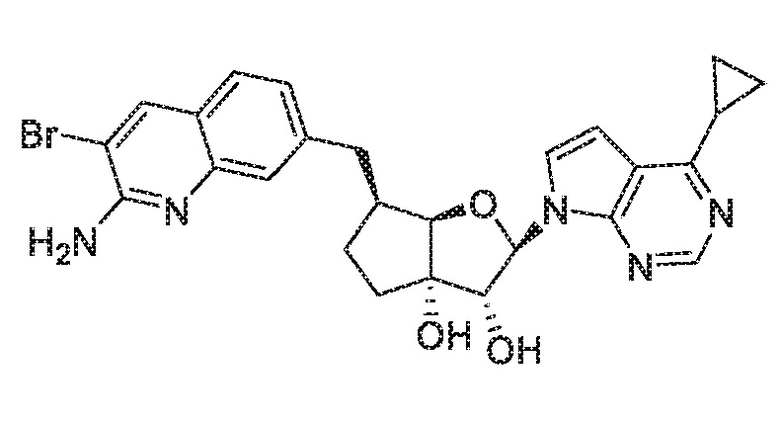
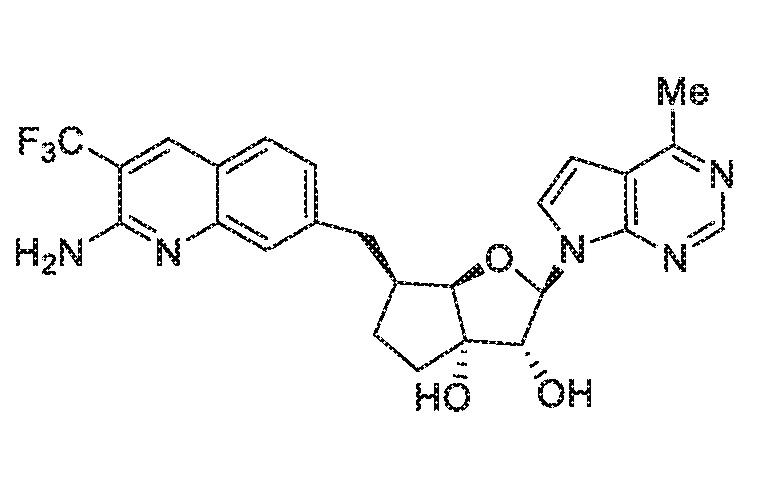
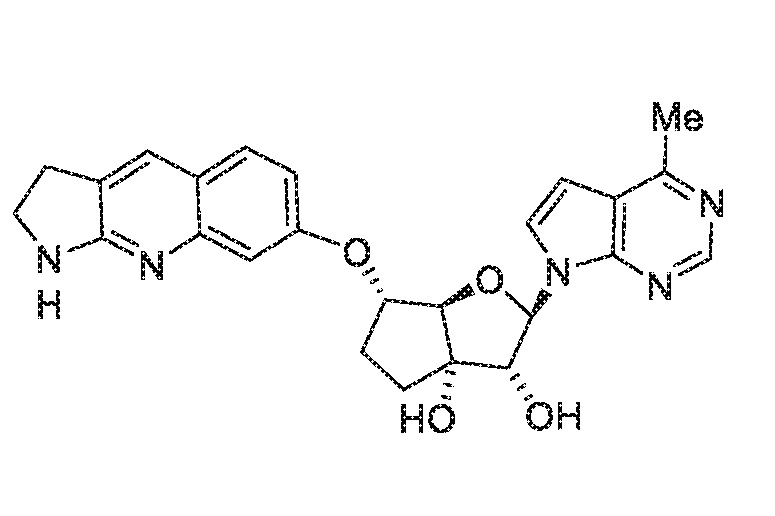
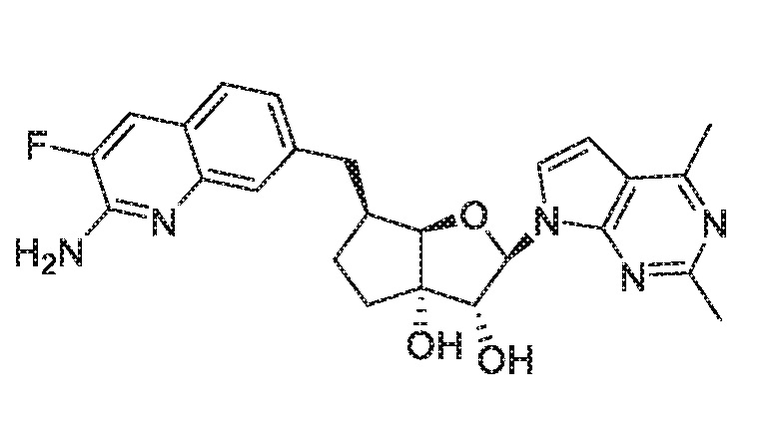
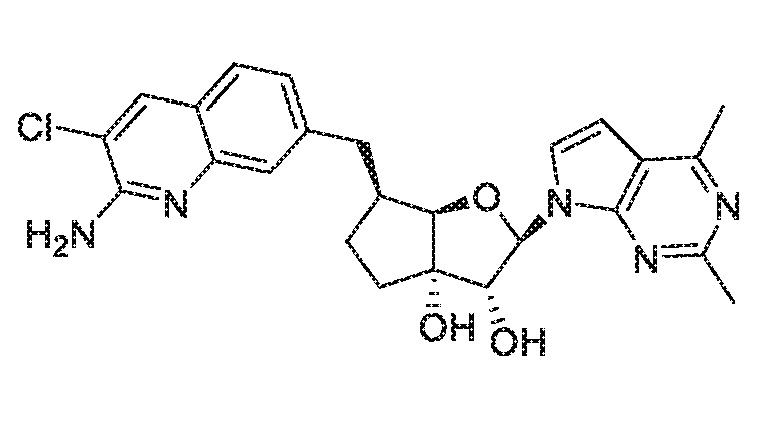
Пример 92
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
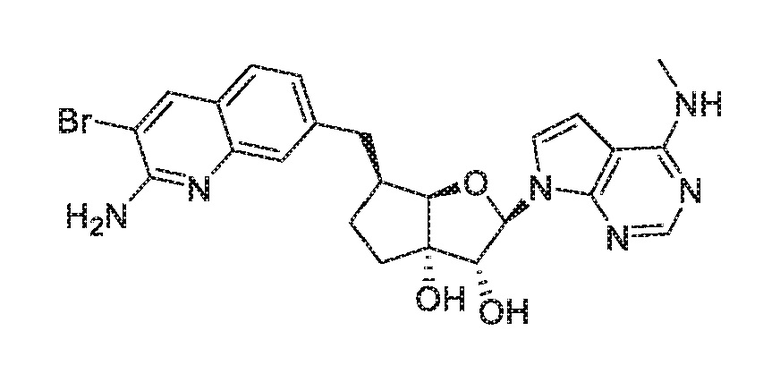
Стадия 1: В сосуд, содержащий (2R,3R,3aS,6S,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол (102 мг, 0,157 ммоль), растворенный в диоксане (3000 мкл), добавляли метиламин (2,0 M в THF, 6,26 мл, 12,5 ммоль) при комнатной температуре. Смесь герметично закрывали и нагревали при 70°C в течение 6 ч. Смесь концентрировали при пониженном давлении с получением (2R,3R,3aS,6S,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде пенистого вещества. MS: 645/647 (M+1/M+3).
Стадия 2: К (2R,3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диолу (101 мг, 0,156 ммоль), растворенному в DCM (1304 мкл), добавляли TFA (1300 мкл, 16,87 ммоль) при комнатной температуре. Смесь перемешивали в течение 5,5 ч при 40°C и затем отключали нагрев и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Реакционную смесь нагревали при 40°C в течение 2 ч. Смесь концентрировали при пониженном давлении и очищали масс-инициируемой обращенно-фазовой колоночной хроматографией (ACN:вода с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 525/527 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,31 (с, 1H), 8,19 (с, 1H), 7,55 (д, J=8,2 Гц, 2H), 7,45 (д, J=3,6 Гц, 1H), 7,28 (с, 1H), 7,09 (дд, J=8,2, 1,4 Гц, 1H), 6,67 (д, J=3,6 Гц, 1H), 6,57 (с, 2H), 5,90 (д, J=8,1 Гц, 1H), 5,25 (д, J=7,1 Гц, 1H), 5,07 (с, 1H), 4,15 (т, J=7,4 Гц, 1H), 3,96 (д, J=5,7 Гц, 1H), 2,99 (д, J=4,5 Гц, 3H), 2,86-2,79 (м, 1H), 2,66-2,58 (м, 1H), 2,29-2,22 (м, 1H), 1,98-1,91 (м, 1H), 1,78-1,65 (м, 2H), 1,58-1,49 (м, 1H).
Примеры 93-97: Примеры 93-97 в Таблице 22 синтезировали таким же способом, как описано на стадиях 1-2 примера 92, заменяя (2R,3R,3aS,6S,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол подходящим хлор-нуклеооснованием. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
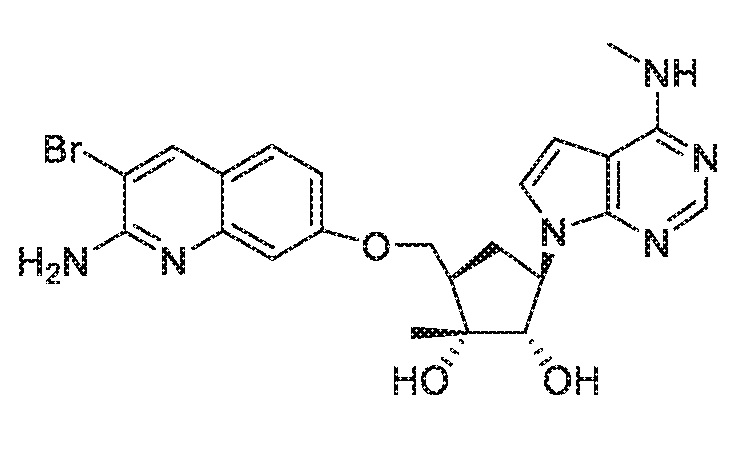
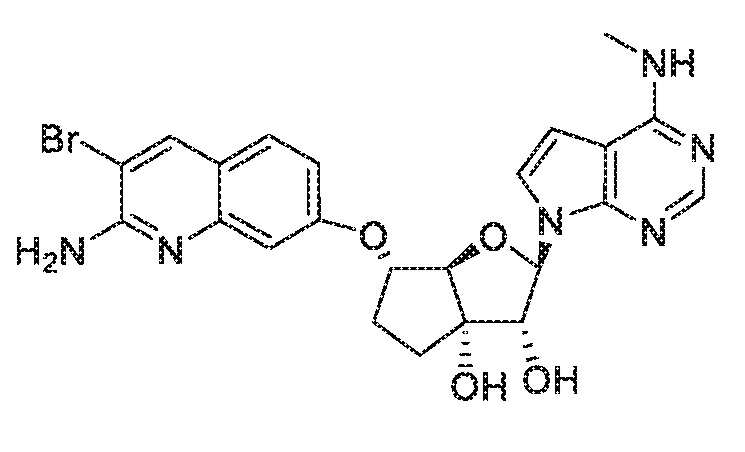
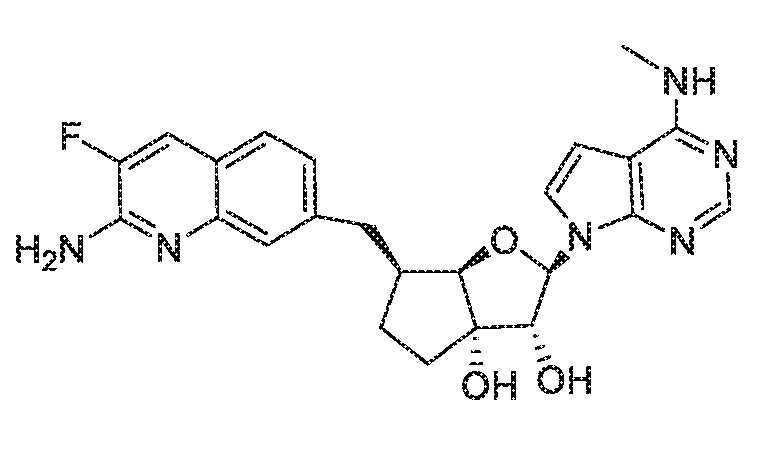
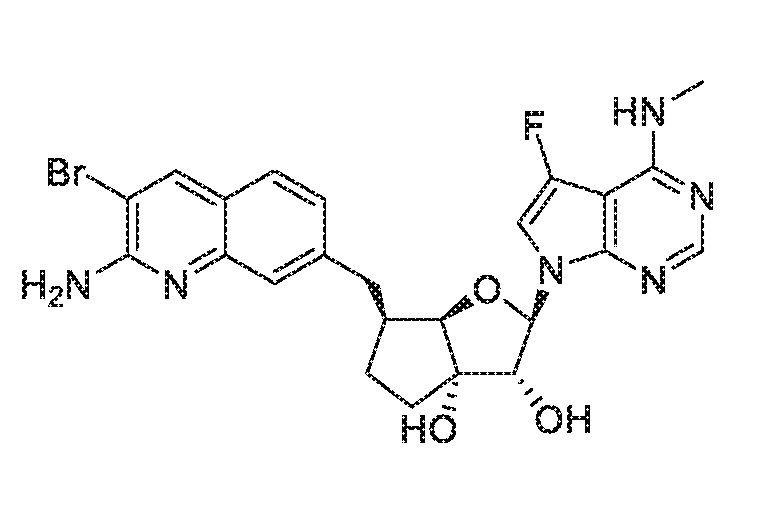
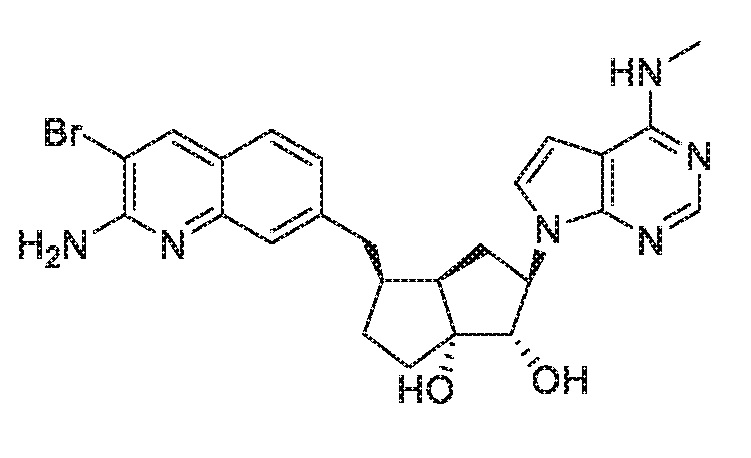
Пример 98
(2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метил-2-((хинолин-7-илокси)метил)тетрагидрофуран-3,4-диол
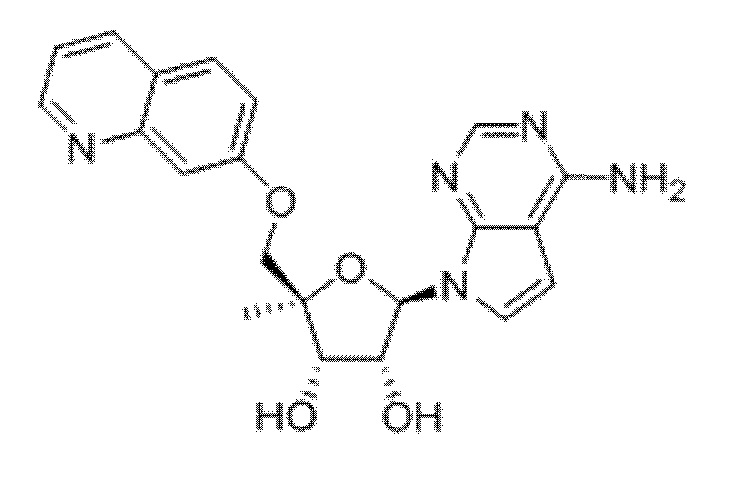
Стадия 1: Раствор ((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метанола (400 мг, 1,18 ммоль), хинолин-7-ола (205 мг, 1,41 ммоль) и трифенилфосфина (1578 мг, 3,06 ммоль) перемешивали в безводном THF (12 мл) в атмосфере азота. Добавляли по каплям DIAD (0,572 мл, 2,94 ммоль) при 0°C. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и промывали при помощи MeOH. Фильтрат концентрировали при пониженном давлении и очищали колоночной хроматографией на диоксиде кремния (EtOAc/PE 0-50% и затем MeOH/DCM 0-5%) с получением 7-(((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)хинолина в виде твердого вещества. Затем к перемешиваемому раствору 7-(((3aS,4R,6R,6aR)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ил)метокси)хинолина (100 мг, 0,214 ммоль) в диоксане (1 мл) добавляли аммиак (28% в воде) (1 мл, 12,94 ммоль) и смесь перемешивали при 120°C в течение 8,5 ч. Реакционную смесь упаривали при пониженном давлении и очищали обращенно-фазовой ВЭЖХ (ACN/вода) с получением 7-((3aR,4R,6R,6aS)-2,2,6-триметил-6-((хинолин-7-илокси)метил)тетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 448 (M+1).
Стадия 2: К соединению 7-((3aR,4R,6R,6aS)-2,2,6-триметил-6-((хинолин-7-илокси)метил)тетрагидрофуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин (11 мг, 0,025 ммоль) добавляли предварительно полученную смесь TFA (70 мкл, 0,909 ммоль)/вода (150 мкл) при 0°C. Полученную суспензию перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (MeCN/вода) с получением (2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метил-2-((хинолин-7-илокси)метил)тетрагидрофуран-3,4-диола в виде твердого вещества. MS: 408 (M+1). 1H ЯМР (400 МГц, Метанол-d4) δ 8,79 (дд, J=4,5, 1,7 Гц, 1H), 8,32 (д, J=6,7 Гц, 1H), 8,10 (с, 1H), 7,91 (д, J=9,0 Гц, 1H), 7,48-7,37 (м, 5H), 6,62 (д, J=3,7 Гц, 1H), 6,30 (д, J=6,7 Гц, 1H), 4,45 (д, J=5,5 Гц, 1H), 4,32-4,21 (м, 2H), 1,53 (с, 3H).
Пример 99: Пример 99 в Таблице 23 синтезировали, следуя Стадиям 1-2 примера 98, описанного выше, исходя из промежуточного соединения 28.
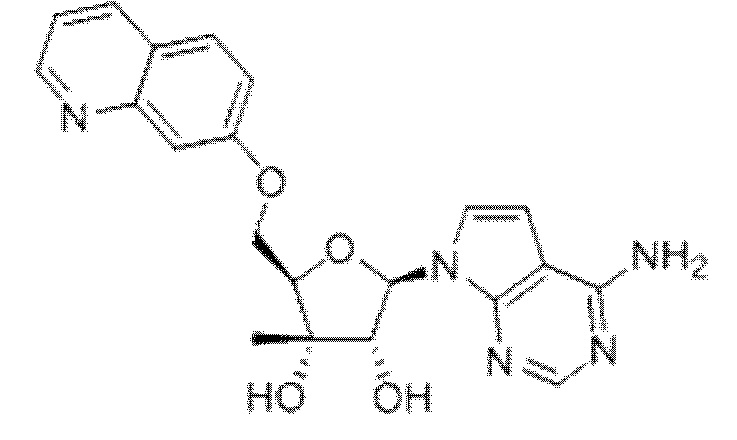
Пример 100
(1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол
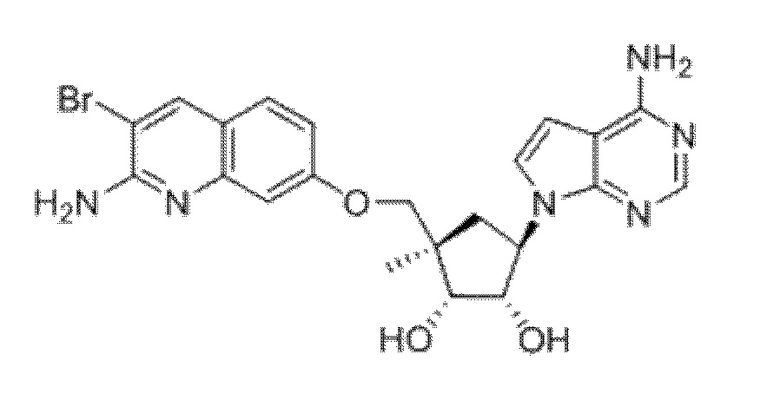
Стадия 1: К раствору бис(триметилсилил)амида лития (73,9 мл, 73,9 ммоль) при -70°C добавляли раствор (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)циклопент-2-енкарбоксилата (8 г, 33,2 ммоль) в THF (8 мл) в течение 2 минут при -70°C. Полученный раствор перемешивали при -70°C в течение 30 минут, затем добавляли иодметан (3,67 мл, 59,0 ммоль) в течение 5 минут. Реакционную смесь нагревали до -25°C и эту температуру поддерживали в течение 2 ч. Полученную смесь разбавляли насыщенным водным раствором NaHCO3 (200 мл) и экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (16,6% EtOAc/PE) с получением (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-1-метилциклопент-2-енкарбоксилата в виде масла. MS: 199 (M-56).
Стадия 2: К перемешиваемой смеси (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-1-метилциклопент-2-енкарбоксилата (7,1 г, 27,8 ммоль) в THF (100 мл) добавляли тетрагидроборат лития (27,8 мл, 55,6 ммоль) при 0°C в атмосфере аргона. Полученную смесь нагревали до 25°C и перемешивали в течение 16 ч. Реакционную смесь гасили при помощи MeOH (50 мл), разбавляли насыщенным водным раствором NH4Cl (300 мл) и затем экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и перекристаллизовывали из PE (100 мл). Твердое вещество собирали фильтрованием и сушили при пониженном давлении с получением трет-бутил ((1R,4S)-4-(гидроксиметил)-4-метилциклопент-2-ен-1-ил)карбамата в виде твердого вещества. MS: 228 (M+1).
Стадия 3: Смесь трет-бутил ((1R,4S)-4-(гидроксиметил)-4-метилциклопент-2-ен-1-ил)карбамата (7,84 г, 34,5 ммоль) и HCl (4 M в диоксане, 80 мл) перемешивали при 25°C в течение 2 ч. Раствор затем концентрировали при пониженном давлении и остаток растирали в порошок с эфиром (200 мл). Твердое вещество собирали, промывали эфиром (100 мл) и сушили с получением ((1S,4R)-4-амино-1-метилциклопент-2-ен-1-ил)метанол гидрохлорида в виде твердого вещества. MS: 128 (M+1).
Стадия 4: К перемешиваемой смеси ((1S,4R)-4-амино-1-метилциклопент-2-ен-1-ил)метанол гидрохлорида (5,5 г, 32,6 ммоль) в 2-пропаноле (120 мл) добавляли 2-(4,6-дихлорпиримидин-5-ил)ацетальдегид (6,85 г, 35,9 ммоль) и триэтиламин (6,60 г, 65,2 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали при 82°C в течение 16 ч. Реакционную смесь гасили водой (250 мл) и экстрагировали этилацетатом (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (25-32% EtOAc/PE) с получением ((1S,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопент-2-ен-1-ил)метанола в виде твердого вещества. MS: 264 (M+1).
Стадия 5: К раствору ((1S,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопент-2-ен-1-ил)метанола (300 мг, 1,138 ммоль) в THF (5 мл) добавляли фенолят натрия (660 мг, 5,69 ммоль) при 0°C в атмосфере аргона. Реакционную смесь перемешивали при 66°C в течение 12 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (100 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/PE) с получением ((1S,4R)-1-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-ен-1-ил)метанола в виде твердого вещества. MS: 322 (M+1).
Стадия 6: К раствору ((1S,4R)-1-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-ен-1-ил)метанола (260 мг, 0,809 ммоль) в DMF (1 мл) добавляли 1H-имидазол (116 мг, 1,699 ммоль) и трет-бутилхлордифенилсилан (289 мг, 1,052 ммоль) одной порцией при 0°C в атмосфере аргона. Реакционную смесь перемешивали при 25°C в течение 1,5 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (150 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-20% EtOAc/PE) с получением 7-((1R,4S)-4-(((трет-бутилдифенилсилил)окси)метил)-4-метилциклопент-2-ен-1-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 560 (M+1).
Стадия 7: К перемешиваемому раствору 7-((1R,4S)-4-(((трет-бутилдифенилсилил)окси)метил)-4-метилциклопент-2-ен-1-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина (260 мг, 0,464 ммоль) в THF (4 мл) добавляли пиридин (4 мл, 49,5 ммоль) и оксид осмия(VIII) (1,299 мл, 0,511 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали при этой же температуре в течение 1 ч. Реакционную смесь гасили насыщенным водным раствором Na2S2O3 (25 мл) и экстрагировали при помощи EtOAc (5 × 20 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в tBuOH (3,00 мл) и воде (3 мл) и добавляли гидросульфит натрия (5,52 мг, 0,053 ммоль) при 25°C под потоком воздуха. Полученную смесь перемешивали в течение 20 минут. Реакционную смесь разбавляли насыщенным водным раствором NaHSO3 (25 мл) и экстрагировали при помощи EtOAc (3 × 25 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и фильтровали. Неочищенный остаток очищали колоночной хроматографией на диоксиде кремния (0-70% EtOAc/PE) с получением (3R,5R)-3-(((трет-бутилдифенилсилил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде масла. MS: 594 (M+1).
Стадия 8: К перемешиваемому раствору (3R,5R)-3-(((трет-бутилдифенилсилил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола (2,2 г, 3,71 ммоль) в безводном ацетоне (12 мл) добавляли 4-метилбензолсульфоновую кислоту (0,064 г, 0,371 ммоль) и 2,2-диметоксипропан (1,93 г, 18,5 ммоль). Полученную смесь перемешивали при 25°C в течение 3 ч. К раствору добавляли EtOAc (300 мл) и насыщенный водный раствор NaHCO3 (100 мл), органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/PE) с получением 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина в виде пенистого вещества. MS: 634 (M+1).
Стадия 9: К перемешиваемому раствору 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина (650 мг, 1,025 ммоль) в THF (5 мл) добавляли тетрабутиламмоний фторид (1 M в THF, 3,08 мл, 3,08 ммоль) при 25°C. Полученную смесь перемешивали при 25°C в течение 2 ч. К раствору добавляли насыщенный водный раствор NaHCO3 (100 мл) и EtOAc (250 мл), затем органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией (0-70% EtOAc/PE) с получением ((3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола в виде пенистого вещества. MS: 396 (M+1).
Стадия 10: К перемешиваемой смеси ((3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (270 мг, 0,683 ммоль) в 1,4-диоксане (6 мл) добавляли 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амин (256 мг, 0,546 ммоль), 1,10-фенантролин (19,7 мг, 0,109 ммоль), иодид меди (I) (10,4 мг, 0,055 ммоль) и карбонат цезия (267 мг, 0,819 ммоль). Полученную смесь перемешивали при 110°C в течение 18 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/PE) с получением 3-бром-N-(4-метоксибензил)-7-(((3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метокси)хинолин-2-амина в виде твердого вещества. MS: 736/738 (M+1/M+3).
Стадия 11: 3-бром-N-(4-метоксибензил)-7-(((3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метокси)хинолин-2-амин (230 мг, 0,312 ммоль) растворяли в 2,2,2-трифторуксусной кислоте (5 мл, 67,3 ммоль), затем раствор перемешивали при 60°C в течение 2 ч. Раствор совместно упаривали с толуолом пять раз с получением (1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола. MS: 576/578 (M+1/M+3).
Стадия 12: К раствору (1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола (230 мг, 0,299 ммоль) в 2-пропаноле (2 мл) добавляли аммиак в i-PrOH(NH3/i-PrOH 5:1) (5 мл, 0,299 ммоль) при -50°C, полученную смесь перемешивали при 130°C в течение 64 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали препаративной ВЭЖХ (ACN/вода) с получением (1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диола в виде твердого вещества. MS: 499/501 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,29 (с, 1H), 8,03 (с, 1H), 7,59 (д, J=9,2 Гц, 1H), 7,31 (д, J=3,6 Гц, 1H), 6,98-6,92 (м, 2H), 6,89 (шир.с, 2H), 6,55 (д, J=3,2 Гц, 1H), 6,51 (шир.с, 2H), 5,03-4,96 (м, 1H), 4,85 (д, J=6,8 Гц, 1H), 4,75 (д, J=4,8 Гц, 1H), 4,56-4,50 (м, 1H), 4,03 (д, J=9,2 Гц, 1H), 3,97-3,91 (м, 2H), 1,93 (д, J=9,6 Гц, 2H), 1,19 (с, 3H).
Пример 101
(1S,2R,3R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(((2-аминохинолин-7-ил)окси)метил)-3-метилциклопентан-1,2-диол
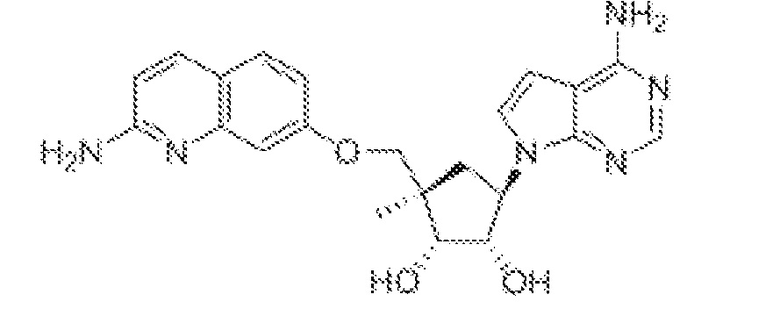
Стадия 1: К раствору (1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диола (26 мг, 0,052 ммоль) в MeOH (3 мл) добавляли Pd/C (10%) (20 мг) при 25°C. Смесь перемешивали в атмосфере водорода при 25°C в течение 30 минут, смесь фильтровали и фильтрат очищали обращенно-фазовой колоночной флэш-хроматографией (ACN/вода) с получением (1S,2R,3R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(((2-аминохинолин-7-ил)окси)метил)-3-метилциклопентан-1,2-диола в виде твердого вещества. MS: 421 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,00 (с, 1H), 7,76 (д, J=9,0 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,28 (д, J=3,6 Гц, 1H), 6,91-6,80 (м, 4H), 6,57-6,52 (м, 2H), 6,26 (шир.с, 2H), 5,01-4,92 (м, 1H), 4,82 (д, J=6,6 Гц, 1H), 4,71 (д, J=4,8 Гц, 1H), 4,53-4,46 (м, 1H), 3,98 (д, J=9,6 Гц, 1H), 3,91-3,89 (м, 2H), 1,91-1,88 (м, 2H), 1,16 (с, 3H).
Пример 102
(1S,2R,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)циклопентан-1,2-диол
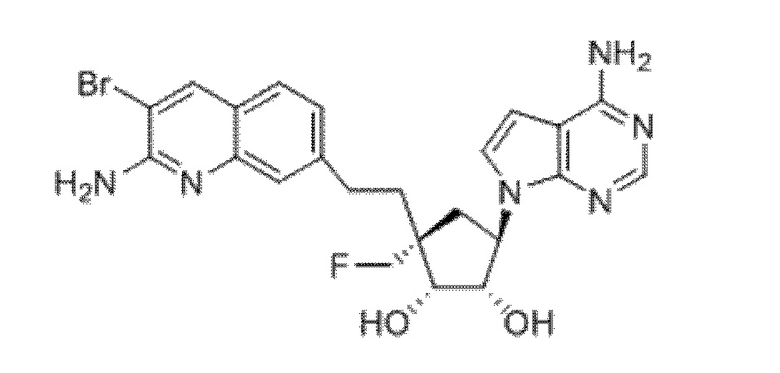
Стадия 1: К перемешиваемой смеси (1R,2S,3R,5R)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)циклопентан-1,2-диола (4,0 г, 14,1 ммоль) (подвергавшегося азеотропной перегонке с толуолом 3x) в пиридине (40 мл) добавляли 1-(хлор(4-метоксифенил)(фенил)метил)-3-метоксибензол (5,25 г, 15,5 ммоль) при комнатной температуре в атмосфере аргона. Полученную смесь перемешивали в течение примерно 3 ч при комнатной температуре. Реакционную смесь гасили MeOH (25 мл). Смесь подвергали азеотропной перегонке с толуолом и остаток очищали колоночной хроматографией на диоксиде кремния (1-10% MeOH/DCM) с получением (1S,2R,3R,5R)-3-((бис(4-метоксифенил)(фенил)метокси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 586 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,59 (с, 1H), 7,81 (д, J=3,6 Гц, 1H), 7,44-7,41 (м, 2H), 7,35-7,24 (м, 7H), 6,92-6,90 (м, 4H), 6,68 (д, J=3,6 Гц, 1H), 4,98-4,93 (м, 2H), 4,79 (д, J=3,6 Гц, 1H), 4,28-4,26 (м, 1H), 3,89-3,87 (м, 1H), 3,75 (с, 6H), 3,20-3,17 (м, 1H), 3,09-3,05 (м, 1H), 2,32-2,26 (м, 2H), 1,76-1,69 (м, 1H).
Стадия 2: К перемешиваемой смеси (1S,2R,3R,5R)-3-((бис(4-метоксифенил)(фенил)метокси)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола (6,0 г, 10,2 ммоль) (подвергавшегося азеотропной перегонке с толуолом 3x) в DMF (80 мл) добавляли гидрид натрия (60% в минеральном масле) (1,64 г, 41,0 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение около 30 минут при 0°C, затем добавляли тетрабутиламмоний иодид (1,89 г, 5,12 ммоль) и (бромметил)бензол (5,25 г, 30,7 ммоль). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (150 мл) и экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/PE) с получением 7-((1R,2S,3R,4R)-2,3-бис(бензилокси)-4-((бис(4-метоксифенил)(фенил)метокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 766 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,46 (с, 1H), 7,75 (д, J=3,9 Гц, 1H), 7,38-7,08 (м, 17H), 6,91-6,84 (м, 6H), 6,61 (д, J=3,6 Гц, 1H), 5,20-5,10 (м, 1H), 4,61-4,48 (м, 2H), 4,39-4,35 (м, 1H), 4,27-4,19 (м, 2H), 3,93-3,91 (м, 1H), 3,71 (с, 6H), 3,15-3,11 (м, 2H), 2,50-2,40 (м, 1H), 2,30-2,20 (м, 1H), 1,82-1,72 (м, 1H).
Стадия 3: К перемешиваемому раствору 7-((1R,2S,3R,4R)-2,3-бис(бензилокси)-4-((бис(4-метоксифенил)(фенил)метокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина (6,0 г, 7,83 ммоль) в DCM (50 мл) добавляли воду (1,411 г, 78 ммоль) и 2,2-дихлоруксусную кислоту (6% DCA в DCM) (9,09 г, 70,5 ммоль) при комнатной температуре в атмосфере аргона. Полученную смесь перемешивали в течение 15 минут при этой температуре. Затем добавляли триэтилсилан (18,21 г, 157 ммоль), полученную смесь перемешивали в течение 50 минут при этой температуре. Реакционную смесь гасили пиридином (11,2 г, 141 ммоль) при 0°C и перемешивали в течение 15 минут. Смесь подвергали азеотропной перегонке с толуолом и остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/PE) с получением ((1R,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола в виде твердого вещества. MS: 464 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,56 (с, 1H), 7,86 (д, J=3,6 Гц, 1H), 7,39-7,27 (м, 5H), 7,15-7,11 (м, 3H), 6,94-6,91 (м, 2H), 6,66 (д, J=3,6 Гц, 1H), 5,36-5,14 (м, 1H), 4,86-4,84 (м, 1H), 4,67-4,52 (м, 2H), 4,45-4,41 (м, 1H), 4,35-4,30 (м, 1H), 4,29-4,25 (м, 1H), 4,03-3,97 (м, 1H), 3,49-3,47 (м, 2H), 2,31-2,27 (м, 2H), 1,74-1,68 (м, 1H).
Стадия 4: К перемешиваемому раствору ((1R,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола (3,1 г, 6,68 ммоль) в DCM (25 мл) добавляли периодинан Десса-Мартина (5,67 г, 13,4 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение 15 минут при 0°C, затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (20 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/PE) с получением (1S,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанкарбальдегида в виде твердого вещества. MS: 462 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 9,79 (с, 1H), 8,57 (с, 1H), 7,85 (д, J=3,6 Гц, 1H), 7,43-7,33 (м, 5H), 7,18-7,13 (м, 3H), 6,96-6,93 (м, 2H), 6,70 (д, J=3,6 Гц, 1H), 5,35-5,28 (м, 1H), 4,75-4,64 (м, 2H), 4,51-4,49 (м, 2H), 4,35-4,23 (м, 2H), 3,32-3,28 (м, 1H), 2,49-2,33 (м, 2H).
Стадия 5: К перемешиваемому раствору (1S,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанкарбальдегида (2,4 г, 5,20 ммоль) в диоксане (20 мл) добавляли карбонат калия (18,8 мл, 37,7 ммоль) и формальдегид (1,01 мл, 5,20 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали в течение 16 ч при 25°C. Реакционную смесь гасили добавлением водного раствора HCl (1 M, 20 мл) для доведения до pH=7 при 0°C. Растворитель удаляли из смеси при пониженном давлении. Остаток растворяли в этаноле (20 мл), затем добавляли борогидрид натрия (0,236 г, 6,23 ммоль) при 0°C в атмосфере аргона. Реакционную смесь перемешивали при 0°C в течение примерно 2 ч. Реакционную смесь гасили водным раствором HCl (1 M, 20 мл, для доведения до pH=7) при 0°C, затем добавляли воду (50 мл) и смесь экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением ((2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,1-диил)диметанола в виде твердого вещества. MS: 494 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,54 (с, 1H), 7,83 (д, J=3,6 Гц, 1H), 7,38-7,29 (м, 5H), 7,12-7,08 (м, 3H), 6,91-6,88 (м, 2H), 6,64 (д, J=3,6 Гц, 1H), 5,29-5,19 (м, 1H), 4,89-4,85 (м, 1H), 4,73-4,69 (м, 1H), 4,61-4,59 (м, 1H), 4,55-4,49 (м, 1H), 4,48-4,46 (м, 1H), 4,39-4,35 (м, 1H), 4,31-4,27 (м, 1H), 4,09-4,07 (м, 1H), 3,61-3,51 (м, 4H), 2,08-2,00 (м, 1H), 1,71-1,63 (м, 1H).
Стадия 6: К перемешиваемому раствору ((2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,1-диил)диметанола (1,2 г, 2,429 ммоль) (подвергавшегося азеотропной перегонке с толуолом 3x) в DCM (30 мл) добавляли триэтиламин (0,737 г, 7,29 ммоль) при 0°C в атмосфере аргона. Затем добавляли (хлор(4-метоксифенил)метилен)дибензол (0,788 г, 2,55 ммоль) при этой температуре, затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (40 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением смеси ((1S,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-(((4-метоксифенил)дифенилметокси)метил)циклопентил)метанола и ((1R,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-(((4-метоксифенил)дифенилметокси)метил)циклопентил)метанола в виде твердого вещества. MS: 766 (M+1). 1H ЯМР смеси (двух региоизомеров) (400 МГц, DMSO-d6) δ 8,57-8,52 (м, 1H), 7,82 (д, J=3,6 Гц, 1H), 7,43-7,24 (м, 15H), 7,13-7,06 (м, 5H), 6,88-6,84 (м, 4H), 6,66 (д, J=3,6 Гц, 1H), 5,14-5,08 (м, 2H), 4,96-4,40 (м, 4H), 4,29-4,12 (м, 2H), 3,77-3,74 (м, 5H), 3,39-3,36 (м, 1H), 3,21-3,19 (м, 1H), 2,09-2,00 (м, 1H), 1,86-1,80 (м, 1H).
Стадия 7: К перемешиваемой смеси ((1S,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-(((4-метоксифенил)дифенилметокси)метил)циклопентил)метанола (1,45 г, 0,473 ммоль) и ((1R,2R,3S,4R)-2,3-бис(бензилокси)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-(((4-метоксифенил)дифенилметокси)метил)циклопентил)метанола (1,45 г, 1,42 ммоль) (подвергавшейся азеотропной перегонке с толуолом 3x) в DMF (15 мл) добавляли гидрид натрия (60% в минеральном масле) (0,227 г, 5,68 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение примерно 30 минут при 0°C, затем добавляли тетрабутиламмоний иодид (0,262 г, 0,710 ммоль) и (бромметил)бензол (0,728 г, 4,26 ммоль). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали при помощи EtOAc (3 × 100 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 50 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением смеси 7-((1R,2S,3R,4S)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(((4-метоксифенил)дифенилметокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде твердого вещества и 7-((1R,2S,3R,4R)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(((4-метоксифенил)дифенилметокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 856 (M+1).
Стадия 8: 7-((1R,2S,3R,4S)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(((4-метоксифенил)дифенилметокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидин (1,00 г, 0,292 ммоль) и 7-((1R,2S,3R,4R)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(((4-метоксифенил)дифенилметокси)метил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидин (1,00 г, 0,876 ммоль) растворяли в AcOH (20 мл) и воде (2,5 мл) при комнатной температуре. Затем температуру повышали до 40°C и реакционную смесь перемешивали в течение примерно 4 ч. Смесь (подвергавшуюся азеотропной перегонке с толуолом 3x) концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением смеси ((1R,2R,3S,4R)-2,3-бис(бензилокси)-1-((бензилокси)метил)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола в виде твердого вещества и ((1S,2R,3S,4R)-2,3-бис(бензилокси)-1-((бензилокси)метил)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола в виде твердого вещества. MS: 584 (M+1). 1H-ЯМР смеси двух региоизомеров (300 МГц, DMSO-d6) δ 8,51-8,49 (м, 1H), 7,78-7,66 (м, 1H), 7,37-7,26 (м, 10H), 7,11-7,07 (м, 3H), 6,89-6,86 (м, 2H), 6,59-6,54 (м, 1H), 5,26-5,16 (м, 1H), 4,74-4,24 (м, 8H), 4,09-4,07 (м, 1H), 3,66-3,50 (м, 4H), 2,08-1,97 (м, 1H), 1,79-1,71 (м, 1H).
Стадия 9: К перемешиваемой смеси ((1S,2R,3S,4R)-2,3-бис(бензилокси)-1-((бензилокси)метил)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола (500 мг, 0,642 ммоль) и ((1R,2R,3S,4R)-2,3-бис(бензилокси)-1-((бензилокси)метил)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентил)метанола (500 мг, 0,214 ммоль) (подвергавшейся азеотропной перегонке с толуолом 3x) в DCM (10 мл) добавляли DAST (310 мг, 1,93 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение примерно 16 ч при комнатной температуре. Смесь гасили насыщенным водным раствором NaHCO3 (25 мл) и экстрагировали при помощи EtOAc (3 × 50 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 25 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (50% EtOAc/PE) с получением 7-((1R,2S,3R,4S)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(фторметил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 586 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,51 (с, 1H), 7,74 (д, J=3,6 Гц, 1H), 7,39-7,33 (м, 10H), 7,15-7,06 (м, 3H), 6,90-6,87 (м, 2H), 6,61 (д, J=3,6 Гц, 1H), 5,30-5,20 (м, 1H), 4,80-4,75 (м, 2H), 4,63-4,57 (м, 5H), 4,52-4,48 (м, 1H), 4,33-4,29 (м, 1H), 4,15 (д, J=4,2 Гц, 1H), 3,63-3,61 (м, 2H), 2,10-1,89 (м, 2H).
Стадия 10: К перемешиваемой смеси 7-((1R,2S,3R,4S)-2,3-бис(бензилокси)-4-((бензилокси)метил)-4-(фторметил)циклопентил)-4-хлор-7H-пирроло[2,3-d]пиримидина (395 мг, 0,674 ммоль) (подвергавшегося азеотропной перегонке с толуолом 3x) в DCM (6 мл) добавляли трихлорборан (1 M в DCM) (6,74 мл, 6,74 ммоль) при -80°C в атмосфере аргона. Полученную смесь перемешивали в течение примерно 60 минут при -80°C. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (5 мл). Смесь очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (1S,2R,3S,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)-3-(гидроксиметил)циклопентан-1,2-диола в виде твердого вещества. MS: 316 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,63 (с, 1H), 7,92 (д, J=3,6 Гц, 1H), 6,71 (д, J=3,6 Гц, 1H), 5,18-5,04 (м, 2H), 4,94-4,92 (м, 2H), 4,73-4,34 (м, 3H), 3,90-3,87 (м, 1H), 3,55-3,45 (м, 2H), 2,04-1,96 (м, 1H), 1,70-1,62 (м, 1H).
Стадия 11: К перемешиваемой смеси (1S,2R,3S,5R)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)-3-(гидроксиметил)циклопентан-1,2-диола (178 мг, 0,564 ммоль) (подвергавшегося азеотропной перегонке с толуолом 3x) в ацетоне (5 мл) добавляли 4-метилбензолсульфоновую кислоту (9,71 мг, 0,056 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение примерно 5 минут при 0°C, затем добавляли 2,2-диметоксипропан (294 мг, 2,82 ммоль) при этой температуре. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (10 мл) и экстрагировали при помощи EtOAc (3 × 30 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 10 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением ((3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола в виде твердого вещества. MS: 356 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,67 (с, 1H), 8,01 (д, J=3,6 Гц, 1H), 6,75 (д, J=3,6 Гц, 1H), 5,29-5,23 (м, 1H), 5,18 (т, J=4,2 Гц, 1H), 5,04 (т, J=6,8 Гц, 1H), 4,68-4,60 (м, 2H), 4,56-4,48 (м, 1H), 3,53-3,45 (м, 2H), 2,24-2,15 (м, 2H), 1,50 (с, 3H), 1,24 (с, 3H).
Стадия 12: К перемешиваемому раствору оксалилдихлорида (0,103 мл, 1,22 ммоль) в безводном DCM (5 мл) добавляли (метилсульфинил)метан (0,174 мл, 2,445 ммоль) при -78°C в атмосфере аргона, смесь перемешивали в течение 0,5 ч при -78°C. Затем к смеси добавляли по каплям раствор ((3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (145 мг, 0,408 ммоль) в безводном DCM (3 мл) при -78°C. Смесь перемешивали еще в течение 0,5 ч при -78°C. При этой температуре к реакционной смеси добавляли триэтиламин (0,568 мл, 4,08 ммоль) затем и полученную смесь перемешивали в течение 0,5 ч при комнатной температуре. Реакцию гасили H2O (10,0 мл) при 0°C и экстрагировали при помощи DCM (20 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (10 × 3 мл), насыщенным солевым раствором (10 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении с получением (3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида в виде масла. MS: 354 (M+1).
Стадия 13: Бром(метил)трифенилфосфоран (367 мг, 1,03 ммоль) растворяли в THF (4 мл) при -30°C в атмосфере аргона, затем бутиллитий (2,5 M в гексане) (0,382 мл, 0,954 ммоль) добавляли по каплям при этой температуре. Реакционную смесь перемешивали при -10°C в течение примерно 30 минут. Затем добавляли (3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегид (130 мг, 0,367 ммоль) в THF (2 мл) при -30°C. Реакционную смесь перемешивали в течение примерно 1 ч при комнатной температуре. Реакционную смесь гасили добавлением насыщенного водного раствора NH4Cl (10 мл) при -40°C и экстрагировали при помощи EtOAc (3 × 30 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 10 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (2:1=PE:EtOAc) с получением 4-хлор-7-((3aS,4R,6S,6aR)-6-(фторметил)-2,2-диметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина. MS: 352 (M+1). 1H-ЯМР (300 МГц, DMSO-d6): δ 8,67 (с, 1H), 8,00 (д, J=3,6 Гц, 1H), 6,73 (д, J=3,6 Гц, 1H), 6,06-5,96 (м, 1H), 5,31-5,08 (м, 4H), 4,79-4,77 (м, 1H), 4,65-4,58 (м, 1H), 4,49-4,42 (м, 1H), 2,49-2,44 (м, 2H), 1,48 (с, 3H), 1,24 (с, 3H).
Стадия 14: 4-хлор-7-((3aS,4R,6S,6aR)-6-(фторметил)-2,2-диметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин (100 мг, 0,284 ммоль) растворяли в 5 мл диоксана и гидрата аммиака (28% в воде)) (5 мл, 36,4 ммоль) в герметично закрытой пробирке. Реакционную смесь перемешивали при 90°C в течение примерно 16 ч. Смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением 7-((3aS,4R,6S,6aR)-6-(фторметил)-2,2-диметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 333 (M+1). 1H ЯМР (300 МГц, DMSO-d6): δ 8,07 (с, 1H), 7,36 (д, J=3,6 Гц, 1H), 6,99 (с, 2H), 6,58 (д, J=3,6Гц, 1H), 6,07-5,98 (м, 1H), 5,26-5,17 (м, 3H), 5,08-5,04 (м, 1H), 4,77-4,74 (м, 1H), 4,68-4,52 (м, 1H), 4,49-4,42 (м, 1H), 2,39-2,35 (м, 2H), 1,48 (с, 3H), 1,25 (с, 3H).
Стадия 15: В атмосфере аргона 7-((3aS,4R,6S,6aR)-6-(фторметил)-2,2-диметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин (20 мг, 0,060 ммоль) растворяли в 9-BBN (0,5 M в THF, 0,602 мл, 0,301 ммоль) при комнатной температуре и смесь перемешивали в течение 1 ч при 60°C. Смесь охлаждали до 0°C и добавляли раствор K3PO4 (63,9 мг, 0,301 ммоль) в 0,30 мл H2O. Смесь перемешивали в течение 0,5 ч при комнатной температуре. Затем к смеси добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (28,2 мг, 0,060 ммоль) в 0,90 мл безводного THF и Pd(dppf)Cl2 (7,37 мг, 9,03 мкмоль), соответственно. Полученную смесь подвергали микроволновому облучению при 70°C в течение 3 ч. Органический слой отделяли и концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной ТСХ (DCM/MeOH=15:1) с получением 7-(2-((3aR,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 675/677 (M+1/M+3).
Стадия 16: В атмосфере аргона 7-(2-((3aR,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(фторметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амин (45 мг, 0,067 ммоль) растворяли в растворе TFA в H2O (2,0 мл, TFA/H2O=1:1) при температуре окружающей среды. Реакционную смесь перемешивали в течение 1 ч при 50°C. Реакционную смесь подвергали азеотропной перегонке с толуолом 3x для удаления TFA. Неочищенный продукт очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора). Продукт дополнительно очищали препаративной ВЭЖХ (ACN/вода с 6,3 мМ NH4HCO3 модификатора) с получением желаемого продукта (1S,2R,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)циклопентан-1,2-диола в виде твердого вещества. MS: 515/517 (M+1/M+3). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,34 (с, 1H), 8,04 (с, 1H), 7,60 (д, J=8,1 Гц, 1H), 7,36 (с, 1H), 7,28 (д, J=3,6 Гц, 1H), 7,17-7,14 (м, 1H), 6,92 (шир.с, 2H), 6,58-6,53 (м, 3H), 4,95-4,83 (м, 3H), 4,79-4,38 (м, 3H), 3,85 (т, J=4,2 Гц, 1H), 2,86-2,69 (м, 2H), 2,01-1,76 (м, 4H).
Пример 103
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол
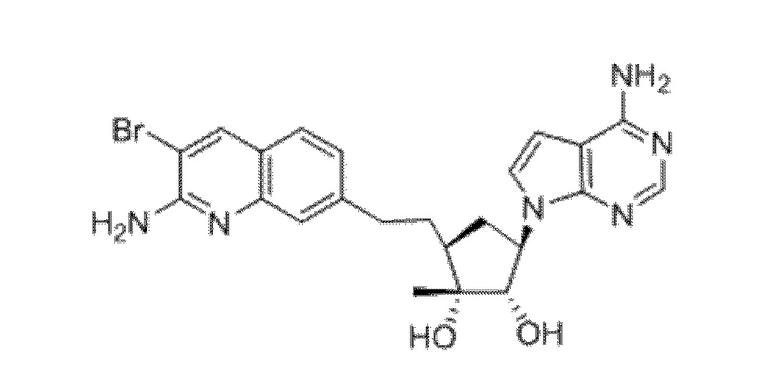
Стадия 1: В атмосфере аргона к раствору оксалилдихлорида (1015 мг, 7,99 ммоль) в безводном DCM (10 мл) добавляли DMSO (1249 мг, 15,99 ммоль) при -78°C. Смесь перемешивали в течение 0,5 ч при -78°C. Затем к смеси добавляли по каплям раствор ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (900 мг, 2,66 ммоль) в безводном DCM (10 мл) при -78°C. Смесь перемешивали еще в течение 0,5 ч при -78°C. При этой температуре к реакционной смеси добавляли TEA (2,70 мг, 26,6 ммоль) и полученную смесь перемешивали в течение 0,5 ч при -78°C. Реакцию гасили H2O (10 мл) при 0°C. Смесь экстрагировали при помощи DCM (50 мл), промывали насыщенным водным раствором NaHCO3 (3 × 30 мл), насыщенным солевым раствором (30 мл). Объединенные органические слои сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного продукта (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида в виде твердого вещества. MS: 336 (M+1).
Стадия 2: К перемешиваемому раствору метилтрифенилфосфоний бромида (2,7 г, 7,50 ммоль) в безводном THF (4,0 мл) добавляли n-BuLi (2,5 M в THF, 2,79 мл, 6,97 ммоль) по каплям при -10°C в атмосфере аргона. Реакционную смесь перемешивали в течение 0,5 ч при комнатной температуре. Затем к смеси добавляли раствор (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида (900 мг, 2,68 ммоль) в безводном THF (6,0 мл) при -10°C. Смесь перемешивали в течение 1,5 ч при комнатной температуре. Реакционную смесь разбавляли DCM (50 мл) и промывали водой (50 мл) и насыщенным солевым раствором (50 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали колоночной хроматографией на диоксиде кремния (EtOAc/PE 0-30%) с получением 4-хлор-7-((3aS,4R,6R,6aR)-2,2,6a-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 334 (M+1).
Стадия 3: В герметично закрываемую пробирку добавляли 4-хлор-7-((3aS,4R,6R,6aR)-2,2,6a-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин (800 мг, 2,40 ммоль), 1,4-диоксан (12 мл) и NH3•H2O (25%, 16 мл) при комнатной температуре. Смесь плотно закрывали и затем перемешивали при 90°C в течение 16 ч. Затем реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением 7-((3aS,4R,6R,6aR)-2,2,6a-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 315 (M+1).
Стадия 4: К перемешиваемому раствору 7-((3aS,4R,6R,6aR)-2,2,6a-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина (100 мг, 0,32 ммоль) в безводном THF (0,5 мл) добавляли 9-BBN (0,5 M в THF, 3,18 мл, 1,59 ммоль) по каплям при 0°C в атмосфере аргона. Реакционный раствор перемешивали при 50°C в течение 1 ч. К реакционному раствору добавляли раствор трехосновного фосфата калия (336 мг, 1,581 ммоль) в воде (1 мл) по каплям при 0°C. Реакционный раствор перемешивали при комнатной температуре в течение 0,5 ч. Добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (163 мг, 0,348 ммоль) в THF (1 мл) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном (25,8 мг, 0,032 ммоль) при комнатной температуре. Полученную реакционную смесь подвергали микроволновому облучению при 70°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой (5 мл) и экстрагировали при помощи EtOAc (2 × 20 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали на системе Combi-flash (Колонка: AQ-C18 колонка, 80 г, 60Å, 40-60 мкм; Подвижная фаза A: вода, Подвижная фаза B: MeCN; Скорость потока: 50 мл/мин; Градиент: 20% B до 90% B за 60 минут (80% удерживание 5 мин)) с получением 7-(2-((3aR,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 657/659 (M+1/M+3).
Стадия 5: Раствор 7-(2-((3aR,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина (40 мг, 0,061 ммоль) в TFA (2 мл, 26,0 ммоль) перемешивали при 60°C в течение 1 ч. TFA удаляли при пониженном давлении с получением неочищенного продукта N-(7-(2-((1S,2R,3S,4R)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-дигидрокси-2-метилциклопентил)этил)-3-бромхинолин-2-ил)-2,2,2-трифторацетамида в виде масла. Смесь N-(7-(2-((1S,2R,3S,4R)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-дигидрокси-2-метилциклопентил)этил)-3-бромхинолин-2-ил)-2,2,2-трифторацетамида (40 мг, 0,067 ммоль) и K2CO3 (28 мг, 0,202 ммоль) в метаноле (3 мл) перемешивали при 60°C в течение 1 ч. Смесь фильтровали и промывали при помощи MeOH (0,5 мл). Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода) с получением (1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диола в виде твердого вещества. MS: 497/499 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,32 (с, 1H), 8,03 (с, 1H), 7,58 (д, J=8,0 Гц, 1H), 7,32 (с, 1H), 7,25 (д, J=3,6 Гц, 1H), 7,11 (д, J=8,0 Гц, 1H), 6,87 (шир.с, 2H), 6,55-6,54 (м, 3H), 4,85 (д, J=6,8 Гц, 1H), 4,80-4,77 (м, 1H), 4,18 (с, 1H), 3,98-3,94 (м, 1H), 2,78-2,73 (м, 1H), 2,59-2,50 (м, 1H), 2,32-2,27 (м, 1H), 1,91-1,83 (м, 2H), 1,63-1,57 (м, 2H), 1,15 (с, 3H).
Пример 104
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-аминохинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-3,3a-диол
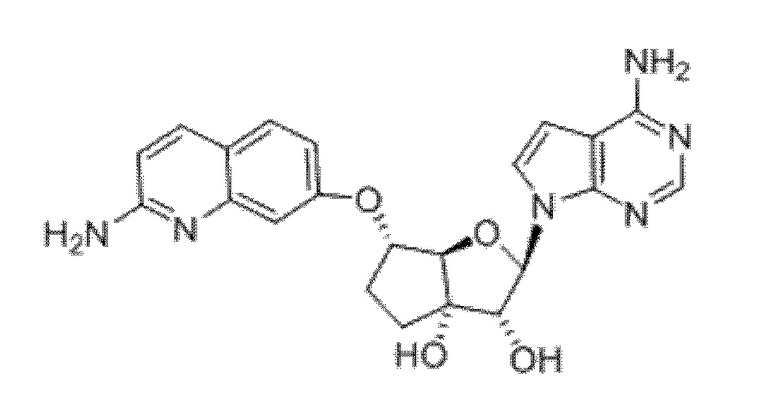
Стадия 1: К раствору (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (45 мг, 0,088 ммоль) в MeOH (6 мл) добавляли дигидроксипалладий на углероде (18,5 мг, 0,026 ммоль) при температуре окружающей среды. Полученную смесь перемешивали при 25°C в течение 30 минут в атмосфере водорода (1,2 атм). Затем реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с модификатором 0,05% TFA). Продукт-содержащие фракции собирали и значение pH раствора доводили до 7~8 при помощи NH3•H2O (25%). Затем раствор концентрировали при пониженном давлении и дополнительно очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-аминохинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 435 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,09 (с, 1H), 7,76 (д, J=9,0 Гц, 1H), 7,52-7,49 (м, 2H), 7,05 (шир.с, 2H), 6,80-6,75 (м, 2H), 6,66 (д, J=3,3 Гц, 1H), 6,55 (д, J=8,7 Гц, 1H), 6,30 (шир.с, 2H), 6,02 (д, J=8,4 Гц, 1H), 5,36 (д, J=7,2 Гц, 1H), 5,30 (с, 1H), 4,59 (д, J=4,5 Гц, 1H), 4,40 (т, J=7,8 Гц, 1H), 4,09-4,08 (м, 1H), 2,50-2,48 (м, 1H), 2,07-1,98 (м, 3H).
Пример 105
(1R,2S,3R,5R)-5-(((2-аминохинолин-7-ил)окси)метил)-1-метил-3-(7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол
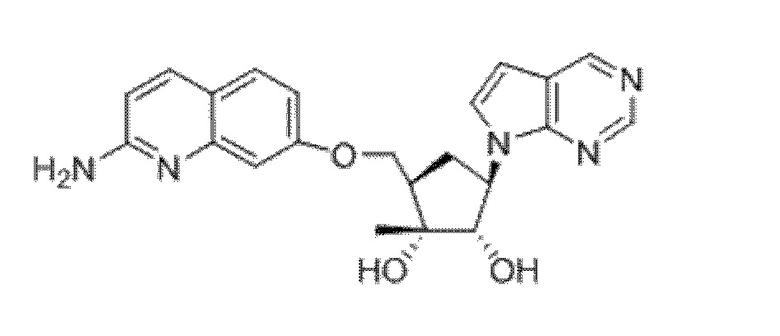
Стадия 1: К раствору (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диола (20 мг, 0,039 ммоль) в MeOH (4 мл) добавляли триэтиламин (7,80 мг, 0,077 ммоль) и безводный Pd/C (10 мг) (10% Pd/C) в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в атмосфере водорода (~ 1 атм) в течение 4 ч. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (1R,2S,3R,5R)-5-(((2-аминохинолин-7-ил)окси)метил)-1-метил-3-(7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 406 (M+1). 1H-ЯМР (400 МГц, DMSO-d6): δ 8,98 (с, 1H), 8,75 (с, 1H), 7,80-7,76 (м, 2H), 7,52 (д, J=8,8 Гц, 1H), 6,94 (д, J=2,4 Гц, 1H), 6,84 (дд, J=8,8, 2,4 Гц, 1H), 6,68 (д, J=3,6 Гц, 1H), 6,58 (д, J=8,8 Гц, 1H), 6,30 (шир.с, 2H), 5,14 (кв., J=9,6 Гц, 1H), 4,95 (д, J=6,8 Гц, 1H), 4,48 (с, 1H), 4,23-4,10 (м, 3H), 2,48-2,37 (м, 2H), 1,80-1,73 (м, 1H), 1,26 (с, 3H).
Пример 106
(1R,2S,3R,5R)-5-(((2-амино-3-метилхинолин-7-ил)окси)метил)-1-метил-3-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол
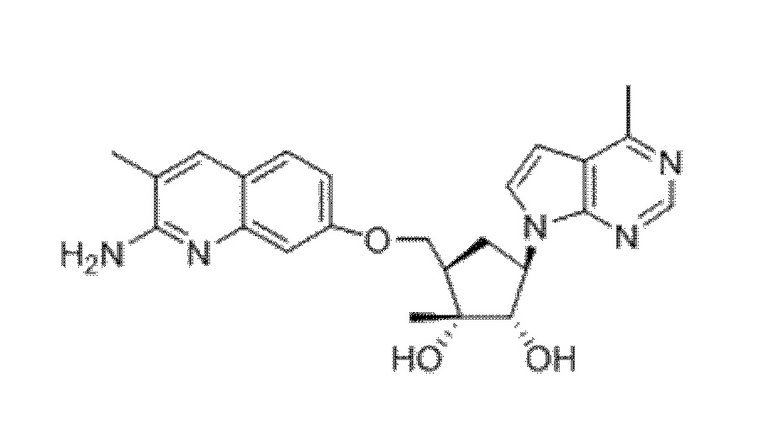
Стадия 1: К смеси (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диола (20 мг, 0,039 ммоль) и Pd(PPh3)4 (4,45 мг, 3,86 мкмоль) в безводном THF (1 мл) по каплям добавляли триметилалюминий (2 M в толуоле, 0,058 мл, 0,116 ммоль) при комнатной температуре в атмосфере аргона. Смесь перемешивали при 100°C в течение 2 ч. После охлаждения до температуры окружающей среды смесь осторожно выливали в водный раствор HCl (1 M, 10 мл). Смесь распределяли между EtOAc (40 мл) и H2O (10 мл). Водный слой концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (1R,2S,3R,5R)-5-(((2-амино-3-метилхинолин-7-ил)окси)метил)-1-метил-3-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 434 (M+1). 1H-ЯМР (400 МГц, DMSO-d6): δ 8,60 (с, 1H), 7,71 (д, J=3,6 Гц, 1H), 7,63 (с, 1H), 7,48 (д, J=8,4 Гц, 1H), 6,95 (д, J=2,0 Гц, 1H), 6,84 (дд, J=8,4, 2,0 Гц, 1H), 6,71 (д, J=3,6 Гц, 1H), 6,12 (шир.с, 2H), 5,10 (кв., J=9,6 Гц, 1H), 4,91 (д, J=7,2 Гц, 1H), 4,45 (с, 1H), 4,21-4,09 (м, 3H), 2,64 (с, 3H), 2,46-2,37 (м, 2H), 2,17 (с, 3H), 1,79-1,72 (м, 1H), 1,26 (с, 3H).
Пример 107
(2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
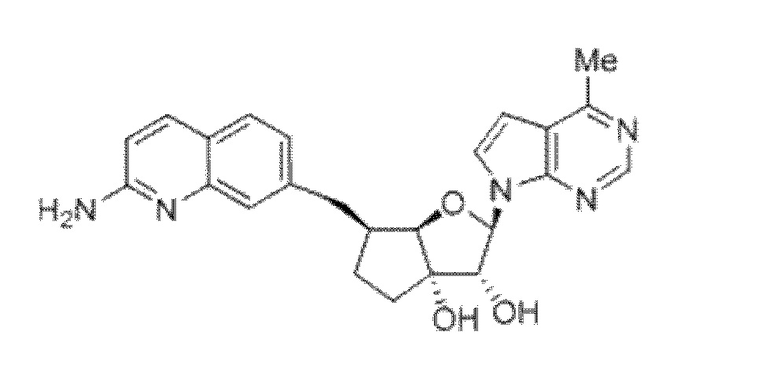
Стадия 1: К раствору (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (20 мг, 0,039 ммоль) в MeOH (5 мл) добавляли триэтиламин (3,97 мг, 0,039 ммоль) и безводный Pd/C (10 мг) (10% Pd/C) в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в атмосфере водорода (1,2 атм) в течение 30 минут. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 ММ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 432 (M+1). 1H-ЯМР (400 МГц, DMSO-d6): δ 8,69 (с, 1H), 7,87 (д, J=3,6 Гц, 1H), 7,79 (д, J=8,8 Гц, 1H), 7,48 (д, J=8,0 Гц, 1H), 7,22 (с, 1H), 7,00 (дд, J=8,0, 1,6 Гц, 1H), 6,82 (д, J=3,6 Гц, 1H), 6,66 (д, J=8,8 Гц, 1H), 6,31 (шир.с, 2H), 6,01 (д, J=8,0 Гц, 1H), 5,29 (д, J=7,2 Гц, 1H), 5,11 (с, 1H), 4,22 (т, J=7,6 Гц, 1H), 4,01 (д, J=5,6 Гц, 1H), 2,84-2,78 (м, 1H), 2,69 (с, 3H), 2,63-2,58 (м, 1H), 2,28-2,25 (м, 1H), 1,98-1,94 (м, 1H), 1,80-1,68 (м, 2H), 1,58-1,53 (м, 1H).
Пример 108
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
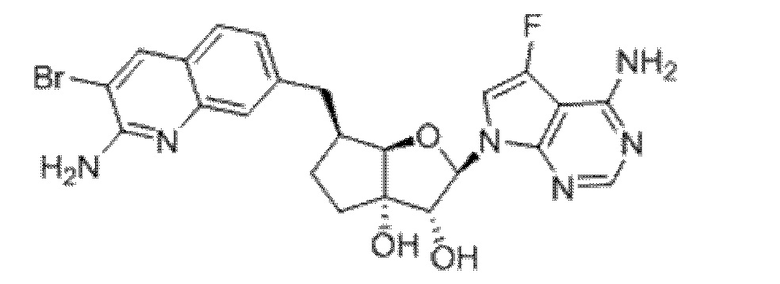
Стадия 1: В высушенный в печи и охлажденный аргоном сосуд, содержащий (3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триол (132,5 мг, 0,257 ммоль), растворенный в безводном ацетонитриле (2,5 мл), добавляли 1,1'-(азодикарбонил)дипиперидин (97 мг, 0,386 ммоль) с последующим добавлением три-н-бутилфосфина (103 мкл, 0,411 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч. В отдельный высушенный в печи и охлажденный аргоном сосуд, содержащий 4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин (88 мг, 0,514 ммоль), растворенный в безводном ацетонитриле (2,5 мл), добавляли DBU (78 мкл, 0,514 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут и эту суспензию переносили в первый раствор через шприц. Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 7,5 ч и затем гасили водой и экстрагировали при помощи EtOAc (3x). Объединенные органические слои затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-50% 3:1 EtOAc:EtOH в гексане) с получением (2R,3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде масла. MS: 668 (M+1).
Стадия 2: В сосуд, содержащий (2R,3R,3aS,6aR)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-2-(4-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол (138 мг, 0,206 ммоль), добавляли аммиак (7 M в MeOH, 2,5 мл, 17,50 ммоль). Сосуд закрывали и нагревали при 140°C в микроволновом реакторе в течение 5 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (0-70% 3:1 EtOAc:EtOH в гексане) с получением (2R,3R,3aS,6aR)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 649 (M+1).
Стадия 3: К (2R,3R,3aS,6aR)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-3,3a-диолу (68 мг, 0,105 ммоль), растворенному в DCM (875 мкл), добавляли TFA (348 мкл, 4,516 ммоль) при комнатной температуре и перемешивали в течение 4 ч. К реакционной смеси добавляли TFA (500 мкл, 6,489 ммоль) и перемешивали в течение ночи при комнатной температуре. Смесь нагревали до 40°C в течение 8 ч. Реакционную смесь концентрировали при пониженном давлении и очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 668 (M+1). 1H ЯМР (600 МГц, DMSO-d6) δ 8,32 (с, 1H), 8,10 (с, 1H), 7,55 (д, J=8,3 Гц, 1H), 7,51 (д, J=1,7 Гц, 1H), 7,29 (с, 1H), 7,12-6,98 (м, 3H), 6,59 (с, 2H), 5,94 (дд, J=8,2, 1,5 Гц, 1H), 5,28 (д, J=7,0 Гц, 1H), 5,09 (с, 1H), 4,01 (т, J=7,5 Гц, 1H), 3,94 (д, J=5,8 Гц, 1H), 2,85-2,79 (м, 1H), 2,65-2,59 (м, 1H), 2,28-2,20 (м, 1H), 1,95-1,89 (м, 1H), 1,79-1,69 (м, 1H), 1,69-1,62 (м, 1H), 1,54-1,47 (м, 1H).
Пример 109
(1S,2R,3S,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол
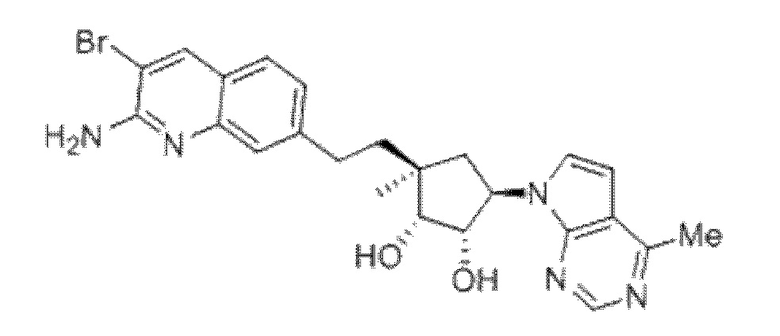
Стадия 1: В микроволновой сосуд добавляли 4-хлор-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин (0,075 г, ,2 ммоль), Pd на твердой подложке (0,077 г, 0,020 ммоль), THF (1 мл) и диметилцинк (2 M в PhMe, 0,5 мл, 1,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь осторожно гасили при помощи IPA, затем по каплям добавляли MeOH. Реакционную смесь фильтровали через слой Целита, промывали при помощи DCM/EtOAc, затем концентрировали при пониженном давлении с получением 4-метил-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидина. MS: 354 (M+1).
Стадия 2: В сосуд добавляли 4-метил-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин (70,7 мг, 0,2 ммоль), THF (1 мл) и 9-BBN (0,5 M в THF, 1 мл, 0,500 ммоль). Реакционную смесь нагревали до 50°C в течение 2 ч, затем охлаждали до комнатной температуры. Добавляли еще одну порцию 9-BBN (0,5 M в THF, 1 мл, 0,5 ммоль) и реакционную смесь нагревали до 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и гасили при помощи K3PO4 (2 M в воде, 0,75 мл, 1,50 ммоль) в атмосфере азота. В отдельный сосуд добавляли 3-бром-N-(2,4-диметоксибензил)-7-иодхинолин-2-амин (100 мг, 0,20 ммоль), 1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (16,3 мг, 0,020 ммоль) в THF (0,5 мл). Эту суспензию добавляли в первый реакционный сосуд и смесь нагревали до 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc, DCM и водой. Органический и водный слои разделяли, пропуская через фазовый разделитель, и органический слой концентрировали при пониженном давлении с получением 3-бром-N-(2,4-диметоксибензил)-7-(2-((3a'R,4'S,6'R,6a'S)-4'-метил-6'-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ил)этил)хинолин-2-амина. MS: 726/728 (M+1/M+3).
Стадия 3: Раствор 3-бром-N-(2,4-диметоксибензил)-7-(2-((3a'R,4'S,6'R,6a'S)-4'-метил-6'-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-4'-ил)этил)хинолин-2-амина (0,2 ммоль) в THF (1 мл), воде (0,3 мл, 16,7 ммоль) и TFA (0,7 мл, 9,09 ммоль) перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем нагревали до 50°C в течение 3 ч. Добавляли еще одну порцию TFA (1 мл, 13 ммоль) при комнатной температуре и реакционную смесь нагревали до 50°C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатор) с получением (1S,2R,3S,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 496/498 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,29 (с, 1H), 8,03 (с, 1H), 7,59 (д, J=9,2 Гц, 1H), 7,31 (д, J=3,6 Гц, 1H), 6,98-6,92 (м, 2H), 6,89 (шир.с, 2H), 6,55 (д, J=3,2 Гц, 1H), 6,51 (шир.с, 2H), 5,03-4,96 (м, 1H), 4,85 (д, J=6,8 Гц, 1H), 4,75 (д, J=4,8 Гц, 1H), 4,56-4,50 (м, 1H), 4,03 (д, J=9,2 Гц, 1H), 3,97-3,91 (м, 2H), 1,93 (д, J=9,6 Гц, 2H), 1,19 (с, 3H).
Пример 110: Пример 110 в Таблице 24 синтезировали с использованием стадии 2, а затем стадии 1 & 3 примера 109. 4-метил-7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин на стадии 2 заменяли подходящим экзо-олефином. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
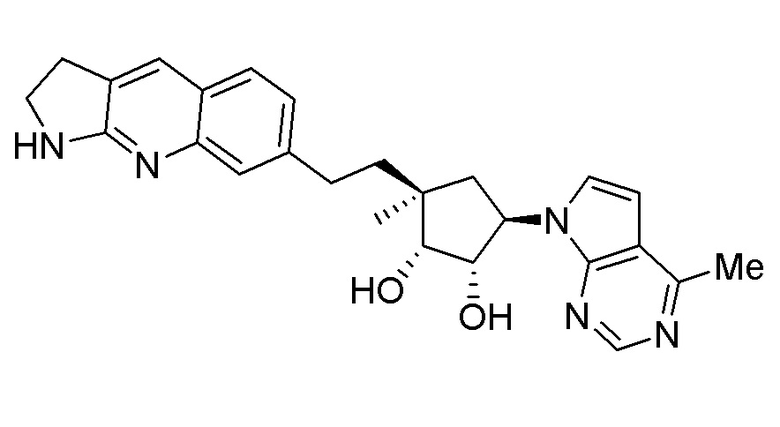
Пример 111
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол
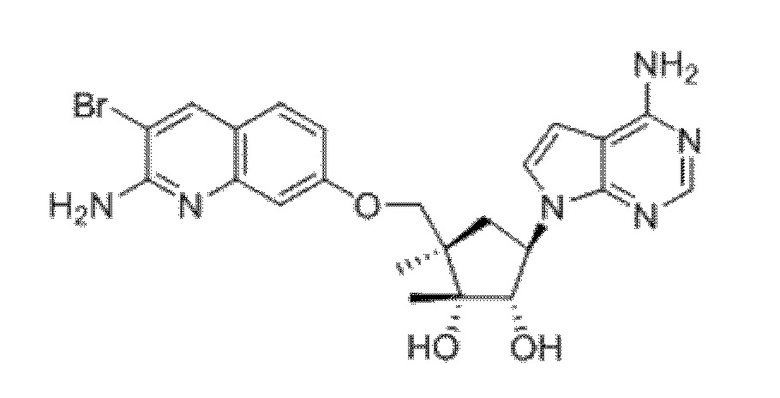
Стадия 1: В сосуд загружали смесь 3-бром-N-(4-метоксибензил)-7-(((3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метокси)хинолин-2-амина (100 мг, 0,136 ммоль) в 50% водном растворе TFA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли при пониженном давлении и остаток очищали препаративной ТСХ (DCM:MeOH=17:1) с получением (1S,2R,3R,5R)-3-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 696/698 (M+1/M+3).
Стадия 2: К перемешиваемому раствору (1S,2R,3R,5R)-3-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-3-метил-5-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола (60 мг, 0,086 ммоль), N-этил-N-изопропилпропан-2-аминий хлорида (0,428 мг, 2,58 мкмоль) и (2R,4S)-4-изопропил-2-метокси-3-((R)-2-метил-1-(1-метил-1H-имидазол-2-ил)пропил)оксазолидина (49 мг, 0,172 ммоль) в THF (0,2 мл) добавляли DIEA (0,045 мл, 0,258 ммоль) и трет-бутилдиметилсилил трифторметансульфонат (34,2 мг, 0,129 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию гасили 10 мл воды и экстрагировали при помощи EtOAc (15 мл × 3). Органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (PE/EtOAc=3:1 с получением (1R,2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-2-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанола в виде масла. MS: 810/812 (M+1/M+3). 1H-ЯМР (300 МГц, Хлороформ-d) δ 8,46 (с, 1H), 8,05 (с, 1H), 7,50-7,44 (м, 3H), 7,40-7,38 (м, 2H), 7,33-7,30 (м, 1H), 7,29-7,25 (м, 4H), 6,99-6,91 (м, 3H), 6,54 (д, J=3,6 Гц, 1H), 5,60-5,58 (м, 1H), 5,31-5,22 (м, 1H), 4,91-4,86 (м, 1H), 4,77 (с, 2H), 4,08-4,04 (м, 3H), 3,84 (с, 3H), 2,83-2,82 (м, 1H), 2,49-2,41 (м, 1H), 2,22-2,14 (м, 1H), 1,34 (с, 3H), 0,79 (с, 9H), - 0,14 (с, 3H), - 0,38 (с, 3H).
Стадия 3: К перемешиваемому раствору (1R,2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-2-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанола (20 мг, 0,025 ммоль) в DCM (0,5 мл) добавляли периодинан Десса-Мартина (20,92 мг, 0,049 ммоль) одной порцией при 0°C в атмосфере аргона. Смесь перемешивали при 0°C в течение 2 ч. Реакцию гасили 5 мл насыщенного водного раствора Na2S2O3 и экстрагировали при помощи EtOAc (5 мл × 3). Органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-2-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанона. MS: 808/810 (M+1/M+3)
Стадия 4: Порцию хлорида церия (III) (37,0 мг, 0,150 ммоль) сушили при 140°C в вакууме в течение 1 ч. Полученный порошок охлаждали в атмосфере аргона. Добавляли безводный THF (0,25 мл) и затем к смеси добавляли метиллитий (1,6 M в простом эфире, 0,094 мл, 0,150 ммоль) при -78°C. Смесь перемешивали при этой температуре в течение 1 ч. Затем быстро добавляли охлажденный раствор (2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-2-метил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанона (20,22 мг, 0,025 ммоль) в THF (0,25 мл) и полученную смесь продолжали перемешивать при этой температуре в течение 6 ч. Реакцию гасили насыщенным водным раствором NH4Cl (5 мл) и смесь экстрагировали при помощи EtOAc (5 мл × 3). Органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (PE/EA=4:1) с получением (1R,2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-1,2-диметил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанола в виде масла. MS: 824/826 (M+1/M+3). 1H-ЯМР (400 МГц, Хлороформ-d) δ 8,41 (с, 1H), 8,08 (с, 1H), 7,53 (д, J=8,8 Гц, 1H), 7,49-7,44 (м, 3H), 7,41-7,38 (м, 2H), 7,28-7,24 (м, 4H), 6,98-6,93 (м, 4H), 6,52 (д, J=3,2 Гц, 1H), 5,63-5,60 (м, 1H), 5,43-5,36 (м, 1H), 4,86 (д, J=8,8 Гц, 1H), 4,79 (с, 2H), 4,17 (д, J=9,2 Гц, 1H), 3,97 (д, J=9,2 Гц, 1H), 3,84 (с, 3H), 2,40-2,32 (м, 2H), 1,27 (с, 3H), 1,22 (с, 3H), 0,78 (с, 9H), 0,03 (с, 3H), -0,04 (с, 3H).
Стадия 5: К перемешиваемому раствору (1R,2R,4R,5S)-2-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-5-((трет-бутилдиметилсилил)окси)-1,2-диметил-4-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентанола (35 мг, 0,042 ммоль) в THF (2 мл) добавляли TBAF (1 M в THF, 0,084 мл, 0,084 ммоль) при 0°C. Смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным водным раствором NH4Cl (20 мл) и экстрагировали при помощи EtOAc (30 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали препаративной ТСХ (PE:EA=1:1) с получением (1R,2S,3R,5R)-5-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-1,5-диметил-3-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 710/712 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,31 (с, 1H), 8,24 (с, 1H), 7,67 (д, J=3,6 Гц, 1H), 7,60 (д, J=8,8 Гц, 1H), 7,49-7,45 (м, 2H), 7,35-7,25 (м, 5H), 7,15-7,12 (м, 1H), 7,07 (с, 1H), 6,94 (д, J=8,4 Гц, 1H), 6,88 (д, J=8,0 Гц, 2H), 6,52-6,51 (м, 1H), 5,19-5,14 (м, 1H), 4,99 (д, J=7,6 Гц, 1H), 4,67 (д, J=6,0 Гц, 2H), 4,56 (т, J=8,8 Гц, 1H), 4,38 (с, 1H), 4,14-4,11 (м, 1H), 3,96-3,94 (м, 1H), 3,71 (с, 3H), 2,17-2,11 (м, 1H), 2,05-2,02 (м, 1H), 1,19-1,16 (м, 6H).
Стадия 6: Раствор (1R,2S,3R,5R)-5-(((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)окси)метил)-1,5-диметил-3-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола (17 мг, 0,024 ммоль) в TFA (1 мл) перемешивали при 50°C в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (DCM:MeOH=12:1) с получением (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-1,5-диметил-3-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диола в виде твердого вещества. MS: 590/592 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,29 (с, 1H), 8,21 (с, 1H), 7,66 (д, J=3,6 Гц, 1H), 7,60 (д, J=8,8 Гц, 1H), 7,50-7,45 (м, 2H), 7,31-7,28 (м, 1H), 7,26-7,24 (м, 2H), 7,03-7,02 (м, 1H), 6,96-6,94 (м, 1H), 6,54 (шир.с, 2H), 6,52 (д, J=3,6 Гц, 1H), 5,15 (кв., J=9,6 Гц, 1H), 5,00 (д, J=7,2 Гц, 1H), 4,57-4,53 (м, 1H), 4,39 (с, 1H), 4,13 (д, J=9,6 Гц, 1H), 3,93 (д, J=9,6 Гц, 1H), 2,21-2,02 (м, 2H), 1,17-1,16 (м, 6H).
Стадия 7: (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-1,5-диметил-3-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол (13 мг, 0,022 ммоль) растворяли в NH3 (жидкость)/i-PrOH (об.:об. = 5:1)) (10 мл) при температуре окружающей среды в герметично закрытой пробирке. Затем реакционную смесь перемешивали при 130°C в течение 48 ч. Реакционную смесь концентрировали при пониженном давлении и очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 ммоль NH4HCO3 модификатора) с получением (1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диола в виде твердого вещества. MS: 513/515 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,30 (с, 1H), 7,93 (с, 1H), 7,60 (д, J=8,8 Гц, 1H), 7,27 (д, J=3,2 Гц, 1H), 7,01 (с, 1H), 6,96-6,85 (м, 3H), 6,60-6,51 (м, 3H), 5,02-4,95 (м, 2H), 4,49 (д, J=8,8 Гц, 1H), 4,30 (с, 1H), 4,26 (д, J=9,2 Гц, 1H), 4,12 (д, J=9,2 Гц, 1H), 2,01-1,94 (м, 2H), 1,21 (с, 6H).
Примеры 112 и 113
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол & (2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
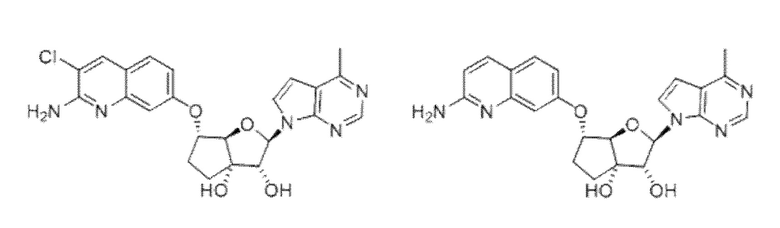
Стадия 1: К перемешиваемому раствору (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (200 мг, 0,390 ммоль) в EtOH (20 мл) добавляли мономедный(I) мономедный(III) оксид (84 мг, 0,586 ммоль), тетраметилхлорид аммония (428 мг, 3,90 ммоль) и (S)-пирролидин-2-карбоновую кислоту (135 мг, 1,17 ммоль) при температуре окружающей среды. Смесь перемешивали при 110°C в течение ночи. Полученную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 468 (M+1). 1H-ЯМР (400 МГц, Метанол-d4) δ 8,69 (с, 1H), 8,00 (с, 1H), 7,75 (д, J=3,6 Гц, 1H), 7,55 (д, J=8,8 Гц, 1H), 6,99-6,94 (м, 2H), 6,82 (д, J=3,6 Гц, 1H), 6,18 (д, J=8,0 Гц, 1H), 4,78 (д, J=4,8 Гц, 1H), 4,64 (д, J=8,0 Гц, 1H), 4,35-4,33 (м, 1H), 2,76 (с, 3H), 2,59-2,49 (м, 1H), 2,28-2,19 (м, 3H). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,70 (с, 1H), 8,09 (с, 1H), 7,96 (д, J=3,6 Гц, 1H), 7,57 (д, J=8,8 Гц, 1H), 6,88-6,84 (м, 3H), 6,62 (шир.с, 2H), 6,15 (д, J=8,4 Гц, 1H), 5,46 (д, J=7,2 Гц, 1H), 5,40 (с, 1H), 4,64 (д, J=5,6 Гц, 1H), 4,48 (т, J=7,6 Гц, 1H), 4,13-4,12 (м, 1H), 2,69 (с, 3H), 2,56-2,54 (м, 1H), 2,08-2,01 (м, 3H). Также с получением (2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 434 (M+1). 1H-ЯМР (400 МГц, Метанол-d4) δ 8,66 (с, 1H), 7,80 (д, J=8,8 Гц, 1H), 7,73 (д, J=3,6 Гц, 1H), 7,52 (д, J=8,8 Гц, 1H), 6,95 (д, J=2,0 Гц, 1H), 6,88 (дд, J=8,4, 2,4 Гц, 1H), 6,81 (д, J=3,6 Гц, 1H), 6,63 (д, J=8,4 Гц, 1H), 6,16 (д, J=8,0 Гц, 1H), 4,76 (д, J=5,2 Гц, 1H), 4,62 (д, J=8,0 Гц, 1H), 4,32 (с, 1H), 2,75 (с, 3H), 2,57-2,47 (м, 1H), 2,26-2,18 (м, 3H). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,69 (с, 1H), 7,95 (д, J=3,6 Гц, 1H), 7,76 (д, J=8,8 Гц, 1H), 7,51 (д, J=8,4 Гц, 1H), 6,84-6,76 (м, 3H), 6,55 (д, J=8,8 Гц, 1H), 6,30 (шир.с, 2H), 6,15 (д, J=8,4 Гц, 1H), 5,46 (д, J=7,2 Гц, 1H), 5,39 (с, 1H), 4,62 (д, J=5,2 Гц, 1H), 4,47 (т, J=7,6 Гц, 1H), 4,13 (с, 1H), 2,69 (с, 3H), 2,56-2,54 (м, 1H), 2,08-1,97 (м, 3H).
Пример 114
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
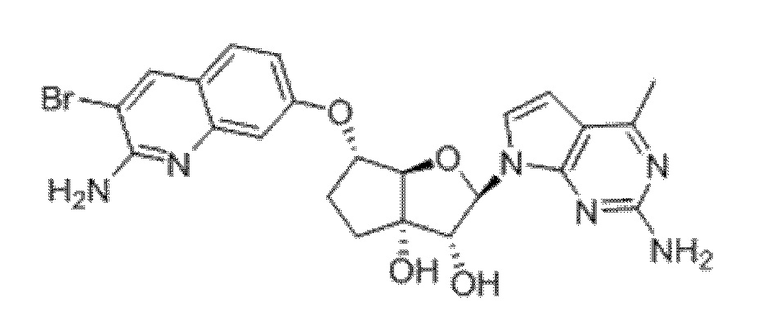
Стадия 1: В высушенный в печи и охлажденный аргоном 2-5-мл микроволновой сосуд, содержащий (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол (0,086 г, 0,217 ммоль), растворенный в безводном ацетонитриле (4,3 мл), добавляли 1,1'-(азодикарбонил)дипиперидин (0,082 г, 0,325 ммоль) с последующим добавлением три-н-бутилфосфина (0,087 мл, 0,346 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч и затем этот раствор использовали непосредственно без определения характеристик, поскольку продукт нестабилен. В отдельный высушенный в печи и охлажденный аргоном микроволновой сосуд, содержащий ди-трет-бутил (4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)карбамат (0,151 г, 0,433 ммоль), растворенный в безводном ацетонитриле (1,0 мл), добавляли DBU (0,065 мл, 0,433 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут и эту суспензию переносили к смеси, описанной выше, через шприц. Объединенную реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 4 ч. Реакцию гасили водой и экстрагировали при помощи EtOAc (3×), органический слой промывали насыщенным солевым раствором и сушили сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (0-100% EtOAc/Hex) с получением ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбоната. MS: 727/729 (M+1/M+3).
Стадия 2: К ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбонату (0,04 г, 0,055 ммоль), растворенному в DCM (1,10 мл), добавляли 2,2,2-трифторуксусную кислоту (0,127 мл, 1,649 ммоль). Смесь перемешивали в течение 6 ч при комнатной температуре. Смесь концентрировали при пониженном давлении и очищали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола, TFA соли, в виде твердого вещества. MS: 527/529 (M+1/M+3). 1H ЯМР (499 МГц, DMSO-d6) δ 9,55-9,19 (м, 3H), 9,15 (д, J=15,5 Гц, 1H), 8,42 (д, J=13,9 Гц, 1H), 8,05 (д, J=25,0 Гц, 1H), 7,29 (с, 1H), 7,27 (с, 2H), 6,21 (д, J=113,4 Гц, 2H), 4,79-4,46 (м, 2H), 4,42-4,24 (м, 2H), 3,85 (д, J=20,8 Гц, 1H), 3,52-3,38 (м, 1H), 3,20-3,10 (м, 1H), 2,98 (д, J=30,6 Гц, 3H), 1,90 (с, 1H), 1,80-1,63 (м, 1H).
Пример 115
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
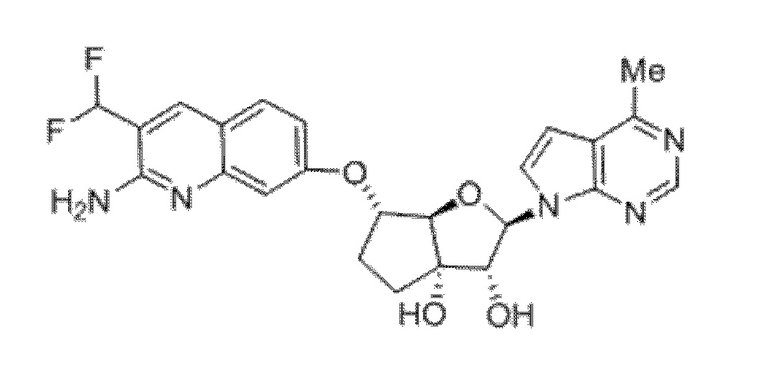
Стадия 1: К перемешиваемой смеси (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (100 мг, 0,302 ммоль) в DCM (1,5 мл) и пиридине (0,3 мл) добавляли трифторметансульфоновый ангидрид (128 мг, 0,453 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение 1 ч при 0°C. Реакционную смесь гасили насыщенным водным раствором NaHCO3 (10 мл), экстрагировали при помощи EtOAc (25 мл × 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0- 50% EtOAc/PE) с получением (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил трифторметансульфоната в виде масла. MS: 464 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,76 (с, 1H), 7,85 (д, J=3,6 Гц, 1H), 6,90 (д, J=3,9 Гц, 1H), 6,30 (д, J=5,1 Гц, 1H), 5,34 (д, J=4,8 Гц, 1H), 4,91 (д, J=3,6 Гц, 1H), 4,54-4,52 (м, 1H), 2,71 (с, 3H), 2,65-2,50 (м, 1H), 2,45-2,13 (м, 3H), 1,59 (с, 3H), 1,40 (с, 3H).
Стадия 2: К перемешиваемой смеси (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил трифторметансульфоната (100 мг, 0,216 ммоль), 3-(дифторметил)-2-((4-метоксибензил)амино)хинолин-7-ола (71,3 мг, 0,216 ммоль) в NMP (3 мл) добавляли Cs2CO3 (211 мг, 0,647 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь разбавляли водой (50 мл) и экстрагировали при помощи DCM (50 мл × 3). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением 3-(дифторметил)-7-(((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 644 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,73 (с, 1H), 8,16 (с, 1H), 7,88 (д, J=3,6 Гц, 1H), 7,72 (д, J=8,7 Гц, 1H), 7,38-7,19 (м, 2H), 7,09-6,83 (м, 7H), 6,32 (д, J=4,8 Гц, 1H), 5,35 (д, J=5,1 Гц, 1H), 4,85-4,84 (м, 1H), 4,69-4,61 (м, 2H), 4,41-4,39 (м, 1H), 3,72 (с, 3H), 2,70 (с, 3H), 2,60-2,16 (м, 4H), 1,55 (с, 3H), 1,41 (с, 3H).
Стадия 3: К 3-(дифторметил)-7-(((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)-N-(4-метоксибензил)хинолин-2-амину (100 мг, 0,155 ммоль) добавляли TFA (5 мл) при 25°C. Полученную смесь перемешивали в течение 1,5 ч при 50°C. Реакционную смесь подвергали азеотропной перегонке с толуолом пять раз (20 мл) для удаления TFA. Остаток добавляли к воде (5 мл) и TFA (5 мл) при 25°C. Смесь перемешивали в течение 16 ч при 25°C. Смесь подвергали азеотропной перегонке с толуолом пять раза (20 мл) для удаления TFA и воды. Остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 484 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,70 (с, 1H), 8,14 (с, 1H), 7,96 (д, J=3,6 Гц, 1H), 7,70 (д, J=8,7 Гц, 1H), 7,27-6,84 (м, 4H), 6,45 (шир.с, 2H), 6,16 (д, J=8,4 Гц, 1H), 5,47 (д, J=7,2 Гц, 1H), 5,41 (с, 1H), 4,66 (д, J=5,4 Гц, 1H), 4,51-4,46 (м, 1H), 4,14 (с, 1H), 2,72 (с, 3H), 2,54-2,50 (м, 1H), 2,10-1,96 (м, 3H).
Пример 116
(1S,2R,3R,5R)-3-(2-(2-амино-3-фторхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол
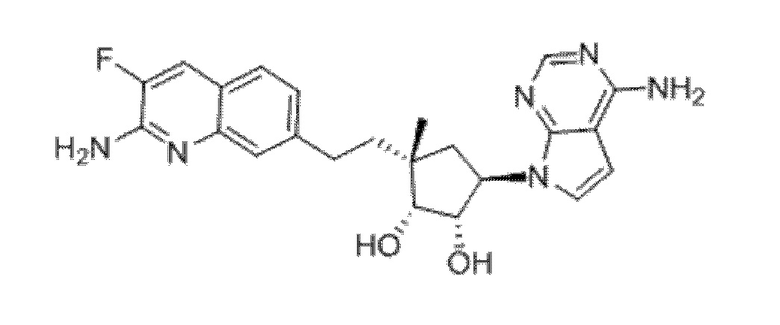
Стадия 1: Под защитным слоем аргона к смеси ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (1,0 г, 3,09 ммоль) в безводном DCM (20 мл) добавляли периодинан Десса-Мартина (2,62 г, 6,18 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакционную смесь гасили насыщенным водным раствором Na2S2O3 (20 мл) при 0°C и экстрагировали при помощи DCM (2 × 60 мл). Объединенные органические слои промывали последовательно насыщенным водным раствором NaHCO3 (60 мл) и насыщенным солевым раствором (60 мл), сушили над безводным Na2SO4, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-33% EtOAc/PE) с получением (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида в виде масла. MS: 322 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 9,75 (с, 1H), 8,65 (с, 1H), 7,92 (д, J=4,0 Гц, 1H), 6,73 (д, J=3,6 Гц, 1H), 5,22-5,16 (м, 1H), 5,11 (дд, J=6,8, 4,8 Гц, 1H), 4,97 (дд, J=7,2, 5,2 Гц, 1H), 3,19-3,14 (м, 1H), 2,54-2,46 (м, 2H), 1,51 (с, 3H), 1,27 (с, 3H).
Стадия 2: Соединение (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегид (1,9 г, 5,91 ммоль) растворяли в 1,4-диоксане (60 мл) при комнатной температуре. Затем добавляли водный раствор формальдегида (37% масс. в воде, 0,701 мл, 7,09 ммоль) и водный раствор карбоната калия (2M, 14,76 мл, 29,5 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь нейтрализовали водным раствором AcOH (50% масс.) и затем экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в EtOH (60 мл) и обрабатывали тетрагидроборатом натрия (0,107 г, 2,83 ммоль) при 0°C. Реакционную смесь перемешивали при 0°C в течение 3 ч. Смесь затем концентрировали при пониженном давлении. Полученный остаток разбавляли водой (50 мл). pH смеси доводили до 7 водным раствором AcOH (50% масс.). Затем смесь экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (9:10:1 DCM/EtOAc/MeOH) с получением ((3aR,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4,4-диил)диметанола в виде пенистого вещества. MS: 354 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,67 (с, 1H), 8,01 (д, J=3,6 Гц, 1H), 6,74 (д, J=3,6 Гц, 1H), 5,27-5,20 (м, 1H), 4,95 (т, J=6,4 Гц, 1H), 4,89 (т, J=5,2 Гц, 1H), 4,63 (д, J=7,2 Гц, 1H), 4,50 (т, J=5,6 Гц, 1H), 3,60-3,49 (м, 3H), 3,44-3,40 (м, 1H), 2,26-2,23 (м, 1H), 2,06-1,92 (м, 1H), 1,48 (с, 3H), 1,22 (с, 3H).
Стадия 3: К раствору ((3aR,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4,4-диил)диметанола (2,5 г, 7,07 ммоль) в DCM (26 мл) добавляли триэтиламин (2,95 мл, 21,20 ммоль) и TBDPS-Cl (3,63 мл, 14,13 ммоль) при 0°C в атмосфере аргона. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 ч. Полученный раствор концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (0-30% EtOAc/PE) с получением ((3aR,4S,6R,6aS)-4-(((трет-бутилдифенилсилил)окси)метил)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола в виде пенистого вещества. MS: 592 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,60 (с, 1H), 7,90 (д, J=3,6 Гц, 1H), 7,67-7,64 (м, 4H), 7,49-7,41 (м, 6H), 6,70 (д, J=3,6 Гц, 1H), 5,24-5,17 (м, 1H), 5,01 (т, J=6,8 Гц, 1H), 4,73 (д, J=7,2 Гц, 1H), 4,60 (шир.с, 1H), 3,77 (д, J=10,0 Гц, 1H), 3,70 (д, J=11,2 Гц, 1H), 3,62-3,58 (м, 2H), 2,29-2,24 (м, 1H), 2,20-2,14 (м, 1H), 1,47 (с, 3H), 1,22 (с, 3H), 1,05 (с, 9H). Также получали ((3aR,4R,6R,6aS)-4-(((трет-бутилдифенилсилил)окси)метил)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанол в виде пенистого вещества. MS: 592 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,49 (с, 1H), 7,80 (д, J=3,6 Гц, 1H), 7,53-7,51 (м, 4H), 7,29-7,24 (м, 6H), 6,56 (д, J=3,6 Гц, 1H), 5,04-4,99 (м, 1H), 4,87 (шир.с, 1H), 4,77 (т, J=6,4 Гц, 1H), 4,44 (д, J=6,4 Гц, 1H), 3,62 (д, J=10,0 Гц, 1H), 3,51 (д, J=10,4 Гц, 1H), 3,46 (д, J=10,4 Гц, 1H), 3,38 (д, J=10,4 Гц, 1H), 2,13-2,10 (м, 1H), 1,93-1,87 (м, 1H), 1,13 (с, 3H), 1,00 (с, 3H), 0,81 (с, 9H).
Стадия 4: К перемешиваемому раствору ((3aR,4R,6R,6aS)-4-(((трет-бутилдифенилсилил)окси)метил)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (1,7 г, 2,87 ммоль) в толуоле (50 мл) добавляли трифенилфосфин (3,01 г, 11,5 ммоль), 1H-имидазол (782 мг, 11,5 ммоль) и дииод (1,46 г, 5,74 ммоль) при комнатной температуре в атмосфере аргона. Затем смесь перемешивали при 120°C в течение 3 ч. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (0-40% EtOAc/PE) с получением 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-6-(иодметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 702 (M+1). 1H ЯМР (400 МГц, Метанол-d4) δ 8,63 (с, 1H), 7,82-7,78 (м, 4H), 7,70 (д, J=3,6 Гц, 1H), 7,50-7,45 (м, 6H), 6,74 (д, J=3,6 Гц, 1H), 5,16-5,10 (м, 1H), 5,08-5,04 (м, 1H), 4,68 (д, J=7,2 Гц, 1H), 3,96 (д, J=11,2 Гц, 1H), 3,75 (т, J=10,0 Гц, 2H), 3,63 (д, J=11,2 Гц, 1H), 2,63-2,57 (м, 1H), 2,40-2,23 (м, 1H), 1,33 (с, 3H), 1,27 (с, 3H), 1,09 (с, 9H).
Стадия 5: К перемешиваемому раствору 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-6-(иодметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина (1,6 г, 2,28 ммоль) в 1,4-диоксане (40 мл) добавляли фенолят натрия (661 мг, 5,70 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали при 80°C в течение ночи. Реакционную смесь затем непосредственно очищали колоночной хроматографией на силикагеле (0-40% EtOAc/PE) с получением 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-6-(иодметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 760 (M+1). 1H ЯМР (400 МГц, DMSO-d6) δ 8,43 (с, 1H), 7,78-7,72 (м, 6H), 7,51-7,47 (м, 10H), 6,62 (д, J=3,6 Гц, 1H), 5,22-5,16 (м, 1H), 5,09 (т, J=6,4 Гц, 1H), 4,61 (д, J=6,8 Гц, 1H), 3,85 (д, J=11,2 Гц, 1H), 3,77-3,70 (м, 2H), 3,63 (д, J=11,2 Гц, 1H), 2,56-2,54 (м, 1H), 2,31-2,28 (м, 1H), 1,24 (с, 3H), 1,19 (с, 3H), 1,03 (с, 9H).
Стадия 6: К перемешиваемому раствору 7-((3aS,4R,6R,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-6-(иодметил)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина (1,6 г, 2,11 ммоль) в EtOAc (20 мл) и этаноле (20 мл) добавляли дигидроксипалладий на углероде (20% масс., 1600 мг, 2,28 ммоль) при комнатной температуре в атмосфере азота. Суспензию дегазировали в вакууме и продували H2 несколько раз, затем смесь перемешивали в атмосфере H2 (1-2 атм) при 25°C в течение 30 мин. Смесь затем фильтровали через слой Целита и фильтрат концентрировали при пониженном давлении с получением 7-((3aS,4R,6S,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 634 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,41 (с, 1H), 7,79 (д, J=2,7 Гц, 1H), 7,72-7,68 (м, 4H), 7,51-7,46 (м, 8H), 7,34-7,27 (м, 3H), 6,58 (д, J=2,7 Гц, 1H), 5,22-5,11 (м, 1H), 5,06 (т, J=4,8 Гц, 1H), 4,52 (д, J=5,1 Гц, 1H), 3,71 (д, J=7,8 Гц, 1H), 3,61 (д, J=7,8 Гц, 1H), 2,50-2,44 (м, 1H), 2,15-2,02 (м, 1H), 1,30 (с, 3H), 1,29 (с, 3H), 1,20 (с, 3H), 1,03 (с, 9H).
Стадия 7: К перемешиваемому раствору 7-((3aS,4R,6S,6aR)-6-(((трет-бутилдифенилсилил)окси)метил)-2,2,6-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-4-фенокси-7H-пирроло[2,3-d]пиримидина (1,1 г, 1,74 ммоль) в THF (10 мл) добавляли тетрабутиламмоний фторид (1M в THF) (3,47 мл, 3,47 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали при 45°C в течение ночи. После завершения растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (0-40% EtOAc/PE) с получением ((3aR,4S,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола в виде твердого вещества. MS: 396 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,37 (с, 1H), 7,80 (д, J=3,9 Гц, 1H), 7,51-7,46 (м, 2H), 7,34-7,26 (м, 3H), 6,56 (д, J=3,6 Гц, 1H), 5,24-5,18 (м, 1H), 5,02 (т, J=6,3 Гц, 1H), 4,57 (т, J=4,8 Гц, 1H), 4,49 (д, J=7,2 Гц, 1H), 3,55-3,51 (м, 1H), 3,42-3,37 (м, 1H), 2,42-2,35 (м, 1H), 2,05-1,97 (м, 1H), 1,47 (с, 3H), 1,23 (с, 3H), 1,16 (с, 3H).
Стадия 8: К перемешиваемому раствору ((3aR,4S,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола (520 мг, 1,315 ммоль) в DCM (10 мл) добавляли периодинан Десса-Мартина (837 мг, 1,97 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали при этой температуре в течение 30 мин. Полученную смесь гасили насыщенным водным раствором NaHCO3 (1M, 20 мл) и смесь экстрагировали DCM (3 × 30 мл). Объединенные органические слои промывали насыщенным солевым раствором (3 × 20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат затем концентрировали при пониженном давлении и полученный неочищенный (3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегид использовали непосредственно на следующей стадии.
Стадия 9: К перемешиваемой смеси бром(метил)трифенилфосфорана (1,32 г, 3,68 ммоль) в THF (20 мл) добавляли н-бутиллитий (2,5M в гексане, 1,37 мл, 3,42 ммоль) при -60oC в атмосфере аргона. Реакционную смесь нагревали до комнатной температуры и поддерживали в течение ~30 минут. Затем к полученному раствору добавляли по каплям неочищенный (3aR,4R,6R,6aS)-2,2,4-триметил-6-(4-фенокси-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегид (1,315 ммоль) в THF (5 мл) при -40°C в атмосфере аргона. Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Реакцию гасили насыщенным водным раствором NH4Cl (20 мл) при -40°C и экстрагировали при помощи EtOAc (3 × 50 мл). Объединенные органические фракции промывали насыщенным солевым раствором (3 × 20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (0-40% EtOAc/PE) с получением 4-фенокси-7-((3aS,4R,6S,6aR)-2,2,6-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 392 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,36 (с, 1H), 7,81 (д, J=3,6 Гц, 1H), 7,50-7,46 (м, 2H), 7,32-7,25 (м, 3H), 6,55 (д, J=3,6 Гц, 1H), 6,20-6,13 (м, 1H), 5,20-5,12 (м, 3H), 5,04 (дд, J=5,2, 7,2 Гц, 1H), 4,50 (д, J=7,2 Гц, 1H), 2,39-2,32 (м, 2H), 1,47 (с, 3H), 1,23 (с, 3H), 1,22 (с, 3H).
Стадия 10: 4-фенокси-7-((3aS,4R,6S,6aR)-2,2,6-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин (272 мг, 0,695 ммоль) растворяли в 1,4-диоксане (15 мл) в герметично закрытой пробирке и затем смесь обрабатывали концентрированной NH3·H2O (28% масс., 15 мл). Полученную смесь нагревали при 120°C в течение 16 ч. Летучие вещества удаляли при пониженном давлении и остаток очищали препаративной ТСХ (1:1 PE:EtOAc) с получением 7-((3aS,4R,6S,6aR)-2,2,6-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 315 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,06 (с, 1H), 7,38 (д, J=3,6 Гц, 1H), 6,97 (шир.с, 2H), 6,57 (д, J=3,6 Гц, 1H), 6,18-6,11 (м, 1H), 5,17-5,08 (м, 2H), 5,08-5,04 (м, 1H), 4,98 (дд, J=4,8, 7,2 Гц, 1H), 4,47 (д, J=6,8 Гц, 1H), 2,33-2,20 (м, 2H), 1,45 (с, 3H), 1,22 (с, 3H), 1,20 (с, 3H).
Стадия 11: В 20-мл микроволновую пробирку, содержащую 7-((3aS,4R,6S,6aR)-2,2,6-триметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин (174 мг, 0,553 ммоль), добавляли 9-борабицикло[3.3.1]нонан (0,5M в THF, 4,43 мл, 2,21 ммоль) при комнатной температуре в атмосфере аргона. Реакционную смесь нагревали при 60°C в течение 1 ч. Смесь охлаждали до 0°C после завершения. К этой смеси добавляли раствор фосфата калия (587 мг, 2,77 ммоль) в воде (1,3 мл) при 0°C. После перемешивания при комнатной температуре в течение 30 минут добавляли Pd(dppf)Cl2 (41 мг, 0,055 ммоль) и раствор 7-бром-3-фторхинолин-2-амина (147 мг, 0,608 ммоль) в THF (4 мл). Полученную смесь подвергали микроволновому облучению при 80°C в течение 2 ч. Реакционную смесь затем разбавляли водой (20 мл) и смесь экстрагировали при помощи EtOAc (3 × 50 мл). Объединенные органические слои промывали насыщенным солевым раствором (3 × 20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (20:1 EtOAc:MeOH) с получением 7-(2-((3aR,4R,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-фторхинолин-2-амина в виде твердого вещества. MS: 477 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,06 (с, 1H), 7,78 (д, J=11,6 Гц, 1H), 7,60 (д, J=8,4 Гц, 1H), 7,38-7,36 (м, 2H), 7,14 (д, J=8,4 Гц, 1H), 6,97 (шир.с, 2H), 6,71 (шир.с, 2H), 6,57 (д, J=3,6 Гц, 1H), 5,05-5,02 (м, 2H), 4,44 (д, J=4,0 Гц, 1H), 2,77-2,70 (м, 2H), 2,27-2,22 (м, 1H), 2,15-2,09 (м, 1H), 1,88-1,73 (м, 2H), 1,46 (с, 3H), 1,25 (с, 3H), 1,21 (с, 3H).
Стадия 12: 7-(2-((3aR,4R,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,4-триметилтетрагидро-4H-циклопента[d][1,3]диоксол-4-ил)этил)-3-фторхинолин-2-амин (129,4 мг, 0,272 ммоль) в TFA (2,72 мл) и воде (2,72 мл) перемешивали в течение в течение ночи при 40°C. Реакционную смесь затем концентрировали при пониженном давлении и остаток очищали масс-инициируемой ВЭЖХ (ACN/вода с 0,1% TFA модификатора) с получением (1S,2R,3R,5R)-3-(2-(2-амино-3-фторхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диола, TFA соли, в виде масла. MS: 437 (M+1). 1H ЯМР (DMSO-d6) δ: 8,36 (с, 1H), 8,10 (д, J=11,2 Гц, 2H), 7,79-7,64 (м, 2H), 7,44 (с, 1H), 7,29 (д, J=8,1 Гц, 1H), 7,24 (с, 1H), 7,14 (с, 1H), 7,04 (с, 1H), 6,96 (д, J=3,6 Гц, 1H), 5,11-5,03 (м, 1H), 5,02-4,79 (м, 1H), 4,65-4,53 (м, 1H), 3,66 (д, J=4,2 Гц, 1H), 2,80 (тд, J=12,7, 4,3 Гц, 1H), 2,67 (тд, J=12,6, 4,3 Гц, 1H), 2,15 (дд, J=13,5, 10,4 Гц, 1H), 1,88 (тд, J=12,9, 4,6 Гц, 1H), 1,67 (тд, J=12,9, 4,6 Гц, 1H), 1,60 (дд, J=13,5, 8,9 Гц, 1H), 1,27 (с, 3H).
Пример 117
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол
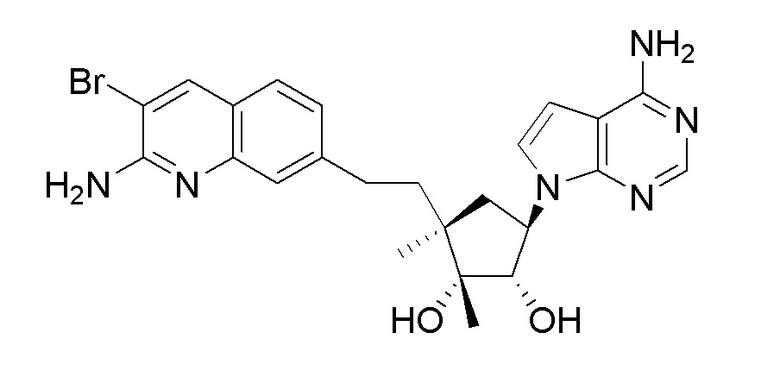
Стадия 1: (1R,4S)-трет-бутил 5-метил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилат (1 г, 4,48 ммоль) растворяли в 4 M HCl/MeOH (10 мл) и реакционную смесь нагревали при кипячении с обратным холодильником и перемешивали при этой температуре в течение 2 ч. Растворитель затем удаляли при пониженном давлении с получением неочищенного (1S,4R)-метил 4-амино-2-метилциклопент-2-енкарбоксилат гидрохлорида, который использовали непосредственно на следующей стадии.
Стадия 2: К перемешиваемому раствору (1S,4R)-метил 4-амино-2-метилциклопент-2-енкарбоксилат гидрохлорида (859 мг, 4,48 ммоль) в 5:1 ацетоне:H2O (12 мл) добавляли бикарбонат натрия (753 мг, 8,96 ммоль) и ди-трет-бутилдикарбонат (1076 мг, 4,93 ммоль). Реакционную смесь перемешивали при 25°C в течение 2 ч. Реакционную смесь разбавляли 100 мл воды и экстрагировали при помощи 100 мл EtOAc. Органическую фазу затем промывали 100 мл насыщенного солевого раствора, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (3:1 PE/EtOAc) с получением (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-2-метилциклопент-2-енкарбоксилата в виде масла. 1H ЯМР (400 МГц, Хлороформ-d) δ 5,58-5,52 (м, 1H), 5,04 (с, 1H), 4,72 (с, 1H), 3,75 (с, 3H), 3,32-3,24 (м, 1H), 2,53 (дт, J=13,9, 8,5 Гц, 1H), 1,90 (дт, J=13,9, 3,2 Гц, 1H), 1,77 (кв., J=1,3 Гц, 3H), 1,46 (с, 9H).
Стадия 3: К перемешиваемому раствору (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-2-метилциклопент-2-енкарбоксилата (4,3 г, 16,84 ммоль) в THF (80 мл) добавляли 1M бис(триметилсилил)амида лития в THF (38,7 мл, 38,7 ммоль, 1M) при -78°C и реакционную смесь перемешивали при -78°C в течение 0,5 ч. Затем добавляли по каплям иодметан (2,63 г, 18,53 ммоль) при -78°C и полученную смесь перемешивали при -20°C в течение 2 ч. Реакцию гасили насыщенным водным раствором NH4Cl (100 мл) и экстрагировали при помощи EtOAc (120 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (20-25% EtOAc/PE) с получением (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-1,2-диметилциклопент-2-енкарбоксилата в виде масла. 1H ЯМР (300 МГц, Хлороформ-d) δ 5,49 (п, J=1,5 Гц, 1H), 5,03 (с, 1H), 4,69 (с, 1H), 3,72 (с, 3H), 2,21-2,15 (м, 2H), 1,69 (т, J=1,5 Гц, 3H), 1,46 (с, 9H), 1,31 (с, 3H).
Стадия 4: К перемешиваемому раствору (1S,4R)-метил 4-((трет-бутоксикарбонил)амино)-1,2-диметилциклопент-2-енкарбоксилата (3,1 г, 11,5 ммоль) в THF (50 мл) добавляли борогидрид лития (2M в THF, 11,5 мл, 23,02 ммоль) по каплям при 0°C. Затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь гасили водой (100 мл) и экстрагировали при помощи EtOAc (100 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (18-22% EtOAc/PE) с получением трет-бутил ((1R,4S)-4-(гидроксиметил)-3,4-диметилциклопент-2-ен-1-ил)карбамата в виде твердого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 5,47 (с, 1H), 4,58 (д, J=8,7 Гц, 1H), 3,54 (д, J=10,5 Гц, 1H), 3,31 (д, J=10,5 Гц, 1H), 2,13 (дд, J=13,8, 8,7 Гц, 1H), 1,76 (дд, J=13,8, 3,0 Гц,1H), 1,66 (д, J=1,5 Гц, 3H), 1,45 (с, 9H), 1,00 (с, 3H).
Стадия 5: К перемешиваемому раствору трет-бутил ((1R,4S)-4-(гидроксиметил)-3,4-диметилциклопент-2-ен-1-ил)карбамата (550 мг, 2,279 ммоль) в 1:1 tBuOH:H2O (6 мл) добавляли 4-метилморфолин 4-оксид (534 мг, 4,56 ммоль) при комнатной температуре. Затем смесь охлаждали до 0°C и добавляли 4% оксид осмия(VIII) в воде (1,88 г, 0,296 ммоль) при 0°C. Реакционную смесь перемешивали при 0°C в течение 16 ч. Реакцию гасили 50 мл насыщенного водного раствора тиосульфата натрия и экстрагировали при помощи 50 мл EtOAc. Органический слой промывали 50 мл воды и 50 мл насыщенного солевого раствора, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (1:1 PE/EtOAc) с получением трет-бутил ((1R,2S,3R,4R)-2,3-дигидрокси-4-(гидроксиметил)-3,4-диметилциклопентил)карбамата в виде твердого вещества. Затем трет-бутил ((1R,2S,3R,4R)-2,3-дигидрокси-4-(гидроксиметил)-3,4-диметилциклопентил)карбамат (530 мг, 1,93 ммоль) растворяли в HCl в MeOH (4M, 10 мл) и реакционную смесь перемешивали при 25°C в течение 2 ч. Растворитель удаляли при пониженном давлении с получением неочищенного продукта, который использовали непосредственно на следующей стадии. Затем к перемешиваемому раствору (1R,2S,3R,5R)-3-амино-5-(гидроксиметил)-1,5-диметилциклопентан-1,2-диол гидрохлорида (402 мг, 1,9 ммоль) в i-PrOH (6 мл) добавляли DIEA (0,664 мл, 3,80 ммоль) и 4,6-дихлор-5-(2,2-диэтоксиэтил)пиримидин (554 мг, 2,09 ммоль) при комнатной температуре. Реакционную смесь нагревали до 100°C и перемешивали при этой температуре в течение 8 ч. Растворитель затем удаляли при пониженном давлении и полученный неочищенный остаток очищали колоночной хроматографией на силикагеле (элюируя при помощи EtOAc) с получением (1R,2S,3R,5R)-3-((6-хлор-5-(2,2-диэтоксиэтил)пиримидин-4-ил)амино)-5-(гидроксиметил)-1,5-диметилциклопентан-1,2-диола в виде масла. MS: 404 (M+1).
Стадия 6: К перемешиваемому раствору (1R,2S,3R,5R)-3-((6-хлор-5-(2,2-диэтоксиэтил)пиримидин-4-ил)амино)-5-(гидроксиметил)-1,5-диметилциклопентан-1,2-диола (230 мг, 0,569 ммоль) в диоксане (3 мл) добавляли HCl в воде (4M, 0,285 мл, 1,139 ммоль) при комнатной температуре. Полученную смесь нагревали до 50°C и перемешивали при этой температуре в течение 15 мин. Реакционную смесь гасили 20 мл насыщенного водного раствора бикарбоната натрия и экстрагировали при помощи EtOAc (3 × 20 мл). Органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением (1R,2S,3R,5R)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)-1,5-диметилциклопентан-1,2-диола в виде твердого вещества. MS: 312 (M+1).
Стадия 7: К перемешиваемому раствору (1R,2S,3R,5R)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-5-(гидроксиметил)-1,5-диметилциклопентан-1,2-диола (540 мг, 1,73 ммоль) в ацетоне (15 мл) добавляли 4-метилбензолсульфоновую кислоту (30 мг, 0,173 ммоль) и 2,2-диметоксипропан (1,80 gg, 17,3 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 16 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (54% EtOAc/PE) с получением ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанола в виде масла. MS: 352 (M+1).
Стадия 8: К перемешиваемому раствору оксалилхлорида (0,30 мл, 3,41 ммоль) в DCM (8 мл) добавляли по каплям DMSO (0,484 мл, 6,82 ммоль) при -78°C и полученную смесь перемешивали при -78°C в течение 0,5 ч. Затем добавляли по каплям ((3aR,4R,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)метанол (400 мг, 1,137 ммоль) в DCM (3 мл) и реакционную смесь продолжали перемешивать при -78°C еще в течение 0,5 ч. Затем добавляли TEA (1,585 мл, 11,37 ммоль) при -78°C и реакционную смесь нагревали до комнатной температуры и перемешивали при этой температуре в течение 1 ч. Затем добавляли 100 мл насыщенного водного раствора хлорида аммония и смесь экстрагировали при помощи EtOAc (2 × 100 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида, который использовали непосредственно на следующей стадии.
Стадия 9: К перемешиваемому раствору метилтрифенилфосфоний бромида (1,14 г, 3,18 ммоль) в THF (8 мл) добавляли н-бутиллитий (2,5M в гексане, 0,455 мл, 1,14 ммоль) по каплям при -20°C. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Затем добавляли по каплям раствор (3aR,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида (398 мг, 1,14 ммоль) в THF (3 мл) при -20°C. Полученную смесь затем нагревали до 25°C и перемешивали в течение 2 ч. Смесь разбавляли 100 мл EtOAc и промывали 100 мл воды и 100 мл насыщенного солевого раствора. Органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (3:1 PE/EtOAc) с получением 4-хлор-7-((3aS,4R,6R,6aR)-2,2,6,6a-тетраметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 348 (M+1).
Стадия 10: В 25-мл герметично закрываемую пробирку, содержащую раствор 4-хлор-7-((3aS,4R,6R,6aR)-2,2,6,6a-тетраметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина (250 мг, 0,719 ммоль) в диоксане (5 мл), добавляли 28% масс. NH3 в H2O (25 мл). Полученную смесь нагревали до 90°C и перемешивали в течение 16 ч. Растворитель удаляли при пониженном давлении с получением неочищенного 7-((3aS,4R,6R,6aR)-2,2,6,6a-тетраметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина, который использовали непосредственно на следующей стадии.
Стадия 11: В 10-мл круглодонную колбу загружали 7-((3aS,4R,6R,6aR)-2,2,6,6a-тетраметил-6-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин (70 мг, 0,213 ммоль) и 9-BBN (0,5M в THF, 2,13 мл, 1,07 ммоль) при комнатной температуре в атмосфере аргона. Полученную смесь нагревали до 50°C и перемешивали в течение 1 ч. К этой неочищенной реакционной смеси добавляли раствор трехосновного фосфата калия (226 мг, 1,07 ммоль) в воде (0,2 мл) при 0°C и полученную смесь нагревали до 50°C и перемешивали в течение 0,5 ч. Затем добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (110 мг, 0,234 ммоль) в THF (0,2 мл) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (15,59 мг, 0,021 ммоль) при комнатной температуре и полученную смесь нагревали до 50°C и перемешивали в течение 1 ч. Смесь разбавляли 30 мл EtOAc и промывали при помощи 30 мл воды и 30 мл насыщенного солевого раствора. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (10% MeOH/DCM) с получением 7-(2-((3aR,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 671/673 (M+1/M+3).
Стадия 12: В 10-мл круглодонную колбу загружали 7-(2-((3aR,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a,4-тетраметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этил)-3-бром-N-(4-метоксибензил)хинолин-2-амин (80 мг, 0,119 ммоль) и TFA (2 мл) при комнатной температуре в атмосфере аргона. Полученную смесь затем нагревали до 50°C и перемешивали в течение 40 минут. Растворитель удаляли при пониженном давлении. Полученное неочищенное вещество очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ с получением (1R,2S,3R)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диола в виде твердого вещества. MS: 511/513 (M+1/M+3). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,33 (с, 1H), 8,04 (с, 1H), 7,58 (д, J=8,4 Гц, 1H), 7,36 (с, 1H), 7,18-7,13 (м, 2H), 6,89 (шир.с, 2H), 6,54-6,53 (м, 3H), 4,90 (д, J=6,9 Гц, 1H), 4,81 (кв., J=9,0 Гц, 1H), 4,41-4,36 (м, 1H), 4,09 (с, 1H), 2,68-2,65 (м, 2H), 2,08-1,90 (м, 3H), 1,66-1,63 (м, 1H), 1,09 (с, 6H).
Пример 118
(1R,2S,3S,4R)-1-(2-(2-амино-3-бромхинолин-7-ил)этил)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопентан-1,2,3-триол
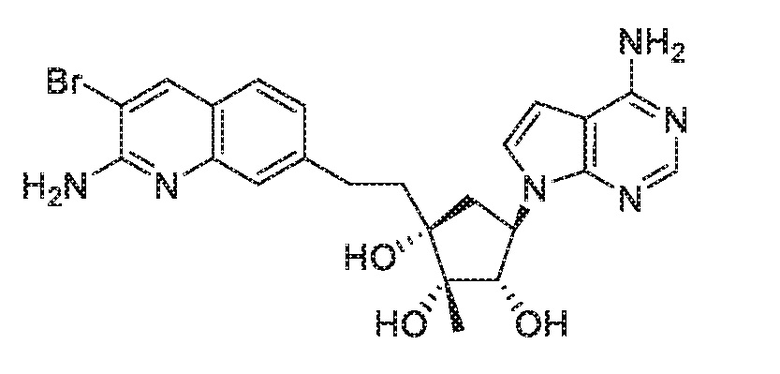
Стадия 1: К перемешиваемому раствору (1R,4S)-4-гидроксициклопент-2-ен-1-илацетата (5,68 г, 40,0 ммоль), 4-хлор-7H-пирроло[2,3-d]пиримидина (9,20 г, 59,9 ммоль) и трифенилфосфин (36,7 г, 140 ммоль) в THF (80 мл) добавляли (E)-диизопропилдиазен-1,2-дикарбоксилат (20,20 г, 100 ммоль) в атмосфере аргона при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением (1R,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-ен-1-илацетата в виде твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ 8,66 (с, 1H), 7,66 (д, J=3,7 Гц, 1H), 6,69 (д, J=3,6 Гц, 1H), 6,32-6,19 (м, 2H), 6,09 (ддт, J=7,4, 4,9, 1,9 Гц, 1H), 6,03-5,92 (м, 1H), 2,53 -2,32 (м, 2H), 2,05 (с, 3H).
Стадия 2: К перемешиваемому раствору (1R,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-ен-1-илацетата (8,6 г, 31,0 ммоль) в DCM (20 мл) добавляли аммиак в MeOH (200 мл, 7M, 1400 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. Раствор концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-15% MeOH/DCM) с получением (1R,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-енола в виде твердого вещества. MS: 236 (M+1).
Стадия 3: К раствору (1R,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-енола (350 мг, 1,49 ммоль) в безводном DCM (7 мл) добавляли периодинан Десса-Мартина (945 мг, 2,23 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь затем охлаждали до 0°C, гасили насыщенным водным раствором бикарбоната натрия (5 мл) и разбавляли при помощи DCM (100 мл). Раствор затем фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (20-35% EtOAc/PE) с получением (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-енона в виде твердого вещества. MS: 234 (M+1).
Стадия 4: К перемешиваемому раствору (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)циклопент-2-енона (870 мг, 3,72 ммоль) в DCM (3 мл) и пиридине (3 мл) добавляли раствор дииода (1,60 г, 6,33 ммоль) в DCM (3 мл) и пиридине (3 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Затем к раствору добавляли DCM (30 мл) и раствор тиосульфата натрия (60 мл, 1 M) и органический слой концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-80% EtOAc/PE) с получением (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-иодциклопент-2-енона в виде твердого вещества. MS: 360 (M+1).
Стадия 5: К перемешиваемому раствору (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-иодциклопент-2-енона (2,9 г, 8,07 ммоль) в N-метил-2-пирролидиноне (25 мл) добавляли иодид меди (I) (0,614 г, 3,23 ммоль), трифениларсин (0,99 г, 3,23 ммоль), дихлорбис(бензонитрил)палладий(II) (1,24 г, 3,23 ммоль) и тетраметилстаннан (14,4 г, 81 ммоль). Полученную смесь затем перемешивали при 80°C в атмосфере аргона в течение 2 ч. Смесь охлаждали и очищали колоночной хроматографией на диоксиде кремния (0-70% EtOAc/PE). Выделенное вещество затем растворяли в DCM (100 мл) и промывали водой (60 мл × 4). Органический слой концентрировали при пониженном давлении и полученный остаток промывали смесью 30:1 PE/EtOAc (40 мл) и затем фильтровали с получением (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопент-2-енона в виде твердого вещества. MS: 248 (M+1).
Стадия 6: К смеси (R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопент-2-енона (900 мг, 3,63 ммоль) и NMO (851 мг, 7,27 ммоль) в THF (90 мл), воде (9,0 мл) и ацетоне (9,0 мл) добавляли по каплям оксид осмия(VIII) в H2O (9,25 мл, 4% масс., 3,63 ммоль) при комнатной температуре (15°C) в атмосфере аргона. Реакционную смесь затем перемешивали в течение 15 ч при комнатной температуре. Реакционную смесь гасили насыщенным раствором тиосульфата натрия (60 мл) в атмосфере аргона и перемешивали в течение 20 минут при 0°C. Полученную смесь затем разбавляли при помощи EtOAc/H2O (600 мл/200 мл). Органический слой отделяли и промывали H2O (200 мл) и насыщенным солевым раствором (2 × 200 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученное неочищенное вещество очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/PE) с получением (2S,3S,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-дигидрокси-2-метилциклопентанона в виде твердого вещества. MS: 282 (M+1).
Стадия 7: К смеси (2S,3S,4R)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-дигидрокси-2-метилциклопентанона (500 мг, 1,78 ммоль) и 4-метилбензолсульфоновой кислоты (61,1 мг, 0,355 ммоль) в безводном ацетоне (25 мл) добавляли 2,2-диметоксипропан (2,77 г, 26,6 ммоль) по каплям при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали в течение 15 ч при 30°C. Реакционную смесь затем гасили насыщенным раствором бикарбоната натрия (20 мл) при 0°C. Полученную смесь разбавляли при помощи EtOAc/H2O (200 мл/30 мл) и органический слой отделяли, промывали насыщенным солевым раствором (80 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-25% EtOAc/PE) с получением (3aS,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилдигидро-3aH-циклопента[d][1,3]диоксол-4(5H)-она в виде твердого вещества. MS: 322 (M+1).
Стадия 8: Хлорид церия(III) (2,45 г, 9,95 ммоль) суспендировали в THF (15 мл) и перемешивали в течение 0,5 ч при комнатной температуре в атмосфере аргона. Во вторую высушенную пламенем круглодонную колбу добавляли этинилтриметилсилан (977 мг, 9,95 ммоль) в безводном THF (10 мл). Раствор TMS-ацетилена и колбу, содержащую CeCl3, охлаждали до -78°C. К раствору TMS-ацетилена добавляли по каплям n-BuLi (3,98 мл, 2,5 M в гексане, 9,95 ммоль) через шприц. Обе смеси перемешивали в течение 20 минут и затем раствор литий TMS-ацетилида переносили через канюлю в быстро перемешиваемую суспензию CeCl3. Смесь перемешивали в течение 0,5 ч при -78°C. (3aS,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметилдигидро-3aH-циклопента[d][1,3]диоксол-4(5H)-он (400 мг, 1,243 ммоль), растворенный в безводном THF (15 мл), охлаждали до -78°C и переносили через канюлю в колбу, содержащую соль ацетилид церия. Полученную смесь перемешивали в течение 2 ч при -78°C. Реакцию гасили насыщенным раствором хлорида аммония (40 мл) при 0°C и разбавляли при помощи EtOAc/H2O (200 мл/80 мл). Органический слой отделяли и промывали насыщенным раствором бикарбоната натрия (100 мл) и насыщенным солевым раствором (100 мл). Органический слой затем сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (0-18% EtOAc/PE) с получением (3aS,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметил-4-((триметилсилил)этинил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола в виде твердого вещества. MS: 420 (M+1).
Стадия 9: К раствору (3aS,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметил-4-((триметилсилил)этинил)тетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола (220 мг, 0,524 ммоль) в безводном THF (5 мл), охлажденному до 0°C, добавляли по каплям TBAF (1,05 мл, 1 M в THF, 1,048 ммоль) в атмосфере аргона. Реакционную смесь перемешивали в течение 1ч при 0°C. Затем растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-20% EtOAc/PE) с получением (3aS,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-этинил-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола в виде твердого вещества. MS: 348 (M+1).
Стадия 10: (3aS,4S,6R,6aS)-6-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-4-этинил-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ол (170 мг, 0,489 ммоль) растворяли в NH3 (15 мл, 20% в iPrOH) при -70°C. Реакционную смесь перемешивали в течение 15 ч при 90°C в герметично закрытой пробирке. Затем растворитель удаляли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-8% MeOH/DCM) с получением (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-этинил-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола в виде твердого вещества. MS: 329 (M+1).
Стадия 11: Раствор (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-этинил-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола (150 мг, 0,457 ммоль) в безводном MeOH (4 мл) восстанавливали в атмосфере водорода с использованием катализатора Линдлара (22,5 мг, 10,57 мкмоль). Реакционную смесь перемешивали в течение 2,5 ч при 30°C. Реакционную смесь затем фильтровали через Целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хиральной ВЭЖХ (EtOH/гексан с 8 мМ NH3-MeOH модификатора) с получением (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметил-4-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола в виде масла. MS: 331 (M+1).
Стадия 12: В атмосфере аргона (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,3a-триметил-4-винилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ол (70 мг, 0,212 ммоль) растворяли в растворе 9-BBN (2,12 мл, 0,5 M в THF, 1,06 ммоль) при комнатной температуре и смесь перемешивали в течение 1 ч при 60°C. Реакционную смесь затем охлаждали до 0°C и добавляли раствор K3PO4 (183 мг, 1,059 ммоль) в H2O (2 мл). Смесь перемешивали в течение 0,5 ч при комнатной температуре. Затем к смеси добавляли раствор 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (99 мг, 0,212 ммоль) и Pd(dppf)Cl2 (26,0 мг, 0,032 ммоль) в безводном THF (2,5 мл). Полученную смесь подвергали микроволновому облучению при 70°C в течение 2 ч. Смесь концентрировали при пониженном давлении и полученный остаток растворяли в EtOAc (100 мл) и затем промывали H2O (30 мл) и насыщенным солевым раствором (2 × 30 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученную неочищенную смесь очищали колоночной хроматографией на диоксиде кремния (0-3% MeOH/DCM) с получением (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ола в виде твердого вещества. MS: 673/675 (M+1/M+3).
Стадия 13: В атмосфере аргона (3aS,4S,6R,6aS)-6-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-4-(2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)этил)-2,2,3a-триметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ол (100 мг, 0,148 ммоль) растворяли в TFA (3,0 мл, 38,9 ммоль) при комнатной температуре. Реакционную смесь перемешивали в течение 4 ч при 60°C. Смесь затем упаривали при пониженном давлении. Полученный остаток совместно упаривали с толуолом (3 × 90 мл). Этот остаток затем очищали обращенно-фазовой колоночной хроматографией (ACN/вода). Продукт дополнительно очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (1R,2S,3S,4R)-1-(2-(2-амино-3-бромхинолин-7-ил)этил)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопентан-1,2,3-триола в виде твердого вещества. MS: 513/515 (M+1/M+3). 1H-ЯМР (400 МГц, DMSO-d6+10% D2O) δ 8,66 (с, 1H), 8,36 (с, 1H), 7,75 (д, J=8,4 Гц, 1H), 7,62 (д, J=3,6 Гц, 1H), 7,50 (с, 1H), 7,33 (д, J=8,0 Гц, 1H), 7,00-6,97 (м, 1H), 5,06 (дд, J=9,6, 18,4Гц, 1H), 4,06 (д, J=8,8 Гц, 1H), 2,96-2,77 (м, 2H), 2,23-2,12 (м, 2H), 1,98-1,81 (м, 2H), 1,38 (с, 3H).
Пример 119
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол 2,2,2-трифторацетат
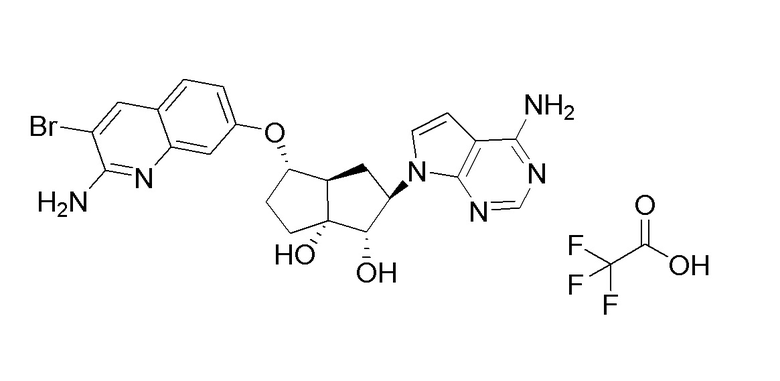
Стадия 1: В высушенный в печи и продутый аргоном сосуд с (3aS,4R,5aR,6S,8aR)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-5H-пенталено[1,6a-d][1,3]диоксол-6-олом (141,4 мг, 0,404 ммоль) добавляли 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амин (379 мг, 0,808 ммоль), 1,10-фенантролин (29,1 мг, 0,162 ммоль), иодид меди (15,40 мг, 0,081 ммоль) и карбонат цезия (395 мг, 1,213 ммоль). Твердые частицы растворяли в ксилоле (4 мл) и реакционную смесь нагревали до 140°C в течение 18 ч в атмосфере аргона. Реакционную смесь затем медленно охлаждали до комнатной температуры. Реакционную смесь фильтровали через Целит и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (20-35-80% EtOAc/гексан) с получением 3-бром-7-(((3aS,4R,5aR,6S,8aR)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-3aH-пенталено[1,6a-d][1,3]диоксол-6-ил)окси)-N-(4-метоксибензил)хинолин-2-амина в виде твердого вещества. MS: 690/692 (M+1/M+3).
Стадия 2: В сосуд с 3-бром-7-(((3aS,4R,5aR,6S,8aR)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-3aH-пенталено[1,6a-d][1,3]диоксол-6-ил)окси)-N-(4-метоксибензил)хинолин-2-амином (37,4 мг, 0,054 ммоль) добавляли аммиак (3,5 мл, 24,50 ммоль, 7N в MeOH). Реакционную смесь нагревали в микроволновой печи при 140°C в течение 5 ч. Реакционную смесь затем концентрировали при пониженном давлении и полученный неочищенный 7-(((3aS,4R,5aR,6S,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-3aH-пенталено[1,6a-d][1,3]диоксол-6-ил)окси)-3-бром-N-(4-метоксибензил)хинолин-2-амин непосредственно использовали на следующей стадии.
Стадия 3: В сосуд, содержащий неочищенный 7-(((3aS,4R,5aR,6S,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидро-3aH-пенталено[1,6a-d][1,3]диоксол-6-ил)окси)-3-бром-N-(4-метоксибензил)хинолин-2-амин (25 мг, 0,037 ммоль), добавляли DCM (0,5 мл) с последующим добавлением TFA (0,4 мл, 5,19 ммоль). Реакционную смесь перемешивали при 40°C в течение 75 минут. Затем добавляли воду (0,1 мл) вместе с дополнительным количеством DCM (0,1 мл) и реакционную смесь перемешивали при 40°C в общей сложности в течение 2,5 ч. Затем снова добавляли DCM (0,2 мл), TFA (0,3 мл) и воду (0,1 мл) и реакционную смесь нагревали до 40°C еще в течение 2 ч. В завершение, добавляли анизол (100 мкл, 0,915 ммоль) и реакционную смесь перемешивали при 40°C в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, растворяли в DMSO, фильтровали и подвергали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением (1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)октагидропентален-1,6a-диола, TFA соли, в виде твердого вещества. MS: 511/513 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,72 (с, 1H), 8,37 (с, 1H), 7,82 (д, J=3,6 Гц, 1H), 7,78 (д, J=8,9 Гц, 1H), 7,07 (дд, J=8,9, 2,0 Гц, 1H), 6,98-6,94 (м, 2H), 4,96-4,89 (м, 1H), 4,56 (д, J=4,2 Гц, 1H), 4,05 (д, J=10,5 Гц, 1H), 2,58-2,52 (м, 1H), 2,36-2,27 (м, 2H), 2,09-2,03 (м, 1H), 1,98-1,87 (м, 2H), 1,75-1,67 (м, 1H).
Пример 120
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)амино)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
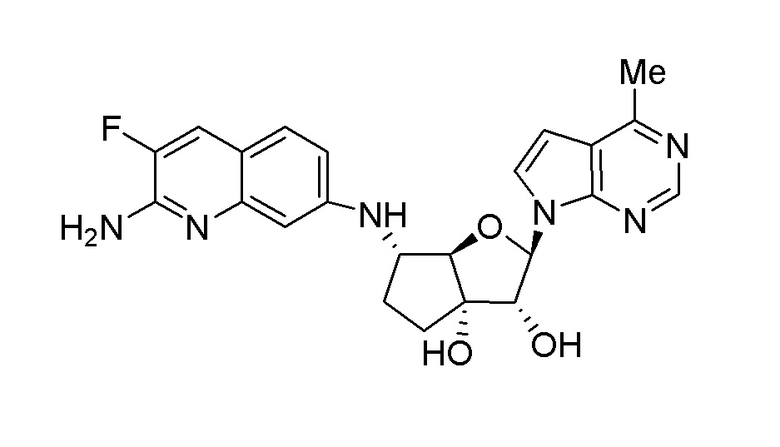
Стадия 1: К смеси (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (200 мг, 0,604 ммоль) и трифенилфосфина (317 мг, 1,21 ммоль) в толуоле (2,5 мл) добавляли изоиндолин-1,3-дион (178 мг, 1,21 ммоль) при комнатной температуре. Затем смесь охлаждали до 0°C и добавляли по каплям DIAD (0,235 мл, 1,21 ммоль). Полученную смесь перемешивали в течение 1,5 ч при 80°C. Реакционную смесь затем концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ (1:1 EtOAc:PE) с получением 2-((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)изоиндолин-1,3-диона в виде твердого вещества. MS: 461 (M+1).
Стадия 2: К перемешиваемому раствору 2-((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)изоиндолин-1,3-диона (220 мг, 0,478 ммоль) в MeOH (1,5 мл) добавляли гидразин гидрат (598 мг, 9,56 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученное твердое вещество суспендировали в DCM (30 мл). Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением (3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-амина в виде масла. MS: 331 (M+1).
Стадия 3: К перемешиваемому раствору (3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-амина (40 мг, 0,097 ммоль) и 7-бром-N-(2,4-диметоксибензил)-3-фторхинолин-2-амина (41,7 мг, 0,107 ммоль) в THF (0,5 мл) добавляли Xantphos Pd G3 (4,59 мг, 4,84 мкмоль) и 2-метилпропан-2-олят натрия (27,9 мг, 0,291 ммоль). Полученную смесь перемешивали при 50°C в течение 16 ч. Реакцию гасили насыщенным водным раствором хлорида аммония (25 мл) и экстрагировали при помощи EtOAc (3 × 40 мл). Объединенные органические слои промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (2:1 EtOAc:PE) с получением N2-(2,4-диметоксибензил)-N7-((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)-3-фторхинолин-2,7-диамина в виде твердого вещества. MS: 641 (M+1).
Стадия 4: N2-(2,4-диметоксибензил)-N7-((3aR,4R,5aR,6S,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)-3-фторхинолин-2,7-диамин (58 мг, 0,091 ммоль) растворяли в TFA (2 мл, 26,0 ммоль). Полученный раствор перемешивали при 50°C в течение ночи. Реакционную смесь затем совместно упаривали с толуолом (2 × 5 мл) при пониженном давлении. Полученный остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора). Продукт дополнительно очищали препаративной ТСХ (10:1 DCM/MeOH), затем обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)амино)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 451 (M+1). 1H-ЯМР (300 МГц, DMSO-d6) δ 8,69 (с, 1H), 7,92 (д, J=3,6 Гц, 1H), 7,53 (д, J=12,0 Гц, 1H), 7,32 (д, J=8,7 Гц, 1H), 6,83 (д, J=3,6 Гц, 1H), 6,69 (д, J=7,8 Гц, 1H), 6,42-6,36 (м, 3H), 6,8 (д, J=4,5 Гц, 1H), 6,11 (д, J=8,1 Гц, 1H), 5,38 (д, J=7,2 Гц, 1H), 5,23 (с, 1H), 4,42 (д, J=7,8 Гц, 1H), 3,96 (с, 1H), 3,55-3,53 (м, 1H), 2,69 (с, 3H), 2,50-2,49 (м, 1H), 2,07-2,02 (м, 2H), 1,94-1,90 (м, 1H).
Пример 121
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-3aH-циклопента[b]фуран-3,3a-диол
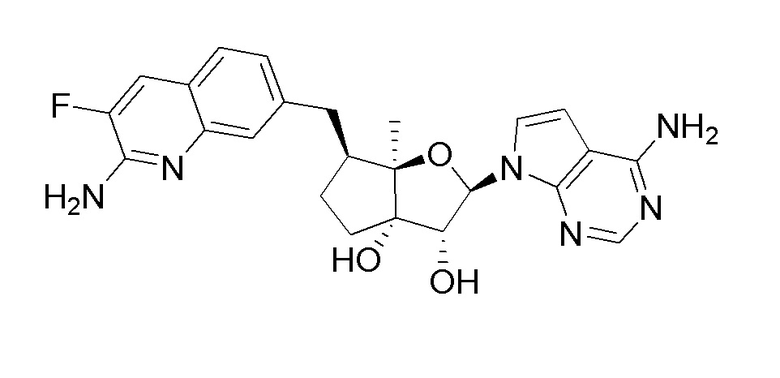
Стадия 1: К раствору (S)-2-метил-CBS-оксазаборолидина (1,788 г, 6,45 ммоль) в THF (31 мл) добавляли комплекс боран-THF (6,45 мл, 1M в THF, 6,45 ммоль) по каплям при 0°C. Реакционную смесь перемешивали в течение 30 минут при 0°C. Раствор 2-метилциклопент-2-енона (3,1 г, 32,2 ммоль) в THF (25 мл) и комплекс боран-THF (22,57 мл, 1M в THF, 22,57 ммоль) добавляли одновременно по каплям при 0°C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакционную смесь осторожно гасили добавлением 180 мл воды при 0°C. Смесь перемешивали в течение 0,5 ч при комнатной температуре и затем экстрагировали при помощи DCM (200 мл). Органический экстракт промывали насыщенным водным раствором хлорида аммония (100 мл) и насыщенным солевым раствором (100 мл), сушили безводным сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением (R)-2-метилциклопент-2-енола в виде масла, которое использовали на следующей стадии без дополнительной очистки.
Стадия 2: К перемешиваемому раствору (R)-2-метилциклопент-2-енола (1 г, 10,19 ммоль) в DCM (10 мл) добавляли DMAP (1,867 г, 15,28 ммоль) и триэтиламин (1,562 мл, 11,21 ммоль) при 0°C в атмосфере аргона. Затем добавляли медленно уксусный ангидрид (2,08 г, 20,4 ммоль). Смесь перемешивали при 0°C в течение 1 ч. Смесь гасили при помощи H2O (50 мл) и экстрагировали при помощи DCM (60 мл × 2). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-15% EtOAc/PE) с получением (R)-2-метилциклопент-2-ен-1-илацетата в виде масла. Затем раствор (R)-2-метилциклопент-2-ен-1-илацетат (700 мг, 4,99 ммоль) в THF (8 мл) добавляли к диизопропиламиду лития (3,99 мл, 2M в THF/гептан, 7,99 ммоль) при -78°C в течение 3 минут. Затем добавляли раствор трет-бутилхлордиметилсилана (1,43 г, 9,49 ммоль) в THF (2 мл) и смесь перемешивали при -78°C в течение 20 минут. Реакционную смесь нагревали до комнатной температуры и перемешивали еще в течение 2 ч. Раствор затем нагревали при кипячении с обратным холодильником в течение ночи, охлаждали до 0°C и обрабатывали концентрированной HCl (2 мл). Смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь затем распределяли между диэтиловым эфиром (40 мл) и водой (20 мл). Водный слой экстрагировали диэтиловым эфиром (30 мл). Объединенные органические слои сушили безводным сульфатом натрия и фильтровали. Фильтрат затем концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-30% EtOAc/PE) с получением (R)-2-(2-метилциклопент-2-ен-1-ил)уксусной кислоты в виде масла. 1H ЯМР (400 МГц, DMSO-d6) δ 12,04 (с, 1H), 5,36-5,34 (м, 1H), 5,26 (с, 1H), 2,77-2,75 (м, 1H), 2,46-2,41 (м, 1H), 2,30-1,91 (м, 3H), 1,64 (с, 3H), 1,51-1,46 (м, 1H).
Стадия 3: К раствору (R)-2-(2-метилциклопент-2-ен-1-ил)уксусной кислоты (10 г, 71,3 ммоль) в трет-бутилового спирта (100 мл) добавляли гидрид тетраоксовольфрама(X) (1,78 г, 7,13 ммоль) и пероксид водорода (18,2 мл, 30% в воде, 178 ммоль). Полученную суспензию перемешивали при 80°C в течение 30 минут и затем реакционную смесь охлаждали до 0°C, затем гасили насыщенным водным раствором тиосульфата натрия (100 мл). Смесь перемешивали в течение 1 ч при комнатной температуре и разбавляли при помощи EtOAc (200 мл). Органические фазы отделяли и водный слой экстрагировали при помощи EtOAc (4 × 100 мл). Объединенные органические фазы промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-60% EtOAc/PE) с получением (3aR,6S,6aS)-6-гидрокси-6a-метилгексагидро-2H-циклопента[b]фуран-2-она в виде масла. 1H ЯМР (400 МГц, DMSO-d6) δ 5,09 (д, J=4,4 Гц, 1H), 3,89-3,86 (м, 1H), 3,03-2,87 (м, 1H), 2,46-2,41 (м, 1H), 2,29-2,29 (м, 1H), 2,11-1,99 (м, 1H), 1,83-1,72 (м, 1H), 1,59-1,48 (м, 1H), 1,40-1,23 (м, 4H).
Стадия 4: К перемешиваемому раствору (3aR,6S,6aS)-6-гидрокси-6a-метилгексагидро-2H-циклопента[b]фуран-2-она (6 г, 38,4 ммоль) в DMF (40 мл) добавляли 1H-имидазол (7,85 г, 115 ммоль) и трет-бутилхлордифенилсилан (12,7 г, 46,1 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь затем гасили насыщенным водным раствором Na2CO3 (100 мл) и экстрагировали при помощи EtOAc (200 мл × 2). Объединенные органические слои промывали водой (2 × 100 мл), затем насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-15% EtOAc/PE) с получением (3aR,6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метилгексагидро-2H-циклопента[b]фуран-2-она в виде масла. MS: 395 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 7,65-7,60 (м, 4H), 7,56-7,37 (м, 6H), 4,11 (т, J=5,6 Гц, 1H), 2,97-2,88 (м, 1H), 2,57-2,51 (м, 1H), 2,28-2,23 (м, 1H), 2,05-1,96 (м, 1H), 1,61-1,48 (м, 1H), 1,46-1,39 (м, 4H), 1,32-1,19 (м, 1H), 1,04 (с, 9H).
Стадия 5: К раствору (3aR,6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метилгексагидро-2H-циклопента[b]фуран-2-она (13 г, 32,9 ммоль) в THF (40 мл) добавляли хлортриметилсилан (17,9 г, 165 ммоль) при -78°C. Добавляли по каплям бис(триметилсилил)амид лития (49,4 мл, 1M в THF, 49,4 ммоль) в течение 5 минут. Полученную смесь перемешивали при -78°C в течение 30 минут. К реакционной смеси добавляли раствор фенил гипохлорселеноита (7,57 г, 39,5 ммоль) в THF (15 мл) и смесь перемешивали при -78°C в течение 2 ч. Реакционную смесь затем гасили насыщенным водным раствором хлорида аммония (100 мл) и экстрагировали при помощи EtOAc (150 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного (3R,3aS,6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метил-3-(фенилселанил)гексагидро-2H-циклопента[b]фуран-2-она в виде масла, которое использовали непосредственно на следующей стадии.
Стадия 6: К раствору неочищенного (3R,3aS,6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метил-3-(фенилселанил)гексагидро-2H-циклопента[b]фуран-2-она (18,08 г, 32,9 ммоль) в DCM (250 мл) добавляли пероксид водорода (18,7 г, 30% в воде, 165 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь затем концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-20% EtOAc/PE) с получением (6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метил-4,5,6,6a-тетрагидро-2H-циклопента[b]фуран-2-она в виде масла. MS: 410 (M+NH4). 1H ЯМР (400 МГц, DMSO-d6) δ 7,64-7,59 (м, 4H), 7,52-7,39 (м, 6H), 5,82-5,81 (м, 1H), 3,85 (т, J=8,8 Гц, 1H), 2,86-2,67 (м, 1H), 2,44-2,30 (м,1H), 2,11-2,01 (м, 1H), 1,97-1,84 (м, 1H), 1,52 (с, 3H), 1,05 (с, 9H).
Стадия 7: Раствор (6S,6aS)-6-((трет-бутилдифенилсилил)окси)-6a-метил-4,5,6,6a-тетрагидро-2H-циклопента[b]фуран-2-она (8 г, 20,4 ммоль) в MeCN (20 мл) суспендировали в растворе 2-гидроксипропан-1,2,3-трикарбоновой кислоты (7,83 г, 40,8 ммоль) в воде (15 мл). Затем добавляли осмат(VI) калия дигидрат (0,375 г, 1,02 ммоль) с последующим добавлением 4-метилморфолин N-оксида (4,77 мл, 50% масс. в воде, 22,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. К реакционной смеси затем добавляли воду (100 мл) и смесь экстрагировали при помощи EtOAc (150 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-50% EtOAc/PE) с получением (3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-3,3a-дигидрокси-6a-метилгексагидро-2H-циклопента[b]фуран-2-она в виде масла. MS: 444 (M+NH4). 1H-ЯМР (300 МГц, DMSO-d6) δ 7,66-7,61 (м, 4H), 7,52-7,41 (м, 6H), 5,99 (д, J=7,2 Гц, 1H), 5,22 (с, 1H), 4,23 (т, J=7,5 Гц, 1H), 4,07 (д, J=7,2 Гц, 1H), 1,87 -1,68 (м, 2H), 1,65-1,51 (м, 2H), 1,35 (с, 3H), 1,05 (с, 9H).
Стадия 8: К перемешиваемому раствору (3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-3,3a-дигидрокси-6a-метилгексагидро-2H-циклопента[b]фуран-2-она (7 г, 16,4 ммоль) и димера хлорбис(циклооктен)иридия(I) (0,147 г, 0,164 ммоль) в DCM (13 мл) добавляли по каплям диэтилсилан (2,17 г, 24,6 ммоль) в атмосфере аргона при комнатной температуре. Полученный раствор перемешивали при комнатной температуре в течение 2 ч. К реакционной смеси затем добавляли твердый фторид тетрабутиламмония тригидрат (5,18 г, 16,4 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь затем гасили насыщенным водным раствором бикарбоната натрия (100 мл) и экстрагировали при помощи DCM (3 × 100 мл). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-50% EtOAc/PE) с получением (3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-6a-метилгексагидро-2H-циклопента[b]фуран-2,3,3a-триола в виде масла. MS: 446 (M+NH4).
Стадия 9: К перемешиваемому раствору (3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-6a-метилгексагидро-2H-циклопента[b]фуран-2,3,3a-триола (5,5 г, 12,8 ммоль) в безводном MeCN (260 мл) в атмосфере аргона добавляли (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (4,86 г, 19,3 ммоль) при 0°C с последующим добавлением трибутилфосфина (5,13 мл, 20,5 ммоль) при 0°C. Полученную смесь перемешивали при 35°C в течение примерно 1 ч. Отдельно, к перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (3,74 г, 24,4 ммоль) в безводном MeCN (25 мл) в атмосфере аргона добавляли DBU (3,48 мл, 23,1 ммоль) при комнатной температуре. Раствор перемешивали при комнатной температуре в течение 30 минут и затем этот раствор переносили в реакционную смесь, изначально содержащую триол, с использованием шприца и полученную реакционную смесь перемешивали при 35°C в течение 1 ч. Реакционную смесь гасили насыщенным водным раствором хлорида аммония (100 мл) и экстрагировали при помощи EtOAc (3 × 200 мл). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 564 (M+1).
Стадия 10: К раствору (2R,3R,3aS,6S,6aR)-6-((трет-бутилдифенилсилил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-2H-циклопента[b]фуран-3,3a-диола (4 г, 7,09 ммоль) в ацетоне (40 мл) добавляли 4-метилбензолсульфоновую кислоту (0,122 г, 0,709 ммоль) и 2,2-диметоксипропан (7,38 г, 70,9 ммоль) при температуре окружающей среды в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 16 ч. Смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-20% EtOAc/PE) с получением 7-((3aR,4R,5aR,6S,8aS)-6-((трет-бутилдифенилсилил)окси)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 604 (M+1).
Стадия 11: К раствору 7-((3aR,4R,5aR,6S,8aS)-6-((трет-бутилдифенилсилил)окси)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина (3,8 г, 6,29 ммоль) в THF (20 мл) в атмосфере аргона добавляли фторид тетрабутиламмония (12,6 мл, 1M в THF, 12,6 ммоль) при 0°C. Реакционную смесь затем перемешивали при комнатной температуре в течение 16 ч и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/PE). Продукт дополнительно очищали препаративной СФХ (CHIRALPAK IF, 40% 8 мМ NH3 в MeOH в CO2) с получением (3aR,4R,5aR,6S,8aS)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола в виде твердого вещества. MS: 366 (M+1).
Стадия 12: Периодинан Десса-Мартина (696 мг, 1,640 ммоль) добавляли по порциям к перемешиваемому раствору (3aR,4R,5aR,6S,8aS)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (400 мг, 1,093 ммоль) в DCM (15 мл) при 0°C. Реакционную смесь затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным раствором бикарбоната натрия (100 мл) и экстрагировали при помощи EtOAc (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-30% EtOAc/PE) с получением (3aR,4R,5aS,8aS)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она в виде твердого вещества. MS: 364 (M+1).
Стадия 13: К смеси реагента Нистеда (4,51 г, 20% в THF, 1,98 ммоль) в безводном THF (20 мл) добавляли TiCl4 (1,98 мл, 1M в DCM, 1,98 ммоль) по каплям при 0°C в атмосфере аргона. Смесь перемешивали при 0°C в течение 5 минут. Затем добавляли раствор (3aR,4R,5aS,8aS)-4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилтетрагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6(5aH)-она (360 мг, 0,990 ммоль) в безводном THF (10 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь затем гасили насыщенным раствором бикарбоната натрия (100 мл) при 0°C. Полученную смесь разбавляли при помощи EtOAc (100 мл) при комнатной температуре и экстрагировали и водный слой затем снова экстрагировали при помощи EtOAc (100 мл × 2). Объединенные органические слои промывали H2O (80 мл) и насыщенным солевым раствором (80 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-20% EtOAc/PE) с получением 4-хлор-7-((3aR,4R,5aR,8aS)-2,2,5a-триметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина в виде твердого вещества. MS: 362 (M+1).
Стадия 14: К смеси 4-хлор-7-((3aR,4R,5aR,8aS)-2,2,5a-триметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидина (240 мг, 0,663 ммоль) в 1,4-диоксане (8 мл) добавляли гидрат аммиака (8 мл, 28% масс., 0,663 ммоль) при комнатной температуре. Реакционную смесь затем перемешивали при 90°C в течение 15 ч в герметично закрытой пробирке. Растворитель удаляли при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (1-10% MeOH/DCM) с получением 7-((3aR,4R,5aR,8aS)-2,2,5a-триметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 343 (M+1).
Стадия 15: 7-((3aR,4R,5aR,8aS)-2,2,5a-триметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амин (200 мг, 0,584 ммоль) совместно упаривали с THF (3 мл) три раза. Затем добавляли раствор 9-BBN (5,84 мл, 0,5M в THF, 2,92 ммоль) при комнатной температуре в атмосфере аргона. Реакционный раствор перемешивали при 60°C в течение 1 ч. Добавляли по каплям раствор фосфата калия (620 мг, 2,92 ммоль) в воде (2,9 мл) при 0°C в атмосфере аргона. Реакционный раствор перемешивали при комнатной температуре в течение 0,5 ч. Затем добавляли 7-бром-3-фторхинолин-2-амин (148 мг, 0,613 ммоль) в THF (2,9 мл) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (42,7 мг, 0,058 ммоль) при комнатной температуре. Реакционную смесь подвергали микроволновому облучению при 80°C в течение 2,5 ч. Реакционную смесь затем охлаждали до комнатной температуры, разбавляли водой (20 мл) и экстрагировали при помощи EtOAc (3 × 50 мл). Объединенные органические слои концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением 7-(((3aR,4R,5aR,6S,8aS)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-3-фторхинолин-2-амина в виде твердого вещества. MS: 505 (M+1).
Стадия 16: В 40-мл сосуд, содержащий раствор 7-(((3aR,4R,5aR,6S,8aS)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2,5a-триметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)-3-фторхинолин-2-амина (130 мг, 0,258 ммоль) в DCM (5 мл), добавляли воду (1,2 мл) с последующим добавлением TFA (4 мл, 51,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем концентрировали при пониженном давлении. Остаток растворяли в смеси DMSO/NH4OH, фильтровали и подвергали масс-инициируемой обращенно-фазовой ВЭЖХ (ACN/вода с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-3aH-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 465 (M+1). 1H ЯМР (600 МГц, DMSO-d6) δ 8,09 (с, 1H), 7,74 (д, J=11,8 Гц, 1H), 7,54 (д, J=8,2 Гц, 1H), 7,44 (д, J=3,7 Гц, 1H), 7,28 (с, 1H), 7,07 (д, J=8,5 Гц, 1H), 7,04 (с, 2H), 6,69-6,63 (м, 3H), 5,85 (д, J=8,2 Гц, 1H), 5,34 (д, J=7,0 Гц, 1H), 4,84 (с, 1H), 4,15 (т, J=7,6 Гц, 1H), 2,84 (дд, J=13,5, 4,8 Гц, 1H), 2,57-2,51 (м, 1H), 1,89 (дд, J=11,7, 5,5 Гц, 1H), 1,87-1,80 (м, 1H), 1,64-1,55 (м, 1H), 1,52-1,40 (м, 2H), 1,17 (с, 3H).
Пример 122
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
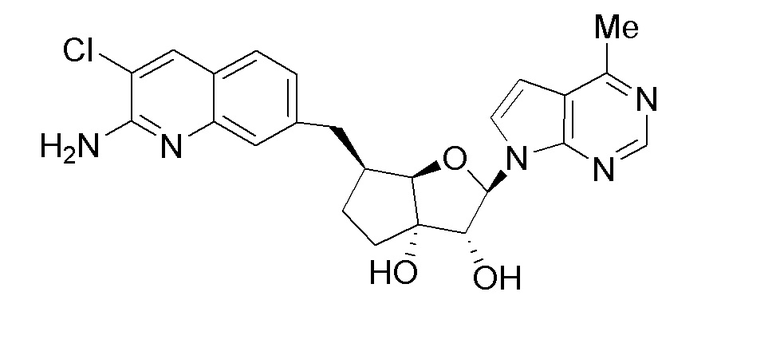
Стадия 1: К раствору (3aR,5aR,8aR)-4-метокси-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола (123 мг, 0,544 ммоль) в безводном THF (2 мл) добавляли раствор 9-BBN (5,44 мл, 0,5M в THF, 2,72 ммоль) по каплям при 0°C в атмосфере аргона. Реакционную смесь затем перемешивали при 52°C в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры. К реакционной смеси добавляли по каплям раствор трехосновного фосфата калия (576 мг, 2,71 ммоль) в воде (0,2 мл) при 0°C в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли 7-бром-3-хлорхинолин-2-амин (140 мг, 0,543 ммоль) в THF (0,3 мл) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорида с дихлорметаном (44,3 мг, 0,054 ммоль) при комнатной температуре. Реакционную смесь подвергали микроволновому облучению при 70°C в течение 2 ч. Реакционную смесь затем охлаждали до комнатной температуры, разбавляли водой (15 мл) и экстрагировали при помощи EtOAc (2 × 20 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ (элюировали смесью 20% EtOAc/PE) с получением 3-хлор-7-(((3aR,4S,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амина в виде твердого вещества. MS: 405 (M+1).
Стадия 2: К раствору 3-хлор-7-(((3aR,4S,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амина (100 мг, 0,247 ммоль) в воде (6 мл) и ацетонитрил (9 мл) добавляли концентрированную HCl (0,5 мл, 6,00 ммоль) при комнатной температуре. Раствор перемешивали при 90°C в течение 1 ч. Реакционный раствор охлаждали до 0°C и затем добавляли по порциям бикарбонат натрия (500 мг). Реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением (3R,3aS,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола в виде твердого вещества. MS: 351 (M+1).
Стадия 3: К перемешиваемому раствору (3R,3aS,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (60 мг, 0,171 ммоль) в безводном MeCN (1 мл) в атмосфере аргона добавляли по каплям (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (64,7 мг, 0,257 ммоль) в MeCN (0,5 мл) при 0°C. Затем добавляли трибутилфосфин (0,068 мл, 0,274 ммоль) в MeCN (0,5 мл) по каплям при 0°C. Полученный раствор перемешивали при 30°C в течение ~1 ч. Отдельно, к перемешиваемому раствору 4-метил-7H-пирроло[2,3-d]пиримидина (43,3 мг, 0,325 ммоль) в безводном DMF (1 мл) добавляли NaH (12,31 мг, 60% в минеральном масле, 0,308 ммоль) при комнатной температуре. Суспензию перемешивали при комнатной температуре в течение 30 минут, затем суспензию переносили в раствор, изначально содержащий триол, через шприц. Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили водой (10 мл) и экстрагировали при помощи EtOAc (2 × 10 мл). Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 466 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,69 (с, 1H), 8,12 (с, 1H), 7,88 (д, J=3,6 Гц, 1H), 7,54 (д, J=8,0 Гц, 1H), 7,28 (с, 1H), 7,08 (дд, J=8,4, 1,6 Гц, 1H), 6,82 (д, J=3,6 Гц, 1H), 6,64 (шир.с, 2H), 6,00 (д, J=8,4 Гц, 1H), 5,31 (д, J=6,8 Гц, 1H), 5,12 (с, 1H), 4,22 (т, J=8,0 Гц, 1H), 4,00 (д, J=6,0 Гц, 1H), 2,85-2,79 (м, 1H), 2,69 (с, 3H), 2,65-2,60 (м, 1H), 2,33-2,25 (м, 1H), 1,98-1,93 (м, 1H), 1,80-1,67 (м, 2H), 1,58-1,51 (м, 1H).
Пример 123
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
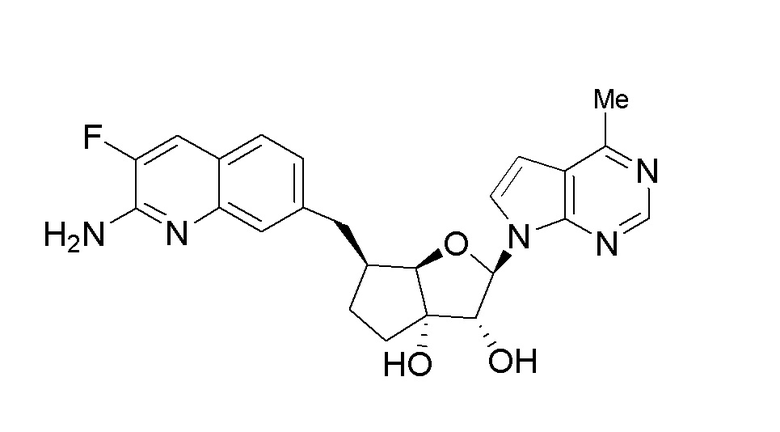
Стадия 1: К раствору (3aR,5aR,8aR)-4-метокси-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксола (245 мг, 1,08 ммоль) в безводном THF (2,5 мл) добавляли раствор 9-BBN (8,66 мл, 0,5M в THF, 4,33 ммоль) по каплям при 0°C в атмосфере аргона. Реакционный раствор перемешивали при 55°C в течение 1 ч. К этому реакционному раствору добавляли раствор K3PO4 (1,15 г, 5,40 ммоль) в воде (2 мл) при 0°C в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Затем добавляли раствор 7-бром-3-фторхинолин-2-амина (273 мг, 1,13 ммоль) в THF (2 мл) и Pd(dppf)Cl2 (119 мг, 0,162 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 75°C в течение 1,5 ч. Реакционную смесь затем концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (2:1 EtOAc/PE) с получением 3-фтор-7-(((3aR,4S,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амина в виде твердого вещества. MS: 389 (M+1).
Стадия 2: Раствор 3-фтор-7-(((3aR,4S,5aR,8aR)-4-метокси-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амина (300 мг, 0,772 ммоль) в 0,4M водной HCl в MeCN/H2O (3:2) (6 мл, 2,400 ммоль) перемешивали при 90°C в течение 1 ч. Реакционный раствор затем охлаждали до 0°C и гасили насыщенным водным раствором Na2CO3 (60 мл) и экстрагировали при помощи EtOAc (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (60 мл), сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением (3R,3aS,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола в виде твердого вещества. MS: 335 (M+1).
Стадия 3: К перемешиваемому раствору (3R,3aS,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (0,067 г, 0,2 ммоль) в безводном MeCN (3 мл) добавляли трибутилфосфин (0,077 г, 0,38 ммоль) с последующим добавлением (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (0,091 г, 0,36 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Отдельно, к перемешиваемому раствору 4-метил-7H-пирроло[2,3-d]пиримидина (0,053 г, 0,400 ммоль) в безводном DMF (2 мл) добавляли NaH (0,024 г, 60% в минеральном масле, 0,600 ммоль) при 0°C. Суспензию перемешивали при комнатной температуре в течение 30 минут. Суспензию затем переносили в раствор, изначально содержащий триол, через шприц. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь затем гасили насыщенным раствором хлорида аммония (30 мл) и экстрагировали при помощи EtOAc (40 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ (1:1 DCM/MeOH). Продукт дополнительно очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 450 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,69 (с, 1H), 7,87 (д, J=4,0 Гц, 1H), 7,74 (д, J=11,6 Гц, 1H), 7,52 (д, J=8,0 Гц, 1H), 7,28 (с, 1H), 7,07 (д, J=8,0 Гц, 1H), 6,82 (д, J=3,6 Гц, 1H), 6,66 (шир.с, 2H), 6,01 (д, J=8,0 Гц, 1H), 5,31 (д, J=7,2 Гц, 1H), 5,12 (с, 1H), 4,22 (д, J=7,6 Гц, 1H), 4,01 (д, J=6,0 Гц, 1H), 2,84-2,79 (м, 1H), 2,69 (с, 3H), 2,67-2,59 (м, 1H), 2,28-2,22 (м, 1H), 1,98-1,94 (м, 1H), 1,76-1,69 (м, 2H), 1,58-1,53 (м, 1H).
Пример 124
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
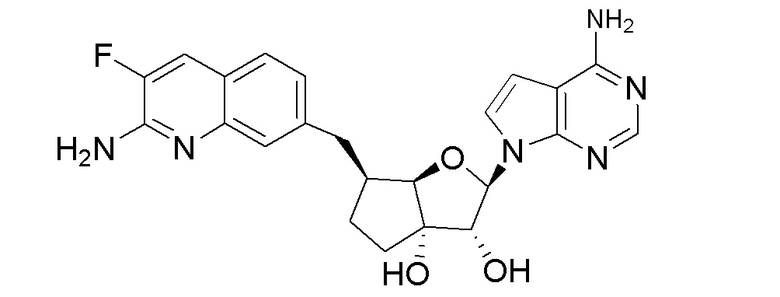
Стадия 1: К перемешиваемому раствору (3R,3aS,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (0,100 г, 0,3 ммоль) в безводном MeCN (4,5 мл) добавляли трибутилфосфин (0,115 г, 0,57 ммоль) с последующим добавлением (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (0,136 г, 0,54 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Отдельно, к перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (0,092 г, 0,60 ммоль) в безводном DMF (2 мл) добавляли гидрид натрия (0,036 г, 60% в минеральном масле, 0,90 ммоль) при 0°C. Суспензию перемешивали при комнатной температуре в течение 30 минут. Суспензию затем переносили в раствор, изначально содержащий триол, через шприц. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили насыщенным раствором хлорида аммония (40 мл) и экстрагировали при помощи EtOAc (100 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (40 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали препаративной ТСХ (1:1 PE/EtOAc) с получением (2R,3R,3aS,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 470 (M+1).
Стадия 2: К смеси (2R,3R,3aS,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (70 мг, 0,149 ммоль) в диоксане (8 мл) в герметично закрываемой пробирке добавляли гидрат аммиака (8 мл, 28%, 0,050 ммоль) при комнатной температуре. Затем реакционную смесь нагревали при 95°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали препаративной ТСХ (10:1 DCM/MeOH). Продукт дополнительно очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 451 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,09 (с, 1H), 7,74 (д, J=12,0 Гц, 1H), 7,53 (д, J=8,4 Гц, 1H), 7,44 (д, J=3,6 Гц, 1H), 7,29 (с, 1H), 7,09-7,05 (м, 3H), 6,68-6,66 (м, 3H), 5,88 (д, J=8,4 Гц, 1H), 5,25-5,20 (м, 1H), 5,07-5,05 (м, 1H), 4,13 (д, J=8,0 Гц, 1H), 3,95 (д, J=5,6 Гц, 1H), 2,84-2,79 (м, 1H), 2,67-2,58 (м, 1H), 2,29-2,13 (м, 1H), 1,96-1,92 (м, 1H), 1,74-1,68 (м, 2H), 1,57-1,49 (м, 1H).
Пример 125
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-метилхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
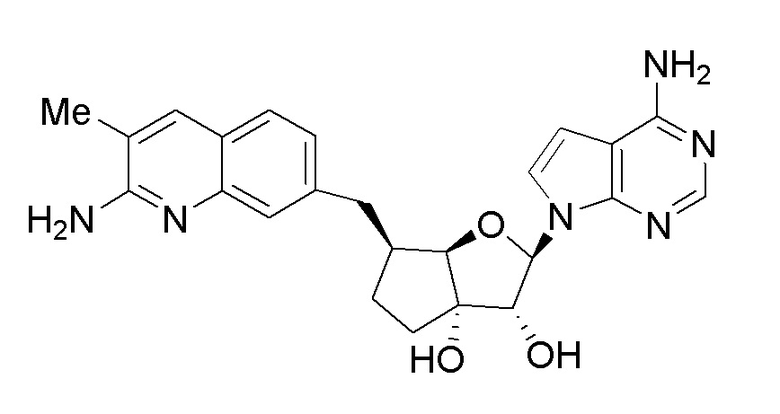
Стадия 1: В микроволновую пробирку добавляли (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол (40 мг, 0,078 ммоль), 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинан (19,6 мг, 0,156 ммоль), PdCl2(dppf) (14,4 мг, 0,020 ммоль), K2CO3 в воде (0,96 мл, 2M, 1,92 ммоль) и DMF (2 мл) при комнатной температуре в атмосфере аргона. Реакционную смесь подвергали микроволновому облучению в течение 1 ч при 130°C. Реакционную смесь затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора). Продукт дополнительно очищали препаративной ВЭЖХ (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-метилхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 447 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,10 (с, 1H), 7,65 (с, 1H), 7,47-7,45 (м, 2H), 7,25 (с, 1H), 7,06 (шир.с, 2H), 7,00 (дд, J=8,0, 1,2 Гц, 1H), 6,68 (д, J=4,0 Гц, 1H), 6,16 (шир.с, 2H), 5,90 (д, J=8,4 Гц, 1H), 5,25 (д, J=7,2 Гц, 1H), 5,07 (с, 1H), 4,14 (т, J=7,6 Гц, 1 H), 3,97 (д, J=5,6 Гц, 1 H), 2,84-2,79 (м, 1 H), 2,63-2,58 (м, 1H), 2,28-2,22 (м, 1H), 2,19 (с, 3H), 1,95 (дд, J=12,0, 4,4 Гц, 1 H), 1,75-1,70 (м, 2H), 1,56-1,51 (м, 1H).
Пример 126
(1S,2R,3S,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метилциклопентан-1,2-диол
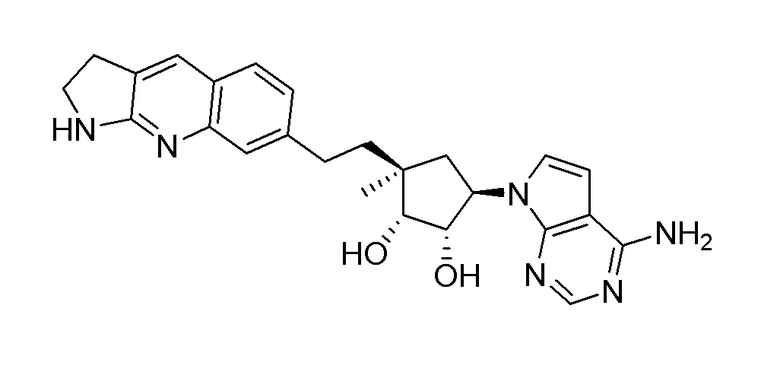
Стадия 1: К раствору 7-((3a'R,4'R,6'R,6a'S)-4'-метил-4'-винилтетрагидро-4'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин-4-амина (223 мг, 0,63 ммоль) в THF (1 мл) добавляли раствор 9-BBN (3,16 мл, 0,5 M в THF, 1,58 ммоль) в атмосфере азота и смесь нагревали до 50°C в течение нескольких часов и затем охлаждали до комнатной температуры и гасили при помощи K3PO4 (~3 мл, 2 M в воде). Смесь перемешивали в течение 15 минут и органический слой отделяли от водного слоя. К смеси RuPhos-Pd-G3 (12,4 мг, 0,015 ммоль) и трет-бутил 7-бром-2,3-дигидро-1H-пирроло[2,3-b]хинолин-1-карбоксилата (56,9 мг, 0,16 ммоль) добавляли THF (0,4 мл) в атмосфере азота. Затем одновременно вводили одну треть вышеуказанного органического слоя раствора 7-((3a'R,4'S,6'R,6a'S)-4'-(2-((1R,5R)-9-борабицикло[3.3.1]нонан-9-ил)этил)-4'-метилтетрагидро-3a'H-спиро[циклогексан-1,2'-циклопента[d][1,3]диоксол]-6'-ил)-7H-пирроло[2,3-d]пиримидин-4-амина (1,39 мл, 0,15 ммоль) и K3PO4 (0,37 мл, 2 M в воде, 0,74 ммоль). Дополнительную промывку сосуда с раствором борана добавляли в реакционный сосуд с THF (0,3 мл). Полученную смесь нагревали до 50°C в течение ночи и затем охлаждали до комнатной температуры. Реакционную смесь разбавляли DCM и водой. Органический и водный слои разделяли. Объединенные органические слои концентрировали при пониженном давлении. Остаток снова растворяли в THF (0,5 мл), воде (0,5 мл, 27,8 ммоль) и TFA (0,5 мл, 6,5 ммоль) и полученную смесь нагревали до 50°C в течение двух часов и затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/H2O с 0,1% NH4OH модификатора) с получением (1S,2R,3S,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метилциклопентан-1,2-диола в виде твердого вещества. MS: 445 (M+1). 1H ЯМР (600 МГц, DMSO-d6) δ 8,05 (с, 1H), 7,61 (с, 1H), 7,47 (д, J=8,1 Гц, 1H), 7,30-7,24 (м, 2H), 7,13 (с, 1H), 7,09-6,98 (м, 1H), 6,92 (с, 2H), 6,54 (д, J=3,5 Гц, 1H), 4,93-4,83 (м, 2H), 4,59 (д, J=5,5 Гц, 1H), 4,40 (кв., J=6,2 Гц, 1H), 3,78 (т, J=5,8 Гц, 1H), 3,57 (т, J=7,8 Гц, 2H), 3,10 (т, J=7,5 Гц, 2H), 2,72 (тд, J=12,9, 5,8 Гц, 1H), 2,62 (тд, J=13,3, 12,9, 5,7 Гц, 1H), 1,88 (дд, J=12,8, 8,8 Гц, 1H), 1,84-1,70 (м, 3H), 1,11 (с, 3H).
Пример 127
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
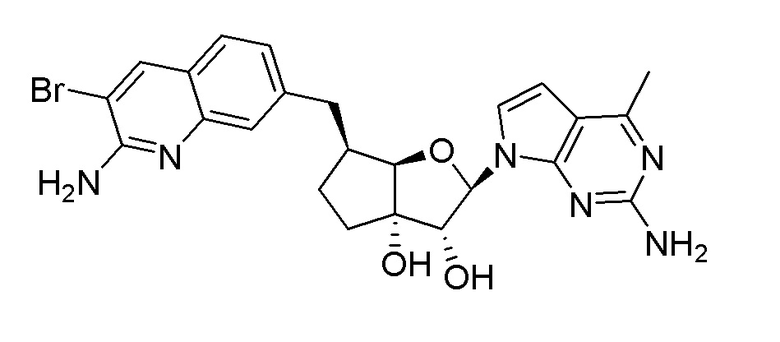
Стадия 1: В высушенный в печи и охлажденный аргоном 2-5-мл микроволновой сосуд, содержащий (3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол (70 мг, 0,177 ммоль), растворенный в безводном MeCN (3 мл), добавляли 1,1'-(азодикарбонил)дипиперидин (67,0 мг, 0,266 ммоль) с последующим добавлением три-н-бутилфосфина (70,8 мкл, 0,283 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч. В отдельный высушенный в печи и охлажденный аргоном сосуд, содержащий ди-трет-бутил (4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбонат (93 мг, 0,266 ммоль), растворенный в безводном ацетонитриле (1 мл), добавляли DBU (53,4 мкл, 0,354 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут и затем эту суспензию переносили через шприц в смесь, описанную выше, изначально содержащую триол. Реакционную смесь поддерживали 30 минут при комнатной температуре, затем нагревали до 40°C в течение ~4 ч. Смесь затем охлаждали до комнатной температуры, гасили водой и экстрагировали при помощи EtOAc (3×). Объединенные органические слои затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-100% EtOAc:гексан) с получением ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)метил]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбоната в виде твердого вещества. MS: 725/727 (M+1/M+3).
Стадия 2: К раствору ди-трет-бутил (7-{(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)метил]-3,3a-дигидроксигексагидро-2H-циклопента[b]фуран-2-ил}-4-метил-7H-пирроло[2,3-d]пиримидин-2-ил)имидодикарбоната (39,8 мг, 0,055 ммоль) в DCM (1,10 мл) добавляли TFA 20 эквивалентнов) и реакционную смесь перемешивали в течение в течение ночи при комнатной температуре. Смесь затем концентрировали при пониженном давлении и остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN:H2O градиент с 0,1% NH4OH) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 525/527 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,31 (с, 1H), 7,55 (д, J=8,2 Гц, 1H), 7,32 (д, J=3,8 Гц, 1H), 7,28 (с, 1H), 7,09 (дд, J=8,2, 1,4 Гц, 1H), 6,55 (с, 2H), 6,51 (д, J=3,8 Гц, 1H), 6,18 (с, 2H), 5,82 (д, J=8,2 Гц, 1H), 5,27 (д, J=6,9 Гц, 1H), 5,03 (с, 1H), 4,08-4,03 (м, 1H), 3,91 (д, J=5,7 Гц, 1H), 2,83-2,78 (м, 1H), 2,64-2,59 (м, 1H), 2,45 (с, 3H), 2,28-2,21 (м, 1H), 1,97-1,93 (м, 1H), 1,72-1,67 (м, 2H), 1,57-1,49 (м, 1H).
Пример 128
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
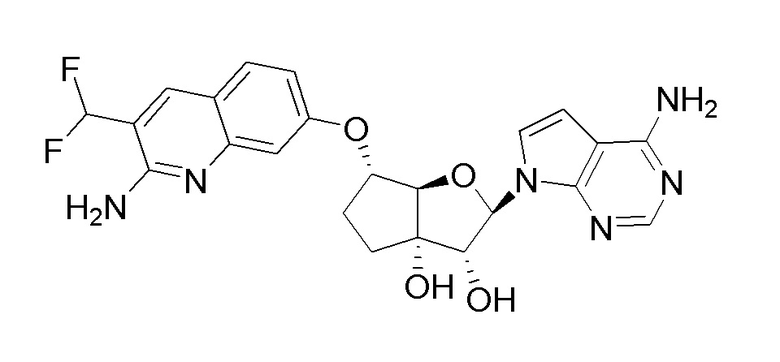
Стадия 1: К перемешиваемому раствору (3R,3aS,6R,6aR)-6-(бензилокси)гексагидро-2H-циклопента[b]фуран-2,3,3a-триола (3,4 г, 12,8 ммоль) в безводном MeCN (170 мл) добавляли по каплям трибутилфосфин (5,10 мл, 20,4 ммоль) в MeCN (70 мл) при 0°C в атмосфере аргона. Затем добавляли по каплям (E)-диазен-1,2-диилбис(пиперидин-1-илметанон) (4,83 г, 19,2 ммоль) в MeCN (70 мл) при 0°C в атмосфере аргона. Полученную смесь перемешивали при 40°C в течение 30 минут. Отдельно, к перемешиваемому раствору 4-хлор-7H-пирроло[2,3-d]пиримидина (3,67 г, 23,88 ммоль) в безводном MeCN (35 мл) добавляли по каплям DBU (3,62 мл, 24,01 ммоль) при 0°C в атмосфере аргона. Полученный раствор перемешивали при 30°C в течение 1 ч. Затем этот раствор переносили в раствор, изначально содержащий триол, через шприц в течение 1 минуты. Полученную реакционную смесь перемешивали при 39°C в течение 2 ч. Реакционную смесь разбавляли при помощи EtOAc (200 мл), промывали водой (2 × 100 мл) и промывали насыщенным солевым раствором (100 мл). Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (ACN/вода с 0,05% NH4HCO3) с получением (2R,3R,3aS,6R,6aR)-6-(бензилокси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 402 (M+1).
Стадия 2: К раствору (2R,3R,3aS,6R,6aR)-6-(бензилокси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола (8,6 г, 15,2 ммоль, 71% масс.) в 2,2-диметоксипропане (100 мл) добавляли 4-метилбензолсульфоновую кислоту (0,262 г, 1,52 ммоль) при комнатной температуре в атмосфере аргона. Смесь перемешивали при 70°C в течение 16 ч. Реакционную смесь затем охлаждали до комнатной температуры и гасили насыщенным водным раствором бикарбоната натрия (10 мл). Смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/PE) с получением 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина в виде масла. MS: 442 (M+1).
Стадия 3: К раствору 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-хлор-7H-пирроло[2,3-d]пиримидина (5 г, 10,75 ммоль) в диоксане (60 мл) добавляли гидроксид аммония (120 мл, 28%, 872 ммоль) при комнатной температуре. Смесь плотно закрывали и перемешивали при 90°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (0-10% MeOH/DCM) с получением 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина в виде твердого вещества. MS: 423 (M+1).
Стадия 4: К смеси 7-((3aR,4R,5aR,6R,8aR)-6-(бензилокси)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-7H-пирроло[2,3-d]пиримидин-4-амина (339 мг, 0,722 ммоль) в MeOH (40 мл) добавляли гидроксид палладия на углероде (1,78 г, 20%, 50% в воде, 2,53 ммоль) при комнатной температуре в атмосфере аргона. Суспензию дегазировали в вакууме и продували H2 несколько раз. Реакционную смесь перемешивали в атмосфере H2 (2 атм) при комнатной температуре в течение 2 ч. Смесь фильтровали через слой Целита и фильтрат концентрировали при пониженном давлении с получением (3aR,4R,5aR,6R,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола в виде твердого вещества. MS: 333 (M+1).
Стадия 5: К перемешиваемой смеси (3aR,4R,5aR,6R,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ола (170 мг, 0,512 ммоль) в DCM (5 мл) и пиридине (0,5 мл) добавляли трифторметансульфоновый ангидрид (188 мг, 0,665 ммоль) при 0°C в атмосфере аргона. Полученную смесь перемешивали в течение 2 ч при 0°C. Реакционную смесь затем гасили насыщенным раствором NaHCO3(30 мл), экстрагировали при помощи EtOAc (30 мл × 3) и объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной ТСХ (1:1 PE:EtOAc) с получением (3aR,4R,5aR,6R,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил трифторметансульфоната в виде твердого вещества. MS: 465 (M+1).
Стадия 6: К перемешиваемому раствору (3aR,4R,5aR,6R,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил трифторметансульфоната (90 мг, 0,194 ммоль) и 2-амино-3-(дифторметил)хинолин-7-ола (44,8 мг, 0,213 ммоль) в NMP (0,5 мл) добавляли Cs2CO3 (95 мг, 0,291 ммоль) при 25°C в атмосфере аргона. Полученную смесь перемешивали в течение 2 ч при 25°C. Реакционную смесь очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением 7-(((3aR,4R,5aR,6S,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)-3-(дифторметил)хинолин-2-амина в виде твердого вещества. MS: 525 (M+1).
Стадия 7: В сосуд, содержащий 7-(((3aR,4R,5aR,6S,8aR)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)-3-(дифторметил)хинолин-2-амин (50 мг, 0,095 ммоль), добавляли TFA (1 мл) и воду (1 мл) при 25°C. Полученную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 485 (M+1). 1H-ЯМР (400 МГц, CD3OD) δ 8,10-8,09 (м, 2H), 7,65 (д, J=8,8 Гц, 1H), 7,41 (д, J=3,6 Гц, 1H), 7,00-6,95 (м, 2H), 6,86-6,63 (м, 2H), 6,04 (д, J=8,4 Гц, 1H), 4,77 (д, J=4,8 Гц, 1H), 4,49 (д, J=8,4 Гц, 1H), 4,30 (с, 1H), 2,53-2,43 (м, 1H), 2,26-2,16 (м, 3H).
Пример 129
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
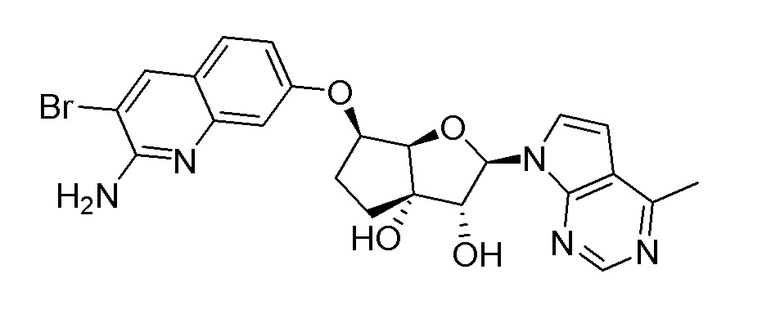
Стадия 1: В сосуд, содержащий (3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ол (50 мг, 0,15 ммоль), 3-бром-N-(2,4-диметоксибензил)-7-иодхинолин-2-амин (113 мг, 0,23 ммоль), 4-(пирролидин-1-ил)пиридин (26,8 мг, 0,181 ммоль), иодид меди (2,87 мг, 0,015 ммоль), трехосновный фосфат калия (128 мг, 0,60 ммоль), добавляли толуол (754 мкл) и реакционную смесь нагревали до 120°C в течение ночи. Реакционную смесь фильтровали, концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-100% EtOAc/CH2Cl2) с получением 3-бром-N-(2,4-диметоксибензил)-7-(((3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амина в виде твердого вещества. MS: 702/704 (M+1/M+3).
Стадия 2: К раствору 3-бром-N-(2,4-диметоксибензил)-7-(((3aR,4R,5aR,6R,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)окси)хинолин-2-амина (64 мг, 0,091 ммоль) в CH2Cl2 (911 мкл) добавляли TFA (1,40 мл, 18,2 ммоль) и 1 каплю воды. Реакционную смесь нагревали до 50°C в течение 4 ч. Раствор концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением (2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 512/514 (M+1/M+3). 1H ЯМР (500 МГц, DMSO-d6) δ 8,63 (с, 1H), 8,24 (с, 1H), 7,78 (д, J=3,8 Гц, 1H), 7,51 (д, J=8,9 Гц, 1H), 6,94 (д, J=2,2 Гц, 1H), 6,86 (дд, J=8,8, 2,4 Гц, 1H), 6,77 (д, J=3,7 Гц, 1H), 6,54 (с, 2H), 6,14 (д, J=8,2 Гц, 1H), 5,46 (д, J=7,0 Гц, 1H), 5,39 (с, 1H), 4,84 (дт, J=8,8, 5,8 Гц, 1H), 4,41 (д, J=5,3 Гц, 1H), 4,33 (т, J=7,6 Гц, 1H), 2,64 (с, 3H), 2,25 (д, J=4,1 Гц, 1H), 2,22-2,12 (м, 1H), 2,11-2,03 (м, 1H), 1,73-1,64 (м, 1H).
Пример 130
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
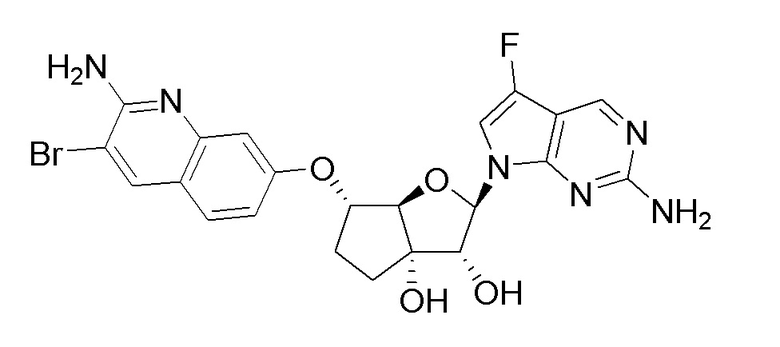
Стадия 1: К перемешиваемой суспензии 2-хлор-5-фтор-7H-пирроло[2,3-d]пиримидина (43,2 мг, 0,252 ммоль) в THF (8,39 мл) добавляли пиридин (20,4 мкл, 0,252 ммоль), DIAD (103 мкл, 0,529 ммоль) и три-н-бутилфосфин (126 мкл, 0,503 ммоль). К смеси добавляли (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-2,3,3a-триол (100 мг, 0,252 ммоль) одной порцией. Смесь оставляли для перемешивания в течение 2 ч. Смесь разбавляли водой и экстрагировали при помощи EtOAc (3x). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-20% MeOH/DCM) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола. MS: 550/552 (M+1/M+3)
Стадия 2: Смесь (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-хлор-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола (55,1 мг, 0,1 ммоль) в 1,4-диоксане (1 мл) и гидроксида аммония (1 мл, 7,19 ммоль) подвергали микроволновому облучению до 100°C в течение 2 ч. Смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (0-15% MeOH/DCM). Продукт дополнительно очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 531/533 (M+1/M+3). 1H ЯМР (500 МГц, DMSO-d6) δ 8,68 (с, 1H), 8,63 (с, 1H), 7,74 (д, J=8,8 Гц, 1H), 7,59 (с, 1H), 7,25-6,72 (м, 5H), 5,99 (д, J=8,5 Гц, 1H), 4,63 (д, J=5,0 Гц, 1H), 4,23 (д, J=8,5 Гц, 2H), 4,03 (с, 2H), 2,13-1,90 (м, 3H).
Пример 131
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол
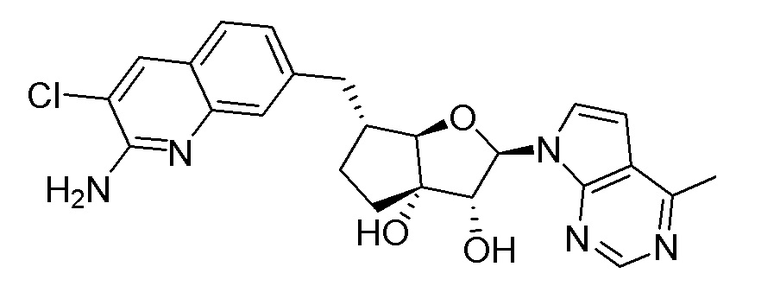
Стадия 1: К смеси димера хлор(1,5-циклооктадиен)иридия(I) (18,10 мг, 0,035 ммоль) и DPPE (28,0 мг, 0,070 ммоль) в CH2Cl2 (3,01 мл) добавляли 4,4,5,5-тетраметил-1,3,2-диоксаборолан (281 мкл, 1,76 ммоль) в атмосфере N2. Смесь дегазировали и снова заполняли три раза N2. После перемешивания в течение 20 минут при 25°C к смеси добавляли 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-метиленгексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин (230 мг, 0,703 ммоль) в CH2Cl2 (3,01 мл) в атмосфере N2. Смесь дегазировали и снова заполняли N2 три раза и полученную смесь перемешивали при 25°C в течение 15 ч. Реакционную смесь охлаждали до 0°C, гасили при помощи 4 мл MeOH, концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-100% EtOAc/DCM) с получением 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-((4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)метил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидина в виде смолы. MS: 456 (M+1).
Стадия 2: В сосуд, содержащий 7-бром-3-хлорхинолин-2-амин (50,9 мг, 0,198 ммоль), 7-((3aR,4R,5aR,8aR)-2,2-диметил-6-((4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)метил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-4-ил)-4-метил-7H-пирроло[2,3-d]пиримидин (75 мг, 0,165 ммоль), аддукт PdCl2(dppf)-CH2Cl2 (26,9 мг, 0,033 ммоль), добавляли THF (2,75 мл), воду (549 мкл) и загружали этоксид таллия (I) (35,0 мкл, 0,49 ммоль). Реакционную смесь нагревали в течение 72 ч при 65°C. Реакционную смесь разбавляли при помощи EtOAc, фильтровали, промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (10-100% EtOAc/DCM) с получением 3-хлор-7-(((3aR,4R,5aR,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амина, который использовали без дополнительной очистки. MS: 506 (M+1).
Стадия 3: 3-хлор-7-(((3aR,4R,5aR,8aR)-2,2-диметил-4-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидроциклопента[2,3]фуро[3,4-d][1,3]диоксол-6-ил)метил)хинолин-2-амин (10 мг, 0,012 ммоль) растворяли в CH2Cl2 (3 мл). Добавляли каплю воды с последующим добавлением TFA (0,457 мл, 5,93 ммоль). Реакционную смесь нагревали до 50°C в течение 2 ч и реакционную смесь концентрировали при пониженном давлении и подвергали СФХ разделению на (Whelk-O (R, R), 21 × 250 MeOH водн./0,1% NH4OH 35% модификатора в CO2) с получением (2R,3R,3aS,6R,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диола в виде твердого вещества MS: 466 (M+1). 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (с, 1H), 8,14 (с, 1H), 7,80 (д, J=3,8 Гц, 1H), 7,58 (д, J=8,2 Гц, 1H), 7,32 (с, 1H), 7,10 (д, J=8,1 Гц, 1H), 6,77 (д, J=3,7 Гц, 1H), 6,66 (с, 2H), 6,01 (д, J=8,1 Гц, 1H), 5,47 (с, 1H), 5,31 (с, 1H), 4,33 (д, J=8,1 Гц, 1H), 3,92 (м, 1H), 2,86 (дд, J=13,9, 8,2 Гц, 1H), 2,71 (дд, J=13,9, 8,2 Гц, 1H), 2,66 (с, 3H), 2,35 (м, 1H), 2,12-1,93 (м, 2H), 1,92-1,81 (м, 1H), 1,60 (м, 1H).
Пример 132
(3aS,4S,5R)-1-((2-амино-3-бромхинолин-7-ил)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диол
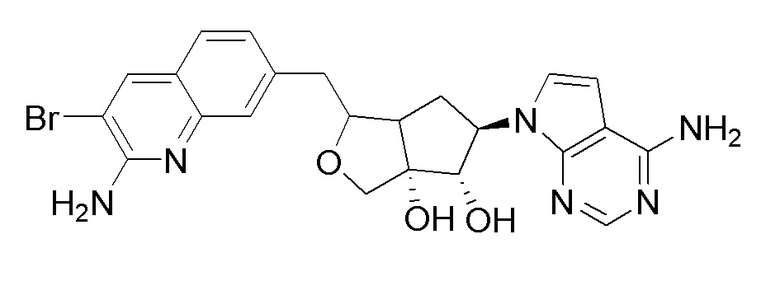
Стадия 1: К перемешиваемому раствору 3-бром-7-иод-N-(4-метоксибензил)хинолин-2-амина (3 г, 6,39 ммоль) в THF (18,0 мл) добавляли аллилтрибутилстаннан (2,18 мл, 7,03 ммоль) и Pd(PPh3)4 (0,739 г, 0,639 ммоль) при комнатной температуре в атмосфере аргона. Полученную смесь нагревали до 95°C и перемешивали в течение 6 ч. Реакцию гасили добавлением воды (200 мл) и экстрагировали этилацетатом (250 мл × 2). Органический слой промывали насыщенным солевым раствором (200 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (5-30% гексан/(3:1) смесь этилацетат:этанол) с получением 7-аллил-3-бром-N-(4-метоксибензил)хинолин-2-амина в виде масла. MS: 383/ 385 (M+1/M+3).
Стадия 2: В круглодонной колбе, снабженной магнитной мешалкой, 7-аллил-3-бром-N-(4-метоксибензил)хинолин-2-амин (1 г, 2,61 ммоль) растворяли в DCM (52,2 мл). Колбу устанавливали на бане сухой лед-ацетон и соединяли с озонатором. Воздух пропускали через озонатор и барботировали в колбу. Реакцию контролировали каждые 5 минут методом ЖХМС, при этом озонатор останавливали и реакционную смесь барботировали воздухом в течение 5 минут, затем брали аликвоту. Когда исходное вещество было полностью израсходовано и наблюдалась соответствующая масса озонида, в холодную реакционную смесь добавляли трифенилфосфан (1,369 г, 5,22 ммоль) и реакционную колбу извлекали из охлаждающей бани и перемешивали еще в течение 30 минут. Реакцию гасили водой (10 мл) экстрагировали при помощи DCM (10 мл) и органическую фазу промывали насыщенным солевым раствором (10 мл). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)ацетальдегида, который использовали на следующей стадии без дополнительной очистки.
Стадия 3: К перемешиваемому раствору 2-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)ацетальдегида (5 г, 13,0 ммоль) в THF (130 мл) добавляли по каплям винилмагний бромид (20,8 мл, 1M в THF, 20,8 ммоль) при 0°C и перемешивали в течение 1 ч. Реакцию гасили насыщенным раствором хлорида аммония (200 мл) и экстрагировали этилацетатом (300 мл × 2). Органический слой промывали насыщенным солевым раствором (200 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% гексан/3:1 смесь этилацетат:этанол) с получением 1-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)бут-3-ен-2-ола. MS: 413/415 (M+1/M+3).
Стадия 4: Раствор 1-(3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)бут-3-ен-2-ола (1,5 г, 3,63 ммоль) в безводном THF (36,3 мл) охлаждали на ледяной бане. Затем добавляли гидрид натрия (363 мг, 9,08 ммоль) в атмосфере азота. После перемешивания в течение 15 минут добавляли по каплям раствор 3-бромпроп-1-ина (0,61 мл, 5,44 ммоль) в толуоле. Полученную реакционную смесь медленно нагревали до комнатной температуры в течение ночи. Реакцию гасили насыщенным водным раствором хлорида аммония и смесь экстрагировали этилацетатом. Органическую фазу отделяли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-30% гексан/3:1 смесь этилацетат:этанол) с получением 3-бром-N-(4-метоксибензил)-7-(2-(проп-2-ин-1-илокси)бут-3-ен-1-ил)хинолин-2-амина в виде твердого вещества. MS: 451/453 (M+1/M+3).
Стадия 5: В сосуд, содержащий октакарбонил дикобальта (80 мг, 0,233 ммоль), добавляли раствор 3-бром-N-(4-метоксибензил)-7-(2-(проп-2-ин-1-илокси)бут-3-ен-1-ил)хинолин-2-амина (700 мг, 1,55 ммоль) в толуоле (15,5 мл) в атмосфере аргона. Реакционную смесь затем нагревали до 100°C в CO аппарате Парра при давлении CO ~70 ф/дюйм2(4,9 кг/см2) в течение 20 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром, пропускали через слой Целита и затем концентрировали при пониженном давлении с получением неочищенного 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3a,4-дигидро-1H-циклопента[c]фуран-5(3H)-она, который использовали как таковой на следующей стадии без дополнительной очистки.
Стадия 6: Раствор 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3a,4-дигидро-1H-циклопента[c]фуран-5(3H)-она (500 мг, 1,04 ммоль) в THF (20 мл) и MeOH (10 мл) охлаждали до -40°C на бане сухой лед/ацетонитрил. Добавляли хлорид церия(III) гептагидрат (389 мг, 1,04 ммоль). Смесь перемешивали холодной в течение 20 минут. Затем добавляли тетрагидроборат натрия (79 мг, 2,09 ммоль). Реакционную смесь затем интенсивно перемешивали холодной в течение 40 минут. Реакционную смесь удаляли из бани и через несколько минут гасили, выливая в делительную воронку, содержащую этилацетат (100 мл) и 3:2:1 насыщенный хлорид аммония:воду:насыщенный солевой раствор (70 мл). После экстрагирования водный слой снова промывали этилацетатом (100 мл × 2). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (0-50% гексан/3:1 смесь этилацетат:этанол) с получением 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3,3a,4,5-тетрагидро-1H-циклопента[c]фуран-5-ола. MS: 481/483 (M+1/M+3).
Стадия 7: К раствору 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3,3a,4,5-тетрагидро-1H-циклопента[c]фуран-5-ола (140 мг, 0,291 ммоль) в DCM (20 мл) добавляли пиридин (0,071 мл, 0,872 ммоль), N, N-диметилпиридин-4-амин (71,1 мг, 0,582 ммоль) и ди-трет-бутилдикарбонат (127 мг, 0,582 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в делительную воронку, содержащую насыщенный раствор хлорида аммония и DCM. После экстрагирования органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное неочищенное вещество очищали колоночной хроматографией на диоксиде кремния (0-5-10% EtOAc/гексан) с получением 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3,3a,4,5-тетрагидро-1H-циклопента[c]фуран-5-ил трет-бутилкарбоната. MS: 581/583 (M+1/M+3).
Стадия 8: В сосуд, содержащий N, N'-((1R,2R)-циклогексан-1,2-диил)бис(2-(дифенилфосфанил)бензамид) (3,56 мг, 5,16 мкмоль), тетрабутиламмоний дифтортрифенилсиликат (9,28 мг, 0,017 ммоль), 4-хлор-7H-пирроло[2,3-d]пиримидин (5,28 мг, 0,034 ммоль) и Pd2dba3 (1,575 мг, 1,720 мкмоль), добавляли безводный THF (1 мл). Эту смесь перемешивали при комнатной температуре в течение 15 минут. Затем добавляли раствор 3-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-3,3a,4,5-тетрагидро-1H-циклопента[c]фуран-5-ил трет-бутилкарбоната (10 мг, 0,017 ммоль) в безводном THF (1 мл). Реакционную смесь перемешивали в атмосфере аргона при комнатной температуре в течение ночи. Смесь выливали в делительную воронку, содержащую воду (10 мл), и экстрагировали этилацетатом (15 мл × 2). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0-50% EtOAc/гексан) с получением 3-бром-7-((5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3,5,6,6a-тетрагидро-1H-циклопента[c]фуран-1-ил)метил)-N-(4-метоксибензил)хинолин-2-амина. MS: 616/618 (M+1/M+3).
Стадия 9: К раствору 3-бром-7-((5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3,5,6,6a-тетрагидро-1H-циклопента[c]фуран-1-ил)метил)-N-(4-метоксибензил)хинолин-2-амина (160 мг, 0,259 ммоль) в THF (2 мл) и воде (1 мл) добавляли 4-метилморфолин 4-оксид (60,8 мг, 0,519 ммоль) и раствор оксида осмия(VIII) (407 мкл, 0,052 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили 40% водным раствором бисульфита натрия (3 мл) и перемешивали в течение 15 минут и затем экстрагировали хлороформом, содержащим 25% изопропилацетата (5 мл × 2). Объединенные органические слои промывали водой (3 мл) и затем насыщенным солевым раствором (3 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 1-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диола, который использовали на следующей стадии без дополнительной очистки.
Стадия 10: К раствору 1-((3-бром-2-((4-метоксибензил)амино)хинолин-7-ил)метил)-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диола (16 мг, 0,025 ммоль) в DCM (5 мл) добавляли моногидрат 4-метилбензолсульфоновой кислоты (14,0 мг, 0,074 ммоль) и 2,2-диметоксипропан (30 мкл, 0,244 ммоль) в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в делительную воронку, содержащую насыщенный водный раствор хлорида аммония (10 мл), и экстрагировали при помощи DCM (10 мл × 2). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 3-бром-7-((4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-5H,8H-фуро[3',4':1,5]циклопента[1,2-d][1,3]диоксол-6-ил)метил)-N-(4-метоксибензил)хинолин-2-амина, который использовали на следующей стадии без дополнительной очистки.
Стадия 11: В сосуд, содержащий 3-бром-7-((4-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-5H,8H-фуро[3',4':1,5]циклопента[1,2-d][1,3]диоксол-6-ил)метил)-N-(4-метоксибензил)хинолин-2-амин (16 мг, 0,023 ммоль), добавляли аммиак (1 мл, 7M в MeOH, 7,00 ммоль). Сосуд герметично закрывали и реакционную смесь нагревали в микроволновой печи в течение 4 часов при 140°C. Реакционную смесь затем концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на диоксиде кремния (10-60% гексан/3:1 смесь этилацетат:этанол). Продукт дополнительно очищали при помощи СФХ (MeOH водн./0,1% NH4OH, 35% модификатора в CO2) с получением 7-(((3aS,4R,8aS)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-5H,8H-фуро[3',4':1,5]циклопента[1,2-d][1,3]диоксол-6-ил)метил)-3-бром-N-(4-метоксибензил)хинолин-2-амина. MS: 671/ 673 (M+1/M +3).
Стадия 12: В колбу, содержащую 7-(((3aS,4R,8aS)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,2-диметилтетрагидро-5H,8H-фуро[3',4':1,5]циклопента[1,2-d][1,3]диоксол-6-ил)метил)-3-бром-N-(4-метоксибензил)хинолин-2-амин (2 мг, 2,16 мкмоль), добавляли TFA (121 мкл, 1,57 ммоль) и реакционную смесь перемешивали при 45°C в течение 3 ч. Неочищенное вещество концентрировали при пониженном давлении и остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением (3aS,4S,5R)-1-((2-амино-3-бромхинолин-7-ил)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диола, TFA соли, в виде твердого вещества. MS: 511/513 (M+1/M+3). 1H ЯМР (499 МГц, DMSO-d6) δ 8,31 (с, 1H), 8,00 (с, 1H), 7,57 (д, J=8,2 Гц, 1H), 7,36 (с, 1H), 7,25 (д, J=3,6 Гц, 1H), 7,14 (д, J=6,9 Гц, 1H), 6,89 (с, 2H), 6,56 (с, 2H), 6,50 (д, J=3,5 Гц, 1H), 5,02 (д, J=7,0 Гц, 1H), 4,99 (с, 1H), 4,92-4,80 (м, 1H), 4,24 (дд, J=10,5, 7,1 Гц, 1H), 4,00 (кв., J=6,7 Гц, 1H), 3,76 (кв., J=9,3 Гц, 2H), 3,05 (дд, J=13,5, 7,6 Гц, 1H), 2,91 (дд, J=13,3, 6,3 Гц, 1H), 2,28-2,19 (м, 1H), 1,99-1,87 (м, 1H), 1,59-1,44 (м, 1H).
Примеры 133 и 134
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол и
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол
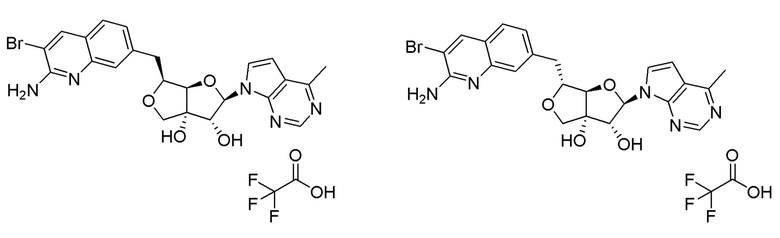
Стадия 1: DMP (61,6 г, 145 ммоль) добавляли по порциям к раствору диацетон-D-глюкозы (25 г, 97 ммоль) в DCM (300 мл) при 0°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь затем охлаждали до 0°C и добавляли насыщенный раствор бикарбоната натрия (100 мл) с последующим добавлением насыщенного раствора сульфита натрия (100 мл). Реакционную смесь перемешивали в течение 30 минут при комнатной температуре и слои разделяли. Водные слои экстрагировали DCM (1 × 200 мл), объединенные органические слои затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-она, который использовали на следующей стадии без дополнительной очистки.
Стадия 2: 500-мл 3-горлую колбу, снабженную магнитной мешалкой, датчиком температуры, капельной воронкой и перегородкой, нагревали техническим феном в вакууме, лабораторную посуду охлаждали до комнатной температуры и загружали (3aR,5R,6aS)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[2,3-d][1,3]диоксол-6(3aH)-он (20 г, 77 ммоль) и толуол (309 мл). Раствор охлаждали до 0°C и добавляли по каплям винилмагний хлорид (58 мл, 1,6M, 93 ммоль) с такой скоростью, чтобы температура не превышала 5°C. После завершения добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Смесь гасили насыщенным водным раствором хлорида аммония (250 мл) и затем разбавляли при помощи EtOAc (500 мл). Слои разделяли и органический слой промывали насыщенным солевым раствором (2 × 250 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (3aR,5R,6R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола, который использовали на следующей стадии без дополнительной очистки.
Стадия 3: Раствор (3aR,5R,6R,6aR)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола (18,0 г, 62,8 ммоль) в THF (165 мл) охлаждали до 0°C и добавляли по порциям гидрид натрия (6,28 г, 157 ммоль). Реакционную смесь перемешивали в течение 30 минут при 0°C и затем в течение 30 минут при комнатной температуре. Затем добавляли TBAI (2,32 г, 6,28 ммоль) с последующим добавлением бензилбромида (14,9 мл, 125 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь охлаждали до 0°C и гасили насыщенным раствором хлорида аммония (200 мл). Смесь разбавляли EtOAc (200 мл) и слои разделяли. Объединенные органические слои промывали насыщенным солевым раствором (2 × 200 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0%-100% EtOAc/гексан) с получением (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксола. 1H ЯМР (600 МГц, CDCl3) δ 7,43 (д, J=7,5 Гц, 2H), 7,37-7,32 (м, 2H), 7,31-7,26 (м, 1H), 5,89 (дд, J=18,0, 11,4 Гц, 1H), 5,85 (д, J=3,6 Гц, 1H), 5,49 (д, J=11,4 Гц, 1H), 5,32 (д, J=18,0 Гц, 1H), 4,71 (д, J=11,4 Гц, 1H), 4,65 (д, J=3,6 Гц, 1H), 4,63 (д, J=11,4 Гц, 1H), 4,34 (д, J=5,7 Гц, 1H), 4,19 (дд, J=5,9 Гц, 1H), 4,01-3,94 (м, 2H), 1,64 (с, 3H), 1,45 (с, 3H), 1,41 (с, 3H), 1,36 (с, 3H).
Стадия 4: Раствор (3aR,5R,6R,6aR)-6-(бензилокси)-5-((S)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6-винилтетрагидрофуро[2,3-d][1,3]диоксола (1000 мг, 2,66 ммоль) и пиридина (0,645 мл, 7,97 ммоль) в DCM (20 мл) охлаждали до -78°C и через раствор пропускали поток озона (озонатор Triogen, с использованием сжатого воздуха) в течение 10 минут. Сосуд продували воздухом и нагревали до комнатной температуры. Реакционную смесь охлаждали до -78°C и пропускали через нее озон еще в течение 10-15 минут. Сосуд продували воздухом и нагревали до 0°C. Неочищенное вещество разбавляли MeOH (20 мл) и добавляли борогидрид натрия (502 мг, 13,3 ммоль) при 0°C. Реакционную смесь перемешивали при этой температуре в течение 3 ч. Реакцию гасили добавлением раствора NaOH (1M, 50 мл), перемешивали в течение 5 минут и разбавляли при помощи EtOAc (200 мл). Органический слой промывали насыщенным солевым раствором (3 × 50 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением ((3aR,5R,6R,6aR)-6-(бензилокси)-5-((S)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ил)метанола, который использовали на следующей стадии без дополнительной очистки.
Стадия 5: Серную кислоту (0,348 мл, 5% об./об. водный раствор, 6,53 ммоль) добавляли к раствору (3aR,5R,6R,6aR)-6-(бензилокси)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметил-6винилтетрагидрофуро[2,3-d][1,3]диоксола (6,15 г, 16,3 ммоль) в MeCN (30 мл) при комнатной температуре и реакционную смесь перемешивали в течение 2 ч. Реакционную смесь подщелачивали минимальным количеством гидроксида натрия и затем добавляли сульфат магния. Суспензию фильтровали и концентрировали при пониженном давлении с получением (R)-1-((3aR,5R,6R,6aR)-6-(бензилокси)-6-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола, который использовали неочищенн без дополнительной очистки.
Стадия 6: Раствор периодата натрия (277 мг, 1,30 ммоль) в воде охлаждали до 0°C, затем добавляли по каплям раствор (R)-1-((3aR,5R,6R,6aR)-6-(бензилокси)-6-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)этан-1,2-диола (315 мг, 0,925 ммоль) в MeOH (2 мл). Реакционную смесь перемешивали в течение 1 ч при 0°C и затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь охлаждали до 0°C и добавляли этиленгликоль (1 мл, 17,9 ммоль). Реакционную смесь перемешивали в течение 5 минут, затем добавляли насыщенный раствор сульфита натрия (50 мл) и реакционную смесь нагревали до комнатной температуры. Смесь разбавляли EtOAc (100 мл) и органический слой промывали насыщенным солевым раствором (3 × 200 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (3aR,4aS,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ола, который использовали без дополнительной очистки.
Стадия 7: Трет-бутоксид калия (183 мг, 1,63 ммоль) добавляли по порциям к суспензии метилтрифенилфосфоний бромида (611 мг, 1,71 ммоль) в THF (4 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем раствор охлаждали до 0°C, добавляли раствор (3aR,4aS,7aR,7bR)-7a-(бензилокси)-2,2диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ола (251 мг, 0,814 ммоль) и реакционную смесь перемешивали в течение 2 ч. Смесь гасили насыщенным водным раствором хлорида аммония (10 мл) и смесь экстрагировали при помощи EtOAc (1 × 50 мл). Объединенные органические слои промывали насыщенным солевым раствором (2 × 50 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на диоксиде кремния (0%-100% EtOAc/гексан) с получением ((3aR,5R,6R,6aR)-6-(бензилокси)-2,2-диметил-5-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ил)метанола. 1H ЯМР (600 МГц, CDCl3) δ 7,40 (д, J=7,3 Гц, 2H), 7,37-7,33 (м, 2H), 7,31-7,27 (м, 1H), 5,94 (ддд, J=17,2, 10,8, 5,3 Гц, 1H), 5,82 (д, J=3,9 Гц, 1H), 5,49 (дт, J=17,3, 1,6 Гц, 1H), 5,30 (дт, J=10,8, 1,5 Гц, 1H), 4,79 (д, J=11,1 Гц, 1H), 4,74 (д, J=11,1 Гц, 1H), 4,73-4,70 (м, 1H), 4,68 (д, J=3,9 Гц, 1H), 3,80 (д, J=12,1 Гц, 1H), 3,69 (д, J=12,1 Гц, 1H), 1,63 (с, 3H), 1,39 (с, 3H).
Стадия 8: В сосуд, содержащий 3-бром-N-(2,4-диметоксибензил)-7-иодхинолин-2-амин (1,62 г, 3,26 ммоль), трис(дибензилиденацетон)дипалладий(0) (75 мг, 0,08 ммоль), трет-бутоксид натрия (310 мг, 3,3 ммоль) и бис(2-дифенилфосфинофенил)эфир (88 мг, 0,16 ммоль), добавляли ((3aR,5R,6R,6aR)-6-(бензилокси)-2,2-диметил-5-винилтетрагидрофуро[2,3-d][1,3]диоксол-6-ил)метанол (500 мг, 1,63 ммоль) в виде раствора в THF (8,16 мл). Реакционную смесь нагревали до 65°C в течение ночи. Реакцию гасили водой и затем экстрагировали при помощи DCM два раза. Объединенные DCM слой сушили при помощи Na2SO4 и концентрировали при пониженном давлении с получением 7-(((3aR,4aR,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-бром-N-(2,4-диметоксибензил)хинолин-2-амина. MS: 677/679 (M+1/M+3).
Стадия 9: Трихлорид бора (0,79 мл, 0,79 ммоль) добавляли к раствору 7-(((3aR,4aR,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-бром-N-(2,4-диметоксибензил)хинолин-2-амина (107 мг, 0,16 ммоль) в DCM (8 мл) при -78°C. Реакционную смесь перемешивали в течение 15 минут затем нагревали до 0°C и перемешивали в течение 30 минут. Реакцию гасили добавлением THF и насыщенного водного раствора NaHCO3 (4:1). Весь растворитель выпаривали при пониженном давлении и неочищенное вещество очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% NH4OH модификатора) с получением (3R,3aS,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)тетрагидрофуро[3,4-b]фуран-2,3,3a(4H)-триола. MS: 397/399 (M+1/M +3).
Стадия 10: В сосуд, содержащий (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)тетрагидрофуро[3,4-b]фуран-2,3,3a(4H)-триол (20 мг, 0,050 ммоль), в безводном ацетонитриле (750 мкл) добавляли 1,1'-(азодикарбонил)дипиперидин (19 мг, 0,076 ммоль) с последующим добавлением три-н-бутилфосфина (20 мкл, 0,08 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч. В отдельной высушенный в печи сосуд, содержащий 4-метил-7H-пирроло[2,3-d]пиримидин (13 мг, 0,10 ммоль), растворенный в безводном DMF (250 мкл), добавляли NaH (4,0 мг, 0,10 ммоль). Эту смесь перемешивали в течение 30 минут при комнатной температуре и затем добавляли к описанной выше смеси, изначально содержащей триол. Полученную реакционную смесь затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь непосредственно очищали препаративной ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением двух изомеров: (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диола в виде TFA соли. MS: 512/514 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,96 (с, 1H), 8,80 (с, 1H), 8,00 (с, 1H), 7,77 (д, J=8,3 Гц, 1H), 7,55 (с, 1H), 7,41 (д, J=8,2 Гц, 1H), 7,07 (с, 1H), 6,25 (д, J=8,0 Гц, 1H), 4,37 (д, J=8,0 Гц, 1H), 4,32-4,30 (м, 1H), 4,14-4,08 (м, 1H), 3,99 -3,95 (м, 1H), 3,42 -3,36 (м, 1H), 3,08-3,03 (м, 2H), 2,82 (с, 3H) и (2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диоли в виде TFA соли. (MS: 512/514 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,85 (с, 1H), 8,75 (с, 1H), 7,92 (с, 1H), 7,77 (д, J=8,1 Гц, 1H), 7,54 (с, 1H), 7,38 (д, J=7,8 Гц, 1H), 6,97 (с, 1H), 6,21 (д, J=7,6 Гц, 1H), 4,46 (д, J=7,6 Гц, 1H), 4,32-4,25 (м, 1H), 4,23-4,20 (м, 1H), 3,99 -3,97 (м, 1H), 3,88-3,86 (м, 1H), 3,13-3,04 (м, 2H), 2,76 (с, 3H).
Пример 135
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол
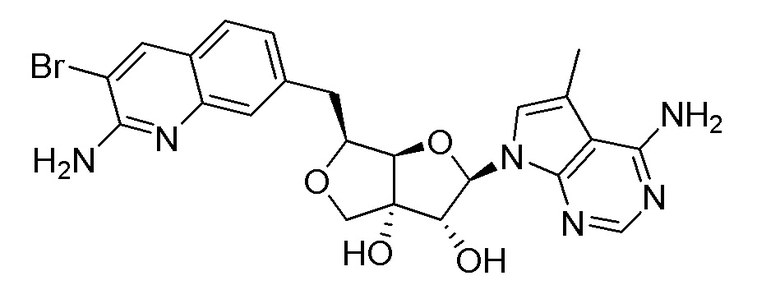
Стадия 1: Неочищенный 7-(((3aR,4aR,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-бром-N-(2,4-диметоксибензил)хинолин-2-амин (1,1 г, 1,6 ммоль) очищали колоночной хроматографией на диоксиде кремния (0-40% EtOAc/гексан) с получением 7-(((3aR,4aR,5S,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-бром-N-(2,4-диметоксибензил)хинолин-2-амина в виде твердого вещества. MS: 677/679 (M+1/M+3). 1H ЯМР (600 МГц, CDCl3) δ 8,03 (с, 1H), 7,65 (с, 1H), 7,44 (д, J=8,2 Гц, 1H), 7,40-7,27 (м, 6H), 7,18 (д, J=7,9 Гц, 1H), 6,52 (д, J=2,3 Гц, 1H), 6,47 (дд, J=8,3, 2,3 Гц, 1H), 6,06 (д, J=3,6 Гц, 1H), 5,85 (с, 1H), 4,76-4,73 (м, 2H), 4,70 (д, J=3,6 Гц, 1H), 4,53 (д, J=2,2 Гц, 1H), 4,49 (д, J=10,5 Гц, 1H), 4,27 (тд, J=7,1, 2,2 Гц, 1H), 4,19-4,11 (м, 2H), 3,93 (д, J=10,3 Гц, 1H), 3,90 (с, 3H), 3,82 (с, 3H), 3,18 -3,11 (м, 2H), 1,64 (с, 3H), 1,46 (с, 3H).
Стадия 2: Трихлорид бора (5 мл, 5,1 ммоль) добавляли к раствору 7-(((3aR,4aR,5S,7aR,7bR)-7a-(бензилокси)-2,2-диметилгексагидрофуро[3',4':4,5]фуро[2,3-d][1,3]диоксол-5-ил)метил)-3-бром-N-(2,4-диметоксибензил)хинолин-2-амина (690 мг, 1,02 ммоль) в DCM (20 мл) при -78°C. Реакционную смесь перемешивали в течение 15 минут, затем нагревали до 0°C и перемешивали в течение 30 минут. Реакцию гасили добавлением THF и насыщенного водного раствора NaHCO3 (8 мл : 2 мл). Смесь концентрировали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% NH4OH модификатора) с получением (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)тетрагидрофуро[3,4-b]фуран-2,3,3a(4H)-триола. MS: 397/399 (M+1/M+3).
Стадия 3: В сосуд, содержащий (3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)тетрагидрофуро[3,4-b]фуран-2,3,3a(4H)-триол (20 мг, 0,05 ммоль) в безводном ацетонитриле (750 мкл), добавляли 1,1'-(азодикарбонил)дипиперидин (19 мг, 0,076 ммоль) с последующим добавлением три-н-бутилфосфина (20мкл, 0,08 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 ч. В отдельной высушенный в печи сосуд, содержащий 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин (17 мг, 0,1 ммоль) в безводном ацетонитриле (250 мкл), добавляли DBU (15 мкл, 0,10 ммоль). Эту смесь перемешивали в течение 30 минут при комнатной температуре и затем добавляли к описанн выше смеси, изначально содержащей триол. Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем непосредственно очищали обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% TFA модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диола, TFA соли, в виде твердого вещества. MS: 546/548 (M+1/M+3).
Стадия 4: Аммиак в метаноле (2 мл, 7M, 14 ммоль) добавляли в микроволновой сосуд, содержащий (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол, TFA соль (16 мг, 0,029 ммоль). Реакционную смесь нагревали при 145°C в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали масс-инициируемой обращенно-фазовой ВЭЖХ (MeCN/вода с 0,1% NH4OH модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диола в виде твердого вещества. MS: 527/529 (M+1/M+3). 1H ЯМР (600 МГц, DMSO-d6) δ 8,32 (с, 1H), 8,08 (с, 1H), 7,56 (д, J=8,3 Гц, 1H), 7,35 (с, 1H), 7,15-7,13 (м, 2H), 6,69 (с, 2H), 6,59 (с, 2H), 6,06 (д, J=8,2 Гц, 1H), 5,54 (д, J=6,7 Гц, 1H), 5,49 (с, 1H), 4,17-4,12 (м, 2H), 4,08-3,99 (м, 1H), 3,92 (д, J=9,0 Гц, 1H), 3,37-3,35 (м, 1H), 3,01-2,89 (м, 2H), 2,40 (с, 3H).
Пример 136: Пример 136 в Таблице 25 синтезировали таким же способом, как описано на стадиях 1-4 примера 135, заменяя 4-хлор-5-метил-7H-пирроло[2,3-d]пиримидин подходящим нуклеооснованием. Используемые для замещения реагенты и исходное вещество приобретали коммерческим путем, синтезировали, как описано выше, или синтезировали известными способами, описанными в литературе.
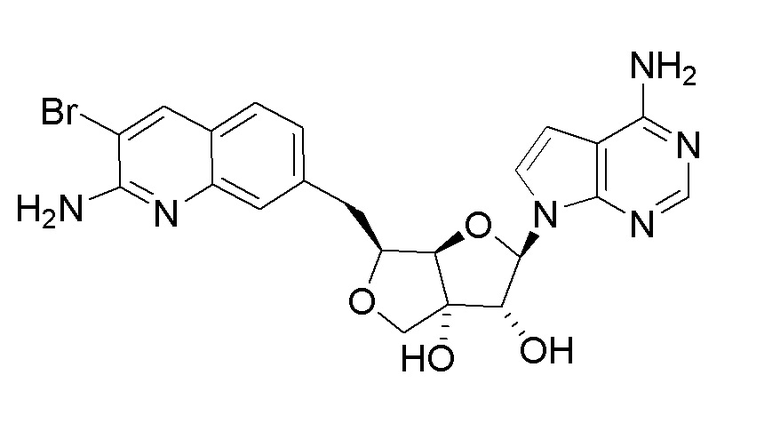
Пример 137
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол
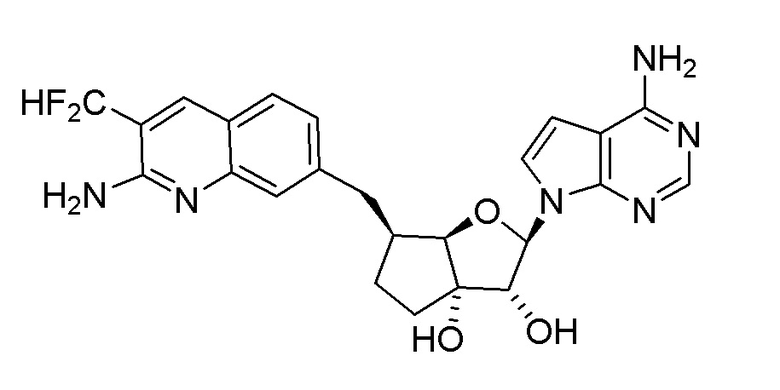
Стадия 1: В герметично закрываемую пробирку загружали (2R,3R,3aS,6aR)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диол (200 мг, 0,650 ммоль), 1,4-диоксан (3 мл) и концентрированный гидрат аммиака (28% масс., 3 мл) при комнатной температуре. Смесь плотно закрывали и затем перемешивали при 90°C в течение 16 ч. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на диоксиде кремния (30% MeOH/DCM) с получением (2R,3R,3aS,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диола в виде масла. MS: 289 (M+1). 1H ЯМР (300 МГц, DMSO-d6) δ 8,08 (с, 1H), 7,31 (д, J=3,9 Гц, 1H), 7,04 (шир.с, 2H), 6,63 (д, J=3,6 Гц, 1H), 6,06 (д, J=8,1 Гц, 1H), 5,37 (д, J=7,2 Гц, 1H), 5,25 (с, 1H), 5,10-5,06 (м, 2H), 4,31-4,23 (м, 2H), 2,65-2,61 (м, 1H), 2,50-2,40 (м, 1H), 2,07-2,02 (м, 1H), 1,72-1,61 (м, 1H).
Стадия 2: Соединение (2R,3R,3aS,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-метиленгексагидро-2H-циклопента[b]фуран-3,3a-диол (60 мг, 0,208 ммоль) совместно упаривали с THF три раза (2 мл каждый). Затем смесь обрабатывали при помощи 9-BBN (2289 мкл, 0,5M в THF, 1,15 ммоль) при комнатной температуре в атмосфере аргона. Смесь перемешивали при 50°C в течение 1 ч. К этой реакционной смеси затем добавляли раствор K3PO4 (220 мг, 1,04 ммоль) в воде (1 мл) при 0°C и перемешивание продолжали при комнатной температуре в течение 0,5 ч. Затем добавляли раствор 7-бром-3-(дифторметил)хинолин-2-амина (56,6 мг, 0,207 ммоль) в THF (3 мл) с последующим добавлением PdCl2(dppf) (15,2 мг, 0,021 ммоль). Полученную реакционную смесь подвергали микроволновому облучению при 70°C в течение 2 ч. Смесь концентрировали при пониженном давлении и полученный остаток очищали обращенно-фазовой колоночной хроматографией (ACN/вода с 5 мМ NH4HCO3 модификатора). Продукт дополнительно очищали обращенно-фазовой ВЭЖХ (ACN/вода с 10 мМ NH4HCO3 модификатора) с получением (2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диола в виде твердого вещества. MS: 483 (M+1). 1H-ЯМР (400 МГц, DMSO-d6) δ 8,17 (с, 1H), 8,09 (с, 1H), 7,67 (д, J=8,4 Гц, 1H), 7,45 (д, J=3,6 Гц, 1H), 7,29 (с, 1H), 7,26-7,00 (м, 4H), 6,68 (д, J=3,6 Гц, 1H), 6,45 (шир.с, 2H), 5,89 (д, J=8,0 Гц, 1H), 5,26 (д, J=6,8 Гц, 1H), 5,08 (с, 1H), 4,13 (т, J=7,6 Гц, 1H), 3,96 (д, J=5,6 Гц, 1H), 2,84 -2,81 (м, 1H), 2,66-2,65 (м, 1H), 2,30-2,23 (м, 1H), 1,97-1,93 (м, 1H), 1,71-1,68 (м, 2H), 1,58-1,51 (м, 1H).
PRMT5-MEP50 ферментный анализ метилирования
PRMT5-MEP50 биохимический анализ представляет собой прямое измерение метилирующей активности ферментного комплекса на коротком пептидном субстрате, происходящем из N-конца H4 гистона. Эксперимент по метилированию осуществляли с рекомбинантным PRMT5-MEP50 белковым комплексом. Оценку ингибирующего эффекта малых молекул определяли по эффективности соединений ингибировать эту реакцию (EC50).
В этом анализе эффективность (EC50) каждого соединения определяли на основании двадцатиточечной (1:2 серийное разведение; наивысшая концентрация соединения 100000 нМ) кривой титрования с использованием следующей описанной в общих чертах процедуры. В каждую лунку белого ProxiPlus 384-луночного планшета добавляли 100 нл соединения (1% DMSO в конечном объеме анализа 10 мкл) с последующим добавлением 8 мкл 1x аналитического буфера (50 мМ Бицина pH 8,0, 1 мМ DTT, 0,004% Tween20, 0,01% BSA), содержащего 1,25 нМ полноразмерного (FL)-PRMT5-MEP50 ферментного комплекса (рекомбинантные белки из бакуловирус-трансфицированных Sf21 клеток: FL-PRMT5; MW=73837 кДа и FL-MEP50; MW=38614) и 1 мкл 150 мкМ S-(5’-Аденозил)-L-Метионин Хлорида (SAM). Планшеты герметично закрывали и помещали в 37°C увлажненную камеру на 60 минут для предварительной инкубации с соединением. Затем каждую реакцию инициировали добавлением 1 мкл 1x аналитического буфера, содержащего 750 нМ биотинилированного H4R3(Mel) пептида. Конечная реакционная смесь в каждой лунке объемом 10 мкл состояла из 1,0 нМ PRMT5-MEP50, 75 нМ биотинилированного пептида и 15 мкМ SAM. Реакции метилирования осуществляли в течение 150 минут в герметично закрытом планшете при 37°C. Реакции сразу гасили добавлением 1 мкл 5% муравьиной кислоты. Планшеты затем замораживали и отправляли в SAMDITM Tech Inc. для определения процента конверсии из H4R3(Me1) в H4R3(Me2). Кривые доза-ответ получали путем построения графика процент эффекта (% конверсии продукта; Y-ось) vs. Log10 концентрации соединения (X-ось). EC50 значения определяли методом нелинейной регрессии в соответствии с моделями для либо сигмоидальных (4 параметра), либо бифазных (7 параметров) кривых доза-ответ.
PRMT5 анализ связывания с клеткой-мишенью (TE)
PRMT5 TE анализ представляет собой биомаркерный анализ для идентификации соединений, которые ингибируют симметричное диметилирование аргинина (SDMA) субстратов PRMT5. Следующие субстраты описаны для PRMT5: Гистон H2A и H4 R3, Гистон H3 R2, Гистон H3 R8, белки Sm сплайсингосомы, рибосомальный белок RPS10, p53, FEN1, нуклеоплазмин, нуклеолин, EGFR и EBNA. Анализ фокусируется на детекции симметрично диметилированных ядерных белков с использованием технологии визуализации с высокой пропускной способностью. Детекцию экспрессии симметрично диметилированных ядерных белков осуществляют с использованием смеси первичных кроличьих моноклональных антител к SDMA (CST 13222), которые, в свою очередь, распознаются Alexafluor 488 краситель-конъюгированным анти-кроличьим IgG вторичным антителом. IN Cell Analyzer 2200 или Opera-Phenix измеряет интенсивность ядерного флуоресцентного красителя Alexafluor 488, которая непосредственно связана с уровнем экспрессии симметрично диметилированных ядерных белков на уровне одной клетки. Интенсивности ядерного красителя AF488 сравнивают со средним значением для DMSO-обработанных клеток (MIN) для представления процента ингибирования для каждой обработанной соединением лунки.
В этом анализе клеточную эффективность (EC50) каждого соединения определяли по десятиточечной (1:3 серийное разведение; наивысшая концентрация соединения 10000 нМ) кривой титрования с использованием следующей описанной в общих чертах процедуры. В каждую лунку BD falcon коллаген-покрытого черного/с прозрачным дном 384-луночного планшета высевали 4000 MCF-7 клеток в 30 мкл среде и давали прикрепиться в течение 5 часов. Среда представляла собой ATCC-сформулированную минимальную эссенциальную среду Игла, № по каталогу 30-2003. К базовой среде добавляли следующие компоненты: 0,01 мг/мл человеческого рекомбинантного инсулина; фетальная бычья сыворотка до конечной концентрации 10%. Дополнительные 30 мкл среды, содержащей 2x соединения, добавляли в каждую лунку. Клетки обрабатывали в течение 3 дней в 37°C CO2 инкубаторе. В день 3 клетки фиксировали реагентом Cytofix, пермеабилизировали смесью 0,4% Triton-X-100/Cytofix и промывали D-PBS без Ca/Mg. Клетки блокировали блокирующим реагентом Licor Odessey в течение 1 часа при комнатной температуре, затем инкубировали с анти-SDMA (1:1000) антителом при 4°C в течение ночи. 1° антитело удаляли, затем осуществляли три промывки при помощи DPBS без Ca/Mg и 0,05% Tween20. Добавляли Hoechst (5мкг/мл), глубокий краситель Cell Mask (1:2000) и Alexa488-конъюгированное козлиное анти-кроличье IgG (2 мкг/мл) в течение 1 часа при комнатной температуре. Осуществляли конечную стадию промывки (три промывки), затем планшет герметично закрывали для визуализации на In Cell Analyzer 2200 или Opera-Phenix. Изображения из анализатора загружали в Columbus для анализа изображения. IC50 значения определяли 4-параметрическим методом robust fit на основании процента флуоресценции vs. (Log10) концентраций соединения.
Репрезентативные соединения по настоящему изобретению испытывали с использованием протокола анализа, описанного в этом примере. Результаты представлены в Таблице 26 ниже.
Когда показано только одно значение EC50, данные соответствовали 4-параметрической однофазной сигмоидальной модели. Когда показаны два значения EC50, данные соответствовали 7-параметрической бифазной модели
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| НОВОЕ ПИРРОЛОПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕЕ, В ЧАСТНОСТИ, АГЕНТ ДЛЯ ПРЕДОТВРАЩЕНИЯ И/ИЛИ ЛЕЧЕНИЯ ОПУХОЛЕЙ, И ТОМУ ПОДОБНОЕ, НА ОСНОВЕ ИНГИБИТОРНОГО ВОЗДЕЙСТВИЯ НА NAE | 2015 |
|
RU2658008C2 |
| СПОСОБ ПОЛУЧЕНИЯ (3aR,4S,6R,6aS)-6-АМИНО-2,2-ДИМЕТИЛТЕТРАГИДРО-3aН-ЦИКЛОПЕНТА[d][1,3]ДИОКСОЛ-4-ОЛ-ДИБЕНЗОИЛ-L-ТАРТРАТА И ПРОДУКТЫ УКАЗАННОГО СПОСОБА | 2008 |
|
RU2477277C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ВОЗДЕЙСТВИЯ, СОДЕРЖАЩИЙ СОЕДИНЕНИЕ ПИРРОЛОПИРИМИДИНА | 2016 |
|
RU2710380C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КАРБОНУКЛЕОЗИДА, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2017 |
|
RU2712944C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ВИРУСНОЙ ПОЛИМЕРАЗЫ | 2013 |
|
RU2654482C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2012 |
|
RU2618673C2 |
| СОЕДИНЕНИЯ, ЯВЛЯЮЩИЕСЯ АНТАГОНИСТАМИ А3-АДЕНОЗИНОВОГО РЕЦЕПТОРА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2737157C2 |
| МОДУЛЯТОРЫ SHIP1 И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2014 |
|
RU2679805C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С NTRK | 2016 |
|
RU2744974C2 |
Изобретение относится к соединению формулы I или его фармацевтически приемлемой соли. В формуле I: X представляет собой CH2 или O; Y представляет собой CH2, NH или O; R1 и R7 взяты вместе с образованием пятичленного углеродного кольца, необязательно замещенного 1-3 галогенами, или пятичленного гетероциклоалкильного кольца, включающего один O атом; R2 представляет собой H, OH, CH3, CHF2 или F; R3 представляет собой H, галоген, NH2, NHCH3, OH, OCH3, C1-4алкил, необязательно замещенный 1-3 галогенами или OH, или C3-5циклоалкил, необязательно замещенный 1-3 галогенами или OH; R5 представляет собой H, NH2 или NHR6; и R4 представляет собой H, галоген, CH3, CHF2 или CF3; или R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 и CF2H; R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил; R8 представляет собой H, галоген, C1-4алкил, необязательно замещенный 1-3 галогенами, C3-5циклоалкил, необязательно замещенный 1-3 галогенами, или фенил, необязательно замещенный 1-3 галогенами; R10 представляет собой H, C1-6алкил, NH2 или галоген. Также предложено соединение формулы Ia, соединение, выбранное из группы индивидуальных соединений, и композиция, включающая указанные выше соединения. Предложенные соединения являются ингибиторами PRMT5 и могут применяться для лечения рака, серповидноклеточной болезни и мутаций, связанных с наследственным персистированием фетального гемоглобина (HPFH). 4 н. и 14 з.п. ф-лы, 26 табл., 137 пр.
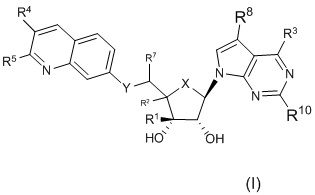
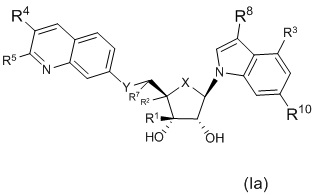
1. Соединение формулы I
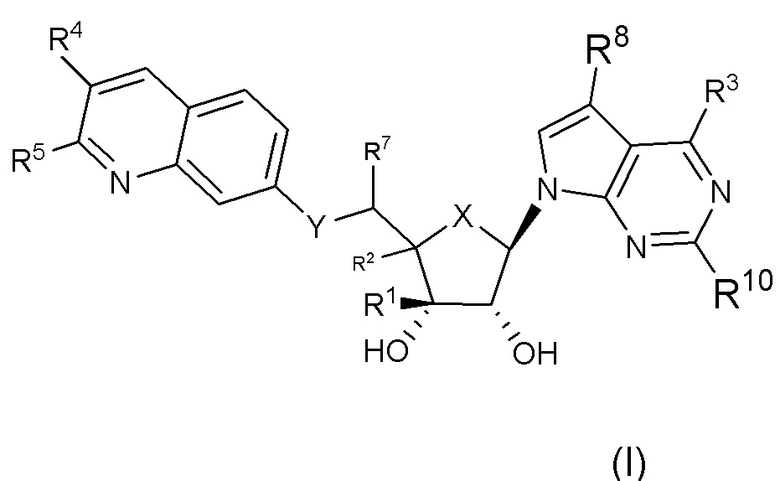
или его фармацевтически приемлемая соль, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
R1 и R7 взяты вместе с образованием пятичленного углеродного кольца, необязательно замещенного 1-3 галогенами, или пятичленного гетероциклоалкильного кольца, включающего один O атом;
R2 представляет собой H, OH, CH3, CHF2 или F;
R3 представляет собой H, галоген, NH2, NHCH3, OH, OCH3, C1-4алкил, необязательно замещенный 1-3 галогенами или OH, или C3-5циклоалкил, необязательно замещенный 1-3 галогенами или OH;
R5 представляет собой H, NH2 или NHR6; и
R4 представляет собой H, галоген, CH3, CHF2 или CF3; или
R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 и CF2H;
R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил;
R8 представляет собой H, галоген, C1-4алкил, необязательно замещенный 1-3 галогенами, C3-5циклоалкил, необязательно замещенный 1-3 галогенами, или фенил, необязательно замещенный 1-3 галогенами;
и
R10 представляет собой H, C1-6алкил, NH2 или галоген.
2. Соединение формулы Ia
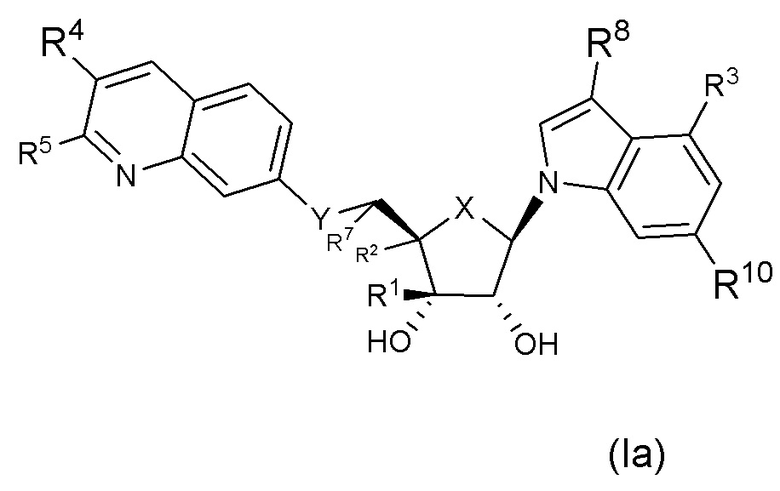
или его фармацевтически приемлемая соль, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
R10 представляет собой H, C1-6алкил, NH2 или галоген;
R1 и R7 взяты вместе с образованием пятичленного кольца;
R2 представляет собой H, OH, CH3, CHF2 или F;
R3 представляет собой H, галоген, CH3, C2H5, циклопропил, NH2, NHCH3, CF3, OH, OCH3 или CHF2;
R4 представляет собой H, галоген, CH3, CHF2 или CF3; и
R5 представляет собой H, NH2 или NHR6; или
R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 и CF2H;
R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил; и
R8 представляет собой H, C1-4алкил или галоген.
3. Соединение по п. 1 формулы Ib
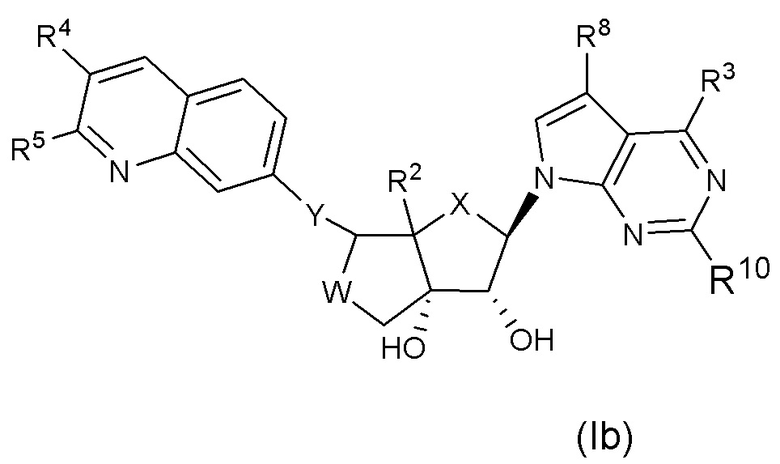
или его фармацевтически приемлемая соль, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
W представляет собой CR11R11 или O;
R2 представляет собой H, OH или CH3;
R3 представляет собой H, галоген, OH, NH2, NHCH3, OCH3, C1-4алкил, необязательно замещенный 1-3 галогенами или OH, или C3-5циклоалкил, необязательно замещенный 1-3 галогенами или OH;
R4 представляет собой H, галоген, CH3, CHF2 или CF3;
R5 представляет собой H, NH2 или NHR6;
R8 представляет собой H, галоген, C1-4алкил, необязательно замещенный 1-3 галогенами, C3-5циклоалкил, необязательно замещенный 1-3 галогенами, или фенил, необязательно замещенный 1-3 галогенами;
R10 представляет собой H, C1-6алкил, NH2 или галоген; и
каждый R11, когда присутствует, независимо выбран из H и галогена.
4. Соединение по п. 3 или его фармацевтически приемлемая соль, где R4 представляет собой H, F, Cl, Br, CF3, CHF2 или CH3.
5. Соединение по п. 3 или 4 или его фармацевтически приемлемая соль, где R10 представляет собой H, NH2, F, Cl, CH3.
6. Соединение по п. 3, 4 или 5 или его фармацевтически приемлемая соль, где R3 представляет собой NH2, Cl, OCH3, CH2OH, CHF2, C(CH3)2OH, CH2CH3, CH(CH3)2, циклопропил, NHCH3 или CH3.
7. Соединение по п. 3, 4, 5 или 6 или его фармацевтически приемлемая соль, где R8 представляет собой H, CH3, CH2CH3, циклопропил, CHF2 или F.
8. Соединение по п. 3, 4, 5, 6 или 7, или его фармацевтически приемлемая соль, где R5 представляет собой NH2, NHCH2CF3 или NHCH2циклопропил.
9. Соединение по п. 3, 4, 5, 6, 7 или 8 или его фармацевтически приемлемая соль, где W представляет собой O, CHF, CF2 или CH2.
10. Соединение по п. 1 формулы Ic
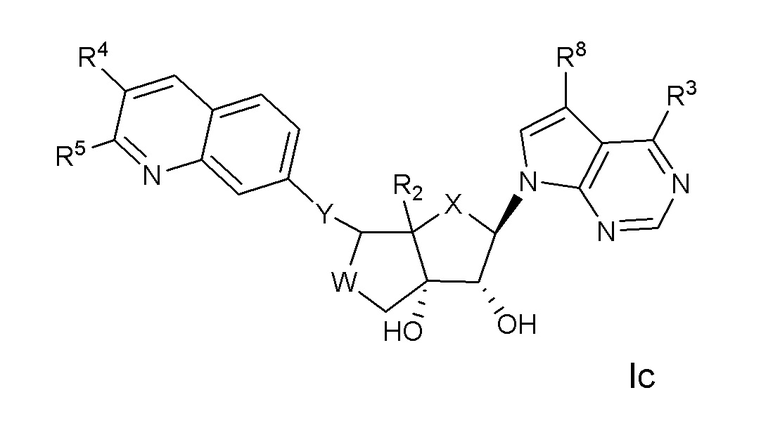
или его фармацевтически приемлемая соль, где
X представляет собой CH2 или O;
Y представляет собой CH2, NH или O;
W представляет собой CH2 или O;
R2 представляет собой H, OH, CH3 или CH2F;
R3 представляет собой H, галоген, CH3, C2H5, циклопропил, NH2, NHCH3, CF3, OH, OCH3 или CHF2, CH2OH, C(CH3)2OH CH2CH3 или CH(CH3)2;
R4 представляет собой H, галоген, CH3, CHF2 или CF3;
R5 представляет собой H, NH2 или NHR6; или
R4 и R5, взятые вместе с атомами углерода, к которым они присоединены, объединяются с образованием 5-членного гетероциклоалкила, включающего один N атом, при этом указанный гетероциклоалкил необязательно замещен одним-четырьмя заместителями, независимо выбранными из галогена, CH3, CF3 и CF2H;
R6, когда присутствует, представляет собой CH3, C2H5, CH2CH2CH3, CH(CH3)2, CH2CHF2, CH2CF3 или CH2-циклопропил; и
R8 представляет собой H, C1-4алкил или галоген.
11. Соединение по п. 10 или его фармацевтически приемлемая соль, где R2 представляет собой H.
12. Соединение по п. 10 или 11 или его фармацевтически приемлемая соль, где R3 представляет собой CH3, Cl, OCH3, CH2OH, C(CH3)2OH, CHF2, CH2CH3, CH(CH3)2, циклопропил или NH2.
13. Соединение по п. 10, 11 или 12 или его фармацевтически приемлемая соль, где R4 представляет собой H, Cl, F, CH3, CHF2, CF3 или Br.
14. Соединение по п. 10, 11, 12 или 13 или его фармацевтически приемлемая соль, где R5 представляет собой NH2, NHCH2CF3 или NHCH2циклопропил.
15. Соединение по п. 10, 11, 12, 13 или 14 или его фармацевтически приемлемая соль, где R8 представляет собой H.
16. Соединение по п. 1 или его фармацевтически приемлемая соль, которое представляет собой:
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4R,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-хлорхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-фторхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-4-((2-амино-3-бромхинолин-7-ил)метил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)метил]-2-[4-амино-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-фторхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол дигидрохлорид,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-хлорхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-(4-амино-5-фенил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-[4-амино-5-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил]-6-[(2-амино-3-фторхинолин-7-ил)метил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-(4-амино-5-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-5,5-дифторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,5S,6S,6aR)-6-[(2-амино-3-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-5-фторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,5S,6S,6aR)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)-6-[(2-амино-3-фторхинолин-7-ил)метил]-5-фторгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-((2,2,2-трифторэтил)амино)хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-((циклопропилметил)амино)хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-бромхинолин-7-ил)метил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-2-метил-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-амино-3-бромхинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-этил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)окси)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(трифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-[4-(гидроксиметил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-бромхинолин-7-ил)окси]-2-[4-(2-гидроксипропан-2-ил)-7H-пирроло[2,3-d]пиримидин-7-ил]гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-(дифторметил)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-5-этил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-изопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(5-фтор-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-циклопропил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(трифторметил)хинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(2,4-диметил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(5-фтор-4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6-((2-аминохинолин-7-ил)окси)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-аминохинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)амино)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-6a-метилгексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-метилхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(2-амино-4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)окси)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)окси)-2-(2-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-хлорхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(3aS,4S,5R)-1-((2-амино-3-бромхинолин-7-ил)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидро-1H-циклопента[c]фуран-3a,4(3H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6R,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-бромхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)тетрагидрофуро[3,4-b]фуран-3,3a(4H)-диол или
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-(дифторметил)хинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-2H-циклопента[b]фуран-3,3a-диол.
17. Соединение или его фармацевтически приемлемая соль, которое представляет собой:
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-этинилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2,3-диметилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-{[(2-амино-3-бромхинолин-7-ил)окси]метил}-5-(4-хлор-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-метокси-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол,
(2R,3S,4R,5R)-2-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилтетрагидрофуран-3,4-диол,
(1S,2R,3S,5R)-3-[2-(2-амино-3-бром-7-хинолинил)этил]-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метил-1,2-циклопентандиол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,8-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-хлор-5-фторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3-хлор-8-фторхинолин-7-ил)метил]-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3,5-дифторхинолин-7-ил)метил)-2-(4-амино-5-фтор-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((6-амино-7-фтор-1,5-нафтиридин-3-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((2-амино-3-хлор-8-фторхинолин-7-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,6-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-((7-амино-6-хлор-1,8-нафтиридин-2-ил)метил)-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(2R,3R,3aS,6S,6aR)-6-[(2-амино-3,5-дифторхинолин-7-ил)метил]-2-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидро-3aH-циклопента[b]фуран-3,3a-диол,
(1S,2R,3aR,4S,6aR)-4-((2-амино-3-фторхинолин-7-ил)метил)-2-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-[(2-амино-3,5-дифторхинолин-7-ил)метил]-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1S,2R,3aR,4S,6aR)-4-[(2-амино-3-хлор-5-фторхинолин-7-ил)метил]-2-(4-амино-5-метил-7H-пирроло[2,3-d]пиримидин-7-ил)гексагидропентален-1,6a(1H)-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-бромхинолин-7-ил)окси)метил)-1-метил-3-(4-(метиламино)-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(2R,3S,4R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метил-2-((хинолин-7-илокси)метил)тетрагидрофуран-3,4-диол,
(1S,2R,3R,5R)-3-(((2-амино-3-бромхинолин-7-ил)окси)метил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол,
(1S,2R,3R,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(((2-аминохинолин-7-ил)окси)метил)-3-метилциклопентан-1,2-диол,
(1S,2R,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(фторметил)циклопентан-1,2-диол,
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1-метилциклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-аминохинолин-7-ил)окси)метил)-1-метил-3-(7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1R,2S,3R,5R)-5-(((2-амино-3-метилхинолин-7-ил)окси)метил)-1-метил-3-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1S,2R,3S,5R)-3-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1S,2R,3S,5R)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метил-5-(4-метил-7H-пирроло[2,3-d]пиримидин-7-ил)циклопентан-1,2-диол,
(1S,2R,3R,5R)-3-(2-(2-амино-3-фторхинолин-7-ил)этил)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-метилциклопентан-1,2-диол,
(1R,2S,3R,5S)-5-(2-(2-амино-3-бромхинолин-7-ил)этил)-3-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-1,5-диметилциклопентан-1,2-диол,
(1R,2S,3S,4R)-1-(2-(2-амино-3-бромхинолин-7-ил)этил)-4-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-2-метилциклопентан-1,2,3-триол или
(1S,2R,3S,5R)-5-(4-амино-7H-пирроло[2,3-d]пиримидин-7-ил)-3-(2-(2,3-дигидро-1H-пирроло[2,3-b]хинолин-7-ил)этил)-3-метилциклопентан-1,2-диол.
18. Композиция, обладающая PRMT5 ингибирующей активностью, для лечения рака, содержащая эффективное количество соединения по любому из пп. 1-17 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
| WO 2017032840 A1, 02.03.2017 | |||
| HULPIA et al., Synthesis of a 3'-C-ethynyl-beta-d-ribofuranose purune nucleoside library: Discovery of C7-deazapurine analogs as potent antiproliferative nucleosides, Eur | |||
| J | |||
| Med | |||
| Chem., 07.2018, v | |||
| Соломорезка | 1918 |
|
SU157A1 |
| Деревянная повозка с кузовом, устанавливаемым на упругих дрожинах | 1920 |
|
SU248A1 |
| WO 2015200680 A2, 30.12.2015 | |||
| US 20170240584 A1, 24.08.2017 | |||
| WO 2012170347 A1, 13.12.2012 | |||
| Приспособление для впрыскивания горючего в двигателях внутреннего горения | 1930 |
|
SU27908A1 |
Авторы
Даты
2024-02-27—Публикация
2019-08-05—Подача