Изобретение относится к сельскому хозяйству, а именно к контролю качества кормовых добавок для сельскохозяйственной птицы, позиционирующих себя в качестве веществ для борьбы с микотоксикозами. Способ предусматривает лабораторный метод изучения способности кормовой добавки к взаимодействию с микотоксинами в условиях, моделирующих желудочно-кишечный тракт сельскохозяйственной птицы. Способ является скринингом эффективных препаратов для конкретной ситуации, связанной с контаминацией корма микотоксинами.
В пробирке моделируются условия желудка (кислая среда) для изучения адсорбции микотоксинов и условия кишечника (щелочная среда) для определения десорбции адсорбатов. «Адсорбция»- общее количество микотоксинов, связанных сорбентом за время нахождения корма в кислой среде желудка, «десорбция» - удаление с поверхности адсорбента микотоксинов в щелочной среде кишечника. Способности кормовой добавки к взаимодействию с микотоксинами вычисляется как разность между адсорбцией и десорбцией.
Важной особенностью моторики в тонком кишечнике птиц является частая антиперистальтика. Это означает, что химус будет иметь слабокислую или нейтральную реакцию, и поэтому процессы десорбции могут быть менее интенсивными, чем у млекопитающих.
В современной практике для проведения опытов in vitro по изучению сорбционной емкости кормовых добавок применяются следующие принципы:
1. Квантитативный метод, используемый для измерения концентрации микотоксинов в рабочих растворах:
- непрямой конкурентный иммуноферментный анализ (ИФА) с применением коммерческих наборов реагентов [Малков М.А., Богомолов В.В., Данькова Т.В., Краснов К.А. Микотоксины - стратегия устранения их влияния на организм сельскохозяйственных животных и птицы // Ценовик. 2012. - №1(181) - С. 74-89.; Йылдырым, Е.А. Изучение истинной сорбционной емкости сорбента микотоксинов Заслон / Е.А. Йылдырым, Л.А. Ильина // Вестник Бурятской ГСХА им. В.Р. Филиппова. - 2018. - №1. - С. 122-126.;
СОСТАВ И СПОСОБ ПОЛУЧЕНИЯ БИОКОМПОЗИТНОЙ КОРМОВОЙ ДОБАВКИ ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦЫ
Круп» УЛ., Олейникова И.И., Кузубова Е.В., Радченко А.И. Патент на изобретение 2721795 С1, 22.05.2020.
Заявка №2019135615 от 06.11.2019.],
- метод тонкослойной хроматографии (ТСХ) с биоавтографическим завершением с использованием культуры Candida pseudotropicalis штамм 44 ПК [Ивлева, А.Р. Адсорбция Т-2 микотоксинов гидроалкалоидами / А.Р. Ивлева, З.А. Канарская //Вестник Международной академии холода. - 2016. -№4. - С. 16-18]
- метод жидкостной хроматографии [Балакришнан У. Применение бета-цеолита в качестве вещества, связывающего мультитоксины в корме для животных / Балакришнан У., Моортхи Р.// Патент на изобретение RU 2670917 С9, 03.03.2022, Заявка №2016137785 от 24.02.2015;
ПОЛИФУНКЦИОНАЛЬНЫЙ КОМПОЗИТНЫЙ ФЕРМЕНТНЫЙ ПРЕПАРАТ ДЛЯ ДЕГРАДАЦИИ ФОСФОРОРГАНИЧЕСКИХ ПЕСТИЦИДОВ. МИКОТОКСИНОВ И МОЛЕКУЛ-РЕГУЛЯТОРОВ КВОРУМА БАКТЕРИАЛЬНЫХ; ПАТОГЕНОВ
Ефременко В.Н., Ахундов Р.Ф.О., Асланлы А.Г.К., Маслова О.В., Степанов Н.А., Сенько О.В., Лягин И.В.
Патент на изобретение 2743197 C1, 16.02.2021. Заявка №2020110063 от 10.03.2020.].
2. Кислотность (рН) и состав рабочих растворов. Кислые условия среды создаются добавлением в водный раствор микотоксинов либо уксусной кислоты, либо соляной кислоты (НС1). Но рН получаемых растворов варьирует при этом от 1,2 до 3,5 ед. То же касается и рабочего раствора со щелочной средой, где рН в разных публикациях заявляется от 6,0 до 9,0 ед. Причем, щелочная среда в некоторых экспериментах создается путем подщелачивания первоначального раствора, а в других - внесением буферного раствора с соответствующим щелочным рН к сорбенту после декантации кислой среды. В публикации - Крюков, B.C. Применение клиптилолита для профилактики микотоксикозов / B.C. Крюков, В.В. Крупинин, А.Н. Котик // Ветеринария. - 1992. - №9-12. - с. 28-29. - используют водно-солевой раствор нейтральной среды.
3. Время инкубации рабочих растворов при имитации пищеварения в желудке в разных экспериментах варьирует от 30 мин. до 60 мин. Эксперимент по десорбции микотоксинов в щелочных условиях кишечника проводится в течение 45-180 минут. Инкубацию рабочих растворов проводят в специальных приборах, которые могут поддерживать температуру с шагом ±2°С и обеспечивать постоянное встряхивание.
4. Концентрация микотоксинов в рабочем растворе и отношение кормовая добавка / микотоксин. В некоторых публикациях указывают соотношение токсинхорбент, например - 1:1000 [изучение сорбционной АКТИВНОСТИ БИОСОРБЕНТОВ ПО ОТНОШЕНИЮ К Т 2 ТОКСИНУ
Садыкова А.Ш., Тарасова Е.Ю., Матросова Л.Е., Семенов Э.И., Канарская З.А., Валиев А.Р. ветеринарный врач. 2021. №3. с. 45-52.]. Но, как правило, процесс приготовления рабочего раствора микотоксинов описывается без указания данного соотношения. В одном эксперименте применяется метод построения изотермы адсорбции, когда ряд одинаковых навесок сорбента перемешивают с растворами адсорбата с нарастающей концентрацией в течение времени, достаточного для установления адсорбционного равновесия (определяют по кинетической кривой) [Николаев, В.Г. Доклиническое изучение энтеросорбентов: химико-фармацевтический аспект / В.Г. Николаев, И.И. Геращенко, Н.Т. Картель, Н.М. Турина, О.Н. Бакалинская, В.В. Сарнацкая, Е.А. Снежкова, К.И. Бардахивская, Л.А. Сахно // Поверхность. - 2011. - №3. - С. 310-319].
Указанные отличия в методиках оценки кормовых добавок на способность сорбировать микотоксины могут приводить к различным результатам при исследовании одного и того же вещества разными лабораториями. Необходима разработка единого, легко воспроизводимого способа in vitro, адекватно оценивающего качество сорбента и возможность проводить скрининг из имеющихся кормовых добавок.
Технической задачей настоящего изобретения является разработка способа определения избирательной активности кормовой добавки для сельскохозяйственной птицы сорбировать (инактивировать) микотоксины. Способ может быть использован для скрининга предлагаемых кормовых добавок для профилактики микотоксикозов, вызванных теми или иными микотоксинами.
Техническим результатом поставленной задачи является унифицированный способ in vitro, с применением метода высокоэффективной жидкостной хроматографии с масс-спектрометрической детекцией для измерения концентрации микотоксинов в рабочих растворах. При использовании данного способа определяется способность кормовой добавки сорбировать микотоксины по разнице между величиной адсорбции токсинов за время нахождения в желудке и величиной десорбции токсина, освобожденного из сорбента за время нахождения корма в кишечнике. Способность выражается количественно в процентах.
Решение поставленной задачи достигается способом, включающим двухэтапный эксперимент связывания микотоксинов кормовой добавкой в рабочих растворах в пробирке in vitro.
Пример конкретного выполнения исследования Для исследований готовятся рабочие растворы микотоксинов в индивидуальном порядке, то есть для каждого микотоксина отдельный раствор. Концентрации растворов микотоксинов, соответствующих содержанию в корме мкг/кг, табл. 1.

Кормовая добавка вносится в сухие чистые полипропиленовые пробирки.
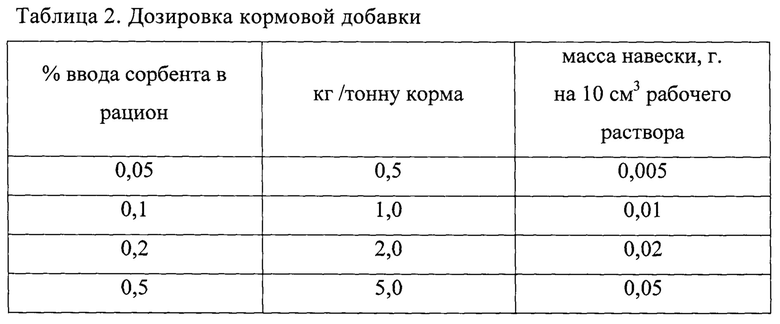
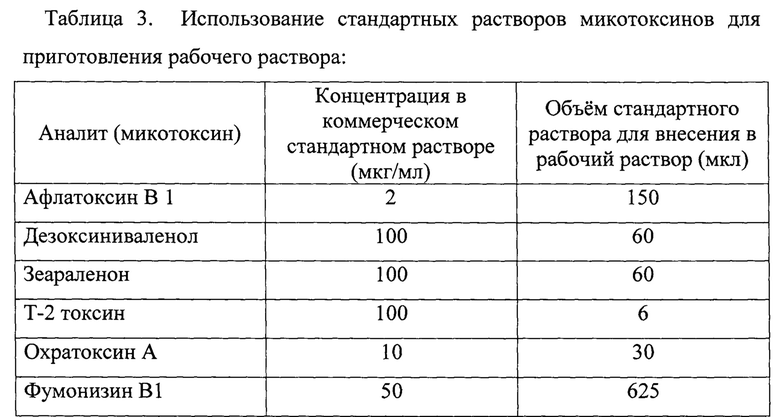
Для приготовления рабочих растворов микотоксинов следует применять стандартные растворы микотоксинов с высокой концентрацией. В 50 мл водного раствора соляной кислоты с рН 1,0-1,5 вносят следующий объем коммерческого стандартного раствора микотоксина, представленный в таблице, и производят перемешивание в течение 15 минут на магнитной мешалке.
Рабочий раствор отбирается на исследование и вносится в объеме 10 мл на пробирку. Четыре пробирки с сорбентом и стеклянными бусами-шариками (d 5 мм) и пятая пробирка без сорбента, только с раствором (холостой опыт), ставиться на инкубацию на 1 час при температуре 40±1°С и активном перемешивании при не менее 250 об/мин. Затем смеси центрифугируют в течение 5 мин. при не менее 4000 об/мин и отбирают аликвоты для анализа.
Раствор полностью удаляется путем декантации от кормовой добавки и вносится натрий-фосфатный буфер в объеме 10 мл с рН буфера 5,0-5,5 достигается поэтапным внесением соляной кислоты. Инкубация растворов с имитацией кишечного пищеварения проводится 3 часа при температуре 40±1°С и активном перемешивании при не менее 250 об/мин. Затем смеси центрифугируют в течение 5 мин не менее 4000 об/мин и отбирают аликвоты для анализа.
Сорбционная емкость определяется по разности между адсорбцией и десорбцией. Выражается в процентах. Способность сорбировать микотоксины кормовой добавкой определяют по разности между адсорбцией и десорбцией микотоксинов из растворов и вычисляется по формуле:
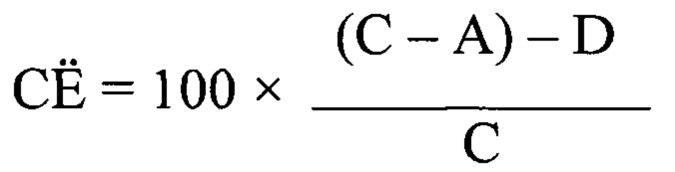
где: СЁ - сорбционная емкость, %;
С - значение концентрации микотоксина в аликвоте исходного рабочего растворе, мкг/кг;
А - значение концентрации микотоксина в аликвоте рабочего раствора после инкубации в кислой среде, мкг/кг;
D - значение концентрации микотоксина в аликвоте рабочего раствора после инкубации в щелочной среде - десорбция, мкг/кг;
Для проведения оценки кормовой добавки и проведения скрининга вводится КЭ - коэффициент эффективности кормовой добавки, который вычисляется по формуле:
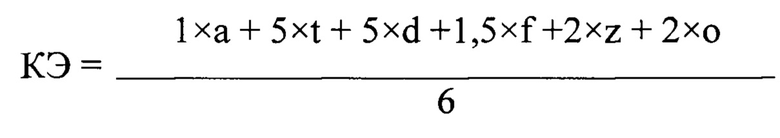
где: КЭ - коэффициент эффективности кормовой добавки;
а - средняя сорбционная емкость в четырех дозировках к афлатоксину В1,%;
t - средняя сорбционная емкость в четырех дозировках к Т2 токсину,%;
d - средняя сорбционная емкость в четырех дозировках к дезоксиниваленолу,%;
f - средняя сорбционная емкость в четырех дозировках к фумонизину В1,%;
z - средняя сорбционная емкость в четырех дозировках к зеараленону,%;
о - средняя сорбционная емкость в четырех дозировках к охратоксину А,%.
Вычисления проводят с точностью до первого десятичного знака, а окончательный результат испытания регистрируют в протоколе с округлением до целого числа.
Способности кормовой добавки для сельскохозяйственной птицы сорбировать микотоксины определяют из коэффициента эффективности кормовой добавки:
1) от 16 до 30 - слабоэффективная способность;
2) от 30 до 100 - норма-эффективная способность;
3) от 100 до 275 - высокоэффективная способность.
Пример 1. Определение и расчет КЭ (коэффициента эффективности) для угля активированного. Для исследований готовят водный раствор соляной кислоты и натрий-фосфатный буфер. Водный раствор соляной кислоты с рН 1-1,5 готовится путем добавления 100 мкл концентрированной соляной кислоты в 1 литр дистиллированной воды, с дальнейшей корректировкой кислотности до нужного уровня рН. Натрий-фосфатный буфер готовится путем внесения в чистую сухую колбу объемом 1000 см 8 г NaCL, 0,2 г. KCl, 1,44 г. K2HPO4, 0,24 г. KH2PO4 и растворением этих солей в 1000 мл дистиллированной воды. Кислотность натрий-фосфатного буфера доводится до 5,0-5,5 поэтапным внесением соляной кислоты. Затем поэтапно проводят опыты с рабочими растворами микотоксинов. 1. Определение сорбционной емкости угля активированного к афлатоксину В1 (АВ1).
В четыре полипропиленовые пробирки объемом 50 см вносят уголь активированный в навесках 0,005; 0,01; 0,02; 0,05 грамм (таблица 2). Рабочий раствор готовят в конической колбе объемом не менее 250 см. В колбу вносят 50 мл водного раствора соляной кислоты с рН 1-1,5 и добавляют стандартный раствор афлатоксина В1 концентрацией 2 мкг/мл в объеме 150 мкл (таблица 3). Смешивание проводят при помощи магнитной мешалки в течение 15 минут. Полученный рабочий раствор при помощи автоматического дозатора добавляют в пробирки к навескам угля активированного в объеме 10 мл. В каждую пробирку добавляют по две стеклянные бусины-шарики (d 5 мм). Пробирки помещают в шейкер-инкубатор на 1 час при температуре 40±1°С и активном перемешивании (не менее 250 об/мин.). Так же в инкубатор помещается колба с оставшимся рабочим раствором для параллельного проведения «холостого» опыта. По истечении времени инкубации, отпущенного на адсорбцию афлатоксина В1 в имитированной среде желудка, пробирки центрифугируются в течение 5 мин. при не менее 4000 об/мин и отбирают аликвоты для анализа в хроматографические виалы, в том числе и из колбы с «холостым» опытом. Анализ проводят согласно ГОСТ 34140-2017 методом определения микотоксинов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием.
Затем раствор полностью удаляется путем декантации от угля активированного и вносится натрий-фосфатный буфер в объеме 10 мл с рН буфера 5,0-5,5. Инкубация растворов с имитацией кишечного пищеварения проводится 3 часа при температуре 40±1°С и активном перемешивании при не менее 250 об/мин. Затем смеси центрифугируют в течение 5 мин не менее 4000 об/мин и отбирают аликвоты для анализа.
Сорбционная емкость определяется по разности между адсорбцией и десорбцией. Выражается в процентах. Определенные концентрации микотоксина афлатоксина В1 в аликвотах, взятых после адсорбции (А -значение концентрации микотоксина в рабочем растворе после инкубации в кислой среде, мкг/кг) и десорбции (D - значение концентрации микотоксина в рабочем растворе после инкубации в щелочной среде - десорбция, мкг/кг), а так же концентрация афлатоксина В1 в рабочем растворе (С - значение концентрации микотоксина в исходном рабочем растворе, мкг/кг) приставляются в формулу, и производится расчет сорбционной емкости (СЕ) по каждой из четырех дозировок угля активированного по отношению к афлатоксину В1.
2. Определение сорбционной емкости угля активированного к охратоксину А (ОТА). Процедура проведения аналогичная для афлатоксина В1. Применение стандартного раствора охратоксина А согласно таблице 3.
3. Определение сорбционной емкости угля активированного к фумонизину В1 (ОТА). Процедура проведения аналогичная для афлатоксина В1. Применение стандартного раствора фумонизина В1 согласно таблице 3.
4. Определение сорбционной емкости угля активированного к Т-2 токсину. Процедура проведения аналогичная для афлатоксина В1. Применение стандартного раствора Т-2 токсина согласно таблице 3.
5. Определение сорбционной емкости угля активированного к дезоксинииваленолу (ДОН). Процедура проведения аналогичная для афлатоксина В1. Применение стандартного раствора дезоксиниваленола согласно таблице 3.
6. Определение сорбционной емкости угля активированного к зеараленону (ЗЕН). Процедура проведения аналогичная для афлатоксина В1. Применение стандартного раствора зеараленона согласно таблице 3.
Расчет «средней сорбционной емкости в четырех дозировках» включает в себя среднее арифметическое целое число, которое получается из четырех чисел, рассчитанных по формуле расчета сорбционной емкости (СЕ), приводимой выше.
Сорбционная емкость активированного угля составила, %
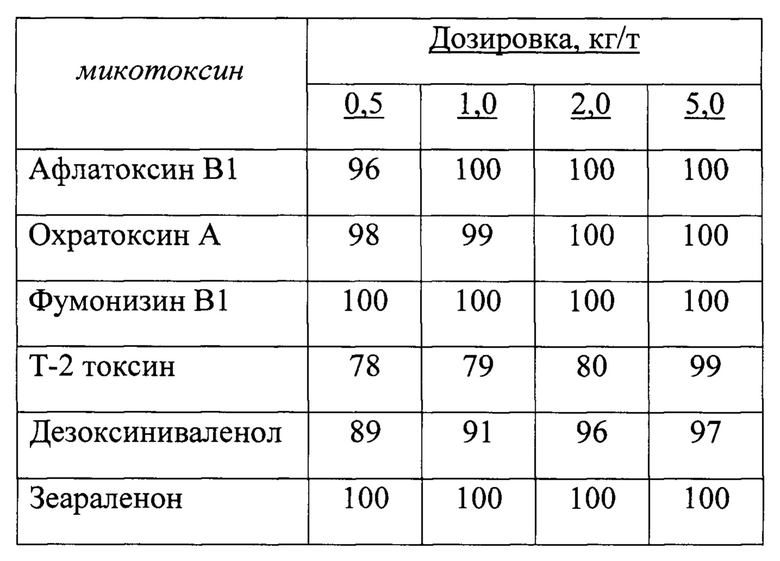
- средняя сорбционная емкость в четырех дозировках к афлатоксину В1 а=(96+100+100+100)/4=99
- средняя сорбционная емкость в четырех дозировках к Т-2 токсину
t=(78+79+80+99)/4=84
средняя сорбционная емкость в четырех дозировках к дезоксиниваленолу
d=(89+91+96+97)/4=93,25=93
- средняя сорбционная емкость в четырех дозировках к фумонизину В1
f=(100+100+100+100)/4=100
- средняя сорбционная емкость в четырех дозировках к зеараленону z=(100+100+100+100)/4=100
- средняя сорбционная емкость в четырех дозировках к охратоксину А
о=(98+99+100+100)/4=99,25=99
Коэффициент эффективности угля активированного составил:

Согласно предложенным нами способом оценки кормовых добавок уголь активированный является сорбентом с высокоэффективной способностью сорбировать микотоксины КЭ 255 (от 100 до 275).
Предлагаемое изобретение имеет следующие особенности и преимущества по сравнению с известными способами:
- применение КЭ позволит оценить сорбент комплексно, учитывая его способность связывать все имеющиеся в кормах микотоксины;
- применение магнитной мешалки для приготовления рабочих растворов;
- инкубация растворов при температуре 40±1°С;
- использование встряхивания при присутствии в пробирке бусов-шариков стеклянных d=5 мм 2 шт на пробирку в процессе инкубации;
- рН растворов: кислая среда - 1,0-1,5 (адсорбция) и слабощелочная среда - 5,0-5,5 (десорбция), что соответствует условиям пищеварения в желудочно-кишечном тракте птицы;
измерение показателей в четырех повторах с прямо-пропорциональным увеличением содержания кормовой добавки в растворе. Только при наличии данных о прямо-пропорциональном увеличении сорбционной емкости можно делать заключение о высокой достоверности результатов. Устанавливается динамика дозировок от 0,5 до 5,0 кг/тонну корма.
применение концентраций микотоксинов в растворе, соответствующих ПДК в зерне согласно Технического регламента Таможенного Союза TP ТС015/2011 «О безопасности зерна» от 9 декабря 2011 г. №874 ИС «Техэксперт: 6 поколение», 31 с.
- измерение начальной и остаточной концентрации микотоксинов в рабочих растворах проводить методом жидкостной хромато-масс-спектрометрии согласно ГОСТ 34140-2017 Межгосударственный стандарт. Продукты пищевые, корма, продовольственное сырье. Метод определения микотоксинов с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Food products, feed, food raw materials. Method for determination of mycotoxins by high performance liquid chromatography - mass spectrometry - M.: Стандартинформ, 2017.- 20 с.
Способ апробирован в нескольких лабораторных испытаниях на зарегистрированных и экспериментальных кормовых добавках. В исследованиях участвовали более 30 кормовых добавок, позиционирующих себя как сорбенты микотоксинов.
Использование КЭ позволит научно обоснованно подбирать кормовые добавки для сельскохозяйственной птицы с целью сорбировать микотоксины и предотвращать негативные последствия микотоксикозов. Учитывая, что в кормах содержится от трех видов микотоксинов, данный комплексный подход к оценке препаратов позволит производителям сельскохозяйственной продукции сделать правильный выбор относительно цены-качества и необходимости применения того или иного сорбента.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЕТОКСИКАЦИИ КОРМОВ ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ПТИЦ ЗА СЧЕТ РАЗЛОЖЕНИЯ Т-2 ТОКСИНА | 2023 |
|
RU2822357C1 |
| КОРМОВОЙ ПРОДУКТ ДЛЯ ПРОДУКТИВНЫХ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ | 2009 |
|
RU2425587C1 |
| Способ повышения продуктивности кур-несушек | 2023 |
|
RU2801715C1 |
| Способ повышения продуктивности лактирующих коров | 2023 |
|
RU2801751C1 |
| Кормовая добавка для профилактики микотоксикозов сельскохозяйственной птицы | 2023 |
|
RU2815881C1 |
| ПОЛИФУНКЦИОНАЛЬНЫЙ КОМПОЗИТНЫЙ ФЕРМЕНТНЫЙ ПРЕПАРАТ ДЛЯ ДЕГРАДАЦИИ ФОСФОРОРГАНИЧЕСКИХ ПЕСТИЦИДОВ, МИКОТОКСИНОВ И МОЛЕКУЛ-РЕГУЛЯТОРОВ КВОРУМА БАКТЕРИАЛЬНЫХ ПАТОГЕНОВ | 2020 |
|
RU2743197C1 |
| ВЕЩЕСТВО, СВЯЗЫВАЮЩЕЕ МИКОТОКСИН | 2011 |
|
RU2534575C2 |
| СПОСОБ ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ ЦЫПЛЯТ SPF | 2023 |
|
RU2823285C1 |
| СПОСОБ СНИЖЕНИЯ ОТРИЦАТЕЛЬНОГО ВОЗДЕЙСТВИЯ МИКОТОКСИНОВ У СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ (ВАРИАНТЫ) | 2018 |
|
RU2680009C1 |
| Комплексная кормовая добавка для сельскохозяйственных животных и птиц | 2020 |
|
RU2729746C1 |
Изобретение относится к сельскому хозяйству, а именно к контролю качества кормовых добавок для сельскохозяйственной птицы. Предложен способ скрининга кормовых добавок для сельскохозяйственной птицы по способности сорбировать микотоксины in vitro, включающий приготовление индивидуальных рабочих растворов шести микотоксинов в кислой среде с рН 1,0-1,5, внесение кормовой добавки в сухие чистые пробирки в четырех дозировках от 0,5 до 5,0 кг/т, добавление рабочих растворов в объеме 10 мл и стеклянных бусов-шариков 2 шт. к навескам кормовой добавки, инкубирование в течение 1 ч при температуре 40±1°С и активном перемешивании 250 об/мин, центрифугирование, измерение концентрации микотоксинов в аликвоте, удаление раствора декантацией, добавление натрий-фосфатного буфера в объеме 10 мл рН буфера 5,0-5,5, который достигается поэтапным внесением соляной кислоты, и инкубирование в течение 3 ч при температуре 40±1°С и активном перемешивании 250 об/мин, центрифугирование, измерение концентрации микотоксинов в аликвоте, расчет сорбционной емкости кормовой добавки к каждому из шести микотоксинов, согласно изобретению оценка кормовой добавки и проведение скрининга определяется по КЭ - коэффициенту эффективности кормовой добавки, который вычисляется по формуле: 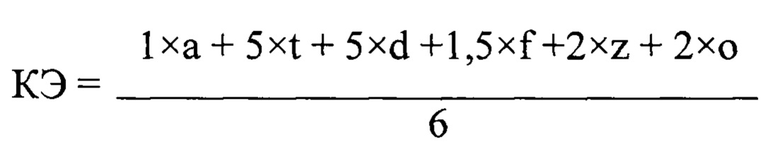 , где КЭ - коэффициент эффективности кормовой добавки; а - средняя сорбционная емкость в четырех дозировках к афлатоксину В1, %; t - средняя сорбционная емкость в четырех дозировках к Т2 токсину, %; d - средняя сорбционная емкость в четырех дозировках к дезоксиниваленолу, %; f - средняя сорбционная емкость в четырех дозировках к фумонизину В1, %; z - средняя сорбционная емкость в четырех дозировках к зеараленону, %; о - средняя сорбционная емкость в четырех дозировках к охратоксину А, %, при этом способность кормовой добавки сорбировать микотоксины определяют по коэффициенту эффективности кормовой добавки: от 16 до 30 - слабоэффективная способность, от 30 до 100 - норма-эффективная способность, от 100 до 275 - высокоэффективная способность. Изобретение позволяет эффективно отбирать кормовые добавки для сельскохозяйственной птицы по способности сорбировать микотоксины. 4 табл., 1 пр.
, где КЭ - коэффициент эффективности кормовой добавки; а - средняя сорбционная емкость в четырех дозировках к афлатоксину В1, %; t - средняя сорбционная емкость в четырех дозировках к Т2 токсину, %; d - средняя сорбционная емкость в четырех дозировках к дезоксиниваленолу, %; f - средняя сорбционная емкость в четырех дозировках к фумонизину В1, %; z - средняя сорбционная емкость в четырех дозировках к зеараленону, %; о - средняя сорбционная емкость в четырех дозировках к охратоксину А, %, при этом способность кормовой добавки сорбировать микотоксины определяют по коэффициенту эффективности кормовой добавки: от 16 до 30 - слабоэффективная способность, от 30 до 100 - норма-эффективная способность, от 100 до 275 - высокоэффективная способность. Изобретение позволяет эффективно отбирать кормовые добавки для сельскохозяйственной птицы по способности сорбировать микотоксины. 4 табл., 1 пр.
Способ скрининга кормовых добавок для сельскохозяйственной птицы по способности сорбировать микотоксины in vitro, включающий приготовление индивидуальных рабочих растворов шести микотоксинов в кислой среде с рН 1,0-1,5, внесение кормовой добавки в сухие чистые пробирки в четырех дозировках от 0,5 до 5,0 кг/т, добавление рабочих растворов в объеме 10 мл и стеклянных бусов-шариков 2 шт. к навескам кормовой добавки, инкубирование в течение 1 ч при температуре 40±1°С и активном перемешивании 250 об/мин, центрифугирование, измерение концентрации микотоксинов в аликвоте, удаление раствора декантацией, добавление натрий-фосфатного буфера в объеме 10 мл с рН буфера 5,0-5,5, который достигается поэтапным внесением соляной кислоты, инкубирование в течение 3 ч при температуре 40±1°С и активном перемешивании 250 об/мин, центрифугирование, измерение концентрации микотоксинов в аликвоте, расчет сорбционной емкости кормовой добавки к каждому из шести микотоксинов, отличающийся тем, что оценка кормовой добавки и проведение скрининга определяется по КЭ - коэффициенту эффективности кормовой добавки, который вычисляется по формуле:
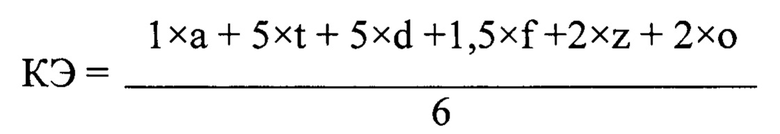 ,
,
где КЭ - коэффициент эффективности кормовой добавки; а - средняя сорбционная емкость в четырех дозировках к афлатоксину В1, %; t - средняя сорбционная емкость в четырех дозировках к Т2 токсину, %; d - средняя сорбционная емкость в четырех дозировках к дезоксиниваленолу, %;
f - средняя сорбционная емкость в четырех дозировках к фумонизину В1, %; z - средняя сорбционная емкость в четырех дозировках к зеараленону, %; о - средняя сорбционная емкость в четырех дозировках к охратоксину А, %,
при этом способность кормовой добавки сорбировать микотоксины определяют по коэффициенту эффективности кормовой добавки: от 16 до 30 - слабоэффективная способность, от 30 до 100 - норма-эффективная способность, от 100 до 275 - высокоэффективная способность.
| КОМПОЗИЦИЯ, АДСОРБИРУЮЩАЯ МИКОТОКСИН, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2745708C1 |
| КОРМОВАЯ ДОБАВКА ДЛЯ ПРОФИЛАКТИКИ МИКОТОКСИКОЗОВ У СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2007 |
|
RU2385623C2 |
| ПРИМЕНЕНИЕ БЕТА-ЦЕОЛИТА В КАЧЕСТВЕ ВЕЩЕСТВА, СВЯЗЫВАЮЩЕГО МУЛЬТИТОКСИНЫ В КОРМЕ ДЛЯ ЖИВОТНЫХ | 2015 |
|
RU2670917C9 |
| ГОГИНА Н.Н | |||
| Методы оценки сорбционной емкости кормовых добавок in vitro (обзор), Птицеводство, N12, 2021, стр.20-23. | |||
Авторы
Даты
2024-05-28—Публикация
2023-12-13—Подача