ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ИЗОБРЕТЕНИЯ
По настоящей заявке испрашивается приоритет по патентной заявке США № 61/345186, поданной 17 мая 2010, включенный здесь путем ссылки в полном объеме.
Настоящее изобретение относится к веществам, связывающим микотоксины, в частности к веществам, связывающим микотоксины при использовании гуминовых соединений.
Микотоксины невидимы, не имеют запаха и не могут быть определены по запаху или по вкусу, но могут привести к значительным экономическим потерям на всех уровнях производства кормов в сельском хозяйстве и, в частности, для животноводства. Микотоксины представляют вторичные метаболиты, продуцируемые мицелиальными грибами, такими как Fusarium, Aspergillus и Penicillium, перед или во время сбора урожая, или во время (неправильного) хранения. Их токсическое воздействие очень разнообразно (Akande, K.E., Abubakar, M.M., Adegbola, T.A., and Bogoro, S.E. 2006 Nutritional and Health Implications of Mycotoxins in Animal Feeds: A Review. Pakistan Journal of Nutrition, 5: 398-403). При потреблении кормового продукта сельскохозяйственными животными микотоксины оказывают негативное воздействие на показатели продуктивности и физиологическое состояние животных, уровень воспроизведения, способность к росту, иммунологическую защиту, а также оказывают канцерогенное, мутагенное, тератогенное воздействие, вызывая тремор или повреждения центральной нервной системы, геморрагические проявления наряду с повреждением печени и почек. Микотоксины метаболизируются в печени и почках, а также микроорганизмами желудочно-кишечного тракта. Следовательно, часто химическая структура и связанная с этим токсичность остатков микотоксинов, выделяемых из организма животных или обнаруживаемых в тканях, отличается от таковой первичной молекулы (Ratcliff, J. The Role of Mycotoxins in Food and Feed Safety. Presented at Animal Feed Manufacturers Association, August 16, 2002). Различные микотоксины могут встречаться одновременно, в зависимости от условий окружающей среды и субстрата (Sohn, H.В., Seo, J.A., and Lee, Y.W. 1999 Co-occurrence of Fusarium Mycotoxins in Mouldy and Healthy Corn from Korea. Food Additives and Contaminants, 16: 153-158). Принимая во внимание это одновременное продуцирование, очень вероятно, что животные подвергнутся воздействию смесей, а не отдельных соединений. Полевые исследования показали, что более тяжелые токсикозы у животных могут быть результатом суммарного и синергетического воздействия различных микотоксинов (Ratcliff, 2002). Проблема микотоксинов касается не только кормового продукта или сниженных показателей продуктивности животных, многие из них концентрируются в мясе, яйцах и молоке животных и могут представлять угрозу для здоровья человека. Растет обеспокоенность по поводу уровней микотоксинов в пищевых продуктах как в продуктах растительного, так и животного происхождения.
Хотя существуют географические и климатические различия в продуцировании и распространенности микотоксинов, воздействие этих веществ очень распространено в мире. Согласно оценкам ежегодно вплоть до 25 процентов мирового урожая сельскохозяйственных культур подвергаются воздействию микотоксинов (Akande, 2006). Большинство стран имеют строгие нормы по уровням микотоксинов в кормовых продуктах, и главной целью сельскохозяйственной и пищевой индустрии является предотвращение загрязнения в поле. На практике для существенного снижения загрязнения микотоксинами требуется правильная стратегия управления для повышения продуктивности растений и снижения стрессовых воздействий на растения. Это включает культивирование адаптированных сортов, использование правильных удобрений, борьбу с сорными растениями, необходимую ирригацию и правильное чередование культур (Edwards, S.G. 2004 Influence of Agricultural Practices on Fusarium Infection of Cereals and Subsequesnt Contamination of Grain by Tricothecenes Mycotoxins. Toxicology Letters, 153: 29-35). Но даже правильная стратегия управления не устраняет загрязнение микотоксинами в годы, благоприятные для развития болезней.
Среди различных микотоксинов, в частности, определены оказывающие воздействие на птицу, некоторые из которых присутствуют в значительном количестве в загрязненных естественным путем пищевых и кормовых продуктах. Они представляют афлатоксин; охратоксин, зеараленон, токсин T-2, вомитоксин и фумонизин. Они оказывают вредное воздействие на птиц, такое как замедление роста, подавление иммунитета и бледность у бройлеров, что в конечном итоге приводит к экономическим потерям.
Афлатоксин Bl - метаболит грибка Aspergillus flavus и Aspegillus parasiticus, представляет чрезвычайно гепатоксичное соединение, которое часто на низких уровнях загрязняет кормовые продукты для птицы. Другое семейство митоксинов, продуцируемое Penicillium и Aspergillus, представляет охратоксин. Охратоксин является самым сильным токсином, оказывающим негативное воздействие на показатели продуктивности и здоровье птицы. Потребление охратоксинов вызывает тяжелые поражения почек. Токсин T-2 индуцирует тяжелые воспалительные реакции и повреждения нервов у животных и людей, в то время как зеараленон не оказывает воздействия на здоровье и продуктивность птицы. Рационы птицы с высокими уровнями загрязнения Fusarium ассоциируются с низкой продуктивностью, отказом от кормового продукта, диареей, слабостью лап, поражением ротовой полости и/или высокой смертностью.
Токсичность и клинические признаки, наблюдаемые у животных в случае присутствия более чем одного микотоксина, взаимосвязаны и отличаются разнообразием. Микотоксины, как правило, сопровождаются другими неизвестными метаболитами, которые могут проявлять синергетическое или суммарное воздействие. Способность связывающих веществ снижать негативное воздействие некоторых комбинаций микотоксинов, присутствующих изначально в кормовом продукте, на продуктивность и биохимические, и гематологические показатели сыворотки требуют дополнительных исследований.
В настоящее время недоступны практические методы детоксикации зерна, загрязненного микотоксином, в промышленных масштабах и экономически эффективным способом. В данный момент одним из наиболее перспективных и практичных подходов является использование адсорбентов. Однако было установлено, что некоторые адсорбенты нарушают усваивание питательных веществ (Kubena, L. F., R. B. Harvey, T. D. Phillips, D. E. Corrier, and W. E. Huff. Diminution of aflatoxicosis in growing chickens by the dietary addition of hydrated sodium calcium aluminosilicate. Poult. Sci. 69:727-735. 1990) и адсорбцию минеральных веществ (Chestnut, А. В., P. D.Anderson, M. A. Cochran, H. A. Fribourg, and K. D. Twinn. 1992. Effects of hydrated sodium calcium aluminosilicate on fescue toxicosis and mineral absorption. J. Anim. Sci. 70:2838-2846), и на практике отсутствует связывающее воздействие на комплекс микотоксинов (Edrington, T.S.; Sarr, А.В.; Kubena, L.F.; Harvey, R.B.; Phillips, T.D. (1996). Hydrated sodium calcium aluminosilicate (HSCAS), acidic HSCAS, and activated charcoal reduce urinary excretion of aflatoxin Ml in turkey poults. Lack of effect by activated charcoal on aflatoxicosis. Toxicology letter, 89: 115-122).
Зеараленон (ZEA) вызывает гиперэстрогенизм у свиней при потреблении таких низких уровней, как мкг/г в кормовом продукте. Патология у свиней более выражена у препубертатных свинок и характеризуется опуханием вульвы, пролапсом вагины и ректума и увеличением молочных желез. У репродуктивных животных зеараленон вызывает неудачное оплодотворение, ложную беременность и аборт. Считается, что метаболизм ZEA по существу происходит в печени, приводя к образованию α и β зеаталенола. Ферментом, катализирующим превращение ZEA в зеараленол, является 3-α- гидроксистероид дегидрогеназа (3α-HSD). Также известно, что этот фермент расщепляет 5-α-андростан-3,17-дион - продукт метаболизма стероидного гормона. Как известно из ряда исследований, ZEA и его метаболиты выводятся из организма, главным образом, через фекалии и мочу. Свиньи более чувствительны к ZEA, чем другой домашний скот, и желательны режимы кормления минимизирующие потери, вызванные непроизводительным расходом кормов и низкой продуктивностью. Некоторые соединения (например, пищевые волокна, формалин, карбонат натрия и монометиламин) продемонстрировали защиту от ряда ксенобиотиков, включая ZEA.
Использование ингибиторов плесени или консервации кислотами может только сократить количество плесени, но не влияет на содержание микотоксинов, продуцированных до проведения обработки. В случае, когда микотоксины уже продуцированы, на них не может быть оказано воздействия в любой форме ингибиторами плесени или смесями кислот, поскольку они представляют очень стабильные соединения. Таким образом, эти токсичные соединения остаются в ранее загрязненных продуктах, даже если плесень не видна и не определяется. Наиболее используемой стратегией снижения воздействия микотоксинов является снижение их биодоступности за счет включения различных агентов, связывающих микотоксины, или адсорбентов, что приводит к снижению потребления микотоксинов и проникновение в кровь и органы-мишени. Основные преимущества адсорбентов включают стоимость, безопасность и простоту добавления в кормовые продукты для животных. Для этой цели были протестированы и использованы различные группы веществ, алюмосиликаты, в частности, самыми используемыми группами являются глиняные и цеолитовые минералы.
Гуминовые кислоты встречаются повсеместно и могут быть найдены в любом веществе, в котором происходит разложение, или они преобразуются как в случае осадочных отложений. Они представляют натуральные компоненты питьевой воды, почвы и лигнита. Гуминовые вещества обладают сильной аффинностью связывания различных, таких как тяжелые металлы, гербициды, различные мутагены, моноароматические и полициклические ароматические соединения и минеральные вещества. Уже в течение многих лет фермеры используют гуматы для ускорения прорастания семян и улучшения роста корневищ (Islam, K.M., Schuhmacher, S.A., and Gropp, M.J. 2005 Humic Substances in Animal Culture. Pakistan Journal of Nutrition, 4: 126-134). Материалы способны стимулировать транспорт кислорода, усиление дыхания и способствуют эффективному использованию нутриентов растениями (Osterberg, R. and Mortensen, K. 1994 The Growth of Fractal Humic Acids: Cluster Correlation and Gel Formation. Radiation and Environmental Biophysics, 33: 269-276). Эти наблюдения натолкнули ученых на исследование специфических свойств гуматов и возможного их положительного влияния на здоровье и хорошее самочувствие людей и животных. Гуминовые вещества используют в качестве противодиарейных, анальгетических, иммуностимулирующих и промотирующих рост агентов в ветеринарной практике в Европе (Islam, 2005). Гуминовые кислоты ингибируют рост бактерий и грибков, таким образом, косвенно снижая уровни микотоксинов в кормовом продукте (Riede, U.N., Zeck-Keapp, G., Freudenberg, N., Keller, H.U., and Seubert, B. 2007 Humate Induced Activation of Human Granulocytes. Virchows Archives of Biology: Cell Pathology, 60: 27-34). Описана способность некоторых гуминовых веществ и их солей взаимодействовать напрямую с микотоксинами за счет их способности связывать микотоксины (Sabater-Vilar, M., Malekinejad, H., Selman, M.H.J., Ven Der Doelen, M.A.M., and Fink-Gremmels, J. 2007, In Vitro Assessment of Absorbents Aiming to Prevent Deoxynivalenol and Zearalenone Mycotoxicosis. Micropathologia, 163: 81-90; Ye, S., Lv, X., and Zhou, A. 2009 In Vitro Evaluation of the Efficacy of Sodium Humate as an Aflatoxin Bl Adsorbent. Australian Journal of Basic and Applied Sciences, 3: 1296-1300; Jansen van Rensburg, C, Van Rensburg, C.E.J., Van Ryssen, J.B.J., Casey, N.H., and Rottinghaus, G.E. 2006 In Vitro and In Vivo Assessment of Humic Acid as an Aflatoxin Binder in Broiler Chickens. Poultry Science, 85:1576-1583).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой группе веществ, связывающих микотоксины, представляющей вещества, содержащие гуминовую кислоту. Предпочтительно вещества, связывающие микотоксины, имеют минимальное содержание гуминовой кислоты 45%, максимальную растворимость около 20% при pH 1,5; 3,0 и 7,0 и in vitro эффективность связывания микотоксинов по меньшей мере 80% и предпочтительно 90%, с минимальной адсорбцией при pH желудка моногастричных животных по меньшей мере 80%, и предпочтительно по меньшей мере 85%, и максимальной десорбцией при нейтральном pH не более чем 10%. В предпочтительном варианте воплощения настоящего изобретения гуминовые вещества комбинируют с адсорбентом, таким как глина, для обеспечения эффективного вещества, связывающего in vivo микотоксины.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 - график средних еженедельных оценок вульвы всех групп свинок; стандартные ошибки составляют в пределах от 0,3 до 0,5.
Фиг. 2 - график изменения средней концентрации этрадиола-17β в плазме для различных партий.
Фиг. 3 - график процентного соотношения фолликул размером ≤6 мм для различных партий.
Фиг. 4 - график процентного соотношения фолликул размером >6 мм для различных партий.
Фиг. 5 - график процентного соотношения свинок с гипоплазией яичников и фолликулами размером >6 мм.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает композиции для добавления в кормовые продукты для животных, которые могут быть загрязненные одним или более микотоксинами. Композиции включают гуминовые вещества, предпочтительно гуминовые вещества с содержанием в пределах от 45% до 99% гуминовых кислот, включая все значения в этих пределах. Композиции должны иметь высокую аффинность к специфическим микотоксинам с образованием, в результате, прочного комплекса между композицией и целевым микотоксином, который не растворяется в желудочно-кишечном тракте, таким образом, микотоксин будет выведен с фекалиями. Следовательно, предпочтительно, чтобы композиции имели растворимости не более чем 20% при pH в пределах от 1,5 до 7,5. Было установлено, что композиции по настоящему изобретению эффективны in vivo и обладают эффективностью in vitro более чем 80%, и предпочтительно более чем 90%, с минимальной абсорбцией при pH 3,0 по меньшей мере 80%, и предпочтительно 85%, и максимальной десорбцией при pH 6,8 не более чем 10%.
Гуминовые вещества, подходящие для настоящего изобретения, могут быть получены из множества источников, но предпочтительным источником является леонардит. Гуминовые вещества предпочтительно скомбинированы с одним или более источником ионов металла, оксидов и глиняных минералов. Предпочтительно в пределах от 10% до 90% источника гуминовых веществ скомбинировано с глиной, такой как бентонит или сепиолит, в пределах от 90% до 10%, включая все значения в этих пределах.
Гуминовые кислоты в натуральных веществах
Гуминовые кислоты образуются в процессе химической и биологической гумификации органического вещества, в частности, растений за счет биологической активности микроорганизмов. Они находятся в буром органическом веществе различных почв, наряду с торфом, компостом, лигнитом, леонардитом и бурым углем. В почвах они также могут быть образованы за счет определенных вторичных процессов, таких как полимеризация полифенолов при выщелачивании дождем из поверхностного слоя листовой подстилки и конденсация фенолов, хинонов и белков, происходящая при воздействии почвенных микроорганизмов и мелких животных на почвенные углеводы.
Гуминовые кислоты не имеют единой, свойственной им структуры, а представляют смесь промежуточных химических продуктов, полученных в результате распада и превращения лигнина и других растительных материалов в каменный уголь. Они представляют трехмерные макроколлоидные молекулы с полиароматическим центром, содержащим изо- и гетероциклические структуры и периферические боковые цепи. Органическая структура гуминовой кислоты естественным образом окислена и отрицательно заряжена. Положительные ионы притягиваются к разрушенным связям в местах окисления, создавая места для прикрепления микронутриентов и микрофлоры. Низкокачественный уголь, называемый лигнитом, содержит больше кислот, чем высококачественный уголь. Леонардит представляет специфическое образование сильно окисленного лигнита. Этот материал имеет самое высокое содержание гуминовых кислот из всех натуральных источников.
Пример 1
Эксперимент проводят для определения содержания гуминовой кислоты в пяти натуральных веществах, содержащих гуминовую кислоту. Гуминовые кислоты измеряют при использовании объемного метода с титрованием экстрактов согласно международному стандарту (ISO 5073:1999 Brown coals and lignites. Determination of humic acids).
Результаты анализов веществ, содержащих гуминовую кислоту, приведены в Таблице 1. Указанное минимальное требование 45% гуминовой кислоты было превышено всеми продуктами, за исключением HS3 (28,34%) и HS4 (44,62%).
Содержание гуминовой кислоты, определенное согласно ISO 5073:1999
Растворимость веществ, содержащих гуминовые кислоты, при различных pH
В большинстве веществ гуминовые кислоты химически прикреплены к неорганическим компонентам (глина или оксиды), и меньшая часть растворена в растворах или почве, в частности, в щелочных условиях. Важной особенностью гуминовых веществ является то, что они могут быть скомбинированы с ионами металлов, оксидов и глины с получением водорастворимых или нерастворимых комплексов и могут взаимодействовать с органическими соединениями, такими как щелочи, жирные кислоты, капиллярно-активные вещества и пестициды.
Адсорбенты, используемые для того чтобы препятствовать желудочно-кишечной адсорбции микотоксинов, имеют высокую аффинность к специфическим микотоксинам, с образованием в результате прочных комплексов, которые не разрушаются и будут выведены из организма с фекалиями. Это подразумевает, что гуминовые кислоты, как основные активные соединения, не могут быть растворены где-либо в желудочно-кишечном тракте. Описанные вещества гуминовых кислот могут иметь растворимость не выше, чем 20% при pH 1,5; 3,0 и 7,0 (то есть минимальный выход ретентата 80%).
Пример 2
Эксперимент проводят для определения нерастворимой части веществ, содержащих гуминовую кислоту. Кратко, 0,15 г продукта растворяют в 75 мл 0,1M фосфатного буфера (отрегулированного до pH 1,5; 3,0 или 7,0), инкубируют в течение одного часа при комнатной температуре на магнитном устройстве для перемешивания (600 оборотов в минуту). Все суспензии фильтруют через 55 мм фильтр (Macherey-Nagel, MN GF-4). Ретентат сушат в течение двух часов при температуре 130°C. Количество ретентата рассчитывают как разницу между пустым фильтром и фильтром+высушенный ретентат. Выход (%) рассчитывают как соотношение «количество ретентата/масса продукта» и выражают в процентах. Проводят трехкратный анализ образцов и рассчитывают среднее. Контрольный материал представляет очищенную гуминовую кислоту (HA, Sigma Aldrich. Lot 0001411101, cas number: 1415-93-6).
Извлечение нерастворимой фракции суспензии HA при pH 7 невозможно. Фильтрация этой суспензии не может быть проведена, поскольку образовавшиеся на стадии инкубации «флотирующие вещества» делают фильтр непроницаемым. Эксперимент повторяют в цитратном буфере, отрегулированном до pH 6,2. Однако результаты были такими же. Суспензии других продуктов легко фильтруются при каждом тестируемом pH. Результаты по выходу ретентатов приведены в Таблице 2. Все, за исключением двух продуктов отвечают минимальным требованиям по выходу ретентата 80% при различных условиях pH. Выход ретентата HS1 при pH 1,5 слишком низкий; выход ретентатов HS3 при всех тестируемых уровнях pH слишком низкий.
Нерастворимая фракция веществ, содержащих гуминовую кислоту, при различных pH, выраженная как мас.% от извлеченного ретентата
Пример 3
Во втором эксперименте на растворимость веществ, содержащих гуминовые кислоты, 0,015 г (вместо 0,15 г) продуктов HS2, HS3 и HA растворяют в 75 мл 0,1M фосфатного буфера (pH 1,5; 3,0 или 7,0).
После выдержки в течение одного часа при комнатной температуре на устройстве для магнитного перемешивания морфология суспензий трех протестированных продуктов имеет явные отличия (Фигура 1). Результаты по выходу ретентатов приведены в Таблице 3. Темно-коричневый цвет суспензии HA при pH 7 соответствует высокой растворимости продукта при этом pH (Таблица 3).
Нерастворимая фракция веществ, содержащих гуминовые кислоты, при различных pH, выраженная как мас.% от извлеченного ретентата
Способность in vitro связывать микотоксины веществ, содержащих гуминовые кислоты
В процессе адсорбции микотоксины в действительности не связываются с поверхностью связывающего вещества. Электростатические силы, которые соединяют токсин и связывающее вещество, не дают постоянных связей, что означает, что процесс адсорбции обратим. Изменение окружающей среды, в которой находится вещество, связывающее микотоксин (например, в желудочно-кишечном тракте), может оказать очень сильное воздействие на эффективность связывания. Основным параметром, оказывающим воздействие, является pH окружающей среды. Изменения pH могут изменить оба - как микотоксин, так и поверхность связывающего вещества, вызывая изменения притяжения между ними. У животного в передней кишке условия низкого pH могут способствовать адсорбции микотоксинов, в то время как далее в пищеварительном тракте (более нейтральный pH) микотоксин может снова выделиться. Очень сильное влияние pH на адсорбцию является чрезвычайно важным для использования in vitro системы, которая имитирует изменение условий pH в желудочно-кишечном тракте.
Пример 4
Исследование проводят in vitro, оценивая эффективность детоксикации микотоксина потенциальными связывающими веществами, содержащими гуминовую кислоту, в отношении зеараленона. Измеряют адсорбцию в кислой окружающей среде (pH 3,0), имитирующей pH желудка моногастричного животного, и десорбцию при близком к нейтральному pH (pH 6,8), имитирующем условия pH в кишечнике моногастричного животного. Чистый процент эффективности детоксикации микотоксина определяют как процент адсорбции минус процент десорбции.
При двукратном повторе аликвоты 0,1 M фосфатного буфера (отрегулированные до pH 3,0), содержащие 300 частей на миллиард зеараленона в растворе (10 мл), добавляют в 15 мл полипропиленовые пробирки Falcon с навинчивающейся крышкой, в которые был добавлен 0,05 грамм каждого адсорбента. Тестируемые пробирки помещают в орбитальный встряхиватель на 60 минут при комнатной температуре. Каждый тестируемый раствор микотоксина центрифугируют при 4000 оборотов в минуту в течение 10 минут. Для анализа микотоксина (адсорбция) выделяют водный супернатант. Осадок ресуспендируют в 0,1 M фосфатном буфере при pH 6,8. Тестируемые пробирки снова помещают в орбитальный встряхиватель на 60 минут при комнатной температуре и затем центрифугируют при 4000 оборотах в минуту в течение 10 минут. Водный супернатант анализируют на зеараленон (десорбция). Концентрацию зеараленона определяют при использовании ELISA (Euro-Diagnostica). В качестве стандарта используют тестируемые буферные растворы зеараленона (pH 3,0 или 6,8) без адсорбентов.
Краткое описание in vitro адсорбции микотоксина пятью образцами представлено в Таблице 4. Результаты показывают, что все продукты эффективно адсорбировали зеараленон при рН 3,0 (адсорбция выше минимально требуемого показателя 85%), за исключением HS3. Значительные различия наблюдаются для десорбции при pH 6,8. Продукты HS3 и HS4 - оба демонстрируют превышение максимального показателя 10% десорбции. Другие три образца отвечают требованиям. Только продукты HS2 и HS5 отвечают минимальным требованиям in vitro эффективности связывания 90%.
In vitro связывание зеараленона веществами, содержащими гуминовую кислоту, при pH 3,0 и 6,8
Пример 5
Два вещества гуминовых кислот (HS2 и HS3) сравнивают с очищенной гуминовой кислотой (HA, Sigma Aldrich. Lot 0001411101, каталожный номер: 1415-93-6) в исследовании in vitro связывания микотоксина, аналогично тесту, описанному в Примере 4, только с одной модификацией, состоящей в том, что зеараленон определяют при использовании анализа ВЭЖХ после выделения микотоксина при использовании колонки AOZ (VICAM, USA).
Анализ ВЭЖХ проводят при использовании системы доставки растворителя с дегазацией гелием SP8800 Ternary LC (Spectra Physics, USA), с 20 мкл петлевым автодозатором SP 8880 (Spectra Physics, USA), интегратором Chromjet (Thermo, USA), нагревателем колонки Croco CilTM (Cluzeau Info Labo, France) и УВ-флуоресцентным детектором FP-920 (Jasco, Japan), колонками Chromsep Nucleosil 100-5 CI8 SS 250*4,6 мм (L*ID) (Varian, the Netherlands) или эквивалентом. Колонки защищены защитной колонкой. В качестве стандарта ВЭЖХ используют аликвоту оригинального тестируемого забуференного раствора зеараленона.
Результаты приведены в Таблице 5. Данные HS2 и HS3 подтверждают результаты Примера 4. Адсорбция зеараленона на очищенной гуминовой кислоте при PH 6,8 очень высокая (96,93%). Однако при pH 6,8 снова выделяется 30,83% связанного зеараленона.
In vitro связывание зеараленона веществами, содержащими гуминовую кислоту, при pH 3,0 и 6,8. Результаты представляют средние показатели дважды повторенных анализов. Для HS3 доступны только однократные анализы
В заключение, два продукта HS2 и HS5 отвечают всем трем предпочтительным характеристикам для улучшенных веществ, связывающих микотоксины по настоящему изобретению.
Пример 6
Материалы и методы
Для определения общих гуминовых кислот в веществах, содержащих гуминовые кислоты, используют растворы.
Гуминовые кислоты измеряют при использовании объемного метода с титрованием экстрактов по Международному стандарту (ISO 5073:1999 Brown coals and lignites. Determination of humic acids). В Таблице 6 приведено краткое описание различных растворов, используемых в процедуре.
Растворы, используемые для определения гуминовой кислоты
Для каждой партии анализируемых образцов титрационный раствор двойной соли сернокислого аммония и сернокислого железа стандартизируют по стандартному раствору дихромата калия. Двадцать пять мл стандартного раствора дихромата калия прокапывают пипеткой в 300 мл коническую колбу. Семьдесят мл добавляют до 80 мл водой. Осторожно добавляют 10 мл концентрированной серной кислоты и 3 капли 1,10- фенантролинового индикатора. После охлаждения раствор титруют стандартным раствором двойной соли сернокислого аммония и сернокислого железа с получением раствора красного цвета. Концентрацию раствора двойной соли сернокислого аммония и сернокислого железа рассчитывают в молях на л следующим образом (1): где концентрацию раствора двойной соли сернокислого аммония и сернокислого железа выражают в молях на л; V представляет раствор двойной соли сернокислого аммония и сернокислого железа, требуемый для титрования.
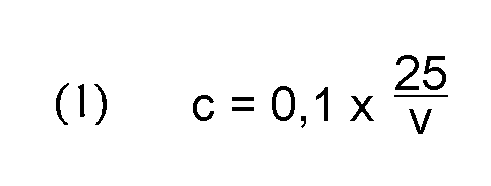
Экстракция общих гуминовых кислот
Получают пять веществ, содержащих гуминовую кислоту, здесь и далее называемых леонардит. В Таблице 7 приведено краткое описание источника каждого леонардита. Для экстракции гуминовых кислот в конические колбы отвешивают образцы 0,2±0,0002 г. Добавляют и перемешивают сто пятьдесят мл щелочного экстракционного раствора пирофосфата натрия (общие гуминовые кислоты) до равномерного увлажнения образцов. На колбу помещают небольшую воронку и нагревают на бане с кипящей водой в течение 2 часов, часто встряхивая, для обеспечения осаждения нерастворимого материала. Колбу удаляют с водяной бани, охлаждают до комнатной температуры и перемещают экстракт и осадок в 200 мл мерную колбу. Экстракт разводят водой до метки и встряхивают для обеспечения тщательного перемешивания.
Определение общих гуминовых кислот
Для определения гуминовых кислот в экстрактах в коническую колбу от 250 мл до 300 мл пипеткой прокапывают 5 мл экстракта. В колбу добавляют пять мл окисляющего раствора дихромата калия. Осторожно добавляют 15 мл концентрированной серной кислоты. Раствор помещают на баню с кипящей водой на 30 минут, затем раствор охлаждают до комнатной температуры и разводят до около 100 мл. В раствор добавляют три капли 1,10- фенантролинового индикатора и титруют титрационным раствором двойной соли сернокислого аммония и сернокислого железа с получением раствора кирпично-красного цвета. В контрольных образцах на общие гуминовые кислоты 5 мл экстракта заменяют на 5 мл пирофосфата натрия.
Расчет общих гуминовых кислот
Общее содержание гуминовой кислоты (WHA,t) рассчитывают как процент по массе от анализируемого образца, по следующей формуле (2), где 0,003 представляет массу углерода в миллимолях, в г/ммоль; Vo представляет объем титрационного раствора двойной соли сернокислого аммония и сернокислого железа, используемого в качестве контрольного титра, в мл; V1 представляет объем титрационного раствора двойной соли сернокислого аммония и сернокислого железа, используемого в титре экстракта, в мл; с представляет концентрацию титрационного раствора двойной соли сернокислого аммония и сернокислого железа, в моль/л; Ve представляет объем экстракта, в мл; Va представляет объем аликвоты, взятой для титрования, в мл; 0,59 представляет среднее соотношение содержания углерода в гуминовых кислотах для бурого угля и лигнитов; m представляет массу образца, взятого для тестирования, в г.
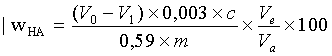
Источники леонардита
Растворимость образцов леонардита при различных pH
Эксперимент проводят для определения нерастворимой части образцов леонардита. Кратко, 0,15 г образца растворяют в 75 мл раствора, отрегулированного до pH 1,5; 3,0 или 7,0. Раствор при pH 1,5 представляет раствор Кларка и Любса, состоящий из 25 мл 0,2M KCl, 20,7 мл 0,2M HCl, разведенного до 100 мл водой MilliQ (Millipore, Brussels, Belgium). Раствор при pH 3,0 представляет 0,1M NaH2PО4, отрегулированный до pH при использовании H3PO4 (Acros, Geel, Belgium); раствор при pH 7,0 представляет 0,1M Na2HPО4.2H2О отрегулированный до pH при использовании 0,1M NaH2PО4. Все химические реагенты от VWR International, Leuven, Belgium). Суспензию выдерживают в течение одного часа при комнатной температуре на устройстве для магнитного перемешивания (600 оборотов в минуту). Через один час все суспензии фильтруют через 55 мм стекловолоконный фильтр (GF-92, Whatman, Dassel, Germany). Ретентат сушат в течение двух часов в сушильной камере при температуре 130°C. Количество ретентата рассчитывают как разницу массы между пустым фильтром и фильтром+высушенный ретентат. Выход (%) рассчитывают как соотношение «количество ретентата/масса продукта» и выражают в процентах. Проводят трехкратный анализ образцов и рассчитывают среднее. Контрольный материал представляет очищенную гуминовую кислоту (HA, Sigma Aldrich, Bornem, Belgium). Извлечение нерастворимой фракции суспензии HA при pH 7 невозможно. Фильтрация этой суспензии не может быть проведена, поскольку образовавшиеся на стадии инкубации «флотирующие вещества» делают фильтр непроницаемым. Эксперимент повторяют в 0,1M растворе цитрата (C6H5Na3O7.2H2O в воде MilliQ), отрегулированном до pH 6,2 при использовании C6H8O7.H2O, для образцов HS2, HS3 и HA. Однако результаты были такими же. Суспензии других продуктов легко фильтруются при каждом тестируемом pH. Для решения вопроса о растворимости гуминовой кислоты при pH 7 эксперимент повторяют при использовании только 0,02г образца вместо 0,15 г. Повторы делают только для образцов HS2, HS3 и HA. Все другие условия теста остаются такими же.
In vitro способность веществ, содержащих гуминовую кислоту, связывать микотоксин
Детали способа in vitro могут быть найдены во внутренней инструкции LB-IV-20/142-E2; Определение эффективности детоксикации микотоксина в «двух фазной процедуре» проводят в сочетании с анализом ВЭЖХ. Однако необходима модификация этой процедуры, поскольку леонардит, включенный в новый продукт - связывающее токсины вещество - сильно препятствует ВЭЖХ определению микотоксинов при инжекции супернатантов непосредственно в систему ВЭЖХ. Следовательно, на стадии очистки используют иммуноаффинную колонку (1AC, Vicam, USA) (более детально смотрите ниже).
Измеряют адсорбцию в кислой среде (pH 3,0), имитирующей pH желудка моногастричного животного, и десорбцию при pH, близком к нейтральному (pH 6,8), имитирующем условия pH в кишечнике моногастричного животного. Чистый процент эффективности детоксикации микотоксина определяют как процент адсорбции минус процент десорбции. При двукратном повторе аликвоты 0,1M раствора фосфата (отрегулированные до pH 3,0), содержащие 300 частей на миллиард зеараленона в растворе (10 мл), добавляют в 15 мл полипропиленовые пробирки Falcon с навинчивающейся крышкой, в которые был добавлен 0,05 грамм каждого адсорбента. Тестируемые пробирки помещают в орбитальный встряхиватель на 60 минут при комнатной температуре. Каждый тестируемый раствор микотоксина центрифугируют (5000-12000 g) в течение 10 минут с получением прозрачного раствора. Для анализа микотоксина (адсорбция) выделяют водный супернатант. Осадок ресуспендируют в 0,1M раствора фосфата при pH 6,8. Тестируемые пробирки снова помещают в орбитальный встряхиватель на 60 минут при комнатной температуре и затем центрифугируют. Водный супернатант анализируют на зеараленон (десорбция). После центрифугирования раствора при pH 3,0 и 6,8 проводят стадию промывки IAC. После удаления защитной жидкости из колонок IAC колонки промывают 8 мл раствора фосфатно-солевого буфера (PBS) с pH 7,4. Затем в колонку вводят 3 мл супернатанта. После этого колонку промывают 20 мл mQ воды и сушат при умеренном вакууме в течение нескольких секунд. Зеараленон элюируют 3 мл 2% (объем/объем) ледяной уксусной кислоты в метаноле (MeOH) в стеклянных пробирках. Весь элюат выпаривают досуха в слабом потоке N2 при температуре 60°C и повторно растворяют в 1,5 мл ацетонитрила/mQ воды 60/40 (объем/объем) перед проведением анализа ВЭЖХ. Концентрации зеараленона определяют при использовании обоих как ВЭЖХ (все образцы), так и ELISA (HS1, HS2, HS4, HS5). В качестве стандарта используют тестируемые буферные растворы зеараленона (pH 3,0 или 6,8) без адсорбентов.
Результаты
Определение содержания общих гуминовых кислот в различных образцах леонардита
Результаты анализа приведены в Таблице 8. Самое высокое содержание общих гуминовых кислот в образцах 2 и 5; образцы 1 и 4 показали средние уровни, в образце 3 самый низкий уровень.
Содержание общих гуминовых кислот в образцах леонардита (n=2)
Растворимость образцов леонардита при различных pH
Результаты извлеченных ретентатов при различных pH при использовании фосфатного раствора приведены в Таблице 9. Наивысшую растворимость во всех тестируемых значениях pH показал образец HS3. Ретентат гуминовой кислоты при pH 7 не может быть извлечен. При pH 7 он полностью растворился с образованием суспензии. Эта суспензия блокировала фильтры. Тест повторяют с HA, HS2, HS3 и раствором цитрата при pH 6,2; из Таблице 10 следует, результаты для HA такие же, как при использовании раствора цитрата. В Таблице 11 приведены результаты извлеченных ретентатов при использовании только 0,02 г HA, HS2, HS3 и фосфатного раствора. Ввиду более низкой концентрации не происходит блокирования фильтров и может быть рассчитан выход. Ясно, что гуминовая кислота показывает самую высокую растворимость при pH 7 по сравнению со всеми другими образцами. Это также подтверждается при визуальном осмотре образцов после выдержки. Из-за ошибки при отвешивании и извлечении малых количеств образца стандартные отклонения велики. Следовательно, предпочтительно использование 0,2 г образца.
Нерастворимая фракция леонардита, выраженная как мас.% от извлеченного ретентата (фосфат, n=3)
Нерастворимая фракция леонардита, выраженная как мас.% от извлеченного ретентата (цитрат, n=3)
Нерастворимая фракция леонардита, выраженная как мас.% от извлеченного ретентата (0,02 г образца, n=3)
In vitro способность леонардита связывать микотоксины
Краткое описание анализа in vitro адсорбции микотоксинов, проведенного при использовании ELISA, представлено в Таблице 12; при использовании ВЭЖХ в Таблице 13. Результаты показывают, что все продукты эффективно адсорбируют зеараленон при pH 3,0; HS3 имеет самую низкую адсорбцию. Значительные различия наблюдаются для десорбции при pH 6,8. Оба HS3 и HS4 показывают самую высокую степень десорбции по сравнению с другими образцами.
In vitro способность образцов леонардита связывать зеараленон, оцененная при использовании ELISA (n=4)
In vitro способность образцов леонардита связывать зеараленон, оцененная при использовании ВЭЖХ (n=3)
Пример 7
Материалы и Методы
План эксперимента
60 самок поросят-отъемышей (RongchangxDabai crossbred) со средней массой 9 кг случайным образом разделяют на 5 разных групп. 3 повтора для каждой группы с 4 поросятами на повтор. Пять групп представляют следующее: 1) негативный контроль (NC), 2) положительный контроль (PC), 3) Toxfin Supreme (TS)1, 4)TS2 и 5)TS3. Группе NC скармливают чистые базовые рационы (не загрязненные ZEA) без Toxfin Supreme; группе PC скармливают рационы, загрязненные ZEA (1 часть на миллион), без Toxfin Supreme; и группам TS1, TS2 и TS3 скармливают рационы, загрязненные ZEA (1 часть на миллион), с добавлением 1, 2 и 3 г/кг Toxfin Supreme, соответственно. Всех поросят содержат в напольных загонах и позволяют потреблять корм и воду без ограничений. Все поросята получают базовые рационы в течение одной недели перед началом исследования таким образом, что они могут адаптироваться к экспериментальным условиям.
Получение кормового продукта, загрязненного зеараленоном
Уровни нутриентов базовых рационов отвечают требованиям NRC (Таблица 14). Около 800 кг кукурузы хранят в комнате при температуре 28° при 70% относительной влажности в течение нескольких недель с получением заплесневелой кукурузы, содержащей около 3 мг/кг ZEA. При добавлении заплесневелой кукурузы для замены нормальной кукурузы в базовом рационе концентрация зеараленона во всех экспериментальных рационах составляет около 1 части на миллион (Таблица 14). Также базовые рационы содержат очень низкую концентрацию ZEA (около 65 частей на миллиард). Концентрацию ZEA пяти различных рационов определяют при использовании набора реактивов для определения зеараленона (Beacon Company).
План эксперимента и композиция рационов
Показатели роста
На 1 и на 42 день фиксируют массу тела и потребление кормового продукта для расчета среднедневного потребления кормового продукта (ADFI), среднедневного привеса (ADG) и коэффициента усвоения корма (FCR).
Тест на эффективность связывания зеараленона
ZEA измеряют в фекалиях, для этого общие фекалии каждой группы собирают и взвешивают на 21, 22, 23, 40, 41 и 42 дни.
После тщательной гомогенизации около 10% общих фекалий хранят при температуре -20°C для дальнейших анализов. В течение этого же периода фиксируют потребление кормового продукта каждой группой для расчета точного количества ZEA, потребленного поросятами. Эффективность связывания ZEA in vivo Toxfin Supreme выражают в процентах и рассчитывают как общее содержание зеараленона в фекалиях по сравнению с общим потреблением ZEA. Анализы ZEA проводят согласно инструкции набора для проведения анализа (Beacon Company).
Содержание β-эстрадиола в сыворотке
На 1, 21 и 42 дни берут три образца крови у каждой группы поросят из наружной хвостовой вены. Анализ сыворотки на β-эстрадиол проводят согласно инструкции набора для проведения анализа (Jiancheng Bio-technology Institute, Nanjing, China).
Измерение размера вульвы
Длину и ширину вульвы каждой свинки измеряют при использовании штангенциркуля с нониусом на 1, 21 и 42 день. Площадь вульвы рассчитывают согласно формуле: площадь=(длина x ширина/2).
Гистологический анализ
В конце эксперимента умерщвляют по 3 свинки из каждой группы. Сразу же удаляют яичники и матку и затем помещают их в растворе Боуина. Затем их парафинируют и разделяют на секции по 5 мкм. Наконец, секции окрашивают гематоксилином и эозином (H&E) и проводят подсчет фоликулярных и ацинусных клеток. Гистологическое исследование проводят при использовании световой микроскопии при участии лаборатории экспериментальной патологии (Department of Veterinary Sciences; Southwest University, Chongqing, China).
Статистический анализ
Данные обрабатывают с использованием теста вариаций гомогеничности Левина перед анализом выявления различий между группами. Данные подвергают однофакторному дисперсионному анализу (ANOVA) с последующим проведением теста Дункана при использовании SPSS 16.0. Различия считаются значительными при P<0,05.
Результаты
Показатели роста
Нет различий в ADFI и FCR свинок среди всех групп и по сравнению с негативной контрольной группой ADG свинок значительно ниже в PC группе (Таблица 15). Добавление Toxfin Supreme в рационы, загрязненные ZEA, при 1, 2 и 3 г/кг улучшает ADG всех свинок и возвращает их к ADG на уровне негативного контроля (Таблица 15). Toxfin Supreme не оказывает воздействия на ADFI и FCR, но помогает восстановление в ADG свинок, получающих рационы, загрязненные ZEA при всех трех концентрациях.
Показатели роста свинок, получающих различные рационы
(кг/день)
Примечание: показатели в одном ряду с разными буквенными индексами значительно отличаются (p<0,05)
In vivo Toxfin Supreme эффективность связывания ZEA
Собирают и анализируют образцы фекалий на присутствие ZEA. В натуральном кормовом продукте, загрязненном ZEA, около 35% ZEA может быть удалено в фекалии (Таблица 16). Toxfin Supreme значительно дозозависимо повышает связывающую способность в отношении ZEA, 64% в TSl, 77% в TS2 и 92% TS3 (Таблица 3).
In vivo эффективность Toxfin Supreme связывания зеараленона (%)
Концентрация β-эстрадиола
На 21 и 42 дни концентрация β-эстрадиола в сыворотке PC группы составляет около 52% и на 41% ниже, чем концентрация в NC группе (Таблица 17). Эти данные показывают, что ZEA значительно снижает секрецию эстрадиола у поросят-отъемышей. По сравнению с PC, концентрация β-эстрадиола в группе TSl, получавшей Toxfin Supreme (1 г/кг), повышена, но все еще ниже, чем таковая в NC группе (Таблица 17). Концентрация β-эстрадиола значительно повышена и достигает уровней NC в группах TS2 (2 г/кг) и TS3 (3 г/кг), получающих Toxfin Supreme (Таблица 4). Toxfin Supreme имеет более высокую эффективность в качестве вещества, связывающего ZEA, при повышенных дозах.
Концентрация β-эстрадиола в сыворотке поросят на 1, 21 и 42 день (нг/л)
Измерение размера вульвы
Размер вульвы каждой свинки измеряют на 1, 21 и 42 день. Размер вульвы в этом исследовании выражают в процентах и рассчитывают как соотношение размера вульвы на 1 и 21 день, и на 1 и 42 день в каждой группе. На оба и на 21, и на 42 день наблюдается увеличение размера вульвы в TS2 и TS3 группах, значительно меньше таковое в PC группе и TS1 группе. Размер вульвы в TS3 группе аналогичен таковому в NC группе (Таблица 18). Toxfin Supreme позволяет уменьшить ZEA индуцированное увеличение размера вульвы при дозировке 2, 3 г/кг (Таблица 18).
Соотношение площади вульвы у свинок, получающих рацион, загрязненный ZEA, между 1 и 21, 42 днями (%)
42,23a
64,35
62,06c
43,85b
54,37ab
47,04а
62,04с
47,93c
53,69hc
50,94ab
Гистологический анализ
Исследование образцов тканей яичников и матки проводят при использовании световой микроскопии, фиксируют относительное количество фоликулярных и ацинусных клеток для каждой группы (Таблица 19). Эти результаты показывают, что количество ацинусов значительно повышено в TS2 и TS3 группе по сравнению с таковым в PC группе. Toxfin Supreme в дозировке 2-3 г/кг снижает воздействие ZEA на развитие у свиней яичников и матки.
Относительное количество фоликулярных и ацинусных клеток в яичниках и матке свинок, получающих рационы, загрязненные зеараленоном (клетки/см2)
Комментарии
В этом эксперименте ~1 часть на миллион ZEA снижает ADG свинок, но нет значительного воздействия на ADFI и FCR. Считается, что адсорбенты микотоксинов оказывают негативное воздействие, снижая рост животных, поскольку адсорбент также может связывать определенные нутриенты, такие как витамины и минеральные вещества, что было показано при оценке in vitro (Tomasevic-Canovic M, Dakovic A, Markovic V. 2000. Adsorpton effects of mineral adsorbents; Part III: Adsorption behaviour in the presence of vitamin B6 and microelements. Acta Veterinaria, 50(l):23-30). В этом исследовании Toxfin Supreme не показал негативного воздействия на рост и даже продемонстрировал небольшое улучшение ADG у свинок. Концентрация минеральных веществ и витаминов может быть относительно достаточной в коммерческих кормовых продуктах, и дозы адсорбента, добавленного в кормовой продукт, очень малы.
Зеараленон хорошо известен как полный агонист рецепторов эстрогена из-за очень похожей химической структуры с эстрадиолом. Одна часть на миллион является причиной очевидных визуальных эффектов гиперэстрогенизма у самок поросят-отъемышей, таких как отек вульвы после 3-6 недель воздействия. Воздействие на ZEA прошедшими обработку рационами в течение 3-6 недель значительно снижает секрецию эстрадиола по сравнению с уровнями секреции у контрольных свинок. Концентрация эстрадиола в сыворотке восстанавливается до нормального уровня, когда в рационы, загрязненные зеараленоном, добавляют Toxfin Supreme в количестве 2, 3 г/кг кормового продукта. Как видно из этого эксперимента, около 75-90% потребляемого свинками зеараленона адсорбируется Toxfin Supreme (2-3 г/кг) и затем выводится с фекалиями. Вот почему Toxfin Supreme может помочь улучшить секрецию эстрадиола и может уменьшить ZEA-индуцированные клинические признаки, такие как покраснение и отек вульвы у свинок.
Пример 8
Материалы и Методы
Экспериментальные животные
Из коммерческого инкубатора получают двадцать четыре дневных бройлера обоего пола промышленного штамма (T44 x SA51). Каждого из них взвешивают и случайным образом распределяют в различные проволочные напольные клетки. Средняя начальная масса составляет 417,35±45,26 г (среднее 200 птиц) при комнатной температуре 20±5°C, естественном освещении и ручной вентиляции.
Получение кормового продукта. Животные получают коммерческий не лечебный, базовый рацион из кукурузно-соевой муки, содержащей в норме или с превышением уровня ключевых нутриентов, рекомендованные Национальным научно-исследовательским советом (National Research Council) (1994). Ингредиенты кормового продукта, используемые для составления контрольного рациона, не содержат определяемых уровней микотоксинов. Базовый контрольный рацион составляют согласно Таблице 20.
Ингредиенты кормового продукта, используемые для составления контрольного рациона. Процент композиции базового рациона (г/100 г)
Получение рациона
Связывающие вещества представляют коммерческие продукты от Kemin Europe N.V. под торговой маркой Toxfin (под кодом B1) и Toxfin Supreme (под кодом B2); Toxfin представляет смесь сепиолита и бентонита, а Toxfin Supreme представляет смесь леонардита и сепиолита. От Kemin Europe N.V получают четыре микотоксигенные грибковые культуры, содержащие афлатоксин B1 (под кодом AFB1), фумонизин B1(под кодом FB1), охратоксин A (под кодом OA) и T-2. Токсины вводят в базовый рацион, смешивая подходящие количества с 2 кг рациона, с последующим смешиванием с остальным базовым рационом в лопастном кормосмесителе с получением требуемых концентраций (Таблица 21). Для тестирования эффективности связывающих веществ в качестве диетотерапии от микотоксикозов в рацион, загрязненный микотоксином, добавляют 3000 частей на миллион B1, а в другой рацион добавляют 3000 частей на миллион B2 (Таблица 21). Связывающие вещества тщательно перетряхивают в течение 30 секунд вручную перед дозировкой в кормовой продукт и смешивают в подходящих количествах с 2 кг рациона, загрязненного микотоксином, с последующим смешиванием с остальным базовым рационом в лопастном кормосмесителе с получением требуемых лекарственных средств.
Образцы различных кормовых продуктов, загрязненных микотоксинами, анализируют перед началом исследования для проверки конечной концентрации OA при использовании ВЭЖХ в качестве индикатора гомогенности.
План эксперимента
Животных случайным образом распределяют по различным экспериментальным группам и помещают в 4 клетки (10 кур в клетке). Обработку повторяют пять раз. В клетках расположены индивидуальные боксы с водой и кормушкой. Птицы проходят акклиматизацию в клетках в течение 1 дня перед началом эксперимента по кормлению. Животных не ограничивают в доступе к корму и воде. Для каждой клетки ежедневно фиксируют потребление кормового продукта. В конце недели животных взвешивают (возраст птиц 28 дней) и затем умерщвляют при использовании CO2.
Уровни содержания в различных экспериментальных рационах микотоксинов и связывающих веществ
Сбор образцов фекалий
Бройлеры получают неограниченный доступ к контрольному рациону в течение 1 дня адаптации в клетках с последующим 3 дневным тестированием для каждого повтора. Каждые 5 дней периода тестирования состоят из 1 дня привыкания, 3 дней кормления экспериментальным рационом и 1 дня перевода; тестируемые рационы скармливают непрерывно в течение 3 дневного периода тестирования. После утреннего кормления в день перевода проводят сбор фекалий (около 400 г влажных фекалий на рацион) с пола из нержавеющей стали позади животных, хранят в пластиковых пакетах в холодильнике и отправляют в сертифицированную лабораторию для проведения анализа на микотоксины. Сразу же после получения в лаборатории влажные образцы подвергают лиофильной сушке.
Количественное определение микотоксинов в фекалиях.
Образцы фекалий бройлеров
Экскременты собирают, как описано выше в части плана эксперимента, и посылают в лабораторию в тот же самый день. Их взвешивают (389,9±69,1 г) и подвергают лиофильной сушке. Образцы повторно взвешивают для определения влаги, измельчают и перемешивают при использовании ступки и пестика. Все образцы замораживают и хранят при температуре -20°C до момента, когда они потребуются.
Устройства и реагенты
Ацетонитрил и метанол для ВЭЖХ получают от Lab-Scan (Dublin, Ireland), а уксусную кислоту для ВЭЖХ - от Merck (Darmstadt, Germany). Ультрачистую воду Milli-Q Plus apparatus - от Millipore (Milford, MA). Иммуноаффинные колонки RIDA для охратоксина A - от R-Biopharm AG (Glasgow, Scotland). Стандарты по афлатоксину B1; фумонизину B1 и охратоксину A - от Sigma (St. Louis, MO) и исходные растворы (0,01 мг/мл) получают в метаноле и хранят при температуре -21°C. Реагенты для буфера бикарбоната натрия pH 8,1 (0,13 M) и PBS фосфатно-солевого буфера pH 7,4 (20 мM) - от Panreac (Barcelona, Spain).
Система LC состоит из высокоэффективного жидкостного хроматографа Agilent Technologies 1100, соединенного с флуоресцентным детектором Agilent при: (1) 365 нм (возбуждение) и 455 нм (эмиссия) для афлатоксина B1; (2) 335 нм (возбуждение) и 440 нм (эмиссия) для фумонизина B1; (3) 333 нм (возбуждение) и 460 нм (эмиссия) для охратоксина A. LC колонка представляет Ace 5 C18, 250×4,6 мм, размер частиц 5 мкм (Advanced Chromatography Technologies, Aberdeen, Scotland). Изократическая подвижная фаза LC представляет: (1) дистиллированная вода, ацетонитрил и метанол (55:30:15 объем/объем/объем); скорость потока: 1,2 мл/минуту для афлатоксина B1; (2) дистиллированная вода, ацетонитрил и уксусная кислота (51:48:1 объем/объем/объем); скорость потока: 1,2 мл/минуту для охратоксина A; (3) дистиллированная вода, ацетонитрил и уксусная кислота (53:46:1 объем/объем/объем); скорость потока: 1,2 мл/минуту для фумонизина В1.
Анализ афлатоксина -B 1, охратоксина-A и фумонизина-B 1 в фекалиях бройлеров
Аналитический метод, используемый с некоторыми модификациями в этом исследовании, ранее был описан Arino et al., (2007). Кратко, (1) афлатоксины-B1:5 г фекалий бройлеров смешивают с 25 мл метанола 70%; (2) охратоксин-A:5 г фекалий бройлеров смешивают с 20 мл метанола 70%; (3) фумонизин-B1:10 г фекалий бройлеров смешивают с 20 мл метанола 75% при использовании гомогенизатора в течение 15 минут. Экстракт центрифугируют при 3500 оборотов в минуту в течение 15 минут и фильтруют при использовании Whatman n°1. Фильтраты афлатоксина и охратоксина очищают при использовании иммуноаффинной колонки RIDA. Иммуноаффинную очистку проводят согласно инструкциям производителя: уравновешивают 2 мл PBS/метанол (90/10), экстракт образца пропускают через колонку медленно и непрерывно, промывают колонку 10 мл PBS/метанол (90/10) и элюируют 2 мл метанола. Элюаты различных токсинов собирают в непрозрачную емкость. Элюаты выпаривают досуха в устройстве для нагревания в слабом потоке азота и повторно растворяют в метанол:дистиллированная вода:уксусная кислота, (30:69:1 объем/объем/объем).
Фильтрат фумонизина элюируют в SPE вакуумном коллекторе (SAX 500 мг). Картриджи сначала кондиционируют 5 мл метанола 75%, затем 5 мл дистиллированной воды при скорости потока 1 мл/минуту перед загрузкой 10 мл раствора образца при скорости потока 0,8 мл/минуту. Затем картриджи промывают метанолом 75% с последующей промывкой метанолом 100%. Удерживаемый в картридже фумонизин элюируют в пробирках темного стекла, содержащих уксусная кислота:метанол (1:99 объем/объем), и элюат выпаривают досуха в устройстве для нагревания в слабом потоке азота и повторно растворяют в растворах для инжекции (ацетонитрил: дистиллированная вода: уксусная кислота, 46:53:1, объем/объем/объем).
Аликвоты по 20 мкл афлатоксина и фумонизина и аликвоты по 100 мкл охратоксина инжектируют в систему LC-FLD. Идентичность охратоксина химически подтверждают образованием метилового эфира согласно Li et al. (1998). Идентичность афлатоксина и фумонизина химически подтверждают согласно UNE-EN 14123 и UNE-EN 13585. Метод анализа проверяют по внутренним стандартам на точность и выход. Средний выход и относительное отклонение от стандарта (RSDr, повторяемость), полученные при использовании описанного способа, составляют 84% для OA; 75% для AFB 1 и 90,6% для FB1, (RSD 5%, 5%, 3,8%, соответственно). Технические показатели в приемлемых пределах указаны в регулирующем документе комиссии (Commission Regulation) № 401/2006 (EC, 2006). Исследование чувствительности к афлалотокину, охратоксину и фумонизину указывают, что пределы количественной оценки (LOQ) составляют: 0,2 нг/г; 2 нг/г и 200 нг/г, соответственно.
Анализ фекалий бройлеров на токсин T-2
Анализ на токсин T-2 проводят при использовании технологии ELISA (Ridascreen®). 5г фекалий бройлеров смешивают с 25 мл метанола 70% и гомогенизируют (магнитная мешалка) в течение 10 минут. Экстракт центрифугируют при 3500 оборотах в минуту в течение 15 минут и фильтруют при использовании Whatman n°1. Общие объемы 50 мкл экстракта разводят 950 мкл PBS буфера. Образцы и стандарты используют согласно инструкциям производителя. Измерение проводят фотометрически при 450 нм и пределы определения составляют <5 частей на миллиард (около 3,5 мкг/кг).
Статистический анализ
Все данные анализируют при использовании ANOVA с процедурой SPSS (SPSS version 15.0; 2006). К среднему по рациону со значительными отклонениями применяют критерии множественных сравнений Тьюки. Коэффициент корреляции Пирсона рассчитывают, исходя из переменных показателей. Все статистические различия базируются на уровне статистической значимости при p<0,05.
Результаты
Клинические эффекты
На 1 день экскременты всех птиц имеют нормальную консистенцию. Это условие начинает изменяться до наступления 3 дня за исключением контрольной партии, когда экскременты становятся липкими и адгезируются на проволочной сетке клетки, настиле в клетке и вокруг птиц. Ранее сообщалось, что это связанно с диареей, вызванной токсичностью фумонизина после 4-13 дней потребления загрязненного кормового продукта. Сообщалось о липких экскрементах у бройлеров, получающих кукурузу, загрязненную Fusarium; снижение усвояемости сухих веществ рациона и диарея связаны с этим феноменом. В настоящем исследовании приведены данные, качественно описывающие консистенцию фекалий, при этом содержание влаги в фекалиях на 3 день незначительно отличается от других рационов (p>0,05) (Таблица 22). Эти показатели считаются нормальными. Не наблюдается смертности, вызванной этими рационами.
Содержание влаги в фекалиях бройлеров, получавших различные рационы в течение 3 дней
Показатели представляют x SD пяти групп из 10 бройлеров на рацион.
Каждый показатель представляет среднее пяти определений.
Потребление и привес. Начальная и конечная масса птиц, получавших экспериментальные рационы, приведены в Таблице 23. Отсутствуют статистически значимые различия в массе тела. Однако конечная масса птиц и потребление кормового продукта при скармливании рациона с T2 (кормовой продукт, загрязненный микотоксином) были соответственно на 2% и 1% меньше, чем таковые у контрольной партии (p>0,05). Наоборот, птицы, получавшие связывающие вещества, показали более высокую конечную массу тела и потребление кормового продукта по сравнению с контрольной партией (p>0,05).
Воздействие экспериментальных рационов на массу тела и общее потребление кормового продукта бройлерами, потреблявшими их в течение 3 дней
3 дня)
53,84
65,5
45,75
58,7
43,23
53,9
39,25
68,5
Показатели представляют x±SD пяти групп из 10 бройлеров на рацион.
1Изменение=процент изменения массы тела относительно контроля
Микотоксины в экскрементах
В Таблице 24 показаны различия в концентрации токсинов в экскрементах птиц после 3 дней скармливания экспериментальных рационов. Результаты показывают, что концентрация афлатоксина B1 в экскрементах птиц, получавших B1, составляет на 66% выше (p<0,05), чем у птиц, потреблявших рацион T2. Концентрация афлатоксина B1 в экскрементах птиц, получавших B2, составляет на 26% выше (p<0,05), чем у птиц, потреблявших рацион T2. Концентрация фумонизина B1 в экскрементах птиц, получавших B1 и B2, соответственно, составляет на 52% и 8% выше по сравнению с птицами, потреблявшими рацион T2. Хотя точный механизм действия связывающих веществ (B1 и B2) неизвестен, авторы настоящего изобретения считают, что связывающие вещества могут частично улавливать молекулы афлатоксина и фумонизина в матрице, предотвращая адсорбцию части афлатоксина и фумонизина желудочно-кишечным трактом. Таким образом, одновременное введение B1 и B2 вместе с пулом микотоксинов показало адсорбцию AFB1 и FBI, и таким образом, ограничение биодоступности AFB1 и FBI и повышение выведения у птиц. Однако связывающие вещества не оказали воздействия на выведение охратоксина A и токсина T-2 после 3 дней потребления рационов. До сих пор не сообщалось о сорбенте, способном снизить воздействие токсина T-2 и токсическое воздействие OA (Kubena et al., 1990; Huff, W. E., L. F. Kubena, R. B. Harvey, and T.D. Phillips. Efficacy of hydrated sodium calcium aluminosilicate to reduce the individual and combined toxicity of aflatoxin and ochratoxin A. Poult. Sci. 71; 64-69. 1992; Bailey, R. H., L. F. Kubena, R. B. Harvey, S. A. (1998). Buckley, and G. E. Rottinghaus. Efficacy of various; sorbents to reduce the toxicity of aflatoxin and T-2 toxin; in broiler chickens. Poult. Sci. 77:1623-1630; Garcia, A.R.; Avila, E.; Rosiles, R.; Petrone, V.M. (2003). Evaluation of two mycotoxin binders to reduce toxicity of broiler diets containing Ochratoxin A and T-2 toxin Contaminated Grain. Avian Diseases 47:691-699).
В предпринятых попытках противодействовать микотоксинам были предложены новые связывающие продукты (Hoerr, F.J., W. W. Carlton, J. Tuite, R. F. Vesonder, W.K. Rohwedder, and G. Szigeti. Experimental thricothecene mycotoxicosis produced in broiler chickens by Fusarium sporotrichiella var. sporotrichioides. Avian Pathol. 11:385-405. 1982; Devegowda, G., and M. V. L. N. Raju. Influence of esterified-glucomannan on performance and organ morphology, serum biochemistry and haematology in broilers exposed to individual and combined mycotoxicosis (aflatoxin, ochratoxin and T-2 toxin). Br. Poult. Sci. 41:640-650. 2000); однако они не были должным образом исследованы, поскольку большую часть из них оценивали только in vitro, что не обеспечивает достоверной информации об активности сорбента в полевых условиях. Это должно рассматриваться не только как процесс оценки адсорбента, но также и как источника микотоксина, поскольку основные оценки приведены для чистого микотоксина, добавленного в кормовой продукт. В реальных условиях загрязнение зерна включает в себя множество других метаболитов, подавляющая часть из которых не установлена, которые оказывают сильное воздействие на птиц. Различные исследования подчеркивают различия, наблюдаемые в токсическом воздействии на птиц, получавших рационы, загрязненные чистым микотоксином, и таковых, получавших рационы, загрязненные микотоксигенными грибковыми культурами (Hoerr et al., 1982; Rotter, R. G., A. A. Frohlich, R. R. Marquardt, and D. Abramson. Comparison of the effects of toxin-free and toxin containing mold contaminated barley on chick performance. Can. J. Anim. Sci. 69:247-259. 1989). Однако в настоящее время использование адсорбентов, связывающих микотоксины, - наиболее применимый путь защиты животных от вредного воздействия деконтаминированного кормового продукта. До настоящего времени отсутствует единый адсорбент, протестированный на эффективность против большинства типов микотоксинов. Однако добавление различных адсорбентов в кормовые продукты для животных обеспечивает универсальный инструмент для предотвращения микотоксикозов.
Концентрация микотоксина в фекалиях, определенная при использовании ВЭЖХ1 после 3 дней потребления экспериментальных рационов, (результаты приведены, как нг/г прошедших лиофильную сушку фекалий)
Показатели с различными индексами значительно отличаются.
1ВЭЖХ используют для определения микотоксинов за исключением T-2, который подтверждают при использовании ELISA
2BLD означает ниже определяемых пределов
Заключение
Результаты, полученные в настоящем исследовании, указывают, что на потребление кормового продукта не сказалось включения рационов, загрязненных микотоксином (p>0.05), после трех дней потребления.
Добавление связывающих веществ не оказывает воздействия на потребление кормового продукта и прирост.
B1 и B2, введенные одновременно с пулом микотоксинов, показали эффективную адсорбцию AFBl и FBI, ограничивая, таким образом, биодоступность AFBl и FBI и повышая выведение у птиц.
Пример 9
Материалы и методы
Животные и кормление
Согласно плану эксперимента 60 молодых свинок (Topigs) содержат в отдельных загонах рядом друг с другом в одном и том же помещении группами по 15 животных. Молодые свинки получают кормовой продукт и воду без ограничений. Ингредиенты композиции приведены в Таблице 25.
Композиция рационов, используемых для определения воздействия адсорбентов на токсикозы, вызванные зеараленоном у препубертатных молодых свинок
(частей на миллион)
При сложении процентов не всегда получают 100%, поскольку не все компоненты определены.
Чистый токсин и коммерчески доступные адсорбенты под торговой маркой Toxfin (под кодом NT) и Toxfin Supreme (под кодом ET) от Kemin Europe N.V.; Toxfin представляет смесь бентонита и сепиолита, а Toxfin Supreme представляет смесь сепиолита и леонардита, минералоиды с высоким содержанием гуминовых веществ. Их включают в экспериментально загрязненный рацион с получением в результате продукта с концентрацией ZEA около 1 части на миллион. Контрольный рацион содержит 0,02 частей на миллион ZEA (из сырьевых материалов) и любой адсорбент (Таблица 25). Рационы ZEA+NT и ZEA+ET содержат около 1 части на миллион ZEA и 3000 частей на миллион NT и ET, соответственно. Молодые свинки получают различные рационы в течение 6 недель. В течение всего исследования фиксируют общее потребление кормового продукта. Расчет проводят, исходя из данных по продуктивности, среднедневному привесу (кг/день), среднедневному потреблению кормового продукта (кг/день) и эффективность использования кормов (прирост/потребление кормового продукта), зафиксированных в течение всего периода тестирования.
Определение зеараленона в кормовом продукте
Для определения зеараленона в образцах кормового продукта используют разрешенный метод AOAC при использовании ВЭЖХ и TLC (Scott, P. M., T. Panalalrs, S. Kanhcre and W. F. Miles. 1978. Определение зеараленона в кукурузных хлопьях и других пищевых продуктах на основе кукурузы проводят при использовании тонкослойной хроматографии, хроматографии с масс-спектрометрией высокого разрешения. l.AOAC 61593). Для расчета показателей зеараленона оценивают двухкратные определения 10 различных смесей кормового продукта.
Клиническая оценка
Еженедельно проводят осмотр всех препубертатных молодых свинок на признаки гиперэстрогенизма. Оценивают отек, покраснение и увеличение размеров вульвы, вызванные эстрогеновой стимуляцией при использовании субъективной 5 бальной шкалы (1=наименьшая стимуляция; 5 = наибольшая стимуляция).
Все участвующие в тестировании молодые свинки были практически здоровы без признаков клинических инфекций. Частота дыхания и сердечного сокращения в норме. Молочные железы, вульва, слизистая, фекалии и моча в норме.
При использовании серологического теста у поросят устанавливают отсутствие всех основных для поросят патогенов за исключением цирковируса. Результаты в этом исследовании не приведены, но они имеются на ферме, с которой взяты поросята.
Образцы крови
Кровь у поросят берут из наружной хвостовой вены, собирая ее в пробирку, содержащую EDTA антикоагулянт для гематологии, и в другую пробирку без EDTA - для биохимического анализа.
Сбор крови проводят на 0,3-ью и 6-ую неделю одновременно со взвешиванием животных. Анализы проводят непосредственно после сбора крови. Фракцию крови, собранную в сухую пробирку, центрифугируют при 2000 g в течение 15 минут при комнатной температуре. Полученную сыворотку перемещают в пробирки Эппендорфа и используют для определения некоторых биологических параметров. Анализ крови и рутинные гематологические анализы проводят при использовании автоматизированного гемометра с адаптированным разведением. Определение ферментативной активности проводят при двукратном повторе, и результаты приведены в международных единицах/литр (МЕ/л).
Эстрадиол-17-β (E2)
Концентрацию эстрадиола-17-β (E2) определяют при использовании конкурентного твердофазного иммуноферментного анализа с хемилюминесцентной детекцией (Immullite ®). Твердая фаза (гранулы) покрыта поликлональным кроличьим антителом к эстрадиолу, разрешенным к использованию. Реагент содержит щелочную фосфатазу (из желудка теленка), коньюгированную с эстрадиолом. Коньюгат фермента с эстрадиолом конкурирует с эстрадиолом в образце за сайты связывания антитела на гранулах. Избыток образца и реагента удаляют центробежным промыванием. Наконец, к гранулам добавляют хемилюминисцентный субстрат, и генерируется сигнал пропорционально связанному ферменту. Результаты приведены в пг/мл, и аналитическая чувствительность составляет 15 пг/мл.
Образцы мочи и фекалий
Шесть животных из каждого загона помещают в индивидуальные камеры для исследования метаболизма при комнатной температуре 27±2°C на 20 календарных дней; 1 неделя для адаптации к камерам и 4 недели (4 дня в неделю) для ежедневных записей потребления и сбора фекалий и мочи. За 12 часов до конца животных по очереди удаляют из трех из камер и возвращают в загоны. Образцы собирают ежедневно. Сбор фекалий и мочи составляет около 10% от общего выделения из организма. Образцы замораживают и отправляют в лабораторию для определения присутствия метаболитов ZEA.
Убой
Через 3 недели потребления рационов 5 поросят из загона с каждым тестируемым рационом забивают в тот же самый день на одной и той же бойне, расположенной менее чем в 50 км от фермы по процедуре коммерческого забоя и согласно Европейским стандартам. Животных усыпляют CO2 и затем умерщвляют. Удаляют матку, почки и печень и взвешивают. Около 25 г свежей печени и почек помещают в пробирки с формалином. Непосредственно после умерщвления извлекают репродуктивные органы, проводят осмотр и помещают их по отдельности в раствор фосфатно-солевого буфера (PBS, Sigma-Aldrich, Madrid) во избежание высыхания структуры для последующей оценки. Около 5 мл желчи каждого забитого животного собирают в пробирку для анализа концентрации для лучшего понимания деградации ZEA. Пробирки с желчью направляют в лабораторию в холодильной камере. Все образцы хранят и транспортируют в разные лаборатории в холодильных камерах. Через 6 недель всех оставшихся животных забивают и проводят забор образцов в тех же условиях, как указано выше. Туши изымают и уничтожают их соответствующим образом.
Исследование на гистопатологию
Выбранные органы (печень, почки, яичники и матку) каждой самки обследуют на наличие тяжелых пороков. Органы взвешивают и измеряют. Проводят оценку макроскопических, микроскопических и морфометрических аспектов. Выбранные ткани и все тяжелые нарушения фиксируют в 10% нейтральном забуференном формалине, парафинируют и разделяют на секции по 3-5 мкм, окрашивают гематоксилином и эозином, и исследуют при использовании световой микроскопии. Гистопатологическое исследование фиксированных тканей проведено в университетской лаборатории патологии.
Данные анализов
Проводят двухфакторный дисперсионный анализ параметров крови, массы яичников, яйцеводов, шейки матки, рога матки и вагины, размеров яичников, яйцеводов, шейки матки, рога матки. Факторами или независимыми переменными, рассматривающимися в этом анализе, являются получаемые рационы (четыре уровня: без добавления ZEA, с добавлением 1 части на миллион ZEA, с добавлением 1 части на миллион ZEA+3000 частей на миллион NT и с добавлением 1 части на миллион ZEA+3000 частей на миллион ET) и время (два уровня: время потребления 3 и 6 недель). Получаемый рацион х время потребления используют для определения, оказывает ли время значительное воздействие на токсикозные эффекты зеараленон/адсорбенты. Различия между получаемыми рационами и временем потребления анализируют при использовании t-теста Стъюдента. Тест хи-квадрат используют для измерения взаимосвязи между категориальными переменными в этом исследовании. Все статистические анализы проводят при использовании SPSS (Statistical Package for the Social Science for Windows, version 15.0,2006).
Результаты
Привес, потребление кормового продукта и эффективность использования кормов для животных
Среднее и стандартное отклонение оценки массы молодых свинок
Краткое описание признаков продуктивности различных партий
потребление кормового продукта, кг/г)
Ни зеараленон, ни адсорбенты не оказывают воздействия на привес молодых свинок (Таблица 26). Нет различий ни в потреблении кормового продукта, ни в эффективности использования корма (Таблица 27). Нет различий среди получавших ZEA молодых свинок по оральному потреблению ZEA. Эти данные подтверждают выводы James and Smith(James, L.J.; Smith, Т.К. (1982). Effect of dietary alfalfa on Zearalenone toxicity and metabolism in rats and swine. Journal of Animal Science, 55:110-118), которые отметили, что у свиней ZEA не оказывает значительного воздействия на показатели роста.
Клинический эффект
После 3 недельного потребления экспериментальных рационов показатели по вульве повышены. Рационы, загрязненные ZEA, приводят к возрастанию оценок по вульве по сравнению с контролем (Фигура 1). Увеличение значительно повышается в следующем порядке: ZEA≥ZEA+NT>ZEA+ET≥CON. После 6 недель потребления рационов эффекты значительно выраженнее, чем таковые, наблюдаемые через 3 недели (Таблица 28). Результаты показывают, что ET и NT не уменьшают все клинические эффекты ZEA, ET адсорбент был более эффективным.
Среднее и стандартное отклонение размера вульвы молодых свинок после 6 недель потребления различных рационов
Результаты анализа крови
Предположительно метаболизм ZEA по существу происходит в печени, приводя к образованию α и β- зеараленола, последний не токсичен.
Среднее и стандартное отклонение параметров крови на 0 день
мм3)
Для того чтобы получить общее представление о токсикологии зеараленона, после 3 и 6 недель потребления рационов проводят исследование в основном на токсичность для печени, почек и репродуктивных органов и другое возможное негативное влияние на ферменты крови или биологические маркеры.
Не наблюдается различий в параметрах крови животных на начало исследования, что указывает на одинаковое состояние здоровья животных в различных партиях (Таблица 29).
Однако ALP и AST активность во всех партиях была выше стандартного показателя (ALP≤300 МЕ/л; AST≤80 МЕ/л). GGT активность незначительно отличается по рационам, но молодые свинки, получающие адсорбент, имеют более высокие показатели (p<0,05).
В Таблице 30 показано воздействие рационов на гематологические параметры у препубертатных молодых свинок после 3 недель потребления рационов с ZEA адсорбентами. У молодых свинок, получавших рационы с ZEA и ZEA+NT, ALP активность значительно ниже, чем у контроля и партий, получавших ZEA+ET. Также из Таблицы 30 видно, что у препубертатных свиней, получающих адсорбент, более высокая GGT активность по сравнению с таковыми, не получавшими его. Не было обнаружено различий по другим параметрам крови между партиями.
Среднее и стандартное отклонение образцов крови после 3 недель потребления различных рационов
(3 недели)
мм3)
NS=незначимо.
†ALP: щелочная фосфатаза; GGT: γ-глутамилтрансфераза; ALT: аланинаминотрансфераза; AST: аспартатаминотрансфераза.
После 6 недель потребления рационов ALP активность значительно выше (p<0,05) у контрольной партии (Таблица 31). GGT активность незначительно отличается между партиями, но препубертатные свиньи, получавшие адсорбент, вновь продемонстрировали более высокие показатели. Различия ALP и GGT между группами и в группах, обнаруженные между 3 и 6 неделями, предположительно могут быть вызваны биологическими изменениями, связанными с восстановлением после стресса.
Среднее и стандартное отклонение образцов крови после 6 недель потребления различных рационов
мм3)
В случае, когда концентрация ZEA в кормовом продукте составляет 1 часть на миллион, в проводимом эксперименте после 6 недель потребления рационов не обнаружено воздействия на функцию печени и параметры крови.
Из Таблицы 31 видно, что на 6 неделю наблюдаются различия (p<0,05) в концентрации β-17-эстрадиола в плазме (E2). Порядок партий по концентрациям от высокой к низкой E2: CON=ZEA+ET>ZEA=ZEA+NT. Эти результаты подтверждают, что ET эффективно связывается с зеараленоном, и средняя концентрация эстрадиола в плазме аналогична таковой в контрольной группе, показывающей базовые уровни эндогенного эстрадиола; для препубертатных молодых свинок его поддерживают добавлением ET после 6 недель потребления рационов. Аналогичные изменения концентрации E2 в плазме обнаружены во всех партиях (Фигура 2). Наблюдался подъем E2 на 3 неделе и возвращение к базовым уровням на 6 неделе. Наблюдается небольшое повышение концентрации E2 в плазме для CON и ZEA+ET, не отличающееся от (p>0,05) базовых уровней, в то время как она отличается для ZEA и ZEA+NT из-за значительного снижения E2 на 6 неделе. Результаты показывают, что зеараленон в рационе во время пубертатной фазы у молодых свинок изменяет гормональный профиль. Действительно, созревание гипоталамо-гипофизарной чувствительности к эстрадиолу завершается способностью увеличивать продуцирование преовуляторного LH, что имеет место в течение препубертатного периода. Гипоталамо-гипофизарный блок демонстрирует чувствительность к эстрогенам задолго до полового созревания. Например, уже в возрасте 40 дней LH повышен в сыворотке после бензоата эстрадиола (EB), но профиль имел множество малых подъемов, которые были не синхронны и имели более низкую интенсивность проявления, чем у молодых свинок в возрасте 160 дней (Fleming, M. W. and R. A. Dailey. 1985. Longitudinal study of the surge of gonadotropins induced by exogenous hormones in prepuberal gilts. Endocrinology 116:1893). Dial et al. (Dial, G.D., O.K.Dial, R.S. Wkinson and P.J.Dziuk. 1984. Endocrine and ovulatory response of the gilt to exogenous gonadotropins and estradiol during sexual maturation. Biol. Reprod. 30:289) сообщалось, что в возрасте 175 дней единственный подъем LH аналогичен таковому у зрелых свиней в ответ на EB, но в более молодом возрасте результаты аналогичны таковым у Dailey (1985) reported that by 175 days of age, a single surge in LH similar to that of a mature sow occurred in response to EB, but at younger ages results were similar to those of Fleming and Dailey (1985). Поскольку зеараленон оказывает воздействие на некоторые ткани-мишени эстрогена, воздействие зеараленона в препубертатный период потенциально может изменить механизм чувствительности к эстрогену, вовлеченный в созревание гипоталамуса и базовую концентрацию E2 в плазме.
Воздействие времени потребления рациона на параметры крови для различных партий
В Таблице 32 показано воздействие рациона на параметры крови и ферменты печени в партии. Несмотря на то, что количество лейкоцитов находится в контрольном интервале с начала до 3 недели, было обнаружено очень значительное их снижение (p 0,001). После 6 недель потребления рационов количество лейкоцитов находится ниже контрольного предела для всех партий (p<0,001) ввиду тяжелой лимфоцитопении (данные не показаны). Предположительно разрушение лимфоцитов вызвано инфецирующими агентами, но у животных не наблюдалось других признаков заболеваний. Кроме того, была обнаружена нейтрофилия (данные не показаны), что предполагает признаки стресса. Активность ALP не изменилась ни в одной из партий в течение 6 недель и во всех партиях наблюдается высокий уровень активности ALP, что указывает на одинаковый уровень стресса. AST и GGT остаются высокими во всех группах животных в течение 3 недель (нет значительных различий; p>0,05), но оба значительно понижены к 6 неделе (p<0,05). Hong Yu et al., (Hong Yu, VMD; En-dong Bao, PhD; Ru-qian Zhao, PhD; Qiong-xia Lv, VMD. (2007). Effect of transportation stress on heat shock protein 70 concentration and mRNA expression in heart and kidney tissues and serum enzyme activities and hormone concentrations of pigs. November 2007, Vol. 68, No. 11, страницы 1145-1150) сообщается о наблюдении, что тяжелый стресс у свиней может проявляться в повышении активности AST в сыворотке.
Анатомические и патологические нарушения
Из Таблицы 33 видно, что рационы, загрязненные ZEA, приводят к повышению массы вагины (p<0,05) после 3 недель потребления. Партии, получавшие рационы с NT и ET, имеют аналогичные данные по массе вагины ZEA группе. Kurtz et al., (Kurtz. H. J., M. E. Naim, G. H. Nelson, С M. Christensen and C. J. Mirocha. 1969. Histologic changes in the genital tracts of swine fed estrogenic mycotoxin. Am. J. Vet. Res. 30551) сообщается о наблюдении метаплазии эпителия шейки матки и вагины у 6 недельных препубертатных молодых свинок, потреблявших ZEA (1 мг/день на животное в течение 8 дней), что может объяснить результаты настоящего исследования. Также наблюдается, что 20% молодых свинок, получающих рационы с ZEA, имеют фолликулы размером >6 мм и гипопластические яичники (Фигура 5). Предположительно эстрогеновая стимуляция ZEA была настолько сильной, что даже гипопластический яичник ответил на воздействие ZEA. У остальных партий отсутствуют фолликулы размером >6 мм и не обнаружены гипопластические яичники. Партии, получавшие рационы с ZEA и NT, имеют самый высокий процент гипопластических яичников (p>0,05) (Таблица 36). Следует отметить, что гипопластические и овулированные яичники наблюдались только у некоторых молодых свинок из партий, получавших ZEA (25%).
После 6 недель потребления результаты по патологии значительно различаются между партиями. Эти различия представляют следующее (Таблица 34):
• Масса яйцевода: ZEA≥ZEA+NT≈ZEA+ET>CON
• Масса и размер рога матки: ZEA=ZEA+NT≥ZEA+ET>CON
• Масса шейки матки: ZEA+ET≥ZEA+NT≥ZEA≥CON
• Масса вагины: ZEA=ZEA+NT>ZEA+ET>CON
• Размер вагины: ZEA=CON=ZEA+NT>ZEA+ET
• Масса репродуктивных органов (яйцевод-шейка матки): ZEA=ZEA+NT≈ZEA+ET>CON.
Также было обнаружено, что масса органов отличается: это были незначительные различия между партиями, получавшими ZEA, ZEA+NT и ZEA+ET, но все они были значительно выше контрольной партии. Эти результаты демонстрируют, что включение ZEA в рацион вызывает избыточный рост репродуктивного органа после 6 недель потребления (p<0,01). Тем не менее добавление ET в рацион показывает самую низкую массу репродуктивных органов для рационов с ZEA. В Таблице 34 показаны симптомы гиперэстрогенизма, вызванные воздействием ZEA на 6 неделе. Под воздействием ZEA различные репродуктивные органы увеличены и имеют более высокую массу. В большинстве случаев прирост массы в партиях, получавших рационы с ZEA и NT, значительно отличаются от контроля и молодых свинок, получавших рационы с ET. Как ожидалось, молодые свинки, получавшие рацион с ZEA, продемонстрировали самые высокие показатели, а контрольная партия показала самые низкие. NT и ET обеспечивают частичное снижение токсического воздействия ZEA. Дополнительно, 20% молодых свинок получавших рацион с ZEA; молодых свинок, получавших рацион с 22% NT, и 10% молодых свинок, получавших рацион с ET, имеют фолликулы размером >6 мм и рост гипопластических яичников (Фигура 5), что не обнаружено в случае контроля.
В Таблице 37 показаны гистопатологические нарушения различных органов после 6 недель потребления рационов. Все молодые свинки, получавшие рационы с ET, имеют пиелит (60% средний и 40% тяжелый), и это значительно выше (p<0,05), чем у других групп животных. Нарушения печени, такие как интерстициальный гепатит, и увеличение соединительной ткани были значительно ниже у контрольной партии (p<0,05), что демонстрирует токсическое воздействие на печень потребления рационов с ZEA. Добавление NT и ET не минимизирует гепатотоксичность. Также был выявлен высокий процент случаев мононуклеарного холангиогепатита у молодых свинок во всех партиях (Таблица 37), включая контрольную группу. Ввиду высокой активности ALP в течение исследования, холангиогепатит может быть результатом длительного стрессового воздействия.
В Таблице 35 показано воздействие времени потребления рациона на структуру репродуктивных органов в партиях. Во всех партиях установлено значительное повышение массы репродуктивных органов. Повышение в контрольной партии указывает на физиологический рост. Наблюдаемый рост структуры и увеличение репродуктивных органов аналогичны для партий, получающих рационы с ZEA и NT - и отличается для партий, получающих рационы с ZEA+ET и контрольных партий. Партии, получающие рацион с ET, и контрольные партии демонстрируют очень похожий, практически аналогичный рост во время исследования. Эти данные демонстрируют, что ET ослабляет симптомы гиперэстрогенизма более эффективно, чем NT.
Другой наблюдаемый эффект состоит в количестве яичников с фолликулами с размером ≤6 мм. После умерщвления все яичники осматривают, и данные записывают и классифицируют их по размеру фолликул, как маленькие/средние (≤6 мм) и большие (>6 мм). На Фигуре 3 показан низкий процент яичников с маленькими фолликулами на 3 неделе и значительное повышение на 6 неделе за исключением группы, получавшей рацион с ET. Процент яичников с маленькими фолликулами незначительно отличается на одной и той же неделе (p>0,05). На Фигуре 4 показано, что большие фолликулы обнаружены у партии, получавшей ZEA, и отсутствует у остальных после 3 недель потребления рационов. После 6 недель потребления рационов большие фолликулы обнаружены во всех группах. Самое низкое количество обнаружено в контроле и партиях, получавших рационы с ET. В целом, не наблюдается значительных различий (p>0,05). Вероятно, что любое увеличение числа или размера фолликул, индуцированное ZEA, маскируется эндогенным продуцированием, поскольку молодые свинки приближаются к периоду полового созревания. Молодые свинки этого возраста и массы имеют препубертатную скорость роста яичников и фолликулов, но он никогда не заканчивается созреванием и большими фолликулами (>6 мм) или процессом овуляции. Фолликулы размером >6 мм и овулированные яичники не ожидаются в возрасте экспериментальных молодых свинок, эстрогенная активность ZEA может способствовать этим нарушениям, а также объясняет множество нарушений, обнаруженных в яйцеводе и яичниках. После 3 недель потребления у партий, получавших ZEA, зарегистрировано 20% случаев больших фолликул (>6 мм) и ни одного случая у остальных (Фигура 5). После 6 недель большие фолликулы наблюдаются во всех партиях. У контрольной партии и партии, получавшей ET, зарегистрировано самое меньшее количество случаев (p<0,05). Гиперактивность яичников (размер фолликул >6 мм и гипопластические яичники) повышен в течение исследования во всех партиях, за исключением контроля. Получавшие ET показали самый низкий объем (p<0,05), что предполагает снижение ET гиперактивности яичников, индуцированной ZEA.
Среднее и стандартное отклонение измерений структуры репродуктивных органов. Результаты получены после 3 недель потребления различных рационов
(3 недели)
Среднее и стандартное отклонение измерений структуры репродуктивных органов. Результаты получены после 6 недель потребления различных рационов
(6 недель)
1,7bc
2,87bc
Воздействие времени потребления рационов на структуру репродуктивных органов для различных партий
Гистопатология репродуктивных органов, почек и печени после 3 недель потребления различных рационов. Результаты приведены в процентах от животных
Гистопатология репродуктивных органов, почек и печени после 6 недель потребления различных рационов. Результаты приведены в процентах от животных
NS=незначимо; *(p<0,05); ***(p<0,01); (p>0,05)
Заключение
Концентрация в кормовом продукте зеараленона 1 часть на миллион и адсорбентов 3000 частей на миллион не ухудшает и не улучшает признаки продуктивности после 6 недель потребления рационов, не оказывает воздействия на ферментативную функцию печени или параметры крови. Не установлено, что ET адсорбент эффективнее NT адсорбента для снижения видимых эффектов гиперэстрогенизма (опухание-отек и увеличение размеров вульвы) в период с 3 недели по 6 неделю. Гистологические исследования показали, что гиперактивность яичников (гипопластические яичники и большой размер фолликул) указывают на то, что воздействие зеараленона может быть значительно снижено добавлением в рацион животного ET адсорбента, и что ET адсорбент способствует нормальной гипоталамо-гипофизарной чувствительности к эстрогену, состоящей в том, что концентрация E2 в плазме остается постоянной (базовые уровни).
Кратко, концентрация ZEA 1 часть на миллион подтверждает многоорганную токсичность у препубертатных молодых свинок после 6 недель потребления, и ET обеспечивают частичное снижение токсического воздействия этого микотоксина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ БЕТА-ЦЕОЛИТА В КАЧЕСТВЕ ВЕЩЕСТВА, СВЯЗЫВАЮЩЕГО МУЛЬТИТОКСИНЫ В КОРМЕ ДЛЯ ЖИВОТНЫХ | 2015 |
|
RU2670917C9 |
| ПРЕПАРАТ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ МИКОТОКСИКОЗОВ МЕЛКОГО РОГАТОГО СКОТА | 2015 |
|
RU2614996C1 |
| Кормовая добавка для профилактики микотоксикозов сельскохозяйственной птицы | 2023 |
|
RU2815881C1 |
| Способ производства влажных консервированных травянистых кормов для животных с использованием кормовой добавки Reasil Humic | 2022 |
|
RU2797367C1 |
| Способ производства влажных консервированных травянистых кормов для животных с использованием кормовой добавки Reasil® Humic | 2022 |
|
RU2806162C1 |
| Влажный консервированный корм для непродуктивных животных | 2023 |
|
RU2808129C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОЙ ДОБАВКИ ДЛЯ ПРОФИЛАКТИКИ МИКОТОКСИКОЗОВ У ЖИВОТНЫХ И ПТИЦЫ | 2012 |
|
RU2502319C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ПРОИЗВОДСТВА МОЛОКА У МОЛОЧНОГО СКОТА И КОРМОВОЙ РАЦИОН | 2015 |
|
RU2715624C2 |
| Кормовая добавка для сельскохозяйственной птицы, обладающая адаптогенным действием | 2019 |
|
RU2705781C1 |
| Способ получения лечебной сыворотки для терапии микотоксикозов животных | 2023 |
|
RU2804773C1 |
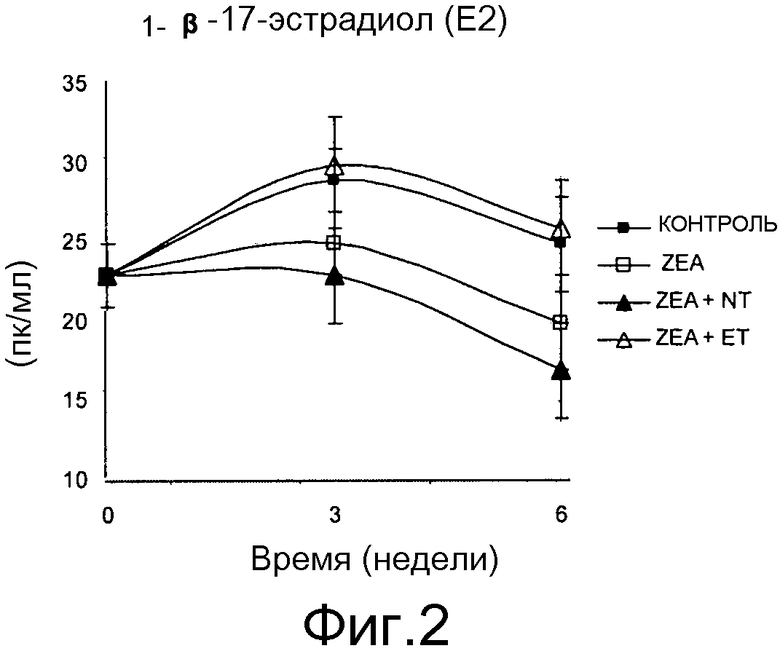
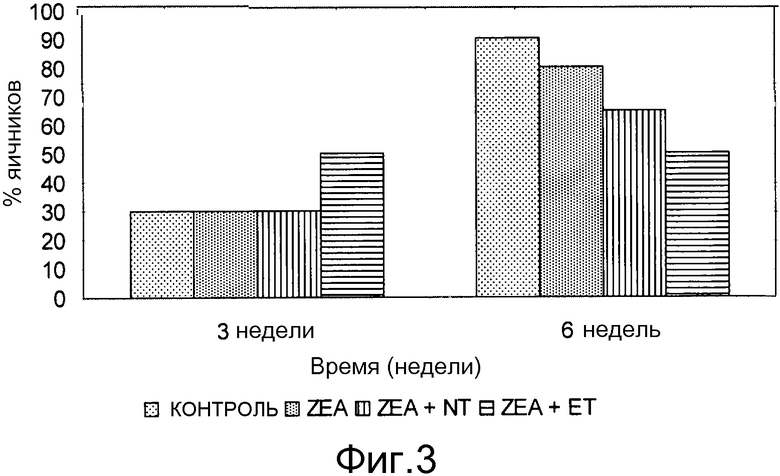
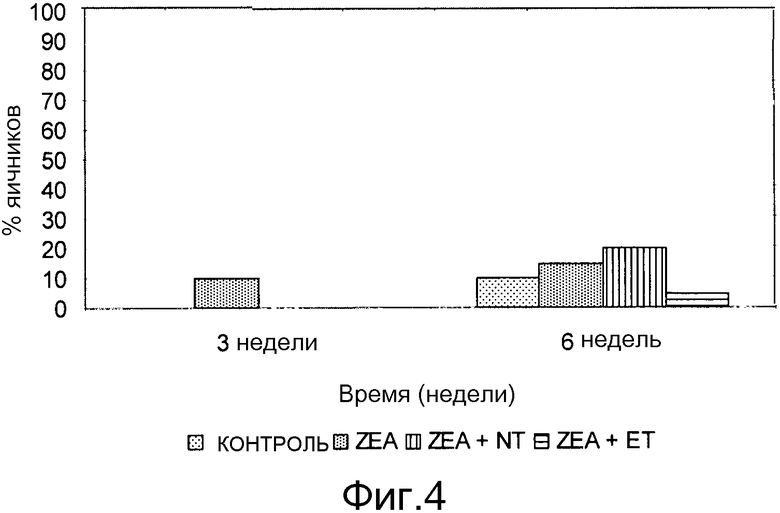
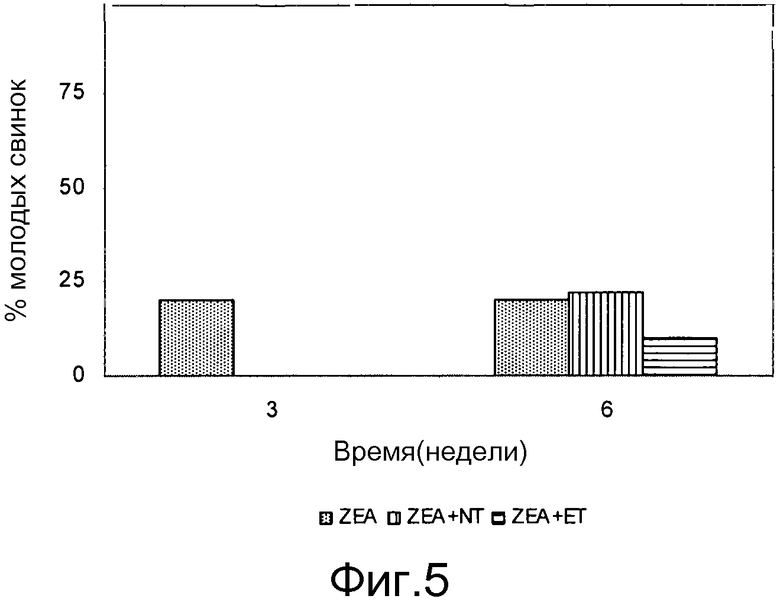
Изобретение относится к веществу, связывающему микотоксины в кормовых продуктах. Вещество включает гуминовые вещества, содержащие 45% или более гуминовой кислоты, комбинированные с адсорбентом, с максимальной растворимостью 20% при pH в пределах от 1,5 до 7,0. Адсорбция при биологическом pH желудка моногастричных животных составляет, по меньшей мере, 80% и десорбция при нейтральном рН не более чем 10%. Эффективность связывания зеараленона in vitro составляет, по меньшей мере, 80% и предпочтительно 90%. 3 з.п. ф-лы, 5 ил., 37 табл., 9 пр.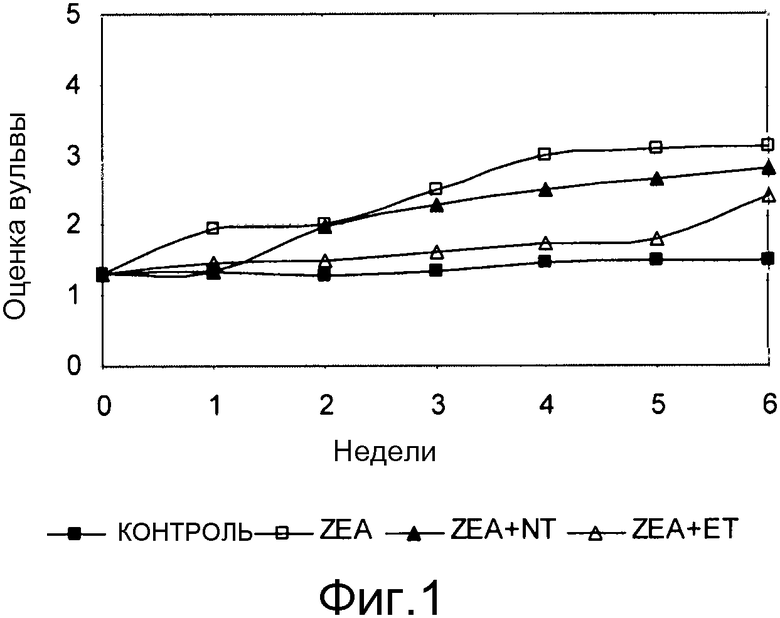
1. Вещество, связывающее микотоксины для кормовых продуктов для животных, включающее гуминовые вещества, включающие 45% или более гуминовой кислоты, комбинированные с адсорбентом, с максимальной растворимостью 20% при pH в пределах от 1,5 до 7,0 и in vitro эффективностью связывания зеараленона по меньшей мере 80% и предпочтительно 90% с адсорбцией при биологическом pH желудка моногастричных животных по меньшей мере 80% и десорбцией при нейтральном pH не более чем 10%.
2. Вещество, связывающее микотоксины, по п.1, дополнительно включающее источник ионов металла, оксидов или глиняных минералов.
3. Вещество, связывающее микотоксины, по п.2, где гуминовые вещества включают в пределах от 10% до 90% связывающего вещества.
4. Вещество, связывающее микотоксины, по п.1, где источник гуминовых веществ включает леонардит.
| Sabater-Vilar M | |||
| et al "In vitro assessment of adsorbents aiming to prevent deoxynivalenol and zearalenone mycotoxicoses", Mycopathologia, 2007, vol | |||
| Деревянное стыковое устройство | 1920 |
|
SU163A1 |
| Горный компас | 0 |
|
SU81A1 |
| Jansen van Rensburg C | |||
| et al "In Vitro and In Vivo Assessment of Humic Acid as an Aflatoxin Binder in Broiler Chickens", Poultry Science, 2006, vol | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| Цоколь для электрической лампы с нарезкой Эдисона, препятствующей вывинчиванию лампы | 1924 |
|
SU1576A1 |
| US 20080008763 A1, 10.01.2008 | |||
Авторы
Даты
2014-11-27—Публикация
2011-05-17—Подача