Область техники
Изобретение относится к области фармакологии и медицины, а именно, к применению соединения - производных пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-онов формулы (I) для комплексной антикоагулянтной терапии за счет дуального ингибирования факторов свертывания крови Ха и XIa.
Уровень техники
Лидирующая причина смертности в современном мире - заболевания сердечнососудистой системы, в первую очередь связанные с тромбозами. При большом количестве физиологических и патологических ситуаций - включая травмы и ожоги, хирургические операции и беременность, инфекционные заболевания (особенно, вирусная пневмония, вызванная COVID-19), инфаркты, ишемические инсульты - тромбозы играют центральную роль в патогенезе. Несмотря на большой прогресс в этой области, все существующие антитромботические препараты не до конца предотвращают риски тромбозов, но при этом все повышают риски кровоизлияний. Поэтому в настоящее время крайне актуальны разработка и внедрение в клиническую практику новых эффективных и безопасных ингибиторов свертывания крови. Один из ключевых шагов в разработке таких лекарственных препаратов - это выбор правильной мишени.
Конкретные механизмы тромбообразования могут отличаться, но активация каскада свертывания крови является ключевым звеном в любых из них. Факторы свертывания Ха и (особенно) XIa рассматриваются как важные потенциальные мишени для разработки новых высокоэффективных антикоагулянтов, которые будут иметь низкие риски с точки зрения кровотечений. Если для фактора Ха в настоящее время одобренные к применению препараты существуют (хотя и обладают существенными недостатками), то для фактора XIa эта задача пока до конца не решена. Предполагается, что такие препараты будут эффективны при широком круге тромботических нарушений, включая артериальные.
Система свертывания крови играет важную роль в норме и патологии. Несмотря на то, что в этой системе уже 30 лет не открывали новых молекул, за это время произошел переворот в представлениях о том, как она работает и какие из ферментов должны стать оптимальными мишенями для терапии.
Фактор Ха (FXa) играет решающую роль в свертывании крови и гемостазе, функционируя как незаменимый компонент ферментативного пути, ведущего к образованию тромбина [Mann K.G. Thrombin formation / K.G. Mann // Chest. - 2005. - Vol. 124. - P. 48-108. Blood coagulation factor X deficiency causes partial embryonic lethality and fatal neonatal bleeding in mice / Dewerchin M. [et al.] // Thromb Haemost. - 2000. - Vol. 83: - P. 185-190.]. Он является единственным известным активатором протромбина, и было показано, что его сборка в протромбиназный комплекс приводит к усилению образования тромбина примерно в 500 ООО раз [Nesheim М.Е., Taswell J.В., Mann K.G. The contribution of bovine factor V and factor Va to the activity of prothrombinase / M.E Nesheim, J.B. Taswell, K.G. Mann II J Biol Chem. - 1979. - Vol. 254. - P. 10952-10962]. Учитывая его ключевую роль, фактор Ха представляет значительный интерес для усилий по разработке лекарств, направленных на подавление тромбоза. Антикоагулянтная терапия десятилетиями состояла только из антагонистов витамина К, таких как варфарин, кроме него в настоящее время используются прямой ингибитор тромбина дабигатран и прямые ингибиторы фактора Ха ривароксабан, апиксабан и эдоксабан. Первым терапевтическим средством, нацеленным в первую очередь на фактор Ха, был фондапаринукс (торговое наименование Арикстра) - непрямой парентеральный ингибитор FXa.
Фактор XIa (FXIa) является зимогеном фермента сериновой протеазы во внутреннем пути свертывания крови и является важным фактором в создании стабильного фибринового сгустка. Несмотря на то, что при нормальных физиологических условиях вклад фактора XIa в нормальный гемостаз минимален, активация этого фактора играет важную роль в развитии тромботических осложнений. На основании фундаментальных и эпидемиологических исследований, а также клинических наблюдений, сформировалось мнение, что фактор XIa следует рассматривать как главную и наиболее перспективную мишень для разработки антикоагулянтных лекарств со сниженным риском кровотечений [Bane С.Е., Gailani D. Factor XI as a target for antithrombotic therapy / C.E. Bane, D. Gailani // Drug Discov. Today. - 2014. - Vol. 19. - P. 1454-1458. Factor XIa inhibitors: a review of the patent literature / R.A. Al-Horani, U.R. Desai // Expert. Opin. Ther. Pat. - 2016. - Vol. 26. - P. 323-345].
Структура факторов свертывания Ха и XIa во многом определяет особенности взаимодействия с ними ингибиторов, специфичность этих взаимодействий и структуру наиболее перспективных и активных ингибиторов.
Существует более десяти химических классов прямых ингибиторов фактора Ха; идентифицировано более 20 различных структурных мотивов как Р1, так и Р4, встречающихся в составе данных ингибиторов, детально описанных в обзорах [Contemporary developments in the discovery of selective factor Xa inhibitors: A review / N.R. Patel, D.V. Patel, P.R. Murumkar, M.R. Yadav // Eur J Med Chem. - 2016. - Vol. 121. - P. 671-98. Компьютерный дизайн низкомолекулярных ингибиторов факторов системы свертывания крови / А.С. Кабанкин, Е.И. Синауридзе, Е.Н. Липец, Ф.И. Атауллаханов // Биохимия. - 2019. - Т. 84. - С. 191-211]. Кроме того, пять соединений с избирательной активностью против фактора Ха используются в клинической практике для лечения патологий, связанных с повышенным тромбообразованием. С химической точки зрения, все существующие на сегодняшний день ингибиторы фактора Ха, исключая антагонисты витамина К, действующие непрямым и неселективным образом на данный фактор свертывания, можно условно разделить на три группы. Первая группа: ингибиторы полисахаридной природы, опосредующие инактивацию фактора Ха с участием антитромбина III (например, фондапаринукс и гепарин). Высокая молекулярная масса этих ингибиторов исключает возможность перорального способа их приема. Вторая группа: основные ингибиторы - соединения с активностью против фактора Ха (например, соединения на основе амидина), которые содержат основные группы, заряжающиеся положительно при нейтральном рН. Заряженные молекулы этих ингибиторов обладают низкой липофильностью, что сказывается на их биодоступности. Третья группа: слабо основные и неосновные ингибиторы - все остальные соединения с ингибирующей активностью в отношении фактора Ха, а также все пероральные ингибиторы фактора Ха, одобренные к медицинскому использованию. Такая классификация отражает исторические аспекты разработки стратегий ингибирования фактора Ха. Первые агенты, селективно влияющие на активность фактора Ха, были получены за счет ферментативного расщепления гепарина и представляли собой небольшие полисахариды [Fondaparinux, а synthetic pentasaccharide: the first in a new class of antithrombotic agents - the selective factor Xa inhibitors / K.A. Bauer [et al.] // Cardiovasc Drug Rev. - 2002. - Vol. 20. - P. 37-52]. Механизм действия этих веществ заключается в их способности связываться с антитромбином III и изменять конформацию этого белка таким образом, что аффинитет антитромбина III к фактору Ха многократно увеличивается. Антитромбин, в свою очередь, с усиленным сродством к фактору Ха связывается в окрестности активного центра этого белка, блокируя его протромбиназную функцию. Таким образом, полисахаридные ингибиторы фактора Ха не являются прямыми ингибиторами данной мишени, однако благодаря клинической эффективности их до сих пор используют в медицине, например, при остром тромбозе глубоких вен. Разработку обратимых низкомолекулярных ингибиторов сильно ускорило появление в 1994 году первых кристаллических структур фактора Ха [Contemporary developments in the discovery of selective factor Xa inhibitors: A review / N.R. Patel, D.V. Patel, P.R. Murumkar, M.R. Yadav // Eur J Med Chem. - 2016. - Vol. 121. - P. 671-98]. Первые стратегии прямого ингибирования фактора Ха с помощью низкомолекулярных соединений базировались на использовании производных амидина, положительно заряженных при рН 7,4 и взаимодействующих с отрицательно заряженным остатком Asp189 кармана S1. Однако из-за низкой биодоступности исследователям пришлось отказаться от использования таких сильноосновных функциональных групп, как амидин, и сфокусироваться на слабоосновных и неосновных Р1-мотивах. Новые нейтральные при физиологическом значении рН Р1-мотивы разрабатывались с учетом их 71-взаимодействия с остатком Tyr228 кармана S1. В большинстве прямых ингибиторов фактора Ха это взаимодействие достигается за счет использования галоген- или метокси-монозамещенных ароматических систем в качестве Р1-мотива; Р4-мотивы большинства ингибиторов также представлены моно- или ди-замещенными ароматическими системами (чаще производными бензола), которые в некоторых случаях связаны с неароматическими гетероциклами. Однако есть примеры ингибиторов, у которых Р4-мотив не содержит какой-либо π-системы, например, соединение GW813893 [Antithrombotic potential of GW813893: а novel, orally active, active-site directed factor Xa inhibitor / Abboud Melanie A. M.A. [et al.] // Journal of Cardiovascular Pharmacology. - 2008. - Vol. 52(1). - P. 66-71]. Как отмечено выше, существует большое разнообразие скаффолдов, которые могут быть использованы вместе для объединения Р1- и Р4-мотивов с целью успешного ингибирования фактора Ха. Важная особенность любого из ранее обнаруженных скаффолдов - их способность придавать молекуле ингибитора V- или L-образную форму, что при связывании способствует такой пространственной ориентации, при которой ингибитор занимает оба кармана активного центра фактора Ха. Кроме того, часто встречаемые скаффолды ингибиторов фактора Ха содержат доноры и/или акцепторы водородной связи для взаимодействия с остатками Gly216 и Gly218. Фактор Ха представляет собой витамин К-зависимую сериновую протеазу, состоящую из двух цепей - тяжелой и легкой, связанных между собой дисульфидными связями. Тяжелая цепь состоит из 303 аминокислотных остатков, а легкая - из 139. Каталитическая триада фактора Ха состоит из Ser195, His57, Asp102 и образует структуру наподобие β-бочки, схожую со структурой трипсина [Structure of Human Des(1-45) Factor Xa at 2•2 A Resolution / K. Padmanabhan, P [et al.] // J Mol Biol. - 1993. - Vol. 232. - P. 947-66].
Предполагается, что ингибиторы активированного фактора XIa (FXIa) будут сочетать антикоагулянтный и профибринолитический эффекты с низким риском кровотечения. Низкомолекулярные ингибиторы FXIa не прошли еще всех необходимых доклинических и клинических испытаний и не получили разрешение для использования при лечении людей, однако разработки ингибиторов FXIa ведутся. По данным PDB (Protein Data Bank), существует более 70 кристаллических структур FXIa, большинство из них содержит каталитический домен или легкую цепь. Лиганды каталитического домена - это пептиды, ковалентные и нековалентные соединения и др. Структура FXIa состоит из двух β-листов, двух спиральных областей, нескольких петель и сходна с другими трипсиноподобными сериновыми протеазами [Factor XIa Inhibitors as New Anticoagulants / M.L. Quan [et al.] // J Med Chem. - 2018. - Vol. 61. - P. 7425-47]. Единственный глубокий карман в активном сайте FXIa - это S1. В основании кармана находится Asp189; сам карман представлен β-цепями и петлями, которые заканчиваются дисульфидным мостиком между Cys191-Cys219 в верхней части кармана. Карман S2 FXIa расположен рядом с His57 и ограничен Tyr58B; карманы S3 и S4 очень малы. Карман S1' - это область, противоположная каталитической триаде Asp102, His57 и Ser195, рядом с другим дисульфидным мостиком, образованным Cys40-Cys58. Карман S2' содержит β-цепь, в которую входят остатки Arg39, His40 и Leu41, а также остатки Ile151 и Tyr143, где часто наблюдаются полярные взаимодействия [Factor XIa Inhibitors as New Anticoagulants / M.L. Quan [et al.] // J Med Chem. - 2018. - Vol. 61. - P. 7425-47]. В основном кристаллические структуры комплексов трипсиноподобных сериновых протеаз показывают, что лиганды фиксируются в глубоком кармане S1 и распространяются в разные карманы в зависимости от сериновой протеазы. Комплексы FXIa содержат лиганды, которые всегда связаны в кармане S1; однако ингибиторы FXIa связываются в разных карманах в зависимости от хемотипа, простираясь от кармана S1 до его ближайших окрестностей, включая карманы S1', S2 и S2'. Многие существующие низкомолекулярные ингибиторы FXIa занимают три кармана - S1, S1', S2'. Карман S1 представляет собой четко определенную полость; карманы S1', S2' - открытые поверхности. Лиганды во всех исследованных экспериментальных структурах из PDB заполняют именно эти карманы. Исследование структур из PDB показало, что практически все лиганды состоят из трех фрагментов (например, BMS-962212 [Discovery of a Parenteral Small Molecule Coagulation Factor XIa Inhibitor Clinical Candidate (BMS-962212) / D.J.P. Pinto [et al.] // J Med Chem. - 2017. - Vol. 60. - P. 9703-23]). Лиганды можно условно разделить на «левый» конец, содержащий преимущественно ароматические кольца с хлорным заместителем, центральный фенилаланиноподобный фрагмент и «правый» конец, также с ароматическими кольцами и атомами кислорода в качестве заместителей. В эксперименте левый конец всегда занимает гидрофобный карман S1. Центральный фенилаланиноподобный фрагмент, присутствующий в большинстве экспериментальных ингибиторов и связанный с остальными и фрагментами лиганда пептидными мостиками, заполняет гидрофобный карман S1'; правый конец помещается в карманы S2', образуя водородные связи с белком. В экспериментальных структурах, помимо нейтральных концевых фрагментов ингибиторов, концевые заряженные фрагменты попадают также в карман S1, - например, с группами COO-, NH4+. Итак, оставляя в стороне ковалентные ингибиторы, необходимость и безопасность использования которых не до конца понятны, можно сказать, что представленные низкомолекулярные соединения находятся на стадии улучшения пероральной биодоступности или доклинических испытаний на животных, за исключением ингибитора FXIa - BMS-962212 [Discovery of a Parenteral Small Molecule Coagulation Factor XIa Inhibitor Clinical Candidate (BMS-962212) / D.J.P. Pinto [et al.] //J Med Chem. - 2017. - Vol. 60. - P. 9703-23], который прошел первую фазу клинических исследований.
С учетом рассмотренных выше аспектов строения активных центров факторов Ха и XIa можно резюмировать, что активный центр фактора XIa имеет большее число карманов, чем протеазный центр фактора Ха, пространственное расположение трех карманов в активном центре фактора XIa требует использования Y-образной формы разрабатываемого ингибитора, в то время как эффективное ингибирование фактора Ха может быть достигнуто при использовании более линейных вариантов низкомолекулярных соединений, способных формировать L-подобные формы. Помимо числа карманов, важное отличие между активными центрами фактора Ха и фактора XIa - различие в сродстве к определенным фрагментам ингибиторов. Так, например, в активном центре фактора XIa имеется положительно заряженный остаток Arg37, что позволяет использовать отрицательно заряженные группы в составе Р2'-мотива для увеличения сродства фактора XIa к ингибитору. Напротив, поверхность активного центра фактора Ха за пределами кармана S1, с которой может связываться низкомолекулярный лиганд, лишена заряженных остатков и сформирована по большей части кластером гидрофобных аминокислот (Phe174, Trp215, Tyr99) [Современные методы разработки новых лекарственных средств, влияющих на систему гемостаза / А.В. Сулимов [и др.] // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. - 2019. - Т. 18 (4). - С. 136-152].
Заявляемое изобретение основано на использовании соединений - гидрированных производных пирроло [3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-онов, которые продемонстрировали дуальное ингибирование факторов Ха и XIa, и могут быть рекомендованы для использования в качестве антикоагулянтов прямого действия.
Из уровня техники известны соединения, представляющие собой производные тетрагидрохинолина, проявляющие ингибирующую активность по отношению к факторам Ха [New factor Ха inhibitors based on 1,2,3,4-tetrahydroquinoline developed by molecular modeling /I. Ilin [et al.] // J. Mol. Graph. Model. - 2019. - Vol. 89. - P. 215-224; Innovative Three-Step Microwave-Promoted Synthesis of N-Propargyltetrahydroquinoline and 1,2,3-Triazole Derivatives as a Potential Factor Xa (FXa) Inhibitors: Drug Design, Synthesis, and Biological Evaluation / F. Santana-Romo [et al.] // Molecules. - 2020. - Vol. 25. - P. 491] и XIa [Tetrahydroquinoline Derivatives as Potent and Selective Factor XIa Inhibitors / M.L. Quan [et al.] // J. Med. Chem. - 2014. - Vol. 57. - P. 955-969; Factor XIa Inhibitors as New Anticoagulants / M.L. Quan [et al.] // J. Med. Chem. - 2018. - Vol. 61 - P. 7425-7447], пирролидин-2-она - к фактору Xa [Structure and property based design of factor Xa inhibitors: Pyrrolidin-2-ones with biary1 P4 motifs / R.J. Young [et al.] // Bioorg. Med. Chem. Lett. - 2008. - Vol. 18. - P. 23-27], роданина - фактору VIII [Rational design of small molecules targeting the C2 domain of coagulation factor VIII / G.A.F. Nicolaes [et al.] // Blood. - 2014. - Vol. 123. - P. 113-120]. Введение роданинового фрагмента в состав ближайшего негидрированного аналога продукта гибридизации производных тетрагидрохинолина и пирролидин-2-она позволяет получить ингибиторы фактора Ха (IC50 ~ 1μМ) [Application of Molecular Modeling to Development of New Factor Xa Inhibitors / V.B. Sulimov [et al.] // BioMed Res. Intern. - 2015. - Article ID 120802. - 15 pages]. Биоизостерная замена является одной из наиболее важных стратегий структурной оптимизации соединений-лидеров при разработке новых лекарственных средств. В частности, введение в молекулу атомов галогена может существенно улучшить фармакокинетику, липофильность и, в целом, биологическую активность. С другой стороны атомы галогенов также являются предпочтительными структурными фрагментами антикоагулянтов, вследствие электроноакцепторных свойств. [Yin Y.; Sasaki S.; Taniguchi Y. Effects of 8-halo-7-deaza-2'-deoxyguanosine triphosphate on DNA synthesis by DNA polymerases and cell proliferation / Y. Yin, S. Sasaki, Y. Taniguchi // Bioorg. Med. Chem. - 2016. - Vol. 24. - P. 3856-3861; Design, synthesis and structural exploration of novel fluorinated dabigatran derivatives as direct thrombin inhibitors / M. L. Li, Y. J. Ren, M. H. Dong, W. X. Ren // Eur. J. Med. Chem. - 2015. - Vol. 96. - P. 122-138; Progress of thrombus formation and research on the structure-activity relationship for antithrombotic drugs / X. Li [et al.] // Eur. J. Med. Chem. - 2022. - Vol. 228. - 114035; Halogen-enriched fragment libraries as chemical probes for harnessing halogen bonding in fragment-based lead discovery / M.O. Zimmermann [et al.] // Future Med. Chem. - 2014. - Vol. 6. - P. 617-639]. Селективную ингибирующую активность проявляют описанные производные 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1,2-дионов: по отношению к факторам Ха [Synthesis, docking, and anticoagulant activity of new factor-Xa inhibitors in a series of pyrrolo [3,2,1-ij]quinoline-1,2-diones // S.M. Medvedeva [et al.] // Pharm. Chem. J. - 2018. - Vol. 51. - P. 975-979] и XII [New Blood Coagulation Factor XIIa Inhibitors: Molecular Modeling, Synthesis, and Experimental Confirmation / A. Tashchilova [et al.] // Molecules. - 2022. - Vol. 27. - 1234]. При этом ни в одном из представленных примеров гетероциклические соединения не проявляют дуального ингибирования факторов Ха и XIa.
Наиболее близкими к заявляемому (прототипом) является применение (Z)-5-(8-R1-4,4-диметил-2-оксо-6-((4-R2-пиперазин-1-ил)метил)-2,4-дигидро-1H-пирроло[3,2,1-ij]хинолин-1-илиден)-2-тиоксотиазолидин-4-онов и (Z)-5-(6-(((гет)тио)метил)-8R1-4,4-диметил-2-оксо-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-онов [Новичихина Н.П. Синтез и свойства новых гетероциклических систем на основе 4,4,6-триметил-4н-пирроло[3,2,1-ij]хинолин-1,2-дионов: дис. канд. хим. наук: 1.4.3. Органическая химия / Н.П. Новичихина. - Воронеж, 2022. - 173 с] для дуального ингибирования факторов свертываемости крови Ха и Х1а при концентрации соединений 30 μМ. Однако необходимо отметить, что наличие в 6 положении пирроло [3,2,1-ij]хинолинового цикла прототипа дополнительного гетероциклического фрагмента увеличивает количество стадий синтеза этих соединений, что показывает, что соединения общей формулы I более легкодоступны.
В качестве референсного образца был выбран Ривароксабан, используемый в настоящее время в антикоагулянтной терапии. Соединения формулы (I) существенно превосходят Ривароксабан по эффективности дуального ингибирования факторов Ха и XIa.
Технической проблемой, решаемой заявляемым изобретением, является поиск соединений для проведения комплексной антикоагулянтной терапии, характеризующихся высокой эффективностью за счет дуального ингибирования факторов свертывания крови Ха и XIa.
Раскрытие изобретения
Техническим результатом является расширение арсенала ингибиторов факторов свертывания крови Ха и XIa применением гидрированных производных пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-онов, характеризующихся высокой эффективностью дуального ингибирования факторов свертывания крови Ха и XIa - до 99% ингибирования по каждому из факторов одновременно при концентрации соединений формулы I 30 μМ, а также являющихся более легкодоступными и полученными упрощенной методикой при сокращении времени синтеза.
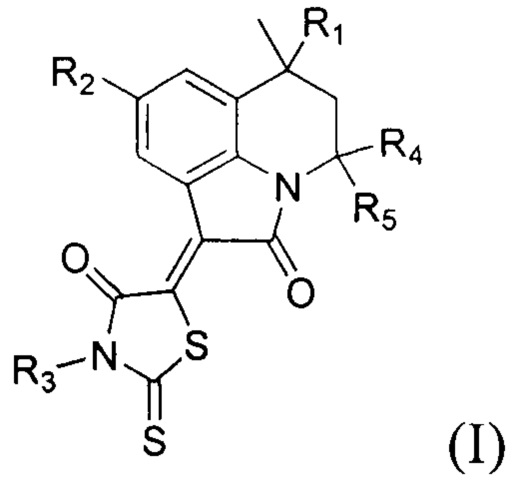
Технический результат достигается применением гидрированных производных пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-онов общей формулы (I):
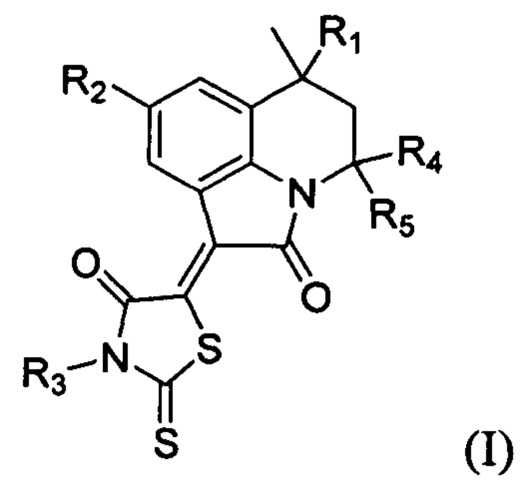
где R1 представляют собой заместитель, выбранный из водорода; алкила (С1-С2); арила без заместителей или замещенного на галоген по положению 4;
R2 представляет собой заместитель, выбранный из водорода; галогена; алкила (С1-С2); алкоксильной группы (С1-С2); ароилокси без заместителя или замещенного по положениям 2,3,4,5,6;
R3 представляет собой заместитель, выбранный из водорода; или алкила (С1-С2);
R4 представляет собой метил,
R 5 представляет собой метил,
или
R4+R5=(СН2)n, где n представляет собой целые числа 4, 5, 6,
в качестве ингибиторов факторы свертывания крови Ха и XIa.
Предпочтительно, когда R1 представляет собой заместитель, выбранный из водорода, метила, фенила, 4-хлорфенила; R2 представляет собой заместитель, выбранный из водорода, брома, йода, фтора, метила, метокси-, бензоилокси-, 2-метоксибензоилокси-, 3,4,5-триметоксибензоилокси-; R3 представляет собой заместитель, выбранный из водорода, этила; при этом R4 представляет собой заместитель, выбранный из метила; R5 представляет собой заместитель, выбранный из метила или R4+R5=(СН2)n, где n представляет собой целые числа, выбранные из 4, 5, 6.
Заявляемое изобретение расширяет арсенал средств для проведения антикоагулянтной терапии.
Осуществление изобретения
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
IC50 - концентрация полумаксимального ингибирования белка-мишени в экспериментах с флюорогенным субстратом в тестовой системе белок-субстрат-ингибитор.
Отобранные соединения эффективно ингибируют факторы свертывания крови Ха и XIa.
Далее представлено более подробное описание примеров осуществления данного изобретения с достижением заявленного результата. Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Все используемые реагенты являются коммерчески доступными, контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), и время реакции указано только для иллюстрации; структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 F254 Merck), масс-спектрометрия или ядерный магнитный резонанс (NMR). Выход продукта приведен только для иллюстрации. 1Н NMR спектры были зарегистрированы на спектрометре Agilent MR 400+ (на рабочей частоте 400 MHz) при нормальных условиях в растворах диметилсульфоксида-D6 (DMSO-D6) если не указано иное, относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, миллионных долях (м.д.). Хроматографический анализ проводился на приборе Agilent Technologies 1260 infinity с масс-детектором Agilent 6230 TOF LC/MS (времяпролетный детектор масс высокого разрешения), метод ионизации - двойное электрораспыление (dual-ESI). Запись и регистрация сигналов проводилась в положительной полярности; небулайзер (N2) 20 psig, газ-осушитель (N2) 6 мл/мин, 325°С; диапазон обнаружения масс составляет 50-2000 Дальтон. Напряжение на капилляре 4.0 кВ, фрагментаторе +191 В, скиммере+66 В, OctRF 750 В. Условия хроматографирования: колонка Poroshell 120 ЕС-С18 (4.6 × 50 мм; 2.7 мкм). Градиентное элюирование: ацетонитрил/вода (0,1% муравьиной кислоты); скорость потока 0.4 мл/мин. Программное обеспечение для обработки результатов исследований -MassHunter Workstation / Data Acquisition V.06.00. Температуры плавления определены на аппарате Stuart SMP30.
Все процедуры, если не оговорено отдельно проводили при комнатной температуре или температуре окружающей среды, т.е. в диапазоне 20-25°С.
Высушивание продуктов до постоянного веса проводили при температуре 35-45°С при атмосферном давлении или с использованием вакуум-сушильного шкафа при остаточном давлении 0,35+0,005 кг/см2 (35±5 кПа).
Для промывания осадков/фильтрата использовали дистиллированную воду, если не оговорено особо.
Целевые гидрированные производные пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-оны (I) синтезировали в два этапа.
Сперва осуществляли синтез исходной матрицы 6-метил-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1,2-дионов с различными заместителями в 4,6 и 8 положениях по известным методикам [Lescheva E.V., Medvedeva S.M., Shikhaliev Kh.S. Synthesis of 4,4,6- trimethyl-8-R-4H-pyrrolo[3,2,1-ij]quinoline-1,2-diones / E.V. Lescheva, S.M. Medvedeva, Kh.S. Shikhaliev // J. Org. Pharm. Chem. - 2014. - Vol. 12. - P. 15-20.; New heterocyclic systems based on substituted 3,4-dihydro-lH-spiro[quinoline-2,1'-cycloalkanes] / Medvedeva, S.M. [et al] // Chem. Heterocycl. Compd. - 2014. - Vol. 50. - P. 1280-1290] в результате кипячения гидрохлоридов тетрагидрохинолинов с коммерческим доступным оксалилхлоридом в сухом толуоле в течение 1-6 часов, как представлено на схеме 1. Так в положении 4 находятся две метильные группы, либо алициклический фрагмент, в положении 6 наряду с метильной группой могут находиться еще одна метильная группа или бензольное кольцо с заместителем или без, в положении 8 - алкильные, алкоксильные, ацилокси заместители или атомы галогенов.
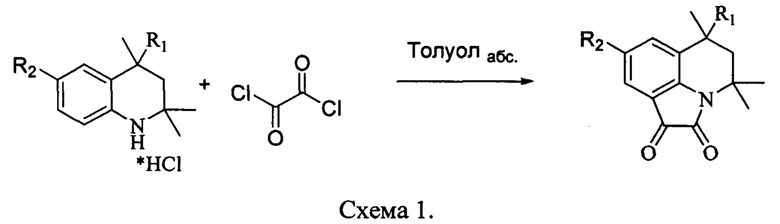
Синтез 8-галогензамещенных пирролохинолиндионов представлен на схемах 2 и 3. Бромирование 6-метил-6-фенил-5,6-дигидро-4Р-пирроло [3,2,1-ij]хинолин-1,2-диона осуществляли согласно описанной методике [Cyclic anthranilic acid derivatives and process for their preparation / Kojima E., Fujimori Sh., Awano K. - Patent No. US 4956372 A; 11.09.1992], используя N-бромсукцинимид (NBS) в качестве бромирующего агента и N,N-диметилформамида (DMF) в качестве растворителя. Данную реакцию распространили на N-хлорсукцинимид (NCS) в качестве хлорирующего агента, для синтеза 8-хлорзамещенных пирролохинолиндионов (схема 2).
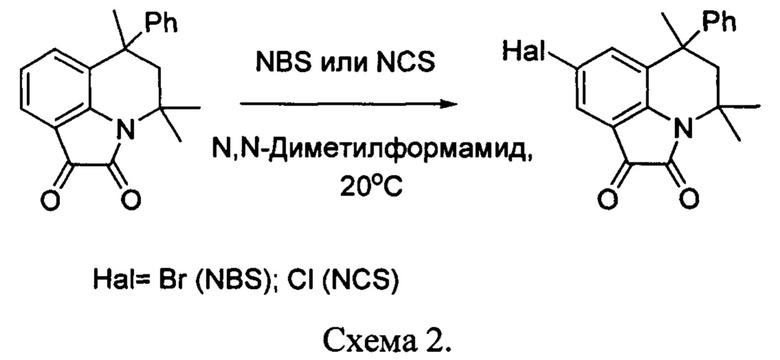
Для получения 8-йодзамещенных пирроло[3,2,1-ij]хинолин-1,2-дионов йодированию подвергались исходные субстраты - 2,2,4-триметил-1,2,3,4-тетрагидрохинолины в соответствии с методикой, представленной в работе [Fluorogenic D-amino acids enable real-time monitoring of peptidoglycan biosynthesis and high-throughput transpeptidation assays / Y.P. Hsu, [et al.] // Nature chemistry. - 2019. - Vol. 11. - P. 335-341].
Последующее взаимодействие гидрохлорида 6-йод-2,2,4-триметил-4-R1-1,2,3,4-тетрагидрохинолина с оксалилхлоридом позволило получить соответствующие дионы (схема 3).
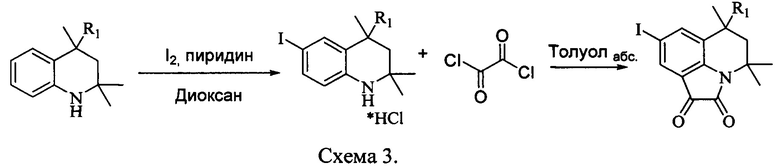
Для получения гибридных молекул на основе 6-метил-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1,2-дионов их вводили в реакцию конденсации с роданинами (7) при кипячении в среде уксусной кислоты в присутствии свежеплавленного ацетата натрия (схема 4).
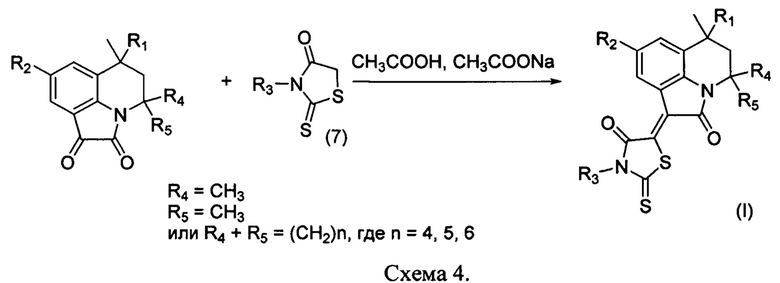
Схемы синтеза соединений (I), способы их получения, а также спектральные данные, физико-химические характеристики представлены в примерах ниже.
ПРИМЕР 1
Синтез (Z)-2-тиоксо-5-(4,4,6-триметил-2-оксо-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)тиазолидин-4-она (Ia) проводили по следующей схеме:
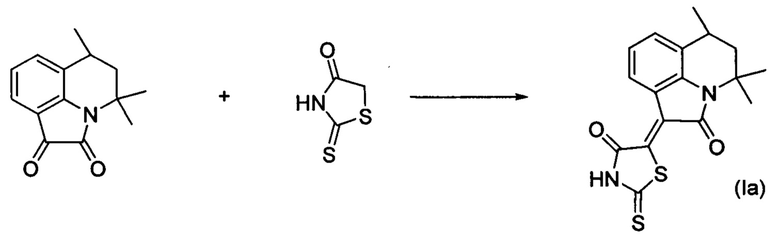
Смесь 4,4,6-триметил-5,6-дигидро-1H-пирроло [3,2,1-ij]хинолин-1,2(4H)-диона (1 ммоль) и 2-тиоксотиазолидин-4-она (1 ммоль) растворяли в ледяной уксусной кислоте (25 мл) и добавляли свежеприготовленный ацетат натрия (2 ммоль) нагревали с обратным холодильником при температуре 120°С в течение 1 ч. Полученный осадок отфильтровывали с помощью воронки фильтровальной лабораторной Шотта, промывали 20 мл воды и перекристаллизовывали из 30 мл смеси пропанол-2 (99.5%): ледяная уксусная кислота, взятых в объемном соотношении 20:1. Высушивание продукта до постоянного веса проводили при температуре 35-45°С при атмосферном давлении или с использованием вакуум-сушильного шкафа при остаточном давлении 0,35±0,005 кг/см2 (35±5 кПа).
Было выделено твердое вещество темно-коричневого цвета массой 0.29 г; выход 85%; температура плавления 261-263°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm):1.32 (3Н, d,J=6.3 Hz, С6-СН3); 1.35 (3Н, s, С4-СН3); 1.56 (2Н, t, J=12.8 Hz, С5-Н); 1.72 (3Н, s, С4-СН3); 1.86-1.90 1H,m, С6-Н); 7.01 (1Н, t, J=12.8 Hz, Н-8); 7.33 (1Н, d, J=7.7 Hz, H-7(9)); 8.52 (1H, d, J=7.7 Hz, H-7(9)); 13.88 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 17.9, 24.4, 25.4, 26.7, 44.9, 54.1, 117.63, 122.2, 124.7, 125.2, 125.3, 129.0, 133.4, 141.1, 165.36, 169.1, 199.7. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C17H16N2O2S2+H+ 345.0727, найдено, 345.0732.
ПРИМЕР 2
Синтез (Z)-5-(8-йод-4,4,6-триметил-2-оксо-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Ib) осуществляли из 8-йод-4,4,6-триметил-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 2 ч.
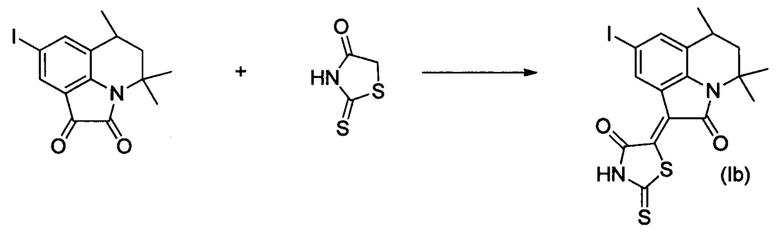
Было выделено твердое вещество темно-коричневого цвета массой 0.28 г.; выход 60%; температура плавления 294-296°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 1.31 (3Н,d,J=6.6Hz, С6-СН3); 1.33 (3Н, s, С4-СН3); 1.56 (1Н, m, С5-Н); 1.71 (3Н, s, C4-CH3); 1.86-1.88 (1Н, m, С5-Н); 2.92 (1Н, s, С6-Н); 7.64-7.68 (1Н, m, Н-7(9)); 8.87-8.91 (1H, m, Н-7(9)); 14.12 (1Н, br.s, NH); 13С NMR (150.90 MHz, DMSO-d6), δ (ppm): 17.8, 24.4, 25.5, 26.5, 44.5, 54.3, 85.7, 119.7,122.9, 128.1,133.1, 136.8, 140.6, 164.9, 199.6. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C17H15IN2O2S2+H+470.9692, найдено, 470.9698.
ПРИМЕР 3
Синтез (Z)-4,4,6-триметил-2-оксо-1-(4-оксо-2-тиоксотиазолидин-5-илиден)-1,2,5,6-тетрагидро-4H-пирроло[3,2,1-ij]хинолин-8-ил бензоата (Ic) осуществляли из 4,4,6-триметил-8-фенокси-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 1 ч.
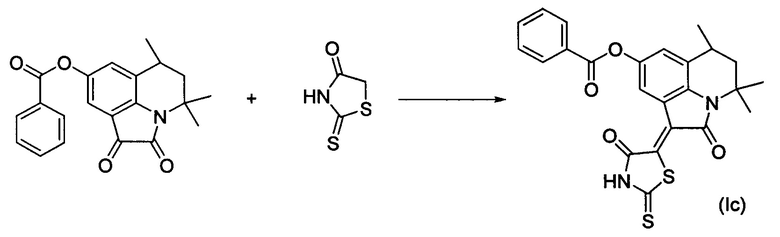
Были выделены коричнево-фиолетовые игольчатые кристаллы массой 0.30 г; выход 65%; температура плавления 276-278°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 1.32 (3Н, d, J=6.7 Hz, C6-CH3); 1.37 (3Н, s, C4-CH3); 1.60 (1H, t, J=12.9 Hz, C5-H); 1.74 (3H, s, C4-CH3); 1.93 (1H, dd, J=13.7 Hz, J=4.5 Hz, C5-H); 2.93-2.98 (1H, m, C6-H); 7.34 (1H, s, H-7(9)); 7.61 (2H, t, J=7.7 Hz, CHarom); 7.76 (1H, t, J=7.5 Hz, CHarom); 8.15 (2H, d, J=7.7 Hz, CHarom); 8.42 (1H, s, H-7(9)); 14.01 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 17.8, 24.4, 25.7, 26.7, 44.7, 54.2, 117.9, 118.8, 122.7, 123.9, 126.3, 128.7, 128.9, 129.7, 134.0, 135.0, 138.9, 145.6, 164.9, 165.4, 169.3, 199.7. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C24H20N2O4S2+H+465.0938, найдено, 465.0944.
ПРИМЕР 4
Синтез (Z)-4,4,6-триметил-2-оксо-1-(4-оксо-2-тиоксотиазолидин-5-илиден)-1,2,5,6-тетрагидро-4H-пирроло[3,2,1-ij]хинолин-8-ил 2-метоксибензоата (Id) осуществляли из 4,4,6-триметил-8-(4-метоксифенокси)-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике аналогичной описанной в Примере. Нагревание вели с обратным холодильником при температуре 120°С в течение 3 ч. 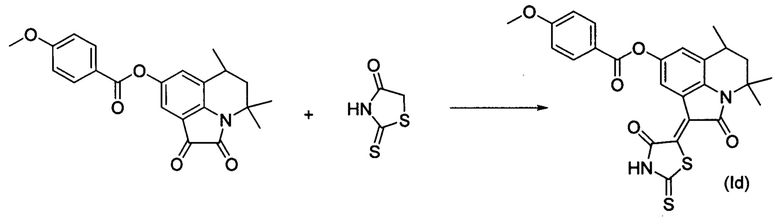
Были выделены темно-синие игольчатые кристаллы массой 0.37 г.; выход 75%; температура плавления 287-289°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 1.33 (3Н, d, J=5.9 Hz, C6-CH3); 1.36 (3Н, s, C4-CH3); 1.60 (1H, t, J=13.0 Hz, C5-H); 1.74 (3H, s, C4-CH3); 1.92 (1H, dd, J=13.7 Hz, J=4.5 Hz, C5-H); 2.94-2.98 (1H, m, C6-H); 3.90 (3H, s, O-CH3); 7.10 (1H, t, J=7,5 Hz, CHarom); 7.24 (1H, d, J=8.5 Hz, CHarom); 7.29 (1H, s, H-7(9)); 7.66 (1H, t, J=7.6 Hz, CHarom); 7.93 (1H, d, J=7.3 Hz, CHarom); 8.41 (1H, d, J=1.2 Hz H-7(9)); 14.01 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 17.9, 24.4, 25.7, 26.6, 44.7, 54.2, 55.8, 112.6, 118.0, 118.5, 118.9, 120.1, 122.7, 124.0, 126.2, 131.4, 134.5, 135.0, 138.8, 145.7, 158.9, 164.3, 165.4, 169.4, 199.7. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C25H22N2O5S2+H+495.1044, найдено, 495.1045.
ПРИМЕР 5
Синтез (Z)-4,4,6-триметил-2-оксо-1-(4-оксо-2-тиоксотиазолидин-5-илиден)-1,2,5,6-тетрагидро-4H-пирроло[3,2,1-ij]хинолин-8-ил 3,4,5-триметоксибензоата (Ie) осуществляли из 4,4,6-триметил-8-(3,4,5-триметоксифенокси)-5,6-дигидро-1h-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 3 ч.
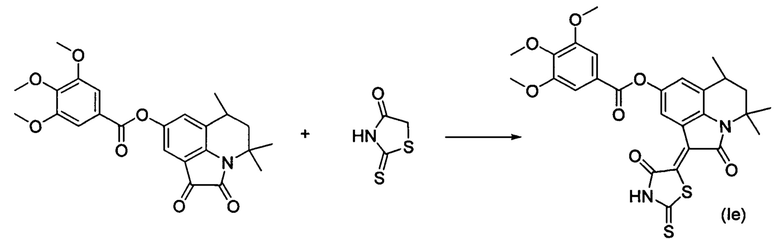
Были выделены коричнево-фиолетовые игольчатые кристаллы массой 0.37 г; выход 67%; температура плавления 314-316°С; lH NMR (600.13 MHz, DMSO-d6), δ (ppm): 1.32 (3Н, d, J=6.6 Hz, C6-CH3); 1.37 (3H, s, C4-CH3); 1.61 (1H, t, J=12.9 Hz, C5-H); 1.74 (3H, s, C4-CH3); 1.93 (1H, dd, J=13.7 Hz, J=4.3 Hz, C5-H); 2.94-2.98 (1H, m, C6-H); 3.34 (3H, s, O-CH3); 3.78 (3H, s, O-CH3); 3.88 (3H, s, O-CH3); 7.31 (1H, s, H-7); 7.42 (2H, s, CHarom); 8.40 (1H, s, H-9); 14.01 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 17.9, 24.4, 25.6, 26.6, 44.7, 54.2, 56.0, 60.1, 107.0, 117.9, 118.0, 118.9,122.6,123.6,123.9, 126.3, 138.9, 142.3, 145.7, 152.8, 164.6, 165.4, 199.8. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C27H26N2O7S2+H+555.1256, найдено, 555.1259
ПРИМЕР 6
Синтез (Z)-3-этил-5-(8-метокси-4,4,6-триметил-2-оксо-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (If) осуществляли из 4,4,6-триметил-8-метокси-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона и 3-этил-2-тиоксотиазолидин-4-она по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 1 ч.
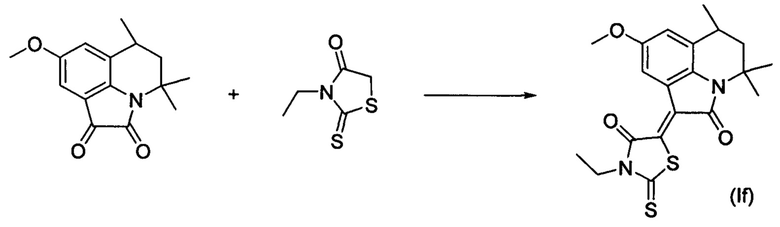
Были выделены темно-синие игольчатые кристаллы массой 0.35 г; выход 86%; температура плавления 230-232°С; 1Н NMR (500.13 MHz, DMSO-d6), δ (ppm): 1.23 (3Н, t, J=7.1 Hz, CH2CH3); 1.33 (3Н, d, J=6.7 Hz, C6-CH3); 1.35 (3H, s, C4-CH3); 1.55-1.66 (1H, m, C5-H); 1.71 (3H, s, C4-CH3); 1.89 (1H, dd, J=13.7 Hz, J=4.7 Hz, C5-H); 2.89-2.94 (1H, m, C6-H); 3.80 (3H, s, O-CH3); 4.10 (1H, q, J=7.1 Hz, CH2CH3); 6.96 (1H, s, H-7(9)); 8.28 (1H, s, H-7(9)); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 11.8, 18.1, 24.3, 25.9, 26.7, 39.1, 45.4, 54.1, 55.9, 111.6, 116.1, 118.3, 126.2, 126.3, 135.7, 155.5, 165.3, 165.4, 197.4. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C20H22N2O3S2+H+403.1146, найдено, 403.1141.
ПРИМЕР 7
Синтез (Z)-5-(4,4,6-триметил-2-оксо-6-фенил-8-фтор-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Ig) осуществляли из 4,4,6-триметил-6-фенил-8-фтор-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С течение 5 ч.
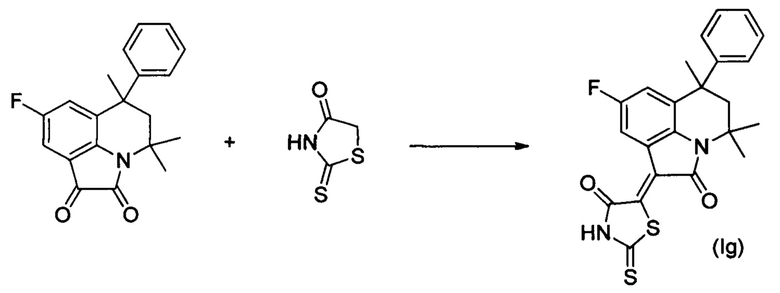
Были выделены темно-синие игольчатые кристаллы массой 0.36 г.; выход 83%; температура плавления 308-310°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 0.70 (3Н, s, С6-СН3); 1.62 (3Н, s, С4-СН3); 1.70 (3Н, s, С4-СН3); 2.13 (1Н, d, J=14.1 Hz, С5-Н); 2.53 (1Н, d, J=14.3 Hz, C5-H); 7.08 (2H, d, J=7.7 Hz, CHarom); 7.18 (1H, t, J=7.2 Hz, CHarom); 7.26 (2H, t, J=6.6 Hz, CHarom); 7.37 (1H, d, J=9.8 Hz, H-7(9)); 8.51 (1H, d, J=7.7 Hz, H-7(9)); 14.10 (1H, br.s, NH); 13C NMR 150.90 MHz, DMSO-d6), δ (ppm): 24.8, 27.8, 30.2, 39.9, 50.5, 54.2, 112.9, 113.1, 117.3, 117.5, 118.8, 118.9, 123.5, 126.3, 126.4, 127.5, 127.6 (C-F), 128.3, 136.0, 137.5, 147.3, 157.2, 158.8, 165.2, 169.4, 199.5. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C23H19FN2O2S2+H+439.0946, найдено, 439.0948.
ПРИМЕР 8
Синтез (Z)-5-(8-бром-4,4,6-триметил-2-оксо-6-фенил-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Ih) осуществляли из 8-бром-4,4,6-триметил-6-фенил-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С течение 6 ч.
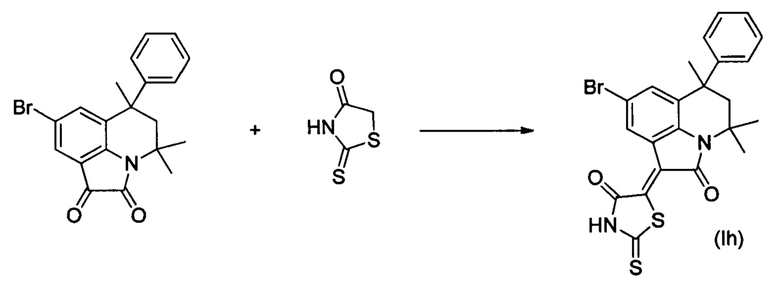
Было выделено твердое вещество темно-коричневого цвета массой 0.39 г; выход 79%; температура плавления 291-293°С; 1H NMR (500.13 MHz, DMSO-d6), δ (ppm): 0.74 (3Н, s, С6-СН3); 1.62 (3Н, s, С4-СН3); 1.72 (3Н, s, С4-СН3); 2.14 (1Н, d, J=14.4 Hz, С5-Н); 2.50 (1Н, d, J=14.1 Hz, C5-H); 7.07 (2H, d, J=7.7 Hz, CHarom); 7.18 (1H, t, J=7.2 Hz, CHarom); 7.27 (2H, t, J=7.5 Hz, CHarom); 7.60 (1H, s, H-7(9)); 8.90 (1H, s, H-7(9)); 14.10 (1H, br.s, NH); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 24.9, 27.9, 39.8, 40.0, 50.6, 54.2, 114.5, 120.1, 122.9, 126.4, 126.5, 128.4, 128.6, 132.7, 136.5, 140.3, 147.4, 165.2, 169.6, 199.6. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C23H19BrN2O2S2+H+499.0145, найдено, 499.0151.
ПРИМЕР 9
Синтез (Z)-5-(8-йод-4,4,6-триметил-2-оксо-6-фенил-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Ii) осуществляли из 8-йод-4,4,6-триметил-6-фенил-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 3 ч.
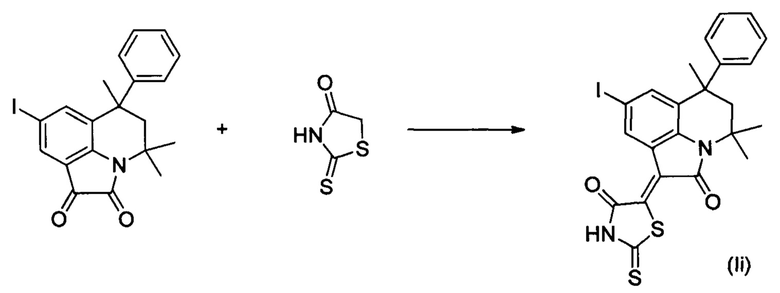
Было выделено твердое вещество коричневого цвета массой 0.44 г.; выход 82%; температура плавления 269-271°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 0.71 (3Н, s, С6-СН3); 1.61 (3Н, s, С4-СН3); 1.70 (3Н, s, С4-СН3); 2.13 (1H, d, J=14.3 Hz, С5-Н); 2.48 (1Н, d, J=14.4 Hz, C5-H); 7.06 (2H, d, J=1.1 Hz, CHarom); 7.18 (1H, t, J=7.2 Hz, CHarom); 7.27 (2H, t, J=7.6 Hz, CHarom); 7.75 (1H, s, H-7(9)); 9.07 (1H, s, H-7(9)); 14.10 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 24.8, 27.8, 30.0, 50.4, 54.2, 85.8, 120.3, 122.7, 126.2, 126.4, 128.2, 128.7, 133.9, 136.0, 138.3, 140.6, 147.3, 164.8, 169.4, 199.4. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C23H19IN2O2S2+H+547.0005, найдено 547.0001.
ПРИМЕР 10
Синтез (Z)-2-тиоксо-3-этил-5-(4,4,6-триметил-2-оксо-6-фенил-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)тиазолидин-4-она (Ij) осуществляли из 4,4,6-триметил-6-фенил-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона и 3-этил-2- тиоксотиазолидин-4-она по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 5 ч.
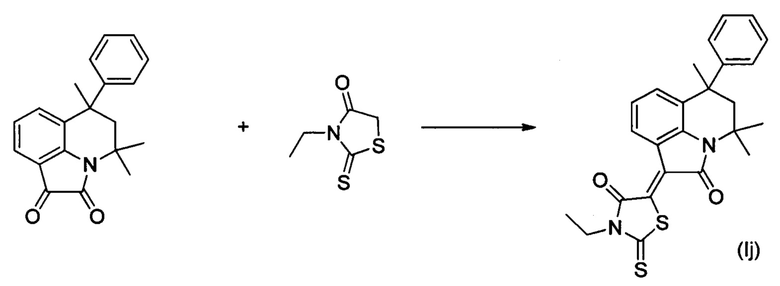
Было выделено твердое вещество темно-красного цвета массой 0.35 г.; выход 77%; температура плавления 254-256°С; 1H NMR (500.13 MHz, DMSO-d6), δ (ppm): 0.75-0.77 (3Н, m, С6-СН3); 1.23 (3Н, tt, J=7.0 Hz, J=2.9 Hz, CH2CH3: 1.64 (3Н, s, C4-CH3); 1.71 (3H, s, C4-CH3); 2.15 (1H, d, J=14.3 Hz, C5-H); 2.52 (1H, d, J=14.3 Hz, C5-H); 4.10-4.13 (2H, m, CH2CH3); 7.07 (2H, d, J=7.7 Hz, CHarom); 7.14-7.26 (4H, m, H-8+CHarom); 7.46 (1H, d, J=7.7 Hz, H-7(9)); 8.77 (1H, d, J=7.8 Hz, H-7(9)); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 11.9, 24.8, 27.9, 30.3, 50.6, 54.1, 118.3, 122.5, 125.3, 126.1, 126.3, 126.4, 128.1, 131.1, 131.3, 141.3, 147.7, 165.3, 166.3, 197.1. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C25H24N2O2S2+H+449.1353, найдено 449.1352.
ПРИМЕР 11
Синтез (Z)-5-(4,4,6-триметил-2-оксо-6-(4-хлорфенил)-8-фтор-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Ik) осуществляли из 4,4,6-триметил-6-(4-хлорфенил)-8-фтор-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 4 ч. 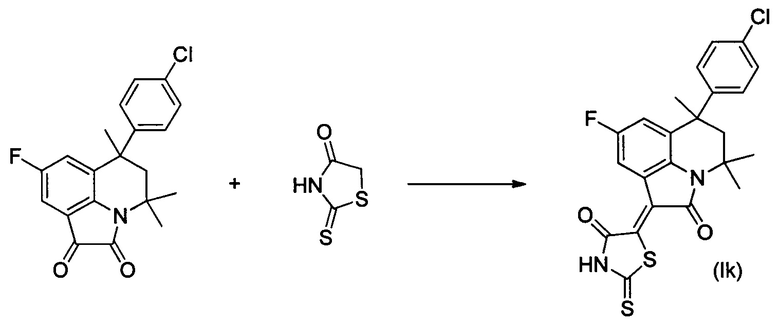
Были выделены темно-синие игольчатые кристаллы массой 0.31 г.; выход 65%; температура плавления 274-276°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 0.74 (3Н, s, С6-СН3); 1.63 (3Н, s, С4-СН3); 1.69 (3Н, s, С4-СН3); 2.13 (1Н, d, J=14.2 Hz, С5-Н); 2.50 (1H, d, J=14.2 Hz, C5-H); 7.11 (2H, d, J=7.6 Hz, CHarom); 7.32 (2H, d, J=8.1 Hz, CHarom); 7.36 (1H, d, J=9.9 Hz, H-7(9)); 8.51 (1H, d, J=9.4 Hz, H-7(9)); 14.10 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 24.9, 27.7, 30.1, 39.6, 50.2, 54.1, 113.0, 113.2, 117.2, 117.3, 118.9, 119.0, 123.4, 126.9, 127.0, 128.1, 128.4_(C-F), 130.1, 136.1, 137.4, 146.3, 157.2, 158.8, 165.1, 169.4, 199.4. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C23H18ClFN2O2S2+H+473.0556, найдено 473.0559.
ПРИМЕР 12
Синтез (Z)-5-(8-йод-4,4,6-триметил-2-оксо-6-(4-хлорфенил)-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-2-тиоксотиазолидин-4-она (Il) осуществляли из 8-йод-4,4,6-триметил-6-(4-хлорфенил)-5,6-дигидро-1H-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 6 ч.
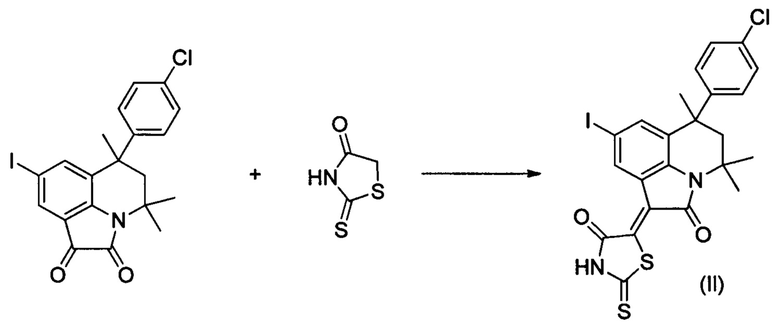
Было выделено твердое вещество темно-фиолетового цвета массой 0.40 г; выход 69%; температура плавления 285-287°С; 1Н NMR (600.13 MHz, DMSO-d6), δ (ppm): 0.76 (3Н, s, С6-СН3); 1.64 (3Н, s, С4-СН3); 1.69 (3Н, s, С4-СН3); 2.15 (1Н, d, J=14.1 Hz, С5-Н); 2.47 (1Н, d, J=14.3 Hz, C5-H); 7.09 (2H, d, J=8.1 Hz, CHarom); 7.19 (1H, t, J=7.8 Hz, CHarom); 7.31 (2H, d, J=8.3 Hz, CHarom); 7.46 (1H, d, J=1.1 Hz, H-7(9)); 8.74 (1H, d, J=7.8 Hz, H-7(9)); 13.99 (1H, br.s, NH); 13C NMR (150.90 MHz, DMSO-d6), δ (ppm): 25.0, 27.8, 30.3, 33.1, 50.5, 54.1, 85.8, 118.5, 120.5, 122.6, 124.5, 125.7, 126.4, 128.1, 128.5, 130.9, 134.3, 138.3, 141.0, 146.9, 165.4, 169.3, 199.7. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C23H18ClIN2IO2S2+H+580.9616, найдено 580.9615.
ПРИМЕР 13
Синтез (Z)-5-(4,4,6-триметил-2-оксо-6-(4-хлорфенил)-8-фтор-5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1(2H)-илиден)-3-этил-2-тиоксотиазолидин-4-она (Im) осуществляли из 4,4,6-триметил-6-(4-хлорфенил)-8-фтор-5,6-дигидро-1Р-пирроло[3,2,1-ij]хинолин-1,2(4H)-диона и 3-этил-2-тиоксотиазолидин-4-она по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 2 ч.
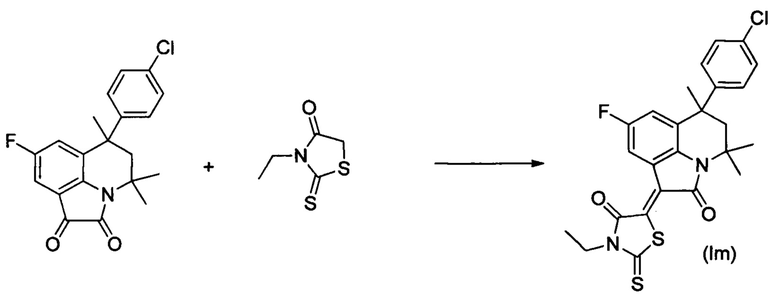
Было выделено твердое вещество коричневого цвета массой 0.37 г; выход 73%; температура плавления 235-237°С; 1Н NMR (500.13 MHz, DMSO-d6), δ (ppm): 0.85, (3Н, s, С6-СН3); 1.26 (3Н, t, J=6.4 Hz, CH2CH3), 1.64 (3Н, s, С4-СН3); 1.71 (3Н, s, С4-СН3); 2.15 (1Н, d,J=14.3 Hz, С5-Н); 2.50 (1Н, d, J=12.3 Hz, С5-Н; 4.15 (2Н, q, J=6.6 Hz, CH2CH3); 7.11 (2H, d, J=8.1 Hz, CHarom); 7.32 (2H, d, J=7.9 Hz, CHarom); 7.41 (1H, s, H-7); 8.53 (1H, s, H-9); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 11.7, 25.1, 27.7, 30.1, 39.2, 39.8, 50.9, 54.3,112.9, 113.2, 117.3, 117.4, 124.6, 127.4, 127.5, 128.1, 128.4, 131.1, 133.0, 137.8, 146.3, 157.2, 159.1, 165.3, 166.5, 196.9. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C25H22ClFN2O2S2+H+501.0869, найдено 501.0871
ПРИМЕР 14
Синтез (Z)-5-(6',6'-диметил-2'-оксо-5',6'-дигидроспиро[циклогексан-1,4'-пирроло[3,2,1-ij]хинолин]-1'(2'H)-илиден)-2-тиоксотиазолидин-4-она (In) осуществляли из 6',6'-диметил-5',6'-дигидроспиро[циклогексан-1,4'-пирроло[3,2,1-ij]хинолин]-1',2'-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 3 ч.
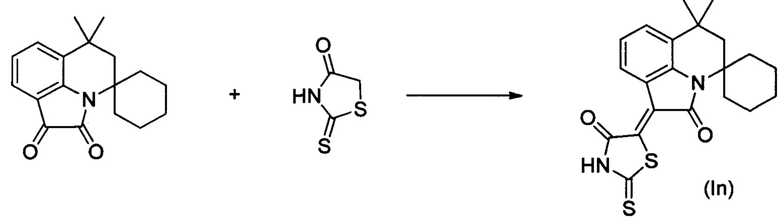
Было выделено твердое вещество коричневого цвета массой 0.27 г.; выход 68%; температура плавления 254-256°С; 1Н NMR (500.13 MHz, DMSO-d6), δ (ppm): 1.20-1.32 (2Н, m, (СН2)5); 1.33 (6Н, s, С6-(СН3)2); 1.55-1.70 (6Н, m, (СН2)5+С5-Н); 2.05 (2Н, s, (СН2)5); 2.53-2.60 (1Н, m, С5-Н+(СН2)5); 7.04 (1Н, t, J=7.3 Hz, Н-8); 7.43 (1H, d, J=7.7 Hz, H-7(9)); 8.58 (1H, d, J=7.6 Hz, H-7(9)); 13.85 (1H, br.s, NH); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 21.8, 25.0, 30.7, 31.5, 33.8, 42.3, 57.9, 118.2, 122.5, 125.1, 125.5, 129.0, 129.7, 133.8, 140.3, 166.0, 169.3, 200.1. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C21H22N2O2S2+H+399.1197, найдено 399.1196.
ПРИМЕР 15
Синтез (Z)-5-(6',8'-диметил-2'-оксо-5',6'-дигидроспиро[циклогексан-1,4'-пирроло[3,2,1-ij]хинолин]-1'(2'H)-илиден)-2-тиоксотиазолидин-4-она (Io) осуществляли из 6',8' -диметил-5',6' -дигидроспиро[циклогексан-1,4'-пирроло[3,2,1-ij]хинолин]-1',2'-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 5 ч.
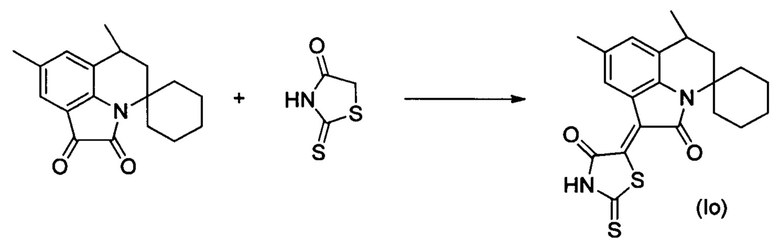
Было выделено твердое вещество темно-фиолетового цвета массой 0.28 г.; выход 71%; температура плавления 294-296°С; 1H NMR(500.13 MHz, DMSO-d6), δ (ppm): 1.20-1.31 (2Н, m, (СН2)5); 1.33 (3Н, d, J=6.8 Hz, С6-СН3); 1.45-1.60 (4Н, m, (СН2)5); 1.69-1.72 (1Н, m, (СН2)5); 1.77-1.87 (3Н, m, С5-Н+(СН2)5); 2.30 (3Н, s, С8-СН3); 2.52 (1Н, dd, J=14.0 Hz, J=4.5 Hz, C5-H); 2.76-2.81 (1H, m, C6-H); 7.13 (1H, s, H-7(9)); 8.37 (1H, s, H-7(9)); 13.85 (1H, br.s, NH); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 18.2, 20.9, 21.4, 21.9, 24.8, 24.9, 31.4, 33.5, 37.8, 58.0, 117.9, 125.4, 125.6, 125.8, 129.7, 131.0, 132.9, 139.7, 165.7, 168.9, 199.8. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C21H22N2O2S2+H+399.1196, найдено 399.1198.
ПРИМЕР 15
Синтез (Z)-5-(6'-метил-2'-оксо-8'-фтор-5',6'-дигидроспиро[циклопентан-1,4'-пирроло[3,2,1-ij]хинолин]-1H'(2'H)-илиден)-2-тиоксотиазолидин-4-она (Ip) осуществляли из 6',8'-диметил-5',6'-дигидроспиро[циклопентан-1,4'-пирроло[3,2,1-ij]хинолин]-1',2'-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 3 ч.
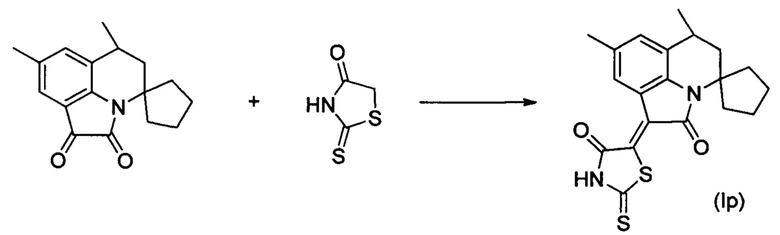
Были выделены темно-синие игольчатые кристаллы массой 0.25 г; выход 65%; температура плавления 288-290°С; 1H NMR (500.13 MHz, DMSO-d6), δ (ppm): 1.31 (3Н, d, J=6.8 Hz,C6-CH3); 1.52-1.59 (2H, m, (CH2)4); 1.61-1.65 (1H, m, (CH2)4); 1.66-1.82 (3H, m, (CH2)4); 1.95-2.03 (2H, m, (CH2)4+C5-H); 2.85-2.95 (2H, m, (CH2)4+C6-H); 7.16 (1H, dd, J=8.4 Hz, J=1.7 Hz, H-7(9)); 8.24-8.27 (1H, m, H-7(9)); 13.85 (1H, br.s, NH); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 17.7, 24.6, 25.0, 26.6, 35.3, 37.8, 42.9, 64.1, 111.6, 111.8, 115.5, 115.7, 117.8, 117.9, 123.8, 127.0, 127.1, 135.2, 137.9, 157.0, 158.9, 164.9, 169.2, 199.48. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C19H17FN2O2S2+H+389.0789, найдено 389.0791.
ПРИМЕР 16
Синтез (Z)-5-(6'-метил-2'-оксо-8'-фтор-5',6'-дигидроспиро[циклогептан-1,4'-пирроло[3,2,1-ij]хинолин]-1'(2'H)-илиден)-2-тиоксотиазолидин-4-она (Iq) осуществляли из 6'-метил-8-фтор-5',6'-дигидроспиро[циклогепттан-1,4'-пирроло[3,2,1-ij]хинолин]-1',2'-диона по методике, аналогичной описанной в Примере 1. Нагревание вели с обратным холодильником при температуре 120°С в течение 4 ч.
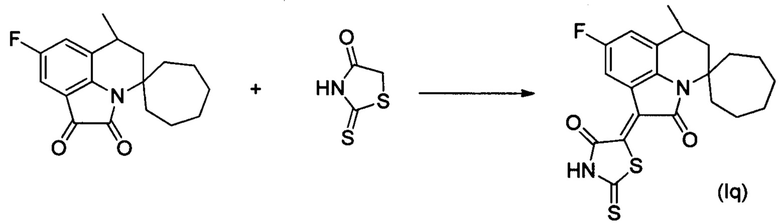
Было выделено твердое вещество коричневого цвета массой 0.32 г; выход 77%; температура плавления 343-345°С; 1Н NMR (500.13 MHz, DMSO-d6), δ (ppm): 1.30 (3Н, d, J=6.8 Hz,C6-CH3); 1.32-1.45 (2H, m, (CH2)6); 1.50-1.65 (6H, m, (CH2)6); 1.66-1.75 (2H, m, (CH2)6); 1.83-1.90 (2H, m, C5-H+(CH2)6); 2.24 (1H, dd, J=9.5 Hz, J=4.3 Hz, C6-H); 2.79-2.84 (1H, m, C6-H); 3.06-3.12 (1H, m, (CH2)6); 7.18 (1H, dd, J=8.2 Hz, J=1.8 Hz, H-7(9)); 8.27 (1H, dd, J=8.4 Hz, J=2.4 Hz, H-7(9)); 13.95 (1H, br.s, NH); 13C NMR (125.76 MHz, DMSO-d6), δ (ppm): 18.1, 22.5, 23.1, 25.3, 29.7, 29.9, 36.3, 37.5, 39.7, 42.4, 61.3, 111.7, 111.9, 115.7, 115.9, 118.2, 118.3, 123.9, 127.1,127.2, 135.2,137.7, 157.0, 158.9, 165.4, 169.2, 199.6. HPLC-HRMS-ESI, m/z ([M+H]+), вычислено для C21H21FN2O2S2+H+417.1102, найдено 417.1100.
Также были синтезированы соединения и с другими вариантами радикалов, приведенных в общей формуле I, которые продемонстрировали схожую активность в ингибировании факторов свертывания крови Ха и XIa.
ПРИМЕР 17
Исследование активности химически синтезированных соединений проявляющих антикоагулянтную активность in vitro
При исследовании ингибирования факторов свертываемости крови Ха и XIa синтезированными соединениями общей формулы I измеряли кинетику гидролиза субстратов, специфичных по отношению к каждому их этих ферментов, в присутствии этих соединений. [New Infestin-4 Mutants with Increased Selectivity against Factor XIIa / V.N. Kolyadko [et al.] // PLoS ONE. - 2015. - Vol. 10(12). - e0144940; New factor Xa inhibitors based on 1,2,3,4-tetrahydroquinoline developed by molecular modelling / I. Ilin [et al.] // Journal of Molecular Graphics and Modelling. - Vol. 89. - 2019. - P. 215-224; New Synthetic Thrombin Inhibitors: Molecular Design and Experimental Verification / E.I. Sinauridze [et al.] PLoS ONE. - 2011. - Vol. 6(5). - е19969]. В случае фактора Xa использовали специфичный низкомолекулярный хромогенный субстрат S2765 (Z-D-Arg-Gly-Arg-pNA⋅2HCl), а для фактора XIa - субстрат S2366 (pyroGlu-Pro-Arg-pNA⋅HCl (оба «Chromogenix», США).
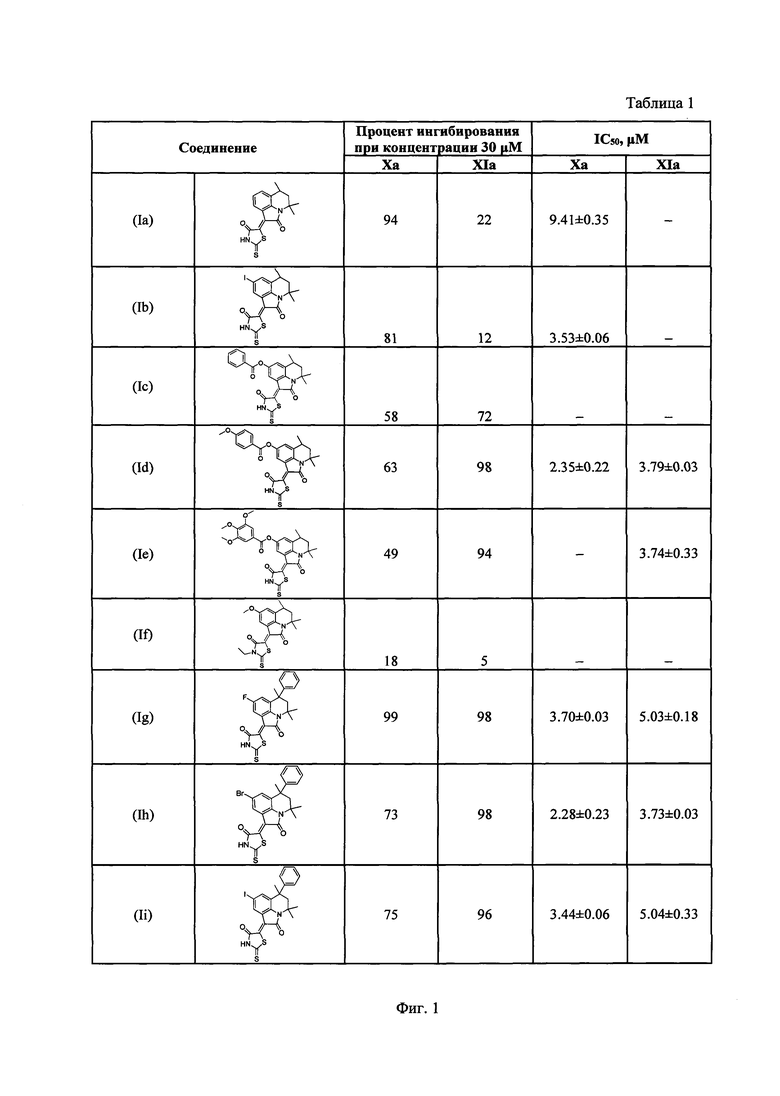
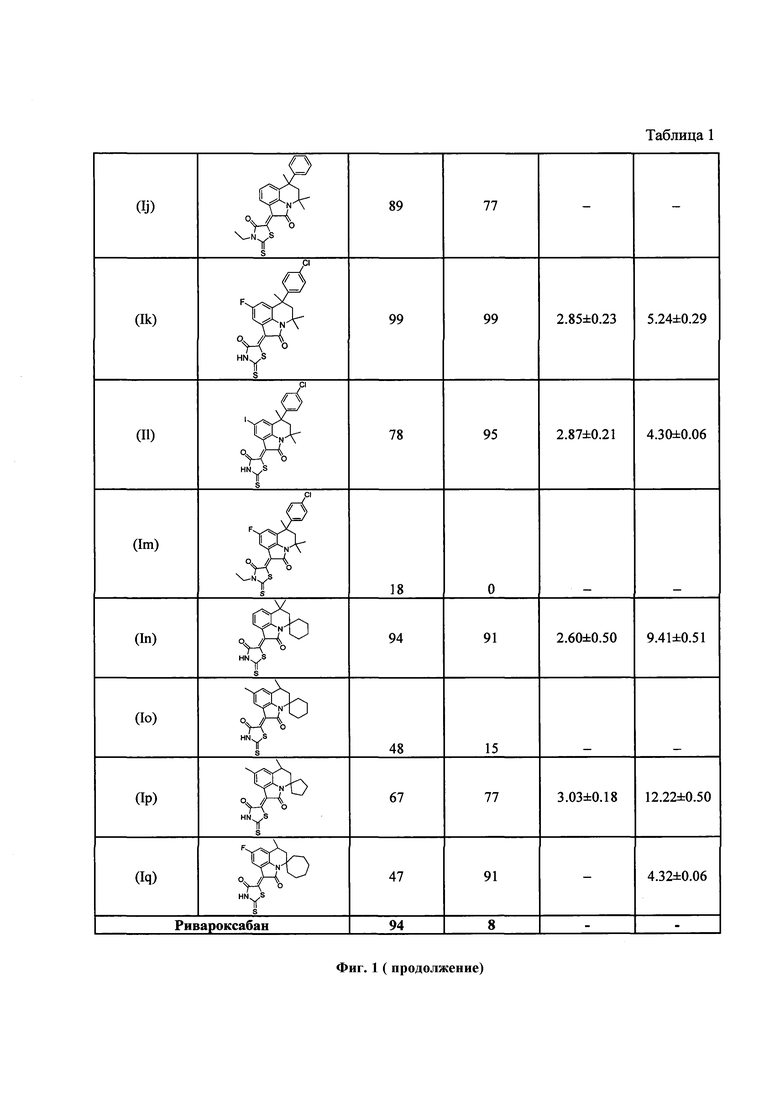
В лунки 96-луночного планшета вносили буфер, содержащий 140 мM NaCl, 20 мМ HEPES, 0.1% ПЭГ 6000 (рН 8.0), добавляли фактор Ха (конечная концентрация 2.5 нмоль⋅л-1) или XIa (конечная концентрация 0.8 нмоль⋅л-1), субстрат S2765 (конечная концентрация 200 мкмоль⋅л-1) или S2366 (конечная концентрация 200 нкмоль⋅л-1) и исследуемые соединения в концентрации 30 мкмоль⋅л-1, содержание N,N-диметилсульфоксида в лунке не более 2%. Кинетику образования 4-нитроанилина (pNA) измеряли с помощью микропланшетного ридера «THERMOmax Microplate Reader» («Molecular Devices Corporation»), США) по поглощению исследуемым раствором света с длиной волны 405 нм. Начальную скорость расщепления субстрата определяли по начальному наклону кривой образования pNA. Скорость расщепления субстрата ферментом в присутствии ингибитора выражали в процентах по отношению к скорости расщепления субстрата в отсутствие ингибитора. Полученные значения приведены на фиг. 1, таблица 1. Обработку результатов осуществляли с помощью программ GraphPad Prism [GraphPad Prism, GraphPad, San Diego (CA), USA] и OriginPro 8 [OriginPro 8, OriginLab Corp., Northampton (MA), USA].
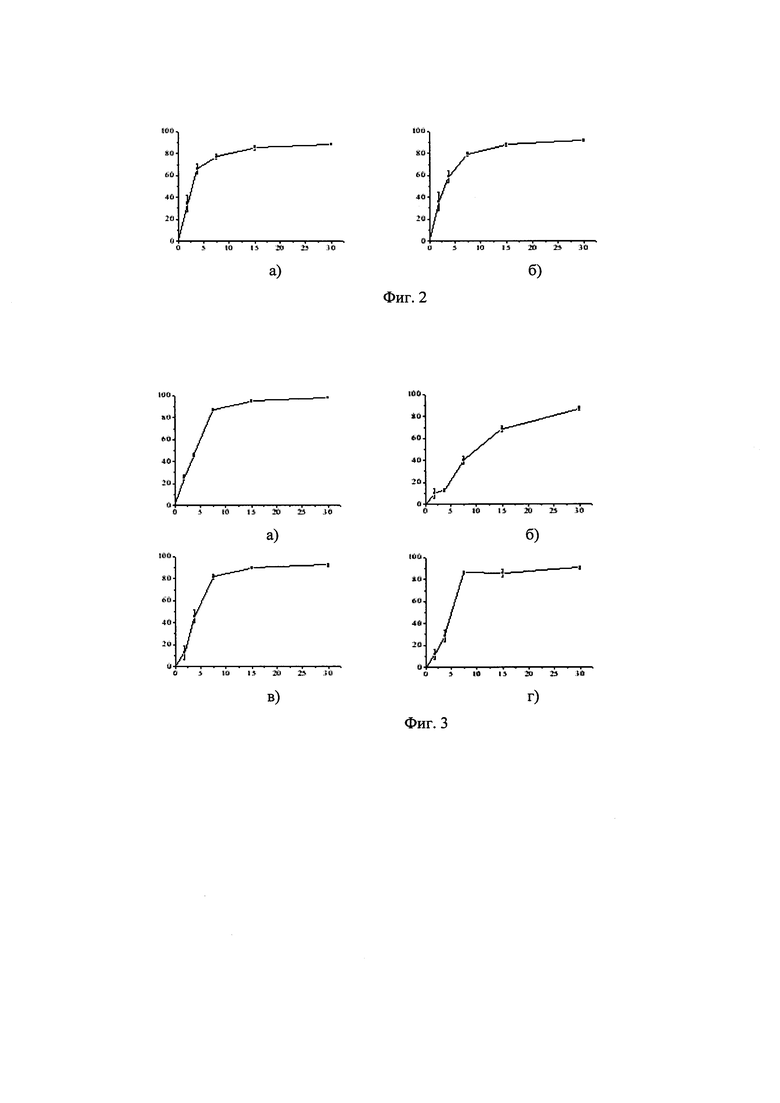
На фиг. 1 приведена таблица 1 с результатами определения ингибирующей активности синтезированных соединений в отношении факторов свертываемости крови Ха и XIa, а также данные по аналогичным исследованиям для Ривароксабан. На фиг. 2 показан процент ингибирования скорости гидролиза хромогенного субстрата, специфичного для фактора Ха (ось ординат, %), в буферном растворе в присутствии различных концентраций ингибиторов (ось абсцисс, μМ) для соединений Ih (a), In (б). На фиг. 3 представлен процент ингибирования скорости гидролиза хромогенного субстрата, специфичного для фактора XIa (ось ординат, %), в буферном растворе в присутствии различных концентраций ингибиторов (ось абсцисс, μМ) для соединений Ih (a), In (б), 1е (в) Iq (г).
Из приведенной таблицы (фиг. 1) видно, что все соединения, существенно превосходят Ривароксабан по эффективности дуального ингибирования факторов свертываемости крови Ха и XIa. Все указанные соединения общей формулы (I) сохраняют стабильность в течение длительного времени (1 года) на воздухе при комнатной температуре. Анализ стабильности осуществляли на основе данных хроматографических и спектральных методов анализа.
Изобретение относится к области фармакологии и медицины, а именно к применению соединения - производного пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-она формулы (I) в качестве ингибиторов факторов свертывания крови Ха и ХIа. В общей формуле (I) R1 представляет собой заместитель, выбранный из водорода; алкила (С1-С2); фенила без заместителей или замещенного на галоген по положению 4; R2 представляет собой заместитель, выбранный из водорода; галогена; алкила (С1-С2); алкоксильной группы (С1-С2); бензоилокси без заместителя или-замещенного метоксильной группой по положениям 3,4,5; R3 представляет собой заместитель, выбранный из водорода; или алкила (С1-С2); R4 представляет собой метил; R5 представляет собой метил; или R4+R5=(СН2)n, где n представляет собой целые числа 4, 5, 6. 1 з.п. ф-лы, 3 ил., 16 пр.
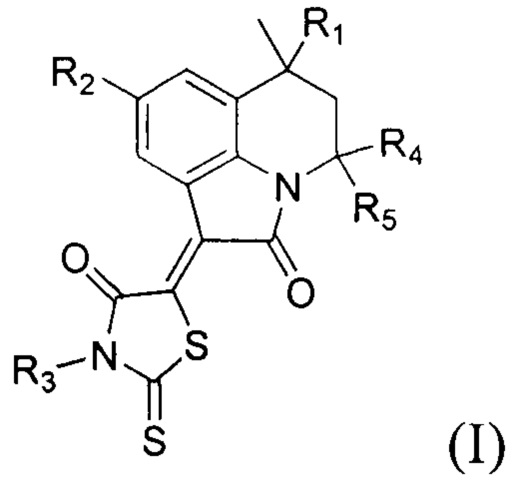
1. Применение гидрированных производных пирроло[3,2,1-ij]хинолин-1-илиден-2-тиоксотиазолидин-4-онов общей формулы (I):
где R1 представляет собой заместитель, выбранный из водорода; алкила (С1-С2); фенила без заместителей или замещенного на галоген по положению 4;
R2 представляет собой заместитель, выбранный из водорода; галогена; алкила (С1-С2); алкоксильной группы (С1-С2); бензоилокси без заместителя или замещенного метоксильной группой по положениям 3,4,5;
R3 представляет собой заместитель, выбранный из водорода; или алкила (С1-С2);
R4 представляет собой метил;
R5 представляет собой метил;
или
R4+R5=(СН2)n, где n представляет собой целые числа 4, 5, 6;
при условии, что соединения общей формулы (I) не представляют собой
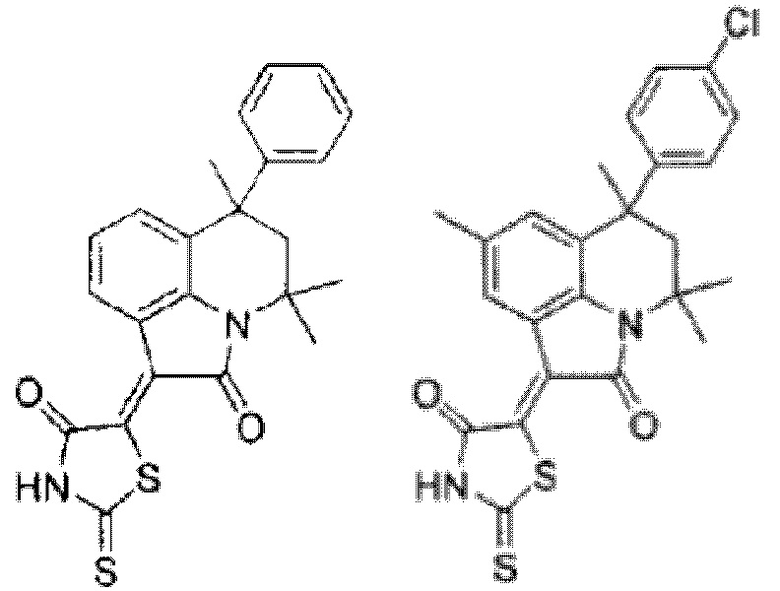
в качестве ингибиторов факторов свертывания крови Ха и ХIа.
2. Применение по п. 1, характеризующееся тем, что R1 представляет собой заместитель, выбранный из водорода, метила, фенила, 4-хлорфенила; R2 представляет собой заместитель, выбранный из водорода, брома, йода, фтора, метила, метокси-, бензоилокси-, 3,4,5-триметоксибензоилокси-; R3 представляет собой заместитель, выбранный из водорода, этила; R4 представляет собой заместитель, выбранный из метила; R5 представляет собой заместитель, выбранный из метила; или R4+R5=(СН2)n, где n представляет собой целые числа, выбранные из 4, 5, 6.
| NOVICHIKHINA, NADEZHDA et al | |||
| Synthesis, Docking, and In Vitro Anticoagulant Activity Assay of Hybrid Derivatives of Pyrrolo[3,2,1-ij]Quinolin-2(1H)-one as New Inhibitors of Factor Xa and Factor XIa | |||
| Molecules, 2020, vol | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| ДВИЖИТЕЛЬ, ИМЕЮЩИЙ ЦЕЛЬЮ ЗАМЕНИТЬ ГРЕБНЫЕ ВИНТЫ И ПРОПЕЛЛЕРЫ | 1923 |
|
SU1889A1 |
| МЕДВЕДЕВА С.М | |||
| и др | |||
| Синтез, докинг и антикоагулянтная активность новых ингибиторов фактора Xa в ряду | |||
Авторы
Даты
2024-05-28—Публикация
2023-04-28—Подача