Область техники
Настоящее изобретение касается мономера амино-LNA и содержащего его олигомера.
Уровень техники
Терапевтические методы лечения заболеваний с применением нуклеинокислотных лекарственных средств включают антисмысловой метод, антигенный метод, метод с использованием аптамеров, метод с использованием миРНК и т.д. Перечисленный в этом списке антисмысловой метод представляет собой метод, в котором болезнь лечат или предотвращают путем введения олигонуклеотида (антисмысловой цепи), комплементарной к вызывающей заболевание мРНК или некодирующей РНК извне для образования двойной цепи и, соответственно, для регулировки работы РНК, участвующей в развитии заболевания, с целью лечения или предотвращения этого заболевания.
Несмотря на то, что различные искусственные нуклеиновые кислоты были разработаны как материалы для нуклеинокислотных лекарств, остаются актуальными такие проблемы, как избежание токсичности в отношении органов, в которых после системного введения могут накапливаться нуклеинокислотные лекарства, таких как печень и почки, и достижение достаточной медицинской эффективности, и все еще нет молекулы, которая могла бы стать в этом вопросе козырной картой. 2'-Амино LNA, которая была разработана Wengel с соавторами в 1998 году (далее по тексту именуется "ALNA") (патентный документ 1 и непатентный документ 1), помогает синтезировать различные искусственные нуклеиновые кислоты путем модификации заместителя в положении 2' и т.д., и к настоящему моменту были синтезированы многочисленные производные ALNA, главным образом, включающие алкильные или ацильные производные (патентные документы 2-4 и непатентные документы 2-11). Также сообщалось о характерном распределении в тканях после системного введения (непатентный документ 12). Однако эти соединения обладают недостаточной фармакологической активностью, и поэтому они до настоящего момента не применялись в фармацевтике.
Авторы настоящего изобретения применили эффективный метод синтеза GuNA, ранее разработанный (патентный документ 5 и непатентный документ 13) для синтеза широкого ряда разнообразных новых производных ALNA, провели скрининг по оценке фармакологической активности и обнаружили новую искусственную нуклеиновую кислоту, обладающую прекрасной фармакологической активностью in vitro и in vivo по сравнению с существующими ALNA, что позволило создать настоящее изобретение.
Процитированные документы
Патентные документы
Патентный документ 1 — WO 99/014226 публикация
Патентный документ 2 — WO 2013/013068 публикация
Патентный документ 3 — WO 2014/124952 публикация
Патентный документ 4 — WO 2016/128583 публикация
Патентный документ 5 — WO 2017/047816 публикация
Непатентные документы
Непатентный документ 1 — S.K. Singh et al., J. Org. Chem. 1998, 63, 6078-6079
Непатентный документ 2 — M. D. Sorensen et al., Chem. Commun. 2003, 2130
Непатентный документ 3 — B. R. Babu et al., Chem. Commun. 2005, 13, 1705-1707
Непатентный документ 4 — T. Bryld et al., Nucleosides, Nucleotides & Nucleic Acids 2007, 26, 1645-1647
Непатентный документ 5 — M. Kalek et al., J. Am. Chem. Soc. 2007, 129, 9392-9400
Непатентный документ 6 — T. Umemoto et al., Org. Biomol. Chem. 2009, 7, 1793-1797
Непатентный документ 7 — M. W. Johannsen et al., Org. Biomol. Chem. 2011, 9, 243-252
Непатентный документ 8 — A. S. Jφrgensen et al., Chem. Commun. 2013, 49, 10751-10753
Непатентный документ 9 — I. K. Astakhova et al., Acc. Chem. Res. 2014, 47, 1768-1777
Непатентный документ 10 — C. Lou et al., Chem. Commun. 2015, 51, 4024-4027
Непатентный документ 11 — A. Ries et al., J. Org. Chem. 2016, 81, 10845-10856
Непатентный документ 12 — K. Fluiter et al., Chem. Bio. Chem. 2005, 6, 1104-1109
Непатентный документ 13 — H. Sawamoto et al., Org. Lett. 2018, 20, 1928-1931
Краткое описание изобретения
Задачи, на решение которых направлено изобретение
Настоящее изобретение касается новой мостиковой искусственной нуклеиновой кислоты, а также олигомера, содержащего ее в качестве мономера.
Способы решения поставленных задач
Для решения описанных выше задач авторы настоящего изобретения провели обширное исследование с целью поиска новой 2'-амино LNA и ее солей, а также олигомера, содержащего ее в качестве мономера, что позволило создать настоящее изобретение.
Настоящее изобретение включает перечисленные ниже пункты [1]-[33], но не ограничивается только ими.
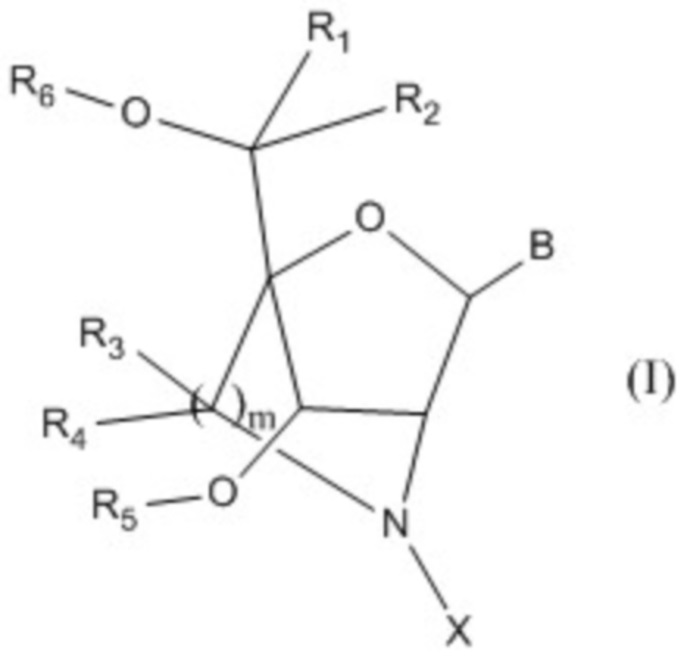
Пункт [1]. Соединение, имеющее общую формулу I:
 ,
,
где
B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
R5 и R6 независимо друг от друга представляют собой атом водорода, защитную группу для гидроксигруппы или фосфатную группу, которая необязательно может иметь заместители;
m представляет собой целое число, равное 1 или 2;
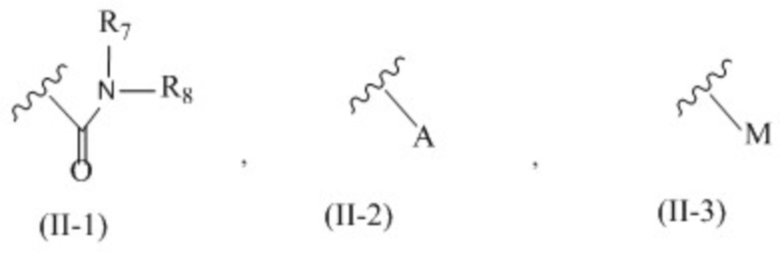
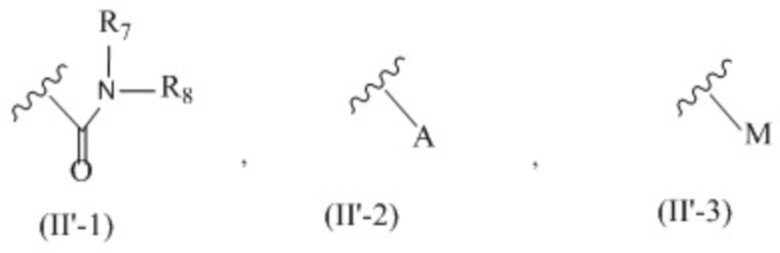
X представляет собой группу, представленную общей формулой (II-1), (II-2) или (II-3):
 ;
;
символ:
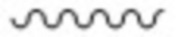 ,
,
который присутствует в формуле (II-1), (II-2) или (II-3), обозначает точку связывания с 2’-аминогруппой;
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями;
A представляет собой ароматическую группу;
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли
(далее по тексту соединение, имеющее формулу (I), или его соли называются "заявленное соединение" или "соединение по настоящему изобретению").
[2]. Соединение по п. [1] или его соль, где B представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
[3]. Соединение по п. [1] или [2] или его соли, где R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода; и
m представляет собой целое число, равное 1.
[4]. Соединение по любому из пп. [1]-[3] или его соли, где
X представляет собой группу, представленную формулой (II-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
[5]. Соединение по п. [4] или его соли, где R7 и R8 независимо друг от друга представляют собой атом водорода или C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями.
[6]. Соединение по п. [5] или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
[7]. Соединение по п. [5] или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
[8]. Соединение по любому из пп. [1]-[3] или его соли, где
X представляет собой группу, представленную формулой (II-2);
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или больше гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
[9]. Соединение по п. [8] или его соли, где A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, при условии что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители выбраны независимо друг от друга из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
[10]. Соединение по п. [9] или его соли, где указанная пяти- или шестичленная гетероарильная группа представляет собой группу, выбранную из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
[11]. Соединение по п. [10] или его соли, где триазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
[12]. Соединение по п. [10] или его соли, где оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
[13]. Соединение по п. [10] или его соли, где тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
[14]. Соединение по любому из пп. [1]-[3] или его соли, где
X представляет собой группу, представленную формулой (II-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
[15]. Соединение по п. [14] или его соли, где M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
[16]. Соединение по любому из пп. [1]-[15] или его соли, где R6 представляет собой атом водорода или DMTr группу, и R5 представляет собой атом водорода или -P(O(CH2)2CN)(N(ipr)2).
[17]. Соединение, выбранное из группы, состоящей из следующих соединений:
3-[[(1R,4R,6R,7S)-4-[[бис(4-метоксифенил)-фенилметокси]метил]-6-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-метилсульфонил-5-окса-2-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 1);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 2);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 3);
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-пурин-6-ил]бензамид (заявленное соединение 4);
3-[[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 5);
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил)окси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 6);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 7);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 8);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(метилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 9);
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 10);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 11);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксопиримидин-1-ил)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 12);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(изопропилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 13);
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 14);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N,N-диметил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 15);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N,N-диметил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 16);
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 17);
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 18);
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметил-6-формамидин (заявленное соединение 19);
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 20);
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 21);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 22);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 23);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 24);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 25);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-4-ил]бензамид (заявленное соединение 26);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламин)фосфанил]оксипропаннитрил (заявленное соединение 27);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-[(6-диметиламино)пиримидин-4-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 28);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)оксипропаннитрил (заявленное соединение 29);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[2-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 30);
3-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 31);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиразин-2-ил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 32);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 33);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 34);
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин (заявленное соединение 35);
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 36);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 37);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 38);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 39);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 40);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]дигидропиримидин-2-он (заявленное соединение 41);
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин (заявленное соединение 42);
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид (заявленное соединение 43); и
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид (заявленное соединение 44).
Олигонуклеотид
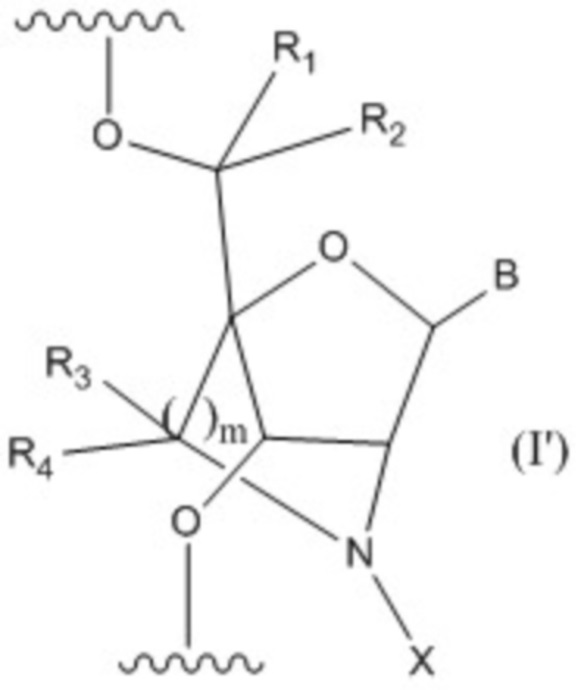
[18]. Олигонуклеотидное соединение, содержащее один или больше нуклеозидов, имеющее общую формулу (I'):
 ,
,
где
B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
m представляет собой целое число, равное 1 или 2;
X представляет собой группу, представленную общей формулой (II'-1), (II'-2) или (II'-3):
 ;
;
символ:
 ,
,
который присутствует в формуле (II'-1), (II'-2) или (II'-3), обозначает точку связывания с 2’-аминогруппой;
A представляет собой ароматическую группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями;
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли
(далее по тексту соединение, имеющее формулу (I'), или его соли называют "заявленное олигонуклеотидное соединение" или "Олигонуклеотидное соединение по настоящему изобретению").
[19]. Соединение по п. [18] или его соли, где B представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
[20]. Олигонуклеотидное соединение по [18] или [19] или его соли, где
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода; и
m представляет собой целое число, равное 1.
[21] (Соединение мочевинного типа) Олигонуклеотидное соединение по любому из пп. [18]-[20] или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
[22]. Олигонуклеотидное соединение по [21] или его соли, где R7 и R8 независимо друг от друга представляют собой атом водорода, C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями.
[23]. Олигонуклеотидное соединение по [22] или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
[24]. Олигонуклеотидное соединение по [23] или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
[25]. (Соединение арильного типа) Олигонуклеотидное соединение по любому из пп. 18-20 или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
[26]. Олигонуклеотидное соединение по [25] или его соли, где
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
[27]. Олигонуклеотидное соединение по [26] или его соли, где пяти- или шестичленная гетероарильная группа выбрана из группы, состоящей из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
[28]. Олигонуклеотидное соединение по [27] или его соли, где триазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
[29]. Олигонуклеотидное соединение по [27] или его соли, где оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
[30]. Олигонуклеотидное соединение по [27] или его соли, где тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
[31]. (Соединение сульфонамидного типа) Олигонуклеотидное соединение по любому из пп. [18]-[20] или его соли, где
X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
[32]. Соединение по любому из пп. [18]-[31] или его соли, где M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
[33]. Олигонуклеотидное соединение по любому из пп. [1]-[32] или его соли, где одна или больше фосфатных связей между нуклеотидами представляют собой тиофосфатную связь.
Эффект изобретения
Согласно настоящему изобретению можно получать новые 2'-амино LNA (далее по тексту сокращенно именуется "ALNA") и олигомер, содержащий эти ALNA в качестве мономера (далее по тексту сокращенно именуется "олигомер ALNA"). Олигомер ALNA по настоящему изобретению демонстрирует функциональное ингибирование целевой микро-РНК in vitro или потенциальную нокдаун-активность в отношении целевого гена, и при введении в живой организм демонстрирует потенциальную нокдаун-активность в отношении целевого гена во многих органах (таких как мышцы), поэтому можно ожидать его применения в качестве нового нуклеинокислотного лекарственного средства.
Варианты осуществления изобретения
Далее по тексту настоящее изобретение описано более подробно. Все процитированные в настоящем тексте публикации включены в заявку посредством ссылки.
Определения
Ниже даны определения терминов, использующихся в настоящем тексте.
Термин "C1-6 алкил, который может быть необязательно замещен одним или более заместителями" при использовании в настоящем тексте означает любую линейную алкильную группу, содержащую 1-6 атомов углерода (C1-6), предпочтительно 1-4 атомов углерода (C1-4), более предпочтительно 1-3 атомов углерода (C1-3), любую разветвленную алкильную группу, содержащую 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, любую циклическую группу, содержащую 3-6 атомов углерода, и любые их комбинации, содержащие 4-6 атомов углерода. Частные примеры линейной алкильной группы, содержащей 1-6 атомов углерода, включают метил, этил, нормальный (сокращенно обозначается "н")-пропил, изо (сокращенно обозначается "изо")-пропил, н-бутил, н-пентил и н-гексил. Частные примеры разветвленной алкильной группы, содержащей 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, включают изопропил, изобутил, третичный (сокращенно обозначается "трет")-бутил, вторичный (сокращенно обозначается "втор-")-бутил, неопентил, изопентил и другие, а примеры циклической алкильной группы, содержащей 3-6 атомов углерода, включают предпочтительно 3-6-членную моноциклическую циклоалкильную группу, и их частные примеры включают циклопропил, циклобутил, циклопентил, циклогексил и другие, но не ограничиваются только ими. Примеры заместителей включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, C2-6 алкенильной группы, C2-6 алкинильной группы, C1-6 алкоксигруппы, арильной группы, арилоксигруппы, аминогруппы, которая может быть необязательно замещена C1-3 алкильной группой, оксогруппы, тиооксогруппы и C1-6 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Термин "C1-3 алкильная группа, которая может быть необязательно замещена одним или более заместителями" при использовании в настоящем тексте представляет собой метил, этил, н-пропил или изопропил, каждый из которых может быть замещен одним или более галогенами, как описано выше для термина "C1-3 алкильная группа, которая может быть необязательно замещена одним или более заместителями". Их частные примеры включают перфторалкил (такой как трифторметил, пентафторэтил или гептафторпропил) и другие.
Термин "C2-6 алкенил, который может быть необязательно замещен одним или более заместителями" при использовании в настоящем тексте означает любую линейную алкенильную группу, содержащую 2-6 атомов углерода (C2-6), предпочтительно содержащую 2-4 атомов углерода (C2-4), более предпочтительно содержащую 2-3 атомов углерода (C2-3), любую разветвленную алкенильную группу, содержащую 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, любую циклическую алкенильную группу, содержащую 3-6 атомов углерода, и любые их комбинации, содержащие 4-6 атомов углерода. Частные примеры линейной алкенильной группы, содержащей 2-6 атомов углерода, включают этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил и другие. Частные примеры разветвленной алкенильной группы, содержащей 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, включают изопропенил, 1-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 1-метил-2-бутенил и другие, а примеры циклической алкенильной группы, содержащей 3-6 атомов углерода, включают 3-6-членные моноциклические циклоалкенильные группы, и их частные примеры включают циклопропенил, циклобутенил, циклопентенил, циклогексенил и другие. Примеры заместителей включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, C2-6 алкенильной группы, C2-6 алкинильной группы, C1-6 алкоксигруппы, арильной группы, арилоксигруппы, аминогруппы, которая может быть необязательно замещена C1-3 алкильной группой, оксогруппы, тиооксогруппы и C1-6 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Термин "C2-6 алкинил, который может быть необязательно замещен одним или более заместителями" при использовании в настоящем тексте означает любую линейную алкинильную группу, содержащую 2-6 атомов углерода (C2-6), предпочтительно любую линейную алкинильную группу, содержащую 2-4 атомов углерода (C2-4), более предпочтительно любую линейную алкинильную группу, содержащую 2-3 атомов углерода (C2-3), любую разветвленную алкинильную группу, содержащую 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, любую циклическую алкинильную группу, содержащую 3-6 атомов углерода, и любые их комбинации, содержащие 4-6 атомов углерода. Частные примеры линейной алкинильной группы, содержащей 2-6 атомов углерода, включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил и другие. Частные примеры разветвленной алкинильной группы, содержащей 3-6 атомов углерода, в которой присутствуют одинаковые или разные разветвленные цепочки, включают изопропинил, 1-метил-1-пропинил, 1-метил-2-пропинил, 2-метил-1-пропинил, 2-метил-2-пропинил, 1-метил-2-бутинил и другие, а примеры циклической алкинильной группы, содержащей 3-6 атомов углерода, включают предпочтительно 3-6-членные моноциклические циклоалкинильные группы, и их частные примеры включают циклобутинил, циклопентинил, циклогексинил и другие, но не ограничиваются только ими. Примеры заместителей включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, C2-6 алкенильной группы, C2-6 алкинильной группы, C1-6 алкоксигруппы, арильной группы, арилоксигруппы, аминогруппы, которая может быть необязательно замещена C1-3 алкильной группой, оксогруппы, тиооксогруппы и C1-6 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Термин "ароматическая группа, которая может быть необязательно замещена одним или более заместителями" при использовании в настоящем тексте охватывает как арильную группу, так и гетероарильную группу. Арильная группа и гетероарильная группа независимо друг от друга могут быть замещены одним или более заместителями. Примеры заместителей включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильной группы, которая может быть необязательно замещена одним или более заместителями, гидроксигруппы, C1-6 алкоксигруппы, арилоксигруппы, аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами, C1-6 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, и арильной группы, предпочтительно – из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами, и атома галогена, и более предпочтительно – из трифторметильной группы, диметиламиногруппы, атома хлора и других, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Термин "арил (арильная группа)" при использовании в настоящем тексте означает функциональную группу или группу-заместитель, которая образована из ароматической углеводородной группы и охватывает группы, состоящие из нескольких циклов, и в частности представляет собой одновалентную группу, содержащую 6-14 атомов углерода, в которой один атом водорода оторван от атома ароматического углеводорода, состоящую из одного или больше 5-членных и/или 6-членных колец, и включает, например, фенил, инденил, нафтил, фенантренил, антраценил и другие. Примеры заместителей для арильных групп также включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильной группы, которая может быть необязательно замещена одним или более заместителями, C1-6 алкоксигруппы, арилоксигруппы, аминогруппы, аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами, и арильной группы, предпочтительно C1-6 алкильная группа, которая может быть необязательно замещена одним или более заместителями, аминогруппа, которая может быть необязательно замещена одной или более C1-3 алкильными группами, и атом галогена, и более предпочтительно – трифторметильная группа, диметиламиногруппа, атом хлора и другие, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Частные примеры арильной группы, которая может быть необязательно замещена одним или более заместителями, включают 2-метилфенил, 3-метилфенил, 4-метилфенил, 2,6-диметилфенил, 2,4-диметилфенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2,4-дихлорфенил, 2,5-дихлорфенил, 2,6-дихлорфенил, 2-бромфенил, 4-метоксифенил, 4-хлорфенил, 2-нитрофенил, 4-нитрофенил, 2-нитрофенил, 2,6-динитрофенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-диметиламинофенил, 3-диметиламинофенил, 4-диметиламинофенил, бифенил и другие. Предпочтительные примеры арильной группы включают фенильную группу, которая замещена атомом галогена, C1-6 алкоксигруппой или нитрогруппой, или незамещенную фенильную группу.
Термин "гетероарил (гетероарильная группа)" при использовании в настоящем тексте означает одновалентную группу, в которой один атом водорода оторван от гетероароматического соединения, содержащего один или более гетероатомов (таких как атом азота, атом кислорода и/или атом серы) в кольцевой структуре и имеющего 5-12 атомов углерода, состоящую из одного или более 5-членных и/или 6-членных колец, и предпочтительно – 5-членную циклическую или 6-членную циклическую гетероарильную группу. Частные примеры гетероарильной группы включают 5-членную циклическую гетероарильную группу, выбранную из пирролила, фурила, тиенила, пиразолила, имидазолила, триазолила, тетразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, оксадиазолила и тиадиазолила; 6-членную циклическую гетероарильную группу, выбранную из пиридила, пиридазинила, пиримидинила и пиразинила, и предпочтительно триазолил, оксадиазолил, тиадиазолил, пиримидинил или пиразинил. Примеры заместителей для гетероарильных групп также включают одну или более (или, предпочтительно, от одной до трех) одинаковых или разных групп, выбранных из группы, состоящей из гидроксигруппы, атома галогена, нитрогруппы, цианогруппы, C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильной группы, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильной группы, которая может быть необязательно замещена одним или более заместителями, C1-6 алкоксигруппы, арилоксигруппы, аминогруппы, аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами, и арильной группы, предпочтительно C1-6 алкильная группа, которая может быть необязательно замещена одним или более заместителями, аминогруппа, которая может быть необязательно замещена одной или более C1-3 алкильными группами, и атом галогена, и более предпочтительно – трифторметильная группа, диметиламиногруппа, атом хлора и другие, и в состав предпочтительно входят группы, устойчивые в условиях реакции олигомеризации.
Частные примеры гетероарильной группы, которая может быть необязательно замещена одним или более заместителями, включают 1,2,4-триазолил, 1,5-диметил-1,2,4-триазолил, 1,2,4-оксадиазолил, 5-метил-1,2,4-оксадиазол-3-ил, 1,2,4-тиадиазолил, 3-метил-1,2,4-тиадиазол-5-ил, 1,3-пиримидинил, 1,5-пиримидинил, 4-трифторметил, 1,5-пиримидинил, 4-диметиламино-2,4-пиримидинил, 3-диметиламино-2,4-пиримидинил, 3-хлор-1,5-пиримидинил и 1,4-пиридазинил, и предпочтительно 1,5-диметил-1,2,4-триазол-3-ил, 1,2,4-оксадиазолил, 3-метил-1,2,4-тиадиазол-5-ил, 1,5-пиримидинил, 4-трифторметил-1,5-пиримидинил, 4-диметиламино-2,4-пиримидинил, 3-диметиламино-2,4-пиримидинил, 3-хлор-1,5-пиримидинил и 1,4-пиридазинил, и более предпочтительно 1,5-диметил-1,2,4-триазол-3-ил, 1,2,4-оксадиазол-3-ил и 3-метил-1,2,4-тиадиазол-5-ил.
Примеры для термина "пяти- или шестичленная гетероарильная группа, содержащая один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями" при использовании в настоящем тексте включают 5-членную циклическую или 6-членную циклическую гетероарильную группу, которая может быть необязательно замещена одним или более заместителями, перечисленными выше при описании термина "гетероарильная группа".
Термин "пяти- или шестичленная гетероарильная группа, содержащая два или три гетероатома, выбранных из атома азота, атома кислорода и атома серы, при условии что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями" при использовании в настоящем тексте означает триазолил, оксадиазолил, тиадиазолил, пиримидинил и пиридазинил, каждый из которых может быть замещен одним или более заместителями, перечисленными выше при описании термина "гетероарильная группа”.
Термин "сульфонильная группа, которая имеет один заместитель, выбранный из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями" означает сульфонильную (S(O)2) группу, которая замещена одним из указанных заместителей. C1-6 алкильная группа, которая может быть необязательно замещена одним или более заместителями, или ароматическая группа, которая может быть необязательно замещена одним или более указанными выше заместителями, и частные примеры заместителей включают метил, трифторметил, фенил, 4-метилфенил и другие, предпочтительно метил и фенил.
Термин "C1-6 алкоксигруппа" при использовании в настоящем тексте означает одновалентную группу, в которой C1-6 алкил связан с атомом кислорода, и представляет собой C1-6 алкил-O группу. Их частные примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, 3-метилбутокси и другие, но не ограничиваются только ими.
Термин "арилокси (группа)" при использовании в настоящем тексте означает одновалентную группу, в которой арильная группа связана с атомом кислорода. Ее частные примеры включают фенокси, п-толил и другие, но не ограничиваются только ими.
Термин "аминогруппа, которая может быть необязательно замещена одной или более C1-3 алкильными группами" при использовании в настоящем тексте означает аминогруппу, в которой один или более атомов водорода могут необязательно быть замещены C1-3 алкильной группой. Ее частные примеры включают метиламино-, этиламино-, изопропиламино-, диметиламино-, диэтиламино-, метилэтиламиногруппу и другие, но не ограничиваются только ими.
Примеры для термина "галоген (атом галогена)" при использовании в настоящем тексте включают атом фтора (фтор), атом хлора (хлор), атом брома (бром) и атом иода (иод), при этом предпочтительны атом фтора или атом хлора.
В контексте настоящего изобретения, когда соединение по настоящему изобретению, промежуточное соединение или исходное соединение и другие содержит функциональную группу (такую как гидроксигруппа, аминогруппа, карбоксильная группа и другие), эта функциональная группа может быть защищена защитной группой, обычно применяемой в органической синтетической химии согласно методам, опубликованным в книге Theodora W. Greene, Peter G. M. Wuts, "Protective Groups in Organic Synthesis" 4-е изд., John Wiley & Sons, Inc. 1999, и после прохождения реакции защитную группу можно удалить с получением целевого соединения. Примеры защитных групп включают защитные группы, обычно применяемые в синтетической органической химии, как описано в указанном выше источнике, и примеры каждой защитной группы в зависимости от функциональной группы описаны ниже.
Термин "защитная группа" в контексте терминов "защитная группа для гидроксигруппы", "защитная группа для аминогруппы", "защитная группа для фосфатной группы" или "защитная группа для меркаптогруппы" при использовании в настоящем тексте не ограничивается какой-либо группой, при условии, что она может стабильно защищать аминогруппу, гидроксигруппу, фосфатную группу или меркаптогруппу в ходе синтеза нуклеиновой кислоты. Их частные примеры включают защитную группу, которая устойчива в кислых или нейтральных условиях, а также может быть отщеплена таким химическим методом как гидрогенолиз, гидролиз, электролиз и фотолиз. Примеры такой защитной группы включают алкильную группу, содержащую 1-6 атомов углерода; алкенильную группу, содержащую 2-6 атомов углерода; алкинильную группу, содержащую 2-6 атомов углерода; ацильную группу; тетрагидропиранильную группу или тетрагидротиопиранильную группу; тетрагидрофуранильную группу или тетрагидротиофуранильную группу; силильную группу; метильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода; метильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода, где указанная алкоксигруппа замещена алкоксигруппой, содержащей 1-6 атомов углерода; метильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода, где указанная алкоксигруппа замещена атомом галогена; этильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода; этильную группу, замещенную атомом галогена; метильную группу, замещенную 1–3 арильными группами; метильную группу, замещенную 1 – 3 арильными группами, где указанные арильные группы замещены алкильными группами, содержащими 1-6 атомов углерода, алкенильными группами, содержащими 2-6 атомов углерода, алкинильными группами, содержащими 2-6 атомов углерода, алкоксигруппами, содержащими 1-6 атомов углерода, атомом галогена и/или цианогруппой; карбонильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода; арильную группу, замещенную атомом галогена, алкоксигруппой, содержащей 1-6 атомов углерода и/или нитрогруппой; карбонильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода, где указанная алкоксигруппа замещена атомом галогена и/или силильной группой, замещенной алкильной группой, содержащей 1-6 атомов углерода; алкенилоксикарбонильную группу; аралкилоксикарбонильную группу, которая может быть необязательно замещена алкоксигруппой, содержащей 1-6 атомов углерода, и/или арильную группу, замещенную нитригруппой, и другие.
Термин "защитная группа для гидроксигруппы" означает защитную группу, которая обычно применяется в синтетической органической химии (в частности, в синтезе нуклеиновых кислот), и включает, например, алифатическую ацильную группу; ароматическую ацильную группу; аминокарбонильную группу, которая может иметь заместители; алкоксикарбонильную группу, которая может иметь заместители; алифатическую сульфонильную группу; ароматическую сульфонильную группу; метильную группу, замещенную 1–3 арильными группами; метильную группу, замещенную 1–3 арильными группами, где указанные арильные группы замещены алкильной группой, содержащей 1-6 атомов углерода, алкоксигруппой, содержащей 1-6 атомов углерода, атомом галогена и/или цианогруппой; или силильную группу. Их частные примеры включают бензил (Bn), 4,4'-диметокситритил (DMTr), 4-метокситритил, трифенилметил, 2-нафтилметил, дифениламинокарбонил (DPC), цианоэтоксикарбонил, тетрагидропиранил, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, терт-бутилдифенилсилил, трифенилсилил, 4-метоксибензил (п-метоксибензил), 3,4-диметоксибензил, 2,6-диметоксибензил, п-фенилбензил, метансульфонил, трифторметансульфонил, метоксиметил, бензоил (Br), феноксиацетил, ацетил и другие, но не ограничиваясь только ими. Бензил (Bn), 4,4'-диметокситритил (DMTr), трет-бутилдиметилсилил, трет-бутилдифенилсилил, триметилсилил (TMS), дифениламинокарбонил (DPC), метансульфонил и трифторметансульфонил являются предпочтительными, и 4,4'-диметокситритил (DMTr) является более предпочтительным.
Термин "фосфатная группа, которая может быть необязательно замещена" при использовании в настоящем тексте означает фосфат, фосфит или гидрофосфит, каждый из которых необязательно может иметь заместители (которые включают защитные группы). Данный термин охватывает фосфатную группу, имеющую формулу -P(RP1)RP2, где RP1 и RP2 независимо друг от друга представляют собой гидроксигруппу, гидроксигруппу, которая защищена защитной группой для синтеза нуклеиновых кислот, меркаптогруппу, меркаптогруппу, которая защищена защитной группой для синтеза нуклеиновых кислот, аминогруппу, алкоксигруппу, содержащую 1-5 атомов углерода, алкилтиогруппу, содержащую 1-6 атомов углерода, цианоалкоксигруппу, содержащую 1-6 атомов углерода, или аминогруппу, которая замещена алкильной группой, содержащей 1-6 атомов углерода. В настоящем тексте группы, имеющие приведенную выше формулу, где RP1 представляет собой ORP1a и RP2 представляет собой NRP2a, называют "фосфорамидитной группой", которая является предпочтительным примером. RP1a представляет собой алкильную группу, содержащую 1-5 атомов углерода, или цианоалкильную группу, содержащую 1-6 атомов углерода, и RP2a представляет собой алкильную группу, содержащую 1-6 атомов углерода. Частные примеры "фосфорамидитной группы" включают группу, имеющую формулу -P(O(CH2)2CN)(N(iPr)2), или группу, имеющую формулу -P(OCH3)(N(iPr)2), и другие, но не ограничиваясь только ими. Предпочтительной является группа, имеющая формулу -P(O(CH2)2CN)(N(iPr)2). Здесь "iPr" представляет собой изопропильную группу.
"Фосфатная группа, которая может быть необязательно замещена заместителями" при использовании в настоящем тексте может формировать хиральное вспомогательное вещество, содержащее атом фосфора. Частные примеры хирального вспомогательного вещества, содержащего атом фосфора, включают оптически активный бициклический оксазафосфолидин, который описан в непатентном документе, N. Oka et al., J. AM. CHEM. SOC. 2008, 130, 16031, и оптически активный 2-тио-1,3,2-окса-тиафосфаран, содержащий пятивалентный атом фосфора, который описан в Непатентном Документе, K. W. Knouse et al., Science 10. 1126/science. aau3369 (2018), но не ограничиваясь только ими.
Термин "защитная группа для аминогруппы" означает защитную группу, которая обычно применяется в синтетической органической химии (в частности, в синтезе нуклеиновых кислот) и включает, например, алифатическую ацильную группу; ароматическую ацильную группу; алкоксикарбонильную группу, которая может быть необязательно замещена; метильную группу, замещенную 1 – 3 арильными группами; и метильную группу, замещенную арильными группами, где указанные арильные группы замещены атомом галогена и/или цианогруппой. Их частные примеры включают ацетильную (Ac), феноксиацетильную (Pac), трет-бутилфеноксиацетильную группу (Tac), п-изопропил-феноксиацетильную группу (iPc-Pac), трифторацетильную, пропионильную группу, изобутирильную, бензоильную (Bz), метоксикарбонильную, этоксикарбонильную, трет-бутоксикарбонильную (Boc), триметилсилилэтоксикарбонильную (Teoc), цианоэтоксикарбонильную (Ceoc), бензилоксикарбонильную (Cbz), аллилоксикарбонильную, 9-флуоренилметоксикарбонильную (Fmoc), диметиламинометиленильную, 2,2,2-трихлорэтоксикарбонильную, трет-амилоксикарбонильную, 4-метоксибензильную, трифенилметильную, 2-нитробензолсульфонильную, 2,4-динитробензолсульфонильную или 2-(триметилсилил)этоксиметильную группу и другие, но не ограничиваются только ими. Предпочтительными являются изобутирильная, бензоильная (Bz), трет-бутоксикарбонильная (Boc) и триметилсилилэтоксикарбонильная (Teoc) группа.
Термин "защитная группа для фосфатной группы" означает защитную группу, которая обычно применяется в синтетической органической химии (в частности, в синтезе нуклеиновых кислот), и ее примеры включают алкильную группу, содержащую 1-6 атомов углерода, и/или алкильную группу, содержащую 1-6 атомов углерода, замещенную цианогруппой; аралкильную группу; аралкильную группу, замещенную арильной группой, где указанная арильная группа замещена нитрогруппой и/или атомом галогена; арильную группу, замещенную алкильной группой, содержащей 1-6 атомов углерода, атомом галогена или нитрогруппой; 2-цианоэтильную группу; 2,2,2-трихлорэтильную группу; бензильную группу; 2-хлорфенильную группу и 4-хлорфенильную группу, и другие, но не ограничиваются только ими.
Термин "защитная группа для меркаптогруппы" означает защитную группу, которая обычно применяется в синтетической органической химии (в частности, в синтезе нуклеиновых кислот), и включает, например, алифатическую ацильную группу, ароматическую ацильную группу, бензоильную группу (Bz), и другие, но не ограничиваются только ими.
Термин "уходящая группа" при использовании в настоящем тексте означает часть субстрата, содержащую пару электронов, которая создается, когда субстрат гетеролитически расщепляется во время реакции, и этот термин охватывает атом галогена (такой как атом фтора, атом хлора, атом брома, атом иода) и "уходящую группу для гидроксила". Примеры уходящей группы для гидроксила включают сульфонилоксигруппу (такую как паратолуолсульфонилокси-, мезилокси и трифторметансульфонилоксигруппа), ацилоксигруппу (предпочтительно, насыщенную или ненасыщенную ацилоксигруппу, содержащую 1-8 атомов углерода, например арильную группу, представленную формулой RL-C(=O)-O-, где RL представляет собой арильную группу, которая может быть необязательно замещена алкильной группой (общее число атомов углерода предпочтительно составляет от 6 до 8, например фенил или п-толил), арилоксигруппу, которая может быть необязательно замещена алкильной группой (общее число атомов углерода предпочтительно составляет от 6 до 8, например фенокси или п-толилокси), аралкильную группу (общее число атомов углерода предпочтительно составляет от 7 до 9, например бензил), арилалкенильную группу (общее число атомов углерода предпочтительно составляет 8 или 9, например циннамил), аралкилоксигруппу (общее число атомов углерода составляет от 7 до 15, например бензилокси или 9-флуоренилметилокси), алкоксигруппу (линейную или разветвленную алкоксигруппу, например метокси, этокси, трет-бутокси), и частные примеры уходящей группы включают иод, бром, хлор, фтор, мезилокси, метансульфонилокси, трифторметансульфонилокси, этансульфонилокси, 2,2,2-трифторэтансульфонилокси, пропансульфонилокси, изопропансульфонилокси, бутансульфонилокси, нонафторбутансульфонилокси, гептафторпропан-1-сульфонилокси, пентансульфонилокси, пентафтопентансульфонилокси, пентансульфонилокси, циклопентансульфонилокси, гексансульфонилокси, циклогексансульфонилокси, o-толуолсульфонилокси, м-толуолсульфонилокси, п-толуолсульфонилокси, бензолсульфонилокси, o-бромбензолсульфонилокси, м-бромбензолсульфонилокси, п-бромбензолсульфонилокси, o-нитробензолсульфонилокси, м-нитробензолсульфонилокси и п-нитробензолсульфонилокси и другие, но не ограничиваются только ими. Предпочтительные примеры уходящей группы включают метансульфонилокси (мезилокси; Ms-O-), трифторметансульфонилокси и п-толуолсульфонилокси.
Примеры "ацильной группы" при использовании в настоящем тексте включают алифатическую ацильную группу и ароматическую ацильную группу. Частные примеры алифатической ацильной группы включают алкилкарбонильную группу, такую как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил, изовалерил, октаноил, нонаноил, деканоил, 3-метилнонаноил, 8-метилнонаноил, 3-этилоктаноил, 3,7-диметилоктаноил, ундеканоил, додеканоил. тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, 1-метилпентадеканоил, 14-метилпентадеканоил, 13,13-диметилтетрадеканоил, гептадеканоил, 15-метилгексадеканоил, октадеканоил, 1-метилгептадеканоил, нонадеканоил, эйкозаноил и генайкозаноил; арилоксиалкилкарбонильную группу, такую как феноксиацетил (pac); карбоксилированную алкилкарбонильную группу, такую как сукциноил, глутароил и адипоил; карбонильную группу, замещенную алкильной группой, содержащей 1-6 атомов углерода, где указанная алкильная группа замещена атомом галогена, такая как хлорацетильная группа, дихлорацетил, трихлорацетил, трифторацетил; алкоксиалкилкарбонильную группу, содержащую 1-6 атомов углерода, такую как метоксиацетил; и ненасыщенную алкилкарбонильную группу, такую как (E)-2-метил-2-бутеноил. Также примеры ароматической ацильной группы включают арилкарбонильную группу, такую как бензоил, α-нафтоил и β-нафтоил; галогенарилкарбонильную группу, такую как 2-бромбензоил и 4-хлорбензоил; арилкарбонильную группу, замещенную алкильной группой, содержащей 1-6 атомов углерода, такую как 2,4,6-триметилбензоил, и 4-толуолил; арилкарбонильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода, такую как 4-анизоил; карбоксилированную арилкарбонил группу, такую как 2-карбоксибензоил, 3-карбоксибензоил и 4-карбоксибензоил; нитроарилкарбонильную группу, такую как 4-нитробензоил и 2-нитробензоил; карбонилированную арилкарбонильную группу, замещенную алкоксигруппой, содержащей 1-6 атомов углерода, такую как 2-(метоксикарбонил)бензоил; и арилированную арилкарбонильную группу, такую как 4-фенилбензоил, но не ограничиваются только ими.
Термин "аралкильная группа" при использовании в настоящем тексте означает алкильную группу, содержащую 1-6 атомов углерода, предпочтительно 1-4 атомов углерода, более предпочтительно 1-3 атомов углерода, и указанная алкильная группа замещена ароматической углеводородной группой (например, 6-14-членной моноциклической, бициклической или трициклической ароматической углеводородной группой). Их частные примеры включают бензил, фенетил, 1-нафтилметил, 2-нафтилметил и другие, но не ограничиваются только ими.
Примеры термина "силильная группа" при использовании в настоящем тексте включают силильную группу, которая замещена алкильной группой, содержащей 1-6 атомов углерода, такую как триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, метил ди-трет-бутилсилил, триизопропилсилил; силильную группу, которая замещена одной или двумя арильными группами, а также тремя алкильными группами, содержащими 1-6 атомов углерода, такую как трет-бутилдифенилсилил, дифенилметилсилил, бутилдифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; и трифенилсилил, но не ограничиваются только ими.
Термин "β-форма" при использовании в настоящем тексте означает соединение, имеющее стереохимию, в которой направление замещения в замещенном основании нуклеиновой кислоты в 1'-положении рибозы нуклеиновой кислоты и направление замещения в замещенном 5'-положении боковой цепи в 4'-положении рибозы нуклеиновой кислоты являются одинаковыми. Для мостиковой искусственной нуклеиновой кислоты 2',4'-LNA, β-форма представляет собой соединение, имеющее стереохимию, в которой направление замещения в замещенном основании нуклеиновой кислоты в 1'-положении рибозы нуклеиновой кислоты и направление замещения в замещенном 5'-положении боковой цепи, не использующемся для образования мостика в 4'-положении рибозы нуклеиновой кислоты, являются одинаковыми.
Термин "β-селективный" при использовании в настоящем тексте означает, что образуется β-форма.
"Основание нуклеиновой кислоты" в термине "основание нуклеиновой кислоты, которое может быть необязательно замещено одним или более заместителями" при использовании в настоящем тексте включает, например, основание природной нуклеиновой кислоты и основание неприродной нуклеиновой кислоты, который содержит ароматический гетероцикл, и охватывает моноциклическое кольцо, бициклическое кольцо и трициклическое кольцо. Необходимо ясно понимать, что основания различных нуклеиновых кислот, которые сейчас рассматриваются как «неприродные» квалифицированными специалистами в данной области, могут быть впоследствии обнаружены в природе. Таким образом, "основание нуклеиновой кислоты" включает не только любой гетероцикл, содержащийся в общеизвестных пурине и пиримидине, но также их гетероциклические аналоги и таутомеры. Частные примеры основания нуклеиновой кислоты включают аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4,N4-этаноцитозин, N6,N6-этано-2,6-диаминопурин, 5-метилцитозин, 5-(C3-C6)-алкинилцитозин, 5-фторцитозин, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолoпиридин, изоцитозин, изогуанин, инозин, N6-арилпурин, N6-ацилпурин, N6-бензилпурин, N6-галогенпурин, N6-винилпурин, N6-ацетиленпурин, N6-ацилпурин, N6-гидроксиалкилпурин, N6-тиоалкилпурин, N2-алкилпурин, N6-алкилпиримидин, N4-ацилпиримидин, N4-бензилпурин, N4-галогенпиримидин, N4-винилпиримидин, N4-ацетиленпиримидин, N4-ацетилпиримидин, N4-гидроксиалкилпиримидин, N6-тиоалкилпиримидин, 6-азапиримидин, 6-азацитозин, 2-и/или 4-меркаптопиримидин, урацил, C5-алкилпиримидин, C5-бензилпиримидин, C5-галогенпиримидин, C5-винилпиримидин, C5-ацетиленпиримидин, C5-ацилпиримидин, C5-гидроксиалкилпурин, C5-амидопиримидин, C5-цианопиримидинил, C5-нитропиримидин, C5-аминопиримидин, N2-алкилпурин, N2-алкил-6-тиопурин, 5-цитидинил, 5-азаурацилил, триазолопиридинил, имидазолопиридинил, пирролопиримидинил, пиразолопиримидинил и другие, но не ограничиваются только ими. Предпочтительные примеры основания нуклеиновой кислоты включают аденин, гуанин, 2,6-диаминопурин, тимин, 2-тиотимин, цитозин, 5-метилцитозин, урацил, 5-фторцитозин, ксантин, 6-аминопурин, 2-аминопурин, 6-хлор-2-аминопурин и 6-хлорпурин, и особенно предпочтительные примеры основания нуклеиновой кислоты включают аденин, гуанин, цитозин, 5-метилцитозин, тимин и урацил. Основание нуклеиновой кислоты может быть дополнительно замещен одним или более заместителями, и примеры заместителей включают гидроксигруппу, C1-6 алкоксигруппу, меркаптогруппу, C1-6 алкилтиогруппу, аминогруппу, аминогруппу, замещенную C1-6 алкильной группой, C1-6 алкильную группу, C1-6 алкинильную группу, оксогруппу, тиооксогруппу и атом галогена. При необходимости и при желании, функциональный атом кислорода, атом серы и атом азота в основании могут быть защищены и/или с них могут быть удалены защитные группы. Подходящие защитные группы хорошо известны в данной области и включают, например, описанные выше защитные группы для гидроксигруппы и защитные группы для аминогруппы, и включают дифениламинокарбонильную группу, силильную группу (такую как триметилсилильная группа, диметилгексилсилильная группа, трет-бутилдиметилсилильная группа и трет-бутилдифенилсилильная группа), тритильную группу, алкильную группу, ацильную группу (такую как ацетильная группа, пропионильная группа, изобутирильная группа, бензоильная группа (Bz), феноксиацетильная группа (Pac)), алкоксикарбонильную группу (такую как трет-бутоксикарбонильная группа (Boc), бензилоксикарбонильная группа (Cbz), дифениламинокарбонильная группа (DPC), цианоэтоксикарбонильная группа (Ceoc)), сульфонильную группу (такую как метансульфонильная группа и п-толуолсульфонильная группа), диметиламинометиленильную группу и другие, но не ограничиваются только ими.
Термин "искусственная нуклеиновая кислота" при использовании в настоящем тексте означает искусственный нуклеозид, искусственный нуклеотид (в настоящем тексте нуклеозид или нуклеотид иногда называют мономером) или искусственный олигонуклеотид. Эти искусственные нуклеиновые кислоты представляют собой не природные нуклеиновые кислоты, а нуклеиновые кислоты, которые можно получить только синтетически. Примеры искусственных нуклеиновых кислот включают такие, в которых основание нуклеиновой кислоты содержит неприродное основание, такие, в которых сахарный фрагмент является модифицированным, и/или такие, которые содержат неприродную фосфатную группу в качестве фосфатного фрагмента, и искусственные нуклеиновые кислоты при использовании в настоящем тексте представляет собой такие, в которых сахарный фрагмент содержит неприродный сахар, в частности такие, которые содержат (деокси) рибозу, в которой атомы углерода в положениях 2' и 4' соединены мостиком.
Термин "искусственный олигонуклеотид" при использовании в настоящем тексте означает вещество, в котором два или более одинаковых или разных "искусственных нуклеотидов" соединены друг с другом через фосфодиэфирную связь или тиофосфодиэфирную связь и т.п., и включает вещество, в котором соединены предпочтительно от 2 до 100, более предпочтительно от 5 до 50, наиболее предпочтительно от 10 до 30 искусственных нуклеотидов, или вещество, в котором нуклеотиды вместе с их комплементарными цепями образуют двойную цепь. В настоящем тексте олигонуклеотид, в котором два или более нуклеотидов связаны друг с другом, иногда называют олигомером.
Ниже описаны варианты соединений по настоящему изобретению.
Соединение, имеющее общую формулу I
В одном варианте осуществления настоящего изобретения описано соединение, имеющее общую формулу I:
 ,
,
где
B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода, или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
R5 и R6 независимо друг от друга представляют собой атом водорода, защитную группу для гидроксигруппы или фосфатную группу, которая необязательно может иметь заместители;
m представляет собой целое число, равное 1 или 2;
X представляет собой группу, представленную общей формулой (II-1), (II-2) или (II-3):
 ;
;
символ:
 ,
,
который присутствует в формуле (II-1), (II-2) или (II-3), обозначает точку связывания с 2’-аминогруппой;
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями;
A представляет собой ароматическую группу;
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли.
В одном варианте осуществления настоящего изобретения соединение, имеющее общую формулу (I), или его соли предпочтительно представляют собой соединение, имеющее общую формулу I-a:
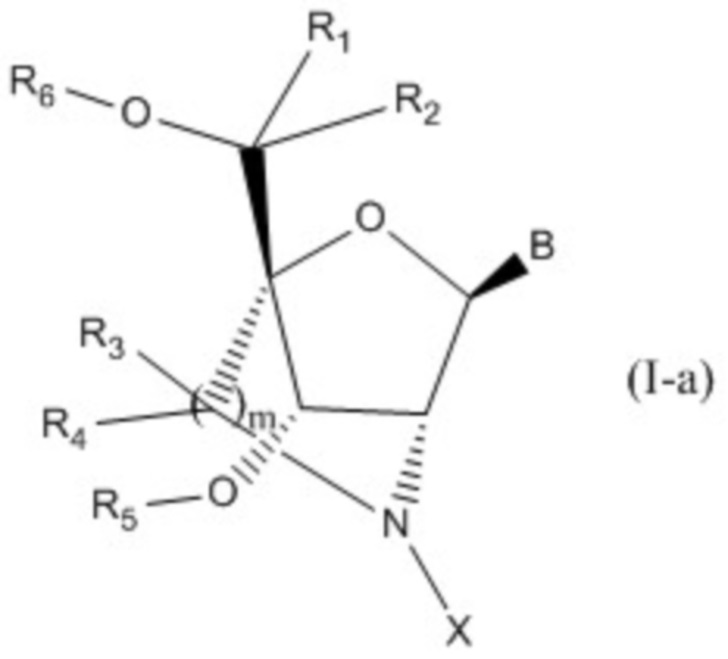
или его соли (где R1, R2, R3, R4, R5, R6, B, X и m имеют определения. указанные для общей формулы (I)).
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где кольцо B в формуле (I) представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где в формуле (I) кольцо B представляет собой 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или 5-урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где в формуле (I) R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода, и m представляет собой целое число, равное 1.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где в формуле (I) R6 представляет собой атом водорода или DMTr группу, и R5 представляет собой атом водорода или -P(O(CH2)2CN)(N(ipr)2).
В одном варианте осуществления настоящего изобретения, описано соединение, имеющее формулу (I), или его соли, где в формуле (I) R6 представляет собой DMTr группу, и R5 представляет собой атом водорода или -P(O(CH2)2CN)(N(ipr)2).
В одном варианте осуществления настоящего изобретения, соединение, имеющее формулу (I), грубо подразделяется на формулу (II-1), (II-2) или (II-3).
Во-первых, охвачено соединение, где в формуле (I) X представляет собой группу, представленную формулой (II-1) (далее по тексту именуется как "Соединение мочевинного типа").
В одном варианте осуществления настоящего изобретения описано соединение, имеющее общую формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее общую формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее общую формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, метильную группу, изопропильную группу или фенильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее общую формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
комбинация R7 и R8 представляет собой комбинацию, где R7 и R8 оба представляют собой атом водорода; комбинацию, где R7 и R8 оба представляют собой метильную группу; комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой метильную группу; комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой изопропильную группу; или комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой фенильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
комбинация R7 и R8 представляет собой комбинацию, где R7 и R8 оба представляют собой атом водорода; комбинацию, где R7 и R8 оба представляют собой метильную группу; комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу; комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу; или комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой фенильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-1); и
один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
Также настоящее изобретение охватывает соединение, где в формуле (I) X представляет собой группу, представленную формулой (II-2) (далее по тексту именуется как "соединение гетероарильного типа").
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из атома азота, атома кислорода и атома серы, при условии, что в состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, при условии что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, при условии что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атомы галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
В одном варианте осуществления настоящего изобретения описано соединение, имеющее формулу (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
пяти- или шестичленная гетероарильная группа в качестве группы А выбрана из группы, состоящей из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
триазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-2); и
тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-3); и
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-3); и
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из метильной группы, которая может быть необязательно замещена одним или более заместителями, и фенильной группы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано соединение, представленное формулой (I), или его соли, где
X представляет собой группу, представленную формулой (II-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
В одном варианте осуществления настоящего изобретения в качестве частных примеров соединения, имеющего формулу (I), или его солей описаны одно или больше соединений, выбранных из приведенных ниже соединений или их солей.
Соединения выбраны из группы, состоящей из следующих соединений:
3-[[(1R,4R,6R,7S)-4-[[бис(4-метоксифенил)-фенилметокси]метил]-6-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-метилсульфонил-5-окса-2-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 1);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 2);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 3);
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-пурин-6-ил]бензамид (заявленное соединение 4);
3-[[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 5);
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил)окси-2-окса-5-азабицикло[2.2.1] гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 6);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 7);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 8);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(метилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 9);
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 10);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 11);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксопиримидин-1-ил)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 12);
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(изопропилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 13);
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 14);
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N,N-диметил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 15);
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N,N-диметил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 16);
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 17);
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 18);
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметил-6-формамидин (заявленное соединение 19);
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 20);
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 21);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-4-ил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 22);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 23);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 24);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 25);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-4-ил]бензамид (заявленное соединение 26);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламин)фосфанил]оксипропаннитрил (заявленное соединение 27);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-[(6-диметиламино)пиримидин-4-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 28);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)оксипропаннитрил (заявленное соединение 29);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[2-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 30);
3-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 31);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиразин-2-ил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 32);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 33);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 34);
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин (заявленное соединение 35);
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 36);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 37);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 38);
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 39);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 40);
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]дигидропиримидин-2-он (заявленное соединение 41);
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин (заявленное соединение 42);
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид (заявленное соединение 43); и
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид (заявленное соединение 44).
Олигонуклеотид
Соединение, имеющее общую формулу (I')
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, содержащее один или более нуклеозидов, имеющее общую формулу (I'):
 ,
,
где
B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
m представляет собой целое число, равное 1 или 2;
X представляет собой группу, представленную общей формулой (II'-1), (II'-2) или (II'-3):
 ;
;
символ:
 ,
,
который присутствует в формуле (II'-1), (II'-2) или (II'-3), обозначает точку связывания с 2’-аминогруппой;
A представляет собой ароматическую группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями;
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
в формуле (I') кольцо B представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
в формуле (I') кольцо B представляет собой 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или 5- урацилильную группу, которая может иметь одну или более защитных групп.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
в формуле (I') R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода, и m представляет собой целое число, равное 1.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
в формуле (I') одна или больше фосфатных связей между нуклеотидами представляют собой тиофосфатную связь и являются сульфированными.
Настоящее изобретение охватывает соединение, где в формуле (I') X представляет собой группу, представленную формулой (II'-1) (далее по тексту именуется как "Соединение мочевинного типа".
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, метильную группу, изопропильную группу или фенильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
комбинация R7 и R8 представляет собой комбинацию, где R7 и R8 оба представляют собой атом водорода; комбинацию, где R7 и R8 оба представляют собой метильную группу; комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой метильную группу; комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой изопропильную группу; или комбинацию, где R7 представляет собой атом водорода, а R8 представляет собой фенильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
комбинация R7 и R8 представляет собой комбинацию, где R7 и R8 оба представляют собой атом водорода; комбинацию, где R7 и R8 оба представляют собой метильную группу; комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу; комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу; или комбинацию, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой фенильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-1); и
один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
Также настоящее изобретение охватывает соединение, где в формуле (I') X представляет собой группу, представленную формулой (II'-2) (далее по тексту именуется как "соединение гетероарильного типа").
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
пяти- или шестичленная гетероарильная группа в качестве группы A выбрана из группы, состоящей из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
триазольная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-2); и
тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из метильной группы, которая может быть необязательно замещена одним или более заместителями, и фенильной группы, которая может быть необязательно замещена одним или более заместителями.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
В одном варианте осуществления настоящего изобретения описано олигонуклеотидное соединение, имеющее формулу (I'), или его соли, где
X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
В одном варианте осуществления настоящего изобретения олигонуклеотид или его соли получены связыванием двух или более нуклеотидов, и предпочтительно содержит 2-100 нуклеотидов, более предпочтительно 5-50 нуклеотидов, и особенно предпочтительно – такие, в которых 10-30 искусственных нуклеотидов соединены или скомбинированы вместе с комплементарными цепями, образуя двойную цепь.
Термин "соль" в выражении "соли соединения" в настоящем тексте означает соли щелочных металлов, такие как соль натрия, соль калия, соль лития; соли щелочноземельных металлов, такие как соль кальция и соль магния; соли металлов, такие как соль алюминия, соль железа, соль цинка, соль меди, соль никеля и соль кобальта; неорганические соли, такие как соли аммония; соли аминов, например органические соли, такие как соль трет-октиламина, соль дибензиламина, соль морфолина, соль глюкозамина, соль алкилового эфира фенилглицина, соль этилендиамина, соль N-метилглюкамина, соль гуанидина, соль диэтиламина, соль триэтиламина, соль гексиламина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина, соль хлорпрокаина, соль прокаина, соль диэтаноламина, соль N-бензилфенетиламина, соль пиперазина, соль тетраметиламмония и соль трис(гидроксиметил)аминометана; соли неорганических кислот, например соли галогеноводородных кислот (таких как фтороводородная кислота, хлороводородная кислота, бромоводородная кислота и иодоводородная кислота), нитратная соль, перхлоратная соль, сульфатная соль и фосфатная соль; соли алкансульфокислот, содержащих от одного до шести атомов углерода, такие как соль метансульфокислоты, соль трифторметансульфокислоты, соль этансульфокислоты; соли арилсульфокислот, такие как бензолсульфонатная соль и п-толуолсульфонатная соль; соли органических кислот, такие как ацетатная соль, малатная соль, фумаратная соль, сукцинатная соль, цитратная соль, тартратная соль, оксалатная соль и малеатная соль; и соли аминокислот, такие как соль глицина, соль лизина, соль аргинина, соль орнитина, соль глутаминовой кислоты и соль аспарагиновой кислоты, но не ограничиваясь только ими. Охватываемые настоящим изобретением соли представляют собой фармацевтически приемлемые соли.
Каждое соединение, имеющее приведенную в настоящем тексте общую формулу (I), включает энантиомерную форму, диастереомерную форму или их смеси. Например, стереоконфигурация сахарного фрагмента в структуре каждого соединения охватывает α-форму и β-форму, однако предпочтительной является β-форма. Когда указанные выше соединения, имеющие общую формулу (I), получают в форме диастереомера или энантиомера, их можно разделить хорошо известными в органическом синтезе (например, в синтезе сахаров) методами, такими как метод хроматографии или метод дробной кристаллизации. Например, соединение 2Td, имеющее приведенную ниже формулу:
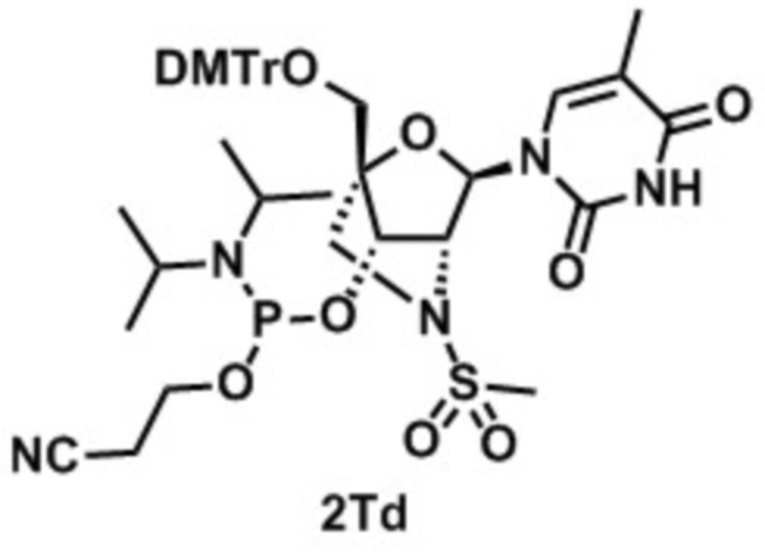
отвечает β-форме по стереоконфигурации сахарного фрагмента.
Каждое соединение, имеющее описанную в настоящем тексте общую формулу I, включает соединения, меченые изотопами (такими как 3H, 13C, 14C, 15N, 18F, 32P, 35S или 125I) и дейтерированные формы.
Описанный в настоящем тексте олигонуклеотид или его аналоги можно смешивать со вспомогательными веществами, традиционно применяемыми в приготовлении фармацевтических средств, такими как вспомогательные соединения, связующие вещества, консерванты, антиоксиданты, разрыхлители, лубриканты и ароматизаторы, для приготовления препаратов для парентерального введения или липосомных препаратов. Также, олигонуклеотид или его аналоги смешивают с фармацевтическими носителями, традиционно применяемыми в фармацевтике для приготовления препаратов для наружного применения, таких как растворы, кремы и мази.
Способ получения
Далее описан способ получения соединений по настоящему изобретению.
Оптически активные вещества, имеющие абсолютную конфигурацию, представленную указанными ниже исходными соединениями и промежуточными соединениями, можно получить, используя в качестве исходных соединений оптически активные вещества или разделяя изомеры, образующиеся на промежуточных стадиях синтеза. Также, описанная ниже реакция замещения основания нуклеиновой кислоты, в которой замещается основание нуклеиновой кислоты, может эффективно протекать в виде β-селективного трансгликозилирования, и полученное соединение, имеющее общую формулу I, может быть получено селективно в целевой β-форме.
Соединение по настоящему изобретению или его фармацевтически приемлемые соли можно получать согласно описанным ниже методам, но не ограничиваясь только ими.
В качестве исходных веществ, если не указана их специальная предварительная подготовка, можно использовать коммерчески доступные реагенты, или их можно получать согласно известным методикам или их аналогам.
Аббревиатуры при использовании в настоящем тексте имеют указанные ниже значения.
ТГФ — тетрагидрофуран
ДМСО — диметилсульфоксид
MsCl — метансульфонилхлорид
DMAP — N,N-диметил-4-аминопиридин
iPr2NEt, DIPEA — N,N-диизопропилэтиламин
BSA — N,O-бис(триметилсилил)ацетамид
TMSOTf — триметилсилилтрифторметансульфонат
TBSOTf — трет-бутилдиметилсилилтрифтор метансульфонат
Bn — бензил
TMS — триметилсилил
TBDPS — трет-бутилдифенилсилил
Ac — ацетил
MOE — метоксиэтил
CH2Cl2 — дихлорметан
MeCN — ацетонитрил
DMTr — 4,4'-диметокситритил
Ниже кратко описан способ получения соединения по настоящему изобретению (мономера).
Соединения сульфонамидного типа
Описан способ получения соединения по настоящему изобретению, имеющего общую формулу I, где X представляет собой группу, представленную формулой (II-3), так называемого соединения сульфонамидного типа. Описан типичный пример схемы получения, но изобретение им не ограничивается.
Реакционная схема 1
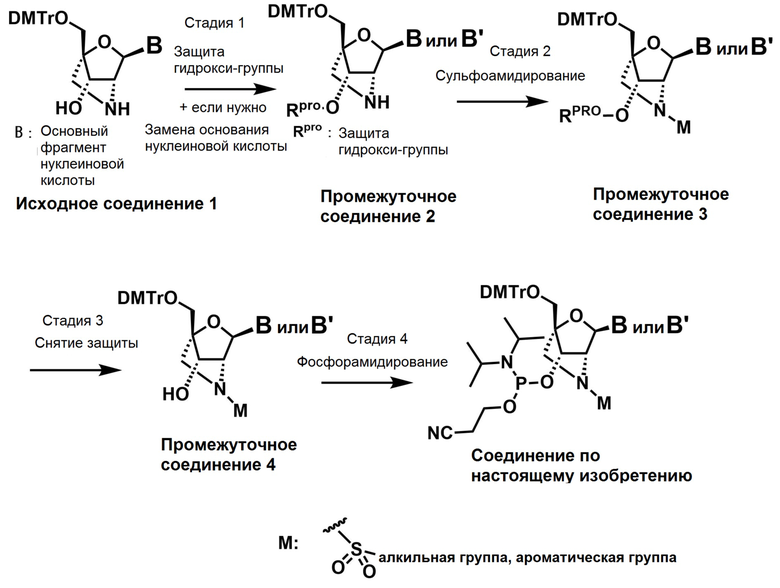
Стадия 1
Защитную группу для гидроксигруппы вводят как R5 группу в общей формуле (I), применяя в качестве исходного вещества 1 (которое можно получить, например, способом, описанным в WO 2017/047816 A1), которое представляет собой сахарное соединение, согласно известному в литературе методу, получая промежуточное соединение 2. Альтернативно, основание нуклеиновой кислоты в исходном соединении 1 (сокращенно "B") подвергают реакции обмена основания нуклеиновой кислоты с другим основанием нуклеиновой кислоты, который опционально может быть защищенным (сокращенно "B'"), и защитную группу для гидроксигруппы также вводят одновременно с реакцией обмена основания нуклеиновой кислоты, получая промежуточное соединение 2.
Такое введение защитной группы для гидроксигруппы можно проводить в условиях реакции, известных в синтетической органической химии (например, в синтезе нуклеиновых кислот), в зависимости от типа защитной группы. Например, когда защитная группа для гидроксигруппы представляет собой защитную группу силильного типа (такую как TMS), можно использовать силилирующий агент (такой как BSA, гексаметилдисилазан, TMS хлорид). В этой реакции можно добавлять кислоту Льюиса (такую как TMSOTf, TBSOTf и хлорид олова).
Силилирующий агент можно применять в количестве примерно 1-20 мольных эквивалентов, и кислоту Льюиса можно применять в количестве от каталитического (примерно 0.05 мольных эквивалентов) до примерно 2 мольных эквивалентов относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; углеводороды, такие как бензол и толуол; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от 0°C до более высокой температуры, и особенно предпочтительно при температуре от комнатной до примерно 60°C.
Также по реакции обмена основания нуклеиновой кислоты (реакция трансгликозилирования), пиримидиновый основание нуклеиновой кислоты, такое как тиминовая группа (T) и урациловая группа (U), можно заменить на другое основание нуклеиновой кислоты (например, аденин (A), гуанин (G), урацил (U), тимин (T), цитозин (C) или 5-метилцитозин (MeC), получая промежуточное соединение 2, где заменено основание нуклеиновой кислоты. Реакцию замены основания можно проводить, например, в присутствии кислоты Льюиса (такой как TMSOTf и TBSOTf), и реакцию можно ускорить путем реакции с силилирующим агентом.
Стадия 2
Затем, используя промежуточное соединение 2 в качестве исходного вещества, алкилсульфонилгалогенид или ароматический сульфонилгалогенид вводят в реакцию с промежуточным соединением 2 согласно известному в литературе методу, чтобы провести сульфоамидирование по атому азота аминогруппы, получая промежуточное соединение 3.
Примеры реагента для сульфоамидирования, использующегося в реакции сульфоамидирования, включают алкилсульфонилгалогенидный реагент (такой как метансульфонилхлорид (MsCl)), алкилсульфангидридный реагент (такой как ангидрид метансульфокислоты), ароматический сульфонилгалогенидный реагент (такой как бензолсульфонилхлорид), или ароматический сульфангидрид (такой как бензол сульфангидрид), и эти реагенты можно использовать в присутствии основания (такого как триэтиламин и DIPEA).
Реагент для сульфоамидирования можно применять в количествах от примерно эквимолярного до небольшого избытка мольных эквивалентов (например, примерно 1.0 мольный эквивалент) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; углеводороды, такие как бензол и толуол; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию предпочтительно проводят при температуре от -25°C до комнатной температуры, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
Стадия 3
Затем защитные группы для гидроксигруппы, которые ввели на стадии 1, удаляют с применением промежуточного соединения 3 в качестве исходного вещества согласно известному в литературе методу, получая промежуточное соединение 4.
Реакцию снятия защиты можно проводить в подходящих условиях (например, в плане подбора реагентов) в зависимости от вида защитной группы. Например, когда защитная группа для гидроксигруппы (сокращенно "RPRO") представляет собой защитную группу силильного типа (такую как TMS), реакцию можно проводить посредством гидролиза в кислых условиях (таких как уксусная кислота-ТГФ-вода) или путем обработки реагентом, являющимся донором фторид-иона (таким как TBAF).
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ, галогенированные углеводороды, такие как дихлорметан, вода или смеси перечисленных растворителей).
Реакцию можно проводить предпочтительно при температуре от -25°C до 100°C, особенно предпочтительно при температуре от 0°C до 50°C.
Стадия 4
Далее промежуточное соединение 4 в качестве исходного вещества подвергают реакции фосфорамидирования в условиях реакции, широко известных в органическом синтезе (в частности, в синтезе нуклеиновых кислот) (например, в отношении реагентов для получения целевого соединения по настоящему изобретению, принадлежащего к классу сульфонамидных соединений.
Примеры реагента для фосфорамидирования включают реагенты, имеющие приведенные ниже формулы:
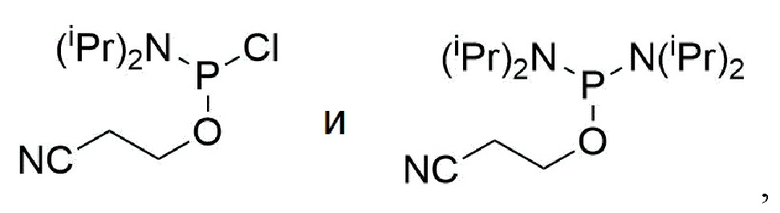 ,
,
но не ограничиваясь только ими.
Реакцию фосфорамидирования можно проводить в присутствии подходящих оснований (таких как DIPEA) или подходящих кислот (таких как диизопропиламмония тетразолид и 4,5-дицианоимидазол).
Реагент для фосфорамидирования можно применять в количестве от 1 до примерно 10 мольных эквивалентов, предпочтительно от 1 до примерно 5 мольных эквивалентов, (например, 3 мольных эквивалентов) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию предпочтительно проводят при температуре от -25°C до 60°C, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
В любой момент, начиная от времени перед описанной выше стадией 1 и заканчивая временем после описанной выше стадии 4, заместитель в кольце основания нуклеиновой кислоты можно подходящим образом модифицировать (например, посредством реакции бензоилирования или ацетилирования по аминозаместителю в цитозиновом кольце).
Также, из описанных выше стадий (1)-(4) несколько стадий (например, стадию (1) и стадию (2), и стадию (2) и стадию (3)) можно проводить последовательно.
Соединение мочевинного типа
Описан способ получения соединения по настоящему изобретению, имеющего общую формулу I, где X представляет собой группу, представленную формулой (II-1), так называемого соединения мочевинного типа. Ниже на Реакционной схеме 2 описан типичный пример схемы получения, но изобретение им не ограничивается.
Реакционная схема 2
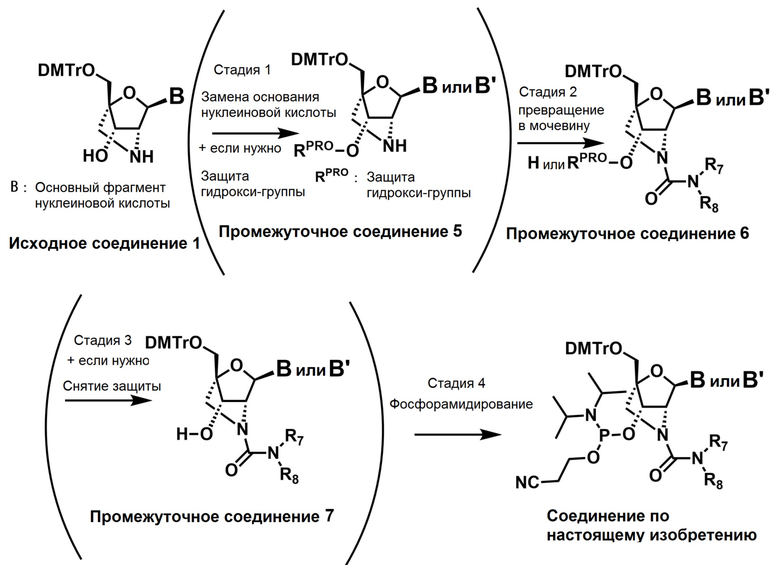
Стадия 1
Перед проведением реакции превращения в мочевину согласно известному в литературе методу, аналогично описанной выше реакционной схеме 1 с использованием соединения 1 в качестве исходного вещества, основание нуклеиновой кислоты в исходном соединении 1 (сокращенно "B") подвергают реакции обмена основания нуклеиновой кислоты с другим основанием нуклеиновой кислоты, которое опционально может быть защищено (сокращенно "B'"), и после этого можно проводить реакцию превращения в мочевину. Также, аналогично описанной выше реакционной схеме, после реакции обмена основания нуклеиновой кислоты можно ввести необходимую защитную группу для гидроксигруппы.
В реакции обмена основания нуклеиновой кислоты (реакция трансгликозилирования), согласно известному в литературе методу, пиримидиновое основание нуклеиновой кислоты, такой как тиминовая группа (T) и урациловая группа (U), можно заменить на другое основание нуклеиновой кислоты (например, аденин (A), гуанин (G), урацил (U), тимин (T), цитозин (C) или 5-метилцитозин (MeC), получая промежуточное соединение 5, где заменено основание нуклеиновой кислоты. Реакцию замены основания можно проводить, например, в присутствии кислоты Льюиса (такой как TMSOTf и TBSOTf), и реакцию можно ускорить посредством реакции с силилирующим агентом (таким как BSA).
Такое введение защитной группы для гидроксигруппы можно проводить в условиях реакции, известных в синтетической органической химии (например, в синтезе нуклеиновых кислот), в зависимости от типа защитной группы. Например, когда защитная группа для гидроксигруппы представляет собой защитную группу силильного типа (такую как TMS), можно использовать силилирующий агент (такой как BSA, гексаметилдисилазан, TMS хлорид). В этой реакции можно добавлять кислоту Льюиса (такую как TMSOTf, TBSOTf и хлорид олова).
Силилирующий агент можно применять в количестве примерно 1-20 мольных эквивалентов, а кислоту Льюиса можно применять в количестве от каталитического (примерно 0,05 мольных эквивалентов) до примерно 2 мольных эквивалентов относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; углеводороды, такие как бензол и толуол; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от 0°C до более высокой температуры, и особенно предпочтительно при температуре от комнатной до примерно 60°C.
Стадия 2
Затем, используя исходное соединение 1 или промежуточное соединение 5 в качестве исходного вещества, согласно известному в литературе методу, проводят реакцию реагента для превращения в мочевину с исходным соединением 1 или промежуточным соединением 5, осуществляя реакцию конверсии в мочевину по аминному атому азота, в результате получая промежуточное соединение 6.
Примеры реагента для превращения в мочевину в данной реакции включают изоцианат, алкилкарбамоил галогенидный реагент (такой как N-метилкарбамоилхлорид) или N,N-диалкилкарбамоил галогенидный реагент (такой как N,N-диалкил карбамоилхлорид), и эти реагенты можно использовать в присутствии основания (такого как DIPEA) или без него.
Реагент для превращения в мочевину можно применять в количестве от примерно эквимольного до небольшого избытка мольных эквивалентов (например, около 1.0 мольного эквивалента) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от -25°C до комнатной температуры, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
Стадия 3
Затем при необходимости, когда вводится защитная группа для гидроксигруппы на описанной выше стадии 1 с использованием промежуточного соединения 6 в качестве исходного вещества, согласно известному в литературе методу, введенную защитную группу для гидроксигруппы удаляют, получая промежуточное соединение 7.
Такую реакцию снятия защиты можно проводить в подходящих условиях (например, в плане выбора применяющихся реагентов) в зависимости от вида защитной группы. Например, когда защитная группа для гидроксигруппы (сокращенно "RPRO") представляет собой защитную группу силильного типа (такую как TMS), реакцию можно проводить посредством гидролиза в кислых условиях (таких как уксусная кислота-ТГФ-вода) или посредством обработки реагентом, являющимся донором фторид-иона (такой как TBAF).
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ, галогенированные углеводороды, такие как дихлорметан, вода, или смесь перечисленных растворителей).
Реакцию можно проводить предпочтительно при температуре от -25°C до 100°C, особенно предпочтительно при температуре от 0°C до 50°C.
Стадия 4
Далее, аналогично стадии 4 в описанной выше реакционной схеме 1, промежуточное соединение 6 или промежуточное соединение 7 в качестве исходного вещества подвергают реакции фосфорамидирования согласно известному в литературе методу, получая заявленное соединение целевого мочевинного типа (например, типа метилмочевины и типа изопропилмочевины).
Примеры реагента для фосфорамидирования включают 2-цианоэтил-N,N-диизопропилхлорфосфорамидит, и этот реагент можно использовать в присутствии основания (такого как триэтиламин, DIPEA).
Реагент для фосфорамидирования можно применять в количестве от 1 до примерно 10 мольных эквивалентов, предпочтительно от 1 до примерно 5 мольных эквивалентов (например, 3 мольных эквивалента) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию предпочтительно проводят при температуре от -25°C до 60°C, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
Также, из описанных выше стадий (1)-(4) несколько стадий (например, стадия (1) и стадия (2), стадия (2) и стадия (3), и стадии (1)-(3)) можно проводить последовательно.
В любой момент, начиная от времени перед описанной выше стадией 1 и заканчивая временем после описанной выше стадии 4, заместитель в кольце основания нуклеиновой кислоты можно подходящим образом модифицировать (например, посредством реакции бензоилирования или ацетилирования по аминозаместителю в цитозиновом кольце).
Соединение арильного типа
Описан способ получения соединения, имеющего общую формулу I, где X представляет собой группу, представленную формулой (II-2), так называемого соединения арильного типа. Ниже на Реакционной схеме 3 описаны примеры схемы получения.
Реакционная схема 3
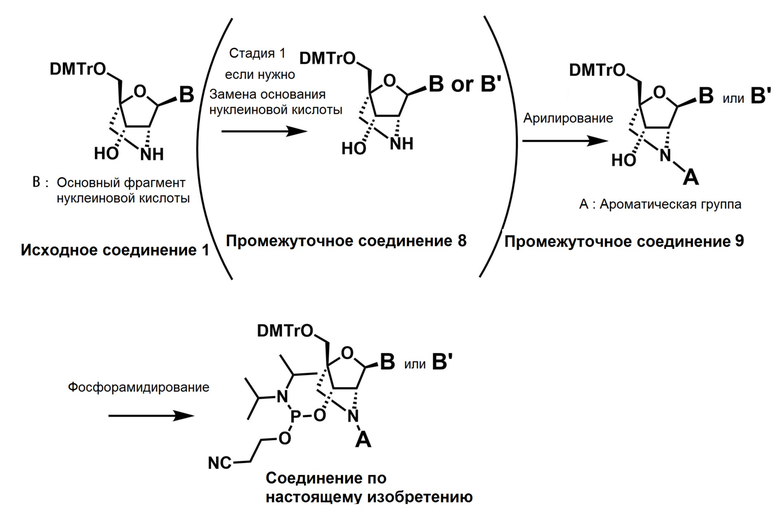
Стадия 1
Перед проведением реакции арилирования согласно известному в литературе методу, аналогично описанной выше реакционной схеме 1 с использованием соединения 1 в качестве исходного вещества, основание нуклеиновой кислоты в исходном соединении 1 (сокращенно "B") подвергают реакции обмена основания нуклеиновой кислоты с другим основанием нуклеиновой кислоты, которое опционально может быть защищено (сокращенно "B'"), и после этого можно проводить реакцию арилирования.
В реакции обмена основания нуклеиновой кислоты (реакция трансгликозилирования), согласно известному в литературе методу, пиримидиновое основание нуклеиновой кислоты, такое как тиминовая группа (T) и урациловая группа (U), можно заменить на другое основание нуклеиновой кислоты (например, аденин (A), гуанин (G), урацил (U), тимин (T), цитозин (C) или 5-метилцитозин (MeC), получая промежуточное соединение 8, где заменено основание нуклеиновой кислоты. Реакцию замены основания можно проводить, например, в присутствии кислоты Льюиса (такой как TMSOTf и TBSOTf), и реакцию можно ускорить посредством реакции с силилирующим агентом (таким как BSA).
Такое введение защитной группы для гидроксигруппы можно проводить в условиях реакции, известных в синтетической органической химии (например, в синтезе нуклеиновых кислот), в зависимости от типа защитной группы. Например, когда защитная группа для гидроксигруппы представляет собой защитную группу силильного типа (такую как TMS), можно использовать силилирующий агент (такой как BSA, гексаметилдисилазан, TMS хлорид). В этой реакции можно добавлять кислоту Льюиса (такую как TMSOTf, TBSOTf и хлорид олова).
Силилирующий агент можно применять в количестве примерно 1-20 мольных эквивалентов, а кислоту Льюиса можно применять в количестве от каталитического (примерно 0,05 мольных эквивалентов) до примерно 2 мольных эквивалентов относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; углеводороды, такие как бензол и толуол; ацетонитрил; вода; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от 0°C до более высокой температуры, и особенно предпочтительно при температуре от комнатной до примерно 60°C.
Стадия 2
Затем, используя исходное соединение 1 или промежуточное соединение 8 в качестве исходного вещества, согласно известному в литературе методу, арилирующий реагент вводят в реакцию с исходным соединением 1 или промежуточным соединением 8 для проведения реакции ароматизации по аминному атому азота, получая в результате промежуточное соединение 9.
Примеры арилирующего реагента, применяющегося в реакции арилирования, включают арилгалогенидное соединение (такое как хлорпиримидин, дихлорпиримидин, фторпиразин, хлортриазол, хлороксадиазол или хлортиадиазол), и эти реагенты можно использовать в присутствии основания (такого как DIPEA).
Арилирующий реагент можно использовать в количестве от примерно одного до примерно пяти мольных эквивалентов (например, три мольных эквивалента) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; апротонные полярные растворители, такие как ДМСО; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от комнатной до повышенной, и особенно предпочтительно при повышенной температуре (такой как 120-130°C).
Стадия 3
Далее, аналогично стадии 4 в описанной выше реакционной схеме 1, промежуточное соединение 9 или промежуточное соединение 8 в качестве исходного вещества вводят в реакцию фосфорамидирования согласно известному в литературе методу, получая заявленное соединение целевого арильного типа (например, ароматического типа или гетероарильного типа).
Примеры реагента для фосфорамидирования включают 2-цианоэтил-N,N-диизопропилхлорфосфорамидит, и эти реагенты можно использовать в присутствии основания (такого как триэтиламин, DIPEA).
Реагент для фосфорамидирования можно применять в количестве от примерно 1 до примерно 10 мольных эквивалентов, и предпочтительно от примерно 1 до примерно 5 мольных эквивалентов (например, 1-3 мольных эквивалента) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; ацетонитрил; или смесь перечисленных растворителей). Реакцию можно проводить предпочтительно при температуре от -25°C до 60°C, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
Также, из описанных выше стадий (1)-(3) несколько стадий (например, стадия (1) и стадия (2)) можно проводить последовательно.
В любой момент, начиная от времени перед описанной выше стадией 1 и заканчивая временем после описанной выше стадии 3, заместитель в кольце основания нуклеиновой кислоты можно подходящим образом модифицировать (например, посредством реакции бензоилирования или ацетилирования по аминозаместителю в цитозиновом кольце), или можно модифицировать заместители в ароматическом кольце введенной арильной группы (например, превратить атом хлора в аминогруппу), или можно модифицировать оба указанных заместителя.
Альтернативный метод проведения замены основания в нуклеиновой кислоте
Вместо реакции обмена основания нуклеиновой кислоты, описанной на стадии 1, частичное превращение основания нуклеиновой кислоты можно осуществлять посредством серии реакций, как показано ниже на реакционной схеме 4. Такую серию реакций можно проводить согласно описанному в литературе методу (например, C.H.Kim. et al., J. Med. Chem. 1987, 330, 862).
Реакционная схема 4
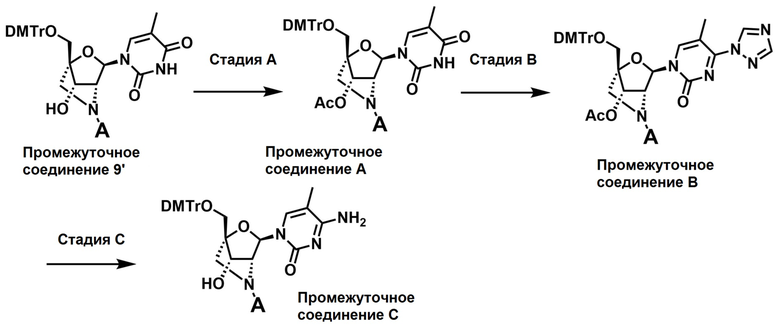
Стадия A
Промежуточное соединение 9', где основание нуклеиновой кислоты представляет собой тимин (такое как промежуточное соединение 2, полученное на описанной выше стадии 2), в качестве исходного вещества вводят в реакцию с ацетилирующим реагентом (таким как уксусный ангидрид) в присутствии основания (такого как пиридин), получая промежуточное соединение A, где гидроксигруппа ацилирована. При необходимости можно добавить каталитическое количество DMAP для активации реакции.
Ацетилирующий реагент можно использовать в количестве примерно 1-3 мольных эквивалентов (например, около 1,5 мольных эквивалентов) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; или пиридин, использующийся в качестве основания). Реакцию предпочтительно проводят при температуре от 0°C до более высокой температуры (например, при комнатной температуре).
Стадия B
После того как тиминовое основание активировано хлорирующим агентом, таким как фосфорилхлорид, промежуточное соединение A в качестве исходного вещества вводят в реакцию с 1,2,4-триазолом в присутствии основания (такого как DIPEA), получая промежуточное соединение B, где основание нуклеиновой кислоты заменен на 1,2,4-триазольную группу.
1,2,4-триазол можно использовать в избыточном мольном количестве (например, примерно от 5 до 20 мольных эквивалентов, включая количество примерно 9-10 мольных эквивалентов).
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, дихлорэтан и хлороформ; ацетонитрил; или смесь перечисленных растворителей). Реакцию предпочтительно проводят при температуре от -25°C до комнатной температуры, и особенно предпочтительно при температуре от 0°C до комнатной температуры.
Стадия C
Промежуточное соединение B в качестве исходного вещества вводят в реакцию с основанием (таким как водный раствор аммиака) для удаления ацетильной группы, которую ввели на описанной выше стадии A, и 1,2,4-триазольной группы, которая была введена на стадии B, получая промежуточное соединение C, где основание нуклеиновой кислоты представляет собой 5-метилцитозин.
Водный раствор аммиака (такой как 28%-ный водный раствор аммиака) можно использовать в мольном избытке относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ; ацетонитрил; или смесь перечисленных растворителей). Реакцию предпочтительно проводят при температуре от 0°C до комнатной температуры, и особенно предпочтительно при комнатной температуре.
Используя промежуточное соединение C в качестве исходного вещества, при необходимости модифицируют заместитель в кольце основания нуклеиновой кислоты (например, бензоилирование или ацетилирование аминового заместителя в цитозиновом кольце), или модифицируют заместитель в ароматическом кольце введенной арильной группы (например, трансформируют атом хлора в аминогруппу), и после этого заместитель вводят в реакцию фосфорамидирования, получая заявленное соединение целевого арильного типа (например, ароматического типа и гетероарильного типа).
Альтернативный метод арилирования 1
Вместо реакции ароматизации с арильным реагентом, как описано на стадии 2, можно применять серию реакций, изображенную на реакционной схеме 5, для осуществления ароматизации.
Реакционная схема 5
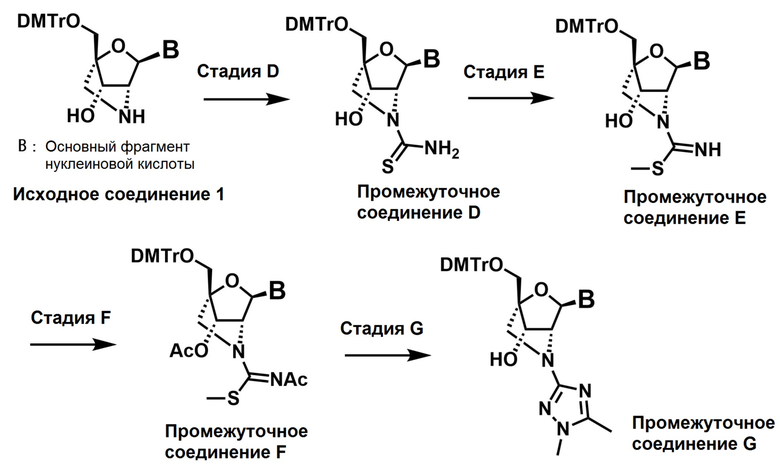
Стадия D
Описанное выше исходное соединение 1 вводят в реакцию с реагентом для превращения в тиомочевину (таким как 1,1-тиокарбонилимидазол), после чего обрабатывают водным раствором аммиака, получая промежуточное соединение D, где группа по аминному атому азота превращена в тиомочевину.
Реагент для превращения в тиомочевину можно использовать в количестве примерно 1-5 мольных эквивалентов, в частности около 2 мольных эквивалентов, относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ). Реакцию предпочтительно проводят при температуре от 0°C до комнатной температуры (например, при комнатной температуре).
Стадия E
Затем промежуточное соединение D в качестве исходного вещества вводят в реакцию с метилирующим реагентом (таким как метилиодид), получая промежуточное соединение, имеющее S-метилированный или карбоимидированный фрагмент или группу.
Метилирующий реагент можно использовать в количестве примерно 1-5 мольных эквивалентов, в частности 3 мольных эквивалента, относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ). Реакцию предпочтительно проводят при температуре от 0°C до комнатной температуры (например, при комнатной температуре).
Стадия F
Промежуточное соединение E в качестве исходного вещества вводят в реакцию с ацетилирующим реагентом (таким как уксусный ангидрид) в присутствии основания (такого как пиридин), получая промежуточное соединение F, претерпевшее ацилирование по карбодиимидной группе и гидроксигруппе. При необходимости можно добавить каталитическое количество DMAP для активации реакции.
Ацетилирующий реагент можно применять в количестве примерно 1-5 мольных эквивалентов (например, примерно 3 мольных эквивалента) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, простые эфиры, такие как ТГФ, или пиридин, применяющийся в качестве основания). Реакцию предпочтительно проводят при температуре от 0°C до комнатной температуры (например, при комнатной температуре).
Стадия G
Промежуточное соединение F в качестве исходного вещества подвергают реакции замыкания кольца с метилгидразином, получая промежуточное соединение G, где сформировано 1,2,4-триазольное кольцо.
Метилгидразин можно использовать в избыточном мольном количестве (например, примерно от 5 до 20 мольных эквивалентов (например, около 10 мольных эквивалентов)) относительно 1 моля субстрата.
Растворители могут быть любыми, при условии, что они не оказывают негативного влияния на прохождение реакции, и реакцию можно проводить в подходящих растворителях (например, спирты, такие как этанол). Реакцию предпочтительно проводят при температуре от 0°C до более высокой температуры (например, при комнатной температуре).
Используя полученное промежуточное соединение G в качестве исходного вещества, при необходимости модифицируют заместитель в кольце основания нуклеиновой кислоты (например, проводят бензоилирование или другую модификацию по амино-заместителю в цитозиновом кольце) или модифицируют заместитель в ароматическом кольце введенной арильной группы (например, трансформируют атом хлора в аминогруппу), и после этого заместитель подвергают реакции фосфорамидирования, получая заявленное соединение целевого арильного типа (например, ароматического типа и гетероарильного типа).
Способ получения олигомера
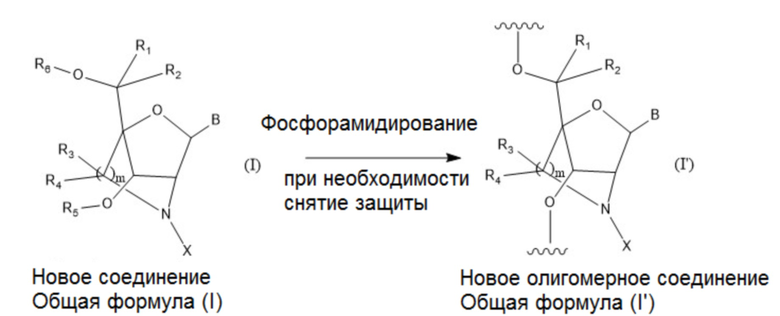
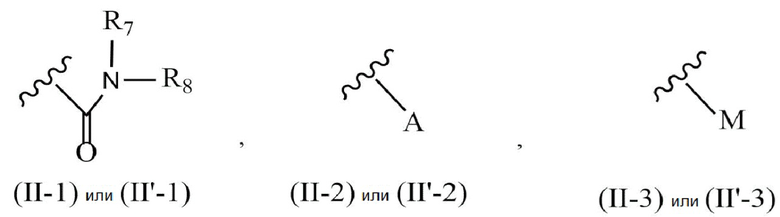
Заявленное соединение или его соли можно использовать как мономерное исходное соединение для получения олигонуклеотида. Олигонуклеотид можно синтезировать посредством реакции олигомеризации соединения, имеющего общую формулу (I), или его солей, с последующим снятием защитной группы для аминогруппы и защитной группы для гидроксигруппы.
Например, олигомеризация не ограничена каким-либо методом, при условии, что этот метод известен в синтетической химии (в частности, в синтезе нуклеиновых кислот), и его можно применять в качестве метода фосфорамидирования. Фосфорамидирование можно проводить, например, согласно методике, описанной в WO 2014/046212 A1.
Посредством олигомеризации можно получить олигонуклеотид, содержащий один или более нуклеотидов, имеющих общую формулу (I).
Способ получения олигонуклеотида, имеющего общую формулу (I'), включает следующую стадию.
a) стадия олигомеризации соединения, имеющего общую формулу (I), или его солей, при необходимости с последующим удалением защитной группы для аминогруппы и защитной группы для гидроксигруппы.
Также, способ получения соединения, имеющего общую формулу (I), или его солей может включать по меньшей мере одну из перечисленных далее стадий:
стадия получения заявленного соединения или его солей;
стадия фосфорамидирования описанного выше промежуточного соединения 4, 7 или 9 или его солей, с получением соединения, имеющего общую формулу (I'), или его солей; и
стадия удаления защитной группы для гидроксигруппы из промежуточного соединения 3 или 6, с получением описанного выше промежуточного соединения 4, 7 или 9.
Способ получения тиофосфатного олигомера
В синтезе олигонуклеотида посредством фосфорамидирования применяют окислитель в реакции превращения фосфитной группы в фосфатную группу. DDTT (((диметиламинометилиден)амино)-3H-1,2,4-дитиаазолин-3-он) или реагент Букажа (3H-1,2-бензодитиол-3-он 1,1-диоксид) применяют вместо окислителя в данной реакции, получая тиофосфатный олигомер, имеющий защитную группу, где атом кислорода во фрагменте P=O фосфатной группы заменен на атом серы по типу P=S, что дает тиофосфатную группу.
Примеры
Далее настоящее изобретение будет описано более подробно посредством примеров, однако настоящее изобретение не ограничивается только этими примерами. Идентификацию соединений проводили методами масс-спектрометрии, высокоэффективной жидкостной хроматографии – масс-спектрометрии; LCMS, ЯМР-спектроскопии, высокоэффективной жидкостной хроматографии (ВЭЖХ) и др. В спектроскопии ЯМР, в случае спектроскопии протонного магнитного резонанса (1H-ЯМР), использовали рабочую частоту 400 МГц, а в случае спектроскопии ЯМР на ядрах фосфора (31P-ЯМР), использовали рабочую частоту 161.8 МГц. При описании спектров ЯМР используются следующие сокращения: "с" = "синглет", "д" = "дублет", "дд" = "дублет дублетов", "т" = "триплет", "тд" = "дублет триплетов", "кв" = "квартет", "квин" = "квинтет", "септ" = "септет", "м" = "мультиплет", "ушир" = "уширенный", "ушир.с" = "уширенный синглет", "ушир.д" = "уширенный дублет", "ушир.т" = "уширенный триплет" и "J" = "константа спин-спинового взаимодействия".
Структура и аббревиатура для каждой искусственной нуклеиновой кислоты (далее по тексту при необходимости обозначаются аббревиатурами) приведены ниже.
Структура и аббревиатура для каждой искусственной нуклеиновой кислоты
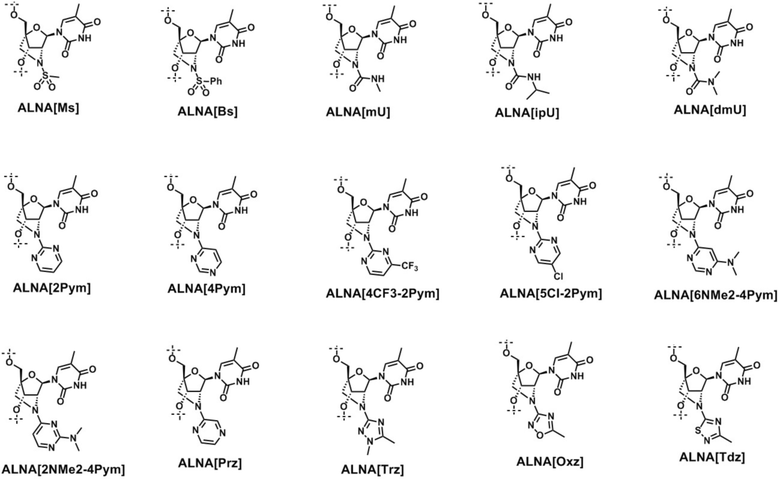
Синтез ALNA[Ms]-T
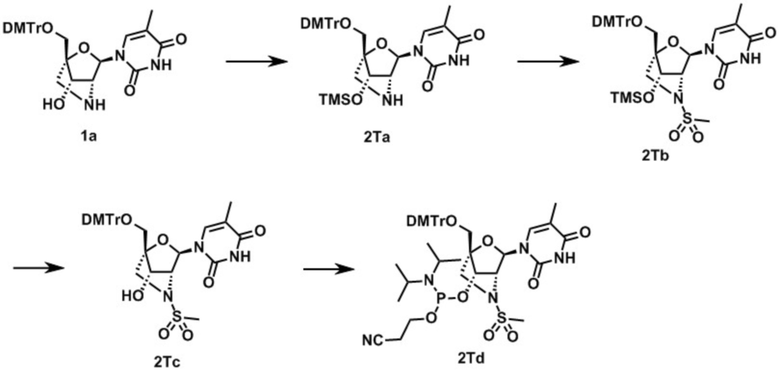
Пример 1. Синтез соединения 2Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В раствор 1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-диона (1a) (который был получен по методике, описанной в WO 2017/047816 A1) (12,35 г, 21,61 ммоль) в дихлорметане добавляли BSA (13 мл, 53,17 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 8 часов. Затем добавляли BSA (5,2 мл, 21 ммоль) и TMSOTf (200 мкл, 1,0 ммоль), и полученную смесь снова перемешивали при комнатной температуре в течение 15 часов. В реакционный раствор добавляли 5%-ный водный раствор бикарбоната натрия (50 мл), полученную смесь перемешивали и экстрагировали дихлорметаном. Водный слой смешивали с дихлорметаном (61 мл) и снова экстрагировали, затем дихлорметановые органические слои объединяли. После упаривания растворителя из органического слоя полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 98/2)), получая соединение 2Ta (10,49 г, выход 75%).
MS (ESI): m/z = 644 (M+H)+
Пример 2. Синтез соединения 2Tb
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-метилсульфонил-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В перемешиваемый раствор соединения 2Ta (10,19 г, 15,83 ммоль) в дихлорметане (50 мл) добавляли DIPEA (5,4 мл, 31 ммоль) и затем мезилхлорид (1,4 мл, 18 ммоль) при охлаждении на ледяной бане, и полученную смесь перемешивали в ледяной бане в течение 1,5 часов. В реакционный раствор добавляли 5%-ный водный раствор бикарбоната натрия (20 мл), полученную смесь перемешивали и экстрагировали дихлорметаном. Водный слой смешивали с дихлорметаном (20 мл), экстрагировали, и экстракт объединяли с дихлорметановым органическим слоем. После упаривания растворителя из органического слоя полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 98/2)), получая соединение 2Tb (6,56 г, выход 57%).
MS (ESI): m/z = 720 (M-H)-
Пример 3. Синтез соединения 2Tc
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В перемешиваемый раствор соединения 2Tb (3,02 г, 4,13 ммоль) в тетрагидрофуране (15 мл) добавляли TBAF (1,35 мл, 4,58 ммоль, 1M раствор в тетрагидрофуране) в ледяной бане, и полученную смесь перемешивали 30 минут. В реакционный раствор добавляли 10%-ный водный раствор хлорида аммония (20 мл) и дихлорметан (20 мл), полученную смесь перемешивали и экстрагировали дихлорметаном. Водный слой смешивали с дихлорметаном (20 мл), экстрагировали, и дихлорметановые органические слои объединяли. После упаривания растворителя из органического слоя полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 98/2), получая соединение 2tc (2,47 г, выход 92%).
MS (ESI): m/z = 648 (M-H)-
Пример 4. Синтез соединения 2Td
3-[[(1R,4R,6R,7S)-4-[[бис(4-метоксифенил)-фенилметокси]метил]-6-(5-метил-2,4-диоксопиримидин-1-ил)-2-метилсульфонил-5-окса-2-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 1)
В раствор соединения 2Tc (2,47 г, 3,80 ммоль) в дихлорметане (12,5 мл) добавляли DIPEA (2,00 мл, 12,0 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамидит (2,10 мл, 9,40 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 5 часов. Затем добавляли 5%-ный водный раствор гидрокарбоната натрия (15 мл) и дихлорметан (10 мл) при охлаждении льдом, полученную смесь перемешивали при комнатной температуре и затем экстрагировали дихлорметаном. Водный слой экстрагировали дихлорметаном (10 мл) и объединяли дихлорметановые слои. После упаривания растворителя из смеси при пониженном давлении, остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 60/40 до 40/60), получая соединение 2Td как заявленное соединение 1 (2,13 г, выход 66%).
MS (ESI): m/z = 850 (M+H)+
31P-ЯМР (CDCl3) δ: 150,30, 149,12.
Синтез ALNA[Ms]-mC
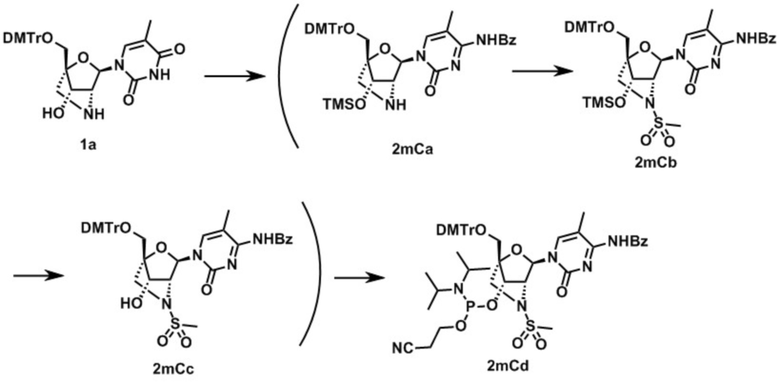
Пример 5. Синтез соединения 2mCc
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид
В суспензию соединения 1a (10,33 г, 18,1 ммоль) и N-(5-метил-2-оксо-1H-пиримидин-4-ил)бензамида (12,42 г, 54,2 ммоль) в толуоле (180 мл) добавляли BSA (44 мл, 180 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 15 минут. Затем добавляли TMSOTf (0,52 мл, 2,71 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь добавляли в перемешиваемый раствор IPE (100 мл), насыщенного водного раствора бикарбоната натрия (50 мл) и воды (50 мл), и полученную смесь перемешивали 10 минут, нерастворимый осадок удаляли фильтрованием через целит (TM). Водный слой удаляли из фильтратов, и органический слой последовательно промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл). Органический слой пропускали через разделитель фаз, и растворитель упаривали. Остаток солюбилизировали дихлорметаном (90 мл), затем добавляли триэтиламин (5,0 мл, 36,0 ммоль) и ангидрид метансульфокислоты (3463 мг, 19,9 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 40 минут. Затем добавляли ангидрид метансульфокислоты (944 мг, 5,42 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли еще ангидрид метансульфокислоты (944 мг, 5,42 ммоль) и триэтиламин (1,3 мл, 9,06 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Смесь разбавляли этилацетатом (80 мл), добавляли воду (40 мл) и насыщенный водный раствор бикарбоната натрия (40 мл), и полученную смесь перемешивали. Водный слой удаляли, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), затем пропускали через разделитель фаз, растворитель упаривали, и полученный остаток сушили в вакууме. К остатку добавляли ТГФ (90 мл), получая раствор, затем добавляли TBAF (0,1 M, раствор в ТГФ, 21,7 мл, 21,7 ммоль) при охлаждении льдом, и реакционную смесь перемешивали при охлаждении льдом 15 минут. Смесь разбавляли этилацетатом (90 мл), добавляли водный раствор хлорида аммония (40 мл) и воду (40 мл), и полученную смесь перемешивали. Водный слой удаляли, органический слой пропускали через разделитель фаз и упаривали растворитель. Остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 95/5), получая соединение 2mCc (5702 мг, выход за три стадии 38%).
MS (ESI): m/z = 753 (M+H)+
Пример 6. Синтез соединения 2mCd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 2)
Соединение 2mCd как заявленное соединение 2 (6809 мг, выход 72%) получали из соединения 2mCc (8099 мг, 9,89 ммоль) аналогично примеру 4.
MS (APCI): m/z = 954 (M+H)+
Синтез ALNA[Ms]-G
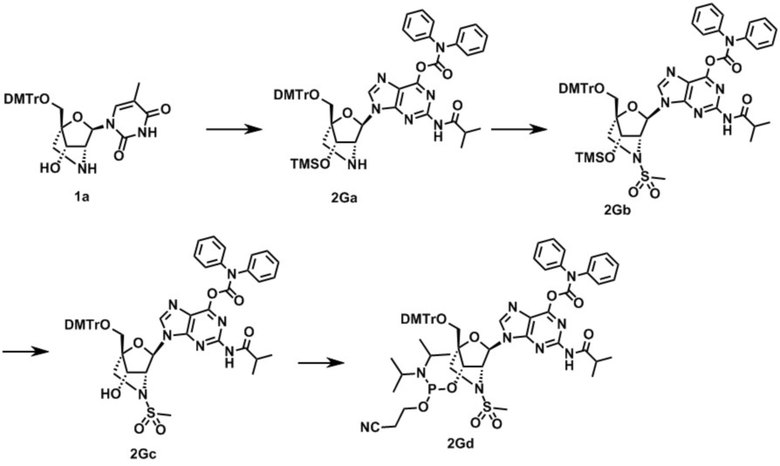
Пример 7. Синтез соединения 2Ga
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат
В раствор соединения 1a (5040 мг, 8,817 ммоль) и [2-(2-метилпропаноиламино)-9H-пурин-6-ил]N,N-дифенилкарбамата (5400 мг, 12,97 ммоль) в 1,2-дихлорэтане (24,7 мл) добавляли BSA (14,8 мл, 60,46 ммоль), и полученную смесь перемешивали при 64°C в течение 1 часа. Затем постепенно добавляли TMSOTf (0,167 мл, 0,864 ммоль) поддерживая температуру смеси 60°C, и полученную смесь перемешивали 1 час. После охлаждения, реакционный раствор постепенно добавляли в перемешиваемую смесь хлороформа (40 мл) и насыщенного водного раствора гидрокарбоната натрия (40 мл), которую готовили отдельно, и полученную смесь перемешивали. Отфильтровывали под вакуумом нерастворенные частицы, фильтраты экстрагировали этилацетатом (50 мл). Органический слой промывали насыщенным водным раствором хлорида натрия (50 мл) и затем сушили над сульфатом натрия. Полученный после упаривания фильтратов при пониженном давлении остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 97/3), получая соединение 2Ga (6350 мг, выход 79%).
MS (ESI): m/z = 935 (M+H)+
Пример 8. Синтез соединения 2Gb
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-метилсульфонил-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино) пурин-6-ил]N,N-дифенилкарбамат
В раствор соединения 2Ga (2370 мг, 2,537 ммоль) в дихлорметане (24,9 мл) добавляли триэтиламин (0,692 мл, 4,984 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 5 минут. Затем добавляли метансульфонилхлорид (0,193 мл, 2,488 ммоль) при охлаждении льдом, и реакционную смесь перемешивали 1 час. В реакционный раствор добавляли метиленхлорид (30 мл) и насыщенный водный раствор гидрокарбоната натрия (30 мл) при охлаждении льдом, и полученную смесь разделяли в делительной воронке. Органический слой промывали насыщенным водным раствором хлорида натрия (30 мл) и сушили над сульфатом натрия. Остаток, полученный после упаривания фильтратов при пониженном давлении, очищали методом хроматографии на силикагеле (гексан/этилацетат, от 67/33 до 50/50), получая соединение 2Gb (2210 мг, выход 88%).
MS (ESI): m/z = 1013 (M+H)+
Пример 9. Синтез соединения 2Gc
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино) пурин-6-ил]N,N-дифенилкарбамат
В раствор соединения 2Gb (2200 мг, 2,173 ммоль) в ТГФ (11 мл) добавляли TBAF (2,4 мл, 3,407 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 5 часов. В реакционный раствор добавляли этилацетат (30 мл) и водный раствор хлорида аммония (30 мл) при охлаждении льдом, полученную смесь фильтровали и разделяли на делительной воронке. Органический слой промывали насыщенным водным раствором хлорида натрия (30 мл) и сушили над сульфатом натрия. Остаток, полученный после упаривания фильтратов при пониженном давлении, очищали методом хроматографии на силикагеле (гексан/этилацетат, от 60/40 до 50/50). Для дополнительной очистки, смесь очищали снова методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 97/3), получая соединение 2Gc (1070 мг, выход 52%).
MS (ESI): m/z = 941 (M+H)+
Пример 10. Синтез соединения 2Gd
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 3)
В раствор соединения 2Gc (1070 мг, 1,139 ммоль) в дихлорметане (5,690 мл) добавляли DIPEA (0,590 мг, 3,407 ммоль) и 2-цианоэтил N,N-диизопропилхлор-фосфорамидит (0,510 мл, 2,282 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 22 часов. В реакционный раствор добавляли дихлорметан (20 мл) и насыщенный водный раствор бикарбоната натрия (20 мл) при охлаждении льдом, и полученную смесь разделяли в делительной воронке. Водный слой удаляли, органический слой пропускали через разделитель фаз. После упаривания фильтратов при пониженном давлении, полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 40/60), получая соединение 2Gd как заявленное соединение 3 (548 мг, выход 42%).
MS (ESI): m/z = 1141 (M+H)+
Синтез ALNA[Ms]-A
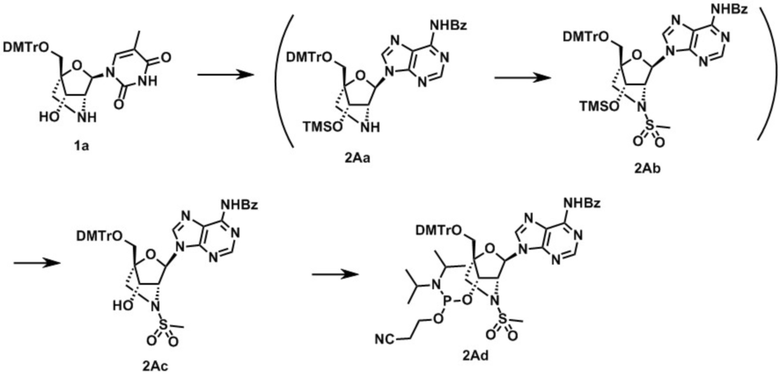
Пример 11. Синтез соединения 2Ac
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-пурин-6-ил]бензамид
В суспензию соединения 1a (10,0 г, 17,6 ммоль) и N-(9H-пурин-6-ил)бензамида (5,04 г, 21,1 ммоль) в толуоле (176 мл) по каплям добавляли BSA (30 мл, 123 ммоль), полученную смесь нагревали до 60°C и перемешивали 30 минут. Затем добавляли TMSOTf (1,03 мл, 5,34 ммоль), и смесь перемешивали при 60°C в течение 15 минут. Реакционную смесь добавляли в смесь IPE (100 мл) и насыщенного водного раствора бикарбоната натрия (100 мл) при перемешивании и охлаждении льдом, полученную смесь перемешивали 20 минут, и нерастворенные частицы отфильтровывали. После двукратной промывки осадка на фильтре диэтиловым эфиром (20 мл), фильтраты разделяли на делительной воронке и промывали насыщенным водным раствором хлорида натрия (50 мл). Смесь пропускали через разделитель фаз и упаривали при пониженном давлении. Остаток солюбилизировали дихлорметаном (24,9 мл), затем добавляли пиридин (4,57 мл, 56,5 ммоль) и ангидрид метансульфокислоты (3614 мг, 20,75 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли насыщенный водный раствор гидрокарбоната натрия (50 мл) и воду (50 мл), смесь перемешивали и разделяли на делительной воронке. Органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), затем смесь пропускали через разделитель фаз и упаривали растворитель при пониженном давлении. В остаток добавляли ТГФ (88 мл), получая раствор, затем добавляли TBAF (1M раствор в ТГФ, 21,1 мл, 21,1 ммоль) при охлаждении льдом, и реакционную смесь перемешивали при охлаждении льдом 30 минут. Смесь разбавляли этилацетатом (80 мл), добавляли водный раствор хлорида аммония (50 мл) и воду (50 мл), и полученную смесь перемешивали при комнатной температуре. Смесь разделяли в делительной воронке, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), затем пропускали через разделитель фаз, и растворитель упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 95/5), получая соединение 2Ac (10,6 г, выход за три стадии 75%).
MS (ESI): m/z = 763 (M+H)+
Пример 12. Синтез соединения 2Ad
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-пурин-6-ил]бензамид (заявленное соединение 4)
В раствор соединения 2Ac (5,60 мг, 7,01 ммоль) в дихлорметане (40 мл) добавляли DIPEA (4,8 мл, 28,0 ммоль) и 2-цианоэтил N,N-диизопропилхлор-фосфорамидит (4,7 мл, 21,0 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Затем добавляли этанол (1,2 мл, 21,0 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 5 минут. Смесь снова охлаждали льдом, добавляли насыщенный водный раствор бикарбоната натрия (20 мл) и насыщенный водный раствор хлорида натрия (20 мл), полученную смесь перемешивали, и органический слой пропускали через разделитель фаз. После упаривания фильтратов при пониженном давлении, остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 67/33 до 10/90), получая соединение 2Ad как заявленное соединение 4 (5,44 г, выход 77%).
MS (ESI): m/z = 964 (M+H)+
Синтез ALNA[Bs]-T
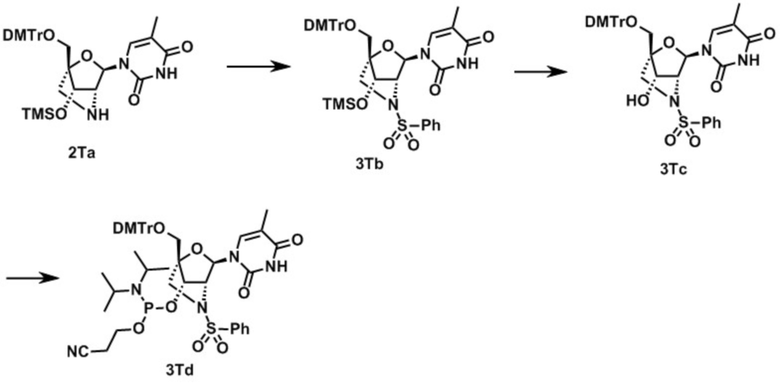
Пример 13. Синтез соединения 3Tb
1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2,4-дион
Соединение 2Ta (1,00 г, 1,56 ммоль) подвергали азеотропной сушке с толуолом. К остатку добавляли дихлорметан (5 мл) и триэтиламин (0,43 мл, 3,1 ммоль), и добивались полного растворения. Полученный раствор охлаждали льдом, добавляли бензолсульфонилхлорид (0,21 мл, 1,6 ммоль), и реакционную смесь перемешивали при охлаждении льдом 4 часа. В реакционный раствор добавляли 5%-ный раствор карбоната калия (20 мл), полученную смесь перемешивали и экстрагировали дихлорметаном (5 мл). Водный слой смешивали с дихлорметаном (5 мл), экстрагировали, экстракты объединяли с дихлорметановым органическим слоем. После упаривания растворителя из органического слоя, полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 40/60 до 20/80), получая соединение 3Tb (0,78 г, выход 64%).
MS (ESI): m/z = 782 (M-H)-
Пример 14. Синтез соединения 3Tc
1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
Соединение 3Tc (0,59 г, выход 84%) синтезировали из соединения 3Tb (0,78 г, 0,99 ммоль) аналогично примеру 3.
MS (ESI): m/z = 710 (M-H)-
Пример 15. Синтез соединения 3Td
3-[[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 5)
В раствор соединения 3Tc (599 мг, 0,765 ммоль) в ацетонитриле (3 мл) добавляли диизопропиламмония тетразолид (171 мг, 0,996 ммоль), 2-цианоэтил N,N,N',N'-тетраизопропилфосфорамидит (0,36 мл, 1,1 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 19 часов. В реакционный раствор добавляли этилацетат (10 мл) и воду (5 мл), смесь перемешивали и отделяли водный слой. В водный слой добавляли этилацетат (10 мл), смесь перемешивали и отделяли органический слой. Органический слой объединяли с полученным выше органическим слоем, и смесь упаривали при 40°C при пониженном давлении. Полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 67/33 до 10/90), получая соединение 3Td как заявленное соединение 5 (0,65 г, выход 86%).
MS (ESI): m/z = 912 (M+H)+
31P-ЯМР (CDCl3) δ: 149,68, 149,22.
Синтез ALNA[Bs]-mC
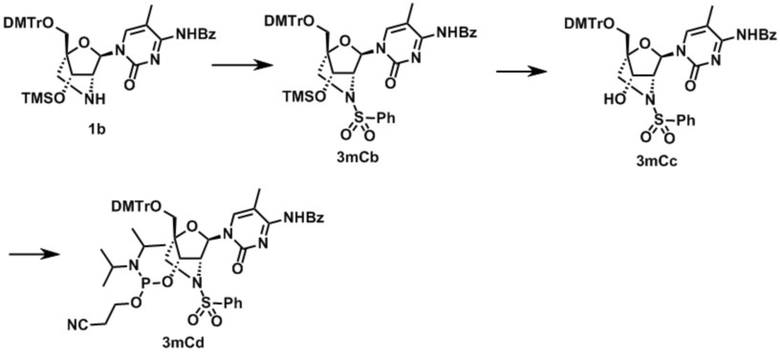
Пример 16. Синтез соединения 3Cb
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид
Соединение 3mCb (0,85 г, выход 71%) синтезировали из соединения 1b (1,00 г, 1,34 ммоль) которое синтезировали по методике, описанной в WO 2017/047816 A1, аналогично примеру 13.
MS (ESI): m/z = 887 (M+H)+
Пример 17. Синтез соединения 3mCb
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид
Соединение 3mCc (0,78 г, выход 99%) синтезировали из соединения 3mCb (0,85 г, 0,96 ммоль) аналогично примеру 14.
MS (ESI): m/z = 813 (M+H)+
Пример 18. Синтез соединения 3mCd
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил)окси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 6)
Соединение 3mCd (0,53 г, выход 55%) как заявленное соединение 6 синтезировали из соединения 3mCc (0,78 г, 0,89 ммоль) аналогично примеру 15.
MS (ESI): m/z =1015 (M+H)+
31P-ЯМР (CDCl3) δ: 149,94, 149,34.
Синтез ALNA[mU]-T
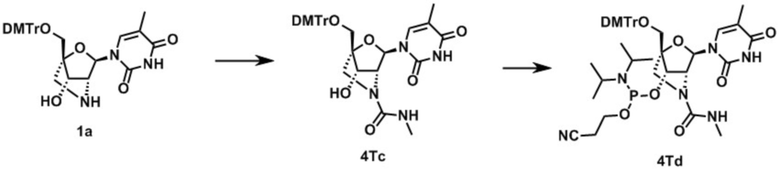
Пример 19. Синтез соединения 4Tc
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-метил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
Соединение 1a (1,20 г, 2,10 ммоль) подвергали азеотропной сушке с толуолом, и в раствор остатка в тетрагидрофуране (6 мл) добавляли N,N-диизопропилэтиламин (0,61 мл, 3,5 ммоль), затем добавляли раствор N-метилкарбамоилхлорида (0,20 г, 2,2 ммоль) в тетрагидрофуране (1 мл) на ледяной бане, и полученную смесь перемешивали 3 часа на ледяной бане. В реакционный раствор добавляли 5%-ный водный раствор бикарбоната натрия (20 мл) и этилацетат (10 мл), полученную смесь перемешивали и экстрагировали этилацетатом. Водный слой (10 мл) экстрагировали этилацетатом (10 мл) два раза, экстракты объединяли и смешивали с органическим слоем. После упаривания растворителя из органического слоя, полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 97/3), получая соединение 4Tc (1,28 г, выход 97%).
MS (ESI): m/z = 627 (M-H)-
Пример 20. Синтез соединения 4Td
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 7)
Соединение 4Td (0,56 г, выход 37%) как заявленное соединение 7 синтезировали из соединения 4Tc (1,16 г, 1,8 ммоль) аналогично примеру 15.
MS (ESI): m/z = 828(M-H)-
31P-ЯМР (CDCl3) δ: 149,31, 147,44.
Синтез ALNA[mU]-mC
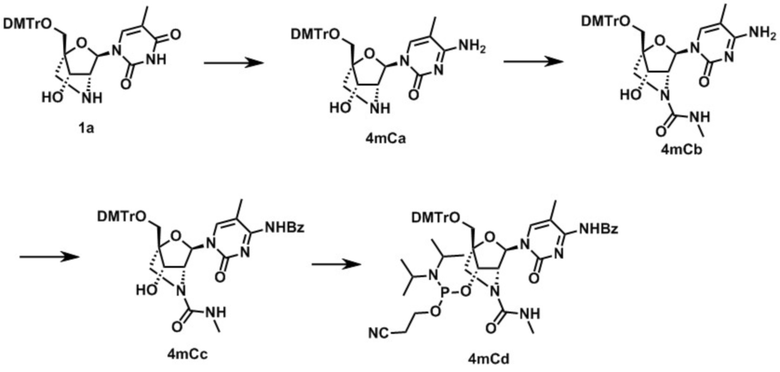
Пример 21. Синтез соединения 4mCa
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он
В перемешиваемый раствор соединения 1a (105,0 г, 184 ммоль) и 5-метилцитозина (69,0 г, 551 ммоль) в 1,2-дихлорэтане (918 мл) по каплям добавляли BSA (584 мл, 2390 ммоль) в течение 18 минут. Реакционную смесь нагревали до 60°C и перемешивали 20 минут. Понижали температуру смеси до 19,5°C при охлаждении льдом, затем добавляли TMSOTf (10 мл, 55,2 ммоль), и реакционную смесь нагревали до 60°C. Перемешивали 40 минут, затем реакционный раствор охлаждали льдом и по каплям добавляли 5%-ный водный раствор гидрокарбоната натрия (525 мл). Затем добавляли хлороформ (1050 мл) и 15%-ный водный раствор хлорида натрия (525 мл). Полученную суспензию фильтровали через целит, отфильтрованный осадок промывали хлороформом (525 мл), получая остаток 1 и фильтрат 1. К остатку 1 добавляли этилацетат (2100 мл) и воду (2100 мл), и полученную смесь перемешивали 1 час. Смесь фильтровали через целит, осадок промывали этилацетатом (1050 мл), получая фильтраты 2. Фильтраты 2 разделяли на делительной воронке, и органический слой дважды промывали водой (525 мл). Отдельно, фильтраты 1 разделяли на делительной воронке, и водный слой экстрагировали хлороформом (525 мл). Органические слои объединяли и промывали водой 1050 мл два раза. Полученный органический слой упаривали при пониженном давлении, получая бледно-желтое твердое вещество (125,6 г). Затем добавляли ТГФ (550 мл), полученную смесь перемешивали и добавляли 1M раствор TBAF/ТГФ (276 мл, 276 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов, затем реакционный раствор гасили водой (550 мл), добавляли хлороформ (550 мл), и полученную смесь разделяли в делительной воронке. Водный слой экстрагировали снова хлороформом (275 мл), и органические слои объединяли. Органический слой промывали водой и затем упаривали при пониженном давлении. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 20/1 до 4/1), получая соединение 4mCa (69,62 г, выход 62%).
MS (ESI): m/z = 593(M+Na)+
Пример 22. Синтез соединения 4mCb
(1R,3R,4R,7S)-3-(4-амино-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
Соединение 4mCa (1,00 г, 1,75 ммоль) подвергали азеотропной сушке с толуолом, в раствор остатка в тетрагидрофуране (5 мл) добавляли триэтиламин (0,49 мл, 3,5 ммоль), затем добавляли раствор N-метилкарбамоилхлорида (0,17 г, 1,8 ммоль) в тетрагидрофуране (1 мл) при охлаждении льдом, и полученную смесь перемешивали 3 часа в ледяной бане. В реакционный раствор добавляли воду (15 мл), этилацетат (1 мл) и хлороформ (15 мл), смесь перемешивали и экстрагировали органическим растворителем. Водный слой экстрагировали хлороформом (5 мл), органические слои объединяли и перемешивали. Органический слой сушили над сульфатом магния, и осадок отфильтровывали. Растворители упаривали из фильтратов, получая соединение 4mCb (1,18 г, выход количественный). Остаток использовали в следующей стадии без очистки.
MS (ESI): m/z = 627 (M-H)-
Пример 23. Синтез соединения 4mCc
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
Соединение 4mCb (1,18 г) подвергали азеотропной сушке с толуолом, в раствор остатка в тетрагидрофуране (5 мл) добавляли бензойный ангидрид (0,51 г, 2,27 ммоль) и метанол (0,01 мл, 0,25 ммоль) при комнатной температуре, и полученную смесь перемешивали при 70°C (температура бани) в течение 4 часов. Затем добавляли 5%-ный водный раствор бикарбоната натрия (10 мл) и этилацетат (10 мл), полученную смесь перемешивали и экстрагировали органическим растворителем. Водный слой экстрагировали этилацетатом (15 мл), органические слои объединяли и перемешивали. После упаривания растворителя из органического слоя, полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 97/3), получая соединение 4mCc (0,99 г, выход 77%).
MS (ESI): m/z = 731 (M-H)-
Пример 24. Синтез соединения 4mCd
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 8)
Соединение 4mCd (0,96 г, выход 77%) как заявленное соединение 8 синтезировали из соединения 4mCc (0,98 г, 1,34 ммоль) аналогично примеру 15.
MS (ESI): m/z = 933 (M+H)+
Синтез ALNA[mU]-G

Пример 25. Синтез соединения 4Ga
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат
В суспензию соединения 1a (30,5 г, 53,4 ммоль) и [2-(2-метилпропаноиламино)-9H-пурин-6-ил]N,N-дифенилкарбамата (26,7 г, 64,1 ммоль) в толуоле (267 мл) по каплям добавляли BSA (91 мл, 372 ммоль) в течение примерно 20 минут, полученную смесь нагревали до 60°C и перемешивали 5 минут. Затем добавляли еще толуол (100 мл), и реакционную смесь перемешивали при 60°C еще 10 минут. Затем добавляли TMSOTf (1,03 мл, 5,34 ммоль), и смесь перемешивали при 60°C в течение 20 минут. Реакционную смесь выливали в перемешиваемую смесь IPE (100 мл), насыщенного водного раствора бикарбоната натрия (50 мл) и воды (50 мл) при перемешивании и охлаждении льдом, перемешивали 2 часа и отфильтровывали нерастворенные частицы. Остаток промывали диэтиловым эфиром (20 мл) два раза, фильтрат разделяли на делительной воронке, и органический слой последовательно промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл). Смесь пропускали через разделитель фаз, упаривали при пониженном давлении, и сушили в вакууме, получая неочищенное соединение 4Ga (48,67 г).
MS (ESI): m/z = 954 (M+H)+
Пример 26. Синтез соединения 4Gc
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат
Соединение 4Ga (17,4 г, 18,6 ммоль) солюбилизировали в ТГФ (100 мл), добавляли DIPEA (4,87 мл, 28,0 ммоль) и N-метилкарбамоилхлорид (1830 мг, 19,6 ммоль) при охлаждении льдом, и полученную смесь перемешивали 30 минут. Затем последовательно добавляли насыщенный водный раствор бикарбоната натрия (100 мл) и этилацетат (100 мл), и полученную смесь перемешивали при комнатной температуре в течение 5 минут. Смесь разделяли в делительной воронке, органический слой последовательно промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл), смесь пропускали через разделитель фаз, растворитель упаривали, и остаток сушили в вакууме. В остаток добавляли ТГФ (90 мл), получая раствор, затем добавляли TBAF (1M раствор в ТГФ, 4,54 мл, 4,54 ммоль) при охлаждении льдом, и реакционную смесь перемешивали при охлаждении льдом 20 минут. Смесь разбавляли этилацетатом (100 мл), добавляли водный раствор хлорида аммония (50 мл) и воду (50 мл), и перемешивали при комнатной температуре в течение 5 минут. Реакционную смесь разделяли в делительной воронке, органический слой пропускали через разделитель фаз, растворители упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 95/5), получая соединение 4Gc (9030 мг, выход за три стадии 54%).
MS (ESI): m/z = 919 (M+H)+
Пример 27. Синтез соединения 4Gd
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(метилкарбамоил)-2-окса-5-азабицикло[2.2.1] гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 9)
Соединение 4Dc как заявленное соединение 9 (8700 мг, выход 79%) синтезировали из соединения 4Gc (9020 мг, 9,82 ммоль) аналогично примеру 12.
MS (ESI): m/z = 1197 (M+H)+
Синтез ALNA[mU]-A
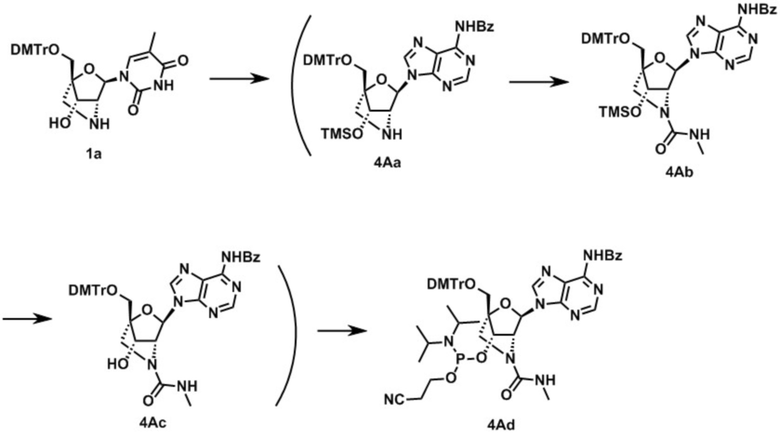
Пример 28. Синтез соединения 4Aa
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид
В суспензию соединения 1a (30,0 г, 52,5 ммоль) и N-(9H-пурин-6-ил)бензамида (15,0 г, 62,7 ммоль) в толуоле (500 мл) по каплям добавляли BSA (90 мл, 368 ммоль), полученную смесь нагревали до 80°C и перемешивали 20 минут. Затем добавляли TMSOTf (1,0 мл, 5,17 ммоль) при охлаждении льдом, и полученную смесь перемешивали при 60°C в течение 20 минут. В перемешиваемую смесь IPE (200 мл) и насыщенного водного раствора бикарбоната натрия (200 мл) добавляли реакционный раствор при охлаждении льдом и перемешивании, полученную смесь перемешивали 20 минут и отфильтровывали нерастворенные частицы. Осадок промывали диэтиловым эфиром (40 мл) два раза, фильтраты разделяли на делительной воронке и промывали насыщенным водным раствором хлорида натрия. Органический слой as сушили над сульфатом натрия, нерастворенные частицы отфильтровывали, фильтраты упаривали при пониженном давлении, и сушили в вакууме, получая неочищенное соединение 4Aa (40,5 г).
MS (ESI): m/z = 757 (M+H)+
Пример 29. Синтез соединения 4Ab
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1[[бис(4-метоксифенил)-фенилметокси]метил]-N-метил-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
Неочищенный продукт 4Aa (8,20 г) солюбилизировали в ТГФ (87 мл), добавляли последовательно DIPEA (3,00 мл, 17,2 ммоль) и N-метил карбамоилхлорид (970 мг, 10,4 ммоль) при комнатной температуре, и полученную смесь перемешивали 30 минут. Затем добавляли этилацетат (100 мл), насыщенный водный раствор бикарбоната натрия (50 мл) и воду (50 мл), смесь разделяли в делительной воронке, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), пропускали через разделитель фаз, растворители упаривали, и остаток сушили в вакууме, получая неочищенный продукт 4Ab (8,70 г).
MS (ESI): m/z = 813(M-H)-
Пример 30. Синтез соединения 4Ac
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1[[бис(4-метоксифенил)фенилметокси]метил]-7-гидрокси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
К сырому продукту 4Ab (8,00 г) добавляли ТГФ (100 мл), получая раствор, добавляли TBAF (1M раствор в ТГФ, 5,00 мл, 5,00 ммоль) при охлаждении льдом, и полученную смесь перемешивали при охлаждении льдом 1 час. Смесь разбавляли этилацетатом (80 мл), добавляли водный раствор хлорида аммония (50 мл) и воду (50 мл), и полученную смесь перемешивали при комнатной температуре. Смесь разделяли в делительной воронке, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), пропускали через разделитель фаз, растворители упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/ метанол, от 100/0 до 97/3), получая соединение 4Ac (6100 мг, выход за три стадии 84%).
MS (ESI): m/z = 742 (M+H)+
Пример 31. Синтез соединения 4Ad
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-2-окса-5-азабицикло[2.2.1] гептан-5-карбоксамид (заявленное соединение 10)
Соединение 4Ad как заявленное соединение 10 (3830 мг, выход 48%) получали из соединения 4Ac (6100 мг, 8,20 ммоль) аналогично примеру 12.
MS (APCI): m/z = 942 (M+H)+
Синтез ALNA[ipU]-T
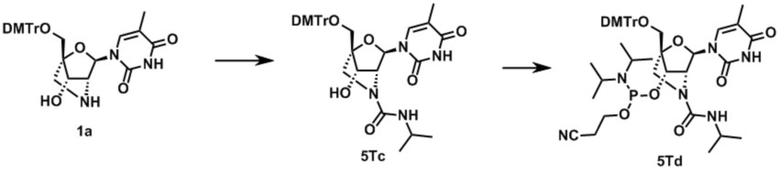
Пример 32. Синтез соединения 5Tc
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-изопропил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
В раствор соединения 1a (1500 мг, 2,624 ммоль) в дихлорметане (26 мл) добавляли 2-изоцианато-пропан (0,27 мл, 2,7 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли смесь этилацетата (10 мл) и насыщенного раствора бикарбоната натрия (20 мл), смесь разделяли в делительной воронке, водный слой экстрагировали этилацетатом (10 мл) два раза, и объединенный органический слой промывали насыщенным водным раствором хлорида натрия 10 мл. Органический слой сушили над безводным сульфатом натрия, фильтровали, и растворители упаривали. Смесь очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 0/100), получая соединение 5tc (1904 мг, выход количественный).
MS (ESI): m/z = 656(M-H)-
Пример 33. Синтез соединения 5Td
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 11)
Соединение 5td как заявленное соединение 11 (1272,9 мг, выход 52%) получали из соединения 5Tc (2020 мг, 2,85 ммоль) аналогично примеру 4.
MS (ESI): m/z = 855(M-H)-
Синтез ALNA[ipU]-mC
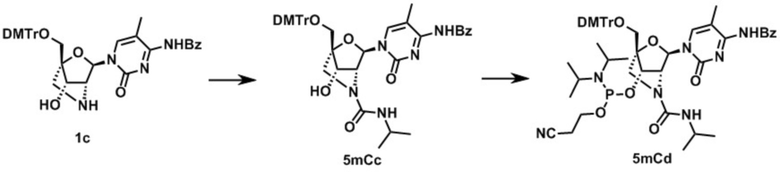
Пример 34. Синтез соединения 5mCc
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил) фенилметокси]метил]-7-гидрокси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
Соединение 5mCc (1168 мг, выход 93%) получали из соединения 1c (1300 мг, 1,657 ммоль), которое синтезировали по методике, описанной в WO 2017/047816 A1.
MS (ESI): m/z = 761 (M+H)+
Пример 35. Синтез соединения 5mCd
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 12)
Соединение 5mCd как заявленное соединение 12 (1002,8 мг, выход 75%) получали из соединения 5mCc (1168 мг, 1,137 ммоль) аналогично примеру 4.
MS (ESI): m/z = 961 (M+H)+
Синтез ALNA[ipU]-G
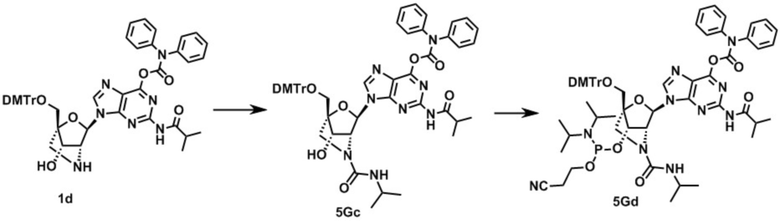
Пример 36. Синтез соединения 5Gc
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(изопропилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат
В раствор соединения 1d, которое синтезировали по методике, описанной в примерах в WO 2017/047816 A1 (2,42 г, 2,81 ммоль), в дихлорметане (28 мл) добавляли изопропилизоцианат (0,31 мл, 3,09 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение трех часов. В реакционный раствор добавляли насыщенный водный раствор бикарбоната натрия, смесь перемешивали, пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 20/80), получая соединение 5Gc (1,41 г, выход 53%).
MS (ESI): m/z = 948 (M+H)+
Пример 37. Синтез соединения 5Gd
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(изопропилкарбамоил)-2-окса-5-азабицикло[2.2.1] гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат (заявленное соединение 13)
Соединение 5Gd как заявленное соединение 13 (1,20 г, выход 70%) получали из соединения 5Gc (1,41 г, 1,49 ммоль) аналогично примеру 4.
MS (ESI): m/z = 1148 (M+H)+
31P-ЯМР (CDCl3) δ: 149,42, 149,39.
Синтез ALNA[ipU]-A
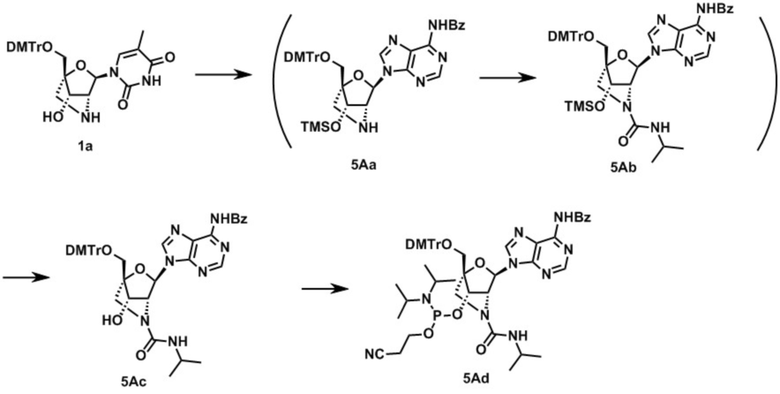
Пример 38. Синтез соединения 5Ac
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-карбоксамид
В суспензию соединения 1a (10,0 г, 17,5 ммоль) и N-(9H-пурин-6-ил)бензамида (5,0 г, 21,0 ммоль) в толуоле (175 мл) по каплям добавляли BSA (30 мл, 122 ммоль), полученную смесь нагревали до 60°C и перемешивали 10 минут, затем добавляли TMSOTf (0,34 мл, 1,8 ммоль), и смесь перемешивали при 60°C в течение 15 минут. Реакционную смесь добавляли в перемешиваемый раствор IPE (100 мл) и насыщенного водного раствора бикарбоната натрия (100 мл) при охлаждении льдом и перемешивании, перемешивали 20 минут и отфильтровывали нерастворенные частицы. После промывки осадка на фильтре диэтиловым эфиром (10 мл), фильтраты разделяли на делительной воронке и промывали насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом натрия, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении. Остаток солюбилизировали в дихлорметане (162 мл), добавляли изопропилизоцианат (1,8 мл, 18 ммоль) при комнатной температуре, и полученную смесь перемешивали 60 минут. Затем добавляли этилацетат (100 мл), насыщенный водный раствор бикарбоната натрия (50 мл) и воду (50 мл), полученную смесь разделяли в делительной воронке, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), сушили над сульфатом натрия, фильтровали, и растворители упаривали. В остаток добавляли ТГФ (162 мл) получая раствор, затем добавляли TBAF (1M раствор в ТГФ, 2,39 мл, 8,11 ммоль) при охлаждении льдом, и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Смесь разбавляли этилацетатом (80 мл), добавляли водный раствор хлорида аммония (50 мл) и воду (50 мл), и перемешивали при комнатной температуре. Смесь разделяли в делительной воронке, органический слой промывали насыщенным водным раствором хлорида натрия (50 мл), затем сушили над сульфатом натрия, фильтровали, и упаривали растворители. Полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 0/100), получая соединение 5Ac (10,1 г, выход за три стадии 77%).
MS (ESI): m/z = 770 (M+H)+
Пример 39. Синтез соединения 5Ad
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-2-окса-5-азабицикло [2.2.1]гептан-5-карбоксамид (заявленное соединение 14)
Соединение 5d как заявленное соединение 14 (4,6 г, выход 51%) получали из соединения 5c (7,0 г, 9,09 ммоль) аналогично примеру 4.
MS (ESI): m/z = 970 (M+H)+
31P-ЯМР (CDCl3) δ: 149,4.
Синтез ALNA[dmU]-T
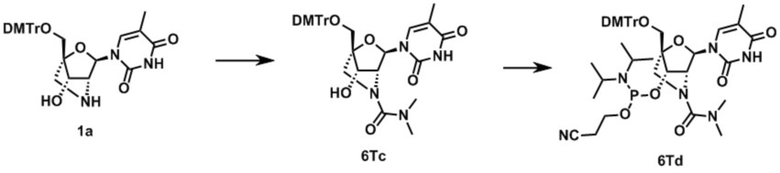
Пример 40. Синтез соединения 6Tc
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N,N-диметил-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид
В раствор соединения 1a (1512 мг, 2,645 ммоль) в тетрагидрофуране (26 мл) добавляли N,N-диизопропилэтиламин (0,483 мл, 2,773 ммоль), смесь охлаждали льдом и добавляли N,N-диметилкарбамоилхлорид (0,255 мл, 2,77 ммоль). Смесь нагревали до комнатной температуры, добавляли N,N-диметилформамид (1 мл, 12,9 ммоль) и перемешивали в течение 4 часов. Затем добавляли смесь этилацетата (10 мл) и насыщенного водного раствора бикарбоната натрия (20 мл), полученную смесь перемешивали и разделяли в делительной воронке, водный слой экстрагировали этилацетатом (10 мл) два раза, органические слои объединяли и промывали насыщенным водным раствором хлорида натрия (10 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали, и растворители упаривали. Смесь очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 0/100), получая соединение 6Tc1 (1705 мг, выход количественный).
MS (ESI): m/z = 642(M-H)-
Пример 41. Синтез соединения 6Td
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N,N-диметил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 15)
Соединение 6Td как заявленное соединение 15 (1565 мг, выход 68%) получали из соединения 6Tc (1758 мг, 2,735 ммоль) аналогично примеру 4.
MS (ESI): m/z = 842(M-H)-
Синтез ALNA[dmU]-mC
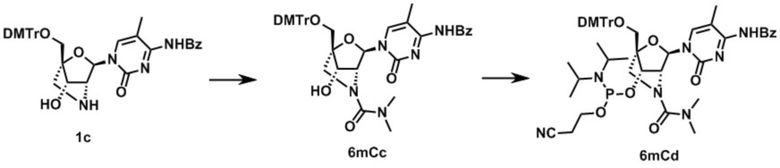
Пример 42. Синтез соединения 6mCc
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-N,N-диметил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид.
В раствор соединения 1c (1300 мг, 1,657 ммоль) в тетрагидрофуране (16,6 мл) добавляли N,N-диизопропилэтиламин (0,317 мл, 1,820 ммоль), полученную смесь охлаждали льдом, добавляли N,N-диметилкарбамоилхлорид (0,168 мл, 1,83 ммоль) и перемешивали при комнатной температуре в течение 10 минут. Кипятили смесь при перемешивании в течение 2 часов, затем добавляли смесь этилацетата (10 мл) и насыщенного водного раствора бикарбоната натрия (20 мл) при комнатной температуре, полученную смесь разделяли в делительной воронке, водный слой экстрагировали этилацетатом (10 мл) два раза, и объединенные органические слои промывали насыщенным водным раствором хлорида натрия (10 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали, и растворители упаривали. Смесь очищали методом хроматографии на силикагеле (гексан/этилацетат, от 70/30 до 30/70), получая соединение 6mCc (1705 мг, выход 79%).
MS (ESI): m/z = 747 (M+H)+
Пример 43. Синтез соединения 6mCd
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N,N-диметил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид (заявленное соединение 16)
Соединение 6mCd как заявленное соединение 16 (936,5 мг, выход 76%) получали из соединения 6mCc (1019 мг, 1,312 ммоль) аналогично примеру 4.
MS (ESI): m/z = 947 (M+H)+
Синтез ALNA[2Pym]-T
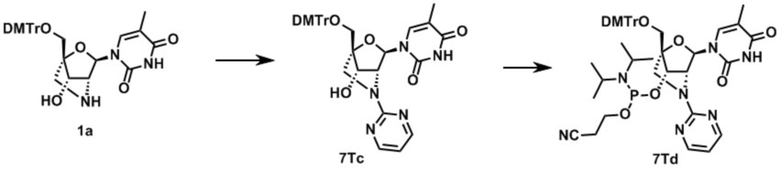
Пример 44. Синтез соединения 7Tc
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион.
Смесь соединения 1a (2,00 г, 3,50 ммоль), 2-хлорпиримидина (1,20 г, 10,5 ммоль), DIPEA (3,05 мл, 17,5 ммоль) и ДМСО (17,5 мл) перемешивали при 130°C в атмосфере азота в течение 6 часов. Этилацетат добавляли в реакционный раствор, полученную смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 7Tc (1,74 г, выход 77%).
HRMS (MALDI) — вычислено для C36H35N5O7 [M+Na]+: 672,2429, получено: 672,2427.
Пример 45. Синтез соединения 7Td
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 17).
В смесь соединения 7Tc (1,73 г, 2,66 ммоль), дихлорметана (13 мл), и DIPEA (1,39 мл, 7,98 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (1,19 мл, 5,32 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз и упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 60/40 до 10/90, Диол: гексан/этилацетат = от 70/30 до 20/80, NH: хлороформ/метанол = от 100/0 до 95/5), получая соединение 7Td как заявленное соединение 17 (1,53 г, выход 68%).
HRMS (FAB) — вычислено для C45H52N7O8P [M+H]+: 850,3693, получено: 850,3699.
31P-ЯМР (CDCl3) δ: 148,72, 148,83.
Синтез ALNA[2Pym]-mC
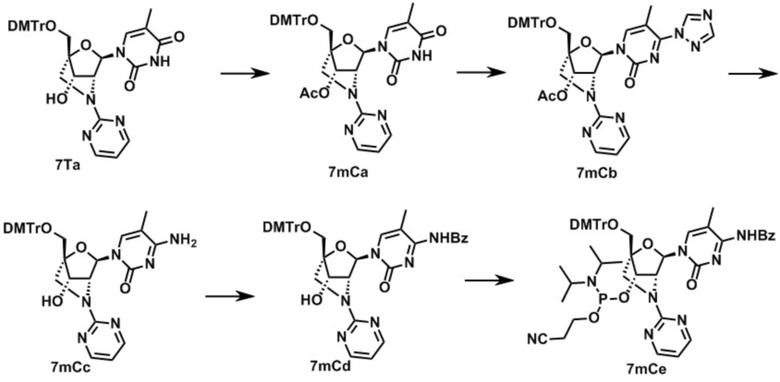
Пример 46. Синтез соединения 7mCa
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 7Ta (3,68 г, 5,67 ммоль), DMAP (69,3 мг, 0,567 ммоль) и пиридина (28 мл) добавляли уксусный ангидрид (0,804 мл, 8,51 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли в реакционный раствор этилацетат, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении. Пиридин удаляли азеотропно с этилацетатом, и полученную смесь растирали в диизопропиловом эфире, получая соединение 7mCa (3,49 г, выход 89%).
HRMS (FAB) — вычислено для C38H38N5O8 [M+H]+: 692,2720, получено: 692,2713.
Пример 47. Синтез соединения 7mCb
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-[5-метил-2-оксо-4-(1,2,4-триазол-1-ил)пиримидин-1-ил]-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат.
В смесь соединения 7mCa (3,46 г, 5,00 ммоль), 1,2,4-триазола (3,11 г, 45,0 ммоль), DIPEA (8,71 мл, 50,0 ммоль) и ацетонитрила (50 мл) добавляли фосфорилхлорид (0,792 мл, 8,50 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, и растворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Смесь растирали в диизопропиловом эфире, получая соединение 7mCb1 (3,40 г, выход 92%).
HRMS (FAB) — вычислено для C40H38N8O7 [M+H]+: 743,2942, получено: 743,2945.
Пример 48. Синтез соединения 7mCc
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он.
В смесь соединения 7mCb (3,40 г, 4,58 ммоль) и ацетонитрила (46 мл) добавляли 28%-ный водный раствор аммиака (31 мл), и полученную смесь перемешивали при комнатной температуре в течение 3 дней. Воду добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении. Смесь растирали в диизопропиловом эфире с небольшим количеством этилацетата, получая соединение 7mCc (2,65 г, выход 89%).
HRMS (FAB) — вычислено для C36H36N6O6 [M+H]+: 649,2775, получено: 649,2766.
Пример 49. Синтез соединения 7mCd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 7mCc (2,62 г, 4,04 ммоль) и ДМФА (20 мл) добавляли бензойный ангидрид (959 мг, 4,24 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Этилацетат добавляли в реакционный раствор, смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 7mCd (1,42 г, выход 47%).
HRMS (FAB) — вычислено для C43H40N6O7 [M+H]+: 753,3037, получено: 753,3035.
Пример 50. Синтез соединения 7mCe
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 18)
В смесь соединения 7mCd (1,40 г, 1,86 ммоль), дихлорметана (9 мл) и DIPEA (0,972 мл, 5,58 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,830 мл, 3,72 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. В реакционный раствор добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз и упаривали растворители. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 80/20 до 30/70, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 7mCe как заявленное соединение 18 (1,01 г, выход 57%).
HRMS (FAB) — вычислено для C52H57N8O8P [M+Na]+: 975,3935, получено: 975,3931.
31P-ЯМР (CDCl3) δ: 149,17, 149,23.
Синтез ALNA[2Pym]-G
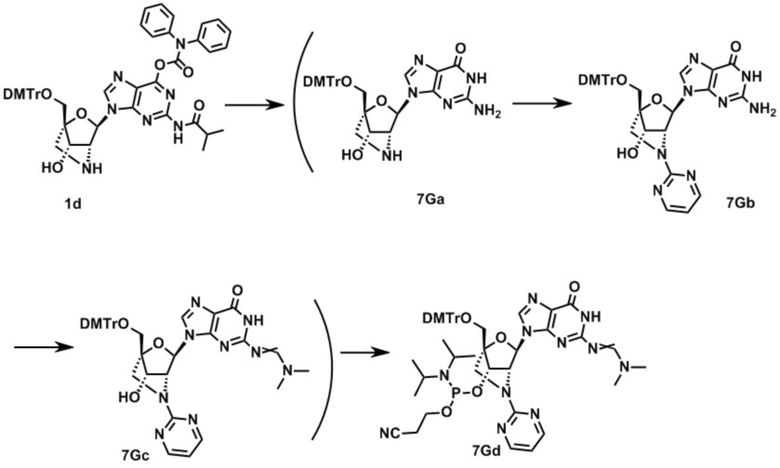
Пример 51. Синтез соединения 7Gc
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин.
В раствор соединения 1d (3,00 г, 3,50 ммоль) в метаноле (20 мл) и ТГФ (20 мл) добавляли 28%-ный водный раствор аммиака (40 мл). Затем добавляли метанол (20 мл) и ТГФ (20 мл), и полученную смесь оставляли при комнатной температуре на 16 часов. Затем добавляли 40%-ный раствор метиламина в метаноле (40 мл), и реакционную смесь оставляли при комнатной температуре на 4 часа. Растворители упаривали, остаток подвергали азеотропной сушке с толуолом и сушили при пониженном давлении. Остаток солюбилизировали в ДМСО (35 мл), добавляли DIPEA (4,8 мл, 28,0 ммоль) и 2-фторпиримидин (0,66 мл, 10,5 ммоль), и полученную смесь перемешивали при 80°C в течение 2 часов, затем при 100°C еще 2 часа. Затем добавляли еще 2-фторпиримидин (0,22 мл, 3,5 ммоль) и DIPEA (1,6 мл, 9,3 ммоль), и смесь перемешивали при 100°C в течение 2 часов. В реакционный раствор добавляли диметилацеталь N,N-диметилформамида (2,3 мл, 17,0 ммоль), и смесь перемешивали при комнатной температуре. Через 1 час добавляли этилацетат (200 мл), насыщенный водный раствор бикарбоната натрия (20 мл) и воду (80 мл), и полученную смесь разделяли в делительной воронке. Органический слой промывали водой (50 мл) три раза и затем промывали насыщенным водным раствором хлорида натрия. Смесь сушили над сульфатом натрия, нерастворенные частицы отфильтровывали, и растворители упаривали при пониженном давлении. Водный слой от разделения на делительной воронке экстрагировали хлороформом (100 мл) три раза, промывали водой (100 мл) и насыщенным водным раствором хлорида натрия. Хлороформенный слой сушили над сульфатом натрия, нерастворенные частицы отфильтровывали, растворители упаривали из фильтратов при пониженном давлении, остаток объединяли с описанными выше экстрактами, и полученную смесь очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 92/8), получая соединение 7Gc (1,66 г, выход за три стадии 65%).
MS (ESI): m/z = 731 (M+H)+
Пример 52. Синтез соединения 7Gd
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметил-6-формамидин (заявленное соединение 19).
Соединение 7Gd как заявленное соединение 19 (1,07 г, выход 53%) получали из соединения 7Gc (1,58 г, 2,16 ммоль) аналогично примеру 4.
MS (ESI): m/z = 931 (M+H)+
Синтез ALNA[2Pym]-A
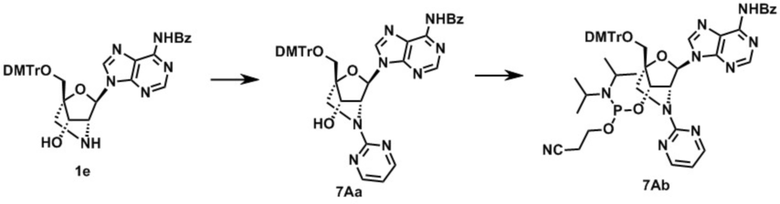
Пример 53. Синтез соединения 7Aa
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид
Смесь соединения 1e, которое синтезировали по методике, описанной в WO 2017/047816 A1 (500 мг, 0,730 ммоль), 2-фторпиримидина (215 мг, 2,19 ммоль), DIPEA (0,509 мл, 2,92 ммоль) и ДМСО (7 мл) перемешивали при 130°C в атмосфере азота в течение 7 часов. Этилацетат добавляли в реакционный раствор, и полученную смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 50/50 до 0/100), получая соединение 7Aa (207 мг, выход 37 %).
HRMS (FAB) — вычислено для C43H38N8O6 [M+Na]+: 785,2807, получено: 785,2807.
Пример 54. Синтез соединения 7Ab
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 20).
В смесь соединения 7Aa (126 мг, 0,165 ммоль), дихлорметана (3 мл) и DIPEA (86,2 мкл, 0,495 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (73,6 мкл, 0,330 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 5 часов. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворитель упаривали. Остаток очищали методом колоночной хроматографии (NH: гексан/этилацетат = от 50/50 до 0/100, SiO2: гексан/этилацетат = от 50/50 до 0/100, диол: гексан/этилацетат = от 60/40 до 10/90), получая соединение 7Ab как заявленное соединение 20 (110 мг, выход 69%).
HRMS (FAB) — вычислено для C52H55N10O7P [M+Na]+: 985,3885, получено: 985,3878.
31P-ЯМР (CDCl3) δ — 149,33, 149,47.
Синтез ALNA[4Pym]-T
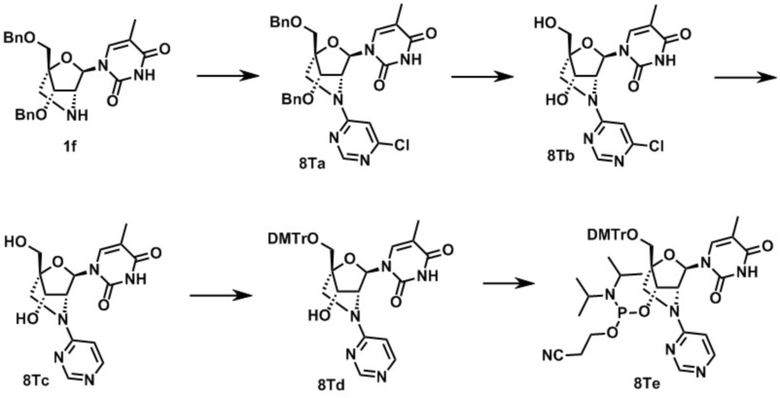
Пример 55. Синтез соединения 8Ta
1-[(1R,3R,4R,7S)-7-бензилокси-1-(бензилоксиметил)-5-(6-хлорпиримидин-4-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
Смесь соединения 1f, которое синтезировали по методике, описанной в WO 2017/047816 A1 (1,00 г, 2,22 ммоль), 4,6-дихлорпиримидина (398 мг, 2,66 ммоль), DIPEA (1,16 мл, 6,66 ммоль) и EtOH (20 мл) (2 порции) перемешивали при 120°C в условиях обработки микроволновым излучением в течение 5 часов для каждой порции. Порции объединяли, нерастворимые фракции реакционных растворов отделяли фильтрованием, промывали этанолом и сушили при пониженном давлении, получая соединение 8Ta (1,54 г, выход 62%).
HRMS (FAB) — вычислено для C29H28ClN5O5 [M+H]+: 562,1857, получено: 562,1859.
Пример 56. Синтез соединения 8Tb
1-[(1R,3R,4R,7S)-5-(6-хлорпиримидин-4-ил)-7-гидроксил-(гидроксиметил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2,4-дион
В смесь соединения 8Ta (3,49 г, 6,21 ммоль) и дихлорметана (62 мл) добавляли трихлорборан (1,0 моль/л раствор в дихлорметане, 62 мл, 62,1 ммоль) при -78°C в атмосфере азота, и полученную смесь постепенно нагревали до комнатной температуры в течение ночи. Медленно добавляли MeOH (62 мл) в реакционный раствор при охлаждении льдом, и полученную смесь перемешивали некоторое время. Реакционную смесь упаривали, остаток растирали в этилацетате, получая соединение 8Tb (3,28 г) в виде сырого продукта.
HRMS (FAB) — вычислено для C15H16ClN5O5 [M+H]+: 382,0918, получено: 382,0919.
Пример 57. Синтез соединения 8Tc
1-[(1R,3R,4R,7S)-7-гидрокси-1-(гидроксиметил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2,4-дион
В смесь соединения 8Tb (3,28 г, 6,21 ммоль, сырой продукт) и MeOH (62 мл) добавляли 20% гидроксид палладия (654 мг, 20 вес.%), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Воду (31 мл) добавляли в реакционный раствор для растворения нерастворимого осадка, и палладий отфильтровали через целит. Фильтраты упаривали, и воду удаляли методом азеотропной сушки с толуолом. Остаток растирали в MeOH, получая соединение 8Tc (1,75 г, выход за две стадии 81%).
HRMS (FAB) — вычислено для C15H17N5O5 [M+H]+: 348,1302, получено: 348,1308.
Пример 58. Синтез соединения 8Td
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В смесь соединения 8Tc (444 мг, 1,28 ммоль) и пиридина (13 мл) добавляли 4,4’-диметокситритилхлорид (520 мг, 1,54 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Насыщенный водный раствор гидрокарбоната натрия по каплям добавляли в реакционный раствор при охлаждении льдом, затем добавляли этилацетат. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом натрия и упаривали. Пиридин подвергали азеотропной сушке этилацетатом, и остаток растирали в диизопропиловом эфире, получая соединение 8Td (652 мг, выход 78%).
HRMS (FAB) — вычислено для C36H35N5O7 [M+H]+: 650,2609, получено: 650,2600.
Пример 59. Синтез соединения 8Te
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 21).
В смесь соединения 8Td (300 мг, 0,462 ммоль), дихлорметана (5 мл) и DIPEA (322 мкл, 1,85 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (309 мкл, 1,39 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10, диол: гексан/этилацетат= от 50/50 до 0/100), получая соединение 8Te как заявленное соединение 21 (263 мг, выход 67%).
HRMS (FAB) — вычислено для C45H52N7O8 [M+H]+: 850,3693, получено: 850,3685.
31P-ЯМР (CDCl3) δ: 148,93, 149,47.
Синтез ALNA[4Pym]-mC
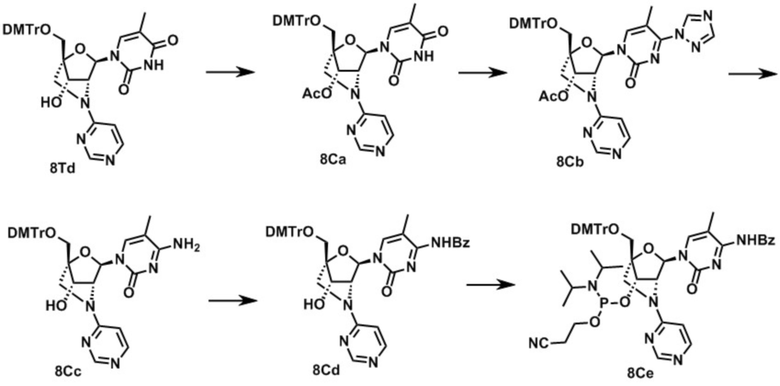
Пример 60. Синтез соединения 8Ca
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 8Td (234 мг, 0,360 ммоль), DMAP (4,4 мг. 0,0360 ммоль) и пиридина (3,6 мл) добавляли уксусный ангидрид (51,1 мкл, 0,540 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали 5%-ным водным раствором сульфата меди, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток растирали в диизопропиловом эфире, получая соединение 8Ca (219 мг, выход 88%).
HRMS (FAB) — вычислено для C38H27N5O8 [M+H]+: 692,2720, получено: 692,2720.
Пример 61. Синтез соединения 8Cb
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-[5-метил-2-оксо-4-(1,2,4-триазол-1-ил)пиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 8Ca (201 мг, 0,291 ммоль), 1,2,4-триазола (181 мг, 2,62 ммоль), DIPEA (507 мкл, 2,91 ммоль) и ацетонитрила (3 мл) добавляли фосфорилхлорид (46,1 мкл, 0,494 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Смесь растирали в диизопропиловом эфире, получая соединение 8Cb (211 мг, выход 98%).
HRMS (FAB) — вычислено для C40H38N8O7 [M+H]+: 743,2942, получено: 743,2939.
Пример 62. Синтез соединения 8Cc
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
В смесь соединения 8Cb (613 мг, 0,825 ммоль) и ацетонитрила (8,3 мл) добавляли 28%-ный водный раствор аммиака (5,5 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи. Ацетонитрил упаривали из реакционного раствора. Нерастворимый осадок отделяли фильтрованием и промывали водой. Сырой продукт растирали в этилацетате, получая соединение 8Cc (380 мг, выход 71%).
HRMS (FAB) — вычислено для C36H36N6O6 [M+H]+: 649,2775, получено: 649,2773.
Пример 63. Синтез соединения 8Cd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 8Cc (378 мг, 0,583 ммоль) и пиридина (6 мл) добавляли бензойный ангидрид (198 мг, 0,875 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии (диол: 0,5% триэтиламин хлороформ/метанол = от 100/0 до 90/10, SiO2: 0,55% триэтиламин хлороформ/метанол = от 100/0 до 90/10), получая соединение 8Cd (247 мг, выход 56%).
HRMS (FAB) — вычислено для C43H40N6O7 [M+H]+: 753,3037, получено: 753,3040.
Пример 64. Синтез соединения 8Ce
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 22).
В смесь соединения 8Cd (135 мг, 0,179 ммоль), дихлорметана (2 мл) и DIPEA (125 мкл, 0,716 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (120 мкл, 0,537 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 дней. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат= от 50/50 до 0/100, диол: гексан/этилацетат= от 60/40 до 10/90, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 8Ce как заявленное соединение 22 (61,9 мг, выход 36%).
HRMS (FAB) — вычислено для C52H57N8O8 [M+H]+: 953,4115, получено: 953,4109.
31P-ЯМР (CDCl3) δ: 149,65, 150,24.
Синтез ALNA[4-CF3-2Pym]-T
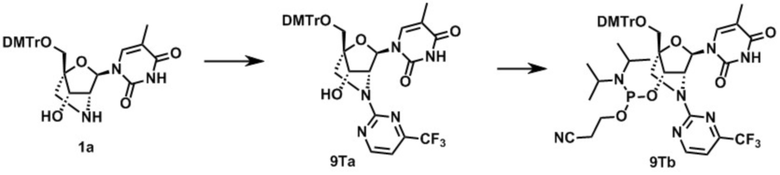
Пример 65. Синтез соединения 9Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
Смесь соединения 1a (500 мг, 0,875 ммоль), 2-хлор-4-(трифторметил)пиримидина (239 мг, 1,31 ммоль), DIPEA (457 мкл, 2,63 ммоль) и EtOH (4,4 мл) перемешивали при 120°C в условиях обработки микроволновым излучением 30 минут. 2-Хлор-4-(трифторметил)пиримидин (239 мг, 1,31 ммоль) и DIPEA (457 мкл, 2,63 ммоль) дополнительно добавляли в реакционный раствор, и полученную смесь перемешивали при 120°C в условиях обработки микроволновым излучением 1 час. Реакционную смесь упаривали, добавляли этилацетат, и смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 9Ta (545 мг, выход 87%).
HRMS (FAB) — вычислено для C37H34F3N5O7 [M+H]+: 718,2489, получено: 718,2491.
Пример 66. Синтез соединения 9Tb
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 23).
В смесь соединения 9Ta (527 мг, 0,734 ммоль), дихлорметана (7 мл) и DIPEA (384 мкл, 2,20 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (328 мкл, 1,47 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 80/20 до 30/70, диол: гексан/этилацетат = от 70/30 до 20/80), получая соединение 9Tb как заявленное соединение 23 (530 мг, выход 79%).
HRMS (FAB) — вычислено для C46H51F3N7O8P [M+H]+: 918,3567, получено: 918,3568.
31P-ЯМР (CDCl3) δ: 149,04, 149,12, 149,20, 149,47.
Синтез ALNA[4-CF3-2Pym]-mC
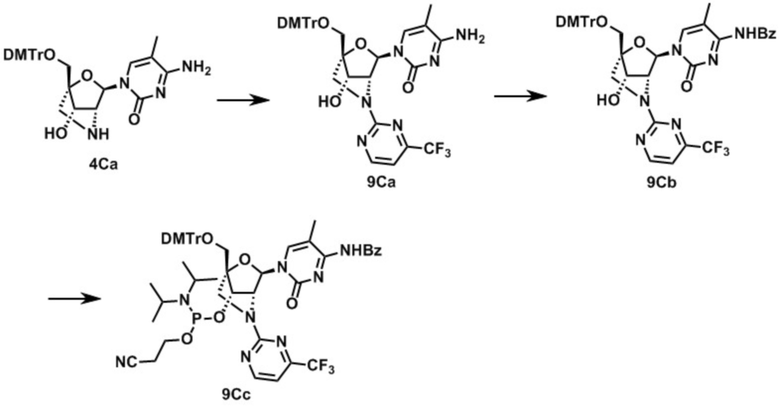
Пример 67. Синтез соединения 9Ca
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
Смесь соединения 4Ca (500 мг, 0,876 ммоль), 2-хлор-4-(трифторметил)пиримидина (317 мкл, 2,63 ммоль), DIPEA (610 мкл, 3,50 ммоль) и EtOH (4,4 мл) перемешивали при 150°C в условиях обработки микроволновым излучением 1 час. Реакционную смесь упаривали, добавляли этилацетат, и смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 9Ca (186 мг, выход 30%).
HRMS (FAB) — вычислено для C37H35F3N6O6 [M+H]+: 717,2648, получено: 717,2651.
Пример 68. Синтез соединения 9Cb
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид
В смесь соединения 9Ca (395 мг, 0,551 ммоль) и ДМФА (5,5 мл) добавляли бензойный ангидрид (131 мг, 0,579 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/15), получая соединение 9Cb (335 мг, выход 74%).
HRMS (FAB) — вычислено для C44H39F3N6O7 [M+H]+: 821,2911, получено: 821,2932.
Пример 69. Синтез соединения 9Cc
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 24).
В смесь соединения 9Cb (316 мг, 0,385 ммоль), дихлорметана (4 мл) и DIPEA (201 мкл, 1,16 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (172 мкл, 0,770 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 100/0 до 50/50, Диол: гексан/этилацетат = от 100/0 до 50/50), получая соединение 9Cc как заявленное соединение 24 (227 мг, выход 58%).
HRMS (FAB) — вычислено для C53H56F3N8O8P [M+H]+: 1021,3989, получено: 1021,3993.
31P-ЯМР (CDCl3) δ: 149,15, 149,28, 149,36, 149,60.
Синтез ALNA[5-Cl-2Pym]-T
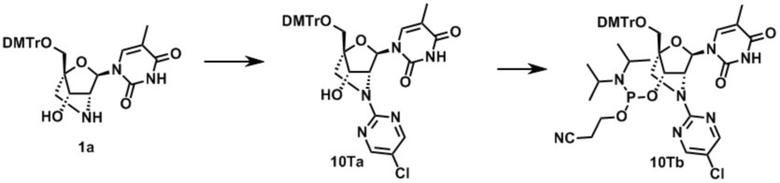
Пример 70. Синтез соединения 10Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
Смесь соединения 1a (500 мг, 0,875 ммоль, 2,5-дихлорпиримидина (196 мг, 1,31 ммоль), DIPEA (457 мкл, 2,63 ммоль) и EtOH (4,4 мл) перемешивали при 150°C в условиях обработки микроволновым излучением 1 час. Нерастворенные частицы в реакционном растворе солюбилизировали хлороформом, и полученную смесь упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 10Ta (263 мг, выход 44%).
HRMS (FAB) — вычислено для C36H34ClN5O7 [M+H]+: 684,2225, получено: 684,2226.
Пример 71. Синтез соединения 10Tb
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 25)
В смесь соединения 10Ta (240 мг, 0,351 ммоль), дихлорметана (3,5 мл) и DIPEA (183 мкл, 1,05 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (157 мкл, 0,702 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 4 дней. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 70/30 до 20/80, диол: гексан/этилацетат = от 70/30 до 20/80), получая соединение 10Tb (201 мг, выход 65%).
HRMS (FAB) — вычислено для C45H51ClN7O8P [M+H]+: 884,3304, получено: 884,3303.
31P-ЯМР (CDCl3) δ: 149,12.
Синтез ALNA[5-Cl-2Pym]-mC
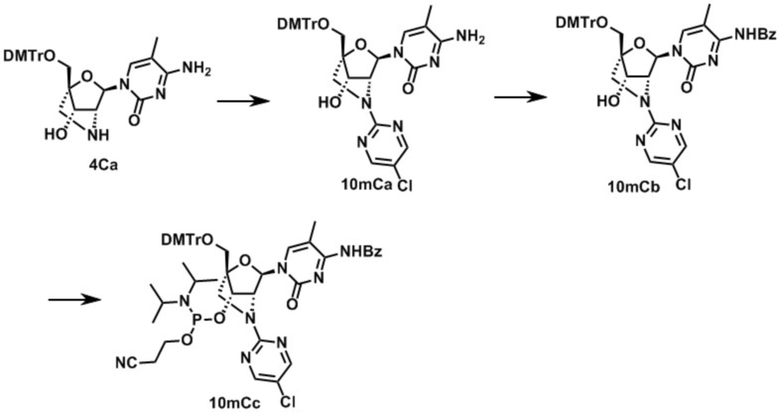
Пример 72. Синтез соединения 10mCa
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
Смесь соединения 4Ca (500 мг, 0,876 ммоль), 2,5-дихлорпиримидина (391 мг, 2,63 ммоль), DIPEA (610 мкл, 3,50 ммоль) и EtOH (4,4 мл) (2 порции) перемешивали при 150°C в условиях обработки микроволновым излучением 1 час для каждой порции. Реакционную смесь упаривали, добавляли воду, и полученную смесь экстрагировали хлороформом. Объединенный органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 10mCa (381 мг, выход 32%).
HRMS (FAB) — вычислено для C36H35ClN6O6 [M+H]+: 683,2385, получено: 683,2389.
Пример 73. Синтез соединения 10mCb
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид
В смесь соединения 10mCa (375 мг, 0,549 ммоль) и ДМФА (5,5 мл) добавляли бензойный ангидрид (130 мг, 0,576 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. В реакционный раствор добавляли еще бензойный ангидрид (24,8 мг, 0,110 ммоль), и смесь дополнительно перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 10mCb (422 мг, выход 98%).
HRMS (MALDI) — вычислено для C43H39ClN6O7 [M+Na]+: 809,2461, получено: 809,2463.
Пример 74. Синтез соединения 10mCc
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-2-окса-5-азабицикло[2.2.1] гептан-3-ил]-5-метилпиримидин-4-ил]бензамид (заявленное соединение 26).
В смесь соединения 10mCb (409 мг, 0,520 ммоль), дихлорметана (5 мл) и DIPEA (272 мкл, 1,56 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (232 мкл, 1,04 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат= от 100/0 до 50/50, диол: гексан/этилацетат = от 100/0 до 50/50), получая соединение 10mCc как заявленное соединение 26 (264 мг, выход 51%).
HRMS (MALDI) — вычислено для C52H56ClN8O8P [M+Na]+: 1009,3540, получено: 1009,3521
31P-ЯМР (CDCl3) δ: 149,28
Синтез ALNA[6-NMe2-4Pym]-T
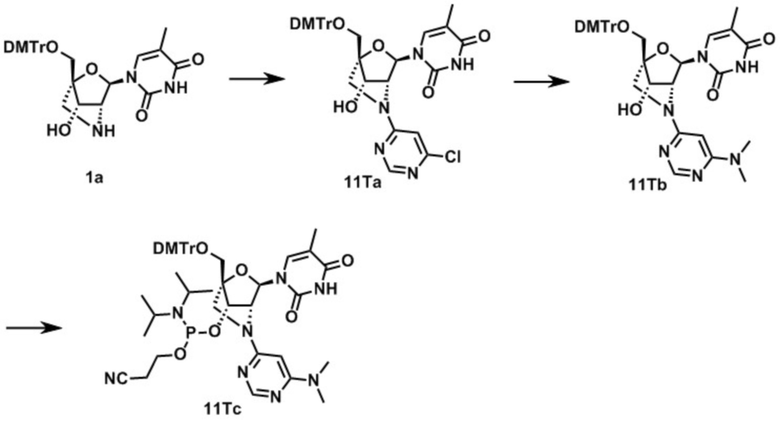
Пример 75. Синтез соединения 11Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(6-хлорпиримидин-4-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион.
Смесь соединения 1a (1,00 г, 1,75 ммоль), 4,6-дихлорпиримидина (391 мг, 2,63 ммоль), DIPEA (914 мкл, 5,25 ммоль) и EtOH (18 мл) перемешивали при 120°C в условиях обработки микроволновым излучением 1 час. Реакционную смесь упаривали, остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 11Ta (1,00 г, выход 84%).
HRMS (FAB) — вычислено для C36H34ClN5O7 [M+H]+: 684,2225, получено: 684,2214.
Пример 76. Синтез соединения 11Tb
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино) пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В смесь соединения 11Ta (500 мг, 0,731 ммоль), DIPEA (637 мкл, 3,66 ммоль) и EtOH (5 мл) добавляли гидрохлорид диметиламина (179 мг, 2,19 ммоль), и полученную смесь перемешивали при 150°C в условиях обработки микроволновым излучением 30 минут. Нерастворимый осадок отфильтровывали и сушили при пониженном давлении, получая соединение 11Tb (386 мг, выход 76%).
HRMS (FAB) — вычислено для C38H40N6O7 [M+H]+: 693,3037, получено: 693,3030.
Пример 77. Синтез соединения 11Tc
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино) пиримидин-4-ил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламин)фосфанил]оксипропаннитрил (заявленное соединение 27)
В смесь соединения 11Tb (335 мг, 0,484 ммоль), дихлорметана (5 мл), DIPEA (253 мкл, 1,45 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (216 мкл, 0,968 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Добавляли ДМФА (2 мл) в реакционный раствор, и смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. В реакционный раствор добавляли еще DIPEA (253 мкл, 1,45 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамидит (216 мкл, 0,968 ммоль), и смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 дней. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10, Диол: гексан/этилацетат = от 50/50 до 0/100), получая соединение 11Tc как заявленное соединение 27 (189 мг, выход 44%).
HRMS (FAB) — вычислено для C47H57N8O8P [M+H]+: 893,4115, получено: 893,4115.
31P-ЯМР (CDCl3) δ: 148,83, 148,99.
Синтез ALNA[6-NMe2-4Pym]-mC
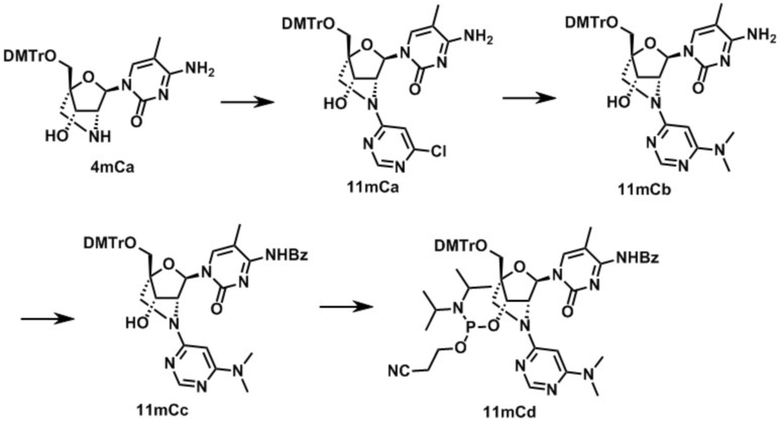
Пример 78. Синтез соединения 11mCa
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(6-хлорпиримидин-4-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он.
Смесь соединения 4mCa (2,00 г, 3,50 ммоль), 4,6-дихлорпиримидина (626 мг, 4,20 ммоль), DIPEA (1,83 мл, 10,5 ммоль) и EtOH (17,5 мл) перемешивали при 100°C в течение 4 часов. Реакционную смесь упаривали, добавляли воду, и полученную смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 11mCa (1,34 г, выход 56%).
HRMS (FAB) — вычислено для C36H35ClN6O6 [M+H]+: 683,2385, получено: 683,2384.
Пример 79. Синтез соединения 11mCb
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[8-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
Смесь соединения 11mCa (1,12 г, 1,64 ммоль), диметиламина (50%-ный водный раствор, 863 мкл, 8,20 ммоль) и EtOH (1 мл) перемешивали при 150°C в условиях обработки микроволновым излучением 30 минут. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии (NH: хлороформ/метанол = от 100/0 до 95/5), получая соединение 11mCb (1,09 г, выход 96%).
HRMS (MALDI) — вычислено для C38H41N7O6 [M+Na]+: 714,3011, получено: 714,3003.
Пример 80. Синтез соединения 11mCc
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино) пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 11mCb (1,08 г, 1,56 ммоль) и ДМФА (8 мл) добавляли бензойный ангидрид (389 мг, 1,72 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 11Cc (1,02 г, выход 82%).
HRMS (MALDI) — вычислено для C45H45N7O7 [M+H]+: 796,3453, получено: 796,3466.
Пример 81. Синтез соединения 11mCd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси (диизопропиламино)фосфанил]окси-5-[(6-диметиламино)пиримидин-4-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 28).
В смесь соединения 11mCc (972 мг, 1,22 ммоль), дихлорметана (12 мл) и DIPEA (637 мкл, 3,66 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (545 мкл, 2,44 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат= от 50/50 до 0/100, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 11mCd как заявленное соединение 28 (788 мг, выход 65%).
HRMS (MALDI) — вычислено для C54H62N9O8P [M+H]+: 996,4532, получено: 996,4513.
31P-ЯМР (CDCl3) δ: 149,06, 149,17.
Синтез ALNA[2-NMe2-4Pym]-T
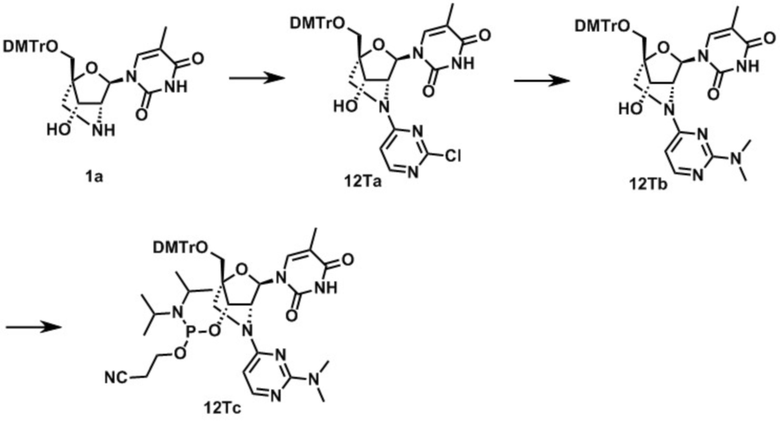
Пример 82. Синтез соединения 12Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(2-хлорпиримидин-4-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
Смесь соединения 1a (2,00 г, 3,50 ммоль), 2,4-дихлорпиримидин (782 мг, 5,25 ммоль), DIPEA (1,83 мл, 10,5 ммоль) и EtOH (17,5 мл) перемешивали при 100°C в течение 4,5 часов. Реакционный раствор упаривали, добавляли воду, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 12Ta (1,86 г, выход 78%).
HRMS (FAB) — вычислено для C36H34ClN5O7 [M+H]+: 684,2225, получено: 684,2223.
Пример 83. Синтез соединения 12Tb
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино) пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион.
В смесь соединения 12Ta (500 мг, 0,731 ммоль), DIPEA (637 мкл, 3,66 ммоль) и EtOH (5 мл) добавляли гидрохлорид диметиламина (179 мг, 2,19 ммоль), и полученную смесь перемешивали при 150°C в условиях обработки микроволновым излучением 30 минут. Реакционный раствор упаривали, и остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5). Смесь растирали в диизопропиловом эфире, получая соединение 12Tb (648 мг) в виде сырого продукта.
HRMS (FAB) — вычислено для C38H40N6O7 [M+H]+: 693,3037, получено: 693,3041.
Пример 84. Синтез соединения 12Tc
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино) пиримидин-4-ил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)оксипропаннитрил (заявленное соединение 29).
В смесь соединения 12Tb (638 мг, 0,731 ммоль, сырой продукт), дихлорметана (7 мл) и DIPEA (382 мкл, 2,19 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлор-фосфорамидит (326 мкл, 1,46 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 5 дней. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/ метанол = от 100/0 до 90/10, диол: гексан/этилацетат = от 50/50 до 0/100), получая соединение 12Tc как заявленное соединение 29 (304 мг, выход 47% за 2 стадии).
HRMS (FAB) — вычислено для C47H57N8O8P [M+H]+: 893,4115, получено: 893,4128.
31P-ЯМР (CDCl3) δ: 148,91, 149,33.
Синтез ALNA[2-NMe2-4Pym]-mC
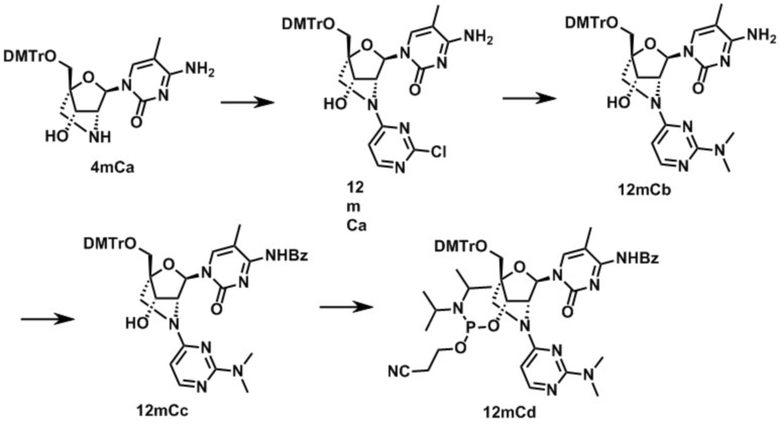
Пример 85. Синтез соединения 12mCa
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(2-хлорпиримидин-4-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он.
Смесь соединения 4mCa (2,00 г, 2,50 ммоль), 2,4-дихлорпиримидина (627 мг, 4,20 ммоль), DIPEA (1,83 мл, 10,5 ммоль) и EtOH (17,5 мл) перемешивали при 100°C в течение 3 часов. Реакционную смесь упаривали, добавляли воду, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 12mCa (1,28 г, выход 54%).
HRMS (MALDI) — вычислено для C36H35ClN6O6 [M+Na]+: 705,2199, получено: 705,2199.
Пример 86. Синтез соединения 12mCb
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
Смесь соединения 12mCa (941 мг, 1,38 ммоль), диметиламина (50%-ный водный раствор, 725 мкл, 6,90 ммоль) и EtOH (14 мл, 0,1 M) перемешивали при 150°C в условиях обработки микроволновым излучением 30 минут. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии (NH: хлороформ/метанол = от 100/0 до 90/10), получая соединение 12mCb (784 мг, выход 82%).
HRMS (MALDI) — вычислено для C38H41N7O6 [M+H]+: 692,3191, получено: 692,3167.
Пример 87. Синтез соединения 12mCc
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино) пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 12mCb (754 мг, 1,09 ммоль) и ДМФА (5,5 мл) добавляли бензойный ангидрид (271 мг, 1,20 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 12mCc (731 мг, выход 84%).
HRMS (MALDI) — вычислено для C45H45N7O7 [M+H]+: 796,3453, получено: 796,3440.
Пример 88. Синтез соединения 12mCd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[2-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 30).
В смесь соединения 12mCc (709 мг, 0,891 ммоль), дихлорметана (9 мл) и DIPEA (466 мкл, 2,67 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (397мкл, 1,78 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 50/50 до 0/100, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 12mCd как заявленное соединение 30 (482 мг, выход 54%).
HRMS (MALDI) — вычислено для C54H62N9O8P [M+H]+: 996,4532, получено: 996,4526.
31P-ЯМР (CDCl3) δ: 149,19, 149,46, 149,65.
Синтез ALNA[Prz]-T

Пример 89. Синтез соединения 13Ta
[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2,4-дион
Смесь соединения 1a (500 мг, 0,875 ммоль), 2-фторпиразина (201 мкл, 2,63 ммоль), DIPEA (610 мкл, 3,50 ммоль) и ДМСО (8,8 мл) перемешивали при 140°C в течение 1,5 часов и при 150°C в течение 4,5 часов в атмосфере азота. Этилацетат добавляли в реакционный раствор, и смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии SiO2: хлороформ/ метанол = от 100/0 до 90/10, SiO2: гексан/этилацетат = от 50/50 до 0/100), получая соединение 13Ta (227 мг, выход 40%).
HRMS (MALDI) — вычислено для C36H35N5O7 [M+Na]+: 672,2429, получено: 672,2409.
Пример 90. Синтез соединения 13Tb
3-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 31)
В смесь соединения 13Ta (214 мг, 0,329 ммоль), дихлорметана (6,6 мл) и DIPEA (172 мкл, 0,987 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (147 мкл, 0,658 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 50/50 до 0/100, NH: этилацетат/метанол = от 100/0 до 90/10), получая соединение 13Tb как заявленное соединение 31 (204 мг, выход 73%).
HRMS (MALDI) — вычислено для C45H52N7O8P [M+Na]+: 872,3507, получено: 872,3507.
31P-ЯМР (CDCl3) δ: 149,12, 149,31.
Синтез ALNA[Prz]-mC
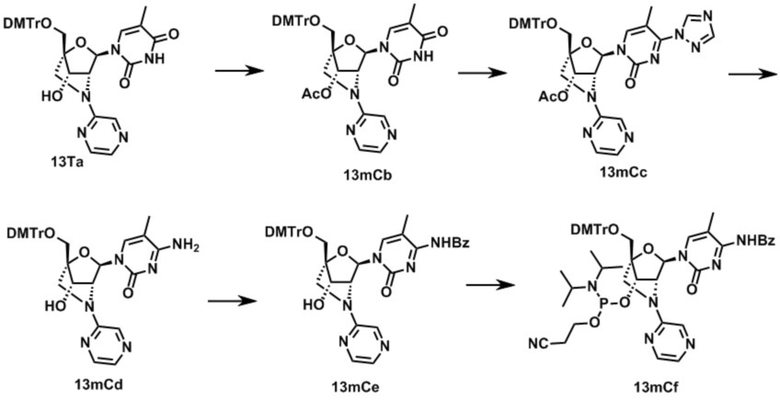
Пример 91. Синтез соединения 13mCb
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 13Ta (746 мг, 1,15 ммоль), DMAP (14,0 мг, 0,115 ммоль) и пиридина (5,8 мл) добавляли уксусный ангидрид (163 мкл, 1,73 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Пиридин подвергали азеотропной сушке этилацетатом, и остаток растирали в диизопропиловом эфире, получая соединение 13MCb (712 мг, выход 90%).
HRMS (MALDI) — вычислено для C38H37N5O8 [M+Na]+: 714,2534, получено: 714,2520.
Пример 92. Синтез соединения 13mCc
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2-оксо-(4-1,2,4-триазол-1-ил)пиримидин-1-ил]-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 13mCb (692 мг, 1,00 ммоль), 1,2,4-триазола (622 мг, 9,00 ммоль), DIPEA (1,74 мл, 10,0 ммоль) и ацетонитрила (10 мл) добавляли фосфорилхлорид (158 мкл, 1,70 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота 1 час. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали, получая соединение 13mCc (753 мг) в виде сырого продукта.
HRMS (MALDI) — вычислено для C40H38N8O7 [M+Na]+: 765,2756, получено: 765,2750.
Пример 93. Синтез соединения 13mCd
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он
В смесь соединения 13mCc (744 г, 1,00 ммоль, сырой продукт) и ацетонитрила (10 мл) добавляли 28%-ный водный раствор аммиака (6,7 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и упаривали, получая соединение 13mCd (638 мг, выход за две стадии 98%).
HRMS (MALDI) — вычислено для C36H36N6O6 [M+Na]+: 671,2589, получено: 671,2591.
Пример 94. Синтез соединения 13mCe
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 13mCd (625 мг, 0,963 ммоль) и ДМФА (4,8 мл) добавляли бензойный ангидрид (327 мг, 1,44 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 13mCe (245 мг, выход 34%).
HRMS (MALDI) — вычислено для C43H40N6O7 [M+Na]+: 775,2851, получено: 775,2845.
Пример 95. Синтез соединения 13mCf
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 32).
В смесь соединения 13mCe (565 мг, 0,751 ммоль), дихлорметана (7,5 мл) и DIPEA (392 мкл, 2,25 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (335 мкл, 1,50 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 70/30 до 20/80, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 13mCf как заявленное соединение 32 (369 мг, выход 52%).
HRMS (MALDI) — вычислено для C50H44N6O8 [M+Na]+: 975,3929, получено: 975,3923.
31P-ЯМР (CDCl3) δ: 149,25, 149,49.
Синтез ALNA[Trz]-T
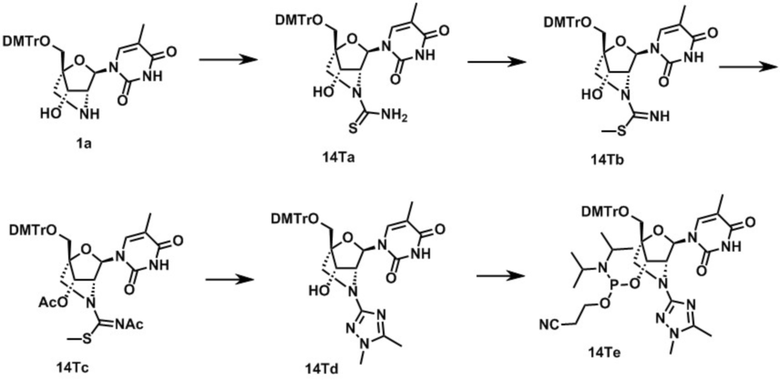
Пример 96. Синтез соединения 14Ta
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карботиоамид
В смесь соединения 1a (2,00 г, 3,50 ммоль) и ТГФ (17,5 мл) добавляли 1,1-тиокарбонил диимидазол (1,25 г, 7,00 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли в реакционный раствор 28%-ный водный раствор аммиака (17,5 мл), и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали, и нерастворенные частицы отфильтровывали. Отфильтрованный осадок промывали водой, получая соединение 14Ta (2,35 г) в виде сырого продукта.
HRMS (MALDI) — вычислено для C33H34N4O7 [M+Na]+: 653,2040, получено: 653,2026.
Пример 97. Синтез соединения 14Tb
метил (1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксимидотиоат.
В смесь соединения 14Ta (2,35 г, 3,50 ммоль, сырой продукт) и ТГФ (17,5 мл), добавляли метилиодид (654 мкл, 10,5 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 дней. Добавляли в реакционный раствор насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 80/20), получая соединение 14Tb (1,88 г, выход за две стадии 83%).
HRMS (MALDI) — вычислено для C34H36N4O7 [M+H]+: 645,2377, получено: 645,2374.
Пример 98. Синтез соединения 14Tc
[(1R,3R,4R,7S)-5-[(Z)-N-ацетил-C-метилсульфонилкарбамидоил]-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 14Tb (1,87 г, 2,90 ммоль, DMAP (35,4 мг, 0,290 ммоль) и пиридина (14,5 мл) добавляли уксусный ангидрид (822 мкл, 8,70 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и полученную смесь промывали 5%-ным водным раствором сульфата меди, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении, получая соединение 14Tc (2,11 г, выход 100%).
HRMS (MALDI) — вычислено для C38H40N4O9S [M+Na]+: 751,2408, получено: 751,2398.
Пример 99. Синтез соединения 14Td
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В смесь соединения 14Tc (1,66 г, 2,28 ммоль) и EtOH (23 мл) добавляли метилгидразин (1,20 мл, 22,8 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали, и остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 14td (985 мг, выход 65%).
HRMS (MALDI) — вычислено для C36H38N6O7 [M+Na]+: 689,2694, получено: 689,2684.
Пример 100. Синтез соединения 14Te
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 33)
В смесь соединения 14Td (576 мг, 0,864 ммоль), дихлорметана (8,6 мл) и DIPEA (451 мкл, 2,59 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (385 мкл, 1,73 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 дней. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 50/50 до 0/100, диол: гексан/этилацетат = от 50/50 до 0/100), получая соединение 14Te как заявленное соединение 33 (517 мг, выход 69%).
HRMS (MALDI) — вычислено для C45H55N8O8P [M+Na]+: 889,3773, получено: 889,3778.
31P-ЯМР (CDCl3) δ: 148,40, 148,45.
Синтез ALNA[Trz]-mC

Пример 101. Синтез соединения 14Ca
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 14Td (918 мг, 1,38 ммоль), DMAP (16,9 мг, 0,138 ммоль) и пиридина (6,9 мл) добавляли уксусный ангидрид (196 мкл, 2,07 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении, получая соединение 14Ca (955 мг, выход 98%).
HRMS (MALDI) — вычислено для C38H40N6O8 [M+Na]+: 731,2800, получено: 731,2791.
Пример 102. Синтез соединения 14Cb
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2-оксо-4-(1,2,4-триазол-1-ил)пиримидин-1-ил]-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 14Ca (915 мг, 1,29 ммоль), 1,2,4-триазола (802 мг, 11,6 ммоль), DIPEA (2,25 мл, 12,9 ммоль) и ацетонитрила (12,9 мл) добавляли фосфорилхлорид (204 мкл, 2,19 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении, получая соединение 14Cb (1,08 г) в виде сырого продукта.
HRMS (MALDI) — вычислено для C40H41N9O7 [M+Na]+: 782,3021, получено: 782,3019.
Пример 103. Синтез соединения 14Cc
4-амино-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2-он.
В смесь соединения 14Cb (1,07 г, 1,29 ммоль), сырой продукт) и ацетонитрила (12,9 мл) добавляли 28%-ный водный раствор аммиака (8,6 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, и фильтраты упаривали, получая соединение 14Cc (748 мг, выход за две стадии 87%).
HRMS (MALDI) — вычислено для C36H39N7O6 [M+Na]+: 688,2854, получено: 688,2857.
Пример 104. Синтез соединения 14Cd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 14Cc (733 мг, 1,10 ммоль) и пиридина (5,5 мл) добавляли бензойный ангидрид (374 мг, 1,64 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли в реакционный раствор 2н. водный раствор гидроксида натрия (5,5 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/ метанол = от 100/0 до 90/10), получая соединение 14Cd (744 мг, выход 88%).
HRMS (MALDI) — вычислено для C43H43N7O7 [M+Na]+: 792,3116, получено: 792,3111.
Пример 105. Синтез соединения 14Ce
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 34).
В смесь соединения 14Cd (730 мг, 0,948 ммоль), дихлорметана (9,5 мл) и DIPEA (0,495 мл, 2,84 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,423 мл, 1,90 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 50/50 до 0/100, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 14Ce как заявленное соединение 34 (672 мг, выход 73%).
HRMS (MALDI) — вычислено для C52H60N9O8P [M+Na]+: 992,4195, получено: 992,4186.
31P-ЯМР (CDCl3) δ: 148,50, 148,58.
Синтез ALNA[Trz]-G
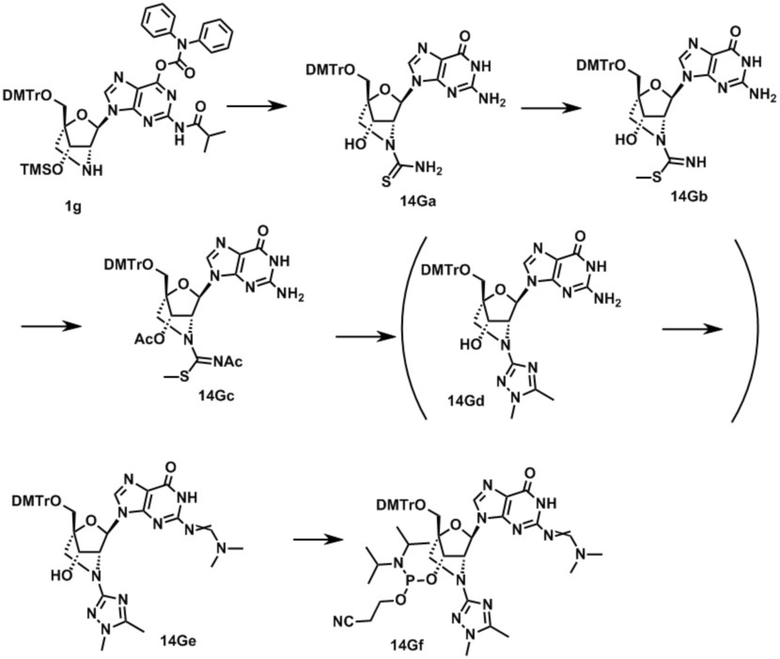
Пример 106. Синтез соединения 14Ga
(1R,3R,4R,7S)-3-(2-амино-6-оксо-1H-пурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-5-карботиоамид.
В раствор соединения 1g, которое синтезировали по методике, описанной в WO 2017/047816 A1 (55,0 г, 58,9 ммоль), в ТГФ (270 мл) добавляли шприцом 1,1-тиокарбонил диимидазол (21,0 г, 118 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли в реакционный раствор 28%-ный водный раствор аммиака (270 мл), и смесь перемешивали при комнатной температуре в течение 30 минут, затем перемешивали при 50°C в течение 46 часов. Хлороформ (700 мл) добавляли в реакционный раствор, и после непродолжительного перемешивания органический слой отделяли в делительной воронке и сушили над безводным сульфатом натрия. Нерастворенные частицы отфильтровывали, растворители упаривали при пониженном давлении, и полученный остаток грубо очищали методом хроматографии на силикагеле (SiO2: хлороформ/метанол = от 100/0 до 90/10). Полученный остаток солюбилизировали в этилацетате (250 мл), затем добавляли толуол (250 мл). Растворители упаривали при пониженном давлении примерно до 300 мл (твердые вещества выпадали в осадок), в полученную суспензию добавляли диизопропиловый эфир (IPE) (50 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Выпавший осадок отделяли фильтрованием и промывали диизопропиловым эфиром (50 мл), затем сушили при пониженном давлении, получая соединение 14Ga (27,9 г, выход 72%).
MS (ESI): m/z = 656 [M+H]+
Пример 107. Синтез соединения 14Gb
Метил (1R,3R,4R,7S)-3-(2-амино-6-оксо-1H-пурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксиимидотиоат.
В раствор соединения 14Ga (27,9 г, 42,5 ммоль) в ТГФ (400 мл) по каплям добавляли метилиодид (4,24 мл, 68,1 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь добавляли в перемешиваемый водный раствор бикарбоната натрия (который был приготовлен из насыщенного водного раствора бикарбоната натрия (400 мл) и воды (400 мл)) и хлороформ (1400 мл) при перемешивании. После перемешивания органический слой отделяли в делительной воронке и сушили над безводным сульфатом натрия. Смесь фильтровали через целит, и фильтрат азеотропно сушили с толуолом, получая соединение 14Gb (26,9 г, выход 82%).
MS (ESI): m/z = 670 [M+H]+
Пример 108. Синтез соединения 14Gc
[(1R,3R,4R,7S)-5-(N-ацетил-C-метилсульфонилкарбоксиимидоил)-3-(2-амино-6-оксо-1H-пурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-2-окса-5-азабицикло[2.2.1] гептан-7-ил]ацетат
В смесь соединения 14Gb (26,9 г, 34,7 ммоль) и пиридина (100 мл) добавляли уксусный ангидрид (9,83 мл, 104 ммоль) и DMAP (424 мг, 3,47 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 4 часов. В реакционный раствор добавляли этилацетат (400 мл) и насыщенный водный раствор бикарбоната натрия (200 мл), смесь интенсивно перемешивали 20 минут, и органический слой отделяли в делительной воронке. Органический слой промывали водой (2 × 200 мл) и насыщенным водным раствором хлорида натрия (200 мл), затем сушили над безводным сульфатом натрия. Нерастворенные частицы отфильтровывали, растворители упаривали при пониженном давлении, и полученный остаток подвергали азеотропной сушке с толуолом, получая соединение 14Gc (30,5 г). Продукт использовали без очистки в следующей стадии.
MS (ESI): m/Z = 754 [M+H]+
Пример 109. Синтез соединения 14Gd
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин
В раствор соединения 14Gc (30,5 г, 35,9 ммоль) в 1,4-диоксане (300 мл) добавляли метилгидразин (18,9 мл, 359 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 часов, затем при 50°C в течение 3 часов. Воду (100 мл) добавляли в реакционный раствор, и смесь упаривали при пониженном давлении. Добавляли хлороформ (250 мл), и после перемешивания смесь пропускали через разделитель фаз, затем органический слой отделяли в делительной воронке. Растворители упаривали, затем остатки растворителей удаляли азеотропно с толуолом. Полученный остаток суспендировали в IPE (100 мл), смесь помещали в ультразвуковую баню на 20 минут, выпавший осадок отделяли фильтрованием и сушили на воздухе, а затем сушили при пониженном давлении.
В раствор полученного остатка в ДМФА (75 мл, 970 ммоль) добавляли диметилацеталь N,N-диметилформамида (50 мл, 375 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Растворители упаривали при пониженном давлении, и остаток после упаривания грубо очищали методом хроматографии на силикагеле (SiO2: хлороформ/метанол = от 100/0 до 90/10, SiO2: этилацетат/метанол = от 90/10 до 72/28). Сырой продукт промывали путем суспендирования в этилацетате (200 мл), отфильтровывали, и отфильтрованный осадок сушили при пониженном давлении, получая соединение 14Gd (11,2 г, выход 40%).
MS (ESI): m/Z = 748 [M+H]+
Пример 110. Синтез соединения 14Ge
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин (заявленное соединение 35).
В раствор соединения 14Gd (6,00 г, 7,60 ммоль) в дихлорметане (60 мл) добавляли DIPEA (5,30 мл, 30,6 ммоль) при охлаждении льдом, затем по каплям добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (5,12 мл, 23,0 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь охлаждали льдом, добавляли насыщенный водный раствор бикарбоната натрия (120 мл) и хлороформ (160 мл), полученную смесь интенсивно перемешивали 15 минут, органический слой отделяли на делительной воронке и сушили над безводным сульфатом натрия. Нерастворенные частицы отфильтровывали, растворители упаривали при пониженном давлении, и полученный остаток очищали методом хроматографии на силикагеле (SiO2: этилацетат/метанол = от 100/0 до 84/16), получая соединение 14Ge как заявленное соединение 35 (5,59 г, выход 74%).
MS (ESI): m/Z = 948 [M+H]+
31P-ЯМР (CDCl3) δ: 148,52, 148,59.
Синтез ALNA[Trz]-A
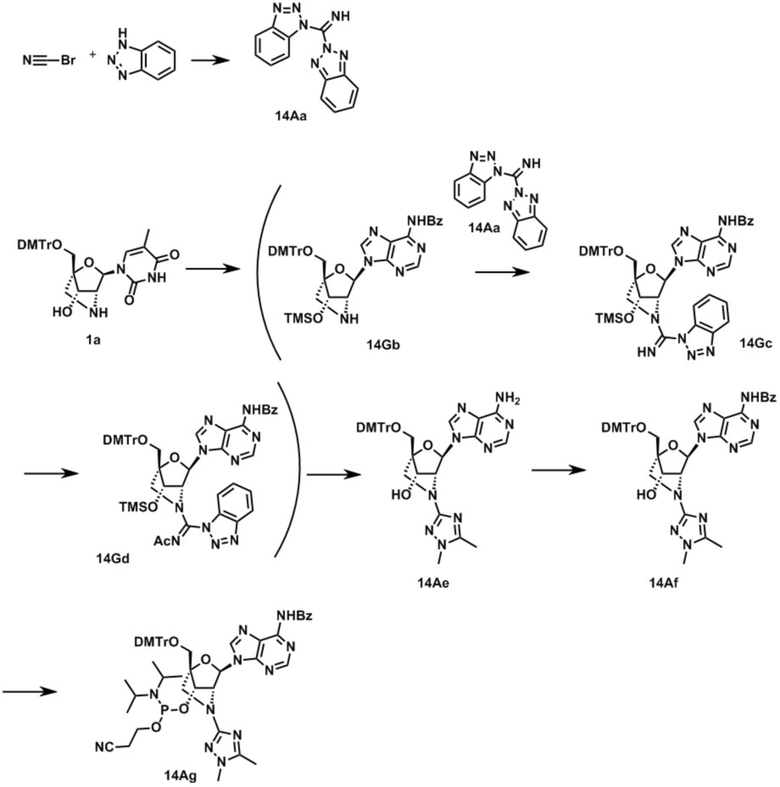
Пример 111. Синтез соединения 14Aa
Бензотриазол-1-ил (Бензотриазол-2-ил)метанимин
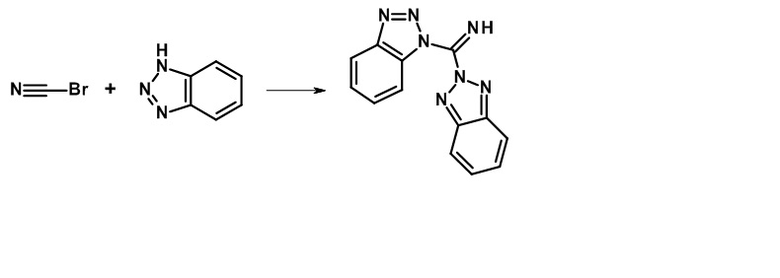
В раствор бензотриазола (7,70 г, 64,6 ммоль) в EtOH (135 мл) по каплям медленно добавляли раствор цианбромида (3,41 г, 32,2 ммоль) в ацетоне (15 мл) при охлаждении льдом, затем медленно прикапывали 2н. раствор гидроксида натрия (16,2 мл, 32,4 ммоль). Смесь перемешивали 30 минут при охлаждении льдом, выпавший осадок отделяли фильтрованием, и отфильтрованный осадок промывали холодным этанолом (80 мл). Смесь сушили на воздухе и затем при пониженном давлении, получая соединение 14Aa (5,14 г, выход 61%).
1H ЯМР (400 МГц, хлороформ-d) δ м.д. 6,92-6,98 (м, 1 H), 7,46-7,55 (м, 2 H), 7,58-7,65 (м, 1 H), 7,77 (ддд, J=8,35, 7,06, 1,03 Гц, 1 H), 8,17-8,22 (м, 1 H), 8,22-8,27 (м, 1 H), 8-31-8,37 (м, 1 H), 9,67 (с, 1 H).
MS (ESI): Не детектировали
Пример 112. Синтез соединения 14Ae
(1R,3R,4R,7S)-3-(6-аминопурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ол.
В суспензию N-(9H-пурин-6-ил)бензамида (5,15 г, 21,5 ммоль) в толуоле (200 мл) шприцом порциями добавляли соединение 1a (10,3 г, 17,9 ммоль), затем добавляли BSA (38 мл, 120 ммоль), и полученную смесь интенсивно перемешивали при 60°C 30 минут. Затем добавляли TMSOTf (0,324 мл, 179 ммоль) при той же температуре, и полученную смесь перемешивали при 60°C в течение 15 минут. Реакционный раствор охлаждали льдом, и раствор добавляли при перемешивании в перемешиваемую смесь IPE (100 мл), воды (100 мл) и насыщенного водного раствора бикарбоната натрия (100 мл) при охлаждении льдом. После интенсивного перемешивания смеси в течение 20 минут, нерастворенные частицы отфильтровывали через целит. Органический слой фильтратов разделяли на делительной воронке, промывали насыщенным водным раствором хлорида натрия (200 мл), затем сушили над безводным сульфатом натрия и упаривали растворители, получая остаток сырого соединения 14Gb.
В раствор полученного сырого продукта в ТГФ (200 мл) добавляли соединение 14Aa (4,72 г, 17,9 ммоль), и смесь перемешивали при комнатной температуре в течение 92 часов, затем перемешивали при 50°C в течение 9 часов. В реакционный раствор добавляли этилацетат (400 мл) и насыщенный водный раствор бикарбоната натрия (200 мл), и после 20 минут перемешивания органический слой разделяли в делительной воронке. Органический слой промывали водой (300 мл) и насыщенным водным раствором хлорида натрия (100 мл), затем сушили над безводным сульфатом натрия, нерастворенные частицы отфильтровывали, и растворители упаривали, получая остаток сырого соединения 14Gc.
В раствор полученного остатка в пиридине (65 мл) добавляли уксусный ангидрид (5,08 мл, 53,8 ммоль) и DMAP (219 мг, 1,79 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 3 часов. В реакционный раствор добавляли этилацетат (400 мл) и насыщенный водный раствор бикарбоната натрия (200 мл), и после 20 минут перемешивания, органический слой отделяли в делительной воронке. Органический слой промывали водой (300 мл) и насыщенным водным раствором хлорида натрия (100 мл), затем сушили над безводным сульфатом натрия. Нерастворенные частицы отфильтровывали, растворители упаривали при пониженном давлении, и остаток подвергали азеотропной сушке с толуолом, получая в остатке сырое соединение 14Gd.
В раствор полученного остатка в 1,4-диоксане (100 мл) по каплям добавляли метилгидразин (9,44 мл, 179 ммоль) при охлаждении на ледяной бане, и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Смесь нагревали до 50°C и перемешивали 10 часов. Воду (100 мл) добавляли в реакционный раствор, растворители упаривали при пониженном давлении, и остаток экстрагировали хлороформом (2 × 150 мл) в делительной воронке. Органические слои объединяли, смесь промывали насыщенным водным раствором хлорида натрия (100 мл) и сушили над безводным сульфатом натрия. Нерастворенные частицы отфильтровывали, растворители упаривали при пониженном давлении, и полученный остаток очищали методом хроматографии на силикагеле (NH-силикагель: хлороформ/метанол = от 100/0 до 99/1), получая соединение 14Ae (4,91 г, выход 41%).
MS (ESI): m/Z = 675 [M-H]-
Пример 113. Синтез соединения 14Af
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид.
В смесь соединения 14Ae (4,80 г, 7,10 ммоль) и пиридина (10 мл) добавляли бензоилхлорид (2,48 мл, 21,3 ммоль) при охлаждении льдом, и полученную смесь перемешивали при охлаждении льдом 3 часа. В реакционный раствор добавляли 2н. раствор гидроксида натрия (25 мл, 50 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор промывали хлороформом (50 мл) четыре раза, органический слой пропускали через разделитель фаз и сушили над безводным сульфатом натрия. Раствор фильтровали через целит и упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 93/7), получая соединение 14Af (4,60 г, выход 83%).
MS (ESI): m/Z = 781 [M+H]+
Пример 114. Синтез соединения 14Ag
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид (заявленное соединение 36).
В смесь соединения 14Af (4,26 г, 5,46 ммоль) и дихлорметана (50 мл) добавляли DIPEA (3,78 мл, 21,8 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамидит (3,66 мл, 16,4 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли насыщенный водный раствор гидрокарбоната натрия (100 мл), и полученную смесь экстрагировали хлороформом (100 мл). Органический слой сушили над безводным сульфатом натрия, отфильтровывали нерастворенные частицы, и растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: этилацетат/метанол = от 100/0 до 94/6, NH-силикагель: этилацетат/метанол = от 100/0 до 93/7), получая соединение 14Ag как заявленное соединение 36 (3,88 г, выход 67%).
MS (ESI): m/Z = 980 [M+H]+
31P-ЯМР (CDCl3) δ: 148,84, 149,04.
Синтез ALNA[Oxz]-T

Пример 115. Синтез соединения 15Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион
В смесь соединения 14Tc (2,10 г, 2,88 ммоль) и EtOH (14,4 мл) добавляли гидроксиламин (50%-ный водный раствор, 1,90 мл, 28,8 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии (SiO2: хлороформ/ метанол = от 100/0 до 90/10), получая соединение 15Ta (1,34 г, выход 71%).
HRMS (MALDI) — вычислено для C35H35N5O8 [M+Na]+: 676,2378, получено: 676,2363.
Пример 116. Синтез соединения 15Tb
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 37)
В смесь соединения 15Ta (300 мг, 0,459 ммоль), дихлорметана (4,6 мл) и DIPEA (240 мкл, 1,38 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (205 мкл, 0,918 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 5 дней. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат= от 60/40 до 10/90, Диол: гексан/этилацетат = от 70/30 до 20/80, NH: хлороформ/метанол = от 100/0 до 95/5), получая соединение 15Tb как заявленное соединение 37 (214 мг, выход 55%).
HRMS (MALDI) — вычислено для C44H52N7O9P [M+Na]+: 876,3456, получено: 876,3441.
31P-ЯМР (CDCl3) δ: 148,83, 149,09.
Синтез ALNA[Oxz]-mC
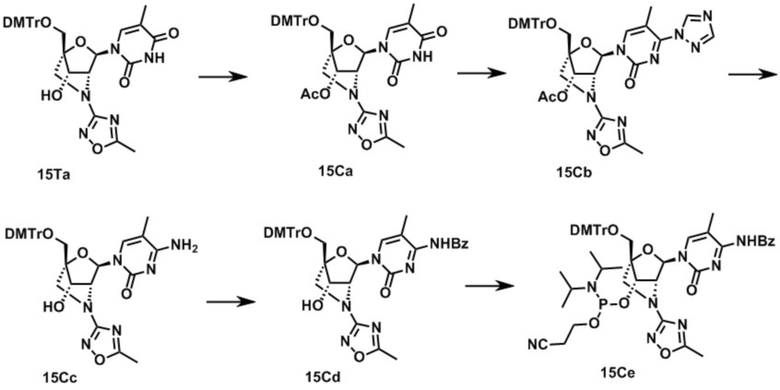
Пример 117. Синтез соединения 15Ca
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]ацетат
В смесь соединения 15Ta (999 мг, 1,53 ммоль), DMAP (18,7 мг, 0,153 ммоль) и пиридина (7,7 мл) добавляли уксусный ангидрид (217 мкл, 2,30 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 дней. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтрат упаривали при пониженном давлении, получая соединение 15Ca (1,10 г, реакция проходит с количественным выходом).
HRMS (MALDI) — вычислено для C37H37N5O9 [M+Na]+: 718,2483, получено: 718,2470.
Пример 118. Синтез соединения 15Cb
[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-метил-1,2,4-оксадиазол-3-ил)-3-[5-метил-2-оксо-4-(1,2,4-триазол-1-ил)пиримидин1-ил]-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 15Ca (1,05 г, 1,51 ммоль), 1,2,4-триазола (939 мг, 13,6 ммоль), DIPEA (2,63 мл, 15,1 ммоль) и ацетонитрила (15 мл) добавляли фосфорилхлорид (239 мкл, 2,57 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении, получая соединение 15Cb (1,32 г) в виде сырого продукта.
HRMS (MALDI) — вычислено для C39H38N8O8 [M+Na]+: 769,2705, получено: 769,2707.
Пример 119. Синтез соединения 15Cc
4-амино-1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он.
В смесь соединения 15Cb (1,30 г, 1,51 ммоль, сырой продукт) и ацетонитрила (15,1 мл) добавляли 28%-ный водный раствор аммиака (10,1 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи. Воду добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз и упаривали, получая соединение 15Cc (0,96 г, выход за две стадии 97%).
HRMS (MALDI) — вычислено для C35H36N6O7 [M+Na]+: 675,2538, получено: 675,2539.
Пример 120. Синтез соединения 15Cd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
В смесь соединения 15Cc (0,93 г, 1,42 ммоль) и пиридина (7,1 мл) добавляли бензойный ангидрид (482 мг, 2,13 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. В реакционный раствор добавляли 2н. водный раствор гидроксида натрия (7,1 мл), и смесь перемешивали при комнатной температуре в течение 1 часа. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/ метанол = от 100/0 до 90/10), получая соединение 15Cd (958 мг, выход 89%).
HRMS (MALDI) — вычислено для C42H40N6O8 [M+Na]+: 779,2800, получено: 779,2794.
Пример 121. Синтез соединения 15Ce
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 38).
В смесь соединения 15Cd (949 мг, 1,25 ммоль), дихлорметана (12,5 мл) и DIPEA (0,653 мл, 3,75 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (0,559 мл, 2,50 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/ этилацетат = от 80/20 до 30/70, NH: гексан/этилацетат = от 50/50 до 0/100), получая соединение 15Ce как заявленное соединение 38 (834 мг, выход 70%).
HRMS (MALDI) — вычислено для C51H57N8O9P [M+Na]+: 979,3878, получено: 979,3876.
31P-ЯМР (CDCl3) δ: 148,98, 149,27.
Синтез ALNA[Tdz]-T
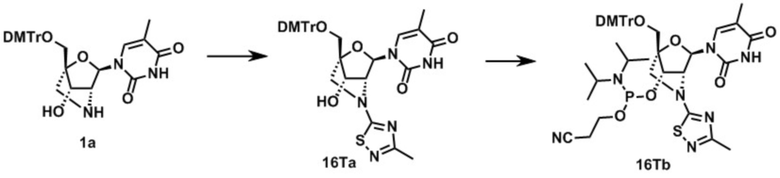
Пример 122. Синтез соединения 16Ta
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2,4-дион.
Смесь соединения 1a (3,00 г, 5,25 ммоль), 5-хлор-3-метил-1,2,4-тиадиазола (848 мг, 6,30 ммоль), DIPEA (2,72 мл, 15,7 ммоль) и ДМСО (26 мл) перемешивали при 120°C в течение 2 часов. Этилацетат добавляли в реакционный раствор, и смесь промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 95/5), получая соединение 16Ta (3,30 г, выход 94%).
MS (ESI): m/z = 670 (M+H)+
Пример 123. Синтез соединения 16Tb
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил (заявленное соединение 39).
В смесь соединения 16Ta (2,26 г, 3,37 ммоль), дихлорметана (17 мл), DIPEA (1,75 мл, 10,1 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (1,51 мл, 6,77 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 70/30 до 20/80, Диол: гексан/этилацетат = от 70/30 до 20/80), получая соединение 16Tb как заявленное соединение 39 (2,45 г, выход 84%).
MS (ESI): m/z = 870 (M+H)+
31P-ЯМР (CDCl3) δ: 149,23, 149,51.
Синтез ALNA[Tdz]-mC
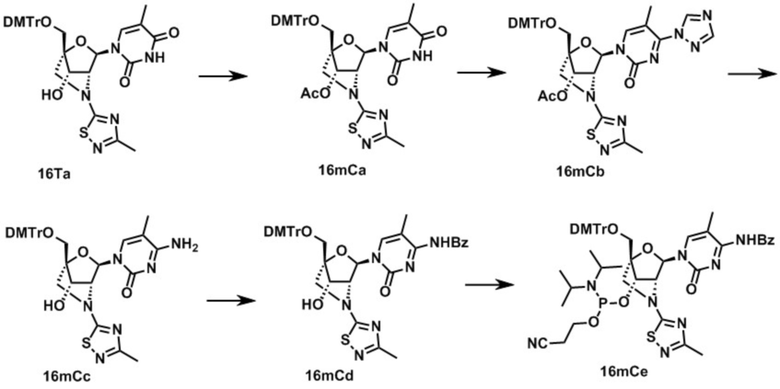
Пример 124. Синтез соединения 16mCa
[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]ацетат.
В смесь соединения 16Ta (5,92 г, 8,84 ммоль), DMAP (120 мг, 0,982 ммоль) и пиридина (18 мл) добавляли уксусный ангидрид (1,25 мл, 13,2 ммоль), и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали, добавляли к остатку этилацетат, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали, получая соединение 16mCa (5,69 г, выход 90%).
MS (ESI): m/z = 712 (M+H)+
Пример 125. Синтез соединения 16mCb
[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-[5-метил-2-оксо-4-(1,2,4-тиадиазол-1-ил)пиримидин-1-ил]-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]ацетат
В смесь соединения 16mCa (5,52 г, 7,75 ммоль), 1,2,4-триазола (4,82 г, 69,8 ммоль), DIPEA (13,4 мл, 77,5 ммоль) и ацетонитрила (39 мл) добавляли фосфорилхлорид (1,23 мл, 13,2 ммоль) при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 часов. Этилацетат добавляли в реакционный раствор, и смесь экстрагировали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали, получая неочищенное соединение 16mCb (6,18 г, содержит примеси).
Пример 126. Синтез соединения 16mCc
4-амино-1-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он.
В смесь соединения 16mCb (6,18 г, 7,75 ммоль, содержит примеси) и ацетонитрила (39 мл) добавляли 28%-ный водный раствор аммиака (39 мл), и полученную смесь перемешивали при комнатной температуре в течение 4 дней. Воду добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 16mCc (4,50 г, выход за 2 стадии 87%).
MS (ESI): m/z = 667 (M-H)-
Пример 127. Синтез соединения 16mCd
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид.
Смесь соединения 16mCc (4,37 г, 6,53 ммоль), бензойного ангидрида (2,22 г, 9,81 ммоль) и пиридина (13 мл) перемешивали при комнатной температуре в течение ночи. В реакционный раствор добавляли 2н. водный раствор гидроксида натрия (13 мл, 26 ммоль), и смесь перемешивали при комнатной температуре в течение 1,5 часов. Этилацетат добавляли в реакционный раствор, и смесь промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния, нерастворенные частицы отфильтровывали, и фильтраты упаривали. Остаток очищали методом колоночной хроматографии (SiO2: хлороформ/метанол = от 100/0 до 90/10), получая соединение 16mCd (4,76 г, выход 94%).
MS (ESI): m/z = 773 (M+H)+
Пример 128. Синтез соединения 16mCe
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид (заявленное соединение 40)
В смесь соединения 16mCd (4,62 г, 5,98 ммоль), дихлорметана (12 мл) и DIPEA (3,10 мл, 17,9 ммоль) добавляли 2-цианоэтил N,N-диизопропилхлорфосфорамидит (2,67 мл, 12,0 ммоль), и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз, растворители упаривали. Остаток очищали методом колоночной хроматографии (SiO2: гексан/этилацетат = от 80/20 до 30/70, NH: гексан/этилацетат = от 70/30 до 20/80), получая соединение 16mCe как заявленное соединение 40 (3,57 г, выход 61%).
MS (ESI): m/z = 974 (M+H)+
31P-ЯМР (CDCl3) δ: 149,45, 149,78.
ALNA[Ms]-mC можно также синтезировать путем трансформации основания нуклеиновой кислоты в ALNA[Ms]-T нуклеозид описанным далее способом.
Синтез соединения 2Cf
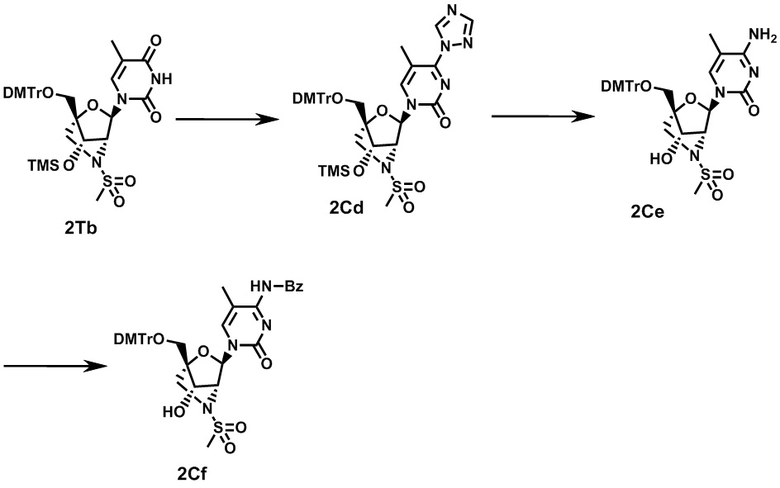
Пример 129. Синтез соединения 2Cd
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-метилсульфонил-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-6-(1,2,4-триазол-1-ил)-1,6-дигидропиримидин-2-он.
Соединение 2Tb (14,1 г, 0,019 моль) солюбилизировали в ацетонитриле (310 мл), добавляли триэтиламин (97,29 мл, 0,961 моль), и полученную смесь перемешивали при 0°C в течение 15 минут. В реакционный раствор добавляли 1,2,4-триазол (30,36 г, 0,439 моль), смесь перемешивали при 0°C в течение 15 минут, затем добавляли фосфорилхлорид (4,44 мл, 0,028 моль), полученную смесь перемешивали при 0°C в течение 15 минут и нагревали до комнатной температуры на 2 часа. Реакционную смесь упаривали при пониженном давлении, добавляли этилацетат (200 мл) и воду (100 мл), и смесь разделяли в делительной воронке. Органический слой промывали раствором карбоната натрия (100 мл) два раза, сушили над сульфатом натрия и упаривали при пониженном давлении, получая соединение 2Cd в виде сырого продукта (11,8 г).
Пример 130. Синтез соединения 2Ce
6-амино-3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он
Неочищенное соединение 2Cd (11,8 г) солюбилизировали в 1,4-диоксане (118 мл), добавляли 25%-ный водный раствор аммиака (118 мл), и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь упаривали при пониженном давлении, и остаток очищали методом хроматографии на силикагеле (дихлорметан/метанол, от 95/5 до 94/6). Полученную смесь перемешивали в растворе дихлорметана/гексана (10/90), и выпавший осадок отделяли фильтрованием, получая соединение 2Ce (8,3 г, выход за две стадии 64%).
MS (ESI): m/z = 649,3 (M+H)+
Пример 131. Синтез соединения 2Cf
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил] дигидропиримидин-2-он.
В раствор соединения 2Ce (8,3 г, 0,012 моль) в ДМФА (63 мл) добавляли бензойный ангидрид (2,57 г, 0,011 моль), и полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли этилацетатом (200 мл), и смесь промывали водой (100 мл) два раза. Органический слой последовательно промывали водой (100 мл) и насыщенным водным раствором хлорида натрия (100 мл), и сушили над сульфатом натрия. Полученную смесь упаривали при пониженном давлении, и остаток очищали методом хроматографии на силикагеле (дихлорметан/метанол, от 99,5/0,5 до 99/1). Полученную смесь перемешивали в растворе дихлорметана/гексана (10/90), и выпавший осадок отделяли фильтрованием, получая соединение 2Cf (4,0 г, выход 47%).
MS (ESI): m/z = 753,1 (M+H)+
Также ALNA[Ms]-mC нуклеозид можно синтезировать описанным ниже способом.
Синтез соединения 2Cj
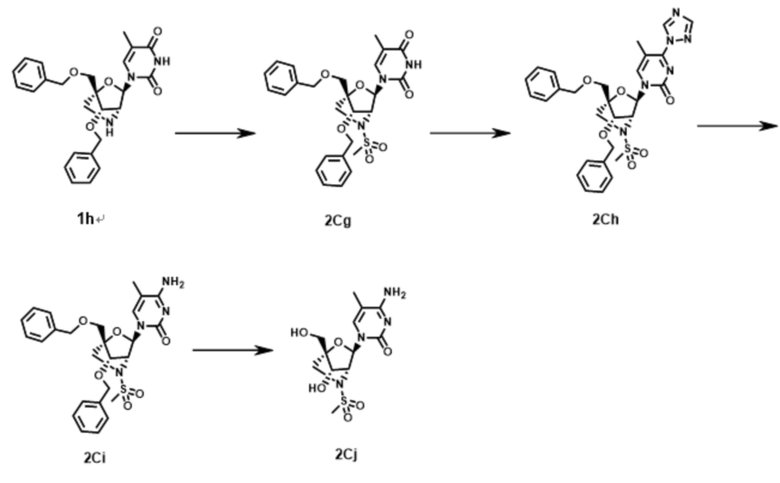
Пример 132. Синтез соединения 2Cg
1-[(1R,3R,4R,7S)-7-бензилокси-1-(бензилоксиметил)-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-дион.
В перемешиваемый раствор 1-[(1R,3R,4R,7S)-7-бензилокси-1-(бензилоксиметил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-2,4-диона (1h) (20,00 г, 21,61 ммоль), который синтезировали по методике, описанной в WO 2017/047816 A1, в дихлорметане (200 мл) добавляли триэтиламин (15,5 мл, 111 ммоль), добавляли мезилхлорид (4,15 мл, 53,4 ммоль) на ледяной бане, и полученную смесь перемешивали в ледяной бане в течение 4,5 часов. Добавляли 5%-ный водный раствор бикарбоната натрия (60 мл) при охлаждении льдом, и полученную смесь перемешивали и разделяли на делительной воронке. Водный слой экстрагировали дихлорметаном (40 мл), экстракты объединяли и смешивали с дихлорметановым органическим слоем. Органический слой промывали 15%-ным раствором хлорида натрия (60 мл) и упаривали растворители. Остаток от упаривания промывали метанолом (90 мл). Полученный осадок отделяли фильтрованием, сушили в вакууме, получая соединение 2Cg (21,94 г, выход 94%).
MS (ESI): m/z = 528 (M+H)+
Пример 133. Синтез соединения 2Ch
1-[(1R,3R,4R,7S)-7-бензилокси-1-(бензилоксиметил)-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-4-(1,2,4-триазол-1-ил)пиримидин-2-он.
Соединение 2Ch (3,4 г) в виде неочищенного продукта получали из соединения 2Cg (3,0 г, 5,6 ммоль) аналогично примеру 129.
Пример 134. Синтез соединения 2Ci
4-амино-1-[(1R,3R,4R,7S)-7-бензилокси-1-(бензилоксиметил)-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он
Соединение 2Ci (2,6 г, выход 87%) получали из соединения 2Ch (3,4 г, 5,8 ммоль) аналогично примеру 130.
MS (ESI): m/z = 527,2 (M+H)+
Пример 135. Синтез соединения 2Cj
4-амино-1-[(1R,3R,4R,7S)-7-гидрокси-1-(гидроксиметил)-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-пиримидин-2-он
Соединение 2Ci (2,6 г, 4,9 ммоль) солюбилизировали в уксусной кислоте (28,6 мл), добавляли 20% палладий на угле (0,35 г), и полученную смесь перемешивали при комнатной температуре в атмосфере водорода 16 часов. Нерастворенные частицы отфильтровывали, и фильтраты упаривали при пониженном давлении. К остатку добавляли 1-бутанол и IPE, смесь перемешивали, и выпавший осадок отделяли фильтрованием. Полученный твердый продукт перекристаллизовывали из метанола, получая соединение 2Cj (1,0 г, выход 58%).
MS (ESI): m/z = 346,9 (M+H)+
ALNA[Ms]-G, где гуаниновое основание защищено диметиламинометиленовой группой, можно синтезировать описанным далее способом. В этом случае, когда мономер с такой защитной группой используется для синтеза олигомера, можно контролировать образование побочных продуктов, которое может наблюдаться при синтезе олигомеров с использованием соединения 2Gd, где положение 6 в гуанине защищено группой DPC.
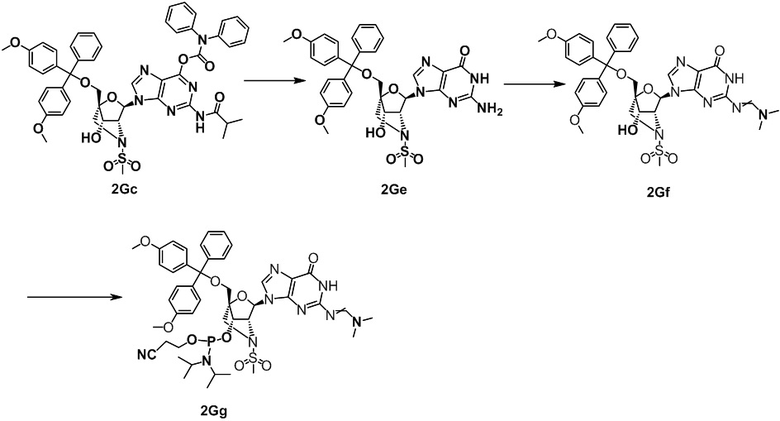
Пример 136. Синтез соединения 2Ge
2-амино-9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-1H-пурин-6-он.
В раствор соединения 2Gc (1000 мг, 1,1 ммоль) в тетрагидрофуране (10 мл) добавляли 28%-ный водный раствор аммиака (5 мл) при комнатной температуре, смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли еще 28%-ный водный раствор аммиака (15 мл), и смесь перемешивали при 70°C в течение 8 часов. Затем добавляли воду и дихлорметан при комнатной температуре, смесь перемешивали, органический слой отделяли и сушили над сульфатом натрия. Остаток фильтровали, растворители упаривали, и полученную смесь очищали методом хроматографии на силикагеле (хлороформ/метанол, от 97/3 до 92/8), получая соединение 2Ge (620 мг, выход 86%).
MS (ESI): m/z = 675 (M+H)+
Пример 137. Синтез соединения 2Gf
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин.
Соединение 2Ge (150 мг, 0,22 ммоль) солюбилизировали в тетрагидрофуране (2,22 мл), добавляли диметилацеталь N,N-диметилформамида (132 мг, 1,11 ммоль) при комнатной температуре, и полученную смесь перемешивали. Добавляли этилацетат при комнатной температуре, и смесь экстрагировали (2 мл) один раз. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. Остаток фильтровали, растворители упаривали, и остаток очищали методом хроматографии на силикагеле (хлороформ/метанол = 99/1, хлороформ/метанол = 93/7), получая соединение 2Gf (145 мг, выход 89%).
MS (ESI): m/z = 728 (M-H)-
Пример 138. Синтез соединения 2Gg
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин.
Соединение 2Gf (900 мг, 1,2 ммоль) солюбилизировали в дихлорметане (15 мл), добавляли N,N-диизопропилэтиламин (747 мг, 5,8 ммоль) и 2-цианоэтил N,N-диизопропилхлорфосфорамизид (1061 мг, 4,5 ммоль) при комнатной температуре, и полученную смесь перемешивали в течение ночи. Затем добавляли насыщенный водный раствор бикарбоната натрия и дихлорметан, и отделяли органический слой. Органический слой сушили над сульфатом натрия и отфильтровывали остаток. Растворители упаривали, полученный остаток очищали методом хроматографии на аминосиликагеле (хлороформ/метанол, от 100/0 до 97/3), затем методом хроматографии на диолсиликагеле (хлороформ/метанол, от 100/0 до 97/3), получая соединение 2Gg (690 мг, выход 60%).
MS (ESI): m/z = 930 (M+H)+
ALNA[Ms]-G, где гуаниновое основание защищено только изобутилоильной группой, можно синтезировать описанным далее способом. В этом случае, когда мономер с такой защитной группой используется для синтеза олигомера, можно контролировать образование побочных продуктов, которое может наблюдаться при синтезе олигомеров с использованием соединения 2Gd, где положение 6 в гуанине защищено группой DPC.
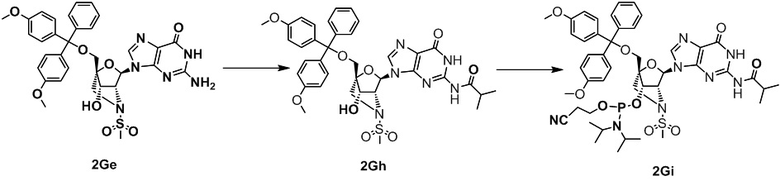
Пример 139. Синтез соединения 2Gh
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
Соединение 2Ge (100 мг, 0,15 ммоль) солюбилизировали в пиридине (1,4 мл), добавляли N,N-диметил-4-аминопиридин (29 мг, 0,24 ммоль) и 2-метил пропаноил-2-метилпропаноат (100 мкл, 0,6 ммоль) при комнатной температуре, и полученную смесь перемешивали при 100°C в течение 4 часов. Затем добавляли еще 2-метил пропаноил-2-метилпропаноат (100 мкл, 0,6 ммоль), и смесь перемешивали при 100°C в течение 2 часов. Затем добавляли насыщенный водный раствор бикарбоната натрия и ацетат натрия при комнатной температуре, и отделяли органический слой. Органический слой сушили над сульфатом натрия. Остаток фильтровали, растворители упаривали, и остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 20/80). Далее полученное соединение солюбилизировали в тетрагидрофуране (1 мл), добавляли 0,1н. водный раствор гидроксида натрия (1 мл), и полученную смесь перемешивали при 0°C в течение 40 минут. В реакционный раствор добавляли воду и этилацетат, органический слой отделяли и промывали водным раствором хлорида аммония, и затем органический слой снова отделяли. Полученный раствор сушили над сульфатом натрия, остаток фильтровали, и растворители упаривали, получая соединение 2Gh (56 мг, выход 50%).
MS (ESI): m/z = 745 (M+H)+
Пример 140. Синтез соединения 2Gi
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
Молекулярные сита 3A добавляли в дихлорметан (3,6 мл), и смесь перемешивали 1 час, затем добавляли соединение 2Gh (500 мг, 0,67 ммоль), 1-метилимидазол (10,9 мг, 0,1 моль), тетразол (84 мг, 1,2 ммоль) и 2-цианоэтил N,N,N',N'-тетраизопропилфосфорамидит (949 мг, 3,1 ммоль) при комнатной температуре, и полученную смесь перемешивали 6 часов. Затем добавляли насыщенный водный раствор бикарбоната натрия при комнатной температуре, и полученную смесь экстрагировали дихлорметаном два раза. Органический слой сушили над сульфатом натрия, и остаток фильтровали. Растворители упаривали, полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат, от 50/50 до 25/75), получая соединение 2Gi (500 мг, выход 79%).
MS (ESI): m/z = 946 (M+H)+
Также ALNA[Ms]-G мономер, где гуаниновое основнаие защищено только изобутилоильной группой, можно синтезировать напрямую трансгликозилированием из соединения 1a, как описано ниже.
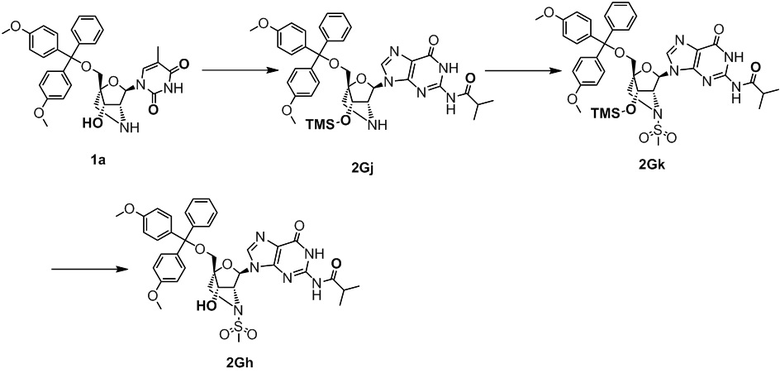
Пример 141. Синтез соединения 2Gj
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
В перемешиваемый раствор соединения 1a (5,0 г, 8,75 ммоль) и 2-метил N-(6-оксо-1,9-дигидропурин-2-ил)пропанамида (3,87 г, 17,5 ммоль) в 1,2-дихлорэтане (30 мл) добавляли BSA (21,4 мл, 87,5 ммоль), и полученную смесь перемешивали при 60ºC 30 минут. Далее добавляли TMSOTf (0,254 мл, 1,31 ммоль), и смесь перемешивали 1,5 часа. После охлаждения в реакционный раствор добавляли хлороформ (50 мл) и насыщенный водный раствор гидрокарбоната натрия (50 мл), и смесь перемешивали. Отфильтровывали нерастворимый осадок, органический слой промывали водой и насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 90/10), получая соединение 2Gj (3,83 г, выход 59%).
MS (ESI): m/z = 739,5 (M+H)+
Пример 142. Синтез соединения 2Gk
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-метилсульфонил-7-триметилсилилокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
В раствор соединения 2Gj (1,0 г, 1,35 ммоль), пиридина (0,327 мл, 4,06 ммоль) в дихлорметане (7 мл) добавляли ангидрид метансульфокислоты (284 мг, 1,63 ммоль) при охлаждении льдом, и полученную смесь перемешивали при охлаждении льдом 45 минут. Насыщенный водный раствор гидрокарбоната натрия добавляли в реакционный раствор, и смесь экстрагировали хлороформом. Органический слой пропускали через разделитель фаз и упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 90/10), получая соединение 2Gk (657 мг, выход 59%).
MS (ESI): m/z = 817,4 (M+H)+
Пример 143. Синтез соединения 2Gh
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид
В раствор соединения 2Gk (3,16 г, 3,87 ммоль) в ТГФ (8 мл) добавляли TBAF (1 моль/л раствор в ТГФ, 4,6 мл, 4,6 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь упаривали, добавляли этилацетат, и органический слой промывали водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом магния и упаривали. Полученный остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 90/10), получая соединение 2Gh (2,57 г, выход 89%).
MS (ESI): m/z = 745,5 (M+H)+
Соединение 2Gh можно также синтезировать из соединения 2Gb как описано ниже.
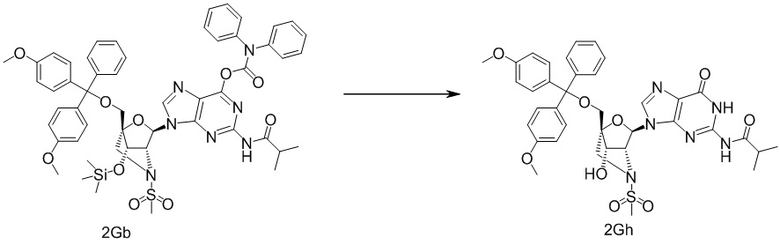
Пример 144. Синтез соединения 2Gh
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
Соединение 2Gb (1010 мг, 1,0 ммоль) солюбилизировали в тетрагидрофуране (10 мл), добавляли тетрабутиламмония фторид (1 моль/л раствор в тетрагидрофуране, 3 мл, 3,0 ммоль) при комнатной температуре, и полученную смесь перемешивали при 70°C в течение 24 часов. Затем добавляли тетрабутиламмония фторид (1 моль/л раствор в тетрагидрофуране, 9 мл, 9,0 ммоль) при комнатной температуре, и смесь перемешивали при 80°C в течение 8 часов. Растворители упаривали, остаток очищали методом хроматографии на силикагеле (хлороформ/метанол, от 98/2 до 93/7). Полученную смесь дополнительно очищали методом хроматографии на силикагеле (хлороформ/метанол, от 100/0 до 94/6), получая соединение 2Gh (570 мг, выход 77%).
MS (ESI): m/z = 745 (M+H)+
Пример 145. Синтез и очистка аналогов олигонуклеотидов (in vitro)
Используя каждый тип амидитов, полученных в описанных выше примерах (заявленные соединения 1-44), синтезировали аналоги олигонуклеотидов, представленные в таблицах 1–4, с помощью ДНК/РНК автоматического синтезатора олигонуклеотидов nS-8II (производство GeneDesign, Inc.) в 0,2 или 1,0 мкмоль масштабе на CPG или полистирольной подложке. Все амидиты переводили в 0,1 M ацетонитрильный раствор, время сочетания для неприродных типов нуклеозидов составляло 10 минут, и все стадии проводили в стандартных условиях для ns-811. Применяли Activator 42 (Sigma-Aldrich) в качестве активатора, Sulfurizing Reagent II (Gren Research Corporation) для тионилирования. В синтезированный олигонуклеотид добавляли 28%-ный водный раствор аммиака, и смесь оставляли реагировать при температуре от 60 до 65ºC на 8 часов для отщепления от подложки и снятия защиты с основания. Упаривали аммиак, и полученную смесь очищали методом обращенно-фазной ВЭЖХ.
Пример 146. Синтез и очистка аналогов олигонуклеотидов (in vivo)
Используя каждый тип амидитов, полученных в описанных выше примерах (заявленные соединения 1-44), синтезировали аналоги олигонуклеотидов, представленные в таблице 5, с помощью ДНК/РНК автоматического синтезатора олигонуклеотидов AKTA oligopilot plus 10 (производство GE Healthcare Inc.) в 20 мкмоль масштабе на полистирольной подложке. ДНК амидит переводили в 0,1 M раствор, и неприродные амидиты переводили в 0,05 M ацетонитрильный раствор, время сочетания для неприродных типов нуклеозидов составляло 20 минут, и когда первое основание было введено на универсальную подложку, стадии сочетания, тиолирования и кэпирования последовательно проводили два раза. Все стадии проводили в стандартных условиях для AKTA oligopilot plus 10. Применяли Activator 42 (Sigma-Aldrich) в качестве активатора, Sulfurizing Reagent II (Gren Research Corporation) для тионилирования. В синтезированный олигонуклеотид добавляли 28%-ный водный раствор аммиака, и смесь оставляли реагировать при температуре от 60 до 65°C на 8 часов для отщепления от подложки и снятия защиты с основания. Упаривали аммиак, и полученную смесь очищали на анионообменной колонке. Избыток солей, присутствующий после анионообменной колонки, удаляли на обессоливающей колонке.
Очистку и подтверждение чистоты синтезированных аналогов нуклеотидов проводили методом обращенно-фазной ВЭЖХ в описанных ниже условиях.
Обращенно-фазная ВЭЖХ
Подвижная фаза
Раствор A — 20 мM водный раствор циклогексиламмония ацетата,
Раствор B — ацетонитрил,
Градиент — A:B = 90:10 → 50:50 (40 мин.) или A:B = 90:10 → 40:60 (45 мин.)
Колонка
Анализ: Waters XBridge@ Oligonucleotide BEH C18 колонка, 130 Å, 2,5 мкм, 4,6 × 50 мм
Получение: Waters XBridge@ Oligonucleotide BEH C18 OBDTM препаративная колонка, 130 Å, 2,5 мкм, 10 × 50 мм
Скорость потока
Анализ — 1 мл/мин.
Получение — 4 мл/мин.
Температура колонки — 60°C
Детектирование — УФ (260 нм)
Очистка анионообменной хроматографией
Подвижная фаза
Раствор A — 20 мM Tris-HCl (pH 8,0) водный раствор.
Раствор B — 20 мM Tris-HCl (pH 8,0), 1 M водный раствор NaBr.
Колонка
GE HiTrap CaptQ ImpRes (анионообменная) 5 мл.
Скорость потока — 5 мл/мин.
Температура колонки — комнатная температура.
Детектирование — УФ (260 нм).
Обессоливающая колонка
Подвижная фаза
Раствор A — H2O.
Раствор B — H2O.
Колонка
GE HiPrep 26/10 Desalting
Скорость потока — 10 мл/мин.
Температура колонки — комнатная температура.
Молекулярный вес синтезированных аналогов олигонуклеотидов определяли на Waters ZQ в указанных ниже условиях.
Подвижная фаза
Раствор A — 400 мM гексафторизопропанол, 15 мM водный раствор триэтиламина
Раствор B — метанол
Градиент — A:B = 80:20 → 70:30 (2,5 мин.) или A:B = 90:10 → 40:60 (45 мин.)
Колонка
Анализ — Waters ACQUITY UPLC@ Oligonucleotide BEH C18 Column, 130 Å, 1,7 мкм, 2,1 × 100 мм
Скорость потока — 0,2 мл/мин.
Температура колонки — 60°C.
Детектирование — УФ (260 нм)
Таблица 1. Результаты масс-спектрометрии для каждой Tm последовательности
gcgttT(X)tttgct (SEQ ID No. 1)
(где маленькие буквы означают основания нуклеиновых кислот, T(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин, и все фосфатные связи представляют собой фосфодиэфирные связи).
Таблица 2. Результаты масс-спектрометрии для каждой SRB1 (2-10-2) последовательности T(X)C(X)agtcatgactT(X)C(X) (SEQ ID No. 2)
(где маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X) или C(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин или 5-метилцитозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Таблица 2
Таблица 3. Результаты масс-спектрометрии для каждой SRB1 (3-10-3) последовательности T(X)T(X)C(X)agtcatgactT(X)C(X)C(X) (SEQ ID No. 3)
(где маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X) или C(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин или 5-метилцитозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Таблица 3
Таблица 4. Результаты масс-спектрометрии для antimiR-21 последовательности
A(m)C(X)atC(X)agtC(X)tgaT(X)aagC(X)tA(m) (SEQ ID No. 4)
(где A(m) представляет собой 2'-MOE аденозин, маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X) или C(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин или 5-метилцитозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Таблица 4
Таблица 5. Результаты масс-спектрометрии для Malat1 последовательности
G(X)T(X)T(X)cactgaatG(X)C(X)G(X) (SEQ ID No. 5)
(где маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X), C(X) или G(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин, 5-метилцитозин или гуанин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Таблица 5
Пример 147. Оценка связывающей способности с целевой цепью и селективности ошибочного связывания оснований
Антисмысловую цепь, содержащую различные искусственные фрагменты нуклеиновой кислоты (где последовательность представляет собой gcgttT(X)tttgct (описанная выше SEQ ID No. 1), маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин); смысловую цепь, т.е. цепь ДНК, имеющую последовательность, комплементарную к антисмысловой цепи (где последовательность представляет собой agcaaaaaacgc (SEQ ID No. 6), и маленькие буквы означают основания нуклеиновых кислот в ДНК); цепь РНК, имеющую комплементарную последовательность (где последовательность представляет собой AGCAAAAAACGC (SEQ ID No. 7), и большие буквы означают основания нуклеиновых кислот); и цепь РНК, имеющую 3 комплементарные последовательности, содержащие 1 ошибочно связанное основание (где последовательность представляет собой AGCAAANAACGC (SEQ ID No. 8), большие буквы означают основания нуклеиновых кислот, и N означает урацил (U), гуанин(G), цитозин(C)) гибридизовывали, формируя двойную цепь, и затем измеряли значение Tm, представляющее собой температуру, при которой наблюдается расхождение 50% двойной цепи, соответственно, оценивая способность олигонуклеотида формировать двойную цепь.
Более конкретно, раствор образца (150 мкл), содержащий водный раствор хлорида натрия 100 ммоль/л, фосфатно-солевой буфер (pH 7,4) 10 ммоль/л, антисмысловую цепь 4 мкмоль/л и антисмысловую цепь 4 мкмоль/л, нагревали до 95°C и затем охлаждали до комнатной температуры в течение 4 часов. Ток азота пропускали через ячейку спектрофотометра (JASCO, V-730, PAC-743R) для предотвращения образования конденсата, и раствор образца постепенно охлаждали до 10°C, затем выдерживали при 10°C в течение 1 минуты и начинали измерение. Температуру поднимали до 80°C со скоростью 0,5°C в минуту и замеряли поглощение УФ-излучения при 260 нм после каждого повышения температуры на 0,5°C. Чтобы избежать изменений концентрации из-за повышения температуры, применяли ячейку с крышкой. Результаты измерений приведены в таблице 6.
Таблица 6. Результаты измерений значения Tm
5'-gcgttT(X)tttgct-3’
5’-AGC AAA NAA CGC-3’
T-A
Соответствие
T-U
Несоответствие
T-G
Несоответствие
T-C
Несоответствие
Как видно из таблицы 6, антисмысловая цепь, содержащая различные искусственные нуклеиновые кислоты, имеет такую же или более высокую связывающую способность с целевой цепью и селективность ошибочного связывания оснований, по сравнению с антисмысловой цепью, содержащей природную ДНК и ALNA[Me] в качестве известной ALNA.
Пример 147. In vitro тестирование нокдаун эффекта в отношении SR-B1
Клетки Hepa 1c1c7 высевали в количестве 2,5 × 103 клеток на лунку и выращивали 24 часа, затем добавляли различные модифицированные антисмысловые олигонуклеиновые кислоты, имеющие комплементарную последовательность к SRB1, в конечной концентрации 100, 20, 4 нмоль/л, и через 48 часов проводили количественное ПЦР исследование. Каждый тест повторяли в одинаковых условиях в 3 лунках. Для оценки антисмысловой активности, коэффициент ингибирования экспрессии SRB1 при добавлении антисмыслового соединения принимали за 100% в случае SRB1-GAPDH в отрицательном контроле. Полученные результаты приведены в таблице 7.
Таблица 7. In vitro тестирование нокдаун эффекта в отношении SR-B1
Показана нокдаун активность в отношении целевого гена (SRB1) для антисмысловых олигонуклеотидов, содержащих искусственные нуклеиновые кислоты, в двух последовательностях 3-10-3 и 2-10-2 при Gymnosis 100 нM.
Были протестированы следующие последовательности:
3-10-3 — T(X)T(X)C(X)agtcatgactT(X)C(X)C(X) (такая же, как SEQ ID No. 3 в приведенной выше таблице 3)
2-10-2 — T(X)C(X)agtcatgactT(X)C(X) (такая же, как SEQ ID No. 2 в приведенной выше таблице 2)
В данном случае маленькие буквы означают основания нуклеиновых кислот, T(X) или C(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин или 5-метилцитозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи.
Как видно из таблицы 7, ALNA[Ms], ALNA[ipU], ALNA[2Pym], ALNA[Prz], ALNA[Trz] и ALNA[Oxz] имеют сильную нокдаун активность in vitro в отношении целевого гена по сравнению с ALNA[Me] в качестве известной ALNA.
Пример 148. In vitro тестирование ингибирующей активности в отношении миРНК-21
Клетки HEK293 высевали в количестве 3,0 × 106 клеток/мл в 10-сантиметровую чашку и выдерживали в течение ночи в CO2 инкубаторе. На следующий день, используя реагент FuGENE HD Transfection Reagent, клетки трансфицировали 10 мкг репортерной плазмиды, в которой последовательность, комплементарную миР-21, клонировали в сайт множественного клонирования вектора psiCHECK-2 (Promega), и выдерживали в CO2 инкубаторе 24 часа. Клетки выделяли и пересеивали в количестве 2,0 × 104 клеток на лунку в 96-луночный планшет, затем добавляли ингибитор миР-21 в который вводили искусственную нуклеиновую кислоту. Клетки выдерживали в CO2 инкубаторе 96 часов. Используя систему Dual-Glo Luciferase Assay System, в планшет-ридере детектировали люминисценцию внутриклеточной люциферазы светлячка и люциферазы Renilla. Чтобы исключить влияние эффективности трансфекции или числа клеток из значения люминисценции вследствие активности люциферазы Renilla, вычисляли долю люминисценции, обуславливаемую активностью люциферазы светлячка. Эта доля в клетках, в которые был введен вектор psiCHECK-2, соответствовала 100% ингибированию, а доля в клетках, в которые был введен вектор psiCHECK-2, в который была клонирована миР-21 комплементарная последовательность, соответствовала 0% ингибированию. По вычисленным значениям вычисляли коэффициент ингибирования и определяли ингибирующую активность для каждого случая. Полученные результаты приведены в таблице 8.
Таблица 8. In vitro ингибирующая активность в отношении миРНК-21
Ниже показана последовательность применявшегося антисмыслового олигонуклеотида.
A(m)C(X)atC(X)agtC(X)tgaT(X)aagC(X)tA(m) (такая же, как SEQ ID No. 4 в приведенной выше таблице 4)
(где A(m) представляет собой 2'-MOE аденозин, маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X) или C(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин или 5-метилцитозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Как видно из таблицы 8, ALNA[mU], ALNA[ipU], ALNA[dmU], ALNA[Trz] и ALNA[Oxz] имеют высокую in vitro ингибирующую активность в отношении микро РНК, в сравнении с ALNA[Me] в качестве известной ALNA.
Пример 149. In vivo тестирование нокдауна MALAT1
Готовили растворы антисмысловых олигонуклеотидов (10 мг/кг и 50 мг/кг), таргетирующих MALAT1, в PBS в концентрации 10 мг/мл и затем разводили добавлением PBS до 5 мг/кг, после чего вводили внутривенно мышам C57BL/6J (самцы, Charles River Japan) 6-недельного возраста. Через 72 часа брали образцы крови из брюшной полой вены мышей под изофлурановой анестезией (Фармакопея Японии, производство Pfizer, Inc.). Проводили коагуляцию крови, затем ее центрифугировали для получения плазмы, которую далее хранили в замороженном виде (при -80°C) до проведения исследования. После эвтаназии посредством кровопускания, отбирали печень, почки, жир, скелетные мышцы (четырехглавая мышца бедра, икроножная мышца), легкие, сердце, желудок, тонкую кишку, яички, кожу, селезенку и мозг и замораживали в жидком азоте. К замороженным тканям добавляли буфер для гомогенизации из набора Maxwell RSC simply RNA Tissue Kit, ткани измельчали, затем выделяли и очищали РНК согласно инструкции из применявшегося набора. RT реакцию и последующие реакции проводили в двух повторностях, и количество РНК на реакцию составляло от 50 до 500 нг. При определении ингибирующей активности принимали за 100% коэффициент ингибирования экспрессии Malat1 для значения Malat1-GAPDH в контрольной группе, которой вводили только растворитель. Полученные результаты приведены в таблицах 9 и 10.
Таблица 9. Коэффициент нокдауна Malat1 (%) в каждом органе при введении 50 мг/кг
Таблица 10. Коэффициент нокдауна Malat1 (%) в каждом органе при введении 10 мг/кг
Ниже показана последовательность применявшегося антисмыслового олигонуклеотида.
G(X)T(X)T(X)cactgaatG(X) (такая же, как SEQ ID No. 5 в приведенной выше таблице 5), (где маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X), C(X) или G(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин, 5-метилцитозин или гуанозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи)
Как видно из таблиц 9 и 10, ALNA[Ms] демонстрирует сильный нокдаун целевого гена во многих органах (печень, почки, скелетные мышцы, легкие, сердце, желудок, тонкая кишка, яички, жир), в сравнении с ALNA[Me] в качестве известной ALNA. ALNA[2Pym] также демонстрирует сильный нокдаун целевого гена в некоторых органах (сердце, тонкая кишка, яички, жир) в сравнении с ALNA[Me] в качестве известной ALNA. ALNA[ipU] также демонстрирует схожий нокдаун-эффект целевого гена в печени в сравнении с ALNA[Me], при этом в легких и селезенке демонстрируя более сильный нокдаун целевого гена, чем ALNA[Me]. Поскольку в селезенке аккумулированы различные иммунные клетки, можно ожидать, что антисмысловые олигонуклеотиды, включающие ALNA[ipU], воздействуют на иммунные клетки, в которые слабо мигрируют обычные нуклеинокислотные лекарственные средства. Кроме того, можно ожидать, что ALNA[ipU] оказывает сильное лекарственное действие на легкие или иммунную систему, в то же время обладая более низкой токсичностью для печени.
Пример 150. Тестирование нокдауна MALAT1 в тканях центральной нервной системы, печени и почках при внутрижелудочковом введении
Мышей C57BL/6J (самцы, Japan Charles River) 7-недельного возраста фиксировали в устройстве для стереотаксической хирургии под анестезией изофлураном (производство Pfizer Inc.). Делали разрез на скальпе при расположении животного на теплоизоляционном мате, обнажая череп. После точного определения положения брегмы, сверлили отверстие в черепе 1-2 мм вокруг левого верхнего желудочка (1,0 мм влево и 0,4 мм ниже брегмы) с помощью стоматологической электрической дрели. Иглу 27 калибра вводили в левый желудочек (1,0 мм влево от брегмы, 0,4 мм ниже, 2,3 мм в глубину), и вводили однократную дозу антисмыслового олигонуклеотида (5мкг/10мкл/голова), таргетирующего MALAT1, которая была приготовлена из расчета 5 мкг/10 мкл в физрастворе, используя микронасос с иглой для инфузий, при скорости потока 2 мкл/мин в течение 5 минут. После этого отверстие в черепе закрывали медицинским цементом Belfast (производство Mutsukagaku Kogyo), разрез зашивали и наносили мазь с гентамицином 0,1% (производство Takata Seiyaku) для предотвращения инфекционных заболеваний. Через семьдесят два (72) часа после введения брали образцы крови из брюшной полой вены мышей под изофлурановой анестезией. Проводили коагуляцию крови, затем ее центрифугировали для получения плазмы, которую далее хранили в замороженном виде (при -30°C) до проведения исследования. После эвтаназии посредством кровопускания, отбирали мозг, спинной мозг, почки и печень. Для извлечения мозга, после эвтаназии отделяли череп от позвоночника и затем извлекали мозг, после этого использовали Brain Matrices (RBM-2000S, производство Bio Research Center Co., Ltd.), представляющий собой нож для изготовления саггиттальных срезов, и делали срезы мозга от средней к левой части мозга толщиной около 2 мм. Затем из срезов извлекали обонятельную луковицу, кору мозга, гиппокамп, полосатое тело и мозжечок. Оставшуюся часть срезов (после удаления 5 указанных выше отделов) объединяли как комплексный образец – ствол мозга. Спинной мозг разделяли по сочленению T13 и извлекали два отдела спинного мозга: до T13 (далее по тексту проксимальный спинной мозг), и вторая часть: T13-L5 (далее по тексту дистальный спинной мозг). Извлеченные органы погружали в RNAlater (раствор для стабилизации РНК, Invitrogen) и хранили при -30°C. Органы и реагент QIAzol Lysis Reagent (QIAGEN) помещали в пробирки, ткани разрушали с помощью гомогенизатора (multi-bead shocker), добавляли хлороформ (производство Jyunsei chemical) и перемешивали. Водный слой выделяли из полученной смеси путем разделения на центрифуге. Очищали РНК по методике, прилагающейся к набору RNeasy 96 Universal Tissue Kit (QIAGEN). RT реакцию и последующие реакции проводили, используя 2–7 нг РНК на реакцию. При определении нокдаун-активности принимали за 100% коэффициент ингибирования экспрессии Malat1 для значения Malat1-GAPDH в контрольной группе, которой вводили только растворитель. Стандартную погрешность вычисляли по индивидуальным значениям.
Таблица 11. Коэффициент нокдауна MALAT1 (%) в тканях ЦНС, печени и почках при введении 5 мкг на голову
Ниже показана последовательность применявшегося антисмыслового олигонуклеотида:
G(X)T(X)T(X)cactgaatG(X)C(X) (такая же, как SEQ ID No. 5 в приведенной выше таблице 5), (где маленькие буквы означают основания нуклеиновых кислот в ДНК, T(X), C(X) или G(X) означает искусственный фрагмент нуклеиновой кислоты, содержащий тимин, 5-метилцитозин или гуанозин, соответственно, и все фосфатные связи представляют собой тиофосфатные связи).
Как видно из таблицы 11, ALNA[Ms], ALNA[mU] и ALNA[Oxz] демонстрируют более сильный нокдаун целевого гена в тканях ЦНС, по сравнению с ALNA[Me] в качестве известной ALNA.
Промышленная применимость
Аминомостиковую искусственную нуклеиновую кислоту (ALNA) по настоящему изобретению можно использовать для получения новых олигомеров искусственных нуклеиновых кислот. Олигомер, содержащий аминомостиковую искусственную нуклеиновую кислоту по настоящему изобретению, демонстрирует более сильный нокдаун целевого гена в некоторых органах и может использоваться в качестве нуклеинокислотного лекарственного средства.
Список последовательностей
SEQ ID No. 1-6 демонстрируют ДНК олигонуклеотиды.
SEQ ID No 7-8 демонстрируют РНК олигонуклеотиды.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MITSUBISHI TANABE PHARMA CORPORATION
OSAKA UNIVERSITY
<120> CROSSLINKED ARTIFICIAL NUCLEIC ACID ALNA
<130> 675103
<150> JP 2018-212424
<151> 2018-11-12
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (6)..(6)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<400> 1
gcgttntttg ct
12
<210> 2
<211> 14
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (2)..(2)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (13)..(13)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (14)..(14)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<400> 2
nnagtcatga ctnn
14
<210> 3
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (2)..(2)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (3)..(3)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (14)..(14)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (15)..(15)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (16)..(16)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<400> 3
nnnagtcatg actnnn
16
<210> 4
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> n is 2'-MOE adenosine
<220>
<221> modified_base
<222> (2)..(2)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (5)..(5)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (9)..(9)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (13)..(13)
<223> n is any one of bridged artificial nucleric acid ALNA
containing thymine
<220>
<221> modified_base
<222> (17)..(17)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (19)..(19)
<223> n is 2'-MOE adenosine
<400> 4
nnatnagtnt ganaagntn
19
<210> 5
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (1)..(1)
<223> n is any one of bridged artificial nucleric acid ALNA
containing guanine
<220>
<221> modified_base
<222> (2)..(2)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (3)..(3)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<220>
<221> modified_base
<222> (12)..(12)
<223> n is any one of bridged artificial nucleric acid ALNA
containing guanine
<220>
<221> modified_base
<222> (13)..(13)
<223> n is any one of bridged artificial nucleric acid ALNA
containing 5-methylcytosine
<400> 5
nnncactgaa tnn
13
<210> 6
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<400> 6
agcaaaaaac gc
12
<210> 7
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<400> 7
agcaaaaaac gc
12
<210> 8
<211> 12
<212> RNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: oligonucleotide
<220>
<221> modified_base
<222> (7)..(7)
<223> n is any one of uracil, guanine or cytosine
<400> 8
agcaaanaac gc
12
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| ПИРИДО[3,4-D]ПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 2017 |
|
RU2796400C2 |
| ЗАМЕЩЕННЫЕ ДИАМИНОКАРБОКСАМИДНЫЕ И ДИАМИНОКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНОВ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПОМОЩЬЮ | 2012 |
|
RU2697712C2 |
| ЗАМЕЩЕННЫЕ ДИАМИНОКАРБОКСАМИДНЫЕ И ДИАМИНОКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНОВ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПОМОЩЬЮ | 2012 |
|
RU2625309C2 |
| ДИФТОРМЕТИЛАМИНОПИРИДИНЫ И ДИФТОРМЕТИЛАМИНОПИРИМИДИНЫ | 2015 |
|
RU2712091C2 |
| КОНЪЮГАТ ЛИГАНДА С ЦИТОТОКСИЧЕСКИМ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2016 |
|
RU2708461C2 |
| АНТИПРОЛИФЕРАТИВНЫЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ PAH | 2020 |
|
RU2786588C1 |
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ | 2018 |
|
RU2793315C2 |
Настоящее изобретение относится к области биотехнологии, в частности к новым модифицированным нуклеиновым кислотам. Изобретение раскрывает новую мостиковую искусственную нуклеиновую кислоту ALNA и олигомер, содержащий ее в качестве мономера. В настоящем изобретении описано, в частности, соединение, имеющее общую формулу (I), а также олигонуклеотидное соединение, имеющее общую формулу (I') (где каждый символ имеет значение, указанное в описании). Новая искусственная нуклеиновая кислота согласно настоящему изобретению обладает улучшенной фармакологической активностью in vitro и in vivo по сравнению с известными ALNA. 3 н. и 30 з.п. ф-лы, 150 пр., 11 табл.

1. Соединение, имеющее общую формулу I
 ,
,
где B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
R5 и R6 независимо друг от друга представляют собой атом водорода, защитную группу для гидроксигруппы или фосфатную группу, которая необязательно может иметь заместители;
m представляет собой целое число, равное 1 или 2;
X представляет собой группу, представленную общей формулой (II-1), (II-2) или (II-3):
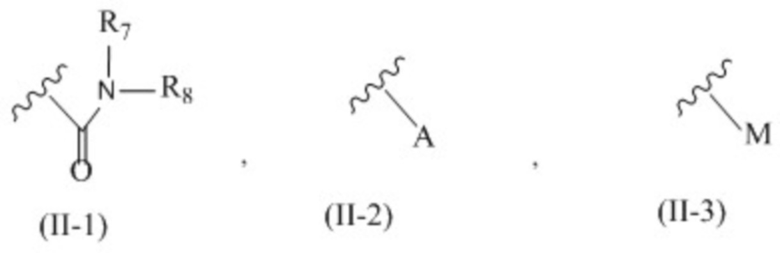 ;
;
символ  , который присутствует в формуле (II-1), (II-2) или (II-3), обозначает точку связывания с 2’-аминогруппой;
, который присутствует в формуле (II-1), (II-2) или (II-3), обозначает точку связывания с 2’-аминогруппой;
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкенильную группу, которая может быть необязательно замещена одним или более заместителями, C2-6 алкинильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями;
A представляет собой ароматическую группу;
M представляет собой сульфонильную группу, которая имеет один заместитель, выбранный из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли.
2. Соединение по п. 1 или его соль, где B представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
3. Соединение по п. 1 или 2 или его соли, где R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода; и
m представляет собой целое число, равное 1.
4. Соединение по любому из пп. 1-3 или его соли, где
X представляет собой группу, представленную формулой (II-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
5. Соединение по п. 4 или его соли, где R7 и R8 независимо друг от друга представляют собой атом водорода или C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями.
6. Соединение по п. 5 или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
7. Соединение по п. 5 или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
8. Соединение по любому из пп. 1-3 или его соли, где
X представляет собой группу, представленную формулой (II-2);
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
9. Соединение по п. 8 или его соли, где A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
10. Соединение по п. 9 или его соли, где указанная пяти- или шестичленная гетероарильная группа представляет собой группу, выбранную из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
11. Соединение по п. 10 или его соли, где триазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
12. Соединение по п. 10 или его соли, где оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
13. Соединение по п. 10 или его соли, где тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
14. Соединение по любому из пп. 1-3 или его соли, где
X представляет собой группу, представленную формулой (II-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
15. Соединение по п. 14 или его соли, где M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
16. Соединение по любому из пп. 1-15 или его соли, где R6 представляет собой атом водорода или DMTr группу, и R5 представляет собой атом водорода или -P(O(CH2)2CN)(N(ipr)2).
17. Соединение, выбранное из группы, состоящей из следующих соединений:
3-[[(1R,4R,6R,7S)-4-[[бис(4-метоксифенил)-фенилметокси]метил]-6-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-метилсульфонил-5-окса-2-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло [2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат;
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-пурин-6-ил]бензамид;
3-[[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил] окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-5-(бензолсульфонил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил)окси-2-окса-5-азабицикло[2.2.1] гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(метилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат;
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-метил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксопиримидин-1-ил)-1-[[бис(4-метоксифенил)фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(изопропилкарбамоил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-2-(2-метилпропаноиламино)пурин-6-ил]N,N-дифенилкарбамат;
(1R,3R,4R,7S)-3-(6-бензамидпурин-9-ил)-1-[[бис(4-метоксифенил)-фенилметокси] метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N-изопропил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-N,N-диметил-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
(1R,3R,4R,7S)-3-(4-бензамид-5-метил-2-оксо-пиримидин-1-ил)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил] окси-N,N-диметил-2-окса-5-азабицикло[2.2.1]гептан-5-карбоксамид;
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметил-6-формамидин;
N'-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид;
3-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиримидин-4-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[4-(трифторметил)пиримидин-2-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(5-хлорпиримидин-2-ил)-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метилпиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[6-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламин)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-[(6-диметиламино)пиримидин-4-ил]-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-[2-(диметиламино)пиримидин-4-ил]-3-(5-метил-2,4-диоксо-пиримидин-1-ил)-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-[2-(диметиламино)пиримидин-4-ил]-7-гидрокси-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-пиразин-2-ил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-5-(1,5-диметил-1,2,4-триазол-3-ил)-3-(5-метил-2,4-диоксопиримидин-1-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин;
N-[9-(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(1,5-диметил-1,2,4-триазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]пурин-6-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(5-метил-1,2,4-оксадиазол-3-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
3-[[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-3-(5-метил-2,4-диоксопиримидин-1-ил)-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1] гептан-7-ил]окси-(диизопропиламино)фосфанил]оксипропаннитрил;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-(3-метил-1,2,4-тиадиазол-5-ил)-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил]бензамид;
N-[1-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-5-метил-2-оксо-пиримидин-4-ил] дигидропиримидин-2-он;
N'-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-N,N-диметилформамидин;
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-[2-цианоэтокси-(диизопропиламино)фосфанил]окси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид; и
N-[9-[(1R,3R,4R,7S)-1-[[бис(4-метоксифенил)-фенилметокси]метил]-7-гидрокси-5-метилсульфонил-2-окса-5-азабицикло[2.2.1]гептан-3-ил]-6-оксо-1H-пурин-2-ил]-2-метилпропанамид.
18. Антисмысловое олигонуклеотидное соединение, содержащее один или более нуклеозидов, имеющее общую формулу (I')
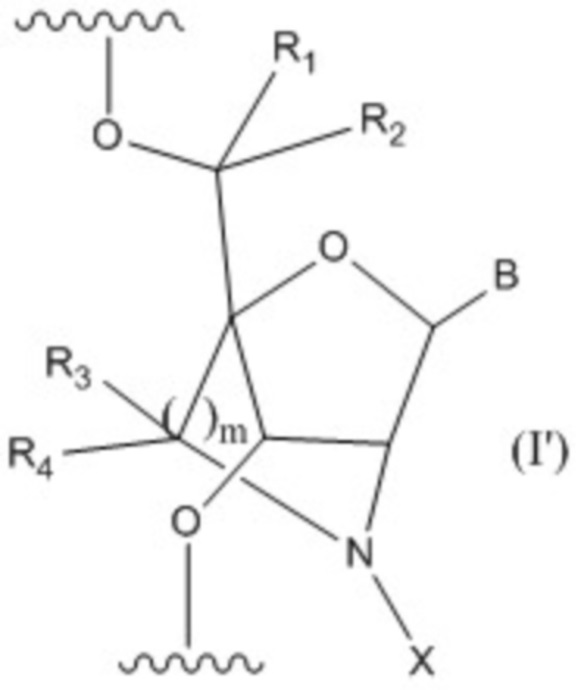 ,
,
где B представляет собой основание нуклеиновой кислоты, где указанное основание может быть необязательно замещено одним или более заместителями;
R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода или C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями;
m представляет собой целое число, равное 1 или 2;
X представляет собой группу, представленную общей формулой (II'-1), (II'-2) или (II'-3):
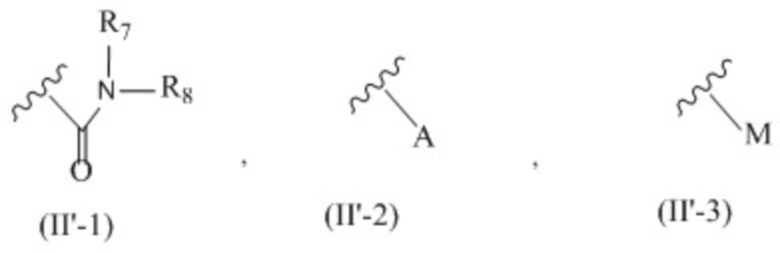 ;
;
символ  , который присутствует в формуле (II'-1), (II'-2) или (II'-3), обозначает точку связывания с 2’-аминогруппой;
, который присутствует в формуле (II'-1), (II'-2) или (II'-3), обозначает точку связывания с 2’-аминогруппой;
A представляет собой ароматическую группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями;
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и ароматической группы, которая может быть необязательно замещена одним или более заместителями,
или его соли.
19. Антисмысловое олигонуклеотидное соединение по п. 18 или его соли, где B представляет собой аденинильную группу, которая может быть необязательно замещена одним или более заместителями, гуанинильную группу, которая может быть необязательно замещена одним или более заместителями, цитозинильную группу, которая может быть необязательно замещена одним или более заместителями, 5-метилцитозинильную группу, которая может быть необязательно замещена одним или более заместителями, или урацилильную группу, которая может быть необязательно замещена одним или более заместителями.
20. Антисмысловое олигонуклеотидное соединение по п. 18 или 19 или его соли,
где R1, R2, R3 и R4 независимо друг от друга представляют собой атом водорода; и
m представляет собой целое число, равное 1.
21. Антисмысловое олигонуклеотидное соединение по любому из пп. 18-20 или его соли,
где X представляет собой группу, представленную формулой (II'-1); и
R7 и R8 независимо друг от друга представляют собой атом водорода, C1-6 алкильную группу, которая может быть необязательно замещена одним или более заместителями, или ароматическую группу, которая может быть необязательно замещена одним или более заместителями.
22. Антисмысловое олигонуклеотидное соединение по п. 21 или его соли, где R7 и R8 независимо друг от друга представляют собой атом водорода, C1-3 алкильную группу, которая может быть необязательно замещена одним или более заместителями.
23. Антисмысловое олигонуклеотидное соединение по п. 22 или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой метильную группу.
24. Антисмысловое олигонуклеотидное соединение по п. 23 или его соли, где один из R7 и R8 представляет собой атом водорода, а другой представляет собой изопропильную группу.
25. Антисмысловое олигонуклеотидное соединение по любому из пп. 18-20 или его соли,
где X представляет собой группу, представленную формулой (II'-2); и
A представляет собой пяти- или шестичленную гетероарильную группу, содержащую один или более гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, которая может быть необязательно замещена одним или более заместителями.
26. Антисмысловое олигонуклеотидное соединение по п. 25 или его соли, где A представляет собой пяти- или шестичленную гетероарильную группу, содержащую два или три гетероатома, выбранных из атома азота, атома кислорода и атома серы, при условии, что в ее состав входят по меньшей мере два атома азота, которая может быть необязательно замещена одним или более заместителями, и заместители независимо друг от друга выбраны из группы, состоящей из C1-3 алкильной группы, которая может быть необязательно замещена одним или более галогеновыми атомами, атома галогена и аминогруппы, которая может быть необязательно замещена одной или более C1-3 алкильными группами.
27. Антисмысловое олигонуклеотидное соединение по п. 26 или его соли, где пяти- или шестичленная гетероарильная группа выбрана из группы, состоящей из триазолильной группы, оксадиазолильной группы, тиадиазолильной группы, пиримидинильной группы и пиразинильной группы, каждая из которых может быть необязательно замещена одним или более заместителями.
28. Антисмысловое олигонуклеотидное соединение по п. 27 или его соли, где триазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 1,5-диметил-1,2,4-триазол-3-ильную группу.
29. Антисмысловое олигонуклеотидное соединение по п. 27 или его соли, где оксадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 5-метил-1,2,4-оксадиазол-3-ильную группу.
30. Антисмысловое олигонуклеотидное соединение по п. 27 или его соли, где тиадиазолильная группа, которая может быть необязательно замещена одним или более заместителями, представляет собой 3-метил-1,2,4-тиадиазол-5-ильную группу.
31. Антисмысловое олигонуклеотидное соединение по любому из пп. 18-20 или его соли,
где X представляет собой группу, представленную формулой (II'-3); и
M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из C1-6 алкильной группы, которая может быть необязательно замещена одним или более заместителями, и арильной группы, которая может быть необязательно замещена одним или более заместителями.
32. Антисмысловое олигонуклеотидное соединение по любому из пп. 18-31 или его соли, где M представляет собой сульфонильную группу, которая замещена одним или более заместителями, выбранными из группы, состоящей из метильной группы и фенильной группы.
33. Антисмысловое олигонуклеотидное соединение по любому из пп. 1-32 или его соли, где одна или больше фосфатных связей между нуклеотидами представляют собой тиофосфатную связь.
| WO 2011156202 A1, 15.12.2011 | |||
| WO 2014124952 A1, 21.08.2014 | |||
| KUMAR T.S | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Org | |||
| Chem., 2009, v | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| SHRESTHA A.R | |||
| et al.: "Guanidine bridged nucleic acid (GuNA): an effect of a cationic bridged nucleic acid on DNA binding affinity", | |||
Авторы
Даты
2024-05-31—Публикация
2019-11-11—Подача