Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии, экологии и сельскохозяйственной микробиологии, и представляет собой новый штамм бактерий Microbacterium sp. ET2, эффективный для улучшения роста и увеличения прироста массы растений, в особенности на начальных этапах развития, за счет способности штамма к образованию ауксинов и стимуляции процессов формирования и роста корней. Способ культивирования штамма предусматривает добавление экзогенного триптофана на безазотистой среде для увеличения биосинтеза ауксинов (ключевое соединение - индолил-3-уксусная кислота). Штамм, проявляющий высокую устойчивость к обработке протравителями, содержащими инсектициды, фунгициды и пестициды, может быть использован для получения биопрепарата и фитостимулятора прорастания семян злаковых культур.
Уровень техники
Многие бактерии, заселяющие ризосферу растений, зачастую относятся к группе PGPB (сокращение от plant growth-promoting bacteria - бактерии, стимулирующие рост растений). Они предоставляют растению перекрестную защиту от различных стресс-факторов, повышают резистентность к фитопатогенам и увеличивают продуктивность, улучшая минеральное питание или воздействуя на гормональный фон растения. Опосредованное влияние PGPB связывают с биологическим контролем и образованием внеклеточных ферментов и соединений, токсичных или сдерживающих рост болезнетворных организмов. PGPB представляют собой альтернативу химическим препаратам в сельском хозяйстве и вызывают особый интерес как фитостимуляторы и биоудобрения для повышения урожайности и адаптационной устойчивости растений, а также для нормализации общего микробиома почвы.
Выбор эффективного штамма PGPB, помимо собственно активных ростстимулирующих характеристик, определяется его конкурентоспособностью, устойчивостью к используемым в сельском хозяйстве химикатам, а также сохранению свойств при хранении и транспортировке.
Бактерии, стимулирующие рост растений и относящиеся к группе PGPB, синтезируют индолил-3-уксусную кислоту (ИУК), - самое активное соединение среди ауксинов (Цавкелова Е.А., Климова С.Ю., Чердынцева Т.А., Нетрусов А.И. Микроорганизмы-продуценты стимуляторов роста растений и их практическое применение (обзор) // Прикладная биохимия и микробиология, (2006). 42(2), 133-143). Пути биосинтеза, количество образуемой ИУК и условия для оптимального уровня ее биосинтеза могут значительно различаться у бактерий, вступающих во взаимодействия с растениями (Spaepen S., Vanderleyden J. Auxin and plant-microbe interactions // Cold Spring Harbor perspectives in biology, (2011). 3(4), a001438.). Образование ИУК выявлено среди представителей родов Azotobacter, Herbaspirillum, Azospirillum, Enterobacter, Rhizobium, Bradyrhizobium, Alcaligenes, Klebsiella, Sphingomonas. Биосинтез ИУК также обнаружен у бацилл, метилобактерий, псевдомонад и стрептомицетов.
Одной из современных стратегий выделения новых штаммов-продуцентов биологически-активных соединений является их поиск среди PGPB, колонизирующих стресс-толерантные растения, произрастающие в экстремальных условиях обитания. Отдельный интерес вызывает обнаружение PGPB среди ранее неизученных или малоизученных в плане фитостимуляции бактерий. К таковым можно отнести и грамположительных, неспорообразующих представителей из рода Microbacterium (семейство Microbacteriaceae, порядок Micrococcales, класс Actinomycetia, филум Actinomycetota).
Известны представители рода Azotobacter, применяемые в качестве азотфиксаторов, а также продуцентов антимикробных соединений и стимуляторов роста в биоудобрениях, например, штаммы Azotobacter chroococcum (RU2286324, опубл. 27.10.2006). Недостатком их использования является последовательное культивирование с пересевами на богатых по минеральному составу средах Эшби и Берка с добавлением значительного количества триптофана (0.6 г/л), что приводит к удорожанию процесса получения биомассы микроорганизма.
Известен штамм Pseudomonas chlororaphis (RU2588473 опубл. 27.06.2016) для защиты растений от фитопатогенных грибов и бактерий, и стимуляции роста растений, образующий гетероциклический антибиотик феназин-1-карбоксамид и ауксины (11 мкг/мл). Недостатком штамма является то, что у него не изучена способность к азотфиксации, а также потенциальная выживаемость при использовании протравителей зерна.
Известен штамм бактерии Azospirillum brasilense IMB В-7197 (UA85924C2, опубл. 10.03.2009), повышающий урожай яровых колосовых культур на 26.4 % за счет ассоциативной азотфиксации, положительного влияния на фотосинтетический аппарат и повышения стойкости к возбудителям корневой гнили. Штамм, однако, не изучен на способность к образованию фитостимуляторов роста.
Известен штамм Achromobacter album ВНИИСХМ В-322Д для получения биопрепарата, повышающего сахаристость на 0.5-1.0% и урожай сахарной свеклы на 8 - 24% (RU2035442C1, опубл. 20.05.1995). Показана устойчивость этого штамма к инсектициду адифуру и контактному фунгициду ТМТД. Биосинтез β-индолилуксусной кислоты был изучен при использовании глюкозоаспарагиновой среды Муромцева с индукцией триптофаном, который добавляли из расчета 0,05 мас. Максимальные значения содержания ИУК составили 68.3 мкг/мл на 10-ые сутки культивирования. Недостатком этого штамма можно считать то, что он усваивает только органические формы азота, поэтому эффективность его использования в обедненных азотом условиях трудно предсказать. Не указана стимулирующая активность штамма в отношении зерновых культур растений, что также ограничивает его применение для злаковых культур.
Известен штамм Microbacterium NRRL В-50470 (RU2634386C2, опуб. 26.10.2017). Штамм обладает супрессорной активностью против фузариоза (парша) пшеницы и ячменя и, таким образом, значительно снижает потери урожая, обусловленные инфицированием грибов Fusarium graminearum. К недостаткам изобретения можно отнести отсутствие информации по ростстимулирующим свойствам штамма Microbacterium, нет данных по биосинтезу ауксинов и устойчивости к фунгицидам и другим пестицидам.
Наиболее близким аналогом к заявляемому изобретению является штамм бактерии Azospirillum zeae OPN-14 (ВКПМ В-12542) в качестве биологического агента с ростстимулирующей и повышающей продуктивность растений активностями (RU2678755C1, опуб. 31.01.2019). Штамм синтезирует ауксин (ИУК) в концентрации 32-46 мкг/мл и проявляет цитокинин-подобную активность, фиксирует атмосферный азот (1269 нМ С2Н4/ч × мг сухой клеточной биомассы), устойчив к ряду гербицидов ("Ларен Про", "Кортес СП", "Аминка"), а также к фунгицидам, содержащим карбендазим. Ростстимулирующее воздействие A. zeae OPN-14 показано на примере стимуляции роста растений гороха, а также на оценке повышения урожайности подсолнечника и яровой пшеницы. Основным недостатком известного штамма является то, что он не устойчив к фунгицидам, имеющим в своем составе тебуконазол и пропиконазол, которые входят во многие наиболее эффективные фунгициды, используемые в сельском хозяйстве в настоящее время.
Таким образом, техническая проблема, решаемая посредством заявляемого изобретения, заключается в необходимости преодоления недостатков, присущих аналогам и прототипу за счет получения штамма бактерий, обладающего ростстимулирующей активностью в отношении злаковых растений, включающей биосинтез ауксинов, а также устойчивостью к современным фунгицидным и инсектицидным препаратам, используемым в сельском хозяйстве в качестве протравителей зерна.
Раскрытие изобретения
Техническим результатом изобретения является получение нового, устойчивого к высушиванию в интервале 20-55 °С, природного штамма не образующих спор бактерий, сохраняющего жизнеспособность при обработке протравителями зерна (на уровне не менее 107 КОЕ/мл), для стимуляции прорастания и улучшения ризогенеза злаковых культур (с увеличением по массе корней не менее, чем на 40-50% на примере пшеницы) за счет микробного триптофан-зависимого биосинтеза ауксина (не менее 20-30 мкг индолил-3-уксусной кислоты /мл).
Технический результат достигается штаммом бактерий Microbacterium sp. ET2, обладающим способностью стимулировать рост семян злаковых культур, и отличающимся устойчивостью к действию протравителей зерна, депонированным под регистрационным номером Aс-2212 во Всероссийской Коллекции Промышленных Микроорганизмов.
Технический результат достигается штаммом бактерий Microbacterium sp. ET2, обладающим способностью стимулировать рост семян злаковых культур, и отличающимся устойчивостью к действию протравителей зерна, депонированным под регистрационным номером Aс-2212 во Всероссийской Коллекции Промышленных Микроорганизмов.
Технический результат также достигается микробным препаратом - фитостимулятор роста и развития сельскохозяйственных растений, включающим штамм Microbacterium sp. ET2, стимулирующий эффект достигается за счет биосинтеза ключевого ауксина - индолил-3-уксусной кислоты. Использование штамма предполагает его выращивание в среде с добавлением 200-400 мкг/мл L-триптофана, и использование в виде исходной или разбавленной жидкой культуры, в том числе, после высушивания на воздухе. Штамм обладает устойчивостью к протравителям зерна, что обеспечивает эффективность его использования за счет конкурентного преимущества в отношении других бактерий, угнетаемых действием этих веществ. Изобретение позволяет ускорить рост злаковых культур и увеличить прирост биомассы растений на ранних этапах развития растений.
Технический результат также достигается применением штамма Microbacterium sp. ET2 для стимуляции прорастания и роста злаковых растений.
В качестве злаковых культур могут быть использованы пшеница, рожь, овес, рис, кукуруза, ячмень, просо.
Заявляемый бактериальный штамм Microbacterium sp. ET2 выделен из ризопланы оранжерейной эпифитной безлистной орхидеи Chiloschista parishii Seidenf., культивируемой в Фондовой оранжерее Главного ботанического сада им. Н.В. Цицина РАН (ГБС РАН, г. Москва).
Штамм Microbacterium sp. ET2 депонирован во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационным номером Aс-2212. Идентификацию штамма проводили на основании изучения его морфолого-культуральных и физиолого-биохимических характеристик, а также с использованием секвенирования по гену 16S рРНК, в том числе во ФГУП ГосНИИГенетика.
Полученный штамм характеризуется следующими признаками:
Штамм Microbacterium sp. ET2 растет на следующих средах (г/л): ТСА - триптозо-соевый агар (триптозо-соевый экстракт - 30.0, агар - 15.0); среда R2A (дрожжевой экстракт - 0.5; пептон - 0.5; казаминовые кислоты - 0.5; декстроза - 0.5; растворимый крахмал - 0.5; пируват натрия - 0.3; К2НРО4 - 0.3; MgSO4 -0.05; агар - 15.0); модифицированная среда Чапека (глюкоза - 20.0; K2HPO4 - 1.0; NaNO3 - 2.0; MgSO4 × 7H2O - 0.5; KCl - 0.5; FeSO4 × 7H2O - 0.01; дрожжевой экстракт - 0.5 г/л; pH 7.0-7.2).
Морфологокультуральные признаки
Клетки представлены грамположительными небольшими округлыми палочками, могут встречаться кокковидные клетки; в фиксированных и окрашенных фуксином препаратах расположены одиночно или в парах. Спор не образуют.
Морфологию колоний на плотных (агаризованных) питательных средах определяли после 5-10 суток роста при 28°C. Колонии на среде ТСА небольшие, округлые, непросвечивающие, более плоские, имеющие диаметр 3 мм, с розоватым оттенком. Колонии на среде R2A округлые, блестящие, более выпуклые, слизистые, диаметр 3 мм; колонии беловатые, с малиново-фиолетовым оттенком различной интенсивности, с возрастом пигмент интенсивнее. Субстрат не пигментируют.
Физиолого-биохимические признаки
Аэроб, мезофил с температурным оптимумом роста 30°C, хорошо растет при 37°C, слабый рост также отмечен при 55°C.
На солевом бульоне хорошо растет при 2% и 5% NaCl, рост отмечен при 10% NaCl. Оптимальное для роста значение pH 6.8-7.2.
Хемоорганогетеротроф. Метаболизм в основном дыхательного типа. В качестве единственного источника углерода использует глюкозу, сахарозу, декстрозу, галактозу, D-маннозу, D-мальтозу, отмечен хороший рост на манните, но слабый на глицерине, органические кислоты цитрат и пируват не потребляет. Не гидролизует казеин молока и не разжижает желатин. На среде с крахмалом слабый рост и незначительная амилолитическая активность. Образует кислоту из углеводов: глюкозы, сахарозы, галактозы, D-маннозы, D-мальтозы. Не восстанавливает нитрат.
Устойчивость к антибиотикам
Штамм проявляет устойчивость к цефалексину (30 мкг/мл) и ампициллину (10 мкг/мл). Чувствителен к тетрациклину (50 мкг/мл).
Принципиальные физиологические свойства
Штамм проявляет невысокую азотфиксирующую активность на агаризованных и жидких средах. Растет диазотрофно на среде Эшби с сахарозой в качестве углевода и микроэлементами по Федорову. Нитрогеназная активность подтверждена ацетиленовым методом, активность этого фермента составляет 1.8 ± 0.2 нг С2Н4/мл ч.
Штамм синтезирует индолиил-3-уксусную кислоту (ИУК, гетероауксин), синтез триптофан-зависимый.
Сведения по биологической безопасности
Штамм не патогенен для теплокровных животных и человека. Не обладает фитопатогенной активностью, что подтверждено отсутствием мацерации на срезах клубней картофеля при нанесении на них уколом живых клеток штамма.
Условия хранения
Штамм поддерживают пересевами на свежие агаризованные питательные среды (например, R2A). Штамм хранят в лиофилизированном виде с использованием сухого обезжиренного молока в качестве защитной среды при +4°C или в пробирках с короткоскошенной средой под слоем стерильного вазелинового масла. Штамм хранится при 4°С в пробирках под ватно-марлевыми пробками.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
На фиг. 1 показан пример стимуляции роста по параметру высоты всходов семян пшеницы в вермикулите после их предпосевной обработки предлагаемым штаммом бактерии Microbacterium sp. ET2. Слева - семена пшеницы, замоченные в течение 1 часа в жидкой культуре Microbacterium sp. ET2, выращенной на безазотистой среде с добавлением L-триптофана в течение 5 суток, и затем разбавленной в 100 раз водопроводной водой. Справа - семена пшеницы находились в течение 1 часа в суспензии аморфного диоксида кремния в водопроводной воде (контроль), после чего их раскладывали в вермикулит. Растения представлены на 13-ые сутки после посева.
На фиг. 2 показан пример стимуляции роста пшеницы в вермикулите после бактеризации семян штаммом Microbacterium sp. ET2 после высушивания культуры при разных температурах. Где (а) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением 400 мкг/мл L-триптофана в течение 5 суток, затем высушенным при 55±2°С в течение суток на носителе (аморфный диоксид кремния); после разведения в воде до исходной концентрации семена замачивали полученной культуре на 1 час; (б) - семена пшеницы, замоченные на 1 час в воде (контроль); (в) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением 400 мкг/мл L-триптофана в течение 5 суток, затем высушенным при 20±2°С в течение суток на носителе (аморфный диоксид кремния); после разведения в воде до исходной концентрации семена замачивали в полученной культуре на 1 час; (г) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением 400 мкг/мл L-триптофана в течение 5 суток, затем высушенным при 30°С в течение суток на носителе (аморфный диоксид кремния); после разведения в воде до исходной концентрации семена замачивали в полученной культуре на 1 час; д) - семена пшеницы, замоченные на 1 час в воде (контроль).
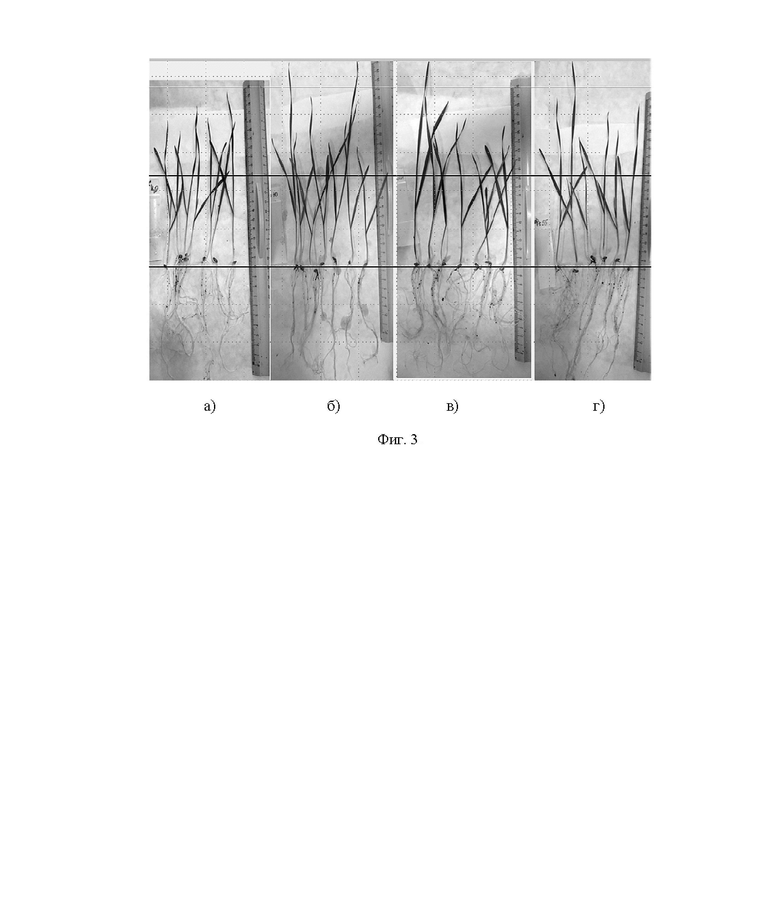
На фиг. 3 показан пример стимуляции роста пшеницы на ранних этапах развития по параметру длины всходов штаммом Microbacterium sp. ET2 после высушивания культуры при разных температурах, где (а) - семена пшеницы, замоченные на 1 час в воде (контроль); (б) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением L-триптофана в течение 5 суток, затем высушенным при 30°С в течение суток; после разведения в воде до исходной концентрации семена замачивали в культуре на 1 час; (в) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением L-триптофана в течение 5 суток, затем высушенным при комнатной температуре (20°С) в течение суток; после разведения в воде до исходной концентрации семена замачивали в культуре на 1 час; (г) - семена пшеницы, бактеризованные предлагаемым штаммом Microbacterium sp. ET2, выращенным на безазотистой среде с добавлением L-триптофана в течение 5 суток, затем высушенным при 55±2°С в течение суток; после разведения в воде до исходной концентрации семена замачивали в культуре на 1 час.
Осуществление изобретения
Возможность осуществления предлагаемого изобретения подтверждается следующими примерами, но не ограничивается ими.
Пример 1. Экстракция ДНК и идентификация штамма
Нуклеотидная последовательность участка 16S рРНК была определена в процессе нанопорового секвенирования по технологии Oxford Nanopore Technologies с использованием прибора MinION (Oxford Nanopore Technologies) и ячейки R9.4.1. Для этого ДНК выделяли из биомассы культуры штамма, выросшей на среде R2A, с помощью набора Monarch (New England BioLabs) в соответствии с протоколом производителя. Оценку качества ДНК проводили в 1% агарозном геле, а также с использованием спектрофотометра Nanodrop (Thermo Scientific). Концентрацию ДНК измеряли на флуориметре Qubit 3.0 (Invitrogen, Thermo Fisher Scientific corporation), подготовку проб производили с использованием набора Qudye dsDNA HS Assay kit (Lumiprobe) по инструкции производителя. Секвенирование геномной ДНК проводили согласно протоколу Native barcoding genomic DNA (with EXP-NBD104, EXP-NBD-114, and SQK-LSK109). При проведении биоинформатического анализа сигналы тока, записанные в формате FAST5, переводили в формат FASTQ, для преобразования использовали программу Guppy basecaller 6.4.6. Сборку генома осуществляли с помощью программ Flye 2.9.1 и Medaka 1.4.2.
Идентификацию проводили путем сравнительного анализа нуклеотидной последовательности, соответствующей фрагменту 16S рРНК, с гомологичными последовательностями из базы данных NCBI (National Center for Biotechnology Information website; www.ncbi.nlm.nih.gov/blast).
Результаты анализа последовательности выявили, что штамм относится к роду Microbacterium и имеет на уровне 99.6% сходство с Microbacterium saccharophilum штамм RS59 (сиквенс фрагмента гена; номер доступа MH715208.1) и на уровне 98.49% сходство с видом Microbacterium caowuchunii штамм ST-M6 (сиквенс полного генома; номер доступа CP044231.1).
Пример 2. Изучение азотфиксирующей активности штамма Microbacterium sp. ET2
Штамм выращивали на плотной среде Эшби, не содержащей связанных форм азота (г/л): сахароза - 20.0; K2HPO4 - 0.2; MgSO4 × 7H2O - 0.2; NaCl - 0.2; K2SO4 - 0.1; CaCO3 - 5.0; FeСl3 - 0.1; раствор микроэлементов по Федорову - 1 мл/л; агар-агар (Oxoid) -15 г/л, вода - дистиллированная. Состав микроэлементов по Федорову, г/л: H3BO3 - 5.0; (NH4)2MoO4 × 2H2O - 5.0; ZnSO4 × 7H2O - 0.2; KI - 0.5; NaBr - 0.5; Al2(SO4)3 × 18H2O - 0.3; вода дистиллированная. Высев проводили бактериологической петлей, штрихами. Выросшую биомассу использовали как инокулят, засевали в жидкую среду того же состава и культивировали при 28°С в течение 4 суток в пенициллиновых флаконах объемом 15 мл с 5 мл среды.
Для определения активности нитрогеназы - ключевого фермента азотфиксации, использовали аналитический метод газовой хроматографии ацетиленовой редукции. Для этого ватные пробки заменяли на герметичные резиновые, закатывали алюминиевым колпачками, вводили 1 мл ацетилена и инкубировали 3 часа при 28°С. Затем из флаконов отбирали 1 мл пробы и измеряли содержание образовавшегося этилена на газовом хроматографе Кристалл 2000М ("Хроматэк", Россия). В качестве отрицательных контрольных проб служили вода дистиллированная и среда без инокулята. Определение проводили в 3-кратной повторности и рассчитывали среднее арифметическое.
В тестируемых условиях потенциальная азотфиксирующая активность составляла 1.8 ± 0.2 нг С2Н4/мл за 1 час инкубации. Несмотря на невысокие показатели нитрогеназной активности, штамм сохраняет способность роста в условиях, лимитированных по содержанию нитратного и аммонийного азота в среде, что является важной характеристикой биологической активности при бактеризации растений и формировании микробно-растительных консорциумов.
Пример 3. Культивирование штамма Microbacterium sp. ET2 и определение содержания ауксинов (индолил-3-уксусная кислота) в среде культивирования.
Штамм культивировали на плотной (агаризованной) среде R2A в течение 3-4 суток, затем биомассу снимали бактериологической петлей и вносили в колбы с 50 мл жидкой среды следующего состава (г/л): K2HPO4 - 0.5; KH2PO4 - 0.3; MgSO4 · 7H2O - 0.1; NaCl - 0.5; CaCl2 · 6H2O - 0.03; дрожжевой экстракт - 0.5; глюкоза - 5.0; вода - водопроводная. В качестве индуктора биосинтеза ИУК в среду вносили L-триптофан в количестве 100, 200 и 400 мкг/мл. Культивировали при 28°С на качалке (100 об/мин) 5 суток.
Количественный анализ ауксина проводили колориметрически (Gordon S.A., Weber R.P. Colorimetric estimation of indole-acetic acid // Plant Physiol. - 1951. - V. 26. - P. 192-195) на спектрофотометре (КФК-3-01-«ЗОМЗ») после 5 сут культивирования с использованием реактива Сальковского (0.05М FeCl3 в 35% HClO4), который добавляли из расчета 1:1 (по объему) к супернатанту, полученному после центрифугирования культуры (10 мин при 10 000g). Пробы инкубировали в темноте при 30°С в течение 15 мин. Контролем служила неинокулированная среда с добавлением реактива. Наличие ИУК проявлялось в розовом (малиновом) окрашивании. Окрашенные пробы фотоколориметрировали при 530 нм, в кювете с длиной оптического пути 0.5 см. Оптическую плотность (ОП) культуры измеряли при 540 нм, в кювете с длиной оптического пути 0.5 см. Концентрацию ИУК определяли по калибровочному графику, построенному в диапазоне концентраций ИУК от 1 до 50 мкг/мл.
Из таблицы 1 видно, что биосинтез ауксина культурой Microbacterium sp. ET2 составляет 22 мкг/мл при использовании 200 мкг/мл экзогенного триптофана и 32 мкг/мл при добавлении 400 мкг/мл L-триптофана. Известно, что штаммы псевдомонад, например, Pseudomonas chlororaphis BKM B-2956D и Pseudomonas aureofaciens BS1393, которая используется в коммерческом препарате "Псевдобактерин-2", образуют 11.2 и 16.4 мкг/мл ауксина (Патент RU 2588473, опубл. 27.06.2016) соответственно. Таким образом, использование экзогенного триптофана в количестве 200 мкг/мл достаточно для биосинтеза необходимых ростстимулирующих количеств ауксина предлагаемым штаммом Microbacterium sp. ET2.
Пример 4. Оценка выживаемости штамма Microbacterium sp. ET2 при воздействии протравителей зерна.
Для эффективной колонизации бактериями корневой системы злаков, засеваемых в почву семенами, проходящими обязательную предпосевную обработку протравителями, необходимо определить устойчивость предлагаемого штамма к воздействию гербицидов, фунгицидов и пестицидов. Для этого использовали объединенные рабочие растворы протравителей, где действующие вещества - это дифеноконазол (67 г/л), имидаклоприд (333 г/л), тебуконазол (17 г/л) и флудиоксонил (75 г/л). Культуру штамма, выращенную на среде R2A, вносили в пробирки с рабочим раствором протравителей, перемешивали на вортексе и оставляли на 2 часа, после чего высевали аликвоту (50 мкл) на поверхность агаризованной среды, растирая шпателем, непосредственно из исходных растворов, а также из их десятичных разведений, полученных с помощью разведения в стерильной водопроводной воде (1:9 по объему). В качестве контроля использовали стерильную водопроводную воду. Подсчет колониеобразующих единиц проводили через 3-5 сут после инкубирования засеянных чашек при 28°С. Результаты представлены в таблице 2.
(пестицид, фунгицид, инсектицид)
Согласно полученным результатам, использованные протравители, несмотря на уменьшение численности жизнеспособных клеток на два порядка в популяции, не оказывали значительного ингибирующего эффекта на культуру штамма Microbacterium sp. ET2 и не вызывали токсичного эффекта, полностью подавляющего его развитие. Культура сохраняла жизнеспособность на уровне 107 КОЕ/мл после обработки протравителем. Устойчивость Microbacterium sp. ET2 к неоникотиноидам (имидаклоприд) и триазолам (тебуконазол и дифеноконазол) обеспечивает эффективность использования этой культуры за счет конкурентного преимущества в отношении других бактерий, угнетаемых действием этих веществ. Например, ранее описанный штамм Azospirillum zeae OPN-14, стимулирующий рост растений, оказался неустойчивым к тебуконазолу (Патент РФ RU2678755C1, опуб. 31.01.2019). Учитывая, что исследованные вещества входят в основные используемые в сельском хозяйстве препараты протравителей, устойчивость к ним штамма Microbacterium sp. ET2 делает его приоритетным для широкого и масштабного применения.
Пример 5. Оценка выживаемости штамма Microbacterium sp. ET2 после высушивания культуры в жидкой среде с добавлением носителя (аморфный диоксид кремния).
Для использования штамма важным является сохранения жизнеспособности культуры при высыхании. Этот фактор определяет сохранность самого препарата, а также устойчивость микроорганизма к высыханию, находясь в почве. Для этих целей культуру штамма Microbacterium sp. ET2, выращенную в жидкой среде (состав указан в примере 3) с триптофаном, высушивали при различных температурах (20°С, 30°С и 55°С). Для этого штамм выращивали в жидкой среде в течение 4-5 суток, аликвоту (4 мл) наливали в открытые чашки Петри (диаметр 40 мм), добавляли 1,4 г аморфного диоксида кремния до консистенции густой сметаны и перемешивали, накрывая сверху стерильной марлей, и оставляли открытыми на сутки. Аморфный диоксид кремния добавляют из расчета, что на 1 мл культуральной жидкости используют 0,2 - 0,5 г аморфного диоксида кремния.
После высыхания и для последующего применения готовили раствор, добавляя стерильную водопроводную воду (4 мл) до исходного объема, получая, таким образом, исходную суспензию, из которой затем готовили последовательные десятичные разведения для высева на поверхность питательной среды и подсчета КОЕ. Чашки инкубировали до появления и подсчета отдельно различимых колоний. Результаты представлены в таблице 3.
Согласно приведенным данным, культура Microbacterium sp. ET2 сохраняет жизнеспособность при высушивании на воздухе в диапазоне температур от 20 до 55°С. При температуре, превышающей 55± 2°С выживаемость микробной популяции снижается, однако, оставаясь на достаточно высоком уровне. Таким образом, предлагаемый штамм устойчив к высушиванию в жидкой культуре, что облегчает его транспортировку и последующее применение на месте бактеризации семян, а также способствует выживанию при недостатке влаги.
Пример 6. Бактеризация семян пшеницы для стимуляции прорастания.
Семена пшеницы замачивали на 1 час в различных вариантах культуры Microbacterium sp. ET2, выращенной в жидкой среде (состав указан в примере 2). Для этого использовали питательную среду с добавлением L-триптофана. Также использовали варианты культуры, смешанной с носителем (аморфный диоксид кремния), для чего в чашки (диаметр 40 мм) вносили 4 мл культуры, к которой прибавляли порошковый носитель и равномерно перемешивали до консистенции густой сметаны. Семена замачивали в жидкой культуре или раскладывали в культуру с носителем, оставляя на 1 час. Ограниченное до 1 часа время инкубации выбрано с целью не увеличивать дополнительное время предпосевной обработки семян зерновых, которое обычно затрачивается при агротехнике, несмотря на то что более длительная бактеризация может способствовать более эффективному стимулирующему действию штамма.
После обработки культурой семена засевали в горшки с вермикулитом с целью избежать любого дополнительного влияния на рост семян за счет биоты и питательных соединений, содержащихся в почвенном субстрате. Семена в количестве 9 штук засевали в один горшок, опыт ставили в трех повторностях. Контролем служили семена, замоченные в водопроводной воде, а также семена, помещенные в носитель (аморфный диоксид кремния в воде). Растения выращивали при температуре 20-22°С и продолжительности освещения 14 часов в течение двух недель. Полив осуществляли водопроводной отстоянной водой по мере необходимости. Анализ роста семян и действия штамма по стимуляции прорастания и развития семян проводили, измеряя длину побега, а также определяя массу корней и побегов. Корни растения отмывали в воде и просушивали между слоями фильтровальной бумаги, после чего взвешивали.
Штамм показал свою эффективность по стимуляции ризогенеза и развитию пшеницы на ранних этапах роста в течение первых двух недель. Было использовано несколько схем опыта:
1. Использовали штамм Microbacterium sp. ET2, выращенный в течение 5-ти суток на среде без азота с добавлением 200 мкг/мл триптофана. Культуру тестировали в двух вариантах: не смешанную (исходная культура в жидкой среде) и смешанную с аморфным диоксидом кремния (носитель). Кроме того, культуру использовали в исходной концентрации, а также, разбавленной в 100 раз водопроводной водой. В опытные варианты растворов семена пшеницы помещали на 1 час. В качестве контроля семена замачивали в водопроводной воде, а также помещали на то же время в среду для культивирования бактерий и суспензию аморфного диоксида кремния, также приготовленную на водопроводной воде. Результаты представлены измерениями на 13-ые сутки после бактеризации и отображены в таблице 4 и на фиг. 1.
опыта
Показатели
± 0.83
± 0.60
± 2.07
± 2.50
± 2.67
± 1.25
± 3.63
± 0.02
± 0.02
± 0.03
± 0.03
± 0.007
± 0.02
± 0.04
± 0.03
± 0.01
± 0.01
± 0.02
± 0.12
± 0.03
± 0.03
Согласно приведенным данным, штамм Microbacterium sp. ET2 стимулирует развитие пшеницы на ранних этапах ее развития. При использовании исходной неразбавленной культуры стимуляция роста растений выражается в увеличении массы корней на 11.1%, массы надземной части (побег, листья) - на 21.4% и высоты растений - на 15.8%. Стимулирующее действие максимально проявляется при использовании жидкой культуры, разбавленной в 100 раз водой: увеличение высоты растений составляет 21.05% (от водного контроля), увеличение массы листьев и корней - 50% и 61.6% соответственно. Полученные данные также показывают, что питательная для бактерий среда в исходном ее виде, из-за избыточного содержания минеральных веществ, несколько подавляет рост растений. С этим может быть связан и более эффективное действие разбавленной культуры. Кроме того, носитель также обладает некоторым ингибирующим действием на прорастание семян пшеницы, что выражается в уменьшении количества проросших семян, как в контрольном варианте с носителем, так и при его использовании совместно с культурой штамма Microbacterium sp. ET2. Семена, обработанные аморфным диоксидом кремния, практически не отличаются либо несколько меньше контрольных (вода) по параметрам высоты и массы надземной части растений. Несмотря на то, что использование штамма Microbacterium sp. ET2 позволяет в некоторой степени преодолеть этот негативный эффект, очевидно, что использование культуры предполагает ее использование без дополнительного смешивания с данным носителем.
Учитывая, что культура показала способность переживать высушивание при температуре выше 50°С (Пример 5) и увеличение выхода ИУК при использовании 400 мкг/мл L-триптофана (Пример 3), было тестировано использование штамма Microbacterium sp. ET2, выращенного на среде без азота с добавлением 400 мкг/мл триптофана в качестве индуктора биосинтеза ИУК в течение 5 суток, с последующим высушиванием. Культуру смешивали с аморфным диоксидом кремния до консистенции густой сметаны и оставляли в открытых емкостях для высыхания на сутки при различных температурах (20°С, 30°С и 55°С). После высыхания и для последующего применения готовили рабочий раствор, добавляя стерильную водопроводную воду до исходного объема, в который, после размешивания, помещали на 1 час семена пшеницы. В качестве контроля семена замачивали в водопроводной воде, а также помещали на то же время в суспензию аморфного диоксида кремния в водопроводной воде. Результаты представлены в таблице 5 и на фиг. 2 и 3.
опыта
Показатели
Согласно полученным результатам, использование 400 мкг/мл экзогенного триптофана позволяет штамму Microbacterium sp. ET2 сохранять эффективность по стимуляции развития прорастающих семян пшеницы после высушивания культуры при различных температурах. Высота бактеризованных растений больше по сравнению с контрольными на 4-8%, масса их надземной части - на 26.7% и 33.3%, а масса корней - на 42.8%.
На фиг. 2 и 3 показаны примеры растений пшеницы на 16-ые сутки после бактеризации предлагаемым штаммом Microbacterium sp. ET2 после высушивания культуры на носителе (аморфный диоксид кремния). В отличие от контроля, инокулированные растения имеют более высокие проростки и более развитую корневую систему.
Таким образом, технический результат заявляемого изобретения - стимуляция роста и развития сельскохозяйственных растений на примере зерновых культур (пшеница). Он достигается тем, что для обработки растений используется штамм бактерии Microbacterium sp. ET2, обладающий выраженной биологической активностью за счет биосинтеза фитогормона ауксина; штамм обладает устойчивостью к химическим протравителям (пестицидам), применяемым в сельском хозяйстве, а также устойчивостью и сохранением жизнеспособности и ростстимулирующей активности при высушивании на воздухе, в том числе при температуре 55±2°С. Использование предлагаемого штамма Microbacterium sp. ET2 в качестве фитостимулятора возможно как в жидкой культуре, выращенной с использованием 200-400 мкг/мл L-триптофана, так и с использованием носителя при культивировании на среде с 400 мкг/мл L-триптофана.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ PAENIBACILLUS POLYMYXA ET3, СТИМУЛИРУЮЩИЙ РОСТ ЗЛАКОВЫХ КУЛЬТУР | 2023 |
|
RU2820273C1 |
| Штамм бактерий Rhodococcus qingshengii Ac-2143 - деструктор гербицида имазетапира и стимулятор роста растений | 2020 |
|
RU2764119C1 |
| КОНСОРЦИУМ ПСИХРОТОЛЕРАНТНЫХ БАКТЕРИАЛЬНЫХ ШТАММОВ ДЛЯ БИОЛОГИЧЕСКОЙ ЗАЩИТЫ И СТИМУЛЯЦИИ РОСТА СЕЛЬСКОХОЗЯЙСТВЕННЫХ РАСТЕНИЙ | 2022 |
|
RU2795906C1 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ К АБИОТИЧЕСКИМ СТРЕССАМ | 2014 |
|
RU2564562C1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS CHLORORAPHIS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ ГРИБОВ И БАКТЕРИЙ И СТИМУЛЯЦИИ РОСТА РАСТЕНИЙ | 2015 |
|
RU2588473C1 |
| Способ фиторемедиации почвы, загрязненной углеводородами, и применение штамма микроорганизма Rhodococcus erythropolis ВКМ Ас-2017Д в качестве стимулятора роста растений | 2016 |
|
RU2618096C1 |
| Способ применения штамма Bacillus pumilus СТ2 (EBC/22-Q1) совместно с минеральными удобрениями и мелиорантами для повышения урожайности и качества сельскохозяйственных культур | 2022 |
|
RU2817304C1 |
| Средство для стимуляции роста сельскохозяйственных культур | 2019 |
|
RU2736340C1 |
| Способ применения штамма Bacillus subtilis 2.2 совместно с минеральными удобрениями и мелиорантами для повышения урожайности и качества сельскохозяйственных культур | 2023 |
|
RU2827179C1 |
| Способ применения штамма Bacillus subtilis 124 совместно с минеральными удобрениями и мелиорантами для повышения урожайности и качества сельскохозяйственных культур | 2023 |
|
RU2827181C1 |

Изобретение относится к области биотехнологии. Штамм бактерий Microbacterium sp. ET2, обладающий способностью стимулировать рост семян пшеницы и отличающийся устойчивостью к действию протравителей зерна, депонирован под регистрационным номером Aс-2212 во Всероссийской Коллекции Промышленных Микроорганизмов. Изобретение может быть использовано в качестве микробного препарата - фитостимулятора роста и развития сельскохозяйственных растений за счет биосинтеза ключевого ауксинов - индолил-3-уксусной кислоты. Способ использования штамма предполагает его выращивание в среде с добавлением 200-400 мкг/мл L-триптофана и использование в виде исходной или разбавленной жидкой культуры, в том числе, после высушивания на воздухе. Штамм обладает устойчивостью к протравителям зерна, что обеспечивает эффективность его использования за счет конкурентного преимущества в отношении других бактерий, угнетаемых действием этих веществ. Изобретение позволяет ускорить рост пшеницы и увеличить прирост биомассы растений на ранних этапах развития растений. 3 н. и 2 з.п. ф-лы, 3 ил., 5 табл., 6 пр.
1. Штамм бактерий Microbacterium sp. ET2, депонированный во Всероссийской Коллекции Промышленных Микроорганизмов под регистрационным номером ВКПМ Ac-2212, обладающий свойством стимуляции прорастания и роста растений пшеницы.
2. Препарат, обладающий стимулирующим рост растений пшеницы свойством, включающий штамм по п. 1, выращенный на безазотистой среде с добавлением L-триптофана.
3. Препарат по п. 2, характеризующийся тем, что дополнительно содержит носитель.
4. Препарат по п. 3, характеризующийся тем, что в качестве носителя используют аморфный диоксид кремния.
5. Применение штамма по п. 1 для стимуляции прорастания и роста растений пшеницы.
Авторы
Даты
2024-05-31—Публикация
2023-07-03—Подача