Изобретение относится к области медицины, а именно к профилактической онкологии и касается средства, обладающего способностью предотвращать развитие рака яичек и наследственного рака.
Канцеропревенция представляет собой комплекс мер (лекарственных и нелекарственных), направленных на системное предотвращение риска и частоты возникновения злокачественных опухолей. Канцерогены, как известно, повреждают участки ДНК, осуществляющие активирующие или тормозные влияния на деление (пролиферация) и созревание (дифференцировка) клеток [1].
Поиск стратегий предотвращения злокачественной биотрансформации клеток является актуальным [2]. Установлено, что большим потенциалом обладает химиопрофилактика рака, как одно из направлений канцеропревенции. Она включает в себя предотвращение начальных фаз канцерогенеза или подавление его начала путем использования природных, синтетических, биологических агентов [3].
Рак яичек является наиболее распространенной опухолью у мужчин в возрасте от 14 до 44 лет [4]. Эта патология демонстрирует прогрессирующий рост на протяжении последних четырех десятилетий. Профилактические программы этого вида рака являются предметом пристального внимания урологов и широко обсуждаются. Самой эффективной мерой снижения частоты заболеваемости злокачественных опухолей яичек считается профилактическое самообследование. Поиск способов химиопрофилактики рака яичка является актуальным [5]. Стратегии профилактики рака яичек и полового члена: являются интегративными. В литературе отсутствует информации об эффективности средств химиопрофилактики рака яичек. Рак яичек является генетическим заболеванием. Наличие родственника с раком яичка в анамнезе увеличивает риск заболевания в 8-10 раз по сравнению с общей мужской популяцией статья [4]. Установлено, что наследуются и многие другие формы злокачественных опухолей. На их долю приходится 10% случаев рака во всем мире [6].
Известна биологическая добавка - комплексный экстракт растительного происхождения, обладающая канцеропревентивным действием [7]. Ее эффективность доказана в отношении канцерогена Диметилбензантрацен (ДМБА). Сочетанное введение этой биодобавки снижает индукцию первичных опухолей у мышей. В ее состав входят экстракты листьев куркумы, зеленого чая, корней шлемника байкальского и др. Эффективность экстракта связывают с иммуномодулирующим действием. К числу недостатков этого средства можно отнести многокомпонентность состава, в который входят лекарственные травы, произрастающих в разных странах мира. Их сырьевые запасы ограничены. Известны средства, обладающее канцеровентивным эффектов в отношении наследственных форм рака. Наиболее эффективным из них является аспирин [8]. Механизм канцеропревентивного действия аспирина связывают с ингибированием активности фермента циклооксигеназы 2 (ЦОГ-2). Однако его эффективность ограничена и не всегда высока. Кроме того, длительный прием аспирина может привести к появлению побочных эффектов. К числу средств, обладающих канцеропревентивными свойствами относятся пептидные биорегуляторы, в частности, эпиталамин. Их канцеропревентивные свойства связывают со способностью регулировать физиологические функции организма, влиять на иммунные реакции, гормональный баланс, процессы клеточной пролиферации и дифференцировки [9]. Однако возможности профилактического использования эпиталамина ограничена парентеральным способом их введения. Кроме того, эпиталамин, как и другие отмеченные выше средства канцеропревенции (растительный экстракт и аспирин), воздействуют на те звенья патогенеза этой патологии, которые не связаны с генетическими факторами. Между тем, первой стадией канцерогенеза является стадия инициации, к числу наиболее важных событий которой относиться повреждение ДНК - мутации [10, 1]. Следует отметить, что процесс канцерогенеза инициируют только те мутации, которые вызывают специфические повреждения ДНК, называемыми драйверными мутациями [11]. В связи с этим, снижение уровня мутагенного воздействия в отношении драйверных мутаций является самым важным этапом канцеропревенции. Совершенно обоснованным являются поиск канцеропревентивных средств среди антимутагенов [12]. Очевидно, что среди средств, снижающих уровень мутаций (антимутагенов) в качестве канцеропревентивных средств будут эффективны только те, которые обладают способностью оказывать влияния на молекулярные события, которые являются критическими для канцерогенеза, то есть снижать уровень драйверных мутаций.
Антимутагенное действия против канцерогена описано для компонентов экстракта корня Glycyrrhiza G. aspera [13]. Это свидетельствует о его канцеропревентивных свойствах. Этот экстракт наиболее близок к заявляемому средству по механизму действия и может быть принят в качестве прототипа. К числу недостатков этого экстракта является то, что его сырьевые запасы не изучались. Перспективы его использования в отношении рака яичек и наследственного рака не определены.
Задачей решаемой данным изобретением, является расширение арсенала лекарственных препаратов, обладающих канцеропревентивным действием в отношении клеток рака яичек и наследственного рака.
Поставленная задача решается путем применения лекарственного препарата Простатилена АЦ в качестве канцерпревентивного средства в отношении ткани яичек (тестикулярной ткани) и сперматозоидов.
Основной составляющей этого лекарственного средства являются биорегуляторный полипептид - простатилен, выделенный из предстательной железы крупного рогатого скота. Простатилен показан для применения в урологической практике и обладает органотропным действием по отношению к предстательной железы. Полипептид характеризуется наличием противовоспалительной активности, способностью улучшать микроциркуляцию крови, время свертывания и др. Показано, что Простатилен не оказывают какого-либо побочного влияния на структуру и функции различных органов и систем [14]. В состав этого лекарственного средства входит также АЦ - хелатное комплексное соединение, которое представляет собой, комплекс цинка аргинил-глицината дидигидрохлорид (ЦАГ). Фармакологические свойства регуляторных пептидов ПЖ, аминокислот (аргинина, глицина), цинка свидетельствуют об их взаимодополняющем воздействии на единые патогенетические механизмы заболеваний ПЖ, мочевого пузыря, нарушений половой и репродуктивной функций. В отличие от Простатилена он оказывает влияния на иммунологические механизмы мужского бесплодия [15]. Влияние препаратов Простатилен АЦ и Простатилен на уровень антиспермальных антител в эякуляте при лечении пациентов с хроническим абактериальным простатитом и сопутствующими нарушениями репродуктивной функции [15]. Методами SCSA и TUNEL показано, что Простатилен АЦ снижает уровень ДНК повреждений в сперматозоидах у пациентов с хроническим простатитом и при мужском бесплодии [16].
В результате проведенных нами экспериментальных исследований обнаружено неизвестное до сих пор свойство Простатилена АЦ - канцеропревентивное в отношении клеток тестикулярной ткани и сперматозоидов.
Способность Простатилена предотвращать развитие злокачественных новообразований является для специалиста фактом неочевидным и не вытекает из уровня техники в данной области, не обнаружено в патентной и научно-медицинской литературе.
Тот факт, что Простатилен снижает уровень ДНК повреждений в сперматозоидах не свидетельствует о том, что препарат обладает канцеропревентивными свойствами. Этот факт для специалиста является не очевидным. Эти данные о способности препарата снижать уровень ДНК повреждений в сперматозоидах были получены путем определения структуры хроматина по Эвенсону (метод SCSA) [16]. Влияние препарата Простатилен АЦ на фрагментацию ДНК сперматозоидов при лечении пациентов с хроническим абактериальным простатитом и сопутствующими нарушениями репродуктивной функции и методом TUNEL [17]. Клиническая значимость этих методов (SCSA TUNEL) определяется тем, что они позволяют дать прогноз в отношении мужского фактора бесплодия. SCSA считается непрямым тестом для определения фрагментации ДНК-сперматозоидов. В основе принципа исследования лежит измерение подверженности ДНК спермы денатурации. Денатурация представляет собой плавление ДНК. При этом обе цепочки ДНК отходят друг от друга, разрывая водородные связи. Сами цепочки ДНК остаются неразрывными [18]. Метод TUNEL является мощным инструментом для оценки проявлений апоптоза (запрограммированной клеточной гибели) в биологических системах [19]. В качестве причин возрастания ДНК-повреждений, выявляемых этими методом (SCSA TUNEL) называются пожилой возраст отцов, воспалительные заболевания, варикоцеле, интоксикации и др. На основании того, что Простатилен обладает способностью снижать уровень разрывов водородных связей между цепочками ДНК или снижать ее повреждения путем предупреждения апоптоза, можно предположить, что Простатилен АЦ снижает уровень повреждений ДНК в сперматозоидах, иными словами обладает антимутагенными свойствами. Однако эти данные не свидетельствуют о том, что препарат обладает канцеропревентивным свойством (предотвращает появление драйверных мутаций). Тезис о том, что все антимутагены обладают канцеропревентивными свойствами неочевиден. Антимутаген может репарировать определенные типы мутаций, которые не обязательно являются драйверными мутациями. Более того, антимутагены могут даже индуцировать эти мутации, а, следовательно, и канцерогенез. Так, установлено, что липоевая кислота обладает антимутагенными свойствами в отношении мутаций, которые индуцирует циклофосфамид [20], с другой стороны, показано, что этот препарат стимулирует определенный тип канцерогенного роста (рак молочной железы) [21].
В настоящем исследовании выявлены канцеропревентивные свойства препарата в отношении ткани яичек. В связи с этим, он может быть использован для химиопрофилактики рака яичек.
В настоящей заявке показано также, что Простатилен АЦ обладает способностью снижать уровень мутаций после воздействия канцерогена в сперматозоидах, поэтому может быть использован в практическом здравоохранении в качестве средства канцеропревенции наследственного рака.
Таким образом, предлагаемое техническое решение соответствует критериям патентоспособности изобретения, а именно «новизна», «изобретательский уровень» и «промышленная применимость».
Канцеропревентивные свойства Простатилена АЦ доказаны, в краткосрочном тесте «метод ДНК-комет» по отношению к клеткам тестикулярной ткани и сперматозоидах крыс in vivo. Этот тест рекомендован для оценки канцерогенности лекарственных средств в Руководстве по доклиническому исследованию [10]. Этот метод является сегодня одним из наиболее используемых методов для оценки канцерогенности, поскольку сравнение результатов анализа comet и канцерогенности с 208 химическими веществами, показывает, что положительный ответ был получен для 94% генотоксичных канцерогенов [22]. Сбой стандартной батареи краткосрочных тестов при обнаружении некоторых генотоксических канцерогенов грызунов и человека.
Для доказательства канцеропревентивных свойств Простатилена АЦ в качестве канцерогена был использован цитостатический препарат Метотрексат. Этот препарат, как и все цитостатические средства, является мутагеном. Доказано, что он обладает способностью индуцировать развитие злокачественных опухолей [23], то есть является канцерогеном. Его канцерогенность подтверждена в тесте ДНК-комет [24].
Данное изобретение будет понятно из следующего описания и приложенных к нему таблиц (1-2).
Изучение канцеропревентивного эффекта Простатилена АЦ проводилось на крысах-самцах линии Wistar репродуктивного возраста (n=15, возраст - 2.5 мес.). Крысы-самцы были разбиты на 3 группы. Первую группу животных представляли собой интактные крысы (фон). Животные экспериментальных групп были разбиты на 2 группы: 1) Контроль (метотрексат); 2) опыт (метотрексат+Простатилен АЦ). Животным экспериментальных групп вводили МТХ (Ebeve Pharma, Австрия) подкожно четырехкратно, с недельными интервалами в дозе 1 мг/кг. Крысам группы «опыт» вводили (в виде суппозиториев) Простатилен АЦ в течение 4-х дней до и 4-хдней после МТХ в дозе 2,66 мг/кг после каждого введения МТХ.
Животные были получены из лаборатории биологического моделирования НИИФиРМ им. Е.Д. Гольдберга, г. Томск. Содержание осуществлялось в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). Животных содержали при 12-часовом световом режиме, на стандартном брикетированном корме, при свободном доступе к воде.
Каждая группа животных (фон, контроль, опыт) включала, согласно требованиям в Руководстве по доклиническому исследованию [10] 5 животных. Крыс рандомизировали по массе тела, по группам после предварительного карантина и внешнего осмотра.
Крыс-самцов подвергали эвтаназии (в СО2 камере) через 2,5 мес. после последнего введения Простатилена АЦ. После эвтаназии у животных выделялись семенники и сперматозоиды (из хвостовой части придатка семенника). Семенник и сперматозоиды хвостовой части придатка семенника гомогенезировали в охлажденном до 4°С фосфатно-солевом буфере (ФСБ), содержащем 20 mM EDTA-Na2 и 10% ДМСО (рН 7.5). Далее пробирки выдерживались в течение 5 мин при комнатной температуре для осаждения крупных фрагментов, после чего 1.5 мл верхнего слоя переносилось в новую пробирку. Суспензии клеток в объеме 60 мкл вносились в пробирку с 240 мкл 0.9% раствора легкоплавкой агарозы (темп. пл. <42°С) в ФСБ, подогретым до 42°С (микротермостат «Термит») и ресуспендировались. Затем 60 мкл раствора агарозы с клетками наносилось на предварительно покрытые 1% универсальной агарозой предметные стекла, которые накрывались покровным стеклом и помещали на лед. Все проводимые впоследствии операции осуществлялись в затемненном помещении при желтом свете. После затвердевания агарозы (около 5 минут) покровные стекла осторожно удалялись, микропрепараты помещались в стеклянную кювету (тип Шиффендекер) и заливались предварительно охлажденным до 4°С лизирующим буфером (10 mM Tris-HCl [рН 10], 2.5 MNaCl, 100 mM EDTA-Na2, 1% TritonX-100, 10% DMSO). Для клеток семенника и хвостовой части придатка семенника в лизирующий буфер был добавлен ДТТ 10 мМ, для деконденсации хроматина, инкубация длилась 24 часа. После окончания лизиса микропрепараты переносились в камеру для электрофореза (Sub Cell GT, "Bio-Rad"). Камера заполнялась буфером для электрофореза (300 mM NaOH, 1 mM EDTA-Na2, рН >13). Приготовленные микропрепараты инкубировались в течение 20 минут для реализации щелочно-лабильных сайтов и щелочной денатурации ДНК. Затем проводился электрофорез в течение 20 минут при напряженности поля 1V/cm и силе тока ~300 mA. По окончании электрофореза микропрепараты перемещались в стеклянную кювету и фиксировались в 70% растворе этилового спирта (время фиксации 15 мин).
После фиксации микропрепараты высушивались, затем микроскопировались. Непосредственно перед микроскопированием проводилась их окраска флуоресцирующим красителем SYBR Green I (Sigma-Aldrich, США) (1:10000 в ТЕ-буфере с 50% глицерином) в течение 20 минут в темноте. Анализ проводился на флуоресцентном микроскопе (Микромед 3 Люм, Россия), совмещенном с цифровой камерой высокого разрешения, при увеличении х200. Полученные с микропрепаратов изображения ДНК-комет фотографировались и анализировались с использованием программного обеспечения CometD. В качестве показателя поврежденности ДНК было использовано процентное содержание ДНК в хвосте (%ДНК в хвосте) [10]. С каждого микропрепарата было проанализировано 100 клеток.
В качестве показателя поврежденности ДНК было использовано процентное содержание ДНК в хвосте (%ДНК в хвосте). Статистическую обработку полученных результатов проводили в программе статистика Statistica 13.3. Достоверность различий определяли с помощью критерия U-критерий Манна-Уитни. Данные представлены в виде среднего арифметического (М) ± стандартной ошибки среднего арифметического (SEM). Статистически значимыми считали различия при р≤0,05.
Пример 1
Оценка канцеропревентивных свойств Простатилена АЦ по отношению к ткани семенника крыс.
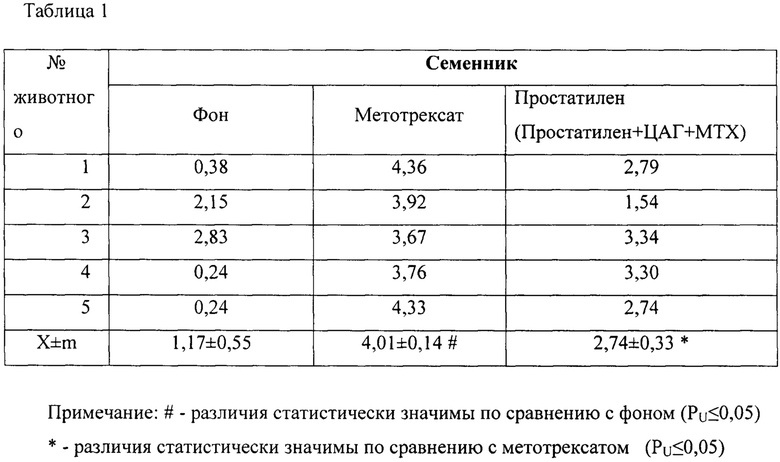
Результаты исследований представлены в таблице 1.
Для изучения влияния Простатилена на количество ДНК-повреждений в клетках ткани семенника были приготовлены микропрепараты описанным выше методом. В группе интактных животных (фон), уровень процента ДНК-комет составил 1.17±0.55. При анализе микропрепаратов у крыс-самцов, получавших МТХ, наблюдалось статистически значимое увеличение (в 3,4 раза, р≤0.05) процента ДНК-комет по сравнению с фоновыми значениями, оно составило 4.01±0.14. В группе животных, которым вводили МТХ и Простатилен АЦ, процент ДНК в хвосте кометы оказался статистически значимо снижен и составил 2,74±0,33.
Пример 2
Оценка канцеропревентивных свойств Простатилена АЦ по отношению к сперматозоидам крыс.
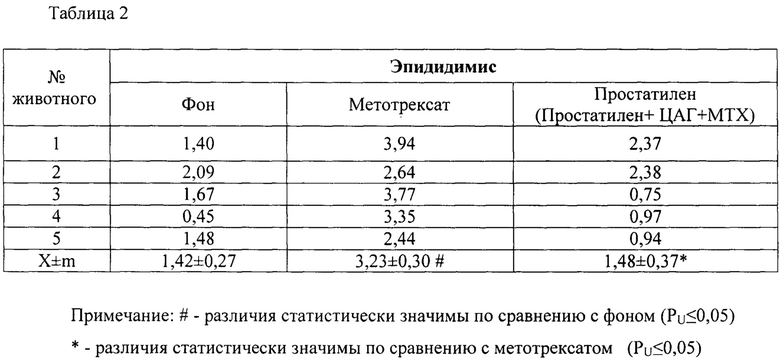
Результаты исследований представлены в таблице 2.
Для изучения влияния Простатилена АЦ на количество ДНК-повреждений в сперматозоидах были приготовлены микропрепараты описанным выше методом. В группе интактных животных (фон), уровень процента ДНК-комет составил 1.42±0.27. При анализе микропрепаратов у крыс-самцов, получавших МТХ, наблюдалось статистически значимое увеличение (в 2,3 раза, р≤0.05) процента ДНК-комет, по сравнению с фоновыми значениями, оно составило 3.23±0.30. В группе животных, которым вводили МТХ и Простатилен АЦ, процент ДНК в хвосте кометы оказался статистически значимо снижен и составил 1.48±0,37.
Применение Простатилена АЦ, в качестве канцеропревентивного средства, позволит эффективно снижать количество ДНК-повреждений (процент ДНК-комет) в семеннике и хвостовой части придатка семенника крыс после воздействия метотрексата.
Литература
1. Тюкавин А.И., Сучков С.В. Опухолевый рост - современный взгляд на патогенез и фармакотерапию (лекция) // Journals.есо-vector.com/PharmForm/article/view/65284/pdf_l. 2021. Т. 3, №2.
2. Свистунов А.А., Осадчук М.А., Осадчук A.M., Лоранская И.Д., Миронова Е.Д. Перспективные направления нелекарственной и лекарственной канцеропревенции. Современное состояние проблемы // Профилактическая медицина. 2021. Т. 24, №5. С. 118-125. https://doi.org/l0.17116/profmed202124051118.
3. Steward W.Р., Brown K. Cancer chemoprevention: a rapidly evolving field // Br J Cancer. 2013. Vol. 109, №LP. 1-7. doi: 10.1038/bjc.2013.280.20.
4. De Toni L., Šabovic I., Cosci I., Ghezzi M., Foresta C. and Garolla A. Testicular Cancer: Genes, Environment, Hormones // Front Endocrinology. 2019. Vol. 10. Article 408. https://doi.org/l0.3389/fendo.2019.00408.
5. Wanessa de Souza K., Elaine Diniz dos Reis P., Pimentel Gomes I., Campos de Carvalho E. [Prevention strategies for testicular and penile cancer: an integrative review] // Rev Esc Enferm USP. 2011. Vol. 45, №1. P. 277-82. doi: 10.1590/s0080-62342011000100039.
6. AlHarthi F., Qari A., Edress A., Abedalthagafi M. Familial/inherited cancer syndrome: a focus on the highly consanguineous Arab population // NPJ Genom Med (Reviev Article open 2020. Vol. 5(3). doi: 10.1038/s41525-019-0110-y.
7. Патент РФ №2619207 С Средство, обладающее канцерпревентивным действием // патент России Гафуров Ю.М. Климович А.А., Кривошапко О.Н., Штода Ю.Н., Ким Н.Ю., Попов А.М. Опубликовано: 12.05.2017 Бюл. №14.
8. Burn J., Sheth Н., Elliott F., Reed L., Macrae F., Mecklin J-P, Möslein G., Fiona McRonald F., Bertario L., Gareth Evans G., Gerdes A-M., W С Ho J., Lindblom A., Morrison PJ, Jem Rashbass J., Ramesar R., Seppälä Т., Thomas H., Pylvänäinen K., Borthwick G., Mathers J., Bishop T. Cancer prevention with aspirin in hereditary colorectal cancer (Lynch syndrome), 10-year follow-up and registry-based 20-year data in the CAPP2 study: a double-blind, randomised, placebo-controlled trial // Lancet. 2020. Vol. 395 (10240). P. 1855-1863. doi: 10.1016/S0140-6736(20)30366-4.
9. Анисимов B.H., Хавинсон B.X. Применение пептидных биорегуляторов для профилактики рака: результаты 35-летних исследований и перспективы // Вопросы онкологии. 2009. Т. 55. №3. С. 291-304.
10. Дурнев А.Д., Меркулов В.А., Жанатаев А.К и др. // Методические рекомендации по оценке ДНК-повреждений методом щелочного гель-электрофореза отдельных клеток в фармакологических исследованиях. Руководство по проведению доклинических исследований лекарственных средств / под редакцией Миронова А.Н. - М.: Гриф и К, 2013. С. 129, 149-153.
11. Morjaria Sh. Driver mutations in oncogenesis // International Journal of Molecular and Immuno Oncology. 2021. Vol. 6, Issue 2. P. 100-102. doi: 10.25259/IJMIO_26_2020.
12. Гончарова P.И., Кужир Т.Д. Молекулярные основы применения антимутагенов в качестве антиканцерогенов // Экологическая генетика. 2005. Т. 3, №3. С. 19-32.
13. Tatsuzaki J., Jinwei Y., Kojo Y., Mine Y., Ishikawa S., Mochizuki M., Inami K. Antimutagenicity Screening of Extracts from Medicinal and Edible Plants against N-Methyl-N-nitrosourea by the Ames Assay // Genes and Environment. 2014. Vol. 36, №2 P. 39-46. https://doi.org/10.3123/jemsge.2014.007.
14. Кузьмин И.В., Боровец С.Ю., Горбачев А.Г., Аль-Шукри С.Х. Простатический биорегуляторный полипептид простатилен: фармакологические свойства и опыт 30-летнего клинического применения в урологии // Урологические ведомости. 2020 Т. 10, №3. С. 243-258. DOI: https://doiorg/10.17816/uroved42472.
15. Аль-Шукри С.Х., Петленко С. В., Боровец С.Ю., Рыбалов М.А., Сорока И.В., Стукань Н.И. Влияние препаратов Простатилен АЦ и Простатилен® на уровень антиспермальных антител в эякуляте при лечении пациентов с хроническим абактериальным простатитом и сопутствующими нарушениями репродуктивной функции // Андрология и генитальная хирургия. 2016. Т. 16. С. 40-43. doi: 10.17650/2070-9781-2016-17-1-40-43.
16. Боровец С.Ю., Рыбалов М.А., Горбачев А.Г., Аль-Шукри С.Х. Влияние препарата Простатилен® АЦ на фрагментацию ДНК сперматозоидов при лечении пациентов с хроническим абактериальным простатитом и сопутствующими нарушениями репродуктивной функции // Андрология и генитальная хирургия. 2017. Т. 18., №3. С. 54-58. https://doi.org/l0.17650/2070-9781-2017-18-3-54-58.
17. Жуков О.Б., Брагина Е.Е., Левина А.В., Евдокимов В.В., Терушкин Р.А., Акрамов М.М., Шахов А.С., Васильев А.Э. Сравнение эффективности препаратов, содержащих комбинацию аргинина и цинка, в лечении мужского бесплодия // Андрология и генитальная хирургия. 2020. Т. 21. С. 26-35. doi: 10.17650/2070-9781-2020-21-2-26-35.
18. Лихачев И.В., Лахно В.Д. Исследование денатурации ДНК на основе модели Пейрарда-Бишопа Доксуа методом молекулярной динамики // Препринты ИПМ им. М.В. Келдыша. 2018. №232. 12 с. doi: 10.20948/prepr-2018-232.
19. Mirzayans R, Murray D. Do TUNEL and Other Apoptosis Assays Detect Cell Death in Preclinical Studies? // Int J Mol Sci. 2020. Vol. 21, №23:9090. doi: 10.3390/ijms21239090.
20. Tripathi R., Banji D. Evaluation of mutagenic and anti-mutagenic potential of alpha-lipoic acid by chromosomal aberration assay in mice // Drug and Chemical Toxicology. 2020. Vol. 43, Issue 4. P. 378-382. doi: 10.1080/01480545.2019.1606231.
21. Rossi C., Di Lena A., La Sorda R., Lattanzio R., Antolini L., Patassini C., Piantelli M., Alberti S. Intestinal tumour chemoprevention with the antioxidant lipoic acid stimulates the growth of breast cancer // Eur J Cancer. 2008. Vol.44, №17. P. 2696-704. doi: 10.1016/j.ejca.2008.08.021.
22. Brambilla G., Martelli A. Failure of the standard battery of short-term tests in detecting some rodent and human genotoxic carcinogens // Toxicology. 2004. Vol. 196, №(1-2). P. 1-19. doi: 10.1016/j.tox.2003.11.003.
23. Kurita D., Miyoshi H., Ichikawa A. et al. Methotrexate-associated Lymphoproliferative Disorders in Patients With Rheumatoid Arthritis: Clinicopathologic Features and Prognostic Factors // Am J Surg Pathol. 2019. Vol. 43, №7. P. 869-884. doi: 10.1097/PAS.0000000000001271.
24. Боровская Т.Г., Вычужанина А.В., Григорьева В.А., Коллантай О.В., Гольдберг В.Е., Дыгай A.M. Оценка влияния n-Тирозола на уровень ДНК-повреждений в тесте ДНК-комет in vivo // Бюллетень экспериментальной биологии и медицины. 2020. - Т. 169, №2. - С. 193-196.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, снижающее уровень генотоксичности цитостатиков | 2018 |
|
RU2697524C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ МУЖСКОЙ РЕПРОДУКТИВНОЙ ФУНКЦИИ НА БАЗЕ ОЦЕНКИ ДИСПЕРСИИ ДНК-ФРАГМЕНТОВ СПЕРМАТОЗОИДОВ | 2022 |
|
RU2795567C1 |
| Фармацевтическая композиция для лечения или профилактики нарушений репродуктивной и эректильной функций у мужчин и ее применение | 2023 |
|
RU2825382C1 |
| Способ коррекции гипогонадизма у животных при моделировании острого повреждения спинного мозга | 2017 |
|
RU2689114C2 |
| СПОСОБ ОЦЕНКИ СУММАРНОЙ ВЕЛИЧИНЫ ГЕНОТОКСИЧЕСКИХ ЭФФЕКТОВ ЛЕКАРСТВЕННЫХ СРЕДСТВ И ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ | 2023 |
|
RU2828488C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ РАКА | 2006 |
|
RU2328294C1 |
| БИСАМИДНОЕ ПРОИЗВОДНОЕ ДИКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ СРЕДСТВА, СТИМУЛИРУЮЩЕГО РЕГЕНЕРАЦИЮ ТКАНЕЙ И ВОССТАНОВЛЕНИЕ СНИЖЕННЫХ ФУНКЦИЙ ТКАНЕЙ | 2015 |
|
RU2647438C2 |
| БИСАМИДНОЕ ПРОИЗВОДНОЕ ДИКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ СРЕДСТВА, СТИМУЛИРУЮЩЕГО РЕГЕНЕРАЦИЮ ТКАНЕЙ И ВОССТАНОВЛЕНИЕ СНИЖЕННЫХ ФУНКЦИЙ ТКАНЕЙ | 2016 |
|
RU2727142C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ РАКА | 2005 |
|
RU2290178C1 |
| Фармацевтическая композиция для лечения или профилактики нарушений репродуктивной функции у мужчин и ее применение | 2024 |
|
RU2837217C1 |
Изобретение относится к области медицины, а именно к применению Простатилена АЦ крысам-самцам репродуктивного возраста в качестве канцеропревентивного средства в отношении рака яичек и наследственного рака. Заявленное решение позволяет использовать препарат Простатилен АЦ в качестве канцеропревентивного средства в отношении клеток тестикулярной ткани и сперматозоидов. 2 табл., 2 пр.
Применение Простатилена АЦ крысам-самцам репродуктивного возраста в качестве канцеропревентивного средства в отношении рака яичек и наследственного рака.
| CN 115845022 A, 28.03.2023 | |||
| РЫБАЛОВ М.А | |||
| и др | |||
| Эффективность комплекса цинка аргинил-глицинат при лечении мужского бесплодия в экспериментальных и клинических исследованиях // Проблемы репродукции | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| САВЕЛЬЕВ С.А | |||
| и др | |||
| Влияние технологии производства на свойства фармацевтических субстанций простаты экстракта // | |||
Авторы
Даты
2024-06-05—Публикация
2023-07-12—Подача