Изобретение относится к области медицины, конкретно к онкологии и может быть использовано для поиска новых эффективных средств, обладающих способностью снижать уровень генотоксичности противоопухолевых препаратов.
Лечение онкологических больных, число которых продолжает увеличиваться, остается одной из важнейших проблем мирового и отечественного здравоохранения. Более того, в последние годы наблюдается тенденция к возрастанию доли молодых пациентов с онкологической патологией [1]. В то же время, благодаря внедрению современных методов диагностики, у большого количества онкологических пациентов заболевание выявляется на ранних стадиях, что позволяет надеяться на хорошие результаты в лечении.
В последние годы успешность химиотерапии больных раком повысилась. Можно отметить значительное улучшение результатов лечения при раке молочной железы, легкого, колоректального рака, и других опухолей. Применение на ранних стадиях болезни различных схем химиотерапии повышает частоту излечения, а при более распространенном опухолевом процессе улучшает качество жизни больных и повышает выживаемость. Однако цитостатические препараты, независимо от механизма действия, обладают выраженным токсическим влиянием на все активно делящиеся клетки организма, в том числе и здоровые (не поврежденные опухолью), приводя к повреждению ДНК, в частности, в клетках костного мозга, эпителии кишечника [2] и, что очень важно, гонадах [3], так как генотоксичность цитостатиков на половые клетки повышает риск появления неполноценного потомства у перенесших успешную химиотерапию пациентов [4]. Так, в настоящее время в России и за рубежом в «золотой стандарт» первой линии химиотерапии больных с различной локализацией опухолей входят препараты платины в сочетании с цитостатиками различных механизмов действия [5, 6], токсичность которых на генетический аппарат давно известна и доказана [7, 8]. Поэтому остро стоит проблема защиты стабильности генетического аппарата клеток здоровых, неповрежденных опухолью тканей организма в период проведения химиотерапии. Повреждающее действие цитостатиков связывают с индукцией образования активных форм кислорода (АФК) и продуктов перекисного окисления липидов (ПОЛ), что представляется важным для направленного поиска средств, снижающих генотоксичность, среди антиоксидантных соединений [9, 10, 11]. Кроме того, при поиске фармакологических средств защиты генома также необходимо учитывать безвредность соединений, где несомненную пользу может принести использование веществ растительного происхождения в связи с отсутствием или малой токсичностью [12, 13].
Известно, что генопротекторными свойствами обладают лекарственные средства, относящиеся к группе антиоксидантов. В современной медицинской практике используются антиоксиданты синтетического и природного (растительного) происхождения. Среди антиоксидантов растительного происхождения применение нашли преимущественно флавоноиды, например рутин, кверцетин, дигидрокверцетин [14]. Основным недостатком препаратов на основе флавоноидов является возможное побочное действие на желудочно-кишечный тракт, проявляющееся в основном в виде тошноты, изжоги [15]. Существует антиоксидантное средство тиофан, которое обладает антимутагенными свойствами [16]. Недостатком этого средства является тот факт, что его антимутагенное действие описано только по отношению к ткани костного мозга. Однако степень выраженности генотоксичности является органоспецифичной и геноповреждающее действие в различных тканях может оказаться различной степени выраженности, а антимутагенное действие лекарственного средства, выявляемое по отношению к одной ткани, может не проявиться по отношению к другой.
Существуют сведения об эффективности использования полисахаридов в качестве антиоксидантов [17]. Важным является то, что полисахариды способны оказывать противоопухолевое действие и их назначение может быть показано пациентам, имеющим в анамнезе онкологическую патологию. Так, применение полисахаридов аира болотного приводит к торможению развития опухоли в печени и пищеводе за счет снижения уровня перекисного окисления липидов и увеличения активности антиоксидантных ферментов [18]. Следует отметить, что в литературе отсутствуют сведения о возможности снижения генотоксичности цитостатиков с помощью полисахаридов растений.
Задачей, решаемой данным изобретением, является расширение арсенала средств, снижающих уровень генотоксического повреждения цитостатиками в клетках костного мозга, эпителия тонкого кишечника и семенников.
Поставленная задача решается путем применения полисахаридов Tussilago farfara L. (мать-и-мачехи обыкновенной) в схемах полихимиотерапии для снижения генотоксического повреждения в клетках костного мозга, эпителия тонкого кишечника и семенников.
Полисахариды Tussilago farfara L. являются перспективными для создания препаратов, корригирующих нарушения ДНК, вызванных антибластомными средствами. В ранее проведенных исследованиях показано, что совместное применение полисахаридов Tussilago farfara L. и цитостатиков в условиях монохимиотерапии снижает гематологическую токсичность, способствует повышению устойчивости слизистой оболочки тонкого кишечника к действию противоопухолевых препаратов [19]. Полихимиотерапевтическое воздействие представляет собой наиболее адекватную клиническим условиям модель цитостатического лечения, т.к. онкологическим больным, как правило, вводят два препарата и более. Однако токсические проявления часто не позволяют провести лечение полностью. Учитывая вышесказанное, разработка фармакологических средств защиты генетических структур от повреждений, вызванных цитостатиками, является актуальной.
Новым в предполагаемом изобретении является применение полисахаридов Tussilago farfara L. в схемах полихимиотерапии для снижения генотоксического действия цитостатиков в клетках костного мозга, эпителия тонкого кишечника и семенников. Новые свойства полисахаридов Tussilago farfara L. были выявлены экспериментальным путем и не вытекают явным образом из уровня техники в данной области, не очевидны для специалиста и не обнаружены в патентной и научно-медицинской литературе. Исходя из вышеизложенного, следует считать предлагаемое изобретение соответствующим условиям патентоспособности: «Новизна», «Изобретательский уровень», «Промышленная применимость».
Полисахариды получены из фармакопейного растительного сырья фракционным методом. Для этого 10,0 г растительного сырья заливали 200,0 мл дистиллированной воды и перемешивали в течение 1,5 часов на магнитной мешалке при температуре 100°С. Экстракцию повторяли дважды, после чего сырье с экстрагентом оставляли на 12 часов. Затем смесь отфильтровывали, извлечение упаривали и осаждали водорастворимые полисахариды двукратным объемом 96% этанола. Раствор декантировали, осадок центрифугировали и высушивали [20].
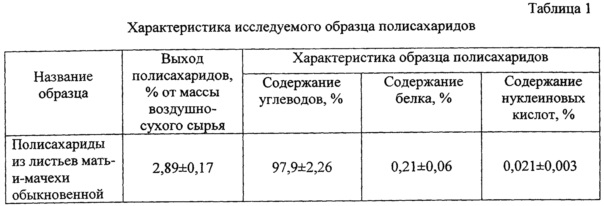
Полученный образец полисахаридов был стандартизован по содержанию углеводов спектрофотометрическим методом [21]; содержанию белка по методу Брэдфорда [22] и нуклеиновых кислот [23]. Характеристики исследуемых образцов представлены в таблице 1.
Компонентный состав и молекулярная масса исследуемого образца определялись методом ВЭЖХ на жидкостном хроматографе Agilent 1100 со спектрофотометрическим детектором (детекция при длине волны - 190 нм), разделение проводилось на эксклюзионной колонке TSK-gel GMPXL 300×7.8 mm («Supelco»), подвижная фаза - вода, 1,0 мл/мин. Установлено, что содержание полисахаридов в растительном сырье (% от сухого сырья) составило 2,89% (таблица 1). Сведения о качественном составе полисахаридов представлены в таблице 2.

Методы выделения и изучения химической структуры полисахаридов Tussilago farfara L. (моносахаридный состав, определение содержания уроновых кислот) разработаны на базе Центра внедрения технологий и лаборатории инновационных фармацевтических технологий СибГМУ (г. Томск). При изучении компонентного состава показано, что данный полисахаридный комплекс состоит из двух основных компонентов: рамногалактуронана I (33%) и нейтральных полисахаридов (67%), представленных суммой арабиногалактана, рамнана и галакторамнана [24].
Изучение генопротекторных и антиапоптотических свойств полисахаридов проводили на мышах-самцах линии C57BL/6 массой 19-20 г 1-й категории разводки лаборатории экспериментального биомоделирования НИИФиРМ им. Е.Д. Гольдберга, Томский НИМЦ (сертификат качества №188-05). Содержание животных осуществляли в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей [25]. Исследование проведено по требованиям лабораторной практики (GLP), приказа МЗ РФ №267 от 19.06.2003 г. «Об утверждении правил лабораторной практики», Федерального закона «О лекарственных средствах» (статья 36), «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» [26].
Полисахариды вводили животным курсом ежедневно в течение 14 сут до введения цитостатиков, внутрибрюшинно в дозе 20 мг/кг. На 15 сут после начала лечения полисахаридами животным трехкратно через день, внутрибрюшинно вводили цитостатические препараты в комбинациях: «цисплатин + паклитаксел» и «цисплатин + иринотекан». Иринотекан (Veropharm) использовали в дозе 10 мг/кг, цисплатин (ТЕВА) - 2,5 мг/кг, паклитаксел (Д-р Редци'с Лабораторис Лтд) - 12 мг/кг, интервал между введением каждого цитостатика составлял 20 мин.
Для оценки генопротекторных и антиапоптотических свойств полисахаридов на фоне полихимиотерапии использовали метод «ДНК-комет» (Comet Assay) в щелочной версии в соответствии с рекомендациями [26]. Мышам контрольной группы (негативный контроль) вводили эквивалентный объем физиологического раствора. В качестве позитивных контролей использовали мышей, которым внутрибрюшинно вводили комбинации противоопухолевых препаратов. Через 3 ч после последнего введения цитостатиков животных забивали методом дислокации шейных позвонков, выделяли бедренные кости и эпителий тонкого кишечника. Эпифизы бедренных костей срезали и вымывали клетки костного мозга 2 мл предварительно охлажденного до 4оС фосфатно-солевого буфера (ФСБ), содержащего 20 mM EDTA-Na2 и 10% ДМСО (рН 7,5). Тонкий кишечник и семенники измельчали в стеклянной пробирке в 3 мл ФСБ и раздавливали стеклянной палочкой. Пробирки выдерживали в течение 5 мин при комнатной температуре для осаждения крупных фрагментов, после чего 1,5 мл верхнего слоя переносили в новую пробирку. Суспензии клеток в объеме 60 мкл вносили в пробирки с 240 мкл 0,9% раствора легкоплавкой агарозы (темп. плав. <42°С) в ФСБ, подогретым до 42°С (микротермостат «Термит») и ресуспендировали. Затем 60 мкл раствора агарозы с клетками наносили на предварительно покрытые 1% универсальной агарозой предметные стекла, покрывали покровным стеклом и помещали на лед. Все проводимые впоследствии операции осуществляли в затемненном помещении при желтом свете. После затвердевания агарозы (около 10 мин) покровные стекла осторожно удаляли, микропрепараты помещали в стеклянную кювету (тип Шиффендекер), заливали предварительно охлажденным до 4°С лизирующим буфером (10 mM Tris-HCl [рН 10], 2,5 М NaCl, 100 mM EDTA-Na2, 1% TritonX-100, 10% DMSO) и инкубировали не менее 1 ч. После окончания лизиса микропрепараты переносили в камеру для электрофореза (Sub Cell GT, "Bio-Rad"). Камеру заполняли буфером для электрофореза (300 mM NaOH, 1 mM EDTA-Na2, рН>13). Приготовленные микропрепараты инкубировали в течение 20 мин для реализаций щелочно-лабильных сайтов и щелочной денатурации ДНК, затем проводили электрофорез в течение 20 мин при напряженности поля 1V/cm и силе тока ~300 mA. По окончании электрофореза микропрепараты перемещали в стеклянную кювету и фиксировали в 70% растворе этилового спирта (время фиксации - 15 мин). После фиксации микропрепараты высушивали и хранили до начала микроскопирования. Непосредственно перед микроскопированием препараты окрашивали флуоресцирующим красителем SYBR Green I (1:10000 в ТЕ-буфере с 50% глицерином) в течение 20 мин в темноте. Анализ проводили на флуоресцентном микроскопе (Микромед 3 Люм, Россия), совмещенным с цифровой камерой высокого разрешения, при увеличении ×200. Полученные с микропрепаратов изображения ДНК-комет анализировали с использованием программного обеспечения CometD. В качестве показателей поврежденности ДНК использовали процентное содержание ДНК в хвосте комет (% ДНК в хвосте) гибель клеток оценивали по процентному содержанию апоптотических ДНК-комет (% апоптотических ДНК-комет). С каждого микропрепарата анализировали не менее 100 клеток [26]. Статистическую обработку результатов проводили с помощью критерия Стьюдента [27].
В ранее проведенных исследованиях было показано, что при использовании цисплатина в сочетании с иринотеканом лимитирующей является гастроинтестинальная токсичность, тогда как при введении цисплатина совместно с паклитакселом в большей степени проявляется повреждающее действие цитостатической терапии на систему крови [28]. В связи с этим для оценки защитного действия полисахаридов Tussilago farfara L. на клетки костного мозга использовали схему полихимиотерапии «цисплатин + паклитаксел», а на клетки эпителия тонкого кишечника - «цисплатин + иринотекан».
В эксперименте животных разделяли на следующие группы:
1. «Негативный контроль» (интактные животные) - мыши, получавшие внутрибрюшинно, ежедневно в течение 14 сут по 0,2 мл физиологического раствора.
2. «Цисплатин + паклитаксел» (позитивный контроль 1) - мыши, получавшие цисплатин в дозе 2,5 мг/кг и паклитаксел в дозе 12 мг/кг на 15 сут после начала эксперимента, трехкратно через день, внутрибрюшинно. Интервал между введениями цитостатиков составлял 20 мин.
3. «Цисплатин + иринотекан» (позитивный контроль 2) - мыши, получавшие цисплатин в дозе 2,5 мг/кг и иринотекан в дозе 10 мг/кг на 15 сут после начала эксперимента, трехкратно через день, внутрибрюшинно. Интервал между введениями цитостатиков составлял 20 мин.
4. «Цисплатин + паклитаксел + полисахариды Tussilago farfara L.» - мыши, получавшие полисахариды Tussilago farfara L. в течение 14 сут, внутрибрюшинно, в дозе 20 мг/кг; цисплатин, в дозе 2,5 мг/кг и паклитаксел в дозе 12 мг/кг на 15 сут после начала лечения полисахаридами, трехкратно через день, внутрибрюшинно. Интервал между введениями цитостатиков составлял 20 мин.
5. «Цисплатин + иринотекан + полисахариды Tussilago farfara L.» - мыши, получавшие полисахариды Tussilago farfara L. в течение 14 сут, внутрибрюшинно, в дозе 20 мг/кг; цисплатин, в дозе 2,5 мг/кг и иринотекан в дозе 10 мг/кг на 15 сут после начала лечения полисахаридами, трехкратно через день, внутрибрюшинно. Интервал между введениями цитостатиков составлял 20 мин.
Изобретение иллюстрируется следующими примерами:
Пример 1. Оценка генопротекторных свойств полисахаридов Tussilago farfara L. в клетках эпителия тонкого кишечника мышей в условиях полихимиотерапии по схеме «цисплатин + иринотекан».
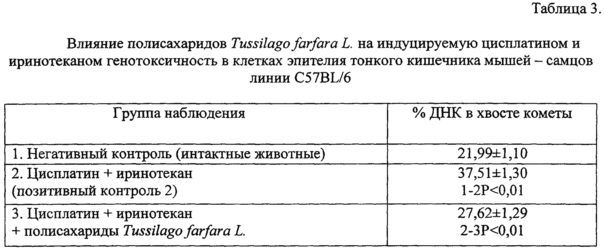
Анализ микропрепаратов показал, что показатель ДНК - повреждений клеток тонкого кишечника в группе животных, леченных по схеме «цисплатин + иринотекан», был выше в 1,7 раза по сравнению с этим значением в негативном контроле (Р<0,01). В то же время, если животные совместно с цисплатином и иринотеканом получали полисахариды, процентное содержание ДНК в хвосте комет в клетках эпителия тонкого кишечника был достоверно ниже в 1,4 раза по сравнению с этим показателем у получавших только полихимиотерапию мышей (таблица 3).
Пример 2. Оценка генопротекторных свойств полисахаридов Tussilago farfara L. в клетках костного мозга мышей в условиях полихимиотерапии по схеме «цисплатин + паклитаксел».
Процентное содержание ДНК в хвосте комет в клетках костного мозга животных, получавших цисплатин и паклитаксел, был выше по сравнению с показателями у интактных животных в 3,2 раза (Р<0,01). В клетках костного мозга животных, леченных по схеме «цисплатин + паклитаксел» в комбинации с полисахаридами % ДНК в хвосте комет был в 10,9 раза ниже, относительно этих показателей в группе соответствующего позитивного контроля (Р<0,01) (таблица 4).

Пример 3. Оценка генопротекторных свойств полисахаридов Tussilago farfara L. в клетках семенников мышей в условиях полихимиотерапии по схеме «цисплатин + паклитаксел».
После введения цисплатина и паклитаксела выявлялось достоверное увеличение (в 3,7 раза) процентного содержания ДНК в хвосте комет по сравнению с негативным контролем. Добавление в схему лечения полисахаридов Tussilago farfara L. приводило к снижению ДНК повреждений в клетках семенников: % ДНК в хвосте кометы был достоверно ниже (в 3,0 раза), относительно этого показателя, у животных леченных только цитостатиками (таблица 5).

Таким образом, генопротекторные свойства полисахаридов Tussilago farfara L. по отношению к клеткам тонкого кишечника продемонстрированы при их использовании совместно с цисплатином и иринотеканом. Включение полисахаридов в схему полихимиотерапии цисплатином и паклитакселом вызывало уменьшение ДНК-повреждений в клетках костного мозга и семенников.
Литература
1. Зикиряходжаев А.Д., Летягин В.П., Воротников И.К., Вишневская Я.В. Злокачественные мезенхимальные опухоли молочной железы у женщин молодого возраста. // Вестник ГУ РОНЦ им. Н.Н. Блохина РАМН. - М., 2007. - 18 - 2 - С. 43-49.
2. Гурова Я.В., Мордык А.В. Проблемы генотоксичности: причины, механизм, необходимость изучения у больных туберкулезом, пути преодоления / ЭНИ Забайкальский медицинский вестник, 2015. - №1. - С. 152-160.
3. Румпель О.А. Токсические эффекты паклитаксела на репродуктивную систему крыс-самцов и пути их снижения: автореф. дис. канд. мед. наук: 14.03.06, 14.03.03 / Румпель Олеся Александровна. - Томск: Научно-исследовательский институт фармакологии Томского научного центра Сибирского отделения Российской академии медицинских наук, 2010. - 23 с.
4. Урманчеева А.Ф., Кутушева Г.Ф. Проблемы фертильности, контрацепции и заместительной терапии у пациенток после лечения рака молочной железы // Онкология. - 2002. - Т. 3, №1. - С. 53.
5. Adamoa, V. Paclitaxel and cisplatin in patients with recurrent and metastatic head and neck squamous cell carcinoma / V. Adamoa, G. Ferraroa, S. Pergolizzi et al // Oral Oncology. - 2004. - V. 40. - P. 525-531.
6. Dison, S. Retrospective analysis of carboplatin and paclitaxel as initial second-line therapy for recurrent epithelial Ovarian carcinoma: Application forward a dynamic disease state model of ovarian, cancer / S. Dison, M Hensley, E. Poynon et al // Clin Oncology. - 2002. - V. 20. - P. 1238-1247.
7. Danesi, C.C. Mutagenic evalution of combined paclitaxel and cisplatin treatment in somatic cells of Drosophila melanogaster / C.C. Danesi, ВС. Bellagamba, RR. Dihl et al. // Mutation Research. - 2010. - V. 696. - P. 139-143.
8.  Sar D. In vivo detection of DNA adducts induced by cisplatin using capillary HPLC-ICP-MS and their correlation with genotoxic damage in Drosophila melanogaster / D.
Sar D. In vivo detection of DNA adducts induced by cisplatin using capillary HPLC-ICP-MS and their correlation with genotoxic damage in Drosophila melanogaster / D.  Sar, M.
Sar, M.  L. Aguado Ortiz et all // Anal. Bioanal. Chem. - 2008. - V. 390. - P. 37-44.
L. Aguado Ortiz et all // Anal. Bioanal. Chem. - 2008. - V. 390. - P. 37-44.
9. Просенко A.E. Серосодержащий фенольный антиоксидант тиофан как перспективный лекарственный препарат / А.Е. Просенко, Е.И. Терах, Н.В. Кандалинцева и др. // Компенсаторно-приспособительные процессы: фундаментальные, экологические и клинические аспекты. - Новосибирск: Сибвузиздат, 2004. - С. 391-392.
10. Зиновьева, В.Н. Коррекция мутагенного действия кверцетина природными и синтетическими фенолсодержащими антиоксидантами / В.Н. Зиновьева, А.А. Спасов // Вопросы биологической и фармацевтической химии. - 2005. - №1. - С. 45-48.
11. Shieh, D.E. Antioxidant and free radi cals cavenging effect of baicalein, baicalin and wogonin / D.E. Shieh, L.T. Liu, C.C. Lin / Anticancer Res. - 2000. - V. 20. - P. 2861-2865.
12. Бариляк, И.Р. Антимутагенные и генопротекторные свойства препаратов растительного происхождения / И.Р. Бариляк, А.В. Исаева // Цитология и генетика. - 1994. - Т. 28, №3. - С. 3-17.
13. Huang, W.H. Antioxidative and anti-infammatory activites of polyhydroxyflavonoids of Scutellaria Baicalensis Georgy / W.-H. Huang, A-R. Lee, C.H. Yang // Biosci. Biotechnol. Biochem. - 2006. - V. 70, №10. - P. 2371-2380.
14. Плотников М.Б., Тюкавкина H.A., Плотникова T.M.. Лекарственные препараты на основе диквертина. Томск: Изд-во Томского университета, 2005, 228 с.
15. Машковский М.Д. Лекарственные средства. - М.: «Новая волна», 2008. - 1206 с.
16. Дыгай A.M., Суслов Н.И., Зюзьков Г.Н. и др. Патент (RU) №24, 38, 691 от 12 января 2012 г. «Средство, обладающее гемостимулирующим, антимутагенным, противоопухолевым, церебропротекторным, антигипоксическим, ноотропным, анксиолитическим, противоневротическим действием».
17. Сычев И.А., Порядин Г.В., Смирнов В.М. Действие полисахаридов на систему крови крыс // Бюл. экспер. биол. и мед. 2006. Т. 141, №5. С. 530-533.
18. Белоусов М.В., Болиева Л.З., Гурьев A.M., и др. Патент (RU) №2014107146/1 от 25.02.2014 «Способ профилактики канцерогенного действия диэтилнитрозамина у экспериментальных животных».
19. Сафонова Е.А., Лопатина К.А., Разина Т.Г., Федорова Е.П., Пахомова А.В., Вычужанина А.В., Зуева Е.П., Ефимова Л.А. Коррекция токсического эффекта паклитаксела на систему крови и эпителий тонкой кишки водорастворимыми полисахаридами мать-и-мачехи обыкновенной, аира болотного и эхинацеи пурпурной // Рос. биотер. жур. 2010. Т. 9, №2. С. 19-24.
20. Методы химии углеводов / Под ред. Р.И. Красновой. - М.: «Мир», 1967. - 507 с.
21. Dubois М., Gilles K.А., Hamilton J.K. et al. Colorimetric method for determination of sugar and related substances // Anal. Chem. - 1956. - Vol. 28. - №3. - P. 350-356.
22. Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analyt. Biochem. - 1976. - Vol. 72. - P. 248-254.
23. Спирин А.С. Спектрофотометрическое определение суммарного количества нуклеиновых кислот // Биохимия. - 1958. - Т. 23, Вып. 5. - С. 656-661.
24. Корж А.П., Гурьев A.M., Белоусов М.В. и др. Моносахаридный состав полисахаридного комплекса листьев мать-и-мачехи // Бюл. сиб. мед. 2011. №5. С. 62-65.
25. Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях (пер. с англ.). СПб, 2012. 48 с.
26. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У. Хабриева. 2-е изд., перераб. и доп. М.: Медицина, 2005. 832 с.
27. Лакин Г.Ф. Биометрия. - М.: Высшая школа, 1980. - 293 с.
28. Wang В., Han Y., Zang J. Comparing irinotecan/cisplatin with etoposide/cisplatin in patients with ED-SCLC: A meta-analysis of efficacy and toxicity // Journal of Medical Colleges of PLA. 2012. Vol. 27. P. 210-225.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СНИЖАЮЩЕЕ ГЕМАТОТОКСИЧНОСТЬ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ | 2009 |
|
RU2397774C1 |
| Способ моделирования нарушений коагуляционного звена системы гемостаза | 2019 |
|
RU2714597C1 |
| Средство, обладающее канцеропревентивным действием в отношении рака яичек и наследственного рака | 2023 |
|
RU2820551C1 |
| АНТИМУТАГЕННОЕ СРЕДСТВО | 2019 |
|
RU2698204C1 |
| Средство для коррекции нарушений в эритроидном ростке кроветворения, вызванных цитостатическим воздействием | 2016 |
|
RU2634572C1 |
| Гемопротекторное средство | 2019 |
|
RU2725135C1 |
| Способ усиления противометастатического действия цисплатина и снижения его побочного действия на систему гемостаза | 2023 |
|
RU2825825C1 |
| Гемопротекторное средство | 2018 |
|
RU2696586C1 |
| Фармацевтическая композиция для терапии воспалительных заболеваний слизистых оболочек кишечника на основе штамма Lactobacillus brevis 47f, проявляющая местную противовоспалительную активность | 2018 |
|
RU2675110C1 |
| Гемостимулирующее средство | 2017 |
|
RU2647833C1 |
Изобретение относится к области медицины, конкретно к онкологии, и может быть использовано для снижения уровня генотоксичности противоопухолевых препаратов. Описано применение полисахаридного комплекса из Tussilago farfara L., состоящего из рамногалактуронана I (33%) и нейтральных полисахаридов (67%), представленных суммой арабиногалактана, рамнана и галакторамнана, в качестве средства, снижающего уровень ДНК-повреждений в клетках костного мозга, эпителия тонкого кишечника и семенников в условиях полихимиотерапии цисплатином в комбинации с иринотеканом или цисплатином в комбинации с паклитакселом. 5 табл., 3 пр.
Применение полисахаридного комплекса из Tussilago farfara L., состоящего из рамногалактуронана I (33%) и нейтральных полисахаридов (67%), представленных суммой арабиногалактана, рамнана и галакторамнана, в качестве средства, снижающего уровень ДНК-повреждений в клетках костного мозга, эпителия тонкого кишечника и семенников в условиях полихимиотерапии цисплатином в комбинации с иринотеканом или цисплатином в комбинации с паклитакселом.
| Е.А.Сафонова и др | |||
| Коррекция токсического эффекта паклитаксела на систему крови и эпителий тонкой кишки водорастворимыми полисахаридами мать-и-мачехи обыкновенной, аира болотного и эхинацеи пурпурной, Российский биотерапевтический журнал, N 2, том 9, 2010, стр.19-23 | |||
| Корж А.П | |||
| и др | |||
| Моносахаридный состав полисахаридного комплекса листьев мать-и-мачехи, Бюллетень сибирской медицины, Экспериментальные и клинические исследования, N 5, 2011, стр.62 | |||
| СРЕДСТВО, СНИЖАЮЩЕЕ ГЕМАТОТОКСИЧНОСТЬ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ | 2009 |
|
RU2397774C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ НАРУШЕНИЙ ЖЕНСКОЙ РЕПРОДУКТИВНОЙ ФУНКЦИИ, ВЫЗВАННЫХ ЦИТОСТАТИЧЕСКИМ ВОЗДЕЙСТВИЕМ | 2008 |
|
RU2367420C1 |
| СРЕДСТВА, ПОВЫШАЮЩИЕ ПРОТИВООПУХОЛЕВУЮ И АНТИМЕТАСТАТИЧЕСКУЮ АКТИВНОСТЬ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ | 2011 |
|
RU2471496C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАРАНЕОПЛАСТИЧЕСКИХ ПРОЦЕССОВ И ХИМИОТЕРАПИИ, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2447888C1 |
Авторы
Даты
2019-08-15—Публикация
2018-04-09—Подача