Область техники
Настоящее изобретение относится к способу дифференциальной диагностики болезни Альцгеймера. В соответствии с предложенным способом определяют уровни экспрессии специфичных биомаркеров, а именно синуклеина, RAGE, PINK и фосфорилированного тау-протеина, в буккальном эпителии. В одном из вариантов осуществления используют набор антител, специфично связывающих биомаркеры.
Уровень техники
Деменция (слабоумие) является распространенным признаком риска развития серьезных когнитивных нарушений различной этиологии (происхождения). Существующие способы клинической диагностики деменции часто носят умозрительный характер и не подкрепляются объективными биохимическими критериями развития этой патологии. Все более возрастающая распространенность деменции при различных нарушениях (нейродегенеративные расстройства, сосудистая патология головного мозга, наследственные аномалии, опухоли центральной нервной системы и т.п.) диктуют крайнюю необходимость разработки надежных маркеров для выявления деменции как патологического процесса, так и для скрининга групп риска с целью профилактики развития когнитивных нарушений [Bonomi C.G. et al., 2023; Deardorff W.J. et al., 2019; Pillai J.A., et al., 2013]. Разработка надежных объективных методов лабораторного определения биомаркеров деменции позволит своевременно выбирать оптимальный метод патогенетически обоснованной терапии, направленной на улучшение психосоматического здоровья пациентов, улучшения их социальной ориентации, а также создаст основу для разработки эффективных методов профилактики тяжелой нейродегенеративной патологии [Van Hulle C. et al., 2021].
Болезнь Альцгеймера является одним из наиболее серьезных и распространенных нейродегенеративных расстройств. Она характеризуется прогрессирующей потерей памяти, выраженной деменцией (слабоумием) и может явиться, по мнению экспертов Всемирной организации здравоохранения (ВОЗ), одной из наиболее вероятных причин смерти в XXI веке. В настоящее время болезнь Альцгеймера наблюдается у более, чем 30 миллионов людей во всем мире, и их количество, как ожидается, удвоится за последующий 30-летний период [Lane С.A. et al., 2018].
Прижизненная диагностика болезни Альцгеймера очень сложна, так как различные формы слабоумия часто встречаются и при других нейродегенеративных заболеваниях, что затрудняет своевременное применение целенаправленного оптимального лечения. Диагностика определенной формы деменции как проявления болезни Альцгеймера окончательно подтверждается только патологом во время вскрытия при исследовании головного мозга с использованием определенных гистохимических и иммуногистохимических методов [Scheltens P. et al., 2021].
Эти обстоятельства диктуют крайнюю необходимость разработки надежных маркеров для прижизненной дифференциальной диагностики болезни Альцгеймера.
Актуальность проблемы, на решение которой направлено применение изобретения, представленное в заявке, чрезвычайно высока. Она связана с тем, что заболеваемость данной патологией неуклонно вырастает, а увеличение доли пожилых людей, страдающих болезнью Альцгеймера и не получающих патогенетически обоснованной терапии, ложится тяжелым медицинским и социальным бременем на общество, вынужденное затрачивать огромные средства на содержание этой категории самостоятельно себя не обслуживающих больных [Khan S. et al., 2020].
Разработка надежных методов прижизненного лабораторного определения биомаркеров болезни Альцгеймера позволит своевременно выбирать оптимальный метод патогенетически обоснованной терапии, направленной на улучшение психосоматического здоровья пациентов, улучшения их социальной ориентации, а также создаст основу для разработки эффективных методов профилактики тяжелой нейродегенеративной патологии.
Использование буккального эпителия как объекта для прижизненной диагностики нейродегенеративных заболеваний является перспективным направлением современной молекулярной диагностики благодаря удобству и информативности метода. Учитывая тот факт, что буккальный эпителий, подобно клеткам эпителия, головного мозга и кожи, в течение эмбриогенеза развивается из эктодермы, клетки буккального эпителия представляют собой потенциальную ткань, отражающую патологические изменения, развивающиеся в мозге [Зуев В.А. и др., 2018].
Раскрытие сущности изобретения
Изобретение относится к способу дифференциальной диагностики болезни Альцгеймера у субъекта, включающему:
а) определение уровней экспрессии биомаркеров синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии и
b) дифференциальное диагностирование болезни Альцгеймера на основании уровней экспрессии указанных биомаркеров, где изменение уровней экспрессии указанных биомаркеров по сравнению с уровнями экспрессии указанных биомаркеров у субъекта без болезни Альцгеймера и у субъекта с сосудистой деменцией указывает на наличие болезни Альцгеймера.
В одном из вариантов осуществления экспрессию указанных биомаркеров определяют иммуноцитохимическим методом.
В одном из вариантов осуществления при проведении иммуноцитохимического метода применяют набор антител, специфических к указанным биомаркерам.
Авторами настоящего изобретения разработана диагностическая панель для верификации экспрессии белков синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии.
В соответствии с настоящим изобретением определяемые в периферических тканях, а именно в буккальном эпителии, уровни экспрессии сигнальных молекул применяются для выявления болезни Альцгеймера.
Согласно настоящему изобретению результаты исследований позволяют рассматривать буккальный эпителий как информативный биологический материал, легко и безопасно доступный для прижизненной персонализированной молекулярной диагностики нейродегенеративных заболеваний. Настоящее изобретение направлено на установление статистически значимых различий показателей экспрессии ряда конкретных биомаркеров, позволивших разработать диагностическую панель для молекулярной верификации деменции как патологического синдрома.
Для осуществления данного способа разработана панель молекулярных биомаркеров для подтверждения подозрения на возникновение болезни Альцгеймера. Применение разработанной панели позволит значительно оптимизировать прижизненную персонифицированную диагностику, скрининг и мониторинг болезни Альцгеймера.
Технический результат, достигаемый при использовании настоящего изобретения, заключается в достоверной прижизненной дифференциальной диагностике болезни Альцгеймера.
Болезнь Альцгеймера, или амилоидопатия, представляет собой хроническое прогрессирующее нейродегенеративное заболевание.
При использовании здесь термин «диагностика» или «диагностирование» означает идентификацию наличия или отсутствия характеристик патологических состояний. В отношении целей настоящего изобретения «диагностика» или «диагностирование» означает определение развития болезни Альцгеймера.
При использовании здесь термин «дифференциальная диагностики» означает способ диагностики, исключающий не подходящие заболевания со сходными симптомами. Применительно к настоящему изобретению дифференциальная диагностика болезни Альцгеймера означает диагностику болезни Альцгеймера с исключением иных форм деменции, в частности сосудистой деменции.
При использовании здесь термин «биомаркер» означает вещество, способное показывать состояние заболевания. В контексте настоящего изобретения, направленного на диагностику когнитивных нарушений, «биомаркер» означает полипептиды, гликопротеины, мРНК или других веществ, количества которых повышаются или снижаются у пациентов, страдающих когнитивными нарушениями или имеющих склонность к когнитивным нарушениям по сравнению с нормальными здоровыми субъектами.
Используемыми в настоящем изобретении биомаркерами являются синуклеин, RAGE, PINK и фосфорилированный тау-протеин в буккальном эпителии.
Синуклеин представляет собой белок, который у человека кодируется геном SNCA.
RAGE представляет собой специфичный рецептор конечного продукта, расширенного гликозилирования, AGER.
PINK представляет собой PTEN индуцированную киназу 1.
Тау-белок (тау-протеин, tau-протеин, τ-протеин, англ. microtubule-associated protein tau, МАРТ) принадлежит к группе белков, ассоциированных с микротрубочками (MAP).
Дополнительные биомаркеры, уровни экспрессии которых также могут определяться при осуществлении настоящего изобретения, включают бета-амилоид, CD34, клаудин, DRP1, эндотелин-1, NF-kB, S100.
Бета-амилоид (Аβ или Abeta) обозначает пептиды из 36-43 аминокислот, которые являются основным компонентом амилоидных бляшек. Формы из 40 и 42 аминокислот бета амилоида (Abeta (1-40) и Abeta (1-42)) в цереброспинальной жидкости известны в качестве потенциальных биомаркеров болезни Альцгеймера.
Клаудины представляют собой семейство небольших (20-24/27 килодальтон (кДа)) трансмембранных белков, которые наряду с окклюдином являются важнейшими компонентами плотных контактов.
DRP1 представляет собой динамин-1-подобный белок, являющейся ГТФазой, которая регулирует деление митохондрий. Динамин-1-подобный белок кодируется геном DNM1L и является частью семейства белков суперсемейства динаминов.
NF-kB обозначает ядерный фактор «каппа-би NF-κВ» - транскрипционный фактор, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла.
Обозначение «S100» относится к группе кальций-связывающих белков с низким молекулярным весом.
Буккальный эпителий представляет собой эпителий внутренней стороны щеки. Буккальный эпителий для целей настоящего изобретения является наиболее информативным биологическим материалом, легко и безопасно доступным для прижизненной персонализированной молекулярной диагностики нейродегенеративных заболеваний, в частности болезни Альцгеймера, учитывая возможность получения его образцов неинвазивным путем и широкий спектр верификации в нем молекулярных биомаркеров. Образец буккального эпителия получают любым известным способом, включая мазок.
Вместе с тем могут быть использованы и образцы иных тканей или клеток, включая, но не ограничиваясь этим, лимфоциты крови.
В соответствии с настоящим изобретением для определения уровней экспрессии биомаркеров используют любые известные методики, включая, но не ограничиваясь этим, ПЦР микрочипы или иммуноанализ. В некоторых вариантах осуществления уровень экспрессии биомаркера определяют путем измерения уровня мРНК или белка.
Предпочтительно биомаркеры анализируют с помощью иммуноанализа, хотя специалистам в данной области хорошо известны и другие методы. Присутствие или количество маркера обычно определяют с использованием антител, специфичных для каждого маркера, и обнаружения специфического связывания. Можно использовать любой подходящий иммуноанализ, например, иммуноферментный анализ (ELISA), иммуноцитохимический анализ (ИЦХ), радиоиммунный анализ (РИА) и т.п. Специфическое иммунологическое связывание антитела с биомаркером можно обнаружить прямо или косвенно. Прямые метки включают флуоресцентные или люминесцентные метки, металлы, красители, радионуклиды и т.п., прикрепленные к антителу. Косвенные метки включают различные ферменты, хорошо известные в данной области, такие как щелочная фосфатаза, пероксидаза хрена и т.п.
При использовании в настоящем описании термин «антитело» означает иммуноглобулин, специфично связывающийся с антигенной областью биомолекулы. В отношении цели настоящего изобретения, антитело специфично связывается с биомаркером. Антитело может представлять собой поликлональное антитело, моноклональное антитело и рекомбинантное антитело. Кроме того, антитело по настоящему изобретению включает функциональные фрагменты молекул антитела, как и полные формы, имеющие две полноразмерных легких цепи и две полноразмерных тяжелых цепи. Функциональный фрагмент молекул антитела означает фрагмент, сохраняющий, по меньшей мере, функцию связывания антигена, и включает Fab, F(ab')2, Fv, и аналогичные фрагменты.
При использовании в настоящем описании, термин «комплекс антиген-антитело» означает продукт связывания биомаркера с антителом, распознающим его.
При использовании здесь термины «белок» и «протеин» взаимозаменяемы.
Краткое описание чертежей
Фиг. 1 представляет распределение удельного веса клеток с экспрессией бета-амилоида в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров).
Фиг. 2 представляет распределение удельного веса клеток с экспрессией CD34 в буккальном эпителии в зависимости от группы сравнения.
Фиг. 3 представляет распределение удельного веса клеток с экспрессией клаудина в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров).
Фиг. 4 представляет распределение удельного веса клеток с экспрессией белка DRP1 в буккальном эпителии в зависимости от группы сравнения
Фиг. 5 представляет распределение удельного веса клеток с экспрессией эндотелина-1 в буккальном эпителии в зависимости от группы сравнения.
Фиг. 6 представляет распределение удельного веса клеток с экспрессией NF-kB в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров)
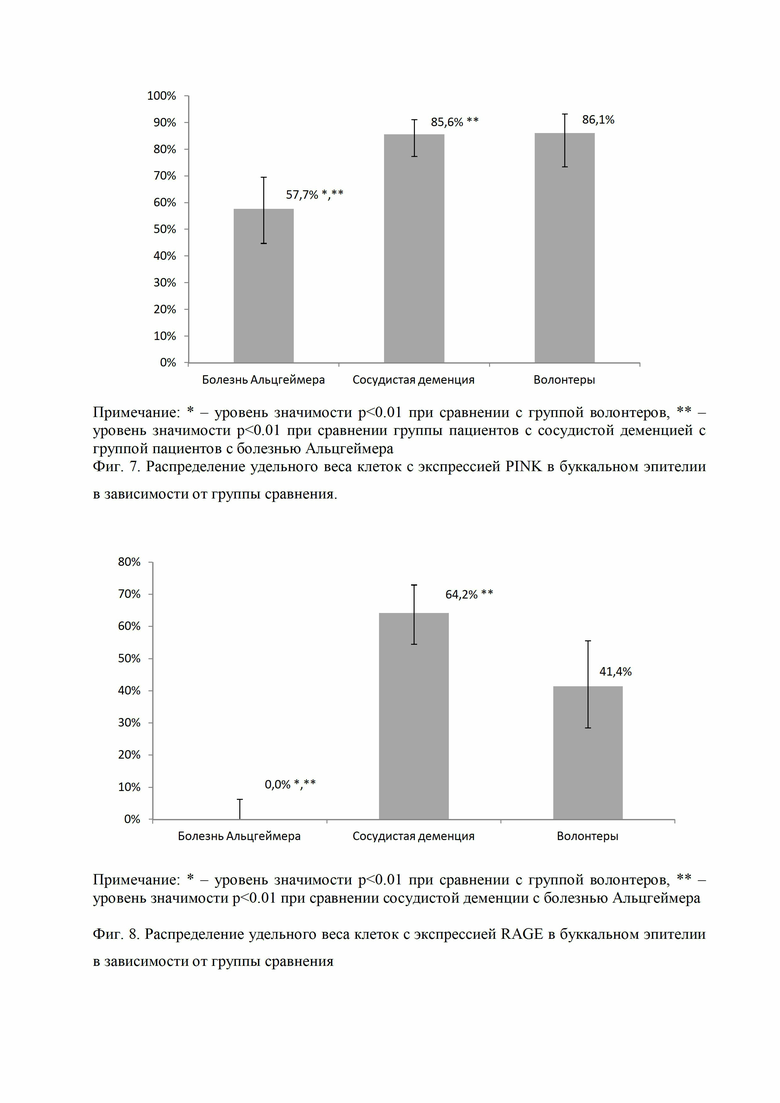
Фиг. 7 представляет распределение удельного веса клеток с экспрессией PFNK в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров, ** - уровень значимости р<0.01 при сравнении группы пациентов с сосудистой деменцией с группой пациентов с болезнью Альцгеймера).
Фиг. 8 представляет распределение удельного веса клеток с экспрессией RAGE в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров, ** - уровень значимости р<0.01 при сравнении сосудистой деменции с болезнью Альцгеймера).
Фиг. 9 представляет распределение удельного веса клеток с экспрессией S100 в буккальном эпителии зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров).
Фиг. 10 представляет распределение удельного веса клеток с экспрессией синуклеина в буккальном эпителии по полу в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров, ** - уровень значимости р<0.01 при сравнении сосудистой деменции с болезнью Альцгеймера).
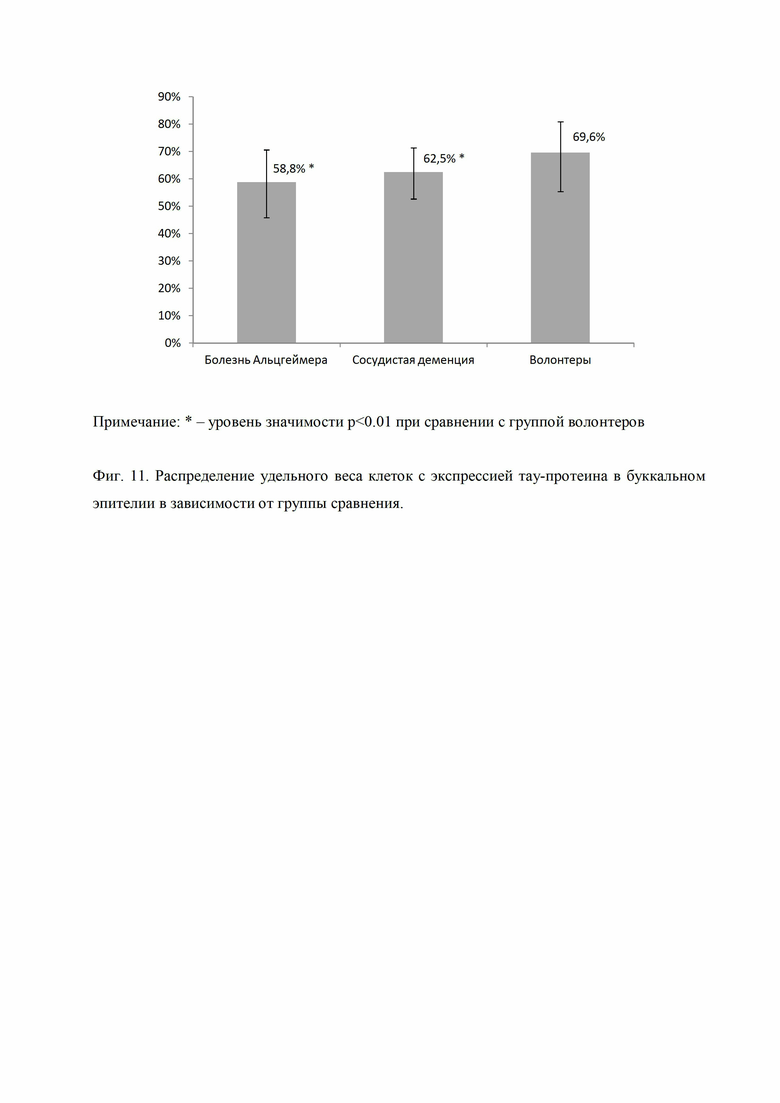
Фиг. 11 представляет распределение удельного веса клеток с экспрессией тау-протеина в буккальном эпителии в зависимости от группы сравнения (* - уровень значимости р<0.01 при сравнении с группой волонтеров).
Осуществление изобретения
Ранее неизвестный способ дифференциальной диагностики болезни Альцгеймера представленный в заявляемой заявке на изобретение был создан при изучении экспрессии (методом иммуноцитохимического анализа) сигнальных молекул (молекулярных маркеров), вовлеченных в процесс нейродегенерации в клетках буккального эпителия у пациентов с деменцией, обусловленной болезнью Альцгеймера и другой нейрососудистой патологией, а также у волонтеров соответствующего возраста без подобной патологии.
Отбор участников исследования проводился с учетом критериев включения и исключения из исследования, путем формирования когорт с проведением экспертной клинической оценки нейропсихических особенностей и геронтологического статуса участников исследования, экспертной оценки медицинских документов, характеризующих состояние здоровья участников исследования. Методология подбора участников исследования заключалась в экспертной оценке медицинской документации (в т.ч. анализ диагнозов, анамнестических данных, результатов биохимических, функциональных, томографических исследований, психометрических тестов), оценке гериатрического статуса на основе комплексной гериатрической оценки и при необходимости дополнительного дообследования и тестирования по рекомендациям экспертов.
В результате предварительных экспертиз отобрано 203 участника исследования, соответствующих техническому заданию.
Критериями включения в основную группу определены: возраст 50 лет и старше, наличие клинических проявлений объективизированных когнитивных расстройств различного генеза (болезнь Альцгеймера или деменция сосудистого генеза).
Критерии исключения из основной группы: наличие онкологических и гематологических заболеваний вне ремиссии, наличие состояний, требующих экстренной медицинской помощи, отказ участника исследования или его законного представителя от участия в исследовании.
Критериями включения в группу волонтеров (контроль) определены: возраст 50 лет и старше, отсутствие когнитивных расстройств додементного и дементного уровней.
Критерии исключения из контрольной группы: наличие онкологических и гематологических заболеваний вне ремиссии, наличие состояний, требующих экстренной медицинской помощи, отказ участника исследования от участия в исследовании.
В результате предварительных экспертиз отобрано 203 участника исследования, соответствующих техническому заданию.
Общая численность обследованных составила 203 человека, из них 53 (26,1%) мужчин и 150 (73,9%) женщин. Все обследуемые были разделены на 3 группы:
1) группа пациентов с клинически диагностированной болезнью Альцгеймера (57 человек, из них 21,0% мужчин и 79,0% женщин);
2) группа пациентов с клинически диагностированной сосудистой деменцией (100 человек, из них 26,0% мужчин и 74,0% женщин);
3) обследуемые волонтеры без клинических проявлений психоневрологических расстройств (46 человек, из них 32,6% мужчин и 67,4% женщин).
Средний возраст обследуемых пациентов суммарно во всех группах составил 84,6±7,6 (с болезнью Альцгеймера - 77,0±12,2 лет, с сосудистой деменцией - 79,7±9,8 лет, 61,7±7,6 у волонтеров).
Применен метод динамического формирования когорт, предусматривающий формирование и переформирование групп и подгрупп в исследовании исходя из варианта когнитивных расстройств и наличия сопутствующей патологии, что позволяет проводить корреляционный анализ в отношении участников с различными вариантами когнитивных расстройств смешанного генеза.
По той причине, что зачастую причины деменции у конкретных пациентов носят смешанный характер, при отборе участников исследования и формирования когорт проводилась экспертная оценка случаев когнитивных расстройств и комплексное гериатрическое обследование для исключения псевдодементных ситуаций.
При отборе волонтеров как потенциальных участников контрольной группы также проводилось экспертное психометрическое обследование, так как у них могли быть додементные (доклинические) когнитивные расстройства при отсутствии жалоб и клинически значимых проявлений, что не позволяло включать их в контрольную группу.
Потенциальная полифакторность дементных расстройств и наличие смешанных форм у одного участника не позволило сформировать стабильные группы для исследования, а требовало подхода динамического формирования групп и подгрупп среди участников.
Для исследования были использованы клетки буккального эпителия.
Выбор ткани определялся не только малоинвазивной доступностью для прижизненной биопсии, но, прежде всего тем, что клетки буккального эпителия продуцируют большое количество биологически активных веществ, включая цитокины, биогенные амины и регуляторные пептиды, которые задействованы в механизме развития нейродегенеративных расстройств.
Иммуноцитохимическим (ИЦХ) методом была исследована экспрессия следующих сигнальных молекул: tau-протеин, бета-амилоид, альфа-синуклеин, DRP1, CD34, эндотелии-1, PINK, NF-kB, RAGE, S100, клаудин. Результат ИЦХ-теста оценивался методом световой микроскопии, а сравнительная количественная оценка экспрессии сигнальных молекул проводилась с использованием морфометрии и компьютерного анализа микроскопических изображений.
Статистическая обработка результатов исследования проводилась в несколько этапов. Все вычисления осуществляли в свободной программной среде R. На первом этапе, для устранения ошибок измерения и подсчета, выявляли значения, резко отличающиеся из общей выборки (выбросы). Выбросы определяли на основе межквартильного размаха (IQR): к ним относили наблюдения со значениями менее Q1-1.5*IQR и более Q3+1.5*IQR. В том случае, когда выбросы признавали за ошибку измерения, данные заменялись на средние значения. На этом же этапе проводили проверку на соответствие нормальному закону распределения с помощью критерия Шапиро-Уилка (Shapiro-Wilk's test). На втором этапе в случае, если данные соответствовали нормальному закону распределения (только для возраста в группах сравнения), типичное значение представляли в виде среднего значения и стандартного отклонения (М±σ), а сравнение групп осуществляли с помощью критерия Стьюдента. При несоответствии данных нормальному закону распределения (все экстенсивные показатели, характеризующие удельный вес клеток с экспрессией маркеров), типичное значение представляли в виде медианы, разброс характеризовали межквартильным интервалом - Me(Q1-Q3), 95% доверительный интервал рассчитывали по методу Уилсона (Wilson). Сравнение групп осуществляли с помощью критерия Манн-Уитни. При парном сравнении нулевую гипотезу отклоняли при уровне значимости критерия менее 0,05. При множественном попарном сравнении (три группы) нулевую гипотезу отклоняли при уровне значимости критерия менее 0,01.
Основные результаты проведенного исследования приводятся ниже в Примерах 1-12.
Вкратце, по результатам исследования установлено, что показатели экспрессии синуклеина, белков RAGE и PFNK в буккальном эпителии статистически значимо ниже у пациентов с болезнью Альцгеймера, чем при сосудистой деменции и у волонтеров.
Показатели экспрессии фосфорилированного тау-протеина в буккальном эпителии статистически значимо выше у пациентов с болезнью Альцгеймера, чем при сосудистой деменции и у волонтеров.
Для дифференциальной диагностики деменции при болезни Альцгеймера от сосудистой деменции разаработана панель биомаркеров для верификации экспрессии синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии.
Изобретение панели молекулярных биомаркеров позволяет предложить способ прижизненной персонифицированной диагностики болезни Альцгеймера.
Пример 1. Бета-амилоид
Удельный вес клеток с экспрессией бета-амилоида в буккальном эпителии был наибольшим (60,7% (50%-67,9%) среди волонтеров, на втором месте (45,9% (31,3%-60%) в группе с сосудистой деменцией и на третьем (41,4% (27,6%-54,3%) в группе с заболеванием Альцгеймера (Фиг. 1).
Как видно из Фиг. 1, площадь экспрессии бета-амилоида в буккальном эпителии у больных Альцгеймером и группы с сосудистой деменцией были статистически значимо ниже, чем среди волонтеров.
Распределение удельного веса клеток с экспрессией бета-амилоида в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 1.

Из данных, представленных в Табл. 1 видно, что во всех группах сравнения различия у мужчин и женщин в экспрессии бета-амилоида в буккальном эпителии находятся в границах статистической погрешности.
Пример 2. Белок CD34
Удельный вес клеток с экспрессией белка CD34 в буккальном эпителии был наибольшим (18,8% (9,8%-23,1%) в группе с сосудистой деменцией, на втором месте (16,0% (11,1%-22,6%) в группе пациентов с болезнью Альцгеймера и на третьем (15,9% (10,3%-28,8%) среди волонтеров (Фиг. 2).
Как видно из Фиг. 2, не было установлено статистически значимых различий в показателях удельного веса клеток с экспрессией CD34 в буккальном эпителии в группах сравнения.
Распределение удельного веса клеток с экспрессией CD34 в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 2.

Из данных, представленных в Табл. 2 видно, что во всех группах сравнения различия в экспрессии CD34 в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 3. Клаудин
Удельный вес клеток с экспрессией клаудина в буккальном эпителии был наибольшим (52,8% (46,9%-57,1%) среди волонтеров, на втором месте (45,9% (33,3%-55,2%) в группе с заболеванием Альцгеймера и на третьем (44,2% (40%-46,8%) в группе с сосудистой деменцией (Фиг. 3).
Как видно из Фиг. 3, статистически значимые снижение показателя удельного веса клеток с экспрессией клаудина в буккальном эпителии в группе сосудистой деменцией по сравнению с волонтерами.
Распределение удельного веса клеток с экспрессией клаудина в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 3.

Из данных, представленных в Табл. 3 видно, что во всех группах сравнения различия вэкспрессии клаудина в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 4. Белок DRP1
Удельный вес клеток с экспрессией белка DRP1 в буккальном эпителии был наибольшим (36,1% (15,4%-46,9%) в группе с заболеванием Альцгеймера, на втором месте (29,4% (18,2%-46,2%) среди волонтеров и на третьем (28,6% (17,9%-50%) в группе с сосудистой деменцией (Фиг. 4).
Как видно из Фиг. 4 не было установлено статистически значимых различий в показателях относительной DRP1 в буккальном эпителии экспрессии в группах сравнения.
Распределение удельного веса клеток с экспрессией DRP1 в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 4.
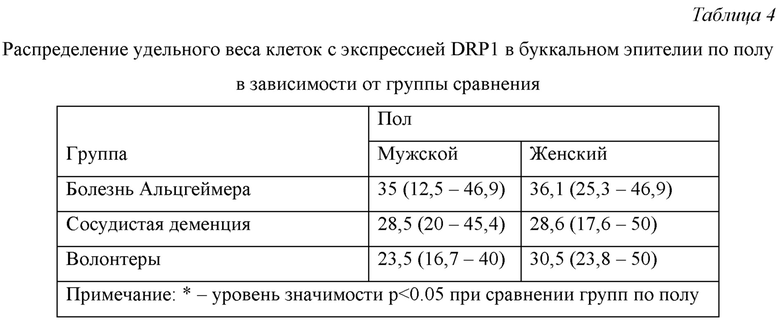
Из данных, представленных в Табл. 4 видно, что во всех группах сравнения различия в экспрессии DRP1 в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 5. Эндотелин-1
Удельный вес клеток с экспрессией эндотелина-1 в буккальном эпителии был наибольшим (37,5% (14,3%-57,7%) в группе с сосудистой деменцией, на втором месте (35,4% (8,8%-66,7%) среди волонтеров и на третьем (29,6% (15,6%-44,7%) в группе пациентов с болезнью Альцгеймера (Фиг. 5).
Как видно из Фиг. 5, не было установлено статистически значимых различий в показателях удельного веса клеток с экспрессией эндотелина-1 в буккальном эпителии в группах сравнения.
Распределение удельного веса клеток с экспрессией эндотелина-1 в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 5.
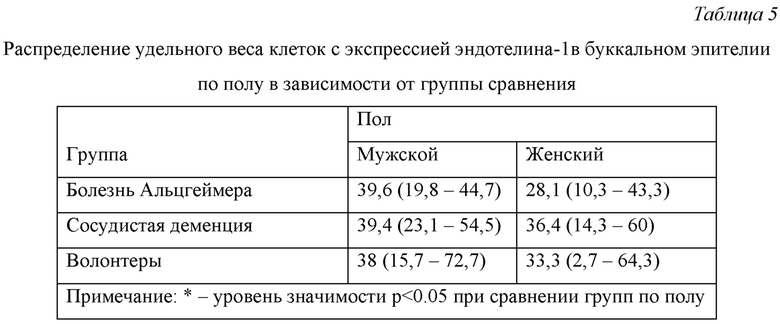
Из данных, представленных в Табл. 5 видно, что во всех группах сравнения различия в экспрессии эндотелина-1 в буккальном эпителии у мужчин и женщин статистически не значимы.
Пример 6. Транскрипционный фактор NF-kB
Удельный вес клеток с экспрессией NF-kB в буккальном эпителии был наибольшим (79,2% (61,5%-81,3%) среди волонтеров, на втором месте (54,3% (21,4%-57,1%) в группе с сосудистой деменцией и на третьем (47,1% (33,3%-69,6%) в группе пациентов с болезнью Альцгеймера (Фиг. 6).
Из Фиг. 6 видно, что показатели удельного веса клеток с экспрессией экспрессии NF-kB в буккальном эпителии статистически значимо ниже в группе с болезнью Альцгеймера и сосудистой деменции по сравнению с волонтерами.

Распределение удельного веса клеток с экспрессией NF-kB в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 6.
Из данных, представленных в Табл. 6 видно, что во всех группах сравнения различия в экспрессии NF-kB в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 7. PTEN индуцированная киназа 1 (PINK)
Удельный вес клеток с экспрессией PINK в буккальном эпителии был наибольшим (86,1% (81,2%-90,7%) среди волонтеров, на втором месте (85,6% (76,6%-91,3%) в группе с сосудистой деменцией и на третьем (57,7% (25%-84%) в группе с заболеванием Альцгеймера (Фиг. 7).
Как видно из Фиг. 7, удельный вес клеток с экспрессией PINK в буккальном эпителии среди больных Альцгеймером статистически значимо ниже как среди волонтеров, так и сосудистой деменции.
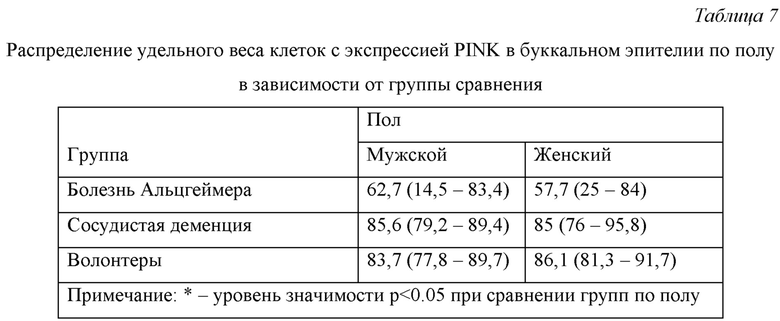
Распределение удельного веса клеток с экспрессией PINK в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 7.
Из данных, представленных в Табл.7 видно, что во всех группах сравнения различия в экспрессии PINK в буккальном эпителии у мужчин и женщин статистически не значимы.
Пример 8. Белок RAGE
Удельный вес клеток с экспрессией RAGE в буккальном эпителии был наибольшим (64,2% (21,8%-77,1%) в группе с сосудистой деменцией, на втором месте (41,4% (10%-70,8%) среди волонтеров и на третьем (0,0% (0%-14,3%) в группе пациентов с болезнью Альцгеймера (Фиг. 8).
Как видно из Фиг. 8, удельный вес клеток с экспрессией RAGE в буккальном эпителии при болезни Альцгеймера был статистически значимо ниже по сравнению с удельным весом таких клеток у волонтеров и при сосудистой деменции.
Распределение удельного веса клеток с экспрессией RAGE в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 8.
Таблица 8
Распределение удельного веса клеток с экспрессией RAGE в буккальном эпителии по полу в зависимости от группы сравнения
Из данных, представленных в Табл. 8 видно, что во всех группах сравнения различия в экспрессии RAGE в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 9. Белок S100
Удельный вес клеток с экспрессией S100 в буккальном эпителии был наибольшим (84,2 % (76,2 % – 88 %) среди волонтеров, на втором месте (72,8 % (67,9 % – 92,3 %)) в группе с сосудистой деменцией и на третьем (59,9 % (45,7 % – 78,3 %) в группе пациентов с болезнью Альцгеймера (Фиг. 9).
Как видно из Фиг. 9 удельный вес клеток с экспрессией S100 в буккальном эпителии среди пациентов с болезнью Альцгеймера был статистически значимо ниже, чем среди группы волонтеров.
Распределение удельного веса клеток с экспрессией S100 в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 9.

Из данных, представленных в Табл. 9 видно, что во всех группах сравнения различия в экспрессии S100 в буккальном эпителии у мужчин и женщин статистически незначимы.
Пример 10. Синуклеин
Удельный вес клеток с экспрессией синуклеина в буккальном эпителии был наибольшим (32,1% (10,3%-50%) в группе с сосудистой деменцией, на втором месте (31,0% (17,2%-50%) среди волонтеров и на третьем (5,3% (0%-13%) в группе пациентов с болезнью Альцгеймера (Фиг. 10).
Как видно из Фиг. 10 удельный вес клеток с экспрессией синуклеина в буккальном эпителии у пациентов с болезнью Альцгеймера статистически значимо ниже, чем в группе с сосудистой деменцией и волонтерами.
Распределение удельного веса клеток с экспрессией синуклеина в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 10.
Из данных, представленных в Табл. 10 видно, что во всех группах сравнения различия в экспрессии синуклеина в буккальном эпителии у мужчин и женщин статистически незначимы.

Пример 11. Тау-протеин
Удельный вес клеток с экспрессией тау-протеина в буккальном эпителии был наибольшим (69,6% (53,1%-85,7%) среди волонтеров, на втором месте (62,5% (45,5%-71,4%) в группе с сосудистой деменцией и на третьем (58,8% (47,6%-67,9%) в группе пациентов с болезнью Альцгеймера (Фиг. 11).
Как видно из Фиг. 11 удельный вес клеток с экспрессией тау-протеина в буккальном эпителии в группах пациентов с болезнью Альцгеймера и сосудистой деменцией была статистически значимо ниже, чем у волонтеров.
Распределение удельного веса клеток с экспрессией тау-протеина в буккальном эпителии по полу в зависимости от группы сравнения представлено в Табл. 11.

Из данных, представленных в Табл. 11 видно, что во всех группах сравнения различия в экспрессии тау-протеина в буккальном эпителии у мужчин и женщин статистически незначимы.
При анализе результатов по верификации тау-протеина следует заметить, что ранее нами была верифицирована экспрессия фосфорилированного (патологического) тау-протеина в лимфоцитах крови и буккальном эпителии пациентов с клинически диагностированной болезнью Альцгеймера [Kvetnoy I.M. et al., 2000; Кветной И.М. и др., 2003].
Учитывая эти обстоятельства, в данном исследовании было решено применить антитела к нефосфорилированному (обычному) тау-протеину и проверить возможность его экспрессии как отрицательного контроля в образцах буккального эпителия у волонтеров по сравнению с группой пациентов с клинически диагностируемой болезнью Альцгеймера и сосудистой деменцией.
Верификация нефосфорилированного тау-протеина в образцах лимфоцитов крови и буккального эпителия и отсутствие при этом статистически значимых различий показателей экспрессии в зависимости от нозологической формы деменции свидетельствуют о том, что именно фосфорилированный тау-протеин может являться дополнительным диагностическим маркером болезни Альцгеймера.
Таким образом, подтверждение вышеописанных ранее полученных нами же результатов позволяет рекомендовать включить фосфорилированный тау-протеин в диагностическую панель молекулярных маркеров нейродегенеративных заболеваний.
Пример 12. Дифференциальная диагностика
Для дифференциальной диагностики болезни Альцгеймера от сосудистой деменции используют панель биомаркеров с учетом экспрессии белков синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии. Дифференциальная диагностика проведена в группе пациентов А (30 человек) по сравнению с группой В (16 человек).
Сводные данные приведены в Табл. 12.
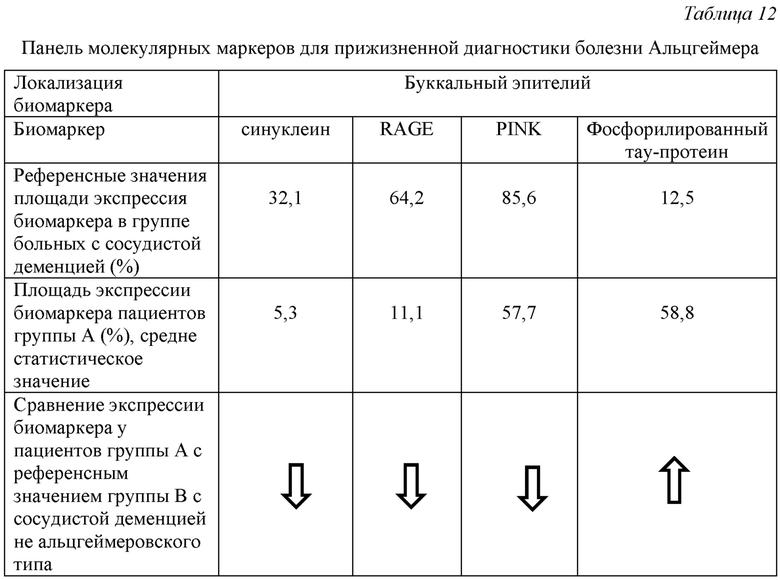
У всех пациентов группы А выявлено статистически значимое снижение показателей экспрессии синуклеина, RAGE, PINK и повышение экспрессии фосфорилированного тау-протеина в буккальном эпителии по сравнению с установленными референсными значениями экспрессии тех же биомаркеров при сосудистой деменции, что свидетельствует о наличии болезни Альцгеймера у обследуемых пациентов.
Полученные результаты подтверждены другими методами диагностики, включая психологические тесты по краткой шкале оценки психического статуса (MMSE).
Для всех пациентов группы А по шкале MMSE результаты были ниже 27 баллов: у 11 человек установлена начальная стадия болезни Альцгеймера (по шкале MMSE 20-23 балла), у 10 человек - стадия умеренной деменции (по шкале MMSE 11-19 баллов), у 9 человек - стадия тяжелой деменции (по шкале MMSE 0-10 баллов). Диагноз пациентов группы А подтверждали также ангиографией сосудов головного мозга и компьютерной томографией.
Вместе с тем для всех пациентов группы В диагностирована сосудистая деменция не альцгеймеровского типа.
Источники информации:
1. Bonomi CG, Assogna М, Di Donna MG, Bernocchi F, De Lucia V, Nuccetelli M, Fiorelli D, Loizzo S, Mercuri NB, Koch G, Martorana A, Motta C. Cerebrospinal Fluid sTREM-2, GFAP, and β-S100 in Symptomatic Sporadic Alzheimer's Disease: Microglial, Astrocytic, and APOE Contributions Along the Alzheimer's Disease Continuum. J Alzheimers Dis. 2023; 6. doi: 10.3233/JAD-221010.
2. Deardorff WJ, Grossberg GT. Behavioral and psychological symptoms in Alzheimer's dementia and vascular dementia. Handb Clin Neurol. 2019; 165: 5-32. doi: 10.1016/B978-0-444-64012-3.00002-2.
3. Khan S., Barve K.H., Kumar M.S. Recent Advancements in Pathogenesis, Diagnostics and Treatment of Alzheimer's Disease. Curr Neuropharmacol. 2020; 18(11): 1106-1125. doi: 10.2174/1570159X18666200528142429.
4. Kvetnoy I.M., Hernandez-Yago J., Kvetnaia T.V., Khavinson V. Kh., Malinin V.V., Yarilin A.A. Tau-protein expression in human blood lymphocytes: promising marker and suitable sample for life-time diagnosis of Alzheimer's disease. Neuroendocrinol. Lett, 2000, V.21, p.313-318.
5. Lane CA, Hardy J, Schott JM. Alzheimer's disease. Eur J Neurol. 2018;25(l):59-70. doi: 10.1111/ene.13439.
6. Pillai JA, Cummings JL. Clinical trials in predementia stages of Alzheimer disease. Med Clin North Am. 2013; 97(3): 439-57. doi: 10.1016/j.mcna.2013.01.002.
7. Scheltens P., De Strooper В., Kivipelto M., Holstege H., Chételat G., Teunissen C.E., Cummings J., van der Flier W.M. Alzheimer's disease. Lancet. 2021; 397(10284): 1577-1590. doi: 10.1016/S0140-6736(20)32205-4.
8. Van Hulle C, Jonaitis EM, Betthauser TJ, Batrla R, Wild N, Kollmorgen G, Andreasson U, Okonkwo O, Bendlin BB, Asthana S, Carlsson CM, Johnson SC, Zetterberg H, Blennow K. An examination of a novel multipanel of CSF biomarkers in the Alzheimer's disease clinical and pathological continuum. Alzheimers Dement. 2021; 17(3): 431-445. doi: 10.1002/alz. 12204.
9. Кветной И.М., Кветная T.B., Ряднова И.Ю., Фурсов Б.Б., Эрнандес-Яго X., Блеса Х.-Р. Иммуногистохимическая верификация тау-протеина в тучных клетках при болезни Альцгеймера. Архив патол., 2003, №1, с. 36-39.
10. Зуев В.А, Дятлова А.С., Линькова Н.С., Кветная Т.В. Экспрессия Аβ42, τ-протеина, Р16, Р53 в буккальном эпителии: перспективы диагностики болезни Альцгеймера и темпа старения организма. Бюллетень Экспериментальной Биологии и Медицины, 2018, Том 166, Номер 11, с. 627-631.




Изобретение относится к способу дифференциальной диагностики болезни Альцгеймера у субъекта. Определяют уровни экспрессии биомаркеров синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии. Статистически значимое снижение показателей экспрессии синуклеина, RAGE, PINK и повышение экспрессии фосфорилированного тау-протеина в буккальном эпителии по сравнению с уровнями экспрессии указанных биомаркеров у субъекта без болезни Альцгеймера и у субъекта с сосудистой деменцией указывает на наличие болезни Альцгеймера. Изобретение обеспечивает достоверную прижизненную диагностику болезни Альцгеймера. 2 з.п. ф-лы, 11 ил., 12 табл., 12 пр.
1. Способ дифференциальной диагностики болезни Альцгеймера у субъекта, включающий:
a) определение уровней экспрессии биомаркеров синуклеина, RAGE, PINK и фосфорилированного тау-протеина в буккальном эпителии и
b) дифференциальную диагностику болезни Альцгеймера на основании уровней экспрессии указанных биомаркеров, где статистически значимое снижение показателей экспрессии синуклеина, RAGE, PINK и повышение экспрессии фосфорилированного тау-протеина в буккальном эпителии по сравнению с уровнями экспрессии указанных биомаркеров у субъекта без болезни Альцгеймера и у субъекта с сосудистой деменцией указывает на наличие болезни Альцгеймера.
2. Способ по п.1, где экспрессию указанных биомаркеров определяют иммуноцитохимическим методом.
3. Способ по п.2, где при проведении иммуноцитохимического метода применяют набор антител, специфических к указанным биомаркерам.
| KVETNOY I.M | |||
| et al | |||
| Tau-protein expression in human blood lymphocytes: a promising marker and suitable sample for life-time diagnosis of Alzheimer's disease | |||
| Neuro Endocrinol Lett | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| ЗУЕВ В.А, и др | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
Авторы
Даты
2024-06-27—Публикация
2023-11-03—Подача