Изобретение относится к анализу органических химических соединений, а именно к способам количественного определения препаратов, содержащих толперизона гидрохлорида, используемым для контроля качества продукции, выпускаемой фармацевтическими производствами и изготавливаемой в аптеках, в частности для определения толперизона гидрохлорида в фармацевтической субстанции и препаратах (твердой дозированной форме).
Толперизон гидрохлорид (ТГХ) (2-метил-1-(4-метилфенил)-3-(1-пиперидил)пропан-1-он гидрохлорид) обладает уникальным свойством подавлять моно- и полисиннаптические рефлексы на уровне спинного мозга, обеспечивая релаксацию при отсутствии сопутствующей седации, не вызывая нарушения координации, спутанности сознания или явлений абстиненции [N. R. Pai, S. S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form. J. Curr. Chem. Pharm. Sci. Vol. 3(4): 243-254, 2013]. Его миорелаксирующий эффект обеспечивается не только блокированием Na-АТФазы, но и посредством ограничения входа Са2+ через потенциалзависимые кальциевые каналы [М. Л. Кукушкин Результаты рандомизированного двойного слепого параллельного исследования эффективности и безопасности применения толперизона у пациентов с острой неспецифической болью в нижней части спины / М. Л. Кукушкин, В. Б. Брылев, Н. С. Ласков и др. // Журнал неврологии и психиатрии. № 117(11): 69-78, 2017; J.W. Bae, Y.S. Park, U. D. Sohn, C. S. Myung, B. K. Ryu, C. G. Jang, S. Y. Lee HPLC determination of tolperisone in human plasma. Arch Pharm Res. Vol. 29(4): 339-342, 2006; М.Л. Кукушкин Современный взгляд на механизм действия Мидокалма®. Лечебное дело. № 2(30): 7-12, 2013], а проведенные клинические исследования [R. Kohne-Volland Клиническое исследование Мидокалма (толперизона гидрохлорида) / Качественная клиническая практика №1: 29-39, 2002]. Не смотря, на то, что в ТГХ внесен в реестр лекарственных средств Японии и Кореи [Q. K. Truong, X. L. Mai, D. H. Kim, J. K. Kim, J. S. Kang, M. H. Woo, D. H. Na, I. K. Chun, K. H. Kim Determination of the quantity of tolperisone hydrochloride in tablets by high performance liquid chromatography. J. Anal. Sci. & Tech. Vol. 30(1): 32-38, 2017, https://doi.org/10.5806/AST.2017.30.1.32; N.R. Pai, S.S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form. J. Curr. Chem. Pharm. Sci. Vol. 3(4): 243-254, 2013; I. C. Nimila, P. Balan, N. Chiranjeevi, V. V. V. M. Kumar Development and validation of a reverse phase hplc method of simultaneous estimation of tolperisone hydrochloride and paracetamol in tablet dosage form. In. J. Pharm. and Pharm. Sci., Vol. 4(5), 84-88 (2012)] в Российской Федерации нет нормативных документов (ОФС), регламентирующих его содержание в лекарственных средствах (ЛС).
Согласно JP XV количественное определение ТГХ в таблетированной форме основанное на его ацидиметрическом титрование (потенциометрическое титрование) в неводной среде имеет ряд недостатков, среди которых следует выделить низкую селективность и длительность единичного определения, за счет необходимости проведения предварительной пробоподготовки [Q. K. Truong, X. L. Mai, D. H. Kim, J. K. Kim, J. S. Kang, M. H. Woo, D. H. Na, I. K. Chun, K. H. Kim Determination of the quantity of tolperisone hydrochloride in tablets by high performance liquid chromatography. J. Anal. Sci. & Tech. Vol. 30(1): 32-38, 2017, https://doi.org/10.5806/AST.2017.30.1.32; N. R. Pai, S. S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form. J. Curr. Chem. Pharm. Sci. Vol. 3(4): 243-254, 2013; I. C. Nimila, P. Balan, N. Chiranjeevi, V. V. V. M. Kumar Development and validation of a reverse phase hplc method of simultaneous estimation of tolperisone hydrochloride and paracetamol in tablet dosage form. In. J. Pharm. and Pharm. Sci., Vol. 4(5), 84-88 (2012)].
Известен метод высокоэффективной жидкостной хроматографии (ВЭЖХ) в сочетание с УФ-детектированием при 260 нм, позволяющий оценивать содержание ТГХ в таблетировании форме в присутствие винилкетона [R. Pai, S. S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form nandini J. Curr. Chem. Pharm. Sc. Vol. 3(4): 243-254, 2013]. Разделение компонентов препарата проводили на колонке Oyster ODS (300 x 4,6 мм, 5 мкм) в изократическом режиме смесью, состоящей из цитратно-фосфатного буферного раствора (рН 2,5) и ацетонитрила (45 : 55 % об./об.). Использование смеси 45 % метанола, 1 % ледяной уксусной кислоты и 0,05 % 1-гексансульфоновой кислоты в качестве подвижной фазы позволяет контролировать содержание ТГХ по внутреннему стандарту (хлорфенезин) в плазме крови на уровне 10 нг/мл [J. W. Bae, Y. S. Park, U. D. Sohn, C. S. Myung, B. K. Ryu, C. G. Jang, S. Y. Lee HPLC determination of tolperisone in human plasma. Arch Pharm Res Vol 29(4): 339-342, 2006]. Незначительное закисление подвижной фазы до 3,0 и разделение компонентов на колонке С18 в изократическом режиме смесью метанол : ацетонитрил : вода (60:30:10 об./об./об.) сопровождается батохромным сдвигом спектра поглощения (275 нм) позволяет снизить ПКО до 1 мкг/мл [N. R. Gohel, B. K. Patel, V. K. Parmar Chemometrics-assisted UV spectrophotometric and RP-HPLC methods for the simultaneous determination of tolperisone hydrochloride and diclofenac sodium in their combined pharmaceutical formulation. Sci. Pharm. Vol. 81(4): 983-1002, 2013, https://doi.org/10.3797/scipharm.1306-01 ]. Изменение состава подвижной фазы (ацетонитрила : вода (40 : 60 об./об.) (рН 3,0)) и разделение аналита на аналитической колонке Symmetry C18 позволяет проводить определение ТГХ в комбинации с парацетамолом [I. C. Nimila, P. Balan, N. Chiranjeevi, V. V. V. M. Kumar Development and validation of a reverse phase hplc method of simultaneous estimation of tolperisone hydrochloride and paracetamol in tablet dosage form. Int. J. Pharm. and Pharmac. Sci. Vol 4(5): 2012.]. Содержание действующего компонента оценивалось УФ-спектрометрически при 258 нм (изобестическая точка). Проводить совместное определение ТГХ и диклофенака натрия позволяет методика ОФ ВЭЖХ, где селективность достигалась пропусканием аналитической формы через колонку Agilent C 18 с последующим элюированием в изократическом режиме смесью ацетонитрила : фосфатного буферного раствора (рН 3,0) [G. Kumaraswamy, V. Swapna, D. S. Kumar RP-HPLC method for simultaneous determination of tolperisone hcl and diclofenac sodium in pharmaceutical dosage form. SOJ Pharm. & Pharmaceut. Sci. Vol. 4: 1-6, 2017, DOI:10.15226/2374-6866/4/3/00162]. Известна методика, где разделение компонентов проводилось на колонке Spherisorb ODS в изократическом режиме с использованием 5,5% триэтиламина в ацетонитрильно-водной среде (70 : 30), с последующей идентификацией и количественным определением при 254 нм, позволяющая снизить предел его обнаружения до 0,2 нг [S. Liawruangrath, B. Liawruangrath, P. Pibool Simultaneous determination of tolperisone and lidocaine by high performance liquid chromatography. J. Pharm. Biomed. Anal. Vol. 26(5-6):865-72, 2001, DOI: 10.1016/s0731-7085(01)00462-9.]. В варианте, разработанном авторами [M. J. Patel, R. Badmanaban, C. N. Patel Reversed phase-high performance liquid chromatographic method for simultaneous estimation of tolperisone hydrochloride and etodolac in a combined fixed dose oral formulations. Pharm. Methods. Vol. 2(2): 124–129, 2011, DOI: 10.4103/2229-4708.84458] разделение ТГХ и этодолака проводили на колонке Phenomenax С-18 в изократическом режиме смесью фосфатного буферного раствора (рН 5,5) : метанола : ацетонитрила : триэтиламина (40:40:20:1,5 об./об./об./об.) с последующим количественным определением УФ-детектором при 257 нм. Известен вариант ОФ-ВЭЖХ в сочетание с УФ-детектированием ТГХ при 261 нм, в котором разделение анализируемой смеси проводили на колонке С 18 SunFire в изократическом режиме смесью метанола и 1,0 % триэтиламина (рН 7,5) (60 : 40 об./об.), позволяющий определять действующее вещество в таблетированной форме и фармацевтической субстанции [U. K. Chhalotiya, K. K. Bhatt, D. A. Shah, S. L. Baldania, S. B. Patel Development of stability indicating lc method for the estimation of tolperisone in bulk and pharmaceutical dosage form. J Ap. Chem. Vol. 2013: 7, 2013, http://dx.doi.org/10.1155/2013/352984]. Известен вариант мицеллярной жидкостной хроматографии в сочетании с диодно-матричным детектированием при 210 нм, в котором разделение компонентов лекарственной формы (ТГХ, лидокаина гидрохлорид) проводилось на колонке С 18 додецилсульфатом натрия с небольшим содержанием изопропанола [N. Youngvises, B. Liawruangrath, S.Liaewruangrath Simultaneous micellar LC determination of lidocaine and tolperisone. J. Pharmac. Biomed. Anal. Vol. 31: 629-38, 2003, DOI: 10.1016/S0731-7085(02)00693-3.]. Возможности вышерассмотренным методик в первую очередь ограничиваются применением дорогостоящего оборудования, внутренних стандартов и реагентов особой степени очистки, что не всегда приемлемо при выполнении рутинного анализа.
Известна УФ-спектрофотометрическая методика в сочетание с хемометрическим подходом (классический метод наименьших или частичных наименьших квадратов, метод регрессии главных компонентов) обработки перекрывающихся спектров препаратов в спектральном диапазоне 220-280 нм позволяющая оценить содержание ТГХ в комбинации с парацетамолом [U. H. Ankita H. Jasani Chemometric assisted spectrophotometric methods for simultaneous determination of paracetamol and tolperisone hydrochloride in pharmaceutical dosage form. Euras. J. Anal. Chem. Vol. 12(3):211-222, 2017, DOI 10.12973/ejac.2017.00164a]. В исследование авторов [R. Badmanaban, M. J. Patel, C. N. Patel Estimation of tolperisone hydrochloride and etodolac in combined dosage form by UV-spectrophotometric methods. J. Pharm. and Tech. Vol. 4(7): 1151-1153б 2011.] в основу определения ТГХ легли результаты методов одновременных уравнений (содержание действующего вещества оценивалось при 256 нм) и производных первого порядка (основанный на измерение поглощения при нулевой точке пересечения другого препарата, для ТГХ- 246,7 нм). Однако рекомендованный подход достаточно сложен в исполнении, в связи, с чем все большее значение в аналитической практике приобретают хемилюминесцентные методики.
Наиболее близким к заявленному изобретению является методика УФ-спектрофотометрическая методика, основанная на измерении поглощения водного извлечения препарата при 260 нм в таблетированной форме [B. B. Koladiya, V. M.Vaghela UV spectrophotometric method: a quantitativeestimation of tolperisone hydrochloride in bulkand pharmaceutical dosage form. Int. J. Pharm. Tech. Res. Vol. 4(3): 1317-1322, 2012]. Основным ограничением рекомендованного метода является завышение результатов определения, за счет поглощения при данной длине волны основной примеси – пиперидина гидрохлорида. Введение в анализ этапа хемометрической обработки спектров или их дериватизация, рекомендованная авторами [V. K. Redasani, P. R. Patel, D. Y. Marathe, S. R. Chaudhari, A. A. Shirkhedkar, S. J. Surana A review on derivative UV-spectrophotometry analysis of drugs in pharmaceutical formulations and biological samples review J. Chil. Chem. Soc. Vol. 63(3), 2018], не только усложняет определение, увеличивает время единичного определения, но требует работы с токсичными растворителями.
Задачей настоящего изобретения является разработка экспрессного, простого, не требующего дорогостоящего оборудования и удобного автоматизированного способа определения содержания ТГХ в фармацевтической субстанции и препаратах пригодного для его использования в условиях обычной контрольно-аналитической лаборатории.
Технический результат заявленного изобретения состоит в упрощении способа определения за счет применения электрохимического (амперометрическое титрование с двумя поляризованными электродами) и способа фиксирования точки эквивалентности (в том числе за счет фотогенерации титранта, что исключает необходимость его стандартизации), повышении чувствительности определения, снижении пределов количественного определения (ПКО) и обнаружения (ПО), при сохранении показателей точности и воспроизводимости.
Технический результат достигается тем, что способ определения содержания толперизона гидрохлорида в твердой дозированной лекарственной форме включает предварительный перевод анализируемого препарата в раствор, помещение пробы анализируемого препарата, переведённую в водную фазу, вводится в поглотительную ячейку, содержащую фотогенерированный йод, полученный в результате облучения при 572 нм светодиодом желто-зеленого свечения присутствии кислорода воздуха вспомогательного раствора, содержащего 0,5 М раствор йодида калия, 0,01% раствора смеси сенсибилизаторов эозинат натрия : флуоресцеин натрия, взятых в молярном соотношении 1:2, и ацетатный буферный раствор с рН 5,5, причем генерирование йода осуществляют со скоростью 2,9⋅10-8 моль/с до его содержания 5,72⋅10-6 моль, фиксирование уменьшения количества йода, осуществляемое амперометрически с двумя поляризованными электродами посредством фиксирования показаний гальванометра после стабилизации силы тока в цепи амперометрической установки, с последующим облучением поглотительного раствора при 572 нм светодиодом желто-зеленого свечения в присутствии кислорода воздуха и измерением времени генерации йода, необходимого для восполнения убыли йода до первоначального количества, и определение содержания толперизона гидрохлорида в твердой дозированной форме, осуществляемое по формулам:
по  :
: 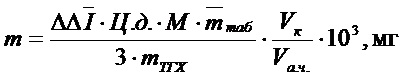 ;
;
по  :
: 
где Ц.д. − цена деления установки: 2,9·10-8 моль/мА и 1,27⋅10-8 моль/с, рассчитанная по силе тока и времени генерации титранта соответственно; М- молярная масса ТГХ, 281,82 г/моль;  − изменение силы тока с учетом постановки холостого опыта, мА;
− изменение силы тока с учетом постановки холостого опыта, мА;  – время генерации титранта с учетом постановки холостого опыта, с;
– время генерации титранта с учетом постановки холостого опыта, с;  − ёмкость мерной колбы, мл;
− ёмкость мерной колбы, мл;  − объем аликвотной части, мл;
− объем аликвотной части, мл;  - масса навески препарата ТГХ, г;
- масса навески препарата ТГХ, г;  - средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
- средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
Сущность заявленного изобретения состоит в том, что в ячейке в результате облучения при 572 нм светодиодом желто-зеленого свечения вспомогательного раствора в присутствии кислорода воздуха (предварительно генерации поглотительный раствор продували воздухом в течение 1-2 минут), содержащего в качестве сенсибилизатора смесь эозината натрия (Э-Na), флуоресцеина натрия (Ф-Na) (в молярном соотношении 1:2) протекает фотогенерация йода, содержание которого контролировалось вольтамперометрическим методом. В результате взаимодействия ТГХ с титрантом наблюдается уменьшение количества последнего в ячейке, что приводит к уменьшению силы тока в амперометрической цепи. После достижения постоянства силы тока в амперометрической цепи поглотительный раствор вновь продувают воздухом в течение 1-2 мин, облучают при 572 нм светодиодом желто-зеленого свечения и измеряют время генерации, пошедшее на восполнение убыли йода. Поглотительный раствор в ячейке заменяют после выполнения 20-30 анализов. Количество ТГХ в исследуемых образцах рассчитывают по формулам. Правильность полученных результатов контролировали методом добавок и арбитражным [N. R. Pai, S. S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form. J. Curr. Chem. Pharm. Sci. Vol. 3(4): 243-254, 2013].
Предложенная для фотогенерации титранта смесь сенсибилизатор позволяет снизить скорость фотогенерации титранта, а, следовательно, и пределы количественного определения и обнаружения.
Предложенный способ автоматизирован, что исключает наличие визуальной ошибки, не требует дорогостоящего оборудования, что позволяет использовать его в условиях обычной контрольно-аналитической лаборатории.
Определение содержания ТГХ в фармацевтической субстанции и препаратах осуществляют следующим способом: навеску пробы, количественно переводили в жидкую фазу, путем растворения навески пробы в 10 мл 0,1 М раствора нитрата натрия, переведением образца в мерную колбу и доведением до метки деионизированной водой. Приготовленные растворы хранили при комнатной температуре не более недели.
Предварительно в поглотительную ячейку для фотохимического титрования помещают 40 мл 0,5 М раствора йодида калия, 10 мл смеси сенсибилизаторов (приготовленной из 0,01% растворов, взятых в молярном соотношении nЭ-Na : nФ-Na = 1:2) и 20 мл ацетатного буферного раствора (рН 5,5). Ячейку продували воздухом и облучали при 572 нм светодиодом желто-зеленого свечения в течение 1- 2 минут. Йод генерируют со скоростью 2,9⋅10-8 моль/с до его содержания 5,72⋅10-6 моль (пороговое значение). После достижения порогового значения отключают источник облучения и вводят 0,1÷0,3 мл рабочего раствора. Так как содержание титранта контролируют амперометрически с двумя поляризованными электродами, взаимодействие ТГХ с последним сопровождается уменьшением количества титранта в ячейке, а, следовательно, и силы тока в амперометрической цепи. После стабилизации силы тока в цепи амперометрической установки и фиксирования показаний гальванометра, поглотительный раствор вновь облучают при 572 нм светодиодом желто-зеленого свечения, генерируя титрант, и измеряют время, необходимое для восполнения его убыли (время генерации). Один и тот же поглотительный раствор позволяет проводить 10-20 определений. Содержание ТГХ в лекарственной форме рассчитывают согласно следующим формулам:
по  :
: 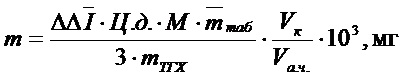 ;
;
по  :
: 
где Ц.д. − цена деления установки: 2,9·10-8 моль/мА и 1,27⋅10-8 моль/с, рассчитанная по силе тока и времени генерации титранта соответственно; М- молярная масса ТГХ, 281,82 г/моль;  − изменение силы тока с учетом постановки холостого опыта, мА;
− изменение силы тока с учетом постановки холостого опыта, мА;  – время генерации титранта с учетом постановки холостого опыта, с;
– время генерации титранта с учетом постановки холостого опыта, с;  − ёмкость мерной колбы, мл;
− ёмкость мерной колбы, мл;  − объем аликвотной части, мл;
− объем аликвотной части, мл;  - масса навески препарата ТГХ, г;
- масса навески препарата ТГХ, г;  - средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
- средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
Для подтверждения результатов определения ТГХ в препарате методом добавок и при исследовании влияния третьего компонента на результаты его фотохимического определения используют стандартный раствор (2 мг/мл) для получения которого навеску субстанции (0,010 г) количественно переносят в мерную колбу емкостью 50 мл, содержащую 10 мл 0,1 М раствора нитрата натрия, и доводят деионизированной водой до метки (срок хранения при комнатной температуре не более недели).
Выбор светодиода осуществляли согласно устойчивости ТГХ к исследуемому диапазону облучения, для чего его водное извлечение облучали в присутствии кислорода воздуха светодиодами в широком диапазоне спектра 360÷940 нм. Содержание ТГХ в растворе определяли согласно методике, рекомендованной [Q. K. Truong, X.L. Mai, D. H. Kim, J. K. Kim, J. S. Kang, M. H. Woo, D. H. Na, I. K. Chun, K. H. Kim Determination of the quantity of tolperisone hydrochloride in tablets by high performance liquid chromatography. J. Anal. Sci. & Tech. Vol. 30(1): 32-38, 2017, https://doi.org/10.5806/AST.2017.30.1.32]. Для определения использовали хроматограф LC 2010 Shimadzu оснащенный спектрофотометрическим детектором Shimadzu SPD-M20. Разделение проводили на аналитической колонке Oyster ODS (300 мм x 4,6 мм) смесью ацетонитрил : буфер (рН 2,5) (к 95 мл 0,1 М раствора лимонной кислоты прибавили 5 мл 0,2 М дигидрофосфата натрия, 10 г лаурилсульфата натрия и разбавили до 1000 мл деинизированной водой; до заданного значения рН доводили ортофосфорной кислотой) в объемном соотношении 55 : 45. Содержание действующего вещества контролировали при 260 нм по площади пика.
На основании полученных данных можно заключить, что в диапазоне длин волн 360÷455 нм и 617÷940 нм происходит фотоокисление (разложение) действующего вещества. Не смотря на то, что ТГХ устойчив в диапазоне длин волн 470÷590 нм дальнейшую разработку методики проводили при длине волны 572 нм, облучая раствор светодиодом желто-зеленого свечения, так как наблюдали практически 100 % выход от теоретически введенного содержания.
Известно, что на скорость фотогенерации титранта, а, следовательно, и чувствительность значительное влияние оказывает кислотность поглотительного раствора и природа сенсибилизатора. Исследование кинетики взаимодействия ТГХ с титрантом в диапазоне рН 1,52÷9,20 в присутствии 0,01 % растворов сенсибилизаторов (Э-Na, Ф-Na) проводили на фармацевтической субстанции, удовлетворяющей требованиям НД 42-11633-01. Результаты определения приведены в табл. 2.
Анализ данных результатов определения, представленных в табл. 2 позволяет установить молярное соотношение, в котором реагируют ТГХ с титрантом ( :
: = 3,00:1,00). Согласно данным (табл. 2) наибольший выход реакции наблюдается при использовании в качестве сенсибилизатора смеси, состоящей из 0,01% растворов Э-Na и Ф-Na, взятых в молярном соотношении 1:2.
= 3,00:1,00). Согласно данным (табл. 2) наибольший выход реакции наблюдается при использовании в качестве сенсибилизатора смеси, состоящей из 0,01% растворов Э-Na и Ф-Na, взятых в молярном соотношении 1:2.
На рис. 1 приведена зависимость выхода реакции (отношение количества найденного ТГХ к теоретически введенному, %) от кислотности поглотительного раствора.
Таблица 1
Результаты устойчивости ТГХ (τоблучения= 10 мин, mТГХ = 10 мг, n= 5, р=0,98)
(3,85)
(3,57)
(3,30)
(3,06)
(3,06)
(3,00)
(3,03)
(3,33)
(3,49)
(3,92)
Таблица 2.
Результаты титрования ТГХ (mТГХ = 10,0 мг, Vк= 50,0 мл, Vа.ч.=0,3 мл, nТГХ= 1,42⋅10-7 моль, n= 5, р= 0,98, λ= 572 нм)


 , мА
, мА ⋅107, моль
⋅107, моль :
:
 , мг
, мг , с
, с ⋅108, моль
⋅108, моль :
:
 , мг
, мг
Примечание: * - содержание увеличено в 2 раза; 1 - раствор сенсибилизатора, приготовленный согласно (патент RU 2 477 284, опубликовано: 10.03.2013 Бюл. № 7); 2 - раствор сенсибилизатора, приготовленный согласно (Басова Е. М. Возможности спектрофлуориметра «Флюорат-02-панорама» в анализе смеси флуоресцентных красителей / Е. М. Басова, В. М. Иванов, О. К. Апендеева / ВЕСТН. МОСК. УН-ТА. СЕР. 2. ХИМИЯ. - 2014. - Т. 55. - № 5. - С. 281-295); 3 - раствор смеси сенсибилизаторов с молярным соотношением 1:1; 4 - растворы 1 и 2 в молярном соотношении 1:1; 5 - раствор смеси сенсибилизаторов с молярным соотношением 1:2.
На рис. 2. приведена зависимость выхода реакции (отношение количества найденного ТГХ к теоретически введенному, %) при рН: 1- 1,52; 2- 5,5; 3- 6,03; 4- 7,38 от времени выдержки.
Анализ зависимости выхода реакции окисления ТГХ от кислотности среды (рис. 2) свидетельствует о количественном протекание реакции в интервале рН 1,52÷5,50. Завышение результатов определения ТГХ по сравнению с теоретически вводимым в ячейку, в слабощелочной среде скорее связано с окислением продуктов его гидролитического разложения (рис. 1).
На основании зависимости выхода реакции окисления ТГХ (рис. 2) установлена его устойчивость в течение 30 мин в интервале рН 1,52÷5,50, что достаточно для проведения серии анализов. В данном диапазоне рН ТГХ взаимодействует с раствором йода в молярном соотношение 1 : 3. Дальнейшую разработку методики проводили при рН 5,50.
Согласно результатам титрования модельных растворов (табл. 1) установлено, что применение смеси приготовленной из 0,01% растворов, взятых в молярных соотношениях
nЭ-Na : nФ-Na = 1:2 в качестве сенсибилизатора в данном диапазоне облучения позволяет проводить анализ из меньших навесок, при сохранении показателей точности и воспроизводимости методики.
При определении содержания ТГХ в препарате, навеску массой 0,100 г (точная навеска,  ) порошка растертых таблеток ТГХ, количественно переносили в мерную колбу емкостью 25 мл, содержащую 10 мл 0,1 М раствора нитрата натрия и доводили до метки деионизированной водой. Полученный раствор отфильтровывали, отбрасывая первые 10 мл фильтрата.
) порошка растертых таблеток ТГХ, количественно переносили в мерную колбу емкостью 25 мл, содержащую 10 мл 0,1 М раствора нитрата натрия и доводили до метки деионизированной водой. Полученный раствор отфильтровывали, отбрасывая первые 10 мл фильтрата.
Согласно инструкции в состав препарата «Мидокалм®» в качестве вспомогательных веществ вводят лактозу моногидрат (ЛМГ) (48,5/ 145,5 мг), крахмал кукурузный (КК) (29,77/ 89,31 мг), кремния диоксид коллоидный безводный (0,8/ 2,4 мг), лимонную кислоту моногидрат (ЛКМ) (0,73/ 2,19 мг), стеариновую кислоту (СК) (1,7/ 5,1 мг), тальк (4,5/ 13,5 мг), целлюлозу микрокристаллическую (14,0/ 42,0 мг) и оболочки: гипромеллозу (4,5/ 13,5 мг), макрогол 6000 (0,392/ 0,785 мг), титана диоксид (0,244/0,487 мг), лактозу моногидрат (0,392/ 0,785 мг) для дозировки 50 и 150 мг соответственно. При исследовании влияния третьего компонента (ЛМГ, ЛКМ, СК; выбор основывался на влияние рН поглотительного раствора) в ячейку вводили анализируемый раствор, содержащий 10,0 мг ТГХ и определенное количество данного компонента, и фиксировали изменение силы тока в цепи амперометрической установки, после его стабилизации ( ). Затем поглотительный раствор продували кислородом воздуха, облучали и фиксировали время генерации титранта, необходимое для восполнения его убыли в растворе (
). Затем поглотительный раствор продували кислородом воздуха, облучали и фиксировали время генерации титранта, необходимое для восполнения его убыли в растворе ( ). На основании результатов титрования рассчитывали содержание ТГХ в растворе.
). На основании результатов титрования рассчитывали содержание ТГХ в растворе.
На основании результатов титрования установлено незначительное занижение содержания ТГХ при введении в ячейку более 5,0 ммоль ЛМГ (5,0 мл 1 М), по 3,0 ммоль Na-КМЦ и Mg-СТ (3,0 мл 1 М) (табл. 3), что превышает количеству, вводимому в препарат. Тем не менее, при выполнении серии анализов, данное влияние необходимо учитывать. Остальные компоненты таблеточной массы не мешали определению.
Таблица 3
Результаты определения ТГХ в присутствии третьего компонента (n= 7, р= 0,98)
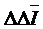 , мг
, мг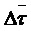 , мг
, мг

Анализ данных, представленных в табл. 4, свидетельствует о сходимости результатов определения ТГХ вольтамперометрическим (по изменению силы тока и времени генерации) и арбитражным методами. Найденное содержание ТГХ (49,0÷49,9) мг входит в интервал, рекомендованный ОФС.1.4.2.0009.15 (47,5÷52,5) мг, что свидетельствует о соответствии его качества препарата требованиям, изложенным в НД.
Таблица 4
Результаты определения ТГХ в препарате «Мидокалм®», ОАО «Гедеон Рихтер», Россия (n= 7, р= 0,98*).
 , г
, г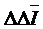
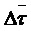
 , мкг
, мкг , мкг
, мкг
Примечание: n – количество измерений; p- доверительная вероятность 98 %;  установлена согласно ОФС.1.4.2.0009.15
установлена согласно ОФС.1.4.2.0009.15
1– N. R. Pai, S. S. Sawant Development and validation of rp-hplc method for determining impurity profiling fortolperisone hydrochloride in tablet dosage form. J. Curr. Chem. Pharm. Sci. Vol. 3(4): 243-254, 2013.
С целью доказательства отсутствия систематической ошибки разработанной методики использовался метод добавок. Стандартный раствор ТГХ добавляли к навеске препарата «Мидокалм®» (серия: 3010920) непосредственно в ходе его растворения (табл. 5). Согласно полученным результатам, ошибка определения в опытах с добавками не превысила относительную ошибку единичного определения предлагаемой методики и имеет отклонения в сторону как положительных, так и отрицательных значений, что свидетельствует об отсутствии систематической ошибки. Пределы обнаружения (ПО) и определения (ПКО) ТГХ рассчитаны на основании уравнений градуировочных графиков. Основные аналитические характеристики методики представлены в таблице 5.
Таблица 5
Метрологические характеристики вольтамперометрической методики определения ТГХ (р= 0,98)
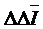 /
/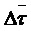 ), мг
), мг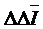 , мА
, мА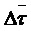 , с
, с = 98,88
= 98,88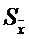 = 0,5333
= 0,5333
ε = 1,81
Δ = 1,79
= 1,79
Sr = 0,02 = 99,31
= 99,31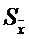 = 0,3401
= 0,3401
ε = 1,15
Δ = 1,14
= 1,14
Sr = 0,01
a = 0,3357
R2 = 0,9971
a = 0,4500
R2 = 0,9955
Таким образом, разработанный способ определения содержания ТГХ в твердой дозированной лекарственной форме, основанный на переведении препарата в аналитическую форму и титровании полученного раствора фотогенерированным йодом, прост в исполнении и не требует дорогостоящего оборудования. Найденное в препаратах содержание ТГХ соответствует заявленному в нормативных документах. Рассчитанные ПО и ПКО составили 0,57 мг и (1,73; 1,74) мг по изменению силы тока и времени генерации соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения содержания дифенгидрамина гидрохлорида (димедрола) в фармацевтической субстанции и препаратах | 2021 |
|
RU2781063C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ АСКОРБИНОВОЙ КИСЛОТЫ В РАСТИТЕЛЬНОМ СЫРЬЕ | 2015 |
|
RU2595878C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОПРИМЕСЕЙ МЫШЬЯКА И СУРЬМЫ В РАСТИТЕЛЬНОМ ЛЕКАРСТВЕННОМ СЫРЬЕ | 2015 |
|
RU2591827C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОИЗВОДНЫХ НИТРОФУРАНА, ПИРАЗОЛА, ИЗОНИКОТИНОВОЙ КИСЛОТЫ, ТИОАМИНОКИСЛОТ В ЛЕКАРСТВЕННЫХ ФОРМАХ | 2011 |
|
RU2479840C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТИОСУЛЬФАТА НАТРИЯ В РАСТВОРАХ | 2013 |
|
RU2552311C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОФЕИНА В ЧАЕ И КОФЕ | 2009 |
|
RU2404428C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИПРОФЛОКСАЦИНА МЕТОДОМ ОБРАЩЕННО-ФАЗНОЙ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2020 |
|
RU2751338C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРОХЛОРИДА 2,7-БИС-[2-(ДИЭТИЛАМИНО)ЭТОКСИ]-ФЛУОРЕНОНА-9 | 2019 |
|
RU2707176C1 |
| ТВЁРДАЯ ПЕРОРАЛЬНАЯ ЛЕКАРСТВЕННАЯ ФОРМА, ПРОЛОНГИРОВАННО ВЫСВОБОЖДАЮЩАЯ АКТИВНУЮ ФАРМАЦЕВТИЧЕСКУЮ СУБСТАНЦИЮ (АФС) В ВЕРХНЕЙ ЧАСТИ ЖЕЛУДКА | 2021 |
|
RU2786063C2 |
| Способ определения активности аминоацилазы | 1980 |
|
SU968070A1 |

Изобретение относится к анализу органических химических соединений. Раскрыт способ определения содержания толперизона гидрохлорида в твердой дозированной лекарственной форме, включающий предварительный перевод анализируемого препарата в раствор, помещение его в поглотительную ячейку, содержащую фотогенерированный йод, полученный в результате облучения при 572 нм светодиодом желто-зеленого свечения в присутствии кислорода воздуха вспомогательного раствора, содержащего 0,5 М раствор йодида калия, 0,01% раствора смеси сенсибилизаторов эозинат натрия : флуоресцеин натрия, взятых в молярном соотношении 1:2, и ацетатный буферный раствор с рН 5,5, причем генерирование йода осуществляют со скоростью 2,9⋅10-8 моль/с до его содержания 5,72⋅10-6 моль, фиксирование уменьшения количества йода, осуществляемое амперометрически с двумя поляризованными электродами посредством фиксирования показаний гальванометра после стабилизации силы тока в цепи амперометрической установки, с последующим облучением поглотительного раствора при 572 нм светодиодом желто-зеленого свечения в присутствии кислорода воздуха и измерением времени генерации йода, необходимого для восполнения убыли йода до первоначального количества, и определение содержания толперизона гидрохлорида в твердой дозированной лекарственной форме по математической формуле. Изобретение обеспечивает упрощение способа определения, повышение чувствительности, снижение пределов количественного определения и обнаружения при сохранении показателей точности и воспроизводимости. 2 ил., 5 табл.
Способ определения содержания толперизона гидрохлорида (ТГХ) в твердой дозированной лекарственной форме, включающий предварительный перевод анализируемого препарата в раствор, помещение его в поглотительную ячейку, содержащую фотогенерированный йод, полученный в результате облучения при 572 нм светодиодом желто-зеленого свечения в присутствии кислорода воздуха вспомогательного раствора, содержащего 0,5 М раствор йодида калия, 0,01% раствора смеси сенсибилизаторов эозинат натрия : флуоресцеин натрия, взятых в молярном соотношении 1:2, и ацетатный буферный раствор с рН 5,5, причем генерирование йода осуществляют со скоростью 2,9⋅10-8 моль/с до его содержания 5,72⋅10-6 моль, фиксирование уменьшения количества йода, осуществляемое амперометрически с двумя поляризованными электродами посредством фиксирования показаний гальванометра после стабилизации силы тока в цепи амперометрической установки, с последующим облучением поглотительного раствора при 572 нм светодиодом желто-зеленого свечения в присутствии кислорода воздуха и измерением времени генерации йода, необходимого для восполнения убыли йода до первоначального количества, и определение содержания толперизона гидрохлорида в твердой дозированной лекарственной форме, осуществляемое по формулам:
по  :
:  ;
;
по  :
: 
где Ц.д. − цена деления установки: 2,9⋅10-8 моль/мА и 1,27⋅10-8 моль/с, рассчитанная по силе тока и времени генерации титранта соответственно; М - молярная масса ТГХ, 281,82 г/моль;  − изменение силы тока с учетом постановки холостого опыта, мА;
− изменение силы тока с учетом постановки холостого опыта, мА;  − время генерации титранта с учетом постановки холостого опыта, с;
− время генерации титранта с учетом постановки холостого опыта, с;  − ёмкость мерной колбы, мл;
− ёмкость мерной колбы, мл;  − объем аликвотной части, мл;
− объем аликвотной части, мл;  - масса навески препарата ТГХ, г;
- масса навески препарата ТГХ, г;  - средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
- средняя масса таблетки, г; 3 - количество моль титранта, вступившего в реакцию.
| BHAVESH K | |||
| et al | |||
| UV Spectrophotometric Method: A Quantitative Estimation of Tolperisone Hydrochloride in Bulk and Pharmaceutical Dosage Form // International Journal of PharmTech Research, 2012, V.4, N.3, pp | |||
| Жатвенная машина | 1923 |
|
SU1317A1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПРОИЗВОДНЫХ ПИПЕРИДИНА (ГРУППЫ БУТИРОФЕНОНОВ) | 2018 |
|
RU2684101C1 |
| US 9315480 B2, 19.04.2016 | |||
| PATEL M.J | |||
| et al | |||
| Reversed phase-high performance liquid chromatographic | |||
Авторы
Даты
2024-07-10—Публикация
2023-08-02—Подача