Изобретение относится к фармацевтике, в частности гастроэнтерологии, и может быть использовано для профилактики или лечения воспалительных заболеваний желудочно-кишечного тракта.
Рифаксимин является полусинтетическим антибиотиком группы рифамицинов, синтезируемый из природного рифамицина S бромированием с получением 3-броморифамицина, последующим присоединением 2-амно-4-метил-пиридина, обработкой реакционной массы аскорбиновой и кристаллизацией конечного соединения формулы:
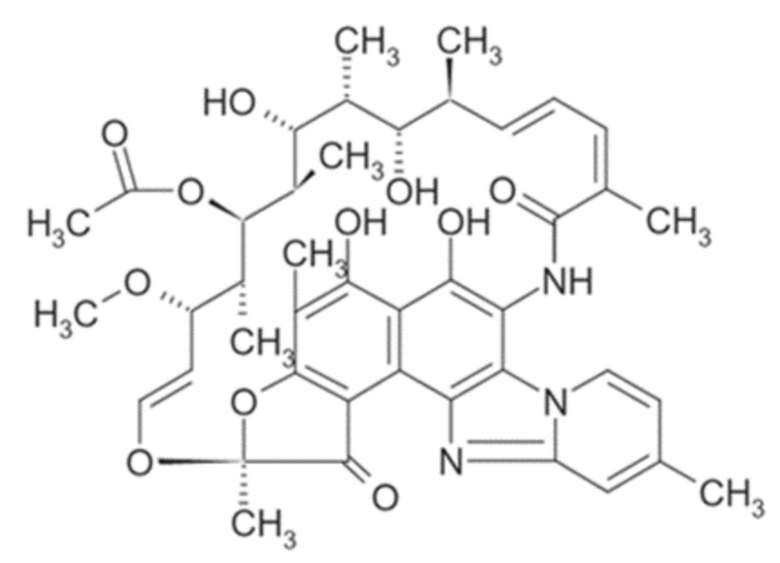
Рифаксимин практически нерастворим в воде, при пероральном приеме остается внутри желудка и кишечника, не проникая сквозь их стенки, создавая высокую концентрацию вещества внутри пищевода и очень низкую в плазме крови, такие свойства обеспечивают его высокую эффективность и безопасность при лечении инфекций желудочно-кишечного тракта.
Чистый рифаксимин – кристаллический порошок от темно красного до розового цвета, в зависимости от полиморфной модификации. При выделении его из органических или водно-органических смесей он может образовывать разнообразные кристаллогидратные структуры, отличающиеся как содержанием воды, так и формами и размерами кристаллов, кроме того, известна аморфная модификация рифаксимина и разнообразные способы ее получения.
В евразийском патенте ЕА 022324 В1 описан аморфный порошок рифаксимина, полученный методом распылительной сушки, при котором спиртовой раствор рифаксимина подается в форсунку, диспергируется до аэрозоля, смешивается с горячим воздухом и высушивается до порошка с характерными аморфными свойствами. В этом же патенте описан способ получения аморфного порошка измельчением кристаллического рифамиксина до агрегатов размером 3-15 микрон.
Кристаллизация рифаксимина из различных растворителей при определенных температурных режимах, интенсивности перемешивания и скорости осаждения, позволяет получить различные полиморфные модификации вещества.
Кристаллизация рифаксимина из водно-спиртовых растворов с нагревом до 45°- 65°С и последующим охлаждением, описана в патенте РФ 2397985, полученный таким способом рифаксимин, имеет δ полиморфную форму, которая при сушке переходит в ε форму. Описанные δ и ε полиморфы рифаксимина обладают разной растворимостью и биодоступностью поэтому могут применяться для производства различных лекарственных препаратов, отличающихся составом и терапевтическим действием.
В патенте РФ 2270200 С2 описаны полиморфные модификации рифаксимина α (демонстрирующую пики при величинах углов дифракции 2θ: 6,6°; 7,4°; 7,9°; 8,8°; 10,5°; 11,1°; 11,8°; 12,9°; 17,6°; 18,5°; 19,7°; 21,0°; 21,4°; 22,1°); β (демонстрирующую пики при величинах углов дифракции 2θ: 5,4°; 6,4°; 7,0°; 7,8°; 9,0°; 10,4°; 13,1°; 14,4°; 17,1°; 17,9°; 18,3°; 20,9°) и γ (демонстрирующую в основном аморфный профиль и несколько значительных пиков при величинах углов дифракции 2θ: 5,0°; 7,1°; 8,4°) и способы их выделения кристаллизацией из водно-спиртовых растворов. В соответствии с описанием рифаксимин растворяют в спирте при температуре 45-65°С, к раствору добавляют воду, охлаждают до начала кристаллизации, после чего повторно нагревают до температуры 40-50°С, выдерживают от 6 до 24 часов, охлаждают до 0°С и сушат полученные кристаллогидраты рифаксимина, при этом в зависимости от остаточной влаги получают полиморф α с содержанием воды 2,0%-3,0%, полиморф β с содержанием воды 5,0%-6,0% и полиморф γ содержащий 1,0%-2,0% воды.
Известные полиморфные модификации рифаксимина являются кристаллогидратами и могут трансформироваться друг в друга в зависимости от содержания воды и температуры - подробно эти процессы описаны в “Crystal forms of rifaximin and their effect on pharmaceutical properties” July 2008 CrystEngComm 10(8). Так рифаксимин α при увлажнении переходит в δ форму, которая, отдавая или принимая влагу, трансформируется в ε или β форму, а β соответственно в зависимости от содержания воды и температуры переходит в γ, δ, ε или α модификации.
В патенте CN 103509038 описана кристаллическая модификация рифаксимина ζ, для получения которой рифаксимин сырец с влагой до 5,0% растворяют в спирте и кристаллизуют рифаксимин охлаждая раствор до температуры -10÷-30°С, полученная кристаллическая модификация имеет характерную дифрактограмму со значениями пиков углов дифракции 2Ɵ: 5,8°, 6,4°, 7,8°, 8,9°, 9,3°, 11,4°, 11,8 °, 12,2°, 12,6°. °, 13,8°, 14,8°, 15,7°, 16,5°, 17,0°, 17,9°, 18,8°, 19,3°, 19,9°, 20,9 °, 21,6°, 23,3°, 25,5°, 28,0°. Получаемый таким способом рифаксимин, как и предыдущие модификации является кристаллогидратом, т.к. в растворе, из которого он кристаллизуется, содержится вода, внесенная при растворении исходного сырца кристаллогидрата.
Все описанные модификации рифаксимина имеют общий недостаток, а именно: они могут переходить из одной формы в другую при изменении влажности и температуры, что приводит к изменениям формы, размера и плотности кристаллов. С течением времени чистые полиморфные модификации приходят в равновесие с другими модификациями, образуя равновесный состав характерный для определенной температуры и влажности наиболее энергетически выгодный для данного термодинамического состояния. Протекание перечисленных процессов в лекарственных формах, приготовленных на основе кристаллогидратов рифаксимина, может приводить к изменению их свойств, в частности растворимости, биодоступности, изменению фармакокинетики. Кроме того, изменение формы и размера кристаллогидратов активного фармацевтического компонента, в твердых лекарственных средствах может приводить к изменению физико-механических характеристик препарата.
Попытки получить стабильные кристаллогидраты рифаксимина, отличающиеся постоянным содержанием влаги, описаны в патенте РФ 2593750 С2. Устойчивость полиморфной формы в нем демонстрируется воздействием на образец рифаксимина среды с относительной влажностью 80% в течение длительного времени, до 5 месяцев, при котором содержание влаги в образце рифаксимина практически не меняется и остается постоянным на уровне 4,5%.
В патенте ЕА 030457 В1 описан сольват рифаксимина τ, который содержит рифаксимин и моноэтиловый эфир диэтиленгликоля в стехиометрическом соотношении с рифаксимином 1:1, в соответствии с описанием эта форма рифаксимина не содержит воды и не меняет свою структуру при воздействии влаги в течение 10 суток. Основным недостатком данной формы рифаксимина является присутствие в нем моноэтилового эфира диэтиленгликоля, содержание которого, при указанном мольном соотношении, составляет 10,3%. Моноэтиловый эфир этиленгликоля, в соответствии с классификацией фармацевтической токсичности по ICH guideline Q3C (R6) Европейского Медицинского Агенства, относится к второму классу токсичности и содержание его в лекарственных препаратах не должно превышать 0,016%, ввиду высокой токсичности использование такого сольвата рифаксимина для фармацевтических целей очень ограниченно.
В качестве ближайшего аналога настоящего изобретения можно рассмотреть международную заявку WO 2018/197538, в которой раскрывается фармацевтическая композиция, обладающая антибиотическим действием, содержащая безводную полиморфную форму рифаксимина β (содержание воды 9,1 масс %),в терапевтически эффективном количестве. Также указанная композиция содержит целлюлозу микрокристаллическую, карбоксиметилкрахмала натрия, тальк, кремния диоксид и магния стеарат в соответствующих количествах, при этом композиция может быть в виде таблетки или капсулы. Недостатком данной фармацевтической композиции является то, что содержание воды в форме β значительно превышает 1%, что не позволяет полностью исключить влияния воды на биодоступность, период нахождения препарата в системном кровотоке и просвете кишечника, развитие возможной резистентности микроорганизмов, а также терапевтическую эффективность.
В приведенных патентных документах стабильность рифаксимина демонстрируется устойчивостью его к воздействию влаги, однако, проведенные испытания не в полной мере характеризуют стабильность полиморфной формы, т.к. фактически, современные таблетированные лекарственные формы хранятся в герметичной таре, как правило, в закрытых стеклянных банках или блистерах, такая упаковка обеспечивает постоянную влажность среды, с которой контактирует таблетированная форма, а основным переменным фактором, воздействующим на препарат является температура, колебания которой связаны как с суточными переменами день - ночь, так и сезонными лето – зима. Колебания температуры приводят к колебаниям термодинамического равновесия, установившегося между различными кристаллогидратными структурами рифаксимина, которые далее приводят к колебаниям формы и размера кристаллов и накоплению деформаций в таблетках. Изменения полиморфного состава действующего вещества и параметров лекарственного препарата таких как прочность таблетки и её распадаемость, вызывают изменение фармакокинетических свойств лекарственного средства, уменьшают предсказуемость его воздействия на организм и снижают эффективность лечения.
Эффективность и безопасность рифаксимина при лечении кишечных инфекций обусловлена чрезвычайно низкой его растворимостью в воде, что делает его практически непроницаемым сквозь стенки кишечника. При пероральном приеме только около 1% рифаксимина попадает в кровь, поэтому воздействие его на внутренние органы минимально, а 99% рифаксимина распределяется по кишечнику обеспечивая высокую активность внутри пищевода. Растворимость вещества определяется его полиморфной формой, а высвобождение вещества из таблетки и заданное распределение по пищеводу зависит от свойств таблетки, поэтому определяющими факторами стабильной эффективности и безопасности рифаксимина являются стабильность полиморфной формы рифаксимина и стабильность физико-химических свойств таблетки.
Целью настоящего изобретения является создание не токсичной фармацевтической композиции рифаксимина с высокой физико-химической и фармакокинетической стабильностью в широких временных и температурных диапазонах и пролонгированным эффектом действия.
Указанная цель достигается тем, что заявленная фармацевтическая композиция, обладающая антибиотическим действием, содержит терапевтически эффективное количество кристаллического рифаксимина, взятого в ангидроформе, а также содержит на одну весовую часть рифаксимина целлюлозы микрокристаллической от 0,6 до 0,8 частей, карбоксиметилкрахмала натрия от 0,035 до 0,045 частей, талька от 0,02 до 0,03 частей, кремния диоксида от 0,015 до 0,02 частей и магния стеарата от 0,005 до 0,01 части.
В предпочтительном частном случае фармацевтическая композиция содержит рифаксимин с содержанием воды менее 1,0%.
Фармацевтическая композиция по изобретению может быть выполнена в форме таблетки или капсулы.
Проведенные авторами исследования показали, что скорость перехода одних полиморфных форм рифаксимина в другие, равновесные с ними, определяется содержанием влаги в кристаллогидрате рифаксимина, так наибольшая скорость трансформации кристаллов наблюдается при содержании влаги 3,0%-6,0%. Колебательные изменения температуры от -30°С до +60°С в образцах с влагой 3,0%-6,0% через 14 циклов нагрева и охлаждения приводят к появлению в темно-красном порошке как отдельных розовых кристаллов, так и светлых разводов по всему объему порошка, что составляло от 3% до 5% от массы порошка. После 60 циклов колебания температуры неоднородность порошка составляла уже от 25% до 30% от массы порошка.
Снижение содержания влаги до 1,0% - 3,0% приводит к резкому снижению скорости перехода полиморфных форм в разные равновесные состояния, вызванные колебаниями температуры, и трансформация кристаллов замедляется. Циклические изменения температуры через 14 циклов не нарушают гомогенности порошка, признаки гетерогенности появляются только через 60 циклов термических колебаний.
Было также неожиданно обнаружено, что при дальнейшем снижении содержания воды 1,0% и менее, переходы рифаксимина в другие полиморфные модификации прекращаются, и форма кристаллов и цвет кристаллов остаются постоянными. Активная фармацевтическая субстанция с такими свойствами является наиболее подходящей для получения лекарственных препаратов с прогнозируемым биохимическим воздействием в течение длительного срока годности. Лекарственные формы, содержащие рифаксимин с влагой менее 1,0% сохраняют высокую стабильность как физико-химических свойств, так и фармакологических, что делает их более удобными, как для производства фармацевтических препаратов, так и для их хранения и транспортировки.
Реализация данного изобретения возможна при получении рифаксимина с содержанием воды менее 1,0% кристаллизацией из осушенного раствора рифаксимина сырца, при этом исключается возможность образования кристаллогидратов и получаемый рифаксимин содержит только одну ангидро полиморфную модификацию. Наиболее подходящими растворителями являются спирты метиловый, этиловый и пропиловый. Кристаллизацию проводят, растворяя рифаксимин сырец, с содержанием основного вещества около 90% и влаги 5-10%, в одном из перечисленных спиртов или их смеси. Для растворения на одну часть рифаксимина загружают растворителя от 2 до 10 частей, соотношение выбирается для конкретного процесса в зависимости от температуры растворения, вязкости полученного раствора и остаточной концентрации целевого вещества в маточной жидкости. Растворение рифаксимина проводят, нагревая суспензию до температуры 40-70°С. Полученный раствор обезвоживают, используя инертные сорбенты, наиболее подходящими являются хлористый кальций, сульфат натрия и сульфат меди или удаляют влагу азеотропной отгонкой воды. Обезвоженный раствор охлаждают до начала кристаллизации или провоцируют её внесением затравочных кристаллов. Перемешивают смесь в течение 2-5 часов до образования устойчивой суспензии и охлаждают до температуры +5÷-10°С, выдерживают при этой температуре 8-16 часов до завершения процесса кристаллизации, фильтруют и промывают охлажденным спиртом, пасту высушивают от остаточных количеств растворителя. Выделенный таким способом кристаллический рифаксимин содержит 98,0%-99,5% основного вещества и 0,2%-0,6% воды. Дифрактограмма полученного рифаксимина с излучающей трубкой Cu имеет характерные максимумы углов пиков дифракции 2Ɵ: 5,12°; 5,35°; 7,04°; 8,41°; 8,73°; 12,54°; 13,51°; 14,57°; 17,95°; 19,79°; 20,67°; 21,47°; 22,11°; 23,25°.
Полученный кристаллический рифаксимин не содержит кристаллогидратной воды и поэтому не трансформируется в различные равновесные кристаллогидратные модификации, что позволяет ему сохраняться в неизменной кристаллической форме при колебаниях температур от -30°С до +60°С. Активное вещество в такой форме является наиболее подходящим для производства твердых лекарственных форм, отличающихся высокой стабильностью физико-химических и фармакологических свойств.
Состав композиции рифаксимина также должен обеспечить высокую стабильность таблетки в течение всего срока хранения в широком диапазоне колебания температур и равномерное высвобождение активной фармацевтической субстанции в кишечнике.
Как было установлено и как будет показано далее, наилучшим образом указанные цели достигаются в композиции, в которой на одну часть рифаксимина имеется связующее вещество - целлюлоза мелкокристаллическая, содержание которой варьируется в пределах от 0,6 до 0,8 весовых частей, разрыхлитель карбоксиметилкрахмала натрия от 0,035 до 0,045 весовых частей и вспомогательные вещества тальк от 0,02 до 0,03 частей, кремния диоксид от 0,015 до 0,02 частей и магния стеарат от 0,005 до 0,01 части на одну весовую часть рифаксимина.
Было также неожиданно обнаружено, что кристаллический рифаксимин в виде ангидроформе в составе вышеописанной фармкомпозиции показывает меньшую концентрацию рифаксимина в плазме в наиболее важный отрезок времени, соответствующий Тмакс = 2-3 часа, что необходимо относить к профилю безопасности препарата, а также показывает большую концентрацию рифаксимина в просвете кишечника (ткани кишечника) в наиболее важный отрезок времени, соответствующий 2-8 часов, что необходимо относить к эффективности препарата, а также снижению риска развития резистентности, проявляя у готовой лекарственной формы признаки пролонгированности действия.
Все технические и специальные термины, использованные в описании, имеют общепринятое в данной области техники значение.
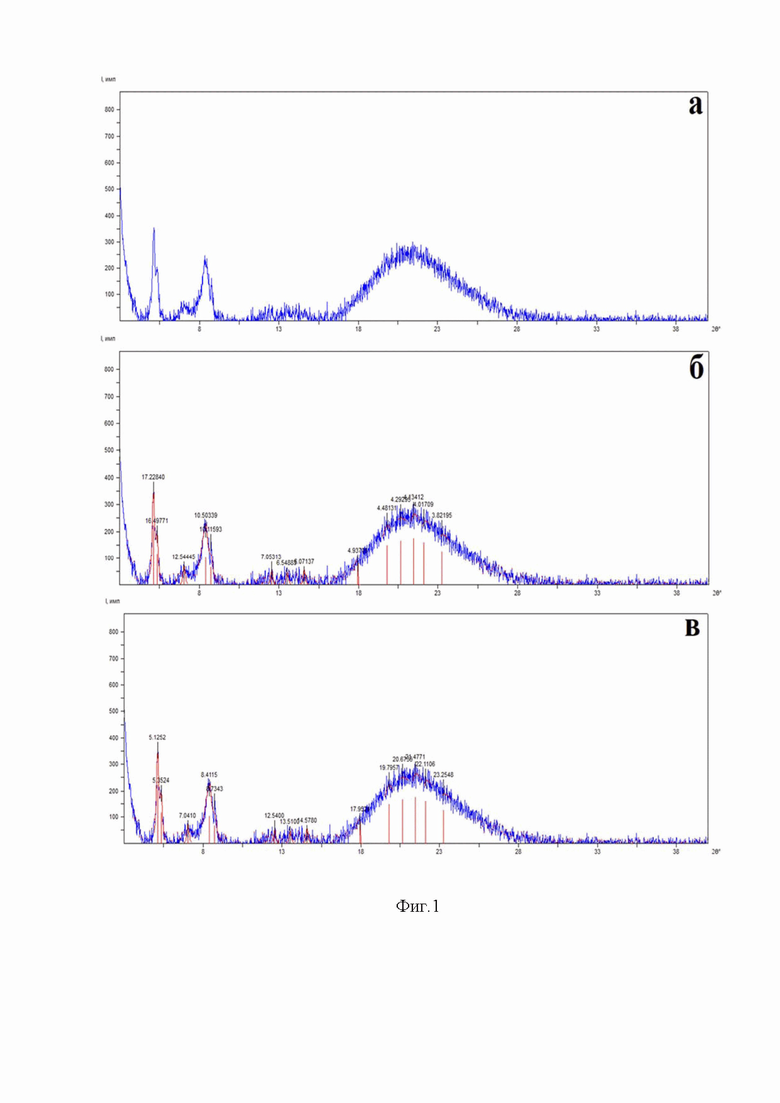
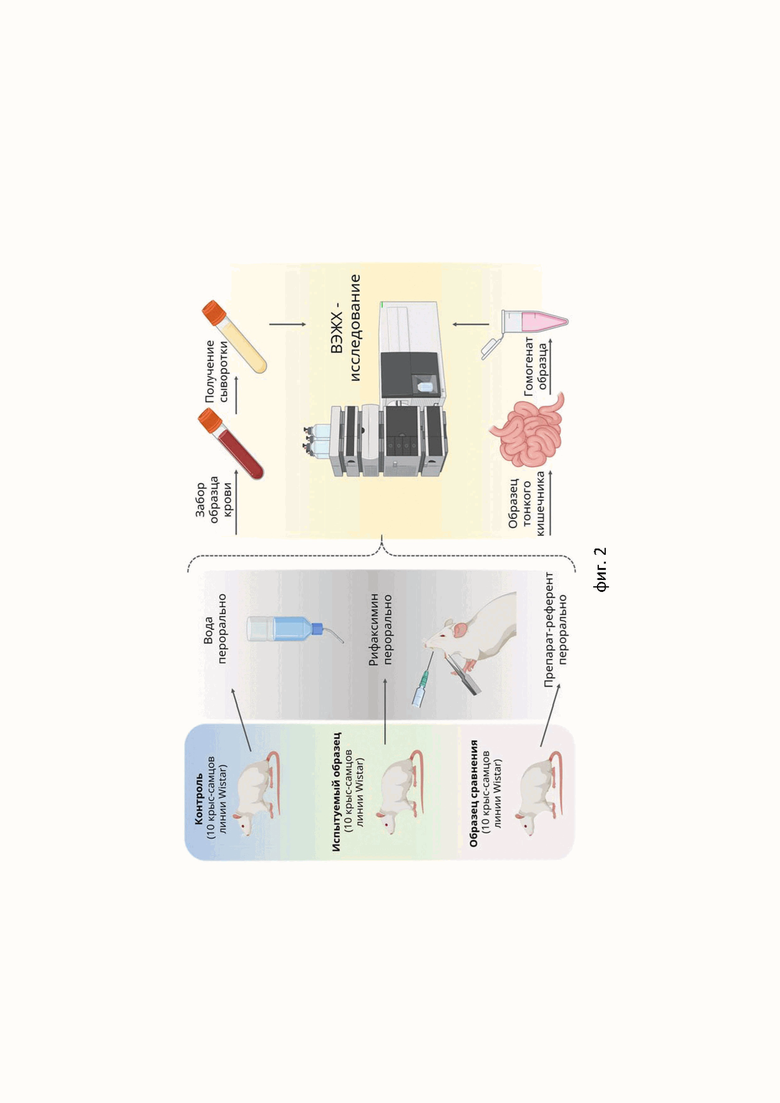
Настоящее изобретение дополнительно проиллюстрировано посредством Фиг. 1 и Фиг. 2. На Фиг.1 изображены дифрактограммы образца ангидроформы рифаксимина: а – необработанная, б – с подписанными значениями d для каждого из пиков, в – с подписанными значениями углов 2θ для каждого из пиков с исключением линий дуплета α1+α2. На Фиг.2 изображена общая схема экспериментов по изменению концентрации рифаксимина в исследуемых образцах сыворотки крови в динамике.
Изобретение поясняется следующими иллюстративными примерами, которые не ограничивают заявленный объем охраны.
Пример 1. Получение ангидроформы рифаксимина.
В колбу емкостью 2000 мл снабженную перегонным холодильником и мешалкой заливают пропанол 1200 мл, при перемешивании присыпают рифаксимина сырца 365 г, с содержанием воды 4% нагревают суспензию до температуры кипения 88°С, при этом рифаксимин растворяется с образованием раствора интенсивно красного цвета. Далее отгоняют в приемную колбу 200 мл водно-спиртовой азеотропной смеси. Раствор охлаждают до температуры 15°С и при интенсивном перемешивании присыпают затравочные кристаллы, продолжают перемешивание до образования устойчивой суспензии в течение 2 часов, после чего охлаждают до температуры +3°С, выдерживают при этой температуре 10 часов. Суспензию отфильтровывают, промывают охлажденным пропанолом 450 мл. Высушивают в токе азота при температуре 50°С в течение 6 часов. Вес полученного сухого кристаллического порошка 299,0 г, содержание основного вещества 99,2%, содержание воды методом Фишера 0,3%. Параметры линий дифрактограммы образца рифаксимин представлены в таблице 1, а также рентгеновская дифрактограмма образца полученной ангидроформы рифаксимина представлена на фиг.1.
Таблица 1. Параметры линий дифрактограммы образца рифаксимина
Анализ полиморфной модификации методом рефрактоскопии показывает характерные максимумы углов пиков дифракции 2Ɵ: 5,12°; 5,35°; 7,04°; 8,41°; 8,73°; 12,54°; 13,51°; 14,57°; 17,95°; 19,79°; 20,67°; 21.47°; 22,11°; 23,25°.
Пример 2. Получение ангидроформы рифаксимина.
В колбу емкостью 2000 мл загружают метанола 1400 мл, присыпают рифаксимина 300 г, содержание основного вещества 97% и воды 6 %, присыпают безводного сульфата меди 600 г, нагревают суспензию до температуры 50°С и перемешивают в течение 12 часов. Осушенный раствор рифаксимина отфильтровывают, охлаждают до температуры -10°С, выпавшие кристаллы рифаксимина отфильтровывают, промывают охлажденным метанолом 100 мл. Высушивают порошок от остаточных количеств растворителя в токе азота при температуре 50°С в течение 4 часов. Вес сухого кристаллического порошка 265,1 г. Содержание основного вещества 98,5%, содержание воды методом Фишера 0,25%. Картина дифракции рентгеновских лучей на порошке (XRPD) продукта характеризуется теми же самыми значениями 2θ для пиков дифракции, представленных на фиг. 1, и соответствует картине дифракции рентгеновских лучей на фиг. 1, рассчитанной на основе данных для монокристалла в соответствии с примером 1.
Пример 3. Получение ангидроформы рифаксимина.
В колбу емкостью 2000 мл, снабженную обратным холодильником загружают этанола 1000 мл, присыпают рифаксимина сырца 160 г, нагревают суспензию до температуры 60°С, перемешивают до растворения, присыпают безводного кальция хлористого 320 г, перемешивают в течение 12 часов, увлажненный хлористый кальций отфильтровывают, прозрачный раствор охлаждают до температуры 5°С, выпавший рифаксимин отфильтровывают, промывают спиртом, высушивают от растворителя. По окончании сушки рифаксимина получают кристаллический рифаксимин 112+,6 г, содержание основного вещества 98,5% и влаги 0,25%. Картина дифракции рентгеновских лучей на порошке (XRPD) продукта характеризуется теми же самыми значениями 2θ для пиков дифракции, представленных на фиг. 1, и соответствует картине дифракции рентгеновских лучей на фиг. 1, рассчитанной на основе данных для монокристалла в соответствии с примером 1.
Пример 4. Получение фармацевтической композиции рифаксимина в ангидроформе.
Рифаксимин, полученный по описанию пример 3 в количестве 105,5 г, смешивают с целлюлозой мелкокристаллической 80 г, кремния диоксидом 1,8 г, карбоксиметилкрахмала натрия 4,5 г, талька 2,7 г и магния стеарата 0,9 г. Тщательно перемешивают смесь до получения однородной массы. Рассыпают смесь на поддоны, высотой слоя смеси около 1 см, помещают поддоны в вакуум сушильный шкаф. Сушат при температуре 65°С и вакууме 1 мм.рт.ст. в течение 16 часов. По окончании процесса получают массу с содержанием влаги 0,9%. Из массы прессуют таблетки весом 380 мг цилиндрической формы диаметром 11 мм. Полученные таблетки, отличаются высокой физико-химической стабильностью при колебаниях температуры от -30°С до 65°С.
Пример 5. Сравнение свойств таблеток рифаксимина наработанных из образцов рифаксимина с различной влажностью.
Порошок кристаллогидрата рифаксимина с влагой 5,0%, порошок рифаксимина с влагой 2,0%, полученный высушиванием рифаксимина с влагой 5,0% и порошок рифаксимина с влагой 0,3%, полученный по примеру 1, используют для получения таблеток одинаковой формы и рецептуры, для чего рифаксимина 100 г смешивают с целлюлозой мелкокрисаталлической 80 г, кремния диоксида 1,8 г, карбоксиметилкрахмала натрия 4,5 г, талька 2,7 г и магния стеарата 0,9 г. Смеси компонентов гомогенизируют до получения однородных таблет масс. Из таблет масс спрессовывают таблетки цилиндрической формы, весом 380 мг диаметром 11 мм. Полученные таблетки закупоривают в герметичные контейнеры и помещают в термостат с циклично меняющейся температурой от -30°С до 65°С, при этом цикл нагрева длится 8 часов, а цикл охлаждения 16 часов. По истечении определенного количества циклов таблетки тестировали на показатели внешний вид и механическую прочность сжатием в диаметральном направлении измеряемую в Ньютонах. Результаты измерений сведены в таблицу 2.
Таблица 2. Зависимость характеристик таблеток рифаксимина от содержания влаги при колебаниях температуры.
прочность на момент таблетирования
прочность через 14 циклов колебания температуры
через 60 циклов
колебания температуры
Приведенные результаты показывают, что фармацевтическая композиция рифаксимина в ангидроформе с влагой менее 1% обеспечивает высокую стабильность лекарственной формы при колебаниях температуры в широком диапазоне.
Пример 6. Изменение концентрации рифаксимина в исследуемых образцах сыворотки крови в динамике.
Использовались аутбредные, половозрелые крысы-самцы Wistar, 30 особей в группе. Количество групп 3: первая группа – получала испытуемый препарат, охарактеризованный в формуле настоящего изобретения; вторая группа – получала референтный препарат (Альфа-Нормикс, Италия, ЛП-008488), третья группа – контрольная (вода перорально). Животные были получены из питомника лабораторных животных «Рапполово» и на время исследования содержались в помещениях вивария в контролируемых условиях: температура окружающего воздуха 22 ± 2°С, относительная влажность 60±5%, при естественной смене суточного цикла и со свободным доступом к полнорационному корму и воде. Содержание и манипуляции с животными соответствовали положениям Директивы ЕС2010/63 «О защите животных, использующихся в научных целях». Животным перорально однократно вводили рифаксимин и референт в дозе 418 мг/кг (рассчитана с учетом межвидового коэффициента пересчета доз и суточной дозы рифаксимина 2400 мг). У животных через промежутки времени (0,5 часа, 1 час, 2 часа, 4 часа, 8 часов, 16 часов, 24 часа, 48 часов) производят забор крови с последующим получением сыворотки и определением концентрации рифаксимина в крови согласно методике действующий фармакопейной статьи 1. Забор крови осуществляли из подъязычной вены с применением ножниц типа «каставьехо» в пробирки Эппендорф с цитратным наполнением. Объем отбираемой крови на каждом этапе составил 0,35 мл. Далее цельную кровь центрифугировали в режиме 3500 с получением сыворотки, которую замораживали до проведения анализа. Сыворотку переносили в центрифужные пробирки, осаждали белки, повторно центрифугировали. Конечный объем аналита составил 0,7 мл. Забор тонкого кишечника осуществляли после цервикальной дислокации животных под хлоралгидратной анестезией (350 мг/кг, внутрибрюшинно). Фрагмент тонкого кишечника (L= 10 мм) промывали от содержимого буферным раствором PBS (рН=7,4), после чего гомогенизировали в том же растворе в соотношении масса ткани:буфер - 1:10. Полученный гомогенат центрифугировали при 10 000g – 20 мин. Супернатант переносили в пробирки типа эппендорф и использовали для проведения анализа.
Содержание рифаксимина в испытуемых образцах оценивали методом ВЭЖХ. Условия хроматографирования: Подвижная фаза: Ацетонитрил—метанол 1:1; колонка: Agilent ZORBAX; температура колонки 40 °С; скорость потока 1,4 мл/мин; детектор спектрофотометрический, 276 нм; объём пробы 20 мкл; хроматоргаф: «Dionex» UltiMate 3000. Полученные результаты обрабатывали методами вариационной статистики.
В ходе статистического анализа использовали пакет прикладных программ StatPlus 7.0. Нормальность распределения данных оценивали с применением теста Шапиро-Уилка. Однородность дисперсий определяли тестом Левена. Статистически значимые оценивали методом однофакторного дисперсионного анализа с пост-тестом Ньюмена-Кейлса (при нормальном распределении данных) или пот-тестом Краскелла-Уоллиса (при распределении данных отличных от нормального) при критическом уровне значимости р<0,05. Парное сравнение осуществляли в тесте Манна-Уитни при р<0,05.
Изменение концентрации рифаксимина мг/мл в исследуемых образцах сыворотки крови в динамике представлено в таблице 3.
Таблица 3. Изменение концентрации рифаксимина мг/мл в исследуемых образцах сыворотки крови в динамике (M±SD)
Примечание: * - достоверно относительно показателя 0,5 часа (ANOVA, с пост-обработкой Ньюмена-Кейлса); # - достоверно относительно образца сравнения (критерии Манна-Уитни, парное сравнение)
В образцах плазмы крови крыс, получавших образец сравнения, рифаксимин детектировался во временном отрезке 16 часов в концентрации ~ 4% от введенной дозы. При этом, начиная с 4 –го часа наблюдалось статистически достоверное уменьшение содержания рифаксимина в плазме крови крыс по отношению к показателю, полученному по истечении 0,5 часа после введения рифаксимина. У животных, которым вводили испытуемый образец, рифаксимин обнаруживался в плазме крови во временном отрезке – 24 часа в концентрации ~ 3% от введенной дозы. Следует отметить, что через 0,5 часа, 1 час и 2 часа после введения рифаксимина, его содержание в образцах плазмы крови животных, получавших испытуемый образец, было достоверно меньше аналогичного у крыс, которым вводили образе сравнения. В дальнейшем в интервале 9-16 часов концентрация рифаксимина в крови у крыс, получавших испытуемый образец, была выше таковой у животных, которым вводили референт. Во временном интервале 0,5-2 часа в образцах плазмы крови крыс, получавших испытуемый образец, обнаруживается меньшее количество рифаксимина, чем в плазме крыс, которым вводили референт, что может свидетельствовать о более низкой системной абсорбции препарата и нахождении его в просвете кишечника в больших концентрациях.
Пример 7. Изменение концентрации рифаксимина в исследуемых образцах сыворотки крови в динамике
Использовались аутбредные, половозрелые крысы-самцы Wistar, 30 особей в группе. Количество групп 3: первая группа – получала испытуемый препарат, охарактеризованный в формуле настоящего изобретения; вторая группа – получала референтный препарат (Альфа-Нормикс, Италия, ЛП-008488), третья группа – контрольная (вода перорально). Животные были получены из питомника лабораторных животных «Рапполово» и на время исследования содержались в помещениях вивария в контролируемых условиях: температура окружающего воздуха 22±20°С, относительная влажность 60±5%, при естественной смене суточного цикла и со свободным доступом к полнорационному корму и воде. Содержание и манипуляции с животными соответствовали положениям Директивы ЕС2010/63 «О защите животных, использующихся в научных целях». Животным перорально однократно вводили рифаксимин и референт в дозе 418 мг/кг (рассчитана с учетом межвидового коэффициента пересчета доз и суточной дозы рифаксимина 2400 мг). Забор тонкого кишечника осуществляли после цервикальной дислокации животных под хлоралгидратной анестезией (350 мг/кг, внутрибрюшинно). Фрагмент тонкого кишечника (L= 10 мм) промывали от содержимого буферным раствором PBS (рН=7,4), после чего гомогенизировали в том же растворе в соотношении масса ткани:буфер - 1:10. Полученный гомогенат центрифугировали при 10 000g – 20 мин. Супернатант переносили в пробирки типа эппендорф и использовали для проведения анализа.
Содержание рифаксимина в испытуемых образцах оценивали методом ВЭЖХ. Условия хроматографирования: Подвижная фаза: Ацетонитрил—метанол 1:1; колонка: Agilent ZORBAX; температура колонки 40 °С; скорость потока 1,4 мл/мин; детектор спектрофотометрический, 276 нм; объём пробы 20 мкл; хроматоргаф: «Dionex» UltiMate 3000. Полученные результаты обрабатывали методами вариационной статистики.
В ходе статистического анализа использовали пакет прикладных программ StatPlus 7.0. Нормальность распределения данных оценивали с применением теста Шапиро-Уилка. Однородность дисперсий определяли тестом Левена. Статистически значимые оценивали методом однофакторного дисперсионного анализа с пост-тестом Ньюмена-Кейлса (при нормальном распределении данных) или пот-тестом Краскелла-Уоллиса (при распределении данных отличных от нормального) при критическом уровне значимости р < 0,05. Парное сравнение осуществляли в тесте Манна-Уитни при р<0,05.
Анализируя изменение концентрации рифаксимина в стенке кишечника было показано, что у крыс, которым вводили референт содержание рифаксимина снижалось с течением времени (p < 0,05). При этом стабильные концентрации были зафиксированы в интервале 0,5-2 часа. В то же время у животных, получавших испытуемый образец, рифаксимин обнаруживался в стенке кишечника спустя 24 часа после введения. В интервале 0,5-2 часа концентрация рифаксимина в стенке кишечника у крыс, получавших испытуемый образец, была выше таковой у животных, которым вводили референт, но статистической достоверности зафиксировано не было (см. таблица 4).
Таблица 4. Изменение концентрации рифаксимина мг/мл в исследуемых образцах супернатанта кишечника в динамике (M±SD).
Повышенное содержание рифаксимина у крыс, получавших испытуемый образец, в интервале 4-24 часа, может свидетельствовать о более медленном клиренсе рифаксимина и его продолжительном присутствии в просвете кишечника. Также о более медленном клиренсе рифаксимина испытуемого образца может свидетельствовать более длительное его нахождение в стенке кишечника крыс. Повышение концентраций рифаксимина в просвете кишечника у испытуемого препарата, на фоне сравниваемого препарата может иметь важное клиническое значение, как со стороны повышения его антимикробной эффективности, так и снижения вероятности формирования устойчивых патогенных штаммов.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ РИФАКСИМИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ | 2006 |
|
RU2397985C2 |
| ПОЛИМОРФ РИФАКСИМИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2593750C2 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ СОЛЕВАЯ ФОРМА 2,2-ДИМЕТИЛ-6-((4-((3,4,5-ТРИМЕТОКСИФЕНИЛ)АМИНО)-1,3,5-ТРИАЗИН-2-ИЛ)АМИНО)-2Н-ПИРИДО[3,2-В][1,4]ОКСАЗИН-3(4Н)-ОНА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2016 |
|
RU2621187C1 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770301C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770300C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2017 |
|
RU2706166C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ СОЕДИНЕНИЯ ST-246 И СПОСОБЫ ПОЛУЧЕНИЯ | 2011 |
|
RU2578606C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ РИФАКСИМИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ПРЕПАРАТАХ | 2004 |
|
RU2270200C2 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ СОЛЕВАЯ ФОРМА 3-(1,2,4-ТРИАЗОЛО[4,3-А]ПИРИДИН-3-ИЛЭТИНИЛ)-4-МЕТИЛ-N-(4-((4-МЕТИЛПИПЕРАЗИН-1-ИЛ)МЕТИЛ)-3-ТРИФТОРМЕТИЛФЕНИЛ)БЕНЗАМИДА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2016 |
|
RU2652992C2 |
| КОМПОЗИЦИИ ТЕЛМИСАРТАНА В ФОРМЕ НАНОЧАСТИЦ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2526914C2 |
Изобретение относится к фармацевтической композиции, характеризующейся пролонгированным антибиотическим действием в просвете кишечника, содержащей терапевтически эффективное количество кристаллического рифаксимина с содержанием воды менее 1,0% с характерными максимумами углов дифракции 2θ: 5,12°; 5,35°; 7,04°; 8,41°; 8,73°; 12,54°; 13,51°; 14,57°; 17,95°; 19,79°; 20,67°; 21,47°; 22,11°; 23,25° из расчета на одну массовую часть рифаксимина целлюлозы микрокристаллической – от 0,6 до 0,8 частей, карбоксиметилкрахмала натрия от 0,035 до 0,045 частей, талька от 0,02 до 0,03 частей, кремния диоксида от 0,015 до 0,02 частей и магния стеарата от 0,005 до 0,01 части. Технический результат - создание нетоксичной фармацевтической композиции рифаксимина с высокой физико-химической и фармакокинетической стабильностью и пролонгированным эффектом действия. 1 з.п. ф-лы, 2 ил., 4 табл., 7 пр.
1. Фармацевтическая композиция, характеризующаяся пролонгированным антибиотическим действием в просвете кишечника, содержащая терапевтически эффективное количество кристаллического рифаксимина с содержанием воды менее 1,0% с характерными максимумами углов дифракции 2θ: 5,12°; 5,35°; 7,04°; 8,41°; 8,73°; 12,54°; 13,51°; 14,57°°; 17,95°; 19,79°; 20,67°; 21,47°; 22,11°; 23,25° из расчета на одну массовую часть рифаксимина целлюлозы микрокристаллической – от 0,6 до 0,8 частей, карбоксиметилкрахмала натрия от 0,035 до 0,045 частей, талька от 0,02 до 0,03 частей, кремния диоксида от 0,015 до 0,02 частей и магния стеарата от 0,005 до 0,01 части.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что она выполнена в форме таблетки или капсулы.
| Секционная консервная коробка | 1930 |
|
SU22490A1 |
| Дальномер | 1931 |
|
SU30457A1 |
| WO 2018197538 A1, 01.11.2018 | |||
| US 8227482 B1, 24.07.2012 | |||
| Кислотный цилиндр для пенного огнетушителя | 1930 |
|
SU25047A1 |
| Прибор для испытания формовочной земли | 1930 |
|
SU22324A1 |
| CN 103509038 A, 15.01.2014 | |||
| С.К | |||
| Зырянов, Е.А | |||
| Байбулатова | |||
| Рифаксимин-альфа и другие кристаллические формы рифаксимина: есть ли отличия? АНТИБИОТИКИ И ХИМИОТЕРАПИЯ | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2024-07-15—Публикация
2024-02-07—Подача