Изобретение относится к области медицины, фармакологии и химико-фармацевтической промышленности, а именно новым полиморфным формам тримебутина малеата и способам их получения и применения.
В клинической практике значительную часть заболеваний составляют функциональные заболевания желудочно-кишечного тракта. Функциональные расстройства кишечника (ФРК) включают группу гетерогенных клинических состояний, которые проявляются симптомами со стороны среднего и нижнего отделов желудочно-кишечного тракта и не сопровождаются какими-либо структурными, системными либо метаболическими изменениями. Несмотря на отсутствие органической основы, функциональные заболевания снижают качество жизни пациентов и наносят большой экономический ущерб обществу как по прямым показателям затрат на медицинское обслуживание и лечение, так и по непрямым показателям, включающим компенсацию временной нетрудоспособности.
В первую очередь к таким заболеваниям относят синдром раздраженной толстой кишки. По данным эпидемиологических исследований 15-20% населения страдает синдромом раздраженной кишки. Выделяют несколько форм этой болезни: по варианту диареи, по варианту запоров, смешанную форму. Менее часто встречаются другие функциональные заболевания кишечника, такие как функциональная диарея, функциональный запор, идиопатическая абдоминальная боль и др.
Во многих странах, начиная с 1969 г., для лечения функциональных расстройств кишечника, в основном при синдроме раздраженной кишки (СРК) применяется тримебутин. В России, в конце 2007 г., он был зарегистрирован под торговым названием Тримедат®. Эффективность тримебутина малеата в снижении абдоминальной боли была продемонстрирована в различных клинических исследованиях. Длительное время полагали, что влияние тримебутина малеата связано с его спазмолитической активностью и считали, что этот препарат действует наподобие миотропного спазмолитика мебеверина. Однако позднее были обнаружены новые данные, касающиеся механизма действия тримебутина малеата, нехарактерные для спазмолитических препаратов. В экспериментальных и клинических исследованиях было показано модулирующее влияние тримебутина малеата на моторную функцию желудочно-кишечного тракта (ЖКТ), которое проявлялось в его нормализующих эффектах на гипо- и гиперкинетические нарушения моторики ЖКТ при терапевтической и хирургической патологии. Тримебутин оказывает значительное обезболивающее действие. При проведении экспериментальных исследований выяснилось, что тримебутин является агонистом опиатных рецепторов и его модулирующее влияние на моторику ЖКТ и обезболивающий эффект определяются благодаря неспецифическому действию этого препарата на все классы периферических опиатных рецепторов - μ, κ и δ. Действуя на энкефалинергическую систему кишечника, регулирует перистальтику ЖКТ. Действует на всем протяжении ЖКТ, снижает давление сфинктера пищевода, способствует опорожнению желудка и усилению перистальтики кишечника; способствует ответной реакции гладкой мускулатуры толстой кишки на пищевые раздражители.
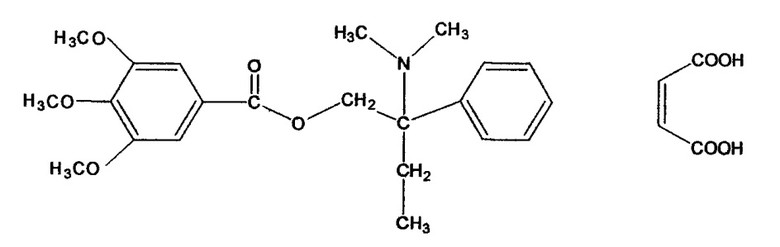
2-(диметиламино)-2-фенилбутил-3,4,5-триметоксибензоата малеат (тримебутина малеат)
Основные показания, для которых применяют малеат тримебутина, включают синдром раздраженного кишечника, послеоперационную паралитическую кишечную непроходимость, подготовку к рентгенологическому и эндоскопическому исследованиям ЖКТ.
В основном тримебутин назначают перорально в виде различных твердых лекарственных форм, в том числе в виде таблеток, как быстрораспадающихся, так и с замедленным действием. Поскольку тримебутин плохо растворим в воде, для повышения его биодоступности была получена и введена в клиническую практику его более растворимая соль - малеат.
В источнике [WO2013134869, “Preparation of sulfonate-based trimebutine salts for use as gastrointestinal endoscopic and medical imagining and for the treatment of visceral pain”, опубл. 19.09.2013] были идентифицированы две различные полиморфные формы тримебутина 3-тиокарбамоилбензолсульфоната. Полиморф А был получен при кристаллизации из смеси ацетона и метанола, в то время как полиморф В был получен при кристаллизации из метанола. Полиморф B более стабилен термодинамически, чем полиморф A. Полиморф А плавится при температуре около 128°С, тогда как полиморф В плавится при температуре около 180°C. Также были идентифицированы три различных полиморфа п-толуолсульфоната тримебутина. Полиморфы A и B получали путем кристаллизации из изопропилового спирта. Полиморф B был получен при кристаллизации из этанола. Полимер С также получают из этанола. Полиморф С более стабилен термодинамически, чем полиморфы А и В. Полиморф А плавится при температуре около 123°С, полиморф B плавится при температуре около 142°С, а полиморф С плавится при температуре около 173°С.
Кристаллическая структура дималеата тримебутина описана в обзоре [Coquerel G. “Limits of the co-crystal concept and beyond”, RSC Drug Discovery Series, 2012, vol.16, pp. 300-317].
Синтез малеата тримебутина описан, например, в патенте GB1342547, где малеат тримебутина получают реакцией основания тримебутина с малеиновой кислотой в воде при нагревании с последующей кристаллизацией.
При этом до настоящего времени неизвестно о получении и исследовании свойств полиморфных форм тримебутина малеата.
Авторами настоящего изобретения неожиданно было установлено, что тримебутина малеат может существовать в новой полиморфной кристаллической форме, которая имеет лучшие свойства, чем тримебутина малеат, полученный согласно способу, описанному в GB1342547, именуемый в дальнейшем «прототип».
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Лекарственное начало» (лекарственная субстанция, лекарственное вещество) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя новую полиморфную форму тримебутина малеата и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, диспергирующие агенты, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от их природы, способа введения композиции и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, таких как моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами диспергирующих агентов и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные таблетки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или получены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные, предпочтительно, малеаты (Подробное описание свойств таких солей дано в Berge S.M., et al., “Pharmaceutical Salts” J. Pharm. Sci. 1977, 66: 1-19). Могут быть получены соли с аминокислотами. В качестве аминокислот могут быть использованы кислые аминокислоты - глутаминовая и аспарагиновая кислоты.
Задачей настоящего изобретения является разработка стабильной при хранении, негигроскопичной, хорошо растворимой, экономически целесообразной, промышленно реализуемой препаративной полиморфной формы тримебутина малеата.
Стабильность в твердом состоянии и срок хранения активных компонентов являются очень важными факторами. Лекарственное соединение и композиции, включающие его, должны обладать способностью храниться в течение значительных периодов времени, не проявляя значительного изменения физико-химических свойств активного компонента (например, его химического состава, плотности, гигроскопичности и растворимости). Кроме того, также является важным представить лекарственный препарат в форме, которая является как можно более чистой. В этом отношении аморфные соединения могут представлять значительные проблемы. Например, с такими соединениями труднее обращаться и включать их в лекарственные формы по сравнению с кристаллическим соединением, и часто оказывается, что они нестабильны и химически загрязнены. Специалисту в данной области будет понятно, что, если лекарственный препарат можно легко получать в стабильной кристаллической форме, то можно решить вышеуказанные проблемы.
Технический результат настоящего изобретения заключается в улучшенных свойствах данного соединения при его препаративном использовании, в частности более высокой скорости растворения, повышенной стабильности при хранении и низкой гигроскопичности.
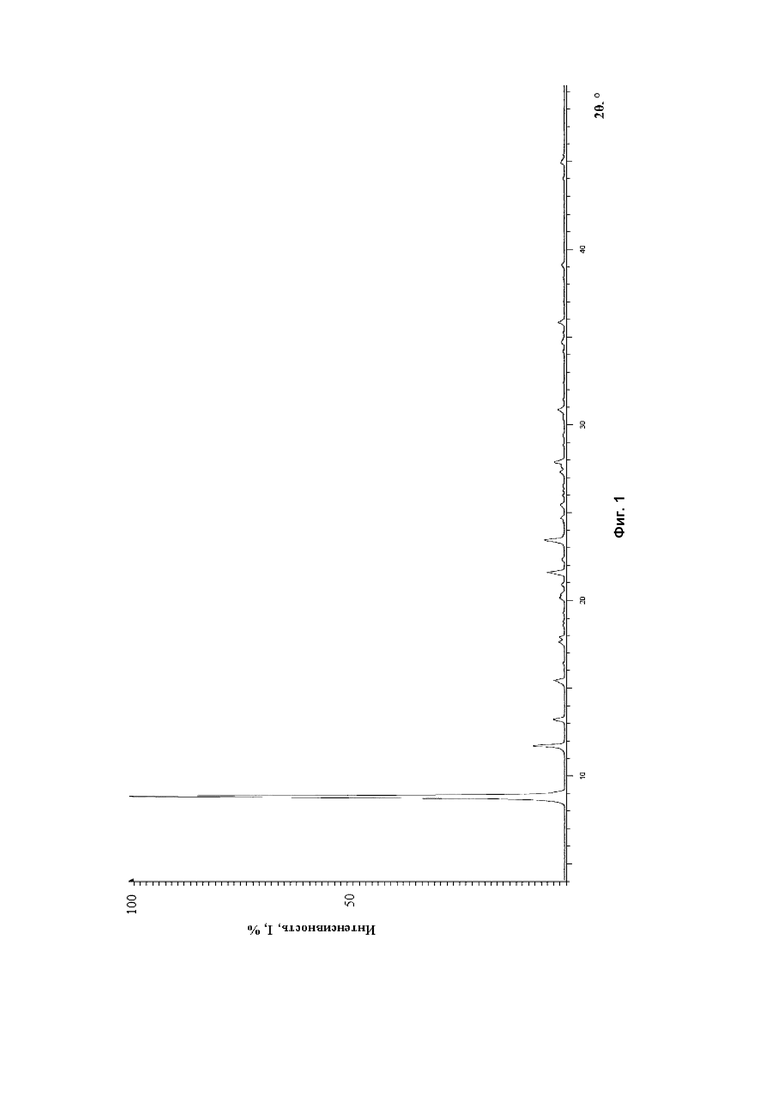
Поставленная задача осуществляется, а технический результат достигается получением новой полиморфной формы тримебутина малеата, имеющей на порошковой рентгеновской дифрактограмме характеристические пики при следующих углах 2θ, ° (± 0,1°): 8,7; 11,6; 13,2; 15,3; 17,6; 20,1; 20,3; 20,8; 21,5; 23,4; 24,7; 25,4; 27,3; 27,9; 30,8; 34,7; 35,8; 39,1; 45,0.
Поставленная задача решается, а заявленный технический результат также достигается созданием фармацевтической композиции для лечения синдрома раздраженного кишечника, послеоперационной паралитической кишечной непроходимости, подготовки к рентгенологическому и эндоскопическому исследованиям ЖКТ, содержащей в терапевтически эффективном количестве вышеупомянутую полиморфную форму соединения тримебутина малеата и, по меньшей мере, один фармацевтически приемлемый носитель.
Поставленная задача решается, а заявленный технический результат достигается также созданием лекарственного средства для лечения синдрома раздраженного кишечника, послеоперационной паралитической кишечной непроходимости, для подготовки к рентгенологическому и эндоскопическому исследованиям ЖКТ в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащего в терапевтически эффективном количестве упомянутую новую полиморфную форму соединения тримебутина малеата или фармацевтическую композицию по настоящему изобретению.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемым эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с новой полиморфной формой соединения тримебутина малеата по настоящему изобретению может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в частности, в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка средства, содержащего новую полиморфную форму соединения тримебутина малеата по настоящему изобретению, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 50-1000 мг, предпочтительно - 300-600 мг. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10-500 мг новой полиморфной формой соединения тримебутина малеата по настоящему изобретению, предпочтительно - 50-300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Также изобретение поясняется чертежом.
На фиг. 1. приведена порошковая рентгеновская дифрактограмма новой полиморфной формы тримебутина малеата, полученной согласно настоящему изобретению. Зависимость интенсивности I, % от угла 2θ, ° (± 0,1°).
Далее приводятся примеры осуществления изобретения, которые иллюстрируют, но не ограничивают изобретение.
Пример 1. Получение полиморфной формы тримебутина малеата
10 мг тримебутина малеата растворяли в 10 мл метанола, нагревая смесь до 40°C. К полученному раствору по каплям добавляли 10 мл воды при той же температуре в течение 20 минут и полученную смесь охлаждали до 5°C в течение суток, после чего отфильтровывали и собирали кристаллическое вещество. Кристаллы сушили при 50°C при пониженном давлении до тех пор, пока масса кристаллов не перестала уменьшаться при дальнейшем высушивании, в результате чего получили 9,75 мг белого твердого вещества с температурой плавления 132-133°С.
Наличие полиморфных форм в тримебутина малеате исследовали с помощью трех методов обнаружения, соответствующих рекомендациям Международной конференции по гармонизации Q6 A: анализ дифференциальной сканирующей калориметрии (ДСК), инфракрасная спектрофотометрия в твердом состоянии (FT-ИК) и порошковая рентгеновская дифракция).
Анализ тримебутина малеата с помощью дифференциальной сканирующей калориметрии был осуществлен на ДСК Perkin Elmer. Термограммы были зарегистрированы в атмосфере азота при скорости нагревания 5°C/мин. Термограммы трех серий продемонстрировали эндотермичность в диапазоне 105,6° - 105,7°C.
FT-ИК спектры тримебутина малеата были зарегистрированы в твердом состоянии в виде дисперсии KBr с помощью FT-ИК спектрофотометра Shimadzu. ИК спектры трех серий идентичны.
Картины порошковой рентгеновской дифракции трех серий тримебутина малеата были получены с помощью дифрактометра, оснащенного горизонтальным гониометром в θ /2θ.
На спектре порошковой рентгеновской дифрактограммы кристаллического вещества (Фиг. 1) наблюдали характеристические пики при углах дифракции 2θ, ° (± 0,1°): 8,7; 11,6; 13,2; 15,3; 17,6; 20,1; 20,3; 20,8; 21,5; 23,4; 24,7; 25,4; 27,3; 27,9; 30,8; 34,7; 35,8; 39,1; 45,0. (Таблица 1).
Таблица 1. Значения пиков порошковой рентгеновской дифрактограммы.
Пример 2. Определение кинетики растворения новой полиморфной формы.
Кинетику растворения новой полиморфной формы тримебутина малеата, полученной в Примере 1, оценивали по содержанию субстанции в растворяющей среде и сравнивали с кинетикой растворения прототипа. Прибор для определения скорости растворения представляет собой трехгорлый сосуд емкостью 1 л. В один из тубусов вводили термометр, в другой - стеклянную трубку для взятия проб и их комплексирования, а в третий - основную деталь прибора - цилиндрическую корзинку высотой 3,6 см и диаметром 2,5 см, сделанную из нержавеющей стали в виде сетки с отверстиями диаметром 40 меш (около 0,351 мм). Корзинка была насажена на ось мотора.
В сосуд наливали растворяющую среду (1000 мл), в данном эксперименте смесь этанола с водой 50:50, поскольку он является одним из распространенных носителей для инъекционных форм и часто используется как растворитель в химических реакциях и системах биологического скрининга. Исследуемый образец помещали в цилиндрическую корзинку, которую устанавливали на расстоянии 2 см от дна сосуда.
Для сравнительного образца 1 использовали 200 мг новой полиморфной формы тримебутина малеата с получением после полного растворения раствора, содержащего 200 м.д. тримебутина малеата, а для сравнительного образца 2 - 200 мг прототипа с получением после полного растворения раствора, содержащего 200 м.д. прототипа.
Температуру растворяющей среды во время опыта поддерживали постоянной (37±0,5°С). Скорость вращения корзинки в среде регулировали с точностью ±5%, она составляла 200 об/мин. Через установленные интервалы времени отбирали для анализа пробы по 1-2 мл для определения содержания лекарственного вещества. Взятый объем растворителя тотчас же восполняли новым.
Полученные результаты приведены в таблице 2 (где величины представляют собой количество (м.д.) образцов 1 или 2 в растворе.
Таблица 2. Кинетика растворения новой полиморфной формы.
(новая полиморфная форма тримебутина малеата)
(прототип)
Результаты демонстрируют, что скорость растворения новой полиморфной формы тримебутина малеата в водно-спиртовой смеси выше, чем скорость растворения прототипа. В частности, время, в течение которого происходит 50 % растворение новой полиморфной формы тримебутина малеата, статистически значительно меньше, чем для сравнительного образца прототипа.
Пример 3. Исследование стабильности при хранения новой полиморфной формы.
Стабильность новой полиморфной формы тримебутина малеата, полученной в Примере 1, оценивали по содержанию субстанции и сравнивают со стабильностью прототипа методом ускоренного старения.
Все образцы хранились в стеклянных флаконах, укупоренных резиновыми пробками с алюминиевыми колпачками, в климатической камере в условия ускоренных испытаний. Содержание действующего вещества определяют методом ВЭЖХ с использованием стандартов.
Метод «ускоренного старения» заключается в выдерживании испытуемого лекарственного средства при температурах и влажности, превышающих температуру и влажность его хранения в процессе обращения. При повышенных температурах, как правило, ускоряются протекающие в лекарственных средствах физико-химические процессы, приводящие со временем к нежелательным изменениям качества. Таким образом, при повышенной температуре промежуток времени, в течение которого контролируемые показатели качества лекарственного средства сохраняются в допустимых пределах (экспериментальный срок годности), искусственно сокращается в сравнении со сроком годности при температуре хранения. Это позволяет значительно сократить время, необходимое для установления срока годности.
По результатам, полученным в процессе «ускоренного старения» лекарственного средства, можно решить также обратную задачу, т.е. установить температуру хранения, обеспечивающую какой-либо заданный срок годности.
Срок годности (С) при температуре хранения (tхр) связан с экспериментальным сроком годности (СЭ) при повышенной температуре экспериментального хранения (tэ) следующей зависимостью:
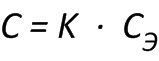 ,
,
где коэффициент соответствия 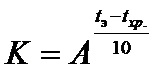
Температурный коэффициент скорости химической реакции (A) принят равным 2,5. Приведенная зависимость основана на правиле Вант-Гоффа о 2-4-кратном росте скоростей химических реакций при увеличении температуры на 10°С.
В соответствии с ОФС.1.1.0009.15 значение коэффициента соответствия (K) в зависимости от выбранного температурного интервала (tэ-tхр), равного 30°С, составляет 15,6. Срок экспериментального хранения при выбранном сроке годности 3 года составляет 71 сутки.
Статистическую обработку параметров проводят с помощью статистического пакета SPSS Statistics 19.0.
Показано, что новая полиморфная форма тримебутина малеата согласно изобретению обладает статистически достоверно увеличенной стабильностью при хранении по сравнению с прототипом.
Установлено, что после 71 суток хранения в условиях метода ускоренного старения новая полиморфная форма тримебутина малеата по настоящему изобретению обладает статистически достоверно увеличенной стабильностью и остаётся химически чистой. Субстанция прототипа остаётся химически чистой в течение менее 10 суток, далее содержание действующего вещества уменьшается более чем на 3%. То есть новая полиморфная форма тримебутина малеата по настоящему изобретению является значительно более стабильной при хранении по сравнению с прототипом.
Таблица 3. Оценка стабильности методом ускоренного старения в сравнении с прототипом.
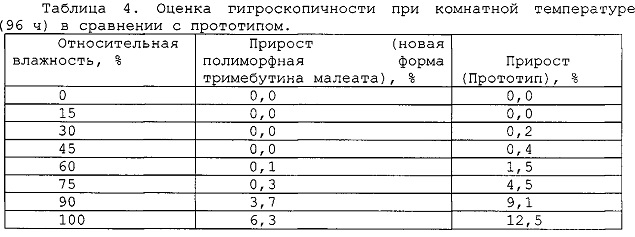
Пример 4. Определение гигроскопичности.
Пониженная гигроскопичность является большим преимуществом новой полиморфной формы тримебутина малеата при получении и хранении субстанции.
Гигроскопичность оценивали при хранении твердого соединения в камерах с постоянной относительной влажностью при комнатной температуре в течение 96 часов. Сравнение безводных полиморфной формы тримебутина малеата и прототипа при комнатной температуре показало, что прототип является гигроскопичным и обнаруживает большое увеличение влажности, начиная с 60% относительной влажности. Новая полиморфная форма тримебутина малеата не обнаруживает никакого существенного увеличения влажности за исключением хранения при относительной влажности выше 90%. Результаты представлены ниже в таблице 4.
Пример 5. Получение лекарственного средства в форме таблеток.
Смешивали 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг полиморфной формы соединения тримебутина малеата и спрессовывали в брусок. Полученный брусок измельчали в гранулы и просеивали через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетировали в подходящую форму таблетки весом 560 мг каждая.
Пример 6. Получение лекарственного средства в форме капсул.
Тщательно смешивали полиморфной формы соединения тримебутина малеата с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывали по 300 мг в желатиновые капсулы подходящего размера.
Пример 7. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивали 500 мг полиморфной формы соединения тримебутина малеата с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтровали и помещали по 1 мл в ампулы, которые запаивали.
Пример 8. Исследование спазмолитической активности новой полиморфной формы.
Эксперименты проводили на изолированных полосках мочевого пузыря нелинейных самок белых крыс массой 173±13 г [И.В. Геращенко, Н.А. Мохорт «Изучение спазмолитической активности производных имидазо[1,2-а]азепиния на изолированных полосках мочевого пузыря крыс» Экспериментальная и клиническая фармакология, 2014, Том 77, № 6, С. 24-26]. Животных содержали при температуре 22-24°C и влажности воздуха 65-75% с 14-часовым световым периодом суток со стандартным комбикормовым рационом при условии свободного доступа к воде. Перед началом эксперимента животных отсаживали в клетку без доступа к еде и воде в течение 1 ч. После взвешивания из животных выделяли мочевой пузырь и размещали на парафиновом хирургическом столике в толще буферного раствора Кребса следующего состава (в ммоль/л): NaCl - 132; KCl - 4,7; NaH2PO4-1,4; NaHCO3 - 16,3; CaCl2-2,5; MgCl2-1,05; глюкоза - 6,5. Аэрацию раствора осуществляли карбогеном (газовая смесь 5 % CО2 / 95 % О2)
У мочевого пузыря после очищения от жировой и соединительной тканей отсекали дно, затем отрезали два кольца шириной 1 мм. Кольца разрезали пополам, получая при этом полоски, которые размещали в проточной камере со скоростью потока 1,5 мл/мин и температурой 37 ± 0,5 °С. Первичное растяжение изолированных полосок производили нагрузкой 0,25 г.
Влияние исследуемой полиморфной формы на базальный тонус изолированных полосок изучали после стабилизации их реакции на периодическую стимуляцию гиперкалиевым раствором Кребса (КСl 40 мМ). Исследуемую полиморфную форму растворяли в диметилсульфоксиде и добавляли к гиперкалиевому раствору Кребса с созданием концентраций 10-7, 10-6, 10-5, 10-4 моль/л, которые прокачивали через камеру накопительно, каждая по 15 мин.
Силу сократительных движений измеряли в изометрическом режиме с помощью емкостных тензометрических датчиков FTK-0,1. Запись сокращений осуществляли персональным компьютером с помощью аналогово-цифрового преобразователя.
По записанной механограмме измеряли базальный тонус в граммах. Далее вычисляли процент расслабления, принимая за 100 % сокращения реакцию полосок в гиперкалиевом растворе Кребса.
Статистическую обработку данных проводили с помощью компьютерной программы Origin 7.5 и Microsoft Office Excel 2010. Оценивали спазмолитическую активность при указанных концентрациях в максимальном проценте расслабления (£max, %). Максимальное расслабление достигало 60 % на фоне раствора новой полиморфной формы при концентрации 10-4 моль/л, что свидетельствует о высокой спазмолитической активности новой полиморфной формы соединения тримебутина малеата.
Изобретение может быть использовано в медицине, фармакологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770300C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770301C2 |
| ТАБЛЕТКИ-РЕТАРД С ТРИМЕБУТИНОМ | 2013 |
|
RU2536254C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ТВЕРДОЙ ПЕРОРАЛЬНОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2009 |
|
RU2418576C2 |
| Комбинация для лечения функциональных заболеваний органов желудочно-кишечного тракта | 2019 |
|
RU2733719C1 |
| КОМПОЗИЦИИ ТЕТРАГИДРОБИОПТЕРИНА И СПОСОБЫ ЕГО КОЛИЧЕСТВЕННОЙ ОЦЕНКИ | 2008 |
|
RU2486899C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФУНКЦИОНАЛЬНЫХ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2020 |
|
RU2744125C1 |
| МАКРОЦИКЛИЧЕСКИЕ ПОЛИМОРФЫ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ТАКИЕ ПОЛИМОРФЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ПОЛУЧЕНИЯ | 2008 |
|
RU2478643C2 |
| ПЕРОРАЛЬНО ВВОДИМАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА РАЗДРАЖЕННОГО КИШЕЧНИКА, СОДЕРЖАЩАЯ РЕГУЛЯТОР ПЕРИСТАЛЬТИКИ КИШЕЧНИКА, СРЕДСТВО, КОТОРОЕ ПРЕДОТВРАЩАЕТ ЗАДЕРЖКУ ГАЗОВ, И ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2011 |
|
RU2581920C2 |
| ПРИМЕНЕНИЕ ТРИМЕБУТИНА МАЛЕАТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2024 |
|
RU2821790C1 |
Изобретение относится к области медицины, фармакологии и химико-фармацевтической промышленности, а именно к новой полиморфной форме тримебутина малеата и фармацевтической композиции в твердой форме, обладающей спазмолитической активностью, где упомянутая композиция содержит в терапевтически эффективном количестве новую полиморфную форму тримебутина малеата и по меньшей мере один фармацевтически приемлемый носитель. 2 н. и 1 з.п. ф-лы, 1 ил., 4 табл., 8 пр.
1. Полиморфная форма тримебутина малеата, отличающаяся тем, что упомянутая полиморфная форма имеет на порошковой рентгеновской дифрактограмме характеристические пики при следующих углах 2θ, ° (± 0,1°): 8,7; 11,6; 13,2; 15,3; 21,5; 23,4; 27,9; 30,8.
2. Фармацевтическая композиция в твердой форме, обладающая спазмолитической активностью, отличающаяся тем, что упомянутая композиция содержит в терапевтически эффективном количестве полиморфную форму тримебутина малеата по п. 1 и по меньшей мере один фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что упомянутую твердую форму выбирают из таблеток или капсул, помещенных в фармацевтически приемлемую упаковку.
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ ДНК ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЦЫПЛЯТ С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2011 |
|
RU2481403C1 |
| WO 9805320 A1, 12.02.1998 | |||
| Полый дорн для пилигримовой прокатки труб | 1986 |
|
SU1342547A1 |
| Coquerel G | |||
| "Limits of the Co-crystal Concept and Beyond", RSC Drug Discovery Series, 2012, N | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| ТКАЦКИЙ СТАНОК | 1920 |
|
SU300A1 |
| WO 2013134869 A1, 19.09.2013 | |||
| EA 201390014 A1, 30.12.2013. | |||
Авторы
Даты
2019-11-14—Публикация
2017-11-20—Подача