Предшествующий уровень техники
Рифаксимин (INN (международное непатентованное название); см. The Merck Index, XIII Ed., 8304) является антибиотиком, который относится к классу рифамицина, и точно он представляет собой пиридо-имидазо-рифамицин, описанный и заявленный в патенте Италии IT №1154655, а в Европейском патенте ЕР №0161534 описан и заявлен способ его получения из рифамицина О (The Merck Index, XIII Ed., 8301).
В обоих этих патентах описана очистка рифаксимина в общих чертах, при этом указано, что кристаллизация может быть осуществлена в подходящих растворителях или системах растворителей, и суммарно показано в некоторых примерах, что продукт, образующийся в результате реакции, можно кристаллизовать из смеси этиловый спирт/вода 7:3 и можно сушить как при атмосферном давлении, так и в вакууме, без указания ни экспериментальных условий кристаллизации и сушки, ни какой-либо отличительной кристаллографической характеристики полученного продукта.
Присутствие разных полиморфов вовсе не отмечено, и, следовательно, экспериментальные условия, описанные в обоих этих патентах, разработаны с целью получения однородного продукта, имеющего пригодную с химической точки зрения чистоту, оставляя в стороне кристаллографические аспекты самого продукта.
Теперь неожиданно обнаружено, что существуют некоторые полиморфные формы, образование которых зависит, помимо растворителя, от временных и температурных условий, в которых проводят как кристаллизацию, так и сушку.
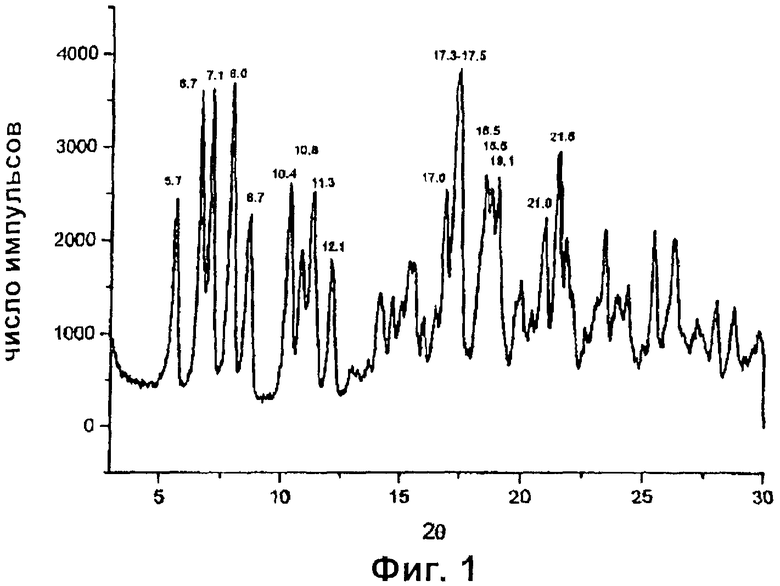
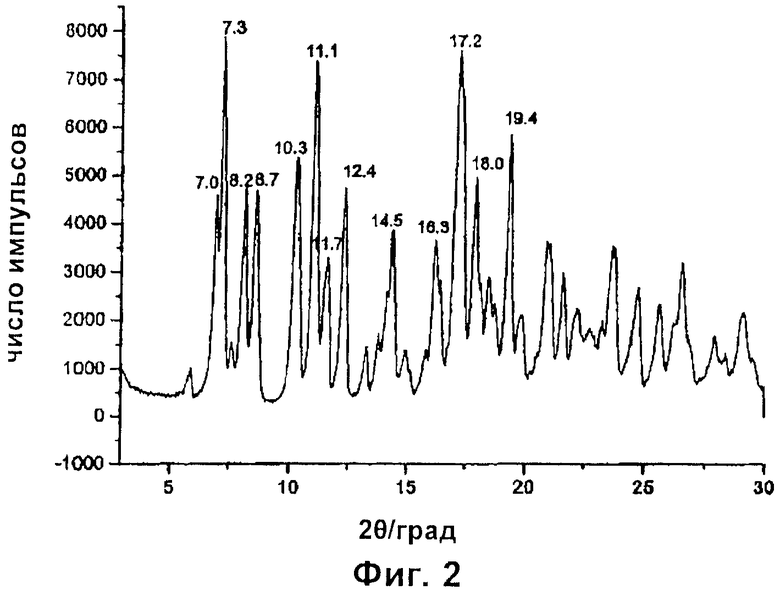
Эти упорядоченные полиморфные формы в дальнейшем будут обычным путем идентифицированы как рифаксимин δ (Фиг.1) и рифаксимин ε (Фиг.2) на основе их соответствующих конкретных дифрактограмм, приведенных в настоящей заявке.
Полиморфные формы рифаксимина охарактеризованы методом дифракции рентгеновских лучей на порошке.
Идентификация и характеристика этих полиморфных форм и одновременно определение экспериментальных условий для их получения очень важны для соединения, наделенного фармакологической активностью, которое, подобно рифаксимину, продается в качестве лекарственного препарата как для медицинского, так и для ветеринарного применения. Действительно, известно, что полиморфизм соединения, которое может быть использовано в качестве активного начала в составе лекарственного препарата, может влиять на фармакотоксикологические свойства лекарственного средства. Различные полиморфные формы активного начала, вводимого в качестве лекарственного средства в пероральной или местной форме, могут модифицировать многие его свойства, такие как биодоступность, растворимость, стабильность, цвет, прессуемость, сыпучесть и обрабатываемость с вытекающей отсюда модификацией профилей токсикологической безопасности, клинической эффективности и эффективности производства.
Вышеуказанное подтверждается полномочными органами, поскольку полномочные органы, которые регулируют выдачу разрешения на выпуск лекарственных средств на рынок, требуют, чтобы способы производства активных начал были стандартизованы и контролировались таким образом, чтобы они давали однородные и стабильные результаты по показателям полиморфизма производственных партий (CPMP/QWP/96, 2003 - Note for Guidance on Chemistry of new Active Substance; CPMP/ICH/367/96 - Note for guidance specifications: test procedures and acceptance criteria for new drug substances and new drug products: chemical substances; Date for coming into operation: May 2000).
Необходимость в вышеупомянутой стандартизации именно в области рифамициновых антибиотиков получила дополнительное подкрепление от Henwood S.Q., de Villiers M.M., Liebenberg W. и Lötter A.P. (Drug Development and Industrial Pharmacy, 26 (4), 403-408, 2000), которые установили, что разные производственные партии рифампицина (INN), произведенные разными производителями, отличаются друг от друга, поскольку они имеют разные полиморфные характеристики и, как следствие, показывают разные профили растворения с результирующим изменением соответствующих фармакологических свойств.
При использовании способы кристаллизации и сушки, в общем виде раскрытые в предшествующих патентах IT №1154655 и ЕР №0161534, было обнаружено, что в некоторых экспериментальных условиях получают недостаточно кристаллическую форму рифаксимина, тогда как в других экспериментальных условиях получают другие кристаллические полиморфные формы рифаксимина. Кроме того, обнаружено, что некоторые параметры, абсолютно не раскрытые в вышеупомянутых патентах, такие как, например, условия хранения и относительная влажность окружающей среды, оказывают неожиданное влияние на определение формы полиморфа.
Полиморфные формы рифаксимина, являющиеся объектом настоящей патентной заявки, никогда не наблюдались и не предполагались, при этом считалось, что отдельный однородный продукт всегда может быть получен, какой бы способ ни был выбран в пределах диапазона описанных условий независимо от условий, используемых для кристаллизации, сушки и хранения.
Теперь обнаружено, что образование форм δ и ε зависит от присутствия воды в кристаллизационном растворителе, от температуры, при которой продукт кристаллизуется, и от количества воды, присутствующей в продукте в конце стадии сушки.
Затем форма δ и форма ε рифаксимина были синтезированы, и они являются объектом изобретения.
В частности, форма δ характеризуется остаточным содержанием воды в высушенном твердом веществе в пределах от 2,5% до 6% (мас./мас.), более предпочтительно от 3% до 4,5%, тогда как форма ε является результатом полиморфного перехода от формы δ при контролируемой температуре.
Эти результаты имеют огромною важность, поскольку они определяют условия промышленного производства на некоторых стадиях обработки, которые могли не считаться критическими для определения полиморфизма продукта, такие как, например, поддержание количества воды для кристаллического продукта в строгом диапазоне значений, или процесс сушки конечного продукта, при котором форма, а именно форма δ, должна быть получена до продолжения сушки с получением формы ε, или условия хранения конечного продукта, или характеристики контейнера, в котором хранят продукт.
Рифаксимин проявляет свою широкую антибактериальную активность в желудочно-кишечном тракте против локализованных желудочно-кишечных бактерий, которые вызывают инфекционную диарею, в том числе анаэробные штаммы. Известно, что рифаксимин характеризуется пренебрежимо малым системным всасыванием в силу его химических и физических свойств (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int. J. Clin. Pharmacol. Res., 14 (2), 51-56, (1994)).
Теперь авторы данного изобретения обнаружили, что на основе двух идентифицированных полиморфных форм рифаксимина возможно модулировать его уровень системного всасывания путем введения различных полиморфных форм рифаксимина, а именно рифаксимина δ и рифаксимина ε, и это является частью настоящего изобретения. Можно иметь почти 100-кратное различие во всасывании в пределах от 0,001 до 0,3 мкг/мл в крови.
Доказанное различие в биодоступности является важным, поскольку можно дифференцировать фармакологические и токсикологические свойства двух полиморфов рифаксимина δ и ε.
Фактически, рифаксимин ε пренебрежимо мало всасывается пероральным путем, тогда как рифаксимин δ демонстрирует умеренное всасывание.
Рифаксимин ε практически не всасывается, может действовать только местно, включая случай желудочно-кишечного тракта, и имеет преимущество, заключающееся в очень низкой токсичности.
С другой стороны, рифаксимин δ, который всасывается умеренно, может найти преимущественное применение против системных микроорганизмов, способных скрываться и частично уклоняться от действия местных антибиотиков.
Что касается возможных неблагоприятных эпизодов, связанных с терапевтическим применением рифаксимина, к ним, в частности, относится индуцирование бактериальной резистентности к антибиотикам. Вообще говоря, в терапевтической практике с использованием антибиотиков всегда возможно индуцирование бактериальной резистентности к тому же или к другому антибиотику посредством отбора устойчивых штаммов.
В случае рифаксимина данный аспект является особенно значимым, поскольку рифаксимин принадлежит семейству рифамицина, член которого, рифампицин, широко применяется в терапии туберкулеза. Современный краткий курс лечения туберкулеза представляет собой комбинированную терапию, включающую четыре активных фармацевтических ингредиента: рифампицин, изониазид, этамбутол и пиразинамид, и среди них рифампицин играет центральную роль. Следовательно, любое лекарственное средство, которое подвергает риску эффективность терапии в результате отбора в отношении устойчивости к рифампицину, будет неблагоприятным Kremer L. et al. "Re-emergence of tuberculosis: strategies and treatment", Expert Opin. Investig. Drugs, 11 (2), 153-157, (2002)).
В принципе, учитывая структурное подобие между рифаксимином и рифампицином, можно было предположить, что при использовании рифаксимина возможен отбор устойчивых штаммов М. tuberculosis и индуцирование перекрестной резистентности к рифампицину. Во избежание этого негативного события решающим является наличие контроля качества рифаксимина, всасываемого системно.
С этой точки зрения различие, обнаруженное в системном всасывании форм δ и ε рифаксимина, является значительным, поскольку при субингибиторной концентрации рифаксимина, например в пределах от 0,1 до 1 мкг/мл, также продемонстрирована возможность отбора устойчивых мутантов (Marchese A. et al. In vitro activity of rifaximin, metronidazole and vancomycin against Clostridium difficile and the rate of selection of spontaneously resistant mutants against representative anaerobic and aerobic bacteria, including ammonia-producing species. Chemotherapy, 46 (4), 253-266, (2000)).
В соответствии со сказанным выше важность настоящего изобретения, которое привело к знанию существования вышеупомянутых полиморфных форм рифаксимина и к различным промышленным путям изготовления чистых отдельных форм, обладающих различными фармакологическими свойствами, несомненно усиливается.
Вышеупомянутые формы δ и ε могут быть преимущественно использованы в виде чистых и однородных продуктов в изготовлении лекарственных препаратов, содержащих рифаксимин.
Как уже говорилось, способ получения рифаксимина из рифамицина О, раскрытый и заявленный в ЕР №0161534, имеет недостатки с точки зрения очистки и идентификации полученного продукта. Он также имеет некоторые ограничения с системной точки зрения, касающиеся, например, очень длительных периодов времени реакции, от 16 до 72 часов, малопригоден для промышленного использования и, к тому же, не обеспечивает восстановление in situ окисленного рифаксимина, который может образоваться в реакционной смеси.
Таким образом, еще одним объектом настоящего изобретения является усовершенствованный способ промышленного производства форм δ и ε рифаксимина, заявленных здесь как продукты и используемых, как определено, в качестве однородных активных начал в изготовлении лекарственных препаратов, содержащих такое активное начало.
Описание изобретения
Как уже говорилось, объектами настоящего изобретения являются форма δ и форма ε антибиотика, известного как рифаксимин (INN), способы их получения и их применение в изготовлении лекарственных препаратов для перорального или местного пути введения.
Способ, являющийся объектом настоящего изобретения, включает взаимодействие одного молярного эквивалента рифамицина О с избытком 2-амино-4-метилпиридина, предпочтительно от 2,0 до 3,5 молярных эквивалентов, в смеси растворителей, приготовленной из воды и этилового спирта в объемном соотношении от 1:1 до 2:1, в течение периода времени от 2 до 8 часов при температуре от 40°С до 60°С.
В конце взаимодействия реакционную массу охлаждают до комнатной температуры и в нее добавляют раствор аскорбиновой кислоты в смеси воды, этилового спирта и водной концентрированной соляной кислоты при сильном перемешивании, чтобы восстановить небольшое количество окисленного рифаксимина, который образуется в процессе реакции, и, наконец, рН доводят до примерно 2,0 добавлением дополнительного количества концентрированного водного раствора соляной кислоты, чтобы лучше удалить избыток 2-амино-4-метилпиридина, использованного в реакции. Суспензию фильтруют, и полученное твердое вещество промывают такой же смесью растворителей вода/этиловый спирт, которая используется в реакции. Такой полуфабрикат назван "сырым рифаксимином".
Сырой рифаксимин может быть непосредственно направлен на последующую стадию очистки. Альтернативно, в случае длительных сроков хранения полуфабриката сырой рифаксимин может быть подвергнут сушке в вакууме при температуре ниже 65°С в течение периода времени от 6 до 24 часов, и такой полуфабрикат назван "высушенным сырым рифаксимином".
Полученный таким образом сырой рифаксимин и/или высушенный сырой рифаксимин очищают путем растворения его в этиловом спирте при температуре от 45°С до 65°С и кристаллизации в результате добавления воды, предпочтительно в массовом количестве от 15% до 70% относительно массового количества этилового спирта, использованного для растворения, и выдержки полученной суспензии при температуре от 50°С до 0°С при перемешивании в течение периода времени от 4 до 36 часов.
Суспензию фильтруют, и полученное твердое вещество промывают водой и сушат в вакууме или при нормальном давлении, с использованием или без использования сушильного агента, при температуре от комнатной температуры до 105°С в течение периода времени от 2 до 72 часов.
Получение форм δ и ε зависит от условий, выбранных для кристаллизации. В частности, доказано, что состав смеси растворителей, из которой осуществляют кристаллизацию, температура, при которой реакционную смесь выдерживают после кристаллизации, и период времени, в течение которого эту температуру поддерживают, являются решающими.
Более точно, рифаксимины δ и ε получают, когда температуру сначала доводят до значения от 28°С до 32°С, чтобы инициировать кристаллизацию, затем температуру суспензии доводят до значения от 40°С до 50°С, и выдерживают суспензию при этом значении температуры в течение периода времени от 6 до 24 часов, затем суспензию быстро охлаждают до 0°С за период времени от 15 минут до одного часа, фильтруют, твердое вещество промывают водой и затем сушат.
Стадия сушки играет важную роль в получении полиморфных форм рифаксимина δ и ε и должна проводиться соответствующим способом, который подходит для данной дозировки воды, например способом Карла Фишера, в целях проверки количества остаточной воды, присутствующей в продукте при сушке.
Получение рифаксимина δ в процессе сушки в действительности зависит от конечного остаточного количества воды, которое должно составлять от 2,5% (мас./мас.) до 6% (мас./мас.), более предпочтительно от 3% до 4,5%, а не от экспериментальных условий давления и температуры, при которых достигается этот критический предел содержания воды.
Чтобы получить плохо всасывающуюся форму ε, начать нужно с формы δ, и сушку нужно продолжать дальше в вакууме или при атмосферном давлении при комнатной температуре или при высокой температуре, в присутствии или в отсутствие сушильных агентов, при условии, что сушку продолжают в течение периода времени, необходимого для достижения превращения в форму ε.
Обе формы δ и ε рифаксимина являются гигроскопическими, со временем они обратимо поглощают воду при наличии соответствующих условий давления и влажности в окружающей среде и склонны к трансформации в другие формы.
Результат переходов из одной формы в другую очень важен в объеме изобретения, поскольку они могут представлять собой альтернативный производственный способ получения формы, желаемой для изготовления лекарственных препаратов. Следовательно, способ, который дает возможность превратить рифаксимин δ в рифаксимин ε эффективным промышленным способом, является важной частью данного изобретения.
Способ, относящийся к трансформации рифаксимина δ в рифаксимин ε, включает сушку рифаксимина δ в вакууме или при атмосферном давлении при комнатной температуре или при высокой температуре, в присутствии или в отсутствие сушильных агентов, и выдержку его в течение некоторого периода времени до достижения превращения, обычно от 6 до 36 часов.
Из сказанного выше следует, что во время стадии хранения продукта особые меры должны быть предприняты, чтобы условия окружающей среды не изменяли содержание воды в продукте, такие как хранение продукта в условиях окружающей среды с контролируемой влажностью или в закрытых контейнерах, не дающих возможности значительного обмена воды с внешним окружением.
Полиморф, названный рифаксимином δ, характеризуется содержанием воды в пределах от 2,5% до 6%, предпочтительно от 3,0% до 4,5%, и порошковой рентгеновской дифрактограммой (показанной на фиг.1), которая демонстрирует пики при значениях углов дифракции 2θ 5,7°±0,2; 6,7°±0,2; 7,1°±0,2; 8,0°±0,2; 8,7°±0,2; 10,4°±0,2; 10,8°±0,2; 11,3°±0,2; 12,1°±0,2; 17,0°±0,2; 17,3°±0,2; 17,5°±0,2; 18,5°±0,2; 18,8°±0,2; 19,1°±0,2; 21,0°±0,2; 21,5°±0,2. Полиморф, названный рифаксимином ε, характеризуется порошковой рентгеновской дифрактограммой (показанной на фиг.2), которая демонстрирует пики при значениях углов дифракции 2θ 7,0°±0,2; 7,3°±0,2; 8,2°±0,2; 8,7°±0,2; 10,3°±0,2; 11,1°±0,2; 11,7°±0,2; 12,4°±0,2; 14,5°±0,2; 16,3°±0,2; 17,2°±0,2; 18,0°±0,2; 19,4°±0,2.
Дифрактограммы были получены на приборе Philips X'Pert с геометрией Bragg-Brentano и при следующих рабочих условиях:
рентгеновская трубка: медь
используемое излучение: К (α1), К (α2)
напряжение и ток генератора: 40 кВ, 40 мА
монохроматор: графит
шаг: 0,02
время на шаг: 1,25 секунд
начальное и конечное значение угла 2θ: 3,0°-30,0°
Оценку содержания воды, присутствующей в анализируемых образцах, всегда проводили методом Карла Фишера.
Рифаксимин δ и рифаксимин ε отличаются друг от друга также тем, что они имеют значительные различия по биодоступности.
Исследование биодоступности этих двух полиморфов проводили на самках собак породы бигль следующим образом: собакам перорально вводили дозу 100 мг/кг в капсуле одного из полиморфов, образцы крови из яремной вены каждого животного отбирали перед каждым дозированием и через 1, 2, 4, 6, 8 и 24 часа после каждого дозирования, переносили образцы в пробирки, содержащие гепарин, и отделяли плазму центрифугированием.
Плазму анализировали на рифаксимин стандартным методом ЖХ-МС/МС (жидкостная хроматография-масс-спектрометрия/масс-спектрометрия), определяли максимум наблюдаемой концентрации в плазме (Cmax), время до достижения Cmax (Tmax) и вычисляли площадь под кривой зависимости концентрации от времени (AUC).
Экспериментальные данные, приведенные ниже в таблице 1, ясно показывают, что рифаксимин ε всасывается пренебрежимо мало, тогда как рифаксимин δ всасывается при значении (Cmax=0,308 мкг/мл) в пределах от 0,1 до 1,0 мкг/мл.
нг/мл
ч
нг·ч/мл
Приведенные выше экспериментальные результаты также показывают различия, существующие между двумя полиморфами рифаксимина.
Формы δ и ε преимущественно могут быть использованы в производстве обладающих антибиотической активностью лекарственных препаратов, содержащих рифаксимин, как для перорального, так и для местного использования. Лекарственные препараты для перорального использования содержат рифаксимин δ и ε вместе с обычными эксципиентами, например разбавителями, такими как маннит, лактоза и сорбит; связывающими агентами, такими как крахмалы, желатины, сахара, производные целлюлозы, природные камеди и поливинилпирролидон; смазывающими агентами, такими как тальк, стеараты, гидрогенизированные растительные масла, полиэтиленгликоль и коллоидный диоксид кремния; разрыхляющими агентами, такими как крахмалы, целлюлозы, альгинаты, камеди и сетчатые полимеры; красящими, корригирующими и подслащивающими агентами.
В пределах объема настоящего изобретения можно применять все твердые препараты, которые можно вводить пероральным путем, например таблетки, покрытые и не покрытые оболочкой, капсулы, изготовленные из мягкого и твердого желатина, пилюли, покрытые сахаром, лепешки, облатки, гранулы и порошки в герметичных упаковках.
Лекарственные препараты для местного использования содержат рифаксимин δ и ε вместе с обычными эксципиентами, такими как белый вазелин, белый воск, ланолин и его производные, стеариловый спирт, пропиленгликоль, лаурилсульфат натрия, эфиры жирных полиоксиэтиленовых спиртов, эфиры жирных полиоксиэтиленовых кислот, сорбитанмоностеарат, глицерилмоностеарат, пропиленгликольмоностеарат, полиэтиленгликоли, метилцеллюлоза, гидроксиметилпропилцеллюлоза, натрийкарбоксиметилцеллюлоза, коллоидный силикат алюминия и магния, альгинат натрия.
В пределах объема настоящего изобретения можно применять любые местные препараты, например мази, помады, кремы, гели и лосьоны.
Ниже изобретение иллюстрируется примерами, которые не должны рассматриваться как ограничение изобретения. Из приведенных результатов действительно явно видно, что формы δ и ε могут быть получены путем соответствующего комбинирования вышеупомянутых условий кристаллизации и сушки.
Пример 1
Получение сырого рифаксимина и высушенного сырого рифаксимина
В трехгорлую колбу, оснащенную механической мешалкой, термометром и дефлегматором, при комнатной температуре последовательно загружают 120 мл деминерализованной воды, 96 мл этилового спирта, 63,5 г рифамицина О и 27,2 г 2-амино-4-метилпиридина. После загрузки массу нагревают при 47±3°С, выдерживают при перемешивании при данной температуре в течение 5 часов, затем охлаждают до 20±3°С, и в течение 30 минут к ней добавляют приготовленную отдельно смесь 9 мл деминерализованной воды, 12,6 мл этилового спирта, 1,68 г аскорбиновой кислоты и 9,28 г водной концентрированной соляной кислоты. По окончании добавления массу выдерживают при перемешивании в течение 30 минут при внутренней температуре 20±3°С, а затем при той же температуре добавляют по каплям 7,72 г концентрированной соляной кислоты до рН, равного 2,0.
По окончании добавления массу выдерживают при перемешивании, постоянно при внутренней температуре, равной 20°С, в течение 30 минут, затем осадок фильтруют и промывают смесью, приготовленной из 32 мл деминерализованной воды и 25 мл этилового спирта. Полученный таким образом "сырой рифаксимин" (89,2 г) сушат в вакууме при комнатной температуре в течение 12 часов с получением 64,4 г "высушенного сырого рифаксимина", который имеет содержание воды, равное 5,6%. Продукт, полученный в результате дополнительной сушки высушенного сырого рифаксимина в вакууме до массы 62,2 г, имеет содержание воды, равное 3,3%, соответствует полиморфной форме δ, характеризующейся порошковой рентгеновской дифрактограммой с пиками при значениях углов 2θ 5,7°±0,2; 6,7°±0,2; 7,1°±0,2; 8,0°±0,2; 8,7°±0,2; 10,4°±0,2; 10,8°±0,2; 11,3°±0,2; 12,1°±0,2; 17,0°±0,2; 17,3°±0,2; 17,5°±0,2; 18,5°±0,2; 18,8°±0,2; 19,1°±0,2; 21,0°±0,2; 21,5°±0,2. Этот продукт гигроскопичен.
Пример 2
Получение рифаксимина ε
Пример 1 повторяют, и после получения формы δ твердый порошок дополнительно сушат в вакууме в течение 24 часов при температуре 65°С. Полученный продукт представляет собой рифаксимин ε, характеризующийся порошковой рентгеновской дифрактограммой с пиками при значениях углов 2θ 7,0°±0,2; 7,3°±0,2; 8,2°±0,2; 8,7°±0,2; 10,3°±0,2; 11,1°±0,2; 11,7°±0,2; 12,4°±0,2; 14,5°±0,2; 16,3°±0,2; 17,2°±0,2; 18,0°±0,2; 19,4°±0,2.
Пример 3
Биодоступность у собак при введении пероральным путем
Восемь чистопородных самок собак породы бигль в возрасте 20 недель и массой от 5,0 до 7,5 кг были разделены на две группы по четыре в каждой. Собакам первой группы вводили рифаксимин δ, собакам второй группы вводили рифаксимин ε в соответствии с приведенной ниже методикой.
Каждой собаке пероральным путем вводили 100 мг/кг одного из полиморфов рифаксимина в желатиновых капсулах, и образцы крови по 2 мл каждый отбирали из яремной вены каждого животного перед каждым дозированном и через 1, 2, 4, 6, 8 и 24 часа после введения.
Каждый образец переносили в пробирку, содержащую гепарин в качестве антикоагулянта, и центрифугировали. Плазму разделили на две аликвоты, каждая по 500 мкл, и заморозили при -20°С.
Рифаксимин, содержащийся в плазме, анализировали стандартным методом ЖХ-МС/МС, и приведенные ниже параметры вычисляли согласно стандартному некомпартментному анализу:
Cmax = максимальная наблюдаемая концентрация рифаксимина в плазме;
Tmax = время, за которое достигается Cmax;
AUC = площадь под кривой концентрация-время, вычисленная по линейной формуле трапеций.
Результаты, приведенные в таблице 1, четко показывают, насколько рифаксимин δ лучше всасывается, более чем в 40 раз, чем рифаксимин ε, который практически не всасывается.
В приведенной ниже таблице 2 представлены сравнительные данные по биодоступности для известных форм рифаксимина α, β и γ и для форм рифаксимина δ и ε по настоящему изобретению.
(нг/мл)
(часы)
(нг·ч/мл)
(нг·ч/мл)
Если сравнивать значения Cmax, то явно видно, что уровень всасывания рифаксимина можно регулировать с получением концентрации в плазме крови в пределах от примерно 1 нг/мл до примерно 1000 нг/мл. Следует отметить, что формы α и β, которые по сравнению с формой δ имеют соответственно более низкое и более высокое содержание воды, демонстрируют всасывание in vivo намного ниже, чем форма δ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФНЫЕ ФОРМЫ РИФАКСИМИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ПРЕПАРАТАХ | 2004 |
|
RU2270200C2 |
| ПОЛИМОРФ РИФАКСИМИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2593750C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИБИОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2024 |
|
RU2822872C1 |
| ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2710013C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА ФОСФАТА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2712169C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА МАЛЕАТА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2708079C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЛЬВАТЫ ГИДРОХЛОРИДА 6-(ПИПЕРИДИН-4-ИЛОКСИ)-2Н-ИЗОХИНОЛИН-1-OHA | 2012 |
|
RU2619129C2 |
| Твердые формы селективного ингибитора CDK4/6 | 2014 |
|
RU2619944C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770300C2 |
| НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ТРИМЕБУТИНА МАЛЕАТА, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2770301C2 |
Изобретение относится к новым кристаллическим полиморфным формам антибиотика рифаксимина (INN), названным рифаксимином δ и рифаксимином ε. Также изобретение относится к способу получения таких полиморфов, который осуществляют путем горячего растворения сырого рифаксимина в этиловом спирте и кристаллизации продукта, которую индуцируют добавлением воды при температуре приблизительно 50°С и проводят в течение приблизительно от 4 до 36 часов, с последующей сушкой, которую проводят в контролируемых условиях до достижения заданного содержания воды в конечном продукте. Новые полиморфы обладают свойствами, позволяющими контролировать всасывание рифаксимина при его использовании в качестве антибиотика. Также изобретение относится к фармацевтическим композициям, содержащим новые полиморфные формы рифаксимина. 4 н. и 16 з.п. ф-лы, 2 табл., 2 ил.
1. Рифаксимин в полиморфной форме δ, где этот полиморф имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ 5,7°±0,2°, 10,8°±0,2°, 12,1°±0,2° и 17,0°±0,2°, и где полиморф имеет содержание воды от 2,5 до 6%.
2. Рифаксимин по п.1, где порошковая рентгеновская дифрактограмма дополнительно содержит пик при значении угла дифракции 2θ примерно 11,3°±0,2°.
3. Рифаксимин по п.1, где порошковая рентгеновская дифрактограмма дополнительно содержит пики при значениях углов дифракции 2θ примерно 7,1°±0,2° и 21,5°±0,2°.
4. Рифаксимин по п.1, где порошковая рентгеновская дифрактограмма дополнительно содержит пики при значениях углов дифракции 2θ примерно 6,7°±0,2° и 8,7°±0,2°.
5. Рифаксимин по п.1, где он имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ примерно 5,7°±0,2°, 6,7°±0,2°, 7,1°±0,2°, 8,0°±0,2°, 8,7°±0,2°, 10,4°±0,2°, 10,8°±0,2°, 11,3°±0,2°, 12,1°±0,2°, 17,0°±0,2°, 17,3°±0,2°, 17,5°±0,2°, 18,5°±0,2°, 18,8°±0,2°, 19,1°±0,2°, 21,0°±0,2°, 21,5°±0,2°.
6. Рифаксимин по п.1, где полиморф имеет содержание воды от 3 до 4,5%.
7. Рифаксимин в полиморфной форме ε, где этот полиморф имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ примерно 8,2°±0,2°, 12,4°±0,2° и 16,3°±0,2°.
8. Способ получения полиморфных форм рифаксимина δ и ε, при котором:
молярный эквивалент рифамицина О подвергают реакции с избытком 2-амино-4-метилпиридина в первой смеси растворителей, содержащей воду и этиловый спирт в объемном соотношении от 1:1 до 2:1, в течение периода времени от 2 до 8 ч при температуре от 40 до 60°С с получением первой реакционной смеси;
первую реакционную смесь обрабатывают при комнатной температуре раствором аскорбиновой кислоты в смеси воды, этилового спирта и концентрированной водной соляной кислоты с получением второй реакционной смеси;
к второй реакционной смеси добавляют концентрированный водный раствор соляной кислоты до достижения рН 2,0 с получением первой суспензии;
первую суспензию фильтруют с получением первого твердого вещества;
первое твердое вещество промывают первой смесью растворителей с получением сырого рифаксимина;
сырой рифаксимин растворяют в этиловом спирте при температуре от 45 до 65°С;
вызывают образование осадка добавлением воды и снижением температуры смеси до значения от 50 до 0°С при перемешивании в течение периода времени от 4 до 36 ч с получением второй суспензии;
вторую суспензию фильтруют с получением второго твердого вещества;
второе твердое вещество промывают водой и сушат в вакууме или в условиях нормального давления, с использованием или без использования сушильного агента, при температуре от комнатной температуры до 105°С в течение периода времени от 2 до 72 ч;
где полиморфная форма рифаксимина δ имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ 5,7°±0,2°, 10,8°±0,2°, 12,1°±0,2° и 17,0°±0,2°, и
где полиморфная форма рифаксимина ε имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ 8,2°±0,2°, 12,4°±0,2° и 16,3°±0,2°.
9. Способ по п.8, где избыток 2-амино-4-метилпиридина составляет от 2,0 до 3,5 молярных эквивалентов относительно рифамицина О.
10. Способ по п.8, где количество воды, добавляемой для образования осадка, составляет от 15 до 70% от массы этилового спирта, использованного для растворения на предыдущей стадии.
11. Способ по п.8, где при добавлении воды для образования осадка температуру снижают до значения от 28 до 32°С.
12. Способ по п.11, дополнительно включающий:
перемешивание второй суспензии при температуре от 40 до 50°С в течение периода времени от 6 до 24 ч с последующим охлаждением смеси до 0°С в течение периода времени от 15 мин до одного часа с получением третьей суспензии;
фильтрование третьей суспензии и сушку полученного твердого вещества до содержания воды от 2,5 до 6% (мас./мас.).
13. Способ по п.12, где содержание воды составляет от 3,0 до 4,5%.
14. Фармацевтическая композиция, обладающая антибиотической активностью, содержащая терапевтически эффективное количество рифаксимина δ, рифаксимина ε или их комбинации и фармацевтически приемлемый эксципиент, где рифаксимин δ имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ примерно 5,7°±0,2°, 10,8°±0,2°, 12,1°±0,2° и 17,0°±0,2°, и
где рифаксимин ε имеет пики на порошковой рентгеновской дифрактограмме при значениях углов дифракции 2θ примерно 8,2°±0,2°, 12,4°±0,2° и 16,3°±0,2°.
15. Фармацевтическая композиция по п.14, где эксципиент выбран из группы, состоящей из разбавляющих, связывающих, смазывающих, разрыхляющих, красящих, корригирующих и подслащивающих агентов.
16. Фармацевтическая композиция по п.14 в форме для перорального введения.
17. Фармацевтическая композиция по п.16, где форма для перорального введения выбрана из группы, состоящей из таблетки, покрытой или не покрытой оболочкой, твердой или мягкой желатиновой капсулы, пилюли, покрытой сахаром, облатки, пластинки, гранулы и порошка в герметичной упаковке.
18. Фармацевтическая композиция по п.14 в форме для местного введения.
19. Фармацевтическая композиция по п.18, где форма для местного введения выбрана из группы, состоящей из мази, помады, крема, геля и лосьона.
20. Фармацевтическая композиция по п.14 для лечения бактериальной активности в желудочно-кишечном тракте, где желудочно-кишечная бактериальная активность вызывает инфекционную диарею.
| 0 |
|
SU161534A1 | |
| US 4341785 А, 27.07.1982 | |||
| Venturini AP, Chemotherapy, 1983, 29, 1-3 | |||
| Cellai L et al, Chemioterapia, 1984, 3, 373-377 | |||
| Descombe JJ et al, Int | |||
| J | |||
| Cldin | |||
| Pharmacol | |||
| Res., 1994, 14, 51-56 | |||
| Jiang ZD, et al, Antimicrob | |||
| Agents and Chemother., 2000; 44, 2205-2206 | |||
| Rizzello F et al, Eur | |||
| J | |||
| Clin | |||
| Pharmacol., 1998, 54, 91-93 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ РИФАМПИЦИНА | 2002 |
|
RU2223764C1 |
Авторы
Даты
2010-08-27—Публикация
2006-02-27—Подача