Изобретение относится к области ветеринарной вирусологии и может быть использовано в научно-исследовательских учреждениях и ветеринарных гистологических лабораториях для диагностики цирковирусной болезни свиней (ЦВБС) в гистологических срезах органов-мишений путем выявления генетического материала вируса в инфицированных клетках при помощи метода гибридизации in-situ основанном на применении меченного флуоресцеином нуклеотидного зонда.
Уровень техники
Для диагностики ЦВБС используют разнообразные лабораторные методы, направленные на выделение вируса, обнаружение его антигена или нуклеотидной последовательности. Среди исследований, направленных на достижение данной цели, применяют выделение вируса в клеточных культурах, полимеразную цепную реакцию (ПЦР), иммуноферментный анализ (ИФА), флуоресцентную гибридизацию in-situ и иммуногистохимическое исследование (ИГХИ) [Стаффорд, В.В., Стрельцова Я.Б., Раев С.А., Южаков А.Г., Забережный А.Д., Алипер Т.И.. Использование метода иммуногистохимии при диагностике цирковирусных болезней свиней Ветеринария. - 2019. - №8. - С. 18-22.; Kim J. and Chae С. 2004. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. J. Vet. Diagn. Invest. 16:45-50].
Согласно ветеринарному руководству США, для диагностики ЦВБС, вызванной цирковирусом свиней 2 типа (ЦВС-2), необходимо учитывать основные пункты: клиническое состояние животных, наличие характерного лимфоидного истощения тканей и подтверждение присутствия геномного материала вируса ЦВС-2 в органах животных методом гибридизации in-situ [[Электронный ресурс]. - Режим доступа: https://www.msdvetmanual.com/generalized-condLtions/porcine-circovirus-diseases/porcine-circovirus-diseases.] Согласно этому, зарубежные ветеринарные специалисты применяют следующую методику. Для визуализации генетического материала ЦВС-2 в тканях методом гибридизации in-situ в качестве РНК-зонда использовали праймеры ЦВС-2 Rc2 CGCACTTCTTTCGTTTTCAG - синтез в масштабе 5ON, с модификацией 5'-биотина (Jnvitrogen) [Martins A.M.C.R.P.F. Diagnostic Techniques for porcine Circovirus Type 2 (PCV-2) by Optical and Transmission Electron Microscopy / A.M.C.R.P.F. Martins, M.H.B. Catroxo, J.G. Bersano, R. Ogata // International Journal of Environmental & Agriculture Research (IJOEAR). Vol. 2. - Issue. 11. - 2016. - P. 21-30.]. Фрагменты органов (легкие, лимфатические узлы, тимус, селезенка, кишечник, почки и печень) от свиней фиксируют в 10% формалине в течение 36-48 часов, затем обезвоживают спиртами возрастающей концентрации (70°, 80°, 95° и абсолютный), после этого ткани просветляют ксилолом, с последующей пропиткой в парафине при температуре 58°С в течение ночи. Из парафиновых блоков готовят срезы толщиной 4 мкм, которые переносят на маркированные предметные стекла и далее хранят при комнатной температуре. Перед реакцией срезы депарафинируют ксилолом, регидратируют в спиртах понижающейся концентрации (абсолютный, 95°, 80°, 70°) и затем ополаскивают в дистиллированной воде. Предварительно, для восстановления антигена, выполняют обработку гистологических срезов с использованием горячей водяной бани при температуре 96°С с добавлением буферного раствора (Dako SI 699) с экспозицией 40 минут. Далее на охлажденных срезах выполняют блокировку эндогенной пероксидазы в течение 20 минут и затем проводят обработку тканей ферментом протеиназой К (Dako) при комнатной температуре - 5-15 минут. Затем, в реакции используют специфические биотинилированные зонды, смешанные со специфической ДНК-мишенью на срезах органов, и после этого накрывают покровным стеклом. Следующим этапом они выполняют денатурацию этих фрагментов и зондов, и гибридизируют в течение ночи (18 часов) в системе гибридизации Dako (денатурация выполняется при 96°С, а гибридизация при 37°С). После промываю стекла со срезами в TBST (трис-солевым буфером/Твином). В качестве системы визуализации используют первичный стрептавидин в разбавляющем буфере (Dako - Kit cod. К0690) в течение 30 минут во влажной камере, затем наносят биотинилтирамид, инкубируют при комнатной температуре в течение 15 минут, а после наносят вторичный стрептавидин также, на 15 мин. Все процедуры чередуют с двумя промывками буфером TBST в течение 5 минут. В качестве субстратной хромогенной системы используют жидкую субстратную хромогенную систему DAB+ (Dako - код К3468), инкубацию проводят в течение 5 минут при комнатной температуре с последующей промывкой в потоке дистиллированной воды. Контрастное окрашивание осуществляют гематоксилином [Braissant О. and Wahli W.A. 1998. A simplified in situ hybridization protocol using non-radioactively labeled probes to detect abundant and rare mRNAs on tissue sections. Biochemica. 1:10-16; Kim J. and Chae C. 2004. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. J. Vet. Diagn. Invest. 16:45-5]. Данную разработку мы взяли за прототип.
На территории Российской Федерации для диагностики цирковирусной болезни свиней используют различные методы. Среди серологических методов наиболее часто применяют непрямой или конкурентный блокирующий ИФА [Орлянкин, Б.Г. Инфекционные респираторные болезни свиней: этиология, диагностика и профилактика / Б.Г. Орлянкин, Т.И. Алипер, Е.А. Непоклонов // Ветеринария. - 2005. - №11. - С. 3-6]. Для определения репродукции ЦВС-2 в культуре клеток используют метод иммунопепероксидазного монослойного анализа [Емельянов, И.А. Разработка иммунопероксидазного монослойного анализа в культуре клеток для определения инфекционной активности цирковируса свиней второго типа / И.А. Емельянов, И.Н. Матвеева // В сборнике: Актуальные проблемы ветеринарной медицины, зоотехнии и биотехнологии. Сборник научных трудов Международной учебно-методической и научно-практической конференции, посвященной 100-летию со дня основания ФГБОУ ВО МГАВМиБ - МВА имени К.И. Скрябина. - 2019. - С. 113-114]. Выявление фрагментов генома возбудителя ЦВБС осуществляют методом ПЦР [Булгаков, А.Д. Молекулярно-генетический анализ геномов вирусов респираторно-репродуктивного синдрома свиней и цирковируса второго типа, циркулирующих на территории российской федерации / А.Д. Булгаков, Т.В. Гребенникова, А.Г. Южаков, Т.И. Алипер, Е.А. Непоклонов // Молекулярная генетика, микробиология и вирусология. - 2014. - №4. - С. 29-33; Раев, С.А. Получение рекомбинантного капсидного белка цирковируса свиней второго типа (генотип 2b) в бакуловирусной системе и использование его для изготовления вакцины / С.А. Раев, К.П. Алексеев, Е.В. Шемельков, А.Д. Булгаков, М.И. Мусиенко, Б.Г. Орлянкин, О.А. Верховский, Т.И. Алипер // Российский ветеринарный журнал. - 2012. - №3. - С. 17-19.].
Кроме вышеперечисленных методов используют гистологическое исследование тканей и органов, которое позволяет обнаружить патологические изменения, свойственные ЦВБС. Для определения локализации АГ ЦВС-2 в тканях применяют метод прямого иммуногистохимического анализа [Стаффорд, В.В. Использование метода иммуногистохимии при диагностике цирковирусных болезней свиней / В.В. Стаффорд, Я.Б. Стрельцова, С.А. Раев, А.Г. Южаков, А.Д. Забережный, Т.И. Алипер // Ветеринария. - 2019. - №8. - С. 18-22].
Технической проблемой является необходимость разработки меченного гибридизационного зонда комплиментарного участку генома вируса ЦВС-2 свиней для создания эффективного и доступного способа диагностики цирковирусной инфекции свиней, для обнаружения генетического материала вируса в тканях и органах свиней, выполнимого в условиях гистологических лабораторий без использования дорогостоящих расходных материалов, и для расширения арсенала способов диагностики и изучения патогенеза изучаемой болезни.
Раскрытие сущности изобретения
Техническим результатом является выявление генетической последовательности цирковируса свиней второго типа в восприимчивых к вирусу клетках органов (легкое, паховый лимфатический узел) и расширение арсенала способов диагностики цирковирусной инфекции свиней.
Данный способ гибридизации in-situ позволяет определить локализацию генома вируса в клетках органов в организме, а также изучить патогенез болезни, сопоставить данные при комплексной диагностике, с патогистологическими изменениями, тем самым подтвердить патологическое влияние вируса на зараженные ткани и органы и поставить окончательный диагноз при латентном течении болезни. Использование данного способа важно для патоморфологических исследований и способствует точной дифференциальной диагностике, изучению патогенеза и иммунного ответа у больного животного.
Предложенный способ заключается в следующем.
Для выполнения гибридизации in-situ на нативных гистологических срезах органов свиней используют олигонуклеотидный ДНК зонд. Гибридизационный ДНК зонд получают по следующей методике: для получения специфичного фрагмента размером 103 п.н., соответствующего участку гена кодирующего капсидный белок цирковируса свиней 2 типа, выполняют ПЦР. Выделение ДНК вируса ЦВС-2 осуществляют при помощи коммерческого набора «РИБО преп» («ИнтерЛабСервис», Россия) по методике производителя.
В ПЦР используют прямой праймер F1 5'-GCGGGAGTCTGGTGACC-3' (436-453) и обратный R1 5'- AGCGGGAAAATGCAGAAGCG-3' (518-538) (GenBank NC 005148). При этом реакционная смесь объемом 25 мкл содержала 5 мкл образца, 2,5 мкл 10х буфера для ПЦР (Диам, Россия), 0,5 мкл смесь dNTP (Диам, Россия), 14,75 мкл воды без нуклеаз, 0,25 мкл Taq-полимеразы (Диам, Россия) и по 10 пМ прямого и обратного праймеров. Термический цикл составляет следующие этапы: 94°С - 5 мин, затем 25 циклов: 95°С - 30 с, 60°С - 30 с и 72°С - 90 с; в конце 72°С - 5 мин. После амплификации проводят электрофорез в 1% агарозном геле, приготовленном на трис-ацетатном буферном растворе (рН 8,0) с добавлением 40 мкл бромистого этидия на литр буфера. ПЦР-фрагмент, соответствующий по электрофоретической подвижности размеру в 103 п.н., вырезают и выделяют из геля при помощи набора «LumiPure» (Lumiprobe, Россия) по методике производителя.
Для мечения ДНК пробы с помощью ПЦР используют. Реакционная смесь содержит следующие компоненты: 4,0 мкл смеси флуоресцеин-12-dUTP 1/3, 2,5 мкл Taq-буфера (х10), по 1 мкл праймеров F2 и R2 до конечной концентрации каждого праймера 0.1-1 мкМ, 0,25 мкл Taq-полимеразы, 5 мкл матричной ДНК (0.02-0.15 мкг/25 мкл смеси), деионизированной воды до 25 мкл. Программа амплификации: 40 циклов: 94°С - 10 с; 55°С - 10 с; 72°С - 30 с, после последнего цикла инкубируют при 72°С - 3 мин.
Дополнительно нуклеотидную последовательность зонда определяют по методу Сэнгера с использованием набора «BigDye 3.1» (Applied Biosystems, США). В итоге получают нуклеотидную последовательность, которую используют в качестве меченного флуоресцеином зонда для реакции гибридизации in-situ:
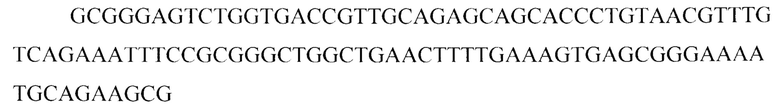
После этого приступают ко второму этапу - реакции гибридизации in-situ. Методика заключается в следующем:
В качестве патологического материала для определения локализации генетического материала цирковируса свиней второго типа от павших животных или вынужденно убитых берут легкое и паховый лимфатический узел. Нативный патологический материал охлаждают в течение 6 часов в холодильной камере при температуре 4°С. Транспортировку проб выполняют в сумке-холодильнике с хладоэлементами, поддерживающими температуру 4°С на всем этапе перевозки. Затем для длительного хранения материал помещают в низкотемпературную камеру и хранят при температуре -70°С. Непосредственно перед исследованием пробы размораживают. Далее из отобранных органов иссекают необходимые образцы размером 0,5 см в длину и ширину и 2 см в толщину. Иссеченные участки органов фиксируют на столиках для криотомии, заполняя область между столиком и тканью специальным криогелем. Столики с объектами помещают в камеру криотома при температуре -34°С на 60 минут. Из готового блока нарезают срезы толщиной 7 микрон и наклеивают на поляризированные стекла. После этого обрабатывают срезы смесью изопропилового спирта 70 мл и физиологического раствора 30 мл, 1 час при 4°С. После этого промывают их в 0,1М ФСБ 3 раза по 5 минут в каждой порции при комнатной температуре.
Приготовление 0,1М ФСБ для отмывки срезов:
Na2HPO4*12H2O - 1,79 г/500 мл
NaH2PO4*2H2O - 0,78 г/500 мл
рН=7.0
Затем срезы ополаскивают в 4% растворе параформальдегида 15 минут при температуре +4°С. Пропись раствора:
40% параформальдегид - 4 г растворяют в 100 мл 0,1 М ФСБ при помощи кипячения.
Перед использованием охлаждают раствор во льду.
После этого промывают в 0,1М ФСБ 3 раза по 5 минут. Готовят раствор протеиназы К в ФСБ из расчета 5 мкл на 1 мл 0,1М ФСБ. Общий объем раствора рассчитывают исходя из 0,3 мл на 1 стекло. Выдерживают в растворе протеиназы К 15 минут при комнатной температуре. Затем промывают в 0,1М ФСБ 3 раза по 5 минут. Готовят гибридизационный буфер (ГБ) рН=7.2:
Формамид 5 мл
50% раствор декстрана сульфата натрия на дистиллированой воде - 1 мл
0,1 М ФСБ 1 мл
20хЦитратный буфер (ЦСБ) (87,5 г NaCl + 44 г Na3цитрат *2H2O + 400 мл бидистиллированной воды) - 1 мл
Регулируют кислотность 37% HCl (12М=>1 мл НС1/11 мл H2O=>1М)
Затем готовят гибридизационную смесь (ГС) из расчета:
Гибридизационный буфер 100 мкл
Гибридизационный зонд 1 мкл
Гибридизационную смесь наносят на стекла в количестве 100 мкл на срез, закрывают покровным стеклом и запечатывают резиновым клеем. Затем помещают их в чашки петри на подставках на нагревательный столик при 96°С на 15 минут. После инкубации в ГС снижают температуру до 37°С и оставляют чаши на 16 часов при заданной температуре.
По истечении 16 часовой инкубации аккуратно размонтируют срезы от покровного стекла в 4х ЦСБ 3 раза по 5 минут:
20х ЦСБ - 60 мл
H2O бидистиллированная - 240 мл
И затем сразу помещают в формамидно-солевую смесь и ополаскивают при комнатной температуре 3 раза по 10 минут в каждой порции:
Формамид - 150 мл
20хЦСБ - 60 мл
Н2О бидистиллированная - 90 мл
После этого, срезы вновь промывают в 4х ЦСБ 3 раза по 10 минут при комнатной температуре. Затем срезы инкубируют в Трис-HCl буфере 30 минут при комнатной температуре и монтируют их покровным стекло на флуоресцентную монтирующую среду. Пропись Трис-HCl буфера:
50 μМ Трис HCl - 5 мл
100 μМ NaCl - 0.58 г
Н2О бидистиллированная до 100 мл
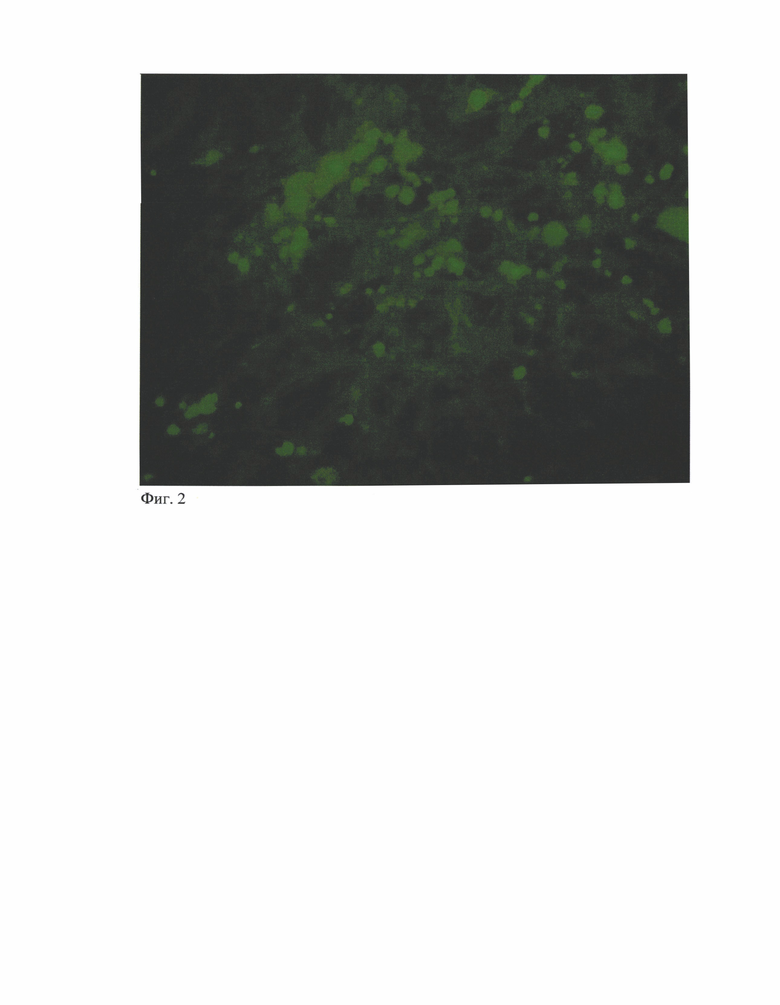
Данный способ применим для гибридизации in-situ на нативных криосрезах легких и пахового лимфатического узла, а также других органов с использованием гибридизационного зонда к нуклеотидной последовательности генома цирковируса свиней 2 типа. Детекция нуклеотидной последовательности вируса происходит в цитоплазме восприимчивых клеток зараженных органов путем визуализации флуоресцентной метки гибридизационного зонда в виде ярко-зеленого свечения в потоке ультрафиолетового луча с длиной волны 480 нм. При использовании предложенного способа при положительной реакции визуализируется флюоресцентная метка, в виде изумрудно-зеленого свечения в цитоплазме восприимчивых клеток (фиг. 1-2).
Предложенный способ обладает высокой специфичностью и чувствительностью, позволяет с точностью выявлять локализацию вируса, а также проводить дифференциальную диагностику ЦВС-2 от других возбудителей инфекций свиней со схожей клинической картиной.
Сектор патоморфологии ФГБНУ ФНЦ ВИЭВ РАН успешно апробировал вышеуказанный способ диагностики цирковируса свиней 2 типа в научной и практической деятельности. Согласно результатам испытаний, данный способ исследования может быть рекомендован для применения в научно-исследовательских институтах и ветеринарных гистологических лабораториях.
Осуществление изобретения иллюстрируется следующим примером:
Пример №1
От 20 павших свиней был отобран свежий материал для исследования (легкое, паховый лимфатический узел), в течение 3 часов материал был доставлен в лабораторию в сумке холодильнике, в плотно закрытой таре при 4°С. В лаборатории с соблюдением правил асептики и антисептики, иссекли образцы размером 0,5 см на 0,5 см из каждого органа, приморозили к криотомным столикам в камере криостата и нарезали по 2 среза на стекло из каждого органа. Срезы толщиной 7 микрон, поместили на поляризованные стекла, высушили. После этого срезы обработали смесью изопропилового спирта 70 мл и физиологического раствора 30 мл, 1 час при 4°С. Затем промыли их в 0,1 М ФСБ 3 раза по 5 минут в каждой порции при комнатной температуре. После ополаснули в 4% растворе параформальдегида 15 минут при температуре +4°С. И промыли в 0,1М ФСБ 3 раза по 5 минут. Далее приготовили раствор протеиназы К в ФСБ из расчета 5 мкл на 1 мл 0,1М ФСБ. Общий объем раствора рассчитывали исходя из 0,2 мл на 1 стекло. Выдерживали в растворе протеиназы К 15 минут при комнатной температуре. Затем промыли в 0,1М ФСБ 3 раза по 5 минут. Во время ополаскиания в ФСБ готовили гибридизационный буфер (ГБ) рН=7.2 и гибридизационную смесь. ГС наносили на стекла в количестве 100 мкл на срез, закрывали покровным стеклом и запечатывали резиновым клеем. Монтированные стекла помещали в чашки Петри на подставках на нагревательный столик при 96°С на 15 минут. После периода инкубации в ГС снижали температуру столика до 37°С и оставляли чашки на 16 часов при заданной температуре. По истечении 16 часовой инкубации аккуратно размонтировали срезы от покровного стекла окуная их в разные порции в 4х ЦСБ 3 раза по 5 минут. После последней порции, стекла со срезами сразу помещали в формамидно-солевую смесь и ополаскивают при комнатной температуре 3 раза по 10 минут в каждой порции. После этого, срезы вновь ополаскивали в 4х ЦСБ 3 раза по 10 минут при комнатной температуре. Затем инкубировали их в Трис-HCl буфере 30 минут при комнатной температуре и монтировали их покровным стеклом на флуоресцентную монтирующую среду.
В результате исследования материала, было выявлено, что 17 свиней было инфицировано цирковирусом свиней второго типа.
Положительный результат реакции на наличие генома цирковируса свиней 2 типа продемонстрирован на фигурах 1 и 2 где четко визуализируется изумрудно-зеленое свечение в цитоплазме восприимчивых клеток. При получении отрицательного результата исследования на наличие генома вируса участки изумрудно-зеленого свечения отсутствуют, что наглядно показано на фигурах 3 и 4.
Пример №2 Получение гибридизационной смеси
Для выполнения исследования нативных гистологических образцов от 20 павших свиней (легкое и бронхиальный лимфоузел) потребовалось 8 мл гибридизационной смеси. Для этого вначале мы приготовили гибридизационный буфер с рН=7.2, состоящий из 15 мл формамида, 3 мл 50% раствора декстрана сульфата натрия на дистиллированной воде, 3 мл 0,1М ФСБ, 3 мл 20хЦСБ. Затем из получившегося объема отбирали 7920 мкл в отдельную емкость и добавляли 80 мкл гибридизационного зонда для получения гибридизационной смеси.
Пример №3 Получение гибридизационного зонда
Для приготовления 8 мл объема гибридизационной смеси потребовалось приготовить 80 мкл гибридизационного зонда. Для этого, необходимый объем нарабатывали исходя из строгой схемы количества веществ и этапов наработки, описанных ниже. Таким образом, для получения специфичного фрагмента размером 103 п.н., соответствующего участку кодирующего капсидный белок цирковируса свиней 2 типа мы использовали ПЦР с прямым праймером F1 5'- GCGGGAGTCTGGTGACC-3' (436-453) и обратным R1 5'- AGCGGGAAAATGCAGAAGCG-3' (518-538) (GenBank NC 005148), а также, коммерческий ПЦР набор «РИБО преп» («ИнтерЛабСервис», Россия), ДНК выделяли по методике производителя. При этом реакционная смесь объемом 25 мкл содержала 5 мкл образца, 2,5 мкл 10х буфера для ПЦР (Диам, Россия), 0,5 мкл смесь dNTP (Диам, Россия), 14,75 мкл воды без нуклеаз, 0,25 мкл Taq-полимеразы (Диам, Россия) и по 10 пМ прямого и обратного праймеров. Термический цикл составлял следующие этапы: 94°С - 5 мин, затем 25 циклов: 95°С - 30 с, 60°С - 30 с и 72°С - 90 с; в конце 72°С - 5 мин.
После амплификации проводили электрофорез в 1% агарозном геле, приготовленном на трис-ацетатном буферном растворе (рН 8,0) с добавлением 40 мкл бромистого этидия на литр буфера. ПЦР-фрагмент, соответствующий по электрофоретической подвижности размеру в 103 п.н., вырезали и выделяли из геля при помощи набора «LumiPure» (Lumiprobe, Россия) по методике производителя.
Для мечения ДНК пробы с помощью ПЦР использовали. Реакционную смесь содержащую следующие компоненты: 4,0 мкл смеси флуоресцеин-12-dUTP 1/3, 2,5 мкл Taq-буфера (х10), по 1 мкл праймеров F2 и R2 до конечной концентрации каждого праймера 0.1-1 мкМ, 0,25 мкл Taq-полимеразы, 5 мкл матричной ДНК (0.02-0.15 мкг/25 мкл смеси), деионизированной воды до 25 мкл. Программа амплификации: 40 циклов: 94°С - 10 с; 55°С - 10 с; 72°С - 30 с, после последнего цикла инкубируют при 72°С - 3 мин. Дополнительно нуклеотидную последовательность зонда определяли по методу Сэнгера с использованием набора «BigDye 3.1» (Applied Biosystems, США). В итоге получали нуклеотидную последовательность, которую использовали в качестве меченного флуоресцеином зонда для реакции гибридизации in-situ:
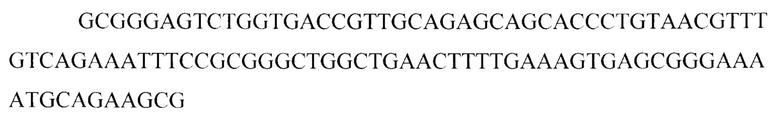
Краткое описание чертежей
Фиг. 1 - Легкое. Положительный результат FISH с ярким свечением флуоресцентной метки при гибридизации зонда с геномом вируса ЦВС-2 в цитоплазме восприимчивых клеток. Ув. 630х.
Фиг. 2 - Паховый лимфатический узел. Положительный результат FISH с ярким свечением флуоресцентной метки при гибридизации зонда с геномом вируса ЦВС-2 в цитоплазме восприимчивых клеток. У в. 630х.
Фиг. 3 - Легкое. Отрицательный результат гибридизации зонда с геномом вируса ЦВС-2 в цитоплазме восприимчивых клеток. Ув. 630х.
Фиг. 4 - Паховый лимфатический узел. Отрицательный результат гибридизации зонда с геномом вируса ЦВС-2 в цитоплазме восприимчивых клеток. Ув. 630х.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing nonEnglishFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="СПОСОБ ДИАГНОСТИКИ ЦИРКОВИРУСНОЙ БОЛЕЗНИ
СВИНЕЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN-SITU (FISH).xml"
softwareName="WIPO Sequence" softwareVersion="2.3.0"
productionDate="2023-12-27">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2023128915</ApplicationNumberText>
<FilingDate>2023-11-08</FilingDate>
</ApplicationIdentification>
<ApplicantName languageCode="ru">ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ
БЮДЖЕТНОЕ НАУЧНОЕ УЧРЕЖДЕНИЕ "ФЕДЕРАЛЬНЫЙ НАУЧНЫЙ ЦЕНТР -
ВСЕРОССИЙСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ ЭКСПЕРИМЕНТАЛЬНОЙ
ВЕТЕРИНАРИИ ИМЕНИ К.И. СКРЯБИНА И Я.Р. КОВАЛЕНКО РОССИЙСКОЙ АКАДЕМИИ
НАУК" (ФГБНУ ФНЦ ВИЭВ РАН)</ApplicantName>
<ApplicantNameLatin>Federal Scientific Centre VIEV (FSC
VIEV)</ApplicantNameLatin>
<InventionTitle languageCode="ru">СПОСОБ ДИАГНОСТИКИ ЦИРКОВИРУСНОЙ
БОЛЕЗНИ СВИНЕЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN-SITU
(FISH)</InventionTitle>
<SequenceTotalQuantity>1</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>103</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..103</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>A section of the gene encoding the capsid
protein of the porcine circovirus type 2</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gcgggagtctggtgaccgttgcagagcagcaccctgtaacgtttgtcag
aaatttccgcgggctggctgaacttttgaaagtgagcgggaaaatgcagaagcg</INSDSeq_sequen
ce>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ВИРУСНОГО РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN-SITU (FISH) | 2023 |
|
RU2823531C1 |
| СПОСОБ ДИАГНОСТИКИ ЦИРКОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ ВТОРОГО ТИПА ПРЯМЫМ ИММУНОГИСТОХИМИЧЕСКИМ АНАЛИЗОМ НА ОСНОВАНИИ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2018 |
|
RU2695330C1 |
| СПОСОБ ДИАГНОСТИКИ КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ С ПОМОЩЬЮ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN SITU (FISH) | 2023 |
|
RU2806252C1 |
| СПОСОБ ДИАГНОСТИКИ ЦИРКОВИРУСА СВИНЕЙ | 2019 |
|
RU2697849C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ, ВЫЗЫВАЮЩАЯ ИММУННЫЙ ОТВЕТ ПРОТИВ ПАРВОВИРУСА И ЦИРКОВИРУСА СВИНЬИ, ВАКЦИНА ПРОТИВ МНОГОСИСТЕМНОГО СИНДРОМА ИСТОЩЕНИЯ СВИНЕЙ (PMWS) (ВАРИАНТЫ), НАБОР ДЛЯ ВАКЦИНАЦИИ И СПОСОБ ЕЕ ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2237492C2 |
| ЦИРКОВИРУС СВИНЕЙ ТИПА II И ЕГО ПРИМЕНЕНИЕ | 1998 |
|
RU2283862C2 |
| ХИМЕРНЫЙ ЦИРКОВИРУС PCV2Gen-1Rep СВИНЕЙ И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2515901C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИММУНИЗАЦИИ СВИНЕЙ ПРОТИВ СВИНОГО ЦИРКОВИРУСА | 2008 |
|
RU2493254C9 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ДЛЯ ИММУНИЗАЦИИ СВИНЕЙ ПРОТИВ ЦИРКОВИРУСА ТИПА 3 И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2016 |
|
RU2744193C2 |
| РЕКОМБИНАНТНАЯ ВИРУСОПОДОБНАЯ ЧАСТИЦА КАПСИДА ЦИРКОВИРУСА (VLP): КОМПОЗИЦИИ, СПОСОБЫ И ПРИМЕНЕНИЯ | 2020 |
|
RU2817679C2 |



Изобретение относится к области биотехнологии, в частности к способу диагностики цирковирусной болезни свиней. Указанный способ основан на флуоресцентной гибридизации in-situ (FISH) и включает использование гибридизационного зонда, специфичного к участку гена кодирующего капсидный белок цирковируса свиней 2 типа, причем объектом исследования являются нативные криотомные срезы из легкого и пахового лимфатического узла. В качестве гибридизационного зонда используется нуклеотидная последовательность с флуоресцеин-12-dUTP красителем. Изобретение обеспечивает выявление генетической последовательности цирковируса свиней второго типа в восприимчивых к вирусу клетках органов (легкое, паховый лимфатический узел) и расширение арсенала способов диагностики цирковирусной инфекции свиней. 4 ил., 3 пр.
Способ диагностики цирковирусной болезни свиней с помощью флуоресцентной гибридизации in-situ (FISH), включающий использование гибридизационного зонда, специфичного к участку гена кодирующего капсидный белок цирковируса свиней 2 типа, отличающийся тем, что объектом исследования являются нативные криотомные срезы из легкого и пахового лимфатического узла, а в качестве гибридизационного зонда используется нуклеотидная последовательность GCGGGAGTCTGGTGACCGTTGCAGAGCAGCACCCTGTAACGTTTGTCAGAAATTTCCGCGGGCTGGCTGAACTTTTGAAAGTGAGCGGGAAAATGCAGAAGCG с флуоресцеин-12-dUTP красителем, детектируемым в ультрафиолетовом свете микроскопа в виде изумрудно-зеленого свечения внутри восприимчивых клеток.
| СПОСОБ ДИАГНОСТИКИ ЦИРКОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ ВТОРОГО ТИПА ПРЯМЫМ ИММУНОГИСТОХИМИЧЕСКИМ АНАЛИЗОМ НА ОСНОВАНИИ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2018 |
|
RU2695330C1 |
| US 10052375 B2, 21.08.2018 | |||
| WO 2010061000 A1, 03.06.2010 | |||
| ПЕТРОВА О.Г | |||
| и др., Диагностика цирковирусной инфекции свиней, Аграрный вестник Урала, 2014, no 3(121), стр | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| БАГРЕЦОВА А.А., Диагностика и профилактика цирковирусной инфекции свиней, МОЛОДЕЖЬ И НАУКА, 2020, no 11, eISSN: 2308-0426. | |||
Авторы
Даты
2024-07-23—Публикация
2023-11-08—Подача