Изобретение относится к химии, в частности, к радиохимии и может быть использовано для получения 5-(2-[18F]фторэтокси)-L-триптофана.
Известен способ получения 5-(2-[18F]фторэтокси)-L-триптофана [ Stefanie D. 5-(2-18F-Fluoroethoxy)-L-Tryptophan as a Substrate of System L Transport for Tumor Imaging by PET / Stefanie D.
Stefanie D. 5-(2-18F-Fluoroethoxy)-L-Tryptophan as a Substrate of System L Transport for Tumor Imaging by PET / Stefanie D.  Linjing Mu,
Linjing Mu,  Claudia Keller, Olga F. Kuznetsova, Christian Schweinsberg, Dominic Franck,
Claudia Keller, Olga F. Kuznetsova, Christian Schweinsberg, Dominic Franck,  Tobias L. Ross, Roger Schibli, Simon M. Ametamey // J. Nucl. Med. - 2012. - 53. - P. 434-442. DOI: 10.2967/jnumed. Ill.096289], путем двухэтапного радиоактивного синтеза.
Tobias L. Ross, Roger Schibli, Simon M. Ametamey // J. Nucl. Med. - 2012. - 53. - P. 434-442. DOI: 10.2967/jnumed. Ill.096289], путем двухэтапного радиоактивного синтеза.
В известном способе раствор [18F] фторида был получен в результате ядерной реакции 18O (p,n) 18F путем облучения обогащенной [18O] воды на 98%, пучком протонов на циклотроне Cyclone 18/9; IBA. Далее раствор [18F] фторида был иммобилизован на анионообменном картридже (QMA Light; Waters), предварительно обработанном K2CO3 5 мл, 0,5 М, а затем 5-10 мл воды. Активность элюировали гидроксидом тетрабутиламмония 0.6 мл, 0.18 мм и высушивали под вакуумом в токе азота при 110°С. Азеотропную сушку повторяли 3 раза, каждый раз добавляя по 1 мл ацетонитрила. К высушенному комплексу [18F]фторида, 20 ГБк, добавляли этиленди(n-толуолсульфоната) по 5-6 мг в 0,9 мл CH3CN и смесь нагревали при температуре 105°С в течение 6 мин.
Реакционную смесь, полученную в первом реакторе, охлаждали до температуры 20°С, разбавляли 10 мл 35%-ным этанолом и пропускали через картридж LiChrolute EN cartridge (Merck). Продукт, 1-[18F]фтор-2-(тозилокси)этан, элюировали диметилсульфоксидом (ДМСО) 0.8-0.9 мл во второй реактор, в который была предварительно загружена динатриевая соль 5-гидрокси-L-триптофана 5-10 мг в смеси ДМСО 0.20 мл и воды 0.15 мл. Реакционную смесь нагревали при температуре 120°С в течение 9 мин. После охлаждения до температуры 20°С, реакционную смесь разбавляли водой 1.8-2.0 мл и очищали с помощью полупрепаративной высокоэффективной жидкостной хроматографии (ВЭЖХ), которую проводили на системе Merck-Hitachi L6200A, оснащенной детектором с переменной длиной волны Knauer и детектором излучения Eberline с колонкой Lichrosorb RP-18 (Phenomenex). Хиральную колонку Crownpak (+) Daicel 150 х 4,6 использовали для анализа энантиомерной чистоты радиоактивно меченого продукта элюент: HClO4 рН 3/ МеОН 93/7, об/об. Для исследований стабильности ex vivo использовали систему жидкостной хроматографии Waters Ultra-performance (UPLC ®) с колонкой UPLC ВЕН С18 и двумя подвижными фазами, т.е. 0,1% TFA и ацетонитрила, соответственно, в сочетании с детектором совместного падения Бертольда (FlowStar LB513), а также обращенно-фазовой радиотонкослойной хроматографией (TLC, алюминиевые листы, силикагель, RP18F254; Macherey-Nagel) с 10% EtOH в 35 мм ацетатном буфере (рН 4) и тепловизор Canberra-Packard Instant Imager (Perkin Elmer, Watford, UK).
Продукт 5-(2-[18F]фторэтокси)-L-триптофан собирали примерно через 14 мин и нейтрализовали гидрокарбонатом натрия (8.4%). Раствор пропускали через стерильный фильтр 0.22 мм и использовали для исследований in vitro и in vivo.
Недостатком известного способа является наличие промежуточной очистки реакционного раствора, которая в свою очередь весьма трудоемка и несет значительную радиоактивную нагрузку на оператора или требует наличие модуля синтеза с двумя реакторами.
Известен способ получения 5-(2-[18F]фторэтокси)-L-триптофана [Abbas, A. Characterization of 5-(2-18F-fluoroethoxy)-L-tryptophan for PET imaging of the pancreas [version 1; referees: 1 approved, 1 approved with reservations] / Ahmed Abbas, Christine Beamish, Rebecca McGirr, John Demarco, Neil Cockburn, Dawid Krokowski, Ting-Yim Lee, Michael Kovacs, Maria Hatzoglou, Savita Dhanvantari // FlOOOResearch. - 2016. - 5:1851] также путем двухэтапного радиоактивного синтеза. [18F]фторид был получен в результате ядерной реакции 18O (p,n) 18F путем облучения обогащенной [18O] воды в циклотроне PETtrace; GE.
Раствор [18F] фторида помещали в установку автоматического синтеза Tracerlab FXF-N; GE, где он улавливался анионообменным картриджем QMA Light; Waters. Активность элюировали 1 мл раствора 1:4 вода/ацетонитрил с Cryptand 222, 15 мг; АВХ и карбонатом калия 5 мг; Aldrich. Активность высушивали в токе азота в вакууме при температуре 95°С. Азеотропную сушку повторяли 2 раза, каждый раз добавляя по 0.5 мл ацетонитрила. Добавляли 1 мл раствора этиленди(n-толуолсульфоната) 10 мг, Aldrich в ацетонитриле и смесь нагревали при температуре 85°С в течение 6 мин. Реакционную смесь охлаждали до температуры 20°С и промежуточный продукт 1-[18F]фтор-2-(тозилокси)этан, выделяли с помощью полупрепаративной ВЭЖХ. Собранную фракцию разводили в воде 2 мл и помещали на картридж С18 (Waters). Продукт элюировали 2 мл диметилсульфоксида (ДМСО) и передавали из установки автоматического синтеза в соседнюю горячую камеру для второй стадии реакции.
Динатриевую соль 5-гидрокси-L-триптофана получали путем объединения 5-гидрокси-L-триптофана 10 мг (Aldrich) с 2 эквивалентами метоксида натрия (метилата натрия) в метаноле (Aldrich) при комнатной температуре. Метанол удаляли с помощью роторного испарителя (V-10; Biotage), а соль растворяли в диметилсульфоксиде (ДМСО). Раствор переносили во второй реактор (реакционную колбу) под действием азота. Затем добавляли раствор 1-[18F]фтор-2-(тозилокси)этан в ДМСО и нагревали при температуре 105°С в течение15 мин. Реакционную смесь разбавляли водой и очищали с помощью полупрепаративной ВЭЖХ, а подвижную фазу из собранной фракции удаляли с помощью роторного испарителя. Продукт 5-(2-[18F]фторэтокси)-L-триптофан растворяли физиологическим раствором с фосфатным буфером с добавлением 8% этанола и пропускали через стерильный фильтр перед использованием.
Недостатком метода является наличие промежуточной очистки реакционного раствора, которая по данному способу осуществляется с применением полупрепаративной ВЭЖХ, что является трудоемким процессом и требует дорогостоящего оборудования. Также данный способ получения требует наличие двух горячих камер.
Из известных аналогов в качестве прототипа к заявляемому способу выбран способ получения 5-(2-[18F]фторэтокси)-L-триптофана [Li, R. Synthesis and evaluation of L-5-(2-[18F]fluoroethoxy)tryptophan as a new PET tracer / Ruifen Li, Shih-Chen Wu, Shih-Chen Wang, Zhe Fu, Yonghong Dang, Li Huo // Applied Radiation and Isotopes. - 2010. - 68. - P. 303-308. doi.org/10.2967/jnumed.111.096289], при котором синтез конечного продукта осуществляется в две стадии: [18F] фторирования этиленди(и-толуолсульфоната) и последующей реакции 1-[18F]фтор-2-(тозилокси)этилен, с промежуточной очисткой реакционной смеси путем твердофазной экстракции на картридже Sep-Pak ТМ Plus QMA.
Водный раствор [18F] фторида был получен в результате ядерной реакции 18O (p,n) 18F путем облучения обогащенной [18O] воды, 98%, пучком протонов с энергией 11 МэВ на циклотроне RDS 111. Водный раствор [18F] фторида добавляли в конический сосуд, содержащий 0.25 мл ацетонитрил (Merck 0,003% H2O), 5 мг (13.3 ммоль) Криптофикс 2.2.2 (Merck) и 5 мл 1 моль/л карбоната калия (Merck, supra pure). Растворитель упаривали в токе азота при температуре 100°С. Азеотропную сушку повторяли 3 раза, каждый раз добавляя по 0,25 мл ацетонитрила.
7.4 мг (20 ммоль) этиленди(и-толуолсульфоната), растворенного в 2 мл ацетонитриле, добавляли к высушенному комплексу [18F]фторида (28.0-33.5 ГБк) и нагревали при температуре 90°С в течение 10 мин. В первом реакторе было получено 12,6-20,0 ГБк 1-[18F]фтор-2-(тозилокси)этан 45-60%) от общей радиоактивности. Промежуточный продукт пропускали через картридж QMA и переносили во второй реактор, картридж QMA промывали этиловым эфиром 2 мл х 2. Радиохимическая активность 1-[18F]фтор-2-(тозилокси)этана была выше 98% по данным ВЭЖХ. Затем реакционную смесь упаривали в токе азота при комнатной температуре в течение 40 с. К реакционной смеси во втором реакторе добавляли 2.64 мг (0.01 ммоль) динатриевой соли 5-гидрокси-L-триптофана растворенной в 0,5 мл диметилсульфоксиде (ДМСО). Реакцию проводили в закрытом реакторе при 100°С в течение 15 мин перемешивая струей азота. Реакционную смесь пропускали через два картриджа silica Sep-Pak и картридж Sep-Pak С18, элюат собирали в емкость для сбора отходов. Картриджи последовательно промывали безводным этиловым эфиром - 10 мл и водой - 1 мл для удаления непрореагировавшего 5-гидрокси-L-триптофана, 1-[18F]фтор-2-(тозилокси)этана и ДМСО. 5-(2-[18F]фторэтокси)-L-триптофан элюировали с картриджей silica Sep-Pak и Sep-Pak CI 8, 6 мл физиологического раствора с фосфатным буфером 0.15 моль/л (PBS, 7.2). Элюат 10 мл набирали в шприц и пропускали через стерильный фильтр диаметром 0,22 мм во флакон для продукта. Выход 3.4-5.5 ГБк.
Процедуры очистки и выделения 5-(2-[18F]фторэтокси)-L-триптофана на картриджах проводились ручным способом. Контроль качества проводился методом ВЭЖХ с применением хроматографической колонки -RP-C18 150x4.0 мм, подвижной фазы, состоящей из смеси растворителей в соотношении 30/70/0.1 (по объему) ацетонитрил/вода/уксусная кислота при скорости потока - 1 мл/мин.
Недостатком известного способа является наличие промежуточной стадии очистки реакционной смеси, которая в свою очередь весьма трудоемка и требует наличие модуля синтеза с двумя реакторами, а также процедуры очистки и выделения, которая осуществляется ручным способом, что несет значительную радиоактивную нагрузку на оператора.
Технический результат, достигаемый в заявляемом способе, заключается в упрощении процесса получения 5-(2-[18F]фторэтокси)-L-триптофана за счет использования одного реактора при двухэтапном радиоактивном синтезе 5-(2-[18F]фторэтокси)-L-триптофана, исключая промежуточную стадию очистки, что позволяет снизить радиоактивную нагрузку на оператора и увеличить экономичность технологии.
Указанный технический результат достигается тем, что в способе получения 5-(2-[18F]фторэтокси)-L-триптофана, включающем получение водного раствора [18F]-фторид в ядерной реакции 18O (p,n) 18F путем облучения, обогащенной на 98% 18O воды пучком протонов, согласно изобретению, облучение обогащенной 18O воды осуществляют пучком протонов с энергией 18 МэВ на циклотроне GE PET tracer 800, полученный водный раствор [18F]-фторид иммобилизуют на анионообменном картридже QMA Light, проводят элюирование радиоактивного [18F]-фторид с анионообменного картриджа раствором, состоящим из водного раствора тетрабутиламмония гидроксида и водных растворов карбоната калия и ацетонитрила, с последующим высушиванием под вакуумом в токе гелия; к высушенной смеси [18F] фторид добавляют этиленди(n-толуолсульфоната) растворенного в ацетонитриле, раствор нагревают в атмосфере гелия, затем нагретый раствор охлаждают; к реакционному раствору в атмосфере гелия добавляют 5-гидрокси-L-триптофан, растворенный в диметилсульфоксиде (ДМСО) и водном растворе NaOH, после чего реакционный раствор нагревают в атмосфере гелия.
Заявленный способ получения 5-(2-[18F]фторэтокси)-L-триптофана иллюстрирован рисунками, где:
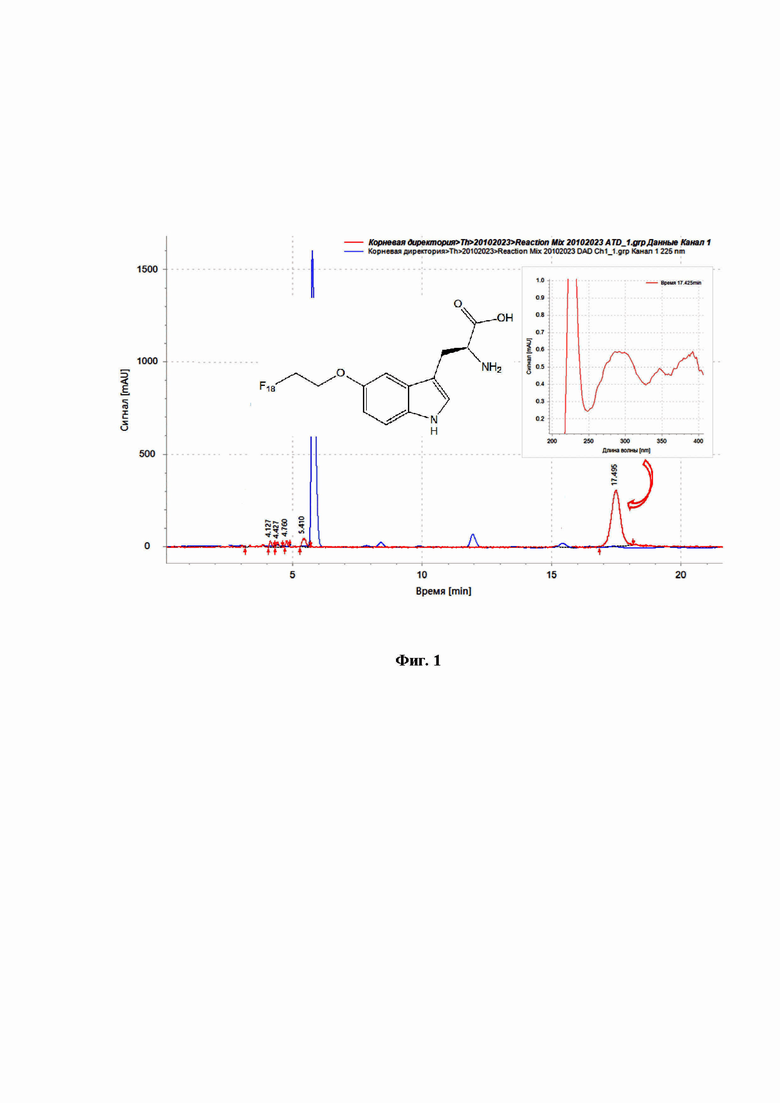
на фиг. 1 представлена хроматограмма раствора 5-(2-[18F]фторэтокси)-L-триптофана, полученная с помощью радиометрического (красный) и спектрофотометрического (синий) детекторов;
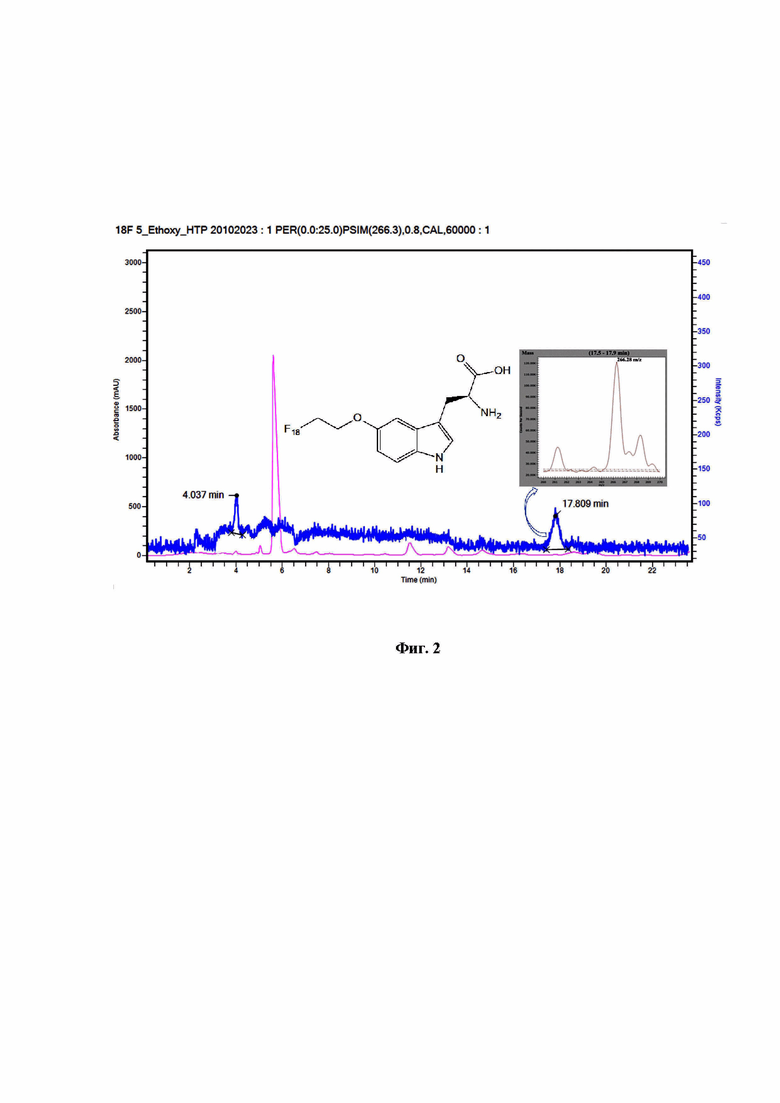
на фиг. 2 представлена хроматограмма раствора 5-(2-[18F]фторэтокси)-L-триптофана, полученная с помощью масс-селективного (синий) и спектрофотометрического (розовый) детекторов.
Способ иллюстрируется примером.
Пример: Способ получения 5-(2-[18F]фторэтокси)-L-триптофана:
- получают водный раствор [18F] фторид в результате ядерной реакции 18O (p,n) [18F] путем облучения обогащенной на 98% 18O воды пучком протонов с энергией 18 МэВ на циклотрон GE PETtracer 800;
- иммобилизовывают полученный водный раствор [18F] фторид на анионообменном картридже QMA Light, предварительно обработанном 10 мл 0.75 молярным водным раствором гидрокарбоната калия и промытым 10 мл воды;
- проводят элюирование радиоактивного [18F]фторид с анионообменного картриджа с помощью раствора, состоящего из 0.5 мл 0.075 молярного водного раствора тетрабутиламмония гидроксида, 80 мкл водного раствора карбоната калия с концентрацией 55 мг/мл и 1.6 мл ацетонитрила с максимальным содержанием воды 1⋅10-5%;
- проводят высушивание под вакуумом в токе гелия при температуре 120°С в течение 12 мин;
- к высушенному [18F-] фторид добавляют 7 мг этиленди(n-толуолсульфоната), растворенного в 1.5 мл ацетонитрила с максимальным содержанием воды 1⋅10-5%;
- раствор нагревают при температуре 75°С в течение 15 мин в атмосфере гелия;
- нагретый раствор охлаждают до температуры 10°С в атмосфере гелия;
- в охлажденный раствор добавляют 7 мг 5-гидрокси-L-триптофана, растворенного в 0.5 мл диметилсульфоксида (ДМСО) и 15 мкл 10% водного раствора NaOH;
- полученный раствор нагревают при перемешивании в течение 10 мин при температуре 100°С в атмосфере гелия.
- раствор охлаждают до 20°С в атмосфере гелия;
- получают раствор содержащий 5-(2-[18F]фторэтокси)-L-триптофан.
Очистку и выделение 5-(2-[18F]фторэтокси)-L-триптофана осуществляют методом препаративной ВЭЖХ. Контроль качества проводят методом ВЭЖХ с применением хроматографической колонки - CN 250x4.0 мм, подвижной фазы, состоящей из смеси ацетонитрил/0.1% муравьиная кислота в соотношении 5/95 при скорости потока - 1 мл/мин и детектировании с помощью радиометрического, спектрофотометрического и масс-селективного детекторов. Хроматограмма, полученного раствора при детектировании с помощью радиометрического и спектрофотометрического детекторов, представлена на фиг.1. Хроматограмма, полученного раствора при детектировании с помощью масс-селективного и спектрофотометрического детекторов, представлена на фиг. 2.
Идентификацию 5-(2-[18F]фторэтокси)-L-триптофана осуществляют путем сравнения времен удерживания и УФ-спектров пика 5-(2-[18F]фторэтокси)-L-триптофана и 5-(2-[19F]фторэтокси)-L-триптофана на хроматограммах, полученных при детектировании с помощью радиометрического и спектрофотометрического детекторов (фиг. 1), а также наличием молекулярного иона [М+Н]+=266 m/z пика 5-(2-[18F]фторэтокси)-L-триптофана на хроматограмме, полученной при детектировании с помощью масс-селективного детектора (фиг. 2).
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ДЛЯ СВЯЗЫВАНИЯ СО СПЕЦИФИЧЕСКИМ ДЛЯ ТРОМБОЦИТОВ ГЛИКОПРОТЕИНОМ IIB/IIIA И ИХ ПРИМЕНЕНИЕ ДЛЯ ВИЗУАЛИЗАЦИИ ТРОМБОВ | 2012 |
|
RU2597425C2 |
| Раствор элюента | 2011 |
|
RU2608932C2 |
| [F-18] МЕЧЕННАЯ L-ГЛЮТАМИНОВАЯ КИСЛОТА, [F-18] МЕЧЕННЫЙ L-ГЛЮТАМИН, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ, А ТАКЖЕ СПОСОБ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2395489C2 |
| Способ синтеза F-меченых биомолекул | 2012 |
|
RU2620598C2 |
| СПОСОБ ОСУЩЕСТВЛЕНИЯ МНОЖЕСТВА ПРОЦЕССОВ СИНТЕЗА ДЛЯ ПОЛУЧЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО СРЕДСТВА СЕРИЯМИ, УСТРОЙСТВО И КАССЕТА ДЛЯ ОСУЩЕСТВЛЕНИЯ ДАННОГО СПОСОБА | 2016 |
|
RU2721551C2 |
| Способ радиоактивного мечения | 2014 |
|
RU2675371C2 |
| Способ получения флутеметамола | 2016 |
|
RU2733398C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРЗАМЕЩЕННОГО ОРГАНИЧЕСКОГО АЛИФАТИЧЕСКОГО СОЕДИНЕНИЯ И СПОСОБ ОЧИСТКИ ФТОРЗАМЕЩЕННОГО ОРГАНИЧЕСКОГО АЛИФАТИЧЕСКОГО СОЕДИНЕНИЯ | 2015 |
|
RU2710558C2 |
| СПОСОБ РАДИОМЕЧЕНИЯ | 2014 |
|
RU2690848C2 |
| СПОСОБ ПОЛУЧЕНИЯ О-(2'-[F]ФТОРЭТИЛ)-L-ТИРОЗИНА | 2015 |
|
RU2583371C1 |
Изобретение относится к области биохимии, в частности к способу получения 5-(2-[18F]фторэтокси)-L-триптофана. Изобретение позволяет эффективно получать 5-(2-[18F]фторэтокси)-L-триптофан. 2 ил., 1 пр.
Способ получения 5-(2-[18F]фторэтокси)-L-триптофана, включающий получение водного раствора [18F]фторид в ядерной реакции 18O (p,n) 18F путем облучения обогащенной на 98% 18O воды пучком протонов, отличающийся тем, что облучение обогащенной 18O воды осуществляют пучком протонов с энергией 18 МэВ на циклотроне GE PETtracer 800, полученный водный раствор [18F]фторид иммобилизуют на анионообменном картридже QMA Light, проводят элюирование радиоактивного [18F]фторид с анионообменного картриджа раствором, состоящим из водного раствора тетрабутиламмония гидроксида и водных растворов карбоната калия и ацетонитрила, с последующим высушиванием под вакуумом в токе гелия; к высушенной смеси [18F]фторид добавляют этиленди(n-толуолсульфонат), растворенный в ацетонитриле, раствор нагревают в атмосфере гелия, затем нагретый раствор охлаждают, к реакционному раствору в атмосфере гелия добавляют 5-гидрокси-L-триптофан, растворенный в диметилсульфоксиде (ДМСО) и водном растворе NaOH, после чего реакционный раствор нагревают в атмосфере гелия.
| СПОСОБ ПОЛУЧЕНИЯ О-(2'-[F]ФТОРЭТИЛ)-L-ТИРОЗИНА | 2015 |
|
RU2583371C1 |
| WO 2011141568 A1, 17.11.2011 | |||
| WO 2012150220 A1, 08.11.2012. | |||
Авторы
Даты
2024-07-31—Публикация
2023-12-25—Подача