Изобретение относится к способам культивирования стартовых живых кормов для рыб, в частности для коловратки солоноватоводной.
Известно, что на ранних стадиях развития культивируемым гидробионтам, таким как рыбы и ракообразные, необходимы живые корма. В морской аквакультуре живыми кормами являются такие организмы, как коловратки солоноватоводные Brachionus plicatilis и науплиусы артемии Artemia salina.
Коловратки и артемии обладают недостаточным питательным составом в природе и не являются естественной добычей культивируемых гидробионтов (Lubzens, E., 2003). Тем не менее их быстрый темп размножения при высокой плотности в большинстве случаев более значителен, чем недостаток питательности. Питательные качества коловраток и артемий улучшались за счет изменения их рациона, в частности, для повышения содержания высоконенасыщенных жирных кислот (например, докозагексаеновой кислоты и эйкозапентаеновой кислоты) путем отбора штаммов микроводорослей. Производство коловраток первоначально основывалось на кормлении живыми микроводорослями (Nannochloropsis sp., Tetraselmis sp., Pavlova lutheri и Isochrysis galbana) или пекарскими дрожжами. Коловратки, которых кормили микроводорослями, быстро обогащались аскорбиновой кислотой (Kaparapu J., 2018).
Диатомовые микроводоросли обитают во всех фотозонах и очень чувствительны к малейшим изменениям физико-химических характеристик окружающей их экосистемы, что делает их идеальными кандидатами для экологического мониторинга. Их высокая адаптируемость к широкому спектру сред подтверждает их потенциальное применение в различных областях. Высокая скорость роста даже при низкой освещенности и градиентах температуры, способность расти в крупномасштабных системах культивирования, образование биопленок, приводит к энергоэффективному сбору урожая (Marella T. K., 2020).
Диатомовые микроводоросли, которые служат кормом для живых кормов, помимо того, что имеют высокий темп роста, еще и неприхотливы в выращивании. Содержание 40% белков, 30% углеводов, 30% липидов и витаминов в культуре микроводорослей является одной из основных причин использования их в качестве корма (Aji L. P., 2011). В составе белков присутствуют все незаменимые аминокислоты. В составе липидов много ненасыщенных жиров, свободных жирных кислот, в том числе незаменимая линолевая кислота. Потребление азота и фосфора диатомовыми микроводорослями в условиях интенсивного культивирования широко используется в аквакультуре. В качестве корма микроводоросли, выращиваются в промышленных масштабах в ряде стран мира, например, таких как Индия, Испания и др. (Бородина А. В., 2005).
Известен способ лабораторного культивирования диатомовых микроводорослей при свето-темновом режиме 18/6 (1000-1200 лк). Температура 20–24°С, соленость 20–24 г/л, рН 8,2–8,7 перемешивание культур происходило с помощью аэратора (Ashokkumar S., 2015). Питательная среда состоит из макро, микроэлементов и витаминов: г/литр: 1) NaNO3 - 75, 2) NaH2PO4⋅H2O - 5, Na2SiO3⋅9H2O – 30, 3) Na2C10H14O8N2⋅H2O - 4,36, (Na2EDTA), CoCl2⋅6H2O - 0.01, 4) CuSO4⋅5H2O - 0.01, 5) FeCl3⋅6H2O - 3.15, MnCl2⋅4H2O - 0.18, 6) Na2MoO4⋅2H2O - 0.006, ZnSO4⋅7H2O - 0.022, Thiamin HCl - 0.1, 7) Biotin - 0.0005, B12 - 0.0005. В отличие от данного способа, в нашем освещение составляет от 2000 лк, соленость 32‰, в питательной среде не используются витаминные добавки.
Известен способ кормления нуаплиусов артемии семью видами монокультур микроводорослей: Prymnesiophyceae (Isochrysis galbana); Dinophyceae (Prorocentrum micans, Gymnodinium wulffii, Prorocentrum cordatum); Chlorodendraphyceae (Tetraselmis suecica); Bacillariophyceae (Phaeaodactylum tricornutum) цисты артемий инкубировали при температуре 28°C в сосудах с фильтрованной морской водой соленостью 18 ‰, при постоянной аэрации и круглосуточном искусственном освещении. Выживаемость науплиусов при питании P. cordatum, P. Micans и T. suecica достигала максимального значения (выше 95%) (Смирнов Д. Ю., 2019).
Способ культивирования коловраток (Пат. SU 1360680) предусматривает повышение продуктивности коловраток путем подавления роста простейших. Для этого после каждой подачи кормовой суспензии проводят циркуляцию культуральной среды по замкнутому контуру с помощью установки. В отличие от данного способа, насос не используется.
Известен способ при котором клон Isochrysis aff. Galbana Т-ISO культивировали полунепрерывно со скоростью обновления от 10 до 50% объема культуры в сутки. Коловратки, которых кормили микроводорослями из культур с достаточным количеством питательных веществ и высокой скоростью обновления, показали более высокий сухой вес и увеличение белка до 60%, липидов до 35% и 100%. % содержания углеводов (Ferreira M., 2008). Похожие результаты были при применении в качестве корма коловраткам, микроводоросли Nannochloropsis gaditana (Ferreira M., 2009).
Наиболее близкий к заявленному технологическому способу является способ культивирования диатомовой микроводоросли Chaetoceros calcitrans для личинок гигантской устрицы (Пат. RU 2663328 C1). При данном способе водоросль культивировали в течение 11 суток, при температуре 22-24°С, освещенности 10 клк, аэрации смесью воздуха и углекислого газа (2%), на модифицированной питательной среде на основе стерильной морской воды соленостью 18‰. Содержание биогенных элементов пропорционально увеличивали до следующих значений, г/л: NaNO3 - 600, NaH2PO4⋅2Н2O - 40, FeCl3⋅6Н2O - 28, Na2ЭДТА - 34,88, Na2SiO3⋅9Н2O - 240, MnCl2⋅4Н2O - 1,8. Способ обеспечивает максимальное накопление биомассы водоросли. В отличие от данного, при нашем способе длительность выращивания культуры 7 суток при солености 32‰, питательная среда состоит из меньшего количества элементов.
Также близкий к заявленному изобретению является способ получения живых кормов для личинок морских рыб (Пат. RU0002717990). Способ заключается в том, что за двое суток до использования коловраток в качестве корма их переводят на питание динофлагеллятами Prorocentrum cordatum и Prorocentrum micans. при начальной концентрации микроводорослей в среде 5×104 кл/мл. Способ обеспечивает получение живых кормов, имеющих высокое содержание докозагексаеновой и эйкозапентаеновой кислот.
Задачей способа «Интенсивного выращивания коловратки солоноватоводной с применением культур морских микроводорослей» является увеличение численности и питательности коловраток, выращенных на диатомовых микроводорослях, для применения в хозяйствах аквакультуры.
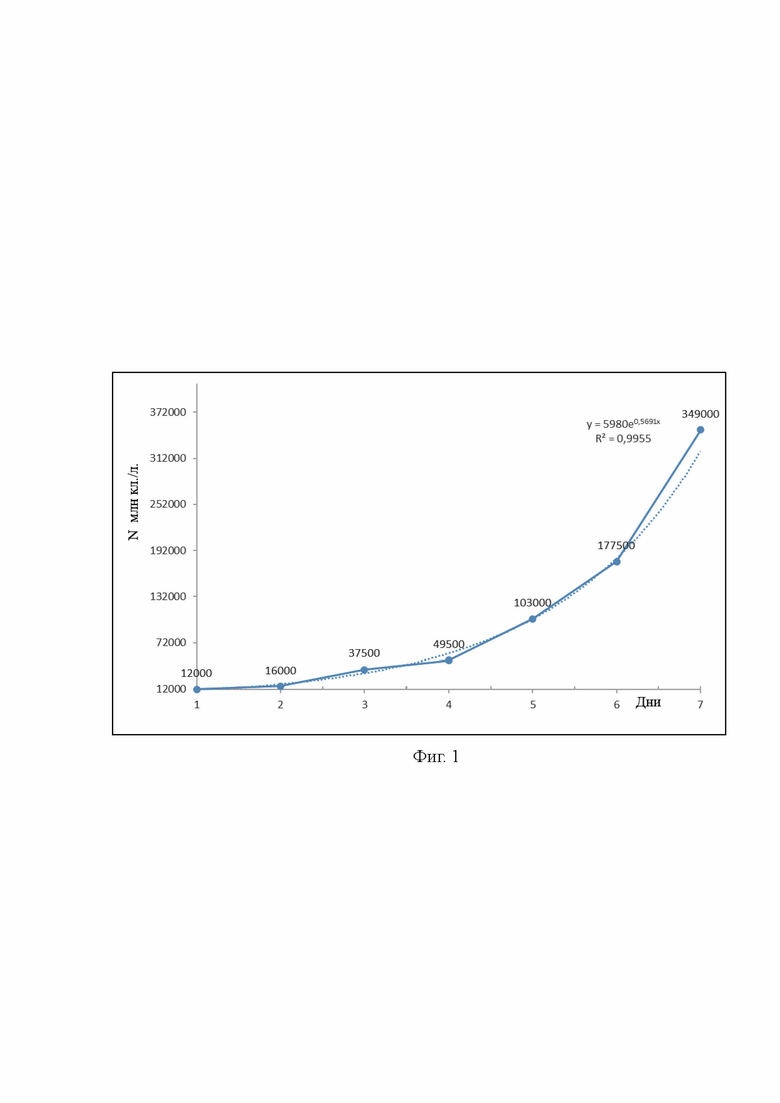
На фиг. 1 представлен рост численности клона микроводоросли рода MBRU_Skel22 Skeletonema sp. взятый из биобанка ННЦМБ. В течение 7 дней выращивания культура быстро достигает численности 349000 млн кл/л, что достаточно для питания культуры коловраток.
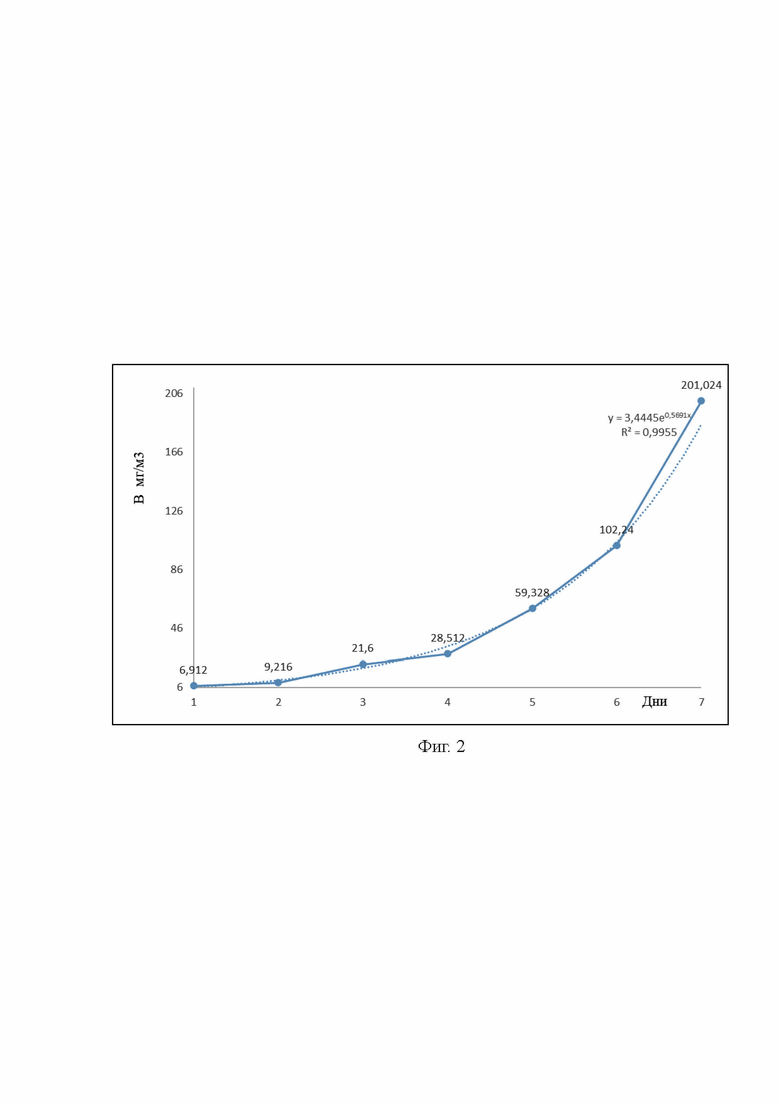
На фиг. 2 представлен рост биомассы культуры микроводорослей Skeletonema sp. Биомассы 201,024 мг/м3 культура так же достигла в течение 7 дней.
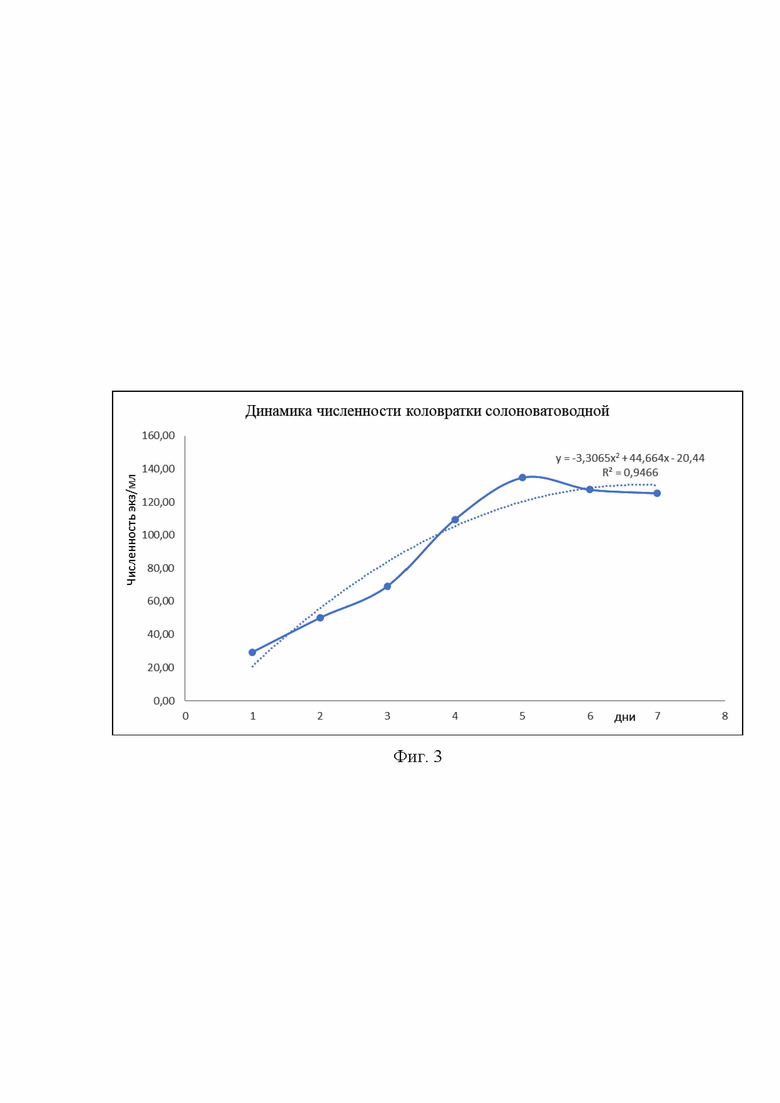
Фиг. 3 отображает рост численности самой кормовой культуры коловратки достигшей пика численности 134 экз/мл. уже на 5-й день кормления диатомовой микроводорослью.
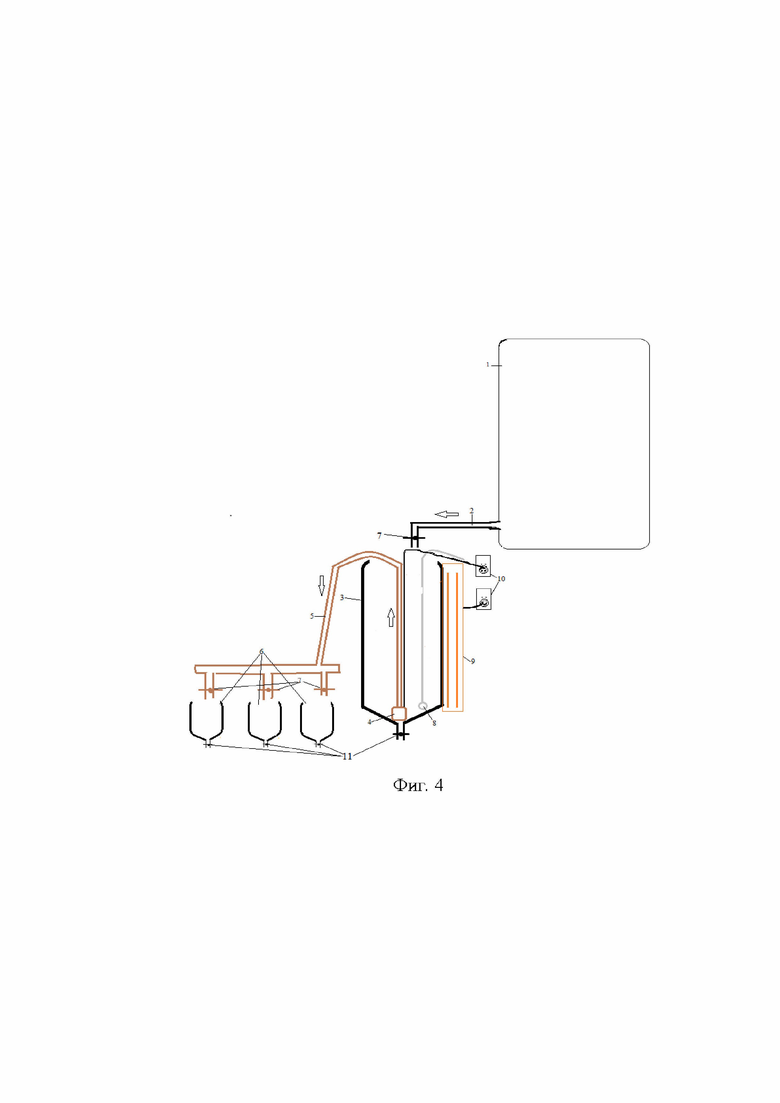
На фиг. 4 представлена схема дозированной подачи культуры в виде отдельных клеток микроводорослей культуре коловраток с помощью насоса подключенного к розетке с регулятором.
Техническим результатом изобретения является получение высококачественного корма для увеличения численности и питательности коловратки солоноватоводной, выращиваемой на хозяйствах аквакультуры, которая, в свою очередь, является кормом для многих культивируемых гидробионтов.
Поставленная задача и заявленный технический результат достигаются способом интенсивного выращивания коловратки солоноватоводной с применением культур морских микроводорослей, характеризующимся тем, что микроводоросли рода Skeletonema культивируют в течение 7 суток, при температуре 21±2°С и освещенности 4000 лк, свето-темновом режиме 12/12, в приготовленной на стерильной морской воде соленостью 32‰ питательной среде, которую постепенно добавляют до объема 200 л, при достижении численности микроводоросли 349000 млн кл/л, цепочки микроводорослей разделяют на отдельные клетки, и подают в резервуары, где выращивается коловратка.
Микроводоросли выращиваются накопительным способом на питательной среде f/2 в течение 7 суток, при температуре 21±2°С, свето-темновой режим 12/12, освещенность от 4000 лк. Питательная среда приготовлена на стерильной морской воде соленостью 32 ‰ и состоит из макро и микроэлементов г/литр: 1) NaNO3 - 75; NaH2PO4⋅H2O - 5, Na2SiO3⋅9H2O - 30, 3) CuSO4⋅5H2O - 0.01, ZnSO4⋅7H2O - 0.022, CoCl2⋅6H2O - 0.01, MnCl2⋅4H2O - 0.18, Na2MoO4⋅2H2O - 0.006, 4) Na2EDTA - 4,3, 5) FeCl3⋅6H2O - 3.15, не включая витамины, что значительно удешевляет культивирование. Длинные цепочки диатомей разбивают на отдельные клетки и в таком виде подают коловраткам.
Способ реализуется следующим образом:
1) Клон культуры диатомовой микроводоросли MBRU_Skel22 Skeletonema sp. взятый из биобанка ННЦМБ ДВО РАН (http://marbank.dvo.ru/index.php/ru/) выращивается на питательной среде f/2, приготовленной на стерилизованной морской воде соленостью 32‰. Освещается диодной лампой 4000 лк, при стандартной температуре 21±2°С, перемешивается с помощью кислородного камня.
2) Доводится до объема 200 л путем постепенного добавления питательной среды.
3) При достижении численности 349000 млн кл/л цепочки микроводорослей разделяются на отдельные клетки.
4) Перед добавлением клеток, коловраток выдерживали сутки без питания для достижения более достоверного результата.
Численность коловраток, 134 экз./мл, при начальной 29 экз./мл, достигается на 5-й день выращивания (рис 3).
Пример реализации изображен на фигуре 4. Питательная среда хранится в отдельном резервуаре (1). Подается самотеком по трубке с регулятором (2) в прозрачную ёмкость, где содержится культура микроводорослей (3). С помощью насоса (4) по шлангу (5) культура микроводорослей в необходимом количестве подается в резервуары, где выращивается коловратка (6). Все наливные шланги оборудованы регуляторами (7). Фотобиореактор с микроводорослями оборудован кислородным камнем (8) для перемешивания культуры. Лампа освещения (9), длиной с фотобиореактор, питается от розетки с регулятором (10), от такой же розетки питается подающий насос. Каждая емкость оборудована сливными отверстиями с регулятором (11).
Список источников
1. Aji L.P. The use of algae concentrates, dried algae and algal substitutes to feed bivalves //Makara Journal of Science. – 2011. – Т. 15. – №. 1. – С. 1.
2. Lubzens E. et al. Production and nutritional value of rotifers //Live feeds in marine aquaculture. – 2003. – С. 300-303.
3. Kaparapu J. Application of microalgae in aquaculture // Phykos. – 2018. – Т. 48. – №. 1. – С. 21-26.
4. Бородина А.В., Шахматов А.П. Потребление азота и фосфора диатомовой микроводорослью Phaeodactylum tricornutum Bohl. в условиях интенсивного культивирования. Всеукр. науч.–практ. конф. мол. учёных по проблемам Черного и Азовского морей (24-27 мая 2005 г.). – Севастополь, 2005. – С. 16-17.
5. Marella T.K., López-Pacheco, I. Y., Parra-Saldívar, R., Dixit, S., Tiwari, Wealth from waste: Diatoms as tools for phycoremediation of wastewater and for obtaining value from the biomass //Science of the Total Environment. – 2020. – Т. 724. – С. 137960.
6. Пат. RU0002717990 МПК A01K 61/00 СПОСОБ ПОЛУЧЕНИЯ ЖИВЫХ КОРМОВ ДЛЯ ЛИЧИНОК МОРСКИХ РЫБ / Авторы: Ханайченко Антонина Николаевна. Патентообладатели Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр «Институт биологии южных морей имени А.О. Ковалевского РАН» (ФИЦ ИнБЮМ) (RU), Дата подачи заявки: 14.03.2019, опубл. 27.03.2020, Бюл. № 9.
7. Пат. RU 2663328 C1 МПК A01K 61/00 СПОСОБ КУЛЬТИВИРОВАНИЯ ДИАТОМОВОЙ ВОДОРОСЛИ CHAETOCEROS CALCITRANS- КОРМА ДЛЯ ЛИЧИНОК ГИГАНТСКОЙ УСТРИЦЫ CRASSOSTREA GIGAS / Авторы Ладыгина Людмила Владимировна (RU), Пиркова Анна Васильевна (RU). Патентообладатели Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр «Институт биологии южных морей имени А.О. Ковалевского РАН» (ФИЦ ИнБЮМ) (RU), (22) Дата подачи заявки: 19.06.2017. (45) Опубл. 03.08.2018, Бюл. № 22.
8. Пат. SU 1360680 A01K 61/00 Способ культивирования коловраток / Авторы БАКАЕВА ЕЛЕНА НИКОЛАЕВНА, АКСЕНОВА ЕЛЕНА ИВАНОВНА, СТРОГОВ ВЛАДИМИР ПАВЛОВИЧ (SU). Патентообладатель Азовский научно-исследовательский институт рыбного хозяйства. Дата подачи 9.06.1986, дата публикации 23.12.1987, Бюл. № 47.
9. Ashokkumar S., Manimaran K., Kim K. Cultivation and identification of microalgae (Diatom) //Marine Algae Extracts: Processes, Products, and Applications. – 2015. – С. 59-78.
10. Смирнов Д. Ю., Аганесова Л. О., Ханайченко А. Н. Изменчивость размерных характеристик и выживаемости науплиусов крымских артемий Artemia spp.(Branchiopoda: Anostraca) при питании микроводорослями разных видов //Морской биологический журнал. – 2019. – Т. 4. – №. 1. – С. 91-99.
11. Ferreira M. et al. Enriching rotifers with “premium” microalgae. Isochrysis aff. galbana clone T-ISO //Aquaculture. – 2008. – Т. 279. – №. 1-4. – С. 126-130.
12. Ferreira M. et al. Enriching rotifers with “premium” microalgae. Nannochloropsis gaditana //Marine Biotechnology. – 2009. – Т. 11. – С. 585-595.
13. Munday R. et al. Acute toxicities of saxitoxin, neosaxitoxin, decarbamoyl saxitoxin and gonyautoxins 1&4 and 2&3 to mice by various routes of administration // Toxicon. – 2013. – Т. 76. – С. 77-83.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения живых кормов для личинок морских рыб | 2019 |
|
RU2717990C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ КОЛОВРАТОК BRACHIONUS PLICATILIS MULLER | 2023 |
|
RU2835807C1 |
| Способ интенсивного когортного культивирования акарций (морских каланоидных копепод) | 2015 |
|
RU2614644C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ СОЛОНОВАТОВОДНЫХ КЛАДОЦЕР MOINA SALINA | 2022 |
|
RU2786108C1 |
| Способ культивирования одноклеточных микроводорослей Chaetoceros muelleri и Isochrysis galbana - живого корма для личинок морских беспозвоночных | 2022 |
|
RU2793471C1 |
| СПОСОБ ПОДГОТОВКИ КОРМОВ ДЛЯ ВЫРАЩИВАНИЯ ГИГАНТСКОЙ УСТРИЦЫ CRASSOSTREA GIGAS В ЧЕРНОМ МОРЕ В УСЛОВИЯХ ПИТОМНИКА | 2014 |
|
RU2548107C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ МОРСКИХ ГЕТЕРОТРОФНЫХ ДИНОФЛАГЕЛЛЯТ OXYRRHIS MARINA | 2023 |
|
RU2810308C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ КАЛАНОИДНЫХ КОПЕПОД CALANUS EUXINUS (ЧЕРНОМОРСКОГО КАЛЯНУСА) | 2014 |
|
RU2541458C1 |
| Способ снижения численности бактерий-оппортунистов в средах выращивания личинок морских рыб и их кормов | 2015 |
|
RU2614604C1 |
| СПОСОБ ИНТЕНСИВНОГО ВЫРАЩИВАНИЯ МАЛЬКОВ КАМБАЛЫ КАЛКАН | 2014 |
|
RU2548106C1 |
Изобретение относится к морскому рыбоводству и может быть использовано в хозяйствах аквакультуры. Способ характеризуется тем, что микроводоросли рода Skeletonema культивируют в течение 7 суток при температуре 21±2°С и освещенности 4000 лк, свето-темновом режиме 12/12, в приготовленной на стерильной морской воде соленостью 32‰ питательной среде, которую постепенно добавляют до объема 200 л. При достижении численности микроводоросли 349000 млн кл/л цепочки микроводорослей разделяют на отдельные клетки и подают в резервуары, где выращивается коловратка. Изобретение обеспечивает увеличение численности и питательных свойств коловратки солоноватоводной, которая, в свою очередь, является кормом для культивируемых гидробионтов. 4 ил.
Способ интенсивного выращивания коловратки солоноватоводной с применением культур морских микроводорослей, характеризующийся тем, что микроводоросли рода Skeletonema культивируют в течение 7 суток при температуре 21±2°С и освещенности 4000 лк, свето-темновом режиме 12/12, в приготовленной на стерильной морской воде соленостью 32‰ питательной среде, которую постепенно добавляют до объема 200 л, при достижении численности микроводоросли 349000 млн кл/л, цепочки микроводорослей разделяют на отдельные клетки и подают в резервуары, где выращивается коловратка.
| СПОСОБ ПОДГОТОВКИ КОРМОВ ДЛЯ ВЫРАЩИВАНИЯ ГИГАНТСКОЙ УСТРИЦЫ CRASSOSTREA GIGAS В ЧЕРНОМ МОРЕ В УСЛОВИЯХ ПИТОМНИКА | 2014 |
|
RU2548107C1 |
| Способ культивирования коловраток | 1986 |
|
SU1360680A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ДИАТОМОВОЙ ВОДОРОСЛИ CHAETOCEROS CALCITRANS - КОРМА ДЛЯ ЛИЧИНОК ГИГАНТСКОЙ УСТРИЦЫ CRASSOSTREA GIGAS | 2017 |
|
RU2663328C1 |
| Способ получения живых кормов для личинок морских рыб | 2019 |
|
RU2717990C1 |
| Многоигольная машина для сшивания матов | 1949 |
|
SU81055A1 |
Авторы
Даты
2024-08-01—Публикация
2024-01-16—Подача