ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет согласно предварительной заявке на патент США №62/779620, поданной 14 декабря 2018 года. Указанная заявка включена в настоящий документ полностью посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] В представленном документе описан водный фармацевтический состав на основе пиридонового соединения, используемый в качестве ингибитора рецепторов, отличных от NMDA-рецепторов, в частности AMPA-рецептора.
[0003] Глутамат и аспартат являются важными аминокислотами для функций нервной системы. Они включают распознавание, память, движение, дыхание, адаптацию сердечно-сосудистой системы и восприятие. Глутамат и аспартат часто называют возбуждающими нейротрансмиттерами из-за их способности увеличивать вероятность того, что клетка-мишень запустит потенциал действия после связывания рецептора. Известны два типа рецепторов: тип рецепторов, представляющих собой ионные каналы, и тип рецепторов, связанных с G-белком. Первый тип дополнительно классифицируют на рецептор N-метил-D-аспартата (NMDA), рецептор α-амино-3-гидрокси-5-метил-4-изоксазол пропионовой кислоты (AMPA), каинатный рецептор и другие рецепторы.
[0004] Известно, что возбуждающие нейротрансмиттеры вызывают нейротоксичность, например, за счет аномального возбуждения центральных нервов, процесса, известного как эксайтотоксичность. Было отмечено, что эксайтотоксичность часто связана с гибелью нервных клеток, вызванной различными заболеваниями нервной системы. Указанные заболевания нервной системы включают ишемию головного мозга, повреждение головы, повреждение спинного мозга, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), хорею Хантингтона, нервное расстройство, вызванное СПИДом, эпилепсию, нейродегенерацию, наблюдаемую после состояния гипоксии, психическое расстройство, нарушение подвижности, боль, спастичность, нервное расстройство, вызванное токсинами в пище, различные нейродегенеративные заболевания, различные психические заболевания, хроническую боль, мигрень, боль при раке и боль, вызванную диабетическим нервным расстройством. Данные заболевания являются серьезными заболеваниями, многие механизмы возникновения которых не выяснены, а эффективные в терапии фармацевтические средства неизвестны.
[0005] Многие заболевания нервной системы тесно связаны с чрезмерным высвобождением или накоплением возбуждающих нейротрансмиттеров и/или изменениями в паттерне экспрессии рецепторов. Например, концентрация глутамата в спинномозговой жидкости и плазме крови увеличивается при инсульте, ишемии головного мозга, повреждении головы и повреждении спинного мозга (Castillo, J., Dazalos, A. and Noya, M., 346 Lancet, 79-83 (1997)). Глутамат, NMDA, AMPA, каинат и другие вызывают нейропатию при чрезмерном воздействии на нервные клетки (Meldrum, B., 18 Brain Res. Reviews, 293 (1993)). При болезни Альцгеймера β-амилоидный белок усиливает нейротоксичность глутамата и способствует высвобождению глутамата (Arias, C., Arrieta, I. and Tapia, R., 41 J. Neurosci. Res. 561-566 (1995)). При болезни Паркинсона гидроксид L-DOPA активирует AMPA-рецептор (Cha, J. J., et al., 132 Neurosci. Lett. 55-58 (1991)) и усиливает нейротоксичность (Olney, J., et al. 108(3) Exp. Neurol. 269-272 (1990); Rosenberg, P. A., et al., 88 Proc. Natl. Acad. Sci. USA 4865-4869 (1991)). L-DOPA также способствует образованию свободных радикалов, что приводит к повышению окислительного стресса (Smith, T. S., et al., 5 Neuroreport, 1009-1011 (1994)). Сообщается, что при хорее Хантингтона вещество, ингибирующее высвобождение глутамата, эффективно улучшает симптомы. Согласно многим сообщениям, при ALS продемонстрировано участие глутамата в этой патологии. В некоторых случаях пациенты со СПИДом страдают от недостаточности распознающей функции нервной системы, в которой предполагается участие глутамата. Например, было показано, что gp120, гликопротеин в оболочке вируса ВИЧ, подавляет поглощение глутамата астроцитами (Dreyer, E. B., 7 Eur. J. Neurosci. 2502-2507 (1995); Ushijima, H., et al., 7 Eur. J. Neurosci. 1353 -1359 (1995)), в то время как вещество, которое ингибирует высвобождение глутамата, подавляет нейродегенерацию, вызванную gp120 (Sindou, P., et al., 126 J. Neurosci. 133-137 (1994); Muller, W. E. G., et al., 226 Eur. J. Pharmacal. Molec. Pharmacal. 209-214 (1992); Lipton, S. A., 42 Neurology, 1403-1405 (1992)).
[0006] При аллергическом энцефаломиелите у мышей с воспалением наблюдается дефицит фермента, расщепляющего глутамат снаружи клетки (Hardin-Pouzet, H., 20 Glia. 79-85 (1997)). Оливопонтоцеребеллярная атрофия (OPCA) представляет собой заболевание, которое иногда сочетается с болезнью Паркинсона. Аутоантитела к GluR2 (субъединица рецептора AMPA), обнаруженные у больных людей, предполагают связь между OPCA и AMPA-рецептором (Gahring, L. C., 48(2) Neurology 494-500 (1997)). Что касается эпилепсии, у мышей, у которых наблюдается неспособность сконструировать субъединицу GluR2 AMPA-рецептора, наблюдается увеличение проницаемости Ca2+ у AMPA-рецептора, что может вызвать смерть (Brusa, R., 270 Science 1677-1680 (1995)). Кроме того, NBQX (2,3-диоксо-6-нитро-1,2,3,4-тетрагидробензо[f]хиноксалин-7-сульфонамид) (Sheardown, et al., 247 Science 571 (1990)) и другие соединения, ингибирующие AMPA-рецепторы, обладают успокаивающим и противосудорожным действием (Turski, L., et al., 260 J. Pharmacal. Exp. Ther. 742 (1992); Kotlinska, J., et al. 60(1) Pharmacal. Biochem. Behavior 119-124 (1998)). Имеются также сообщения о связи между AMPA-рецептором/каинатным рецептором и нарушением мочеиспускания, злоупотреблением наркотиками, болью и другими нарушениями (Yoshiyama, M., et al. 280(2) J. Pharmacol. Exp. Ther. 894-904 (1997); Gray, A., et al., 268(3) Neuroscience Letters 127-130 (1999)).
[0007] Вещества, проявляющие антагонистическое действие по отношению к рецепторам возбуждающих нейротрансмиттеров, могут быть использованы для терапии вышеупомянутых заболеваний нервной системы. Особенно привлекательными являются антагонисты рецепторов, отличных от NMDA-рецепторов, таких как AMPA-рецептор или каинатный рецептор. Например, в публикации международной патентной заявки № WO 00/01376 сообщается, что ингибиторы взаимодействия глутамата с AMPA- и/или каинатным рецепторным комплексом являются пригодными в лечении демиелинизирующих нарушений, таких как энцефалит, острый диссеминированный энцефаломиелит, острая демиелинизирующая полинейропатия (синдром Гийена-Барре), хроническая воспалительная демиелинизирующая полинейропатия, рассеянный склероз, болезнь Маркиафавы-Бигнами, центральный понтинный миелинолиз, синдром Девича, болезнь Бало, ассоциированная с HIV или HTLV миелопатия, прогрессирующая мультифокальная лейкоэнцефалопатия, вторичное демиелинизирующее нарушение; например, эритематозная волчанка ЦНС, узелковый полиартериит, синдром Шегрена, саркоидоз и изолированный церебральный васкулит.
[0008] Конкурентные соединения, ингибирующие AMPA-рецептор, и неконкурентные соединения, ингибирующие AMPA-рецептор, описаны в патенте США № 6949571. Конкурентные соединения, ингибирующие AMPA-рецептор, содержащие хиноксалиндионовый остов, описаны в публикациях международных патентных заявок №№ WO 94/25469 и WO 96/10023, а также в патенте США №5356902. Имеются сообщения о неконкурентных соединениях, ингибирующих AMPA-рецептор, в публикациях международных патентных заявок №№ WO 95/01357, WO 97/28135, WO 97/18163, WO 97/43276, WO 97/34878, WO 98/38173, и в Европейском патенте № EP 802195, и в патенте Германии № DE 19643037.
[0009] Соединения, которые продемонстрировали превосходную ингибирующую активность в отношении AMPA-рецептора и/или каинатного рецептора, включают 1,2-дигидропиридиновые соединения. В публикации международной патентной заявки № WO 98/55480 определены соединения, представленные формулой (а), в качестве лиганда для субъединицы GABAAα.
 (a)
(a)
[0010] В формуле (I) R представляет собой атом водорода, C1-6алкильную группу, C2-6алкенильную группу, C2-6алкинильную группу или C1-6алкоксигруппу; V представляет собой CH или N; W представляет собой O или S; X представляет собой фенильную группу, которая является незамещенной или замещенной одной или несколькими группами, выбранными из C1-6алкильной группы, CF3, цианогруппы, нитрогруппы, галогена или ароматической гетерогруппы, которая является незамещенной или замещенной одной или несколькими группами, выбранными из C1-6алкильной группы, CF3 или галогена; Y представляет собой атом водорода, C1-6алкильную группу, C2-6алкенильную группу, C2-6алкинильную группу или арильную группу; и Z представляет собой галоген, C3-6циклоалкильную группу, C1-6алкилтиогруппу, C2-6алкенилтиогруппу или арильную группу. В публикации международной патентной заявки № WO 00/07988 определены соединения, представленные формулой (b), как пригодные для терапии эпилепсии.
 (b)
(b)
[0011] В формуле (b) n равен 0, 1, 2, 3, 4 или 5; X представляет собой атом водорода, C1-4алкильную группу, C1-4алкоксигруппу, трифторметильную группу, трифторметоксигруппу или галоген; A представляет собой аминогруппу, C1-4алкиламиногруппу, C1-4диалкиламиногруппу, морфолиногруппу, пиперидиногруппу или пирролидиногруппу. Однако связь соединений формулы (b) с AMPA-рецептором или каинатным рецептором неизвестна. Кроме того, соединения, которые ингибируют AMPA-рецептор и/или каинатный рецептор и могут быть использованы в качестве водных фармацевтических средств, еще не были определены.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0012] Авторы настоящего изобретения сообщают о фармацевтическом составе, содержащем солюбилизирующее средство и терапевтически эффективное количество соединения, представленного следующей формулой (I),
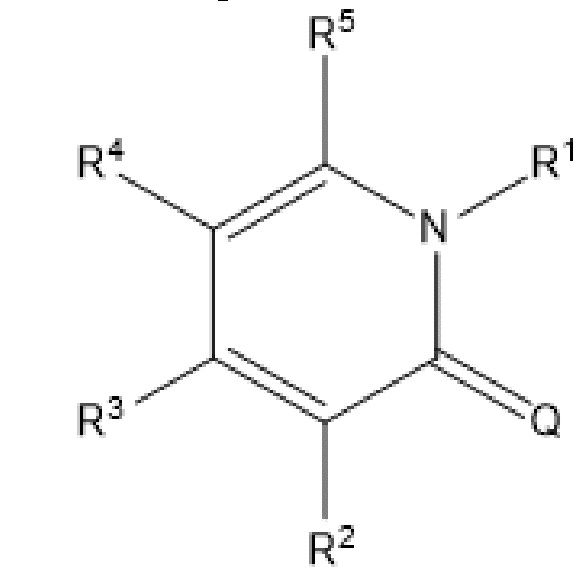 (I),
(I),
где Q представляет собой O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной. Соединение и солюбилизирующее средство могут присутствовать в таком соотношении, при котором разведение состава в водной среде обеспечивает соединение в пересыщенном растворе. Это может произойти, например, после восстановления из лиофилизированного препарата. В по меньшей мере одном варианте осуществления состав способен обеспечивать доставку от приблизительно 0,5 до приблизительно 24 миллиграммов указанного соединения парентерально, например, внутривенно.
[0013] Подходящими солюбилизирующими средствами могут быть циклодекстрин или комбинация более одного циклодекстрина. Подходящие циклодекстрины включают, например, α-циклодекстрин, β-циклодекстрин, и гидроксипропил-β-циклодекстрин, и сульфобутиловый эфир β-циклодекстрина. В одном варианте осуществления соединение представляет собой перампанел, который является противоэпилептическим лекарственным средством. Перампанел химически описывается как 2-(6'-оксо-1'-фенил-1',6'-дигидро[2,3'-бипиридин]-5'-ил)бензонитрил. Одним источником гидрата перампанела является FYCOMPA™ (перампанел; Eisai Co., Ltd., Токио), химически описывается как 2-(2-оксо-1-фенил-5-пиридин-2-ил-1,2-дигидропиридин-3-ил) бензонитрила гидрат (4:3). Молекулярная формула перампанела торговой марки FYCOMPA представляет собой C23H15N3O⋅3/4H2O, и молекулярная масса составляет 362,90 (3/4 гидрат). В некоторых вариантах осуществления молярное соотношение сульфобутилового эфира β-циклодекстрина и перампанел составляет от 28 до 108. В некоторых вариантах осуществления оно составляет от 50 до 75.
[0014] Также существуют полиморфы перампанела (см., например, патент США № 8304548, опубликованный как заявка на патент Соединенных Штатов Америки № 2010/0324297, раскрытие которых включено в настоящий документ посредством ссылки во всей их полноте). Соединение может находиться в аморфной фазе (см., например, патент США № 7803818, раскрытие которого включено в настоящий документ посредством ссылки во всей своей полноте). Соединение может находиться в растворе. Этот раствор может представлять собой водный раствор. Состав может быть лиофилизирован. В некоторых вариантах осуществления состав лиофилизируют при концентрации, которая ниже уровня, необходимого для пересыщения соединения, затем восстанавливают в водном растворе при концентрации, которая обеспечивает достижение пересыщения.
[0015] Варианты осуществления могут также обеспечивать стабильный при хранении водный фармацевтический состав для внутривенного введения, содержащий водный пересыщенный раствор перампанела и сульфобутилового эфира β-циклодекстрина. Перампанел и указанный сульфобутиловый эфир β-циклодекстрина могут присутствовать, например, в молярном соотношении молей сульфобутилового эфира β-циклодекстрина и молей перампанела, составляющем от 60 до 110. Водная среда может характеризоваться значением pH от 2,5 и 9 и в некоторых вариантах осуществления от 6 до 8. Количество солюбилизирующего средства по весу к объему может составлять от 0,005% до 60%. В некоторых вариантах осуществления количество составляет от 3% до 9,5%.
[0016] Дополнительные варианты осуществления могут предусматривать способ получения фармацевтического состава в водной среде, содержащего солюбилизирующее средство и терапевтически эффективное количество соединения, представленного следующей формулой,
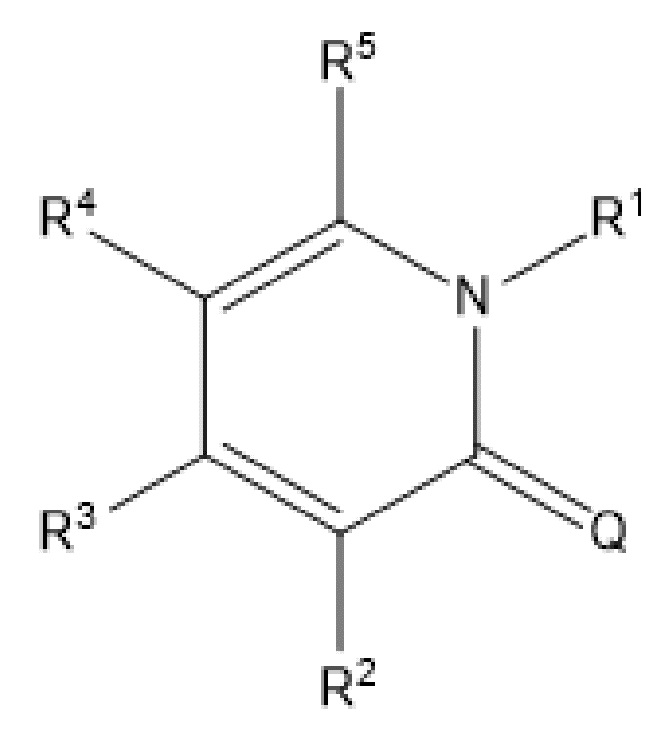 ,
,
где Q обозначает O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, включающий стадии
a) солюбилизации соединения при кислом pH в солюбилизирующем средстве и
b) регулирования pH до значения от 6 до 8 посредством добавления разбавителя.
[0017] Солюбилизирующее средство может представлять собой циклодекстрин. Например, оно может представлять собой α-циклодекстрин, β-циклодекстрин, и гидроксипропил-β-циклодекстрин, и сульфобутиловый эфир β-циклодекстрина. Солюбилизирующее средство также может представлять собой смесь циклодекстринов. Соединение может представлять собой перампанел.
[0018] Дополнительные варианты осуществления предусматривают способ лечения нейродегенеративного заболевания с помощью фармацевтического состава в водной среде, содержащего солюбилизирующее средство и терапевтически эффективное количество соединения, представленного следующей формулой,
 ,
,
где Q обозначает O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, включающий стадии
a) идентификации пациента, нуждающегося в этом, и
b) введения терапевтически эффективного количества указанного фармацевтического состава в водной среде.
[0019] Солюбилизирующее средство может представлять собой, например, одно из α-циклодекстрина, β-циклодекстрина, гидроксипропил-β-циклодекстрина и сульфобутилового эфира β-циклодекстрина. Соединение может представлять собой перампанел. В некоторых вариантах осуществления введение проводят с использованием материалов, изготовленных не из поливинилхлорида (PVC). pH фармацевтического состава может составлять, например, от 6 до 8.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0020] Фиг. 1 представляет собой схематическую иллюстрацию основы определения максимального переохлаждения ΔTmax с помощью политермического метода для изучения ширины метастабильной зоны. Фигура 1 взята из Sangwal, K., "Novel Approach to Analyze Metastable Zone Width Determined by the Polythermal Method: Physical Interpretation of Various Parameters' Crystal Growth & Design" 2009, Vol 9(2), 942-950.
[0021] Фиг. 2 представляет собой графическую иллюстрацию зависимости растворимости от pH перампанела при 5°C без какого-либо солюбилизатора и с 5% сульфобутилового эфира бета-циклодекстрина (SBE-β-CD), 5% гидроксипропил-бета-циклодекстрина (HPBCD), 5% никотинамида и 5% полисорбата 80.
[0022] Фиг. 3 представляет собой графическую иллюстрацию зависимости растворимости от pH перампанела при 22°C в растворах SBE-β-CD с различной концентрацией от 20% до 50%.
[0023] На фиг. 4 показаны результаты HPLC-анализа 0,48 мг/мл составов перампанела в 30% и 40% SBE-β-CD после разведения до концентрации 0,12 мг/мл в воде для инъекций и 7,5% растворе бикарбоната натрия для инъекций.
[0024] На фиг. 5 показаны pH и внешний вид 0,8 мг/мл состава перампанела в 40% SBE-β-CD после разведения до 0,12 мг/мл в пяти различных разбавителях.
[0025] На фиг. 6 показаны измеренное и прогнозируемое время индукции для различных концентраций перампанела в 40% SBE-β-CD при комнатной температуре и в объеме 5 мл.
[0026] На фиг. 7 показана зависимость температуры осаждения от скорости охлаждения для 1,75 мг/мл раствора, 40% SBE-β-CD, при этом показано, что линейная экстраполяция к нулевой скорости охлаждения должна выполняться с данными из экспериментов, проводимых при <0,5 градуса/час.
[0027] На фиг. 8 показана зависимость значений температуры осаждения образцов из 40% раствора SBE-β-CD, pH 7 от концентрации лекарственного средства и скорости охлаждения.
[0028] На фиг. 9 показан контурный график зависимости температуры осаждения (градус Цельсия) от концентрации (мг/мл) и скорости охлаждения (градус Цельсия/час), показывающий отдельные точки данных и аппроксимацию данных в виде контурных линий.
[0029] Фиг. 10 представляет собой 3-D график, иллюстрирующий взаимосвязь между скоростью охлаждения (град./час), концентрацией перампанела (мг/мл) и температурой осаждения (градус Цельсия). Данный график является еще одним представлением тех же данных, что и представленные на фиг. 9. Температура осаждения при нулевой скорости охлаждения экстраполируется из этих данных для получения границы метастабильной зоны. Точки представляют собой отдельные точки данных, в которых происходит осаждение с разной скоростью охлаждения. Сетка представляет собой поверхность, которая соответствует данным.
[0030] На фиг. 11 показана граница метастабильной зоны (с 95% доверительными интервалами) для образца в 40% растворе SBE-β-CD, pH 7. Кривая растворимости образца и предлагаемая конц. DP добавлены к графику для справки.
ПОДРОБНОЕ ОПИСАНИЕ
[0031] Описанные в настоящем документе варианты осуществления включают стабильные при хранении водные фармацевтические составы для внутривенного введения. Варианты осуществления включают терапевтически эффективное количество соединения, представленного следующей формулой (I),
 (I),
(I),
где Q представляет собой O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной.
[0032] В некоторых вариантах осуществления соединение формулы (I) находится в пересыщенном водном составе; то есть присутствует в концентрации, превышающей предел его растворимости. В некоторых вариантах осуществления это происходит после восстановления (в случае лиофилизации) и растворения в водной среде. При пересыщении соединение находится в метастабильном состоянии, в котором соединение не будет выпадать в осадок из раствора, если только не будет добавлена затравка, чтобы вызвать образование центра кристаллизации и осаждение. Кривые растворимости и ширины метастабильной зоны отображают в кратком виде и графически они представляют собой диапазон условий, при которых кристаллы будут расти, и те условия, которые приведут к первичному образованию центра кристаллизации. На фиг. 1 изображен пример кривой зависимости растворимости от температуры и соответствующей метастабильной зоны. На фиг. 1 температура отложена по горизонтальной оси, а концентрация материала отложена по вертикальной оси графика. Жирная линия на фиг. 1 представляет собой кривую растворимости. Кривая растворимости обозначает зависимость концентрации в состоянии термодинамического равновесия твердой и жидкой фазы в системе растворителей от температуры. Ее также называют кривой с точками прозрачности, поскольку ее можно получить экспериментально путем нагревания взвеси материала в системе растворителей до обеспечения полного растворения, в результате чего получается прозрачный раствор (точка прозрачности). Кристаллы будут расти при концентрациях выше кривой растворимости.
[0033] Пунктирная линия на фиг. 1 представляет собой границу метастабильной зоны. Граница метастабильной зоны обозначает зависимость концентрации вещества в системе растворителей, выше которой происходит первичное образование центров кристаллизации, от температуры. Ее также называют "кривой с точками помутнения", поскольку ее можно получить экспериментально путем охлаждения насыщенного раствора с фиксированной скоростью до тех пор, пока не произойдет образование центра кристаллизации и раствор не станет мутным (точка помутнения). При концентрациях выше границы метастабильной зоны будет происходить спонтанная кристаллизация, т. е. первичное образование центра кристаллизации.
[0034] Варианты осуществления могут включать подходящие количества соединения формулы (I) для доставки необходимого количества соединения пациенту, нуждающемуся в лечении. Например, в одном варианте осуществления состав способен обеспечивать доставку от приблизительно 0,5 до приблизительно 24 миллиграммов соединения человеку парентерально, например, внутривенно, за один курс введения.
[0035] Водные составы также содержат солюбилизирующее средство. В некоторых вариантах осуществления солюбилизирующее средство представляет собой сульфобутиловый эфир бета-циклодекстрина (SBE-β-CD). Одной торговой маркой SBE-β-CD, который может быть пригодным, является SBE-β-CD торговой марки CAPTISOL®, доступный от Ligand Pharm., Inc., Калифорния. Другие солюбилизирующие средства могут быть пригодны, включая другие члены семейства циклодекстринов. Дополнительные солюбилизирующие средства, которые могут использоваться включают этанол, макрогол, пропиленгликоль, полисорбат, глицерин, полиэтоксилированное гидрогенизированное касторовое масло, этаноламин, полоксамер F68, глюконат натрия, никотинамид, мочевину, декстран, лактат натрия, аргинин, глицин, сульфит натрия, карбонат натрия, ацетат натрия, натриевую соль бензойной кислоты, хлорид магния, натриевую соль салициловой кислоты, гидросульфит натрия, этилендиаминтетрауксусная кислота, гидроксипропил-бета-циклодекстрин, циклоамилозы и другие. В некоторых вариантах осуществления присутствует только одно солюбилизирующее средство. Например, применяют только SBE-β-CD. В других вариантах осуществления присутствует несколько солюбилизирующих средств.
[0036] Составы могут содержать дополнительные компоненты. Одним из необязательных компонентов является буфер. Подходящие буферы включают, например, без ограничения буферы, приемлемые для парентерального применения, со значением pH от 2 до 11. Подходящие буферы включают ацетатный, аммиачный, аскорбатный, бензоатный, бикарбонатный, цитратный, фосфатный, диэтаноламиновый, лактат-глициновый, сукцинатный, тартратный, трометаминовый буфер и другие. Если состав подлежит лиофилизации, могут быть добавлены один или несколько буферов до количества по общему весу композиции для предварительного разведения, которое препятствовало бы надлежащему замораживанию лиофилизированного состава.
[0037] Способы синтеза соединений формулы (I) описаны в патенте США № 6949571, раскрытие которого полностью включено в настоящий документ посредством ссылки. Иллюстративный пример соединения формулы (I) представляет собой 2-(6'-оксо-1'-фенил-1',6'-дигидро[2,3'-бипиридин]-5'-ил)бензонитрил. Оно также известно как "перампанел". Перампанел доступный, например, как FYCOMPA от Eisai Co., Ltd., Токио. Перампанел торговой марки FYCOMPA представляет собой 2-(2-оксо-1-фенил-5-пиридин-2-ил-1,2-дигидропиридин-3-ил)бензонитрила гидрат (4:3). Молекулярная формула перампанела FYCOMPA представляет собой C23H15N3O ⋅ 3/4H2O, и молекулярная масса составляет 362,90 (3/4 гидрат). Структура перампанела проиллюстрирована ниже:
 .
.
[0038] Перампанел характеризуется особенно плохой растворимостью в воде. Перампанел характеризуется растворимостью в воде, составляющей приблизительно 0,001 мг/мл при pH 7 и комнатной температуре. Многие попытки солюбилизировать перампанел в воде были неудачными. Описанный в настоящем документе состав демонстрирует пересыщенное состояние, которое неожиданно является метастабильным.
[0039] Используемый в настоящем документе термин "острое нейродегенеративное заболевание" может представлять собой, например, цереброваскулярные нарушения в острой стадии (субарахноидальное кровоизлияние, церебральный инфаркт и т. п.), повреждение головы, повреждение спинного мозга и невропатии, вызванные гипоксией или гипогликемией. "Хроническое нейродегенеративное заболевание", например, может представлять собой болезнь Альцгеймера, болезнь Паркинсона, хорею Хантингтона, боковой амиотрофический склероз, спиноцеребеллярную дегенерацию, эпилепсию, эпилептический статус и т. п. "Инфекционный энцефаломиелит" может представлять собой, например, ассоциированный с HIV энцефаломиелит, и "демиелинизирующее заболевание" может представлять собой энцефалит, острый диссеминированный энцефаломиелит, рассеянный склероз, острый полирадикулоневрит, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую полинейропатию, болезнь Маркиафавы-Бигнами, центральный понтинный миелинолиз, оптический нейромиелит, болезнь Девича, болезнь Бало, ассоциированную с HIV миелопатию, ассоциированную с HTLV миелопатию, прогрессирующую мультифокальную лейкоэнцефалопатию, вторичное демиелинизирующее заболевание и т. п. "Вторичное демиелинизирующее заболевание" может представлять собой эритематозную волчанку ЦНС, узелковый полиартериит, синдром Шегрена, саркоидоз, изолированный церебральный васкулит и т. п.
[0040] Используемый в настоящем документе термин "терапевтически эффективное количество" относится к количеству, которое используется для восстановления нейродегенерации, вызванной нейродегенеративным заболеванием, и восстановления нервной функции у субъекта, нуждающегося в этом. Для специалистов в данной области техники терапевтически эффективное количество, а также дозировка и частота введения могут быть определены в соответствии с их знаниями и стандартной методологией обычных экспериментов. Используемый в настоящем документе термин "и/или" означает, что включены оба случая в случае "и" и в случае "или".
[0041] Кроме того, хотя структурная формула соединения может выражать определенный изомер для удобства, данное описание охватывает все изомеры, такие как геометрические изомеры, полученные из структуры соединения, оптические изомеры из-за асимметричного углерода, ротамеры, стереоизомеры и таутомеры, а также смесь изомеров и не ограничивается описанием формулы, приведенной для удобства, но может представлять собой другой изомер или может представлять собой смесь. Соответственно, несмотря на то, что в молекуле присутствует асимметричный атом углерода, и могут присутствовать оптически активные вещества и рацемические вещества, настоящее изобретение не ограничивается ими, но охватывает любое из них. Кроме того, может присутствовать кристаллический полиморфизм, но, опять же, нет ограничений в отношении какой-либо из форм монокристалла или смесей форм. Соединение (I) или его соль могут представлять собой ангидрид или гидрат, и рассматривается любой из них. Также рассматриваются метаболит, который образуется при разложении in vivo соединения (I), относящегося к настоящему изобретению, и пролекарство соединения (I) или его соли, относящиеся к настоящему изобретению. Хотя в данной заявке обсуждаются конкретные гидраты перампанела, варианты осуществления не следует рассматривать как ограничивающиеся каким-либо конкретным гидратом, если не указано иное.
[0042] В описании настоящей заявки нет конкретного ограничения для "соли", в той мере, в которой она образует соль с соединением по настоящему изобретению и является фармакологически приемлемой. Варианты осуществления включают соль с галогеноводородами (такую, как гидрофторид, гидрохлорид, гидробромид или гидройодид), соль с неорганической кислотой (такую как сульфат, нитрат, перхлорат, фосфат, карбонат или бикарбонат), соль с органической карбоновой кислотой (такую как ацетат, трифторацетат, оксалат, малеат, тартрат, фумарат или цитрат), соль с органической сульфоновой кислотой (такую как метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат или камфорсульфонат), соль с аминокислотой (такую как, аспартат или глутамат), соль четвертичного амина, соль щелочного металла (такую как, соль натрия или соль калия) и соль щелочноземельного металла (такую как, соль магния или соль кальция). Дополнительные варианты осуществления включают примеры "фармакологически приемлемой соли", такой как гидрохлорид, оксалат, мезилат и т. д., и других, известных в данной области. См., например, Gibson, M., Ed. (2004). Pharmaceutical Preformulation and Formulation A Practical Guide from Candidate Drug Selection to Commercial Dosage Form. New York, Interpharm/CRC., раскрытие которого, связанное с фармацевтически приемлемыми солями, полностью включено в настоящий документ посредством ссылки.
[0043] Используемый в настоящем документе термин "атом галогена" означает фтор, хлор, бром, йод и т.п. Термин "C1-6алкильная группа" обозначает алкильную группу, содержащую 1-6 атомов углерода, и примеры включают алкильные группы с линейной или разветвленной цепью, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, 2,2-диметилпропильная группа, 1-этилпропильная группа, 2-этилпропильная группа, н-гексильная группа, 1-метил-2-этилпропильная группа, 1-этил-2-метилпропильная группа, 1,1,2-триметилпропильная группа, 1-пропилпропильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 2,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,3-диметилбутильная группа, 2-этилбутильная группа, 2-метилпентильная группа, 3-метилпентильная группа и т. п.
[0044] Термин "C2-6алкенильная группа" обозначает алкенильную группу, содержащую 2-6 атомов углерода, и примеры включают винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, изопропенильную группу, 2-метил-1-пропенильную группу, 3-метил-1-пропенильную группу, 2-метил-2-пропенильную группу, 3-метил-2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1-пентенильную группу, 1-гексенильную группу, 1,3-гексадиенильную группу, 1,6-гексадиенильную группу и т. п.
[0045] Термин "C2-6алкинильная группа" обозначает алкинильную группу, содержащую 2-6 атомов углерода, и примеры включают этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 3-метил-1-пропинильную группу, 1-этинил-2-пропинильную группу, 2-метил-3-пропинильную группу, 1-пентинильную группу, 1-гексинильную группу, 1,3-гексадиинильную группу, 1,6-гексадиинильную группу и т. п.
[0046] Термин "C1-6алкоксигруппа" обозначает алкоксигруппу, содержащую 1-6 атомов углерода, и примеры включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, втор-пропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, изопентилоксигруппу, втор-пентилоксигруппу, н-гексоксигруппу, изогексоксигруппу, 1,1-диметилпропоксигруппу, 1,2-диметилпропоксигруппу, 2,2-диметилпропоксигруппу, 2-этилпропоксигруппу, 1-метил-2-этилпропоксигруппу, 1-этил-2-метилпропоксигруппу, 1,1,2-триметилпропоксигруппу, 1,1,2-триметилпропоксигруппу, 1,1-диметилбутоксигруппу, 1,2-диметилбутоксигруппу, 2,2-диметилбутоксигруппу, 2,3-диметилбутоксигруппу, 1,3-диметилбутоксигруппу, 2-этилбутоксигруппу, 1,3-диметилбутоксигруппу, 2-метилпентоксигруппу, 3-метилпентоксигруппу, гексилоксигруппу и т. п.
[0047] Термин "C2-6алкенилоксигруппа" обозначает алкенилоксигруппу, содержащую 2-6 атомов углерода, и примеры включают винилоксигруппу, аллилоксигруппу, 1-пропенилоксигруппу, 2-пропенилоксигруппу, изопропенилоксигруппу, 2-метил-1-пропенилоксигруппу, 3-метил-1-пропенилоксигруппу, 2-метил-2-пропенилоксигруппу, 3-метил-2-пропенилоксигруппу, 1-бутенилоксигруппу, 2-бутенилоксигруппу, 3-бутенилоксигруппу, 1-пентенилоксигруппу, 1-гексенилоксигруппу, 1,3-гексадиенилоксигруппу, 1,6-гексадиенилоксигруппу и т. п.
[0048] Термин "C3-8циклоалкильная группа" обозначает циклоалкильную группу, состоящую из 3-8 атомов углерода, и примеры включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, циклооктильную группу и т. п.
[0049] Термин "C3-8циклоалкенильная группа" обозначает C3-8циклоалкенильную группу, состоящую из 3-8 атомов углерода, и примеры включают циклопропен-1-ильную, циклопропен-3-ильную, циклобутен-1-ильную, циклобутен-3-ильную, 1,3-циклобутадиен-1-ильную, циклопентен-1-ильную, циклопентен-3-ильную, циклопентен-4-ильную, 1,3-циклопентадиен-1-ильную, 1,3-циклопентадиен-2-ильную, 1,3-циклопентадиен-5-ильную, циклогексен-1-ильную, циклогексен-3-ильную, циклогексен-4-ильную, 1,3-циклогексадиен-1-ильную, 1,3-циклогексадиен-2-ильную, 1,3-циклогексадиен-5-ильную, 1,4-циклогексадиен-3-ильную, 1,4-циклогексадиен-1-ильную, циклогептен-1-ильную, циклогептен-3-ильную, циклогептен-4-ильную, циклогептен-5-ильную, 1,3-циклогептен-2-ильную, 1,3-циклогептен-1-ильную, 1,3-циклогептадиен-5-ильную, 1,3-циклогептадиен-6-ильную, 1,4-циклогептадиен-3-ильную, 1,4-циклогептадиен-2-ильную, 1,4-циклогептадиен-1-ильную, 1,4-циклогептадиен-6-ильную, 1,3,5-циклогептатриен-3-ильную, 1,3,5-циклогептатриен-2-ильную, 1,3,5-циклогептатриен-1-ильную, 1,3,5-циклогептатриен-7-ильную, циклооктен-1-ильную, циклооктен-3-ильную, циклооктен-4-ильную, циклооктен-5-ильную, 1,3-циклооктадиен-2-ильную, 1,3-циклооктадиен-1-ильную, 1,3-циклооктадиен-5-ильную, 1,3-циклооктадиен-6-ильную, 1,4-циклооктадиен-3-ильную, 1,4-циклооктадиен-2-ильную, 1,4-циклооктадиен-1-ильную, 1,4-циклооктадиен-6-ильную, 1,4-циклооктадиен-7-ильную, 1,5-циклооктадиен-3-ильную, 1,5-циклооктадиен-2-ильную, 1,3,5-циклооктатриен-3-ильную, 1,3,5-циклооктатриен-2-ильную, 1,3,5-циклооктатриен-1-ильную, 1,3,5-циклооктатриен-7-ильную, 1,3,6-циклооктатриен-2-ильную, 1,3,6-циклооктатриен-1-ильную, 1,3,6-циклооктатриен-5-ильную, 1,3,6-циклооктатриен-6-ильную группу и т. п.
[0050] Термин "5-14-членная неароматическая гетероциклическая группа" означает моноциклический тип, дициклический тип или трициклический тип 5-14-членной неароматической гетероциклической группы, которая содержит один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Конкретные примеры групп включают, например, пирролидинильную группу, пирролильную группу, пиперидинильную группу, пиперазинильную группу, имидазолильную группу, пиразолидильную группу, имидазолидильную группу, морфолильную группу, тетрагидрофурильную группу, тетрагидропиранильную группу, пирролинильную группу, дигидрофурильную группу, дигидропиранильную группу, имидазолинильную группу, оксазолинильную группу и т. п. Кроме того, группа, производная от пиридонового кольца и неароматического конденсированного кольца (например, группа, производная от фталимидного кольца, сукцинимидного кольца и т. п.), также включена в неароматическую гетероциклическую группу.
[0051] Термин "C6-14ароматическая гидрокарбоциклическая группа" и "арильная группа" означают ароматическую гидрокарбоциклическую группу, состоящую из 6-14 атомов углерода, и моноциклическую группу, и конденсированную группу дициклической группы, трициклической группы и т. п. Конкретные примеры групп включают фенильную группу, инденильную группу, 1-нафтильную группу, 2-нафтильную группу, азуленильную группу, гепталенильную группу, бифенильную группу, индатенильную группу, аценафтильную группу, флуоренильную группу, феналенильную группу, фенантренильную группу, антраценильную группу, циклопентациклооктенильную группу, бензоциклооктенильную группу и т. п.
[0052] Термин "5-14-членная ароматическая гетероциклическая группа" и "гетероарильная группа" означает моноциклический тип, дициклический тип или трициклический тип 5-14-членной ароматической гетероциклической группы, которая содержит один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Например, конкретные примеры групп включают 1) ароматические гетероциклические группы, содержащие азот, такие как пирролильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, триазолильная группа, тетразолильная группа, бензотриазолильная группа, пиразолильная группа, имидазолильная группа, бензимидазолильная группа, индолильная группа, изоиндолильная группа, индолизинильная группа, пренильная группа, индазолильная группа, хинолильная группа, изохинолильная группа, хинолизиильная группа, фталазильная группа, нафтилидинильная группа, хиноксалильная группа, хиназолинильная группа, циннолинильная группа, птеридинильная группа, имидазотриазинильная группа, пиразинопиридазинильная группа, акридинильная группа, фенантридинильная группа, карбазолильная группа, карбазолинильная группа, перимидинильная группа, фенантролинильная группа, фенацинильная группа, имидазопиридинильная группа, имидазопиримидинильная группа, пиразолопиридинильная группа, пиразолопиридинильная группа и т. п; 2) ароматические гетероциклические группы, содержащие серу, такие как тиенильная группа или бензотиенильная группа; 3) ароматические гетероциклические группы, содержащие кислород, такие как фурильная группа, пиранильная группа, циклопентапиранильная группа, бензофурильная группа или изобензофурильная группа; и 4) ароматические гетероциклические группы, содержащие 2 или более различных гетероатомов, таких как тиазолильная группа, изотиазолильная группа, бензотиазолильная группа, бензтиадиазолильная группа, фенотиазинильная группа, изоксазолильная группа, фуразанильная группа, феноксазинильная группа, оксазолильная группа, изоксазоильная группа, бензоксазолильная группа, оксадиазолильная группа, пиразолоксадиазолильная группа, имидазотиазолильная группа, тиенофуранильная группа, фуропирролильная группа или пиридоксадинильная группа.
[0053] Термин "стабильный при хранении" означает, что состав не подвергается осаждению в отсутствие затравки при хранении при 20°C в течение по меньшей мере одного дня. Термин "время индукции" означает время, прошедшее для жидкости до появления осадка.
[0054] Относительное количество соединения формулы (I) в составе может изменяться в широком диапазоне. Это может зависеть от множества факторов, включая без ограничения особенности соединения, активность соединения в отношении конкретного нарушения, которое подлежит лечению, и предполагаемый способ введения.
[0055] В одном варианте осуществления количество соединения формулы (I) в составе чаще всего находится в диапазоне от приблизительно 0,5 до 24 мг, разведенных до объема от 50 до 100 мл. Во многих вариантах осуществления количество соединения в составе зависит от количества солюбилизатора, который также присутствует в составе.
[0056] В составах можно использовать любую фармацевтически приемлемую водную среду, такую как вода достаточно высокой чистоты. Это включает использование стерильной апирогенной дистиллированной воды или воды для инъекций. В одном из способов получения SBE-β-CD растворяют в воде для инъекций. Затем pH раствора понижают до кислого уровня и перампанел растворяют в растворе. В это время может быть проведена фильтрация кислого раствора перампанела для удаления центров кристаллизации. Затем pH раствора повышают до нейтрального и добавляют воду для инъекций до достижения конечного объема. В одном варианте осуществления pH раствора понижают до кислого уровня с помощью фосфорной кислоты. В другом варианте осуществления pH повышают до нейтрального с помощью гидроксида натрия.
[0057] Обычно конечный раствор фильтруют и высушивают. Фильтрация может производиться, например, через фильтр с диаметром пор 0,22 мкм. Путем фильтрации состава можно избежать присутствия центров кристаллизации, которые могут вызвать образование кристаллов, когда состав восстанавливают и разбавляют до нейтрального (или приблизительно нейтрального) pH. Состав может быть высушен для удаления любого растворителя, который используется при получении состава, перед восстановлением и разбавлением водной средой. Растворитель может представлять собой любое из известных солюбилизирующих средств, включая трет-бутиловый спирт.
[0058] Высушивание может осуществляться любым известным способом, таким как распылительное высушивание, стерильное распылительное высушивание, грануляция в псевдоожиженном слое, сублимационное высушивание, лиофилизация, высушивание на лотках и т.п., и можно использовать либо один способ, либо комбинацию нескольких способов, но эти примеры не являются ограничивающими. В случае стерильного распылительного высушивания композиция, содержащая тонкодисперсные частицы, может быть получена путем распылительного высушивания дисперсии тонкодисперсных частиц с помощью распылительной сушилки или т.п.
[0059] В случае грануляции в псевдоожиженном слое композицию, содержащую тонкодисперсные частицы, получают путем распыления и гранулирования дисперсии тонкодисперсных частиц по настоящему изобретению с циклодекстрином, лактозой, крахмалом или другим порошком. В случае сублимационного высушивания (также известного как лиофилизация) композицию, содержащую тонкодисперсные частицы, получают путем добавления сахара или другого средства, регулирующего тоничность, к дисперсии тонкодисперсных частиц, а затем использования сублимационной сушилки для удаления растворителя путем замораживания обычно при температуре от -20°C до -60°C. В случае высушивания на лотках композицию, содержащую тонкодисперсные частицы, получают посредством высушивания дисперсии тонкодисперсных частиц обычно при температуре от 50°C до 80°C, либо как есть, либо после адсорбции растворителя со вспомогательным веществом. После высушивания композиция, содержащая тонкодисперсные частицы, может находиться в виде порошка, которым заполнен флакон, или может быть восстановлена в воде и переведена из кристаллического в аморфное состояние.
[0060] pH состава может поддерживаться после разбавления с обеспечением долгосрочной стабильности состава при комнатной температуре. Согласно одному аспекту соединение солюбилизируют при кислом pH в комбинации с высокой концентрацией солюбилизирующего средства. Это обеспечивает растворение значительного количества соединения. Затем состав разбавляют до нейтрального pH в комбинации с солюбилизирующим средством. Диапазон значений pH состава может изменяться от 1,5 до 8,0, и диапазон концентрации солюбилизирующего средства может изменяться от 20% до 50%. Типичные варианты осуществления, которые включают водный разбавитель, характеризуются значением pH от 1 до 10, при этом диапазон концентрации солюбилизирующего средства составляет от 3% до 9,5%. В других вариантах осуществления значение pH может составлять от 6 до 8. Вводимые составы также показывают приемлемые тоничность и pH для внутривенной инфузии.
[0061] Составы можно упаковывать и вводить любым подходящим путем парентерального введения. Составы для внутривенной инъекции могут быть упакованы, например, в стеклянный флакон, в предварительно заполненный шприц или в ампулу. В одном варианте осуществления составы не упакованы и не вводятся с компонентами, изготовленными из поливинилхлорида (PVC), но упакованы или вводятся с компонентами, которые имеют полиэтиленовую (PE) или стеклянную поверхности. Составы можно вводить со стандартными растворами разбавителей для внутривенного (I.V.) введения, например, D5W, физиологическим раствором, обычными разбавителями или раствором Рингера с лактатом.
[0062] Подходящие дозировки могут быть установлены в зависимости от таких факторов, как особенности соединения и тип нарушения, подлежащего лечению. Как будет очевидно специалистам в данной области техники, доза фармацевтического средства изменяется в зависимости от степени симптома, возраста, пола, веса тела, лекарственной формы, чувствительности к фармацевтическим препаратам и т. д. В случае взрослых суточная доза обычно составляет от приблизительно 30 мкг до 1 г, но может составлять от 100 мкг до 500 мг или от 100 мкг до 30 мг. Его можно вводить один раз в день или несколькими порциями в день. Могут использоваться дополнительные режимы дозирования, как определено врачом, для лечения конкретного нарушения. Доступный в настоящее время продукт FYCOMPA характеризуется одобренными FDA суточными дозами, составляющими 2 мг, 4 мг, 6 мг, 8 мг, 10 мг и 12 мг. Маркировка и листок-вкладыш, одобренные FDA, включены в настоящий документ посредством ссылки во всей своей полноте, в частности, информация, касающаяся "Дозировки и введения", а также "Лекарственных форм и дозировок". В одном варианте осуществления составы для парентерального введения могут содержать достаточные количества активного ингредиента, например перампанела, для достижения такого же или подобного эффекта действия in vivo при лечении конкретного нарушения.
[0063] ПРИМЕРЫ
[0064] Следующие примеры предоставлены только с целью иллюстрации и не должны толковаться как ограничение объема прилагаемой формулы изобретения.
Пример 1. Исследования растворимости
[0065] Перампанел представляет собой основное лекарственное средство, которое плохо растворяется в воде. Одним источником перампанела является FYCOMPA, полученная от Eisai Co. Ltd., Токио. Растворимость в воде при 22°C снижается с 30 мкг/мл при pH 2 до примерно 1 мкг/мл при pH 7. В исследованиях растворимости изучалось множество различных солюбилизаторов, начиная от органических сорастворителей, поверхностно-активных веществ, аминокислот, комплексообразователей и циклодекстринов. Дополнительные исследования растворимости были проведены в зависимости от pH с применением четырех выбранных солюбилизаторами в диапазоне значений pH от 2 до 6. Растворимость при применении всех четырех солюбилизаторов снижалась при увеличении pH с 2 до 6 (см. фиг. 2).
[0066] Были проведены исследования для определения влияния концентрации сульфобутилового эфира бета-циклодекстрина (SBE-β-CD) и pH на растворимость перампанела. В одном варианте осуществления лекарственное средство солюбилизируют при кислом pH в растворах SBE-β-CD с высокой концентрацией, а затем вводят при нейтральном pH в растворах SBE-β-CD с низкой концентрацией после разведения. Диапазон значений pH, изучаемых для состава, составлял от 1,5 до 8,0 с диапазоном концентраций SBE-β-CD от 20% до 50%. Для разведенного раствора для введения исследуемый диапазон значений pH составлял от 6 до 8, при этом диапазон концентрации SBE-β-CD составлял от 3% до 9,5%.
[0067] В целом растворимость перампанела увеличивалась с уменьшением pH и увеличением концентрации SBE-β-CD. На фиг. 3 показана солюбилизация перампанела при различных концентрациях SBE-β-CD.
[0068] В одном варианте осуществления лекарственный препарат вводят после разбавления жидкостью для внутривенного введения. Растворимость перампанела в SBE-β-CD определяли в условиях разбавления в нейтральном диапазоне значений pH. Концентрации перампанела после разбавления могут составлять всего лишь 0,08 мг/мл (8 мг в 100 мл) и вплоть до 0,24 мг/мл (12 мг в 50 мл). В таблице 1 показано, что растворимость перампанела в разбавленных растворах SBE-β-CD в диапазоне нейтральных значений pH ниже, чем ожидаемые концентрации перампанела, что указывает на то, что лекарственный препарат будет пересыщенным при нейтральном pH.
Таблица 1. pH-растворимость перампанела в SBE-β-CD в концентрациях, изменяющихся от 3% до 9,5%
aЭкспериментальное определение не выполнено
Пример 2. Исследования с разбавленными составами
[0069] Получали составы на основе перампанела (0,48 мг/мл) с 30% и 40% SBE-β-CD при pH 2 и разбавляли либо водой для инъекций (WFI), либо 7,5% раствором бикарбоната натрия для инъекций. Концентрация перампанела в разбавленном составе составляла 0,12 мг/мл. На фиг. 4 показаны результаты HPLC-анализа в определенные моменты времени для разбавленного раствора в течение 29 часов хранения при комнатной температуре. Отсутствовали какие-либо изменения в анализируемой величине за этот период времени и отсутствовали изменения прозрачности при визуальном определении разбавленного раствора через 5 дней, что указывает на то, что раствор обладает достаточной физической стабильностью для введения.
[0070] На фиг. 5 показаны pH и внешний вид 0,8 мг/мл состава перампанела в 40% SBE-β-CD после разведения до 0,12 мг/мл в пяти различных разбавителях. WFI, D5W и физиологический раствор не смогли обеспечить повышение pH вводимого раствора до более 4. Бикарбонат натрия и раствор Рингера с лактатом смогли обеспечить повышение pH до 8,63 и 4,74 соответственно; однако они не так часто используются в больничных условиях, как физиологический раствор и D5W. Подобно результатам на фиг. 4, разбавленные растворы были прозрачными при визуальном определении при использовании луча для обеспечения эффекта Тиндаля после хранения в течение по меньшей мере 4 дней (см. фиг. 5).
[0071] Данные исследования с разбавленными составами показали, что кислые растворы перампанела с 40% SBE-β-CD препятствуют использованию обычно используемых разбавителей, таких как физиологический раствор и D5W, поскольку эти разбавители не обладают буферной способностью для повышения pH вводимого раствора до допустимых пределов. Следовательно кислотный состав должен быть смешан с фармацевтически приемлемым разбавителем, чтобы способствовать увеличению pH перед смешиванием с физиологическим раствором или D5W.
[0072] Исследования также показали, что разбавленные составы перампанела в SBE-β-CD при нейтральном pH стабильны в течение нескольких дней без признаков осаждения лекарственного средства.
Пример 3. Определение соотношения SBE-β-CD и перампанела
[0073] Общий способ получения состава с pH 2 заключается в солюбилизации лекарственного средства в кислом растворе SBE-β-CD (pH 1,8-2,0), добавлении воды для инъекций (WFI) для увеличения объема партии и фильтрации через фильтр с диаметром пор 0,22 мкм. Способ получения состава с pH 7 заключается в солюбилизации лекарственного средства в кислом растворе SBE-β-CD, регулировании pH до 7, добавлении WFI для увеличения объема партии и фильтрации через фильтр с диаметром пор 0,22 мкм.
[0074] Исследования были предназначены для получения приемлемого молярного соотношения SBE-β-CD и перампанела. Пригодность состава оценивалась по прозрачности раствора при pH 2 после перемешивания перампанела в кислом растворе SBE-β-CD в течение ночи. Прозрачность раствора также оценивали после регулирования pH до 7. По мере увеличения соотношения SBE-β-CD:перампанел степень растворения лекарственного средства увеличивается, общая применимость в производстве улучшается, а доза SBE-β-CD для пациента увеличивается. Было обнаружено, что составы, характеризующиеся молярными соотношениями SBE-β-CD:перампанел от 28 до 108, пригодны для получения пересыщенных растворов при pH 7, которые оставались прозрачными и в которых не образовывался осадок в течение по меньшей мере шести часов. Более высокое соотношение позволяет увеличить солюбилизирующую способность SBE-β-CD, что увеличивает степень растворения при pH 2 и лучше поддерживает пересыщенное состояние при регулировании pH до 7. Для дальнейшего рассмотрения был выбран состав, предусматривающий соотношение SBE-β-CD:перампанел 81.
[0075] Существуют два состава, которые удовлетворяют этому соотношению SBE-β-CD:перампанел:
(A) 0,8 мг/мл раствор перампанела в 40% SBE-β-CD;
(B) 0,6 мг/мл раствор перампанела в 30% SBE-β-CD.
[0076] Оба этих состава аналогичны по применимости в производстве, обеспечивают доставку одинаковой дозы SBE-β-CD и идентичны в отношении степени пересыщения после разбавления в жидкостях для внутривенного введения при pH 7. Форма выпуска лекарственного препарата 4 мг/флакон считается удобной для дозирования в диапазоне от 8 до 12 мг. Такая форма выпуска удобным образом достигается путем заполнения 5 мл 0,8 мг/мл раствора перампанела флакона объемом 10 мл или заполнения 10 мл 0,4 мг/мл раствора перампанела в 20% SBE-β-CD флакона подходящего размера.
Пример 4. Практическая осуществимость лиофилизации
[0077] Была оценена практическая осуществимость лиофилизации от 0,8 до 1,0 мг/мл растворов перампанела в 40% SBE-β-CD при pH 2 и pH 7. Лиофилизацию проводили в стеклянных флаконах типа 1 объемом 10 мл с 4 мг перампанела в каждом флаконе. Лиофилизированные осадки имели хорошую структуру и время восстановления составляло от 15 до 20 минут без перемешивания. Восстановленные растворы при pH 2 и pH 7 были прозрачными и не содержали твердых частиц. Восстановленные растворы при pH 7 показали хорошую физическую стабильность с течением времени. В восстановленном 1 мг/мл составе при pH 7 не наблюдалось осаждения лекарственного средства даже через три месяца хранения при 2-8°C.
[0078] Было показано, что осаждение лекарственного средства в пересыщенных восстановленных растворах при pH 7 может быть вызвано только добавлением затравки перампанела, которая обеспечивает образование центра кристаллизации и вызывает осаждение лекарственного средства с течением времени. Во время производства лекарственный препарат при pH 7 может быть стерильно отфильтрован через фильтр с диаметром пор 0,22 мкм, который эффективно удаляет любые центры кристаллизации, которые могут вызвать осаждение.
Пример 5. Стабильность состава
[0079] Были получены экспериментальные образцы составов, содержащие 40% SBE-β-CD. Значения pH состава изменяли, и они составляли 2,0, 4,5 и 7,0. При pH 2 были получены как жидкие, так и лиофилизированные составы, содержащие 0,8 мг/мл перампанела. При pH 4,5 получали лиофилизированный состав с концентрацией 0,8 мг/мл. При pH 7 были получены лиофилизированные составы с концентрацией 0,8 мг/мл (соотношение SBE-β-CD:перампанел=81) и 1,0 мг/мл (соотношение SBE-β-CD:перампанел=65), чтобы понять влияние соотношения на физическую и химическую устойчивость перампанела. Описание компонентов данных пяти составов представлено в таблице 2.
Таблица 2. Составы композиций перампанела на основе SBE-β-CD для обеспечения стабильности
a В каждый флакон был добавлен избыточный объем 0,5 мл (согласно USP <1151>), чтобы гарантировать, что удаляемый объем можно удалить из флакона.
[0080] Исследование стабильности было начато для экспериментальных образцов составов, перечисленных таблице 2. Составы хранили при 5°C, 25°C/60% относительной влажности (RH) и 40°C/75% RH в течение 1 месяца и проводили испытания на физическую стабильность (внешний вид, pH, твердые частицы согласно USP, время восстановления, внешний вид восстановленных растворов) и химическую стабильность (содержание и примеси). Краткое изложение результатов стабильности экспериментального образца состава представлено ниже с соответствующими данными.
[0081] Внешний вид
[0082] Жидкость раствор был прозрачным, бесцветным и никакого образования видимых частиц не наблюдали для образцов, которых подвергали испытанию в течение не более 1 месяца.
[0083] Лиофилизированный состав: изменения внешнего вида осадка отсутствуют в течение не более 1 месяца.
[0084] Время восстановления:
[0085] Время восстановления для лиофилизированных образцов, подвергнутых испытанию, составляло от 11 минут до 23 минут.
[0086] Внешний вид восстановленных растворов:
[0087] все восстановленные растворы были прозрачными и бесцветными. Никакого образования видимых частиц не наблюдали для образцов, подвергнутых испытанию в течение не более 1 месяца. Результаты показаны в таблице 3.
Таблица 3. Время восстановления после хранения в течение одного месяца
[0088] pH
[0089] Заметные изменения отсутствовали (≤ 0,2 значения pH) в pH составов в течение не более 1 месяца. Результаты показаны в таблице 4.
Таблица 4. pH в исходный момент времени и после хранения в течение одного месяца
[0090] Твердые частицы
[0091] Твердые частицы в составах в начальный момент времени находились в пределах согласно USP <788> для частиц/контейнер. Результаты показаны в таблице 5.
Таблица 5. Твердые частицы в составе
≥ 10 мкм: не более 6000 частиц/контейнер
≥ 25 мкм: не более 600 частиц/контейнер
[0092] Содержание влаги:
[0093] содержание влаги в лиофилизированных составах составляло от 0,6% до 2,1%. Максимальное увеличение содержания влаги после 1 месяца хранения составило 1% для лиофилизированного состава для pH 7 при 40°C/75% RH. Результаты показаны в таблице 6.
Таблица 6. Содержание влаги в лиофилизированном составе в исходный момент времени и через один месяц
[0094] Содержание
[0095] Заметные изменения в содержании составов отсутствовали в течение не более 1 месяца. Максимальная наблюдаемая потеря активности составляла 1,1% для жидкого состава с pH 2 при 40°C/75% RH. Результаты показаны в таблице 7.
Таблица 7. Активность в исходный момент времени и после хранения в течение одного месяца
[0096] Примеси:
[0097] Отсутствовали изменения в общем содержании примесей в лиофилизированных составах (0,06-0,07%) при любых условиях хранения через 1 месяц. Единственное увеличение количества примесей наблюдалось в жидком составе с pH 2, которое изменилось от 0,06% до 0,17% после 1 месяца хранения при 40°C/75% RH. Результаты измерения после 1 месяца хранения показаны в таблице 8.
Таблица 8. Измерение количества примесей в исходный момент времени и после хранения в течение 1 месяца
[0098] В отдельном испытании количество примесей измеряли в течение периода времени, составляющего один год, для лиофилизированных составов с концентрацией 1,0 мг/мл и 0,8 мг/мл. Эти результаты показаны в таблицах 9A и 9B и в таблицах 10A и 10B соответственно.
Таблица 9A
1 мг/мл, партия № 692-015
полнота растворения
C
C
C
C
C
C
C
C
C
C
(частицы/
контейнер)
воды (%)
восстановления (мин.)
(HPLC) (%)
1 C: бесцветный; 2 н. т.: не тестировали; 3 н. п.: не применимо
Таблица 9B
RRT
1 мг/мл, партия № 692-015
Таблица 10A
0,8 мг/мл, партия № 692-009
полнота растворения
C
C
C
C
C
C
C
C
C
C
(частицы/
контейнер)
воды (%)
восстановления
(HPLC) (%)
1 C: бесцветный; 2 н. т.: не тестировали; 3 н. п.: не применимо
Таблица 10B
RRT
0,8 мг/мл, партия № 692-009
1Н. о.: не определено
Пример 6. Стабильность лекарственного препарата во время введения
[0099] В одном варианте осуществления лиофилизированный лекарственный препарат будет подвергаться восстановлению, разбавлению в физиологическом растворе в пакете для внутривенного введения и прохождению через инфузионный набор и катетерную систему.
[00100] Восстановленные растворы при pH 7 оставались прозрачными при визуальном определении и не содержали осадка (при использовании луча для обеспечения эффекта Тиндаля) до трех месяцев при 2-8°C. Были проведены исследования, чтобы проверить, можно ли обнаружить какое-либо образование осадка с помощью аналитических методов определения твердых частиц. Физическую стабильность восстановленного раствора определяли как зависимость от времени для 1 мг/мл состава перампанела при pH 7, используя тест согласно USP <788> и измерения интенсивности рассеяния света. Тест согласно USP <788> обнаруживает твердые частицы с размерами в диапазоне микронных размеров. Интенсивность рассеяния света может использоваться как ранний индикатор увеличения количества невидимых частиц, которые потенциально могут быть предшественниками осаждения лекарственного средства. Результаты в таблице 11 показывают отсутствие изменений в количестве твердых частицах или интенсивности рассеяния света в восстановленном растворе в течение не более 72 часов после восстановления. Этот результат подтверждает, что в восстановленном растворе не происходит осаждения даже на уровне не обнаруживаемых невооруженным глазом частиц.
Таблица 11. Физическая стабильность лиофилизированного 1 мг/мл состава перампанела при pH 7 после восстановления
a Требования согласно USP <788>:
≥ 10 мкм - не более 6000 частиц/контейнер
≥ 25 мкм - не более 600 частиц/контейнер
Пример 7. Исследования совместимости
[00101] Во время введения восстановленный лекарственный препарат можно набрать в шприц перед смешиванием с жидкостью для внутривенного введения. Поэтому была оценена физическая стабильность и совместимость восстановленного лекарственного препарата со шприцами из полипропилена (PE). Состав выдерживали в контакте со шприцем при комнатной температуре в течение 24 часов вместе с контрольным раствором, помещенным в стеклянный флакон. В таблице 12 показано, что не было различий в содержании перампанела между шприцем и контрольным образцом, что указывает на то, что лекарственный препарат физически стабилен и совместим при контакте со шприцем в течение не более 24 часов.
Таблица 12. Совместимость состава перампанела (лиофилизированный состав, pH 7) с полипропиленовым шприцем. Показаны концентрации и внешний вид после 24 часов хранения при комнатной температуре.
[00102] Физическую стабильность и совместимость лиофилизированного состава с pH 7 оценивали в физиологическом растворе, помещенном в пакет для внутривенного введения из сополимера полиэтилена (PE). Исследуемые концентрации перампанела составляли 0,08 мг/мл и 0,24 мг/мл. Образцы отбирали из пакета в различные моменты времени в течение не более 72 часов и проводили анализ в отношении содержания основного вещества, pH и количества невидимых частиц. Растворы выглядели прозрачными и не показали изменений pH, интенсивности рассеяния света и содержания основного вещества через 72 часов в нормальном физиологическом растворе, помещенном в полиэтиленовый пакет (таблица 13). Эти данные позволяют сделать вывод об отсутствии физической нестабильности или несовместимости, демонстрируемых перампанелом в пакетах для внутривенного введения из полиэтилена в течение не более 72 часов.
Таблица 13. Совместимость состава перампанела с физиологическим раствором, помещенным в пакет из сополимера полиэтилена (PE). pH, интенсивность рассеяния света и содержание перампанела измеряли в течение 72 часов.
[00103] Исследования совместимости также были повторены после разбавления состава перампанела с помощью 5% декстрозы, помещенного в пакет для внутривенного введения из сополимера полиэтилена (PE). Образцы отбирали из пакета в различные моменты времени в течение не более 76 часов и анализировали с помощью HPLC. В таблице 14 показано отсутствие уменьшения концентрации перампанела в течение 76 часов.
Таблица 14. Совместимость состава перампанела в 5% декстрозе, помещенного в пакет из сополимера полиэтилена (PE). Содержание перампанела измеряли в течение 72 часов.
[00104] Физическую стабильность и совместимость лиофилизированного состава с pH 7 также оценивали в физиологическом растворе в пакете для внутривенного введения из поливинилхлорида (PVC) Исследуемая концентрация перампанела составляла 0,12 мг/мл. Образцы отбирали из пакета в различные моменты времени в течение не более 11 часов и проводили анализ в отношении содержании перампанела. В таблице 15 показано, что пакет из PVC продемонстрировал адсорбционные потери, составляющие примерно 18% в течение 11 часов.
Таблица 15. Совместимость состава перампанела в физиологическом растворе в пакете из поливинилхлорида (PVC). Содержание перампанела измеряли в течение 11 часов.
[00105] Была изучена совместимость лекарственного препарата с инфузионным набором и катетерной системой. Были оценены два набора для введения: один набор, содержащий трубки с полиэтиленовым покрытием, и один набор, содержащий трубки из поливинилхлорида. Данные наборы для введения были оценены с перампанелом в физиологическом растворе.
[00106] Набор для инфузии был соединен с пакетом с физиологическим раствором на одном конце и с катетером для внутривенного введения на другом конце. Разбавленный лекарственный препарат выдерживали в контакте со всеми компонентами в течение 72 часов. В различные моменты времени из катетера собирали 25 мл раствора и анализировали в отношении содержания перампанела. Раствор, находящийся в контакте с набором для введения из PVC, показал потерю активности лекарственного средства, составляющую 42%, в течение первых 2 часов. Внешний вид слабоактивного раствора был прозрачным и без осадка; следовательно, потеря активности связана с адсорбцией лекарственного средства на трубке из PVC. Раствор, находящийся в контакте с набором для введения, покрытым полиэтиленом, не показал потери лекарственного средства в течение 72 часов. Кроме того, отсутствовали измерения pH и интенсивности рассеяния света раствора, находящийся в контакте с набором для введения из PE.
Пример 8. Исследование времени индукции
[00107] Исследования времени индукции осуществляли для определения периода времени, который должен пройти до образования кристаллов, для различных концентраций перампанела в 40% SBE-β-CD, pH 7, при комнатной температуре и в объеме, составляющем 5 мл. Измеренные концентрации исследуемых растворов составили 1,16, 1,64 и 1,97 (мг/мл). Данные о времени осаждения анализировали согласно способу, использованному в Zaitseva et.al., в J. Crystal Growth, 148 (1995) 276-282. Исходя из этих данных прогнозируемое время индукции 0,8 мг/мл раствора (что эквивалентно x=0,599 на графике зависимости ln времени (сек.) от 1/Ln (S) ^ 2) составило 3,3 года (95% доверительные интервалы составляли 1,3 года на нижнем пределе и 7,9 года на верхнем пределе). Анализ данных, использованный для этого прогноза, представлен на фиг. 6, где S соответствует степени пересыщения и S=X/Xo, где Xo представляет собой растворимость. Поскольку во флаконе с восстановленным лекарственным препаратом не должно быть твердых частиц в течение нескольких дней, прогнозируемое время индукции поддерживает утверждение о жизнеспособности композиции с 40% SBE-β-CD, pH 7.
Пример 9. Исследование ширины метастабильной зоны
[00108] Исследования ширины метастабильной зоны для составов перампанела на основе SBE-β-CD, содержащих различные концентрации перампанела, были выполнены для оценки метастабильной зоны для составов, содержащих 40% SBE-β-CD при pH 7. Лиофилизация обеспечивает длительное хранение, но требует восстановления перед использованием. Когда лиофилизированный состав восстанавливают, раствор находится в метастабильном пересыщенном состоянии. Анализ ширины метастабильной зоны позволяет оценить, насколько состав близок к границе метастабильного состояния.
[00109] Получали растворы перампанела различной концентрации в 40% SBE-β-CD при pH 7 и помещали в сосуд для смешивания с регулируемой температурой с датчиком LASENTECH® для обнаружения осаждения. Хотя специалисты в данной области техники поймут, что составы, указанные в предыдущих примерах примерах, могут быть получены с помощью ряда способов, следующий способ используется для получения составов при различных концентрациях перампанела в 40% SBE-β-CD, pH 7, жидкая форма, для испытаний, указанных ниже. Сначала получают раствор SBE-β-CD с pH 1,8 путем добавления приблизительно 25 мл воды в химический стакан, а затем добавления приблизительно 20 г SBE-β-CD. SBE-β-CD характеризуется содержанием воды, составляющим 4,7%, он является 100% чистым и характеризуется теоретической массой 20 г/0,953 или 21,0 г. SBE-β-CD медленно добавляют при перемешивании до его растворения. Проверяют объем, чтобы убедиться, что он не превышает 40 мл. pH раствора регулируют до pH 1,75 с помощью 85% фосфорной кислоты.
[00110] Затем рассчитывают вес перампанела, используемого для получения необходимой концентрации, путем деления 100 мг продукта (1-[содержание влаги в перампанеле/100]) и (безводная чистота перампанела/100). В некоторых примерах содержание влаги составляет 3,7%, а чистота безводного вещества составляет 99,9%. Рассчитанное количество перампанела добавляют к раствору с pH 1,75, затем перемешивают в течение ночи при 40°C. Раствор фильтруют через фильтр с диаметром пор 20 мкм при 40°C, затем нагревают до 40°C. При этой температуре pH регулируют до 7. Объем регулируют до 50 мл водой и перемешивают.
[00111] Растворы охлаждали с определенной скоростью и регистрировали температуру, при которой происходило осаждение. Активность для каждого образца измеряли с помощью HPLC-анализа. Данные о температуре осаждения анализировали в соответствии со способом, описанным Sangwal, K. в Crystal Growth and Design, 9, 2 (2009) 942-950.
[00112] Анализ первоначально собранных данных показал, что наилучшим способом экстраполяции границы метастабильной зоны является выполнение линейной экстраполяции к нулевой скорости охлаждения для данных, собранных при скоростях охлаждения, меньших или равных 0,5 град./час, как показано на фиг. 7. Первоначально собранные данные представлены в таблице 16.
Таблица 16. Краткое изложение данных исследования ширины метастабильных зон. Н. о. = Не наблюдали какого-либо образования осадка.
(град. Цельсия/час)
(градус Цельсия)
перампанела (мг/мл)
[00113] График зависимости температуры осаждения перампанела из 40% раствора SBE-β-CD, pH 7 от концентрации лекарственного средства (мг/мл) и скорости охлаждения (град. Цельсия/час) представлен на фиг. 8. Контурный график (см. фиг. 9) и 3-D график (см. фиг. 10), иллюстрирующие взаимосвязь между скоростью охлаждения (град./час), концентрацией перампанела (мг/мл) и температурой осаждения, были построены с использованием программного обеспечения DESIGN-EXPERT®, версия 7.1.6. В модели DESIGN-EXPERT® использовались параметры температуры осаждения, скорости охлаждения, концентрации и концентрации2, чтобы поверхность соответствовала данным. Программа DESIGN-EXPERT® затем смогла экстраполировать температуру осаждения при нулевой скорости охлаждения для различных концентраций лекарственного средства с 95% доверительными интервалами на основе аппроксимации данных.
[00114] Эти экстраполированные данные были использованы для получения фиг. 11, на которой представлен прогноз границы метастабильной зоны для перампанела в составе 40% SBE-β-CD при pH 7. Теоретически, если концентрация лекарственного средства остается на уровне или ниже границы метастабильной зоны, то лекарственное средство не должно выпадать в осадок из раствора при определенных температурах. Эти данные показывают, что 0,8 мг/мл не должно выпадать в осадок при хранении при температурах до нуля градусов C; однако из-за вариабельности результатов 95% доверительный интервал велик при более низких концентрациях лекарственного средства.
[00115] Результаты этого исследования показывают, что 0,8 мг/мл состав находится в пределах метастабильной зоны до нуля градусов C. Из-за вариабельности данных (особенно при более низких концентрациях лекарственного средства) нижний 95% доверительный интервал метастабильной зоны пересекает ноль градусов по Цельсию при температуре около 10 градусов по Цельсию. Таким образом, после восстановления рекомендуется хранить раствор при контролируемой комнатной температуре и иметь ограничение на хранение в холодильнике и в замороженном состоянии, чтобы лекарственный препарат оставался в зоне метастабильности и не происходило осаждение.
Пример 10
[00116] Состав перампанела, раскрытый в настоящем документе, вводят внутривенно пациенту, нуждающемуся в таком лечении. Лечение повторяют по мере необходимости и по решению лечащего врача.
[00117] Хотя были описаны и проиллюстрированы конкретные варианты осуществления, следует понимать, что они никоим образом не являются ограничивающими, поскольку специалисты в данной области техники могут осуществлять модификации. Настоящая заявка предполагает любые и все модификации, которые находятся в пределах сущности и объема водных фармацевтических составов на основе 1,2-дигидропиридиновых соединений, раскрытых и заявленных в настоящем документе.
Пронумерованные варианты осуществления изобретения
1. Фармацевтический состав, содержащий солюбилизирующее средство и терапевтически эффективное количество соединения или гидрата соединения, представленного следующей формулой
 ,
,
где Q обозначает O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной;
где указанное соединение и указанное солюбилизирующее средство присутствуют в таком соотношении, при котором разведение указанного состава в водной среде обеспечивает соединение в пересыщенном водном растворе.
2. Фармацевтический состав по п. 1, где соединение и солюбилизирующее средство присутствуют в молярном соотношении молей солюбилизирующего средства и молей соединения, составляющем от 60 до 110.
3. Фармацевтический состав по п. 1, где указанное солюбилизирующее средство представляет собой циклодекстрин.
4. Фармацевтический состав по п. 3, где указанное солюбилизирующее средство выбрано из группы, состоящей из α-циклодекстрина, β-циклодекстрина, гидроксипропил-β-циклодекстрина и смеси двух или более различных циклодекстринов.
5. Фармацевтический состав по п. 4, где указанное солюбилизирующее средство представляет собой сульфобутиловый эфир β-циклодекстрина.
6. Фармацевтический состав по п. 5, где указанное солюбилизирующее средство представляет собой натриевую соль сульфобутилового эфира β-циклодекстрина.
7. Фармацевтический состав по п. 5, где указанное соединение представляет собой перампанел или его гидрат.
8. Фармацевтический состав по п. 7, где молярное соотношение сульфобутилового эфира β-циклодекстрина и перампанела составляет от 28 до 108.
9. Фармацевтический состав по п. 1, где соединение находится в аморфной фазе.
10. Фармацевтический состав по п. 1, где состав находится в растворе.
11. Фармацевтический состав по п. 10, где указанный раствор представляет собой водный раствор.
12. Фармацевтический состав по п. 9, где состав является лиофилизированным.
13. Стабильный при хранении водный фармацевтический состав для внутривенного введения, содержащий водный пересыщенный раствор перампанела и сульфобутилового эфира β-циклодекстрина.
14. Фармацевтический состав по п. 13, где указанный перампанел и указанный сульфобутиловый эфир β-циклодекстрина присутствуют в молярном соотношении молей сульфобутилового эфира β-циклодекстрина и молей перампанела, составляющем от 60 до 110.
15. Фармацевтический состав по п. 14, где указанный водный пересыщенный раствор перампанела характеризуется pH от 2,5 до 9.
16. Фармацевтический состав по п. 15, где указанный водный пересыщенный раствор перампанела характеризуется pH от 6 до 8.
17. Фармацевтический состав по п. 13, где количество солюбилизирующего средства составляет от 0,005% до 60% по весу.
18. Фармацевтический состав по п. 13, где количество солюбилизирующего средства составляет от 3% до 9,5% по весу.
19. Фармацевтический состав по п. 13, где фармацевтический состав находится при температуре, которая больше или равняется 0°C.
20. Фармацевтический состав по п. 13, где фармацевтический состав находится при температуре, которая больше или равняется 10°C.
21. Способ получения фармацевтического состава в водной среде, содержащего солюбилизирующее средство и терапевтически эффективное количество соединения, представленного следующей формулой
 ,
,
где Q обозначает O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, включающий стадии
a) солюбилизации соединения при кислом pH в солюбилизирующем средстве и
b) регулирования pH до значения от 6 до 8 посредством добавления разбавителя.
22. Способ по п. 21, где указанное солюбилизирующее средство выбрано из группы, состоящей из α-циклодекстрина, β-циклодекстрина и гидроксипропил-β-циклодекстрина.
23. Способ по п. 21, где указанное солюбилизирующее средство представляет собой натриевую соль сульфобутилового эфира β-циклодекстрина.
24. Способ по п. 23, где указанное соединение представляет собой перампанел или его гидрат.
25. Способ по п. 23, дополнительно включающий обеспечение лиофилизации указанного фармацевтического состава.
26. Способ по п. 25, где указанную стадию лиофилизации осуществляют при концентрации соединения, которая ниже концентрации соединения, соответствующей пересыщению в водной среде.
27. Способ лечения нейродегенеративного заболевания с помощью фармацевтического состава в водной среде, содержащего солюбилизирующее средство и терапевтически эффективное количество соединения, представленного следующей формулой, или его гидрата,
 ,
,
где Q обозначает O, R3 и R5 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает атом водорода или C1-6алкильную группу; и R1 обозначает C3-8циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, и R2 и R4 являются одинаковыми или отличными друг от друга, и при этом каждый обозначает группу, представленную формулой -X-A, где X обозначает одинарную связь, и A обозначает C3-6циклоалкильную группу, 5-14-членную неароматическую гетероциклическую группу, ароматическую C6-14гидрокарбоциклическую группу или 5-14-членную ароматическую гетероциклическую группу, которая может быть соответственно замещенной, включающий стадии
a) идентификации пациента, нуждающегося в этом, и
b) введения терапевтически эффективного количества указанного фармацевтического состава в водной среде.
28. Способ по п. 27, где указанное солюбилизирующее средство выбрано из группы, состоящей из α-циклодекстрина, β-циклодекстрина, гидроксипропил-β-циклодекстрина и/или смеси двух или более различных циклодекстринов.
29. Способ по п. 27, где указанное солюбилизирующее средство предусматривает натриевую соль сульфобутилового эфира β-циклодекстрина.
30. Способ по п. 29, где указанное соединение представляет собой перампанел или его гидрат.
31. Способ по п. 27, где стадию введения осуществляют в материалах, изготовленных не из поливинилхлорида (PVC).
32. Способ по п. 27, где pH фармацевтического состава составляет от 6 до 8.
33. Способ по п. 29, где указанное соединение представляет собой перампанел в лиофилизированной матрице, содержащей 2-6 мг перампанела и 1500-2500 мг SBE-β-CD, которая при восстановлении с помощью воды обеспечивает раствор с pH 5-9.
34. Способ по п. 33, где указанное соединение представляет собой перампанел в лиофилизированной матрице, содержащей 2-6 мг перампанела и 1500-2500 мг SBE-β-CD, которая при восстановлении с помощью воды обеспечивает раствор с pH 6-8.
35. Способ по п. 34, где указанное соединение представляет собой перампанел в лиофилизированной матрице, содержащей 3-5 мг перампанела и 1900-2100 мг SBE-β-CD, которая при восстановлении с помощью воды обеспечивает раствор с pH 6-8.
36. Способ по п. 35, где указанное соединение представляет собой перампанел в лиофилизированной матрице, содержащей 4 мг перампанела и 2000 мг SBE-β-CD, которая при восстановлении с помощью воды обеспечивает раствор с pH 6-8.






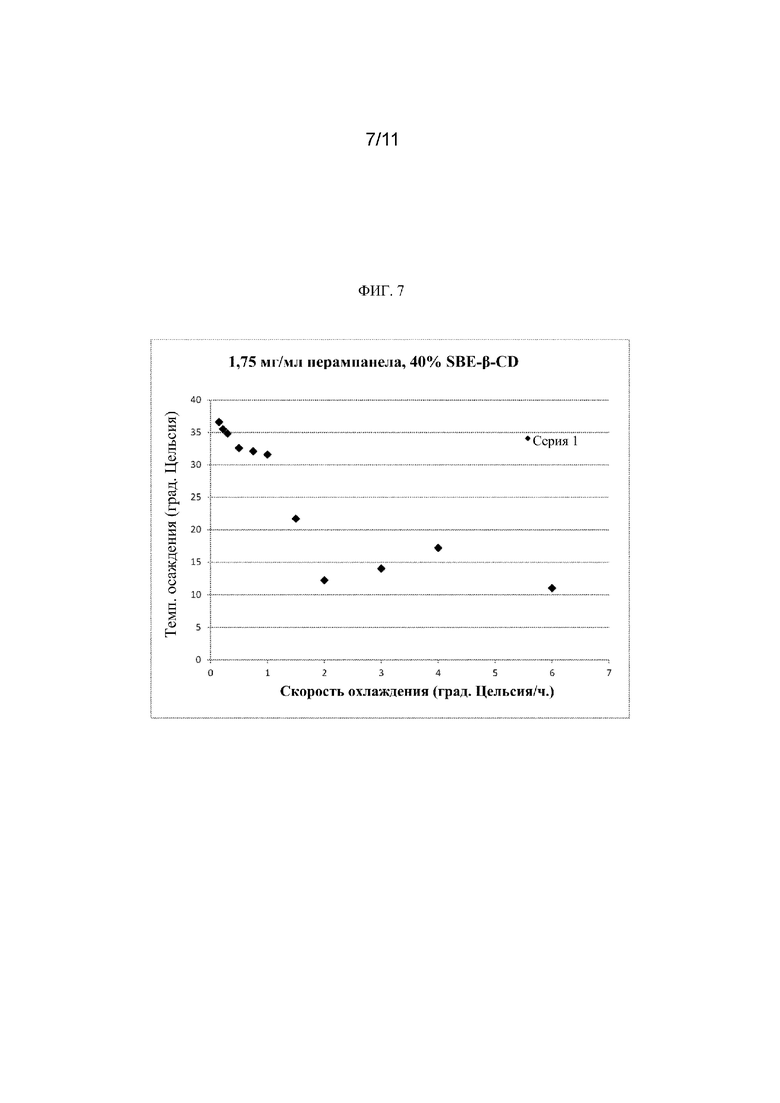

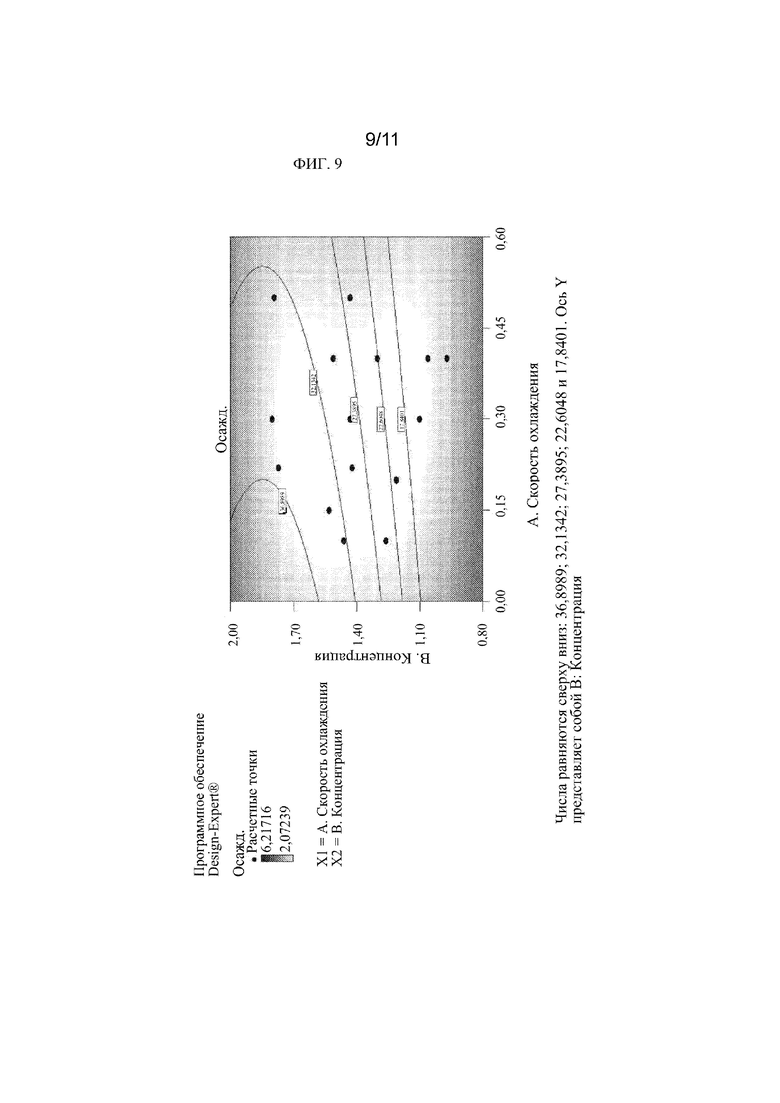
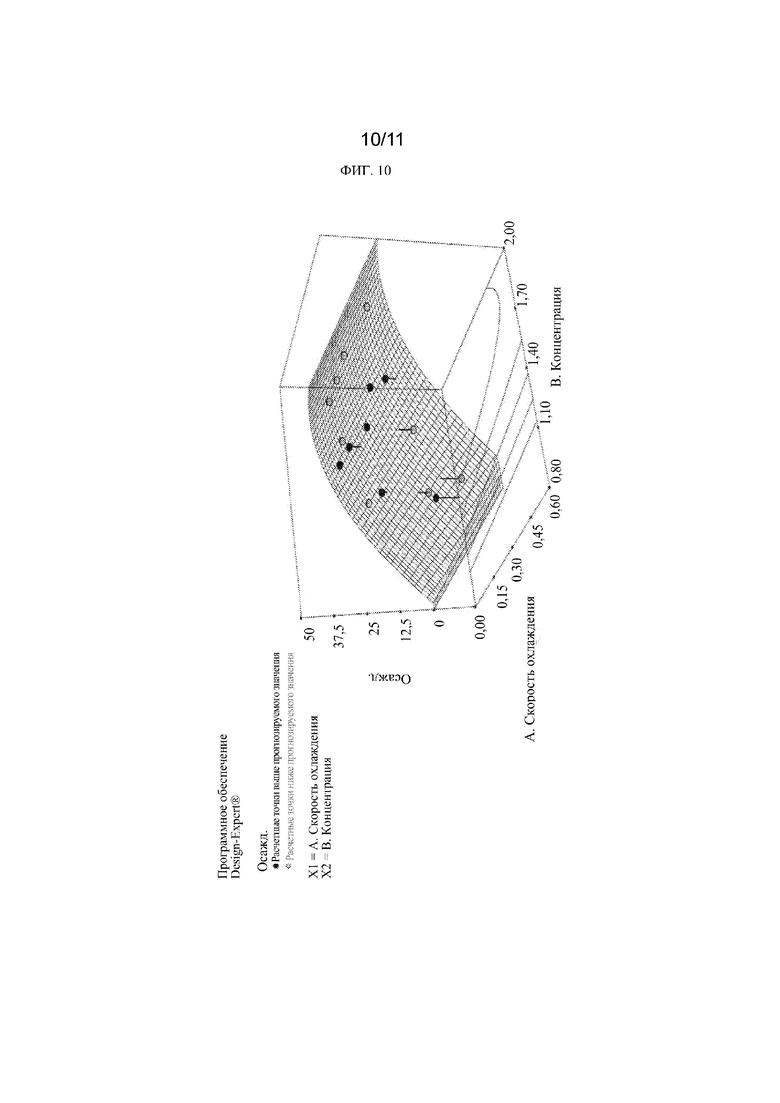

Группа изобретений относится к химии и фармацевтической промышленности, а именно: к фармацевтическому составу для ингибирования рецептора AMPA; к способу его получения; к водному фармацевтическому составу для ингибирования рецептора AMPA для внутривенного введения; к лекарственному препарату для ингибирования рецептора AMPA для внутривенного введения субъекту; а также к способу лечения эпилепсии. Предложенный фармацевтический состав содержит солюбилизирующее средство, представляющее собой сульфобутиловый эфир β-циклодекстрина, и терапевтически эффективное количество перампанела или его гидрата, причем молярное соотношение указанных ингредиентов в составе составляет 28-108 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела. Группа изобретений обеспечивает фармацевтические составы, стабильные при хранении, и лекарственный препарат, стабильный также и во время введения. 5 н. и 40 з.п. ф-лы, 11 ил., 18 табл., 10 пр.
1. Фармацевтический состав для ингибирования рецептора AMPA, содержащий солюбилизирующее средство и терапевтически эффективное количество перампанела или его гидрата,
где указанное солюбилизирующее средство представляет собой сульфобутиловый эфир β-циклодекстрина; и
где указанный перампанел и указанный сульфобутиловый эфир β-циклодекстрина присутствуют в молярном соотношении от 28 до 108 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела.
2. Фармацевтический состав для ингибирования рецептора AMPA по п. 1, где указанное солюбилизирующее средство представляет собой натриевую соль сульфобутилового эфира β-циклодекстрина.
3. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1 или 2, где гидрат перампанела представляет собой 3/4 гидрат.
4. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-3, где перампанел находится в аморфной фазе.
5. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1 или 2, где состав представляет собой раствор.
6. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1, 2 или 5, где состав представляет собой водный раствор.
7. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-3, где состав является лиофилизированным.
8. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-7, где молярное соотношение сульфобутилового эфира β-циклодекстрина и перампанела составляет 81 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела.
9. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-6, содержащий 1,0 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
10. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-6, содержащий 0,8 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
11. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-6, содержащий 0,6 мг/мл раствора перампанела в 30% сульфобутиловом эфире β-циклодекстрина.
12. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-6, содержащий от 0,8 до 1,0 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
13. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-6, имеющий pH 7.
14. Фармацевтический состав для ингибирования рецептора AMPA по п. 8, где фармацевтический состав проявляет терапевтический эффект лечения эпилепсии.
15. Фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 1-7 или 14, где терапевтически эффективное количество перампанела или его гидрата выбрано из группы, состоящей из 2 мг, 4 мг, 6 мг, 8 мг, 10 мг и 12 мг.
16. Водный фармацевтический состав для ингибирования рецептора AMPA для внутривенного введения, содержащий водный пересыщенный раствор перампанела и сульфобутиловый эфир β-циклодекстрина в качестве солюбилизирующего средства, где указанный перампанел и указанный сульфобутиловый эфир β-циклодекстрина присутствуют в молярном соотношении от 60 до 110 молей сульфобутилового эфира β-циклодекстрина на 1 моль перампанела.
17. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, где указанный водный пересыщенный раствор перампанела характеризуется pH от 2,5 до 9.
18. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, где указанный водный пересыщенный раствор перампанела характеризуется pH от 6 до 8.
19. Водный фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 16-18, где количество солюбилизирующего средства составляет от 0,005 до 60% по весу.
20. Водный фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 16-18, где количество солюбилизирующего средства составляет от 3 до 9,5% по весу.
21. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, где молярное соотношение составляет 81 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела.
22. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, содержащий 1,0 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
23. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, содержащий 0,8 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
24. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, содержащий 0,6 мг/мл раствора перампанела в 30% сульфобутиловом эфире β-циклодекстрина.
25. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, содержащий от 0,8 до 1 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
26. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, имеющий pH 7.
27. Водный фармацевтический состав для ингибирования рецептора AMPA по п. 16, где фармацевтический состав проявляет терапевтический эффект лечения эпилепсии.
28. Водный фармацевтический состав для ингибирования рецептора AMPA по любому из пп. 16-27, где перампанел присутствует в терапевтически эффективном количестве, выбранном из группы, состоящей из 2 мг, 4 мг, 6 мг, 8 мг, 10 мг и 12 мг.
29. Способ получения фармацевтического состава для ингибирования рецептора AMPA, содержащего солюбилизирующее средство и терапевтически эффективное количество перампанела или его гидрата, включающий стадии
a) солюбилизации перампанела или его гидрата при кислом pH в солюбилизирующем средстве, где указанное солюбилизирующее средство представляет собой сульфобутиловый эфир β-циклодекстрина, где указанный сульфобутиловый эфир β-циклодекстрина и указанный перампанел присутствуют в молярном соотношении от 28 до 108 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела, с образованием раствора, и
b) регулирования pH раствора до значения от 6 до 8 посредством добавления разбавителя.
30. Способ по п. 29, где указанное солюбилизирующее средство представляет собой натриевую соль сульфобутилового эфира β-циклодекстрина.
31. Способ по любому из пп. 29 или 30, где указанный фармацевтический состав включает гидрат перампанела.
32. Способ по любому из пп. 29-31, дополнительно включающий обеспечение лиофилизации указанного фармацевтического состава.
33. Способ по любому из пп. 29-32, где указанный гидрат перампанела представляет собой 3/4 гидрат.
34. Способ по п. 29, где молярное соотношение составляет 81 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела.
35. Способ по п. 29, где фармацевтический состав содержит 1,0 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
36. Способ по п. 29, где фармацевтический состав содержит 0,8 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
37. Способ по п. 29, где фармацевтический состав содержит 0,6 мг/мл раствора перампанела в 30% сульфобутиловом эфире β-циклодекстрина.
38. Способ по п. 29, где фармацевтический состав содержит от 0,8 до 1 мг/мл раствора перампанела в 40% сульфобутиловом эфире β-циклодекстрина.
39. Способ по п. 29, где фармацевтический состав имеет pH 7.
40. Способ по п. 29, где фармацевтический состав проявляет терапевтический эффект лечения эпилепсии.
41. Способ по любому из пп. 29 или 40, где терапевтически эффективное количество перампанела или его гидрата выбрано из группы, состоящей из 2 мг, 4 мг, 6 мг, 8 мг, 10 мг и 12 мг.
42. Лекарственный препарат для ингибирования рецептора AMPA для внутривенного введения субъекту, включающий состав солюбилизирующего средства и терапевтически эффективного количества перампанела или его гидрата;
где указанное солюбилизирующее средство представляет собой сульфобутиловый эфир β-циклодекстрина;
где указанный сульфобутиловый эфир β-циклодекстрина и указанный перампанел присутствуют в молярном соотношении от 28 до 108 моль сульфобутилового эфира β-циклодекстрина на 1 моль перампанела; и
где в указанном составе концентрация перампанела составляет 1 мг/мл, 0,8 мг/мл, 0,6 мг/мл, 0,4 мг/мл, 0,24 мг/мл и 0,08 мг/мл.
43. Лекарственный препарат по п. 42, имеющий pH 7.
44. Лекарственный препарат по п. 42, где молярное соотношение составляет 81 моль сульфобутилового эфира βциклодекстрина на 1 моль перампанела.
45. Способ лечения эпилепсии, включающий:
a) идентификацию пациента, нуждающегося в лечении эпилепсии; и
b) введение пациенту лекарственного препарата по любому из пп. 42-44.
| WO 2018169798 A9, 18.10.2018 | |||
| WO 2016127170 A1, 11.08.2016 | |||
| CN 106389367 A, 15.02.2017 | |||
| CN 106389367 A, 15.02.2017 | |||
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ | 2002 |
|
RU2358733C2 |
Авторы
Даты
2024-08-12—Публикация
2019-12-16—Подача