Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармации и медицины, а именно к фармацевтическим композициям анти-CD20 антитела, в частности дивозилимаба, которые могут быть использованы для лечения заболевания или нарушения, опосредованного CD20.
Уровень техники
Лимфоциты представляют собой одну из нескольких популяций лейкоцитов; они специфично распознают и реагируют на чужеродный антиген. Тремя основными классами лимфоцитов являются В-лимфоциты (В-клетки), Т-лимфоциты (Т-клетки) и естественные клетки-киллеры (NK). В-лимфоциты представляют собой клетки, ответственные за производство антител и гуморальный иммунный ответ. В-клетки созревают в костном мозге и покидают его, экспрессируя антигенсвязывающее антитело на клеточной поверхности. Когда ранее не подвергавшаяся никакому воздействию В-клетка впервые сталкивается с антигеном, для которого связанное с мембраной антитело является специфическим, клетка начинает быстро делиться и ее потомство дифференцируется с образованием В-клеток памяти и эффекторных клеток, называемых «плазмацитами». В-клетки памяти имеют большую продолжительность жизни и продолжают экспрессировать связанное с мембраной антитело с такой же специфичностью, что и у исходной родительской клетки. Плазмациты не продуцируют связанное с мембраной антитело, но вместо этого продуцируют секретируемую форму антитела. Секретируемые антитела представляют собой главные эффекторные молекулы гуморального иммунного ответа.
Антиген CD20 (который называют также антигеном, дифференцировка которого характерна только для человеческих В-лимфоцитов, Вр35) представляет собой гидрофобный трансмембранный белок с молекулярной массой примерно 35 кДа, локализованный на пре-В- и зрелых В-лимфоцитах (Valentine и др., J. Biol. Chem. 264(19), 1989, cc. l 1282-11287; и Einfeld и др., EMBO J. 7(3), 1988, сс. 711-717). Антиген экспрессируется также на поверхности более чем 90% В-клеток при неходжкинских лимфомах (HXJI) (Anderson и др., Blood 63(6), 1984, сс. 1424-1433), но он не обнаружен на гематопоэтических стволовых клетках, про-В-клетках, здоровых плазмацитах или в других здоровых тканях (Tedder и др., J. Immunol. 135(2), 1985, сс. 973-979). Вероятно, CD20 регулирует раннюю(ие) стадию(ии) процесса активации цикла клеточной инициации и дифференцировки (Tedder и др., выше) и возможно функционирует в качестве кальциевых ионных каналов (Tedder и др., J. Cell. Biochem. 14D, 1990, с. 195).
Из уровня техники известны анти-CD20 антитела: ритуксимаб (rituximab), обинутузумаб (obinutuzumab), офатумумаб (ofatumumab), окрелизумаб (ocrelizumab) и другие.
Также из уровня техники известны фармацевтические композиции различных анти-CD20 антител. Известна фармацевтическая композиция, содержащая ритуксимаб, натрия цитрат, полисорбат 80, натрия хлорид, хлористоводородную кислоту и гидроксид натрия (препарат Мабтера, концентрат для приготовления раствора для инфузий, номер российского регистрационного удостоверения (РУ) П N013127/01). Известна фармацевтическая композиция, содержащая ритуксимаб, рекомбинантную человеческую гиалуронидазу, гистидин, гистидина гидрохлорид моногидрат, трегалозы дигидрат, метионин, полисорбат 80 (препарат Мабтера, раствор для подкожного введения, номер российского РУ ЛП-№(000358)-(РГ-RU)). Известна фармацевтическая композиция, содержащая обинутузумаб, гистидин, гистидина гидрохлорид моногидрат, трегалозы дигидрат, полоксамер 188 (препарат Газива, концентрат для приготовления раствора для инфузий, номер российского РУ ЛП-002867). Известна фармацевтическая композиция, содержащая офатумумаб, аргинин, натрия ацетата тригидрат, натрия хлорид, полисорбат 80, дигидрат динатриевой соли ЭДТА, соляную кислоту (препарат Kesimpta, ЕМЕА/Н/С/005410). Известна фармацевтическая композиция, содержащая окрелизумаб, натрия ацетат тригидрат, уксусную кислоту, трегалозы дигидрат и полисорбат 20 (препарат Окревус, концентрат для приготовления раствора для инфузий, номер российского РУ ЛП-004503).
Дивозилимаб также относится к анти-CD20 антителам (WHO Drug Information, Vol.35, No. 1, 2021, CAS 2254 061-60-2)..
Из уровня техники не известны фармацевтические композиции, содержащие дивозилимаб в качестве действующего вещества.
В связи с вышесказанным, актуальным является разработка улучшенных стабильных фармацевтических композиций анти-CD20 антитела, в частности дивозилимаба, стабильных при хранении по показателям «содержание мономера» и «содержание кислых фракций», и которые могут быть использованы в качестве лекарственного средства для лечения заболевания или нарушения, опосредованного CD20.
Краткое описание чертежей
Фигура 1 представляет собой аминокислотную последовательность моноклонального антитела дивозилимаба, где показано количество потенциальных сайтов химической деградации для легкой и тяжелой цепей.
Фигура 2 представляет собой зависимость содержания фракции мономера по методу эксклюзионной ВЭЖХ от времени при температуре +37°С.

Фигура 3 представляет собой зависимость содержания кислой фракции по методу ионообменной ВЭЖХ от времени при температуре +37°С.
Состав 1, состав 2 и состав 3 описаны выше в фигуре 2.
Фигура 4 представляет собой зависимость содержания фракции мономера по методу эксклюзионной ВЭЖХ от времени при температуре +25°С.
Состав 1, состав 2 и состав 3 описаны выше в фигуре 2.
Фигура 5 представляет собой зависимость содержания кислой фракции по методу ионообменной ВЭЖХ от времени при температуре +25°С.
Состав 1, состав 2 и состав 3 описаны выше в фигуре 2.
Фигура 6 представляет собой зависимость содержания фракции мономера по методу эксклюзионной ВЭЖХ от времени при температуре +(2-8)°С.
Состав 1, состав 2 и состав 3 описаны выше в фигуре 2.
Фигура 7 представляет собой зависимость содержания кислой фракции по методу ионообменной ВЭЖХ от времени при температуре +(2-8)°С.
Состав 1, состав 2 и состав 3 описаны выше в фигуре 2.
Подробное описание изобретения
Определения
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Термин «антитело» или «иммуноглобулин» (Ig) включает полноразмерные антитела или любой антигенсвязывающий фрагмент (т.е. «антигенсвязывающую часть») или его отдельные цепи. Термин «антитело» в рамках данного изобретения используется в самом широком смысле и может охватывать, но не ограничиваясь, в частности, моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, гуманизированные, полностью человеческие антитела и химерные антитела.
Полноразмерное антитело относится к гликопротеину, содержащему по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в данном описании как VH) и константную область тяжелой цепи. Константная область является идентичной во всех антителах одного и того же изотипа, но отличается в антителах различного изотипа. Тяжелые цепи γ, α и δ содержат константную область, которая состоит из трех константных доменов CH1, СН2 и СН3 (выстроены в ряд) и шарнирной области, которая придает гибкость (Woof J., Burton D., Nat Rev Immunol 4, 2004, cc.89-99). У млекопитающих известно только два типа легких цепей, которые обозначают как лямбда (λ) и каппа (κ). Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном описании как VL) и константной области легкой цепи. Примерная длина легкой цепи составляет 211-217 аминокислот. Предпочтительно легкая цепь представляет собой легкую лямбда (λ)-цепь, а константный домен CL предпочтительно представляет собой С-лямбда (λ).
Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), расположенные между областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями хозяина или факторами, включая различные клетки иммунной системы (например, эффекторными клетками), и первый компонент (C1q) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела или «антигенсвязывающий фрагмент», как использовано в данном описании, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. В данном изобретении под «антигенсвязывающий фрагментом» подразумевается Fab-фрагмент, то есть одновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1, который связан с мономером Fc-фрагмента.
Антитело по данному изобретению, «которое связывает» целевой антиген, представляет собой антитело, которое связывает антиген с достаточной аффинностью так, что антитело можно применять в качестве диагностического и/или терапевтического агента при нацеливании на белок или клетку или ткань, экспрессирующую антиген, и в незначительной степени перекрестно реагирует с другими белками. По данным аналитических методов: сортинга флуоресцентно-активированных клеток (FACS), радиоиммунопреципитации (RIA) или ИФА (ELISA), в таких вариантах изобретения степень связывания антитела с белком, не являющимся «мишенью» (с «нецелевым белком»), составляет менее 10% от связывания антитела с конкретным белком-мишенью. По отношению к связыванию антитела с молекулой-мишенью термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени означает связывание, которое заметно (измеримо) отличается от неспецифического взаимодействия.
Термины «анти-CD20 антитело», «антитело к CD20», «антитело, специфически связывающееся с CD20» или «антитело против CD20» и им подобные являются взаимозаменяемыми в рамках данного изобретения и относятся к антителу, которое специфически связывается с CD20.
Термин «фармацевтическая композиция» относится к композиции и/или составу, содержащему анти-CD20 антитело в терапевтически эффективном количестве и эксципиенты или вспомогательные вещества (носители, разбавители, наполнители, растворители и т.п.), выбор и соотношение которых зависит от их природы, способа назначения и дозировки.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от соединения(ий) по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Термин «водная композиция» при использовании в данном документе относится к композиции на основе воды, в качестве воды могут быть использованы: вода, вода для инъекций, физиологический раствор (0,9-1,0%-ный водный раствор хлористого натрия).
Термин «лиофилизированный», используемый в настоящем документе, относится к препарату, который был подвергнут процессу, известному в данной области техники как сушка из замороженного состояния, включающему в себя замораживание препарата и последующее удаление льда из замороженного содержимого.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8°С. При этом активный агент может сохранять и физическую, и химическую стабильность, и биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Как правило, аминокислоты представляют собой L-аминокислоты. Например, если используют гистидин и гистидина гидрохлорид моногидрат, как правило, это L-гистидин и L-гистидина гидрохлорид моногидрат. Например, если используют пролин, то как правило, это L-пролин. Можно также использовать эквиваленты аминокислот, например, фармацевтически приемлемые соли пролина (например, пролина гидрохлорид).
Термин «лекарственное средство» или «препарат» подразумевает вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, растворов, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
Термин «применение» относится к возможности применения фармацевтической композиции анти-CD20 антитела согласно изобретению для лечения, облегчения течения заболеваний или нарушений, для ускорения ремиссии, снижения частоты рецидивов заболеваний или нарушений.
Термин «заболевание или нарушение, опосредованное CD20» подразумевает все заболевания или нарушения, которые либо прямо, либо косвенно связаны с CD20, включая этиологию, развитие, прогресс, персистентность или патологию заболевания или нарушения.
«Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Используемый в данном документе, чтобы «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включают ссылки на лечебную, паллиативную и профилактическую терапию.
Термин «парентеральное введение» означает режимы введения, обычно выполняемые с помощью инъекции (инфузии), и включает, в частности, внутривенную, внутримышечную, внутриартериальную, внутритрахеальную, внутрикапсулярную, внутриорбитальную, внутрикардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную, эпидуральную и надчревную инъекцию или инфузию.
Сокращения:
ВЭФ - вертикальный электрофорез,
ИО ВЭЖХ - ионообменная высокоэффективная жидкостная хроматография,
Э ВЭЖХ - эксклюзионная высокоэффективная жидкостная хроматография,
РТМ - post-translational modification, пост-трансляционные модификации,
КЩП - кислотно-щелочной профиль,
н/п - не применимо.
Авторами изобретения было установлено, что присутствие трегалозы в составе фармацевтических композиций дивозилимаба негативно сказывается на стабильности антитела. При этом в рамках данного изобретения было определено, что разработанная фармацевтическая композиция обладает высокой стабильностью по показателям «содержание мономера» и «содержание кислых фракций».
В настоящем изобретении раскрыты улучшенные стабильные фармацевтические композиции анти-CD20 антитела, в частности дивозилимаба, которые могут быть использованы в качестве лекарственного средства для лечения заболеваний или нарушений, опосредованных CD20.
В рамках данного изобретения было определено, что разработанная фармацевтическая композиция благодаря полученному сочетанию вспомогательных веществ обладает повышенной стабильностью по показателям «содержание мономера» и «содержание кислых фракций».
Агрегацию белков определяют как самоассоциацию мономеров в нативной или частично развернутой форме. Многие заболевания связанны с агрегацией белков in vivo, в т.ч. болезнь Альцгеймера, прионные расстройства. Агрегация также является частым проявлением нестабильности, наблюдаемым при производстве, хранении и использовании биологических препаратов. Агрегация может влиять на эффективность и биораспределение, а также увеличить вероятность неблагоприятных иммунных реакций у пациентов. Неблагоприятные иммунные реакции на терапевтические белки хорошо задокументированы и клинически могут проявляться как снижение эффективности препарата, инфузионные реакции, синдром высвобождения цитокинов, анафилаксия или даже смерть (Moussa ЕМ, Panchal JP, Moorthy BS, Blum JS, Joubert MK, Narhi LO, Topp EM. Immunogenicity of Therapeutic Protein Aggregates. J Pharm Sci. 2016 Feb).
Согласно Ph. Eur. (Европейской фармакопеи) следует анализировать профиль изоформ. Было показано, что анионные модификации, вызывающие снижение pI на 1-2 единицы, снижают клиренс из плазмы и накопление в тканях. (Ryman JT, Meibohm В. Pharmacokinetics of Monoclonal Antibodies. CPT Pharmacometrics Syst Pharmacol. 2017 Sep). Данные показатели являются критическими.
При выборе состава учитывали назначение, способ применения и переносимость препарата (например, уменьшение дискомфорта при введении), а также обеспечение стабильности и сохранение активности белковой молекулы в составе препарата.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции анти-CD20 антитела, содержащей:
(i) анти-CD20 антитело;
(ii) ацетатный буфер;
(iii) сорбитол;
(iv) метионин;
(v) воду для инъекций.
Концентрация анти-CD20 антитела, содержащегося в фармацевтических композициях по настоящему изобретению, может варьироваться в зависимости от желаемых свойств композиций, а также от конкретных условий, способов и целей использования фармацевтических композиций.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 1,5-120,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 1,5-1000,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 1,5-80,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 1,5-60,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 5,0-50,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 10,0-50,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 10,0-40,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 15,0-35,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 20,0-30,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 22,0-27,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-CD20 антитело находится в концентрации 25,0 мг/мл.
В качестве анти-CD20 антитела может выступать антитело, которое специфически связывается с CD20. Анти-CD20 антитело может представлять собой полноразмерное антитело или его антигенсвязывающий фрагмент, который специфически связывается с CD20. Анти-CD20 антитело может иметь различную специфичность (например, моноспецифическое, биспецифическое антитело), различную валентность (например, моновалентное, бивалентное, трехвалентное антитело), различный формат (например, классическое антитело, scFv, scFv-Fc, Minibody), различное происхождение (например, мышиное, человеческое, верблюжье, химерное).
Антитела, согласно изобретению, могут представлять собой антитела любого класса (например, IgA, IgD, IgE, IgG и IgM) или подкласса (изотипа) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2).
В качестве анти-CD20 антитела могут выступать, например, ритуксимаб (rituximab), обинутузумаб (obinutuzumab), офатумумаб (ofatumumab), окрелизумаб (ocrelizumab) и другие.
В некоторых вариантах осуществления изобретения анти-СБ20 антитело представляет собой дивозилимаб.
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь натрия ацетата и уксусной кислоты.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 0,5-3,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 1,0-2,5 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 1,0-2,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 1,5-2,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 1,7-1,8 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат содержится в концентрации 1,74 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат представляет собой натрия ацетата тригидрат.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,0-6,0.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,4-5,6.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,5.
В некоторых вариантах осуществления изобретения уксусная кислота представляет собой уксусную кислоту ледяную.
В некоторых вариантах осуществления изобретения сорбитол содержится в концентрации 40,0-60,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол содержится в концентрации 45,0-55,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол содержится в концентрации 50,0 мг/мл.
В некоторых вариантах осуществления изобретения метионин содержится в концентрации 0,05-0,30 мг/мл.
В некоторых вариантах осуществления изобретения метионин содержится в концентрации 0,10-0,20 мг/мл.
В некоторых вариантах осуществления изобретения метионин содержится в концентрации 0,15 мг/мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(ii) анти-CD20 антитело;
(iii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(vi) сорбитол - 45,0-55,0 мг/мл;
(vii) метионин - 0,10-0,20 мг/мл;
(viii) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(ii) анти-CD20 антитело - 1,5-120,0 мг/мл;
(iii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(vi) сорбитол - 45,0-55,0 мг/мл;
(vii) метионин - 0,10-0,20 мг/мл;
(viii) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций до - 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-120,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 5,0-50,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 10,0-40,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 10,0-40,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 20,0-30,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти -CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) дивозилимаб - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-CD20 антитело - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) дивозилимаб - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции анти-CD20 антитела, представленной в сухой форме, то есть в форме порошка или гранул для растворения в подходящем растворителе (например, воде) перед введением. Такое лекарственное средство может быть получено, например, с помощью лиофилизации, т.е. процесса, известного в данной области техники как сушка из замороженного состояния, включающая в себя замораживание препарата и последующее удаление растворителя из замороженного содержимого.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции анти-CD20 антитела, полученной лиофилизацией любой фармацевтической композиции анти-CD20 антитела, описанной выше. Таким образом, фармацевтические композиции по настоящему изобретению могут быть как водными, так и лиофилизированными (лиофилизаты).
Лиофилизаты используют для получения других лекарственных форм. Например, лиофилизат для приготовления раствора для инъекций, лиофилизат для приготовления концентрата для приготовления раствора для инфузий. Лиофилизаты восстанавливают путем растворения в подходящем растворителе, чаще всего в воде для инъекций. Также лиофилизированные композиции восстанавливают сначала в необходимом объеме растворителя (чаще всего в воде), а затем дополнительно разводят в подходящем растворителе (например, 5% раствор глюкозы, 0,9% раствор хлорида натрия).
Фармацевтические композиции по настоящему изобретению, как правило, пригодны для парентерального введения в виде стерильных лекарственных средств, предназначенных для введения в организм человека с нарушением целостности кожных покровов или слизистых оболочек, минуя желудочно-кишечный тракт путем инъекций, инфузий или имплантации. В частности, предполагается, что парентеральное введение включает, помимо прочего, подкожную, внутрибрюшинную, внутримышечную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставнную, трансдермальную инъекцию или инфузию; и почечные диализные инфузионные методики. Предпочтительные варианты осуществления изобретения включают внутривенный и подкожный пути. Любой способ введения пептидов или белков, принятый в данной области, может соответствующим образом использоваться для композиции анти-CD20 антитела по данному изобретению.
Фармацевтическая композиция анти-CD20 антитела по настоящему изобретению может быть использована после разведения. Для этого необходимое количество композиции из флакона переносят в емкость для инфузий, содержащую стерильный 0,9% раствор натрия хлорида или стерильный 5% раствор декстрозы. Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий.
Фармацевтические композиции по настоящему изобретению можно хранить в любом подходящем для этого сосуде. Например, стеклянный или полимерный контейнер, флакон, ампула, шприц, картридж или бутылка необходимого объема. Сосуды могут снабжаться дополнительными средствами для введения, например капельницы, автоинжекторы.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
В одном из аспектов настоящее изобретение относится к применению фармацевтической композиции анти-CD20 антитела, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта.
В некоторых вариантах осуществления изобретения фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг.
В некоторых вариантах осуществления изобретения фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг.
В некоторых вариантах осуществления изобретения фармацевтическая композиция вводится каждые 24 недели.
В некоторых вариантах осуществления изобретения фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции анти-CD20 антитела, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов введения фармацевтической композиции.
В некоторых вариантах осуществления изобретения первая доза анти-CD20 антитела 125 мг или 500 мг может быть введена субъекту в два этапа с 14-дневным интервалом в дозе 62,5 мг или 250 мг (то есть в 1-й день субъекту выполняется введение анти-CD20 антитела в дозе 62,5 мг или 250 мг, на 15-й день также выполняется введение анти-CD20 антитела аналогичными дозами 62,5 мг или 250,0 мг). Анти-CD20 антитело водится в виде описанной выше фармацевтической композиции.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции анти-CD20 антитела, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов введения фармацевтической композиции, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг и второе введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 125 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции анти-CD20 антитела, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов введения фармацевтической композиции, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 250 мг и второе введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 250 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 500 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения анти-CD20 антитело представляет собой дивозилимаб.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 125 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 500 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция дивозилимаба вводится каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 125 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 500 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции дивозилимаба, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов введения описанной выше фармацевтической композиции дивозилимаба.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции дивозилимаба, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе дивозилимаба 62,5 мг и второе введение описанной выше фармацевтической композиции в дозе дивозилимаба 62,5 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе дивозилимаба 125 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения применение фармацевтической композиции дивозилимаба, описанной выше, для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе дивозилимаба 250 мг и второе введение описанной выше фармацевтической композиции в дозе дивозилимаба 250 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе дивозилимаба 500 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредованное CD20, выбрано из группы:
(i) онкологическое заболевание или нарушение или
(ii) аутоиммунное заболевание или нарушение.
В некоторых вариантах осуществления изобретения онкологическое заболевание или нарушение выбрано из группы: В-клеточная лимфома, лейкоз.
В некоторых вариантах осуществления изобретения В-клеточная лимфома представляет собой неходжкинскую лимфому, лимфому Ходжкина.
В некоторых вариантах осуществления изобретения лейкоз выбран из группы: хронический лимфоцитарный лейкоз, мелкоклеточная лимфоцитарная лимфома.
В некоторых вариантах осуществления изобретения аутоиммунное заболевание или нарушение выбрано из группы: рассеянный склероз, аксональная невропатия, АНЦА васкулиты, IgG4-связанная болезнь, амилоидов, аксиальный спондилоартрит, антифосфолипидный синдром, артериит Такаясу, аутоиммунная апластическая анемия, аутоиммунная болезнь внутреннего уха, аутоиммунная гемолитическая анемия, аутоиммунная гиперлипидемия, аутоиммунная дизавтономия, аутоиммунная крапивница, аутоиммунная невромиотония (синдром Исаакса), аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия с тепловыми антителами, аутоиммунное поражение тестикул, аутоиммунный ангионевротический отек, аутоиммунный гепатит, аутоиммунный диабет, аутоиммунный иммунодефицит, аутоиммунный перикардит, аутоиммунный тиреоидит, аутоиммунный прогестероновый дерматит, болезнь Аддисона, болезнь Бехчета, болезнь Грейвса (диффузный токсический зоб), заболевания спектра оптиконевромиелита (болезнь Девика), болезнь Кастлемана, болезнь Крона, болезнь Ормонда (ретроперитонеальный фиброз), болезнь Рейно, болезнь Чарга Стросса, буллезный пемфигоид, буллезный эпидермолиз, васкулит, васкулит почек, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, везикулобуллезный дерматоз, гигантоклеточный артериит, витилиго, волчаночный нефрит, воспалительная аневризма аорты, воспалительные заболевания кишечника, врожденная блокада сердца, вульгарный пемфигус, герпетиформный дерматит, гестационный пемфигоид, гипогаммаглобулинемия, гломерулонефрит, гранулематоз с полиангиитом (синдром Вегенера), дерматомиозит, дилатационная кардиомиопатия, демиелинизирующая невропатия, дискоидная красная волчанка, идиопатическая возвратная макрогематурия (IgA нефропатия), идиопатическая воспалительная миопатия, идиопатический воспалительный псевдотумор, идиопатическая тромбоцитопеническая пурпура, идиопатический гипокомплементемический тубулоинтерстициальный нефрит, идиопатический легочный фиброз, сахарный диабет, истинная красноклеточная аплазия, концентрический склероз Бало, красный плоский лишай, склероатрофический лишай, лейкоцитокластический васкулит, лимитированная склеродермия (CREST синдром), лимбический энцефалит, линейный IgA-зависимый буллезный дерматоз, листовидный пемфигус, макроглобулинемия Вальденстрема, медиастинальный фиброз, миастенический криз, миастенический синдром Ламберта-Итона, миастения гравис, микроскопический полиангиит, миозит, миокардит Коксаки, множественный склероз, мультифокальная моторная невропатия, мультифокальный фибросклероз, неврит зрительного нерва, недифференцированное заболевание соединительной ткани увеит, нейтропения, неспецифический язвенный колит, нефрит, ассоциированный с антителами к базальной мембраны канальцев и клубочков, опсоклонус, острая моторная аксональная невропатия, острый геморрагический лейкоэнцефалит, острый диссеминированный энцефаломиелит, палиндромный ревматизм, паранеопластическая мозжечковая дегенерация, паранеопластический синдром, парапротеинемическая полиневропатия, пароксизмальная ночная гемоглобинурия, пемфигоид конъюнктивы, пемфигоид слизистых оболочек, первичный билиарный цирроз, первичный склерозирующий холангит, периаортит, периартериит, перивенозный энцефаломиелит, периферическая невропатия, периферический увеит, пернициозная анемия, подострый бактериальный эндокардит, полимиозит, полиневропатия с органомегалией (poems синдром), поперечный миелит, постинфарктный синдром, посттравматический перикардит, псориаз, псориатический артрит, пузырчатка, пурпура Шенлейна-Геноха, реакция отторжения трансплантата в следствие антител к HLA, реактивный артрит, ревматическая лихорадка, ревматическая полимиалгия, ревматоидный артрит, рефлекторная симпатическая дистрофия, рефрактерная эпилепсия, рецидивирующий полихондрит, саркоидоз, синдром Гийена-Барре, синдром Кавасаки, синдром Когана, синдром Микулича, синдром Стиффа-Персона, синдром Шегрена, синдром Эванса, системная красная волчанка, склеродермия системная, склеродермия ограниченная, тиреоидит Риделя, тиреоидит Хашимото, тиреоидная офтальмопатия, тиреоидный криз, тромботическая тромбоцитопеническая пурпура, узелковый полиартериит, фетальная и неонатальная аллоиммунная тромбоцитопения, фиброзирующий альвеолит, В-клеточная неходжкинская лимфома, В-клеточный хронический лимфоцитарный лейкоз, холодовая гемагглютининовая болезнь, хорея Сиденхема (малая или ревматическая хорея), хроническая болезнь Лайма, хроническая воспалительная димиелинизируюшая полиневропатия, хронический рецидивирующий мультифокальный остеомиелит, хронический склерозирующий сиалоаденит (воспалительная опухоль Кюттнера), целиакия, эндометриоз, энцефалит, энцефалопатия, ассоциированные с аутоантителами, энцефалит Хашимото, эозинофильный фасциит, эссенциальная смешанная криоглобулинемия, ювенильный диабет, ювенильный ревматоидный артрит.
В некоторых вариантах осуществления изобретения рассеянный склероз представляет собой ремитирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз, первично-прогрессирующий рассеянный склероз, рассеянный склероз с обострениями, высокоактивный рассеянный склероз, агрессивный рассеянный склероз, злокачественный рассеянный склероз (болезнь Марбурга), диффузный миелинокластический склероз Шильдера, миелокортикальный рассеянный склероз, клинически изолированный синдром.
В некоторых вариантах осуществления изобретения субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
В одном из аспектов настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного CD20, включающему введение описанной выше фармацевтической композиции нуждающемуся в этом субъекту в терапевтически эффективном количестве.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов введения описанной выше фармацевтической композиции.
В некоторых вариантах осуществления изобретения первая доза анти-CD20 антитела 125 мг или 500 мг может быть введена субъекту в два этапа с 14-дневным интервалом в дозе 62,5 мг или 250 мг (то есть в 1-й день субъекту выполняется введение анти-CD20 антитела в дозе 62,5 мг или 250 мг, на 15-й день также выполняется введение анти-CD20 антитела аналогичными дозами 62,5 мг или 250,0 мг). Анти-CD20 антитело водится в виде описанной выше фармацевтической композиции.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг и второе введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 125 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 250 мг и второе введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 250 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе анти-CD20 антитела 500 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения анти-CD20 антитело представляет собой дивозилимаб.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 125 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 500 мг.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция дивозилимаба вводится каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 125 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения описанная выше фармацевтическая композиция вводится в дозе дивозилимаба 500 мг каждые 24 недели.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов введения описанной выше фармацевтической композиции дивозилимаба.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе дивозилимаба 62,5 мг и второе введение описанной выше фармацевтической композиции в дозе дивозилимаба 62,5 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе дивозилимаба 125 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения способ лечения заболевания или нарушения, опосредованного CD20, включает как минимум 5 циклов, где 1-й цикл включает первое введение описанной выше фармацевтической композиции в дозе дивозилимаба 250 мг и второе введение описанной выше фармацевтической композиции в дозе дивозилимаба 250 мг через 2 недели после первого введения, следующие циклы включают введение описанной выше фармацевтической композиции в дозе дивозилимаба 500 мг каждые 24 недели после первого введения.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредованное CD20, выбрано из группы:
(i) онкологическое заболевание или нарушение или
(ii) аутоиммунное заболевание или нарушение.
В некоторых вариантах осуществления изобретения онкологическое заболевание или нарушение выбрано из группы: В-клеточная лимфома, лейкоз.
В некоторых вариантах осуществления изобретения В-клеточная лимфома представляет собой неходжкинскую лимфому, лимфому Ходжкина.
В некоторых вариантах осуществления изобретения лейкоз выбран из группы: хронический лимфоцитарный лейкоз, мелкоклеточная лимфоцитарная лимфома.
В некоторых вариантах осуществления изобретения аутоиммунное заболевание или нарушение выбрано из группы: рассеянный склероз, аксональная невропатия, АНЦА васкулиты, IgG4-связанная болезнь, амилоидов, аксиальный спондилоартрит, антифосфолипидный синдром, артериит Такаясу, аутоиммунная апластическая анемия, аутоиммунная болезнь внутреннего уха, аутоиммунная гемолитическая анемия, аутоиммунная гиперлипидемия, аутоиммунная дизавтономия, аутоиммунная крапивница, аутоиммунная невромиотония (синдром Исаакса), аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия с тепловыми антителами, аутоиммунное поражение тестикул, аутоиммунный ангионевротический отек, аутоиммунный гепатит, аутоиммунный диабет, аутоиммунный иммунодефицит, аутоиммунный перикардит, аутоиммунный тиреоидит, аутоиммунный прогестероновый дерматит, болезнь Аддисона, болезнь Бехчета, болезнь Грейвса (диффузный токсический зоб), заболевания спектра оптиконевромиелита (болезнь Девика), болезнь Кастлемана, болезнь Крона, болезнь Ормонда (ретроперитонеальный фиброз), болезнь Рейно, болезнь Чарга Стросса, буллезный пемфигоид, буллезный эпидермолиз, васкулит, васкулит почек, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, везикулобуллезный дерматоз, гигантоклеточный артериит, витилиго, волчаночный нефрит, воспалительная аневризма аорты, воспалительные заболевания кишечника, врожденная блокада сердца, вульгарный пемфигус, герпетиформный дерматит, гестационный пемфигоид, гипогаммаглобулинемия, гломерулонефрит, гранулематоз с полиангиитом (синдром Вегенера), дерматомиозит, дилатационная кардиомиопатия, демиелинизирующая невропатия, дискоидная красная волчанка, идиопатическая возвратная макрогематурия (IgA нефропатия), идиопатическая воспалительная миопатия, идиопатический воспалительный псевдотумор, идиопатическая тромбоцитопеническая пурпура, идиопатический гипокомплементемический тубулоинтерстициальный нефрит, идиопатический легочный фиброз, сахарный диабет, истинная красноклеточная аплазия, концентрический склероз Бало, красный плоский лишай, склероатрофический лишай, лейкоцитокластический васкулит, лимитированная склеродермия (CREST синдром), лимбический энцефалит, линейный IgA-зависимый буллезный дерматоз, листовидный пемфигус, макроглобулинемия Вальденстрема, медиастинальный фиброз, миастенический криз, миастенический синдром Ламберта-Итона, миастения гравис, микроскопический полиангиит, миозит, миокардит Коксаки, множественный склероз, мультифокальная моторная невропатия, мультифокальный фибросклероз, неврит зрительного нерва, недифференцированное заболевание соединительной ткани увеит, нейтропения, неспецифический язвенный колит, нефрит, ассоциированный с антителами к базальной мембраны канальцев и клубочков, опсоклонус, острая моторная аксональная невропатия, острый геморрагический лейкоэнцефалит, острый диссеминированный энцефаломиелит, палиндромный ревматизм, паранеопластическая мозжечковая дегенерация, паранеопластический синдром, парапротеинемическая полиневропатия, пароксизмальная ночная гемоглобинурия, пемфигоид конъюнктивы, пемфигоид слизистых оболочек, первичный билиарный цирроз, первичный склерозирующий холангит, периаортит, периартериит, перивенозный энцефаломиелит, периферическая невропатия, периферический увеит, пернициозная анемия, подострый бактериальный эндокардит, полимиозит, полиневропатия с органомегалией (poems синдром), поперечный миелит, постинфарктный синдром, посттравматический перикардит, псориаз, псориатический артрит, пузырчатка, пурпура Шенлейна-Геноха, реакция отторжения трансплантата в следствие антител к HLA, реактивный артрит, ревматическая лихорадка, ревматическая полимиалгия, ревматоидный артрит, рефлекторная симпатическая дистрофия, рефрактерная эпилепсия, рецидивирующий полихондрит, саркоидоз, синдром Гийена-Барре, синдром Кавасаки, синдром Когана, синдром Микулича, синдром Стиффа-Персона, синдром Шегрена, синдром Эванса, системная красная волчанка, склеродермия системная, склеродермия ограниченная, тиреоидит Риделя, тиреоидит Хашимото, тиреоидная офтальмопатия, тиреоидный криз, тромботическая тромбоцитопеническая пурпура, узелковый полиартериит, фетальная и неонатальная аллоиммунная тромбоцитопения, фиброзирующий альвеолит, В-клеточная неходжкинская лимфома, В-клеточный хронический лимфоцитарный лейкоз, холодовая гемагглютининовая болезнь, хорея Сиденхема (малая или ревматическая хорея), хроническая болезнь Лайма, хроническая воспалительная димиелинизируюшая полиневропатия, хронический рецидивирующий мультифокальный остеомиелит, хронический склерозирующий сиалоаденит (воспалительная опухоль Кюттнера), целиакия, эндометриоз, энцефалит, энцефалопатия, ассоциированные с аутоантителами, энцефалит Хашимото, эозинофильный фасциит, эссенциальная смешанная криоглобулинемия, ювенильный диабет, ювенильный ревматоидный артрит.
В некоторых вариантах осуществления изобретения рассеянный склероз представляет собой ремитирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз, первично-прогрессирующий рассеянный склероз, рассеянный склероз с обострениями, высокоактивный рассеянный склероз, агрессивный рассеянный склероз, злокачественный рассеянный склероз (болезнь Марбурга), диффузный миелинокластический склероз Шильдера, миелокортикальный рассеянный склероз, клинически изолированный синдром.
Фармацевтические композиции можно вводить в виде одного терапевтического средства или в комбинации с дополнительными терапевтическими средствами по мере необходимости. Таким образом, в одном варианте осуществления предлагаемые способы лечения и/или профилактики используют в комбинации с введением терапевтически эффективного количества другого активного средства. Другое активное средство можно вводить до, в течение или после введения фармацевтических композиций по настоящему изобретению. Другое активное средство можно вводить как часть предлагаемой композиции или, альтернативно, в виде отдельного состава.
Осуществление изобретения
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации, включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Методики
1. Определение концентрации белка в исследуемых образцах.
Концентрацию белка определяли с помощью метода УФ-спектрофотометрии при длине волны 280 нм в планшетах для УФ-спектрофотометрии.
Каждый образец разводили соответствующим раствором вспомогательных веществ до концентрации ~ 0.5 мг/мл. В лунку планшета для УФ-спектрофотометрии помещали 150 мкл разведенного образца. Измеряли оптическую плотность помещенных в планшет растворов на планшетном спектрофотометре при длине волны 280 нм. В качестве раствора сравнения использовали соответствующий раствор вспомогательных веществ.
Концентрацию белка (С) в мг/мл рассчитывали по формуле:
С=А(280)*bε*lC=A280*bε*l,
А(280) - значение оптической плотности при длине волны 280 нм;
е - коэффициент экстинкции исследуемого белка;
b - суммарный коэффициент разведения образца;
l - толщина слоя в лунке планшета (для 150 мкл l=0.42 см, для планшета half-area 175 мкл=1 см).
2. Замена буферного раствора и концентрирование образцов. Диализ и концентрирование образцов проводили несколькими способами:
- в концентрационных ячейках Stirred Cell (Millipore) под давлением,
- в центрифужных пробирках Amicon с мембраной 10 кДа (Millipore),
- в диализных пробирках с мембраной 10 кДа на 2 мл или 0.5 мл (Thermo scientific).
Диализ проводили в течение 2-3 часов, после чего использованный буфер для диализа заменяли на новый, диализ продолжали дополнительно в течение нескольких часов при постоянном перемешивании на орбитальном шейкере (100 rpm) и комнатной температуре.
3. Определение коллоидной стабильности методом «шейк-тест».
Исследуемые образцы разделяли на 2 части по 200 мкл и помещали в стеклянные виалы, по 1 виале на каждый состав откладывали в холодильник на хранение при 2-8°С, остальные устанавливали в шейкер и шейкировали со скоростью 800 rpm при температуре 2-8°С в течение указанного времени. После окончания стресса пробирки убирали из шейкера и передавали на анализ.
4. Определение коллоидной стабильности методом криоконцентрирования.
Исследуемые образцы разделяли на 2 части и помещали в полимерные пробирки: по 1 пробирке на каждый состав откладывали в холодильник на хранение при 2-8°С, остальные устанавливали в морозильную камеру и хранили при температуре минус 16-20°С в течение указанного времени. После окончания стресса пробирки убирали из морозильной камеры, выдерживали при комнатной температуре до полного оттаивания содержимого, перемешивали растворы и передавали на анализ.
5. Определение термической стабильности методом «Термостресс».
Исследуемые образцы разделяли на 2 части и помещали в отдельные стеклянные виалы: по 1 виале на каждый состав откладывали в холодильник на хранение при 2-8°С, остальные устанавливали в термостат и инкубировали при необходимой температуре в течение указанного времени. После окончания прогрева виалы убирали из термостата, выдерживали при комнатной температуре около 15 мин и передавали на анализ.
6. Определение гомогенности и точки агрегации белка с помощью метода динамического светорассеяния (DLS).
Определение гомогенности исследуемых образцов осуществляли на приборе DynaPro Plate Reader II (Wyatt). Для этого 35 мкл раствора помещали в лунку 384-луночного планшета 384 LV/EB. После заполнения планшет заклеивали пленкой. Для удаления пузырьков воздуха из лунок после заполнения планшет на безворсовой салфетке центрифугировали в планшетном роторе в течение 3-5 минут, 3000 об/мин, при этом температура камеры центрифуги не должна быть ниже 20°С во избежание конденсации образца на пленке.
Температура измерения 25°С.
Выдерживание при температуре перед началом измерения 5 секунд.
Интенсивность рассеянного света при θ=158°.
Число измерений на один повтор 10.
Время одного измерения - 5 с.
Определение точки агрегации исследуемых белков осуществляли на приборе DynaPro Plate Reader II (Wyatt). Подготовку проб осуществляли по методике, описанной выше для определения гомогенности методом DLS.
Температурный диапазон нагрева - 40-85°С.
Скорость нагрева - 0.188°С/мин.
Число образцов в одном измерении - не более 16.
Интенсивность рассеянного света - θ=158°.
Число измерений на один повтор - 3.
Время одного измерения - 5 с.
Строили температурный тренд с помощью ПО прибора, которое и автоматически рассчитывает точку агрегации белка (Onset temperature).
7. Определение чистоты образцов методом эксклюзионной (Э) высокоэффективной жидкостной хроматографии (ВЭЖХ).
Колонка Tosoh TSK-GelG3000SWXL 7.8 mm ID × 30 cm, cat. №08541.
Температура колонки: 25°C
Скорость потока подвижной фазы: 0.7 мл/мин.
Объем вкола: 10 мкл (концентрация образца 5 мг/мл. разведение - раствором вспомогательных веществ).
Для прочих концентраций объем вкола эквивалентен концентрации.
Концентрация образца: 5 мг/мл.
Длина волны детектора: 220 нм.
Продолжительность элюирования: 25 мин.
Подвижная фаза: Динатрия гидрофосфат б/в 7.1 мг/мл.
Натрия хлорид 17.54 мг/мл.
рН подвижной фазы доводили до 7.0 ортофосфорной кислотой.
8. Определение кислотно-щелочного профиля образцов на приборе Caliper LabChip GX II.Приготовление образцов.
Образцы разводили до концентрации 1 мг/мл. К 200 мкл полученного раствора вносили 2 мкл раствора карбоксипептидазы В (СрВ) с концентрацией 5 мг/мл. Перемешивали и инкубировали в течение 2 часов при температуре 37°С. Испытуемые образцы диализовали против трех смен воды в центрифужных пробирках Amicon Ultra и концентрировали до 2 мг/мл.
Приготовление рабочих растворов.
Рабочие растворы и планшет с анализируемыми образцами готовили в соответствии с методикой от производителя с использованием набора НТ Protein Charge Variant Labeling Kit.
Подготовка чипа.
Подготовку чипа и пробирки с буфером проводили по методике от производителя с использованием буферных растворов из набора Protein Charge Variant Buffer Kit.
Запуск анализа является стандартной операцией. Метод анализа Protein Charge Variant 68s.
9. Определение кислотно-щелочного профиля образцов методом ионно-обменной (ИО) ВЭЖХ.
Хроматографические условия:
Колонка: Pro РАСТМ WCX-10 Analytical (Dionex), 250×4 мм;
Предколонка: Pro Рас WCX-10G, 4×50 мм;
Подвижная фаза:
Раствор А 0,02 М 2-(N-морфолино)этансульфоновая кислота (МЭС), рН 6,0;
Раствор В 0,02 М МЭС, 0,4 М натрия хлорид, рН 6,0;
Скорость подвижной фазы: 0,7 мл/мин;
Температура колонки: 30°С;
Температура автосемплера: 5°С;
Детектор: УФ, 280 нм;
Объем вводимой пробы: 4 0 мкл.
10. РТМ in silico.
В структуре белков могут присутствовать определенные участки, склонные к химической деградации, например, ацетилированию, карбамилированию, метилированию, фосфорилированию, окислению и другим процессам. Типы химических модификаций определяются структурой аминокислот или их последовательностью в полипептидной цепи. Для прогнозирования склонности белков к указанным выше изменениям сайты РТМ и их количество могут быть исследованы in silico в первичной структуре белка.
11. Исследование стабильности.
Исследуемые образцы разделяли на несколько аликвот и помещали в отдельные стерильные стеклянные флаконы: по 1 флакону на каждую контрольную точку и устанавливали в термостат, инкубировали при 25°С/37°С в течение 6 месяцев/4 недель и (5±3)°С в течение 24 месяцев, периодически отбирая контрольные точки согласно плану.
При отборе контрольных точек и после завершения хранения флаконы перемещали из термостата или холодильника и передавали на анализ.
12. Определение чистоты методом гель-электрофореза в полиакриламидном геле (ПААГ) в редуцирующих и нередуцирующих условиях
Определение проводили методом вертикального электрофореза в полиакриламидном геле (ПААГ) в редуцирующих и нередуцирующих условиях (нагрузка 10 и 40 мкг) в присутствии натрия лаурилсульфата с последующей окраской геля красителем кислотным синим 83.
Определение проводили с использованием аппарата для электрофореза со следующими характеристиками: ширина геля не менее 13 см, высота (от нижнего края зубца гребенки) не менее 12 см, толщина 1 мм. Для формирования лунок в концентрирующем геле применяли гребенку с количеством зубцов не менее 20, размеры: ширина 4-6,5 мм, толщина 1 мм.
Субстанцию-раствор разводили водой до концентрации 2 мг/мл.
80 мкл полученного раствора смешивали с 80 мкл буферного раствора для нанесения образцов, содержащего 2-меркаптоэтанол (редуцирующие условия) или не содержащего 2-меркаптоэтанол (нередуцирующие условия). Полученные смеси инкубировали при 100°С в течение 1 мин. (образцы, не содержащие 2-меркаптоэтанол) или 3 мин. (образцы, содержащие 2-меркаптоэтанол), охлаждали до комнатной температуры, затем центрифугировали в течение 4-6 с, перемешивали (испытуемые растворы).
Электрофорез в редуцирующих условиях проводили в 12,5% ПААГ, в нередуцирующих условиях - в 8% ПААГ.
Нижнюю камеру аппарата для электрофореза заполняли электродным буферным раствором и вставляли в нее электрофоретическую ячейку с гелем. Верхний резервуар заполняли электродным буферным раствором, удаляли из лунок пузырьки воздуха.
Электрофорез в редуцирующих и нередуцирующих условиях проводили при комнатной температуре в режиме постоянного напряжения. При прохождении фронта красителя синего бромфенолового через концентрирующий гель напряжение составляет 100 В. После вхождения фронта красителя синего бромфенолового в нижний разделяющий гель на 5-7 мм напряжение увеличивали до 180 В. После продвижения красителя синего бромфенолового на 10 см от нижнего края концентрирующего геля напряжение отключают, отделяли гель от стекол ячейки.
После проведения электрофореза в нередуцирующих условиях гель инкубировали в фиксирующем растворе в течение 16-18 ч. Затем раствор сливали, заливали окрашивающий раствор и инкубировали на орбитальном шейкере при 50 об/мин. в течение 1 ч. Затем окрашивающий раствор сливали, отмывочный раствор нагревали до температуры 40-50°С, заливали гель и помещали на орбитальный шейкер при 50 об./мин. на 30 мин. Процедуру отмывки повторяли до четкой визуализации полос в треке раствора для оценки чувствительности. Окрашенный гель сканировали.
Количество основных диффузных полос, наблюдаемых в геле после электрофореза в редуцирующих и нередуцирующих условиях, определяли по трекам растворов, содержащих 10 мкг белка.
Чистоту субстанции оценивали по трекам растворов, содержащих 40 мкг белка в буферном растворе для нанесения образца, содержащем или не содержащем 2-меркаптоэтанол, при помощи программы GelPro.
Примеры
Примеры, описанные ниже, приведены для анти-CD20 антитела дивозилимаба.
Пример 1.
На критические показатели кислотно-щелочного профиля и содержания агрегатов влияет состав вспомогательных веществ. В данном примере рассматривается влияние стабилизаторов и осмотических агентов на исследуемые показатели качества.
Для исследования использовали осмотические агенты в концентрациях, обеспечивающих осмотическое давление тока крови: 270-330 мОсм. В скрининг были взяты следующие вспомогательные вещества: натрия ацетат тригидрат (буферный агент, поддержание необходимого уровня рН), уксусная кислота леденая (поддержание необходимого уровня рН), D-трегалоза дигидрат (стабилизатор, осмолитик), D-сорбитол (стабилизатор, осмолитик), D-маннитол (стабилизатор, осмолитик), L-пролин (стабилизатор, осмолитик).
Составы вспомогательных веществ исследуемых фармацевтических композиций представлены в таблице 1.
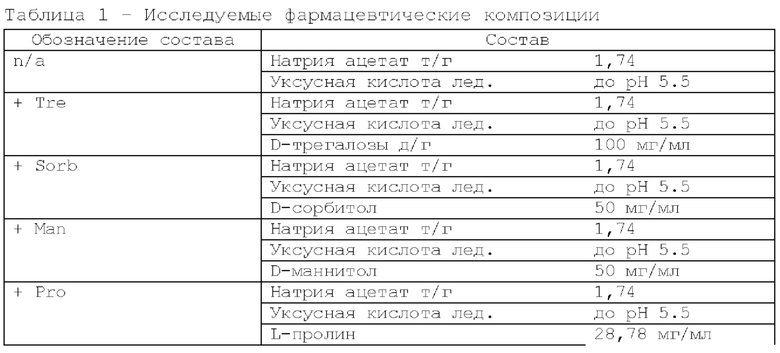
Исследование проводили для образцов, содержащих 5 мг/мл дивозилимаба. Образцы с различным составом вспомогательных веществ получали методом диафильтрации в соответствии с методикой 2. Для выявления влияния различных вспомогательных веществ образцы в исследуемых составах подвергали стрессовым воздействиям в соответствии с методиками 3, 4, 5. Образцы до и после стрессирования анализировали в соответствии с методиками 6, 7, 8. Результаты представлены в таблицах 2, 3 и 4.
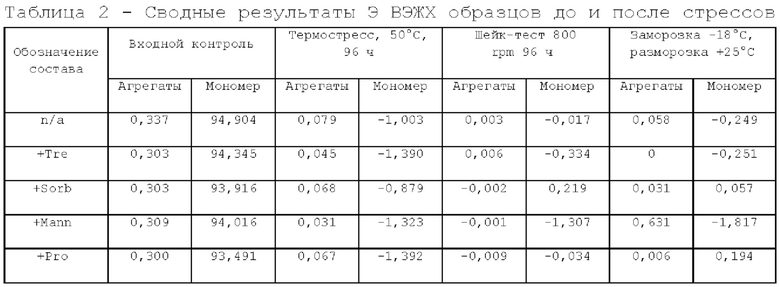
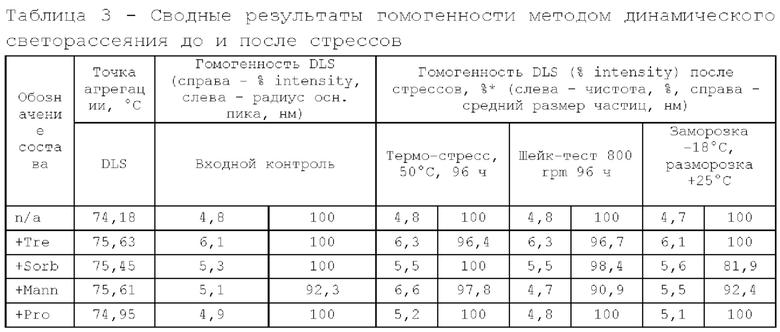
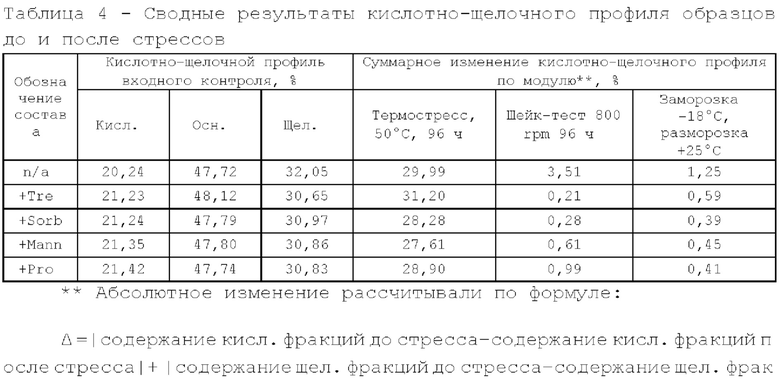
По результатам Э ВЭЖХ, наименьший прирост агрегатов после проведения термостресса и шейк-теста имеют образцы с добавлением сорбитола. Состав, содержащий трегалозы дигидрат в качестве осмотического агента, имеет самое высокое изменение в кислотно-щелочном профиле и уменьшение содержания мономера после термостресса и не рекомендован к дальнейшей разработке.
По результатам динамического светорассеяния и значению точки агрегации все образцы имеют высокую термическую стабильность. Также можно заметить, что при добавлении осмотического агента термостабильность белка в растворе увеличивается (для первого образца, который не содержит осмотический агент, значение точки агрегации самое низкое в группе). При сравнении гидродинамического радиуса у составов, содержащих сорбитол, прослеживается тенденция к большей компактизации белковой глобулы.
Для выбора оптимального стабилизатора была использована методика прогнозирования РТМ in silico, описанная в методике 10. По результатам анализа первичной аминокислотной последовательности потенциально деградация белка может проходить по пути дезаимидирования боковых групп некоторых аминокислот (например, аспарагина и глутамина) и процессов окисления метионина. На фигуре 1 показано количество потенциальных сайтов химической деградации для легкой и тяжелой цепей.
Легкая цепь содержит потенциально два сайта изомеризации и один сайт дезамидирования. Тяжелая цепь содержит один сайт гидролиза и гликозилирования, три сайта изомеризации, шесть сайтов дезамидирования и семь сайтов окисления.
По результатам анализа первичной белковой последовательности дивозилиимаба потенциально деградация белка может проходить по пути дезаимидирования боковых групп некоторых аминокислот (например, аспарагина и глутамина) и процессов окисления метионина.
В качестве стабилизатора, препятствующего процессам окисления, предложен L-метионин. Это вспомогательное вещество в составе фармацевтической композиции действует как стабилизатор, поглотитель растворенного кислорода и поглотитель свободных радикалов. Конкурирует с чувствительными к окислению участками молекулы за окислительные агенты.
Для выбора стабилизатора в составе фармацевтической композиции в скрининг были взяты L-метионин в различных концентрациях и полисорбат 80.
Составы вспомогательных веществ исследуемых фармацевтических композиций представлены в таблице 5.
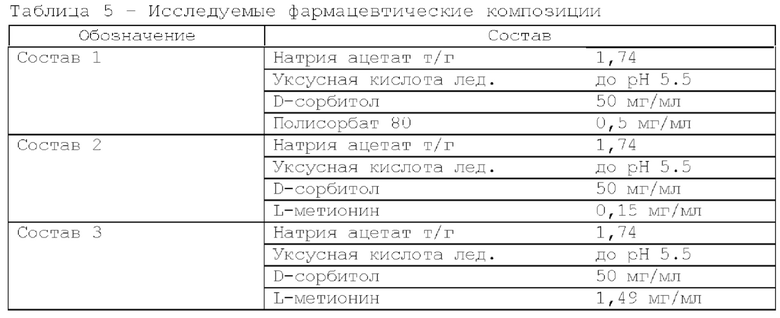
Исследование проводили для образцов, содержащих 25 мг/мл дивозилимаба. Образцы с различным составом вспомогательных веществ получали методом диафильтрации в соответствии с методикой 2. Для выявления влияния различных вспомогательных веществ образцы в исследуемых составах хранили в соответствии с методикой 11 при температурах 37°С, 25°С и (2-8)°С в течение 5 недель, 6 месяцев и 24 месяцев соответственно. Образцы до и после стрессирования анализировали в соответствии с методиками 7 и 9. Результаты представлены в таблицах 6, 7 и 8.
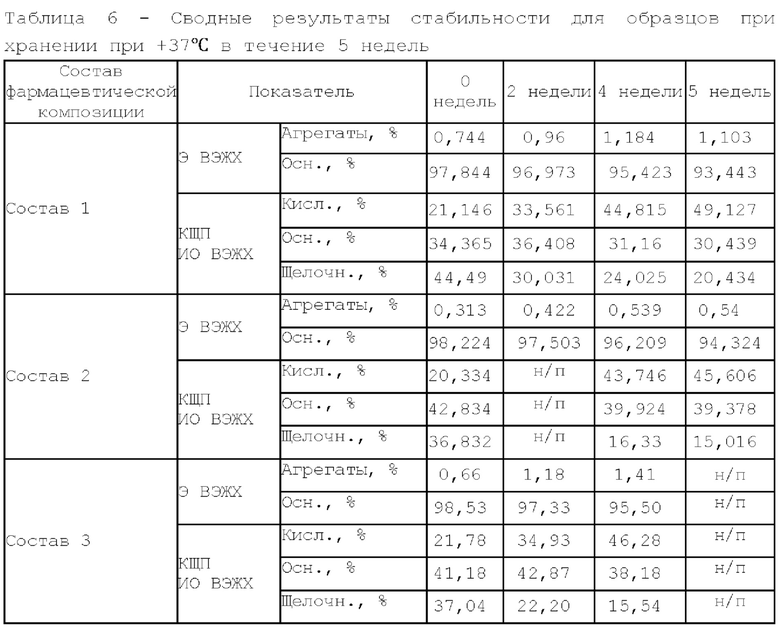
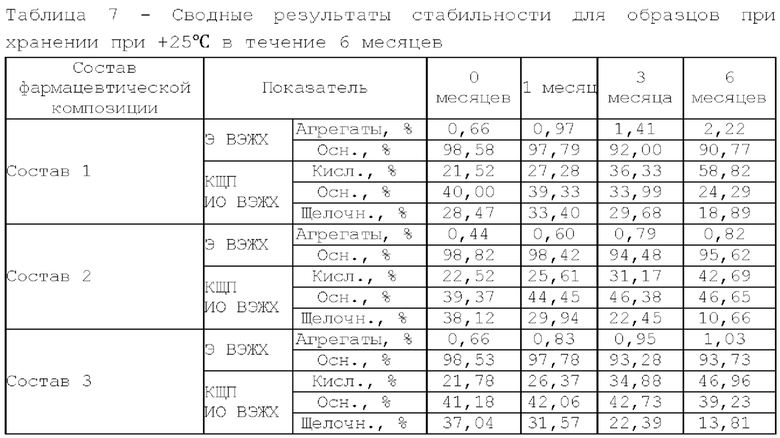
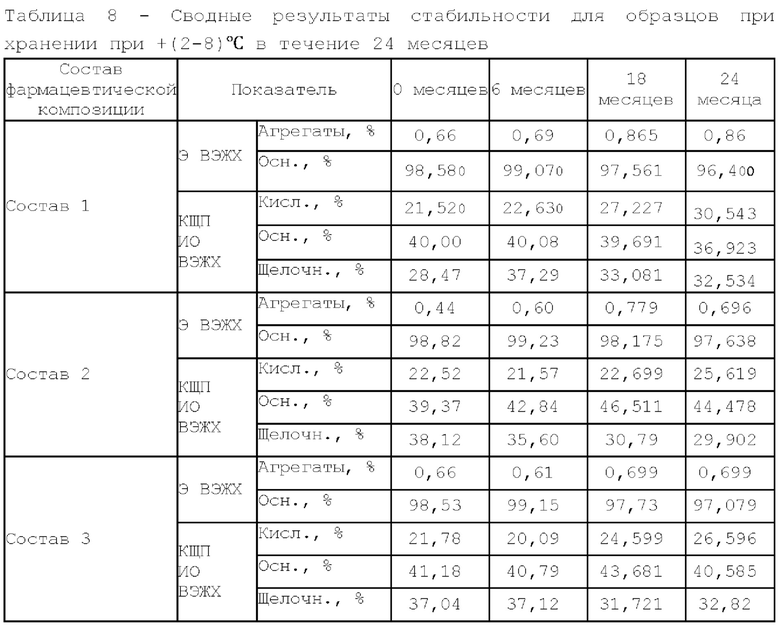
Зависимости содержания мономера по методу Э ВЭЖХ и кислых фракций по методу ИО ВЭЖХ для всех температурных режимов приведены на фигурах 2, 3, 4, 5, 6 и 7.
Препарат в составе 2 имеет меньшее падение содержания мономера по методу Э ВЭЖХ и меньший прирост кислых фракций при всех температурных режимах в ходе хранения.
Пример 2.
Для выбранного состава вспомогательных веществ было проведено хранение согласно методике 11 для температурных режимов 25°С, 37°С и (2-8)°С в течение 5 недель, 6 месяцев и 24 месяца соответственно с концентрацией дивозилимаба 25 мг/мл и 50 мг/мл.

Результаты стабильности получены согласно методикам 1, 7, 9, 12 и представлены в таблицах 9, 10 и 11 для концентрации дивозилимаба 25 мг/мл и 50 мг/мл.
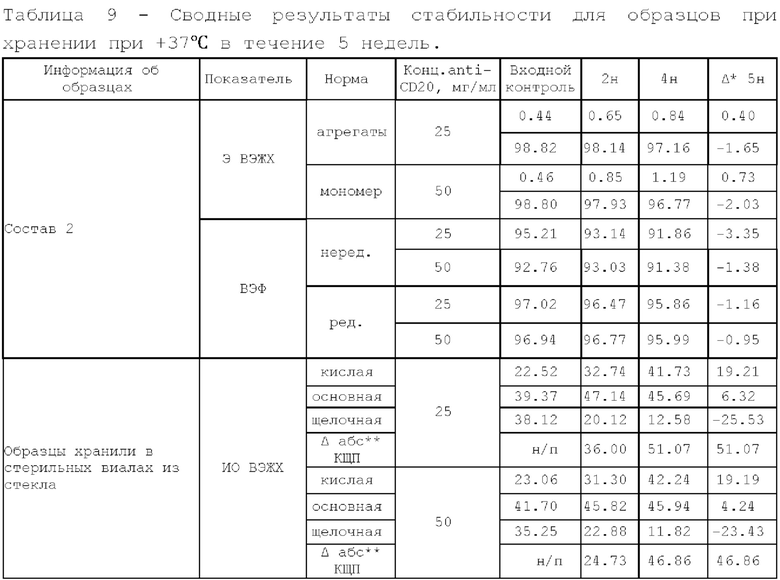
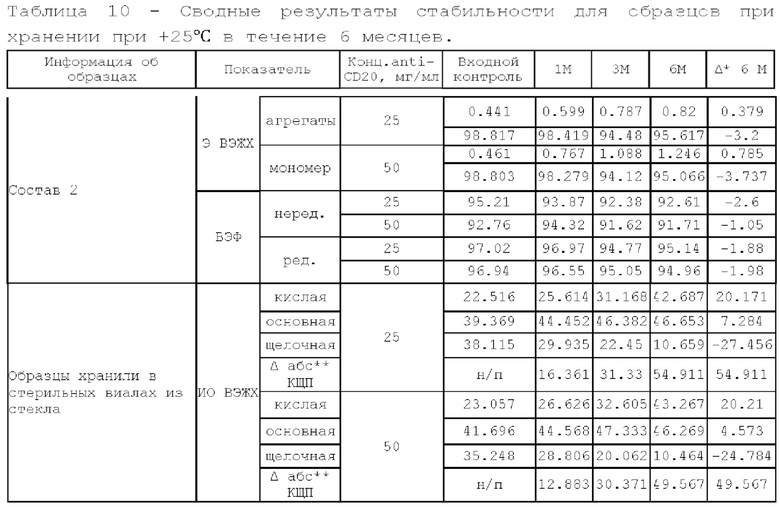
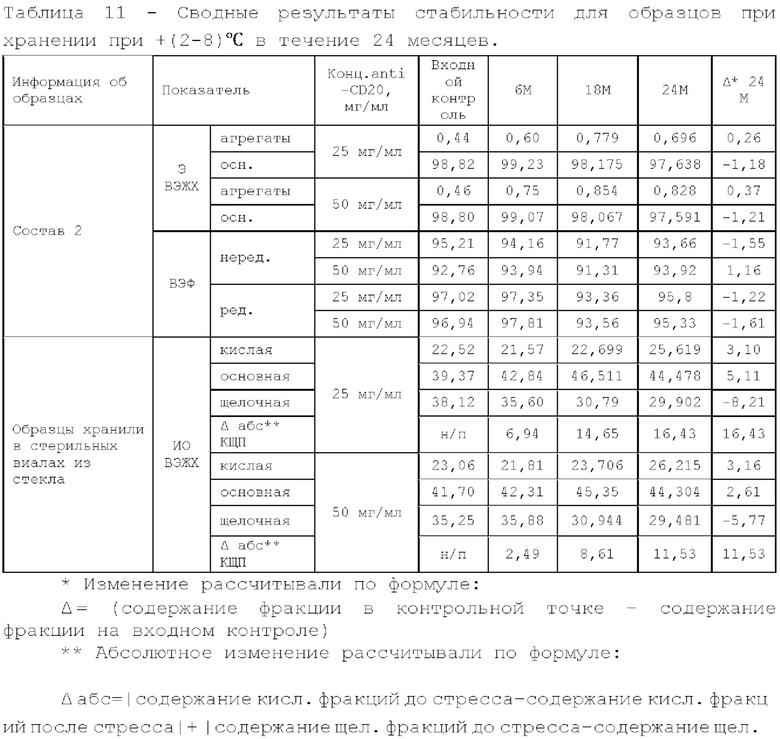

Данные стабильности для образцов с концентрациями дивозилимаба 25 мг/мл и 50 мг/мл сопоставимы.
Пример 3. Применение дивозилимаба для терапии пациентов с рассеянным склерозом с обострениями, исследование II фазы, исследование эффективности и безопасности BCD-132-2.
Дизайн исследования
Исследование №BCD-132-2 по своему дизайну представляло собой международное многоцентровое рандомизированное двойное слепое двойное маскированное плацебо-контролируемое исследование с использованием активного препарата сравнения (терифлуномид).
В рамках исследования №BCD-132-2 оценка эффективности препарата дивозилимаба (BCD-132) в лечении пациентов с рассеянным склерозом с обострениями проводилась на основании показателей МРТ головного мозга, а также клинических показателей, связанных с обострениями и уровнем инвалидизации после введения препарата дивозилимаба в дозе 125 и 500 мг в сравнении с препаратом терифлуномид и в сравнении с плацебо. В исследование включались пациенты с диагнозом рассеянного склероза (в соответствии с критериями диагностики рассеянного склероза, МакДональд, модификация 2017 г. ), типом течения - рассеянный склероз с обострениями и уровнем инвалидизации по шкале EDSS не выше 5,5 баллов.
После стратификации пациенты были рандомизированы в исследование в группы дивозилимаб 125 мг, дивозилимаб 500 мг, Терифлуномид и Плацебо в соотношении 2:2:2:1 соответственно. Всего 319 субъектов было включено в исследование на этапе скрининга, при этом 271 участник был рандомизирован в исследование. В рамках основного период исследования - 24 недели терапии (1 цикл терапии) пациенты групп исследуемого препарата получали препарат дивозилимаба в соответствующих дозировках (одна группа в дозе 125 мг и вторая - 500 мг) в виде внутривенной инфузии. При этом первую предустановленную дозу в рамках первого цикла (125 или 500 мг) пациенты получали в виде двух внутривенных инфузий с 14-дневным интервалом (то есть в День 1 пациентам выполнялась внутривенная инфузия препаратом дивозилимаба в дозе 62,5 мг или 250 мг в зависимости от группы распределения, в День 15 также выполнялась инфузия аналогичными дозами). Также все пациенты, рандомизированные в одну из двух групп исследуемого препарата, с целью сохранения двойного слепого дизайна ежедневно однократно перорально принимали плацебо в таблетированной форме. Пациенты группы сравнения получали ежедневно препарат терифлуномид в дозе 14 мг перорально 1 раз в день. При этом также с целью сохранения двойного слепого дизайна пациентам группы препарата сравнения выполнялись внутривенные инфузии плацебо с частотой и режимом дозирования, аналогичными таковым для групп исследуемого препарата дивозилимаба. Пациентам группы плацебо выполнялись внутривенные инфузии плацебо с частотой и режимом дозирования, аналогичными таковым для групп исследуемого препарата дивозилимаба (то есть инфузии в Дни 1 и 15), также они ежедневно однократно перорально принимали плацебо в таблетированной форме.
Были получены и проанализированы данные 1 этапа исследования (24 недели терапии).
Сводная информация о клинической эффективности, полученная в ходе исследования №BCD-132-2.
Согласно полученным результатам доказано превосходство исследуемого препарата дивозилимаба в обеих дозах (125 мг и 500 мг) над плацебо и его неменьшая эффективность по сравнению с препаратом сравнения терифлуномид по первичной конечной точке, которая отражает активность демиелинизирующего процесса в головном мозге у пациентов с рассеянным склерозом с обострениями, и которая является наиболее достоверной величиной для оценки эффекта применяемой терапии в течение анализируемого периода (6 месяцев) согласно рекомендациям по исследованию препаратов для лечения рассеянного склероза ЕМА - «Общее количество T1 Gd+очагов (per scan), выявленное при выполнении МРТ головного мозга после 24 недель заслепленного применения препаратов дивозилимаба/терифлуномид/плацебо».
В основе исследования лежали две гипотезы: гипотеза превосходства исследуемого препарата над плацебо и гипотеза неменьшей эффективности между исследуемым препаратом BCD-132 и препаратом сравнения терифлуномид. Данные гипотезы были проверены для конечной точки эффективности - «Общее количество T1 Gd+ очагов (per scan), выявленное при выполнении МРТ головного мозга после 24 недель заслепленного применения препаратов BCD-132/терифлуномид/плацебо». Односторонний 97,5% доверительный интервал для разницы средних арифметических значений общего количества T1 Gd+ очагов per scan между группой препарата BCD-132, 125 мг и группой плацебо составил (-Inf; -0,6075], между группой BCD-132, 500 мг и плацебо (-Inf; -0,5974]. Полученные результаты в группах исследуемого препарата BCD-132 свидетельствуют о том, что, верхняя граница доверительного интервала в обеих группах не превышает предустановленную границу превосходства 0. Двусторонний 95% доверительный интервал для разницы средних арифметических значений общего количества T1 Gd+очагов per scan между группой препарата BCD-132, 125 мг и группой препарата сравнения терифлуномид составил [-0,6657; -0,1980], между группой BCD-132, 500 мг и группой терифлуномид [-0,6525; -0,1897]. Полученные результаты в группах исследуемого препарата BCD-132 свидетельствуют о том, что, верхняя граница доверительного интервала в обеих группах не превышает предустановленную границу неменьшей эффективности 0,9975 (δ=0,9975).
При сравнении средних арифметических значений общего количества T1 Gd+ очагов per scan между группами BCD-132, 125 мг и терифлуномид, а также BCD-132, 500 мг и терифлуномид наблюдалась статистически значимая разница (р=0,0004 - для сравнения группы BCD-132, 125 мг и терифлуномид, р=0,0005 - для сравнения групп BCD-132, 500 мг и терифлуномид, двусторонний t-критерий Стьюдента-Уэлча). Ввиду того, что рассчитанная верхняя граница доверительного интервала для обеих групп препарата BCD-132 не превышает предустановленную границу неменьшей эффективности 0,9975 (δ=0,9975), гипотеза неменьшей эффективности исследуемых групп над препаратом сравнения терифлуномид по первичной конечной точке доказана.
Это свидетельствует об эффективности проводимой терапии и достижении исследованием своей основной цели.
Динамическая оценка средних значений общего количества накапливающих гадолиний (Gd+) очагов в режиме Т1 (существуют два основных вида МРТ изображений: Т1-взвешенное и Т2-взвешенное. На Т1-взвешенном изображении фиксируется скорость возврата атомов из положения на боку в вертикальное положение. На Т2-взвешенном изображении время удержания атомов в положении на боку после кратковременного перпендикулярного импульса) показала уменьшение количества очагов в группах препарата дивозилимаб и терифлуномид: в группе терифлуномид динамика не была статистически значимой, в группах дивозилимаб статистически значимое уменьшение относительно скрининга было показано уже на 9 неделе.
Оценка комплексного показателя CUA (совокупное количество новых накапливающих контраст очагов на МРТ в Т1 режиме и новых очагов в Т2-режиме или случаев увеличения очагов в Т2-режиме, без двойного сложения) с помощью анализа per scan показала, что средние значения за оцениваемый период были статистически значимо ниже в группах препарата дивозилимаб по сравнению с группами терифлуномид и плацебо (р<0,05). Динамическое наблюдение CUA показало достоверное уменьшение средних значений показателя в обеих группах препарата дивозилимаб (р<0,05; непараметрический тест Вилкоксона с поправкой Беньямини-Йекутили). В группах терифлуномид и плацебо значимой динамики не выявлено.
Сопоставимая картина в виде уменьшения активности демиелинизирующего процесса, наблюдалась и при оценке доли пациентов без очагов. У большинства пациентов в группах препарата дивозилимаба после 24 недель лечения отсутствовали очаги, накапливающие контраст в Т1-режиме (94,44% и 93,06%). Эти значения были статистически значимо выше, чем в группах терифлуномид и плацебо (68,06 и 56,36%) (р<0,05)).
Оценка других конечных точек, представленных показателями МРТ, показала статистически значимое уменьшение объема гипоинтенсивных очагов и количества новых/увеличившихся очагов в T2WI/FLAIR режимах за период 24 недель, в том числе при сравнении доли пациентов с новыми или увеличившимися очагами, в группах препарата дивозилимаба. Среднегодовая частота всех обострений (ARR) в исследуемых группах, рассчитанная с помощью пуассоновской регрессии, была ниже в группах терифлуномид и дивозилимаб (125 и 500). Показатель ARR со статистической значимостью был ниже в группе дивозилимаб 500 мг.
Положительную динамику состояния пациентов показала оценка по шкале EDSS (расширенная шкала инвалидизации), которая выявила статистически значимое снижение показателя после 1 цикла терапии в группе дивозилимаба 500 мг. Общая доля пациентов со стойким прогрессированием через 24 недели терапии составила 4,17% в группе Терифлуномид и в группе BCD-132, 125 мг, 1,39% в группе BCD-132, 500 мг и 7,27% в группе Плацебо (р=0,3999; точный тест Фишера). При оценке неврологического дефицита и когнитивных функций с использованием ряда других шкал и опросников (Тест оценки времени прохождения 7,62 метра - Timed 25-Foot walk, тест с 9-ю отверстиями - «9-НРТ», символьно-цифровой тест - SDMT) значимой отрицательной динамики в группах не отмечалось, также, как и при оценке качества жизни пациентов (SF-36, EQ-5D, MSQOL-54).
Основные результаты оценки эффективности после 24 недель терапии в рамках исследования BCD-132-2 представлены в таблице 12.
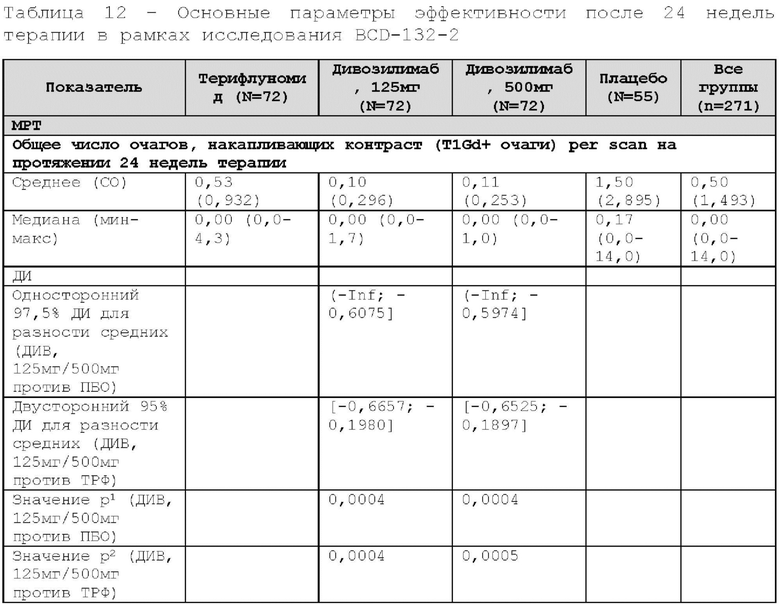
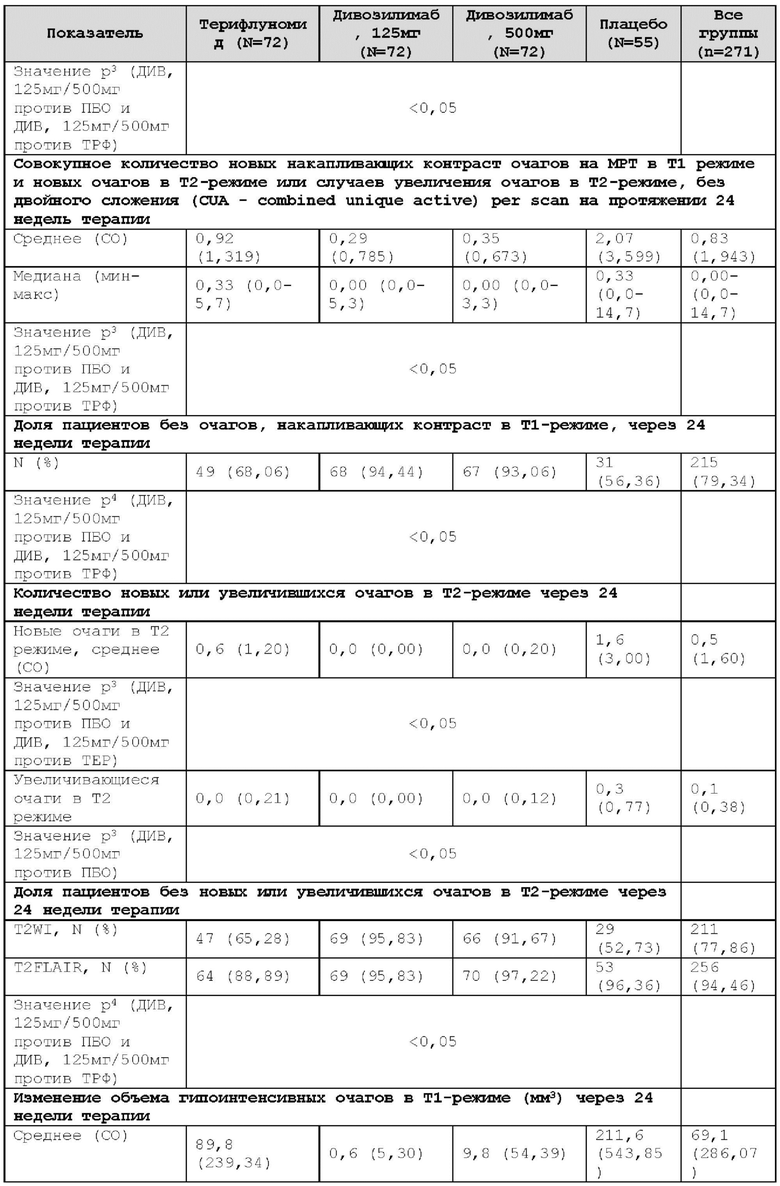
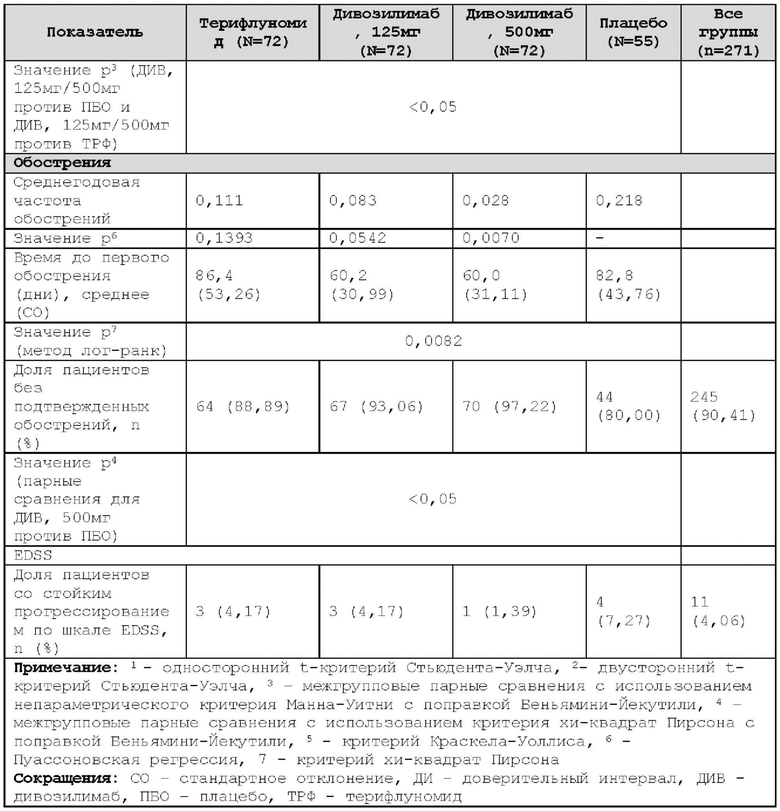
Доля пациентов без подтвержденных обострений представлена в таблице 13. В группах BCD-132 она составила 93,06% и 97,22% пациентов (125 мг и 500 мг, соответственно) к 24 неделе терапии. Всем пациентам с обострениями было проведено МРТ-исследование головного мозга с контрастированием до назначения глюкокортикостероидов (ГКС). В случае если по результатам проведенной МРТ отмечались очаги, накапливающие контраст в Т1-режиме, и отмечались новые и/или увеличившиеся очаги в T2-WI и Т2-FLAIR-режимах, то такое обострение учитывалось как МРТ-подтвержденное. Такие обострения отсутствовали в группах дивозилимаба к 24 неделе терапии, тогда как в группах терифлуномид и плацебо доля составила 5,56% и 7,27%, соответственно. Доля пациентов с ОННК (Оценочная независимая неврологическая комиссия) подтвержденными обострениями составила 6,94% и 1,39% в группах BCD-132 (125 мг и 500 мг, соответственно) в сравнении с 11,11% и 20,00% в группах ТФЛ и ПБО, соответственно.
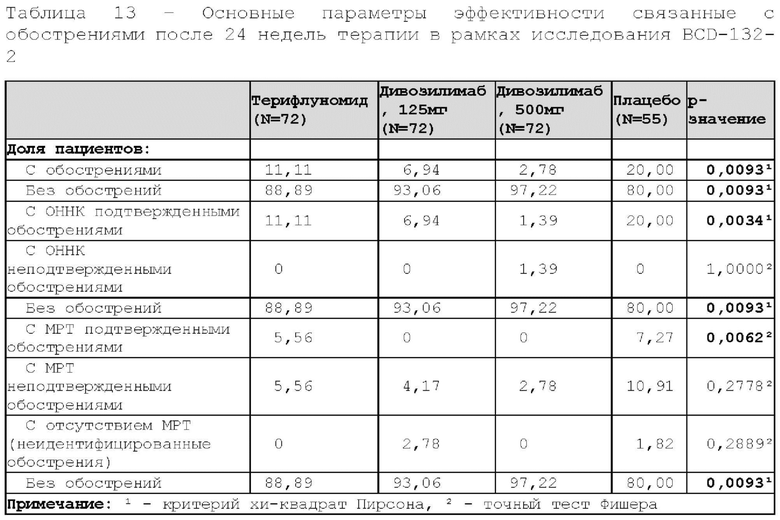
Оценка динамики отдельных ключевых параметров МРТ головного мозга и клинических показателей продемонстрировала положительный эффект от применяемой терапии в виде снижения активности демиелинизирующего процесса в головном мозге и уменьшения количества обострений у пациентов. Несколько более выраженный эффект наблюдался в группе большей дозировки исследуемого препарата дивозилимаба по сравнению с меньшей дозировкой при сопоставимых параметрах безопасности.
Полученные данные говорят об эффективности дивозилимаба при лечении пациентов с рассеянным склерозом с обострениями.
Сводная информация о клинической безопасности, полученная в ходе исследования №BCD-132-2.
На протяжении оцениваемого периода во всех исследуемых группах наблюдался приемлемый профиль безопасности. Проводимая терапия в целевой популяции больных с рассеянным склерозом с обострениями переносилась пациентами удовлетворительно. Анализ по конечным точкам безопасности не выявил статистически значимых различий. Среди НЯ, связанных с исследуемым внутривенным препаратом, по мнению исследователей, по органам и системам на протяжении анализируемого периода наиболее часто (более чем у 5% пациентов) регистрировались инфекции дыхательных путей, инфузионные реакции, отклонения в лабораторных и инструментальных данных (снижение числа нейтрофилов, снижение числа лимфоцитов, снижение числа лейкоцитов). Помимо них были зарегистрированы и такие инфекционные состояния как: инфекция, вызванная вирусом герпеса и оральный герпес, инфекция, обусловленная грибами рода Candida и энтеровирусная инфекция, инфекция мочевыводящих путей и цистит, пневмония.
Отклонения со стороны других органов и систем регистрировались менее, чем у 5% пациентов. Преимущественно, зарегистрированные НЯ имели легкую и умеренную степень (1-2 ст.тяжести). Статистически значимых различий между группами ни по одному из отклонений, связанных с исследуемым внутривенным препаратом, по мнению исследователей, не выявлено. НЯ 3-4 степени тяжести по СТСАЕ v. 5.0, связанные, по мнению исследователя, с внутривенным препаратом были представлены отклонениями лабораторных и инструментальных данных, нарушениями со стороны печени и желчевыводящих путей и нарушениями со стороны сосудов.
Вывод
Исследование проведено на репрезентативной, сбалансированной по основным демографическим параметрам и характеристикам заболевания популяции, приближенной к целевой популяции больных с рассеянным склерозом.
Полученные данные об эффективности, безопасности обосновывают применение препарата дивозилимаба в дозах 125 и 500 мг.
В рамках многоцентрового открытого исследования II фазы №BCD-132-2 в популяции пациентов с рассеянным склерозом был продемонстрирован значимый терапевтический эффект применения препарата дивозилимаб. С учетом полученных в рамках исследования показателей эффективности при удовлетворительном профиле безопасности применение препарата дивозилимаб отвечает балансу риска и пользы в данной популяции пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИ-TRBV9 АНТИТЕЛА И ЕЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2826886C1 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОα | 2016 |
|
RU2665966C2 |
| ВОДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛЕВИЛИМАБА И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2745814C1 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОа | 2017 |
|
RU2764521C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ УМЕНЬШЕНИЯ АГРЕГАЦИИ МАКРОМОЛЕКУЛ ПРИ ФИЗИОЛОГИЧЕСКИХ УСЛОВИЯХ | 2009 |
|
RU2563823C2 |
| ВОДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИ-IL17A АНТИТЕЛА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2754760C2 |
| ПРЕПАРАТ АНТИТЕЛА | 2008 |
|
RU2476238C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ПЕМБРОЛИЗУМАБА И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2791857C2 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С CD20 | 2018 |
|
RU2724469C2 |

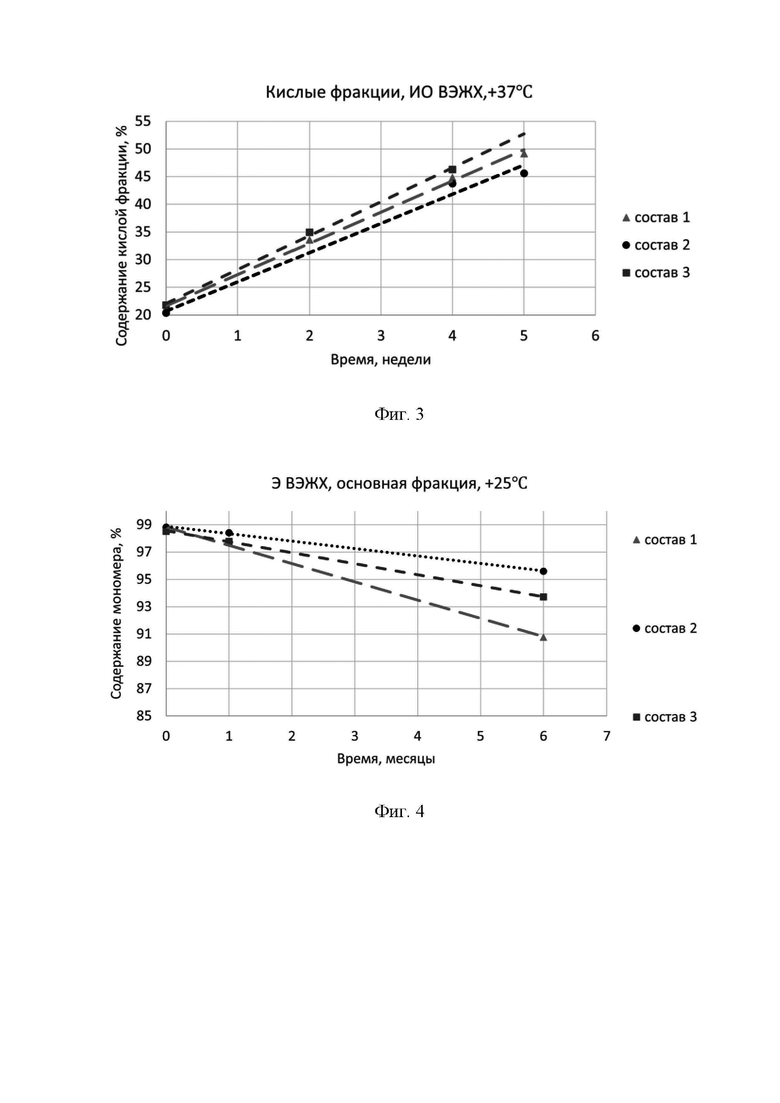
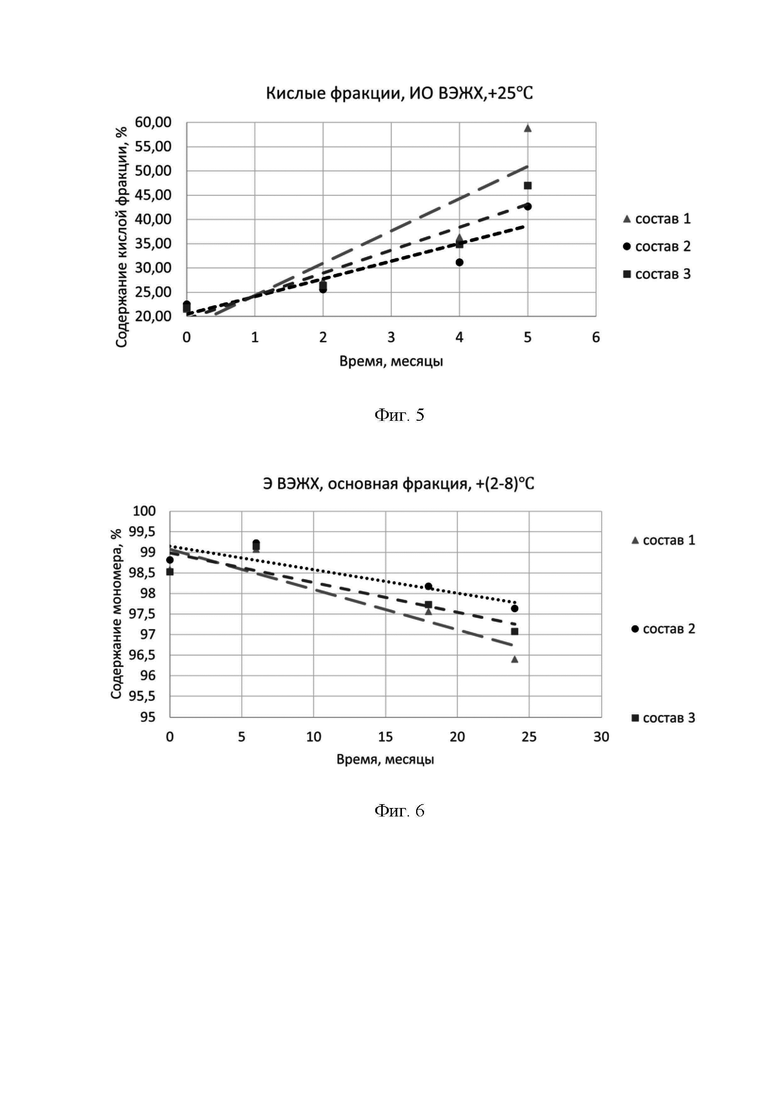
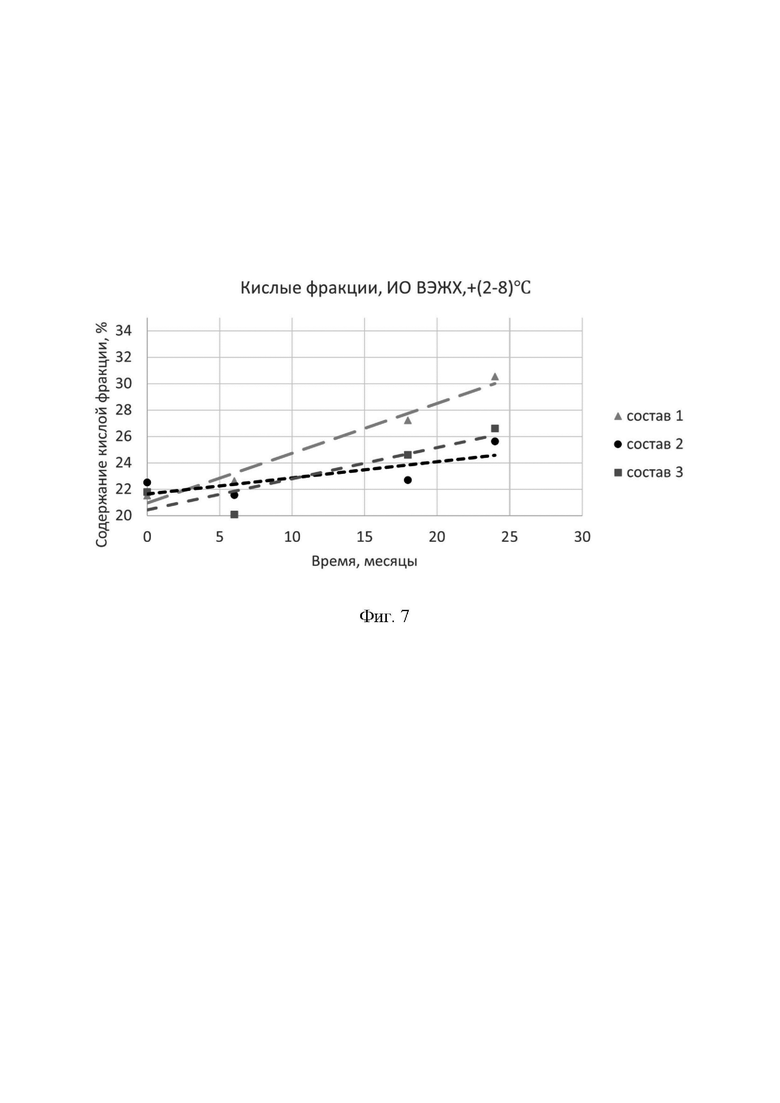
Группа изобретений относится к области фармацевтики и медицины. Первый объект представляет собой фармацевтическую композицию, содержащую анти-CD20 антитело, представляющее собой дивозилимаб, ацетатный буфер, сорбитол, метионин и воду для инъекций. Второй объект – применение фармацевтической композиции для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта. Третий объект – способ лечения заболевания или нарушения, опосредованного CD20, включающий введение фармацевтической композиции нуждающемуся в этом субъекту в терапевтически эффективном количестве. Технический результат заключается в стабильности при хранении фармацевтических композиций анти-CD20 антитела дивозилимаба, которые могут быть использованы в качестве лекарственного средства для лечения заболеваний или нарушений, опосредованных CD20. 3 н. и 50 з.п. ф-лы, 7 ил., 13 табл., 3 пр.
1. Фармацевтическая композиция анти-CD20 антитела, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл; и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций.
2. Фармацевтическая композиция по п. 1, где анти-CD20 антитело находится в концентрации 5,0-50,0 мг/мл.
3. Фармацевтическая композиция по п. 1, где анти-CD20 антитело находится в концентрации 10,0-40,0 мг/мл.
4. Фармацевтическая композиция по п. 1, где анти-CD20 антитело находится в концентрации 20,0-30,0 мг/мл.
5. Фармацевтическая композиция по п. 1, где анти-CD20 антитело находится в концентрации 25,0 мг/мл.
6. Фармацевтическая композиция по п. 1, где натрия ацетат содержится в концентрации 1,0-2,0 мг/мл.
7. Фармацевтическая композиция по п. 6, где натрия ацетат содержится в концентрации 1,5-2,0 мг/мл.
8. Фармацевтическая композиция по п. 6, где натрия ацетат содержится в концентрации 1,74 мг/мл.
9. Фармацевтическая композиция по п. 6, где натрия ацетат представляет собой натрия ацетата тригидрат.
10. Фармацевтическая композиция по п. 1, где уксусная кислота добавлена до рН 5,4-5,6.
11. Фармацевтическая композиция по п. 1, где уксусная кислота добавлена до рН 5,5.
12. Фармацевтическая композиция по п. 1, где уксусная кислота представляет собой уксусную кислоту ледяную.
13. Фармацевтическая композиция по п. 1, где сорбитол содержится в концентрации 45,0-55,0 мг/мл.
14. Фармацевтическая композиция по п. 1, где сорбитол содержится в концентрации 50,0 мг/мл.
15. Фармацевтическая композиция по п. 1, где метионин содержится в концентрации 0,10-0,20 мг/мл.
16. Фармацевтическая композиция по п. 1, где метионин содержится в концентрации 0,15 мг/мл.
17. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-6 0,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 0,5-3,0 мг/мл и
уксусной кислоты - до рН 5,0-6,0;
(iii) сорбитол - 40,0-60,0 мг/мл;
(iv) метионин - 0,05-0,30 мг/мл;
(v) воду для инъекций - до 1 мл.
18. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,0-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
19. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,5-2,0 мг/мл и
уксусной кислоты - до рН 5,4-5,6;
(iii) сорбитол - 45,0-55,0 мг/мл;
(iv) метионин - 0,10-0,20 мг/мл;
(v) воду для инъекций - до 1 мл.
20. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
21. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 1,5-60,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
22. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
23. Фармацевтическая композиция по п. 1, содержащая:
(i) дивозилимаб - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
24. Фармацевтическая композиция по п. 1, содержащая:
(i) анти-CD20 антитело, представляющее собой дивозилимаб, - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
25. Фармацевтическая композиция по п. 1, содержащая:
(i) дивозилимаб - 25,0 мг/мл;
(ii) ацетатный буфер, представляющий собой смесь
натрия ацетата тригидрат - 1,74 мг/мл и
уксусной кислоты - до рН 5,5;
(iii) сорбитол - 50,0 мг/мл;
(iv) метионин - 0,15 мг/мл;
(v) воду для инъекций - до 1 мл.
26. Применение фармацевтической композиции по любому из пп. 1-25 для лечения заболевания или нарушения, опосредованного CD20, у нуждающегося в этом субъекта, где заболевание или нарушение выбрано из группы:
(i) онкологическое заболевание или нарушение или
(ii) аутоиммунное заболевание или нарушение.
27. Применение по п. 26, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг.
28. Применение по п. 26, где фармацевтическая композиция вводится в дозе анти-СD20 антитела 500 мг.
29. Применение по п. 26, где фармацевтическая композиция вводится каждые 24 недели.
30. Применение по п. 26, где фармацевтическая композиция вводится в дозе анти-СD20 антитела 125 мг каждые 24 недели.
31. Применение по п. 26, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг каждые 24 недели.
32. Применение по п. 26, включающее как минимум 5 циклов введения фармацевтической композиции.
33. Применение по п. 26, включающее как минимум 5 циклов введения фармацевтической композиции, где 1-й цикл включает первое введение фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг и второе введение фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг через 2 недели после первого введения, следующие циклы включают введение фармацевтической композиции в дозе анти-CD20 антитела 125 мг каждые 24 недели после первого введения.
34. Применение по п. 26, включающее как минимум 5 циклов введения фармацевтической композиции, где 1-й цикл включает первое введение фармацевтической композиции в дозе анти-CD20 антитела 250 мг и второе введение фармацевтической композиции в дозе анти-CD20 антитела 250 мг через 2 недели после первого введения, следующие циклы включают введение фармацевтической композиции в дозе анти-CD20 антитела 500 мг каждые 24 недели после первого введения.
35. Применение по п. 26, где онкологическое заболевание или нарушение выбрано из группы: В-клеточная лимфома, лейкоз.
36. Применение по п. 35, где В-клеточная лимфома представляет собой неходжкинскую лимфому, лимфому Ходжкина.
37. Применение по п. 35, где лейкоз выбран из группы: хронический лимфоцитарный лейкоз, мелкоклеточная лимфоцитарная лимфома.
38. Применение по п. 26, где аутоиммунное заболевание или нарушение выбрано из группы: рассеянный склероз, аксональная невропатия, АНЦА васкулиты, IgG4-связанная болезнь, амилоидоз, аксиальный спондилоартрит, антифосфолипидный синдром, артериит Такаясу, аутоиммунная апластическая анемия, аутоиммунная болезнь внутреннего уха, аутоиммунная гемолитическая анемия, аутоиммунная гиперлипидемия, аутоиммунная дизавтономия, аутоиммунная крапивница, аутоиммунная невромиотония (синдром Исаакса), аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия с тепловыми антителами, аутоиммунное поражение тестикул, аутоиммунный ангионевротический отек, аутоиммунный гепатит, аутоиммунный диабет, аутоиммунный иммунодефицит, аутоиммунный перикардит, аутоиммунный тиреоидит, аутоиммунный прогестероновый дерматит, болезнь Аддисона, болезнь Бехчета, болезнь Грейвса (диффузный токсический зоб), заболевания спектра оптиконевромиелита (болезнь Девика), болезнь Кастлемана, болезнь Крона, болезнь Ормонда (ретроперитонеальный фиброз), болезнь Рейно, болезнь Чарга Стросса, буллезный пемфигоид, буллезный эпидермолиз, васкулит, васкулит почек, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, везикулобуллезный дерматоз, гигантоклеточный артериит, витилиго, волчаночный нефрит, воспалительная аневризма аорты, воспалительные заболевания кишечника, врожденная блокада сердца, вульгарный пемфигус, герпетиформный дерматит, гестационный пемфигоид, гипогаммаглобулинемия, гломерулонефрит, гранулематоз с полиангиитом (синдром Вегенера), дерматомиозит, дилатационная кардиомиопатия, демиелинизирующая невропатия, дискоидная красная волчанка, идиопатическая возвратная макрогематурия (IgA нефропатия), идиопатическая воспалительная миопатия, идиопатический воспалительный псевдотумор, идиопатическая тромбоцитопеническая пурпура, идиопатический гипокомплементемический тубулоинтерстициальный нефрит, идиопатический легочный фиброз, сахарный диабет, истинная красноклеточная аплазия, концентрический склероз Бало, красный плоский лишай, склероатрофический лишай, лейкоцитокластический васкулит, лимитированная склеродермия (CREST синдром), лимбический энцефалит, линейный IgA-зависимый буллезный дерматоз, листовидный пемфигус, макроглобулинемия Вальденстрема, медиастинальный фиброз, миастенический криз, миастенический синдром Ламберта-Итона, миастения гравис, микроскопический полиангиит, миозит, миокардит Коксаки, множественный склероз, мультифокальная моторная невропатия, мультифокальный фибросклероз, неврит зрительного нерва, недифференцированное заболевание соединительной ткани, увеит, нейтропения, неспецифический язвенный колит, нефрит, ассоциированный с антителами к базальной мембраны канальцев и клубочков, опсоклонус, острая моторная аксональная невропатия, острый геморрагический лейкоэнцефалит, острый диссеминированный энцефаломиелит, палиндромный ревматизм, паранеопластическая мозжечковая дегенерация, паранеопластический синдром, парапротеинемическая полиневропатия, пароксизмальная ночная гемоглобинурия, пемфигоид конъюнктивы, пемфигоид слизистых оболочек, первичный билиарный цирроз, первичный склерозирующий холангит, периаортит, периартериит, перивенозный энцефаломиелит, периферическая невропатия, периферический увеит, пернициозная анемия, подострый бактериальный эндокардит, полимиозит, полиневропатия с органомегалией (poems синдром), поперечный миелит, постинфарктный синдром, посттравматический перикардит, псориаз, псориатический артрит, пузырчатка, пурпура Шенлейна-Геноха, реакция отторжения трансплантата вследствие антител к HLA, реактивный артрит, ревматическая лихорадка, ревматическая полимиалгия, ревматоидный артрит, рефлекторная симпатическая дистрофия, рефрактерная эпилепсия, рецидивирующий полихондрит, саркоидоз, синдром Гийена-Барре, синдром Кавасаки, синдром Когана, синдром Микулича, синдром Стиффа-Персона, синдром Шегрена, синдром Эванса, системная красная волчанка, склеродермия системная, склеродермия ограниченная, тиреоидит Риделя, тиреоидит Хашимото, тиреоидная офтальмопатия, тиреоидный криз, тромботическая тромбоцитопеническая пурпура, узелковый полиартериит, фетальная и неонатальная аллоиммунная тромбоцитопения, фиброзирующий альвеолит, В-клеточная неходжкинская лимфома, В-клеточный хронический лимфоцитарный лейкоз, холодовая гемагглютининовая болезнь, хорея Сиденхема (малая или ревматическая хорея), хроническая болезнь Лайма, хроническая воспалительная димиелинизируюшая полиневропатия, хронический рецидивирующий мультифокальный остеомиелит, хронический склерозирующий сиалоаденит (воспалительная опухоль Кюттнера), целиакия, эндометриоз, энцефалит, энцефалопатия, ассоциированные с аутоантителами, энцефалит Хашимото, эозинофильный фасциит, эссенциальная смешанная криоглобулинемия, ювенильный диабет, ювенильный ревматоидный артрит.
39. Применение по п. 38, где рассеянный склероз представляет собой ремитирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз, первично-прогрессирующий рассеянный склероз, рассеянный склероз с обострениями, высокоактивный рассеянный склероз, агрессивный рассеянный склероз, злокачественный рассеянный склероз (болезнь Марбурга), диффузный миелинокластический склероз Шильдера, миелокортикальный рассеянный склероз, клинически изолированный синдром.
40. Способ лечения заболевания или нарушения, опосредованного CD20, включающий введение фармацевтической композиции по любому из пп. 1-25 нуждающемуся в этом субъекту в терапевтически эффективном количестве, где заболевание или нарушение, опосредованное CD20, выбрано из группы:
(i) онкологическое заболевание или нарушение или
(ii) аутоиммунное заболевание или нарушение.
41. Способ лечения заболевания или нарушения по п. 40, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг.
42. Способ лечения заболевания или нарушения по п. 40, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг.
43. Способ лечения заболевания или нарушения по п. 40, где фармацевтическая композиция вводится каждые 24 недели.
44. Способ лечения заболевания или нарушения по п. 40, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 125 мг каждые 24 недели.
45. Способ лечения заболевания или нарушения по п. 40, где фармацевтическая композиция вводится в дозе анти-CD20 антитела 500 мг каждые 24 недели.
46. Способ лечения заболевания или нарушения по п. 40, включающий как минимум 5 циклов введения фармацевтической композиции.
47. Способ лечения заболевания или нарушения по п. 40, включающий как минимум 5 циклов, где 1-й цикл включает первое введение фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг и второе введение фармацевтической композиции в дозе анти-CD20 антитела 62,5 мг через 2 недели после первого введения, следующие циклы включают введение фармацевтической композиции в дозе анти-CD20 антитела 125 мг каждые 24 недели после первого введения.
48. Способ лечения заболевания или нарушения по п. 40, включающий как минимум 5 циклов, где 1-й цикл включает первое введение фармацевтической композиции в дозе анти-CD20 антитела 250 мг и второе введение фармацевтической композиции в дозе анти-CD20 антитела 250 мг через 2 недели после первого введения, следующие циклы включают введение фармацевтической композиции в дозе анти-CD20 антитела 500 мг каждые 24 недели после первого введения.
49. Способ лечения заболевания или нарушения по п. 40, где онкологическое заболевание или нарушение выбрано из группы: В-клеточная лимфома, лейкоз.
50. Способ лечения заболевания или нарушения по п. 49, где В-клеточная лимфома представляет собой неходжкинскую лимфому, лимфому Ходжкина.
51. Способ лечения заболевания или нарушения по п. 49, где лейкоз выбран из группы: хронический лимфоцитарный лейкоз, мелкоклеточная лимфоцитарная лимфома.
52. Способ лечения заболевания или нарушения по п. 40, где аутоиммунное заболевание или нарушение выбрано из группы: рассеянный склероз, аксональная невропатия, АНЦА васкулиты, IgG4-связанная болезнь, амилоидоз, аксиальный спондилоартрит, антифосфолипидный синдром, артериит Такаясу, аутоиммунная апластическая анемия, аутоиммунная болезнь внутреннего уха, аутоиммунная гемолитическая анемия, аутоиммунная гиперлипидемия, аутоиммунная дизавтономия, аутоиммунная крапивница, аутоиммунная невромиотония (синдром Исаакса), аутоиммунная ретинопатия, аутоиммунная тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия с тепловыми антителами, аутоиммунное поражение тестикул, аутоиммунный ангионевротический отек, аутоиммунный гепатит, аутоиммунный диабет, аутоиммунный иммунодефицит, аутоиммунный перикардит, аутоиммунный тиреоидит, аутоиммунный прогестероновый дерматит, болезнь Аддисона, болезнь Бехчета, болезнь Грейвса (диффузный токсический зоб), заболевания спектра оптиконевромиелита (болезнь Девика), болезнь Кастлемана, болезнь Крона, болезнь Ормонда (ретроперитонеальный фиброз), болезнь Рейно, болезнь Чарга Стросса, буллезный пемфигоид, буллезный эпидермолиз, васкулит, васкулит почек, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, везикулобуллезный дерматоз, гигантоклеточный артериит, витилиго, волчаночный нефрит, воспалительная аневризма аорты, воспалительные заболевания кишечника, врожденная блокада сердца, вульгарный пемфигус, герпетиформный дерматит, гестационный пемфигоид, гипогаммаглобулинемия, гломерулонефрит, гранулематоз с полиангиитом (синдром Вегенера), дерматомиозит, дилатационная кардиомиопатия, демиелинизирующая невропатия, дискоидная красная волчанка, идиопатическая возвратная макрогематурия (IgA нефропатия), идиопатическая воспалительная миопатия, идиопатический воспалительный псевдотумор, идиопатическая тромбоцитопеническая пурпура, идиопатический гипокомплементемический тубулоинтерстициальный нефрит, идиопатический легочный фиброз, сахарный диабет, истинная красноклеточная аплазия, концентрический склероз Бало, красный плоский лишай, склероатрофический лишай, лейкоцитокластический васкулит, лимитированная склеродермия (CREST синдром), лимбический энцефалит, линейный IgA-зависимый буллезный дерматоз, листовидный пемфигус, макроглобулинемия Вальденстрема, медиастинальный фиброз, миастенический криз, миастенический синдром Ламберта-Итона, миастения гравис, микроскопический полиангиит, миозит, миокардит Коксаки, множественный склероз, мультифокальная моторная невропатия, мультифокальный фибросклероз, неврит зрительного нерва, недифференцированное заболевание соединительной ткани, увеит, нейтропения, неспецифический язвенный колит, нефрит, ассоциированный с антителами к базальной мембраны канальцев и клубочков, опсоклонус, острая моторная аксональная невропатия, острый геморрагический лейкоэнцефалит, острый диссеминированный энцефаломиелит, палиндромный ревматизм, паранеопластическая мозжечковая дегенерация, паранеопластический синдром, парапротеинемическая полиневропатия, пароксизмальная ночная гемоглобинурия, пемфигоид конъюнктивы, пемфигоид слизистых оболочек, первичный билиарный цирроз, первичный склерозирующий холангит, периаортит, периартериит, перивенозный энцефаломиелит, периферическая невропатия, периферический увеит, пернициозная анемия, подострый бактериальный эндокардит, полимиозит, полиневропатия с органомегалией (poems синдром), поперечный миелит, постинфарктный синдром, посттравматический перикардит, псориаз, псориатический артрит, пузырчатка, пурпура Шенлейна-Геноха, реакция отторжения трансплантата вследствие антител к HLA, реактивный артрит, ревматическая лихорадка, ревматическая полимиалгия, ревматоидный артрит, рефлекторная симпатическая дистрофия, рефрактерная эпилепсия, рецидивирующий полихондрит, саркоидоз, синдром Гийена-Барре, синдром Кавасаки, синдром Когана, синдром Микулича, синдром Стиффа-Персона, синдром Шегрена, синдром Эванса, системная красная волчанка, склеродермия системная, склеродермия ограниченная, тиреоидит Риделя, тиреоидит Хашимото, тиреоидная офтальмопатия, тиреоидный криз, тромботическая тромбоцитопеническая пурпура, узелковый полиартериит, фетальная и неонатальная аллоиммунная тромбоцитопения, фиброзирующий альвеолит, В-клеточная неходжкинская лимфома, В-клеточный хронический лимфоцитарный лейкоз, холодовая гемагглютининовая болезнь, хорея Сиденхема (малая или ревматическая хорея), хроническая болезнь Лайма, хроническая воспалительная димиелинизируюшая полиневропатия, хронический рецидивирующий мультифокальный остеомиелит, хронический склерозирующий сиалоаденит (воспалительная опухоль Кюттнера), целиакия, эндометриоз, энцефалит, энцефалопатия, ассоциированные с аутоантителами, энцефалит Хашимото, эозинофильный фасциит, эссенциальная смешанная криоглобулинемия, ювенильный диабет, ювенильный ревматоидный артрит.
53. Способ лечения заболевания или нарушения по п. 52, где рассеянный склероз представляет собой ремитирующий рассеянный склероз, вторично-прогрессирующий рассеянный склероз, первично-прогрессирующий рассеянный склероз, рассеянный склероз с обострениями, высокоактивный рассеянный склероз, агрессивный рассеянный склероз, злокачественный рассеянный склероз (болезнь Марбурга), диффузный миелинокластический склероз Шильдера, миелокортикальный рассеянный склероз, клинически изолированный синдром.
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, КОТОРОЕ СПЕЦИФИЧЕСКИ СВЯЗЫВАЕТСЯ С CD20 | 2018 |
|
RU2724469C2 |
| Привод к откидным створкам саморазгружающихся вагонов | 1932 |
|
SU31972A1 |
| НОВЫЙ СОСТАВ, СОДЕРЖАЩИЙ КОНЪЮГАТ ПЭГ И ИНТЕРФЕРОН-АЛЬФА-2БЕТА, ОБЛАДАЮЩИЙ СНИЖЕННОЙ БОЛЕЗНЕННОСТЬЮ ПРИ ВВЕДЕНИИ | 2014 |
|
RU2572800C1 |
| WO 2017079150 A1, 11.05.2017 | |||
| WO 2021068971 A1, 15.04.2021 | |||
| БОЙКО О | |||
| В | |||
| и др | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| C.C | |||
Авторы
Даты
2024-08-12—Публикация
2022-10-26—Подача