Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармации и медицины, а именно к фармацевтическим композициям анти-TRBV9 антитела, которые могут быть использованы для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9.
Уровень техники
Причиной возникновения аутоиммунных заболеваний являются аутореактивные Т-лимфоциты (Haroon N et al., Arthritis Rheum. 2013 Oct; 65 (10): 2645-54., Duarte J. et al., PloS One 2010 May 10; 5(5):e10558; Konig M. et al., Front Immunol 2016 Jan 25; 7:11). Важнейшую роль в появлении аутореактивных клонов Т-лимфоцитов играет взаимодействие антигенраспознающего Т-клеточного рецептора (TCR) с белками главного комплекса гистосовместимости (МНС, HLA), которые представляют на своей поверхности процессированные пептиды внутриклеточных белков или белков патогенных организмов. Ряд аутоиммунных заболеваний ассоциирован с наличием у человека определенного варианта гена HLA. Так, аллель HLA-B27 ассоциирован с анкилозирующим спондилитом, реактивным артритом и болезнью Крона. Риск развития аутоиммунных заболеваний у носителей определенных аллельных вариантов HLA может объясняться предпочтительной презентацией этими аллелями определенных пептидов, являющихся аутоантигенами, иммунный ответ против которых инициирует развитие аутоиммунного заболевания. Одним из возможных механизмов возникновения аутоиммунной реакции является презентация молекулами комплекса гистосовместимости пептидов из белков бактериального или вирусного происхождения, гомологичных собственным пептидам организма, что может приводить к возникновению иммунного ответа против собственных антигенов за счет кросс-реактивности.
Из уровня техники известно, что маркером, позволяющим идентифицировать клон Т-лимфоцитов, вовлеченный в патогенез аутоиммунного заболевания, является последовательность Т-клеточного рецептора (T-cell receptor, TCR). Субъединицы Т-клеточных рецепторов структурно относятся к суперсемейству иммуноглобулинов и формируются из нескольких генных сегментов. Вариабельные участки TCR образуют антигенсвязывающий центр TCR. Это означает, что они клоноспецифичны, т.е. отличаются у Т-лимфоцитов, реагирующих на разные антигены.
Т-лимфоциты (Т-клетки) стимулируются, когда антигены связываются с их Т-клеточными рецепторами (TCRs). TCR, определяющая структура Т-клеток, представляет собой трансмембранный гетеродимер, состоящий либо из альфа- и бета-цепей, либо из дельта- и гамма-цепей, соединенных дисульфидной связью. Внутри этих цепей находятся комплементарные детерминирующие регионы (CDRs), которые определяют антиген, с которым будет связываться TCR. Развитие TCR происходит через специфический для лимфоцитов процесс рекомбинации генов, который собирает конечную последовательность из большого числа потенциальных сегментов. Эта генетическая рекомбинация сегментов гена TCR в соматических Т-клетках происходит на ранних стадиях развития тимуса. Локус гена TCRa содержит переменные (V) и присоединяющиеся (J) сегменты гена (Va и Ja), тогда как локус TCRβ содержит сегмент гена D в дополнение к сегментам Vβ и Jβ. Соответственно, α-цепь генерируется в результате рекомбинации VJ, а β-цепь участвует в рекомбинации VDJ.
Локус гена цепи TCR а состоит из 4 6 переменных сегментов (TRAV), 8 присоединяющихся сегментов (TRAJ) и постоянной области. Локус гена цепи TCR β состоит из 48 переменных сегментов (TRBV), за которыми следуют два сегмента разнообразия (TRBD), 12 соединительных сегментов (TRBJ) и две постоянные области (Bio-Rad. Mini-review | An overview of T cell receptors [Electronic resource] // Bio-Rad. URL: https://www.bio-rad-antibodies.com/t-cell-receptor-minireview.html (accessed: 2 4.04.2020)).
В настоящее время накоплен значительный объем данных, свидетельствующих о том, что развитие HLA-B27-ассоциированных заболеваний обусловлено экспансией антигенспецифических клонов Т-лимфоцитов.
Описан консенсусный вариант аутоиммунных TCR при анкилозирующем спондилите (рентгенологический аксиальный спондилоартрит);
показано, что он представлен у больных анкилозирующим спондилитом в синовиальной жидкости и периферической крови и отсутствует при той же глубине анализа у здоровых доноров независимо от статуса по аллелю HLA*B27 (FahamM. et al., Arthritis Rheumatol. 2017; 69(4):774-784; Komech E et al. 12th EJI-EFIS Tatra Immunology Conference; 2016 Sep 3-7; Strbske Pleso, Slovakia. Abstract book p. 39). Указанные TCR относятся к TRBV9 семейству (согласно номенклатуре IMGT).
Показано, что Т-клеточные рецепторы, несущие бета цепи семейства TRBV9, вовлечены также в развитие такого аутоиммунного заболевания как целикиа (Petersen J et al., J Immunol. 2015; 194(12): 6112-22). Также они обнаруживаются на поверхности Т-клеток, подверженных маглинизации в случае Т-клеточных лимфом и Т-клеточных лейкемий, в том числе Т-клеточной лимфомы, вызванной вирусом Эпштейн-Барр (EBV) (Toyabe S et al., Clin Exp Immunol. 2003; 134(1): 92-97).
Учитывая вышесказанное, белок TRBV9 может служить мишенью для цитотоксического моноклонального антитела, которое будет индуцировать истощение TRBV9+ Т-лимфоцитов (TRBV9-положительных Т-лимфоцитов), включая патогенные аутореактивные клоны Т-лимфоцитов.
Из уровня техники известны моноклональные анти-TRBV9 антитела: WO2019/132738, W02020/139171, W02020/091635, W02020/139175. Также из уровня техники известна фармацевтическая композиция анти-ТИВУ9 антитела, включающая цитратный буфер (WO2020/139171). Однако, авторами данного изобретения было установлено, что анти-TRBV9 антитело в растворе цитратного буфера склонно к агрегации, следовательно композиция анти-TRBV9 антитела, включающая цитратный буфер, не будет стабильной.
В связи с вышесказанным, актуальным является разработка стабильных фармацевтических композиций анти-TRBV9 антитела, которые могут быть использованы в качестве лекарственного средства для лечения заболевания или нарушения, опосредованное Т-клеточным рецептором человека, несущим TRBV9.
Подробное описание изобретения
Определения
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Термин «антитело» или «иммуноглобулин» (Ig) включает полноразмерные антитела или любой антигенсвязывающий фрагмент (т.е. «антигенсвязывающую часть») или его отдельные цепи. Термин «антитело» в рамках данного изобретения используется в самом широком смысле и может охватывать, но не ограничиваясь, в частности, моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, гуманизированные, полностью человеческие антитела и химерные антитела.
Полноразмерное антитело относится к гликопротеину, содержащему по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в данном описании как VH) и константную область тяжелой цепи. Константная область является идентичной во всех антителах одного и того же изотипа, но отличается в антителах различного изотипа. Тяжелые цепи γ, α и δ содержат константную область, которая состоит из трех константных доменов CH1, СН2 и СН3 (выстроены в ряд) и шарнирной области, которая придает гибкость (Woof J., Burton D., Nat Rev Immunol 4, 2004, cc. 89-99). У млекопитающих известно только два типа легких цепей, которые обозначают как лямбда (λ) и каппа (κ). Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном описании как VL) и константной области легкой цепи. Примерная длина легкой цепи составляет 211-217 аминокислот. Предпочтительно легкая цепь представляет собой легкую лямбда (λ)-цепь, а константный домен CL предпочтительно представляет собой С-лямбда (λ).
Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), расположенные между областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями хозяина или факторами, включая различные клетки иммунной системы (например, эффекторными клетками), и первый компонент (C1q) классической системы комплемента.
Термин «антигенсвязывающая часть» антитела или «антигенсвязывающий фрагмент», как использовано в данном описании, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. В данном изобретении под «антигенсвязывающий фрагментом» подразумевается Fab-фрагмент, то есть одновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1, который связан с мономером Fc-фрагмента.
Термин «вариабельный» относится к тому факту, что определенные сегменты вариабельных доменов широко отличаются в последовательности среди антител. Домен V опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределяется на участке вариабельных доменов из 110 аминокислот. Напротив, V области состоят из инвариантных фрагментов, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими участками чрезвычайной вариабельности, называемых «гипервариабельными областями» или CDR. Каждый вариабельный домен нативных тяжелых и легких цепей содержит четыре FR, в основном принимающих конфигурацию бета-листов, связанных тремя гипервариабельными областями, которые образуют петли, связывающие, и в некоторых случаях являющиеся частью бета-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в тесной близости с помощью FR и с гипервариабельными областями другой цепи вносят вклад в образование антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest. 5 th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (АЗКЦ, ADCC).
Термин «гипервариабельная область» по данному описанию относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Обычно гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR», и/или такие остатки из «гипервариабельной петли».
«Kabat номенклатура» или «номенклатура по Kabat» применяются в данном изобретении к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем остальные аминокислотные остатки в вариабельных участках тяжелой и легкой цепи антитела (Kabat et al. Ann. N.Y. Acad. Sci., 190:382-93 (1971); Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991)).
Антитело по данному изобретению, «которое связывает» целевой антиген, представляет собой антитело, которое связывает антиген с достаточной аффинностью так, что антитело можно применять в качестве диагностического и/или терапевтического агента при нацеливании на белок или клетку или ткань, экспрессирующую антиген, и в незначительной степени перекрестно реагирует с другими белками. По данным аналитических методов: сортинга флуоресцентно-активированных клеток (FACS), радиоиммунопреципитации (RIA) или ИФА (ELISA), в таких вариантах изобретения степень связывания антитела с белком, не являющимся «мишенью» (с «нецелевым белком»), составляет менее 10% от связывания антитела с конкретным белком-мишенью. По отношению к связыванию антитела с молекулой-мишенью термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени означает связывание, которое заметно (измеримо) отличается от неспецифического взаимодействия.
Специфическое связывание можно определять количественно, например, определяя связывание молекулы по сравнению со связыванием контрольной молекулы. Например, специфическое связывание можно определять конкурентной реакцией с другой молекулой, аналогичной мишени, например, с избытком немеченой мишени. В этом случае специфическое связывание указывается, если связывание меченой мишени с зондом конкурентно ингибируется избытком немеченой мишени. В данном описании термин «специфическое связывание» или выражения «специфически связывается с» или «специфический к» конкретному полипептиду или эпитопу на конкретном полипептиде-мишени можно характеризовать на примере молекулы, имеющей KD (константу аффинности) к мишени по меньшей мере около 200 нМ, или же по меньшей мере около 150 нМ, или же по меньшей мере около 100 нМ, или же по меньшей мере около 60 нМ, или же по меньшей мере около 50 нМ, или же по меньшей мере около 4 0 нМ, или же по меньшей мере около 30 нМ, или же по меньшей мере около 2 0 нМ, или же по меньшей мере около 10 нМ, или же по меньшей мере около 8 нМ, или же по меньшей мере около 6 нМ, или же по меньшей мере около 4 нМ, или же по меньшей мере около 2 нМ, или же по меньшей мере около 1 нМ или выше. В одном варианте изобретения термин «специфическое связывание» относится к связыванию, при котором молекула связывается с конкретным полипептидом или эпитопом на конкретном полипептиде, практически не связываясь с каким-либо другим полипептидом или эпитопом на полипептиде.
Термин «моноклональное антитело» или «mAb» относится к антителу, которое синтезировано и выделено отдельной клональной популяцией клеток.
Термин «рекомбинантное антитело» означает антитело, которое экспрессируется в клетке или клеточной линии, содержащей нуклеотидную последовательность (нуклеотидные последовательности), которая кодирует антитело, при этом указанная нуклеотидная последовательность (нуклеотидные последовательности) не ассоциирована с клеткой в природе.
Определение «выделенный» («изолированный»), применяемое для описания различных антител по данному изобретению, означает антитело, идентифицированное и выделенное и/или регенерированное из клетки или клеточной культуры, в которой оно экспрессируется. Примеси (загрязняющие компоненты) из природной среды представляют собой материалы, которые, как правило, мешают диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. Обычно выделенный полипептид получают в результате по меньшей мере одной стадии очистки.
Термины «анти-TRBV9 антитело», «антитело к TRBV9», «антитело, специфически связывающееся с бета цепью семейства TRBV9» или «антитело против бета цепи семейства TRBV9» и им подобные являются взаимозаменяемыми в рамках данного изобретения и относятся к антителу, которое специфически связывается с эпитопом бета цепи семейства TRBV9 Т-клеточного рецептора человека.
Термин «фармацевтическая композиция» относится к композиции и/или составу, содержащему анти-TRBV9 антитело в терапевтически эффективном количестве и эксципиенты или вспомогательные вещества (носители, разбавители, наполнители, растворители и т.п.), выбор и соотношение которых зависит от их природы, способа назначения и дозировки.
Термин «эксципиент» или «вспомогательное вещество» используется в данном документе для описания любого компонента, отличающегося от соединения(-ий) по данному изобретению. Это вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Термин «водная композиция» при использовании в данном документе относится к композиции на основе воды, в качестве воды могут быть использованы: вода, вода для инъекций, физиологический раствор (0,9-1,0%-ный водный раствор хлористого натрия).
Термин «лиофилизированный», используемый в настоящем документе, относится к препарату, который был подвергнут процессу, известному в данной области техники как сушка из замороженного состояния, включающему в себя замораживание препарата и последующее удаление льда из замороженного содержимого.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при 2-8°С. При этом активный агент может сохранял и физическую, и химическую стабильность, и биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Термин «длительное хранение» или «долговременная стабильность» следует понимать, как обозначение того, что фармацевтическая композиция может храниться в течение трех месяцев или более, в течение шести месяцев или более, в течение одного года или более, а также композиция может быть с минимальным сроком хранения в стабильном состоянии по меньшей мере два года.
Термин «буферный агент» относится к кислотному или щелочному компоненту (обычно слабой кислоте или слабому основанию) буфера или буферного раствора. Буферный агент помогает поддерживать значение рН данного раствора при или около заранее определенного значения, и буферные агенты обычно выбирают для дополнения заранее определенного значения. Буферный агент может представляет собой единственное соединение, которое приводит к желательному буферному эффекту, в особенности, если указанный буферный агент смешан с (и подходяще способен к протонному обмену с) подходящим количеством (в зависимости от заранее определенного желательного значения) его соответствующего «кислотного/щелочного конъюгата».
Термин «буфер», или «буферный раствор», или «буферная система» относится к водному раствору, содержащему смесь кислоты (обычно слабой кислоты, такой как, например, уксусная кислота, лимонная кислота) и ее конъюгированного основания (такой как, например, ацетатной или цитратной соли, например, ацетат натрия, цитрат натрия, а также гидраты указанных солей, например, натрия ацетат тригидрат) или альтернативно смесь основания (обычно слабого основания, например, гистидина) и его конъюгированной кислоты (например, гистидина гидрохлорида или гистидина гидрохлорида моногидрата, или L- гистидина гидрохлорида (г/х) моногидрата (м/г), или L-гистидина г/х м/г, или гистидина г/х м/г). Значение рН «буферного раствора» мало изменяется при добавлении к нему небольшого количества сильного основания или сильной кислоты, а также при разбавлении и концентрировании, благодаря «буферному эффекту», обеспечиваемому «буферным агентом».
В качестве буферных растворов могут быть использованы, например, ацетатный, фосфатный, цитратный, гистидиновый, сукцинатный и другие. В общем случае, преимущественными являются значения рН фармацевтической композиции от 4,0 до 8,0.
Под «стабилизатором» понимается вспомогательное вещество или смесь двух и более вспомогательных веществ, которые обеспечивают физическую и/или химическую стабильность активного вещества.
Термины «осмотический агент» или «агент, регулирующий тоничность», а также «осмолитик» в том виде, как они здесь использованы, относятся к эксципиенту, который может обеспечивать требуемое осмотическое давление жидкого раствора антитела. В некоторых воплощениях агент, регулирующий тоничность, может подводить осмотическое давление жидкого препарата антитела до изотоничного так, что данный препарат антитела является физиологически совместимым с клетками ткани организма субъекта. В еще одном воплощении «агент, регулирующий тоничность», может способствовать увеличению стабильности антител. «Изотоничный» препарат представляет собой препарат, который имеет осмотическое давление, эквивалентное человеческой крови. Изотоничные препараты обычно имеют осмотическое давление от примерно 239 до 376 мОсм/кг.
Термин «солюбилизатор» при использовании в данном тексте означает фармацевтически приемлемое неионногенное поверхностно-активное вещество. Можно использовать один солюбилизатор, а также комбинации солюбилизаторов. Примерами солюбилизаторов являются, но не ограничиваются ими, полисорбат 20 или полисорбат 80, полоксамер 184 или полоксамер 188, или PLURONIC®.
Как правило, аминокислоты представляют собой L-аминокислоты. Например, если используют гистидин и гистидина гидрохлорид моногидрат, как правило, это L-гистидин и L-гистидина гидрохлорид моногидрат. Например, если используют пролин, то как правило, это L-пролин. Можно также использовать эквиваленты аминокислот, например, фармацевтически приемлемые соли пролина (например, пролина гидрохлорид).
Термин «лекарственное средство» или «препарат» подразумевает вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, растворов, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
Термин «применение» относится к возможности применения фармацевтической композиции анти-TRBV9 антитела согласно изобретению для лечения, облегчения течения заболеваний или нарушений, для ускорения ремиссии, снижения частоты рецидивов заболеваний или нарушений.
Термин «заболевание или нарушение, Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9» подразумевает все заболевания или нарушения, которые либо прямо, либо косвенно связаны с Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, включая этиологию, развитие, прогресс, персистентность или патологию заболевания или нарушения.
«Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Используемый в данном документе, чтобы «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включает ссылки на лечебную, паллиативную и профилактическую терапию.
Термин «парентеральное введение» означает режимы введения, обычно выполняемые с помощью инъекции (инфузии), и включает, в частности, внутривенную, внутримышечную, внутриартериальную, внутритрахеальную, внутрикапсулярную, внутриорбитальную, внутрикардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную, эпидуральную и надчревную инъекцию или инфузию.
Сокращения
anti-TRBV9 (анти-TRBV9)-моноклональное антитело к TRBV9
IC-входной контроль (incoming control)
FT-замораживание и размораживание (freeze-thaw)
kD-параметр диффузионного взаимодействия
SH-шейкирование (shake)
Tag-температура агрегации
Tonset-температура начала плавления
Tm-температура плавления
Т-температура
TS-термостресс (thermal stress)
С-концентрация белка
Osm-осмоляльность
TS50 96Н-термическое воздействие при 50°С в течение 96 часов
Δ TS50 96Н-изменение показателя качества после термического воздействия при 50°С в течение 120 часов
TS50 120Н-термическое воздействие при 50°С в течение 96 часов
Δ TS50 120Н-изменение показателя качества после термического воздействия при 50°С в течение 120 часов
Acid 3.0 2 4Н-кислый гидролиз до рН 3,0 и выдерживание в течение 1 или 24 часов
Δ Acid 3.0 24Н-изменение показателя качества после стресс-воздействия после кислого гидролиза до рН 3,0 и выдерживания в течение 1 или 24 часов
Basic 9.0 1Н-щелочной гидролиз до рН 9,0 и выдерживание в течение 1 часа
Δ Basic 9.0 1Н-изменение показателя качества после стресс-воздействия после щелочного гидролиза до рН 9,0 и выдерживания в течение 1 часа
SH800 96Н-шейкирование в течение 96 часов при 800 об/мин
Δ SH800 96Н-изменение показателя качества после шейкирования в течение 96 часов при 800 об/мин
SH800 120Н-шейкирование в течение 120 часов при 800 об/мин
Δ SH800 120Н-изменение показателя качества после шейкирования в течение 120 часов при 800 об/мин
fr-th 3 cycle-три цикла замораживания-размораживания
Δ fr-th 3 cycle-изменение показателя качества после трех циклов замораживания-размораживания
FT 5С-пять циклов замораживания-размораживания
Δ FT 5С-изменение показателя качества после пяти циклов замораживания-размораживания
ИО ВЭЖХ-ионообменная высокоэффективная жидкостная хроматография
ПО-программное обеспечение
Э ВЭЖХ-эксклюзионная высокоэффективная жидкостная
n/а-не определяли
abs-абсолютное изменение показателя качества
С кон-концентрация после концентрирования
DSF-дифференциальная сканирующая флуориметрия
DLS-динамическое светорассеяние
КЩП-кислотно-щелочной профиль
Oxid 0.1%-окисление 0.1% раствором перекиси водорода
Δ Oxid 0.1%-изменение показателя качества после окисления 0.1% раствором перекиси водорода
ПАВ-поверхностно-активное вещество
AS37-ускоренное хранение при 37°С
2W-2 недели
4W-4 недели
Δ AS37-изменение показателя качества после ускоренного хранения при 37°С
Мах-максимальное значение
Min-минимальное значение
рН-водородный показатель
Скон./Снач.-отношение концентраций до и после концентрирования
Н-вязкость
КЭФ-капиллярный электрофорез
Ред.-редуцирующие условия
Неред.-нередуцирующие условия
В настоящем изобретении раскрыты стабильные фармацевтические композиции анти-TRBV9 антитела, которые могут быть использованы в качестве лекарственного средства для лечения заболеваний или нарушений, опосредованных Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции, которая содержит по меньшей мере одно анти-TRBV9 антитело в терапевтически эффективном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. В одном из аспектов настоящее изобретение относится к фармацевтической композиции, которая содержит анти-TRBV9 антитело в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
При выборе состава учитывались назначение, способ применения и переносимость препарата (например, уменьшение дискомфорта при введении), а также обеспечение стабильности и сохранение активности белковой молекулы в составе препарата.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции, содержащей:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) воду для инъекций.
В качестве анти-TRBV9 антитела может выступать антитело, которое специфически связывается с бета цепью семейства TRBV9. Анти-TRBV9 антитело может представлять собой полноразмерное антитело или его антигенсвязывающий фрагмент, который специфически связывается с бета цепью семейства TRBV9. анти-TRBV9 антитело может иметь различную специфичность (например, моноспецифическое, биспецифическое антитело), различную валентность (например, моновалентное, бивалентное, трехвалентное антитело), различный формат (например, классическое антитело, scFv, scFv-Fc, Minibody), различное происхождение (например, мышиное, человеческое, верблюжье, химерное).
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело относится к выделенному моноклональному антителу.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело относится к моноспецифическому антителу.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело является рекомбинантным антителом.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело включает:
1) вариабельный домен тяжелой цепи, содержащий:
(a) HCDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(b) HCDR2 с аминокислотной последовательностью SEQ ID NO: 2 и
(c) HCDR3 с аминокислотной последовательностью, выбранной из группы SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6;
2) вариабельный домен легкой цепи, содержащий:
(a) LCDR1 с аминокислотной последовательностью SEQ ID NO: 7,
(b) LCDR2 с аминокислотной последовательностью SEQ ID NO: 8 и
(c) LCDR3 с аминокислотной последовательностью SEQ ID NO: 9.
Антитела, согласно изобретению, могут представлять собой антитела любого класса (например, IgA, IgD, IgE, IgG и IgM) или подкласса (изотипа) (например, IgGl, IgG2, IgG3, IgG4, IgAl и IgA2).
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело представляет собой полноразмерное антитело IgG.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID No: 14 и вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID No: 17.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело включает тяжелую цепь с аминокислотной последовательностью SEQ ID No: 22 и легкую цепь с аминокислотной последовательностью SEQ ID No: 25 (кандидат 42 или антитело 42).
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID No: 15 и вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID No: 17.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело включает тяжелую цепь с аминокислотной последовательностью SEQ ID No: 23 и легкую цепь с аминокислотной последовательностью SEQ ID No: 25 (кандидат 43 или антитело 43).
Концентрация анти-TRBV9 антитела, содержащегося в фармацевтических композициях по настоящему изобретению, может варьироваться в зависимости от желаемых свойств композиций, а также от конкретных условий, способов и целей использования фармацевтических композиций.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0,5-300,0 мг/мл. В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0,5-280,0 мг/мл. В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0, 5-250,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0,5-225,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5-190,0 мг/мл, или 200,0 -225, 0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-95 мг/мл, или 100-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-95 мг/мл, или 100-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-85 мг/мл, или 90,0-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5 -95 мг/мл, или 100-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-3 0 0,0 мг/мл; или 1,5-75 мг/мл, или 80,0-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-75 мг/мл, или 80,0-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-50,0 мг/мл, или 60,0-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-50,0 мг/мл, или 60,0-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5 -3 0,0 мг/мл, или 40,0-125,0 мг/мл, или 150,0-225,0 мг/мл, или 240,0-300,0 мг/мл; или 1,5-30,0 мг/мл, или 40,0-125,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5-50,0 мг/мл, или 60,0-150,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5-35,0 мг/мл, или 40,0-60,0 мг/мл, или 70,0-125,0 мг/мл, или 180,0-225,0 мг/мл, или 2 4 0,0 -3 0 0,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 4,0-6,0 мг/мл, или 8,0-12,0 мг/мл, или 23,0-32,0 мг/мл, или 40,0-60,0 мг/мл, или 70,0-105,0 мг/мл, или 180,0-225,0 мг/мл, или 240,0-300,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 4,0-6,0 мг/мл, или 8,0-12,0 мг/мл, или 23,0-32,0 мг/мл, или 50,0-105,0 мг/мл, или 18 0,0 -225,0 мг/мл, или 240,0-300,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 4,0-6,0 мг/мл, или 8,0-12,0 мг/мл, или 23,0-32,0 мг/мл, или 70,0-105,0 мг/мл, или 18 0,0 -225,0 мг/мл, или 240,0-300,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5 мг/мл, или 5,0 мг/мл, или 10,0 мг/мл, или 25,0 мг/мл, или 30,0 мг/мл, или 4 0,0 мг/мл, или 5 0,0 мг/мл, или 6 0,0 мг/мл, или 7 0,0 мг/мл, или 7 3,0 мг/мл, или 8 0,0 мг/мл, или 85,0 мг/мл, или 90,0 мг/мл, или 91,4 мг/мл, или 91,8 мг/мл, или 10 0,0 мг/мл, или 103,0 мг/мл, или 125,0 мг/мл, или 186,0 мг/мл, или 212,0 мг/мл.
В некоторых вариантах осуществления изобретения
фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый буфер;
(iii) воду для инъекций.
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь гистидина и гистидина гидрохлорида моногидрата.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-14,11 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-11,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-10,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-8,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-5,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-3,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-1,5 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-1,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,4-0,8 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,45-0,8 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,5-0,8 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,45-0,6 мг/мл, или 0,65-0,8 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,5-0,6 мг/мл, или 0,65-0,8 мг/мл.
В некоторых вариантах осуществления изобретения гистидин находится в концентрации 0,517 мг/мл, или 0,580 мг/мл, или 0,689 мг/мл, или 0,746 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-19,06 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-15,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-12,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-10,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-8,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-6,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-5,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,05-4,5 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,08-4,2 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,08-4,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,1-4,2 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,1-4,0 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,1-3,5 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,08-1,0 мг/мл или 2,0-4,2 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,08-0,15 мг/мл, или 0,2-0,4 мг/мл, или 2,2-4,2 мг/мл.
В некоторых вариантах осуществления изобретения гистидина гидрохлорида моногидрат находится в концентрации 0,117 мг/мл, или 0,270 мг/мл, или 0,350 мг/мл, или 3,185 мг/мл.
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения гистидиновый буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0,5-300,0 мг/мл, или 1,5-225,0 мг/мл, или 5,0-125,0 мг/мл, или 5,0-100,0 мг/мл, 5,0-50,0 мг/мл, или 5,0-30,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5 мг/мл, или 5,0 мг/мл, или 10,0 мг/мл, или 25,0 мг/мл, или 30,0 мг/мл, или 4 0,0 мг/мл, или 50,0 мг/мл, или 6 0,0 мг/мл, или 7 0,0 мг/мл, или 7 3,0 мг/мл, или 8 0,0 мг/мл, или 85,0 мг/мл, или 9 0,0 мг/мл, или 91,4 мг/мл, или 91,8 мг/мл, или 10 0,0 мг/мл, или 103,0 мг/мл, или 125,0 мг/мл, или 186,0 мг/мл, или 212,0 мг/мл, 225,0 мг/мл, 300,0 мг/мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) ацетатный буфер;
(iii) воду для инъекций.
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь натрия ацетата и уксусной кислоты.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,014-12,88 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,014-8,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,5-3,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,5-2,5 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,5-0,8 мг/мл, или 1,6-3,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат находится в концентрации 0,64 4 мг/мл, или 2,311 мг/мл.
В некоторых вариантах осуществления изобретения натрия ацетат представляет собой натрия ацетата тригидрат.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 3,5-6,1.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,4-6,1.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,4-5,6 или до рН 5,9-6,1.
В некоторых вариантах осуществления изобретения уксусная кислота добавлена до рН 5,5 или до рН 6,0.
В некоторых вариантах осуществления изобретения уксусная кислота представляет собой уксусную кислоту ледяную.
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения ацетатный буфер представляет собой смесь:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 0,5-300,0 мг/мл, или 1,5-225,0 мг/мл, или от 5,0-125,0 мг/мл, или 5,0-100,0 мг/мл, 5,0-50,0 мг/мл, или 5,0-30,0 мг/мл.
В некоторых вариантах осуществления изобретения анти-TRBV9 антитело находится в концентрации 1,5 мг/мл, или 5,0 мг/мл, или 10,0 мг/мл, или 25,0 мг/мл, или 30,0 мг/мл, или 4 0,0 мг/мл, или 50,0 мг/мл, или 6 0,0 мг/мл, или 7 0,0 мг/мл, или 7 3,0 мг/мл, или 8 0,0 мг/мл, или 85,0 мг/мл, или 90,0 мг/мл, или 91,4 мг/мл, или 91,8 мг/мл, или 10 0,0 мг/мл, или 103,0 мг/мл, или 125,0 мг/мл, или 186,0 мг/мл, или 212,0 мг/мл, 225,0 мг/мл, 300,0 мг/мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция дополнительно содержит один или несколько осмотических агентов.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент;
(iv) воду для инъекций.
В некоторых вариантах осуществления изобретения
фармацевтическая композиция содержит:
Осмотический агент может находиться в энантиомерной (например, L- или D-энантиомер) или рацемической форме; в форме изомеров, таких как альфа или бета, включая альфа, альфа; или бета, бета; или альфа, бета; или бета, альфа; в форме свободной кислоты или свободного основания; в форме соли; в гидратированной форме (например, моногидрат или дигидрат) или в безводной форме. Примерами осмотических агентов являются, но не ограничиваются ими, сахара (трегалоза, трегалозы дигидрат, сахароза, глюкоза), полиолы (маннит (или маннитол), сорбит (или сорбитол)), аминокислоты (пролин или L-пролин, аргинин или L-аргинин, глицин или L-глицин), или соли (натрия хлорид, калия хлорид, магния хлорид).
В некоторых вариантах осуществления изобретения осмотический агент находится в концентрации 0,001-200,0 мг/мл.
В некоторых вариантах осуществления изобретения осмотический агент находится в концентрации 0,001-180,0 мг/мл.
В некоторых вариантах осуществления изобретения осмотический агент находится в концентрации 0,001-150,0 мг/мл.
В некоторых вариантах осуществления изобретения осмотический агент находится в концентрации 0,001-130,0 мг/мл.
В некоторых вариантах осуществления изобретения осмотический агент находится в концентрации 6,0-130,0 мг/мл.
В некоторых вариантах осуществления изобретения осмотический агент представляет собой пролин, сорбитол, трегалозу или натрия хлорид.
В некоторых вариантах осуществления изобретения пролин находится в концентрации 0,001-60,0 мг/мл.
В некоторых вариантах осуществления изобретения пролин находится в концентрации 14,0-32,0 мг/мл.
В некоторых вариантах осуществления изобретения пролин находится в концентрации 17,0-32,0 мг/мл.
В некоторых вариантах осуществления изобретения пролин находится в концентрации 17,0-23,0 мг/мл или 25,0-29,0 мг/мл.
В некоторых вариантах осуществления изобретения пролин находится в концентрации 19,0 мг/мл, или 21,0 мг/мл, или 27,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 0,001-100,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 20,0-80,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 35,0-65,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 40,0-60,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 45,0-55,0 мг/мл.
В некоторых вариантах осуществления изобретения сорбитол находится в концентрации 50,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 0,001-200,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 0,001-180,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 40,0-160,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 60,0-140,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 70,0-130,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 80,0-120,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 90,0-110,0 мг/мл.
В некоторых вариантах осуществления изобретения трегалоза находится в концентрации 100,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 0,001-18,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 3,0-16,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 5,0-14,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 7,0-12,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 7,0-11,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 7,5-11,5 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 7,5-10,5 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 8,0-10,0 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 8,5-9,5 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид находится в концентрации 9,0 мг/мл.
В некоторых вариантах осуществления изобретения
фармацевтическая композиция дополнительно содержит один или несколько стабилизаторов.
В качестве стабилизаторов могут быть использованы аминокислоты, например, аргинин, гистидин, глицин, лизин, глутамин, пролин, но, не ограничиваясь ими; поверхностно-активные вещества, например, полисорбат 20 (торговое наименование Tween 20), полисорбат 80 (торговое наименование Tween 80), полиэтилен-полипропилен гликоль и его кополимеры (торговые наименования Полоксамер (Poloxaner), Плуроник (Pluronic)), натрия додецилсульфат (SDS), но, не ограничиваясь ими; антиоксиданты, например, метионин, ацетилцистеин, аскорбиновая кислота, монотиоглицерол, соли серистых кислот, и т.п., но не ограничиваясь ими; хелатирующие агенты, например, этилендиаминтетрауксусная кислота (ЭДТА), диэтилентриаминпентауксусная кислота (ДТПА), цитрат натрия и т.п., но не ограничиваясь ими.
В некоторых вариантах осуществления изобретения стабилизатор находится в концентрации 0,001-100,0 мг/мл.
В некоторых вариантах осуществления изобретения стабилизатор находится в концентрации 0,001-50,0 мг/мл.
В некоторых вариантах осуществления изобретения стабилизатор находится в концентрации 0,001-30,0 мг/мл.
В некоторых вариантах осуществления изобретения стабилизатор находится в концентрации 0,35-9,5 мг/мл.
В некоторых вариантах осуществления изобретения стабилизатор представляет собой аминокислоту или поверхностно-активное вещество.
В некоторых вариантах осуществления изобретения аминокислота находится в концентрации 0,001-100,0 мг/мл.
В некоторых вариантах осуществления изобретения аминокислота находится в концентрации 0,001-50,0 мг/мл.
В некоторых вариантах осуществления изобретения аминокислота находится в концентрации 0,001-30,0 мг/мл.
В некоторых вариантах осуществления изобретения аминокислота находится в концентрации 0,35-9,5 мг/мл.
В некоторых вариантах осуществления изобретения аминокислота находится в концентрации 1,1-9,5 мг/мл.
В некоторых вариантах осуществления изобретения аминокислота представляет собой глицин или метионин.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-100,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-80,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-60,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-40,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-20,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 0,001-15,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 3,0-12,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 5,5-9,5 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 6,0-9,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 6,5-8,5 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 7,0-8,0 мг/мл.
В некоторых вариантах осуществления изобретения глицин находится в концентрации 7,51 мг/мл.
В некоторых вариантах осуществления изобретения метионин находится в концентрации 0,001-5,8 мг/мл.
В некоторых вариантах осуществления изобретения метионин находится в концентрации 1,1-5,8 мг/мл.
В некоторых вариантах осуществления изобретения метионин находится в концентрации 1,1-1,9 мг/мл или 3,2-5,8 мг/мл.
В некоторых вариантах осуществления изобретения метионин находится в концентрации 1,4 9 мг/мл или 4,48 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество находится в концентрации 0,001-6,0 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество находится в концентрации 0,001-4,0 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество находится в концентрации 0,001-3,0 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество находится в концентрации 0,1-2,0 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество находится в концентрации 0,35-1,3 мг/мл.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество представляет собой полоксамер 188, или полисорбат 80, или полипропиленгликоль.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,001-6,0 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,001-4,0 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,001-2,5 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,35-1,3 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,35-0,65 мг/мл или 0,7-1,3 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,35-0,65 мг/мл или 0,8-1,2 мг/мл.
В некоторых вариантах осуществления изобретения полоксамер 188 находится в концентрации 0,5 мг/мл или 1,0 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 0,001-5,0 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 0,001-3,5 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 0,001-2,5 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 0,7-1,3 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 0,8-1,2 мг/мл.
В некоторых вариантах осуществления изобретения полисорбат 80 находится в концентрации 1,0 мг/мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер,
(iii) осмотический агент;
(iv) стабилизатор;
(v) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер,
(iii) осмотический агент, представляющий собой пролин;
(iv) стабилизатор, представляющий собой глицин;
(v) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент, представляющий собой пролин;
(iv) стабилизатор, представляющий собой полоксамер 188;
(v) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент, представляющий собой сорбитол;
(iv) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер
(iii) осмотический агент, представляющий собой трегалозу
(iv) воду для инъекций
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент, представляющий собой натрия хлорид;
(iv) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент, представляющий собой натрия хлорид 6,0-11,5 мг/мл;
(iv) воду для инъекций до 1 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) анти-TRBV9 антитело;
(ii) гистидиновый или ацетатный буфер;
(iii) осмотический агент, представляющий собой натрия хлорид;
(iv) стабилизатор, представляющий собой полоксамер 188 или полисорбат 80;
(v) воду для инъекций.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
В одном из аспектов настоящее изобретение относится к фармацевтической композиции для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, у субъекта, нуждающегося в этом, содержащей анти-TRBV9 антитело и по меньшей мере одно другое терапевтически активное соединение.
В некоторых вариантах другое терапевтически активное соединение представляет собой антитело, химиотерапевтическое средство или противогормональное средство.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции анти-TRBV9 антитела, представленной в сухой форме, то есть в форме порошка или гранул для растворения в подходящем растворителе (например, воде) перед введением. Такое лекарственное средство может быть получено, например, с помощью лиофилизации, т.е. процесса, известного в данной области техники как сушка из замороженного состояния, включающая в себя замораживание препарата и последующее удаление растворителя из замороженного содержимого.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции анти-TRBV9 антитела, полученной лиофилизацией любой фармацевтической композиции анти-TRBV9 антитела, описанной выше. Таким образом фармацевтические композиции по настоящему изобретению могут быть как водными, так и лиофилизированными (лиофилизаты).
Лиофилизаты используют для получения других лекарственных форм. Например, лиофилизат для приготовления раствора для инъекций, лиофилизат для приготовления концентрата для приготовления раствора для инфузий. Лиофилизаты восстанавливают путем растворения в подходящем растворителе, чаще всего в воде для инъекций. Также лиофилизированные композиции восстанавливают сначала в необходимом объеме растворителя (чаще всего в воде), а затем дополнительно разводят в подходящем растворителе (например, 5% раствор глюкозы, 0,9% раствор хлорида натрия).
Фармацевтические композиции по настоящему изобретению, как правило, пригодны для парентерального введения в виде стерильных лекарственных средств, предназначенных для введения в организм человека с нарушением целостности кожных покровов или слизистых оболочек, минуя желудочно-кишечный тракт путем инъекций, инфузий или имплантации. В частности, предполагается, что парентеральное введение включает, помимо прочего, подкожную, внутрибрюшинную, внутримышечную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставнную, трансдермальную инъекцию или инфузи.; и почечные диализные инфузионные методики. Предпочтительные варианты осуществления изобретения включают внутривенный и подкожный пути. Любой способ введения пептидов или белков, принятый в данной области, может соответствующим образом использоваться для композиции анти-TRBV9 антитела по данному изобретению.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция анти-TRBV9 антитела по настоящему изобретению предназначена для парентерального введения.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция анти-TRBV9 антитела по настоящему изобретению предназначена для внутримышечного, внутривенного или подкожного введения.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция анти-TRBV9 антитела по настоящему изобретению может быть введена внутривенно в виде инфузий.
Фармацевтическая композиция анти-TRBV9 антитела по настоящему изобретению может быть использована после разведения. Для этого необходимое количество композиции из флакона переносят в емкость для инфузий, содержащую стерильный 0,9% раствор натрия хлорида или стерильный 5% раствор декстрозы. Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий.
Фармацевтические композиции по настоящему изобретению можно хранить в любом подходящем для этого сосуде. Например, стеклянный или полимерный контейнер, флакон, ампула, шприц, картридж или бутылка необходимого объема. Сосуды могут снабжаться дополнительными средствами для введения, например капельницы, автоинжекторы.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или широко продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
В одном из аспектов настоящее изобретение относится к применению фармацевтической композиции анти-TRBV9 антитела, описанной выше, для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, у субъекта, нуждающегося в этом.
Терапевтически эффективное количество фармацевтичекой композиции анти-TRBV9 антитела по настоящему изобретению зависит от состояния субъекта, подлежащего лечению, тяжести состояния, предшествующей терапии и истории болезни, и ответу на терапевтическое средство. Подходящую дозу можно регулировать по решению лечащего врача так, что ее можно вводить пациенту один раз или посредством нескольких введений.
В некоторых вариантах осуществления изобретения субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредованное Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, выбрано из группы: артропатиии, воспалительные заболевания кишечника, заболевания глаз, васкулиты, болезни системы кровообращения, заболевания почек, заболевания пищеварительной системы, лимфопролиферативные заболевания.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредованное Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, выбрано из группы:
- артропатиии, в частности спондилоартриты (рентгенологический аксиальный спондилоартрит (анкилозирующий спондилит), аксиальный спондилоартрит, периферический спондилоартрит, псориатический артрит, спондилоартрит, ассоциированный с воспалительными заболеваниями кишечника, реактивный артрит, недифференцированный периферический спондилоартрит), сакроилиит, ассоциированный с псориазом, сакроилиит, ассоциированный с воспалительными заболеваниями кишечника, недифференцированная олигоартропатия, ювенильный спондилоартрит/энтезит-ассоциированный артрит, юношеский анкилозирующий спондилит (артрит, ассоциированный с энтезитом), ювенильный артрит, недифференцированный ювенильный артрит;
- воспалительные заболевания кишечника, в частности язвенный колит, болезнь Крона;
- заболевания глаз, в частности неинфекционные увеиты, передний увеит;
- васкулиты, в частности болезнь Бехчета;
- болезни системы кровообращения, в частности аортит, фиброз створок аортального и/или митрального клапанов с регургитацией, нарушения ритма, нарушения проводимости, нарушения функции левого желудочка, перикардит, миокардит;
- заболевания почек, в частности IgA-нефропатия;
- заболевания пищеварительной системы, в частности целиакия;
- лимфопролиферативные заболевания, в частности Т-клеточная лимфома, Т-клеточный лейкоз.
В некоторых вариантах осуществления изобретения заболевание или нарушение, опосредованное Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, выбрано из группы: спондилоартриты, сакроилиит, ассоциированный с псориазом, сакроилиит, ассоциированный с воспалительными заболеваниями кишечника, недифференцированная олигоартропатия, ювенильный спондилоартрит/энтезит-ассоциированный артрит, юношеский анкилозирующий спондилит (артрит, ассоциированный с энтезитом), ювенильный артрит, недифференцированный ювенильный артрит, язвенный колит, болезнь Крона, неинфекционные увеиты, передний увеит, болезнь Бехчета, аортит, фиброз створок аортального и/или митрального клапанов с регургитацией, нарушения ритма, нарушения проводимости, нарушения функции левого желудочка, перикардит, миокардит, IgA-нефропатия, целиакия, Т-клеточная лимфома, Т-клеточный лейкоз.
В некоторых вариантах осуществления изобретения спондилоартрит представляет собой рентгенологический аксиальный спондилоартрит (анкилозирующий спондилит), аксиальный спондилоартрит, периферический спондилоартрит, псориатический артрит, спондилоартрит, ассоциированный с воспалительными заболеваниями кишечника, реактивный артрит, недифференцированный периферический спондилоартрит.
Фармацевтические композиции можно вводить в виде одного терапевтического средства или в комбинации с дополнительными терапевтическими средствами по мере необходимости. Таким образом, в одном варианте осуществления предлагаемые способы лечения и/или профилактики используют в комбинации с введением терапевтически эффективного количества другого активного средства. Другое активное средство можно вводить до, в течение или после введения фармацевтических композиций по настоящему изобретению. Другое активное средство можно вводить как часть предлагаемой композиции или, альтернативно, в виде отдельного состава.
Осуществление изобретения
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Методики
1. Получение образцов моноклонального антитела к TRBV9. Получение образцов антитела с концентрацией 5-50 мг/мл
осуществляли в концентрационных ячейках Stirred Cell (Millipore) под давлением. Для этого антитело в исходном составе помещали в ячейку, при непрерывном перемешивании белок концентрировали под потоком сжатого воздуха до необходимой концентрации, после чего поэтапно вносили в ячейку не менее, чем 10 кратный объем водного раствора с целевым составом, включающим буферные, осмотические агенты и, если необходимо, дополнительные водорастворимые стабилизаторы. По завершении процесса диафильтрации продолжали концентрирование до концентрации, превышающей целевую, выгружали из ячейки, определяли точную концентрацию белка методом УФ-спектрофотометрии. Затем к образцу вносили концентрат соответствующего раствора вспомогательных веществ и концентрат поверхностно-активного вещества для получения раствора с целевой концентрацией белка.
Получение образцов белка с концентрацией более 20 мг/мл проводили в кассетах Pellicon (Millipore) в режиме тангенциального потока. Для этого антитело в исходном составе помещали в емкость для диафильтрации, концентрировали белок до требуемой концентрации, после чего к системе подключали подачу не менее, чем 10 кратного объема раствора с целевым составом, содержащим буферные агенты и, если необходимо, дополнительные водорастворимые стабилизаторы. По завершении процесса диафильтрации продолжали концентрирование до концентрации, превышающей целевую, выгружали из системы и определяли точную концентрацию белка.
При получении составов, содержащих солюбилизаторы, например, полоксамер 188, концентраты поверхностно-активных веществ, вносили к антителу после завершения диафильтрации и концентрирования при финальном разведении антитела раствором вспомогательных веществ до целевой концентрации.
При асептическом наполнении в конечный контейнер (например, стерильный стеклянный или полимерный сосуд, флакон или шприц) раствор антитела фильтровали через стерилизующую мембрану с размером пор 0,22 мкм.
2. Определение концентрации белка в исследуемых образцах.
Концентрацию белка определяли методом УФ-спектрофотометрии при длине волны 280 нм в планшетах для УФ-спектрофотометрии. Каждый образец разводили соответствующим раствором вспомогательных веществ до концентрации около 0.5 мг/мл. В лунку планшета для УФ-спектрофотометрии помещали 150 мкл разведенного образца. Измеряли оптическую плотность помещенных в планшет растворов на планшетном спектрофотометре при длине волны 280 нм. В качестве раствора сравнения использовали соответствующий раствор вспомогательных веществ.
Концентрацию белка (С) в мг/мл рассчитывали по формуле:
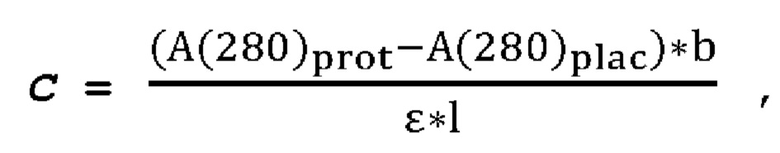
где А280-значение оптической плотности при длине волны 280 нм;
ε-коэффициент экстинкции исследуемого белка;
b-суммарный коэффициент разведения образца;
l-толщина слоя в лунке планшета, см. где для стандартного 96-луночного планшета 200 мкл 0.56 см. Для планшета half-area 175 мкл 1 см. Для полноразмерного планшета 150 мкл 0,42 см.
3. Определение температуры агрегации белка методом динамического светорассеяния.
Определение точки агрегации исследуемых белков (в концентрации 1-5 мг/мл) осуществляли на приборе DynaPro Plate Reader II. Для этого 35 мкл раствора помещали в лунку планшета из черного пластика с прозрачным дном, который постепенно нагревали в установке при постоянном измерении интенсивности рассеянного света. Параметры измерения:
- Начальная температура измерения-25°С.
- Интенсивность рассеянного света при θ=158°.
- Число измерений на один повтор-3.
- Время одного измерения-5 с.
- Скорость нагрева-0,15°С/мин.
- Конечная температура-80°С.
Температурный тренд и точка агрегации были определены с использованием ПО Dynamics V7.
4. Определение температуры плавления белка методом дифференциальной сканирующей флуориметрии.
К образцу белка добавляли флуоресцентный краситель Sypro Orange. Анализировали в амплификаторе CFX96 С1000 Touch Thermal Cycler в режиме реального времени. Нагрев проводили от 25 до 85°С, канал детектирования-ROX. Для обработки результатов использовали программное обеспечение CFX Manager (Bio-Rad).
5. Определение гидродинамического радиуса частиц в растворе методом динамического светорассеяния
Для проведения анализа в лунки планшета из черного пластика с прозрачным дном помещали 35 мкл образца в каждой концентрации. Анализ проводили на приборе DynaPro Plate Reader II. Каждую лунку анализировали 10 раз. Полученные данные обрабатывали в программном обеспечении Dynamics V7.
6. Определение параметра диффузионного взаимодействия (kD) методом динамического светорассеяния
Последовательным разведением получали ряд растворов белка от 30 мг/мл до 0,94 мг/мл. В качестве растворителя использовали соответствующие растворы вспомогательных веществ.
Для проведения анализа в лунки планшета из черного пластика с прозрачным дном помещали 35 мкл образца в каждой концентрации. Анализ проводили на приборе DynaPro Plate Reader II. Каждую лунку анализировали 10 раз. Полученные данные обрабатывали в программном обеспечении Dynamics V7, где строили зависимость коэффициента диффузии от концентрации белка в растворе и определяли угол наклона прямой для полученной зависимости.
7. Определение термической стабильности при термострессе при 50°С (TS50).
Исследуемые образцы разделяли на две аликвоты по 150 мкл и помещали в отдельные стеклянные виалы: по одной виале на каждый состав откладывали в холодильник на хранение при 5±3°С, остальные устанавливали в термостат и инкубировали при 50°С в течение 96 часов или 120 часов. При отборе контрольных точек или после окончания прогрева виалы убирали из термостата, выдерживали при комнатной температуре около 15 мин и передавали на анализ.
8. Определение коллоидной стабильности при шейкировании (SH800).
Исследуемые образцы разделяли на две аликвоты по 150 мкл и помещали в стеклянные виалы по одной виале на каждый состав откладывали в холодильник на хранение при температуре 5±3°С, остальные устанавливали в термошейкер и шейкировали со скоростью 800 об./мин при температуре 5±3°С в течение 96 или 120 часов. При отборе контрольных точек или после окончания стресса виалы убирали из термошейкера и передавали на анализ.
9. Определение коллоидной стабильности при замораживании и оттаивании (FT(-20)).
Исследуемые образцы разделяли на две аликвоты и помещали в полимерные пробирки: по одной пробирке на каждый состав откладывали в холодильник на хранение при 5±3°С, остальные устанавливали в морозильную камеру и хранили при температуре минус (20±2)°С до полной заморозки. После пробирки убирали из морозильной камеры, выдерживали при комнатной температуре до полного оттаивания содержимого, перемешивали растворы с помощью вортекса и снова устанавливали в морозильную камеру. Повторяли необходимое количество раз. После окончания стресса пробирки убирали из морозильной камеры, выдерживали при комнатной температуре до полного оттаивания содержимого, перемешивали растворы с помощью вортекса и передавали на анализ.
10. Определение стабильности при кислом гидролизе (Acid). Исследуемые образцы разделяли на две аликвоты и помещали в
полимерные пробирки: по 1 пробирке на каждый состав откладывали в холодильник на хранение при 5±3°С (входной контроль допускается передавать на анализ единожды для всех исследований при старте хранения), у остальных доводили рН до 4,0±0,1 или 3,0±0,1 раствором хлористоводородной кислоты при перемешивании, после чего убирали в холодильник на хранение при 5±3°С. По истечении 1 ч или 24 ч гидролиз останавливали при перемешивании добавлением раствора гидроксида натрия до исходного значения рН. Затем растворы передавали на анализ.
11. Определение стабильности при щелочном гидролизе (Basic) Исследуемые образцы разделяли на две аликвоты и помещали в полимерные пробирки: по одной пробирке на каждый состав откладывали в холодильник на хранение при 5±3°С (входной контроль допускается передавать на анализ единожды для всех исследований при старте хранения), у остальных доводили рН до 9,0±0,1 раствором гидроксида натрия при перемешивании, после чего убирали в холодильник на хранение при 5±3°С. По истечении 1 ч или 24 ч гидролиз останавливали при перемешивании добавлением раствора хлористоводородной кислоты до исходного значения рН. Затем растворы передавали на анализ.
12. Ускорение хранение.
Исследуемые образцы разделяли на отдельные аликвоты (одна для входного контроля-допускается передавать на анализ единожды для всех исследований при старте хранения) и помещали в отдельные стерильные стеклянные флаконы: часть флаконов на каждый состав откладывали в холодильник на хранение при 5±3°С (входной контроль), остальные устанавливали в термостат и инкубировали при 25±2°С в течение 6 месяцев, периодически отбирая контрольные точки согласно плану. При отборе контрольных точек и после завершения хранения флаконы убирали из термостата и передавали на анализ.
13. Определение чистоты образцов методом эксклюзионной высокоэффективной жидкостной хроматографии (Э ВЭЖХ).
Колонка Tosoh TSK-Gel G3000SWXL 7.8 mm ID × 30 cm, 5 мкм.
Предколонка: TSK-Gel Guard SWXL, 6,0 мм ID × 4,0 см, 7 мкм, 300 .
.
Температура колонки: 25°С.
Скорость потока подвижной фазы: 0,5 мл/мин.
Объем вкола: 25 мкл.
Концентрация образца: 0,5 мг/мл.
Длина волны детектора: 214 и 360 нм. Продолжительность элюирования: 30 мин.
Подвижная фаза: Динатрия гидрофосфат б/в 14,196 мг/мл.
Натрия хлорид 11,688 мг/мл. рН подвижной фазы доводили до 6,9 ортофосфорной кислотой.
14. Оценка профиля заряженных форм в капилляре на приборе Caliper LabChip GX II
Анализ проводили в соответствии с инструкцией к набору НТ Protein charge variant kit. Испытуемые образцы доводили до концентрации белка 1 мг/мл с помощью разведения или концентрирования в центрифужных фильтрах Amicon Ultra 10 кДа на 0,5 мл (Millipore) (в зависимости от исходной концентрации образцов). Содержание белка контролировали методом УФ-спектрофотометрии при длине волны 280 нм.
В каждый полученный образец добавляли по 2 мкл раствора карбоксипептидазы и инкубировали в течение 2 часов при температуре 37±2°С. По истечении указанного времени образцы диализовали против воды в центифужных пробирках Amicon Ultra и концентрировали до 2 мг/мл.
В 96-луночный планшет вносили установленные инструкцией количества раствора Labelling Buffer, раствора Dye Mixture и 25 мкл испытуемого образца, планшет ставили в темное место на 10 минут, затем в каждую лунку добавляли по 60 мкл воды и перемешивали.
Планшет с растворами центрифугировали с использованием планшетного ротора на центрифуге и устанавливали в прибор Caliper LabChip GX II. Для проведения анализа использовали специальный чип, который заполняют буферным раствором Running Buffer с рН, установленный в соответствии с инструкцией. Обработку результатов проводили с помощью ПО LabChip GX.
15. Определение профиля заряженных форм методом ионообменной высокоэффективной жидкостной хроматографии (ИО ВЭЖХ).
Колонка: ProPac WCX-10, 4×250 мм, размер частиц 10 мкм
Предколонка: ProPac WCX-10G, 4×50 мм, размер частиц 10 мкм
Элюент А: Раствор 28,8 мМ натрия дигидрофосфата, рН=6,5
Элюент В: Раствор 28,8 мМ натрия дигидрофосфата, 250mM натрия хлорида, рН=6,5
Скорость потока: 0,7 мл/мин. Температура колонки: 30°С
Температура автосэмплера: 4°С
Детектор: УФ, 280 нм, ширина окна пропускания (bandwidth) 16 нм
Референсная длина волны: 360 нм, ширина окна пропускания (bandwidth) 100 нм
Объем пробы: 4 0 мкл, режим Needle wash
Время хроматографирования: 60 мин.
Исследуемый образец разводили до концентрации 1,0 мг/мл и проводили обработку карбоксипептидазой В в соотношении 100:2,8 полученный раствор перемешивают и инкубируют в течение 2 часов при температуре 37±2°С.
Режим элюирования:
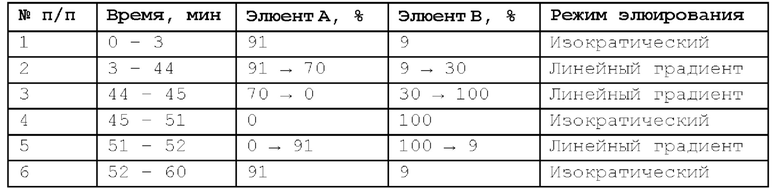
16. Определение чистоты и родственных примесей методом капиллярного гель-электрофореза в присутствии додецилсульфата натрия (КЭФ ред. и неред.).
Образец разводили до концентрации 4,0 мг/мл. 25 мкл полученного раствора помещали в микропробирку вместимостью 1,5 мл, добавляли 70 мкл буфера для приготовления образцов SDS-MW Sample Buffer, 2 мкл внутреннего стандарта с молекулярной массой 10 кДа, 5 мкл 0,5М раствора йодацетамида (КЭФ неред.) или 5 мкл 2-меркаптоэтанол (КЭФ ред.). Полученный раствор перемешивали в течение 15 с, центрифугировали в течение 5 с при скорости 2800 об/мин и помещали в твердотельный термостат при 65°С на 4 мин (КЭФ. неред.) или при 70°С на 10 мин (КЭФ. ред.). Раствор охлаждали до комнатной температуры.
В программном обеспечении 32Karat Software использовали методику анализа SDS MW Separation-РА 800 plus.met.
Условия проведения капиллярного гель-электрофореза:
Капилляр: 5 0 мкм × 30,2 см
Эффективная длина капилляра: 20,0 см
Полярность: обратная, вход слева (-), выход справа (+)
Температура капилляра: 25°С
Время анализа и напряжения разделения: 35 мин, 15 кВ
Длина волны детектирования: 220 нм.
17. Определение чистоты образцов на приборе Caliper Labchip GXII в нередуцирующих условиях.
Приготовление анализируемых образцов.
Для приготовления восстанавливающего раствора использовали 7 00 мкл НТ Protein Express Sample Buffer. В буфер вносили алкилирующий агент-24,5 мкл 1М йодацетамида (IAM).
В микропробирку вносили 35 мкл восстанавливающего буфера. Образцы разводили до концентрации 2 мг/мл. Вносили в пробирку по 5 мкл образца. Денатурировали образцы при 100°С в течение 5 минут. Перемешивали пробирки на вортексе, после чего добавляли 7 0 мкл воды и перемешивали на вортексе. Переносили по 4 4 мкл каждого образца в лунки 96-луночного планшета.
Рабочие растворы и подготовку чипа проводили в соответствии с методикой от производителя с использованием набора НТ Protein Express Reagent Kit. Запуск анализа является стандартной операцией. Метод анализа: НТ Protein Express 200.
18. Определение кислотно-щелочного профиля образцов методом капиллярного зонального электрофореза
Испытуемый образец объемом 50-100 мкл помещали в центрифужный ультрафильтр типа Amicon Ultra (0,5 мл, 10 кДа, UFC501096, Millipore Ltd.), добавляли по 4 00 мкл воды очищенной и проводили ультрафильтрацию с помощью центрифуги в течение 10 мин при 10000 об/мин при температуре 10°С. Процедуру ультрафильтрации проводили 3 раза, добавляя каждый раз по 4 00-450 мкл воды к остатку в центрифужных ультрафильтрах. После ультрафильтрации остатки переносили в микропробирку вместимостью 0,5 мл.
Определяли содержание белка в полученном растворе методом спектрофотомерии.
Открывали программное обеспечение 32Karat Software, выбирали инструмент с UV- или PDA- детектором. Для UV-детектора выбирали фильтр с длиной волны 214 нм.
Условия проведения анализа:
Напряжение при разделении:-30 кВ
Полярность: прямая (вход слева (+), выход справа (-))
Температура капилляра в картридже: 25°С
Температура в лотке с образцами: 10°С
Длина волны детектирования: 214 нм
Скорость передачи данных: 4 Гц
Время анализа: 15 мин
Готовили к работе капилляр кварцевый с внутренним диаметром 50 мкм, длиной 30,2 см (эффективная длина-20 см). Устанавливали капилляр в картридж с апертурой 200 × 100 мкм. В пластиковые виалы объемом 1,5 мл вносили растворы:
- 1,5 мл 0,1М раствор НС1;
- 1,5 мл буфер для разделения;
- 1,5 мл вода очищенная;
- 1,0 мл вода очищенная для слива.
В программном обеспечении 32Karat Software выбирали методику анализа «CZE Conditioning-PA 800 plus ABP.met».
19. Измерение вязкости образцов методом вискозиметрии Испытуемый образец отбирали пипеткой для измерения вязкости microVISC Pipettes в объеме 350-400 мкл. Пипетку помещали в вискозиметр RheoSence microVISC. Измерение вязкости производили с использованием термостата для вискозиметра, в автоматическом режиме (AUTO) при температуре 25,0°С.
20. Измерение рН.
Испытуемый образец отбирали в микропробирку в объеме 200-300 мкл и проводили измерение рН на приборе Mettler Toledo SevenEasy с электродом Mettler Toledo InLabUltraMiero.
21. Определение стабильности при окислении.
Исследуемые образцы разделяли на две аликвоты по 150 мкл и помещали в отдельные стеклянные виалы: по одной виале на каждый состав откладывали в холодильник на хранение при 5±3°С, к остальным образцам добавляли пероксид водорода из расчета конечной концентрации водорода пероксида в образцах
0,1%, выдерживали в течение 4 часов при температуре (5±3)°С. Окисление останавливали добавлением эквивалентного количества L-метионина.
22. Обработка результатов.
Абсолютное изменение показателей качества в ходе стрессов рассчитывали по формуле:
Δ=(значение после стресса-значение до стресса)
Абсолютное изменение профиля заряженных форм рассчитывали по формуле (abs):
Δ=|содержание кисл. фракций до стресса-содержание кисл. фракций после стресса+|содержание щел. фракций до стресса
- содержание щел. фракций после стресса |
+|содержание доминир. фракции до стресса
- содержание доминир. фракции после стресса |
23. Приготовление инфузионных растворов.
Растворы готовили путем разбавления исследуемых составов 0,9% раствором NaCl до концентрации белка 0,5 мг/мл.
Примеры
Примеры, описанные ниже, приведены для анти-TRBV9 антитела, включающего вариабельный домен тяжелой цепи, содержащий:
(a) HCDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(b) HCDR2 с аминокислотной последовательностью SEQ ID NO: 2 и
(c) HCDR3 с аминокислотной последовательностью, выбранной из группы SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6;
1) вариабельный домен легкой цепи, содержащий:
(a) LCDR1 с аминокислотной последовательностью SEQ ID NO: 7,
(b) LCDR2 с аминокислотной последовательностью SEQ ID NO: 8 и
(c) LCDR3 с аминокислотной последовательностью SEQ ID NO: 9.
В частности, примеры, описанные ниже, приведены для анти-TRBV9 антитела, включающего вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID No: 14 и вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID No: 17.
В частности, примеры, описанные ниже, приведены для анти-TRBV9 антитела, включающего тяжелую цепь с аминокислотной
последовательностью SEQ ID No: 22 и легкую цепь с аминокислотной последовательностью SEQ ID No: 25 (кандидат 42 или антитело 42).
Пример 1. Выбор природы буферной системы
В настоящем исследовании в качестве буферных агентов выбраны пригодные для фармацевтического применения вспомогательные вещества, применимые в составах лекарственных препаратов на основе терапевтических белков. В качестве основы фармацевтической композиции выбраны 4 типовые буферные системы, пригодные для парентерального введения: ацетатная, цитратная, гистидиновая и фосфатная. рН и концентрация растворов приведены к значениям 5.5 и 20 мМ соответственно для эффективного сравнения стабилизирующих свойств буферных растворов различной природы.
Для оценки пригодности буферных систем было проведено исследование влияния природы буферного раствора на коллоидную и конформационную стабильность белка. Для оценки влияния определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, способность к концентрированию, изменение чистоты и кислотно-щелочного профиля после термического воздействия.
Составы исследуемых буферных растворов представлены в таблице 1.
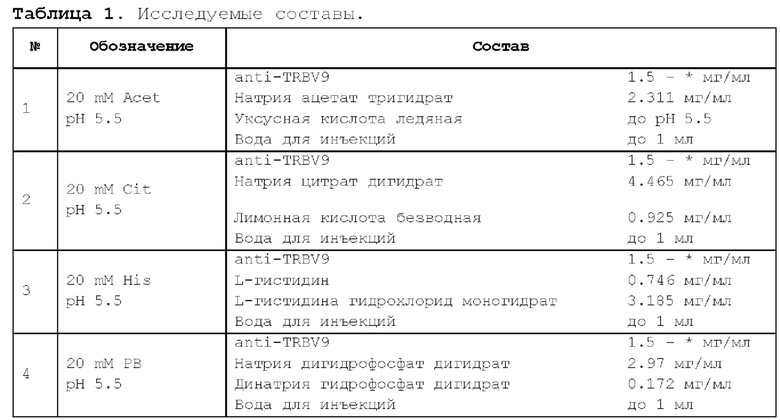
* максимальная концентрация белка лимитирована прямым концентрированием и указана в таблице 2.
Исследование показателей прогнозирования стабильности.
Параметр диффузионного взаимодействия (kD) отражает зависимость коэффициента диффузии образца от концентрации молекул. Если при увеличении концентрации коэффициент диффузии снижается (kD<0), то полидисперсность данного раствора увеличивается и в нем образуются более крупные частицы. Такие образцы обладают низкой растворимостью и склонны к агрегации, а их составы не рекомендуются для использования.
Температура агрегации и плавления позволяет оценить склонность белка к агрегации. Наиболее стабильны те образцы, в которых агрегация частиц начинается при большей температуре и где при нагревании образуются менее крупные частицы.
Результаты исследования температуры агрегации методом 3, температуры плавления методом 4, параметра диффузионного взаимодействия методом 6 и вязкости методом 19 представлены в таблице 2.
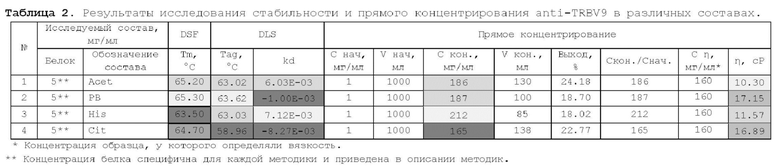
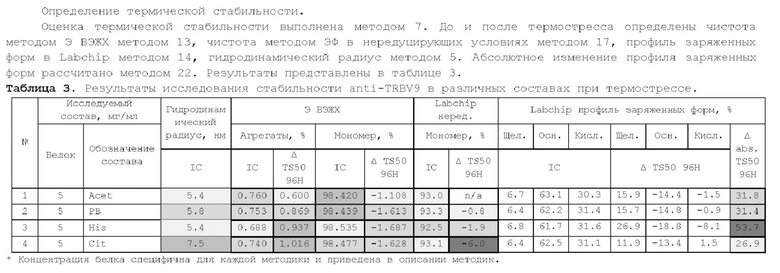
Составы на основе ацетатного буфера показали отличные стабилизирующие свойства по конформационной стабильности (высокая температура плавления), коллоидной стабильности (высокая температура агрегации по DLS, значение kD>0, высокое значение концентрации белка после прямого концентрирования, низкое значение вязкости раствора с концентрацией белка 160 мг/мл, низкое содержание агрегатов после термостресса при контроле Э ВЭЖХ), химической стабильности (удовлетворительные значения по изменению профиля изоформ после термостресса).
Составы на основе гистидинового буфера продемонстрировали отличные показатели коллоидной стабильности: значение kD>0, высокое значение полученной концентрации при прямом концентрировании, низкое значение вязкости раствора с концентрацией белка 160 мг/мл.
Пример 2. Выбор рН и концентрации буферного раствора
В настоящем исследовании в качестве основы фармацевтической композиции выбраны 2 типовые буферные системы, пригодные для парентерального введения: ацетатная и гистидиновая. Исследование проводили в формате полного двухфакторного эксперимента с двумя уровнями и центральной точкой. В качестве количественных факторов исследовали уровень рН (от 5.0 до 6.0 для ацетатного буферного раствора и от 5.5 до 6.5 для гистидинового буферного раствора) и концентрацию буферных агентов (от 5 до 50 мМ).
Для оценки пригодности буферных систем было проведено исследование влияния природы буферного раствора на коллоидную и конформационную стабильность белка. В качестве отклика определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, изменение чистоты и кислотно-щелочного профиля после термического воздействия, способность к концентрированию. Исследуемые составы представлены в таблице 4.
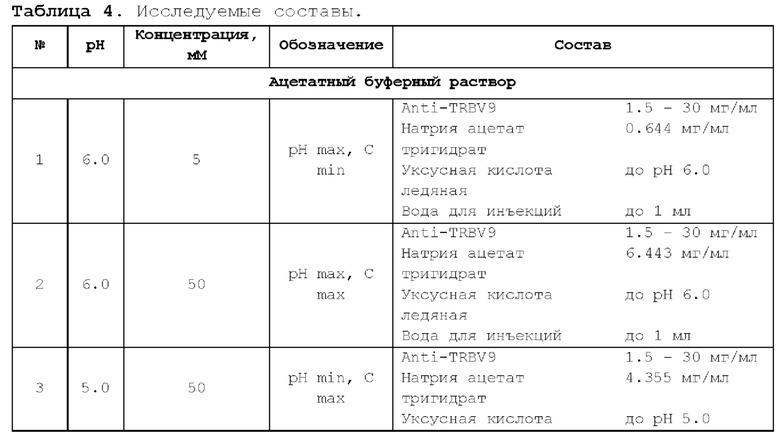
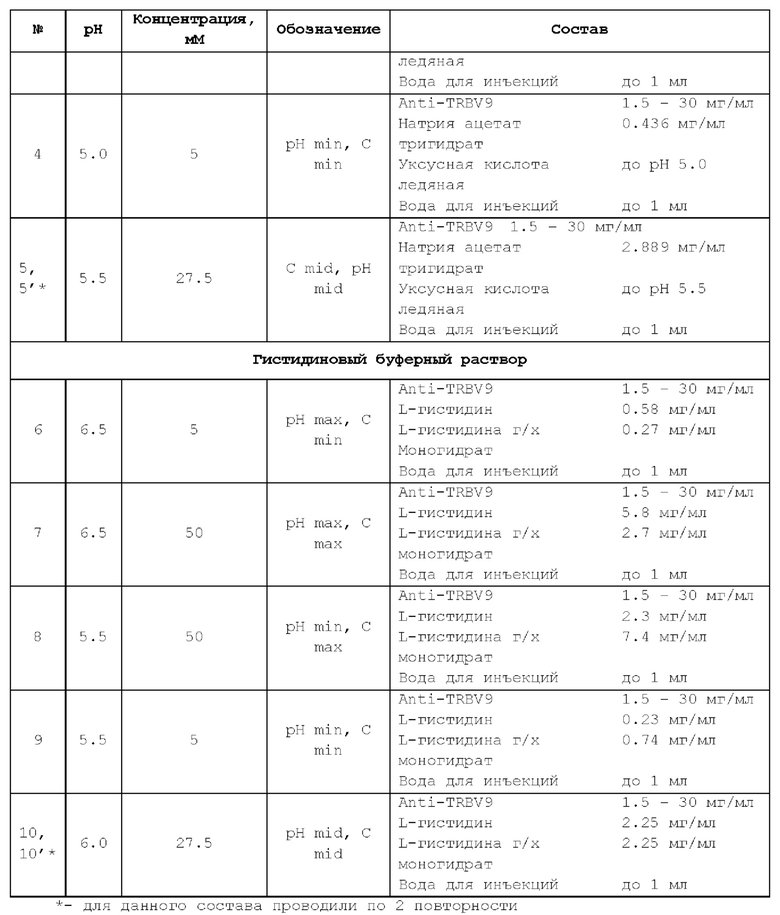
Исследование показателей прогнозирования стабильности.
Результаты исследования температуры агрегации методом 3, температуры плавления методом 4, параметра диффузионного взаимодействия методом 6 и способности к концентрированию методом 1 представлены в таблице 5.
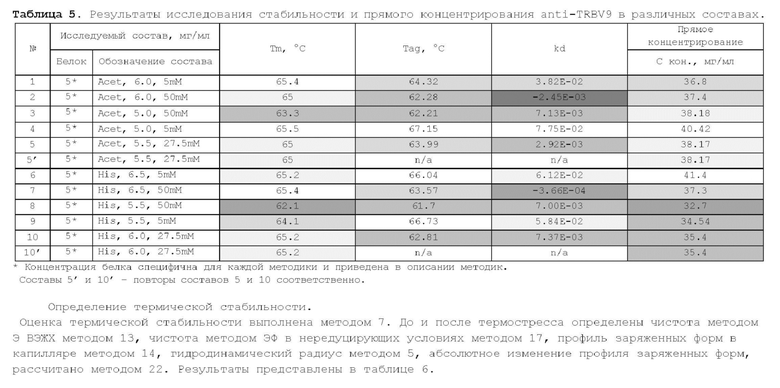
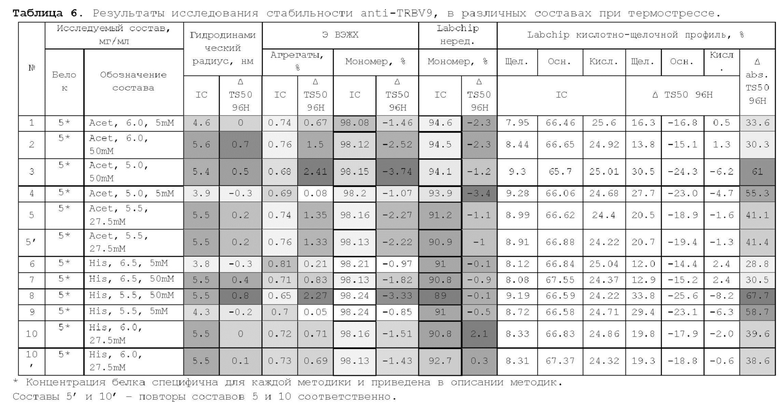
Фармацевтические композиции на основе ацетатного буфера показали отличную конформационную стабильность, высокую температуру плавления. Также для данных составов характерны: высокие температура агрегации и значение kD, незначительное увеличение примесей (при контроле Э ВЭЖХ и LabChip) и отсутствие изменения гидродинамического радиуса при термострессировании. Также для данных составов выявлены способность к стабилизации профиля заряженных форм.
Составы на основе гистидинового буфера продемонстрировали отличную конформационную стабильность: в данном буфере исследуемый белок имеет высокую температуру плавления, коллоидную стабильность: высокие температура агрегации и значение kD, что говорит о его повышенной стабильности и меньшей склонности к агрегации при проведении концентрирования и диафильтрации. Данные составы показали высокие значения концентрации при прямом концентрировании и по результатам контроля наблюдается незначительное изменение качества белка при термострессировании (при контроле Э ВЭЖХ и Labchip в нередуцирующих условиях). Также данные составы демонстрируют отличную стабилизацию кислотно-щелочного профиля.
Пример 3. Выбор осмотического агента
В настоящем исследовании в качестве основы фармацевтической композиции выбрана гистидиновая буферная система. В качестве осмотических агентов исследовали пригодные для парентерального введения вспомогательные вещества. Количество осмотических агентов, обеспечивающее близкую осмолярность к физиологическим средам организма, рассчитывали по формуле:
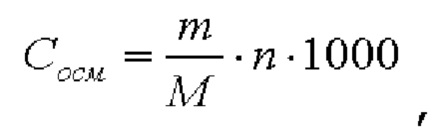
где Сосм-осмолярность раствора, миллиосмоль на литр (мОсм/л);
m-содержание вещества в растворе, г/л;
М-молярная масса вещества, г;
n-суммарное число ионов, образующихся из одной молекулы растворенного вещества в результате диссоциации (n=1 для недиссоциирующих веществ; n=2, 3 для веществ, образующих при растворении соответствующее количество ионов).
Для оценки пригодности буферных систем было проведено исследование влияния природы буферного раствора на коллоидную и конформационную стабильность белка. В качестве отклика определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, изменение чистоты и кислотно-щелочного профиля после термического воздействия, кислого гидролиза и шейкирования, а также была оценена способность к концентрированию. Исследуемые составы представлены в таблице 7.
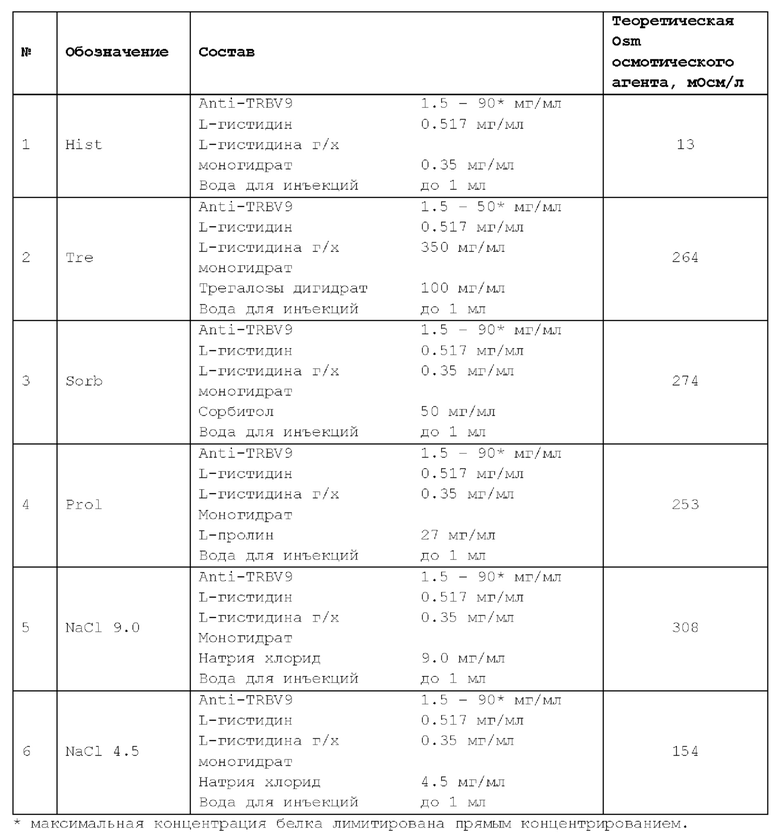
Исследование показателей прогнозирования стабильности. Результаты исследования температуры агрегации методом 3, температуры плавления методом 4, параметра диффузионного взаимодействия методом 6 и способности к концентрированию методом 1 представлены в таблице 8.
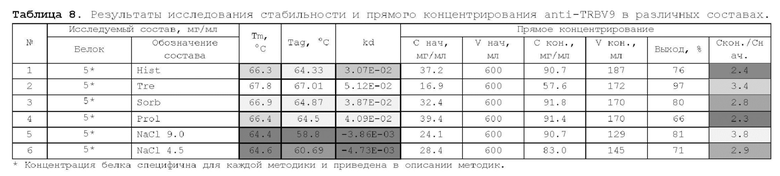
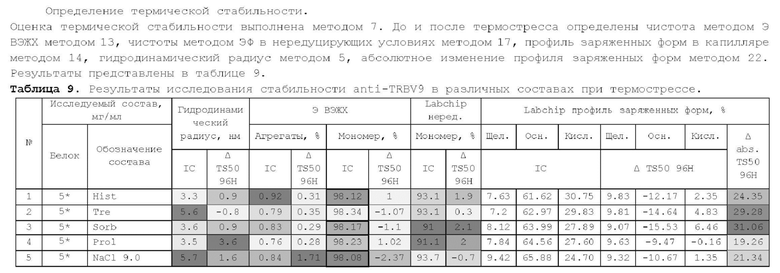
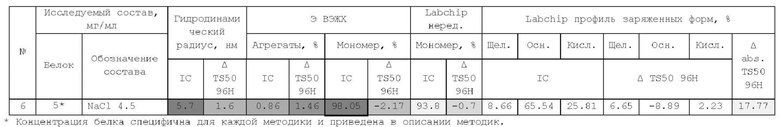
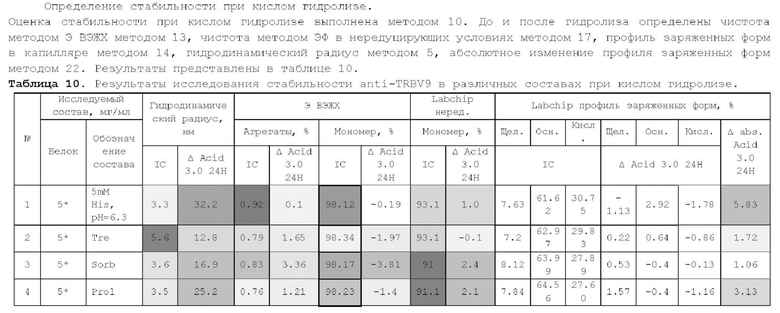
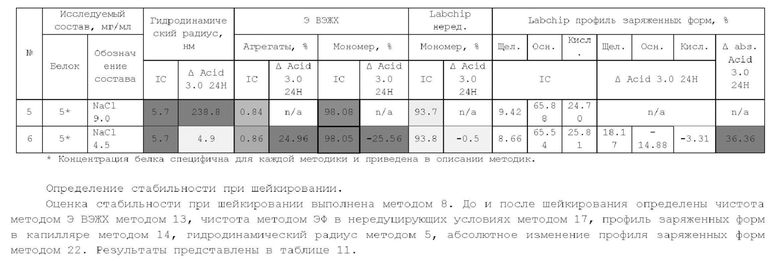
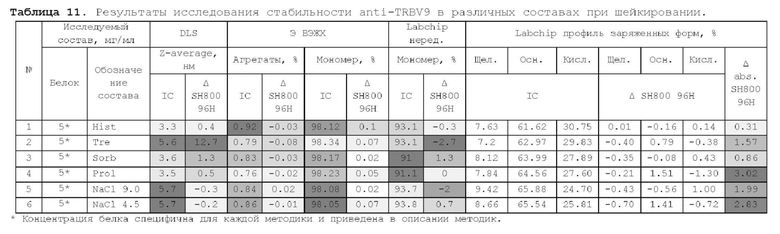
Данные составы продемонстрировали высокую температуру плавления, температуру агрегации, а также приемлемое значение kD. Данные составы показали высокое значение концентрации при прямом концентрировании и по результатам контроля наблюдается незначительное изменение качества белка при термострессировании и шейкировании (при контроле Э ВЭЖХ). Также данные составы демонстрируют незначительное значение абсолютного изменения кислотно-щелочного профиля при шейкировании и при кислом гидролизе.
Пример 4. Выбор осмотического агента при добавлении стабилизаторов
В настоящем исследовании в качестве основы фармацевтической композиции выбрана гистидиновая буферная система. В качестве стабилизаторов исследовали пригодные для парентерального введения вспомогательные вещества, перечисленные в таблице 12.
Для обеспечения физиологичной осмоляльности композиций содержание осмотических агентов было снижено с учетом вклада стабилизаторов в осмоляльность растворов.
В рамках исследования была проведена оценка влияния полученных составов на коллоидную и конформационную стабильность белка. В качестве отклика определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, изменение чистоты и кислотно-щелочного профиля после термического воздействия, шейкирования, кислого гидролиза, нескольких циклов замораживания и размораживания.
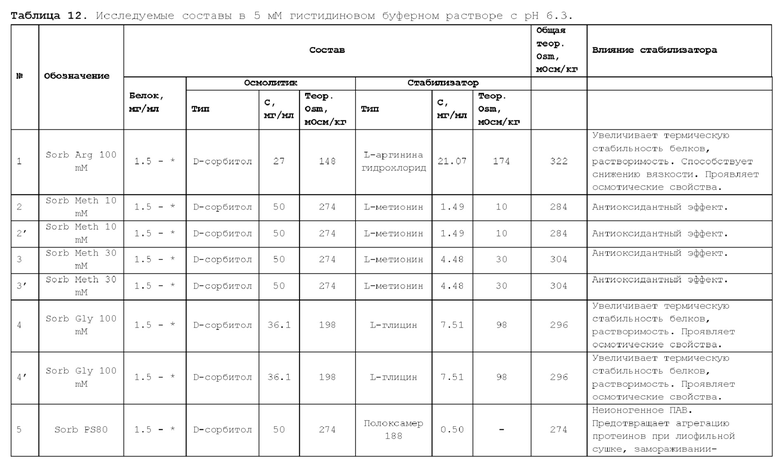
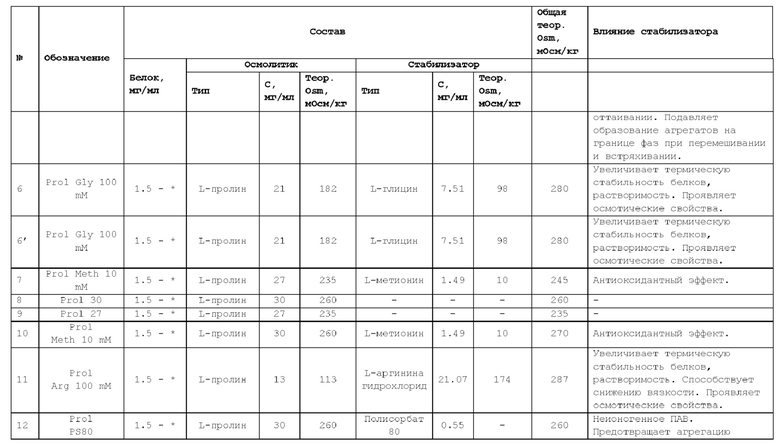
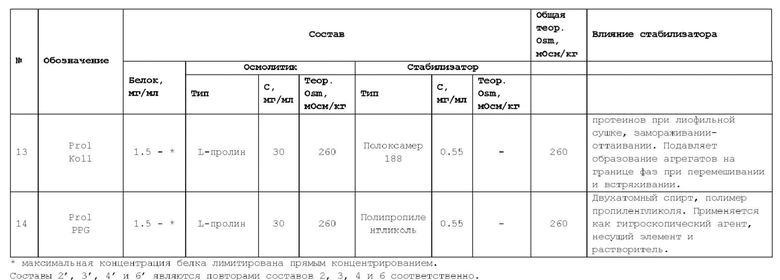

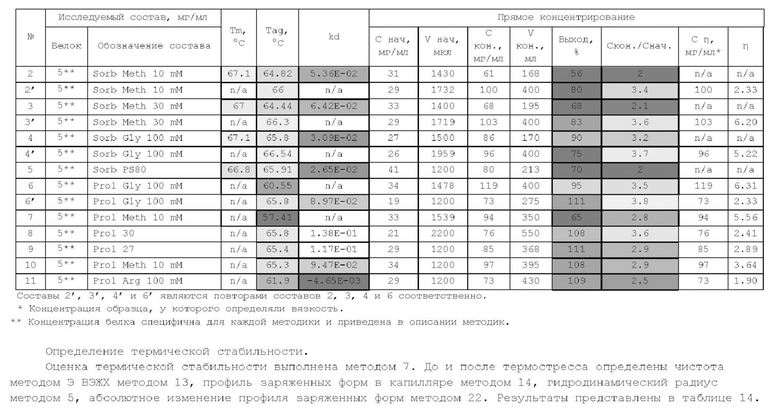
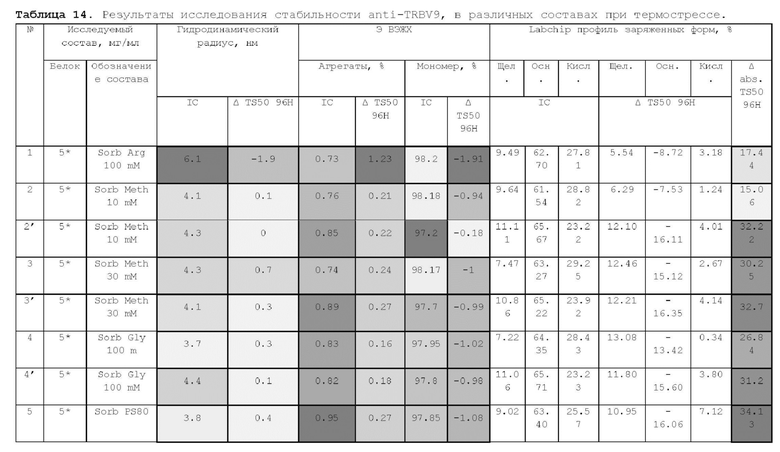
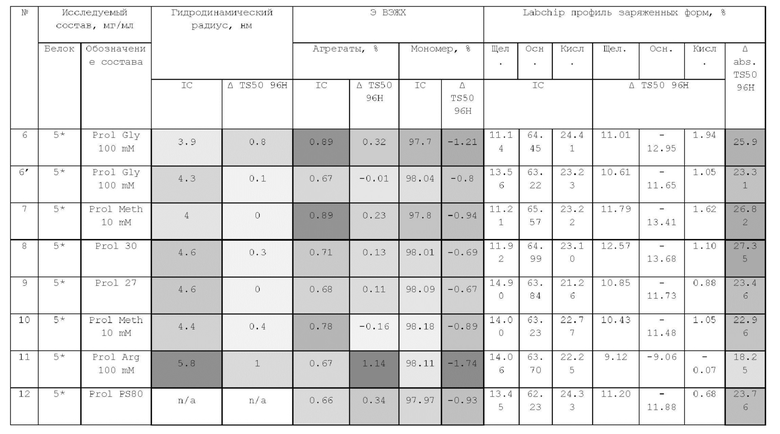
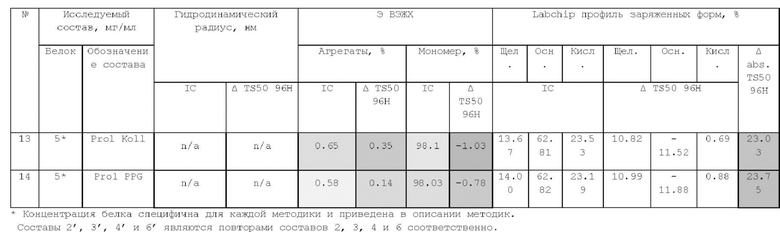
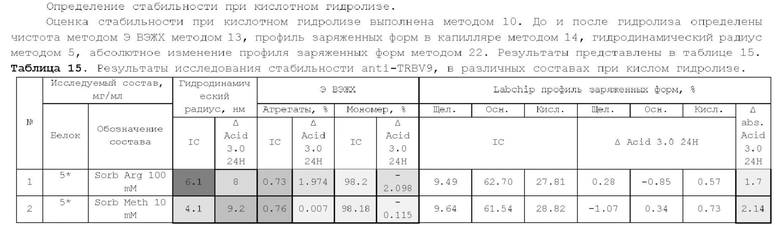
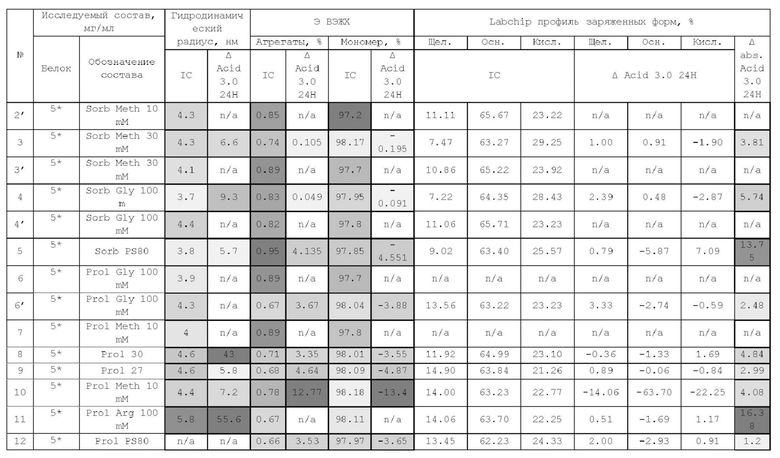
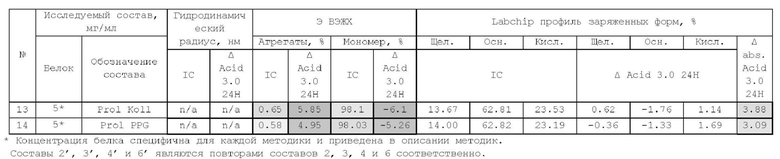
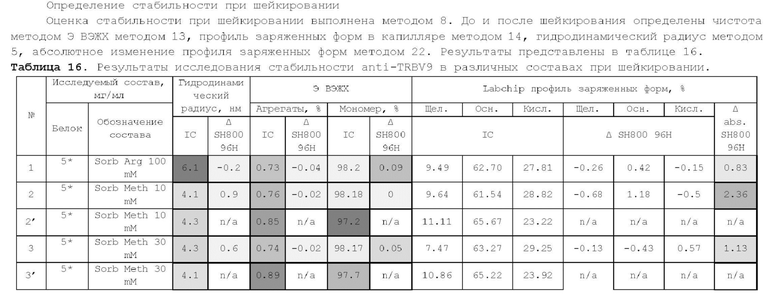
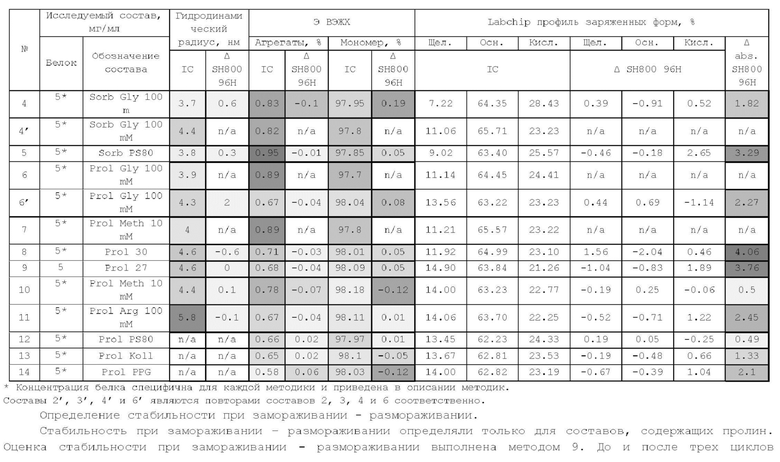
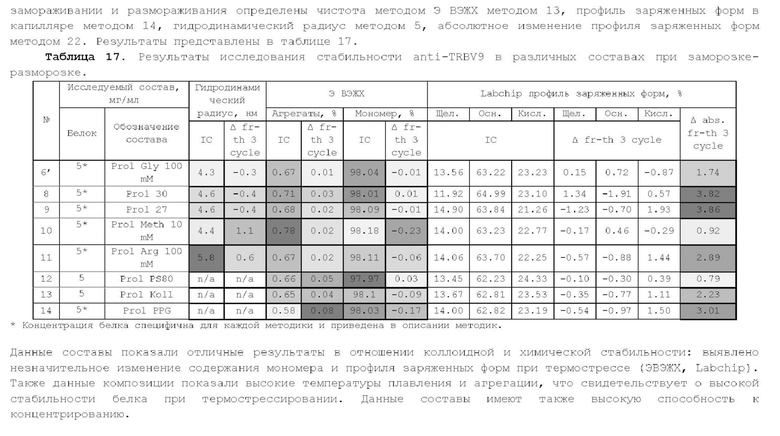
Пример 5. Определение критических количественных факторов состава и оптимизация состава
В настоящем исследовании в качестве основы фармацевтической композиции выбрана гистидиновая буферная система. Исследование проводили в формате дробного 3-факторного эксперимента с двумя уровнями. В качестве количественных факторов исследовали концентрацию белка (от 10 до 50), рН (от 5,7 до 6.9), концентрацию осмотического агента (от 19 до 35).
В рамках исследования была проведена оценка влияния исследуемых факторов на коллоидную и конформационную стабильность белка. В качестве отклика определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, изменение чистоты и кислотно-щелочного профиля после термического воздействия, шейкирования, кислого и щелочного гидролиза, нескольких циклов замораживания и размораживания, окисления.
Исследуемые составы приведены в таблице 18.
В таблице 19 приведены составы 5 mM гистидинового буфера для различных рН, участвующих в эксперименте.
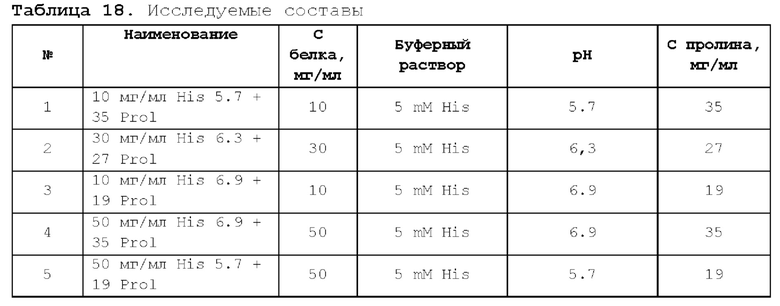

Исследование показателей прогнозирования стабильности.
Оценка точки плавления и точки начала денатурации выполнена методом 4, точки агрегации-методом 3. Оценка диффузионного параметра взаимодействия выполнена методом 6, рН измерен методом 20. Результаты представлены в таблице 20.
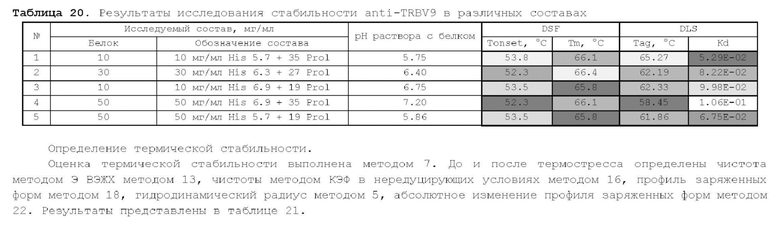
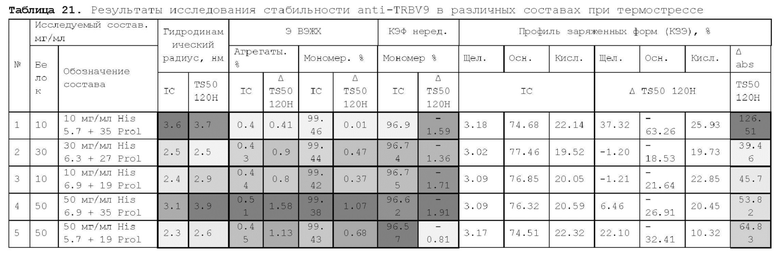
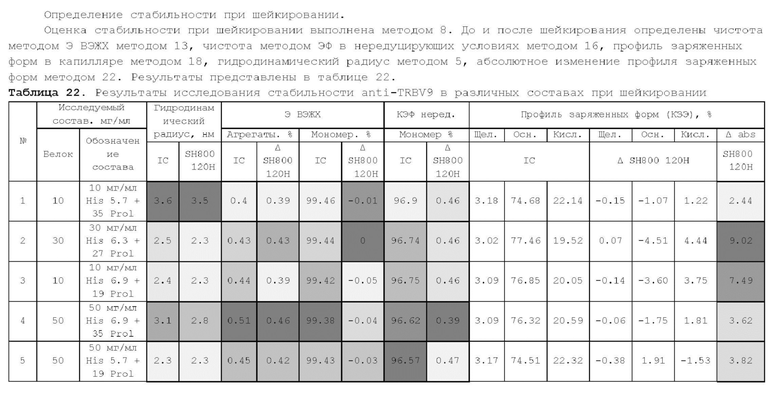
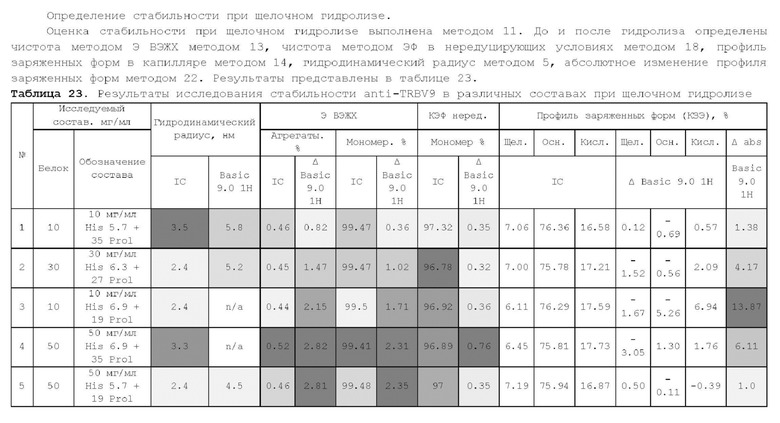
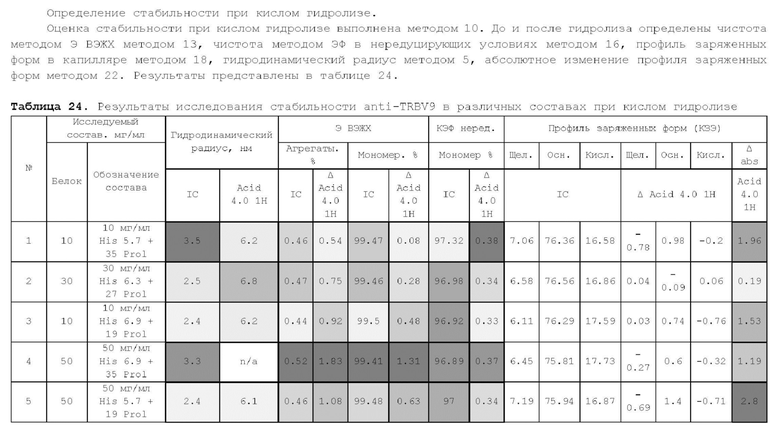
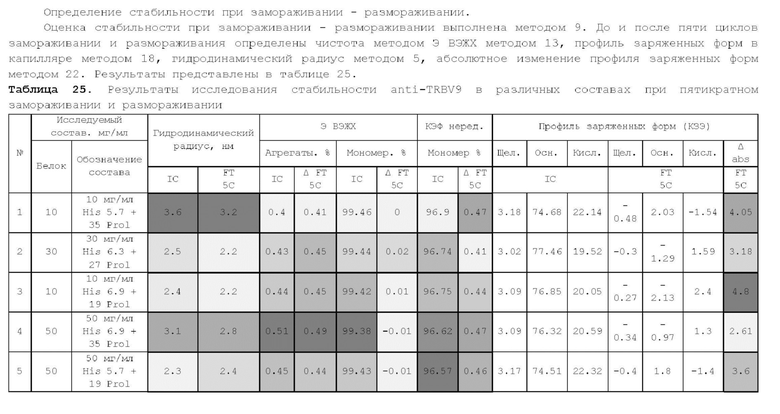
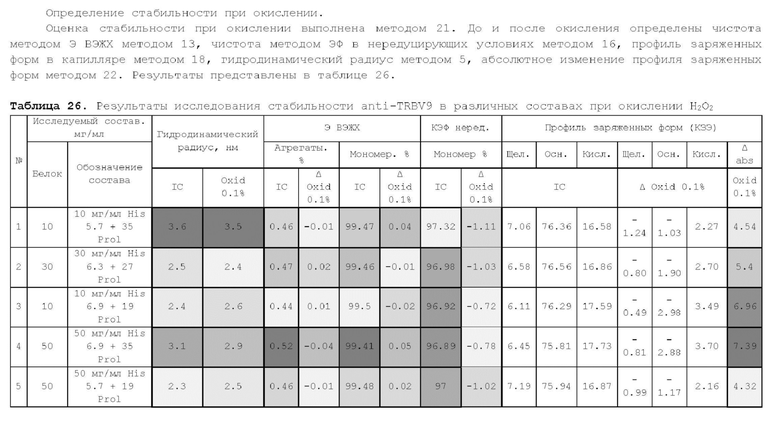
Данные составы показали отличные значения температуры плавления, температуры агрегации, гидродинамического радиуса, а также значение параметра диффузионного взаимодействия, что говорит о высокой устойчивости при термическом и других видах стрессирования. Также данные составы продемонстрировали положительное влияние на коллоидную и химическую стабильность: незначительное изменение содержания мономера (ЭВЭЖХ, КЭФ неред.) при окислении, щелочном и кислом гидролизе и замораживании-размораживании.
Пример 6. Выбор дополнительных осмотических агентов и стабилизаторов
В настоящем исследовании в качестве основы фармацевтической композиции выбрана гистидиновая буферная система (5 mM гистидиновый буфер, рН 6.3). В качестве стабилизаторов и ПАВ исследовали пригодные для парентерального введения вспомогательные вещества.
В рамках исследования была проведена оценка влияния каждого из исследуемых осмотических агентов, стабилизаторов или ПАВ на коллоидную и конформационную стабильность белка. В качестве отклика определяли температуру агрегации, температуру плавления, параметр диффузионного взаимодействия, изменение чистоты и кислотно-щелочного профиля после термического воздействия, шейкирования, нескольких циклов замораживания и размораживания. Дополнительно в инфузионных растворах данных составов был оценен гидродинамический радиус и чистота (ЭВЭЖХ) до и после хранения 24 часа при температуре 2-8°С.
Исследуемые составы приведены в таблице 27.
Исследование показателей прогнозирования стабильности.
Для составов с ПАВами не проводили тесты, связанные с нагревом, такие как определение температуры начала денатурации и температуры плавления, определение температуры агрегации по причине деградации ПАВ при нагревании и, как следствие, получения не интерпретируемых результатов. Также для них не проводили прямое концентрирование по причине возможного влияния мицеллообразования, вызванного ПАВами, на процесс концентрирования.
Результаты исследования температуры агрегации методом 3, начала денатурации и температуры плавления методом 4, параметра диффузионного взаимодействия методом 6 и прямого концентрирования методом 1 представлены в таблице 28.
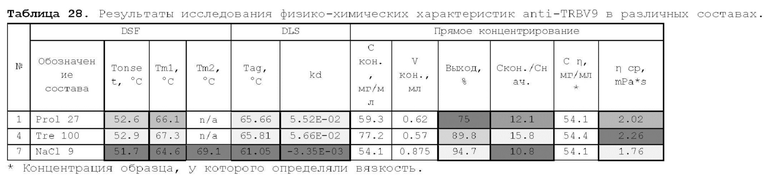
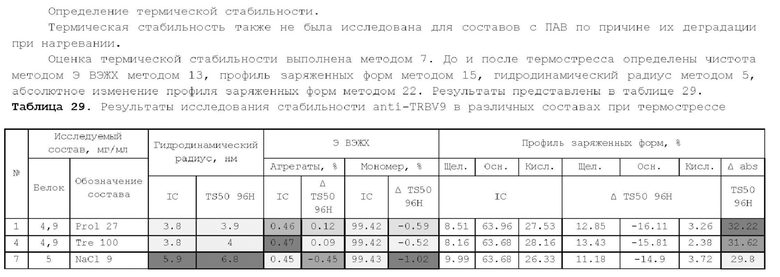
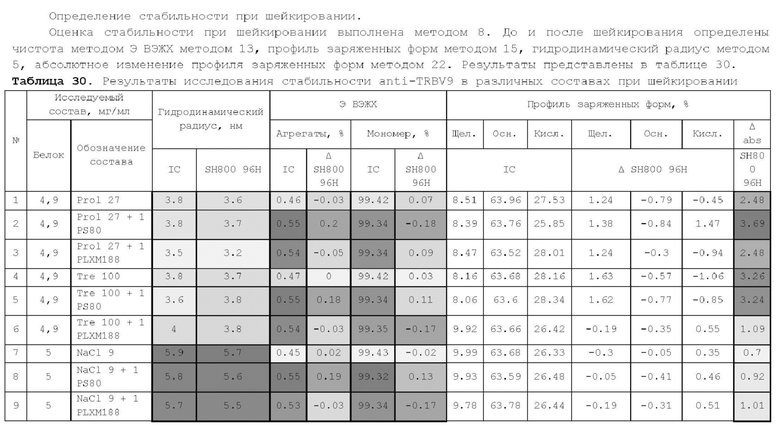
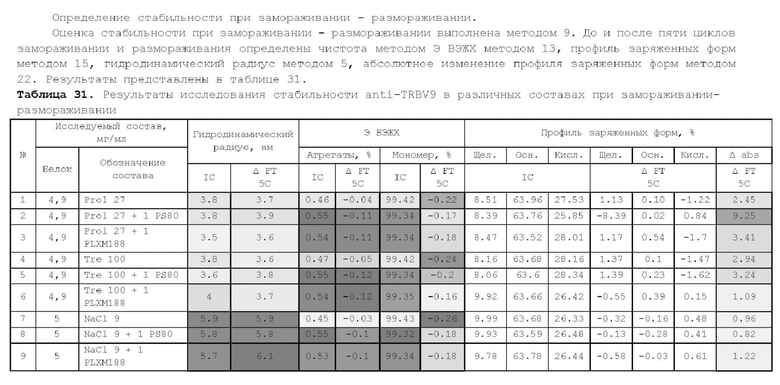
Определение стабильности инфузионных растворов полученного состава.
Инфузионные растворы готовили по методу 23. До и после хранения инфузионных растворов определены чистота методом Э ВЭЖХ методом 13, гидродинамический радиус методом 5. Результаты представлены в таблице 32.
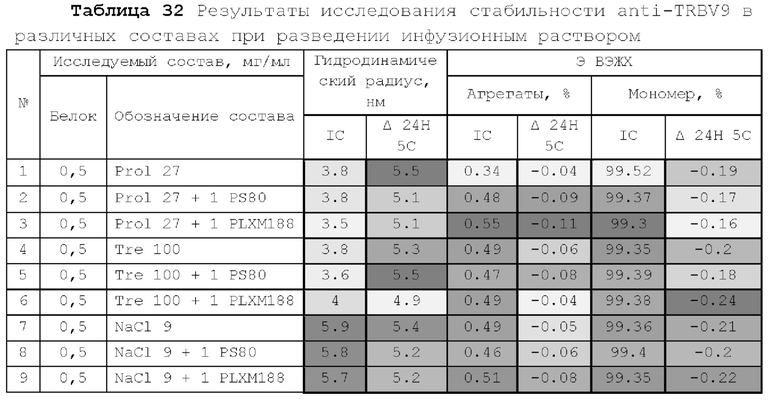
Данные составы показали высокие значения температуры начала денатурации и температуры плавления, а также температуры агрегации и параметра диффузионного взаимодействия, что свидетельствует о его повышенной термической стабильности. Данные составы продемонстрировали отличную коллоидную стабильность при шейкировании, замораживании-размораживании и разведении инфузионным раствором, также для данных составов характерны незначительное изменение содержания мономера при контроле Э ВЭЖХ и отличная стабильность профиля заряженных форм при контроле ИО ВЭЖХ при всех видах стрессирования.
Пример 7. Подтверждение стабильности при ускоренном хранении
В настоящем исследовании в качестве основы фармацевтической композиции выбрана гистидиновая буферная система (5 mM гистидиновый буфер, рН 6.3), в качестве осмотического агента был использован пролин. В рамках исследования было исследовано влияние добавления ПАВ в двух различных концентрациях: 0,5 и 1,0 мг/мл, в качестве образца сравнения был использован образец без ПАВ.
До и после стрессирования определяли изменение концентрации, рН, чистоты и кислотно-щелочного профиля.
Исследуемые составы представлены в таблице 33.
* Исследовались концентрации белка 25, 50, 100 мг/мл
Определение стабильности при ускоренном хранении.
Оценка ускоренной стабильности выполнена методом 12. До и после стресса определены содержание белка методом 2, рН методом 20, чистота методом Э ВЭЖХ методом 13, профиль заряженных форм в капилляре методом 14.
Результаты исследования представлены в таблицах 34-36.
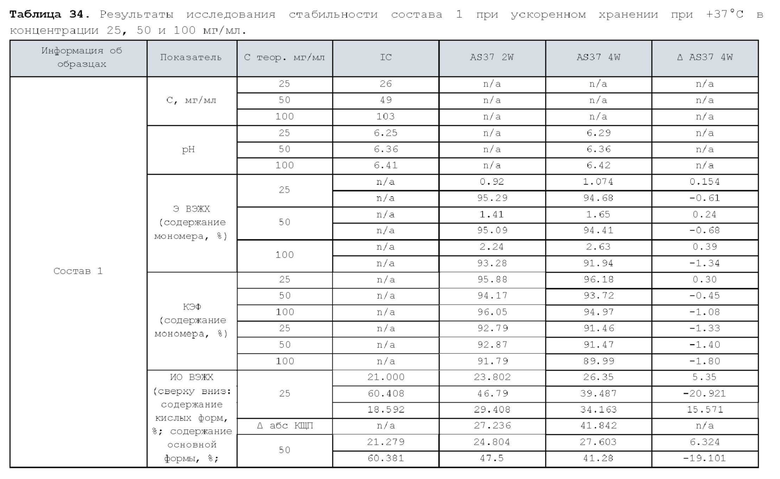
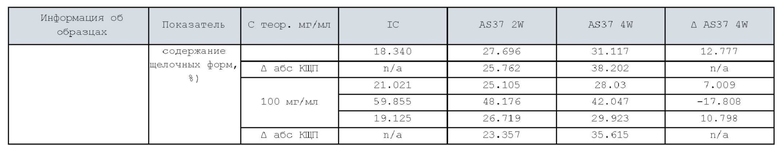
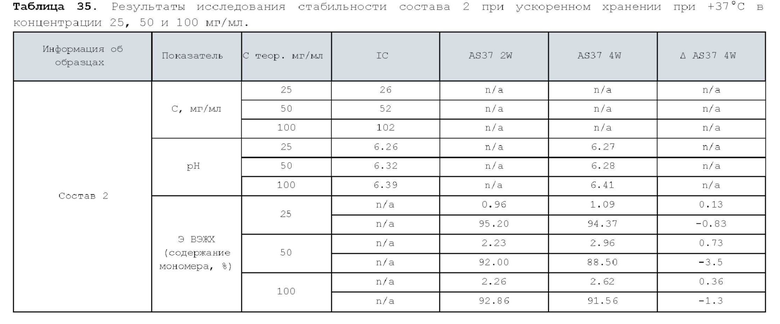
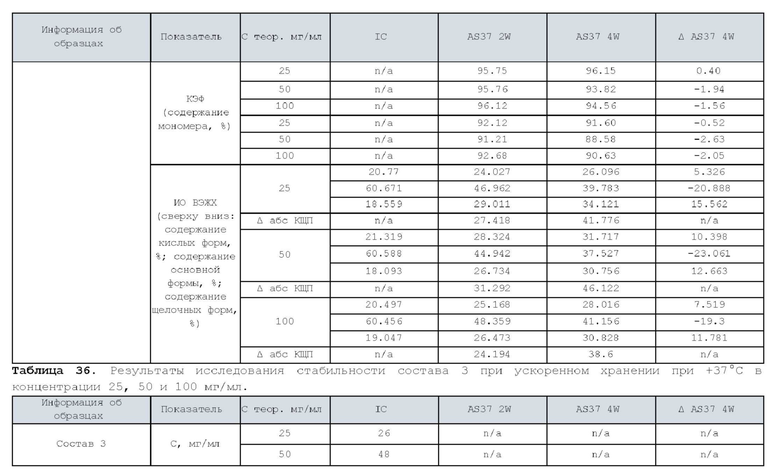
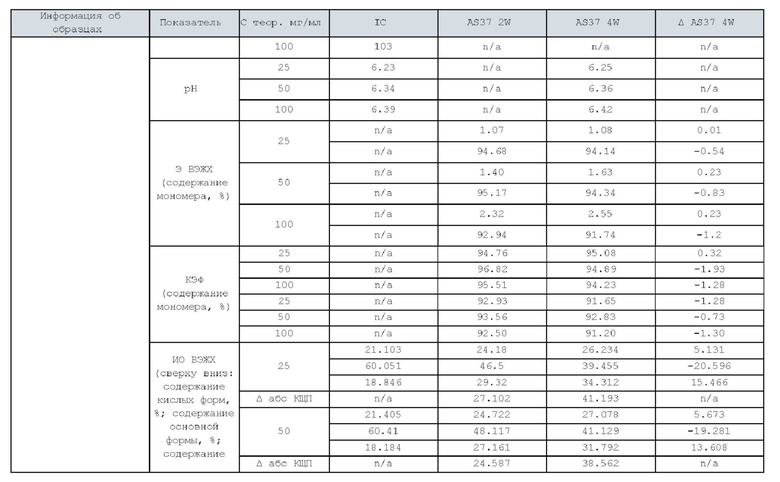
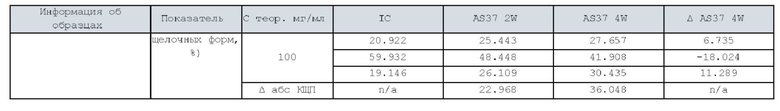
Данные составы продемонстрировали отличную коллоидную стабильность при проведении исследования стабильности при ускоренном хранении (Т=37°С), а также высокое содержание мономера при контроле ЭВЭЖХ и стабилизацию профиля заряженных форм при контроле ИО ВЭЖХ.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЗАО "БИОКАД"
<120> Фармацевтическая композиция анти-TRBV9 антитела и ее применение
<160> 25
<170> BiSSAP 1.3.6
<210> 1
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR1
<400> 1
Asp Tyr Leu Val His
1 5
<210> 2
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR2
<400> 2
Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe Glu
1 5 10 15
Gly
<210> 3
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR3_01
<400> 3
Ser Trp Arg Arg Gly Leu Arg Gly Leu Gly Phe Asp Tyr
1 5 10
<210> 4
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR3_02
<400> 4
Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr
1 5 10
<210> 5
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR3_03
<400> 5
Ser Trp Arg Arg Gly Ile Arg Gly Leu Gly Phe Asp Tyr
1 5 10
<210> 6
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HCDR3_04
<400> 6
Ser Trp Arg Arg Gly Ile Arg Gly Ile Gly Phe Asp Tyr
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_LCDR1
<400> 7
Lys Ala Ser Lys Ser Ile Asn Lys Tyr Leu Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_LCDR2
<400> 8
Asp Gly Ser Thr Leu Gln Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_LCDR3
<400> 9
Gln Gln His Asn Glu Tyr Pro Pro Thr
1 5
<210> 10
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_01
<400> 10
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Leu Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser
115 120
<210> 11
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_02
<400> 11
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser
115 120
<210> 12
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_03
<400> 12
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Ile Arg Gly Leu Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser
115 120
<210> 13
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_04
<400> 13
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Ile Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser
115 120
<210> 14
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_042
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 15
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VH_043
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Cys Ser Leu Lys Asn Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VL
<400> 16
Asp Val Gln Met Thr Gln Ser Pro Tyr Asn Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Asn Cys Lys Ala Ser Lys Ser Ile Asn Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Pro Asn Lys Leu Leu Ile
35 40 45
Tyr Asp Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Gly Leu Glu Pro
65 70 75 80
Glu Asp Phe Gly Leu Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Pro
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 17
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_VL_042_043
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Tyr Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Lys Ser Ile Asn Lys Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Pro Asn Lys Leu Leu Ile
35 40 45
Tyr Asp Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 18
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_01
<400> 18
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Leu Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 19
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_02
<400> 19
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 20
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_03
<400> 20
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Ile Arg Gly Leu Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 21
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_04
<400> 21
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Arg Glu Pro Gly Glu
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Glu Ala Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Ile Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Phe Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 22
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_042
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 23
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_HC_043
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Leu Val His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Thr Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Glu Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Ala Ser Thr Ala Asn
65 70 75 80
Leu Gln Ile Cys Ser Leu Lys Asn Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Ser Trp Arg Arg Gly Leu Arg Gly Ile Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 24
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_LC
<400> 24
Asp Val Gln Met Thr Gln Ser Pro Tyr Asn Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Asn Cys Lys Ala Ser Lys Ser Ile Asn Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Pro Asn Lys Leu Leu Ile
35 40 45
Tyr Asp Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Arg Gly Leu Glu Pro
65 70 75 80
Glu Asp Phe Gly Leu Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Pro
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 25
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> anti-TRBV9_LC_042_43
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Tyr Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Lys Ser Ile Asn Lys Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Pro Asn Lys Leu Leu Ile
35 40 45
Tyr Asp Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Glu Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И ЕГО ЛИОФИЛИЗАЦИЯ | 2018 |
|
RU2789476C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| ВОДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛЕВИЛИМАБА И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2745814C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К SOST, И ЕЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2779430C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛ К CD40 И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778572C1 |
| КОМПОЗИЦИИ АНТИ-PD-1 АНТИТЕЛ | 2019 |
|
RU2772781C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К LAG-3, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771384C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ TIGIT, ОТДЕЛЬНО И В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ РЕЦЕПТОРА 1 ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-1), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820576C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО ПРОТИВ IL-5, И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2824390C2 |
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой фармацевтическую композицию анти-TRBV9 антитела для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, содержащую анти-TRBV9 антитело, гистидиновый или ацетатный буфер, воду для инъекций, 2 объект – применение фармацевтической композиции анти-TRBV9 антитела для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, у субъекта, нуждающегося в этом. Технический результат заключается в стабильности фармацевтических композиций анти-TRBV9 антитела, которые могут быть использованы для лечения заболевания или нарушения, опосредованного Т-клеточным рецептором человека, несущим TRBV9. 2 н. и 122 з.п. ф-лы, 36 табл., 7 пр.
1. Фармацевтическая композиция анти-TRBV9 антитела для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, содержащая:
где анти-TRBV9 антитело включает:
1) вариабельный домен тяжелой цепи, содержащий:
(a) HCDR1 с аминокислотной последовательностью SEQ ID NO: 1,
(b) HCDR2 с аминокислотной последовательностью SEQ ID NO: 2
и
(c) HCDR3 с аминокислотной последовательностью, выбранной из группы SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 или SEQ ID NO: 6;
2) вариабельный домен легкой цепи, содержащий:
(a) LCDR1 с аминокислотной последовательностью SEQ ID NO: 7,
(b) LCDR2 с аминокислотной последовательностью SEQ ID NO: 8
и
(c) LCDR3 с аминокислотной последовательностью SEQ ID NO: 9.
2. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело представляет собой полноразмерное антитело IgG.
3. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело относится к изотипу IgG1, IgG2, IgG3 или IgG4 человека.
4. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID No: 14 и вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID No: 17.
5. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело включает тяжелую цепь с аминокислотной последовательностью SEQ ID No: 22 и легкую цепь с аминокислотной последовательностью SEQ ID No: 25.
6. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело включает вариабельный домен тяжелой цепи с аминокислотной последовательностью SEQ ID No: 15 и вариабельный домен легкой цепи с аминокислотной последовательностью SEQ ID No: 17.
7. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело включает тяжелую цепь с аминокислотной последовательностью SEQ ID No: 23 и легкую цепь с аминокислотной последовательностью SEQ ID No: 25.
8. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело находится в концентрации 1,5-50,0 мг/мл.
9. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело находится в концентрации 1,5-35,0 мг/мл.
10. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело находится в концентрации 4,0-6,0 мг/мл, или 8,0-12,0 мг/мл, или 23,0-32,0 мг/мл.
11. Фармацевтическая композиция по п. 1, где анти-TRBV9 антитело находится в концентрации 1,5 мг/мл, или 5,0 мг/мл, или 10,0 мг/мл, или 25,0 мг/мл, или 30,0 мг/мл, или 50,0 мг/мл, или 60,0 мг/мл, или 70,0 мг/мл, или 73,0 мг/мл, или 80,0 мг/мл, или 85,0 мг/мл, или 90,0 мг/мл, или 91,4 мг/мл, или 91,8 мг/мл, или 100,0 мг/мл.
12. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-11,0 мг/мл.
13. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-10,0 мг/мл.
14. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-8,0 мг/мл.
15. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-5,0 мг/мл.
16. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-3,0 мг/мл.
17. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-1,5 мг/мл.
18. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-1,0 мг/мл.
19. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,4-0,8 мг/мл.
20. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,45-0,6 мг/мл, или 0,65-0,8 мг/мл.
21. Фармацевтическая композиция по п. 1, где гистидин находится в концентрации 0,517 мг/мл, или 0,580 мг/мл, или 0,689 мг/мл, или 0,746 мг/мл.
22. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-15,0 мг/мл.
23. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-12,0 мг/мл.
24. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-10,0 мг/мл.
25. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-8,0 мг/мл.
26. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-6,0 мг/мл.
27. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-5,0 мг/мл.
28. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,05-4,5 мг/мл.
29. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,08-4,2 мг/мл.
30. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,08-1,0 мг/мл или 2,0-4,2 мг/мл.
31. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,08-0,15 мг/мл, или 0,2-0,4 мг/мл, или 2,2-4,2 мг/мл.
32. Фармацевтическая композиция по п. 1, где гистидина гидрохлорида моногидрат находится в концентрации 0,117 мг/мл, или 0,270 мг/мл, или 0,350 мг/мл, или 3,185 мг/мл.
33. Фармацевтическая композиция по п. 1, где натрия ацетат находится в концентрации 0,014-8,0 мг/мл.
34. Фармацевтическая композиция по п. 1, где натрия ацетат находится в концентрации 0,5-3,0 мг/мл.
35. Фармацевтическая композиция по п. 1, где натрия ацетат находится в концентрации 0,5-0,8 мг/мл, или 1,6-3,0 мг/мл.
36. Фармацевтическая композиция по п. 1, где натрия ацетат находится в концентрации 0,644 мг/мл, или 2,311 мг/мл.
37. Фармацевтическая композиция по п. 1, где натрия ацетат представляет собой натрия ацетата тригидрат.
38. Фармацевтическая композиция по п. 1, где уксусная кислота добавлена до рН 5,4-5,6 или до рН 5,9-6,1.
39. Фармацевтическая композиция по п. 1, где уксусная кислота добавлена до рН 5,5 или до рН 6,0.
40. Фармацевтическая композиция по п. 1, где уксусная кислота представляет собой уксусную кислоту ледяную.
41. Фармацевтическая композиция по п. 1 дополнительно содержащая один или несколько осмотических агентов, выбранных из: пролина, сорбитола, трегалозы или натрия хлорида.
42. Фармацевтическая композиция по п. 41, где осмотический агент находится в концентрации 0,001-200,0 мг/мл.
43. Фармацевтическая композиция по п. 41, где осмотический агент находится в концентрации 0,001-130,0 мг/мл.
44. Фармацевтическая композиция по п. 41, где пролин находится в концентрации 0,001-60,0 мг/мл.
45. Фармацевтическая композиция по п. 41, где пролин находится в концентрации 14,0-32,0 мг/мл.
46. Фармацевтическая композиция по п. 41, где пролин находится в концентрации 17,0-23,0 мг/мл или 25,0-29,0 мг/мл.
47. Фармацевтическая композиция по п. 41, где пролин находится в концентрации 19,0 мг/мл, или 21,0 мг/мл, или 27,0 мг/мл.
48. Фармацевтическая композиция по п. 41, где сорбитол находится в концентрации 0,001-100,0 мг/мл.
49. Фармацевтическая композиция по п. 41, где сорбитол находится в концентрации 20,0-80,0 мг/мл.
50. Фармацевтическая композиция по п. 41, где сорбитол находится в концентрации 35,0-65,0 мг/мл.
51. Фармацевтическая композиция по п. 41, где сорбитол находится в концентрации 50,0 мг/мл.
52. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 0,001-200,0 мг/мл.
53. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 0,001-180,0 мг/мл.
54. 63. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 40,0-160,0 мг/мл.
55. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 60,0-140,0 мг/мл.
56. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 70,0-130,0 мг/мл.
57. Фармацевтическая композиция по п. 41, где трегалоза находится в концентрации 100,0 мг/мл.
58. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 0,001-18,0 мг/мл.
59. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 3,0-16,0 мг/мл.
60. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 5,0-14,0 мг/мл.
61. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 7,0-12,0 мг/мл.
62. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 7,5-11,5 мг/мл.
63. Фармацевтическая композиция по п. 41, где натрия хлорид находится в концентрации 9,0 мг/мл.
64. Фармацевтическая композиция по пп. 1, 41, дополнительно содержащая один или несколько стабилизаторов, выбранных из аминокислоты или поверхностно-активного вещества,
где аминокислота представляет собой глицин или метионин; где поверхностно-активное вещество представляет собой полоксамер 188, или полисорбат 80, или полипропиленгликоль.
65. Фармацевтическая композиция по п. 64, где аминокислота находится в концентрации 0,001-100,0 мг/мл.
66. Фармацевтическая композиция по п. 64, где аминокислота находится в концентрации 1,1-9,5 мг/мл.
67. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-100,0 мг/мл.
68. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-80,0 мг/мл.
69. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-60,0 мг/мл.
70. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-40,0 мг/мл.
71. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-20,0 мг/мл.
72. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 0,001-15,0 мг/мл.
73. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 3,0-12,0 мг/мл.
74. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 5,5-9,5 мг/мл.
75. Фармацевтическая композиция по п. 64, где глицин находится в концентрации 7,51 мг/мл.
76. Фармацевтическая композиция по п. 64, где метионин находится в концентрации 0,001-5,8 мг/мл.
77. Фармацевтическая композиция по п. 64, где метионин находится в концентрации 1,1-5,8 мг/мл.
78. Фармацевтическая композиция по п. 64, где метионин находится в концентрации 1,1-1,9 мг/мл или 3,2-5,8 мг/мл.
79. Фармацевтическая композиция по п. 64, где метионин находится в концентрации 1,49 мг/мл или 4,48 мг/мл.
80. Фармацевтическая композиция по п. 64, где поверхностно-активное вещество находится в концентрации 0,001-6,0 мг/мл.
81. Фармацевтическая композиция по п. 64, где поверхностно-активное вещество находится в концентрации 0,35-1,3 мг/мл.
82. Фармацевтическая композиция по п. 64 где полоксамер 188 находится в концентрации 0,001-6,0 мг/мл.
83. Фармацевтическая композиция по п. 64, где полоксамер 188 находится в концентрации 0,001-4,0 мг/мл.
84. Фармацевтическая композиция по п. 64, где полоксамер 188 находится в концентрации 0,001-2,5 мг/мл.
85. Фармацевтическая композиция по п. 64, где полоксамер 188 находится в концентрации 0,35-1,3 мг/мл.
86. Фармацевтическая композиция по п. 64, где полоксамер 188 находится в концентрации 0,35-0,65 мг/мл или 0,7-1,3 мг/мл.
87. Фармацевтическая композиция по п. 64, где полоксамер 188 находится в концентрации 0,5 мг/мл или 1,0 мг/мл.
88. Фармацевтическая композиция по п. 64, где полисорбат 80 находится в концентрации 0,001-5,0 мг/мл.
89. Фармацевтическая композиция по п. 64, где полисорбат 80 находится в концентрации 0,001-3,5 мг/мл.
90. Фармацевтическая композиция по п. 64, где полисорбат 80 находится в концентрации 0,001-2,5 мг/мл.
91. Фармацевтическая композиция по п. 64, где полисорбат 80 находится в концентрации 0,7-1,3 мг/мл.
92. Фармацевтическая композиция по п. 64, где полисорбат 80 находится в концентрации 1,0 мг/мл.
93. Фармацевтическая композиция по п. 41, содержащая:
94. Фармацевтическая композиция по п. 41, содержащая:
95. Фармацевтическая композиция по п. 41, содержащая:
96. Фармацевтическая композиция по п. 41, содержащая:
97. Фармацевтическая композиция по п. 41, содержащая:
98. Фармацевтическая композиция по п. 41, содержащая:
99. Фармацевтическая композиция по п. 41, содержащая:
100. Фармацевтическая композиция по п. 41, содержащая:
101. Фармацевтическая композиция по п. 41, содержащая:
102. Фармацевтическая композиция по п. 4 1, содержащая:
103. Фармацевтическая композиция по п. 41, содержащая:
104. Фармацевтическая композиция по п. 41, содержащая:
105. Фармацевтическая композиция по п. 41, содержащая:
106. Фармацевтическая композиция по п. 41, содержащая:
107. Фармацевтическая композиция по п. 41, содержащая:
108. Фармацевтическая композиция по п. 4 1, содержащая:
109. Фармацевтическая композиция по п. 41, содержащая:
110. Фармацевтическая композиция по п. 4 1, содержащая:
111. Фармацевтическая композиция по п. 41, содержащая:
112. Фармацевтическая композиция по п. 41, содержащая:
113. Фармацевтическая композиция по п. 41, содержащая:
114. Фармацевтическая композиция по п. 41, содержащая:
115. Фармацевтическая композиция по п. 41, содержащая:
116. Фармацевтическая композиция по п. 41, содержащая:
117. Фармацевтическая композиция по п. 41, содержащая:
118. Фармацевтическая композиция по п. 41, содержащая:
119. Фармацевтическая композиция по п. 41, содержащая:
120. Фармацевтическая композиция по п. 41, содержащая:
121. Применение фармацевтической композиции анти-TRBV9 антитела по любому из пп. 1-120 для лечения заболевания или нарушения, опосредованного Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, у субъекта, нуждающегося в этом.
122. Применение по п. 121, где заболевание или нарушение, опосредованное Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, выбрано из группы: артропатиии, воспалительные заболевания кишечника, заболевания глаз, васкулиты, болезни системы кровообращения, заболевания почек, заболевания пищеварительной системы, лимфопролиферативные заболевания.
123. Применение по п. 122, где заболевание или нарушение, опосредованное Т-лимфоцитами, несущими в составе Т-клеточного рецептора сегмент TRBV9, выбрано из группы: спондилоартриты, сакроилиит, ассоциированный с псориазом, сакроилиит, ассоциированный с воспалительными заболеваниями кишечника, недифференцированная олигоартропатия, ювенильный спондилоартрит/энтезит-ассоциированный артрит, юношеский анкилозирующий спондилит (артрит, ассоциированный с энтезитом), ювенильный артрит, недифференцированный ювенильный артрит, язвенный колит, болезнь Крона, неинфекционные увеиты, передний увеит, болезнь Бехчета, аортит, фиброз створок аортального и/или митрального клапанов с регургитацией, нарушения ритма, нарушения проводимости, нарушения функции левого желудочка, перикардит, миокардит, IgA-нефропатия, целиакия, Т-клеточная лимфома, Т-клеточный лейкоз.
124. Применение по п. 123, где спондилоартрит представляет собой рентгенологический аксиальный спондилоартрит (анкилозирующий спондилит), аксиальный спондилоартрит, периферический спондилоартрит, псориатический артрит, спондилоартрит, ассоциированный с воспалительными заболеваниями кишечника, реактивный артрит, недифференцированный периферический спондилоартрит.
| Моноклональные антитела, которые специфически связываются с участком бета цепи семейства TRBV-9 Т-клеточного рецептора человека, и способы их применения | 2018 |
|
RU2711871C1 |
| Гуманизированные антитела против участка бета цепи 9-го семейства TRBV9 TKP человека, и способы их применения | 2018 |
|
RU2712251C1 |
| WO 2020204765 A1, 08.10.2020 | |||
| НОВЫЙ СОСТАВ, СОДЕРЖАЩИЙ КОНЪЮГАТ ПЭГ И ИНТЕРФЕРОН-АЛЬФА-2БЕТА, ОБЛАДАЮЩИЙ СНИЖЕННОЙ БОЛЕЗНЕННОСТЬЮ ПРИ ВВЕДЕНИИ | 2014 |
|
RU2572800C1 |
| Водная фармацевтическая композиция рекомбинантного моноклонального антитела к ФНОα | 2016 |
|
RU2665966C2 |
| ВОДНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ЛЕВИЛИМАБА И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2745814C1 |
| US 2020046812 A1, 13.02.2020. | |||
Авторы
Даты
2024-09-17—Публикация
2022-01-31—Подача