ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к кератину BD-4, молекуле нуклеиновой кислоты, кодирующей кератин BD-4, экспрессирующему вектору, содержащему указанную молекулу нуклеиновой кислоты, клетке-хозяину, содержащей указанный экспрессирующий вектор или геном, в который интегрирована указанная молекула нуклеиновой кислоты, к способам получения кератина BD-4 и фармацевтическим композициям, содержащим указанный кератин. Кроме того, указанный кератин и указанную фармацевтическую композицию применяют в изготовлении жаропонижающих, анальгезирующих, противокашлевых отхаркивающих, противосудорожных, противоэпилептических, гипотензивных, противовоспалительных и противовирусных лекарственных средств.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Кератин представляет собой белок, который широко встречается в эпидермисе человека и животных и является основным компонентом волос, перьев, копыт, раковин, когтей, рогов и так далее. Он представляет собой чрезвычайно важный структурный белок для соединительной ткани и играет роль в защите организма.
Кератин широко представлен в организме и является возобновляемым источником огромного значения, но он не имел широкого и эффективного применения. Основная причина заключается в том, что кератин не растворим в различных растворителях и кератин обычно более устойчив к ферментативному гидролизу протеазами по сравнению с другими белками. Таким образом, природный кератин очень трудно экстрагировать и получить.
Благодаря бурному развитию современной биотехнологии, такой как геномика, протеомика, генная инженерия и инженерия микроорганизмов, было открыто все больше и больше генов. Использование систем экспрессии белков для получения и производства целевых белков является важным способом изучения биологических функций генов или белков.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая задача, которую решает настоящее изобретение, заключается в предоставлении кератина BD-4, молекулы нуклеиновой кислоты, кодирующей кератин BD-4, экспрессирующего вектора, содержащего указанную молекулу нуклеиновой кислоты, и клетки-хозяина, содержащей указанный экспрессирующий вектор или геном, в который интегрирована указанная молекула нуклеиновой кислоты, а также способов получения кератина BD-4, фармацевтических композиций, содержащих кератин BD-4, и применения вышеуказанных кератина BD-4, молекулы нуклеиновой кислоты, экспрессирующего вектора, клетки-хозяина или фармацевтических композиций в изготовлении жаропонижающих, анальгезирующих, противокашлевых отхаркивающих, противосудорожных, противоэпилептических, понижающих кровяное давление, противовоспалительных и противовирусных лекарственных средств.
Для решения технических задач настоящего изобретения в настоящем изобретении предложены следующие технические решения:
Первый аспект технического решения по настоящему изобретению относится к кератину BD-4, отличающемуся тем, что его аминокислотная последовательность представляет собой:
(1) аминокислотную последовательность, приведенную в SEQ ID NO. 1 в перечне последовательностей.
(2) аминокислотную последовательность, приведенную в SEQ ID NO. 1 в перечне последовательностей, образованную путем замены, делеции или добавления 1-35 аминокислот с образованием аминокислотной последовательности, которая по существу сохраняет ту же биологическую функцию.
Кроме того, могут быть осуществлены стандартные модификации кератина BD-4, или к кератину BD-4 может быть присоединена метка для детекции или очистки.
Кроме того, стандартные модификации включают ацетилирование, амидирование, циклизацию, гликозилирование, фосфорилироввание, алкилирование, биотинилирование, модификацию флуоресцентными группами, модификацию полиэтиленгликолем PEG, модификацию иммобилизацией, сульфатирование, окисление, метилирование, дезаминирование, образование дисульфидных связей или разрыв дисульфидных связей; метки включают His6, GST, EGFP, MBP, Nus, HA, IgG, FLAG, c-Myc, Profinity eXact.
Второй аспект технического решения по настоящему изобретению относится к молекуле нуклеиновой кислоты, кодирующей кератин BD-4 по первому аспекту.
Кроме того, нуклеотидная последовательность указанной молекулы нуклеиновой кислоты представляет собой:
(1) Нуклеотидную последовательность, приведенную в SEQ ID NO. 2 в перечне последовательностей.
(2) Нуклеотидные последовательности, полученные путем оптимизации последовательности на основе нуклеотидной последовательности, приведенной в SEQ ID NO. 2.
(3) Нуклеотидные последовательности, комплементарные нуклеотидной последовательности, указанной выше в (1) или (2).
Третий аспект технического решения по настоящему изобретению относится к экспрессирующему вектору, отличающемуся тем, что он содержит молекулу нуклеиновой кислоты, описанную во втором аспекте.
Кроме того, указанный экспрессирующий вектор может относиться к серии рЕТ, серии pUC, серии pQE, серии pBV, серии pMAL, pPIC9, pPIC9K, pHIL-S1, pPICZα/A, pYAM75P, pHIL-D2, pA0815, pPIC3K, pPICZ, pHWO10, pGAPZ, pGAPZa, pPIC3.5K и так далее; предпочтительный экспрессирующий вектор представляет собой вектор серии рЕТ; наиболее предпочтительный экспрессирующий вектор представляет собой рЕТ-28а(+).
Четвертый аспект технического решения по настоящему изобретению относится к клетке-хозяину отличающейся тем, что она содержит экспрессирующий вектор по третьему аспекту или молекула нуклеиновой кислоты по второму аспекту интегрирована в геном.
Кроме того, указанная клетка-хозяин включает бактерии, дрожжи, аспергилл, клетки растений или клетки насекомых.
Кроме того, указанные бактерии включают Escherichia coli или дрожжи.
Компетентные клетки-хозяева могут относиться к серии BL21, серии Transetta, серии Rosetta, серии DH5α, серии JM, серии Тор, серии Orgami, Trans 1-Т1, TG1, TB1; Y11430, MG1003, GS115 (AOX1), KM71, SMD1168 и так далее; предпочтительные компетентные клетки для экспрессии представляют собой BL21 (DE3), Transetta (DE3).
Пятый аспект технического решения по настоящему изобретению относится к способу получения кератина BD-4 по первому аспекту, отличающемуся тем, что он включает следующие стадии:
A. Синтезируют молекулу нуклеиновой кислоты, соответствующей кератину BD-4, описанному в первом аспекте, связывают указанную молекулу нуклеиновой кислоты в соответствующий экспрессирующий вектор и трансформируют клетку-хозяина указанным экспрессирующий вектором. Культивируют клетк-хозяева с экспрессирующий вектором в оборудовании для ферментации при определенных условиях и индуцируют экспрессию кератина BD-4 с получением раствора неочищенного белка, содержащего кератин BD-4.
B. Раствор неочищенного белка, экспрессированного на стадии А, отделяют, очищают и сушат с получением кератина BD-4.
Кроме того, на стадии А указанные клетки-хозяева в основном выбирают из Escherichia coli, кератин BD-4 экспрессируется в тельцах включения Escherichia coli, а оборудование для ферментации включает встряхиваемые колбы или ферментеры.
Кроме того, на стадии А после индуцирования экспрессии кератина BD-4 примеси можно отмыть посредством очищающих агентов и растворить с получением раствора для получения раствора неочищенного белка.
Кроме того, среда на стадии А может представлять собой среду LB, среду ТВ, среду SB, среду SOB, среду SOC, среду PDA, среду YPD, среду с бенгальским красным, среду Chashi с высоким содержанием солей, среду DOBA, среду на основе риса кодзи и ее модифицированный состав, и так далее; для ферментации во встряхиваемых колбах предпочтительна среда LB, среда ТВ, наиболее предпочтительна среда ТВ; для ферментера предпочтительна среда LB и ее модифицированный состав.
Кроме того, индуктор на стадии А может представлять собой IPTG (изопропилтиогалактозид), лактозу, арабинозу и так далее; предпочтительны IPTG и лактоза.
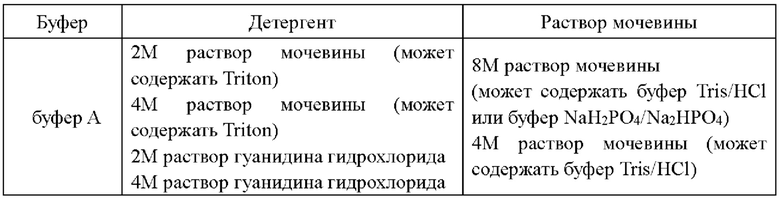
Кроме того, на стадии А полученную культуральную жидкость центрифугируют и затем отбрасывают супернатант; осадок суспендируют в буфере, бактерии разрушаются, вновь центрифугируют и отбрасывают супернатант; после промывания осадка детергентом его вновь растворяют в растворе мочевины с получением раствора неочищенного белка BD-4.
При этом буфер предпочтительно представляет собой буфер А, и пропорции являются следующими: объем культуральной жидкости : объем буфера А=1~100:1, предпочтительно 10:1;
Очищающий агент может представлять собой раствор мочевины, раствор гуанидина гидрохлорида, Тритон и буфер А, и так далее, предпочтительно раствор мочевины, наиболее предпочтительно 2М раствор мочевины (может содержать 1% Тритон). Пропорции являются следующими: объем культуральной жидкости : объем 2М мочевины = 0,2~100:1, предпочтительно 1~15:1;
Раствор мочевины предпочтительно представляет собой 8М раствор мочевины, и пропорции являются следущими: объем культуральной жидкости : объем 8М мочевины = 0,2~100:1, предпочтительно 2~15:1.
Кроме того, на стадии В способ разделения и очистки включает способ очистки по технологии мембранной ультрафильтрации и микрофильтрации, способ очистки посредством колоночной хроматографии, способ высаливания и способ диализа.
Кроме того, на стадии В способ разделения и очистки представляет собой следующее:
(1) Способ диализа предназначен для очистки раствора неочищенного белка, полученного на стадии А, методом диализа для получения раствора целевого белка BD-4.
Отсечение по молекулярной массе у диализного мешка может составлять 0,5-10 кДа, предпочтительное отсечение по молекулярной массе диализного мешка составляет 3,5-10 кДа, а наиболее предпочтительное отсечение по молекулярной массе диализного мешка составляет 10 кДа.
(2) В способе ультрафильтрации и микрофильтрации раствор неочищенного белка, полученный на стадии А, очищают посредством мембранной технологии, такой как мембрана для ультрафильтрации или мембрана для микрофильтрации с получением концентрированного раствора целевого белка BD-4.
Предпочтительно, очистку с применением мембраны для микрофильтрации осуществляют дважды, первый раз размер пор мембраны составляет 1000~1500 нм, а второй раз размер пор мембраны составляет 20~50 нм.
(3) Способ колоночной хроматографии предназначен для пропускания раствора неочищенного белка, полученного на стадии А, через хроматографическую колонку, такую как различные обменные колонки или колонки для эксклюзионной хроматографии, для выделения и очистки целевого белка BD-4.
Предпочтительная колонка для эксклюзионной хроматографии представляет собой колонку с декстрановым гелем, Superdex 30 Increase, Superdex 75 Increase, Superdex 200 Increase и Superose 6 Increase и так далее.
Предпочтительная обменная колонка представляет собой колонку с ионообменной смолой: колонку с анионообменной смолой: HiTrap Q FF, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE, Toyopearl Q-650M и Toyopearl SuperQ-650M и так далее; колонку с катионообменной смолой: HiTrap SP FF, HiTrap Capto SP ImpRes, Capto SP ImpRes, HiTrap Capto SP, Toyopearl SP-650M и Toyopearl Super SP-650M. Наиболее предпочтительна колонка с анионообменной смолой.
В качестве элюента можно использовать общепринятые в области техники элюенты, такие как вода и солевой раствор. Солевой раствор включает раствор хлорида натрия, раствор однозамещенного фосфата натрия, раствор двузамещенного фосфата натрия, ацетат натрия, уксусную кислоту и тому подобное.
(4) Способ высаливания предназначен для очистки раствора неочищенного белка, полученного на стадии А, методом высаливания для получения суспензии целевого белка BD-4.
Высаливающий реагент может представлять собой сульфат аммония, сульфат натрия, хлорид натрия, хлорид магния, сульфат алюминия, нитрат аммония, хлорид аммония, сульфат магния и тому подобное. Предпочтительный высаливающий агент представляет собой сульфат аммония и его водный раствор. Насыщенный водный раствор сульфата аммония добавляют для достижения конечной концентрации сульфата аммония 10-50%, предпочтительно 20-30%, более предпочтительно 25%.
Количество высаливаний составляет от 1 до 3 раз, предпочтительно 2 раза.
После высаливания осадок промывают чистой водой, а частота промываний составляет от 2 до 5 раз, предпочтительно 3 раза.
Кроме того, раствор целевого белка BD-4, очищенного на стадии В, может быть подвергнут лиофилизационной сушке или вакуумной сушке в сухой порошок, либо концентрированный раствор может быть подвергнут распылительной сушке непосредственно в сухой порошок.
В шестом аспекте технического решения по настоящему изобретению предложена фармацевтическая композиция, отличающаяся тем, что она содержит кератин BD-4, описанный в пятом аспекте, или молекулу нуклеиновой кислоты, описанную во втором аспекте, или первый экспрессирующий вектор по третьему аспекту, или клетку-хозяина по четвертому аспекту, и фармацевтически приемлемый носитель или эксципиент.
Кератин, полученный на вышеуказанных стадиях настоящего изобретения, может быть подвергнут лиофилизационной сушке или вакуумной сушке в сухой порошок, либо концентрированная жидкость может быть подвергнута распылительной сушке непосредственно в сухой порошок, а затем изготовлены различные лекарственные формы.
Настоящее изобретение относится к фармацевтической композиции, содержащей любой кератин, полученный на вышеуказанных стадиях, и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к фармацевтической композиции, содержащей кератин по настоящему изобретению в качестве активного ингредиента и стандартные фармацевтические эксципиенты или адъюванты. В целом, на кератин по настоящему изобретению приходится 0,1-100,0% общей массы фармацевтической композиции.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая фармацевтически эффективную дозу белка в качестве активного ингредиента и фармацевтически приемлемый носитель.
Фармацевтическую композицию по настоящему изобретению можно получать способами, известными в области техники. При использовании для данной задачи, при необходимости белок по настоящему изобретению можно комбинировать с одним или более твердых или жидких фармацевтических эксципиентов и/или адъювантов для получения подходящих способа введения или дозировки, которые можно применять в качестве лекарственной формы у человека или в ветеринарии.
Кератин по настоящему изобретению или фармацевтическую композицию, содержащую его, можно вводить в виде стандартной лекарственной формы. Путь введения может быть энтеральный или парентеральный, такой как пероральное введение, внутримышечное, подкожное, в полость носа, в слизистую рта, глаза, легкие, кожу, вагину, брюшную полость и прямую кишку и так далее, предпочтительно пероральное введение.
Белок кератин по настоящему изобретению или фармацевтическую композицию, содержащую его, можно вводить путем инъекции. Инъекции включают внутривенную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию, внутрибрюшинную инъекцию и инъекцию в точку акупунктуры и так далее.
Лекарственная форма для введения может представлять собой жидкую лекарственную форму, твердую лекарственную форму или полутвердую лекарственную форму. Жидкие лекарственные формы могут представлять собой растворы (включая истинные растворы и коллоидные растворы), эмульсии (включая эмульсии типа «масло-в-воде», эмульсии типа «вода-в-масле» и двойные эмульсии), суспензии, инъекции (включая водные инъекции, порошковые инъекции и инфузии), глазные капли, капли для носа, лосьон и линимент и так далее. Твердые лекарственные формы могут представлять собой таблетки (включая обычные таблетки, таблетки с кишечно-растворимой оболочкой, защечные таблетки, диспергируемые таблетки, жевательные таблетки, шипучие таблетки, таблетки, распадающиеся в полости рта), капсулы (включая твердые капсулы, мягкие капсулы и капсулы с кишечно-растворимой оболочкой), гранулированные препараты, порошки, пеллеты, микропилюли, суппозитории, пленки, пластыри, аэрозольные (порошковые) спреи, спреи и так далее; мягкие лекарственные формы могут представлять собой мази, гели, пасты и так далее.
Кератин по настоящему изобретению может быть составлен в виде обычных препаратов, препаратов с замедленным высвобождением, препаратов с контролируемым высвобождением, препаратов направленного действия и различных систем доставки на основе частиц.
Для изготовления лекарственной формы в виде таблетки можно широко применять различные эксципиенты, известные в области техники, включая разбавители, связывающие агенты, смачивающие агенты, разрыхлители, смазывающие агенты и скользящие агенты. Разбавитель может представлять собой крахмал, декстрин, сахарозу, глюкозу, лактозу, маннит, сорбит, ксилит, микрокристаллическую целлюлозу, сульфат кальция, двузамещенный фосфат кальция, карбонат кальция и так далее; увлажняющий агент может представлять собой воду, этанол, изопропанол и так далее; связывающий агент может представлять собой крахмальный сироп, декстрин, сироп, мед, раствор глюкозы, микрокристаллическую целлюлозу, сироп акации, желатиновый сироп, натрий-карбоксиметилцеллюлозу метил целлюлозу, гипромеллозу, щелочную целлюлозу, этилцеллюлозу акриловую смолу, карбомер, поливинилпирролидон, полиэтилендипропанол и так далее; разрыхлитель может представлять собой сухой крахмал, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу с низкой степенью замещения, поперечно-сшитый поливинилпирролидон, поперечно-сшитую натрий-карбоксиметилцеллюлозу, карбоксиметилкрахмал натрия, бикарбонат натрия и лимонную кислоту, карбонат кальция, сложный эфир жирных кислот и полиоксиэтиленсорбита, додецилсульфонат натрия, смазывающий и скользящий агент может представлять собой тальк, диоксид кремния, стеарат, винную кислоту, жидкий парафин, полиэтиленгликоль и так далее.
Таблетки также могут быть изготовлены в виде таблеток с оболочкой, таких как таблетки в сахарной оболочке, таблетки с пленочным покрытием, таблетки с кишечнорастворимой оболочкой или двухслойные таблетки и многослойные таблетки.
Для изготовления дозированной единицы в виде пилюли можно широко применять различные носители, известные в области техники. Примеры носителей включают, например, разбавители и абсорбенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрогенизированное растительное масло, поливинилпирролидон, полиэтиленгликоль лаурат, каолин, тальк и так далее; связывающие агенты, такие как гуммиарабик, ксантановая камедь, желатин, этанол, мед, жидкий сахар, паста или тесто на основе риса и так далее; разрыхлители, такие как агаровый порошок, сухой крахмал, альгинат, натрия лаурилсульфонат, метилцеллюлоза, этилцеллюлоза и так далее.
Для изготовления дозированной единицы в виде суппозитория можно широко применять различные носители, известные в области техники. Примерами носителей являются, например, полиэтиленгликоль, лецитин, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и тому подобное.
Для изготовления дозированной единицы в виде капсулы активный ингредиент кератин по настоящему изобретению смешивают с различными вышеупомянутыми носителями и помещают полученную смесь в твердые желатиновые капсулы или мягкие капсулы. Активный ингредиент кератин по настоящему изобретению также можно изготовить в виде микрокапсул, суспендировать в водной среде с образованием суспензии или заполнять твердые капсулы или изготовить в форме инъекций для применения.
Например, из кератина по настоящему изобретению изготавливают инъекционные препараты, такие как растворы, суспензионные растворы, эмульсии и лиофилизированные порошки для инъекций. Такие препараты могут быть водными или неводными, и могут содержать один и/или более фармакодинамически приемлемых носителей, разбавителей, связывающих агентов, смазывающих агентов, консервантов, поверхностно-активных веществ или диспергирующих агентов. Например, разбавитель может быть выбран из воды, этанола, полиэтиленгликоля, 1,3-пропиленгликоля, этоксилированного изостеарилового спирта, полиоксиэтилированного изостеарилового спирта, сложных эфиров полиоксиэтилена и сорбита и тому подобного. Кроме того, для получения изотонической инъекции в инъекционный препарат можно добавлять соответствующее количество хлорида натрия, глюкозы или глицерина. Кроме того, также можно добавлять стандартные растворители, буферы, вещества для доведения рН и так далее. Эти дополнительные материалы являются общепринятыми в данной области.
Кроме того, при необходимости в указанные фармацевтические препараты также можно добавлять красители, консерванты, ароматизаторы, корригенты, подсластители или другие материалы.
Для решения задачи лечения и усиления терапевтического эффекта кератин или фармацевтическую композицию по настоящему изобретению можно вводить любым известным способом введения.
Дозировка фармацевтической композиции с кератином по настоящему изобретению зависит от множества факторов, таких как природа и тяжесть заболевания, подлежащего профилактике или лечению, пол, возраст, массу тела, индивидуальные особенности и индивидуальный ответ пациента или животного, путь введения, число введений и цель лечения, так что терапевтическая доза по настоящему изобретению может иметь широкий диапазон изменений. В целом дозировки фармацевтических ингредиентов по настоящему изобретению хорошо известны специалистам в области техники. Соответствующие корректировки можно осуществлять в соответствии с фактическим количеством лекарственного средства, содержащегося в итоговом препарате в композиции кератина по настоящему изобретению для того, чтобы отвечать требованиям к терапевтически эффективному количеству и реализовывать профилактические или терапевтические задачи настоящего изобретения. Соответствующий суточный диапазон доз кератина по настоящему изобретению: доза кератина по настоящему изобретению составляет 0,01~500 мг/кг массы тела. Он составляет предпочтительно 0,5~100 мг/кг массы тела, более предпочтительно 1~50 мг/кг массы тела и наиболее предпочтительно 2~30 мг/кг массы тела. Вышеуказанную дозу можно вводить в единичной лекарственной форме или делить на несколько введений, например в форме двух, трех или четырех введений, в зависимости от клинического опыта врача, осуществляющего введение, и схем введения, включающих применение других терапий. Суммарная доза, необходимая для каждой терапии, может быть разделена на многократные или однократные дозы. Белковую или фармацевтическую композицию по настоящему изобретению можно принимать в отдельности или применять в комбинации с другими терапевтическими лекарственными средствами или симптоматическими лекарственными средствами и корректировать дозу.
В седьмом аспекте технического решения по настоящему изобретению предложено применение кератина BD-4 по первому аспекту или молекулы нуклеиновой кислоты по второму аспекту, или экспрессирующего вектора по третьему аспекту или клетки-хозяина по четвертому аспекту, или фармацевтической композиции по шестому аспекту в изготовлении жаропонижающих, анальгезирующих, противокашлевых отхаркивающих, противосудорожных, противоэпилептических, гипотензивных, противовоспалительных или противовирусных лекарственных средств.
Для решения задач настоящего изобретения в настоящем изобретении предложены следующие технические решения. В частности, получение кератина BD-4 по настоящему изобретению включает следующие стадии:
(1) Синтез нуклеотидной последовательности и определение точности последовательности
Предпочтительная нуклеотидная последовательность показана в SEQ ID No. 2.
(2) Перенос указанной нуклеотидной последовательности в экспрессирующий вектор;
Экспрессирующий вектор может относиться к серии рЕТ, серии pUC, серии pQE, серии pBV, серии pMAL, pPIC9K, pHIL-S1, pPICZα/A, pYAM75P, pHIL-D2, pA0815, pPIC3K, pPICZ, pHWO10, pGAPZ, pGAPZa, pPIC3.5K и так далее. Предпочтительный экспрессирующий вектор представляет собой вектор серии рЕТ; наиболее предпочтительный экспрессирующий вектор представляет собой рЕТ-28а(+).
(3) Трансфицирование клетки-хозяина указанным экспрессирующий вектором
Клетка-хозяин может представлять собой Е. coli или дрожжи; предпочтительная клетка-хозяин представляет собой Е. coli;
Компетентные клетки-хозяева могут относиться к серии BL21, серии Transetta, серии Rosetta, серии DH5α, серии JM, серии Тор, серии Orgami, Trans 1-Т1, TG1, TB1; Y11430, MG1003, GS115 (AOX1), KM71, SMD1168 и так далее. Предпочтительные компетентные клетки для экспрессии представляют собой BL21 (DE3) и Transetta (DE3).
(4) Указанные клетки-хозяева будут представлять собой ферментируемую культуру для индуцирования экспрессии целевого белка BD-4 в подходящих условиях;
В устройствах для ферментации можно применять встряхиваемые колбы или ферментационные чаны;
Среда может представлять собой среду LB, среду ТВ, среду SB, среду SOB, среду SOC, среду PDA, среду YPD, среду с бенгальским красным, среду Chashi с высоким содержанием солей, среду DOBA, среду на основе риса кодзи и их улучшенные составы, и так далее; для ферментации во встряхиваемых колбах предпочтительна среда LB, среда ТВ, наиболее предпочтительна среда ТВ; для ферментера предпочтительна среда LB и ее улучшенные составы.
Индуктор может представлять собой IPTG, лактозу, арабинозу и так далее; предпочтительны IPTG и лактоза.
(5) Обогащение продукта целевым белком BD-4
Полученную на стадии (4) ферментационную среду центрифугируют и отбрасывают супернатант; осадок суспендируют в буфере, бактерии разрушают, вновь центрифугируют и отбрасывают супернатант; после промывания осадка детергентами его растворяют в растворе мочевины с получением раствора неочищенного белка BD-4.
В том числе, буфер предпочтительно представляет собой буфер А, а пропорции являются следующими: объем культуральной жидкости : объем буфера А=1~100:1, предпочтительно 10:1;
Очищающий агент может представлять собой раствор мочевины, раствор гуанидина гидрохлорида, Тритон, буфер А, и так далее, предпочтительно раствор мочевины, наиболее предпочтительноо 2М раствор мочевины (может содержать 1% Тритон). Пропорции являются следующими: объем культуральной жидкости : объем 2М мочевины = 0,2~100:1, предпочтительно 1~15:1;
Раствор мочевины предпочтительно представляет собой 8М раствор мочевины. Пропорции являются следующими: объем культуральной жидкости : 8М раствор мочевины = 0,2~100:1, предпочтительно 2~15:1.
(6) Выделение и очистка целевого белка BD-4
Для получения целевого белка BD-4 необходимо произвести очистку раствора неочищенного белка, полученного на стадии (5). Очистку можно осуществлять на стадиях диализа, или ультрафильтрации и микрофильтрации, или колоночной хроматографии, или высаливания.
A. На стадии диализа раствор неочищенного белка, полученного на стадии (5), очищают методом диализа с получением раствора целевого белка BD-4.
Отсечение по молекулярной массе у диализного мешка может составлять 0,5-10 кДа, предпочтительное отсечение по молекулярной массе у диализного мешка составляет 3,5-10 кДа, а наиболее предпочтительное отсечение по молекулярной массе у диализного мешка составляет 10 кДа.
Б. На стадии ультрафильтрации и микрофильтрации раствор неочищенного белка, полученный на стадии (5), очищают посредством мембранной технологии, такой как ультрафильтрующая мембрана или микрофильтрующая мембрана, с получением концентрированного раствора целевого белка BD-4.
Предпочтительно, очистку с применением микрофильтрующей мембраны осуществляют дважды, первый раз размер пор мембраны составляет 1000~1500 нм, а второй раз размер пор мембраны составляет 20~50 нм.
B. На стадии колоночной хроматографии раствор неочищенного белка, полученный на стадии (5), пропускают через хроматографическую колонку, такую как различные обменные колонки или колонка для эксклюзионной хроматографии для выделения и очистки целевого белка BD-4.
Предпочтительная колонка для эксклюзионной хроматографии представляет собой колонку с декстрановым гелем, Superdex 30 Increase, Superdex 75 Increase, Superdex 200 Increase, Superose 6 Increase и так далее; предпочтительная обменная колонка представляет собой колонку с ионообменной смолой: колонку с анионообменной смолой HiTrap Q FF, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE, Toyopearl Q-650M и Toyopearl SuperQ-650M и так далее; колонку с катионообменной смолой: HiTrap SP FF, HiTrap Capto SP ImpRes, Capto SP ImpRes, HiTrap Capto SP, Toyopearl SP-650M, Toyopearl Super SP-650M. Наиболее предпочтительна колонка с анионообменной смолой.
В качестве элюента можно использовать стандартные элюенты, такие как вода, солевой раствор, и указанный солевой раствор включает раствор хлорида натрия, раствор однозамещенного фосфата натрия, раствор двузамещенного фосфата натрия, ацетат натрия, уксусную кислоту и тому подобное.
Г. Стадия высаливания предназначена для очистки раствора неочищенного белка, полученного на стадии (5), методом высаливания с получением суспензии целевого белка BD-4.
Высаливающий реагент может представлять собой сульфат аммония, сульфат натрия, хлорид натрия, хлорид магния, сульфат алюминия, нитрат аммония, хлорид аммония, сульфат магния и тому подобное. Предпочтительный высаливающий агент представляет собой сульфат аммония и его водный раствор. Насыщенный водный раствор сульфата аммония добавляют для достижения конечной концентрации сульфата аммония 10-50%, предпочтительно 20-30%, более предпочтительно 25%.
Количество высаливаний составляет от 1 до 3, предпочтительно 2.
После высаливания осадок промывают чистой водой, а количество промываний составляет от 2 до 5 раз, предпочтительно 3 раза.
Раствор целевого белка BD-4, очищенного на стадиях А-Г, может быть подвергнут лиофилизационной или вакуумной сушке в сухой порошок, либо концентрированный раствор может быть подвергнут распылительной сушке непосредственно в сухой порошок.
Технические эффекты, представляющие собой преимущества настоящего изобретения:
1. Белок по настоящему изобретению представляет собой кератин, полученный впервые, а способ получения по настоящему изобретению характеризуется высоким выходом и высокой чистотой образца.
2. В настоящем изобретении в ходе фармакодинамических исследований белка BD-4 с применением липополисахарида (LPS) и модели индуцированной дрожжами лихорадки у крыс SD показано, что белок BD-4 может существенно подавлять повышение температуры тела и оказывает выраженный жаропонижающий эффект через 4 часа и через 8 часов после введения дрожжей.
3. В настоящем изобретении в ходе фармакодинамического исследования белка BD-4 в отношении судорог, вызванных у мышей пилокарпином (PLO) и пентилентетразолом (PTZ), соответственно, показано, что белок BD-4 может существенно пролонгировать инкубационный период эпилепсии II класса и III класса у мышей.
4. В настоящем изобретении в ходе фармакодинамического исследования белка BD-4 на мышах показано, что белок BD-4 обладает очевидным отхаркивающим эффектом при использовании метода экскреции фенолового красного.
5. В настоящем изобретении в ходе фармакодинамического исследования белка BD-4 методом индуцирования кашля у мышей аммиачной водой показано, что белок BD-4 может существенно уменьшать число эпизодов кашля и пролонгировать инкубационный период кашля и обладает выраженным противокашлевым действием.
6. В настоящем изобретении в ходе фармакодинамического исследования белка BD-4 на мышах ICR показано, что белок BD-4 может значительно сокращать количество «корчей» при введении мышам уксусной кислоты и обладает выраженным анальгезирующим действием.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Анализ экспрессированного белка BD-4 посредством SDS-PAGE (электрофореза на полиакриламидном геле в присутствии додецилсульфата натрия) в восстанавливающих условиях.
(М: Стандарт молекулярной массы белка; S: Экспрессированный белок).
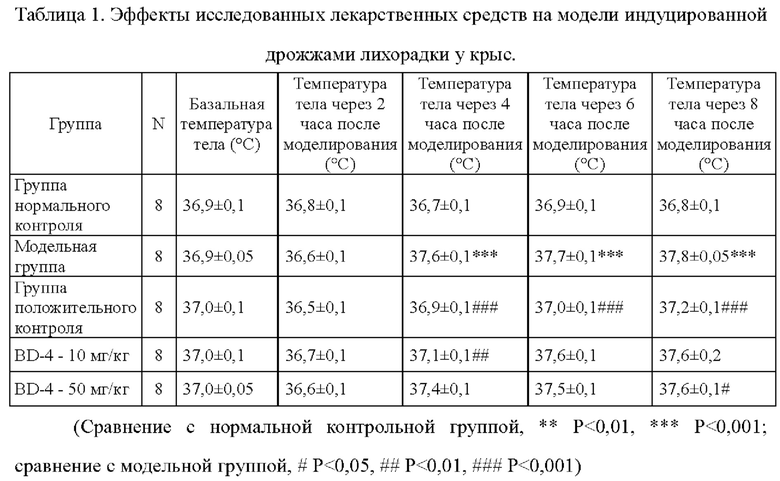
Фиг. 2. Влияние белка BD-4 на модели индуцированной дрожжами лихорадки у крыс.
(Сравнение с нормальной контрольной группой, ** Р<0,01, *** Р<0,001; сравнение с модельной группой, # Р<0,05, ## Р<0,01, ### Р<0,001).
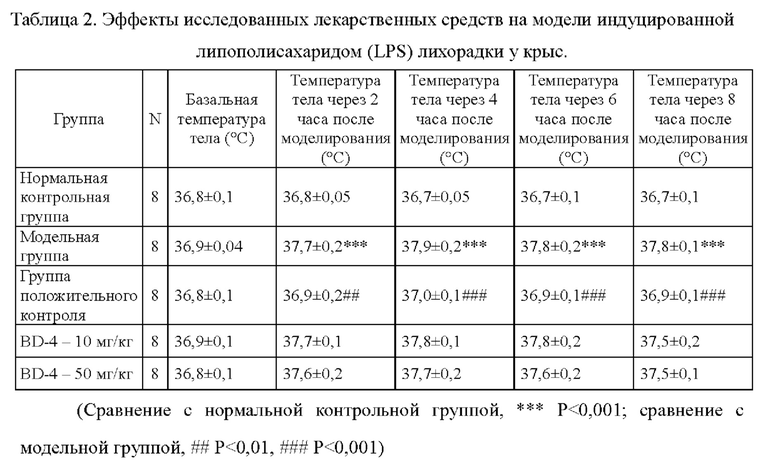
Фиг. 3. Влияние белка BD-4 на индуцированную липополисахаридом (LPS) лихорадку у крыс.
(Сравнение с нормальной контрольной группой, *** Р<0,001; сравнение с модельной группой, ## Р<0,01, ### Р<0,001).
СВЕДЕНИЯ О ВОЗМОЖНОСТИ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Приведенные ниже примеры и примеры исследования фармакологической активности служат для дальнейшей иллюстрации настоящего изобретения, но не ограничивают настоящее изобретение никоим образом.
Экспериментальные способы в приведенных ниже примерах и примерах исследования фармакологической активности представляют собой стандартные способы, если не указано иное; использованные экспериментальные материалы приобретены в компаниях, предоставляющих стандартные биохимические реагенты, если не указано иное.
Пример 1. Ферментация во встряхиваемой колбе для получения раствора А неочищенного белка BD-4 (среда ТВ)
Синтезировали нуклеотидную последовательность, показанную в SEQ ID No. 2, и переносили ее в вектор рЕТ-28а(+); подтверждали последовательность для получения экспрессирующего вектора, содержащего правильную последовательность; трансфицировали указанным экспрессирующим вектором клетки BL21 (DE3), получали компетентные в плане экспрессии клетки-хозяева, содержащие целевую нуклеотидную последовательность. Добавляли среду LB и инкубировали на шейкере при 37°С и 220 об/мин в течение 1 часа с получением рекомбинантного штамма.
Осуществляли посев рекомбинантного штамма в чашку со средой LBA, содержащей канамицин, и помещали чашку вверх дном в инкубатор, поддерживающий постоянную температуру 37°С в течение ночи на 16 часов.
Готовили 400 мл среды ТВ, делили на 2 флакона, по 200 мл на каждый флакон.
Добавляли канамицин (конечная концентрация 50 мкг/мл) в каждый флакон (200 мл) среды ТВ. Отбирали одну колонию с чашки и инокулировали среду ТВ. Размножали и культивировали в течение ночи при 37°С и 200 об/мин на шейкере для получения жидкого посевного материала.
Готовили 28,8 л среды ТВ, делили на 144 флакона, по 200 мл на каждый флакон. Добавляли канамицин (конечная концентрация 50 мкг/мл) в каждый флакон (200 мл) среды ТВ, затем добавляли 2 мл жидкого посевного материала и инкубировали на шейкере при 37°С и 220 об/мин в течение 2-3 часов. Измеряли OD600, при достижении OD600 (оптической плотности при 600 нм) приблизительно 1,0 добавляли индуктор для индуцирования экспрессии белка на шейкере, условия индуцирования выбирали согласно следующей таблице.

Объединяли бактериальную суспензию из всех флаконов, центрифугировали при 7000 об/мин в течение 5 минут и отбрасывали надосадочную жидкость после стерилизации; осадок суспендировали приблизительно в 3 л буфера, пропускали через сито с размером ячеек 80-100 и фильтрат дважды отжимали при помощи пресса высокого давления под давлением 800-1000 бар, по 2 минуты каждый раз. Центрифугировали жидкость с разрушенными бактериями при 7000 об/мин в течение 30 минут, отбрасывали надосадочную жидкость и получали осадок (то есть тельца включений). Осадок дважды промывали 1 л детергента, центрифугировали, а надосадочную жидкость отбрасывали. Осадок растворяли в растворе мочевины 4 раза, соответственно в 800 мл, 600 мл, 400 мл и 400 мл. Указанные четыре раствора объединяли и центрифугировали при 700 об/мин в течение 30 минут. Осадок отбрасывали, а надосадочная жидкость представляла собой раствор А с неочищенным белком.
Раствор А с неочищенным белком BD-4 анализировали посредством SDS-PAGE в восстанавливающих условиях, концентрация разделяющего геля составляла 12,5%, и затем окрашивали Кумасси бриллиантовым синим R250; наблюдалась четкая синяя полоса, соответствующая молекулярной массе приблизительно 45 кДа.
Пример 2. Ферментация во встряхиваемой колбе для получения раствора В неочищенного белка BD-4 (другая среда)
Синтез и секвенирование для подтверждения, что получен экспрессирующий вектор, содержащий последовательность, показанную в SEQ ID No.2, осуществляли в Примере 1; указанным экспрессирующим вектором трансфицировали клетки Transetta (DE3) с получением компетентных в плане экспрессии клеток-хозяев, содержащих целевую нуклеотидную последовательность.
Готовили 20 мл среды LB, отбирали 800 мкл, добавляли 50 мкл клеток-хозяев, содержащих целевую кодирующую последовательность, и инкубировали при 37°С и 220 об/мин в течение 1 часа на шейкере.
Набирали вышеуказанную бактериальную суспензию в петлю и осуществляли посев штрихом на чашку со средой LBA, содержащей канамицин, и помещали чашку вверх дном в инкубатор, поддерживающий постоянную температуру 37°С, в течение ночи на 16 часов.
Отбирали 10 мл среды LB, добавляли канамицин (конечная концентрация 50 мкг/мл), отбирали одну колонию с чашки и инокулировали среду LB. Размножали и культивировали в течение ночи при 37°С и 200 об/мин в течение 15 ч на шейкере для получения жидкого посевного материала.
Готовили 1 л среды, как показано в Таблице ниже, и делили на 10 флаконов по 100 мл в каждом. Добавляли канамицин (конечная концентрация 50 мкг/мл) в каждый флакон со средой (100 мл) и затем добавляли 1 мл раствора с посевным материалом. Инкубировали при 37°С и 220 об/мин в течение 2-3 часов на шейкере. Измеряли OD600 и при достижении значения OD600 приблизительно 1,0 добавляли индуктор IPTG (конечная концентрация 0,5 мМ). Индуцировали экспрессию белка при 37°С и скорости шейкера 220 об/мин.

Объединяли бактериальную суспензию из всех флаконов, центрифугировали при 10000 об/мин в течение 10 минут и отбрасывали надосадочную жидкость после стерилизации; осадок суспендировали приблизительно в 100 мл буфера, пропускали через сито с размером ячеек 80-100 и фильтрат дважды отжимали при помощи пресса высокого давления под давлением 800-1000 бар, по 2 минуты каждый раз. Центрифугировали жидкость с разрушенными бактериями 30 минут при 10000 об/мин, отбрасывали надосадочную жидкость.
К осадку добавляли по 40 мл просветляющего буфера А, центрифугировали и отбрасывали надосадочную жидкость, повторяли трижды; осадок двукратно промывали путем добавления 40 мл 2М раствора мочевины в качестве детергента, центрифугирования и отбрасывания надосадочной жидкости; затем для растворения осадка к нему добавляли 8М раствор мочевины (содержащей 50 мМ буфер Tris/HCl) 3 раза, соответственно 40 мл, 30 мл, 30 мл; объединенные растворы затем центрифугировали при 7000 об/мин в течение 30 минут, осадок отбрасывали, а надосадочная жидкость представляла собой раствор В неочищенного белка.
Раствор В с неочищенным белком BD-4 анализировали посредством SDS-PAGE в восстанавливающих условиях, концентрация разделяющего геля составляла 12,5%, и затем окрашивали Кумасси бриллиантовым синим R250; наблюдалась четкая синяя полоса, соответствующая молекулярной массе приблизительно 45 кДа.
Пример 3. Получение раствора С неочищенного белка BD-4 в ферментере Синтез и секвенирование для подтверждения, что получен экспрессирующий вектор, содержащий последовательность, показанную в SEQ ID No. 2, осуществляли в Примере 1; указанным экспрессирующим вектором трансфицировали клетки BL21 (DE3) с получением компетентных в плане экспрессии клеток-хозяев, содержащих целевую нуклеотидную последовательность. Добавляли среду LB и инкубировали на шейкере при 37°С и 220 об/мин в течение 1 часа с получением рекомбинантного штамма.
В чашку со средой LBA, содержащей канамицин, добавляли 100 мкл рекомбинантного штамма, распределяли шпателем по поверхности до равномерного высыхания и помещали чашку вверх дном в инкубаторе, поддерживающем постоянную температуру 37°С, для культивирования в течение ночи. Отбирали три одиночные колонии, делали посев штрихом на чашку, содержащую канамицин и затем культивировали чашку в течение ночи. После подтверждения того, что ферментация во встряхиваемых флаконах и экспрессия прошли корректно, штаммы консервировали 15% глицерином и делили по 0,8 мл для получения рабочего банка клеток, который хранили в холодильнике при -80°С для дальнейшего применения.
Из рабочего банка клеток брали 1 ампулу с бактериями, находящимися в глицерине, отбирали 100 мкл, добавляли 40 мл среды LB, добавляли канамицин (конечная концентрация 50 мкг/мл), инкубировали на шейкере при 37°С и 220 об/мин в течение 6 часов с получением раствора посевного материала первого уровня.
Отбирали 1,2 мл раствора посевного материала первого уровня, добавляли его в 120 мл среды LB, добавляли канамицин (конечная концентрация 50 мкг/мл) и затем инкубировали на шейкере при 37°С и 220 об/мин в течение 6 часов с получением раствора посевного материала первого уровня.
Отбирали 1,2 мл раствора посевного материала первого уровня, добавляли его в 120 мл среды LB, добавляли канамицин (конечная концентрация 50 мкг/мл) и затем инкубировали на шейкере при 37°С и 220 об/мин в течение 7 часов с получением раствора посевного материала второго уровня.
В 5 л ферментер добавляли 3 л модифицированной среды LB, затем добавляли 120 мл раствора посевного материала второго уровня, 3 мл канамицина (конечная концентрация 50 мкг/мл) и культивировали при 37°С и 30% растворенного кислорода (скорость серии) в течение 8 часов.
Следили за значением OD около 20 и 3 г лактозы в качестве индуктора. Осуществляли индуцрование при 20°С, осуществляли подачу при скорости 30 мл/час и инкубировали при 20°С в течение 24 часов.
Центрифугировали суспензию бактерий при 7000 об/мин в течение 5 минут и отбрасывали надосадочную жидкость после стерилизации; осадок суспендировали приблизительно в 200 мл буфера А, пропускали через сито с размером ячеек 80-100 и фильтрат дважды отжимали при помощи пресса высокого давления под давлением 800-1000 бар, по 2 минуты каждый раз. Центрифугировали жидкость с разрушенными бактериями в течение 30 минут при 7000 об/мин и отбрасывали надосадочную жидкость.
К осадку добавляли 2М раствор мочевины (включающий 1% Тритон) и дважды промывали его, каждый раз 1 л; затем добавляли 1 л 2М раствора мочевины для однократного промывания, центрифугировали и отбрасывали надосадочную жидкость.
Затем добавляли осадок к 8М раствору мочевины (содержащему 50 мМ буфер Tris/HCl) для растворения 4 раза, соответственно, 400 мл, 300 мл, 200 мл, 100 мл; объединяли 4 раствора, центрифугировали при 7000 об/мин в течение 30 минут, осадок отбрасывали, а надосадочная жидкость представляла собой раствор С неочищенного белка.
Раствор С неочищенного белка BD-4 анализировали посредством SDS-PAGE в восстанавливающих условиях, концентрация разделяющего геля составляла 12,5%, и затем окрашивали Кумасси бриллиантовым синим R250; наблюдалась четкая синяя полоса, соответствующая молекулярной массе приблизительно 45 кДа.
Пример 4. Раствор С неочищенного белка получали посредством мембранной технологии с получением белка BD-4
Раствор С неочищенного белка, полученный в Примере 3, очищали посредством технологии мембранной микрофильтрации: вначале использовали 1500 нм или 1000 нм керамический мембранный элемент для разделения твердой и жидкой фракций; жидкость, находящуюся во внутреннем отсеке, отбрасывали, и затем использовали 20 нм или 50 нм керамический мембранный элемент для повторной микрофильтрации жидкости из внешнего отсека для удаления мочевины; жидкость из внутреннего отсека после второй микрофильтрации подвергали лиофилизациоиной сушке с получением целевого белка BD-4; чистота по результатам электрофореза составляла 95,6%.
Подтверждение структуры белка BD-4:
1. Анализ посредством электрофореза в восстанавливающих условиях в полиакриламидном геле в присутствии SDS (SDS-PAGE)
Инструмент: Камера для электрофореза белков (Bio-Rad).
Способ и результаты: Раствор белка BD-4 анализировали посредством SDS-PAGE в восстанавливающих условиях, концентрация разделяющего геля составляла 12,5%, и проводили окрашивание Кумасси бриллиантовым синим R250. Молекулярная масса полосы BD-4 соответствовала приблизительно 45 кДа.
2. Анализ последовательности цельного белка на основе LC-MS/MS
Основные материалы: Ацетонитрил, муравьиная кислота, бикарбонат аммония, дитиотреитол (DTT), йодоацетамид (IAA), трипсин, химотрипсин, Glu-C, Asp-N;
Основные устройства: Капиллярный высокопроизводительный жидкий хроматограф (Thermo Ultimate 3000), масс-спектрометр, в котором комбинируются технологии электрораспыления, ионной ловушки и Orbitrap (гибридный квадрупольный масс-спектрометр Q Exative с технологией Orbitrap от Thermo).
Методы и результаты
Белок BD-4 подвергали предварительной обработке, такой как растворение замещение, восстановительное алкилирование и различный протеолиз для получения расщепленных ферментами пептидов; раствор пептидов после расщепления рестриктазами анализировали посредством тандемной жидкостной хроматографии и масс-спектрометрии. Файл с исходными данными масс-спектрометрии использовали для поиска в базах данных белков с применением Maxquant (1.6.2.10). Согласно результатам идентификации охват составлял 100%, и было установлено соответствие целевой последовательности SEQ ID No.l.
Пример 5. Очистка раствора А неочищенного белка с получением белка BD-4
Раствор А неочищенного белка, полученный в Примере 1, очищали с применением следующих трех методов:
Первый метод: диализ;
Раствор А неочищенного белка фильтровали через фильтрующую мембрану 0,45 мкм и объединяли фильтрат. Проводили диализ фильтрата в диализном мешке с отсечением по молекулярной массе 10 кДа, диализ осуществляли в течение 72 часов и жидкость, находящуюся внутри, подвергали лиофилизационной сушке с получением целевого белка BD-4; чистота по результатам электрофореза составила 90,1%.
Второй метод: высаливание;
Раствор А неочищенного белка помещали в контейнер с мешалкой для двукратного высаливания: Медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25% или 50%, в ходе процесса высаливания белок отделялся. По окончании высаливания осуществляли фильтрацию для завершения первого высаливания; добавляли 400 мл чистой воды для суспендирования осадка и затем медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25%. Осуществляли второе высаливание, фильтрование, и осадок представлял собой экстракт неочищенного белка. Экстракт неочищенного белка промывали три раза водой: добавляли 200 мл чистой воды для суспендирования, перемешивали, оставляли постоять и фильтровали; затем повторяли операции три раза, подвергали осадок лиофилизационной сушке с получением целевого белка BD-4.
Третий метод: колоночная хроматография;
Раствор А неочищенного белка очищали на колонке с анионообменной смолой, такой как HiTrap Q FF, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE и так далее. Элюировали градиентом раствора NaCl, затем 20 мМ буфером NaH2PO4/Na2HPO4 (рН 8,0). Элюированные фракции объединяли с учетом результатов электрофореза SDS-PAGE, объединенный элюат центрифугировали дважды при 7000 об/мин, каждый раз в течение 1 часа; надосадочную жидкость фильтровали с применением фильтрующей мембраны 0,45 мкм и фильтраты объединяли. Фильтраты концентрировали посредством диализа против воды, отсечение по молекулярной массе у диализного мешка составляло 10 кДа, а жидкость, находящуюся внутри, подвергали лиофилизационной сушке с получением целевого белка BD-4.
Подтверждали, что продукт, являющийся белком BD-4, полученный тремя способами, имеет такую же аминокислотную последовательность, как и белок, полученный в Примере 4, с применением того же способа подтверждения структуры, как и в Примере 4.
Пример 6. Очистка раствора В неочищенного белка с получением белка BD-4
Раствор В неочищенного белка, полученный в Примере 2, очищали с применением следующих трех методов:
Первый метод: диализ;
Раствор В неочищенного белка фильтровали через мембрану 0,45 мкм, фильтрат диализовали против воды, диализ осуществляли в течение более чем 72 часов, и находящийся внутри раствор подвергали лиофилизационной сушке с получением целевого белка BD-4.

Второй метод: колоночная хроматография;
Раствор В неочищенного белка очищали на колонке с анионообменной смолой, такой как HiTrap Q FF 16/10, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE и так далее. Осуществляли градиентное элюирование, где элюент представлял собой раствор NaCl с 20 мМ буфером NaH2PO4/Na2HPO4 (рН 8,0). Элюированные фракции объединяли с учетом результатов электрофореза SDS-PAGE, объединенный элюат центрифугировали дважды при 7000 об/мин, каждый раз в течение 1 часа; надосадочную жидкость фильтровали с применением фильтрующей мембраны 0,45 мкм и фильтраты объединяли. Фильтраты концентрировали посредством диализа против воды, отсечение по молекулярной массе у диализного мешка составляло 10 кДа, а жидкость, находящуюся внутри, подвергали лиофилизационной сушке с получением целевого белка BD-4.
Третий метод: высаливание;
Раствор В неочищенного белка помещали в контейнер с мешалкой для двукратного высаливания: Медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25% или 50%, в ходе процесса высаливания белок отделялся. По окончании высаливания осуществляли фильтрацию для завершения первого высаливания; добавляли 400 мл чистой воды для суспендирования осадка и затем медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25%. Осуществляли второе высаливание, фильтрование, и осадок представлял собой экстракт неочищенного белка. Экстракт неочищенного белка промывали три раза водой: добавляли 200 мл чистой воды для суспендирования, перемешивали, оставляли постоять и фильтровали; затем повторяли операции три раза, подвергали осадок лиофилизационной сушке с получением целевого белка BD-4.
Подтверждали, что продукт, являющийся белком BD-4, полученный тремя способами, имеет такую же аминокислотную последовательность, как и белок, полученный в Примере 4, с применением того же способа подтверждения структуры, как и в Примере 4.
Пример 7. Очистка раствора С неочищенного белка с получением белка BD-4 методом высаливания
Раствор С неочищенного белка, полученный в Примере 3, помещали в контейнер с мешалкой для двукратного высаливания: Медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25% или 50%, в ходе процесса высаливания белок отделялся. По окончании высаливания осуществляли фильтрацию для завершения первого высаливания; добавляли 400 мл чистой воды для суспендирования осадка и затем медленно по стенке добавляли насыщенный раствор сульфата аммония до достижения конечной концентрации сульфата аммония 25%. Осуществляли второе высаливание, фильтрование, и осадок представлял собой экстракт неочищенного белка. Экстракт неочищенного белка промывали три раза водой: добавляли 200 мл чистой воды для суспендирования, перемешивали, оставляли постоять и фильтровали; затем повторяли операции три раза, подвергали осадок лиофилизационной сушке с получением целевого белка BD-4.
Полученный продукт, являющийся белком BD-4, имел такую же аминокислотную последовательность, как и белок, полученный в Примере 4, согласно тому же способу подтверждения структуры, как и в Примере 4.
Фармакологический анализ
Экспериментальный Пример 1. Фармакодинамическое исследование белка BD-4 (белок из Примера 4) на модели индуцированной дрожжами лихорадки у крыс SD.
Животные: Самцы крыс SD массой 230-260 граммов.
Воздействие: дрожжи (OXOID LP0021), аспирин (SIGMA А2093), белок BD-4;
Устройства: электронные весы (SARTORIUS модель BP121S), электронный термометр (CITIZEN модель CT-513W).
Экспериментальные группы:
Нормальная контрольная группа;
Модельная группа: модель лихорадки, индуцированной дрожжами;
Группа положительного контроля:
Группа, получающая аспирин 300 мг/кг;
Группа, получающая белок BD-4, 10 мг/кг, 50 мг/кг.
Способ:
Подготовка экспериментальных животных: Животным, используемым в эксперименте, давали адаптироваться к экспериментальным условиям (температура 22°С±2°С, относительная влажность 50%±2%) в течение 1 суток. Преадаптация к измерению ректальной температуры в 8:00 и 15:00, крыс выдерживали без пищи со свободным доступом к воде в течение 12 ч до эксперимента. Перед измерением ректальной температуры животным давали освободиться от экскрементов. Перед каждым измерением температуры на кончик электронного термометра наносили вазелин. Вводили в ректальный проход на 2 см (для обеспечения одинаковой глубины введения возможно нанесение отметки на расстоянии 2 см) и регистрировали температуру тела после стабилизации показателей.
Подкожная инъекция сухих дрожжей для создания модели лихорадки у крыс: Перед началом моделирования измеряли температуру тела крыс. Отбирали соответствующих критериям крыс с температурой тела 36,2-37,3°С и случайным образом делили на группы по 8 крыс в каждой. После перорального введения аспирина и различных доз белка BD-4 немедленно осуществляли подкожную инъекцию 20% суспензии дрожжей (10 мл/кг), а в группе нормального контроля осуществляли внутрибрюшинную инъекцию равного объема физиологического раствора. Регистрировали температуру тела крыс через 2 часа всего на протяжении 8 часов.
Статистика:
По результатам измерения температуры тела во всех временных точках в день эксперимента рассчитывали среднее значение, стандартное отклонение и стандартную ошибку температуры тела в каждой группе крыс. Данные в каждой группе сравнивали при помощи Т-критерия, различия считали значимыми при Р<0,05.
Результаты эксперимента:
Моделирование представляло собой подкожную инъекцию 20% дрожжей, которую осуществляли немедленно после перорального введения аспирина (300 мг/кг), белка BD-4 (10 мг/кг, 50 мг/кг). После моделирования измеряли температуру тела животных через 2 часа, 4 часа, 6 часов и 8 часов. Результаты приведены в Таблице 1 и на Фиг. 2.
Результаты эксперимента:
Для создания модели осуществляли пероральное введение аспирина (300 мг/кг) и белка BD-4 (10 мг/кг, 50 мг/кг) и немедленно осуществляли подкожную инъекцию 20% дрожжей. После создания модели измеряли температуру тела животных через 2 часа, 4 часа, 6 часов и 8 часов. Результаты демонстрируют, что:
1) Температура тела крыс в экспериментальной группе существенно повышалась через 4 часа, 6 часов и 8 часов после моделирования. Различия по сравнению с нормальной группой были статистически значимыми, Р<0,05. Модель успешно воспроизводилась и была стабильной и надежной.
2) В группе положительного контроля, получавшей аспирин, наблюдали эффективное подавление повышения температуры тела крыс через 4 часа, 6 часов и 8 часов после моделирования. Различия по сравнению с экспериментальной группой были статистически значимыми, Р<0,05, а действие лекарственных средств, служивших положительным контролем, было относительно стабильным.
3) В группе, получавшей белок BD-4 в дозе 10 мг/кг, наблюдали значимое подавление повышения температуры тела крыс через 4 часа после моделирования. Различия по сравнению с экспериментальной группой были статистически значимыми, Р<0,05. В группе, получавшей дозу 50 мг/кг, наблюдали значимое подавление повышения температуры тела крыс через 8 часов после начала эксперимента, и различия по сравнению с экспериментальной группой были статистически значимыми, Р<0,05.
Экспериментальный Пример 2. Фармакодинамическое исследование белка BD-4 (белок из Примера 4) на модели индуцированной липополисахаридом (LPS) лихорадки у крыс SD.
Животные: Самцы крыс SD массой 230-260 граммов.
Воздействие: липополисахарид (LPS, SIGMA L-2880), аспирин (SIGMA А2093), белок BD-4;
Устройства: электронные весы (SARTORIUS модель BP121S), электронный термометр (CITIZEN модель CT-513W).
Экспериментальные группы:
Модельная группа: модель лихорадки, индуцированной липополисахаридом;
Группа положительного контроля: Группа, получающая аспирин 300 мг/кг;
Группа, получающая белок BD-4, 10 мг/кг, 50 мг/кг.
Способ: для создания модели лихорадки у крыс использовали метод внутрибрюшинной инъекции липополисахарида.
Подготовка экспериментальных животных: Животным, используемым в эксперименте, давали адаптироваться к экспериментальным условиям (температура 22°С±2°С, относительная влажность 50%±2%) в течение 1 суток. Преадаптация к измерению ректальной температуры в 8:00 и 15:00, крыс выдерживали без пищи со свободным доступом к воде в течение 12 ч до эксперимента. До начала эксперимента перед измерением ректальной температуры животным давали освободиться от экскрементов. Перед каждым измерением температуры на кончик электронного термометра наносили вазелин. Вводили в ректальный проход на 2 см (для обеспечения одинаковой глубины введения возможно нанесение отметки на расстоянии 2 см) и регистрировали температуру тела после стабилизации показателей.
Внутрибрюшинная инъекция липополисахарида для воспроизведения модели лихорадки у крыс: Перед моделированием измеряли температуру тела крыс. Отбирали соответствующих критериям крыс с температурой тела 36,2-37,3°С и случайным образом делили на группы по 8 крыс в каждой. После перорального введения аспирина и различных доз белка BD-4 немедленно осуществляли подкожную инъекцию липополисахарида (20 мкг/кг, 2 мл/кг), а в группе нормального контроля осуществляли внутрибрюшинную инъекцию равного объема физиологического раствора. Регистрировали температуру тела крыс через 2 часа всего на протяжении 8 часов.
Статистика:
По результатам измерения температуры тела во всех временных точках в день эксперимента рассчитывали среднее значение температуры тела в каждой группе крыс, стандартное отклонение и стандартную ошибку. Данные в каждой группе сравнивали при помощи Т-критерия, различия считали значимыми при Р<0,05.
Результаты эксперимента:
После перорального введения аспирина (300 мг/кг), белка BD-4 (10 мг/кг, 50 мг/кг) немедленно осуществляли внутрибрюшинную инъекцию липополисахарида. После моделирования измеряли температуру тела животных через 2 часа, 4 часа, 6 часов и 8 часов после начала эксперимента. Результаты приведены в Таблице 2 и на Фиг. 3.
Результаты эксперимента:
Для создания модели осуществляли пероральное введение аспирина (300 мг/кг) и белка BD-4 (10 мг/кг, 50 мг/кг), 20 мкг/кг липополисахарида немедленно инъецировали в брюшную полость немедленно после введения. После создания модели измеряли температуру тела животных через 2 часа, 4 часа, 6 часов и 8 часов.
Результаты демонстрируют, что:
1) Внутрибрюшинная инъекция 20 мкг/кг липополисахарида может успешно индуцировать повышение температуры тела у крыс. Температура тела крыс в модельной группе существенно повышалась через 4 часа, 6 часов и 8 часов после моделирования. Различия по сравнению с нормальной группой были статистически значимыми, Р<0,05, и модель стабильна.
2) В группе положительного контроля, получавшей лекарственное средством аспирин, наблюдали эффективное подавление повышения температуры тела модельных крыс через 2 часа, 4 часа, 6 часов и 8 часов после моделирования. Различия по сравнению с экспериментальной группой были статистически значимыми, Р<0,05, а действие лекарственных средств, служивших положительным контролем, относительно стабильно.
3) У модельных крыс, получавших белок BD-4, наблюдали тенденцию к понижению температуры тела после моделирования, но это не было статистически значимым.
Экспериментальный Пример 3. Фармакодинамическое исследование белка BD-4 (белок из Примера 4) на модели судорожной эпилепсии у мышей, индуцированной вызывающим судороги веществом пилокарпин (PLO).
Животные: самцы мышей ICR;
Препараты: Пилокарпин НС1 (PLO, пилокарпин, пилокарпина гидрохлорид), диазепам (диазепам в таблетках), белок BD-4.
Экспериментальные группы:
Модельная группа:
Группа, получавшая диазепам (диазепам) 2 мг/кг;
Группа, получавшая белок BD-4, 50 мг/кг, 200 мг/кг.
Способ:
Подготовка модели и введение:
Лекарственное средство вводили однократно после полудня за день до моделирования, в день моделирования осуществляли внутрибрюшинную инъекцию PLO-225 мг/кг (моделирующий агент) через 1 час после введения исследуемого лекарственного средства в желудок. Служащее положительным контролем лекарственное средсто можно вводить однократно за 20 минут до моделирования. Наблюдения проводили в течение 30 минут после инъекции PLO.
Отслеживаемые параметры: 1) Ситуация судорог: время судорог от II степени до IV степени; 2) время до смерти.
Степень судорожной активности: Оценка по стандартной шкале Расина: 0 степень: Отсутствие ответа; I степень: проявляется в виде судорожных сокращений лицевой мускулатуры или уголков рта; II степень: возможно кивание головой; III степень: Судорожные сокращения одной лапы; IV степень: ригидность или судорожные сокращения тела; V степень: генерализованная эпилепсия (генерализованные тонические судороги).
Обработка данных:
В каждой группе мышей подсчитывали число случаев судорог IV степени и смертей в ходе эксперимента; инкубационный период для II, III и IV степени. У мышей, у которых судорожная активность IV степени не наблюдалась, инкубационный период регистрировали как максимальное значение 1800 секунд. Для статистической обработки числа случаев использовали критерий хи-квадрат. Для инкубационного периода рассчитывали среднее арифметическое значение и стандартную ошибку и использовали Т-критерий для сравнения модельной группы с другими группами. Р<0,05 считали значимым различием.
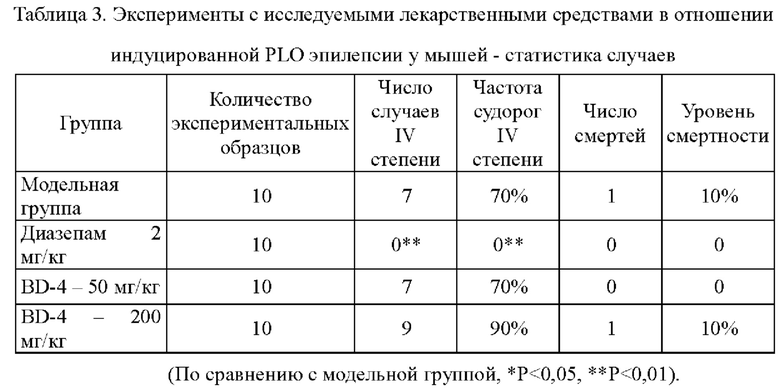
Результаты эксперимента приведены в Таблице 3 и Таблице 4.


Результаты эксперимента:
1) Результаты эксперимента показывают, что судорожная активность IV степени в модельной группе встречается в 70% случаев. 2 из 40 мышей погибли.
2) Служащие положительным контролем лекарственные средства полностью подавляют частоту эпилептических судорог IV степени и значительно пролонгируют инкубационный период судорог II, III и IV степени у мышей.
3) При сравнении инкубационного периода эпилептических проявлений II степени группы, получавшие BD-4 в дозе 50 мг/кг статистически достоверно отличались от модельной группы; при сравнении инкубационного периода эпилепсии III степени группы, получавшие BD-4 в дозе 50 мг/кг и 200 мг/кг статистически достоверно отличались от модельной группы;
Экспериментальный Пример 4. Исследование эффективности белка BD-4 (белок из Примера 4) в отношении эпилепсии у мышей, индуцированной пентилентетразолом (PTZ)
Животные: самцы мышей ICR;
Препараты: Пентилентетразол (PTZ), ретигабин, белок BD-4.
Экспериментальные группы:
Модельная группа;
Группа, получавшая Ретигабин 60 мг/кг;
Группа, получавшая белок BD-4, 50 мг/кг, группа, получавшая белок BD-4, 200 мг/кг;
Способ:
Подготовка модели и введение:
Введение осуществляли однократно после полудня за день до моделирования, в день моделирования осуществляли внутрибрюшинную инъекцию PTZ-65 мг/кг (моделирующий агент) через 1 час после введения исследуемого лекарственного средства через желудочный зонд, лекарственное средство, служившее положительным контролем, можно было вводить однократно за полчаса до моделирования. Продолжали наблюдения в течение 15 минут после инъекции PTZ.
Отслеживаемые параметры: 1) Состояние судорог: 1) время начала проявлений III степени - IV степени; 2) ситуация смерти.
Степень проявлений: Оценка по стандартной шкале Расина: 0 степень: Отсутствие ответа; I степень: проявляется в виде судорожных сокращений лицевой мускулатуры или уголков рта; II степень: возможно кивание головой; III степень: судорожные сокращения одной лапы; IV степень: ригидность или судорожные сокращения тела; V степень: Генерализованная эпилепсия (генерализованные тонические судороги).
Обработка данных:
В каждой группе мышей подсчитывали число случаев с судорогами и смертей в ходе эксперимента; инкубационный период Ш и IV степени. У мышей, у которых не наблюдалась судорожная активность IV степени, инкубационный период регистрировали как наибольшее значение 900 секунд. Для статистической обработки числа случаев использовали критерий хи-квадрат. Для инкубационного периода рассчитывали среднее и стандартную ошибку. Для сравнения модельной группы с другими группами использовали Т-критерий, а Р<0,05 считали значимым различием.
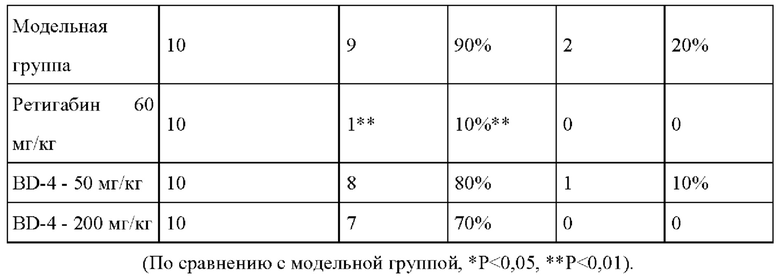
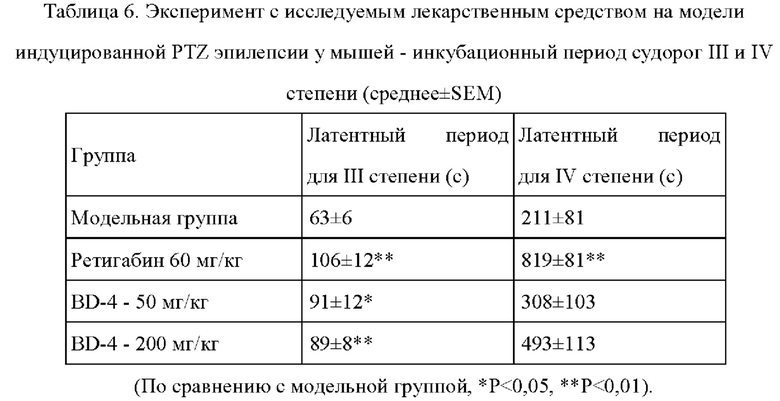
Результаты эксперимента: см. Таблицу 5 и Таблицу 6.

Результаты эксперимента:
1) Результаты эксперимента показали, что судорожная активность IV степени в модельной группе встречается в 90% случаев. Три мыши из 40 погибли.
2) Служащие положительным контролем лекарственные средства могли значительно подавлять частоту эпилептических судорог IV степени и значительно пролонгировать инкубационный период судорог III и IV степени у мышей.
3) При сравнении инкубационного периода эпилепсии III степени группы, получавшие BD-4 в дозе 50 мг/кг и 200 мг/кг, статистически достоверно отличались от модельной группы.
Экспериментальный Пример 5. Фармакодинамическое исследование отхаркивающего действия белка BD-4 (белок из Примера 4) методом экскреции фенолового красного у мышей.
Животные: самцы мышей ICR;
Препараты и реагенты: Мукосултан (амброксола гидрохлорид в таблетках), феноловый красный, бикарбонат натрия, белок BD-4;
Устройства: центрифуга (тип Sigma-3K15), весы (тип XS105DU), считывающее устройство для микропланшетов (тип BIO-TEK).
Экспериментальные группы:
Контрольная группа, получающая растворитель;
Группа, получающая мукосултан 30 мг/кг;
Группа, получающая белок BD-4, 20 мг/кг, группа, получающая белок BD-4, 50 мг/кг.
Способ:
Подготовка модели и введение:
Животных выдерживали без пищи со свободным доступом к воде в течение 16 часов до эксперимента. Перорально вводили мукосултан и различные дозы белка BD-4 (вводимый объем 10 мл/кг) по группам, а контрольная группа растворителя получала равный объем дистиллированной воды. Через один час осуществляли внутрибрюшинную инъекцию 2,5% раствора фенолового красного, через 30 минут умерщвляли мышь путем удаления шеи. Забирали трахею ниже щитовидного хряща до ветви трахеи. Помещали трахею в 3 мл 5% раствора NaHCO3 и оставляли на 3 часа. Отбирали 1 мл надосадочной жидкости и центрифугировали при 3000 об/мин в течение 5 минут. Измеряли и регистрировали поглощение при 546 нм. Рассчитывали экскрецию фенолового красного согласно стандартной кривой для фенолового красного.
Обработка данных:
Регистрировали момент времени перорального введения, момент времени внутрибрюшинной инъекции 2,5% раствора фенолового красного и момент времени забора трахеи, соответственно; в каждой группе образцов измеряли поглощение с применением считывающего устройства для микропланшетов при 546 нм, рассчитывали экскрецию фенолового красного согласно стандартной кривой для фенолового красного. По данным, полученным в каждой группе, рассчитывали среднее арифметическое и стандартную ошибку, для сравнения контрольной группы, получавшей растворитель, с другими группами использовали Т-критерий, а Р<0,05 считали значимым различием.
Результаты эксперимента:
Давали мукосултан (30 мг/кг) и различные дозы белка BD-4 (20 мг/кг, 50 мг/кг). Через один час осуществляли внутрибрюшинную инъекцию 2,5% раствора фенолового красного, а через 30 минут умерщвляли мышей путем удаления их шей. Забирали трахею ниже щитовидного хряща до ветви трахеи, помещали трахею в 3 мл 5% раствора NaHCO3 и оставляли на 3 часа, отбирали 1 мл надосадочной жидкости, центрифугировали при 3000 об/мин в течение 5 минут, измеряли и регистрировали поглощение при 546 нм. Рассчитывали экскрецию фенолового красного согласно стандартной кривой для фенолового красного. Результаты показаны в Таблице 7.

Результаты эксперимента:
1) Результаты эксперимента показали, что по сравнению с контрольной группой, получавшей растворитель, количество экскреции фенолового красного в группе, получавшей мукосултан 30 мг/кг, существенно повышалась, Р<0,05, что было статистически достоверным.
2) По сравнению с контрольной группой, получавшей растворитель, BD-4 в дозе 20 мг/кг существенно повышал экскрецию фенолового красного, Р<0,05, что было статистически достоверным.
Экспериментальный Пример 6. Исследование противокашлевого эффекта белка BD-4 (белок из Примера 4) на кашель, индуцированный у мышей аммиачной водой.
Животные: самцы мышей ICR;
Препараты и реагенты: декстрометорфана гидробромид, аммоний, 0,2% Na-CMC (натрийкарбоксиметилцеллюлоза), белок BD-4;
Устройства: Компрессорный небулайзер (тип 403Т), весы (тип XS105DU).
Экспериментальные группы:
Контрольная группа, получавшая растворитель;
Группа, получавшая декстрометорфан 15 мг/кг;
Группа, получавшая белок BD-4, 20 мг/кг, группа, получавшая белок BD-4, 50 мг/кг.
Способ:
Подготовка модели и введение:
Перорально вводили декстрометорфан и различные дозы белка BD-4 (вводимый объем 10 мл/кг) по группам, а контрольная группа растворителя получала такой же объем дистиллированной воды. Через один час их помещали в закрытый ящик и распыляли 10% аммиачную воду в течение 10 секунд, а затем наблюдали и регистрировали инкубационный период кашля у мышей и число покашливаний в течение 2 минут.
Обработка данных:
Регистрировали момент времени перорального введения, момент времени распыления, инкубационный период кашля у мышей и число покашливаний в течение 2 минут, соответственно. Инкубационный период кашля относится к количеству секунд от начала распыления аммония до возникновения кашля. В основе кашля у мышей лежит сокращение их абдоминальной мускулатуры (сокращение грудной клетки) при одновременном открывании рта. По данным, полученным в каждой группе, рассчитывали среднее арифметическое и стандартную ошибку, для сравнения модельной группы с другими группами использовали Т-критерий, и Р<0,05 считали значимым различием.
Результаты эксперимента:
Мышам заранее давали декстрометорфан (15 мг/кг) и различные дозы белка BD-4 (20 мг/кг, 50 мг/кг), через один час их помещали в закрытый ящик и распыляли 10% аммиачную воду в течение 10 секунд, а затем наблюдали и регистрировали инкубационный период кашля у мышей и число покашливаний в течение 2 минут. Результаты показаны в Таблице 8.

Результаты эксперимента:
1) Результаты эксперимента показали, что группа, получавшая декстрометорфан, и контрольная группа, получавшая растворитель, демонстрировали существенное улучшение по показателю инкубационного периода и количеству покашливаний, Р<0,05, что было статистически значимым.
2) В группах, получавших BD-4 в дозах 20 мг/кг и 50 мг/кг, происходило существенное улучшение количества покашливаний по сравнению с контрольной группой, получавшей растворитель, Р<0,05, что было статистически значимым; в группе, получавшей BD-4 в дозе 20 мг/кг, происходило существенное улучшение инкубационного периода. При сравнении с контрольной группой, получавшей растворитель, наблюдали значительное улучшение, Р<0,05, что было статистически значимым.
Экспериментальный Пример 7. Фармакодинамическое исследование белка BD-4 (белок из Примера 4) на вызванные уксусной кислотой «корчи» у мышей ICR. Животные: самцы мышей ICR;
Препараты и реагенты: аспирин, физиологический раствор, ледяная уксусная кислота, белок BD-4.
Экспериментальные группы:
Модельная группа;
Группа, получавшая аспирин 300 мг/кг;
Группа, получавшая белок BD-4, 50 мг/кг, группа, получавшая белок BD-4, 200 мг/кг.
Способ:
Через одни сутки после адаптации экспериментальных животных к окружающей обстановке им заблаговременно за один час давали перорально аспирин 300 мг/кг, белок BD-4 50 мг/кг, 200 мг/кг, и объем введения составлял 10 мл/кг, Затем в брюшную полость вводили 0,6% раствор уксусной кислоты и регистрировали в течение 15 минут инкубационный период (в секундах) и частоту «корчей» у животных.
Обработка данных:
Для данных для каждой группы рассчитывали среднее и стандартную ошибку. При сравнении с модельной группой с применением Т-критерия Р<0,05 считали статистически значимым.
Результаты эксперимента:
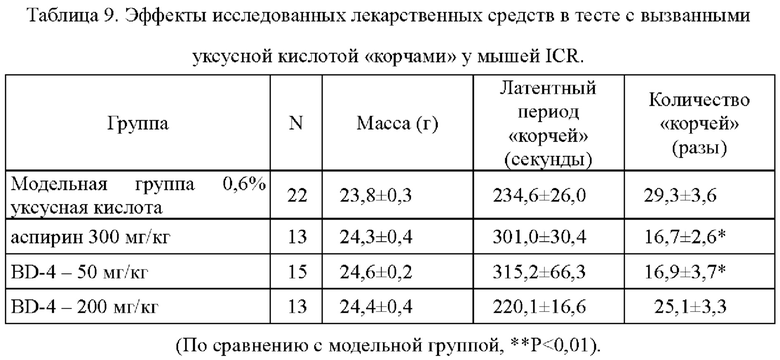
Через один час после перорального введения аспирина 300 мг/кг и различных доз белка BD-4 (50 мг/кг, 200 мг/кг) мышам внутрибрюшинно вводили 0,6% раствор уксусной кислоты и регистрировали латентный период «корчей» и их частоту у мышей ICR. Результаты показаны в Таблице 9.
Результаты эксперимента:
Инъекции 0,6% раствора уксусной кислоты в брюшную полость мышей приводили к глубокой и обширной по площади и длительной болевой стимуляции, вызывающей у мышей «корчи» (живот сокращался в форме буквы «S», туловище и задние ноги вытянуты, ягодицы были приподняты, а бедра делали гребущие движения). Инкубационный период и количество «корчей» у мышей использовали в качестве индекса ответа на боль, чтобы установить наличие анальгезирующего действия исследуемого образца. Результаты данного эксперимента показали:
1) Аспирин 300 мг/кг может существенно отложить инкубационный период «корчей» и сократить частоту «корчей» и обладает определенным анальгезирующим действием. При сравнении с модельной группой, Р<0,05, что было статистически значимым.
2) В группе с дозой 50 мг/кг BD-4 способен существенно сокращать количество «корчей» у мышей. При сравнении с модельной группой, Р<0,05, что было статистически значимым.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> INSTITUTE OF MATERIA MEDICA ,CHINESE ACADEMY OF MEDICAL
SCIENCES
<120> КЕРАТИН BD-4, ЕГО ПОЛУЧЕНИЕ, И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ,
И ПРИМЕНЕНИЕ
<130> IEC220202
<150> CN201911028740.5
<151> 2019-10-28
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 401
<212> PRT
<213> Bos taurus
<400> 1
Met Ser Tyr Ser Cys Cys Leu Pro Asn Leu Ser Phe Arg Ser Ser Cys
1 5 10 15
Ser Ser Arg Pro Cys Val Pro Ser Ser Cys Cys Gly Thr Thr Leu Pro
20 25 30
Gly Ala Cys Asn Ile Pro Ala Asn Val Gly Ser Cys Asn Trp Phe Cys
35 40 45
Glu Gly Ser Phe Asn Gly Ser Glu Lys Glu Thr Met Gln Phe Leu Asn
50 55 60
Asp Arg Leu Ala Ser Tyr Leu Glu Lys Val Arg Gln Leu Glu Arg Asp
65 70 75 80
Asn Ala Glu Leu Glu Ser Arg Ile Leu Glu Arg Ser Gln Gln Gln Glu
85 90 95
Pro Leu Val Cys Pro Asn Tyr Gln Ser Tyr Phe Arg Thr Ile Glu Glu
100 105 110
Leu Gln Gln Lys Ile Leu Cys Ser Lys Ser Glu Asn Ala Arg Leu Val
115 120 125
Val Gln Ile Asp Asn Ala Lys Leu Ala Ser Asp Asp Phe Arg Thr Lys
130 135 140
Tyr Glu Thr Glu Val Ser Leu Arg Gln Leu Val Glu Ala Asp Leu Asn
145 150 155 160
Gly Leu Arg Arg Ile Leu Asp Glu Leu Thr Leu Cys Lys Ser Asp Leu
165 170 175
Glu Ala Arg Val Glu Ser Leu Lys Glu Glu Leu Ile Cys Leu Lys Gln
180 185 190
Asn His Glu Gln Glu Val Asn Thr Leu Arg Ser Gln Leu Gly Asp Arg
195 200 205
Leu Asn Val Glu Val Asp Ala Ala Pro Thr Val Asp Leu Asn Arg Val
210 215 220
Leu Asn Glu Thr Arg Ala Gln Tyr Glu Ala Leu Val Glu Thr Asn Arg
225 230 235 240
Arg Asp Val Glu Glu Trp Tyr Ile Arg Gln Thr Glu Glu Leu Asn Lys
245 250 255
Gln Val Val Ser Ser Ser Glu Gln Leu Gln Ser Tyr Gln Ala Glu Ile
260 265 270
Ile Glu Leu Arg Arg Thr Val Asn Ala Leu Glu Val Glu Leu Gln Ala
275 280 285
Gln His Asn Leu Arg Asp Ser Leu Glu Asn Thr Leu Thr Glu Thr Glu
290 295 300
Ala Arg Tyr Ser Cys Gln Leu Ala Gln Val Gln Gly Leu Ile Gly Asn
305 310 315 320
Val Glu Ser Gln Leu Ala Glu Ile Arg Ser Asp Leu Glu Arg Gln Asn
325 330 335
Gln Glu Tyr Gln Val Leu Leu Asp Val Arg Ala Arg Leu Glu Cys Glu
340 345 350
Ile Asn Thr Tyr Arg Gly Leu Leu Asp Ser Glu Asp Cys Lys Leu Pro
355 360 365
Cys Asn Pro Cys Ala Thr Thr Asn Ala Cys Glu Arg Pro Cys Ile Ser
370 375 380
Asn Pro Cys Val Ser Arg Ala Arg Cys Gly Pro Cys Asn Thr Phe Val
385 390 395 400
His
<210> 2
<211> 1206
<212> DNA
<213> Bos taurus
<400> 2
atgtcgtaca gttgctgtct tccaaatctg tcattccgct cctcttgtag tagccgtcct 60
tgcgtcccct caagctgctg cggcacgacc ctgcctggag catgcaacat tcctgccaac 120
gtcgggagct gtaactggtt ttgcgaggga agtttcaacg gcagcgagaa ggagactatg 180
caattcctga atgatcgcct ggcatcctac ttggaaaaag tccggcaatt ggagcgtgac 240
aacgccgagt tggagtcccg gatcttggaa cggtctcagc aacaggagcc tttggtttgc 300
ccaaactacc aaagctactt tcggacgatc gaagagttgc agcagaagat actgtgcagt 360
aagtcggaaa acgcacgttt ggtggtccag attgataacg cgaagctggc ttccgacgac 420
ttccgcacaa agtacgaaac ggaggttagc ttgcgccagt tggttgaggc ggaccttaac 480
gggctgcgcc gtatcctgga tgagttgacg ctgtgcaagt ctgacctgga agcgcgggta 540
gaatcgttga aggaagagct gatatgcctg aagcagaacc acgagcagga agtgaatacg 600
cttcggtcgc aacttggtga ccggttgaac gtggaggtgg atgctgcccc gaccgtcgat 660
ttgaaccgcg tcttgaatga gacccgtgcg cagtatgagg cactggtgga aacaaatcgg 720
cgtgacgtgg aagaatggta catccgccaa accgaagaat taaacaagca ggtcgtctct 780
agcagcgaac aactgcagag ttaccaggcc gagatcattg agttgcgccg gaccgtgaac 840
gctttggagg tcgaactgca agcgcaacat aaccttcgcg acagtcttga gaacacactg 900
acggagaccg aggcgcggta ttcttgtcag cttgcccagg ttcagggact tatcgggaac 960
gttgagagcc agttagcgga aatccgcagc gaccttgagc ggcagaatca agagtaccag 1020
gtccttctgg acgtgcgggc tcgccttgag tgtgagatta atacgtaccg cggattgttg 1080
gattcggaag actgcaaatt gccatgtaac ccctgcgcca ctacgaatgc gtgcgaacgc 1140
ccgtgcatta gcaacccatg cgtctcgcgt gcgcgttgcg gcccgtgtaa tacctttgtc 1200
cattaa 1206
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КЕРАТИН BD-3, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2815384C1 |
| КЕРАТИН BD-1, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825994C1 |
| КЕРАТИН BD-11, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825992C1 |
| КЕРАТИН BD-10, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2823655C1 |
| КЕРАТИН BD-6, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825993C1 |
| КЕРАТИН BD-13, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825991C1 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
| Терапевтический биопрепарат для лечения гепатоцеллюлярной карциномы | 2014 |
|
RU2739218C2 |
| ВЫСОКОГЛИКОЗИЛИРОВАННЫЙ СЛИТЫЙ БЕЛОК НА ОСНОВЕ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА VIII, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2722374C1 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |


Изобретение относится к области биотехнологии, конкретно к вариантам кератина, и может быть использовано в медицине в изготовлении лекарственного средства для жаропонижающей терапии, анальгезирующей терапии, противокашлевой терапии, отхаркивающей терапии, противосудорожной терапии или противоэпилептической терапии. Изобретение обеспечивает терапевтическое применение кератина, обладающего эффективностью в подавлении повышения температуры тела на модели лихорадки у крыс SD и пролонгировании инкубационного периода эпилепсии II класса и III класса у мышей; отхаркивающим действием в способе экскреции фенолового красного у мышей; противокашлевым действием в способе стимуляции кашля с помощью аммиачной воды у мышей, тенденцией к уменьшению количества «корчей» у мышей и анальгезирующим действием при вызванных уксусной кислотой «корчах» у мышей ICR. 6 н. и 2 з.п. ф-лы, 3 ил., 9 табл., 14 пр.
1. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для жаропонижающей терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
2. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для анальгезирующей терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
3. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для противокашлевой терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
4. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для отхаркивающей терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
5. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для противосудорожной терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
6. Применение кератина или фармацевтической композиции в изготовлении лекарственного средства для противоэпилептической терапии; где указанный кератин имеет аминокислотную последовательность, как показано в SEQ ID NO. 1; где указанная фармацевтическая композиция содержит указанный кератин и фармацевтически приемлемый носитель или эксципиент.
7. Применение по любому из пп. 1-6, где указанный кератин модифицирован, и модификация выбрана из группы, состоящей из ацетилирования, амидирования, циклизации, гликозилирования, фосфорилирования, алкилирования, биотинилирования, модификации флуоресцентной группой, модификации полиэтиленгликолем PEG, модификации иммобилизацией, сульфатирования, окисления, метилирования, дезаминирования, образования дисульфидных связей и разрыва дисульфидных связей.
8. Применение по любому из пп. 1-6, где к указанному кератину присоединена метка для детекции или очистки, и указанная метка выбрана из группы, состоящей из His6, GST, EGFP, MBP, Nus, HA, IgG, FLAG и c-Myc.
| GAO F | |||
| et al | |||
| Recombinant Human Hair Keratin Nanoparticles Accelerate Dermal Wound Healing, APPLIED MATERIALS & INTERFACES, 2019, v | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Металлоулавливающий аппарат для драг | 1928 |
|
SU18681A1 |
| CN 104490929 A, 08.04.2015 | |||
| US 6221843 B1, 24.04.2001 | |||
| RU 2012146368 A, 10.05.2014 | |||
| YAMPOLSKY L.Y | |||
| et al | |||
| The exchangeability of amino acids in proteins, Genetics, 2005, v.170, n.4, | |||
Авторы
Даты
2024-08-15—Публикация
2020-10-28—Подача