ОБЛАСТЬ ТЕХНИКИ
В соответствии с настоящим изобретением предложены кератин BD-13, молекула нуклеиновой кислоты, кодирующая кератин BD-13, вектор экспрессии, содержащий указанную молекулу нуклеиновой кислоты, клетка-хозяин, содержащая вектор экспрессии или молекулу нуклеиновой кислоты, встроенную в геном, способ получения кератина BD-13, фармацевтическая композиция, содержащая указанный кератин, и применение указанного кератина и фармацевтической композиции для получения лекарственного средства для жаропонижающего, болеутоляющего, противокашлевого, отхаркивающего, противосудорожного, противоэпилептического, противогипертонического, противовоспалительного и противовирусного действия.
УРОВЕНЬ ТЕХНИКИ
Кератин представляет собой вид белка, который широко распространен в эпидермисе людей и животных и является главным компонентом волоса, перьев, копыт, панцирей, когтей, рогов и т.д. Это чрезвычайно важный структурный белок соединительной ткани, и он играет роль в защите организма.
Кератин широко представлен в организмах и является возобновляемым ресурсом с большой потребительской ценностью, но он не нашел широкого и эффективного применения. Основная причина этого состоит в том, что кератин нерастворим в различных растворителях, и кератин, как правило, более устойчив к ферментативному гидролизу протеазами, чем другие белки. Следовательно, очень трудно экстрагировать и получить природный кератин.
С быстрым развитием современной биотехнологии, такой как геномика, протеомика, генная инженерия и микробная инженерия, открывали все больше и больше генов. Применение систем экспрессии белков для получения и продукции целевых белков является важным способом исследования биологических функций генов или белков.
Целевой кератин получали с помощью системы экспрессии белков, а затем использовали для исследования его структуры и функции. Настоящее изобретение не раскрыто в других литературных источниках, является новым и имеет изобретательский уровень.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Технические проблемы, которые решает настоящее изобретение, состоят в обеспечении кератина BD-13, молекулы нуклеиновой кислоты, кодирующей кератин BD-13, вектора экспрессии, содержащего указанную молекулу нуклеиновой кислоты, и клетки-хозяина, содержащей вектор экспрессии или молекулу нуклеиновой кислоты, встроенную в геном, и способа получения кератина BD-13, фармацевтической композиции, содержащей кератин BD-13, и применения указанных выше кератина BD-13, молекулы нуклеиновой кислоты, вектора экспрессии, клетки-хозяина или фармацевтической композиции для получения лекарственного средства для жаропонижающего, болеутоляющего, противокашлевого, отхаркивающего, противосудорожного, противоэпилептического, противогипертонического, противовоспалительного и противовирусного действия.
Для того чтобы решить технические проблемы в соответствии с настоящим изобретением предложены следующие технические решения:
Первый аспект технического решения в соответствии с настоящим изобретением состоит в обеспечении кератина BD-13, причем последовательность аминокислот кератина BD-13 представляет собой:
(1) последовательность аминокислот, представленную в SEQ ID NO: 1 в перечне последовательностей.
(2) последовательность аминокислот, у которой по существу сохраняется та же биологическая функция, что и у кератина BD-13, образованную путем замены, делеции или добавления 1 - 35 аминокислот в последовательности аминокислот, представленной в SEQ ID NO: 1 в перечне последовательностей.
Кроме того, кератин BD-13 может содержать стандартную модификацию; или кератин BD-13 дополнительно связан с меткой для детектирования или очистки.
Более того, стандартная модификация включает ацетилирование, амидирование, циклизацию, гликозилирование, фосфорилирование, алкилирование, биотинилирование, модификацию флуоресцентной группой, модификацию полиэтиленгликолем (ПЭГ), модификацию иммобилизацией, сульфатирование, окисление, метилирование, дезаминирование, образование дисульфидной связи или разрыв дисульфидной связи; метка включает His6, GST, EGFP, MBP, Nus, HA, IgG, FLAG, c-Myc, Profinity eXact.
Во втором аспекте технического решения в соответствии с настоящим изобретением предложена молекула нуклеиновой кислоты, кодирующая кератин BD-13 в соответствии с первым аспектом.
Кроме того, последовательность нуклеотидов молекулы нуклеиновой кислоты представляет собой:
(1) последовательность нуклеотидов, представленную в SEQ ID NO: 2 в перечне последовательностей,
(2) последовательность нуклеотидов, полученную путем оптимизации последовательности на основе последовательности нуклеотидов, представленной в SEQ ID NO: 2,
(3) последовательность нуклеотидов, комплементарную последовательности нуклеотидов в (1) или (2) выше.
В третьем аспекте технического решения в соответствии с настоящим изобретением предложен вектор экспрессии, причем указанный вектор экспрессии содержит молекулу нуклеиновой кислоты, описанную во втором аспекте.
Кроме того, вектор экспрессии может представлять собой вектор серии pET, вектор серии pUC, вектор серии pQE, вектор серии pBV, вектор серии pMAL, pPIC9, pPIC9K, pHIL-S1, pPICZα/A, pYAM75P, pHIL-D2, pA0815, pPIC3K, pPICZ, pHWO10, pGAPZ, pGAPZa, pPIC3.5K, и т.д.; указанный вектор экспрессии предпочтительно представляет собой вектор серии pET; указанный вектор экспрессии более предпочтительно представляет собой pET-28a(+).
В четвертом аспекте технического решения в соответствии с настоящим изобретением предложена клетка-хозяин, причем указанная клетка-хозяин содержит вектор экспрессии в соответствии с третьим аспектом или молекулу нуклеиновой кислоты в соответствии со вторым аспектом, встроенную в геном.
Кроме того, клетка-хозяин включает бактерии, дрожжи, аспергиллы, клетки растения или клетки насекомого.
Более того, бактерии включают Escherichia coli или дрожжи.
Компетентные клетки-хозяева могут быть серии BL21, серии Transetta, серии Rosetta, серии DH5α, серии JM, серии Top, серии Orgami, Trans1-T1, TG1, TB1; Y11430, MG1003, GS115 (AOX1), KM71, SMD1168 и т.д.; предпочтительные компетентные клетки для экспрессии представляют собой BL21 (DE3), Transetta (DE3).
В пятом аспекте технического решения в соответствии с настоящим изобретением предложен способ получения кератина BD-13 в соответствии с первым аспектом, причем указанный способ включает следующие этапы:
A. синтез молекулы нуклеиновой кислоты, соответствующей кератину BD-13, описанному в первом аспекте, соединение молекулы нуклеиновой кислоты с соответствующим вектором экспрессии и трансформация вектором экспрессии клетки-хозяина, культивирование клетки-хозяина с вектором экспрессии в устройстве для ферментации при определенных условиях и индукция экспрессии кератина BD-13 с получением неочищенного раствора белка, содержащего кератин BD-13;
B. осуществление разделения, очистки и сушки неочищенного раствора белка, полученного на этапе A, с получением кератина BD-13.
Кроме того, на этапе A клетка-хозяин предпочтительно выбрана из Escherichia coli, кератин BD-13 экспрессируется в тельцах включения Escherichia coli, и устройство для ферментации включает встряхиваемую колбу или ферментер.
Кроме того, на этапе A, после индукции экспрессии кератина BD-13, примеси можно удалить с помощью агента для очистки с получением неочищенного раствора белка путем растворения в растворе.
Кроме того, среда на этапе A может представлять собой среду LB, среду TB, среду SB, среду SOB, среду SOC, среду PDA, среду YPD, среду с бенгальским розовым, среду Chashi с высоким содержанием соли, среду DOBA, среду на основе риса кодзи (koji), и их модифицированные формулы, и т.д.; при ферментации во встряхиваемой колбе предпочтительна среда LB, среда TB, наиболее предпочтительна среда TB; при ферментации в ферментере предпочтительна среда LB и ее модифицированные формулы.
Кроме того, индуктор на этапе A может представлять собой изопропилтиогалактозид (ИПТГ), лактозу, арабинозу и т.д.; предпочтительно он представляет собой ИПТГ или лактозу.
Кроме того, на этапе A, полученный ферментативный бульон центрифугируют, а затем супернатант отбрасывают; преципитат суспендируют в буфере, бактерии разрушают, снова центрифугируют, и супернатант отбрасывают; затем преципитат промывают агентом для очистки, а затем растворяют в растворе мочевины с получением неочищенного раствора белка BD-13.
В том числе, буфер предпочтительно представляет собой буфер A, и его дозировка составляет: объем ферментативного бульона: объем буфера A = 1 ~ 100:1, предпочтительно 10:1;
Агент для очистки может представлять собой раствор мочевины, раствор гидрохлорида гуанидина, тритон и буфер A, и т.д., предпочтительно представляет собой раствор мочевины, наиболее предпочтительно 2 М раствор мочевины (может содержать 1% тритон). Дозировка составляет: объем ферментативного бульона: объем 2 М мочевины = 0,2 ~ 100:1, предпочтительно 1 ~ 15:1;
Раствор мочевины предпочтительно представляет собой 8 М раствор мочевины, и его дозировка составляет: объем ферментативного бульона: объем 8 М мочевины = 0,2 ~ 100: 1, предпочтительно 2 ~ 15: 1.
Кроме того, на этапе B, способ разделения и очистки включает способ очистки на основе технологии ультрафильтрации и микрофильтрации через мембрану, способ очистки с помощью колоночной хроматографии, способ высаливания и способ диализа.
Кроме того, на этапе B, способ разделения и очистки представляет собой такой способ, как описано далее.
(1) Способ диализа предназначен для очистки неочищенного раствора белка, полученного на этапе A, с помощью способа диализа с получением раствора целевого белка BD-13.
Порог по молекулярной массе у диализного мешка может составлять 0,5 - 10 кДа, предпочтительный порог по молекулярной массе у диализного мешка составляет 3,5 - 10 кДа, и наиболее предпочтительный порог по молекулярной массе у диализного мешка составляет 10 кДа.
(2) Способ ультрафильтрации и микрофильтрации предназначен для очистки неочищенного раствора белка, полученного на этапе A, с помощью мембранной технологии, такой как мембрана для ультрафильтрации или мембрана для микрофильтрации, с получением концентрированного раствора целевого белка BD-13.
Предпочтительно, очистку с помощью микрофильтрационной мембраны проводят дважды, причем размер пор мембраны составляет 1000 ~ 1500 нм в первый раз, и размер пор мембраны составляет 20 ~ 50 нм во второй раз.
(3) Способ колоночной хроматографии состоит в пропускании неочищенного раствора белка, полученного на этапе A, через хроматографическую колонку, такую как различные обменные колонки или колонки для эксклюзионной хроматографии, чтобы отделить и очистить целевой белок BD-13.
Предпочтительная эксклюзионная колонка представляет собой колонку с декстрановым гелем Superdex 30 Increase, Superdex 75 Increase, Superdex 200 Increase и Superose 6 Increase, и т.д.; предпочтительная обменная колонка представляет собой колонку с ионообменной смолой: колонку с анионообменной смолой: HiTrap Q FF, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE, Toyopearl Q-650M и Toyopearl SuperQ-650M, и т.д.; колонку с катионообменной смолой: HiTrap SP FF,HiTrap Capto SP ImpRes,Capto SP ImpRes,HiTrap Capto SP, Toyopearl SP-650M и Toyopearl Super SP-650M. Наиболее предпочтительная колонка представляет собой колонку с анионообменной смолой.
В качестве элюента можно применять элюенты, которые стандартно применяют в данной области техники, такие как вода и солевой раствор. Солевой раствор включает раствор хлорида натрия, раствор однозамещенного фосфата натрия, раствор двузамещенного фосфата натрия, ацетат натрия, уксусную кислоту и тому подобные растворы.
(4) Способ высаливания предназначен для очистки неочищенного раствора белка, полученного на этапе A, с помощью способа высаливания с получением суспензии целевого белка BD-13.
Высаливающий агент может представлять собой сульфат аммония, сульфат натрия, хлорид натрия, хлорид магния, сульфат алюминия, нитрат аммония, хлорид аммония, сульфат магния и тому подобные агенты. Предпочтительный высаливающий агент представляет собой сульфат аммония и его водный раствор. Добавляют насыщенный водный раствор сульфата аммония, чтобы добиться конечной концентрации сульфата аммония 10 - 50%, предпочтительно 20 - 30%, более предпочтительно 25%.
Количество высаливаний составляет от 1 до 3 раз, предпочтительно 2 раза.
После высаливания преципитат промывают чистой водой, и количество промывок составляет от 2 до 5 раз, предпочтительно 3 раза.
Затем раствор целевого белка BD-13, очищенного на этапе B, можно лиофилизировать или подвергнуть вакуумной сушке с получением сухого порошка, или концентрированный раствор можно напрямую высушить распылением с получением сухого порошка.
В шестом аспекте технического решения в соответствии с настоящим изобретением предложена фармацевтическая композиция, причем указанная фармацевтическая композиция содержит кератин BD-13, описанный в первом аспекте, или молекулу нуклеиновой кислоты, описанную во втором аспекте, или вектор экспрессии в соответствии с третьим аспектом, или клетку-хозяина в соответствии с четвертым аспектом и фармацевтически приемлемый носитель или вспомогательное вещество.
Кератин, полученный на описанных выше этапах в соответствии с настоящим изобретением, можно лиофилизировать или подвергнуть вакуумной сушке с получением сухого порошка, или концентрированную жидкость можно непосредственно высушить распылением с получением сухого порошка, а затем сделать различные дозированные формы.
В соответствии с настоящим изобретением предложена фармацевтическая композиция, содержащая любой кератин, полученный на описанных выше этапах, и фармацевтически приемлемый носитель.
В соответствии с настоящим изобретением также предложена фармацевтическая композиция, содержащая кератин в соответствии с настоящим изобретением в качестве активного ингредиента и стандартные фармацевтические вспомогательные вещества или адъюванты. Как правило, кератин в соответствии с настоящим изобретением составляет 0,1 - 100,0% от общей массы фармацевтической композиции.
В соответствии с настоящим изобретением также предложена фармацевтическая композиция, которая содержит фармацевтически эффективную дозу белка в качестве активного ингредиента и фармацевтически приемлемый носитель.
Фармацевтическую композицию в соответствии с настоящим изобретением можно получить в соответствии со способами, известными в данной области техники. При применении для данной цели, при необходимости, белок в соответствии с настоящим изобретением можно объединить с одним или более твердыми или жидкими фармацевтическими вспомогательными веществами и/или адъювантами с получением подходящей формы для введения или дозирования, которую можно применять в качестве лекарственной формы для применения человеком или в ветеринарии.
Кератин в соответствии с настоящим изобретением или содержащую его фармацевтическую композицию можно вводить в виде единичной дозированной формы. Путь введения может быть энтеральным или парентеральным, таким как пероральное введение, внутримышечное, подкожное введение, введение через носовую полость, через слизистую рта, глаз, легкое, кожу, влагалище, брюшную полость и прямую кишку, и т.д., пероральное введение является предпочтительным.
Белок кератин в соответствии с настоящим изобретением или содержащую его фармацевтическую композицию можно вводить путем инъекции. Инъекция включает внутривенную инъекцию, внутримышечную инъекцию, подкожную инъекцию, внутрикожную инъекцию, интраперитонеальную инъекцию и инъекцию в акупунктурную точку, и т.д.
Дозированная форма для введения может представлять собой жидкую дозированную форму, твердую дозированную форму или полутвердую дозированную форму. Жидкая дозированная форма может представлять собой раствор (включая истинный раствор и коллоидный раствор), эмульсию (включая эмульсию типа масло в воде, типа вода в масле и двойную эмульсию), суспензию, форму для инъекции (включая водную форму для инъекции, порошковую форму для инъекции и инфузии), лосьон для закапывания в глаз, капли назальные, лосьон и линимент, и т.д. Твердая дозированная форма может представлять собой таблетку (включая стандартную таблетку, таблетку с энтеросолюбильным покрытием, буккальную таблетку, диспергируемую таблетку, жевательную таблетку, шипучую таблетку, таблетку для рассасывания), капсулу (включая твердую капсулу, мягкую капсулу и капсулу с энтеросолюбильным покрытием), гранулированный препарат, порошок, пеллет, микропилюлю, суппозиторий, пленку, пластырь, воздушный (порошковый) спрей, спрей, и т.д.; полутвердая дозированная форма может представлять собой мазь, гель, пасту, и т.д.
Кератин в соответствии с настоящим изобретением можно включить в состав стандартных препаратов, препаратов с замедленным высвобождением, препаратов с контролируемым высвобождением, таргетных (направленных) препаратов и различных систем доставки на основе частиц.
Для того чтобы получить из единичной дозированной формы таблетку, можно применять различные вспомогательные вещества, широко известные в данной области техники, включая разбавители, связующие вещества, смачивающие агенты, дезинтегрирующие агенты, скользящие вещества и скользящие агенты. Разбавитель может представлять собой крахмал, декстрин, сахарозу, глюкозу, лактозу, маннит, сорбит, ксилит, микрокристаллическую целлюлозу, сульфат кальция, двузамещенный фосфат кальция, карбонат кальция и т.д.; увлажнитель может представлять собой воду, этанол, изопропанол и т.д.; связующее вещество может представлять собой крахмальную патоку, декстрин, сироп, мед, раствор глюкозы, микрокристаллическую целлюлозу, сироп акации, желатиновый сироп, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гипромеллозу, щелочную целлюлозу, этилцеллюлозу, акриловую смолу, карбомер, поливинилпирролидон, полиэтилендипропанол и т.д.; дезинтегрирующий агент может представлять собой сухой крахмал, микрокристаллическую целлюлозу, низкозамещенную гидроксипропилцеллюлозу, связанный поперечными связями поливинилпирролидон, связанную поперечными связями карбоксиметилцеллюлозу натрия, карбоксиметилкрахмал натрия, бикарбонат натрия и желудевую (rafter) кислоту, карбонат кальция, сложный эфир полиоксиэтиленсорбита и жирных кислот, додецилсульфонат натрия; скользящее вещество и глидант может представлять собой тальк, диоксид кремния, стеарат, винную кислоту, жидкий парафин, полиэтиленгликоль и т.д.
Таблетки также можно дополнительно получить в виде таблеток с покрытием, таких как покрытые сахаром таблетки, покрытые пленочной оболочкой таблетки, таблетки с энтеросолюбильным покрытием или двухслойные таблетки и многослойные таблетки.
Для того чтобы получить единичную форму для введения в виде пилюли, можно применять различные носители, широко известные в данной области техники. Примеры носителей представляют собой, например, разбавители и абсорбенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрогенизированное растительное масло, поливинилпирролидон, лаурат полиэтиленгликоля, каолин, тальк и т.д.; связующие вещества, такие как гуммиарабик, ксантановая камедь, желатин, этанол, мед, жидкий сахар, рисовая паста или тесто, и т.д.; дезинтегрирующие агенты, такие как порошок агара, сухой крахмал, альгинат, лаурилсульфонат натрия, метилцеллюлоза, этилцеллюлоза и т.д.
Для того чтобы получить единичную форму для введения в виде суппозитория, можно применять различные носители, широко известные в данной области техники. Примеры носителей представляют собой, например, полиэтиленгликоль, лецитин, масло какао, высшие спирты, эфиры высших спиртов, желатин, полусинтетические глицериды и тому подобные носители.
Для того чтобы получить единичную дозу в виде капсулы, активный ингредиент кератин в соответствии с настоящим изобретением смешивают с указанными выше различными носителями, и полученную в результате этого смесь помещают в твердые желатиновые капсулы или мягкие капсулы. Активный ингредиент кератин в соответствии с настоящим изобретением также можно заключить в микрокапсулы, суспендировать в водной среде с получением суспензии, наполнить им твердые капсулы или включить в состав инъекционного препарата для введения.
Например, кератин в соответствии с настоящим изобретением включают в состав инъекционных препаратов, таких как растворы, суспензионные растворы, эмульсии и лиофилизированный порошок для инъекций. Такие препараты могут быть водными или неводными и могут содержать один и/или более фармакодинамически приемлемых носителей, разбавителей, связующих веществ, скользящих веществ, консервантов, поверхностно-активных веществ или диспергирующих агентов. Например, разбавитель может быть выбран из воды, этанола, полиэтиленгликоля, 1,3-пропиленгликоля, этоксилированного изостеарилового спирта, полиоксилированного изостеарилового спирта, сложных эфиров полиоксиэтиленсорбита и жирных кислот и тому подобных разбавителей. Кроме того, для получения изотонического состава для инъекции, в препарат для инъекции можно добавить подходящее количество хлорида натрия, глюкозы или глицерина. Кроме того, также можно добавить стандартные солюбилизаторы, буферы, регулирующие pH агенты и т.д. Эти вспомогательные материалы стандартно применяют в данной области техники.
Кроме того, при необходимости, в фармацевтические препараты также можно добавить красящие агенты, консерванты, ароматизаторы, отдушки, подсластители или другие материалы.
Для того чтобы достичь цели лечения и улучшить терапевтическое действие, кератин или фармацевтическую композицию в соответствии с настоящим изобретением можно вводить любым известным способом введения.
Дозировка фармацевтической композиции кератина в соответствии с настоящим изобретением зависит от множества факторов, таких как природа и тяжесть заболевания, которое необходимо предотвратить или лечить, пол, возраст, масса тела, личность и индивидуальный ответ пациента или животного, путь введения, количество введений и цель лечения, поэтому терапевтическая доза в соответствии с настоящим изобретением может изменяться в широком диапазоне. В общем случае, дозировка фармацевтических ингредиентов в соответствии с настоящим изобретением хорошо известна специалисту в данной области техники. Можно внести подходящую корректировку в соответствии с фактическим количеством лекарственного средства, содержащимся в конечном препарате композиции кератина в соответствии с настоящим изобретением, чтобы удовлетворить требование к терапевтически эффективному количеству и осуществить задачу предотвращения или терапии в соответствии с настоящим изобретением. Подходящий диапазон суточных дозировок кератина в соответствии с настоящим изобретением: дозировка кератина в соответствии с настоящим изобретением составляет 0,01 ~ 500 мг/кг массы тела, предпочтительно 0,5 ~ 100 мг/кг массы тела, более предпочтительно 1 ~ 50 мг/кг массы тела и наиболее предпочтительно 2 ~ 30 мг/кг массы тела. Приведенную выше дозировку можно вводить в виде единичной дозированной формы или разделить на несколько, например, две, три или четыре, дозированных форм, в зависимости от клинического опыта осуществляющего введение врача и схемы введения дозировок, включая применение других способов терапии. Суммарную дозу, необходимую для каждого лечения, можно разделить на множество доз или использовать единичные дозы. Белок или фармацевтическую композицию в соответствии с настоящим изобретением можно применять отдельно или комбинировать с другими терапевтическими средствами или симптоматическими средствами, и дозировку можно регулировать.
В седьмом аспекте технического решения в соответствии с настоящим изобретением предложено применение кератина BD-13 в соответствии с первым аспектом, или молекулы нуклеиновой кислоты в соответствии со вторым аспектом, или вектора экспрессии в соответствии с третьим аспектом, или клетки-хозяина в соответствии с четвертым аспектом, или фармацевтической композиции в соответствии с шестым аспектом для получения лекарственного средства для жаропонижающего, болеутоляющего, противокашлевого, отхаркивающего, противосудорожного, противоэпилептического, противогипертонического, противовоспалительного и противовирусного действия.
Для того чтобы осуществить задачу настоящего изобретения, в соответствии с настоящим изобретением предложены следующие технические решения. В частности, способ получения кератина BD-13 в соответствии с настоящим изобретением включает следующие этапы:
(1) Синтез последовательности нуклеотидов и определение точности последовательности;
Предпочтительная последовательность нуклеотидов представлена в SEQ ID NO: 2.
(2) Перенос последовательности нуклеотидов в вектор экспрессии;
Вектор экспрессии может представлять собой вектор серии pET, серии pUC, серии pQE, серии pBV, серии pMAL, pPIC9K, pHIL-S1, pPICZα/A, pYAM75P, pHIL-D2, pA0815, pPIC3K, pPICZ, pHWO10, pGAPZ, pGAPZa, pPIC3.5K и т.д. Предпочтительный вектор экспрессии представляет собой вектор серии pET; наиболее предпочтительный вектор экспрессии представляет собой pET-28a(+).
(3) Трансфекцию вектором экспрессии клетки-хозяина;
Клетка-хозяин может представлять собой E. coli или клетку дрожжей; предпочтительная клетка-хозяин представляет собой E. coli;
Компетентные клетки могут представлять собой клетки серии BL21, серии Transetta, серии Rosetta, серии DH5α, серии JM, серии Top, серии Orgami, Trans1-T1, TG1, TB1; Y11430, MG1003, GS115 (AOX1), KM71, SMD1168 и т.д. Предпочтительная компетентная для экспрессии клетка представляет собой BL21 (DE3) или Transetta (DE3).
(1) Культивирование клетки-хозяина при условиях, подходящих для того, чтобы вызвать экспрессию целевого белка BD-13;
устройство для ферментации, которое можно применять, представляет собой встряхиваемую колбу или ферментер;
среда может представлять собой среду LB, среду TB, среду SB, среду SOB, среду SOC, среду PDA, среду YPD, среду с бенгальским розовым, среду Chashi с высоким содержанием соли, среду DOBA, культуральную среду на основе риса кодзи, и их улучшенные формулы, и т.д.; при ферментации во встряхиваемой колбе предпочтительна среда LB, среда TB, и наиболее предпочтительна среда TB; при ферментации в ферментере предпочтительна среда LB и ее улучшенные формулы.
Индуктор может представлять собой ИПТГ, лактозу, арабинозу и т.д.; предпочтительно представляет собой ИПТГ или лактозу.
(2) Обогащение продуктом целевого белка BD-13;
Центрифугировать ферментированные жидкости с бактериями, полученные на этапе (4), и отбросить супернатант; суспендировать преципитат в буфере, затем разрушить бактерии, а затем снова центрифугировать и отбросить супернатант; после промывки преципитата с помощью агента для очистки, растворить в растворе мочевины с получением неочищенного раствора белка BD-13.
В том числе, буфер предпочтительно представляет собой буфер A, и его дозировка составляет: объем ферментативного бульона: объем буфера A =1~100: 1, предпочтительно 10: 1;
Агент для очистки может представлять собой раствор мочевины, раствор гидрохлорида гуанидина, тритон, буфер A и т.д., предпочтительно представляет собой раствор мочевины, наиболее предпочтительно 2 М раствор мочевины (может содержать 1% тритон). Дозировка составляет объем ферментативного бульона: объем 2 М мочевины = 0,2 ~ 100: 1, предпочтительно 1 ~ 15: 1;
Раствор мочевины предпочтительно представляет собой 8 М раствор мочевины. Его дозировка составляет объем ферментативного бульона: объем 8 М мочевины = 0,2 ~ 100:1, предпочтительно 2 ~ 15: 1.
(1) Разделение и очистку целевого белка BD-13.
Неочищенный раствор белка, полученный на этапе (5), необходимо очистить с получением целевого белка BD-13. Очистку можно осуществить с помощью этапов диализа, или ультрафильтрации и микрофильтрации, или колоночной хроматографии, или высаливания.
A. На этапе диализа неочищенный раствор белка, полученный на этапе (5), очищают с помощью способа диализа с получением раствора целевого белка BD-13.
Порог по молекулярной массе у диализного мешка может составлять 0,5 - 10 кДа, предпочтительный порог по молекулярной массе у диализного мешка составляет 3,5 - 10 кДа, и наиболее предпочтительный порог по молекулярной массе у диализного мешка составляет 10 кДа.
B. На этапе ультрафильтрации и микрофильтрации неочищенный раствор белка, полученный на этапе (5), очищают с помощью мембранной технологии, такой как мембрана для ультрафильтрации или мембрана для микрофильтрации, с получением концентрированного раствора целевого белка BD-13.
Предпочтительно, очистку с помощью микрофильтрационной мембраны проводят дважды, причем размер пор мембраны составляет 1000 ~ 1500 нм в первый раз, и размер пор мембраны составляет 20 ~ 50 нм во второй раз.
C. На этапе колоночной хроматографии неочищенный раствор белка, полученный на этапе (5), пропускают через хроматографическую колонку, такую как различные обменные колонки или колонки для эксклюзионной хроматографии, чтобы отделить и очистить целевой белок BD-13.
Предпочтительная эксклюзионная колонка представляет собой колонку с декстрановым гелем, Superdex 30 Increase, Superdex 75 Increase, Superdex 200 Increase, Superose 6 Increase, и т.д.; предпочтительная обменная колонка представляет собой колонку с ионообменной смолой: колонку с анионообменной смолой HiTrap Q FF, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE, Toyopearl Q-650M, Toyopearl SuperQ-650M, и т.д.; колонку с катионообменной смолой HiTrap SP FF, HiTrap Capto SP ImpRes, Capto SP ImpRes, HiTrap Capto SP, Toyopearl SP-650M, Toyopearl Super SP-650M. Наиболее предпочтительная колонка представляет собой колонку с анионообменной смолой.
В качестве элюента можно применять элюенты, которые стандартно применяют в данной области техники, такие как вода, солевой раствор, и солевой раствор включает раствор хлорида натрия, раствор однозамещенного фосфата натрия, раствор двузамещенного фосфата натрия, ацетат натрия, уксусную кислоту и тому подобные растворы.
D. Этап высаливания предназначен для очистки неочищенного раствора белка, полученного на этапе (5), с помощью способа высаливания с получением суспензии целевого белка BD-13.
Высаливающий агент может представлять собой сульфат аммония, сульфат натрия, хлорид натрия, хлорид магния, сульфат алюминия, нитрат аммония, хлорид аммония, сульфат магния и тому подобные агенты. Предпочтительный высаливающий агент представляет собой сульфат аммония и его водный раствор. Добавляют насыщенный водный раствор сульфата аммония, чтобы добиться конечной концентрации сульфата аммония 10 - 50%, предпочтительно 20 - 30%, более предпочтительно 25%.
Количество высаливаний составляет от 1 до 3 раз, предпочтительно 2 раза.
После высаливания преципитат промывают чистой водой, и количество промывок составляет от 2 до 5 раз, предпочтительно 3 раза.
Раствор целевого белка BD-13, очищенный на этапах A - D, можно лиофилизировать или подвергнуть вакуумной сушке с получением сухого порошка, или концентрированный раствор можно напрямую высушить распылением с получением сухого порошка.
Полезные технические эффекты настоящего изобретения:
1. Белок в соответствии с настоящим изобретением представляет собой кератин, полученный впервые, и способ получения в соответствии с настоящим изобретением обладает свойствами получения высокого выхода и высокой чистоты образца.
2. В соответствии с настоящим изобретением, посредством фармакодинамического исследования белка BD-13 в модели вызванной дрожжами и липополисахаридом (ЛПС) лихорадки у крыс SD доказано, в подавляющем большенстве точек времени после создания моделя белка BD-13 может значимо ингибировать повышение температуры тела, и оказывает сильное действие;
3. В соответствии с настоящим изобретением, одельное фармакодинамическое исследование белка BD-13 при вызванных амитразолом (PTZ) и пилокарпином (PLO) эпилепсии у мышей, соответственно, доказало, что белок BD-13 может значимо продлевать период латентности судорог при эпилепсии III класса у мышей;
4. Настоящее изобретение доказывает, что у белка BD-13 есть тенденция к повышению выделения фенолового красного и потенциал отхаркивающего действия, с помощью фармакодинамического исследования белка BD-13 в способе с выделением фенолового красного у мышей;
5. В соответствии с настоящим изобретением, фармакодинамическое исследование противокашлевого действия белка BD-13 в способе стимуляции кашля с помощью водного раствора аммиака у мышей доказывает, что белок BD-13 наблюдали тенденцию к уменьшению количества откашливаний и увеличению латентного периода, а также потенциал противокашлевого действия;
6. Настоящее изобретение доказывает, что белок BD-13 может значимо уменьшать количество корчей у мышей и оказывает значимое болеутоляющее действие, посредством фармакодинамического исследования белка BD-13 при вызванных уксусной кислотой корчах у мышей ICR.
ЧЕРТЕЖИ
Фигура 1. Анализ экспрессированного белка BD-13 методом электрофореза в полиакриламидном геле в восстанавливающих условиях в присутствии ДСН (ПААГ/ДСН).
(M - стандарт молекулярных масс белков; S - экспрессированный белок BD-13)
Фигура 2. Действие белка BD-13 в модели вызванной дрожжами лихорадки у крыс.
(По сравнению с группой нормального контроля, ** P<0,01, *** P<0,001; по сравнению с модельной группой, # P<0,05,## P<0,01,### P<0,001).
Фигура 3. Действие белка BD-13 на вызванную липополисахаридом (ЛПС) лихорадку у крыс.
(По сравнению с группой нормального контроля, *** P<0,001; по сравнению с модельной группой, ## P<0,01,### P<0,001)
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
Следующие примеры и примеры исследования фармакологической активности используют, чтобы дополнительно проиллюстрировать настоящее изобретение, но это не означает какое-либо ограничение настоящего изобретения.
Экспериментальные способы в следующих примерах и примеры исследования фармакологической активности представляют собой стандартные способы, если не указано иное; применяемые экспериментальные материалы, если не указано иное, приобретены у стандартных компаний-поставщиков биохимических реагентов.
Пример 1. Ферментация во встряхиваемой колбе с получением неочищенного раствора A белка BD-13 (среда TB).
Синтезировать последовательность нуклеотидов, представленную в SEQ ID NO: 2, и перенести ее в вектор pET-28a(+); подтвердить последовательность, чтобы получить вектор экспрессии, содержащий правильную последовательность; трансфицировать указанным вектором экспрессии клетки BL21 (DE3), получить компетентные для экспрессии клетки-хозяева, содержащие целевую последовательность нуклеотидов. Добавить среду LB и инкубировать на качалке при 37°C и 220 об/мин в течение 1 часа с получением рекомбинантного штамма.
Захватить рекомбинантный штамм и посеять его штрихом на чашку с LBA, содержащую канамицин, и поместить чашку вверх дном в термостат с постоянной температурой 37°C на ночь на 16 часов.
Распределить 400 мл среды TB по 2 бутылям, в каждой бутыли по 200 мл. Добавить канамицин (конечная концентрация 50 мкг/мл) в каждую бутыль (200 мл) со средой TB. Взять одну колонию с чашки и добавить ее в среду TB. Размножить и культивировать на качалке в течение ночи при 37°C и 220 об/мин с получением жидкости для посева.
Распределить 28,8 л среды TB по 144 бутылям, в каждой бутыли по 200 мл. Добавить канамицин (конечная концентрация 50 мкг/мл) в каждую бутыль (200 мл) со средой TB, затем добавить 2 мл раствора для посева, и инкубировать на качалке при 37°C и 220 об/мин в течение 2 - 3 часов. Отслеживать ОП600, когда ОП600 достигнет приблизительно 1,0, добавить индуктор, чтобы вызвать экспрессию белка на качалке, условия индукции выбраны из следующей таблицы.
25°C
37°C
8 ч
5 ч
Объединить содержащие бактерии жидкости из всех бутылей, центрифугировать при 7000 об/мин в течение 5 минут, и отбросить супернатант после стерилизации; преципитат суспендировать приблизительно в 3 л буфера, фильтровать через сито с порами 80 - 100 меш, и фильтрат разрушить с помощью измельчителя под высоким давлением при давлении 800 - 1000 бар, дважды, по 2 минуты каждый раз. Центрифугировать жидкость с разрушенными бактериями при 7000 об/мин в течение 30 минут, отбросить супернатант и получить преципитат (т.е., тельца включения). Преципитат промывали дважды 1 л детергента, центрифугировали и отбрасывали супернатант. Преципитат растворяли в растворе мочевины 4 раза, соответственно: 800 мл, 600 мл, 400 мл и 400 мл. Четыре раствора объединяли и центрифугировали при 7000 об/мин в течение 30 минут. Преципитат отбрасывали, и полученный супернатант представлял собой неочищенный раствор A белка.
4 М раствор мочевины (может содержать тритон)
2 М раствор гидрохлорида гуанидина
4 М раствор гидрохлорида гуанидина
(может содержать буфер трис/HCl или
буфер NaH2PO4/Na2HPO4)
4 М раствор мочевины (может содержать буфер трис/HCl)
Неочищенный раствор A белка BD-13 анализировали с помощью восстанавливающего ПААГ/ДСН. Концентрация разделяющего геля составляла 12,5%, затем проводили окрашивание по методу с использованием кумасси бриллиантового голубого R250; четкая голубая полоса видна в области молекулярной массы 53 кДа.
Пример 2. Ферментация во встряхиваемой колбе с получением неочищенного раствора B белка BD-13 (другая среда).
В Примере 1, для подтверждения того, что получили вектор экспрессии, содержащий последовательность, представленную в SEQ ID NO: 2, его синтезировали и секвенировали; указанным вектором экспрессии трансфицировали клетки Transetta (DE3) с получением компетентных для экспрессии клеток-хозяев, содержащих целевую последовательность нуклеотидов.
Приготовить 20 мл среды LB, взять 800 мкл, добавить 50 мкл клеток-хозяев, содержащих целевую кодирующую последовательность, и инкубировать при 37° C и 220 об/мин в течение 1 часа на качалке.
Захватить поученную выше содержащую бактерии жидкость и посеять ее штрихом на чашку с LBA, содержащую канамицин, и поместить чашку вверх дном в термостат с постоянной температурой 37°C на ночь на 16 часов.
Взять 10 мл среды LB, добавить канамицин (конечная концентрация 50 мкг/мл), взять одну колонию с чашки и добавить ее в среду LB. Размножить и культивировать в течение ночи при 37°C и 220 об/мин в течение 15 часов с получением жидкости для посева на качалке.
Распределить 1 л среды, представленной в таблице ниже, по 10 бутылям по 100 мл в каждую. Добавить канамицин (конечная концентрация 50 мкг/мл) в каждую бутыль со средой (100 мл), а затем добавить 1 мл раствора для посева. Инкубировать при 37°C и 220 об/мин в течение 2 - 3 часов на качалке. Отслеживать ОП600 и добавить индуктор ИПТГ (конечная концентрация 0,5 мМ), когда ОП600 достигнет приблизительно 1,0. Вызвать экспрессию белка при 37°C и 220 об/мин на качалке.
Объединить содержащие бактерии жидкости из всех бутылей, центрифугировать при 10000 об/мин в течение 10 минут и отбросить супернатант после стерилизации; преципитат суспендировать в приблизительно 100 мл буфера, фильтровать через сито с порами 80 - 100 меш и фильтрат разрушить с помощью измельчителя под высоким давлением при давлении 800 - 1000 бар, дважды, по 2 минуты каждый раз. Центрифугировать жидкость с разрушенными бактериями при 10000 об/мин в течение 30 минут и отбросить супернатант.
Добавить 40 мл агента для очистки буфера A к преципитату для трехкратной промывки, центрифугировать и отбросить супернатант; добавить 40 мл агента для очистки 2 М раствора мочевины к преципитату для двукратной промывки, центрифугировать и отбросить супернатант; преципитат затем добавить в 8 М раствор мочевины (содержащий 50 мМ буфер трис/HCl) для трехкратного растворения, соответственно: 40 мл, 30 мл, 30 мл; объединенные растворы центрифугировать при 7000 об/мин в течение 30 минут, преципитат отбросить, и полученный супернатант представлял собой неочищенный раствор B белка.
Неочищенный раствор B белка BD-13 анализировали с помощью восстанавливающего ПААГ/ДСН, причем концентрация разделяющего геля составляла 12,5%, затем проводили окрашивание по методу с использованием кумасси бриллиантового голубого R250; четкая голубая полоса видна в области молекулярной массы 53 кДа.
Пример 3. Получение неочищенного раствора C белка BD-13 в ферментере.
В Примере 1, для подтверждения того, что получили вектор экспрессии, содержащий последовательность, представленную в SEQ ID NO: 2, его синтезировали и секвенировали; указанным вектором экспрессии трансфицировали клетки BL21 (DE3) с получением компетентных для экспрессии клеток-хозяев, содержащих целевую последовательность нуклеотидов. Добавить компетентные для экспрессии клетки-хозяева в среду LB и инкубировать на качалке при 37°C и 220 об/мин в течение 1 часа с получением рекомбинантного штамма.
В чашку с LBA, содержащим канамицин, добавить 100 мкл рекомбинантного штамма, распределять с помощью шпателя до тех пор, пока агар не станет равномерно сухим, и поместить чашку вверх дном в термостат с постоянной температурой 37°C для культивирования в течение ночи. Взять три отдельные колонии, посеять их штрихом на чашку, содержащую канамицин, а затем культивировать чашку в течение ночи. После трех партий ферментации во встряхиваемой колбе и подтверждения правильности экспрессии, штаммы консервировали с добавлением 15% глицерина и разделяли на аликвоты по 0,8 мл каждая с получением рабочего банка клеток, который хранили в морозильной камере при -80°C для дальнейшего применения.
Вынуть 1 пробирку с бактериями в глицерине из рабочего банка клеток, взять 100 мкл и добавить их в 40 мл среды LB, добавить канамицин (конечная концентрация 50 мкг/мл), инкубировать на качалке при 37°C и 220 об/мин в течение 6 часов с получением раствора для посева первого уровня.
Взять 1,2 мл раствора для посева первого уровня, добавить их в 120 мл среды LB, добавить канамицин (конечная концентрация 50 мкг/мл), а затем инкубировать на качалке при 37°C и 220 об/мин в течение 6 часов с получением раствора для посева второго уровня.
Добавить 3 л модифицированного бульона LB в ферментер емкостью 5 л, затем добавить 120 мл раствора для посева второго уровня, 3 мл канамицина (конечная концентрация 50 мкг/мл) и инкубировать при 37°C и 30% растворенного кислорода (серия скоростей) в течение приблизительно 8 часов. Отслеживать значение ОП, пока оно не достигнет приблизительно 20, и добавить 3 г лактозы в качестве индуктора. Индукцию проводили при 20°C, подпитывали при скорости потока 30 мл/час и инкубировали при 20°C в течение 24 часов.
Центрифугировать содержащий бактерии раствор при 7000 об/мин в течение 5 минут и отбросить супернатант после стерилизации; преципитат суспендировать приблизительно в 200 мл буфера A, фильтровать через сито с порами 80 - 100 меш и фильтрат разрушить с помощью измельчителя под высоким давлением при давлении 800 - 1000 бар, дважды, по 2 минуты каждый раз. Центрифугировать жидкость с разрушенными бактериями при 7000 об/мин в течение 30 минут и отбросить супернатант.
Добавить 2 М раствор мочевины (содержащей 1% тритон) к преципитату и промыть его дважды, каждый раз 1 л; затем добавить 1 л 2 М раствора мочевины для однократной промывки, центрифугировать и отбросить супернатант. Преципитат затем добавить в 8 М раствор мочевины (содержащий 50 мМ буфер трис/HCl) для растворения 4 раза, соответственно: 400 мл, 300 мл, 200 мл, 100 мл; четыре раствора объединить, центрифугировать при 7000 об/мин в течение 30 минут, преципитат отбросить, и супернатант представлял собой неочищенный раствор C белка.
Неочищенный раствор C белка BD-13 анализировали с помощью восстанавливающего ПААГ/ДСН, причем концентрация разделяющего геля составляла 12,5%, затем проводили окрашивание по методу с использованием кумасси бриллиантового голубого R250; четкая голубая полоса видна в области молекулярной массы 53 кДа.
Пример 4. Белок BD-13 получали из неочищенного раствора A белка с помощью диализа.
Неочищенный раствор A белка, полученный в Примере 1, фильтровали через мембранный фильтр с диаметром пор 0,45 мкм, и фильтраты объединяли. Проводили диализ фильтрата против воды в течение 72 часов с порогом по молекулярной массе у диализного мешка 10 кДа, и внутреннюю жидкость лиофилизировали с получением целевого белка BD-13; чистота, измеренная с помощью электрофореза, составляла 96,5%.
Подтверждение структуры белка BD-13:
1. Анализ методом электрофореза в полиакриламидном геле в восстанавливающих условиях в присутствии ДСН (ПААГ/ДСН).
Устройство: для электрофореза белков (Bio-Rad).
Способы и результаты: Раствор белка BD-13 анализировали с помощью восстанавливающего ПААГ/ДСН, концентрация разделяющего геля составляла 12,5%, и гель окрашивали по методу с использованием кумасси бриллиантового голубого R250. Молекулярная масса полосы BD-13 составляла приблизительно 53 кДа.
2. Полный анализ белковой последовательности на основе ЖХ/МС/МС.
Основные материалы: ацетонитрил, муравьиная кислота, бикарбонат аммония, дитиотреитол (ДТТ), йодацетамид (ИАА), трипсин, химотрипсин, Glu-C, Asp-N;
Основные устройства: высокоэффективной жидкостной хроматограф для капиллярных потоков (Thermo Ultimate 3000), масс-спектрометр с комбинированными ионизацией электрораспылением и ионными ловушками Orbitrap (масс-спектрометр Thermo Q Exactive Hybrid Quadrupole-Orbitrap).
Способы и результаты:
Проводили предварительные обработки белка BD-13, такие как замена растворителя, восстановительное алкилирование и различный протеолиз с получением отщепленных ферментами пептидов; раствор пептидов после рестрикционного расщепления анализировали с помощью жидкостной хроматографии с тандемной масс-спектрометрией. Для исходного файла данных масс-спектрометрии используют Maxquant (1.6.2.10) для поиска в базах данных белков, чтобы проанализировать результаты. Результат идентификации подтвердил, что последовательность соответствовала целевой последовательности SEQ ID NO: 1.
Пример 5. Неочищенный раствор A белка очищали с помощью других способов с получением белка BD-13.
Неочищенный раствор A белка, полученный в Примере 1, очищали с помощью следующих двух способов:
Первый способ: высаливание;
Неочищенный раствор A белка помещали в контейнер с перемешиванием для двух этапов высаливания: медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25% или 50%. В процессе высаливания белок отделяется. После завершения высаливания, фильтровать для завершения первого этапа высаливания; добавить 400 мл чистой воды к преципитату, чтобы суспендировать, а затем медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25%. Осуществить второй этап высаливания и фильтрацию, и преципитат представляет собой неочищенный экстракт белка. Неочищенный экстракт белка промыть три раза водой: добавить 200 мл чистой воды, чтобы суспендировать, перемешать, дать отстояться и фильтровать; после повторения этого процесса три раза, преципитат лиофилизировать с получением целевого белка BD-13.
Второй способ: колоночная хроматография;
Неочищенный раствор A белка очищали с помощью колонки с анионообменной смолой, такой как HiTrap Q FF 16/10, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE и т.д. Элюент представлял собой градиент элюирующего раствора NaCl плюс 20 мМ буфер NaH2PO4/Na2HPO4 (pH 8,0). Элюированные фракции объединяли в соответствии с результатами детектирования с помощью электрофореза в ПААГ/ДСН. Объединенный элюат центрифугировали дважды при 7000 об/мин каждый раз в течение 1 часа; супернатант фильтровали через мембранный фильтр с диаметром пор 0,45 мкм и фильтраты объединяли. Фильтраты концентрировали с помощью диализа против воды, порог по молекулярной массе у диализного мешка составлял 10 кДа, и внутреннюю жидкость лиофилизировали с получением целевого белка BD-13.
Подтвердили, что у белкового продукта BD-13, полученного с помощью указанных двух способов, была такая же последовательность аминокислот, как и у белка, полученного в Примере 4, с помощью такого же способа подтверждения структуры, что и описанный в Примере 4.
Пример 6. Белок BD-13 получали путем очистки неочищенного раствора B белка.
Неочищенный раствор B белка, полученный в Примере 2, очищали с помощью следующих трех способов:
Первый способ: диализ;
Неочищенный раствор B белка фильтровали через мембрану с диаметром пор 0,45 мкм, фильтрат подвергали диализу против воды, диализ проводили в течение более чем 72 часов и внутренний раствор лиофилизировали с получением целевого белка BD-13.
Второй способ: колоночная хроматография;
Неочищенный раствор B белка очищали с помощью колонки с анионообменной смолой, такой как HiTrap Q FF 16/10, HiTrap Capto Q ImpRes, Capto Q ImpRes, HiTrap Capto Q, HiTrap DEAE и т.д. Элюент представлял собой градиент элюирующего раствора NaCl плюс 20 мМ буфер NaH2PO4/Na2HPO4 (pH 8,0). Элюированные фракции объединяли в соответствии с результатами детектирования с помощью электрофореза в ПААГ/ДСН. Объединенный элюат центрифугировали дважды при 7000 об/мин каждый раз в течение 1 часа; супернатант фильтровали через мембранный фильтр с диаметром пор 0,45 мкм и фильтраты объединяли. Фильтраты концентрировали с помощью диализа против воды, порог по молекулярной массе у диализного мешка составлял 10 кДа, и внутреннюю жидкость лиофилизировали с получением целевого белка BD-13.
Третий способ: высаливание;
Неочищенный раствор B белка помещали в контейнер с перемешиванием для двух этапов высаливания: медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25% или 50%. В процессе высаливания белок отделяется. После завершения высаливания, фильтровать для завершения первого этапа высаливания; добавить 400 мл чистой воды к преципитату, чтобы суспендировать, а затем медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25%. Осуществить второй этап высаливания и фильтрацию, и преципитат представляет собой неочищенный экстракт белка. Неочищенный экстракт белка промыть три раза водой: добавить 200 мл чистой воды, чтобы суспендировать, перемешать, дать отстояться и фильтровать; после повторения этого процесса три раза, преципитат лиофилизировать с получением целевого белка BD-13.
Подтвердили, что у белкового продукта BD-13, полученного с помощью указанных трех способов, была такая же последовательность аминокислот, как и у белка, полученного в Примере 4, с помощью такого же способа подтверждения структуры, что и описанный в Примере 4.
Пример 7. Белок BD-13 получали путем очистки неочищенного раствора C белка.
Неочищенный раствор C белка, полученный в Примере 3, очищали с помощью следующих двух способов:
Первый способ: технология микрофильтрационной мембраны;
Неочищенный раствор C белка очищали с помощью технологии микрофильтрационной мембраны: сначала использовать сердцевину керамической мембраны с порами 1500 нм или 1000 нм для отделения твердого вещества от жидкости; отбросить внутреннюю жидкость, а затем использовать сердцевину керамической мембраны с порами 20 нм или 50 нм для повторной микрофильтрации, чтобы удалить мочевину; внутреннюю жидкость после второй микрофильтрации лиофилизировать с получением целевого белка BD-13.
Второй способ: высаливание;
Неочищенный раствор B белка помещали в контейнер с перемешиванием для двух этапов высаливания: медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25%. В процессе высаливания белок отделяется. После завершения высаливания, фильтровать для завершения первого этапа высаливания; добавить 400 мл чистой воды к преципитату, чтобы суспендировать, а затем медленно добавить насыщенный раствор сульфата аммония по стенке с получением конечной концентрации сульфата аммония 25%. Осуществить второй этап высаливания и фильтрацию, и преципитат представляет собой неочищенный экстракт белка. Неочищенный экстракт белка промыть три раза водой: добавить 200 мл чистой воды, чтобы суспендировать, перемешать, дать отстояться и фильтровать; после повторения этого процесса три раза, преципитат лиофилизировать с получением целевого белка BD-13.
Подтвердили, что у белкового продукта BD-13, полученного с помощью указанных двух способов, была такая же последовательность аминокислот, как и у белка, полученного в Примере 4, с помощью такого же способа подтверждения структуры, что и описанный в Примере 4.
Фармакологическое исследование.
Экспериментальный пример 1. Фармакодинамическое исследование белка BD-13 (белка в Примере 4) в модели лихорадки у крыс SD, вызванной дрожжами.
Животные: 230 - 260 грамм, самцы крыс SD;
Лекарства: дрожжи (OXOID LP0021), аспирин (SIGMA A2093), белок BD-13;
Устройства: электронные весы (типа BP121S SARTORIUS), электронный клинический термометр (типа CT-513W CITIZEN).
Распределение по экспериментальным группам:
Группа нормального контроля;
Модельная группа: модель вызванной дрожжами лихорадки;
Группа положительного контроля: группа 300 мг/кг аспирина;
Белок BD-13, группа 10 мг/кг, группа 50 мг/кг.
Способ:
Подготовка экспериментальных животных. После адаптации экспериментальных животных к условиям эксперимента (температура 22°C ± 2°C, относительная влажность 50% ± 2%) в течение 1 дня с предварительной адаптацией к измерению ректальной температуры в 8:00 и 15:00, крыс лишали пищи, воду давали без ограничений в течение 12 ч перед проведением эксперимента, и позволяли животным опорожнить кишечник перед измерением ректальной температуры. Нанести вазелин на электронный термометрический зонд перед каждым измерением температуры. Вставить в прямую кишку крысы на 2 см (можно сделать отметку 2 см, чтобы удостовериться в том, что глубина постоянна при каждом введении) и записать температуру тела после того, как показания стабилизируются.
Подкожная инъекция сухих дрожжей, чтобы воспроизвести модель лихорадки у крыс. Температуру тела крыс измеряли перед созданием модели. Пригодных крыс с температурой тела 36,2 - 37,3°C выбирали и произвольно делили на группы по 8 крыс в каждой группе. После перорального введения аспирина и различных доз белка BD-13, 20% суспензию дрожжей (10 мл/кг) незамедлительно вводили путем подкожной инъекции, и группе нормального контроля вводили путем интраперитонеальной инъекции равный объем нормального солевого раствора. Температуры тела крыс отслеживали через 2 часа в течение всего 8 часов.
Статистический анализ:
На основании температуры тела, измеренной в каждый момент времени в день эксперимента, рассчитать среднее значение, стандартное отклонение и стандартную ошибку температуры тела для каждой группы крыс. Результаты для каждой группы сравнивали с помощью критерия Стьюдента, и P<0,05 считали значимым различием.
Результаты эксперимента:
Незамедлительно после перорального введения аспирина (300 мг/кг), белка BD-13 (10 мг/кг, 50 мг/кг), осуществляли подкожную инъекцию 20% дрожжей, чтобы создать модель. Температуру тела животных отслеживали через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. Результаты представлены в Таблице 1 и на Фигуре 2.
Результаты эксперимента:
Незамедлительно после перорального введения аспирина (300 мг/кг) и белка BD-13 (10 мг/кг, 50 мг/кг), осуществляли подкожную инъекцию 20% дрожжей, чтобы создать модель. Температуру тела животных отслеживали через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. Результаты показали, что:
1) Температура тела крыс в модельной группе значительно повышалась через 2 часа, 4 часа, 6 часов, и через 8 часов после создания модели. По сравнению с нормальной группой, P<0,05, наблюдали статистическое различие. Модель была успешно создана и была стабильна и надежна.
2) В группе положительного контроля лекарственное средство аспирин может эффективно ингибировать повышение температуры тела модельных крыс через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. По сравнению с модельной группой, P<0,05, наблюдали статистически значимое различие, и действие лекарственного средства положительного контроля было относительно стабильным.
3) Различные дозы белка BD-13 могут ингибировать повышение температуры тела модельных крыс после создания модели, 10 мг/кг и действие лекарственного средства положительного контроля было относительно стабильны, могут значимо ингибировать повышение температуры тела модельных крыс через 2 часа, 4 часа, 6 часа и 8 часа после создания модели. По сравнению с модельной группой, P<0,05, наблюдали статистически значимое различие.
Экспериментальный пример 2. Фармакодинамическое исследование действия белка BD-13 (белка из Примера 4) на вызванную липополисахаридом (ЛПС) лихорадку у крыс SD.
Животные: 230 - 260 грамм, самцы крыс SD;
Лекарственные средства: липополисахарид (ЛПС, SIGMA L-2880), аспирин (SIGMA A2093), белок BD-13;
Устройства: электронные весы (типа BP121S SARTORIUS), электронный клинический термометр (типа CT-513W CITIZEN).
Распределение по экспериментальным группам:
Группа нормального контроля;
Модельная группа: модель вызванной липополисахаридом лихорадки;
Группа положительного контроля: группа 300 мг/кг аспирина;
Белок BD-13, группа 10 мг/кг, группа 50 мг/кг.
Способ: способ интраперитонеальной инъекции липополисахарида, чтобы воспроизвести модель лихорадки у крыс.
Подготовка экспериментальных животных. После адаптации экспериментальных животных к условиям эксперимента (температура 22°C ± 2°C, относительная влажность 50% ± 2%) в течение 1 дня с предварительной адаптацией к измерению ректальной температуры в 8:00 и 15:00, крыс лишали пищи, воду давали без ограничений в течение 12 ч перед проведением эксперимента, и позволяли животным опорожнить кишечник перед измерением ректальной температуры. Нанести вазелин на электронный термометрический зонд перед каждым измерением температуры. Вставить в прямую кишку крысы на 2 см (можно сделать отметку 2 см, чтобы удостовериться в том, что глубина постоянна при каждом введении) и записать температуру тела после того, как показания стабилизируются.
Интраперитонеальная инъекция липополисахарида, чтобы воспроизвести модель лихорадки у крыс. Температуру тела крыс измеряли перед созданием модели. Пригодных крыс с температурой тела 36,2 - 37,3°C выбирали и произвольно делили на группы по 8 крыс в каждой группе. После перорального введения аспирина и различных доз белка BD-13, липополисахарид (20 мкг/кг, 2 мл/кг) незамедлительно вводили путем интраперитонеальной инъекции, и группе нормального контроля вводили путем интраперитонеальной инъекции равный объем нормального солевого раствора. Температуры тела крыс отслеживали через 2 часа в течение всего 8 часов.
Статистический анализ:
На основании температуры тела, измеренной в каждый момент времени в день эксперимента, рассчитать среднее значение, стандартное отклонение и стандартную ошибку температуры тела для каждой группы крыс. Результаты для каждой группы сравнивали с помощью критерия Стьюдента, и P<0,05 считали значимым различием.
Результаты эксперимента:
Незамедлительно после перорального введения аспирина (300 мг/кг), белка BD-13 (10 мг/кг, 50 мг/кг), осуществляли интраперитонеальную инъекцию 20 мкг/кг липополисахарида, чтобы создать модель. Температуру тела животных отслеживали через 2 часа, 4 часа, 6 часов и 8 часов после создания модели. Результаты представлены в Таблице 3 и на Фигуре 3.
Результаты эксперимента:
Незамедлительно после перорального введения аспирина (300 мг/кг), белка BD-13 (10 мг/кг, 50 мг/кг), соответственно, осуществляли интраперитонеальную инъекцию 20 мкг/кг липополисахарида, чтобы создать модель. Температуру тела животных отслеживали через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. Результаты показали, что:
1) Интраперитонеальная инъекция 20 мкг/кг липополисахарида может успешно вызывать повышение температуры тела у крыс. Температура тела крыс в модельной группе значительно повышалась через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. По сравнению с нормальной группой, P<0,05, наблюдали статистически значимое различие, и модель была стабильна.
2) В группе положительного контроля лекарственное средство аспирин может эффективно ингибировать повышение температуры тела модельных крыс через 2 часа, 4 часа, 6 часов и через 8 часов после создания модели. По сравнению с модельной группой, P<0,05, наблюдали статистически значимое различие, и действие лекарственного средства положительного контроля было относительно стабильным.
3) Белок BD-13 в группе с дозой 10 мг/кг может ингибировать повышение температуры тела модельных крыс через 2 часа после создания модели, и по сравнению с модельной группой, P<0,05, было статистически значимым.
Экспериментальный пример 3. Фармакодинамическое исследование белка BD-13 (белка из Примера 4) при эпилепсии с судорогами у мышей, вызванной вызывающим судороги агентом пилокарпином (PLO).
Животные: самцы мышей ICR;
Лекарственные средства: пилокарпин HCl (PLO, пилокарпин, пилокарпина гидрохлорид), диазепам (таблетки диазепама), белок BD-13.
Распределение по экспериментальным группам:
Модельная группа:
Группа 2 мг/кг диазепама;
Белок BD-13, группа 50 мг/кг, группа 200 мг/кг.
Способ:
Создание модели и введение:
Лекарственное средство вводили один раз после полудня за день до создания модели, PLO-225 мг/кг (агент для создания модели) вводили путем интраперитонеальной инъекции через 1 час после внутрижелудочного введения исследуемого лекарственного средства в день создания модели. И лекарственное средство положительного контроля можно вводить однократно за 20 минут до создания модели. Вели наблюдение в течение 30 минут после инъекции PLO.
Наблюдаемые показатели:  ситуация с судорогами: время от судорог II степени до судорог IV степени;
ситуация с судорогами: время от судорог II степени до судорог IV степени;  время до смерти.
время до смерти.
Степень судорог: относится к стандартной оценке по шкале Расина: степень 0: нет ответа; степень I: проявляется как подергивание мимических мышц или уголков рта; степень II: может кивать; степень III: подергивание одной конечностью; степень IV: оцепенение или подергивание тела; степень V: генерализованная эпилепсия (генерализованные тонические судороги).
Обработка результатов:
Подсчитать количество судорог IV степени и смертей в каждой группе мышей в эксперименте; латентный период для степени II, III и IV. Латентный период у мышей без приступов до степени IV регистрировали как максимум 1800 секунд. Критерий хи-квадрат использовали для статистического анализа количества случаев. Рассчитывали среднее значение и стандартную ошибку латентного периода, и критерий Стьюдента использовали для сравнения модельной группы с другими группами. P<0,05 считали значимым различием.
Результаты эксперимента: см. Таблицу 3 и Таблицу 4.
Результаты эксперимента:
1) Результаты эксперимента показали, что частота судорог IV степени в модельной группе составляла 90%. Среди 40 мышей умерло пятеро.
2) Лекарственные средства положительного контроля могут полностью подавлять частоту эпилептических припадков IV степени и значимо продлевать латентный период эпилептического припадка III и IV степени у мышей.
3) При сравнении латентного периода эпилепсии степени IV, BD-13 наблюдали тенденция к увеличению латентного периода степени IV по сравнению с модельной группой, но не было статистически значимым.
Экспериментальный пример 4. Исследование эффективности действия белка BD-13 (белка из Примера 4) на вызванную пентилентетразолом (PTZ) эпилепсию у мышей.
Животные: самцы мышей ICR;
Лекарства: пентилентетразол (PTZ), ретигабин, белок BD-13.
Распределение по экспериментальным группам:
Модельная группа;
Группа 60 мг/кг ретигабина;
Белок BD-13, группа 50 мг/кг, группа 200 мг/кг;
Способ:
Создание модели и введение:
Лекарственное средство вводили один раз после полудня за день до создания модели. В день создания модели вводили 65 мг/кг PTZ (агента для создания модели) путем интраперитонеальной инъекции через 1 час после внутрижелудочного введения исследуемого лекарственного средства, и лекарственное средство положительного контроля можно ввести однократно за полчаса до создания модели. Продолжали вести наблюдение в течение 15 минут после инъекции PTZ.
Наблюдаемые показатели:  ситуация с судорогами: время от судорог III степени до судорог VI степени;
ситуация с судорогами: время от судорог III степени до судорог VI степени;  ситуация со смертностью.
ситуация со смертностью.
Степень судорог: относится к стандартной оценке по шкале Расина: степень 0: нет ответа; степень I: проявляется как подергивание мимических мышц или уголков рта; степень II: может кивать; степень III: подергивание одной конечностью; степень IV: оцепенение или подергивание тела; степень V: генерализованная эпилепсия (генерализованные тонические судороги).
Обработка результатов:
Подсчитать случаи судорог и смертей в каждой группе мышей в эксперименте; латентный период для степени III и IV. Латентный период у мышей без приступов до степени IV регистрировали как максимум 900 секунд. Критерий хи-квадрат использовали для статистического анализа количества случаев. Рассчитывали среднее значение и стандартную ошибку латентного периода, и критерий Стьюдента использовали для сравнения модельной группы с другими группами, и P<0,05 считали значимым различием.
Результаты эксперимента: см. Таблицу 5 и Таблицу 6.
Результаты эксперимента:
1) Результаты эксперимента показали, что частота судорог IV степени в модельной группе составляла 90%. Две из 40 мышей умерли.
2) Лекарственные средства положительного контроля могут значимо уменьшать частоту эпилептических припадков IV степени и значимо продлевать латентный период до судорог III и IV степени у мышей.
3) При сравнении латентного периода эпилепсии III степени, в группе дозы 200 мг/кг BD-13 наблюдали статистически значимого различия по сравнению с модельной группой.
Экспериментальный пример 5. Фармакодинамическое исследование отхаркивающего действия белка BD-13 (белка из Примера 4) с помощью способа выделения фенолового красного у мышей.
Животные: самцы мышей ICR;
Лекарственные средства и реагенты: мукосольван (таблетки гидрохлорида амброксола), феноловый красный, бикарбонат натрия, белок BD-13;
Устройства: центрифуга (типа Sigma-3K15), весы (типа XS105DU), считывающее устройство для микропланшетов (типа BIO-TEK).
Распределение по экспериментальным группам:
Контрольная группа, которой вводили растворитель;
Группа 30 мг/кг мукосольвана;
Белок BD-13 - группа 20 мг/кг, группа 50 мг/кг.
Способ:
Создание модели и введение:
Животных лишали пищи, а воду предоставляли без ограничений за 16 часов до эксперимента. Группам вводили перорально мукосольван и различные дозы белка BD-13 (вводимый объем 10 мл/кг), и контрольной группе, получающей растворитель, давали такой же объем дистиллированной воды. Через один час вводили 2,5% раствор фенолового красного путем интраперитонеальной инъекции. Мышей умерщвляли путем дислокации шеи через 30 минут. Взять трахею от области под щитовидным хрящем до разветвления трахеи, поместить трахею в 3 мл 5% раствора NaHCO3 и оставить на 3 часа. Взять 1 мл супернатанта и центрифугировать при 3000 об/мин в течение 5 минут. Измерить и зарегистрировать поглощение на 546 нм. В соответствии со стандартной кривой фенолового красного, рассчитывали выделение фенолового красного.
Обработка результатов:
Зарегистрировать момент времени перорального введения, момент времени интраперитонеальной инъекции 2,5% раствора фенолового красного, и момент времени сбора трахеи, соответственно. Поглощение для каждой группы образцов измерить с помощью спектрофотометра для прочтения микропланшетов на 546 нм, рассчитать выделение фенолового красного по стандартной кривой фенолового красного. Рассчитать среднее значение и стандартную ошибку результатов в каждой группе, и использовать критерий Стьюдента для сравнения контрольной группы растворителя с другими группами, и P<0,05 считать значимым различием.
Результаты эксперимента:
Ввести мукосольван (30 мг/кг) и различные дозы белка BD-13 (20 мг/кг, 50 мг/кг). Через один час 2,5% раствор фенолового красного ввести путем интраперитонеальной инъекции, и через 30 минут мышей умертвить путем дислокации шеи. Взять трахею от области под щитовидным хрящом до разветвления трахеи, поместить трахею в 3 мл 5% раствора NaHCO3 и оставить на 3 часа, взять 1 мл супернатанта и центрифугировать при 3000 об/мин в течение 5 минут, измерить и зарегистрировать поглощение на 546 нм. В соответствии со стандартной кривой фенолового красного, рассчитывали выделение фенолового красного. Результаты представлены в Таблице 7.
Результаты эксперимента:
1) Результаты эксперимента показали, что по сравнению с контрольной группой, которой вводили растворитель, количество выделенного фенолового красного в группе 30 мг/кг мукосольвана было значительно выше, P<0,05, и различие было статистически значимым.
2) По сравнению с контрольной группой BD-13 наблюдали тенденция к повышению выделения фенолового красного, но не было статистически значимым.
Экспериментальный пример 6. Противокашлевое действие белка BD-13 (белка из Примера 4) на кашель, вызванный водным раствором аммиака, у мышей.
Животные: самцы мышей ICR;
Лекарственные средства и реагенты: гидробромид декстрометорфана, водный раствор аммиака, 0,2% CMC-Na, белок BD-13;
Устройство: компрессорный небулайзер (типа 403T), весы (типа XS105DU).
Распределение по экспериментальным группам:
Контрольная группа, которой вводили растворитель;
Группа 15 мг/кг декстрометорфана;
Белок BD-13 - группа 20 мг/кг, группа 50 мг/кг.
Способ:
Создание модели и введение:
Декстрометорфан и различные дозы белка BD-13 (вводимый объем 10 мл/кг) вводили перорально группам, а контрольной группе, получившей растворитель, вводили такой же объем дистиллированной воды. Через один час мышей помещали в закрытую коробку и распыляли 10% водный раствор аммиака в течение 10 секунд, а затем наблюдали и регистрировали латентный период кашля у мышей и количество откашливаний за 2 минуты.
Обработка результатов:
Зарегистрировать момент времени перорального введения, момент времени проведения эксперимента по распылению, латентный период кашля у мышей и количество откашливаний в течение 2 минут, соответственно. Латентный период кашля относится к количеству секунд от начала распыления аммиака до возникновения кашля. Акт откашливания у мышей происходит в результате сокращения мышц брюшного пресса (сокращения грудной клетки) и одновременного открывания рта. Рассчитать среднее значение и стандартную ошибку результатов в каждой группе, и использовать критерий Стьюдента для сравнения модельной группы с другими группами, и P<0,05 считать значимым различием.
Результаты эксперимента:
Заранее дать декстрометорфан (15 мг/кг) и различные дозы белка BD-13 (20 мг/кг, 50 мг/кг). Через один час мышей поместить в закрытую коробку и распылить 10% водный раствор аммиака в течение 10 секунд, а затем наблюдать за мышами и зарегистрировать латентный период кашля у мышей и количество откашливаний в течение 2 минут. Результаты представлены в Таблице 8.
Результаты эксперимента:
1) Результаты эксперимента показали, что в группе декстрометорфана наблюдали значительное улучшение латентного периода и количества откашливаний по сравнению с контрольной группой, которой вводили растворитель, P<0,05, и различие было статистически значимым.
2) В группе дозы 50 мг/кг BD-13 наблюдали тенденция к улучшению латентного периода и количества откашливаний по сравнению с контрольной группой, но не было статистически значимым.
Экспериментальный пример 7. Фармакодинамическое исследование действия белка BD-13 (белка из Примера 4) на вызванные уксусной кислотой корчи у мышей ICR.
Животные: самцы мышей ICR;
Лекарственные средства и реагенты: аспирин, физиологический солевой раствор, ледяная уксусная кислота, белок BD-13.
Распределение по экспериментальным группам:
Модельная группа;
Группа 300 мг/кг аспирина;
Белок BD-13 - группа 50 мг/кг, группа 200 мг/кг.
Способ:
Через один день после адаптации экспериментальных животных к окружающей обстановке, им вводили перорально 300 мг/кг аспирина, 50 мг/кг белка BD-13, 200 мг/кг белка BD-13 заблаговременно за один час, и вводимый объем составлял 10 мл/кг. Затем вводили 0,6% раствор уксусной кислоты путем интраперитонеальной инъекции, и латентный период (секунды) и частоту корчей у животного наблюдали в течение 15 минут.
Обработка результатов:
Рассчитали среднее значение и стандартную ошибку результатов для каждой группы. Проводили сравнение с модельной группой с помощью критерия Стьюдента, P<0,05 считали статистически значимым различием.
Результаты эксперимента:
Через один час после перорального введения 300 мг/кг аспирина и различных доз белка BD-13 (50 мг/кг, 200 мг/кг), 0,6% раствор уксусной кислоты вводили путем интраперитонеальной инъекции, чтобы наблюдать латентный период и частоту корчей у мышей ICR. Результаты представлены в Таблице 9.
Результаты эксперимента:
0,6% раствор уксусной кислоты вводили путем интраперитонеальной инъекции в брюшную полость мышей, что вызывало глубокий и длительный болезненный стимул на и большой площади, заставляющий мышей корчиться (брюшная полость сокращалась в форме буквы «S», туловище и задние конечности вытягивались, ягодицы поднимались, и мыши ползали). Латентный период до начала корчей и количество корчей у мышей использовали в качестве показателей болевого ответа, чтобы определить, оказывал ли исследуемый образец болеутоляющее действие. Результаты данного эксперимента показали:
1) 1) аспирин в дозе 300 мг/кг мог значительно отсрочивать латентный период корчей и уменьшать количество корчей и оказывал значимое болеутоляющее действие. Проводили сравнение с модельной группой, P<0,05, и было статистически значимым.
2) Доза 200 мг/кг BD-13 в экспериментальной группе могла значительно уменьшать количество корчей у мышей. Проводили сравнение с модельной группой, P<0,05, и различие было статистически значимым.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Институт Материа Медика Китайской академии медицинских наук
<120> КЕРАТИН BD-13, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
И ПРИМЕНЕНИЕ
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 486
<212> PRT
<213> Bos taurus
<400> 1
Met Thr Cys Gly Ser Tyr Arg Ala Leu Pro Ala Phe Ser Cys Val Ser
1. 5 10 15
Ala Cys Gly Pro Arg Pro Gly Arg Cys Cys Ile Thr Ala Ala Pro Tyr
20 25 30
Arg Gly Ile Ser Cys Tyr Arg Gly Leu Thr Gly Gly Phe Gly Ser Arg
35 40 45
Ser Val Cys Gly Gly Phe Arg Ala Gly Tyr Cys Gly Arg Ser Phe Gly
50 55 60
Tyr Arg Ser Gly Gly Val Gly Gly Leu Ser Pro Pro Cys Ile Thr Thr
65 70 75 80
Val Ser Val Asn Glu Ser Leu Leu Thr Pro Leu Asn Leu Glu Ile Asp
85 90 95
Pro Asn Ala Gln Cys Val Lys Gln Glu Glu Lys Glu Gln Ile Lys Cys
100 105 110
Leu Asn Asn Arg Phe Ala Ala Phe Ile Asp Lys Val Arg Phe Leu Glu
115 120 125
Gln Gln Asn Lys Leu Leu Glu Thr Lys Leu Gln Phe Tyr Gln Asn Arg
130 135 140
Gln Cys Cys Glu Ser Asn Leu Glu Pro Leu Phe Asn Gly Tyr Ile Glu
145 150 155 160
Thr Leu Arg Arg Glu Ala Glu Cys Val Glu Ala Asp Ser Gly Arg Leu
165 170 175
Ser Ser Glu Leu Asn Ser Leu Gln Glu Val Leu Glu Gly Tyr Lys Lys
180 185 190
Lys Tyr Glu Glu Glu Val Ser Leu Arg Ala Thr Ala Glu Asn Glu Phe
195 200 205
Val Ala Leu Lys Lys Asp Val Asp Cys Ala Tyr Leu Arg Lys Ser Asp
210 215 220
Leu Glu Ala Asn Val Glu Ala Leu Ile Gln Glu Ile Asp Phe Leu Arg
225 230 235 240
Arg Leu Tyr Glu Glu Glu Ile Arg Val Leu Gln Ala His Ile Ser Asp
245 250 255
Thr Ser Val Ile Val Lys Met Asp Asn Ser Arg Asp Leu Asn Met Asp
260 265 270
Asn Ile Val Ala Glu Ile Lys Ala His Tyr Asp Asp Ile Ala Ser Arg
275 280 285
Ser Arg Ala Glu Ala Glu Ser Trp Tyr Arg Ser Lys Cys Glu Glu Ile
290 295 300
Lys Ala Thr Val Ile Arg His Gly Glu Thr Leu Arg Arg Thr Lys Glu
305 310 315 320
Glu Ile Asn Glu Leu Asn Arg Thr Ile Gln Arg Leu Thr Ala Glu Val
325 330 335
Glu Asn Ala Lys Cys Gln Asn Ser Lys Leu Glu Ala Ala Val Thr Gln
340 345 350
Ala Glu Gln Gln Gly Glu Ala Ala Leu Asn Asp Ala Lys Cys Lys Leu
355 360 365
Ala Gly Leu Glu Glu Ala Leu Gln Lys Ala Lys Gln Asp Met Ala Cys
370 375 380
Leu Leu Lys Glu Tyr Gln Glu Val Met Asn Ser Lys Leu Gly Leu Asp
385 390 395 400
Ile Glu Ile Ala Thr Tyr Arg Arg Leu Leu Glu Gly Glu Glu Gln Arg
405 410 415
Leu Cys Glu Gly Val Gly Ser Val Asn Val Cys Val Ser Ser Ser Arg
420 425 430
Gly Gly Val Val Cys Gly Asp Leu Cys Ala Ser Gly Ala Ala Pro Ala
435 440 445
Val Thr Thr Ser Val Cys Ser Ala Pro Cys Ser Gly Asn Val Val Val
450 455 460
Gly Thr Ser Asp Ala Cys Gly Pro Cys Ser Arg Val Gly Gly Ser Ile
465 470 475 480
Leu Gly Cys Lys Lys Cys
485
<210> 2
<211> 1461
<212> ДНК
<213> Bos taurus
<400> 2
atgacctgcg ggagctatcg tgcgctgccg gcgtttagct gcgtgagcgc gtgcggcccg 60
cgtccgggcc gttgctgcat taccgcggcg ccctatcgtg gcataagctg ctatcgtggc 120
ctgaccggcg gctttggcag ccgtagcgtg tgcggcggct ttcgtgcggg ctactgcggc 180
cgtagttttg gctatcgtag cggcggcgtg ggcggcctga gcccgccgtg tattaccacc 240
gtgagcgtga atgaaagcct gctgaccccg ctgaacctgg aaatagatcc gaatgcgcaa 300
tgcgtgaaac aggaggagaa agagcagata aaatgtctga acaatcgttt tgcggcgttc 360
atagataaag tccgctttct ggaacagcag aacaaactgc tggaaaccaa actgcagttc 420
tatcagaatc gtcagtgctg tgaaagcaac ctggagccgc tgttcaacgg ctatattgaa 480
accctgcgtc gtgaagcgga atgcgtggaa gcggatagcg gccgtttaag cagcgaactg 540
aactcgcttc aggaagtcct ggaaggctat aaaaagaaat acgaggagga agtcagcctt 600
cgtgccaccg cggaaaatga atttgttgca ctgaaaaaag atgtggactg cgcgtatctg 660
cgtaaaagcg atttggaagc gaatgtggaa gcgctgattc aggagattga ttttctgcgt 720
cgtctgtacg aagaagagat tcgtgttctg caggcgcata ttagcgatac cagcgtgata 780
gtgaagatgg ataatagccg cgatctgaac atggacaata tcgtggcgga aatcaaggcg 840
cattacgatg atattgcgag ccgttcgcgt gcggaagcgg agtcatggta tcgttcaaag 900
tgcgaggaga ttaaagcgac cgtaattcgt catggcgaaa cgctgcgccg taccaaagaa 960
gaaataaatg agctgaatcg taccatccag cgtctgaccg cggaagtcga aaatgcgaaa 1020
tgtcagaata gcaaactgga agcggcggtg acccaggcgg aacagcaggg cgaggcggcg 1080
ctgaatgatg cgaaatgcaa actggcgggc ctggaagaag cgttgcagaa agcgaaacag 1140
gatatggcgt gcttgctgaa agaatatcag gaggtcatga atagcaaact gggcctggat 1200
atagaaattg ccacctaccg tcgcctgctt gaaggcgagg aacagcgtct gtgcgaaggc 1260
gtgggcagcg tgaatgtgtg cgtgagcagc agccgtggcg gcgtggtgtg cggcgatctg 1320
tgcgcgagcg gtgcggcgcc ggcggtgacc accagcgtgt gcagcgcgcc gtgcagcggc 1380
aatgtggtgg tgggcaccag cgatgcatgc ggcccgtgca gccgtgtggg cggcagcatt 1440
ctgggctgca aaaaatgcta a 1509
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КЕРАТИН BD-6, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825993C1 |
| КЕРАТИН BD-11, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825992C1 |
| КЕРАТИН BD-3, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2815384C1 |
| КЕРАТИН BD-10, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2823655C1 |
| КЕРАТИН BD-1, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2825994C1 |
| Кератин BD-4, его получение, и фармацевтические композиции, и применение | 2020 |
|
RU2824893C1 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| НОВЫЕ АНТИ-CLDN18.2 АНТИТЕЛА | 2020 |
|
RU2830887C2 |
| Антитела против TIGIT и их применение | 2019 |
|
RU2750705C1 |
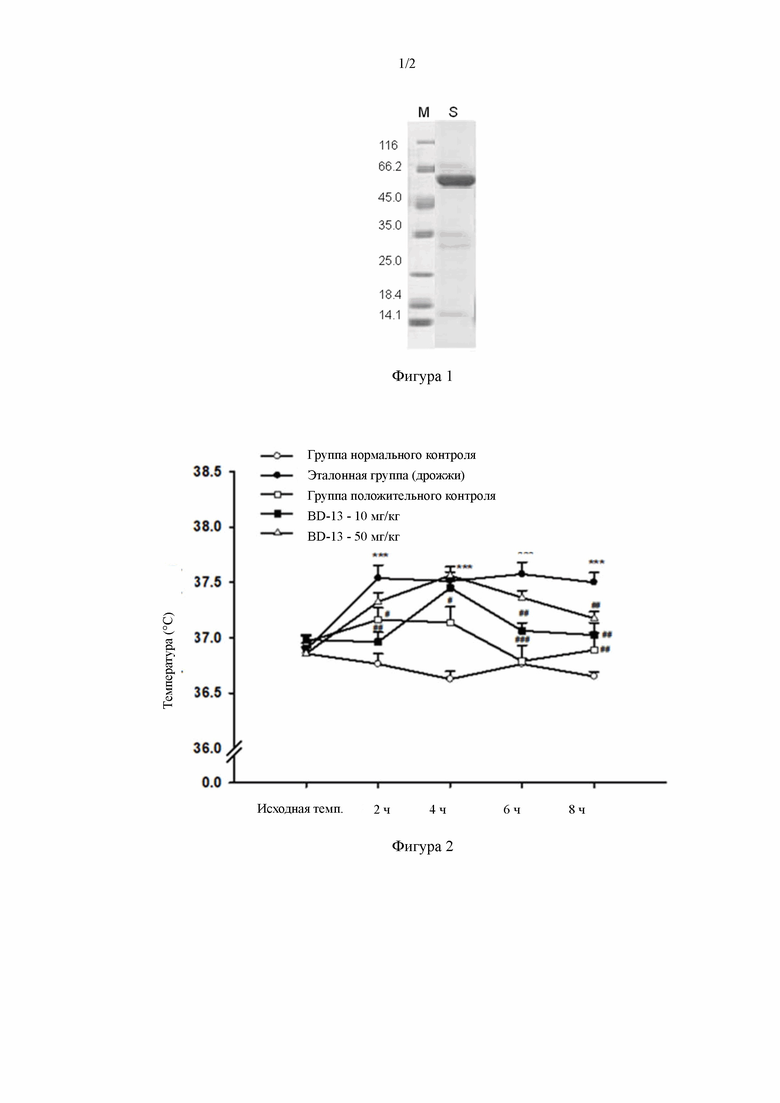
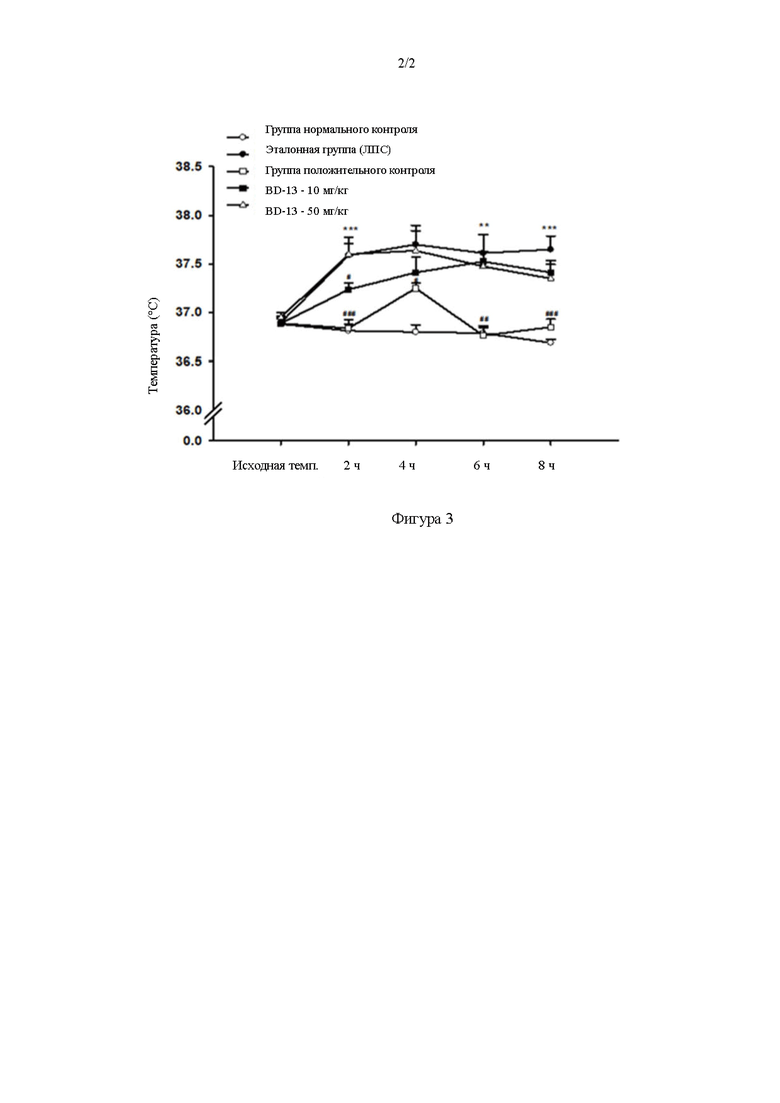
Изобретение относится к области биотехнологии, конкретно к вариантам кератина, и может быть использовано в медицине для получения лекарственного средства, обладающего жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием. Изобретение обеспечивает терапевтическое применение кератина, обладающего эффективностью в снижении подъема температуры тела на модели лихорадки у крыс SD и продлении периода латентности судорог при эпилепсии III класса у мышей, отхаркивающим действием в способе с выделением фенолового красного у мышей, противокашлевым действием в способе стимуляции кашля с помощью водного раствора аммиака у мышей и тенденцией к уменьшению количества «корчей» у мышей и потенциалом болеутоляющего действия при вызванных уксусной кислотой «корчах» у мышей ICR. 5 н. и 5 з.п. ф-лы, 3 ил., 9 табл., 14 пр.
1. Применение кератина для получения лекарственного средства, где лекарственное средство обладает жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием, причем последовательность аминокислот указанного кератина представляет собой последовательность аминокислот, представленную в SEQ ID NO: 1 в перечне последовательностей.
2. Применение по п. 1, отличающееся тем, что указанный кератин дополнительно содержит стандартную модификацию, где указанная стандартная модификация выбрана из группы, состоящей из ацетилирования, амидирования, циклизации, гликозилирования, фосфорилирования, алкилирования, биотинилирования, модификации флуоресцентной группой, модификации полиэтиленгликолем ПЭГ, модификации иммобилизацией, сульфатирования, окисления, метилирования, дезаминирования, образования дисульфидной связи или разрыва дисульфидной связи; или указанный кератин дополнительно связан с меткой для детектирования или очистки.
3. Применение по п. 2, отличающееся тем, что метка выбрана из группы, состоящей из His6, GST, EGFP, MBP, Nus, HA, IgG, FLAG, c-Myc.
4. Применение молекулы нуклеиновой кислоты, кодирующей кератин, последовательность аминокислот которого охарактеризована в п. 1, для получения лекарственного средства, где лекарственное средство обладает жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием.
5. Применение по п. 4, отличающееся тем, что последовательность нуклеотидов указанной молекулы нуклеиновой кислоты представляет собой:
(1) последовательность нуклеотидов, представленную в SEQ ID NO: 2 в перечне последовательностей; или
(3) последовательность нуклеотидов, комплементарную последовательности нуклеотидов в (1) выше.
6. Применение вектора экспрессии для экспрессии кератина, последовательность аминокислот которого охарактеризована в п. 1, для получения лекарственного средства, где лекарственное средство обладает жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием, причем указанный вектор экспрессии содержит молекулу нуклеиновой кислоты, охарактеризованную в п. 4 или 5.
7. Применение клетки-хозяина для экспрессии кератина, последовательность аминокислот которого охарактеризована в п. 1, для получения лекарственного средства, где лекарственное средство обладает жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием, причем указанная клетка-хозяин содержит вектор экспрессии, охарактеризованный в п. 6, или молекулу нуклеиновой кислоты, охарактеризованную в п. 4 или 5, причем указанная молекула нуклеиновой кислоты встроена в геном.
8. Применение по п. 7, отличающееся тем, что указанная клетка-хозяин выбрана из группы, состоящей из бактерии, дрожжей, аспергилла, клетки растения или клетки насекомого.
9. Применение по п. 8, отличающееся тем, что указанная бактерия представляет собой Escherichia coli.
10. Фармацевтическая композиция, обладающая жаропонижающим, болеутоляющим, противокашлевым, отхаркивающим, противосудорожным и противоэпилептическим действием, причем указанная фармацевтическая композиция содержит в фармацевтически эффективном количестве:
(a) кератин, причем последовательность аминокислот указанного кератина представляет собой последовательность аминокислот, представленную в SEQ ID NO: 1 в перечне последовательностей; или
(b) кератин, который имеет дополнительную модификацию, охарактеризованную в п. 2 или 3;
и фармацевтически приемлемый носитель или вспомогательное вещество.
| Емкость для вязкой жидкости | 1980 |
|
SU1193068A1 |
| GAO F | |||
| et al., Recombinant Human Hair Keratin Nanoparticles Accelerate Dermal Wound Healing, APPLIED MATERIALS & INTERFACES, 2019, v.11, n.20, p.18681-18690 | |||
| CN 104490929 A, 08.04.2015 | |||
| US 6221843 B1, 24.04.2001 | |||
| RU 2012146368 A, 10.05.2014 | |||
| YAMPOLSKY L.Y | |||
| et al., | |||
Авторы
Даты
2024-09-02—Публикация
2020-10-28—Подача