Изобретение относится к области медицины, а именно к способу диагностики инсулинорезистентности. Способ основан на определении уровня внутриклеточных липидов в моноцитах периферической крови пациентов с верифицированным диагнозом сахарный диабет 1 типа (СД1) методом проточной цитофлуориметрии.
Под инсулинорезистентностью понимают ухудшение действия гормона инсулина на клетки инсулин-чувствительных тканей - скелетных мышц, печени и жировой ткани. По современным представлениям, инсулинорезистентность является глубинным патофизиологическим дефектом, запускающим каскад патологических реакций и приводящим к формированию целого комплекса нарушений и заболеваний. Известно, что инсулинорезистентность является характерной особенностью сахарного диабета 2 типа (СД2) и рассматривается как важное звено патогенеза заболевания [1]. При этом большое внимание уделяется повышению уровня свободных жирных кислот, хронической гипергликемии, развитию субклинического хронического воспаления в жировой ткани, окислительному и метаболическому стрессу, изменению экспрессии генов и митохондриальной дисфункции [2]. В тоже время, эктопическое накопление жира в тканях (печень, скелетные мышцы, поджелудочная железа) является критическим для индукции резистентности к инсулину [3].
СД1 - аутоиммунное заболевание, характеризующееся разрушением бета-клеток и абсолютным дефицитом инсулина. Несмотря на то, что патогенез СД1 отличается от патогенеза СД2 становится очевидным, что инсулинорезистентность при СД1 играет гораздо более важную роль, чем общепринято. Недавно было установлено, что развитие сердечно-сосудистых заболеваний у больных СД1 обусловлено в большей степени инсулинорезистентностью, а не гипергликемией [4]. S. J. Cleland с коллегами в 2013 году выдвинули концепцию «двойного диабета», который представляет комбинацию СД1 с резистентностью к инсулину, как это наблюдается при СД2 [5].
После выделения инсулина из поджелудочной железы в портальную циркуляцию в физиологическом состоянии печень захватывает 50-80% секретируемого гормона до того, как он достигнет периферического кровообращения. В результате уровень инсулина в печени примерно в два-три раза выше, чем уровень инсулина в периферических тканях. Однако, при СД1 инсулин, вводимый в подкожную клетчатку, непосредственно попадает в периферическое кровообращение. Таким образом, пациенты с СД1 имеют более высокие концентрации инсулина в периферическом кровообращении и низкие в печеночной крови по сравнению с лицами без диабета. Эта приводит к хронической гиперинсулинемии периферического кровообращения и является преобладающим фактором инсулинорезистентности [6,7].
Инсулинорезистентность клинически определяется как сниженный ответ тканей-мишеней на стимуляцию инсулином. Длительная гиперинсулинемия приводит к адаптивному уменьшению количества рецепторов плазматической мембраны для гормона (из-за их интернализации и деградации). гиперинсулинемия может приводить к тяжёлой гипогликемии и полифагии, что способствует набору веса - так замыкается «порочный круг» инсулинорезистентности, при котором в дальнейшем требуется повышение дозы инсулина для улучшения гликемического статуса [8].
Избыточная масса жировой ткани приводит к развитию инсулинорезистентности за счет прямого выделения в кровь повышенного количества свободных жирных кислот (СЖК), которые организм использует в качестве источника энергии, при этом глюкоза не успевает окисляться в тканях, ее уровень в крови повышается, по принципу обратной связи увеличивается секреция инсулина. [8]. Более того, исследования с повышением уровня циркулирующих СЖК говорят о том, что избыточное накопление внутриклеточных липидов (особенно ДАГ и церамида) нарушает фосфоинозитол-3-киназный путь действия инсулина [8,9,10,11].
Измерение инсулинорезистентности при СД1 затруднено из-за гипоинсулинемии. Признанным лучшим маркером для количественной оценки инсулинорезистентности является скорость утилизации глюкозы, полученная с помощью эугликемического-гиперинсулинемического клэмп-теста. Однако этот метод инвазивный, трудоемкий и длительный. Оценка модели гомеостаза HOMA-IR и индекс Мацуды были наиболее распространенными двумя моделями, используемыми для оценки инсулинорезистентности в клинической практике. Однако они могут применяться только в контексте сохраненной функции β-клеток, что ограничивает их использование при СД1, поэтому были разработаны модели оценки инсулинорезистентности по скорости утилизации глюкозы [12,13,14].
Моноциты - это клетки врождённого иммунитета, относящиеся к мононуклеарным макрофагам. После патогенной инфекции или повреждения циркулирующие моноциты могут быть привлечены в различные ткани, где они оседают и дифференцируются в макрофаги. Макрофаги являются высоко гетерогенными и пластичными иммунными клетками с особыми характеристиками, зависящими от их происхождения и микроокружения. Стимулы, присутствующие в окружающей среде, вызывают поляризацию макрофагов в сторону провоспалительного или противовоспалительного профиля. Островки Лангерганса имеют свои резидентные макрофаги, которые являются сенсорами секреторной активности и жизнеспособности β-клеток. Более того, макрофаги - центральное звено в инициировании вялотекущего хронического воспаления при аутоиммунном инсулите при СД1 за счёт привлечения аутореактивных Т-клеток [15] и других макрофагов, которые выделяют провоспалительные цитокины, активирующие NFκB-зависимые пути в β-клетках и вызывающие апоптоз [15,16].
Профиль активации макрофагов зависит от факторов, присутствующих локально в микроокружении ткани (цитокины, факторы роста и так далее). Выделяют два основных типа поляризации макрофагов. Классически активированные макрофаги M1 (поляризованные IFN-γ и GM-CSF) играют роль в повреждении тканей и производят большое количество провоспалительных цитокинов IL-12, IL-23, TNF-α, IL-1β. Альтернативно поляризованные М2-клетки (активированные иммунными комплексами, апоптотическими клетками, CSF-1 и IL-4) производят большое количество противовоспалительных факторов (например, IL-10 или TGF-β1) и играют роль в разрешении воспаления, заживлении ран и ремоделировании тканей [15,16,17].
Моноциты и макрофаги экспрессируют все компоненты инсулиновой сигнализации, что указывает на функционирование инсулинового сигнального каскада и возможное развитие инсулинорезистентности моноцитов при системной инсулинорезистентности [18,19]. В недавних экспериментах было показано, что при старании развивается резистентности моноцитов к инсулину не только у пациентов с СД2, но и у здоровых людей [20]. При этом чувствительность моноцитов к инсулину отрицательно коррелирует с воспалительными реакциями и может быть полезна для субклинической оценки риска сердечно-сосудистых заболеваний и/или резистентности к инсулину у пациентов [20].
Исследование образцы островков поджелудочной железы ограничено из-за трудностей в отборе, что заставляет исследователей активно искать клетки и/или маркеры, которые также могли бы отражать сахарный диабет 1 типа, но были бы более доступны для получения. Инфильтрирующие островки иммунные клетки находятся в равновесии с циркулирующими пулами моноцитов периферической крови, и изменения в них могут частично отражать патологические процессы в островках [21]. Гипергликемия приводит к чрезмерной продукции АФК β-клетками и развитию окислительного стресса, что в дальнейшем нарушает физиологический баланс М1/М2 макрофагов и склоняет их к поляризации в провоспалительные фенотипы. Обработка человеческих моноцитарных макрофагов глюкозой в высокой концентрации изменяет профиль цитокинов M1/M2, стимулируя выработку TNF-α, IL-1β, IL-6 (М1) [22]. Более того, клетки стенок сосудов также содержат макрофаги моноцитарного происхождения. Они могут поглощать модифицированные богатые холестеролом ЛПНП, после чего превращаются в пенистые клетки и повреждают стенки сосудов (зона липоидоза).
С развитием гипергликемии меняется и липидный обмен в моноцитах. Высокий уровень насыщенных ЖК потенцирует воспаление и инсулинорезистентность, воздействуя на моноциты островков Лангерганса через TLR4, который их активирует. Так пальмитат (C16:0) индуцирует проатерогенный (провоспалительный) фенотип моноцитов через синтез церамидов de novo, а инкубация моноцитов с мононенасыщенной олеиновой кислотой (C18:1) способствует накоплению триацилглиценолов [23].
Методы оценки действия инсулина in vivо разделяют на прямые и непрямые. Прямые (экзогенные) методы определяют влияние инфузии инсулина на метаболизм глюкозы. К ним относят инсулиновый тест толерантности (ИТТ), инсулиновый супрессивный тест (ИСТ) и эугликемический гиперинсулинемический клэмп (ЭГК). Непрямые методы (эндогенные) оценивают действие эндогенного инсулина. Это пероральный глюкозо-толерантный тест (ПГТТ), внутривенный глюкозо-толерантный тест (ВВГТТ) и постоянная инфузия глюкозы с модельной оценкой (ПИГМО). Ценность данных методов исследования высока, тем не менее они сложны, трудоемкие и нагрузочны для пациента. Расчетные методы чувствительности к инсулину (индексы HOMA, Caro, Matsuda) теряют свою диагностическую точность уже на стадии нарушенной толерантности к глюкозе (предиабет), а тем более, на стадии выраженной дисгликемии, которая регистрируется у пациентов с СД1. Недавно было показано, что нарушение трансдукции гормональных сигналов и изменение метаболизма присущие печени, мышцам и жировой ткани пациентов с СД1 могут быть выявлены ex vivo в изолированных моноцитах и фибробластах после культивирования их с жирными кислотами-индукторами инсулинорезистентности клеток и тканей [24].
Для оценки инсулинорезистентности у пациентов с СД1 была разработана модель расчетной скорости утилизации глюкозы (eGDR), основанная на легкодоступных и широко применяемых клинических данных, таких как соотношение окружности талии к окружности бёдер, гипертония, уровень HbA1С. Однако, эта модель не отражает возраст начала заболевания [13,14,25]. Результаты изучения точности и полезности eGDR показали, что этот показатель, помимо инсулинорезистентности, значительно связан с доклиническим атеросклерозом сонных артерий, ишемической болезнью сердца, инсультом и смертностью у лиц с СД [13,25].
Наиболее близким по техническому решению к заявляемому способу является способ диагностики синдрома инсулинорезистентности, который основан на определении отношения процентного содержания жирно-кислотный которых методом газожидкостной хроматографии в изолированных лимфоцитах [26]. Способ включает выделение лимфоцитов, расчёт процентного содержания насыщенных жирных кислот к ненасыщенным. При значении величины этого показателя более 0,45 диагностируют синдром инсулинорезистентности. Описанное средство принято за прототип изобретения. Протопит относится к диагностическим средствам, но описывает оценку инсулинорезистентности при метаболическом синдроме, а не при СД1.
Основным недостатком прототипа изобретения является использование в основе метода газожидкостной хроматографии, который имеет ряд недостатков: трудоёмкость, сложность стандартизации, сложность пробоподготовки и высокую стоимость оборудования. Эти недостатки делают метод менее доступным и более сложным для использования в клинических исследованиях.
Цель настоящего изобретения заключается в улучшении точности, достоверности и возможности ранней диагностики синдрома инсулинорезистентности у пациентов с СД1. Техническим результатом, на достижение которого направлено изобретение, является способ диагностики инсулинорезистентности у пациентов с СД1.
Технический результат достигается в два последовательных этапа с использованием определенных реактивов и расходных материалов.
1. Выделение мононуклеаров из венозной крови человека
Реактивы: фиколла раствор (пл.1.077 г/см3, ПанЭко, Россия), Хэнкса раствор (с Са и Mg), pH 6.8-7.2 (ПанЭко, Россия), 1х PBS (Sigma, США).
Оборудование: ламинарный бокс, лабораторная центрифуга, счетчик клеток, автоматические дозаторы на 1-10, 10-100 и 100-1000 мкл.
Материалы: эппендорфы 2 мл, пробирки 15 мл, пробирки 50 мл, стерильные наконечники для дозаторов, пипетки Пастера.
Биологический материал: кровь, полученная путем венозной пункции, в вакуумной пробирке с гепарином.
1. На 2,5 мл фиколла наслоить 5 мл крови.
2. Центрифугировать 20 минут 2500 об/мин при комнатной температуре.
3. Собрать кольцо на границе раздела двух фаз пастеровской пипеткой в чистые 50 мл пробирки.
4. Добавить раствор Хэнкса (с Са и Mg) до 30 мл.
5. Центрифугировать 20 минут 1000 об/мин (200 g) при комнатной температуре.
6. Слить надосадок. Добавить раствор Хэнкса (с Са и Mg) до 30 мл.
7. Центрифугировать 20 минут 1000 об/мин (200 g) при комнатной температуре.
8. Осадок клеток ресуспендировать в PBS до концентрации 0,2*106 клеток в 100 мкл.
2. Оценка жизнеспособности и уровня внутриклеточных липидов методом проточной цитофлуориметрии
Реактивы: 1х PBS (Sigma, США), Nile Red (Sigma, США), DAPI, 1х PBS (Sigma, США),
Оборудование: мини-центрифуга Eppendorf, проточный цитофлуориметр Cytoflex (Beckman Coulter), автоматические дозаторы на 1-10, 10-100 и 100-1000 мкл.
Материалы: эппендорфы 2 мл, наконечники для дозаторов.
Биологический материал: клеточная суспензия мононуклеаров.
Пробоподготовка: приготовить рабочее разведение Nile Red - сток с концентрацией 0,5 мг/мл (в DMSO) развести в пропорции 1:500 1x PBS.
1. Приготовить микс клеток от каждой пробы для неокрашенного образца и контролей красителей (Unstained, Nile Red, DAPI).
2. Центрифугировать клетки при 2000 об/мин 5 минут.
3. Надосадок слить.
4. В каждую пробу за исключением Unstained добавить по 500 мкл рабочего раствора Nile Red, ресуспендировать на вортексе.
5. Инкубировать в течение 5 минут в темноте при комнатной температуре.
6. Добавить в каждый образец по 1,5 мл 1x PBS.
7. Центрифугировать клеточную суспензию при 2000 об/мин 5 минут.
8. Надосадок слить, добавить в каждый образец по 2 мл 1x PBS.
9. Центрифугировать клеточную суспензию при 2000 об/мин 5 минут.
10. Осадок ресуспендировать в 100 мкл 1x PBS.
11. В исследуемые образцы и контроль DAPI добавить по 2 мкл рабочего раствора DAPI (10 мкг/мл).
12. Проанализировать 10000 событий на проточном цитофлуориметре по каналам FL-2 (PE) и PB450.
Сущность изобретения поясняется следующими чертежами:
на фигуре 1 представлен дизайн исследования;
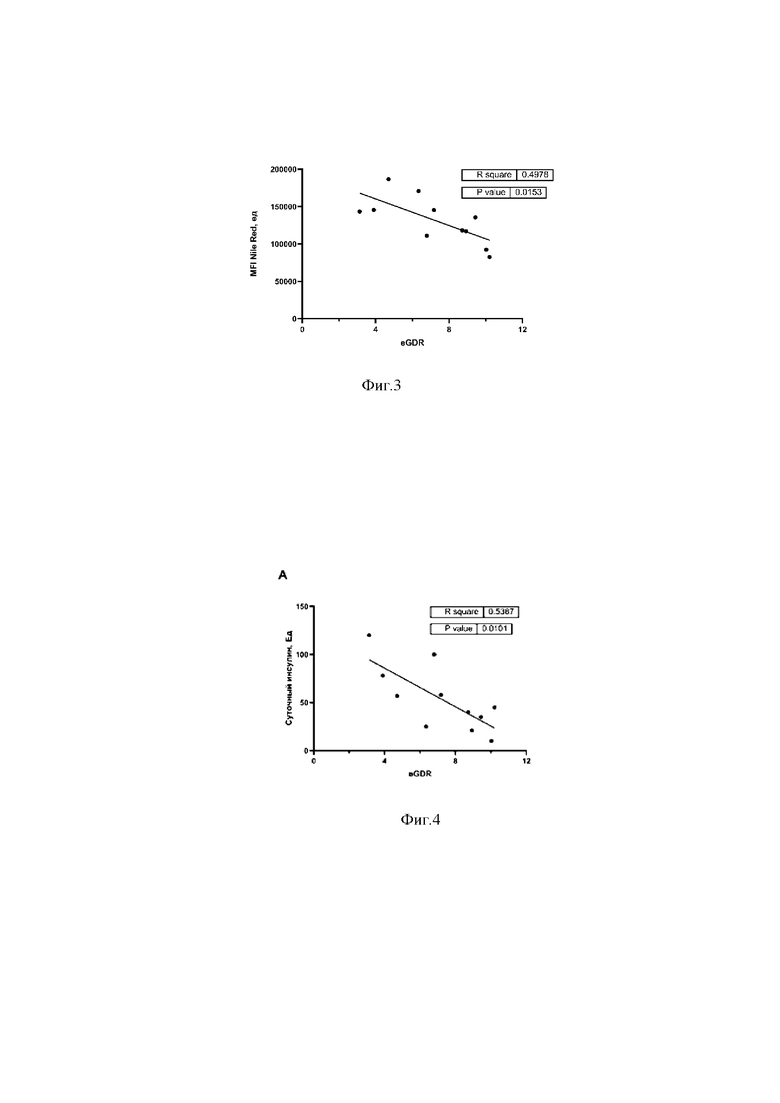
на фигуре 2 показана средняя интенсивность флуоресценции (MFI) липофильного красителя Нильского красного (Nile Red) в моноцитах, выделенных из периферической крови здоровых субъектов и пациентов с сахарным диабетом 1 типа;
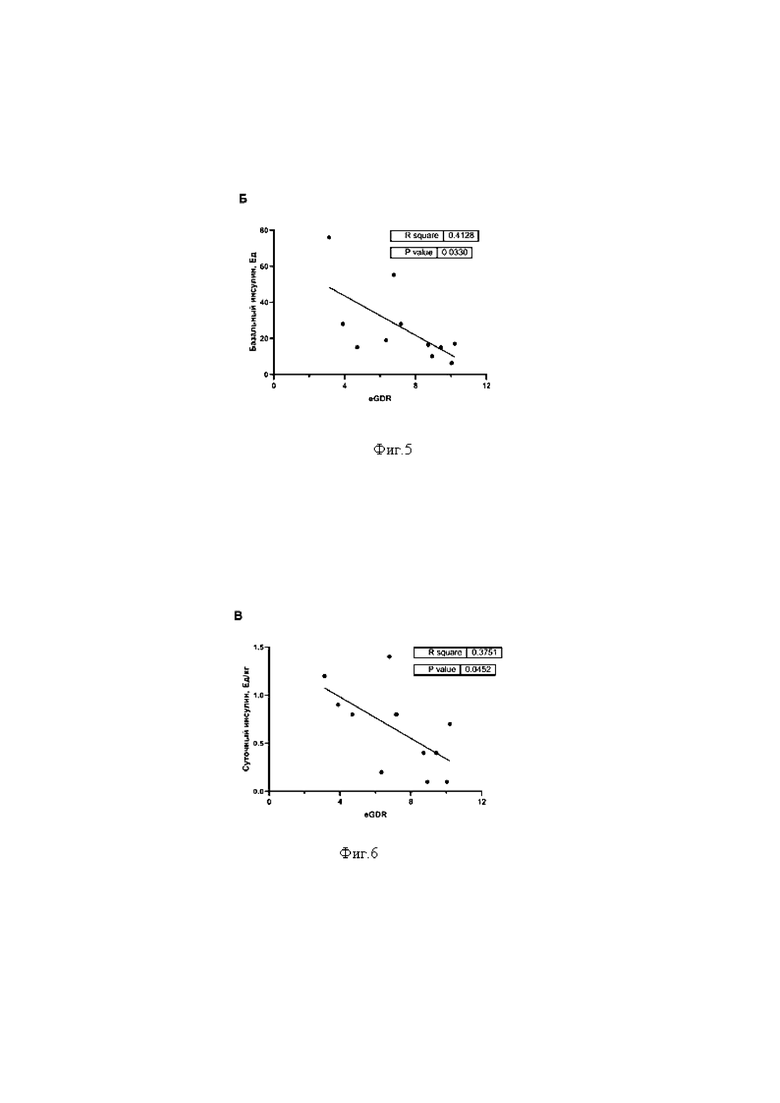
на фигуре 3 показана корреляция между расчётной скоростью утилизации глюкозы (eGDR) у пациентов с СД 1 типа и средней интенсивность флуоресценции (MFI) липофильного красителя Nile Red в изолированных моноцитах периферической крови;
на фигуре 4 представлен корреляционный анализ, взаимосвязь между показателями eGDR и суточной дозой инсулина, получаемой пациентами с СД 1 типа;
на фигуре 5 представлен корреляционный анализ для корреляций «eGDR-базальная доза инсулина, Ед» r2=0,4128, р=0,0330
на фигуре 6 представлен корреляционный анализ для корреляций «eGDR-суточная доза инсулина, Ед/кг» r2=0,3751, р=0,0452
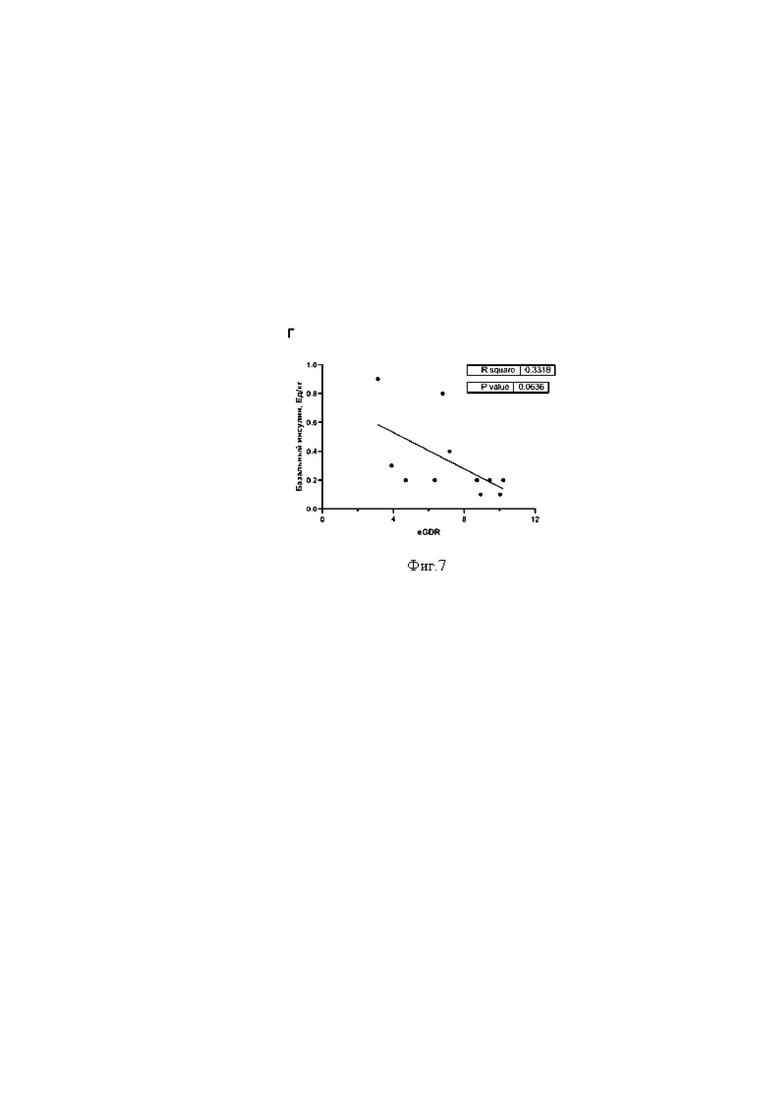
на фигуре 7 представлен корреляционный анализ для корреляций «eGDR-базальная доза инсулина, Ед/кг» r2=0,3318, р=0,0636.
В исследование было включены пациенты с установленным диагнозом сахарный диабет 1 типа (Е10 по МКБ-10) в возрасте от 18 до 44 лет (средний возраст группы 28,7 ± 9,9 лет), длительность заболевания которых составляет от 2 до 22 лет (средний стаж заболевания группы 10,4 ± 7,3 лет).
Дизайн исследования представлен на фиг.1. Группу контроля составили добровольцы без нарушений углеводного обмена в возрасте от 23 до 50 лет (средний возраст группы 32,7 ± 9,7 лет).
Всем пациентам с СД1 и лицам контрольной группы проведена оценка клинических и лабораторных данных (табл. 1). У пациентов с СД1 и контрольной группы исследовали мононуклеары (моноциты и лимфоциты), выделенные из цельной гепаринизированной крови.
Таблица 1 - Список обследований пациентов с СД1 и лиц из контрольной группы.
– антропометрия:
– рост,
– масса тела и ИМТ,
– окружность талии (ОТ)
– HbA1С
– ХС-ЛПНП;
– ХС-ЛПВП;
– ТАГ;
– индекс атерогенности
– гематокрит (%);
– количество эритроцитов (×1012/л);
– количество лейкоцитов (× 109/л)
– мочевая кислота;
– общий белок, альбумин;
– билирубин общий и прямой;
– микроэлементы (натрий, калий, кальций общий, фосфор, железо)
Критерии набора в основную группу (пациенты с сахарным диабетом 1 типа) представлены в таблице 2.
Таблица 2 - Критерии набора в основную группу
– мужской пол;
– длительность заболевания более года;
– ИМТ от 18,5 до 34,9 кг/м2;
– подписание информированного согласия
– инфекционные заболевания в стадии обострения;
– специфические инфекционные заболевания, такие как: ВИЧ/СПИД, вирусные гепатиты с любой степенью активности, цирроз печени вирусной и аутоиммунной этиологии, туберкулез;
– онкологические заболевания;
– ХОБЛ и бронхиальная астма;
– курение на момент включения в исследование;
– гемотрансфузии в период 1 месяца до включения в исследование и в настоящий момент; прием препаратов железа;
– пред- и постоперационный период;
– острая почечная, печеночная, сердечная недостаточность;
– скорость клубочковой фильтрации ниже 45 мл/мин/1,73м2, стадия протеинурии;
– декомпенсация сахарного диабета с наличием кетоацидоза/осмотической дегидратации;
– наличие ампутаций нижних конечностей в анамнезе;
– отказ пациента от участия в исследовании, не подписанное информированное согласие
Критерии набора в контрольную группу представлены в таблице 3.
Таблица 3 - Критерии набора в контрольную группу.
– ИМТ от 18,5 до 34,9 кг/м2;
– отсутствие нарушений углеводного обмена по данным исследования гликированного гемоглобина и проведения ПГТТ с 75 г глюкозы
– инфекционные заболевания в стадии обострения;
– онкологические заболевания;
– ХОБЛ и бронхиальная астма;
– курение на момент включения в исследование;
– гемотрансфузии в период 1 месяца до включения в исследование и в настоящий момент; прием препаратов железа;
– пред- и постоперационный период;
– острая почечная, печеночная, сердечная недостаточность;
– скорость клубочковой фильтрации ниже 45 мл/мин/1,73м2, стадия протеинурии;
– декомпенсация сахарного диабета с наличием кетоацидоза/осмотической дегидратации;
– наличие ампутаций нижних конечностей в анамнезе;
– отказ пациента от участия в исследовании, не подписанное информированное согласие
В результате проведённых исследований было установлено, что у обследованных пациентов с СД1 в моноцитах отмечается увеличение величины средней интенсивности флуоресценции витального красителя Nile Red (MFI), отражающей уровень внутриклеточных липидов в клетках, величина которого составила 131,7×103 ± 31,4×103 ед., что в 1,6 раз (р=0,0002) превышало значение этого показателя у контрольной группы (84,96×103 ± 14,2×103 ед.) (фиг.2).
Таким образом, метаболические изменения в мононуклеарной фракции периферической крови пациентов с СД1 характеризуются повышенным накоплением внутриклеточных липидов.
Известно, что накопление внутриклеточных липидов играют важную роль в развитии инсулинорезистентности. Поэтому нами была оценена взаимосвязь между инсулинорезистентностью и содержанием внутриклеточных липидов в мононуклеарах периферической крови пациентов с СД1. Ранее для оценки инсулинорезистентности у пациентов с СД1 была разработана модель расчётной скорости утилизации глюкозы (eGDR) с использованием «золотого стандарта» оценки инсулинорезистентности методом клэмпа, основанная на легкодоступных и широко применяемых клинических данных, таких как соотношение окружности талии к окружности бёдер, гипертония и уровень гликированного гемоглобинаHbA1С [25]. Нами была рассчитана eGDR для пациентов с СД1 и группы контроля по формуле 1.
Формула 1
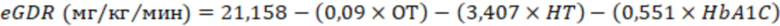
Примечание: ОТ - окружность талии (см), HT - гипертония (да - 1/нет - 0) и HbA1c - уровень гликированного гемоглобина в %.
Во многих исследованиях, оценивавших наличие взаимосвязи между результатами, полученными с использованием «золотого стандарта» оценки инсулинорезистентности методом эугликемического гиперинсулинемического клэмпа, с расчетными величинами индекса eGDR были показаны корреляции, позволяющие использовать расчётную скорость утилизации глюкозы для косвенной оценки инсулинорезистентности у пациентов с СД 1 типа [27,28,29], а также прогнозирования развития осложнений и сопутствующих патологий основного заболевания - гипертонии, гиперлипидемии, фиброза, неалкогольной жировой болезни печени (НАЖБП), микро- и макрососудистых нарушений [28,29,30].
Анализ взаимосвязи с помощью коэффициента Пирсона между величиной расчётной скорости утилизации глюкозы и интенсивностью флуоресценции Nile Red в моноцитах пациентов с СД1 показал наличие обратной линейной корреляции (r2=0,4978, р=0,0153) (фиг.3). Это свидетельствует о том, что наличие синдрома инсулинорезистентности у пациентов с СД 1 типа значимо коррелирует с увеличением уровня внутриклеточных липидов в мононуклеарах.
Известно, что потребность в инсулине у пациентов с СД 1 типа является суррогатным маркером резистентности к инсулину [31]. Нами также была проведена оценка взаимосвязи величины индекса eGDR с суточной и базальной дозами инсулина, получаемого пациентами с СД 1 типа для поддержания нормогликемии.
Важно отметить, что в ходе корреляционного анализа полученных данных была обнаружена взаимосвязь между показателями eGDR и суточной дозой инсулина, получаемой пациентами с СД 1 типа, выраженной в Ед (r2=0,5387, р=0,0101) (фиг.4).
В то же время, зависимость величины eGDR от других показателей, связанных с экзогенным введением инсулина пациентам, была менее выражена: для корреляций «eGDR-базальная доза инсулина, Ед» r2=0,4128, р=0,0330 (фиг.5), «eGDR-суточная доза инсулина, Ед/кг» r2=0,3751, р=0,0452 (фиг.6), «eGDR-базальная доза инсулина, Ед/кг» r2=0,3318, р=0,0636 (фиг.7).
У пациентов с СД1 типа значение расчётной скорости утилизации глюкозы в среднем составляло 7,22 ± 2,49 мг/кг/мин, что на 29,3% (р=0,0052) меньше этого показателя у референтной группы здоровых добровольцев без диагноза СД 1 типа, у которых среднее значение расчётной скорости утилизации глюкозы составляло 10,21±0,65 мг/кг/мин.
Пациенты с СД 1 типа были разделены на две группы в зависимости от выявленных значений расчётной скорости утилизации глюкозы следующим образом: пациентов с индексом eGDR < 8 считали инсулинорезистентными, значения индекса eGDR > 8 принимали как характеристику нормальной чувствительности тканей к гормону, что согласуется с данными других мировых лабораторий [25,28,29].
Среди обследованных пациентов с установленным диагнозом СД1 без проявлений синдрома инсулинорезистентности (eGDR> 8 и средняя суточная доза инсулина 30,2±14,4 ЕД/сутки) средняя интенсивность флуоресценции витального красителя Nile Red в изолированных моноцитах периферической крови составила 109,2х103 ± 21,4х103 единиц. У пациентов с СД1, демонстрирующих признаки приобретенного синдрома инсулинорезистентности, выражающегося в снижении индекса расчётной скорости утилизация глюкозы менее 8 и увеличении суточной дозы инсулина, требуемой для поддержания нормогликемии до 73,0±33,9 ЕД/сутки, средняя интенсивность флуоресценции витального красителя Nile Red в изолированных моноцитах периферической крови была 150,4х103 ± 26,0х103 единиц. При этом средняя интенсивность флуоресценции витального красителя Nile Red составила 84,5х103 ± 14,2х103 единиц у здоровых добровольцев (средняя расчётная скорость утилизации глюкозы у здоровых составила 10,21±0,65).
Таким образом, величина средней интенсивности флуоресценции витального красителя Nile Red в изолированных моноцитах периферической крови пациентов с СД 1 типа, превышающая 110 х 103 ед., предлагается в качестве референсного значения для диагностики синдрома инсулинорезистентности у этих пациентов.
Клинический пример 1.
Пациент Л., 42 года, Е10.7 - Инсулинзависимый сахарный диабет: с множественными осложнениями. Сопутствующий диагноз: Ожирение 1 стадии, I степени (ИМТ 31,62 кг/м2). Гипертоническая болезнь II стадии, достигнутая степень артериальной гипертензии 1. Риск сердечно-сосудистых осложнений 4. Хроническая сердечная недостаточность 1, ФК 1 по NYHA. Стаж заболевания 11 лет. Уровень глюкозы в крови 15,8 ммоль/л. ИМТ 31,62 кг/м2. Гликированный гемоглобин - 8,56%. АД 160/90. Суточная доза инсулина 1,21 ЕД/кг, базальная доза 0,87 ЕД/кг. Расчётная скорость утилизация глюкозы составляет 3,13 мг/кг/мин.
Проведено определение содержания внутриклеточных липидов в моноцитах периферической крови предложенным выше способом и установлено, что интенсивность флуоресценции витального красителя Nile Red в изолированных клетках составила 143,3 х103 ед., что позволяет диагностировать у больного приобретенного синдрома инсулинорезистентности на фоне СД1 типа.
Данное заключение подтверждается высокими суточными дозами инсулина, необходимыми для поддержания нормогликемии, и низким значением расчётной скорости утилизация глюкозы (eGDR - 3,13 мг/кг/мин).
Клинический пример 2.
Пациент И., 44 года, Е10.3 - Сахарный диабет I типа С поражением глаз. Сопутствующий диагноз: ожирение I степени (ИМТ - 30 кг/м2). Стаж заболевания 6 лет. Уровень глюкозы в крови 6,9 ммоль/л. Гликированный гемоглобин - 8,8%, АД 132/70 мм.рт.ст. В моче белок 229,95 мг/л. Суточная доза инсулина 0,9 ЕД/кг, базальная доза инсулина 0,32 ЕД/кг. Расчётная скорость утилизация глюкозы составляет 3,90 мг/кг/мин. По результатам осмотра офтальмолога диагностирована непролиферативная диабетическая ретинопатия. У пациента была отобрана периферическая кровь из вены, на градиенте фиккола выделены мононуклеары, проведено гейтирование моноцитарной фракции и определение содержания внутриклеточных липидов в моноцитах периферической крови. В результате проведенного исследования было установлено, что интенсивность флуоресценции витального красителя Nile Red в клетках 145,5 х103 ед., что позволило сделать вывод о наличие у пациента приобретенного синдрома инсулинорезистентности на фоне СД1 типа.
Данное заключение подтверждается высокими суточными дозами инсулина, необходимыми для поддержания нормогликемии, и низким значением расчётной скорости утилизация глюкозы (eGDR - 3,90 мг/кг/мин).
Клинический пример 3.
Пациент М., 18 лет, Е10.4 - Инсулинзависимый сахарный диабет: с неврологическими осложнениями. Сопутствующий диагноз: Дистальная симметричная сенсорная полинейропатия нижних конечностей. Стаж заболевания 5 лет. Уровень глюкозы в крови 11,9 ммоль/л. Гликозилированный гемоглобин 8,2%. Микроальбуминурия 28,0 мг/л. Суточная доза инсулина 0,4 ЕД/кг, базальная доза инсулина 0,2 ЕД/кг. Расчётная скорость утилизация глюкозы составляет 9,44 мг/кг/мин. С целью диагностики возможного наличия у пациента приобретенного синдрома инсулинорезистентности на фоне СД 1, в соответствии с предлагаемым способом, был выполнен отбор периферической крови из вены, на градиенте фиккола были выделены мононуклеары, проведено гейтирование моноцитарной фракции и определено содержание внутриклеточных липидов в моноцитах периферической крови. Величина средней интенсивности флуоресценции витального красителя Nile Red в клетках составила 92,5 х103 ед. Полученные результаты обследования позволили отвергнуть предположение о наличии у пациента синдрома инсулинорезистентности. Сделанный вывод подтверждается относительно небольшой дозой инсулина, необходимой для поддержания нормогликемии и высоким показателем расчётной скорости утилизация глюкозы (eGDR - 9,44 мг/кг/мин).
В сравнении с применяемыми в клинической практике индексами для определения инсулинорезистентности у пациентов разработанный способ расширяет круг лиц, у которых возможно проведение диагностики синдрома инсулинорезистентности, так как применим для пациентов с СД1 типа и является менее инвазивным и трудоемким в сравнении с эугликемическим-гиперинсулинемическим клэмп-тестом. Сравнительно с моделью расчетной скорости утилизации глюкозы (eGDR), которая используется для оценки инсулинорезистентности у пациентов с сахарным диабетом 1 и 2 типов, предложенный метод основан на легко доступных и широко используемых клинических данных разработанный способ позволяет более достоверно оценить наличие синдрома инсулинорезистентности.
Преимущества разработанного способа диагностики инсулинорезистентности:
1. Способ является прямым методом определения инсулинорезистентности, так как он основан на определении маркеров патогенетических механизмов развития синдрома. Это позволяет повысить точность, достоверность и возможность ранней диагностики синдрома инсулинорезистентности, а также расширить круг лиц, у которых возможно проведение диагностики синдрома инсулинорезистентности
2. Относительная лёгкость и доступность разработанного способа (в современных медицинских лечебных учреждениях использование метода проточной цитометрии является рутинным подходом) позволяет проводить повторные исследования у одного и того же пациента, что в свою очередь позволяет оценить эффекты вмешательств с использованием конкретных терапевтических стратегий.
Список использованных источников:
1. Cefalu W. T. Insulin resistance: cellular and clinical concepts //Experimental biology and medicine. - 2001. - Т. 226. - №. 1. - С. 13-26.
2. Kilpatrick E. S., Rigby A. S., Atkin S. L. Insulin Resistance, the Metabolic Syndrome, and Complication Risk in Type 1 Diabetes: “Double diabetes” in the Diabetes Control and Complications Trial //Diabetes care. - 2007. - Т. 30. - №. 3. - С. 707-712.
3. Liu H. Y. et al. Hepatic autophagy is suppressed in the presence of insulin resistance and hyperinsulinemia: inhibition of FoxO1-dependent expression of key autophagy genes by insulin //Journal of Biological Chemistry. - 2009. - Т. 284. - №. 45. - С. 31484-31492.
4. Priya, G. A review of insulin resistance in type 1 diabetes: is there a place for adjunctive metformin? [Electronic resource] / G. Priya, S. Kalra //Diabetes Therapy. - 2018. - V. 9. - P. 349-361. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5801219/.
5. Cleland, S. J. Insulin resistance in type 1 diabetes: what is ‘double diabetes’ and what are the risks? [Electronic resource] / S. J. Cleland, B. M. Fisher, H. M. Colhoun, N. Sattar, J. R. Petrie // Diabetologia. - 2013. - V. 56. - P. 1462-1470. - URL: https://link.springer.com/article/10.1007/s00125-013-2904-2.
6. Gregory J. M. Iatrogenic hyperinsulinemia, not hyperglycemia, drives insulin resistance in type 1 diabetes as revealed by comparison with GCK-MODY (MODY2) [Electronic resource] / J. M. Gregory, T. J. Smith, J. C. Slaughter, H. R. Mason, C. C. Hughey, M. S. Smith, B. Kandasamy, S. A. W. Greeley, L. H. Philipson, R. N. Naylor, L. R. Letourneau // Diabetes. - 2019. - V. 68. - N 8. - P. 1565-1576. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6692813/.
7. Mertens J. Hepatopathy associated with type 1 diabetes: Distinguishing non-alcoholic fatty liver disease From glycogenic hepatopathy [Electronic resource] / J. Mertens, C. De Block, M. Spinhoven, A. Driessen, S. M. Francque, W. J. Kwanten // Frontiers in Pharmacology. - 2021. - P. 2921. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8573337/.
8. Wolosowicz M. The causes of insulin resistance in type 1 diabetes mellitus: is there a place for quaternary prevention? [Electronic resource] / M. Wolosowicz, B. Lukaszuk, A. Chabowski // International Journal of Environmental Research and Public Health. - 2020. - V. 17. - N 22. - P. 8651. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7700208/.
9. Kaul K. Insulin resistance in type 1 diabetes mellitus [Text] / K. Kaul, M. Apostolopoulou, M. Roden // Metabolism. - 2015. - V. 64. - N 12. - P. 1629-1639.
10. Lair B. Novel insights and mechanisms of lipotoxicity-driven insulin resistance [Electronic resource] / B. Lair, C. Laurens, B. Van Den Bosch, C. Moro // International journal of molecular sciences. - 2020. - V. 21. - N 17. - P. 6358. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7504171/.
11. Mertens, J. Hepatopathy associated with type 1 diabetes: Distinguishing non-alcoholic fatty liver disease From glycogenic hepatopathy [Electronic resource] / J. Mertens, C. De Block, M. Spinhoven, A. Driessen, S. M. Francque, W. J. Kwanten // Frontiers in Pharmacology. - 2021. - P. 2921. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8573337/.
12. Kącka A. Comparison of novel markers of metabolic complications and cardiovascular risk factors between obese non-diabetic and obese type 1 diabetic children and young adults [Electronic resource] / A. Kącka, A. Charemska, E. Jarocka-Cyrta, B. Głowińska-Olszewska // Frontiers in Endocrinology. - 2022. - V. 13. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9791985/.
13. Zabala, A. Estimated glucose disposal rate and risk of stroke and mortality in type 2 diabetes: a nationwide cohort study [Electronic resource] / A. Zabala, V. Darsalia, M. Lind, A. M. Svensson, S. Franzén, B. Eliasson, T. Nyström // Cardiovascular diabetology. - 2021. - V. 20. - P. 1-9. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8495918/.
14. Zheng, X. A new model to estimate insulin resistance via clinical parameters in adults with type 1 diabetes [Text] / X. Zheng, B. Huang, S. Luo, D. Yang, W. Bao, J. Li, J. Yan // Diabetes/metabolism research and reviews. - 2017. - V. 33. - N 4. - P. e2880.
15. Cosentino, C. Crosstalk between macrophages and pancreatic β-cells in islet development, homeostasis and disease [Electronic resource] / C. Cosentino, R. Regazzi // International Journal of Molecular Sciences. - 2021. - V. 22. - N 4. - P. 1765. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/33578952/.
16. Orliaguet, L. Mechanisms of macrophage polarization in insulin signaling and sensitivity [Electronic resource] / L. Orliaguet, E. Dalmas, K. Drareni, N. Venteclef, F. Alzaid // Frontiers in endocrinology. - 2020. - V. 11. - P. 62. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7042402/.
17. Juhas, U. Monocytes of newly diagnosed juvenile DM1 patients are prone to differentiate into regulatory IL-10+ M2 macrophages [Electronic resource] / U. Juhas, M. Ryba-Stanisławowska, A. Brandt-Varma, M. Myśliwiec, J. Myśliwska // Immunologic Research. - 2019. - V. 67. - P. 58-69. - URL: https://link.springer.com/article/10.1007/s12026-019-09072-0.
18. Olefsky J. M., Glass C. K. Macrophages, inflammation, and insulin resistance //Annual review of physiology. - 2010. - Т. 72. - С. 219-246.
19. Tsuchiya K. et al. Expanded granulocyte/monocyte compartment in myeloid-specific triple FoxO knockout increases oxidative stress and accelerates atherosclerosis in mice //Circulation research. - 2013. - Т. 112. - №. 7. - С. 992-1003.
20. Nakamura S. et al. Age-associated decline of monocyte insulin sensitivity in diabetic and healthy individuals //Diabetes and Vascular Disease Research. - 2021. - Т. 18. - №. 1. - С. 1479164121989281.
21. Yin, M. Identification of monocyte-related transcriptomic signature of peripheral blood mononuclear cells in type 1 diabetes [Electronic resource] / M. Yin, Y. Zhang, J. Huang, X. Li, H. Yu, X. Li // Chinese Medical Journal. - 2022. - V. 135. - N 21. - P. 2608-2610. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9943828/.
22. Zhang, B. Hyperglycemia modulates M1/M2 macrophage polarization via reactive oxygen species overproduction in ligature‐induced periodontitis [Text] / B. Zhang, Y. Yang, J. Yi, Z. Zhao, R. Ye // Journal of periodontal research. - 2021. - V. 56. - N 5. - P. 991-1005.
23. Pararasa, C. Age‐associated changes in long‐chain fatty acid profile during healthy aging promote pro‐inflammatory monocyte polarization via PPAR γ [Electronic resource] / C. Pararasa, J. Ikwuobe, S. Shigdar, A. Boukouvalas, I. T. Nabney, J. E. Brown, H. R. Griffiths // Aging cell. - 2016. - V. 15. - N 1. - P. 128-139. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4717269/.
24. Jones IV A. R. et al. Type 1 diabetes alters lipid handling and metabolism in human fibroblasts and peripheral blood mononuclear cells //PLoS One. - 2017. - Т. 12. - №. 12. - С. e0188474.
25. Ren, X. Estimated glucose disposal rate and risk of cardiovascular disease: evidence from the China Health and Retirement Longitudinal Study [Electronic resource] / X. Ren, M. Jiang, L. Han, X. Zheng // BMC geriatrics. - 2022. - V. 22. - N 1. - P. 1-10. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9753298/.
26. RU 2153170С1 «Способ диагностики синдрома инсулинорезистентности».
27. Januszewski, A. S., Sachithanandan, N., Ward, G., Karschimkus, C. S., O'Neal, D. N., Jenkins, A. J. Estimated insulin sensitivity in Type 1 diabetes adults using clinical and research biomarkers //Diabetes Research and Clinical Practice. - 2020. - Т. 167. - С. 108359.
28. Epstein E. J. et al. Use of the estimated glucose disposal rate as a measure of insulin resistance in an urban multiethnic population with type 1 diabetes //Diabetes care. - 2013. - Т. 36. - №. 8. - С. 2280-2285.
29. Lam‐Chung C. E. et al. Association of estimated glucose disposal rate and chronic diabetic complications in patients with type 1 diabetes //Endocrinology, Diabetes & Metabolism. - 2021. - Т. 4. - №. 4. - С. e00288.
30. Chillaron J. J. et al. Estimated glucose disposal rate in assessment of the metabolic syndrome and microvascular complications in patients with type 1 diabetes //The journal of clinical endocrinology & metabolism. - 2009. - Т. 94. - №. 9. - С. 3530-3534.
31. Ajie M. et al. Disease duration and chronic complications associate with immune activation in individuals with longstanding type 1 diabetes //Journal of Clinical Endocrinology and Metabolism. - 2023. - 108(8): 1909-1920.
32. Benito-Vicente, A. Molecular mechanisms of lipotoxicity-induced pancreatic β-cell dysfunction [Text] / A. Benito-Vicente, S. Jebari-Benslaiman, U. Galicia-Garcia, A. Larrea-Sebal, K. B. Uribe, C. Martin // International Review of Cell and Molecular Biology. - 2021. - V. 359. - P. 357-402.
33. Morandi, A. Oxidative stress in youth with type 1 diabetes: Not only a matter of gender, age, and glycemic control [Text] / A. Morandi, M. Corradi, S. Orsi, C. Piona, C. Zusi, S. Costantini, C. Maffeis // Diabetes Research and Clinical Practice. - 2021. - V. 179. - P. 109007.
34. Negi, C. K. Nrf2, a novel molecular target to reduce type 1 diabetes associated secondary complications: The basic considerations [Text] / C. K. Negi, G. Jena // European Journal of Pharmacology. - 2019. - V. 843. - P. 12-26.
35. Yuan, T. New insights into oxidative stress and inflammation during diabetes mellitus-accelerated atherosclerosis [Electronic resource] / T. Yuan, T. Yang, H. Chen, D. Fu, Y. Hu, J. Wang, X. Xie // Redox biology. - 2019. - V. 20. - P. 247-260. - URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6205410/.
36. Vergès, B. Cardiovascular disease in type 1 diabetes: A review of epidemiological data and underlying mechanisms [Text] / B. Vergès // Diabetes & metabolism. - 2020. - V. 46. - N 6. - P. 442-449.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ СИНДРОМА ИНСУЛИНОРЕЗИСТЕНТНОСТИ | 1999 |
|
RU2153170C1 |
| СПОСОБ РАННЕЙ ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ РИСКА РАЗВИТИЯ САХАРНОГО ДИАБЕТА 2 ТИПА | 2017 |
|
RU2655635C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА | 2009 |
|
RU2398572C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТИПА САХАРНОГО ДИАБЕТА | 2021 |
|
RU2788106C1 |
| Твердая лекарственная форма антидиабетического препарата на основе N-замещенного производного амринона - ингибитора киназы гликогенсинтазы | 2016 |
|
RU2663913C1 |
| СПОСОБ СКРИНИНГОВОЙ ДИАГНОСТИКИ ИНСУЛИНОРЕЗИСТЕНТНОСТИ | 2012 |
|
RU2493566C1 |
| СПОСОБ ДИАГНОСТИКИ ПОДТИПОВ ГЕСТАЦИОННОГО САХАРНОГО ДИАБЕТА | 2024 |
|
RU2835479C1 |
| Способ определения компенсации сахарного диабета 1 типа у подростков | 2015 |
|
RU2613272C1 |
| Способ диагностики ранних неврологических нарушений у пациентов с сахарным диабетом 1 типа | 2021 |
|
RU2808480C2 |
| Способ ранней неинвазивной диагностики метаболических нарушений у детей и подростков | 2020 |
|
RU2734336C1 |
Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для диагностики инсулинорезистентности у больных сахарным диабетом 1 типа. Методом проточной цитофлуориметрии в изолированных моноцитах периферической крови, обработанных липофильным красителем Nile Red, оценивают уровень внутриклеточных липидов. При средней интенсивности флуоресценции MFI больше 110,0×103 единиц диагностируют синдром инсулинорезистентности. Способ обеспечивает возможность ранней диагностики синдрома инсулинорезистентности у пациентов с сахарным диабетом 1 типа за счет оценки уровня внутриклеточных липидов путем определения MFI липофильного красителя Nile Red в моноцитах. 7 ил., 3 табл., 3 пр.
Способ диагностики инсулинорезистентности у больных сахарным диабетом 1 типа, включающий исследование периферический крови, отличающийся тем, что методом проточной цитофлуориметрии в изолированных моноцитах периферической крови, обработанных липофильным красителем Nile Red при инкубации в течение 5 минут в темноте при комнатной температуре, оценивают уровень внутриклеточных липидов по величине интенсивности флуоресценции липофильного красителя Nile Red, и при средней интенсивности флуоресценции MFI больше 110,0×103 единиц диагностируют синдром инсулинорезистентности.
| Способ определения инсулинорезистентности имунного генеза у больных сахарным диабетом I типа | 1989 |
|
SU1767433A1 |
| DIAZ G | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RAMIREZ-CASTRILLON M | |||
| et al | |||
| Nile Red Incubation Time Before Reading Fluorescence Greatly Influences the Yeast Neutral Lipids Quantification | |||
| Front Microbiol | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| ANGELINI G | |||
Авторы
Даты
2024-08-19—Публикация
2024-01-11—Подача