Изобретение относится к области медицины, а именно к экспериментальной челюстно-лицевой хирургии и хирургической стоматологии.
Развитие направления дентальной имплантации как метода замещения дефектов зубных рядов в последние десятилетия обусловливает повышенный интерес клиницистов к способам восстановления утраченного объема костной ткани альвеолярного гребня. Традиционно для восстановления атрофичных гребней используются различные варианты костных трансплантатов: аутогенные, ксеногенные, аллогенные, синтетические. Аутологичная кость, являясь «золотым стандартом», тем не менее, не лишена некоторых недостатков, к которым следует отнести ограниченный объем, дополнительное травмирование пациента в донорской зоне, удлинение времени операции и ее технической сложности при заборе трансплантата, а также возможные затруднения с получением согласия пациента на дополнительное вмешательство [1, 2].
Разработка новых остеопластических материалов требует экспериментального исследования их безопасности и эффективности на доклиническом этапе. С этой целью используются различные виды животных, такие как мышь, крыса, морская свинка, кролик, собака, коза и овца. Кроме того, для изучения вопросов биосовместимости используются различные места имплантации и методы. Среди них внутрибрюшинное, подкожное, внутрикостное и внутримышечное применение [3].
Использование грызунов (крысы, кролики) в качестве животной модели широко применяется в силу своей доступности, однако не может служить полноценной моделью для оценки регенерации костной ткани человека по ряду причин, среди которых различия в микроархитектонике, скорости изменений и метаболизме костной ткани [1, 4]. Механизмы регенерации кости зависят от размера дефекта, поскольку на транспорт кислорода и питательных веществ, миграцию клеток и прорастание сосудов в зону дефекта сильно влияют расстояния, которые приходится преодолевать [1]. Из-за малых размеров костей скелета у грызунов невозможно воссоздание больших дефектов, также ограничено количество рекомендуемых имплантатов на одну особь. В частности, для кроликов, не более 6 имплантатов, согласно стандарту биологической оценки медицинских изделий ISO [4].
При выборе вида животного для экспериментального исследования также важны такие факторы, как легкость содержания, доступность, этическая сторона вопроса. В частности, использование некоторых животных, например, собак, может быть не одобрено общественностью. В то же время с целью минимизации количества особей, используемых в эксперименте, применение более крупных животных позволяет нам создание нескольких дефектов в одной особи.
Наиболее частым используемым видом животных при сегментарных дефектах костей является овца [4]. Овцы - крупные животные, имеющие сопоставимые с людьми скорость ремоделирования и метаболизма костной ткани. Размеры костей скелета представителей данного вида позволяют создать у одной особи несколько дефектов, что удовлетворяет современному требованию на рациональное использование животных в эксперименте и сокращение их количества [5].
В литературе описано множество вариантов локализации дефектов в скелете овец: подвздошная кость, лопатка, бедренная и большеберцовая кости [1, 2, 5, 6]. Однако использование предлагаемых локализаций в длинных костях скелета не отвечает требованию сходной архитектоники костной ткани с альвеолярным гребнем челюсти человека, требует сложной хирургической техники, иммобилизации или установки наружных элементов фиксации у животного. Кроме того, при формировании костного дефекта цилиндрической формы в трубчатой кости может возникать сообщение с костномозговой полостью и как следствие контакт с нею исследуемого остеопластического материала, что повлияет на чистоту эксперимента. Формирование дефектов в подвздошной кости и лопатке, хотя и предоставляет зону с более предпочтительным соотношением компактного и губчатого вещества, тем не менее, также подразумевает достаточно сложный оперативный доступ. Моделирование дефекта в челюстных костях у баранов и овец затруднено в связи с анатомическими особенностями расположения корней зубов и сосудисто-нервного пучка [7, 8]. У молодой особи в проекции формирования костного дефекта на челюстях препятствием являются зачатки постоянных зубов.
Известен патент на изобретение № RU2730970 «Способ создания экспериментальной модели периимплантита». У взрослой овцы Северо-Кавказской породы производят перфорацию кортикальной пластинки челюстной кости по вершине альвеолярного гребня беззубого участка челюсти хирургической фрезой диаметром 2 мм со скоростью вращения 1200 об/мин на глубину 5 мм без охлаждения. Устанавливают одноэтапный винтовой дентальный имплантат диаметром 2,5 мм, длиной 10 мм, с крутящим моментом 15 Нсм, на внутрикостную часть которого предварительно накручена лигатура из хлопковой нити. Способ позволяет исключить летальность подопытных субъектов, получив при этом полноценную модель периимплантита с большим объемом окружающих тканей, доступных для исследования.
Недостатком данного способа является, что создание экспериментальной модели не предназначено для исследования регенераторного потенциала остеопластических материалов.
Так же известен патент на изобретение № RU2345423 «Способ моделирования костного дефекта бедренной кости». Сущность способа моделирования костного дефекта бедренной кости заключается в том, что интрамедулярно проводят спицу и затем осуществляют циркулярный разрез с сохранением латеральной губы бедренной кости. Использование данного изобретения по словам авторов позволит получить модель, более адекватную по клиническому течению и рентгенологическим проявлениям к костным дефектам бедренной кости человека, скальчатым переломам длинных трубчатых костей, однако данная модель анатомически не схожа с костной тканью челюстей человека.
И патент на изобретение № RU2758556 «Способ моделирования дефекта костной ткани для изучения остеоинтеграции костнопластического материала и регенерации губчатой костной ткани в эксперименте на кроликах». Способ предполагает рассечение апоневроза области ростральной половины гребня подвздошной кости. Тупо отслаивают мышцы. Формируют краевой прямоугольный дефект в ростральной половине гребня подвздошной кости, не резецируя переднюю ость и внутренний кортикальный слой. В дефект устанавливают прямоугольной формы костнопластический материал и фиксируют его костным швом. Осуществляют шов мышц и апоневроза. Способ позволяет создать адекватную модель для изучения остеоинтеграции костнопластических материалов и регенерации губчатой ткани путем обеспечения имплантации достаточного для изучения количества имплантируемого материала, снижения риска миграции трансплантата, низкой травматичности, сохранения функции конечностей для повседневной активности животного в ходе эксперимента и исключения повреждения.
Недостатки данного способа обусловлены малыми размерами костей скелета у грызунов невозможно воссоздание больших дефектов, также ограничено количество рекомендуемых имплантатов на одну особь.
Ближайшим аналогом заявляемого изобретения является патент на изобретение № RU 2820621 «Способ экспериментального моделирования хирургических вмешательств на нижней челюсти». Способ предполагает, что предварительно введенное под наркоз животное располагают на операционном столе. Осуществляют доступ к области операционного интереса путем применения наружного операционного доступа. При этом сначала создают линейный разрез кожи и мягких тканей вдоль основания нижней челюсти от подбородочного выступа до угла челюсти. Производят разрез до кости. После этого производят отслоение надкостницы в области операционного интереса. Далее отгибают отслоенный участок, обнажая челюстную кость. Затем на обнаженном участке осуществляют экспериментальные хирургические стоматологические манипуляции. Производят ушивание раны многорядным швом при помощи резорбируемого шовного материала. Далее наблюдают животное в послеоперационном периоде с осуществлением исследований биологических процессов в области проведенных экспериментальных хирургических стоматологических манипуляций. Способ позволяет безопасно, с низкой травматизацией, осуществлять экспериментальные хирургические стоматологические манипуляции, обеспечивает быстрое восстановление после операции, позволяет наблюдать животное в долгосрочной перспективе.
Однако, недостатком данного способа хирургического вмешательства является, что моделирования дефекта в челюстных костях животных может быть затруднено в связи с анатомическими особенностями расположения корней зубов и сосудисто-нервного пучка. Выполнение костных дефектов в области жевательного аппарата животного может снижать аппетит и замедлять восстановление в послеоперационном периоде.
Учитывая вышеперечисленные недостатки, задачей изобретения является поиск новых областей и способов хирургического доступа для создания экспериментальной модели исследования остеопластических материалов. Сущность изобретения заключается в том, что способ моделирования костного дефекта осуществляется за счет доступа к локтевому отростку локтевой кости овцы, выполняют трепанационные дефекты в костной ткани глубиной 5мм, диаметром 7мм, образованные костные столбики удаляют, формируя костные дефекты цилиндрической формы, затем заполняют сформированные костные дефекты гранулами экспериментальных остеопластических материалов. Технический результат достигается за счет использования в качестве экспериментальной живой модели область локтевого отростка локтевой кости овцы, а так же разработанного хирургического способа, обеспечивающего доступ к отростку и формирование на нем костных дефектов соответствующих понятию критического по определению дефекта наименьшего размера, не заживающего без лечения в течение определенного периода. Что позволяет выполнять экспериментальные исследования регенераторного потенциала гранул остеопластических материалов с наименьшим травматизмом для животного и обеспечивая быструю реабилитацию в послеоперационном периоде.
Способ обеспечивает возможность получения полноценной информации об изменениях в области имплантируемых дефектов на различных стадиях регенераторного процесса, оценить эффективность и безопасность остеопластических материалов.
Заявляемое изобретение поясняется с помощью Фиг.1-7, где на
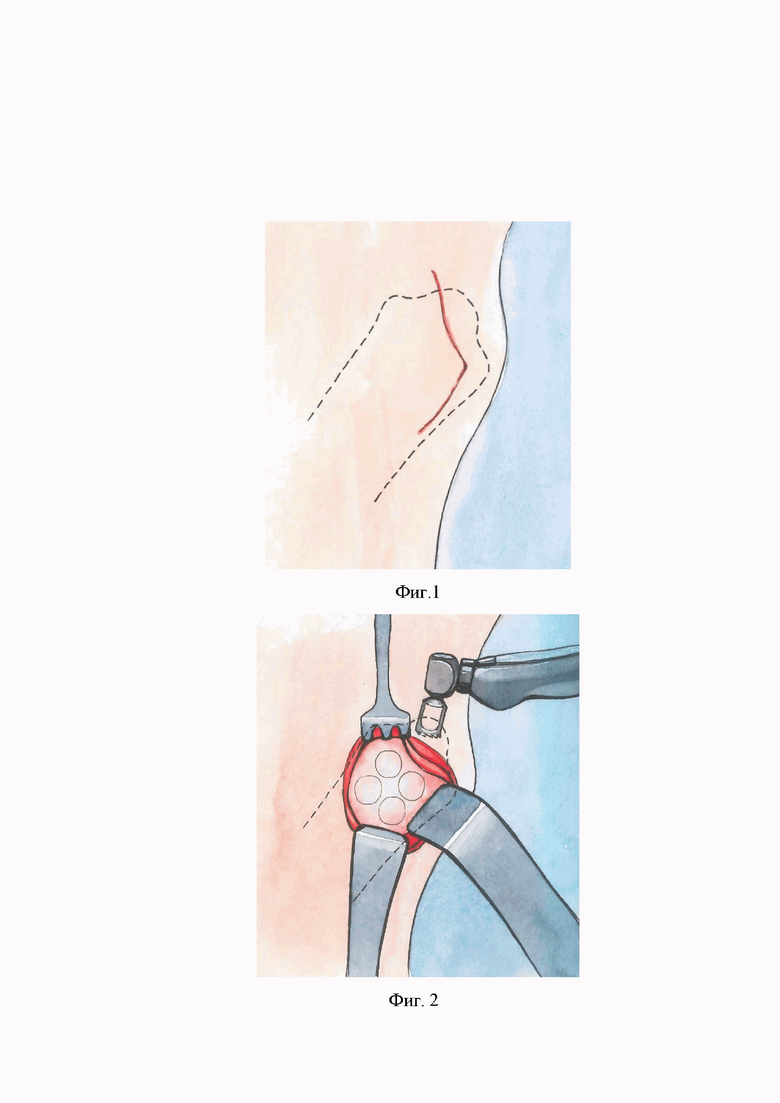
Фиг. 1 – разрез кожи по контуру локтевого отростка овцы
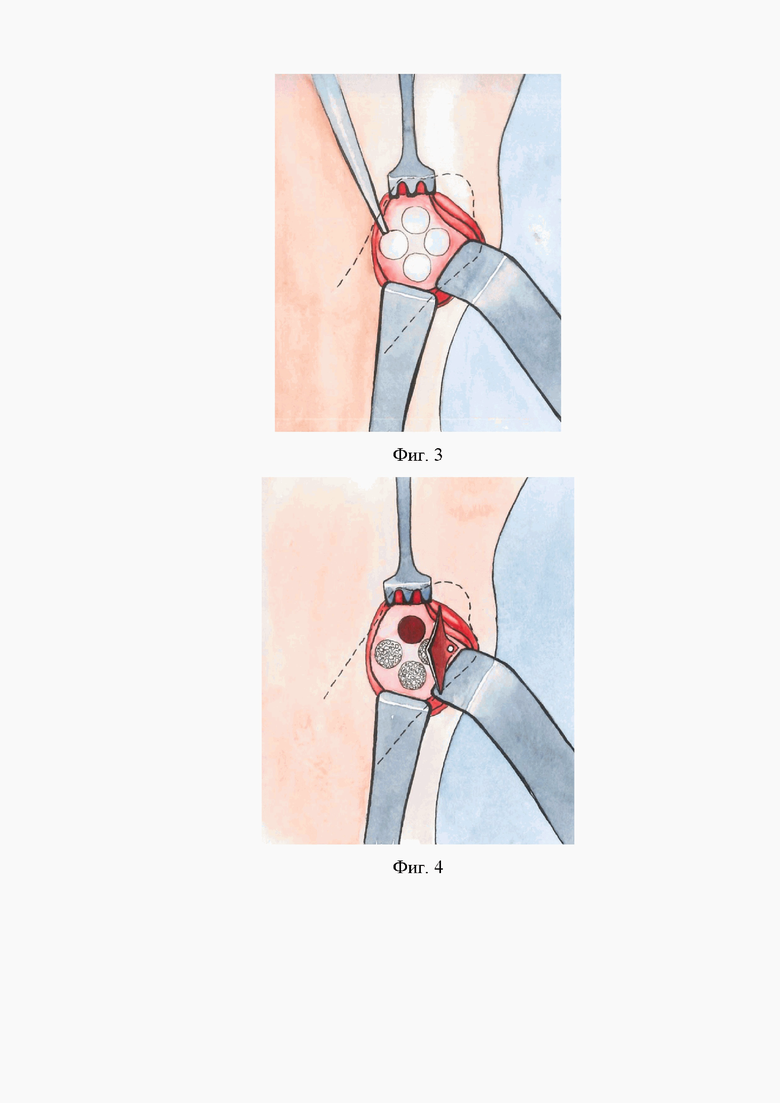
Фиг. 2 – формирование трепанационных костных столбиков
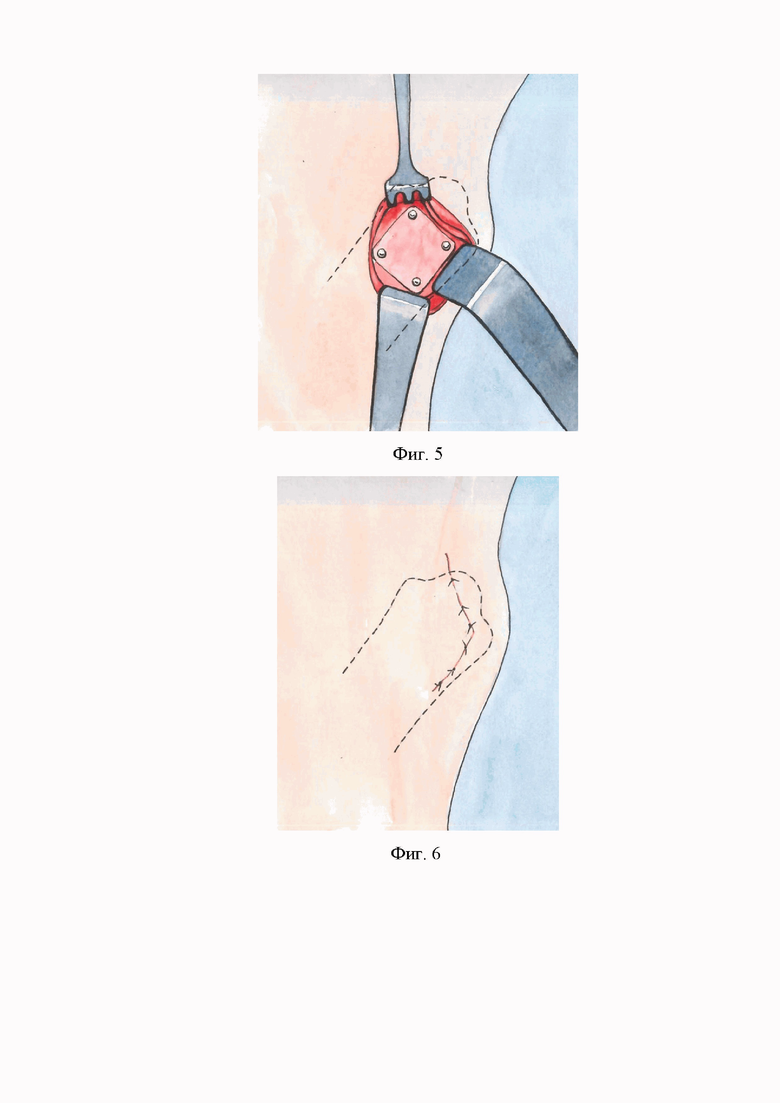
Фиг. 3 – удаление прямым люксатором костных столбиков
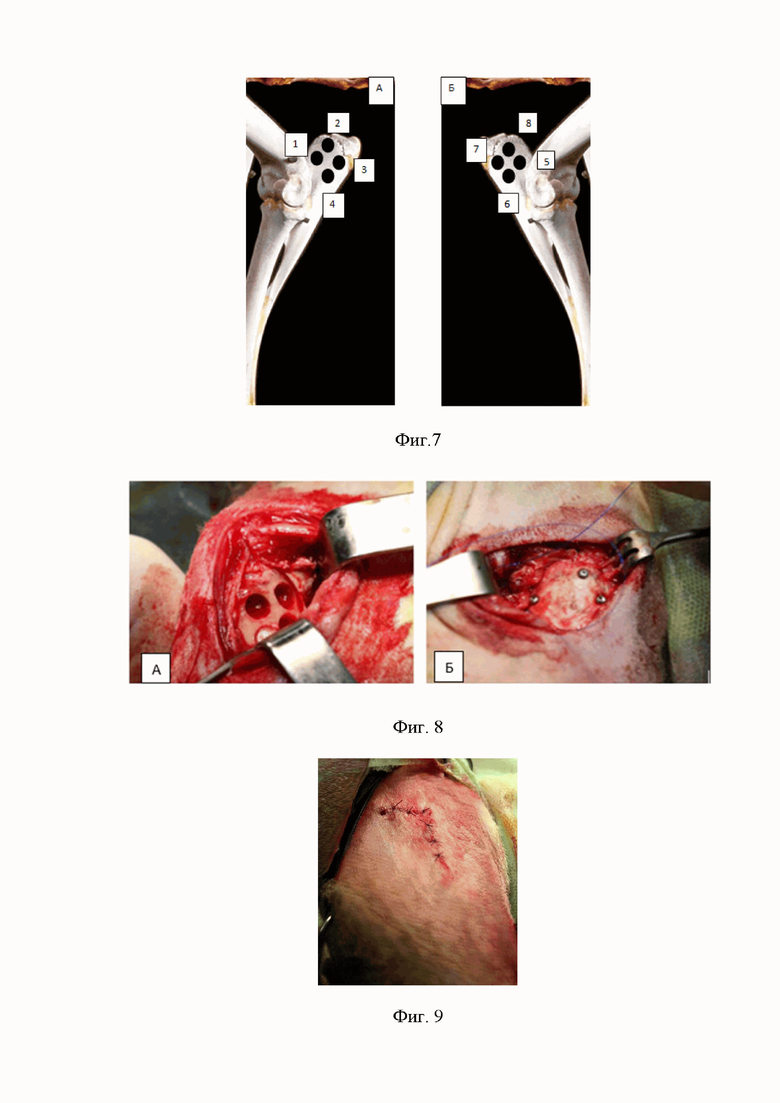
Фиг. 4 – формирование костных дефектов за счет имплантации гранул остеопластических материалов
Фиг. 5 – изоляция костных дефектов
Фиг. 6 – ушивание операционной раны
Фиг. 7 – схема имплантации гранул остеопластических материалов в локтевой отросток овцы, слева (А), справа (Б)
Фиг. 8 – операция на локтевом отростке овцы. А – Вид сформированных дефектов в локтевом отростке овцы. Б – Операционное поле после фиксации коллагеновой мембраны. Момент нанесения метки нерезорбируемой шовной нитью (синего цвета)
Фиг. 9 – вид операционной области после наложения швов
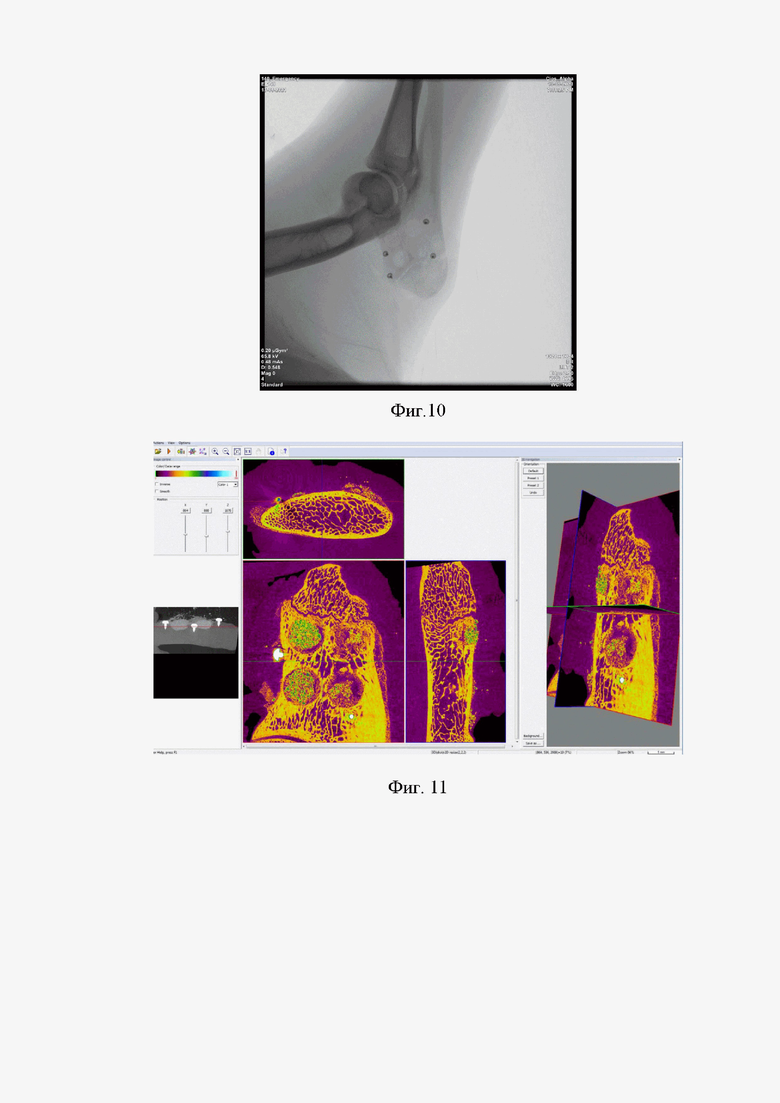
Фиг. 10 – контрольная рентгенограмма локтевого отростка овцы сразу после операции. Визуализируются 4 трепанационных отверстия, титановые пины, фиксирующие коллагеновую мембрану
Фиг. 11 – визуализация в программе DataViewer и CTvox
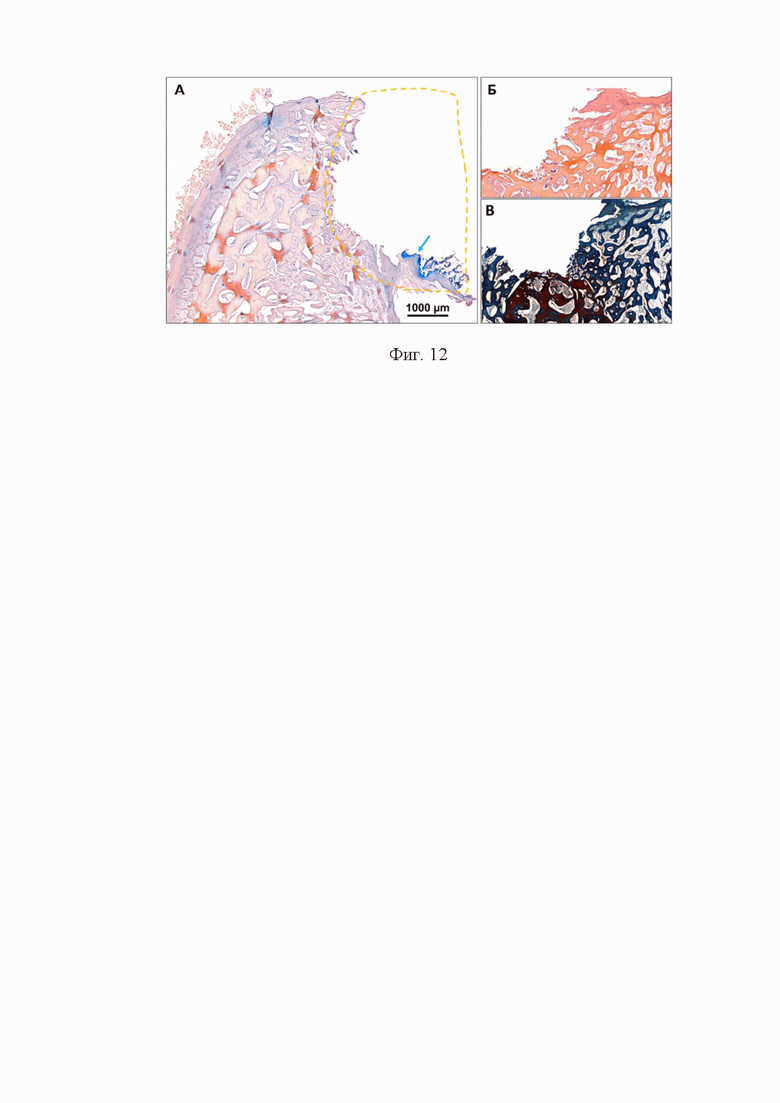
Фиг. 12 – гистотопограммы криосрезов образцов гранул остеопластических материалов контрольной группы через 3 недели ортотопической имплантации в локтевой отросток овцы
Способ включает в себя:
1. Выполнение углообразного разреза кожи по контуру локтевого отростка овцы отступая от его края 1,5 см согласно Фиг.1
2. Формирование трепанационной фрезой d7 мм L10 под внешним охлаждением трепанационные костные столбики на глубину 5мм согласно Фиг.2.
3. Удаление прямым люксатором костных столбиков, формируя костные дефекты согласно Фиг.3.
4. Фиксация коллагеновой мембраны. Формирование костных дефектов за счет имплантации гранул остеопластических материалов согласно Фиг.4.
5. Изоляция коллагеновой мембраной костных дефектов, окончательное фиксирование пинами согласно Фиг.5.
6. Послойное ушивание операционной раны согласно Фиг.6.
7. Выведение животного из эксперимента на 3 неделях, 3 и 6 месяце, забор локтевых отростков овцы. Проведение исследования препаратов посредством компьютерной микротомографии и гистологического метода.
Экспериментально-клинический пример.
В работе использовалась модель местного действия материала после имплантации в область дефекта костной ткани животных. Дефект представлял собой трепанацию в области локтевых отростков передних правой и левой конечностях (по 4 дефекта в каждом отростке, всего 8 дефектов). Все созданные дефекты имели глубину 5 мм, диаметр 7 мм, согласно Фиг.7.
В эксперименте использовали 7 групп экспериментальных образцов согласно таблице 1, остеопластического материала и 1 контроль. В качестве последнего использовали кровяной аутосгусток. В каждой группе образцов размер крошки составлял 0,25-1 мм.
Таблица 1 - Группы экспериментальных образцов
Ход операции на локтевом отростке овцы: по контуру наружной поверхности локтевого отростка локтевой кости овцы, отступая 1,5 см от его края, проводили угловой разрез кожи. Распатором скелетировали кортикальную пластинку локтевого отростка. Используя стоматологическую трепанационную фрезу D=7мм и L= 10, применяемую в хирургии полости рта для забора костных блоков, угловой наконечник и физиодиспенсер марки W&H. Под внешним охлаждением выполняли 4 трепанационных дефекта в костной ткани глубиной 5 мм, диаметром 7мм. Образованные костные столбики удаляли прямым периотомом открывая костные девекты цилиндрической формы. В полученные дефекты имплантации гранулы остеопластических материалов. В каждой зоне имплантации у 1-го и 5-го образцов делали метку нерезорбируемой шовной нитью. Дефекты с имплантированными гранулами остеопластических материалов изолировали от окружающих мягких тканей барьерной мембраной «BioPlate Barrier» (производство Кардиоплант), которую фиксировали титановыми пинами. Кожный лоскут возвращали на место и фиксировали швами Viсryl 4.0 Имплантацию проводили согласно Фиг. 8-9.
После хирургического этапа проводили рентгенологический прицельный контроль в каждой области имплантации согласно Фиг. 10.
Выведение животных из эксперимента осуществлялось на сроках 3 недели, 3 месяца и 6 месяцев после оперативного вмешательства.
Для изучения структуры локтевых отростков овцы и определения их минеральной плотности использовали рентгеновский компьютерный микротомограф Skyscan 1176 (Bruker microCT, Бельгия). Сканированные объекты реконструировались в программе Nrecon (1.7.4.2, Bruker-microCT, Бельгия). 3D визуализация полученных результатов в зависимости от рентгенологической плотности проводилась в программе CTvox (3.3.0r1403, Bruker-microCT, Бельгия) согласно Фиг. 11
Оценка результатов эксперимента осуществлялась также гистологическими методами. Для морфофункциональной оценки образцов проводили комплексный гистохимический анализ, при этом использовались методы окрашивания микропрепаратов гематоксилином Майера и эозином Y (H&E), трихромная дифференциальная окраска на коллаген по методу Лилли, дифференциальная окраска на хрящевую и костную ткань с помощью альцианового синего, согласно Фиг. 12.
Согласно Фиг.12 представлены гистотопограммы криосрезов гранул остеопластических материалов контрольной группы через 3 недели ортотопической имплантации в локтевой отросток локтевой кости овцы. А– окраска на костно-хрящевое дифференцирование, ядра клеток окрашены синим, компоненты матрикса – бежево-розовым, зрелая хрящевая ткань – ярко-голубая, незрелая хрящевая ткань – сиренево-розовый; Б–H&E, ядра клеток окрашены синим, компоненты матрикса – розовое и светло красное окрашивание, кальцификаты – интенсивно пурпурные; В– окраска трихром по Лилли, ядра клеток – красно-коричнево-черные, новообразованные зрелые коллагеновые компоненты внеклеточного матрикса или недеминерализованная костная ткань – синие, неколлагеновые компоненты матрикса или деминерализованная костная ткань – темно красные. Желтым штрих-пунктиром отмечена область костного дефекта. Световая микроскопия.
Результаты клинического применения хирургического способа моделирования костного дефекта на локтевом отростке овец для исследования регенераторного потенциала гранул остеопластических материалов. Все животные благополучно перенесли операцию, в послеоперационном периоде не наблюдалось ограничения двигательной активности, нарушений аппетита.
По данным компьютерной микротомографии, при выведении животного через 3 недели от момента операции более выраженный уровень регенерации и формирование зрелой костной ткани на дне дефекта обнаружено у образцов 5, 2 и 3. В контрольном образце рост трабекул внизу дефекта плохо визуализировался, как в 6 пробе, присутствовали незначительные островки ретикулофиброзной костной ткани внизу дефекта.
На сроке 3 месяца в препаратах локтевых отростков овец наиболее выраженной регенерацией и сформированной костной тканью отличалась 5 проба, в остальных пробах было примерно на одном уровне, разница в цифровых данных связана с характеристиками аугментатов и их содержанием в дефектах. При изучении материалов, полученных спустя 6 месяцев поле операции, наиболее выраженной регенерацией костной ткани отличались проба 5 и, чуть хуже, контроль. Наиболее низкий уровень регенерации отмечен в образцах 7 и 4. Развитие костной ткани во всех остальных пробах было сопоставимо, разница в цифровых данных также связана, по всей видимости, с характеристиками остеопластических материалов и их содержанием в дефектах. В ходе дифференциального гистохимического анализа образцов было установлено, что все экспериментальные материалы не обладают длительным токсическим действием, при этом контактной токсичностью (инактивирующейся со временем) обладают материалы 2 и 3, и очень слабой 1 и 4. Образцы 1 – 4 обладают не прямым, но опосредованным остеогенным действием, возможно за счет медленного, но длительного поступления ионов кальция и фосфатов в окружающие ткани вследствие резорбтивных процессов. Материалы 5 и 7 в наибольшей степени и напрямую стимулируют процессы неооссификации. Материал 6 обладает наименьшим регенеративным потенциалом, однако и он опосредованно может способствовать регенерации за счет пролонгации репаративно-воспалительной фазы и поступления соответствующих сигнальных факторов от клеток реципиента при резорбции костной крошки. По степени выраженности регенераторного потенциала у исследуемых образцов ксеноматериалов наилучшие результаты были получены при использовании коллагеновой крошки с субтотальной минерализацией. По данным гистологического исследования в образцах контрольной группы на всех сроках имплантации не наблюдалось зарастания костного дефекта, дефект заполнялся фиброзной тканью, которая со временем подвергалась инволюции и перестройке с остаточными компонентами таковой к 6 месяцам наблюдения. Локтевой отросток локтевой кости овцы по толщине и структуре в ходе хирургической операции продемонстрировал сходство с челюстной костью человека. Модель дефекта костной ткани в локтевом отростке овцы показала также легкую доступность данной области для оперативного вмешательства и низкую морбидность для животного.
Список используемой литературы
1. Ferguson J.C., Tangl S., Barnewitz D., Genzel A., Heimel P., Hruschka V. et al. A large animal model for standardized testing of bone regeneration strategies. BMC veterinary research. 2018, no.14(1), 330. doi.org/10.1186/s12917-018-1648-0.
2. Hettwer W., Horstmann P.F., Bischoff S., Güllmar D., Reichenbach J.R., Poh P.S.P. et al. Establishment and effects of allograft and synthetic bone graft substitute treatment of a critical size metaphyseal bone defect model in the sheep femur. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica. 2019, no.127(2): 53–63. doi.org/10.1111/apm.12918.
3. Nuss K.M., Auer J.A., Boos A., von Rechenberg B. An animal model in sheep for biocompatibility testing of biomaterials in cancellous bones. BMC musculoskeletal disorders. 2006, no.7: 67. doi.org/10.1186/1471-2474-7-67.
4. Курзалов А.П., Быков И.М., Ананьева А.Ш., Веревкина Ю.В. Экспериментальное моделирование повреждений костных структур: монография. М.: Издательский дом Академии Естествознания, 2021. 176 с.
5. Lansdowne J.L., Devine D., Eberli U., Emans P., Welting T.J., Odekerken J.C. et al. Characterization of an ovine bilateral critical sized bone defect iliac wing model to examine treatment modalities based on bone tissue engineering. BioMed research international. 2014, 250958. doi.org/10.1155/2014/250958.
6. Bajuri M.Y., Selvanathan N., Dzeidee Schaff F.N., Abdul Suki M.H., Ng A.M.H. Tissue-Engineered Hydroxyapatite Bone Scaffold Impregnated with Osteoprogenitor Cells Promotes Bone Regeneration in Sheep Model. Tissue engineering and regenerative medicine. 2021, no.18(3): 377–385. doi.org/10.1007/s13770-021-00343-2.
7. Nolff M.C., Kokemueller H., Hauschild G., Fehr M., Bormann K.H., Spalthoff S. et al. Comparison of computed tomography and microradiography for graft evaluation after reconstruction of critical size bone defects using beta-tricalcium phosphate. Journal of cranio-maxillo-facial surgery : official publication of the European Association for Cranio-Maxillo-Facial Surgery. 2010, no.38(1): 38–46. doi.org/10.1016/j.jcms.2009.07.010).
8. Paré A., Charbonnier B., Veziers J., Vignes C., Dutilleul M., De Pinieux G. et al. Standardized and axially vascularized calcium phosphate-based implants for segmental mandibular defects: A promising proof of concept. Acta biomaterialia. 2022, no.154: 626–640. doi.org/10.1016/j.actbio.2022.09.071.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НАПРАВЛЕННОЙ КОСТНОЙ РЕГЕНЕРАЦИИ ПРИ АТРОФИИ АЛЬВЕОЛЯРНОЙ КОСТИ ЧЕЛЮСТЕЙ С ПРОВЕДЕНИЕМ ДВУХЭТАПНОЙ ДЕКОРТИКАЦИИ И ФОРМИРОВАНИЕМ ПЬЕЗОХИРУРГИЧЕСКОЙ СЕТКИ НА РЕЦИПИЕНТНОЙ ОБЛАСТИ | 2023 |
|
RU2816539C1 |
| Способ экспериментального моделирования хирургических вмешательств на нижней челюсти | 2023 |
|
RU2820621C1 |
| Способ реконструкции альвеолярного гребня в дистальных отделах верхней челюсти для установки дентальных имплантатов | 2018 |
|
RU2700543C1 |
| ОСТЕОПЛАСТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ РЕМОДЕЛИРОВАНИЯ ПЕРИИМПЛАНТНОЙ ЗОНЫ ЧЕЛЮСТНОЙ КОСТИ | 2020 |
|
RU2765850C1 |
| СПОСОБ СОЗДАНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ПЕРИИМПЛАНТИТА | 2019 |
|
RU2730970C1 |
| Биокомпозитный остеопластический матрикс | 2018 |
|
RU2699994C1 |
| Способ пластики дистального отдела альвеолярного отростка верхней челюсти при хроническом полипозном верхнечелюстном синусите | 2019 |
|
RU2714169C1 |
| Способ наращивания объема костной ткани гребня альвеолярного отростка челюсти | 2016 |
|
RU2645963C2 |
| СПОСОБ РЕКОНСТРУКЦИИ ВЕРХНЕЧЕЛЮСТНОЙ ПАЗУХИ ПРИ АДЕНТИИ И ВЕРХНЕЧЕЛЮСТНОМ СИНУСИТЕ | 2016 |
|
RU2611757C1 |
| СПОСОБ СОЗДАНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ОСТЕОПОРОЗА | 2017 |
|
RU2676658C1 |
Изобретение относится к области медицины, а именно к экспериментальной челюстно-лицевой хирургии и хирургической стоматологии. Осуществляют доступ к локтевому отростку локтевой кости овцы. Выполняют трепанационные дефекты в костной ткани глубиной 5 мм, диаметром 7 мм. Образованные костные столбики удаляют, формируя костные дефекты цилиндрической формы. Затем заполняют сформированные костные дефекты гранулами экспериментальных остеопластических материалов. Способ обеспечивает возможность получения полноценной информации об изменениях в области имплантируемых дефектов на различных стадиях регенераторного процесса, оценить эффективность и безопасность остеопластических материалов. 12 ил., 1 табл., 1 пр.
Способ моделирования костного дефекта на локтевом отростке овец для исследования регенераторного потенциала остеопластических материалов, отличающийся тем, что осуществляют доступ к локтевому отростку локтевой кости овцы, выполняют трепанационные дефекты в костной ткани глубиной 5 мм, диаметром 7 мм, образованные костные столбики удаляют, формируя костные дефекты цилиндрической формы, затем заполняют сформированные костные дефекты гранулами экспериментальных остеопластических материалов.
| Sartoretto S.C | |||
| et al | |||
| Sheep as an experimental model for biomaterial implant evaluation | |||
| Acta Ortop Bras | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Способ экспериментального моделирования хирургических вмешательств на нижней челюсти | 2023 |
|
RU2820621C1 |
| Способ моделирования дефекта костной ткани для изучения остеоинтеграции костнопластического материала и регенерации губчатой костной ткани в эксперименте на кроликах | 2021 |
|
RU2758556C1 |
| ВЗРЫВАТЕЛЬ ИЗБИРАТЕЛЬНОГО ДЕЙСТВИЯ | 1929 |
|
SU18168A1 |
| Мураев А.А | |||
| и др | |||
| Экспериментальная модель для изучения репаративной костной регенерации при реконструкции нижней челюсти | |||
| Бюллетень | |||
Авторы
Даты
2024-11-18—Публикация
2024-08-15—Подача